Настоящее изобретение относится к производным этинила формулы 1

в которой
U - это =N- или =C(R5)-;
V - это -СН= или -N=;
W - это =СН- или =N-;
при условии, что только одна из групп U, V или W является атомом азота,
R5 - это водород, метил или галоген;
Y - это -N(R6)-, -O-, -C(R7')R7)-, -CH2O- или -CH2S(O)2-;
причем R6 - это водород или низший алкил, a R7/R7' независимо друг от друга представляют собой водород, гидрокси-группу, низший алкил или низшую алкокси-группу;
R1 - это фенил или гетероарил, которые могут содержать один или два заместителя, выбранных из галогена, низшего алкила или низшей алколкси-группы;
R2/R2' независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, С3-С6-циклоалкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил или кольцо, включающее CH2OCH2-;
m равно 0, 1 или 2;
в случае если m равно 1,
R3/R3' независимо друг от друга представляют собой водород, низший алкил, CH2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил;
или R3 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил или кольцо, включающее (CH2)2OCH2-;
n равно 0 или 1;
в случае если n - это 1,
R4/R4' независимо друг от друга представляют собой водород, низший алкил, CH2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил;
R4 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил;
если n равно 0, a Y - это -N(R6)-, то R6 и R2 могут составлять совместно с атомом углерода и атомом азота, к которому они присоединены, C3-C6-циклоалкил;
если пит равны 0, то R2 и R7 могут составлять совместно с атомом углерода, к которому они присоединены, C3-6-циклоалкил;
или к фармацевтически приемлемой соли, образованной добавлением кислоты, к рацемической смеси, или к его соответствующему энантиомеру и/или оптическому изомеру и/или его стереоизомеру.
Неожиданным открытием явилось то, что соединения общей формулы 1 являются аллостерическими модуляторами метаботропного глутаматного рецептора 5 подтипа (mGluR5).
В центральной нервной системе (ЦНС) передача импульсов происходит путем взаимодействия нейротрансмиттера, испускаемого нейроном, с нейрорецептором.
Глутамат является главным нейротрансмиттером возбуждения в мозгу и играет исключительную роль в различных функциях центральной нервной системы (ЦНС). Глутамат-зависимые рецепторы импульсов подразделяются на две большие группы. Первая основная группа, собственно, ионотропные рецепторы, формирует лиганд-контролируемые ионные каналы. Метаботропные глутаматные рецепторы (mGluR) принадлежат ко второй основной группе и, кроме того, принадлежат к семейству рецепторов, сопряженных с G-белком.
К настоящему времени известно восемь различных членов семейства mGluR, и некоторые из них имеют даже подтипы. В соответствии с их гомологией последовательностей, механизмами передачи сигнала и агонистической селективностью, этим восемь рецепторов могут быть подразделены на три подгруппы:
mGluR1 и mGluR5 принадлежат к группе I, mGluR2 и mGluR3 принадлежат к группе II и mGluR4, mGluR6, mGluR7 и mGluR8 принадлежат к группе III.
Лиганды метаботропных глутаматных рецепторов, принадлежащих к первой группе, могут быть использованы для лечения или профилактики острых и/или хронических неврологических расстройств, таких как психоз, эпилепсия шизофрения, болезнь Альцгеймера, когнитивные расстройства и нарушения памяти, а также хроническая и острая боль.
Другими показаниями к применению в этой связи являются ограниченная функция мозга, причиной которой явились операции с отключением или трансплантаты, недостаточное кровоснабжение мозга, травмы позвоночника, черепно-мозговые травмы, вызванная беременностью гипоксия, остановка сердца и гипогликемия. Другими показаниями к применению являются ишемия, хорея Гентингтона, амиотрофический боковой склероз (ALS), слабоумие, вызванное СПИДом, глазные травмы, ретинопатия, идиопатический паркинсонизм или паркинсонизм медикаментозного происхождения, а также состояния, которые приводят к глутамат-дефицитным функциям, таким как, например, мышечные спазмы, конвульсии, мигрень, недержание мочи, никотиновая зависимость, опиатная зависимость, тревожность, рвота, дискинезия и депрессии.
Расстройства, которые полностью или частично опосредованы mGluRS, - это, например, острые, травматические или хронические дегенеративные процессы нервной системы, такие как болезнь Альцгеймера, старческое слабоумие, болезнь Паркинсона, хорея Гентингтона, амиотрофический боковой склероз и рассеянный склероз, психиатрические заболевания, такие как шизофрения и тревожность, депрессия, боль и наркотическая зависимость (Expert Opin. Ther. Patents (2002), 12, (12)).
Новым направлением в разработке селективных модуляторов является идентификация соединений, которые действуют по аллостерическому механизму, модулируя рецепторы путем связывания по сайту, отличному от высоко консервативного ортостерического сайта связывания. В недавнее время выяснилось, что аллостерические модуляторы mGluR5 представляют собой новые фармацевтические субстанциии, открывающие возможность этой привлекательной альтернативы. Аллостерические модуляторы были описаны, например, в WO 2008/151184, WO 2006/048771, WO 2006/129199 и WO 2005/044797, а также в Molecular Pharmacology, 40, 333-336, 1991; The Journal of Pharmacology and Experimental Therapeutics, Vol 313, No. 1, 199-206, 2005.
В последние годы были достигнуты значительные успехи в понимании патофизиологичеких механизмов различных нарушений развития, свидетельствующие о том, что синтез белка в синапсах запускается за счет активации метаботропных глутаматных рецепторов I группы. Подобные нарушения включают синдром фрагильной X-хромосомы, аутизм, идиопатический аутизм, комплекс туберозного склероза, нейрофиброматоз 1 типа или синдром Ретта (Annu. Rev. Med., 2011, 62, 31.1-31.19; Neuroscience 156, 2008, 203-215).
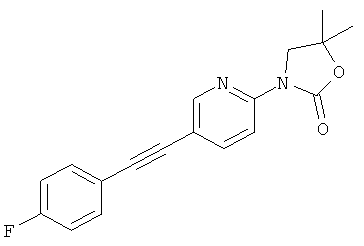
На предшествующем уровне техники описаны позитивные аллостерические модуляторы. Они представляют собой соединения, которые сами по себе не активируют рецепторы, но значительно усиливают отклики, индуцируемые агонистами, увеличивают силу и максимум эффективности. В результате связывания этих соединений повышается сродство агониста глутаматного сайта на его внеклеточном N-концевом сайте связывания. Таким образом, аллостеричекая модуляция является привлекательным механизмом повышения активации нужного физиологического рецептора. Существует недостаток селективных аллостерических модуляторов для рецептора mGluR5. Обычные модуляторы рецептора mGluR5, как правило, недостаточно растворимы в воде и обладают низкой биодоступностью при оральном введении.
Поэтому сохраняется потребность в соединениях, которые лишены этих недостатков и которые представляют собой эффективные селективные аллостерические модуляторы для рецепторов mGluR5.
Соединения формулы I выбраны благодаря их ценным терапевтическим свойствам. Их можно использовать для лечения или профилактики нарушений, имеющих отношение к аллостерическим модуляторам рецептора mGluR5.
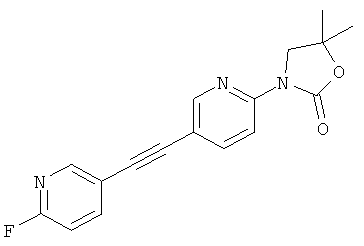
Наиболее предпочтительными показаниями к применению соединений, представляющих собой аллостерические модуляторы, это шизофрения и когнитивная деятельность.
Настоящее изобретение относится к соединениям формулы I, а также к их фармацевтически приемлемым солям, в случаях если оно относится к смесям энантиомеров или диастереомеров или их энантиомерно или диастереомерно чистым формам, к таким соединениям в качестве фармацевтически активных веществ, к способам их получения, а также к их применению для лечения или профилактики нарушений, имеющих отношение к аллостерическим модуляторам рецептора mGluR5, таким как шизофрения, когнитивная деятельность, синдром фрагильной X-хромосомы или аутизм, а также к фармацевтическим композициям, содержащим соединения формулы I.
Приведенные ниже определения общих понятий, использованных в настоящем описании, применяются независимо от того, встречаются ли обсуждаемые термины по отдельности или в комбинации.
Используемый в настоящем описании термин "низший алкил" обозначает насыщенную, т.е. алифатическую углеводородную группу, включающую неразветвленную или разветвленную углеродную цепь из 1-4 атомов углерода. Примерами термина "алкил" являются метил, этил, н-пропил и изопропил.
Термин "алкокси" обозначает группу -O-R', в которой R' - это низший алкил по вышеприведенному определению.
Термин "этинил" обозначает группу -С≡С-.
Термин "циклоалкил" обозначает насыщенное углеродное кольцо, содержащее от 3 до 6 атомов углеродного кольца, например циклопропил, циклобутил, циклопентил или циклогексил.
Термин "гетероарил" обозначает 5- или 6-членное ароматическое кольцо, содержащее по меньшей мере один N-, О- или S-гетероатом, например пиридинил, пиримидинил, пиразолил, пиридазинил, имидазолил, триазолил, тиенил или пиразинил.
Термин "фармацевтически приемлемая соль" или "фармацевтически приемлемая соль, образованная добавлением кислоты" включает соли неорганических и органических кислот, например хлороводородной кислоты, азотной кислоты, серной кислоты, фосфорной кислоты, лимонной кислоты, муравьиной кислоты, фумаровой кислоты, малеиновой кислоты, уксусной кислоты, янтарной кислоты, винной кислоты, метаносульфоновой кислоты, п-толуолсульфоновой кислоты и т.п.
Одним вариантом осуществления настоящего изобретения является соединение формулы I-А1,

в которой U - это =N- или =C(R5)-;
V - это -CH= или -N=;
W - это =CH- или =N-;
при условии, что только одна из групп U, V или W может являться атомом азота;
R5 - это водород, метил или галоген;
R1 - это фенил или гетероарил, которые могут содержать от одного до двух заместителей, выбранных из галогена, низшего алкила или низшей алкокси-группы;
R2/R2' независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, C3-C6-циклоалкил, CH2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил или кольцо, включающее CH2OCH2-;
R3/R3' независимо друг от друга представляют собой водород, низший алкил, CH2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил;
или R3 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять C3-6-циклоалкил или кольцо, включающее (CH2)2OCH2-;
или фармацевтически приемлемая соль, образованная добавлением кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или его стереоизомер.
Примерами соединений формулы I-А1 являются следующие:
3-(3-фтор-5-фенилэтинил-пиридин-2-ил)-5,5-диметил-оксазолидин-2-он
(5RS)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он
(5R или 5S)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он
(5S или 5R)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он
5,5-диметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он
3-[5-(3-фтор-фенилэтинил)-пиридин-2-ил]-5,5-диметил-оксазолидин-2-он
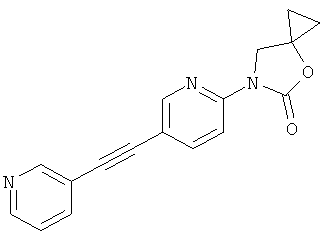
5,5-диметил-3-(5-пиридин-3-илэтинил-пиридин-2-ил)-оксазолидин-2-он
(5RS)-5-трет-бутил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он
6-(5-фенилэтинил-пиридин-2-ил)-4-окса-6-аза-спиро[2.4]гептан-5-он
7-(5-фенилэтинил-пиридин-2-ил)-5-окса-7-аза-спиро[3.4]октан-6-он
3-(5-фенилэтинил-пиридин-2-ил)-1-окса-3-аза-спиро[4.4]нонан-2-он
3-(5-фенилэтинил-пиридин-2-ил)-1-окса-3-аза-спиро[4.5]декан-2-он
(5RS)-5-трет-бутил-5-метил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он
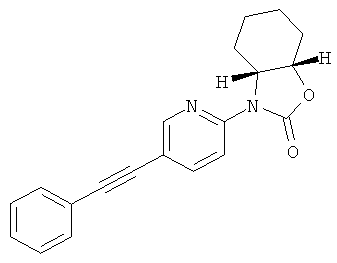
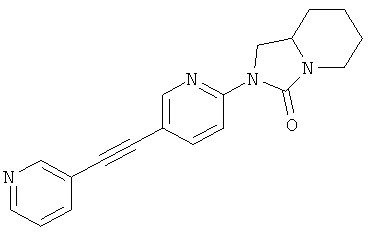
(3aRS,6aSR)-3-(5-фенилэтинил-пиридин-2-ил)-гексагидро-циклопентаоксазол-2-он
(3aRS,6aSR)-3-(5-пиридин-3-илэтинил-пиридин-2-ил)-гексагидро-циклопентаоксазол-2-он
(3aRS,6aSR)-3-[5-(5-фтор-пиридин-3-илэтинил)-пиридин-2-ил]-гексагидро-циклопентаоксазол-2-он
(RS)-4,5,5-триметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он
4,4,5,5-тетраметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он
3-[5-(5-фтор-пиридин-3-илэтинил)-пиридин-2-ил]-5,5-диметил-оксазолидин-2-он
5,5-диметил-3-(5-пиримидин-5-илэтинил-пиридин-2-ил)-оксазолидин-2-он
5,5-диметил-3-[5-(1-метил-1Н-пиразол-4-илэтинил)-пиридин-2-ил]-оксазолидин-2-он
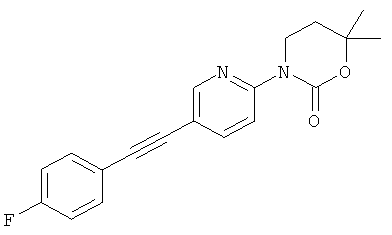
3-[5-(4-фтор-фенилэтинил)-пиридин-2-ил]-5,5-диметил-оксазолидин-2-он
3-[5-(3,4-дифтор-фенилэтинил)-пиридин-2-ил]-5,5-диметил-оксазолидин-2-он
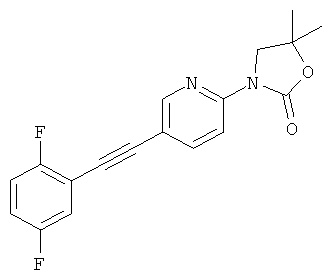
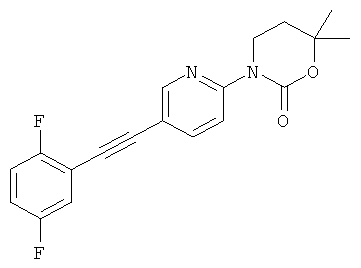
3-[5-(2,5-дифтор-фенилэтинил)-пиридин-2-ил]-5,5-диметил-оксазолидин-2-он
3-[5-(6-фтор-пиридин-3-илэтинил)-пиридин-2-ил]-5,5-диметил-оксазолидин-2-он
6-(5-пиридин-3-илэтинил-пиридин-2-ил)-4-окса-6-аза-спиро[2.4]гептан-5-он
(6SR,7RS)-3-(5-фенилэтинил-пиридин-2-ил)-гексагидро-бензооксазол-2-он
(3aSR,7aRS)-(3aRS,7RS)-1-(5-фенилэтинил-пиридин-2-ил)-гексагидро-пирано[4,3-d]оксазол-2-он или
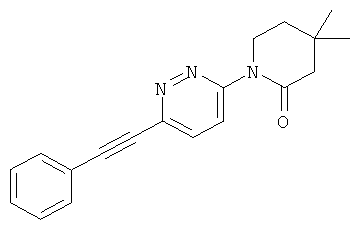
5,5-диметил-3-(6-(фенилэтинил)пиридазин-3-ил)оксазолидин-2-он.
Еще одним вариантом осуществления настоящего изобретения является
соединение формулы
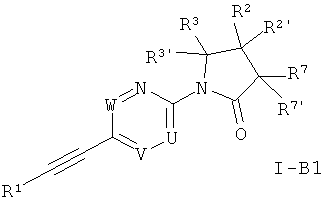
в которой U - это =N- или =C(R5)-;
V - это -CH= или -N=;
W - это =CH- или =N-;
при условии, что только одна из групп U, V или W может являться атомом азота.
R5 - это водород, метил или галоген;
R1 - это фенил или гетероарил, которые могут содержать один или два заместителя, выбранных из галогена, низшего алкила или низшей алкокси-группы;
R2/R2' независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, C3-C6-циклоалкил, CH2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил или кольцо, включающее CH2OCH2-;
R3/R3' независимо друг от друга представляют собой водород, низший алкил, CH2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил;
или R3 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять C3-6-циклоалкил или кольцо, включающее (CH2)2OCH2-;
R7/R7 независимо друг от друга представляют собой водород, гидрокси-группу, низший алкил или низшую алкокси-группу;
или фармацевтически приемлемая соль, образованная добавлением кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или его стереоизомер.
В частности, примерами соединений формулы I-В1 являются следующие:
4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-прирролидин-2-он
(3RS)-3-гидрокси-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-прирролидин-2-он
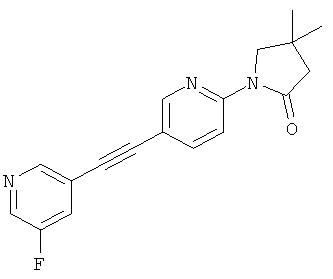
1-(3-фтор-5-фенилэтинил-пиридин-2-ил)-4,4-диметил-прирролидин-2-он
1-[5-(5-фтор-пиридин-3-илэтинил)-пиридин-2-ил]-4,4-диметил-прирролидин-2-он
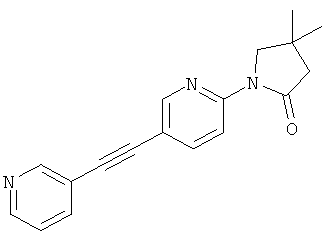
4,4-диметил-1-(5-пиридин-3-илэтинил-пиридин-2-ил)-прирролидин-2-он
1-[5-(5-хлор-пиридин-3-илэтинил)-пиридин-2-ил]-4,4-диметил-прирролидин-2-он
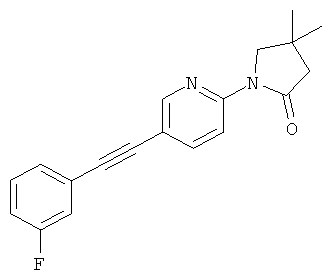
1-[5-(3-фтор-фенилэтинил)-пиридин-2-ил]-4,4-диметил-прирролидин-2-он
4,4-диметил-1-(3-метил-5-фенилэтинил-пиридин-2-ил)-прирролидин-2-он
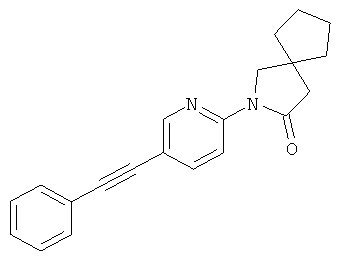
2-(5-фенилэтинил-пиридин-2-ил)-2-аза-спиро[4.4]нонан-3-он
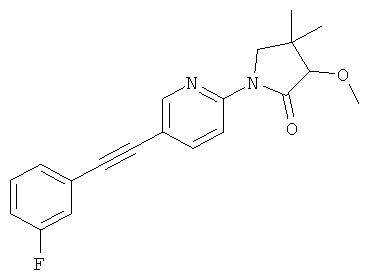
(RS)-3-метокси-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-прирролидин-2-он
(5R или 5S)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он
(5S или 5R)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он
(RS)-1-[5-(5-хлор-пиридин-3-илэтинил)-пиридин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он
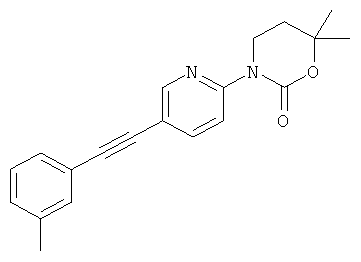
(RS)-3-метокси-4,4-диметил-1-(5-м-толилэтинил-пиридин-2-ил)-прирролидин-2-он
(RS)-1-[5-(3-фтор-фенилэтинил)-пиридин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он
(RS)-1-[5-(4-фтор-фенилэтинил)-пиридин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он
6-(5-фенилэтинил-пиридин-2-ил)-2-окса-6-аза-спиро[3.4]октан-7-он
4,4-диметил-5'-фенилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он
5'-(3-фтор-фенилэтинил)-4,4-диметил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он
5'-(3-хлор-фенилэтинил)-4,4-диметил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он
5'-(5-хлор-пиридин-3-илэтинил)-4,4-диметил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он
5'-(4-фтор-фенилэтинил)-4,4-диметил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он
5'-(2,5-дифтор-фенилэтинил)-4,4-диметил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он
4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)-прирролидин-2-он
2-(5-фенилэтинил-пиримидин-2-ил)-2-аза-спиро[4.4]нонан-3-он
1-[5-(3-фтор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-прирролидин-2-он
1-[5-(3-хлор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-прирролидин-2-он
1-[5-(4-фтор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-прирролидин-2-он
1-[5-(2,5-дифтор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-прирролидин-2-он
(RS)-3-метокси-4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)-прирролидин-2-он
(5R или 5S)-5-метоксиметил-3-(5-фенилэтинил-пиримидин-2-ил)-оксазолидин-2-он
(5S или 5R)-5-метоксиметил-3-(5-фенилэтинил-пиримидин-2-ил)-оксазолидин-2-он
(RS)-1-[5-(3-фтор-фенилэтинил)-пиримидин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он
(R или S)-1-[5-(3-фтор-фенилэтинил)-пиримидин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он
(S или R)-1-[5-(3-фтор-фенилэтинил)-пиримидин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он
(R или S)-1-[5-(2,5-дифтор-фенилэтинил)-пиримидин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он
4,4-диметил-1-(6-(фенилэтинил)пиридазин-3-ил)прирролидин-2-он
4,4-диметил-1-(5-(пиридин-3-илэтинил)пиразин-2-ил)прирролидин-2-он.
Еще одним вариантом осуществления настоящего изобретения является соединение формулы

в которой
U - это =N- или =C(R5)-;
V - это -CH= или -N=;
W - это =CH- или =N-;
при условии, что только одна из групп U, V или W может являться атомом азота.
R5 - это водород, метил или галоген;
R6 - это водород или низший алкил;
R1 - это фенил или гетероарил, которые могут содержать один или два заместителя, выбранных из галогена, низшего алкила или низшей алкокси-группы;
R2/R2' независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, C3-C6-циклоалкил, CH2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил или кольцо, включающее CH2OCH2-;
R3/R3' независимо друг от друга представляют собой водород, низший алкил, CH2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил;
или R3 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять C3-6-циклоалкил или кольцо, включающее (CH2)2OCH2-;
или R6 и R2 могут составлять совместно с атомом углерода и атомом азота, к которому они присоединены, C3-6-циклоалкил;
или фармацевтически приемлемая соль, образованная добавлением кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или его стереоизомер.
Примерами соединений формулы I-C1 являются следующие:
4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-имидазолидин-2-он
3,4,4-триметил-1-(5-фенилэтинил-пиридин-2-ил)-имидазолидин-2-он
3-этил-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-имидазолидин-2-он
3-изопропил-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-имидазолидин-2-он
1-метил-3-(5-фенилэтинил-пиридин-2-ил)-1,3-диаза-спиро[4.4]нонан-2-он
(RS)-4-циклопентил-3-метил-1-(5-фенилэтинил-пиридин-2-ил)-имидазолидин-2-он
3,4,4-триметил-1-(5-пиридин-3-илэтинил-пиридин-2-ил)-имидазолидин-2-он
1-[5-(5-фтор-пиридин-3-илэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
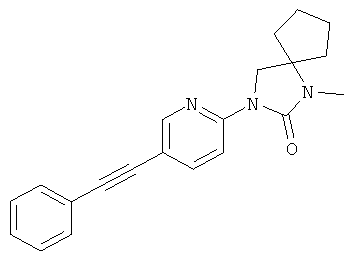
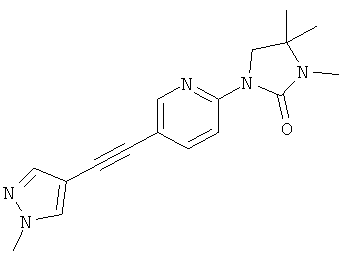
3,4,4-триметил-1-[5-(1-метил-1Н-пиразол-4-илэтинил)-пиридин-2-ил]-имидазолидин-2-он
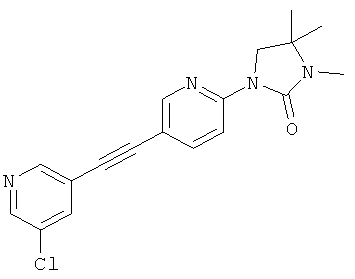
1-[5-(5-хлор-пиридин-3-илэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
3,4,4-триметил-1-(5-пиридазин-4-илэтинил-пиридин-2-ил)-имидазолидин-2-он
1-[5-(3-фтор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
1-[5-(3-хлор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
3,4,4-триметил-1-(5-пиримидин-5-илэтинил-пиридин-2-ил)-имидазолидин-2-он
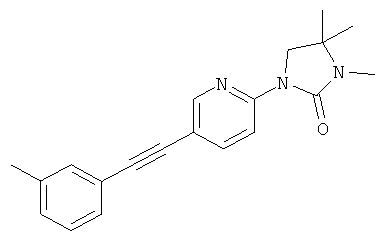
3,4,4-триметил-1-(5-м-толилэтинил-пиридин-2-ил)-имидазолидин-2-он
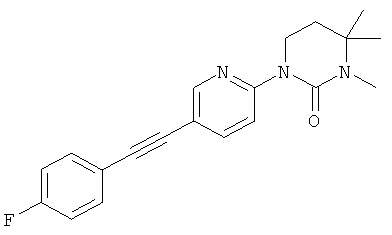
1-[5-(4-фтор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
(RS)-2-(5-фенилэтинил-пиридин-2-ил)-гексагидро-имидазо[1,5-а]пиридин-3-он
(RS)-2-(5-пиридин-3-илэтинил-пиридин-2-ил)-гексагидро-имидазо[1,5-а]пиридин-3-он
(RS)-2-[5-(3-фтор-фенилэтинил)-пиридин-2-ил]-гексагидро-имидазо[1,5-а]пиридин-3-он
(RS)-4-циклопропил-3-метил-1-(5-фенилэтинил-пиридин-2-ил)-имидазолидин-2-он
(3aSR7aRS)-(3aRS,7RS)-1-метил-3-(5-фенилэтинил-пиридин-2-ил)-октагидро-бензоимидазол-2-он
(3aSR,7aRS)-(3aRS,7RS)-1-метил-3-(5-пиридин-3-илэтинил-пиридин-2-ил)-октагидро-бензоимидазол-2-он
(3aSR,7aRS)-(3aRS,7RS)-1-[5-(5-фтор-пиридин-3-илэтинил)-пиридин-2-ил]-3-метил-октагидро-бензоимидазол-2-он
4-метил-6-(5-фенилэтинил-пиридин-2-ил)-4,6-диаза-спиро[2.4]гептан-5-он
(3aSR,7aRS)-(3aRS,7RS)-1-этил-3-(5-фенилэтинил-пиридин-2-ил)-октагидро-бензоимидазол-2-он
(3aSR,7aRS)-(3aRS,7RS)-1-этил-3-(5-пиридин-3-илэтинил-пиридин-2-ил)-октагидро-бензоимидазол-2-он
(3aSR,7aRS)-(3aRS,7RS)-1-изопропил-3-(5-фенилэтинил-пиридин-2-ил)-октагидро-бензоимидазол-2-он
(3aRS,6aSR)-1-метил-3-(5-(фенилэтинил)пиридин-2-ил)гексагидроциклопента[d]имидазол-2(1Н)-он
(RS)-4-трет-бутил-3-метил-1-(5-фенилэтинил-пиридин-2-ил)-имидазолидин-2-он
1-[5-(3-фтор-фенилэтинил)-3-метил-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
(3aSR,6aRS)-1-[5-(3-фтор-фенилэтинил)-пиридин-2-ил]-3-метил-гексагидро-циклопента-имидазол-2-он
1-[3-фтор-5-(4-фтор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
1-[3-фтор-5-(3-фтор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
6-[5-(4-фтор-фенилэтинил)-пиридин-2-ил]-4-метил-4,6-диаза-спиро[2.4]гептан-5-он
6-[5-(3-фтор-фенилэтинил)-пиридин-2-ил]-4-метил-4,6-диаза-спиро[2.4]гептан-5-он
3,4,4-триметил-1-(5-фенилэтинил-пиримидин-2-ил)-имидазолидин-2-он
1-[5-(3-фтор-фенилэтинил)-пиримидин-2-ил]-3,4,4-триметил-имидазолидин-2-он
1-[5-(2,5-дифтор-фенилэтинил)-пиримидин-2-ил]-3,4,4-триметил-имидазолидин-2-он
1-[5-(4-фтор-фенилэтинил)-пиримидин-2-ил]-3,4,4-триметил-имидазолидин-2-он
1-[5-(3,4-ди-фтор-фенилэтинил)-пиримидин-2-ил]-3,4,4-триметил-имидазолидин-2-он
3-изопропил-4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)-имидазолидин-2-он
1-[5-(3-фтор-фенилэтинил)-пиримидин-2-ил]-3-изопропил-4,4-диметил-имидазолидин-2-он
1-[5-(4-фтор-фенилэтинил)-пиримидин-2-ил]-3-изопропил-4,4-диметил-имидазолидин-2-он
1-[5-(4-фтор-фенилэтинил)-пиримидин-2-ил]-3-этил-4,4-диметил-имидазолидин-2-он
1-[5-(3-фтор-фенилэтинил)-пиримидин-2-ил]-3-этил-4,4-диметил-имидазолидин-2-он
4-метил-6-(5-фенилэтинил-пиримидин-2-ил)-4,6-диаза-спиро[2.4]гептан-5-он
3,4,4-триметил-1-(6-(м-толилэтинил)пиридазин-3-ил)имидазолидин-2-он
1-(6-((3-хлорфенил)этинил)пиридазин-3-ил)-3,4,4-триметилимидазолидин-2-он
3,4,4-триметил-1-(5-(фенилэтинил)пиразин-2-ил)имидазолидин-2-он
3,4,4-триметил-1-(5-(пиридин-3-илэтинил)пиразин-2-ил)имидазолидин-2-он
1-(5-((3-фторфенил)этинил)пиразин-2-ил)-3,4,4-триметилимидазолидин-2-он
1-(5-((4-фторфенил)этинил)пиразин-2-ил)-3,4,4-триметилимидазолидин-2-он
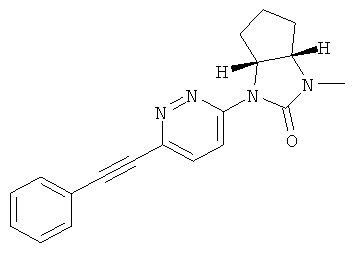
(3aRS,6aSR)-1-метил-3-(6-фенилэтинил-пиридазин-3-ил)-гексагидро-циклопентаимидазол-2-он или
(3aSR,6aRS)-1-[6-(3-фтор-фенилэтинил)-пиридазин-3-ил]-3-метил-гексагидро-циклопентаимидазол-2-он.
Еще одним вариантом осуществления настоящего изобретения является соединение формулы

в которой U - это =N- или =C(R5)-;
V - это -CH= или -N=;
W - это =CH- или =N-;
при условии, что только одна из групп U, V или W может являться атомом азота.
R5 это водород, метил или галоген;
R1 - это фенил или гетероарил, которые могут содержать один или два заместителя, выбранных из галогена, низшего алкила или низшей алкокси-группы;
R2/R2' независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, C3-C6-циклоалкил, CH2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил или кольцо, включающее CH2OCH2-;
R3/R3' независимо друг от друга представляют собой водород, низший алкил, CH2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C7-циклоалкил;
или R3 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять C3-6-циклоалкил или кольцо, включающее (CH2)2OCH2-;
R4/R4' независимо друг от друга представляют собой водород, низший алкил, CH2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил;
R4 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять C3-6-циклоалкил;
или фармацевтически приемлемая соль, образованная добавлением кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или его стереоизомер.
Примерами соединений формулы I-D1 являются следующие:
5,5-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
6,6-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
6,6-диметил-3-(5-пиридин-3-илэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
3-[5-(5-фтор-пиридин-3-илэтинил)-пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он
3-[5-(5-хлор-пиридин-3-илэтинил)-пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он
3-[5-(3-фтор-фенилэтинил)-пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он
3-[5-(3-хлор-фенилэтинил)-пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он
6,6-диметил-3-(5-м-толилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
3-[5-(4-фтор-фенилэтинил)-пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он
3-[5-(3,4-дифтор-фенилэтинил)-пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он
3-[5-(2,5-дифтор-фенилэтинил)-пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он
7,7-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазепан-2-он
(RS)-5-гидрокси-6,6-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
(4aRS,7aSR)-3-(5-фенилэтинил-пиридин-2-ил)-гексагидро-циклопента[е][1,3]оксазин-2-он
(4aRS,7aRS)-3-(5-фенилэтинил-пиридин-2-ил)-гексагидро-циклопента[е][1,3]оксазин-2-он
(RS)-5,6,6-триметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
(RS)-6-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
(RS)-5-метокси-6,6-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
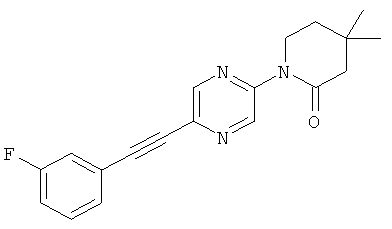
(RS)-5,6,6-триметил-3-(5-фенилэтинил-пиримидин-2-ил)-[1,3]оксазинан-2-он
(RS)-3-[5-(2,5-дифтор-фенилэтинил)-пиримидин-2-ил]-5,6,6-триметил-[1,3]оксазинан-2-он
(RS)-3-[5-(3-фтор-фенилэтинил)-пиримидин-2-ил]-5,6,6-триметил-[1,3]оксазинан-2-он
(RS)-3-[5-(4-фтор-фенилэтинил)-пиримидин-2-ил]-5,6,6-триметил-[1,3]оксазинан-2-он
6,6-диметил-3-(6-(фенилэтинил)пиридазин-3-ил)-1,3-оксазинан-2-он
6,6-диметил-3-(5-(фенилэтинил)пиразин-2-ил)-1,3-оксазинан-2-он
(RS)-3-[5-(3-фтор-фенилэтинил)-пиридин-2-ил]-5-метокси-6,6-диметил-[1,3]оксазинан-2-он.
Еще одним вариантом осуществления настоящего изобретения является соединение формулы

в которой
U - это =N- или =C(R5)-;
V - это -CH= или -N=;
W - это =CH- или =N-;
при условии, что только одна из групп U, V или W может являться атомом азота.
R5 - это водород, метил или галоген;
R7/R7' независимо друг от друга представляют собой водород, гидрокси-группу, низший алкил или низшую алкокси-группу;
R1 - это фенил или гетероарил, которые могут содержать один или два заместителя, выбранных из галогена, низшего алкила или низшей алкокси-группы;
R2/R2' независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, C3-C6-циклоалкил, CH2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил или кольцо, включающее CH2OCH2-;
R3/R3' независимо друг от друга представляют собой водород, низший алкил, CH2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил;
или R3 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять C3-6-циклоалкил или кольцо, включающее (CH2)2OCH2-;
R4/R4' независимо друг от друга представляют собой водород, низший алкил, CH2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил;
R4 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять C3-6-циклоалкил;
или фармацевтически приемлемая соль, образованная добавлением
кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или его стереоизомер.
В частности, примерами соединений формулы I-Е1 являются следующие:
5,5-диметил-5'-фенилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он
5'-(3-фтор-фенилэтинил)-5,5-диметил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он
5,5-диметил-1-(5-фенилэтинил-пиримидин-2-ил)-пиперидин-2-он
4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)-пиперидин-2-он
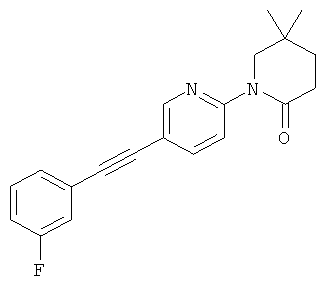
1-[5-(3-фтор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-пиперидин-2-он
1-[5-(2,5-дифтор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-пиперидин-2-он
4,4-диметил-1-(6-(фенилэтинил)пиридазин-3-ил)пиперидин-2-он
1-(5-((3-фторфенил)этинил)пиразин-2-ил)-4,4-диметилпиперидин-2-он
4,4-диметил-1-(5-(пиридин-3-илэтинил)пиразин-2-ил)пиперидин-2-он или
4,4-диметил-1-(5-(фенилэтинил)пиразин-2-ил)пиперидин-2-он.
Еще одним вариантом осуществления настоящего изобретения является соединение формулы

в которой U - это =N- или =C(R5)-;
V - это -CH= или -N=;
W - это =CH- или =N-;
при условии, что только одна из групп U, V или W может являться атомом азота.
R5 - это водород, метил или галоген;
R6 - это водород или низший алкил;
R1 - это фенил или гетероарил, которые могут содержать один или два заместителя, выбранных из галогена, низшего алкила или низшей алкокси-группы;
R2/R2' независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, C3-C6-циклоалкил, CH2-низшую алкокси-группу, или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил или кольцо, включающее CH2OCH2-;
R3/R3' независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил;
или R3 и R2 могут совместно с атомом углерода, к которому они
присоединены, составлять С3-6-циклоалкил или кольцо, включающее (CH2)2OCH2-;
R4/R4' независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил;
R4 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять C3-6-циклоалкил;
или фармацевтически приемлемая соль, образованная добавлением кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или его стереоизомер.
Примерами соединений формулы I-F1 являются следующие:
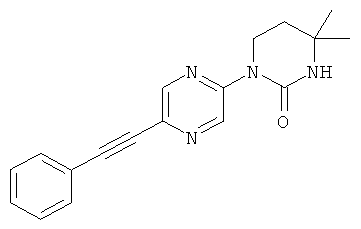
5,5-диметил-1-(5-фенилэтинил-пиридин-2-ил)-тетрагидро-пиримидин-2-он
1,5,5-триметил-3-(5-фенилэтинил-пиридин-2-ил)-тетрагидро-пиримидин-2-он
3,4,4-триметил-1-(5-фенилэтинил-пиридин-2-ил)-тетрагидро-пиримидин-2-он
1-[5-(2,5-дифтор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-тетрагидро-пиримидин-2-он
1-[5-(4-фтор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-тетрагидро-пиримидин-2-он
3,4,4-триметил-5'-фенилэтинил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-он
5'-(3-фтор-фенилэтинил)-3,4,4-триметил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-он
5'-(2,5-дифтор-фенилэтинил)-3,4,4-триметил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-он
4,4-диметил-1-(5-(фенилэтинил)пиразин-2-ил)тетрагидропиримидин-2(1Н)-он
3,4,4-триметил-1-(5-(фенилэтинил)пиразин-2-ил)тетрагидропиримидин-2(1Н)-он
1-(5-((3-фторфенил)этинил)пиразин-2-ил)-4,4-диметилтетрагидропиримидин-2(1Н)-он или
1-(5-((3-фторфенил)этинил)пиразин-2-ил)-3,4,4-триметилтетрагидропиримидин-2(1Н)-он.
Еще одним вариантом осуществления настоящего изобретения является соединение формулы

в которой
U - это =N- или =C(R5)-;
V - это -СН= или -N=;
W - это =СН- или =N-;
при условии, что только одна из групп U, V или W может являться атомом азота.
R5 - это водород, метил или галоген;
Y - это -N(R6)-, -O-, -C(R7')R7)-, -СН2О- или -CH2S(O)2-;
причем R6 - это водород или низший алкил, a R7/R7' независимо друг от друга представляют собой водород, гидрокси-группу, низший алкил или низшую алкокси-группу;
R1 - это фенил или гетероарил, которые могут содержать один или два заместителя, выбранных из галогена, низшего алкила или низшей алкокси-группы;
R2/R2' независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, C3-C6-циклоалкил, СН2-низшую алкокси-группу, или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил или кольцо, включающее CH2OCH2-;
или R6 и R2 могут составлять совместно с атомом углерода и атомом азота, к которому они присоединены, C3-6-циклоалкил;
или R2 и R7 могут составлять совместно с атомом углерода, к которому они присоединены, C3-6-циклоалкил;
или фармацевтически приемлемая соль, образованная добавлением кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или его стереоизомер.
Примерами соединений формулы I-G1 являются следующие:
(1RS,5SR)-6-(5-фенилэтинил-пиридин-2-ил)-6-аза-бицикло[3.2.0]гептан-7-он
3,3-диметил-1-(5-фенилэтинил-пиридин-2-ил)-азетидин-2-он или
(1RS,5SR)-6-(5-пиридин-3-илэтинил-пиридин-2-ил)-6-аза-бицикло[3.2.0]гептан-7-он.
Еще одним объектом настоящего изобретения является соединение
формулы I, в которых Y - это -CH2O-, например:
(RS)-6-метил-4-(5-фенилэтинил-пиридин-2-ил)-морфолин-3-он или
6,6-диметил-4-(5-фенилэтинил-пиридин-2-ил)-морфолин-3-он.
Еще одним объектом настоящего изобретения является соединение
формулы I, в котором Y- это -CH2S(O)2-, например:
1,1 -диоксо-4-(5-фенилэтинил-пиридин-2-ил)-тиоморфолин-3-он Еще одним объектом настоящего изобретения является соединение
формулы I, в которых m равно 2, например:
7,7-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазепан-2-он.
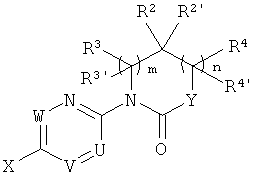
Одним из объектов настоящего изобретения является производное этинила формулы I

в которой
Х - это N или C-R5,
где R5 - это водород или галоген;
Y - это N-R6, О или CHR7,
где R6 - это водород или низший алкил, а R7 - это водород, гидрокси-группа, низший алкил или низшая алкокси-группа;
R1 - это фенил или гетероарил, которые могут в качестве заместителя содержать галоген, низший алкил или низшую алкокси-группу;
R2/R2' независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил;
m равно 0 или 1; в случае если m равно 1,
R3'/R3 независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил;
n равно 0 или 1; в случае если n равно 1,
R4/R4' независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять C3-C6-циклоалкил;
если m равно 1 и n равно 0, R3 и R2 могут составлять совместно с атомом углерода, к которому они присоединены, С3-6-циклоалкил;
если m равно 0 и n равно 1, R4 и R2 могут составлять совместно с атомом углерода, к которому они присоединены, С3-6-циклоалкил;
или фармацевтически приемлемая соль, образованная добавлением кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или его стереоизомер.
Получение соединений формулы I по настоящему изобретению можно осуществлять последовательными или сходящимися путями синтеза. Синтезы соединений по настоящему изобретению показаны в нижеследующих схемах 1-3. Навыки, необходимые для проведения реакций и очистки конечных продуктов, доступны специалистам в данной области техники. Заместители и индексы, использованные в нижеследующем описании способов получения, имеют значение, раскрытое выше.
Соединения формулы I можно получить способами, представленными ниже, способами, раскрытыми в примерах, или аналогичными им. Подходящие условия проведения реакции для индивидуальных стадий синтеза известны специалистам в данной области техники. Последовательность реакций не ограничивается приведенной в схемах, при этом, в зависимости от исходных веществ и их относительной реакционной способности, последовательность стадий можно свободно изменять. Исходные вещества могут быть коммерчески доступными или могут быть получены способами, аналогичными тем, которые приведены ниже, способами, раскрытыми в источниках, ссылки на которые даны в настоящем описании, или в примерах, или способами, известными в данной области техники.
Описываемые соединения формулы I и их фармацевтически приемлемые соли можно получать способами, известными в данной области техники, например способом, описанным ниже, который включает реакцию соединения формулы
в которой X - это «хорошая» уходящая группа, которую можно заместить ацетиленовой группой, - например, атом брома или иода, триалкилстаннильная группа, бороновая кислота или эфирная группа бороновой кислоты
с подходящим арилацетиленом формулы

с получением соединения формулы

в котором заместители описаны выше,
или, по желанию, превращение полученного соединения в его фармацевтически приемлемую соль, образованную добавлением кислоты.
Получение соединений формулы 1 раскрыто далее более детально в схемах 1-6 и в Примерах 1-174.
Схема 1

Соединение этинил-пиридина, этинил-пиримидина, этинил-пиразина или этинил-пиридазина формулы I-А можно получить путем замещения подходящего 5-иод-2-фтор-пиридина, 5-иод-2-фтор-пиримидина, 2-хлор-5-иодпиридазина или 2-бром-5-иодпиразина 1 и т.п. и в подходящем аминоспирте 2 с помощью основания, такого как пиридин, триэтиламин или карбонат цезия в растворителе, таком как NMP, пиридин или диоксан с получением соответствующего 5-иод-2-аминоалкокси-аддуктов формулы 3, которые обрабатывают фосгеном или эквивалентом фосгена, таким как трифосген, в присутствии основания, такого как пиридин, в растворителе, таком как дихлорметан, с получением соответствующего циклизованного производного уретана или мочевины 4. Связывание по Соногашира иод-гетероарильного производного 4 с соответствующим образом замещенным арилацетиленом 5 дает целевое этинильное соединение общей формулы I-A или I-D (Схема 1).
Схема 2

Соединение этинил-пиридина, этинил-пиримидина, этинил-пиразина или этинил-пиридазина формулы 1-В можно получить введением подходящего производного 5-иод-2-амино-пиридина или 5-иод-2-амино-пиримидина, 5-иод-2-амино-пиразина или 5-иод-2-амино-пиридазина 6 и т.п. в реакцию с подходящим замещенным ангидридом 7 в растворителе, таком как DMF, с получением соответствующего имидного производного 8, который восстанавливают с помощью восстанавливающего агента, например с помощью борогидрида натрия, в растворителе, таком как THF и/или МеОН, с получением соответствующего спиртового производного 9. Реакция вещества 9 с ангидридом трифторуксусной кислоты в растворителе, таком как дихлорметан, с последующим восстановлением с помощью триэтилсилана в растворителе, таком как TFA, приводит к целевому амиду 10. Связывание по Соногашира амид 10 с подходящим замещенным арилацетиленом 5 приводит к целевому этинильному соединению формулы I-В или I-Е (Схема 2).
Схема 3

Этинил-пиридиновое, этинил-пиримидиновое, этинил-пиразиновое или этинил-пиридазиновое соединение формулы I-С можно получить путем замещения подходящего 5-иод-2-фтор-пиридина, 5-иод-2-фтор-пиримидина, 2-хлор-5-иодпиридазина или 2-бром-5-иодпиразина 1 и т.п. (1), в которых Y - это «хорошая» уходящая группа, которую можно заместить в ходе нуклеофильного замещения на амин, - например атом фтора, хлора или брома или алкилсульфонильная группа, с помощью подходящего производного диаминоалкила 11 в присутствии основания, такого как пиридин или карбонат цезия, в растворителе, таком как NMP, пиридин или диоксан, с получением соответствующего N-гетероарил производного 12, которое циклизуют с помощью фосгена или эквивалента фосгена в присутствии основания, такого как пиридин или триэтиламин, в растворителе, таком как дихлорметан или THF, с получением соответствующего производного мочевины 13, которое далее соединяют с подходящим замещенным арилацетиленом 5 с получением целевого этинильного соединения формулы I-C или I-F (Схема 3).
Схема 4

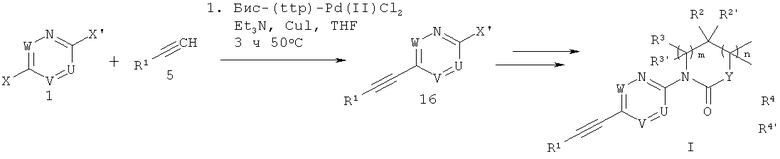
Соединение этинил-пиридина или этинил-пиримидина формулы 1 можно получить, например, путем связывания по Соногашира 2-бром-6-иод-пиридина, 2-бром-5-иод-пиримидина, 2-бром-5-иодпиридазина или 2-бром-5-иодпиразина 1 и т.п. с этинилтриметилсиланом 15 с получением гетероарильного 2-бром-5-триметилсиланилэтинил-замещенного производного 16. Замещение соединения 16 с помощью подходящего лактама, циклического карбамата или циклического производного мочевины 17 в присутствии основания, например карбоната цезия, или с помощью ксантофоса и Pd2(dba)3 в растворителе, например в толуле, приводит к соответствующему производному 5-триметилсиланилэтинила 18. Связывание по Соногашира совместно с in-situ удалением силильной группы 18 в присутствии фторида и подходящего замещенного арил-галогенида 19 дает целевое арилэтинильное соединение формулы I (Схема 4).
Схема 5

Арилэтинильное соединение формулы 1 можно получить путем связывания по Соногашира 5-бром- или 5-иод-гетероарильного производного 4, 10 или 13 (в которых Y=Br, I) с этинилтриметилсиланом 15 с получением соответствующего 5-триметилсиланилэтинильного производного 18. Связывание по Соногашира совместно с in-situ удалением силильной группы соединения 18 и подходящего замещенного арил-галогенида 19 дает целевое этинил-пиридиновое или этинил-пиримидиновое соединение формулы I (Схема 5).
В целом, последовательность стадий, используемых для синтеза соединений формулы I в каждом конкретном случае также можно модифицировать - например, сначала проводить связывание по Соногашира с подходящим замещенным арильным или гетероарилэтинильным производным с последующим введением лактама, циклического карбамата или циклической мочевины, используя способы, аналогичные описанным в схемах 1-4 (Схема 6).
Схема 6
Соединение формулы I, раскрытое в настоящем описании, а также его фармацевтически приемлемую соль применяют для лечения или профилактики психоза, эпилепсии, шизофрении, болезни Альцгеймера, когнитивных расстройств и нарушений памяти, хронической и острой боли, ограниченной мозговой функции, обусловленной операциями с отключением или трансплантантами, недостаточного кровоснабжения мозга, травм позвоночника, черепно-мозговых травм, гипоксии при беременности, остановки сердца и гипогликемии, ишемии, хореи Гентингтона, амиотрофического бокового склероза (ALS), слабоумия, вызванного СПИДом, глазных травм, ретнопатии, идиопатического паркинсонизма или медикаментозного паркинсонизма, мышечных спазмов, конвульсий, мигрени, недержания мочи, гастроэнтерального рефлюкса, повреждения или недостаточности печени, вызванных как приемом медикаментов, так и болезнью, синдрома фрагильной X-хромосомы, синдрома Дауна, аутизма, никотиновой зависимости, опиатной зависимости, тревожности, рвоты, дискинезии, расстройств приема пищи, в частности, булимии или нервной анорексии, и депрессии, в частности, для лечения и профилактики острых и/или хронических неврологических нарушений, тревожности, для лечения хронической и острой боли, недержания мочи и тучности.
Предпочтительными показаниями к применению являются шизофрения и когнитивные расстройства.
Настоящее изобретение относится также к применению соединения формулы I, раскрытого в данном описании, а также его фармацевтически приемлемой соли, в изготовлении лекарства, предпочтительно для лечения и предотвращения указанных выше расстройств.
Биологический анализ и полученные данные:
Анализ внутриклеточной мобилизации Са2+
Была получена моноклональная клеточная линия НЕК-293, стабильно трансфецированная с помощью кДНК, кодирующей человеческий рецептор mGlu5a; для экспериментов с позитивными аллостерическими модуляторами mGlu5 (PAMs) была выбрана клеточная линия с низким уровнем экспрессии рецептора и низкой конститутивной активностью рецептора, чтобы осуществить дифференциацию агонистической активности, а не активности РАМ. Клетки выращивали согласно стандартным методикам (Freshney, 2000) в среде Игла, модифицированной Дульбекко, с высоким содержанием глюкозы, с добавлением 1 мМ глютамина, 10% (об/об) инактивированной нагреванием сыворотки крови плодов коровы, пенициллина/стрептомицина, 50 мкг/мл гигромицина и 15 мкг/мл бластицидина (все реагенты для культивирования клеток и антибиотики производства Invitrogen, Базель, Швейцария).
Примерно за 24 ч до эксперимента 5×104 клеток/лунку высевали на черных 96-луночных планшетах с прозрачным дном, покрытых поли-O-лизином. Клетки нагружали с помощью 2,5 мкм Fluo-4AM в нагружающем буфере (IxHBSS, 20 мМ HEPES) в течение 1 ч при 37°С и промывали пять раз нагружающим буфером. Клетки перемещали в систему Functional Drug Screening System 7000 (Hamamatsu, Париж, Франция), добавляли 11 полулогарифмических серийных разведении тестируемых соединений при 37°С, и клетки инкубировали в течение 10-30 мин, осуществляя запись флюоресценции в режиме он-лайн. По окончании этой стадии преинкубации к клеткам добавляли агонист L-глутамата в концентрации, соответствующей EC20 (как правило, около 80 мкм), осуществляя запись флюоресценции в режиме он-лайн. Для того чтобы объяснить ежедневные вариации в реактивности клеток, величину EC20 глутамата определяли непосредственно перед каждым экспериментом путем записи полной кривой зависимости «доза-отклик» для глутамата.
Отклик определяли как разницу между пиковой и базальной флюоресценцией (т.е. флюоресценцией без добавления L-глутамата), нормализованную к максимальному стимулирующему эффекту, полученному при насыщающих концентрациях L-глутамата. Графики строили в процентах от максимальной стимуляции с помощью программы XLfit, предназначенной для построения кривых, которая итеративно отображает данные по алгоритму Левенберга-Марквардта. Использовали уравнение для односайтового конкурентного анализа: y=A+((B-A)/(1+((x/C)D))), где y - это процент от максимального стимулирующего эффекта, A - минимальное значение у, В -максимальное значение у, C - EC50, x - log 10 концентрации конкурирующего вещества и D - наклон кривой (коэффициент Хилла). По этой кривой были рассчитаны EC50 (концентрация, при которой достигается половина от максимальной стимуляции) и коэффициент Хилла как максимальный отклик в процентах от максимального стимулирующего эффекта, полученного при насыщающих концентрациях L-глутамата.
Положительные сигналы, полученные в течение преинкубации с тестовыми РАМ-соединениями (т.е. перед внесением L-глутамата в концентрации EC20), являлись индикатором агонистической активности; отсутствие таких сигналов свидетельствовало об отсутствии агонистической активности. Подавление сигнала, наблюдаемое после добавления EC20-концентрации L-глутамата, указывало на ингибиторную активность тестируемого соединения.
В нижеследующем списке примеров приведены соответствующие результаты для соединений, имеющих EC50<300 моль.
Соединения формулы (I) и его фармацевтически приемлемые соли можно применять в качестве лекарственных средств, например в форме лекарственных препаратов. Фармацевтические препараты можно вводить орально, например в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Кроме того, введение можно проводить ректально, например в форме суппозиториев, или парэнтерально, например в форме растворов для инъекций.
Соединения формулы (I) и их фармацевтически приемлемые соли можно процессировать с фармацевтически инертными, неорганическими или органическими наполнителями для производства фармацевтических препаратов. Можно использовать, например, лактозу, кукурузный крахмал или их производные, тальк, стеариновую кислоту или ее соли и т.п., в качестве подобных наполнителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Подходящими наполнителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п.; при этом, в зависимости от природы действующего вещества, в случае мягких желатиновых капсул наполнитель, как правило, не требуется. Подходящими наполнителями для изготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар, глюкоза и т.п. В случае водных растворов для инъекции, приготовленных из растворимых воде солей соединений формулы (I), можно использовать адъюванты, такие как спирты, полиолы, глицерин, растительные масла и т.п., но, как правило, в них нет необходимости. Подходящими наполнителями для суппозиториев являются, например, природные или отвержденные жиры, воски, жиры, полужидкие или жидкие полиолы и т.п.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать дополнительные терапевтически значимые вещества.
Как упоминалось ранее, лекарственные средства, содержащие соединение формулы (I) или его фармацевтически приемлемую соль и терапевтически инертный наполнитель, также являются объектом настоящего изобретение, равно как и способ изготовления таких лекарственных средств, который включает приведение одного или более соединений формулы I или их фармацевтически приемлемых солей и, по желанию, одного или более иных терапевтически значимых веществ к галеновой дозированной форме совместно с одним или более терапевтически инертными носителями.
Кроме того, как упоминалось ранее, применение соединений формулы (I) для изготовления лекарственных средств, эффективных для профилактики и/или лечения перечисленных выше заболеваний, также является объектом настоящего изобретения.
Дозировку можно варьировать в широких пределах, и ее подбирают, разумеется, с учетом индивидуальных требований в каждом конкретном случае. В целом, эффективная доза для орального или парентерального введения находится в диапазоне 0,01-20 мг/кг/в сутки, при этом доза 0,1-10 мг/ кг/в сутки предпочтительна для всех описанных выше показаний к применению. Суточная доза для взрослого человека весом 70 кг, соответственно, лежит в диапазоне 0,7-1400 мг в сутки, предпочтительно между 7 и 700 мг в сутки.
Изготовление фармацевтических композиций, включающих соединения по изобретению:
Таблетки следующего состава изготавливают обычным способом:
мг/на таблетку
Список Примеров:


 или
или 
 или
или 



























 или
или 
 или
или 














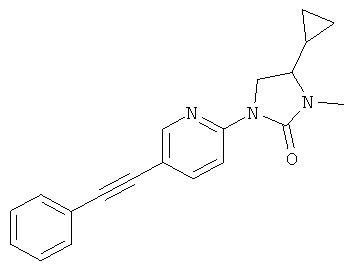











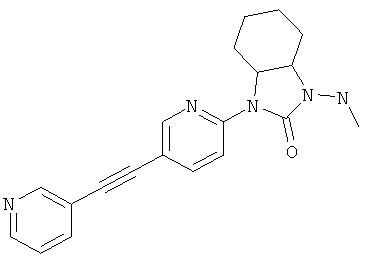
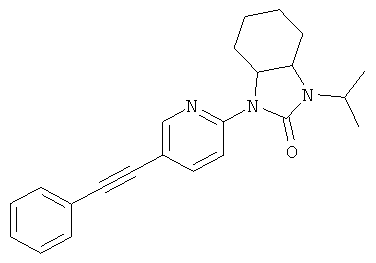

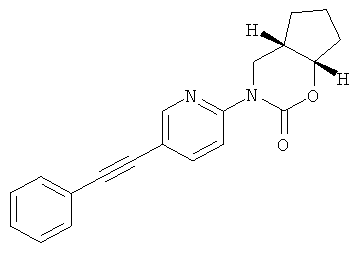




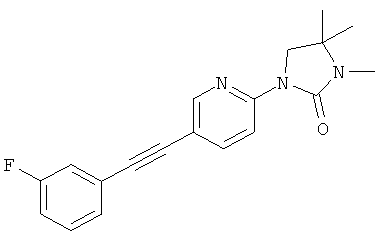



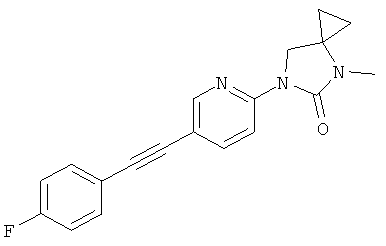
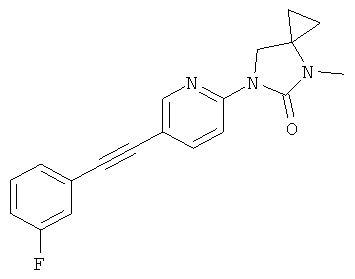



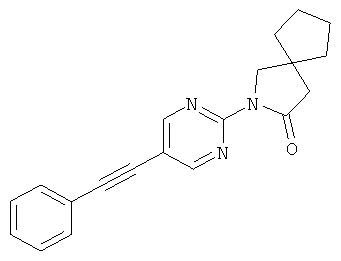



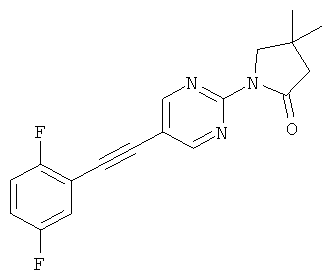

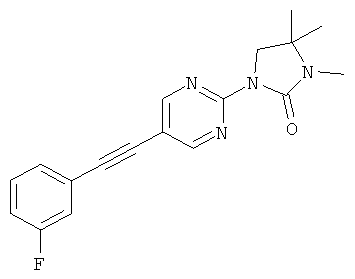




 или
или 
 или
или 
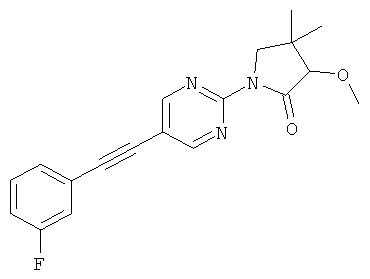
 или
или 
 или
или 
 или
или 
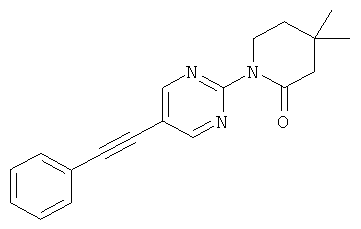



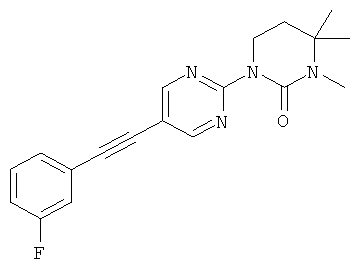




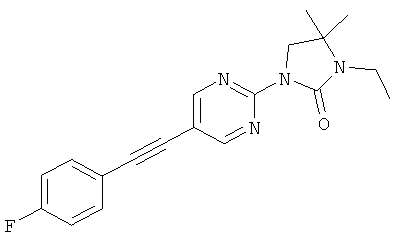

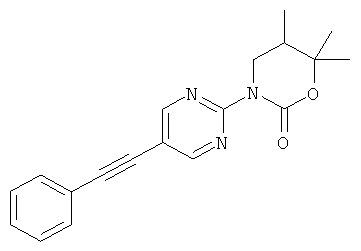





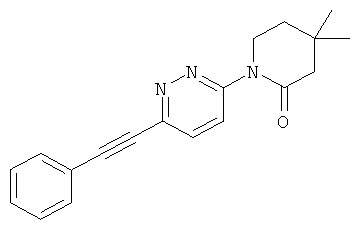
















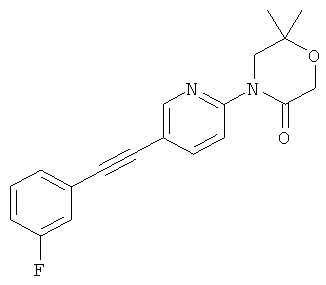


Экспериментальная часть:
Пример 1
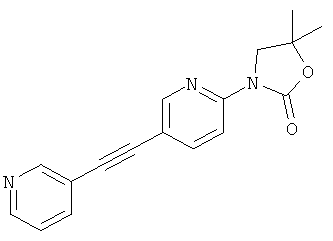
3-(3-Фтор-5-фенилэтинил-пиридин-2-ил)-5,5-диметил-оксазолидин-2-он
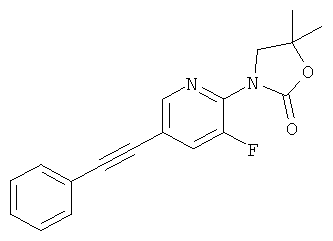
Стадия 1: 1-(3-фтор-5-иод-пиридин-2-иламино)-2-метил-пропан-2-ол

2,3-Дифтор-6-иодпиридин (500 мг, 2,07 ммоль) растворяли в NMP (500 мкл) и добавляли пиридин (201 мкл, 2,49 ммоль, 1,2 эквив.) и 1-амино-2-метилпропан-2-ол (555 мг, 6.22 ммоль, 3 эквив.) при комнатной температуре. Смесь перемешивали в течение 16 ч при 100°С. Реакционную смесь охлаждали и экстрагировали с помощью насыщенного раствора NaHCO3 и затем дважды небольшими объемами дихлорметана. Неочищенный продукт очищали с помощью флэш-хроматографии путем прямого нанесения слоев дихлорметана на колонку с силикагелем, элюировали градиентом этилацетаттептан, от 0:100 до 100:0. Целевое соединение, 1-(3-фтор-5-иодпиридин-2-иламино)-2-метилпропан-2-ол (590 мг, 1,9 ммоль, выход 91,7%) получали в виде бесцветного масла, MS: m/e=311,0 (M+H+).
Стадия 2: 3-(3-фтор-5-иодпиридин-2-ил)-5,5-диметилоксазолидин-2-он

(580 мг, 1,87 ммоль) 1-(3-фтор-5-иодпиридин-2-иламино)-2-метилпропан-2-ола (Пример 1, стадия 1) растворяли в дихлорметане (10 мл) и добавляли пиридин (300 мкл, 3,74 ммоль, 2 эквив.) при комнатной температуре. Смесь охлаждали до 0-5°С и добавляли по каплям фосген (20% в толуоле) (1,19 мл, 2,24 ммоль, 1,2 эквив.) в течение 15 мин при 0-5°С. Смесь перемешивали в течение 1 ч при 0-5°С. Реакционную смесь экстрагировали с помощью насыщенного раствора NaHCO3 и затем дважды небольшими объемами дихлорметана. Неочищенный продукт очищали с помощью флэш-хроматографии путем непосредственного нанесения слоев дихлорметана на колонку с силикагелем, элюировали градиентом гептан:этилацетат от 100:0 до 50:50. Целевое соединение, 3-(3-фтор-5-иодпиридин-2-ил)-5,5-диметилоксазолидин-2-он (500 мг, 1,49 ммоль, выход 79,5%) получали в виде белого твердого вещества, MS: m/e=337,0 (M+H+).
Стадия 3: 3-(3-фтор-5-фенилэтинил-пиридин-2-ил)-5,5-диметил-оксазолидин-2-он

Бис-(трифенилфосфин)-палладий(II)дихлорид (12,5 мг, 17,9 мкмоль, 0,05 эквив.) растворяли в 1 мл DMF. Добавляли 3-(3-фтор-5-иодпиридин-2-ил)-5,5-диметилоксазолидин-2-он (120 мг, 357 мкмоль) (Пример 1, стадия 2) и фенилацетилен (72,9 мг, 78,4 мкл, 714 мкмоль, 2 эквив.) при комнатной температуре. Добавляли триэтиламин (108 мг, 149 мкл, 1,07 ммоль, 3 эквив.), трифенилфосфин (2,81 мг, 10,7 мкмоль, 0,03 эквив.) и иодид меди (I) (2,04 мг, 10,7 мкмоль, 0,03 эквив.) и смесь перемешивали в течение 3 ч при 70°С. Реакционную смесь охлаждали и экстрагировали с помощью насыщенного раствора NaHCO3 и затем дважды небольшими объемами дихлорметана. Неочищенный продукт очищали с помощью флэш-хроматографии путем прямого нанесения слоев дихлорметана на колонку с силикагелем, элюировали градиентом этилацетат: гептан, от 0:100 до 40:60. Целевое соединение, 3-(3-фтор-5-(фенилэтинил)пиридин-2-ил)-5,5-диметилоксазолидин-2-он (96 мг, 309 мкмоль, выход 86,6%) получали в виде желтого твердого вещества, MS: m/e=311,2 (М+Н+).
Пример 2
(5RS)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он

Указанное в заголовке соединение, светло-коричневое твердое вещество, MS: m/e=309,1 (M+H+), получали способом, аналогичным описанному в Примере 1, стадия 3, из 3-(5-бром-пиридин-2-ил)-5-метоксиметил-оксазолидин-2-она (CAS 170011-45-7) и фенилацетилена.
Пример 3
(5R или 5S)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазол идин-2-он
 или
или 
Указанное в заголовке соединение, белые кристаллы, MS: m/e=309,1 (M+H+), получали путем разделения (5RS)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-она (Пример 2) с помощью хиральной колонки (CHIRALPAK AD, в качестве растворителя - гептан:изопропанол 80:20).
Пример 4
(5S или 5R)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазол идин-2-он
 или
или 
Указанное в заголовке соединение, белые кристаллы, MS: m/e=309,1 (M+H+), получали путем разделения (5RS)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-она (Пример 2) с помощью хиральной колонки (CHIRALPAK AD, в качестве растворителя - гептан:изопропанол 80:20).
Пример 5
5,5-Диметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он
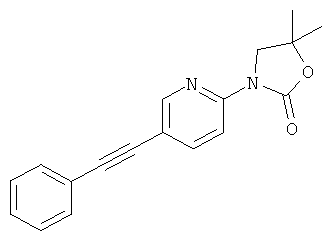
Стадия 1: 3-(5-иод-пиридин-2-ил)-5,5-диметил-оксазолидин-2-он
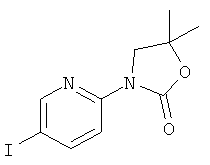
Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=292,9 (M+H+), способами, аналогичными описанным в Примере 1, стадия 1 и стадия 2, из 2-фтор-5-иодпиридина и 1-амино-2-метилпропан-2-ола.
Стадия 2: 5,5-диметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=293,0 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из 3-(5-иод-пиридин-2-ил)-5,5-диметил-оксазолидин-2-она (Пример 5, стадия 1) и фенилацетилена.
Пример 6
3-[5-(3-Фтор-фенилэтинил)-пиридин-2-ил]-5,5-диметил-оксазолидин-2-он
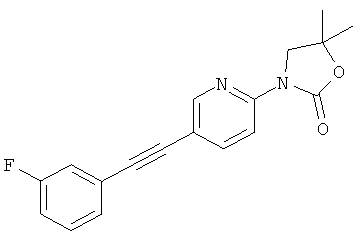
Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=311,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из 3-(5-иод-пиридин-2-ил)-5,5-диметил-оксазолидин-2-она (Пример 5, стадия 1) и 3-фторфенилацетилена.
Пример 7

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=294,1 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из 3-(5-иод-пиридин-2-ил)-5,5-диметил-оксазолидин-2-она (Пример 5, стадия 1) и 3-этинил-пиридина.
Пример 8 (5RS)-5-трет-бутил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он

Стадия 1: (5RS)-5-трет-бутил-3-(5-иод-пиридин-2-ил)-оксазолидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=346,9 (M+H+), способами, аналогичными описанным в Примере 1, стадия 1 и стадия 2, из 2-фтор-5-иодпиридина и (rac)-1-амино-3,3-диметилбутан-2-ол гидрохлорида.
Стадия 2: (5RS)-5-трет-бутил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=321,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (5RS)-5-трет-бутил-3-(5-иод-пиридин-2-ил)-оксазолидин-2-она (Пример 8, стадия 1) и фенилацетилена.
Пример 9
6-(5-Фенилэтинил-пиридин-2-ил)-4-окса-6-аза-спиро[2.4]гептан-5-он

Указанное в заголовке соединение получали в виде бесцветного твердого вещества, MS: m/e=291,2 (М+Н+), способами, аналогичными описанным в Примере 1, исходя из 2-фтор-5-бромпиридина, 1-аминометил-циклопропанола (Russian J. Org. Chem. 2001, 37, 1238) и фенилацетилена.
Пример 10
7-(5-Фенилэтинил-пиридин-2-ил)-5-окса-7-аза-спиро[3.4]октан-6-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=305,2 (M+H+), способами, аналогичными описанным в Примере 1, исходя из 2-фтор-5-бромпиридина, 1-аминометил-циклобутанола (WO 2006/29115 А2) и фенилацетилена.
Пример 11
3-(5-Фенилэтинил-пиридин-2-ил)-1-окса-3-аза-спиро[4.4]нонан-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=319,2 (М+Н+), способами, аналогичными описанным в Примере 1, исходя из 2-фтор-5-бромпиридина, 1-аминометил-циклопентанола и фенилацетилена.
Пример 12
3-(5-Фенилэтинил-пиридин-2-ил)-1-окса-3-аза-спиро[4.5]декан-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=333,2 (M+H+), способами, аналогичными описанным в Примере 1, исходя из 2-фтор-6-бромпиридина, 1-аминометил-циклогексанола и фенилацетилена.
Пример 13
4,4-Диметил-1-(5-фенилэтинил-пиридин-2-ил)-прирролидин-2-он

Стадия 1: 1-(5-иод-пиридин-2-ил)-3,3-диметил-прирролидин-2.5-дион

6-иодпиридин-2-амин (1 г, 4,55 ммоль) растворяли в DMF (5 мл), и добавляли 3,3-диметилдигидрофуран-2,5-диона (1,28 г, 10,0 ммоль, 2,2 эквив.) при комнатной температуре. Смесь перемешивали в течение 3 ч при 150°С. Реакционную смесь выпаривали досуха и наносили непосредственно колонку с силикагелем. Неочищенное вещество очищали с помощью флэш-хроматографии на силикагеле (20 г, градиент этилацетат/гептан, от 0:100 до 100:0). Целевое соединение, 1-(5-иодпиридин-2-ил)-3,3-диметилприрролидин-2,5-дион (1,3 г, 3,94 ммоль, выход 86,6%) получали в виде желтого твердого вещества, MS: m/e=331,0 (M+H+).
Стадия 2: (5RS)-5-гидрокси-1-(5-иод-пиридин-2-ил)-4,4-диметил-прирролидин-2-он

(800 мг, 2,42 ммоль) 1-(5-иодпиридин-2-ил)-3,3-диметилприрролидин-2,5-диона (Пример 13, стадия 1) растворяли в THF (6 мл) и МеОН (2 мл) и охлаждали раствор до 0-5°С. Добавляли NaBH4 (101 мг, 2,67 ммоль, 1,1 эквив.) при 0-5°С и перемешивали смесь в течение 1 ч при 0-5°С. Реакционную смесь экстрагировали насыщенным раствором NaHCO3 и затем дважды небольшими объемами дихлорметана. Неочищенный продукт очищали с помощью флэш-хроматографии путем прямого нанесения слоев дихлорметана на колонку с амино-силикагелем, элюировали градиентом этил ацетат/гептан, от 0:100 до 100:0. Целевое соединение, (5-RS)-5-гидрокси-1-(5-иод-пиридин-2-ил)-4,4-диметил-прирролидин-2-он (370 мг, выход 46%) получали в виде белого твердого вещества, MS: m/e=333,0 (M+H+).
Стадия 3: 1-(5-иод-пиридин-2-ил)-4.4-диметил-прирролидин-2-он

(275 мг, 828 мкмоль) (5RS)-5-гидрокси-1-(5-иодпиридин-2-ил)-4,4-диметилприрролидин-2-она (Пример 13, стадия 2) растворяли в CH2Cl2 (2 мл) и добавляли ангидрид трифторуксусной кислоты (140 мкл, 994 мкмоль, 1,2 эквив.) при комнатной температуре. Смесь перемешивали в течение 1 ч при 20-25°С. Раствор выпаривали досуха, остаток растворяли в трифторуксусной кислоте (957 мкл, 12,4 ммоль, 15 эквив.) и добавляли триэтилсилан (159 мкл, 994 мкмоль, 1,2 эквив.) при комнатной температуре. Смесь перемешивали 1 ч при комнатной температуре. Реакционную смесь выпаривали и экстрагировали насыщенным раствором NaHCO3 и затем дважды небольшими объемами дихлорметана. Неочищенный продукт очищали с помощью флэш-хроматографии путем прямого нанесения слоев дихлорметана на колонку с силикагелем (20 г, градиент этилацетат/гептан, от 0:100 до 100:0). Целевое соединение, 1-(5-иодпиридин-2-ил)-4,4-диметилприрролидин-2-он (209 мг, выход 80%) получали в виде белого твердого вещества, MS: m/e=317,0 (М+Н+).
Стадия 4: 4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-прирролидин-2-он

Указанное в заголовке соединение получали в виде желтого масла, MS: m/e=291,1 (M+H+), таким же образом, как описано в Примере1, стадия 3, из 1-(5-иод-пиридин-2-ил)-4,4-диметил-прирролидин-2-она (Пример 13, стадия 3) и фенилацетилена.
Пример 14
(3RS)-3-Гидрокси-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-прирролидин-2-он

Стадия 1: (4RS)-4-гидрокси-3,3-диметил-дигидро-фуран-2,5-дион
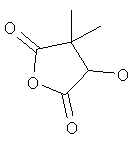
(3RS)-3-Гидрокси-2,2-диметил-янтарную кислоту [Tempahedron Letters (2002), 43(52), 9513-9515] (120 мг, 0,74 ммоль) суспендировали в CH2Cl2 (2 мл) и охлаждали до 0-5°С. Добавляли ангидрид трифторуксусной кислоты (260 мкл, 1,85 ммоль) и перемешивали реакционную смесь 2 ч при комнатной температуре. Реакционную смесь выпаривали досуха и использовали без дополнительной очистки в следующей стадии.
Стадия 2: (4RS)-4-гидрокси-1-(5-иод-пиридин-2-ил)-3,3-диметил-прирролидин-2.5-дион

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=346,8 (М+Н+), аналогично тому, как описано в Примере 12, стадия 1, из 5-иодпиридин-2-амина и (4RS)-4-гидрокси-3,3-диметил-дигидро-фуран-2,5-диона (Пример 14, стадия 1).
Стадия 3: (4RS)-4-(трет-бутил-дифенил-силанилокси)-1-(5-иод-пиридин-2-ил)-3.3-диметил-прирролидин-2.5-дион

(2,4 г, 3,47 ммоль, 50%) (4RS)-4-гидрокси-1-(5-иод-пиридин-2-ил)-3,3-диметил-прирролидин-2,5-диона (Пример 14, стадия 2) растворяли в дихлорметане (20 мл). Добавляли имидазол (520 мг, 7,63 ммоль) и трет-бутилдифенилхлорсилан (1,0 г, 3,64 ммоль) при комнатной температуре и перемешивали смесь в течение 3 ч при комнатной температуре. Добавляли насыщенный раствор NaHCO3 и экстрагировали смесь дихлорметаном. Органические экстракты высушивали над сульфатом натрия, фильтровали и выпаривали. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (градиентом этилацетат/гептан, от 0:100 до 30:70). Целевое соединение получали в виде белого твердого вещества (1,5 г, выход 74%), MS: m/e=585,1 (M+H+).
Стадия 4: (3RS,5RS)-3-(трет-бутил-дифенил-силанилокси)-5-гидрокси-1-(5-иод-пиридин-2-ил)-4.4-диметил-прирролидин-2-он
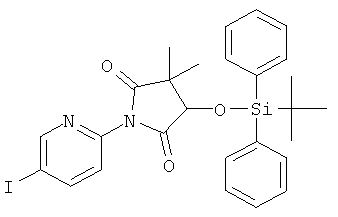
Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=587,0 (M+H+), аналогично тому, как описано в Примере 12, стадия 2, из (4RS)-4-(трет-бутил-дифенил-силанилокси)-1-(5-иод-пиридин-2-ил)-3,3-диметил-прирролидин-2,5-диона (Пример 14, стадия 3).
Стадия 5: (3RS)-3-(трет-бутил-дифенил-силанилокси)-1-(5-иод-пиридин-2-ил)-4,4-диметил-прирролидин-2-он

Указанное в заголовке соединение получали в виде бесцветного масла, MS: m/e=571,1 (M+H+), аналогично тому, как описано в Примере 12, стадия 3, из (3RS,5RS)-3-(трет-бутил-дифенил-силанилокси)-5-гидрокси-1-(5-иод-пиридин-2-ил)-4,4-диметил-прирролидин-2-она (Пример 14, стадия 4).
Стадия 6: (3RS)-3-(трет-бутил-диФенил-силанилокси)-4,4-диметил-1-(5-Фенилэтинил-пиридин-2-ил)-прирролидин-2-он

Указанное в заголовке соединение получали в виде коричневого масла, MS: m/e=545,3 (М+H+), аналогично тому, как описано в Примере 1, стадия 3, из (3RS)-3-(трет-бутил-дифенил-силанилокси)-1-(5-иод-пиридин-2-ил)-4,4-диметил-прирролидин-2-она (Пример 14, стадия 5) и фенилацетилена.
Стадия 7: (3RS)-3-гидрокси-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-прирролидин-2-он

(100 мг, 0,18 ммоль) (3RS)-3-(трет-бутил-дифенил-силанилокси)-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-прирролидин-2-она (Пример 14, стадия 6) растворяли в THF (1 мл) и добавляли TBAF (1M в THF) (184 мкл, 0,184) по каплям при комнатной температуре. Смесь перемешивали в течение 1 ч при 60°С. Реакционную смесь экстрагировали насыщенным раствором NaHCO3 и два раза этилацетатом. Органические слои экстрагировали водой, высушивали над Na2SO4, фильтровали и выпаривали досуха. Неочищенное вещество очищали с помощью флэш-хроматографии на силикагеле (20 г, градиентом этилацетат/гептан, от 0:100 до 100:0). Целевое соединение, (3RS)-3-гидрокси-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-прирролидин-2-он (44 мг, выход 78%) получали в виде белого твердого вещества, MS: m/e=307,3 (M+H+).
Пример 15
4,4-Диметил-1-(5-фенилэтинил-пиридин-2-ил)-имидазолидин-2-он
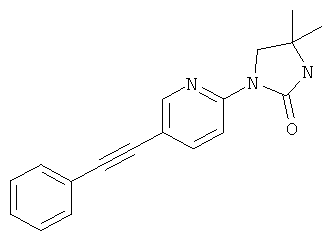
Стадия 1: N-1-(5-иод-пиридин-2-ил)-2-метил-пропан-1,2-диамин

Указанное в заголовке соединение получали в виде бесцветного масла, MS: m/e=292,0 (M+H+), аналогично тому, как описано в Примере 1, стадия 1, из 2-фтор-5-иодпиридина и 2-метилпропан-1,2-диамина.
Стадия 2: 1-(5-иод-пиридин-2-ил)-4.4-диметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=318,0 (M+H+), аналогично тому, как описано в Примере 1, стадия 2, из N-1-(5-иод-пиридин-2-ил)-2-метил-пропан-1,2-диамина (Пример 15, стадия 1).
Стадия 3: 4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-имидазолидин-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=292,1 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из 1-(5-иод-пиридин-2-ил)-4,4-диметил-имидазолидин-2-она (Пример 15, стадия 2) и фенилацетилена.
Пример 16
3,4,4-Триметил-1-(5-фенилэтинил-пиридин-2-ил)-имидазолидин-2-он

(110 мг, 378 мкмоль) 4,4-диметил-1-(5-(фенилэтинил)пиридин-2-ил)имидазолидин-2-она (Пример 15, стадия 3) растворяли в DMF (0,5 мл) и охлаждали до 0-5°С. Добавляли NaH (55%) (19,8 мг, 453 мкмоль, 1,2 эквив.) и перемешивали смесь в течение 30 мин при 0-5°С. Добавляли иодметан (35,3 мкл, 566 мкмоль, 1,5 эквив.) и перемешивали смесь в течение 30 мин при 0-5°С. Реакционную смесь обрабатывали насыщенным раствором NaHCO3 и экстрагировали дважды небольшим объемом CH2Cl2. Органические слои наносили непосредственно на колонку с силикагелем, и неочищенное вещество очищали с помощью флэш-хроматографии на силикагеле (20 г, градиентом этилацетат/гептан, от 0:100 до 100:0). Целевое соединение, 3,4,4-триметил-1-(5-фенилэтинил-пиридин-2-ил)-имидазолидин-2-он (93 мг, выход 81%) получали в виде желтого твердого вещества, MS: m/e=306,2 (М+Н+).
Пример 17
3-Этил-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-имидазолидин-2-он

Указанное в заголовке соединение получали в виде желтого масла, MS: m/e=320,2 (M+H+), аналогично тому, как описано в Примере 16, исходя из 4,4-диметил-1-(5-(фенилэтинил)пиридин-2-ил)имидазолидин-2-она (Пример 15, стадия 3) и иодэтана.
Пример 18
3-Изопропил-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-имидазолидин-2-он
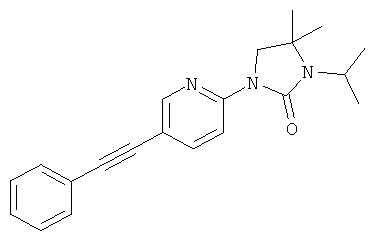
Указанное в заголовке соединение получали в виде желтого масла, MS: m/e=334,3 (М+H+), аналогично тому, как описано в Примере 16, исходя из 4,4-диметил-1-(5-(фенилэтинил)пиридин-2-ил)имидазолидин-2-она (Пример 15, стадия 3) и 2-бромпропана.
Пример 19
(5RS)-5-трет-бутил-5-метил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он

Стадия 1: 1-дибензиламино-3.3-диметил-бутан-2-он

(2,15 мл, 16,8 ммоль) дибензиламина растворяли в ацетонитриле (30 мл). Добавляли карбонат калия (2,3 г, 16,8 ммоль, 1,5 эквив.) и 1-бром-3,3-диметилбутан-2-он (1,5 мл, 11,2 ммоль, 1,0 эквив.) и перемешивали смесь 16 ч при 90°С. Реакционную смесь экстрагировали насыщенным раствором NaHCO3 и два раза этилацетатом. Органические слои экстрагировали водой, высушивали над Na2SO4, фильтровали и выпаривали досуха. Неочищенное вещество очищали с помощью флэш-хроматографии на силикагеле (70 г, градиентом этилацетат/гептан, от 0:100 до 100:0). Целевое соединение, 1-(дибензиламино)-3,3-диметилбутан-2-он (1,6 г, выход 48,5%) получали в виде желтого масла, MS: m/e=296,3 (M+H+).
Стадия 2: (RS)-1-дибензиламино-2,3,3-триметил-бутан-2-ол

(1,6 г, 5,4 ммоль) 1-дибензиламино-3,3-диметил-бутан-2-она (Пример 19, стадия 1) растворяли в диэтиловом эфире (20 мл) и охлаждали до 0-5°С. Добавляли метилмагний бромид (3М в диэтиловом эфире) (2,2 мл, 6,5 ммоль, 1,2 эквив.) по каплям при 0-5°С и перемешивали смесь в течение 72 ч при комнатной температуре. Реакционную смесь экстрагировали насыщенным раствором NH4Cl и два раза этилацетатом. Органические слои экстрагировали водой, высушивали над Na2SO4, фильтровали и выпаривали досуха. Неочищенное вещество очищали с помощью флэш-хроматографии на силикагеле (50 г, градиентом этилацетат/гептан, от 0:100 до 100:0). Целевое соединение, (RS)-1-дибензиламино-2,3,3-триметил-бутан-2-ол (1,2 г, выход 71%) получали в виде желтого масла, MS: m/e=312,4 (М+Н+).
Стадия 3: (RS)-1-амино-2.3.3-триметил-бутан-2-ол

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=132,1 (M+H+) из (RS)-1-дибензиламино-2,3,3-триметил-бутан-2-ола (Пример 19, стадия 2) путем гидрирования в течение 16 ч при комнатной температуре с помощью Pd/C (10%) в этилацетате.
Стадия 4: (RS)-1-(5-иод-пиридин-2-иламино)-2,3,3-триметил-бутан-2-ол

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=335, 1 (М+Н+), аналогично тому, как описано в Примере 1, стадия 1, из 2-фтор-5-иодпиридина и (RS)-1-амино-2,3,3-триметил-бутан-2-ола (Пример 19, стадия 3).
Стадия 5: (5RS)-5-трет-бутил-3-(5-иод-пиридин-2-ил)-5-метил-оксазолидин-2-он
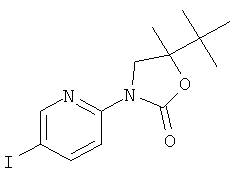
Указанное в заголовке соединение получали в виде желтого масла, MS: m/e=361,1 (M+H+), аналогично тому, как описано в Примере 1, стадия 2, из (RS)-1-(5-иод-пиридин-2-иламино)-2,3,3-триметил-бутан-2-ола (Пример 19, стадия 4).
Стадия 6: (5RS)-5-трет-бутил-5-метил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=335,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (5RS)-5-трет-бутил-3-(5-иод-пиридин-2-ил)-5-метил-оксазолидин-2-она (Пример 19, стадия 5) и фенилацетилена.
Пример 20
5,5-Диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Стадия 1: 3-(5-иод-пиридин-2-ил)-5,5-диметил-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде бесцветного масла, MS: m/e=333,1 (М+Н+), способами, аналогичными описанным в Примере 1, стадия 1 и стадия 2, из 2-фтор-5-иодпиридина и 3-амино-2,2-диметилпропан-1-ола.
Стадия 2: 5,5-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде светло-коричневого масла, MS: m/e=307,3 (М+Н+), аналогично тому, как описано в Примере 1, стадия 3, из 3-(5-иод-пиридин-2-ил)-5,5-диметил-[1,3]оксазинан-2-она (Пример 20, стадия 1) и фенилацетилена.
Пример 21
1-(3-Фтор-5-фенилэтинил-пиридин-2-ил)-4,4-диметил-прирролидин-2-он

Указанное в заголовке соединение получали в виде оранжевого твердого вещества, MS: m/e=309,2 (M+H+), способами, аналогичными описанным в Примере 13, с использованием 2-амино-3-фтор-5-иодпиридина вместо 5-иодпиридин-2-амина.
Пример 22
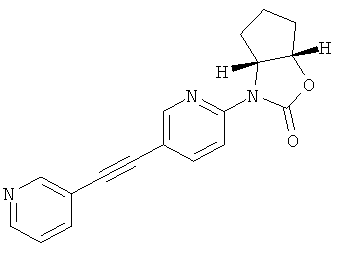
(3aRS,6aSR)-3-(5-Фенилэтинил-пиридин-2-ил)-гексагидро-циклопентаоксазол-2-он

Стадия 1: (3aRS,6aSR)-3-(5-Иод-пиридин-2-ил)-гексагидро-циклопентаоксазол-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=331,1 (М+Н+), способами, аналогичными описанным в Примере 1, стадия 1 и стадия 2, из 2-фтор-5-иодпиридина и (1SR,2RS)-2-аминоциклопентанола гидрохлорида.
Стадия 2: (3aRS,6aSR)-3-(5-фенилэтинил-пиридин-2-ил)-гексагидро-циклопентаоксазол-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=305,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (3aRS,6aSR)-3-(5-иод-пиридин-2-ил)-гексагидро-циклопентаоксазол-2-она (Пример 13, стадия 1) и фенилацетилена.
Пример 23
(3aRS,6aSR)-3-(5-Пиридин-3-илэтинил-пиридин-2-ил)-гексагидро-циклопентаоксазол-2-он

Указанное в заголовке соединение получали в виде бесцветного масла, MS: m/e=306,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (3aRS,6aSR)-3-(5-иод-пиридин-2-ил)-гексагидро-циклопентаоксазол-2-она (Пример 13, стадия 1) и 3-этинил-пиридина.
Пример 24
(3aRS,6aSR)-3-[5-(5-Фтор-пиридин-3-илэтинил)-пиридин-2-ил]-гексагидро-циклопентаоксазол-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=324,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (3aRS,6aSR)-3-(5-иод-пиридин-2-ил)-гексагидро-циклопентаоксазол-2-она (Пример 13, стадия 1) и 3-этинил-5-фтор-пиридина (CAS 872122-54-8).
Пример 25
5,5-Диметил-1-(5-фенилэтинил-пиридин-2-ил)-тетрагидро-пиримидин-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=306,2 (М+Н+), способами, аналогичными описанным в Примере 15, исходя из 2-фтор-5-иодпиридина, с использованием 2,2-диметилпропан-1,3-диамина вместо 2-метилпропан-1,2-диамина.
Пример 26
1,5,5-Триметил-3-(5-фенилэтинил-пиридин-2-ил)-тетрагидро-пиримидин-2-он
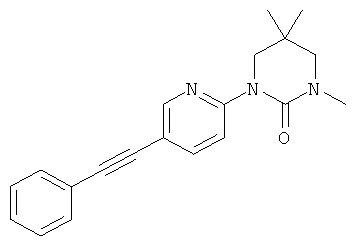
Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=306,2 (М+H+), способами, аналогичными описанным в Примере 16, из 5,5-диметил-1-(5-фенилэтинил-пиридин-2-ил)-тетрагидро-пиримидин-2-она (Пример 25) и иодметана.
Пример 27
(RS)-4,5,5-Триметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=307,2 (М+Н+), способами, аналогичными описанным в 10 Примере 1, из 2-фтор-5-иодпиридина, с использованием (RS)-3-амино-2-метил-бутан-2-ола (CAS 6291-17-4) вместо 1-амино-2-метилпропан-2-ола.
Пример 28
4,4,5,5-Тетраметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он
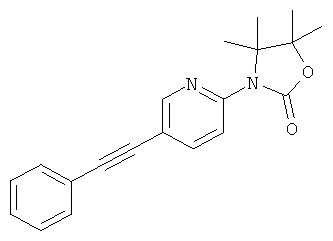
Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=321,2 (М+Н+), способами, аналогичными описанным в Примере 1, из 2-фтор-5-иодпиридина, с использованием 3-амино-2,3-диметил-бутан-2-ола (CAS 89585-13-7) вместо 1-амино-2-метилпропан-2-ола.
Пример 29
3-[5-(5-Фтор-пиридин-3-илэтинил)-пиридин-2-ил]-5,5-диметил-оксазол идин-2-он

Стадия 1: 5.5-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-оксазолидин-2-он
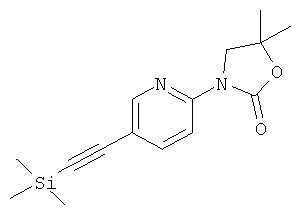
Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=289,0 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из 3-(5-иод-пиридин-2-ил)-5,5-диметил-оксазолидин-2-она (Пример 5, стадия 1) и этинилтриметилсилана.
Стадия 2: 3-[5-(5-фтор-пиридин-3-илэтинил)-пиридин-2-ил]-5,5-диметил-оксазолидин-2-он

5,5-Диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-оксазолидин-2-он (Пример 29, стадия 1) (100 мг, 0,35 ммоль) растворяли в THF (3 мл). Добавляли 3-фтор-5-иодпиридин (100 мг, 0,45 ммоль, 1,3 эквив.), Et3N (145 мкл, 1,04 ммоль, 3 эквив.), бис-(трифенилфосфин)-палладий(И)дихлорид (10 мг, 14 мкмоль, 0,05 эквив.), трифенилфосфин (11 мг, 17 мкмоль, 0,05 эквив.), трифенилфосфин (3 мг, 10 мкмоль, 0,03 эквив.) и иодид меди (I) (1 мг, 3,5 мкмоль, 0,01 эквив.) в атмосфере азота и нагревали смесь до 60°С. Добавляли 1М TBAF в THF (520 мкл, 0,52 ммоль, 1,5 эквив.) по каплям в течение 20 мин при 60°С. Реакционную смесь перемешивали в течение 3 ч при 60°С. Добавляли насыщенный раствор NaHCO3 и экстрагировали смесь дихлорметаном. Органические экстракты высушивали над сульфатом натрия, фильтровали и выпаривали. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле (градиент дихлорметан/метанол, от 100:0 до 90:10). Целевое соединение, 3-[5-(5-фтор-пиридин-3-илэтинил)-пиридин-2-ил]-5,5-диметил-оксазолидин-2-он получали в виде белого твердого вещества (55 мг, выход 51%), MS: m/e=312,3 (M+H+).
Пример 30
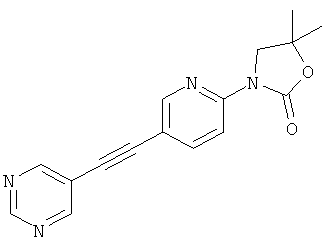
5,5-Диметил-3-(5-пиримидин-5-илэтинил-пиридин-2-ил)-оксазолидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=295,2 (M+H+), аналогично тому, как описано в Примере 29, стадия 2, из 5,5-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-оксазолидин-2-она (Пример 29, стадия 1) и 5-бромпиримидина.
Пример 31
5,5-Диметил-3-[5-(1-метил-1Н-пиразол-4-илэтинил)-пиридин-2-ил]-оксазолидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=297,2 (M+H+), аналогично тому, как описано в Примере 29, стадия 2, из 5,5-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-оксазолидин-2-она (Пример 29, стадия 1) и 4-иод-1-метил-1Н-пиразол.
Пример 32
3-[5-(4-Фтор-фенилэтинил)-пиридин-2-ил]-5,5-диметил-оксазолидин-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=311,2 (М+Н+), аналогично тому, как описано в Примере 1, стадия 3, из 3-(5-иод-пиридин-2-ил)-5,5-диметил-оксазолидин-2-она (Пример 5, стадия 1) и 1-этинил-4-фтор-бензола.
Пример 33
3-[5-(3,4-Дифтор-фенилэтинил)-пиридин-2-ил]-5,5-диметил-оксазолидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=329,2 (М+H+), аналогично тому, как описано в Примере 29, стадия 2, из 5,5-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-оксазолидин-2-она (Пример 29, стадия 1) и 1,2-дифтор-4-иодбензола.
Пример 34
3-[5-(2,5-Дифтор-фенилэтинил)-пиридин-2-ил]-5,5-диметил-оксазолидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=329,2 (M+H+), аналогично тому, как описано в Примере 29, стадия 2, из 5,5-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-оксазолидин-2-она (Пример 29, стадия 1) и 1,4-дифтор-2-иодбензола.
Пример 35
3-[5-(6-Фтор-пиридин-3-илэтинил)-пиридин-2-ил]-5,5-диметил-оксазол идин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=312,2 (М+H+), аналогично тому, как описано в Примере 29, стадия 2, из 5,5-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-оксазолидин-2-она (Пример 29, стадия 1) и 2-фтор-5-иодпиридина.
Пример 36
6-(5-Пиридин-3-илэтинил-пиридин-2-ил)-4-окса-6-аза-спиро[2.4]гептан-5-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=292,2 (M+H+), способами, аналогичными описанным в Примере 1, исходя из 2-фтор-5-бромпиридина, 1-аминометил-циклопропанола (Russian J. Org. Chem. 2001, 37, 1238) и 3-этинил-пиридина.
Пример 37
1-[5-(5-Фтор-пиридин-3-илэтинил)-пиридин-2-ил]-4,4-диметил-прирролидин-2-он

Стадия 1: 2-бром-5-триметилсиланилэтинил-пиридин

2-Бром-5-иодпиридин (2,5 г, 8,8 ммоль) растворяли в атмосфере азота в 50 мл THF. Добавляли бис-(трифенилфосфин)-палладий(II)дихлорид (618 мг, 880 мкмоль, 0,1 эквив.), этинилтриметилсилан (950 мг, 1,34 мл, 9,6 ммоль, 1,1 эквив.), триэтиламин (1,78 г, 2,44 мл, 17,6 ммоль, 3 эквив.) и иодид меди (I) (84 мг, 440 мкмоль, 0,05 эквив.) и перемешивали смесь в течение 3 ч при 50°С. Реакционную смесь охлаждали и выпаривали досуха. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле, элюировали градиентом этилацетаттептан, от 0:100 до 15:85. Целевое соединение, 2-бром-5-триметилсиланилэтинил-пиридин (1,95 г, 7,7 ммоль, выход 87%) получали в виде белого твердого вещества, MS: m/e=254,1/256,1 (M+H+).
Стадия 2: 4,4-диметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-прирролидин-2-он

(260 мг, 1,0 ммоль) 2-бром-5-триметилсиланилэтинил-пиридина (Пример 37, стадия 1) растворяли в толуоле (2 мл) и добавляли 4,4-диметилприрролидин-2-он (115 мг, 1,0 ммоль, 1,0 эквив.), карбонат цезия (660 мг, 2,05 ммоль, 2,0 эквив.), ксантофос (CAS 161265-03-8) (24 мг, 0,04 ммоль, 0,04 эквив.) и Pd2(dba)3 (19 мг, 0,02 ммоль, 0,02 эквив.) в атмосфере азота. Смесь перемешивали в течение 1 ч при 90°С. Неочищенный продукт очищали с помощью флэш-хроматографии путем прямого нанесения смеси в толуоле на колонку с силикагелем, элюировали градиентом этилацетат: гептан, от 0:100 до 40:60. Целевое соединение, 4,4-диметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-прирролидин-2-он (230 мг, 0,81 ммоль, выход 75%) получали в виде желтого твердого вещества, MS: m/e=287,1 (М+Н+).
Стадия 3: 1-[5-(5-фтор-пиридин-3-илэтинил)-пиридин-2-ил]-4,4-диметил-прирролидин-2-он

4,4-Диметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-прирролидин-2-он (Пример 37, стадия 2) (80 мг, 0,28 ммоль) растворяли в DMF (1 мл). Добавляли 3-фтор-5-иодпиридина (87 мг, 0,39 ммоль, 1,4 эквив.), Et3N (85 мг, 117 мкл, 0,84 ммоль, 3 эквив.), бис-(трифенилфосфин)-палладий(II)дихлорид (10 мг, 14 мкмоль, 0,05 эквив.), трифенилфосфин (2 мг, 8,4 мкмоль, 0,03 эквив.) и иодид меди (I) (2 мг, 8,4 мкмоль, 0,03 эквив.) в атмосфере азота и нагревали смесь до 70°С. Добавляли по каплям 1М TBAF в THF (300 мкл, 0.3 ммоль, 1.1 эквив.) в течение 20 мин при 70°С. Реакционную смесь перемешивали в течение 30 мин при 70°С и выпаривали раствор досуха. Неочищенный продукт очищали с помощью флэш-хроматографии с помощью колонки с 20 г силикагеля, элюировали градиентом гептан: этилацетат, от 100:0 до 0:100. Целевое соединение, 1-[5-(5-фтор-пиридин-3-илэтинил)-пиридин-2-ил]-4,4-диметил-прирролидин-2-он (36 мг, выход 42%) получали в виде белого твердого вещества, MS: m/e=310,2 (М+Н+).
Пример 38
4,4-Диметил-1-(5-пиридин-3-илэтинил-пиридин-2-ил)-прирролидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=292,1 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 4,4-диметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-прирролидин-2-она (Пример 37, стадия 2) и 3-иодпиридина.
Пример 39
1-[5-(5-Хлор-пиридин-3-илэтинил)-пиридин-2-ил]-4,4-диметил-прирролидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=326,2/328,2 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 4,4-диметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-прирролидин-2-она (Пример 37, стадия 2) и 3-хлор-5-иодпиридина.
Пример 40
1-[5-(3-Фтор-фенилэтинил)-пиридин-2-ил]-4,4-диметил-прирролидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=309,2 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 4,4-диметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-прирролидин-2-она (Пример 37, стадия 2) и 1-фтор-3-иодбензола.
Пример 41
4,4-Диметил-1-(3-метил-5-фенилэтинил-пиридин-2-ил)-прирролидин-2-он

Стадия 1: 2-бром-3-метил-5-триметилсиланилэтинил-пиридин

Указанное в заголовке соединение получали в виде желтого масла, MS: m/e=268,1/270,1 (M+H+), аналогично тому, как описано в Примере 37, стадия 1, с использованием 2-бром-5-иод-3-метилпиридина вместо 2-бром-6-иодпиридина.
Стадия 2: 4,4-диметил-1-(3-метил-5-триметилсиланилэтинил-пиридин-2-ил)-прирролидин-2-он

Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=301,3 (M+H+), аналогично тому, как описано в Примере 37, стадия 2, из 2-бром-3-метил-5-триметилсиланилэтинил-пиридина (Пример 41, стадия 1) и 4,4-диметилприрролидин-2-она.
Стадия 3: 4.4-диметил-1-(3-метил-5-сЬенилэтинил-пиридин-2-ил)-прирролидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=305,3 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 4,4-диметил-1-(3-метил-5-триметилсиланилэтинил-пиридин-2-ил)-прирролидин-2-она (Пример 41, стадия 2) и иодбензола.
Пример 42
5,5-Диметил-5'-фенилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он

Стадия 1: 5,5-диметил-5'-триметилсиланилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=301,3 (M+H+), аналогично тому, как описано в Примере 37, стадия 2, из 2-бром-5-триметилсиланилэтинил-пиридина (Пример 37, стадия 1), с использованием 5,5-диметил-пиперидин-2-она (CAS 4007-79-8) вместо 4,4-диметилприрролидин-2-она.
Стадия 2: 5,5-диметил-5'-фенилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он

Указанное в заголовке соединение получали в виде желтого масла, MS: m/e=305,2 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 5,5-диметил-5'-триметилсиланилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-она (Пример 42, стадия 1) и иодбензола.
Пример 43
5'-(3-Фтор-фенилэтинил)-5,5-диметил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он

Указанное в заголовке соединение получали в виде желтого масла, MS: m/e=323,2 (М+H+), аналогично тому, как описано в Примере 37, стадия 3, из 5,5-диметил-5'-триметилсиланилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-она
(Пример 42, стадия 1) и 1-фтор-3-иодбензола.
Пример 44
1-Метил-3-(5-фенилэтинил-пиридин-2-ил)-1,3-диаза-спиро[4.4]нонан-2-он

Стадия 1: трет-бутиловый эфир {1-[(5-иод-пиридин-2-иламино)-метил]-циклопентил}-карбаминовой кислоты

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=418,2 (М+Н+), аналогично тому, как описано в Примере 1, стадия 1, из 2-фтор-5-иодпиридина и трет-бутил 1-(аминометил)циклопентилкарбамата (CAS 889949-09-1) с использованием в качестве растворителя чистого пиридина вместо NMP.
Стадия 2: (1-амино-циклопентилметил)-(5-иод-пиридин-2-ил)-амин гидрохлорид

Защитную ВОС-группу удаляли в ходе реакции трет-бутилового эфира {1-[(5-иод-пиридин-2-иламино)-метил]-циклопентил} карбаминовой кислоты (Пример 44, стадия 1) с 4Н HCl в диоксане в течение 1 ч при комнатной температуре. Указанное в заголовке соединение получали фильтрацией гидрохлоридной соли в виде светло-желтого твердого вещества, MS: m/e=318,1 (М+H+).
Стадия 3: 3-(5-иод-пиридин-2-ил)-1,3-диаза-спиро[4.4]нонан-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=344,1 (M+H+), аналогично тому, как описано в Примере 1, стадия 2, из гидрохлорида (1-амино-циклопентилметил)-(5-иод-пиридин-2-ил)-амина (Пример 44, стадия 2).
Стадия 4: 3-(5-фенилэтинил-пиридин-2-ил)-1,3-диаза-спиро[4.4]нонан-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=318,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из 3-(5-иод-пиридин-2-ил)-1,3-диаза-спиро[4.4]нонан-2-она (Пример 44, стадия 3) и фенилацетилена.
Стадия 5: 1 -метил-3-(5-фенилэтинил-пиридин-2-ил)-1,3-диаза-спиро[4.4]нонан-2-он

Указанное в заголовке соединение получали в виде светло-желтого масла, MS: m/e=332,2 (M+H+), аналогично тому, как описано в Примере 16, из 3-(5-фенилэтинил-пиридин-2-ил)-1,3-диаза-спиро[4.4]нонан-2-она (Пример 44, стадия 4) и иодметана.
Пример 45
(RS)-4-Циклопентил-3-метил-1-(5-фенилэтинил-пиридин-2-ил)-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=346,2 (М+H+), способами, аналогичными описанным в Примере 44, из 2-фтор-5-иодпиридина, с использованием (RS)-трет-бутил 2-амино-1-циклопентилэтилкарбамата (CAS 936497-76-6) вместо трет-бутил 1-(аминометил)циклопентилкарбамата.
Пример 46
(1RS,5SR)-6-(5-Фенилэтинил-пиридин-2-ил)-6-аза-бицикло[3.2.0]гептан-7-он

Стадия 1: (1RS,5SR)-6-(5-бром-пиридин-2-ил)-6-аза-бицикло[3.2.0] гептан-7-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=268,2 (М+Н+), аналогично тому, как описано в Примере 37, стадия 2, из 2,5-дибромпиридина и (1RS,5SR)-6-аза-бицикло[3.2.0]гептан-7-она (CAS 22031-52-3).
Стадия 2: (1RS,5SR)-6-(5-Фенилэтинил-пиридин-2-ил)-6-аза-бицикло[3.2.0]гептан-7-он

Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=289,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (1RS,5SR)-6-(5-бром-пиридин-2-ил)-6-аза-бицикло[3.2.0]гептан-7-она (Пример 46, стадия 1) и фенилацетилена.
Пример 47
(6SR,7RS)-3-(5-фенилэтинил-пиридин-2-ил)-гексагидро-бензооксазол-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=319,2 (M+H+), способами, аналогичными описанным в Примере 1, исходя из 2-фтор-5-бромпиридина, (5SR,6RS)-2-амино-циклогексанола гидрохлорида (CAS 190792-72-4) и фенилацетилена.
Пример 48
3,4,4-Триметил-1-(5-пиридин-3-илэтинил-пиридин-2-ил)-имидазолидин-2-он

Стадия 1: 1-(5-иод-пиридин-2-ил)-3,4,4-триметил-имидазолидин-2-он
Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=332,1 (М+Н+), аналогично тому, как описано в Примере 16, из 1-(5-иод-пиридин-2-ил)-4,4-диметил-имидазолидин-2-она (Пример 15, стадия 2) и иодметана.
Стадия 2: 3.4.4-триметил-1-(5-пиридин-3-илэтинил-пиридин-2-ил)-имидазолидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=307,3 (М+H+), аналогично тому, как описано в Примере 1, стадия 3, из 1-(5-иод-пиридин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 48, стадия 1) и 3-этинил-пиридина.
Пример 49
1-[5-(5-Фтор-пиридин-3-илэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Стадия 1: 3,4,4-триметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-имидазолидин-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=302,3 (M+H+), аналогично тому, как описано в Примере 37, стадия 1, из 1-(5-иод-пиридин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 48, стадия 1) и этинилтриметилсилана.
Стадия 2: 1-[5-(5-фтор-пиридин-3-илэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=325,4 (М+Н+), аналогично тому, как описано в Примере 37, стадия 3, из 3,4,4-триметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-имидазолидин-2-она (Пример 49, стадия 1) и 3-фтор-5-иодпиридина.
Пример 50
3,4,4-Триметил-1-[5-(1-метил-1Н-пиразол-4-илэтинил)-пиридин-2-ил]-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=310,3 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 3,4,4-триметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-имидазолидин-2-она (Пример 49, стадия 1) и 4-иод-1-метил-1Н-пиразола.
Пример 51
1-[5-(5-Хлор-пиридин-3-илэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=341,1/343,3 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 3,4,4-триметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-имидазолидин-2-она (Пример 49, стадия 1) и 3-хлор-5-иодпиридина.
Пример 52
3,4,4-Триметил-1-(5-пиридазин-4-илэтинил-пиридин-2-ил)-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=308,4 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 3,4,4-триметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-имидазолидин-2-она (Пример 49, стадия 1) и 4-бром-пиридазина.
Пример 53
1-[5-(3-Фтор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=324,3 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из 1-(5-иод-пиридин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 48, стадия 1) и 1-этинил-3-фтор-бензола.
Пример 54
1-[5-(3-Хлор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=340,1/342,2 (М+H+), аналогично тому, как описано в Примере 1, стадия 3, из 1-(5-иод-пиридин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 48, стадия 1) и 1-этинил-3-хлор-бензола.
Пример 55
3,4,4-Триметил-1-(5-пиримидин-5-илэтинил-пиридин-2-ил)-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=308,2 (М+H+), аналогично тому, как описано в Примере 37, стадия 3, из 3,4,4-триметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-имидазолидин-2-она (Пример 49, стадия 1) и 5-бром-пиримидина.
Пример 56
3,4,4-Триметил-1-(5-м-толилэтинил-пиридин-2-ил)-имидазолидин-2-он

Указанное в заголовке соединение получали в виде коричневого масла, MS: m/e=320,1 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из 1-(5-иод-пиридин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 48, стадия 1) и 1-этинил-3-метил-бензола.
Пример 57
1-[5-(4-Фтор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=324,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из 1-(5-иод-пиридин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 48, стадия 1) и 1-этинил-4-фтор-бензола.
Пример 58
(RS)-2-(5-Фенилэтинил-пиридин-2-ил)-гексагидро-имидазо[1,5-а]пиридин-3-он

Стадия 1: (RS)-2-(5-иод-пиридин-2-ил)-гексагидро-имидазо[1,5-а]пиридин-3-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=344,0 (М+H+), способами, аналогичными описанным в Примере 1, стадия 1 и стадия 2, из 2-фтор-5-иодпиридина и (RS)-гексагидро-имидазо[1,5-а]пиридин-3-она (CAS 76561-92-7) с использованием в качестве растворителя чистого пиридина вместо NMP.
Стадия 2: (RS)-2-(5-фенилэтинил-пиридин-2-ил)-гексагидро-имидазо[1,5-а]пиридин-3-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=318,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (RS)-2-(5-иод-пиридин-2-ил)-гексагидро-имидазо[1,5-а]пиридин-3-она (Пример 58, стадия 1) и фенилацетилена.
Пример 59
2-(5-Фенилэтинил-пиридин-2-ил)-2-аза-спиро[4.4]нонан-3-он

Указанное в заголовке соединение получали в виде светло-желтого вещества, MS: m/e=317,2 (М+Н+), аналогично тому, как описано в Примере 37, стадия 2, из 2-бром-5-фенилэтинил-пиридина (Пример 58, стадия 1) и 2-аза-спиро[4.4]нонан-3-она (CAS 75751-72-3).
Пример 60
(RS)-3-метокси-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-прирролидин-2-он

Стадия 1: (RS)-4-иод-N-(5-иод-пиридин-2-ил)-2-метокси-3,3-диметил-бутирамид
Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=474,9 (M+H+), аналогично тому, как описано в патенте WO 9637466, стр.17, стадия 2, исходя из (RS)-3-метокси-4,4-диметил-дигидро-фуран-2-она (CAS 100101-82-4) вместо 3-t-бутилкарбамоилокси-тетрагидрофуран-2-она, с использованием 2-амино-5-иодпиридина вместо 2-амино-4-трифторметилпиридина.
Стадия 2: (RS)-1-(5-иод-пиридин-2-ил)-3-метокси-4,4-диметил-прирролидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=347,0 (М+H+), аналогично тому, как описано в патенте WO 9637466, стр.17, стадия 3, из (RS)-4-иод-N-(5-иод-пиридин-2-ил)-2-метокси-3,3-диметил-бутирамида (Пример 60, стадия 1).
Стадия 3: (RS)-3-метокси-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-прирролидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=321,3 (М+Н+), аналогично тому, как описано в Примере 1, стадия 3, из (RS)-1-(5-иод-пиридин-2-ил)-3-метокси-4,4-диметил-прирролидин-2-она (Пример 60, стадия 2) и фенилацетилена.
Пример 61
(5R или 5S)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазол идин-2-он
 или
или 
Указанное в заголовке соединение, желтое масло, MS: m/e=321,3 (М+Н+), получали путем разделения (RS)-3-метокси-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)-прирролидин-2-она (Пример 60) с помощью хиральной колонки (CHIRALPAK AD, с использованием смеси гептан:изопропанол 90:10 в качестве растворителя).
Пример 62
(5S или 5R)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)-оксазол идин-2-он
 или
или 
Указанное в заголовке соединение, белые кристаллы, MS: m/e=321,3 (M+H+), получали путем разделения (RS)-3-метокси-4,4-диметил-1-(5-фенилэтинил-) пиридин-2-ил)-прирролидин-2-она (Пример 60) с помощью хиральной колонки (CHIRALPAK AD, с использованием смеси гептан:изопропанол 90:10 в качестве растворителя).
Пример 63
(RS)-1-[5-(5-Хлор-пиридин-3-илэтинил)-пиридин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он

Стадия 1: (RS)-3-метокси-4.4-диметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-прирролидин-2-он
Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=317,2 (M+H+), аналогично тому, как описано в Примере 37, стадия 1, из (RS)-1-(5-иод-пиридин-2-ил)-3-метокси-4,4-диметил-прирролидин-2-она (Пример 60, стадия 2) и этинилтриметилсилана.
Стадия 2: (RS)-1-[5-(5-хлор-пиридин-3-илэтинил)-пиридин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=356,1/358,2 (М+Н+), аналогично тому, как описано в Примере 37, стадия 3, из (RS)-3-метокси-4,4-диметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-прирролидин-2-она (Пример 63, стадия 1) и 3-хлор-5-иодпиридина.
Пример 64
(RS)-3-метокси-4,4-диметил-1-(5-м-толилэтинил-пиридин-2-ил)-прирролидин-2-он

Указанное в заголовке соединение получали в виде оранжевого масла, MS: m/e=335,2 (М+H+), аналогично тому, как описано в Примере 1, стадия 3, из (RS)-1-(5-иод-пиридин-2-ил)-3-метокси-4,4-диметил-прирролидин-2-она (Пример 60, стадия 2) и 1-этинил-3-метил-бензола.
Пример 65
(RS)-1-[5-(3-Фтор-фенилэтинил)-пиридин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он

Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=339,2 (М+Н+), аналогично тому, как описано в Примере 1, стадия 3, из (RS)-1-(5-иод-пиридин-2-ил)-3-метокси-4,4-диметил-прирролидин-2-она (Пример 60, стадия 2) и 1-этинил-3-фторбензола.
Пример 66
(RS)-1-[5-(4-Фтор-фенилэтинил)-пиридин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он

Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=339,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (RS)-1-(5-иод-пиридин-2-ил)-3-метокси-4,4-диметил-прирролидин-2-она (Пример 60, стадия 2) и 1-этинил-4-фторбензола.
Пример 67
3,4,4-Триметил-1-(5-фенилэтинил-пиридин-2-ил)-тетрагидро-пиримидин-2-он

Стадия 1: трет-бутиловый эфир [3-(5-иод-пиридин-2-иламино)-1,1-диметил-пропил]-карбаминовой кислоты
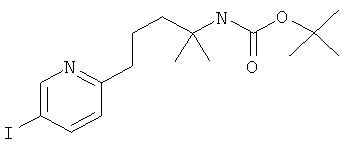
Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=406,3 (М+Н+), аналогично тому, как описано в Примере 1, стадия 1, из 2-фтор-5-иодпиридина и трет-бутил-4-амино-2-метилбутан-2-илкарбамата (CAS 880100-43-6).
Стадия 2: n-1-(5-иод-пиридин-2-ил)-3-метил-бутане-1,3-диамин гидрохлорид
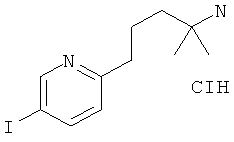
Защитную ВОС-группу удаляли в ходе реакции трет-бутилового эфира [3-(5-иод-пиридин-2-иламино)-1,1-диметил-пропил]карбаминовой кислоты (Пример 67, стадия 1) с 4Н HCl в диоксане в течение 4 ч при комнатной температуре. Указанное в заголовке соединение получали фильтрацией гидрохлоридной соли в виде розового твердого вещества, MS: m/e=306,1 (M+H+).
Стадия 3: 1-(5-иод-пиридин-2-ил)-4,4-диметил-тетрагидро-пиримидин-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=332,1 (M+H+), аналогично тому, как описано в Примере 1, стадия 2, из N-1-(5-иод-пиридин-2-ил)-3-метил-бутан-1,3-диамина гидрохлорида (Пример 67, стадия 2).
Стадия 4: 1-(5-иод-пиридин-2-ил)-3,4,4-триметил-тетрагидро-пиримидин-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=346,0 (М+H+), аналогично тому, как описано в Примере 16, из 1-(5-иод-пиридин-2-ил)-4,4-диметил-тетрагидро-пиримидин-2-она (Пример 67, стадия 3) и иодметана.
Стадия 5: 3,4.4-триметил-1-(5-фенилэтинил-пиридин-2-ил)-тетрагидро-пиримидин-2-он

Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=320,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из 1-(5-иод-пиридин-2-ил)-3,4,4-триметил-тетрагидро-пиримидин-2-она (Пример 67, стадия 4) и фенилацетилена.
Пример 68
1-[5-(2,5-дифтор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-тетрагидро-пиримидин-2-он

Стадия 1: 3,4,4-триметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-тетрагидро-пиримидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=316,2 (M+H+), аналогично тому, как описано в Примере 37, стадия 1, из 1-(5-иод-пиридин-2-ил)-3,4,4-триметил-тетрагидро-пиримидин-2-она (Пример 67, стадия 4) и этинилтриметилсилана.
Стадия 2: 1[5-(2,5-дифтор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-тетрагидро-пиримидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=356,2 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 3,4,4-триметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-тетрагидро-пиримидин-2-она (Пример 68, стадия 1) и 1,4-дифтор-2-иодбензола.
Пример 69
1-[5-(4-Фтор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-тетрагидро-пиримидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=338,3 (М+H+), аналогично тому, как описано в Примере 37, 15 стадия 3, из 3,4,4-триметил-1-(5-триметилсиланилэтинил-пиридин-2-ил)-тетрагидро-пиримидин-2-она (Пример 68, стадия 1) и 1-фтор-4-иодбензола.
Пример 70
(RS)-2-(5-Пиридин-3-илэтинил-пиридин-2-ил)-гексагидро-имидазо[1,5-а]пиридин-3-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=319,1 (М+H+), аналогично тому, как описано в Примере 1, стадия 3, из (RS)-2-(5-иод-пиридин-2-ил)-гексагидро-имидазо[1,5-а]пиридин-3-она (Пример 58, стадия 1) и 3-этинил-пиридина.
Пример 71
(RS)-2-[5-(3-Фтор-фенилэтинил)-пиридин-2-ил]-гексагидро-имидазо[1,5-а]пиридин-3-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=336,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (Р8)-2-(5-иод-пиридин-2-ил)-гексагидро-имидазо[1,5-а]пиридин-3-она (Пример 58, стадия 1) и 1-этинил-3-фторбензола.
Пример 72
6,6-Диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Стадия 1: бензиловый эфир (3-гидрокси-3-метил-бутил)-карбаминовой кислоты

(10 г, 42,1 ммоль) метил-3-(бензилоксикарбониламино)пропионата (CAS 54755-77-0) растворяли в THF (150 мл) и охлаждали до 0-5°С. Добавляли по каплям 3Н метилмагния бромид в THF (56,2 мл, 120 ммоль, 4 эквив.) и перемешивали смесь в течение 1 ч при 0-5°С. Реакционную смесь экстрагировали насыщенным раствором NH4Cl и затем два раза - EtOAc. Органические слои высушивали над Na2SO4 и выпаривали досуха. Целевое соединение, бензиловый эфир (3-гидрокси-3-метил-бутил)карбаминовой кислоты (11,6 г, количественно) получали в виде бесцветного масла, MS: m/e=238,1 (М+Н+) и использовали в следующей стадии без дополнительной очистки.
Стадия 2: 6.6-диметил-[1,3]оксазинан-2-он

(11,6 г, 48,9 ммоль) бензилового эфира (3-гидрокси-3-метил-бутил)карбаминовой кислоты (Пример 72, стадия 1) растворяли в THF (250 мл) и добавляли порциями гидрид натрия (60%, 5,2 г, 108 ммоль, 2,2 эквив.). Смесь перемешивали в течение 3 ч при комнатной температуре. Осторожно добавляли 5 мл насыщенного раствора NaHCO3 и смесь вместе с ISOLUTE выпаривали досуха. Неочищенный продукт очищали с помощью флэш-хроматографии путем прямого нанесения остатка на колонку с силикагелем, элюировали градиентом этилацетат: метанол, от 100:0 до 90:10. Целевое соединение, 6,6-диметил-[1,3]оксазинан-2-он (3,2 г, выход 51%) получали в виде желтого твердого вещества, MS: m/e=130,1 (M+H+).
Стадия 3: 6,6-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде оранжевого твердого вещества, MS: m/e=303,2 (М+H+), аналогично тому, как описано в Примере 37, стадия 2, из 2-бром-5-триметилсиланилэтинил-пиридина (Пример 37, стадия 1), с использованием 6,6-диметил-[1,3]оксазинан-2-она (Пример 72, стадия 2) вместо 4,4-диметилприрролидин-2-она.
Стадия 4: 6,6-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=307,2 (М+H+), аналогично тому, как описано в Примере 37, стадия 3, из 6,6-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-она (Пример 72, стадия 3) и иодбензола.
Пример 73
6,6-Диметил-3-(5-пиридин-3-илэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Стадия 1: 3-(5-иод-пиридин-2-ил)-6.6-диметил-[1,3]оксазинан-2-он
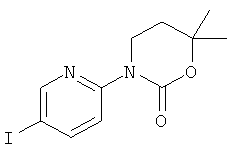
Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=333,1 (M+H+), способами, аналогичными описанным в Примере 1, стадия 1 и стадия 2, из 2-фтор-5-иодпиридина и 4-амино-2-метил-бутан-2-ола гидрохлорида.
Стадия 2: 6,6-диметил-3-(5-пиридин-3-илэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=308,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из 3-(5-иод-пиридин-2-ил)-6,6-диметил-[1,3]оксазинан-2-она (Пример 73, стадия 1) и фенилацетилена.
Пример 74
3-[5-(5-Фтор-пиридин-3-илэтинил)-пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=326,3 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 6,6-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-она (Пример 72, стадия 3) и 3-фтор-5-иодпиридина.
Пример 75
3-[5-(5-Хлор-пиридин-3-илэтинил)-пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=342,1/344,2 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 6,6-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-она (Пример 72, стадия 3) и 3-хлор-5-иодпиридина.
Пример 76
3-15-(3-Фтор-фенилэтинил)-пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=325,4 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 6,6-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-она (Пример 72, стадия 3) и 1-фтор-3-иодбензола.
Пример 77
3-[5-(3-Хлор-фенилэтинил)-пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=341,2/343,2 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 6,6-диметил-3-(5-триметилсиланилзтинил-пиридин-2-ил)-[1,3]оксазинан-2-она (Пример 72, стадия 3) и 1-хлор-3-иодбензола.
Пример 78
6,6-Диметил-3-(5-м-толилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=321,4 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 6,6-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-она (Пример 72, стадия 3) и 1-иод-3-метилбензола.
Пример 79
3-[5-(4-Фтор-фенилэтинил)-пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=325,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из 3-(5-иод-пиридин-2-ил)-6,6-диметил-[1,3]оксазинан-2-она (Пример 73, стадия 1) и 1-этинил-4-фторбензола.
Пример 80
3-[5-(3,4-Дифтор-фенилэтинил)-пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=343,1 (М+Н+), аналогично тому, как описано в Примере 1, стадия 3, из 3-(5-иод-пиридин-2-ил)-6,6-диметил-[1,3]оксазинан-2-она (Пример 73, стадия 1) и 4-этинил-1,2-дифторбензола.
Пример 81
3-[5-(2,5-Дифтор-фенилэтинил)-пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=343,1 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 6,6-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-она (Пример 72, стадия 3) и 1,4-дифтор-2-иодбензола.
Пример 82
6-(5-Фенилэтинил-пиридин-2-ил)-2-окса-6-аза-спиро[3.4]октан-7-он

Стадия 1: 6-(5-триметилсиланилэтинил-пиридин-2-ил)-2-окса-6-аза-спиро[3,4]октан-7-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=301,3 (M+H+), аналогично тому, как описано в Примере 37, стадия 2, из 2-бром-5-триметилсиланилэтинил-пиридина (Пример 37, стадия 1) и 2-окса-6-аза-спиро[3.4]октан-7-она (CAS 1207174-87-5).
Стадия 2: 6-(5-фенилэтинил-пиридин-2-ил)-2-окса-6-аза-спиро[3.4]октан-7-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=305,3 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 6-(5-триметилсиланилэтинил-пиридин-2-ил)-2-окса-6-аза-спиро[3.4]октан-7-она (Пример 82, стадия 1) и иодбензола.
Пример 83
(RS)-4-Циклопропил-3-метил-1-(5-фенилэтинил-пиридин-2-ил)-имидазолидин-2-он

Указанное в заголовке соединение получали в виде оранжевого твердого вещества, MS: m/e=318,1 (M+H+), способами, аналогичными описанным в Примере 58, из 2-фтор-5-иодпиридина, с использованием (RS)-1-циклопропил-этан-1,2-диамина вместо (RS)-гексагидро-имидазо[1,5-а]пиридин-3-она.
Пример 84
(3aSR,7aRS)-(3aRS,7RS)-1-Метил-3-(5-фенилэтинил-пиридин-2-ил)-октагидро-бензоимидазол-2-он

Стадия 1: (1SR,2RS)-(1RS,2RS)-N-(5-иод-пиридин-2-ил)-циклогексан-1,2-диамин

Указанное в заголовке соединение получали в виде коричневого масла, MS: m/e=318,1 (M+H+), аналогично тому, как описано в Примере 1, стадия 1, из 2-фтор-5-иодпиридина и гас-циклогексан-1,2-диамина.
Стадия 2: (3aSR,7aRS)-(3aRS,7aRS)-1-(5-иод-пиридин-2-ил)-октагидро-бензоимидазол-2-он
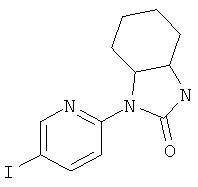
Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=344,1 (M+H+), аналогично тому, как описано в Примере 1, стадия 2, из (1SR,2RS)-(1RS,2RS)-N-(5-иод-пиридин-2-ил)-циклогексан-1,2-диамина (Пример 84, стадия 1).
Стадия 3: (3aSR,7aRS)-(3aRS,7aRS)-1-(5-Иод-пиридин-2-ил)-3-метил-октагидро-бензоимидазол-2-он
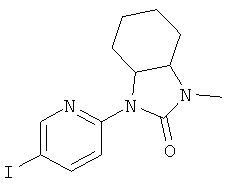
Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=358,0 (M+H+), аналогично тому, как описано в Примере 16, из (3aSR,7aRS)-(3aRS,7aRS)-1-(5-иод-пиридин-2-ил)-октагидро-бензоимидазол-2-она (Пример 84, стадия 2) и иодметана.
Стадия 4: (3aSR,7aRS)-(3aRS,7RS)-1-метил-3-(5-фенилэтинил-пиридин-2-ил)-октагидро-бензоимидазол-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=332,3 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (3aSR,7aRS)-(3aRS,7aRS)-1-(5-иод-пиридин-2-ил)-3-метил-октагидро-бензоимидазол-2-она (Пример 84, стадия 3) и фенилацетилена.
Пример 85
(3aSR,7aRS)-(3aRS,7RS)-1-Метил-3-(5-пиридин-3-илэтинил-пиридин-2-ил)-октагидро-бензоимидазол-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=333,3 (М+Н+), аналогично тому, как описано в Примере 1, стадия 3, из (3aSR,7aRS)-(3aRS,7aRS)-1-(5-иод-пиридин-2-ил)-3-метил-октагидро-бензоимидазол-2-она (Пример 84, стадия 3) и 3-этинил-пиридина.
Пример 86
(3aSR,7aRS)-(3aRS,7RS)-1-[5-(5-Фтор-пиридин-3-илэтинил)-пиридин-2-ил]-3-метил-октагидро-бензоимидазол-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS; m/e=351,3 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (3aSR,7aRS)-(3aRS,7aRS)-1-(5-иод-пиридин-2-ил)-3-метил-октагидро-бензоимидазол-2-она (Пример 84, стадия 3) и 3-этинил-5-фтор-пиридина (генерируемого в ходе in situ реакции Соногашира 3-фтор-5-иодпиридина с этинилтриметилсиланом и TBAF).
Пример 87
4,4-Диметил-5'-фенилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он

Стадия 1: 4,4-диметил-5'-триметилсиланилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он
Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=301,3 (M+H+), аналогично тому, как описано в Примере 37, стадия 2, из 2-бром-5-триметилсиланилэтинил-пиридина (Пример 37, стадия 1), с использованием 4,4-диметил-пиперидин-2-она (CAS 55047-81-9) вместо 4,4-диметилприрролидин-2-она.
Стадия 2: 4,4-диметил-5'-фенилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=305,2 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 4,4-диметил-5'-триметилсиланилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-она (Пример 87, стадия 1) и иодбензола.
Пример 88
5'-(3-Фтор-фенилэтинил)-4,4-диметил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=323,2 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 4,4-диметил-5'-триметилсиланилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-она (Пример 87, стадия 1) и 1-фтор-3-иодбензола.
Пример 89
5'-(3-Хлор-сренилэтинил)-4,4-диметил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=339,2/341,1 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 4,4-диметил-5'-триметилсиланилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-она (Пример 87, стадия 1) и 1-хлор-3-иодбензола.
Пример 90
5'-(5-Хлор-пиридин-3-илэтинил)-4,4-диметил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=340,1/342,2 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 4,4-диметил-5'-триметилсиланилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-она (Пример 87, стадия 1) и 1-хлор-3-иодпиридина.
Пример 91
5'-(4-Фтор-сренилэтинил)-4,4-диметил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=323,2 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 4,4-диметил-5'-триметилсиланилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-она (Пример 87, стадия 1) и 1-фтор-4-иодбензола.
Пример 92
5'-(2,5-Дифтор-фенилэтинил)-4,4-диметил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-он
Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=341,1 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 4,4-диметил-5'-триметилсиланилэтинил-3,4,5,6-тетрагидро-[1,2']бипиридинил-2-она (Пример 87, стадия 1) и 1,4-дифтор-2-иодбензола.
Пример 93
7,7-Диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазепан-2-он

Стадия 1: 3-(5-иод-пиридин-2-ил)-7,7-диметил-[1,3]оксазепан-2-он

Указанное в заголовке соединение получали в виде бесцветного масла, MS: m/e=346,9 (М+H+), способами, аналогичными описанным в Примере 1, стадия 1 и стадия 2, из 2-фтор-5-иодпиридина и 5-амино-2-метилпентап-2-ола (CAS 108262-66-4).
Стадия 2: 7,7-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазепан-2-он

Указанное в заголовке соединение получали в виде оранжевого твердого вещества, MS: m/e=321,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из 3-(5-иод-пиридин-2-ил)-7,7-диметил-[1,3]оксазепан-2-она (Пример 93, стадия 1) и фенилацетилена.
Пример 94
(3aSR,7aRS)-(3aRS,7RS)-1-(5-Фенилэтинил-пиридин-2-ил)-гексагидро-пирано[4,3-d]оксазол-2-он

Стадия 1: (3aSR,7aRS-(3aRS,7RS)-1-(5-иод-пиридин-2-ил)-гексагидро-пирано[4,3-d]оксазол-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=346,9 (M+H+), способами, аналогичными описанным в Примере 1, стадия 1 и стадия 2, из 2-фтор-5-иодпиридина и (3RS,4RS)-(3RS,4SR)-4-аминотетрагидро-2Н-пиран-3-ола (CAS 33332-01-3).
Стадия 2: (3aSR,7aRS)-(3aRS,7RS)-1-(5-фенилэтинил-пиридин-2-ил)-гексагидро-пирано[4.3-d]оксазол-2-он

Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=321,1 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (3aSR,7aRS)-(3aRS,7RS)-1-(5-иод-пиридин-2-ил)-гексагидро-пирано[4,3-d]оксазол-2-она (Пример 94, стадия 1) и фенилацетилена.
Пример 95
(RS)-5-Гидрокси-6,6-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Стадия 1: этиловый эфир (RS)-2-(трет-бутил-дифенил-силанилокси)-3-дибензиламино-пропионовой кислоты

(5,8 г, 18,6 ммоль) этилового эфира (RS)-3-дибензиламино-2-гидрокси-пропионовой кислоты (CAS 93715-75-4) растворяли в DMF (40 мл) и добавляли трет-бутилхлордифенилсилан (6,76 мл, 26 ммоль, 1,4 эквив.), имидазол (1,9 г, 27,9 ммоль, 1,5 эквив.) и DMAP (227 мг, 1,9 ммоль, 0,1 эквив.) при комнатной температуре. Смесь перемешивали в течение 3 ч при 80°С. Реакционную смесь выпаривали и экстрагировали с помощью насыщенного раствора NaHCO3 и затем два раза с помощью EtOAc. Органические слои экстрагировали солевым раствором, высушивали над Na2SO4 и выпаривали досуха. Неочищенный продукт очищали с помощью флэш-хроматографии на колонке с силикагелем, элюировали градиентом этилацетат: гептан, от 0:100 до 40:60. Целевое соединение, этиловый эфир (RS)-2-(трет-бутил-дифенил-силанилокси)-3-дибензиламино-пропионовой кислоты (8,1 г, выход 79%), получали в виде бесцветного масла, MS: m/e=552,5 (M+H+).
Стадия 2: (RS)-3-(трет-бутил-дифенил-силанилокси)-4-дибензиламино-2-метил-бутан-2-ол

(8,0 г, 14,5 ммоль) этилового эфира (RS)-2-(трет-бутил-дифенил-силанилокси)-3-дибензиламино-пропионовой кислоты (Пример 95, стадия 1) растворяли в THF (100 мл) и добавляли по каплям метилмагния бромид (3М в диэтиловом эфире) (19,3 мл, 58 ммоль, 4 эквив.) при комнатной температуре. Смесь перемешивали в течение 3,5 ч при комнатной температуре. Реакционную смесь экстрагировали с помощью насыщенного раствора NaHCO3 и затем два раза с помощью EtOAc. Органические слои экстрагировали солевым раствором, высушивали над Na2SO4 и выпаривали досуха. Целевое соединение, (RS)-3-(трет-бутил-дифенил-силанилокси)-4-дибензиламино-2-метил-бутан-2-ол (6,9 г, выход 84%) получали в виде белого твердого вещества, MS: m/e=538,5 (М+H+) и использовали в следующей стадии без дополнительной очистки.
Стадия 3: (RS)-4-амино-3-(трет-бутил-дифенил-силанилокси)-2-метил-бутан-2-ол

(RS)-3-(трет-бутил-дифенил-силанилокси)-4-дибензиламино-2-метил-бутан-2-ол (Пример 95, стадия 2) гидрогенизировали в EtOH с помощью Pd(OH)2 в течение 16 ч при 60°С. Целевое соединение, (К3)-4-амино-3-(трет-бутил-дифенил-силанилокси)-2-метил-бутан-2-ол (4,2 г, выход 92%) получали в виде бесцветного масла, MS: m/e=358,2 (M+H+) и использовали в следующей стадии без дополнительной очистки.
Стадия 4: (RS)-5-(2,2-диметил-1,1-дифенил-пропокси)-6,6-диметил-[1,3]оксазинан-2-он

(1,83 мг, 5,1 ммоль) (RS)-4-амино-3-(трет-бутил-дифенил-силанилокси)-2-метил-бутан-2-ола (Пример 95, стадия 3) растворяли в THF (35 мл) и охлаждали до 0-5°С. Добавляли по каплям растворенные в 15 мл THF триэтиламин (2,14 мл, 15,4 ммоль, 3 эквив.) и трифосген (1,67 г, 5,63 ммоль, 1,1 эквив.) при 0-5°С. Смесь перемешивали в течение 1 ч при 0-5°С. Реакционную смесь вместе с ISOLUTE выпаривали и неочищенный продукт очищали с помощью флэш-хроматографии путем прямого нанесения остатка на колонку с силикагелем, элюировали градиентом гептакэтилацетат, от 100:0 до 0:100. Целевое соединение, (RS)-5-(2,2-диметил-1,1-дифенил-пропокси)-6,6-диметил-[1,3]оксазинан-2-он (535 мг, выход 27%) получали в виде белого твердого вещества, MS: m/e=384,3 (M+H+).
Стадия 5: (RS)-5-(2,2-диметил-1,1-дифенил-пропокси)6,6-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-[1,3]-оксазинан-2-он

Указанное в заголовке соединение получали в виде желтого масла, MS: m/e=557,3 (M+H+), аналогично тому, как описано в Примере 37, стадия 2, из 2-бром-5-триметилсиланилэтинил-пиридина (Пример 37, стадия 1) и (RS)-5-(2,2-диметил-1,1-дифенил-пропокси)-6,6-диметил-[1,3]оксазинан-2-она (Пример 95, стадия 4).
Стадия 6: (RS)-5-гидрокси-6,6-диметил-3-(5-Фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=323,1 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из (RS)-5-(2,2-диметил-1,1-дифенил-пропокси)-6,6-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-она (Пример 95, стадия 5) и иодбензола.
Пример 96
4-Метил-6-(5-фенилэтинил-пиридин-2-ил)-4,6-диаза-спиро[2.4]гептан-5-он

Стадия 1: 2-бром-5-фенилэтинил-пиридин

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=258/260 (M+H+), аналогично тому, как описано в Примере 37, стадия 1, из 2-бром-5-иодпиридина, с использованием фенилацетилена вместо этинилтриметилсилана.
Стадия 2: 4,6-диаза-спиро[2.4]гептан-5-он

(0,88 г, 5,53 ммоль) 1-(аминометил)циклопропанамина дигидрохлорида (CAS 849149-67-3) растворяли в THF (10 мл) и добавляли CDI (0,9 г, 5,53 ммоль, 1,0 эквив.) при комнатной температуре. Смесь перемешивали в течение 16 ч при 70°С. Реакционную смесь выпаривали и экстрагировали с помощью насыщенного раствора NaHCO3 и затем пять раз дихлорметаном. Органические слои высушивали над Na2SO4 и выпаривали досуха. Целевое соединение, 4,6-диаза-спиро[2.4]гептан-5-он (0.52 г, чистота 50%, выход 42%) получали в виде белого твердого вещества, MS: m/e=113,0 (M+H+) и использовали без дополнительной очистки в следующей стадии.
Стадия 3: 6-(5-фенилэтинил-пиридин-2-ил)-4,6-диаза-спиро[2.4]гептан-5-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=290,1 (M+H+), аналогично тому, как описано в Примере 37, стадия 2, из 2-бром-5-фенилэтинил-пиридина (Пример 96, стадия 1) и 4,6-диаза-спиро[2.4]гептан-5-она (Пример 96, стадия 2).
Стадия 4: 4-метил-6-(5-фенилэтинил-пиридин-2-ил)-4,6-диаза-спиро[2.4]гептан-5-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=304,1 (M+H+), аналогично тому, как описано в Примере 16, из 6-(5-фенилзтинил-пиридин-2-ил)-4,6-диаза-спиро[2.4]гептан-5-она (Пример 96, стадия 3) и иодметана.
Пример 97
3,3-Диметил-1-(5-фенилэтинил-пиридин-2-ил)-азетидин-2-он

Стадия 1: N-(5-бром-пиридин-2-ил)-3-хлор-2,2-диметил-пропионамид

К раствору 2-амино-5-бромпиридина (100 мг, 0,454 ммоль) в дихлорметане (6 мл) добавляли триэтиламин (0,19 мл, 1,364 ммоль, 3 эквив.) и 3-хлор-2,2-диметил-пропионил хлорид (CAS 4300-97-4) (140 мг, 0,909 ммоль, 2 эквив.) при 0-5°С. Смесь перемешивали в течение 16 ч при комнатной температуре. Реакционную смесь выпаривали и неочищенный продукт очищали с помощью флэш-хроматографии на колонке с силикагелем, элюировали градиентом этилацетат: гептан, от 5:95 до 10:90. Целевое соединение, N-(5-бром-пиридин-2-ил)-3-хлор-2,2-диметил-пропионамид (154 мг, выход 74%) получали в виде белого твердого вещества.
Стадия 2: 1-(5-бром-пиридин-2-ил)-3.3-диметил-азетидин-2-он

(250 мг, 0,738 ммоль) N-(5-бром-пиридин-2-ил)-3-хлор-2,2-диметил-пропионамида (Пример 97, стадия 1), растворенного в DMF (3 мл), добавляли при комнатной температуре к раствору NaH (29,5 мг, 0,738 ммоль, 1 эквив.) в 5 мл DMF. Смесь перемешивали в течение 3 ч при 70°С. Реакционную смесь выпаривали и неочищенный продукт очищали с помощью флэш-хроматографии на колонке с силикагелем, элюировали градиентом этилацетаттептан, от 10:90 до 15:85. Целевое соединение, 1-(5-бром-пиридин-2-ил)-3,3-диметил-азетидин-2-он (160 мг, выход 72%) получали в виде белого твердого вещества.
Стадия 3: 3,3-диметил-1-(5-фенилэтинил-пиридин-2-ил)-азетидин-2-он

Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=277,0 (М+H+), аналогично тому, как описано в Примере 1, стадия 3, из 1-(5-бром-пиридин-2-ил)-3,3-диметил-азетидин-2-она (Пример 97, стадия 2) и фенилацетилена.
Пример 98
(1RS,5SR)-6-(5-Пиридин-3-илэтинил-пиридин-2-ил)-6-аза-бицикло[3.2.0]гептан-7-он

Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=290,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (1RS,5SR)-6-(5-бром-пиридин-2-ил)-6-аза-бицикло[3.2.0]гептан-7-она (Пример 46, стадия 1) и 3-этинил-пиридина.
Пример 99
(3aSR,7aRS)-(3aRS,7RS)-1-Этил-3-(5-фенилэтинил-пиридин-2-ил)-октагидро-бензоимидазол-2-он

Стадия 1: (3aSR,7aRS)-(3aRS,7aRS)-1-(5-иод-пиридин-2-ил)-3-этил-октагидро-бензоимидазол-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=372,2 (M+H+), аналогично тому, как описано в Примере 16, из (3aSR,7aRS)-(3aRS,7aRS)-1-(5-иод-пиридин-2-ил)-октагидро-бензоимидазол-2-она (Пример 84, стадия 2) и иодэтана путем перемешивания реакционной смеси при 60°С вместо 0-5°С.
Стадия 2: (3aSR,7aRS)-(3aRS,7RS)-1-Этил-3-(5-фенилэтинил-пиридин-2-ил)-октагидро-бензоимидазол-2-он

Указанное в заголовке соединение получали в виде коричневого масла, MS: m/e=346,4 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (3aSR,7aRS)-(3aRS,7aRS)-1-(5-иод-пиридин-2-ил)-3-этил-октагидро-бензоимидазол-2-она (Пример 99, стадия 1) и фенилацетилена.
Пример 100
(3aSR,7aRS)-(3aRS,7RS)-1-Этил-3-(5-пиридин-3-илэтинил-пиридин-2-ил)-октагидро-бензоимидазол-2-он

Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=347,8 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (3aSR,7aRS)-(3aRS,7aRS)-1-(5-иод-пиридин-2-ил)-3-этил-октагидро-бензоимидазол-2-она (Пример 99, стадия 1) и 3-этинил-пиридина.
Пример 101
(3aSR,7aRS)-(3aRS,7RS)-1-Изопропил-3-(5-фенилэтинил-пиридин-2-ил)-октагидро-бензоимидазол-2-он

Стадия 1: (3aSR,7aRS)-(3aRS,7aRS)-1-(5-иод-пиридин-2-ил)-3-изопропил-октагидро-бензоимидазол-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества аналогично тому, как описано в Примере 16, из (3aSR,7aRS)-(3aRS,7aRS)-1-(5-иод-пиридин-2-ил)-октагидро-бензоимидазол-2-она (Пример 84, стадия 2) и изопропилиодида путем перемешивания реакционной смеси при 60°С вместо 0-5°С.
Стадия 2: (3aSR,7aRS)-(3aRS,7RS)-1-изопропил-3-(5-Фенилэтинил-пиридин-2-ил)-октагидро-бензоимидазол-2-он

Указанное в заголовке соединение получали в виде коричневого масла, MS: m/e=360,1 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (3aSR,7aRS)-(3aRS,7aRS)-1-(5-иод-пиридин-2-ил)-3-изопропил-октагидро-бензоимидазол-2-она (Пример 101, стадия 1) и фенилацетилена.
Пример 102
(4aRS,7aSR)-3-(5-Фенилэтинил-пиридин-2-ил)-гексагидро-циклопента[е][1,3]оксазин-2-он

Стадия 1: (4aRS,7aSR)-3-(5-иод-пиридин-2-ил)-гексагидро-циклопента[е][1,3]оксазин-2-он
Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=345,0 (М+H+), способами, аналогичными описанным в Примере 1, стадия 1 и стадия 2, из 2-фтор-6-иодпиридина и (1SR,2RS)-2-аминометил-циклопентанола (CAS 40482-02-8) с использованием трифосгена и триэтиламина в THF, в течение 12 ч при комнатной температуре вместо условий, применяемых в Примере 1, стадия 2.
Стадия 2: (4aRS,7aSR)-3-(5-Фенилэтинил-пиридин-2-ил)-гексагидро-циклопента[е][1,3]оксазин-2-он

Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=319,0 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (4aRS,7aSR)-3-(5-иод-пиридин-2-ил)-гексагидро-циклопента[е][1,3]оксазин-2-она (Пример 102, стадия 1) и фенилацетилена.
Пример 103
(4aRS,7aRS)-3-(5-Фенилэтинил-пиридин-2-ил)-гексагидро-циклопента[е][1,3]оксазин-2-он

Стадия 1: (4aRS,7aRS)-3-(5-иод-пиридин-2-ил)-гексагидро-циклопента[e]]1,3]оксазин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=345,0 (М+Н+), способами, аналогичными описанным в Примере 1, стадия 1 и стадия 2, из 2-фтор-5-иодпиридина и (1SR,2SR)-2-аминометил-циклопентанола (CAS 40482-00-6) с использованием трифосгена и триэтиламина в THF, в течение 12 ч при комнатной температуре вместо условий, применяемых в Примере 1, стадия 2.
Стадия 2: (4aRS,7aRS)-3-(5-Фенилэтинил-пиридин-2-ил)-гексагидро-ииклопента[e][1,3]оксазин-2-он

Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=318,8 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (4aRS,7aRS)-3-(5-иод-пиридин-2-ил)-гексагидро-циклопента[e][1,3]оксазин-2-она (Пример 103, стадия 1) и фенилацетилена.
Пример 104
(RS)-5,6,6-Триметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Стадия 1: трет-бутиловый эфир (RS)-(3-гидрокси-2,3-диметил-бутил)карбаминовой кислоты

Указанное в заголовке соединение получали в виде бесцветного масла, MS: m/e=218,3 (M+H+), аналогично тому, как описано в Примере 95, стадия 2, из метил-3-(трет-бутоксикарбониламино)-2-метилпропионата (CAS 182486-16-4).
Стадия 2: (RS)-5,6,6-триметил-[1,3]оксазинан-2-он
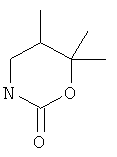
Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=144,0 (M+H+), аналогично тому, как описано в Примере 72, стадия 2, из трет-бутилового эфира (RS)-(3-гидрокси-2,3-диметил-бутил)карбаминовой кислоты (Пример 104, стадия 1).
Стадия 3: (RS)-5,6,6-триметил-3-(5-Фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде желтого масла, MS: m/e=321,1 (M+H+), аналогично тому, как описано в Примере 37, стадия 2, из 2-бром-5-фенилэтинил-пиридина (Пример 96, стадия 1) и (RS)-5,6,6-триметил-[1,3]оксазинан-2-она (Пример 104, стадия 2).
Пример 105
(RS)-6-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=323,1 (M+H+), аналогично тому, как описано в Примере 37, стадия 2, из 2-бром-5-фенилэтинил-пиридина (Пример 96, стадия 1) и (RS)-6-метоксиметил-[1,3]оксазинан-2-она (CAS 39754-63-7).
Пример 106
(3aRS,6aSR)-1-метил-3-(5-(фенилэтинил)пиридин-2-ил)гексагидроциклопента[d]имидазол-2(1Н)-он

Стадия 1: трет-бутиловый эфир (3aSR,6aRS)-2-оксо-гексагидро-циклопентаимидазол-1-карбоновой кислоты:

Раствор (rac)-цис-2-(трет-бутоксикарбониламино)циклопентанкарбоновой кислоты (2,28 г, 9,98 ммоль) и N-метилморфолина (1,1 г, 1,21 мл, 11,0 ммоль, 1,1 эквив.) в 28 мл дихлорэтана перемешивали при комнатной температуре в течение 10 мин. Затем добавляли азид дифенилфосфорной кислоты (3,02 г, 2,37 мл, 11,0 ммоль, 1,1 эквив.) по каплям при комнатной температуре, и бесцветный раствор перемешивали в течение 45 мин при комнатной температуре, в результате чего раствор приобрел светло-желтый цвет. Раствор затем нагревали до 75°С, перемешивали в течение ночи и охлаждали. После обработки смесью дихлорметан/вода, объединенные органические слои выпаривали досуха. Оранжевые кристаллы растирали с этилацетатом и фильтровали с получением 1,27 г белых кристаллов. Маточный раствор концентрировали и образовавшиеся кристаллы вещества снова фильтровали с получением дополнительных 0,55 г продукта. Общий выход может достигать 1,82 г (81%) указанного в заголовке соединения в виде кристаллического белого вещества, MS: m/e=227,3 (М+Н+).
Стадия 2: трет-бутиловый эфир (3aSR,6аР8)-3-метил-2-оксо-гексагидро-циклопентаимидазол-1-карбоновой кислоты:

К раствору трет-бутилового эфира (3aSR,6aRS)-2-оксо-гексагидро-циклопентаимидазол-1-карбоновой кислоты (Пример 106, стадия 1) (1,82 г, 8,04 ммоль) в 30 мл DMF добавляли 60% суспензию гидрида натрия в минеральном масле (386 мг, 9,65 ммоль, 1,2 эквив.). Суспензию перемешивали в течение 45 мин при комнатной температуре (с выделением газа), затем добавляли иодметан (0,604 мл, 9,65 ммоль, 1,2 эквив.) и смесь перемешивали при комнатной температуре в течение ночи. После концентрирования в вакууме и обработки смесью этилацетат/вода получали 2,05 г желтого масла, содержащего капли минерального масла, которое непосредственно использовали в следующей стадии без дополнительной характеристики.
Стадия 3: (3aRS,6aSR)-1-метил-гексагидро-циклопентаимидазол-2-он:

К раствору трет-бутилового эфира (3aSR,6aRS)-3-метил-2-оксо-гексагидро-циклопентаимидазол-1-карбоновой кислоты (Пример 106, стадия 2) (1,99 г, 8,28 ммоль) в 30 мл дихлорметана добавляли трифторуксусную кислоту (7,55 г, 5,1 мл, 66,3 ммоль, 8 эквив.) и желтый раствор перемешивали в течение 5 ч при комнатной температуре. Реакционную смесь гасили добавлением насыщенного раствора бикарбоната натрия и доводили pH водной фазы до 9. После обработки смесью дихлорметан/вода органические слои высушивали, фильтровали и концентрировали в вакууме с получением 1,07 г грязно-белого твердого вещества, которое растворяли в холодном этилацетате и фильтровали с получением указанного в заголовке соединения (822 мг, 71%) в виде белых кристаллов, которое непосредственно использовали в следующей стадии без дополнительной характеристики.
Стадия 4: (3aRS,6aRS)-1-метил-3-(5-(фенилэтинил) пиридин-2-ил)гексагидроциклопента[d]имидазол-2(1Н)-он:

К суспензии 2-бром-5-(фенилэтинил)пиридина (Пример 96, стадия 1) (55,0 мг, 0,213 ммоль), (3aR,6aS)-1-метилгексагидроциклопента[с1]имидазол-2(1Н)-она (Пример 106, стадия 3) (35,8 мг, 0,256 ммоль, 1,2 эквив.), 139 мг карбоната цезия (139 мг, 0,426 ммоль, 2 эквив.) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (ксантофос) (5 мг, 0,008 ммоль, 0,04 эквив.) в 1 мл толуола добавляли трис(дибензилиденацетон)дипалладий(0) (Pd2(dba)3) (4 мг, 0,0046 ммоль, 0,02 эквив.) в атмосфере аргона. Смесь перемешивали в течение ночи при 70°С. Смесь непосредственно наносили на колонку с 20 г силикагеля и элюировали градиентом гептан - 33% этилацетат в гептане с получением указанного в заголовке соединения (49 мг, 73%) в виде аморфного светло-желтого твердого вещества, MS:m/e=318,1 (М+Н+).
Пример 107
(RS)-4-трет-бутил-3-метил-1-(5-фенилэтинил-пиридин-2-ил)" имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=334,1 (M+H+), способами, аналогичными описанным в Примере 106, исходя из (rac)-2-(трет-бутоксикарбониламино-метил)-3,3-диметил-масляной кислоты вместо (rac)-цис-2-(трет-бутоксикарбониламино)циклопентанкарбоновой кислоты.
Пример 108
1-[5-(3-Фтор-фенилэтинил)-3-метил-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Стадия 1: 4,4-диметил-1-(3-метил-5-триметилсиланилэтинил-пиридин-2-ил)-имидазолидин-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=302,1 (M+H+), аналогично тому, как описано в Примере 37, стадия 2, из 2-бром-3-метил-5-триметилсиланилэтинил-пиридина (Пример 41, стадия 1) и 4,4-диметил-имидазолидин-2-она (CAS 24572-33-6).
Стадия 2: 1-[5-(3-фтор-фенилэтинил)-3-метил-пиридин-2-ил]-4,4-диметил-имидазолидин-2-он
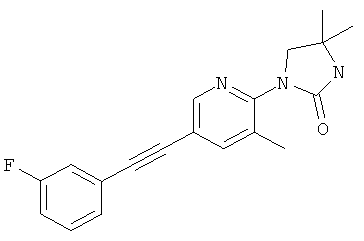
Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=324,4 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 4,4-диметил-1-(3-метил-5-триметилсиланилэтинил-пиридин-2-ил)-имидазолидин-2-она (Пример 108, стадия 1) и 1-фтор-3-иодбензола.
Стадия 3: 1-[5-(3-фтор-фенилэтинил)-3-метил-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=338,3 (М+H+), аналогично тому, как описано в Примере 16, из 1-[5-(3-фтор-фенилэтинил)-3-метил-пиридин-2-ил]-4,4-диметил-имидазолидин-2-она (Пример 108, стадия 2) и иодметана.
Пример 109
(3aSR,6aRS)-1-[5-(3-Фтор-фенилэтинил)-пиридин-2-ил]-3-метил-гексагидро-циклопента-имидазол-2-он

Стадия 1: (3aRS,6aSR)-1-метил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-гексагидро-циклопента-имидазол-2-он

Указанное в заголовке соединение, грязно-белое твердое вещество, MS: m/e=314,1 (M+H+), получали в соответствии с общей схемой, описанной в Примере 106, стадия 4, исходя из 2-бром-5-((триметилсилил)этинил)-пиридина (Пример 37, стадия 1) и (3aRS,6aSR)-1-метилгексагидроциклопента[d]имидазол-2(1Н)-она (Пример 106, стадия 3).
Стадия 2: (3aSR,6aRS)-1-[5-(3-фтор-фенилэтинил)-пиридин-2-ил]-3-метил-гексагидро-циклопента-имидазол-2-он

Указанное в заголовке соединение, светло-желтое масло, MS: m/e=336,2 (M+H+), получали в соответствии с общей схемой, описанной в Примере 37, стадия 3, исходя из (3aRS,6aSR)-1-метил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-гексагидро-циклопента-имидазол-2-она (Пример 109, стадия 1) и 1-фтор-3-иодбензола.
Пример 110
1-[3-Фтор-5-(4-фтор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Стадия 1: 1-(3-фтор-5-иод-пиридин-2-ил)-4,4-диметил-имидазолидин-2-он

2,3-Дифтор-5-иодпиридин (300 мг, 1,24 ммоль) растворяли в 2 мл толуола. Добавляли (140 мг, 1,24 ммоль, 1 эквив.) 4,4-диметилимидазолидин-2-она (CAS 24572-33-6) и карбоната цезия (650 мг, 1,99 ммоль, 1,6 эквив.) и нагревали смесь до 100°С в течение 4 ч. Реакционную смесь наносили непосредственно на колонку с силикагелем и очищали с помощью флэш-хроматографии, элюировали градиентом этилацетат: гептан, от 0:100 до 100:0. Целевое соединение, 1-(3-фтор-5-иод-пиридин-2-ил)-4,4-диметил-имидазолидин-2-он (205 мг, выход 49%) получали в виде белого твердого вещества, MS: m/e=336,1 (M+H+).
Стадия 2: 1-(3-фтор-5-иод-пиридин-2-ил)-3,4,4-триметил-имидазолидин-2-он
Указанное в заголовке соединение, желтое масло, MS: m/e=350,0 (M+H+), получали в соответствии с общей схемой, описанной в Примере 16, из 1-(3-фтор-5-иод-пиридин-2-ил)-4,4-диметил-имидазолидин-2-она (Пример 110, стадия 1) и иодметана.
Стадия 3: 1-[3-фтор-5-(4-фтор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=342,1 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из 1-(3-фтор-5-иод-пиридин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 110, стадия 2) и 1-этинил-4-фторбензола.
Пример 111
1-[3-Фтор-5-(3-фтор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=342,1 (М+Н+), аналогично тому, как описано в Примере 1, стадия 3, из 1-(3-фтор-5-иод-пиридин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 110, стадия 2) и 1-этинил-3-фторбензола.
Пример 112
6-[5-(4-Фтор-фенилэтинил)-пиридин-2-ил]-4-метил-4,6-диаза-спиро[2.4]гептан-5-он

Стадия 1: 4-метил-4.6-диаза-спироГ2.41 гептан-5-он

Указанное в заголовке соединение получали в виде белого твердого вещества способами, аналогичными описанным в Примере 106, стадии 1-3, исходя из 1-((трет-бутоксикарбониламино)метил)циклопропанкарбоновой кислоты вместо (rac)-цис-2-(трет-бутоксикарбониламино)циклопентанкарбоновой кислоты.
Стадия 2: 4-метил-6-(5-триметилсиланилэтинил-пиридин-2-ил)-4,6-диаза-спиро[2.4]гептан-5-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=300,2 (М+Н+), аналогично тому, как описано в Примере 37, стадия 2, из 2-бром-5-триметилсиланилэтинил-пиридина (Пример 37, стадия 1) и 4-метил-4,6-диаза-спиро[2.4]гептан-5-она (Пример 112, стадия 1).
Стадия 3: 6-[5-(4-фтор-фенилэтинил)-пиридин-2-ил]-4-метил-4,6-диаза-спиро[2.4]гептан-5-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=322,2 (М+H+), аналогично тому, как описано в Примере 37, стадия 3, из 4-метил-6-(5-триметилсиланилэтинил-пиридин-2-ил)-4,6-диаза-спиро[2.4]гептан-5-она (Пример 112, стадия 2) и Ч-фтор-4-иодбензола.
Пример 113
6-[5-(3-Фтор-фенилэтинил)-пиридин-2-ил]-4-метил-4,6-диаза-спиро[2.4]гептан-5-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=322,2 (М+Н+), аналогично тому, как описано в Примере 37, стадия 3, из 4-метил-6-(5-триметилсиланилэтинил-пиридин-2-ил)-4,6-диаза-спиро[2.4]гептан-5-она (Пример 112, стадия 2) и 1-фтор-3-иодбензола.
Пример 114
(RS)-5-метокси-6,6-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Стадия 1: метиловый эфир (К3)-3-бензилоксикарбониламино-2-метокси-пропионовой кислоты

Указанное в заголовке соединение получали аналогично тому, как описано в Примере 16, исходя из метилового эфира (RS)-3-бензилоксикарбониламино-2-гидрокси-пропионовой кислоты, который непосредственно использовали в следующей стадии без дополнительной характеристики.
Стадия 2: (RS)-5-метокси-6,6-диметил-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде светло-желтого масла, MS: m/e=160,2 (M+H+), способами, аналогичными описанным в Примере 95, стадия 2 и Пример 72, стадия 2, из метилового эфира (RS)-3-бензилоксикарбониламино-2-метокси-пропионовой кислоты (Пример 114, стадия 1).
Стадия 3: (RS)-5-метокси-6,6-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде светло-желтого масла, MS: m/e=337,3 (М+H+), аналогично тому, как описано в Примере 37, стадия 2, из 2-бром-5-фенилэтинил-пиридина (Пример 96, стадия 1) и (RS)-5-метокси-6,6-диметил-[1,3]оксазинан-2-она (Пример 114, стадия 2).
Пример 115
4,4-Диметил-1-(5-фенилэтинил-пиримидин-2-ил)-прирролидин-2-он

Стадия 1: 2-метансульфонил-5-фенилэтинил-пиримидин

Растворяли бис-(трифенилфосфин)-палладий(II)дихлорид (1,48 г, 2,11 ммоль, 0,05 эквив.) в 200 мл THF. Добавляли (10 г, 42,2 ммоль) 5-бром-2-(метилсульфонил)пиримидина и (9,26 мл, 84,4 ммоль, 2 эквив.) фенилацетилена при комнатной температуре. Добавляли триэтиламин (17,6 мл, 127 ммоль, 3 эквив.), трифенилфосфин (330 мг, 1,3 ммоль, 0,03 эквив.) и иодид меди (I) (80 мг, 420 мкмоль, 0,01 эквив.) и перемешивали смесь в течение 4 ч при 65°C. Реакционную смесь охлаждали и экстрагировали с помощью насыщенного раствора NaHCO3 и затем два раза с помощью EtOAc. Органические слои экстрагировали водой, высушивали над сульфатом натрия и выпаривали досуха. Неочищенный продукт очищали с помощью флэш-хроматографии на колонке с силикагелем, элюировали градиентом этилацетат: гептан, от 0:100 до 100:0. Целевое соединение, 2-метансульфонил-5-фенилэтинил-пиримидин (6,2 г, выход 57%) получали в виде желтого твердого вещества, MS: m/e=259,1 (М+Н+).
Стадия 2: 4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)-прирролидин-2-он

(100 мг, 0,39 ммоль) 2-метансульфонил-5-фенилэтинил-пиримидина (Пример 115, стадия 1) растворяли в 1 мл диоксана. Добавляли 4,4-диметилприрролидин-2-он (53 мг, 465 мкмоль, 1,2 эквив.) и карбонат цезия (190 мг, 580 мкмоль, 1,5 эквив.) при комнатной температуре. Смесь перемешивали в течение 4 ч при 100°С. Реакционную смесь охлаждали, выпаривали и экстрагировали с помощью насыщенного раствора NaHCO3 и затем дважды небольшими объемами дихлорметана. Неочищенный продукт очищали с помощью флэш-хроматографии путем прямого нанесения слоев дихлорметана на колонку с силикагелем, элюировали градиентом этилацетат:гептан, от 0:100 до 100:0. Целевое соединение, 4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)-прирролидин-2-он (32 мг, выход 28%) получали в виде светло-желтого твердого вещества, MS: m/e=292,1 (M+H+).
Пример 116
5,5-Диметил-1-(5-фенилэтинил-пиримидин-2-ил)-пиперидин-2-он

Указанное в заголовке соединение получали в виде коричневого масла, MS: m/e=306,2 (M+H+), аналогично тому, как описано в Примере 115, стадия 2, из 2-метансульфонил-5-фенилэтинил-пиримидина (Пример 115, стадия 1) и 5,5-диметилпиперидин-2-она (CAS 4007-79-8).
Пример 117
2-(5-Фенилэтинил-пиримидин-2-ил)-2-аза-спиро[4.4]нонан-3-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=318,2 (M+H+), аналогично тому, как описано в Примере 115, стадия 2, из 2-метансульфонил-5-фенилэтинил-пиримидина (Пример 115, стадия 1) и 2-аза-спиро[4.4]нонан-3-она (CAS 75751-72-3).
Пример 118
1-[5-(3-Фтор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-прирролидин-2-он

Стадия 1: 1-(5-бром-пиримидин-2-ил)-4,4-диметил-прирролидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=270,1/272,2 (М+Н+), аналогично тому, как описано в Примере 115, стадия 2, из 5-бром-2-фторпиримидина и 4,4-диметилприрролидин-2-она.
Стадия 2: 1-[5-(3-фтор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-прирролидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=310,2 (M+H+), аналогично тому, как описано в Примере 115, стадия 1, из 1-(5-бром-пиримидин-2-ил)-4,4-диметил-прирролидин-2-она (Пример 118, стадия 1) и 1-этинил-3-фтор-бензола.
Пример 119
1-[5-(3-Хлор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-прирролидин-2-он

Стадия 1: 2-хлор-5-(3-хлор-фенилэтинил)-пиримидин

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=248/250 (М+H+), аналогично тому, как описано в Примере 115, стадия 1, из 2-хлор-5-иодпиримидина и 1-хлор-3-этинил-бензола.
Стадия 2: 1-[5-(3-хлор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-прирролидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=326,3/328,3 (М+H+), аналогично тому, как описано в Примере 115, стадия 2, из 2-хлор-5-(3-хлор-фенилэтинил)-пиримидина (Пример 119, стадия 1) и 4,4-диметилприрролидин-2-она.
Пример 120
1-[5-(4-Фтор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-прирролидин-2-он

Стадия 1: 2-бром-5-триметилсиланилэтинил-пиримидин

2-Бром-5-иодпиримидин (1,2 г, 4,2 ммоль) растворяли в атмосфере азота в 25 мл THF. Добавляли бис-(трифенилфосфин)-палладий(II)дихлорид (300 мг, 420 мкмоль, 0,1 эквив.), этинилтриметилсилан (540 мг, 0,77 мл, 5,48 ммоль, 1,3 эквив.), триэтиламин (0,85 г, 1,17 мл, 8,4 ммоль, 2 эквив.) и иодид меди (I) (40 мг, 210 мкмоль, 0,05 эквив.) и перемешивали смесь в течение 4 ч при 50°С. Реакционную смесь охлаждали и выпаривали досуха. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле, элюировали градиентом этилацетат:гептан, от 0:100 до 40:60. Целевое соединение, 2-бром-5-триметилсиланилэтинил-пиримидин (0,75 г, выход 70%) получали в виде желтого твердого вещества, MS: m/e=255/257 (M+H+).
Стадия 2: 4,4-диметил-1-(5-триметилсиланилэтинил-пиримидин-2-ил)-прирролидин-2-он

Растворяли (200 мг, 0,78 ммоль) 2-бром-5-триметилсиланилэтинил-пиримидина (Пример 120, стадия 1) в толуоле (7 мл) и добавляли 4,4-диметилприрролидин-2-он (89 мг, 0,78 ммоль, 1,0 эквив.), карбонат цезия (410 мг, 1,25 ммоль, 1,6 эквив.), ксантофос (CAS 161265-03-8) (18 мг, 0,03 ммоль, 0,04 эквив.) и Ра2(dba)3 (14 мг, 0,01 ммоль, 0,02 эквив.) в атмосфере азота. Смесь перемешивали в течение 2 ч при 90°С. Неочищенный продукт очищали с помощью флэш-хроматографии путем прямого нанесения смеси в толуоле на колонку с силикагелем, элюировали градиентом этилацетаттептан, от 0:100 до 100:0. Целевое соединение, 4,4-диметил-1-(5-триметилсиланилэтинил-пиримидин-2-ил)-прирролидин-2-он (164 мг, выход 73%) получали в виде светло-красных кристаллов, MS: m/e=288,1 (М+Н+).
Стадия 3: 1-[5-(4-фтор-фенилэтинил)-пиридин-2-ил]-4,4-диметил-прирролидин-2-он

4,4-Диметил-1-(5-триметилсиланилэтинил-пиримидин-2-ил)-прирролидин-2-он (Пример 120, стадия 2) (30 мг, 0,1 ммоль) растворяли в DMF (1 мл). Добавляли 1-фтор-4-иодбензол (32 мг, 0,14 ммоль, 1,4 эквив.), Et3N (43 мкл, 0,31 ммоль, 3 эквив.), бис-(трифенилфосфин)-палладий(И)дихлорид (4 мг, 5,2 мкмоль, 0,05 эквив.) и иодид меди (I) (0,6 мг, 3,1 мкмоль, 0,03 эквив.) в атмосфере азота и нагревали смесь до 70°С. Добавляли по каплям 1М TBAF в THF (115 мкл, 0,115 ммоль, 1,1 эквив.) в течение 20 мин при 70°С. Реакционную смесь перемешивали в течение 30 мин при 70°С и выпаривали вместе с ISOLUTE досуха. Неочищенный продукт очищали с помощью флэш-хроматографии на колонке с 20 г силикагеля, элюировали с помощью смеси гептан:этилацетат в соотношении от 100:0 до 0:100. Целевое соединение, 1-[5-(4-фтор-фенилэтинил)-пиридин-2-ил]-4,4-диметил-прирролидин-2-он (24 мг, выход 73%) получали в виде белого твердого вещества, MS: m/e=310,1 (M+H+).
Пример 121
1-[5-(2,5-Дифтор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-прирролидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=328,2 (M+H+), аналогично тому, как описано в Примере 120, стадия 3, из 4,4-диметил-1-(5-триметилсиланилэтинил-пиримидин-2-ил)-прирролидин-2-она (Пример 120, стадия 2) и 1,4-дифтор-2-иодбензола.
Пример 122
3,4,4-Триметил-1-(5-фенилэтинил-пиримидин-2-ил)-имидазолидин-2-он

Стадия 1: 1-(5-иод-пиримидин-2-ил)-4,4-диметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=319 (M+H+), аналогично тому, как описано в Примере 115, стадия 2, из 2-хлор-5-иодпиримидина и 4,4-диметил-имидазолидин-2-она (CAS 24572-33-6).
Стадия 2: 1-(5-иод-пиримидин-2-ил)-3,4,4-триметил-имидазолидин-2-он
(55 мг, 173 мкмоль) 1-(5-иод-пиримидин-2-ил)-4,4-диметил-имидазолидин-2-она (Пример 122, стадия 1) растворяли в DMF (1 мл) и охлаждали до 0-5°С. Добавляли NaH (55%) (9 мг, 225 мкмоль, 1,3 эквив.) и перемешивали смесь в течение 30 мин при 0-5°С. Добавляли иодметан (13 мкл, 200 мкмоль, 1,2 эквив.) и перемешивали смесь в течение 30 мин без охлаждающей ванны. Реакционную смесь обрабатывали насыщенным раствором NaHCO3 и экстрагировали дважды небольшими объемами CH2Cl2. Органические слои наносили непосредственно на колонку с силикагелем и неочищенное вещество очищали с помощью флэш-хроматографии на силикагеле (20 г, градиент этилацетат/гептан, от 0:100 до 100:0). Целевое соединение, 1-(5-иод-пиримидин-2-ил)-3,4,4-триметил-имидазолидин-2-он (31 мг, выход 54%) получали в виде белого твердого вещества, MS: m/e=333,1 (M+H+).
Стадия 3: 3.4,4-триметил-1-(5-фенилэтинил-пиримидин-2-ил)-имидазолидин-2-он

Указанное в заголовке соединение получали в виде желтого масла, MS: m/e=307,4 (M+H+), аналогично тому, как описано в Примере 115, стадия 1, из 1-(5-иод-пиримидин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 122, стадия 2) и фенилацетилена.
Пример 123
1-[5-(3-Фтор-фенилэтинил)-пиримидин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=325,2 (М+Н+), аналогично тому, как описано в Примере 115, стадия 1, из 1-(5-иод-пиримидин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 122, стадия 2) и 1-этинил-3-фтор-бензола.
Пример 124
1-[5-(2,5-Дифтор-фенилэтинил)-пиримидин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Стадия 1: 4,4-диметил-1-(5-триметилсиланилэтинил-пиримидин-2-ил)-имидазолидин-2-он

10 Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=289,0 (М+H+), аналогично тому, как описано в Примере 120, стадия 2, из 2-бром-6-триметилсиланилэтинил-пиримидина (Пример 120, стадия 1) и 4,4-диметил-имидазолидин-2-она (CAS 24572-33-6).
Стадия 2: 1-[5-(2,5-дифтор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=329,2 (M+H+), аналогично тому, как описано в Примере 120, стадия 3, из 4,4-диметил-1-(5-триметилсиланилэтинил-пиримидин-2-ил)-имидазолидин-2-она (Пример 124, стадия 1) и 1,4-дифтор-2-иодбензола.
Стадия 3: 1-[5-(2,5-дифтор-фенилэтинил)-пиримидин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=343,1 (M+H+), аналогично тому, как описано в Примере 122, стадия 2, из 1-[5-(2,5-дифтор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-имидазолидин-2-она (Пример 124, стадия 2) и иодметана.
Пример 125
1-[5-(4-Фтор-фенилэтинил)-пиримидин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=325,2 (M+H+), аналогично тому, как описано в Примере 115, стадия 1, из 1-(5-иод-пиримидин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 122, стадия 2) и 1-этинил-4-фтор-бензола.
Пример 126
1-[5-(3,4-Дифтор-фенилэтинил)-пиримидин-2-ил]-3,4,4-триметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=343,1 (M+H+), аналогично тому, как описано в Примере 115, стадия 1, из 1-(5-иод-пиримидин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 122, стадия 2) и 4-этинил-1,2-дифтор-бензола.
Пример 127
(RS)-3-метокси-4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)-прирролидин-2-он

Стадия 1: (RS)-4-иод-N-(5-иод-пиримидин-2-ил)-2-метокси-3,3-диметил-бутирамид
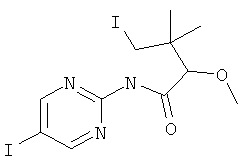
Указанное в заголовке соединение получали в виде оранжевого твердого вещества, MS: m/e=476,0 (М+H+), аналогично тому, как описано в патенте WO 9637466, стр.17, стадия 2, исходя из (RS)-3-метокси-4,4-диметил-дигидро-фуран-2-она (CAS 100101-82-4) вместо 3-t-бутилкарбамоилокси-тетрагидрофуран-2-она, и с использованием 2-амино-5-иодпиримидина вместо 2-амино-4-трифторметилпиридина.
Стадия 2: (RS)-1-(5-иод-пиримидин-2-ил)-3-метокси-4,4-диметил-прирролидин-2-он
Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=348,0 (М+Н+), аналогично тому, как описано в патенте WO 9637466, стр.17, стадия 3, из (RS)-4-иод-N-(5-иод-пиримидин-2-ил)-2-метокси-3,3-диметил-бутирамида (Пример 127, стадия 1).
Стадия 3: (RS)-3-метокси-4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)-прирролидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=322,2 (М+Н+), аналогично тому, как описано в Примере 115, стадия 1, из (RS)-1-(5-иод-пиримидин-2-ил)-3-метокси-4,4-диметил-прирролидин-2-она (Пример 127, стадия 2) и фенилацетилена.
Пример 128
(5R или 5S)-5-метоксиметил-3-(5-фенилэтинил-пиримидин-2-ил)-оксазолидин-2-он
 или
или 
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=322,3 (М+Н+), получали путем разделения (RS)-3-метокси-4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)-прирролидин-2-она (Пример 127) с помощью хиральной колонки (CHIRALPAK AD, с использованием смеси гептан:изопропанол 90:10 в качестве растворителя).
Пример 129
(5S или 5R)-5-метоксиметил-3-(5-фенилэтинил-пиримидин-2-ил)-оксазолидин-2-он
 или
или 
Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=322,3 (M+H+), получали путем разделения (RS)-3-метокси-4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)-прирролидин-2-она (Пример 127) с помощью хиральной колонки (CHIRALPAK AD, с использованием смеси гептан:изопропанол 90:10 в качестве растворителя).
Пример 130
(RS)-1-[5-(3-Фтор-фенилэтинил)-пиримидин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=340,2 (М+H+), аналогично тому, как описано в Примере 115, стадия 1, из (RS)-1-(5-иод-пиримидин-2-ил)-3-метокси-4,4-диметил-прирролидин-2-она (Пример 127, стадия 2) и 1-этинил-3-фтор-бензола.
Пример 131
(R или S)-1-[5-(3-Фтор-фенилэтинил)-пиримидин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он
 или
или 
Указанное в заголовке соединение, белые кристаллы, MS: m/e=340,3 (M+H+), получали путем разделения (Р8)-1-[5-(3-фтор-фенилэтинил)-пиримидин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-она (Пример 130) с помощью хиральной колонки (CHIRALPAK AD, с использованием смеси гептан:изопропанол 90:10 в качестве растворителя).
Пример 132
(S или R)-1-[5-(3-Фтор-фенилэтинил)-пиримидин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он
 или
или 
Указанное в заголовке соединение, белые кристаллы, MS: m/e=340,3 (M+H+), получали путем разделения (RS)-1-[5-(3-фтор-фенилэтинил)-пиримидин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-она (Пример 130) с помощью хиральной колонки (CHIRALPAK AD, с использованием смеси гептан:изопропанол 90:10 в качестве растворителя).
Пример 133
(R или S)-1-[5-(2,5-Дифтор-фенилэтинил)-пиримидин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он
 или
или 
Стадия 1: (RS)-3-метокси-4,4-диметил-1-(5-триметилсиланилэтинил-пиримидин-2-ил)-прирролидин-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=318,1 (М+Н+), аналогично тому, как описано в Примере 115, стадия 1, из (RS)-1-(5-иод-пиримидин-2-ил)-3-метокси-4,4-диметил-прирролидин-2-она (Пример 127, стадия 2) и этинил-триметил-силана.
Стадия 2: (RS)-1-[5-(2,5-дифтор-фенилэтинил)-пиримидин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=358,1 (M+H+), аналогично тому, как описано в Примере 120, стадия 3, из (RS)-3-метокси-4,4-диметил-1-(5-триметилсиланилэтинил-пиримидин-2-ил)-прирролидин-2-она (Пример 133, стадия 1) и 1,4-дифтор-2-иод-бензола.
Стадия 3: (R или 5)-1-[5-(2,5-диФтор-Фенилэтинил)-пиримидин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-он
 или
или 
Указанное в заголовке соединение, белые кристаллы, MS: m/e=358,1 (М+H+), получали путем разделения (RS)-1-[5-(2,5-дифтор-фенилэтинил)-пиримидин-2-ил]-3-метокси-4,4-диметил-прирролидин-2-она (Пример 133, стадия 2) с помощью хиральной колонки (Reprosil Chiral NR, с использованием смеси гептан: EtOH 70:30 в качестве растворителя).
Пример 134
4,4-Диметил-1-(5-фенилэтинил-пиримидин-2-ил)-пиперидин-2-он

Стадия 1: 4,4-диметил-1-(5-триметилсиланилэтинил-пиримидин-2-ил)-пиперидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=302,2 (М+Н+), аналогично тому, как описано в Примере 115, стадия 1, из 2, из 2-бром-5-триметилсиланилэтинил-пиримидина (Пример 120, стадия 1) и 4,4-диметил-пиперидин-2-она (CAS 55047-81-9).
Стадия 2: 4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)-пиперидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=306,3 (М+H+), аналогично тому, как описано в Примере 120, стадия 3, из 4,4-диметил-1-(5-триметилсиланилэтинил-пиримидин-2-ил)-пиперидин-2-она (Пример 134, стадия 1) и иодбензола.
Пример 135
1-[5-(3-Фтор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-пиперидин-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=324,2 (М+H+), аналогично тому, как описано в Примере 120, стадия 3, из 4,4-диметил-1-(5-триметилсиланилэтинил-пиримидин-2-ил)-пиперидин-2-она (Пример 134, стадия 1) и 1-фтор-3-иодбензола.
Пример 136
1-[5-(2,5-Дифтор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-пиперидин-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=342,3 (M+H+), аналогично тому, как описано в Примере 120, стадия 3, из 4,4-диметил-1-(5-триметилсиланилэтинил-пиримидин-2-ил)-пиперидин-2-она (Пример 134, стадия 1) и 2,5-дифтор-3-иодбензола.
Пример 137
3,4,4-Триметил-5'-фенилэтинил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-он

Стадия 1: 4,4-диметил-тетрагидро-пиримидин-2-он
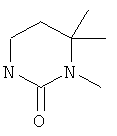
(3,4 г, 14,3 ммоль) трет-бутилового эфира (3-амино-3-метил-бутил)карбаминовой кислоты гидрохлорида растворяли в THF (60 мл) и добавляли KOtBu (6,4 г, 57,1 ммоль, 4 эквив.). Смесь перемешивали в течение 16 ч при 60°С и затем выпаривали вместе с ISOLUTE досуха. Неочищенный продукт очищали с помощью флэш-хроматографии путем прямого нанесения остатка на колонку с силикагелем, элюировали градиентом этилацетат:метанол, от 100:0 до 70:30. Целевое соединение, 4,4-диметил-тетрагидро-пиримидин-2-он (1,65 г, выход 90%) получали в виде светло-желтого твердого вещества, MS: m/e=129,1 (M+H+).
Стадия 2: 4,4-диметил-5'-триметилсиланилэтинил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-он
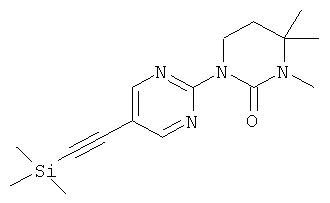
Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=303,2 (М+H+), аналогично тому, как описано в Примере 120, стадия 2, из 2, из 2-бром-5-триметилсиланилэтинил-пиримидина (Пример 120, стадия 1) и 4,4-диметил-тетрагидро-пиримидин-2-она (Пример 137, стадия 1).
Стадия 3: 4,4-диметил-5'-фенилэтинил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=329,2 (М+H+), аналогично тому, как описано в Примере 120, стадия 3, из 4,4-диметил-5'-триметилсиланилэтинил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-она (Пример 137, стадия 2) и иодбензола.
Стадия 4: 3.4,4-триметил-5'-фенилэтинил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=321,1 (М+Н+), аналогично тому, как описано в Примере 122, стадия 2, из 4,4-диметил-5'-фенилэтинил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-она (Пример 137, стадия 3) и иодметана.
Пример 138
5'-(3-Фтор-фенилэтинил)-3,4,4-триметил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-он

Стадия 1: 5'-(3-фтор-фенилэтинил)-4,4-диметил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=325,2 (М+Н+), аналогично тому, как описано в Примере 120, стадия 3, из 4,4-диметил-5'-триметилсиланилэтинил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-она (Пример 137, стадия 2) и 1-фтор-3-иодбензола.
Стадия 2: 5'-(3-фтор-фенилэтинил)-3,4,4-триметил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-он

Указанное в заголовке соединение получали в виде желтого масла, MS: m/e=339,2 (М+Н+), аналогично тому, как описано в Примере 122, стадия 2, из 5'-(3-фтор-фенилэтинил)-4,4-диметил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-она (Пример 138, стадия 1) и иодметана.
Пример 139
5'-(2,5-Дифтор-фенилэтинил)-3,4,4-триметил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-он

Стадия 1: 5'-(2,5-дифтор-фенилэтинил)-4,4-диметил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=343,1 (M+H+), аналогично тому, как описано в Примере 120, стадия 3, из 4,4-диметил-5'-триметилсиланилэтинил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-она (Пример 137, стадия 2) и 1,4-дифтор-2-иодбензола.
Стадия 2: 5'-(2,5-дифтор-фенилэтинил)-3.4,4-триметил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=357,2 (M+H+), аналогично тому, как описано в Примере 122, стадия 2, из 5'-(2,5-дифтор-фенилэтинил)-4,4-диметил-3,4,5,6-тетрагидро-[1,2']бипиримидинил-2-она (Пример 139, стадия 1) и иодметана.
Пример 140
3-Изопропил-4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)-имидазолидин-2-он

Стадия 1: 1-(5-иод-пиримидин-2-ил)-3-изопропил-4,4-диметил-имидазолидин-2-он
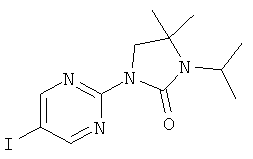
Указанное в заголовке соединение получали в виде светло-желтого масла, MS: m/e=361,0 (М+Н+), аналогично тому, как описано в Примере 122, стадия 2, из 1-(5-иод-пиримидин-2-ил)-4,4-диметил-имидазолидин-2-она (Пример 122, стадия 1) и 2-иодпропана.
Стадия 2: 3-изопропил-4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=335,2 (M+H+), аналогично тому, как описано в Примере 115, стадия 1, из 1-(5-иод-пиримидин-2-ил)-3-изопропил-4,4-диметил-имидазолидин-2-она (Пример 140, стадия 1) и фенилацетилена.
Пример 141
1-[5-(3-Фтор-фенилэтинил)-пиримидин-2-ил]-3-изопропил-4,4-диметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=353,3 (M+H+), аналогично тому, как описано в Примере 115, стадия 1, из 1-(5-иод-пиримидин-2-ил)-3-изопропил-4,4-диметил-имидазолидин-2-она (Пример 140, стадия 1) и 1-этинил-3-фторбензола.
Пример 142
1-[5-(4-Фтор-фенилэтинил)-пиримидин-2-ил]-3-изопропил-4,4-диметил-имидазолиди н-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=353.3 (М+Н+), аналогично тому, как описано в Примере 115, стадия 1, из 1-(5-иод-пиримидин-2-ил)-3-изопропил-4,4-диметил-имидазолидин-2-она (Пример 140, стадия 1) и 1-этинил-4-фторбензола.
Пример 143
1-[5-(4-Фтор-фенилэтинил)-пиримидин-2-ил]-3-этил-4,4-диметил-имидазолидин-2-он

Стадия 1: 1-(5-бром-пиримидин-2-ил)-4,4-диметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=271,1/273,1 (M+H+), аналогично тому, как описано в Примере 120, стадия 2, из 5-бром-2-иодпиримидина и 4,4-диметил-имидазолидин-2-она (CAS 24572-33-6).
Стадия 2: 1-(5-бром-пиримидин-2-ил)-3-этил-4,4-диметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=299,2/301,2 (M+H+), аналогично тому, как описано в Примере 122, стадия 2, из 1-(5-бром-пиримидин-2-ил)-4,4-диметил-имидазолидин-2-она (Пример 143, стадия 1) и этилиодида.
Стадия 3: 1-(5-иод-пиримидин-2-ил)-3-этил-4,4-диметил-имидазолидин-2-он
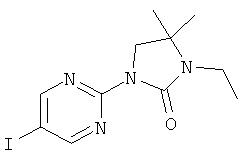
(350 мг, 1,17 ммоль) 1-(5-бром-пиримидин-2-ил)-3-этил-4,4-диметил-имидазолидин-2-она (Пример 143, стадия 2) растворяли в диоксане (20 мл) и добавляли иодид натрия (700 мг, 4,68 ммоль, 4 эквив.), иодид меди (I) (21 мг, 0,234 ммоль, 0,2 эквив.) и транс-N,N'-диметилцикпогексан-1,2-диамин (33 мг, 37 мкл, 0,234 ммоль, 0,2 эквив.). Смесь перемешивали в течение 16 ч при 100°С. Реакционную смесь охлаждали и экстрагировали с помощью насыщенного раствора NaHCO3 и затем два раза этилацетатом. Органические слои экстрагировали солевым раствором, высушивали над сульфатом натрия и выпаривали досуха. Целевое соединение, 1-(5-иод-пиримидин-2-ил)-3-этил-4,4-диметил-имидазолидин-2-он (350 мг, выход 86%) получали в виде коричневого твердого вещества, MS: m/e=347,0 (M+H+) и использовали без дополнительной очистки в следующей стадии.
Стадия 4: 1-[5-(4-фтор-фенилэтинил)-пиримидин-2-ил]-3-этил-4,4-диметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=339,3 (М+H+), аналогично тому, как описано в Примере 115, стадия 1, из 1-(5-иод-пиримидин-2-ил)-3-этил-4,4-диметил-имидазолидин-2-она (Пример 143, стадия 3) и 1-этинил-4-фторбензола.
Пример 144
1-[5-(3-Фтор-фенилэтинил)-пиримидин-2-ил]-3-этил-4,4-диметил-имидазолидин-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=339,3 (M+H+), аналогично тому, как описано в Примере 115, стадия 1, из 1-(5-иод-пиримидин-2-ил)-3-этил-4,4-диметил-имидазолидин-2-она (Пример 143, стадия 3) и 1-этинил-3-фторбензола.
Пример 145
(RS)-5,6,6-Триметил-3-(5-фенилэтинил-пиримидин-2-ил)-[1,3]оксазинан-2-он

Стадия 1: трет-бутиловый эфир (RS)-(3-гидрокси-2.3-диметил-бутил)карбаминовой кислоты

Указанное в заголовке соединение получали в виде бесцветного масла, MS: m/e=218,3 (M+H+), аналогично тому, как описано в Примере 95, стадия 2, из метил 3-(трет-бутоксикарбониламино)-2-метилпропионата (CAS 182486-16-4).
Стадия 2: (RS)-5,6,6-триметил-[1,3]оксазинан-2-он
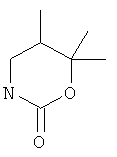
Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=144,0 (M+H+), аналогично тому, как описано в Примере 72, стадия 2, из трет-бутилового эфира (RS)-(3-гидрокси-2,3-диметил-бутил)карбаминовой кислоты (Пример 145, стадия 1).
Стадия 3: 2-бром-5-фенилэтинил-пиримидин

Указанное в заголовке соединение получали в виде белого твердого вещества аналогично тому, как описано в Примере 120, стадия 1, из 2-бром-5-иодпиримидина и фенилацетилена.
Стадия 4: (RS)-5,6,6-триметил-3-(5-Фенилэтинил-пиримидин-2-ил)-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=322,2 (М+H+), аналогично тому, как описано в Примере 120, стадия 2, из 2-бром-5-фенилэтинил-пиримидина (Пример 145, стадия 3) и (RS)-5,6,6-триметил-[1,3]оксазинан-2-она (Пример 145, стадия 2).
Пример 146
(RS)-3-[5-(2,5-Дифтор-фенилэтинил)-пиримидин-2-ил]-5,6,6-триметил-[1,3]оксазинан-2-он

Стадия 1: (RS)-5,6,6-триметил-3-(5-триметилсиланилэтинил-пиримидин-2-ил)-[1,3]оксазинан-2-он
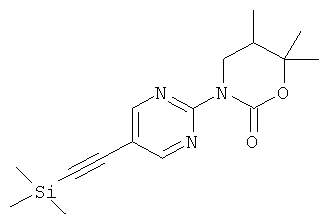
Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e=318,1 (М+Н+), аналогично тому, как описано в Примере 120, стадия 2, из 2-бром-5-триметилсиланилэтинил-пиримидина (Пример 120, стадия 1) и (RS)-5,6,6-триметил-[1,3]оксазинан-2-она (Пример 145, стадия 2).
Стадия 2: (RS)-3-[5-(2,5-диФтор-фенилэтинил)-пиримидин-2-ил]-5,6,6-триметил-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=358,4 (М+Н+), аналогично тому, как описано в Примере 120, стадия 3, из (RS)-5,6,6-триметил-3-(5-триметилсиланилэтинил-пиримидин-2-ил)-[1,3]оксазинан-2-она (Пример 146, стадия 1) и 1,4-дифтор-2-иодбензола.
Пример 147
4-Метил-6-(5-фенилэтинил-пиримидин-2-ил)-4,6-диаза-спиро[2.4]гептан-5-он

Стадия 1: 4-метил-4,6-диаза-спиро[2.4]гептан-5-он

Указанное в заголовке соединение получали в виде белого твердого вещества способами, аналогичными описанным в Примере 106, стадии 1-3, исходя из 1-((трет-бутоксикарбониламино)метил)циклопропанкарбоновой кислоты вместо (rac)-цис-2-(трет-бутоксикарбониламино)циклопентанкарбоновой кислоты.
Стадия 2: 4-метил-6-(5-фенилэтинил-пиримидин-2-ил)-4,6-диаза-спиро[2.4]гептан-5-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=305.3 (М+H+), аналогично тому, как описано в Примере 120, стадия 2, из 2-бром-5-фенилэтинил-пиримидина (Пример 145, стадия 3) и 4-метил-4,6-диаза-спиро[2.4]гептан-5-она (Пример 147, стадия 1).
Пример 148
(RS)-3-[5-(3-Фтор-фенилэтинил)-пиримидин-2-ил]-5,6,6-триметил-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=340,1 (M+H+), аналогично тому, как описано в Примере 120, стадия 3, из (RS)-5,6,6-триметил-3-(5-триметилсиланилэтинил-пиримидин-2-ил)-[1,3]оксазинан-2-она (Пример 146, стадия 1) и 1-фтор-3-иодбензола.
Пример 149
(RS)-3-[5-(4-Фтор-фенилэтинил)-пиримидин-2-ил]-5,6,6-триметил-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=340,1 (M+H+), аналогично тому, как описано в Примере 120, стадия 3, из (RS)-5,6,6-триметил-3-(5-триметилсиланилэтинил-пиримидин-2-ил)-[1,3]оксазинан-2-она (Пример 146, стадия 1) и 1-фтор-4-иодбензола.
Пример 150
4,4-Диметил-1-(6-(фенилэтинил)пиридазин-3-ил)прирролидин-2-он

К раствору 3-хлор-6-(фенилэтинил)пиридазина (CAS 77778-15-5) (180 мг, 839 мкмоль) и 4,4-диметилприрролидин-2-она (CAS 66899-02-3) (142 мг, 1,26 ммоль, 1,5 эквив.) в 2 мл DMF добавляли карбонат цезия (546 мг, 1,68 ммоль, 2 эквив.). Суспензию нагревали 16 ч при 120°С и затем остужали до комнатной температуры. Добавляли этилацетат (10 мл) и отфильтровывали нерастворимые соли. После концентрирования в вакууме остаток растворяли в 10 мл этилацетата. Добавляли силикагель (4 г) и суспензию выпаривали досуха. Силикагель с адсорбированной неочищенной смесью наносили на колонку для флэш-хроматографии с 20 г силикагеля и элюировали 3 мин с помощью гептана, а затем градиентом гептан - 45% этилацетат в гептане, в течение 25 мин, с получением 36 мг (выход 15%) указанного в заголовке соединения в виде желтых кристаллов, MS: m/e=292,3 (M+H+).
Пример 151
4,4-Диметил-1-(6-(фенилэтинил)пиридазин-3-ил)пиперидин-2-он

Стадия 1: 3-иод-6-(фенилэтинил)пиридазин

К раствору 100 мг (0,466 ммоль) 3-хлор-6-(фенилэтинил)пиридазина в 5 мл ацетонитрила добавляли иодид натрия (209 мг, 1,4 ммоль, 3 эквив.), уксусную кислоту (56 мг, 53,3 мл, 0,93 ммоль, 2 эквив.) и 95% серную кислоту (4,6 мг, 2,5 мл, 0,47 ммоль, 1 эквив.). Оранжевый раствор перемешивали в течение 8 ч при 70°С и затем остужали и выдерживали в течение ночи. После обычной обработки смесью этилацетат/вода остаток адсорбировали на 4 г силикагеля и очищали с помощью флэш-хроматографии на колонке с 20 г силикагеля с помощью градиента гептан -50% этилацетат в гептане, с получением 82 мг (выход 58%) указанного в заголовке соединения в виде светло-желтых кристаллов, MS: m/e=307,1 (M+H+).
Стадия 2: 4,4-диметил-1-(6-(фенилэтинил)пиридазин-3-ил)пиперидин-2-он

К тщательно перемешанной суспензии 3-иод-6-(фенилэтинил)пиридазина (Пример 151, стадия 1) (80 мг, 261 мкмоль), 4,4-диметилпиперидин-2-она (66,5 мг, 314 мкмоль, 1,2 эквив.) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (ксантофоса) (6,05 мг, 10,5 мкмоль, 0,04 эквив.) в 2 мл толуола добавляли в атмосфере аргона трис(дибензилиденацетон)дипалладий(0) (Pd2(dba)3) (4,79 мг, 5,23 мкмоль, 0,02 эквив.) и перемешивали смесь в течение 4 ч при 100°С. Неочищенную смесь непосредственно очищали с помощью флэш-хроматографии на колонке с 20 г силикагеля с помощью градиента гептан - 50% этилацетат в гептане, и получали 18 мг (выход 23%) указанного в заголовке соединения в виде белого твердого вещества, MS: m/e=306,2 (М+Н+).
Пример 152
5,5-Диметил-3-(6-(фенилэтинил)пиридазин-3-ил)оксазолидин-2-он

Стадия 1: 2-метил-1-(6-фенилэтинил-пиридазин-3-иламино)-пропан-2-ол

Раствор 3-хлор-6-(фенилэтинил)пиридазина (CAS 77778-15-5) (300 мг, 1,4 ммоль) и 1-амино-2-метилпропан-2-ола (137 мг, 147 мкл, 1,54 ммоль, 1,1 эквив.) в 3 мл пиридина нагревали в течение 20 ч при 120°С в закрытой пробирке. Растворитель удаляли в вакууме. Остаток растворяли в смеси этилацетат/метанол, адсорбировали на 4 г силикагеля и очищали на колонке для флэш-хроматографии с 20 г наполнителя с помощью градиента гептан-этилацетат, с получением 90 мг (выход 24%) указанного в заголовке соединения в виде светло-желтых кристаллов, MS: m/e=268,2 (M+H+).
Стадия 2: 5,5-диметил-3-(6-(фенилэтинил)пиридазин-3-ил)оксазолидин-2-он

Раствор 2-метил-1-(6-(фенилэтинил)пиридазин-3-иламино)пропам-2-ола {Пример 152, стадия 1) (90 мг, 337 мкмоль) и триэтиламина (102 мг, 141 мкл, 1,01 ммоль, 3 эквив.) в 4 мл THF охлаждали до 0-5°С, затем добавляли трифосген (99,9 мг, 337 мкмоль, 1 эквив.) и реакционную смесь перемешивали в течение 1 ч при 0-5°С. Реакционную смесь гасили с помощью 5 мл 5% раствора бикарбоната натрия и обрабатывали смесью этилацетат/вода. Неочищенное вещество адсорбировали на силикагель и очищали с помощью флэш-хроматографии с помощью градиента 5 гептан - 50% этилацетат в гептане с получением указанного в заголовке соединения (51 мг, выход 52%) в виде светло-желтых кристаллов, MS: m/e=294,2 (M+H+).
Пример 153
6,6-Диметил-3-(6-(фенилэтинил)пиридазин-3-ил)-1,3-оксазинан-2-он

Стадия 1: 2-метил-4-(6-фенилэтинил-пиридазин-3-иламино)-бутан-2-ол

Раствор 3-хлор-6-(фенилэтинил)пиридазина (CAS 77778-15-5) (125 мг, 0,582 ммоль), 4-амино-2-метилбутан-2-ола гидрохлорида (244 мг, 1,75 ммоль, 3 эквив.) и триэтиламина (206 мг, 284 мл, 2,04 ммоль, 2 эквив.) в 1,25 мл пиридина нагревали в течение 20 ч при 85°С. Растворитель удаляли в вакууме. Остаток растворяли в смеси этилацетат/метанол, адсорбировали на 4 г силикагеля и очищали на колонке для флэш-хроматоргафии с 20 г наполнителя с помощью градиента гептан/этилацетат в соотношении от 85:15 до 15:85, с получением 44 мг (выход 27%) указанного в заголовке соединения в виде белых кристаллов, MS: m/e=282,2 (M+H+).
Стадия 2: 6.6-диметил-3-(6-(фенилэтинил)пиридазин-3-ил)-1.3-оксазинан-2-он

Указанное в заголовке соединение, кристаллическое желтое вещество, MS: m/e=308,3 (M+H+), получали в соответствии с общей схемой, описанной в Примере 152, стадия 2, исходя из 2-метил-4-(6-фенилэтинил-пиридазин-3-иламино)-бутан-2-ола (Пример 153, стадия 1) и трифосгена.
Пример 154
3,4,4-Триметил-1-(6-(м-толилэтинил)пиридазин-3-ил)имидазолидин-2-он

Стадия 1: N-1-(6-иод-пиридазин-3-ил)-2-метил-пропан-1,2-диамин

Суспензию 3-хлор-6-иод-пиридазина (CAS 135034-10-5) (500 мг, 2,08 ммоль) и 2-метилпропан-1,2-диамина (220 мг, 262 мкл, 2,5 ммоль, 1,2 эквив.) в 4 мл пиридина нагревали в течение 16 ч при 100°С. Растворитель удаляли в вакууме. Неочищенное вещество (508 мг) непосредственно использовали в следующей стадии.
Стадия 2: 1-(6-хлор-пиридазин-3-ил)-4,4-диметил-имидазолидин-2-он:
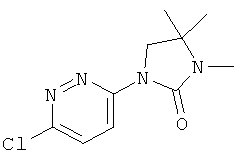
К раствору неочищенного N-1-(6-иодпиридазин-3-ил)-2-метилпропан-1,2-диамина (Пример 154, стадия 1) (580 мг, 1,99 ммоль) и пиридина (346 мг, 353 мкл, 4,37 ммоль, 2,2 эквив.) в 5 мл дихлорметана добавляли по каплям (1,96 г, 2,1 мл, 3,97 ммоль, 2 эквив.) 20% раствора фосгена в толуоле при 0-2°С в течение 10 мин. После перемешивания в течение 2 ч при 0-4°С, реакционную смесь доводили до комнатной температуры и выдерживали в течение ночи. Реакционную смесь гасили с помощью 5 мл 5% раствора бикарбоната натрия и обрабатывали смесью дихлорметан/вода. Неочищенное вещество адсорбировали на силикагель и очищали с помощью флэш-хроматографии с помощью градиента гептан - 80% этилацетат в гептане, с получением указанного в заголовке соединения (в котором иод полностью замещен хлором) (140 мг, выход 31%) в виде белых кристаллов, MS: m/e=227,2, 229,4 (М+Н+).
Стадия 3: 1-(6-хлор-пиридазин-3-ил)-3.4.4-триметил-имидазолидин-2-он

К раствору 1-(6-хлорпиридазин-3-ил)-4,4-диметилимидазолидин-2-она (Пример 154, стадия 2) (140 мг, 618 мкмоль) в DMF (3 мл) добавляли 60% суспензию гидрида натрия (37,1 мг, 926 мкмоль, 1,5 эквив.). После перемешивания при комнатной температуре в течение 10 мин, добавляли иодметан (132 мг, 57,9 мкл, 926 мкмоль, 1,5 эквив.) и суспензию перемешивали в течение 1 ч при комнатной температуре. Растворитель удаляли в вакууме и остаток обрабатывали смесью этилацетат/вода. Указанное в заголовке соединение получали в виде светло-коричневых кристаллов (129 мг, выход 87%), MS: m/e=241,2, 243,4 (M+H+).
Стадия 4: 1-(6-иод-пиридазин-3-ил)-3,4,4-триметил-имидазолидин-2-он

Указанное в заголовке соединение, кристаллическое светло-желтое вещество (149 мг, 86%), MS: m/e=333,0 (M+hT), получали из 1-(6-хлор-пиридазин-3-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 154, стадия 3) в соответствии с общей схемой, описанной в Примере 151, стадия 1, путем катализируемого кислотой замещения хлора на иод.
Стадия 5: 3,4,4-триметил-1-(6-(м-толилэтинил)пиридазин-3-ил)имидазолидин-2-он

К раствору 1-(6-иодпиридазин-3-ил)-3,4,4-триметилимидазолидин-2-она (Пример 154, стадия 4) (75 мг, 226 мкмоль), 1-этинил-3-метилбензола (44,6 мг, 49,5 мкл, 384 мкмоль, 1,7 эквив.), триэтиламина (68,5 мг, 94,4 мкл, 677 мкмоль, 3 эквив.), бис(трифенилфосфин)палладия (II) хлорида (9,51 мг, 13,5 мкмоль, 0,06 эквив.) и трифенилфосфина (1,78 мг, 6,77 мкмоль, 0,03 эквив.) в 2 мл THF добавляли добавляли в атмосфере аргона иодид меди (I) (1,29 мг, 6,77 мкмоль, 0,03 эквив.). Суспензию нагревали до 60°С в течение 2 ч, растворяли в 5 мл этилацетата и адсорбировали на 4 г силикагеля. Очищали с помощью флэш-хроматографии на силикагеле с помощью градиента гептан - 50% этилацетат/гептан, с получением указанного в заголовке соединение в виде светло-желтых кристаллов (18 мг, выход 25%), MS: m/e=321,2 (M+H+).
Пример 155
1-(6-((3-Хлорфенил)этинил)пиридазин-3-ил)-3,4,4-триметилимидазолидин-2-он

Указанное в заголовке соединение, кристаллическое желтое вещество (36 мг, выход 47%), MS: m/e=341,2, 343,3 (M+H+), получали в соответствии с общей схемой, описанной в Примере 154, стадия 5, исходя из 1-(6-иод-пиридазин-3-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 154, стадия 4) и 3-хлорфенил-ацетилена.
Пример 156
3,4,4-Триметил-1-(5-(фенилэтинил)пиразин-2-ил)имидазолидин-2-он

Стадия 1: N-1-(5-иод-пиразин-2-ил)-2-метил-пропан-1,2-диамин
К раствору 2-бром-5-иодпиразина (CAS 622392-04-5) (250 мг, 878 мкмоль) 0,7 мл пиридина, добавляли 2-метилпропан-1,2-диамин (116 мг, 138 мкл, 1,32 ммоль, 1,5 эквив.) при комнатной температуре. Бесцветный раствор перемешивал в течение 16 ч при 100°С. Реакционную смесь охлаждали и концентрировали вакууме. Неочищенное вещество непосредственно использовали в следующе стадии.
Стадия 2: 1-(5-иод-пиразин-2-ил)-4,4-диметил-имидазолидин-2-он
Указанное в заголовке соединение, грязно-белое твердое вещество (72 мг, выход 26%), получали в соответствии с общей схемой, описанной в Примере 154, стадия 2, исходя из N-1-(5-иод-пиразин-2-ил)-2-метил-пропан-1,2-диамина (Пример 156, стадия 1), путем циклизации с помощью фосгена. Неочищенное вещество непосредственно использовали в следующей стадии без дополнительной характеристики.
Стадия 3: 1 -(5-иод-пиразин-2-ил)-3,4,4-триметил-имидазолидин-2-он
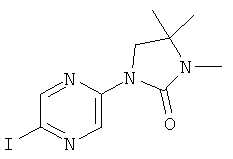
Указанное в заголовке соединение, грязно-белое твердое вещество (77 мг, выход 99%), получали в соответствии с общей схемой, описанной в Примере 154, стадия 3; путем алкилирования 1-(5-иод-пиразин-2-ил)-4,4-диметил-имидазолидин-2-она (Пример 156, стадия 2) с помощью метилиодида. Неочищенное вещество непосредственно использовали в следующей стадии без дополнительной характеристики.
Стадия 4: '3,4,4-триметил-1-(5-(фенилэтинил)пиразин-2-ил)имидазолидин-2-он

Указанное в заголовке соединение, кристаллическое желтое вещество (69 мг, выход 75%), MS: m/e=307,3 (М+Н+), получали в соответствии с общей схемой, описанной в Примере 154, стадия 5, исходя из 1-(5-иод-пиразин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 156, стадия 3) и фенилацетилена.
Пример 157
3,4,4-Триметил-1-(5-(пиридин-3-илэтинил)пиразин-2-ил)имидазолидин-2-он

Указанное в заголовке соединение, кристаллическое желтое вещество, MS: m/e=308,3 (М+Н+), получали в соответствии с общей схемой, описанной в Примере 154, стадия 5;, исходя из 1-(5-иод-пиразин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 156, стадия 3) и 3-пиридилацетилена.
Пример 158
1-(5-((3-Фторфенил)этинил)пиразин-2-ил)-3,4,4-триметилимидазолидин-2-он
Указанное в заголовке соединение, кристаллическое желтое вещество, MS: m/e=325,2 (M+H+), получали в соответствии с общей схемой, описанной в Примере 154, стадия 5, исходя из 1-(5-иод-пиразин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 156, стадия 3) и 3-фторфенилацетилена.
Пример 159
1-(5-((4-Фторфенил)этинил)пиразин-2-ил)-3,4,4-триметилимидазолидин-2-он

Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=325,2 (М+Н+), получали согласно общему способу, описанному в Примере 154, стадия 5, исходя из 1-(5-иод-пиразин-2-ил)-3,4,4-триметил-имидазолидин-2-она (Пример 156, стадия 3) и 4-фторфенилацетилена.
Пример 160
4,4-Диметил-1-(5-(пиридин-3-илэтинил)пиразин-2-ил)прирролидин-2-он

Стадия 1: 1-(5-бром-пиразин-2-ил)-4,4-диметил-прирролидин-2-он
К хорошо перемешенной суспензии 2-бром-6-иодпиразина (300 мг, 1,05 ммоль), 4,4-диметилпиперидин-2-она (155 мг, 1,37 ммоль, 1,3 эквив.) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (ксантофоса) (24,4 мг, 0,042 ммоль, 0,04 эквив.) в 4 мл толуола добавляли в атмосфере аргона трис(дибензилиденацетон)дипалладий(0) (Pd2(dba)3), (19,3 мг, 0,021 ммоль, 0,02 эквив.) и перемешивали смесь в течение 5 ч при 100°С. Неочищенную смесь адсорбировали на силикагеле и очищали с помощью флэш-хроматографии на колонке с 20 г силикагеля с использованием смеси 2:1 гептан/этилацетат в качестве элюента. Указанное в заголовке соединение (151 мг, выход 53%) получали в виде белого твердого вещества, MS: m/e=270,1, 272,1 (M+H+).
Стадия 2: 4,4-диметил-1-(5-(пиридин-3-илэтинил)пиразин-2-ил)прирролидин-2-он

Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=310,4 (M+H+), получали в соответствии с общей схемой, описанной в Примере 154, стадия 5;, исходя из 1-(5-бром-пиразин-2-ил)-4,4-диметил-прирролидин-2-она (Пример 160, стадия 1) и 3-фторфенилацетилена.
Пример 161
1-(5-((3-Фторфенил)этинил)пиразин-2-ил)-4,4-диметилпиперидин-2-он

Стадия 1: 1-(5-бром-пиразин-2-ил)-4.4-диметил-пиперидин-2-он
Указанное в заголовке соединение, грязно-белое твердое вещество, MS: m/e=284,2, 286,0 (М+Н+), получали в соответствии с общей схемой, описанной в Примере 160, стадия 1, исходя из 2-бром-5-иодпиразина и 4,4-диметил-пиперидин-2-она.
Стадия 2: 1 -(5-((3-фторфенил)этинил)пиразин-2-ил)-4.4-диметилпиперидин-2-он

Указанное в заголовке соединение, грязно-белое твердое вещество, MS: m/e=324,3 (М+Н+), получали в соответствии с общей схемой, описанной в Примере 154, стадия 5, исходя из 1-(5-бром-пиразин-2-ил)-4,4-диметил-пиперидин-2-она (Пример 161, стадия 1) и 3-фторфенилацетилена.
Пример 162
4,4-Диметил-1-(5-(пиридин-3-илэтинил)пиразин-2-ил)пиперидин-2-он

Указанное в заголовке соединение, грязно-белое твердое вещество, MS: m/e=307,2 (M+H+), получали в соответствии с общей схемой, описанной в Примере 154, стадия 5, исходя из 1-(5-бром-пиразин-2-ил)-4,4-диметил-пиперидин-2-она (Пример 161, стадия 1) и 3-пиридилацетилена.
Пример 163
4,4-Диметил-1-(5-(фенилэтинил)пиразин-2-ил)пиперидин-2-он

Указанное в заголовке соединение, желтое твердое вещество, MS: m/e=306,2 (М+Н+), получали в соответствии с общей схемой, описанной в Примере 154, стадия 5, исходя из 1-(5-бром-пиразин-2-ил)-4,4-диметил-пиперидин-2-она (Пример 161, стадия 1) и фенилацетилена.
Пример 164
4,4-Диметил-1-(5-(фенилэтинил)пиразин-2-ил)тетрагидропиримидин-2(1Н)-он

Стадия 1: 1-(5-бром-пиразин-2-ил)-4,4-диметил-тетрагидро-пиримидин-2-он

Указанное в заголовке соединение, светло-коричневые кристаллы, MS: m/e=285,0, 287,0 (M+H+), получали в соответствии с общей схемой, описанной в Примере 160, стадия 1;, исходя из 2-бром-6-иодпиразина и 4,4-диметил-тетрагидро-пиримидин-2-она (Пример 137, стадия 1).
Стадия 2: 4,4-диметил-1-(5-(фенилэтинил)пиразин-2-ил)тетрагидропиримидин-2(1Н)-он

Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=307,3 (M+H+), получали согласно общему способу, описанному в Примере 45, стадия 5, исходя из 1-(5-бром-пиразин-2-ил)-4,4-диметил-тетрагидро-пиримидин-2-она (Пример 164, стадия 1) и фенилацетилена.
Пример 165
3,4,4-Триметил-1-(5-(фенилэтинил)пиразин-2-ил)тетрагидропиримидин-2(1Н)-он

К раствору 4,4-диметил-1-(5-(фенилэтинил)пиразин-2-ил)тетрагидропиримидин-2(1Н)-она (Пример 164, стадия 2) (30 мг, 0,098 ммоль) в 2 мл DMF добавляли суспензию 60% гидрида натрия (4,7 мг, 0,118 ммоль, 1,2 эквив.). После перемешивания при комнатной температуре в течение 15 мин, добавляли иодметан (7,4 мл, 16,7 мг, 0,118 ммоль, 1,2 эквив.) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали в вакууме и обрабатывали смесью этилацетат/вода. Очистка с помощью флэш-хроматографии на колонке, упакованной 20 г силикагеля, с элюцией градиентом гептан - 50% этилацетат в гептане, давала указанное в заголовке соединение (25,4 мг, выход 81%) в виде грязно-белого твердого вещества, MS: m/e=321,3 (M+H+).
Пример 166
1-(5-((3-Фторфенил)этинил)пиразин-2-ил)-4,4-диметилтетрагидропиримидин-2(1Н)-он

Указанное в заголовке соединение, грязно-белое твердое вещество, MS: m/e=325,3 (M+H+), получали в соответствии с общей схемой, описанной в Примере 154, стадия 5, исходя из 1-(5-бром-пиразин-2-ил)-4,4-диметил-тетрагидро-пиримидин-2-она (Пример 164, стадия 1) и 3-фторфенилацетилена.
Пример 167
1-(5-((3-Фторфенил)этинил)пиразин-2-ил)-3,4,4-триметилтетрагидропиримидин-2(1Н)-он

Указанное в заголовке соединение, светло-желтое твердое вещество, MS: m/e=339,1 (М+Н+), получали в соответствии с общей схемой, описанной в Примере 165, путем алкилирования 1-(5-((3-фторфенил)этинил)пиразин-2-ил)-4,4-диметилтетрагидропиримидин-2(1Н)-она (Пример 166) с помощью метилиодида.
Пример 168
6,6-Диметил-3-(5-(фенилэтинил)пиразин-2-ил)-1,3-оксазинан-2-он

Стадия 1: 2-бром-5-фенилэтинил-пиразин
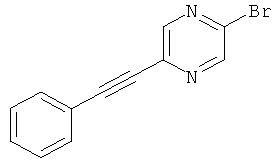
К раствору 2-бром-5-иодпиразина (500 мг, 1,76 ммоль), фенилацетилена (224 мг, 241 мкл, 2,19 ммоль, 1,25 эквив.), триэтиламина (533 мг, 734 мкл, 5,27 ммоль, 3 эквив.), бис(трифенилфосфин)палладия (II) хлорида (73,9 мг, 0,105 ммоль, 0,06 эквив.) и трифенил-фосфина (13,8 мг, 0,053 ммоль, 0,03 эквив.) в 10 мл THF добавляли в атмосфере аргона иодид меди (I) (10,0 мг, 0,053 ммоль, 0,03 эквив.). Суспензию нагревали и выдерживали при 60°С в течение ночи, растворяли в 5 мл этилацетата и адсорбировали на 4 г силикагеля. Очистка с помощью флэш-хроматографии на силикагеле с помощью смеси 2:1 этилацетат/гептане давала указанное в заголовке соединение в виде светло-коричневого твердого вещества (107 мг, выход 23%). Это вещество непосредственно использовали в следующей стадии без дополнительной характеристики.
Стадия 2: 2-метил-4-(5-фенилэтинил-пиразин-2-иламино)-бутан-2-ол
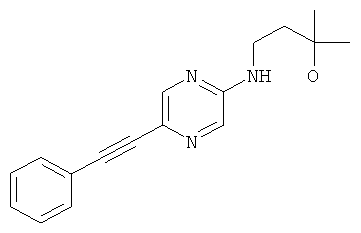
Раствор 2-бром-5-(фенилэтинил)пиразина (Пример 168, стадия 1) (158 мг, 0,061 ммоль), 4-амино-2-метилбутан-2-ола гидрохлорида (255 мг, 1,83 ммоль, 30 эквив.) и триэтиламина (185 мг, 255 мкл,1,83 ммоль, 30 эквив.) в 3 мл пиридина перемешивали в течение ночи при 85°С. Реакционную смесь концентрировали в вакууме. После обработки смесью дихлорметан/вода/соль и высушивания над сульфатом магния органические слои концентрировали в вакууме. Неочищенный продукт хроматографировали на колонке, упакованной 20 г силикагеля, элюировали с помощью градиента этилацетата в гептане, от 25% до 100%, что приводило к указанному в заголовке соединению (87,5 мг, выход 51%) в виде грязно-белого твердого вещества, MS: m/e=282,2 (M+H+).
Стадия 3: 6,6-диметил-3-(5-(фенилэтинил)пиразин-2-ил)-1,3-оксазинан-2-он

Раствор 2-метил-4-(5-(фенилэтинил)пиразин-2-иламино)бутан-2-ола (Пример 168, стадия 2) (84 мг, 0,30 ммоль) и триэтиламина (91 мг, 125 мкл, 0,90 ммоль, 3 эквив.) в 2 мл THF охлаждали до 0-5°С и добавляли порциями трифосген (89 мг, 0,30 ммоль, 1 эквив.). Смесь перемешивали в течение 1 ч при 0-5°С в течение 2 ч при комнатной температуре. Реакционную смесь гасили насыщенным раствором карбоната натрия с последующей обработкой смесью этилацетат/вода. Органические слои объединяли, высушивали и концентрировали. Неочищенный продукт хроматографировали на колонке, упакованной 20 г силикагеля, элюировали с помощью градиента гептан - 50% этилацетат в гептане с получением указанного в заголовке соединения (66,1 мг, выход 72%) в виде грязно-белого твердого вещества, MS: m/e=308,3 (М+Н+).
Пример 169
(RS)-3-[5-(3-Фтор-фенилэтинил)-пиридин-2-ил]-5-метокси-6,6-диметил-[1,3]оксазинан-2-он

Стадия 1: (RS)-5-метокси-6.6-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=333,2 (M+H+), аналогично тому, как описано в Примере 37, стадия 2, из 2-бром-5-триметилсиланилэтинил-пиридина (Пример 37, стадия 1) и (RS)-5-метокси-6,6-диметил-[1,3]оксазинан-2-она (Пример 114, стадия 2).
Стадия 2: (RS)-3-[5-(3-фтор-фенилэтинил)-пиридин-2-ил]-5-метокси-6,6-диметил-[1,3]оксазинан-2-он

Указанное в заголовке соединение получали в виде желтого масла, MS: m/e=355,0 (М+Н+), аналогично тому, как описано в Примере 37, стадия 3, из (RS)-5-метокси-6,6-диметил-3-(5-триметилсиланилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-она (Пример 169, стадия 1) и 1-фтор-3-иодбензола.
Пример 170
(3aRS,6aSR)-1-Метил-3-(6-фенилэтинил-пиридазин-3-ил)-гексагидро-циклопентаимидазол-2-он

К раствору (3aRS,6aRS)-1-метил-гексагидро-циклопентаимидазол-2-она (Пример 106, стадия 3) (55 мг, 0,39 ммоль, 1,5 эквив.) в 3 мл DMF добавляли 60% суспензию гидрида натрия в минеральном масле (17 мг, 0,42 ммоль, 1,6 эквив.). Белую суспензию перемешивали в течение 30 мин при комнатной температуре. Затем добавляли 3-хлор-6-(фенилэтинил)пиридазин (CAS 77778-15-5) (56 мг, 0,261 ммоль) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После обработки смесью этилацетат/вода, высушивания над сульфатом магния и концентрирования в вакууме остаток очищали с помощью флэш-хроматографии на силикагеле, элюировали градиентом гептан - 50% этилацетат/гептан с получением 40 мг (выход 48%) указанного в заголовке соединения в виде грязно-белого твердого вещества, MS: m/e=319,1 (M+H+).
Пример 171
(RS)-6-Метил-4-(5-фенилэтинил-пиридин-2-ил)-морфолин-3-он

Стадия 1: (RS)-4-(5-иод-пиридин-2-ил)-6-метил-морфолин-3-он
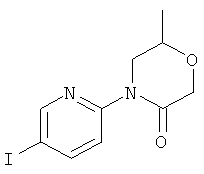
Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=319,0 (M+H+), аналогично тому, как описано в Примере 37, стадия 2, из 2,5-дииодпиридина и (RS)-6-метил-морфолин-3-она (CAS 127958-63-8).
Стадия 2: (RS)-6-метил-4-(5-Фенилэтинил-пиридин-2-ил)-морфолин-3-он

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e=293,1 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из (RS)-4-(5-иод-пиридин-2-ил)-6-метил-морфолин-3-она (Пример 171, стадия 1) и фенилацетилена.
Пример 172
6,6-Диметил-4-(5-фенилэтинил-пиридин-2-ил)-морфолин-3-он

Стадия 1: этиловый эфир (2-дибензиламино-1,1-диметил-этокси)уксусной кислоты

(4,9 г, 18,2 ммоль) 1-(дибензиламино)-2-метилпропан-2-ола (CAS 344868-41-3) растворяли в дихлорэтане (50 мл) и осторожно добавляли этил 2-диазоацетат (2,83 мл, 27,3 ммоль, 1,5 эквив.) и димер ацетата родия (II) (200 мг, 0,455 ммоль, 0,025 эквив.) при комнатной температуре. Смесь перемешивали в течение 3 ч при 80°С. Реакционную смесь выпаривали вместе с ISOLUTE, и неочищенный продукт очищали с помощью флэш-хроматографии путем прямого нанесения остатка на колонку с силикагелем, элюировали градиентом гептан:этилацетат, от 100:0 до 70:30. Целевое соединение, этиловый эфир (2-дибензиламино-1,1-диметил-этокси)уксусной кислоты (1,03 г, чистота 80%, выход 13%) получали в виде бесцветной жидкости, MS: m/e=356,3 (М+Н+). Стадия 2: 6.6-диметил-морфолин-3-он

Этиловый эфир (2-дибензиламино-1,1-диметил-этокси)-уксусной кислоты (Пример 172, стадия 1) гидрогенизировали в EtOH с помощью Pd(OH)2 в течение 16 ч при 60°С. Целевое соединение, 6,6-диметил-морфолин-3-он (585 мг, чистота 60%, количественно) получали в виде бесцветной жидкости, MS: m/e=129 (M+H+) и использовали в следующей стадии без дополнительной очистки.
Стадия 3: 6,6-диметил-4-(5-триметилсиланилэтинил-пиридин-2-ил)-морфолин-3-он

Указанное в заголовке соединение получали в виде желтого масла, MS: m/e=303,2 (M+H+), аналогично тому, как описано в Примере 37, стадия 2, из 2-бром-5-триметилсиланилэтинил-пиридина (Пример 37, стадия 1) и 6,6-диметил-морфолин-3-она (Пример 172, стадия 2).
Стадия 4: 6,6-диметил-4-(5-фенилэтинил-пиридин-2-ил)-морфолин-3-он

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e=307,3 (M+H+), аналогично тому, как описано в Примере 37, стадия 3, из 6,6-диметил-4-(5-триметилсиланилэтинил-пиридин-2-ил)-морфолин-3-она (Пример 172, стадия 3) и иодбензола.
Пример 173
1,1-Диоксо-4-(5-фенилэтинил-пиридин-2-ил)-тиоморфолин-3-он

Стадия 1: 4-(5-бром-пиридин-2-ил)-тиоморфолин-3-он

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e=273,0/274,9 (M+H+), аналогично тому, как описано в Примере 37, стадия 2, из 2,5-дибромпиридина и тиоморфолин-3-она.
Стадия 2: 4-(5-бром-пиридин-2-ил)-1,1-диоксо-тиоморфолин-3-он

(240 мг, 0,88 ммоль) 4-(5-бром-пиридин-2-ил)-тиоморфолин-3-она (Пример 173, стадия 1) растворяли в дихлорэтане (10 мл) и добавляли mCPBA (300 мг, 1,76 ммоль, 2 эквив.) при 0-5°С. Смесь перемешивали в течение 2 ч при 20-25°С. Реакционную смесь экстрагировали с помощью насыщенного раствора NaHCO3 и затем пять раз дихлорметаном. Органические слои объединяли, высушивали над Na2SO4 и выпаривали досуха. Целевое соединение, 4-(5-бром-пиридин-2-ил)-1,1-диоксо-тиоморфолин-3-он (167 мг, выход 62%), получали в виде светло-коричневого твердого вещества, MS: m/e=305,1/307,1 (M+H+).
Стадия 3: 1,1-диоксо-4-(5-фенилэтинил-пиридин-2-ил)-тиоморфолин-3-он

Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e=327,2 (M+H+), аналогично тому, как описано в Примере 1, стадия 3, из 4-(5-бром-пиридин-2-ил)-1,1-диоксо-тиоморфолин-3-она (Пример 173, стадия 2) и фенилацетилена.
Пример 174
(3aSR,6aRS)-1-[6-(3-Фтор-фенилэтинил)-пиридазин-3-ил]-3-метил-гексагидро-циклопентаимидазол-2-он

Стадия 1: 3-хлор-6-(3-фтор-фенилэтинил)-пиридазин

К тщательно премешанному раствору 2-хлор-5-иодпиразина (600 мг, 2,5 ммоль) и 3-фторфенил-ацетилена (315 мг, 303 мкл, 2,62 ммоль, 1,05 эквив.) в 7 мл THF добавляли в атмосфере аргона бис(трифенилфосфин)-палладия(II)дихлорид (175 мг, 0,250 ммоль, 0,02 эквив.), иодид меди (I) (23,8 мг, 0,125 ммоль, 0,01 эквив.) и триэтиламин (556 мг, 761 мкп, 5,49 ммоль, 2,2 эквив.). Смесь перемешивали в течение 2 ч при комнатной температуре. Неочищенную смесь фильтровали, адсорбировали на силикагель и очищали с помощью флэш-хроматографии на колонке с 50 г силикагеля с помощью градиента гептан - 25% этилацетат в гептане. Указанное в заголовке соединение (450 мг, выход 78%) получали в виде светло-желтых кристаллов, MS: m/e=233,1, 235,0 (M+H+).
Стадия 2: (3aSR,6aRS)-1-[6-(3-фтор-фенилэтинил)-пиридазин-3-ил]-3-метил-гексагидро-циклопентаимидазол-2-он

Указанное в заголовке соединение, грязно-белое твердое вещество, MS: m/e=337,2 (M+H+), получали в соответствии с общей схемой, описанной в Примере 170, исходя из 3-хлор-6-((3-фторфенил)-этинил)пиридазина и (3aRS,6aSR)-1-метил-гексагидро-циклопентаимидазол-2-она.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ЭТИНИЛА | 2010 |
|
RU2553461C2 |
| ПОЗИТИВНЫЕ АЛЛОСТЕРИЧЕСКИЕ МОДУЛЯТОРЫ (РАМ) | 2010 |
|
RU2561920C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА В КАЧЕСТВЕ АНТАГОНИСТОВ mGluR5 | 2010 |
|
RU2527106C2 |
| ПРОИЗВОДНЫЕ ОКСАЗОЛИНОВ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ ЦНС | 2010 |
|
RU2569887C2 |
| ПРОИЗВОДНЫЕ ЭТИНИЛА КАК МОДУЛЯТОРЫ МЕТАБОТРОПНОГО РЕЦЕПТОРА ГЛУТАМАТА | 2016 |
|
RU2721776C2 |
| ПРОИЗВОДНЫЕ ИНДОЛИН-2-ОНА И 1,3-ДИГИДРО-ПИРРОЛО[3,2-C]ПИРИДИН-2-ОНА | 2015 |
|
RU2697512C2 |
| ПРОИЗВОДНЫЕ ДИГИДРООКСАЗОЛ-2-АМИНА | 2011 |
|
RU2587512C2 |
| ПРОИЗВОДНЫЕ ТИАЗОЛО[4,5-c]ПИРИДИНА В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРОВ mGluR5 | 2006 |
|
RU2425834C2 |
| ЭТИНИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2016 |
|
RU2722014C2 |
| ПРОИЗВОДНЫЕ ПИРИДИН-2-КАРБОКСАМИДА В КАЧЕСТВЕ АНТАГОНИСТОВ mGluR5 | 2006 |
|
RU2411237C2 |
Изобретение относится к новому этинильному производному формулы I, в виде рацемической смеси или соответствующего энантиомера и/или оптического изомера и/или стереоизомера или к фармацевтически приемлемой соли указанных соединений, образованных добавлением кислоты. Соединения являются аллостерическими модуляторами метаботропного глутаматного рецептора 5 подтипа (mGluR5) и могут найти применение для лечения заболеваний, опосредованных действием mGluR5, где заболеванием является шизофрения, когнитивные расстройства, синдром фрагильной Х-хромосомы или аутизм. В формуле I
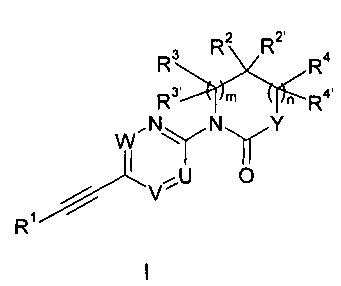
U - это N или C(R5); V - это СН или N; W - это СН или N; при условии, что только одна из групп U, V или W является атомом азота, R5 - это водород, метил или галоген; Y - это -N(R6)-, -О-, -C(R7′)(R7)-, -CH2O- или -CH2S(O)2-; причем R6 - это водород или низший алкил, a R7/R7′ независимо друг от друга представляют собой водород, гидрокси-группу, низший алкил или низшую алкокси-группу; R1 - это фенил или 5-6-членный гетероарил, содержащий 1-2 гетероатома, выбранных из атомов азота, которые могут содержать один или два заместителя, выбранных из галогена или низшего алкила; R2/R2′ независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, С3-С6-циклоалкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил или кольцо, включающее -СН2ОСН2-; m равно 0, 1 или 2; в случае если m равно 1, R3/R3′ независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил; или же R3 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять С3-6-циклоалкил или кольцо, включающее -(СН2)2ОСН2-; n равно 0 или 1; в случае если n равно 1, R4/R4′ независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил; R4 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять С3-6-циклоалкил; или если n равно 0, a Y - это -N(R6)-, то R6 и R2 могут составлять совместно с атомом углерода и атомом азота, к которому они присоединены, С3-6-циклоалкил; или если n и m равны 0, то R2 и R7 могут составлять совместно с атомом углерода, к которому они присоединены, С3-6-циклоалкил. 4 н. и 24 з.п. ф-лы, 1 табл., 174 пр.
1. Этинильное производное формулы I

в которой
U - это N или C(R5);
V - это СН или N;
W - это СН или N;
при условии, что только одна из групп U, V или W является атомом азота,
R5 - это водород, метил или галоген;
Y - это -N(R6)-, -О-, -C(R7′)(R7)-, -CH2O- или -CH2S(O)2-;
причем R6 - это водород или низший алкил, a R7/R7′ независимо друг от друга представляют собой водород, гидрокси-группу, низший алкил или низшую алкокси-группу;
R1 - это фенил или 5-6-членный гетероарил, содержащий 1-2 гетероатома, выбранных из атомов азота, которые могут содержать один или два заместителя, выбранных из галогена или низшего алкила;
R2/R2′ независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, С3-С6-циклоалкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил или кольцо, включающее -СН2ОСН2-;
m равно 0, 1 или 2;
в случае если m равно 1,
R3/R3′ независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил;
или же R3 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять С3-6-циклоалкил или кольцо, включающее -(СН2)2ОСН2-;
n равно 0 или 1;
в случае если n равно 1,
R4/R4′ независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил;
R4 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять С3-6-циклоалкил;
или если n равно 0, a Y - это -N(R6)-, то R6 и R2 могут составлять совместно с атомом углерода и атомом азота, к которому они присоединены, С3-6-циклоалкил;
или если n и m равны 0, то R2 и R7 могут составлять совместно с атомом углерода, к которому они присоединены, С3-6-циклоалкил;
или фармацевтически приемлемая соль, образованная добавлением кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или его стереоизомер.
2. Этинильное производное формулы I-A1, охватываемой формулой I, по п. 1

в которой
U - это N или C(R5);
V - это СН или N;
W - это СН или N;
при условии, что только одна из групп U, V или W может являться атомом азота;
R5 - это водород, метил или галоген;
R1 - это фенил или 5-6-членный гетероарил, содержащий 1-2 гетероатома, выбранных из атомов азота, которые могут содержать один или два заместителя, выбранных из галогена или низшего алкила;
R2/R2′ независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, С3-С6-циклоалкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил или кольцо, включающее -СН2ОСН2-;
R3/R3′ независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил;
или R3 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять С3-6-циклоалкил или кольцо, включающее -(СН2)2OCH2-;
или их фармацевтически приемлемые соли, образованные добавлением кислоты, рацемические смеси, или их соответствующие энантиомеры и/или оптические изомеры и/или их стереоизомеры.
3. Этинильное производное формулы I-A1 по п. 2, которое может представлять собой:
3-(3-фтор-5-фенилэтинил-пиридин-2-ил)-5,5-диметил-оксазолидин-2-он
(5RS)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)оксазолидин-2-он
(5R или 5S)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)оксазолидин-2-он
(5S или 5R)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)оксазолидин-2-он
5,5-диметил-3-(5-фенилэтинил-пиридин-2-ил)оксазолидин-2-он
3-[5-(3-фтор-фенилэтинил)пиридин-2-ил]-5,5-диметил-оксазолидин-2-он
5,5-диметил-3-(5-пиридин-3-илэтинил-пиридин-2-ил)оксазолидин-2-он
(5RS)-5-трет-бутил-3-(5-фенилэтинил-пиридин-2-ил)оксазолидин-2-он
6-(5-фенилэтинил-пиридин-2-ил)-4-окса-6-аза-спиро[2.4]гептан-5-он
7-(5-фенилэтинил-пиридин-2-ил)-5-окса-7-аза-спиро[3.4]октан-6-он
3-(5-фенилэтинил-пиридин-2-ил)-1-окса-3-аза-спиро[4.4]нонан-2-он
3-(5-фенилэтинил-пиридин-2-ил)-1-окса-3-аза-спиро[4.5]декан-2-он
(5RS)-5-трет-бутил-5-метил-3-(5-фенилэтинил-пиридин-2-ил)-оксазолидин-2-он
(3aRS,6aSR)-3-(5-фенилэтинил-пиридин-2-ил)-гексагидро-циклопентаоксазол-2-он
(3aRS,6aSR)-3-(5-пиридин-3-илэтинил-пиридин-2-ил)гексагидро-циклопентаоксазол-2-он
(3aRS,6aSR)-3-[5-(5-фтор-пиридин-3-илэтинил)-пиридин-2-ил]гексагидро-циклопентаоксазол-2-он
(RS)-4,5,5-триметил-3-(5-фенилэтинил-пиридин-2-ил)оксазолидин-2-он
4,4,5,5-тетраметил-3-(5-фенилэтинил-пиридин-2-ил)оксазолидин-2-он
3-[5-(5-фтор-пиридин-3-илэтинил)пиридин-2-ил]-5,5-диметил-оксазолидин-2-он
5,5-диметил-3-(5-пиримидин-5-илэтинил-пиридин-2-ил)оксазолидин-2-он
5,5-диметил-3-[5-(1-метил-1Н-пиразол-4-илэтинил)пиридин-2-ил]оксазолидин-2-он
3-[5-(4-фтор-фенилэтинил)пиридин-2-ил]-5,5-диметил-оксазолидин-2-он
3-[5-(3,4-дифтор-фенилэтинил)пиридин-2-ил]-5,5-диметил-оксазолидин-2-он
3-[5-(2,5-дифтор-фенилэтинил)пиридин-2-ил]-5,5-диметил-оксазолидин-2-он
3-[5-(6-фтор-пиридин-3-илэтинил)пиридин-2-ил]-5,5-диметил-оксазолидин-2-он
6-(5-пиридин-3-илэтинил-пиридин-2-ил)-4-окса-6-аза-спиро[2.4]гептан-5-он
(6SR,7RS)-3-(5-фенилэтинил-пиридин-2-ил)гексагидро-бензооксазол-2-он
(3aSR,7aRS)-(3aRS,7RS)-1-(5-фенилэтинил-пиридин-2-ил)гексагидро-пирано[4,3-d]оксазол-2-он или
5,5-диметил-3-(6-(фенилэтинил)пиридазин-3-ил)оксазолидин-2-он.
4. Этинильное производное формулы I-B1, охватываемой формулой I, по п. 1

в которой
U - это N или C(R5);
V - это СН или N;
W - это СН или N;
при условии, что только одна из групп из U, V или W может являться атомом азота;
R5 - это водород, метил или галоген;
R1 - это фенил или 5-6-членный гетероарил, содержащий 1-2 гетероатома, выбранных из атомов азота, которые могут содержать один или два заместителя, выбранных из галогена или низшего алкила;
R2/R2′ независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, С3-С6-циклоалкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил или кольцо, включающее СН2ОСН2-;
R3/R3′ независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил;
или R3 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять С3-6-циклоалкил или кольцо, включающее (СН2)2ОСН2-;
R7/R7′ независимо друг от друга представляют собой водород, гидрокси-группу, низший алкил или низшую алкоксигруппу;
или фармацевтически приемлемая соль, образованная добавлением кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или его стереоизомер.
5. Этинильное производное по п. 1, которое может представлять собой:
4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)пирролидин-2-он
(3RS)-3-гидрокси-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)пирролидин-2-он
1-(3-фтор-5-фенилэтинил-пиридин-2-ил)-4,4-диметил-пирролидин-2-он
1-[5-(5-фтор-пиридин-3-илэтинил)-пиридин-2-ил]-4,4-диметил-пирролидин-2-он
4,4-диметил-1-(5-пиридин-3-илэтинил-пиридин-2-ил)пирролидин-2-он
1-[5-(5-хлор-пиридин-3-илэтинил)пиридин-2-ил]-4,4-диметил-пирролидин-2-он
1-[5-(3-фтор-фенилэтинил)пиридин-2-ил]-4,4-диметил-пирролидин-2-он
4,4-диметил-1-(3-метил-5-фенилэтинил-пиридин-2-ил)пирролидин-2-он
2-(5-фенилэтинил-пиридин-2-ил)2-аза-спиро[4.4]нонан-3-он
(RS)-3-метокси-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)пирролидин-2-он
(5R или 5S)-5-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)оксазолидин-2-он
(RS)-1-[5-(5-хлор-пиридин-3-илэтинил)пиридин-2-ил]-3-метокси-4,4-диметил-пирролидин-2-он
(RS)-3-метокси-4,4-диметил-1-(5-м-толилэтинил-пиридин-2-ил)пирролидин-2-он
(RS)-1-[5-(3-фтор-фенилэтинил)пиридин-2-ил]-3-метокси-4,4-диметил-пирролидин-2-он
(RS)-1-[5-(4-фтор-фенилэтинил)пиридин-2-ил]-3-метокси-4,4-диметил-пирролидин-2-он
6-(5-фенилэтинил-пиридин-2-ил)-2-окса-6-аза-спиро[3.4]октан-7-он
4,4-диметил-5′-фенилэтинил-3,4,5,6-тетрагидро[1,2′]бипиридинил-2-он
5′-(3-фтор-фенилэтинил)-4,4-диметил-3,4,5,6-тетрагидро[1,2′]бипиридинил-2-он
5′-(3-хлор-фенилэтинил)-4,4-диметил-3,4,5,6-тетрагидро[1,2′]бипиридинил-2-он
5′-(5-хлор-пиридин-3-илэтинил)-4,4-диметил-3,4,5,6-тетрагидро[1,2′]бипиридинил-2-он
5′-(4-фтор-фенилэтинил)-4,4-диметил-3,4,5,6-тетрагидро[1,2′]бипиридинил-2-он
5′-(2,5-дифтор-фенилэтинил)-4,4-диметил-3,4,5,6-тетрагидро-[1,2′]бипиридинил-2-он
4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)пирролидин-2-он
2-(5-фенилэтинил-пиримидин-2-ил)-2-аза-спиро[4.4]нонан-3-он
1-[5-(3-фтор-фенилэтинил)-пиримидин-2-ил]-4,4-диметил-пирролидин-2-он
1-[5-(3-хлор-фенилэтинил)пиримидин-2-ил]-4,4-диметил-пирролидин-2-он
1-[5-(4-фтор-фенилэтинил)пиримидин-2-ил]-4,4-диметил-пирролидин-2-он
1-[5-(2,5-дифтор-фенилэтинил)пиримидин-2-ил]-4,4-диметил-пирролидин-2-он
(RS)-3-метокси-4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)пирролидин-2-он
(5R или 5S)-5-метоксиметил-3-(5-фенилэтинил-пиримидин-2-ил)оксазолидин-2-он
(RS)-1-[5-(3-фтор-фенилэтинил)пиримидин-2-ил]-3-метокси-4,4-диметил-пирролидин-2-он
(R или S)-1-[5-(3-фтор-фенилэтинил)пиримидин-2-ил]-3-метокси-4,4-диметил-пирролидин-2-он
(S или R)-1-[5-(3-фтор-фенилэтинил)пиримидин-2-ил]-3-метокси-4,4-диметил-пирролидин-2-он
(R или S)-1-[5-(2,5-дифтор-фенилэтинил)пиримидин-2-ил]-3-метокси-4,4-диметил-пирролидин-2-он
4,4-диметил-1-(6-(фенилэтинил)пиридазин-3-ил)пирролидин-2-он
4,4-диметил-1-(5-(пиридин-3-илэтинил)пиразин-2-ил)пирролидин-2-он.
6. Этинильное производное формулы I-C1, охватываемой формулой I, по п. 1

в которой
U - это N или C(R5);
V - это СН или N;
W - это СН или N;
при условии, что только одна из групп из U, V или W может являться атомом азота;
R5 - это водород, метил или галоген;
R6 - это водород или низший алкил;
R1 - это фенил или 5-6-членный гетероарил, содержащий 1-2 гетероатома, выбранных из атомов азота, которые могут содержать один или два заместителя, выбранных из галогена или низшего алкила;
R2/R2′ независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, С3-С6-циклоалкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил или кольцо, включающее СН2ОСН2-;
R3/R3′ независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил;
или R3 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять С3-6-циклоалкил или кольцо, включающее (СН2)2ОСН2-;
или R6 и R2 составляют совместно с атомом углерода и атомом азота, к которому они присоединены, С3-6-циклоалкил;
или фармацевтически приемлемая соль, образованная добавлением кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или его стереоизомер.
7. Этинильное производное формулы I-C1 по п. 6, которое представляет собой:
4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)имидазолидин-2-он
3,4,4-триметил-1-(5-фенилэтинил-пиридин-2-ил)имидазолидин-2-он
3-этил-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)имидазолидин-2-он
3-изопропил-4,4-диметил-1-(5-фенилэтинил-пиридин-2-ил)имидазолидин-2-он
1-метил-3-(5-фенилэтинил-пиридин-2-ил)-1,3-диаза-спиро[4.4]нонан-2-он
(RS)-4-циклопентил-3-метил-1-(5-фенилэтинил-пиридин-2-ил)имидазолидин-2-он
3,4,4-триметил-1-(5-пиридин-3-илэтинил-пиридин-2-ил)имидазолидин-2-он
1-[5-(5-фтор-пиридин-3-илэтинил)пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
3,4,4-триметил-1-[5-(1-метил-1Н-пиразол-4-илэтинил)пиридин-2-ил]-имидазолидин-2-он
1-[5-(5-хлор-пиридин-3-илэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
3,4,4-триметил-1-(5-пиридазин-4-илэтинил-пиридин-2-ил)имидазолидин-2-он
1-[5-(3-фтор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
1-[5-(3-хлор-фенилэтинил)-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
3,4,4-триметил-1-(5-пиримидин-5-илэтинил-пиридин-2-ил)имидазолидин-2-он
3,4,4-триметил-1-(5-м-толилэтинил-пиридин-2-ил)имидазолидин-2-он
1-[5-(4-фтор-фенилэтинил)пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
(RS)-2-(5-фенилэтинил-пиридин-2-ил)гексагидро-имидазо[1,5-а]пиридин-3-он
(RS)-2-(5-пиридин-3-илэтинил-пиридин-2-ил)гексагидро-имидазо[1,5-а]пиридин-3-он
(RS)-2-[5-(3-фтор-фенилэтинил)-пиридин-2-ил]гексагидро-имидазо[1,5-а]пиридин-3-он
(RS)-4-циклопропил-3-метил-1-(5-фенилэтинил-пиридин-2-ил)имидазолидин-2-он
(3aSR,7aRS)-(3aRS,7RS)-1-метил-3-(5-фенилэтинил-пиридин-2-ил)октагидро-бензоимидазол-2-он
(3aSR,7aRS)-(3aRS,7RS)-1-метил-3-(5-пиридин-3-илэтинил-пиридин-2-ил)октагидро-бензоимидазол-2-он
(3aSR,7aRS)-(3aRS,7RS)-1-[5-(5-фтор-пиридин-3-илэтинил)пиридин-2-ил]-3-метил-октагидро-бензоимидазол-2-он
4-метил-6-(5-фенилэтинил-пиридин-2-ил)-4,6-диаза-спиро[2.4]гептан-5-он
(3aSR,7aRS)-(3aRS,7RS)-1-этил-3-(5-фенилэтинил-пиридин-2-ил)октагидро-бензоимидазол-2-он
(3aSR,7aRS)-(3aRS,7RS)-1-этил-3-(5-пиридин-3-илэтинил-пиридин-2-ил)октагидро-бензоимидазол-2-он
(3aSR,7aRS)-(3aRS,7RS)-1-изопропил-3-(5-фенилэтинил-пиридин-2-ил)октагидро-бензоимидазол-2-он
(3aRS,6aSR)-1-метил-3-(5-(фенилэтинил)пиридин-2-ил)гексагидроциклопента[d]имидазол-2(1Н)-он
(RS)-4-трет-бутил-3-метил-1-(5-фенилэтинил-пиридин-2-ил)имидазолидин-2-он
1-[5-(3-фтор-фенилэтинил)-3-метил-пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
(3aSR,6aRS)-1-[5-(3-фтор-фенилэтинил)пиридин-2-ил]-3-метил-гексагидро-циклопента-имидазол-2-он
1-[3-фтор-5-(4-фтор-фенилэтинил)пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
1-[3-фтор-5-(3-фтор-фенилэтинил)пиридин-2-ил]-3,4,4-триметил-имидазолидин-2-он
6-[5-(4-фтор-фенилэтинил)пиридин-2-ил]-4-метил-4,6-диаза-спиро[2.4]гептан-5-он
6-[5-(3-фтор-фенилэтинил)пиридин-2-ил]-4-метил-4,6-диаза-спиро[2.4]гептан-5-он
3,4,4-триметил-1-(5-фенилэтинил-пиримидин-2-ил)имидазолидин-2-он
1-[5-(3-фтор-фенилэтинил)пиримидин-2-ил]-3,4,4-триметил-имидазолидин-2-он
1-[5-(2,5-дифтор-фенилэтинил)пиримидин-2-ил]-3,4,4-триметил-имидазолидин-2-он
1-[5-(4-фтор-фенилэтинил)пиримидин-2-ил]-3,4,4-триметил-имидазолидин-2-он
1-[5-(3,4-дифтор-фенилэтинил)-пиримидин-2-ил]-3,4,4-триметил-имидазолидин-2-он
3-изопропил-4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)имидазолидин-2-он
1-[5-(3-фтор-фенилэтинил)-пиримидин-2-ил]-3-изопропил-4,4-диметил-имидазолидин-2-он
1-[5-(4-фтор-фенилэтинил)пиримидин-2-ил]-3-изопропил-4,4-диметил-имидазолидин-2-он
1-[5-(4-фтор-фенилэтинил)пиримидин-2-ил]-3-этил-4,4-диметил-имидазолидин-2-он
1-[5-(3-фтор-фенилэтинил)пиримидин-2-ил]-3-этил-4,4-диметил-имидазолидин-2-он
4-метил-6-(5-фенилэтинил-пиримидин-2-ил)-4,6-диаза-спиро[2.4]гептан-5-он
3,4,4-триметил-1-(6-(м-толилэтинил)пиридазин-3-ил)имидазолидин-2-он
1-(6-((3-хлорфенил)этинил)пиридазин-3-ил)-3,4,4-триметилимидазолидин-2-он
3,4,4-триметил-1-(5-(фенилэтинил)пиразин-2-ил)имидазолидин-2-он
3,4,4-триметил-1-(5-(пиридин-3-илэтинил)пиразин-2-ил)имидазолидин-2-он
1-(5-((3-фторфенил)этинил)пиразин-2-ил)-3,4,4-триметилимидазолидин-2-он
1-(5-((4-фторфенил)этинил)пиразин-2-ил)-3,4,4-триметилимидазолидин-2-он
(3aRS,6aSR)-1-метил-3-(6-фенилэтинил-пиридазин-3-ил)-гексагидро-циклопентаимидазол-2-он или
(3aSR,6aRS)-1-[6-(3-фтор-фенилэтинил)-пиридазин-3-ил]-3-метил-гексагидро-циклопентаимидазол-2-он.
8. Этинильное производное формулы I-D1, охватываемой формулой I, по п. 1

в которой
U - это N или C(R5);
V - это СН или N;
W - это СН или N;
при условии, что только одна из групп U, V или W может являться атомом азота;
R5 - это водород, метил или галоген;
R1 - это фенил или 5-6-членный гетероарил, содержащий 1-2 гетероатома, выбранных из атомов азота, которые могут содержать один или два заместителя, выбранных из галогена или низшего алкила;
R2/R2′ независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, С3-С6-циклоалкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил или кольцо, включающее СН2ОСН2-;
R3/R3′ независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил;
или R3 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять С3-6-циклоалкил или кольцо, включающее (СН2)2ОСН2-;
R4/R4′ независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил;
R4 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять С3-6-циклоалкил;
или фармацевтически приемлемая соль, образованная добавлением кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или его стереоизомер.
9. Этинильное производное по п. 1, представляющее собой:
5,5-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
6,6-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
6,6-диметил-3-(5-пиридин-3-илэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
3-[5-(5-фтор-пиридин-3-илэтинил)пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он
3-[5-(5-хлор-пиридин-3-илэтинил)пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он
3-[5-(3-фтор-фенилэтинил)пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он
3-[5-(3-хлор-фенилэтинил)пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он
6,6-диметил-3-(5-м-толилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
3-[5-(4-фтор-фенилэтинил)пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он
3-[5-(3,4-дифтор-фенилэтинил)пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он
3-[5-(2,5-дифтор-фенилэтинил)пиридин-2-ил]-6,6-диметил-[1,3]оксазинан-2-он
7,7-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазепан-2-он
(RS)-5-гидрокси-6,6-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
(4aRS,7aSR)-3-(5-фенилэтинил-пиридин-2-ил)гексагидро-циклопента[е][1,3]оксазин-2-он
(4aRS,7aRS)-3-(5-фенилэтинил-пиридин-2-ил)гексагидро-циклопента[е][1,3]оксазин-2-он
(RS)-5,6,6-триметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
(RS)-6-метоксиметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
(RS)-5-метокси-6,6-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазинан-2-он
(RS)-5,6,6-триметил-3-(5-фенилэтинил-пиримидин-2-ил)-[1,3]оксазинан-2-он
(RS)-3-[5-(2,5-дифтор-фенилэтинил)пиримидин-2-ил]-5,6,6-триметил-[1,3]оксазинан-2-он
(RS)-3-[5-(3-фтор-фенилэтинил)пиримидин-2-ил]-5,6,6-триметил-[1,3]оксазинан-2-он
(RS)-3-[5-(4-фтор-фенилэтинил)пиримидин-2-ил]-5,6,6-триметил-[1,3]оксазинан-2-он
6,6-диметил-3-(6-(фенилэтинил)пиридазин-3-ил)-1,3-оксазинан-2-он
6,6-диметил-3-(5-(фенилэтинил)пиразин-2-ил)-1,3-оксазинан-2-он
(RS)-3-[5-(3-фтор-фенилэтинил)пиридин-2-ил]-5-метокси-6,6-диметил-[1,3]оксазинан-2-он.
10. Этинильное производное формулы I-E1, охватываемой формулой I, по п. 1
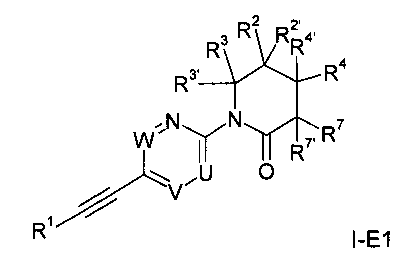
в которой
U - это N или C(R5);
V - это СН или N;
W - это СН или N;
при условии, что только одна из групп U, V или W может являться атомом азота;
R5 - это водород, метил или галоген;
R7/R7′ независимо друг от друга представляют собой водород, гидрокси-группу, низший алкил или низшую алкокси-группу;
R1 - это фенил или 5-6-членный гетероарил, содержащий 1-2 гетероатома, выбранных из атомов азота, которые могут содержать один или два заместителя, выбранных из галогена или низшего алкила;
R2/R2′ независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, С3-С6-циклоалкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил или кольцо, включающее СН2ОСН2-;
R3/R3′ независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил;
или R3 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять С3-6-циклоалкил или кольцо, включающее (СН2)2ОСН2-;
R4/R4′ независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил;
R4 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять С3-6-циклоалкил;
или фармацевтически приемлемая соль, образованная добавлением кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или его стереоизомер.
11. Этинильное производное формулы I-E1 по п. 10, которое может представлять собой:
5,5-диметил-5′-фенилэтинил-3,4,5,6-тетрагидро[1,2′]бипиридинил-2-он
5′-(3-фтор-фенилэтинил)-5,5-диметил-3,4,5,6-тетрагидро[1,2′]бипиридинил-2-он
5,5-диметил-1-(5-фенилэтинил-пиримидин-2-ил)пиперидин-2-он
4,4-диметил-1-(5-фенилэтинил-пиримидин-2-ил)пиперидин-2-он
1-[5-(3-фтор-фенилэтинил)пиримидин-2-ил]-4,4-диметил-пиперидин-2-он
1-[5-(2,5-дифтор-фенилэтинил)пиримидин-2-ил]-4,4-диметил-пиперидин-2-он
4,4-диметил-1-(6-(фенилэтинил)пиридазин-3-ил)пиперидин-2-он
1-(5-((3-фторфенил)этинил)пиразин-2-ил)-4,4-диметилпиперидин-2-он
4,4-диметил-1-(5-(пиридин-3-илэтинил)пиразин-2-ил)пиперидин-2-он или
4,4-диметил-1-(5-(фенилэтинил)пиразин-2-ил)пиперидин-2-он.
12. Этинильное производное формулы I-F1, охватываемой формулой I, по п. 1

в которой
U - это N или C(R5);
V - это СН или N;
W - это СН или N;
при условии, что только одна из групп U, V или W может являться атомом азота;
R5 - это водород, метил или галоген;
R6 - это водород или низший алкил;
R1 - это фенил или 5-6-членный гетероарил, содержащий 1-2 гетероатома, выбранных из атомов азота, которые могут содержать один или два заместителя, выбранных из галогена или низшего алкила;
R2/R2′ независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, С3-С6-циклоалкил, СН2-низшую алкокси-группу, или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил или кольцо, включающее СН2ОСН2-;
R3/R3′ независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил;
или R3 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять С3-6-циклоалкил или кольцо, включающее (СН2)2OCH2-;
R4/R4′ независимо друг от друга представляют собой водород, низший алкил, СН2-низшую алкокси-группу или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил;
R4 и R2 могут совместно с атомом углерода, к которому они присоединены, составлять С3-6-циклоалкил;
или фармацевтически приемлемая соль, образованная добавлением кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или его стереоизомер.
13. Этинильное производное формулы I-F1 по п. 12, которое может представлять собой:
5,5-диметил-1-(5-фенилэтинил-пиридин-2-ил)тетрагидропиримидин-2-он
1,5,5-триметил-3-(5-фенилэтинил-пиридин-2-ил)тетрагидропиримидин-2-он
3,4,4-триметил-1-(5-фенилэтинил-пиридин-2-ил)тетрагидропиримидин-2-он
1-[5-(2,5-дифтор-фенилэтинил)пиридин-2-ил]-3,4,4-триметил-тетрагидро-пиримидин-2-он
1-[5-(4-фтор-фенилэтинил)пиридин-2-ил]-3,4,4-триметил-тетрагидропиримидин-2-он
3,4,4-триметил-5′-фенилэтинил-3,4,5,6-тетрагидро[1,2′]бипиримидинил-2-он
5′-(3-фтор-фенилэтинил)-3,4,4-триметил-3,4,5,6-тетрагидро[1,2′]бипиримидинил-2-он
5′-(2,5-дифтор-фенилэтинил)-3,4,4-триметил-3,4,5,6-тетрагидро[1,2′]бипиримидинил-2-он
4,4-диметил-1-(5-(фенилэтинил)пиразин-2-ил)тетрагидропиримидин-2(1Н)-он
3,4,4-триметил-1-(5-(фенилэтинил)пиразин-2-ил)тетрагидропиримидин-2(1Н)-он
1-(5-((3-фторфенил)этинил)пиразин-2-ил)-4,4-диметилтетрагидропиримидин-2(1Н)-он или
1-(5-((3-фторфенил)этинил)пиразин-2-ил)-3,4,4-триметилтетрагидропиримидин-2(1Н)-он.
14. Этинильное производное формулы I-G1, охватываемой формулой I, по п. 1

в которой
U - это N или C(R5);
V - это СН или N;
W - это СН или N;
при условии, что только одна из групп U, V или W может являться атомом азота;
R5 - это водород, метил или галоген;
Y - это -C(R7′)(R7)-;
причем R7/R7′ независимо друг от друга представляют собой водород, гидрокси-группу, низший алкил или низшую алкокси-группу;
R1 - это фенил или 5-6-членный гетероарил, содержащий 1-2 гетероатома, выбранных из атомов азота, которые могут содержать один или два заместителя, выбранных из галогена или низшего алкила;
R2/R2′ независимо друг от друга представляют собой водород, низший алкил, гидрокси-группу, низшую алкокси-группу, С3-С6-циклоалкил, СН2-низшую алкокси-группу, или могут совместно с атомом углерода, к которому они присоединены, составлять С3-С6-циклоалкил или кольцо, включающее СН2ОСН2-;
или R6 и R2 могут составлять совместно с атомом углерода и атомом азота, к которому они присоединены, С3-6-циклоалкил;
или R2 и R7 могут составлять совместно с атомом углерода, к которому они присоединены, С3-6-циклоалкил;
или фармацевтически приемлемая соль, образованная добавлением кислоты, рацемическая смесь или его соответствующий энантиомер и/или оптический изомер и/или его стереоизомер.
15. Этинильное производное формулы I-G1 по п. 14, которое может представлять собой:
(1RS,5SR)-6-(5-фенилэтинил-пиридин-2-ил)-6-азабицикло[3.2.0]гептан-7-он
3,3-диметил-1-(5-фенилэтинил-пиридин-2-ил)азетидин-2-он или
(1RS,5SR)-6-(5-пиридин-3-илэтинил-пиридин-2-ил)-6-аза-бицикло[3.2.0]гептан-7-он.
16. Этинильное производное по п. 1, в котором Y - это -CH2O-.
17. Этинильное производное по п. 1, которое может представлять собой:
(RS)-6-метил-4-(5-фенилэтинил-пиридин-2-ил)морфолин-3-он или
6.6- диметил-4-(5-фенилэтинил-пиридин-2-ил) морфолин-3-он.
18. Этинильное производное по п. 1, в котором Y - это -CH2S(O)2-.
19. Этинильное производное по п. 1, которое может представлять собой:
1,1-диоксо-4-(5-фенилэтинил-пиридин-2-ил)тиоморфолин-3-он.
20. Этинильное производное по п. 1, в котором m равно 2.
21. Этинильное производное по п. 1, которое может представлять собой:
7,7-диметил-3-(5-фенилэтинил-пиридин-2-ил)-[1,3]оксазепан-2-он.
22. Способ получения соединения формулы I по п. 1, включающий: введение в реакцию соединения формулы

в которой X - это подходящая уходящая группа, которую можно легко заместить ацетиленовой группой, выбранная из атомов брома или иода, триалкилстаннильной группы, остатка бороновой кислоты или эфира бороновой кислоты,
с подходящим арилацетиленом формулы

с получением соединения формулы

в которой заместители такие, как описано в п. 1, или
по желанию, превращение полученных соединений в их фармацевтически приемлемые соли, образованные добавлением кислот.
23. Соединение по любому из пп. 1-21 для применения в качестве терапевтически активного вещества, обладающего свойствами аллостерического модулятора рецепторов mGluR5.
24. Соединение по любому из пп. 1-21 или его рацемическая смесь или соответствующий энантиомер или оптический изомер или стереоизомер или его фармацевтически приемлемая соль, образованная добавлением кислоты, для применения в качестве лекарственного средства, обладающего свойствами аллостерического модулятора рецепторов mGluR5.
25. Соединение по любому из пп. 1-21 для получения лекарственного средства для лечения или профилактики шизофрении, когнитивных расстройств, синдрома фрагильной Х-хромосомы или аутизма, связанных с аллостерическими модуляторами рецепторов mGluR5.
26. Фармацевтическая композиция, обладающая свойствами аллостерического модулятора рецепторов mGluR5, включающая по меньшей мере одно соединение формулы (I) по любому из пп. 1-21 или его рацемическую смесь или соответствующий энантиомер или оптический изомер или стереоизомер или его фармацевтически приемлемую соль, образованную добавлением кислоты, в эффективном количестве.
27. Применение соединения по любому из пп. 1-21 или его рацемической смеси или соответствующего энантиомера или оптического изомера или стереоизомера или его фармацевтически приемлемой соли, образованной добавлением кислоты, в изготовлении лекарственного средства для лечения или профилактики заболеваний, связанных с аллостерическими модуляторами рецепторов mGluR5.
28. Применение соединения по п. 27, где заболеванием является шизофрения, когнитивные расстройства, синдром фрагильной Х-хромосомы или аутизм.
| WO2008151184 A1, 11.12.2008 | |||
| WO2011051201 A1, 05.05.2011 & RU2012120307A | |||
| US 2009042855 A1, 12.02.2009 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| 2004 |
|
RU2373210C2 | |
| WO 9902497 A2, 21.01.1999. | |||
Авторы
Даты
2016-01-20—Публикация
2011-04-11—Подача