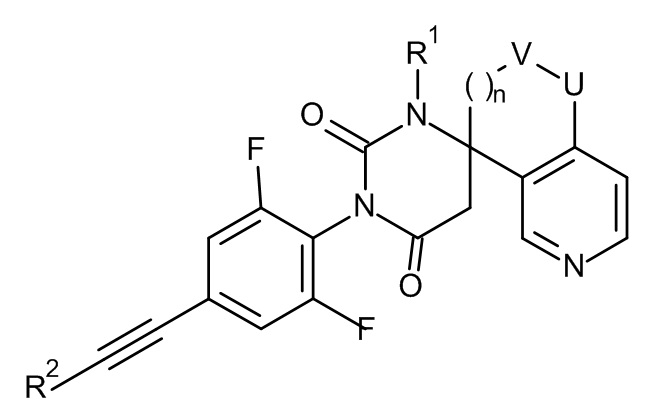
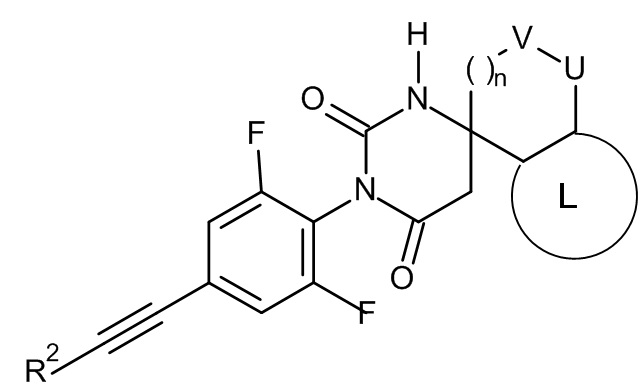
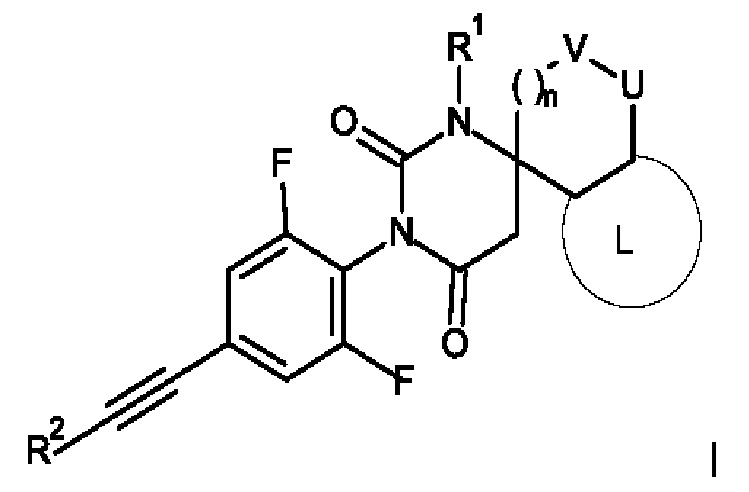
Настоящее изобретение относится к соединениям формулы I
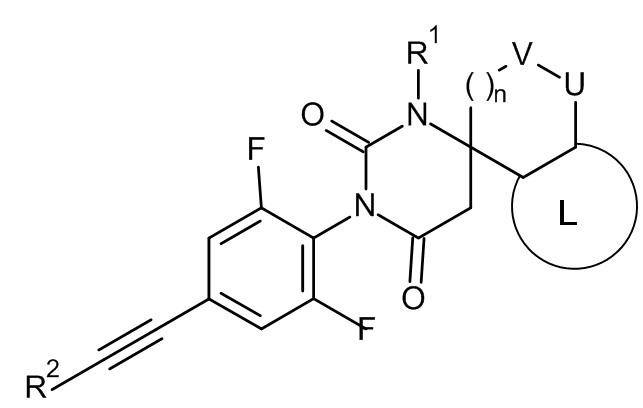 I
I
где:
R1 представляет собой низший алкил;
R2 представляет собой фенил или пиридинил, причем атом N в пиридинильной группе может быть в различных положениях;
n равно 0, 1 или 2;
V/U представляют собой независимо друг от друга O или CH2, причем V и U не могут быть одновременно O;
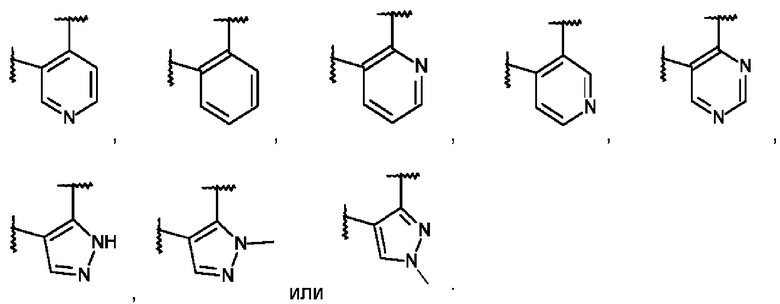
L представляет собой пяти- или шестичленную гетероарильную группу, выбранную из
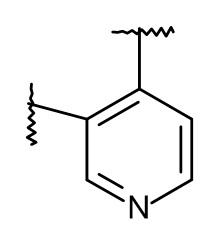 ,
, 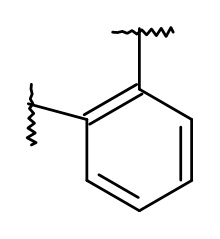 ,
, 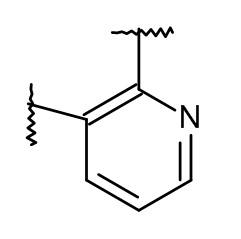 ,
, 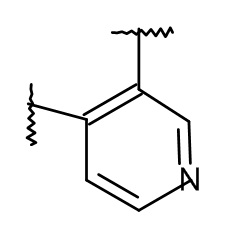 ,
, 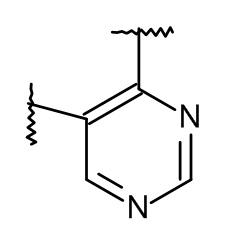 ,
, 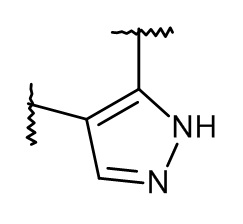 ,
, 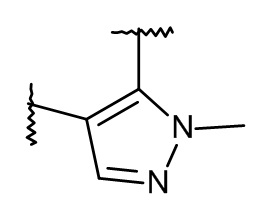 или
или 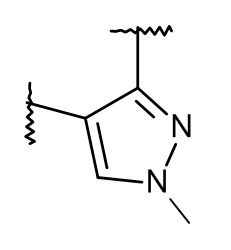 ;
;
или к их фармацевтически приемлемой соли или соли присоединения присоединения кислоты, к рацемической смеси, или к их соответствующему энантиомеру и/или их оптическому изомеру и/или их стереоизомеру.
Неожиданно было обнаружено, что соединения общей формулы I представляют собой положительные аллостерические модуляторы (PAMs, от англ. positive allosteric modulators) метаботропного рецептора глутамата 4 (mGluR4).
Метаботропный рецептор глутамата 4 представляет собой белок, который кодируется у человека геном GRM4.
Совместно с GRM6, GRM7 и GRM8 он принадлежит к III группе семейства метаботропных рецепторов глутамата и сопряжен по принципу отрицательной взаимосвязи с аденилатциклазой за счет активации белка Gαi/o. Он экспрессируется в первую очередь на пресинаптических окончаниях, выполняя функцию ауторецептора или гетерорецептора, и его активация приводит к снижению высвобождения медиаторов из пресинаптических окончаний. В настоящее время mGluR4 привлекает внимание исследователей, в первую очередь, из-за своего уникального распределения, а также полученного недавно доказательства, что активация этого рецептора играет ключевую модуляторную роль во многих метаболических путях в ЦНС и не только в ЦНС (Celanire S, Campo B, Expert Opinion in Drug Discovery, 2012).
Сходство в лиганд-связывающих доменах белков mGluRs III группы обуславливает сложность идентификации селективных ортостерических агонистов данного рецептора, хотя в этой области и были достигнуты некоторые успехи. Тем не менее, нацеливание на положительные аллостерические модуляторы (PAMs), а не на ортостерические агонисты, предоставляет более широкие возможности для идентификации молекул, которые проявляют особую селективность среди белков mGluRs.
Выяснилось, что mGluR4 PAMs представляют собой многообещающие терапевтические средства для лечения моторных (и немоторных) симптомов, а также представляют собой модифицирующий заболевание агент в лечении болезни Паркинсона, действующий по недофаминергическому пути.
Болезнь Паркинсона представляет собой прогрессирующее нейродегенеративное заболевание, которое приводит к потере дофаминергических нейронов в черном веществе (SN, от лат. substantia nigra). Одним из последствий истощения запаса дофамина в этом заболевании является ряд двигательных расстройств, включая брадикинезию, акинезию, тремор, нарушение походки и проблемы баланса. Такие моторные нарушения составляют отличительную черту БП болезни Паркинсона (БП), хотя имеется и множество других немоторных симптомов, связанных с данным заболеванием. В раннем течении этого заболевания, симптомы БП можно эффективно лечить заменой или наращиванием дофамина, с применением агонистов рецептора дофамина D2, леводопы или ингибиторов моноаминоксидазы B. Однако по мере прогрессирования заболевания эти агенты становятся менее эффективными для контроля моторных симптомов. Кроме того, их применение ограничено в случае побочных эффектов, включающих дискинезии, индуцируемые агонистом дофамина.
Таким образом, сохраняется необходимость в новых подходах к лечению БП, улучшающих эффективность контроля моторных симптомов.
В качестве потенциального терапевтического подхода к болезни Паркинсона была предложена активация метаботропного рецептора глутамата 4 (mGluR4). Белок mGluR4, член III группы mGluRs, представляет собой преимущественно пресинаптический рецептор глутамата, который экспрессируется в некоторых ключевых локализациях в циркуляции базального ядра, контролирующих движение. Активация mGluR4 агонистами, селективными к III группе, снижает ингибиторный и постсинаптический потенциал возбуждения, преимущественно за счет снижения высвобождения ГАМК (гамма-аминомасляной кислоты) и глутамата, соответственно.
Особый интерес представляет поиск новых лекарств, которые облегчают моторные симптомы паркинсонизма, при этом ослабляя непрерывно происходящую деградацию нигростриальных нейронов. Для ортостерического агониста mGluR4, LAP4, обнаружен нейропротекторный эффект в модели БП на грызунах 6-OHDA, и первый положительный аллостерический модулятор (-)-PHCCC снижал нигростриальную дегенерацию у мышей, которым вводили 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (MPTP). Эти исследования предоставляют убедительные преклинические доказательства того, что активаторы mGluR4 дают верный подход не только для симптоматического лечения БП, но потенциально также представляют собой модификаторы заболевания в случае такого показания к применению.
Нейропротекторные эффекты селективных модуляторов mGluR4 также были описаны в литературе: Neuroreport, 19(4), 475-8, 2008; Proc.Natl. Acad. Sci, USA, 100(23), 13668-73, 2003; J.Neurosci. 26(27), 7222-9, 2006; Mol. Pharmacol. 74(5), 1345-58, 2008.
Тревожные расстройства стоят в ряду наиболее частых психических расстройств в мире, и они сопутствуют болезни Паркинсона (Prediger R, et al. Neuropharmacology 2012; 62:115-24). Избыточная глутаматергическая нейротрансмиссия представляет собой одну из важных характеристик патофизиологии тревожности. Исходя из пресинаптическиой локализации mGluR4 в участках мозга, которые затрагиваются при расстройствах тревожности и настроения, а также торможении повышенной возбудимости головного мозга, активаторы mGluR4 могут представлять собой новое поколение седативных препаратов (Eur. J. Pharmacol., 498(1-3), 153-6, 2004).
В 2010 Addex сообщал, что ADX88178 был активен в двух преклинических моделях тревожности на грызунах: тест «закапывание шариков» у мышей и «приподнятый крестообразный лабиринт» у мышей и крыс. Для ADX88178 также был показан анксиолитико-подобный профиль в тесте «приподнятый крестообразный лабиринт» на крысах после получения пероральной дозы.
Также было показано, что модуляторы mGluR4 оказывают антидепрессивное действие (Neuropharmacology, 46(2), 151-9, 2004).
Кроме того, было также показано, что модуляторы mGluR4 участвуют в ингибировании секреции глюкагона (Diabetes, 53(4), 998-1006, 2004). Таким образом, ортостерические или положительные аллостерические модуляторы mGluR4 обладают потенциалом для лечения диабета 2 типа за счет своего гипогликемического действия.
Более того, было показано, что mGluR4 экспрессируется в линии раковых предстательной железы (Anticancer Res. 29(1), 371-7, 2009) или колоректальной карциноме (СП. Cancer Research, 11(9) 3288-95, 2005). Поэтому модуляторы mGluR4 потенциально могут также быть эффективными в лечении рака.
Других предположительных эффектов mGluR4 PAM's можно ожидать для лечения рвоты, обсессивно-компульсивного расстройства, анорексии и аутизма.
Соединения формулы I отличаются тем, что они обладают ценными терапевтическими свойствами. Их можно применять для лечения или профилактики расстройств, ассоциированными с аллостерическими модуляторами рецептора mGluR4.
Наиболее предпочтительные показания к применению для соединений, которые представляют собой аллостерические модуляторы рецептора mGluR4, это: болезнь Паркинсона, тревожность, рвота, обсессивно-компульсивное расстройство, анорексия, аутизм, нейропротекция, рак, депрессия и диабет 2 типа.
Настоящее изобретение относится к соединениям формулы I и их фармацевтически приемлемым солям, к этим соединениям в качестве фармацевтически активной субстанции, к способам их получения, а также их применению для лечения или профилактики расстройств, ассоциированных с аллостерическими модуляторами рецептора mGluR4, такими как болезнь Паркинсона, тревожность, рвота, обсессивно-компульсивное расстройство, аутизм, рак, депрессия, диабет 2 типа и для нейропротекции, а также к фармацевтическим композициям, содержащим соединения формулы I. Еще одной целью настоящего изобретения является способ лечения или профилактики болезни Паркинсона, тревожности, рвоты, обсессивно-компульсивного расстройства, анорексии, аутизма, рака, депрессии, диабета 2 типа и осуществления нейропротекции, включающий введение эффективного количества соединения формулы I млекопитающему, которое в этом нуждается.
Кроме того, настоящее изобретение включает все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры, или аналоги, содержащие изотопы водорода, фтора, углерода, кислорода или азота.
Ниже следующие определения общих терминов, используемых в настоящем описании, применяются независимо от того, встречается ли такой термин отдельно или в комбинации.
В данном тексте термин "низший алкил" обозначает насыщенную группу с линейной или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например, метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, третбутил и т.п. Предпочтительные алкильные группы представляют собой группы с 1-4 атомами углерода.
Термин "пяти- или шестичленная гетероарильная группа" представляет собой группу, выбранную из следующих:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или 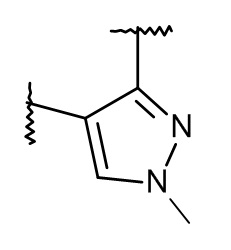 , причем такие гетероарильные группы присоединены к правой части спиро-группы.
, причем такие гетероарильные группы присоединены к правой части спиро-группы.
В соответствии с приведенным выше определением, можно предложить следующие соединения формулы I:
 ,
,  ,
,
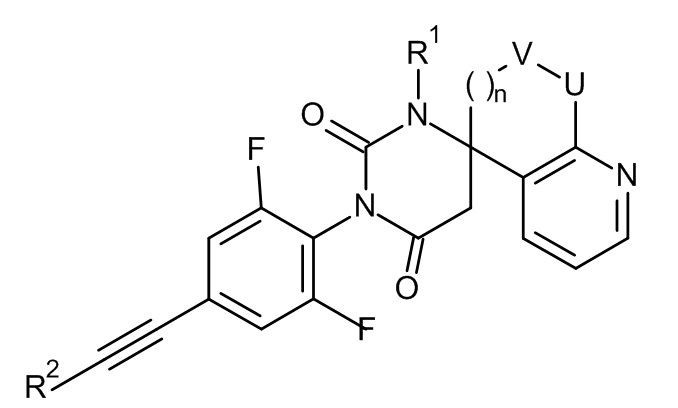 ,
, 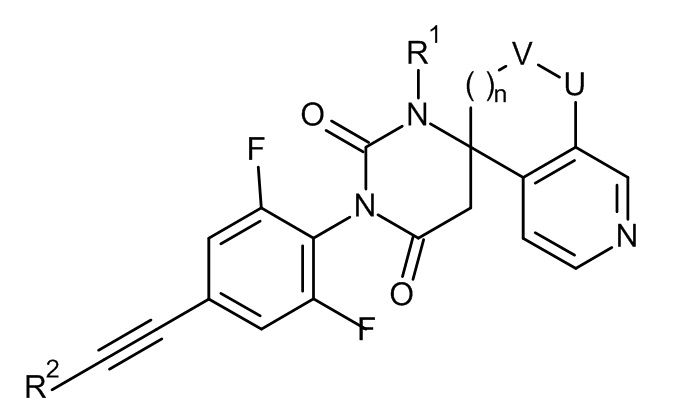 ,
,
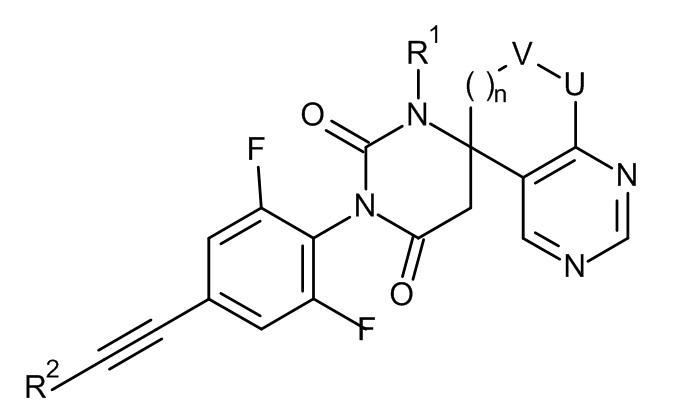 ,
, 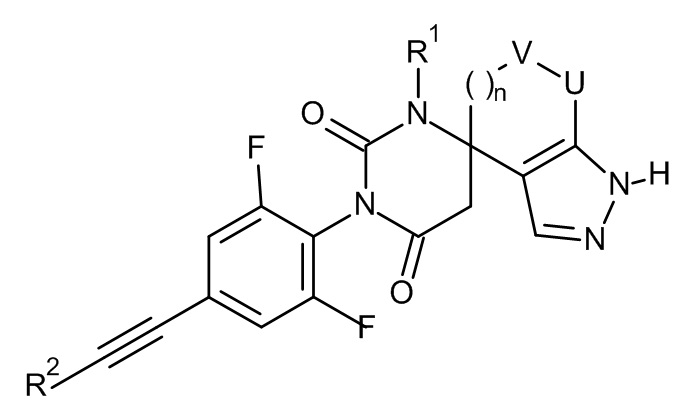 ,
,
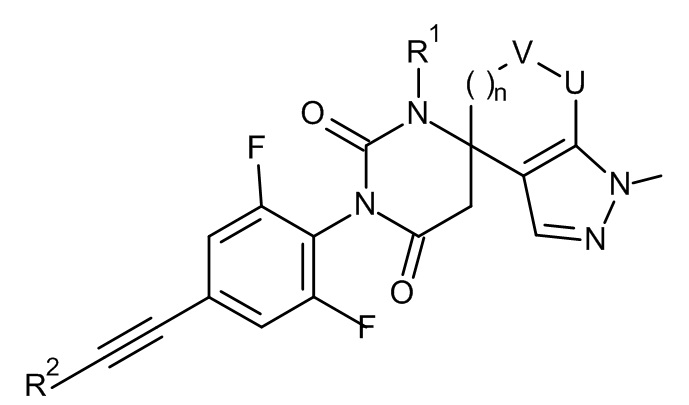 и
и 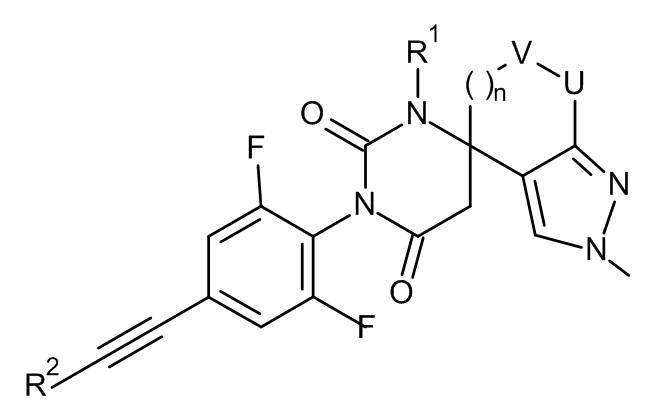 .
.
Термин "фармацевтически приемлемые соли присоединения кислоты" включает соли с неорганическими и органическими кислотами, такими как хлороводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.п.
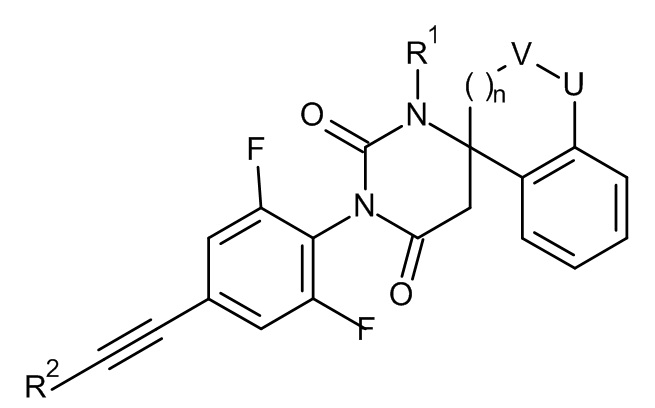
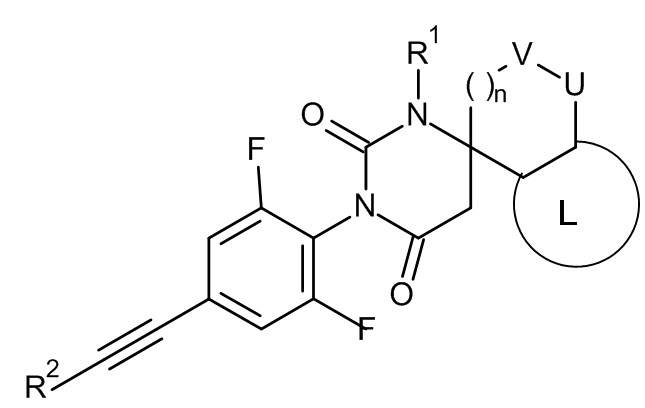
Одним воплощением настоящего изобретения являются соединения формулы IA
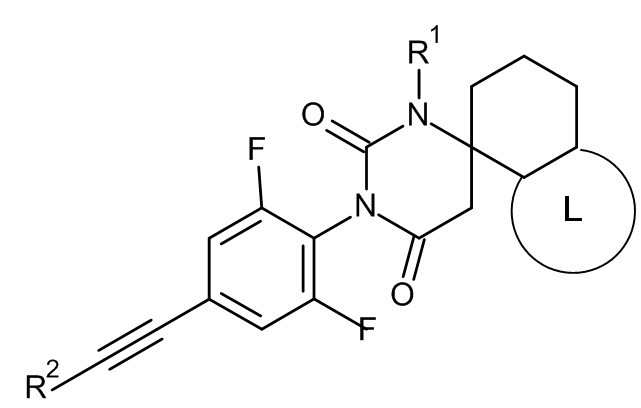 IA
IA
где
R1 представляет собой низший алкил;
R2 представляет собой фенил или пиридинил, причем атом N в пиридинильной группе может быть в различных положениях;
L представляет собой пяти- или шестичленную гетероарильную группу, выбранную из
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
или их фармацевтически приемлемая соль или соль присоединения кислоты, рацемическая смесь, или их соответствующий энантиомер и/или оптический изомер и/или их стереоизомер, например следующие соединения:
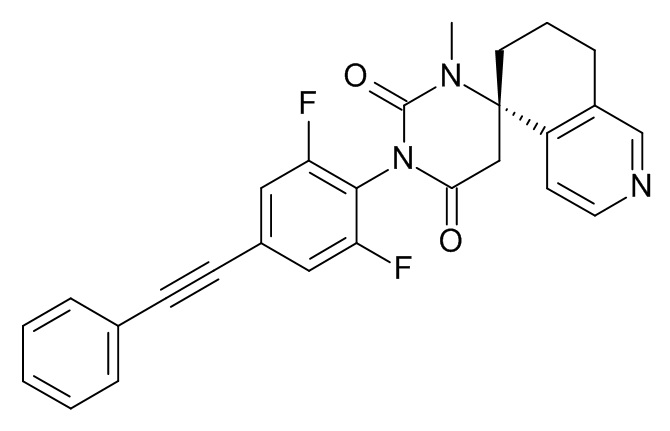
(8S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[6,7-дигидро-5H-изохинолин-8,6'-гексагидропиримидин]-2',4'-дион,
(6S)-3-[2,6-дифтор-4-[2-(3-пиридил)этинил]фенил]-1-метилспиро[гексагидропиримидин-6,1'-тетралин]-2,4-дион,
(5S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[7,8-дигидро-6H-хинолин-5,6'-гексагидропиримидин]-2',4'-дион,
(5S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[7,8-дигидро-6H-изохинолин-5,6'-гексагидропиримидин]-2',4'-дион,
(5S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[7,8-дигидро-6H-хиназолин-5,6'-гексагидропиримидин]-2',4'-дион,
(8S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-этилспиро[6,7-дигидро-5H-изохинолин-8,6'-гексагидропиримидин]-2',4'-дион.
(4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[1,5,6,7-тетрагидроиндазол-4,6'-гексагидропиримидин]-2',4'-дион,
(4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1',2-диметилспиро[6,7-дигидро-5H-индазол-4,6'-гексагидропиримидин]-2',4'-дион или
(4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1,1'-диметилспиро[6,7-дигидро-5H-индазол-4,6'-гексагидропиримидин]-2',4'-дион.
Еще одним воплощением настоящего изобретения являются соединения формулы IB
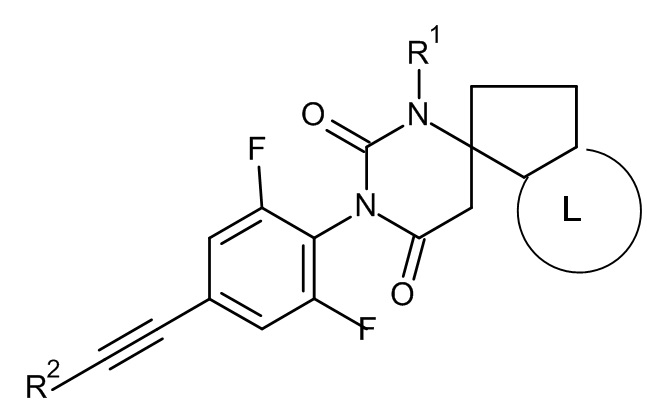 IB
IB
где:
R1 представляет собой низший алкил;
R2 представляет собой фенил или пиридинил, причем атом N в пиридинильной группе может быть в различных положениях;
L представляет собой пяти- или шестичленную гетероарильную группу, выбранную из
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
или их фармацевтически приемлемая соль или соль присоединения кислоты, рацемическая смесь, или их соответствующий энантиомер и/или оптический изомер и/или их стереоизомер, например следующие соединения:
(6S)-3-[2,6-дифтор-4-[2-(3-пиридил)этинил]фенил]-1-метилспиро[гексагидропиримидин-6,1'-индан]-2,4-дион или
(5S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[6,7-дигидроциклопента[b]пиридин-5,6'-гексагидропиримидин]-2',4'-дион.
Еще одним воплощением настоящего изобретения являются соединения формулы IC
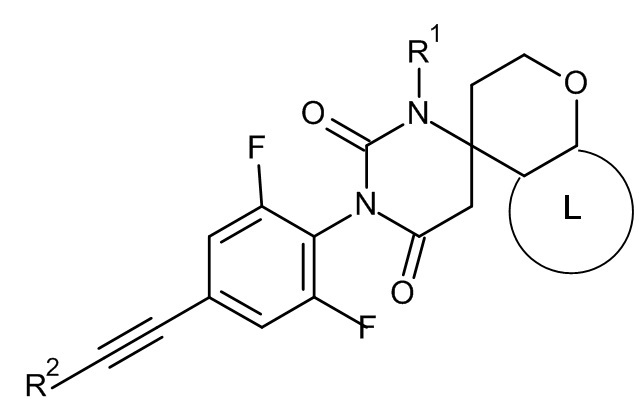 IC
IC
где:
R1 представляет собой низший алкил;
R2 представляет собой фенил или пиридинил, причем атом N в пиридинильной группе может быть в различных положениях;
L представляет собой пяти- или шестичленную гетероарильную группу, выбранную из
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
или их фармацевтически приемлемая соль или соль присоединения кислоты, рацемическая смесь, или их соответствующий энантиомер и/или оптический изомер и/или стереоизомер, например следующие соединения:
(4S)-3'-[2,6-дифтор-4-[2-(3-пиридил)этинил]фенил]-1'-метилспиро[хроман-4,6'-гексагидропиримидин]-2',4'-дион или
(4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[2,3-дигидропирано[2,3-b]пиридин-4,6'-гексагидропиримидин]-2',4'-дион.
Еще одним воплощением настоящего изобретения являются соединения формулы ID
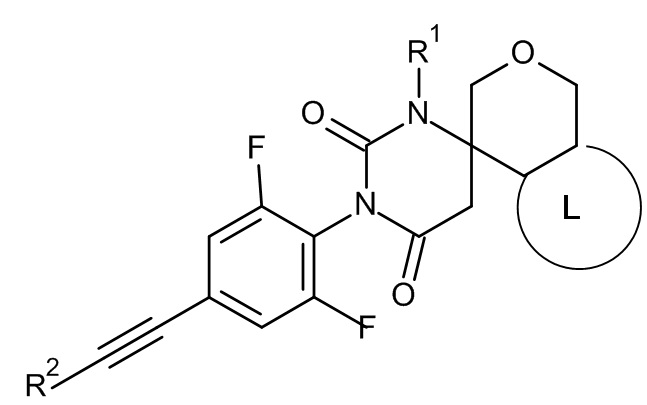 ID
ID
где:
R1 представляет собой низший алкил;
R2 представляет собой фенил или пиридинил, причем атом N в пиридинильной группе может быть в различных положениях;
L представляет собой пяти- или шестичленную гетероарильную группу, выбранную из
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
или их фармацевтически приемлемая соль или соль присоединения кислоты, рацемическая смесь, или их соответствующий энантиомер и/или оптический изомер и/или стереоизомер, например следующие соединения:
(6S)-3-[2,6-дифтор-4-[2-(3-пиридил)этинил]фенил]-1-метилспиро[гексагидропиримидин-6,4'-изохроман]-2,4-дион.
Еще одним воплощением настоящего изобретения являются соединения формулы IE
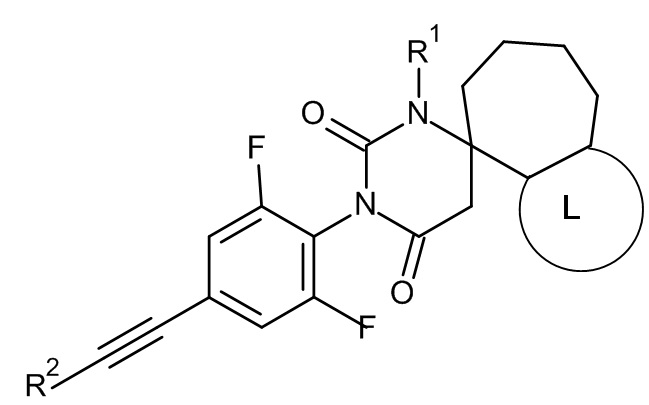 IE
IE
где
R1 представляет собой низший алкил;
R2 представляет собой фенил или пиридинил, причем атом N в пиридинильной группе может быть в различных положениях;
L представляет собой пяти- или шестичленную гетероарильную группу, выбранную из
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
или их фармацевтически приемлемая соль или соль присоединения кислоты, рацемическая смесь, или их соответствующий энантиомер и/или оптический изомер и/или стереоизомер, например следующие соединения:
(4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[5,6,7,8-тетрагидро-1H-циклогепта[c]пиразол-4,6'-гексагидропиримидин]-2',4'-дион,
(4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1,1'-диметилспиро[5,6,7,8-тетрагидроциклогепта[c]пиразол-4,6'-гексагидропиримидин]-2',4'-дион или
(4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1',2-диметилспиро[5,6,7,8-тетрагидроциклогепта[c]пиразол-4,6'-гексагидропиримидин]-2',4'-дион.
Получение соединений формулы I по настоящему изобретению можно проводить последовательными или сходящимися путями синтеза. Пути синтеза соединений по настоящему изобретению показаны на ниже следующей схеме 1. Навыки, необходимые для проведения реакций и очистки получаемых продуктов, доступны специалисту в данной области техники. Заместители и индексы, используемые в ниже следующем описании способа, имеют значение, раскрытое выше в данном тексте.
Соединения формулы I можно получить приведенными ниже способами, способами, описанными в примерах, или аналогичными способами. Подходящие условия реакции для отдельных стадий реакции известны специалисту в данной области техники. Последовательность реакций не ограничена той последовательностью, которая представлены на схемах, а наоборот, в зависимости от исходных веществ и их относительной реакционной способности, последовательность стадий реакции можно легко изменять. Исходные вещества либо имеются в продаже, либо их можно получить способами, аналогичными способам, приведенным ниже, способами, раскрытыми в источниках, на которые даны ссылки в описании или в примерах, либо способами, известными в данной области техники.
Раскрытые соединения формулы I и их фармацевтически приемлемые соли можно получить способами, известными в данной области техники, например описанным ниже вариантом способа, включающим
a) алкилирование соединения формулы
 I-1
I-1
с помощью R1-I в присутствии NaH или Cs2CO3 в N,N-диметилформамиде (ДМФА) с получением соединения формулы
 I
I
где R1 представляет собой низший алкил, а остальные заместители описаны выше, или, по желанию, переведение полученных соединений в фармацевтически приемлемые соли присоединения кислоты.
Получение соединений формулы I описано далее более подробно на схеме 1 и в примерах 1-17.
Схема 1
R1 представляет собой низший алкил
4. R1-I, NaH или Cs2CO3
ДМФА, 1-16ч, 25°С
3. NaH, ТГФ или ДМФА,1-16ч, 25°С
2. i) CDI, толуол
1ч, 100°C
ii) 1-16ч, 25-100°C
X представляет собой Br или I
1. Bis-(tpp)-Pd(II)Cl2
Et3N, TPP, CuI
ТГФ или ДМФА, 1-16ч, 60-80°C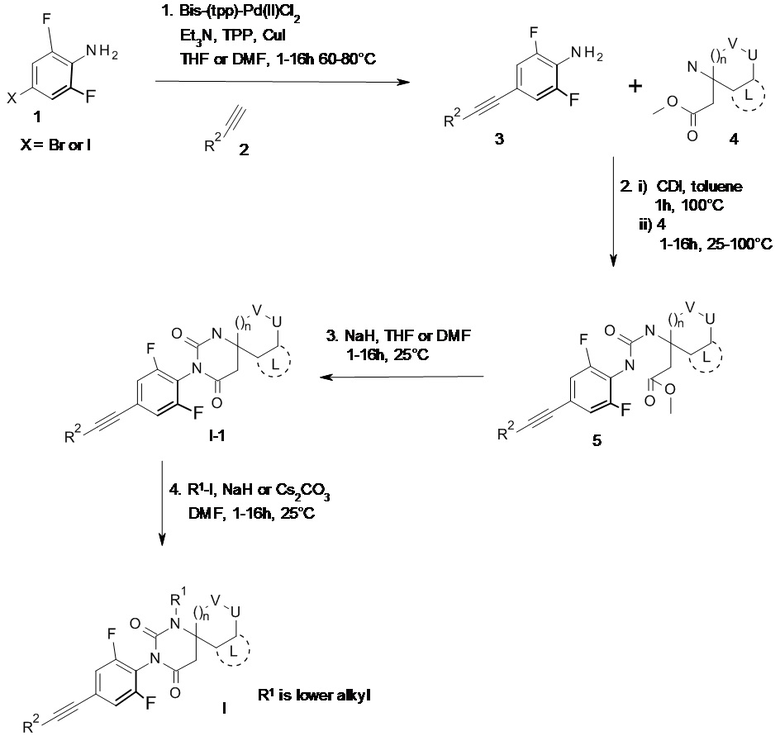 Соединения общей формулы I можно получить, например, реакцией сочетания по Соногашира подходящим образом замещенного анилина или аминопиридина 1 с подходящим образом замещенным арилацетиленом 2 с получением желаемого замещенного ацетилена формулы 3. Введение в реакцию замещенного ацетилена формулы 3 с подходящим образом замещенным аминоэфиром формулы 4 в присутствии фосгена или эквивалента фосгена, таким как трифосген или карбонилдиимидазол (CDI, от англ. N,N'-carbonyldiimidazole), в присутствии или в отсутствие основания, такого как триэтиламин, в растворителе, таком как ДМФА, толуол или диоксан, дает желаемые аналоги мочевины формулы 5. Закрытие кольца в соединении 5 с помощью сильного основания, такого как NaH или KOtBu, в растворителе, таком как тетрагидрофуран (ТГФ) или ДМФА, дает желаемые пиримидин-2,4-дионы формулы I-1. Введение заместителя R2 (R2 - низший алкил) путем алкилирования дает целевые этинилфенил-, этинилпиридил- или этинилизотиазолил-замещенные пиримидин-2,4-дионы общей формулы I (схема 1).
Соединения общей формулы I можно получить, например, реакцией сочетания по Соногашира подходящим образом замещенного анилина или аминопиридина 1 с подходящим образом замещенным арилацетиленом 2 с получением желаемого замещенного ацетилена формулы 3. Введение в реакцию замещенного ацетилена формулы 3 с подходящим образом замещенным аминоэфиром формулы 4 в присутствии фосгена или эквивалента фосгена, таким как трифосген или карбонилдиимидазол (CDI, от англ. N,N'-carbonyldiimidazole), в присутствии или в отсутствие основания, такого как триэтиламин, в растворителе, таком как ДМФА, толуол или диоксан, дает желаемые аналоги мочевины формулы 5. Закрытие кольца в соединении 5 с помощью сильного основания, такого как NaH или KOtBu, в растворителе, таком как тетрагидрофуран (ТГФ) или ДМФА, дает желаемые пиримидин-2,4-дионы формулы I-1. Введение заместителя R2 (R2 - низший алкил) путем алкилирования дает целевые этинилфенил-, этинилпиридил- или этинилизотиазолил-замещенные пиримидин-2,4-дионы общей формулы I (схема 1).
Говоря вообще, последовательность стадий, применяемую для синтеза соединений формулы I, в определенных случаях также можно модифицировать.
Биологический анализ и полученные данные
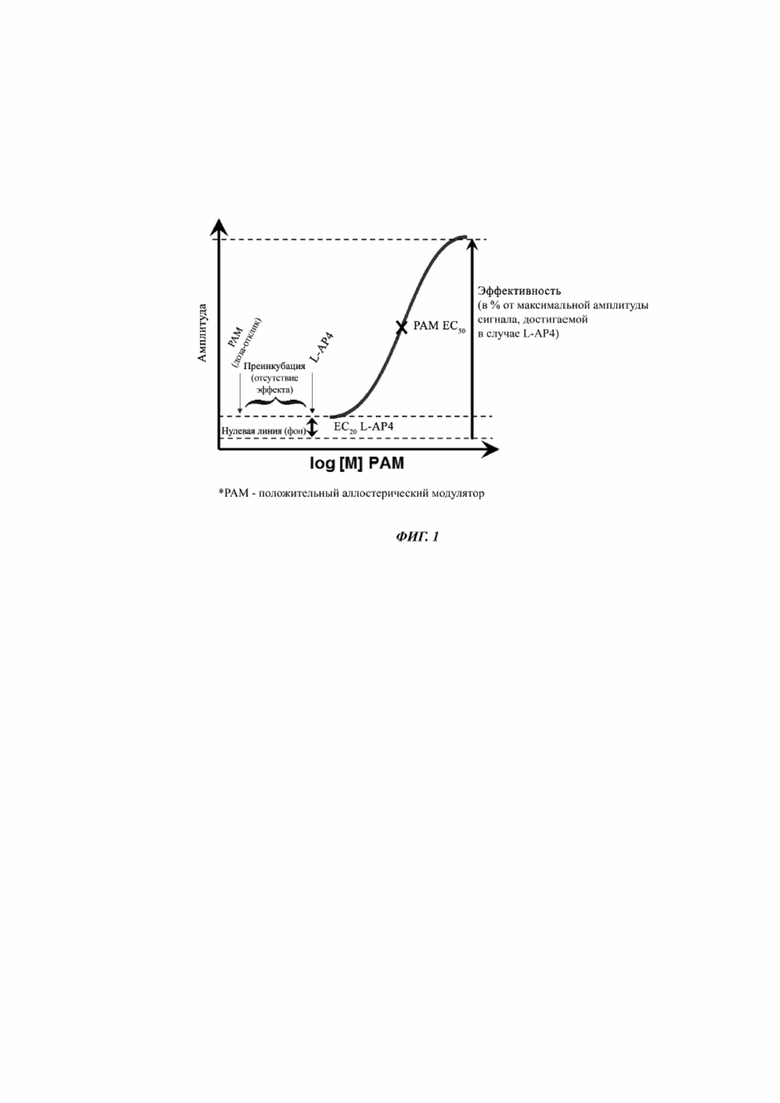
Определение величины EC50 с помощью in vitro анализа мобилизации Ca2+ на рекомбинантном mGlu4 человека, экспрессируемом в клетках HEK293
Получали моноклональную клеточную линию HEK-293, стабильно трансфицированную с помощью кДНК, кодирующей рецептор человека mGlu4; для работы с положительными аллостерическими модуляторами (PAMs) рецептора mGlu4, отбирали клеточную линию с низким уровнем экспрессии рецептора и низкой конститутивной активностью рецептора, чтобы сделать возможной дифференциацию агонистической активности и PAM-активности. Клетки культивировали по стандартным протоколам (Freshney, 2000) в среде Игла, модифицированной Дюльбекко, с высоким содержанием глюкозы, со следующими добавками: 1 мМ глутамин, 10 об.% инактивированная нагреванием фетальная сыворотка коровы, пенициллин/стрептомицин, 50 мкг/мл гигромицин и 15 мкг/мл бластицидин (поставщик всех реагентов клеточной культуры и антибиотиков - Invitrogen, Базель, Щвейцария).
Примерно за 24 ч до начала эксперимента, 5×104 клеток/лунку высевали на покрытые поли-D-лизином 96-луночных планшетах (черные лунки с прозрачным дном). Клетки нагружали с помощью 2,5 мкМ Fluo-4AM в загрузочном буфере (1×HBSS, 20 мМ HEPES) в течение 1 ч при 37 C и промывали пять раз загрузочным буфером. Клетки переносили в систему Functional Drug Screening System 7000 (Hamamatsu, Париж, Франция), добавляли 11 полулогарифмических серийных разведений тестируемых соединений при 37 C, и клетки инкубировали в течение 10-30 мин с он-лайн регистрацией флюоресценции. После этой преинкубационной стадии к клеткам добавляли агонист (2S)-2-амино-4-фосфонобутановую кислоту (L-AP4) в концентрации, соответствующей EC20, с он-лайн регистрацией флюоресценции; для расчета межсуточных вариаций чувствительности клеток, определяли EC20 L-AP4 непосредственно перед каждым экспериментом путем записи полной кривой «доза-отклик» для L-AP4.
Отклики измеряли как пиковое возрастание флюоресценции за вычетом фона (т.е. флюоресценция без добавления L-AP4), нормализованное к максимальному стимулирующему эффекту, полученному без насыщающих концентраций L-AP4. Строили графики по % максимальной стимуляции в программе для аппроксимации кривой XLfit, которая итерационно наносит на график данные по алгоритму Левенберга-Марквардта. Использовали уравнение для односайтового конкурентного анализа y = A + ((B-A)/(1+((x/C)D))), где y представляет собой % максимального стимулирующего эффекта, A представляет собой минимальное значение y, B представляет собой максимальное значение y, C представляет собой EC50, x равен log10 концентрации конкурирующего соединения, а D представляет собой наклон кривой (коэффициент Хилла). Из этих кривых вычисляли EC50 (концентрацию лекарственного вещества, при которой достигают 50% максимальной активации рецептора), коэффициент Хилла, а также максимальный отклик в % от максимального стимулирующего эффекта, получаемого при насыщающих концентрациях L-AP4 (см. Фиг. 1).
Положительные сигналы, которые получали в ходе преинкубации с тестовыми PAM-соединениями (т.е. до внесения концентрации EC20 L-AP4) свидетельствовали об агонистической активности, а отсутствие таких сигналов указывало на отсутствие агонистической активности. Если наблюдали угнетение сигнала после добавления EC20-концентрации L-AP4, то это говорило об ингибиторной активности тестируемого соединения.
Фиг. 1: Наглядное представление схемы эксперимента для скринингового анализа Ca2+-мобилизации mGlu4 PAM и определение величин EC50 и % Emax.
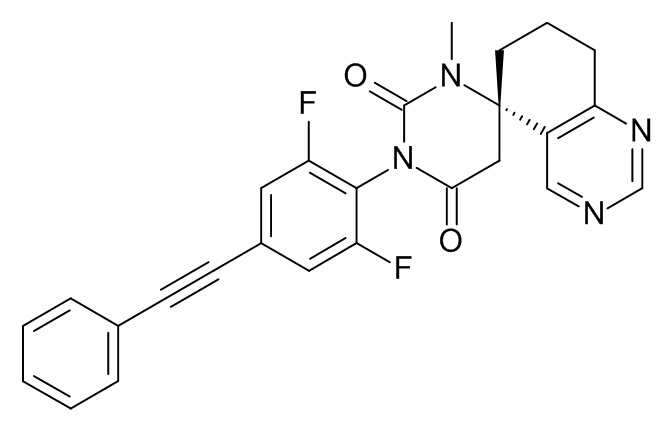
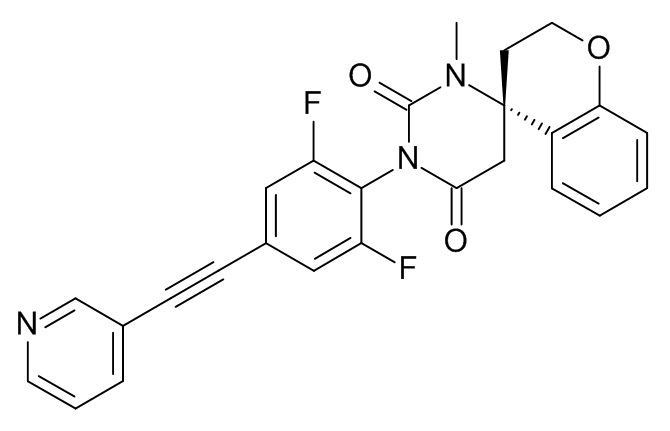
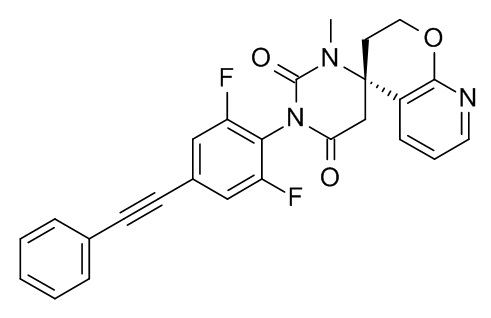
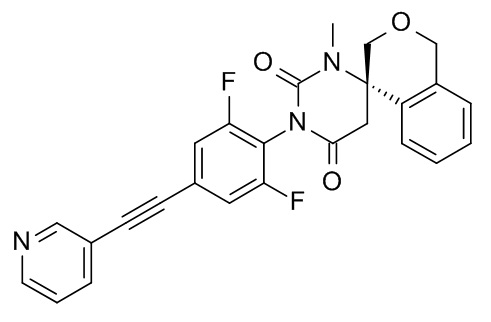
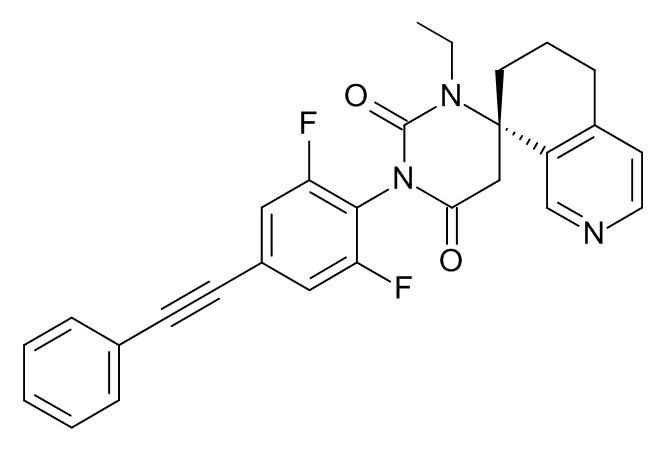
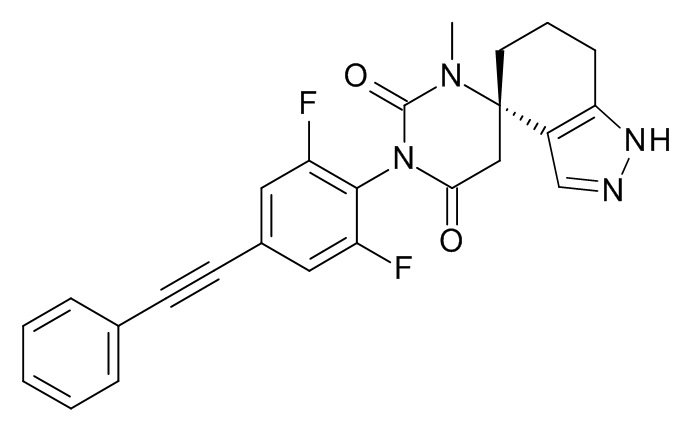
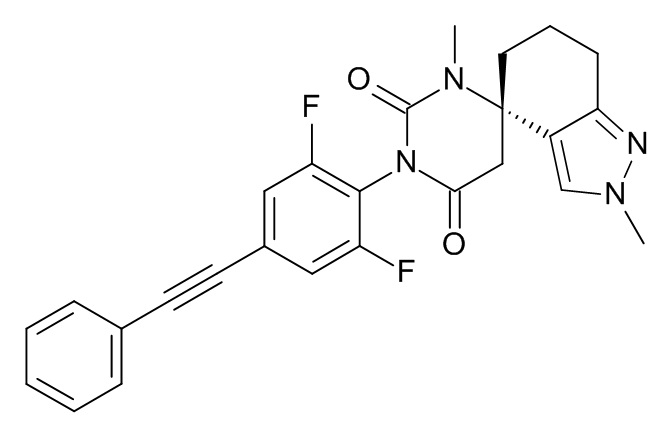
Список примеров соединений и данные:
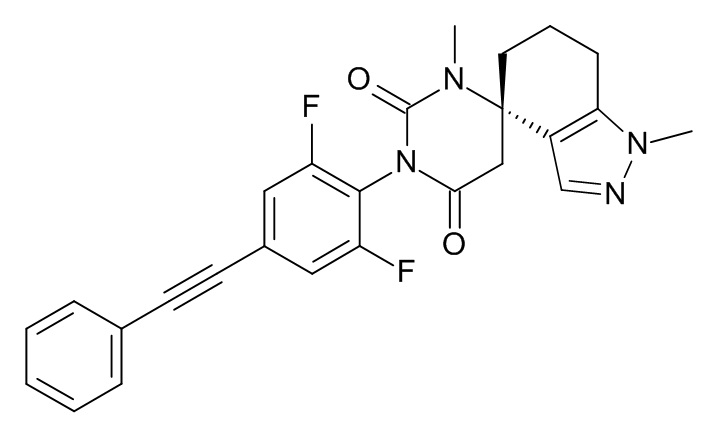
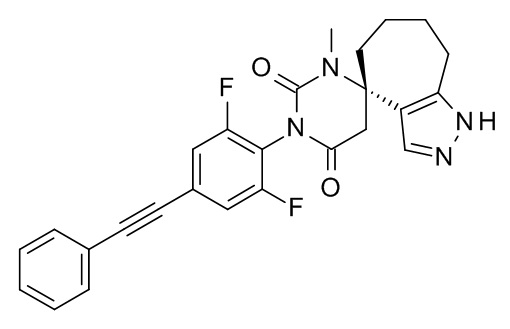
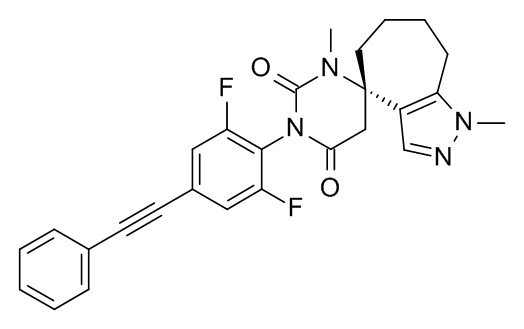
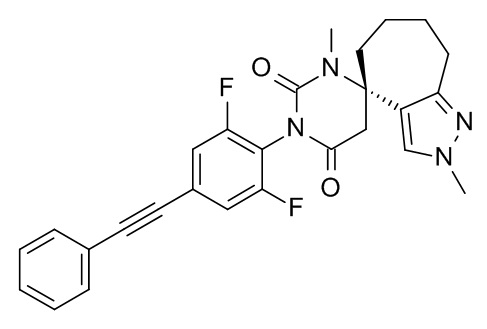
Соединения формулы (I) и их фармацевтически приемлемые соли можно применять в качестве лекарственных средств, например в форме фармацевтических препаратов. Такие фармацевтические препараты можно вводить перорально, например в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Кроме того, введение можно осуществлять ректально, например, в форме суппозиториев, или парентерально, например, в форме растворов для инъекций.
Соединения формулы (I) и фармацевтически приемлемые соли можно процессировать совместно с фармацевтически инертными неорганическими или органическими носителями для изготовления фармацевтических препаратов. Можно применять, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.п., в качестве носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п.; при этом, в зависимости от природы действующего вещества, как правило, для мягких желатиновых капсул носитель не требуется. Подходящими носителями для изготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар, глюкоза и т.п. Адьюванты, такие как спирты, полиолы, глицерин, растительные масла и т.п., можно применять для водных растворов для инъекций растворимых в воде солей соединений формулы (I), но, как правило, в них нет необходимости. Подходящими носителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полутвердые или жидкие полиолы и т.п.
Кроме того, такие фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для варьирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать и другие терапевтически ценные вещества.
Как упоминалось ранее, лекарственные средства, содержащие соединение формулы (I) или его фармацевтически приемлемые соли и терапевтически инертный эксципиент, также являются целью настоящего изобретения, равно как и способ получения таких лекарственных средств, включающий приведение одного или более соединения формулы I или его фармацевтически приемлемой соли и, по желанию, одного или более других терапевтически ценных веществ в галеновую лекарственную форму вместе с одним или более терапевтически инертными носителями.
Как уже упоминалось выше, применение соединений формулы (I) для изготовления лекарственных средств, полезных для профилактики и/или лечения указанных выше заболеваний, также является целью настоящего изобретения.
Дозу можно варьировать в широких пределах и, разумеется, ее следует подбирать в соответствии с индивидуальными потребностями в каждом конкретном случае. В целом, эффективная доза для перорального или парентерального введения находится в пределах 0,01-20 мг/кг/сутки, при этом доза 0,1-10 мг/кг/сутки предпочтительна для всех описанных показаний. Суточная доза для взрослого человека весом 70 кг, соответственно, лежит в пределах 0,7-1400 мг в сутки, предпочтительно между 7 и 700 мг в сутки.
Изготовление фармацевтических композиций, включающих соединения по настоящему изобретению
Таблетки следующего состава изготавливают стандартным способом:
Процедура изготовления
1. Смешать ингредиенты 1, 2, 3 и 4 и гранулировать с очищенной водой.
2. Высушить гранулы при 50°C.
3. Пропустить гранулы через подходящее помольное оборудование.
4. Добавить ингредиент 5 и смешивать три минуты; спрессовать с помощью подходящего пресса.
Капсулы следующего состава изготавливают таким образом:
Процедура изготовления
1. Смешать ингредиенты 1, 2 и 3 в подходящем смесителе в течение 30 минут.
2. Добавить ингредиенты 4 и 5 и смешивать в течение 3 минут.
3. Наполнить полученной смесью подходящие капсулы.
Соединение формулы I, лактозу и кукурузный крахмал сначала смешивают в смесителе и затем в измельчителе. Смесь возвращают в смеситель; к ней добавляют тальк и тщательно смешивают. С помощью специального оборудования наполняют смесью подходящие капсулы, например твердые желатиновые капсулы.
Растворы для инъекции следующего состава изготавливают следующим образом:
Процедура изготовления
Соединение формулы I растворяют в смеси полиэтиленгликоля 400 и части воды для инъекции. Доводят pH до 5,0 уксусной кислотой. Объем доводят до 1,0 мл оставшимся количеством воды. Раствор фильтруют, разливают во флаконы с необходимым избытком и стерилизуют.
Экспериментальная часть
Пример 1
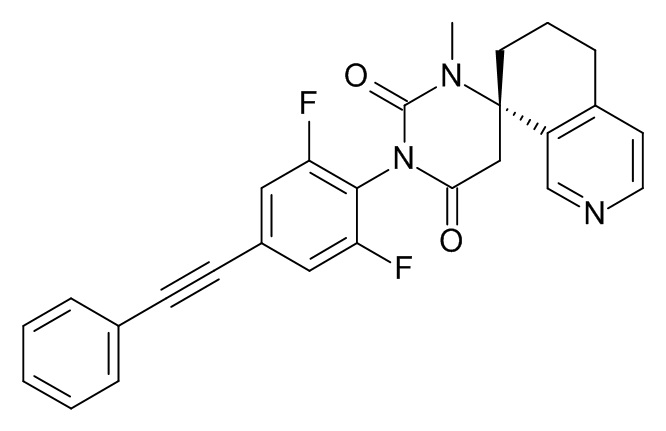
(8S)-3'-[2,6-Дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[6,7-дигидро-5H-изохинолин-8,6'-гексагидропиримидин]-2',4'-дион
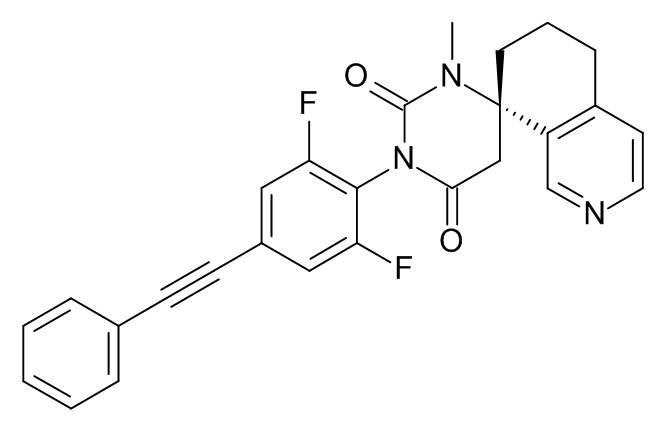
Стадия 1: 2,6-дифтор-4-фенилэтинил-фениламин
Бис-(трифенилфосфин)-палладий(II)дихлорид (826 мг; 1,18 ммоль; 0,02 экв.) растворяли в 100 мл ТГФ. При комнатной температуре вносили 2,6-дифтор-4-иоданилин (15 г; 58,8 ммоль) и фенилацетилен (7,2 г; 7,8 мл; 70,6 ммоль; 1,2 экв.). Добавляли триэтиламин (29,8 г; 41 мл; 0,29 моль; 5 экв.), трифенилфосфин (617 мг; 2,35 ммоль; 0,04 экв.) и иодид меди(I) (112 мг; 0,58 ммоль; 0,01 экв.) и эту смесь перемешивали в течение 1 ч при 60°C. Реакционную смесь охлаждали и экстрагировали насыщенным раствором NaHCO3 и дважды этилацетатом. Органические слои промывали трижды водой, высушивали над сульфатом натрия и выпаривали досуха. Неочищенный продукт очищали флеш-хроматографией на колонке с силикагелем, элюировали градиентом этилацетат:гептан от 0:100 до 40:60. Целевой 2,6-дифтор-4-фенилэтинил-фениламин (12,6 г; выход 93%) получали в виде желтого твердого вещества, MS: m/e = 230,1 (M+H+).
Стадия 2: (R,E)-N-(6,7-дигидроизохинолин-8(5H)-илиден)-2-метилпропан-2-сульфинамид
Растворяли 6,7-дигидроизохинолин-8(5H)-он (1 г; 6,79 ммоль) в 10 мл ТГФ. Вносили (R)-2-метилпропан-2-сульфинамид (CAS 196929-78-9) (1,24 г; 10,2 ммоль; 1,5 экв.) и этоксид титана (IV) (4,65 г; 4,23 мл; 20,4 ммоль; 3,0 экв.) и полученную смесь перемешивали в течение 3 ч при 65°C. Реакционную смесь охлаждали и добавляли насыщенный раствор NaHCO3 и этилацетат. Полученную суспензию фильтровали через слой Celite и фильтрат экстрагировали дважды этилацетатом. Органические слои промывали солевым раствором, высушивали над сульфатом натрия и выпаривали досуха. Неочищенный продукт очищали флеш-хроматографией на колонке с силикагелем, элюировали градиентом этилацетат:гептан от 10:90 до 100:0. Целевой (R,E)-N-(6,7-дигидроизохинолин-8(5H)-илиден)-2-метилпропан-2-сульфинамид (1,02 г; выход 60%) получали в виде желтого твердого вещества, MS: m/e = 251,2 (M+H+).
Стадия 3: Метил-2-((S)-8-((R)-1,1-диметилэтилсульфинамидо)-5,6,7,8-тетрагидроизохинолин-8-ил)ацетат
Метилацетат (0,6 г; 0,375 мл; 8,15 ммоль; 2 экв.) растворяли в 10 мл сухого ТГФ и этот раствор охлаждали до -70°C. Добавляли по каплям LDA (2,0 M в ТГФ/гептан/этилбензол) (4,07 мл; 8,15 ммоль; 2 экв.) в интервале от -75°C до -65°C и эту смесь перемешивали в течение 30 минут при -70°C. Добавляли по каплям триизопропоксид хлортитана (4,25 г; 16,3 ммоль; 4 экв.), растворенный в 10 мл сухого ТГФ, в интервале от -75°C до -65°C, и эту смесь перемешивали в течение 30 минут при -70°C. Добавляли по каплям (R,E)-N-(6,7-дигидроизохинолин-8(5H)-илиден)-2-метилпропан-2-сульфинамид (Пример 1, стадия 2) (1,02 г; 4,07 ммоль), растворенный в 10 мл сухого ТГФ, в интервале от -75°C до -65°C, и эту смесь перемешивали в течение 1 ч при -70°C. Добавляли насыщенный раствор NaHCO3 и полученную смесь перемешивали в течение 10 минут. К полученной суспензии добавляли этилацетат, и эту смесь перемешивали в течение 10 минут. Полученную суспензию фильтровали через слой Celite и фильтрат дважды экстрагировали этилацетатом. Органические слои промывали солевым раствором, высушивали над сульфатом натрия и выпаривали досуха. Неочищенный продукт очищали флеш-хроматографией на колонке с силикагелем, элюировали градиентом дихлорметан:метанол от 100:0 до 90:10. Целевой метил-2-((S)-8-((R)-1,1-диметилэтилсульфинамидо)-5,6,7,8-тетрагидроизохинолин-8-ил)ацетат (0,92 г; выход 70%) получали в виде желтого масла, MS: m/e = 325,2 (M+H+).
Стадия 4: (S)-Метил-2-(8-амино-5,6,7,8-тетрагидроизохинолин-8-ил)ацетат
Метил-2-((S)-8-((R)-1,1-диметилэтилсульфинамидо)-5,6,7,8-тетрагидроизохинолин-8-ил)ацетат (Пример 1, стадия 3) (920 мг; 2,84 ммоль) растворяли в 10 мл MeOH и добавляли HCl (4н в диоксане) (7,1 мл; 28,4 ммоль; 10 экв.). Эту смесь перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь выпаривали и экстрагировали насыщенным раствором NaHCO3 и дважды дихлорметаном. Органические слои объединяли, высушивали над сульфатом натрия и выпаривали досуха. Неочищенный продукт очищали флеш-хроматографией на колонке с силикагелем, элюировали градиентом метанол:дихлорметан от 0:100 до 20:80. Целевой (S)-метил-2-(8-амино-5,6,7,8-тетрагидроизохинолин-8-ил)ацетат (340 мг; выход 54%) получали в виде желтого масла, MS: m/e = 221,2 (M+H+).
Стадия 5: (S)-Метил-2-(8-(3-(2,6-дифтор-4-(фенилэтинил)фенил)уреидо)-5,6,7,8-тетрагидроизохинолин-8-ил)ацетат
2,6-Дифтор-4-фенилэтинилфениламин (Пример 1, стадия 1) (360 мг; 1,57 ммоль; 1,0 экв.) растворяли в ДМФА (4,0 мл) и добавляли при комнатной температуре CDI (255 мг; 1,57 ммоль; 1,0 экв.). Смесь перемешивали в течение 1 ч при 100°C. К этой смеси добавляли (S)-метил-2-(8-амино-5,6,7,8-тетрагидроизохинолин-8-ил)ацетат (Пример 1, стадия 4) (100 мг; 0,50 ммоль; 1,0 экв.) и перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь выпаривали с Isolute®. Неочищенный продукт очищали флеш-хроматографией, элюировали градиентом этилацетат:гептан от 20:80 до 100:0. Целевой (S)-метил-2-(8-(3-(2,6-дифтор-4-(фенилэтинил)фенил)уреидо)-5,6,7,8-тетрагидроизохинолин-8-ил)ацетат (300 мг; выход 40%) получали в виде белого твердого вещества, MS: m/e = 476,3 (M+H+).
Стадия 6: (S)-1'-(2,6-дифтор-4-(фенилэтинил)фенил)-6,7-дигидро-1'H,5H-спиро[изохинолин-8,4'-пиримидин]-2',6'(3'H,5'H)-дион
При комнатной температуре растворяли (300 мг; 0,63 ммоль) (S)-метил-2-(8-(3-(2,6-дифтор-4-(фенилэтинил)фенил)уреидо)-5,6,7,8-тетрагидроизохинолин-8-ил)ацетат (Пример 1, стадия 5) в ТГФ (3 мл) и добавляли натрия гидрид (60% в минеральном масле) (38 мг; 0,946 ммоль; 1,5 экв.). Эту смесь перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь экстрагировали насыщенным раствором NaHCO3 и дважды этилацетатом. Органические слои промывали водой и солевым раствором, высушивали над сульфатом натрия и выпаривали досуха. Целевой (S)-1'-(2,6-дифтор-4-(фенилэтинил)фенил)-6,7-дигидро-1'H,5H-спиро[изохинолин-8,4'-пиримидин]-2',6'(3'H,5'H)-дион (240 мг; выход 86%) получали в виде светло-желтого твердого вещества, MS: m/e = 444,2 (M+H+).
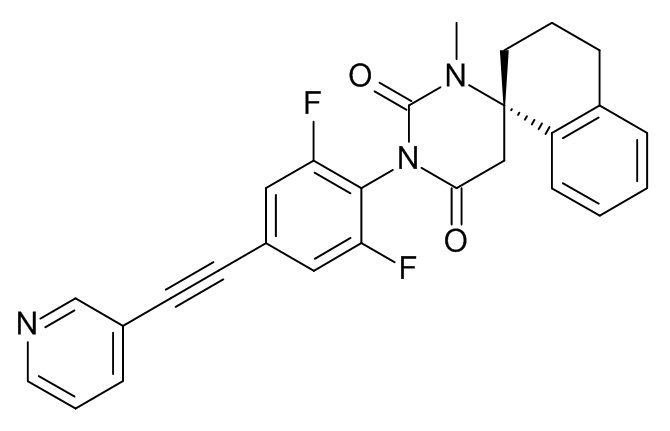
Стадия 7: (8S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[6,7-дигидро-5H-изохинолин-8,6'-гексагидропиримидин]-2',4'-дион
При комнатной температуре растворяли (240 мг; 0,54 ммоль) (S)-1'-(2,6-дифтор-4-(фенилэтинил)фенил)-6,7-дигидро-1'H,5H-спиро[изохинолин-8,4'-пиримидин]-2',6'(3'H,5'H)-дион (Пример 1, стадия 6) в ДМФА (2 мл) и вносили карбонат цезия (265 мг; 0,81 ммоль; 1,5 экв.) и иодметан (115 мг; 51 мкл; 0,81 ммоль; 1,5 экв.). Эту смесь перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь выпаривали с Isolute®. Неочищенный продукт очищали флеш-хроматографией на колонке с силикагелем, элюировали градиентом этилацетат:гептан от 30:70 до 100:0. Целевой (8S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[6,7-дигидро-5H-изохинолин-8,6'-гексагидропиримидин]-2',4'-дион (37 мг; выход 15%) получали в виде светло-желтого масла, MS: m/e = 458,3 (M+H+).
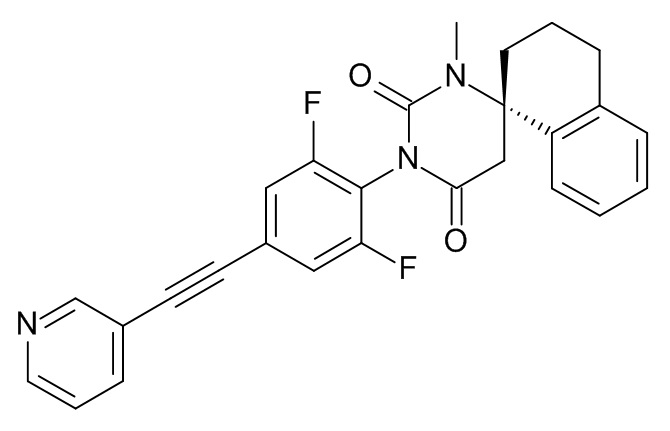
Пример 2
(6S)-3-[2,6-Дифтор-4-[2-(3-пиридил)этинил]фенил]-1-метилспиро[гексагидропиримидин-6,1'-тетралин]-2,4-дион
Стадия 1: (S)-метил-2-(1-амино-1,2,3,4-тетрагидронафталин-1-ил)ацетат
Указанное в заголовке соединение получали в виде желтой жидкости, MS: m/e = 220,1 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 2, 3 и 4, исходя из 3,4-дигидронафталин-1(2H)-она.
Стадия 2: 2,6-дифтор-4-[2-(3-пиридил)этинил]анилин
Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e = 231,1 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 1, из 2,6-дифтор-4-иоданилин и 3-этинилпиридина.
Стадия 3: (6S)-3-[2,6-дифтор-4-[2-(3-пиридил)этинил]фенил]-1-метилспиро[гексагидропиримидин-6,1'-тетралин]-2,4-дион
Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e = 458,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 5, 6 и 7, исходя из 2,6-дифтор-4-[2-(3-пиридил)этинил]анилина (Пример 2, стадия 2) и (S)-метил-2-(1-амино-1,2,3,4-тетрагидронафталин-1-ил)ацетата (Пример 2, стадия 1).
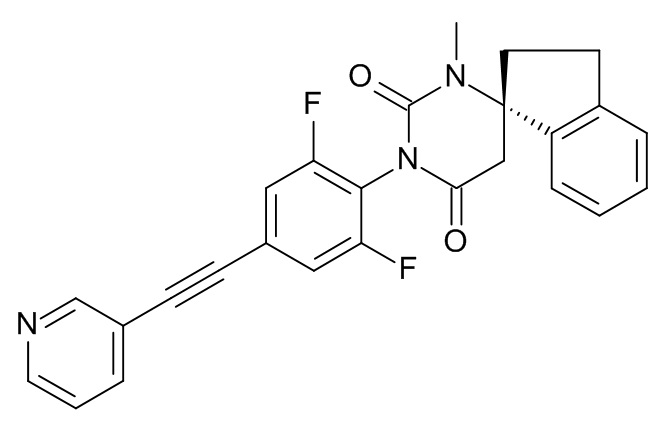
Пример 3
(6S)-3-[2,6-Дифтор-4-[2-(3-пиридил)этинил]фенил]-1-метилспиро[гексагидропиримидин-6,1'-индан]-2,4-дион
Стадия 1: (S)-метил-2-(1-амино-2,3-дигидро-1H-инден-1-ил)ацетат
Указанное в заголовке соединение получали в виде желтой жидкости, MS: m/e = 206,1 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 2,3 и 4, исходя из 2,3-дигидро-1H-инден-1-она.
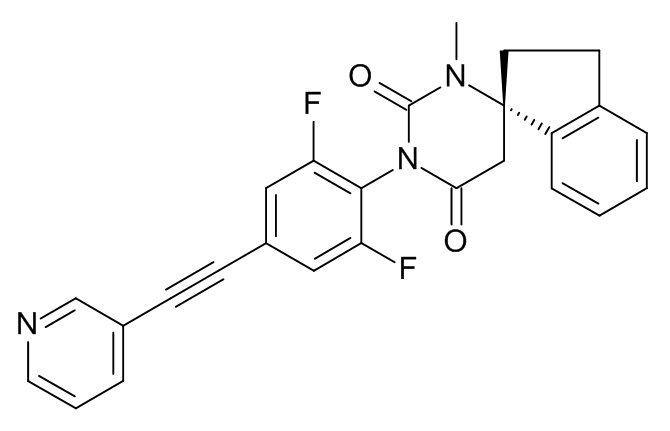
Стадия 2: (6S)-3-[2,6-дифтор-4-[2-(3-пиридил)этинил]фенил]-1-метилспиро[гексагидропиримидин-6,1'-индан]-2,4-дион
Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e = 444,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 5, 6 и 7, исходя из 2,6-дифтор-4-[2-(3-пиридил)этинил]анилина (Пример 2, стадия 2) и (S)-метил-2-(1-амино-2,3-дигидро-1H-инден-1-ил)ацетата (Пример 3, стадия 1).
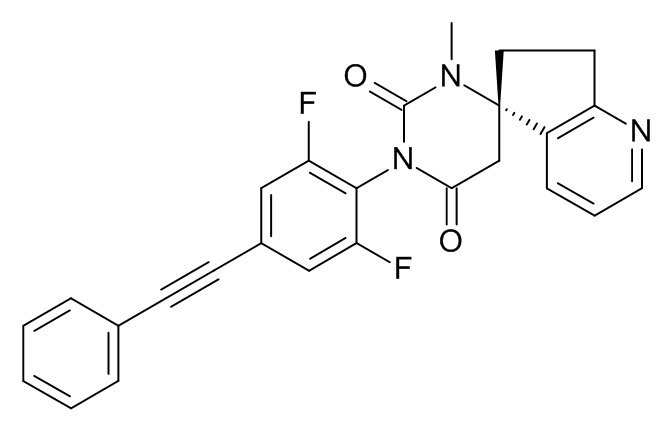
Пример 4
(5S)-3'-[2,6-Дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[6,7-дигидроциклопента[b]пиридин-5,6'-гексагидропиримидин]-2',4'-дион
Стадия 1: (S)-метил-2-(5-амино-6,7-дигидро-5H-циклопента[b]бипиридин-5-ил)ацетат
Указанное в заголовке соединение получали в виде коричневого масла, MS: m/e = 207,1 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 2,3 и 4, исходя из 6,7-дигидро-5H-циклопента[b]бипиридин-5-она.
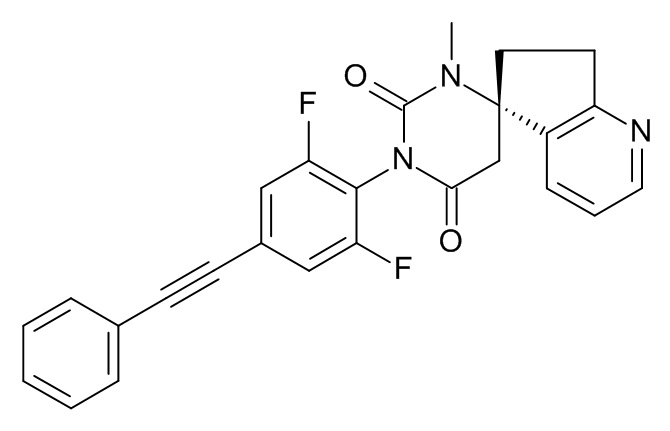
Стадия 2: (5S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[6,7-дигидроциклопента[b]пиридин-5,6'-гексагидропиримидин]-2',4'-дион
Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e = 444,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 5, 6 и 7, исходя из 2,6-дифтор-4-фенилэтинилфениламина (Пример 1, стадия 1) и (S)-метил-2-(5-амино-6,7-дигидро-5H-циклопента[b]бипиридин-5-ил)ацетата (Пример 4, стадия 1).
Пример 5
(5S)-3'-[2,6-Дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[7,8-дигидро-6H-хинолин-5,6'-гексагидропиримидин]-2',4'-дион
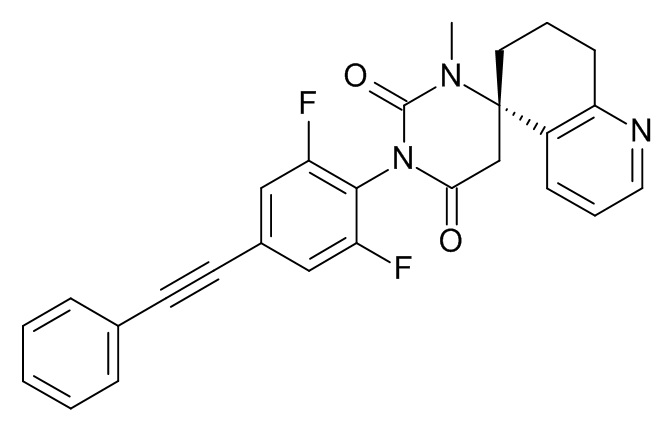
Стадия 1: (S)-метил-2-(5-амино-5,6,7,8-тетрагидрохинолин-5-ил)ацетат
Указанное в заголовке соединение получали в виде желтого масла, MS: m/e = 221,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 2,3 и 4, исходя из 7,8-дигидрохинолин-5(6H)-она.
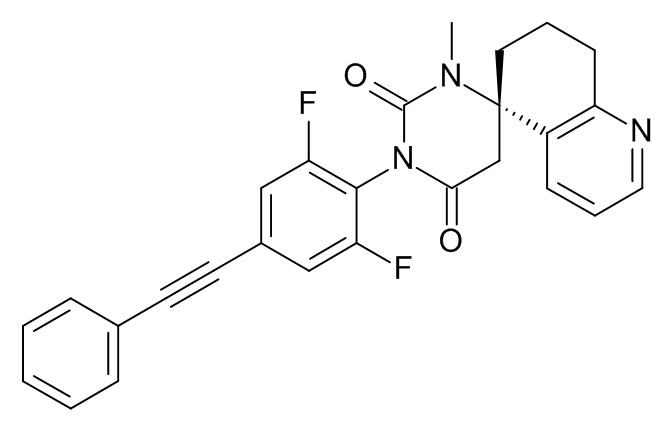
Стадия 2: (5S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[7,8-дигидро-6H-хинолин-5,6'-гексагидропиримидин]-2',4'-дион
Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 458,3 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 5, 6 и 7, исходя из 2,6-дифтор-4-фенилэтинил-фениламина (Пример 1, стадия 1) и (S)-метил-2-(5-амино-5,6,7,8-тетрагидрохинолин-5-ил)ацетата (Пример 5, стадия 1).
Пример 6
(5S)-3'-[2,6-Дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[7,8-дигидро-6H-изохинолин-5,6'-гексагидропиримидин]-2',4'-дион
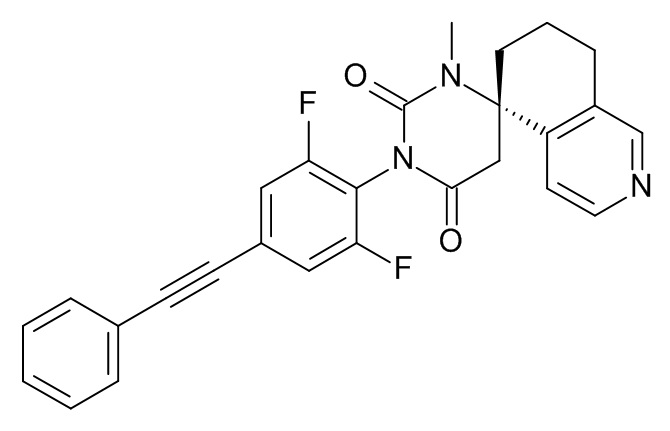
Стадия 1: (S)-метил-2-(5-амино-5,6,7,8-тетрагидроизохинолин-5-ил)ацетат
Указанное в заголовке соединение получали в виде желтого масла, MS: m/e = 221,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 2,3 и 4, исходя из 7,8-дигидроизохинолин-5(6H)-она.
Стадия 2: (5S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[7,8-дигидро-6H-изохинолин-5,6'-гексагидропиримидин]-2',4'-дион
Указанное в заголовке соединение получали в виде коричневой пены, MS: m/e = 458,3 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 5, 6 и 7, исходя из 2,6-дифтор-4-фенилэтинилфениламина (Пример 1, стадия 1) и (S)-метил-2-(5-амино-5,6,7,8-тетрагидроизохинолин-5-ил)ацетата (Пример 6, стадия 1).
Пример 7
(5S)-3'-[2,6-Дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[7,8-дигидро-6H-хиназолин-5,6'-гексагидропиримидин]-2',4'-дион
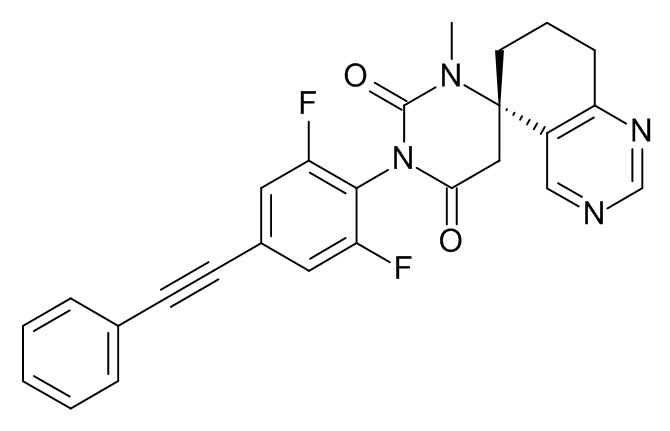
Стадия 1: (S)-метил-2-(5-амино-5,6,7,8-тетрагидрохиназолин-5-ил)ацетат
Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e = 222,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 2,3 и 4, исходя из 7,8-дигидро-6H-хиназолин-5-она.
Стадия 2: (5S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[7,8-дигидро-6H-хиназолин-5,6'-гексагидропиримидин]-2',4'-дион
Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 459,3 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 5, 6 и 7, исходя из 2,6-дифтор-4-фенилэтинил-фениламина (Пример 1, стадия 1) и (S)-метил-2-(5-амино-5,6,7,8-тетрагидрохиназолин-5-ил)ацетата (Пример 7, стадия 1).
Пример 8
(4S)-3'-[2,6-Дифтор-4-[2-(3-пиридил)этинил]фенил]-1'-метилспиро[хроман-4,6'-гексагидропиримидин]-2',4'-дион
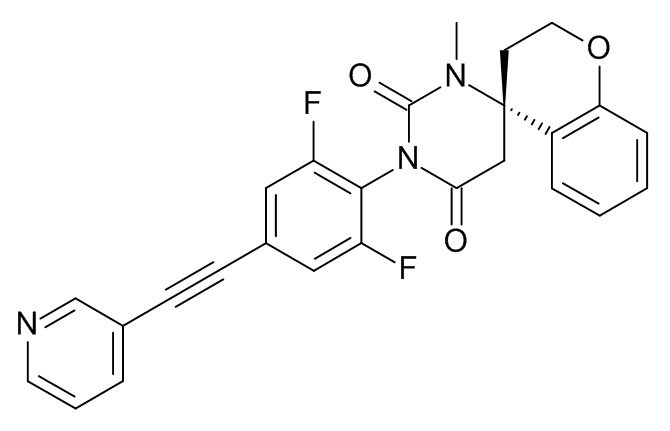
Стадия 1: (S)-метил-2-(4-аминохроман-4-ил)ацетат
Указанное в заголовке соединение получали в виде светло-желтого масла, MS: m/e = 205,1 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 2,3 и 4, исходя из хроман-4-она.
Стадия 2: (S)-1'-(2,6-дифтор-4-иодфенил)-3'-метил-1'H-спиро[хроман-4,4'-пиримидин]-2',6'(3'H,5'H)-дион
Указанное в заголовке соединение получали в виде светло-коричневого твердого вещества, MS: m/e = 485,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 5, 6 и 7, исходя из 2,6-дифтор-4-иоданилина и (S)-метил-2-(4-аминохроман-4-ил)ацетата (Пример 8, стадия 1).
Стадия 2: (4S)-3'-[2,6-дифтор-4-[2-(3-пиридил)этинил]фенил]-1'-метилспиро[хроман-4,6'-гексагидропиримидин]-2',4'-дион
Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e = 460,3 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 1, исходя из (S)-1'-(2,6-дифтор-4-иодфенил)-3'-метил-1'H-спиро[хроман-4,4'-пиримидин]-2',6'(3'H,5'H)-диона (Пример 8, стадия 2) и 3-этинилпиридина.
Пример 9
(4S)-3'-[2,6-Дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[2,3-дигидропирано[2,3-b]пиридин-4,6'-гексагидропиримидин]-2',4'-дион
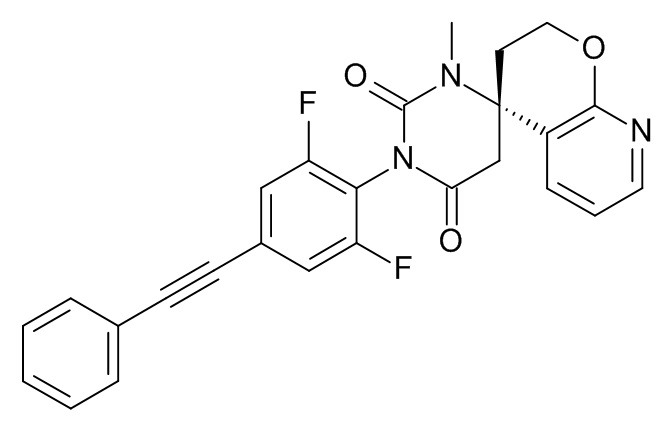
Стадия 1: (S)-метил-2-(4-амино-3,4-дигидро-2H-пирано[2,3-b]бипиридин-4-ил)ацетат
Указанное в заголовке соединение получали в виде светло-желтого масла, MS: m/e = 223,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 2,3 и 4, исходя из 2H-пирано[2,3-b]бипиридин-4(3H)-она.
Стадия 2: (4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[2,3-дигидропирано[2,3-b]пиридин-4,6'-гексагидропиримидин]-2',4'-дион
Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 460,3 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 5, 6 и 7, исходя из 2,6-дифтор-4-фенилэтинил-фениламина (Пример 1, стадия 1) и (S)-метил-2-(4-амино-3,4-дигидро-2H-пирано[2,3-b]бипиридин-4-ил)ацетата (Пример 9, стадия 1).
Пример 10
(6S)-3-[2,6-Дифтор-4-[2-(3-пиридил)этинил]фенил]-1-метилспиро[гексагидропиримидин-6,4'-изохроман]-2,4-дион

Стадия 1: (S)-метил-2-(4-аминоизохроман-4-ил)ацетат
Указанное в заголовке соединение получали в виде светло-желтого масла, MS: m/e = 222,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 2,3 и 4, исходя из изохроман-4-она.
Стадия 2: (6S)-3-[2,6-дифтор-4-[2-(3-пиридил)этинил]фенил]-1-метилспиро[гексагидропиримидин-6,4'-изохроман]-2,4-дион
Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 460,3 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 5, 6 и 7, исходя из 2,6-дифтор-4-[2-(3-пиридил)этинил]анилина (Пример 2, стадия 2) и (S)-метил-2-(4-аминоизохроман-4-ил)ацетата (Пример 10, стадия 1).
Пример 11
(8S)-3'-[2,6-Дифтор-4-(2-фенилэтинил)фенил]-1'-этилспиро[6,7-дигидро-5H-изохинолин-8,6'-гексагидропиримидин]-2',4'-дион

Указанное в заголовке соединение получали в виде желтого масла, MS: m/e = 472,3 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадия 7, исходя из (S)-1'-(2,6-дифтор-4-(фенилэтинил)фенил)-6,7-дигидро-1'H,5H-спиро[изохинолин-8,4'-пиримидин]-2',6'(3'H,5'H)-диона (Пример 1, стадия 6) и иодэтана.
Пример 12
(4S)-3'-[2,6-Дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[1,5,6,7-тетрагидроиндазол-4,6'-гексагидропиримидин]-2',4'-дион

Стадия 1: 2-((2-(триметилсилил)этокси)метил)-6,7-дигидро-2H-индазол-4(5H)-он
6,7-Дигидро-2H-индазол-4(5H)-он (CAS 912259-10-0) (1,46 г; 10,7 ммоль) растворяли в ТГФ (15 мл) и охлаждали до 0-5°C. Осторожно, порциями добавляли гидрид натрия (60% дисперсия в минеральном масле) (450 мг; 11,3 ммоль; 1,05 экв.) и эту смесь перемешивали в течение 60 минут при комнатной температуре. Реакционную смесь снова охлаждали до 0-5°C, добавляли (2-(хлорметокси)этил)триметилсилан (2,28 мл; 2,15 г; 12,9 ммоль; 1,2 экв.), и эту смесь перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь осторожно экстрагировали насыщенным раствором NaHCO3 и дважды этилацетатом. Органические слои промывали солевым раствором, высушивали над сульфатом натрия и выпаривали досуха. Целевой 2-((2-(триметилсилил)этокси)метил)-6,7-дигидро-2H-индазол-4(5H)-он (количественный выход) получали в виде желтого масла, MS: m/e = 267,2 (M+H+).
Стадия 2: (S)-метил-2-(4-амино-2-((2-(триметилсилил)этокси)метил)-4,5,6,7-тетрагидро-2H-индазол-4-ил)ацетат
Указанное в заголовке соединение получали в виде желтого масла, MS: m/e = 341,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 2,3 и 4, исходя из 2-((2-(триметилсилил)этокси)метил)-6,7-дигидро-2H-индазол-4(5H)-она (Пример 12, стадия 1), но с перемешиванием на стадии отщепления с HCl в течение 10 минут вместо 1 ч.
Стадия 3: (S)-1'-(2,6-дифтор-4-(фенилэтинил)фенил)-3'-метил-2-((2-(триметилсилил)этокси)метил)-2,5,6,7-тетрагидро-1'H-спиро[индазол-4,4'-пиримидин]-2',6'(3'H,5'H)-дион
Указанное в заголовке соединение получали в виде белой пены, MS: m/e = 577,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадии 5, 6 и 7, исходя из 2,6-дифтор-4-фенилэтинилфениламина (Пример 1, стадия 1) и (S)-метил-2-(4-амино-2-((2-(триметилсилил)этокси)метил)-4,5,6,7-тетрагидро-2H-индазол-4-ил)ацетата (Пример 12, стадия 2).
Стадия 4: (4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[1,5,6,7-тетрагидроиндазол-4,6'-гексагидропиримидин]-2',4'-дион
Указанное в заголовке соединение получали в виде белой пены, MS: m/e = 447,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадия 4, с перемешиванием реакционной смеси 16 ч при комнатной температуре, исходя из (S)-1'-(2,6-дифтор-4-(фенилэтинил)фенил)-3'-метил-2-((2-(триметилсилил)этокси)метил)-2,5,6,7-тетрагидро-1'H-спиро[индазол-4,4'-пиримидин]-2',6'(3'H,5'H)-диона (Пример 12, стадия 3).
Пример 13
(4S)-3'-[2,6-Дифтор-4-(2-фенилэтинил)фенил]-1',2-диметилспиро[6,7-дигидро-5H-индазол-4,6'-гексагидропиримидин]-2',4'-дион

Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e = 461,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадия 7, исходя из (4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[1,5,6,7-тетрагидроиндазол-4,6'-гексагидропиримидин]-2',4'-диона (Пример 12) и иодметана, с использованием колонки Reprosil Chiral NR® со смесью гептан:этанол 60:40 в качестве растворителя для разделения двух получившихся изомеров.
Пример 14
(4S)-3'-[2,6-Дифтор-4-(2-фенилэтинил)фенил]-1,1'-диметилспиро[6,7-дигидро-5H-индазол-4,6'-гексагидропиримидин]-2',4'-дион

Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e = 461,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадия 7, исходя из (4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[1,5,6,7-тетрагидроиндазол-4,6'-гексагидропиримидин]-2',4'-диона (Пример 12) и иодметана, с использованием колонки Reprosil Chiral NR® со смесью гептан:этанол 60:40 в качестве растворителя для разделения двух получившихся изомеров.
Пример 15
(4S)-3'-[2,6-Дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[5,6,7,8-тетрагидро-1H-циклогепта[c]пиразол-4,6'-гексагидропиримидин]-2',4'-дион

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 461,3 (M+H+), используя те же химические превращения, которые описаны в Примере 12, исходя из 5,6,7,8-тетрагидро-1H-циклогепта[c]пиразол-4-она (CAS 115215-89-9) вместо 6,7-дигидро-2H-индазол-4(5H)-она.
Пример 16
(4S)-3'-[2,6-Дифтор-4-(2-фенилэтинил)фенил]-1,1'-диметилспиро[5,6,7,8-тетрагидроциклогепта[c]пиразол-4,6'-гексагидропиримидин]-2',4'-дион

Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 475,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадия 7, исходя из (4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[5,6,7,8-тетрагидро-1H-циклогепта[c]пиразол-4,6'-гексагидропиримидин]-2',4'-диона (Пример 15) и иодметана, с использованием колонки Reprosil Chiral NR® со смесью гептан:этанол 60:40 в качестве растворителя для разделения двух получившихся изомеров.
Пример 17
(4S)-3'-[2,6-Дифтор-4-(2-фенилэтинил)фенил]-1',2-диметилспиро[5,6,7,8-тетрагидроциклогепта[c]пиразол-4,6'-гексагидропиримидин]-2',4'-дион

Указанное в заголовке соединение получали в виде белой пены, MS: m/e = 475,2 (M+H+), используя те же химические превращения, которые описаны в Примере 1, стадия 7, исходя из (4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[5,6,7,8-тетрагидро-1H-циклогепта[c]пиразол-4,6'-гексагидропиримидин]-2',4'-диона (Пример 15) и иодметана, с использованием хиральной колонки (Reprosil Chiral NR со смесью гептан:этанол 60:40 в качестве растворителя) для разделения двух полученных изомеров.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ЭТИНИЛА | 2017 |
|
RU2745068C2 |
| ЭТИНИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2016 |
|
RU2722014C2 |
| СПИРОЦИКЛИЧЕСКИЕ ПИРРОЛОПИРАЗИН(ПИПЕРИДИН)АМИДЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ ИОННЫХ КАНАЛОВ | 2012 |
|
RU2634900C2 |
| ПРОИЗВОДНОЕ ДИГИДРОПИРИДАЗИН-3,5-ДИОНА | 2014 |
|
RU2662832C2 |
| ПРОИЗВОДНЫЕ АРИЛЭТИНИЛА | 2011 |
|
RU2573560C2 |
| НОВОЕ ПИРРОЛОПИРИМИДИНОВОЕ СОЕДИНЕНИЕ ИЛИ ЕГО СОЛЬ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЕЕ, В ЧАСТНОСТИ, АГЕНТ ДЛЯ ПРЕДОТВРАЩЕНИЯ И/ИЛИ ЛЕЧЕНИЯ ОПУХОЛЕЙ, И ТОМУ ПОДОБНОЕ, НА ОСНОВЕ ИНГИБИТОРНОГО ВОЗДЕЙСТВИЯ НА NAE | 2015 |
|
RU2658008C2 |
| ЗАМЕЩЕННЫЕ ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБ ПРИМЕНЕНИЯ | 2016 |
|
RU2744766C2 |
| УСИЛИТЕЛЬ ПРОТИВООПУХОЛЕВОГО ВОЗДЕЙСТВИЯ, СОДЕРЖАЩИЙ СОЕДИНЕНИЕ ПИРРОЛОПИРИМИДИНА | 2016 |
|
RU2710380C1 |
| ЗАМЕЩЕННЫЕ ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2020 |
|
RU2827641C1 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
Изобретение относится к новому соединению формулы I или его фармацевтически приемлемой соли присоединения кислоты или его соответствующему энантиомеру. Соединения обладают активностью в отношении метаботропного рецептора глутамата 4 и могут быть использованы для лечения болезни Паркинсона, тревожности, рвоты, обсессивно-компульсивного расстройства, аутизма, рака, депрессии, диабета 2 типа и для нейропротекции. В формуле I
R1 представляет собой низший алкил; R2 представляет собой фенил или пиридинил, причем атом N в пиридинильной группе может быть в различных положениях; n равно 0, 1 или 2; V/U представляют собой независимо друг от друга О или СН2, причем V и U не могут быть одновременно О; L представляет собой пяти- или шестичленную гетероарильную группу, выбранную из
3 н. и 12 з.п. ф-лы, 1 ил., 4 табл., 17 пр.
1. Соединение формулы I
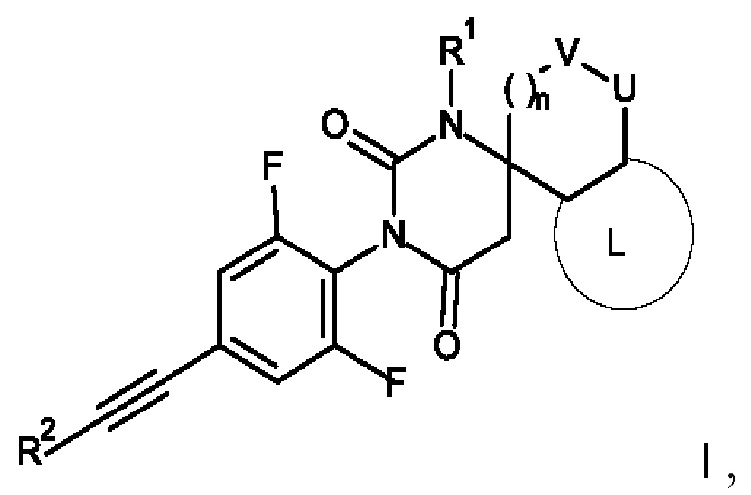
где R1 представляет собой низший алкил;
R2 представляет собой фенил или пиридинил, причем атом N в пиридинильной группе может быть в различных положениях;
n равно 0, 1 или 2;
V/U представляют собой независимо друг от друга О или СН2, причем V и U не могут быть одновременно О;
L представляет собой пяти- или шестичленную гетероарильную группу, выбранную из:
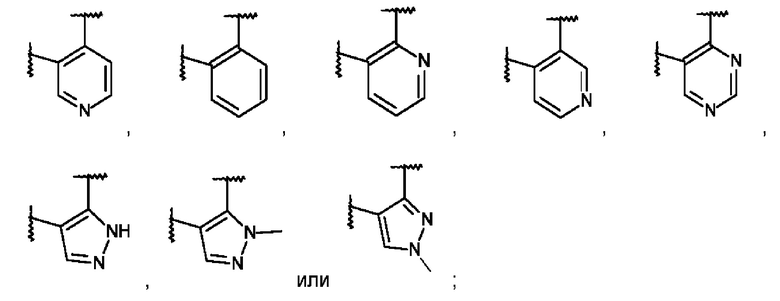
или его фармацевтически приемлемая соль присоединения кислоты или его соответствующий энантиомер.
2. Соединение формулы IA по п. 1
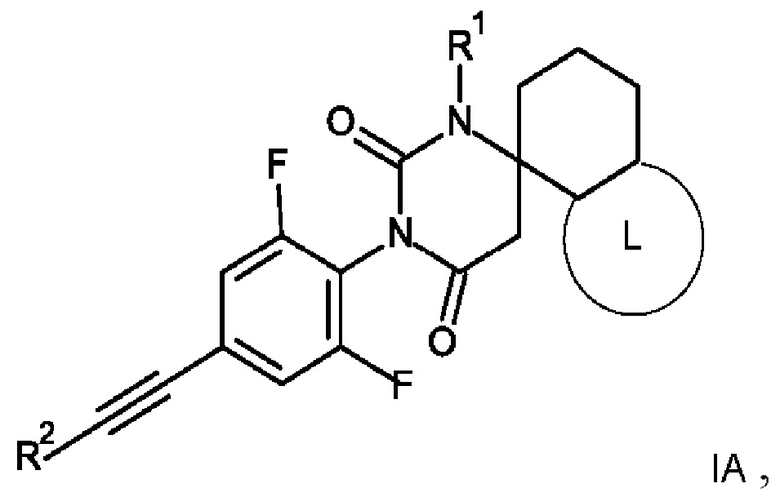
где R1 представляет собой низший алкил;
R2 представляет собой фенил или пиридинил, причем атом N в пиридинильной группе может быть в различных положениях;
L представляет собой пяти- или шестичленную гетероарильную группу, выбранную из:
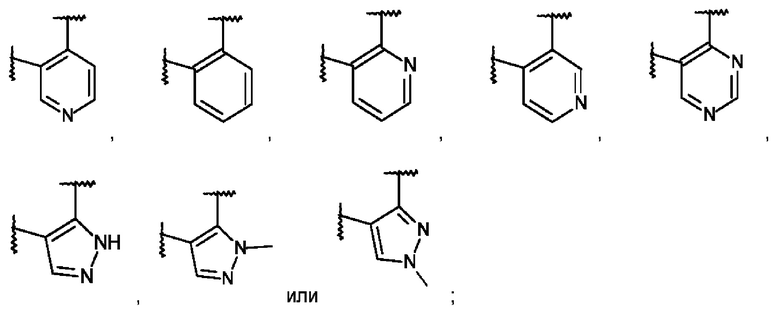
или его фармацевтически приемлемая соль присоединения кислоты или его соответствующий энантиомер.
3. Соединение формулы IA по п. 1 или 2, которое представляет собой одно из следующих соединений:
(8S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[6,7-дигидро-5Н-изохинолин-8,6'-гексагидропиримидин]-2',4'-дион,
(6S)-3-[2,6-дифтор-4-[2-(3-пиридил)этинил]фенил]-1-метилспиро[гексагидропиримидин-6,1'-тетралин]-2,4-дион,
(5S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[7,8-дигидро-6Н-хинолин-5,6'-гексагидропиримидин]-2',4'-дион,
(5S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[7,8-дигидро-6Н-изохинолин-5,6'-гексагидропиримидин]-2',4'-дион,
(5S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[7,8-дигидро-6Н-хиназолин-5,6'-гексагидропиримидин]-2',4'-дион,
(8S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-этилспиро[6,7-дигидро-5Н-изохинолин-8,6'-гексагидропиримидин]-2',4'-дион,
(4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[1,5,6,7-тетрагидроиндазол-4,6'-гексагидропиримидин]-2',4'-дион,
(4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1',2-диметилспиро[6,7-дигидро-5Н-индазол-4,6'-гексагидропиримидин]-2',4'-дион или
(4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1,1'-диметилспиро[6,7-дигидро-5Н-индазол-4,6'-гексагидропиримидин]-2',4'-дион.
4. Соединение формулы IB по п. 1
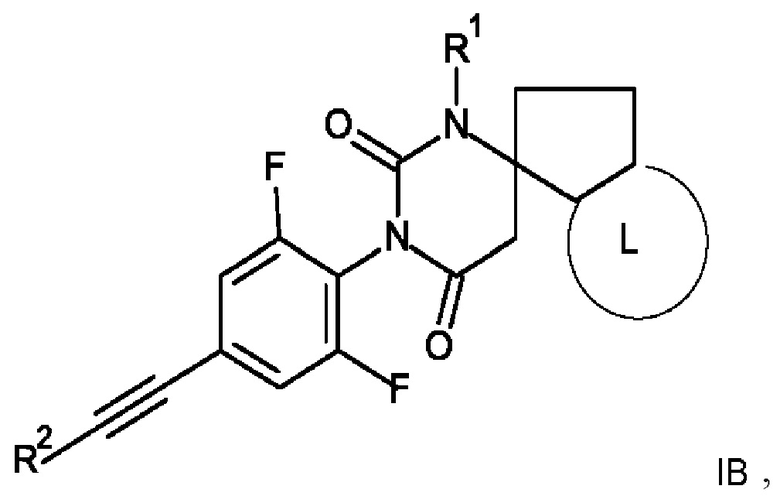
где R1 представляет собой низший алкил;
R2 представляет собой фенил или пиридинил, причем атом N в пиридинильной группе может быть в различных положениях;
L представляет собой пяти- или шестичленную гетероарильную группу, выбранную из:
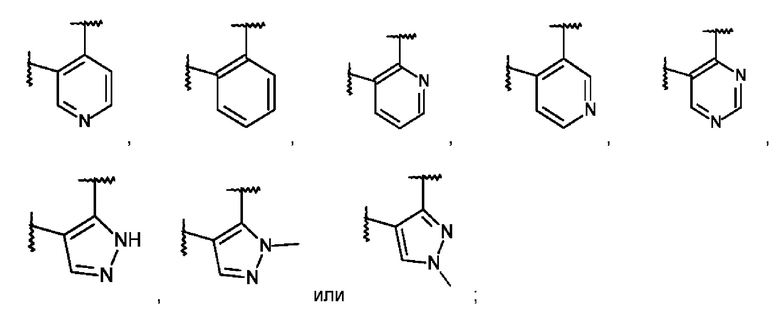
или его фармацевтически приемлемая соль присоединения кислоты или его соответствующий энантиомер.
5. Соединение формулы IB по п. 1 или 4, которое представляет собой одно из следующих соединений:
(6S)-3-[2,6-дифтор-4-[2-(3-пиридил)этинил]фенил]-1-метилспиро[гексагидропиримидин-6,1'-индан]-2,4-дион или
(5S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[6,7-дигидроцикло-пента[b]пиридин-5,6'-гексагидропиримидин]-2',4'-дион.
6. Соединение формулы IС по п. 1
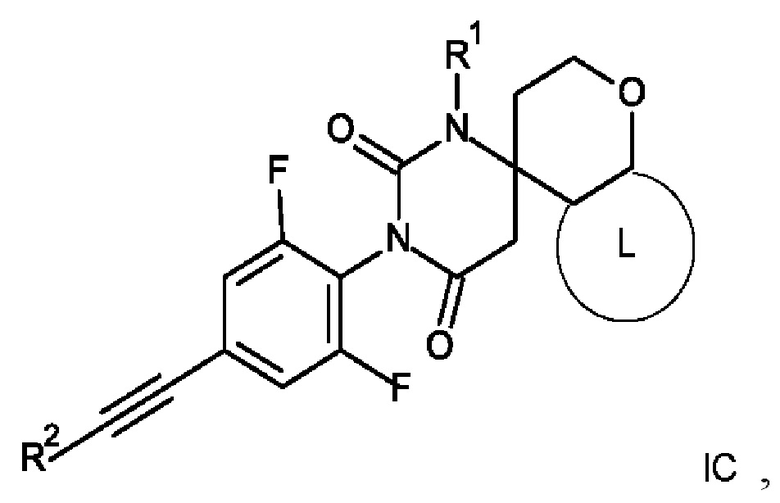
где R1 представляет собой низший алкил;
R2 представляет собой фенил или пиридинил, причем атом N в пиридинильной группе может быть в различных положениях;
L представляет собой пяти- или шестичленную гетероарильную группу, выбранную из:
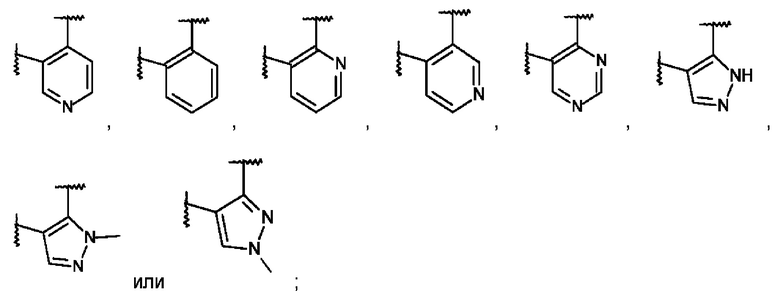
или его фармацевтически приемлемая соль присоединения кислоты или его соответствующий энантиомер.
7. Соединение формулы IС по п. 1 или 6, которое представляет собой одно из следующих соединений:
(4S)-3'-[2,6-дифтор-4-[2-(3-пиридил)этинил]фенил]-1'-метилспиро[хроман-4,6'-гексагидропиримидин]-2',4'-дион или
(4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[2,3-дигидропирано[2,3-b]пиридин-4,6'-гексагидропиримидин]-2',4'-дион.
8. Соединение формулы ID по п. 1
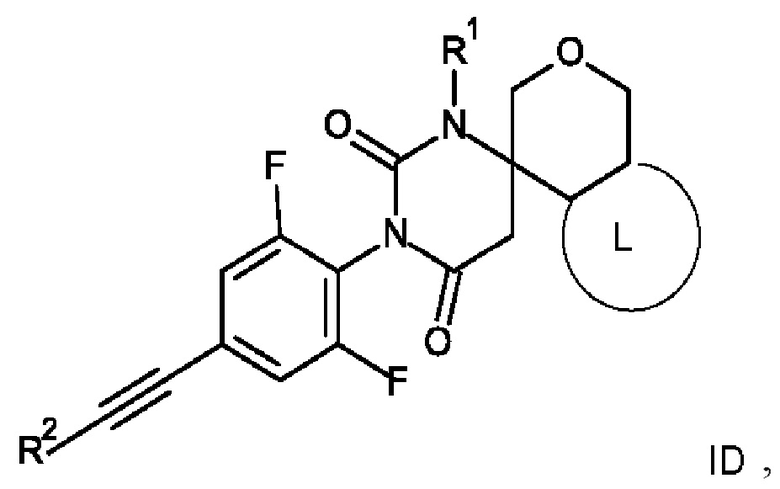
где R1 представляет собой низший алкил;
R2 представляет собой фенил или пиридинил, причем атом N в пиридинильной группе может быть в различных положениях;
L представляет собой пяти- или шестичленную гетероарильную группу, выбранную из:
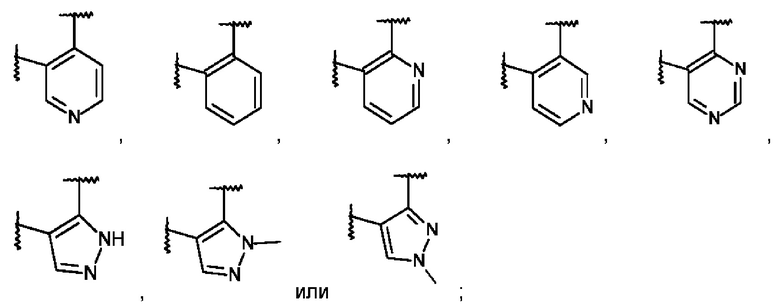
или его фармацевтически приемлемая соль присоединения кислоты или его соответствующий энантиомер.
9. Соединение формулы ID по п. 1 или 8, при этом указанное соединение представляет собой
(6S)-3-[2,6-дифтор-4-[2-(3-пиридил)этинил]фенил]-1-метилспиро[гексагидропиримидин-6,4'-изохроман]-2,4-дион.
10. Соединение формулы IE по п. 1
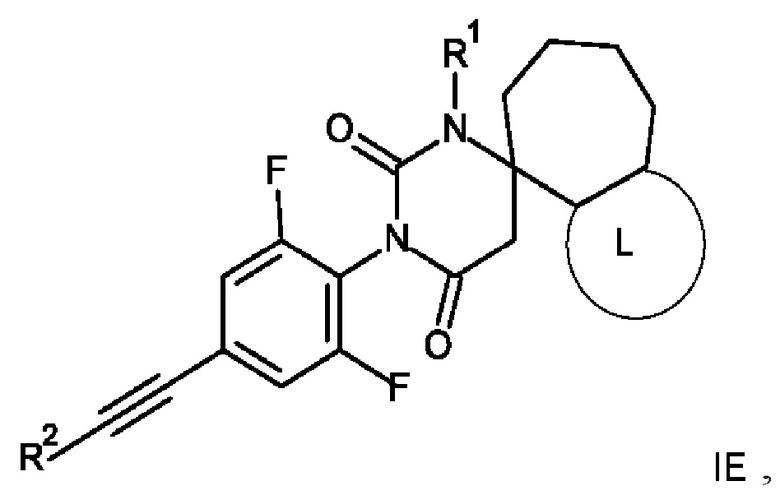
где R1 представляет собой низший алкил;
R2 представляет собой фенил или пиридинил, причем атом N в пиридинильной группе может быть в различных положениях;
L представляет собой пяти- или шестичленную гетероарильную группу, выбранную из:
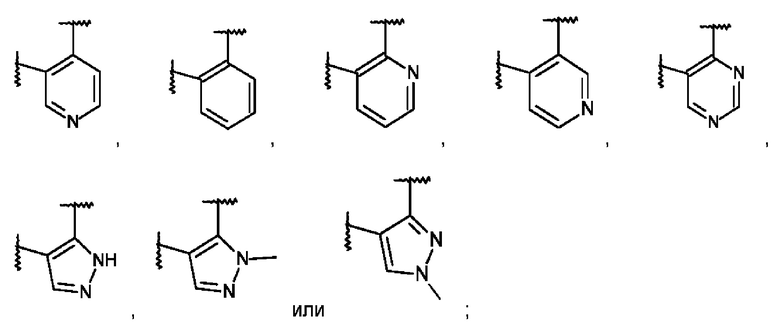
или его фармацевтически приемлемая соль присоединения кислоты или его соответствующий энантиомер.
11. Соединение формулы IE по п. 1 или 10, которое представляет собой одно из следующих соединений:
(4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1'-метилспиро[5,6,7,8-тетрагидро-1Н-цикпогепта[с]пиразол-4,6'-гексагидропиримидин]-2',4'-дион,
(4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1,1'-диметилспиро[5,6,7,8-тетрагидроциклогепта[с]пиразол-4,6'-гексагидропиримидин]-2',4'-дион или
(4S)-3'-[2,6-дифтор-4-(2-фенилэтинил)фенил]-1',2-диметилспиро[5,6,7,8-тетрагидроциклогепта[с]пиразол-4,6'-гексагидропиримидин]-2',4'-дион.
12. Соединение формулы I по любому из пп. 1-11 для применения в качестве терапевтически активного вещества, обладающее активностью в отношении метаботропного рецептора глутамата 4.
13. Соединение формулы I по любому из пп. 1-11 для применения для лечения болезни Паркинсона, тревожности, обсессивно-компульсивного расстройства, аутизма, рака, депрессии, диабета 2 типа, связанных с нарушением активности метаботропного рецептора глутамата 4, и для нейропротекции.
14. Фармацевтическая композиция, обладающая активностью в отношении метаботропного рецептора глутамата 4, включающая эффективное количество соединения формулы I, определенного в любом из пп. 1-11, и фармацевтически приемлемые эксципиенты.
15. Применение соединения формулы I по любому из пп. 1-11 для изготовления лекарственного препарата для лечения болезни Паркинсона, тревожности, обсессивно-компульсивного расстройства, аутизма, рака, депрессии, диабета 2 типа, связанных с нарушением активности метаботропного рецептора глутамата 4, и для нейропротекции.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| ТРИЦИКЛИЧЕСКИЕ СПИРО-ПРОИЗВОДНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ CRTH2 | 2006 |
|
RU2478639C2 |
Авторы
Даты
2020-05-22—Публикация
2016-07-11—Подача