ЗАЯВКА НА ПРИОРИТЕТ
Данная заявка заявляет приоритет даты подачи предварительной патентной заявки США с серийным номером, 61/362,222, поданной 7 июля 2010 г. под названием "ПОЛУЧЕНИЕ ФУНКЦИОНАЛИЗИРОВАННОЙ ДНК-КАССЕТЫ И ОПОСРЕДОВАННАЯ КВАНТОВЫМИ ТОЧКАМИ/НАНОЧАСТИЦАМИ ДОСТАВКА В РАСТЕНИЯ".
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способам использования наночастиц для неинвазивной доставки молекул функционализированных линейных нуклеотидных кассет в растительные клетки, имеющие интактную клеточную стенку.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Наночастицы обладают уникальными свойствами, которые используются для доставки ДНК в определенные животные клетки. Было найдено, что при инкубации некоторых наночастиц, покрытых ДНК, с клетками, не имеющими клеточной стенки, клетки поглощали наночастицы и начинали экспрессировать гены, кодируемые ДНК. Полупроводниковые наночастицы (например, квантовые точки ("QD")) с размером частиц в диапазоне 3-5 нм также использовались в качестве носителей для доставки молекул в клетки. ДНК и белки можно присоединить к некоторым лигандам, прикрепленным к поверхности QD. См., например, Patolsky, et al. (2003) J. Am. Chem. Soc. 125: 13918. Покрытые карбоновыми кислотами или аминами QD могут быть сшиты с молекулами, содержащими тиольную группу, см., например, Dubertret et al. (2002) Science 298: 1759; Akerman, et al. (2002) Proc. Natl. Acad. Sci. U.S.A. 99: 12617; Mitchell, et al. (1999) J. Am. Chem. Soc. 121:8122, или N-гидроксисукцинимильную ("NHS") сложноэфирную группу, с использованием стандартных протоколов биоконъюгации. См., например, Pinaud, et al. (2004) J. Am. Chem. Soc. 126:6115; Bruchez, et al. (1998) Science 281:2013. Альтернативным путем присоединения молекул к поверхности QD является конъюгация покрытых стрептавидином QD с биотинилированными белками, олигонуклеотидами или антителами. См., например, Dahan, et al. (2003) Science 302:442; Pinaud, et al. (2004) J. Am. Chem. Soc. 126:6115; Wu, et al. (2003) Nature Biotechnol. 21:41; Jaiswal, et al. (2003) Nature Biotechnol. 21:47; и Mansson, et al. (2004) Biochem. Biophys. Res. Commun. 314:529.
Доставка молекул чужеродных нуклеиновых кислот в растения осложняется наличием стенки у клеток растений. В основе существующих способов для генетической трансформации растений лежит инвазивная доставка. У клеток растений клеточная стенка представляет собой барьер, препятствующий доставке экзогенно вносимых молекул. Для доставки в покрытые стенкой клетки растений генов и низкомолекулярных соединений используется множество инвазивных способов клеточной доставки, например, биолистическая доставка (генная пушка), микроинъекция, электропорация и опосредованная агробактериями трансформация, но доставку белков можно осуществить только с помощью микроинъекции. Если необходима доставка молекул нуклеиновых кислот с помощью наночастиц, то клеточную стенку удаляют перед добавлением частиц к протопластам растения. См., например, Torney, et al. (2007) Nature Nanotechnol. 2:295-300.
Более того, общепринятые методики трансформации растений, такие как опосредованная агробактериями трансформация, требуют использования рекомбинантной плазмиды. Эти общепринятые методики, поэтому, приводят к нежелательному встраиванию каркасной последовательности бактериального вектора в геном хозяина вместе в присоединенными к нему экзогенными генами. См., например, Kohli et al. (1999) Plant J. 17:591-601; и Meza et al. (2002) Nucleic Acids Res. 30(20):4556-66. Присутствие векторной базовой последовательности в трансплантате бесполезно в процедурах биолистического переноса. Кроме того, векторные базовые последовательности имеют тенденцию стимулировать нежелательную рекомбинацию, обеспечивая АТ-богатые последовательности в качестве "горячих точек" рекомбинации в процессе образовании вторичных структур. Muller et al. (1999) J. Mol. Biol. 291: 29-46. Векторные каркасные последовательности могут дополнительно обеспечивать новые последовательности "филлерной" ДНК (вставок ДНК), гомологичной фланкирующей геномной ДНК растений, которые могут выделяться в окружающую среду. Kohli et al. (1998) Proc. Natl. Acad. Sci. U.S.A. 95:7203-8; Pawlowski and Somers (2000) Proc. Natl. Acad. Sci. U.S.A. 95: 12106-10; Svitashev et al. (2002) Plant J. 32:433-45.
Трансформация трансгенными кассетами с использованием бомбардировки частицами имела ограниченный успех на культуре тканей и на растениях риса (Oryza sativa) и картофеля (Solarium tuberosum). Fu et al. (2000) Transgenic Res. 9: 11-9; Loc et al. (2002) Mol. Breeding 9:231-44; Romano et al. (2003) Transgenic Res. 12:461-73; и Agrawal et al. (2005) Mol. Breeding 16:247-60. Предполагается, что эти биолистические методики генерируют больший процент трансгенных растений риса и картофеля с простыми схемами встраивания. Две группы линейных генетических конструкций (gus и bar, и 1Ax1 и bar), в которых отсутствуют базовые векторные последовательности, независимо переносили в элитный сорт EM12 пшеницы (Triticum aestivum L.) бомбардировкой частицами и выделяли генетически стабильные растения с низкокопийным встроенным трансгеном. Yao et al. (2006) J. Exp. Botany 57(14):3737-46. Наблюдаемая эффективность трансформации при биолистической бомбардировке составляла от 0,2 до 0,6. Id. Предполагается, что три потенциальных элемента (а именно, снижение степени конкатемеризации перед встраиванием трансгена; ограничение возможности перестановок в трансгене; и предупреждение гомологичных взаимодействий между различными трансгенами в течение событий встраивания) действуют сообща, обеспечивая простые интактные трансгенные локусы, представленные простыми картинами гибридизации. Agrawal et al. (2005), выше.
На сегодняшний момент бомбардировка частицами и Whiskers™ (см. патенты США №№ 5,464,765 и 5,302,523) вместе с расщепленными ферментами рестрикции фрагментами ДНК являются единственным путем доставки линейных ДНК-кассет в клетки растений, имеющих интактные клеточные стенки.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении описаны способы и композиции для использования наночастиц и линеаризованных молекул нуклеиновых кислот для введения представляющей интерес молекулы в растительную клетку, имеющую клеточную стенку. Некоторые варианты осуществления способов по изобретению можно использовать для получения стабильно трансформированного генетически-модифицированного фертильного растения. В некоторых вариантах осуществления изобретения отличительные свойства молекул функционализированных линейных нуклеотидных кассет позволяют доставку представляющих интерес последовательностей определенных генов без нежелательных нуклеотидных последовательностей, например, без ограничения, векторных базовых последовательностей.
В вариантах осуществления изобретения для трансформации растительных клеток, имеющих клеточную стенку, можно использовать несколько различных типов наночастиц. В некоторых вариантах осуществления изобретения наночастицы могут быть ПЭГилированы (иметь присоединенные молекулы ПЭГ) с молекулами функционализированных линейных нуклеотидных кассет. В конкретных вариантах осуществления изобретения наночастицами могут быть полупроводниковые наночастицы, такие как квантовые точки ("QD"); или частицы золота. В других вариантах осуществления изобретения молекулами функционализированных линейных нуклеотидных кассет может быть линеаризованная плазмидная ДНК. В альтернативных вариантах осуществления изобретения молекулы функционализированных линейных нуклеотидных кассет могут содержать последовательности, кодирующие фосфинотрицин-N-ацетилтрансферазу (PAT) и/или желтый флуоресцентный белок (YFP).
Также изобретение относится к способам введения целевой молекулы в растительную клетку, имеющую клеточную стенку, причем способы могут включать в себя предоставление растительной клетки, имеющей клеточную стенку; покрытие поверхности наночастиц по меньшей мере одной молекулой функционализированной линейной нуклеотидной кассеты, представляющей интерес; осуществление контакта между растительной клеткой, имеющей клеточную стенку, и наночастицами, покрытыми молекулой(ами) функционализированной линейной нуклеотидной кассеты, представляющей интерес; и обеспечение возможности поглощения наночастицы и молекул(ы) функционализированных линейных нуклеотидных кассет, представляющих интерес, растительной клеткой, содержащей клеточную стенку. В конкретных вариантах осуществления изобретения представляющей интерес молекулой функционализированной линейной нуклеотидной кассеты может быть биотинилированная молекула линеаризованной двухцепочечной ДНК, содержащей представляющий интерес ген. В дополнительных вариантах осуществления изобретения представляющей интерес молекулой функционализированной линейной нуклеотидной кассеты может быть химически немодифицированная молекула двухцепочечной ДНК, содержащая представляющий интерес ген. В конкретных вариантах осуществления изобретения наночастицой может быть QD-стрептавидиновая наночастица. Функционализированные молекулы линейных нуклеотидных кассет можно конъюгировать с наночастицами с использованием разнообразных реагентов с различными функциональными группами. В некоторых вариантах осуществления изобретения поверхность наночастиц может быть функционализирована белками и/или другими молекулами, например, пестицидами, которые несут совместимые функциональные группы. В некоторых вариантах осуществления изобретения поверхность наночастицы может быть конъюгирована более чем с одним типом молекул. Поэтому, в конкретных вариантах осуществления изобретения поверхность наночастиц может быть совместно функционализирована проникающими в клетку пестицидами и молекулами линеаризованных нуклеотидных кассет, например, для облегчения направленной доставки биомолекул.
Дополнительно раскрыты способы интрогрессии признака в растение. В некоторых вариантах осуществления изобретения способ может включать в себя предоставление растительной клетки; покрытие поверхности наночастиц средством для экспрессии признака в растении; осуществление контакта между растительной клеткой и наночастицами, покрытыми средством для экспрессии признака в растении; обеспечение возможности поглощения наночастицы и средства для экспрессии признака в растении растительной клеткой для получения трансформированной растительной клетки; регенерацию целого растения из трансформированной растительной клетки; и размножение растения. В некоторых вариантах осуществления изобретения признак, который можно интрогрессировать согласно способам по изобретению, включает в себя признак, выбранный, без ограничения, из: мужской стерильности, устойчивости к гербициду, устойчивости к насекомым и устойчивости к бактериальному заболеванию, грибковому заболеванию и/или вирусному заболеванию.
Также раскрыты способы по изобретению, которые можно использовать для in planta трансформации растений. В некоторых вариантах осуществления изобретения растение может быть выбрано из растений рода Arabidopsis, например, A. thaliana. В конкретных вариантах осуществления изобретения растение, трансформированное с помощью in planta трансформации, может быть выбрано из растений A. thaliana экотипа Columbia.
Дополнительно раскрыты генетически модифицированные растительные клетки (ГМ) и способы их получения, причем растительные клетки имеют одну или несколько нуклеиновых кислот, введенных в них способами по настоящему изобретению. В некоторых вариантах осуществления изобретения плазмида, содержащая по меньшей мере один представляющий интерес ген и селектируемый маркер, может быть введена в клетку растения, имеющую клеточную стенку, с помощью наночастиц согласно настоящему изобретению. В дополнительных вариантах осуществления изобретения можно отобрать стабильные трансформанты, которые имеют стабильно встроенный по меньшей мере один представляющий интерес ген и/или селектируемый маркер. В альтернативных вариантах осуществления изобретения растительную клетку, уже содержащую по меньшей мере один представляющий интерес ген, можно размножать для получения других клеток, содержащих представляющую интерес молекулу. В других вариантах осуществления изобретения растительной клеткой, содержащей представляющую интерес молекулу, может являться способная к регенерации клетка, которую можно использовать для регенерации целого растения, включающего молекулу, представляющую интерес.
Дополнительно раскрыты способы создания регенерируемых растительных клеток, включающих в себя представляющую интерес молекулу, для использования в культуре тканей. Культура тканей может обладать способностью к регенерации растений, имеющих по существу одинаковый генотип с регенерируемыми клетками. Регенерируемыми клетками в таких культурах тканей могут быть, например, зародыши, протопласты, меристемные клетки, каллюс, пыльца, листья, пыльники, корни, кончики корней, цветки, семена, стручки или стебли. Дополнительно, некоторые варианты осуществления изобретения относятся к растениям, регенерированным из культур тканей по изобретению.
Дополнительно раскрыты способы получения стабилизированных линий растений, включающих в себя желаемый признак или молекулу нуклеиновой кислоты, представляющую интерес, причем желаемый признак или молекула нуклеиновой кислоты, предоставляющая интерес, могут быть первоначало введены путем поглощения наночастицы через растительную клеточную стенку. Способы получения стабилизированных линий растений хорошо известны среднему специалисту в данной области и могут включать в себя методики, такие как, но не ограничиваясь ими: самоопыление; возвратное скрещивание; получение гибридов; скрещивание с популяциями; и т. п. Поэтому в изобретении раскрыты растения и растительные клетки, включающие в себя желаемый признак или молекулу нуклеиновой кислоты, представляющую интерес, первоначально введенную в растительную клетку (или ее предшественников) путем введения наночастицы через клеточную стенку. Растительную клетку, включающую в себя желаемый признак или молекулу нуклеиновой кислоты, представляющую интерес, первоначально введенные в растительную клетку (или ее предшественников) путем введения наночастицы через клеточную стенку, можно использовать в скрещивании с другими отличающимися от нее растительными клетками, чтобы получить гибридные клетки, семена и/или растения первого поколения (F1) с желаемыми характеристиками.
Кроме типичных аспектов и вариантов осуществления изобретения, описанных выше, дополнительные аспекты и варианты осуществления будут очевидны в свете следующих описаний.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 включает диаграмму нелинеаризованной плазмиды pDAB3831.
Фиг.2 включает последовательность ДНК плазмиды pDAB3831. Фрагмент ДНК от 7666 и до 3870 п.о. был амплифицирован с помощью ПЦР и использован для трансформации Arabidopsis, что дало растения Т2 со стабильно встроенной вставкой.
Фиг.3 включает выравнивание последовательностей между последовательностью ДНК фосфинотрицин-N-ацетилтрансферазы (PAT) из трансформированного с помощью Dendrimer генома Arabidopsis и последовательностью РАТ из базы данных NCBI.
Фиг.4 включает выравнивание последовательностей между геномом Arabidopsis, трансформированного последовательностью ДНК желтого флуоресцентного белка (YFP), и последовательностью YFP из базы данных NCBI.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO:1 представляет собой последовательность прямого праймера, используемого для амплификации полноразмерной экспрессионной кассеты 4,6 т.п.о. на плазмиде pDAB3831: /5Biosq/TGAAAGTGTACATCAACGAA.
SEQ ID NO:2 представляет собой последовательность обратного праймера, используемого для амплификации полноразмерной экспрессионной кассеты 4,6 т.п.о. на плазмиде pDAB3831: /5Biosq/CCGCAACTATTTCAACAC.
SEQ ID NO:3 представляет собой последовательность прямого праймера, используемого для амплификации гена YFP: TGTTCCACGGCAAGATCCCCTACG.
SEQ ID NO:4 представляет собой последовательность обратного праймера, используемого для амплификации гена YFP: TATTCATCTGGGTGTGATCGGCCA.
SEQ ID NO: 5 представляет собой последовательность прямого праймера, используемого для амплификации гена РАТ: GGAGAGGAGACCAGTTGAGATTAG.
SEQ ID NO:6 представляет собой последовательность обратного праймера, используемого для амплификации гена РАТ: AGATCTGGGTAACTGGCCTAACTG.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
I. Общее описание нескольких вариантов осуществления изобретения
Способы по изобретению, позволяющие неинвазивный перенос генов, могут быть очень полезны для получения генетически модифицированных растений с желаемыми признаками. Неинвазивный перенос генов может облегчать направленное воздействие и редактирование молекулярных сайтов в клетке для областей, таких как включение желаемых входных данных, выходных данных и агрономических признаков в сельскохозяйственные растения. Описанные способы также могут быть полезны в качестве "не содержащей ГМО" возможности транзиентной трансформации растений, экспансии технологии интрогрессии признаков и устойчивости к заболеваниям на древесные и овощные культуры, технологии для которых на настоящий момент ограничены.
В недавней патентной заявке (США, серийный номер 60/978,059) продемонстрировано неинвазивное средство доставки ДНК на основе наночастиц с использованием наночастиц с различной полезной нагрузкой, inter alia, для доставки кольцевой плазмидной ДНК, и однозначно продемонстрировано стабильное встраивание трансгенов в семена Т1 растений Arabidopsis. Полученные в ходе этого трансгенные растения, содержащие кольцевую плазмидную ДНК, проявляли желаемые фенотипы переносимости гербицида и показывали высокую степень переносимости по меньшей мере при 4 последовательных опрыскиваниях применяемым в сельском хозяйстве уровнем глуфосината аммония. В патенте США с серийным номером 60/978,059 была продемонстрирована, inter alia, генетическая трансформация Arabidopsis с помощью положительно заряженных золотых наночастиц с использованием кольцевой плазмидной ДНК. В настоящем исследовании описано, inter alia, использование молекул функционализированных линейных нуклеотидных кассет для стабильной генетической трансформации растений.
В патенте США с серийным номером 60/978,059 описана, inter alia, опосредованная положительно заряженными наночастицами доставка плазмидной ДНК. Однако до настоящего момента демонстрация стабильной геномной интеграции трансгена с использованием доставки линейной плазмиды не была опубликована. В настоящем изобретении описано применение опосредованной наночастицами доставки молекул функционализированных линейных нуклеотидных кассет для стабильной генетической трансформации в растениях. Молекулярный анализ показал экспрессию РАТ совместно с YFP в трансгенных растениях Т1 Arabidopsis, трансформированных геном pat и геном yfp способами по изобретению. Трансгенные растения Т1 являются фертильными и дают семена. Эти семена можно размножить и можно провести сегрегационный анализ совместно с молекулярным и беловым анализами.
В настоящем документе раскрыты способы, которые позволяют получить простые события интеграции ДНК в растениях, и, таким образом, упростить последующие попытки интрогрессии. Использование молекул функционализированных линейных нуклеотидных кассет обеспечивает преимущества в генетической трансформации по сравнению, например, с плазмидами. Например, молекулы функционализированных линейных нуклеотидных кассет могут не содержать векторных каркасных последовательностей или селектируемых маркерных генов.
II. Термины
В нижеследующих описании и таблицах используется ряд терминов. С целью обеспечения ясного и согласованного понимания описания и формулы изобретения, включая объем, даваемый в этих терминах, приведены следующие определения:
Возвратное скрещивание: в контексте настоящего изобретения возвратное скрещивание представляет собой процесс, при котором селекционер многократно скрещивает гибридное потомство с одним из родителей, например, первое поколение гибридов F1 с одним из родительских генотипов гибрида F1.
Зародыш: в контексте настоящего изобретения "зародыш" может относиться к маленькому растению, содержащемуся в зрелом семени.
Наночастица: в контексте настоящего изобретения "наночастица" может относиться к микроскопической частице с размерами в нанодиапазоне, например, меньше 100 нм. Наночастицы, подходящие для использования в настоящем изобретении, могут иметь размер от 1 нм до 0,84 мкм. Одним классом наночастиц являются "квантовые точки" (QD). Квантовая точка может иметь медианный диаметр 1-10 нм, например, 2-4 нм. Другие варианты наночастиц включают, без ограничения: золотые наночастицы, покрытые золотом наночастицы, пористые наночастицы, мезопористые наночастицы, кремниевые наночастицы, полимерные наночастицы, такие как дендримеры, вольфрамовые наночастицы, желатиновые наночастицы, нанооболочки, наноядра, наносферы, нанотрубочки, магнитные наночастицы и их комбинации.
Из доступных наночастиц, наиболее продемонстрировано применение в биовизуализации и биосенсорных технологиях люминесцентных полупроводниковых нанокристаллов (QD). Их применение основано на комбинации уникальных фотофизических характеристик и размеров, сравнимых с размерами крупных белков. Гидродинамический радиус гидрофильных вариантов квантовых точек CdSe-ZnS варьирует от 5 нм (для нанокристаллов, с группами на поверхности, замещенными на молекулярные лиганды) до 20 нм для нанокристаллов, заключенных в блок-сополимеры. Одна QD может быть конъюгирована с несколькими биомолекулами (например, антителами, пептидами и молекулами нуклеиновых кислот), чтобы обеспечить полифункциональные биоконъюгаты QD с повышенной авидностью. В дополнение, их сильная устойчивость к химической и фотодеградации может потенциально позволять длительное флуоресцентное наблюдение специфичных биологических процессов. Nie and Emory (1997) Science 275: 1102-6. Для того чтобы получить полифункциональные биоконъюгаты QD, стабильные даже во внутриклеточном окружении, можно одновременно применять на одном комплексе множество схем нековалентной конъгации на основе металлоаффинной самосборки и связывания биотина с авидином без необходимости дополнительной очистки. Yezhelyev et al. (2008) J. Am. Chem. Soc. 130(28):9006-12. Используя в среднем 10 YFP плюс номинально 50 проникающих в клетку пептидов (СРР) на QD, можно осуществить внутриклеточную доставку белков с молекулярным весом по меньшей мере 300 кДа и размером 150 ангстрем. Id. Конъюгаты QD-b-PE доставляют "груз" в гораздо большем диапазоне размеров и молекулярных весов; например, со средним соотношением 2,5 Стрептавидин-b-ПЭ на конъюгат доставляемые вещества имеют молекулярный вес, который превышает 103 кДа, и общий размер, приближающийся к 500 ангстремам. Молекулярный вес и размер могут значительно увеличиваться при использовании коъюгатов с большими валентностями b-PE.
Молекула нуклеиновой кислоты: полимерная форма нуклеотидов, которая может включать как смысловую, так и антисмысловую цепи РНК, кДНК, геномной ДНК, искусственные хромосомы (АСЕ) и синтетические формы и смешанные полимеры вышеперечисленного. Нуклеотид относится к рибонуклеотиду, дезоксирибонуклеотиду или модифицированной форме нуклеотида любого типа. В контексте настоящего изобретения "молекула нуклеиновой кислоты" является синонимом "нуклеиновой кислоты" и "полинуклеотида". Если не указано иное, то молекула нуклеиновой кислоты обычно имеет длину по меньшей мере 10 оснований. Термин включает одно- и двухцепочечные формы ДНК. Молекула нуклеиновой кислоты может включать любые или все природные и модифицированные нуклеотиды, соединенные друг с другом природными и/или неприродными нуклеотидными связями.
Функционально связанный: первая нуклеотидная последовательность функционально связана со второй нуклеотидной последовательностью, когда первая нуклеотидная последовательность функционально взаимосвязана со второй нуклеотидной последовательностью. Например, промотор функционально связан с кодирующей последовательностью, если промотор влияет на транскрипцию или экспрессию кодирующей последовательности. При рекомбинантном получении функционально связанные нуклеотидные последовательности могут быть непрерывными и, при необходимости соединения двух кодирующих белки областей, могут иметь одну рамку считывания. Однако нуклеиновые кислоты не должны быть непрерывными, для того чтобы быть функционально связанными.
ПЭГилированный: В контексте настоящего изобретения термин "ПЭГилированный" может относиться к наночастицам (например, золотым наночастицам и квантовым точкам), поверхность которых модифицирована полиэтиленгликолем (ПЭГ) для улучшения биосовместимости. ПЭГилированные наночастицы могут быть дополнительно покрыты различными лигандами направленного действия, например, пептидами и антителами, для увеличения эффективности доставки в определенные клетки и ткани. ПЭГ конъюгирован с наночастицами с различными лекарственными соединениями, липосомами и полимерными мицеллами, например, для того чтобы увеличить время нахождения в кровотоке имеющих оболочку наночастиц за счет снижения неспецифической адсорбции белков вследствие эффекта стерической стабилизации.
Квантовая точка: в контексте настоящего изобретения "квантовая точка" (QD) (также иногда именуемая нанокристаллами) может относиться к полупроводниковой наноструктуре, которая ограничивает движение электронов зоны проводимости, дырок валентной зоны или экситонов (связанных пар электронов зоны проводимости и дырок валентной зоны) во всех трех измерениях. Это ограничение может быть следствием, например, электростатических потенциалов (генерируемых внешними электродами, допированием, деформацией, примесями и т.д.); присутствия поверхности раздела между различными полупроводниковыми материалами (например, в нанокристаллических системах "ядро-оболочка"); присутствия полупроводниковой поверхности (например, полупроводниковый нанокристалл); или их комбинации. Квантовая точка может иметь дискретный (квантованный) энергетический спектр. Соответствующие волновые функции могут быть пространственно локализованы в квантовой точке, но распространяются на множество периодов кристаллической решетки. Квантовая точка содержит маленькое конечное число (например, порядка 1-100) электронов зоны проводимости; дырок валентной зоны; или экситонов (то есть, конечное число элементарных электрических зарядов).
Квантовые точки представляют собой особый класс полупроводниковых материалов, которые могут являться кристаллами, состоящими из веществ, относящихся к группам II-VI, III-V или IV-VI периодической системы элементов Менделеева. Их размеры могут варьировать в диапазоне, например, от 2 до 10 нанометров (10-50 атомов) в диаметре. В некоторых вариантах осуществления изобретения квантовые точки могут быть изготовлены с ядром из селенида кадмия и оболочкой из сульфида цинка (CdSe/ZnS), и обладают спектром полезных электрических и оптических свойств, которые отличаются по характеристикам от свойств исходных веществ. Квантовые точки исследовали в качестве визуализирующих агентов in vivo и in vitro вследствие их высокого квантового выхода, высокого молярного коэффициента экстинкции и высокой устойчивости к фотообесцвечиванию.
Устойчивый к глифосату: устойчивость к дозе глифосата относится к способности растения выживать (то есть растение может не умирать) при воздействии дозы глифосата. В некоторых случаях устойчивые растения могут временно приобрести желтую окраску, или как-либо иначе проявлять вызванное глифосатом поражение (например, избыточное количество ростков и/или ингибирование роста), но восстанавливаться.
Стабилизированный: в контексте настоящего изобретения термин "стабилизированный" может относиться к характеристикам растения, которые воспроизводимо передаются от одного поколения к другому поколению инбредных растений одного сорта.
Трансген: в контексте настоящего изобретения термин "трансген" может относиться к последовательности экзогенной нуклеиновой кислоты. В одном примере трансгеном является последовательность гена (например, гена устойчивости к гербициду); гена, кодирующего промышленно или фармацевтически полезное соединение; или гена, кодирующего желаемый арготехнический признак. В еще одном примере трансгеном является последовательность антисмысловой нуклеиновой кислоты, причем экспрессия последовательности антисмысловой нуклеиновой кислоты ингибирует экспрессию последовательности нуклеиновой кислоты-мишени. Трансген может содержать регуляторные последовательности, функционально связанные с трансгеном (например, промотор). В некоторых вариантах осуществления изобретения представляющая интерес молекула функционализированной линейной нуклеотидной кассеты, вводимая с помощью опосредованной наночастицами трансформации, содержит трансген. Однако в других вариантах осуществления изобретения, когда желательны дополнительные геномные копии последовательности эндогенной нуклеиновой кислоты, представляющая интерес молекула функционализированной линейной нуклеотидной кассеты содержит последовательность эндогенной нуклеиновой кислоты, либо она содержит нуклеотидную последовательность, находящуюся в антисмысловой ориентации относительно молекулы нуклеиновой килоты-мишени в организме-хозяине.
Поглощение: в контексте настоящего изобретения термин "поглощение" может относиться к перемещению частицы, такой как наночастица (например, квантовые точки или наночастицы золота), через клеточную стенку или клеточную мембрану, причем перемещение не происходит исключительно в результате импульса, приданного частице чем-либо помимо клетки, которая поглощает частицу. Неограничивающими примерами устройств или способов, которые вызывают перемещение частицы через клеточную стенку или клеточную мембрану исключительно в результате импульса, приданного частице, являются биолистические устройства, генная пушка, микроинъекция и/или методики импалефекции.
III. Доставка молекул нуклеиновых кислот с использованием наночастиц для стабильной трансформации растительных клеток
А. Общее описание
В этом изобретении описаны, например, новые способы трансформации растений с использованием опосредованного наночастицами переноса молекул функционализированных линейных нуклеотидных кассет для генетической трансформации и получения стабильных трансгенных растений. В способах по некоторых вариантам осуществления изобретения может быть предложено не только быстрое создание трансгенного организма, но также несколько возможностей желаемых генетических модификаций по сравнению с другими способами трансформации. Варианты осуществления настоящего изобретения привели в результате к впервые опубликованному стабильно трансформированному растению, полученному посредством опосредованной наночастицами доставки линеаризованной плазмидной ДНК. Раскрытые способы генетической модификации отличаются от традиционных способов генетической трансформации растений, не зависят от биолистической доставки и могут быть очень полезны для создания трансгенных сельскохозяйственных культур.
Трансгенные растения обычно получают Agrobacterium-опосредованной трансформацией или бомбардировкой частицами. В дополнение к представляющему интерес гену трансгенные растения часто обязательно содержат последовательности векторного каркаса и гены селектируемого маркера, например, которые придают резистентность к антибиотикам или гербицидам. Поскольку гены селектируемых маркеров и векторные каркасные последовательности являются как лишними, так и нежелательными в методиках переноса ДНК, то получение свободных от вектора трансгенных растений является предпочтительным. Удаление векторных каркасных последовательностей, которое позволяют способы по некоторых вариантам осуществления, может ограничить число гомологичных рекомбинаций и влияние вызывающих рекомбинацию элементов на процесс интеграции.
В вариантах осуществления настоящего изобретения может быть достигнуто прямое создание трансгенных растений с помощью неинвазивной опосредованной наночастицами доставки линейных нуклеотидных кассет, например, посредством способа погружения цветка. Такие способы могут обеспечить более простой путь проведения желаемых трансформаций растений относительно других способов, доступных в данной области. В некоторых вариантах осуществления изобретения способы можно использовать для создания свободных как от вектора, так и от маркера, трансгенных растений. В некоторых вариантах осуществления изобретения способы трансформации не зависят от культуры тканей и поэтому могут быть более удобны и целесообразны для растений, воспроизводимых половым размножением.
В некоторых вариантах осуществления способы по изобретению могут обеспечивать способность неинвазивно трансформировать не совместимые с Agrobacterium растения и/или их клетки в суспензионной культуре. Такие способы могут обеспечить огромные возможности. Желаемые входные данные и агротехнические признаки могут требовать доставки множества генов в одной процедуре трансформации. В некоторых вариантах осуществления способы по изобретению позволяют доставку молекул множества нуклеиновых кислот, одновременно устраняя необходимость конструирования крупных плазмид, содержащих все представляющие интерес гены, что может быть обременительно, если вообще возможно.
В. Молекулы нуклеиновых кислот
С приходом методик молекулярной биологии, которые позволили выделение и характеристику генов, которые кодируют определенные белковые или РНК-продукты (например, интерферирующие РНК ("РНКи")), ученые в области биологии растений стали заинтересованы в генетической модификации генома клеток для включения в него чужеродных генов и их экспрессии, или дополнительных или модифицированных версий природных или эндогенных генов (иногда регулируемых разными промоторами), например, с целью изменения признаков клетки определенным образом. Такие чужеродные дополнительные и/или модифицированные гены собирательно именуются в настоящем документе "трансгенами". Трансгены могут, например, кодировать представляющий интерес белок, или могут транскрибироваться в РНКи. За последние пятнадцать-двадцать лет были разработаны несколько способов получения трансгенных клеток, и в конкретных вариантах осуществления настоящее изобретение относится к трансформированным версиям клеток и способам их получения посредством введения в растительную клетку, имеющую клеточную стенку, одной или нескольких молекул функционализированных нуклеотидных кассет посредством поглощения наночастицы через клеточную стенку. В некоторых вариантах осуществления изобретения трансген может содержаться в синтезированной линейной ДНК-кассете.
Трансформация клеток может включать в себя молекулу нуклеиновой кислоты, которая содержит ген под контролем или функционально связанный с регуляторным элементом (например, промотором, энхансером, последовательностью терминации или их комбинацией). Таким образом, молекула нуклеиновой кислоты может содержать один или несколько таких функционально связанных комбинаций гена и регуляторного элемента.
В вариантах осуществления изобретения представляющей интерес молекулой нуклеиновой кислоты может быть молекула функционализированной линейной нуклеотидной кассеты. Молекулы функционализированных линейных нуклеотидных кассет можно получить, например, расщеплением кольцевой плазмиды по меньшей мере одной рестрикционной эндонуклеазой, так чтобы вырезать содержащуюся в ней экспрессионную кассету. Рестрикционные эндонуклеазы будут расщеплять плазмиду по одному или нескольким сайтам рестрикции в нуклеотидной последовательности плазмиды. Поэтому, плазмиды можно конструировать таким образом, чтобы позволять создание одной или нескольких определенных молекул линейных нуклеотидных кассет путем расщепления с помощью по меньшей мере одной конкретной рестрикционной эндонуклеазы. В альтернативном варианте, в данной нуклеотидной последовательности плазмиды можно провести поиск сайтов, узнаваемых одной или несколькими конкретными рестрикционными эндонуклеазами, что позволит получить одну или несколько определенных молекул линейных нуклеотидных кассет. Путем отбора сайтов рестрикции, которые находятся в определенных местах в кольцевой плазмиде или линейной молекуле нуклеиновой кислоты, можно получить в результате молекулы линейных нуклеотидных кассет, у которых отсутствуют одна или несколько последовательностей из молекулы нуклеиновой кислоты-предшественника. Например, можно получить молекулу линейной нуклеотидной кассеты, в которой отсутствуют инородные нуклеотидные последовательности (например, векторный каркас, селектируемые маркеры, такие как маркеры для селекции в бактериях, и ненужные нуклеотидные последовательности, гомологичные геномной ДНК клетки-мишени). В альтернативном варианте можно синтезировать молекулу линейной нуклеотидной кассеты, в которой отсутствуют инородные нуклеотидные последовательности.
Молекулы линейных нуклеотидных кассет можно синтезировать с использованием проточных термоциклических систем. См. международную публикацию РСТ, WO 2008/045288. Вместо использования маленьких пробирок, в проточных термоциклерах для амплификации ДНК используют постоянный или непрерывный поток жидкости, многократно проходящий через различные температурные зоны. ПЦР-смесь вводят в жидкость-носитель, с которой она не смешивается, и затем жидкость-носитель проходит через множество температурных зон для осуществления амплификации ДНК в ПЦР-смеси. Специфичная последовательность ДНК в образце амплифицируется по мере циклов ее прохождения через температурные зоны. ПЦР-продукт можно очистить на гель-фильтрационной колонке.
Молекулы нуклеиновых кислот можно конъюгировать с наночастицами, используя различные реагенты с разными функциональными группами. Различные химические реакции для конъюгирования молекул нуклеиновых кислот с наночастицами перечислены в таблице 1.
В вариантах осуществления изобретения, в которых представляющая интерес молекула линейной нуклеотидной кассеты содержит один или несколько генов, гены могут представлять собой доминантный или рецессивный аллель. Например, ген(ы) может(могут) придавать такие признаки, как устойчивость к гербицидам, устойчивость к насекомым, мужская фертильность, мужская стерильность, улучшенные питательные качества и промышленное использование. Гены, придающие эти и другие признаки, известны в данной области, и согласно способам по изобретению любой ген можно ввести в растительную клетку, содержащую клеточную стенку.
Экспрессионные векторы для линеаризации и поглощения посредством наночастиц: маркерные гены
Экспрессионные векторы для линеаризации и поглощения посредством наночастиц могут необязательно включать по меньшей мере один генетический маркер, например, функционально связанный с регуляторным элементом, который позволяет трансформированным клеткам, содержащим маркер, либо выживать при отрицательной селекции (например, ингибировании роста клеток, которые не содержат ген селектируемого маркера) или при положительной селекции (например, скрининге продукта, кодируемого генетическим маркером). В данной области хорошо известны множество селектируемых маркерных генов для трансформации, которые включают, например, без ограничения: гены, кодирующие ферменты, метаболически нейтрализующие селективный химический агент, который может представлять собой антибиотик или гербицид; или гены, кодирующие измененную мишень, которая может быть нечувствительна к ингибитору. В данной области также известны способы специфичной положительной селекции. Однако в некоторых вариантах осуществления изобретения молекулы линеаризованных нуклеотидных кассет не содержат маркерных генов.
Одним селектируемым маркерным геном, который может подходить для трансформации растений определенными нуклеотидными молекулами, является ген неомицин-фосфотрансферазы II (nptII), необязательно, под контролем регуляторных сигналов растений, который придает устойчивость к канамицину. См., например, Fraley et al. (1983) Proc. Natl. Acad. Sci. U.S.A. 80:4803. Другим геном селектируемого маркера, который можно использовать, является ген гигромицин-фосфотрансферазы, который придает устойчивость к антибиотику гигромицину. См., например, Vanden Elzen et al. (1985) Plant Mol. Biol. 5:299.
Дополнительные гены селектируемых маркеров, которые можно использовать в способах по изобретению, включают гены бактериального происхождения, например, придающие устойчивость к антибиотикам, такие как гены гентамицин-ацетилтрансферазы, стрептомицин-фосфотрансферазы, аминогликозид-3'-аденилтрансферазы и устойчивости к блеомицину. См., Hayford et al. (1988) Plant Physiol. 86: 1216; Jones et al. (1987) Mol. Gen. Genet. 210:86; Svab et al. (1990) Plant Mol. Biol. 14: 197; и Hille et al. (1986) Plant Mol. Biol. 7:171. Другие гены селектируемых маркеров могут придавать устойчивость к гербицидам, таким как глифосат, глуфосинат или бромоксинил. См. Comai et al. (1985) Nature 317:741-744; Gordon-Kamm et al. (1990) Plant Cell 2:603-618; и Stalker et al. (1988) Science 242:419-423.
Гены других селектируемых маркеров, которые можно использовать в способах по изобретению, включают гены небактериального происхождения. Эти гены включают, например, без ограничения, гены мышиной дигидрофолатредуктазы, растительной 5-енолпирувилшикимат-3-фосфатсинтетазы и растительной ацетолактатсинтетазы. См. Eichholtz et al. (1987) Somatic Cell Mol. Genet. 13:67; Shah et al. (1986) Science 233:478; и Charest et al. (1990) Plant Cell Rep. 8:643.
Для другого класса маркерных генов, подходящих для трансформации растений, может потребоваться скрининг предположительно трансформированных клеток растения, а не прямая генетическая селекция трансформированных клеток на устойчивость к токсичному веществу, такому как антибиотик. Эти гены особенно полезны для количественной оценки или визуализации пространственной картины экспрессии гена в определенных тканях, и их часто именуют "репортерными генами", потому что для исследования экспрессии гена их можно слить с геном или регуляторной последовательностью гена. Обычно используемые гены для скрининга трансформированных клеток включают, без ограничения, β-глюкуронидазу (GUS), β-галактозидазу, люциферазу и хлорамфениколтрансферазу. См. Jefferson (1987) Plant Mol. Biol. Rep. 5:387; Teeri et al. (1989) EMBO J. 8:343; Koncz et al. (1987) Proc. Natl. Acad. Sci U.S.A. 84: 131; и DeBlock et al. (1984) EMBO J. 3:1681. Недавно стали доступны in vivo способы визуализации активности GUS, которые не требуют разрушения ткани растения. Публикация Molecular Probes 2908 (1993) Imagene Green™, p. 1-4; и Naleway et al. (1991) J. Cell Biol. 115:151a.
Совсем недавно в качестве маркеров экспрессии генов в прокариотических и эукариотических клетках стали использовать гены, кодирующие флуоресцентные белки (например, GFP, EGFP, EBFP, ECFP и YFP). См. Chalfie et al. (1994) Science 263:802. Таким образом, флуоресцентные белки и мутации флуоресцентных белков можно использовать в качестве скринируемых маркеров в некоторых вариантах осуществления изобретения.
Экспрессионные векторы для поглощения посредством наночастиц: промоторы
Гены, включенные в молекулы линейных нуклеотидных кассет, могут, необязательно, управляться нуклеотидной последовательностью, содержащей регуляторный элемент, например, промотор. В области трансформации на сегодняшний момент хорошо известны несколько типов промоторов, а также другие регуляторные элементы, которые можно использовать индивидуально или совместно с промоторами.
Промотор представляет собой область ДНК, которая может располагаться выше начала транскрипции, и может участвовать в узнавании и связывании РНК-полимеразы и/или других белков для инициации транскрипции. "Растительным промотором" может быть промотор, способный инициировать транскрипцию в растительных клетках. Примеры промоторов, зависящих от стадии развития растений, включают промоторы, которые предпочтительно инициируют транскрипцию в определенных тканях, таких как листья, корни, семена, волокна, сосуды ксилемы, трахеиды или склеренхима. Такие промоторы относят к тканепредпочтительным. Промоторы, которые инициируют транскрипцию только в определенных тканях, относят к тканеспецифичным. Специфичный к типу клетки промотор, в первую очередь, управляет экспрессией в определенных типах клеток в одном или нескольких органах, например, в сосудистых клетках в корнях или листьях. Индуцибельным промотором может быть промотор, который может находится под контролем окружающей среды. Примеры условий окружающей среды, которые могут влиять на транскрипцию, управляемую индуцибельными промоторами, включают, без ограничения, анаэробные условия или наличие освещения. Тканеспецифичные, тканепредпочтительные, специфичные к типу клетки и индуцибельные промоторы составляют класс "неконститутивных" промоторов. "Конститутивный" промотор является промотором, который может быть активен в большинстве условий окружающей среды.
1. Индуцибельные промоторы
Индуцибельный промотор может быть функционально связан с геном, предназначенным для экспрессии в клетке. Необязательно, индуцибельный промотор может быть функционально связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть функционально связана с геном, предназначенным для экспрессии в клетке. С индуцибельным промотором скорость транскрипции увеличивается в ответ на действие индуцирующего агента.
В настоящем изобретении можно использовать любой индуцибельный промотор. См. Ward et al. (1993) Plant Mol. Biol. 22:361-366. Типичные индуцибельные промоторы включают, без ограничения, промоторы, полученные из ACEI-системы, отвечающие на присутствие ионов меди (Mett et al. (1993) Proc. Natl. Acad. Sci. U.S.A. 90:4567-71); промотор гена In2 из маиса, который отвечает за переносимость бензолсульфамидного гербицида (Hershey et al. (1991) Mol. Gen Genetics 227:229-237; и Gatz et al. (1994) Mol. Gen. Genetics 243:32-38); и промотор Tet-репрессора из Tn10 (Gatz et al. (1991) Mol. Gen. Genetics 227:229-237). Особенно пригодным индуцибельным промотором может быть промотор, который отвечает на индуцирующий агент, на который растения обычно не отвечают. Таким типовым индуцибельным промотором является индуцибельный промотор из гена стероидного гормона, транскрипционная активность которого может индуцироваться глюкокортикостероидным гормоном. Schena et al. (1991) Proc. Natl. Acad. Sci. U.S.A. 88:0421.
2. Конститутивные промоторы
Конститутивный промотор может быть функционально связан с геном, предназначенным для экспрессии в клетке, или конститутивный промотор может быть функционально связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть функционально связана с геном, предназначенным для экспрессии в клетке.
В вариантах осуществления данного изобретения можно использовать различные конститутивные промоторы. Типичные конститутивные промоторы включают без ограничения: промоторы из вирусов растений, но не ограничены ими, такие как промотор 35S из CaMV (Odell et al. (1985) Nature 313:810-812); промоторы генов актина из риса (McElroy et al. (1990) Plant Cell 2: 163-171); промотор убиквитина (Christensen et al. (1989) Plant Mol. Biol. 12:619-632 и Christensen et al. (1992) Plant Mol. Biol. 18:675-689); pEMU (Last et al. (1991) Theor. Appl. Genet. 81:581-588); MAS (Velten et al. (1984) EMBO J. 3:2723-2730); промотор гистона Н3 кукурузы (Lepetit et al. (1992) Mol. Gen. Genetics 231:276-285 и Atanassova et al. (1992) Plant Journal 2 (3):291-300); и ALS-промотор, XbaI/NcoI-фрагмент в 5'-направлении от структурного гена ALS3 Brassica napus (или нуклеотидная последовательность, аналогичная указанному XbaI/NcoI-фрагменту). См. международную публикацию РСТ WO 96/30530.
3. Тканеспецифичные или тканепредпочтительные промоторы
Тканеспецифичный промотор может быть функционально связан с геном, предназначенным для экспрессии в клетке. Необязательно, тканеспецифичный промотор может быть функционально связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть функционально связана с геном, предназначенным для экспрессии в клетке. Растения, трансформированные представляющим интерес геном, функционально связанным с тканеспецифичным промотором, могут продуцировать белковый продукт трансгена исключительно или предпочтительно в определенной ткани.
В вариантах осуществления данного изобретения можно использовать любой тканеспецифичный или тканепредпочтительный промотор. Типичные тканеспецифичные или тканепредпочтительные промоторы включают, без ограничения, предпочтительно функционирующий в корнях промотор, например, промотор гена фазеолина (Murai et al. (1983) Science 23:476-82 и Sengupta-Gopalan et al. (1985) Proc. Natl. Acad. Sci. U.S.A. 82:3320-4); специфично функционирующий в листьях и индуцируемым освещением промотор, например, промоторы генов cab или rubisco (Simpson et al. (1985) EMBO J. 4(11):2723-2729 и Timko et al. (1985) Nature 318:579-82); специфично функционирующий в пыльниках промотор, например промотор гена LAT52 (Twell et al. (1989) Mol. Gen. Genetics 217:240-5); специфично функционирующий в пыльце промотор, например, промотор гена Zml3 (Guerrero et al. (1993) Mol. Gen. Genetics 244:161-8); или предпочтительно функционирующий в микроспорах промотор, например, промотор гена apg (Twell et al. (1993) Sex. Plant Reprod. 6:217-24).
Транспорт белка, продуцированного трансгенами, в субклеточный компартмент, такой как хлоропласт, вакуоль, пероксисома, глиоксисома, клеточная стенка или митохондрия, или с целью секреции в апопласт, можно осуществить посредством функционального связывания нуклеотидной последовательности, кодирующей сигнальную последовательность, с 5' и/или 3'-областью гена, кодирующего белок, представляющий интерес. Такие "направляющие" последовательности на 5'- и/или 3'-конце гена могут определять, например, во время синтеза и процессинга белка, клеточный компартмент, в который в итоге поступит кодируемый белок. В альтернативном варианте такие направляющие в субклеточный компартмент белки могут быть напрямую связаны с наночастицей, для того чтобы направить наночастицу, покрытую представляющими интерес молекулами нуклеиновых кислот, в желаемый субклеточный компартмент.
Присутствие сигнальной последовательности направляет полипептид либо во внутриклеточную органеллу, либо в субклеточный компартмент, либо на секрецию в апопласт. В данной области известно множество сигнальных последовательностей. См., например, Becker et al. (1992) Plant Mol. Biol. 20:49; Close, P.S., Master's Thesis, Iowa State University (1993), Knox et al. (1987) Plant Mol. Biol. 9:3-17; Lerner et al. (1989) Plant Physiol. 91: 124-9; Fontes et al. (1991 ) Plant Cell 3:483-96; Matsuoka et al. (1991) Proc. Natl. Acad. Sci. U.S.A. 88:834; Gould et al. (1989) J. Cell. Biol. 108:1657; Creissen et al. (1991) Plant J. 2:129; Kalderon et al. (1984) Cell 39:499-509; Steifel et al. (1990) Plant Cell 2:785-93.
Гены чужеродных белков и агротехнические гены
Трансгенные растения по вариантам осуществления настоящего изобретения могут продуцировать чужеродный белок в коммерческих количествах. Таким образом, методики селекции и разведения трансформированных растений дают множество трансгенных растений, которые собирают общепринятым образом. Чужеродный белок затем можно экстрагировать из представляющей интерес ткани или из общей биомассы. Экстракцию белка из растительной биомассы можно выполнить известными способами, которые обсуждаются, например, в Heney and Orr (1981) Anal. Biochem. 114:92-6.
В некоторых аспектах изобретения растительным материалом, предназначенным для коммерческого получения чужеродного белка, может быть растение, ткань растения или клетка растения. В некоторых аспектах представляющей интерес биомассой может быть семя растения. Для трансгенных растений, которые показывают более высокие уровни экспрессии, может быть создана генетическая карта, например, посредством общепринятых RFLP-, ПЦР- и SSR-анализов, которые идентифицируют приблизительное местоположение на хромосоме встроенной молекулы ДНК. Примеры методик в этой области см. в Glick and Thompson, Methods in Plant Molecular Biology and Biotechnology CRC Press, Boca Raton 269:284 (1993). Информация о картировании местоположения на хромосоме может быть полезной, например, для защиты патентуемого объекта - трансгенного растения, или для оценки биологической безопасности. При проведении неправомочного разведения и осуществления скрещивания с другой зародышевой плазмой, можно провести сравнение карты области интеграции с аналогичными картами для подозрительных растений, для того чтобы определить, имеют ли последние общее происхождение с растением - объектом защиты. Сравнение карт может включать в себя гибридизацию, RFLP, ПЦР, SSR и секвенирование, которые все являются общепринятыми методиками.
Аналогичным образом, агротехнические гены можно экспрессировать в трансформированных клетках или их потомстве. Более конкретно, растения можно генетически модифицировать посредством способов по изобретению для экспрессии разных фенотипов, представляющих агротехнический интерес. Типичные гены, которые можно использовать в этом отношении, включают, но не ограничены этим, гены, упорядоченные по категориям ниже.
1. Гены, которые придают устойчивость к вредителям или заболеваниям:
А) Гены устойчивости к заболеваниям. Защитные свойства растения часто активируются специфичным взаимодействием между продуктом гена устойчивости к заболеванию (R) в растении и продуктом соответствующего гена авирулентности (Avr) в патогене. Сорт растения можно трансформировать клонированными генами устойчивости, чтобы создать растения, устойчивые к опреденным штаммам патогена. См., например, Jones et al. (1994) Science 266:789 (клонирование гена томата Cf-9 для устойчивости к Cladosporium fulvum); Martin et al. (1993) Science 262: 1432 (ген томата Pto для устойчивости к Pseudomonas syringae pv. tomato кодирует протеинкиназу); Mindrinos et al. (1994) Cell 78:1089 (ген RSP2 для устойчивости к Pseudomonas syringae).
B) Ген, придающий устойчивость к вредителям, например, цистообразующей нематоде сои. См., например, международную публикацию PCT WO 96/30517 и международную публикацию PCT WO 93/19181.
C) Белок Bacillus thuringiensis, его производное или синтетический полипептид, смоделированной на его основе. См., например, Geiser et al. (1986) Gene 48:109 (клонирование и нуклеотидная последовательность гена Bt δ-эндотоксина). Более того, молекулы ДНК, кодирующие гены δ-эндотоксина, можно приобрести в Американской Коллекции Типовых Культур (Manassas, VA), например, под номерами доступа ATCC - 40098, 67136, 31995 и 31998.
D) Лектин. См., например, Van Damme et al. (1994) Plant Molec. Biol. 24:25 (нуклеотидные последовательности нескольких генов маннозо-связывающего лектина из Clivia miniata).
E) Витамин-связывающий белок, например, авидин. См. международную публикацию PCT US93/06487 (применение авидина и гомологов авидина в качестве ларвицидов против насекомых-вредителей).
F) Ингибитор фермента, например, ингибитор протеазы или протеиназы, или ингибитор амилазы. См., например, Abe et al. (1987) J. Biol. Chem. 262:16793 (нуклеотидная последовательность ингибитора цистеиновой протеиназы риса), Huub et al. (1993) Plant Molec. Biol. 21:985 (нуклеотидная последовательность кДНК, кодирующей ингибитор I табачной протеиназы), Sumitani et al. (1993) Biosci. Biotech. Biochem. 57: 1243 (нуклеотидная последовательность ингибитора альфа-амилазы из Streptomyces nitrosporeus) и патент США № 5,494,813.
G) Специфичный для насекомых гормон или феромон, например, экдистероид и ювенильный гормон, их вариант, миметик на их основе, или их антагонист или агонист. См., например, Hammock et al. (1990) Nature 344:458 (бакуловирусная экспрессия клонированной эстеразы ювенильного гормона, инактиватора ювенильного гормона).
H) Специфичный для насекомых белок или нейропептид, который при экспрессии нарушает физиологию обработанного вредителя. См., например, Regan (1994) J. Biol. Chem. 269:9 (экспрессионное клонирование дает ДНК, кодирующую рецептор диуретического гормона насекомого); и Pratt et al. (1989) Biochem. Biophys. Res. Comm. 163: 1243 (аллостатин может быть идентифицирован в Diploptera puntata). См. также патент США № 5,266,317 (гены, кодирующие специфичные для насекомых паралитические нейротоксины).
I) Специфичный для насекомых яд, вырабатываемый в природе змеями, осами или любым другим организмом. См., например, Pang et al. (1992) Gene 116: 165 (гетерологичная экспрессия в растениях гена, кодирующего токсичный для насекомых пептид скорпиона).
J) Фермент, отвечающий за гипераккумуляцию монотерпена, сесквитерпена, стероида, гидроксамовой кислоты, производного фенилпропаноида или другой небелковой молекулы с инсектицидным действием.
K) Фермент, участвующий в модификационных процессах, включая посттрансляционную модификацию биологически активных молекул, например, гликолитический фермент, протеолитический фермент, липолитический фермент, нуклеаза, циклаза, трансаминаза, эстераза, гидролаза, фосфатаза, киназа, фосфорилаза, полимераза, эластаза, хитиназа или глюканаза, либо природные, либо синтетические. См. международную публикацию PCT WO 93/02197 (нуклеотидная последовательность гена каллазы). Молекулы ДНК, которые содержат кодирующие хитиназу последовательности, можно получить, например, из ATCC под номерами доступа 39637 и 67152. См. также Kramer et al. (1993) Insect Biochem. Molec. Biol. 23:691 (нуклеотидная последовательность кДНК, кодирующей хитиназу бражника табачного) и Kawalleck et al. (1993) Plant Molec. Biol. 21:673 (нуклеотидная последовательность гена ubi4-2 полиубиквитина петрушки).
L) Молекула, которая стимулирует сигнальную трансдукцию. См., например, Botella et al. (1994) Plant Molec. Biol. 24:757 (нуклеотидные последовательности для кДНК-клонов кальмодулина золотистой фасоли) и Griess et al. (1994) Plant Physiol. 104:1467 (нуклеотидная последовательность кДНК-клона кальмодулина кукурузы).
M) Пептид с гидрофобным моментом. См., например, международную публикацию PCT WO 95/16776 (пептидные производные тахиплезина, которые ингибируют грибковые патогены растений) и международную публикацию PCT WO 95/18855 (синтетические антимикробные пептиды, придающие устойчивость к заболеваниям).
N) Мембранная пермеаза, белок, которые формирует или бллокирует каналы. См. например, Jaynes et al. (1993) Plant Sci 89:43 (гетерологичная экспрессия аналога литического пептида цекропина-β для придания трансгенным растениям табака устойчивости к Pseudomonas solanacearum).
O) Вирусный инвазивный белок или получаемый из него комплексный токсин. Например, аккумуляция белков оболочки вируса в трансформированных клетках растения придает устойчивость к вирусной инфекции и/или развитию заболевания, вызываемого вирусом, из которого получен ген белка оболочки, а также родственными вирусами. См. Beachy et al. (1990) Ann. rev. Phytopathol. 28:451. Устойчивость, опосредованная белком оболочки, была придана трансформированным растениям против вируса мозаики люцерны, вируса мозаики огурца, вируса табачной полоски, X-вируса картофеля, Y-вируса картофеля, вируса гравировки табака, вируса погремковости табака и вируса табачной мозаики. Id.
P) Специфичное к насекомым антитело или получаемый из него иммунотоксин. Таким образом, антитело, мишенью которого является критическая метаболическая функция в насекомом, может инактивировать фермент-мишень, убивая насекомое. См. Taylor et al., Abstract #497, Seventh Int'l Symposium on Molecular Plant-Microbe Interactions (Edinburgh, Scotland) (1994) (инактивация фермента в трансгенном табаке посредством продукции одноцепочечных фрагментов антитела).
Q) Специфичное к вирусу антитело. См., например, Tavladoraki et al. (1993) Nature 366:469 (трансгенные растения, экспрессирующие гены рекомбинантного антитела, защищены от заражения вирусом).
R) Останавливающий развитие белок, продуцируемый в природе патогеном или паразитом. Например, грибковые эндо α-1,4-D-полигалактуроназы способствуют колонизации грибков и высвобождению питательных веществ из растения путем растворения клеточной стенки гомо-α-1,4-D-галактуроназой. См. Lamb et al. (1992) Bio/Technology 10: 1436. См. также Toubart et al. (1992) Plant J. 2:367 (клонирование и характеристика гена, кодирующего белок-ингибитор эндополигалактуроназы из фасоли).
S) Останавливающий развитие белок, продуцируемый в природе растением. См., например, Logemann et al. (1992) Bio/Technology 10:305 (трансгенные растения, экспрессирующие ген инактивации рибосом из ячменя, обладают повышенной устойчивостью к грибковым заболеваниям).
2. Гены, которые придают устойчивость к гербициду:
A) Гербицид, который ингибирует точку роста или меристему, такой как имидазолинон или сульфонилмочевина. Типичные гены в этой категории кодируют мутантный фермент ALS и AHAS, как описано, например, Lee et al. (1988) EMBO J. 7:1241 и Miki et al. (1990) Theor. Appl. Genet. 80:449, соответственно.
B) Устойчивость к глифосату, придаваемая, например, генами мутантной 5-енолпирувилшикимат-3-фосфатсинтетазы (EPSP) (посредством введения рекомбинантных нуклеиновых кислот и/или различных форм in vivo мутагенеза нативных генов EPSP), генов aroA и генов глифосат-ацетилтрансферазы (GAT), соответственно); устойчивость к другим фосфоносоединениям, придаваемая такими генами, как гены глюфосинат-фосфинотрицинацетилтрансферазы (PAT) из видов Streptomyces, включая Streptomyces hygroscopicus и Streptomyces viridichromogenes); и устойчивость к пиридинокси- или фенокси-пропионовым кислотам и циклогексонам (придаваемая генами, кодирующими ингибитор ACCазы). См., например, патент США № 4,940,835 и патент США № 6,248,876 (нуклеотидные последовательности форм EPSP, которые придают растению устойчивость к глифосату). Молекулу ДНК, кодирующую мутантный ген aroA, можно получить в ATCC под номером доступа 39256. См. также патент США № 4,769,061 (нуклеотидная последовательность мутантного гена aroA). В европейской патентной заявке № 0333033 и патенте США № 4,975,374 описаны нуклеотидные последовательности генов глутаминсинтетазы, которые могут придавать устойчивость к гербицидам, таким как L-фосфинотрицин. Нуклеотидные последовательности типичных генов фосфинотрицин-ацетилтрансферазы приводятся в Европейской патентной заявке № 0242246 и в DeGreef et al. (1989) Bio/Technology 7:61 (получение трансгенных растений, которые экспрессируют химерные гены bar, кодирующие белки с РАТ-активностью). Примеры генов, придающих устойчивость к феноксипропионовым кислотам и циклогексонам, таким как сетоксидим и галоксифоп, включают гены Acc1-S1, Acc1-S2 и Acc1-S3, описанные Marshall et al. (1992) Theor. Appl. Genet. 83:435. Гены GAT, способные придавать устойчивость к глифосату, описаны, например, в WO 2005012515. Гены, придающие устойчивость к 2,4-D-феноксипропионовой кислоте и пиридилокси-ауксиновым гербицидам описаны, например, в WO 2005107437.
C) Гербицид, ингибирующий фотосинтез, такой как триазин (гены psbA и gs+) или бензонитрил (ген нитрилазы). См., например, Przibila et al. (1991) Plant Cell 3: 169 (трансформация Chlamydomonas плазмидами, кодирующими мутантные гены psbA). Нуклеотидные последовательности генов нитрилаз описаны в патенте США № 4,810,648, и молекулы ДНК, содержащие эти гены, доступны под номерами доступа ATCC - 53435, 67441 и 67442. См. также Hayes et al. (1992) Biochem. J. 285: 173 (клонирование и экспрессия ДНК, кодирующей глутатион-S-трансферазу).
3. Гены, которые придают признак, увеличивающий прибыль, или вносят в него вклад, такие как:
A) Модифицированный метаболизм жирных кислот, например, путем трансформации растения антисмысловым геном стеарил-ACP десатуразы для увеличения содержания стеариновой кислоты в растении. См. Knultzon et al. (1992) Proc. Natl. Acad. Sci. U.S.A. 89:2624.
B) Сниженное содержание фитата. Введение гена, кодирующего фитазу, может усилить расщепление фитата, добавляя больше свободного фосфата в трансформированное растение. См., например, Van Hartingsveldt et al. (1993) Gene 127:87 (нуклеотидная последовательность гена фитазы из Aspergillus niger). Можно ввести ген для уменьшения содержания фитата. В кукурузе, например, это можно выполнить клонированием и повторным введением ДНК, ассоциированной с одним аллелем, который может отвечать за мутанты кукурузы, отличающиеся низким содержанием фитиновой кислоты. См. Raboy et al. (1990) Maydica 35:383.
C) Модифицированный углеводный состав растений, обусловленный, например, трансформированием растений геном, кодирующим фермент, который изменяет схему ветвления крахмала. См. Shiroza et al. (1988) J. Bacteol. 170:810 (нуклеотидная последовательность гена мутантной фруктозил-трансферазы из Streptococcus); Steinmetz et al. (1985) Mol. Gen. Genet. 20:220 (ген левансукразы); Pen et al. (1992) Bio/Technology 10:292 (α-амилаза); Elliot et al. (1993) Plant Molec. Biol. 21:515 (нуклеотидные последовательности генов инвертазы томата); Sogaard et al. (1993) J. Biol. Chem. 268:22480 (ген α-амилазы ячменя); и Fisher et al. (1993) Plant Physiol. 102:1045 (фермент II ветвления крахмала эндосперма кукурузы).
С. Наночастицы
Некоторые варианты осуществления изобретения относятся к способам введения молекулы функционализированной линейной нуклеотидной кассеты, представляющей интерес, в растительную клетку, содержащую клеточную стенку. В некоторых вариантах осуществления изобретения способ может включать в себя осуществление контакта между наночастицами, покрытыми представляющей интерес молекулой функционализированной линейной нуклеотидной кассеты, и растительной клеткой; и обеспечение возможности поглощения наночастицы через клеточную стенку. В конкретных вариантах осуществления изобретения наночастица может обратимо или необратимо содержать, быть покрыта или как-либо иначе связана с представляющей интерес молекулой функционализированной линейной нуклеотидной кассеты и/или нести ее. В этих и дополнительных вариантах осуществления изобретения наночастица может быть функционализирована группой, которая вступает в реакцию с группой на молекуле функционализированной линейной нуклеотидной кассеты, представляющей интерес, для того чтобы получить наночастицу, конъюгированную с молекулой функционализированной линейной нуклеотидной кассеты, представляющей интерес. В некоторых вариантах осуществления изобретения молекулу функционализированной линейной нуклеотидной кассеты, представляющую интерес, можно ввести в наночастицы до контакта с растительной клеткой, имеющей клеточную стенку, или одновременно с введением наночастицы в растительную клетку, имеющую клеточную стенку. Примеры наночастиц, которые можно использовать в вариантах осуществления настоящего изобретения, включают, без ограничения, квантовые точки, другие полупроводниковые наночастицы, положительно заряженные наночастицы, золотые наночастицы, покрытые золотом наночастицы, пористые наночастицы, мезопористые наночастицы, кремниевые наночастицы, полимерные наночастицы, такие как дендримеры, вольфрамовые наночастицы, желатиновые наночастицы, нанооболочки, наноядра, наносферы, нанотрубочки и магнитные наночастицы.
В конкретных вариантах осуществления изобретения поверхность наночастицы может быть функционализирована, что может, например, позволять направленное поглощение или может позволять обратимое или необратимое связывание другие веществ с поверхностью наночастицы. В качестве неограничивающего объем изобретения примера, поверхность наночастицы (например, квантовой точки) могла бы быть функционализирована самособирающемся монослоем, например, алкантиолятов, которые можно дополнительно функционализировать или получить их производные. В дополнительном неограничивающем объем изобретения примере, поверхность наночастиц можно модифицировать линкерами, которые сами можно дополнительно функционализировать или модифицировать, например, стрептавидином. В одном варианте осуществления изобретения наночастица может быть ПЭГилирована. В других вариантах осуществления изобретения наночастица может содержать или может быть полифункционализирована одним или несколькими из ядра (активного или неактивного), стерической оболочки (активной или инертной), расщепляемого соединения, и/или направляющей молекулы или лиганда.
В некоторых вариантах осуществления изобретения наночастицей может быть конъюгат стрептавидин-QD. Конъюгат стрептавидин-QD изготовлен из нанометрового кристалла полупроводникового материала (CdSe), который покрыт дополнительной полупроводниковой оболочкой (ZnS) для улучшения оптических свойств материала. Он имеет узкий симметричный спектр эмиссии с максимумом около 605 нм. Ядро и оболочка дополнительно покрыты полимерной оболочкой, которая позволяет конъюгировать их с биомолекулами и сохранять их оптические свойства. Эта полимерная оболочка напрямую связана со стрептавидином. Конъюгат стрептавидина и QD имеет размер крупной макромолекулы или белка (приблизительно 15-20 нм). Поверхность подготавливали, чтобы она имела низкий неспецифичный сигнал при инкубации с образцами в различных водных буферах. Квантовые точки можно соединить со стрептавидином напрямую посредством реакции связывания активированных сложных эфиров. В результате образуется материал со стрептавидином, ковалентно присоединенным к поверхности (обычно 5-10 молекул стрептавидина на квантовую точку в конъюгате), что дает в результате конъюгаты стрептавидина и квантовых точек с высоко специфичной биологической активностью.
Согласно вариантам осуществления настоящего изобретения растительной клеткой, имеющей клеточную стенку, может быть любая растительная клетка, содержащая интактную и целую клеточную стенку. Примеры клеток, имеющих клеточную стенку, включают, без ограничения: водоросли, табак, морковь, кукурузу, канолу, рапс, хлопчатник, пальму, арахис, сою, сахарный тростник, Otyza sp., Arabidopsis sp. и Ricinus sp. Варианты осуществления изобретения могут включать клетки, содержащие клеточную стенку из любой ткани или любого места, где они были найдены, включая, без ограничения: зародыши, меристемные клетки, каллюс, пыльцу, включая гаплоидные и двойные гаплоидные микроспоры, листья, пыльники, корни, кончики корней, цветки, семена, стручки, стебли и культуру ткани.
В конкретных вариантах осуществления изобретения молекулой функционализированной линейной нуклеотидной кассеты, представляющей интерес, может быть любая молекула функционализированной линейной нуклеотидной кассеты, которую можно доставить в растительную клетку, имеющую клеточную стенку, по настоящему изобретению. Молекулы функционализированных линейных нуклеотидных кассет, представляющие интерес, могут содержать нуклеотидные последовательности, без ограничения: молекулы ДНК, РНК, РНКи, гены, плазмиды, космиды, YAC (дрожжевые искусственные хромосомы) и BAC (бактериальные искусственные хромосомы). Молекулы функционализированных линейных нуклеиновых кислот, представляющие интерес, могут быть введены в растительную клетку, имеющую клеточную стену, одновременно, например, со следующими соединениями, без ограничения: полипептидами, ферментами, гормонами, гликопептидами, сахарами, жирами, сигнальными пептидами, антителами, витаминами, мессенджерами, вторичными мессенджерами, аминокислотами, цАМФ, лекарственными соединениями, гербицидами, фунгицидами, антибиотиками и/или их комбинациями.
Наночастицы, такие как квантовые точки, можно функционализировать с использованием ПЭГ, используя протокол согласно Dubertret et al. (2002) Science 298:1759, или по вышеуказанному протоколу, модифицированному в соответствии с решением опытного специалиста. Например, покрытые TOPO (триоктилфосфиноксидом) CdSe/ZnS-квантовые точки можно ресуспендировать с ПЭГ-ПЭ в хлороформе с последующим выпариванием растворителя и солюбилизацией полученных ПЭГилированных квантовых точек в воде.
В аспектах изобретения наночастицы могут быть поглощены различными частями клетки. Примеры мест, которые могут поглощать наночастицы, включают без ограничения: цитозоль, ядро, тонопласты, пластиды, этиопласты, хромопласты, лейкопласты, элайопласты, протеинопласты, амилопласты, хлоропласты и просвет двойной мембраны. В других вариантах осуществления изобретения поглощение наночастиц растительной клеткой, содержащей клеточную стенку, может произойти по симпластическому или апопластическому пути.
D. Стабильно трансформированные растительные клетки
Стабильно трансформированной растительной клеткой по изобретению может быть любая растительная клетка, способная трансформироваться с использованием молекулы функционализированной линейной нуклеотидной кассеты, представляющей интерес, путем опосредованной наночастицами трансформации. Соответственно, растительная клетка может быть выделена или культивирована из двудольного или однодольного растения. Растительная клетка также может присутствовать в ткани растения или в целом растении. Неограничивающие примеры стабильно трансформированных растительных клеток из двудольных растений по изобретению включают: люцерну, фасоль, брокколи, капусту, морковь, цветную капусту, сельдерей, китайскую капусту, хлопчатник, огурец, баклажан, латук, дыню, горох, перец, арахис, картофель, оранжевую тыкву, редис, рапс, шпинат, сою, зеленую тыкву, сахарную свеклу, подсолнечник, табак, томат и арбуз. Неограничивающие примеры стабильно трансформированных растительных клеток из однодольных растений по изобретению включают: кукурузу, лук, рис, сорго, пшеницу, рожь, чечевицу, сахарный тростник, овес, тритикале, просо и газонную траву.
Для скрининга трансгенных растений, которые экспрессируют ген устойчивости к глуфосинату, их можно опрыскивать используемым в сельском хозяйстве уровнем гербицида, глуфосината аммония (GLA). Всходы Т1 Arabidopsis, полученные с использованием способов по изобретению, показывали устойчивость к гербициду при пяти последовательных применениях используемой в сельском хозяйстве дозировки глуфосината, например, через день, начинаЯ с 7-го дня после прорастания. Геномную ДНК из этих трансгенных растений анализировали на присутствие pat и yfp с помощью ПЦР, и результаты показали присутствие последовательностей ДНК pat и yfp. Секвенирование ПЦР-продуктов в результате выявило корректные последовательности трансгенов pat и yfp в Т1-растениях Arabidopsis, полученных с использованием способов по изобретению.
Трансгенные растения по изобретению можно регенерировать из стабильно трансформированных растительных клеток, полученных способами по изобретению. Такие растения можно использовать или культивировать любым образом, причем присутствие представляющих интерес молекул нуклеиновых кислот является желательным. Соответственно, трансгенные растения могут быть генетически модифицированы, inter alia, для того чтобы они имели один или несколько желательных признаков, путем трансформирования их молекулами функционализированных линейных нуклеотидных кассет с помощью опосредованной наночастицам трансформации, и возделаны и культивированы любым способом, известным опытным специалистам в данной области.
Следующие примеры приведены для иллюстрации некоторых конкретных признаков и/или вариантов осуществления. Примеры не следует истолковывать, как ограничивающие изобретение конкретными приведенными признаками или вариантами осуществления.
ПРИМЕРЫ
Пример 1: Получение наночастиц для трансформации растительных клеток
Получение ДНК; плазмидная ДНК
ДНК плазмиды pDAB383 (фигура 1) была выделена и подготовлена для трансформации растения линейной ДНК, опосредованной покрытыми стрептавидином квантовыми точками. Эта плазмида содержит ген селектируемого маркера, РАТ, управляемый промотором убиквитина 10 из Arabidopsis (AtUbi10), и ген желтого флуоресцентного белка из Philadium (PhiYFP), управляемый промотором вируса мозаики прожилок маниоки (CsVMV). Эксперименты по трансформации исследовали с использованием линеаризованной ДНК.
Для линеаризации pDAB3831 выполняли ПЦР. Плазмиду pDAB3831 амплифицировали с помощью ПЦР, используя проточную термоциклическую систему. Международная публикация РСТ WO 2008/045288. Приготавливали образец, содержащий: 12% MgCl2 (25 мМ), 0,33% Taq ДНК-полимеразы (5 ед./мкл), 2,0% смеси четырех дезоксинуклеотидов (дезоксиаденозина трифосфата (dATP), дезоксицитидина трифосфата (dCTP), дезоксигуанозина трифосфата (dGTP) и дезокситимидина трифосфата (dTTP), 8,0% матрицы (мкг/мл), 61,66% раствора Pluronic F108 (1,5% раствора), 4% прямого праймера, 4% обратного праймера и 8% реакционного буфера (10× концентрации). Сопряженные секторы системы устанавливали на температуру 95°C, 59°C и 72°C для реакций диссоциации, отжига и удлинения, соответственно. ПЦР-смесь прокачивали через систему, используя сосуд под давлением 20 PSI. После поступления реакционной смеси в термоконтролируемый отсек, использовали минеральное масло для проталкивания образца по всей длине каналов. Скорость потока реакционной смеси поддерживали с помощью регулятора потока на 0,25 мл/мин. Специфичную ДНК, присутствующую в образце, амплифицировали по мере его циклического прохождения через температурные зоны. После тридцатого цикла собирали содержимое. ПЦР-продукт очищали на гель-фильтрационной колонке с последующим осаждением этанолом. Образец очищенного продукта анализировали на Agilent Bioanalyzer™, а также электрофорезом в агарозном геле, чтобы подтвердить размер и концентрацию ПЦР-продукта.
Матрицей, используемой для описанной выше ПЦР, была DAS-плазмида pDAB3831. Прямой праймер SEQ ID NO: 1 и обратный праймер синтезировали для амплификации полной экспрессионной кассеты 4,6 т.п.о. (то есть линеаризованной ДНК), содержащей оба гена и их промоторы. В дополнение, для обеспечения конъюгации линейной дцДНК с поверхностью наночастиц, молекулы биотина химически присоединяли к фосфатной группе праймеров, используя биотин-TEG-CE-фосфорамидит. Данный фосфорамидит имеет удлиненное 15-атомное спейсерное плечо со смешанной полярностью на основе триэтиленгликолевого линкера. Выгодой удлиненного спейсерного плеча, отделяющего функцию биотина от остального олигонуклеотида, является снижение любых эффектов стерических затруднений при связывании молекулы стрептавидина. При мечении прямого праймера биотин находится в начале ДНК. При мечении обратного праймера биотин находится в конце фрагмента ДНК. Биотинилированный (в обеих ориентациях) фрагмент ДНК, таким образом, может быть присоединен к покрытым стрептавидином наночастицам. С использованием биотинилированных олигонуклеотидов и проточной термоциклической системы было получено приблизительно 20 мг линейного фрагмента ДНК.
Образование комплексов линейной ДНК и наночастиц
Покрытые стрептавидином квантовые точки были получены от Evident Technology (Troy, NY). 1 мл покрытых стрептавидином квантовых точек (4 нмоль) инкубировали 30 минут с 0,5 мг биотинилированной линеаризованной плазмидной ДНК при комнатной температуре с образованием комплекса линейная ДНК/QD.
Пример 2: Трансформация бутонов цветков Arabidopsis
Растительный материал для трансформации in planta
Синхронное прорастание семян важно для гарантии однородности развития цветков у растений Т0. Семена A. thaliana экотипа Columbia суспендировали в 0,1% (вес/объем) растворе агара и инкубировали 48 часов при 4°C для завершения стратификации. 60 мг семян взвешивали и переносили в 15 мл пробирку. Добавляли 13 мл 0,1% (вес/объем) раствора агара и встряхивали на вортексе до равномерного распределения семян. Это давало концентрацию раствора семян, составляющую 4,6 мг семян/мл 0,1% (вес/объем) раствора агара (или примерно 230 семян/мл). Приготавливали 6 пробирок (72 мл раствора) для посева на 4 поддона, которые содержали 18 (31/2-дюймовых) горшка в каждом лотке. Раствор семян инкубировали 48 часов при 4°C для завершения стратификации. В каждый горшок высевали индивидуально по 1,0 мл стратифицированного раствора семян. После посева на все горшки, для поддержания влажности почвы на лотки помещали колпаки для размножения. Колпаки убирали через 5 дней после даты посева. Семена всходили, и растения выращивали в Conviron® (модели CMP4030 и CMP3244, Controlled Environments Limited, Winnipeg, Manitoba, Canada) в условиях длинного светового дня (16 часов света/8 часов темноты) при интенсивности освещения 120-150 мкмоль/м2с, при постоянной температуре (22°C) и влажности (40-50%). Растения поливали через 10-14 дней после высаживания раствором Хоагланда и впоследствии дистиллированной водой для поддержания почвы влажной, но не мокрой. Через 4 недели после посева срезали цветки, чтобы получить еще более однородный рост вторичных цветков. На 5-й неделе после посева растения подготавливали для процесса трансформации.
Трансформация in planta
Трансформацию A. thaliana экотипа Columbia линейной ДНК/квантовыми точками выполняли, используя модифицированный протокол от Clough и Bent. Clough and Bent (1998) Plant J. 16:735-43. 20 мл суспензии с раствором комплекса линейной ДНК/QD с концентрацией 0,5 мг линейной ДНК и 4 нМ PQD приготавливали и использовали для обработки растений Arabidopsis (в основном незрелых соцветий с несколькими оплодотворенными стручками). Перед погружением растений к раствору линейной ДНК/QD добавляли Silwet L-77 до концентрации 0,05% (объем/объем) (250 мкл/500 мл) - 0,005% и хорошо перемешивали. Наземные части растения погружали в раствор линейной ДНК/PQD на 30 секунд при мягком покачивании. Обработанные растения помещали на бок на 30 минут в тень при 22-24°C. Растения переносили в Conviron в описанные выше условия, оставляли расти до зрелости, после чего собирали семена.
Для скрининга массы собранных семян от растений Т0 использовали лотки для селекции (лотки 10,5"×21"×1"), приблизительно, 10000 семян на каждый лоток. Для гарантии того, что селекционное опрыскивание было проведено правильно, использовали два контроля: отрицательный контроль трансформации, Col-0; и Columbia Col-0 дикого типа с внесенными гомозиготными семенами с селектируемым маркером РАТ (фосфинотрицин-ацетилтрансферазой) в качестве положительного контроля трансформации. Для достижения синхронизации семена стратифицировали в 0,1% (вес/объем) растворе агара в течение 48 часов перед посевом. Чтобы обеспечить 10000 семян на лоток для отбора, 200 мг семян добавляли к 0,1% (вес/объем) раствору агара и встряхивали на вортексе до равномерного суспендирования семян. Стратифицированные семена затем высевали на лотки для отбора, заполненные Sunshine mix LP5 и поливали через поддон раствором Хоагланда. Для эффективности опрыскивания для селекции важно, чтобы 40 мл суспендированных семян были посеяны равномерно на лоток для селекции. После посева на каждый лоток для селекции помещали куполы для размножения, и растения выращивали для проведения селекции. Куполы для размножения убирали приблизительно через 5 дней после посева.
Пример 3: Анализ трансформированных растений Arabidopsis
Отбор трансформированных растений
Свежесобранные семена Т1 оставляли сушиться на 7 дней при комнатной температуре. Семена Т1 высевали в лотки для проращивания (26,5×51 см), в каждый лоток высевали аликвоту 200 мг стратифицированных семян Т1 (приблизительно 10000 семян), которые предварительно ресуспендировали в 40 мл 0,1% (вес/объем) раствора агарозы и оставляли на 2 дня при 4°C для завершения периода покоя и гарантии одновременного прорастания семян.
Sunshine Mix LP5 покрывали мелкозернистым вермикулитом и поливали через поддон раствором Хоагланда до тех пор, пока почва не становилась влажной, избыток влаги удаляли самотеком. Каждую аликвоту (40 мл) стратифицированных семян высевали равномерно на вермикулит с помощью пипетки и закрывали куполами для увлажнения на 4-5 дней. Купола удаляли за 1 день до первой селекции трансформантов с использованием послевсходового опрыскивания глуфосинатом.
Через семь дней после посадки (DAP) растения Т1 (семядоля и стадия 2-4 листьев, соответственно) опрыскивали последовательно пять раз в течение пяти дней 0,2% (вес/объем) раствором гербицида Liberty (200 г кислотных эквивалентов (к.э.)/л глуфосината, Bayer Crop Sciences, Kansas City, MO) в количестве 10 мл раствора для опрыскивания на лоток (703 л/га), используя наконечник пневматического опрыскивателя DeVilbiss для достижения эффективной концентрации 280 г к.э./га глуфосината на одну обработку. Через 4-7 дней после последнего опрыскивания идентифицировали выжившие растения (активно растущие), и пересаживали их индивидуально в 3-дюймовые горшки, подготовленные с горшечной средой (Metro Mix 360). Пересаженные растения закрывали колпаками для влажности на 3-4 дня и помещали в ростовую камеру на 22°C как раньше или переносили сразу в теплицу. Колпаки впоследствии убирали, и растения выращивали в теплице (при 22±5°C, 50±30% относительной влажности, 14 ч света/10 часах темноты и минимум 500 мкЭрг/м2с1 естественного + искусственного света).
Молекулярный анализ и доказательство геномной интеграции трансгенов
Геномную ДНК из трансгенных растений A. thaliana выделяли из листового материала 6-недельных растений, используя Plant DNAZOL™ (Invitrogen) согласно инструкциям изготовителя. ПЦР-праймеры подбирали для детекции трансгенов YFP и PAT. YFP-праймеры представлены как SEQ ID NO: 3 и SEQ ID NO:4. РАТ-праймеры представлены как SEQ ID NO:5 и SEQ ID NO:6.
ПЦР-амплификация трансгенов на геномной ДНК
ПЦР-амплификацию РАТ и YFP выполняли, используя набор TaKaRa ExTaq™ (Takara, Otsu, Shiga, Japan). Гены амплифицировали в общем объеме реакционной смеси 50 мкл. ПЦР-смесь содержала 100 нг геномной ДНК-матрицы, 1× реакционный буфер ExTaq, 0,2 мМ смесь dNTP (четырех дезоксинуклетидов), 10 пмоль каждого праймера и 0,025 ед./мкл ExTaq-полимеразы. Использовали следующие условия проведения ПЦР: 1 цикл при 96°C в течение 5 мин; и 31 цикл при следующих условиях: 15 сек при 94°C, 30 сек при 65°C, 1 мин при 72°C; и конечное удлинение в течение 7 мин при 72°C. Продукт ПЦР-амплификации анализировали электрофорезом в 0,8% ТАЕ-агарозном геле и визуализировали окрашиванием бромистым этидием. Фрагменты ДНК очищали из агарозного геля, используя набор для очистки из геля QIAEX™ II (Qiagen, Valencia, CA).
ПЦР-фрагменты секвенировали, используя прямой праймер для РАТ (SEQ ID NO:5) и прямой праймер для YFP (SEQ ID NO:3), с использованием усовершенствованной методики секвенирования по Сэнгеру (MWG Biotech, Huntsville, AL). Данные полученные в результате секвенирования анализировали, используя программу Sequencher.
Результаты секвенирования ПЦР-ампликонов РАТ и YFP совпадали с ожидаемой нуклеотидной последовательностью для этих генов. Эти результаты ясно указывают на то, что последовательности РАТ и YFP из pDAB3831 были стабильно интегрированы в геномную ДНК Arabidopsis с использованием протокола трансформации ДНК наночастицами и линейной ДНК-кассетой.
Настоящие результаты указывают на то, что последовательности РАТ и YFP были введены в геном с помощью опосредованной наночастицами доставки линеаризованной ДНК в примере 1, и таким образом, обеспечивают доказательство стабильной интеграции трансгенов в геномную ДНК растений Arabidopsis.
Пример 4: Опосредованная наночастицами доставка молекул функционализированных линейных нуклеотидных кассет в культивируемые растительные клетки
Получение материала одиночных растительных клеток
Использовали как клетки BY2, так и клетки NT1. Клетки BY2 представляют собой быстрорастущую линию клеток растений табака, в которых отсутствует зеленый пигмент. Клетки NT1 представляют собой фотоаутотрофные клетки, выделенные из табака. За 3-4 дня до трансформации однонедельную суспензионную культуру пересевали в свежую среду, перенося 2 мл культуры NT1 или BY2 в 40 мл среды NT1B или LSBY2, содержащей 50 нМ DAS-PMTI-1 (ингибитор микротрубочек) и 0,5-0,1% (объем/объем) DMSO в 250-мл колбе. Одиночные клетки собирали либо через четыре, либо через семь дней после обработки ингибитором микротрубочек. Используемые одиночные клетки BY2 пропускали через проточный цитометр Beckman для подсчета живых клеток. Клетки исследовали, используя дифференциальный интерференционно-контрастный (DIC) микроскоп, соединенный с конфокальной системой визуализации, чтобы определить, что одиночные клетки содержат большое число пластид (амилопластов), распределенных по цитоплазме клетки. Клетки пересевали один раз в 14 дней, перенося 1 мл суспензии при 3,0 OD600. Культивируемые клетки использовали в качестве клеток-мишеней для трансформации.
Получение наночастиц и обработка клеток
Для трансформации растений линейной ДНК/квантовыми точками (QD) выделяли и подготавливали плазмидную ДНК. Плазмида содержит ген селектируемого маркера, РАТ, управляемый промотором убиквитина 10 из Arabidopsis (AtUbi10), и ген желтого флуоресцентного белка из Philadium (PhiYFP), управляемый промотором вируса мозаики прожилок маниоки (CsVMV). Штамм Escherichia coli, содержащий плазмиду, высевали и растили до помутнения среды Луреа-Бертани, содержащей ампициллин, при 37°C. ДНК выделяли, используя набор Qiagen Plasmid Midi-Prep (Qiagen, Valencia, CA).
Для линеаризации плазмидной ДНК выполняли ПЦР, используя проточную термоциклическую систему. Международная публикация РСТ WO 2008/045288. Приготавливали образец, содержащий: 12% MgCl2 (25 мМ), 0,33% Taq ДНК-полимеразы (5 ед./мкл), 2,0% смеси dNTP (дезоксиаденозина трифосфата (dATP), дезоксицитидина трифосфата (dCTP), дезоксигуанозина трифосфата (dGTP) и дезокситимидина трифосфата (dTTP), 8,0% матрицы (мкг/мл), 61,66% раствора Pluronic F108 (1,5% раствора), 4% прямого праймера, 4% обратного праймера и 8% реакционного буфера (10× концентрации). Сопряженные секторы системы устанавливали на температуру 95°C, 59°C и 72°C для реакций диссоциации, отжига и удлинения, соответственно. ПЦР-смесь прокачивали через систему, используя сосуд под давлением 20 PSI. После поступления реакционной смеси в термоконтролируемый отсек, использовали минеральное масло для проталкивания образца по всей длине каналов. Скорость потока реакционной смеси поддерживали с помощью регулятора потока на 0,25 мл/мин. Специфичную ДНК, присутствующую в образце, амплифицировали по мере его циклического прохождения через температурные зоны. После тридцатого цикла собирали содержимое. ПЦР-продукт очищали на гель-фильтрационной колонке с последующим осаждением этанолом. Образец очищенного продукта анализировали на Agilent Bioanalyzer™, а также электрофорезом в агарозном геле, чтобы подтвердить размер и концентрацию ПЦР-продукта.
Прямой и обратный праймеры синтезировали для амплификации полной экспрессионной кассеты (то есть, линеаризованной ДНК), содержащей оба гена и их промоторы. В дополнение, для обеспечения конъюгации линейной дцДНК с поверхностью наночастиц молекулы биотина химически присоединяли к фосфатной группе праймеров, используя биотин-TEG-CE-фосфорамидит. Биотинилированный (в обеих ориентациях) фрагмент ДНК, таким образом, может быть присоединен к покрытым стрептавидином наночастицам. С использованием биотинилированных олигонуклеотидов и проточной термоциклической системы линейный фрагмент ДНК был получен в миллиграммовых количествах.
Образование комплексов линейной ДНК и наночастиц
Покрытые стрептавидином квантовые точки были получены от Evident Technology (Troy, NY). 1 мл покрытых стрептавидином квантовых точек (4 нмоль) инкубировали 30 минут с 0,5 мг биотинилированной линеаризованной плазмидной ДНК при комнатной температуре с образованием комплекса линейная ДНК/QD.
Наночастицы, конъюгированные с линейной ДНК, добавляли в количестве 1-3 мкл/мл к 500 мкл клеток в 24-луночном планшете и мягко вращали на качалке в течение 20 минут в темноте. В это время наночастицы переносятся через клеточную стенку.
Пример 5: Опосредованная полифункционализированными наночастицами трансформация in planta растений Arabidopsis
Трансформацию in planta растений Arabidopsis можно провести, используя модифицированный протокол от Clough и Bent, 1998. Для повышения эффективности трансформации оптимизировали концентрацию ДНК на полифункционализированной наночастице вместе с молекулами направляющих доменов белковой трансдукции (PTD) и NLS-единиц (единиц сигнала ядерной локализации).
Растительный материал: здоровые растения Arabidopsis выращивали в условиях длинного светового дня в горшках в почве до цветения. Первые соцветия удаляли для усиления пролиферации множества вторичных соцветий. Растения готовы примерно через 4-6 дней после удаления соцветий. Растения A. thaliana экотип Columbia (Col-0) были выбраны в качестве исходных (растения Т0) для трансформации in planta цветков. Синхронизированное прорастание семян важно для гарантии однородности развития цветков у растений Т0. Семена растений дикого типа суспендировали в 0,1% растворе агара и инкубировали 48 часов при 4°C для завершения стратификации. 60 мг семян взвешивали на бумаге для взвешивания и переносили в 15 мл пробирку. Добавляли 13 мл 0,1% раствора агара и встряхивали на вортексе до равномерного распределения семян. Это давало концентрацию раствора семян, составляющую 4,6 мг семян/мл раствора (или примерно 230 семян/мл). Приготавливали 6 пробирок (72 мл раствора) для посева на 4 поддона, которые содержали 18 (31/2 дюймовых) горшка в каждом лотке, и высевали в общем 2 горшка. Раствор инкубировали 48 часов при 4°C для завершения стратификации. В каждый горшок высевали индивидуально по 1,0 мл стратифицированного раствора семян на горшок. После посева на все горшки, для поддержания влажности почвы на лотки помещали колпаки для размножения. Колпаки убирали через 5 дней после даты посева. Семена всходили, и растения выращивали в Conviron® (модели CMP4030 и CMP3244, Controlled Environments Limited, Winnipeg, Manitoba, Canada) в условиях длинного светового дня (16 часов света/8 часов темноты) при интенсивности освещения 120-150 мкмоль/м2с, при постоянной температуре (22°C) и влажности (40-50%). Растения поливали через 10-14 дней после высаживания растений раствором Хоагланда и впоследствии дистиллированной водой для поддержания почвы влажной, но не мокрой. Через 4 недели после посева срезали цветки, чтобы получить еще более однородный рост вторичных цветков. На 5-й неделе после посева растения подготавливали для процесса трансформации.
Получение наноконъюгатов для обработки цветков: для обработки были выбраны наночастицы с диапазоном размеров 2-120 нм и полифункционализированы линейной ДНК-кассетой и направляющими пептидами согласно Derufus et. al. (2007). Были получены квантовые точки с максимумом эмиссии 655 или 705 нм и модифицированные стрептавидином и аминогруппами. Концентрации QD измеряли с помощью оптического поглощения при 595 нм, используя коэффициенты экстинкции, предоставленные поставщиком. Используемыми сшивающими агентами являлись сульфо-LC-SPDP (сульфосукцинимидил-6-(3'-[2-пиридилдитио]-пропионамидо)гексаноат) (Pierce) и сульфо-SMCC (сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат) (Sigma). Аминомодифицированные стрептавидин-QD конъюгировали с конъюгированными с биотином линейными ДНК-кассетами и направляющими пептидами, используя сшивающие агенты. QD ресуспендировали в растворе, содержащем 50 мМ фосфат натрия, 150 мМ хлорид натрия, pH 7,2, используя фильтры Amicon Ultra-4 (порог 100 кДа). К QD добавляли сшивающий агент (в 1000-кратном избытке) и оставляли для прохождения реакции на 1 час. Образцы фильтровали самотеком на колонке NAP-5 (для удаления избытка сшивающего агента) в аналогичном буфере с добавленной 10 мМ EDTA. Пептиды обычно использовали из лиофилизированного порошка. Пептиды и линейные ДНК-кассеты добавляли к фильтрованным QD и оставляли для прохождения реакции на ночь при 4°C. С использованием трех фильтров Amicon продукт дважды фильтровали с фосфатно-солевым буфером по Дульбекко (PBS), дважды с высокосолевым буфером (1,0 М хлорид натрия, 100 мМ цитрат натрия, рН 7,2) и снова дважды с PBS. Промывки высокой солью требуются для удаления электростатически связанных молекул ДНК и пептидов, которые не удаляются только промывками PBS. Сульфо-SMCC имеет N-гидроксисукцинимидный (NHS) сложный эфир на одном конце, который вступает в реакцию с аминомодифицированными QD с образованием амидной связи. Сульфо-SPDP также содержит вступающий в реакцию с аминогруппами N-гидроксисукцинимидный (NHS) сложный эфир, который быстро вступает в реакцию с любой молекулой, содержащий первичный амин, таким образом образуя стабильную амидную связь.
Трансформация in planta и скрининг устойчивых растений Т1: приготавливали конечный объем 250-500 мл суспензии из раствора конъюгата наночастиц, направляющего пептида и линейной ДНК-кассеты, и затем растения Arabidopsis (в основном незрелые соцветия с несколькими оплодотворенными стручками) использовали для обработки. Перед погружением растений к раствору NHpD-конъюгата добавляли Silwet L-77 до концентрации 0,05% (250 мкл/500 мл) - 0,005% и хорошо перемешивали. Наземные части растения погружали в раствор NHpD-конъюгата на 2-30 секунд при мягком покачивании. Обработанные растения помещали под колпак или закрывали на 16-24 часа при 22-24°C. Растения переносили в Conviron и оставляли расти до зрелости, после чего собирали семена. Для скрининга массы собранных семян от растений Т0 использовали лотки для селекции (лотки 10,5"×21"×1") и приблизительно 10000 семян на каждый лоток. Для гарантии того, что селекционное опрыскивание было проведено правильно, использовали два контроля: отрицательный контроль трансформации, Col-0; и Columbia Col-0 дикого типа с внесенными гомозиготными семенами с селектируемым маркером РАТ (фосфинотрицин-ацетилтрансферазой) в качестве положительного контроля трансформации. Для достижения синхронизации семена стратифицировали в 0,1% (вес/объем) растворе агара в течение 48 часов перед посевом. Чтобы обеспечить 10000 семян на лоток для отбора, 200 мг семян добавляли к 0,1% раствору агара и встряхивали на вортексе до равномерного суспендирования семян. Стратифицированные семена затем высевали на лотки для отбора, заполненные Sunshine mix LP5, и поливали через поддон раствором Хоагланда. Для эффективности опрыскивания для селекции важно, чтобы 40 мл суспендированных семян были посеяны равномерно на лоток для селекции. После посева на каждый лоток для селекции помещали куполы для размножения, и растения выращивали для проведения селекции, используя условия, указанные ранее. Куполы для размножения убирали приблизительно через 5 дней после посева. Всходы опрыскивали через пять дней после посева и повторно через 10 дней после посева, используя 0,2% (объем/объем) раствор (20 мкл/10 мл дистиллированной воды) глуфосината аммония (гербицид LIBERTY® от Bayer CropSciences) в количестве 10 мл раствора для опрыскивания на лоток (703 л/га) и наконечник пневматического опрыскивателя DeVilbiss для достижения эффективной концентрации 280 г/га глуфосината на одну обработку. Количество приготавливаемого гербицида Liberty® вычисляли следующим образом: (703 л/га объема опрыскивания = 280 GPA). (280 г активного ингредиента (а.и.)/га) × (1 га/703 л) × (1 л/200 г а.и. глуфосината) = 0,20% раствор (или 20 мкл/10 мл). 10 мл раствора переносили с помощью пипетки в 20 мл сцинтиляционную пробирку для каждого опрыскиваемого лотка. Опрыскивание проводили горизонтально и вертикально. Через 4-7 дней после второго опрыскивания идентифицировали устойчивые к гербициду растения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДОСТАВКА ЛИНЕЙНОЙ МОЛЕКУЛЫ ДНК В РАСТЕНИЯ ДЛЯ СТАБИЛЬНОЙ ТРАНСФОРМАЦИИ С ПОМОЩЬЮ ПЕГИЛИРОВАННЫХ КВАНТОВЫХ ТОЧЕК | 2011 |
|
RU2575097C2 |
| КОНЪЮГАТЫ КВАНТОВОЙ ТОЧКИ С ПЕПТИДОМ-НОСИТЕЛЕМ, ПРИГОДНЫЕ ДЛЯ ВИЗУАЛИЗАЦИИ И ДОСТАВКИ МОЛЕКУЛ В РАСТЕНИЯ | 2012 |
|
RU2609637C2 |
| РАСТИТЕЛЬНЫЙ ПЕПТИД ГАММА-ЗЕИН ДЛЯ ДОСТАВКИ БИОМОЛЕКУЛ В РАСТИТЕЛЬНЫЕ КЛЕТКИ | 2011 |
|
RU2563805C2 |
| ПРИМЕНЕНИЕ ДЕНДРИМЕРНОЙ НАНОТЕХНОЛОГИИ ДЛЯ ДОСТАВКИ БИОМОЛЕКУЛ В РАСТИТЕЛЬНЫЕ КЛЕТКИ | 2010 |
|
RU2571928C2 |
| СПОСОБЫ ПЕРЕНОСА МОЛЕКУЛЯРНЫХ ВЕЩЕСТВ В КЛЕТКИ РАСТЕНИЙ | 2008 |
|
RU2495935C2 |
| ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ | 2010 |
|
RU2556376C2 |
| ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ | 2017 |
|
RU2664865C2 |
| ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ | 2010 |
|
RU2612156C2 |
| ТОЛЕРАНТНОЕ К СТРЕССУ ТРАНСГЕННОЕ РАСТЕНИЕ ПШЕНИЦЫ | 2005 |
|
RU2376377C2 |
| СИНТЕТИЧЕСКИЕ ТРАНЗИТНЫЕ ПЕПТИДЫ ХЛОРОПЛАСТА ИЗ BRASSICA | 2013 |
|
RU2636035C2 |


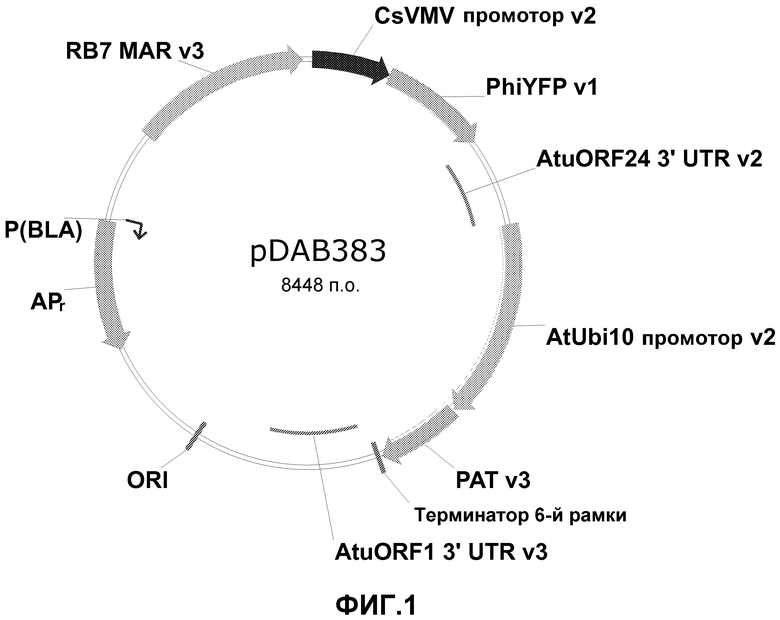









Изобретение относится к области биохимии, в частности к способу введения молекулы функционализированной линейной нуклеотидной кассеты, представляющей интерес, в клетку растения, имеющую клеточную стенку, способу введения молекулы функционализированной линейной нуклеотидной кассеты, представляющей интерес, в растительный материал, а также к способу интрогрессии признака в растение. Вышеуказанные способы предполагают использование наночастицы, являющейся квантовой точкой, которая содержит функциональную группу, которая взаимодействует с молекулой функционализированной линейной нуклеотидной кассеты, представляющей интерес. Изобретение позволяет эффективно вводить молекулу, представляющую интерес, в растительную клетку, имеющую клеточную стенку. 3 н. и 20 з.п. ф-лы, 4 ил., 1 табл., 5 пр.
1. Способ введения молекулы функционализированной линейной нуклеотидной кассеты, представляющей интерес, в клетку растения, имеющую клеточную стенку, причем способ включает в себя:
предоставление растительной клетки, имеющей клеточную стенку;
покрытие наночастицы, являющейся квантовой точкой, молекулой функционализированной линейной нуклеотидной кассеты, представляющей интерес, где наночастица, являющаяся квантовой точкой, содержит функциональную группу, которая взаимодействует с молекулой функционализированной линейной нуклеотидной кассеты, представляющей интерес;
осуществление контакта между растительной клеткой, имеющей клеточную стенку, и покрытой наночастицей, являющейся квантовой точкой; и
обеспечение возможности поглощения наночастицы, являющейся квантовой точкой, и молекулы функционализированной линейной нуклеотидной кассеты, представляющей интерес, растительной клеткой, содержащей клеточную стенку; и
отбор растений, которые имеют стабильно интегрированную молекулу линейной нуклеотидной кислоты, представляющую интерес.
2. Способ по п. 1, в котором наночастицей, являющейся квантовой точкой, является конъюгированная наночастица стрептавидин-QD.
3. Способ по п. 1, дополнительно включающий в себя обеспечение возможности поглощения наночастицы, являющейся квантовой точкой, компартментом растительной клетки, содержащей клеточную стенку.
4. Способ по п. 1, дополнительно включающий в себя покрытие наночастицы, являющейся квантовой точкой, белком, направляющим в субклеточный компартмент.
5. Способ по п. 4, в котором компартмент выбран из группы, состоящей из цитозоля, ядра, тонопластов, пластиды, этиопласта, хромопласта, лейкопласта, элайопласта, протеопласта, амилопласта, хлоропласта и просвета двойной мембраны.
6. Способ по п. 1, в котором растительной клеткой, имеющей клеточную стенку, является растительная клетка из видов коммерческих сельскохозяйственных растений.
7. Способ по п. 6, в котором растительная клетка выбрана из группы, состоящей из клеток табака, моркови, кукурузы, канолы, рапса, хлопчатника, пальмы, арахиса, сои, Oryza sp., Arabidopsis sp., Ricinus sp.и сахарного тростника.
8. Способ по п. 6, в котором растительная клетка относится к ткани, выбранной из группы, состоящей из зародыша, меристемы, каллюса, пыльцы, листьев, пыльников, корней, кончиков корней, цветков, семян, стручков и стеблей.
9. Способ по п. 1, в котором растительной клеткой, имеющей клеточную стенку, является культивированная клетка.
10. Способ по п. 1, в котором наночастицей, являющейся квантовой точкой, является полупроводниковая наночастица.
11. Способ по п. 1, дополнительно включающий в себя модификацию поверхности наночастицы, являющейся квантовой точкой.
12. Способ по п. 1, в котором молекула функционализированной линейной нуклеотидной кассеты, представляющая интерес, содержит нуклеотидную последовательность, выбранную из группы, состоящей из молекул ДНК, РНК, РНКи и генов.
13. Способ по п. 12, в котором молекула функционализированной линейной нуклеотидной кассеты, представляющая интерес, содержит ген.
14. Способ по п. 13, в котором геном является ген чужеродного белка, агротехнический ген или маркерный ген.
15. Способ по п. 1, в котором молекула функционализированной линейной нуклеотидной кассеты, представляющая интерес, получена с помощью ПЦР-амплификации нуклеотидной последовательности.
16. Способ по п. 15, в котором нуклеотидная последовательность получена из молекулы нуклеиновой кислоты, выбранной из группы, состоящей из плазмид, космид, искусственных хромосом, дрожжевых искусственных хромосом и бактериальных искусственных хромосом.
17. Способ по п. 12, дополнительно включающий в себя отбор клеток, которые имеют стабильно интегрированную молекулу функционализированной линейной нуклеотидной кассеты, представляющую интерес.
18. Способ по п. 17, в котором выбранные клетки являются регенерируемыми клетками.
19. Способ по п. 18, дополнительно включающий в себя регенерацию растения из регенерируемых клеток.
20. Способ введения молекулы функционализированной линейной нуклеотидной кассеты, представляющей интерес, в растительный материал, причем способ включает в себя: предоставление растительного материала, причем растительный материал выбран из группы, состоящей из растительных клеток, растительных тканей и растений;
предоставление наночастицы, являющейся квантовой точкой;
покрытие наночастицы, являющейся квантовой точкой, молекулой функционализированной линейной нуклеотидной кассеты, представляющей интерес, где наночастица, являющаяся квантовой точкой, содержит функциональную группу, которая взаимодействует с молекулой функционализированной линейной нуклеотидной кассеты, представляющей интерес;
обеспечение контакта между клеткой, имеющей клеточную стенку, и покрытой наночастицей, являющейся квантовой точкой; и
обеспечение возможности поглощения наночастицы, являющейся квантовой точкой, и молекулы функционализированной линейной нуклеотидной кассеты, представляющей интерес, растительным материалом; и
отбор растений, которые имеют стабильно интегрированную молекулу линейной нуклеотидной кислоты, представляющую интерес.
21. Способ по п. 20, в котором растительный материал является растительной тканью, выбранной из группы, состоящей из зародыша, меристемной ткани, каллюса, пыльцы, листьев, пыльников, корней, кончиков корней, цветков, семян, стручков и стеблей.
22. Способ интрогрессии признака в растение, причем способ включает в себя:
предоставление растительной клетки;
предоставление наночастицы, являющейся квантовой точкой, способной взаимодействовать с молекулой функционализированной линейной нуклеотидной кассеты;
покрытие наночастицы, являющейся квантовой точкой, средством для экспрессии признака в растении, где наночастица, являющаяся квантовой точкой, содержит функциональную группу, которая взаимодействует с молекулой функционализированной линейной нуклеотидной кассеты, представляющей интерес;
обеспечение контакта между растительной клеткой и покрытой наночастицей, являющейся квантовой точкой;
обеспечение возможности поглощения наночастицы, являющейся квантовой точкой, и средства для экспрессии признака в растении растительной клеткой;
регенерацию целого растения из трансформированной растительной клетки; и
размножение растения, где размноженное растение имеет стабильно интрогрессированный признак.
23. Способ по п. 22, в котором признак выбран из группы, состоящей из экспрессии белка, представляющего интерес, мужской стерильности, устойчивости к гербицидам, устойчивости к насекомым, устойчивости к бактериальным заболеваниям, устойчивости к грибковым заболеваниям и устойчивости к вирусным заболеваниям.
| KLEIN TM et al., High-velocity microprojectiles for delivering nucleic acids into living cells, Nature, 1987, Vol | |||
| Перепускной клапан для паровозов | 1922 |
|
SU327A1 |
| Деревянный торцевой шкив | 1922 |
|
SU70A1 |
| MIKI B | |||
| et al., A procedure for the microinjection of plant cells and protoplasts, Journal of tissue culture methods, 1989, Vol | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Способ подпочвенного орошения с применением труб | 1921 |
|
SU139A1 |
| US2009104700 A1, 23.04.2009 | |||
| THI LOC N.et al., Linear | |||
Авторы
Даты
2016-02-10—Публикация
2011-07-07—Подача