ЗАЯВЛЕНИЕ О ПРИОРИТЕТЕ
По настоящей заявке испрашивается приоритет по дате подачи предварительной заявки на патент США "ДОСТАВКА ЛИНЕЙНОЙ МОЛЕКУЛЫ ДНК В РАСТЕНИЯ ДЛЯ СТАБИЛЬНОЙ ТРАНСФОРМАЦИИ С ПОМОЩЬЮ ПЕГИЛИРОВАННЫХ КВАНТОВЫХ ТОЧЕК" с порядковым номером 61/362224, поданной 7 июля 2010 года.
УРОВЕНЬ ТЕХНИКИ
Наночастицы имеют уникальные свойства, которые были использованы для доставки ДНК в конкретные животные клетки. Наночастицы имеют уникальные свойства, которые использовались для доставки ДНК в конкретные животные клетки. Было найдено, что когда определенные наночастицы, покрытые ДНК, инкубируются с клетками, не имеющими клеточной стенки, клетки поглощают наночастицы и начинают экспрессировать гены, кодированные на ДНК. Полупроводниковые наночастицы (например, квантовые точки (QD)) в диапазоне размеров 3-5 нм также были использованы в качестве носителей для доставки молекул в клетки. ДНК и белки могут быть связаны с некоторыми лигандами, прикрепленными к поверхности QD. См., например, Patolsky, F. et al., J. Am. Chem. Soc. 125:13918 (2003). Покрытые карбоновой кислотой или амином QD могут быть сшиты с молекулами, содержащими тиоловую группу, см., например, Dubertret B. et al., Science 298:1759 (2002); Akerman et al., Proc. Natl. Acad. Sci. U.S.A. 99:12617 (2002); Mitchell et al., J. Am. Chem. Soc. 121:8122 (1999)), или N-гидроксисукцинимильную (NHS) эфирную группу, с использованием стандартных протоколов биоконъюгации. См., например, Pinaud, et al., Am. Chem. Soc. 126:6115 (2004); Bruchez, et al., Science 281:2013 (1998). Альтернативным путем для присоединения молекул к поверхности QD является способ конъюгации покрытых стрептавидином QD с биотинилированными белками, олигонуклеотидами или антителами. См., например, Dahan, et al., Science 302:442 (2003); Pinaud, et al., J. Am. Chem. Soc. 126:6115 (2004); Wu, et al., Nature Biotechnol. 21:41 (2003); Jaiswal, et al., Nature Biotechnol. 21:47 (2003); и Mansson, et al., Biochem. Biophys. Res. Commun. 314:529 (2004).
Доставка чужеродных молекул нуклеиновых кислот в растения является сложной задачей из-за наличия стенок у растительных клеток. Используемые способы для генетической трансформации растений основаны на инвазивной доставке. Клеточная стенка в клетках растений является барьером для доставки экзогенно вносимых молекул. Для достижения доставки генов и малых молекул в клетки растений с клеточной стенкой были использованы многочисленные инвазивные способы, такие как биолистическая доставка (генная пушка), микроинъекция, электропорация и опосредованная Agrobacterium трансформация, но доставка белков была достигнута только с использованием микроинъекции. Когда желательна доставка молекул нуклеиновых кислот в клетки растений, клеточную стенку удаляют перед добавлением частиц к протопластам растения (см. Torney, et al., Nature Nanotechnol. 2:295-300 (2007)).
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Здесь описаны способы и композиции для использования наночастиц и линеаризованных молекул нуклеиновых кислот для введения представляющей интерес молекулы в растительную клетку, которая имеет клеточную стенку. Некоторые воплощения раскрытых способов могут использоваться для продуцирования стабильно трансформированных генетически модифицированных фертильных растений. В некоторых воплощениях характерные свойства линейных молекул нуклеиновых кислот обеспечивают доставку специфических, представляющих интерес, генных последовательностей без последовательностей посторонних нуклеиновых кислот, которые могут иметь регуляторные функции для целевого трансгенного организма.
В некоторых воплощениях наночастицы могут включать молекулы пегилированной линейной нуклеиновой кислоты. В конкретных воплощениях наночастицы могут быть полупроводниковыми наночастицами, такими как квантовые точки (QD). В некоторых воплощениях молекулой линейной нуклеиновой кислоты может быть линеаризованная плазмидная ДНК. В других воплощениях молекулы линейной нуклеиновой кислоты могут включать кодирующие последовательности фосфинотрицин-N-ацетилтрансферазы (PAT) и/или желтого флуоресцентного белка (YFP).
Также раскрыты способы введения представляющей интерес молекулы в клетку растения, имеющую клеточную стенку, где способы могут включать предоставление клетки растения, имеющей клеточную стенку; покрытие поверхности наночастицы ПЭГ для получения ПЭГилировнных наночастиц; покрытие ПЭГилировнных наночастиц по меньшей мере одной молекулой линейной нуклеиновой кислоты представляющей интерес; приведение в контакт друг с другом клетки растения, имеющей клеточную стенку, с ПЭГилировнными наночастицами, покрытыми молекулой(ами) линейной нуклеиновой кислоты представляющей интерес; и предоставления возможности поглощения наночастицы и молекулы(молекул) линейной нуклеиновой кислоты представляющей интерес в клетку, имеющую клеточную стенку.
Дополнительно раскрыты способы интогрессии генетического признака в растение. В некоторых воплощениях способ может включать предоставление растительной клетки; покрытие поверхности наночастиц ПЭГ для продуцирования ПЭГилированных наночастиц; покрытие ПЭГилированных наночастиц средствами экспрессии генетического признака в растении; приведение в контакт друг с другом клетки растения с ПЭГилировнными наночастицами, покрытыми средствами экспрессии генетического признака в растении; и обеспечение поглощения клеткой растения наночастицы со средствами экспрессии генетического признака в растении для получения трансформированной клетки растения; регенерацию целого растения из трансформированной растительной клетки; и репродукцию растения. В некоторых воплощениях генетический признак, который может быть интрогрессирован в соответствии со способами изобретения, включают признак, выбранный без ограничения из: мужской фертильности; устойчивости к гербицидам; устойчивости к насекомым; и устойчивости к бактериальному, грибковому заболеванию и/или вирусному заболеванию.
Также раскрытые способы по изобретению могут быть использованы для трансформации растений in planta. В некоторых воплощениях растение может быть выбрано из растений рода Arabidopsis, например A. thaliana. В конкретном воплощении, растение, трансформированное in planta, может быть выбрано из экотипа Колумбия растений A. thaliana.
Дополнительно раскрытыми являются генетически модифицированные (ГМ) растительные клетки и способы их получения, где клетки растений имеют одну или несколько нуклеиновых кислот, введенных в них посредством способов настоящего изобретения. В некоторых воплощениях плазмида, содержащая по меньшей мере один представляющий интерес ген и селектируемый маркер, может быть введена в клетку растения, имеющую клеточную стенку, посредством наночастицы в соответствии с настоящим изобретением. В дополнительных вариантах воплощениях могут быть отобраны стабильные трансформанты, которые имеют стабильно интегрированный по меньшей мере один представляющий интерес ген и/или селектируемый маркер. В альтернативных воплощениях клетка растения, которая уже содержит представляющий интерес ген, может быть размножена для получения других клеток, содержащих представляющую интерес молекулу. В других вариантах воплощениях клетка растений, уже содержащая представляющую интерес молекулу, может быть регенерируемой клеткой, которая может быть использована для регенерации целого растения, включающего представляющую интерес молекулу.
Дополнительно раскрытыми являются способы получения регенерируемых клеток растений, содержащих представляющую интерес молекулу, для применения в тканевых культурах. Эта тканевая культура может быть способной регенерировать растения, имеющие по существу тот же самый генотип, что и регенерируемые клетки. Регенерируемые клетки в таких тканевых культурах могут быть зародышами, протопластами, меристематическими клетками, каллусом, пыльцой, листьями, пыльниками, корнями, кончиками корней, цветками, семенами, стручками или стеблями. Кроме того, некоторые воплощения обеспечивают растения, регенерированные из тканевых культур этого изобретения.
Дополнительно раскрытыми являются способы генерирования стабилизированных линий растений, содержащих желаемый генетический признак или представляющую интерес молекулу нуклеиновой кислоты, где желаемый генетический признак или представляющая интерес молекула нуклеиновой кислоты могут сначала вводиться за счет поглощения наночастицы через клеточную стенку растения. Способы генерирования стабилизированных линий растений хорошо известны специалисту с обычной квалификацией в данной области и могут включать, без ограничения, такие способы, как самоопыление, обратное скрещивание, получение гибридов, скрещивания с популяциями и т.п. Таким образом, также раскрыты растения и клетки растений, содержащие желаемый генетический признак или представляющую интерес молекулу нуклеиновой кислоты, впервые введенные в клетку растения (или в ее предшественники) поглощением наночастиц через клеточную стенку. Клетки растения, содержащие желаемый генетический признак или представляющую интерес молекулу нуклеиновой кислоты, впервые введенные в растение или в клетку (или в ее предшественники) поглощением наночастиц через клеточную стенку, могут быть использованы в скрещиваниях с другими, отличающимися, клетками растений для получения гибридных клеток первой генерации (F1), семян и/или растений с желаемыми характеристиками.
Кроме иллюстративных аспектов и вариантов воплощений, описанных выше, дополнительные аспекты и воплощения станут очевидными в свете следующих описаний.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 включает графическое описание нелинеаризованной плазмиды pDAB3831.
Фиг.2 включает графическое описание плазмиды pDAB3831, линеаризованной с помощью фермента рестрикции KpnI.
Фиг.3 включает выравнивание последовательностей между последовательностью ДНК фосфинотрицин-N-ацетилтрансферазы (PAT) из наночастиц с линейной ДНК трансформированного генома Arabidopsis и последовательностью PAT из базы данных NCBI.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1 показывает последовательность прямого праймера, используемого для амплификации гена YFP:
TGTTCCACGGCAAGATCCCCTACG.
SEQ ID NO:2 показывает последовательность обратного праймера, используемого для амплификации гена YFP:
TATTCATCTGGGTGTGATCGGCCA.
SEQ ID NO:3 показывает последовательность прямого праймера, используемого для амплификации гена PAT:
GGAGAGGAGACCAGTTGAGATTAG.
SEQ ID NO:4 показывает последовательность обратного праймера, используемого для амплификации гена PAT:
AGATCTGGGTAACTGGCCTAACTG.
НАИЛУЧШИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
I. Обзор некоторых воплощений
Способы по изобретению, обеспечивающие неинвазивную передачу генов могут быть очень полезными для создания генетически модифицированных растений с желаемыми генетическими признаками. Неинвазивная передача генов может способствовать специфическому нацеливанию и корректированию молекулярных сайтов внутри клеток для применения в таких областях, как ведение желаемых показателей, достижение итогового результата и получение желаемых агрономических признаков культур растений. Описанные способы, как альтернатива для ГМО, также могут быть полезны для транзиентной трансформации растений, для расширения технологии интрогрессии генетических признаков и придания деревьям или овощным культурам устойчивости к патологиям, где технология в настоящее время ограничена.
Недавняя заявка на патент США No.60/978059 раскрывает неинвазивные средства доставки ДНК, основанные на наночастицах, используя различные несущие полезную нагрузку наночастицы, в том числе для доставки кольцевой плазмидной ДНК, и ясно демонстрирует стабильную интеграцию трансгенов в семена T1 растений Arabidopsis. Полученные так трансгенные растения, содержащие кольцевую плазмидную ДНК, демонстрируют желаемые толерантные к гербицидам фенотипы, и показывают высокий уровень толерантности при одновременном опрыскиванием в поле по меньшей мере четырехкратным количеством глюфосината аммония. Заявка США No.60/978059 показала, среди прочего, генетическую трансформацию в Arabidopsis за счет применения положительно заряженных наночастиц золота с кольцевой плазмидной ДНК. Настоящая работа описывает, в частности, применение линейных молекул нуклеиновых кислот для стабильной генетической трансформации растений.
Заявка США No.60/978059 описывает, в частности, доставку плазмидной ДНК, опосредованную положительно заряженными наночастицами. Однако до настоящего времени не сообщалось о достижении стабильной геномной интеграции трансгена при использовании для доставки линейных плазмид. Это изобретение описывает применение линейных молекул нуклеиновой кислоты с использованием положительно заряженных наночастиц для стабильный генетической трансформации растений. Молекулярный анализ показывается экспрессию PAT вместе с YFP в трансгенных растениях Arabidopsis T1, трансформированных геном pat и геном yfp способами по изобретению. Трансгенные растения T1 являются фертильными и продуцируют семена. Эти семена могут использоваться для размножения, и наряду с молекулярным и белковыми анализами может быть выполнен сегрегационный анализ.
Молекулы линейных нуклеиновых кислот имеют характерные свойства, которые отличают их от кольцевой плазмидной ДНК. Например, молекулы линейных нуклеиновых кислот могут иметь четко определенную генную кассету без остова несущего вектора и без селектируемого маркера - бактериального антибиотика.
Гербицид глюфосинат аммония (GLA), может быть распылен в поле с уровнем концентрации для скрининга трансгенов. Саженцы Arabidopsis T1, полученные с использованием способов по изобретению, показали устойчивость к гербицидам при пятикратном уровне дозирования глюфосината в поле, например, в режиме "через день", начиная с семи дней после появления всходов. Геномные ДНК этих трансгенных растений были проанализированы на предмет присутствия pat и yfp методом ПЦР, и результаты показали присутствие целевых последовательностей pat и yfp в ДНК. Секвенирование полученных продуктов ПЦР показало наличие правильных трансгенных последовательностей pat и yfp в Arabidopsis T1, полученных с использованием способов по изобретению.
II. Термины
В описании и таблицах, которые следуют далее, используется ряд терминов. Для того чтобы обеспечить ясное и единообразное понимание описания и формулы изобретения, в том числе объема притязаний, который должен поддерживаться таким терминам, представлены следующие определения.
Обратное скрещивание. Как используется здесь, термин "обратное скрещивание" может быть процессом, в котором селекционер многократно скрещивает гибридное потомство с одним из родителей, например, гибрид первой генерации F1 с одним из родительских генотипов этого гибрида F1.
Зародыш. Как используется здесь, термин "зародыш" может относиться к маленькому растению, содержащемуся в зрелом семени.
Наночастица. Как используется здесь, термин "наночастица" может относиться к микроскопической частице, имеющей по меньшей мере один нанометровый размер, например, меньше 100 нм. Наночастицы, подходящие для применения в настоящем изобретении, могут иметь размер 1 нм-0,84 мкм. Одним из классов наночастиц является "квантовая точка" (QD). Квантовая точка может иметь медианный диаметр 1 нм-10 нм, предпочтительно 2-4 нм. Другие варианты наночастиц включают, без ограничения: наночастицы золота; покрытые золотом наночастицы; пористые наночастицы; мезопористые наночастицы; наночастицы диоксида кремния; полимерные наночастицы, включая дендримеры; вольфрамовые наночастицы; желатиновые наночастицы, нанооболочки; наноядра; наносферы; наностержни; магнитные наночастицы и их комбинации.
Среди доступных наночастиц, люминесцентные полупроводниковые нанокристаллы (QD) обеспечивают многие известные применения при биологической визуализации и зондировании. Их полезность является следствием комбинации уникальных фото-физических характеристик и размеров, сопоставимым с размером большого белка. Гидродинамические радиус гидрофильных QD из CdSe-ZnS варьирует от 5 нм (для нанокристаллов, кэпирующих молекулярные лиганды) до 20 нм для нанокристаллов, инкапсулированных в блок-сополимеры. Один QD может быть конъюгирован с несколькими биомолекулами (например, с антителами, пептидами и молекулами нуклеиновых кислот), с получением многофункциональных биоконъюгатов QD с расширенной авидностью. Кроме того, их сильная устойчивость к химической и фото деградации может в целом обеспечить долгосрочный флуоресцентный мониторинг специфических биологических процессов. См. Nie и Emory, Science 275: 1 102-106 (1997). Множество схем нековалентных конъюгаций, основанных на самосборке из-за аффинности металлов и биотин-авидинового связывания, могут одновременно использоваться в рамках одного и того же комплекса, без необходимости дополнительной очистки, приводя к получению многофункциональных биоконъюгатов QD, которые являются стабильными даже во внутриклеточных средах. См. Yezhelyev et al., J. Am. Chem. Soc. 130(28):9006-12 (2008). Используя в среднем по 10 YFP плюс номинальное количество, равное 50, проникающих в клетку пептидов (CPP) на одну QD, может быть достигнута внутриклеточная доставка белковой нагрузки с молекулярным весом по меньшей мере 300 кДа и с пространственным размером 150 ангстрем. См. там же. Доставляемая нагрузка для QD-b-PE конъюгатов имеют гораздо больший диапазон размеров и молекулярных весов; например, доставленные сборки, из расчета в среднем 2,5 стрептавидин-b-PE на конъюгат, имеют молекулярный вес, который в целом превышает 103 кДа и пространственные размеры приближаются к 500 ангстремам. Молекулярный вес и размер может быть значительно увеличен, если используются конъюгаты с более высокими b-PE валентностями.
Молекула нуклеиновой кислоты. Полимерные формы нуклеотидов, которые могут включать как смысловые, так и антисмысловые цепи РНК, кДНК, геномной ДНК, искусственных хромосом (ACE), и синтетические формы и смеси вышеуказанных полимеров. Нуклеотид относится к рибонуклеотиду, дезоксирибонуклеотиду или к модифицированной форме обоих типов нуклеотидов. Термин "молекула нуклеиновой кислоты", как используется здесь, является синонимом терминов "нуклеиновая кислота" и "полинуклеотид". Молекула нуклеиновой кислоты обычно имеет по меньшей мере 10 оснований по длине, если не указано иное. Этот термин включает одноцепочечные и двухцепочечные формы ДНК. Молекула нуклеиновой кислоты может включать как отдельно, так и вместе, природные и модифицированные нуклеотиды, которые связаны между собой естественными и/или не встречающимися в природе нуклеотидными связями.
Операбельно связанный. Первая последовательность нуклеиновой кислоты операбельно связана со второй последовательностью нуклеиновой кислоты, когда первая последовательность нуклеиновой кислоты находится в функциональной взаимосвязи со второй последовательностью нуклеиновой кислоты. Например, промотор является операбельно связанным с кодирующей последовательностью, если промотор влияет на транскрипцию или экспрессию кодирующей последовательности. При рекомбинантном продуцировании, последовательности операбельно связанных нуклеиновых кислот могут быть смежными, и, при необходимости, могут соединять две кодирующие области белка в той же рамке считывания. Однако для того чтобы быть операбельно связанными, нуклеиновые кислоты могут и не быть смежными.
Пегилированный. Как используется в настоящем документе, термин "пегилированный" может касаться наночастиц (например, квантовых точек), когда поверхности наночастиц были изменены с помощью полиэтиленгликоля (PEG, ПЭГ) для улучшения биосовместимости. Пегилированные наночастицы могут быть дополнительно покрыты различными нацеливающими лигандами, например, пептидами и антителами, для улучшения эффективности доставки к конкретным клеткам и тканям. ПЭГ был конъюгирован с наночастицами и с различными лекарственными веществами, липосомами и полимерными мицеллами, для того чтобы, например, продлить время циркуляции наночастиц с покрытием в крови, путем снижения неспецифической адсорбции белков за счет эффекта пространственной стабилизации.
Квантовая точка. Как используется в настоящем документе, термин "квантовая точка" (QD), также иногда ранее известные как нанокристаллы, может относиться к полупроводниковой наноструктуре, которая ограничивает движение электронов зоны проводимости и дырок валентной зоны, или экситонов (связанных пар электронов зоны проводимости и дырок валентной зоны) во всех трех пространственных направлениях. Это ограничение может быть обусловлено, например, электростатическими потенциалами (генерируемыми наружными электродами, за счет легирования, деформацией, примесями и т.п.), присутствием границы раздела между различными полупроводниковыми материалами (например, в нанокристаллических системах ядро-оболочка), присутствием полупроводниковой поверхности (например, у полупроводникового нанокристалла) или их комбинациями. Квантовая точка может иметь дискретный квантованный энергетический спектр. Соответствующие волновые функции могут быть пространственно локализованными в квантовой точке, но простираются на многие периоды кристаллической решетки. Квантовая точка содержит малое конечное число (например, порядка 1-100) электронов зоны проводимости, дырок зоны валентности или экситонов (т.е. имеет конечное число элементарных электрических зарядов).
Квантовые точки являются особым классом полупроводниковых материалов, которые могут быть кристаллами, состоящими из материалов элементов периодических групп II-VI, III-V или IV-VI. Их размеры могут варьироваться, например, от 2 до 10 нанометров (10-50 атомов) в диаметре. В некоторых воплощениях квантовые точки могут быть изготовлены в виде ядра и оболочки из селенида кадмия и сульфида цинка (CdSe/ZnS), и они имеют ряд полезных электрических и оптических свойств, которые различаются по своему характеру от характеристик исходного объемного материала.
Наночастицы в виде квантовых точек были исследованы как средство для визуализации in vivo и in vitro, из-за высокого квантового выхода, высокого коэффициента молярного поглощения и высокой стойкости к Фотообесцвечиванию.
Устойчивый к глифосату. Устойчивость к дозе глифосата относится к способности растения выживать (т.е. растение не может погибнуть) под действием данной дозы глифосата. В некоторых случаях толерантные растения могут временно пожелтеть или иным образом проявить какое-либо повреждение, индуцированное глифосатом (например, избыточное побегообразование и/или замедление роста), но затем они восстанавливаются.
Стабилизированный. Как используется в настоящем документе, термин "стабилизированный" может относиться к характеристикам растения, которые репродуцибельно передаются от одной генерации к следующей генерации инбредных растений одного сорта.
Трансген. Как используется в настоящем документе, термин "трансген" может относиться к последовательности экзогенной нуклеиновой кислоты. В качестве одного из примеров, трансген представляет собой последовательность гена (например, гена устойчивости к гербициду), ген, кодирующий промышленно или фармацевтически полезное соединение, или ген, кодирующий желаемый сельскохозяйственный признак. В еще одном примере трансген представляет собой последовательность антисмысловой нуклеиновой кислоты, где экспрессия последовательности антисмысловой нуклеиновой кислоты ингибирует экспрессию последовательности целевой нуклеиновой кислоты. Трансген может содержать регуляторные последовательности, операбельно связанные с трансгеном (например, промотор). В некоторых воплощениях представляющая интерес молекула нуклеиновой кислоты, которая должна быть введена трансформацией посредством наночастиц, представляет собой трансген. Однако в других воплощениях, представляющая интерес молекула нуклеиновой кислоты представляет собой последовательность эндогенной нуклеиновой кислоты, для которой желательны дополнительные геномные копии последовательности эндогенной нуклеиновой кислоты, или молекулой нуклеиновой кислоты, которая находится в антисмысловой ориентации по отношению к целевой молекуле нуклеиновой кислоты в организме хозяина.
Поглощение. Как используется в настоящем документе, термин "поглощение" может относиться к транслокации частицы, такой как наночастица (например, квантовой точке), через клеточную стенку или клеточную мембрану, где транслокация имеет место не только как результат импульса, придаваемого этой частице чем-то другим, чем клетка, в которую эта частица поглощается. Неограничивающие примеры устройств или способов, которые вызывают транслокацию частицы через клеточную стенку или клеточную мембрану только в результате импульса, придаваемого частице, представляют собой биолистику, генную пушку, микроинъекцию и/или введение методом прокола с помощью наноматериалов (импалефекция).
III. Доставка молекул ДНК с помощью наночастиц для стабильной трансформации клеток растений
А. Обзор
Это изобретение описывает, в частности, новые способы трансформации растений, используя перенос посредством наночастиц линеаризованной плазмидной ДНК для генетической трансформации и развития стабильных трансгенных растений. Способы согласно некоторым воплощениям настоящего изобретения могут предоставить не только быструю генерацию трансгенного организма, но также и дополнительные возможности для желательных геномных модификаций, по сравнению с другими способами трансформации. Воплощения изобретения привели к стабильно трансформированному растению, о котором сообщается впервые, полученному посредством доставки линеаризованной плазмидной ДНК, опосредованной наночастицами. Раскрытые способы генетической модификации представляют собой отказ от традиционных способов генетической трансформации растений, и могут быть очень полезными для генерации трансгенных культур растений.
B. Молекулы ДНК
С появлением молекулярных биологических методик, которые обеспечили выделение и характеризацию генов, которые кодируют конкретный белок или РНК-продукты (например, интерферирующие РНК (RNAi), ученые в области биологии растений испытывали сильный интерес к созданию генома клеток, которые содержат и экспрессируют чужеродные гены, или дополнительные или модифицированные варианты нативных или эндогенных генов (возможно под управлением различных промоторов), для того чтобы, например, определенным способом изменить генетические признаки клетки. Такие чужеродные дополнительные и/или модифицированные гены упомянуты здесь общим термином "трансгены." Трансгены могут, например, кодировать представляющий интерес белок, или быть транскрибированы в RNAi. За последние пятнадцать - двадцать лет были разработаны несколько методов для продуцирования трансгенных клеток, и настоящее изобретение в специфических воплощениях касается вариантов трансформированных клеток, и методов их продуцирования посредством введения в клетки растения, имеющих клеточную стенку, одну или несколько линейных молекул нуклеиновой кислоты за счет поглощения наночастицы через стенку клетки. В некоторых воплощениях изобретения трансген может содержаться в линеаризовавшем векторе экспрессии.
Трансформация клетки может включать конструирование вектора экспрессии, который будет функционировать в конкретной клетке. Такой вектор может включать последовательность нуклеиновой кислоты, которая включает ген под контролем регулирующего элемента или оперативно связанный с регулирующим элементом (например, с промотором, энхансером, последовательностью терминации или их комбинацией). Так, вектор экспрессии может содержать одну или несколько таких операбельно связанных комбинаций ген/регулирующий элемент. Вектор(ы) может быть в форме плазмиды, и может использоваться отдельно или в комбинации с другими плазмидами, для того чтобы обеспечить трансформацию клетки, используя методы трансформации как описано здесь, чтобы включить трансген(ы) в генетический материал клетки растения, содержащей клеточную стенку.
В иных воплощениях, представляющая интерес молекула нуклеиновой кислоты, может быть линейной молекулой нуклеиновой кислоты. Линейные молекулы нуклеиновой кислоты могут быть получены, например, расщеплением кольцевой плазмиды эндонуклеазой рестрикции. Эндонуклеазы рестрикции расщепляют плазмиду на одном или нескольких сайтах распознавания в пределах нуклеотидной последовательности плазмиды. Таким образом, могут быть созданы плазмиды, обеспечивающие продуцирование одной или нескольких специфических линейных молекул нуклеиновой кислоты, за счет расщепления специфической эндонуклеазой рестрикции. Альтернативно, данная нуклеотидная последовательность плазмиды может быть проанализирована с целью поиска сайтов распознавания одной или несколькими специфическими эндонуклеазами рестрикции, которые обеспечивают продуцирование одной или нескольких специфических линейных молекул нуклеиновой кислоты (нуклеиновых кислот). Путем выбора сайтов рестрикции, которые расщепляются по специфическим положениям в пределах кольцевой плазмиды или линейной молекулы нуклеиновой кислоты, могут быть получены линейные молекулы нуклеиновой кислоты, у которых отсутствует одна или несколько последовательностей молекулы нуклеиновой кислоты-предшественника. Например, может быть получена линейная молекула нуклеиновой кислоты в которой отсутствуют чужеродные нуклеиновокислотные последовательности (например, остов несущего вектор, маркеры селекции, такие как бактериальные маркеры селекции и не являющиеся необходимыми последовательности нуклеиновой кислоты, которые являются гомологичными геномной ДНК целевой клетки). Альтернативно, линейная молекула нуклеиновой кислоты может быть синтезирована так, чтобы в ней отсутствовали чужеродные нуклеиновокислотные последовательности.
В иных воплощениях, где представляющая интерес молекула включает один или несколько генов, ген(ы) может (могут) быть доминантной или рецессивной аллелью. Например, ген(ы) может (могут) придать такие признаки, как устойчивость к гербициду, устойчивость к насекомым, устойчивость к бактериальным заболеваниям, устойчивость к грибам, устойчивость к вирусным заболеваниям, мужская фертильность, мужская стерильность, улучшенное пищевое качество и промышленное использование. Гены, придающие эти и другие признаки, известны в данной области техники, и любой ген может быть введен в клетку, содержащую клеточную стенку, согласно способам изобретения.
Экспрессирующие векторы для линеаризации и поглощения посредством наночастиц: Маркерные гены
Экспрессирующие векторы могут необязательно включать по меньшей мере один генетический маркер, например, операбельно связанный с регуляторным элементом, который позволяет трансформированным клеткам, содержащим этот маркер, извлекаться либо отрицательным отбором (т.е. ингибированием роста клеток, которые не содержат этот ген селектируемого маркера) либо положительным отбором (т.е. скринингом продукта, кодируемого этим генетическим маркером). Многие гены селектируемых маркеров для трансформации хорошо известны в данной области техники и включают, например, без ограничения: гены, кодирующие ферменты, которые метаболически детоксифицируют селективный химический агент, который может быть антибиотиком или гербицидом; или гены, кодирующие измененную мишень, которая может быть нечувствительна к ингибитору. Специфические способы положительного отбора также известны в данной области техники.
Один ген селектируемого маркера, который может быть подходящим для трансформации растений некоторыми молекулами нуклеиновых кислот, представляет собой ген неомицинфосфотрансферазы II (nptII), необязательно под контролем регуляторных сигналов растения, который придает устойчивость к канамицину. См., например, Fraley et al., Proc. Natl. Acad. Sci. U.S.A., 80:4803 (1983). Другой ген селектируемого маркера, который может быть использован, представляет собой ген гигромицинтрансферазы, который придает устойчивость к антибиотику гигромицину. См., например, Vanden Elzen et al., Plant Mol. Biol., 5:299 (1985).
Дополнительные гены селектируемых маркеров, которые могут быть использованы в способах по изобретению, включают гены селектируемых маркеров бактериального происхождения, например, те, которые придают устойчивость к антибиотикам, таким как гентамицинацетилтрансфераза, стрептомицинфосфотрансфераза, аминогликозид-3'-аденилтрансфераза и блеомицин. См. Hayford et al., Plant Physiol. 86:1216 (1988), Jones et al., Mol. Gen. Genet, 210:86 (1987), Svab et al., Plant Mol. Biol. 14:197 (1990), и Hille et al., Plant Mol. Biol. 7:171 (1986). Другие гены селектируемых маркеров придают устойчивость к гербицидам, таким как глифосат, глюфосинат или бромоксинил. См. Comai et al., Nature 317:741-744 (1985), Gordon-Kamm et al., Plant Cell 2:603-618 (1990) и Stalker et al., Science 242:419-423 (1988).
Другие гены селектируемых маркеров, которые могут быть использованы для трансформации растений, включают гены небактериального происхождения. Эти гены включают, например, без ограничения, дигидрофолатредуктазу мыши, 5-енолпирувилшикимат-3-фосфатсинтазу растений и ацетолактатсинтазу растений. См. Eichholtz et al., Somatic Cell Mol. Genet. 13:67 (1987), Shah et al., Science 233:478 (1986), и Charest et al., Plant Cell Rep. 8:643 (1990).
Другой класс генов маркеров, подходящих для трансформации растений, может потребоваться для скрининга предположительно трансформированных клеток растений, а не для прямого генетического отбора трансформированных клеток на устойчивость к токсичному веществу, такому как антибиотик. Эти гены в частности применимы для количественного определения или визуализации пространственной картины экспрессии гена в конкретных тканях, и они часто называются "репортерными генами", поскольку они могут быть слиты с геном или регуляторной последовательностью гена для исследования экспрессии гена. Гены, обычно используемые для скрининга трансформированных клеток, включают, без ограничения, β-глюкуронидазу (GUS), β-галактозидазу, люциферазу и хлорамфениколацетилтрансферазу. См. Jefferson, R. A., Plant Mol. Biol. Rep. 5:387 (1987), Teeri et al., EMBO J. 8:343 (1989), Koncz et al., Proc. Natl. Acad. Sci. U.S.A. 84:131 (1987), и DeBlock et al., EMBO J. 3:1681 (1984).
Совсем недавно, гены, кодирующие флуоресцентные белки (например, GFP, EGFP, EBFP, ECFP и YFP), были использованы в качестве маркеров при экспрессии генов в прокариотических и эукариотических клетках. См. Chalfie et al., Science 263:802 (1994). Таким образом, флуоресцентные белки и мутанты флуоресцентных белков могут быть использованы как маркеры при скрининге в некоторых воплощениях изобретения.
Экспрессирующие векторы для поглощения посредством наночастицы: Промоторы
Гены, включенные в экспрессирующие векторы, могут запускаться нуклеотидной последовательностью, содержащей регуляторный элемент, например, промотор. Некоторые типы промоторов хорошо известны в области техники трансформации, также как и другие регуляторные элементы, которые могут быть использованы самостоятельно или в комбинации с промоторами.
Промотор представляет собой область ДНК, которая может находиться слева (в положении "апстрим") от старта транскрипции, и может быть включено узнавание и связывание РНК полимеразы и/или других белков, для того чтобы инициировать транскрипцию. "Промотор растения" может быть промотором, который способен инициировать транскрипцию в клетках растений. Примеры промоторов под контролем развития включают промоторы, которые преимущественно инициируют транскрипцию в конкретных тканях, таких как листья, корни, семена, волокна, сосуды ксилемы, трахеиды или склеренхима. Такие промоторы называются “тканепредпочтительными”. Промоторы, которые инициируют транскрипцию только в конкретных тканях, называют "тканеспецифическими". Промотор, специфический для "типа клетки", первоначально запускает экспрессию в определенных типах клеток в одном или нескольких органах, например, в клетках сосудов корней или листьев. "Индуцибельный" промотор может представлять собой промотор, который может быть под контролем окружающей среды. Примеры условий окружающей среды, которые могут влиять на транскрипцию под индуцибельными промоторами, включают, без ограничения, анаэробные условия или наличие света. Тканеспецифические, тканепредпочтительные, специфичные для типа клеток и индуцибельные промоторы образуют класс "неконститутивных промоторов". "Конститутивный промотор" представляет собой промотор, который может быть активным при большинстве условий окружающей среды.
1. Индуцибельные промоторы
Индуцибельный промотор может быть операбельно связан с экспрессируемым в клетке геном. Необязательно, индуцибельный промотор может быть операбельно связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть операбельно связана с экспрессируемым в клетке геном. В случае индуцибельного промотора, скорость транскрипции увеличивается в ответ на индуцирующий агент.
Любой индуцибельный промотор может быть использован в воплощении настоящего изобретения. См. Ward et al., Plant Mol. Biol. 22:361-366 (1993). Примеры индуцибельных промоторов включают, без ограничения, промоторы системы ACEI, который отвечает на медь (Mett et al., Proc. Natl. Acad. Sci. U.S.A. 90:4567-4571 (1993)); промотор гена In2 маиса, который отвечает на антидот к бензолсульфамидным гербицидам (Hershey et al., Mol. Gen Genetics 227:229-237 (1991) и Gatz et al., Mol. Gen. Genetics 243:32-38 (1994)); и промотор репрессора Tet из Tn1O (Gatz et al., Mol. Gen. Genetics 227:229-237 (1991)). Особенно полезным индуцибельным промотором может быть промотор, который отвечает на индуцирующий агент, на который растения в обычных условиях не отвечают. Примером такого индуцибельного промотора является индуцибельный промотор гена стероидного гормона, транскрипционная активность которого может быть индуцирована глюкокортикостероидным гормоном. См. Schena et al., Proc. Natl. Acad. Sci. U.S.A. 88:0421 (1991).
2. Конститутивные промоторы
Конститутивный промотор может быть операбельно связан с экспрессируемым в клетке геном, или конститутивный промотор может быть операбельно связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть операбельно связана с экспрессируемым в клетке геном.
Различные конститутивные промоторы могут быть использованы в настоящем изобретении. Примеры конститутивных промоторов включают, без ограничения, промоторы вирусов растений, такие как промотор 35S из CaMV (Odell et al., Nature 313:810-812 (1985)); промоторы генов актина риса (McElroy et al., Plant Cell 2:163-171 (1990)); промотор убиквитина (Christensen et al., Plant Mol. Biol. 12:619-632 (1989) и Christensen et al., Plant Mol. Biol. 18:675-689 (1992)); промотор pEMU (Last et al., Theor. Appl. Genet. 81:581-588 (1991)); промотор MAS (Velten et al., EMBO J. 3:2723-2730 (1984)); и промотор гистона Н3 маиса (Lepetit et al., Mol. Gen. Genetics 231:276-285 (1992) и Atanassova et al., Plant Journal 2 (3):291-300 (1992)); и промотор ALS, XbaI/NcoI-фрагмент (по 5'-концу) структурного гена ALS3 Brassica napus (или нуклеотидная последовательность, сходная с указанным XbaI/NcoI-фрагментом. См. международную публикацию PCT WO 96/30530.
3. Тканеспецифические или тканепредпочтительные промоторы
Тканеспецифический промотор может быть операбельно связан с экспрессируемым в клетке геном. Необязательно, этот тканеспецифический промотор может быть операбельно связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть операбельно связана с экспрессируемым в клетке геном. Растения, трансформированные представляющим интерес геном, операбельно связанным с тканеспецифическим промотором, могут продуцировать белковый продукт этого трансгена исключительно или преимущественно в конкретной ткани.
Любой тканеспецифический или тканепредпочтительный промотор может быть применен в настоящем изобретении. Примеры тканеспецифических или тканепредпочтительных промоторов включают, без ограничения: корнепредпочтительный промотор, например, промотор гена фазеолина (Murai et al., Science 23:476-482 (1983) и Sengupta-Gopalan et al., Proc. Natl. Acad. Sci. U.S.A. 82:3320-3324 (1985)); листоспецифический и светоиндуцируемый промотор, например, промотор cab или rubisco (Simpson et al., EMBO J. 4(11):2723-2729 (1985) и Timko et al., Nature 318:579-582 (1985)); специфический для пыльников промотор, например, промотор LAT52 (Twell et al., Mol. Gen. Genetics 217:240-245 (1989)); специфический для пыльцы промотор, например, промотор ZM13 (Guerrero et al., Mol. Gen. Genetics 244:161-168 (1993)), или микроспоропредпочтительный промотор, например, промотор apg (Twell et al., Sex. Plant Reprod. 6:217-224 (1993)).
Транспорт продуцируемого трансгенами белка в субклеточный компартмент, такой как хлоропласт, вакуоль, пероксисома, глиоксисома, клеточная стенка или митохондрия, или для секреции в апопласт, может быть выполнен посредством операбельного связывания нуклеотидной последовательности, кодирующей сигнальную последовательность 5'- и/или 3'-концевой области гена, кодирующего представляющий интерес белок. Нацеливающие на 5'- и/или 3'-конец структурного гена последовательности, в ходе синтеза и процессинга белка, могут определять, например, где может быть окончательно компартментализован кодируемый белок. Альтернативно, такие белки, нацеливающие на субклеточный компартмент, могут быть непосредственно связаны с наночастицей, для направления наночастицы, покрытой представляющей интерес молекулой, в желаемый субклеточный компартмент.
Наличие сигнальной последовательности может направить полипептид либо во внутриклеточную органеллу, либо в субклеточный компартмент, или для секреции в апопласт. Многие сигнальные последовательности являются известными в данной области техники. См., например, Becker et al., Plant Mol. Biol. 20:49 (1992), Close, P.S., Master's Thesis, Iowa State University (1993), Knox, C, et al., Plant Mol. Biol. 9:3-17 (1987), Lerner et al., Plant Physiol. 91:124-129 (1989), Fontes et al., Plant Cell 3:483-496 (1991), Matsuoka et al., Proc. Natl. Acad. Sci. 88:834 (1991), Gould et al., J. Cell. Biol. 108:1657 (1989), Creissen et al., Plant J. 2:129 (1991), Kalderon, et al., Cell 39:499-509 (1984), Steifel, et al., Plant Cell 2:785-793 (1990).
Гены чужеродных белков и агрономические гены
Трансгенные растения, согласно воплощениям настоящего изобретения, могут продуцировать чужеродный белок в коммерческих количествах. Таким образом, методы отбора и размножения трансформированных растений дают множество трансгенных растений, которые собирают общеизвестным способом. Затем чужеродный белок может быть экстрагирован из представляющей интерес ткани или из общей биомассы. Экстракция белка из биомассы растения может быть выполнена известными способами, которые обсуждаются, например, в работе Heney и Orr, Anal. Biochem. 114:92-96 (1981).
В некоторых аспектах изобретения, растительный материал, обеспечивающий коммерческую продукцию чужеродного белка, может быть растением, тканью растения или клеткой растения. Для трансгенных растений, которые демонстрируют более высокие уровни экспрессии, может быть создана генетическая карта, например, посредством традиционных анализов RFLP, PCR и SSR, которая идентифицирует приблизительное расположение хромосом в объединенной молекуле ДНК. В этой связи, см. примеры методологий в Glick и Thompson, Methods in Plant Molecular Biology and Biotechnology, CRC Press, Boca Raton 269:284 (1993). Информация по картированию, касающаяся расположения хромосом, может быть полезна, например, для патентной защиты трансгенного растения, как объекта изобретения, или для оценки биологической безопасности. Если может быть предприняты несанкционированные размножение и скрещивания с другой зародышевой плазмой, эта карта области интеграции может быть сравнена с аналогичными картами для подозреваемых растений, для того чтобы определить, имеется ли у последнего общее происхождение с растением, которое является объектом изобретения. Сравнения карт могут включать гибридизации, RFLP, PCR, SSR и секвенирование, все из которых являются общепринятыми способами.
Аналогично, агрономические гены могут быть экспрессированы в трансформированных клетках или в их потомстве. Более конкретно, растения могут быть генетически сконструированы посредством способов этого изобретения для экспрессии различных фенотипов, представляющих агрономический интерес. Примеры генов, которые могут быть использованы в этом отношении, включают, без ограничения, гены, сгруппированные ниже в отдельные категории.
1. Гены, которые придают устойчивость к вредителям или заболеваниям:
A) Гены устойчивости к патологиям растений. Защита растений часто активируются специфическим взаимодействием между продуктом гена устойчивости к патологии (R) растения и продуктом соответствующего гена авирулентности (Avr) патогена. Сорта растений могут быть трансформированы клонированными генами устойчивости для сконструированных растений, которые являются устойчивыми к специфическим штаммам патогенов. См., например, Jones et al., Science 266:789 (1994) (клонирование гена Cf-9 для устойчивости томата к Cladosporium fulvum); Martin et al., Science 262:1432 (1993) (ген Pto томата, для устойчивости к поражающему томат Pseudomonas syringae, кодирующий протеинкиназу); Mindrinos et al., Cell 78:1089 (1994) (ген RSP2 для устойчивости к Pseudomonas syringae).
B) Ген, придающий устойчивость к вредителю, такому как соевая цистообразующая нематода (Heterodera glycines). См., например, международную публикацию РСТ WO 96/30517; международную публикацию PCT WO 93/19181.
C) Белок Bacillus thuringiensis, его производное или синтетический полипептид, моделирующий его. См., например, Geiser et al., Gene 48:109 (1986) (клонирование и нуклеотидная последовательность гена Bt δ-эндотоксина). Более того, молекулы ДНК, кодирующие гены δ-эндотоксина, могут быть приобретены из American Type Culture Collection (Manassas, Va.), например, под номерами доступа АТСС 40098, 67136, 31995 и 31998.
D) Лектин. См., например, Van Damme et al., Plant Molec. Biol. 24:25 (1994) (нуклеотидные последовательности некоторых генов, связывающего маннозу лектина Clivia miniata.
E) Белок, связывающий витамин, например, авидин. См. международную публикацию РСТ US93/06487 (применение авидина и гомологов авидина в качестве ларвицидов против насекомых-вредителей).
F) Ингибитор фермента, например, ингибитор протеазы или протеиназы, или ингибитор амилазы. См., например, Abe et al., J. Biol. Chem. 262:16793 (1987) (нуклеотидная последовательность ингибитора цистеинпротеиназы), Huub et al., Plant Molec. Biol. 21:985 (1993) (нуклеотидная последовательность кДНК, кодирующая ингибитор I протеиназы табака), Sumitani et al., Biosci. Biotech. Biochem. 57:1243 (1993) (нуклеотидная последовательность ингибитора альфа-амилазы Streptomyces nitrosporeus) и патент США No. 5494813.
G) Специфический для насекомых гормон или феромон, например, экдистероидный или ювенильный гормон, его вариант, миметик на его основе, или его антагонист или агонист. См., например, Hammock et al., Nature 344:458 (1990) (экспрессии бакуловирусом клонированной эстеразы ювенильного гормона, инактиватора ювенильного гормона).
H) Специфический для насекомых пептид или нейропептид, который после экспрессии нарушает физиологию пораженного вредителя. См., например, Regan, J. Biol. Chem. 269:9 (1994) (экспрессионное клонирование дает ДНК, кодирующую рецептор диуретического гормона насекомого), и Pratt et al., Biochem. Biophys. Res. Comm. 163:1243 (1989) (аллостатин может быть идентифицирован в Diploptera puntata). См. также патент США No. 5266317 (гены, кодирующие паралитические нейротоксины, специфические для насекомых).
I) Специфический для насекомых яд, продуцируемый в природе змеей, осой или любым другим организмом. См., например, Pang et al., Gene 116: 165 (1992) (гетерологичная экспрессии в растениях гена, кодирующего насекомотоксичный для скорпиона пептид).
J) Фермент, ответственный за сверхнакопление монотерпена, сесквитерпена, стероида, гидроксамовой кислоты, производного фенилпропаноида или другой небелковой молекулы с инсектицидной активностью.
K) Фермент, участвующий в модификации, включая посттрансляционную модификацию, биологически активной молекулы, например: гликолитический фермент; протеолитический фермент; липолитический фермент; нуклеаза; циклаза; трансаминаза; эстераза; гидролаза; фосфатаза; киназа; фосфорилаза; полимераза; эластаза; хитиназа; или глюканаза, независимо от того, являются ли они природными или синтетическими. См. международную публикацию РСТ WO 93/02197 (нуклеотидная последовательность гена каллазы). Молекулы ДНК, которые содержат кодирующие хитиназу последовательности, могут быть получены, например, из АТСС под номерами доступа 39637 и 67152. См. также Kramer et al., Insect Biochem. Molec. Biol. 23:691 (1993) (нуклеотидная последовательность кДНК, кодирующая хитиназу табачного бражника) и Kawalleck et al., Plant Molec. Biol. 21:673 (1993) (нуклеотидная последовательность гена полиубиквитина ubi-4-2 петрушки).
L) Молекула, которая стимулирует трансдукцию сигнала. См. например, Botella et al., Plant Molec. Biol. 24:757 (1994) (нуклеотидные последовательности для кДНК-клонов кальмодулина фасоли золотистой (Phaseolus aureus)) и Griess et al., Plant Physiol. 104:1467 (1994) (нуклеотидная последовательность кДНК-клона кальмодулина маиса).
M) Пептид с гидрофобным моментом. См. международную публикацию PCT WO 95/16776 (пептидные производные тахиплезина, которые ингибируют патогены грибов растений) и международную публикацию РСТ WO 95/18855 (синтетические антимикробные пептиды, которые придают устойчивость к заболеваниям).
N) Мембранная пермеаза, образователь каналов или блокатор каналов. См., например, Jaynes et al., Plant Sci 89:43 (1993) (гетерологичная экспрессии аналога цекропин-β-литического пептида для придания трансгенным растениям табака устойчивости к Pseudomonas solanacearum).
O) Вирус-инвазивный белок или произведенный из него комплексный токсин. Например, накапливание вирусных белков оболочки в трансформированных клетках растений придает устойчивость к вирусной инфекции и/или к развитию заболевания, вызываемого вирусом, из которого может быть получен ген белка оболочки, а также родственными вирусами. См. Beachy et al., Ann. rev. Phytopathol. 28:451 (1990). Опосредованная белком оболочки устойчивость была придана растениям после трансформации против вируса болезни мозаики люцерны, вируса болезни мозаики огурца, вируса полосатости табака, вируса картофеля Х, вируса картофеля Y, вируса гравировки табака, вируса погремковости табака и вируса мозаики табака. См. там же.
P) Специфическое для насекомых антитело или иммунотоксин, произведенный из него. Так, антитело, нацеленное на критическую метаболическую функцию в кишечнике насекомого, может инактивировать находящийся по его влиянием фермент, приводя насекомое к гибели. Ср. Taylor et al., Abstract #497, Seventh Int'l Symposium on Molecular Plant-Microbe Interactions (Edinburgh, Scotland) (1994) (ферментативная инактивация в трансгенном табаке за счет продуцирования одноцепочечных фрагментов антител).
Q) Вирус-специфическое антитело. См., например, Tavladoraki et al., Nature 366:469 (1993) (трансгенные растения, экспрессирующие гены рекомбинантных антител, защищены от вирусной атаки).
R) Задерживающий развитие белок, продуцируемый в природе патогеном или паразитом. Например, эндо-1,4-D-полигалактуроназы грибов облегчают колонизацию грибов и высвобождение питательных веществ растений солюбилизизацией гомо-α-1,4-D-галактуроназы клеточных стенок растения. См. Lamb et al., Bio/Technology 10:1436 (1992). См. также Toubart et al., Plant J. 2:367 (1992) (клонирование и характеризация гена, который кодирует белок, ингибирующий эндополигалактуроназу бобов).
S) Задерживающий развитие белок, продуцируемый в природе растением. См. например, Logemann et al., Bio/Technology 10:305 (1992) (трансгенные растения, экспрессирующие ген, инактивирующий рибосомы ячменя, имеют увеличенную устойчивость к грибным заболеваниям).
2. Гены, которые придают устойчивость к гербициду:
A) Гербицид, который ингибирует точку роста или меристему, например, имидазолинон или сульфонилмочевина. Примерами генов в этой категории являются гены, которые кодируют мутантный белок ALS и AHAS, как описано, например, Lee et al., EMBO J. 7:1241 (1988), и Miki et al., Theor. Appl. Genet. 80:449 (1990), соответственно.
B) устойчивость к глифосату, придаваемая, например, мутантными генами 5-енолпирувилшикимат-3-фосфатсинтазы (EPSP) (за счет введение рекомбинантных нуклеиновых кислот и/или различных форм мутагенеза нативных генов EPSP in vivo), генами aroA и генами глифосатацетилтрансферазы (GAT), соответственно); другие фосфоновые соединения, такие как глюфосинат (гены фосфинотрицинацетилтрансферазы (РАТ) из Streptomyces species, включая Streptomyces hygroscopicus и Streptomyces viridichromogenes), и пиридинокси- или фенокси-пропионовые кислоты и циклогексоны (гены, кодирующие ингибиторы ACC-азы). См., например, патент США No. 4940835 и патент США No. 6248876 (нуклеотидные последовательности форм EPSP, которые могут придавать растению устойчивость к глифосату). Молекула ДНК, кодирующая мутантный ген aroA, может быть получена под номером доступа АТСС 39256. См. также патент США No. 4769061 (нуклеотидная последовательность мутантного гена aroA). Европейская заявка на патент No. 0333033 и патент США No. 4975374 раскрывают нуклеотидные последовательности генов глутаминсинтетазы, которые могут придавать устойчивость к гербицидам, таким как L-фосфинотрицин. Нуклеотидная последовательность иллюстративных генов PAT предоставлена в европейской заявке No. 0242246 и в работе DeGreef et al., Bio/Technology 7:61 (1989) (получение трансгенных растений, которые экспрессируют химерные гены bar, кодирующие активность РАТ). Примеры генов, придающих устойчивость к феноксипропионовым кислотам и циклогексонам, таким как сетоксидим и галоксифоп, включают гены Acc1-S1, Acc1-S2 и Acc1-S3, описанные Marshall et al., Theor. Appl. Genet. 83:435 (1992). Гены GAT, способные придавать устойчивость к глифосату, описаны, например, в WO 2005012515. Гены, придающие устойчивость к 2,4-D, фопу и пиридилоксиауксиновым гербицидам, описаны, например, в WO 2005107437.
C) Гербицид, который ингибирует фотосинтез, такой как триазин (гены psbA и гены gs+) или бензонитрил (ген нитрилазы). См., например, Przibila et al., Plant Cell 3:169 (1991) (трансформация Chlamydomonas плазмидами, кодирующими мутантные гены psbA). Нуклеотидные последовательности для генов нитрилазы раскрыты в патенте США No. 4810648, а молекулы ДНК, содержащие эти гены, доступны под номерами доступа АТСС 53435, 67441 и 67442. См. также Hayes et al., Biochem. J. 285: 173 (1992) (клонирование и экспрессия ДНК, кодирующей глутатион-S-трансферазу).
3. Гены, которые придают или вносят вклад в признак добавленной ценности, такой как:
A) Модифицированный метаболизм жирных кислот, например, путем трансформации растения антисмысловым геном стеарил-ACP-десатуразы для увеличения содержания стеариновой кислоты в этом растении. См. Knultzon et al., Proc. Natl. Acad. Sci. U.S.A. 89:2624 (1992).
B) Уменьшенное содержание фитата. Введение гена, кодирующего фитазу, может усилить разрушение фитата, добавляя тем самым дополнительный свободный фосфат трансформированному растению. См. например, Van Hartingsveldt et al., Gene 127:87 (1993) (нуклеотидная последовательность гена фитазы Aspergillus niger). Возможно введение гена для уменьшения содержания фитата. Например, в маисе это может быть выполнено клонированием с последующим повторным введением ДНК, ассоциированной с единственным аллелем, который может быть ответственным за мутанты маиса, которые характеризуются низкими уровнями фитиновой кислоты. См. Raboy et al., Maydica 35:383 (1990).
C) Модифицированный состав углеводов, производимый, например, трансформацией растений геном, кодирующим фермент, который изменяет характер ветвления крахмала. См. Shiroza et al., J. Bacteol. 170:810 (1988) (нуклеотидная последовательность гена фруктозилтрансферазы мутантов Streptococcus), Steinmetz et al., Mol. Gen. Genet. 20:220 (1985) (ген левансахаразы), Pen et al., Bio/Technology 10:292 (1992) (α-амилаза), Elliot et al., Plant Molec. Biol. 21:515 (1993) (нуклеотидные последовательности генов инвертазы томата), Sogaard et al., J. Biol. Chem. 268:22480 (1993) (ген β-амилазы ячменя) и Fisher et al., Plant Physiol. 102:1045 (1993) (фермент II ветвления крахмала эндосперма маиса).
C. Наночастицы
Согласно некоторым воплощениям, изобретение предоставляет способы введения представляющей интерес линейной молекулы нуклеиновой кислоты в клетку, включающую клеточную стенку (например, клетку растения). В некоторых воплощениях способ может включать размещение наночастицы, покрытой представляющей интерес линейной молекулой нуклеиновой кислоты, в контакте с клеткой, и предоставления возможности поглощения наночастицы через клеточную стенку. В конкретных воплощениях наночастица может быть обратимо или необратимо содержать, быть покрытой, или иным образом связанной с и/или нести представляющую интерес линейную молекулу нуклеиновой кислоты. В некоторых воплощениях представляющая интерес линейная молекула нуклеиновой кислоты может быть введена в наночастицы перед контактом с клеткой растения, имеющей клеточную стенку, или одновременно, с введением наночастицы в клетку растения, имеющей клеточную стенку. Примеры наночастиц, которые могут использоваться в воплощениях настоящего изобретения, включают без ограничения, квантовые точки, отдельно или в комбинации с полупроводниковыми наночастицами; положительно заряженные наночастицы; наночастицы золота; покрытые золотом наночастицы, пористые наночастицы, мезопористые наночастицы, наночастицы диоксида кремния, полимерные наночастицы, включая дендримеры, вольфрамовые наночастицы, желатиновые наночастицы, нанооболочки, наноядра, наносферы, наностержни и магнитные наночастицы.
Согласно воплощениям настоящего изобретения, клетка растения, имеющая клеточную стенку, может быть любой клеткой растения, включающей интактную и целую клеточную стенку. Примеры клеток, имеющих клеточную стенку, включают, без ограничения, водоросли, табак, морковь, маис, канолу, рапс, хлопчатник, пальму, арахис, сою, сахарный тростник, Oryza sp., Arabidopsis sp. и Ricinus sp.
Воплощения изобретения могут включать клетки, имеющие клеточную стенку, из любой ткани или из любого места, где они могут быть найдены, включая без ограничения: в зародышах, меристематических клетках, каллусе, пыльце, включая гаплоидные и диплоидные микроспоры, листьях, пыльниках, корнях, кончиках корней, цветках, семенах, стручках, стеблях и тканевой культуре.
В воплощениях изобретения представляющая интерес линейная молекула нуклеиновой кислоты может быть любой молекулой нуклеиновой кислоты, которую можно доставить согласно настоящему изобретению в клетку растения, имеющую клеточную стенку.
Представляющие интерес молекулы нуклеиновой кислоты могут включать, без ограничения: ДНК; РНК; молекулы RNAi; гены; плазмиды; космиды; YAC (искусственной хромосомы грибов) и BAC (искусственной хромосомы бактерий). Представляющие интерес молекулы нуклеиновой кислоты могут быть введены в клетку растения, имеющую клеточную стенку совместно с, например, но без ограничения, полипептидами, ферментами, гормонами, гликопептидами, сахарами, жирами, сигнальными пептидами, антителами, витаминами, мессенджерами, вторичными мессенджерами, аминокислотами, цАМФ, лекарственными веществами, гербицидами, фунгицидами, антибиотиками и/или с их комбинациями.
В конкретных воплощениях изобретения поверхность наночастицы может быть функционализирована, что может, например, обеспечивать нацеленное поглощение или допускать обратимое или необратимое связывание других веществ с поверхностью наночастицы. В качестве неограничивающего примера, поверхность наночастицы (например, квантовой точки) может быть функционализована самособирающимся монослоем, например, алкантиолатами, которые могут быть дополнительно функционализированы или дериватизированы. В дополнительном неограничивающем примере поверхность наночастицы может быть дериватизирована линкерами, которые сами затем могут быть дополнительно функционализированы или дериватизированы. В одном воплощении наночастица может быть ПЭГилирована. В другом воплощении наночастица может содержать или может быть мультифункционализирована одним или несколькими ядрами (активными или неактивными), стерическим (пространственным) покрытием (активным или инертным), расщепляемой связью и/или нацеливающими молекулой или лигандом.
Наночастицы, такие как квантовые точки, могут быть функционализированы ПЭГом, используя протокол Dubertret et al., Science 298:1759 (2002), или в соответствии с этим протоколом, измененным по усмотрению квалифицированного специалиста. Например, квантовые точки CdSe/ZnS, покрытые TOPO (три-октилфосфиноксид) могут быть суспендированы в хлороформе с PEG-PE, с последующим испарением растворителя и солюбилизацией с водой получаемых ПЭГилированных квантовых точек.
В аспектах изобретения наночастица может поглощаться в различные части клеток. Примеры местоположений, в которые может поглощаться наночастица, включают, без ограничения, цитозоль, ядро, тонопласты, пластиды, этиопласты, хромопласты, лейкопласты, элайопласты, протеинопласты, амилопласты, хлоропласты и просвет двойной мембраны. В других воплощениях, поглощение наночастицы в клетку, содержащую клеточную стенку, может осуществляться посредством симпластного или апопластного пути.
D. Стабильно трансформированные клетки растения
Стабильно трансформированная клетка растения по изобретению может быть любой клеткой растения, способной к тому, чтобы быть трансформированной представляющей интерес линейной молекулой нуклеиновой кислоты, путем трансформации, опосредованной наночастицами. Соответственно, клетка растения может быть выделена или культивирована из двудольного или однодольного растения. Клетка растения может также быть представлена в ткани растения или в целом растении. Неограничивающие примеры стабильно трансформированных клеток двудольных растений по изобретению включают клетки: люцерны; бобов; брокколи; капусты; моркови; цветной капусты; сельдерея; китайской капусты; хлопчатника; огурца; баклажана; салата; дыни; гороха; перца; арахиса; картофеля; тыквы; редиса/редьки; рапса; шпината; сои; тыквы; сахарной свеклы; подсолнечника; табака; томата и арбуза. Неограничивающие примеры стабильно трансформированных клеток однодольных растений по изобретению включают клетки зерновых, лука, риса, сорго обыкновенного, пшеницы, ржи, проса, сахарного тростника, овса, тритикале, проса прутьевидного и газонной травы.
Трансгенные растения согласно изобретению могут быть регенерированы из стабильно трансформированных клеток растения, полученных способами по изобретению. Такие растения могут использоваться или выращиваться любым способом, в котором желательно присутствие представляющих интерес молекул нуклеиновой кислоты. Соответственно, трансгенные растения inter alia могут быть получены методами генной инженерии, для того чтобы иметь один или несколько желаемых генетических признаков, будучи трансформированными линейными молекулами нуклеиновой кислоты посредством опосредованной наночастицами трансформации, с посадкой и культивацией любым способом, известным специалисту в данной области техники.
Следующие примеры предоставлены для иллюстрации отдельных специфических признаков и/или воплощений. Примеры не должны рассматриваться как ограничивающие настоящее изобретение частными признаками и иллюстративными воплощениями.
ПРИМЕРЫ
Пример 1: Получение наночастиц для трансформации клетки растения
Получение плазмидной ДНК
ДНК плазмиды pDAB3831, Фиг. 1, была выделена и подготовлена для трансформации растения, опосредованной линейной ПЭГилированной квантовой точкой(PQD)/ДНК. Эта плазмида содержит селектируемый ген маркера PAT, который запускается промотором 10 Arabidopsis Ubiquitin (AtUbi10), и ген желтого флуоресцентного белка Philadium (JPhiYFP), который запускается промотором вируса прожилковой мозаики маниоки (CsVMV). Штамм Escherichia coli, содержащий плазмиду, был инокулирован и выращен до появления мутности в бульоне Luria-Bertani, содержащем ампициллин при 37°C. ДНК была выделена с использованием набора Qiagen Plasmid Midi-Prep kit (Qiagen, Valencia, CA). Выделенная ДНК линеаризовалась посредством расщепления ферментом рестрикции. Для расщепления ДНК использовался фермент рестрикции KpnI, получая, таким образом линеаризованную плазмидную ДНК.
Получение линейных ДНК-PQD комплексов
Квантовые точки были получены из Ocean Nanotechnology (Springdale, AZ). Квантовые точки CdSe/ZnS, покрытые 2 мг TOPO (триоктилфосфиноксид), были суспендированы в хлороформе с 0,15 мг (5,5 мкмМ) PEG-PE (1,2-диацил-sn-глицеро-3-фосфоэтаноламин-N-[метокси-поли(этиленгликоль)]) (Avanti Polar Lipids, Alabaster, AL), с последующим испарением растворителя и солюбилизации с водой. Конъюгирование с ПЭГ было выполнено для защиты от цитотоксичности.
PQD были конъюгированы с линейной плазмидной ДНК. 2 мг PQD с 4 мг HS-PEG-OCH3 (Prochimia, Zacisze, Польша) были суспендированы в течение ночи при приблизительно 60-70°C. Растворитель был удален в вакуумной печи. Затем остаток был суспендирован в 1 мл воды (18M). Последняя стадия сопровождалась переходом осадка красного цвета в оранжевый, оптически прозрачный чистый раствор. Для покрытия H3CO-PEG-SH-QD линеаризованной плазмидной ДНК для экспериментов по трансформации, 0,02 мг очищенной линеаризонной плазмидной ДНК (pDAB3831) инкубировали с полученными конъюгатами PQD в 2 мл воды в течение 2 часов при 23°C в темноте. Torney, et al., Nature Nanotechnol. 2:295-300 (2007).
Пример 2: Трансформация цветочных зародышей Arabidopsis
Для генетической трансформации in planta, плазмида pDAB3831 была расщеплена ферментом рестрикции KpnI, для линеаризации ДНК. После расщепления ферментом рестрикции, линеаризовавшая ДНК использовалась при определенном соотношении ПЭГ, QD и линейной ДНК.
Линеаризованная ДНК была смешана с квантовыми точками и ПЭГ, и инкубировалась в течение 30 минут. Затем, нанокомплекс, состоящий из наночастиц и раствора линеаризованной плазмидной ДНК, был смешан с рабочим раствором, содержащим 5%-ный раствор сахарозы в воде с 0,02-0,04% Silwet-L77.
Растительный материал для трансформации in planta
Синхронизированное прорастание семени является важным для гарантии однородности развития цветков на растениях T0. Семена A. thaliana cv. Columbia были суспендированы в растворе агара 0,1% (масс./об.) и инкубировали при 4°C в течение 48 часов, до полной стратификации. Были отвешены 60 мг семян и перенесены в пробирку на 15 мл. Для равномерного распределения семян в пробирку добавляли 13 мл 0,1% (масс./об.) раствора агара, и ее подвергали перемешиванию вращением. Это привело к суспензии с концентрацией семян из расчета 4,6 мг на 1 мл 0,1% (масс./об.) раствора агара (или приблизительно 230 семян/мл). Были подготовлены 6 пробирок (72 мл суспензии) для посева в 4 поддонах, размещающих 18 чашек (3 1/2 дюйма) в каждом поддоне. Суспензию семян инкубировали в течение 48 часов при 4°C для завершения стратификации. В каждую чашку индивидуально засевали 1,0 мл суспензии стратифицированных семян на одну чашку. После засева всех чашек, поддоны были закрыты куполами для поддержания почвы в увлажненном состоянии при росте растений. Купола были удалены спустя 5 дней после даты посева. После прорастания семян и появления растений, они были помещены для роста в камеру Conviron® (модели CMP4030 и CMP3244, Controlled Environments Limited, Winnipeg, Manitoba, Canada) на режим длинного дня (16 часов освещения/8 часов темноты), при интенсивности света 120-150 мкмМоль/м2·сек (по эквиваленту световой энергии, поглощенной растением), при постоянной температуре (22°C) и влажности (40-50%). Через 10-14 дней после посева растений их подвергали орошению раствором Hoagland's и затем DI водой, для того чтобы держать почву увлажненной, но не мокрой. Через 4 недели после даты посева растений у них были срезаны цветки для интенсификации роста вторичных цветков. Растения были готовы к процессу трансформации на 5-й неделе после посева.
Трансформации in planta
Трансформация A. thaliana cv. Columbia при помощи линейной ДНК/PQD была выполнена с использованием модифицированного протокола Clough-Bent. См., Clough and Bent, Plant J. 16:735-43 (1998). Было приготовлено 20 мл суспензии комплекса линейной ДНК/PQD при концентрации 0,5 мг линейной ДНК и 4 нМ PQD, которая использовалась для обработки растений Arabidopsis (главным образом незрелые соцветия, включающие небольшое количество оплодотворенных стручков). Перед погружением растений, к суспензии комплекса линейной ДНК/PQD был добавлен Silwet L-77 до концентрации 0,05% (масс./об.) (250 мкл/500 мл) - 0,005%, и раствор был хорошо перемешан. Надземные части растения были погружены на 30 секунд в раствор линейной ДНК/PQD с аккуратным перемешиванием. Обработанные растения были поставлены в исходное состояние в тень на 30 минут при 22-24°C. Растения были размещены в камеру Conviron в условия, как описано выше, для предоставления возможности созревания и сбора семян.
Для скринирования общего урожая семян от растений T0 использовались лотки для селекции размером 10,5×21×1 дюймов, из расчета приблизительно 10000 семян на лоток.
Для гарантии того, что опрыскивание при селекции выполнено корректно, использовали две группы контроля: растения Col-0 в качестве отрицательного контроля трансформанта, и растения Columbia Col-0 дикого типа, обогащенные гомозиготными семенами для селектируемого маркера PAT (фосфинотрицин-N-ацетилтрансферазы), в качестве положительного контроля трансформанта. Семена, с целью синхронизации, были стратифицированы в растворе агара с концентрацией 0,1% (масс./об.) в течение 48 часов до посева. Для обеспечения плотности посева 10000 семян на лоток для селекции, к раствору агара с концентрацией 0,1% (масс./об.) было добавлено 200 мг семян, и раствор был подвергнут перемешиванию вращением до тех пор, пока семена не были равномерно суспендированы. Затем, стратифицированные семена высевали на лотках для селекции, которые были заполнены почвенной смесью Sunshine LP5 и получали для увлажнения раствор Hoagland's путем подачи раствора снизу. Для эффективного опрыскивания при селекции растений важно, чтобы 40 мл суспендированных семян были равномерно высеяны в лоток для селекции. После посева, каждый лоток для селекции был закрыт куполом, и растения выращивались для селекции. Купола были удалены приблизительно через 5 дней после посева.
Пример 3: Анализ трансформированного Arabidopsis
Селекция трансформированных растений
Свежесобранным семенам T1 давали возможность высохнуть в течение 7 дней при комнатной температуре. Семена T1 высевали в лотки размером 26,5×51 см для прорастания, при этом в каждый высевалась аликвота 200 мг стратифицированных семян T1 (приблизительно 10000 семян), которые были ранее суспендированы в 40 мл 0,1% (масс./об.) раствора агара, и хранились при 4°C в течение 2 дней, из-за требований завершения периода покоя и для гарантии синхронного прорастания семян.
Грунтовая смесь Sunshine LP5 была покрыта чистым вермикулитом и подверглась увлажнению раствором Hoagland's путем подачи раствора снизу с последующим удалением избытка влаги за счет силы тяжести. Каждая аликвота стратифицированных семян объемом 40 мл равномерно наносилась пипеткой на вермикулит и закрывалась куполами для сохранения влажности в течение 4-5 дней. Купола были удалены за 1 день до первичной селекции трансформантов с использованием опрыскивания глюфосатом в послевсходовый период.
Спустя семь дней после посадки (DAP) (от семядоли и стадии 2-4 листов, соответственно) растения T1 последовательно опрыскивали пять раз в течение пяти дней 0,2%-ным раствором (масс./об.) гербицида Liberty (200 г глюфосината по активному веществу на 1 л, Bayer Crop Sciences, Kansas City, MO) при объеме опрыскивания 10 мл на лоток (703 л/га) с использованием наконечника DeVilbiss для распыления сжатым воздухом, чтобы обеспечить доставку эффективного количества глюфосината при норме 280 г/га глюфосината по активному веществу на одно опрыскивание. Выжившие растения (активно растущие растения), были идентифицированы через 4-7 дней после заключительного опрыскивания и пересажены в индивидуальные 3-дюймовые горшки с питательной средой для роста в горшках (Metro Mix 360). Пересаженные растения были покрыты куполами для сохранения влажности на 3-4 дня, и они были помещены для роста в камеру при 22°C, как и до того, или были перенесены непосредственно в теплицу. Впоследствии купола были сняты, и растения были размещены в теплице (22±5°C; относительная влажность 50±30%; световой режим: 14 часов освещения/10 часов темноты; освещенность (естественный + дополнительный свет) по эквиваленту поглощенной растением световой энергии - 500 мкмМоль/м2·сек).
Молекулярные и биохимические исследования
Были выполнены молекулярные анализы по интеграции PAT и YFP в геном растения. Продукты амплификации ПЦР были секвенированы и сравнены с трансгенными последовательностями.
Молекулярный анализ и доказательство геномной интеграции трансгенов в потомство T1 Arabidopsis thaliana (cv Columbia)
Геномная ДНК из трансгенных растений A. thaliana была извлечена из материала листа 6-недельных растений с использованием набора Plant DNAZOL™ (Invitrogen) согласно инструкциям изготовителя. Для обнаружения трансгенов PAT и YFP были сконструированы праймеры для ПЦР.
Примеры YFP представлены как SEQ ID NO: 1 и SEQ ID NO: 2. Праймеры PAT представлены как SEQ ID NO: 3 и SEQ ID NO: 4.
ПЦР амплификация геномной ДНК трансгенов
Реакции амплификации ПЦР для PAT и YFP были выполнены с использованием набора TaKaRa ExTaq™ (Takara, Otsu, Shiga, Japan). Генные продукты были амплифицированы в полном объеме реакции, составляющем 50 мкл. Реакция ПЦР содержала 100 нанограммов геномной матрицы ДНК, реакционный буферов 1 X ExTaq, 0,2 мМ dNTP, 10 пМ каждого примера и 0,025 Ед./мкл ExTaq. Использовались следующие условия ПЦР: 1 цикл при 96°C в течение 5 минут, и 31 цикл при следующих условиях: 94°C в течение 15 секунд, 65°C в течение 30 секунд, 72°C в течение 1 минуты и заключительная амплификация при 72°C в течение 7 минут. Продукт амплификации ПЦР был проанализирован электрофорезом на 0,8% геле агарозы и был визуализирован окрашиванием бромистым этидием. Фрагменты ДНК были выделены из геля агарозы, используя набор для очистки из геля QIAEX™ II (Qiagen, Valencia, CA).
Фрагменты из ПЦР были секвенированы, используя прямой праймер для PAT (SEQ ID NO: 3) и обратный праймер для YFP (SEQ ID NO: 1), с использованием улучшенной методики секвенирования по Sanger (MWG Biotech., Huntsville, AL). Данные по последовательностям были проанализированы с использованием программного обеспечения Sequencher.
Результаты секвенирования ампликонов PAT и YFP из ПЦР соответствовали ожидаемой нуклеотидной последовательности для этих генов. Эти результаты ясно показывают, что последовательности PAT и YFP из pDAB3831 были стабильно интегрированы в геномную ДНК Arabidopsis при использовании протокола трансформации ПЭГилированной квантовой точкой и линейной ДНК.
Генные продукты для PAT и YFP (желтая флуоресцентная метка, Evrogen) из ПЦР были амплифицированы в общем объеме реакции 50 мкл смеси, содержащей 100 нанограммов матричной геномной ДНК, реакционный буфер 1Х ExTaq (TaKaRa Bio), 0,2 мМ dNTP, 10 пМ праймера и 0,025 Ед./мкл ExTaq. Использовались следующие условия ПЦР: 1 цикл при 96°C в течение 5 минут и 31 цикл по следующей программе ПЦР: 94°C, 15 секунд; 65°C, 30 секунд; 72°C, 1 мин. Заключительная амплификация была выполнена при 72°C в течение 7 минут, для полного синтеза продукта ПЦР. Изображения геля были получены с использованием системы визуализации BioRad Gel Imagining System. См. Фиг. 1 и 2. Амплифицированные фрагменты были выделены из геля, используя набор для очистки из геля (Qiagen, Valencia, CA) согласно инструкциям изготовителя.
Фрагменты из ПЦР были секвенированы, используя прямой праймер для PAT и прямой праймер для YFP, с использованием улучшенной методики секвенирования по Sanger (MWG Biotechnologies, Inc.), а последовательности были проанализированы с использованием программного обеспечения Sequencher.
Настоящие результаты ясно показывают, что последовательности PAT и YFP были доставлены посредством положительно заряженной наночастицей, содержащей линеаризовавшую ДНК, полученную в Примере 1, и таким образом обеспечивают доказательство стабильной интеграции трансгенов в геномную ДНК растений T1 Arapidopsis.
Пример 4: Опосредованная наночастицами доставка линейных молекул нуклеиновой кислоты в культивируемые клетки растения
Подготовка растительного материала в виде единичной клетки
Например, используются как клетки BY2, так и клетки NT1. Клетки BY2 не имеют зеленого цвета и представляют собой быстрорастущую линию клеток табака. Клетки NT1 представляют собой фотоавтотрофные клетки, выделенные из табака. За три - четыре дня до трансформации, однонедельную суспензионную культуру субкультивировали в свежей среде путем переноса 2 мл культуры NT1 или BY2 в 40 мл среды NTIB или LSBY2, содержащей 50 нМ DAS-PMTI-1 (ингибитор микроканальцев) и 0,5-0,1% (об./об.) диметилсульфоксида, в колбу на 250 мл. Единичные клетки были собраны или через четыре дня или через семь дней после обработки ингибитором микроканальцев. Используемые единичные клетки BY2 были проанализированы с помощью проточного цитометра Beckman Flow для подсчета жизнеспособных клеток. Клетки исследованы с использованием микроскопа дифференциально-интерференционного контраста (DIC), снабженного конфокальной системой отображения, для установления того, что единичные клетки включают большие количества пластид (амилопластов), распределенных по всей цитоплазме клеток. Клетки субкультивировали один раз в 14 дней, путем переноса 1 мл суспензии с 3,0 Ед. оптической плотности при OD600. Культивируемые клетки используются как целевые клетки для трансформации.
Препарат наночастиц и обработка клеток
Плазмидная ДНК выделена и подготовлена для трансформации растения, опосредованной линейной ПЭГилированной квантовой точкой(PQD)/ДНК. Плазмида содержит ген селектируемого маркера PAT, который запускается промотором 10 Arabidopsis Ubiquitin (AtUbi10), и ген желтого флуоресцентного белка Philadium (JPhiYFP), который запускается промотором вируса прожилковой мозаики маниоки (CsVMV). Штамм Escherichia coli, содержащий плазмиду, был инокулирован и выращен до появления мутности в бульоне Luria-Bertani, содержащем ампициллин при 37°C. ДНК была выделена с использованием набора Qiagen Plasmid Midi-Prep kit (Qiagen, Valencia, CA). Выделенная ДНК линеаризовалась посредством расщепления ферментом рестрикции. Для расщепления ДНК использовался фермент рестрикции KpnI, получая, таким образом линеаризованную плазмидную ДНК.
Квантовые точки были получены из Ocean Nanotechnology (Springdale, AZ). Квантовые точки CdSe/ZnS, покрытые 2 мг TOPO (триоктилфосфиноксид), были суспендированы в хлороформе с 0,15 мг (5,5 мкмМ) PEG-PE (1,2-диацил-sn-глицеро-3-фосфоэтаноламин-N-[метокси-поли(этиленгликоль)]) (Avanti Polar Lipids, Alabaster, AL), с последующим испарением растворителя и солюбилизации с водой. Конъюгирование с ПЭГ было выполнено для защиты от цитотоксичности.
PQD были конъюгированы с линейной плазмидной ДНК. 2 мг PQD с 4 мг HS-PEG-OCH3 (Prochimia, Zacisze, Польша) были суспендированы в течение ночи при приблизительно 60-70°C. Растворитель был удален в вакуумной печи. Затем остаток был суспендирован в 1 мл воды (18M). Последняя стадия сопровождалась переходом осадка красного цвета в оранжевый, оптически прозрачный чистый раствор. Для покрытия H3CO-PEG-SH-QD линеаризованной плазмидной ДНК для экспериментов по трансформации, 0,02 мг очищенной линеаризонной плазмидной ДНК (pDAB3831) инкубировали с полученными конъюгатами PQD в 2 мл воды в течение 2 часов при 23°C в темноте. Torney, et al., Nature Nanotechnol. 2:295-300 (2007).
PQD при концентрации 1-3 мкл/мл были добавлены в 24-луночный микротитровальный планшет к 500 мкл клеток, и планшет подвергали осторожному вращению в шейкере в течение 20 минут в темноте. Наночастицы прошли через клеточные стенки.
Пример 5: Трансформация Arabidopsis, опосредованная мультифункционализированной наночастицей in planta
Трансформация Arabidopsis in planta может быть выполнена с использованием модифицированного протокола Clough-Bent (1998). Концентрация ДНК на мультифункционализированной наночастице вместе с молекулами хоуминга, такими как домен белковой трансдукции (PTD) и единицами сигнала ядерной локализации (NLS), оптимизирована, для того чтобы достичь повышенной эффективности трансформации.
Растительный материал: Здоровые растения Arabidopsis выращены в режиме продолжительного дня в горшках с почвой до цветения. Первые стрелки были подрезаны для стимуляции пролиферации множества вторичных стрелок. Растения были готовы спустя примерно 4-6 дней после подрезки. Arabidopsis thaliana экотипа Columbia (Col-0) использовались как базовый фон (растение T0) для трансформации цветков in planta. Синхронизированное прорастание семян является важным, для того чтобы гарантировать однородность развития цветков на растениях T0. Семена дикого типа суспендировали в 0,1% растворе агара и инкубировали при 4°C в течение 48 часов для завершения стратификации. 60 мг семян взвешивали на бумаге и переносили в пробирки на 15 мл. Добавляли 13 мл 0,1%-ного раствора агара и пробирки подвергали перемешиванию вращением, до тех пор, пока семена не были равномерно диспергированы. Это привело к суспензии с концентрацией семян из расчета 4,6 мг на 1 мл раствора (или приблизительно 230 семян/мл). Были подготовлены 6 пробирок (72 мл суспензии) для посева в 4 поддонах, размещающих 18 чашек (3 1/2 дюйма) в каждом поддоне, и в 2 общих чашках. Суспензию семян инкубировали в течение 48 часов при 4°C для завершения стратификации. В каждую чашку индивидуально засевали 1,0 мл суспензии стратифицированных семян на одну чашку. После засева всех чашек, поддоны были закрыты куполами для поддержания почвы в увлажненном состоянии при росте растений. Купола были удалены спустя 5 дней после даты посева. После прорастания семян и появления растений, они были помещены для роста в камеру Conviron® (модели CMP4030 и CMP3244, Controlled Environments Limited, Winnipeg, Manitoba, Canada) на режим длинного дня (16 часов освещения/8 часов темноты), при интенсивности света 120-150 мкмМоль/м2·сек (по эквиваленту световой энергии, поглощенной растением), при постоянной температуре (22°C) и влажности (40-50%). Через 10 - 14 дней после посева растений их подвергали орошению раствором Hoagland's и затем DI водой, для того чтобы держать почву увлажненной, но не мокрой. Через 4 недели после даты посева растений у них были срезаны цветки для интенсификации роста вторичных цветков. Растения были готовы к процессу трансформации на 5-й неделе после посева.
Подготовка наноконъюгатов для обработки цветков: Наночастицы/квантовые точки в диапазоне размеров 2 - 120 нм были выбраны для обработки, и мультифункционализированы фрагментом очищенной pDAB3138 и единицами пептида для хоуминга согласно Derufus et al. (2007).
Квантовые точки с максимумами эмиссии при 655 или 705 нм, и модифицированные при помощи ПЭГ с аминогруппами, были получены из Quantum Dot Corporation (ITK amino). Концентрации QD измеряли по оптическому поглощению при 595 нм, используя коэффициенты экстинкции, предоставленные поставщиком. Использованные кросс-линкеры представляли собой сульфо-LC-SPDP (сульфосукцинимидил 6-(3'-[2-пиридилдитио]-пропионамидо)гексаноат) (Pierce) и сульфо-SMCC (сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат) (Sigma). Модифицированные амином QD конъюгировали с тиол-содержащей плазмидной ДНК и пептидами хоуминга, используя сульфо-LC-SPDP и сульфо-SMCC в качестве кросс-линкеров. QD ресуспендировали в растворе 50 мМ фосфата натрия, 150 нМ хлористого натрия, pH 7,2, используя фильтры Amicon Ultra-4 (с отсечкой 100 кДа). К QD добавляли кросс-линкер (1000-кратный избыток) с предоставлением возможности реагировать в течение 1 часа. Образцы отфильтровывали на колонке NAP-5 под действием силы тяжести (для удаления избытка кросс-линкера) в аналогичный буфер, дополненный 10 мМ EDTA. Линеаризованную плазмидую ДНК pDAB3831 обрабатывали 0,1М DTT в течение 1 часа и отфильтровывали на колонке NAP-5 в EDTA-содержащий буфер. Как правило, использовали пептиды в форме лиофилизированного порошка. Пептиды и линеаризованная плазмидная ДНК были добавлены к отфильтрованным QD с предоставлением возможности реагировать в течение ночи при 4°C. Используя три фильтра Amicon, продукт был отфильтрован фосфатно-физиологическим раствором по Dulbecco (PBS), дважды с высокосолевым буфером (1,0М хлористого натрия, 100 мМ цитрат натрия, pH 7,2), и снова дважды с PBS. Отмывка с высокосолевым буфером необходима для удаления электростатически связанных ДНК и пептидов, которые не удалены отмывкой только одним PBS. Сульфо-SMCC имеет на одном конце N-гидроксисукцинимидный эфир (NHS), который реагирует с модифицированными амином QD, с образованием амидной связи, и малеимидной группы на другом конце, которая реагирует с тиолированной плазмидной ДНК, с образованием тиоэфира. Сульфо-LC-SPDP также содержит амино-реактивный N-гидроксисукцинимидный эфир (NHS), который быстро реагирует с любой молекулой, содержащей первичной амин, образуя, таким образом, устойчивую амидную связь.
Трансформация in planta и скринирование устойчивых растений T1: Была получена суспензия с итоговым объемом 250-500 мл, содержащая наночастицы, пептиды хоуминга и раствор конъюгата плазмидной ДНК (NHpD), и растения Arabidopsis (главным образом незрелые цветочные группы с некоторым количеством оплодотворенных стручков) использовали для дальнейшей обработки. До погружения растений, к раствору конъюгатов NHpD был добавлен Silwet L-77 до концентрации 0,05% (250 мкл/500 мл) - 0,005%, и раствор был хорошо перемешан. Надземные части растения были погружены в раствор конъюгатов NHpD на 2-30 секунд с аккуратным перемешиванием. Обработанные растения держали под куполом или покрытием в течение 16-24 часов при 22-24°C. Растения были перенесены в камеру Conviron для предоставления возможности роста растений до созревания и сбора семян. Для скринирования общего урожая семян от растений T0 использовались лотки для селекции (размером 10,5×21×1 дюймов), содержащие приблизительно 10000 семян на лоток. Для гарантии того, что опрыскивание при селекции выполнено корректно, использовали две группы контроля: растения Col-0 в качестве отрицательного контроля трансформанта, и растения Columbia Col-0 дикого типа, обогащенные гомозиготными семенами для селектируемого маркера PAT (фосфинотрицин-N-ацетилтрансферазы), в качестве положительного контроля трансформанта. Семена, с целью синхронизации, были стратифицированы в растворе агара с концентрацией 0,1% (масс./об.) в течение 48 часов до посева. Для обеспечения плотности посева 10000 семян на лоток для селекции, к раствору агара с концентрацией 0,1% (масс./об.) было добавлено 200 мг семян, и раствор был подвергнут перемешиванию вращением до тех пор, пока семена не были равномерно суспендированы. Затем, стратифицированные семена высевали на лотках для селекции, которые были заполнены почвенной смесью Sunshine LP5 и получали для увлажнения раствор Hoagland's путем подачи раствора снизу. Для эффективного опрыскивания при селекции растений важно, чтобы 40 мл суспендированных семян были равномерно высеяны в лоток для селекции. После посева, каждый лоток для селекции был закрыт куполом, и растения выращивались для селекции в условиях, указанных выше. Купола были удалены приблизительно через 5 дней после посева.
Рассаду подвергали опрыскиванию через пять дней после посадки и еще раз через десять дней после посадки, путем опрыскивания ростков 0,2%-ным (масс./об.) раствором (20 мкл/10 мл dH2O) глюфосината аммония (гербицид Liberty® от Bayer Crop Sciences), при объеме опрыскивания 10 мл на лоток (703 л/га), с использованием наконечника DeVilbiss для распыления сжатым воздухом, чтобы обеспечить доставку эффективного количества глюфосината при норме 280 г глюфосината на гектар на одно опрыскивание (GPA). Количество гербицида Liberty® для приготовления рассчитывалось следующим образом: (703 л по распыляемому объему на гектар=280 GPA). (280 г (по кислоте) на гектар)×(1 га/703 л)×(1 л/200 г глюфосината (по кислоте)=0,20%-ный раствор (или 20 мкл/10 мл). 10 мл раствора для каждого лотка, который подвергается опрыскиванию, переносили пипеткой в сцинцилляционный флакон на 20 мл. Опрыскивание выполняли с использованием горизонтального и вертикального перемещения. Растения, устойчивые к гербициду, были идентифицированы через четыре - семь дней после второго опрыскивания.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУЧЕНИЕ ФУНКЦИОНАЛИЗИРОВАННОЙ ЛИНЕЙНОЙ ДНК-КАССЕТЫ И ОПОСРЕДОВАННАЯ КВАНТОВЫМИ ТОЧКАМИ/НАНОЧАСТИЦАМИ ДОСТАВКА В РАСТЕНИЯ | 2011 |
|
RU2574785C2 |
| КОНЪЮГАТЫ КВАНТОВОЙ ТОЧКИ С ПЕПТИДОМ-НОСИТЕЛЕМ, ПРИГОДНЫЕ ДЛЯ ВИЗУАЛИЗАЦИИ И ДОСТАВКИ МОЛЕКУЛ В РАСТЕНИЯ | 2012 |
|
RU2609637C2 |
| РАСТИТЕЛЬНЫЙ ПЕПТИД ГАММА-ЗЕИН ДЛЯ ДОСТАВКИ БИОМОЛЕКУЛ В РАСТИТЕЛЬНЫЕ КЛЕТКИ | 2011 |
|
RU2563805C2 |
| ПРИМЕНЕНИЕ ДЕНДРИМЕРНОЙ НАНОТЕХНОЛОГИИ ДЛЯ ДОСТАВКИ БИОМОЛЕКУЛ В РАСТИТЕЛЬНЫЕ КЛЕТКИ | 2010 |
|
RU2571928C2 |
| СПОСОБЫ ПЕРЕНОСА МОЛЕКУЛЯРНЫХ ВЕЩЕСТВ В КЛЕТКИ РАСТЕНИЙ | 2008 |
|
RU2495935C2 |
| ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ | 2010 |
|
RU2556376C2 |
| ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ | 2017 |
|
RU2664865C2 |
| ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ | 2010 |
|
RU2612156C2 |
| СИНТЕТИЧЕСКИЕ ТРАНЗИТНЫЕ ПЕПТИДЫ ХЛОРОПЛАСТА ИЗ BRASSICA | 2013 |
|
RU2636035C2 |
| ЭНХАНСЕР ПАЛОЧКОВИДНОГО ВИРУСА САХАРНОГО ТРОСТНИКА (SCBV) И ЕГО ПРИМЕНЕНИЕ В ФУНКЦИОНАЛЬНОЙ ГЕНОМИКЕ РАСТЕНИЙ | 2013 |
|
RU2639517C2 |

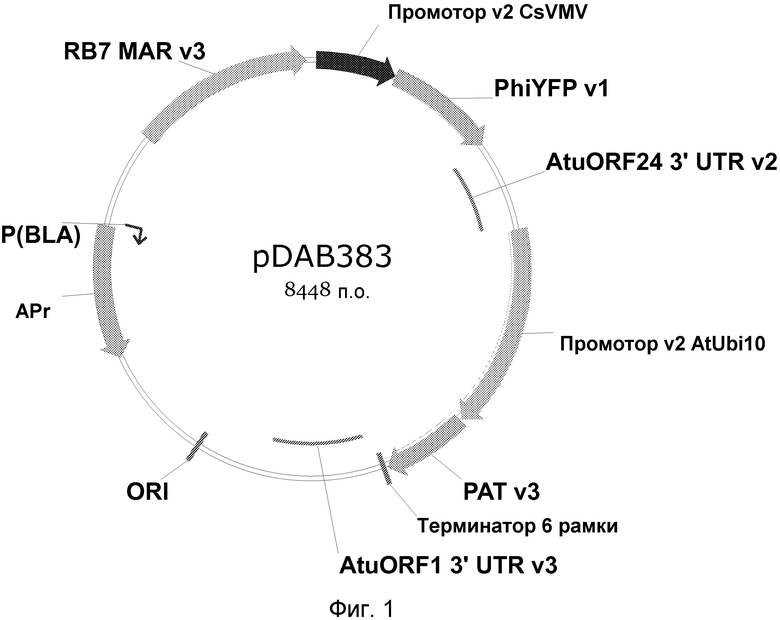
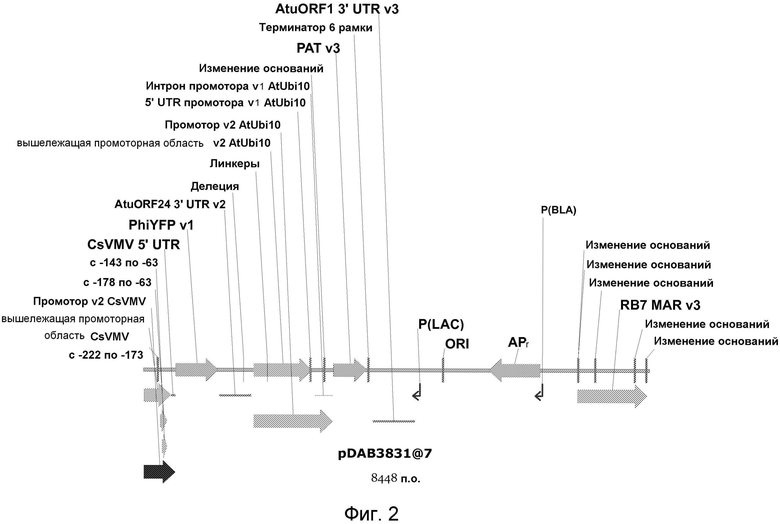

Изобретение относится к области биохимии, в частности к способу стабильного интегрирования представляющей интерес линейной молекулы нуклеиновой кислоты в клетку растения, имеющую клеточную стенку, с использованием положительно заряженной полупроводниковой наночастицы. Также раскрыт способ стабильного интегрирования представляющей интерес линейной молекулы нуклеиновой кислоты в растительный материал с использованием наночастицы, являющейся квантовой точкой. Изобретение позволяет эффективно и стабильно интегрировать представляющую интерес линейную молекулу нуклеиновой кислоты в клетку растения, имеющую клеточную стенку. 2 н. и 19 з.п. ф-лы, 3 ил., 5 пр.
1. Способ стабильного интегрирования представляющей интерес линейной молекулы нуклеиновой кислоты в клетку растения, имеющую клеточную стенку, включающий:
предоставление клетки растения, имеющей клеточную стенку;
покрытие положительно заряженной полупроводниковой наночастицы представляющей интерес линейной молекулой нуклеиновой кислоты;
приведение клетки, имеющей клеточную стенку, и имеющей покрытие положительно заряженной полупроводниковой наночастицы в контакт друг с другом; и
предоставление возможности поглощения положительно заряженной полупроводниковой наночастицы и представляющей интерес линейной молекулы нуклеиновой кислоты в клетку, содержащую клеточную стенку, и
отбор растительной клетки, которая имеет стабильно интегрированную представляющую интерес линейную молекулу нуклеиновой кислоты.
2. Способ по п. 1, где наночастица покрыта полиэтиленгликолем.
3. Способ по п. 1, дополнительно включающий предоставление возможности поглощения наночастицы в компартмент клетки растения, содержащей клеточную стенку.
4. Способ по п. 3, дополнительно включающий покрытие наночастицы белком, нацеливающим на субклеточный компартмент.
5. Способ по п. 3, где компартмент выбран из группы, состоящей из цитозоля, ядра, тонопластов, пластиды, этиопласта, хромопласта, лейкопласта, элайопласта, протеинопласта, амилопласта, хлоропласта и просвета двойной мембраны.
6. Способ по п. 1, где клетка растения, имеющая клеточную стенку, представляет собой клетку растения из коммерческих видов зерновых растений.
7. Способ по п. 6, где клетка растения, имеющая клеточную стенку, выбрана из группы, состоящей из клеток табака, моркови, маиса, канолы, рапса, хлопчатника, пальмы, арахиса, сои, Oryza sp., Arabidopsis sp., Ricinus sp. и сахарного тростника.
8. Способ по п. 1, где клетка растения происходит из ткани, выбранной из группы, состоящей из зародыша, меристемы, каллуса, пыльцы, листьев, пыльников, корней, кончиков корней, цветков, семян, стручков и стеблей.
9. Способ по п. 1, где клетка растения, имеющая клеточную стенку, представляет собой культивируемую клетку.
10. Способ по п. 1, где полупроводниковая наночастица представляет собой квантовую точку.
11. Способ по п. 1, дополнительно включающий дериватизацию поверхности наночастицы.
12. Способ по п. 1, где представляющая интерес линейная молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, выбранную из группы, состоящей из молекул ДНК, РНК, RNAi и генов.
13. Способ по п. 12, где представляющая интерес линейная молекула нуклеиновой кислоты содержит ген.
14. Способ по п. 13, где ген представляет собой ген чужеродного белка, агрономический ген или маркерный ген.
15. Способ по п. 1, где представляющая интерес линейная молекула нуклеиновой кислоты получена путем расщепления молекулы нуклеиновой кислоты нуклеазой.
16. Способ по п. 15, где молекула нуклеиновой кислоты, расщепленная нуклеазой, выбрана из группы, состоящей из плазмиды, космиды, искусственных хромосом, искусственных хромосом дрожжей и искусственных хромосом бактерий.
17. Способ по п. 14, дополнительно включающий отбор клеток, в которые стабильно интегрирована представляющая интерес молекула.
18. Способ по п. 17, где отобранные клетки являются регенерируемыми клетками.
19. Способ по п. 18, дополнительно включающий регенерацию растения из регенерируемых клеток.
20. Способ стабильного интегрирования представляющей интерес линейной молекулы нуклеиновой кислоты в растительный материал, где способ включает:
предоставление растительного материала, где растительный материал выбран из группы, включающей клетки растения, ткани растения и растения;
покрытие наночастицы, являющейся квантовой точкой, полиэтиленгликолем;
покрытие наночастицы, являющейся квантовой точкой, линейной молекулой нуклеиновой кислоты, представляющей интерес;
приведение клетки растения, имеющей клеточную стенку, и имеющей покрытие наночастицы, являющейся квантовой точкой, в контакт друг с другом; и
предоставление возможности поглощения наночастицы, являющейся квантовой точкой, и представляющей интерес линейной молекулы нуклеиновой кислоты в растительный материал.
21. Способ по п. 20, где растительный материал представляет собой ткань растения, выбранную из группы, состоящей из зародыша, ткани меристемы, каллуса, пыльцы, листьев, пыльников, корней, кончиков корней, цветков, семян, стручков и стеблей.
| KLEIN TM et al., High-velocity microprojectiles for delivering nucleic acids into living cells, Nature, 1987, Vol | |||
| Перепускной клапан для паровозов | 1922 |
|
SU327A1 |
| Деревянный торцевой шкив | 1922 |
|
SU70A1 |
| MIKI B | |||
| et al., A procedure for the microinjection of plant cells and protoplasts, Journal of tissue culture methods, 1989, Vol | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Способ подпочвенного орошения с применением труб | 1921 |
|
SU139A1 |
| US2009104700 A1, 23.04.2009 | |||
| THI LOC N.et al., Linear | |||
Авторы
Даты
2016-02-10—Публикация
2011-07-07—Подача