Настоящее изобретение предлагает способы получения рекомбинантных белков и вариантных протеаз. Конкретно настоящее изобретение предлагает способы применения сайт-определяющих библиотек. Настоящее изобретение также предлагает варианты субтилизина, подходящие для разных применений.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Сериновые протеазы составляют подгруппу карбонильных гидролаз, представляющую собой отдельный класс ферментов, обладающих широким диапазоном специфичности и биологических функций. Субтилизины являются предметом многочисленных исследований, в основном, вследствие их применения в чистке и пищевой промышленности. Дополнительные усилия направлены на вредные условия окружающей среды (такие как воздействие окисляющих средств, хелатирующих средств, экстремальных значений температуры и/или pH), которые могут оказывать неблагоприятное влияние на функционирование указанных ферментов при разных применениях. Тем не менее, в данной области остается потребность в ферментативных системах, обладающих устойчивостью к указанным неблагоприятным условиям при сохранении прежней активности, или при повышенной активности по сравнению с известными в данной области ферментами.
В данной области известны разные способы получения рекомбинантных белков. Как правило, белки модифицируют с целью получения желательных свойств. В большинстве способов в нуклеотидную последовательность клонированного гена, кодирующего белок, вводят мутации, после чего модифицированный ген экспрессируют с получением мутантов, которые подвергают скринингу на представляющую интерес активность. Свойства мутантов обычно сравнивают со свойствами белка дикого типа.
Исторически процесс конструирования белков используют как эквивалентный подход к решению проблемы, связанной с обнаружением в пространстве целого белка последовательности, наиболее подходящей для целевого применения. Данная проблема является крайне сложной и "NP-тяжелой". В теории сложности проблемы, которые относят к классу P, считаются простыми и поддающимися эффективному решению, для их решения существуют алгоритмы полиномиального времени. NP-тяжелые проблемы представляют собой проблемы, для решения которых в настоящее время отсутствуют алгоритмы полиномиального времени, и если одна NP-тяжелая проблема будет решена, можно будет решить все NP-тяжелые проблемы (см., например, Pierce and Winfree, Protein Engineer., 15:779-782 [2002]). Существующие в настоящее время стратегии создания и скрининга библиотек, как правило, включают в себя получение множества белковых последовательностей, которые содержат случайные различия на протяжении всей последовательности, или различия, встречающиеся в контролируемой случайной манере в определенных положениях белка. Такие библиотеки обычно содержат большое число членов, которые являются "отрицательными" в отношении исходного представляющего интерес свойства, следовательно, чтобы обнаружить относительно небольшое количество членов с положительными мутациями, нужно провести скрининг большого числа объектов. Как правило, отрицательные мутации игнорируют и информацию о последовательности получают только для положительных членов.
Насыщающий мутагенез (Estell et al., in World Biotech Report 1984, vol. 2: USA, Online Publications, London [1984], pages 181-187; и Wells et al., Gene 34:315-323 [1985]) представляет собой метод, который можно использовать для поиска в пространстве белка мутаций, оптимизирующих некоторые свойства белка. В нескольких группах разработаны стратегии идентификации участков, подлежащих изменению под действием насыщающего мутагенеза (Reetz et al., Agnew. Chem. Int. Edn., 44:4192-4196 [2005]; Kato et al., J. MoI. Biol., 351 :683-692 [2005]; и Sandberg et al., Proc. Natl. Acad. Sci., 90:8367-8371 [1993]), однако общая система идентификации участков отсутствует.
Кроме того, поскольку большинство способов получения рекомбинантных белков приводит к генерированию множества аминокислотных мутаций, для получения белка с желательным свойством требуется скрининг большого числа вариантов. Как правило, чтобы получить полезный вариант, скрининг повторяют снова и снова. Следовательно, большинство способов являются трудоемкими и занимают много времени. В данной области продолжает существовать потребность в эффективных способах получения рекомбинантных белков, которые дают желательные результаты.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает способы получения рекомбинантных белков. Конкретно, настоящее изобретение предлагает способы применения сайт-определяющих библиотек. В частности, настоящее изобретение предлагает способы применения полученной информации о ряде целевых свойств, позволяющие рационально и эффективно конструировать библиотеки для оптимизации этих свойств. В некоторых воплощениях настоящее изобретение предлагает способы конструирования библиотек, улучшенных, по меньшей мере, по двум целевым свойствам.
Настоящее изобретение предлагает способы идентификации положений аминокислотной последовательности белка, которые связаны с улучшением целевых свойств белка. В некоторых особенно предпочтительных воплощениях настоящее изобретение предлагает способы определения мутаций, приводящих к получению белка с указанными целевыми свойствами, а также с улучшенными свойствами. В некоторых других особенно предпочтительных воплощениях настоящее изобретение предлагает способы идентификации аминокислотных положений и мутаций, приводящих к определенному проценту улучшения свойств по сравнению с белком дикого типа (например, одно из свойств улучшается на 110% по сравнению с белком дикого типа). В следующих предпочтительных воплощениях настоящее изобретение предлагает способы идентификации мутаций, которые приводят к получению белка, по меньшей мере, одно свойство которого значительно улучшено, и, по меньшей мере, одно другое свойство не сильно ухудшено по сравнению с белком дикого типа (например, одно свойство лучше на 110% по сравнению с белком дикого типа, а другое свойство хуже не более чем на 90% по сравнению с белком дикого типа). В следующих предпочтительных воплощениях библиотеки конструируют на основе данной информации. В некоторых воплощениях библиотеки конструируют с использованием всех идентифицированных мутаций, тогда как в некоторых других воплощениях библиотеки конструируют с использованием подгруппы идентифицированных мутаций. Действительно, предполагается, что библиотеки не ограничиваются каким-либо конкретным числом и/или типом мутаций.
Настоящее изобретение предлагает способы получения рекомбинантных белков, включающие в себя следующие стадии: получение библиотеки вариантов белка; тестирование библиотеки вариантов белка, по меньшей мере, по одному представляющему интерес свойству с помощью представляющего интерес анализа; идентификация диапазона значений для указанного, по меньшей мере, одного представляющего интерес свойства; идентификация минимума диапазона значений, связанных с благоприятным результатом представляющего интерес анализа; и получение множества вариантов белка, содержащих, по меньшей мере, одну мутацию, превосходящую указанный минимум диапазона значений, характеризующих, по меньшей мере, одно представляющее интерес свойство, которые составляют библиотеку вариантов белка, содержащих, по меньшей мере, одну мутацию, где библиотека обогащена компонентами, которые дают благоприятный результат в представляющем интерес анализе. В некоторых воплощениях благоприятный результат соответствует значению, превышающему примерно 50%, примерно 60%, примерно 70%, примерно 80%, примерно 90% или примерно 95% от максимального значения, наблюдаемого при тестировании, описанном на указанной выше первой стадии. В некоторых альтернативных воплощениях способов настоящего изобретения используют несколько представляющих интерес анализов. В некоторых предпочтительных воплощениях белок представляет собой фермент. В некоторых особенно предпочтительных воплощениях фермент выбран из группы, включающей в себя протеазы, трансферазы, металлопротеазы, эстеразы, амилазы, целлюлазы, оксидазы, кутиназы и липазы.
Настоящее изобретение также предлагает способы получения рекомбинантных белков, включающие в себя следующие стадии: получение библиотеки вариантов белка; тестирование библиотеки вариантов белка по меньшей мере, по двум представляющим интерес свойствам с помощью представляющего интерес анализа; идентификация диапазона значений для, по меньшей мере, двух представляющих интерес свойств; идентификация минимума диапазона значений, связанных с благоприятным результатом представляющего интерес анализа; и получение множества вариантов белка, превосходящих минимум диапазона, по меньшей мере, по двум представляющим интерес свойствам, которые составляют библиотеку вариантов белка, обогащенную компонентами, характеризующимися благоприятными результатами в представляющем интерес анализе. В некоторых воплощениях благоприятный результат соответствует значению, превышающему примерно 50%, примерно 60%, примерно 70%, примерно 80%, примерно 90% или примерно 95% от максимального значения, наблюдаемого при тестировании, описанном на указанной выше первой стадии. В некоторых предпочтительных воплощениях белок представляет собой фермент. В некоторых особенно предпочтительных воплощениях фермент выбран из группы, включающей в себя протеазы, трансферазы, металлопротеазы, эстеразы, амилазы, целлюлазы, оксидазы, кутиназы и липазы.
Настоящее изобретение также предлагает способы получения рекомбинантных белков, включающие в себя следующие стадии: получение белка дикого типа и библиотеки вариантов белка дикого типа; тестирование библиотеки вариантов белка и белка дикого типа, по меньшей мере, по одному представляющему интерес свойству с помощью представляющего интерес анализа; идентификация диапазона значений для, по меньшей мере, одного представляющего интерес свойства; идентификация минимума диапазона значений, связанных с благоприятным результатом представляющего интерес анализа; идентификация вариантов белка, имеющих благоприятный результат по сравнению с результатами, полученными для белка дикого типа, где благоприятный результат связан с улучшенным представляющим интерес свойством; и получение множества вариантов белка, превосходящих минимум диапазона, по меньшей мере, по одному представляющему интерес свойству, которые составляют библиотеку улучшенных вариантов белка, обогащенную компонентами, характеризующимися благоприятными результатами в представляющем интерес анализе. В некоторых предпочтительных воплощениях способы дополнительно включают в себя стадию определения показателя функционирования, где показатель функционирования определяют путем деления значения, полученного для каждого улучшенного варианта белка, на значение, полученное для белка дикого типа. В некоторых особенно предпочтительных воплощениях способы дополнительно включают в себя стадию идентификации улучшенных вариантов белка, где улучшенные варианты белка имеют значения показателя функционирования выше 1,1 по результатам представляющего интерес анализа. В некоторых других воплощениях белок представляет собой фермент. В некоторых особенно предпочтительных воплощениях, фермент выбран из группы, включающей в себя протеазы, трансферазы, металлопротеазы, эстеразы, амилазы, целлюлазы, оксидазы, кутиназы и липазы. В некоторых альтернативных воплощениях белок выбран из антител и факторов роста. В следующих предпочтительных воплощениях белок дикого типа представляет собой зрелую форму фермента, выбранного из группы, включающей в себя протеазы, трансферазы, металлопротеазы, эстеразы, амилазы, целлюлазы, оксидазы, кутиназы и липазы. В некоторых предпочтительных воплощениях, представляющее интерес свойство выбрано из группы, включающей в себя заряд, эффективность стирки, эффективность чистки твердых поверхностей, растворимость, термостабильность, стабильность при хранении, устойчивость к детергентам, связывание субстрата, ингибирование ферментов, уровень экспрессии, скорость реакции и деградацию субстрата. В некоторых воплощениях белок дикого типа и вариант белка являются компонентами, по меньшей мере, одной детергентной композиции. В некоторых предпочтительных воплощениях эффективность стирки тестируют с применением детергентной композиции, которая находится в порошкообразной или жидкой форме, имеющей pH от 5 до 12,0.
Настоящее изобретение также предлагает способы получения улучшенного варианта исходного белка с определенной укладкой, включающие в себя следующие стадии: анализ множества вариантов тестируемого белка с определенной укладкой, соответствующих диапазону представляющего интерес свойства по данным представляющего интерес анализа; идентификация минимума диапазона представляющего интерес свойства, связанного с благоприятным результатом представляющего интерес анализа; анализ исходного белка с определенной укладкой с помощью представляющего интерес способа; и получение улучшенного варианта исходного белка путем введения аминокислотной замены в исходный белок, где улучшенный вариант характеризуется значениями, превышающими минимум диапазона представляющего интерес свойства. В некоторых предпочтительных воплощениях исходный белок отличается от тестируемого белка. В некоторых воплощениях способы дополнительно включают в себя стадию определения показателя функционирования, где показатель функционирования определяют путем деления значения, полученного для улучшенного варианта белка, на значение, полученное для исходного белка. В некоторых воплощениях тестируемые белки и исходные белки являются ферментами. В некоторых особенно предпочтительных воплощениях, ферменты выбраны из группы, включающей в себя протеазы, трансферазы, металлопротеазы, эстеразы, амилазы, целлюлазы, оксидазы, кутиназы и липазы. В некоторых альтернативных воплощениях тестируемые и исходные белки выбраны из антител и факторов роста. В следующих предпочтительных воплощениях исходный белок представляет собой зрелую форму фермента, выбранного из группы, включающей в себя протеазы, трансферазы, металлопротеазы, эстеразы, амилазы, целлюлазы, оксидазы, кутиназы и липазы. В некоторых предпочтительных воплощениях представляющее интерес свойство выбрано из группы, включающей в себя заряд, эффективность стирки, эффективность чистки твердых поверхностей, термостабильность, растворимость, стабильность при хранении, устойчивость к детергентам, связывание субстрата, ингибирование ферментов, уровень экспрессии, скорость реакции и деградацию субстрата. В некоторых воплощениях тестируемые и исходные белки являются компонентами, по меньшей мере, одной детергентной композиции. В отдельном альтернативном воплощении улучшенный вариант белка является компонентом детергентной композиции. В некоторых предпочтительных воплощениях эффективность стирки тестируют с применением детергентной композиции, которая находится в порошкообразной или жидкой форме, имеющей pH от 5 до 12,0.
Настоящее изобретение также предлагает выделенные варианты субтилизина Bacillus, где вариант субтилизина представляет собой зрелую форму, обладающую протеолитической активностью и содержащую замену по одному или более положениям, выбранным из следующей группы: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 33, 35, 36, 37, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 62, 65, 66, 67, 71, 72, 73, 76, 77, 78, 79, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 101, 102, 103, 104, 105, 106, 107, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 139, 141, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 156, 157, 158, 159, 160, 162, 163, 164, 165, 166, 167, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 194, 195, 196, 197, 198, 199, 200, 201, 203, 204, 206, 207, 209, 210, 212, 213, 214, 215, 216, 217, 218, 219, 220, 222, 223, 224, 225, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 267, 268, 269, 270, 271, 272, 273 и 274, где положения пронумерованы в соответствии с аминокислотной последовательностью субтилизина B. amyloliquefaciens BPN', описанной как SEQ ID NO:2. В некоторых воплощениях одно или более положений выбраны из следующей группы: 1, 2, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 21, 22, 23, 24, 25, 26, 28, 29, 30, 31, 33, 35, 36, 37, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 62, 65, 66, 67, 71, 72, 73, 77, 78, 79, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 101, 102, 103, 104, 105, 106, 107, 109, 110, 111, 112, 113, 114, 115, 116, 118, 119, 122, 123, 124, 125, 126, 127, 128, 129, 131, 133, 134, 135, 136, 137, 139, 141, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 156, 157, 158, 159, 160, 162, 163, 164, 165, 166, 167, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 194, 195, 196, 197, 198, 199, 200, 201, 203, 204, 206, 207, 212, 213, 214, 215, 216, 217, 218, 219, 220, 222, 223, 224, 225, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 267, 268, 269, 270, 271, 272, 273 и 274, и где положения пронумерованы в соответствии с аминокислотной последовательностью субтилизина B. amyloliquefaciens BPN', описанной как SEQ ID NO:2. В некоторых воплощениях одно или более положений выбраны из следующей группы: 2, 3, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 19, 20, 21, 21, 22, 23, 25, 26, 28, 29, 30, 31, 33, 35, 36, 37, 39, 40, 41, 42, 44, 46, 47, 48, 49, 50, 51, 53, 54, 55, 56, 57, 58, 59, 60, 62, 65, 66, 67, 71, 73, 77, 78, 79, 81, 82, 83, 84, 85, 86, 88, 89, 90, 91, 92, 93, 94, 95, 96, 102, 105, 106, 110, 111, 112, 113, 114, 115, 116, 122, 123, 124, 125, 126, 128, 129, 131, 133, 134, 135, 136, 137, 139, 141, 143, 145, 146, 147, 148, 149, 150, 151, 152, 153, 156, 157, 158, 159, 160, 162, 165, 166, 167, 169, 170, 171, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 186, 187, 189, 190, 191, 192, 194, 195, 196, 197, 198, 199, 200, 201, 203, 204, 206, 207, 212, 214, 216, 217, 218, 219, 220, 222, 223, 224, 225, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 260, 261, 262, 263, 264, 265, 267, 268, 269, 270, 271, 272, 273 и 274, и где положения пронумерованы в соответствии с аминокислотной последовательностью субтилизина B. amyloliquefaciens BPN', описанной как SEQ ID NO:2. В некоторых воплощениях, вариант субтилизина также содержит замену по одному или более положениям, выбранным из 18, 52, 72, 117, 119, 127, 144, 185, 209 и 213, и где положения пронумерованы в соответствии с аминокислотной последовательностью субтилизина B. amyloliquefaciens BPN', описанной как SEQ ID NO:2. В некоторых предпочтительных воплощениях, замена включает в себя одну или несколько, выбранных из следующей группы: A001C, A001D, A001E, A001F, A001G, A001H, A001I, A001K, A001L, A001M, A001N, A001Q, A001R, A001S, A001V, A001W, Q002A, Q002D, Q002E, Q002G, Q002S, S003A, S003D, S003F, S003G, S003I, S003K, S003L, S003M, S003N, S003P, S003Q, S003R, S003T, S003V, S003W, S003Y, P005C, P005E, P005G, P005N, P005Q, P005T, Y006A, Y006C, Y006E, Y006F, Y006G, Y006K, Y006M, Y006N, Y006P, Y006Q, Y006R, Y006T, Y006V, Y006W, S009A, S009C, S009E, S009F, S009G, S009H, S009K, S009L, S009M, S009P, S009Q, S009R, S009T, S009V, S009W, Q010A, Q010C, Q010E, Q010F, Q010G, Q010H, Q010I, Q010K, Q010L, Q010M, Q010R, Q010S, Q010T, Q010V, Q010W, I011C, I011L, I011T, I011V, I011Y, K012A, K012C, K012D, K012E, K012F, K012G, K012H, K012I, K012N, K012Q, K012S, K012T, K012V, K012W, K012Y, A013C, A013F, A013G, A013H, A013L, A013R, A013S, A013T, A013V, P014A, P014C, P014D, P014E, P014F, P014G, P014I, P014K, P014L, P014M, P014N, P014Q, P014R, P014S, P014T, P014V, P014W, P014Y, A015C, A015D, A015E, A015F, A015G, A015H, A015I, A015K, A015L, A015M, A015P, A015Q, A015R, A015T, A015V, A015Y, L016A, L016C, L016I, L016M, L016Q, L016S, L016T, H017F, H017I, H017L, H017M, H017V, H017W, H017Y, S018A, S018E, S018F, S018G, S018H, S018I, S018K, S018L, S018M, S018N, S018P, S018Q, S018R, S018T, S018V, S018W, S018Y, Q019A, Q019C, Q019D, Q019E, Q019G, Q019I, Q019K, Q019M, Q019R, Q019T, Q019V, G020A, G020C, G020D, G020E, G020F, G020H, G020K, G020M, G020N, G020P, G020Q, G020R, G020S, G020W, Y021A, Y021C, Y021D, Y021E, Y021F, Y021G, Y021H, Y021K, Y021M, Y021R, Y021S, Y021T, Y021V, Y021W, T022A, T022C, T022E, T022F, T022G, T022H, T022I, T022K, T022L, T022M, T022N, T022Q, T022S, T022V, T022W, T022Y, S024C, S024F, S024G, S024H, S024I, S024K , S024L, S024M, S024N, S024Q, S024R, S024T, S024W, S024Y, N025C, N025E, N025F, N025G, N025H, N025I, N025K, N025L, N025M, N025P, N025R, N025S, N025T, N025V, N025W, K027A, K027D, K027E, K027F, K027G, K027H, K027L, K027M, K027P, K027R, K027S, K027W, K027Y, S033A, S033F, S033G, S033H, S033P, S033T, S033W, I035A, I035C, I035D, I035R, I035S, I035T, I035V, D036A, D036C, D036E, D036Q, D036S, D036W, S037A, S037C, S037E, S037F, S037G , S037H, S037K, S037L, S037M, S037P, S037Q, S037R, S037T, S037W, H039C, H039Q, H039T, H039V, P040A, P040C, P040E, P040F, P040G, P040G, P040H, P040I, P040K, P040L , P040M, P040N, P040Q, P040R, P040S, P040T, P040V, P040W, D041E, L042I, L042M, L042V, K043A, K043C, K043D, K043E, K043F, K043G, K043I, K043L, K043M, K043N, K043R, K043S, K043T, K043V, K043W, K043Y, V044A, V044C, V044I, V044L, V044M, V044P, V044S, V044T, A045C, A045E, A045F, A045H, A045I, A045K, A045L, A045M, A045N, A045P, A045Q, A045S, A045T, A045V, A045Y, G046A, G046C, G046E, G046H, G046K, G046M, G046N, G046Q, G046T, G046W, G046Y, A048C, A048D, A048E, A048F, A048H, A048I, A048K, A048L, A048M, A048Q, A048R, A048S, A048T, A048V, A048W, A048Y, M050A, M050C, M050F, M050H, M050I, M050K, M050L, M050Q, M050R, M050S, M050T, M050V, M050W, M050Y, V051A, V051C, V051D, V051E, V051H, V051I , V051L, V051P, V051Q, P052C, P052D, P052E, P052F, P052H, P052I, P052K, P052L, P052Q, P052R, P052S, P052T, P052V, P052W, P052Y, S053E, S053F, S053G, S053H, S053I, S053K, S053L, S053M, S053N, S053Q, S053R, S053T, S053V, S053W, E054A, E054N, E054Q, E054S, T055A, T055C, T055D, T055F, T055G, T055H, T055I, T055K, T055M, T055P, T055Q, T055R, T055S, T055V, T055W, T055Y, N056D, N056M, N056P, N056Q, N056S, N056T, N056V, P057N, P057Q, P057T, P057V, P057W, F058C, F058E, F058G, F058H, F058L, F058M, F058N, F058Q, F058S, F058V, F058Y, Q059A, Q059C, Q059D, Q059E, Q059F, Q059G, Q059H, Q059K, Q059L, Q059M, Q059N, Q059P, Q059R, Q059S, Q059T, Q059V, Q059W, Q059Y, D060E, D060G, N062A, N062C, N062D, N062E, N062F, N062G, N062H, N062I, N062K, N062L, N062M, N062Q, N062R, N062S, N062T, N062V, N062W, N062Y, T066S, T066W, T066Y, H067A, H067C, H067F, H067I, H067L, H067M, H067N, H067P, H067R, H067S, H067T, T071I, T071Y, N077S, S078A, S078C, S078D, S078F, S078G, S078I, S078K, S078L, S078M, S078N, S078P, S078Q, S078R, S078T, S078V, S078W, S078Y, I079A, I079C, I079E, I079F, I079G, I079H, I079K, I079L, I079N, I079Q, I079R, I079S, I079T, I079V, I079W, I079Y, V081F, V081I, V081L, V081M, V081T, G083F, G083P, Q084A, Q084C, Q084H, Q084I, Q084N, Q084T, A085C, A085F, A085G, A085R, A085S, P086A, P086D, P086E, P086G, P086M, P086N, P086Q, P086R, P086S, P086T, P086W, P086Y, S089C, S089D, S089E, S089F, S089G, S089H, S089K, S089L, S089V, S089W, S089Y, L090A, L090D, L090E, L090G, L090H, L090M, L090Q, L090T, L090V, Y091A, Y091C, Y091D, Y091E, Y091F, Y091H, Y091I, Y091L, Y091M, Y091Q, Y091S, Y091T, Y091V, L096F, L096H, L096I, L096K, L096M, L096T, L096V, G097A, G097C, G097D, G097E, G097H, G097K, G097L, G097M, G097P, G097Q, G097R, G097S, G097T, G097V, A098C, A098D, A098F, A098G, A098H, A098I, A098L, A098P, A098Q, A098R, A098S, A098T, A098V, A098Y, D099C, D099E, D099I, D099K, D099L, D099N, D099P, D099Q, D099R, D099S, D099T, S101A, S101C, S101E, S101F, S101G, S101I, S101K, S101L, S101M, S101N, S101P, S101Q, S101R, S101T, S101V, S101Y, G102A, G102C, G102E, G102F, G102I, G102N, G102S, G102V, G102Y, Q103A, Q103C, Q103E, Q103F, Q103G, Q103I, Q103K, Q103L, Q103M, Q103N, Q103R, Q103S, Q103T, Q103V, Q103W, S105A, S105C, S105D, S105E, S105F, S105G, S105I, S105K, S105L, S105M, S105N, S105P, S105R, S105V, S105W, W106A, W106C, W106E, W106F, W106G, W106H, W106I, W106L, W106M, W106N, W106R, W106S, W106T, W106V, W106Y, N109A, N109C, N109E, N109F, N109G, N109H, N109L, N109M, N109P, N109Q, N109R, N109S, N109T, N109V, N109W, N109Y, I111C, I111F, I111L, I111M, I111N, I111P, I111T, I111V, I111W, E112A, E112C, E112D, E112F, E112G, E112I, E112L, E112M, E112N, E112Q, E112R, E112S, E112T, E112V, E112W, E112Y, W113D, W113E, W113F, W113N, W113P, W113Q, W113S, W113V, W113Y, I115E, I115H, I115N, I115R, I115T, I115V, I115W, I115Y, A116C, A116D, A116E, A116F, A116G, A116H, A116I, A116K, A116L, A116M, A116N, A116P, A116Q, A116R, A116S, A116T, A116V, A116W, A116Y, N118A, N118C, N118D, N118E, N118F, N118G, N118H, N118I, N118K, N118L, N118M, N118Q, N118R, N118S, N118T, N118V, N118W, N118Y, I122A, I122C, I122H, I122K, I122L, I122M, I122N, I122P, N123A, N123C, N123D, N123E, N123G, N123I, N123L, N123M, N123Q, N123S, N123T, N123V, M124C, M124D, M124I, M124L, M124S, M124T, M124V, M124W, S125A, S125C, S125E, S125F, S125I, S125K, S125M, S125N, S125P, S125Q, S125R, S125T, S125W, L126A, L126C, L126I, L126K, L126N, L126R, L126S, L126T, L126V, L126W, L126Y, G127A, G127C, G127E, G127F, G127I, G127K, G127M, G127N, G127P, G127Q, G127S, G127T, G127V, G127W, G127Y, G128A, G128D, G128F, G128H, G128L, G128N, G128P, G128S, G128T, G128V, G128W, G128Y, P129A, P129C, P129D, P129E, P129F, P129G, P129I, P129K, P129L, P129M, P129N, P129Q, P129S, P129T, P129V, P129Y, G131A, G131C, G131E, G131F, G131K, G131L, G131M, G131N, G131P, G131Q, G131R, G131S, G131T, G131V, G131W, G131Y, A133C, A133D, A133E, A133F, A133G, A133I, A133K, A133L, A133M, A133P, A133R, A133S, A133T, A133V, A133W, A133Y, A134D, A134E, A134F, A134G, A134I, A134K, A134L, A134M, A134P, A134Q, A134R, A134S, A134T, A134V, A134W, L135D, L135E, L135M, L135R, L135W, L135Y, K136E, K136H, K136L, K136M, K136N, K136R, K136S, K136T, K136V, K136W, K136Y, A137C, A137E, A137F, A137H, A137K, A137L, A137M, A137N, A137P, A137Q, A137R, A137S, A137T, A137V, A137W, A137Y, V139C, V139I, V139L, V139N, V139S, V139T, K141A, K141C, K141D, K141E, K141F, K141G, K141H, K141I, K141L, K141M, K141N , K141Q, K141R, K141S, K141V, K141W, K141Y, V143A, V143C, V143D, V143E, V143F, V143G, V143K, V143L, V143M, V143N, V143Q, V143R, V143S, V143T, V143W, A144C, A144D, A144E, A144G, A144I, A144K, A144L, A144M, A144R, A144S, A144T, A144V, A144W, S145A, S145C, S145D, S145E, S145F, S145G, S145H, S145I, S145L, S145M, S145Q, S145R, S145T, S145V, S145W, S145Y, G146A, G146C, G146D, G146E, G146M, G146Q, G146R, G146S, G146T, G146Y, A153S, G154L, G154P, G154T, E156A, E156C, E156F, E156K, E156L, E156N, E156Q, E156R, E156S, E156T, E156V, E156W, E156Y, T158A, T158D, T158E, T158G, T158H, T158I, T158K, T158L, T158M, T158N, T158Q, T158S, T158V, T158Y, S159A, S159C, S159D, S159E, S159G, S159H, S159I, S159K, S159M, S159Q, S159R, S159T, G160D, G160E, G160K, G160N, G160P, G160Q, G160S, G160T, S162A, S162C, S162E, S162H, S162K, S162L, S162M, S162N, S162Q, S162R, S162T, S162V, S163G, S163P, Y167A, Y167F, Y167H, Y167I, P168D, P168G, P168I, P168M, P168S, P168Y, G169A, G169E, G169F, G169H, G169I, G169M, G169N, G169R, G169T, G169V, G169Y, K170A, K170C, K170F, K170G, K170H, K170R, K170V, K170W, K170Y, Y171G, Y171K, Y171P, P172A, P172C, P172E, P172K, P172L, P172M, P172N, P172Q, P172R, P172S, P172T, P172V, P172Y, S173A, S173C, S173E, S173I, S173T, S173V, V174C, V174F, V174H, V174R, V174T, I175G, I175L, I175M, I175R, I175T, I175V, A176C, A176E, A176F, A176K, A176M, A176S, A176Y, A179G , V180A, V180C, V180L, V180N, V180S, V180T, D181C, D181E, D181G, D181H, D181M, D181N, D181S, D181T, D181W, S182A, S182C, S182D, S182F, S182G, S182H, S182I, S182K, S182M, S182P, S182Q, S182R, S182V, S182Y, S183A, S183C, S183E, S183F, S183G, S183H, S183I, S183K, S183L, S183M, S183N, S183Q, S183R, S183T, S183V, S183W, S183Y, N184C, N184D, N184E, N184G, N184H, N184K, N184L, N184M, N184Q, N184S, N184T, N184V, N184W, Q185A, Q185C, Q185E, Q185F, Q185G, Q185H, Q185I, Q185K, Q185L, Q185M, Q185N, Q185S, Q185T, Q185V, Q185W, R186I, R186L, R186W, A187C, A187D, A187E, A187F, A187G, A187P, A187S, A187W, A187Y, S188A, S188C, S188D, S188E, S188F, S188G, S188H, S188I, S188K, S188L, S188M, S188P, S188Q, S188T, S188V, S188W, S188Y, S190F, S190H, S190I, S190K, S191A, S191G, S191N, S191P, V192A, V192S, V192T, V192Y, G193F, G193H, G193I, G193N, G193P, G193R , G193T, P194C, P194E, P194H, P194I, P194K, P194L, P194M, P194Q, P194T, P194V, P194W, L196A, M199P, M199S, A200C, A200G, A200K, A200Y, G202D, G202E, G202F, G202L, G202P, G202V, G202Y, Q206A, Q206C, Q206D, Q206E, Q206F, Q206G, Q206H, Q206I, Q206L, Q206M, Q206N, Q206P, Q206R, Q206S, Q206T, Q206V, Q206W, Q206Y, S207D, S207E, S207K, S207Q, S207T, S207V, P210A, P210C, P210S, P210T, N212A, N212C, N212E, N212F, N212G, N212H, N212K, N212L, N212M, N212P, N212Q, N212R, N212S, N212V, K213A, K213C, K213D, K213E, K213F, K213H, K213I , K213L, K213M, K213N, K213Q, K213R, K213S, K213T, K213V, K213Y, Y214W, G215A, G215C, G215D, G215E, G215I, G215M, G215N, G215Q, G215S, G215T, G215V, A216C, A216D, A216E, A216G, A216K, A216L, A216M, A216N, A216P, A216Q, A216R, A216S, A216V, A216W, Y217A, Y217C, Y217D, Y217E, Y217F, Y217G, Y217H, Y217I, Y217K, Y217L, Y217M, Y217N, Y217Q, Y217R, Y217S, Y217T, Y217V, Y217W, N218A, N218C, N218E, N218F, N218G, N218H, N218K, N218M, N218R, N218S, N218T, N218W, N218Y, G219A, G219C, G219D, G219H, G219I, G219M, G219P, G219Q, G219R, G219S, G219T, G219V, G219W, T220D, T220E, T220F, T220G, T220K, T220M, T220S, T220Y, A223E, A223F, A223L, A223M, A223R, A223S, A223V, A223W, A223Y, S224A, S224C, S224F, S224G, S224H, S224M, S224N, S224Q, S224R, S224T, P225A, P225C, P225F, P225G, P225H, P225I, P225K, P225L, P225M, P225R, P225S, P225T, P225V, P225Y, A228P, A228R, A228S, A228T, A228W, G229A, G229H, G229I, G229S, A230C, A230E, A230G , A230Q, A230R, A230S, A230T, A230V, A231C, A231I, A231P, A231R, I234A, I234C, I234L, I234M, I234N, I234P, I234Q, I234S, I234T, I234V, L235A, L235C, L235G, L235I , L235K, L235M, L235N, L235Q, L235R, L235S, L235T, L235V, L235W, L235Y, S236A, S236C, S236D, S236E, S236G, S236H, S236N, S236Q, S236T, S236V, S236Y, K237A, K237E , K237F, K237G, K237H, K237I, K237L, K237M, K237N, K237Q, K237R, K237S, K237T, K237V, K237W, K237Y, H238C, H238D, H238E, H238F, H238M, H238R, H238S, P239C, P239D, P239E, P239F, P239H, P239L, P239M, P239N, P239Q, P239R, P239S, P239T, P239V, P239W, P239Y, N240A, N240C, N240D, N240F, N240G, N240K, N240L, N240Q, N240R, N240S, N240T, N240V, N240W, N240Y, W241A, W241F, W241G, W241H, W241I, W241K, W241M, W241Q, W241T, W241V, T242A, T242C, T242E, T242F, T242G, T242K, T242M, T242N, T242P, T242R, T242S, T242W, T242Y, N243C, N243E, N243F, N243G, N243I, N243Q, N243S, N243T, N243V, N243W, N243Y, T244A, T244D, T244F, T244G, T244H, T244K, T244L, T244M, T244N, T244P, T244Q, T244R, T244S, T244V, T244W, T244Y, Q245A, Q245C, Q245D, Q245E, Q245H, Q245I, Q245K, Q245L, Q245M, Q245R, Q245T, Q245V, Q245Y, R247W, S248A, S248E, S248F, S248G, S248H, S248I, S248L, S248M, S248N, S248Q, S248R, S248T, S248V, S248W, S248Y, S249C, S249D, S249H, S249I, S249K, S249L, S249M, S249N, S249Q, S249R, S249T, S249V, S249W, S249Y, L250D, L250F, L250H, L250I, L250M, L250T, L250V, E251A, E251T, E251W, N252A, N252C, N252E, N252G, N252H, N252I, N252L, N252M, N252Q, N252R, N252S, N252T, N252V, N252Y, T253A, T253C, T253E, T253G, T253H, T253K, T253M, T253S, T253V, T254A, T254C, T254L, T254M, T254R, T254S, T254V, T255A, T255C, T255D, T255E, T255F, T255G, T255H, T255I, T255K, T255L, T255M, T255R, T255S, T255V, K256A, K256C, K256D, K256E, K256F, K256H, K256I, K256L, K256M, K256N, K256P, K256Q, K256R, K256S, K256T, K256V, K256W, K256Y, L257A, L257C, L257F, L257G, L257H, L257I, L257K, L257M, L257N, L257R, L257S, L257T, L257V, L257W, L257Y, G258Q, D259A, D259E, D259F, D259G, D259L, D259N, D259P, D259Q, D259R, D259S, D259T, D259V, D259W, D259Y, S260A, S260C, S260D, S260E, S260F, S260G, S260H, S260L, S260M, S260N, S260P, S260R, S260V, S260W, S260Y, F261H, F261W, Y262A, Y262C, Y262E, Y262F, Y262H, Y262L, Y262M, Y262N, Y263F, Y263M, Y263T, G264F, G264I, G264L, K265A, K265C, K265E, K265G, K265H, K265L, K265M, K265N, K265Q, K265R, K265S, K265W, K265Y, G266C, G266F, G266L, G266M, G266P, G266R, G266V, G266W, G266Y, L267A, L267C, L267E, L267G, L267H, L267I, L267M, L267N, L267Q, L267S, L267T, L267V, I268A, I268C, I268K, I268L, I268M, I268P, I268R, I268V, N269D, N269E, N269K, N269L, N269P, N269Q, N269S, Q271A, Q271C, Q271D, Q271E, Q271F, Q271G, Q271H, Q271I, Q271K, Q271L, Q271M, Q271N, Q271P, Q271R, Q271S, Q271T, Q271V, Q271W, Q271Y, A272E, A272F, A272G, A272H, A272K, A272L, A272M, A272N, A272Q, A272R, A272S, A272T, A272V, A272W, A272Y, A274C, A274D, A274F, A274G, A274H, A274I, A274K, A274L, A274Q, A274S, A274T и A274V.
В некоторых предпочтительных воплощениях замена включает в себя сочетание, выбранное из следующей группы: Y021H-A045V-Y217E, Y021W-S101E-G128R-Y217Q, Y021H-Y217E, Y021H-A045V-S101N-Y217Q, Y021H-A045I-Y217E, Y021H-A045I-S101E-Y217Q, Y021W-A045I-S101E-Y217E, D036N-S101E-Y217L, Y021H-A045V-Y217Q, Y021H-A045I-S101E-Y217L, Y021H-A045I-Y217E, Y021H-Y217Q, Y021W-S101E-Y217L, Y021W-A045V-S101E-Y217L, Y021H-A045V-S101E-Y217E, S101E-Y217L, Y021H-A045V-S101E-Y217Q, Y021H-Y217L, Y021W-A045I-S101N-Y217L, S101N-K213I-Y217Q, Y021W-S101N-Y217L, Y021H-S101E-Y217E, M119F-K213K-Y217Q, Y021W-A045V-Y217E, Y021W-A045I-Y217E, M119F-K213I-Y217Q, Y021W-Y217E-N212S, M119F-K213L-Y217E, K213I-Y217Q, A045I-Y217Q, Y021W-A045V-S101E-Y217Q, Y021H-A045V-S101E-Y217L, S101S-M119F-K213I-Y217Q, K213N-Y217Q, M119F-Y217Q, S024H-A092G-A114G, S101N-M119F-K213I-Y217Q, S101N-K213L-Y217Q, S101N-M119F-K213K-Y217L, S101N-M119F-K213I-Y217L, Y021H-A045V-S101E, S101N-K213L-Y217E, A045V-Y217L, S101N-K213I-Y217L, S101S-M119M-K213K-Y217L, Y021H-Y217L, S101E-K213L-Y217L, K213I-Y217E, S101N-M119F-Y217E, Y021W-A045V-Y217L, A092G-A114G, S024H-A092G-Q103E, Y021W-S101E, V26Q-K213I, Y021H-S101N, S101E-K213N-Y217E. В некоторых предпочтительных воплощениях замена включает в себя сочетание, выбранное из следующей группы: S024S-V028V-M050M-A092A-Q103E-A114G-V246V, S024S-V028V-M050V-A092A-Q103Q-A114A-V246V, S024S-V028V-M050V-A092A-Q103Q-A114G-V246V, S024H-V028V-M050V-A092A-Q103Q-A114A-V246T, S024H-V028V-M050V-A092A-Q103E-A114A-V246V, S024H-V028V-M050V-A092A-Q103Q-A114G-V246V, S024H-V028V-M050M-A092A-Q103E-A114A-V246V, S024H-V028V-M050M-A092A-Q103E-A114A-V246T, S024S-V028V-M050M-A092G-Q103Q-A114A-V246T, S024H-V028V-M050M-A092A-Q103Q-A114G-V246T, S101E-M119N-K213N, S101N-K213I, S101N-M119H, M119H-K213I-Y217L, S101N-M119H-K213N-Y217L, S101N-K213L-Y217E, M119N-K213N-Y217L, M119F-K213L-Y217E, S101P-K213N, S101N-M119H-K213N, S101N-M119F-K213I-Y217L, K213L, M119N-K213N, K213N, K213I-Y217E, S101N-M119H-Y217Q, S101P-K213N-Y217L, M119N-K213I, K213N-Y217Q, M119H-K213N, S101N-K213L-Y217Q, S101P-K213N, S101E-K213N-Y217E, S101E-M119H-K213I-Y217Q, S101E-M119H-K213N, K213I-Y217Q, S101N-K213I-Y217Q, M119H-Y217Q, S101N-M119N-K213N-Y217Q, M119H-K213I-Y217Q, K213I-Y217Q, S101E-M119N-Y217L, M119F-K213L, M119H-K213N-Y217E, S101N-M119N-K213N-Y217Q, S101N-M119H-K213N-Y217Q, M119H-K213I-Y217Q, Y217Q, M119H-K213N-Y217Q, S101N-M119F-Y217E, M119F-Y217Q, S101N-M119F-K213I-Y217Q, S101N-K213I-Y217L, S101N-M119H-K213N-Y217L, S101E-K213L-Y217L, S101N-K213N-Y217Q, S101N-M119H-K213L, S101N-M119H-K213I, S101P-K213N-Y217L, M119F-K213I-Y217Q, S101N-K213I-Y217Q, S101E-M119H-K213I-Y217L, S101N-M119H-K213I-Y217Q, M119H-K213N-Y217E, S101N-M119N-K213N-Y217L, A048E-K213L, A048H-K213L, V026Q-A048Y-K213L, K213N, V026N-K213L, V026N-K213L, V026Y-K213N, A048D-K213N, V026Q-A048E-K213L, A048H-K213N, V026Q-A048H-K213L, A048H-K213L, K213L, K213N, V147D-K213L, K213I, V026Q-A048E-K213N, V026N-A048E-K213N, A048E-K213L, V026Y-A048E-K213I, A048D-K213N, K213I, A048H-K213N, V147D-K213N, Y021H-A045V-S101E-Y217L, Y021H-Y217L, Y021H-A045V-S101E-Y217Q, Y021H-A045I-S101E-Y217L, Y021H-Y217Q, Y021H-A045V-Y217E, A045V-Y217L, Y021H-A045V-S101N-Y217Q, Y021W-S101P-Y217L, Y021W-A045I-Y217E, Y021H-A045V-S101E-Y217E, Y021H-A045I-S101E-Y217L, Y021H-A045I-S101E-Y217Q, Y021H-A045V-Y217E, Y021W-S101E-Y217L, S101E-Y217L, Y021H-A045V-Y217Q, Y021H-Y217E, Y021W-Y217E-(N0212S), A045I-Y217Q, Y021H-A045V-Y217E, Y021W-A045V-S101E-Y217Q, Y021H-S101E-Y217E, Y021W-S101N-Y217L, S024S-V028V-M050M-A092A-Q103Q-A114A-V246T, Y021H-A045V-S101E, Y021W-A045V-S101E-Y217L, S101N-M119H-K213K-Y217Q, S101S-M119N-K213N-Y217Q, Y021H-A045V-S101P-Y217L, S024S-V028V-M050M-A092A-Q103Q-A114G-V246T, S101S-M119F-K213I-Y217Q, S101S-M119M-K213K-Y217L, Y021H-A045I-S101E-Y217Q, Y021H-A045V-S101E-Y217E, Y021H-A045V-S101E, Y021H-Y217L, Y021H-A045I-Y217E, Y021W-A045I-S101E-Y217E, S101N-M119F-K213K-Y217L, S101E-M119H-K213N-Y217E, Y021H-A045I-Y217E, S101S-M119H-K213L-Y217L, Y021H-Y217E, S101S-M119F-K213K-Y217Q и Y021H-A045I-S101E-Y217L. В некоторых предпочтительных воплощениях замена включает в себя сочетание, выбранное из следующей группы: S024S-V028T-M050V-A092G-Q103E-A114G-V246T, S101N-M119H, M119N-K213N-Y217L, Y217L, M119N-K213N, K213N, K213N-Y217Q, S101E-K213N-Y217E, S101E-M119N-Y217L, Y217Q, S101N-M119N-K213N-Y217E, S101N-M119N-K213N-Y217L, Y021H-A045I-S101E-Y217L, S101E-Y217L, A045I-Y217Q, S101S-M119M-K213K-Y217L, Y021H-A045I-S101E-Y217L.
Кроме того, настоящее изобретение предлагает варианты, описанные в таблицах в разделе Примеры, а также композиции, содержащие указанные варианты.
Настоящее изобретение также предлагает выделенные нуклеиновые кислоты, кодирующие вариант субтилизина, векторы экспрессии, содержащие указанные нуклеиновые кислоты, и клетки-хозяева, содержащие указанные векторы. Кроме того, настоящее изобретение предлагает чистящие композиции, содержащие вариант субтилизина. В некоторых воплощениях чистящая композиция представляет собой стиральный детергент. В некоторых воплощениях стиральный детергент представляет собой детергент для стирки в холодной воде, детергент с низким pH или компактный детергент. Кроме того, настоящее изобретение предлагает способы получения варианта субтилизина Bacillus, включающие в себя: трансформацию клетки-хозяина вектором экспрессии, содержащим нуклеиновую кислоту, кодирующую вариант субтилизина; и культивирование трансформированной клетки-хозяина в условиях, подходящих для получения варианта субтилизина. В некоторых воплощениях способы дополнительно включают в себя стадию выделения полученного варианта субтилизина. В некоторых воплощениях клетка-хозяин представляет собой разновидность Bacillus, а в подгруппе указанных воплощений разновидность Bacillus представляет собой B. subtilis. Настоящее изобретение также предлагает способ чистки, включающий в себя стадию приведения в контакт поверхности и/или изделия, содержащего ткань, с чистящей композицией, содержащей выделенный вариант субтилизина.
Кроме того, настоящее изобретение предлагает способы получения рекомбинантной протеазы, включающие в себя следующие стадии: a) получение совокупности сайт-определяющих библиотек (SEL), каждая из которых содержит множество вариантов протеазы, содержащих разные замены в одинаковых аминокислотных положениях; b) тестирование вариантов протеазы из SEL и стандартной протеазы по представляющему интерес свойству; c) определение показателя функционирования (PI) для всех тестируемых вариантов протеазы; d) идентификация двух или более аминокислотных положений как неограничивающих, где, по меньшей мере, один из множества вариантов протеазы каждой из двух SEL имеет PI выше 0,5; и f) получение библиотеки множественных мутаций, содержащей совокупность вариантов протеазы с множественными заменами, причем каждый вариант содержит замены в двух или более неограничивающих положениях. В некоторых воплощениях тест включает в себя два или более разных анализов, выбранных из группы, включающей в себя анализ на удаление пятен (с микрообразцов), анализ устойчивости к LAS, анализ устойчивости к детергенту и анализ удельной активности. В некоторых воплощениях протеаза выбрана из группы, включающей в себя бактериальную сериновую протеазу, бактериальный субтилизин и бактериальную нейтральную металлопротеазу.
В других воплощениях настоящее изобретение предлагает способы получения варианта субтилизина Bacillus с множественными заменами, включающие в себя: тестирование множества вариантов субтилизина с одной заменой с помощью первого анализа первого свойства и второго анализа второго свойства, где свойству исходного субтилизина присваивают значение 1,0 в каждом тесте, благоприятное первое или второе свойство имеет значение больше 1,0, а излишне неблагоприятное первое или второе свойство имеет значение менее чем примерно 0,80, или, в некоторых предпочтительных воплощениях, менее чем примерно 0,60; идентификацию замены, по меньшей мере, в одном из вариантов субтилизина с одной заменой, которая связана с благоприятным первым свойством, и которая не связана с излишне неблагоприятным вторым свойством; идентификацию замены, по меньшей мере, в одном из вариантов субтилизина с одной заменой, которая связана с благоприятным вторым свойством, и которая не связана с излишне неблагоприятным первым свойством; и введение замены, идентифицированной на предыдущих стадиях, в субтилизин с получением варианта субтилизина с множественными заменами. В некоторых воплощениях способы дополнительно включают в себя тестирование вариантов субтилизина с множественными заменами с помощью первого анализа и второго анализа, где улучшенный вариант субтилизина достигает значения более 1,0 по результатам как первого, так и второго анализов, значения более 1,0 в первом анализе и значения от 0,80 до 1,0 во втором анализе. В некоторых воплощениях способы дополнительно включают в себя получение улучшенного варианта (вариантов) субтилизина. В некоторых воплощениях, первое и второе свойства имеют отрицательную корреляцию. В некоторых воплощениях благоприятное первое или второе свойство имеет значение больше, чем примерно 1,2. В некоторых воплощениях излишне неблагоприятное первое или второе свойство имеет значение менее чем примерно 0,40. В некоторых воплощениях первое свойство представляет собой стабильность, а второе свойство представляет собой эффективность чистки. В подгруппе данных свойств стабильность включает в себя устойчивость к детергенту, а эффективность чистки включает в себя эффективность удаления крови, молока, чернил (BMI) в детергенте. В некоторых воплощениях исходный бактериальный субтилизин представляет собой зрелую форму субтилизина B. amyloliquefaciens BPN', имеющего аминокислотную последоватлеьность, описанную как SEQ ID NO:2. В других воплощениях исходный бактериальный субтилизин представляет собой зрелую форму субтилизина дикого типа B. lentus GG36, имеющую аминокислотную последовательность, описанную как SEQ ID NO:562, или BPN", содержащий замену Y217L (SEQ ID NO:565), одну или в сочетании с другими модификациями. В некоторых воплощениях настоящего изобретения, эффективность стирки тестируют в порошкообразной или жидкой детергентной композиции, имеющей pH от 5 до 12,0. Предполагается, что порядок стадий не ограничивается точно перечисленным выше, поскольку в настоящем изобретении можно использовать любой подходящий порядок. Однако в некоторых предпочтительных воплощениях более чем примерно 50%, или более чем примерно 65% замен находятся в положениях, составляющих в исходном субтилизине доступную для растворителя поверхность (SAS).
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1A приведена карта pHPLT-VAAcl, а на фиг.1B приведена карта pHPLT-BPN'.
На фиг.2A изображена зависимость чистящей способности BPN'-Y217L CCL в североамериканском стиральном детергенте в отношении BMI от изменения заряда. Подобным образом, на фиг.2B изображена зависимость чистящей способности GG36 CCL в североамериканском стиральном детергенте в отношении BMI от изменения заряда.
На фиг.3A изображена зависимость чистящей способности BPN'-Y217L CCL в западноевропейском жидком стиральном детергенте в отношении BMI от изменения заряда. Подобным образом, на фиг.3B изображена зависимость чистящей способности GG36 CCL в западноевропейском жидком стиральном детергенте в отношении BMI от изменения заряда.
На фиг.4A изображена зависимость чистящей способности BPN'-Y217L CCL в японском порошкообразном стиральном детергенте в отношении BMI от изменения заряда. Подобным образом, на фиг.4B изображена зависимость чистящей способности GG36 CCL в японском порошкообразном стиральном детергенте в отношении BMI от изменения заряда.
На фиг.5A изображена зависимость чистящей способности BPN'-Y217L CCL в детергенте для посудомоечных машин в отношении спекшегося яичного желтка от изменения заряда. Подобным образом, на фиг.5B изображена зависимость чистящей способности GG36 CCL в детергенте для посудомоечных машин в отношении спекшегося яичного желтка от изменения заряда.
На фиг.6 изображена зависимость устойчивости к LAS/EDTA от изменения суммарного заряда по сравнению с исходным BPN'-Y217L, для библиотеки, содержащей 80 вариантов.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает способы получения рекомбинантных белков. Конкретно, настоящее изобретение предлагает способы применения сайт-определяющих библиотек.
На практике обычно нет необходимости выявлять наилучшую последовательность в пространстве белка с целью создания белка, оптимального для конкретного применения. В большинстве применений подлежащей решению проблемой является идентификация, по меньшей мере, одной белковой последовательности, которая характеризуется значением, равным или превышающим минимальное необходимое для ряда свойств значение. Для решения данной проблемы необходима информация о мутациях, оказывающих благоприятное влияние на конкретное свойство, а также информация о мутациях, оказывающих неблагоприятное влияние на одно из целевых свойств. Настоящее изобретение предлагает способы достижения цели путем идентификации положений в белке, изменение которых может привести к улучшению основного свойства и сохранению других свойств в желательных пределах.
Настоящее изобретение предлагает способы определения всех положений белка, участвующих в формировании всех представляющих интерес свойств, путем создания "сайт-определяющих библиотек" по каждому сайту. В предпочтительных воплощениях такие библиотеки содержат 9-19 мутаций в каждом положении и используются для анализа каждого положения на применимость в способах получения рекомбинантных белков и конструировании библиотек. Каждое свойство измеряют по сравнению с исходным ферментом и рассчитывают кажущуюся разницу свободной энергии каждого мутанта и фермента дикого типа. Указанные кажущиеся значения дельта дельта G ("т.е., ΔΔG") используют для определения аддитивности.
Идеальным способом анализа вариантов является определение разницы свободной энергии у варианта и исходного белка в представляющем интерес процессе. Свободную энергию Гиббса для процесса определяют как максимальное количество работы, которую может выполнить система. Изменение свободной энергии по сравнению с исходным ферментом (ΔΔG) рассчитывают по следующей формуле:
ΔΔG = -RT ln(kvariant/kparent)
где kvariant представляет собой константу скорости реакции вариантного фермента, а kparent представляет собой константу скорости реакции исходного фермента, R обозначает газовую постоянную, а T обозначает абсолютную температуру. Большинство анализов не предназначено для определения истинной свободной энергии, поэтому для вычислений авторы используют следующую формулу:
ΔΔG = -RT ln(Pvariant/Pparent)
где Pvariant представляет собой рабочую характеристику варианта, а Pparent представляет собой рабочую характеристику исходного фермента, измеренные в одинаковых условиях. Можно ожидать, что с точки зрения распределения и аддитивности данных значения ΔΔGapp ведут себя так же, как и значения ΔΔG. Однако, поскольку ΔΔG представляет собой максимальное количество работы, которое может совершить вариант по сравнению с исходным ферментом, величина ΔΔGapp, как правило, может быть ниже, чем величина ΔΔG, свидетельствуя о том, что результаты могут быть синергическими, поскольку свойства двух аддитивных положений могут быть выше, чем значение, полученное путем сложения значений ΔΔGapp.
Способы настоящего изобретения можно использовать для получения эффективных библиотек, которые используют для разработки нескольких свойств одновременно. Хотя некоторые ферменты описаны в данном документе, указанные способы можно использовать в применении к любому белку, представляющему интерес с точки зрения генной инженерии. Сайт-определяющие библиотеки (SEL) получают по способам, описанным в данном документе, путем введения от 12 до 19 замен по каждому положению. Полученные мутации анализируют с помощью анализов активности и стабильности. Для каждого положения в качестве точки сравнения приведена аминокислота дикого типа. Для каждого свойства исходного фермента определяют значение и стандартное отклонение ΔΔGapp. Значение, полученное для исходного фермента (µparent), нормализуют по 0 и определяют стандартное отклонение (σparent) для ΔΔGap. Указанные значения используют для сравнения при измерении каждого свойства по каждому положению молекулы. Результаты определения сайтов анализируют на доказательство корреляции свойств. Строят графики зависимости значений ΔΔGapp одного свойства от значений ΔΔGapp другого свойства и рассчитывают коэффициенты корреляции. Наблюдают корреляцию двух активностей в отношении субстратов двух белков.
Для анализа положений аминокислотной последовательности определяют два типа сайтов. "Непродуктивные" сайты не содержат мутаций, отвечающих за улучшение свойства по сравнению с исходным ферментом, тогда как "продуктивные" сайты содержат, по меньшей мере, одну замену, приводящую к улучшению свойства по сравнению с исходным ферментом. Вероятность того, что сайт является продуктивным, определяют путем деления числа продуктивных сайтов на общее число сайтов. Хотя вероятность того, что какая-либо мутация приводит к улучшению по сравнению с исходным ферментом, является низкой (т.е., 6%-28%), вероятность того, что заданный сайт содержит, по меньшей мере, одну повышающую мутацию, является очень высокой.
Важно определить взаимосвязь распределения продуктивных и непродуктивных сайтов и структурных признаков (таких как спрятанные аминокислоты, взаимодействующие аминокислоты, положения вблизи активного центра и др.) протеазы, а также консервативные или изменяемые в процессе эволюции участки последовательности. Такое определение проводят путем анализа структуры и сравнения последовательности с основными гомологами.
Как указано в примерах, мутации, оказывающие вредное влияние на одно свойство, коррелируют с мутациями, оказывающими вредное влияние на другое свойство, независимо от соотношения свойств. Только в небольшом числе положений (5-10%) могут присутствовать мутации, оказывающие вредное влияние на все свойства. Такие положения определяют "укладку" и являются консервативными с точки зрения эволюции. Значение данного явления заключается в том, что, в отличие от идентификации улучшающих мутаций, которая требует применения, в сущности, предсказательного скрининга по данному свойству, идентификацию мутаций, которые предположительно оказывают вредное влияние на какое-либо свойство, можно проводить с помощью любого скрининга. Упрощенная стратегия получения рекомбинантных белков включает в себя конструирование SEL и скрининг с использованием простых анализов активности и/или стабильности. Идентифицируют вредные мутации и затем положения, в которых может присутствовать несколько вредных мутаций, используют для получения библиотек и комбинаторных мутаций с улучшением нескольких свойств. Кроме того, выбор участков, которые находятся на поверхности белка, взаимодействуют с немногими другими элементами и являются вариабельными по результатам выравнивая последовательностей, позволяет достичь высокого соотношения продуктивных сайтов. Участки, которые находятся во внутренней части молекулы, контактируют с многими другими элементами и являются высоко консервативными с точки зрения эволюции, характеризуются высокой вероятностью вредных мутаций, поэтому их следует избегать. Подразумевается, что в настоящем изобретении можно использовать любой подходящий способ анализа последовательности и/или информации о структуре, включающий в себя, без ограничения, компьютерные и/или электронные методы и/или программы.
Способы позволяют проводить попарное сравнение ряда вариантов, активность которых составляет более 5% масс. и менее 5% для каждого из двух свойств, и определять коэффициенты корреляции для двух свойств.
Получение библиотек
В некоторых особенно предпочтительных воплощениях результаты применения сайт-определяющих библиотек используют для получения комбинаторных библиотек. Традиционная направленная эволюция включает в себя получение статистических библиотек и скрининг большого числа библиотек по отдельным свойствам, объединение указанных процессов и их повторение. Несколько исследователей обнаружили (см., например, Bloom et al, Curr. Opin. Struct. Biol., 15:447-452 [2005]; Bloom et al., Proc. Natl. Acad. Sci. USA 103:5869-5874 [2006]; и Guo et al., Proc. Natl. Acad. Sci. USA 101:9205-9210 [2004]), что накопление положительных мутаций по одному свойству обычно приводит к ухудшению других свойств. Вероятность того, что какая-либо мутация будет приводить к улучшению какого-либо свойства, является низкой, вероятность того, что мутация будет ухудшающей, является высокой (>85%), а вероятность того, что накопление более трех (3) мутаций, увеличивающих активность, будет приводить к ухудшению нескольких других свойств, является очень высокой. Данную проблему можно избежать путем использования сайт-определяющих данных для построения библиотек, обладающих несколькими улучшенными свойствами. Непродуктивные участки не используют для создания комбинаторных библиотек, а продуктивные участки дополнительно классифицируют по проценту улучшающих мутаций.
Чистящие композиции
Чистящие композиции настоящего изобретения предпочтительно используют, например, для стирки, чистки твердых поверхностей, в качестве средств для посудомоечных машин, а также в качестве косметических средств, например, для зубных протезов, зубов, волос и кожи. Однако благодаря уникальным преимуществам, заключающимся в повышенной эффективности в растворах при пониженной температуре, ферменты настоящего изобретения идеально подходят для стирки. Кроме того, ферменты настоящего изобретения можно использовать в составе как гранулярных, так и жидких композиций.
Вариантные протеазы настоящего изобретения также можно использовать в качестве вспомогательных продуктов для стиральных средств. В некоторых воплощениях используют чистящие композиции, эффективные в растворе при низких температурах. Вспомогательный продукт может включать в себя, в простейшей форме, одну или несколько протеаз. В некоторых воплощениях вспомогательный продукт вводят в состав лекарственного средства, предназначенного для добавления в процесс чистки. В настоящем изобретении также можно использовать любые подходящие стандартные лекарственные формы, включающие в себя, без ограничения, пилюли, таблетки, капсулы или другие формы, такие как дозированные порошки или жидкости. В некоторых воплощениях, чтобы увеличить объем такой композиции, в ее состав вводят наполнитель (наполнители) или носитель (носители). Подходящие наполнители или носители включают в себя, без ограничения, разные соли, такие как сульфаты, карбонаты и силикаты, а также тальк, глину и т.п. Подходящие наполнители или носители для жидких композиций включают в себя, без ограничения, воду или низкомолекулярные первичные и вторичные спирты, в том числе полиолы и диолы. Примеры таких спиртов включают в себя, без ограничения, метанол, этанол, пропанол и изопропанол. В некоторых воплощениях композиции содержат примерно от 5% до 90% таких веществ. Кислые наполнители используют для уменьшения pH. Альтернативно чистящие добавки включают в себя дополнительные ингредиенты, которые более подробно описаны ниже.
Чистящие композиции и чистящие добавки настоящего изобретения содержат эффективное количество, по меньшей мере, одного из описанных здесь вариантов протеаз, используемого отдельно или в сочетании с другими протеазами и/или другими ферментами. Требуемый уровень фермента достигают путем добавления одного или нескольких вариантов протеаз настоящего изобретения. Как правило, чистящие композиции настоящего изобретения содержат, по меньшей мере, примерно 0,0001 массовый процент, примерно от 0,0001 до 1, примерно от 0,001 до 0,5, или даже примерно от 0,01 до 0,1 массового процента, по меньшей мере, одной из вариантных протеаз настоящего изобретения.
Описанные в данном документе чистящие композиции обычно получают с учетом того, что при проведении операций водной чистки моечная вода имеет pH примерно от 5,0 до 11,5 или даже примерно от 7,5 до 10,5. pH неразбавленных жидких композиций обычно составляет примерно от 3,0 до 9,0 или даже примерно от 3 до 5. Гранулярные стиральные средства обычно имеют pH примерно от 9 до 11. Способы поддерживания pH на рекомендуемом уровне хорошо известны специалистам в данной области и включают в себя применение буферов, щелочей, кислот и др.
Подходящие чистящие композиции с низкими значениями pH в неразбавленном виде обычно имеют значение pH примерно от 3 до 5, и, как правило, не содержат поверхностно-активных веществ, которые гидролизуются в указанном диапазоне pH. Такие поверхностно-активные вещества включают в себя соединения на основе алкилсульфата натрия, которые содержат, по меньшей мере, один этиленоксидный фрагмент, или даже примерно от 1 до 16 молей этиленоксида. Указанные чистящие композиции обычно содержат количество модификатора pH, такого как гидроксид натрия, моноэтаноламин или хлористоводородная кислота, достаточное для обеспечения pH неразбавленной чистящей композиции примерно от 3 до 5. Такие композиции обычно содержат, по меньшей мере, один кислотоустойчивый фермент. В некоторых воплощениях композиции являются жидкими, а в других воплощениях они находятся в твердом виде. pH жидкой композиции обычно измеряют в неразбавленном виде. pH твердой композиции измеряют в виде 10% раствора указанной композиции в дистиллированной воде. В данных воплощениях все измерения pH проводят при 20°C.
В некоторых воплощениях, если вариантную протеазу (вариантные протеазы) используют в составе гранулярной или жидкой композиции, желательно, чтобы вариантная протеаза была заключена в капсулу, защищающую ее от других компонентов гранулярной композиции в процессе хранения. Кроме того, заключение в капсулу позволяет контролировать доступность вариантной протеазы в процессе чистки. В некоторых воплощениях инкапсулирование повышает эффективность вариантной протеазы (вариантных протеаз) и/или других ферментов. В данной связи, вариантные протеазы настоящего изобретения заключают в капсулу с использованием любого подходящего известного в данной области капсулирующего вещества. В некоторых воплощениях в капсулу обычно заключают, по меньшей мере, часть катализатора вариантной протеазы (вариантных протеаз) настоящего изобретения. Как правило, капсулирующее вещество способно растворяться и/или диспергироваться в воде. В некоторых воплощениях температура стеклования (Тс) капсулирующего вещества составляет 0°C или выше. Температура стеклования описана более подробно в WO 97/11151. Капсулирующее вещество выбирают из группы, включающей в себя углеводы, природные или синтетические камеди, хитин, хитозан, целлюлозу и производные целлюлозы, силикаты, фосфаты, бораты, поливиниловый спирт, полиэтиленгликоль, парафиновые воски и их сочетания. Если капсулирующее вещество представляет собой углевод, его обычно выбирают из моносахаридов, олигосахаридов, полисахаридов и их сочетаний. Обычно капсулирующее вещество представляет собой крахмал. Подходящие крахмалы описаны в EP 0922499; US 4977252; US 5354559 и US 5935826. В некоторых воплощениях капсулирующее вещество представляет собой микросферу, полученную из пластика, такого как термопластмассы, акрилонитрил, метакрилонитрил, полиакрилонитрил, полиметакрилонитрил и их смеси; подходящие коммерчески доступные микросферы включают в себя поставляемые EXPANCEL® (Stockviksverken, Sweden) и PM 6545, PM 6550, PM 7220, PM 7228, EXTENDOSPHERES®, LUXSIL®, Q-CEL® и SPHERICEL® (PQ Corp., Valley Forge, PA)
Как описано в данном документе, вариантные протеазы настоящего изобретения можно использовать, в частности, в чистящей промышленности, в том числе, без ограничения, в составе стиральных средств и детергентов для мытья посуды. При таком применении ферменты находятся под воздействием разных условий окружающей среды. Вариантные протеазы настоящего изобретения обладают преимуществами по сравнению со многими используемыми в настоящее время ферментами, которые заключаются в стабильности при разных условиях.
В действительности существуют разные условия стирки, воздействию которых подвергаются участвующие в стирке протеазы, указанные условия включают в себя состав детергентной композиции, объем моечной воды, температуру моечной воды и продолжительность стирки. Кроме того, детергентные композиции, используемые в разных географических регионах, обеспечивают разные концентрации соответствующих компонентов в моечной воде. Например, европейский детергент обычно обеспечивает примерно 4500-5000 м.д. компонентов детергента в моечной воде, тогда как японский детергент обычно обеспечивает примерно 667 м.д. компонентов детергента в моечной воде. В Северной Америке, в особенности в Соединенных Штатах, детергенты обычно обеспечивают примерно 975 м.д. компонентов детергента в моечной воде.
Система с низкой концентрацией детергента включает в себя детергенты, которые обеспечивают менее чем примерно 800 м.д. компонентов детергента в моечной воде. Японские детергенты, как правило, представляют собой системы с низкой концентрацией детергента, поскольку они обеспечивают примерно 667 м.д. компонентов детергента в моечной воде.
Система со средней концентрацией детергента включает в себя детергенты, которые обеспечивают примерно от 800 м.д. до 2000 м.д. компонентов детергента в моечной воде. Детергенты Северной Америки, как правило, считаются системами со средней концентрацией детергента, поскольку они обеспечивают примерно 975 м.д. компонентов детергента в моечной воде. Бразильские детергенты обычно обеспечивают примерно 1500 м.д. компонентов детергента в моечной воде.
Система с высокой концентрацией детергента включает в себя детергенты, которые обеспечивают более чем примерно 2000 м.д. компонентов детергента в моечной воде. Европейские детергенты, как правило, считаются системами с высокой концентрацией детергента, поскольку они обеспечивают примерно 4500-5000 м.д. компонентов детергента в моечной воде.
Детергенты Латинской Америки, которые обычно содержат фосфатные компоненты и характеризуются высоким пенообразованием, можно классифицировать и как системы со средней, и как системы с высокой концентрацией детергента, поскольку они обеспечивают от 1500 до 6000 м.д. компонентов детергента в моечной воде. Как указано выше, бразильский детергент обычно обеспечивают примерно 1500 м.д. компонентов детергента в моечной воде. Однако в других географических регионах, не ограничивающихся странами Латинской Америки, могут выпускаться детергенты, содержащие фосфатные компоненты и характеризующиеся высоким пенообразованием, которые представляют собой системы с высокой концентрацией детергента и обеспечивают до 6000 м.д. компонентов детергента в моечной воде.
В свете вышесказанного, очевидно, что концентрации детергентных компонентов в типичных моечных растворах разных стран варьируют от менее 800 м.д. ("географические разновидности с низкой концентрацией детергента"), например, примерно 667 м.д. в Японии, до примерно 800-2000 м.д. ("географические разновидности со средней концентрацией детергента"), например, примерно 975 м.д. в США и примерно 1500 м.д. в Бразилии, и до более чем примерно 2000 м.д. ("географические разновидности с высокой концентрацией детергента"), например, примерно от 4500 до 5000 м.д. в Европе и примерно 6000 м.д. в географических разновидностях, которые содержат фосфатные компоненты и характеризуются высоким пенообразованием.
Концентрации в типичных моечных растворах определяют эмпирически. Например, в США типичная стиральная машина вмещает примерно 64,4 л моечного раствора. Соответственно, чтобы получить концентрацию детергента в моечном растворе примерно 975 м.д., к 64,4 л моечного раствора нужно добавить примерно 62,79 г детергентной композиции. Данное количество потребитель обычно отмеряет в моечный раствор с помощью мерной чашки, поставляемой вместе с детергентом.
С другой стороны, в разных географических регионах используют разные температуры стирки. В Японии обычно используют более низкую температуру моечной воды, чем в Европе. Например, в Северной Америке и Японии температура моечной воды обычно составляет примерно от 10 до 30°C (например, примерно 20°C), тогда как в Европе температура моечной воды обычно составляет примерно от 30 до 60°C (например, примерно 40°C).
В другом примере, в разных географических регионах вода имеет разную жесткость. Жесткость воды обычно описывают в пересчете на количество смешанных гран Ca2+/Mg2+ на галлон. Жесткость воды представляет собой меру количества кальция (Ca2+) и магния (Mg2+) в воде. Большая часть воды в Соединенных Штатах является жесткой, однако степень жесткости варьирует. Вода с жесткостью от средней (60-120 м.д.) до высокой (121-181 м.д.) содержит от 60 до 181 частей на миллион (части на миллион превращают в граны на галлон США путем деления м.д. # на 17,1) придающих жесткость минералов.
Жесткость европейской воды обычно составляет более 10,5 (например 10,5-20,0) смешанных гран Ca2+/Mg2+ на галлон (например, примерно 15 смешанных гран Ca2+/Mg2+ на галлон). Жесткость воды в Северной Америке обычно больше, чем жесткость воды в Японии, но меньше, чем жесткость воды в Европе. Например, жесткость воды в Северной Америке может составлять от 3 до 10 гран, 3-8 гран или примерно 6 гран. Жесткость воды в Японии, как правило, ниже, чем жесткость воды в Северной Америке, обычно она составляет менее 4, например, 3 смешанных грана Ca2+/Mg2+ на галлон.
Соответственно, в некоторых воплощениях настоящее изобретение предлагает вариантные протеазы, которые демонстрируют неожиданные рабочие характеристики при стирке, по меньшей мере, в одном наборе условий (включающих в себя температуру воды, жесткость воды и/или концентрацию детергента). В некоторых воплощениях вариантные протеазы настоящего изобретения сравнимы по характеристикам стирки с другими субтилизиновыми протеазами. В некоторых воплощениях вариантные протеазы настоящего изобретения обладают улучшенными характеристиками стирки по сравнению с коммерчески доступными в настоящее время субтилизиновыми протеазами. Так, в некоторых предпочтительных воплощениях настоящего изобретения предлагаются вариантные протеазы, которые обладают повышенной устойчивостью к окислению, повышенной термостабильностью и/или повышенной устойчивостью к хелатирующим агентам. Кроме того, вариантные протеазы настоящего изобретения можно использовать для получения чистящих композиций, которые не содержат детергенты, опять же, сами по себе или в сочетании с моющими компонентами и стабилизаторами.
В некоторых воплощениях настоящего изобретения чистящие композиции содержат, по меньшей мере, одну вариантную протеазу настоящего изобретения в количестве, составляющем от примерно 0,00001% до примерно 10% по отношению к массе композиции, и остальную часть (например, составляющую от примерно 99,999% до примерно 90,0% по отношению к массе композиции), включающую в себя вспомогательные чистящие вещества. В других аспектах настоящего изобретения чистящие композиции настоящего изобретения содержат, по меньшей мере, одну вариантную протеазу в количестве, составляющем от примерно 0,0001% до примерно 10%, от примерно 0,001% до примерно 5%, от примерно 0,001% до примерно 2%, от примерно 0,005% до примерно 0,5% по отношению к массе композиции, и остальную часть чистящей композиции (например, составляющую от примерно 99,9999% до примерно 90,0%, от примерно 99,999% до примерно 98%, от примерно 99,995% до примерно 99,5% по массе) включающую в себя вспомогательные чистящие вещества.
В некоторых воплощениях предпочтительные чистящие композиции помимо одной или более описанных здесь вариантных протеаз содержат один или более других ферментов или производных ферментов, которые обеспечивают улучшение характеристик чистки и/или ухода за тканью. Такие ферменты включают в себя, без ограничения другие протеазы, липазы, кутиназы, амилазы, целлюлазы, пероксидазы, оксидазы (например, лакказы) и/или манназы.
В композициях настоящего изобретения можно использовать любые другие подходящие протеазы. Подходящие протеазы включают в себя животные, растительные или микробные протеазы. В некоторых особенно предпочтительных воплощениях используют микробные протеазы. В некоторых воплощениях используют химически или генетически модифицированные мутанты. В некоторых воплощениях протеаза представляет собой сериновую протеазу, предпочтительно щелочную микробную протеазу или трипсиноподобную протеазу. Примеры щелочных протеаз включают в себя субтилизины, в особенности, полученные из Bacillus (например, субтилизин, lentus, amyloliquefaciens, субтилизин Carlsberg, субтилизин 309, субтилизин 147 и субтилизин 168). Другие примеры включают в себя мутантные протеазы, описанные в патентах США №№ RE 34606, 5955340, 5700676, 6312936 и 6482628, которые включены в настоящее описание в качестве ссылки. Другие примеры протеаз включают в себя, без ограничения, трипсин (например, свиной или бычий) и протеазу Fusarium, описанную в WO 89/06270. Предпочтительные коммерчески доступные ферменты-протеазы включают в себя MAXATASE®, MAXACALTM, MAXAPEMTM, OPTICLEAN®, OPTIMASE®, PROPERASE®, PURAFECT® и PURAFECT® OXP (Genencor); ALCALASE®, SAVINASE®, PRIMASE®, DURAZYMTM, RELASE® и ESPERASE® (Novozymes); и BLAPTM (Henkel Kommanditgesellschaft auf Aktien, Duesseldorf, Germany). Разные протеазы описаны в WO95/23221, WO 92/21760 и патентах США №№ 5801039, 5340735, 5500364, 5855625, US RE 34606, 5955340, 5700676, 6312936 и 6482628, а также в других патентах.
Кроме того, в настоящем изобретении можно использовать любую подходящую липазу. Подходящие липазы включают в себя, без ограничения, бактериальные или грибковые ферменты. В объем настоящего изобретения входят химически или генетически модифицированные мутантные формы. Примеры подходящих липаз включают в себя липазу Humicola lanuginosa (см., например, EP 258068 и EP 305216), липазу Rhizomucor miehei (см., например, EP 238023), липазу Candida lipase, такую как липаза C. antarctica (например, липаза C. antarctica A или B; см., например, EP 214761), липазу Pseudomonas, такую как липаза P. alcaligenes и P. pseudoalcaligenes (см., например, EP 218272), липазу P. cepacia (см., например, EP 331376), липазу P. stutzeri (см., например, GB 1372034), липазу P. fluorescens, липазу Bacillus (например, липазу B. subtilis [Dartois et al., Biochem. Biophys. Acta 1131:253-260 [1993]); липазу B. stearothermophilus [см., например, JP 64/744992]; и липазу B. pumilus [см., например, WO 91/16422]).
Кроме того, в некоторых воплощениях настоящего изобретения можно использовать ряд клонированных липаз, включающих в себя, без ограничения, липазу Penicillium camembertii (см., Yamaguchi et al., Gene 103:61-67 [1991]), липазу Geotricum candidum (см., Schimada et al, J. Biochem., 106:383-388 [1989]), и разные липазы Rhizopus, такие как липаза R. delemar (см., Hass et al, Gene 109:117-113 [1991]), липазу SL R. niveus (Kugimiya et al., Biosci. Biotech. Biochem. 56:716-719 [1992]) и липазу R. oryzae.
В некоторых воплощениях настоящего изобретения также можно использовать и другие типы липолитических ферментов, таких как кутиназы, которые включают в себя, без ограничения, кутиназу, полученную из Pseudomonas mendocina (см., WO 88/09367), и кутиназу, полученную из Fusarium solani pisi (см., WO 90/09446).
Другие подходящие липазы включают в себя коммерчески доступные ферменты, такие как MI LIPASETM, LUMA FASTTM и LIPOMAXTM (Genencor); LIPOLASE® и LIPOLASE® ULTRA (Novozymes); а также LIPASE PTM "Amano" (Amano Pharmaceutical Co. Ltd., Japan).
В некоторых воплощениях настоящего изобретения чистящие композиции дополнительно содержат липазы в количестве, составляющем от примерно 0,00001% до примерно 10% дополнительной липазы по отношению к массе композиции, где остальную часть массы композиции дополняют вспомогательные чистящие вещества. В других аспектах настоящего изобретения чистящие композиции дополнительно содержат липазы в количестве, составляющем от примерно 0,0001% до примерно 10%, от примерно 0,001% до примерно 5%, от примерно 0,001% до примерно 2%, от примерно 0,005% до примерно 0,5% по отношению к массе композиции.
В некоторых воплощениях настоящего изобретения также можно использовать любые амилазы (альфа и/или бета), подходящие для применения в щелочных растворах. Подходящие амилазы включают в себя, без ограничения, ферменты бактериального или грибкового происхождения. Некоторые воплощения охватывают применение химически или генетически модифицированных мутантных форм. Амилазы, подходящие для применения в настоящем изобретении, включают в себя, без ограничения, α-амилазы, полученные из B. licheniformis (см., например, GB 1296839). Коммерчески доступные амилазы, подходящие для применения в настоящем изобретении, включают в себя, без ограничения DURAMYL®, TERMAMYL®, FUNGAMYL® и BANTM (Novozymes), а также RAPIDASE® и MAXAMYL® P (Genencor).
В некоторых воплощениях настоящего изобретения чистящие композиции дополнительно содержат амилазы в количестве, составляющем от примерно 0,00001% до примерно 10% дополнительной амилазы по отношению к массе композиции, где остальную часть массы композиции дополняют вспомогательные чистящие вещества. В других аспектах настоящего изобретения чистящие композиции настоящего изобретения дополнительно содержат амилазы в количестве, составляющем от примерно 0,0001% до примерно 10%, от примерно 0,001% до примерно 5%, от примерно 0,001% до примерно 2%, от примерно 0,005% до примерно 0,5% по отношению к массе композиции.
В некоторых других воплощениях чистящие композиции настоящего изобретения могут содержать любые подходящие целлюлазы. Подходящие целлюлазы включают в себя, без ограничения, ферменты бактериального или грибкового происхождения. Некоторые воплощения охватывают применение химически или генетически модифицированных мутантных форм. Подходящие целлюлазы включают в себя, без ограничения, целлюлазы Humicola insolens (см., например, патент США № 4435307). Особенно предпочтительными являются целлюлазы, которые лучше обеспечивают сохранение цвета (см., например, EP 0495257). Коммерчески доступные целлюлазы, пригодные для применения в настоящем изобретении, включают в себя, без ограничения, CELLUZYME® (Novozymes) и KAC-500(B)TM (Kao Corporation). В некоторых воплощениях целлюлазы используют в виде частей или фрагментов зрелых целлюлаз дикого типа или вариантных целлюлаз, из которых удалена часть N-конца (см., например, патент США № 5874276). В некоторых воплощениях чистящие композиции настоящего изобретения дополнительно содержат целлюлазы в количестве, составляющем от примерно 0,00001% до примерно 10% дополнительной целлюлазы по отношению к массе композиции, где остальную часть массы композиции дополняют вспомогательные чистящие вещества. В других аспектах настоящего изобретения чистящие композиции настоящего изобретения дополнительно содержат целлюлазы в количестве, составляющем от примерно 0,0001% до примерно 10%, от примерно 0,001% до примерно 5%, от примерно 0,001% до примерно 2%, от примерно 0,005% до примерно 0,5% по отношению к массе композиции.
В детергентных композициях настоящего изобретения также можно использовать любые подходящие маннаназы. Подходящие маннаназы включают, без ограничения, ферменты бактериального или грибкового происхождения. Некоторые воплощения охватывают применение химически или генетически модифицированных мутантных форм. Известны разные маннаназы, которые можно использовать в настоящем изобретении (см., например, патент США № 6566114, патент США № 6602842 и патент США № 6440991, которые включены в данное описание в качестве ссылки). В некоторых воплощениях чистящие композиции настоящего изобретения дополнительно содержат маннаназы в количестве, составляющем от примерно 0,00001% до примерно 10% дополнительной маннаназы по отношению к массе композиции, где остальную часть массы композиции дополняют вспомогательные чистящие вещества. В других аспектах настоящего изобретения чистящие композиции настоящего изобретения дополнительно содержат маннаназы в количестве, составляющем от примерно 0,0001% до примерно 10%, от примерно 0,001% до примерно 5%, от примерно 0,001% до примерно 2%, от примерно 0,005% до примерно 0,5% по отношению к массе композиции.
В некоторых воплощениях в состав композиций настоящего изобретения входят пероксидазы, которые можно использовать в сочетании с пероксидом водорода или его источником (таким как перкарбонат, перборат или персульфат). В некоторых альтернативных воплощениях используют оксидазы в сочетании с кислородом. Оба типа ферментов используют для "обесцвечивания раствора" (т.е., для предотвращения переноса текстильного красителя с окрашенной ткани на другую ткань, если указанные ткани стирают вместе в моющем растворе), предпочтительно в сочетании со средством, повышающим эффективность (см., например, WO 94/12621 и WO 95/01426). Подходящие пероксидазы/оксидазы включают, без ограничения, ферменты растительного, бактериального или грибкового происхождения. Некоторые воплощения охватывают применение химически или генетически модифицированных мутантных форм. В некоторых воплощениях чистящие композиции настоящего изобретения дополнительно содержат пероксидазы и/или оксидазы в количестве, составляющем от примерно 0,00001% до примерно 10% дополнительной пероксидазы и/или оксидазы по отношению к массе композиции, где остальную часть массы композиции дополняют вспомогательные чистящие вещества. В других аспектах настоящего изобретения чистящие композиции настоящего изобретения дополнительно содержат пероксидазы и/или оксидазы в количестве, составляющем от примерно 0,0001% до примерно 10%, от примерно 0,001% до примерно 5%, от примерно 0,001% до примерно 2%, от примерно 0,005% до примерно 0,5% по отношению к массе композиции.
В некоторых воплощениях можно использовать другие ферменты, включающие в себя, без ограничения, пергидролазы (см., например, WO 05/056782). Кроме того, некоторые особенно предпочтительные воплощения охватывают применение смесей вышеупомянутых ферментов, например, одной или более других протеаз, амилаз, липаз, маннаназ и/или, по меньшей мере, одной целлюлазы. Действительно, предполагается, что в настоящем изобретении можно использовать разные смеси указанных ферментов. Также предполагается, что уровни вариантной протеазы (вариантных протеаз) и одного или более других ферментов могут независимо варьировать до 10%, где массу чистящей композиции дополняют вспомогательные чистящие вещества. Конкретные вспомогательные чистящие вещества можно легко выбрать с учетом подлежащих чистке поверхностей, изделий или тканей, а также формы композиции, желательной для условий чистки, присутствующих во время применения (таких как применение моющего детергента).
Примеры подходящих вспомогательных чистящих веществ включают в себя, без ограничения, поверхностно-активные вещества, моющие компоненты, отбеливающие средства, активаторы отбеливания, катализаторы отбеливания, другие ферменты, системы, стабилизирующие ферменты, хелатирующие средства, оптические отбеливатели, грязеудаляющие полимеры, средства, ингибирующие перенос красителя, диспергирующие средства, средства, подавляющие пенообразование, красители, отдушки, пигменты, используемые в качестве наполнителей соли, гидротропные вещества, светочувствительные средства, флуоресцирующие вещества, кондиционеры для тканей, гидролизуемые поверхностно-активные вещества, консерванты, антиоксиданты, противоусадочные средства, разглаживающие средства, гермициды, фунгициды, средства для удаления пятен, серебро-содержащие средства для ухода за тканью, средства от потускнения и/или антикоррозийные средства, источники щелочности, солюбилизирующие средства, носители, технологические добавки, пигменты и средства, регулирующие pH (см., например, патенты США №№ 6610642, 6605458, 5705464, 5710115, 5698504, 5695679, 5686014 и 5646101, которые включены в данное описание в качестве ссылки). Воплощения конкретных чистящих композиций подробно описаны ниже. Если вспомогательные чистящие вещества не совместимы с вариантными протеазами настоящего изобретения в чистящих композициях, то используют способы, в которых вспомогательные чистящие вещества и протеазу (протеазы) держат отдельно (т.е., они не контактируют друг с другом) до объединения при необходимости двух компонентов. Такие способы раздельного применения включают в себя любые подходящие известные в данной области способы (например, применение капсул, капсулирование, применение таблеток, физическое разделение и др.).
В некоторых предпочтительных воплощениях эффективное количество одной или нескольких вариантных протеаз, описанных в данном документе, вводят в состав композиций, используемых для чистки разных поверхностей, нуждающихся в удалении белковых пятен. Такие чистящие композиции включают в себя композиции для чистки твердых поверхностей, тканей и посуды. Действительно, в некоторых воплощениях настоящее изобретение предлагает композиции для чистки тканей, тогда как в других воплощениях настоящее изобретение предлагает композиции для чистки изделий, отличных от тканей. Следует отметить, что настоящее изобретение предлагает чистящие композиции для личной гигиены, в том числе чистящие композиции для ухода за полостью рта (включающие в себя средства для чистки зубов, зубные пасты, жидкости для полоскания рта и др., а также композиции для чистки зубных протезов), кожей и волосами. Подразумевается, что настоящее изобретение охватывает детергентные композиции в любой форме (например, в виде жидкостей, гранул, брусков, полутвердых веществ, гелей, эмульсий, таблеток, капсул и др.).
В качестве примера ниже более подробно описаны некоторые чистящие композиции, в состав которых могут входить вариантные протеазы настоящего изобретения. Чистящие композиции настоящего изобретения, предназначенные для применения в стиральных машинах, предпочтительно содержат, по меньшей мере, одно поверхностно-активное вещество и, по меньшей мере, один моющий компонент, а также одно или более чистящих вспомогательных средств, предпочтительно выбранных из органических полимерных соединений, отбеливающих средств, других ферментов, средств, подавляющих пенообразование, диспергирующих средств, диспергирующих средств на основе известкового мыла, средств, препятствующих суспендированию и повторному осаждению грязи, и ингибиторов коррозии. В некоторых воплощениях стиральные композиции также содержат смягчающие средства (в качестве других вспомогательных чистящих средств). Композиции настоящего изобретения также можно использовать в качестве моющих добавок в твердом или жидком виде. Такие добавки предназначаются для дополнения и/или усиления действия традиционных детергентных композиций, их можно добавлять на любой стадии процесса чистки. В некоторых воплощениях плотность композиций стиральных средств настоящего изобретения варьирует от примерно 400 до примерно 1200 г/литр, тогда как в других воплощениях она варьирует от примерно 500 до примерно 950 г/литр при 20°C.
В отдельных воплощениях композиции настоящего изобретения, предназначенные для мытья посуды вручную, содержат, по меньшей мере, одно поверхностно-активное вещество и, предпочтительно, по меньшей мере, одно другое вспомогательное чистящее средство, выбранное из органических полимерных соединений, средств, повышающих пенообразование, ионов металлов II группы, растворителей, гидротропов и других ферментов.
В некоторых воплощениях в сочетании с вариантными протеазами настоящего изобретения можно использовать разные чистящие композиции, например, описанные в патенте США № 6605458. Так, в некоторых воплощениях композиция, содержащая, по меньшей мере, одну вариантную протеазу настоящего изобретения, представляет собой гранулярную композицию для чистки тканей, а в других воплощениях композиция представляет собой гранулярную композицию для чистки тканей, используемую для стирки окрашенных тканей, в следующих воплощениях композиция представляет собой гранулярную композицию для чистки тканей, которая обеспечивает смягчение на всем объеме стирки, в других воплощениях композиция представляет собой жидкую композицию для чистки тканей в тяжелых условиях. В некоторых воплощениях композиции, содержащие, по меньшей мере, одну вариантную протеазу настоящего изобретения, представляют собой композиции для чистки тканей, например, описанные в патентах США №№ 6610642 и 6376450. Кроме того, вариантные протеазы настоящего изобретения можно использовать для получения композиций гранулярных стиральных средств, в особенности пригодных для применения в условиях стирки, присутствующих в Европе или Японии (см., например, патент США № 6610642).
В некоторых альтернативных воплощениях настоящее изобретение предлагает композиции для чистки твердых поверхностей, содержащие, по меньшей мере, одну вариантную протеазу, описанную в данном документе. Так, в некоторых воплощениях композиция, содержащая, по меньшей мере, одну вариантную протеазу настоящего изобретения, представляет собой композицию для чистки твердых поверхностей, например, одну из описанных в патентах США №№ 6610642, 6376450 и 6376450.
В следующих воплощениях настоящее изобретение предлагает композиции для мытья посуды, содержащие, по меньшей мере, одну вариантную протеазу, описанную в данном документе. Так, в некоторых воплощениях композиция, содержащая, по меньшей мере, одну вариантную протеазу настоящего изобретения, представляет собой композицию для чистки твердых поверхностей, например, одну из описанных в патентах США №№ 6610642 и 6376450. В других воплощениях настоящее изобретение предлагает композиции для мытья посуды, содержащие, по меньшей мере, одну вариантную протеазу, описанную в данном документе. В некоторых воплощениях композиции, содержащие, по меньшей мере, одну вариантную протеазу настоящего изобретения, включают в себя композиции для ухода за полостью рта, такие как описанные в патентах США №№ 6376450 и 6376450. Композиции, соединения и вспомогательные чистящие вещества, описанные в вышеуказанных патентах США №№ 6376450, 6605458, 6605458 и 6610642, можно использовать в сочетании с описанными в данном документе вариантными протеазами.
Чистящие композиции настоящего изобретения получают в виде любых подходящих форм с помощью любых способов, выбранных специалистом в данной области, неограничивающие примеры которых описаны в патентах США №№ 5879584, 5691297, 5574005, 5569645, 5565422, 5516448, 5489392 и 5486303, включенных в данное описание в качестве ссылки. Чистящую композицию с низким значением pH получают путем доведения pH с помощью такого вещества, как моноэтаноламин, или кислого вещества, такого как HCl.
Ниже приведен неограничивающий список вспомогательных средств, подходящих для получения описанных здесь чистящих композиций, хотя в целях настоящего изобретения их применение не является обязательным. В некоторых воплощениях указанные вспомогательные средства вводят в состав композиций с целью обеспечения или повышения эффективности чистки, для обработки подлежащей чистке основы, или для модификации эстетических характеристик чистящей композиции, как в случае ароматизирующих средств, красителей, пигментов и т.п. Очевидно, что такие вспомогательные средства добавляют к вариантным протеазам настоящего изобретения. Конкретные типы указанных вспомогательных компонентов и их уровни зависят от физической формы композиции и вида чистящей операции, для которой их используют. Подходящие вспомогательные средства включают в себя, без ограничения, поверхностно-активные вещества, моющие компоненты, хелатирующие средства, средства, ингибирующие перенос красителя, осаждающие средства, диспергирующие средства, другие ферменты и стабилизаторы ферментов, каталитические вещества, активаторы отбеливания, усилители отбеливания, пероксид водорода, источники пероксида водорода, заранее полученные перкислоты, полимерные диспергирующие средства, средства, обеспечивающие удаление глинистой грязи/препятствующие повторному осаждению, блескообразующие добавки, средства, подавляющие пенообразование, красители, отдушки, эластификаторы структуры, мягчители тканей, носители, гидротропы, технологические добавки и/или пигменты. Помимо приведенного ниже описания, подходящие примеры и уровни указанных других вспомогательных средств можно найти в патентах США №№5576282, 6306812 и 6326348, которые включены в настоящее описание в качестве ссылки. Вышеупомянутые вспомогательные средства могут составлять остаток чистящих композиций настоящего изобретения.
В некоторых воплощениях чистящие композиции настоящего изобретения содержат поверхностно-активное вещество или поверхностно-активную систему, где поверхностно-активное вещество выбрано из неионных поверхностно-активных веществ, анионных поверхностно-активных веществ, катионных поверхностно-активных веществ, амфолитических поверхностно-активных веществ, цвиттерионных поверхностно-активных веществ, полуполярных неионных поверхностно-активных веществ и их смесей.
В некоторых других воплощениях чистящие композиции настоящего изобретения содержат один или более моющих компонентов или моющих систем детергента. Моющие компоненты включают в себя, без ограничения, полифосфатные соли щелочных металлов, аммония и алканоламмония, силикаты щелочных металлов, карбонаты щелочноземельных и щелочных металлов, поликарбоксилатные соединения алюмосиликатных компонентов, простые эфиры гидроксиполикарбоксилатов, сополимеры малеинового ангидрида и этилена или винилметилового простого эфира, 1,3,5-тригидроксибензол-2,4,6-трисульфоновую кислоту и карбоксиметилоксиянтарную кислоту, разные соли щелочных металлов, аммония и замещенного аммония и полиуксусных кислот, таких как этилендиаминтетрауксусная кислота и нитрилотриуксусная кислота, а также поликарбоксилаты, такие как меллитовая кислота, янтарная кислота, лимонная кислота, оксидиянтарная кислота, полималеиновая кислота, бензол 1,3,5-трикарбоновая кислота, карбоксиметилоксиянтарная кислота и их растворимые соли.
В некоторых других воплощениях чистящие композиции настоящего изобретения содержат хелатирующее средство. Подходящие хелатирующие средства включают в себя медь-содержащие, железо-содержащие и/или марганец-содержащие хелатирующие средства и их смеси.
В некоторых следующих воплощениях описанные здесь чистящие композиции содержат осаждающее средство. Подходящие осаждающие средства включают в себя полиэтиленгликоль, полипропиленгликоль, поликарбоксилат, грязеудаляющие полимеры, такие как полителефталевая кислота, глины, такие как каолинит, монтмориллонит, атапульгит, иллит, бентонит, галлуазит и их смеси.
В некоторых других воплощениях чистящие композиции настоящего изобретения также содержат одно или более средств, ингибирующих перенос красителя. Подходящие полимерные ингибирующие перенос красителя средства включают в себя, без ограничения, поливинилпирролидононовые полимеры, полимеры на основе N-оксидов полиаминов, coполимеры N-винилпирролидона и N-винилимидазола, поливинилоксазолидоны и поливинилимидазолы, или их смеси.
В некоторых следующих воплощениях чистящие композиции настоящего изобретения также содержат диспергирующие средства. Подходящие водорастворимые органические диспергирующие средства включают в себя гомо- или сополимерные кислоты или их соли, где поликарбоновая кислота содержит, по меньшей мере, два карбоксильных радикала, отделенных друг от друга не более чем двумя атомами углерода.
В некоторых особенно предпочтительных воплощениях чистящие композиции содержат один или более детергентных ферментов, которые обеспечивают эффективность чистки и/или улучшают уход за тканью. Примеры подходящих ферментов включают в себя, без ограничения, гемицеллюлазы, пероксидазы, протеазы, целлюлазы, ксиланазы, липазы, фосфолипазы, эстеразы, кутиназы, пектиназы, кератиназы, редуктазы, оксидазы, фенолоксидазы, липоксигеназы, лигниназы, пуллуланазы, танназы, пентозаназы, маланазы, β-глюканазы, арабинозидазы, гиалуронидазу, хондроитиназу, лакказу и амилазы, или их смеси. Обычно смеси содержат традиционные ферменты, например, по меньшей мере, одну протеазу, по меньшей мере, одну липазу, по меньшей мере, одну кутиназу и/или, по меньшей мере, одну целлюлазу в сочетании, по меньшей мере, с одной амилазой.
В некоторых других воплощениях ферменты, используемые для получения чистящих композиций, стабилизируют с помощью любого подходящего метода. В некоторых воплощениях ферменты, применяющиеся в данном изобретении, стабилизируют путем добавления в конечные композиции водорастворимых источников ионов кальция и/или магния, которые обеспечивают доступ таких ионов к ферментам.
В некоторых следующих воплощениях чистящие композиции настоящего изобретения содержат каталитические комплексы металлов. Одним из металл-содержащих катализаторов отбеливания является каталитическая система, содержащая катион переходного металла с определенной каталитической активностью в отношении отбеливания, такой как катион меди, железа, титана, рутения, вольфрама, молибдена или марганца, вспомогательный катион металла, обладающий низкой каталитической активностью в отношении отбеливания, или не обладающий такой активностью, такой как катион цинка или алюминия, и компонент, обеспечивающий определенные константы стабильности для каталитического и вспомогательного катиона металлов, в частности, этилендиаминтетрауксусная кислота, этилендиаминтетра(метиленфосфоновая кислота) и их водорастворимые соли. Такие катализаторы раскрыты в патенте США № 4430243.
В некоторых воплощениях описанных здесь композиций в качестве катализатора используют соединение марганца. Такие соединения и уровни, на которых их можно использовать, хорошо известны в данной области, они включают в себя, например, катализаторы на основе марганца, раскрытые в патенте США № 5576282. Кроме того, известны кобальтовые катализаторы отбеливания, подходящие для применения в настоящем изобретении, которые описаны, например, в патентах США №№ 5597936 и 5595967. Такие кобальтовые катализаторы можно легко получить с помощью известных способов, таких как описанные, например, в патентах США №№ 5597936 и 5595967. В некоторых воплощениях предлагаемые здесь композиции также могут содержать комплекс переходного металла с макрополициклическим жестким лигандом (т.е., "MRL"). В качестве практического, но не ограничивающего примера, состав композиций и процессы чистки подбирают так, чтобы они обеспечивали присутствие в водной моечной среде активных элементов MRL на уровне, порядок которого составляет, по меньшей мере, одну часть на сто миллионов, предпочтительно от примерно 0,005 м.д. до примерно 25 м.д., более предпочтительно от примерно 0,05 м.д. до примерно 10 м.д., и наиболее предпочтительно от примерно 0,1 м.д. до примерно 5 м.д. MRL в моечном растворе. Предпочтительные переходные металлы, используемые для получения растворимых катализаторов отбеливания, включают в себя марганец, железо и хром. Предпочтительные для настоящего изобретения MRL включают в себя особый тип сверхжестких лигандов с поперечными мостиками, например, 5,12-диэтил-1,5,8,12-тетраазобицикло[6.6.2]гексадекан. Подходящие комплексы переходных металлов с MRL можно легко получить с помощью известных способов, таких как описанные, например, в WO 00/332601 и патенте США № 6225464.
Как указано выше, чистящие композиции настоящего изобретения можно получить в виде любых подходящих форм с помощью любых способов, выбранных специалистом в данной области, неограничивающие примеры которых описаны в патентах США №№ 5879584, 5691297, 5574005, 5569645, 5565422, 5516448, 5489392 и 5486303, включенных в данное описание в качестве ссылки.
Чистящие композиции, раскрытые в настоящем описании, можно использовать для чистки изделий (например, поверхности, посуды или ткани). Как правило, по меньшей мере, часть изделия приводят в контакт с воплощением чистящей композиции настоящего изобретения, в чистом виде или разбавленным моечной жидкостью, после чего изделие необязательно стирают и/или ополаскивают. В целях настоящего изобретения термин "стирка" включает в себя, без ограничения, трение и механическое перемешивание. В некоторых воплощениях чистящие композиции обычно используют в концентрациях, составляющих от примерно 500 м.д. до примерно 15000 м.д. в растворе. Если моечный растворитель представляет собой воду, температура воды обычно варьирует от примерно 5°C до 90°C, и, если изделие содержит ткань, массовое отношение воды к ткани, как правило, составляет от примерно 1:1 до примерно 30:1.
В других воплощениях настоящее изобретение также предлагает композиции и способы, включающие в себя применение разных поверхностно-активных веществ и смесей поверхностно-активных веществ, которые позволяют определить и улучшить эффективность протеаз, входящих в состав детергентных композиций. С помощью программного обеспечения для планирования экспериментов разрабатывают план смешанного эксперимента с симплексной решеткой, чтобы определить активность протеазы в присутствии поверхностно-активных веществ, наиболее часто используемых в жидких стиральных детергентах; таких как линейный алкилбензолсульфонат (LAS), алкилэтоксисульфат (AES) и алкоголь-этоксилат (AE). LAS и AES представляют собой анионные поверхностно-активные вещества, а AE представляет собой неионное поверхностно-активное вещество.
Неожиданно было обнаружено, что выбор композиции поверхностно-активного вещества, обеспечивающего оптимальную эффективность протеазы, не сводится просто к выбору поверхностно-активного вещества, в котором протеаза является наиболее стабильной. Скорее, оптимальная композиция поверхностно-активных веществ основана на сочетании разных поверхностно-активных веществ в соотношении, обеспечивающем наилучшие общие чистящие результаты, где смесь включает в себя поверхностно-активные вещества, которые при использовании в отсутствие других поверхностно-активных веществ, дестабилизируют протеазу.
Например, установлено, что в некоторых воплощениях протеаза может лучше функционировать в присутствии первого поверхностно-активного вещества, если присутствует второе поверхностно-активное вещество, но хуже, если присутствует третье поверхностно-активное вещество. В других воплощениях протеаза может обладать устойчивостью к гораздо более высоким уровням первого поверхностно-активного вещества в зависимости от соотношения второго и третьего поверхностно-активных веществ. Тот факт, что ферменты можно использовать в присутствии разных поверхностно-активных веществ, если их соотношение тщательно подобрано, противоречит традиционному убеждению, что ферменты нужно использовать в сочетании только с теми поверхностно-активными веществами, которые не оказывают неблагоприятного влияния на их активность, что ограничивает применение ферментов определенными детергентными композициями.
Отчасти на основании описанных здесь наблюдений, в композициях и способах настоящего изобретения используют детергентные композиции, содержащие, по меньшей мере, одну протеазу и смесь поверхностно-активных веществ в заранее подобранном соотношении, которое обеспечивает активность протеазы, где выбор поверхностно-активных веществ не ограничивается измерением стабильности в каждом поверхностно-активном веществе. В некоторых случаях протеаза инактивируется или проявляет пониженную активность в присутствии другого соотношения одних и тех же поверхностно-активных веществ, или в присутствии любой подгруппы поверхностно-активных веществ, но в отсутствие, по меньшей мере, одного из поверхностно-активных веществ, входящих в состав смеси. В некоторых случаях протеаза инактивируется или проявляет пониженную активность в присутствии одного из поверхностно-активных веществ, в отсутствие другого поверхностно-активного вещества, входящего в состав смеси. Подобным образом, в некоторых случаях присутствие первого поверхностно-активного вещества позволяет использовать повышенное количество второго поверхностно-активного вещества, причем такое же количество второго поверхностно-активного вещества в отсутствие первого поверхностно-активного вещества инактивирует протеазу или уменьшает ее активность.
В добавление к вышесказанному, присутствие поверхностно-активного вещества первого типа (например, неионного или анионного детергента) позволяет использовать детергент второго типа, причем детергент второго типа в отсутствие поверхностно-активного вещества первого типа инактивирует протеазу или уменьшает ее активность.
В указанных экспериментах используют субтилизин Bacillus amyloliquefaciens BPN'-Y217L ("FNA"; Genencor), а также варианты данного фермента. При низких температурах (например, при 16°C) протеаза является активной в композиции, содержащей относительно низкое количество AE и более высокое количество AES или LAS, или и того, и другого. Для сравнения, протеаза обладает более низкой активностью в композиции, содержащей только AES, только LAS и, в особенности, только AE. Следовательно, предпочтительной композицией является не композиция, содержащая только одно поверхностно-активное вещество, в котором протеаза является наиболее активной, а скорее композиция, которая содержит, по меньшей мере, два, предпочтительно, все три поверхностно-активных вещества, любое из которых может инактивировать или уменьшать активность протеазы, если его используют отдельно на достаточном уровне. Конкретное соотношение AES>LAS>AE дает наилучший результат для данной протеазы при низкой температуре.
Наоборот, при высоких температурах (например, при 32°C) протеаза является активной в композиции, содержащей только AES, или AES в сочетании с LAS, и относительно низкое количество AE. Таким образом, устойчивость к AES, повышающаяся с увеличением температуры, делает включение других поверхностно-активных веществ в состав композиции менее важным.
Также проводят некоторые другие тесты. Активность протеазы после инкубации определяют с использованием субстрата AAPF-pNA. В каждой детергентой композиции определяют точку плавления фермента, T.пл. Наконец, выбирают четыре композиции, тестируют их с помощью терготометра, и определяют корреляцию с результатами анализа в 96-луночном формате (см. пример 22).
Определения
Если не указано иначе, при осуществлении настоящего изобретения можно использовать традиционные методы, обычно применяющиеся в молекулярной биологии, белковой инженерии, микробиологии и способах получения рекомбинантных ДНК, которые находятся в пределах компетенции специалистов в данной области. Такие методы известны специалистам в данной области и описаны в многочисленных руководствах и справочниках (см., например, Sambrook et al., "Molecular Cloning: A Laboratory Manual", Second Edition (Cold Spring Harbor), [1989]); и Ausubel et al., "Current Protocols in Molecular Biology" [1987]). Все патенты, патентные заявки, статьи и публикации, упомянутые в данном документе как выше, так и ниже, специально включены в настоящее изобретение в качестве ссылки.
Если не указано иначе, все технические и научные термины, используемые в данном документе, имеют традиционные значения, известные рядовым специалистам в области, к которой принадлежит данное изобретение. Определения указанных терминов можно найти в разных доступных словарях, известных специалистам в данной области. В данном документе описаны предпочтительные способы и материалы, однако при осуществлении настоящего изобретения можно использовать любые способы и материалы, подобные или эквивалентные описанным здесь. Соответственно, определенные ниже термины более полно описываются со ссылкой на Описание в целом. Кроме того, в данном документе единственное число включает в себя ссылку на множественное число, если контекст однозначно не указывает иначе. Численные интервалы являются включительными для чисел, определяющих интервал. Если не указано иначе, последовательности нуклеиновых кислот описываются слева направо в направлении от 5'-конца к 3'-концу; аминокислотные последовательности описываются слева направо в направлении от аминоконца к карбоксиконцу, соответственно. Следует понимать, что настоящее изобретение не ограничивается конкретными описанными методами, схемами и реагентами, поскольку они могут варьировать в зависимости от обстановки, в которой их используют специалисты в данной области.
Если не указано иначе, при осуществлении настоящего изобретения используют традиционные методы очистки белков, молекулярной биологии, микробиологии, рекомбинантных ДНК и секвенирования белков, известные специалистам в данной области.
Кроме того, заголовки настоящего описания не являются ограничением разных аспектов или воплощений изобретения, и могут быть отнесены в качестве ссылки к описанию в целом. Соответственно, определенные ниже термины могут быть более полно описаны со ссылкой на описание в целом. Тем не менее, чтобы облегчить понимание изобретения, ниже приводятся определения ряда терминов.
В данном документе термины "протеаза" и "протеолитическая активность" относятся к белку или пептиду, обладающему способностью гидролизовать пептиды или субстраты, содержащие пептидные связи. Существует много способов измерения протеолитической активности (Kalisz, "Microbial Proteinases," In: Fiechter (ed.), Advances in Biochemical Engineering/Biotechnology, [1988]). Например, протеолитическую активность можно определить с помощью сравнительных анализов, позволяющих измерить способность соответствующей протеазы гидролизовать коммерческий субстрат. Примеры субстратов, используемых для анализа протеазы или протеолитической активности, включают в себя, без ограничения, диметилказеин (Sigma C-9801), бычий коллаген (Sigma C-9879), бычий эластин (Sigma E-1625) и бычий кератин (ICN Biomedical 902111). Способы проведения колориметрических анализов с использованием указанных субстратов хорошо известны в данной области (см., например, WO 99/34011; и патент США № 6376450, которые включены в настоящее описание в качестве ссылки). Концентрацию активного фермента во фракциях, собираемых в процессе градиентного элюирования, можно определить с помощью анализа pNA (см., например, Del Mar et al., Anal. Biochem., 99:316-320 [1979]). В данном анализе измеряют скорость высвобождения п-нитроанилина в результате ферментативного гидролиза растворимого синтетического субстрата, сукцинил-аланин-аланин-пролин-фенилаланин-п-нитроанилид (sAAPF-pNA). Скорость образования продукта желтого цвета в результате реакции гидролиза, измеряемая при 410 нм с помощью спектрофотометра, пропорциональна концентрации активного фермента. Общую концентрацию белка можно определить путем измерения поглощения при 280 нм. Чистоту фермента выражают в виде отношения активный фермент/общий белок.
В данном документе "род Bacillus" включает в себя все виды гена "Bacillus," известные специалистам в данной области, которые включают в себя, без ограничения, B. subtilis, B. licheniformis, B. lentus, B. brevis, B. stearothermophilus, B. alkalophilus, B. amyloliquefaciens, B. clausii, B. halodurans, B. megaterium, B. coagulans, B. circulans, B. lautus и B. thuringiensis. Показано, что род Bacillus продолжает подвергаться таксономической реорганизации. Так, подразумевается, что данный род содержит переклассифицированные виды, включающие в себя, без ограничения, такие организмы, как B. stearothermophilus, который сейчас называют "Geobacillus stearothermophilus". Продукция устойчивых эндоспор в присутствии кислорода считается определяющим признаком рода Bacillus, хотя данная характеристика также применима к организмам с недавно присвоенными названиями Alicyclobacillus, Amphibacillus, Aneurinibacillus, Anоxybacillus, Brevibacillus, Filobacillus, Gracilibacillus, Halobacillus, Paenibacillus, Salibacillus, Thermobacillus, Ureibacillus и Virgibacillus.
Термины "полинуклеотид" и "нуклеиновая кислота", используемые в данном описании как взаимозаменяемые, относятся к полимерным формам нуклеотидов любой длины, которые содержат либо рибонуклеотиды, либо дезоксирибонуклеотиды. Указанные термины охватывают, без ограничения, одноцепочечные, двухцепочечные или трехцепочечные ДНК, геномные ДНК, кДНК, РНК, гибриды ДНК-РНК или полимеры, содержащие пуриновые и пиримидиновые основания, или другие природные, химически или биохимически модифицированные, неприродные или дериватизированные нуклеотидные основания. Неограничивающими примерами полинуклеотидов являются: гены, фрагменты генов, хромосомальные фрагменты, EST, экзоны, интроны, мРНК, тРНК, рРНК, рибозимы, кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенная ДНК с любой последовательностью, выделенная РНК с любой последовательностью, нуклеотидные зонды и праймеры. В некоторых воплощениях полинуклеотиды содержат модифицированные нуклеотиды, такие как метилированные нуклеотиды и аналоги нуклеотидов, урацил, другие сахара и соединяющие группы, такие как фторрибоза и тиоат, и нуклеотидные ветви. В альтернативных воплощениях последовательность нуклеотидов прерывается ненуклеотидными компонентами.
В данном документе термины "конструкция ДНК" и "трансформирующая ДНК" используются как взаимозаменяемые и относятся к ДНК, используемой для введения последовательностей в клетку или организм хозяина. ДНК можно получить in vitro методом ПЦР или с помощью любого другого подходящего метода (методов), известного специалистам в данной области. В особенно предпочтительных воплощениях конструкция ДНК содержит представляющую интерес последовательность (например, экзогенную последовательность). В некоторых воплощениях такая последовательность функционально связана с другими элементами, такими как регулирующие элементы (например, промоторы и др.). Конструкция ДНК также может содержать селектируемый маркер. Кроме того, она может содержать экзогенную последовательность, фланкируемую гомологичными боксами. В другом воплощении трансформирующая ДНК содержит другие негомологичные последовательности, присоединенные к концам (например, штатные последовательности или фланкирующие последовательности). В некоторых воплощениях концы экзогенной последовательности смыкаются, так что трансформирующая ДНК образует замкнутый цикл. Трансформирующие последовательности могут быть дикого типа, мутантные или модифицированные. В некоторых воплощениях конструкция ДНК содержит последовательности, гомологичные последовательностям, присутствующим в хромосоме клетки-хозяина. В других воплощениях конструкция ДНК содержит негомологичные последовательности. Полученную in vitro конструкцию ДНК можно использовать для: 1) вставки гетерологичных последовательностей в целевую последовательность-мишень клетки-хозяина, и/или 2) мутагенеза участка хромосомы клетки-хозяина (т.е., замены эндогенной последовательности на гетерологичную последовательность), 3) удаления геном-мишеней, и/или 4) введения хозяину способной к репликации плазмиды.
В данном документе термины "экспрессионная кассета" и "ветор экспрессии" относятся к конструкциям нуклеиновых кислот, полученным рекомбинантными или синтетическими методами, которые содержат ряд специфических элементов нуклеиновых кислот, обеспечивающих транскрипцию конкретной нуклеиновой кислоты в клетке-мишени. Рекомбинантную экспрессионную кассету можно вставить в плазмиду, хромосому, митохондриальную ДНК, пластидную ДНК, вирус или фрагмент нуклеиновой кислоты. Как правило, рекомбинантная экспрессионная кассета, как часть вектора экспрессии, содержит, в числе других последовательностей, подлежащую транскрипции нуклеотидную последовательность и промотор. В предпочтительных воплощениях векторы экспрессии обладают способностью внедрять фрагменты гетерологичной ДНК в клетку-хозяина и осуществлять их экспрессию. Многие прокариотические и эукариотические векторы экспрессии являются коммерчески доступными. Выбор подходящих векторов экспрессии находится в сфере компетенции специалистов в данной области. Термины "экспрессионная кассета" и "конструкция ДНК", а также их грамматические эквиваленты используются как взаимозаменяемые. Выбор подходящих векторов экспрессии находится в сфере компетенции специалистов в данной области.
В данном документе термин "вектор" относится к полинуклеотидной конструкции, предназначенной для введения нуклеиновых кислот в клетки одного или более типов. Векторы включают в себя векторы клонирования, векторы экспрессии, челночные векторы, плазмиды, кассеты и т.п. В некоторых воплощениях полинуклеотидная конструкция содержит последовательность ДНК, кодирующую протеазу (например, предшественник протеазы или зрелую протеазу), которая функционально связана с подходящей пропоследовательностью (например, секреторной последовательностью и др.), способной осуществлять экспрессию ДНК в подходящем хозяине.
В данном документе термин "плазмида" относится к конструкции циклической двухцепочечной (дц) ДНК, используемой в качестве вектора клонирования, которая образует внехромосомный самореплицирующийся генетический элемент у некоторых эукариотов или прокариотов, или интегрируется в хромосому хозяина.
В данном документе термин "введение" в применении к нуклеотидной последовательности относится к любому способу, подходящему для переноса нуклеотидной последовательности в клетку. Такие способы введения включают в себя, без ограничения, слияние протопластов, трансфекцию, трансформацию, конъюгацию и трансдукцию (см., например, Ferrari et al., "Genetics, " in Hardwood et al, (eds.), Bacillus, Plenum Publishing Corp., pages 57-72, [1989]).
В данном документе термины "трансформированный" и "стабильно трансформированный" относятся к клетке, которая содержит неприродную (гетерологичную) полинуклеотидную последовательность, интегрированную в геном данной клетки, или существующую в виде эписомальной плазмиды, и сохраняющуюся, по меньшей мере, у двух поколений.
Нуклеиновая кислота является "функционально связанной", если ее помещают в функциональную зависимость от другой нуклеотидной последовательности. Например, ДНК, кодирующая секреторную лидерную последовательность (т.е., сигнальный пептид), функционально связана с ДНК, кодирующей полипептид, если она экспрессируется в виде белка-предшественника, который участвует в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или участок связывания с рибосомой функционально связан с кодирующей последовательностью, если его расположение обеспечивает трансляцию. Как правило, термин "функционально связанный" означает, что связанные последовательности ДНК являются смежными, а в случае секреторной лидерной последовательности они являются смежными и находятся в одной фазе считывания. Однако энхансеры могут быть не смежными. Связывание осуществляют путем лигирования по традиционным участкам рестрикции. Если такие участки отсутствуют, используют синтетические олигонуклеотидные адапторы или линкеры, в соответствии с обычной практикой.
В данном документе термин "ген" относится к полинуклеотиду (например, сегменту ДНК), который кодирует полипептид и содержит участки, предшествующие кодирующим участкам и сопровождающие их, а также последовательности (интроны), встроенные между отдельными кодирующими сегментами (экзонами).
В данном документе термин "гомологичные гены" относится к паре генов из разных, но обычно родственных видов, которые соответствуют друг другу и являются идентичными или обладают высокой степенью подобия. Термин охватывает гены, которые отделяются в процессе видообразования (т.е., развития новых видов) (например, ортологические гены), а также гены, которые отделяются в результате генетической дупликации (например, паралогические гены).
В данном документе белки определяются как имеющие одинаковую "укладку", если они содержат одинаковые основные вторичные структуры с одинаковой конфигурацией и одинаковыми топологическими связями. Разные белки с одинаковой укладкой часто содержат периферические элементы вторичной структуры и участки изгибов, которые отличаются по размеру и конформации. В некоторых случаях указанные различающиеся участки могут составлять половину структуры. Белки, которые относят к одной укладочной категории, не обязательно имеют общее эволюционное происхождение (например, структурное подобие, обусловленное физическими и химическими свойствами белков, способствует определенным порядку укладки и топологии цепи).
В данном документе термин "гомология" относится к подобию или идентичности последовательности, предпочтительно к идентичности. Гомологию определяют с помощью стандартных методов, известных в данной области (см., например, Smith and Waterman, Adv. Appl. Math., 2:482 [1981]; Needleman and Wunsch, J. MoI. Biol., 48:443 [1970]; Pearson and Lipman, Proc. Natl. Acad. Sci. USA 85:2444 [1988]; программы, такие как GAP, BESTFIT, FASTA и TFASTA из программного обеспечения Wisconsin Genetics (Genetics Computer Group, Madison, WI); и Devereux et al., Nucl. Acid Res., 12:387-395 [1984]).
В данном документе "аналогичная последовательность" представляет собой последовательность, относящуюся к гену, функция которого практически идентична функции гена протеазы BPN'. Аналогичные последовательности определяют с помощью известных способов выравнивания последовательностей. Широко используется метод выравнивания BLAST, хотя, как указано выше и ниже, существуют другие способы выравнивания последовательностей.
Одним примером подходящего алгоритма является PILEUP. PILEUP осуществляет выравнивание нескольких последовательностей из группы родственных последовательностей с помощью прогрессивного двухточечного метода. Данный алгоритм также может изобразить дерево, демонстрирующее взаимоотношения в кластерах, которое используется для выравнивания. PILEUP использует упрощение метода прогрессивного выравнивания Feng and Doolittle (Feng and Doolittle, J. MoI. Evol., 35:351-360 [1987]). Этот метод подобен описанному Higgins and Sharp (Higgins and Sharp, CABIOS 5:151-153 [1989]). В PILEUP используют параметры, включающие в себя вес гэпа по умолчанию 3,00, длину гэпа по умолчанию 0,10 и гэпы со взвешенными концами.
Другим примером подходящего алгоритма является BLAST, описанный Altschul et al., (Altschul et al., J. MoI. Biol., 215:403-410, [1990]; и Karlin et al., Proc. Natl. Acad. Sci. USA 90:5873-5787 [1993]). Предпочтительной программой BLAST является WU-BLAST-2 (см. Altschul et al., Meth. Enzymol., 266:460-480 [1996]). WU-BLAST-2 использует несколько параметров поиска, большая часть которых имеет значения, используемые по умолчанию. Регулируемым параметрам присваивают следующие значения: интервал перекрывания = 1, доля перекрывания = 0,125, порог слова (T)=11. Параметры HSP S и HSP S2 имеют динамические значения и устанавливаются самой программой в зависимости от состава конкретной последовательности и содержания конкретной базы данных, по сравнению с которой проводится анализ представляющей интерес последовательности. Однако значения можно регулировать, чтобы увеличить чувствительность. Значение % идентичности аминокислотных последовательностей определяют путем деления числа совпадающих идентичных остатков на общее число остатков в "более длинной" последовательности выравниваемых участков. "Более длинная" последовательность имеет наибольшее число фактических остатков в выравниваемом участке (гэпы, введенные программой WU-Blast-2 для минимизации баллов при выравнивании, игнорируются).
Таким образом, "процент (%) идентичности нуклеотидных последовательностей" определяют как процент нуклеотидных остатков в последовательности-кандидате, идентичных нуклеотидным остаткам исходной последовательности (т.е., представляющей интерес последовательности). В предпочтительном способе используют модуль BLASTN набора параметров по умолчанию WU-BLAST-2 с установкой интервала перекрывания и доли перекрывания на 1 и 0,125, соответственно.
В данном документе термин "рекомбинантный" относится к клеткам или векторам, модифицированным путем введения гетерологичной нуклеотидной последовательности, или к клеткам, полученным из такой модифицированной клетки. Так, например, рекомбинантные клетки экспрессируют гены, которые не обнаружены в идентичной форме в природном (нерекомбинантном) предшественнике клетки, или экспрессируют нативные гены, которые в нерекомбинантном предшественнике клетки экспрессируются аномально, на пониженном уровне, или совсем не экспрессируются в результате преднамеренного вмешательства человека. "Рекомбинация", "рекомбинирование" и получение "рекомбинантной" нуклеиновой кислоты обычно включает в себя сборку двух или более фрагментов нуклеиновых кислот с получением химерного гена.
В некоторых предпочтительных воплощениях мутантные последовательности ДНК получают путем сайт-насыщающего мутагенеза, по меньшей мере, по одному кодону. В другом предпочтительном воплощении сайт-насыщающий мутагенез проводят по двум или более кодонам. В следующем воплощении гомология мутантных последовательностей ДНК по отношению к последовательности дикого типа составляет более чем примерно 50%, более чем примерно 55%, более чем примерно 60%, более чем примерно 65%, более чем примерно 70%, более чем примерно 75%, более чем примерно 80%, более чем примерно 85%, более чем примерно 90%, более чем примерно 95% или более чем примерно 98%. В альтернативных воплощениях мутантную ДНК получают in vivo с помощью любого известного способа мутагенеза, такого как, например, облучение, применение нитрозогуанидина и т.п. Затем целевую последовательность ДНК выделяют и используют в способах настоящего изобретения.
В данном документе термины "амплификация" и "амплификация генов" относятся к процессу несоразмерной репликации ДНК, который обеспечивает более высокое число копий амплифицируемого гена, чем исходно присутствующее в геноме. В некоторых воплощениях селекция клеток путем выращивания в присутствии лекарственного средства (такого как ингибитор ингибируемого фермента) приводит к амплификации либо эндогенного гена, кодирующего генный продукт, необходимый для роста в присутствии лекарственного средства, либо к амплификации экзогенных (т.е., введенных) последовательностей, кодирующих указанный генный продукт, или и тех, и других.
"Амплификация" представляет собой особый случай репликации нуклеиновой кислоты с участием специфической матрицы. Ее следует отличать от репликации на неспецифической матрице (т.е., репликации, которая является матрица-зависимой, но не зависит от специфической матрицы). Специфичность матрицы в данном описании отличают от точности воспроизведения при репликации (т.е., синтеза правильной полинуклеотидной последовательности) и нуклеотидной (рибо- или дезоксирибо-) специфичности. Специфичность матрицы часто называют специфичностью "мишени". Целевые последовательности представляют собой "мишени" в том смысле, что их нужно отделять от других нуклеиновых кислот. Способы амплификации разработаны, в первую очередь, для такого отделения.
В данном документе термин "праймер" относится к олигонуклеотиду, либо природному, например, выделенному из рестрикционного гидролизата, либо полученному синтетическим способом, который способен функционировать как точка инициации синтеза в условиях, подходящих для индуцирования синтеза продукта удлинения праймера, комплементарного нуклеотидной цепи (т.е., в присутствии нуклеотидов и индуцирующего реагента, такого как ДНК-полимераза, при подходящих значениях температуры и pH). Для максимальной эффективности амплификации предпочтительно использовать одноцепочечный праймер, однако он может быть и двухцепочечным. Если праймер является двухцепочечным, его вначале обрабатывают, чтобы разделить цепи, и затем используют для получения продуктов удлинения. Предпочтительно праймер представляет собой олигодезоксирибонуклеотид. Праймер должен быть достаточно длинным, чтобы инициировать синтез продуктов удлинения в присутствии индуцирующего агента. Точная длина праймеров зависит от многих факторов, включающих в себя температуру, источник праймера и применение способа.
В данном документе термин "зонд" относится к олигонуклеотиду (т.е., последовательности нуклеотидов), либо природному, например, выделенному из рестрикционного гидролизата, либо полученному синтетическим способом, рекомбинантным способом или методом амплификации ПЦР, который способен гибридизоваться с другим, представляющим интерес олигонуклеотидом. Зонд может быть одноцепочечным или двухцепочечным. Зонды можно использовать для детекции, идентификации и выделения конкретных генных последовательностей. Подразумевается, что в настоящем изобретении используют зонды, меченные какой-либо "репортерной молекулой", позволяющей детектировать их в любой системе детекции, включающей в себя, без ограничения, ферментную (например, ELISA, а также ферментные гистохимические анализы), флуоресцентную, радиоактивную и люминесцентную системы. Предполагается, что настоящее изобретение не ограничивается какой-либо конкретной системой детекции или меткой.
В данном документе термин "мишень" при использовании в применении к полимеразной цепной реакции относится к участку нуклеиновой кислоты, который связывается с праймерами, используемыми для полимеразной цепной реакции. Таким образом "мишень" можно отделить от других нуклеотидных последовательностей. "Сегмент" представляет собой участок нуклеиновой кислоты в последовательности-мишени.
В данном документе термин "полимеразная цепная реакция" ("ПЦР") относится к способам, описанным в патентах США №№ 4683195 4683202 и 4965188, включенных в данное описание в качестве ссылки, которые представляют собой методы увеличения концентрации сегмента последовательности-мишени в смеси геномных ДНК без клонирования или очистки. Указанный способ амплификации последовательности-мишени включает в себя введение большого избытка двух олигонуклеотидных праймеров в смесь ДНК, содержащую целевую последовательность-мишень, после чего смесь подвергают последовательности термических циклов в присутствии ДНК-полимеразы. Два праймера являются комплементарными соответствующим цепям двухцепочечной последовательности-мишени. Чтобы провести амплификацию, смесь подвергают денатурации, после чего праймеры отжигают с комплементарными последовательностями из молекулы-мишени. После отжига праймеры удлиняют с помощью полимеразы с получением новой пары комплементарных цепей. Стадии денатурации, отжига праймеров и удлинения под действием полимеразы можно повторять много раз (т.е., денатурация, отжиг и удлинение цепи составляют один "цикл"; таких "циклов" может быть много), чтобы получить высокую концентрацию амплифицируемого сегмента целевой последовательности-мишени. Длина амплифицируемого сегмента целевой последовательности-мишени определяется положениями праймеров по отношению друг к другу и, следовательно, является регулируемым параметром. Поскольку данный процесс включает в себя повторяющиеся стадии, способ называют "полимеразная цепная реакция" (далее "ПЦР"). Поскольку целевые амплифицируемые сегменты последовательности-мишени становятся преобладающими (с точки зрения концентрации) в смеси, их называют "амплифицированные методом ПЦР".
В данном документе термин "реагенты для амплификации" относится к реагентам (дезоксирибонуклеотидтрифосфаты, буфер и др.), необходимым для амплификации, за исключением праймеров, нуклеотидной матрицы и фермента, используемого для амплификации. Как правило, реагенты для амплификации вместе с другими компонентами реакции помещают в реакционный сосуд (пробирка, лунка микропланшета и др.).
В данном документе термин "ОТ-ПЦР" относится к репликации и амплификации последовательностей РНК. В данном способе ПЦР проводят методом обратной транскрипции, чаще всего с использованием одного фермента, термостабильной полимеразы, как описано в патенте США № 5322770, включенном в данное описание в качестве ссылки. В процессе ОТ-ПЦР матрицу РНК превращают в кДНК с помощью обратно-транскриптазной активности полимеразы и затем амплифицируют, используя полимеризующую активность полимеразы (т.е., как в других методах ПЦР).
В данном документе термины "рестрикционные эндонуклеазы" и "рестриктазы" относятся к бактериальным ферментам, каждый из которых разрезает двухцепочечную ДНК в определенном участке нуклеотидной последовательности или около него.
Термин "участок рестрикции" относится к нуклеотидной последовательности, распознаваемой и расщепляемой конкретной рестрикционной эндонуклеазой, и обычно является местом вставки фрагментов ДНК. В некоторых воплощениях участки рестрикции вставляют рекомбинантными методами в селективный маркер и в области 5'- и 3'-концов конструкции ДНК.
Термин "гомологичная рекомбинация" относится к обмену фрагментами двух молекул ДНК или парных хромосом по участкам идентичных или почти идентичных нуклеотидных последовательностей. В предпочтительном воплощении хромосомальная интеграция представляет собой гомологичную рекомбинацию.
В данном документе термин "аминокислотный" относится к пептидным или белковым последовательностям или их фрагментам. Термины "белок", "пептид" и "полипептид" используются как взаимозаменяемые.
В данном документе термины "представляющий интерес белок" и "представляющий интерес полипептид" относятся к целевому и/или исследуемому белку/полипептиду. В некоторых воплощениях представляющий интерес белок экспрессируется внутри клетки, тогда как в других воплощениях он представляет собой секретируемый полипептид. В особенно предпочтительных воплощениях указанные ферменты включают в себя сериновые протеазы настоящего изобретения. В некоторых воплощениях представляющий интерес белок представляет собой секретируемый полипептид, гибридизованный с сигнальным пептидом (т.е., секретируемый белок имеет амино-концевое удлинение). Почти все секретируемые белки содержат амино-концевое удлинение, которое играет важную роль в направлении белков-предшественников к мембране и их перемещении через мембрану. Такое удлинение может быть удалено протеолитически под действием сигнальной пептидазы в процессе переноса через мембрану или сразу после этого переноса.
Говорят, что полинуклеотид "кодирует" РНК или полипептид, если в нативном состоянии, или после манипуляций с помощью способов, известных специалистам в данной области, он может подвергаться транскрипции и/или трансляции с образованием РНК, полипептида или их фрагментов. Считается, что антисмысловая цепь такой нуклеиновой кислоты тоже кодирует последовательности. Как известно в данной области, ДНК может транскрибироваться под действием РНК-полимеразы с получением РНК, а РНК может подвергаться обратной транскрипции с получением ДНК. Таким образом, ДНК может кодировать РНК, и наоборот.
Термины "штамм-хозяин" или "клетка-хозяин" относятся к подходящему хозяину вектора экспрессии, содержащего ДНК настоящего изобретения.
Фермент "экспрессируется на повышенном уровне" в клетке-хозяине, если уровень его экспрессии в данной клетке превышает уровень экспрессии в соответствующей клетке дикого типа.
Термины "белок" и "полипептид" в настоящем описании используют как взаимозаменяемые. Для обозначения аминокислот в данном документе используют 3-буквенный код, утвержденный объединенной комиссией по биохимической номенклатуре (JCBN). Кроме того, следует понимать, что полипептид может кодироваться несколькими нуклеотидными последовательностями вследствие вырожденности генетического кода.
"Пропоследовательность" представляет собой аминокислотную последовательность между сигнальной последовательностью и зрелой протеазой, которая необходима для секреции протеазы. Отщепление пропоследовательности приводит к образованию зрелой активной протеазы.
Термин "сигнальная последовательность" или "сигнальный пептид" относится к любой последовательности нуклеотидов и/или аминокислот, которая может участвовать в секреции зрелых форм белка или их предшественников. Данное определение сигнальной последовательности является функциональным и относится ко всем аминокислотным последовательностям, кодируемым N-концевым фрагментом гена белка, который участвует в осуществлении секреции белка. Сигнальные последовательности часто, но не всегда, присоединяются к N-концевому фрагменту белка или к N-концевому фрагменту предшественника белка. Сигнальная последовательность может быть эндогеной или экзогенной. Сигнальная последовательность может представлять собой последовательность, обычно связанную с конкретным белком (например, протеазой), или она может являться продуктом гена, кодирующего другой секретируемый белок. Пример экзогенной сигнальной последовательности включает в себя первые семь аминокислотных остатков сигнальной последовательности субтилизина Bacillus subtilis, присоединенные к остатку сигнальной последовательности субтилизина Bacillus lentus (ATCC 21536).
Термин "гибридная сигнальная последовательность" относится к сигнальным последовательностям, которые содержат фрагмент, полученный из хозяина вектора экспрессии, гибридизованный с сигнальной последовательностью экспрессируемого гена. В некоторых воплощениях используют синтетические последовательности.
Термин "зрелая" форма белка или пептида относится к конечной функциональной форме белка или пептида. Например, зрелая форма протеазы настоящего изобретения содержит, по меньшей мере, аминокислотную последовательность, идентичную последовательности остатков в положениях 1-275 SEQ ID NO:2.
Термин "предшественник" белка или пептида относится к зрелой форме белка, содержащей пропоследовательность, функционально связанную с амино- или карбокси-концом белка. Предшественник также может содержать "сигнальную" последовательность, функционально связанную с амино-концом пропоследовательности. Предшественник также может содержать другие полинуклеотиды, которые участвуют в пост-трансляционной активности (например, полинуклеотиды, после отщепления которых образуется зрелая форма белка или пептида).
Термин "природный фермент" относится к ферменту, имеющему немодифицированную аминокислотную последовательность, идентичную присутствующей в природе. Природные ферменты включают в себя нативные ферменты, ферменты, которые естественным образом экспрессируются или присутствуют в конкретном микроорганизме.
Термины "происходящий из" и "полученный из" относятся не только к протеазе, которая продуцируется или может продуцироваться исследуемым штаммом организма, но и к протеазе, кодируемой последовательностью ДНК, выделенной из такого штамма, и продуцируемой организмом-хозяином, содержащим такую последовательность ДНК. Кроме того, данный термин относится к протеазае, которая кодируется последовательностью ДНК, полученной синтетическим способом и/или из кДНК, и которая имеет отличительные характеристики рассматриваемой протеазы.
"Производное" в объеме данного определения обычно сохраняет протеолитическую активность, характерную для формы дикого типа, нативной или исходной формы, в той степени, которая позволяет использовать производное для тех же целей, что и форму дикого типа, нативную или исходную форму. Функциональные производные сериновой протеазы охватывают природные, синтетические или рекомбинантные пептиды или пептидные фрагменты, которые имеют основные характеристики сериновой протеазы настоящего изобретения.
Термин "функциональное производное" относится к производному нуклеиновой кислоты, которое обладает функциональными характеристиками нуклеиновой кислоты, кодирующей сериновую протеазу. Функциональные производные нуклеиновой кислоты, кодирующие сериновую протеазу настоящего изобретения, включают в себя природные, синтетические или рекомбинантные нуклеиновые кислоты или их фрагменты и кодируют сериновую протеазу настоящего изобретения. Нуклеиновая кислота дикого типа, кодирующая сериновые протеазы данного изобретения, включает в себя известные в данной области природные аллели и гомологи, образовавшиеся в результате вырожденности генетического кода.
Термин "идентичный" в применении к двум нуклеотидным или полипептидным последовательностям относится к остаткам двух последовательностей, которые признаны одинаковыми после выравнивания последовательностей с получением максимального соответствия с помощью одного из алгоритмов сравнения или анализа последовательностей.
Термин "оптимальное выравнивание" относится к выравниванию, которое дает максимальный процент совпадений.
"Процент идентичности последовательностей", "процент идентичности аминокислотных последовательностей", "процент идентичности генных последовательностей" и/или "процент идентичности нуклеотидных/полинуклеотидных последовательностей" в применении к двум аминокислотным, полинуклеотидным и/или генным последовательностям (в зависимости от ситуации), относится к проценту идентичных остатков в двух последовательностях при оптимальном выравнивании последовательностей. Так, 80% идентичности аминокислотных последовательностей означает, что 80% аминокислот в двух полипептидных последовательностях идентичны при оптимальном выравнивании.
Фраза "практически идентичный", используемая в отношении двух нуклеиновых кислот или полипептидов, означает, что полинуклеотид или полипептид, по меньшей мере, примерно на 70%, предпочтительно, по меньшей мере, примерно на 75%, предпочтительно, по меньшей мере, примерно на 80%, предпочтительно, по меньшей мере, примерно на 85%, предпочтительно, по меньшей мере, примерно на 90%, предпочтительно по меньшей мере, примерно на 95%, предпочтительно по меньшей мере, примерно на 97%, предпочтительно, по меньшей мере, примерно на 98% и предпочтительно, по меньшей мере, примерно на 99% идентичен сравниваемой последовательности, где сравнение проводят с помощью программ или алгоритмов (таких как BLAST, ALIGN, CLUSTAL) с использованием стандартных параметров. Способность первого полипептида и второго полипептида вступать в перекрестные иммунологические реакции свидетельствует о том, что два полипептида являются практически идентичными. Как правило, в перекрестные иммунологические реакции способны вступать полипептиды, которые отличаются консервативными аминокислотными заменами. Таким образом, полипептид является практически идентичным второму полипептиду, например, если указанные полипептиды отличаются только консервативной заменой. Другим признаком того, что две нуклеотидные последовательности являются практически идентичными, является способность двух молекул гибридизоваться друг с другом в жестких условиях (например, в диапазоне условий от средней до высокой жесткости).
Термин "эквивалентный" в данном контексте относится к ферментам сериновым протеазам, которые кодирует полинуклеотид, способный гибридизоваться в условиях от средней до высокой жесткости с полинуклеотидом, имеющим последовательность SEQ ID NO 1. Например, эквивалентная зрелая сериновая протеаза имеет последовательность, которая, по меньшей мере, примерно на 70%, по меньшей мере, примерно на 75%, по меньшей мере, примерно на 80%, по меньшей мере, примерно на 85%, по меньшей мере, примерно на 90%, по меньшей мере, примерно на 91%, по меньшей мере, примерно на 92%, по меньшей мере, примерно на 93%, по меньшей мере, примерно на 94%, по меньшей мере, примерно на 95%, по меньшей мере, примерно на 96%, по меньшей мере, примерно на 97%, по меньшей мере, примерно на 98%, и/или по меньшей мере, примерно на 99% идентична аминокислотной последовательности зрелой сериновой протеазы BPN' SEQ ID NO:2.
Термин "выделенный" или "очищенный" относится к веществу, удаленному из исходной среды (например, из природной среды, если он встречается в природе). Например, говорят, что вещество является "очищенным", если оно присутствует в конкретной смеси в более высокой или более низкой концентрации, чем в природе или в организме дикого типа. Например, природный полинуклеотид или полипептид, присутствующий в живом организме, не является выделенным, однако тот же полинуклеотид или полипептид, отделенный от некоторых или всех веществ, существующих совместно с ним в природной системе, называют выделенным. В некоторых воплощениях такие полинуклеотиды являются частью вектора и/или такие полинуклеотиды или полипептиды входят в состав композиции, и тем не менее являются выделенными, поскольку вектор или композиция не являются частью их природного окружения. В предпочтительных воплощениях говорят, что нуклеиновая кислота или белок являются очищенными, если они дают по существу одну полосу при электрофорезе в геле или блоттинге.
Термин "выделенный" в применении к последовательности ДНК означает, что последовательность ДНК удалена из природной генетической среды, следовательно, не содержит других посторонних или нежелательных кодирующих последовательностей, и находится в виде формы, подходящей для применения в системе получения рекомбинантного белка. Такие выделенные молекулы представляют собой молекулы, отделенные от их природного окружения, и включают в себя кДНК и геномные клоны. Выделенные молекулы ДНК настоящего изобретения не содержат других генов, с которыми они обычно ассоциированы, однако они могут содержать природные 5'- и 3'-нетранслируемые участки, такие как промоторы и терминаторы. Способы идентификации ассоциированных участков известны специалистам в данной области (см., например, Dynan and Tijan, Nature 316:774-78 [1985]). Альтернативой термину "выделенная последовательность ДНК" может служить выражение "клонированная последовательность ДНК".
Термин "выделенный" в применении к белку означает, что белок находится в условиях, отличных от его природного окружения. В предпочтительной форме выделенный белок практически не содержит других белков, особенно других гомологичных белков. Выделенный белок имеет чистоту, составляющую более чем примерно 10%, предпочтительно, более чем примерно 20%, более предпочтительно, более чем примерно 30% по данным SDS-PAGE. Другие аспекты данного изобретения охватывают белок в виде высокоочищенной формы (т.е., чистота составляет более чем примерно 40%, более чем примерно 60%, более чем примерно 80%, более чем примерно 90%, более чем примерно 95%, более чем примерно 97% и даже более чем примерно 99%) по данным SDS-PAGE.
В данном документе термин "комбинаторный мутагенез" относится к способам получения библиотек вариантов исходной последовательности. Варианты, входящие в состав указанных библиотек, содержат одну или несколько мутаций, выбранных из ранее определенного набора мутаций. Кроме того, эти способы позволяют вводить случайные мутации, которые не являются членами ранее определенного набора мутаций. В некоторых воплощениях способы включают в себя способы, описанные в патентной заявке США № 09/699250, поданной 26 октября 2000, которая включена в настоящее описание в качестве ссылки. В альтернативных воплощениях способы комбинаторного мутагенеза охватывают применение коммерчески доступных наборов (например, QuikChange® Multisite, Stratagene, San Diego, CA).
В данном документе термин "библиотека мутантов" относится к популяции клеток, которые являются идентичными по основной части генома, но содержат разные гомологи одного или нескольких генов. Такие библиотеки можно использовать, например, для идентификации генов или оперонов с улучшенными свойствами.
В данном документе термин "исходный ген" относится к представляющему интерес гену, кодирующему представляющий интерес белок, который подлежит улучшению и/или изменению с помощью способов настоящего изобретения.
В данном документе термин "выравнивание нескольких последовательностей" ("MSA") относится к выравниванию последовательностей нескольких гомологов исходного гена с помощью алгоритма (например, Clustal W).
В данном документе термины "консенсусная последовательность" и "каноническая последовательность" относятся к архетипической аминокислотной последовательности, с которой сравнивают все варианты конкретного белка или представляющей интерес последовательности. Термины также относятся к последовательности, которая содержит нуклеотиды, наиболее часто встречающиеся в представляющей интерес последовательности ДНК. Для каждого положения гена консенсусная последовательность предоставляет аминокислоту, которая наиболее часто встречается в данном положении по результатам MSA.
В данном документе термин "консенсусная мутация" относится к различию в последовательности исходного гена и консенсусной последовательности. Консенсусные мутации идентифицируют путем сравнения последовательностей исходного гена и консенсусной последовательности методом MSA. В некоторых воплощениях консенсусные мутации вводят в исходный ген, чтобы придать ему больше сходства с консенсусной последовательностью. Консенсусные мутации также включают в себя аминокислотные изменения. приводящие к изменению аминокислоты в исходном гене на аминокислоту, которая более часто встречается в данном положении по результатам MSA по сравнению с частотой встречаемости этой аминокислоты в исходном гене. Таким образом, термин консенсусная мутация включает в себя все одиночные аминокислотные изменения, соответствующие замене аминокислоты исходного гена на аминокислоту, которая является более распространенной по данным MSA.
В данном документе термин "исходный хит" относится к варианту, который идентифицируют путем скрининга библиотеки с комбинаторным консенсусным мутагенезом. В предпочтительных воплощениях исходные хиты обладают улучшенными функциональными характеристиками по сравнению с исходным геном.
В данном документе термин "улучшенный хит" относится к варианту, который идентифицируют путем скрининга улучшенной библиотеки с комбинаторным консенсусным мутагенезом.
В данном документе термины "улучшающая мутация" и "мутация, улучшающая функциональные характеристики" относятся к мутации, которая после введения в исходный ген, приводит к улучшению его функциональных характеристик. В некоторых предпочтительных воплощениях указанные мутации идентифицируют путем секвенирования хитов, который были идентифицированы в данном способе на стадии скрининга. В большинстве воплощений мутации, которые чаще встречаются в хитах, более вероятно являются улучшающими мутациями, чем мутации в неподвергавшейся скринингу библиотеке с комбинаторным консенсусным мутагенезом.
В данном документе термин "улучшенная библиотека с комбинаторным консенсусным мутагенезом" относится к библиотеке CCM, которую создают и конструируют на основе скрининга и/или секвенирования продуктов, полученных в предыдущем цикле CCM мутагенеза и скрининга. В некоторых воплощениях улучшенную библиотеку с CCM получают на основе последовательности исходного продукта, полученного в предыдущем цикле CCM. В других воплощениях при конструировании улучшенной библиотеки с CCM предпочтительными являются мутации, часто наблюдающиеся в исходных продуктах, полученных в предыдущих циклах мутагенеза и скрининга. В некоторых предпочтительных воплощениях при получении таких библиотек пренебрегают праймерами, которые кодируют мутации, ухудшающие характеристики, или увеличивают концентрации праймеров, которые кодируют мутации, улучшающие характеристики, по отношению к другим праймерам, которые используют для получения предшествующих библиотек CCM.
В данном документе термин "мутации, ухудшающие характеристики" относится к мутациям в библиотеке комбинаторного консенсусного мутагенеза, которые реже встречаются в продуктах, полученных после скрининга, чем в библиотеке комбинаторного консенсусного мутагенеза, не подвергавшейся скринингу. В предпочтительных воплощениях в процессе скрининга происходит удаление и/или уменьшение встречаемости вариантов, которые содержат "мутации, ухудшающие характеристики".
В данном документе термин "функциональный анализ" относится к анализу, с помощью которого определяют активность белка. В особенно предпочтительных воплощениях термин относится к аналитическим системам, в которых белок анализируют на способность функционировать в его обычной роли. Например, в случае ферментов функциональный анализ включает в себя определение эффективности фермента при катализе реакции.
В данном документе термин "целевое свойство" относится к свойству исходного гена, которое нужно изменить. Предполагается, что настоящее изобретение не ограничивается каким-либо конкретным целевым свойством. Однако в некоторых предпочтительных воплощениях целевое свойство представляет собой стабильность генного продукта (например, устойчивость к денатурации, протеолизу или другим деструктивным факторам), хотя в других воплощениях изменению подлежит уровень продукции в хозяине. Предполагается, что фактически любое свойство исходного гена может найти применение в настоящем изобретении.
Термин "свойство" или его грамматические эквиваленты в применении к нуклеиновой кислоте в данном документе относятся к любым характеристическим особенностям или признакам нуклеиновой кислоты, которые можно выбрать или детектировать. Указанные свойства включают в себя, без ограничения, свойство, вляющее на связывание с полипептидом, свойство, которое появляется у клетки, содержащей конкретную нуклеиновую кислоту, свойство, влияющее на транскрипцию гена (например, длина промотора, распознавание промотора, регуляция промотора, функция энхансера), свойство, влияющее на процессинг РНК (например, сплайсинг РНК, стабильность РНК, конформация РНК и пост-транскрипционная модификация), свойство, влияющее на трансляцию (например, уровень мРНК, регуляция мРНК, связывание мРНК с рибосомальными белками, пост-трансляционная модификация). Например, участок связывания фактора транскрипции, полимеразы, регуляторного фактора и др. в нуклеиновой кислоте можно изменить с целью получения желательных характеристик или идентификации нежелательных характеристик.
Термин "свойство" или его грамматические эквиваленты в применении к полипептиду (в том числе к белкам) в данном документе относятся к любым характеристическим особенностям или признакам полипептида, которые можно выбрать или детектировать. Указанные свойства включают в себя, без ограничения, устойчивость к окислению, специфичность к субстрату, каталитическую активность, термическую стабильность, устойчивость к щелочам, профиль активности при разных значениях pH, устойчивость к протеолитической деградации, KM, kcat, отношение kcat/kM, укладка белка, способность индуцировать иммунный ответ, способность связываться с лигандом, способность связываться с рецептором, способность секретироваться, способность презентироваться на поверхности клетки, способность олигомеризоваться, способность участвовать в передаче сигнала, способность стимулировать пролиферацию клеток, способность ингибировать пролиферацию клеток, способность индуцировать апоптоз, способность подвергаться модификации в результате фосфорилирования или гликозилирования, и/или способность лечить заболевание и др.
В данном документе термин "скрининг" имеет значение, традиционно используемое в данной области, и, как правило, относится к многостадийному процессу. На первой стадии получают мутантную нуклеиновую кислоту или кодируемый ею вариантный полипептид. На второй стадии определяют свойство мутантной нуклеиновой кислоты или вариантного полипептида. На третьей стадии определенное свойство сравнивают со свойством соответствующей исходной нуклеиновой кислоты, со свойством соответствующего природного полипептида, или со свойством исходного вещества (например, исходной последовательности), используемого для получения мутантной нуклеиновой кислоты.
Специалистам в данной области известно, что выбор процедуры скрининга, используемой для получения нуклеиновой кислоты или белка с измененным свойством, зависит от свойства исходного вещества, модификация которого приводит к получению мутантной нуклеиновой кислоты, которое предполагается облегчить. Следовательно, специалист в данной области может определить, что изобретение не ограничивается каким-либо конкретным свойством, подлежащим скринингу, и что в нижеследующем описании свойств перечислены только иллюстративные примеры. Способы скрининга по конкретным свойствам широко описаны в данной области. Например, можно измерить связывание, pH, специфичность и др. до и после введения мутации, где замена определяет изменение. Предпочтительно используют скрининги с высокой пропускной способностью, позволяющие одновременно анализировать несколько образцов, которые включают в себя, без ограничения, анализы с применением чипов, фаговых дисплеев и нескольких субстратов и/или индикаторов.
В данном документе некоторые воплощения скринингов включают в себя стадии обогащения популяции вариантов представляющими интерес вариантами. Примеры указанных воплощений включают в себя выбор вариантов, обеспечивающих преимущественный рост организму-хозяину, а также методы фаговых дисплеев или других дисплеев, в которых отдельные варианты из популяции вариантов улавливаются на основе связывающих или каталитических свойств. В предпочтительном воплощении библиотеку вариантов подвергают воздействию (тепла, протеазы, денатурации), после чего с помощью скрининга идентифицируют варианты, оставшиеся интактными, или осуществляют обогащение библиотеки данными вариантами путем селекции. Подразумевается, что данный термин охватывает все подходящие способы селекции. Безусловно, предполагается, что настоящее изобретение не ограничивается каким-либо конкретным способом скрининга.
В данном документе термин "направленная рандомизация" относится к способу получения множества последовательностей, в которых одно или два положения рандомизированы. В некоторых воплощениях рандомизация является полной (т.е., в рандомизированном положении могут встречаться все четыре нуклеотида, A, T, G и C). В альтернативных воплощениях нуклеотидная рандомизация ограничивается поднабором четырех нуклеотидов. Направленную рандомизацию можно применять по одному или нескольким кодонам последовательности, кодирующей один или более представляющих интерес белков. При экспрессии полученные библиотеки продуцируют популяции белков, в которых одно или более аминокислотных положений могут содержать смесь всех 20 аминокислот, или подгруппу аминокислот, в зависимости от схемы рандомизации конкретного кодона. В некоторых воплощениях отдельные члены популяции, полученной в результате направленной рандомизации, различаются по числу аминокислот вследствие направленной или случайной инсерции или делеции кодонов. В других воплощениях полученные популяции белков содержат синтетические аминокислоты. В некоторых предпочтительных воплощениях большая часть членов популяции, полученной в результате направленной рандомизации, в большей степени гомологична консенсусной последовательности, чем исходный ген. В некоторых воплощениях последовательность кодирует один или более представляющих интерес белков. В альтернативных воплощениях белки выполняют разные биологические функции. В некоторых предпочтительных воплощениях экзогенная последовательность содержит, по меньшей мере, один селектируемый маркер. Такая последовательность может кодировать один или более представляющих интерес белков. Она может выполнять другие биологические функции. Зачастую экзогенная последовательность может содержать в качестве селектируемого маркера ген, отвечающий за устойчивость к антибиотику.
Термины "модифицированная последовательность" и "модифицированные гены" используются в данном документе как взаимозаменяемые и относятся к последовательности, которая отличается от природной последовательности нуклеиновой кислоты делецией, инсерцией или прерыванием последовательности. В некоторых предпочтительных воплощениях продукт экспрессии модифицированной последовательности представляет собой укороченный белок (например, если модификация представляет собой делецию или прерывание последовательности). В некоторых особенно предпочтительных воплощениях укороченный белок сохраняет биологическую активность. В альтернативных воплощениях продукт экспрессии модифицированной последовательности представляет собой удлиненный белок (например, если модификация включает в себя инсерцию в последовательность нуклеиновой кислоты). В некоторых воплощениях следствием инсерции является экспрессия укороченного белка (например, если инсерция приводит к образованию стоп-кодона). Таким образом, инсерция может приводить к экспрессии как укороченного, так и удлиненного белка.
В данном документе термины "мутантная последовательность" и "мутантный ген" используются как взаимозаменяемые и относятся к последовательности, которая содержит изменение, по меньшей мере, одного кодона, присутствующего в последовательности клетки-хозяина дикого типа. Продукт экспрессии мутантной последовательности представляет собой белок, аминокислотная последовательность которого отличается от последовательности дикого типа. Продукт экспрессии может обладать измененными функциональными характеристиками (например, повышенной ферментативной активностью).
Термины "мутагенный праймер" или "мутагенный олигонуклеотид" (используемые здесь как взаимозаменяемые) относятся к олигонуклеотидным составам, которые соответствуют фрагменту последовательности матрицы и способны гибридизоваться с ним. Мутагенный праймер не имеет точного соответствия нуклеотидной матрице, причем несовпадение, или несовпадения, можно использовать для введения целевой мутации в библиотеку нуклеиновых кислот. В данном документе термины "немутагенный праймер" или "немутагенный олигонуклеотид" относятся к олигонуклеотидным составам, которые точно совпадают с нуклеотидной матрицей. В одном воплощении данного изобретения используют только мутагенные праймеры. В другом предпочтительном воплощении изобретения праймеры конструируют так, чтобы, по меньшей мере, одному участку соответствовала олигонуклеотидная смесь, содержащая как мутагенный праймер, так и немутагенный праймер. Путем добавления смеси мутагенных праймеров и немутагенных праймеров, соответствующих, по меньшей мере, одному из мутагенных праймеров, можно получить библиотеку нуклеиновых кислот, в которой представлен ряд комбинаторных мутационных моделей. Например, если нужно, чтобы некоторые члены библиотеки мутантных нуклеиновых кислот сохраняли исходную последовательность по отдельным положениям, а другие члены имели бы мутации в этих участках, немутагенные праймеры обеспечивают получение определенного уровня немутантных членов библиотеки нуклеиновых кислот по данному остатку. В способах данного изобретения используют мутагенные и немутагенные олигонуклеотиды, длина которых обычно составляет 10-50 оснований, более предпочтительно примерно 15-45 оснований. Однако для получения желательного результата мутагенеза могут потребоваться праймеры, длина которых составляет или меньше 10 оснований, или больше 50 оснований. Мутагенные и немутагенные праймеры необязательно должны иметь одинаковую длину, однако они должны перекрываться в участке добавления мутации. Праймеры можно добавлять в заранее определенном соотношении в соответствии с настоящим изобретением. Например, библиотеку, содержащую значительный уровень некоторой специфической мутации и более низкое количество другой мутации в одном участке, или в разных участках, можно получить путем регуляции количества добавляемых праймеров. Альтернативно, путем добавления меньших или больших количеств немутагенных праймеров можно регулировать частоту встречаемости соответствующей мутации (мутаций) в библиотеке мутантных нуклеиновых кислот.
В данном документе фраза "смежные мутации" относится к мутациям, которые несет один олигонуклеотидный праймер. Например, независимо от того, находятся ли смежные мутации рядом или близко друг к другу, их вводят в конечную мутантную нуклеотидную матрицу с помощью одного праймера.
В данном документе фраза "несмежные мутации" относится к мутациям, которые находятся на разных олигонуклеотидных праймерах. Например, несмежные мутации рядом вводят в конечную мутантную нуклеотидную матрицу с помощью полученных отдельно олигонуклеотидных праймеров.
Термины "последовательность дикого типа" или "ген дикого типа", используемые в данном описании как взаимозаменяемые, относятся к нативной последовательности или последовательности, которая в природе присутствует в клетке-хозяине. В некоторых воплощениях термин последовательность дикого типа относится к представляющей интерес последовательности, которую используют в качестве исходного материала при получении рекомбинантного белка. Последовательность дикого типа может кодировать либо гомологичный, либо гетерологичный белок. Гомологичный белок представляет собой белок, который клетка-хозяин продуцирует без вмешательства извне. Гетерологичный белок представляет собой белок, который клетка-хозяин не продуцирует без вмешательства извне.
Если не указано иначе, нумерация аминокислотных положений соответствует нумерации, используемой для зрелой последовательности субтилизина Bacillus amyloliquefaciens SEQ ID NO:2. Однако данное изобретение не ограничивается мутацией указанного конкретного субтилизина, а охватывает протеазы-предшественники, содержащие аминокислотные остатки в положениях, "эквивалентных" конкретным идентифицированным остаткам субтилизина Bacillus amyloliquefaciens.
В данном документе термины "модификация" и "мутация" относятся к любому изменению или преобразованию аминокислотной последовательности. Подразумевается, что данный термин охватывает замены, делеции, инсерции и/или замещение боковых цепей аминокислот в представляющей интерес аминокислотной последовательности (например, в последовательности субтилизина). Также предполагается, что данный термин охватывает химическую модификацию представляющей интерес аминокислотной последовательности (например, последовательности субтилизина).
В данном документе термин "антитела" относится к иммуноглобулинам. Антитела включают в себя, без ограничения, иммуноглобулины, непосредственно полученные из видов, из которых желательно получать антитела. Кроме того, настоящее изобретение охватывает модифицированные антитела. Данный термин также относится к фрагментам антител, которые сохраняют способность связывать эпитоп, с которым связывается интактное антитело, и включают в себя фрагменты поликлональных антител, моноклональных антител, химерных антител, антиидиотипических (анти-ID) антител. Фрагменты антител включают в себя, без ограничения, гипервариабельные участки (CDR), вариабельные участки одноцепочечных фрагментов (scFv), вариабельные участки тяжелых цепей (VH), вариабельные участки легких цепей (VL). В объем настоящего изобретения также входят поликлональные и моноклональные антитела. Предпочтительно антитела представляют собой моноклональные антитела.
Термин "устойчивый к окислению" относится к протеазам настоящего изобретения, которые сохраняют определенную величину ферментативной активности в течение заданного периода времени в условиях, преобладающих при протекании протеолиза, гидролиза, чистки или другого процесса настоящего изобретения, например, при воздействии отбеливающих или окисляющих средств, или при приведении в контакт с указанными средствами. В некоторых воплощениях протеазы сохраняют, по меньшей мере, примерно 50%, примерно 60%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 92%, примерно 95%, примерно 96%, примерно 97%, примерно 98% или примерно 99% протеолитической активности после контакта с отбеливающим или окисляющим средством в течение определенного периода времени, составляющего, например, по меньшей мере, примерно 1 минуту, примерно 3 минуты, примерно 5 минут, примерно 8 минут, примерно 12 минут, примерно 16 минут, примерно 20 минут и т.д. В некоторых воплощениях стабильность измеряют с помощью способов, описанных в Примерах.
Термин "устойчивый к хелатирующему средству" относится к протеазам настоящего изобретения, которые сохраняют определенную величину ферментативной активности в течение заданного периода времени в условиях, преобладающих при протекании протеолиза, гидролиза, чистки или другого процесса настоящего изобретения, например, при воздействии хелатирующего средства, или при приведении в контакт с хелатирующим средством. В некоторых воплощениях протеазы сохраняют, по меньшей мере, примерно 50%, примерно 60%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 92%, примерно 95%, примерно 96%, примерно 97%, примерно 98% или примерно 99% протеолитической активности после контакта с хелатирующим средством в течение определенного периода времени, составляющего, например, по меньшей мере, примерно 10 минут, примерно 20 минут, примерно 40 минут, примерно 60 минут, примерно 100 минут и т.д. В некоторых воплощениях устойчивость к хелатирующему средству измеряют с помощью способов, описанных в Примерах.
Термины "термически стабильный" и "термостабильный" относятся к протеазам настоящего изобретения, которые сохраняют определенную величину ферментативной активности после воздействия определенной температуры в течение заданного периода времени в условиях, преобладающих при протекании протеолиза, гидролиза, чистки или другого процесса настоящего изобретения, например, при изменении температуры. Изменение температуры включает в себя увеличение или уменьшение температуры. В некоторых воплощениях протеазы сохраняют, по меньшей мере, примерно 50%, примерно 60%, примерно 70%, примерно 75%, примерно 80%, примерно 85%, примерно 90%, примерно 92%, примерно 95%, примерно 96%, примерно 97%, примерно 98% или примерно 99% протеолитической активности после воздействия измененной температуры в течение определенного периода времени, составляющего, например, по меньшей мере, примерно 60 минут, примерно 120 минут, примерно 180 минут, примерно 240 минут, примерно 300 минут и т.д. В некоторых воплощениях термостабильность измеряют с помощью способов, описанных в Примерах.
Термин "повышенная стабильность" относится к протеазе, устойчивой к окислению, воздействию хелатирующего средства, температуры и/или pH, которая сохраняет с течением времени более высокую величину протеолитической активности, чем другие сериновые протеазы (например, субтилизиновые протеазы) и/или ферменты дикого типа.
Термин "пониженная стабильность" относится к протеазе, устойчивой к окислению, воздействию хелатирующего средства, температуры и/или pH, которая сохраняет с течением времени более высокую величину протеолитической активности, чем другие сериновые протеазы (например, субтилизиновые протеазы) и/или ферменты дикого типа.
Термин "чистящая активность" относится к чистящим характеристикам протеазы в условиях, преобладающих при протекании протеолиза, гидролиза, чистки или другого процесса настоящего изобретения. В некоторых воплощениях чистящие характеристики определяют с помощью разных анализов чистки, включающих в себя анализы чувствительных к ферментам пятен, таких как пятна травы, крови, молока или яичного белка, разными хроматографическими, спектрофотометрическими или другими количественными методами после воздействия на пятна стандартных условий стирки. Примеры анализов включают в себя, без ограничения, анализы, описанные в WO 99/34011 и патенте США № 6605458 (которые включены в данное описание в качестве ссылки), а также способы, описанные в Примерах.
Термин "количество, эффективное для очищения" в применении к протеазе обозначает количество описанной ранее протеазы, которое обеспечивает желательный уровень ферментативной активности в конкретной чистящей композиции. Указанное эффективное количество, которое может легко установить рядовой специалист в данной области, зависит от многих факторов, таких как конкретный тип используемой протеазы, цель чистки, конкретный состав чистящей композиции, требуемая форма композиции, жидкая или сухая (например, гранулярная, бруски), и др.
Термин "вспомогательные чистящие средства" в данном документе относится ко всем жидким, твердым или газообразным веществам, выбранным для конкретного типа желательной чистящей композиции и формы продукта (такого как жидкая, гранулированная, порошкообразная, в виде брусков, пастообразная, в виде спрея, таблеточная, гелеобразная или пенообразная композиция), причем указанные вещества предпочтительно совместимы с ферментом протеазой, используемым в композиции. В некоторых воплощениях гранулированные композиции находятся в "компактном" виде, а в других воплощениях жидкие композиции находятся в "концентрированном" виде.
Термин "улучшенные рабочие характеристики" в применении к чистящей активности относится к повышенной или улучшенной чистящей активности в отношении пятен, чувствительных к определенному ферменту, таких как пятна от яиц, молока, травы или крови, которую определяют визуально после стандартного цикла чистки и/или нескольких циклов чистки.
Термин "ухудшенные рабочие характеристики" в применении к чистящей активности относится к пониженной или ухудшенной чистящей активности в отношении пятен, чувствительных к определенному ферменту, таких как пятна от яиц, молока, травы или крови, которую определяют визуально после стандартного цикла чистки.
Термин "сравнимые рабочие характеристики" относится к чистящей активности, которая составляет, по меньшей мере, примерно 60%, по меньшей мере, примерно 70%, по меньшей мере, примерно 80%, по меньшей мере, примерно 90%, или, по меньшей мере, примерно 95% от чистящей активности сравниваемой субтилизиновой протеазы (например, коммерчески доступной протеазы), включающей в себя, без ограничения, протеазу OPTIMASETM (Genencor), протеазные продукты PURAFECTTM (Genencor), протеазу SAVINASETM (Novozymes), BPN'-варианты (см., например, патент США № Re 34606), RELASETM, DURAZYMETM, EVERLASETM, протеазу KANNASETM (Novozymes), протеазы MAXACALTM, MAXAPEMTM, PROPERASETM (Genencor; см. также патент США № Re 34606 и патенты США №№ 5700676; 5955340; 6312936; и 6482628), и вариантные протеазные продукты B. lentus (например, описанные в WO 92/21760, WO 95/23221 и/или WO 97/07770). Примеры вариантов субтилизиновой протеазы включают в себя, без ограничения, варианты, содержащие замены или делеции по положениям остатков, эквивалентным положениям 76, 101, 103, 104, 120, 159, 167, 170, 194, 195, 217, 232, 235, 236, 245, 248 и/или 252 BPN'. Чистящие характеристики можно определить путем сравнения протеазы настоящего изобретения с субтилизиновыми протеазами с помощью разных анализов чистки, в которых используются чувствительные к ферментам пятна, такие как пятна от травы, крови или молока, и детекция обычными спектрофотометрическими или аналитическими методами после цикла чистки в стандартных условиях.
В данном документе "композиции для чистки тканей" включают в себя композиции стиральных средств для ручной и машинной стирки, в том числе дополнительные стиральные композиции и композиции, подходящие для замачивания и/или предварительной обработки загрязненных тканей (например, одежды, постельного белья и других текстильных материалов).
В данном документе термин "композиции для чистки отличных от тканей изделий" относится к композициям для чистки нетекстильных (т.е., нетканевых) поверхностей, включающим в себя, без ограничения, детергентные композиции для мытья посуды, композиции для ухода за полостью рта, композиции для чистки зубных протезов и композиции для личной гигиены.
"Компактная" форма чистящих композиций настоящего изобретения лучше всего характеризуется плотностью и, с точки зрения состава, количеством неорганической соли, используемой в качестве наполнителя. Неорганические соли, используемые в качестве наполнителя, являются традиционными ингредиентами порошкообразных детергентных композиций. В традиционных детергентных композициях соли, используемые в качестве наполнителя, присутствуют в больших количествах, составляющих обычно примерно от 17 до 35% по отношению к общей массе композиции. В компактных композициях, наоборот, соль-наполнитель присутствует в количестве, не превышающем примерно 15% от общей массы композиции. В некоторых воплощениях соль-наполнитель присутствует в количестве, не превышающем примерно 10%, или, более предпочтительно, примерно 5% по отношению к массе композиции. В некоторых воплощениях неорганические соли-наполнители выбраны из сульфатов и хлоридов щелочных и щелочноземельных металлов. Предпочтительной солью-наполнителем является сульфат натрия.
В данном документе термин "поверхностно-активное вещество" относится к любому соединению, которое известно в данной области как обладающее поверхностно-активными свойствами. Поверхностно-активные вещества обычно включают в себя анионные, катионные, неионные и цвиттерионные соединения, которые дополнительно описаны в данном документе.
В данном документе термины "приведение в контакт" и "подвергание воздействию" относится к помещению поверхностно-активного вещества и липолитического фермента в достаточной близости к маслянистому пятну или маслянистому загрязнению, чтобы обеспечить, по меньшей мере, уменьшение количества пятна или загрязнения под действием фермента и поверхностно-активного вещества путем продуцирования жирных кислот, которые солюбилизируются в поверхностно-активном веществе. Приведение в контакт может происходить в стиральной машине, сточной трубе, на поверхности тела и т.п.
Экспериментальная часть
Настоящее изобретение описано более подробно в нижеследующих примерах, которые не предназначены для ограничения объема изобретения, определенного в формуле изобретения. Нижеследующие примеры предлагаются для иллюстрации, но не для ограничения заявленного изобретения.
В приведенном ниже описании экспериментальной части используют следующие сокращения: м.д. (миллионные доли); M (молярный); мM (миллимолярный); мкM (микромолярный); нM (наномолярный); моль (моли); ммоль (миллимоли); мкмоль (микромоли); нмоль (наномоли); г (граммы); мг (миллиграммы); мкг (микрограммы); пг (пикограммы); л (литры); мл (миллилитры); мкл (микролитры); см (сантиметры); мм (миллиметры); мкм (микрометры); нм (нанометры); ед. (единицы); В (вольт); ММ (молекулярная масса); сек (секунды); мин (минуты); ч (часы); °C (градусы Цельсия); QS (достаточное количество); ND (не закончено); NA (не применимо); об/мин (обороты в минуту); H2O (вода); dH2O (деионизированная вода); (HCl (хлористоводородная кислота); ак (аминокислота); п. о. (пары оснований); т. о. (тысячи пар оснований); кД (килодальтон); кДНК (копийная или комплементарная ДНК); ДНК (дезоксирибонуклеиновая кислота); оцДНК (одноцепочечная ДНК); дцДНК (двухцепочечная ДНК); dNTP (дезоксирибонуклеотидтрифосфат); РНК (рибонуклеиновая кислота); MgCl2 (хлорид магния); NaCl (хлорид натрия); масс/об (соотношение массы к объему); об/об (соотношение по объему); g (сила тяжести); OD (оптическая плотность); забуференный фосфатом раствор Дульбекко (DPBS); SOC (2% бактотриптон, 0,5% бактодрожжевой экстракт, 10 мМ NaCl, 2,5 мМ KCl); бульон Terrific (TB; 12 г/л бактотриптона, 24 г/л глицерина, 2,31 г/л KH2PO4 и 12,54 г/л K2HPO4); OD280 (оптическая плотность при 280 нм); OD600 (оптическая плотность при 600 нм); A405 (поглощение при 405 нм); Vmax (максимальная начальная скорость реакции, катализируемой ферментом); PAGE (электрофорез в полиакриламидном геле); PBS (забуференный фосфатом физиологический раствор [150 мM NaCl, 10 мM натрий-фосфатный буфер, pH 7,2]); PBST (PBS+0,25% TWEEN® 20); ПЭГ (полиэтиленгликоль); ПЦР (полимеразная цепная реакция); ОТ-ПЦР (ПЦР с обратной транскрипцией); SDS (додецилсульфат натрия); трис (трис(гидроксиметил)аминометан); HEPES (N-[2-гидроксиэтил]пиперазин-N-[2-этансульфоновая кислота]); HBS (забуференный HEPES физиологический раствор); трис-HCl (гидрохлорид трис[гидроксиметил]аминометана); трицин (N-[трис(гидроксиметил)метил]глицин); CHES (2-(N-цикло-гексиламино)этансульфоновая кислота); TAPS (3-{[трис-(гидроксиметил)метил]амино}пропансульфоновая кислота); CAPS (3-(циклогексиламино)пропансульфоновая кислота; ДМСО (диметилсульфоксид); DTT (1,4-дитио-DL-треитол); SA (синапиновая кислота (s,5-диметокси-4-гидроксикоричная кислота); TCA (трихлоруксусная кислота); Glut и GSH (восстановленный глутатион); GSSG (окисленный глутатион); TCEP (трис[2-карбоксиэтил]фосфин); Ки (кюри); мКи (милликюри); мкКи (микрокюри); ВЭЖХ (высокоэффективная жидкостная хроматография); ОФ-ВЭЖХ (высокоэффективная жидкостная хроматография на обращенной фазе); ТСХ (тонкослойная хроматография); MALDI-TOF (время-пролетная ионизация лазерной десорбцией с использованием матрицы); Ts (тозил); Bn (бензил); Ph (фенил); Ms (мезил); Et (этил), Me (метил); Taq (ДНК-полимераза Thermus aquaticus); фрагмент Кленова (большой фрагмент (Кленова) ДНК-полимеразы I); EGTA (этиленгликоль-бис(β-аминоэтиловый эфир) N,N,N',N'-тетрауксусной кислоты); EDTA (этилендиаминтетрауксусная кислота); bla (ген устойчивости к β-лактамазе или ампициллину); HDL (липопротеин высокой плотности); MJ Research (MJ Research, Reno, NV); Baseclear (Baseclear BV, Inc., Leiden, the Netherlands); PerSeptive (PerSeptive Biosystems, Framingham, MA); ThermoFinnigan (ThermoFinnigan, San Jose, CA); Argo (Argo BioAnalytica, Morris Plains, NJ); Seitz EKS (SeitzSchenk Filtersystems GmbH, Bad Kreuznach, Germany); Pall (Pall Corp., East Hills, NY); Spectrum (Spectrum Laboratories, Dominguez Rancho, CA); Molecular Structure (Molecular Structure Corp., Woodlands, TX); Accelrys (Accelrys, Inc., San Diego, CA); Chemical Computing (Chemical Computing Corp., Montreal, Canada); New Brunswick (New Brunswick Scientific, Co., Edison, NJ); CFT (Center for Test Materials, Vlaardingen, the Netherlands); Test Fabrics (Test Fabrics, Inc., West Pittiston, PA), Procter & Gamble (Procter & Gamble, Inc., Cincinnati, OH); GE Healthcare (GE Healthcare, Chalfont St. Giles, United Kingdom); OXOID (Oxoid, Basingstoke, Hampshire, UK); Megazyme (Megazyme International Ireland Ltd., Bray Business Park, Bray, Co., Wicklow, Ireland); Finnzymes (Finnzymes Oy, Espoo, Finland); Kelco (CP Kelco, Wilmington, DE); Corning (Corning Life Sciences, Corning, NY); (NEN (NEN Life Science Products, Boston, MA); Pharma AS (Pharma AS, Oslo, Norway); Dynal (Dynal, Oslo, Norway); Bio-Synthesis (Bio-Synthesis, Lewisville, TX); ATCC (American Type Culture Collection, Rockville, MD); Gibco/BRL (Gibco/BRL, Grand Island , NY); Sigma (Sigma Chemical Co, St. Louis, MO); Pharmacia (Pharmacia Biotech, Piscataway, NJ); NCBI (National Center for Biotechnology Information); Applied Biosystems (Applied Biosystems, Foster City, CA); BD Biosciences и/или Clontech (BD Biosciences CLONTECH Laboratories, Palo Alto, CA); Operon Technologies (Operon Technologies, Inc., Alameda, CA); MWG Biotech (MWG Biotech, High Point, NC); Oligos Etc (Oligos Etc. Inc, Wilsonville, OR); Bachem (Bachem Bioscience, Inc., King of Prussia, PA); Difco (Difco Laboratories, Detroit, MI); Mediatech (Mediatech, Herndon, VA; Santa Cruz (Santa Cruz Biotechnology, Inc, Santa Cruz, CA); Oxoid (Oxoid Inc, Ogdensburg, NY); Worthington (Worthington Biochemical Corp, Freehold, NJ); GIBCO BRL или Gibco BRL (Life Technologies, Inc, Gaithersburg, MD); Millipore (Millipore, Billerica, MA); Bio-Rad (Bio-Rad, Hercules, CA); Invitrogen (Invitrogen Corp, San Diego, CA); NEB (New England Biolabs, Ipswich, MA); Sigma (Sigma Chemical Co, St. Louis, MO); Pierce (Pierce Biotechnology, Rockford, IL); Takara (Takara Bio Inc. Otsu, Japan); Roche (Hoffmann-La Roche, Basel, Switzerland); EM Science (EM Science, Gibbstown, NJ); Qiagen (Qiagen, Inc, Valencia, CA); Biodesign (Biodesign Intl., Saco, Maine); Aptagen (Aptagen, Inc., Herndon, VA); Sorvall (Sorvall brand, from Kendro Laboratory Products, Asheville, NC); United States Testing (United States Testing Co, Hoboken, NJ); Molecular Devices (Molecular Devices, Corp, Sunnyvale, CA); R&D Systems (R&D Systems, Minneapolis, MN); Stratagene (Stratagene Cloning Systems, La Jolla, CA); Marsh (Marsh Biosciences, Rochester, NY); Geneart (Geneart GmbH, Regensburg, Germany); DNA2.0 (DNA2.0, Menlo Park, CA); Gene Oracle (Gene Oracle, Mountain View, CA); Bio-Tek (Bio-Tek Instruments, Winooski, VT); Biacore (Biacore, Inc, Piscataway, NJ); PeproTech (PeproTech, Rocky Hill, NJ); SynPep (SynPep, Dublin, CA); New Objective (New Objective brand; Scientific Instrument Services, Inc., Ringoes, NJ); Waters (Waters, Inc., Milford, MA); Matrix Science (Matrix Science, Boston, MA); Dionex (Dionex, Corp., Sunnyvale, CA); Monsanto (Monsanto Co, St. Louis, MO); Wintershall (Wintershall AG, Kassel, Germany); BASF (BASF Co, Florham Park, NJ); Huntsman (Huntsman Petrochemical Corp, Salt Lake City, UT); Enichem (Enichem Iberica, Barcelona, Spain); Fruka Chemie AG (Fluka Chemie AG, Buchs, Switzerland); Gist-Brocades (Gist-Brocades, NV, Delft, the Netherlands); Dow Corning (Dow Corning Corp, Midland, MI); и Microsoft (Microsoft, Inc., Redmond, WA).
ПРИМЕР 1
Анализы
В нижеследующих примерах разные анализы используют, как описано ниже для простоты прочтения. Все отклонения от приведенных ниже методик указаны в примерах.
A. Определение содержания белка методом TCA с использованием 96-луночных титрационных микропланшетов
Анализ BPN' (например, стандартной протеазы) и вариантов BPN' проводят с использованием фильтрованного культурального супернатанта из титрационных микропланшетов после выращивания в течение 3-4 дней при 33°C и при встряхивании при 230 об/мин во влажной атмосфере. Для анализа используют новый 96-луночный плоскодонный титрационный микропланшет (MTP). Вначале в каждую лунку помещают 100 мкл/лунку 0,25н HCl. Затем добавляют 50 мкл фильтрованного культурального бульона. Определяют рассеяние/поглощение света при 405 нм (используют режим 5-секундного перемешивания в планшет-ридере), чтобы обеспечить "контрольное" прочтение. Для проведения анализа в планшеты вносят 100 мкл/лунку 15% (масс/об) трихлоруксусной кислоты (TCA) и инкубируют от 5 до 30 мин при комнатной температуре. Затем определяют рассеяние/поглощение света при 405 нм (используют режим 5-секундного перемешивания в планшет-ридере).
Анализ GG36 (например, стандартной протеазы) и ее вариантов проводят с использованием фильтрованного культурального супернатанта из титрационных микропланшетов после выращивания в течение примерно 3 дней при 37°C и при встряхивании при 300 об/мин во влажной атмосфере. В данном анализе в каждую лунку 96-луночного плоскодонного титрационного микропланшета добавляют 100 мкл 0,25M раствора HCl. Затем в лунки добавляют аликвоты фильтрованных культуральных супернатантов (содержащих протеазы) объемом 25 мкл. Определяют рассеяние/поглощение света при 405 нм (используют режим 5-секундного перемешивания в планшет-ридере), чтобы обеспечить "контрольное" прочтение. После проведения измерения во все лунки добавляют 100 мкл 30% (масс/об) раствора TCA, и титрационные микропланшеты инкубируют от 5 до 15 минут при комнатной температуре. Наконец, определяют конечное значение рассеяния/поглощения света при 405 нм (используют режим 5-секундного перемешивания в планшет-ридере).
Используемое оборудование: Biomek FX Robot (Beckman Coulter) и ридер для MTP SpectraMAX (тип 340; Molecular Devices); MTP от Costar (тип 9017). Используемое оборудование: Biomek FX Robot (Beckman Coulter) и ридер для MTP SpectraMAX, тип 340 (Molecular Devices); MTP типа 9017 (Costar).
Вычисления проводят путем вычитания значений контрольных образцов (ТХУ отсутствует) из значений тестируемых образцов, содержащих ТХУ, с получением относительного содержания белка в образцах. При желании стандартную кривую можно получить путем калибровки значений образцов, содержащих ТХУ, с использованием AAPF-анализов клонов с известными коэффициентами перехода. Однако кривая для образцов, содержащих ТХУ, является линейной на участке, соответствующем концентрации белка от 50 до 500 молекул белка на мл (м.д.), и, следовательно, может использоваться для определения характеристик фермента с целью выбора вариантов с хорошими характеристиками. Увеличение мутности/светорассеяния в образцах коррелирует с общим количеством осажденного белка в культуральном супернатанте.
B. AAPF-анализ протеазы в 96-луночных титрационных микропланшетах
Чтобы определить активность протеазы настоящего изобретения и ее вариантов, анализируют гидролиз N-сукцинил-L-аланил-L-аланил-L-пролил-L-фенил-п-нитроанилида (suc-AAPF-pNA). Используют следующие растворы реагентов: 100 мM трис/HCl, pH 8,6, содержащий 0,005% TWEEN®-80 (трис-буфер для разбавления); 100 мМ трис-буфер, pH 8,6, содержащий 10 мМ CaCl2 и 0,005% TWEEN®-80 (трис/Ca-буфер); и 160 мМ suc-AAPF-pNA в ДМСО (исходный раствор suc-AAPF-pNA) (Sigma: S-7388). Чтобы получить рабочий раствор suc-AAPF-pNA, 1 мл исходного раствора suc-AAPF-pNA добавляют к 100 мл трис/Ca-буфера и тщательно перемешивают в течение, по меньшей мере, 10 секунд. Анализ проводят путем добавления 10 мкл разбавленного раствора протеазы в каждую лунку, после чего сразу добавляют 190 мкл рабочего раствора suc-AAPF-pNA с концентрацией 1 мг/мл. Растворы перемешивают в течение 5 сек и затем прочитывают изменение поглощения в кинетическом режиме (20 считываний в течение 5 минут) при 410 нм в ридере для MTP при 25°C. Активность протеазы выражают в виде единиц поглощения (активность=ΔOD.мин-1мл-1).
C. Анализы устойчивости к поверхностно-активным веществам и хелатирующим средствам
Устойчивость к LAS и LAS/EDTA определяют после инкубации анализируемой протеазы с LAS и LAS/EDTA соответственно, в виде функции остаточной активности, определенной с помощью AAPF-анализа.
Устойчивость к LAS, методика
Реагенты:
Додецилбензолсульфонат, натриевая соль (=LAS): Sigma D-2525
TWEEN®-80: Sigma P-8074
Трис-буфер (свободная кислота): Sigma T-1378; 6,35 г растворяют примерно в 960 мл воды; pH доводят до 8,2, используя 4н HCl. Конечная концентрация триса составляет 52,5 мM.
Исходный раствор LAS: получают 10,5% раствор LAS в воде MQ (=10,5 г на 100 мл MQ)
Трис-буфер: 100 мМ/pH 8,6 (100 мM трис/0,005% Tween®-80)
Трис-Ca-буфер, pH 8,6 (100 мM трис/10 мM CaCl2/0,005% Tween®-80)
Оборудование:
Плоскодонные MTP (Costar No. 9017)
Biomek FX
Многоканальная пипетка ASYS
Ридер для MTP Spectramax
Инкубатор/шейкер iEMS
Инкубатор/шейкер Innova 4330
Многоканальная пипетка Biohit
Шейкер BMG Thermostar
Получают 0,063% раствор LAS в 52,5 мМ трис-буфере pH 8,2. Рабочий раствор suc-AAPF-pNA получают путем добавления 1 мл исходного раствора suc-AAPF-pNA с концентрацией 100 мг/мл (в ДМСО) к 100 мл (100 мM) трис-буфера, pH 8,6. Чтобы разбавить супернатанты, в плоскодонные планшеты вносят разбавляющий буфер, затем добавляют аликвоту супернатанта и тщательно перемешивают. Соотношение разбавления зависит от концентрации протеазных контролей в планшетах для культивирования (AAPF-активности). Желательная концентрация белка составляет 80 м.д.
Десять мкл разбавленного супернатанта добавляют к 190 мкл 0,063% буфера LAS/лунку. MTP покрывают пленкой, встряхивают в течение нескольких секунд, помещают в инкубатор (Innova 4230) и инкубируют при 45°C в случае BPN' или GG36 в течение 60 минут, встряхивая при 200 об/мин. Начальную активность (t=10 минут) определяют после 10 минут инкубации путем переноса 10 мкл смеси в каждую лунку нового MTP, содержащую 190 мкл рабочего раствора suc-AAPF-pNA. Полученные растворы тщательно перемешивают и измеряют AAPF-активность с помощью ридера для MTP (20 считываний в течение 5 минут при 25°C).
Чтобы определить конечную активность (t=60 минут), после 60 минут инкубации из инкубационного планшета берут еще 10 мкл раствора. AAPF-активность определяют с помощью описанного выше способа. Стабильность образцов определяют путем вычисления отношения остаточной и начальной AAPF-активности по следующей формуле:
Остаточная активность (%)=[значение t-60]*100/[значение t-10].
Определение устойчивости к LAS/EDTA
Стабильность вариантов протеазы в присутствии типичного анионного поверхностно-активного вещества (LAS = линейный алкилбензолсульфонат, додецилбензолсульфонат натрия - DOBS) и динатриевой соли EDTA измеряют после инкубации в определенных условиях, остаточную активность определяют с помощью AAPF-анализа. В качестве реагентов используют натриевую соль додецилбензолсульфоната (DOBS, Sigma No. D-2525), TWEEN®-80 (Sigma No. P-8074), ди-натрий EDTA (Siegfried Handel No. 164599-02), HEPES (Sigma No. H-7523), контрольный буфер: 50 мМ HEPES (11,9 г/л) + 0,005% TWEEN®-80, pH 8,0, опытный буфер: 50 мМ HEPES (11,9 г/л), 0,1% (масс/об) DOBS (1 г/л), 10 мМ EDTA (3,36 г/л), pH 8,0, культуральные супернатанты, содержащие стандартную протеазу и варианты протеазы с содержанием белка 200-400 мкг/мл. Оборудование: MTP с V- или U-образным дном в качестве планшетов для разбавления (Greiner 651101 и 650161, соответственно), MTP с F-образным дном (Corning 9017) для контрольного буфера и буфера LAS/EDTA, а также планшеты для suc-AAPF-pNA, Biomek FX (Beckman Coulter), ридер для MTP Spectramax Plus 384 (Molecular Devices), инкубатор/шейкер iEMS (амплитуда 1 мм) (Thermo Electron Corporation), липкая пленка: Nunc (236366).
Инкубатор/шейкер iEMS (Thermo/Labsystems) устанавливают на 29°C. Культуральные супернатанты разбавляют в планшетах, содержащих контрольный буфер, до концентрации ~ 25 м.д. (планшет основного разведения). 20 мкл образца из планшета основного разведения добавляют в планшеты, содержащие 180 мкл контрольного буфера, с получением конечной инкубационной концентрации 2,5 м.д. Содержимое перемешивают, держат при комнатной температуре и на этом же планшете проводят анализ AAPF. 20 мкл образца из планшета основного разведения добавляют также в планшеты, содержащие 180 мкл опытного буфера (50 мМ HEPES (11,9 г/л), 0,1% (масс/об) DOBS (1 г/л), 10 мМ EDTA (3,36 г/л), pH 8,0). Растворы перемешивают и сразу помещают в шейкер iEMS, где их встряхивают при 29°C в течение 30 мин при 400 об/мин. После инкубации в течение 30 минут опытный планшет подвергают анализу AAPF. Стабильность образцов определяют путем вычисления отношения остаточной и начальной AAPF-активности по следующей формуле:
Остаточная активность (%)=[mOD.мин-1 опытный]*100/[mOD.мин-1 контрольный].
D. Анализы чистящих характеристик
Способность вариантов протеазы удалять пятна определяют в коммерчески доступных детергентах. Коммерческие детергентные составы подвергают инактивации нагреванием, чтобы разрушить ферментативную активность всех белковых компонентов при сохранении свойств неферментных компонентов. Данный способ можно использовать для получения коммерческих детергентов, подходящих для тестирования вариантов фермента настоящего изобретения.
Микрообразцы тканей:
Микрообразцы тканей круглой формы с диаметром ¼" заказывают и получают от CFT. Один или два микрообразца помещают вертикально в каждую лунку 96-луночного MTP, чтобы воздействию подвергалась вся поверхность (т.е., их не кладут на дно лунки).
BMI-анализ микрообразцов тканей
Микрообразцы, содержащие кровь, молоко и чернила (BMI), диаметром 0,25 дюйма, получают от CFT. Перед вырезанием образцов ткань (EMPA 116) промывают водой. Один микрообразец помещают вертикально в каждую лунку 96-луночного титрационного микропланшета, чтобы воздействию подвергалась вся поверхность образца (т.е., не кладут на дно лунки). Нужный детергентный раствор получают по способу, описанному в данном документе. После уравновешивания термомиксера при 25°C в каждую лунку MTP, содержащую микрообразцы, добавляют 190 мкл детергентного раствора. К полученной смеси добавляют 10 мкл разбавленного раствора фермента так, что конечная концентрация фермента составляет 1 мкг/мл (определяемая с помощью анализа BCA). MTP закрывают пленкой и помещают в инкубатор на 30 минут, встряхивая при 1400 об/мин. После инкубации в соответствующих условиях 100 мкл раствора из каждой лунки переносят в свежий MTP. Новый MTP, содержащий 100 мкл раствора/лунку, прочитывают при 405 нм с помощью ридера для MTP SpectraMax. В анализе также используют пустые контроли и контроль, который содержит два микрообразца и детергент, но не содержит фермент.
Анализ с использованием микрообразцов запеченного яйца
В данном анализе используют 96-луночные планшеты, содержащие в качестве субстрата запеченные желтки куриных яиц. Желтки куриных яиц отделяют от белков, высвобождают из мембранного мешочка и разбавляют на 20% (об/масс) водой Milli-Q. Разбавленный желток перемешивают в течение 15 мин при комнатной температуре с помощью магнитной мешалки. Пять мкл осторожно переносят с помощью 8-канальной пипетки в центр каждой лунки 96-луночного V-образного планшета (Costar #3894). Планшеты нагревают при 90°C в течение 1 часа и затем охлаждают до комнатной температуры. Планшеты, содержащие в качестве субстрата запеченный яичный желток, хранят при комнатной температуре и используют в течение одной недели после получения. Детергенты для посудомоечных машин получают с помощью какого-либо способа, описанного в данном документе, и заранее нагревают до 50°C. В каждую лунку 96-луночного планшета с помощью 8-канальной пипетки добавляют аликвоту детергента объемом 190 мкл. Затем в каждую лунку добавляют десять мкл разбавленного фермента, используя 96-канальное пипетирующее устройство. Планшет осторожно закрывают липкой фольгой и инкубируют при 50°C при встряхивании в течении 30 мин. Затем 120 мкл реакционной смеси переносят в новый 96-луночный плоскодонный планшет и определяют поглощение/рассеяние света при 405 нм. Поглощение/рассеяние света при 405 нм пропорционально удалению яичного желтка.
Анализ с использованием микрообразцов яичного желтка
Детергенты для посудомоечных машин получают с помощью какого-либо способа, описанного в данном документе. В качестве оборудования используют шейкер/инкубатор New Brunswick Innova 4230 и ридер для MTP SpectraMAX (тип 340). MTP получают от Costar (тип 9017). Застарелый яичный желток с окрашенными образцами (CS-38) получают из Центра по материалам для тестирования. Перед вырезанием круглых микрообразцов размером 0,25 дюйма ткань промывают водой. Один микрообразец помещают в каждую лунку 96-луночного титрационного микропланшета. Тестируемый детергент уравновешивают при 50°C. В каждую лунку MTP, содержащую микрообразцы, добавляют 190 мкл детергентного раствора. К полученной смеси добавляют 10 мкл разбавленного раствора фермента. MTP закрывают липкой фольгой и помещают в инкубатор на 30 минут при встряхивании. После инкубации 100 мкл раствора из каждой лунки переносят в свежий MTP. Этот MTP прочитывают при 405 нм с помощью ридера для MTP SpectraMax. В анализе также используют пустые контроли и контроли, которые содержат микрообразцы и детергент, но не содержат фермент.
Фиксация образцов "3K"
Данный тип микрообразцов предварительно обрабатывают, используя описанный ниже способ фиксации. В 10-литровом стакане с помощью ковша тщательно перемешивают 8 литров дистиллированной воды и 80 мл 30% раствора пероксида водорода. Сорок кусочков образцов EMPA 116 выкладывают веером перед добавлением в раствор, чтобы гарантировать однородную фиксацию. С помощью ковша образцы заставляют циркулировать в растворе в течение всего 30 минут, непрерывно в течение первых пяти минут и периодически в течение оставшихся 25 минут. После завершения процесса фиксации раствор отбрасывают, а образцы промывают 6 раз, используя примерно 6 литров дистиллированной воды для одного ополаскивания. После промывания образцы сушат на бумажных салфетках. Затем высушенные на воздухе образцы компостируют, используя кольцевой штамп ¼", на вытесняющем прессе. Наконец, один микрообразец вертикально помещают в каждую лунку 96-луночного MTP, чтобы воздействию подвергалась вся поверхность (т.е., не кладут на дно лунки).
"Замоченный" образец
Данный тип микрообразца замачивают в деионизированной воде на 20 минут при температуре окружающей воды. После замачивания образцы помещают на бумажные салфетки и сушат. Затем высушенные на воздухе образцы компостируют, используя кольцевой штамп ¼", на вытесняющем прессе. Наконец, два микрообразца вертикально помещают в каждую лунку 96-луночного MTP, чтобы воздействию подвергалась вся поверхность (т.е., не кладут на дно лунки).
Детергенты
Инактивацию нагреванием жидких стиральных детергентов Северной Америки (NA) и Западной Европы (WE) для применения в тяжелых условиях (HDL) проводят путем помещения предварительно взвешенного жидкого детергента (в стеклянной бутыли) в водяную баню при 95°С, где его держат 2 часа. Время инкубации для инактивации нагреванием гранулярных стиральных детергентов Северной Америки (NA) и Японии (JPN) для применения в тяжелых условиях (HDG) составляет 8 часов, а для детергентов HDG Западной Европы (WE) время инкубации составляет 5 часов. Время инкубации для инактивации нагреванием детергентов для посудомоечных машин (ADW) NA и WE составляет 8 часов. Детергенты получают из местных супермаркетов. Обработанные и необработанные теплом детергенты анализируют в течение 5 минут, растворяя детергент, чтобы точно определить процент дезактивации. Активность фермента тестируют с помощью анализа AAPF.
Рабочие растворы получают из инактивированных нагреванием исходных растворов. Все детергенты являются коммерчески доступными. Чтобы воссоздать желательные условия, к растворам детергентов добавляют соответствующие количества веществ, обеспечивающих жесткость воды (6 или 12 гран на галлон), и буфера (таблица 1-1). Растворы перемешивают на вортексе или путем переворачивания бутылей.
Способность стандартной сериновой протеазы и ее вариантов удалять пятна с микрообразцов ткани определяют в формате MTP с использованием коммерчески доступного детергента (Calgonit 5 мл). Используют следующие реагенты: буфер 5 мМ HEPES, pH 8,0 или 5 мМ MOPS, pH 7, 3:1 Ca:Mg до средней жесткости воды. (CaCl2: MgCl2·6H2O); исходный раствор с жесткостью 15000 гран на галлон (gpg) разбавляют до 6 gpg, 2 образца BMI (кровь/молоко/чернила) на планшет: EMPA-116 хлопковые образцы BMI, обработанные CFT: предварительно прополосканные и вырезанные 2 образца на лунку, и инактивированный нагреванием готовый к использованию детергент TIDE® 2X Cold с подтвержденным отсутствием активности протеазы.
(ºС)
г/л
BPN'
В инкубаторе устанавливают желательную температуру (16°C или 32°C). 10 мкл образцов из планшета основного разведения, содержащих ~10 м.д. фермента, добавляют в планшеты, содержащие 2 образца BMI и 190 мкл рабочих растворов детергента, описанных выше. Объем регулируют так, чтобы получить конечную концентрацию вариантов в аналитических планшетах 0,5 м.д. Планшеты сразу переносят в инкубаторы iEMS и инкубируют 30 минут, встряхивая при 1400 об/мин при заданной температуре. После инкубации 100 мкл супернатанта переносят в новый 96-луночный планшет и измеряют поглощение при 405 нм и/или 600 нм с помощью ридера для MTP. В данном анализе также используют контрольные лунки, которые содержат 1 или 2 микрообразца и детергент, но не содержат образцов протеазы. Измерение при 405 нм дает более высокое значение поглощения и свидетельствует об удалении пигмента, тогда как измерение при 600 нм позволяет получить данные о мутности и очистке.
Расчет способности удалять пятна, используемый во всех методах анализа микрообразцов:
Величину поглощения корректируют с учетом контрольного образца (субстрат в отсутствие фермента) и получают меру гидролитической активности. Для каждого образца (варианта) рассчитывают показатель функционирования. Показатель функционирования свидетельствует об активности варианта (фактическое значение) по сравнению со стандартным ферментом (теоретическое значение) при одинаковой концентрации белка. Кроме того, теоретические значения можно рассчитывать, используя параметры уравнения Ленгмюра для стандартного фермента.
Ферменты и оборудование
Образцы стандартной сериновой протеазы и ее вариантов получают из фильтрованных бульонов культур, выращенных в планшетах MTP. Используемое оборудование: Biomek FX Robot (Beckman Coulter), ридер для MTP SpectraMAX (тип 340; Molecular Devices), инкубатор/шейкер iEMS (Thermo/Labsystems); MTP с F-образным дном (Costar, тип 9017, используют для прочтения реакционных планшетов после инкубации); и MTP с V-образным дном (Greiner 651101, используют для предварительного разбавления супернатанта). В данном анализе протеазы гидролизуют субстрат и высвобождают пигмент и нерастворимые частицы. Следовательно, степень помутнения является показателем активности фермента.
E. Относительная удельная активность протеаз и их вариантов
Чтобы охарактеризовать варианты протеазы, рассчитывают относительную удельную активность, используя suc-AAPF-pNA в качестве субстрата, которая позволяет сравнивать варианты со стандартной протеазой дикого типа и классифицировать их. Удельную активность в отношении субстрата suc-AAPF-pNA определяют путем деления протеолитической активности на значения результатов анализа TCA, полученные для каждого образца с помощью описанных выше анализов. Используя указанные значения, рассчитывают относительную удельную активность (удельная активность варианта/удельная активность стандартной протеазы).
F. Эффективность мытья посуды
Эффективность вариантов протеазы тестируют в разных условиях автоматического мытья посуды. Композиции детергентов для мытья посуды приведены в нижеследующих таблицах. Указанные детергенты поставляются wfk Testmaterials (www.testgewebe.de/en/products/detergents/) и имеют обозначения, установленные wfk Testmaterials. Указанные детергенты получают от поставщика без ферментов, чтобы проводить анализ вариантов протеазы.
IEC-60436 WFK типа С (рН=10,5 при 3 г/л)
Способы получения пятен всех типов (яичный желток, рубленое мясо и яйцо, а также яйцо с молоком) описаны ниже. Перед нанесением отдельных типов загрязнений тестируемую посуду тщательно моют. Это необходимо делать, поскольку остатки некоторых устойчивых пятен могут оставаться на посуде после предыдущих тестов. Новую посуду перед первым использованием в тесте также тщательно моют три раза.
Получение пятен яичного желтка на нержавеющей стали
Используемые в данных экспериментах противни из нержавеющей стали (10×15 см; шлифованные с одной стороны) тщательно моют при 95°C в лабораторной посудомоечной машине с использованием сильно щелочного коммерческого детергента (например, детергента ECOLAB®; Henkel) с получением чистых и обезжиренных противней. Перед первым применением с указанных листов снимают заусеницы. Перед загрязнением яичным желтком противни сушат в течение 30 минут при 80°C в тепловом шкафу. Подлежащие шлифованию поверхности не трогают перед загрязнением. Кроме того, на поверхностях не допускаются пятна от воды или ворс. Перед загрязнением охлажденные противни взвешивают.
Яичные желтки получают путем отделения примерно 10-11 яиц (200 г яичного желтка) от белков. Желтки перемешивают вилкой в стеклянном стакане до получения однородной суспензии желтка. Затем желтки процеживают (через сито с отверстиями примерно 0,5 мм), чтобы удалить крупные частицы и все фрагменты яичной скорлупы.
С помощью плоской щетки (2,5") наносят 2,0±0,1 г суспензии яичного желтка настолько однородно, насколько это возможно, на площадь 140 см2 шлифованных сторон всех противней из нержавеющей стали, оставляя незагрязненный край шириной примерно 1 см (при необходимости используют липкую ленту). Загрязненные противни сушат в горизонтальном положении (чтобы предотвратить образование капель на краях противней) при комнатной температуре в течение 4 часов (макс. 24 ч).
Чтобы денатурировать белки яичного желтка, противни погружают на 30 секунд в кипящую деминерализованную воду (при необходимости используют крепежное устройство). Затем противни снова сушат в течение 30 мин при 80°C. После сушки и охлаждения противни взвешивают. После взвешивания противни оставляют, по меньшей мере, на 24 ч (20°C, 40-60% относительной влажности) и затем подвергают их моечному тесту. Для тестирования используют только противни, удовлетворяющие требованиям тестирования, то есть, содержащие 1000±100 мг/140 см2 (яичного желтка после денатурации). После проведения моечных тестов противни сушат в течение 30 мин при 80°C в тепловом шкафу, охлаждают и снова взвешивают. Процент эффективности чистки определяют путем деления мг яичного желтка, высвобожденного при мойке, на мг денатурированного нанесенного яичного желтка и умножения на 100.
Получение пятен рубленого мяса и яиц на фарфоровых тарелках
В данных экспериментах используют десертные тарелки (Arzberg, диаметром 19 см, белые, глазированный фарфор) соответствующие EN 50242, форма 1495, № 0219. Всего 225 г постной свинины и говядины (в соотношении 50:50) мелко рубят и держат в охлажденном виде. Смесь дважды пропускают через мясорубку. Поддерживают температуру не выше 35°C. Затем 225 г рубленого мяса смешивают с 75 г яйца (белок и желток перемешивают вместе). Затем препарат замораживают и держат до трех месяцев при -18°C перед применением. Если свинина отсутствует, используют 100% говядину, поскольку они являются взаимозаменяемыми.
Смесь рубленого мяса и яиц (300 г) нагревают до комнатной температуры и смешивают с 80 мл деминерализованной воды. Затем смесь гомогенизируют в течение 2 мин, используя ручной кухонный блендер. С помощью вилки распределяют 3 г смеси рубленое мясо/яйцо/вода на каждой белой фарфоровой тарелке, оставляя незагрязненную полосу у края тарелки шириной примерно 2 см. Нанесенное количество составляет примерно 11,8±0,5 мг/см2. Тарелки сушат в течение примерно 2 часов при 120°C в заранее нагретом тепловом шкафу. После охлаждения тарелки готовы к использованию.
После тестирования мытья посуды на тарелки распыляют раствор нингидрина (1% в этаноле), чтобы лучше идентифицировать остатки белка рубленого мяса. Чтобы инициировать цветную реакцию, тарелки нагревают в течение 10 мин при 80°C в тепловом шкафу. Определение эффективности мытья определяют путем визуального наблюдения результатов цветных реакций остатков рубленого мяса в соответствии с фотографическим каталогом IKW (IKW - The German Cosmetic, Toiletry, Perfumery and Detergent Association).
Получение яичных/молочных пятен на нержавеющей стали
Используемые в данных экспериментах противни из нержавеющей стали (10×15 см; шлифованные с одной стороны) тщательно моют при 95°C в лабораторной посудомоечной машине с использованием сильно щелочного коммерческого детергента, чтобы удалить жир и очистить противни. Противни шлифуют в сухом состоянии целлюлозной тканью. Подлежащие шлифованию поверхности не трогают перед загрязнением. Кроме того, на поверхностях не допускаются пятна от воды или ворс. Перед загрязнением противни помещают на 30 мин в тепловой шкаф при 80°С. После охлаждения противни взвешивают.
Желтки и белки целых сырых яиц (3-4 яйца; примерно 160 г/яйцо) помещают в миску и взбивают при помощи взбивалки для яиц. Затем к смеси добавляют 50 мл полуобезжиренного молока (жирность 1,5%, ультравысокотемпературное, гомогенизированное). Молоко и яйца смешивают без получения пены. С помощью плоской щетки однородно распределяют 1,0±0,1 г яичной/молочной смеси на шлифованную сторону противней из нержавеющей стали, используя весы для проверки распределения. У коротких сторон противней оставляют полосу шириной примерно 1,0 см. Загрязненные противни сушат в горизонтальном положении (чтобы предотвратить образование капель на краях противней) при комнатной температуре в течение 4 часов (макс. 24 ч).
Затем противни погружают на 30 секунд в кипящую деминерализованную воду (при необходимости используют крепежное устройство). Затем противни снова сушат в течение 30 мин при 80°C. После сушки и охлаждения противни взвешивают. После взвешивания противни оставляют стоять, по меньшей мере, в течение 24 часов (20°C, 40-60% относительной влажности) и затем подвергают их моечному тесту. Для тестирования используют только противни, удовлетворяющие требованиям тестирования, то есть, содержащие 190±10 мг яичного желтка/молока.
После проведения моечных тестов противни сушат в течение 30 мин при 80ºC в тепловом шкафу, охлаждают и снова взвешивают. Процент эффективности чистки определяют путем деления мг смеси яйцо/молоко, высвобожденной при мойке, на мг нанесенной смеси яйцо/молоко и умножения на 100.
Моечное оборудование и условия мойки
Моечные тесты проводят в посудомоечной машине (Miele, модель G690SC), снаряженной загрязненной посудой и загрязненными противнями из нержавеющей стали, полученными с помощью описанных выше способов. Используют определенное количество детергента. Тесты проводят при температуре 50°C. Жесткость воды составляет 21° GH (немецкой жесткости). Как описано выше, после мытья тарелки, загрязненные рубленым мясом, визуально оценивают, используя фотографическую оценочную шкалу от 0 до 10, где "0" соответствует совсем грязной тарелке, а "10" соответствует чистой тарелке. Данные значения являются показателем способности фермент-содержащего детергента удалять пятна или грязь (SR). Мытые пластины из нержавеющей стали, загрязненные яичным желтком или смесью яичный желток/молоко, анализируют гравиметрически, определяя количество оставшегося пятна после мойки. Вариант протеазы тестируют на уровне от 0 до 30 мг/активный белок на цикл мойки.
G. Анализ ингибирования с использованием эглина C
Как описано в данном документе, концентрацию и удельную активность сериновой протеазы определяют путем титрования с ингибитором. Эглин С из пиявки Hirudo medicinalis представляет собой прочно связывающийся ингибитор субтилизинов и протеазы ASP (Heinz et al., Biochemistry, 31: 8755-66, 1992), следовательно, его можно использовать для измерения концентрации фермента, которую, в свою очередь, используют для вычисления удельной активности. Коротко говоря, определяют степень ингибирования фермента под действием нескольких известных концентраций эглина С. Исходя из полученной информации рассчитывают концентрацию эглина С, необходимую для полного ингибирования. Она соответствует концентрации фермента в образце.
Активность протеазы измеряют с помощью описанного выше анализа с использованием хромогенного AAPF. Ген эглина С синтезируют и экспрессируют в E. coli с помощью стандартных методов. Он обладает такими же свойствами и ингибиторной активностью, как и эглин С, полученный от Sigma. Концентрацию исходного раствора эглина С определяют путем измерения ингибирования образца субтилизина Bacillus lentus с известной удельной активностью. Затем калиброванный образец эглина С используют для определения концентрации и удельной активности вариантов субтилизина. Указанные значения используют для получения 96-луночных планшетов с исходными растворами фермента, где все варианты разбавляют до обычной концентрации.
H. Показатель функционирования
Показатель функционирования свидетельствует об активности варианта (фактическое значение) по сравнению со стандартной протеазой (теоретическое значение) при одинаковой концентрации белка. Кроме того, теоретические значения можно рассчитывать, используя параметры кривой связывания (т.е. уравнения Ленгмюра) для стандартной протеазы. Если показатель функционирования (PI) больше 1 (PI>1), вариант считается лучше, чем стандартный фермент (например, дикого типа), если PI равен 1 (PI=1), это свидетельствует о том, что вариант имеет такие же характеристики, как и стандартный фермент, а если PI меньше 1 (PI<1), считается, что вариант функционирует хуже, чем стандартный фермент. Таким образом, PI позволяет идентифицировать лучшие варианты, а также менее желательные варианты для применения в определенных условиях.
ПРИМЕР 2
Получение протеазы BPN' в B. subtilis
В данном примере описаны эксперименты, используемые для получения протеазы BPN' в B. subtilis. Трансформацию B. subtilis плазмидой pHPLT-BPN' проводят с помощью известных в данной области способов (см., например, WO 02/14490, включенный в данное описание в качестве ссылки). Ниже приведена последовательность ДНК (гибридная лидерная последовательность aprE-BPN', ДНК-последовательность про-BPN' и зрелой BPN' из B. amyloliquefaciens), кодирующая белок-предшественник BPN':


В приведенной выше последовательности жирным шрифтом выделена последовательность ДНК, кодирующая зрелую протеазу, стандартный шрифт обозначает лидерную последовательность (aprE-гибридный лидер BPN'), а про-последовательности (BPN') выделены подчеркиванием. Аминокислотная последовательность (гибридный лидер aprE-BPN', про-BPN' и зрелая BPN') белка-предшественника BPN' приведена ниже. Жирным шрифтом и подчеркиванием выделена последовательность зрелой протеазы BPN'.

Конструирование вектора экспрессии BPN' (pHPLT-BPN')
ПЦР-фрагменты получают в стандартных условиях в присутствии полимеразы TGO (Roche Diagnostics) с использованием pJH101term. Плазмида pJH101 соответствует pJH101 (Ferrari et al., J Bacteriol, 154: 1513-5 [1983]), где в участок EcoRI/BamHI вставлен следующий фрагмент:


Данный фрагмент включает в себя ген BPN' и гибридную сигнальную последовательность (содержащую первые восемь аминокислот сигнальной последовательности aprE B. subtilis и сигнальную последовательность BPN' B. amyloliquefaciens, начиная с 9-ой аминокислоты). Данный фрагмент используют в качестве матрицы для реакции ПЦР, которую проводят с использованием следующих праймеров: AK04-14: GtcctctgttaacTTACTGAGCTGCCGCCTGTAC (SEQ ID NO:4), который отжигают с 3'-концом гена зрелой BPN', вводя участок HpaI ниже стоп-кодона трансляции; и AK04-21.1: TTATGCGAGgctagcaaaaggagagggtaaagagtgagaagc (SEQ ID NO:5), который отжигают с 5'-концом сигнальной последовательности BPN', вводя участок NheI по 5'-концу.
Фрагмент ПЦР, полученный с помощью данной реакции, очищают, используя набор для очистки ПЦР Qiagen, в стандартных условиях. Очищенный фрагмент расщепляют рестрикционными ферментами NheI и HpaI в стандартных условиях и затем лигируют в вектор, расщепленный NheI/HpaI, который содержит промотор LAT (pHPLT-VAAc1, описанный в US2006/0014265 и показанный на фиг. 3A).
Затем лигационную смесь pHPLT-BPN' используют для трансформации B. subtilis (ΔaprE, ΔnprE, oppA, ΔspoIIE, degUHy32, ΔamyE::(xy1R, pxy1A-comK), как описано в WO 02/14490, включенном в данное описание в качестве ссылки. Селективное культивирование трансформантов B. subtilis, несущих вектор pHPLT-BPN' (см. фиг.3B), проводят при встряхивании в колбах, содержащих 25 мл среды MBD (среда определенного состава на основе MOPS), в присутствии 20 мг/л неомицина. Инкубация трансформированных клеток приводит к получению секретируемой протеазы BPN', обладающей протеолитической активностью. Анализ в геле проводят с использованием 10% бис-трис-гелей NuPage Novex (Invitrogen®, № по каталогу NP0301BOX). Чтобы получить образцы для анализа, 2 объема супернатанта смешивают с 1 объемом 1M HCl, 1 объемом буфера для образцов 4X LDS (Invitrogen®, № по каталогу NP0007) и 1% PMSF (20 мг/мл), после чего смесь нагревают в течение 10 минут при 70ºC. Затем 25 мкл каждого образца загружают на гель вместе с 10 мкл SeeBlue и 2 предварительно окрашенными белковыми стандартами (Invitrogen®, № по каталогу LC5925). Результаты отчетливо демонстрируют, что описанный в данном примере способ клонирования BPN' позволяет получить активную BPN', продуцируемую B. subtilis.
ПРИМЕР 3
Получение сайт-определяющих библиотек BPN' и библиотек множественных мутаций
В данном примере описано конструирование вариантов BPN'.
Получение сайт-определяющей библиотеки BPN' (SEL)
Вектор pHPLT-BPN', содержащий кассету экспрессии BPN', используют в качестве матричной ДНК. Данный вектор содержит уникальный участок рестрикции BgKI, который используют для конструирования SEL. Для получения библиотек используют праймеры, синтезируемые Invitrogen® (обессоленные, на уровне 50 нмоль) и перечисленные в таблице 7-1.
Чтобы получить SEL BPN', проводят три амплификации ПЦР: две мутагенные ПЦР проводят, чтобы ввести представляющий интерес мутантный кодон в последовательность ДНК, кодирующую зрелую BPN', а третью ПЦР проводят для того, чтобы гибридизовать два продукта мутагенных ПЦР с получением вектора экспрессии pHPLT-BPN', содержащего целевой мутантный кодон в последовательности, кодирующей зрелую BPN'. Способ мутагенеза основан на кодон-специфической стратегии. В данном способе все возможные мутации получают одновременно в конкретном триплете ДНК с использованием прямых и обратных олигонуклеотидных праймеров длиной от 25 до 45 нуклеотидов, содержащих конкретную синтезированную последовательность триплета ДНК (в NNS N=А, C, T или G, а S=C или G), которая соответствует последовательности кодона, подлежащего изменению. Это обеспечивает произвольное включение нуклеотидов в конкретный кодон последовательности, кодирующей зрелую BPN'. Номер, приведенный в названии праймера (таблица 3-1), соответствует положению конкретного кодона последовательности, кодирующей зрелую BPN'. Два других праймера, которые используют для конструирования SEL, содержат участок рестрикции BglII наряду с фрагментом ДНК-последовательности pHPLT-BPN', фланкирующим участок рестрикции BglII.
Конструирование каждой SEL начинают с двух первичных амплификаций ПЦР, в которых используют праймер pHPLT-BglII-FW и специфический обратный мутагенный праймер BPN', а в последующей амплификации ПЦР используют праймер pHPLT-BglII-RV и специфический прямой мутагенный праймер BPN' (в прямом и обратном мутагенных праймерах присутствуют равнозначные положения кодона зрелой BPN'). Введение мутаций в последовательность зрелой BPN' осуществляют с использованием высокоточной ДНК-полимеразы Finnzymes Phusion (№ по каталогу F-530L). Все амплификации ПЦР проводят в соответствии с методикой Finnzymes с использованием полимеразы. Используют следующие условия ПЦР:
Первичная ПЦР 1:
праймер pHPLT-BglII-FW и специфический к BPN' обратный мутагенный праймер - по 1 мкл (10 мкM);
Первичная ПЦР 2:
праймер pHPLT-BglII-RV и специфический к BPN' прямой мутагенный праймер - по 1 мкл (10 мкM); в среде, содержащей
ПЦР проводят с помощью термоциклера PTC-200 Peltier MJ Research (местонахождение) с использованием следующей программы: 30 секунд 98°C, 30X (10 секунд 98°C, 20 секунд 55°C, 1 минута 72°C) и 5 мин 72°C. В результате реакций получают два фрагмента длиной примерно от 2 до 3 т.о., которые перекрываются примерно на 30 нуклеотидных оснований вблизи представляющего интерес кодона зрелой BPN'. Гибридизацию проводят в третьей реакции, используя два вышеуказанных фрагмента, а также прямой и обратный праймеры BglII. Гибридизационную реакцию ПЦР проводят следующим образом:
праймер pHPLT-BglII-FW и праймер pHPLT-BglII-RV - по 1 мкл (10 мкM)
Для гибридизационной ПЦР используют следующую программу: 30 секунд 98°C, 30X (10 секунд 98°C, 20 секунд 55°C, 2:05 минуты 72°C) и 5 мин 72°C, и термоциклер PTC-200 Peltier MJ Research®.
Амплифицированный линейный фрагмент размером 4,8 т.о. очищают с помощью набора для очистки продуктов ПЦР Qiagen® Qiaquick (№ по каталогу 28106) и расщепляют под действием рестрикционного фермента BglII с получением липких концов на обоих сторонах гибридного фрагмента. Используемые для расщепления реакционные смеси содержат:
- 35 мкл очищенного линейного фрагмента ДНК
- 4 мкл буфера React® 3 (Invitrogen®)
- 1 мкл BglII, 10 ед/мл (Invitrogen®)
Реакционные условия: 1 час, 30°С.
В результате лигирования расщепленного и очищенного фрагмента BglII получают циклические и мультимерные ДНК-продукты, содержащие желательную мутацию, которые затем непосредственно переносят в компетентные клетки Bacillus subtilis:
- 30 мкл очищенного BglII-расщепленного фрагмента ДНК
- 8 мкл буфера для ДНК-лигазы T4 (Invitrogen® № по каталогу 46300-018)
- 1 мкл ДНК-лигазы T4, 1 ед/мкл (Invitrogen® № по каталогу 15224-017)
Реакционные условия: 16-20 часов, 16ºC
Лигационную смесь используют для трансформации B. subtilis (ΔaprE, ΔnprE, oppA, ΔspoIIE, degUHy32, ΔamyE::(xy1R,pxy1A-comK), как описано в WO 02/14490, включенном в данное описание в качестве ссылки. Для получения каждой библиотеки 96 отдельных колоний отбирают и выращивают в среде MOPS, содержащей неомицин и 1,25 г/л дрожжевого экстракта, после чего проводят анализ последовательностей (BaseClear) и скрининг. Число компонентов библиотеки варьирует от 1 до 275. Каждый номер обозначает кодон зрелой последовательности bpn', подвергшийся произвольной мутации. Каждая библиотека содержит максимум 19 вариантов BPN'.
(Таблица 3-1, см. в конце описания)
Получение библиотеки множественных мутаций BPN'
Синтетические библиотеки множественных мутаций BPN' (или комбинаторные библиотеки) производят Geneart, Baseclear и Bioke. Каждая синтетическая библиотека множественных мутаций BPN' содержит смесь генов BPN', в которых два или более выбранных кодонов зрелой последовательности произвольно заменены специфическими последовательностями ДНК. Например: комбинаторную библиотеку BPN' можно сконструировать так, что кодон 22 зрелой последовательности будет заменен триплетами ДНК, кодирующими Thr, Gln, Val или Tyr, кодон 26 будет заменен триплетами ДНК, кодирующими Val, Gln, Asn или Tyr, кодон 31 будет заменен триплетами ДНК, кодирующими Ile, His, Tyr или Asn, а кодон 48 будет заменен триплетами ДНК, кодирующими Ala, Glu, His или Asp. В данном примере комбинаторная библиотека содержит максимум 256 комбинаторных вариантов BPN'. Однако типичная библиотека множественных мутаций BPN' может содержать до нескольких тысяч уникальных вариантов гена BPN'. Компоненты библиотеки множественных мутаций, содержащие концевые участки AvaI и HindIII (см., например, BPN' дикого типа) расщепляют с помощью AvaI и HindIII, очищают гель-хроматографией и клонируют в векторе pHPLT путем лигазной реакции с использованием ДНК-лигазы T4 Invitrogen® (№ по каталогу 15224-025) в соответствии с рекомендациями производителя для общего клонирования с использованием липких концов. AvaI/HindIII фрагмент BPN' дикого типа:

Чтобы провести трансформацию с использованием лигационной реакционной смеси, библиотеку ДНК (смесь компонентов библиотеки BPN' клонируют в pHPLT) амплифицируют, используя набор TempliPhi (Amersham, № по каталогу 25-6400). Для проведения амплификации 1 мкл лигационной реакционной смеси смешивают с 5 мкл буфера для образца из набора TempliPhi и нагревают в течение 3 минут при 95°C, чтобы денатурировать ДНК. Реакционную смесь охлаждают путем помещения на лед на 2 минуты, после чего центрифугируют в течение короткого периода времени. Затем добавляют 5 мкл реакционного буфера и 0,2 мкл полимеразы phi29 из набора TempliPhi и реакционные смеси инкубируют при 30°C в устройстве для проведения ПЦР MJ Research в течение 4 часов. Фермент phi29 инактивируют нагреванием путем инкубации при 65°C в течение 10 минут.
Чтобы провести трансформацию с использованием библиотек, 0,1 мкл продукта реакции амплификации TempliPhi смешивают с 500 мкл компетентных клеток B. subtilis (ΔaprE, ΔnprE, oppA, ΔspoIIE, degUHy32, ΔamyE::(xy1R, pxy1A-comK) с последующим энергичным встряхиванием при 37°C в течение 1 часа. По прошествии указанного времени аликвоты объемом 100 и 500 мкл помещают на чашки с HI-агаром, содержащие 20 м.д. неомицина и 0,5% снятого молока. В нижеследующей таблице приведен перечень некоторых отдельных замен, используемых в настоящем изобретении.
(Таблица 3-2, см. в конце описания)
Получение неочищенных образцов ферментов, содержащих варианты BPN'
Вариантные белки BPN' получают путем выращивания трансформантов B. subtilis в 96-луночном MTP при 37°C в течение 68 часов в среде MBD (среда с определенным составом на основе MOPS). Среду MBD получают, в основном, в соответствии с известным в данной области способом (см. Neidhardt et al., J. Bacteriol., 119: 736-747 [1974]), за исключением того, что NH4Cl2, FeSO4 и CaCl2 не включают в состав основной среды, используют 3 мM K2HPO4 и основную среду дополняют 60 мM мочевиной, 75 г/л глюкозы и 1% сойтон. Питательные микроэлементы используют в виде 100X исходного раствора, один литр которого содержит 400 мг FeSO4·7H2O, 100 мг MnSO4·H2O, 100 мг ZnSO4·7H2O, 50 мг CuCl2·2H2O, 100 мг CoCl2·6H2O, 100 мг NaMoO4·2H2O, 100 мг Na2B4O7·10H2O, 10 мл 1M CaCl2 и 10 мл 0,5 M цитрата натрия.
ПРИМЕР 4
Устойчивость вариантов BPN' к LAS
В данном примере описаны эксперименты, позволяющие оценить устойчивость разных вариантов BPN' с одной заменой и вариантов BPN' с множественными заменами в присутствии LAS. Устойчивость к LAS измеряют путем определения активности в отношении AAPF до и после инкубации в присутствии LAS при повышенной температуре (45°C) с помощью способов, описанных в примере 1. В нижеследующих таблицах приведены результаты в виде значений относительной стабильности, в которых отражена стабильность вариантов BPN' по сравнению с ферментом BPN' дикого типа. А именно, относительная стабильность представляет собой отношение остаточной активности варианта к остаточной активности фермента дикого типа. Значение, превышающее единицу, указывает на повышенную стабильность в присутствии LAS.
В таблице 4-1 приведены значения относительной стабильности вариантов BPN' по сравнению с BPN' дикого типа. При разработке настоящего изобретения установлено, что многие варианты BPN' явно обладают более высокой стабильностью в присутствии LAS, чем BPN' дикого типа. В частности, анализ устойчивости к LAS 92 участков BPN' показывает, что 40 участков (43%) являются неблагоприятными (вредными) и 52 участка (57%) являются благоприятными (полезными). Кроме того, из 1508 тестируемых вариантов 96 (6%) являются превосходными (повышенная устойчивость), 196 (13%) являются нейтральными (такая же устойчивость), а 1216 (81%) являются плохими (пониженная устойчивость).
(Таблица 4-1, см. в конце описания)
(Таблица 4-2, см. в конце описания)
ПРИМЕР 5
Удельная активность вариантов BPN'
В данном примере описаны эксперименты, позволяющие определить относительную удельную активность BPN' и вариантов BPN'. Удельную активность в отношении AAPF измеряют с помощью способов, описанных в примере 1. В таблице 5-1 приведены результаты в виде значений относительной удельной активности, в которых отражена активность вариантов BPN' по сравнению с активностью BPN' дикого типа.
А именно, относительная удельная активность представляет собой отношение удельной активности варианта к удельной активности фермента дикого типа. Значение, превышающее единицу (PI>1), указывает на повышенную удельную активность в отношении субстрата AAPF.

ПРИМЕР 6
Сравнительный анализ данных, полученных для вариантов BPN'
В данном примере описаны результаты экспериментов, проводимых для определения экспрессии белков, способности удалять пятна, устойчивости к LAS и активности в отношении AAPF (тестирование по представляющим интерес свойствам) BPN' и вариантов BPN'. Результаты получают с помощью способов, описанных в примере 1. Как описано в данном документе, функциональность вариантов BPN' количественно определяют как показатель функционирования (PI), который представляет собой отношение эффективности варианта к эффективности исходного белка. В данном документе используют следующую градацию PI: улучшающие мутации (PI>1,0); нейтральные мутации (PI>0,5); невредные мутации (PI>0,05); и вредные мутации (PI<0,05). "Комбинируемые мутации" представляют собой мутации, приводящие к получению вариантов, которые имеют значения показателя функционирования = 0,5, по меньшей мере, по одному свойству, и >0,05 по всем свойствам. Комбинируемые мутации представляют собой мутации, которые можно комбинировать для получения белков с подходящими показателями функционирования по одному или нескольким желательным свойствам. Положения, в которых встречаются мутации, классифицируют следующим образом: неограничивающие положения, которые содержат ≥20% мутаций, нейтральных, по меньшей мере, для одного свойства; и ограничивающие положения, которые содержат <20% мутаций, нейтральных для активности и стабильности.
Указанные данные можно использовать для генной инженерии любого субтилизина. Даже если субтилизин, подлежащий генной инженерии, содержит в определенном положении аминокислоту, отличную от аминокислоты субтилизина BPN', такую информацию можно использовать для идентификации, по меньшей мере, одной замены, которая изменяет желательные свойства, путем идентификации наилучшей замены, в том числе замены на аминокислоту BPN' дикого типа.
В таблице 6-1 приведены значения показателя функционирования (Pi) для 5004 вариантов субтилизина BPN' по 275 положениям. Показатели функционирования, менее или равные 0,05, принимают за 0,05 и выделяют жирным курсивом. Кроме того, при определении стабильности, если показатель функционирования в отношении активности в анализе стабильности менее или равен 0,05, связанный с ним показатель функционирования в отношении стабильности принимают за 0,05.
(Таблица 6-1, см. в конце описания)
Комбинируемые мутации:
В таблице 6-2 приведены варианты субтилизина BPN', которые содержат комбинируемые мутации по 275 положениям (2907). Указанные варианты имеют значения показателя функционирования ≥0,5, по меньшей мере, для одного свойства, и >0,05 для обоих свойств.
(Таблица 6-2, см. в конце описания)
ПРИМЕР 7
Сравнительный анализ данных, полученных для вариантных протеаз
В данном примере сравниваются результаты экспериментов, проводимых для определения чистящей способности, устойчивости к LAS, активности в отношении AAPF и содержания белков (тестирование по представляющим интерес свойствам) BPN', GG36 (GCI-P036) и вариантных протеаз. Как описано в данном документе, функциональность вариантных протеаз количественно определяют как показатель функционирования (PI), который представляет собой отношение эффективности варианта к эффективности стандартной протеазы. В данном документе используют следующую классификацию PI: улучшающие мутации (PI>1,0); нейтральные мутации (PI>0,5); невредные мутации (PI>0,05); и вредные мутации (PI≤0,05).
Продуктивные участки представляют собой участки, содержащие, по меньшей мере, одну улучшающую мутацию по какому-либо свойству. Продуктивные, неограничивающие участки представляют собой участки, содержащие ≥20% нейтральных мутаций (PI>0,5) и, по меньшей мере, одну повышающую мутацию ((PI>1,0) по любому тестируемому свойству (кроме экспрессии белка). В приведенной ниже таблице 7-1 результаты, полученные для вариантов, которые удовлетворяют определению продуктивных, неограничивающих участков, показаны в виде процента (%) тестируемых вариантов, удовлетворяющих определению улучшающей мутации (PI>1).





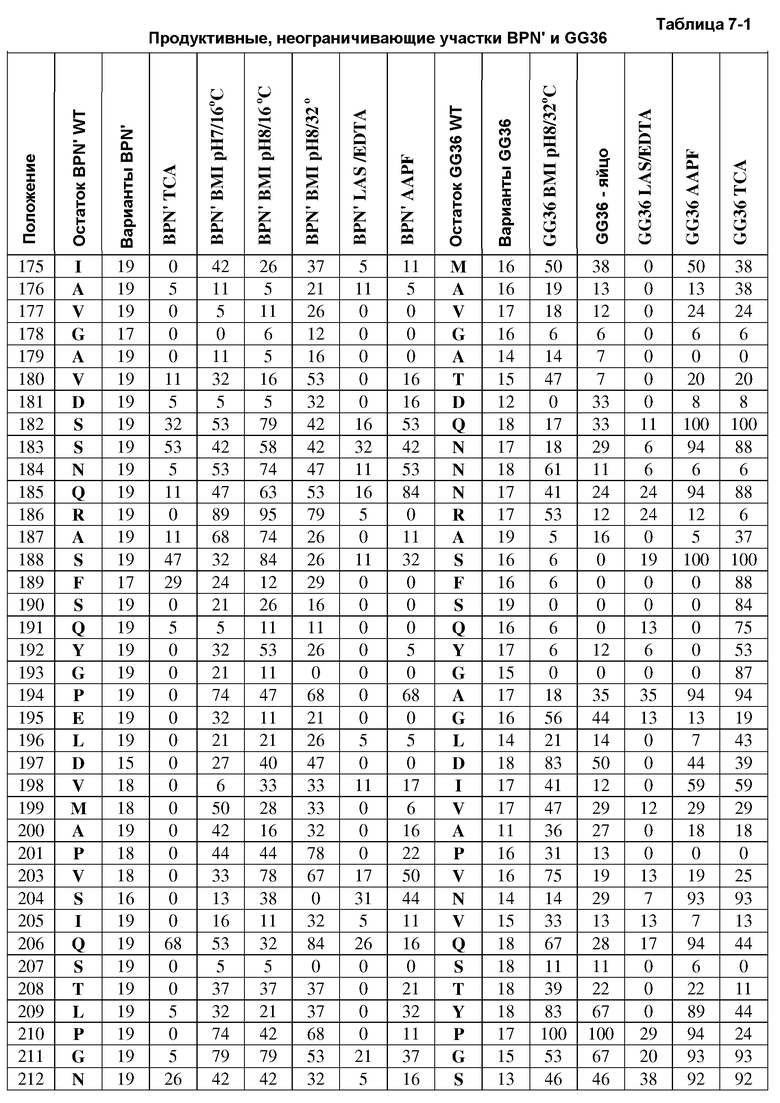


Высокопродуктивные участки представляют собой участки, которые содержат ≥20% улучшающих мутаций (PI>1), по меньшей мере, по одному свойству, отличному от экспрессии белка (TCA-анализ). В приведенной ниже таблице 7-2 результаты, полученные для вариантов, которые удовлетворяют определению высокопродуктивных участков, показаны в виде процента (%) тестируемых вариантов, удовлетворяющих определению улучшающей мутации (PI>1).






Ограничивающие участки представляют собой участки, которые содержат менее 20% мутаций, нейтральных по отношению к активности и стабильности. В приведенной ниже таблице 7-3 результаты, полученные для вариантов, которые удовлетворяют определению ограничивающих участков, показаны в виде процента (%) тестируемых вариантов, удовлетворяющих определению нейтральной мутации (PI>0,5).

Коротко говоря, в процессе разработки настоящего изобретения установлено, что 10 положений зрелого участка двух стандартных субтилизинов представляют собой ограничивающие положения в отношении активности и стабильности. Следовательно, остальные 265 положений зрелого участка двух стандартных субтилизинов являются неограничивающими положениями (≥20% нейтральных мутаций) в отношении активности и стабильности.
ПРИМЕР 8
Получение протеазы в B. subtilis
В данном примере описаны эксперименты, проводимые для получения разных протеаз в B. subtilis. В частности, описаны способы трансформации B. subtilis векторами экспрессии, несущими GG36 и BPN'-Y217L. Трансформацию проводят с помощью известных в данной области способов (см., например, WO 02/14490).
Получение протеазы GG36
В данном примере описаны эксперименты, проводимые для получения GG36 (также называемой в данном описании субтилизин B. lentus) в B. subtilis. Экспрессионная плазмида pAC-GG36ci содержит ген GG36 с улучшенным кодоном, гибридизованный по восьмому кодону с сигнальной последовательностью aprE, и находящийся под контролем консенсусного промотора aprE и терминатора транскрипции BPN'. В приведенной ниже последовательности жирным курсивом выделен консенсусный промотор aprE, стандартный шрифт указывает сигнальную последовательность, подчеркивание - пропоследовательность, жирным шрифтом выделена ДНК, которая кодирует зрелую протеазу GG36, и подчеркивание с курсивом обозначает терминатор BPN'. Участок, кодирующий зрелую протеазу GG36, фланкируется участками рестрикции KpnI и XhoI, обеспечивающими клонирование:

Далее приведена аминокислотная последовательность белка-предшественника GG36. В данной последовательности зрелая протеаза GG36 выделена жирным шрифтом:

Аминокислотную последовательность зрелой протеазы GG36 (SEQ ID NO: 562) используют в качестве основы для получения описанных здесь библиотек вариантов:

Плазмида pAC-GG36ci содержит следующие элементы: pUB110 = фрагмент ДНК из плазмиды pUB110 (McKenzie et al., Plasmid 15:93-103 [1986]), pBR322 = фрагмент ДНК из плазмиды pBR322 (Bolivar et al., Gene 2:95-113 [1977]), pC194 = фрагмент ДНК из плазмиды pC194 (Horinouchi et al., J Bacteriol, 150:815-825 [1982]). Плазмида имеет следующие признаки: Ori for B. subtilis = точка начала репликации pUB110, CAT = ген устойчивости к хлорамфениколу из pC194, pMB1 origin = точка начала репликации pBR322, bla = бета-лактамаза pBR322, Short aprE promoter = консенсусный тринскрипционный промотор, Signal Peptide= сигнальный пептид, ProPeptide = проучасток GG36, GG36ci Mature Peptide = зрелая GG36 (заменяется кодирующими участками для каждого варианта, экспрессирующегося в данном исследовании), терминатор BPN' = терминатор транскрипции субтилизина BPN'.
Получение протеазы BPN'-Y217L (субтилизин PURAFECT® PRIME)
В данном примере описаны эксперименты, проводимые для получения субтилизина B. amyloliquefaciens BPN'-Y217L (коммерчески доступного как субтилизин PURAFECT® PRIME; его также называют "FNA") в B. subtilis. Экспрессионная плазмида pAC-FN Are содержит ген BPN'-Y217L, гибридизованный по восьмому кодону с сигнальной последовательностью aprE, и находящийся под контролем консенсусного промотора aprE и терминатора транскрипции BPN'. В приведенной ниже последовательности жирным курсивом выделен консенсусный промотор aprE, стандартный шрифт указывает сигнальную последовательность, подчеркивание - пропоследовательность, жирным шрифтом выделена ДНК, которая кодирует зрелую протеазу BPN'-Y217L, и подчеркивание с курсивом обозначает терминатор BPN'. Участок, кодирующий зрелую протеазу BPN'-Y217L, содержит участки рестрикции KpnI и XhoI, обеспечивающие клонирование:

Далее приведена аминокислотная последовательность белка-предшественника BPN'-Y217L. В данной последовательности зрелая протеаза BPN'-Y217L выделена жирным шрифтом:

Аминокислотную последовательность зрелой протеазы BPN'-Y217L используют в качестве основы для получения описанных здесь библиотек вариантов:


Плазмида pAC-FNAre содержит следующие элементы: pUB110 = фрагмент ДНК из плазмиды pUB110 (McKenzie et al., Plasmid 15:93-103, [1986]), pBR322 = фрагмент ДНК из плазмиды pBR322 (Bolivar et al., Gene 2:95-113 [1977]), pC194 = фрагмент ДНК из плазмиды pC194 (Horinouchi et cil, J. Bacteriol 150:815-825 [1982]). Плазмида имеет следующие признаки: Ori for B. subtilis = точка начала репликации pUB110, CAT = ген устойчивости к хлорамфениколу из pC194, pMB1 origin = точка начала репликации pBR322, bla = бета-лактамаза pBR322, Short aprE promoter = консенсусный тринскрипционный промотор, Signal Peptide= сигнальный пептид, ProPeptide = проучасток BPN'-Y217L, BPN'-Y217L Mature Peptide = зрелая BPN'-Y217L (заменяется кодирующими участками для каждого варианта, экспрессирующегося в данном исследовании), терминатор BPN' = терминатор транскрипции субтилизина BPN'.
ПРИМЕР 9
Экспрессия вариантов фермента
В данном примере описаны способы экспрессии разных рекомбинантных ферментов в трансформированном B. subtilis.
Субтилизин - 2-мл масштаб
Клоны B. subtilis, содержащие векторы экспрессии BPN'-Y217L или GG36, реплицируют с помощью стального 96-луночного репликатора из исходных растворов в глицерине в 96-луночных культуральных планшетах (BD, 353075), содержащих 200 мкл среды LB + 25 мкг/мл хлорамфеникола, выращивают в течение ночи при 37°C, 220 об/мин во влажной атмосфере. После культивирования в течение ночи аликвоту объемом 200 мкл используют для инокуляции 2000 мкл среды с определенным составом + 25 мкг/мл хлорамфеникола в пластмассовых культуральных пробирках объемом 5 мл. Среда для культивирования представляет собой среду с полуопределенным составом на основе буфера MOPS, содержащую мочевину в качестве основного источника азота, глюкозу в качестве основного источника углерода, и дополненную 1% сойтоном для здорового роста клеток. Культуральные пробирки инкубируют при 37°C, 220 об/мин, в течение 60 часов. После инкубации культуральные бульоны центрифугируют при более 8000 × RCF. Супернатантный раствор декантируют в полипропиленовые конические пробирки объемом 15 мл для хранения. Дополнительную очистку или концентрирование не проводят. Получают исходные растворы супернатанта в 40% пропиленгликоле (конечная концентрация), чтобы обеспечить долговременную стабильность, и хранят при 4°C.
ПРИМЕР 10
Получение вариантов фермента
В данном примере описано получение зарядных "лестниц" ферментов и комбинаторных заряженных библиотек.
Зарядные "лестницы" ферментов
Несколько вариантов белка, охватывающих диапазон представляющих интерес физических свойств, выбирают из существующих библиотек или получают с помощью методов направленного мутагенеза, известных в данной области (см., например, патентные заявки США №№ 10/576331, 11/581102 и 11/583334). Затем полученный определенный набор зондовых белков анализируют с помощью представляющего интерес теста.
Типичные варианты заряженной "лестничной совокупности" протеаз, показанные в нижеследующих таблицах, анализируют с помощью способов, описанных в данном документе. В указанных таблицах изменение заряда сравнивают с ферментом дикого типа.
Комбинаторные заряженные библиотеки ферментов
Получение комбинаторных заряженных библиотек субтилизина B. lentus (=GG36)
Плазмиду pAC-GG36ci, содержащую ген GG36 с улучшенным кодоном, отправляют в DNA2.0 для получения комбинаторных заряженных библиотек (CCL). Им также отправляют штамм Bacillus subtilis (генотип: ΔaprE, ΔnprE, ΔspoIIE, amyE::xylRPxylAcomK-phleo) для трансформации. Кроме того, в DNA2.0 Inc. заказывают получение позиционных библиотек по каждому из четырех участков протеазы GG36, показанных в таблице 10-3. Варианты получают в виде исходных растворов в глицерине в 96-луночных планшетах.
GG36 CCL конструируют путем идентификации четырех равномерно распределенных, экспонированных на поверхности незаряженных полярных аминокислотных остатков вне активного центра. Такими остатками являются Ser-85, Gln-107, Ser-182 и Asn-242 (остатки 87, 109, 188 и 248 по нумерации BPN'). Комбинаторную 81-членную библиотеку (от G-1 до G-81) получают путем составления всех сочетаний трех возможностей по каждому участку: аминокислоты дикого типа, аргинина или аспарагиновой кислоты.



Получение CCL субтилизина B. amyloliquefaciens BPN'-Y217L
Плазмиду pAC-FNAre, содержащую ген BPN'-Y217L, отправляют в DNA2.0 Inc. (Menlo Park, CA) для получения CCL. Им также отправляют штамм Bacillus subtilis (генотип: ΔaprE, ΔnprE, ΔspoIIE, amyE::xylRPxylAcomK-phleo) для трансформации. В DNA2.0 Inc. заказывают получение позиционных библиотек по каждому из четырех участков протеазы BPN'-Y217L, показанных в таблице 10-4. Варианты получают в виде исходных растворов в глицерине в 96-луночных планшетах.
Комбинаторную заряженную библиотеку субтилизина BPN'-Y217L конструируют путем идентификации четырех равномерно распределенных, экспонированных на поверхности незаряженных полярных аминокислотных остатков вне активного центра. Такими остатками являются Ser-87, Asn-109, Ser-188 и Ser-248. Комбинаторную 81-членную библиотеку (от F-1 до F-81) получают путем составления всех сочетаний трех возможностей по каждому участку: аминокислоты дикого типа, аргинина или аспарагиновой кислоты.


ПРИМЕР 11
Эффективность варианта BPN'-Y217L и субтилизина GG36
В данном примере описано тестирование BPN'-Y217L и вариантов GG36 с помощью анализов микрообразцов BMI и запеченного яйца в детергентах, представляющих разные географические регионы рынка (например, различающиеся по pH, T и/или жесткости воды), для применения в стирке и посудомоечных машинах, как описано в примере 1.
Вышеуказанные наблюдения относятся к другим сериновым протеазам, таким как субтилизины BPN'-Y217L и GG36. Например, на фиг.2A и 2B показан заряд BPN'-Y217L и GG36, соответственно, оптимальный для эффективной чистки в условиях стирки Северной Америки, с использованием готового, инактивированного нагреванием детергента TIDE® 2X. Левые оси Y демонстрируют эффективность чистки микрообразцов, где более высокое число указывает на лучшее удаление пятна BMI. Правые оси Y демонстрируют показатель функционирования, определенный как эффективность чистки вариантов (закрашенные символы) по сравнению с исходной молекулой (незакрашенные символы). Горизонтальные линии представляют показатель функционирования при стандартных отклонениях 2 или 3 выше уровня шума данного анализа. Комбинаторная заряженная библиотека (CCL) BPN'-Y217L демонстрирует, что оптимальный заряд наблюдается при нулевых изменениях заряда по сравнению с исходным BPN'-Y217L, тогда как CCL GG36 демонстрирует, что оптимальный заряд наблюдается при отличии от исходного GG36 на два отрицательных заряда.
Фиг.3A, 3B, 4A, 4B, 5A и 5B демонстрируют, что расположение оптимального заряда зависит от среды раствора, которую определяет состав детергента, pH, температура и ионная сила, которая зависит от жесткости воды и концентрации детергента. Например, оптимальный заряд для CCL BPN'-Y217L сильно сдвигается от нуля для условий стирки в Северной Америке до более положительных значений в условиях Западной Европы и Японии. Более того, оптимальный заряд наблюдается для жидких и гранулярных (порошкообразных) композиций стирального детергента. Подобным образом, оптимальный заряд наблюдается для CCL как BPN'-Y217L, так и GG36, в детергенте для посудомоечных машин (ADW) при применении (например, калгонит Reckitt Benckiser 40°C, 12 gpg, pH 10) запеченного яйца в качестве субстрата.
При разработке настоящего изобретения показано, что чистящая эффективность заряженных вариантов протеазы (например, GG36, BPN'-Y217L и др.) в разных детергентах в значительной степени зависит от pH и проводимости рабочего раствора. Конечная проводимость является мерой ионной силы и зависит от жесткости воды, концентрации и состава детергента. Например, существует корреляция чистящей эффективности вариантов GG36 и BPN'-Y217L в отношении пятен запеченного яйца в детергентах ADW Европы и Северной Америки при pH 10,6 и проводимости 3,0 мСм/см. В частности, чистящая эффективность заряженных вариантов хорошо коррелирует при условии одинаковых pH и проводимости. Данный факт позволяет экстраполировать результаты скрининга эффективности фермента с использованием конкретного детергента на другой детергент с такими же значениями pH и проводимости. Подобным образом, можно экстраполировать результаты скрининга эффективности фермента в буфере с совпадающими значениями pH и проводимости, на детергент, обладающий подобными рабочими значениями pH и проводимости.
ПРИМЕР 12
Устойчивость к LAS и хелатирующим средствам
Данный пример описывает определение взаимозависимости заряда белка и стабильности в реакционной среде, содержащей один или оба из анионного поверхностно-активного вещества и хелатирующего средства. Для определения активности протеазы в опытном и контрольном образцах проводят анализ с использованием suc-AAPF-pNA. Для определения альфа-амилазной активности в опытном и контрольном образцах, проводят анализ с использованием BODIPY-крахмал. Остаточные количества LAS и EDTA на опытных планшетах не влияют на результаты анализов с использованием suc-AAPF-pNA или BODIPY-крахмал.
Устойчивость к LAS/EDTA
В качестве реагентов используют: контрольный буфер: 50 мM HEPES, 0,005% Tween-80, pH 8,0; и опытный буфер: 50 мM HEPES, 0,1% (масс/об) LAS (натриевая соль додецилбензолсульфоната, Sigma D-2525), 10 мM EDTA, pH 8,0. Варианты ферментов (20 м.д.) разбавляют 1:20 в 96-луночном несвязывающем плоскодонном планшете, содержащем либо контрольный, либо опытный буфер, и перемешивают. Контрольный планшет инкубируют при комнатной температуре, а опытный планшет сразу инкубируют при 37°C в течение 30-60 мин (в зависимости от стабильности тестируемого фермента). После инкубации измеряют активность фермента с помощью анализа протеолитической активности с применением suc-AAPF-pNA. Долю оставшейся или остаточной активности определяют путем деления скорости реакции опытного образца на скорость реакции контрольного образца. Обнаружено, что в контрольном буфере исходные ферменты и варианты являются стабильными в течение 60 мин.
На фиг.6 показана зависимость устойчивости к LAS/EDTA от изменения суммарного заряда по сравнению с исходным BPN'-Y217L, для библиотеки, содержащей 80 вариантов. Данную библиотеку получают и конструируют с помощью способов, описанных в примере 2, так, чтобы сравнить несколько суммарных зарядов с исходной молекулой BPN'-Y217L. Как видно из фигуры, увеличение числа отрицательных зарядов (до -4) по сравнению с исходным BPN'-Y217L улучшает объединенную устойчивость к LAS/хелатирующему средству. Это является примером оптимизации физического свойства белка, в данном случае суммарного заряда, приводящей к улучшению стабильности белка в сложной среде стирального детергента.
ПРИМЕР 13
Способность вариантов из библиотеки множественных мутаций (MML) BPN' удалять пятна
Библиотеки множественных мутаций BPN' (или комбинаторные библиотеки) производят Geneart и DNA2.0, как описано выше, с использованием BPN' в качестве исходного белка. Как указано ранее, данные компании также производят вариантные белки BPN'. Концентрацию белка в культуральных супернатантах определяют путем осаждения с помощью TCA, как описано в примере 1. Способность вариантов удалять пятна во время стирки анализируют на образцах EMPA 116 (пятна BMI, CFT) при pH 8/16°C, pH 7/16°C и pH 8/32°C с помощью методов, описанных в примере 1, используя нижеследующие модификации. В качестве детергента используют инактивированный нагреванием TIDE® 2X Cold (Procter & Gamble). Коммерческие детергентные составы подвергают инактивации нагреванием, чтобы разрушить эндогенную ферментативную активность всех белковых компонентов при сохранении свойств неферментных компонентов. Инактивацию нагреванием детергентов проводят путем помещения предварительно взвешенного жидкого детергента (в стеклянной бутыли) на водяную баню при 95°С, где его держат 2 часа. Детергент получают из местных супермаркетов. Обработанные и необработанные теплом детергенты анализируют в течение 5 минут, растворяя детергент, чтобы точно определить процент дезактивации. Активность фермента тестируют с помощью анализа AAPF. Функциональность вариантов BPN' количественно определяют как показатель функционирования (Pi) (т.е., отношение характеристик варианта и исходного BPN'). Результаты приведены в таблице 13-1. Варианты BPN' со значением Pi, больше или равным 0,5, по результатам одного или нескольких анализов способности удалять пятна BMI и/или осаждения TCA характеризуются улучшенными свойствами и/или повышенной экспрессией. Показатели функционирования, менее или равные 0,05, относят к 0,05 и выделяют в таблице жирным курсивом. Для каждого варианта с показателем функционирования, менее или равным 0,05, по результатам TCA-анализа белка, все значения относят к 0,05. В данной таблице "ND" означает "не определенный".
pH 8/16°C
pH 7/16ºC
pH 8/32ºC
ПРИМЕР 14
Способность двойных вариантов BPN' удалять пятна
Используя BPN' в качестве исходного белка, с помощью гибридизующей ПЦР получают двойные варианты по положениям 217 и 222 (нумерация BPN'). Вариантные белки BPN' получают с помощью описанных выше способов. Концентрацию белка в культуральных супернатантах определяют путем осаждения с помощью TCA, как описано в примере 1. Способность вариантов удалять пятна во время стирки анализируют на образцах EMPA 116 (пятна BMI, CFT) при pH 8/16°C в инактивированном нагреванием TIDE® 2X Cold (Procter & Gamble) с помощью способов, описанных в примере 1. Функциональность вариантов BPN' количественно определяют как показатель функционирования (Pi) (т.е., отношение характеристик варианта и BPN'-Y217L). Результаты приведены в таблице 14-1. Варианты BPN' со значением Pi больше или равным 0,5 по результатам анализов способности удалять пятна BMI и/или осаждения TCA характеризуются улучшенными свойствами и/или повышенной экспрессией.
ПРИМЕР 15
Получение протеазы ASP в B. subtilis
Способы получения протеазы 69B4 (также называемой в данном документе "ASP", "Asp", "протеаза ASP" и "протеаза Asp") в B. subtilis описаны в патентной заявке США № 10/576331, включенной в данное опиание в качестве ссылки во всей полноте. Коротко говоря, приведенная ниже последовательность ДНК (синтетическая последовательность ДНК ASP), содержащая кодон, адаптированный для видов Bacillus, кодирует белок-предшественник ASP:


В данной последовательности жирным шрифтом выделена ДНК, которая кодирует зрелую протеазу, стандартным шрифтом показана лидерная последовательность, а подчеркиванием выделены N-концевая и C-концевая пропоследовательности. Зрелый фермент сериновая протеаза, полученная из штамма Cellulomonas 69B4 (DSM 983316035), содержит 189 аминокислот в длину, каталитическую триаду, состоящую из His32, Asp56 и Ser137, как показано ниже (каталитическая триада выделена жирным и подчеркиванием):

ПРИМЕР 16
Получение комбинаторных мутантов ASP и библиотек множественных мутаций
В данном примере описаны способы получения комбинаторных мутантов и библиотеки множественных мутаций ASP. Получение комбинаторных мутантов ASP описано в патентной заявке США № 10/576331.
Получение библиотеки множественных мутаций
Библиотеку множественных мутаций получают в соответствии с инструкцией, прилагающейся к набору Stratagene QCMS, за исключением используемой в реакции концентрации праймера. А именно, 1 мкл метилированной, очищенной плазмиды pUC18-ASP (примерно 70 нг) смешивают с 15 мкл стерильной дистиллированной воды, 1,5 мкл dNTP, 2,5 мкл буфера 10×, 1 мкл ферментной смеси и 1,0 мкл смеси мутантных праймеров (всего 100 пмоль праймеров). Смесь праймеров получают, используя 10 мкл каждого из восемнадцати мутантных праймеров (100 пмоль/мкл); добавление к библиотеке 50 нг каждого праймера, в соответствии с рекомендациями Stratagene, приводит к уменьшению мутаций в предыдущем цикле мутагенеза. Таким образом, методику модифицируют в текущем цикле мутагенеза путем введения всего 100 пмоль праймеров в каждую реакцию. Реакцию проводят, используя следующие циклические условия: 95ºC в течение 1 мин, затем 30 циклов, включающих в себя 95ºC в течение 1 мин, 55ºC в течение 1 мин и 65ºC в течение 12 мин, в термоциклере MJ Research PTC2-200 с использованием тонкостенных пробирок для ПЦР объемом 0,2 мл. Продукт реакции расщепляют путем инкубации с 1 мкл DpnI из набора QCMS при 37ºC в течение ночи. Добавляют еще 0,5 мкл DpnI, после чего реакционную смесь инкубируют в течение 1 часа.
Затем библиотеку ДНК (мутировавший одноцепочечный продукт pUC18-ASP) методом электропорации вводят в электрокомпетентные клетки E.coli (Invitrogen®, № по каталогу C4040-52, One Shot® TOP10 ElectrocompTM E. coli, dam+), трансформированные клетки выращивают и подвергают селекции на чашках с агаром, содержащим 100 мг/л ампициллина, с получением библиотеки множественных мутаций в клетках E.coli. Колонии (десятки тысяч) собирают, и получают плазмидную ДНК с помощью набора для получения минипрепарата ДНК Qiagen spin (№ по каталогу 27106) в соответствии с инструкцией производителя. Минипрепарат ДНК элюируют, используя 50 мкл буфера Qiagen EB, входящего в состав набора.
Минипрепарат ДНК расщепляют с помощью рестрикционных ферментов ДНК PstI и HindIII. Смесь компонентов библиотеки ASP (PstI × HindIII) очищают методом гель-хроматографии и клонируют в векторном фрагменте HindIII × PstI pHPLT размером 4154 пар оснований, в который ее вставляют путем лигирования с помощью ДНК-лигазы T4 Invitrogen® (№ по каталогу 15224-025) в соответствии с рекомендациями производителя для клонирования с использованием липких концов). В другой стратегии синтетические компоненты библиотеки ASP получают от GeneArt. Полученные компоненты библиотеки ASP также расщепляют PstI и HindIII, очищают и вставляют в векторный фрагмент HindIII × PstI pHPLT размером 4154 пар оснований с помощью лигазной реакции.
Чтобы непосредственно использовать лигационную реакционную смесь для трансформации клеток Bacillus, библиотеку ДНК (смесь компонентов библиотеки ASP, клонированных в pHPLT) амплифицируют, используя набор TempliPhi (Amersham, № по каталогу 25-6400). Для этого 1 мкл лигационной реакционной смеси смешивают с 5 мкл буфера для образца из набора TempliPhi и нагревают в течение 3 минут при 95ºC, чтобы денатурировать ДНК. Реакционную смесь помещают на лед, охлаждают в течение 2 минут и центрифугируют в течение короткого периода времени. Затем добавляют 5 мкл реакционного буфера и 0,2 мкл полимеразы phi29 из набора TempliPhi, после чего реакционные смеси инкубируют при 30ºC в устройстве для проведения ПЦР MJ Research в течение 4 часов. Фермент phi29 инактивируют нагреванием в реакционных смесях путем инкубации при 65ºC в течение 10 мин в устройстве для проведения ПЦР.
Для трансформации Bacillus с использованием библиотек 0,1 мкл продукта реакции амплификации TempliPhi смешивают с 500 мкл компетентных клеток B. subtilis (ΔaprE, ΔnprE, oppA, ΔspoIIE, degUHy32, ΔamyE::(xy1R, pxy1A-comK) с последующим энергичным встряхиванием при 37ºC в течение 1 часа, после чего аликвоты объемом 100 и 500 мкл помещают на чашки с HI-агаром, содержащие 20 м.д. сульфата неомицина (Sigma, № по каталогу N-1876; содержит 732 мкг неомицина на мг) и 0,5% снятого молока. Девяносто пять клонов выбирают из библиотеки для секвенирования.
Мутагенез протекает благоприятно, поскольку только 14% клонов имеют последовательность, равнозначную исходной (ASP, содержащий R014I-A064K-T086K-T116E-R123F), и примерно 3% клонов содержат дополнительные мутации. Все остальные секвенированные клоны (72%) являются мутантами и из них примерно 94% являются уникальными мутантами. Результаты секвенирования библиотеки приведены ниже в таблице 16-1.
Варианты ASP, содержащей R014I-A064K-T086K-T116E-R123F
ПРИМЕР 17
Корреляция вредных мутаций по нескольким свойствам
В данном пример разъясняется принцип, заключающийся в том, что вредные мутации по одному свойству коррелируют с вредными мутациями по каждому другому свойству, независимо от корреляции свойств. Как указано в данном документе, только небольшое число положений (5-10%) может содержать мутации, оказывающие вредное влияние на все свойства. Такие положения определяют укладку белка и являются консервативными с точки зрения эволюции. Значение данного явления заключается в том, что, в отличие от идентификации улучшающих мутаций, которая требует применения, в сущности, предсказательного скрининга по данному свойству, идентификацию мутаций, которые предположительно оказывают вредное влияние на какое-либо свойство, можно проводить с помощью любого скрининга, включающего в себя, без ограничения, описанные здесь способы.
Вариантные ферменты получают с помощью способов, описанных в данном документе и в патентных заявках США №№ 10/576331, 10/581014, 11/581102 и 11/583334, которые включены в настоящее описание в качестве ссылки во всей полноте. В приведенных ниже таблицах показано попарное сравнение ряда вариантов с масс. активностью более 5% и с активностью по каждому из двух свойств менее 5%, и указаны коэффициенты корреляции для двух свойств. Аналитические системы, используемые в данном примере, также предлагаются для вышеупомянутых применений. В качестве свойств используют активность в отношении казеина (CAS), активность в отношении кератина (KER), активность в отношении AAPF (AAPF), устойчивость к LAS (LAS) и термостабильность в случае ASP; а также образование перкислот (PAF) и деградация перкислот (PAD) в случае ACT.
Анализ гидролиза кератина
В данной аналитической системе используют следующие растворы химических веществ и реагентов:
Пикрилсульфоновая кислота (TNBS)
Sigma P-2297 (5% раствор в воде)
Способ:
Перед инкубацией кератин просеивают через сито 100 мкм маленькими порциями. Затем 10 г кератина с размером частиц < 100 мкм перемешивают в растворе детергента в течение, по меньшей мере, 20 минут при комнатной температуре, поддерживая рН равным 8,2. Наконец, суспензию центрифугируют в течение 20 минут при комнатной температуре (Sorvall, ротор GSA, 13000 об/мин). Затем описанную процедуру повторяют. Наконец влажный осадок суспендируют в детергенте с получением общего объема 200 мл и проводят пипетирование, продолжая перемешивать. Перед инкубацией в MTP вносят 200 мкл субстрата на лунку с помощью многоканальной пипетки Biohit и наконечника 1200 мкл (6 порций по 200 мкл, которые распределяют так быстро, как это возможно, чтобы избежать оседания кератина на наконечниках). Затем в MTP, содержащие субстрат, добавляют 10 мкл фильтрованной культуры. Планшеты накрывают пленкой, помещают в инкубатор и инкубируют при 20ºC в течение 3 часов при 350 об/мин (New Brunswick Innova 4330). После инкубации планшеты центрифугируют 3 минуты при 3000 об/мин (центрифуга Sigma 6K 15). Примерно за 15 минут до удаления первого планшета из инкубатора, получают реагент TNBS путем смешивания 1 мл раствора TNBS и 50 мл реагента A.
В каждую лунку MTP вносят 60 мкл смеси TNBS-реагент A. Из инкубационных планшетов 10 мкл переносят в MTP, содержащие смесь TNBS-реагент A. Планшеты покрывают пленкой и встряхивают в течение 20 минут в настольном шейкере (BMG Thermostar) при комнатной температуре и 500 об/мин. Наконец, в лунки добавляют 200 мкл реагента B, перемешивают в течение 1 минуты на шейкере и измеряют поглощение при 405 нм с использованием ридера для MTP.
Вычисление кератин-гидролизующей активности
Полученное значение поглощения корректируют по пустому значению (субстрат в отсутствие фермента). Результирующее значение поглощения является мерой гидролитической активности. Для каждого образца (варианта) рассчитывают показатель функционирования. Показатель функционирования свидетельствует об активности варианта (фактическое значение) по сравнению со стандартным ферментом (теоретическое значение) при одинаковой концентрации белка. Кроме того, теоретические значения можно рассчитывать, используя параметры уравнения Ленгмюра для стандартного фермента. Если показатель функционирования (PI) больше 1 (PI>1), вариант считается лучше, чем стандартный фермент (например, дикого типа), если PI равен 1 (PI=1), это свидетельствует о том, что вариант имеет такие же характеристики, как и стандартный фермент, а если PI меньше 1 (PI<1), считается, что вариант функционирует хуже, чем стандартный фермент. Таким образом, PI позволяет идентифицировать лучшие варианты, а также менее желательные варианты для применения в определенных условиях.
Анализ гидролиза диметилказеина (96-луночный формат)
В данной аналитической системе используют следующие растворы химических веществ и реагентов:
Способ:
Чтобы получить субстрат, 4 г DMC растворяют в 400 мл буфера PIPES. Фильтрованные культуральные супернатанты разбавляют буфером PIPES; конечная концентрация контролей в культуральном планшете составляет 20 м.д. Затем 10 мкл каждого разбавленного супернатанта добавляют в лунки MTP, содержащие 200 мкл субстрата. Планшет MTP покрывают пленкой, встряхивают в течение нескольких секунд, помещают в термостат и держат при 37ºC в течение 2 часов, не встряхивая.
Примерно за 15 минут до удаления первого планшета из термостата, получают реагент TNBS путем смешивания 1 мл раствора TNBS и 50 мл реагента A. В каждую лунку MTP вносят 60 мкл смеси TNBS-реагент A. Инкубационные планшеты встряхивают в течение нескольких секунд и затем 10 мкл переносят в MTP, содержащие смесь TNBS-реагент A. Планшеты покрывают пленкой и встряхивают в течение 20 минут в настольном шейкере (BMG Thermostar) при комнатной температуре и 500 об/мин. Наконец, в лунки добавляют 200 мкл реагента B, перемешивают в течение 1 минуты на шейкере и измеряют поглощение при 405 нм с использованием ридера для MTP.
Вычисление диметилказеин-гидролизующей активности:
Полученное значение поглощения корректируют по пустому значению (субстрат в отсутствие фермента). Результирующее значение поглощения является мерой гидролитической активности. (Условную) Удельную активность образца рассчитывают путем деления поглощения на определенную концентрацию белка.
Анализ термостабильности
В данном анализе измеряют гидролиз диметилказеина (DMC) до и после нагревания забуференного культурального супернатанта. Используют такие же растворы химических веществ и реагентов, как и в анализе гидролиза DMC.
Способ:
Фильтрованные культуральные супернатанты разбавляют до 20 м.д. буфером PIPES (исходя их концентрации контролей в культуральных планшетах). Затем 50 мкл каждого разбавленного супернатанта помещают в пустые лунки MTP. Планшет MTP инкубируют в инкубаторе/шейкере iEMS HT (Thermo Labsystems) в течение 90 минут при 60ºC и 400 об/мин. Планшеты охлаждают на льду в течение 5 минут. Затем 10 мкл раствора добавляют в новый MTP, содержащий 200 мкл субстрата DMC/лунку. Этот MTP покрывают пленкой, встряхивают в течение нескольких секунд и помещают в термостат, где держат при 37ºC в течение 2 часов, не встряхивая. Используют такой же метод детекции, как и для анализа гидролиза DMC.
Расчет термостабильности:
Остаточную активность образца выражают в виде отношения конечного поглощения и начального поглощения, которые корректируют по пустым значениям.
Как показано в нижеследующих таблицах, коррелируют (коэффициенты корреляции >0,5) только такие свойства, как CAS, KER и AAPF в случае ASP. Все другие свойства не коррелируют (коэффициент корреляции <0,3). Несмотря на то, что свойства не коррелируют, вероятность того, что мутация оказывает вредное влияние на два свойства, гораздо выше, чем у случайного совпадения. В таблице 17-1 приведены рассчитанные отношения наблюдаемого числа вариантов и числа вариантов, ожидаемого исходя из теории вероятности. Значения, превышающие 1, указывают на положительную корреляцию, а значения меньше 1 указывают на отрицательную корреляцию.





| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОТЕАЗЫ, СОДЕРЖАЩИЕ ОДНУ ИЛИ НЕСКОЛЬКО КОМБИНИРУЕМЫХ МУТАЦИЙ | 2009 |
|
RU2560978C2 |
| КОМПОЗИЦИИ И СПОСОБЫ, ВКЛЮЧАЮЩИЕ ВАРИАНТЫ МИКРОБНЫХ ПРОТЕАЗ | 2009 |
|
RU2541786C2 |
| Способы и композиции, содержащие варианты сериновой протеазы | 2012 |
|
RU2663114C2 |
| КОМПОЗИЦИИ И СПОСОБЫ, ВКЛЮЧАЮЩИЕ ВАРИАНТЫ СЕРИНОВОЙ ПРОТЕАЗЫ | 2012 |
|
RU2718648C2 |
| СПОСОБЫ УЛУЧШЕНИЯ ЭФФЕКТИВНОСТИ БЕЛКОВ | 2008 |
|
RU2569106C2 |
| СПОСОБЫ УЛУЧШЕНИЯ МНОЖЕСТВЕННЫХ СВОЙСТВ БЕЛКА | 2008 |
|
RU2553550C2 |
| ПОТРЕБИТЕЛЬСКИЕ ТОВАРЫ С ВАРИАНТАМИ ПРОТЕАЗЫ | 2011 |
|
RU2598717C2 |
| МОДИФИЦИРОВАННЫЙ СУБТИЛИЗИН, ДНК, КОДИРУЮЩАЯ МОДИФИЦИРОВАННЫЙ СУБТИЛИЗИН, ВЕКТОР ЭКСПРЕССИИ, КОДИРУЮЩИЙ ДНК, И ШТАММ КУЛЬТУРЫ КЛЕТКИ ХОЗЯИНА | 1994 |
|
RU2136756C1 |
| БЕЛКИ, ВЫЗЫВАЮЩИЕ ИЗМЕНЕННУЮ ИММУНОГЕННУЮ РЕАКЦИЮ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ | 2002 |
|
RU2311458C2 |
| ВАРИАНТЫ СЕРИНОВОЙ ПРОТЕАЗЫ С МНОЖЕСТВЕННЫМИ МУТАЦИЯМИ | 2007 |
|
RU2558261C2 |


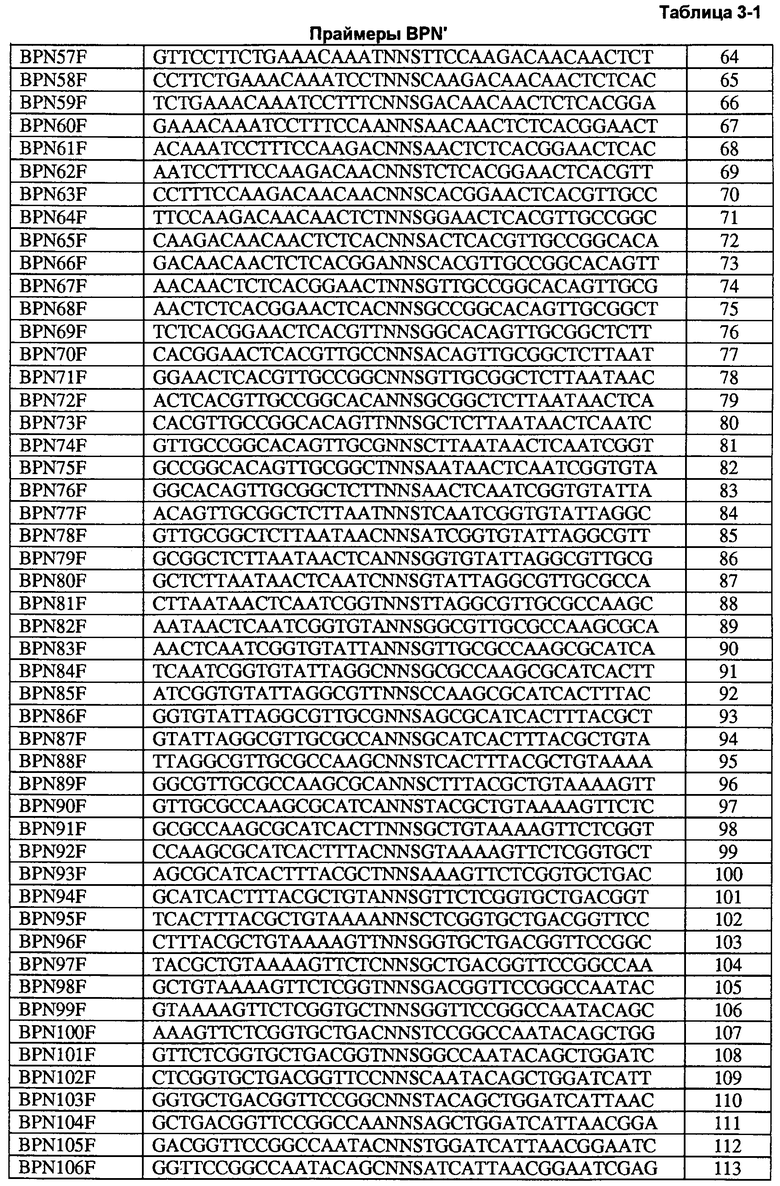





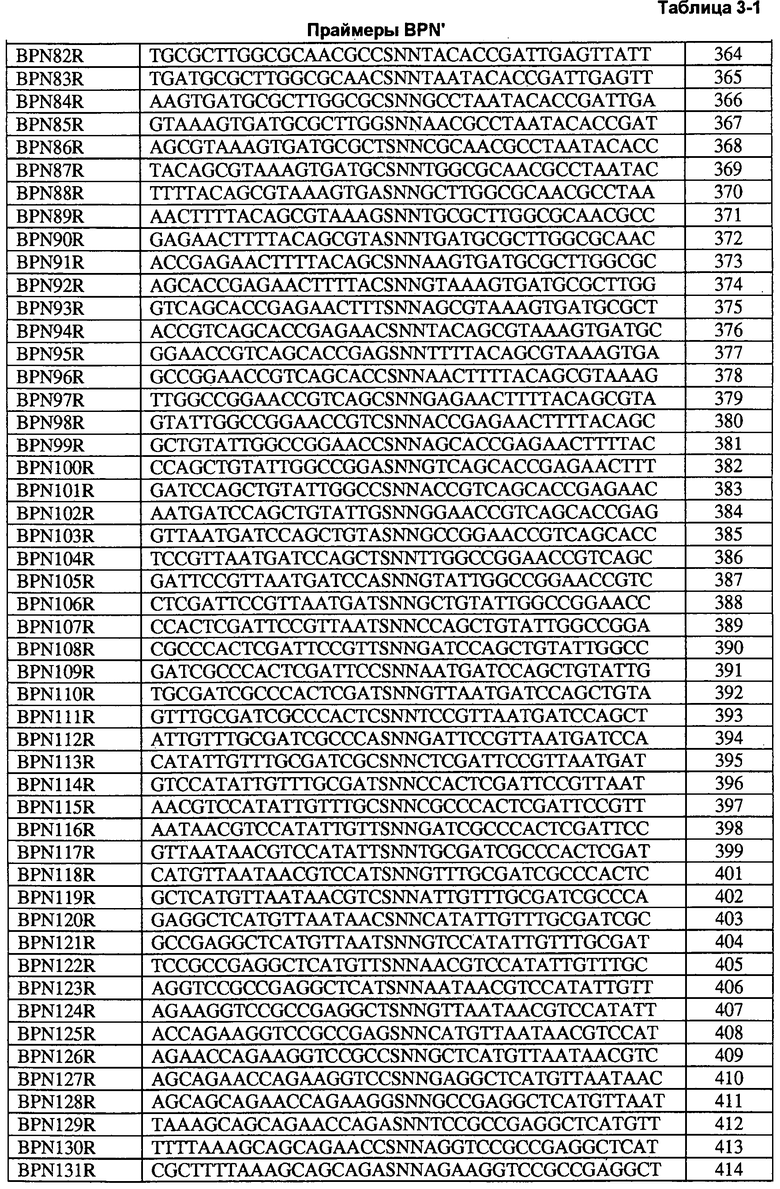


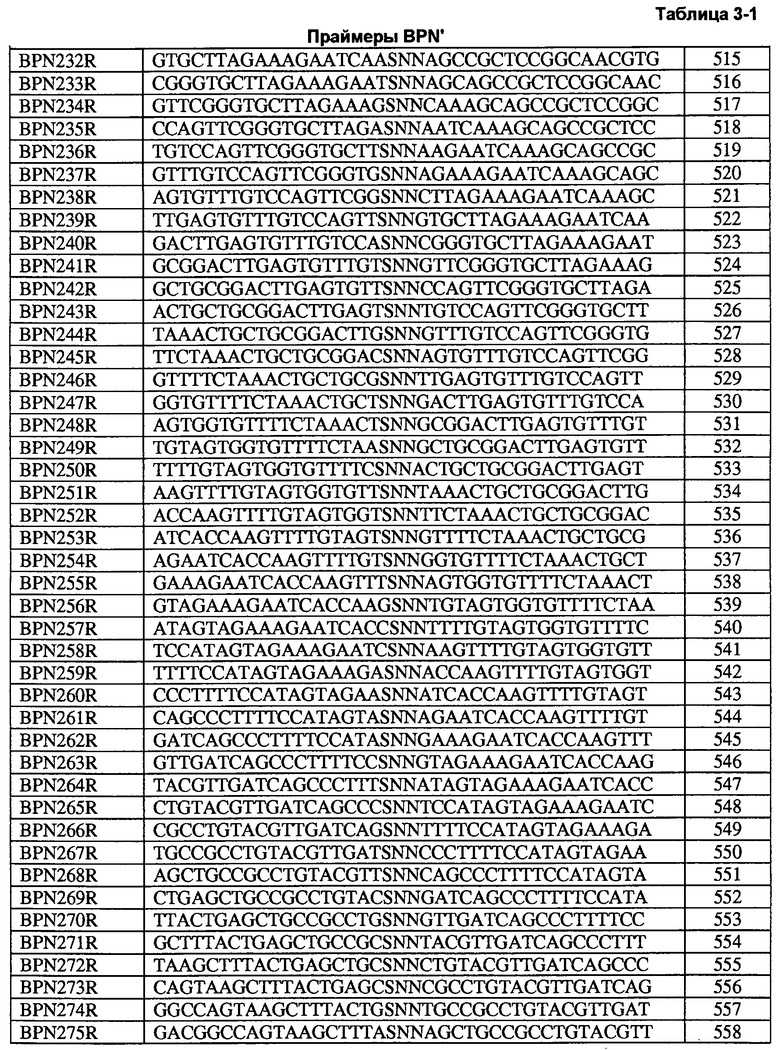











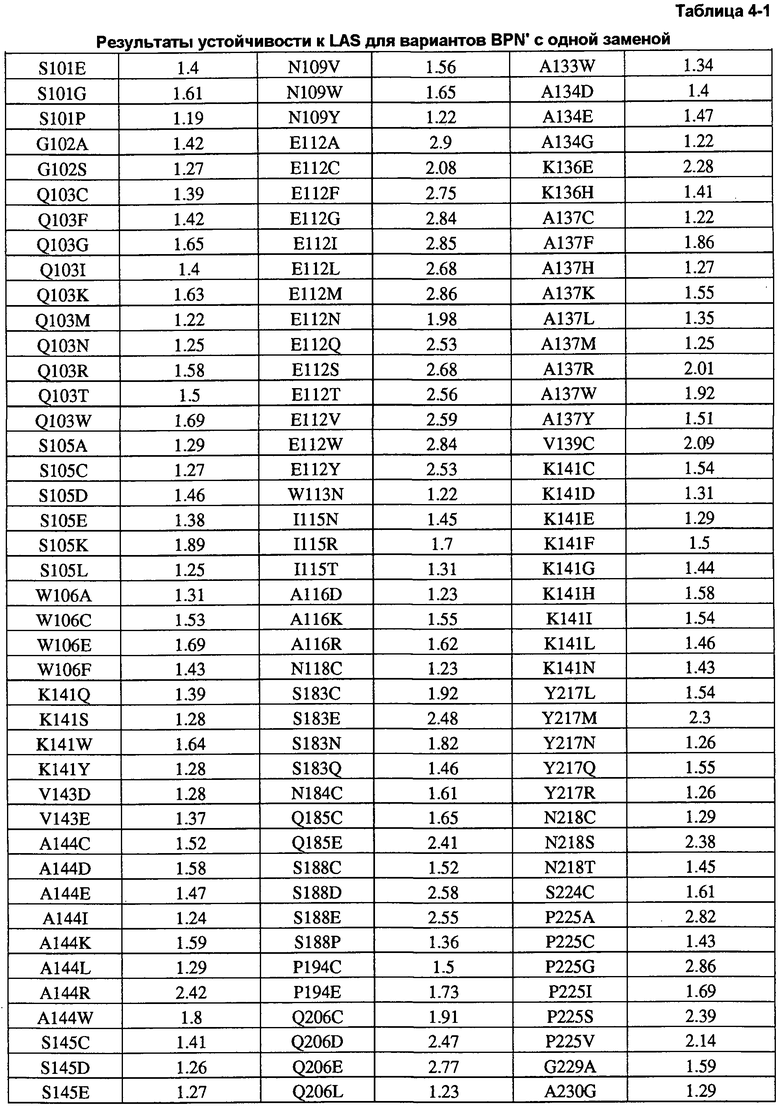


















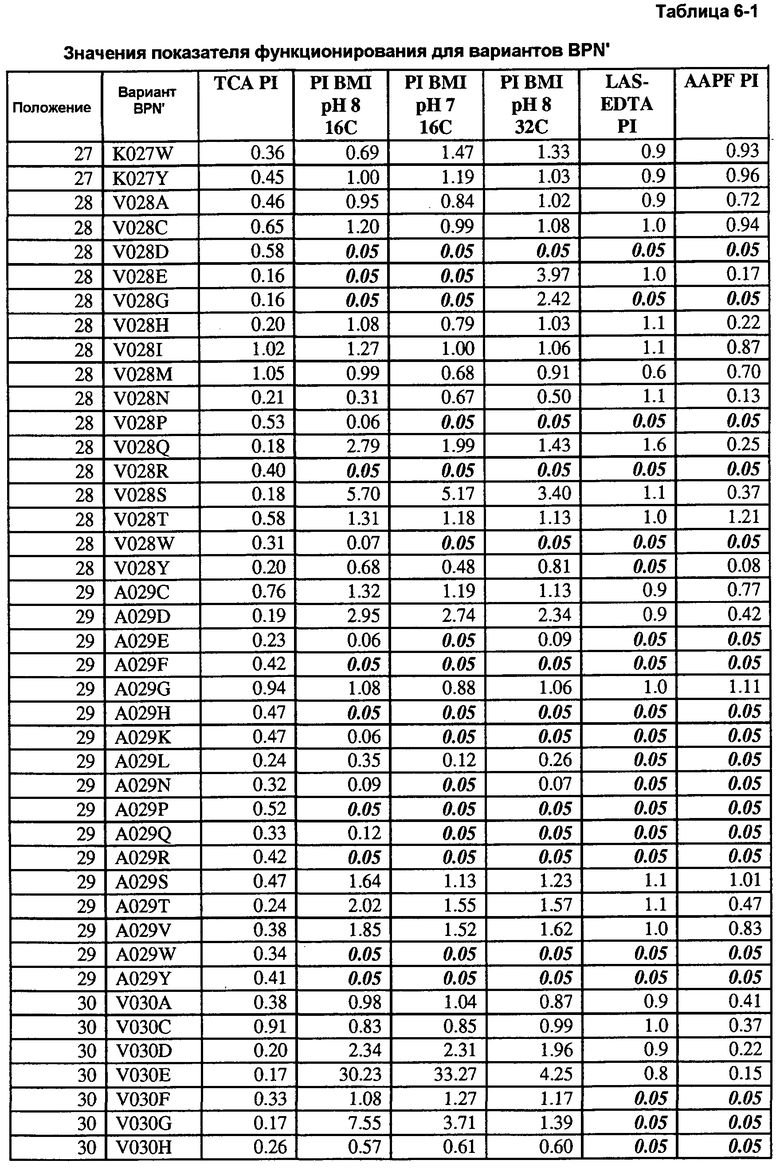









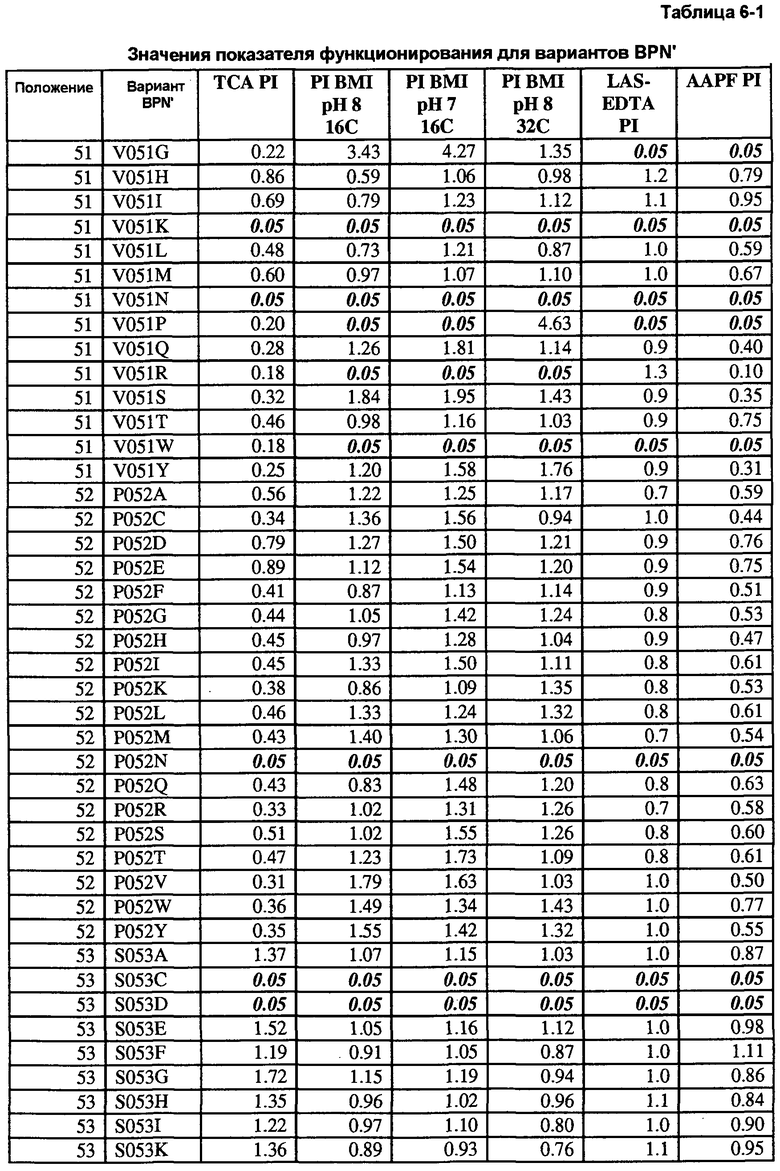














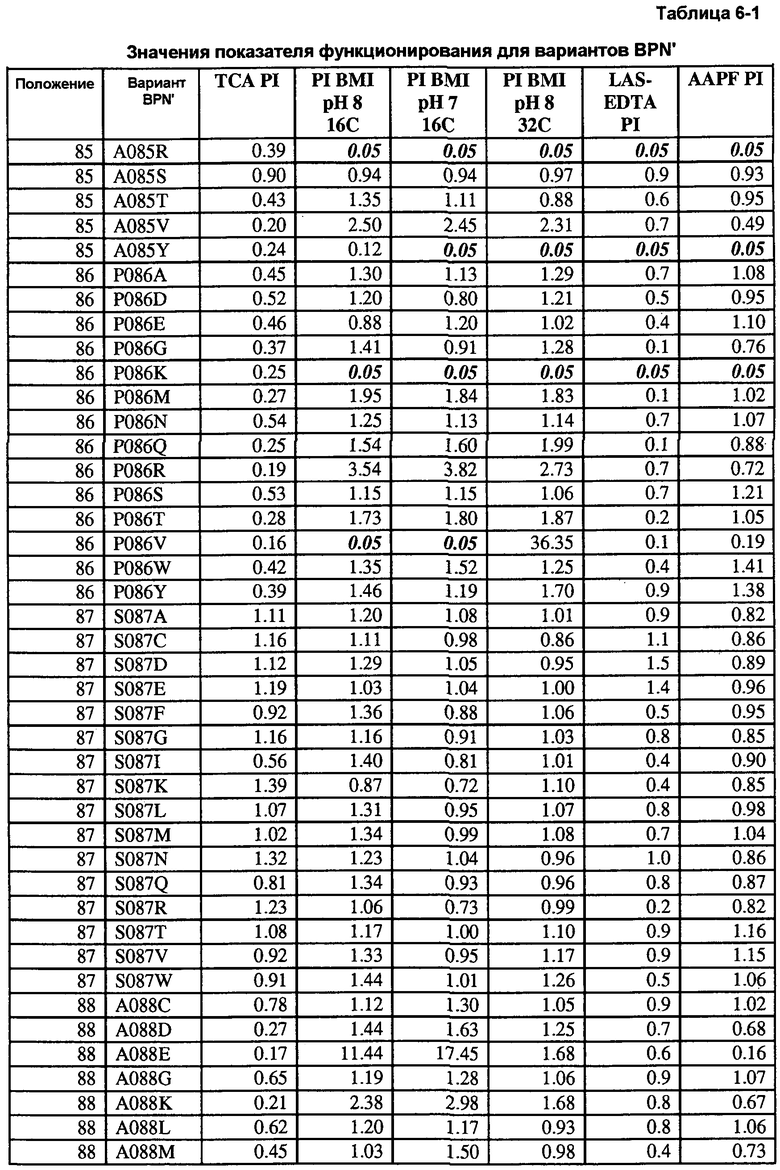














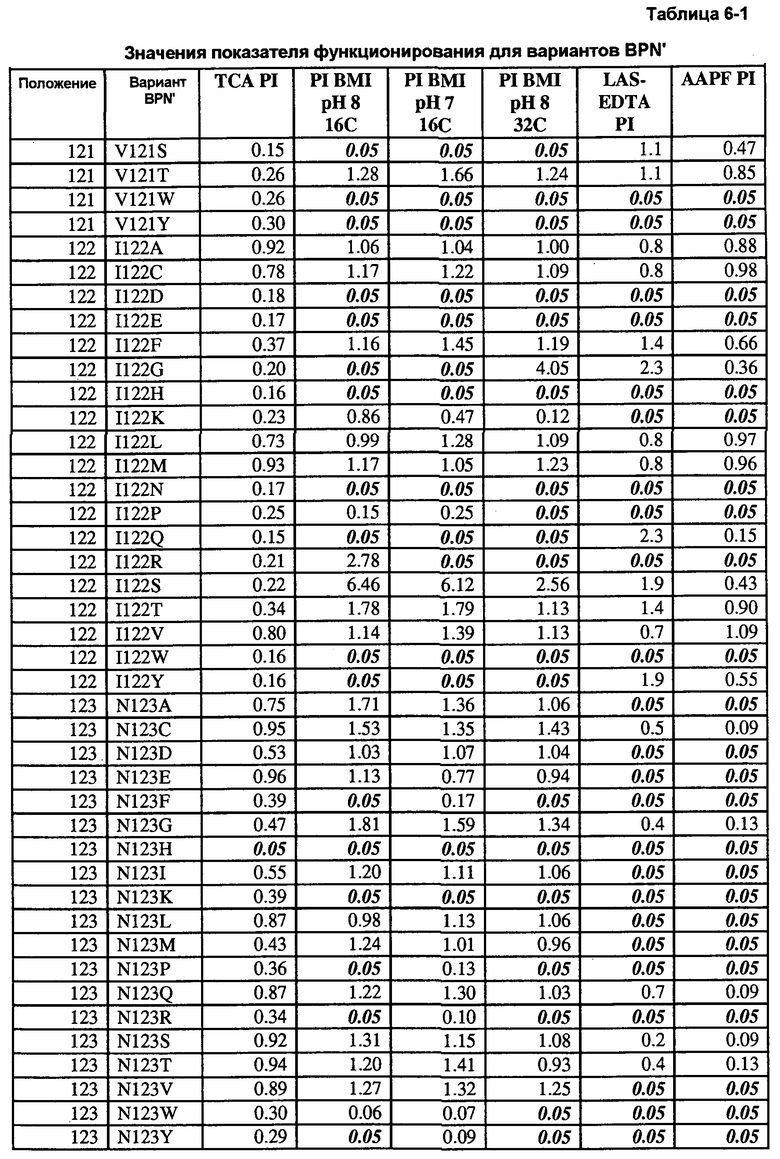











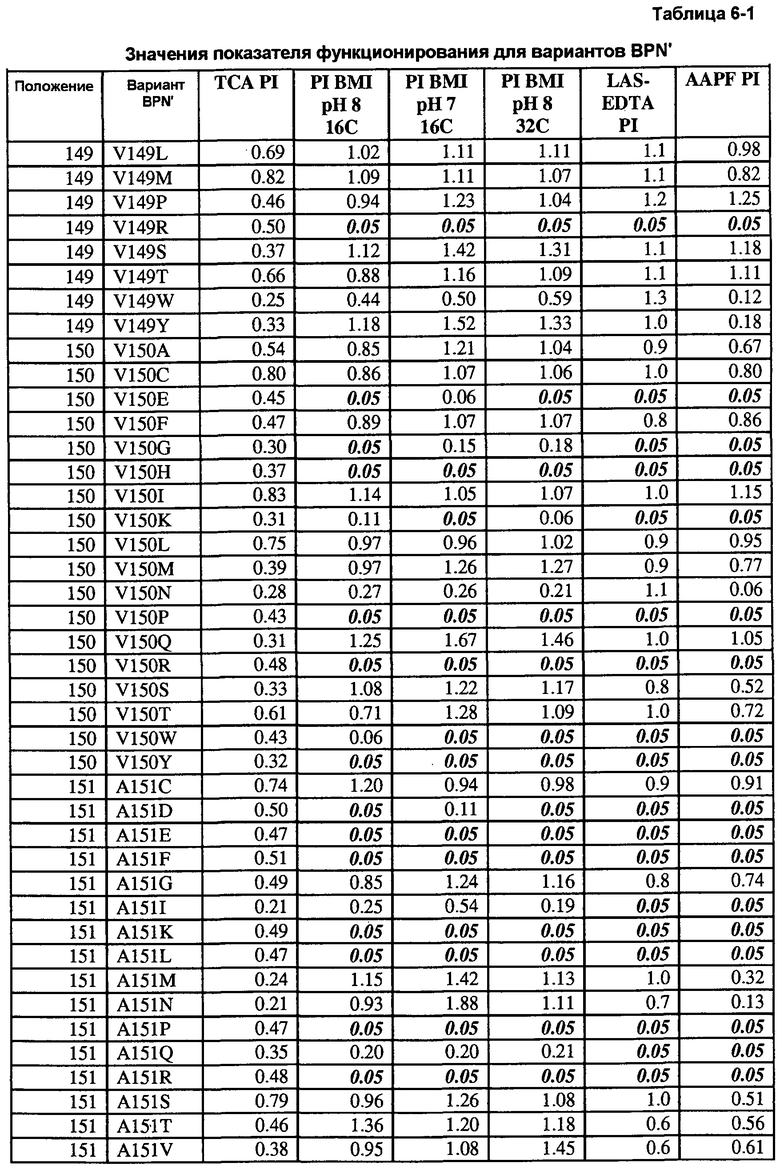









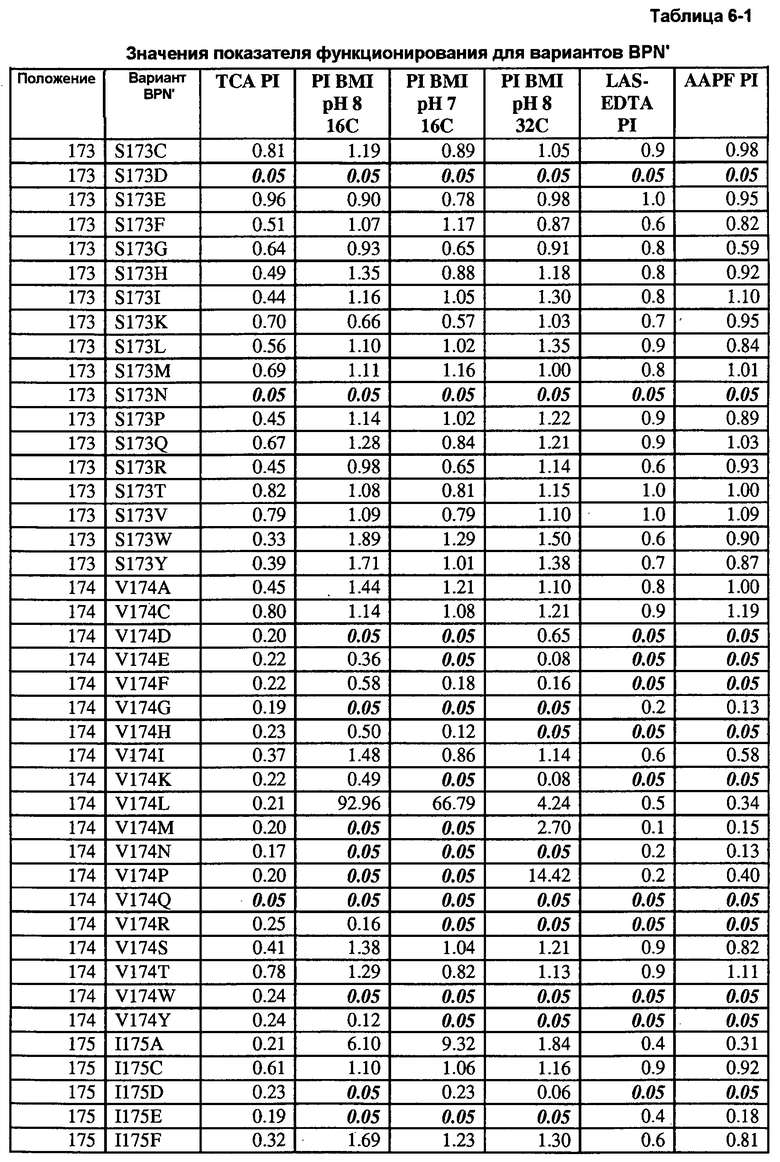








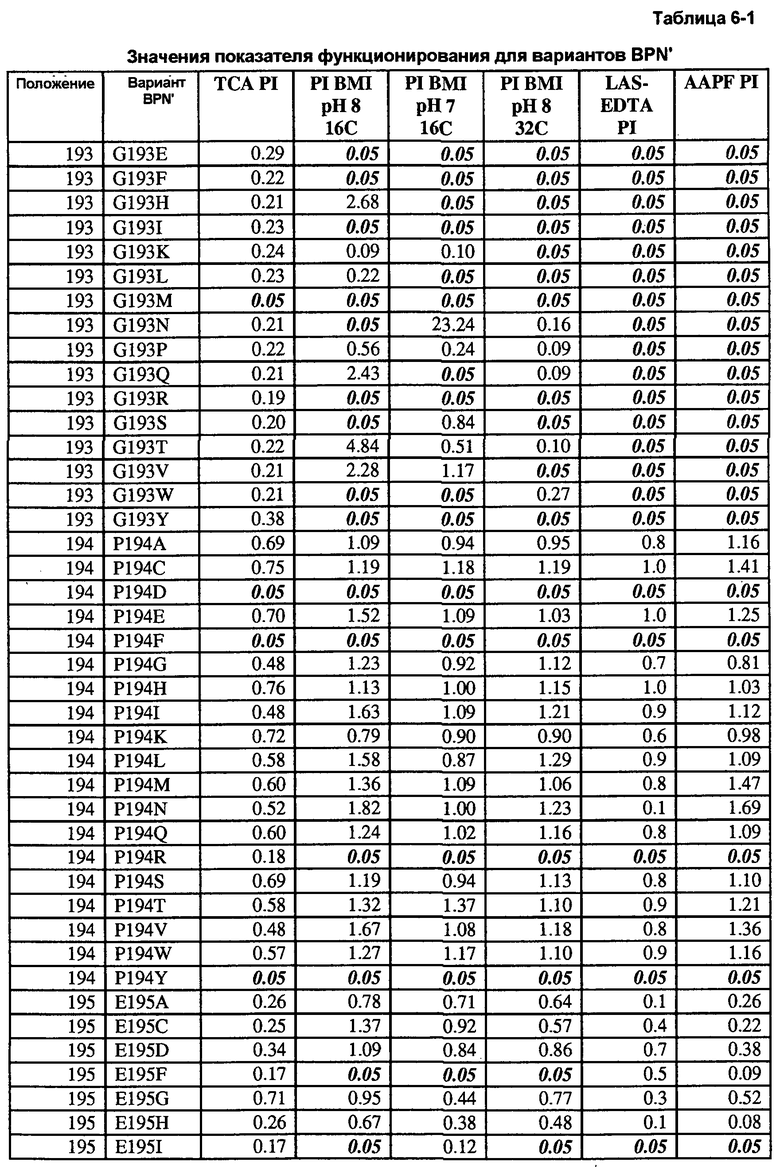



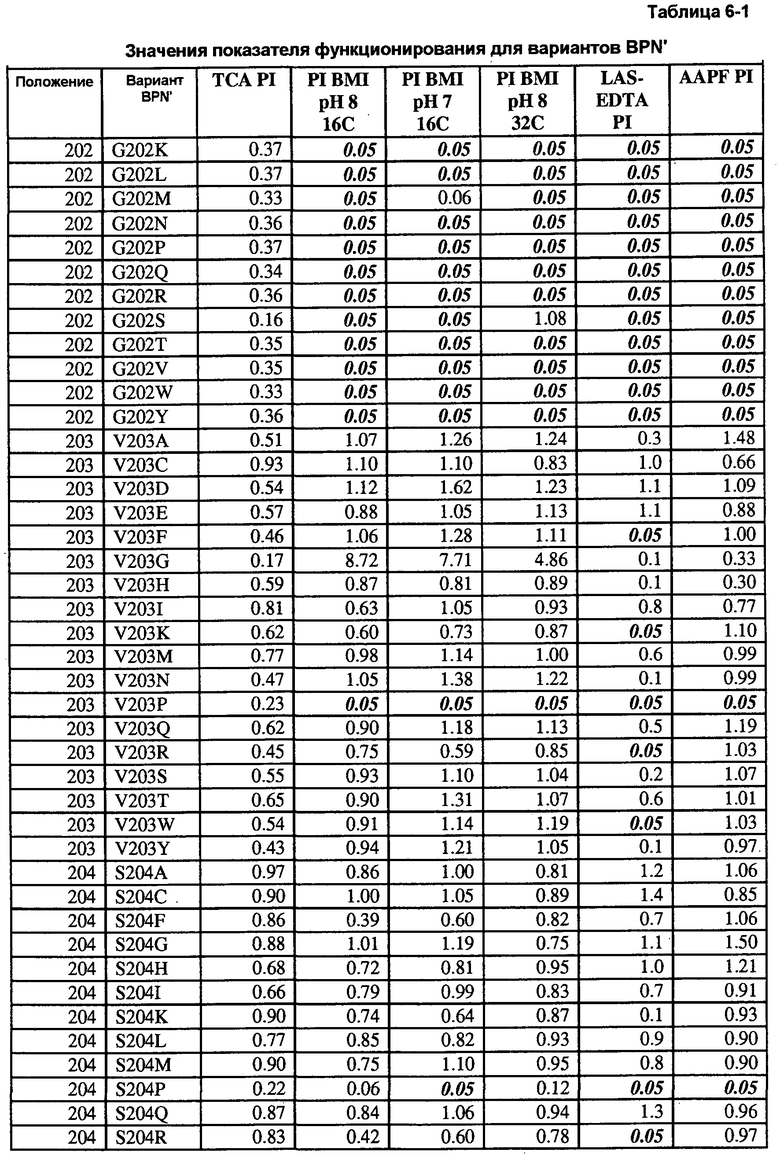




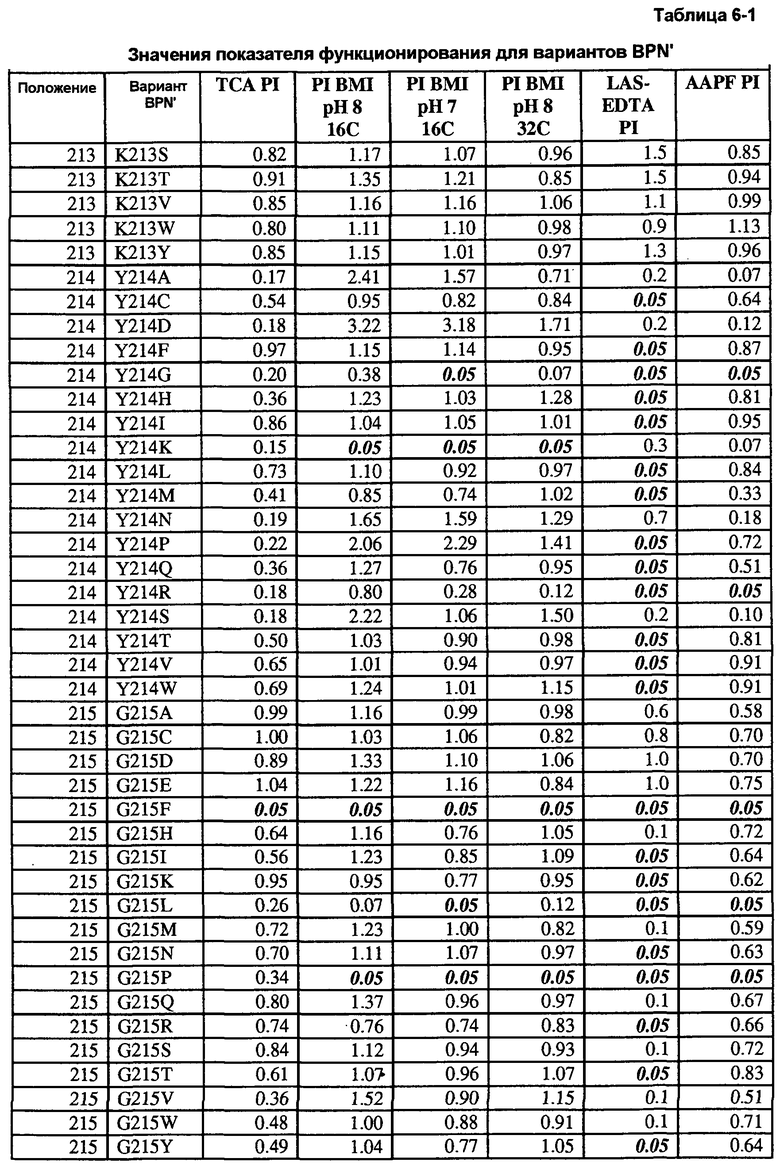























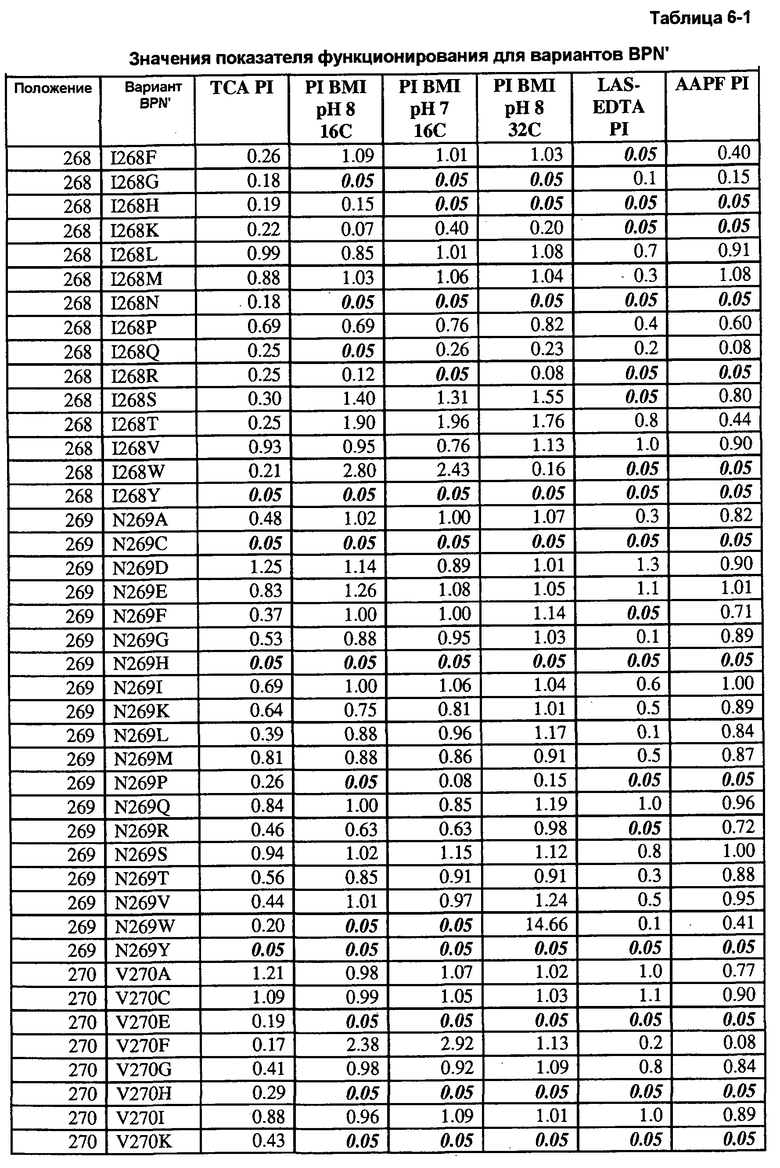














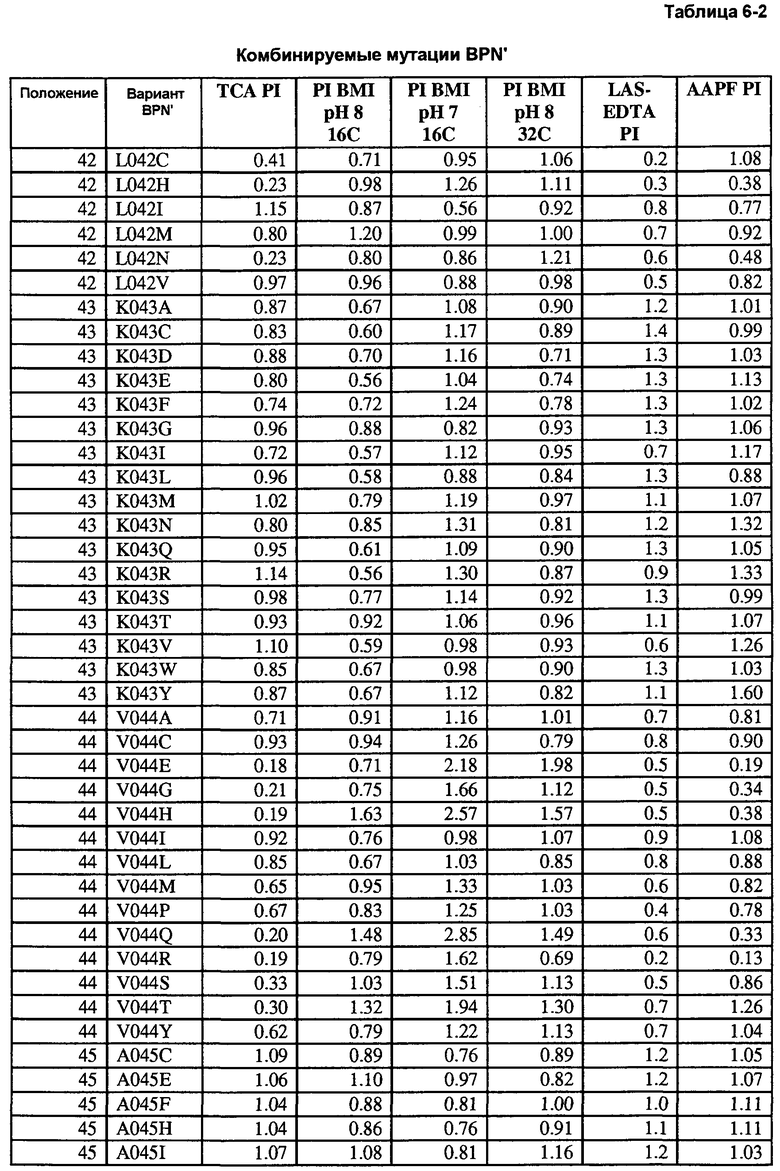



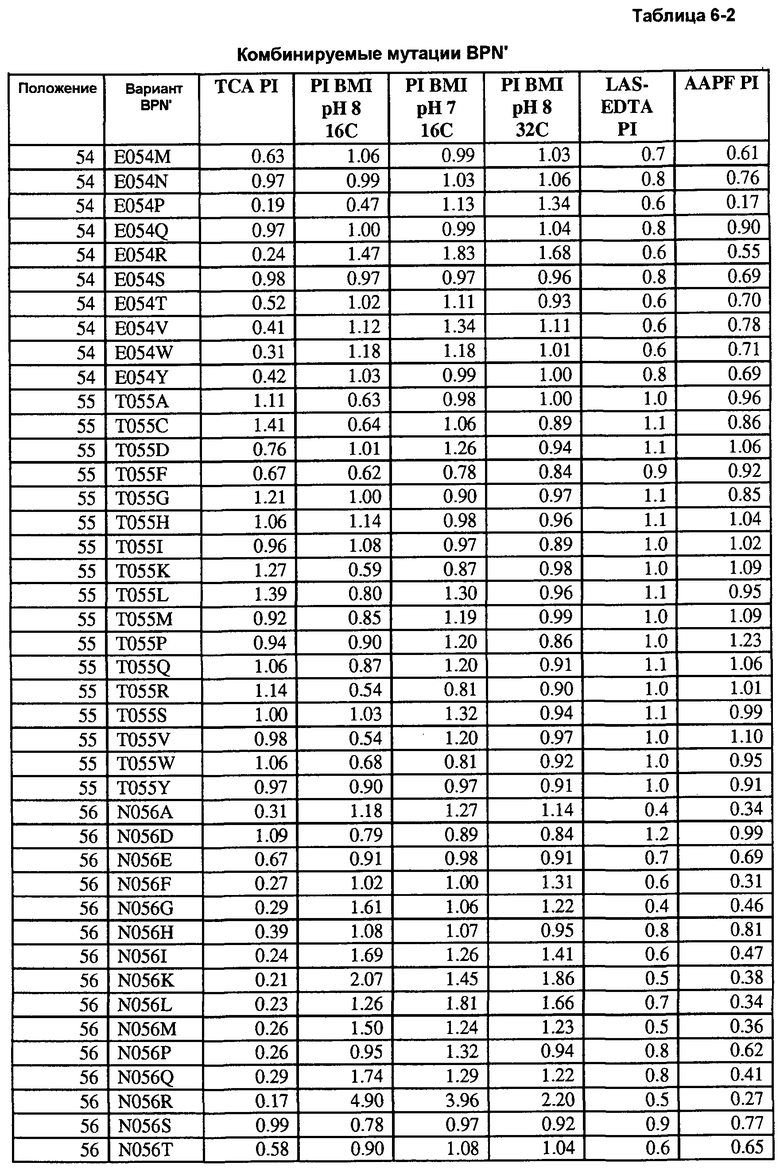





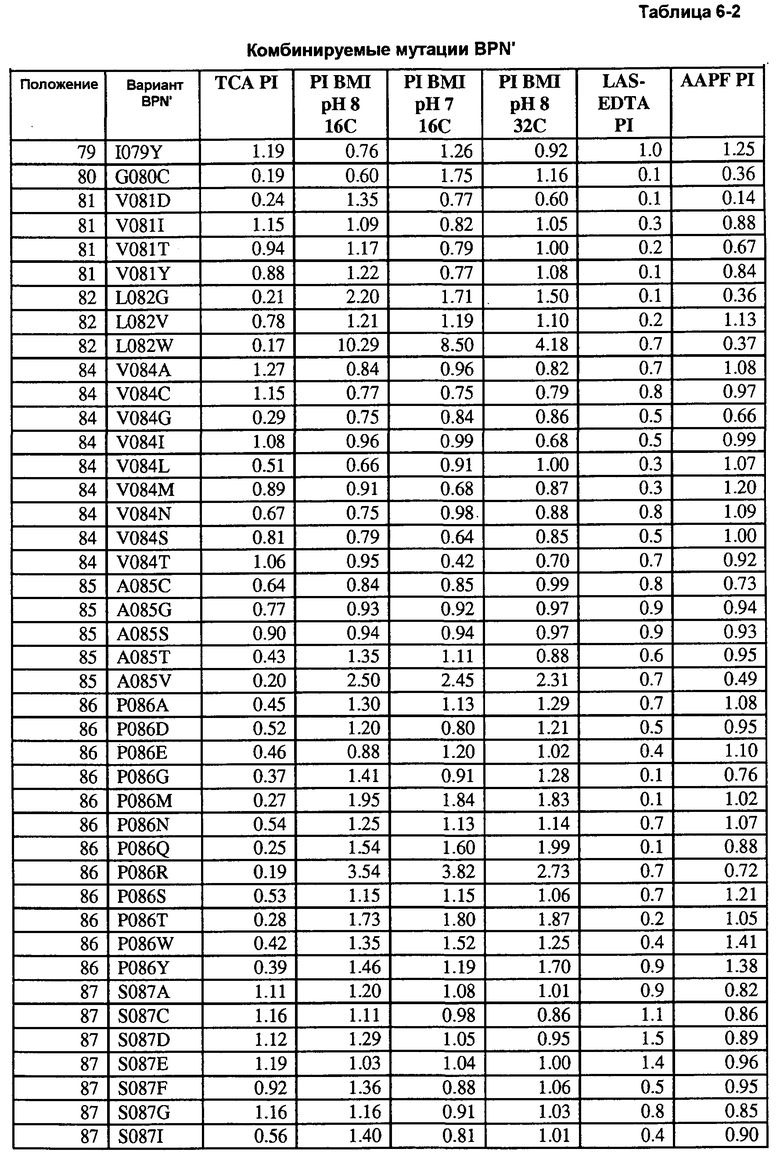



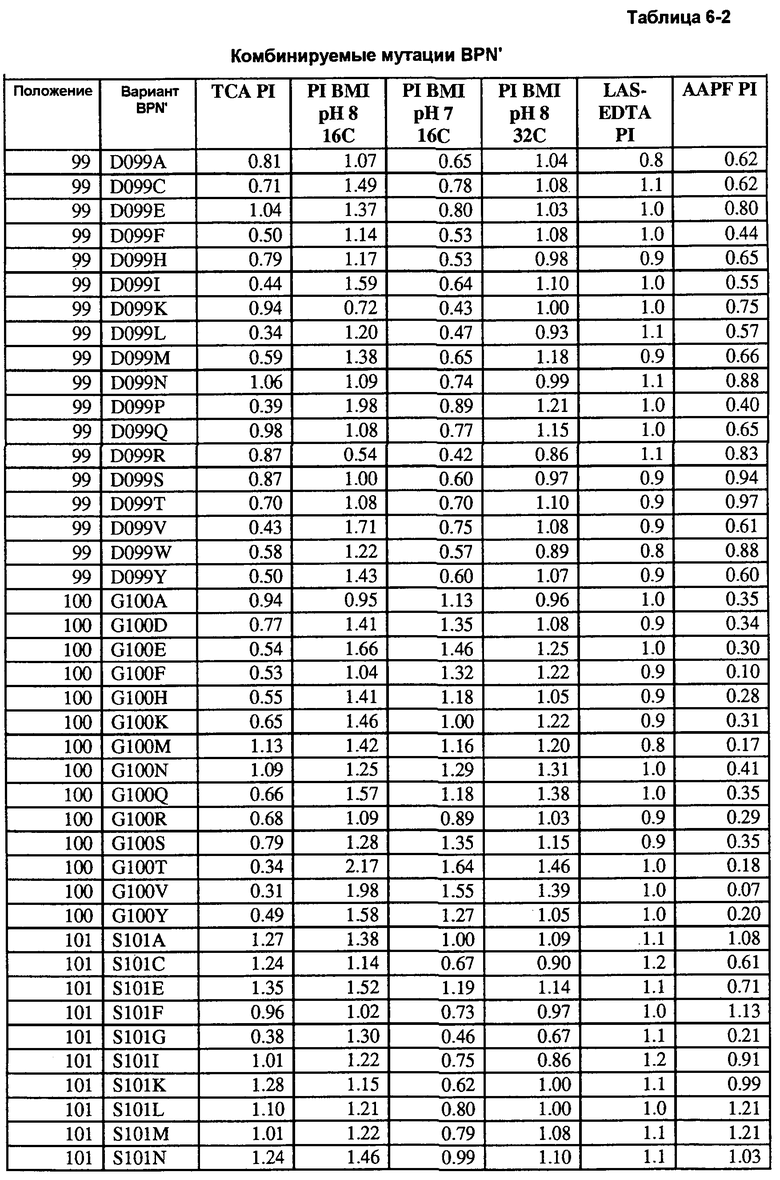

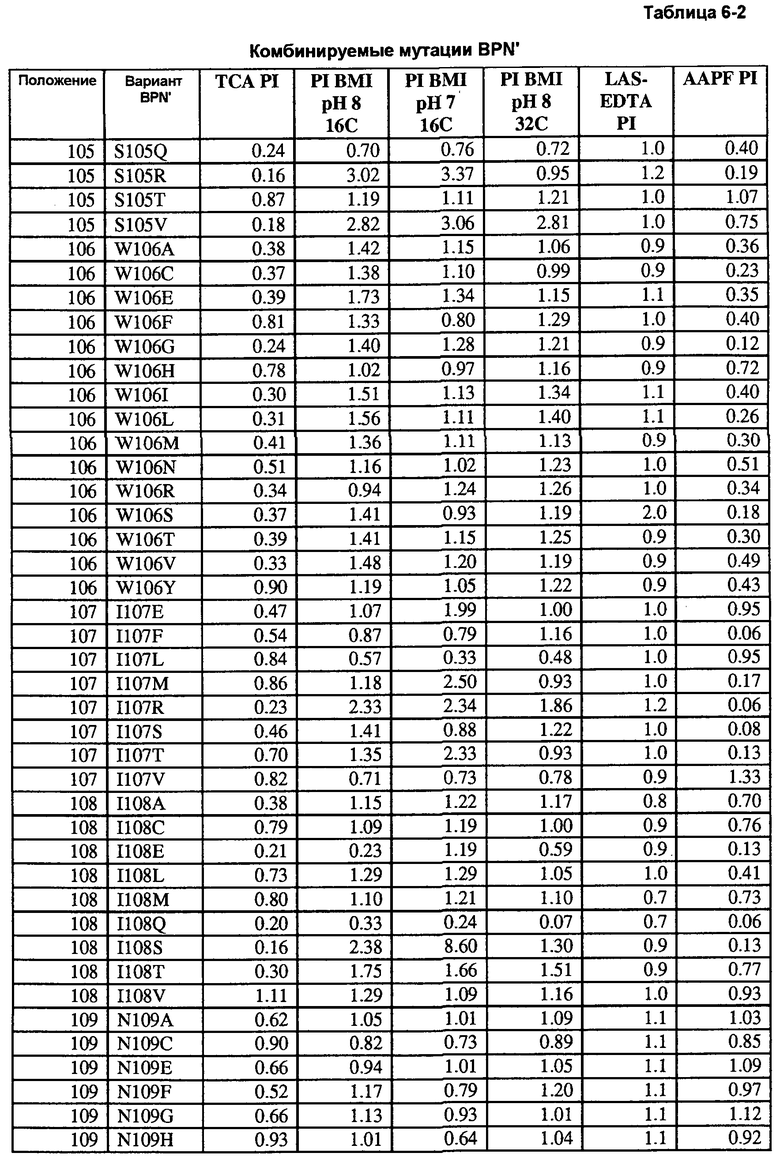




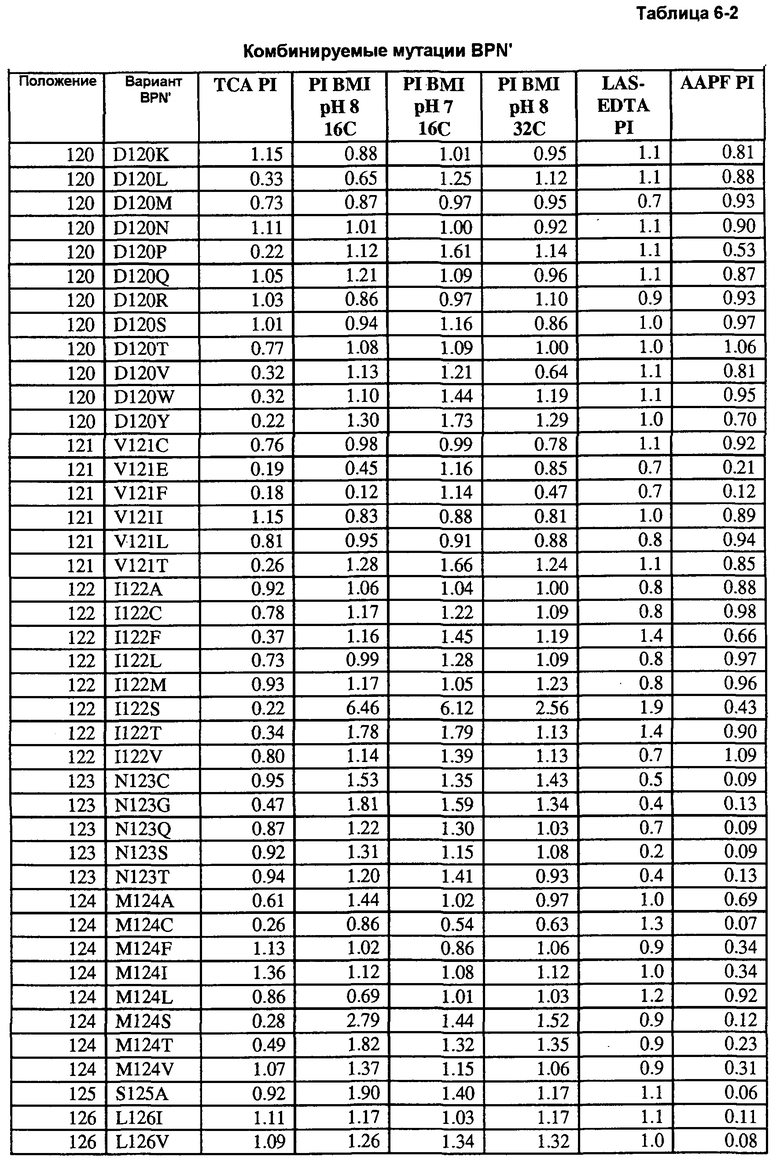








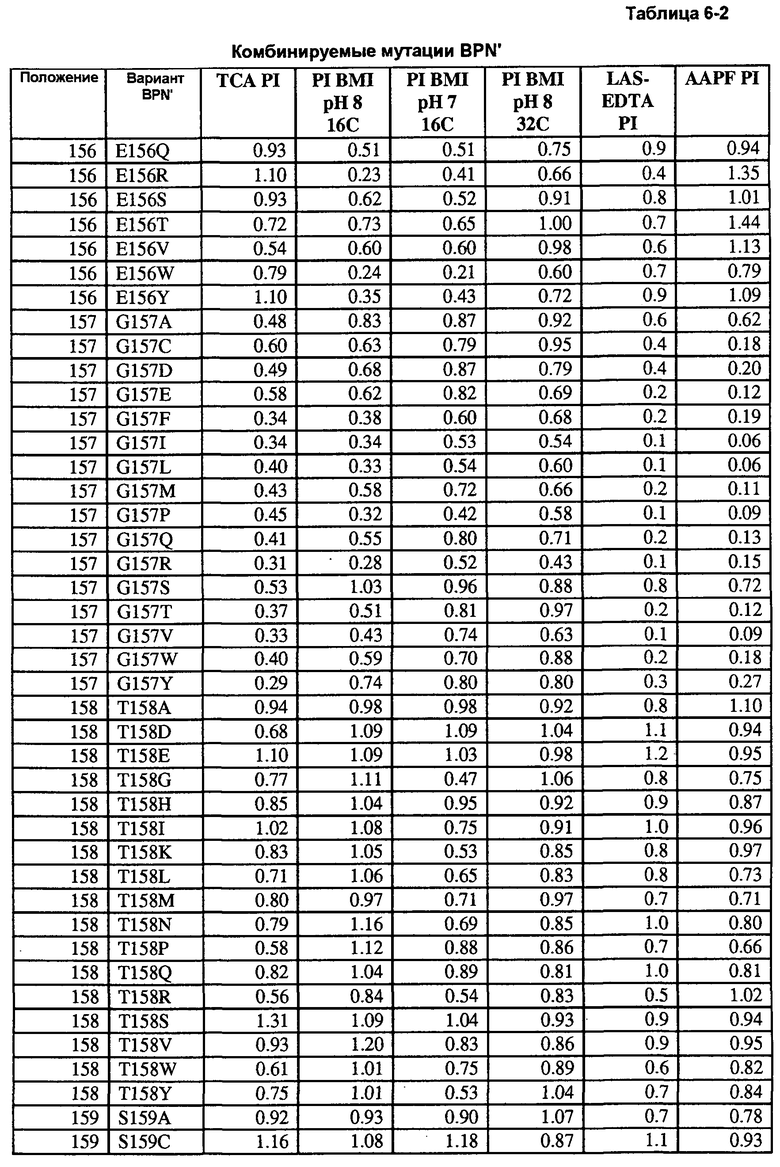




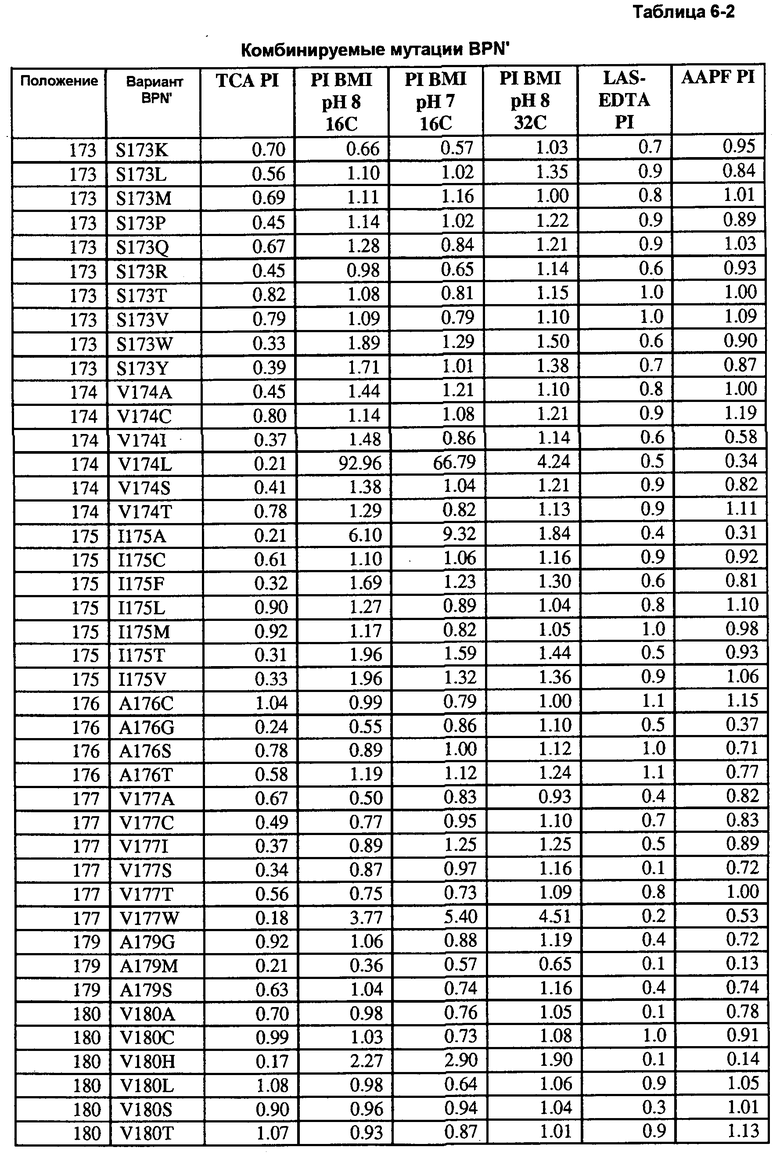











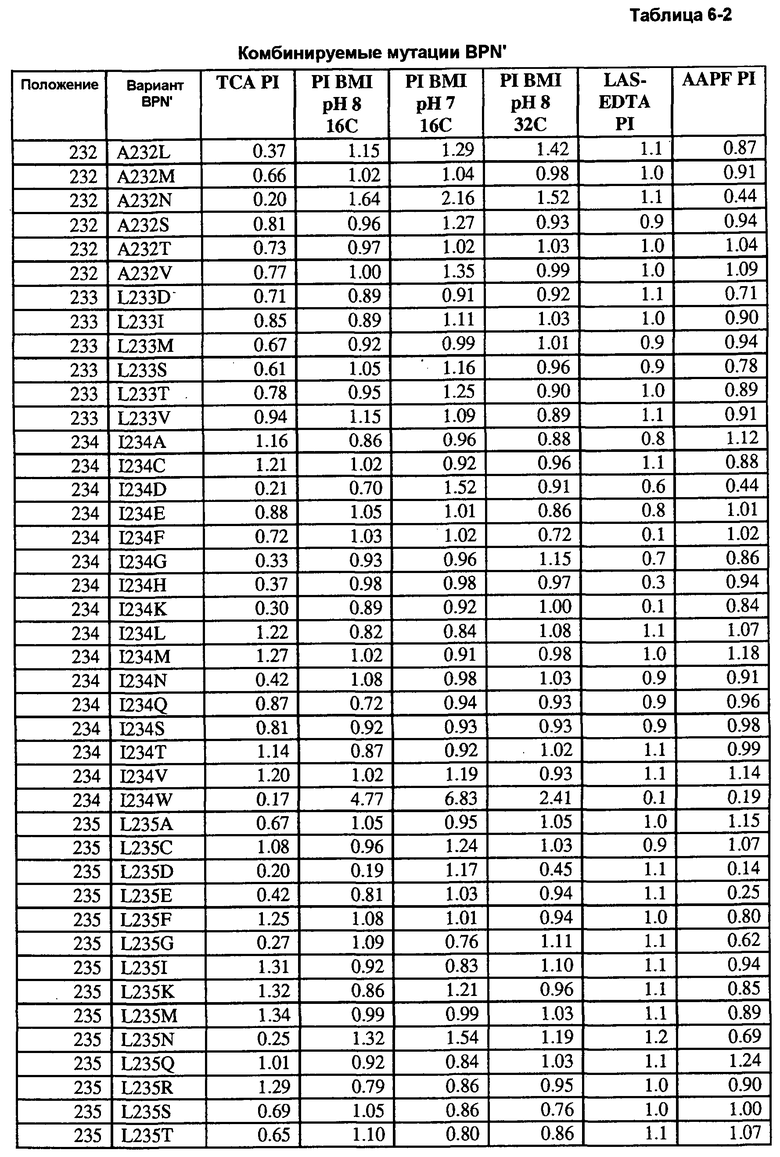





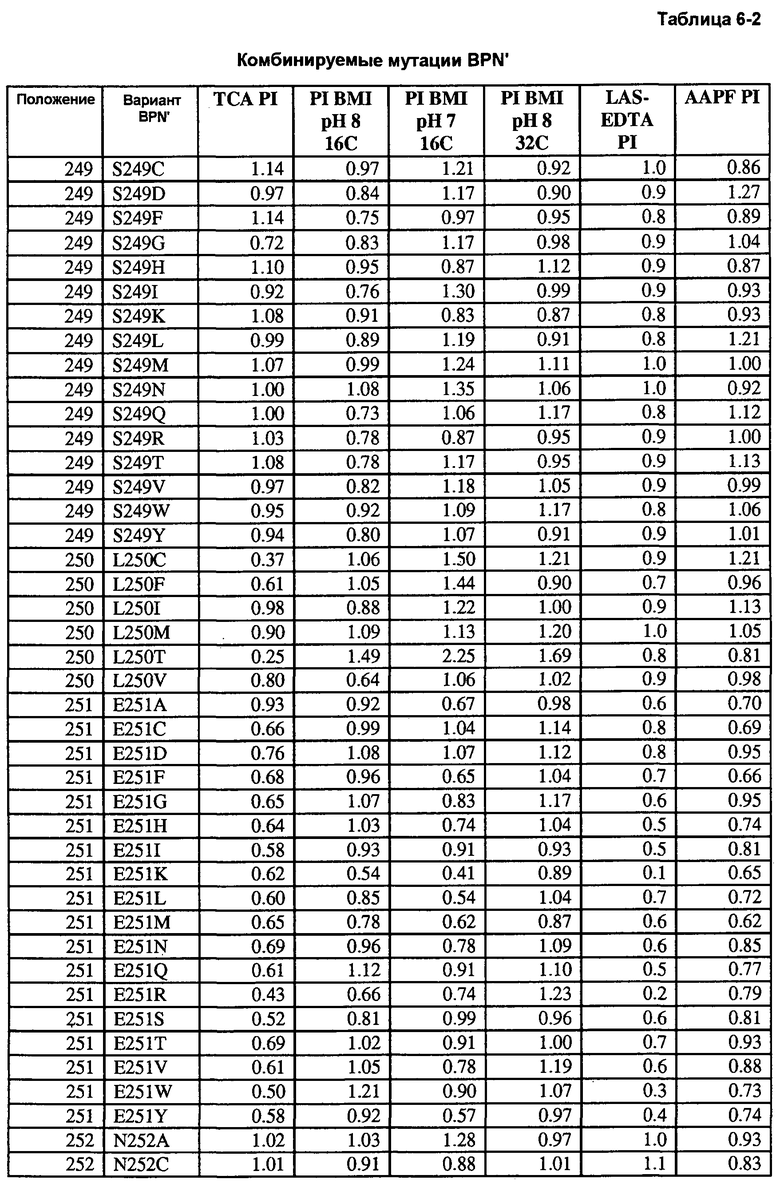




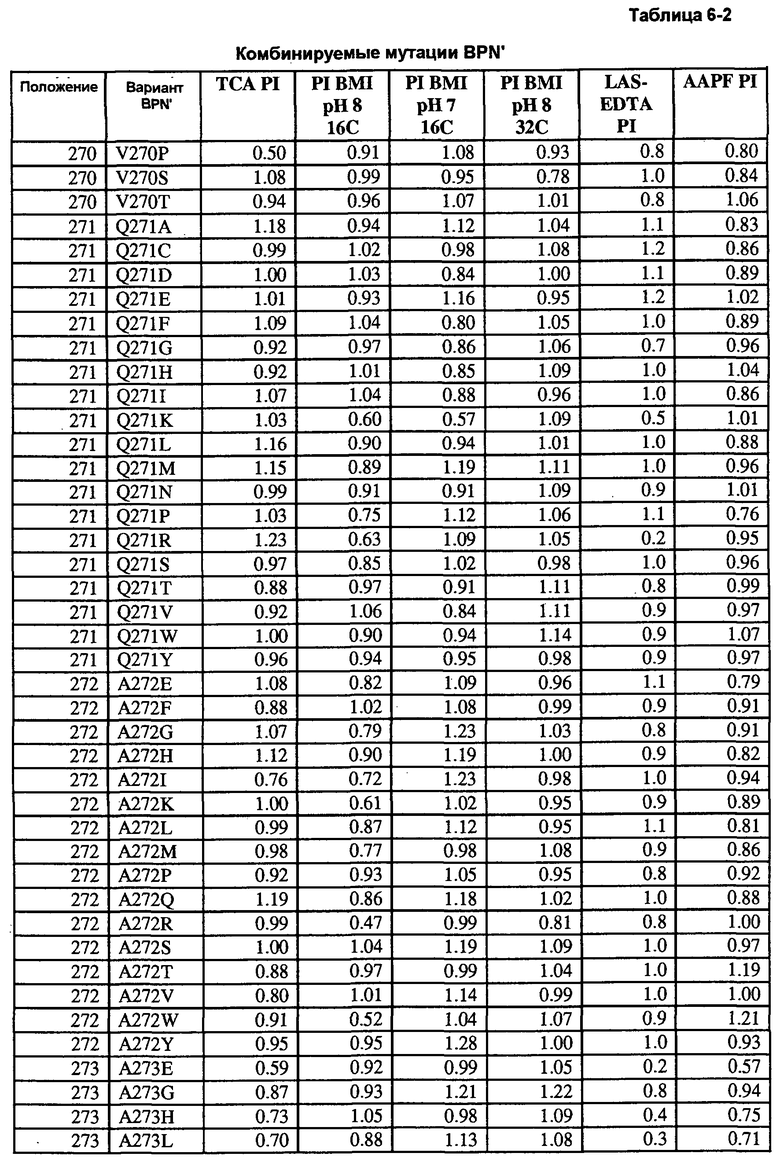































































































































































Изобретение относится к биотехнологии и представляет собой выделенный вариант субтилизина Bacillus. Изобретение относится также к выделенной нуклеиновой кислоте, кодирующей вариант субтилизина, вектору экспрессии, содержащему нуклеиновую кислоту, клетке-хозяину, способной экспрессировать вариант субтилизина, а также к чистящей композиции, содержащей вариант субтилизина и способу очистки. Изобретение позволяет получать вариант субтилизина с улучшенными моющими свойствами. 7 н. и 8 з.п. ф-лы, 17 табл., 17 пр.
1. Выделенный вариант субтилизина Bacillus, где указанный вариант субтилизина представляет собой зрелую форму, обладающую активностью субтилизина и содержащую замену по одному или более положениям, выбранную из: A1C, A1D, A1E, A1M, A1N, A1Q, A1S, Q2E, S3D, S3Q, Y6E, Y6W, S9C, S9E, S9G, S9P, S9T, Q10E, I11V, K12A, K12C, K12D, K12E, K12F, K12G, K12H, K12I, K12N, K12Q, K12S, K12T, K12V, K12W, K12Y, P14C, P14D, P14E, P14G, P14I, P14L, P14N, P14S, P14T, P14V, A15C, A15D, A15E, A15P, L16I, S18E, S18H, S18I, S18M, S18Q, S18T, S18V, S18Y, Q19C, Q19D, Q19E, G20C, G20D, G20E, G20H, T22C, T22E, T22F, T22L, T22W, T22Y, N25E, N25F, N25W, K27G, K27P, I35A, I35C, I35S, I35T, I35V, S37E, S37R, P40C, P40E, P40F, P40H, P40I, P40L, P40Q, P40R, P40W, K43A, K43C, K43D, K43E, K43G, K43L, K43M, K43R, K43S, K43W, M50I, M50K, P52K, P52R, S53E, S53K, S53R, N56D, F58C, Q59C, Q59D, Q59E, Q59N, H67P, S78C, S78D, S78F, S78I, S78K, S78L, S78N, S78Q, S78R, S78W, S78Y, I79E, P86Y, S89C, S89D, S89G, Y91I, Y91V, L96I, L96V, A98C, A98D, A98I, A98S, A98T, D99R, S101C, S101E, S101G, S101P, G102A, G102S, Q103C, Q103F, Q103G, Q103I, Q103K, Q103M, Q103N, Q103R, Q103T, Q103W, S105A, S105C, S105D, S105E, S105K, S105L, W106A, W106C, W106E, W106F, W106G, W106H, W106I, W106L, W106M, W106R, W106S, W106T, W106V, W106Y, N109C, N109F, N109H, N109L, N109P, N109Q, N109R, N109V, N109W, N109Y, E112A, E112C, E112F, E112G, E112I, E112L, E112M, E112N, E112Q, E112S, E112T, E112V, E112W, E112Y, W113N, I115N, I115R, I115T, A116D, A116K, A116R, N118C, M124I, M124L, L126I, L126V, L126W, G128A, G128S, G131P, G131R, A133C, A133D, A133E, A133F, A133I, A133L, A133P, A133R, A133W, A134D, A134E, A134G, K136E, K136H, A137C, A137F, A137H, A137K, A137L, A137M, A137R, A137W, A137Y, V139C, K141C, K141D, K141E, K141F, K141G, K141H, K141I, K141L, K141N, K141Q, K141S, K141W, K141Y, V143D, V143E, A144C, A144D, A144E, A144I, A144K, A144L, A144R, A144W, S145C, S145D, S145E, S145F, S145L, S145M, S145R, E156C, E156Y, T158D, T158E, T158V, S159C, S159D, S159Q, S162C, S162E, S162M, S162N, S162Q, G169A, K170A, P172E, P172R, A176C, S182C, S182D, S182Q, S183C, S183E, S183N, S183Q, N184C, Q185C, Q185E, S188C, S188D, S188E, S188P, P194C, P194E, Q206C, Q206D, Q206E, Q206L, Q206M, Q206W, Q206Y, N212C, N212E, K213A, K213C, K213D, K213E, K213H, K213I, K213L, K213M, K213N, K213Q, K213S, K213T, K213V, A216C, A216D, A216E, Y217C, Y217D, Y217E, Y217K, Y217L, Y217M, Y217N, Y217Q, Y217R, N218C, N218S, N218T, S224C, P225A, P225C, P225G, P225I, P225S, P225V, G229A, A230G, I234V, L235G, L235I, L235K, L235M, L235N, L235Q, L235S, L235W, L235Y, S236E, S236H, H238F, P239N, P239T, P239V, T244D, T244F, T244H, T244K, T244R, Q245C, Q245D, Q245E, S248E, N252C, N252E, T254A, T254C, T255C, T255D, T255E, K256A, K256C, K256D, K256E, K256F, K256H, K256I, K256L, K256M, K256N, K256P, K256Q, K256S, K256T, K256V, K256W, K256Y, S260C, S260D, S260E, S260P, K265A, K265C, K265E, K265H, K265L, K265M, K265N, K265Q, K265S, K265Y, N269D, Q271C, Q271D, Q271E, A272E, V008I, T022M, T022S, T0026F, T0026G, I031E, I031F, I031H, I031N, I031S, I031T, A0045E, V072A, V072C, S087D, A092S, L096M, S101Y, Q103A, Q103E, Q103L, Q103S, Q103V, Y104F, Y104W, V147A, V147E, V147S, V149A, V149C, V149D, V149E, V149F, G166S, K170E, V203C, S101Q, S101T, S101V, G166N, G166Q, G166R, S101I, S101L, S101N, G166H, G166K, G166M, G097E, V149S, V149T, G166C, G097D, V149P, где указанные положения соответствуют аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной в SEQ ID NO:2.
2. Вариант субтилизина по п. 1, где указанная замена включает в себя сочетание замен, выбранное из: S101E-Y217L, K213I-Y217Q и K213I-Y217E.
3. Вариант субтилизина по п. 1, где указанная замена включает в себя сочетание, выбранное из: S101N-K213I, K213L, K213N, K213I-Y217E, K213N-Y217Q, S101P-K213N, K213I-Y217Q, Y217Q, K213I, и S101E-Y217L.
4. Вариант субтилизина по п. 1, где указанная замена включает в себя сочетание, выбранное из: Y217L и S101E-Y217L.
5. Выделенная нуклеиновая кислота, кодирующая вариант субтилизина по п. 1.
6. Вектор экспрессии, содержащий нуклеиновую кислоту по п. 5.
7. Клетка-хозяин, способная экспрессировать вариант субтилизина по п. 1, содержащая вектор экспрессии по п. 6.
8. Чистящая композиция, содержащая вариант субтилизина по п. 1 в эффективном количестве.
9. Чистящая композиция по п. 8, где указанная чистящая композиция представляет собой стиральное средство.
10. Чистящая композиция по п. 9, где указанное стиральное средство представляет собой детергент для стирки в холодной воде, детергент с низким pH или компактный детергент.
11. Способ получения варианта субтилизина Bacillus, включающий следующие стадии:
a) трансформация клетки-хозяина вектором экспрессии, содержащим нуклеиновую кислоту, кодирующую вариант субтилизина по п. 1; и
b) культивирование трансформированной клетки-хозяина в условиях, подходящих для получения варианта субтилизина, с получением варианта субтилизина.
12. Способ по п. 11, дополнительно включающий стадию сбора полученного варианта субтилизина.
13. Способ по п. 11, где указанная клетка-хозяин представляет собой вид Bacillus.
14. Способ по п. 13, где указанный вид Bacillus представляет собой B. subtilis.
15. Способ чистки, который включает стадию приведения поверхности и/или изделия, содержащего ткань, в контакт с чистящей композицией, содержащей выделенный вариант субтилизина по любому из пп. 1-4.
| ROLLENCE ML Engineering thermostability in subtilisin BPN' by in vitro mutagenesis, Crit Rev Biotechnol | |||
| Механическая топочная решетка с наклонными частью подвижными, частью неподвижными колосниковыми элементами | 1917 |
|
SU1988A1 |
| US 0006312936 B1, 06.11.2001 | |||
| МОДИФИЦИРОВАННЫЙ СУБТИЛИЗИН, ДНК, КОДИРУЮЩАЯ МОДИФИЦИРОВАННЫЙ СУБТИЛИЗИН, ВЕКТОР ЭКСПРЕССИИ, КОДИРУЮЩИЙ ДНК, И ШТАММ КУЛЬТУРЫ КЛЕТКИ ХОЗЯИНА | 1994 |
|
RU2136756C1 |
| ВАРИАНТ СУБТИЛИЗИНА (ВАРИАНТЫ), КОДИРУЮЩАЯ ЕГО ДНК, ЭКСПРЕССИРУЮЩИЙ ВЕКТОР, ОЧИЩАЮЩАЯ КОМПОЗИЦИЯ, КОРМ ДЛЯ ЖИВОТНЫХ, КОМПОЗИЦИЯ ДЛЯ ОБРАБОТКИ ТКАНИ | 1998 |
|
RU2252958C2 |
Авторы
Даты
2016-02-10—Публикация
2009-06-03—Подача