ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА СВЯЗАННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет временных патентных заявок США №№ 60/933307, 60/933331 и 60/933312, поданных 6 июня 2007 года, включенных, таким образом, в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к эффективным способам получения белка с одним или несколькими полезными характеристиками в промышленном, потребительском или фармацевтическом применениях. В некоторых предпочтительных вариантах осуществления настоящее изобретение относится к способам производства превосходных ферментов для заданного применения посредством скрининга сокращенного набора испытываемых ферментов.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Свойства белков, функционирующих за пределами их естественного окружения, часто являются субоптимальными. Например, ферменты (например, протеазы, липазы, амилазы, целлюлазы и т.д.) часто используются для очистки материи от красителей в детергентах для стирки, которые типично состоят из сложных сочетаний активных ингредиентов. Фактически, большинство чистящих продуктов содержит систему поверхностно-активных веществ, отбеливатели, моющие компоненты, гасители мыльной пены, грязесуспендирующие компоненты, грязеотталкивающие компоненты, оптические отбеливатели, смягчители, дисперсанты, соединения, подавляющие перенос красителя, абразивы, бактерициды и отдушки, а также ферменты для очистки. Таким образом, несмотря на сложность современных детергентов, существует много красок, которые сложно удалить полностью отчасти из-за субоптимальной эффективности фермента. Несмотря на многие исследования в разработке ферментов, в данной области сохраняется потребность в способах для создания белков для конкретных применений и условий. Фактически, в данной области сохраняется потребность в способах быстрой и систематичной адаптации электростатических свойств других для оптимизации их эффективности в коммерческих приложениях. В частности, в данной области сохраняется потребность в способах создания в промышленном отношении применимых ферментов, включая, в качестве неограничивающих примеров, липазы, амилазы, кутиназы, маннаназы, оксидоредуктазы, целлюлазы, пектиназы, протеазы и другие ферменты, для того, чтобы обеспечить увеличенную активность, стабильность и растворимость в очищающих растворах. Кроме того, в данной области сохраняется потребность в способах создания рекомбинантных ферментов, которые могут быть экспрессированы при высоких уровнях из трансформированных клеток-хозяев.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к эффективным способам получения белка с одной или несколькими полезными характеристиками в промышленном, потребительском или фармацевтическом применениях. В некоторых предпочтительных вариантах осуществления настоящее изобретение относится к способам производства превосходных ферментов для заданного применения через скрининг сокращенного набора испытываемых ферментов.
Настоящее изобретение относится к способам предоставления библиотеки вариантов белков, содержащим: тестирование множества вариантов белков, охватывающих диапазон интересующего свойства (например, физического свойства) в интересующем тесте; идентификацию оптимального значения в диапазоне интересующего свойства, которое связано с благоприятным результатом в интересующем тесте; и предоставление множества вариантов белков в пределах оптимального значения диапазона интересующего свойства, посредством этого предоставляя библиотеку вариантов белков, обогащенную членами, имеющими благоприятный результат в интересующем тесте. В некоторых предпочтительных вариантах осуществления благоприятный результат соответствует значению более приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 95% от максимального значения, наблюдаемого в интересующем тесте. В дополнительных вариантах осуществления способы дополнительно содержат стадию тестирования множества вариантов белков и белка дикого типа в интересующем тесте. В других дополнительных вариантах осуществления способы содержат стадию идентификации вариантов белков, обладающих улучшенным результатом, где белок дикого типа достигает значения, равного 1,0, в интересующем тесте, и варианты белков обладают улучшенным результатом, достигая значения, превышающего 1,0. В некоторых предпочтительных вариантах осуществления показатель эффективности = эффективность теста/эффективность дикого типа. В некоторых особенно предпочтительных вариантах осуществления белок представляет собой фермент. В некоторых дополнительных предпочтительных вариантах осуществления фермент представляет собой протеазу, амилазу, целлюлазу, полиэстеразу, эстеразу, липазу, кутиназу, пектиназу или оксидазу. В некоторых дополнительных вариантах осуществления белок представляет собой антитело или гормон или цитокин (например, фактор роста). В некоторых предпочтительных вариантах осуществления протеаза представляет собой нейтральную металлопротеазу. В некоторых особенно предпочтительных вариантах осуществления родительская протеаза представляет собой зрелую форму дикого типа нейтральной металлопротеазы. В других дополнительных предпочтительных вариантах осуществления вариант получают из нейтральной металлопротеазы семейства Bacillaceae. В других вариантах осуществления вариант получен из нейтральной металлопротеазы рода Bacillus. В некоторых других вариантах осуществления протеаза представляет собой сериновую протеазу. В некоторых особенно предпочтительных вариантах осуществления родительская протеаза представляет собой зрелую форму дикого типа сериновой протеазы. В других дополнительных предпочтительных вариантах осуществления вариант получен из сериновой протеазы подотряда Micrococcineae. В дополнительных вариантах осуществления вариант получен из сериновой протеазы рода Cellulomonas. Еще в дополнительных вариантах осуществления интересующее свойство представляет собой заряд относительно фермента дикого типа. В некоторых особенно предпочтительных вариантах осуществления интересующее свойство представляет собой электрокинетический потенциал. В некоторых дополнительных предпочтительных вариантах осуществления интересующий тест содержит эффективность стирки. В некоторых особенно предпочтительных вариантах осуществления эффективность стирки содержит эффективность удаления крови-молока-чернил (КМЧ) в детергенте. В некоторых вариантах осуществления эффективность стирки тестируют в моющем составе, образованном в виде порошкообразного или жидкого детергента, который имеет pH от 5 до 12,0. Еще в дополнительных вариантах осуществления эффективность стирки тестируют в холодной воде с жидким детергентом, который имеет щелочной pH. В некоторых альтернативных вариантах осуществления интересующий тест содержит измерение связывания субстрата и/или измерение ингибирования фермента, и/или измерение уровней экспрессии, и/или измерение стабильности в детергенте, и/или измерение тепловой стабильности, и/или измерение скорости реакции, и/или измерение степени завершенности реакции, и/или измерение тепловой активности.
Настоящее изобретение также относится к способам производства улучшенного варианта укладки тестируемого белка, включающим: анализ множества вариантов укладки зондового белка, охватывающего диапазон интересующего свойства в интересующем тесте; идентификацию оптимального значения в диапазоне интересующего свойства, которое связано с благоприятным результатом в интересующем анализе; анализ белка, который является родительским для укладки тестируемого белка в интересующем анализе; и производство улучшенного варианта укладки тестируемого белка посредством введения замены аминокислоты в родительский белок из условия, чтобы улучшенный вариант находился в пределах оптимального значения диапазона интересующего свойства. В некоторых вариантах осуществления укладка тестируемого белка и укладка зондового белка различны. В некоторых дополнительных вариантах осуществления укладка тестируемого белка представляет собой сериновую протеазу и укладка зондового белка представляет собой нейтральную металлопротеазу.
Настоящее изобретение также относится к способам производства варианта фермента, специфичного к краске-субстрату, содержащим: определение электрокинетического потенциала краски-субстрата в эталонном буфере; определение электрокинетического потенциала родительского фермента в эталонном буфере; и производство варианта фермента, специфичного к краске-субстрату посредством введения замены аминокислоты в родительский фермент из условия, чтобы электрокинетический потенциал варианта фермента был ближе к электрокинетическому потенциалу краски-субстрата, чем к электрокинетическому потенциалу родительского фермента.
Настоящее изобретение дополнительно относится к способам производства композиции для очистки множества красок, содержащим: определение электрокинетического потенциала каждой из множества красок в эталонном буфере; выбор очищающего фермента, обладающего электрокинетическим потенциалом в эталонном буфере, в основном равным электрокинетическому потенциалу одной краске из множества, где выбор продолжается до тех пор, пока не будет образована пара каждой краски из множества, по меньшей мере, с одним очищающим ферментом; и изготовление композиции для очистки множества красок посредством включения очищающих ферментов из стадии b в моющий раствор с pH и удельной электропроводностью, в основном равной таковой эталонного буфера.
Настоящее изобретение относится к способам предоставления библиотеки вариантов белков, включающим: a) тестирование множества вариантов белков, охватывающего диапазон, по меньшей мере, одного интересующего свойства, по меньшей мере, в одном интересующем тесте; b) идентификацию оптимального значения в диапазоне интересующего свойства, которое связано с благоприятным результатом, по меньшей мере, в одном интересующем тесте; и c) предоставление множества вариантов белков в пределах оптимального значения диапазона интересующего свойства из условия, чтобы была предоставлена библиотека вариантов белков, обогащенная членами, обладающими благоприятным результатом, по меньшей мере, в одном интересующем тесте. В некоторых вариантах осуществления интересующее свойство представляет собой физическое свойство. В некоторых дополнительных вариантах осуществления благоприятный результат соответствует значению, большему чем, по меньшей мере, приблизительно, 50% от максимального значения, наблюдаемого в интересующем тесте. В некоторых дополнительных вариантах осуществления благоприятный результат соответствует значению, большему чем, по меньшей мере, приблизительно, 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 95% от максимального значения, наблюдаемого в интересующем тесте. В некоторых дополнительных вариантах осуществления способы дополнительно содержат стадию: d) тестирование множества вариантов белков и, по меньшей мере, одного белка дикого типа, по меньшей мере, в одном интересующем тесте. В некоторых дополнительных вариантах осуществления способы дополнительно содержат стадию идентификации вариантов белков, которые обладают улучшенным результатом, где белок дикого типа достигает величины показателя эффективности 1,0, по меньшей мере, в одном интересующем тесте и варианты белков, обладающие улучшенным результатом, достигают величины, превышающей 1,0. В некоторых вариантах осуществления белок представляет собой антитело, гормон или цитокин. В некоторых предпочтительных вариантах осуществления белок представляет собой фермент. В некоторых особенно предпочтительных вариантах осуществления фермент представляет собой протеазу, амилазу, целлюлазу, полиэстеразу, эстеразу, липазу, кутиназу, пектиназу, оксидазу или трансферазу. В некоторых особенных более предпочтительных вариантах осуществления протеаза представляет собой нейтральную металлопротеазу или сериновую протеазу. В некоторых дополнительных предпочтительных вариантах осуществления сериновая протеаза представляет собой субтилизин. В некоторых альтернативных предпочтительных вариантах осуществления нейтральная металлопротеаза получена из члена семейства Bacillaceae. Еще в некоторых дополнительных вариантах осуществления сериновая протеаза получена из члена рода Cellulomonas. В некоторых дополнительных вариантах осуществления фермент представляет собой целлюлазу, тогда как в других вариантах осуществления фермент представляет собой амилазу. В некоторых дополнительных вариантах осуществления интересующее свойство представляет собой заряд. В некоторых дополнительных вариантах осуществления заряд вариантов белков и фермента дикого типа определяют и сравнивают. В некоторых дополнительных вариантах осуществления интересующее свойство представляет собой электрокинетический потенциал. Еще в некоторых дополнительных вариантах осуществления электрокинетический потенциал вариантов белков и фермента дикого типа определяют и сравнивают. В некоторых предпочтительных вариантах осуществления электрокинетический потенциал варианта белка находится между приблизительно -40 мВ и приблизительно +40 мВ, тогда как в других вариантах осуществления электрокинетический потенциал варианта белка находится между приблизительно -20 мВ и приблизительно +20 мВ, и в других дополнительных вариантах осуществления электрокинетический потенциал варианта белка находится между приблизительно -10 мВ и приблизительно +10 мВ. В некоторых дополнительных вариантах осуществления интересующий тест включает эффективность стирки. В некоторых предпочтительных вариантах осуществления эффективность стирки включает эффективность очистки от крови-молока-чернил. В некоторых дополнительных вариантах осуществления варианты белков и белок дикого типа тестируют в моющем составе. В некоторых предпочтительных вариантах осуществления моющий состав выполнен в виде порошкообразного или жидкого детергента, обладающего pH между приблизительно 5 и приблизительно 12,0. В некоторых дополнительных предпочтительных вариантах осуществления эффективность стирки тестируют в холодной воде с жидким детергентом, обладающим основным pH. В некоторых альтернативных вариантах осуществления эффективность стирки тестируют в горячей воде с детергентом. В некоторых предпочтительных вариантах осуществления, по меньшей мере, один интересующий тест включает измерение связывания субстрата, ингибирование фермента, уровни экспрессии, стабильность в детергенте, тепловую стабильность, скорость реакции, степень завершенности реакции, тепловую активность, разжижение крахмала, разложение биомассы и/или осахаривание.
Настоящее изобретение также относится к способам производства, по меньшей мере, одного улучшенного варианта укладки тестируемого белка, включающим: a) тестирование множества вариантов укладки зондового белка, охватывающего диапазон, по меньшей мере, одного интересующего свойства, по меньшей мере, в одном интересующем анализе; b) идентификацию оптимального значения в диапазоне, по меньшей мере, одного интересующего свойства, которое связано с благоприятным результатом, по меньшей мере, в одном интересующем анализе; c) тестирование белка, который является родительским для укладки тестируемого белка, по меньшей мере, в одном интересующем анализе; и d) производство, по меньшей мере, одного улучшенного варианта укладки тестируемого белка посредством введения аминокислотной модификации в родительский белок из условия, чтобы, по меньшей мере, один улучшенный вариант находился в пределах оптимального значения диапазона, по меньшей мере, одного интересующего свойства. В некоторых дополнительных вариантах осуществления модификация содержит, по меньшей мере, одну замену аминокислоты. Еще в некоторых дополнительных вариантах осуществления укладка тестируемого белка и укладка зондового белка различаются. В некоторых вариантах осуществления интересующее свойство представляет собой электрокинетический потенциал. В некоторых других дополнительных вариантах осуществления укладка тестируемого белка содержит, по меньшей мере, одну сериновую протеазу, и укладка зондового белка содержит, по меньшей мере, одну нейтральную металлопротеазу.
Настоящее изобретение также относится к способам производства варианта фермента, специфичного к краске-субстрату, включающим: a) определение электрокинетического потенциала краски-субстрата в эталонном буфере; b) определение электрокинетического потенциала родительского фермента в эталонном буфере; и c) производство варианта фермента, специфичного к краске-субстрату посредством введения, по меньшей мере, одной аминокислотной модификации в родительский фермент из условия, чтобы электрокинетический потенциал варианта фермента, специфичного к краске-субстрату, был ближе к электрокинетическому потенциалу краски-субстрата, чем к электрокинетическому потенциалу родительского фермента. В некоторых вариантах осуществления модификация включает, по меньшей мере, одну замену аминокислоты, делецию и/или вставку. В некоторых альтернативных вариантах осуществления модификация включает химическую модификацию родительского фермента. В некоторых дополнительных вариантах осуществления вариант фермента, специфичный к краске-субстрату, положительно заряжен и является эндотермическим, и краска-субстрат отрицательно заряжена. В некоторых альтернативных вариантах осуществления вариант фермента, специфичного к краске, отрицательно заряжен и является экзотермическим, и краска-субстрат отрицательно заряжена. В некоторых дополнительных вариантах осуществления вариант фермента, специфичного к краске, положительно заряжен и является экзотермическим, и краска-субстрат положительно заряжена. В других дополнительных вариантах осуществления вариант фермента, специфичного к краске, отрицательно заряжен и является эндотермическим, и краска-субстрат положительно заряжена.
Настоящее изобретение также относится к способам производства композиции для очистки множества красок, включающим: a) определение электрокинетического потенциала каждой краски из множества в эталонном буфере; b) отбор очищающего фермента, обладающего электрокинетическим потенциалом в эталонном буфере, который в основном равен электрокинетическому потенциалу, по меньшей мере, одной краски из множества; и c) производство композиции для очистки множества красок, где композиция содержит, по меньшей мере, один очищающий фермент, выбранный на стадии b). В некоторых дополнительных вариантах осуществления композиция содержит моющий раствор с pH и удельной электропроводностью, которые в основном равны таковым эталонного буфера. В некоторых дополнительных вариантах осуществления стадия отбора устанавливает более чем один очищающий фермент. В некоторых других дополнительных вариантах осуществления композиция содержит, по меньшей мере, два очищающих фермента и где, по меньшей мере, два очищающих фермента обладают электрокинетическими потенциалами, которые соответствуют электрокинетическим потенциалам, по меньшей мере, двух красок из множества.
Настоящее изобретение также относится к композициям для очистки множества красок, произведенным с использованием способов, изложенных в настоящем документе. В некоторых предпочтительных вариантах осуществления композиции содержат, по меньшей мере, один очищающий фермент. В некоторых альтернативных вариантах осуществления, по меньшей мере, один очищающий фермент представляет собой вариант белка. В некоторых дополнительных вариантах осуществления вариант белка более отрицательно заряжен, чем белок-предшественник дикого типа, используемый для производства варианта белка, тогда как в некоторых альтернативных вариантах осуществления вариант белка более положительно заряжен, чем белок-предшественник дикого типа, используемый для производства варианта белка. В некоторых дополнительных вариантах осуществления вариант белка более отрицательно заряжен, чем белок-предшественник дикого типа, используемый для производства варианта белка для увеличения стабильности в детергентах, содержащих анионные поверхностно-активные вещества.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фиг.1 показывает относительную активность на микрообразцах с кровью-молоком-чернилами (КМЧ) (нормализована по отношению к образецу с лучшей эффективностью) для вариантов ASP как функцию от изменения суммарного заряда по отношению к ASP дикого типа, которую измеряли в жидком детергенте AATCC (залитые треугольники) и буфере (незалитые круги) с совпадающим pH и удельной электропроводностью (5 мМ HEPES pH 8,0, 2,5 мМ NaCl).
Фиг.2 показывает относительную активность кровь-молоко-чернила (КМЧ) на микрообразцах (нормализована по отношению к образцу с оптимальной эффективностью) для комбинаторной библиотеки заряда ASP как функцию изменения суммарного заряда по отношению к ASP дикого типа, которую измеряли в жидком детергенте AATCC (залитые треугольники).
Фиг.3 показывает относительную активность КМЧ на микрообразцах (нормализована по отношению к образцу с оптимальной эффективностью) для вариантов ASP как функцию изменения заряда по отношению к ASP дикого типа, которую измеряли в 5 мМ HEPES pH 8,0 с переменной концентрацией NaCl: 2,5 мМ (незалитые круги), 16 мМ (серые круги) и 100 мМ (черные круги).
Фиг.4 показывает относительную активность кровь-молоко-чернила (КМЧ) на микрообразцах (нормализована по отношению к родительской молекуле) для вариантов из комбинаторной зарядовой библиотеки FNA (график A) и GG36 (график B) (залитые значки) как функцию изменения суммарного заряда по отношению к родительской FNA или GG36 дикого типа (незалитые значки), которую измеряли в североамериканских условиях для жидкостей для стирки.
Фиг.5 показывает относительную активность кровь-молоко-чернила (КМЧ) на микрообразцах (нормализованную по отношению к родительской молекуле) для вариантов комбинаторной зарядовой библиотеки FNA (график A) и GG36 (график B) (залитые значки) как функцию изменения суммарного заряда по отношению к родительской FNA или GG36 дикого типа (незалитые значки), которую измеряли в западноевропейских условиях для жидкостей для стирки.
Фиг.6 показывает относительную активность кровь-молоко-чернила (КМЧ) на микрообразцах (нормализованную по отношению к родительской молекуле) для вариантов комбинаторной зарядовой библиотеки FNA (график A) и GG36 (график B) (залитые значки) как функцию изменения суммарного заряда по отношению к родительской FNA или GG36 дикого типа (незалитые значки), которую измеряли в японских условиях для порошков для стирки.
Фиг.7 показывает относительную активность к печеным яйцам на микрообразцах (нормализованную по отношению к родительской молекуле) для вариантов комбинаторной зарядовой библиотеки FNA (график A) и GG36 (график B) (залитые значки) как функцию изменения суммарного заряда по отношению к родительской FNA или GG36 дикого типа (незалитые значки), которую измеряли в западноевропейских условиях для автоматической мойки посуды.
Фиг.8 показывает активность на микрообразцах с рисовым крахмалом (нормализованную по отношению к родителю) для вариантов комбинаторной зарядовой библиотеки S242Q (незалитые значки) как функцию изменения суммарного заряда по отношению к родителю (залитые значки), которую измеряли в североамериканских условиях стирки.
Фиг.9 показывает активность к рисовому крахмалу на микрообразцах (нормализованную по отношению к родителю) для вариантов комбинаторной зарядовой библиотеки TS23t (незалитые значки) как функцию изменения суммарного заряда по отношению к родителю (залитые значки), которую измеряли в западноевропейских условиях стирки.
Фиг.10 показывает относительную специфическую активность гидролиза BODIPY крахмала (нормализованную по отношению к родителю) для вариантов комбинаторной зарядовой библиотеки S242Q (незалитые значки) как функцию изменения суммарного заряда по отношению к родителю (залитые значки).
Фиг.11 показывает конечную вязкость AmyS в рамках первой шкалы зарядов как функцию изменения суммарного заряда по отношению к AmyS дикого типа.
Фиг.12 по первой оси показывает активность КМЧ на микрообразцах для вариантов ASP как функцию электрокинетического потенциала, которую измеряли в буфере (5 мМ HEPES pH 8,0, 2,5 мМ NaCl). Вторая ось отображает активность КМЧ на микрообразцах для вариантов ASP (нормализованную к пиковому значению аппроксимации нормального распределения, сплошная линия) как функцию z-оценки. Электрокинетический потенциал краски-субстрата равен -8,97 мВ.
Фиг.13 показывает активность КМЧ на микрообразцах для вариантов ASP как функцию доли связанной ASP, которую измеряли в 5 мМ HEPES pH 8,0 с переменной концентрацией NaCl: 2,5 мМ NaCl (незалитые), 16 мМ NaCl (серые) и 100 мМ NaCl (черные).
Фиг.14 показывает долю связанной ASP как функцию изменения суммарного заряда по отношению к ASP дикого типа, которую измеряли в детергенте AATCC HDL (треугольники) или в 5 мМ HEPES pH 8,0 с переменной концентрацией NaCl: 2,5 мМ NaCl (незалитые круги), 16 мМ NaCl (серые круги) и 100 мМ NaCl (черные круги).
Фиг.15 показывает частичное связывание зарядовых комбинаторных вариантов ASP (незалитые значки) как функцию изменения суммарного заряда по отношению к родителю ASP-R14I (залитые значки), которое измеряли в 5 мМ HEPES pH 8,0 с 2,5 мМ NaCl.
Фиг.16 показывает частичное связывание ASP как функцию электрокинетического потенциала, измеренного в 5 мМ HEPES pH 8,0 с 2,5 мМ NaCl.
Фиг.17 показывает уровни экспрессии вариантов ASP в Bacillus subtilis как функцию изменения суммарного заряда по отношению к ASP дикого типа.
Фиг.18 показывает на первой оси уровни экспрессии вариантов ASP (залитые круги) и NprE (незалитые круги) в Bacillus subtilis как функцию электрокинетического потенциала, измеренного в эталонном буфере 5 мМ HEPES pH 8,0 с 2,5 мМ NaCl. Вторая ось обозначает уровни экспрессии вариантов ASP (нормализованные к пиковому значению аппроксимации нормального распределения, сплошная линия) как функция z-оценки.
Фиг.19 показывает стабильность вариантов ASP в присутствии LAS как функцию изменения суммарного заряда по отношению к ASP дикого типа.
Фиг.20 показывает стабильность вариантов FNA в присутствии LAS/ЭДТА как функцию изменения суммарного заряда по отношению к родительскому FNA.
Фиг.21 показывает стабильность вариантов TS23t в присутствии LAS/ЭДТА как функцию изменения суммарного заряда по отношению к родительскому TS23t-7mut.
Фиг.22 показывает термостабильность вариантов ASP как функцию изменения суммарного заряда по отношению к ASP дикого типа.
Фиг.23 показывает тепловую стабильность AmyS в рамках первой шкалы зарядов как функцию изменения заряда по отношению к AmyS дикого типа.
Фиг.24 показывает тепловую активность ASP (график A) и NprE (график B) как функцию изменения суммарного заряда по отношению к ASP и NprE дикого типа соответственно при различных температурах, 40°C, 50°C и 60°C. Тепловая активность показана как коэффициент для активности при 30°C (активность при повышенной температуре, деленная на активность при 30°C).
Фиг.25 показывает тепловую активность ASP (график A) и NprE (график B) как функцию электрокинетического потенциала при различных температурах, 40°C, 50°C и 60°C. Тепловая активность показана как коэффициент для активности при 30°C (активность при повышенной температуре, деленная на активность при 30°C).
Фиг.26 показывает тепловую стабильность вариантов ASP со шкалой зарядов при 30°C (незалитые круги) и 40°C (залитые круги) в 5 мМ HEPES pH 8,0 с 2,5 мМ NaCl.
На фиг.27 предоставлена матрица изменения заряда, показывающая изменение заряда для замен аминокислотных остатков при pH 8,6. С помощью этой матрицы можно легко определить изменение суммарного заряда варианта фермента по сравнению с родительским ферментом.
На фиг.28 предоставлена матрица изменения способности образовывать водородные связи, показывающая изменение способности образовывать водородные связи для замен аминокислотных остатков. С помощью этой матрицы можно легко определить изменение способности образовывать водородные связи варианта фермента по сравнению с родительским ферментом.
На фиг.29 предоставлена матрица изменения гидрофобности Кайта-Дулиттла, показывающая изменение гидрофобности для замен аминокислотных остатков. С помощью этой матрицы можно легко определить суммарное изменение гидрофобности варианта фермента по сравнению с родительским ферментом.
На фиг.30 предоставлена матрица изменения гидрофобности Эйзенберга, показывающая изменение гидрофобности для замен аминокислотных остатков. С помощью этой матрицы легко определить изменение суммарной гидрофобности варианта фермента по сравнению с родительским ферментом.
На фиг.31 предоставлена активность очистки от рисового крахмала AmyS в рамках первой шкалы зарядов как функция pH. pH 3,0-4,25 представляет собой 200 мМ формиат натрия +0,01% Tween-80. pH 4,25-5,5 представляет собой 200 мМ ацетат натрия +0,01% Tween-80. Данные совпадают с кривыми титрования, каждая с одним значением pKa.
На фиг.32 предоставлены значения pKa, определенные на фиг.31, построенной в зависимости от изменения заряда по отношению к AmyS дикого типа.
ОБЩЕЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к эффективным способам получения белка с одним или несколькими полезными характеристиками в промышленном, потребительском или фармацевтическом применениях. В некоторых предпочтительных вариантах осуществления, настоящее изобретение относится к способам производства превосходных ферментов для заданного применения посредством скрининга сокращенного набора испытываемых ферментов.
Протеаза субтилизин является основным ферментом, используемым в детергентах для стирки и возможно наиболее широко используемым ферментом в мире. Почти двадцать лет назад было отмечено, что поверхностные электростатические эффекты могут модулировать каталитическую активность субтилизина (смотрите, например, Russell and Fersht, Nature 328:496-500 [1987]). Позже было замечено, что мутации, которые касаются изменения суммарного заряда субтилизина, обладают сильным действием на эффективность стирки в детергентах (смотрите, например, EP патент № 0479870 B1, включенный в настоящий документ в качестве ссылки). Предполагалось, что положительное воздействие является результатом сдвига pI (изоэлектрическая точка) субтилизина в сторону pH моющего раствора. Однако последняя работа показала, что это заключение не всегда применимо (смотрите, например, патент США № 6673590 B1, включенный в настоящий документ в качестве ссылки). Как показано в этом патенте, действие зарядовых мутаций на субтилизин существенно зависит от концентрации детергента, причем мутации, снижающие pI родительского субтилизина, предоставляют фермент, который более эффективен при низкой концентрации детергента, и мутации, повышающие pI, предоставляют фермент, который более эффективен при высокой концентрации детергента. Это очень полезно, потому что концентрация детергента в моющих растворах значительно меняется в мировом масштабе. Таким образом, специалистам в данной области стало очевидно, что существует оптимальная pI для эффективности стирки субтилизина, которая зависит от pH и концентрации детергента в моющем растворе. Были описаны дальнейшие попытки к улучшению активности субтилизина в детергентах для стирки (смотрите патентную заявку США № 2005/0221461, включенную в настоящий документ в качестве ссылки). К удивлению, было обнаружено, что варианты субтилизина, обладающие таким же суммарным электростатическим зарядом, как у родительского субтилизина, обладают увеличенной эффективностью стирки как в условиях мытья с низкой, так и с высокой концентрацией детергента. Таким образом, электростатические свойства белков (например, ферментов) обладают значительным действием на их функции.
Ранее попытки разработать превосходные белки были сосредоточены на минимизации связывания фермента с поверхностями. Например, некоторые способы касались изменения последовательности субтилизина для получения вариантов фермента со сниженной адсорбцией на нерастворимых основах (смотрите, например, WO 95/07991). В другом подходе pI субтилизина изменяли для того, чтобы получить варианты фермента с суммарным зарядом, равным нулю при определенном pH (смотрите, например, WO 91/00345). Однако в процессе разработки по настоящему изобретению было определено, что эти подходы не всегда успешны. Как описано в настоящем документе, поверхностные свойства ферментов, включая связывающие свойства, как правило, вместо непрерывного изменения обладают оптимумами как функцией заряда в поверхностном заряде или гидрофобности. Даже для ферментов, которые обычно достаточно активны, поверхностные свойства могут приводить к тому, что реакция в целом будет проходить значительно ниже при некоторых условиях и с некоторыми субстратами, чем при других условиях и/или с другими субстратами. В некоторых вариантах осуществления настоящего изобретения поверхностные свойства фермента модифицированы посредством изменения свойства одной или нескольких аминокислот на поверхности фермента. Когда эти изменения выполнены в сайтах на поверхности, которые не взаимодействуют с любыми другими аминокислотами и не необходимы для функции фермента, свойства белка предсказывают с использованием способов по настоящему изобретению, исходя из свойств аминокислот, замененных в этих позициях. В некоторых вариантах осуществления эти сайты легко определяют исходя из структурных данных, тогда как в других вариантах осуществления применение находят выравнивания гомологичных последовательностей, данные библиотеки оценки сайтов и/или любое их сочетание. В дополнительных вариантах осуществления матрицы замен аминокислот находят применение для направления замены аминокислоты(-кислот) и для установления тех физических свойств белка, которые коррелируют со свойствами незамененных аминокислот.
Настоящее изобретение относится к эффективным способам получения белка с одной или несколькими полезным характеристиками для промышленного, потребительского или фармацевтического применения. В частности, настоящее изобретение относится к способам производства превосходных ферментов для заданного применения посредством скрининга сокращенного набора испытываемых ферментов. Несмотря на то что в настоящем документе дано описание в отношении образцовой сериновой протеазы (например, ASP) и образцовой металлопротеазы (например, NprE), композиции и способы по настоящему изобретению не ограничены протеазами. Фактически, настоящее изобретение находит применение для повышения эффективности различных классов ферментов, а также протеаз (например, амилаз, целлюлаз, оксидаз, оксидоредуктаз, кутиназ, маннаназ, пектиназ, амилаз, липаз и т.п.). Фактически, не планируется, что настоящее изобретение ограничено любым конкретным ферментом или классом ферментов. Кроме того, настоящее изобретение находит применение при оптимизации свойств неферментативных белков и производстве требуемых превосходных белков.
Если не указано иначе, осуществление настоящего изобретения на практике касается общепринятых способов, общеупотребимых в молекулярной биологии, микробиологии и рекомбинации ДНК, которые известны специалистам в данной области. Такие способы известны специалистам в данной области и описаны во многих руководствах и справочных изданиях, хорошо известных специалистам в данной области. Все патенты, патентные заявки, статьи и публикации, отмеченные в настоящем документе как выше, так и ниже, настоящим явно включены в настоящий документ в качестве ссылки.
Пока в настоящем документе не установлено обратное все технические и научные термины, используемые в настоящем документе, имеют такое же значение, которое обычно подразумевается специалистом в той области, к которой принадлежит это изобретение. Хотя любые способы и материалы, сходные или эквивалентные материалам и способам, описываемым в настоящем документе, находят применение при осуществлении настоящего изобретения на практике, некоторые из предпочтительных способов и материалов описаны в настоящем документе. Таким образом, термины, определенные непосредственно ниже, более полно описаны посредством ссылки на Описание в целом.
Также, как используется в настоящем документе, упоминание в единственном числе включает множественное число до тех пор, пока в контексте явно не будет указано обратное. Числовые диапазоны включают числа, определяющие диапазон. Если не указано иначе, нуклеиновые кислоты записаны слева направо в направлении от 5' к 3'; аминокислотные последовательности записаны слева направо в направлении от амино- к карбоксиконцу, соответственно. Следует понимать, что это изобретение не ограничено конкретными описанными способами, протоколами и реактивами, так как они могут меняться в зависимости от контекста, в котором они используются специалистами в данной области.
Предполагается, что каждая максимальная числовая граница, заданная на всем протяжении этого описания, включает каждую нижнюю числовую границу, как если бы такие нижние числовые границы были бы явно указаны в настоящем документе. Каждая минимальная числовая граница, заданная на всем протяжении этого описания, включает каждую верхнюю числовую границу, как если бы такая верхняя числовая граница была явно указана в настоящем документе. Каждый числовой диапазон, заданный на всем протяжении этого описания, будет включать в себя любой более узкий числовой диапазон, который входит в такой более широкий числовой диапазон, как если бы все такие более узкие числовые диапазоны были явно указаны в настоящем документе.
Кроме того, предоставленные в настоящем документе заголовки не являются ограничениями различных аспектов или вариантов осуществления изобретения, которые можно получить, обратившись к описанию в целом. Таким образом, термины, определенные непосредственно ниже, более полно определяются посредством обращения к описанию в целом. Тем не менее для того, чтобы облегчить понимание изобретения, определенные термины определены ниже.
Определения
Как используется в настоящем документе, термины «протеаза» и «протеолитическая активность» относятся к белку или пептиду, проявляющему способность к гидролизу пептидов или субстратов, обладающих пептидными связями. Для измерения протеолитической активности существует множество хорошо известных процедур (смотрите, например, Kalisz, «Microbial Peptidases» In: Fiechter (ed.), Advances in Biochemical Engineering/Biotechnology, [1988]). Например, протеолитическую активность можно установить с помощью сравнительных тестов, которые анализируют способность соответствующей протеазы к гидролизу коммерческого субстрата. Образцовые субстраты, пригодные для такого анализа протеазы или протеолитической активности, включают в качестве неограничивающих примеров диметил казеин (Sigma C-9801), бычий коллаген (Sigma C-9879), бычий эластин (Sigma E-1625) и бычий кератин (ICN Biomedical 902111). Колориметрические тесты, использующие эти субстраты, хорошо известны в данной области (смотрите, например, WO 99/34011; и патент США № 6376450, которые включены в настоящий документ в качестве ссылки). Анализ pNA (смотрите, например, Del Mar et al., Anal Biochem, 99:316-320 [1979]) также находит применение при определении концентрации активного фермента во фракциях, собранных в процессе градиентного элюирования. Этот анализ измеряет скорость, с которой высвобождается p-нитроанилин, когда фермент гидролизует растворимый синтетический субстрат, сукцинил-аланин-аланин-пролин-фенилаланин-p-нитроанилид (sAAPF-pNA). Скорость развития желтой окраски из реакции гидролиза измеряют на спектрофотометре при 410 нм, и она пропорциональна концентрации активного фермента. Кроме того, измерение оптической плотности при 280 нм можно использовать для определения общей концентрации белка. Отношение активного фермента к общему белку дает чистоту фермента.
Как используется в настоящем документе, термины «протеаза ASP», «протеаза Asp» и «Asp» указывают на сериновые протеазы, описываемые в настоящем документе и описанные в патенте США с серийным номером заявки 10/576331, включенной в настоящий документ в качестве ссылки. В некоторых предпочтительных вариантах осуществления, протеаза Asp представляет собой протеазу, созданную в настоящем документе как протеаза 69B4, полученную из штамма 69B4 Cellulomonas. Таким образом, в предпочтительных вариантах осуществления термин «протеаза 69B4» относится к встречающейся в природе зрелой протеазе, полученной из штамма 69B4 Cellulomonas (DSM 16035), обладающей в основном идентичной аминокислотной последовательностью, которая предоставлена в SEQ ID NO:8. В альтернативных вариантах осуществления настоящее изобретение относится к фрагментам протеазы ASP.
Термин «гомологи протеазы Cellulomonas» относится к встречающимся в природе протеазам, обладающим аминокислотными последовательностями в значительной степени сходными со зрелой протеазой, полученной из штамма 69B4 Cellulomonas, или полинуклеотидным последовательностям, которые кодируют такие встречающиеся в природе протеазы, и эти протеазы сохраняют функциональные характеристики сериновой протеазы, кодируемой такими нуклеиновыми кислотами. В некоторых вариантах осуществления эти гомологи протеазы обозначают как «целлюломонадины»
Как используется в настоящем документе, термины «вариант ASP», «вариант протеазы ASP» и «вариант протеазы 69B» используются для упоминания о протеазах, которые сходны с ASP дикого типа, в частности их функцией, но обладают мутациями в их аминокислотных последовательностях, которые делают их отличающимися в последовательности от протеазы дикого типа.
Как используется в настоящем документе, «Cellulomonas ssp.» относится ко всем видам рода «Cellulomonas», которые представляют собой грамположительные бактерии, классифицированные в качестве членов семейства Cellulomonadaceae, подотряда Micrococcineae, отряда Actinomycetales, класса Actinobacteria. Установлено, что продолжается таксономическая реорганизация рода Cellulomonas. Таким образом, предполагается, что род включает виды, которые были переклассифицированы.
Как используется в настоящем документе, «Streptomyces ssp.» относится ко всем видам рода «Streptomyces», которые представляют собой грамположительные бактерии, классифицированные в качестве членов семейства Streptomycetaceae, подотряда Streptomycineae, отряда Actinomycetales, класса Actinobacteria. Установлено, что продолжается таксономическая реорганизация рода Streptomyces. Таким образом, предполагается, что род включает виды, которые были переклассифицированы.
Как используется в настоящем документе, «род Bacillus» включает все виды рода «Bacillus», которые известны специалистам в данной области, включая в качестве неограничивающих примеров B. subtilis, B. licheniformis, B. lentus, B. brevis, B. stearothermophilus, B. alkalophilus, B. amyloliquefaciens, B. clausii, B. halodurans, B. megaterium, B. coagulans, B. circulans, B. lautus и B. thuringiensis. Установлено, что продолжается таксономическая реорганизация рода Bacillus. Таким образом, предполагается, что род включает виды, которые были реорганизованы, включая в качестве неограничивающих примеров такие организмы, как B. stearothermophilus, который теперь называется «Geobacillus stearothermophilus». Образование эндоспор, устойчивых к присутствию кислорода, считается определяющим признаком рода Bacillus, хотя эта характеристика также применима к недавно предложенным Alicyclobacillus, Amphibacillus, Aneurinibacillus, Anoxybacillus, Brevibacillus, Filobacillus, Gracilibacillus, Halobacillus, Paenibacillus, Salibacillus, Thermobacillus, Ureibacillus и Virgibacillus.
Термины «полинуклеотид» и «нуклеиновая кислота», используемые в настоящем документе взаимозаменяемо, указывают на полимерную форму нуклеотидов любой длины, или рибонуклеотиды, или дезоксирибонуклеотиды. Эти термины включают в качестве неограничивающих примеров одно-, двух- или трехцепочечные ДНК, геномную ДНК, кДНК, РНК, ДНК-РНК гибриды или полимер, содержащий пуриновые и пиримидиновые основания, или другие естественные, химически, биохимически модифицированные, неестественные нуклеотидные основания или их производные. Перечисленное ниже представляет собой неограничивающие примеры полинуклеотидов: гены, фрагменты генов, фрагменты хромосом, EST, экзоны, интроны, мРНК, тРНК, рРНК, рибозимы, кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенные ДНК с любой последовательностью, выделенные РНК с любой последовательностью, зонды из нуклеиновых кислот и праймеры. В некоторых вариантах осуществления полинуклеотиды содержат модифицированные нуклеотиды, такие как метилированные нуклеотиды и нуклеотидные аналоги, урацил, другие сахара и связывающие группы, такие как фторрибоза и тиоат, и ветвящиеся нуклеотиды. В альтернативных вариантах осуществления последовательность нуклеотидов прерывается ненуклеотидными компонентами.
Как используется в настоящем документе, термины «ДНК конструкция» и «трансформирующая ДНК» используют взаимозаменяемо, чтобы указать на ДНК, используемую для введения последовательности в клетку-хозяина или организм. ДНК может быть создана in vitro с помощью ПЦР или любого другого пригодного способа(-ов), известных для этих целей в данной области. В особенно предпочтительных вариантах осуществления ДНК конструкция содержит интересующую последовательность (например, вводимую последовательность). В некоторых вариантах осуществления последовательность функционально связана с дополнительными элементами, такими как управляющие элементы (например, промоторы и т.д.). ДНК конструкция может дополнительно содержать селективный маркер. Она может дополнительно содержать вводимую последовательность, фланкированную гомологичными фрагментами. В дополнительном варианте осуществления трансформирующая ДНК содержит другие добавленные на концы негомологичные последовательности (например, спейсерные последовательности или фланкирующие последовательности). В некоторых вариантах осуществления концы вводимой последовательности закрыты из условия, чтобы трансформирующая ДНК образовывала замкнутый круг. Трансформирующие последовательности могут быть дикого типа, мутантными или модифицированными. В некоторых вариантах осуществления ДНК конструкция содержит последовательности, гомологичные хромосоме клетки-хозяина. В других вариантах осуществления ДНК конструкция содержит негомологичные последовательности. Когда ДНК конструкция собрана in vitro, ее можно использовать для: 1) вставки гетерологичной последовательности в требуемую намеченную последовательность клетки-хозяина; и/или 2) мутагенеза области в хромосоме клетки-хозяина (т.е. замены эндогенной последовательности на гетерологичную последовательность), и/или 3) удаления намеченных генов; и/или введения реплицирующей плазмиды в хозяина.
Как используется в настоящем документе, термины «экспрессирующая кассета» и «экспрессирующий вектор» относятся к конструкциям из нуклеиновых кислот, созданных рекомбинантно или синтетически, с рядом определенных элементов нуклеиновых кислот, которые дают возможность транскрибировать определенную нуклеиновую кислоту в клетке-мишени. Рекомбинантная экспрессирующая кассета может быть встроена в плазмиду, хромосому, митохондриальную ДНК, плазмидную ДНК, вирус или фрагмент нуклеиновой кислоты. Типично, часть экспрессирующего вектора с рекомбинантной экспрессирующей кассетой включает, среди прочих последовательностей, подлежащую транскрипции последовательность нуклеиновой кислоты и промотор. В предпочтительных вариантах осуществления экспрессирующие векторы обладают способностью встраиваться и экспрессировать фрагменты гетерологичной ДНК в клетке-хозяине. Многие прокариотические и эукариотические экспрессирующие векторы доступны коммерчески. Выбор соответствующих экспрессирующих векторов находится в компетенции специалистов в данной области. Термин «экспрессирующая кассета» используется взаимозаменяемо с «ДНК конструкцией» и их грамматическими эквивалентами. Выбор соответствующих экспрессирующих векторов находится в компетенции специалистов в данной области.
Как используется в настоящем документе, термин «вектор» относится к полинуклеотидной конструкции, разработанной для введения нуклеиновых кислот в один или несколько типов клеток. Векторы включают клонирующие векторы, экспрессирующие векторы, челночные векторы, плазмиды, кассеты и т.п. В некоторых вариантах осуществления полинуклеотидная конструкция содержит последовательность ДНК, кодирующую протеазу (например, прекурсор или зрелую протеазу), которая функционально связана с соответствующей пропоследовательностью (например, секреторной и т.д.), поддающейся воздействию на экспрессию ДНК в подходящем хозяине.
Как используется в настоящем документе, термин «плазмида» относится к кольцевой двухцепочечной (дц) ДНК конструкции, используемой в качестве клонирующего вектора и которая образует внехромосомный самореплицирующийся генетический элемент в некоторых эукариотах или прокариотах, или встраивается в хромосому хозяина.
Как используется в настоящем документе в контексте введения последовательности нуклеиновой кислоты в клетку, термин «введенный» относится к любому способу, пригодному для переноса последовательности нуклеиновой кислоты в клетку. Такие способы для введения включают в качестве неограничивающих примеров слияние протопластов, трансфекцию, трансформацию, конъюгацию и трансдукцию (смотрите, например, Ferrari et al., «Genetics», in Hardwood et al, (eds.), Bacillus. Plenum Publishing Corp., страницы 57-72 [1989]).
Как используется в настоящем документе, термины «трансформированный» и «стабильно трансформированный» относятся к клетке, которая имеет неродную (гетерологичную) полинуклеотидную последовательность, встроенную в ее геном, или к эписомальной плазмиде, которая сохраняется, по меньшей мере, в течение двух делений.
Как используется в настоящем документе, термин «нуклеотидная последовательность, кодирующая селективный маркер», относится к нуклеотидной последовательности, которая допускает экспрессию в клетках-хозяевах и где экспрессия селективного маркера дает клеткам, содержащим экспрессированный ген, способность расти в присутствии соответствующего селективного средства или в отсутствие необходимого питательного вещества.
Как используется в настоящем документе, термины «селективный маркер» и «селектируемый маркер» относятся к нуклеиновой кислоте (например, гену, способному экспрессироваться в клетке-хозяине), которая делает возможным легкий отбор этих хозяев, содержащих вектор. Примеры таких селективных маркеров включают в качестве неограничивающих примеров противомикробные вещества. Таким образом, термин «селективный маркер» относится к генам, которые обеспечивают индикацию того, что клетка-хозяин поглотила вводимую интересующую ДНК, или наступление какой-нибудь другой реакции. Типично, селективные маркеры представляют собой гены, которые дают устойчивость к противомикробным веществам или метаболическое преимущество над клеткой-хозяином, что позволяет отличать клетки, содержащие экзогенную ДНК, от клеток, которые не получили экзогенную последовательность в процессе трансформации. «Постоянный селективный маркер» представляет собой селективный маркер, который расположен в хромосоме микроорганизма, подлежащего трансформации. Постоянный селективный маркер кодирует ген, который отличается от селективного маркера в трансформирующей ДНК конструкции. Селективные маркеры хорошо известны специалистам в данной области. Как указано выше, предпочтительно, чтобы маркер представлял собой маркер устойчивости к противомикробному средству (например, ampR; phleoR; specR; kanR; eryR; tetR; cmpR и neoR (смотрите, например, Guerot-Fleury, Gene, 167:335-337 [1995]; Palmeros et al., Gene 247:255-264 [2000]; и Trieu-Cuot et al., Gene, 23:331-341, [1983]). Другие маркеры, пригодные в соответствии с изобретением, включают в качестве неограничивающих примеров ауксотрофные маркеры, такие как триптофан, и маркеры обнаружения, такие как β-галактозидаза.
Как используется в настоящем документе, термин «промотор» относится к последовательности нуклеиновой кислоты, которая функционирует для управления транскрипцией гена, расположенной в направлении 5'-3'. В предпочтительных вариантах осуществления промотор соответствует клетке-хозяину, в которой намеченный ген должен быть экспрессирован. Промотор вместе с другими транскрипционными и трансляционными регуляторными последовательностями нуклеиновых кислот (также называемые «управляющие последовательности») необходимы для экспрессии заданного гена. В основном, транскрипционные и трансляционные регуляторные последовательности включают в качестве неограничивающих примеров промоторные последовательности, участки связывания рибосомы, транскрипционные стартовые и конечные последовательности, трансляционные стартовые и конечные последовательности, и последовательности энхансеров или активаторов.
Нуклеиновая кислота «функционально связана», когда она расположена в функциональной связи с другой последовательностью нуклеиновой кислоты. Например, ДНК, кодирующая секреторную лидерную последовательность (т.е. сигнальный пептид), функционально связана с ДНК для полипептида, если она экспрессирована в виде предбелка, который участвует в секреции полипептида; промотор или энхансер функционально связаны с кодирующей последовательностью, если они влияют на транскрипцию последовательности; или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если он расположен так, чтобы облегчать трансляцию. Как правило, «функционально связанный» обозначает, что ДНК связанные последовательности являются смежными и, в случае секреторной лидерной последовательности, смежны и совпадают по фазе считывания. Однако энхансеры не обязаны быть смежными. Сшивка выполняется посредством лигирования в подходящих участках рестрикции. Если такие сайты не существуют, то используют синтетические олигонуклеотидные адаптеры или линкеры в соответствии с традиционной практикой.
Как используется в настоящем документе, термин «ген» относится к полинуклеотиду (например, сегменту ДНК), который кодирует полипептид и содержит области, предшествующие и последующие за кодирующими областями, а также промежуточные последовательности (интроны) между отдельными кодирующими сегментами (экзонами).
Как используется в настоящем документе, термин «гомологичные гены» относится к паре генов из различных, но обычно родственных видов, которые соответствуют друг другу и которые идентичны или очень сходны друг с другом. Термин охватывает гены, которые разделились посредством видообразования (т.е. развития новых видов) (например, ортологичные гены), а также гены, которые разделились посредством удвоения генов (например, паралогичные гены).
Как используется в настоящем документе, «ортолог» и «ортологичные гены» относятся к генам в различных видах, которые развились из общего гена-предшественника (т.е. гомологичный ген) посредством видообразования. Типично, ортологи сохраняют одну функцию в течение эволюции. Установление ортологов находит применение в достоверном прогнозе функции гена во вновь секвенированных геномах.
Как используется в настоящем документе, «паралог» и «паралогичные гены» относятся к генам, которые связаны посредством удвоения внутри генома. Тогда как ортологи сохраняют одну функцию в течение эволюции, паралоги развивают новые функции, даже через одинаковые функции, которые часто состоят в родстве с исходным геном. Примеры паралогичных генов включают в качестве неограничивающих примеров гены, кодирующие трипсин, химотрипсин, эластазу и тромбин, все они являются сериновыми протеазами и встречаются вместе в пределах одних и тех же видов.
Как используется в настоящем документе, «гомология» относится к сходству или идентичности последовательностей, причем идентичность является предпочтительной. Эту гомологию определяют с использованием стандартных способов, известных в данной области (смотрите, например, Smith и Waterman, Adv. Appl. Math., 2:482 [1981]; Needleman и Wunsch, J. Mol. Biol., 48:443 [1970]; Pearson и Lipman, Proc. Natl. Acad. Sci. USA, 85:2444 [1988]; программ, таких как GAP, BESTFIT, FASTA и TFASTA из пакета программного обеспечения Wisconsin Genetics, Genetics Computer Group, Madison, WI; и Devereux et al., Nucl. Acid Res., 12:387-395 [1984]).
Как используется в настоящем документе, «аналогичная последовательность» представляет собой последовательность, в которой функция гена является в основном такой же, как у гена, основанного на родительском гене (например, протеаза штамма 69B4 Cellulomonas). Дополнительно, аналогичные гены содержат, по меньшей мере, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 97%, приблизительно 98%, приблизительно 99% или приблизительно 100% идентичности последовательности с последовательностью родительского гена. Альтернативно, аналогичные последовательности обладают выравниванием от 70 до 100% генов, обнаруженных в области родительского гена (например, протеаза штамма 69B4 Cellulomonas) и/или обладают, по меньшей мере, между 5-10 генами, обнаруженными в области, выровненной с генами в хромосоме, содержащей родительский ген (например, хромосома штамма 69B4 Cellulomonas). В дополнительных вариантах осуществления более чем одно из указанных выше свойств относится к последовательности. Аналогичные последовательности определяют с помощью известных способов выравнивания последовательностей. Общеупотребительным способом выравнивания является BLAST, хотя, как отмечается выше и ниже, существуют другие способы, которые также находят применение при выравнивании последовательностей.
Одним из примеров пригодных алгоритмов является PILEUP. PILEUP создает множественное выравнивание последовательностей из группы родственных последовательностей, используя попарные выравнивания. Также можно построить дерево, отражающее кластерные взаимосвязи, используемые для создания выравнивания. PILEUP использует упрощенный способ прогрессивного выравнивания авторов Feng и Doolittle (Feng и Doolittle, J. Mol. Evol., 35:351-360 [1987]). Этот способ схож со способом, описанным авторами Higgins и Sharp (Higgins и Sharp, CABIOS 5:151-153 [1989]). Полезные параметры PILEUP включают gap weight по умолчанию, равный 3,00, gap length weight по умолчанию, равный 0,10, и weighted end gaps.
Другим примером пригодного алгоритма является алгоритм BLAST, описанный авторами Altschul et al., (Altschul et al., J. Mol. Biol., 215:403-410 [1990]; и Karlin et al., Proc. Natl. Acad. Sci., USA, 90:5873-5787 [1993]). В частности, воплощением пригодного алгоритма BLAST является программа WU-BLAST-2 (смотрите Altschul et al., Meth. Enzymol., 266:460-480 [1996]). WU-BLAST-2 использует несколько параметров поиска, для большинства которых установлены значения по умолчанию. Для настраиваемых параметров установлены следующие значения: overlap span=1, overlap fraction=0,125, word threshold (T)=11. Параметры HSP S и HSP S2 являются динамическими значениям и определяются самой программой при формировании конкретной последовательности и формировании конкретной базы данных, против которых будет проводиться поиск интересующей последовательности. Однако для увеличения чувствительности значения могут быть настроены. Значение процента идентичности аминокислотных последовательностей определяют как количество совпадающих идентичных остатков, деленное на общее количество остатков в «более длинной» последовательности в выровненной области. «Более длинная» последовательность представляет собой последовательность, имеющую больше всего истинных остатков в выровненной области (пропуски введены программой WU-Blast-2 для максимизации игнорируемой оценки выравнивания).
Таким образом, «процент (%) идентичности последовательности нуклеиновой кислоты» определяется как процент нуклеотидных остатков в испытываемой последовательности, которые идентичны нуклеотидным остаткам стартовой последовательности (т.е. интересующей последовательности). Предпочтительный способ использует модуль BLASTN программы WU-BLAST-2, со значениями параметров по умолчанию, при overlap span и overlap fraction, установленных на 1 и 0,125, соответственно.
Как используется в настоящем документе, термин «гибридизация» относится к процессу, посредством которого цепочка нуклеиновой кислоты соединяется с комплементарной цепочкой посредством спаривания оснований, известному в данной области.
Считается, что последовательность нуклеиновой кислоты «поддается избирательной гибридизации» с эталонной последовательностью нуклеиновой кислоты, если две последовательности специфически гибридизуются друг с другом при условиях гибридизации и отмывки от умеренных до крайне строгих. Условия гибридизации основаны на температуре плавления (Tm) связанного комплекса нуклеиновой кислоты или зонда. Например, «максимальная жесткость» типично наступает при Tm-5°C (на 5° ниже Tm зонда); «крайне строгий» - при снижении приблизительно на 5-10°C относительно Tm; «средняя строгость» - при снижении приблизительно на 10-20°C относительно Tm зонда; и «низкая строгость» - при снижении приблизительно на 20-25°C относительно Tm. Функционально максимально жесткие условия можно использовать для идентификации последовательностей, обладающих строгой идентичностью или идентичностью, близкой к строгой, с зондом для гибридизации; тогда как среднюю или низкую строгость гибридизации можно использовать для идентификации или обнаружения гомологов полинуклеотидной последовательности.
Умеренные и крайне строгие условия гибридизации хорошо известны в данной области. Пример условий с высокой строгостью включает гибридизацию приблизительно при 42°C в 50% формамиде, 5×SSC, 5× растворе Денхардта, 0,5% SDS и 100 мкг/мл денатурированного ДНК-носителя с последующей отмывкой два раза в 2×SSC и 0,5% SDS при комнатной температуре и два дополнительных раза в 0,1×SSC и 0,5% SDS 42°C. Пример умеренно строгих условий включают инкубацию в течение ночи 37°C в растворе, содержащем 20% формамид, 5×SSC (150 мМ NaCl, 15 мМ трицитрат натрия), 50 мМ фосфат натрия (pH 7,6), 5× раствор Денхардта, 10% сульфат декстрана и 20 мг/мл денатурированной порезанной ДНК спермы лосося, с последующей отмывкой фильтров в 1×SSC приблизительно при 37-50°C. Специалисты в данной области знают, как подобрать температуру, ионную силу и т.д. по мере необходимости для приспособления к таким факторам, как длина зонда и т.п.
Как используется в настоящем документе, «рекомбинантный» включает упоминание о клетке или векторе, которые были модифицированы введением последовательности гетерологичной нуклеиновой кислоты, или о клетке, которая получена из клетки, модифицированной таким образом. Следовательно, например, рекомбинантные клетки экспрессируют гены, которые не обнаружены в идентичной форме в естественной (нерекомбинантной) форме клетки, или экспрессируют природные гены, которые в ином случае ненормально экспрессированы, недостаточно экспрессированы или неэкспрессированы вовсе как результат преднамеренного вторжения человека. «Рекомбинация», «рекомбинирование» и создание «рекомбинированной» нуклеиновой кислоты как правило представляют собой сборку двух или более фрагментов нуклеиновой кислоты, где сборка дает начало химерному гену.
В предпочтительном варианте осуществления мутантные последовательности ДНК, созданные с помощью сайт-насыщающего мутагенеза, по меньшей мере, в одном кодоне. В другом предпочтительном варианте осуществления сайт-насыщающий мутагенез выполняется для двух или более кодонов. В дополнительном варианте осуществления мутантные последовательности ДНК обладают более чем 50%, более чем 55%, более чем 60%, более чем 65%, более чем 70%, более чем 75%, более чем 80%, более чем 85%, более чем 90%, более чем 95% или более чем 98% гомологии с последовательностью дикого типа. В альтернативных вариантах осуществления мутантная ДНК создана in vivo с использованием любой известной процедуры мутагенеза, такой как, например, радиация, нитрозогуанидин и т.п. Затем требуемую последовательность ДНК выделяют и используют в способах, предоставленных в настоящем документе.
Как используется в настоящем документе, термин «последовательность-мишень» относится к последовательности ДНК в клетке-хозяине, которая кодирует последовательность, когда это требуется для вводимой последовательности, подлежащей введению в геном клетки-хозяина. В некоторых вариантах осуществления последовательность-мишень кодирует функциональный ген или оперон дикого типа, тогда как в других вариантах осуществления последовательность-мишень кодирует функциональный мутантный ген или оперон, или нефункциональный ген или оперон.
Как используется в настоящем документе, «фланкирующая последовательность» относится к любой последовательности, которая находится или выше или ниже обсуждаемой последовательности (например, для генов A-B-C, ген B фланкируется последовательностями генов A и C). В предпочтительном варианте осуществления вводимая последовательность фланкирована гомологичными фрагментами с каждой стороны. В другом варианте осуществления вводимая последовательность и гомологичные фрагменты содержат блок, который фланкирован спейсерной последовательностью с каждой стороны. В некоторых вариантах осуществления фланкирующая последовательность присутствует только с одной стороны (или 3' или 5'), но в предпочтительных вариантах осуществления она находится с каждой стороны фланкируемой последовательности. В некоторых вариантах осуществления фланкирующая последовательность присутствует только с одной стороны (или 3' или 5'), тогда как в предпочтительных вариантах осуществления она присутствует с каждой стороны фланкируемой последовательности.
Как используется в настоящем документе, термин «спейсерная последовательность» относится к любой дополнительной ДНК, которая фланкирует гомологичные фрагменты (типично вектор последовательности). Однако термин охватывает любые негомологичные последовательности ДНК. Не имея ограничений в теории, спейсерная последовательность предоставляет некритическую мишень для клетки для инициации поглощения ДНК.
Как используется в настоящем документе, термины «амплификация» и «амплификация гена» относятся к процессу, с помощью которого специфические последовательности ДНК непропорционально копируются из условия, чтобы амплифицированный ген присутствовал в большем числе копий, чем изначально присутствует в геном. В некоторых вариантах осуществления отбор клеток на основании роста в присутствии лекарственного средства (например, ингибитор фермента, поддающегося ингибированию) приводит к амплификации или эндогенного гена, кодирующего продукт гена, требующийся для роста в присутствии лекарственного средства, или посредством амплификации экзогенных (т.е. введенных) последовательностей, кодирующих этот продукт гена, или и к тому и к другому.
«Амплификация» представляет собой особый случай репликации нуклеиновой кислоты, предполагающий специфичность матрицы. Это отличается от репликации неспецифичной матрицы (т.е. репликации, которая является зависящей от матрицы, но не зависит от специфичности матрицы). Здесь специфичность матрицы различается по точности репликации (т.е. синтезу правильной полинуклеотидной последовательности) и нуклеотидной (рибо- или дезоксирибо-) специфичности. Специфичность матрицы часто описывают в терминах специфичности «мишени». Последовательности-мишени представляют собой «мишени» в том смысле, что происходит поиск и отсортировывание «мишени» от других нуклеиновых кислот. Изначально способы амплификации были созданы для такого отсортировывания.
Как используется в настоящем документе, термин «соамплификация» относится к введению в одну клетку амплифицируемого маркера в сочетании с другими генными последовательностями (т.е. содержащими один или несколько не подлежащих отбору генов, таких как гены, содержащиеся в экспрессирующем векторе) и применению соответствующего давления отбора из условия, чтобы клетки амплифицировали как амплифицируемый маркер, так и другие, не подлежащие отбору генные последовательности. Амплифицируемый маркер может быть физически связан с другими генными последовательностями или альтернативно в одну клетку могут быть введены два раздельных фрагмента ДНК, один содержит амплифицируемый маркер и другой содержит не подлежащий отбору маркер.
Как используется в настоящем документе, термины «амплифицируемый маркер», «амплифицируемый ген» и «амплифицируемый вектор» относятся к гену или вектору, кодирующему ген, который допускает амплификацию этого гена при соответствующих условиях роста.
В большинстве способов амплификации «специфичность матрицы» достигается посредством выбора фермента. Ферменты амплификации представляют собой ферменты, которые в условиях их использования будут обрабатывать только специфические последовательности нуклеиновых кислот в гетерологичной смеси нуклеиновых кислот. Например, в случае репликазы Qβ, РНК MDV-1 представляет собой специфическую матрицу для репликазы (смотрите, например, Kacian et al., Proc. Natl. Acad. Sci. USA 69:3038 [1972]) и другие нуклеиновые кислоты не реплицируются этим ферментом амплификации. Подобным образом, в случае РНК полимеразы T7, этот фермент амплификации обладает строгой специфичностью к своим собственным промоторам (смотрите, Chamberlin et al., Nature 228:227 [1970]). В случае ДНК лигазы T4, фермент не будет лигировать два олигонуклеотида или полинуклеотида, если имеет место несовпадение между олигонуклеотидным или полинуклеотидным субстратом и матрицей в точке лигирования (смотрите, Wu и Wallace, Genomics 4:560 [1989]). В конечном счете, было обнаружено, что Taq и Pfu полимеразы, благодаря их способности работать при высокой температуре, проявляют высокую специфичность к последовательностям, связанным и, таким образом, обозначенным с помощью праймеров; высокая температура приводит к термодинамическим условиям, которые способствуют гибридизации праймеров с последовательностями-мишенями, но не гибридизации не с последовательностями-мишенями.
Как используется в настоящем документе, термин «амплифицируемая нуклеиновая кислота» относится к нуклеиновым кислотам, которые могут быть амплифицированы любым способом амплификации. Предполагается, что «амплифицируемая нуклеиновая кислота» обычно будет содержать «матрицу образца».
Как используется в настоящем документе, термин «матрица образца» относится к нуклеиновой кислоте, которая происходит из образца, который анализируют на присутствие «мишени» (определена ниже). В отличие от этого «фоновая матрица» используется в отношении нуклеиновой кислоты, отличной от матрицы образца, которая может присутствовать или отсутствовать в образце. Фоновая матрица чаще всего является произвольной. Это может быть результатом переноса или это может быть из-за присутствия загрязнителей из нуклеиновых кислот, которые должны быть найдены и удалены из образца. Например, нуклеиновые кислоты из организмов, отличные от тех, что должны быть обнаружены, могут присутствовать в качестве фона в тестируемом образце.
Как используется в настоящем документе, термин «праймер» относится к олигонуклеотиду, который или встречается в природе в виде очищенного продукта расщепления рестриктазами или создан синтетически, который способен действовать в качестве точки инициации синтеза, когда он помещен в условия, в которых индуцирован синтез продукта праймерного удлиняющегося сегмента, который комплементарен цепочке нуклеиновой кислоты, (т.е. в присутствии нуклеотидов и индуцирующего агента, такого как ДНК полимераза, и при подходящих температуре и pH). Для максимальной эффективности амплификации праймер предпочтительно является одноцепочечным, но альтернативно может быть двухцепочечным. Если праймер является двухцепочечным, то сначала его обрабатывают для разделения его цепочек перед использованием для изготовления продуктов элонгации. Предпочтительно, праймер представляет собой олигодезоксирибонуклеотид. Праймер должен быть достаточно длинным для того, чтобы направлять синтез продуктов элонгации в присутствии индуцирующего агента. Точные длины праймеров будут зависеть от многих факторов, включая температуру, источник праймера и применяемого способа.
Как используется в настоящем документе, термин «зонд» относится к олигонуклеотиду (т.е. последовательности нуклеотидов), который или встречается в природе в виде очищенного продукта расщепления рестриктазами или создан синтетически, рекомбинантно или с помощью ПЦР амплификации, который поддается гибридизации с другим интересующим олигонуклеотидом. Зонд может быть одноцепочечным или двухцепочечным. Зонды пригодны для обнаружения, идентификации и выделения определенных генетических последовательностей. Предполагается, что любой зонд, используемый в настоящем изобретении, будет мечен любой «репортерной молекулой» для того, чтобы его можно было обнаружить в любой системе обнаружения, включая в качестве неограничивающих примеров ферментативные (например, ELISA, а также гистохимические анализы, основанные на ферменте), флуоресцентные, радиоактивные и люминесцентные системы. Не планируется, что настоящее изобретение будет ограничиваться любой конкретной системой обнаружения или меткой.
Как используется в настоящем документе, термин «мишень» при использовании в отношении полимеразной цепной реакции относится к области нуклеиновой кислоты, связанной праймерами, используемыми в полимеразной цепной реакции. Таким образом, происходит поиск и отсортировывание «мишени» от других последовательностей нуклеиновых кислот. «Сегмент» определен как область нуклеиновой кислоты внутри последовательности-мишени.
Как используется в настоящем документе, термин «полимеразная цепная реакция» («ПЦР») относится к способам из патентов США №№ 4683195, 4683202 и 4965188, включенных, таким образом, в качестве ссылки, которые включают способы для повышения концентрации сегмента последовательности-мишени в смеси геномной ДНК без клонирования или очистки, которые известны специалистам в данной области. Так как требуемые амплифицированные сегменты последовательности-мишени становятся преобладающими последовательностями (в пересчете на концентрацию) в смеси, о них говорят, что они «ПЦР амплифицированы».
Как используется в настоящем документе, термин «реактивы для амплификации» относится к тем реактивам (дезоксирибонуклеотид трифосфаты, буфер и т.д.), которые необходимы для амплификации, за исключением праймеров, матрицы из нуклеиновой кислоты и фермента амплификации. Типично, реактивы для амплификации наряду с другими компонентами реакции помещают и содержат в реакционном сосуде (пробирке, микролунке и т.д.).
С помощью ПЦР можно амплифицировать одну копию специфической последовательности-мишени в геномной ДНК до уровня, который можно определить с помощью нескольких различных способов (например, гибридизация с меченым зондом; встраивание биотинилированных праймеров с последующим обнаружением фермент-авидинового конъюгата; встраивание дезоксинуклеотид трифосфатов, меченных 32P, таких как dCTP или dATP, в амплифицированный сегмент). В дополнение к геномной ДНК любая олигонуклеотидная или полинуклеотидная последовательность может быть амплифицирована с помощью соответствующего набора праймерных молекул. В частности, амплифицированные сегменты, созданные самим процессом ПЦР, сами являются эффективными матрицами для последующих ПЦР амплификаций.
Как используется в настоящем документе, термины «ПЦР продукт», «ПЦР фрагмент» и «продукт амплификации» относятся к полученной смеси соединений после завершения двух или более циклов ПЦР из стадий денатурации, отжига и элонгации. Эти термины охватывают случай, в котором происходила амплификация одного или нескольких сегментов одной или нескольких последовательностей-мишеней.
Как используется в настоящем документе, термин «RT-ПЦР» относится к репликации и амплификации РНК последовательностей. В этом способе, в котором обратная транскрипция объединена с ПЦР, наиболее часто используется процедура с одним ферментом, в которой применяется термостабильная полимераза, как описано в патенте США № 5322770, включенном в настоящий документ в качестве ссылки. В RT-ПЦР, РНК матрица превращается в кДНК благодаря обратной транскриптазной активности полимеразы и затем амплифицируется с использованием полимеразной активности полимеразы (т.е. как в других способах ПЦР).
Как используется в настоящем документе, термины «рестрикционные эндонуклеазы» и «рестрикционные ферменты» относятся к бактериальным ферментам, каждый из которых режет двухцепочечную ДНК непосредственно в или рядом с конкретной нуклеотидной последовательностью.
«Участок рестрикции» относится к нуклеотидной последовательности, распознаваемой и разрезаемой с помощью заданной рестрикционной эндонуклеазы, и часто представляет собой сайт для встраивания фрагментов ДНК. В определенных вариантах осуществления участки рестрикции создают внутри селективного маркера и в 5'- и 3'-концах ДНК конструкции.
Как используется в настоящем документе, термин «хромосомная интеграция» относится к процессу, при помощи которого вводимую последовательность вводят в хромосому клетки-хозяина. Гомологичные области трансформирующей ДНК выравниваются с гомологичными областями хромосомы. Впоследствии последовательность между гомологичными фрагментами замещается вводимой последовательностью через двойной кроссинговер (т.е. гомологичную рекомбинацию). В некоторых вариантах осуществления настоящего изобретения, гомологичные участки инактивирующего хромосомного сегмента ДНК конструкции выравниваются с фланкирующими гомологичными областями естественной хромосомной области хромосомы Bacillus. Впоследствии естественная хромосомная область в двойном кроссинговере (т.е. гомологичной рекомбинации) удаляется с помощью ДНК конструкции.
«Гомологичная рекомбинация» обозначает обмен фрагментами ДНК между двумя молекулами ДНК или спаренными хромосомами в сайте с идентичными или почти идентичными нуклеотидными последовательностями. В предпочтительном варианте осуществления хромосомная интеграция представляет собой гомологичную рекомбинацию. «Гомологичные последовательности», как используется в настоящем документе, обозначают последовательность нуклеиновой кислоты или полипептида, обладающую 100%, 99%, 98%, 97%, 96%, 95%, 94%, 93%, 92%, 91%, 90%, 88%, 85%, 80%, 75% или 70% идентичностью последовательности с другой последовательностью нуклеиновой кислоты или полипептида при оптимальном выравнивании для сравнения. В некоторых вариантах осуществления гомологичные последовательности обладают от 85% до 100% идентичностью последовательности, тогда как в других вариантах осуществления имеет место от 90% до 100% идентичность последовательности и в более предпочтительных вариантах осуществления имеет место 95% и 100% идентичность последовательности.
Как используется в настоящем документе, «аминокислота» относится к пептидным или белковым последовательностям или их фрагментам. Термины «белок», «пептид» и «полипептид» используют взаимозаменяемо.
Как используется в настоящем документе, «интересующий белок» и «интересующий полипептид» относятся к требуемому и/или оцениваемому белку/полипептиду. В некоторых вариантах осуществления «интересующий белок» представляет собой «родительский белок» (т.е. стартовый белок). В некоторых вариантах осуществления родительский белок представляет собой фермент дикого типа, который используется в качестве стартовой точки в конструировании/проектировании белка. В некоторых вариантах осуществления интересующий белок экспрессирован внутриклеточно, тогда как в других вариантах осуществления он представляет собой секретируемый полипептид. В особенно предпочтительных вариантах осуществления эти ферменты включают сериновые протеазы и металлопротеазы, описываемые в настоящем документе. В некоторых вариантах осуществления интересующий белок представляет собой секретируемый полипептид, слитый с сигнальным пептидом (т.е. аминоконцевым удлиняющим сегментом на белке, подлежащем секреции). Почти все секретируемые белки используют аминоконцевой белковый удлиняющий сегмент, который играет ключевую роль при направлении и перемещении белков-предшественников через мембрану. Этот удлиняющий сегмент протеолитически удаляется с помощью сигнальной пептидазы во время или сразу после прохождения через мембрану.
Как используется в настоящем документе, термин «гетерологичный белок» относится к белку или полипептиду, который в природе не встречается в клетке-хозяине. Примеры гетерологичных белков включают ферменты, такие как гидролазы, включая протеазы. В некоторых вариантах осуществления гены, кодирующие белки, представляют собой встречающиеся в природе гены, тогда как в других вариантах осуществления используются мутировавшие и/или синтетические гены.
Как используется в настоящем документе, «гомологичный белок» относится к белку или полипептиду, который является нативным или встречается в клетке в природе. В предпочтительных вариантах осуществления клетка представляет собой грамположительную клетку, тогда как в особенно предпочтительных вариантах осуществления клетка представляет собой клетку-хозяина Bacillus. В альтернативных вариантах осуществления, гомологичный белок представляет собой нативный белок, синтезируемый другими организмами, включая в качестве неограничивающих примеров E. coli, Cellulomonas, Bacillus, Streptomyces, Trichoderma и Aspergillus. Данное изобретение относится к клеткам-хозяевам, продуцирующим гомологичный белок посредством технологии рекомбинантных ДНК.
Как используется в настоящем документе, по определению, белки имеют общую «укладку», если они имеют одинаковые основные вторичные структуры в одинаковом расположении и с одинаковыми топологическими связями. Различные белки с одинаковой укладкой часто имеют периферические элементы вторичной структуры и поворачивают области, которые отличаются размером и конформацией. В некоторых случаях эти различающиеся периферические области могут содержать половину структуры. Белки, помещенные вместе в один тип укладки, не обязательно обладают общим эволюционным предком (например, структурные сходства возникают из физики и химии белков, которые способствуют определенному расположению при упаковке и топологии цепей).
Как используется в настоящем документе, «укладка тестируемого белка» относится к белкам, чей показатель эффективности в интересующем анализе должен быть улучшен.
Как используется в настоящем документе, термины «связывание» и «распределение» относятся к количеству фермента, связанного с субстратом, или белка, адсорбированного на поверхности, независимо от установления равновесия в термодинамическом смысле или обратимости или необратимости адсорбции в кинетическом смысле.
Как используется в настоящем документе, «область оперона» содержит группу смежных генов, которые транскрибируются в виде одной транскрипционной единицы с общим промотором, и таким образом подлежат совместной регуляции. В некоторых вариантах осуществления оперон содержит ген-регулятор. В наиболее предпочтительных вариантах осуществления используются опероны, которые обладают повышенной экспрессией, судя по измерениям уровней РНК, но обладают неизвестной или излишней функцией.
Как используется в настоящем документе, «противомикробная область» представляет собой область, содержащую, по меньшей мере, один ген, который кодирует противомикробный белок.
Говорят, что полинуклеотид «кодирует» РНК или полипептид, если в своем нативном состоянии или при манипуляциях посредством способов, известных специалистам в данной области, он может быть транскрибирован и/или транслирован для синтеза РНК, полипептида или его фрагмента. Об антисмысловой цепи такой нуклеиновой кислоты также говорят, что она кодирует последовательности.
Как известно в данной области, ДНК может быть транслирована с помощью РНК полимеразы для образования РНК, но РНК может быть обратно транскрибирована с помощью обратной транскриптазы для образования ДНК. Таким образом, ДНК может кодировать РНК и наоборот.
Термины «регуляторный сегмент», или «регуляторная последовательность», или «последовательность, контролирующая экспрессию» относятся к полинуклеотидной последовательности ДНК, которая функционально связана с полинуклеотидной последовательностью ДНК, которая кодирует аминокислотную последовательность полипептидной цепи, чтобы влиять на экспрессию кодируемой аминокислотной последовательности. Регуляторная последовательность может ингибировать, подавлять или способствовать экспрессии функционально связанной полинуклеотидной последовательности, кодирующей аминокислоту.
«Штамм-хозяин» или «клетка-хозяин» относится к организму-хозяину, пригодному для экспрессии вектора, содержащего ДНК по настоящему изобретению.
Фермент «сверхэкспрессирован» в клетке-хозяине, если фермент экспрессирован в клетке при более высоком уровне, чем уровень, при котором он экспрессирован в соответствующей клетке дикого типа.
В настоящем документе термины «белок» и «полипептид» используются взаимозаменяемо. На протяжении этого раскрытия используется трехбуквенный код для аминокислот, определенный в соответствии с IUPAC-IUB Объединенной комиссией по биохимической номенклатуре (JCBN). Также следует понимать, что полипептид может кодироваться более чем одной нуклеотидной последовательностью по причине вырожденности генетического кода.
«Пропоследовательность» представляет собой аминокислотную последовательность между сигнальной последовательностью и зрелой протеазой, которая необходима для секреции протеазы. Отщепление пропоследовательности приведет к образованию зрелой активной протеазы.
Термины «сигнальная последовательность» или «сигнальный пептид» относятся к любой последовательности нуклеотидов и/или аминокислот, которые участвуют в секреции зрелой или прекурсорной формы белка. Это определение сигнальной последовательности является функциональным, что говорит о том, что включены все те аминокислотные последовательности, кодируемые N-концевой частью белкового гена, которые участвуют в осуществлении секреции белка. Они часто, но не всегда, связаны с N-концевой частью белка или с N-концевой частью белка-предшественника. Сигнальная последовательность может быть эндогенной или экзогенной. Сигнальная последовательность может быть естественным образом связана с белком (например, протеазой), или может быть из другого гена, кодирующего другой секретируемый белок. Одна образцовая экзогенная сигнальная последовательность содержит первые семь аминокислотных остатков сигнальной последовательности из субтилизина B. subtilis, слитого с остатком от сигнальной последовательности субтилизина из B. lentus (ATCC 21536).
Термин «гибридная сигнальная последовательность» относится к сигнальным последовательностям, в которых часть последовательности, полученная из экспрессирующего организма-хозяина, слита с сигнальной последовательностью гена, подлежащего экспрессии. В некоторых вариантах осуществления применяются синтетические последовательности.
Термин «в значительной степени одинаковая сигнальная активность» относится к сигнальной активности, на которую указывает значительной степени одинаковая секреция протеазы в сбраживаемую среду, например уровень протеазы в сбраживаемой среде составляет, по меньшей мере, 50%, по меньшей мере, 60%, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% от уровней секретируемой протеазы в сбраживаемой среде, которая обеспечена сигнальной последовательностью SEQ ID NO:9.
Термин «зрелая» форма белка или пептида относится к конечной функциональной форме белка или пептида. В качестве примера, зрелая форма протеазы ASP по настоящему изобретению, по меньшей мере, содержит аминокислотную последовательность из SEQ ID NO:8, тогда как зрелая форма протеазы NprE по настоящему изобретению, по меньшей мере, содержит аминокислотную последовательность из SEQ ID NO:3.
Термин «прекурсорная» форма белка или пептида относится к зрелой форме белка, которая имеет пропоследовательность, функционально связанную с амино- или карбоксиконцом белка. Прекурсор также может обладать «сигнальной» последовательностью, функционально связанной с аминоконцом пропоследовательности. Прекурсор также может содержать дополнительные полинуклеотиды, которые участвуют в посттрансляционной активности (например, полинуклеотиды отщепляются оттуда, чтобы покинуть зрелую форму белка или пептида).
«Встречающийся в природе фермент» и «встречающийся в природе белок» указывают на фермент или белок, обладающий немодифицированной аминокислотной последовательностью, идентичной последовательности, найденной в природе. Встречающиеся в природе ферменты включают нативные ферменты, такие ферменты естественным образом экспрессированы или найдены в конкретном микроорганизме.
Термины «выделенный из» и «полученный из» относятся не только к ферменту (например, протеазе), синтезированному или синтезируемому штаммом рассматриваемого организма, но также к ферменту, кодируемому последовательностью ДНК, выделенной из такого штамма, и продуцируемому в организме-хозяине, содержащим такую последовательность ДНК. Дополнительно, термин относится к ферменту, который кодируется последовательностью ДНК синтетического и/или кДНК происхождения, и который обладает идентификационными характеристиками рассматриваемого фермента.
«Производное» в рамках этого определения, как правило, сохраняет характеристическую протеолитическую активность, наблюдаемую у дикого типа, нативной или родительской формы в случае, если производное пригодно для целей, сходных с целями применения дикого типа, нативной или родительской формы. Функциональные производные фермента охватывают встречающиеся в природе, синтетически или рекомбинантно созданные пептиды или фрагменты пептидов, обладающие основными характеристиками родительского фермента.
Термин «функциональное производное» относится к производному нуклеиновой кислоты, имеющему функциональные характеристики нуклеиновой кислоты, кодирующей фермент. Функциональные производные нуклеиновой кислоты, которые кодируют ферменты, предоставленные в настоящем документе, охватывают встречающиеся в природе, синтетически или рекомбинантно созданные нуклеиновые кислоты или фрагменты. Нуклеиновая кислота дикого типа, кодирующая ферменты по настоящему изобретению, включает встречающиеся в природе аллели и гомологи, основанные на вырожденности генетического кода, известной в данной области.
Термин «идентичный» в контексте двух последовательностей нуклеиновых кислот или полипептидов относится к остаткам в двух последовательностях, которые являются одинаковыми при выравнивании с максимальным совпадением, которое измеряется с использованием одного из следующих алгоритмов сравнения последовательностей или анализа.
Термин «оптимальное выравнивание» относится к выравниванию, дающему наивысшее значение процента идентичности.
«Процент идентичности последовательностей», «процент идентичности аминокислотных последовательностей», «процент идентичности генных последовательностей» и/или «процент идентичности последовательности нуклеиновых кислот/полинуклеотидов» по отношению к двум аминокислотным, полинуклеотидным и/или генным последовательностям (в соответствующих случаях) относятся к процентному содержанию остатков, которые идентичны в двух последовательностях, когда эти последовательности оптимально выровнены. Таким образом, 80% идентичность аминокислотных последовательностей обозначает, что 80% аминокислот в двух оптимально выровненных полипептидных последовательностях идентичны.
Таким образом, фраза «в значительной степени идентичны» в контексте двух нуклеиновых кислот или полипептидов относится к полинуклеотиду или полипептиду, который обладает, по меньшей мере, 70% идентичностью последовательности, предпочтительно - по меньшей мере, 75%, предпочтительно - по меньшей мере, 80%, предпочтительно - по меньшей мере, 85%, предпочтительно - по меньшей мере, 90%, предпочтительно - по меньшей мере, 95%, предпочтительно - по меньшей мере, 97%, предпочтительно - по меньшей мере, 98% и предпочтительно - по меньшей мере, 99% идентичностью последовательности по сравнению с эталонной последовательностью при использовании программ или алгоритмов (например, BLAST, ALIGN, CLUSTAL) со стандартными параметрами. Одним признаком того, что два полипептида в значительной степени идентичны, является то, что первый полипептид обладает иммунологической перекрестной реактивностью со вторым полипептидом. Типично, полипептиды, которые отличаются консервативными аминокислотными заменами, иммунологически кроссреактивны. Таким образом, полипептид в значительной степени идентичен второму полипептиду, например, когда два пептида отличаются только консервативной заменой. Другой признак того, что две последовательности нуклеиновой кислоты в значительной степени идентичны, заключается в том, что две молекулы гибридизуются друг с другом при строгих условиях (например, в диапазоне от средне до крайне строгих).
Термин «выделенный» или «очищенный» относится к материалу, который удален из своего исходного окружения (например, природного окружения, если он встречается в природе). Например, о материале говорят, что он «очищен», когда в конкретной композиции он присутствует в большей или меньшей концентрации, чем встречается в существующем в природе организме или в организме дикого типа, или в сочетании с компонентами, которые обычно не присутствуют при экспрессии во встречающемся в природе организме или в организме дикого типа. Например, встречающийся в природе полинуклеотид или полипептид, присутствующий в живом организме, не является выделенным, но тот же полинуклеотид или полипептид, отделенный от некоторых или всех материалов, сосуществующих с ним в естественной системе, является выделенным. В некоторых вариантах осуществления такие полинуклеотиды являются частью вектора и/или такие полинуклеотиды или полипептиды являются частью композиции, и все же выделены в таком векторе или композиции, которые не являются частью их естественной среды. В некоторых предпочтительных вариантах осуществления, говорят, что нуклеиновая кислота или белок очищены, например, если они являются источником в основном одной полосы на электрофоретическом геле или в блоттинге.
Термин «выделенный», при использовании в отношении последовательности ДНК, относится к последовательности ДНК, которая была удалена из ее естественного генетического окружения и таким образом свободна от других посторонних или нежелательных кодирующих последовательностей и существует в форме, пригодной для использования в генетически сконструированных системах продуцирования белка. Такие выделенные молекулы представляют собой молекулы, которые отделены от их естественного окружения и включают кДНК и геномные клоны. Выделенные молекулы ДНК по настоящему изобретению свободны от других генов, с которыми они, как правило, связаны, но могут содержать встречающиеся в природе 5'- и 3'-нетранслируемые области, такие как промоторы и терминаторы. Идентификация связанных областей будет очевидна специалистам в данной области (смотрите, например, Dynan и Tijan, Nature 316:774-78, 1985). Термин «выделенная последовательность ДНК» альтернативно обозначается как «клонированная последовательность ДНК».
Термин «выделенный», при использовании в отношении белка, относится к белку, который найден в состоянии, отличающемся от естественной среды. В предпочтительной форме, выделенный белок в значительной степени свободен от других белков, конкретно, от других гомологичных белков. Выделенный белок обладает более чем 10% чистотой, предпочтительно более чем 20% чистотой и даже более предпочтительно более чем 30% чистотой, которую определяют с помощью SDS-PAGE. Дополнительные аспекты изобретения охватывают белок в форме с высокой степенью очистки (т.е. более 40% чистоты, более 60% чистоты, более 80% чистоты, более 90% чистоты, более 95% чистоты, более 97% чистоты и даже более 99% чистоты), которую определяют с помощью SDS-PAGE.
Как используется в настоящем документе, термин «комбинаторный мутагенез» относится к способам, в которых создают библиотеки вариантов стартовых последовательностей. В этих библиотеках варианты содержат одну или несколько мутаций, выбранных из предопределенного набора мутаций. Кроме того, способы предоставляют средства для введения случайных мутаций, которые не являются членами предопределенного набора мутаций. В некоторых вариантах осуществления способы содержат способы, изложенные в заявке США № 09/699250, поданной 26 октября 2000 года, включенной, таким образом, в качестве ссылки. В альтернативных вариантах осуществления, способы комбинаторного мутагенеза охватывают коммерчески доступные наборы (например, QUIKCHANGE® Multisite, Stratagene, La Jolla, CA).
Как используется в настоящем документе, термин «библиотека мутантов» относится к популяции клеток, которые идентичны в большей части своих геномов, но включают различные гомологи одного или нескольких генов. Такие библиотеки можно использовать, например, для идентификации генов или оперонов с улучшенными характеристиками.
Как используется в настоящем документе, термин «стартовый ген» относится к интересующему гену, который кодирует интересующий белок, который должен быть улучшен и/или изменен с использованием настоящего изобретения.
Как используется в настоящем документе, термин «вариант» относится к белку, который был получен из белка-предшественника (например, «родительского» белка) посредством добавления, замены или делеции одной или нескольких аминокислот. В некоторых вариантах осуществления вариант содержит, по меньшей мере, одну модификацию, которая содержит изменения заряда по сравнению с белком-предшественником. В некоторых предпочтительных вариантах осуществления, белок-предшественник представляет собой родительский белок, который представляет собой белок дикого типа.
Как используется в настоящем документе, термины «множественное выравнивание последовательностей» и «МВП» относятся к последовательностям множества гомологов стартового гена, которые выровнены с использованием алгоритма (например, Clustal W).
Как используется в настоящем документе, термины «консенсусная последовательность» и «каноническая последовательность» относятся к первоначальной аминокислотной последовательности, с которой сравнивают все варианты конкретного белка или интересующей последовательности. Термины также относятся к последовательности, в которой приведены нуклеотиды, которые наиболее часто присутствуют в интересующей последовательности ДНК. Для каждой позиции в гене консенсусная последовательность дает аминокислоту, которая наиболее часто встречается в этой позиции в МВП.
Как используется в настоящем документе, термин «консенсусная мутация» относится к различиям в последовательности стартового гена и консенсусной последовательности. Консенсусные мутации устанавливают сравнением последовательности стартового гена и консенсусной последовательности полученного из МВП. В некоторых вариантах осуществления консенсусные мутации введены в стартовый ген из условия, чтобы он стал больше похож на консенсусную последовательность. Консенсусные мутации также включают аминокислотные замены, которые меняют аминокислоту в стартовом гене на аминокислоту, которая более часто встречается в МВП в этой позиции по отношению к частоте этой аминокислоты в стартовом гене. Таким образом, термин консенсусная мутация включает все единичные аминокислотные замены, которые заменяют аминокислоту стартового гена на аминокислоту, которая встречается более часто, чем аминокислота в МВП.
Как используется в настоящем документе, термин «исходный вариант с благоприятными свойствами» относится к варианту, который был идентифицирован посредством скрининга библиотеки комбинаторного консенсусного мутагенеза. В предпочтительных вариантах осуществления исходные варианты с благоприятными свойствами обладают улучшенными эксплуатационными характеристиками по сравнению со стартовым геном.
Как используется в настоящем документе, термин «улучшенный вариант с благоприятными свойствами» относится к варианту, который был установлен посредством скрининга расширенной библиотеки комбинаторного консенсусного мутагенеза.
Как используется в настоящем документе, термины «улучшающая мутация» и «мутация, повышающая эффективность» относятся к мутации, которая ведет к улучшенной эффективности, когда ее вводят в стартовый ген. В некоторых предпочтительных вариантах осуществления, эти мутации идентифицируют посредством секвенирования вариантов с благоприятными свойствами, установленными в ходе стадии скрининга данного способа. В большинстве вариантов осуществления, вероятно, что мутации, которые чаще находят в вариантах с благоприятными свойствами, являются улучшающими мутациями по сравнению с нескринированной библиотекой комбинаторного консенсусного мутагенеза.
Как используется в настоящем документе, термин «обогащенная библиотека комбинаторного консенсусного мутагенеза» относится к библиотеке ККМ, которая спроектирована и сконструирована на основе результатов скрининга и/или секвенирования из раннего цикла ККМ мутагенеза и скрининга. В некоторых вариантах осуществления обогащенная библиотека ККМ основана на последовательности исходного варианта с благоприятными свойствами, полученного из раннего цикла ККМ. В дополнительных вариантах осуществления, обогащенная ККМ спроектирована из условия, чтобы мутациям, которые часто наблюдаются в исходных вариантах с благоприятными свойствами из ранних циклов мутагенеза и скрининга, отдавалось предпочтение. В некоторых предпочтительных вариантах осуществления, это осуществляется посредством пропуска праймеров, которые кодируют мутации, снижающие эффективность, или посредством увеличения концентрации праймеров, которые кодируют мутации, повышающие эффективность, по отношению к другим праймерам, которые использовались в ранних библиотеках ККМ.
Как используется в настоящем документе, термин «мутации, снижающие эффективность» относится к мутациям в библиотеке комбинаторного консенсусного мутагенеза, которые реже находят в вариантах с благоприятными свойствами в результате скрининга по сравнению с нескринированной библиотекой комбинаторного консенсусного мутагенеза. В предпочтительных вариантах осуществления процесс скрининга удаляет и/или снижает относительное содержание вариантов, которые содержат «мутации, снижающие эффективность».
Как используется в настоящем документе, термин «функциональный анализ» относится к анализу, который обеспечивает измерение активности белка. В особенно предпочтительных вариантах осуществления термин относится к аналитическим системам, в которых белок анализируют на предмет его способности функционировать при его обычной нагрузке. Например, в случае ферментов, функциональный анализ касается определения эффективности фермента в катализе реакции.
Как используется в настоящем документе, термин «намеченное свойство» относится к свойству стартового гена, которое должно быть изменено. Не планируется, что настоящее изобретение ограничивается любым конкретным намеченным свойством. Однако, в некоторых предпочтительных вариантах осуществления, намеченное свойство представляет собой стабильность продукта гена (например, устойчивость к денатурации, протеолизу или другим разрушающим факторам), тогда как в других вариантах осуществления изменен уровень продукции в продуцирующем организме-хозяине. Фактически, предполагается, что любое свойство стартового гена найдет применение в настоящем изобретении.
Термин «свойство» или его грамматические эквиваленты в контексте нуклеиновой кислоты, как используется в настоящем документе, относится к любой характеристике или свойству нуклеиновой кислоты, которое можно выбрать или обнаружить. Эти свойства включают в качестве неограничивающих примеров, свойство воздействовать на связывание с полипептидом, свойство, придаваемое клетке, содержащей конкретную нуклеиновую кислоту, свойство воздействовать на транскрипцию гена (например, сила промотора, распознание промотора, регулирование промотора, энхансерная функция), свойство воздействовать на процессинг РНК (например, сплайсинг РНК, стабильность РНК, конформацию РНК и посттранскрипционную модификацию), свойство воздействовать на трансляцию (например, уровень, регулирование, связывание мРНК с рибосомальными белками, посттрансляционная модификация). Например, в нуклеиновой кислоте сайт связывания фактора транскрипции, полимеразы, регуляторного фактора и т.д. может быть изменен для создания требуемых характеристик или для идентификации нежелательных характеристик.
Термин «свойство» или его грамматические эквиваленты в контексте полипептида, как используется в настоящем документе, относится к любой характеристике или свойству полипептида, которое можно выбрать или обнаружить. Эти свойства включают в качестве неограничивающих примеров окислительную стабильность, субстратную специфичность, каталитическую активность, тепловую стабильность, стабильность в щелочах, pH профиль активности, устойчивость к протеолитической деградации, KM, kcat, отношение kcat/KM, укладку белка, стимулирование иммунного ответа, способность связываться с лигандом, способность связываться с рецептором, способность секретироваться, способность экспонироваться на поверхности клетки, способность к олигомеризации, способность передавать сигналы, способность стимулировать клеточную пролиферацию, способность ингибировать клеточную пролиферацию, способность индуцировать апоптоз, способность модифицироваться фосфорилированием или гликозилированием, способность лечить заболевание.
Как используется в настоящем документе, термин «скрининг» имеет свое обычное значение в данной области и, в основном, представляет собой многостадийный процесс. На первой стадии предоставляют мутантную нуклеиновую кислоту или вариант ее полипептида. На второй стадии определяют свойство мутантной нуклеиновой кислоты или варианта полипептида. На третьей стадии свойство, которое определили, сравнивают со свойством соответствующей родительской нуклеиновой кислоты, со свойством соответствующего встречающегося в природе полипептида или со свойством стартового материала (например, начальной последовательности) для создания мутантной нуклеиновой кислоты.
Профессионалу в данной области будет ясно, что процедура скрининга для получения нуклеиновой кислоты или белка с измененным свойством зависит от свойства стартового материала, модификация которого предназначена для облегчения создания мутантной нуклеиновой кислоты. Поэтому профессионал оценит то, что изобретение не ограничено любым определенным свойством, подлежащим скринингу, и что следующее описание свойств перечисляет только пояснительные примеры. Способы скрининга конкретного свойства, как правило, описаны в данной области. Например, можно измерить связывание, pH, специфичность и т.д. до и после мутации, где перемена указывает на изменение. Предпочтительно, скрининг осуществляется высокопроизводительным способом, одновременно включая множество образцов, подлежащих скринингу, включая в качестве неограничивающих примеров анализы с использованием чипов, фаговый дисплей и множество субстратов и/или индикаторов.
Как используется в настоящем документе, в некоторых вариантах осуществления скрининг охватывает стадии отбора, на которых интересующие варианты обогащают из совокупности вариантов. Примеры этих вариантов осуществления включают отбор вариантов, которые дают организму-хозяину преимущество в росте, а также фаговый дисплей или любой другой способ выявления, где варианты могут быть захвачены из совокупности вариантов на основании их связывающих или каталитических свойств. В предпочтительном варианте осуществления библиотека вариантов подвергаются внешнему воздействию (нагревание, протеаза, денатурация) и впоследствии варианты, которые остаются интактными, идентифицируют в скрининге или обогащают посредством отбора. Предполагается, что термин охватывает любые пригодные средства для отбора. Фактически, не планируется, что настоящее изобретение будет ограничено любым конкретным способом скрининга.
Как используется в настоящем документе, термин «нацеленный случайный отбор» относится к процессу, в котором создается множество последовательностей, в которых одна или несколько позиций были рандомизированы. В некоторых вариантах осуществления рандомизация является полной (т.е. все четыре нуклеотида, A, T, G и C, могут встречаться в рандомизированной позиции). В альтернативных вариантах осуществления, рандомизация нуклеотида ограничена поднабором четырех нуклеотидов. Нацеленный случайный отбор может быть применен к одному или нескольким кодонам последовательности, кодирующим один или несколько интересующих белков. После экспрессии из полученных библиотек создают белковые популяции, в которых одна или несколько аминокислотных позиций могут содержать смесь из всех 20 аминокислот или поднабора аминокислот, который определяется схемой рандомизации рандомизированного кодона. В некоторых вариантах осуществления отдельные члены популяции, полученной в результате нацеленного случайного отбора, отличаются по количеству аминокислот из-за нацеленной или случайной вставки или делеции кодонов. В дополнительных вариантах осуществления синтетические аминокислоты включены в созданные белковые популяции. В некоторых предпочтительных вариантах осуществления большая часть членов популяции, полученной в результате нацеленного случайного отбора, проявляет более высокую гомологию последовательности по отношению к консенсусной последовательности, чем стартовый ген. В некоторых вариантах осуществления последовательность кодирует один или несколько интересующих белков. В альтернативных вариантах осуществления белки имеют различные биологические функции. В некоторых дополнительных предпочтительных вариантах осуществления вводимая последовательность содержит, по меньшей мере, один селективный маркер.
Термины «модифицированная последовательность» и «модифицированные гены», используемые в настоящем документе взаимозаменяемо, относятся к последовательности, которая содержит делецию, вставку или нарушение встречающейся в природе последовательности нуклеиновой кислоты. В некоторых предпочтительных вариантах осуществления продукт экспрессии модифицированной последовательности представляет собой усеченный белок (например, если модификация представляет собой делецию или нарушение последовательности). В некоторых особенно предпочтительных вариантах осуществления усеченный белок сохраняет биологическую активность. В альтернативных вариантах осуществления продукт экспрессии модифицированной последовательности представляет собой удлиненный белок (например, модификации, содержащие вставку в последовательность нуклеиновой кислоты). В некоторых вариантах осуществления вставка приводит к усеченному белку (например, когда вставка приводит к образованию стоп-кодона). Таким образом, вставка может приводить или к усеченному белку, или к удлиненному белку в качестве продукта экспрессии.
Как используется в настоящем документе, термины «мутантная последовательность» и «мутантный ген» используют взаимозаменяемо и они относятся к последовательности, которая обладает изменением, по меньшей мере, в одном кодоне, встречающемся в последовательности клетки-хозяина дикого типа. Продукт экспрессии мутантной последовательности представляет собой белок с измененной аминокислотной последовательностью по отношению к дикому типу. Продукт экспрессии может обладать измененными функциональными возможностями (например, улучшенной ферментативной активностью).
Термины «мутагенный праймер» или «мутагенный олигонуклеотид» (используются в настоящем документе взаимозаменяемо) предназначены для обозначения олигонуклеотидных структур, которые соответствуют части матричной последовательности и которые поддаются гибридизации с ней. Что касается мутагенных праймеров, праймер не будет точно совпадать с матричной нуклеиновой кислотой, несовпадение или несовпадения в праймере используются для введения требуемой мутации в библиотеку нуклеиновых кислот. Как используется в настоящем документе, «немутагенный праймер» или «немутагенный олигонуклеотид» относятся к олигонуклеотидным структурам, которые точно совпадают с матричной нуклеиновой кислотой. В одном из вариантов осуществления изобретения используются только мутагенные праймеры. В другом предпочтительном варианте осуществления изобретения праймеры спроектированы для того, чтобы, по меньшей мере, в одной области, в которую мутагенный праймер был включен, также имел место немутагенный праймер, включенный в олигонуклеотидную смесь. Добавляя смесь мутагенных праймеров и немутагенных праймеров, соответствующих, по меньшей мере, одному из мутагенных праймеров, в результате можно создать библиотеку нуклеиновых кислот, в которой представлено множество комбинаторных мутационных шаблонов. Например, если требуется, чтобы некоторые члены библиотеки мутантных нуклеиновых кислот сохранили свою родительскую последовательность в определенных позициях, тогда как другие члены являлись мутантами в таких сайтах, немутагенные праймеры предоставляют способность получить конкретный уровень немутантных членов в библиотеке нуклеиновых кислот для заданного остатка. Способы по изобретению используют мутагенные и немутагенные олигонуклеотиды, которые, как правило, обладают длиной между 10-50 основаниями, более предпочтительно, длиной приблизительно 15-45 оснований. Однако может быть необходимо использовать праймеры, которые или короче 10 оснований, или длиннее 50 оснований, для получения требуемого результата мутагенеза. В отношении соответствующих мутагенных и немутагенных праймеров не обязательно, чтобы соответствующие олигонуклеотиды были одинаковой длины, но только чтобы происходило перекрытие в области, соответствующей вводимой мутации.
В некоторых вариантах осуществления праймеры добавляют в предопределенном соотношении. Например, если требуется, чтобы полученная библиотека имела значительный уровень определенной специфической мутации и меньшее количество отличающейся мутации в том же или другом сайте, посредством подбора количества добавляемого праймера можно создать требуемую смещенную библиотеку. Альтернативно, добавляя большие или меньшие количества немутагенных праймеров, можно регулировать частоту, с которой соответствующая мутация(и) образуется в библиотеке мутантных нуклеиновых кислот.
Как используется в настоящем документе, фраза «смежные мутации» относится к мутациям, которые присутствуют в одном олигонуклеотидном праймере. Например, смежные мутации могут быть прилегающими или близкими друг к другу, однако они будут введены в конечные мутантные матричные нуклеиновые кислоты с помощью одного праймера.
Как используется в настоящем документе, фраза «несмежные мутации» относится к мутациям, которые представлены отдельными олигонуклеотидными праймерами. Например, несмежные мутации будут введены в конечные мутантные матичные нуклеиновые кислоты с помощью раздельно изготовленных олигонуклеотидных праймеров.
Термины «последовательность дикого типа», «последовательность нуклеиновой кислоты дикого типа» и «ген дикого типа», используемые в настоящем документе взаимозаменяемо, относятся к последовательности, которая является нативной или встречающейся в природе в клетке-хозяине. В некоторых вариантах осуществления последовательность дикого типа относится к интересующей последовательности, которая представляет собой начальную точку проекта по конструированию белка. Последовательность дикого типа может кодировать или гомологичный, или гетерологичный белок. Гомологичный белок представляет собой белок, который клетка-хозяин будет продуцировать без вмешательства. Гетерологичный белок представляет собой белок, который клетка-хозяин не будет продуцировать без вмешательства.
Термин «окислительно устойчивый» относится к протеазам по настоящему изобретению, которые сохраняют определенное количество ферментативной активности в течение заданного периода времени в условиях, преобладающих в процессе протеолиза, гидролиза, очистки или другого процесса по изобретению, например, когда они подвергаются или приводятся в контакт с отбеливателями или окисляющими средствами. В некоторых вариантах осуществления протеазы сохраняют, по меньшей мере, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 92%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99% протеолитической активности после контакта с отбеливающим или окисляющим средством в течение заданного периода времени, например, по меньшей мере, 1 минута, 3 минуты, 5 минут, 8 минут, 12 минут, 16 минут, 20 минут и т.д.
Термин «хелатирующий агент-стабильный» относится к протеазам по настоящему изобретению, которые сохраняют определенное количество ферментативной активности в течение заданного периода времени в условиях, преобладающих в ходе протеолиза, гидролиза, очистки или другого процесса по изобретению, например, когда они подвергаются или приводятся в контакт с хелирующими агентами. В некоторых вариантах осуществления протеазы сохраняют, по меньшей мере, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 92%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99% протеолитической активности после контакта с хелатирующим агентом в течение заданного периода времени, например, по меньшей мере, 10 минут, 20 минут, 40 минут, 60 минут, 100 минут и т.д.
Термины «термически стабильный» и «термостабильный» относятся к ферментам по настоящему изобретению, которые сохраняют определенное количество ферментативной активности после воздействия установленных температур в течение заданного периода времени в условиях, преобладающих в процессе ферментативной обработки, гидролиза, очистки или другого процесса по изобретению, например, когда их подвергают воздействию измененных температур. Измененные температуры включают повышенные или пониженные температуры. В некоторых вариантах осуществления протеазы сохраняют, по меньшей мере, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 92%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99% протеолитической активности после воздействия измененных температур в течение заданного периода времени, например, по меньшей мере, 60 минут, 120 минут, 180 минут, 240 минут, 300 минут и т.д.
Термины «температурно активированный» и «тепловая активность» относятся к ферментам по настоящему изобретению, которые получают определенное количество ферментативной активности при установленных температурах в течение заданного периода времени в условиях, преобладающих в течение ферментативной обработки, гидролиза, очистки или другого процесса по изобретению, например, когда они подвергаются измененным температурам. Измененные температуры включают повышенные или пониженные температуры. В некоторых вариантах осуществления протеазы получают, по меньшей мере, приблизительно 10%, приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 92%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99% или более ферментативной активности при установленных температурах в течение заданного периода времени, например, по меньшей мере, в течение 10 минут, 20 минут, 30 минут, 60 минут, 120 минут, 180 минут, 240 минут, 300 минут и т.д.
Как используется в настоящем документе, термин «химическая стабильность» относится к устойчивости белка (например, фермента) к химическим реактивам, которые неблагоприятно влияют на его активность. В некоторых вариантах осуществления такие химические реактивы включают в качестве неограничивающих примеров перекись водорода, надкислоты, анионные детергенты, катионные детергенты, неионные детергенты, хелатирующие агенты и т.д. Однако не планируется, что настоящее изобретение будет ограничено любым конкретным уровнем химической стабильности или пределами химической стабильности. В частности, термины «стабильный в детергенте» и «LAS-стабильный» относятся к протеазам по настоящему изобретению, которые сохраняют определенное количество ферментативной активности после воздействия моющего состава в течение заданного периода времени в условиях, преобладающих в ходе протеолиза, гидролиза, очистки или другого процесса по изобретению. В некоторых вариантах осуществления протеазы сохраняют, по меньшей мере, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 92%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99% протеолитической активности после воздействия детергента в течение заданного периода времени, например, по меньшей мере, 60 минут, 120 минут, 180 минут, 240 минут, 300 минут и т.д.
Как используется в настоящем документе, термин «стабильность при мытье» относится к стабильности белка (например, фермента) в условиях, преобладающих в ходе ферментативной обработки, гидролиза, очистки или другого процесса по изобретению. Однако не планируется, чтобы настоящее изобретение ограничивалось любым конкретным уровнем стабильности при мытье. В частности, термины «стабильный при мытье» и «стабильность в условиях мытья» относятся к протеазам по настоящему изобретению, которые сохраняют определенное количество ферментативной активности в течение заданного периода времени в условиях, преобладающих в ходе ферментативного гидролиза, очистки или другого процесса по изобретению. В некоторых вариантах осуществления протеазы сохраняют, по меньшей мере, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 92%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99% протеолитической активности после воздействия детергента в течение заданного периода времени, например, по меньшей мере, в течение 5 минут, 10 минут, 30 минут, 60 минут, 120 минут, 180 минут, 240 минут, 300 минут и т.д.
Термины «увеличенная стабильность» или «уменьшенная стабильность» в контексте окисления, хелатирования, термически и/или pH-стабильного фермента относится к более или менее сохраненной ферментативной активности со временем по сравнению с соответствующими ферментами дикого типа.
Термины «увеличенная стабильность» или «уменьшенная стабильность» в контексте окисления, хелатирования, термически и/или pH-стабильного фермента относится к более или менее сохраненной ферментативной активности со временем по сравнению с соответствующими ферментами дикого типа.
Термин «увеличенная стабильность» в контексте окисления, хелатирования, термически и/или pH-стабильной протеазы относится к сохранению более высокой протеолитической активности в течение времени по сравнению с другими сериновыми протеазами (например, субтилизиновые протеазы) и/или ферментами дикого типа.
Термин «уменьшенная стабильность» в контексте окисления, хелатирования, термически и/или pH-стабильной протеазы относится к сохранению более низкой протеолитической активности в течение времени по сравнению с другими сериновыми протеазами (например, субтилизиновыми протеазы) и/или ферментами дикого типа.
Как используется в настоящем документе, термины «польза» и «благоприятный результат» относятся к следствию от улучшения белка для того, чтобы сделать его более пригодным для применения к животным, человеку и в промышленности. В некоторых вариантах осуществления благоприятный результат напрямую связан с использованием белка в конечном запланированном применении, таком как чистящая эффективность очищающие протеазы, тогда как в других вариантах осуществления он предоставляет пользу, касающуюся его производства. Примеры благоприятных результатов включают в качестве неограничивающих примеров улучшения в: связывании субстрата, ингибировании фермента, скоростях реакций, стабильности в детергенте, тепловой стабильности, тепловой активности, конформационной стабильности, устойчивости к протеолизу и/или автолизу, уровнях экспрессии, растворимости, восстанавливаемости, pH профиле активности, эмульгируемости, способности к пенообразованию и смачиванию.
Как используется в настоящем документе, термины «является экзотермическим» и «является эндотермическим» используются в соответствии с их обыкновенными значениями в данной области. В некоторых аналитических системах, описываемых в настоящем документе, сохраняемая доля активности меньше единицы указывает на то, что вариант менее активен при высоких температурах (например, «является экзотермическим») и таким образом более пригоден для применения при низких температурах. С другой стороны, сохраняемая доля активности больше единицы указывает на то, что вариант является более активным при высоких температурах (например, «является эндотермическим») и таким образом является более пригодным для применения при высоких температурах.
Как используется в настоящем документе, термин «физическое свойство» относится к любому параметру, пригодному для описания физико-химических характеристик белка. Как используется в настоящем документе, используемые взаимозаменяемо «интересующее физическое свойство» и «интересующее свойство» относятся к физическим свойствам белков, подлежащих исследованию и/или модифицикации. Термин «белок» в общем смысле охватывает ферменты, полипептиды и полиэлектролиты. Примеры физических свойств включают в качестве неограничивающих примеров суммарный поверхностный заряд и распределение заряда на поверхности белка, суммарную гидрофобность и распределение гидрофобных остатков на поверхности белка, плотность поверхностных зарядов, плотность распределения гидрофобности по поверхности, общее количество поверхностных ионизируемых групп, поверхностное натяжение, размер белка и его распределение в растворе, температуру плавления, теплоемкость и второй вириальный коэффициент.
Как используется в настоящем документе, термин «чистящий состав» включает, если не указано иначе, гранулированные или порошковые моющие средства общего назначения или для жестких условий, в частности чистящие детергенты; жидкие, гелеобразные или пастообразные моющие средства общего назначения, в частности, так называемые жидкости для жестких условий; жидкие детергенты для деликатной материи; средства для ручного мытья посуды или облегченные средства для мытья посуды, в частности средства с обильным пенообразованием; средства для автоматического мытья посуды, включая различные таблетированные, гранулированные, жидкие средства и средства для ополаскивания посуды для домашнего и институционального применения; жидкие чистящие и дезинфицирующие средства, включая антибактериальные средства для ручного мытья, чистящие плитки, полоскания для рта, очищающие средства для зубов и полости рта, шампуни для автомобилей и ковров, чистящие средства для ванных комнат; шампуни и ополаскиватели для волос; гели для душа и пены для ванны и средства для очистки металла; а также вспомогательные чистящие средства, такие как отбеливающие добавки и средства для «stain-stick» или предварительной обработки.
Как используется в настоящем документе, термины «моющий состав» и «моющий состав» используются в отношении смесей, которые предназначены для использования в моющей среде для очистки испачканных предметов. В некоторых предпочтительных вариантах осуществления, термин используется в отношении стирки материи и/или предметов одежды (например, «детергенты для стирки»). В альтернативных вариантах осуществления, термин относится к другим детергентам, таким как детергенты, используемые для очистки посуды, столовых приборов и т.д. (например, «детергенты для мытья посуды»). Не планируется, что настоящее изобретение должно ограничиваться любым конкретным моющим составом или композицией. Фактически, предполагается, что термин охватывает детергенты, которые содержат поверхностно-активные вещества, трансфераза(ы), гидролитические ферменты, оксидоредуктазы, моющие компоненты, отбеливатели, активаторы отбеливания, синьки и флуоресцентные красители, ингибиторы слеживания, маскирующие агенты, активаторы ферментов, антиоксиданты и солюбилизаторы.
Как используется в настоящем документе, термин «эталонный буфер» относится к буферу с известным pH и ионной силой, который используют для измерения интересующего свойства (например, электрокинетического потенциала).
Как используется в настоящем документе, термин «улучшенный вариант» относится к варианту фермента, который проявляет показатель эффективности, превышающий 1,0, по отношению к дикому типу или другой родительской молекуле, которая указана в контексте.
Как используется в настоящем документе, термин «вариант фермента, специфичный к краске-субстрату» относится к ферменту, который предпочтительно гидролизует конкретную краску в присутствии других красок.
Как используется в настоящем документе, термин «интересующий анализ» относится к любому способу тестирования, используемому для определения конкретного интересующего свойства фермента. В некоторых вариантах осуществления используются множественные интересующие анализы.
Как используется в настоящем документе, «увеличенную эффективность» в детергенте определяют как увеличение очистки от красок (например, травы, чая, вина, крови, dingy, пищи и т.д.), которое определяют посредством обыкновенной оценки после стандартного цикла стирки. В конкретных вариантах осуществления варианты фермента по настоящему изобретению обеспечивают увеличенную эффективность при удалении цветных красителей и грязи. В дополнительных вариантах осуществления ферменты по настоящему изобретению обеспечивают увеличенную эффективность при удалении и/или обесцвечивании красок.
Как используется в настоящем документе, термин «чистящий состав для твердых поверхностей» относится к моющим составам для очистки твердых поверхностей, таких как полы, стены, кафель, оборудование для ванн и кухонь и т.п. Такие композиции предоставляются в любой форме, включая в качестве неограничивающих примеров твердые вещества, жидкости, эмульсии и т.д.
Как используется в настоящем документе, «композиция для мытья посуды» относится ко всем формам композиции для очистки посуды, включая в качестве неограничивающих примеров гранулированные и жидкие формы.
Как используется в настоящем документе, «чистящий состав для материи» относится ко всем формам моющих составов для очистки материи, включая в качестве неограничивающих примеров, гранулированные, жидкие и кусковые формы.
Как используется в настоящем документе, «текстиль» относится к тканой материи, а также штапельным волокнам и нитям, пригодным для превращения в или использования в качестве пряжи, тканой, вязаной или нетканой материи. Термин охватывает пряжи, изготовленные из натуральных, а также синтетических (например, искусственных) волокон.
Как используется в настоящем документе, «текстильные материалы» является общим термином для волокон, промежуточных продуктов из пряжи, пряжи, материи и изделий, выполненных из материи (например, предметы одежды и другие вещи).
Как используется в настоящем документе, «материя» охватывает любые текстильные материалы. Таким образом, предполагается, что термин охватывает предметы одежды, а также материю, пряжи, волокна, нетканые материалы, натуральные материалы, синтетические материалы и любой другой текстильный материал.
Как используется в настоящем документе, термин «совместимый» обозначает, что вещества чистящего состава не снижают ферментативную активность ферментов по настоящему изобретению до такой степени, что ферменты становятся неэффективны, как это требуется в случаях нормального использования. Конкретные вещества чистящего состава детально проиллюстрированы ниже в настоящем документе.
Как используется в настоящем документе, «эффективное количество фермента» относится к количеству фермента, необходимому для достижения ферментативной активности, требуемой для конкретного применения (например, продукт личной гигиены, чистящий состав и т.д.). Такие эффективные количества легко устанавливаются специалистом в данной области и основываются на множестве факторов, таких как конкретный используемый вариант фермента, применение для очистки, конкретная композиция чистящего состава и требуется ли жидкая или сухая (например, гранулированная, кусковая) композиция и т.п.
Как используется в настоящем документе, «чистящие композиции не для материи» охватывает чистящие композиции для твердых поверхностей, композиции для мытья посуды, чистящие композиции для личной гигиены (например, чистящие композиции для полости рта, чистящие композиции для зубов, персональные чистящие композиции и т.д.), и композиции, пригодные для использования в целлюлозной и бумажной промышленности.
Если не указано иначе, концентрации всех компонентов или композиции находится в соответствии с активной концентрацией того компонента или композиции, за исключением примесей, например, остаточных растворителей или побочных продуктов, которые могут присутствовать в коммерчески доступных источниках.
Массы ферментативных компонентов основаны на общем активном белке. Все процентные содержания и отношения вычисляются по массе, если не указано иначе. Все процентные содержания и отношения вычисляются на основе целой композиции, если не указано иначе.
Следует понимать, что каждое максимальное числовое ограничение, даваемое на всем протяжении этого описания, включает каждое нижнее числовое ограничение, как если бы такие нижние числовые ограничения были явно указаны в настоящем документе. Каждое минимальное числовое ограничение, даваемое на всем протяжении этого описания, будет включать каждое верхнее числовое ограничение, как если бы такие верхние числовые ограничения были явно указаны в настоящем документе. Каждый числовой диапазон, указанный на всем протяжении этого описания, будет включать каждый числовой диапазон, который входит в пределы такого широкого числового диапазона, как если бы более узкие числовые диапазоны были явно указаны в настоящем документе.
Термин «активность очистки» относится к эффективности очистки, достигаемой ферментом в условиях, преобладающих в ходе ферментативной обработки, гидролиза, очистки или другого процесса по изобретению. В некоторых вариантах осуществления эффективность очистки определяют посредством применения различных чистящих тестов, относящихся к чувствительным к ферменту краскам, например, траве, крови, молоку или яичному белку, которая определяется различными хроматографическими, спектрофотометрическими или другими количественными способами после того, как краски подвергают стандартным условиям мытья. Образцовые анализы включают в качестве неограничивающих примеров анализы, описанные в WO 99/34011 и патенте США № 6605458 (которые включены в настоящий документ в качестве ссылки), а также те способы, которые включены в примеры.
Термин «эффективное для очистки количество» фермента относится к количеству протеазы, описываемой в настоящем документе, перед которым достигается требуемый уровень ферментативной активности в конкретном чистящем составе. Такие эффективные количества легко определяются специалистом в данной области и основаны на многих факторах, таких как конкретный используемый фермент, чистящее применение, конкретная композиция чистящего состава и требуется ли жидкая или сухая (например, гранулированная, кусковая) композиция и т.д.
Термин «вспомогательные очищающие вещества», как используется в настоящем документе, обозначает любое жидкое, твердое или газообразное вещество, выбранное для конкретного требуемого типа чистящего состава и формы продукта (например, жидкость, гранулы, порошок, кусок, паста, спрей, таблетка, гель или пенная композиция), эти вещества также предпочтительно совместимы с протеолитическим ферментом, используемым в композиции. В некоторых вариантах осуществления гранулированные композиции находятся в «компактной» форме, тогда как в других вариантах осуществления жидкие композиции находятся в «концентрированной» форме.
Термины «увеличенная эффективность» и «благоприятное свойство» в контексте активности очистки относятся к увеличенной или повышенной активности очистки определенных чувствительных к ферменту красок, таких как кровь-молоко-чернила, яйца, трава, чай, вино и т.д., которую определяют посредством обычной оценки после стандартного цикла стирки и/или множества циклов отмывки по сравнению с родительским ферментом. В конкретных вариантах осуществления варианты протеазы по настоящему изобретению предоставляют увеличенную эффективность при удалении окрашенных красок.
Термины «уменьшенная эффективность» и «неблагоприятное свойство» в контексте активности очистки относятся к сниженной или меньшей активности очистки конкретных чувствительных к ферменту красок, таких как кровь-молоко-чернила, яйца, трава, чай, вино и т.д., которую определяют посредством обычной оценки после стандартного цикла стирки по сравнению с родительским ферментом.
Термины «сравнительная эффективность» и «приемлемое свойство» в контексте активности очистки относятся, по меньшей мере, приблизительно к 60%, по меньшей мере, приблизительно 70%, по меньшей мере, приблизительно 80%, по меньшей мере, приблизительно 90% или, по меньшей мере, приблизительно 95% активности очистки сравниваемого фермента (например, коммерчески доступных протеаз). Эффективность очистки может быть определена посредством сравнения протеаз по настоящему изобретению с другими протеазами в различных чистящих тестах, касающихся чувствительных к ферменту красок, таких как кровь, молоко и/или чернила (КМЧ), которую определяют с помощью обыкновенных спектрофотометрических или аналитических способов после цикла стирки при стандартных условиях.
Как используется в настоящем документе, система «с низкой концентрацией детергента» содержит детергенты, в которых приблизительно менее 800 м.д. моющих компонентов присутствуют в воде для мытья. Японские детергенты типично рассматриваются как системы с низкой концентрацией детергента, так как обычно они содержат приблизительно 667 м.д. моющих компонентов, присутствующих в воде для стирки.
Как используется в настоящем документе, системы «со средней концентрацией детергента» содержат детергенты, где между приблизительно 800 м.д. и приблизительно 2000 м.д. моющих компонентов присутствует в воде для стирки. Как правило, североамериканские детергенты рассматриваются как системы со средней концентрацией детергента, так как они обычно содержат приблизительно 975 м.д. моющих компонентов, присутствующих в воде для стирки. Бразильские детергенты типично содержат приблизительно 1500 м.д. моющих компонентов, присутствующих в воде для стирки.
Как используется в настоящем документе, системы «с высокой концентрацией детергента» содержат детергенты, где приблизительно больше 2000 м.д. моющих компонентов присутствует в воде для стирки. Европейские детергенты как правило рассматриваются как системы с высокой концентрацией детергента, так как они содержат приблизительно 3000-8000 м.д. моющих компонентов в воде для стирки.
Как используется в настоящем документе, «чистящие композиции для материи» включают моющие составы для ручной и машинной стирки, включая добавочные композиции для стирки и композиции, пригодные для использования при замачивании и/или предварительной обработке окрашенной материи (например, одежды, полотен и других текстильных материалов).
Как используется в настоящем документе, «чистящие композиции не для материи» включают чистящие композиции для нетесктильных (т.е. не материи) поверхностей, включая в качестве неограничивающих примеров моющие составы для мытья посуды, чистящие композиции для полости рта, чистящие композиции для зубов и персональные чистящие композиции.
«Компактная» форма чистящих композиций в настоящем документе лучше всего отражена в плотности и, с точки зрения композиции, в количестве наполнителей из неорганических солей. Наполнители из неорганических солей представляют собой традиционные ингредиенты моющих составов в порошковой форме. В традиционных моющих составах солевые наполнители присутствуют в существенных количествах, типично 17-35% по массе от общей композиции. В отличие от этого в компактных композициях солевые наполнители присутствуют в количествах, не превышающих 15% от общей композиции. В некоторых вариантах осуществления солевые наполнители присутствуют в количествах, которые не превышают 10% или, более предпочтительно, 5% по массе композиции. В некоторых вариантах осуществления наполнители из неорганических солей выбраны из сульфатов и хлоридов щелочных и щелочноземельных металлов. Предпочтительный солевой наполнитель представляет собой сульфат натрия.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к эффективным способам получения белка с одной или несколькими полезным характеристиками для промышленного, потребительского или фармацевтического применения. В некоторых предпочтительных вариантах осуществления настоящее изобретение относится к способам производства превосходных ферментов для заданного применения посредством скрининга сокращенного набора испытываемых ферментов.
Большая часть стратегий, используемых в настоящее время для улучшения эффективности белка для промышленного, потребительского или фармацевтического применения, сосредоточена на заменах аминокислот в или около активного центра фермента для того, чтобы увеличить каталитическую эффективность. Однако, в процессе разработки настоящего изобретения, было установлено, что мутации еще где-либо на поверхности фермента кардинально увеличивают эффективность фермента сверх того, чего возможно достичь посредством улучшения каталитической эффективности. По существу, скорость реакции, управляющая опосредованным ферментами превращением субстратов в продукты, только частично контролируется скоростью самой стадии химического каталитического превращения. Ферменты и субстраты взаимодействуют в качестве коллоидной системы перед их соединением в виде фермент-субстратного ES комплекса, а также в процессе разрушения комплекса фермент-продукт EP, который образуется после химического превращения. Даже если реакционная стадия проходит при высокой скорости, сближение фермента и субстрата может быть чрезвычайно медленным (например, диффузионно-ограниченным), как в случае коллоидных частиц с одинаковыми зарядами, испытывающих электростатические силы отталкивания. Подобным образом высвобождение фермента из комплекса фермент-продукт EP может быть чрезвычайно низким (например, диффузионно-ограниченным), как в случае коллоидных систем, испытывающих близкодействующие притягивающие гидрофобные и диспергирующие силы. Оба состояния увеличивают ферментативное время преобразования из субстрата в продукт и становятся стадией, ограничивающей скорость по сравнению с химическим превращением. Тогда как легко представить себе, что противоположно заряженные коллоидные частицы фактически будут ускорять образование ES комплексов (например, выше диффузионного предела), то последующее разрушение EP комплекса будет мучительно медленным (если предположить, что заряды не образовались и не исчезли) и общая скорость реакции будет снижена. Следовательно, асимметрия попарного взаимодействия потенциально используется для того, чтобы обеспечить минимальное время преобразования как для ES, так и для EP комплекса. Это особенно важно в промышленной биотехнологии, поскольку желательно превратить весь субстрат в продукт за кратчайшее время, возможное в частых условиях ограничения ферментом. Исторически белковые инженеры сосредотачивались на конкретных фермент-субстратных взаимодействиях стадии химического превращения и не достигли успеха при выявлении вклада как близко-, так и дальнодействующих неспецифических взаимодействий, возникающих из межмолекулярных коллоидных и поверхностных сил, которые управляют стадиями ассоциации и диссоциации. Целью настоящего изобретения является оптимизация межмолекулярных сил до точки, в которой стадия химического превращения сделается ограничивающей скорость. Когда стадия химического превращения станет ограничивать скорость, она может быть улучшена посредством изменений в активном центре фермента. Эта цель уместна, или если субстрат представляет собой маленький пептид в растворе, или в случае нерастворимого макроскопического субстрата. Тем не менее знание вовлеченного механизма(ов) не необходимо для того, чтобы выполнить и использовать настоящее изобретение. Также не предполагается, что настоящее изобретение должно ограничиваться любым конкретным механизмом.
В качестве примера, в применениях для стирки в жидкости, наблюдали оптимальное для эффективности значение заряда между ферментом и субстратом в виде заряженной краски. Не ограничиваясь теорией, когда фермент и субстраты в виде красок имеют сильные заряды противоположных знаков, обнаруживается низкая эффективность, вероятно, из-за крепкого непродуктивного связывания. Наоборот, когда их сильные заряды обладают одним знаком, обнаруживается низкая эффективность, вероятно, из-за увеличенного отталкивания. Для заданной укладки фермента это оптимальное для эффективности значение заряда достоверно описывается в единицах суммарного заряда по отношению к родительскому ферменту. Однако при сравнении эффективности среди различных укладок фермента должна применяться общая шкала. Примеры общих шкал включают в качестве неограничивающих примеров заряд фермента, экспериментально установленный через электрокинетический потенциал, электрофоретические, водород-ионные титриметрические измерения или даже вычисления с использованием общедоступного (например, SwissProt) или коммерческого программного обеспечения (например, DelPhi, MOE). Как описано в настоящем документе, для заданной краски-субстрата и моющего состава оптимальные ферменты из различных укладок проявляют сравнимый суммарный заряд. Эта находка предоставляет основу для способов быстрой идентификации самых эффективных ферментов для заданного применения в любой реакционной среде.
На положение оптимального значения эффективности в значительной степени влияет используемая среда (например, моющий состав, pH, ионная сила и т.п.), а также суммарный заряд и распределение зарядов аминокислотных остатков интересующего фермента. Таким образом, предполагается существование оптимального фермента для различных составов с меняющимися pH, ионной силой, типом и содержанием поверхностно-активного вещества, моющими компонентами и хелатирующими агентами, все из них влияют на электростатические явления. Использование смесей ферментов, в которых каждый член смеси обладает отличающимся оптимальным значением заряда, предполагается для производства составов, пригодных для широкого диапазона условий (например, протеазы в чистящих составах, продаваемых в различных географических областях или районов, обладающих различиями в жесткости воды). Использование смесей ферментов, в которых каждый член смеси отлично очищает определенную краску, также рассматривается для производства составов, пригодных для очистки большого разнообразия красок. Дополнительно, использование смесей ферментов, в которых каждый член смеси обладает отличающимся оптимальным значением заряда, рассматривается в случаях, когда сам субстрат фермента подвергается изменениям заряда в ходе ферментативной реакции.
Хотя описание в настоящем документе относится к протеазам и кровяным, молочным и чернильным краскам, способы по настоящему изобретению пригодны для оптимизации любого фермент-субстратного взаимодействия в любой реакционной среде. В частности, способы по настоящему изобретению рассматриваются для использования при улучшении свойств других протеаз и классов ферментов (например, амилаз, целлюлаз, оксидаз, липаз, кутиназ, пектиназ, маннаназ и т.д.). Дополнительно, способы по настоящему изобретению рассматриваются в качестве пригодных для использования при улучшении свойств ферментов и других белков в других составах (например, буферах).
В некоторых вариантах осуществления способы по настоящему изобретению находят применение при улучшении целлюлаз. Целлюлазы взаимодействуют с целлюлозными субстратами для предоставления множества преимуществ во многих промышленных применениях. Это включает в качестве неограничивающих примеров влияние на текстильные изделия при окраске одежды из грубых тканей, очистка материи от краски при стирке, удаление пиллинга и предотвращение пиллинга хлопковых и хлопок/синтетических смесей волокон, и расщепление биомассы на сбраживаемые сахара. Эффективность целлюлаз во всех этих применениях может быть улучшена посредством оптимизации их поверхностных зарядов и/или гидрофобностей, как описано в настоящем документе для протеаз, для получения оптимальной эффективности при заданных условиях применения. В частности, одна из основных проблем, связанных с использованием целлюлаз в применениях по уходу за текстилем и материей, состоит в том, что обработка целлюлазой приводит к обветшанию материи. Поскольку материя представляет собой заряженную поверхность, применение способов по настоящему изобретению для оптимизации заряда на поверхности фермента находит применение для предотвращения проникновения целлюлазы внутрь волокон. Варианты фермента, обладающего оптимальным зарядом, все же могут шлифовать поверхность, реагируя с поверхностью волокна, но не могут проникать через поверхность. Таким образом, настоящее изобретение относится к способам для получения целлюлаз, обладающих хорошей эффективностью при уходе за материей при меньшей потере прочности материи. В некоторых дополнительных вариантах осуществления, улучшенные целлюлазы, предоставленные настоящим изобретением, находят применение для биомассы и другие применения.
Кроме того, способы по настоящему изобретению находят применение для улучшения амилаз, используемых для гидролиза крахмала, что полезно в различных коммерческих и промышленных применениях.
Полиэстеразы и кутиназы используются для модификации поверхностей полиэфиров. Эта реакция находит применение при предоставлении преимуществ в уходе за материей для полиэфирных и полиэфир/хлопковых смесей. Одним из основных недостатков известных ферментов является то, что они очень крепко связываются с материей. Это приводит к низкой эффективности фермента во множестве применений по уходу за материей. Настоящее изобретение относится к средствам для повышения эффективности полиэстераз и кутиназ посредством модификации поверхностного заряда и/или гидрофобности этих ферментов.
Липазы используются в применениях для стирки для очистки от маслянистых красок. Как правило, эти краски являются крайне гидрофобными. Настоящее изобретение относится к средствам для повышения эффективности липаз посредством оптимизации поверхностного заряда и/или гидрофобности этих ферментов. Другим недостатком применения липаз является образование неприятного запаха в результате связывания липазы с материей и/или краской. Подобным образом настоящее изобретение находит применение при минимизации образования неприятного запаха посредством оптимизации поверхностного заряда и/или гидрофобности липазы(з) для ослабления связывания фермента с материей.
Обычно для чистящих композиций требуются составы, которые содержат протеазу наряду с непротеолитическими ферментами. Часто протеазы разрушают другие ферменты, а также самих себя (т.е. посредством автолиза). В настоящее время это решено посредством добавления соединений, которые ингибируют протеазы.
Настоящее изобретение находит применение при увеличении устойчивости ферментов к протеолизу посредством определения оптимального значения физического свойства данного фермента при устойчивости к протеазе.
В кратком изложении способы по настоящему изобретению вовлекают одну или несколько стадий, подробно описанных ниже: (I) анализ зондовых белков, охватывающих диапазон физического свойства; (II) определение оптимального значения физического свойства для заданного благоприятного результата; и (III) предоставление вариантов белка, обладающих оптимальным значением физического свойства.
I. Анализ зондовых белков
В некоторых вариантах осуществления эта стадия вовлекает тестирование множества зондовых белков (т.е. «укладок зондовых белков»), охватывающих диапазон интересующего физического свойства (т.е. «интересующее свойство») в соответствующем анализе. В некоторых вариантах осуществления зондовые белки содержат ограниченный набор белков и/или их вариантов. В некоторых образцовых вариантах осуществления эта стадия включает тестирование множества сериновых протеаз и/или металлопротеаз (например, двух различных укладок белка) на одно или несколько преимуществ. Например, предоставлены варианты двух протеаз со шкалой зарядов, ASP (сериновая протеаза) и NprE (нейтральная металлопротеаза). Варианты протеазы ASP со шкалой зарядов, как описано в настоящем документе, охватывают относительное изменение суммарного заряда в диапазоне от -4 до +4 по сравнению с родительской ASP (например, R14I) или от -5 до +3 по сравнению с ASP дикого типа. В некоторых вариантах осуществления набор зондовых белков также содержит коммерчески доступные белки, которые служат в качестве базовой отметки для запланированного применения (например, субтилизин, используемый в чистящих составах).
II. Определение оптимального значения физического свойства
В некоторых предпочтительных вариантах осуществления эта стадия включает установление оптимального значения физического свойства или его диапазона для благоприятного результата. В некоторых образцовых вариантах осуществления измеряли эффективность очистки для вариантов протеазы со шкалой зарядов. При сравнении преимуществ, полученных с помощью белков с различными укладками, использовалась общая шкала физического свойства (например, заряд белка представляли как электрокинетический потенциал). В отличие от этого, при сравнении преимуществ, полученных с помощью белков, обладающих одинаковой укладкой, может использоваться относительная шкала (например, изменение суммарного заряда по отношению к белку дикого типа или родительскому белку). В некоторых особенно предпочтительных вариантах осуществления, использовались зондовые белки, охватывающие широкий диапазон физического свойства, для того, чтобы увеличить вероятность обнаружения оптимального значения для этого физического свойства. При установлении величины оптимального значения или диапазона оптимальных значений для интересующего преимущества посредством тестирования зондовых белков можно предсказать как общее направление, так и амплитуду изменения, вероятно, необходимые для превращения образца с низкой эффективностью (например, лежащей за рамками оптимального диапазона) в образец с превосходной эффективностью (например, в рамках оптимального диапазона).
Использование более одной серии зондовых белков рассматривается для того, чтобы дать возможность установить различные оптимумы физического свойства для интересующего преимущества. Например, в некоторых вариантах осуществления, для очищающей протеазы как шкалы зарядов, так и шкалы гидрофобности тестируют на эффективность очистки в анализе с кровью-молоком-чернилами. Наоборот, рассматривается, что одно физическое свойство может проявлять различные оптимумы для различных преимуществ. Например, существует оптимальный заряд протеазы для эффективной очистки для NprE, который отличается от оптимального заряда протеазы для стабильности в детергенте.
В некоторых вариантах осуществления связанные с зарядом физические свойства сравнивают среди белков с различной укладкой в единицах измеренного электрокинетического потенциала, суммарного заряда, плотности заряда и/или количества ионизируемых групп на поверхности. В основном, любой способ определения заряда белка на основе титрования или электрофоретических измерений пригоден для сравнения различных укладок белков. В некоторых альтернативных вариантах осуществления, сравнение различных укладок белков осуществляют посредством вычисления одной или нескольких из вышеупомянутых величин исходя, по возможности, из первичной, вторичной и/или третичной структуры. Используемые для этих целей обычные биоинформационные инструменты включают расчет изоэлектрической точки с использованием уравнения Хендерсона-Хессельбаха (например, European Molecular Biology Laboratory) или электростатического уравнения Пуассона-Больцмана (например, DelPhi, MOE).
В некоторых вариантах осуществления связанные с гидрофобностью физические свойства сравнивают среди белков с различными укладками в отношении измеренного распределения белка между его естественной водной средой и гидрофобной фазой. В качестве неограничивающих примеров, примеры включают поверхностное натяжение на границах раздела воздух-вода и гетпан-вода, а также контактный угол и измерения смачивания между водной фазой и фазой, содержащей твердый субстрат. В основном, любой способ, пригодный для описания распределения белка между двумя фазами, пригоден для использования в настоящем изобретении, включая оптические (например, эллипсометрия, поверхностный плазмонный резонанс, интерферометрия и/или коэффициент отражения), акустические (например, кварцевые микровесы), флуоресцентные, спектроскопические (например, нарушенное полное инфракрасное отражение) или концентрационные (например, активность фермента) исследования. В некоторых вариантах осуществления суммарный вклад в гидрофобность вычисляют с использованием одной или нескольких из множества шкал гидрофобности аминокислот, доступных из литературы и известных в данной области, которые учитывают информацию о первичной, вторичной и/или третичной структуре белка.
Шкалы зарядов и гидрофобности не являются независящими друг от друга, поскольку заряженные остатки добавляют гидрофобные свойства. Таким образом, вместо того, чтобы просто отдать предпочтение одной шкале относительно другой, некоторые варианты осуществления настоящего изобретения используют множество различных шкал (например, теоретически или экспериментально установленных) для установления зависимостей физического свойства. Ссылки на 23 наиболее общеупотребительных шкалы гидрофобности включают: гидрофобность (Rao и Argos) вычисление параметра погруженности спирали в мембрану (Rao и Argos, Biochim. Biophys. Acta 869:197-214 [1986]); гидрофобность (Black и Mould) вычисление гидрофобности физиологических L-альфа аминокислот (Black и Mould, Anal. Biochem., 193:72-82 [1991]); гидрофобность (Bull и Breese) вычисление гидрофобности (свободная энергия переноса на поверхности в ккал/моль) (Bull и Breese, Arch. Biochem. Biophys. 161:665-670 [1974]); гидрофобность (Chothia) вычисление доли остатков, 95% погруженных (в 12 белках) (Chothia, J. Mol. Biol., 105:1-14 [1976]); гидрофобность (Kyte и Doolittle) вычисление гидрофобности (Kyte и Doolittle, J. Mol. Biol., 157:105-132 [1982]); гидрофобность (Eisenberg et al.) вычисление нормализованной консенсусной шкалы гидрофобности (Eisenberg et al., J. Mol. Biol. 179:125-142 [1984]); гидрофобность, (Fauchere и Pliska) вычисление шкалы гидрофобности (pi-r) (Fauchere и Pliska, Eur. J. Med. Chem., 18:369-375 [1983]); гидрофобность (Guy) вычисление шкалы гидрофобности, основанной на свободной энергии переноса (ккал/моль) (Guy, Biophys J., 47:61-70 [1985]); гидрофобность (Janin) вычисление свободной энергии переноса глобулярного белка с внутренней стороны на наружную (Janin, Nature 277:491-492 [1979]); гидрофобность (Abraham и Leo) вычисление гидрофобности (∆G1/2cal) (Abraham и Leo, Proteins: Structure, Function and Genetics 2: 130-152 [1987]); гидрофобность (Manavalan et al.) вычисление средней окружающей гидрофобности (Manavalan et al., Nature 275:673-674 [1978]); гидрофобность (Miyazawa et al.) вычисление шкалы гидрофобности (энергия контакта выведена из трехмерных данных) (Miyazawa et al., Macromolecules 18:534-552 [1985]); гидрофобность (Aboderin) вычисление подвижности аминокислот на хроматографической бумаге (RF) (Aboderin, Int. J. Biochem., 2:537-544 [1971]); гидрофобность ВЭЖХ (Parker et al.) вычисление шкалы гидрофильности, полученной из времени удержания пептида во ВЭЖХ (Parker et al., Biochem., 25:5425-5431 [1986]); Hphob. ВЭЖХ pH 3,4 вычисление индексов гидрофобности при pH 3,4, определенных посредством ВЭЖХ (Cowan и Whittaker, Peptide Res., 3:75-80 [1990]); Hphob. ВЭЖХ pH 7,5 вычисление индексов гидрофобности при pH 7,5, определенных посредством ВЭЖХ (Cowan и Whittaker, Peptide Res., 3:75-80 [1990]); гидрофобность (Rose et al.) (AA) вычисление средней частичной потери площади (f) [средняя погруженная площадь/площадь в стандартном состоянии] (Rose et al., Science 229:834-838 [1985]); и гидрофобность (Roseman) вычисление шкалы гидрофобности (pi-r) (Roseman, J. Mol. Biol., 200:513-522 [1988]).
В некоторых вариантах осуществления связанные с растворимостью физические свойства сравнивают среди белков с различной укладкой в отношении как ранее описанной шкалы заряда, так и ранее описанной шкалы гидрофобности. В основном любое термодинамическое или кинетическое количественное описание белок-белкового взаимодействия по отношению к белок-сольвентному является пригодным для использования в способах по настоящему изобретению. Например, находят применение второй вириальный коэффициент (смотрите, Wilson, Acta Crystallographica, D50:361-365 [1994]), хи-параметр, осмотическое давление и коэффициенты активности или летучести, отражающие отклонения от идеального поведения при смешивании (смотрите, например, Reid et al., «Properties of Gases and Liquids», 4th Ed. McGraw-Hill, [1987]).
В некоторых вариантах осуществления связанные с размером физические свойства сравнивают среди белков с различной укладкой с использованием любых экспериментальных средств, пригодных для определения линейных размеров белка или полимера. В дополнительных вариантах осуществления размер выводят из молекулярной массы с использованием обычно доступных корреляционных связей между конформацией белка или полимера (спираль, глобула, разветвленная), их молекулярными массами и гидродинамическим или вращательным радиусом. Пригодные способы для определения размера или молекулярной массы в качестве неограничивающих примеров включают статическое и динамическое светорассеяние, электрофорез в геле, масс-спектроскопию и хроматографию. В дополнительных вариантах осуществления размер легко оценивают исходя из знаний об экспериментально установленной кристаллической структуре белка или моделей, основанных на структурной гомологии. Температуры плавления белков (Tm) типично устанавливают посредством наблюдения за репортерным физическим свойством на протяжении температурного сканирования. Пригодные способы включают в качестве неограничивающих примеров дифференциальную сканирующую калориметрию, циркулярный дихроизм, динамическое рассеяние света и спектроскопию в УФ-видимом спектре.
III. Предоставление вариантов белка, обладающих оптимальным значением физического свойства
Когда на предыдущей стадии была определена величина или диапазон оптимального значения, было предоставлено множество испытываемых белков, которым навязывали интересующее физическое свойство. Пригодные способы для предоставления испытываемых белков включают в качестве неограничивающих примеров создание искусственных вариантов ферментов с помощью рекомбинантных способов, а также очистку естественных вариантов фермента (например, гомологов) с помощью хроматографии, синтеза гликозилированных или фосфорилированных вариантов фермента in vitro или создание конъюгатов фермента in vitro. Другой способ изменить гидрофобность белка через гликозилирование состоит в создании новых сайтов гликозилирования на поверхности фермента. Эти варианты будут гликозилированы в процессе экспрессии in vivo.
Использование шкалы зарядов для зондовых белков ASP и NprE показало, что преимущество или благоприятный результат от изменения физического свойства хорошо описывается тем же стандартным нормальным распределением. В некоторых вариантах осуществления использовали набор зондовых белков для определения среднего и ширины этого распределения для заданного применения. Затем это распределение использовали как ориентир для определения направления и величины улучшения, необходимого для получения дополнительных вариантов фермента из такой же или отличающейся укладки, которые обладают требуемым преимуществом в тестировании при таких же условиях.
Например, оптимальные уровни экспрессии как вариантов ASP со шкалой зарядов, так и вариантов NprE со шкалой зарядов в Bacillus subtilis при одинаковых условиях роста придерживаются одинакового стандартного распределения и возникают при электрокинетических потенциалах, равных -8,84 мВ для каждого фермента. Например, оптимальная эффективность очистки вариантов ASP со шкалой зарядов красок кровь-молоко-чернила в буфере, совпадающая с североамериканским pH и удельной электропроводностью детергента, придерживается стандартного нормального распределения при оптимальном значении очистки при электрокинетических потенциалах -9,68 мВ, в основном равных таковым краски-субстрата -8,97 мВ. Дополнительно, протеазы ASP и NprE, отвечающие этому требованию к заряду, предоставлены с использованием белковой инженерии, химической модификации через ковалентные или нековалентные связи, отбор естественных изолятов и посттрансляционных модификаций (например, гликозилирования).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Следующие примеры предоставлены для того, чтобы наглядно показать и дополнительно проиллюстрировать определенные предпочтительные варианты осуществления и аспекты настоящего изобретения и не рассматриваются в качестве ограничения его объема.
В следующем раскрытии экспериментальной части используются следующие сокращения: °C (градус по Цельсию); об/мин (обороты в минуту); H2O (вода); HCl (соляная кислота); aa и AA (аминокислота); п.о. (пара оснований); т.п.н. (тысяча пар оснований); кДа (килодальтон); г (граммы); мкг (микрограммы); мг (миллиграммы); нг (нанограммы); мкл (микролитры); мл (миллилитры); мм (миллиметры); нм (нанометры); мкм (микрометры); M (молярный); мМ (миллимолярный); мкМ (микромолярный); Ед. (единицы); В (вольты); ММ (молекулярная масса); с (секунды); мин (минуты); ч (часы); MgCl2 (хлорид магния); NaCl (хлорид натрия); OD280 (оптическая плотность при 280 нм); OD405 (оптическая плотность при 405 нм); OD600 (оптическая плотность при 600 нм); PAGE (электрофорез в полиакриламидном геле); EtOH (этанол); PBS (фосфатно-солевой буфер [150 мМ NaCl, 10 мМ натрий фосфатный буфер, pH 7,2]); LAS (лаурил сульфонат натрия); SDS (додецилсульфат натрия); Трис (три(гидроксиметил)аминометан); TAED (N,N,N'N'-тетраацетилэтилендиамин); BES (сложный полиэфирсульфон); MES (2-морфолиноэтансульфоновая кислота, моногидрат; общая масса 195,24; Sigma # M-3671); CaCl2 (хлорид кальция, безводный; общая масса 110,99; Sigma # C-4901); ДМФА (N,N-диметилформамид, общая масса 73,09, d=0,95); Abz-AGLA-Nba (2-аминобензоил-L-аланилглицил-L-лейцил-L-аланино-4-нитробензиламид, общая масса 583,65; Bachem # H-6675, VWR, по каталогу # 100040-598); SBG1% («супербульон с глюкозой»; 6 г сойтона [Difco], 3 г дрожжевого экстракта, 6 г NaCl, 6 г глюкозы); pH доводили до 7,1 с помощью NaOH перед стерилизацией с использованием известных в данной области способов; масс./об. (масса к объему); об./об. (объем к объему); Npr и npr (нейтральная металлопротеаза); SEQUEST® (программа поиска в базе данных SEQUEST, University of Washington); Npr и npr (ген нейтральной металлопротеазы); nprE и NprE (нейтральная металлопротеаза из B. amyloliquefaciens); PMN (очищенная MULTIFECT® металлопротеаза); МС (масс-спектроскопия); ИУК (индекс удаления краски) и КМЧ (кровь-молоко-чернила).
Кроме того, были получены материалы из некоторых из следующих учреждений: TIGR (The Institute for Genomic Research, Rockville, MD); AATCC (American Association of Textile and Coloring Chemists); Amersham (Amersham Life Science, Inc. Arlington Heights, IL); Corning (Corning International, Corning, NY); ICN (ICN Pharmaceuticals, Inc., Costa Mesa, CA); Pierce (Pierce Biotechnology, Rockford, IL); Equest (Equest, Warwick International Group, Inc., Flintshire, UK); EMPA (Eidgenossische Material Prufungs und Versuch Anstalt, St. Gallen, Switzerland); CFT (Center for Test Materials, Vlaardingen, The Netherlands); Amicon (Amicon, Inc., Beverly, MA); ATCC (American Type Culture Collection, Manassas, VA); Becton Dickinson (Becton Dickinson Labware, Lincoln Park, NJ); Perkin-Elmer (Perkin-Elmer, Wellesley, MA); Rainin (Rainin Instrument, LLC, Woburn, MA); Eppendorf (Eppendorf AG, Hamburg, Germany); Waters (Waters, Inc., Milford, MA); Geneart (Geneart GmbH, Regensburg, Germany); Perseptive Biosystems (Perseptive Biosystems, Ramsey, MN); Molecular Probes (Molecular Probes, Eugene, OR); BioRad (BioRad, Richmond, CA); Clontech (CLONTECH Laboratories, Palo Alto, CA); Cargill (Cargill, Inc., Minneapolis, MN); Difco (Difco Laboratories, Detroit, MI); GIBCO BRL или Gibco BRL (Life Technologies, Inc., Gaithersburg, MD); New Brunswick (New Brunswick Scientific Company, Inc., Edison, NJ); Thermoelectron (Thermoelectron Corp., Waltham, MA); BMG (BMG Labtech, GmbH, Offenburg, Germany); Greiner (Greiner Bio-One, Kremsmuenster, Austria); Novagen (Novagen, Inc., Madison, WI); Novex (Novex, San Diego, CA); Finnzymes (Finnzymes OY, Finland); Qiagen (Qiagen, Inc., Valencia, CA); Invitrogen (Invitrogen Corp., Carlsbad, CA); Sigma (Sigma Chemical Co., St. Louis, MO); DuPont Instruments (Asheville, NY); Global Medical Instrumentation или GMI (Global Medical Instrumentation; Ramsey, MN); MJ Research (MJ Research, Waltham, MA); Infors (Infors AG, Bottmingen, Switzerland); Stratagene (Stratagene Cloning Systems, La Jolla, CA); Roche (Hoffmann La Roche, Inc., Nutley, NJ); Agilent (Agilent Technologies, Palo Alto, CA); Merck (Merck & Co., Rahway, NJ); Ion Beam Analysis Laboratory (Ion Bean Analysis Laboratory, The University of Surrey Ion Beam Centre (Guildford, UK); TOM (Terg-o-Meter); КМЧ (кровь-молоко-чернила); BaChem (BaChem AG, Bubendorf, Switzerland); Molecular Devices (Molecular Devices, Inc., Sunnyvale, CA); Corning (Corning International, Corning, NY); MicroCal (Microcal, Inc., Northhampton, MA); Chemical Computing (Chemical Computing Corp., Montreal, Canada); NCBI (National Center for Biotechnology Information); Beckman (Beckman-Coulter, Fullerton, CA); SeitzSchenk (SeitzSchenk Filtersystems GmbH, Bad Kreuznach, Germany); Pall (Pall Corp., East Hills, NY); и Malvern Instruments (Malvern Instruments, Inc., Worcestershire, UK).
ПРИМЕР 1
Анализы
В описанных ниже примерах использовали следующие анализы. Любые отклонения от предоставленных ниже протоколов отмечены в примерах. В этих экспериментах спектрофотометр использовали для измерения оптической плотности продуктов, образованных после завершения реакций.
A. Определение содержания белка
Анализ с БХК (бицинхониновая кислота)
В этих анализах использовали анализ с БХК (Pierce) для определения концентрации белка в образцах протеаз в масштабе планшета микротитратора (ПМТ). В этой аналитической системе использовали следующие химические растворы и растворы реактивов: реактив для анализа белка с БКХ и буфер для разведения Pierce (50 мМ MES, pH 6,5, 2 мМ CaCl2, 0,005% TWEEN®-80). Использовали оборудование: ПМТ-ридер SpectraMAX (тип 340; Molecular Devices). ПМТ были получены из Costar (тип 9017).
В тесте 200 мкл реактива с БХК раскапывали в каждую лунку, с последующим добавлением 20 мкл разбавленного белка. После тщательного перемешивания ПМТ инкубировали в течение 30 минут при 37°C. Удаляли пузырьки воздуха и считывали оптическую плотность (OD) раствора в лунках при 562 нм. Чтобы определить концентрацию белка, фоновое показание прибора вычитали из показаний прибора для образцов. Для белковых стандартов (очищенная протеаза) построили график OD562 для получения калибровочной кривой. Концентрацию белка в образцах интерполировали из калибровочной кривой.
Тест Бредфорда
В этих анализах использовали тест с окрашивающим реактивом Бредфорда (Quick Start) для определения концентрации белка в образцах протеазы в масштабе ПМТ. В этой аналитической системе использовали следующие химические растворы и растворы реактивов: окрашивающий реактив Бредфорда Quick Start (BIO-RAD, по каталогу № 500-0205), буфер для разведения (10 мМ NaCl, 0,1 мМ CaCl2, 0,005% TWEEN®-80). Использовали оборудование: робот Biomek FX (Beckman) и ПМТ-ридер SpectraMAX (тип 340). ПМТ были из Costar (тип 9017).
В тесте 200 мкл окрашивающего реактива Бредфорда раскапывали в каждую лунку, с последующим добавлением 15 мкл буфера для разведения. В конце в лунки добавляли 10 мкл фильтрованной культуральной жидкости. После тщательного перемешивания, ПМТ инкубировали, по меньшей мере, в течение 10 минут при комнатной температуре. Пузырьки воздуха выдували и OD лунок считывали при 595 нм. Для определения концентрации белка фоновое показание прибора (т.е. из неинокулированных лунок) вычитали из показаний прибора для образцов. Полученные значения OD595 предоставляют относительную меру содержания белка в образцах.
B. Анализы эффективности фермента
Детергенты, используемые в этом анализе, не содержали ферменты или ферменты, присутствующие в коммерческих детергентах, были разрушены посредством тепловой деактивации, как описано в этом документе в другом месте. Используемое оборудование включало Eppendorf Thermomixer и ПМТ-ридер SpectraMAX (тип 340). ПМТ были получены из Costar (тип 9017).
Изготовление детергента (AATCC HDL; условия США)
Воду Milli-Q доводили до твердости воды 6 gpg (Ca/Mg=3/1) и добавляли 1,5 г/л AATCC 2003 стандартного эталонного жидкого детергента без осветлителя. Моющий раствор энергично взбалтывали, по меньшей мере, в течение 15 минут. Затем добавляли 5 мМ HEPES (свободная кислота) и pH доводили до 8,0.
Анализ микрообразцов с КМЧ
Круглые микрообразцы, содержащие кровь, молоко и чернила (КМЧ), диаметром 0,25 дюйма были получены из CFT Vlaardingen. Перед вырезанием образцов ткань (EMPA 116) промывали водой. По одному микрообразцу вертикально размещали в каждой лунке 96-луночного планшета микротитратора для того, чтобы обнажить всю площадь поверхности (т.е. не плашмя на дно лунки). Требуемый моющий раствор изготавливали, как описано в настоящем документе. После уравновешивания термомиксера при 25°C в каждую лунку в ПМТ, содержащем микрообразцы, добавляли 190 мкл моющего раствора. К этой смеси добавляли 10 мкл разбавленного раствора фермента для того, чтобы конечная концентрация фермента составляла 1 мкг/мл (определяли с помощью анализа с БХК). ПМТ запечатывали лентой и помещали в инкубатор на 30 минут при встряхивании 1400 об/мин. После инкубирования при соответствующих условиях по 100 мкл раствора из каждой лунки переносили в чистых ПМТ. Новый ПМТ, содержащий 100 мкл раствора на лунку, считывали при 405 нм с использованием ПМТ-ридера SpectraMax. Также включали пустые контроли, контроль, содержащий два микрообразца и детергент без фермента.
Анализ микроочистки от печеного яйца
96-луночные планшеты с субстратом из печеного яичного желтка изготавливали из желтков куриных яиц. Желтки куриных яиц отделяли от белков, высвобождали из мембранного мешочка и разводили до 20% (объем/масса) водой Milli-Q. Разбавленный желток взбалтывали в течение 15 мин при комнатной температуре с использованием магнитной мешалки. По пять мкл аккуратно раскапывали в центр каждой лунки 96-луночного V-донного планшета (Costar #3894) с использованием 8-канальной пипетки. Планшеты запекали при 90°C в течение 1 часа и охлаждали при комнатной температуре. Планшеты с субстратом из печеного желтка яйца хранили при комнатной температуре и использовали в течение одной недели после изготовления. Детергенты для автоматического мытья посуды изготавливали, как описано в другом месте этого документа, и предварительно нагревали до 50°C. Добавляли аликовоты детергента по 190 мкл в каждую лунку 96-луночного планшета с использованием 8-канальной пипетки. В каждую лунку добавляли по десять мкл разбавленного фермента с использованием 96-канального пипеттора. Планшет аккуратно запечатывали липким фольговым изолятором и инкубировали при 50°C при встряхивании в течение 30 мин. 120 мкл реакционной смеси переносили в новых 96-луночный плоскодонный планшет, и оптическую плотность/рассеяние света определяли при 405 нм. Оптическая плотность/рассеяние света при 405 нм пропорциональна удалению яичного желтка. Анализ микрообразцов с яичным желтком
Детергенты для автоматического мытья посуды изготавливали, как описано в другом месте этого документа. Используемое оборудование включало в себя шейкер/инкубатор New Brunswick Innova 4230 и ПМТ-ридер SpectraMAX (тип 340). ПМТ были получены из Costar (тип 9017). Старый яичный желток с образцами пигмента (CS-38) получали из Центра тестовых материалов (Vlaardingen, Netherlands). Перед вырезанием 0,25-дюймовых круглых микрообразцов материю промывали водой. По одному микрообразцу помещали в каждую лунку 96-луночного планшета микротитратора. Тестовый детергент уравновешивали при 50°C. 190 мкл моющего раствора добавляли в каждую лунку ПМТ, содержащие микрообразцы. К этой смеси добавляли 10 мкл разбавленного раствора фермента. ПМТ запечатывали клейкой фольгой и помещали в инкубатор на 30 минут при встряхивании. После инкубирования 100 мкл раствора из каждой лунки переносили в свежий ПМТ. Этот ПМТ считывали при 405 нм с использованием ПМТ-ридера SpectraMax. Также были включены пустые контроли, а также контроли, содержащие микрообразцы и детергент, но без фермента.
Анализ микрообразцов с рисовым крахмалом
Анализ с рисовым крахмалом представляет собой тест на эффективность амилазы. Детергенты изготавливали, как описано в другом месте этого документа. Используемое оборудование включало шейкер/инкубатор New Brunswick Innova 4230 и ПМТ-ридер SpectraMAX (тип 340). ПМТ получали из Corning (тип 3641). Состарившийся рисовый крахмал с оранжевыми образцами пигмента (CS-28) получали из Центра тестовых материалов (Vlaardingen, Netherlands). Перед вырезанием 0,25-дюймовых круглых микрообразцов материю промывали водой. По два микрообразца помещали в каждую лунку 96-луночного планшета микротитратора. Тестовый детергент уравновешивали при 20°C (Северная Америка) или 40°C (Западная Европа). 190 мкл моющего раствора добавляли в каждую лунку ПМТ, содержащего микрообразцы. К этой смеси добавляли 10 мкл разбавленного раствора фермента. ПМТ запечатывали клейкой фольгой и помещали в инкубатор на 1 час при встряхивании при 750 об/мин при требуемой тестовой температуре (типично 20°C или 40°C). После инкубирования 150 мкл раствора из каждой лунки переносили в свежий ПМТ. Для количественной оценки очистки этот ПМТ считывали при 488 нм с использованием ПМТ-ридера SpectraMax. Также включали пустые контроли, а также содержащие микрообразцы и детергент, но без фермента.
Вычисление эффективности фермента
Полученное значение оптической плотности корректировали по пустому значению (т.е. полученному после инкубирования микрообразцов в отсутствие фермента). Полученная оптическая плотность представляла собой меру для гидролитической активности.
C. suc-AAPF-pNA анализ гидролиза для тестирования протеазной активности
В этой аналитической системе использовали следующие растворы реактивов: 100 мМ Трис/HCl, pH 8,6, 0,005% TWEEN®-80 (Трис); 100 мМ Трис/HCl, pH 8,6, 10 мМ CaCl2 и 0,005% TWEEN®-80 (Трис/Ca); и 160 мМ suc-AAPF-pNA в ДМСО (основной раствор suc-AAPF-pNA) (Sigma: S-7388). Для приготовления рабочего раствора suc-AAPF-pNA 1 мл основного раствора AAPF добавляли в 100 мл Трис/Ca буфера и хорошо перемешивали, по меньшей мере, в течение 10 секунд. Анализ проводили посредством добавления 10 мкл разбавленного раствора протеазы в каждую лунку, с последующим добавлением (быстро) 190 мкл рабочего раствора AAPF 1 мг/мл. Растворы смешивали в течение 5 с, и степень изменения оптической плотности определяли при 410 нм в ПМТ-ридере при 25°C.
D. Анализ гидролиза с диметилказеином для тестирования протеазной активности
В этой аналитической системе использовали следующие химикаты и растворы: диметилказеин (ДМК): Sigma C-9801; TWEEN®-80: Sigma P-8074; буфер PIPES (свободная кислота): Sigma P-1851 - 15,1 г растворяли приблизительно в 960 мл воды, pH доводили до 7,0 с помощью 4 н. NaOH, добавляли 1 мл 5% TWEEN®-80, и объем доводили до 1000 мл. Конечная концентрация PIPES и TWEEN®-80 составляла 50 мМ и 0,005%, соответственно; пикрилсульфоновая кислота (TNBS): Sigma P-2297 (5% раствор в воде); реактив A: 45,4 г Na2B4O7·10H2O (Merck 6308) и 15 мл 4 н. NaOH растворяли вместе до конечного объема 1000 мл (при необходимости, при нагревании); и реактив B: 35,2 г NaH2PO4·1H2O (Merck 6346) и 0,6 г Na2SO3 (Merck 6657) растворяли вместе до конечного объема 1000 мл.
Чтобы подготовить субстрат, 4 г ДМК растворяли в 400 мл буфера PIPES. Фильтрованные культуральные супернатанты разбавляли буфером PIPES; конечная концентрация контролей в ростовом планшете составляла 20 м.д. Затем по 10 мкл каждого разбавленного супернатанта добавляли в 200 мкл субстрата в лунках ПМТ. Планшет ПМТ покрывали лентой, встряхивали в течение нескольких секунд и помещали в печь при 37°C на 2 часа без встряхивания. Приблизительно за 15 минут до изъятия первого планшета из печи, реактив TNBS изготавливали смешиванием 1 мл раствора TNBS с 50 мл реактива A. В каждую лунку ПМТ вносили по 60 мкл TNBS реактива A. Инкубированные планшеты встряхивали в течение нескольких секунд, после чего по 10 мкл переносили в ПМТ с TNBS реактивом A. Планшеты накрывали лентой и встряхивали в течение 20 минут в настольном шейкере (BMG Thermostar) при комнатной температуре и 500 об/мин. В конце в лунки добавляли по 200 мкл реактива B, в течение 1 минуты перемешивали в шейкере, и оптическую плотность при 405 нм определяли с использованием ПМТ-ридера.
Полученное значение оптической плотности корректировали по пустому значению (субстрат без фермента). Полученная оптическая плотность представляла собой меру гидролитической активности. Специфическую (случайную) активность образца вычисляли делением оптической плотности и установленной концентрации белка.
E. Определение концентрации амилазы титрованием антител
Как описано в настоящем документе, концентрацию α-амилазы и специфическую активность определяли титрованием с ингибирующим поликлональным антителом. Было обнаружено, что поликлональные антитела, индуцированные к α-амилазе (AmyS) Bacillus stearothermophilus, сильно ингибируют AmyS и α-амилазу из Bacillus sp. TS23 (например, связывание является достаточно крепким, чтобы обеспечить линейную потерю активности при титровании). Следовательно, это антитело можно использовать для измерения концентрации фермента, который, в свою очередь, используется для вычисления специфической активности. В кратком изложении, измеряют величину ингибирования фермента, образованного несколькими известным концентрациями антитела. Из этой информации экстраполируют концентрацию антитела, требуемую для полного ингибирования, которая эквивалентна концентрации фермента в образце. Измеряли α-амилазную активность и ингибирование с использованием флуорогенного анализа с BODIPY-крахмалом. Буфер был 50 мМ MOPS, pH 7,0, содержащий 0,005% Tween-80.
Поликлональное антитело, направленное против очищенного AmyS, индуцировали в кролике и очищали стандартными способами. Эмпирическое значение «видимой концентрации» основного раствора антитела определяли посредством измерения ингибирования образца AmyS с известной специфической активностью. Затем образец антитела использовали для определения концентрации и специфической активности вариантов AmyS и TS23t. Эти значения использовали для создания нормализованных 96-луночных основных планшетов с ферментом, в которых все варианты разбавляли до обычной концентрации.
F. Определение концентрации протеазы ингибированием с эглином C
Как описано в настоящем документе, концентрацию и специфическую активность субтилизина и протеазы ASP определяли титрованием с эглином C. Эглин C из пиявки Hirudo medicinalis представляет собой белковый ингибитор, крепко связывающийся с субтилизином и протеазой ASP (Heinz et al., Biochemistry, 31(37):8755-66 [1992]). Следовательно, эглин C можно использовать для измерения концентрации фермента, которая, в свою очередь, делает возможным вычисление специфической активности. В кратком изложении, измеряют величину ингибирования фермента, вызванного несколькими известными концентрациями эглина C. Из этой информации вычисляют концентрацию эглина C, необходимую для полного ингибирования. Это эквивалентно концентрации фермента в образце.
Активность протеазы измеряли с использованием хромогенного анализа с suc-AAPF-pNA, описанного выше. Ген эглина C синтезировали и экспрессировали в Е. coli стандартными способами. Его свойства и ингибирующая способность были такими же, как у эглина C, купленного в Sigma. Концентрацию основного раствора эглина C определяли измерением ингибирования образца субтилизина Bacillus lentus с известной специфической активностью. Затем калиброванный образец эглина C использовали для определения концентрации и специфической активности вариантов субтилизина и протеазы ASP. Эти значения использовали для создания нормализованных 96-луночных основных планшетов с ферментом, в которых все варианты разбавляли до обычной концентрации.
G. Электрофорез нативного белка в геле
Электрофоретическую подвижность образцов вариантов белка измеряли с использованием системы PhastGel (GE Healthcare) на нативных полиакриламидных гелях промышленного производства (PhastGel Homogeneous) с концентрацией или 7,5% или 12,5%. Использовали буферные полоски (PhastGel Native), состоящие из pH 8,8 в 0,88 M L-аланине, 0,25 M буфере Трис. Типичные условия пробега состояли из 400 B в течение 12,75 минут при расстоянием от анода до катода 3,7 см.
Альтернативно, электрофоретическую подвижность образцов вариантов белка измеряли на 1 мм толстых 0,5-1,5% агарозных гелях при различных значениях pH (т.е. 5,8, 8,0 и 10,0) при выборе подходящей буферной системы. Электрофорез проводили при неденатурирующих условиях. Расстояние между катодом и анодом составляло 13,9 см. Образцы по 1-2 мкг белка смешивали с 5% глицерином + 0,05% бромфенолового синего и загружали на каждую дорожку. Типично гели прогоняли в течение 1 часа при 100 B.
В любом случае гели окрашивали в красителе луисвилль синий, растворенном в 10% уксусной кислоте, и обесцвечивали в 10% метаноле и 10% acidic кислоте в воде. Можно одновременно загрузить от 12 до 20 вариантов белков, в зависимости от используемой нативной гель-системы. Как следствие, электрофоретическая подвижность варианта белка может быть сразу оценена по отношению к стандартам в шкале зарядов, загруженным в тот же гель.
H. Тепловая инактивация детергента
Тепловая инактивация коммерческих моющих составов служит для уничтожения ферментативной активности любых белковых компонентов, сохраняя свойства неферментативных компонентов. Таким образом, этот способ пригоден для подготовки коммерчески приобретенных детергентов для использования при тестировании вариантов фермента по настоящему изобретению. Для североамериканских (NA) и западноевропейских (WE) жидких детергентов для стирки в жестких условиях (HDL) тепловую инактивацию осуществляли, помещая предварительно взвешенный детергент (в стеклянной бутылке) в водяную баню при 95°C на 2 часа. Время инкубирования для тепловой инактивации североамериканских (NA) и японских (JPN) гранулированных детергентов для стирки в жестких условиях (HDG) составляло 8 часов и для западноевропейских (WE) HDG детергентов оно составляло 5 часов. Время инкубирования для тепловой инактивации NA и WE детергентов для автоматического мытья посуды (ADW) составляло 8 часов. Детергенты покупали в местных магазинах. Как не нагретые, так и нагретые детергенты анализировали в течение 5 минут растворения детергента для точного определения процента деактивации. Активность фермента тестировали с помощью анализа с suc-AAPF-pNA.
Для тестирования активности фермента в инактивированных теплом детергентах рабочие растворы детергентов изготовляли из инактивированных теплом основных растворов. Соответствующие количества жесткости воды (6 gpg или 12 gpg) и буфера добавляли в моющие растворы для достижения требуемых условий (таблица 1-1). Растворы смешивали интенсивным перемешиванием или переворачиванием бутылок.
Условия для стирки и мытья посуды
I. Анализ с BODIPY-крахмалом для определения активности амилазы
Анализ с BODIPY-крахмалом выполняли с использованием EnzChek® Ultra Amylase Assay Kit (E33651, Invitrogen). 1 мг/мл основного раствора крахмального субстрата DQ изготавливали растворением содержимого флакона, содержащего лиофилизированный субстрат, в 100 мкл 50 мМ натрий-ацетатного буфера при pH 4,0. Сосуд встряхивали в течение приблизительно 20 секунд и оставили при комнатной температуре, в темноте, для случайного перемешивания, пока не растворится. Добавляли 900 мкл буфера для анализа (50 мМ ацетат натрия с 2,6 мМ CaCl2 pH 5,8), и сосуд встряхивали в течение приблизительно 20 секунд. Раствор субстрата хранили при комнатной температуре, в темноте, пока не будет готов для использования, или при 4°C. Для анализа изготавливали рабочий раствор субстрата DQ 100 мкг/мл из раствора субстрата 1 мг/мл в буфере для анализа. По 190 мкл раствора субстрата 100 мкг/мл добавляли в каждую лунку в 96-луночный плоскодонный планшет микротитратора. По 10 мкл образцов фермента добавляли в лунки, перемешивали в течение 30 секунд с использованием термомиксера при 800 об/мин. В анализ включали пустой образец, который содержал только буфер и субстрат (пустой образец без фермента). Степень изменения интенсивности флуоресценции измеряли (возбуждение: 485 нм, испускание: 520 нм) во флуоресцентном ридере планшетов микротитратора при 25°C в течение 5 минут.
J. Гидролиз кукурузной муки для определения активности амилазы
Анализ ферментативной активности гидролизом субстрата из крахмала кукурузной муки.
Органическую кукурузную мука (Azure Farms, лот № 03227) равномерно вносили в 96-луночный микропланшет Greiner, полипропиленовый, черный, с плоскодонными трубообразными лунками, (по каталогу № 655209), используя дозатор для сухих веществ (V&P Scientific). 85 мкл 20 мМ ацетата натрия pH 5,6 добавляли в каждую лунку и перемешивали. На верхнюю часть планшета накладывали уплотнение из фольги, и планшет предварительно инкубировали при 70°C в термомиксере в течение 20-30 минут. Образцы фермента разбавляли в полипропиленовом планшете Agilent (5042-1385) в 20 мМ натрий-ацетатном буфере. По 11 мкл разбавленных образцов фермента добавляли в планшет с субстратом и планшет прочно запечатывали другой фольгой. Затем планшеты переносили в инкубатор/шейкер Labnet VorTemp 56 с металлическими блоками, (по каталогу № S2056A) предварительно нагревали до 95°C и скорость встряхивания устанавливали на 500 об/мин. Инкубирование продолжали в течение 30 минут. В конце инкубирования планшеты быстро охлаждали в ведре со льдом и реакцию гидролиза крахмала останавливали добавлением 100 мкл 0,1 н. H2SO4 в каждую лунку. В кратком изложении, планшет перемешивали, и продукты реакции гидролиза крахмала анализировали с помощью или анализа PAHBAH или ВЭЖХ.
Колориметрическое определение концентрации растворимого сахара из ферментативного гидролиза субстрата из кукурузной муки. Аликвоты по 80 мкл of 0,5 н. NaOH добавляли во все лунки пустого планшета для ПЦР с последующим добавлением 20 мкл реактива PAHBAH (5% масс./об. p-гидроксибензойной кислоты гидразид (PAHBAH, Sigma # H9882, растворен в 0,5 н. HCl) и перемешиванием (реакционный планшет PAHBAH). По 10 мкл супернатантов реакции гидролиза крахмала добавляли в реакционный планшет PAHBAH. Все планшеты герметически закрывали и помещали в термоциклер (MJ Research Tetrad), запрограммированный на 2 минуты при 95°C, и затем охлаждали до 20°C. Образцы по 80 мкл прореагировавших реакционных смесей PAHBAH переносили в планшет для считывания, и оптическую плотность измеряли в спектрофотометре при 405 нм.
ВЭЖХ определение концентрации растворимого сахара из ферментативного гидролиза субстрата из кукурузной муки. Все стандарты растворимого сахара (DP1-DP7), полученные из Sigma (St. Louis, MO), разбавляли водой Milli-Q до 100 мг/мл и использовали для превращения площади пика для сахаров в действительные концентрации сахаров. Погашенный планшет из анализа с гидролизом крахмала центрифугировали в центрифуге Beckman Coulter Allegra 6R в течение 5 минут при 3000 об/мин 25°C. Супернатант пиппетировали из центрифугированного планшета и переносили в фильтровальный планшет Multiscreen-HV (по каталогу № MAHVN4550). Фильтровальный планшет центрифугировали над ВЭЖХ планшетом Agilent в центрифуге Hettich Rotanta в течение 10 минут при 6000 об/мин 25°C. Подвижную фазу в виде 50 мкл 0,01 н. серной кислоты (0,1 н. серную кислоту разбавляли в 10 раз водой Milli-Q), переносили в каждую лунку другого чистого ВЭЖХ планшета Agilent. В кратком изложении фильтрованный планшет перемешали и 50 мкл фильтрата переносили в соответствующие лунки в планшете с 50 мкл подвижной фазы в каждой лунке. Разбавленные сахарные стандарты добавляли в пустые лунки в планшет, который включали в калибровку. В кратком изложении содержимое перемешивали на платформенном шейкере и планшет накрывали крышкой Nalgene Pre-slit Well Cap. ВЭЖХ колонку (колонка Bio-Rad Aminex HPX-87H, по каталогу № 125-0140) изготавливали досрочно с 2 л подвижной фазы, проходящей при постоянной скорости потока 0,6 мл/минуту. Все образцы в планшете прогоняли во вводимом объеме 20 мкл и анализировали с использованием AMINEXH.M и RID (коэффициент преломления) в качестве детектора. После завершения прогона, скорость потока в ВЭЖХ упала до 0,05 мл/мин.
K. Определение снижения вязкости крахмала амилазой
В этом анализе снижение вязкости раствора субстрата из кукурузного крахмала измеряли в вискозиметре. Из кукурузного крахмала порционным способом изготавливали свежую субстратную суспензию из 30% твердого сухого вещества кукурузной муки в дистиллированной воде и доводили до pH 5,8 с помощью серной кислоты. Для каждого цикла, 50 граммов суспензии (15 граммов твердого сухого вещества) отвешивали и предварительно инкубировали в течение 10 минут для нагревания до 70°C. После добавления амилазы, температуру немедленно повышали с 70°C до 85°C при скорости вращения 75 об/мин. Когда температура суспензии и амилазной смеси достигала 85°C, температуру поддерживали на постоянном уровне и следили за вязкостью в течение дополнительных 30 минут.
L. Измерение связывания фермента с макромолекулярными субстратами
Анализы связывания выполняли для определения связывания субстрата: вариантов протеазы (ASP) со шкалой зарядов (изменение заряда = от -5 до +3 по отношению к ASP дикого типа) с лигнином и целлюлозой, и вариантов амилаза (AmyS) со шкалой зарядов (изменение заряда = от -12 до +12 по отношению к AmyS дикого типа) с кукурузной соломой и жмыхом. Используемые субстраты содержали: лигнин (полученный полным осахариванием жмыха), 87,5% жидкий, жмых (жмых сахарного тростника из Бразилии, предобработанный и разбавленный кислотами в National Renewable Energy Laboratory, промытый и буферизованный при pH 5), PASC (целлюлоза, разбухая в фосфорной кислоте; чистая, аморфная целлюлоза, разбавленная 50 мМ ацетатом натрия, pH 5), AFEX (кукурузная солома с аммиачно разрыхленными волокнами) и PCS (разбавленная серной кислотой предобработанная кукурузная солома, промытая и доведенная до pH 5). Перед использованием все субстраты приводили к требуемому процентному содержанию твердого вещества.
Связывание протеазы
Варианты протеазы ASP со шкалой зарядов (изменение заряда = от -5 до +3 по отношению к ASP дикого типа) очищали и разбавляли до 0,5-1,5 мг/мл. Растворы с содержанием приблизительно 2,4% лигнина, 0,5% PASC и 1% жмыха изготавливали в боратном буфере (40 мМ, pH 8,5, 0,016% Tween20). По 200 мкл каждого добавляли в 96-луночные фильтровальные планшеты. В контрольные лунки помещали буферный раствор. 10 мкл 0,276 г/мл Tween-20 добавляли в каждую лунку для того, чтобы конечная концентрация Tween-20 составляла 1,38%. В контрольные лунки вносили по 10 мкл воды. Для анализа связывания лигнина и жмыха, варианты ASP со шкалой зарядов разбавляли до 200 м.д. и 10 мкл разбавленного фермента добавляли в каждую лунку. Для анализа связывания PASC, шкалу ASP разбавляли до 40 м.д. и по 10 мкл разбавленного фермента добавляли в каждую лунку. После добавления ферментов, каждую лунку перемешивали с помощью наконечников пипеток. Планшеты герметично запечатывали и инкубировали при комнатной температуре при встряхивании. После 1 часа инкубирования фильтрат собирали в 96-луночные планшеты. Активность фермента в фильтрате измеряли посредством анализа с suc-AAPF-pNA после разбавления фильтрата 1:20. Процент связанного белка вычисляли как отношение активности в фильтрате в образцах, инкубированных с субстратом, к активности в контрольных лунках.
Связывание амилазы
Варианты амилазы со шкалой зарядов очищали и разбавляли до 200 м.д. для тестирования. Изготавливали 1% раствор целлюлозного жмыха в боратном буфере (40 мМ, pH 8,5, 0,016% Tween80). По 150 мкл раствора жмыха добавляли в каждую лунку в микротитровальный фильтрационный планшет. По 150 мкл боратного буфера добавляли в серию отдельных лунок, которые служили в качестве контролей. 10 мкл вариантов амилазы со шкалой зарядов добавляли в фильтровальный планшет, каждое условие дублировали. Планшет инкубировали при комнатной температуре в течение 2 часов. Собирали фильтрат и измеряли активность амилазы в супернатанте посредством анализа с BODIPY-крахмалом.
Связывание протеазы с микрообразцами
Варианты протеазы инкубировали с КМЧ микрообразцами или без них при стандартных условиях мытья в течение 30 минут. Количество свободного фермента измеряли посредством анализа с suc-AAPF-pNA. Долю фермента, связанного с микрообразцами, вычисляли следующим образом: связанная доля = (активность фермента в отсутствие образца - активность фермента в присутствии образца)/(активность фермента в отсутствие образца).
Связывание α-амилазы с микрообразцами
Варианты амилазы инкубировали с микрообразцами с CS-28 рисовым крахмалом или без них при стандартных условиях мытья в течение 30 минут. Количество свободного фермента измеряли посредством анализа с BODIPY-крахмалом. Долю фермента, связанного с микрообразцами, вычисляли следующим образом: связанная доля = (активность фермента в отсутствие образца - активность фермента в присутствии образца)/(активность фермента в отсутствие образца)
ПРИМЕР 2
Производство протеазы в B. subtilis
В этом примере описаны эксперименты, которые проводили для создания различных протеаз в B. subtilis. В частности, предоставлены способы, используемые для трансформации B. subtilis экспрессирующими векторами с NprE, ASP, GG36 и FNA re. Трансформацию выполняли, как известно в данной области (смотрите, например, WO 02/14490).
Производство протеазы NprE
Предоставлены способы, используемые для трансформации плазмиды pUBnprE в B. subtilis. Предоставленная ниже последовательность ДНК (лидерная последовательность nprE, nprE pro и ДНК зрелой последовательности nprE из B. amyloliquefaciens) кодирует белок-предшественник NprE:
gtgggtttaggtaagaaattgtctgttgctgtcgccgcttcctttatgagtttaaccatcagtctgccgggtgttcaggccgctgagaatcctcagcttaaagaaaacctgacgaattttgtaccgaagcattctttggtgcaatcagaattgccttctgtcagtgacaaagctatcaagcaatacttgaaacaaaacggcaaagtctttaaaggcaatccttctgaaagattgaagctgattgaccaaacgaccgatgatctcggctacaagcacttccgttatgtgcctgtcgtaaacggtgtgcctgtgaaagactctcaagtcattattcacgtcgataaatccaacaacgtctatgcgattaacggtgaattaaacaacgatgtttccgccaaaacggcaaacagcaaaaaattatctgcaaatcaggcgctggatcatgcttataaagcgatcggcaaatcacctgaagccgtttctaacggaaccgttgcaaacaaaaacaaagccgagctgaaagcagcagccacaaaagacggcaaataccgcctcgcctatgatgtaaccatccgctacatcgaaccggaacctgcaaactgggaagtaaccgttgatgcggaaacaggaaaaatcctgaaaaagcaaaacaaagtggagcat gccgccacaaccggaacaggtacgactcttaaaggaaaaacggtctcattaaatatttcttctgaaagcggcaaatatgtgctgcgcgatctttctaaacctaccggaacacaaattattacgtacgatctgcaaaaccgcgagtataacctgccgggcacactcgtatccagcaccacaaaccagtttacaacttcttctcagcgcgctgccgttgatgcgcattacaacctcggcaaagtgtatgattatttctatcagaagtttaatcgcaacagctacgacaataaaggcggcaagatcgtatcctccgttcattacggcagcagatacaataacgcagcctggatcggcgaccaaatgatttacggtgacggcgacggttcattcttctcacctctttccggttcaatggacgtaaccgctcatgaaatgacacatggcgttacacaggaaacagccaacctgaactacgaaaatcagccgggcgctttaaacgaatccttctctgatgtattcgggtacttcaacgatactgaggactgggatatcggtgaagatattacggtcagccagccggctctccgcagcttatccaatccgacaaaatacggacagcctgataatttcaaaaattacaaaaaccttccgaacactgatgccggcgactacggcggcgtgcatacaaacagcggaatcccgaacaaagccgcttacaatacgattacaaaaatcggcgtgaacaaagcggagcagatttactatcgtgctctgacggtatacctcactccgtcatcaacttttaaagatgcaaaagccgctttgattcaatctgcgcgggacctttacggctctcaagatgctgcaagcgtagaagctgcctggaatgcagtcggattgtaa (SEQ ID NO:1).
В вышеуказанной последовательности жирным обозначено, что эта ДНК кодирует зрелую протеазу NprE, обычный шрифт обозначает лидерную последовательность (лидерная последовательность nprE), и подчеркнуты обозначает пропоследовательности (nprE pro). Предоставленная ниже аминокислотная последовательность (лидерная последовательность NprE, NprE pro и ДНК зрелой последовательности NprE) соответствует полноразмерному белку-предшественнику NprE. В этой последовательности NprE, подчеркивание обозначает пропоследовательность и жирный обозначает зрелую протеазу NprE:
MGLGKKLSVAVAASFMSLTISLPGVQAAENPQLKENLTNFVPKHSLVQSELPSVSDKAIKQYLKQNGKVFKGNPSERLKLIDQTTDDLGYKHFRYVPVVNGVPVKDSQVIIHVDKSNNVYAINGELNNDVSAKTANSKKLSANQALDHAYKAIGKSPEAVSNGTVANKNKAELKAAATKDGKYRLAYDVTIRYIEPEPANWEVTVDAETGKILKKQNKVEH AATTGTGTTLKGKTVSLNISSESGKYVLRDLSKPTGTQIITYDLQNREYNLPGTLVSSTTNQFTTSSQRAAVDAHYNLGKVYDYFYQKFNRNSYDNKGGKIVSSVHYGSRYNNAAWIGDQMIYGDGDGSFFSPLSGSMDVTAHEMTHGVTQETANLNYENQPGALNESFSDVFGYFNDTEDWDIGEDITVSQPALRSLSNPTKYGQPDNFKNYKNLPNTDAGDYGGVHTNSGIPNKAAYNTITKIGVNKAEQIYYRALTVYLTPSSTFKDAKAALIQSARDLYGSQDAASVEAAWNAVGL (SEQ ID NO:2).
Последовательность зрелой NprE использовали в качестве основы при создании библиотек вариантов:
AATTGTGTTLKGKTVSLNISSESGKYVLRDLSKPTGTQIITYDLQNREYNLPGTLVSSTTNQFTTSSQRAAVDAHYNLGKVYDYFYQKFNRNSYDNKGGKIVSSVHYGSRYNNAAWIGDQMIYGDGDGSFFSPLSGSMDVTAHEMTHGVTQETANLNYENQPGALNESFSDVFGYFNDTEDWDIGEDITVSQPALRSLSNPTKYGQPDNFKNYKNLPNTDAGDYGGVHTNSGIPNKAAYNTITKIGVNKAEQIYYRALTVYLTPSSTFKDAKAALIQSARDLYGSQDAASVEAAWNAVGL (SEQ ID NO:3).
Экспрессирующий вектор pUBnprE сконструировали амплификацией гена nprE из хромосомной ДНК B. amyloliquefaciens посредством ПЦР с использованием двух специфических праймеров:
Oligo AB1740: CTGCAGGAATTCAGATCTTAACATTTTTCCCCTATCATTTTTCCCG (SEQ ID NO:4); и
Oligo AB1741: GGATCCAAGCTTCCCGGGAAAAGACATATATGATCATGGTGAAGCC (SEQ ID NO:5).
ПЦР выполняли на термоциклере с высокоточной ДНК полимеразой Phusion (Finnzymes). ПЦР смесь содержала 10 мкл 5× буфера (Finnzymes Phusion), 1 мкл 10 мМ dNTP, 1,5 мкл ДМСО, по 1 мкл каждого праймера, 1 мкл ДНК полимеразы Finnzymes Phusion, 1 мкл раствора хромосомной ДНК 50 нг/мкл, 34,5 мкл воды Milli-Q. Использовали следующий протокол ПЦР: 1) 30 с при 98°C; 2) 10 с при 98°C; 3) 20 с при 55°C; 4) 1 мин при 72°C; 5) 25 циклов из стадий со 2 до 4; и 5) 5 мин при 72°C.
В результате это дало фрагмент ДНК 1,9 т.п.н., который расщепляли с использованием ДНК рестриктаз BglII и BclI. Многокопийный вектор Bacillus pUB110 (смотрите, например, Gryczan, J Bacteriol, 134:318-329 [1978]) расщепляли с помощью BamHI. Затем ПЦР фрагмент×BglII×BclI лигировали в вектор pUB110×BamHI для создания экспрессирующего вектора pUBnprE.
pUBnprE трансформировали в штамм B. subtilis (∆aprE, ∆nprE, oppA, ∆spoIIE, degUHy32, ∆amyE::(xylR,pxylA-comK). Трансформацию в B. subtilis выполняли, как описано в WO 02/14490, включенном в настоящий документ в качестве ссылки. Избирательный рост трансформантов B. subtilis, содержащих вектор pUBnprE, осуществляли во встряхиваемых колбах, содержащих 25 мл среды MBD (среда определенного состава на основе MOPS), с 20 мг/л неомицина. Среду MBD изготавливали, в основном, как известно в данной области (смотрите Neidhardt et al, J Bacteriol, 119: 736-747 [1974]), за исключением того, что NH4Cl2, FeSO4 и CaCl2 были исключены из основной среды, использовали 3 мМ K2HPO4 и в основную среду добавляли 60 мМ мочевину, 75 г/л глюкозы и 1% сойтон. Также, питательные микроэлементы подготовили в виде 100× основного раствора, содержащего в одном литре 400 мг FeSO4·7H2O, 100 мг MnSO4·H2O, 100 мг ZnSO4·7H2O, 50 мг CuCl2·2H2O, 100 мг CoCl2·6H2O, 100 мг NaMoO4·2H2O, 100 мг Na2B4O7·10H2O, 10 мл 1 М CaCl2 и 10 мл 0,5 M цитрата натрия. Культуру инкубировали в течение трех дней при 37°C в инкубаторе/шейкере (Infors). Это культивирование привело к образованию секретированной протеазы NprE с протеолитической активностью, которую демонстрировали посредством протеолитических анализов. Анализ гелей выполняли с использованием гелей NuPage Novex 10%-Bis-Трис (Invitrogen, по каталогу № NP0301BOX). Чтобы подготовить образцы к анализу, 2 объема супернатанта смешивали с 1 объемом 1 М HCl, 1 объемом 4×LDS буфера для образцов (Invitrogen, по каталогу № NP0007) и 1% PMSF (20 мг/мл) и затем нагревали в течение 10 минут при 70°C. Затем по 25 мкл каждого образца загружали в гель вместе с 10 мкл предварительно окрашенных белковых стандартов SeeBlue Plus2 (Invitrogen, по каталогу № LC5925). Результаты ясно показывали, что стратегия клонирования nprE, описанная в этом примере, пригодна для производства активной NprE в B. subtilis.
Производство протеазы ASP
Предоставлены способы, используемые для трансформации плазмиды pHPLT-ASP-C1-2 в B. subtilis. Для оптимизации экспрессии ASP в B. subtilis, создавали синтетическую последовательность ДНК с помощью DNA2.0 для использования в этих экспериментах с экспрессией. Ниже предоставлена последовательность ДНК (синтетическая последовательность ДНК ASP), с адаптацией использования кодонов видами Bacillus, которые кодируют белок-предшественник ASP дикого типа:
atgacaccacgaactgtcacaagagctctggctgtggcaacagcagctgctacactcttggctgggggtatggcagcacaagctaacgaaccggctcctccaggatctgcatcagcccctccacgattagctgaaaaacttgaccctgacttacttgaagcaatggaacgcgatctggggttagatgcagaggaagcagctgcaacgttagcttttcagcatgacgcagctgaaacgggagaggctcttgctgaggaactcgacgaagatttcgcgggcacgtgggttgaagatgatgtgctgtatgttgcaaccactgatgaagatgctgttgaagaagtcgaaggcgaaggagcaactgctgtgactgttgagcattctcttgctgatttagaggcgtggaagacggttttggatgctgcgctggagggtcatgatgatgtgcctacgtggtacgtcgacgtgcctacgaattcggtagtcgttgctgtaaaggcaggagcgcaggatgtagctgcaggacttgtggaaggcgctgatgtgccatcagatgcggtcacttttgtagaaacggacgaaacgcctagaacgatg ttcgacgtaattggaggcaacgcatatactattggcggccggtctagatgttctatcggattcgcagtaaacggtggcttcattactgccggtcactgcggaagaacaggagccactactgccaatccgactggcacatttgcaggtagctcgtttccgggaaatgattatgcattcgtccgaacaggggcaggagtaaatttgcttgcccaagtcaataactactcgggcggcagagtccaagtagcaggacatacggccgcaccagttggatctgctgtatgccgctcaggtagcactacaggttggcattgcggaactatcacggcgctgaattcgtctgtcacgtatccagagggaacagtccgaggacttatccgcacgacggtttgtgccgaaccaggtgatagcggaggtagccttttagcgggaaatcaagcccaaggtgtcacgtcaggtggttctggaaattgtcggacggggggaacaacattctttcaaccagtcaacccgattttgcaggcttacggcctgagaatgattacgactgactctggaagttcccct gctccagcacctacatcatgtacaggctacgcaagaacgttcacaggaaccctcgcagcaggaagagcagcagctcaaccgaacggtagctatgttcaggtcaaccggagcggtacacattccgtctgtctcaatggacctagcggtgcggactttgatttgtatgtgcagcgatggaatggcagtagctgggtaaccgtcgctcaatcgacatcgccgggaagcaatgaaaccattacgtaccgcggaaatgctggatattatcgctacgtggttaacgctgcgtcaggatcaggagcttacacaatgggactcaccctcccctga (SEQ ID N0:6).
В приведенной выше последовательности жирным обозначена ДНК, которая кодирует зрелую протеазу ASP, обычный шрифт обозначает лидерную последовательность (лидерная последовательность ASP), и подчеркивание обозначает N-концевые и C-концевые пропоследовательности. Предоставленная ниже аминокислотная последовательность соответствует полноразмерному белку-предшественнику ASP, с подчеркиваниями, обозначающими pro последовательности, и жирным, обозначающим зрелую протеазу ASP.
MTPRTVTRALAVATAAATLLAGGMAAQANEPAPPGSASAPPRLAEKLDPDLLEAMERDLGLDAEEAAATLAFQHDAAETGEALAEELDEDFAGTWVEDDVLYVATTDEDAVEEVEGEGATAVTVEHSLADLEAWKTVLDAALEGHDDVPTWYVDVPTNSVVVAVKAGAQDVAAGLVEGADVPSDAVTFVETDETPRTM FDVIGGNAYTIGGRSRCSIGFAVNGGFITAGHCGRTGATTANPTGTFAGSSFPGNDYAFVRTGAGVNLLAQVNNYSGGRVQVAGHTAAPVGSAVCRSGSTTGWHCGTITALNSSVTYPEGTVRGLIRTTVCAEPGDSGGSLLAGNQAQGVTSGGSGNCRTGGTTFFQPVNPILQAYGLRMITTDSGSSP APAPTSCTGYARTFTGTLAAGRAAAQPNGSYVQVNRSGTHSVCLNGPSGADFDLYVQRWNGSSWVTVAOSTSPGSNETITYRGNAGYYRYVVNAASGSGAYTMGLTLP (SEQ ID NO:7).
Последовательность зрелой ASP использовали в качестве основы при создании библиотек вариантов, описываемых в настоящем документе:
FDVIGGNAYTIGGRSRCSIGFAVNGGFITAGHCGRTGATTANPTGTFAGSSFPGNDYAFVRTGAGVNLLAQVNNYSGGRVQVAGHTAAPVGSAVCRSGSTTGWHCGTITALNSSVTYPEGTVRGLIRTTVCAEPGDSGGSLLAGNQAQGVTSGGSGNCRTGGTTFFQPVNPILQAYGLRMITTDSGSSP (SEQ ID NO:8).
Экспрессирующие кассеты Asp конструировали в векторе pXX-KpnI и впоследствии клонировали в вектор pHPLT для экспрессии ASP в B. subtilis. pXX-KpnI представляет собой вектор, основанный на pUC, с управляющим экспрессией промотором aprE (B. subtilis), геном cat и дубликатом промотора aprE для амплификации копийности в B. subtilis. Ген bla делает возможным избирательный рост в E. coli. KpnI, введенный в участок связывания рибосомы, в 5'-3' направлении от промоторной области aprE, вместе с сайтом HindIII дает возможность клонирования экспрессирующих кассет Asp в pXX-KpnI. pHPLT-EBS2c2, производное pHPLT (Solingen et al, Extremophiles 5:333-341 [2001]), содержит промотор (PLAT) термостабильной амилазы LAT Bacillus licheniformis, с идущими за ними участками рестрикции XbaI и HpaI для клонирования экспрессионных конструкций ASP. Экспрессирующую кассету Asp клонировали в вектор pXX-KpnI, содержащий ДНК, кодирующую гибридный сигнальный пептид (SEQ ID NO:9), сконструированный из 5 N-концевых аминокислот сигнального пептида субтилизина AprE, слитого с 25 C-концевыми аминокислотами сигнального пептида Asp:
MRSKKRTVTRALAVATAAATLLAGGMAAQA (SEQ ID NO:9).
Гибридный сигнальный пептид ASP кодируется следующей последовательностью ДНК:
ATGAGAAGCAAGAAGCGAACTGTCACAAGAGCTCTGGCTGTGGCAACAGCAGCTGCTACACTCTTGGCTGGGGGTATGGCAGCACAAGCT (SEQ ID NO:10).
Экспрессирующую кассету Asp, клонированную в вектор pXX-KpnI, трансформировали в E. coli (Electromax DH10B, Invitrogen, по каталогу № 12033-015). Используемые праймеры и стратегия клонирования предоставлены ниже. Впоследствии экспрессирующие кассеты клонировали из этих векторов и вводили в экспрессирующий вектор pHPLT для трансформирования в штамм B. subtilis (∆aprE, ∆nprE, oppA, ∆spoIIE, degUHy32, ∆amyE::(xylR,pxylA-comK). Также ниже предоставлены праймеры и стратегия клонирования для экспрессирующих кассет ASP, клонированных в pHPLT.
Праймеры получали из MWG и Invitrogen. Высокоточную ДНК Taq полимеразу Platinum Invitrogen (по каталогу № 11304-029) использовали для ПЦР амплификации (0,2 мкМ праймеров, от 25 до 30 циклов) в соответствии с протоколом Invitrogen. Реакции лигирования экспрессирующих кассет ASP и векторов-хозяев выполняли с использованием T4 ДНК лигазы Invitrogen (по каталогу № 15224-025), используя протокол, рекомендованный для полного клонирования липких концов.
Экспрессию гена asp исследовали в штамме B. subtilis (∆aprE, ∆nprE, oppA, ∆spoIIE, degUHy32, ∆amyE::(xylR,pxylA-comK). Плазмиду pHPLT-ASP-C1-2 трансформировали в B. subtilis (∆aprE, ∆nprE, oppA, ∆spoIIE, degUHy32, ∆amyE::(xylR,pxylA-comK). Трансформацию выполняли, как известно в данной области (смотрите, например, WO 02/14490, включенный в настоящий документ в качестве ссылки).
Избирательный рост трансформантов B. subtilis (∆aprE, ∆nprE, oppA, ∆spoIIE, degUHy32, ∆amyE::(xylR,pxylA-comK), содержащих вектор pHPLT-ASP-C1-2, осуществляли во встряхиваемых колбах, содержащих 25 мл синтетической среды с максатазой (SMM), с 0,97 г/л CaCl2·6H2O взамен 0,5 г/л CaCl2 (смотрите, патент США № 5324653, включенный в настоящий документ в качестве ссылки) с 20 мг/л неомицина. Это выращивание привело к производству секретированной ASP, обладающей протеолитической активностью. Анализ гелей выполняли с использованием гелей NuPage Novex 10% Bis-Трис (Invitrogen, по каталогу № NP0301BOX). Чтобы подготовить образцы для анализа, 2 объема супернатанта смешивали с 1 объемом 1 М HCl, 1 объемом 4×LDS буфера для образцов (Invitrogen, по каталогу № NP0007) и 1% PMSF (20 мг/мл) и впоследствии нагревали в течение 10 мин при 70°C. Затем по 25 мкл каждого образца загружали в гель вместе с 10 мкл предварительно окрашенных белковых стандартов SeeBlue Plus2 (Invitrogen, по каталогу № LC5925). Результаты ясно показывали, что стратегия клонирования asp, описанная в этом примере, пригодна для производства активной Asp в B. subtilis.
ASP в pXX-KpnI и p2JM103-DNNDPI
ASP-syntc-mature-RV GTGTGCAAGCTTTCAAGGGGAACTTCCAGAGTCAGTC (SEQ ID NO:12)
Экспрессирующие кассеты ASP в pHPLT
pHPLT-ASPmat-RV CATGCATCCCGGGTTAAGGGGAACTTCCAGAGTCAGTC (SEQ ID NO:14)
Производство протеазы GG36
В этом примере предоставлены эксперименты по производству GG36 (также упоминаемому в настоящем документе как субтилизин B. lentus), которые проводили в B. subtilis. Экспрессионную плазмиду pAC-GG36ci собирали с использованием кодон-оптимизированного гена GG36, слитого с восьмым кодоном сигнальной последовательности aprE под управлением консенсусного промотора aprE и терминатора транскрипции BPN'. В предоставленной ниже последовательности, жирный и курсивный шрифт обозначает консенсусный промотор aprE, обычный шрифт обозначает сигнальную последовательность, подчеркнутый шрифт обозначает пропоследовательность, жирный шрифт обозначает ДНК, которая кодирует зрелую протеазу GG36, и подчеркнутый курсивный шрифт обозначает терминатор BPN'. Кодирующая область зрелой протеазы GG36 фланкирована участками рестрикции KpnI и XhoI для целей клонирования:
atctcaaaaaaatgggtctactaaaatattactccatctattataataaattcacagaatagtcttttaagtaagtctactctgaatttttttaaaaggagagggtaaaga gtgagaagcaaaaaattgtggatcgtcgcgtcgaccgcattgctgatttctgttgcttttagctcatccatcgcatccgctgctgaagaagcaaaagaaaaatatttaattggctttaatgagcaggaagctgtcagtgagtttgtagaacaagttgaggcaaatgacgaggtagccattctctctgaggaagaggaagtcgaaattgaattgcttcatgaatttgaaacgattcctgttctgtccgttgagttaagcccagaagatgtggacgcgttagagctcgatccagctatttcttatattgaagaggatgcagaagtaactacaatg gcgcaatcggtaccatggggaattagcagagtacaagccccagctgcacataaccgtggattgacaggttctggtgtaaaagttgctgtccttgataccggtatttccactcatccagacttaaatattcgtggtggagctagctttgtaccaggggaaccatccactcaagatggcaatggacatggcactcatgttgccggcacaatcgcggctcttaacaattcaattggtgttcttggcgtagcgccaagcgcagaactatacgctgttaaagtattaggagcaagcggttcaggctctgtcagctctattgcccaaggattggaatgggcagggaacaatggcatgcacgttgctaatcttagtttaggatctccttcgccaagtgccacacttgagcaagctgttaatagcgcgacttctagaggcgttcttgttgtagcggcctctggaaattcaggtgcaggctcaatcagctatccggcccgttatgcgaacgctatggcagtcggagctactgaccaaaacaacaaccgcgccagcttttcacagtatggcgcagggcttgacattgtcgcaccaggtgtaaacgtgcagagcacttacccaggttcaacatatgccagcttaaacggtacatcaatggctactcctcatgttgcaggtgcggctgcacttgttaaacaaaagaacccatcttggtccaatgtacaaatccgcaatcatcttaagaatacggcaactagcttaggaagcacaaacttgtatggaagcggacttgtcaatgcagaagctgcaactcgttaa aagcttaactcgagataaaaaaccggccttggccccgccggttttttat (SEQ ID NO:15).
Аминокислотная последовательность белка-предшественника GG36 предоставлена ниже. В этой последовательности жирным обозначена зрелая протеаза GG36:
MRSKKLWIVASTALLISVAFSSSIASAAEEAKEKYLIGFNEQEAVSEFVEQVEANDEVAILSEEEEVEIELLHEFETIPVLSVELSPEDVDALELDPAISYIEEDAEVTTMAQSVPWGISRVQAPAAHNRGLTGSGVKVAVLDTGISTHPDLNIRGGASFVPGEPSTQDGNGHGTHVAGTIAALNNSIGVLGVAPSAELYAVKVLGASGSGSVSSIAQGLEWAGNNGMHVANLSLGSPSPSATLEQAVNSATSRGVLVVAASGNSGAGSISYPARYANAMAVGATDQNNNRASFSQYGAGLDIVAPGVNVQSTYPGSTYASLNGTSMATPHVAGAAALVKQKNPSWSNVQIRNHLKNTATSLGSTNLYGSGLVNAEAATR (SEQ ID NO:16).
Аминокислотную последовательность зрелой протеазы GG36 использовали в качестве основы при создании библиотек вариантов, описываемых в настоящем документе:
AQSVPWGISRVQAPAAHNRGLTGSGVKVAVLDTGISTHPDLNIRGGASFVPGEPSTQDGNGHGTHVAGTIAALNNSIGVLGVAPSAELYAVKVLGASGSGSVSSIAQGLEWAGNNGMHVANLSLGSPSPSATLEQAVNSATSRGVLVVAASGNSGAGSISYPARYANAMAVGATDQNNNRASFSQYGAGLDIVAPGVNVQSTYPGSTYASLNGTSMATPHVAGAAALVKQKNPSWSNVQIRNHLKNTATSLGSTNLYGSGLVNAEAATR (SEQ ID NO:17).
Элементы плазмиды pAC-GG36ci включали: pUB110 = фрагмент ДНК из плазмиды pUB110 (McKenzie et al., Plasmid 15:93-103 [1986]), pBR322 = фрагмент ДНК из плазмиды pBR322 (Bolivar et al., Gene 2:95-113 [1977]), pC194 = фрагмент ДНК из плазмиды pC194 (Horinouchi et al., J Bacteriol, 150:815-825 [1982]). Плазмида обладала следующими свойствами: Ori для B. subtilis = участок начала репликации их pUB110, CAT = ген устойчивости к хлорамфениколу из pC194, pMB1 origin = участок начала репликации из pBR322, bla = β-лактамаза из pBR322, короткий промотор aprE = консенсусный транскрипционный промотор, сигнальный пептид = сигнальный пептид, Pro пептид = pro область GG36, зрелый пептид GG36ci = зрелый GG36 (замещен кодирующими областями для каждого варианта, экспрессированного в этом исследовании), терминатор BPN' = терминатор транскрипции из субтилизина BPN'.
Производство протеазы FNA
В этом примере описаны эксперименты, которые проводили для производства FNA (также называемой в настоящем документе как субтилизин BPN'-Y217L B. amyloliquefaciens) в B. subtilis. Экспрессионную плазмиду pAC-FNAre собирали с использованием гена FNA, слитого на восьмом кодоне сигнальной последовательности aprE под управлением консенсусного промотора aprE и терминатора транскрипции BPN'. В предоставленной ниже последовательности жирный и курсивный шрифт обозначает консенсусный промотор aprE, стандартный шрифт обозначает сигнальную последовательность, подчеркнутый шрифт обозначает пропоследовательность, жирный шрифт обозначает ДНК, которая кодирует зрелую протеазу FNA, и подчеркнутый курсивный шрифт обозначает терминатор BPN'. Кодирующая область зрелой протеазы FNA содержит участки рестрикции KpnI и XhoI для целей клонирования:
gaattcatctcaaaaaaatgggtctactaaaatattattccatctattataataaattcacagaatagtcttttaagtaagtctactctgaatttttttaaaaggagagggtaaagagtgagaagcaaaaaatt gtgagaagcaaaaaattgtggatcagtttgctgtttgctttagcgttaatctttacgatggcgttcggcagcacatccagcgcgcaggctgcagggaaatcaaacggggaaaagaaatatattgtcgggtttaaacagacaatgagcacgatgagcgccgctaagaagaaagacgtcatttctgaaaaaggcgggaaagtgcaaaagcaattcaaatatgtagacgcagctagcgctacattaaacgaaaaagctgtaaaagaattgaaaaaagacccgagcgtcgcttacgttgaagaagatcacgtagcacacgcgtac gcgcagtccgtgccatatggcgtatcacaaattaaagcccctgctctgcactctcaaggctacaccggttcaaatgttaaagtagcggttatcgacagcggtatcgattcttctcatccagatcttaaagtagcaggcggagccagcatggttccttctgaaacaaatcctttccaagacaacaactctcacggaacacacgttgctggtaccgttgcggctcttaataactcaatcggtgtattaggcgttgcgccaagcgcatcactttacgctgtaaaagttctcggcgccgacggttccggccaatacagctggatcattaacggaatcgagtgggcgatcgcaaacaatatggacgttattaacatgagcctcggcggaccgtccggttctgctgctttaaaagcggcagttgataaagccgttgcatccggcgtcgtagtcgttgcggcagccggcaacgaaggcacttccggcagctcaagcacagtgggctaccctggtaaatacccttctgtcattgcagtaggcgctgtcgacagcagcaaccaaagagcatctttctcaagcgtaggacctgagctcgatgtcatggcacctggcgtatctatccaaagcacgcttcctggaaacaaatacggcgcgttgaacggtacatcaatggcatctccgcacgttgccggagccgcggctttgattctttctaagcacccgaactggacaaacactcaagtccgcagctctctagaaaacaccactacaaaacttggtgattctttctactatggaaaagggctgatcaatgtacaggcggcagctcagtaa aactcgagataaaaaaccggccttggccccgccggttttttat (SEQ ID NO:18).
Аминокислотная последовательность белка-предшественника FNA предоставлена ниже. В этой последовательности жирным обозначена зрелая протеаза FNA: MRSKKLWISLLFALALIFTMAFGSTSSAQAAGKSNGEKKYIVGFKQTMSTMSAAKKKDVISEKGGKVQKQFKYVDAASATLNEKAVKELKKDPSVAYVEEDHVAHAYAQSVPYGVSQIKAPALHSQGYTGSNVKVAVIDSGIDSSHPDLKVAGGASMVPSETNPFQDNNSHGTHVAGTVAALNNSIGVLGVAPSASLYAVKVLGADGSGQYSWIINGIEWAIANNMDVINMSLGGPSGSAALKAAVDKAVASGVVVVAAAGNEGTSGSSSTVGYPGKYPSVIAVGAVDSSNQRASFSSVGPELDVMAPGVSIQSTLPGNKYGALNGTSMASPHVAGAAALILSKHPNWTNTQVRSSLENTTTKLGDSFYYGKGLINVQAAAQ (SEQ ID NO:19).
Аминокислотная последовательность зрелой протеазы FNA использовали в качестве основы при изготовлении библиотек вариантов, описываемых в настоящем документе:
AQSVPYGVSQIKAPALHSQGYTGSNVKVAVIDSGIDSSHPDLKVAGGASMVPSETNPFQDNNSHGTHVAGTVAALNNSIGVLGVAPSASLYAVKVLGADGSGQYSWIINGIEWAIANNMDVINMSLGGPSGSAALKAAVDKAVASGWWAAAGNEGTSGSSSTVGYPGKYPSVIAVGAVDSSNQRASFSSVGPELDVMAPGVSIQSTLPGNKYGALNGTSMASPHVAGAAALILSKHPNWTNTQVRSSLENTTTKLGDSFYYGKGLINVQAAAQ (SEQ ID NO:20).
Элементы плазмиды pAC-FNAre содержали: pUB110 = фрагмент ДНК из плазмиды pUB110 (McKenzie et al., Plasmid 15:93-103, [1986]), pBR322 = фрагмент ДНК из плазмиды pBR322 (Bolivar et al., Gene 2:95-113 [1977]), pC194 = фрагмент ДНК из плазмиды pC194 (Horinouchi et al., J. Bacteriol 150:815-825 [1982]). Свойства плазмида были следующими: Ori для B. subtilis = участок начала репликации из pUB110, CAT = ген устойчивости к хлорамфениколу из pC194, pMB1 origin = участок начала репликации из pBR322, bla = β-лактамаза из pBR322, короткий промотор aprE = консенсусный транскрипционный промотор, сигнальный пептид = сигнальный пептид, Pro пептид = pro область FNA, зрелый пептид FNA = зрелая FNA (замещена кодирующими областями для каждого варианта, экспрессированного в этом исследовании), терминатор BPN' = терминатор транскрипции из субтилизина BPN'.
ПРИМЕР 3
Производство амилазы в B. subtilis
В этом примере описаны эксперименты, которые проводили для производства α-амилазы Bacillus stearothermophilus (также называемой в настоящем документе как AmyS), мутантной усеченной формы AmyS (S242Q, обладающей 29 аминокислотной делецией, также называемой в настоящем документе как S242Q), и усеченной формы α-амилазы из Bacillus sp. TS-23 (также упоминаемой в настоящем документе, как AmyTS-23t), и их вариантов в B. subtilis. Трансформацию выполняли, как известно в данной области (смотрите, например, WO 02/14490). В кратком изложении, ген, кодирующий родительские амилазы, клонировали в экспрессирующий вектор pHPLT, который содержит промотор LAT (PLAT), последовательность, кодирующую сигнальный пептид LAT (preLAT), за которой идут участки рестрикции PstI и HpaI для клонирования.
Кодирующая область для сигнального пептида LAT показана ниже:
atgaaacaacaaaaacggctttacgcccgattgctgacgctgttatttgcgctcatcttcttgctgcctcattctgcagcttcagca (SEQ ID NO:21).
Аминокислотная последовательность сигнального пептида LAT показана ниже:
MKQQKRLYARLLTLLFALIFLLPHSAASA (SEQ ID NO:22).
Кодирующая область для зрелой амилазы AmyS показана ниже:
gccgcaccgtttaacggtaccatgatgcagtattttgaatggtacttgccggatgatggcacgttatggaccaaagtggccaatgaagccaacaacttatccagccttggcatcaccgctctttggctgccgcccgcttacaaaggaacaagccgcagcgacgtagggtacggagtatacgacttgtatgacctcggcgaattcaatcaaaaagggaccgtccgcacaaaatatggaacaaaagctcaatatcttcaagccattcaagccgcccacgccgctggaatgcaagtgtacgccgatgtcgtgttcgaccataaaggcggcgctgacggcacggaatgggtggacgccgtcgaagtcaatccgtccgaccgcaaccaagaaatctcgggcacctatcaaatccaagcatggacgaaatttgattttcccgggcggggcaacacctactccagctttaagtggcgctggtaccattttgacggcgttgactgggacgaaagccgaaaattaagccgcatttacaaattccgcggcatcggcaaagcgtgggattgggaagtagacacggaaaacggaaactatgactacttaatgtatgccgaccttgatatggatcatcccgaagtcgtgaccgagctgaaaaactgggggaaatggtatgtcaacacaacgaacattgatgggttccggcttgatgccgtcaagcatattaagttcagtttttttcctgattggttgtcgtatgtgcgttctcagactggcaagccgctatttaccgtcggggaatattggagctatgacatcaacaagttgcacaattacattacgaaaacaaacggaacgatgtctttgtttgatgccccgttacacaacaaattttataccgcttccaaatcagggggcgcatttgatatgcgcacgttaatgaccaatactctcatgaaagatcaaccgacattggccgtcaccttcgttgataatcatgacaccgaacccggccaagcgctgcagtcatgggtcgacccatggttcaaaccgttggcttacgcctttattctaactcggcaggaaggatacccgtgcgtcttttatggtgactattatggcattccacaatataacattccttcgctgaaaagcaaaatcgatccgctcctcatcgcgcgcagggattatgcttacggaacgcaacatgattatcttgatcactccgacatcatcgggtggacaagggaaggggtcactgaaaaaccaggatccgggctggccgcactgatcaccgatgggccgggaggaagcaaatggatgtacgttggcaaacaacacgctggaaaagtgttctatgaccttaccggcaaccggagtgacaccgtcaccatcaacagtgatggatggggggaattcaaagtcaatggcggttcggtttcggtttgggttcctagaaaaacgaccgtttctaccatcgctcggccgatcacaacccgaccgtggactggtgaattcgtccgttggaccgaaccacggttggtggcatggcct (SEQ ID NO:23).
Аминокислотную последовательность зрелой амилазы AmyS использовали в качестве основы при изготовлении библиотек вариантов, описываемых в настоящем документе:
AAPFNGTMMQYFEWYLPDDGTLWTKVANEANNLSSLGITALWLPPAYKGTSRSDVGYGVYDLYDLGEFNQKGTVRTKYGTKAQYLQAIQAAHAAGMQVYADVVFDHKGGADGTEWVDAVEVNPSDRNQEISGTYQIQAWTKFDFPGRGNTYSSFKWRWYHFDGVDWDESRKLSRIYKFRGIGKAWDWEVDTENGNYDYLMYADLDMDHPEWTELKNWGKWYVNTTNIDGFRLDAVKHIKFSFFPDWLSYVRSQTGKPLFTVGEYWSYDINKLHNYITKTNGTMSLFDAPLHNKFYTASKSGGAFDMRTLMTNTLMKDQPTLAVTFVDNHDTEPGQALQSWVDPWFKPLAYAFILTRQEGYPCVFYGDYYGIPQYNIPSLKSKIDPLLIARRDYAYGTQHDYLDHSDIIGWTREGVTEKPGSGLAALITDGPGGSKWMYVGKQHAGKVFYDLTGNRSDTVTINSDGWGEFKVNGGSVSVWVPRKTTVSTIARPITTRPWTGEFVRWTEPRLVAWP (SEQ ID NO:24).
Аминокислотную последовательность зрелой усеченной амилазы S242Q с замещенной аминокислотой, показанной курсивом, использовали в качестве основы при изготовлении библиотек вариантов, описываемых в настоящем документе:
AAPFNGTMMQYFEWYLPDDGTLWTKVANEANNLSSLGITALWLPPAYKGTSRSDVGYGVYDLYDLGEFNQKGTVRTKYGTKAQYLQAIQAAHAAGMQVYADVVFDHKGGADGTEWVDAVEVNPSDRNQEISGTYQIQAWTKFDFPGRGNTYSSFKWRWYHFDGVDWDESRKLSRIYKFRGIGKAWDWEVDTENGNYDYLMYADLDMDHPEWTELKNWGKWYVNTTNIDGFRLDAVKHIKFQFFPDWLSYVRSQTGKPLFTVGEYWSYDINKLHNYITKTNGTMSLFDAPLHNKFYTASKSGGAFDMRTLMTNTLMKDQPTLAVTFVDNHDTEPGQALQSWVDPWFKPLAYAFILTRQEGYPCVFYGDYYGIPQYNIPSLKSKIDPLLIARRDYAYGTQHDYLDHSDIIGWTREGVTEKPGSGLAALITDGPGGSKWMYVGKQHAGKVFYDLTGNRSDTVTINSDGWGEFKVNGGSVSVWVPRKTT (SEQ ID NO:25).
Кодирующая область для зрелой амилазы AmyTS-23t показана ниже:
aatacggcgccgatcaacgaaacgatgatgcagtattttgaatgggatctgccgaatgatggaacgctgtggacgaaagtcaaaaacgaagcggcgaatcttagcagcctgggaatcacagcactttggcttccgccggcatataaaggaacgagccaaagcgatgtcggctatggcgtctatgatctgtatgacctgggcgaatttaaccaaaaaggcacgatccggacgaaatatggcacgaaaacacagtatatccaagcgatccaggcagcaaaagcagcaggcatgcaagtctatgccgacgtcgtctttaatcataaagcgggagcggatggcacagaatttgtcgatgccgtcgaagttgatccgagcaacagaaaccaagaaacgagcggcacgtatcaaatccaagcgtggacgaaatttgattttccgggcagaggcaatacgtatagcagctttaaatggcgctggtatcattttgacggcacggattgggatgaaagcagaaaactgaaccggatctataaatttcggagcacgggcaaagcatgggattgggaagtcgatacggaaaacggcaactatgactatctgatgtttgccgatctggatatggatcatccggaagtcgtcacggaactgaaaaattggggcacgtggtatgttaatacgacgaacatcgatggctttagactggatgccgtcaaacatatcaaatatagcttttttccggactggctgacgtatgtcagaaaccagacgggcaaaaacctttttgccgtcggcgaattttggagctatgacgtcaacaaacttcataactatatcacgaaaacgaacggcagcatgagcctttttgatgccccgcttcataacaacttttatacggcgagcaaaagctcaggctattttgatatgagatatctgctgaacaacacgctgatgaaagatcaaccgagcctggcagtcacactggtcgataaccatgatacacaaccgggccaaagccttcaaagctgggtcgaaccgtggtttaaaccgctggcgtatgcctttatcctgacgagacaagaagggtatccttgcgtcttttatggcgactattatggcatcccgaaatataatatcccgggcctgaaaagcaaaatcgatccgctgctgatcgccagacgggattatgcctatggcacacagcgggattatatcgaccatcaggacatcatcggctggacaagagaaggcatcgatacgaaaccgaatagcggactggcagcactgattacagatggaccgggcggaagcaaatggatgtatgtcggcaaaaaacatgccggcaaagtcttttatgatctgacgggcaacagaagcgatacggtcacgatcaatgctgatggctggggagaatttaaagtcaatggcggcagcgtttcaatctgggtcgccaaa (SEQ ID NO:26).
Аминокислотную последовательность зрелой амилазы AmyTS-23t использовали в качестве основы при изготовлении библиотек вариантов, описываемых в настоящем документе:
NTAPINETMMQYFEWDLPNDGTLWTKVKNEAANLSSLGITALWLPPAYKGTSQSDVGYGVYDLYDLGEFNQKGTIRTKYGTKTQYIQAIQAAKAAGMQVYADVVFNHKAGADGTEFVDAVEVDPSNRNQETSGTYQIQAWTKFDFPGRGNTYSSFKWRWYHFDGTDWDESRKLNRIYKFRSTGKAWDWEVDTENGNYDYLMFADLDMDHPEVVTELKNWGTWYVNTTNIDGFRLDAVKHIKYSFFPDWLTYVRNQTGKNLFAVGEFWSYDVNKLHNYITKTNGSMSLFDAPLHNNFYTASKSSGYFDMRYLLNNTLMKDQPSLAVTLVDNHDTQPGQSLQSWVEPWFKPLAYAFILTRQEGYPCVFYGDYYGIPKYNIPGLKSKIDPLLIARRDYAYGTQRDYIDHQDIIGWTREGIDTKPNSGLAALITDGPGGSKWMYVGKKHAGKVFYDLTGNRSDTVTINADGWGEFKVNGGSVSIWVAK (SEQ ID NO:27).
Ген AmyS амплифицировали в виде фрагмента PstI-HpaI из плазмиды pICatH-Ethyl4(ori1) с использованием праймеров:
Ethyl4F: 5' CTTCTTGCTG CCTCATTCTG CAGCTTCAGC AGCCGCACCG TTTAACGGTA CCATG 3' (SEQ ID NO:28); и
Ethyl4R: 5' CAGGAAATCCGTCCTCTGTTAACTCAGGTCGTTTTTCTAGGAAC 3' (SEQ ID NO:29).
Продукты ПЦР очищали с помощью колонок Qiaquik из Qiagen, и ресуспендировали в 50 мкл деионизированной воды. 50 мкл очищенной ДНК расщепляли с помощью HpaI (Roche) и PstI (Roche) и результирующую ДНК ресуспендировали в 30 мкл деионизированной воды. 10-20 нг/мкл ДНК клонировали в плазмиду pHPLT с использованием сайтов клонирования PstI и HpaI. Легирующие смеси напрямую трансформировали в отвечающие требованиям клетки B. subtilis (генотип: ∆vpr, ∆wprA, ∆mpr-ybfJ, ∆nprB). Клетки B. subtilis обладают геном компетентности (comK), который расположен под индуцируемым ксилозой промотором, так что ксилозу использовали для индуцирования компетентности для связывания и поглощения ДНК.
Элементы плазмиды pHPLT-AmyS включали: pUB110 = фрагмент ДНК из плазмиды pUB110 (McKenzie et al., Plasmid 15: 93-103 [1986]). Свойства плазмиды включают: ori-pUB110 = участок начала репликации из pUB110, neo = ген устойчивости к неомицину из pUB110, Plat = транскрипционный промотор из амилазы B. licheniformis, Pre LAT = сигнальный пептид из амилазы B. licheniformis, AmyS = кодирующая область усеченной AmyS и вариантов амилазы, терминатор = терминатор транскрипции из амилазы B. licheniformis.
ПРИМЕР 4
Экспрессия вариантов фермента
Этот пример описывает способы, используемые для экспрессии различных рекомбинантных ферментов трансформированного B. subtilis из предыдущих примеров.
Нейтральные металлопротеазы - масштаб 600 мл
Рекомбинантный Bacillus subtilis культивировали посредством традиционной периодической ферментации в питательной среде. Один глицериновый флакон культуры B. subtilis, содержащей нейтральную металлопротеазу B. amyloliquefaciens или ее вариант, использовали для инокулирования 600 мл 1% среды SBG, содержащей 200 мг/л хлорамфеникола. Культуры выращивали в течение 36-48 часов при 37°C, по истечении этого времени культуральную жидкость собирали посредством центрифугирования при 12000 об/мин, как известно в данной области. Эту процедуру выполняли дважды. Секретированные нейтральные металлопротеазы концентрировали приблизительно 10-кратно с использованием Amicon filter system 8400 с BES (полиэфирсульфон) порогом 10 кДа.
Концентрированный супернатант диализировали в течение ночи при 4°C против 25 мМ буфера MES, pH 5,4, содержащего 10 мМ NaCl. Затем диализат загрузили в катионообменную колонку Poros HS20 (общий объем ~83 мл; связывающая емкость ~4,5 г белка/мл колонки; воды), как описано ниже. Колонку предварительно уравновешивали в 25 мМ буфере MES, pH 5,4, содержащем 10 мМ NaCl. Затем приблизительно 200-300 мл образца загружали в колонку. Связанный белок элюировали с использованием градиента pH от 5,4 до 6,2 при объеме буфера MES, равном 10 объемам колонки. Элюирование белка было между pH 5,8 и 6,0, и его оценивали с использованием протеолитической активности, как описано в настоящем документе, и 10% (масс./об.) NUPAGE® SDS-PAGE (Novex). Затем собирали фракции, содержащие нейтральную протеазу. Хлориды кальция и цинка в соотношении 3:1 добавляли перед регулированием pH до 5,8. Для очистки белка использовали Perceptive Biosystems BIOCAD® Vision (GMI). Определили, что очищенный белок, который оценивали с использованием 10% (масс./об.) NUPAGE® SDS-PAGE, является гомогенным с чистотой, превышающей 95%.
Сериновые протеазы - масштаб 600 мл
Рекомбинантный Bacillus subtilis культивировали посредством традиционной периодической ферментации в питательной среде. Один глицериновый сосуд культуры B. subtilis, содержащей сериновую протеазу C. bogoriensis или ее вариант, использовали для инокулирования 600 мл 1% среды SBG, содержащей 200 мг/л хлорамфеникола. Культуры выращивали в течение 36-48 часов при 37°C, по истечении этого времени культуральную жидкость собирали посредством центрифугирования в течение 30 мин при 12000 об/мин (SORVALL® центрифуга модели RC5B) при 10°C, как известно в данной области. Эту процедуру выполняли дважды. Полученный супернатант очищали глубокой фильтрацией через Seitz EKS (SeitzSchenk). Полученный стерильный культуральный супернатант дополнительно концентрировали приблизительно в 10 раз посредством ультрафильтрации с использованием кассеты для ультрафильтрации с порогом 10 кДа (Pall Omega 10 kDa Minisette; Pall). Полученные образцы неочищенной сериновой протеазы замораживали и хранили при -20°C до дальнейшего использования.
Разделенный клеточный культуральный бульон диализировали против 20 мМ (2-(4-морфолино)этансульфоновой кислоты (MES), pH 5,4, 1 мМ CaCl2 с использованием диализной трубки Spectra-Por7 (Spectrum) с порогом молекулярной массы в 8К (MWCO). Диализ выполняли в течение ночи или до тех пор, пока удельная электропроводность образца была меньше или равнялась удельной электропроводности буфера MES. Диализированные образцы фермента очищали с использованием BioCad VISION (Applied Biosystems) c катионообменной колонкой (PerSeptive Biosystems) 10×100 мм (7,845 мл) POROS High Density Sulfo-propyl (HS) 20 (20 микрон). После загрузки фермента в предварительно уравновешенную колонку при 5 мл/мин, колонку промывали при 40 мл/мин с градиентом pH от 25 мМ MES, pH 6,2, 1 мМ CaCl2 до 25 мМ (N-[2-гидроксиэтил]пиперазин-N'-[2-этан]сульфоновой кислоты [C8H18N2O4S, CAS # 7365-45-9]) (HEPES) pH 8,0, 1 мМ CaCl2 в 25 объемах колонки. Фракции (8 мл) собирали в течение пробега. Стадию отмывки pH 8,0 проводили в 5 объемах колонки и затем фермент элюировали с использованием градиента (0-100 мМ NaCl в том же буфере в 35 объемах колонки). Активность протеазы во фракциях наблюдали с использованием анализа с suc-AAPF-pNA. Активность протеазы, которую элюировали при 40 мМ NaCl, была концентрированной, и буфер заменили (с использованием 5K MWCO VIVA Science 20 мл концентратор) на 20 мМ MES, pH 5,8, 1 мМ CaCl2. Этот материал использовали для дальнейшего описания фермента.
Сериновые протеазы - масштаб 200 мкл
Клоны B. subtilis, содержащие белки ASP из экспрессирующих векторов, реплицировали стальным 96-луночным репликатором из глицериновых основных растворов в 96-луночные культуральные планшеты (BD, 353075), содержащие 200 мкл среды TSP +20 мкг/мл неомицина, выращивали в течение ночи при 37°C, 220 об/мин в увлажненной камере. Аликвоту 15 мкл из ночной культуры использовали для инокулирования 185 мкл среды определенного состава +20 мкг/мл неомицина в фильтровальных планшетах Millipore MultiScreen. Среду для культивирования обогащали средой полуопределенного состава, основанной на буфере MOPS, с мочевиной в качестве основного источника азота, глюкозой в качестве основного источника углерода, и добавляли 1% сойтона для активного клеточного роста. Фильтровальные планшеты инкубировали в увлажненной камере при 37°C, 220 об/мин, в течение 60 часов. После этого инкубирования культуральные бульоны фильтровали через фильтровальный планшет и собирали. Никакой дополнительной очистки или концентрирования не выполняли. Для основных растворов фильтратов составляли смесь с конечной концентрацией пропиленгликоля 40% для долгосрочной стабильности и хранили в 96-луночных чистых несвязывающих полистироловых планшетах (Corning, CLS3641) при 4°C.
Субтилизины - масштаб 2 мл
Клоны B. subtilis, содержащие экспрессирующие векторы FNA или GG36, реплицировали стальным 96-луночным репликатором из глицериновых основных растворов в 96-луночные культуральные планшеты (BD, 353075), содержащие 200 мкл среды LB +25 мкг/мл хлорамфеникола, выращивали в течение ночи при 37°C, 220 об/мин в увлажненной камере. Аликвоту 200 мкл из ночной культуры использовали для инокулирования 2000 мкл среды определенного состава +25 мкг/мл хлорамфеникола в 5 мл пластиковых культуральных пробирках. Среду для культивирования обогащали средой полуопределенного состава, основанной на буфере MOPS, с мочевиной в качестве основного источника азота, глюкозой в качестве основного источника углерода и добавляли 1% сойтона для активного клеточного роста. Культуральные пробирки инкубировали при 37°C, 220 об/мин, в течение 60 часов. После этого инкубирования культуральные бульоны центрифугировали при более 8000×RCF. Раствор супернатанта декантировали в 15 мл полипропиленовые конические пробирки для хранения. Не выполняли дополнительной очистки или концентрирования. Для основных растворов супернатантов составляли смесь с конечной концентрацией пропиленгликоля 40% для долгосрочной стабильности и хранили при 4°C.
Экспрессия амилазы - масштаб 2 мл
Клоны B. subtilis, содержащие экспрессирующие векторы AmyS, S242Q или AmyTS23t, реплицировали стальным 96-луночным репликатором из глицериновых основных растворов в 96-луночные культуральные планшеты (BD, 353075), содержащие 150 мкл среды LB +10 мкг/мл неомицина, выращивали в течение ночи при 37°C, 220 об/мин в увлажненной камере. Аликвоту 100 мкл ночной культуры использовали для инокулирования 2000 мкл среды определенного состава +10 мкг/мл неомицина в 5 мл пластиковых культуральных пробирках. Среду для культивирования обогащали средой полуопределенного состава, основанной на буфере MOPS, с мочевиной в качестве основного источника азота, глюкозой в качестве основного источника углерода и добавляли 1% сойтона и 5 мМ кальция для активного клеточного роста. Культуральные пробирки инкубировали при 37°C, 250 об/мин, в течение 72 часов. После этого инкубирования культуральные бульоны центрифугировали в течение 10 минут при 3000 g. Раствор супернатанта декантировали в 15 мл полипропиленовые конические пробирки и аликвоты по 80 мкл каждого образца вносили в 96-луночные планшеты для количественного определения белка.
ПРИМЕР 5
Производство вариантов фермента
Этот пример описывает производство фермента со шкалами зарядов и комбинаторных зарядовых библиотек.
Фермент со шкалами зарядов
Множество вариантов белков, охватывающее диапазон интересующего физического свойства, выбирали из существующих библиотек или создавали способами сайт-специфического мутагенеза, известными в данной области (смотрите, например, заявки на патенты США с серийными номерами 10/576331, 11/581102 и 11/583334). Затем этот ограниченный набор зондовых белков анализируют в интересующем тесте.
Образцовые варианты протеазы со шкалой зарядов приведены в следующих таблицах, и их анализировали, как описано в настоящем документе. В этих таблицах изменение заряда указано по отношению к ферменту дикого типа.
Варианты ASP со шкалой зарядов
Варианты NprE со шкалой зарядов
Варианты FNA со шкалой зарядов
Варианты GG36 со шкалой зарядов
Образцовые варианты амилазы со шкалой зарядов приведены в следующих таблицах и их анализировали, как описано в настоящем документе. В этих таблицах изменение заряда указано по отношению к ферменту дикого типа.
Последовательность гена AmyS предоставляли компании Gene Oracle (Mountain View, CA) для синтеза 28 вариантов со шкалой зарядов, приведенных в таблице 5-5. Gene Oracle синтезировала и клонировала варианты AmyS в вектор pGov4 и трансформировала их в E. coli. ДНК, выделенные из miniprep, а также столбики агара были доставлены для каждого варианта.
Варианты ПЦР амплифицировали и клонировали в экспрессирующий вектор pHPLT B. subtilis. Варианты амплифицировали в виде фрагмента PstI-HindIII из плазмиды pGov4 с использованием праймеров:
AmyS праймер F 5'- CTCATCTTCTTGCTGCCTCATTCTGCAGCTTC-3' (SEQ ID NO:30); и
AmyS праймер R 5'- TTATCCTTTACCTTGTCTCCAAGC-3' (SEQ ID NO:31).
Продукты ПЦР очищали с использованием колонок Qiagen Qiaquik и ресуспендировали в 50 мкл воды Milli-Q. 50 мкл очищенной ДНК расщепляли с помощью HindIII (Roche) и PstI (Roche) и результирующую ДНК ресуспендировали в 30 мкл деионизированной воды. 10-20 нг/мкл ДНК клонировали в плазмиду pHPLT с использованием сайтов клонирования PstI и HpaI. Легирующие смеси напрямую трансформировали в компетентные клетки B. subtilis (генотип: amyE::xylRPxylAcomK-phleo). Эти клетки B. subtilis обладают геном компетентности (comK), который расположен под индуцируемым ксилозой промотором, так что ксилозу использовали, чтобы индуцировать компетентность для связывания и поглощения ДНК.
AmyS с первой шкалой зарядов
AmyS со второй шкалой зарядов
AmyS-S242Q со шкалой зарядов
Комбинаторные зарядовые библиотеки ферментов
Создание комбинаторных зарядовых библиотек субтилизина B. lentus (=GG36)
Плазмиду pAC-GG36ci, содержащую кодон-оптимизированный ген GG36, посылали в DNA2.0 Inc. (Menlo Park, CA) для создания комбинаторных зарядовых библиотек (КЗБ). Также они были предоставлены со штаммом Bacillus subtilis (генотип: ∆aprE, ∆nprE, ∆spoIIE, amyE::xylRPxylAcomK-phleo) для трансформаций. Кроме того, в DNA2.0 Inc. был сделан запрос на создание позиционных библиотек в каждом из четырех сайтов в протеазе GG36, которые показаны в таблице 5-7. Варианты поставлялись в виде глицериновых основных растворов в 96-луночных планшетах.
КЗБ GG36 проектировали посредством идентификации четырех равномерно распределенных, расположенных на поверхности, незаряженных полярных аминокислотных остатков за пределами активного центра. Этими остатками являются Ser-85, Gln-107, Ser-182 и Asn-242 (остатки 87, 109, 188 и 248 согласно нумерации BPN'). Комбинаторную библиотеку из 81 члена (с G-1 до G-81) создавали посредством осуществления всех комбинаций из трех возможностей в каждом сайте: дикий тип, аргинин или аспарагиновая кислота.
Варианты КЗБ GG36
Создание КЗБ субтилизина BPN'-Y217L (=FNA) B. amyloliquefaciens
Плазмиду pAC-FNAre, содержащую ген FNA, посылали в DNA2.0 Inc. (Menlo Park, CA) для создания КЗБ. Также они были предоставлены со штаммом Bacillus subtilis (генотип: ∆aprE, ∆nprE, ∆spoIIE, amyE::xylRPxylAcomK-phleo) для трансформаций. В DNA2.0 Inc. был сделан запрос на создание позиционных библиотек для каждого из четырех сайтов протеазы FNA, которые приведены в таблице 5-8. Варианты поставлялись в виде глицериновых основных растворов в 96-луночных планшетах.
Комбинаторную зарядовую библиотеку субтилизина BPN'-Y217L проектировали посредством идентификации четырех равномерно распределенных, расположенных на поверхности, незаряженных полярных аминокислотных остатков за пределами активного центра. Этими остатками являются Ser-87, Asn-109, Ser-188 и Ser-248. Комбинаторную библиотеку из 81 члена (с F-1 до F-81) создавали посредством выполнения всех комбинаций трех возможностей в каждом сайте: дикий тип, аргинин или аспарагиновая кислота.
Варианты КЗБ FNA
Создание КЗБ AmyS-S242Q B. stearothermophilus
Плазмидную ДНК AmyS-S242Q выделяли из трансформированного штамма B. subtilis (генотип: ∆aprE, ∆nprE, amyE::xylRPxylAcomK-phleo) и посылали в DNA2.0 Inc. в качестве матрицы для создания КЗБ. В DNA2.0 Inc. (Mountain View, CA) был выполнен запрос на создание позиционных библиотек в каждом из четырех сайтов в амилазе AmyS-S242Q (S242Q), которые приведены в таблице 5-9. Варианты поставлялись в виде глицериновых основных растворов в 96-луночных планшетах.
Комбинаторную зарядовую библиотеку AmyS S242Q проектировали посредством идентификации следующих четырех остатков: Gln-97, Gln-319, Gln-358 и Gln-443. Для четырех сайтов создавали КЗБ из 81 члена посредством осуществления всех комбинаций трех возможностей в каждом сайте: дикий тип, аргинин или аспарагиновая кислота.
Варианты КЗБ S242Q
Создание КЗБ AmyTS23t из Bacillus sp.
AmyTS23t представляет собой усеченную форму α-амилазы TS-23 из Bacillus sp. Была описана экспрессия AmyTS23t во многих штаммах B. subtilis с удаленной протеазой (degUHy32, oppA, ∆spoII3501, amyE::xylRPxylAcomK- ermC, ∆aprE, ∆nprE, ∆epr, ∆ispA, ∆bpr, ∆vpr, ∆wprA, ∆mpr-ybfJ, ∆nprB) (смотрите, например, US2005/0202535A1). Плазмидную ДНК AmyTS23t, выделенную из трансформированных клеток B. subtilis, посылали в DNA2.0 Inc. (Menlo Park, CA) в качестве матрицы для создания КЗБ. В DNA2.0 был выполнен запрос на изготовление родительской конструкции для КЗБ посредством введения следующих семи мутаций в AmyTS23t, которая, таким образом, была названа AmyTS23t-7mut (в этом документе также обозначается, как TS23t'): Q98R, M201L, S243Q, R309A, Q320R, Q359E и K444E. Варианты поставлялись в виде глицериновых основных растворов в 96-луночных планшетах. Впоследствии в DNA2.0 Inc. был выполнен запрос на создание позиционных библиотек в каждом из четырех сайтов в амилазе AmyTS23t-7mut, которые приведены в таблице 5-10.
Комбинаторную зарядовую библиотеку AmyTS23t проектировали посредством идентификации следующих четырех остатков в AmyTS23t-7mut: Gln-87, Asn-225, Asn-272 и Asn-282. Для четырех сайтов создавали КЗБ из 81 члена посредством осуществления всех комбинаций трех возможностей в каждом сайте: дикий тип, аргинин или аспарагиновая кислота.
Варианты КЗБ AmyTS23t
ПРИМЕР 6
Эффективность фермента
Этот пример описывает тестирование вариантов ASP в анализе с микрообразцами КМЧ (кровь-молоко-чернила) при концентрации детергента AATCC HDL 1,0 мкг/мл или в 5 мМ HEPES буфере при различных ионных силах. Также описано тестирование вариантов FNA и GG36 в анализах с микрообразцами КМЧ и печеным яйцом в детергентах, представленных на рынке в различных географических областях (например, с различающимися pH, T и/или жесткостью воды), как для применения в стирке, так и для автоматического мытья посуды. Более того, этот пример описывает тестирование вариантов α-амилазы при очистке применения, а также в разжижении крахмала. Использовали способы, предоставленные в примере 1 (смотрите, «Анализы эффективности фермента» и «Четыре кукурузных гидролиза»).
На фиг. 1 показано изменение суммарного заряда, оптимальное для эффективной очистки с помощью ASP в детергенте ААТСС HDL. Эффективность измеряют в переводе на относительную эффективность очистки, наблюдаемую в анализе активности с микрообразцами КМЧ. В этом анализе значение приблизительно 1,0 указывает на максимальную эффективность очистки. Как следует из фигуры, накопление крайне отрицательных (-5) или положительных (+3) зарядов по отношению к дикому типу приводит к низкой эффективности очистки. Точное оптимальное значение заряда для эффективной очистки сосредоточено около -2 по отношению к ASP дикого типа. Это является примером оптимизации физического свойства белка (например, суммарного заряда) для улучшения заданного результата или пользы (например, эффективности очистки в жидком детергенте для стирки). Оптимальное значение заряда устанавливали на этом ограниченном наборе зондовых белков, совпадающих с оптимальным значением заряда, которое наблюдали при измерении всей комбинаторной зарядовой библиотеки ASP, как показано на фиг. 2. Следовательно, использование зондовых белков является предсказательным для поведения всей библиотеки.
Согласно теории Дебай-Хюккеля (Israelachivili, Intermolecular and Surface Forces, Second Edition: With Applications to Colloidal and Biological Systems, Academic Press 2nd Ed. [1992]), электростатические взаимодействия прежде всего управляются силами двойного слоя между взаимодействующими частицами при постоянном потенциале или постоянном заряде (ферменты, субстраты, материя и детергент), их размере и диэлектрической постоянной окружающей среды. Для того, чтобы описать электростатическое поведение частиц в сложной среде, такой как моющий состав, их взаимодействие в сокращенной среде, обладающей таким же дебаевским радиусом экранирования, является достаточным. Этот способ осуществляется через выбор буфера с pH и удельной электропроводностью, совпадающими с таковыми детергента при условиях мытья. Как указано на фиг. 1, скрининг ASP со шкалой зарядов в этом буфере правильно предсказал оптимальное значение заряда, равное -2, наблюдаемое в детергенте ААТСС (залитые круги). Фиг. 3 показывает относительное удаление краски КМЧ как функцию изменения заряда по отношению к ASP дикого типа, в 5 мМ HEPES буфере при pH 8,0 с различными количествами индифферентного электролита, в этом случае NaCl. При добавлении в этот буфер 2,5 мМ NaCl, pH и удельная электропроводность совпадают с типичными североамериканскими условиями мытья. Добавление NaCl в более высоких концентрациях представляет японские и европейские условия мытья, типично с большей ионной силой как из-за увеличенной жесткости воды, так и из-за концентрации детергента. Таким образом, оптимальное значение заряда ASP является функцией от окружающего раствора (например, моющего состава).
Существуют две особенности, которые непосредственно стали очевидными. Во-первых, использование модельной системы, состоящей из ограниченного количества зондовых белков для заданного физического свойства (например, варианты ASP со шкалой зарядов) в сокращенной среде буфера с совпадающими pH и удельной электропроводностью, является предсказательным для поведения большой библиотеки ASP, скрининг которой проводили в условиях детергента. Фактически, оптимальное значение заряда, показанное на фиг. 1, измеренное в буфере, содержащем 2,5 мМ NaCl (незалитые круги), идентично оптимальному значению, наблюдаемому для этой ASP со шкалой зарядов, скрининг которой проводили в детергенте ААТСС при североамериканских условиях мытья. Во-вторых, расположение оптимального значения заряда строго является функцией ионной силы. При дополнительном добавлении NaCl оптимальное значение заряда сдвигается по направлению к вариантам с положительным зарядом по отношению к ASP дикого типа. Вкратце, использование зондовых белков со шкалой зарядов делает возможным быстрое предсказание эффективности различных вариантов фермента для составов, соответствующих рынкам в различных географических областях.
Вышеуказанные наблюдения сохраняются для других сериновых протеаз, таких как субтилизины FNA и GG36. Например, фиг. 4A и 4B показывают оптимальное значение заряда для FNA и GG36, соответственно, при эффективной очистке в североамериканских условиях стирки с использованием детергента TIDE 2X. Левые оси ординат показывают эффективность очистки микрообразца, где более высокие значения указывают на превосходное удаление краски КМЧ. Правые оси ординат показывают показатель эффективности, определяемый как эффективность очистки вариантов (залитые значки) по отношению к родительской молекуле (незалитые значки). Горизонтальные линии отражают показатель эффективности при 2 или 3 стандартных отклонениях выше уровня шума в анализе. Комбинаторная зарядовая библиотека (КЗБ) FNA проявляет оптимальное значение заряда при нулевом изменении зарядов по отношению к родительской FNA, тогда как КЗБ GG36 проявляет оптимальное значение при двух отрицательных зарядах к родительской GG36.
Фиг.5A, 5B, 6A, 6B, 7A и 7B показывают, что расположение оптимального значения заряда является функцией окружающего раствора, определяемой моющим составом, pH, температурой и ионной силой за счет жесткости воды и концентрации детергента. Например, оптимальное значение заряда для КЗБ FNA кардинально сдвигается от нуля при североамериканских условиях стирки к более положительным при западноевропейских и японских условиях. Кроме того, оптимальное значение заряда наблюдено как для жидких, так и гранулированных (порошков) моющих составов для стирки. Подобным образом, оптимальное значение заряда было наблюдено как для КЗБ FNA, так и для КЗБ GG36 в детергенте для автоматического мытья посуды (ADW) для (например, Reckitt Benckiser Calgonit 40°C, 12 gpg, pH 10) печеного яйца в качестве субстрата фермента.
Как было показано в процессе разработки настоящего изобретения, на эффективность очистки зарядовых вариантов протеаза (например, ASP, GG36, FNA и т.п.) в различных детергентах в значительной степени влияет pH и удельная электропроводность рабочего раствора. Итоговая удельная электропроводность представляет собой меру ионной силы, на нее влияют жесткость воды, концентрация и композиция детергента. Например, существует зависимость между эффективностью очистки вариантов GG36 и FNA против краски печеного яйца в европейских и североамериканских детергентах ADW, когда их проводят при pH 10,6 и удельной электропроводности 3,0 мСм/см. В частности, эффективность очистки зарядовых вариантов хорошо коррелирует, что обеспечено совпадающими pH и удельной электропроводностью. Эта находка делает возможным скрининг эффективности фермента с использованием заданного детергента для экстраполирования этих результатов на другой детергент с совпадающими pH и удельной электропроводностью. Подобным образом, можно проводить скрининг эффективности фермента в буфере с совпадающими pH и удельной электропроводностью для экстраполирования этих результатов на детергент, проявляющий схожие рабочие pH и удельную электропроводность.
Подобным образом, существует оптимальное значение заряда для эффективной очистки зарядовыми вариантами амилазы (например, AmyS-S242Q и AmyTS23t, и т.д.) в чистящих применениях, которое строго является функцией pH и удельной электропроводности рабочего раствора. В частности, как было определено в процессе разработки настоящего изобретения, варианты S242Q с положительным изменением заряда превосходно подходят для очистки микрообразцов с рисовым крахмалом в североамериканских условиях стирки (например, TIDE 2X), как указано на фиг.8, тогда как варианты AmyTS23t с отрицательным изменением заряда превосходно подходят для очистки микрообразцов с рисовым крахмалом при западноевропейских условиях стирки, как указано на фиг.9. Кроме того, эти наблюдения сохраняют правдивость для амилазы, используемой в реакциях гидролиза крахмала. Как показано на фиг.10, положительные варианты S242Q проявляют более высокую специфическую активность при гидролизе субстратов из BODIPY-крахмала.
Разжижение крахмала с помощью вариантов AmyS со шкалой зарядов определяли посредством мониторинга конечной вязкости после разжижения кукурузного крахмала. Низкая величина вязкости указывает на разрушение полисахаридов крахмала. Как показано на фиг.11, для разжижения наблюдали оптимальное значение заряда (например, от -4 до -2). Варианты AmyS, которые были очень отрицательными (например, от -12 до -10), проявляли очень высокие конечные вязкости, и варианты, которые были очень положительными (например, +6 или выше), проявляли даже еще большие конечные вязкости (например, за пределами чувствительности лабораторных инструментов за счет превышения вращающего момента).
ПРИМЕР 7
Определение электрокинетического потенциала
Этот пример описывает определение электрокинетического потенциала фермента и субстрата. Присутствие заряда на поверхности частицы влияет на распределение ионов в окружающей межфазной области. Результатом является повышенная концентрация противоионов с противоположным зарядом по отношению к заряду частицы в области поверхности частицы. Когда заряд уходит от поверхности частицы, в конечном счете, гетерогенное распределение ионов становится гомогенным. Расстояние, на котором достигается гомогенное распределение, называется дебаевская длина (1/k) или расстояние экранирования и зависит от ионной силы, как показано в выражении ниже, где ε0 представляет собой диэлектрическую проницаемость свободного пространства (8,854×10-12 Ф·м-1), εr представляет собой диэлектрическую проницаемость жидкости, k представляет собой константу Больцмана (1,38×10-23 Дж·К-1), T представляет собой температуру в Кельвинах, e представляет собой заряд электрона (1,6022×10-19 Кл), I представляет собой молярную ионную силу и NA представляет собой число Авогадро (6,022×1023 моль-1).

Молярная ионная сила может быть вычислена по следующему уравнению, где C i представляет собой концентрацию ионных частиц и Z i представляет собой валентность.

Для воды при 298 K, выражение дебаевской длины упрощается до следующего вида.
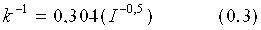
Слой жидкости, окружающий частицу, существует в виде двух частей; внутренняя область (слой Штерна), в котором ионы прочно связаны, и наружная (диффузионная) область, в которой они связаны менее прочно. Внутри диффузионного слоя существуют границы, внутри которых ионы и частицы образуют стабильную структуру. При движении частицы ионы внутри этих границ двигаются с ним. Те ионы, что находятся за пределами границы, не движутся вместе с частицей. Электрический потенциал в этих границах, также называемых поверхностью гидродинамического сдвига, определяется как электрокинетический потенциал.
При электрофоретическом рассеянии света, электрокинетический потенциал z вычисляют по измеренной электрофоретической подвижности u с помощью приведенного ниже уравнения Генри, где ε представляет собой диэлектрическую постоянную, h представляет собой вязкость раствора, k представляет собой величину, обратную дебаевской длине, a представляет собой радиус частицы, и f(ka) представляет собой функцию Генри.

Единицы k обратны длине, при 1/k, представляющей собой «толщину» двойного электрического слоя (дебаевская длина). Параметр a относится к радиусу частицы, и, следовательно, ka представляет собой отношение радиуса частицы к толщине двойного электрического слоя. Функция Генри f(ka) зависит от формы частицы, но для сферы она известна. В вышеуказанном выражении она меняется в пределах от f(0)=1 (предел Хюккеля) до f(¥)=1,5 (предел Смолуховского). Для маленьких частиц, таких как белки в среде с низкими диэлектрическими свойствами (или низкой ионной силой), предел Хюккеля f(ka)=1 представляет собой наиболее подходящую модель.
Электрокинетические потенциалы белков измеряли на Zetasizer NS (Malvern Instruments, UK) в соответствии с принципом, описанным выше. Электрокинетические потенциалы КМЧ-окрашенных материй измеряли с помощью SurPass (Anton-Paar, Austria), используя реализацию мембранного потенциала из вышеуказанного принципа. Из определения поверхностного заряда, обычно выражаемого в Кулонах:

Также это может быть выражено в виде суммарного заряда z, умноженного на элементарный заряд e 1,6×10-19 Кл:

Следовательно, ожидаемое изменение электрокинетического потенциала за счет увеличения суммарного заряда имеет вид:

Также можно измерить электрокинетические потенциалы с помощью нативного гелевого способа (Sparks et al., Journal of Lipid Research, 33: 123-130 [1992]), как описано в примере 1. Электрофоретическая подвижность, измеренная в нативных гелях, обычно меньше, чем в растворе за счет помех, создаваемых гелевой матрицей. Электрокинетические потенциалы, вычисленные этим способом, обычно ниже по сравнению со способами, основанными на растворах. Следовательно, при получении посредством нативного гелевого способа, авторы изобретения относятся к ним как к видимым электрокинетическим потенциалам.
Эффективный заряд данного состава считается его электрокинетическим потенциалом. Использование электрокинетического потенциала в качестве общей шкалы зарядов делает возможным сравнение вариантов фермента, обладающих различными укладками (например, сериновые протеазы, металлопротеазы и т.д.), а также взаимодействий с различными субстратами (например, микрообразцы с КМЧ) при интересующих условиях (например, детергент AATCC HDL). Хотя электрокинетический потенциал является предпочтительным для сравнения различных укладок белков, электрофоретические подвижности или измеренные заряды также предоставляют абсолютную шкалу и достаточны для сравнения. Фиг.12 показывает эффективность КМЧ (левая ось ординат) как функцию электрокинетического потенциала (нижняя ось абсцисс) для сериновой протеазы ASP (черные круги). Варианты ASP со шкалой зарядов охватывают диапазон в 8 зарядов по отношению к ASP дикого типа. Как описано в примере 5, существует оптимальное значение суммарного заряда для эффективной очистки. Фиг.12 иллюстрирует то, что эффективность против КМЧ как функция электрокинетического потенциала фермента хорошо описывается стандартным нормальным распределением, которое показано сплошной линией, со средним μ, равным -9,68 мВ, стандартное отклонение σ составляет 11,39 мВ и пиковое значение составляет 0,4056 [A600-фон]. Это распределение показано в стандартных сокращенных координатах с помощью активности против КМЧ, деленной на пиковое значение на правой оси ординат как функции от Z-оценки на верхней оси абсцисс. Обычно Z-оценка определяется как (X-μ)/σ, где X в этом случае представляет собой электрокинетический потенциал.
Активность протеаз на микрообразцах с КМЧ
Эталонный буфер: 5 мМ HEPES pH 8,0, 2,5 мМ NaCl
Нормальное распределение уникально для каждой краски-субстрата при заданных условиях реакции (pH, удельная электропроводность, тип соли, хелатирующие агенты детергента и т.д.). Различные преимущества или благоприятные результаты следуют из нормального распределения физического свойства, которое сохраняется среди ферментов с различными укладками, например, как в случае с уровнями экспрессии и электрокинетическими потенциалами вариантов ASP и NprE со шкалами зарядов. При нормальном распределении пиковое значение попадает в среднее значение. Сравнение зарядов фермента и субстрата на общей шкале электрокинетического потенциала показывает, что оптимальное значение эффективности против КМЧ возникает, когда среднее значение электрокинетического потенциала фермента, в этом случае -9,68 мВ, в основном совпадает с электрокинетическим потенциалом краски-субстрата, в этом случае -8,97 мВ, измеренным при тех же условиях.
Уровни эффективности стандартных нормальных распределений удобно описываются в значениях их z-оценок, как показано в таблице 7-1 (смотрите, Abramowitz and Stegun, Handbook of Mathematical Functions with Formulas, Graphs, and Mathematical Tables, Dover, New York, 9th Ed. [1964]). Переход в электрокинетические потенциалы представляет собой непосредственно данное знание о среднем значении и стандартном отклонении, определяющих распределение для заданного применения. В этом примере измеренная эффективность очистки для укладки белка ограничивается значениями электрокинетического потенциала между -40 мВ и +20 мВ. Варианты с эффективностью очистки выше 80% от значения при их оптимальной укладке (т.е. z=±0,65), ограничиваются значениями электрокинетического потенциала между -17,08 мВ и -2,28 мВ. Варианты с эффективностью очистки выше 90% от значения при их оптимальной укладке (т.е. z=±0,46), ограничиваются значениями электрокинетического потенциала между -14,92 мВ и -4,44 мВ.
Различные краски-субстраты (например, трава, body soils, помидоры) имеют различные электрокинетические потенциалы при одном составе и одна краска-субстрат имеет различные электрокинетические потенциалы при различных составах (например, североамериканский HDL, европейский порошковый детергент для мытья посуды). Независимо, тогда как меняется заряд краски-субстрата, ожидается, что стандартное отклонение нормального распределения останется постоянным. Зная электрокинетические потенциалы фермент и субстрат в данном моющем составе, можно быстро идентифицировать ожидаемый уровень эффективности для этого варианта, а также направление и величину изменения заряда, необходимые для того, чтобы достичь оптимальных уровней эффективности. Измерение электрокинетического потенциала субстрата в требуемой реакционной среде делает возможной оптимизацию ферментативной реакции на корпускулярном субстрате в этой среде. Любая ферментативная реакция в любой среде может быть оптимизирована с помощью сходного процесса.
В некоторых вариантах осуществления ферменты со специфичностью к определенной краске получены посредством оптимизации эффективности фермента на конкретной краске при заданных условиях. Это достигается измерением электрокинетического потенциала краски в условиях удаления краски и последующим изменением фермента, чтобы получить вариант(ы), обладающий в основном равным электрокинетическим потенциалом при тех же условиях (например, электрокинетический потенциал, соответствующий, по меньшей мере, приблизительно 80%, приблизительно 90%, приблизительно 95%, приблизительно 97% или приблизительно 99% от оптимальной эффективности). В некоторых вариантах осуществления это достигается посредством модификации одной или нескольких аминокислот на поверхности фермента с помощью генетической или химической модификации. В других вариантах осуществления ферменты со специфичностью к определенной краске получают скринингом природных изолятов или гомологов зондового фермента для обнаружения ферментов, обладающих электрокинетическим потенциалом внутри намеченного диапазона. Хотя этот пример направлен на очистку краски КМЧ, способы по настоящему изобретению также пригодны для использования при оптимизации очистки других красок, таких как, но без ограничений, трава, вино или моча. Подобным образом, хотя этот пример направлен на активность сериновой протеазы, способы по настоящему изобретению также пригодны для использования при оптимизации активности других ферментов, таких как, но не ограничиваясь, протеазы, амилазы, целлюлазы, липазы, полиэстеразы, эстеразы, кутиназы, пектиназы, маннаназы и оксидоредуктазы.
ПРИМЕР 8
Распределение фермента на краске-субстрате
Этот пример описывает установление связи между зарядом фермента, распределением краски-субстрата и эффективностью очистки. Фиг.13 и следующие таблицы показывают эффективность очистки зондовых белков ASP со шкалой зарядов в 5 мМ HEPES pH 8,0 буфере при различных ионных силах, измеренную в виде активности против микрообразцов с КМЧ как функции распределения фермента на краске-субстрате, измеренного истощением. Ионную силу контролировали посредством добавления различных количеств индифферентного электролита: 2,5 мМ NaCl (незалитые круги), 16 мМ NaCl (серые круги) и 100 мМ NaCl (залитые круги). Эффективность очистки зондовых белков ASP со шкалой зарядов от КМЧ попадает как в низкое, так и в высокое распределение фермента на краске-субстрате. Оптимальное распределение для эффективной очистки находится между фракциями связанного фермента, равными 0,1 и 0,5. Тогда как ожидалась низкая эффективность при маленьком распределении фермента на субстрате, обнаружение низкой эффективности при высоком распределении фермента на субстрате не является интуитивно-понятным.
5 мМ HEPES pH 8,0 с 2,5 мМ NaCl
5 мМ HEPES pH 8,0 с 16 мМ NaCl
5 мМ HEPES pH 8,0 с 100 мМ NaCl
На фиг.14 показана связанная фракция фермента как функция от заряда по отношению к ASP дикого типа в 5 мМ HEPES pH 8,0 буфере при различных ионных силах (круги) и в детергенте AATCC HDL (треугольники). Как следует из этой фигуры, накопление крайне отрицательного (-5) заряда по отношению к ASP дикого типа приводит к низкому распределению фермента на краске-субстрате и, таким образом, низкой эффективности очистки в условиях низкого содержания соли. Подобным образом, как подтверждается этой фигурой, накопление крайне положительных (+3) зарядов по отношению к ASP дикого типа приводит к избыточному распределению фермента на краске-субстрате и, таким образом, низкой эффективности очистки в условиях низкого содержания соли.
Сходным образом график связанной фракции фермента от изменения суммарного заряда для всей комбинаторной зарядовой библиотеки ASP в 5 мМ HEPES pH 8 буфере с 2,5 мМ NaCl, показанный на фиг.15, имеет сходство с графиком, полученным для вариантов ASP со шкалой зарядов. Вновь использование зондовых белков (например, со шкалой зарядов) было репрезентативным для поведения целой библиотеки. Таким образом, использование зондовых белков ASP со шкалой зарядов делает возможность быстро устанавливать оптимальный заряд для распределения фермента на краске-субстрате. В этом случае суммарный заряд, меняющийся в пределах от -2 до +2 по отношению к ASP дикого типа, соответствует связанной фракции в пределах от 0,1 до 0,5, оптимальных для эффективной очистки в условиях низкой концентрации соли. Это является примером оптимизации физического свойства белка, в этом случае суммарного заряда/гидрофобности, для модулирования фермент-субстратного связывания.
На фиг.16 показана фракция фермента, связанного с краской-субстратом, как функция электрокинетического потенциала фермента в 5 мМ HEPES pH 8,0 буфере с 2,5 мМ NaCl. Как ожидалось, общий профиль схож с ранее описанным профилем на фиг.14, при добавлении такого же количества индифферентного электролита. Электрокинетический потенциал краски-субстрата равен -8,97 мВ.
Не ограничиваясь теорией, отрицательно заряженные варианты фермента, показанные в виде залитых кругов (например, более отрицательные чем -15 мВ), отталкиваются при приближении к отрицательно заряженной краске-субстрату, приводя к низкому распределению. Наоборот, положительно заряженные варианты, показанные в виде незалитых кругов (например, выше точки нулевого заряда), притягиваются к отрицательно заряженной краске-субстрату, приводя к высокому распределению. Таким образом, для эффективной очистки существует оптимальное распределение.
В основном при любом сочетании фермента, субстрата и условий раствора, распределение на краске-субстрате ограничено окном электрокинетического потенциала, в середине которого находится значение электрокинетического потенциала краски-субстрата, измеренное при таких же условиях, в этом случае -8,97 мВ. Ширина окна электрокинетического потенциала определяет ожидаемую связанную фракцию. Например, окно электрокинетического потенциала шириной 30 мВ, заданное в пределах -8,97±15 мВ, охватывает распределение субстрата между менее 0,1 (плохо связывающиеся вещества) и более 0,5 (хорошо связывающиеся вещества). Окно электрокинетического потенциала шириной 20 мВ, заданное в пределах -8,97±10 мВ, охватывает распределение субстрата между более 0,1 и менее 0,5. Окно электрокинетического потенциала шириной 10 мВ, заданное в пределах -8,97±5 мВ между 0,15 и 0,4, может считаться оптимальным для эффективной очистки этой краски-субстрата при этих условиях.
Различные краски-субстраты (например, трава, body soils, томаты и т.д.) обладают различными электрокинетическими потенциалами при одинаковом составе и одна и та же краска-субстрат обладает различными электрокинетическими потенциалами при различных составах (например, североамериканский HDL, европейский порошковый детергент для мытья посуды). Независимо, предполагается, что окно электрокинетического потенциала, охватывающее различные уровни распределения субстрата, остается постоянным. Знание о электрокинетических потенциалах фермента и субстрата в данном моющем составе делает возможным быстрое определение ожидаемого уровня распределения субстрата для этого варианта, а также направление и величину изменения заряда, необходимые для того, чтобы достичь оптимального распределения. Таким образом, измерение электрокинетического потенциала субстрата в требуемой реакционной среде делает возможной оптимизацию ферментативной реакции на конкретном субстрате в этой среде. Любая ферментативная реакция в любой среде может быть оптимизирована с помощью сходного процесса. Наоборот, знание об электрокинетическом потенциале поддерживающего каркаса материи (т.е. балласт) находит применение при предупреждении связывания. Тогда как краска КМЧ обладает электрокинетическим потенциалом -8,97 мВ, неокрашенная хлопковая основа материи обладает электрокинетическим потенциалом -14,43 мВ.
Хотя этот пример направлен на распределение сериновой протеазы на красках-субстратах КМЧ, способы по настоящему изобретению также пригодны для использования при оптимизации распределения других ферментов и субстратов. Например, способы по настоящему изобретению пригодны для использования при оптимизации распределения вариантов целлюлазы на материях или биомассе, как описано в примере 14. В некоторых вариантах измеряют осуществление электрокинетического потенциала обрабатываемой материи при соответствующих условиях эксплуатации и получают те варианты целлюлазы, которые отличаются вплоть до +/-30 мВ от полученного электрокинетического потенциала материи. Эти варианты получают с помощью генной инженерии или химической модификации. Затем варианты подвергают скринингу на эффективность полирования поверхности и потерю прочности при растяжении при условиях эксплуатации в буфере для текстильного применения или в детергентах для чистящего применения. Таким образом, варианты целлюлазы с оптимальной эффективностью полирования поверхности и минимальной потерей прочности при растяжении могут быть эффективно определены с помощью этого способа. Дополнительно, с помощью этого способа могут быть легко установлены варианты целлюлазы с оптимальным связыванием с субстратами из растительных биополимеров для увеличенного осахаривания при производстве топливного этанола.
ПРИМЕР 9
Экспрессия белка
Этот пример описывает установление взаимосвязи между зарядом белка и экспрессией белка.
Производство вариантов ASP в масштабе 14-л ферментера
Проводили серию ферментаций с подпиткой в 14-литровом масштабе для сравнения уровней производства вариантов комбинаторной зарядовой библиотеки протеазы ASP (R14I-N112E-T116E-R123F-R159F, R14I-N112E-T116E-R123F, R14I-N112E-T116E, R14I-N112E, R14I, R14I-D184T, R14I-D184T-T86K, R14I-T86K-D184T-A64K и R14I-T86K-D184T-A64K-Q81K), заряд которых менялся от -5 до +3. Семенные культуры выращивали посредством инокулирования 2-л неэкранированных встряхиваемых колб, содержащих 600 мл среды для культивирования (среда LB +1% глюкозы +20 мг/л неомицина), с помощью 1 мл глицеринового основного раствора Bacillus subtilis, соответствующего каждому варианту. Культуры инкубировали при 37°C, при встряхивании 175 об/мин во встряхиваемом инкубаторе, пока OD550 не достигала 0,8-1,5. В этот момент целые семенные культуры асептически переносили в 14-л ферментеры, оснащенные встроенным контроллером для мониторинга: температуры, процента растворенного кислорода (% DO), pH и встряхивания. Проводили мониторинг отходящих газов с помощью встроенного масс-спектрометра. Используемые для ферментации среды (7 л) состояли из 10% соевой муки в буфере на фосфатной основе, содержащем сульфат магния, микроэлементы и дополнительный неомицин 20 мг/л. Начальные параметры ферментирования устанавливали на: температура 37°C, pH 6,8 (доводили гидроксидом аммония в ходе цикла), встряхивание 750 об/мин, 40% DO (поддерживали в ходе цикла посредством регулирования воздуха и встряхивания), поток воздуха 11 ст.л./мин и давление 1 бар. Для того чтобы контролировать пенообразование, добавляли пеногаситель (Mazu DF204). Запрограммировали линейный процесс подпитки культуры на скорости от 0,5 до 2,1 г/мин глюкозы в течение 10 часов (с использованием 60% раствора глюкозы для подпитки) с повышением pH в качестве сигнала запуска. Забор ферментационных образцов проводили каждые 4 часа, забирая по 15 мл цельного бульона для выполнения следующих измерений: плотность клеток (измеряли оптическую плотность при 550 нм) на спектрофотометре, производство варианта ASP, глюкоза, азот, фосфат и общий белок. Общая длительность цикла ферментации составляла от 40 до 45 часов.
Измерение титра варианта ASP с помощью анализа с AAA-Pna
Образцы культур B. subtilis, полученные в процессе ферментации, анализировали на предмет производства вариантов протеазы ASP. Оценивали активность синтезированных ферментов против субстрата, N-сукцинил-Ala-Ala-Ala-p-нитроанилида (AAA-pNA). В анализе измеряли образование модифицированной протеазы по увеличению оптической плотности при 405 нм в результате гидролиза и высвобождения p-нитроанилина (Estell et al, J Biol Chem, 260: 6518-6521 [1985]). Аликвоты очищенных супернатантов B. subtilis из ферментера анализировали в буфере, содержащем: 100 мМ Трис, 0,01 мМ CaCl2, 0,005% Triton X-100 при pH 8,6. Протеаза ASP дикого типа служила в качестве стандарта для создания калибровочной кривой для вычисления количества синтезированного белка в г/л ферментационного бульона.
На фиг.17 изображены уровни экспрессии зондовых белков ASP со шкалой зарядов в Bacillus subtilis как функция суммарного заряда по отношению к ASP дикого типа. Как следует из этой фигуры, накопление крайне отрицательных (-5) или положительных (+3) зарядов по отношению к ASP дикого типа приводит к низким уровням экспрессии. Использование зондовых белков ASP со шкалой зарядов делает возможным быстрое установление оптимального суммарного заряда для улучшения экспрессии в данном организме-хозяине. В этом случае суммарный заряд, меняющийся в диапазоне от -2 до +1 по отношению к ASP дикого типа, соответствует оптимальным уровням экспрессии. При оптимальном значении заряда как таковом, наблюдаемом для ASP (-2), наблюдали примерно 4-кратное улучшение экспрессии по сравнению с вариантами, обладающими предельными изменениями заряда. Эти наблюдения в масштабе встряхиваемой колбы были подтверждены в масштабе 14-л ферментера. В таблице 9-1 показаны два измерения экспрессии в 14-л ферментерах, приблизительный титр ASP на 40 часов, а также производство ASP, вычисленное по линейной части кривых экспрессии. Титры встряхиваемых колб предоставлены для сравнения в последней колонке. Все титры были нормализованы по отношению к уровням ASP-R14I. Изменение суммарного заряда в диапазоне между -2 и +1 по отношению к ASP дикого типа соответствует оптимальным уровням экспрессии в масштабе ферментера. Это является другим примером оптимизации физического свойства белка, в этом случае суммарного заряда, для модулирования совершенно другого преимущества, в этом случае рекомбинантной экспрессии белка.
Экспрессия и секреция белка в клетке-хозяине касается взаимодействия экспрессированного белка с множеством белков организма-хозяина. Оптимальное взаимодействие экспрессированного белка с белками клетки-хозяина, в частности, при взаимодействии, ограничивающем скорость, является важным для производства белка. Это взаимодействие может быть оптимизировано посредством модификации поверхностного заряда/гидрофобности экспрессированного белка (или белка клетки-хозяина). Тем не менее, знание вовлеченного механизма(ов) не обязательно для того, чтобы выполнить и использовать настоящее изобретение.
На фиг.18 показаны уровни экспрессии двух различных протеаз в Bacillus subtilis как функции электрокинетического потенциала. Экспрессия сериновой протеазы ASP показана в черных кругах, тогда как экспрессия металлопротеазы NprE показана в незалитых треугольниках. Эти варианты протеазы охватывают диапазон, по меньшей мере, в 8 зарядов по отношению к ферменту дикого типа. Как описывалось ранее, существует оптимальное значение суммарного заряда для экспрессии. Общая шкала зарядов, такая как электрокинетический потенциал в эталонном растворе, таком как 5 мМ HEPES pH 8,0 с добавлением 2,5 мМ NaCl, позволяет сравнивать уровни экспрессии вариантов, обладающие двумя значительно различающимися укладками белка. Экспрессия белка ограничена окном электрокинетического потенциала шириной 40 мВ, в этом случае между -40 мВ и +20 мВ. Как и для эффективности против КМЧ, уровни экспрессии ASP и NprE в Bacillus subtilis как функция электрокинетического потенциала фермент хорошо описываются стандартным нормальным распределением со средним значением μ, равным -8,92 мВ, стандартным отклонением σ, равным 8,95 мВ, и пиковым значением 181 [мг белка на литр культуры], обозначенным сплошной линией. Это распределение представлено в стандартных сокращенных координатах уровнями экспрессии, деленными на пиковое значение на правой оси ординат как функция z-оценки на верхней оси абсцисс. Обычно z-оценку определяют как (X-μ)/σ, где X в этом случае представляет собой электрокинетический потенциал. Это нормальное распределение является уникальным для каждого организма-хозяина при данных условиях культивирования (например, pH, удельная электропроводность, тип соли, минералы и т.д.). Оптимальное значение уровней экспрессии среди укладок белков возникает при среднем значении распределения, равном -8,92 мВ.
Уровни эффективности стандартных нормальных распределений удобно описываются в значениях их z-оценок, как указано в таблице 9-2. Перевод в электрокинетический потенциал является непосредственным знанием среднего значения и стандартного отклонения, определяющих распределение для заданного применения. В этом примере все измеренные уровни экспрессии ограничены величинами электрокинетического потенциала между -40 мВ и +20 мВ. Варианты с уровнями экспрессии выше 80% от их значения при оптимальной укладке белка (т.е. z=±0,65), ограничены величинами электрокинетического потенциала между -14,73 мВ и -3,11 мВ. Варианты с уровнями экспрессии выше 90% от их значения при оптимальной укладке белка (т.е. z=±0,46), ограничены величинами электрокинетического потенциала между -13,03 мВ и -4,80 мВ. Показаны другие уровни эффективности, z-оценки и перевод в диапазоны электрокинетического потенциала.
Экспрессия протеаз в Bacillus subtilis
Эталонный буфер: 5 мМ HEPES pH 8,0 с 2,5 мМ NaCl
Знание электрокинетических потенциалов для существующих белков, экспрессированных в данном продуцирующем организме-хозяине, делает возможным быстрое установление ожидаемых уровней экспрессии для белков, обладающих различной укладкой белка, но сравнимым электрокинетическим потенциалом при измерении при одинаковых условиях. Кроме того, знание электрокинетических потенциалов позволяет определить направление и величину изменения заряда, необходимые для того, чтобы достичь оптимальных уровней экспрессии. Применение этого способа сохраняется за рамками Bacillus subtilis, предоставляя уровни экспрессии белков, обладающих различными укладками, которые сравнивают в рамках одного организма (или в рамках организма, обладающего значительной филогенетической гомологией) при одинаковых условиях роста.
Ради иллюстрации описана оптимизация заряда NprE для увеличения экспрессии белка в B. subtilis.
Стадия 1 касается измерения уровней экспрессии, по меньшей мере, одного варианта NprE, а также зондовые ASP со шкалой зарядов, клонированных в том же организме-хозяине и выращенных при таких же условиях. В данном случае, вариант NprE с четырьмя положительными мутациями по сравнению с NprE дикого типа (T14R-S23R-N46K-T54R) экспрессирован в B. subtilis. Серия зондовых белков ASP указывает на существование оптимального значения заряда для экспрессии (фиг.17). Это оптимальное значение существует для варианта ASP с 2 отрицательными зарядами по сравнению с ASP дикого типа. Для определения направления и величины изменения заряда для NprE, зондовые белки ASP и родительский NprE должны быть сравнены на общей шкале зарядов.
Стадия 2 касается измерения (или вычисления) электрокинетического потенциала зондовых белков ASP со шкалой зарядов и варианта NprE при одинаковых условиях раствора. В данном случае, эталонный раствор с низкой ионной силой для минимизации скрининга зарядовых эффектов. Пригодный эталонный раствор представляет собой 5 мМ HEPES pH 8,0 буфер, содержащий 2,5 мМ NaCl.
Как отмечалось ранее, на фиг.18 показаны уровни экспрессии зондовых белков ASP как функция электрокинетического потенциала, измеренная в эталонном растворе. Было обнаружено, что вариант NprE (+4), показанный на этом графике, обладает средним значением электрокинетического потенциала, равным 13,24 мВ, соответствующим низким уровням экспрессии белка (например, 33,7 мг белка на литр культуры). Для того, чтобы получить Варианты NprE, которые могут быть экспрессированы при высоких уровнях в B. subtilis, это вариант NprE сконструировали так, чтобы он был на или рядом с пиковым значением, определенным средним значением нормального распределения электрокинетического потенциала μ, равным -8,92 мВ. Это соответствует оптимальным уровням экспрессии в этом организме-хозяине, которые составляют приблизительно до 181 мг белка на литр культуры. Для достижения этой цели, был получен более отрицательный вариант(ы) NprE (это является необходимым направлением изменения заряда). Задана необходимая величина изменения заряда: -8,92 мВ-(13,28 мВ)=-22,2 мВ. Это представляет собой ограничение заряда.
Стадия 3 касается получения интересующих вариантов NprE посредством конструирования белка в этом примере. Другие возможности получения интересующих вариантов NprE включают отбор природных изолятов, гликозилирование или химическую модификацию, чтобы совпасть с требуемым электрокинетическим потенциалом. Уравнение (0.7) используется для того, чтобы направлять усилия по конструированию белка. NprE обладает гидродинамическим радиусом, равным 2,654 нм, который измеряли, например, посредством рассеяния света в условиях высокой ионной силы для устранения влияния сил двойного слоя на гидродинамический радиус. Согласно уравнению (0.3), дебаевская длина k -1 равна 2,087 нм в условиях четко определенного эталонного раствора для измерений электрокинетического потенциала. После введения этих величин в уравнение (0.7), вместе с предварительно описанными физическими константами, вычислили ожидаемое изменение электрокинетического потенциала, равное 3,04 мВ, для каждого изменения суммарного заряда. Следовательно, для того, чтобы закрыть пропуск электрокинетического потенциала для +4 варианта NprE, сконструировали варианты NprE с -22,2/3,04=-7,3 или семью отрицательными зарядами. Этот расчет обычно переоценивает необходимое количество зарядов за счет неопределенностей, связанных с положением плоскости сдвига при измерениях электрофоретической подвижности (смотрите, Hunter in «Zeta Potential in Colloid Science», Academic Press, [1981]). Спроектированы варианты NprE, обладающие суммарным отрицательным зарядом по сравнению с родительской NprE. Для быстрой идентификации типов замен аминокислот для снижения положительного заряда родительского NprE предоставлена матрица зарядов.
Как показано на фиг.18, вариант NprE T60D, обладающий 5 отрицательными изменениями зарядов по сравнению с родительской NprE (T14R-S23R-N46K-T54R), находится ближе всего к оптимальному значению для экспрессии среди протестированных вариантов NprE. Вариант NprE T60D обладает электрокинетическим потенциалом, равным -10,72 мВ, и уровнями экспрессии, равными 171,9 мг белка на литр культуры. Это является 5-кратным улучшением по сравнению с величинами, полученными для родительского варианта NprE T14R-S23R-N46K-T54R.
ПРИМЕР 10
Стабильность в присутствии LAS и хелатирующего агента
Этот пример описывает установление взаимосвязи между зарядом белка и стабильностью в реакционной среде, содержащей только анионное поверхностно-активное вещество или хелатирующий агент или оба эти компонента. Для определения активности протеазы в подвергавшихся давлению и не подвергавшихся давлению образцах, использовали анализ с suc-AAPF-pNA. Для определения активности α-амилазы подвергавшихся давлению и не подвергавшихся давлению образцов использовали анализ с BODIPY-крахмалом. Остаточные LAS и ЭДТА из планшетов, подвергавшихся давлению, не влияли на анализы с suc-AAPF-pNA или BODIPY-крахмалом.
Стабильность в присутствии LAS
Используемые реактивы включали: додецилбензолсульфонат, натриевая соль (=LAS), Sigma D-2525; TWEEN®-80, Sigma P-8074; ТРИС буфер (свободная кислота), Sigma T-1378; 6,35 г растворяли приблизительно в 960 мл воды, pH доводили до 8,2 с помощью 4 н. HCl. Конечная концентрация ТРИС составляла 52,5 мМ; основной раствор LAS: 10,5% раствор LAS в воде MQ (=10,5 г на 100 мл MQ); ТРИС буфер-100 мМ/pH 8,6 (100 мМ Трис/0,005% TWEEN80); и ТРИС-Ca буфер, pH 8,6 (100 мМ Трис/10 мМ CaCl2/0,005% TWEEN80). Используемое оборудование включало: плоскодонные ПМТ, Costar (#9017); Biomek FX; ASYS Multipipettor; ПМТ-ридер Spectramax; инкубатор/шейкер iEMS; инкубатор/шейкер Innova 4330; многоканальная пипетка Biohit; и шейкер BMG Thermostar.
Стабильность в присутствии LAS измеряли после инкубирования тестируемых протеаз в присутствии 0,06% LAS (додецилбензолсульфонат натрия), посредством измерения остаточной активности в анализе с suc-AAPF-pNA. 0,063% раствор LAS изготавливали в 52,5 мМ Трис буфере pH 8,2. Рабочий раствор AAPF изготавливали добавлением 1 мл 100 мг/мл основного раствора AAPF (в ДМСО) к 100 мл (100 мМ) Трис буфера, pH 8,6. Для разбавления супернатантов плоскодонные планшеты заполняли буфером для разведения и добавляли аликвоту супернатанта и хорошо перемешивали. Степень разбавления зависела от концентрации контролей ASP в ростовых планшетах (активность с suc-AAPF-pNA). Требуемая концентрация белка составляла 80 м.д.
По 10 мкл разбавленного супернатанта добавляли к 190 мкл 0,063% LAS буфера на лунку. ПМТ накрывали лентой, встряхивали в течение нескольких секунд и помещали в инкубатор (Innova 4230) при 25° или 35°C на 60 минут при встряхивании 200 об/мин. Начальную активность (t=10 минут) определяли после 10 минут инкубирования посредством переноса по 10 мкл смеси в каждую лунку в свежий ПМТ, содержащий по 190 мкл рабочего раствор suc-AAPF-pNA. Эти растворы хорошо перемешивали и активность с suc-AAPF-pNA измеряли с помощью ПМТ-ридера (20 считываний прибора за 5 минут при 25°C).
Итоговую активность (t=60 минут) определяли посредством удаления других 10 мкл раствора из планшета для инкубирования после 60 минут инкубирования. Затем определяли активность с suc-AAPF-pNA, как описано выше. Вычисления выполняли следующим образом:
% остаточной активности=[t-60 значение]*100/[t-10 значение].
На фиг.19 показана стабильность в присутствии LAS как функция изменения суммарного заряда по отношению к ASP дикого типа, для библиотеки, содержащей 229 вариантов. Эта библиотека была спроектирована и сконструирована (смотрите, например, заявки на патенты США серийные №№ 10/576331 и 11/583334) так, чтобы покрывать несколько суммарных зарядов по отношению к родительской молекуле ASP, обладающей мутацией R14I. Стабильность в детергенте измеряли в пересчете на отношение остаточной активности после инкубирования в LAS в течение 60 мин к инкубированию лишь в течение 10 минут. Как следует из фигуры, накопление отрицательных зарядов (до -5) по отношению к ASP дикого типа, является полезным для сохранения стабильности в присутствии LAS. Это является примером оптимизации физического свойства белка, в этом случае суммарного заряда, для улучшения стабильности белка в сложной жидкой среде для стирки.
Стабильность в присутствии LAS/ЭДТА
Используемые реактивы содержали: контрольный буфер: 50 мМ HEPES, 0,005% Tween-80, pH 8,0; и стресс-буфер 50 мМ HEPES, 0,1% (масс./об.) LAS (додецилбензолсульфонат, натриевая соль, Sigma D-2525), 10 мМ ЭДТА, pH 8,0. Варианты фермента (20 м.д.) разбавляли 1:20 в 96-луночном несвязывающем плоскодонном планшете, содержащем или контрольный, или стресс-буфер и смешивали. Контрольный планшет инкубировали при комнатной температуре, тогда как стресс-планшет немедленно помещали в 37°C на 30-60 минут (в зависимости от стабильности тестируемого фермента). После инкубирования активность фермента измеряли с использованием анализа с suc-AAPF-pNA для протеаз анализа с BODIPY-крахмалом для амилаз. Доля остающейся или остаточной активности равна скорости реакции подверженного давлению образца, деленной на скорость реакции в контрольном образце. Родительские ферменты и варианты стабильны в течение 60 минут в контрольном буфере.
На фиг.20 изображена стабильность в присутствии LAS/ЭДТА как функция изменения суммарного заряда по отношению к родителю FNA для библиотеки, содержащей 80 вариантов. Эта библиотека была спроектирована и сконструирована в соответствии со способами, описанными в примере 2, для того, чтобы охватить несколько суммарных зарядов по отношению к родительской молекуле FNA. Как видно из фигуры, накопление отрицательных зарядов (до -4) по отношению к родителю FNA, является полезным для сохранения комбинированной стабильности в присутствии LAS/хелатирующего агента. Это является примером оптимизации физического свойства белка, в этом случае суммарного заряда, для улучшения стабильности белка в сложной жидкой среде для стирки.
Для стабильности ASP и FNA в присутствии LAS/ЭДТА существует зависимость от зарядов. Увеличение отрицательного заряда увеличивает стабильность. Но даже если суммарный заряд на один или два заряда положительнее, чем у родителя, с помощью нашего способа можно обнаружить расположение зарядовых мутаций, которые дают равную или большую стабильность, чем родительская. Также этот подход эффективен для более крупных ферментов, таких как TS23t', который показан на фиг.21, где вредоносное влияние на стабильность, вызванное добавлением положительных зарядов, может быть компенсировано посредством оптимального расположения зарядов, которое увеличивает стабильность.
ПРИМЕР 11
Тепловая стабильность
Этот пример описывает установление взаимосвязи между зарядом белка и тепловой стабильностью. Протеолитические анализы основывались на гидролизе диметилказеина (ДМК), до и после нагревания буферизованного культурального супернатанта. Амилазные анализы основывались на гидролизе BODIPY-крахмала до и после нагревания культурального супернатанта. Для этих анализов использовали такие же растворы химикатов и реактивов, которые описаны в примере 1.
Анализ тепловой стабильности для протеаз
Фильтрованные культуральные супернатанты разбавляли до 20 м.д. в буфере PIPES (на основе концентрации контролей в ростовых планшетах). Сначала по 10 мкл каждого разбавленного образца фермента брали для определения начальной активности в анализе с диметилказеином и обработали, как описано ниже. Затем по 50 мкл каждого разбавленного супернатанта помещали в пустые лунки ПМТ. ПМТ планшет инкубировали в инкубаторе/шейкере iEMS HT (Thermo Labsystems) в течение 90 минут при 60°C и 400 об/мин. Планшеты охлаждали во льду 5 минут. Затем по 10 мкл раствора добавляли в свежий ПМТ, содержащий 200 мкл диметилказеинового субстрата на лунку для определения конечной активности после инкубирования. Этот ПМТ накрывали лентой, встряхивали в течение нескольких секунд и помещали в печь при 37°C на 2 часа без встряхивания.
Остаточную активность образца выражали в виде отношения конечной оптической плотности к начальной оптической плотности, оба корректировались по отрицательным контролям. На фиг. 22 показан коэффициент термостабильности как функция изменения суммарного заряда по отношению к ASP дикого типа для библиотеки SEL. Более высокий индекс показывает более термостабильный вариант. Как видно из фигуры, накопление противоположных друг другу отрицательных (-2) или положительных (+2) зарядов по отношению к ферменту дикого типа является вредоносным для тепловой стабильности. Существует определенное оптимальное значение заряда для тепловой стабильности, сосредоточенное около нулевого изменения суммарного заряда по отношению к ASP дикого типа. Это является примером оптимизации физического свойства белка, в этом случае суммарного заряда, для улучшения тепловой стабильности фермента для применения для стирки в жидкости.
Анализ тепловой стабильности для α-амилаз
Фильтрованные культуральные супернатанты серийно разводили в 50 мМ ацетате натрия +2 мМ CaCl2, pH 5,8 с 002% Tween. По 10 мкл каждого разбавленного культурального супернатанта анализировали для определения начальной активности амилазы с помощью анализа с BODIPY-крахмалом. По 50 мкл каждого разбавленного культурального супернатанта помещали в VWR низкопрофильный ПЦР 96-луночный планшет. По 30 мкл минерального масла добавляли в каждую лунку в качестве герметизирующего материала. Планшет инкубировали на BioRad DNA engine Peltier Thermal Cycler при 95°C в течение 30 или 60 минут в зависимости от стабильности родительского фермента. После инкубирования планшет охлаждали до 4°C в течение 5 мин и затем хранили при комнатной температуре. По 10 мкл каждого образца добавляли в свежий планшет и анализировали для определения конечной активности амилазы с помощью анализа с BODIPY-крахмала, как описано в примере 1.
Вычисление термостабильности
Остаточную активность образца выражали в виде отношения конечной оптической плотности к начальной оптической плотности, оба корректировались по отрицательным контролям. Также эти наблюдения были выполнены для зарядовых вариантов амилазы. На фиг.23 показана остаточная активность AmyS с первой шкалой зарядов как функция изменения заряда по отношению к дикому типу. Вновь накопление крайне отрицательных зарядов (-12) или положительных зарядов (+10) по отношению к ферменту дикого типа является вредоносным для тепловой стабильности. Это является примером оптимизации физического свойства белка, в этом случае суммарного заряда, для улучшения тепловой стабильности фермента для применения для стирки в жидкости.
ПРИМЕР 12
Тепловая активность
Этот пример описывает установление взаимосвязи между зарядом белка и скоростью реакции в зависимости от температуры, где тепловая активность является только одним проявлением.
Анализ стабильности в процессе условий мытья
Этот анализ основан на анализе гидролиза suc-AAPF-pNA до и после нагревания забуференного культурального супернатанта. Использовали те же растворы химикатов и реактивов, как описано в анализе гидролиза suc-AAPF-pNA в примере 1.
Способ
Фильтрованные культуральные супернатанты разбавляли до 400 м.д. в 100 мМ Трис буфере, pH 8,6 с 0,005 масс.% TWEEN 80 (на основании концентрации белка (с помощью БХК) в контролях в ростовых планшетах). Сначала для каждого анализа приготовили 20-кратное разведение. Затем 10 мкл разбавленного образца добавляли в 190 мкл 5 мМ HEPES буфера pH 8,0, содержащего 2,5 мМ NaCl. Ожидаемые конечные концентрации фермента в каждой лунке были порядка 1 м.д. ПМТ планшет инкубировали в инкубаторе/шейкере iEMS HT (Thermo Labsystems) в течение 30 минут при 30°C или 40°C и 400 об/мин. Затем по 10 мкл каждого разбавленного образца фермента забирали для определения начальной активности в анализе с suc-AAPF-pNA и обрабатывали, как описано выше в течение как 7 минут, так и 30 минут.
Вычисление стабильности в процессе условий мытья
Остаточную активность образцов выражали в виде отношения степени гидролиза suc-AAPF-pNA после 30 минут к степени гидролиза suc-AAPF-pNA после 7 минут, обе корректировались по отрицательным контролям.
В некоторых вариантах осуществления желательно создавать ферменты с улучшенной эффективностью при различных температурах реакции. Например, в качестве части глобальной тенденции сохранения энергии, желательно разработать очищающие протеазы, способные функционировать при пониженных температурах, как в случае мытья в холодной воде. Для данной фермент-субстратной реакции общий активационный барьер реакции представляет собой сумму каталитических (энергетический барьер активации химического превращения) и физических (энтальпия связывания с субстратом и/или продуктом) составляющих. Хорошо известно, что экзотермические реакции протекают на большей скорости при пониженных температурах, тогда как эндотермические реакции протекают на большей скорости при повышенных температурах. Этот феномен в химической термодинамике хорошо описывается уравнением Вант-Гоффа, связывающим изменение температуры с изменением в константе равновесия при заданном изменении энтальпии (смотрите, Laidler, «Chemical Kinetics», Harper Collins 3rd Ed. [1987]). Это также описывается в единицах парциальной молярной теплоемкости или энергетического барьера активации. Тогда как замены аминокислот вдали от активного центра могут не влиять на активационный барьер для химического катализа, они влияют на энтальпию связывания с субстратом и/или продуктом. Следовательно, для того, чтобы увеличить скорость реакции при пониженных температурах, энтальпии связывания фермента определяют возможность конструирования для повышения общей энтальпии экзотермической реакции, независимо от энтальпии реакции, связанной только с каталитической стадией. Наоборот, для того, чтобы увеличить скорость реакции при повышенных температурах, член энтальпии связывания фермент может быть разработан для повышения общей энтальпии эндотермической реакции, независимо от энтальпии реакции, связанной только с каталитической стадией. Одна стратегия для выполнения этого состоит в изменении заряда или гидрофобности фермента.
На фиг.24 КМЧ показана остаточная активность на микрообразцах при повышении температуры по сравнению с начальной активностью очистки при 30°C, как функция изменения суммарного заряда зондовых белков ASP и NprE со шкалами зарядов по отношению к протеазам дикого типа. Сохраняемая доля активности менее единицы указывает, что вариант менее активен при высоких температурах (например, является экзотермическим) и таким образом более пригоден для использования при низких температурах. Наоборот, сохраняемая доля активности, превышающая единицу, указывает на то, что вариант более активен при повышенных температурах (например, является эндотермическим), и таким образом более пригоден для применения при повышенных температурах. Как показано на этой фигуре, варианты, обладающие более отрицательным зарядом, чем протеазы дикого типа, являются экзотермическими, тогда как варианты, обладающие более положительными зарядами, являются эндотермическими. Эту информацию можно применить для эффективного получения ферментов с превосходной эффективностью при измененных температурах, при условии, что на стабильность вариантов не будет оказано сильного влияния. Фактически, фиг.26 указывает на то, что стабильность вариантов ASP сохраняется как при 30°C, так и при 40°C.
Часто пренебрегают вкладом энтальпии связывания в общую энтальпию реакции и полагают, что повышение скоростей реакций происходит только за счет каталитической стадии. На самом деле, предполагают, что скорости реакций увеличиваются только с температурой, имеющийся фермент термостабилен, в соответствии с некоторой разновидностью закона Аррениуса (смотрите, Laidler, выше). Как показано в настоящем документе, экзотермические варианты ASP и NprE (отрицательно заряженные отношению к их протеазам дикого типа), обладающие меньшей активностью при повышенных температурах, явно противоречат этому предположению. Это является примером оптимизации физического свойства белка, в этом случае суммарного заряда, для улучшения скорости ферментативных реакций при определенных температурах в применении для стирки в жидкости. Таким образом, использование ограниченного набора зондовых белков ASP или NprE со шкалами зарядов делает возможной быструю идентификацию эндотермических и экзотермических вариантов в рамках этих укладок белков. В частности, когда целью является идентификация ферментов для повышенной эффективности стирки в холоде, настоящее изобретение указывает ограничить поиски экзотермическими вариантами.
Для того, чтобы разработать критерии для применения этих находок среди белков с другими типами укладки, необходимо описать влияние зарядов на общей шкале. На фиг.25 показана остаточная активность на микрообразцах с КМЧ при повышении температуры по сравнению с начальной активностью при 30°C как функция электрокинетического потенциала зондовых белков ASP и NprE со шкалами зарядов, измеренного при тех же условиях (реакционных буфер 5 мМ HEPES pH 8,0, содержащий 2,5 мМ NaCl). Величина электрокинетического потенциала краски-субстрата, несвязанной КМЧ, равна -8,97 мВ при измерении при тех же условиях. Как ожидалось, общий профиль каждой кривой схож с фиг.24 с зарядом, выраженным в виде суммарного заряда по отношению к протеазам дикого типа. Кроме того, информация об электрокинетическом потенциале указывает на то, что при этих условиях истинно положительные варианты (выше нулевого заряда; например, 0 мВ) являются эндотермическими, тогда как отрицательные варианты являются экзотермическими. При поиске ферментов, пригодных для применения для мытья в холоде, посредством отбора природных изолятов, химических модификаций или конструирования белка, настоящее изобретение относится к руководству по идентификации белков с любым типом укладки белка, которые обладают отрицательными электрокинетическими потенциалами при этих условиях. Вкратце, использование зондовых белков, охватывающих интересующее физическое свойство (например, ASP со шкалой зарядов), дает критерии для быстрой идентификации победителей (например, вариантов белков, обладающих благоприятным результатом в интересующем тесте).
Способы по настоящему изобретению могут быть экстраполированы на любое сочетание фермента, субстрата и реакционной среды. В частности, величины электрокинетического потенциала, указывающие на экзотермическое или эндотермическое поведение, являются функцией зарядов фермента и субстрата в окружении данного состава. В этом случае варианты фермента противоположного знака, сравниваемые с субстратом, являются эндотермическими. На это наглядно указывает изменение в угловом коэффициенте около или в 0 мВ, точке нулевого заряда, в которой белок быстро меняет знак. Без ограничения теорией, противоположно заряженные ферменты и субстраты (или продукты реакции) прочно связаны и остаются в контакте значительно дольше стадии химического каталитического превращения (например, диффузионно ограниченная). Это ограничивает концентрацию фермента, доступного для выполнения последующих реакций. Следовательно, добавление тепловой энергии повышает эффективность фермента, поскольку это способствует высвобождению ферментов из субстратного (или продуктного) комплекса и, таким образом, снижает количество непроизводительных связываний. Для любого заданного сочетания фермента, субстрата и окружающего состава, область экзотермических и эндотермических вариантов представляет собой функцию заряда в нулевой точке и заряда субстрата. Если при условиях применения субстрат заряжен отрицательно, эндотермические варианты ограничены положительными величинами электрокинетического потенциала или правой частью от точки нулевого заряда. Наоборот, если субстрат положительно заряжен, эндотермические варианты ограничены отрицательными величинами электрокинетического потенциала или левой частью от точки нулевого заряда. В основном электрокинетические потенциалы продукта фермента и субстрата являются отрицательными для эндотермических вариантов и положительными для экзотермических вариантов.
Таким образом, использование ограниченного набора зондовых белков ASP или NprE со шкалами зарядов делает возможной быструю идентификацию эндотермических и экзотермических вариантов в пределах этих типов укладки белка. В частности, когда целью является идентификация ферментов для улучшения эффективности стирки в холоде, настоящее изобретение указывает ограничиться поиском экзотермических вариантов.
Этот способ применим для улучшения протеаз для эффективной очистки при различных температурах, амилаз для разжижения крахмала, целлюлаз для разложения биомассы и любого фермента, который требует тепловой активации при низких или высоких температурах. В условиях, когда накопление зарядов является вредоносным, например, для тепловой стабильности или эффективности каталитической стадии, использование способов, описанных в заявке США №60/933331 для уравновешивания противоречащих свойств, пригодно для того, чтобы добиться тепловой активации с помощью этого подхода.
ПРИМЕР 13
Статистическое определение свойств аминокислот
Характеристики аминокислот, такие как заряд, гидрофобность, образование водородной связи и т.д., являются важными свойствами белков. Например, если субстрат заряжен, поверхностный заряд или суммарный заряд белка, вероятно, будут важны для активности, тогда как гидрофобность, вероятно, будет важна для растворимости. Интересно иметь статистически подтвержденный тест для установления свойств аминокислот, которые важны для эффективности белка. Такой тест может указывать на существование корреляционной связи между свойствами аминокислот и эффективностью мутантного белка. Для каждого свойства аминокислот существует оценка, которая в числовом виде отражает изменение в свойстве, когда одна аминокислота заменяется другой. Существует несколько матриц замен или они могут быть разработаны для предсказания изменений в свойствах при заменах аминокислот. Четыре таких примера приведены на фигурах. Матрица изменения заряда для приблизительного изменения заряда при pH 8,6 предоставлена на фиг. 27. Матрица замен для образования водородных связей предоставлена на фиг. 28. Матрица гидрофобности Кайта-Дулиттла предоставлена на фиг. 29 (Kyte и Doolittle, выше). В заключение, матрица гидрофобности Эйзенберга предоставлена на фиг. 30 (Eisenberd et al., выше).
В любом наборе данных об изменениях, таких как библиотека данных для оценки сайтов протеазы ASP (WO 2005/052146), могут быть выделены варианты, которые лучше, чем произвольное пороговое значение (такое как >100% активности дикого типа, >50% активности дикого типа или >5% активности дикого типа), и те, которые хуже. Матрицу замен аминокислот можно использовать для того, чтобы дать числовую оценку для каждой замены аминокислот. Для удобства оценки можно использовать как есть (оценки зарядов) или разбивать на квинтили (гидропатичность, гидрофобность, образование водородных связей). Например, в случае гидропатичности Кайта-Дулиттла, оценки были разделены на -2 квинтиль (оценки <-4), -1 квинтиль (оценки между -4 и -1), 0 квинтиль (оценки между -1 и +1), +1 квинтиль (оценки между 1 и 4) и +2 квинтиль (оценки более 4). Можно легко посчитать количество вариантов, которые превышают пороговое значение и имеют определенное значение или диапазон значений для свойства аминокислоты. Исходя из процентного содержания мутаций, которые находятся выше и ниже пороговых значений, и процентного содержания аминокислотных замен, которые обладают заданной оценкой или диапазоном оценок, может быть вычислена ожидаемая численность каждого класса на основании отсутствия корреляции между аминокислотными свойствами и эффективностью. Это можно сравнить с наблюдаемым количеством и вычислить отношение наблюдаемого к ожидаемому. Отношения, значительно превышающие 1, являются показательными для положительной корреляции свойства с эффективностью, и отношения меньше 1 являются показательными для отрицательной корреляции свойства с эффективностью. Генерируют набор из десяти случайных перетасовок оценок аминокислот и вычисляют десять отношений наблюдаемое/ожидаемое (н/о) для случайных наборов данных. Затем результаты усредняют и определяют стандартные отклонения для рандомизированных данных. Фактические отношения н/о можно сравнить с рандомизированными усредненными значениями и определить в качестве значимых при уровнях в 1, 2 или 3 сигмы на основе рандомизированных стандартных отклонений. Результаты для ASP, ацилтрансферазы (ACT) и AmyS приведены в таблицах 13-1, 13-2 и 13-3, соответственно. Отношения наблюдаемое/ожидаемое, которые являются значимыми при уровне в 1 сигму, показаны жирным шрифтом.
Квинтили ACT для множества свойств
Квинтили AmyS для множества свойств
На таблице 13-1 показаны вычисления для вариантов ASP, которые лучше дикого типа (∆∆G<0) при сравнении с оценками изменения заряда, основанными на матрице с фиг.27 (∆CHRG). Имеет место сильный эффект изменения заряда, который значим при уровне 3 сигмы для кератиновой (KER) и AAPF активности, а также КМЧ активности, LAS, температурной (THER) стабильности, тогда как такие эффекты не выявлены для казеиновой (CAS) активности и экспрессии белка ([белок]) в B. subtilis. В таблице 13-1 также приведены величины для образования водородных связей (∆HB), где оценка -2 обозначает потерю способности к образованию водородных связей. Для этого фермента и этих свойств, пониженное образование водородных связей, как правило, предпочтительно. Кроме того, в таблице 13-1 приведены результаты для гидрофобности Кайта-Дулиттла (∆K-D) и шкал гидрофобности Эйзенберга (∆E). Имеют место значительные гидрофобные эффекты для всех свойств, причем шкала Эйзенберга показывает более выраженные эффекты.
В таблице 13-2 приведены эффекты изменения заряда (∆CHRG) и гидрофобности Кайта-Дулиттла (∆K-D) для ACT (смотрите, например, заявка на патент США № 10/581014) на образование надкислоты (PAF), разложение надкислоты (PAD) и экспрессию белка в E. coli. Несомненно, свойства замененных аминокислот, такие как заряд и гидрофобность, могут влиять на уровни экспрессии в B. subtilis и E. coli, а также основную активность и стабильность белков.
В таблице 13-3 приведены вычисления для вариантов AmyS, которые лучше дикого типа при гидролизе кукурузной муки в течение 5, 10 и 60 минут (CF5, CF10, CF60), в активности на субстратах DP7 при pH 4,0 и 5,8 (pH 4, pH 5,8), в очистке от рисового крахмала при pH 8,6 и 10 (очистка 8 и очистка 10) и экспрессии белка в B. subtilis (EXP). Влияние заряда на активность имеет противоположное направление по отношению ко влиянию заряда на экспрессию. Образование водородных связей и гидрофобность также проявляют статистически значимое влияние на эти свойства. Несомненно, свойства замененных аминокислот, такие как заряд и гидрофобность, могут влиять на уровни экспрессии в B. subtilis и E. coli, а также основную активность и стабильность белков.
Квинтили AmyE для множества свойств
В таблице 13-4 приведены вычисления для вариантов AmyE, которые лучше дикого типа при гидролизе кукурузной муки (CF), в активности по отношению к олигосахаридным субстратам DP3 и DP7 (DP3 и DP7), в тепловой стабильности (DP3 HS), в очистке микрообразцов с рисовым крахмалом при pH 8,6 и 10 (очистка 8 и очистка 10) и в экспрессии в B. subtilis (EXP). На активность очистки самым сильным влиянием обладает заряд.
ПРИМЕР 14
Оптимизация реакций с субстратами, проявляющими переменный заряд
Превращение целлюлозы оценивалось с помощью способов, известных в данной области (смотрите, например, Baker et al., Appl Biochem Biotechnol, 70-72:395-403 [1998]). В экспериментах использовали стандартный анализ превращения целлюлозы. В этом анализе фермент и буферизованный субстрат помещали в контейнеры и инкубировали при температуре с течением времени. Реакцию останавливали достаточным количеством 100 мМ глицина, pH 11, чтобы довести pH реакционной смеси, по меньшей мере, до pH 10. После остановки реакции, аликвоту реакционной смеси фильтровали через 0,2 мкм мембрану для удаления твердых частиц. Затем фильтрованный раствор анализировали на предмет растворимых сахаров с помощью ВЭЖХ, в соответствии со способами, описанными в Baker et al., выше.
Предварительно обработанная кукурузная солома (ПОКС)
Кукурузную солому предварительно обрабатывали в 2% масс./масс. H2SO4, как описано (Schell et al, J Appl Biochem Biotechnol, 105:69-86 [2003]), и затем многократно промывали деионизированной водой до получения pH 4,5. Ацетат натрия добавляли для получения конечной концентрации 50 мМ и раствор титровали до pH 5,0. Концентрация целлюлозы в реакционной смеси составляла приблизительно 7%.
Аликвоты ПОКС до и после осахаривания с помощью коммерческой смеси целлюлаз, Spezyme CP и Indiage 44L, дозировали в 1,5 мл центрифужные пробирки Eppendorf и заполняли приблизительно одну треть объема. Образцы центрифугировали при 6000 об/мин в течение 5 мин, супернатант заменяли на воду Milli-Q™ и процесс повторяли 5 раз. Из промытой кукурузной соломы изготавливали основной раствор 100 мг/мл в воде Milli-Q™. Для измерения электрокинетического потенциала этот основной раствор разбавляли до 1 мг/мл в 50 мМ натрий-ацетатном буфере pH 5,0. Аликвоты 1 мл каждого образца субстрата переносили в чистую одноразовую кювету Zetasizer NS™ Malvern Instruments (UK).
Таблица 14-1 указывает на то, что на всем протяжении реакции осахаривания заряд субстрата ПОКС, выраженный в виде электрокинетического потенциала, дважды становился почти отрицательным. Без ограничения теорией, существует множество объяснений для увеличения отрицательного заряда, включая, в качестве неограничивающих примеров, обогащение лигнином, нереагирующую часть этого субстрата, а также непроизводительное связывание или загрязнение целой целлюлазы и других белков. Как видно из активности на микрообразцах с КМЧ в примере 8 (распределение фермента на субстрате), имеет место оптимальный для эффективности электрокинетический потенциал фермента (например, степень завершенности реакции и скорость реакции), который совпадает с электрокинетическим потенциалом субстрата в условиях реакционной среды. Различные предварительные обработки биомассы могут сильно влиять на начальный заряд субстрата. Если на всем протяжении реакции не совпадает электрокинетический потенциал фермента или субстрата, фермент-субстратное взаимодействие больше не будет оптимальным. Этот эффект становится важным при изменениях приблизительно в 10 мВ, которые относятся к случаю превращения биомассы.
Стратегии исправления этой ситуации включают в качестве неограничивающих примеров предоставление смеси ферментов, охватывающей различные заряды; подход с подпиткой, в котором ферменты, обладающие различными зарядами при новом оптимальном значении, вносят в различные моменты реакции и/или при различных степенях превращения; контроль поверхностного заряда субстрата посредством добавления композиционных средств, конкретно поверхностно-активных веществ (ионных и неионных) или других белков; контроль поверхностного заряда субстрата посредством регулирования pH; регулирование ионной силы на всем протяжении реакции для того, чтобы сдвигать оптимальные значения заряда фермента; ультрафильтрацию через полупроницаемую мембрану, конкретно обратный осмос и нанофильтрацию, для контролирования ионной силы на всем протяжении реакции; добавления хелатирующих агентов для контролирования ионной силы посредством удаления солей; и контролирование заряда биомассы субстрата посредством процессов предварительной обработки.
Электрокинетический потенциал кукурузной соломы, предварительно обработанной кислотой
Химическая модификация препаратов целлюлазы из Trichoderma sp.
Этот пример описывает обработку коммерческого препарата целлюлазы из Trichoderma sp. LAMINEX BG enzyme complex (Genencor Division, Danisco US, Inc.) янтарным ангидридом для ацетилирования остатков лизин. Ацетилирование остатков лизин в LAMINEX BG enzyme complex изменяет суммарный заряд белков (например, увеличивает отрицательный заряд). Другие сходные химические модификации также можно использовать для превращения положительного заряда лизина в отрицательно заряженные группы (например, обработка ацетоксиянтарным ангидридом, малеиновым ангидридом, виннокаменным ангидридом и фталевым ангидридом) или даже два отрицательных заряда (например, обработка тримеллитовым ангидридом, цис-акронитовым ангидридом и 4-нитрофталевым ангидридом). Другие химические модификации можно использовать для удаления положительных зарядов остатков лизина, что приводит к образованию незаряженного остатка (например, обработка уксусным ангидридом, масляным ангидридом, изомасляным ангидридом, капроновым ангидридом, валериановым ангидридом, изовалериановым ангидридом и триметилуксусным ангидридом).
Остатки лизина в препарате целлюлазы модифицировали с помощью янтарного ангидрида, используя различные опубликованные способы (Lundblad, Chemical Reagents for Protien Modification, Editor: R. Lundblad, 3rd Edition CRC press, 1984). Для этой реакции изготавливали образец LAMINEX BG enzyme complex массой 236 мг в 1 мл 500 мМ HEPES буфера pH 8. Перед добавлением ферментативного комплекса изготавливали раствор янтарного ангидрида (Aldrich) растворением порошка в ДМСО до конечной концентрации 500 мг/мл. Аликвоту янтарного ангидрида добавляли из условия, чтобы в реакционной пробирке достигалось соотношение лизина к янтарной кислоте >1:100. В другую реакционную пробирку вносили только сходные объемы ДМСО и фермент, которая служила в качестве контроля с немодифицированным белком. Пробирки энергично перемешивали и оставляли при комнатной температуре на ночь. На следующий день 1:10 объема 1 M глицина pH 3 добавляли в каждую пробирку, чтобы остановить реакцию с янтарным ангидридом.
Химическую модификацию подтверждали сравнением модифицированного и немодифицированного белков в нативных гелях. Анализировали пробеги аликвот из каждой реакции (химически модифицированные и немодифицированные) в градиентных 8-25%, нативных гелях pH 8,8 при 100 В (Phast System gels, GE Healthcare). Белки визуализировали окрашиванием геля в кумаси синем, чтобы подтвердить, что модификация была успешной. Окрашивание показало сдвиги в миграции полос белков, что подтвердило изменения в зарядах различных компонентов белка из препарата целлюлазы. Модифицированные образцы препаратов целлюлазы Trichoderma sp. были заряжены более отрицательно, чем немодифицированные образцы.
Для разделения модифицированных и немодифицированных (контрольных) белков, обессоливали аликвоты по 80 мкл из каждого образца с помощью вращающихся опресняющих колонок (Pierce). При 280 нм измеряли оптическую плотность обессоленных образцов (включая контроль без модификации) с использованием спектрофотометра NanoDrop™ (Thermo), в двух экземплярах после разбавления образца 1:10 для определения общей концентрации белка в образцах.
Оценка связывания лигнина
Лигнин, сложный биополимер из фенилпропаноида, является основным неуглеводным компонентом древесины, который связывается с волокнами целлюлозы для отвержения и укрепления клеточных стенок растений. Так как он сшит с другими компонентами клеточной стенки, лигнин минимизирует доступность целлюлозы гемицеллюлозы для ферментов, расщепляющих целлюлозу. Таким образом, как правило, лигнин связан с пониженной расщепляемостью растительной биомассы (Berlin et al., Appl Biochem Biotechnol, 121-124: 163-170 [2005]). В частности, связывание целлюлаз с лигнином снижает расщепление целлюлозы целлюлазами. Лигнин является гидрофобным и частично отрицательно заряженным. Таким образом, изобретатели ожидали, что добавление отрицательных зарядов в целлюлазу может снизить их связывание с лигнином.
Как описано в настоящем документе, проводили реакцию для измерения влияния химической модификации на способность препарата целлюлазы из Trichoderma sp. связывать компонент растительных полимеров, а именно лигнин. В кратком изложении, 50 мкл 1,16% лигнина (полученного при полном осахаривании жмыха), изготовленного в 50 мМ натрий-ацетатном буфере при pH 5, объединяли с 4 мкл обессоленного модифицированного или немодифицированного препарата целлюлазы из Trichoderma sp. Микроцентрифужные пробирки, содержащие реакционную смесь, инкубировали при комнатной температуре в течение 1 часа и затем центрифугировали на большой скорости для отделения растворимых материалов от нерастворимых. Собирали по десять мкл супернатанта из каждой пробирки. Реакционные пробирки снова перемешивали и инкубировали в течение дополнительных 2 часов, после чего собирали вторые аликвоты по 10 мкл супернатанта из каждой пробирки. Образцы супернатанта анализировали с помощью SDS-PAGE. Снижение интенсивности полос в модифицированных препаратах целлюлазы из Trichoderma sp. указывало на снижение связывания лигнина.
Оценка связывания со жмыхом
Жмых представляет собой биомассу, которая остается после сахарного тростника, который измельчили, чтобы выжать из него сок. Раствор, содержащий 2% целлюлозы жмыха (обработан кислотой, 28% твердых частиц, 57% гликанов), изготавливали в 50 мМ ацетате натрия при pH 5. Образцы немодифицированных или химически модифицированных препаратов целлюлазы из Trichoderma sp. разбавляли в десять раз в таком же натрий-ацетатном буфере. Аликвоты разбавленных ферментов смешивали или с раствором жмыха, или чистым буфером и инкубировали в течение 1 часа при комнатной температуре. Супернатант собирали и анализировали активность компонента целлюлазы, а именно β-глюкозидазы.
Активность β-глюкозидазы измеряли с использованием анализа с хлор-нитро-фенил-β-D-глюкозидом (ХНФГ). Анализ с ХНФГ является кинетическим анализом, в котором β-глюкозидаза превращает ХНФГ в окрашенный продукт 2-хлор-4-нитрофенол (ХНФ). OD измеряют при 405 нм через 10 минут при 37°C. Скорости получали в виде Vmax с помощью программного обеспечения SpectraMax и затем конвертировали в специфическую активность (мкМ ХНФ/с/мг белка). В кратком изложении, 200 мкл 50 мМ натрий-ацетатного буфера pH 5,0 добавляли в каждую лунку 96-луночного планшета микротитратора. Планшет накрывали и помещали в Eppendorf Thermomixer при 37°C на 15 минут, чтобы позволить температуре выровняться. После уравновешивания по пять мкл образцов фермента, серийно разведенного в 50 мМ натрий-ацетатном буфере pH 5,0, добавляли в каждую лунку. 10 мМ основной раствор ХНФГ разводили 1:5 с использованием 50 мМ натрий-ацетатного буфера, pH 5,0, затем 20 мкл разведенного раствора ХНФГ (2 мМ) добавляли в каждую лунку, содержащую образцы фермента. Микротитровальный планшет переносили в спектрофотометр (SpectraMAX, тип 340; Molecular Devices), установленный на 37°C, и считывали OD при 405 нм в течение 0-15 мин, считывание происходило через интервал ≤9 секунд.
Величина активности β-глюкозидазы из образцов фермента целлюлазы, которая оставалась несвязанной со жмыховым субстратом, была значительно выше в случае химически модифицированного препарата целлюлазы из Trichoderma sp. В частности, как определяли с помощью анализа с ХНФГ, менее 50% немодифицированной β-глюкозидазы оставалось не связанной (например, 50% связанной) со жмыховым субстратом, тогда как приблизительно 80% модифицированной bglu оставалось несвязанной (например, 20% связанной) со жмыховым субстратом. Взятые вместе, данные о связывании модифицированной целлюлазы показывают, что уменьшение положительных зарядов на целлюлазе ведет к сниженному связыванию с более отрицательно заряженным растительным полимерным субстратом. В этом случае растительный полимерный субстрат представлял собой лигнин, остающийся в биомассе, обработанной кислотой. Было показано, что обработанная кислотой биомасса из кукурузной соломы, растительный биополимер сходного химического состава, принимает увеличивающийся более отрицательный заряд в процессе осахаривания, что установлено посредством измерения электрокинетического потенциала (смотрите, таблицу 14-1).
Осахаривание предварительно обработанного кислотой жмыха
Осахаривание целлюлозы, присутствующей в предварительно обработанном кислотой жмыхе (ПОКЖ), содержащем меняющиеся количества дополнительного лигнина, оценивали с использованием химически модифицированных и немодифицированных препаратов целлюлазы из Trichoderma sp. и анализировали с помощью ВЭЖХ, чтобы наблюдать за высвобождением сахаров, с DP1 до DP7. В планшете микротитратора, изготавливали 200 мкл 3,5% ПОКЖ в 50 мМ натрий-ацетатном буфере при pH 5 и доводили до различных количеств лигнина. В лунки добавляли по двадцать микролитров раствора фермента целлюлазы (немодифицированного или модифицированного LAMINEX BG). Планшет покрывали алюминиевыми планшетными уплотнителями и помещали в инкубаторы при 50°C, при встряхивании, на 24 часа или 48 часов. Реакцию останавливали добавлением по 100 мкл 100 мМ глицина pH 10 в каждую лунку. После тщательного перемешивания, содержимое лунок планшета микротитратора фильтровали через 96-луночный фильтровальный планшет Millipore (0,45 мкм, PES). Фильтрат разбавляли в планшете, содержащем 100 мкл 10 мМ глицина pH 10, и количество полученных растворимых сахаров (с DP1 до DP7) измеряли с помощью ВЭЖХ. ВЭЖХ Agilent 1100 серии оборудовали обеззоливающей/защитной колонкой (Biorad, по каталогу № 125-0118) и углеводной колонкой на свинцовой основе Aminex (Aminex, по каталогу № HPX-87P). В качестве подвижной фазы использовали воду при скорости потока 0,6 мл/мин. Все стандарты растворимых сахаров (DP1-DP7), полученные из Sigma, разбавляли в воде Milli-Q до 100 мг/мл и использовали для пересчета площади пика для отдельных сахаров в фактические концентрации сахаров. Процент превращения вычисляли делением сахаров, измеренных в ВЭЖХ на 100% превращение целлюлозы в глюкозу.
Связывание целлюлазы с лигнином будет снижать ее эффективность при расщеплении целлюлозы. Это проявляется в виде снижения превращения целлюлозы в присутствии повышенных количеств лигнина, присутствующего при реакциях осахаривания. Эта тенденция сохраняется в модифицированных препаратах целлюлазы. Однако имело место 10% увеличения превращения целлюлозы в образцах модифицированной целлюлазы по сравнению с образцами немодифицированной целлюлазы при вышеуказанных условиях реакции. Этот результат указывает на то, что отрицательный заряд целлюлазы снижает непроизводительное связывание целлюлазы с лигнином. Кроме того, этот пример показывает, что химическая модификация является альтернативой для мутагенеза для управления зарядом фермента.
Химически модифицированная CBH2 увеличивает осахаривание ПОКЖ
Очищенные варианты CBH1, CBH2, EG1, EG2 и β-глюкозидаза из Trichoderma sp. химически модифицировали, как описано выше. Вариант CBH2, используемый в этом эксперименте, обладает множеством замен (P98L/M134V/T154A/I2112V/S316P/S413Y, где номера соответствуют зрелой CBH2 целлюлазе дикого типа), как описано в публикации патента США № 2006/0205042. Аминокислотная последовательность зрелого варианта CBH2 представляет собой следующее:
QACSSVWGQCGGQNWSGPTCCASGSTCVYSNDYYSQCLPGAASSSSSTRAASTTSRVSPTTSRSSSATPPPGSTTTRVPPVGSGTATYSGNPFVGVTLWANAYYASEVSSLAIPSLTGAMATAAAAVAKVPSFVWLDTLDKTPLMEQTLADIRAANKNGGNYAGQFVVYDLPDRDCAALASNGEYSIADGGVAKYKNYIDTIRQIVVEYSDVRTLLVIEPDSLANLVTNLGTPKCANAQSAYLECINYAVTQLNLPNVAMYLDAGHAGWLGWPANQDPAAQLFANVYKNASSPRALRGLATNVANYNGWNITSPPPYTQGNAVYNEKLYIHAIGPLLANHGWSNAFFITDQGRSGKQPTGQQQWGDWCNVIGTGFGIRPSANTGDSLLDSFVWVKPGGECDGTSDSSAPRFDYHCALPDALQPAPQAGAWFQAYFVQLLTNANPSFL (SEQ ID NO:32).
Химические модификации вариантов CBH1, CBH2, EG1, EG2 и β-глюкозидазы были подтверждены их измененной подвижностью в нативном геле по сравнению с немодифицированными белками. Модифицированные варианты CBH1, CBH2, EG1, EG2 и β-глюкозидаза обладали более отрицательными зарядами. Концентрации всех белков измеряли с использованием спектрофотометра NanoDrop™ (Thermo). Реакцию осахаривания проводили в планшете микротитратора, в каждой лунке планшета микротитратора изготавливали 150 мкл 7% ПОКЖ в 50 мМ натрий-ацетатном буфере при pH 5, 20 мкл смеси ферментов, всего 21 мкг белка, добавляли для того, чтобы конечное отношение белка к целлюлозе в каждой лунке составляло 20 мг/г. Шесть смесей ферментов были изготовлены добавлением очищенных модифицированных или немодифицированных Bglu, варианта CBH2, EG1 или EG2 в фон T. reesei, в котором были инактивированы гены, кодирующие целлобиогидролазу I (CBHI, Cel7a), целлобиогидролазу II (CBHII, Cel6a), эндоглюканазу I (EGI, Cel7b) и эндоглюканазу II (EGII, Cel5a) (смотрите, США 2007/0128690). В каждую смесь добавляли 72,5% фона T. reesei, 2,5% Bglu, 15% варианта CBH2, 5% EG1, 5% EG2, первые четыре смеси содержали один немодифицированный белок, в пятой смеси все белки были немодифицированными и шестая смесь содержала все модифицированные белки. Планшет инкубировали при 50°C в течение 72 часов. Реакцию останавливали добавлением по 100 мкл 100 мМ глицина pH 10 в каждую лунку. После тщательного перемешивания содержимое лунок планшета микротитратора фильтровали через 96-луночный фильтровальный планшет Millipore (0,45 мкм, PES). Фильтрат разводили в планшете, содержащем 100 мкл 10 мМ глицина pH 10, и количество образовавшихся растворимых сахаров (с DP1 до DP7) измеряли с помощью ВЭЖХ. ВЭЖХ Agilent 1100 серии оснащали обеззоливающей/защитной колонкой (Biorad, по каталогу № 125-0118) и углеводной колонкой на свинцовой основе Aminex (Aminex, по каталогу № HPX-87P). В качестве подвижной фазы использовали воду при скорости потока 0,6 мл/мин. Все стандарты растворимых сахаров(DP1-DP7), полученные из Sigma, разбавляли водой Milli-Q до 100 мг/мл и использовали для пересчета площади пика для отдельных сахаров в фактические концентрации сахаров. Процент превращения вычисляли делением сахаров, измеренных с помощью ВЭЖХ, на 100% превращение целлюлозы в глюкозу.
Как было установлено в процессе разработки настоящего изобретения, шестая смесь ферментов (модифицированные EG2, EG1, вариант CBH2 и β-глюкозидаза), в которой все белки были модифицированы, обладала высоким превращением целлюлозы, тогда как пятая смесь ферментов, в которой все белки были немодифицированы, обладала самым низким превращением целлюлозы. При сравнении первых четырех смесей ферментов, вторая смесь ферментов с немодифицированным CBH2 дала следующее самое низкое суммарное превращение целлюлозы. Таким образом, модифицированные белки обладали очевидными преимуществами перед немодифицированными белками при превращении целлюлозы.
Изготовление вариантов CBH2 из T. reesei с поверхностным зарядом
Как установлено в процессе разработки настоящего изобретения, сукцинилирование поверхностных остатков лизина CBH2 повышали эффективность на ПОКЖ, как описано выше, и на предварительно обработанной кукурузной соломе. Заряд модифицированного варианта CBH2 составлял приблизительно -17 по сравнению с немодифицированным вариантом CBH2. Имея это в виду, для определения оптимального поверхностного заряда для эффективного применения целлюлазы разработали CBH2 со шкалой зарядов. Кодирующая область родительского белка дикого типа T. reesei cbh2 приведена ниже, где стандартным шрифтом показана ДНК сигнальной последовательности и жирным шрифтом показана последовательность ДНК зрелого фермента:
atgattgtcggcattctcaccacgctggctacgctggccacactcgcagctagtgtgcctctagaggagcggcaagcttgctcaagcgtctggggccaatgtggtggccagaattggtcgggtccgacttgctgtgcttccggaagcacatgcgtctactccaacgactattactcccagtgtcttcccggcgctgcaagctcaagctcgtccacgcgcgccgcgtcgacgacttctcgagtatcccccacaacatcccggtcgagctccgcgacgcctccacctggttctactactaccagagtacctccagtcggatcgggaaccgctacgtattcaggcaacccttttgttggggtcactccttgggccaatgcatattacgcctctgaagttagcagcctcgctattcctagcttgactggagccatggccactgctgcagcagctgtcgcaaaggttccctcttttatgtggctggatactcttgacaagacccctctcatggagcaaaccttggccgacatccgcaccgccaacaagaatggcggtaactatgccggacagtttgtggtgtatgacttgccggatcgcgattgcgctgcccttgcctcgaatggcgaatactctattgccgatggtggcgtcgccaaatataagaactatatcgacaccattcgtcaaattgtcgtggaatattccgatatccggaccctcctggttattgagcctgactctcttgccaacctggtgaccaacctcggtactccaaagtgtgccaatgctcagtcagcctaccttgagtgcatcaactacgccgtcacacagctgaaccttccaaatgttgcgatgtatttggacgctggccatgcaggatggcttggctggccggcaaaccaagacccggccgctcagctatttgcaaatgtttacaagaatgcatcgtctccgagagctcttcgcggattggcaaccaatgtcgccaactacaacgggtggaacattaccagccccccatcgtacacgcaaggcaacgctgtctacaacgagaagctgtacatccacgctattggacctcttcttgccaatcacggctggtccaacgccttcttcatcactgatcaaggtcgatcgggaaagcagcctaccggacagcaacagtggggagactggtgcaatgtgatcggcaccggatttggtattcgcccatccgcaaacactggggactcgttgctggattcgtttgtctgggtcaagccaggcggcgagtgtgacggcaccagcgacagcagtgcgccacgatttgactcccactgtgcgctcccagatgccttgcaaccggcgcctcaagctggtgcttggttccaagcctactttgtgcagcttctcacaaacgcaaacccatcgttcctgtaa (SEQ ID NO:33).
Аминокислотная последовательность родительского белка-предшественника дикого типа cbh2 T. reesei показана ниже:
MIVGILTTLATLATLAASVPLEERQACSSVWGQCGGQNWSGPTCCASGSTCVYSNDYYSQCLPGAASSSSSTRAASTTSRVSPTTSRSSSATPPPGSTTTRVPPVGSGTATYSGNPFVGVTPWANAYYASEVSSLAIPSLTGAMATAAAAVAKVPSFMWLDTLDKTPLMEQTLADIRTANKNGGNYAGQFVVYDLPDRDCAALASNGEYSIADGGVAKYKNYIDTIRQIVVEYSDIRTLLVIEPDSLANLVTNLGTPKCANAQSAYLECINYAVTQLNLPNVAMYLDAGHAGWLGWPANQDPAAQLFANVYKNASSPRALRGLATNVANYNGWNITSPPSYTQGNAVYNEKLYIHAIGRLLANHGWSNAFFITDQGRSGKQPTGQQQWGDWCNVIGTGFGIRPSANTGDSLLDSFVWVKPGGECDGTSDSSAPRFDSHCALPDALQPAAQAGAWFQAYFVQLLTNANPSFL (SEQ ID NO:34).
Аминокислотная последовательность зрелого родительского белка дикого типа cbh2 T. reesei показана ниже:
QACSSVWGQCGGQNWSGPTCCASGSTCVYSNDYYSQCLPGAASSSSSTRAASTTSRVSPTTSRSSSATPPPGSTTTRVPPVGSGTATYSGNPFVGVTPWANAYYASEVSSLAIPSLTGAMATAAAAVAKVPSFMWLDTLDKTPLMEQTLADIRTANKNGGNYAGQFVVYDLPDRDCAALASNGEYSIADGGVAKYKNYIDTIRQIVVEYSDIRTLLVIEPDSLANLVTNLGTPKCANAQSAYLECINYAVTQLNLPNVAMYLDAGHAGWLGWPANQDPAAQLFANVYKNASSPRALRGLATNVANYNGWNITSPPSYTQGNAVYNEKLYIHAIGRLLANHGWSNAFFITDQGRSGKQPTGQQQWGDWCNVIGTGFGIRPSANTGDSLLDSFVWVKPGGECDGTSDSSAPRFDSHCALPDALQPAAQAGAWFQAYFVQLLTNANPSFL (SEQ ID NO:35).
Выбранные для мутагенеза остатки включали неконсервативные, расположенные на поверхности остатки лизина, аргинина, аспарагина и глутамина, которые были отобраны для замены, чтобы ввести отрицательные заряды. Сукцинилированные лизины в модифицированной CBH2 идентифицировали с помощью масс-спектрометрии и отбирали для мутагенеза в глутамат, что приводило к разнице в зарядах -2 на замену. Другие остатки отбирали для замены с помощью анализа трехмерной структуры CBH2, объединенного с выравниванием аминокислот гомологичных последовательностей CBH2 (смотрите, например, публикация США № US 2006/0205042, фиг.3 включена в настоящий документ в качестве ссылки). Поверхностные остатки, которые были высоко вариабельными в выравнивании аминокислотных последовательностей CBH2, были кандидатами на мутагенез. Однако избегали накопления замен в непосредственной близости. Аргинин замещали глутамином (заряд -1), и глутамин, и аспарагин замещали соответствующими карбоксильными вариантами (заряд -1). Кроме того, аспартатные и глутаматные остатки отбирали для замены на соответствующие аминные остатки для завершения шкалы зарядов (заряд +1). Конкретные замены CBH2 приведены в таблице 5-1, где приведены все позиции, за исключением R63 и R77, расположенных в каталитическом домене CBH2. Суммарный положительный заряд может быть создан или посредством удаления отрицательно заряженного остатка, или посредством введения положительно заряженного остатка. Подобным образом, суммарный отрицательный заряд может быть создан или посредством удалениея положительно заряженного остатка, или посредством введения отрицательно заряженного остатка.
Шкала зарядов замен в CBH2
Для изготовления CBH2 со шкалой зарядов были разработаны десять зарядовых вариантов CBH2 (с C-1 до C-10), охватывающие диапазон зарядом от +8 до -32 по сравнению с CBH2 дикого типа и приведенные в таблице 14-3.
Варианты CBH2 со шкалой зарядов
Аминокислотные последовательности вариантов обратно транслировали в ДНК и оптимизировали кодоны для экспрессии в Trichoderma reesei с использованием программного обеспечения GeneDisigner (DNA2.0). Гены вариантов cbh2 с оптимизированными кодонами синтезировали и ДНК вариантов CBH2 с различными поверхностными зарядами (РПЗ) ПЦР-амплифицировали из конструкций DNA2.0 с использованием праймеров:
GGHTK22 прямой
5'-CACCATGATCGTGGGAATTCTTACTACTC-3' (SEQ ID NO:36); и
GGTHK23 обратный
5'-CTACAAAAACGAAGGGTTCGCATT-3' (SEQ ID NO:37).
Однако в одном эксперименте сайт-направленный мутагенез использовали для введения мутаций K129E и K157E (зарядовый вариант C3 cbh2) в геномную ДНК CBH2 дикого типа. Зарядовый вариант C3 CBH2 cbh2 клонировали в pTrex3GM и экспрессировали, как описано в настоящем документе. ПЦР продукты очищали и клонировали в pENTR/TOPO для трансформации E. coli TOP10 клеток. Плазмидную ДНК выделяли из отдельных колоний и подтверждали правильную последовательность. CBH2 РПЗ клонировали в pTrex3GM, pTTTpyr(pcbh1) и pTTTpyr(pstp1), как показано в таблице 14-4.
Экспрессионные клоны вариантов CBH2 с различными поверхностными зарядами
Экспрессия вариантов CBH2 в T. reesei
Этот пример описывает способы, используемые для экспрессии вариантов CBH2 с различными поверхностными зарядами (РПЗ) в T. reesei. В кратком изложении, биолистическая трансформация T. reesei экспрессирующим вектором pTrex3gM, содержащим открытую рамку считывания зарядового варианта C3 cbh2 (с мутациями K129E и K157E), выполняли с применением следующего протокола. Использовали T. reesei, в которой были инактивированы гены, кодирующие целлобиогидролазу I (CBHI, Cel7a), целлобиогидролазу II (CBHII, Cel6a), эндоглюканазу I (EGI, Cel7b) и эндоглюканазу II (EGII, Cel5a). Трансформацию штамма Trichoderma reesei способом биоллистической трансформации выполняли с использованием Biolistic® PDS-1000/he Particle Delivery System из Bio-Rad (Hercules, CA) по инструкциям производителя (смотрите WO 05/001036 и US 2006/0003408). Трансформантов переносили в новые ацетамидные селекционные планшеты. Стабильные трансформанты инокулировали в фильтровальные планшеты микротитратора (Millipore), содержащие по 200 мкл минимальной глициновой среды на лунку (6,0 г/л глицина; 4,7 г/л (NH4)2SO4; 5,0 г/л KH2PO4; 1,0 г/л MgSO4·7H2O; 33,0 г/л PIPPS; p.H. 5,5) с добавлением после стерилизации ~2% смеси глюкозы/софорозы в качестве источника углерода, 10 мл/л 100 г/л CaCl2, 2,5 мл/л микроэлементов T. reesei (400×): 175 г/л безводной лимонной кислоты; 200 г/л FeSO4·7H2O; 16 г/л ZnSO4·7H2O; 3,2 г/л CuSO4·5H2O; 1,4 г/л MnSO4·H2O; 0,8 г/л H3BO3. Трансформанты выращивали в жидкой культуре в течение 5 дней в O2-богатой камере, смонтированной в инкубаторе на 28°C. Образцы супернатанта из фильтровального планшета микротитратора получали с помощью вакуумного коллектора. Образцы прогоняли в 4-12% гелях NuPAGE (Invitrogen) в соответствии с инструкциями производителя. Гели окрашивали краской Simply Blue (Invitrogen). Экспрессия дополнительных вариантов CHB2 с различными поверхностными зарядами может быть выполнена с применением этого способа.
ПРИМЕР 15
Модулирование профиля фермента pH-активность
Этот пример описывает применение мутаций поверхностных зарядов для оптимизации профиля фермента pH-активность для заданной реакции.
На фиг.31 показана активность очистки микрообразца с рисовым крахмалом как функция pH для AmyS с первой шкалой зарядов из примера 5. Диапазон pH от 3,0 до 4,25 были в 200 мМ формиате натрия, содержащем 0,01% Tween-80, тогда как диапазон pH от 4,25 до 5,5 был в 200 мМ ацетате натрия, содержащем 0,01% Tween-80. Данные соответствуют кривым титрования, каждая с отдельным значением pKa.
На фиг.32 показан видимый pKa для катализа AmyS как функция изменения заряда для AmyS с первой шкалой зарядов из примера 5. Эти данные демонстрируют, что профили pH-активность для α-амилазы могут быть значительно сдвинуты посредством мутаций поверхностных зарядов, даже в 200 мМ буфере. Хотя о таком сообщали для субтилизина при очень низкой ионной силе (Russell et al., J Mol Biol, 193: 803-13 [1987]) и для D-ксилозаизомеразы (Cha et al., Mol Cell, 8: 374-82 [1998]), предполагается, что в первый раз это было выполнено для α-амилазы, и, как ни удивительно, даже при высокой ионной силе.
Все патенты и публикации, отмеченные в этом описании, указывают на уровень для специалистов в области, к которой принадлежит изобретение. Специалисты в данной области охотно признают то, что настоящее изобретение хорошо приспособлено для осуществления целей и получения отмеченных результатов и преимуществ, а также того, что связано с ними. Композиции и способы, описываемые в настоящем документе, показательные для предпочтительных вариантов осуществления, являются образцовыми, и не предназначены для ограничения объема изобретения. Профессионалам в данной области будет совершенно понятно, что варьирование замен и модификаций моет быть выполнено в описываемом в настоящем документе изобретении, без отклонения от объема и области и сущности изобретения.
Изобретение, иллюстративно описываемое в настоящем документе, в надлежащей мере может быть осуществлено на практике в отсутствие любого элемента или элементов, ограничения или ограничений, которые не прямо описаны в настоящем документе. Употребленные термины и выражения используют в качестве терминов описания, но не ограничения, и не имеет места намерение, что при использовании таких терминов и выражений исключаются любые эквиваленты показанных и описанных свойств или их фрагментов, но установлено, что различные модификации возможны в рамках заявленного объема изобретения. Таким образом, следует понимать, что хотя настоящее изобретение определенно раскрыто с помощью предпочтительных вариантов осуществления и дополнительных свойств, специалисты в данной области могут прибегнуть к модификации и изменению идей, раскрытых в настоящем документе, и считается, что такие модификации и изменения находятся в рамках области данного изобретения, которые определены настоящим документом.
В настоящем документе изобретение описано ориентировочно и в общем. Каждая более узкая разновидность и менее общая группировка попадает в пределы общего раскрытия, также образуя часть изобретения. Это включает общее описание изобретения с исключением или негативным ограничением, удаляющим любой объект из рода, независимо от того, определенно указан исключенный объект в настоящем документе или нет.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИДЕНТИФИКАЦИИ УЛУЧШЕННЫХ ВАРИАНТОВ БЕЛКА | 2008 |
|
RU2520808C2 |
| СПОСОБЫ УЛУЧШЕНИЯ ЭФФЕКТИВНОСТИ БЕЛКОВ | 2008 |
|
RU2569106C2 |
| ВАРИАНТЫ АЛЬФА-АМИЛАЗЫ С ИЗМЕНЕННЫМИ СВОЙСТВАМИ | 2008 |
|
RU2499044C2 |
| КОМПОЗИЦИИ И СПОСОБЫ, ВКЛЮЧАЮЩИЕ В СЕБЯ ПРИМЕНЕНИЕ ВАРИАНТНЫХ МИКРОБНЫХ ПРОТЕАЗ | 2009 |
|
RU2575073C2 |
| ВАРИАНТЫ СЕРИНОВОЙ ПРОТЕАЗЫ С МНОЖЕСТВЕННЫМИ МУТАЦИЯМИ | 2007 |
|
RU2558261C2 |
| ПРИМЕНЕНИЕ И ПОЛУЧЕНИЕ СТАБИЛЬНОЙ ПРИ ХРАНЕНИИ НЕЙТРАЛЬНОЙ МЕТАЛЛОПРОТЕИНАЗЫ | 2006 |
|
RU2433182C2 |
| ПРОТЕАЗА Streptomyces | 2008 |
|
RU2486244C2 |
| ПРИМЕНЕНИЕ БЕЛКОВЫХ ГИДРОЛИЗАТОВ ДЛЯ СТАБИЛИЗАЦИИ ДЕТЕРГЕНТНЫХ СОСТАВОВ МЕТАЛЛОПРОТЕАЗЫ | 2008 |
|
RU2484138C2 |
| ПРОДУЦИРОВАНИЕ ТЕРМОЛИЗИНА И ЕГО ВАРИАНТОВ И ЕГО ИСПОЛЬЗОВАНИЕ В ЖИДКИХ ДЕТЕРГЕНТАХ | 2008 |
|
RU2536255C2 |
| ВАРИАНТЫ АЛЬФА-АМИЛАЗЫ TS-23 С ИЗМЕНЕННЫМИ СВОЙСТВАМИ | 2009 |
|
RU2526516C2 |
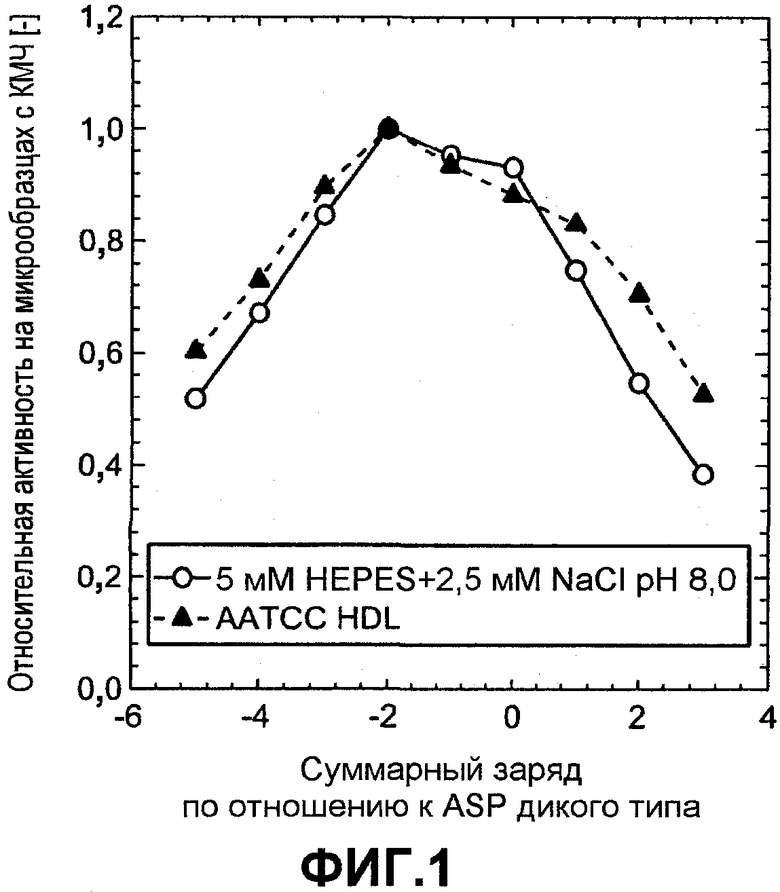
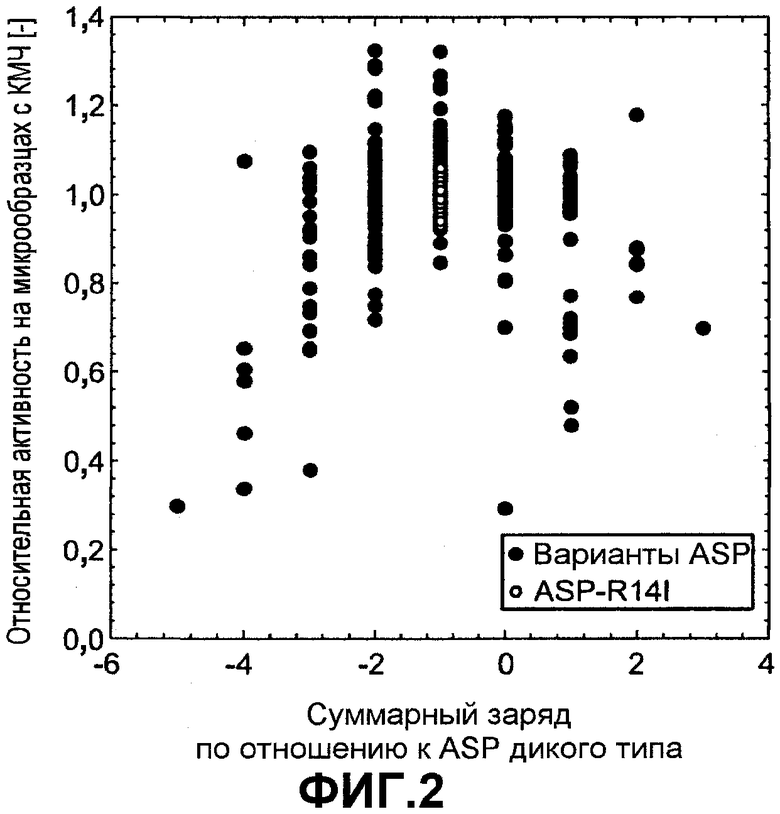

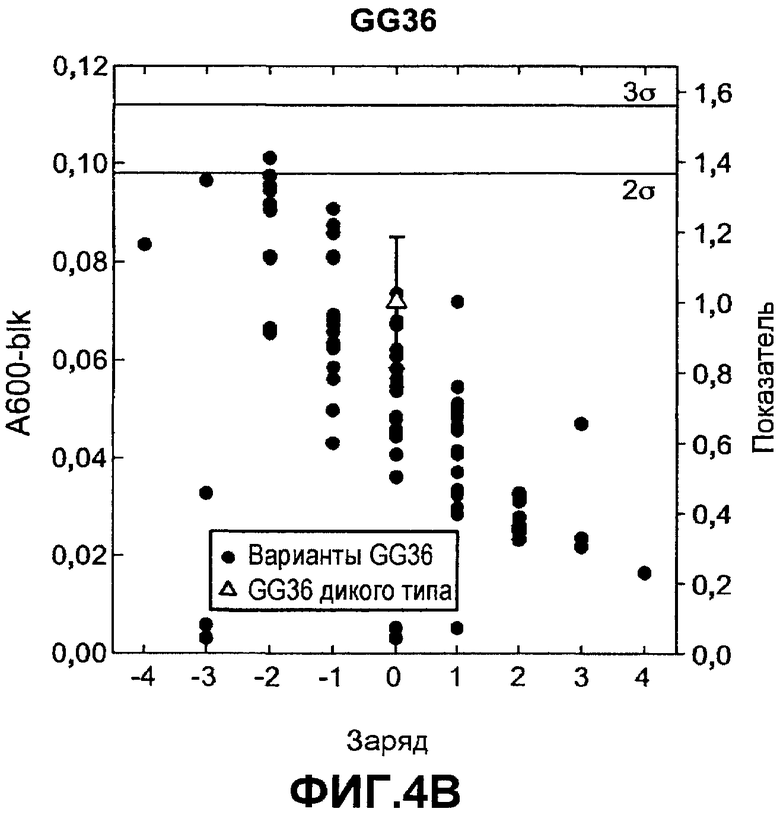
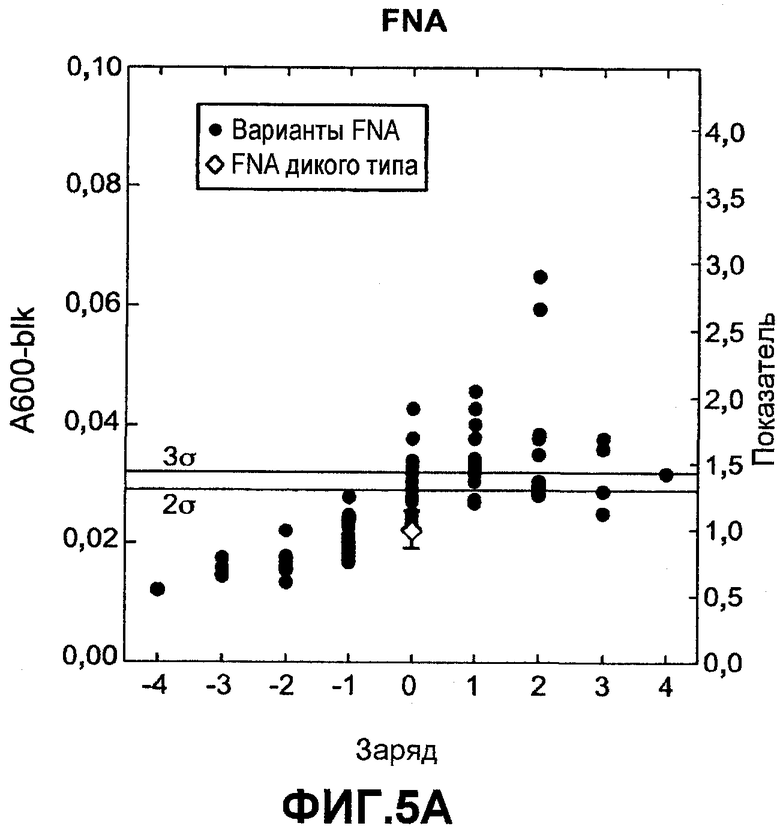
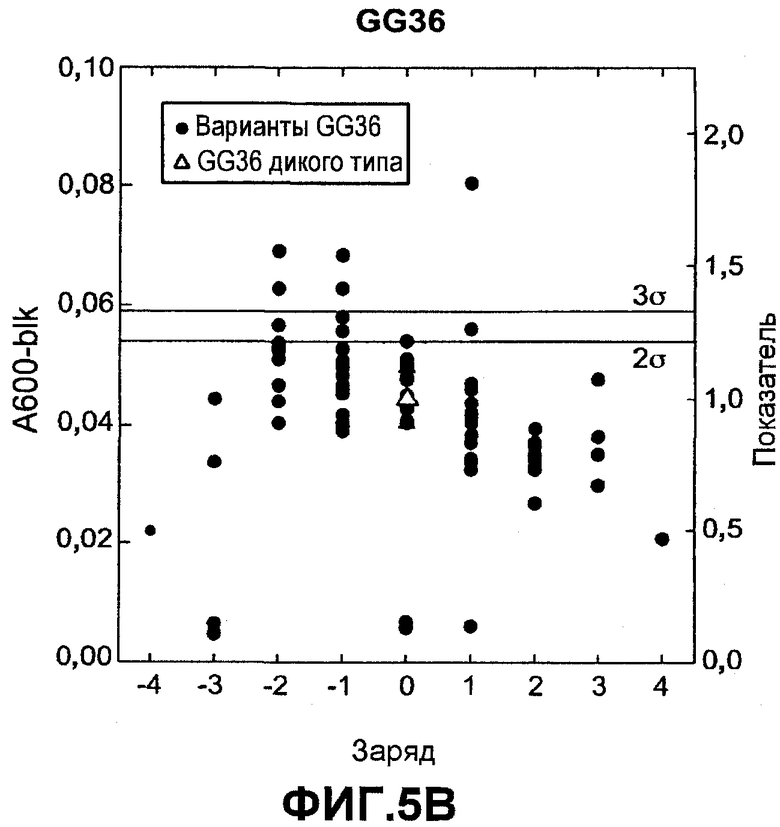


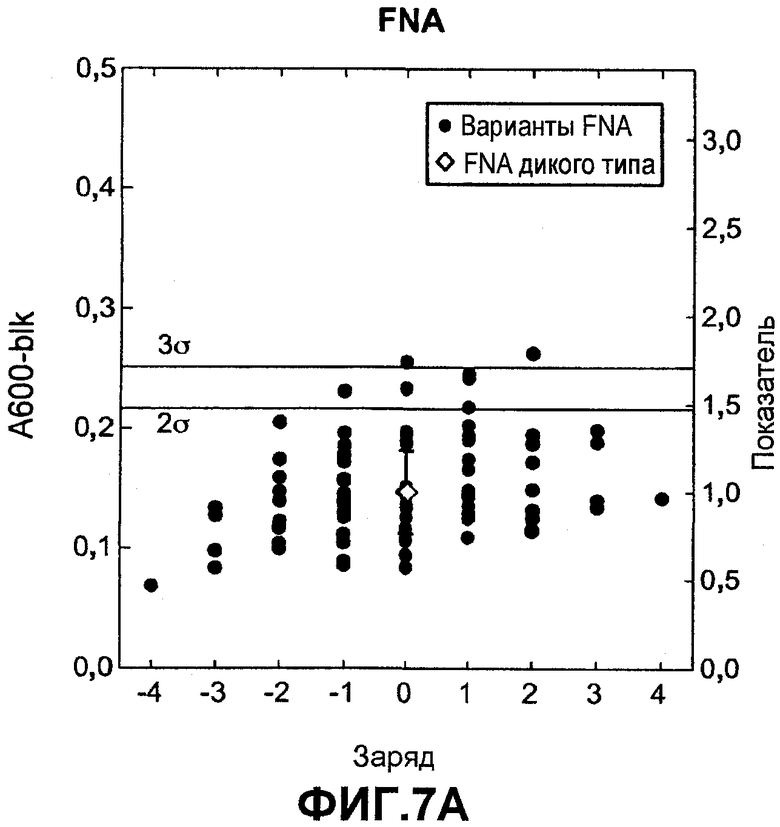
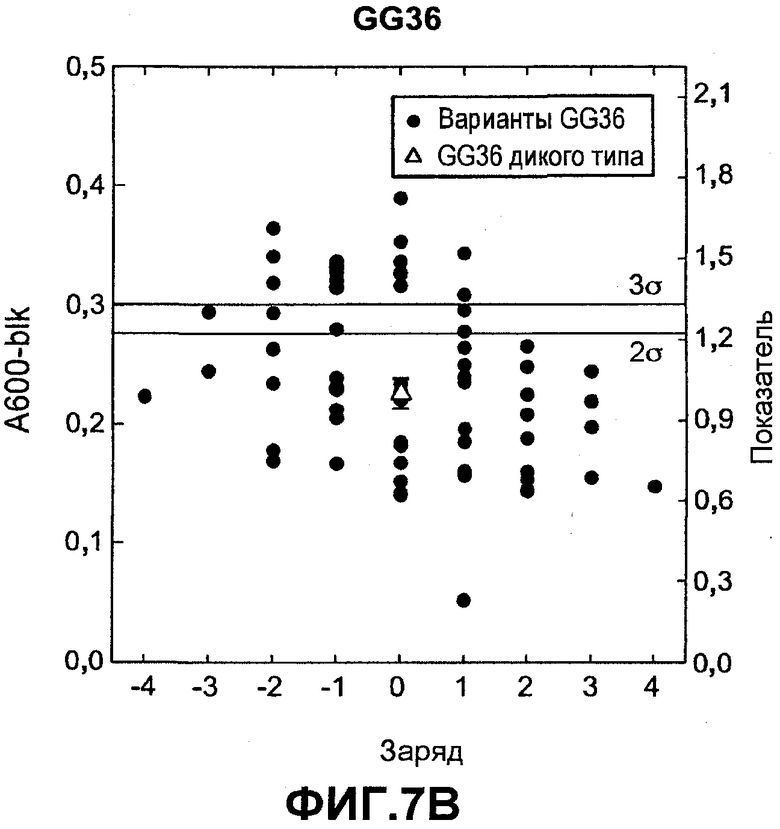
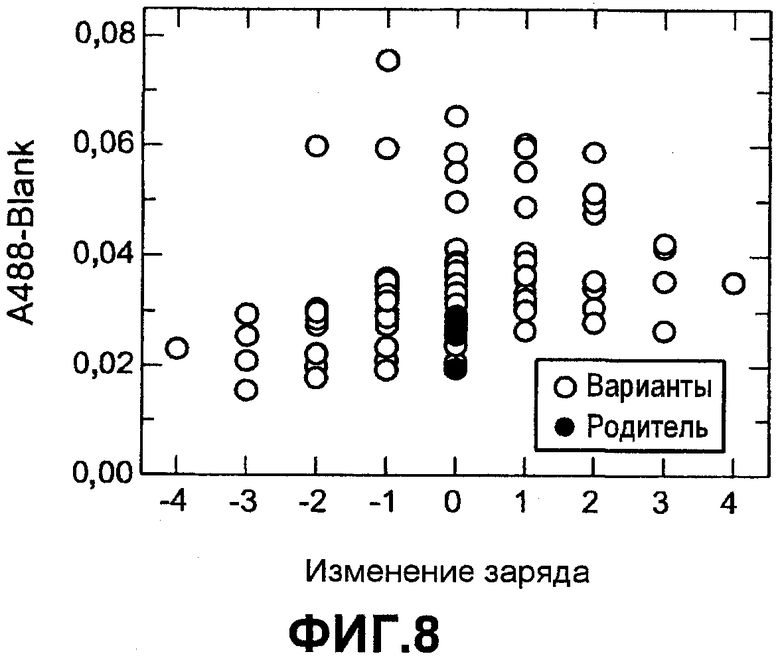

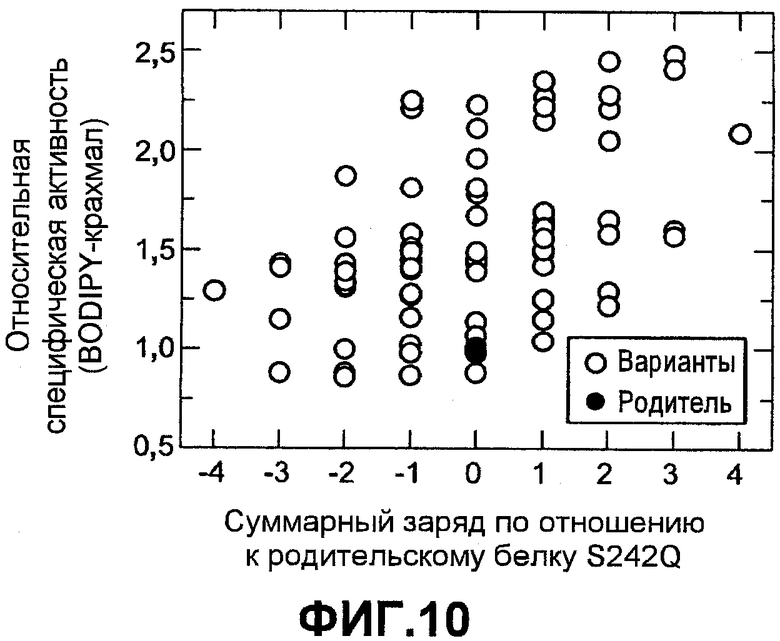
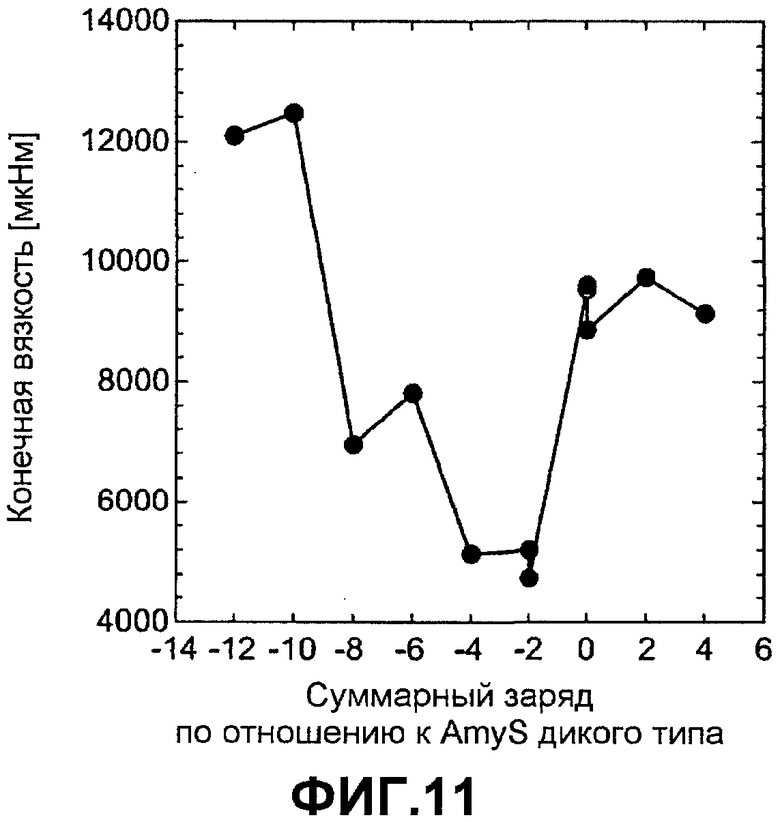
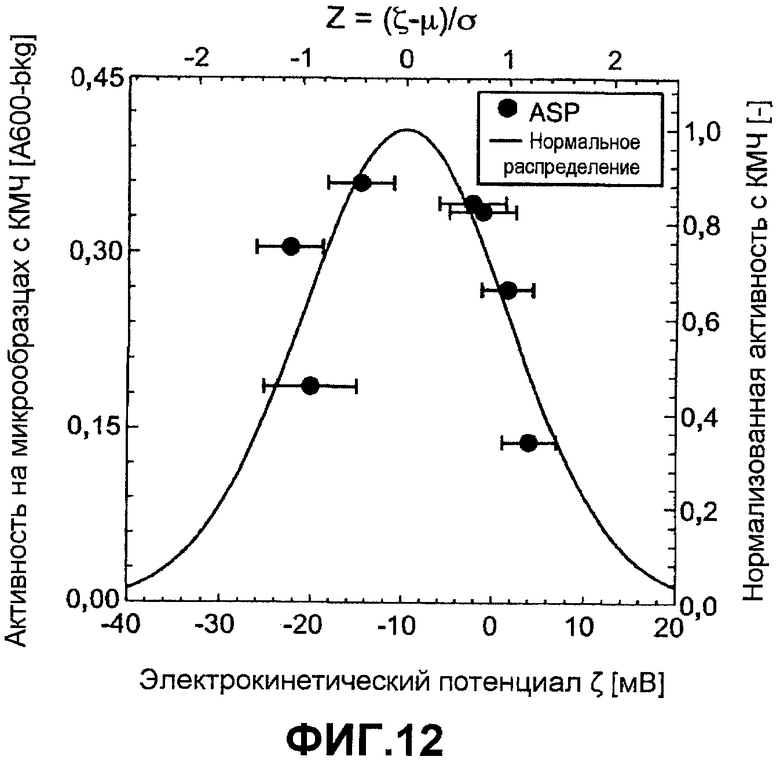
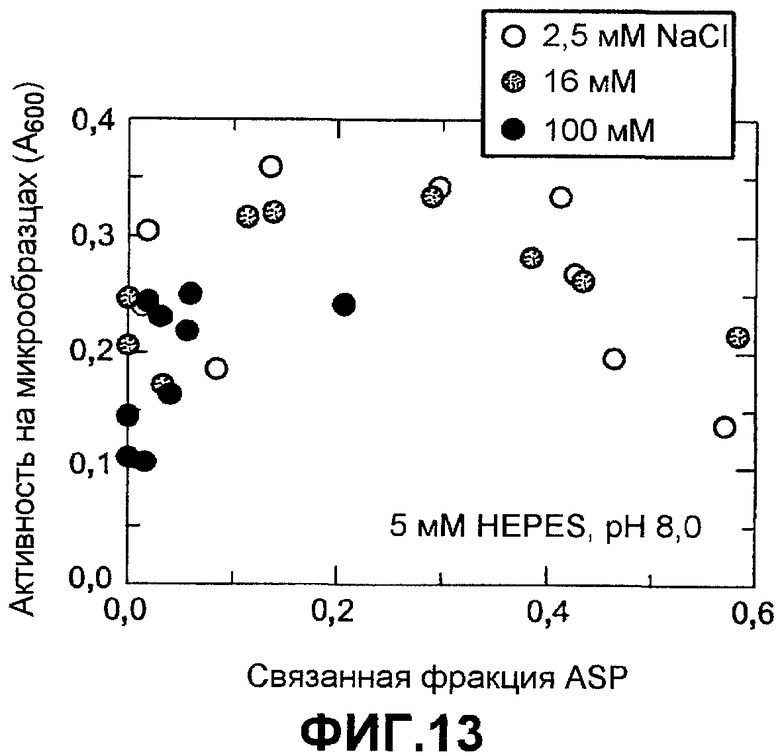
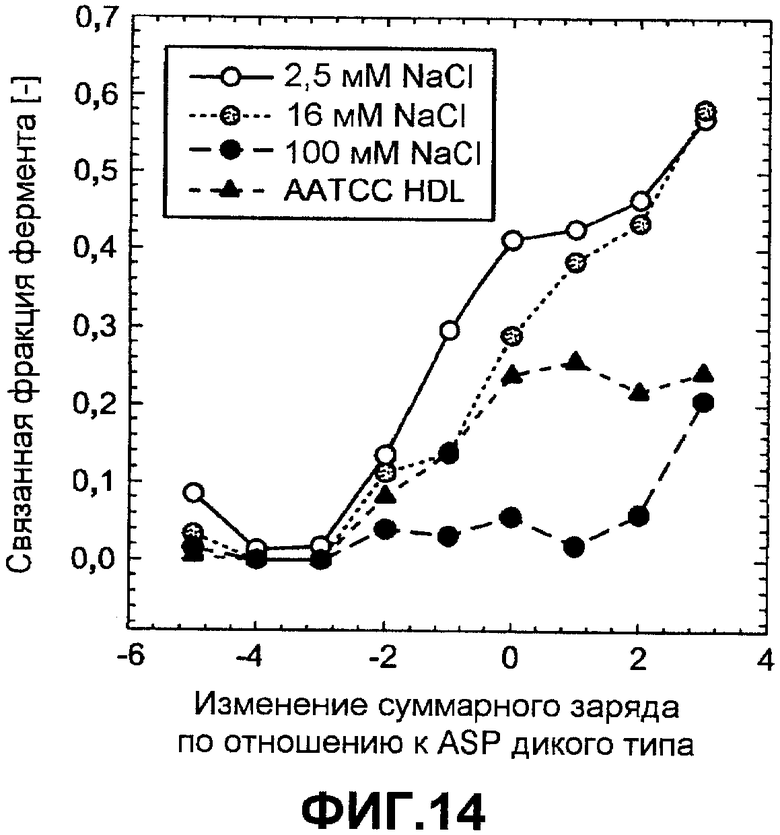

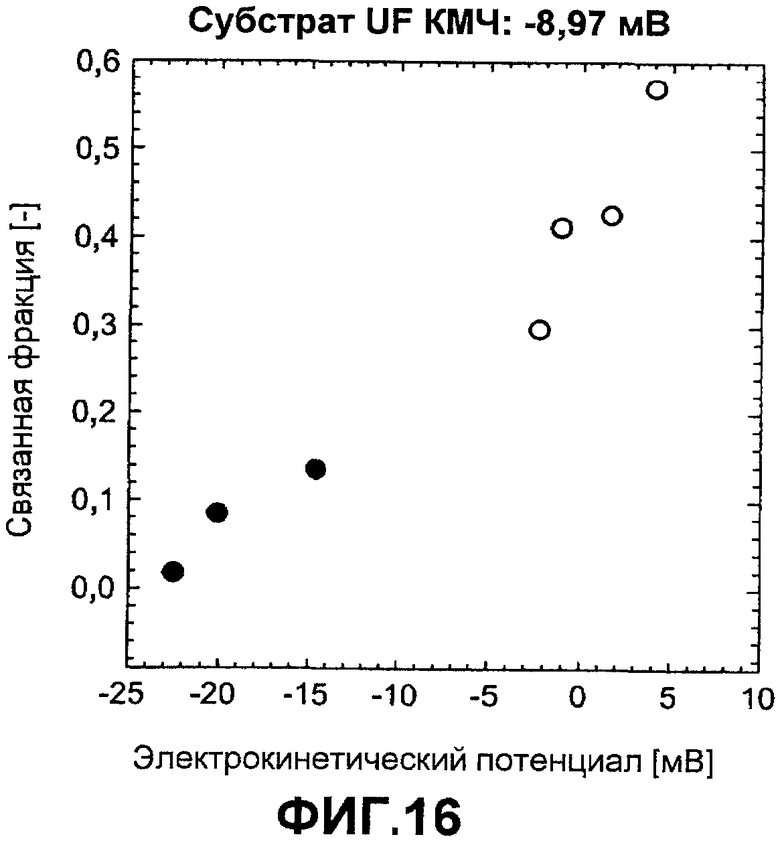

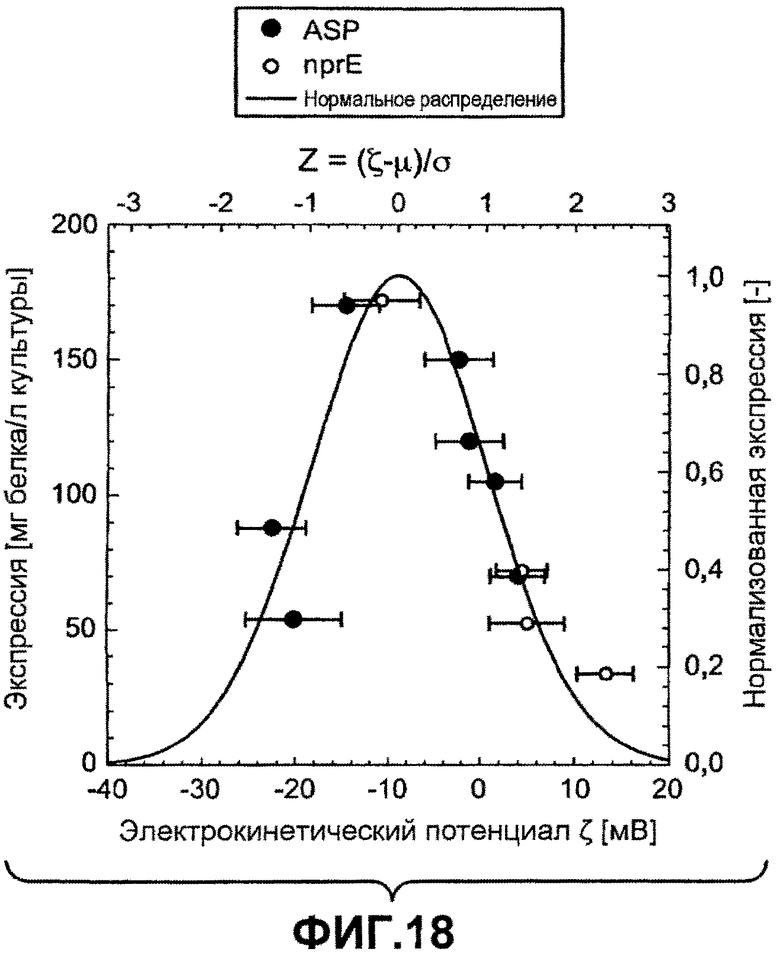




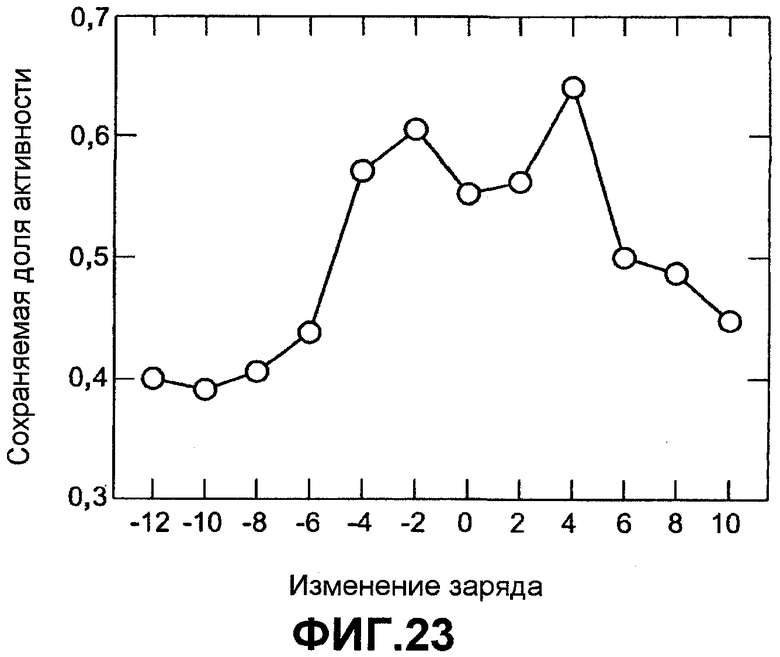

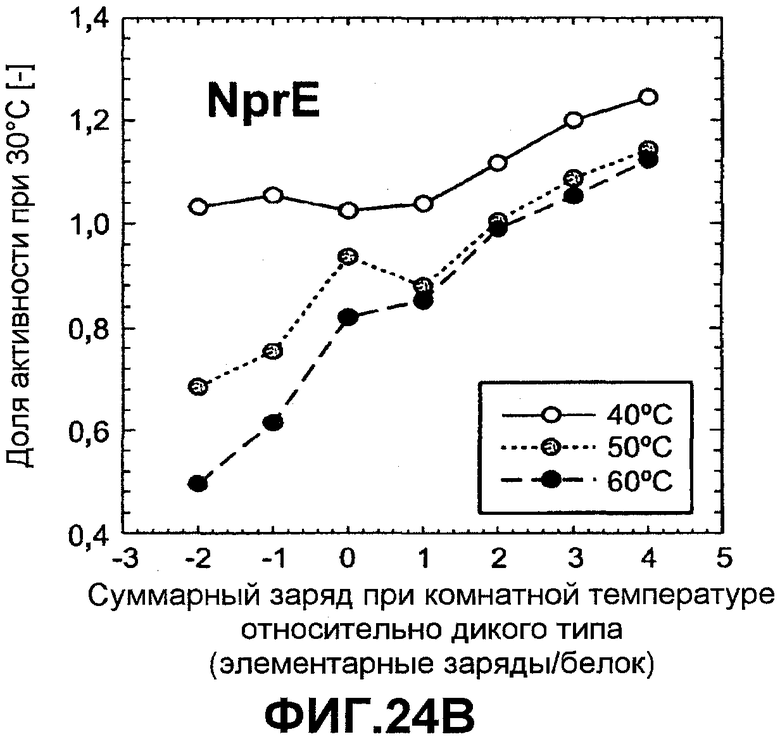
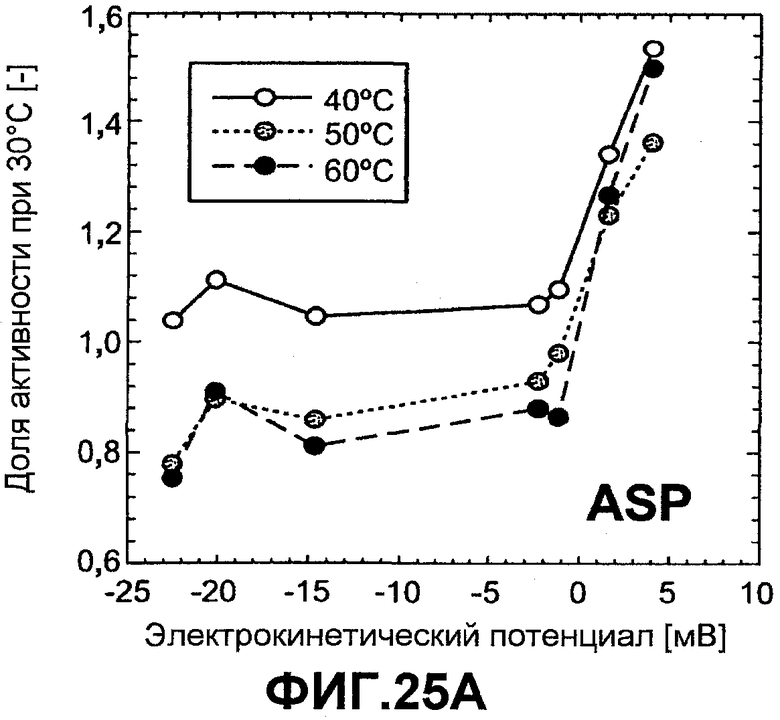
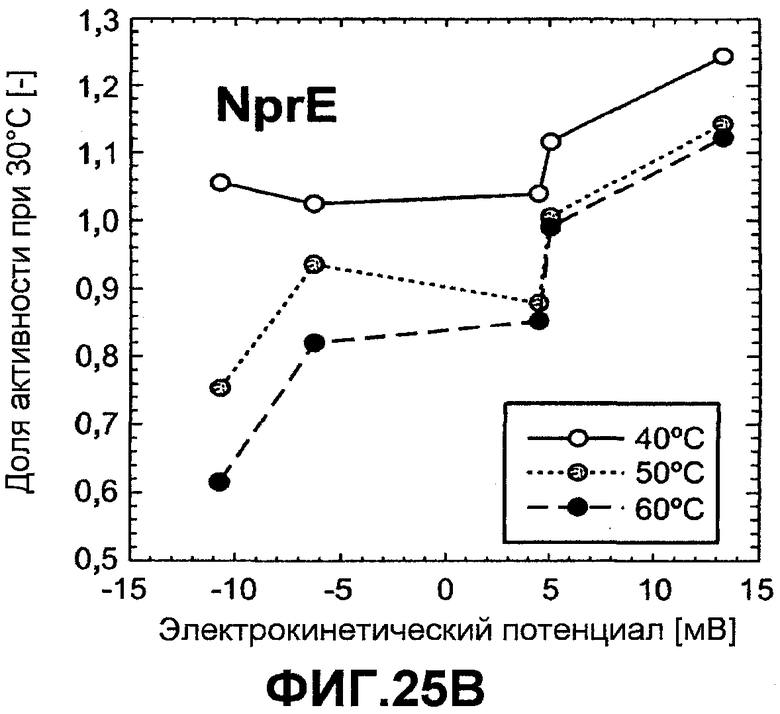
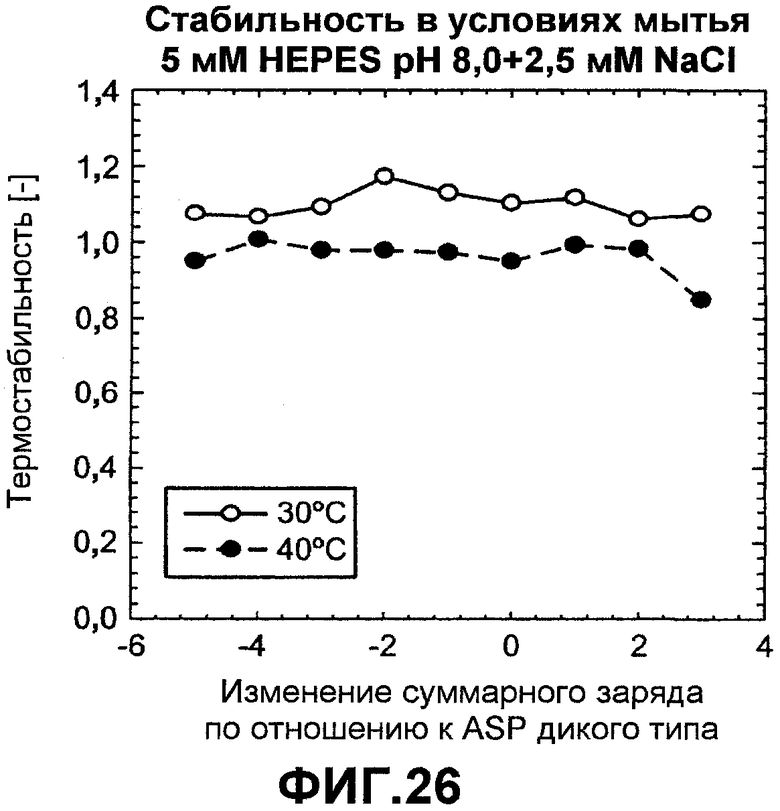
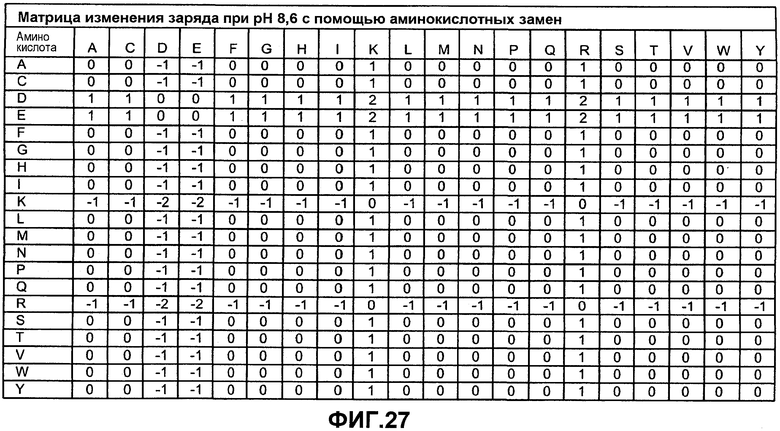



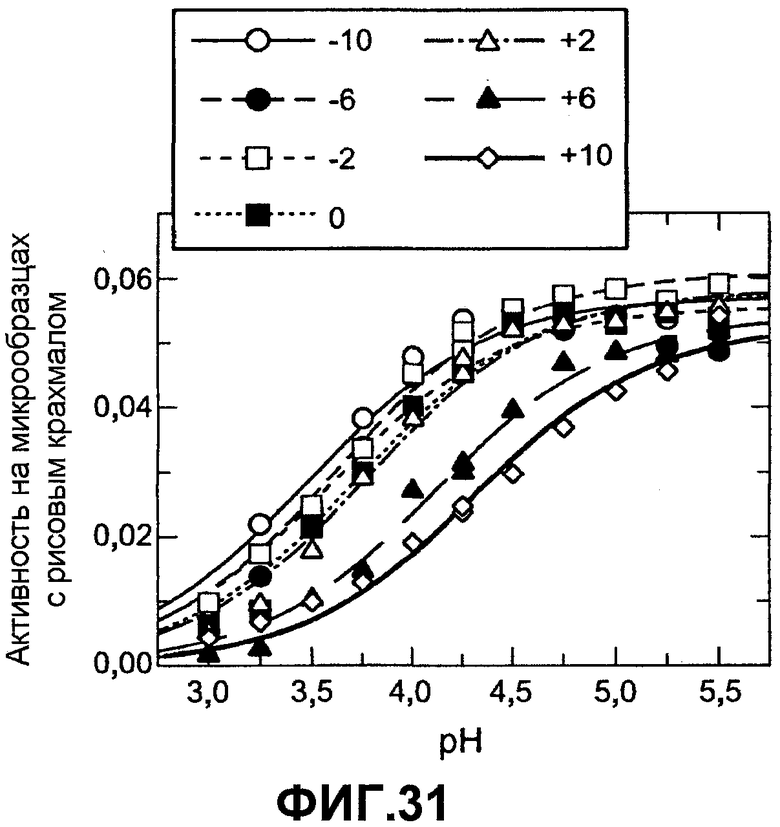

Настоящее изобретение относится к способу предоставления вариантов протеазы или амилазы со значением эффективности, по меньшей мере, в одном интересующем тесте, превышающим показатель эффективности для указанного фермента дикого типа. Тестируют множество вариантов фермента, охватывающее определённый диапазон суммарного поверхностного заряда или электрокинетического потенциала, по меньшей мере, в одном интересующем тесте. Такой тест включает измерение: эффективности стирки, связывания субстрата, ингибирования фермента, уровней экспрессии, стабильности в детергенте, тепловой стабильности, скорости реакции, степени завершенности реакции и/или тепловой активности. Идентифицируют значение поверхностного заряда или электрокинетического потенциала, при котором эффективность в тесте составляет по меньшей мере 50% от максимальной. Создают новое множество (библиотеку) вариантов фермента, обогащенное членами, обладающими значением по меньшей мере 50% от максимального значения, в указанном, по меньшей мере, одном интересующем тесте в пределах указанного значения заряда или потенциала. Тестируют указанное множество вариантов фермента и, по меньшей мере, один фермент дикого типа в указанном, по меньшей мере, одном интересующем тесте. Если значение показателя эффективности превышает показатель для фермента дикого типа, то идентифицируют варианты фермента, показывающие улучшенный результат. Использование изобретения обеспечивает новый способ получения вариантов ферментов с улучшенной активностью. 18 з.п. ф-лы, 32 ил., 14 табл., 15 пр.
1. Способ предоставления библиотеки вариантов фермента, обладающих значением показателя эффективности, по меньшей мере, в одном интересующем тесте, превышающим показатель эффективности для указанного фермента дикого типа, включающий:
a) тестирование множества вариантов фермента, охватывающего определённый диапазон суммарного поверхностного заряда или электрокинетического потенциала, по меньшей мере, в одном интересующем тесте;
b) идентификацию оптимального значения в пределах указанного диапазона суммарного поверхностного заряда или электрокинетического потенциала, которое связано со значением по меньшей мере 50% от максимального значения, в указанном, по меньшей мере, одном интересующем тесте;
c) предоставление множества вариантов фермента в пределах оптимального значения указанного диапазона суммарного поверхностного заряда или электрокинетического потенциала, так что обеспечивается библиотека вариантов фермента, обогащенная членами, обладающими значением, по меньшей мере, 50% от максимального значения, в указанном, по меньшей мере, одном интересующем тесте;
d) тестирование указанного множества вариантов фермента и, по меньшей мере, одного фермента дикого типа в указанном, по меньшей мере, одном интересующем тесте; и
e) идентификацию вариантов фермента, показывающих улучшенный результат, где значение показателя эффективности для фермента дикого типа в указанном, по меньшей мере, одном интересующем тесте составляет 1,0, а значение показателя эффективности для указанных вариантов фермента, показывающих улучшенный результат, превышает 1, 0;
где указанный фермент представляет собой протеазу или амилазу, и где указанный интересующий тест включает измерение эффективности стирки, связывания субстрата, ингибирования фермента, уровней экспрессии,стабильности в детергенте, тепловой стабильности, скорости реакции, степени завершенности реакции, и/или тепловой активности.
2. Способ по п.1, где указанное оптимальное значение в пределах указанного диапазона суммарного поверхностного заряда или электрокинетического потенциала связано со значением, большим чем, по меньшей мере, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 95% от максимального значения, наблюдаемого в интересующем тесте.
3. Способ по п.1, где фермент представляет собой протеазу.
4. Способ по п.3, где указанная протеаза представляет собой нейтральную металлопротеазу или сериновую протеазу.
5. Способ по п.4, где указанная сериновая протеаза представляет собой субтилизин.
6. Способ по п.4, где указанная нейтральная металлопротеаза получена из члена семейства Bacillaceae.
7. Способ по п.4, где указанная сериновая протеаза получена из члена рода Cellulomonas.
8. Способ по п.1, где указанный фермент представляет собой амилазу.
9. Способ по п.1, где на стадии (а) тестируют множество вариантов фермента, охватывающее определенный диапазон суммарного поверхностного заряда.
10. Способ по п.1, где на стадии (а) тестируют множество вариантов фермента, охватывающее определенный диапазон электрокинетического потенциала.
11. Способ по п.10, где указанный электрокинетический потенциал указанного варианта фермента находится между приблизительно -40 мВ и приблизительно +40 мВ.
12. Способ по п.10, где указанный электрокинетический потенциал указанного варианта фермента находится между приблизительно -20 мВ и приблизительно +20 мВ.
13. Способ по п.10, где указанный электрокинетический потенциал указанного варианта фермента находится между приблизительно -10 мВ и приблизительно +10 мВ.
14. Способ по п.1, где указанный интересующий тест включает эффективность стирки.
15. Способ по п.14, где указанная эффективность стирки включает эффективность отстирывания крови-молока-чернил.
16. Способ по п.15, где указанные варианты фермента и фермент дикого типа тестируют в композиции детергента.
17. Способ по п.16, где указанная композиция детергента составлена в виде порошкообразного или жидкого детергента, обладающего pH между приблизительно 5 и приблизительно 12,0.
18. Способ по п.16, где указанную эффективность стирки тестируют в холодной воде с жидким детергентом, обладающим основным pH.
19. Способ по п.16, где указанную эффективность стирки тестируют в горячей воде с детергентом.
| СOHEN et al., "In vitro enzyme evolution: the screening challenge of isolating the one in a million", Trends in biotechnology vol.19, no.12, 2001, pр.507-510 | |||
| Сканирующее устройство кругового обзора | 1988 |
|
SU1612271A2 |
| ВАРИАНТ СУБТИЛИЗИНА (ВАРИАНТЫ), КОДИРУЮЩАЯ ЕГО ДНК, ЭКСПРЕССИРУЮЩИЙ ВЕКТОР, ОЧИЩАЮЩАЯ КОМПОЗИЦИЯ, КОРМ ДЛЯ ЖИВОТНЫХ, КОМПОЗИЦИЯ ДЛЯ ОБРАБОТКИ ТКАНИ | 1998 |
|
RU2252958C2 |
| WO2005005654 A1, 20.01.2005 | |||
| US6197567 B1, 06.03.2001 | |||
Авторы
Даты
2015-06-20—Публикация
2008-06-06—Подача