Настоящее изобретение относится к способу получения 1,4-диаминобутана (DAB, ДАБ), включающему в себя по меньшей мере одну биокаталитическую стадию.
Соединение ДАБ является важным сырьем для получения некоторых важных технических пластмасс: полиамида-4,6 либо в форме гомополимера или сополимера, например, содержащего приблизительно 5 масс.% мономера полиамида-6 (капролактама). Гомополимер, полиамид-4,6 (найлон-4,6), описан еще в 1938 (US-A-2,130,948, Carothers). Он является продуктом поликонденсации мономеров ДАБ и адипиновой кислоты. В настоящее время главным образом продукты на основе полиамида-4,6 производит и продает фирма DSM в Нидерландах под торговой маркой STANYL®.
Для синтеза ДАБ известен ряд химических способов. Такие химические способы страдают от такого недостатка, как то, что исходные материалы получают из источников, которые считают невозобновляемыми. Таким образом существует реальная необходимость в предоставлении новых и осуществимых способов синтеза ДАБ, основанных на использовании возобновляемых углеродных источников и использующих биохимические способы (также называемых "биотрансформацией").
Способ получения ДАБ, включающий в себя по меньшей мере одну ферментативную стадию, описан в РСТ заявках, опубликованных как в WO 2006/005603 и в WO 2006/00504. Оба документа описывают ферментативное получение ДАБ в микроорганизме, имеющем повышенный уровень орнитиндекарбоксилазной активности.
Настоящий способ относится к альтернативному способу получения ДАБ. Способ согласно настоящему изобретению включает в себя по меньшей мере одну биокаталитическую стадию, которая содержит биокаталитическое получение по меньшей мере одного N-защищенного предшественника ДАБ и последующее in vitro превращение N-защищенного предшественника в ДАБ.
Было показано, что выделение ДАБ после биокаталитического получения сопровождается значительными трудностями. В WO 2007/079944 описано выделение органического амина, например, ДАБ. В конкретном варианте осуществления, описанного в нем, концентрируют бесклеточную питательную среду, содержащую сульфатную или фосфатную соль амина (поэтому, например, DAB-дисульфат) и добавляют основание, например, аммиак. В зависимости от условий образуется двухслойная система. Из слоя, содержащего преимущественно органические соединения, может быть выделен нужный амин.
Подробное описание изобретения
Согласно одному из вариантов осуществления способ получения ДАБ включает в себя по меньшей мере одну биокаталитическую стадию и содержит стадии (а) биокаталитического получения N-защищенного предшественника ДАБ, приводящего к получению биокаталитической реакционной смеси, содержащей N-защищенный предшественник ДАБ, (b) выделения N-защищенного предшественника из биокаталитической реакционной смеси, (с) превращения N-защищенного предшественника в ДАБ.
Согласно конкретному варианту осуществления настоящее изобретение, относящееся к получению ДАБ включает в себя по меньшей мере одну биокаталитическую стадию, которая содержит биокаталитическое получение по меньшей мере одного N-защищенного предшественника ДАБ, выбранного из группы, состоящей из ^-защищенного орнитина, N-защищенного ДАБ и N-защищенного 4-аминобутиральдегида и последующей конверсии in vitro N-защищенного предшественника в ДАБ.
Что касается "превращения in vitro", то здесь это означает превращение N-защищенного предшественника ДАБ в ДАБ в среде, находящейся вне клетки. Превращение in vitro может быть превращением по меньшей мере под действием одного биокатализатора или может быть химическим превращением, включающим в себя по меньшей мере одну химическую стадию или могут комбинацией по меньшей мере одной биокаталитической и одной химической стадии.
Что касается "N-защищенного предшественника ДАБ", то здесь это обозначает соединение, содержащее защищенную аминогруппу и которое может быть превращено в ДАБ посредством по меньшей мере одной химической или биокаталитической реакции или комбинации биокаталитической и химической реакций.
Что касается "N5-защищенного орнитина", то здесь это обозначает молекулу орнитина, которая содержит защитную группу у его N5 атома; что касается "N-защищенного ДАБ", то здесь это обозначает молекулу ДАБ, которая содержит защитную группу у одной из ее аминогрупп; и что касается "N-защищенного 4-аминобутиральдегида", то здесь это обозначает молекулу 4-аминобутиральдегида, которая содержит защитную группу у аминогруппы.
Защитные группы, о которых выше шла речь, могут быть выбраны из группы, состоящей из ацильных групп, содержащих 1-6 атомов углерода или могут быть гуанидильной группой. Такую защитную группу следует выбирать так, чтобы была возможность осуществить по меньшей мере одно биокаталитическое превращение, легко выделить N-защищенный предшественник из биокаталитической реакционной смеси (например, из ферментационной питательной среды) и последующие биокаталитические и/или химические реакции, что в конечном итоге приводит к получению ДАБ.
N-защищенные предшественники ДАБ могут быть получены ацилированием, например, 4-аминобутиральдегида или орнитина. Например, ацилированием ангидридом уксусной кислоты в муравьиной кислоте для введения формильной защитной группы или реакцией ангидридов С2-С6карбоновых кислот или хлорангидридов для введения N-ацетильной, N-пропионильной, N-бутирильной, N-валерильной или N-капроильной защитной группы, соответственно.
Предшественниками, защищенными N-гуанидильной группой, являются, например, протеиногенный аргинин или N-гуанидиламинобутиральдегид или N-гуанидил-ДАБ. Описан ферментативный путь, например, в ЕР 1260588, который описывает биохимическое получение агматина из аргинина под действием аргининдекарбоксилазы. Агматин представляет собой N-гуанидил-защищенный ДАБ. Агматин (N-гуанидил-защищенный ДАБ) может быть легко депротектирован с образованием ДАБ путем кислотного гидролиза, например, кипячением агматина в концентрированном растворе минеральной кислоты, например, в водном концентрированном растворе хлористоводородной или серной кислоты. Это приводит к образованию дигидросоли ДАБ и побочных продуктов: диоксида углерода и аммиака (последний находится в форме его аммониевой соли с использованной минеральной кислотой). Для получения ДАБ в форме его свободного амина, следует выделить его дигидросоль, повторно растворить и нейтрализовать основанием.
В соответствии с последующим вариантом осуществления настоящее изобретение относится к способу получения ДАБ, согласно которому по меньшей мере образуется один N-защищенный предшественник ДАБ, причем данный N-защищенный предшественник выбран из группы, состоящей из N5-ацетилорнитина, N-ацетилДАБ и N-ацетил-4-аминобутиральдегида.
Согласно одному из конкретных вариантов осуществления способ получения ДАБ, включающий по меньшей мере одну биокаталитическую стадию, состоит из стадий: (а) биокаталитического получения N5-ацетилорнитина, приводящего к получению биокаталитической реакционной смеси, содержащей N5-ацетилорнитин, (b) выделения N5-ацетилорнитина из биокаталитической реакционной смеси и (с) превращения N5-ацетилорнитина в ДАБ.
Согласно одному из конкретных вариантов осуществления способ получения ДАБ, включающий по меньшей мере одну биокаталитическую стадию, состоит из стадий: (а) биокаталитического получения N5-ацетилДАБ, приводящего к биокаталитической реакционной смеси, содержащей N-ацетилДАБ, (b) выделения N-ацетилДАБ из биокаталитической реакционной смеси и (с) превращения N-ацетилДАБ в ДАБ.
Согласно одному из конкретных вариантов осуществления способ получения ДАБ, включающий по меньшей мере одну биокаталитическую стадию, состоит из стадий: (а) биокаталитического получения N-ацетил-4-аминобутиральдегида, приводящего к биокаталитической реакционной смеси, содержащей N-ацетил-4-аминобутиральдегид, (b) выделения N-ацетил-4-аминобутиральдегида из биокаталитической реакционной смеси и (с) превращения N-ацетил-4-аминобутиральдегида в ДАБ.
При ссылке на амин или N-защищенный амин в прямом или косвенном виде, например, N-защищенный ДАБ, имеется в виду, что эти термины означают нейтральную аминогруппу, соответствующий заряженный протонированный амин, а также его соли.
Определения
Термин "или", так, как он использован здесь, определяется как "и/или" за исключением особо указанных случаев.
Термин, используемый в единственном числе, определяется как "по меньшей мере один" за исключением особо указанных случаев.
Имеется в виду, что при ссылке на существительное (например, соединение, добавку и т.д.) в единственном числе, включено также и множественное число.
При ссылке на соединение, которое существует в виде стереоизомеров, такое соединение может представлять собой любой из этих стереоизомеров или являться их комбинацией. Таким образом, при ссылке на аминокислоту, существующую в виде энантиомеров, аминокислота может быть L-энантиомером или D-энантиомером или являться их комбинацией. В случае, когда существует природный стереоизомер, соединение предпочтительно является природным стереоизомером.
Когда упоминается фермент при ссылке на класс ферментов (ЕС) в скобках, класс ферментов представляет собой такой класс, в котором фермент классифицирован или может быть классифицирован согласно Номенклатуре Ферментов, предоставленной Комитетом по Номенклатуре Международного Союза по Биохимии и Молекулярной Биологии (NC-IUBMB), причем данная номенклатура может быть найдена в http://www.chem.qmul.ac.uk/iubmb/enzyme/. Имеется в виду, что включены и другие подходящие ферменты, которые пока не выделены в отдельный класс, но по существу могут быть классифицированы.
Термин "гомологичный" или "гомолог" или "ортолог" относится к родственным последовательностям, имеющим функциональную связь, и обычно определяется, исходя из степени идентичности последовательности. Эти термины могут описывать взаимосвязь, обнаруженную в генах одних видов, подвидов, разновидностей, сортов или штаммов и соответствующих или эквивалентных генов других видов, подвидов, разновидностей, сортов или штаммов. Они могут также описывать взаимосвязь между геном, найденным в природе и искусственно сконструированным геном или между двумя искусственно сконструированными генами. Функциональная взаимосвязь может проявляться одним из нескольких способов, включающих, но не ограничивающихся (а) степенью идентичности последовательности; (b) одной и той же или подобной биологической функцией. Предпочтительно, проявляются как (а), так и (b). Подразумевается также, что термин гомолог включает в себя последовательности нуклеиновых кислот (последовательности полинуклеотидов), которые отличаются от другой последовательности нуклеиновой кислоты из-за вырождаемости генетического кода и кодируют одну и ту же полипептидную последовательность.
Повсюду в тексте, где использован термин "гомолог" в применении к полипептиду, речь идет о полипептиде, имеющем ту же самую или подобную биологическую функцию и в определенной степени идентичную последовательность относительно стандартного полипептида. Конкретно речь идет об идентичности последовательности, соответствующей по меньшей мере 30%, предпочтительно по меньшей мере 40%, особенно предпочтительно по меньшей мере, 60%, особенно предпочтительно по меньшей мере, 65%, особенно предпочтительно по меньшей мере, 70%, особенно предпочтительно по меньшей мере, 75%, особенно предпочтительно по меньшей мере, 80%, конкретно по меньшей мере 85%, особенно предпочтительно, по меньшей мере, 90%, по меньшей, мере 91%, по меньшей мере, 92%, по меньшей мере, 93%, по меньшей мере, 94%>, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мер, 97%, 98% или по меньшей мере, 99%).
"Идентичность последовательности" или "сходство последовательности" здесь определяется как взаимосвязь между двумя или несколькими полипептидными последовательностями или двумя или несколькими последовательностями нуклеиновых кислот, определенная сравнением последовательностей. Обычно, проводят сравнение идентичности или сходства последовательностей по всей длине последовательностей, но можно также проводить сравнение только между частями последовательностей, выровненных друг с другом. В данной области техники "идентичность" или "сходство" также означает степень сходства последовательностей между полипептидными последовательностями или последовательностями нуклеиновых кислот, в зависимости от ситуации, что определяется совпадением между такими последовательностями.
Разработаны предпочтительные способы определения идентичности или сходства, дающие наибольшее соответствие между изученными последовательностями. В контексте настоящего изобретения способ предпочтительной компьютерной программы для определения идентичности и сходства между двумя последовательностями включает в себя BLASTP и BLASTN (Altschul, S. F. et al., J. Mol. Biol. 1990, 215, 403-410, открыто доступный из NCBI и других источников (BLAST Manual, Altschul, S., et al., NCBI NLM NIH Bethesda, MD 20894). Предпочтительными параметрами сравнения полипептидной последовательности при использовании BLASTP являются штраф за открытие пробела 10,0, штраф за последующий пробел 0,5, матрица Blosum 62. Предпочтительными параметрами сравнения последовательности нуклеиновых кислот при использовании BLASTP являются штраф за открытие пробела 10,0, штраф за последующий пробел 0,5, полная матрица ДНК (матрица тождественности ДНК).
Что касается "биотрансформации" или "биокаталитической реакции", то здесь это означает биохимическую реакцию, в которой в качестве катализатора используют фермент.Везде согласно настоящему изобретению, указывают, что когда используют биокатализатор, по меньшей мере, одна реакционная стадия в настоящем способе катализируется биологическим материалом или веществом, выделенным из биологического источника, например, из организма, или биомолекулой, выделенной из него. В частности, биотрансформация может быть ферментативной стадией. В частности, биокатализатор может содержать один или несколько ферментов. Биокатализатор может быть использован в любой форме. В конкретном варианте осуществления используют один или несколько ферментов, выделенных из природного окружения (выделенных из организма, в котором они образуются), например, в виде раствора, эмульсии, дисперсии, (суспензии) лиофилизованных клеток, в виде лизата или будучи иммобилизованными на подложке. В одном из вариантов осуществления один или несколько ферментов образуют часть живого организма (например, живых цельных клеток). Ферменты могут выполнять каталитическую функцию внутри клетки. Также возможно, чтобы фермент мог секретироваться в среду, где находятся клетки.
Что касается "биокаталитической реакционной смеси", то это означает здесь среду, в которой проходит биокаталитическая реакция. Это может быть клеточное окружение (для внутриклеточных или внеклеточных биокаталитических реакций) или бесклеточная среда.
Что касается "ферментативной стадии", то здесь это означает стадию способа, на которой образование или конверсия конкретного химического соединения происходит в одноклеточном организме, особенно предпочтительно в микроорганизме в культуре клеток. "Ферментативное получение" означает здесь получение химического соединения в микроорганизме, содержащем биокатализатор в культуре клеток, содержащей ферментируемый источник углерода, в котором углерод входит в состав любого из указанных соединений, которые могут превращаться в конкретное химическое соединение, которое может быть получено или в котором клетки содержат соединение для его превращения в конкретное химическое соединение, которое может быть получено из источника углерода. Микроорганизм может быть природным производителем конкретного химического соединения или он может приобрести способность продуцировать конкретное химическое соединение в результате трансформации геном, кодирующим по меньшей мере один подходящий фермент, используя технологии рекомбинантной ДНК. Природный производитель конкретного химического соединения может быть также трансформирован геном, кодирующим по меньшей мере один подходящий фермент, используя технологию рекомбинантной ДНК для того, чтобы увеличить продукцию нужного химического соединения и/или уменьшить продукцию компонентов, которые могут снизить продуктивность нужного химического соединения или помешать осуществлению дальнейших стадий способа согласно настоящему изобретению.
Предпочтительные микроорганизмы для ферментативного получения N-защищенного предшественника ДАБ могут иметь эукариотическое или прокариотическое происхождение. В частности, они могут быть выбраны из клеток животных (в том числе человека), растительных клеток, бактерий, архебактерий, дрожжей и грибов. Особенно предпочтительно, чтобы микроорганизмы могли быть выбраны из группы, состоящей из бактерий, например, Bacillus (в частности, В. subtilis), Brevibacterium (в частности, В. ketoglutamicum), коринебактерий (в частности,С.glutamicum), Escherichia (в частности, Е. coli), Klebsiella (в частности, К. pneumoniae), молочнокислых бактерий (в частности, L. lactis), пропионовых бактерий, псевдомонад (в частности, P. putida), Rodococcus (в частности, R. erythropolis, Streptomyces (в частности, S. coelicor и S. clavuligerus), дрожжей, например, Kluyveromyces (в частности, К. lactis), Penicillium (в частности, P. chrysogenum), Saccharomyces (в частности, S. cerevisiae), Aspergillus (в частности, A. niger), Pichia (в частности, P. pastoris), Hansenula, Schizosaccharomyces (в частности,& pombe), Yarowia (в частности,Y. lypolytica), грибов, например, Talaromyces.
В наиболее предпочтительном варианте осуществления ферментативное получение N-защищенного предшественника происходит в микроорганизме, в котором N-защищенный предшественник образуется in vivo. Предпочтительно, образование N-защищенного предшественника согласно настоящему изобретению представляет собой биотрансформацию в N-защищенный предшественник из любого подходящего источника углерода.
Источник углерода для способа ферментации может, в частности, содержать по меньшей мере одно соединение, выбранное из группы монофункциональных спиртов, полифункциональных спиртов, карбоновых кислот, диоксида углерода, жирных кислот, глицеридов, в том числе смесей, содержащих любые из указанных соединений. Подходящие монофункциональные спирты включают в себя метанол и этанол, подходящие полифункциональные спирты включают в себя глицерин и углеводы. Подходящие жирные кислоты или глицериды можно, в частности, получить в форме годного к употреблению в пищу масла, предпочтительно растительного масла.
В частности, можно использовать углеводы, поскольку углеводы обычно можно получить в больших количествах из биологически возобновляемых источников, например сельскохозяйственных продуктов, предпочтительно, сельскохозяйственных отходов. Предпочтительно используют углевод, выбранный из группы, состоящей из глюкозы, фруктозы, сахарозы, лактозы, сахарозы, крахмала, целлюлозы и гемицеллюлозы. Особенно предпочтительными являются глюкоза, олигосахариды, содержащие глюкозу, и полисахариды, содержащие глюкозу.
Кроме того, в качестве источника углерода могут быть использованы аминокислоты или их производные, глутамат или его производные и/или орнитин или его производные.
В качестве источника азота могут быть использованы неорганические азотсодержащие соединения, например, аммиак, соли аммония, мочевина, нитраты и нитриты или органические азотсодержащие соединения, например, аминокислоты или их производные, особенно предпочтительно, глутамат или его производные и/или орнитин или его производные.
Когда здесь ссылаются на биокатализатор, это может относиться к организму, экспрессирующему по меньшей мере один фермент, необходимый для биокаталитической функции, или это может относиться по меньшей мере к одному ферменту, полученному или выделенному из этого организма. Организм может иметь эукариотическое или прокариотическое происхождение. В частности, организм может быть выбран из животных (в том числе человека), растений, бактерий, архебактерий, дрожжей и грибов.
В одном из вариантов осуществления биокатализатор образуется в животных, в частности, в их частях, например, печени, поджелудочной железе, мозгу, почках, сердце или других органах. Животные могут, в частности, быть выбраны их группы млекопитающих, особенно предпочтительно, могут быть выбраны их группы приматов (например, Homo sapiens), Leporidae, Muridae, Suidae и Bovidae.
Подходящими растениями в качестве источника биокатализаторов могут являться растения, выбранные их группы Asplenium; Cucurbitaceae, в частности, Cucurbita, например, Cucurbita moschata (сквош), или Cucumis; Mercurialis, например, Mercurialis perennis; Hydnocarpus; и Ceratonia.
Подходящие бактерии в качестве источника биокатализаторов могут, в частности, быть выбраны их группы Acinetobacter, Agrobacterium, Alcaligenes, Bacillus, Brevibacterium, Clostridium, Corynebacterium, Deinococcus, Enterobacter, Enterococcus, Erwinia, Escherichia, Geobacillus, Klebsiella, Lactobacillus, Lactococcus, Legionella, Mycobacterium, Neisseria, Nitrosomonas, Novosphingobium, Paracoccus, Proteus, Pseudomonas, Ralstonia, Rhodobacter, Rhodopseudomonas, Salmonella, Shigella, Staphylococcus, Streptococcus, Streptomyces, Thermus, Vibrio и Zymomonas.
Подходящие архебактерий в качестве источника биокатализаторов могут, в частности, быть выбраны их группы Aeropyrum, Archaeoglobus, Halobacterium, Methanobacterium, Methanobrevibacter, Methanocaldococcus, Methanococcus, Methanopyrus, Methanosarcina, Methanosphaera, Pyrobaculum и Thermoplasma.
Подходящие грибы в качестве источника биокатализаторов могут, в частности, быть выбраны их группы Aspergillus, Neurospora, Penicillium, Rhizopus и Trichoderma.
Подходящие дрожжи в качестве источника биокатализаторов могут, в частности, быть выбраны их группы Candida, Cytophagia, Hansenula, Humicola, Kluyveromyces, Mucor, Rhizoctonia, Saccharomyces и Yarrowia.
Специалистам в данной области техники будет ясно, что могут быть использованы биокатализаторы, встречающиеся в природе (дикого типа), или мутанты биокатализаторов, встречающихся в природе, обладающие подходящей активностью в способе согласно настоящему изобретению. Свойства биокатализатора, встречающегося в природе, могут быть улучшены использованием биологических способов, известных специалистам в данной области техники, например, молекулярной эволюцией или рациональным дизайном. Мутанты биокатализаторов дикого типа могут, например, быть получены модификацией кодирующей ДНК в организме, способном действовать как биокатализатор или способном продуцировать биокаталитическое соединение (например, фермент), используя способы мутагенеза, известные специалистам в данной области техники (случайный мутагенез, сайт-направленный мутагенез, направленную эволюцию, рекомбинацию генов и т.д.). В частности, ДНК может быть модифицирована так, чтобы она кодировала фермент, который бы отличался от фермента дикого типа по меньшей мере на одну аминокислоту, так, чтобы она кодировала фермент, который бы отличался от фермента дикого типа наличием одного или нескольких замещений аминокислот, делеций и/или инсерций или так, чтобы мутант сочетал в себе последовательности двух или нескольких исходных ферментов или оказывал влияние на экспрессию подобным образом модифицированной ДНК в подходящей клетке (хозяине). Последнее может быть достигнуто способами, известными специалистам в данной области техники, например, оптимизацией кодона или оптимизацией пар кодонов, например, на основе способа, описанного в WO 2008/000632.
Мутантный биокатализатор может обладать улучшенными свойствами, например, в отношении одного или нескольких следующих аспектов: селективности к субстрату, активности, стабильности, устойчивости к действию растворителей, рН профилю, температурному профилю, субстратному профилю, чувствительности к ингибированию, использованию кофакторов и сродству к субстрату. Мутанты с улучшенными свойствами могут быть идентифицированы применением, например, подходящей высокой пропускной способностью скрининга или селекционных способов, основанных на способах, известных специалистам в данной области техники.
Когда ссылаются на биокатализатор, в частности, на фермент из конкретного источника, рекомбинантные биокатализаторы из конкретного источника, рекомбинантные биокатализаторы, в частности, ферменты, находящиеся в организме донора, но фактически образующиеся в организме хозяина (генетически модифицированном), обычно имеют в виду, что они включены как биокатализаторы, в частности, ферменты из первого организма.
Условия реакции для любой биокаталитической стадии в контексте настоящего изобретения могут быть выбраны в зависимости от известных характеристик данного биокатализатора, в частности, фермента, информации, представленной здесь и необязательно от некоторых обычных экспериментов.
Использованные значения рН реакционной среды, могут быть выбраны в широких пределах, определяемых активностью биокатализатора при этих значениях рН. Могут быть использованы щелочные, нейтральные или кислые условия в зависимости от биокатализатора и других факторов. В том случае, если способ включает в себя использование микроорганизма, например, для экспрессирования фермента, являющегося катализатором в данном способе изобретения, рН выбирают так, чтобы этот микроорганизм был способен выполнять свою запланированную функцию или функции. В частности, рН может находиться в пределах четырех единиц рН ниже нейтрального значения рН и двух единиц рН выше нейтрального значения рН, т.е. между рН 3 и рН 9 в случае преимущественно водной системы при 25°С. Систему считают водной, если вода является единственным растворителем или преобладающим растворителем (>50 масс.%, в частности >90 масс.% в расчете на общую массу жидкости), в котором, например, может быть растворено небольшое количество спирта или другого растворителя (<50 масс.%), в частности <10 масс % в расчете на общую массу жидкости) (например, в качестве источника углерода) в такой концентрации, чтобы присутствующий микроорганизм сохранял свою активность. В частности при использовании дрожжей и/или грибов предпочтительны кислые условия, в частности, рН может находиться в диапазоне от рН 3 до рН 8 в расчете на преимущественно водную среду при 25°С. При желании рН может быть изменен при использовании кислоты и/или основания или забуферен подходящей комбинацией кислоты и основания.
Условия инкубации могут быть выбраны в широких пределах, определяемых сохранением достаточной активности биокатализатора и/или ее ростом. Они включают в себя аэробные, микроаэробные условия, условия с ограниченным содержанием кислорода и анаэробные условия.
Анаэробные условия здесь определяются как условия в отсутствии кислорода или условия, в которых практически кислород не поглощается биокатализатором, в частности, микроорганизмом, и обычно соответствуют скорости поглощения кислорода, меньшей, чем 5 ммоль/л.час, в частности, скорости поглощения кислорода, меньшей, чем 2,5 ммоль/л.час. или меньшей, чем 1 ммоль/л.час.
Аэробные условия являются условиями, в которых достаточное количество кислорода для неограниченного роста растворено в среде, способной поддержать скорость поглощения кислорода при значении по меньшей мере равной 10 ммоль/л.час, особенно предпочтительно более чем 20 ммоль/л.час, еще более предпочтительно, более чем 50 ммоль/л.час, и наиболее предпочтительно, более чем 100 ммоль/л.час.
Условия с ограниченным содержанием кислорода определяют как условия, в которых поглощение кислорода ограничивается переносом кислорода из газовой фазы в жидкость. Нижний предел для условий с ограниченным содержанием кислорода определяют по нижнему пределу для анаэробных условий, т.е. обычно при скорости, равной по меньшей мере 1 ммоль/л.час, и, в частности, равной по меньшей мере 2,5 ммоль/л.час. или по меньшей мере 5 ммоль/л.час. Верхний предел для условий с ограниченным содержанием кислорода определяют по нижнему пределу для аэробных условий, т.е. при скорости, меньшей, чем 100 ммоль/л.час, меньшей, чем 50 ммоль/л.час, меньшей, чем 20 ммоль/л.час. или меньшей, чем 10 ммоль/л.час.
Вопрос о том, являются ли условия аэробными, анаэробными или условиями с ограниченным содержанием кислорода, зависит от условий, в которых проводится способ, в частности, от количества и состава входящего потока газа, реальных свойств перемешивания/массопереноса, характерных для используемого оборудования, типа используемого микроорганизма и плотности микроорганизма.
Используемая температура не является критической до тех пор, пока биокатализатор, в частности фермент, обладает достаточной активностью. Обычно, температура может быть равна по меньшей мере 0°С, в частности, по меньшей мере 15°С, особенно предпочтительно по меньшей мере 20°С. Нужная максимальная температура зависит от биокатализатора. Обычно, такая максимальная температура известна в данной области техники, например, указана в спецификации в случае коммерчески доступного биокатализатора или может быть определена по стандартной методике, исходя из обычных общих знаний и представленной здесь информации. Температура обычно равна 90°С или меньше, предпочтительно, 70°С или меньше, в частности, 50°С или меньше, особенно предпочтительно 40°С или меньше.
В частности, если биокаталитическая реакция происходит вне организма хозяина, реакционная среда, содержащая органический растворитель, может быть использована в высокой концентрации (например, в большей, чем 50%,или в большей, чем 90 масс.%), в случае, если используют фермент, который сохраняет достаточную активность в такой среде.
В предпочтительном варианте осуществления настоящее изобретение относится к биокаталитическому способу, в результате которого образуется N-защищенный предшественник ДАБ, N5-защищенный орнитин. Например, получение N5-ацетилорнитина может содержать одну или несколько следующих реакций, катализируемых ферментами:
1. глутамат в N-ацетилглутамат
2. N-ацетилглутамат в N-ацетилглутамат-5-фосфат
3. N-ацетилглутамат-5-фосфат в N-ацетилглутаматполуальдегид
4. N-ацетилглутаматполуальдегид в N -ацетилорнитин
5. N-ацетилорнитин в N-ацетилорнитин
Реакцию 1) можно катализировать ферментом, выбранным из группы ацилтрансфераз (ЕС 2.3.1), предпочтительно, из группы аминокислотных N-ацетилтрансфераз (ЕС 2.3.1.1). Предпочтительно, фермент должен быть специфичным к ацетил-КоА в качестве донора ацетильной группы и к глутамату в качестве акцептора ацетильной группы. Аминокислотная N-ацетилтрансфераза может быть получена из прокариот или эукариот. Типичные белки, которые могут катализировать реакцию 1) приведены в таблице 1 вместе с их номером доступа в базе данных Uniprot и их источником (микро)организмом.
Реакцию 2) можно катализировать ферментом, выбранным из группы ацетилглутаматкиназ (ЕС 2.7.2.8). Фермент может использовать АТФ в качестве кофактора. Ацетилглутаматкиназа может быть получена из прокариот или эукариот. Типичные белки, которые могут катализировать реакцию 2) приведены в таблице 1 вместе с их номером доступа в базе данных Uniprot и их источником (микро)организмом.
Реакцию 3) можно катализировать ферментом, выбранным из группы оксидоредуктаз (ЕС 1.2.1), предпочтительно из группы N-ацетил-гамма-глутамилфосфатредуктаз (ЕС 1.2.1.38). Этот фермент может использовать NADH или NADPH в качестве кофактора. N-ацетил-гамма-глутамилфосфатредуктаза может быть получена из прокариот или эукариот. Типичные белки, которые могут катализировать реакцию 3) приведены в таблице 1 вместе с их номером доступа в базе данных Uniprot и их источником (микро)организмом.
Реакцию 4) можно катализировать ферментом, выбранным из группы трансаминаз (ЕС 2.6.1), предпочтительно, из группы ацетилорнитинтрансаминаз (ЕС 2.6.1.11). Этот фермент может использовать глутамат в качестве донора аминогруппы. Ацетилорнитинтрансаминаза может быть получена из прокариот или эукариот.Типичные белки, которые могут катализировать реакцию 4) приведены в таблице 1 вместе с их номером доступа в базе данных Uniprot и их источником (микро)организмом.
Реакцию 5) можно катализировать N-ацилтрансферазой, например, глутамат-N-ацетилтрансферазой (ЕС 2.3.1.35).
Глутамат может быть получен из подходящего источника углерода в результате реакций биосинтеза глутамата, хорошо известных в данной области техники. Предпочтительно, используют микроорганизмы, аккумулирующие большое количество глутаминовой кислоты, например, Corynebacterium glutamicum. В данной области техники хорошо известны способы получения глутаминовой кислоты, например, генетической инженерией (Kimura Е., Adv Biochem Eng Biotechnol. 2003; 79:37-57).
Альтернативно, получение N5-ацетилорнитина может содержать одну или несколько следующих реакций, катализируемых ферментами:
6) глутамат в N-ацетилглутамат
7) N-ацетилглутамат плюс орнитин в N2-ацетилорнитин
8) N2-ацетилорнитин в N5-ацетилорнитин
Реакция 6) идентична реакции 1) и ее можно катализировать тем же самым типом ферментов.
Реакцию 7) можно катализировать ферментом, выбранным из группы ацилтрансфераз (ЕС 2.3.1), предпочтительно, глутамат-N-ацетилтрансфераз (ЕС 2.3.1.35). Предпочтительно, фермент использует орнитин в качестве акцептора ацетильной группы, благодаря чему образуется глутамат и N-ацетилорнитин в качестве продукта реакции. Глутамат-N-ацетилтрансферазы могут проявлять гидролитическую активность в отношении N-ацетилглутамата, образуя в качестве продуктов гидролиза глутамат и ацетат. Предпочтительно, используемый фермент не проявляет заметной гидролитической активности; альтернативно фермент дикого типа может быть модифицирован так, что его гидролитическая активность будет существенно ниже в сравнении с ферментом дикого типа. Глутамат-N-ацетилтрансфераза может быть получена из прокариот или эукариот. Типичные белки, которые могут катализировать реакцию 7) приведены в таблице 1 вместе с их номером доступа в базе данных Uniprot и их источником (микро)организмов.
Реакция 8) идентична реакции 5) и ее можно катализировать тем же самым ферментом.
В дополнительном предпочтительном варианте осуществления настоящее изобретение относится к биокаталитическому способу, в результате чего N-защищенный ДАБ образуется из N5-защищенного орнитина. Обычно, подходящая декарбоксилаза обладает декарбоксилазной активностью в отношении N5-защищенного орнитина и способна катализировать превращение N5-защищенного орнитина в N-защищенный ДАБ.
Фермент, способный декарбоксилировать N5-защищенный орнитин, может, в частности, быть выбран из группы декарбоксилаз (Е.С. 4.1.1), предпочтительно из группы орнитиндекарбоксилаз (ЕС 4.1.1.17), диаминопимелатдекарбоксилаз (ЕС 4.1.1.20), декарбоксилаз разветвленноцепных альфа-кетокислот (ЕС 4.1.1.72), декарбоксилаз альфа-кетоизовалерата, декарбоксилаз альфа-кетоглутарата (ЕС 4.1.1.71).
Одна или несколько подходящих декарбоксилаз может быть выбрана из группы оксалатдекарбоксилаз (ЕС 4.1.1.2), ацетоацетатдекарбоксилаз (ЕС 4.1.1.4), валиндекарбоксилаз/лейциндекарбоксилаз (ЕС 4.1.1.14), аспартат-1-декарбоксилаз (ЕС 4.1.1.11), 3-гидроксиглутаматдекарбоксилаз (ЕС 4.1.1.16), лизиндекарбоксилаз (ЕС 4.1.1.18), аргининдекарбоксилаз (ЕС 4.1.1.19), 2-оксоглутаратдекарбоксилаз (ЕС 4.1.1.71) и диаминобутиратдекарбоксилаз (ЕС 4.1.1.86).
Декарбоксилаза может, в частности, представлять собой декарбоксилазу в организме, выбранном из группы тыквенных; огурцов; дрожжей; грибов, например, Candida flareri, Hansenula sp., Kluyveromyces marxianus, Neurospora crassa, Rhizopus javanicus, и Saccharomyces cerevisiae; млекопитающих, в частности, из мозга млекопитающих; и бактерий, например, Bacillus cadaveris, Escherichia coli, Lactococcus lactis, Mycobacterium tuberculosis, Pseudomonas sp.и Zymomonas mobilis.
В дополнительном предпочтительном варианте осуществления настоящее изобретение относится к биокаталитическому способу, в результате которого N-защищенный ДАБ образуется из N-защищенного 4-аминобутиральдегида. Например, получение N-ацетилДАБ может содержать одну или несколько следующих реакций, катализируемых ферментами:
9. глутамат в 4-аминобутират
10. 4-аминобутират в N-ацетил-4-аминобутират
11. N-ацетил-4-аминобутират в N-ацетил-4-аминобутиральдегид
12. N-ацетил-4-аминобутиральдегид в N-ацетилДАБ
Реакцию 9) можно катализировать ферментом, выбранным из группы декарбоксилаз (ЕС 4.1.1), предпочтительно из группы глутаматдекарбоксилаз (ЕС 4.1.1.15). Глутаматдекарбоксилаза может быть получена из прокариотов или эукариотов или архебактерий.
Реакцию 10) можно катализировать ферментом, выбранным из группы ацилтрансфераз (ЕС 2.3.1), предпочтительно, из группы аминокислотных N-ацетилтрансфераз (ЕС 2.3.1.1), глицин-N-ацилтрансфераз (ЕС 2.3.1.13), аспартат-N-ацетилтрансфераз (ЕС 2.3.1.17), глутамат-N-ацетилтрансфераз (ЕС 2.3.1.35), D-аминокислотных N-ацетилтрансфераз (ЕС 2.3.1.36) и диамино-N-ацетилтрансфераз (ЕС 2.3.1.57). Предпочтительно, используемый фермент селективен к субстрату, 4-аминобутирату. Фермент дикого типа может иметь низкую активность/селективность к 4-аминобутирату в качестве акцептора аминогруппы. Такие ферменты дикого типа могут быть модифицированы так, что их активность/селективность к 4-аминобутирату становится значительно выше в сравнении с ферментами дикого типа. Используемый фермент может использовать ацетил-КоА в качестве донора ацетильной группы. Альтернативно фермент может также использовать N-ацетилированную аминокислоту в качестве донора ацетильной группы, например, N-ацетилглутамат.Фермент может быть получен из прокариот или эукариот или архебактерий.
Альтернативно, N-ацетил-4-аминобутират может быть превращен в N-ацетил-4-аминобутиральдегид в результате следующих реакций, катализируемых ферментами:
11а. N-ацетил-4-аминобутират в N-ацетил-4-аминобутират фосфат
11b. N-ацетил-4-аминобутират фосфат в N-ацетил-4-аминобутиральдегид
Реакцию 11а) можно катализировать ферментом, выбранным из группы фосфотрансфераз (ЕС 2.7.2), предпочтительно из группы ацетаткиназ (ЕС 2.7.2.1), аспартаткиназ (ЕС 2.7.2.4), бутираткиназ (ЕС 2.7.2.7), ацетилглутаматкиназ (2.7.2.8) и глутамат-5-киназ (2.7.2.11).
Реакцию 11b) можно катализировать ферментом, выбранным из группы оксидоредуктаз (ЕС 1.2.1), предпочтительно из группы N-ацетил-гамма-глутамилфосфатредуктаз (ЕС 1.2.1.38).
Типичные белки, которые могут катализировать реакционную стадию 9) через реакцию 11) приведены в таблице 2 вместе с их номером доступа в базе данных Uniprot и их источником (микро)организмом.
Реакция 12) относится к биокаталитическому способу, в результате которого N-защищенный ДАБ образуется из N-защищенного 4-аминобутиральдегида.
Обычно соответствующая аминотрансфераза обладает аминотрансферазной активностью по отношению к N-защищенному 4-аминобутиральдегиду, проявляя способность катализировать превращение N-защищенного 4-аминобутиральдегида в N-защищенный ДАБ.
Аминотрансфераза может, в частности, быть выбрана из группы аспартатаминотрансфераз, омега-аминотрансферазы (ЕС 2.6.1), аминотрансферазы класса III (ЕС 2.6.1), 4-аминобутиратаминотрансфераз (ЕС 2.6.1.19), L-лизин-6-аминотрансферазы (ЕС 2.6.1.36), 5-аминовалератаминотрансфераз (ЕС 2.6.1.48), лизин:пируват-6-аминотрансфераз (ЕС 2.6.1.71) и путресцинаминотрансферазы (ЕС 2.6.1.82).
В одном из вариантов осуществления аминотрансфераза может быть выбрана из группы аланинаминотрансфераз (ЕС 2.6.1.2), лейцинаминотрансфераз (ЕС 2.6.1.6), аминотрансфераз аланин-оксикислот (ЕС 2.6.1.12), β-аланинпируватаминотрансфераз (ЕС 2.6.1.18), (S)-3-амино-2-метилпропионатных аминотрансфераз (ЕС 2.6.1.22), L,L-диаминопимелатных аминотрансфераз (ЕС 2.6.1.83).
Аминотрансфераза может в частности быть выбрана из аминотрансфераз из млекопитающих, растений или микроорганизмов. Особенно предпочтительно, аминотрансфераза может быть выделена из Asplenium, особенно предпочтительно, Asplenium unilaterale или Asplenium septentrionale, Bacillus, в частности, Bacillus weihenstephanensis, Bacillus cereus и Bacillus subtilis, Ceratonia, особенно предпочтительно, Ceratonia siliqua, Enterobacter, Erwinia, особенно предпочтительно, E. carotovora, Escherichia, особенно предпочтительно E.coli, Legionella, Mercurialis, в частности, Mercurialis perennis, особенно предпочтительно, из всходов Mercurialis perennis, Neisseria, Nitrosomonas, Pseudomonas, в частности, Pseudomonas aeruginosa, Rhodobacter, в частности, Rhodobacter sphaeroides, Rhodopseudomonas, Salmonella, особенно предпочтительно, S. typhi, S. paratyphi, Shigella, особенно предпочтительно, 57 г.boydii, Sh. flexneri, S. sonnei, Staphylococcus, в частности, Staphylococcus aureus, Vibrio, в частности, Vibrio fluvialis, или дрожжей, в частности, Saccharomyces cerevisiae.
В случае если фермент выделяют их млекопитающих, он может, в частности, быть выделен из почки млекопитающих, печени млекопитающих, из сердца млекопитающих или мозга млекопитающих. Например, подходящий фермент может быть выбран из группы, содержащей 4-аминобутиратаминотрансферазу из печени млекопитающих, в частности, 4-аминобутиратаминотрансферазу из печени свиньи; 4-аминобутиратаминотрансферазу из мозга млекопитающих, в частности, 4-аминобутиратаминотрансферазу из мозга человека, свиньи или крысы; омега-аминотрансферазу Vibrio fluvialis, 4-аминобутиратаминотрансферазу из Е. coli и 5-аминовалератаминотрансферазу из Clostridium, в частности, из Clostridium aminovalericum.
В частности, аминодонор может быть выбран из группы, содержащей аммиак, аммонийные ионы, амины и аминокислоты. Соответствующие амины являются первичные амины и вторичные амины. Аминокислота может иметь D- или L-конфигурацию. Примерами аминодоноров являются аланин, глутамат, изопропиламин, 2-аминобутан, 2-аминогептан, фенилметанамин, 1-фенил-1-аминоэтан, глутамин, тирозин, фенилаланин, аспартат, альфа-аминоизобутират, бета-аланин, 4-аминобутират и альфа-аминоадипат.
В дополнительном предпочтительном варианте осуществления способ получения N-защищенного ДАБ содержит биокаталитическую реакцию, протекающую в присутствии фермента, способного катализировать реакцию восстановительного аминирования в присутствии источника аммония, выбранного из группы оксидоредуктаз, действующих на CH-NH2 группу доноров (ЕС 1.4), в частности, из группы аминокислотных дегидрогеназ (Е.С.1.4.1). Обычно, подходящая аминокислотная дегидрогеназа имеет 6-дегидрогеназную активность в отношении 6-аминокапроновой кислоты, катализируя превращение N-защищенного 4-аминобутиральдегида в N-защищенный ДАБ. В частности, подходящая аминокислотная дегидрогеназа может быть выбрана из группы диаминопимелатных дегидрогеназ (ЕС 1.4.1.16), лизин-6-дегидрогеназ (ЕС 1.4.1.18), глутаматдегидрогеназ (ЕС 1.4.1.3; ЕС 1.4.1.4) и лейциндегидрогеназ (ЕС 1.4.1.9).
В одном из вариантов осуществления аминокислотная дегидрогеназа может быть выбрана из аминокислотных дегидрогеназ, классифицированных как глутаматдегидрогеназы, действующих вместе с NAD или NADP в качестве акцепторов (ЕС 1.4.1.3), глутаматдегидрогеназ, действующих вместе с NADP в качестве акцептора (ЕС 1.4.1.4), лейциндегидрогеназ (ЕС 1.4.1.9), диаминопимелатных дегидрогеназ (ЕС 1.4.1.16) и лизин-6-дегидрогеназ (ЕС 1.4.1.18).
Аминокислотная дегидрогеназа может в частности быть получена из организмов, выбранных из группы Corynebacterium, в частности, Corynebacterium glutamicum; Proteus, в частности, Proteus vulgaris; Agrobacterium, в частности, Agrobacterium tumefaciens; Geobacillus, в частности, Geobacillus stearothermophilus; Acinetobacter, в частности, Acinetobacter sp.ADP1; Ralstonia, в частности, Ralstonia solanacearum; Salmonella, в частности, Salmonella typhimurium; Saccharomyces, в частности, Saccharomyces cerevisiae; Brevibacterium, в частности, Brevibacterium flavum; и Bacillus, в частности, Bacillus sphaericus, Bacillus cereus или Bacillus subtilis. Например, подходящая аминокислотная дегидрогеназа может быть выделена из диаминопимелатных дегидрогеназ из Bacillus, в частности, Bacillus sphaericus; диаминопимелатных дегидрогеназ из Brevibacterium sp.; диаминопимелатных дегидрогеназ из Corynebacterium, в частности, диаминопимелатных дегидрогеназ из Corynebacterium glutamicum; диаминопимелатных дегидрогеназ из Proteus, в частности, диаминопимелатных дегидрогеназ из Proteus vulgaris; лизин-6-дегидрогеназ из Agrobacterium, в частности, Agrobacterium tumefaciens, лизин-6-дегидрогеназ из Geobacillus, в частности, из Geobacillus stear other mophilus; глутаматдегидрогеназ, действующих с NADH или NADPH в качестве кофактора (ЕС 1.4.1.3) из Acinetobacter, в частности, глутаматдегидрогеназ из Acinetobacter sp.ADP1; глутаматдегидрогеназ (ЕС 1.4.1.3) из Ralstonia, в частности, глутаматдегидрогеназ из Ralstonia solanacearum; глутаматдегидрогеназ, действующих вместе с NADPH в качестве кофакторов (ЕС 1.4.1.4) из Salmonella, в частности, глутаматдегидрогеназ из Salmonella typhimurium; глутаматдегидрогеназ (ЕС 1.4.1.4) из Saccharomyces, в частности, глутаматдегидрогеназ из Saccharomyces cerevisiae; глутаматдегидрогеназ (ЕС 1.4.1.4) из Brevibacterium, в частности, глутаматдегидрогеназ из Brevibacterium flavum и лейциндегидрогеназ из Bacillus, в частности, лейциндегидрогеназ из Bacillus cereus или Bacillus subtilis.
Биокаталитический фермент может быть использован в любой форме. Например, биокаталитический фермент может быть использован, например, в форме дисперсии, эмульсии, раствора или в иммобилизованной форме (например, нанесенным на подложку, например, дисперсный или монолитный материал) - в виде неочищенного фермента, в виде коммерчески доступного фермента, в виде фермента, дополнительно очищенного из коммерчески доступного препарата, в виде фермента, полученного из его источника комбинацией известных способов очистки, в составе цельных клеток (необязательно пермеабилизированных и/или иммобилизованных), которые естественным путем или благодаря генетической модификации обладают гидролитической активностью, или в лизатах клеток, обладающих такой активностью.
Биокаталитический фермент может быть получен или выделен из любого организма, в частности, из животных, растений, бактерий, плесневых грибов, дрожжей или грибов.
Даже рядовому специалисту в данной области техники будет ясно, что мутанты встречающихся в природе ферментов (дикого типа) с биокаталитической активностью могут найти применение в способе согласно настоящему изобретению. Например, мутанты ферментов дикого типа могут быть получены модификацией ДНК, кодирующей ферменты дикого типа, при использовании способов мутагенеза, известных специалистам в данной области техники (случайный мутагенез, сайт-направленный мутагенез, направленная эволюции, перетасовкой генов и т.д.), так, чтобы ДНК кодировала фермент, который отличается по меньшей мере одной аминокислотой от фермента дикого типа или так, чтобы она кодировала фермент, который был бы короче по сравнению с ферментом дикого типа и осуществляла экспрессию модифицированной таким образом ДНК в подходящей клетке (хозяине). Мутанты биокаталитического фермента могут иметь улучшенные свойства, например, в отношении одного или нескольких аспектов: селективности к субстрату, активности, стабильности, устойчивости к действию растворителей, рН профилю, температурному профилю, субстратному профилю.
Когда ссылаются на фермент из конкретного источника, рекомбинантные ферменты, полученные из первого организма, но фактически образующиеся во втором (генетически модифицированном) организме, как правило имеют в виду, что они включаются как ферменты из этого первого организма.
Клетка, в частности, рекомбинантная клетка, содержащая один или несколько ферментов для катализа на одной или нескольких реакционных стадиях в способе настоящего изобретения, может быть сконструирована при использовании способов молекулярной биологии, которые известны в данной области per se (Maniatis et al. 1982 "Molecular cloning: a laboratory manual". Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.; Miller 1972 "Experiments in molecular genetics", Cold Spring Harbor Laboratory, Cold Spring Harbor; Sambrook and Russell 2001 "Molecular cloning: a laboratory manual" (3rd edition), Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press; F. Ausubel et al, eds., "Current protocols in molecular biology", Green Publishing and Wiley Interscience, New York 1987). Например, если один или несколько биокатализаторов образуются в рекомбинантной клетке (которая может быть гетерологической системой), такие способы могут быть использованы для создания вектора (например, рекомбинантного вектора), который содержит один или несколько генов, кодирующих один или несколько указанных биокатализаторов. Может быть использован один или несколько векторов, каждый из которых содержит один или несколько таких генов. Такой вектор может содержать один или несколько регуляторных элементов, например, один или несколько промоторов, которые могут быть функционально связаны с геном, кодирующим биокатализатор.
Так, как используют здесь, термин "функционально связанный" относится к связи полинуклеотидных элементов (или кодирующих последовательностей или последовательностей нуклеиновых кислот) в функциональной взаимосвязи. Последовательность нуклеиновых кислот является "функционально связанной", когда она находится в функциональной взаимосвязи с другой последовательностью нуклеиновых кислот. Например, промотор или энхансер функционально связан с кодирующей последовательностью, если это влияет на транскрипцию кодирующей последовательности.
Так, как используют здесь, термин "промотор" относится к фрагменту нуклеиновой кислоты, который выполняет функцию контроля за транскрипцией одного или нескольких генов, расположенных выше участка инициации транскрипции гена по ходу транскрипции, и структурно идентифицируется наличием связывающего сайта для ДНК-зависимой РНК полимеразы, сайтов инициации транскрипции и других последовательностей ДНК, включающих, но не ограниченных сайтами связывания транскрипционных факторов, сайтами связывания репрессорных и активаторных белков и любыми другими последовательностями нуклеотидов, известными специалистам в данной области техники, для прямого или косвенного влияния на регуляцию степени транскрипции с данного промотора. "Конститутивный" промотор представляет собой промотор, активный в большинстве условий, связанных с окружающей средой и с индивидуальным развитием организма. "Индуцируемый" промотор представляет собой промотор, активный при определенной регуляции связанной с окружающей средой или стадией развития. Термин "гомологический", когда его используют для обозначения связи между данной (рекомбинантной) нуклеиновой кислотой или полипептидной молекулой и данным организмом хозяина или клеткой хозяина, обозначает, что в природе нуклеиновая кислота или полипептидная молекула образуются в клетке хозяина или в организме хозяина того же вида, предпочтительно, той же разновидности или штамма.
Промотор, который может быть использован для достижения экспрессии последовательностей нуклеиновой кислоты, кодирующих фермент, для применения в данном способе изобретения, в частности, аминотрансферазы, аминокислотной дегидрогеназы или декарбоксилазы, например, вышеописанных здесь, может быть нативным в отношении последовательности нуклеиновой кислоты, кодирующей экспрессируемый фермент, или может быть гетерологическим в отношении последовательности нуклеиновой кислоты (кодирующей последовательности), с которой она функционально связана. Предпочтительно, промотор является гомологическим, т.е. эндогенным в отношении клетки хозяина.
Если используют гетерологический промотор (в отношении к последовательности нуклеиновой кислоты, кодирующей интересующий нас фермент), то гетерологический промотор предпочтительно способен продуцировать более высокий стационарный уровень транскрипта, содержащего кодирующую последовательность (или способную продуцировать большее количество молекул транскрипта, т.е. молекул мРНК в единицу времени) в сравнении с промотором, который является нативным в отношении кодирующей последовательности. В этом контексте подходящие промоторы включают в себя как конститутивный, так и индуцируемый природные промоторы, а также сконструированные промоторы, которые хорошо известны специалистам в данной области техники.
"Сильный конститутивный промотор" представляет собой промотор, который способствует инициированию мРНК при высокой частоте в сравнении с нативной клеткой хозяином. Примеры таких сильных конститутивных промоторов в грамположительных микроорганизмах включают в себя SP01-26, SP01-15, veg, рус (промотор пируваткарбоксилазы) и атуЕ.
Примеры индуцируемых промоторов в грамположительных микроорганизмах включают в себя индуцируемый IPTG Pspac промотор, индуцируемый ксилозой PxylA промотор.
Примеры конститутивных и индуцируемых промоторов в грамположительных микроорганизмах включают в себя, но не ограничены tac, tet, trp-tet, Ipp, lac, Ipp-lac, laclq, T7, T5, T3, gal, trc, ara (PBAD), SP6, λ-PR, и λ-PL.
Промоторы для клеток (мицелиальных) грибов известны в данной области техники и могут быть, например, gpdA промоторами глюкозо-6-фосфатдегидрогеназы, промоторами протеазы, например, рерА, рерВ, рерС, gla промоторами глюкоамилазы, амилазы amyА, amyВ промоторами, промоторами каталазы catR или catA, промотором глюкоз оксидазы goxC, промотором бета-галактозидазы lacA, aglA промотором альфа-глюкозидазы, tefA промотором фактора элонгации трансляции, промоторами ксиланазы, например, xlnA, xlnB, xlnC, xlnD, промоторами целлюлазы, например, eglA, eglB, cbhA, промоторами регуляторов транскрипции, например, areA, creA, xlnR, расС, prtT или другими промоторами и могут быть найдены в числе других на вебсайте NCBI (http://www.ncbi.nlm.nih.gov/entrez/)
Термин "гетерологический", используемый в отношении нуклеиновой кислоты (ДНК или РНК) или белка относится к нуклеиновой кислоте или белку, которые не встречаются в природе как часть организма, клетки, генома или последовательности ДНК или РНК, в которой они находятся или которые находятся в клетке или локализации или локализациях в геноме или последовательности ДНК или РНК, которая отличается от той, которая находится в природе. Гетерологические нуклеиновые кислоты или белки не являются эндогенными в отношении клетки, в которую они внедрены, но получены из другой клетки, или синтетическим или рекомбинантным путем. Обычно, хотя и необязательно, такие нуклеиновые кислоты кодируют белки, которые обычно не продуцируются клеткой, в которой ДНК транскрибируется или экспрессируется. Аналогично экзогенная РНК кодирует белки, обычно не экспрессируемые в клетке, в которой находится экзогенная РНК. Гетерологические нуклеиновые кислоты или белки можно также рассматривать как чужеродные нуклеиновые кислоты или белки. Любая нуклеиновая кислота или белок, которую специалист в данной области техники может рассматривать как гетерологический или чужеродный по отношению к клетке, в которой он экспрессируется, здесь описывается термином гетерологическая нуклеиновая кислота или белок.
Способ согласно настоящему изобретению может быть осуществлен в организме хозяина, который может быть новым.
Соответственно, данное изобретение также относится к клетке-хозяину, содержащей один или несколько ферментов, способных катализировать по меньшей мере одну реакционную стадию в способе данного изобретения.
В конкретном варианте осуществления клетка-хозяин согласно настоящему изобретению представляет собой рекомбинантную клетку, содержащую последовательность нуклеиновой кислоты, кодирующую фермент, способный катализировать реакцию трансаминирования или восстановительного аминирования с образованием N2-защищенного орнитина из N-защищенного глутаматполуальдегида или кодировать фермент, способный катализировать N-ацилтрансферазную реакцию с образованием N5-защищенного орнитина из N2-защищенного орнитина или кодировать фермент, способный катализировать аминотрансферазную реакцию с образованием N-защищенного ДАБ из N-защищенного 4-аминобутиральдегида. Указанная последовательность может служить частью вектора или может быть внедрена в хромосомную ДНК.
Выделение N-защищенного предшественника ДАБ
Перед превращением N-защищенного предшественника в ДАБ, N-защищенный предшественник следует выделить из биокаталитической реакционной смеси.
Выделение N-защищенного предшественника из биокаталитической реакционной смеси может быть проведено способами, известными в данной области техники, для выделения подобных химических соединений из биокаталитической реакционной смеси. В частности, при использовании ферментативного способа получения, например, способ выделения может включать по меньшей мере одну стадию, выбранную из группы, состоящей из клеточного разделения (фильтрации, мембранного разделения (MF), седиментации (как гравитационной, так и центрифугальной), кристаллизации для удаления клеток. Для экономически благоприятной очистки может потребоваться дополнительное концентрирование и очистка N-защищенного предшественника. Для дополнительного концентрирования могут быть использованы такие способы, как упаривание и мембранное разделение (RO, NF и UF). Также может быть использован такой способ, как (эвтектическое) концентрирование замораживанием.
Может быть необходимо дополнительное выделение либо при помощи ионообменной хроматографии, либо кристаллизации/осаждения.
Этот способ необязательно приведет к полной очистке N-защищенного предшественника, но N-защищенный предшественник должен быть очищен по меньшей мере до такой степени, чтобы последующее превращение N-защищенного предшественника в ДАБ не было значительно затруднено из-за наличия примесей и побочных продуктов, образующихся в биокаталитической реакционной смеси. Необязательно N-защищенный предшественник также может быть подвергнут концентрированию.
Более того, N-защищенный предшественник может быть перенесен в среду, которая оптимизирована для проведения по меньшей мере одной последующей стадии. Превращение N-защищенного предшественника ДАБ в ДАБ
Прямое или косвенное превращение N-защищенного предшественника в ДАБ согласно настоящему изобретению может включать в себя по меньшей мере одну биокаталитическую (в частности, ферментативную) или химическую стадию превращения. Оно также может включать в себя комбинацию биокаталитической и химической стадий превращения.
Например, превращение биокаталитически полученного N- защищенного ДАБ в незащищенный ДАБ может быть проведено в результате биокаталитического или химического гидролитического процесса. Для биокаталитического процесса могут быть использованы соответствующие гидролазы. В предпочтительном способе настоящего изобретения проводят биокатализ деацилирования. В частности может быть использован гидролитический фермент, способный катализировать деацилирование N-Ac-ДАБ, особенно предпочтительно способный катализировать деацилирование N-ацетилДАБ.
Когда N-ацетилДАБ превращается в ДАБ либо химическим, либо биокаталитическим гидролизом, это обычно приводит к образованию как ДАБ, так и ацетата. После выделения ДАБ фракцию, содержащую ацетат, предпочтительно используют повторно в данном способе. В случае проведения ферментативного способа ацетат может быть повторно использован в качестве источника углерода для выращивания микроорганизма, или, в качестве источника углерода для получения N-защищенного ДАБ или соединения, которое может быть превращено в N-защищенный ДАБ при использовании ферментативного способа.
Термин "гидролитический фермент» используют здесь применительно к ферментам из классификационной группы Е.С.3. Предпочтительно один или несколько использованных гидролитических ферментов выбраны из группы гидролаз сложных эфиров карбоновых кислот (Е.С. 3.1.1), гидролаз тиоловых эфиров (Е.С. 3.1.2) и пептидаз (Е.С. 3.4).
В частности может быть использована пептидаза (Е.С. 3.4). Предпочтительными пептидазами являются пептидазы, выбранные из группы карбоксипептидаз серинового типа (Е.С. 3.4.16), металлокарбоксипептидаз (Е.С. 3.4.17), карбоксипептидаз цистеинового типа (Е.С. 3.4.18), сериновых эндопептидаз (Е.С. 3.4.21), цистеиновых эндопептидаз (Е.С. 3.4.22), аспарагиновых эндопептидаз (Е.С. 3.4.23) и металлоэндопептидаз (Е.С. 3.4.24), в частности, сериновых эндопептидаз (Е.С. 3.4.21). В частности хорошие результаты получены с сериновой эндопептидазой, предпочтительно, субтилизином (Е.С.3.4.21.62), например, субтилизина Карлсберга.
Примерами организмов, из которых могут быть получены гидролитические ферменты, включают в себя Trichoderma sp, например, из Trichoderma reesei; Rhizopus sp., например, из Rhizopus oryzae; Bacillus sp, например, из Baccillus licheniformis, Bacillus subtilis, Bacillus amyloliquefaciens, Bacillus clausii, Bacillus lentus, Bacillus alkalophilus, Bacillus halodurans; Aspergillus sp., например, из Aspergillus oryzae или Aspergillus niger; Streptomyces sp., например, из caespitosus Streptomyces или Streptomyces griseus; Candida sp.; из грибов; Humicola sp; Rhizoctonia sp.; Cytophagia; Mucor sp.; и тканей животных, в частности, из поджелудочной железы, например, из свиной поджелудочной железы, бычьей поджелудочной железы или овечьей поджелудочной железы.
Как было указано выше, предпочтительным ферментом является субтилизин. В данной области известны различные субтилизины, смотри, например, US 5,316,935 и цитированные в нем ссылки. Субтилизин А является коммерчески доступным субтилизином из Novozymes. Особенно предпочтительным является субтилизин Карлсберга. Было показано, что Alcalase® является особенно подходящим для использования в способе настоящего изобретения. Этот продукт предоставлен Novozymes (Bagsvaerd, Denmark). Alcalase® является дешевой и доступной в промышленных масштабах смесью протеолитических ферментов, которая производится Bacillus licheniformis (содержащей в качестве основного ферментативного компонента, субтилизин Карлсберга). Эксперименты с очищенным субтилизином подтверждают, что субтилизин катализирует переэтерификацию, активацию и образование пептидной связи.
Novozymes (Bagsvaerd, Denmark) предлагает озозим, лигуаназу, Alcalase®, Alcalase-ultra® (в частности, эффективную при щелочных рН), дурамил, эсперазу, канназу, савиназу, савиназу ультра, термамил, термамил ультра, новобат, поларзим, ньютразу, новолин, пиразу, новокор (бактериальные щелочные протеазы).
Протеиназа-К предоставлена New England Biolabs, Ipswich (MA), USA).
Novo Nordisk Biochem North America Inc (Franklinton NC, USA) предлагает Протеазу Bacillus species (Esperase 6.0 T; Savinase 6.0 T), Протеазу Bacillus subtilis (Neutrase 1.5 MG), Протеазу Bacillus licheniformis (Alcalase 3.0 T).
Amano International Enzyme Co (Troy, Va, USA) предлагает Протеазу Bacillus subtilis (Proleather; Protease N) и Протеазу Aspergillus oryzae (Прозим 6).
Соответствующими примерами ферментов этого класса являются, например, липаза Rhizopus japonicus, липаза АР-6 Aspergillus niger, липаза QL Alcaligenes sp, протеаза В Bacillus amyloliquefaciens (SEQ ID NO 19), Делволаза Bacillus licheniformis (SEQ ID NO 20), Rhizopus oryzae липаза, эспераза, алькалаза, ацилаза Aspergillus species, Прозим, Протеаза М, Протеаза N. Гидролазу предпочтительно выбирают из группы гидролаз, активных по отношению к сложноэфирным связям (липазы, эстеразы) (ЕС 3.1), пептидных гидролаз, активных по отношению к пептидным связям, (пептидаз, протеиназ) (ЕС 3.4) и гидролаз, активных по отношению к C-N связям, отличным от пептидных связей (ЕС 3.5).
В частности гидролазы, активные по отношению к C-N связям, отличным от пептидных связей, могут быть выбраны из группы гидролаз эфиров карбоновых кислот (ЕС 3.1.1) и амидаз, активных по отношению к линейным амидам (ЕС 3.5.1), особенно из группы аминоамидаз, более предпочтительно, из группы аминоамилаз из Mycobacterium, более предпочтительно, из группы аминоамидаз из Mycobacterium neoaurum.
Химический гидролиз N-защищенного ДАБ может включать способ, известный в данной области, для проведения подобных реакций. Соответствующий способ включает в себя деацилирование реагентом (РhO)3РСl2, полученным in situ титрованием раствора трифенилфосфата хлором. Этот способ широко описан Saggiari et al. (Organic Letters (2004), 6 (22), pp. 3885-3888.
Превращение N5-защищенного орнитина в незащищенный ДАБ может происходить как правило, во-первых, путем декарбоксилирования N5-защищенного орнитина в защищенный ДАБ и последующего гидролиза N-защищенного ДАБ с образованием незащищенного ДАБ, как это было описано ранее.
Для специфического декарбоксилирования N5-защищенного орнитина с образованием N-защищенного ДАБ следует использовать подходящий биокатализатор, например, обладающий лиазной активностью. Соответствующие ферменты с лиазной активностью относятся к классу ЕС 4. Особенно предпочтительно использовать углерод-углеродные лиазы (ЕС 4.1), например, карбоксилазы (ЕС 4.1.1), представленные орнитиндекарбоксилазой (SpeC) Escherichia coli (ЕС 4.1.1.17), декарбоксилазой разветвленных альфа-кетокислот (KdcA; SEQ ID 8) и декарбоксилазой альфа-кетоизовалерата (KivD; SEQ ID 10) Lactococcus lactis и лизиндекарбоксилазой (LysA; SEQ ID 12) Eschericia coli.
Альтернативно, первое упомянутое специфическое декарбоксилирование N5-защищенного орнитина может быть проведено химическим превращением, известным в данной области техники для подобных химических соединений. С этой целью соответствующие реакции химического декарбоксилирования могут быть проведены нагреванием соединения в высококипящем растворителе, например, дифенилметане, необязательно в присутствии каталитического количества органического пероксида или могут быть проведены нагреванием соединения с одним или несколькими эквивалентами кетона или альдегида.
Последующий гидролиз N-защищенного ДАБ может быть проведен биокаталитическим или химическим способом, как это описано выше для биокаталитически полученного N-защищенного ДАБ.
В качестве альтернативы вышеописанного двухстадийного превращения может быть использован одностадийный способ получения ДАБ из N5-защищенного орнитина. Этот способ может протекать либо путем начального деацилирования N5-защищенного орнитина и последующего декарбоксилирования, либо путем начального декарбоксилирования N5-защищенного орнитина и последующего деацилирования в соответствии со способами, известными в данной области техники для подобных соединений. Декарбоксилирование может быть проведено подобно тому, как описано выше. Деацилирование может быть проведено способом, описанным выше для N-защищенного ДАБ.
Превращение N-защищенного 4-аминобутиральдегида в незащищенный ДАБ может происходить при специфическом замещении кислорода альдегидной группы на аминогруппу, вследствие чего происходит образование N-защищенного ДАБ и при последующем снятии защиты с последнего. Для первого превращения следует использовать соответствующий биокатализатор, например, фермент с трансферазной активностью (ЕС 2), как описано выше. Соответствующие ферменты с трансферазной активностью для данной конкретной цели представлены трансферазами, переносящими азотсодержащие группы (ЕС 2.6), особенно предпочтительно, аминотрансферазами (трансаминазы) (ЕС 2.6.1), еще более предпочтительно 4-аминобутиратаминотрансферазой из печени млекопитающих, особенно предпочтительно, 4-аминобутиратаминотрансферазой из печени свиньи; 4-аминобутиратаминотрансферазой из мозга млекопитающих, особенно предпочтительно, 4-аминобутиратаминотрансферазой из мозга человека, свиньи или крысы; омега-аминотрансферазой Vibrio fluvialis, 4-аминобутиратаминотрансферазой из Е. coli и 5-аминовалератаминотрансферазой из Clostridium, особенно предпочтительно, из Clostridium aminovalericum, ортнитинтрансаминазой (ЕС 2.6.1.11), L-аланин-3-оксопропионатаминотрансферазой (ЕС 2.6.2.18) и путресцинаминотрансферазой, например, Shigella или Salmonella Особенно подходящими аминотрансферазами являются, например, омега-аминотрансфераза Vibrio fluvialis (SEQ ID 5) или аминотрансферазы Pseudomonas aeruginosa (gi9946143 (SEQ ID 1) или gi9951072 (SEQ ID 3)), Paracoccus denitrifwans (ZP 00628577; SEQ ID 14), Bacillus weihenstephanensis (ZP 01186960 (SEQ ID 16)).
Другие подходящие биокатализаторы для превращения N-защищенного 4-аминобутиральдегида в незащищенный ДАБ представляют собой ферменты, оксидоредуктазы (ЕС 1), особенно предпочтительно, оксидоредуктазы, оказывающие действие на CH-NH2 группы (ЕС 1.4) или CH-NH группы (ЕС 1.5) доноров, и особенно предпочтительно, ферменты классов ЕС 1.4.1, 1.4.3 (предпочтительно 1.4.3.4) и 1.4.99.
Альтернативно, первое превращение N-защищенного 4-аминобутиральдегида может быть проведено химической конверсией, известной в данной области техники, для подобных химических веществ. Подходящие для этих целей химические реакции могут быть проведены восстановительным аминированием N-защищенного 4-аминобутиральдегида согласно способам, известным в данной области техники, для подобных соединений (смотри, например, DE 4322065). Подобным способом является, например, реакция с аммиаком и водородом над гетерогенным катализатором (например, RaNi, Ni/SiO2 и/или Al2O3, Ru/C, Rh/C) или гомогенным катализатором (например, гомогенным катализатором Rh).
Последующий гидролиз N-защищенного ДАБ может быть проведен биокаталитическим или химическим способом, как было описано выше для биокаталитически полученного N-защищенного ДАБ.
Описание фигур
Фиг.1. ТСХ образца в конечный момент времени биотрансформации N-Ac-орнитина в N-Ac-ДАБ. 1. Глутамат DC; 2) Аспартат DC; 3) LysA; 4) KdcA; 5) KivD; 6) Kgd; 7) Лизин DC; 8) ODC LJ110; 9) ODC DH5α; 10) Контроль без фермента; 11) Контроль без химического соединения; 12) Образец сравнения N-Ac-орнитина; 13) Образец сравнения N-Ac-ДАБ; 14) Образец сравнения N-Ac-Ornithine & N-Ac-DAB.
Примеры
Общие способы
Молекулярные и генетические методики
Стандартные генетические и молекулярнобиологические методики обычно известны в данной области техники и описаны ранее (Maniatis et al. 1982 "Molecular cloning: a laboratory manual". Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.; Miller 1972 "Experiments in molecular genetics", Cold Spring Harbor Laboratory, Cold Spring Harbor; Sambrook and Russell 2001 "Molecular cloning: a laboratory manual" (3rd edition), Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press; F. Ausubel et al., eds., "Current protocols in molecular biology", Green Publishing and Wiley Interscience, New York 1987).
Плазмиды и Штаммы
pBAD/Myc-His С получен от Invitrogen (Carlsbad, СА, USA). Плазмиду pBAD/Myc-His-DEST, сконструированную, как описано в WO 2005/068643, используют для экспрессии белка. Е. coli ТОР10 (Invitrogen, Carlsbad, С A, USA) используют для всех процедур клонирования и для экспрессии всех целевых генов.
Среда
LB среду (10 г/л триптона, 5 г/л экстракта дрожжей, 5 г/л NaCl) используют для выращивания Е. coli. Антибиотики (50 мкг/мл карбеницилина) добавляют для сохранения плазмид. Для индукции экспрессии гена под контролем промотора Pbad в производных плазмиды pBAD/Myc-His-DEST плазмидов, добавляют L-арабинозу до конечной концентрации, равной 0,2% (масса/объем).
Получение аминоамидазы М. пеоаигит
Аминоамидаза была получена в результате роста штамма АТСС 25795 Mycobacterium пеоаигит в следующих условиях. Один литр среды Mycomed, содержащей 4,8 г/л нитрилотриуксусной кислоты (NTA), 4 г/л мочевины, 6 г/л глюкозы, 20 г/л дрожжевого углеродного материала (YCB от Difco), 1,55 г/л К2НРО4 и 0,85 г/л NaH2PO4. рН воды доводят до 7 и засевают исходной культурой штамма АТСС 2579 Mycobacterium пеоаигит, выращенной в среде глицерина. Прекультуру встряхивают на шейкере New Brunswick Scientific G53 (150 об/мин, амплитуда 4 см) при 37°С в течение 168 часов. Когда оптическая плотность (D620 нм) достигает значения 3.45, используют 500 мл прекультуры для засевания 9 л среды Mycomed. Экспрессию амидазы индуцируют NTA, присутствующей в среде Mycomed. Выращиваемую культуру перемешивают при 375-750 об/мин и скорости аэрации в диапазоне 0,5-2 л/мин. рН поддерживают постоянным при значении, равном 7, добавлением Н3РО4 и NaOH. Температура культивации равна 37°С. После 44 часов культивации в культуру добавляют 10 г/л YCB. После 68 часов культивации в культуру добавляют 10 г/л глюкозы. Через 94 часов культивации культуру собирают центрифугированием при 12,000 g в течение 10 минут. Осадки клеток промывают в 20 мМ HEPES/NaOH буфера, рН 7 и далее лиофилизируют для хранения. Идентификация плазмид
Плазмиды, несущие различные гены, идентифицируют генетическими, биохимическими и/или фенотипическими способами, обычно известными в данной области техники, например, устойчивостью трансформантов к действию антибиотиков, диагностическому PCR анализу трансформированной клетки или очищенной плазмидной ДНК, рестрикционному анализу очищенной плазмидной ДНК или анализом ДНК последовательности.
Клонирование целевых генов
Дизайн конструкций для экспрессии
Сайты attB добавляют до сайта связывания рибосом и инициирующего кодона и после терминирующего трансляцию кодона для облегчения клонирования с использованием технологии Gateway (Invitrogen, Carlsbad, СА, USA).
Синтез гена и конструирование плазмид
Синтетические гены были получены от DNA2.0 и оптимизированы по кодам для экспрессии в Е. coli в соответствии со стандартными процедурами DNA2.0. Гены аминотрансферазы из Vibrio fluvialis JS17 [SEQ ID No. 5] и Bacillus weihenstephanensis KBAB4 [SEQ ID No.16], кодирующие аминокислотные последовательности V. fluvialis JS17 омега-аминотрансферазы [SEQ ID No.6] и В. weihenstephanensis KBAB4 аминотрансферазы (ZP 01186960) [SEQ ID No.17], соответственно, были оптимизированы по кодона и итоговые последовательности [SEQ ID NO:7] и [SEQ ID NO:8] были получены путем синтеза ДНК.
Конструкции генов клонируют в pBAD/Myc-His-DEST экспрессионные векторы, используя Gateway технологию (Invitrogen) с помощью введенных сайтов attB и pDONR201 (Invitrogen) в качестве исходного вектора, как описано в протоколах производителя (www.invitrogen.com). Таким образом получены экспрессионные векторы pBAD-Vfl_AT и pBAD-Bwe_AT, соответственно. Соответствующие экспрессионные штаммы получают трансформацией химически компетентного Е. coli ТОР10 (Invitrogen) соответствующими pBAD-экспрессионными векторами.
Аналогично, экспрессионный вектор получают с геном аминотрансферазы из Paracoccus denitrificans [SEQ ID No 14], кодирующей аминокислотную последовательность SEQ ID No 15.
Клонирование при помощи PCR
Гены аминотрансферазы амплифицируют из геномной ДНК при помощи PCR, используя PCR Supermix High Fidelity (Invitrogen) в соответствии с техническими характеристиками производителя, используя праймеры, перечисленные в таблице 3.
Реакции PCR анализируют при помощи электрофореза в агарозном геле и продукты PCR надлежащего размера элюируют из геля с использованием набора реактивов QIA для быстрой очистки продуктов PCR (Qiagen, Hilden, Germany). Очищенные продукты PCR клонируют в pBAD/Myc-His-DEST экспрессионные векторы, используя Gatewey технологию (Invitrogen) по введенным attB сайтам и используя pDONR-zeo (Invitrogen) в качестве исходного вектора, как описано в протоколах производителя. Последовательность генов, клонированных путем PCR, подтверждают секвенированием ДНК. Таким образом получают экспрессионные векторы pBAD-Рaе-_gi9946143_AT, pBAD-Pae_gi9951072_AT and pBAD-Pde_AT_ZP00628577. Соответствующие экспрессионные штаммы получают трансформацией химически компетентного Е. coli ТОР10 (Invitrogen) с соответствующими pBAD-экспрессионными конструкциями.
Выращивание Е. coli для экспрессии белка
Мелкомасштабное выращивание проводят в 96-луночных планшетах с глубокими лунками, содержащими 940 мкл среды, содержащей 0,02% (масса/объем) L-арабинозы. Инокуляцию проводят перенесением клеток из замороженной исходной культуры при помощи 96-луночного штампа (Kiihner, Birsfelden, Switzerland). Планшеты инкубируют на орбитальном встряхивателе (300 об/мин, амплитуда 5 см) при 25°С в течение 48 час. Обычно достигают D620HM, равной 2-4.
Получение клеточных лизатов Приготовление лизирующего буфера
Лизирующий буфер содержит ингредиенты, представленные в таблице 4.
Раствор готовят непосредственно перед употреблением.
Получение экстракта, не содержащего клеток, с помощью лизиса Клетки, полученные мелкомасштабным выращиванием (смотри предыдущий параграф) выделяют центрифугированием и супернатант удаляют. Клеточную массу, образующуюся при центрифугировании, замораживают при -20°С в течение по меньшей мере 16 час и затем размораживают на льду. 500 мкл свежеприготовленного буфера для лизиса добавляют в каждую лунку и клетки ресуспендируют интенсивным встряхиванием планшета в течение 2-5 минут. Для успешного лизиса планшет инкубируют при комнатной температуре в течение 30 минут. Для удаления клеточного дебриса, планшет центрифугируют при 4°С и 6000 g в течение 20 минут. Супернатант переносят на новый планшет и хранят на льду до последующего использования.
Получение экстракта, не содержащего клеток, с помощью ультразвука Клетки, полученные среднемасштабным выращиванием (смотри предыдущий параграф) собирали центрифугированием и супернатант удаляли. 1 мл буфера на основе фосфата калия, рН7, добавляют к 0,5 г влажного клеточного осадка и клетки ресуспендируют интенсивным перемешиванием. Для успешного лизиса клетки подвергают действию ультразвука в течение 20 минут. Для удаления клеточного дебриса, лизаты центрифугируют при 4°С и 6000 g в течение 20 минут. Супернатант переносят на новый планшет и хранят на льду до последующего использования.
Биоконверсия N-ацетил-4-аминобутиральдегида в N-ацетил-ДАБ
Условия скрининга
Все ферменты суспендируют в 100 мМ буфере на основе фосфата калия, рН 7,5 до конечного объема, равного 100 мкл. Ферментативные реакции начинают добавлением 150 мкл исходного раствора, содержащего донор аминогруппы (L-аланин или (S)-альфа-метилбензиламин) и кофактор (PLP). Конечные концентрации в реакционной смеси на 250 мкл равны: N-ацетил-аминобутанал (70 мМ), донор аминогруппы (140 мМ), PLP (12,5 мМ). Два донора аминогруппы испытывают отдельно. Реакционные смеси инкубируют в течение ночи (16,5 и 16 часов) при 28°С, встряхивая при 560 об/мин на орбитальном встряхивателе IKA. После инкубации реакционные смеси блокируют и разбавляют добавлением 750 мкл 60% ацетонитрила, разбавленного 0,2% муравьиной кислотой. Микротитровальные планшеты центрифугируют при 3500 об/мин в течение 20 минут. Анализ проводят при помощи ЖХ-МС анализа (смотри Resolve Job 2009-02-00649).
Аналитические способы
В общей сложности при помощи ЖХ-МС анализа было проанализировано 148 образцов с использованием аналитического способа, описанного в работе 2009-01-00306. Предел чувствительности; линейный участок: для донора аминогруппы L-аланина 0 мкмоль/л-550 мкмоль/л и для донора аминогруппы (S)-альфа-метилбензиламина 0 мкмоль/л-280 мкмоль/л.
Результаты биоконверсии М-ацетил-4-аминобутираальдегида в N-ацетилДАБ
В общей сложности проведен скрининг 148 образцов для определения способа превращения >1-ацетил-4-аминобутиральдегида в N-ацетил ДАБ. Степень превращения всех образцов определяют при помощи ЖХ-МС анализа. Степень превращения рассчитывают, исходя из данных по образованию N-ацетилДАБ. В общей сложности при использовании L-аланина в качестве донора аминогруппы было обнаружено 31 активных аминотрансфераз (>2% конверсии). 20 из них также являются положительными при использовании (S)-α-метилбензиламина в качестве донора аминогруппы. Пять из этих аминотрансфераз приведены в таблице 5.
Таблица 5
Аминотрансферазы, демонстрирующие >2%-ную степень конверсии при биопревращении N-ацетил-4-аминобутиральдегида в N-ацетил-ДАБ.
Биопревращение N-АцетилДАБ в ДАБ. Условия скрининга
Все ферменты суспендируют в 100 мМ буфере на основе фосфата калия, рН 7,5 до конечного объема, равного 100 мкл. Ферментативные реакции начинают добавлением 150 мкл буфера, содержащего 13,33 мг/мл N-ацетил-ДАБ НСl в 100 мМ буфере на основе фосфата калия (конечная реакционная концентрация равна 8 мг/мл ≈48 мМ N-ацетил-ДАБ). Реакционные смеси инкубируют в течение ночи при 37°С, встряхивая при 460 об/мин на IKA орбитальном встряхивателе. После инкубации реакционные смеси блокируют и разбавляют добавлением 750 мкл 100 мМ НСЮ4 в Н2О, рН 1,0. Микротитровальные планшеты центрифугируют при 3500 об/мин в течение 20 минут и анализируют на наличие ДАБ при помощи HPLC-PCR-FL анализа, как описано ниже.
Способ ВЭЖХ-МС анализа для определения ДАБ
Приготовление образков:
Для разбавления образцов используют смеси ацетонитрила и воды с 0,2% муравьиной кислотой. Процентное содержание ацетонитрила составляет по меньшей мере 50%.
В использованных условиях ДАБ элюируется за 6,3 минуты
Результаты биоконверсии N-ацетилДАБ в ДАБ
Отбор испытанных ферментов, которые проявляют гидролитическую активность при биоконверсии N-ацетилДАБ в ДАБ, продемонстрирован в таблице 6. Некоторые из этих ферментов также охарактеризованы своими последовательностями, приведенными в этой патентной заявке.
Заключение
Показано, что большое количество гидролитических ферментов используют в качестве биокатализаторов для превращения N-ацетил-ДАБ в ДАБ.
Предшественники N-защищенного ДАБ с другими ацил-защитными группами могут быть получены, например, ацилированием, например, 4-аминобутиральдегида или орнитина. Например, ацилированием уксусным ангидридом в муравьиной кислоте для введения формильной защитной группы или реакцией ангидрида С2-С6карбоновых кислот или ацилхлорида для введения N-ацетильной, N-пропионильной, N-бутирильной, N-валерильной или N-капроильной защитной группы, соответственно.
Предполагается, что такие предшественники N-защищенных ДАБ, как, например, N-формил ДАБ и высшие гомологи с С3-С6 ацильными защитными группами, могут быть аналогично превращены в ДАБ при помощи вышеописанных ферментов.
Биоконверсия N5-ацетилорнитина в N-ацетилДАБ
Культивация клеток и экспрессия
Биоконверсию проводят с использованием декарбоксилаз. Большая часть декарбоксилаз экспрессируется в E.coli в стандартных условиях.
Прекультуры получают инокуляцией 5 мл среды LBcarb с Е. coli Тор 10, содержащего pBAD-DEST_lysA, pBAD-DEST_kdcA, pBAD-DESTkivD или pBAD-DEST_kgd из исходных глицериновых стоков. Прекультуры инкубируют в течение ночи при 28°С. 0,5 мл каждой прекультуры разбавляют в 50 мл среды LBcarb. Культуры инкубируют при 28°С до достижения D600, равной 0,6 (в среднем через 3-4 часа). Экспрессию белка индуцируют добавлением арабинозы до конечной концентрации, равной 0,02%. После ночной инкубации при 28°С клетки собирают (10 мин, 5000 об/мин, 4°С). Для анализа электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) по 1 мл образца отбирают перед индукцией, через 3 часа после индукции и ночью. Клетки осаждают центрифугированием (5 мин, 13,000 об/мин) и осадок хранят при -20°С.
Две орнитиндекарбоксилазы pBAD2_ODC E.coli DH5a/LJ110 выращивают и экспрессируют в несколько отличных условиях. В этом случае основную культуру выращивают до D620, равной 1,5 перед стимулированием 50 мкМ IPTG. Все остальные условия остаются теми же, что и описанные выше.
Получение образцов, не содержащих клеток (CFE) под действием ультразвукового излучения
Осадки клеток размораживают во льду и ресуспендируют в 2 объемах 50 мМ калий-фосфатного (KPi) буфера при рН 7,5. Суспензии клеток подвергают действию ультразвукового излучения в течение 10 минут с периодическими импульсами в течение 10 секунд. После действия ультразвукового излучения клеточный дебрис отделяют центрифугированием (20 мин, 13,200 об/мин, 4°С). Используют анализ электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) для определения уровней экспрессии и образцы, не содержащие клеток (CFE), хранят при -20°С.
MgC12
Все реакции превращения N-Ac-орнитина в N-Ac-ДАБ проводят при перемешивании и инкубации при 37°С. Образцы отбирают в момент времени: 0; 2; 18; 28 и 44 часов и хранят при -20°С. Для анализа 500 мкл каждого образца добавляют к 500 мкл ацетонитрила и центрифугируют при максимальной скорости в течение 10 минут. Образцы анализируют ТСХ и элюируют смесью аммиак: метанол (1:1) и проявляют спреем нингидрина. Для количественного анализа определяют содержание образцов при помощи ЖХ-МС-МС (LC MS-MS) в соответствии с нижеописанным способом.
Способ анализа ВЭЖХ-МС для определения N-ацетил-ДАБ
Приготовление образков:
Для разбавления образца используют смесь ацетонитрила и воды с 0,2% муравьиной кислотой. Процентное содержание ацетонитрила составляет по меньшей мере 50%.
Эксперименты проводят при использовании РЕ SCIEX API2000 ЖХ-МС/МС от Applied Biosystems.
В использованных условиях N-Ac-ДАБ элюируется за 4,2 минуты.
Результаты биоконверсии N5-ацетил-орнитина в N-Ацетил-ДАБ
Для превращения орнитина в ДАБ образцы, полученные в момент завершения реакции (44 час.), анализируют ТСХ (фигура 1).
Все образцы, полученные в момент завершения реакции, анализируют при помощи ЖХ-МС-МС (LC MS-MS). Те из них, которые характеризуются величиной, являющейся по меньшей мере на 3 микромоля более высокой по сравнении с уровнем контрольных образцов представлены в таблице 8.

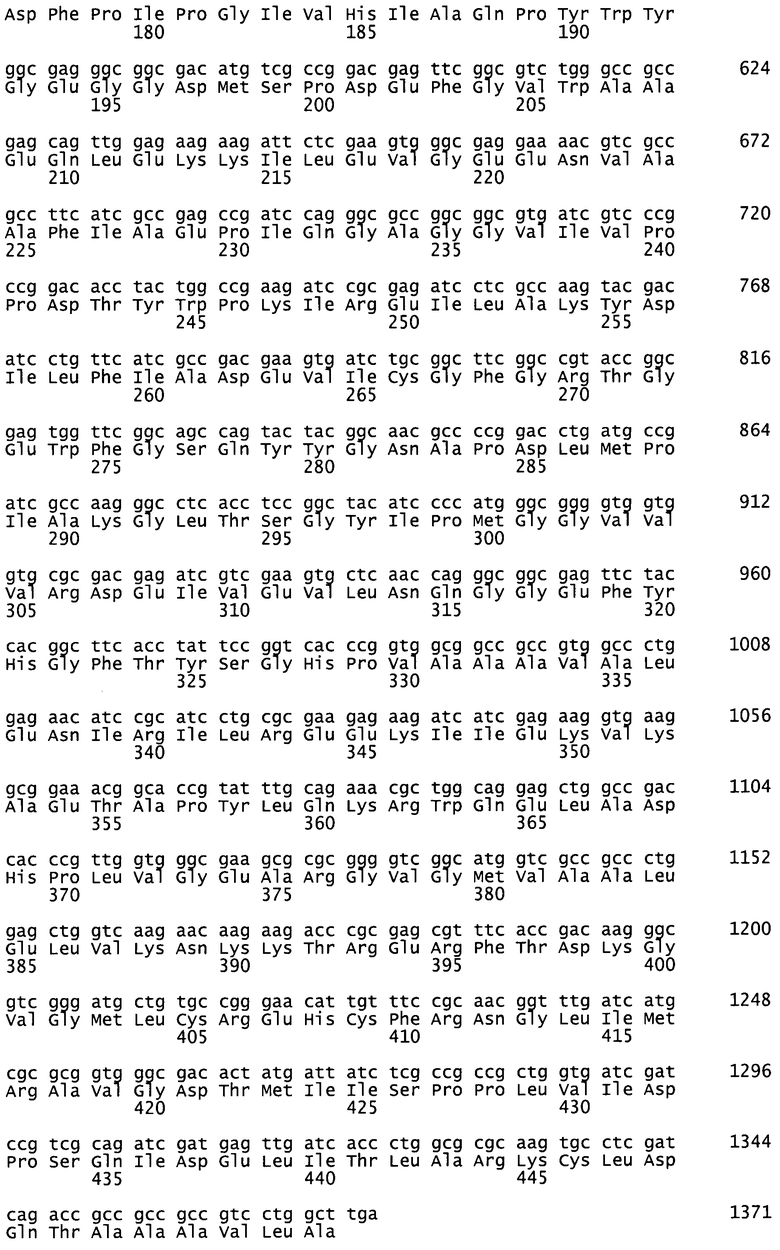






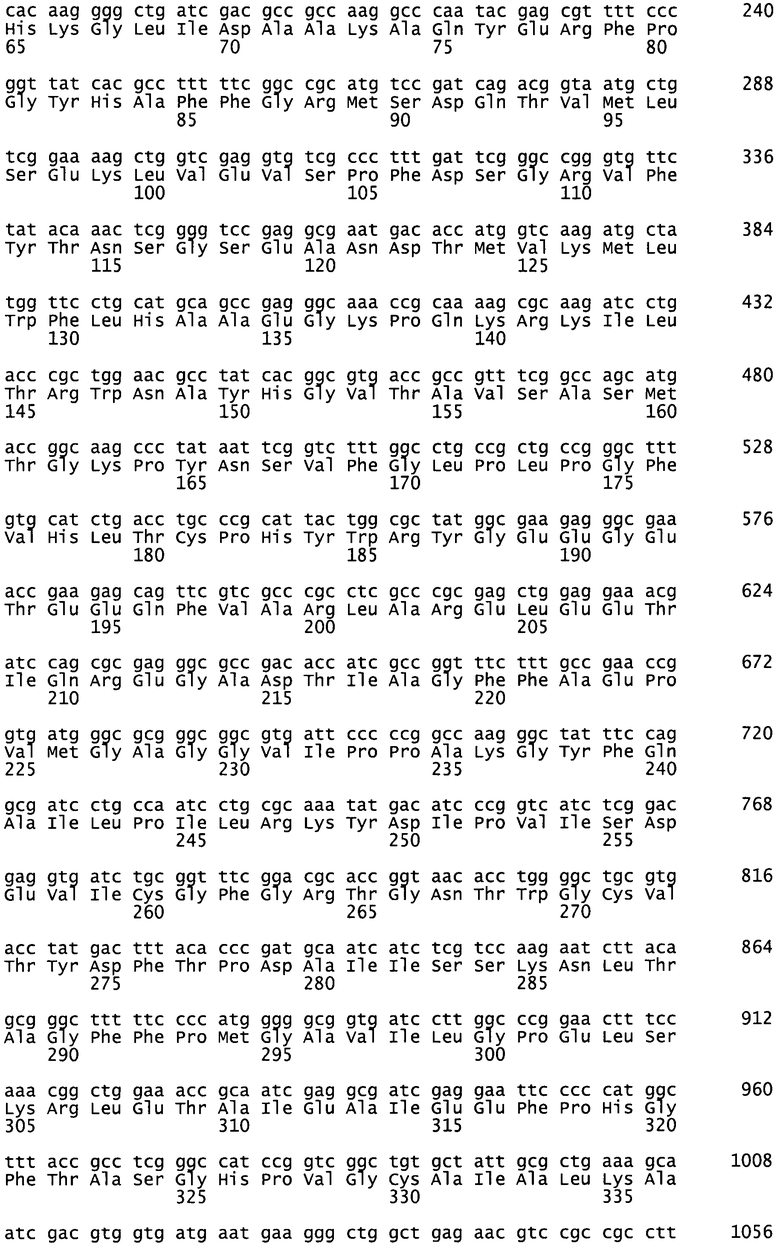
















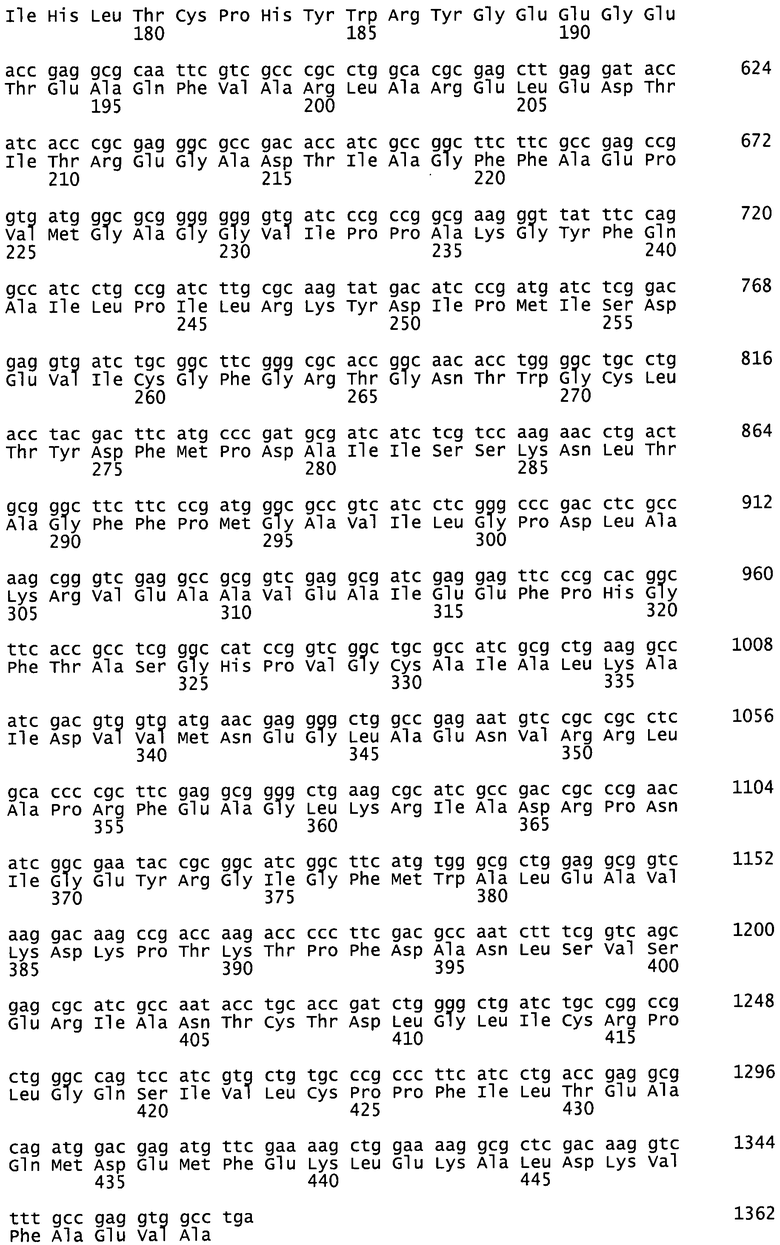














Изобретение относится к способу получения 1,4-диаминобутана (ДАБ). Способ предусматривает по меньшей мере одну биокаталитическую стадию, содержащую биокаталитическое получение N-ацетилДАБ, с последующим превращением in vitro N-защищенного предшественника в ДАБ. N-ацетилДАБ получают из N5-ацетилорнитина с помощью декарбоксилазы или N-ацетил-4-аминобутиральдегида с помощью аминотрансферазы. Превращение in vitro N-защищенного предшественника в ДАБ происходит с помощью биокаталитического или химического процесса гидролиза. Изобретение обеспечивает получение ДАБ из возобновляемых углеродных источников. 8 з.п. ф-лы, 1 ил., 8 табл.

1. Способ получения 1,4-диаминобутана [ДАБ], включающий в себя по меньшей мере одну биокаталитическую стадию, содержащую биокаталитическое получение N-ацетилДАБ из N5-ацетилорнитина с помощью декарбоксилазы или N-ацетил-4-аминобутиральдегида с помощью аминотрансферазы, и последующее превращение in vitro N-защищенного предшественника в ДАБ, где превращение in vitro N-защищенного предшественника в ДАБ происходит с помощью биокаталитического или химического процесса гидролиза.
2. Способ по п.1, в котором биокаталитическая стадия протекает в одноклеточном организме.
3. Способ по п.2, в котором биокаталитическая стадия протекает в клетке-хозяине, выбранной из группы, состоящей из бактерий, архебактерий, дрожжей и грибов.
4. Способ по любому из пп.1-3, в котором N-защищенный ДАБ превращается в ДАБ по действием гидролитического фермента.
5. Способ по п.4, в котором гидролитический фермент выбран из группы, состоящей из гидролаз эфиров карбоновых кислот, гидролаз тиоловых эфиров, липаз и пептидаз, в частности, из липаз и пептидаз.
6. Способ по п.4, в котором гидролитическим ферментом является пептидаза, выбранная из группы карбоксипептидаз серинового типа, металлокарбоксипептидаз, карбоксипептидаз цистеинового типа, сериновых эндопептидаз, цистеиновых эндопептидаз, аспарагиновых эндопептидаз и металлоэндопептидаз, в частности из сериновых эндопептидаз.
7. Способ по п.6, в котором сериновой эндопептидазой является субтилизин, предпочтительно субтилизин Карлсберга.
8. Способ по любому из пп.1-7, включающий стадии
а) биокаталитического получения N-ацетилДАБ, приводящего к биокаталитической реакционной смеси, содержащей N-ацетилДАБ,
b) выделения N-ацетилДАБ из биокаталитической реакционной смеси,
c) превращения N-ацетилДАБ в ДАБ.
9. Способ по п.8, в котором выделение N-ацетилДАБ из биокаталитической реакционной смеси проводят по меньшей мере в одну стадию, выбранной из группы, состоящей из фильтрования, седиментации, кристаллизации, аффинной хроматографии, разделительной хроматографии, мембранного разделения и упаривания.
| WO 2006005604 A, 19.01.2006 | |||
| JP 04349890 A, 04.12.1992 | |||
| JP 56151494 A, 24.11.1981 | |||
| Композиция для гидрофобной отделки целлюлозусодержащих текстильных материалов | 1977 |
|
SU726240A1 |
| Устройство для автоматического регулирования действий приборов, в частности топок | 1927 |
|
SU10179A1 |
Авторы
Даты
2016-03-20—Публикация
2010-07-20—Подача