Изобретение относится к медицине, в частности к онкогинекологии, гематологии, генетике, и может быть использовано для выделения групп высокого онкологического риска, для прогнозирования риска возникновения злокачественных новообразований шейки и тела матки, яичников, молочных желез.
Теоретической предпосылкой для выбора объема и методов комплексного обследования женщин и прогнозирования риска возникновения злокачественных новообразований шейки и тела матки, яичников и молочных желез стала информация о том, что для нормального функционирования органов репродуктивной системы необходим ряд условий: иммунологическая состоятельность, адекватный гемостаз, хорошее кровоснабжение матки, яичников и молочных желез и отсутствие тканевой гипоксии (Сухих Г.Т., Ванько Л.В., Кулаков В.И. Иммунитет и генитальный герпес. Издательство НГМА Нижний Новгород - Москва, 1997. - 221 с.).
Наследственные нарушения соединительной ткани (ННСТ) (Оганов Р.Г. Проект рекомендаций по наследственным нарушениям соединительной ткани. М., 2013. - 29 с. ), характеризуются нарушениями стромально-мышечного или сосудистого компонента, очагами дезорганизации соединительной ткани со снижением ее васкуляризации, интерстициальным склерозом, лимфогистиоцитарным инфильтратом стромы и накоплением коллагена III типа (Col III) и IV типа (Col IV) (Кан Н.Е., Тютюнник В.Л., Кесова М.И, Демура Т.А., Сергунина О.А., Тютюнник Н.В. Морфологические и иммуногистохимические особенности миометрия при недифференцированной дисплазии соединительной ткани как основа развития акушерских осложнений. Акушерство и гинекология. №10 - 2013. С. 28-32).
Нарушение кровотока и ишемия в репродуктивных органах наряду с развитием оксидативного стресса активируют локальный воспалительный процесс и возникновение эндотелиальной дисфункции (Мурашко Л.Е., Файзуллин Л.З., Мурашко А.В. Роль эндотелина в патогенезе преэклампсии. Акушерство и гинекология. №11. - 2013. С. 4-8), которая реализуется дестабилизацией процессов развития сосудистой сети шейки и тела матки, яичников и молочных желез. Состояние эпителия репродуктивных органов, в последующем участвующего в онкологической трансформации, напрямую зависит от кровоснабжения субэпителиальных слоев и функционирования фибробластов стромы, секретирующих компоненты внеклеточного матрикса (предшественники белков коллагена и эластина) и колониестимулирующих факторов (гранулоциты, макрофаги). Именно коллаген служит главным препятствием инвазивному росту, и для распространения опухолевых клеток он должен быть разрушен (Бергельсон Л.Д. Мембраны, молекулы, клетки. М., Наука. 1982. 184 с., Марголис Л.Б., Бергельсон Л.Д. Липосомы и их взаимодействие с клетками. М., 1986. 240 с.). Обеспечивая опору и питание эпителиальным клеткам и железам, соединительная ткань тесно связана с мышечной тканью и сосудами (Гладких Н.Н. Клинико-патогенетические аспекты изменений в системе гемостаза при врожденной дисплазии соединительной ткани / Η.Н. Гладких, А.В. Ягода // Гематология и трансфузиология. - 2007. - N 3. - С. 42-47). Соединительнотканная строма в виде рыхлой волокнистой ткани составляет основу маточных труб, а в яичниках является «ложем» для фолликулов различной степени зрелости и основой мозгового вещества, в котором проходят магистральные кровеносные сосуды и нервы, эпителиальные тяжи (остатки канальцев первичной почки). Структурные нарушения стромы яичников при ННСТ обусловливают диссонанс внутриорганной регуляции роста и созревания фолликулов, проявляющийся ановуляцией и эстрогенной недостаточностью. Соединительнотканные волокна составляют 70% ткани шейки матки и взаимосвязаны с нарушением влагалищного биотопа, при котором патогенные бактерии и вирусы в генитальном тракте способствуют процессам гемокоагуляции и усугубляют состояние тромботической готовности у пациенток с ННСТ (Кудинова Е.Г., Момот А.П., Карбышев И.А., Тараненко И.А. Бактериально-вирусные инфекции и процессы гемокоагуляции у беременных с мезенхимальной дисплазией. Бюллетень СО РАМН. 2013. - №5. С. 53-59). С уменьшением количества рыхлой соединительной ткани в структуре миометрия у пациенток с ННСТ наблюдается высокая частота расстройств менструаций в анамнезе по типу олигоменореи и аномальных маточных кровотечений, а также дистрофические изменения миометрия и недостаточность нервно-мышечного аппарата матки в репродуктивном возрасте (Уварова Е.В., Кудинова Е.Г., Момот А.П. Нарушения репродуктивного здоровья у молодых женщин с недифференцированными формами дисплазии соединительной ткани. // Материалы сб. конгр. «Анестезия и реанимация в акушерстве и неонатологии». - М., 2010 - С. 52-58).
В основе развития злокачественных новообразований шейки и тела матки, яичников и молочных желез лежит нарушение метаболизма периферических тканей организма и снижение чувствительности их к репродуктивным гормонам. Наследственные нарушения соединительной ткани связаны с состоянием тромботической готовности крови (Суханова Г.А. Тромботические мезенхимальные дисплазии и их связь с другими тромбофилиями. / Г.А. Суханова, З.С. Баркаган, Ε.Ф. Котовщикова. // Гематология и трансфузиология. - 2003. - №6. - С. 13-14). Генетические нарушения в работе онкогенов и антионкогенов, участвующих в контроле клеточного цикла и в репарации ДНК, являются фундаментальными в этиологии подавляющего большинства злокачественных опухолей человека (Горбунова В.Н. Генетика человека с основами медицинской генетики. - М.: Академия, 2012. - 240 с.; Горбунова В.Н., Имянитов Е.Н. Генетика и канцерогенез. Уч. пособие. СПб. 2007. - 57 с.). Длительно существующая наклонность к тромбозу в сосудистом русле, нарушение сбалансированного взаимодействия железистого эпителия репродуктивных органов и экстрацеллюлярного матрикса - стромы органов, сосудов и эпителия, обеспечивающих нормальное функционирование и противоопухолевую локальную защиту в сочетании с генетически обусловленным нарушением коллагенообразования стромально-сосудистого компонента репродуктивных органов приводят к десенситизации рецепторов и иммунному дисбалансу, что сопровождается возникновением злокачественных новообразований.
В обеспечении противоопухолевой защиты участвует система врожденного (неспецифического) иммунитета (субклассы Т-лимфоцитов и В-лимфоцитов). NK-клетки (естественные киллеры) способствуют развитию вторичного (специфического) иммунного ответа (Сидельникова В.М., Сухих Г.Т. Невынашивание беременности. М., - МИА - 2010 - С. 295-299) и выделяют цитотоксический фактор, разрушающий раковую клетку (Бергельсон Л.Д. Гликолипиды и противоопухолевый иммунитет. Наука и человечество. М., «Знание». - 1988. - С. 159-169). Наряду с системой комплемента в локусе системы HLA, неспецифическими медиаторами (интерферонами, интерлейкинами), к системе врожденного иммунитета относятся моноциты, которые выступают как источники дендритных клеток и участники механизмов иммунологической толерантности в организме (Генерирование дендритных клеток из моноцитарных предшественников дендритных клеток с помощью gm-csf в отсутствие дополнительных цитокинов. www.findpatent.ru/patent/236/2364625.html.). Активация моноцитов ассоциирована с увеличением уровня цитокинов (IL-8, IL-6, TNF-альфа) и последующей стимуляцией активности и пролиферации Т-лимфоцитов периферической крови.
Выявление степени риска у пациенток с ННСТ, генетическими и анамнестическими факторами тромбогенного риска (ФТР) позволяет расширить объем диагностических мероприятий и клинических исследований, что способствует снижению заболеваемости злокачественными новообразованиями шейки и тела матки, яичников и молочных желез.
Известен способ прогнозирования Коваленко Т.Ф., Ванюшевой О.В., Шилова И.А., Сосина Д.В. и др., представленный в работе «Промоторы генов MTHFR при гипергомоцистеинемии и Ген фосфотензина - супрессора опухолей (PTEN) при злокачественных и доброкачественных опухолях эндометрия и яичников» (Биоорганическая Химия. 2006. - Т. 32. N 4. С. 414-423).
PTEN в локусе 10q23.3 хромосомы кодирует тирозиновую фосфатазу, которая выступает как антионкобелок и обеспечивает контроль за пролиферацией клеток и внедрением их в соседние ткани (Song M.S., Salmena L., Pandolfi P.P. The functions and regulation of the PTEN tummour suppressor // Nat. Rev. Moll. Cell. Biol. - 2012. - B 5. - T. 13. - C. 283-296). Авторами доказано, что модификации промоторов генов MTHFR при гипергомоцистеинемии и промотора гена PTEN возникают в результате ошибочного метилирования, преобладание которых служит маркером риска возникновения злокачественных опухолей эндометрия и яичников.
Недостатком данной работы является то, что авторы не учитывали участие соединительнотканных структур организма в механизме противоопухолевой защиты и не сопоставляли полученные результаты с признаками ННСТ и ФТР. В работе указаны результаты определения промоторов генов MTHFR при гипергомоцистеинемии и PTEN при злокачественных новообразованиях эндометрия и яичников у женщин, и не представлены результаты исследования определения промоторов генов MTHFR при гипергомоцистеинемии и PTEN у пациенток с ННСТ и ФТР. Дефицит MTHFR приводит к снижению метилирования ДНК и активации онкогенов. Аномальное метилирование, снижение общего уровня метилирования генома и увеличение степени злокачественности опухоли может привести к экспрессии клеточных онкогенов (Esteller Μ., Corn PG., Baylin SB, Herman JG., et al. A gene Hypermethylation profile of human cancer. Cancer Res. 2001. 61 (8); 3225 - 9). Для опухолей молочной железы, яичников, шейки и тела матки показана корреляция между снижением общего уровня метилирования генома (недостаточного присоединения метальной группы к цитозину в молекуле ДНК) и увеличением степени злокачественности опухоли (Шуматова Т.А., Приходченко Н.Г., Оденбах Л.А., Ефремова И.В. Роль метилирования ДНК и состояния фолатного обмена в развитии патологических процессов в организме человека. Тихоокеанский мед. журнал. 2013. №4. С. 39-43).
Задачей изобретения является создание способа прогнозирования риска возникновения злокачественных новообразований женских половых органов и молочных желез по совокупности фенотипических и висцеральных признаков ННСТ с генетическими, анамнестическими факторами тромбогенного риска и клиническими данными.
Достигаемый результат - Повышение точности прогнозирования степени риска возникновения злокачественных новообразований шейки и тела матки, яичников и молочных желез у женщин.
Сущность изобретения состоит в том, что у женщин репродуктивного возраста при выявлении как минимум одного фенотипического и/или висцерального признаков ННСТ в разных системах и органах, как минимум одного генетического и как минимум одного анамнестического факторов тромбогенного риска и инфицирования генитального тракта, определяется степень риска (низкая, средняя и высокая) и проводится клиническое обследование для раннего выявления маркеров злокачественных новообразований шейки и тела матки, яичников и молочных желез.
Совокупная оценка риска злокачественных новообразований шейки и тела матки, яичников и молочных желез у женщин с ННСТ заключается в вычислении баллов представительства генетических факторов тромбогенного риска, анамнестических данных и клинических признаков:
I генетические факторы тромбогенного риска - промоторы (мутации и полиморфизмы) генов, предрасполагающих к тромбозу: F5 Лейден (1691G>А, А/A), FII (20210G>A, А/А), гена MTHFR (С677>Т, Т/Т) и гена PAI 1 (5G>4G, А/А);
II анамнестические данные - семейный тромботический (у ближайших кровных родственников 1-й и 2-й степени родства (сибсы, полусибсы, родители, прародители) - инфаркт миокарда, инсульт, тромбоэмболические осложнения, флеботромбоз), онкологический (злокачественные новообразования соматических и репродуктивных органов), личный тромботический анамнез (ишемические состояния головного мозга, мигрень, цефалгии); гинекологический отягощенный анамнез (расстройства менструаций (РМ), воспалительные заболевания органов малого таза (ВЗОМТ), репродуктивные потери (неразвивающаяся беременность (НБ), антенатальная гибель плода (АГП)), акушерский анамнез (преждевременная отслойка нормально расположенной плаценты (ПОНРП), преэклампсия (ПЭ), задержка внутриутробного развития плода (ЗВРП));
III клинические признаки -
1) состояние тромботической готовности крови (признаки гиперкоагуляции во внутреннем (укорочение АПТВ) или внешнем пути (укорочение ПТВ) свертывания, изменения тромбоцитарного гемостаза в сторону усиления агрегационной активности тромбоцитов выше референсных значений, угнетение фибринолиза и продукции естественных антикоагулянтов (снижение активности протеина С и антитромбина III менее референсных значений),
2) снижение пролиферативной активности NK-клеток в смешанной культуре лимфоцитов и количества моноцитов периферической крови менее референсных значений,
3) наличие ДНК возбудителей бактериально-вирусных инфекций в отделяемом мочеполовых органов: Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma genitalium, Herpes simplex 1, 2 типа, Human papilloma virus (16, 18, 31, 33, 35, 36, 45, 51, 52, 58 тип), Cytomegalovirus,
4) отклонения репродуктивных гормонов крови (значения эстрадиола, прогестерона ниже референсных, значения пролактина выше референсных),
5) изменения эхографических параметров шейки матки (кисты, гиперплазия эндоцервикса, полипы), тела матки (гиперплазия эндометрия, полипы эндометрия, миоматозные узлы), яичников (кисты и кистозные образования, эндометриоидные гетеротопии), молочных желез (кисты и фиброаденомы).
Разработана прогностическая таблица факторов риска возникновения злокачественных новообразований шейки и тела матки, яичников, молочных желез.
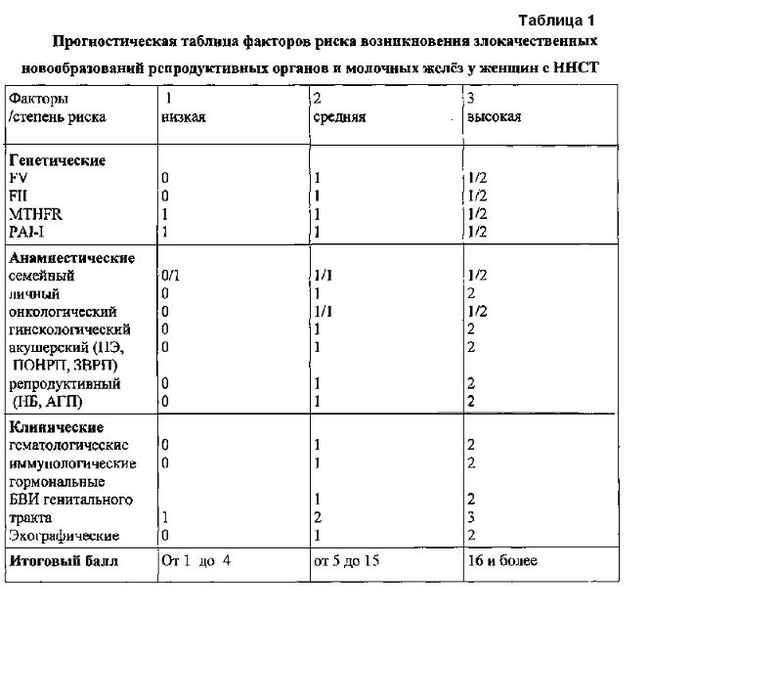
Пояснение к прогностической таблице: Генетические: однонуклеотидные замены в генах (мутации или полиморфизмы генов белков свертывания крови): 0 - нет полиморфизма, 1 балл - гетерозигота (норма/мутация); 2 балла - гомозигота (мутация /мутация). Семейный тромботический, онкологический анамнез: 0 балла - нет тромбозов или онкологических заболеваний, 1 балл - заболевание у одного из родителей или прародителей, 2 балла - заболевание у одного родителя и одного прародителя. Личный анамнез (тромбоз): 0 баллов - нет, 1 балл - ишемические атаки, флеботромбоз. Гинекологический анамнез: ВЗОМТ, РМ: 0 - баллов - нет расстройств менструаций или ВЗОМТ; 1 балл - РМ или ВЗОМТ, 2 балла - РМ и ВЗОМТ; Акушерский анамнез: 0 баллов - нет ПЭ, ПОНРП, ЗВРП, 1 балл - ПЭ или ПОНРП или ЗВРП, 2 балла - 2 и более осложнений беременности; Репродуктивный анамнез: 0 баллов - нет репродуктивных потерь, 1 балл - неразвивающаяся беременность (НБ) или антенатальная гибель плода (АГП), 2 балла - НБ и АГП. Клинические: Гематологические: состояние тромботической готовности (СТГ): 0 баллов - нет, 1 балл во время беременности, 2 балла - вне и во время беременности. Иммунологические: (количество NK-клеток, моноцитов периферической крови): 0 баллов - нет изменений в количестве NK-клеток и моноцитов периферической крови, 1 балл - отклонения в количестве NK-клеток или моноцитов, 2 балла - отклонения в количестве NK-клеток и моноцитов. Гормональные: уровень эстралиола, прогестерона, пролактина: 0 баллов - нет отклонений, 1 балл - отклонения в уровне одного из параметров, 2 балла - отклонения в уровне 2-х и более параметров. Бактериально-вирусное инфицирование генитального тракта (БВИ) - 1 балл - ДНК 1 возбудителя, 2 балла - ДНК 2 возбудителей, 3 балла - ДНК 3 и более возбудителей в течение жизни. Эхографические: 0 баллов - нет изменений, 1 балл - изменения стромы органов без изменений эпителия, 2 балла - изменения стромы и эпителия органов.
Обоснование предлагаемого способа.
Комплексное обследование 365 женщин включало оценку ННСТ (фенотипических и висцеральных признаков), анамнестических данных и клинических факторов тромбогенного риска (ФТР).
В дизайне исследования были определены 4 группы:
Группа 1 - пациентки с признаками ННСТ и ФТР в анамнезе и их родственники,
группа 2 - пациентки с ННСТ и без ФТР и их родственники,
группа 3 - пациентки без ННСТ и ФТР и их родственники,
группа 4 - пациентки без признаков ННСТ и с ФТР в анамнезе и их родственники.
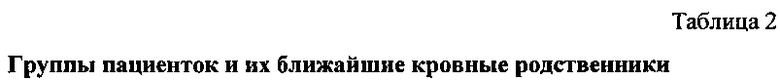
Оценка фенотипических и висцеральных признаков ННСТ и выделение пациенток в группу обследования проводилось в соответствии с документом: Оганов Р.Г. Проект рекомендаций по наследственным нарушениям соединительной ткани. М., 2013.
Определение генетических факторов тромбогенного риска - мутаций и полиморфизмов генов, предрасполагающих к тромбозу, проведено в режиме реального времени (Real-Time PCR) с использованием конкурирующих TaqMan-зондов, комплементарным полиморфным участками ДНК в плазме крови методом полимеразной цепной реакции на оборудовании ООО «НПО ДНК-Технология» (Россия): F5 Лейден (1691G>A, А/А), FII (20210G>А, А/А), гена MTHFR (С677>Т, Т/Т) и гена PAI 1 (5G>4G, А/А).
Определение анамнестических факторов риска
Характеристика семейного (тромботических и онкологических заболеваний) у 4280 ближайших кровных родственников женщин - 1-й (мать и отец), 2-й, 3-й степени родства (праматери и праотцы, родные дяди, тети, сибсы, полусибсы), личного (ишемические состояния головного мозга, мигрень, цефалгии), гинекологического (расстройства менструаций, воспалительные заболевания органов малого таза), акушерского (преэклампсия, преждевременная отслойка нормально расположенной плаценты, задержка внутриутробного развития плода), репродуктивного анамнеза (неразвивающаяся беременность, антенатальная гибель плода), осуществлена с использованием выкопировки данных амбулаторно-поликлинической документации.
Определение клинических факторов тромбогенного риска
О состоянии хронической тромботической готовности (СТГ) у пациенток с клиническими признаками ННСТ, ассоциированными с повышенным риском тромбообразования, судили по показателям системы гемостаза (Момот А.П. Патология гемостаза. Принципы и алгоритмы клинико-лабораторной диагностики. СПб. ФормаТ. - 2006. 209 с.). Взятие венозной крови осуществлялось из локтевой вены в пробирки VACUETTE с буферным раствором цитрата натрия в соотношении 9:1. Кровь центрифугировали при 1400g в течение 15 мин при комнатной температуре. Для исследования агрегации тромбоцитов получали богатую тромбоцитами плазму после центрифугирования крови при 160g в течение 7 мин.
Анализ сосудисто-тромбоцитарного гемостаза получен при исследовании агрегационной функции тромбоцитов с автоматическим определением количества тромбоцитов периферической крови с использованием индукторов АДФ (2 мкМ, 0,1 мкМ), коллаген, адреналин, ристомицин, арахидоновая кислота (реагенты фирмы «Технология-Стандарт», Россия) на оптическом агрегометре Chronolog 490-4D (компания Chronolog Corporation, США).
Исследование параметров плазменно-коагуляционного гемостаза у женщин проведено с использованием автоматического коагулометра Sysmex СА-1500 с применением набора реагентов фирмы Siemens/Германия методом скрининговых коагуляционных тестов (АПТВ (активированное парциальное тромбопластиновое время), ПТВ (протромбиновое время)).
Определение маркеров тромбинемии проводилось по уровню растворимых фибрин-мономерных комплексов (РФМК) в тесте с орто-фенантролином, времени самосборки фибрин-мономеров (ВСФМ) для распознавания нарушений на конечном этапе свертывания с оценкой дисфибриногенемии.
Измерение эндогенного тромбинового потенциала, характеризующего динамику образования тромбина, проводилось с помощью теста генерации тромбина, который измеряет динамику как образования, так и инактивации тромбина, использовался флюориметр Fluoroskan Ascent «ThermoFisher SCIENTIFIC» (Финляндия), с программным обеспечением «Thrombinoscope 3.0.0.26». Коагуляция исследуемой плазмы крови осуществлялась в присутствии 5 пмоль тканевого фактора и 4 мкмоль фосфолипидов (Besser Μ., Baglin С., Luddington R. et al. High rate of unpro voced recurrent venous thrombosis in assotiated with high thrombin - generation potential in a prospective cohort study. J. Thromb. Haemost. 2008; 6 (10): 1720-1725).
Для оценки антикоагулянтного потенциала крови использовались хромогенные методы определения активности антитромбина III (ATIII) и протеина C с применением тест-систем фирмы «Технология Стандарт» (Россия) и «Siemens» (Германия) соответственно.
Фибринолитическая активность плазмы оценивалась в коагуляционном тесте XIIa-зависимого фибринолиза с применением реагентов фирмы «Технология Стандарт» (Россия), активность плазминогена - хромогенным методом с применением тест-системы той же фирмы.
Определение концентрации и пролиферативной активности NK-клеток периферической крови в смешанной культуре лимфоцитов с фенотипом лимфоцитов CD56+16+; CD56+16-, отражающих степень иммунного ответа и скорость синтеза ДНК, проводилось методом иммуноферментного анализа с помощью моноклональных антител к структурам СД-56+16+; СД-56+16-. Определение количества моноцитов в периферической крови производилось с использованием гематологического анализатора.
Определение гормональной полноценности менструального цикла проводилось на 2-й день по уровню ЛГ, ФСГ, пролактина и эстрадиола и на 22-й день по уровню прогестерона в плазме крови.
Измерение эхографических параметров шейки и тела матки, яичников и молочных желез проводилось по общепринятой методике ультразвуковым сканером «HAWC-2102» с допплерометрической приставкой с оценкой размеров и строения эндоцервикса, миометрия, эндометрия, состояния стромы и фолликулов яичников, стромы и эпителия протоков молочных желез.
Выявление ДНК Herpes simplex 1, 2 типа, Cytomegalovirus, Human papilloma virus 16, 18, 31, 33, 35, 36, 45, 51, 52, 58 тип, Chlamydia trachomatis, Mycoplasma genitalium, Ureaplasma urealyticum осуществлялось методом полимеразной цепной реакции.
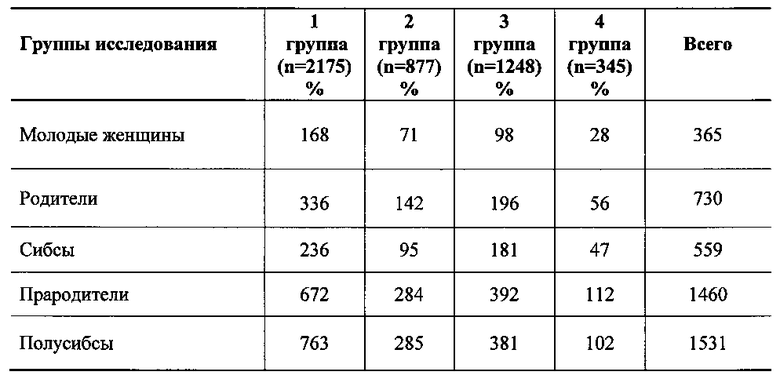
Семейный тромботический анамнез был выявлен у 72,5% пациенток 1 группы, у 28,9% - 2, у 19,4% - 3 и у 33,3% - 4 групп. Злокачественные новообразования репродуктивных органов обнаружены в семье каждой третьей пациентки с ННСТ и ФТР (36,3%), у 23,9% - 2, у 10,2% - 3 и у 25,0% - 4 группы. При этом отмечена тенденция к «омоложению» рака органов репродуктивной системы: рак яичников, шейки матки и аденокарцинома эндометрия выявлены уже в возрасте репродукции только у матерей пациенток 1 группы. Частота рака репродуктивных органов на 1000 населения в 1 группе оказалась наивысшей (p<0,0001) у женщин 1-го и 2-го поколения (95,0 и 56,0), во 2, 3 и 4 группе соответственно меньше (42,0 и 49,0; 10,0 и 20,0; 35,0 и 45,0).
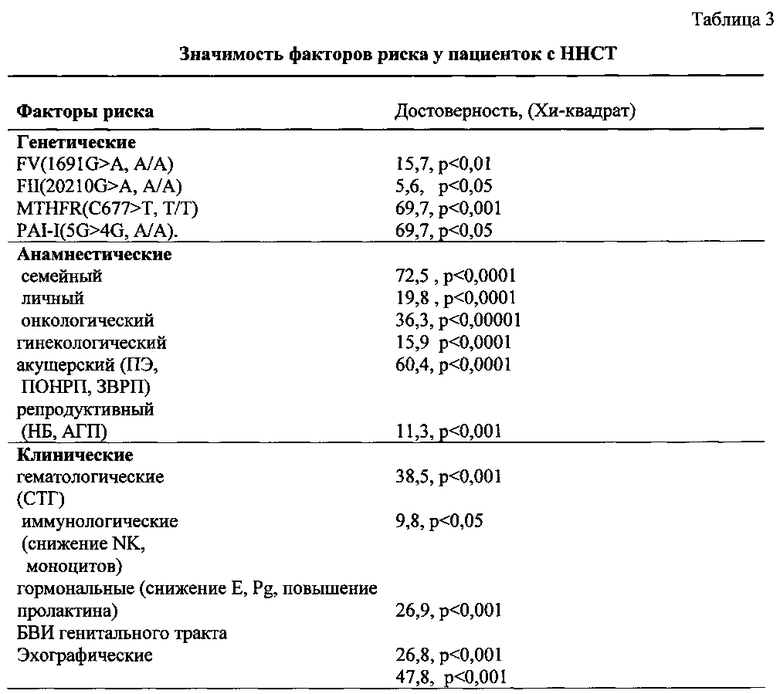
У пациенток с ННСТ и ФТР при проведении статистического двумерного кросс-спектрального анализа Фурье, определяющего корреляцию между частотой злокачественных новообразований и изменениями в геноме пациенток, оказалось, что при идентичной частоте носительства мутаций и полиморфизмов генов, предрасполагающих к тромбозу, выявлено статистически большее (p<0,0001) количество злокачественных новообразований шейки и тела матки, яичников и молочных желез у кровных родственников 1 и 2 поколения. Частота рака молочных желез (РМЖ) у женщин с ННСТ и носительством полиморфизма в гене MTHFR (С677Т С/Т, Т/Т) в 9 раз, в гене ингибитора активатора плазминогена PAI-I (675 5G/4G, 5А/А) в 6,2 раза выше, частота рака тела матки (РТМ) у женщин с ННСТ и носительством полиморфизма в гене MTHFR (С677Т С/Т, Т/Т) в 5,9 раз, в гене ингибитора активатора плазминогена PAI-I (675 5G/4G, 5А/А) в 5,1 раза оказалась выше по сравнению с пациентками без ННСТ.
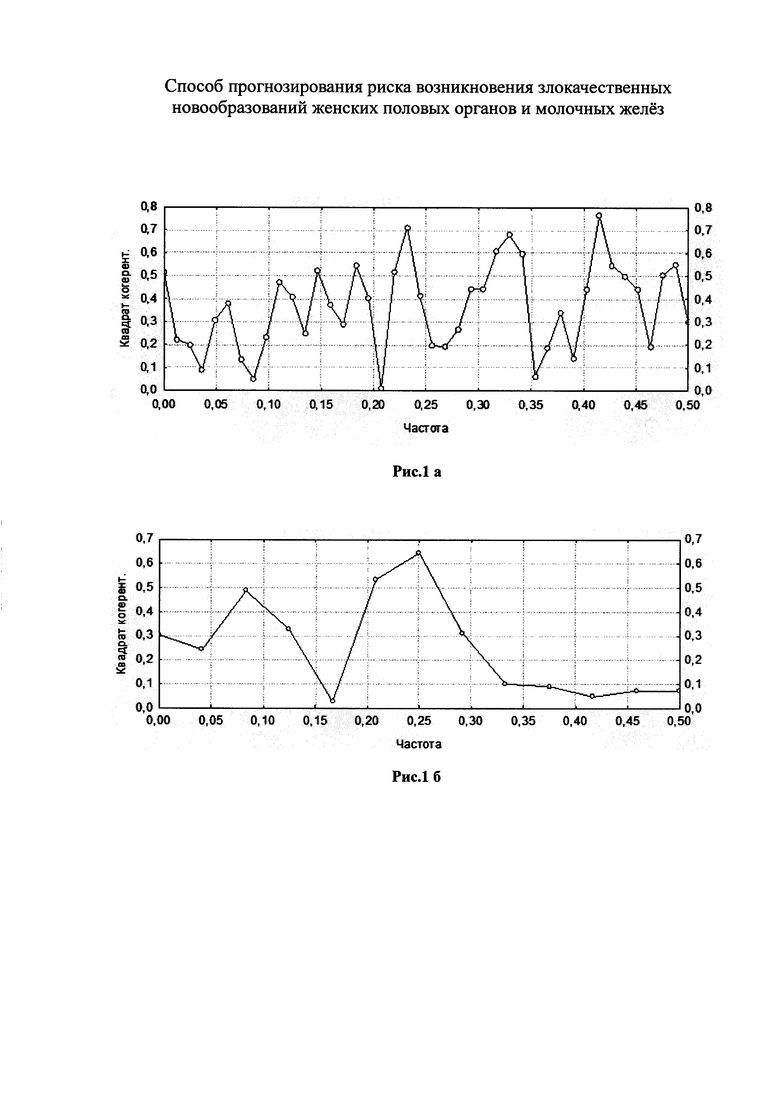
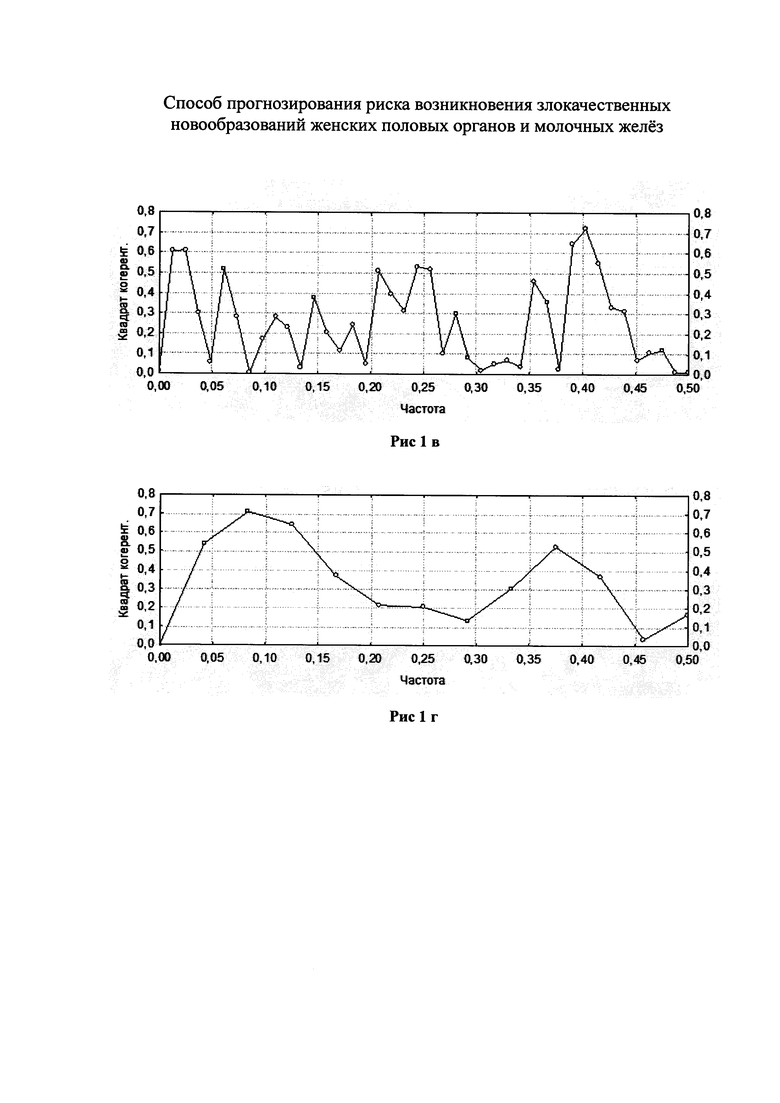
На рисунках приведена частота возникновения злокачественных новообразований, зависящая от частоты носительства промоторов указанных генов, предрасполагающих к тромбозу у кровных родственниц пациенток с ННСТ.
На рис. 1а, б показана при проведении двумерного кросс-спектрального анализа Фурье частота рака молочной железы у родственниц пациенток с ННСТ и с полиморфизмом MTHFR (n=82) и у родственниц пациенток без ННСТ и с полиморфизмом MTHFR (n=24). На рис. 1в, г показана при проведении двумерного кросс-спектрального анализа Фурье частота рака тела матки у родственниц пациенток с ННСТ и с полиморфизмом PAI-1 (n=82) и у родственниц пациенток с полиморфизмом PAI-1 без ННСТ (n=24).
В ходе исследования установлено, что 97,4% пациенток с ННСТ и ФТР являются носителями промоторов генов, обусловливающих склонность к тромбозу, что достоверно выше (p<0,01), чем у женщин 2, 3 и 4 групп соответственно (91,0%, 74,2% и 87,5%). Расстройства менструаций в анамнезе указали 50,2% пациенток 1 группы и 35,3% пациенток 4 группы.
Пациентки из 1 группы чаще указали на осложнения при первой беременности (p<0,001), осложненное течение последней беременности в виде наклонности к тромбозам (15,1%), по сравнению со 2, 3 и 4 группой (соответственно 11,3%, 0 и 8,3%): преэклампсия (ПЭ) - 36,3%, преждевременная отслойка нормально расположенной плаценты (ПОНРП) - (2,4%), задержка внутриутробного развития плода (ЗВРП) (29,3%) по сравнению с 2, 3 и 4 группой, в которых ПЭ - 2,3%, 0, 2,6%, ПОНРП отсутствовала, а ЗВРП составила соответственно 25,8%; 2,8% и 11,8%. Каждая вторая пациентка с ННСТ и лишь каждая шестая без ННСТ имела воспалительные заболевания наружных и внутренних половых органов до первой беременности: ВЗОМТ в форме эндометрита и/или сальпингоофорита в молодом репродуктивном возрасте имели 15,9% пациенток 1 группы и 9,6% - 2 группы, что достоверно чаще, чем у молодых женщин, не имевших признаков ННСТ (p<0,0001), цервицит и вагинит в 1,6 раза чаще, чем во 2 группе, в 6 раз чаще, чем в 3 группе (без ННСТ и ФТР) и в 13 раз чаще, чем в 4 группе. ДНК Ureaplasma urealyticum, Mycoplasma genitalium (20,7), Citomegalovirus, Herpes simplex 1, 2 типа, Human papilloma virus (16, 18, 31, 33, 35, 36, 45, 51, 52, 58 тип), (6,1 и 5,3%), в цервикальном канале в 1 группе больных выявлены в 2,5 раза чаще, чем у пациенток 3 и 4 групп соответственно (18,8; 7,3 и 15,5%), (4,4%; 3,7 и 3,3%) и (1,3; 1,2% и 2,2%). При этом инфицирование цервикального эпителия онкогенными подтипами Human papilloma virus в 1 группе пациенток в 4 и более раза превысило таковые у первобеременных без расстройств менструаций.
Анализ исследования системы гемостаза выявил состояние тромботической готовности, характеризующееся увеличением агрегационной активности тромбоцитов у пациенток с ННСТ в 1 и 2 группе (28,2% и 25,7%) по сравнению с пациентками 3 и 4 группы соответственно (16,0% и 16,7%); активацию внешнего (38,5 и 35,7%) и внутреннего путей свертывания плазменного звена крови (34,6 и 25,0%) по сравнению с 3 и 4 группой (9,5 и 15,8%) и (9,5 и 31,5%); повышение количества растворимого фибрина (РФМК) в плазме (35,3 и 37,5%) и укорочение времени самосборки фибрин-мономера (ВСФМ) (45,7 и 9,8%), по сравнению с 3 и 4 группой соответственно (4,0 и 13,6%) и (25,7% и 6,7%). Угнетение XIIa зависимого фибринолиза (p<0,01) в 1 и 2 группе (9,1 и 16,7%) и дефицит естественных антикоагулянтов (антитромбин III) (6,5 и 2,2%), в 3 и 4 группе отсутствовали, нарушения в системе протеина C (27,6 и 22,0%) в 1 и 2 группе, в 3 и 4 группе (11,8% и 8,3%).
Доля пациентов с ННСТ и ФТР с высоким эндогенным тромбиновым потенциалом (ЭТП) оказалась выше, в сравнении с пациентами без ННСТ (50,0 и 30,0%). У них выявлено снижение пролиферативной активности NK клеток с фенотипом CD56+16+; CD56+16 - в сравнении с пациентками без ННСТ и уменьшение количества моноцитов периферической крови.
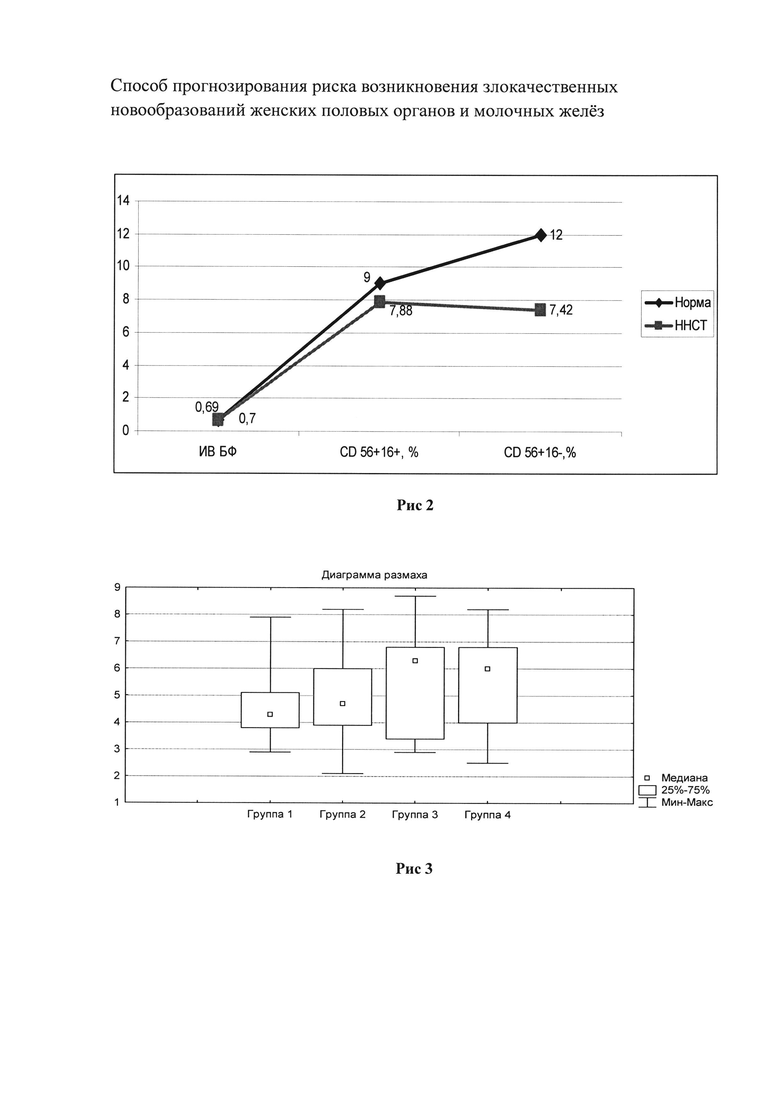
На рис. 2 показано количество NK-клеток с фенотипом CD56+16+; CD56+16-, которое у пациенток с ННСТ и ФТР статистически меньше по сравнению с пациентками без ННСТ и ФТР.
На рис. 3 приведена диаграмма размаха количества моноцитов периферической крови в 1 группе (ННСТ и ФИР), 2 группе (ННСТ и без ФТР), 3 группе (без ННСТ и БЕЗ ФТР), 4 группе (без ННСТ и с ФТР).
Как следует из диаграммы, у пациенток с ННСТ и ФТР количество моноцитов периферической крови статистически меньше по сравнению с пациентками без ННСТ и с ФТР.
При исследовании гормонов у пациенток 1 группы установлено при нормативных уровнях (M±SD) фолликулостимулирующего (ФСГ) 5,81±0,31 МЕ/л, лютеинизирующего гормона (ЛГ) 5,62±0,60 МЕ/л, повышение пролактина 269,08±28,20 мМЕ/л, снижение количества эстрадиола 34,15±2,03 пг/мл и прогестерона 1,40±0,17 н/моль/л. Известно, что эстрадиол стимулирует васкуляризацию соединительной ткани, пролактин секретируется не только клетками гипофиза, но и иммунной системы (лимфоциты, лейкоциты), а прогестерон тормозит митотическую активность эпителиальных клеток (Поликлиническая гинекология, под ред. Прилепской В.Н. М. «МЕДпресс-информ». 2005, с. 175). Недостаточность прогестерона у пациенток с ННСТ в проведенном исследовании проявилась пролиферацией соединительнотканного и эпителиального компонентов молочной железы и возникновением кистозных образований молочных желез, а снижение уровней эстрадиола и прогестерона наряду с повышением прогестерона проявилось расстройствами менструаций и формированием недостаточности лютеиновой фазы.
При эхографической диагностике у женщин 1 группы с ННСТ и ФТР изменения структуры шейки (кисты, гиперплазия эндоцервикса 47,8%) и тела матки (гиперплазия эндометрия) составили 36,4%, кисты и кистозные новообразования яичников 26,8%, диффузные дисгормональные гиперплазии молочных желез (кисты, гиперплазия железистого компонента, фиброз) 22,4%, что оказалось статистически выше по сравнению с пациентками без ННСТ и ФТР соответственно 13,3%, 3,6%, 7,8% и 12,0%.
Таким образом, у женщин с фенотипическими и/или висцеральными признаками ННСТ, генетические и анамнестические ФТР, гематологические (состояние тромботической готовности), иммунологические (снижение пролиферативной активности NK-клеток в смешанной культуре лимфоцитов и уменьшение количества моноцитов в периферической крови, участвующих в механизмах иммунологической толерантности в организме) к чужеродным агентам на фоне изменений репродуктивных гормонов (эстрадиола, пролактина, прогестерона) и эхографические нарушения структуры шейки и тела матки, яичников и молочных желез, а также инфицирование возбудителями бактериально-вирусных инфекций генитального тракта служат маркерами риска возникновения злокачественных новообразований репродуктивных органов и молочных желез.
Заявляемый способ прогнозирования риска возникновения злокачественных новообразований женских половых органов и молочных желез осуществляется следующим образом.
У женщин, имеющих фенотипические и/или висцеральные признаки ННСТ и инфицирование генитального тракта возбудителями бактериально-вирусных инфекций, при выявлении в семейном анамнезе у кровных родственников тромботических или онкологических заболеваний, проводится клиническое исследование, которое включает в себя определение следующих параметров:
Мутации и полиморфизмы генов, кодирующих белки свертывания крови и фибринолиза периферической крови: FII протромбина (G20210>A, А/A), F5 Лейден (1691G>А, А/А) гена MTHFR (С677>Т, Т/Т) и гена ингибитора активатора плазминогена PAI 1 (5G>4G, А/А).
Исследование сосудисто-тромбоцитарного гемостаза и оценка агрегационной функции тромбоцитов на агрегометре с применением в качестве агонистов агрегации АДФ, адреналина и коллагена, плазменно-коагуляционного гемостаза - на автоматическом коагулометре. Для отнесения пациенток в группу риска используются прогностически значимые уровни агрегационной активности тромбоцитов, параметров внутреннего (активированное парциальное тромбопластиновое время - АПТВ) и внешнего (протромбиновое время - ПТВ) путей свертывания крови - выше референсных значений. Определение в плазме крови эндогенного тромбинового потенциала с помощью теста генерации тромбина (прогностически значимый уровень ЭТП>1900 нмольхмин), маркеров тромбинемии по уровню растворимых фибрин-мономерных комплексов (РФМК) в тесте с орто-фенантролином (прогностически значимый уровень более 8 мкг/ 100 мл), времени самосборки фибрин-мономера (ВСФМ) для распознавания нарушений на конечном этапе свертывания (прогностически значимый уровень ВСФМ<30 секунд, что свидетельствует о тромботической готовности в кровеносном русле).
Определение численности моноцитов периферической крови - прогностически значимый уровень менее референсных значений.
Определение пролиферативной активности в смешанной культуре лимфоцитов периферической крови: прогностически значимый уровень - уменьшение количества NK-клеток с фенотипом CD56+16+; CD56+16-.
Выявление ДНК бактериально-вирусных возбудителей генитального тракта - Herpes simplex 1, 2 типа, Citomegalovirus, Human papilloma virus 16, 18, 31, 33, 35, 36, 45, 51, 52, 58 тип, Chlamydia trachomatis, Mycoplasma genitalium, Ureaplasma urealyticum методом полимеразной цепной реакции.
Функциональная полноценность менструального цикла определяется на 2-й день по уровню ЛГ, ФСГ, пролактина, эстрадиола и на 22-й день по уровню прогестерона. Прогностически значимый уровень - количество эстрадиола, прогестерона ниже и количество пролактина выше референсных значений.
Установление эхографических признаков изменений структуры шейки и тела матки, яичников, молочных желез ультразвуковым сканером с допплерометрической приставкой по общепринятой методике.
При низкой степени риска (1-4 балла) (табл. 1) злокачественных новообразований шейки и тела матки, яичников, молочных желез у женщин с ННСТ мутации генов FII и FV отсутствуют, полиморфизмы генов, кодирующих MTHFR и PAI-I в гетерозиготном варианте, тромботический семейный анамнез характеризуется тромбозами у 1 из родителей и 1 из прародителей, онкологические заболевания у родственников и тромбозы в личном анамнезе отсутствуют, гинекологические заболевания, репродуктивные потери и осложнения при предыдущей беременности отсутствуют, признаки ННСТ и инфицирование генитального тракта одним бактериально-вирусным возбудителем установлены на фоне отсутствия нарушений эхоструктуры репродуктивных органов. Наблюдение пациенток при низкой степени риска рекомендуется 1 раз в 2 года с обследованием репродуктивных органов.
Агрегационная активность тромбоцитов с применением в качестве агонистов агрегации АДФ, адреналина и коллагена в пределах референсных значений. Количество эндогенного тромбина, маркеров тромбинемии, длительность времени самосборки фибрин-мономеров в пределах референсных значений.
Количество активированных NK-клеток - CD56+16+ и CD56+16-, моноцитов в пределах референсных значений.
Уровень ЛГ/ФСГ соответствует 1,5-2,0; ФСГ, ЛГ, пролактин, эстрадиол, прогестерон сыворотки крови - соответствуют нормативным для фазы менструального цикла, дефицит прогестерона и эстрадиола не выявляется, признаки недостаточности лютеиновой фазы (НЛФ) отсутствуют.
Эхографические признаки изменений структуры шейки и тела матки, яичников и молочных желез отсутствуют.
Средняя степень риска (5-15 баллов) возникновения злокачественных новообразований шейки и тела матки, яичников и молочных желез устанавливается у женщин с ННСТ, тромботическим семейным (тромбозы у 1 из родителей и 1 или 2 прародителей), личные тромбозы однократно, онкологические заболевания могут присутствовать у 1 родителя или 1/2 прародителей, когда признаки ННСТ выявляются на фоне состояния тромботической готовности, снижения иммунологических показателей крови, инфицирования генитального тракта не более 2-х бактериально-вирусных возбудителей при отсутствии изменений, в гормональных параметрах репродуктивных гормонов и установлении морфологических признаков изменений структуры репродуктивных органов без нарушения пропорциональности структуры органа и гиперплазии эпителия. Гинекологические заболевания в анамнезе (расстройства менструаций или воспалительные заболевания органов малого таза (однократно), репродуктивные потери (однократно) и осложнения при предыдущей беременности (однократно). При средней степени риска рекомендуется наблюдение 1 раз в 1 год с обследованием репродуктивных органов и выявление генетической предрасположенности на основе изучения генов злокачественных новообразований репродуктивных органов (генная диагностика).
Мутации и полиморфизмы генов, кодирующих белки свертывания крови и фибринолиза: FII протромбина (G20210>A), F5 Лейден (1691G>A), гена MTHFR (С677>Т) и гена ингибитора активатора плазминогена PAI 1 (5G>4G), гетерозиготные варианты в геноме.
Агрегационная активность тромбоцитов с применением в качестве агонистов агрегации АДФ, адреналина и коллагена выше референсных значений. Исследование плазменно-коагуляционного гемостаза - признаки гиперкоагуляции по внутреннему (укорочение АПТВ) или внешнему пути свертывания крови (укорочение ПТВ) менее референсных значений. Количество эндогенного тромбина, длительность времени самосборки фибрин-мономеров в пределах референсных значений, маркеры тромбинемии выше референсных значений в пределах (8,0-16,0 мг/100 мл).
Снижение активированных NK-клеток - CD56+16+; CD56+16- менее референсных значений при нормативном количестве моноцитов периферической крови.
Уровень ЛГ/ФСГ соответствует 1,5-2,0; ФСГ, ЛГ, пролактин, эстрадиол сыворотки крови - соответствует нормативным для фазы менструального цикла на 2 д.ц.: ФСГ в пределах 2,8-11,3 мМЕ/мл; ЛГ - 1,1-11,6 мМЕ/мл, пролактин - 590 мМЕ/л, эстрадиол - 13-191 пг/мл, дефицит прогестерона - прогестерон на 21-23 день цикла менее 0,1-1,13 нг/мл. Отмечены признаки гиперпролактинемии, НЛФ. Эхографические признаки изменений размеров и структуры тела матки без гиперплазии эндометрия, наличие миоматознных узлов небольших размеров (до 2 см), увеличение толщины стенок матки, но без нарушения пропорциональности развития передней и задней стенки, кисты шейки матки без гиперплазии эндоцервикса.
Высокая степень риска (16 и более баллов) возникновения злокачественных новообразований шейки и тела матки, яичников и молочных желез устанавливается у женщин с ННСТ с тромботическим личным и семейным анамнезом (тромбозы у родителей и прародителей), онкологическим семейным анамнезом, а признаки ННСТ выявляются на фоне инфицирования генитального тракта более, чем 2-мя возбудителями бактериально-вирусных инфекций, нарушений эхоструктуры репродуктивных органов и изменений гематологического и иммунного статуса и гормональных параметров репродуктивных гормонов. При высокой степени риска рекомендуется наблюдение 1 раз в 6 месяцев с обследованием репродуктивных органов и выявление генетической предрасположенности на основе изучения генов злокачественных новообразований репродуктивных органов, которая оценивает риск наследственной предрасположенности к раку молочной железы: BRCA1, BRCA2; FMR1-ген синдрома ломкой Х-хромосомы. Мутации и полиморфизмы генов, кодирующих белки свертывания крови и фибринолиза: FII протромбина (G20210>A, А/А), F5 Лейден (1691G>A, А/А), полиморфизмов гена MTHFR (С677>Т, Т/Т) и гена ингибитора активатора плазминогена PAI 1 (5G>4G, А/А) в гетерозиготном или гомозиготном варианте в геноме более 2-х.
Исследование плазменно-коагуляционного гемостаза - признаки гиперкоагуляции по внутреннему (укорочение АПТВ) и внешнему пути (укорочение ПТВ) свертывания крови. Количество эндогенного тромбинового потенциала, агрегационной активности тромбоцитов с применением в качестве агонистов агрегации АДФ, адреналина и коллагена выше референсных значений, маркеров тромбинемии по уровню растворимых фибрин-мономерных комплексов (РФМК) в тесте с орто-фенантролином более 16 мкг/ 100 мл, времени самосборки фибрин-мономера (ВСФМ) менее референсных значений.
У женщин определяются уменьшение в 1,5-2 раза процентного содержания NK-клеток по сравнению с нормой и количества моноцитов периферической крови менее референсных значений, при сочетании изменений эхоструктуры шейки и тела матки, яичников, молочных желез с нарушениями функциональной активности репродуктивных органов по уровню гормонов. Эхографические признаки структурных нарушений проявляются в виде гиперплазии эндоцервикса, эндометрия, гиперплазии железистой ткани молочных желез, увеличения структурных образований репродуктивных органов в виде кист эндоцервикса, миоматозных узлов и эндометриоидных очагов, кистозных образований яичников. Толщина железистой ткани в центральных отделах молочных желез превышает 14 мм, в эндоцервиксе более 5 мм, в эндометрии более 15 мм, а структура отличается наличием дополнительных эхонегативных включений, которые локализуются в центральных или периферических отделах эндоцервикса, эндометрия, яичников, молочных желез, размеры от 0,5 до 2 см.
Уровень ЛГ/ФСГ соответствует >2,0; ФСГ, ЛГ, пролактин, эстрадиол сыворотки крови - не соответствуют нормативным для фазы менструального цикла на 2 д.ц.: ФСГ 2,8-11,3 мМЕ/мл; ЛГ - 1,1-11,6 мМЕ/мл, пролактин 590 мМЕ/л, дефицит эстрадиола - 13-191 пг/мл, дефицит прогестерона- прогестерон на 21-23 день цикла менее 0,1-1,13 нг/мл. Отмечены признаки гиперпролактинемии, НЛФ.
Изобретение иллюстрируется следующими примерами из практики.
Пример 1.
Пациентка Н., 22 года, обратилась на прием к врачу женской консультации г. Новосибирска по поводу аномальных маточных кровотечений. При поступлении ей проведено комплексное обследование. Семейный и личный тромботический анамнез пациентки не отягощен. Пубертатный анамнез характеризовался олигоменореей. У пациентки выявлены фенотипические признаки ННСТ: миопия легкой степени тяжести и висцеральные: соматоформная ВД по гипотоническому типу. При определении полиморфизмов протромбогенных генов в плазме крови таковые не выявлены, в генитальном тракте бактериальные и вирусные возбудители не выявлены.
Исследование плазменно-коагуляционного гемостаза выявило нормокоагуляцию, агрегационная активность тромбоцитов с добавлением индукторов АДФ, адреналина и коллагена - не нарушена. Количество активированных NK-клеток - CD56+16+ - 9,0%; CD56+16- - 12,0%, моноцитов, периферической крови 5,6%. Определение маркеров тромбинемии по уровню растворимых фибрин-мономерных комплексов (РФМК) в тесте с орто-фенантролином (уровень 4 мг/ 100 мл), времени самосборки фибрин-мономера (ВСФМ) для распознавания нарушений на конечном этапе свертывания (ВСФМ) 34,0 секунды; эндогенного тромбинового потенциала с помощью теста генерации тромбина - уровень ЕТР 1656,0 нмоль×мин.
При эхографическом обследовании выявлены фолликулярная киста правого яичника диаметром 26 мм, единичные кисты эндоцервикса 4-5 мм.
Значения уровней ФСГ, пролактина и лютеинизирующего гормона, эстрадиола и прогестерона соответствовали нормам для данного возраста.
По результатам комплексного обследования пациентка была выделена в группу риска низкой степени по развитию злокачественных новообразований шейки матки, яичников и молочных желез. Общая сумма баллов в соответствии с прогностической таблицей 3 балла, что соответствовало низкой степени риска. После проведенного обследования пациентке рекомендовано наблюдение 1 раз в 2 года и эхографическое обследование репродуктивных органов.
Пример 2.
Пациентка Н., 20 лет, находилась на амбулаторном лечении в женской консультации №2 г. Новосибирска по поводу аномальных маточных кровотечений с менархе. При определении протромбогенных полиморфизмов генов в плазме крови выявлено носительство гетерозиготного полиморфизма гена MTHFR (С677>Т) и гена ингибитора активатора плазминогена PAI 1 (5G>4G). Из анамнеза: отягощенный тромботический анамнез - у матери тромбофлебит, гипертоническая болезнь. У праотца - рак желудка; у праматери - рак молочных желез. Оценка фенотипических проявлений ННСТ выявила признаки сколиоза, плоскостопия, миопии легкой степени тяжести; оценка висцеральных признаков ННСТ выявила соматоформную ВД по гипотоническому типу, хронический тонзиллит, пролапс митрального клапана.
Оценка агрегационной функции тромбоцитов с применением в качестве агонистов агрегации АДФ 75%, адреналином 72%, коллагеном 50,0% (при референсных значениях 50-70,0 секунд). Исследование плазменно-коагуляционного гемостаза - признаки гиперкоагуляции (АПТВ) по внутреннему и нормокоагуляции (ПТВ) по внешнему пути свертывания крови. Определение в плазме крови эндогенного тромбинового потенциала с помощью теста генерации тромбина выявило уровень ЕТР 1860,0 нмоль×мин; маркеров тромбинемии по уровню растворимых фибрин-мономерных комплексов (РФМК) в тесте с орто-фенантролином (уровень 12 мг/ 100 мл); времени самосборки фибрин-мономера (ВСФМ) для распознавания нарушений на конечном этапе свертывания - уровень ВСФМ 34 секунды. Снижение активированных NK-клеток - CD56+16+ - 7,8%; CD56+16- - 9,6,0%; численность моноцитов периферической крови в пределах нормы - 5,4%
Эхографические критерии - изменение размеров и структуры тела матки эндометрий в 1 фазу пролиферации 8 мм, в фазу секреции 14 мм, тело матки шаровидной формы, гиперэхогенные включения в структуре миометрия до 14 структуры миометрия, толщина задней стенки 28 мм, толщина передней стенки 20 мм, кисты шейки 6-9 мм матки, эндоцервикс 3 мм.
Методом полимеразной цепной реакции в отделяемом мочеполовых органов выявлены Ureaplasma urealiticum; Human papilloma virus 16 тип.
Уровень ЛГ/ФСГ соответствует 1,5; на 2 д.ц.: ФСГ в пределах 5,6 мМЕ/мл; ЛГ - 8,6 мМЕ/мл, пролактин - 256 мМЕ/л, эстрадиол - 68 пг/мл, дефицит прогестерона - прогестерон на 21-23 день цикла менее 0,1 нг/мл. Отмечены признаки нормопролактинемической галактореи, НЛФ.
По результатам комплексного обследования пациентка была выделена в группу риска средней степени (15 баллов) по развитию злокачественных новообразований. Пациентке рекомендовано выявление генетической предрасположенности на основе изучения генов злокачественных новообразований репродуктивных органов (генная диагностика), наблюдение 1 раз в 1 год и обследование репродуктивных органов. У пациентки при дополнительном обследовании выявлено очаговое образование правой молочной железы, которое после проведенного обследования удалено оперативным путем: гистологический диагноз - фиброаденома.
Пример 3.
Пациентка К. 23 лет, находилась на амбулаторном лечении в женской консультации г. Новосибирска по поводу хронического эндоцервицита, цервикальной эктопии. Из анамнеза ВЗОМТ в виде хронического эндометрита, двухстороннего аднексита. Мать умерла в 42 г от рака молочной железы; у праматери острое нарушение мозгового кровообращения; у праотца - инфаркт миокарда.
Оценка фенотипических проявлений ННСТ выявила признаки сколиоза, гипермобильности голеностопных суставов, миопический астигматизм; оценка висцеральных признаков ННСТ выявила соматоформную ВД по гипертоническому типу, оперативное лечение по поводу паховой грыжи в детстве; нефроптоз справа; хронический гастродуоденит, хронический пиелонефрит; диффузно-узловой зоб 1 ст. В анамнезе 1 замершая беременность, при последующей беременности - преэклампсия в 32 недели, рождение ребенка с признаками задержки внутриутробного развития массой тела 2670 граммов, длиной 46 см в сроке 38-39 недель беременности.
При исследовании генома: гетерозиготная мутация FII протромбина (G20210>A), гомозиготный полиморфизм гена MTHFR (С677>Т).
Показатели иммунного и гематологического статуса: снижение активированных NK-клеток - CD56+16+ - 6,8%; CD56+16- - 7,0%; численность моноцитов периферической крови 3,4% снижена по сравнению с референсными значениями.
Количество эндогенного тромбинового потенциала ЕТР 1962,0 нмоль×мин; маркеров тромбинемии по уровню растворимых фибрин-мономерных комплексов (РФМК) в тесте с орто-фенантролином (уровень 21 мг/ 100 мл), время самосборки фибрин-мономера (ВСФМ) 26 секунд; при исследовании плазменно-коагуляционного гемостаза - признаки гиперкоагуляции по внутреннему (АПТВ) и внешнему пути свертывания крови (ПТВ) секунд; агрегационная активность тромбоцитов с применением в качестве агонистов агрегации АДФ повышена - 80,0%, адреналином 78%, коллагеном >74,0% при референсных значениях (50-70,0 секунд).
При эхографическом исследовании признаки увеличения размеров шейки матки, гиперплазия эндоцервикса (7 мм), неоднородная структура эндо- и экзоцервикса, множественные кисты шейки матки диаметром 6-12 мм, диффузные изменения миометрия. В ткани молочных желез признаки гиперплазии железистого компонента (18 мм), признаки смешанного варианта мастопатии.
ПЦР-диагностика отделяемого эндоцервикса выявила носительство Candida albicans, Human papilloma virus 18,31 тип.
Данных за снижение функциональной активности яичников отмечено не было, уровень ФСГ, ЛГ, пролактина, эстрадиола и прогестерона соответствовал норме.
С учетом проведенного исследования К. был выставлен диагноз: цервикальная эктопия с высоким риском онкотрансформации. Кольпоскопическая картина соответствовала атипической зоне трансформации, йоднегативной зоне на 6,9 часах, картине мозаики, по поводу чего проведена прицельная биопсия шейки матки. Гистологическое исследование биопсийного участка шейки матки подтвердило наличие цервикальной интраэпителиальной дисплазии (CIN II), по поводу чего проведена диатермоконизация шейки матки с последующей терапией: орошением участка конизации шейки матки макрофагальной средой. По результатам комплексного обследования пациентка была выделена в группу риска по развитию злокачественных новообразований высокой степени. Сумма баллов с учетом прогностической шкалы риска по развитию доброкачественных и злокачественных новообразований репродуктивных органов составила 22 балла, что соответствовало высокой степени риска. Пациентке было рекомендовано выявление генетической предрасположенности на основе изучения генов злокачественных новообразований репродуктивных органов (генная диагностика). Пациентка была включена в диспансерную группу с наблюдением 1 раз в 6 месяцев и обследованием репродуктивных органов 1 раз в 6 месяцев.
Таким образом, заявляемый способ позволяет повысить точность прогнозирования риска злокачественных новообразований женских половых органов и молочных желез путем выделения в группу высокого риска пациенток с наследственными нарушениями соединительной ткани, факторами тромбогенного риска и инфицированием генитального тракта бактериально-вирусными возбудителями. Способ найдет широкое применение, так как выявление отклонений в гематологических, иммунологических, эхографических и гормональных показателях позволит своевременно провести у пациенток с ННСТ диагностику стадии злокачественных новообразований репродуктивных органов и молочных желез.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ дифференциальной диагностики доброкачественных и злокачественных новообразований яичников | 2018 |
|
RU2686180C1 |
| Способ прегестационного прогнозирования рецидива ранних репродуктивных потерь и первичной плацентарной недостаточности | 2019 |
|
RU2709246C1 |
| Способ прогнозирования риска развития миомы матки | 2017 |
|
RU2650990C1 |
| Способ выбора тактики лечения миомы матки и ее сочетания с аденомиозом у женщин | 2019 |
|
RU2718267C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ ЖЕНСКОЙ ПОЛОВОЙ СФЕРЫ | 2018 |
|
RU2687780C1 |
| Способ диагностики хронического эндометрита различной степени выраженности у пациенток с аномальными маточными кровотечениями, при отсутствии эндометриопатии в анамнезе, посредством иммуногистохимического исследования нарушения клеточного иммунитета в эндометрии | 2023 |
|
RU2830413C1 |
| Способ прогнозирования риска возникновения репродуктивных нарушений у женщин с субклиническим и манифестным гипотиреозом | 2022 |
|
RU2804212C1 |
| Способ прогнозирования риска развития гиперплазии эндометрия у женщин с нормальной массой тела | 2024 |
|
RU2834521C1 |
| СПОСОБ И СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННЫХ ГИПЕРПЛАСТИЧЕСКИХ ПРОЦЕССОВ ЭНДОМЕТРИЯ | 2004 |
|
RU2275194C1 |
| Способ дифференциальной диагностики рака яичников, кистозных образований яичника и рака тела матки | 2024 |
|
RU2836527C1 |
Изобретение относится к медицине, а именно к онкогинекологии, гематологии и генетике, и предназначено для прогнозирования риска возникновения злокачественных новообразований шейки и тела матки, яичников, молочных желез. Для осуществления способа у женщин репродуктивного возраста выявляют признаки наследственных нарушений (ННСТ) соединительной ткани в разных системах и органах, как минимум одного генетического и как минимум одного анамнестического факторов тромбогенного риска (ФТР) и инфицирования генитального тракта. В соответствии с выявленными признаками устанавливают низкий, средний или высокий риск возникновения злокачественных новообразований женских половых органов и молочных желез. Использование изобретения позволяет повысить точность прогнозирования и степень риска возникновения злокачественных новообразований шейки и тела матки, яичников и молочных желез у женщин. 3 ил., 3 табл., 3 пр.
Способ прогнозирования риска возникновения злокачественных новообразований женских половых органов и молочных желез, состоящий в том, что у женщин репродуктивного возраста выявляют признаки наследственных нарушений соединительной ткани в разных системах и органах, генетических и анамнестических факторов тромбогенного риска и инфицирования генитального тракта, и
- низкий риск возникновения злокачественных новообразований прогнозируют у пациенток с признаками наследственных нарушений соединительной ткани, гетерозиготными вариантами полиморфизмов генов, кодирующих функционирование метилентетрагидрофолатредуктазы (MTHFR) и/или ингибитора активатора плазминогена I типа (PAI-I), с тромботическим семейным анамнезом и однократной бактериально-вирусной инфекцией генитального тракта при отсутствии семейного онкологического и личного тромботического анамнеза, состояния тромботической готовности и снижения NK-клеток и моноцитов периферической крови и нарушения уровня репродуктивных гормонов и эхоструктуры женских половых органов и молочных желез;
- средний риск возникновения злокачественных новообразований прогнозируют у пациенток с признаками наследственных нарушений соединительной ткани, тромботическим и онкологическим семейным и личным анамнезом, гетерозиготными мутациями и полиморфизмами генов, кодирующих функционирование факторов свертывания крови протромбина (FII), фактора Лейден (FV), метилентетрагидрофолатредуктазы (MTHFR) и ингибитора активатора плазминогена I типа (PAI-I), бактериально-вирусной инфекцией генитального тракта (не более 2-х возбудителей), с изменениями эхоструктуры женских половых органов и молочных желез, состоянием тромботической готовности и снижением NK-клеток и моноцитов периферической крови при отсутствии отклонений в репродуктивных гормонах;
- высокий риск возникновения злокачественных новообразований прогнозируют у пациенток с признаками наследственных нарушений соединительной ткани, тромботическим и онкологическим семейным и личным анамнезом, гетеро- и гомозиготными мутациями и полиморфизмами генов, кодирующих функционирование факторов свертывания крови протромбина (FII), фактора Лейден (FV), метилентетрагидрофолатредуктазы (MTHFR) и ингибитора активатора плазминогена I типа (PAI-I), состоянием тромботической готовности и снижением NK-клеток и моноцитов периферической крови, бактериально-вирусной инфекцией генитального тракта - более 2-х возбудителей, нарушением уровня репродуктивных гормонов и эхоструктуры женских половых органов и молочных желез.
| OZEN F et al | |||
| Замок с ключом фигурного сечения | 1914 |
|
SU677A1 |
| Asian Pac J Cancer Prev., 2013, 14(5), p.2903-8 | |||
| СПОСОБ ОЦЕНКИ СОСТОЯНИЯ ГИПЕРПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ ШЕЙКИ МАТКИ | 2012 |
|
RU2503960C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВОЗНИКНОВЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2011 |
|
RU2465590C1 |
| US 2005019782 A1, 27.01.2005 | |||
| US 2014087400 A1, 27.03.2014 | |||
| SEMENZA JC et al | |||
| Breast cancer risk and methylenetetrahydrofolate reductase polymorphism | |||
| Breast Cancer Res Treat., 2003, 77(3), p.217-23. | |||
Авторы
Даты
2016-03-27—Публикация
2014-09-02—Подача