Настоящее изобретение относится к способу получения известного тиофенкарбоксамида, более конкретно к способу получения 5-хлор -N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)-фенил]-1,3-оксазолидин-5-ил}-метил)-2-тиофенкарбоксамида в модификации II (его вариантам).
Соединение 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)-фенил]-1,3-оксазолидин-5-ил}-метил)-2-тиофенкарбоксамид известен из патентных заявок WO 01/47949 и WO 2004/060887 и соответствует формуле (I):
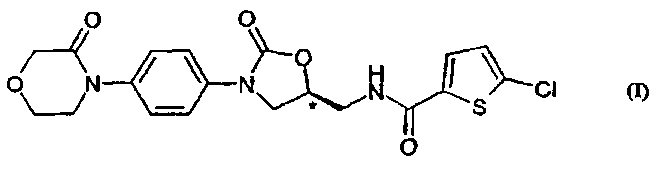
Соединение формулы (I) является низкомолекулярным, принимаемым орально ингибитором фактора свертывания крови Ха, которое может применяться для предупреждения, вторичной профилактики и/или лечения различных заболеваний, вызванных тромбоэмболией (см. заявку WO 01/47919), в особенности инфаркта миокарда, стенокардии (включая нестабильную ангину), реокклюзии и рестеноза после ангиопластики или аортокоронарного шунтирования, кровоизлияния в мозг, транзиторных ишемических атак, периферийного облитерирующего эндартериита, эмболии легочной артерии и глубоких венозных тромбозов.
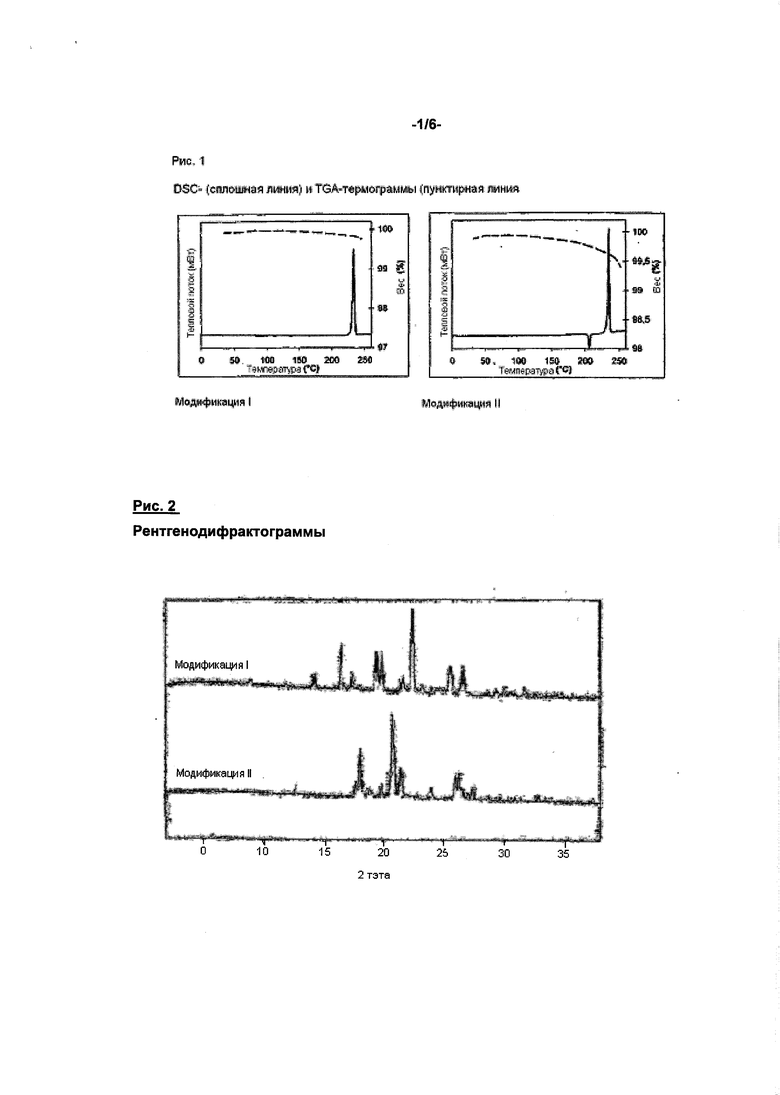
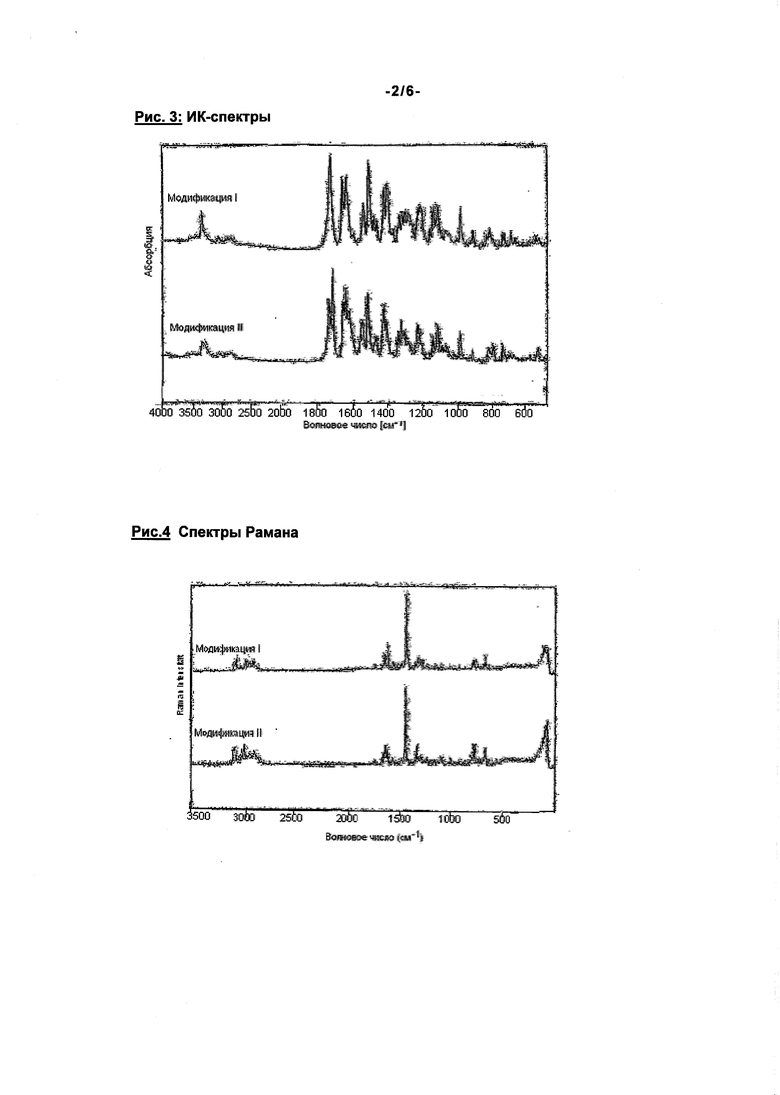
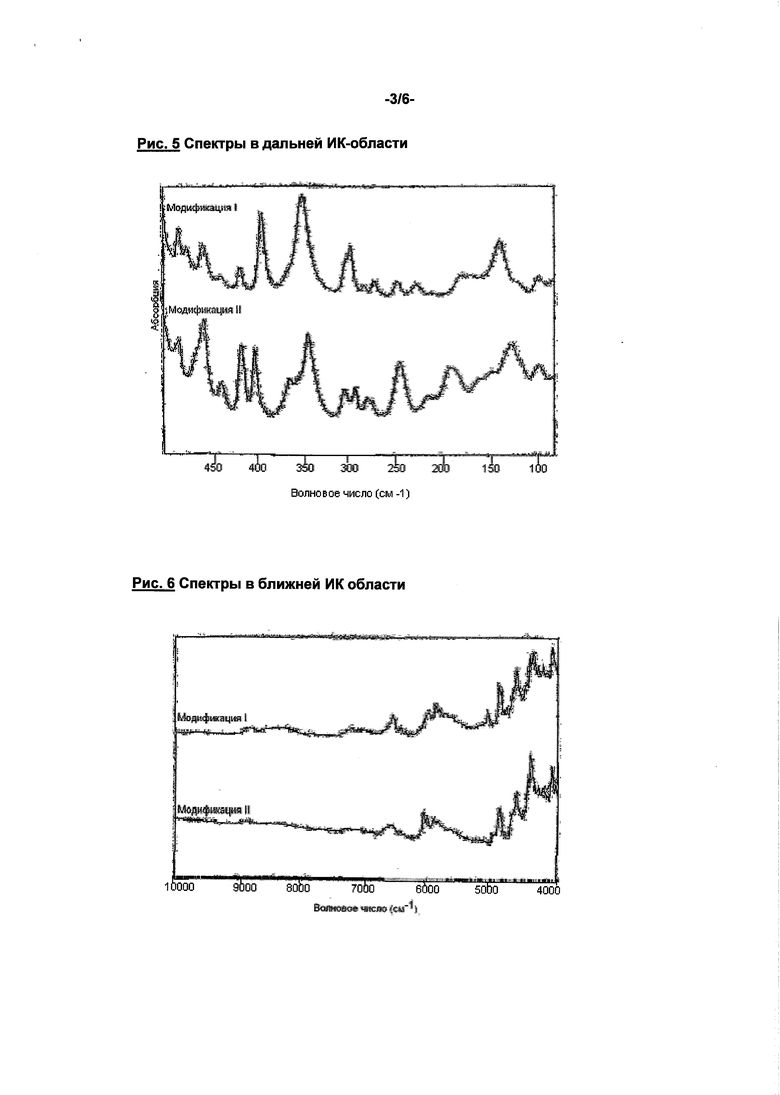
Соединение формулы (I) может быть получено способами, описанными в патентах WO 01/47949 и WO 2004/060887. При этом соединение формулы (I) получается в кристаллической модификации, которая в дальнейшем будет обозначаться как модификация I. Модификация I имеет точку плавления 230°C и характеристическую рентгенодифрактограмму, ИК-спектр, спектр Рамана, спектр в дальней ИК-области и спектр в ближней ИК-области (см. нижеприведенные табл. 1-6 и рис. 1-6).
Неожиданно была найдена еще одна форма вышеуказанного тиофенкарбоксамида формулы I, а именно модификация II.
Поэтому объектом изобретения является способ получения соединения формулы (I)
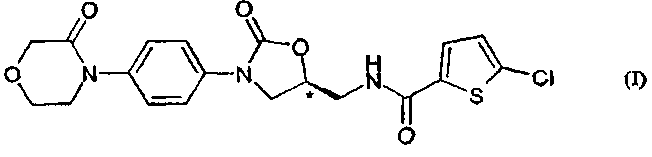
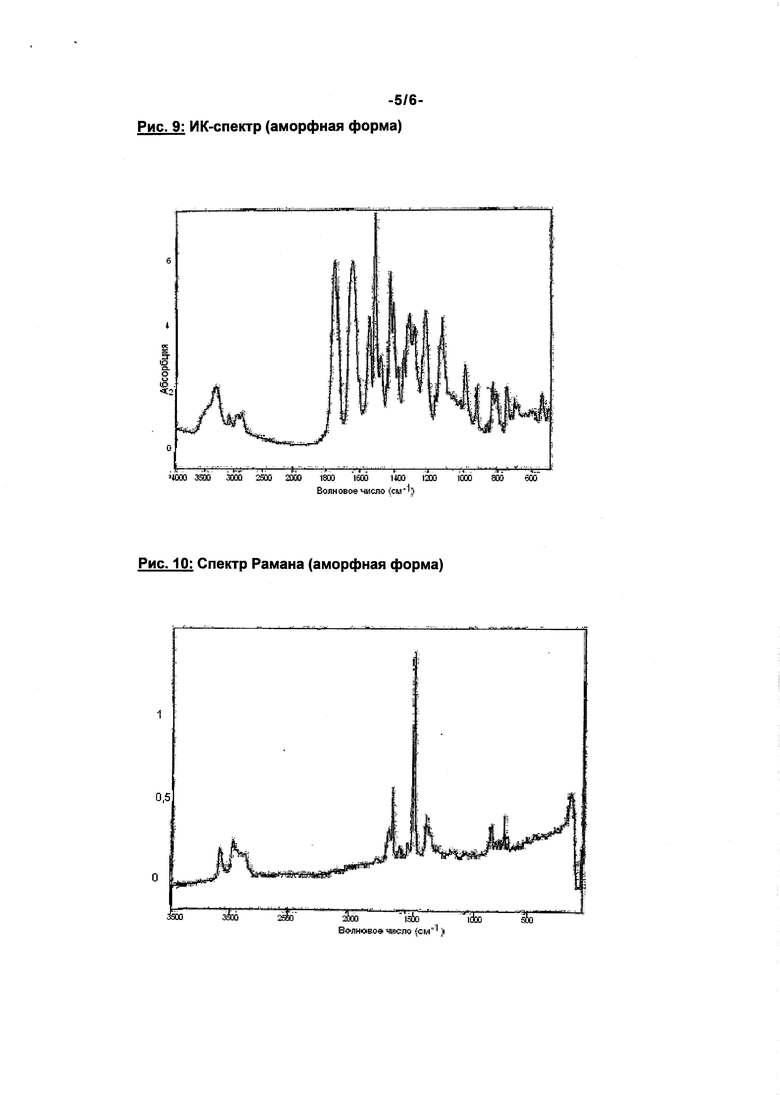
в модификации II, характеризующейся следующими спектральными данными в ближней ИК-области [см-1]:
4086, 4228, 4418, 4457, 4634, 4905, 5846, 5911, 6026, 6081, 6582,
который заключается в том, что соединение формулы (I) в модификации I, характеризующейся следующими спектральными данными в ближней ИК-области [см-1]:
4082, 4142, 4170, 4228, 4299, 4376, 4429, 4479, 4633, 4791, 4877, 4907, 5081, 5760, 5885, 6002, 6441, 6564, 8473, 8833, растворяют в инертном растворителе, выбранном из группы, включающей ацетон, тетрагидрофуран, 1-пентанол и их смеси, и осаждают соединение путем добавки н-гептана при температуре в пределах от 0 до 80°C, предпочтительно в пределах от 20°C до 25°C (далее: "вариант А"),
или
соединение формулы (I) в модификации I, характеризующейся вышеуказанными спектральными данными в ближней ИК-области, растворяют в 1,4-диоксане и раствор выдерживают при температуре в пределах от 30°C, предпочтительно от 50°C, до температуры рефлюкса растворителя до полного испарения растворителя (далее: "вариант Б"),
или
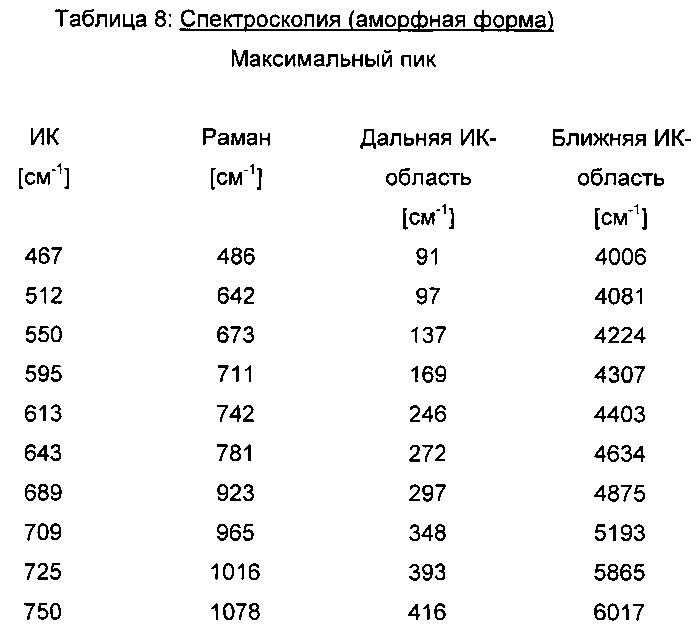
соединение формулы (I) в аморфной форме, характеризующейся следующими спектральными данными в ближней ИК-области [см-1]: 4006, 4081, 4224, 4307, 4403, 4634, 4875, 5193, 5865, 6017, 6073, 6696, 7028, 8452, 8873, суспендируют в этаноле и перемешивают или встряхивают суспензию при температуре в пределах от 20 до 25°C до преобразования, предпочтительно до количественного преобразования, в модификацию II (далее: "вариант В").
В случае варианта А предлагаемого способа получаемый осадок выделяют и высушивают с получением соединения формулы (I) в модификации II.
В случае варианта Б предлагаемого способа в результате полного испарения 1,4-диоксана выкристализовывается целевой продукт формулы I в модификации II.
В случае варианта В предлагаемого способа получаемый в результате преобразования продукт кристаллизации выделяют и высушивают с получением соединения формулы (I) в модификации II.
Установлено, что соединение формулы (I) в модификации (II) имеет более высокую растворимость (почти в 4 раза) по сравнению с известной модификацией I.
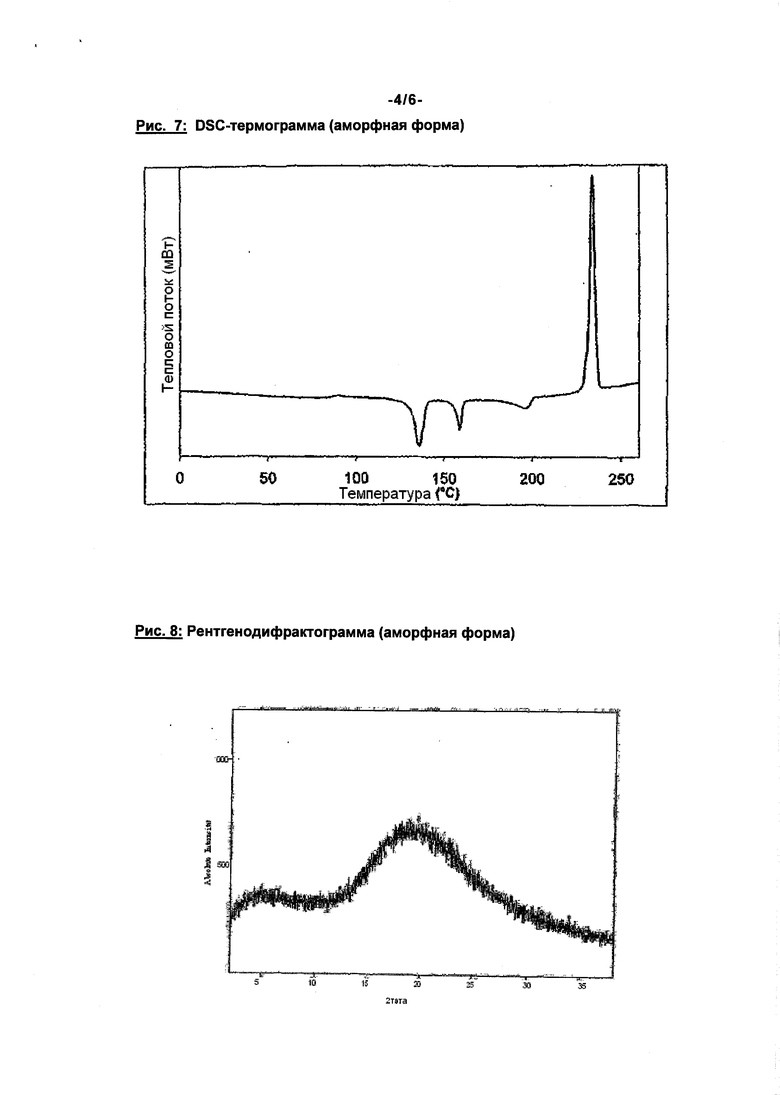
Помимо спектра в ближней ИК-области, представленного на рис. 6, модификация II соединения формулы (I) по сравнению с известной модификацией I имеет также четко отличающиеся рентгенодифрактограмму, ИК-спектр и спектр Римана (см. рис. 2-5). Соединение формулы (I) в модификации II плавится при 203°C, преобразуется соответственно при 195°C и этим четко отличается от модификации I (температура плавления 230°C) (см. рис. 1).
Согласно изобретению соединение формулы (I) в модификации II применяется в фармацевтических препаративных формах с высокой чистотой. В целях стабильности фармацевтическая препаративная форма содержит, в основном, соединение формулы (I) в модификации II и не содержит другие формы в больших долях, как, например, другую модификацию или сольват соединения формулы (I). Предпочтительно лекарственное средство содержит более 90 весовых процентов, особенно предпочтительно более 95 весовых процентов соединения формулы (I) в модификации II относительно общего веса полученного соединения формулы (I). Соединение формулы (I) в модификации II применяется для лечения и/или профилактики болезней, преимущественно болезней и/или осложнений, вызванных тромбоэмболией.
К «заболеваниям, вызванным тромбоэмболией», в смысле данного изобретения, относятся, в особенности, такие болезни, как инфаркт миокарда с подъемом сегмента ST (STEMI) и без подъема сегмента ST (non-STEMI), стабильная стенокардия, реокклюзии и рестенозы после коронарной интервенции, как ангиопластика или аортокоронарное шунтирование, периферийный облитерирующий эндартериит, эмболия легочной артерии, глубокие венозные тромбозы и тромбозы почечной вены, транзиторные ишемические атаки, а также тромболитическое и тромбоэмболическое кровоизлияние в мозг.
Соединение согласно изобретению пригодно поэтому для предупреждения и лечения кардиогенных тромбоэмболий, как, например, хроническая ишемия мозга, апоплексический удар и системные тромбоэмболии и ишемии, для пациентов с острой, перемежающейся или персистирующей сердечной аритмией, как мерцание предсердий, и таких пациентов, которые подвержены дефибриляциям сердца. Модификация II соединения формулы (I) по сравнению с известной модификацией I имеет четко отличающиеся рентгенодифрактограмму, ИК-спектр, спектр Римана, спектр в ближней ИК-области и спектр в дальней ИК-области (см. рис. 2-6). Соединение формулы (I) в модификации II плавится при 203°C, преобразуется, соответственно, при 195°C и этим четко отличается от модификации I (температура плавления 230°C) (см. рис. 1).
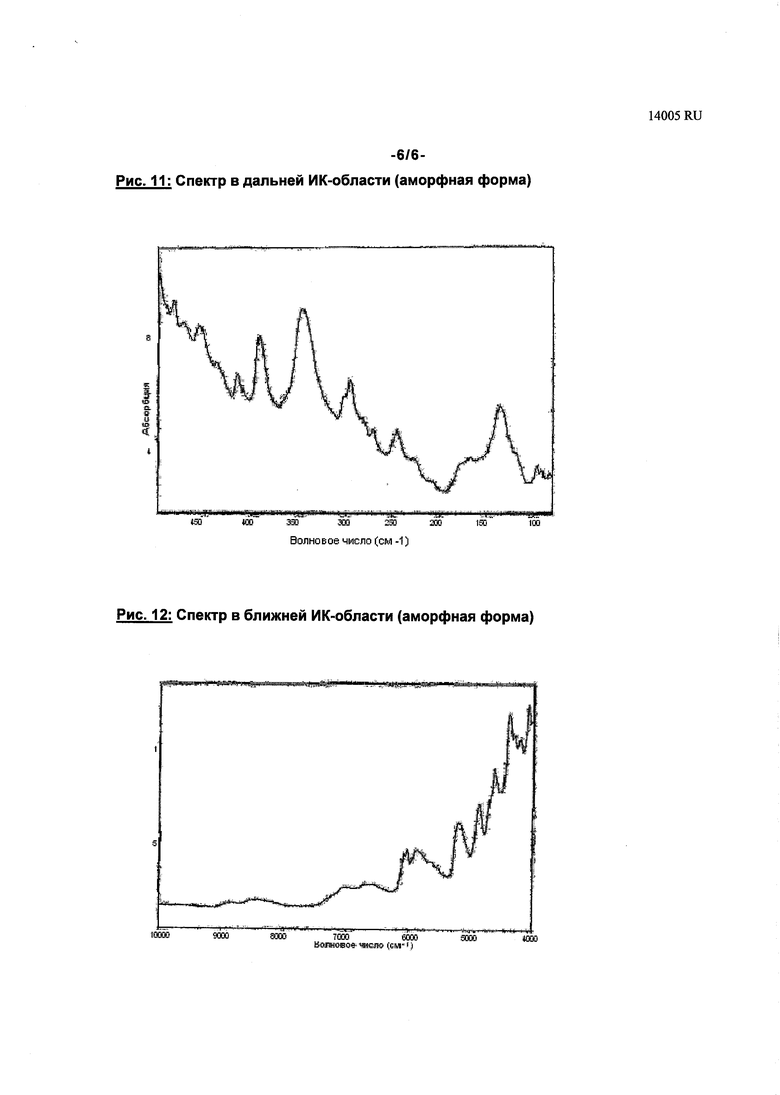
Аморфная форма соединения формулы (I) имеет характеристические рентгенодифрактограмму, спектр в ближней ИК-области, спектр в дальней ИК-области и спектр Римана (см. рис. 8-12). Соединение формулы (I) в аморфной форме имеет температуру стеклования порядка 83°C (см. рис. 7, сплошная линия).
Согласно изобретению соединение формулы (I) в модификации II или в аморфной форме применяется в фармацевтических препаративных формах с высокой чистотой. В целях стабильности фармацевтическая препаративная форма содержит, в основном, соединение формулы (I) в модификации II или в аморфной форме и не содержит другие формы в больших долях, как, например, другую модификацию или сольват соединения формулы (I). Предпочтительно лекарственное средство содержит более 90 весовых процентов, особенно предпочтительно более 95 весовых процентов соединения формулы (I) в модификации II или в аморфной форме относительно общего веса полученного соединения формулы (I). Соединение формулы (I) в модификации II или в аморфной форме применяется для лечения и/или профилактики болезней, преимущественно болезней и/или осложнений, вызванных тромбоэмболией.
К «заболеваниям, вызванным тромбоэмболией», в смысле данного изобретения, относятся, в особенности, такие болезни, как инфаркт миокарда с подъемом сегмента ST (STEMI) и без подъема сегмента ST (non-STEMI), стабильная стенокардия, реокклюзии и рестенозы после коронарной интервенции, как ангиопластика или аортокоронарное шунтирование, периферийный облитерирующий эндартериит, эмболия легочной артерии, глубокие венозные тромбозы и тромбозы почечной вены, транзиторные ишемические атаки, а также тромботическое и тромбоэмболическое кровоизлияние в мозг.
Соединение согласно изобретению пригодно поэтому для предупреждения и лечения кардиогенных тромбоэмболий, как, например, хроническая ишемия мозга, апоплексический удар и системные тромбоэмболии и ишемии, для пациентов с острой, перемежающейся или персистирующей сердечной аритмией, как мерцание предсердий, и таких пациентов, которые подвержены дефибриляциям сердца, для пациентов с заболеваниями клапанов сердца или с искусственными клапанами сердца. Кроме того, соединение согласно изобретению пригодно для лечения диссеминированного внутрисосудистого свертывания (ДВС).
Тромбоэмболические осложнения появляются при микроангиопатической гемолитической анемии, экстракорпоральном кровообращении, как гемодиализ, а также при протезах сердечного клапана.
Кроме того, соединения согласно изобретению подходят для профилактики и/или лечения атеросклеротических заболеваний кровеносных сосудов и воспалительных болезней, как ревматические заболевания двигательного аппарата, а также для профилактики и/или лечения болезни Альцгеймера. Соединение согласно изобретению может также применяться для торможения роста опухолей и образования метастазов, при микроангиопатии, старческой дегенерации желтого пятна, диабетической ретинопатии, диабетической нефропатии и прочих микрососудистых заболеваниях, а также для предупреждения и лечения осложнений, вызванных тромбоэмболией, например венозной тромбоэмболией, для онкологических больных, в особенности таких, которые подвергаются сложным операциям или химио- и радиотерапии.
Соединения согласно изобретению могут применяться и для предотвращения коагуляции вне живого организма, например для консервирования крови и плазмы, для чистки/обработки катетеров и других медицинских инструментов и приборов, для покрытия искусственных поверхностей медицинских препаратов и приборов, используемых в живом организме и вне его, или при биологических пробах, содержащих фактор Ха.
Соединения согласно изобретению могут также применяться в комбинации с другими биологически активными веществами, в особенности для лечения и/или профилактики названных ранее болезней. В качестве пригодных биологически активных веществ могут быть названы, к примеру, и преимущественно следующие вещества:
- средства, понижающие уровень липидов в крови, в особенности ингибиторы НМС-СоА-(3-гидрокси-3-метилглютарил-кофермент А)-редуктазы;
- коронарная терапевтика/вазодилататоры, в особенности ингибиторы АПФ (ангиотензинпревращающего фермента); антагонисты рецептора АII- (ангиотензин II); антагонисты β-адреноцептора; антагонисты альфа-1-адреноцептора; мочегонное средство; блокиратор канала кальция-В; вещества, способствующие повышению циклического гуанозинмонофосфата (цГМФ), как, например, стимуляторы растворимой гуанилатциклазы;
- активаторы плазминогена (тромболитики/фибринолитики) и соединения, повышающие тромболиз/фибринолиз, как замедлители ингибитора активатора плазминогена (PAI-ингибиторы) или замедлители ингибитора тромбин-активаторов фибринолиза (TAFI-ингибиторы);
- вещества, препятствующие свертыванию крови (антикоагулянты);
- вещества, тормозящие слияние бляшек (тормоз слияния бляшек, тормоз слияния тромбоцитов);
- а также антагонисты рецептора фибриногена (антагонисты гликопротеина IIb/IIIa).
Соединения согласно изобретению могут действовать системно и/или локально. Для этого можно выбрать соответствующий способ введения, например оральный, парентеральный, легочный, назальный, сублингвальный, лингвальный, буккальный, ректальный, дермальный, трансдермальный, конъюнктивальный, ушной или применять в виде имплантата или стента.
Для этих способов приема соединения согласно изобретению могут отпускаться в соответствующих подходящих формах применения.
Для орального применения пригодны формы, быстро и/или модифицированно высвобождающие соединение согласно изобретению, которые содержат соединение формулы (I) в модификации II или в аморфной форме, как, например, таблетки (без покрытия или с покрытием, например, устойчивым к действию желудочного сока, или покрытием, растворимым с задержкой или нерастворимым, контролирующим высвобождение соединения согласно изобретению), быстро растворяющиеся в полости рта таблетки или пленки/облатки, пленки/лиофилизаты, капсулы (к примеру, капсулы в твердом или мягком желатине), драже, гранулы, пеллеты, порошок, суспензии или аэрозоли.
Парентеральный прием может производиться без стадии всасывания (например, внутривенный, внутриартериальный, внутрисердечный, внутриспинальный или внутрипоясничный) или с включением всасывания (к примеру, внутримышечный, подкожный, внутрикожный, вводимый через кожу или внутрибрюшинный). Для парентерального применения пригодны такие лекарственные формы, как препараты для инъекций и вливаний в форме суспензий, лиофилизатов или стерильных порошков.
Для прочих путей введения пригодны, например, лекарственные формы для ингаляции (среди прочих порошковые ингаляторы, распылители), лингвально, сублингвально или буккально принимаемые таблетки, пленки/облатки или капсулы, суппозитории, ушные или глазные препараты, вагинальные капсулы, водные суспензии (лосьоны, микстуры), жирорастворимые суспензии, мази, кремы, трансдермальные терапевтические системы (например, пластыри), молоко, пасты, пенки, присыпки, имплантанты или стенты (тюбики).
Предпочтительным является оральное или парентеральное введение, особенно оральное введение. Соединение согласно изобретению может быть переведено в указанные формы применения. Это может быть сделано известным изготовителю способом путем смешивания с инертными, нетоксичными, фармацевтически приемлемыми добавками. К таким добавкам относятся, среди прочих, носители (к примеру, микрокристаллическая целлюлоза, лактоза, маннитол), растворители (например, жидкий полиэтиленгликоль), эмульгаторы и диспергаторы или смачиватели (например, лаурилсульфат натрия, олеат полиоксисорбита), связывающие вещества (например, поливинилпирролидон), синтетические или природные полимеры (к примеру, альбумин), стабилизаторы (к примеру, антиоксиданты, как аскорбиновая кислота), красители (к примеру, неорганические пигменты как оксид железа) и добавки для вкуса и/или запаха.
В целом было обнаружено, что при парентеральном применении для достижения действенных результатов предпочтительное количество приема составляет от 0,001 до 1 мг/кг, предпочтительное 0,01 - 0,5 мг/кг веса тела. При оральном применении дозировка составляет 0,01 - 100 мг/кг, предпочтительно 0,01 -20 мг/кг и совсем предпочтительно 0,1-10 мг/кг веса тела.
Тем не менее, при необходимости может потребоваться отклониться от названных количеств, а именно в зависимости от веса тела, пути введения, индивидуальной переносимости активного вещества, способа приготовления и времени или интервала приема. Так, в некоторых случаях может быть достаточно обойтись количеством, меньшим, чем минимально названное, в то время как в других случаях должно быть превышено названное верхнее предельное количество. В случае применения больших количеств рекомендуется разделить дозу на несколько приемов в день.
Приведенные в следующих примерах процентные данные являются, если нет другого указания, весовыми процентами, доли - массовыми долями. Соотношения растворителей, степени разбавления и данные концентрации водно-водных растворов приведены относительно объемов.
Примеры выполнения
Термограммы были получены с применением дифференциального сканирующего калориментра DSC 7 или Pyris-1 и термогравиметрического анализатора TGA 7 фирмы Perkin-Elmer. Рентгенодифрактограммы были записаны в трансмиссионном дифрактометре Stoe. Спекторы ИК, в дальней ИК-области, в ближней ИК-области и Рамана были сняты с помощью Фурье-ИК-спетрометров IFS 66 м (ИК, дальняя область ИК), IFS 28/N (ближняя ИК-область) и RFS 100 (спекторы Рамана) фирмы Bruker.
Пример 1: Получение 5-хлор-1N-(1(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)-фенил]-1,3-оксазолидин-5-ил)-метил)-2-тиофенкарбоксамида в модификации II
Пример 1.1
Приблизительно 200 мг 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)-фенил]-1,3-оксазолидин-5-ил}-метил)-2-тиофенкарбоксамида в модификации I растворялись в 80 мл тетрагидрофурана при нагревании. Раствор фильтровался и делился пополам. К одной половине при комнатной температуре добавлялся н-гептан до выпадения биологически активного вещества в осадок. Осадок отфильтровывался и высушивался при комнатной температуре. По результатам рентгенодифрактометрии он соответствовал названному в заглавии соединению в модификации II.
Пример 1.2
Приблизительно 200 мг 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)-фенил]-1,3-оксазолидин-5-ил}-метил)-2-тиофенкарбоксамида в модификации I растворялись при нагревании в 40 мл 1-пентанола. Раствор фильтровался и делился пополам. К одной половине добавлялся н-гептан до выпадения биологически активного вещества в осадок. Осадок отфильтровывался и высушивался при комнатной температуре. По результатам рентгенодифрактометрии он соответствовал названному в заглавии соединению в модификации II.
Пример 1.3
Приблизительно 200 мг 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)-фенил]-1,3-оксазолидин-5-ил}-метил)-2-тиофенкарбоксамида в модификации I растворялись при нагревании в 40 мл 1,4-диоксана. Раствор фильтровался и делился пополам. Одна половина выдерживалась в сушильном шкафу при 50°C до полного испарения растворителя. По результатам рентгенодифрактометрии осадок соответствовал названному в заглавии соединению в модификации II.
Пример 1.4
Приблизительно 50 мг 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)-фенил]-1,3-оксазолидин-5-ил}-метил)-2-тиофенкарбоксамида в аморфной форме, полученного расплавлением модификации I указанного тиофенкарбоксиамида в печи Кофлера при 240°C и последующим мгновенным остыванием до комнатной температуры, были суспендированы в 2 мл этанола и перемешивались в течение 0,5 часа при 25°C. Продукт кристаллизации выделялся и высушивался. По результатам рентгенодифрактометрии осадок соответствовал названному в заглавии соединению в модификации II.
Пример 1.5
Приблизительно 100 мг 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)-фенил]-1,3-оксазолидин-5-ил}-метил)-2-тиофенкарбоксамида в модификации I растворялись при нагревании в 50 мл ацетона. Раствор фильтровался и в ледяной бане добавлялся н-гептан, пока не осядет биологически активное вещество. Осадок отфильтровывался и высушивался при комнатной температуре. По результатам рентгенодифрактометрии осадок соответствовал названному в заглавии соединению в модификации II.
Данные, характеризующие соединение формулы (I) в известной модификации I и в предлагаемой модификации II, сведены в следующих таблицах 1-6.




Пример 2: Получение 5-хлор-N-(((5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)-Фенил]-1.3-оксазолидин-5-ил}-метил)-2-тиофенкарбоксамида в аморфной форме
Пример 2.1
Приблизительно 50 мг 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)-фенил]-1,3-оксазолидин-5-ил}-метил)-2-тиофенкарбоксамида в модификации I расплавлялись в печи Кофлера при 240°C и затем мгновенно охлаждались до комнатной температуры. Исследования активного вещества на рентгенодифрактометре показали, что оно имеет аморфную форму.
Пример 2.2
Приблизительно 3 г 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)-фенил]-1,3-оксазолидин-5-ил}-метил)-2-тиофенкарбоксамида в модификации I расплавлялись в сушильном шкафу при 250°C и затем мгновенно охлаждались до комнатной температуры. Исследования активного вещества на рентгенодифрактометре показали, что оно имеет аморфную форму.
Данные, характеризующие соединение формулы (I) в аморфной форме, сведены в таблицах 7,8.
Таблица 7: Дифференциальная сканирующая калориметрия и термогравиметрия (аморфная форма)
Температура стеклования около 83°C

Изобретение относится к способу получения 5-xлop-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)-фенил]-1,3-оксазолидин-5-ил}метил)-2-тиофенкарбоксамида, представленного формулой I, в модификации (II) (его вариантам). Способ получения соединения формулы (I) в модификации II, характеризующейся следующими спектральными данными в ближней ИК-области [см-1]: 4086, 4228, 4418, 4457, 4634, 4905, 5846, 5911, 6026, 6081, 6582, заключается в том, что соединение формулы (I) в модификации I, характеризующейся следующими спектральными данными в ближней ИК-области [см-1]: 4082, 4142, 4170, 4228, 4299, 4376, 4429, 4479, 4633, 4791, 4877, 4907, 5081, 5760, 5885, 6002, 6441, 6564, 8473, 8833, растворяют в инертном растворителе, выбранном из группы, включающей ацетон, тетрагидрофуран, 1-пентанол и их смеси, и осаждают соединение путем добавки н-гептана при температуре в пределах от 0 до 80°C. Также способ получения соединения формулы (I), в модификации II, осуществляют путем растворения соединения (I) в модификации I, в 1,4-диоксане, выдерживая раствор при температуре в пределах от 30°C до температуры рефлюкса растворителя до полного испарения растворителя. Способ получения соединения формулы (I) в модификации II осуществляют путем суспендирования соединения (I) в модификации I в этаноле при перемешивании или встряхивании суспензии при температуре в пределах от 20 до 25°C до преобразования в модификацию II. Технический результат - получение 5-xлop-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолинил)-фенил]-1,3-оксазолидин-5-ил}метил)-2-тиофенкарбоксамида, представленного формулой I, в модификации II, обладающей высокой растворимостью. 3 н. и 1 з.п. ф-лы, 12 ил., 7 табл., 2 пр.
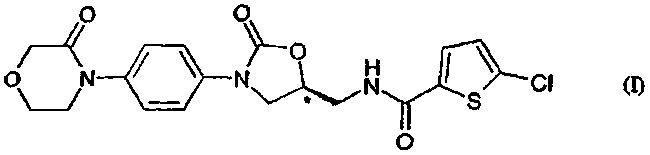
1. Способ получения соединения формулы (I)

в модификации II, характеризующейся следующими спектральными данными в ближней ИК-области [см-1]:
4086, 4228, 4418, 4457, 4634, 4905, 5846, 5911, 6026, 6081, 6582, отличающийся тем, что соединение формулы (I) в модификации I, характеризующейся следующими спектральными данными в ближней ИК-области [см-1]:
4082, 4142, 4170, 4228, 4299, 4376, 4429, 4479, 4633, 4791, 4877, 4907, 5081, 5760, 5885, 6002, 6441, 6564, 8473, 8833,
растворяют в инертном растворителе, выбранном из группы, включающей ацетон, тетрагидрофуран, 1-пентанол и их смеси, и осаждают соединение путем добавки н-гептана при температуре в пределах от 0 до 80°C.
2. Способ получения соединения формулы (I)
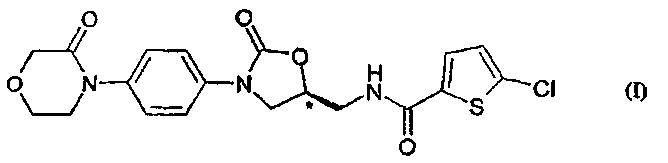
в модификации II, характеризующейся следующими спектральными данными в ближней ИК-области [см-1]:
4086, 4228, 4418, 4457, 4634, 4905, 5846, 5911, 6026, 6081, 6582,
отличающийся тем, что соединение формулы (I) в модификации I, характеризующейся следующими спектральными данными в ближней ИК-области [см-1]:
4082, 4142, 4170, 4228, 4299, 4376, 4429, 4479, 4633, 4791, 4877, 4907, 5081, 5760, 5885, 6002, 6441, 6564, 8473, 8833,
растворяют в 1,4-диоксане и раствор выдерживают при температуре в пределах от 30°C до температуры рефлюкса растворителя до полного испарения растворителя.
3. Способ получения соединения формулы (I)
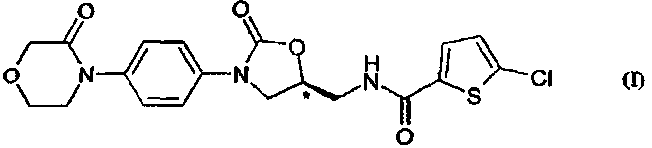
в модификации II, характеризующейся следующими спектральными данными в ближней ИК-области [см-1]:
4086, 4228, 4418, 4457, 4634, 4905, 5846, 5911, 6026, 6081, 6582,
отличающийся тем, что соединение формулы (I) в аморфной форме, характеризующейся следующими спектральными данными в ближней ИК-области [см-1]:
4006, 4081, 4224, 4307, 4403, 4634, 4875, 5193, 5865, 6017, 6073, 6696, 7028, 8452, 8873,
суспендируют в этаноле и перемешивают или встряхивают суспензию при температуре в пределах от 20 до 25°C до преобразования в модификацию II.
4. Способ по п. 3, отличающийся тем, что перемешивают или встряхивают суспензию до количественного преобразования в модификацию II.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| DE 10129725 A1, 02.01.2003 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| ROEHRIG S | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2016-03-27—Публикация
2006-09-22—Подача