Перекрестные ссылки на смежные заявки
Настоящая заявка испрашивает приоритет по предварительной заявке США № 61/245,315, поданной 24 сентября 2009 г., предварительной заявке США № 61/255,582, поданной 28 октября 2009 г., предварительной заявке США № 61/314,629, поданной 17 марта 2010 г., предварительной заявке США № 61/358,167, поданной 24 июня 2010 г., заявке на патент США № 12/887,544, поданной 22 сентября 2010 г., и заявке на патент США № 12/887,552, поданной 22 сентября 2010 г. Полное описание указанных выше заявок на патент США включено в настоящий документ путем ссылки для любых целей.
Предпосылки создания изобретения
Фармацевтические средства, предназначенные для перорального введения, как правило, имеют форму таблеток. Таблетки глотают целиком, разжевывают или рассасывают в полости рта. Мягкие таблетки, которые разжевываются или растворяются в полости рта, часто применяют при введении фармацевтических средств, при которых проглатывание таблетки целиком является нецелесообразным. В случае жевательных таблеток разжевывание способствует распаду составляющих таблетку частиц в процессе рассасывания таблетки и может увеличить скорость всасывания в пищеварительном тракте. Мягкие таблетки также являются благоприятными в тех случаях, когда необходимо обеспечить доступ к фармацевтически активному веществу при топическом введении в полость рта или горло для обеспечения местного воздействия и/или системного всасывания. Мягкие таблетки также используют для облегчения введения лекарственных средств у детей и пациентов пожилого возраста. Мягкие таблетки для рассасывания в полости рта до проглатывания особенно предпочтительны при назначении детям для улучшения соответствия требованиям к лекарственным средствам.
Мягкие таблетки по существу изготавливают путем прессования смеси порошкообразных ингредиентов, и они, как правило, содержат фармацевтически активное вещество, ароматизатор и/или связующие вещества. Порошковую смесь, как правило, подают в полость пресс-формы таблеточного пресса и формируют таблетку путем приложения давления. Твердость полученной таблетки зависит непосредственно от используемого при прессовании давления и совместимости ингредиентов в составе. Более мягкую таблетку, которую легче раскусить, можно получить путем приложения более низкого давления. Полученная таблетка является более мягкой, но также более хрупкой и ломкой, и недостатком является то, что ее производство может включать в себя сложные и дорогостоящие технологические этапы. Примеры мягких таблеток для рассасывания в полости рта без разжевывания раскрыты в патентах США №№ 5,464,632, 5,223,264, 5,178,878, 6,589,554 и 6,224,905.
Существует потребность в эстетически приятных жевательных таблетках и таблетках для рассасывания в полости рта, при изготовлении которых используют таблеточные машины на основе прессования, которые, как правило, используются для производства твердых таблеток для проглатывания с высокой плотностью. При использовании низкой сжимающей силы данные машины, как правило, производят очень хрупкие таблетки, обладающие недостаточной прочностью при упаковке, транспортировке и хранении. Настоящее изобретение относится к раскрытию способа изготовления таблеток, таких как жевательные таблетки или таблетки для рассасывания в полости рта, с использованием радиочастотного излучения (РЧ-излучения), при котором можно использовать высокоскоростные таблеточные машины.
Изложение сущности изобретения
В одном аспекте настоящее изобретение относится к способу изготовления таблетки путем прессования порошковой смеси в плите пресс-формы для образования таблетированной формы, причем порошковая смесь включает в себя фармацевтически активное вещество и плавкое связующее вещество, и приложения к таблетированной форме радиочастотного излучения в течение времени, достаточного для размягчения или расплавления связующего вещества в таблетированной форме для образования таблетки. В одном варианте осуществления полученная таблетка представляет собой таблетку для рассасывания в полости рта.
В одном аспекте настоящее изобретение относится к таблетке, содержащей первый слой и второй слой, причем: (i) первый слой включает в себя фармацевтически активное вещество, а композиция первого слоя отличается от композиции второго слоя; (ii) плотность таблетки составляет менее приблизительно 0,8 г/см3; и (iii) рассасывание таблетки в полости рта при помещении на язык занимает менее приблизительно 30 с.
В другом аспекте настоящее изобретение относится к способу изготовления таблетки, содержащей первый слой и второй слой, включающему этапы, на которых: (i) добавляют первую порошковую смесь на плиту пресс-формы, причем первая порошковая смесь включает в себя фармацевтически активное вещество и связующее вещество; (ii) добавляют вторую порошковую смесь на плиту пресс-формы, причем вторая порошковая смесь включает в себя связующее вещество, а композиция второй порошковой смеси отличается от композиции первой порошковой смеси; (iii) прессуют первую порошковую смесь и вторую порошковую смесь на плите пресс-формы для образования таблетированной формы; и (iv) прилагают к таблетированной форме излучение в течение периода времени, достаточного для активации связующих веществ внутри таблетированной формы для сплавления таблетированной формы в таблетку таким образом, чтобы плотность таблетки составляла менее приблизительно 0,8 г/см3, а таблетка рассасывалась в полости рта при помещении ее на язык в течение менее приблизительно 30 с.
Другие особенности и преимущества настоящего изобретения станут понятны из подробного описания настоящего изобретения и формулы изобретения.
Краткое описание чертежей
На ФИГ. 1A-F представлены виды сбоку в сечении варианта осуществления настоящего изобретения, на которых показан процесс производства таблетки 4a из порошковой смеси 4 в плите пресс-формы 2.
На ФИГ. 2A-H представлены виды сбоку в сечении варианта осуществления настоящего изобретения, на которых показан процесс производства двухслойной таблетки 12 из порошковых смесей 10 и 11 в плите пресс-формы 2.
На ФИГ. 3A-G представлены виды сбоку в сечении варианта осуществления настоящего изобретения, на которых показан процесс производства таблетки 40, содержащей предварительно образованные вставки 30 и 31, из порошковой смеси 20 в плите пресс-формы 2.
На ФИГ. 4A и 4B представлен вид в перспективе станка с делительно-поворотным столом 195.
На ФИГ. 5A и 5B представлены виды сверху станка с делительно-поворотным столом 195 в положении останова.
На ФИГ. 6A и 6B представлены виды в сечении нижнего формовочного узла 110 в положении, соответствующем началу производственного цикла.
На ФИГ. 7 представлен вид в сечении станка с делительно-поворотным столом и РЧ-блоком 195 до прессования порошковой смеси 101.
На ФИГ. 8 представлен вид в сечении станка с делительно-поворотным столом и РЧ-блоком 195, на котором показан процесс производства таблеток 101a.
На ФИГ. 9 представлен вид в сечении блока выталкивания таблеток 160 до выталкивания таблеток 101a.
На ФИГ. 10 представлен вид в сечении блока выталкивания таблеток 160 после выталкивания таблеток 101a в блистер 190.
На ФИГ. 11A-D представлены виды в сечении альтернативных вариантов осуществления формовочных устройств и плиты пресс-формы.
На ФИГ. 12 A-D представлены виды в сечении альтернативных вариантов осуществления формовочных устройств и плиты пресс-формы.
На ФИГ. 13A представлен вид в сечении формовочных устройств с волнообразной поверхностью.
На ФИГ. 13B представлен вид в перспективе формовочных устройств с волнообразной поверхностью.
На ФИГ. 14 представлен вид в сечении формовочных устройств с выступами на поверхности.
Подробное описание изобретения
Предполагается, что любой специалист в данной области может воспользоваться всеми возможностями изобретения с помощью приведенного в настоящем документе описания. Следующие специфические варианты осуществления могут рассматриваться лишь в качестве примеров, которые ни в коей мере не ограничивают раскрываемую сущность настоящего изобретения.
Если не указано другое, все технические и научные термины, используемые в настоящем документе, имеют значения, понятные специалистам в области, к которой относится настоящее изобретение. Все публикации, заявки на патенты, патенты и другие указанные в настоящем документе документы также включены в настоящий документ путем ссылки. В настоящем документе все процентные отношения приводятся по весу, если не указано другое.
Как описано выше, в одном аспекте настоящее изобретение относится к способу изготовления таблетки путем прессования порошковой смеси в плите пресс-формы для образования таблетированной формы, причем порошковая смесь включает в себя фармацевтически активное вещество и плавкое связующее вещество, а также приложения к таблетированной форме радиочастотного излучения в течение времени, достаточного для размягчения или расплавления связующего вещества в таблетированной форме для образования таблетки.
Порошковая смесь
Как описано выше, таблетку производят путем прессования порошковой смеси, содержащей фармацевтически активное вещество (описанное в настоящем документе), связующее вещество (описанное в настоящем документе) и необязательно фармацевтически приемлемый носитель. Примеры связующих веществ включают в себя без ограничений плавкие связующие вещества и связующие материалы, активируемые водой. Носитель содержит один или более применимых эксципиентов для получения таблеток. Примеры применимых эксципиентов включают в себя без ограничений наполнители, адсорбенты, разрыхлители, смазывающие вещества, скользящие вещества, подсластители, суперразрыхлители, вкусоароматические добавки, антиоксиданты, консерванты, загустители, а также их смеси. В одной частице порошковой смеси могут присутствовать один или более из описанных выше ингредиентов.
Применимые наполнители включают в себя без ограничений углеводы (как описано в настоящем документе) и нерастворимые в воде пластически деформируемые материалы (например, микрокристаллическая целлюлоза или другие производные целлюлозы), а также их смеси.
Применимые адсорбенты включают в себя без ограничений нерастворимые в воде адсорбенты, такие как дикальцийфосфат, трикальцийфосфат, силикатированная микрокристаллическая целлюлоза (например, такая как целлюлоза, доступная в продаже под маркой PROSOLV, производство PenWest Pharmaceuticals, г. Паттерсон, штат Нью-Йорк), алюмометасиликат магния (например, такой как алюмометасиликат магния, доступный в продаже под маркой NEUSILIN, производство компании Fuji Chemical Industries (USA) Inc., г. Роббинсвилль, штат Нью-Джерси), глины, кремнеземы, бентонит, цеолиты, силикаты магния, гидроталькит, вигум, а также их смеси.
Применимые разрыхлители включают в себя без ограничений натриевую соль гликолята крахмала, поперечносшитый поливинилпирролидон, поперечносшитую карбоксиметилцеллюлозу, крахмалы, микрокристаллическую целлюлозу и их смеси.
Применимые смазывающие вещества включают в себя без ограничений длинноцепочечные жирные кислоты и их соли, такие как стеарат магния и стеариновая кислота, тальк, глицеридные воски и их смеси.
Применимые скользящие вещества включают в себя без ограничений коллоидный диоксид кремния.
Примеры подсластителей включают в себя без ограничений синтетические или натуральные сахара; искусственные подсластители, такие как сахарин, сахарин натрия, аспартам, ацесульфам, тауматин, глицирризин, сукралоза, дигидрохалькон, алитам, миракулин, монеллин и стевиозид; сахарные спирты, такие как сорбит, маннит, глицерин, лактит, мальтит и ксилит; сахара, выделенные из сахарного тростника и сахарной свеклы (сахароза), декстрозу (также называемую глюкозой), фруктозу (также называемую левулозой) и лактозу (также называемую молочным сахаром); изомальт, а также их соли и смеси.
Примеры суперразрыхлителей включают в себя без ограничений кроскармеллозу натрия, натриевую соль гликолята крахмала и поперечносшитый повидон (кросповидон). В одном варианте осуществления таблетка содержит до приблизительно 5 вес.% таких суперразрыхлителей.
Примеры вкусоароматических добавок включают в себя без ограничений эфирные масла, включая дистиллированные, экстрагированные растворителями или холодным прессованием измельченные цветы, листья, очищенные или превращенные в волокнистую массу целые фрукты, содержащие смеси спиртов, эфиров, альдегидов и лактонов; эссенции, включающие либо разбавленные растворы эфирных масел, либо смеси синтетических химических соединений, смешанных для имитации естественных запахов фруктов (например, клубники, малины и черной смородины); искусственные и природные запахи пива и алкогольных напитков, например, коньяка, виски, рома, джина, хереса, портвейна и вина, табака, кофе, чая, какао и мяты; фруктовые соки, включая сок, выдавленный из промытых и очищенных фруктов, таких как лимон, апельсин и лайм, побеги мяты, перечная мята, винтергрен, корица, какао, ваниль, лакрица, ментол, эвкалипт, анисовое семя, орехи, например, арахис, кокос, лесной орех, каштан, грецкий орех и орех колы, миндаль, изюм; пудра, мука или части растительных материалов, включая части растения табака, например, рода Nicotiana, в количествах, незначительно повышающих уровень никотина, а также имбирь.
Примеры антиоксидантов включают в себя без ограничений токоферолы, аскорбиновую кислоту, пиросульфит натрия, бутилгидрокситолуен, бутилированный гидроксианизол, этилендиаминтетрауксусную кислоту и ее соли, а также их смеси.
Примеры консервантов включают в себя без ограничений лимонную кислоту, винную кислоту, молочную кислоту, оксиянтарную кислоту, уксусную кислоту, бензойную кислоту и сорбиновую кислоту, а также их смеси.
Примеры загустителей включают в себя без ограничений пектин, полиэтиленоксид и каррагинан, а также их смеси. В одном варианте осуществления уровни загустителей составляют от приблизительно 0,1% до приблизительно 10 вес.%.
В одном варианте осуществления настоящего изобретения средний размер частиц порошковой смеси составляет менее 500 мкм, как например, от приблизительно 50 мкм до приблизительно 500 мкм, как например, от приблизительно 50 мкм до 300 мкм. В частности, частицы данного размера используют при прямом прессовании.
В одном варианте осуществления порошковая смесь/таблетка по существу не содержит суперразрыхлителей. В настоящем документе «по существу не содержит» означает содержание менее 5%, как например, менее 1%, как например, менее 0,1%, как например, полное отсутствие (например, 0%). Примеры суперразрыхлителей включают в себя без ограничений гликолят крахмала, поперечносшитый поливинилпирролидон и поперечносшитую карбоксиметилцеллюлозу.
В одном варианте осуществления порошковая смесь/таблетка по существу не содержит нерастворимых в воде наполнителей прямого прессования. Нерастворимые в воде наполнители включают в себя без ограничений микрокристаллическую целлюлозу, микрокристаллическую целлюлозу прямого прессования, целлюлозы, нерастворимые в воде целлюлозы, крахмал, кукурузный крахмал и модифицированные крахмалы. Как описано в данном варианте осуществления, «по существу не содержит» означает содержание менее 2 процентов, например, менее 1 процента или ни одного.
Плавкое связующее вещество
В одном варианте осуществления порошковая смесь/таблетка, составляющая предмет настоящего изобретения, включает в себя по меньшей мере одно плавкое связующее вещество. В одном варианте осуществления температура плавления плавкого связующего вещества составляет от приблизительно 30°C до приблизительно 140°C, как например, от приблизительно 40°C до приблизительно 140°C, как например от приблизительно 55°C до приблизительно 100°C. Размягчение или расплавление плавкого(их) связующего(их) вещества (веществ) приводит к спеканию таблетированной формы благодаря связыванию размягченного или расплавленного связующего вещества с фармацевтически активным веществом и/или другими ингредиентами в прессованной порошковой смеси.
В одном варианте осуществления плавкое связующее вещество представляет собой связующее вещество, расплавляемое РЧ-излучением. Под связующим веществом, расплавляемым РЧ-излучением, понимается твердое связующее вещество, способное размягчаться или плавиться под воздействием радиочастотного (РЧ) излучения. Связующее вещество, расплавляемое РЧ-излучением, как правило, является полярным и может снова застывать или затвердевать при охлаждении.
В одном варианте осуществления связующее вещество, расплавляемое РЧ-излучением, представляет собой связующее вещество, не расплавляемое РЧ-излучением. В таком варианте осуществления порошковая смесь содержит эксципиент, который нагревается при обработке РЧ-излучением (например, полярный эксципиент) таким образом, что полученное тепло способно размягчить или расплавить плавкое связующее вещество. Примеры таких эксципиентов включают в себя без ограничений полярные жидкости, такие как вода и глицерин; порошковые металлы и соли металлов, такие как порошковое железо, хлорид натрия, гидроксид алюминия и гидроксид магния; стеариновую кислоту; мальтодекстрин и стеарат натрия.
Другие примеры плавких связующих веществ включают в себя аморфные полимеры углеводов. Под «аморфными полимерами углеводов» понимают молекулу, имеющую множество мономеров углеводов, причем такая молекула имеет уровень кристалличности менее 20%, как например, менее 10%, как например, менее 5%. Примеры аморфных полимеров углеводов включают в себя без ограничений гидрогенизированный гидролизат крахмала, полидекстрозу и олигосахариды. Примеры олигосахаридов включают в себя без ограничений фруктоолигосахарид, галактоолигосахарид, мальтоолигосахарид, инулин и изомальтоолигосахарид.
Примеры применимых плавких связующих веществ включают в себя: жиры, такие как кокосовое масло, гидрогенизированное растительное масло, такое как косточковое пальмовое масло, хлопковое масло, подсолнечное масло и соевое масло; моно-, ди- и триглицериды; фосфолипиды; цетиловый спирт; воски, такие как карнаубский воск, спермацетовый воск, пчелиный воск, канделильский воск, шеллачный воск, микрокристаллический воск и парафиновый воск; растворимые в воде полимеры, такие как полиэтиленгликоль, поликапролактон, GlycoWax-932, глицериды лауроил-макрогола-32 и глицериды стеароил-макрогола-32; полиэтиленоксиды и эфиры сахарозы.
В одном варианте осуществления плавкое связующее вещество представляет собой связующее вещество, расплавляемое РЧ-излучением, а связующее вещество, расплавляемое РЧ-излучением, представляет собой полиэтиленгликоль (ПЭГ), такой как ПЭГ-4000. Особенно предпочтительное связующее вещество, расплавляемое РЧ-излучением, представляет собой ПЭГ, содержащий по меньшей мере 95 вес.% частиц ПЭГ размером менее 100 мкм (измеряется стандартными способами, такими как рассеяние света или лазерное излучение, либо гранулометрический анализ) с молекулярной массой от 3000 до 8000 дальтон.
Связующее(ие) вещество(а) может (могут) составлять от приблизительно 0,01 процента до приблизительно 70 процентов порошковой смеси/таблетки, как например, от приблизительно 1 процента до приблизительно 50 процентов, как например, от приблизительно 10 процентов до приблизительно 30 процентов порошковой смеси/таблетки.
В одном варианте осуществления средний размер частиц связующего вещества составляет менее 250 мкм, как например, менее 100 мкм.
Водосодержащий материал
В одном варианте осуществления порошковая смесь/таблетка, составляющая предмет настоящего изобретения, включает в себя по меньшей мере один водосодержащий материал. Примеры водосодержащих материалов включают в себя без ограничений материалы, в которых вода химически связана с материалом (например, гидратированную соль), материалы, в которых вода адсорбирована или абсорбирована (например, пористый материал, такой как кремнеземы и микрогубки), а также материалы с инкапсулированной водой (например, капсулы, наполненные жидкостью). Примеры таких материалов включают в себя без ограничений пирогенные диоксиды кремния; коллоидные диоксиды кремния, такие как коллоидный диоксид кремния; силикаты, такие как силикат кальция, силикат алюминия, метасиликат магния-алюминия (такой как NEUSILIN, US-2 производства Fuji Chemical Ltd) и силикат магния; глины; цеолиты и вигум.
В одном варианте осуществления порошковая смесь/таблетка содержит по меньшей мере одну гидратированную соль. Примеры гидратированных солей включают в себя без ограничений гидрат сульфата натрия, гидрат карбоната натрия, гидрат хлорида кальция, гидрат гидрофосфата натрия, а также их смеси. В одном варианте осуществления молекулярная масса гидратированной соли составляет от приблизительно 150 до приблизительно 400 дальтон, как например, от приблизительно 200 до приблизительно 350 дальтон.
В одном варианте осуществления порошковая смесь/таблетка содержит по меньшей мере одну капсулу, наполненную жидкостью. В дополнительном варианте осуществления вода высвобождается из капсулы при ее разрыве, причем такой разрыв вызывают добавлением излучения.
Уровень(и) водосодержащего(их) материала(ов) может (могут) составлять от приблизительно 0,01 процента до приблизительно 70 процентов порошковой смеси/таблетки, как например, от приблизительно 1 процента до приблизительно 50 процентов, как например, от приблизительно 1 процента до приблизительно 30 процентов, как например, от приблизительно 2 процентов до приблизительно 10 процентов порошковой смеси/таблетки.
Связующий материал, активируемый водой
В одном варианте осуществления порошковая смесь/таблетка, составляющая предмет настоящего изобретения, содержит по меньшей мере один связующий материал, активируемый водой. Под связующим материалом, активируемым водой, понимается материал, активирующийся или гидратирующий при взаимодействии с водой (например, высвобождающейся из водосодержащего материала добавлением излучения) и способствующий соединению/сплавлению порошковой смеси в таблетку. Примеры таких материалов включают в себя без ограничений гидролизованные белки, гидратируемые полимеры и гидроколлоиды. Применимые гидролизованные белки включают в себя без ограничений гидролизованный коллаген. Применимые гидратируемые полимеры включают в себя без ограничений крахмалы, модифицированные крахмалы, метилцеллюлозу и гидроксипропилцеллюлозу. Применимые гидроколлоиды включают в себя без ограничений желатин, геллановую камедь, каррагинан и пектин.
Углевод
В одном варианте осуществления порошковая смесь содержит по меньшей мере один углевод. Углевод может влиять на растворимость и вкус таблетки, способствовать распределению плавкого связующего вещества по большей площади поверхности, а также разбавлению и ослаблению фармацевтически активного вещества. В одном варианте осуществления частицы углеводов (например, сорбита) действуют как связующее вещество и спекаются при нагревании. Примеры углеводов включают в себя без ограничений растворимые в воде сжимаемые углеводы, такие как сахара (например, декстроза, сахароза, мальтоза, изомальт и лактоза), крахмалы (например, кукурузный крахмал), сахарные спирты (например, маннит, сорбит, мальтит, эритрит, лактит и ксилит) и гидролизаты крахмала (например, декстрины и мальтодекстрины).
Уровни углевода(ов) могут составлять от приблизительно 5 процентов до приблизительно 95 процентов порошковой смеси/таблетки, как например, от приблизительно 20 процентов до приблизительно 90 процентов или от приблизительно 40 процентов до приблизительно 80 процентов порошковой смеси/таблетки. Размер частиц углевода может влиять на содержание используемого плавкого связующего вещества, причем при большем размере частиц углевода площадь поверхности меньше, и, следовательно, требуется меньше плавкого связующего вещества. В одном варианте осуществления, в котором содержание углевода(ов) составляет более 50 вес.% порошковой смеси, а средний размер частицы углевода(ов) составляет более 100 мкм, содержание плавкого связующего вещества составляет от приблизительно 10 до приблизительно 30 вес.% порошковой смеси/таблетки.
Фармацевтически активное вещество
Порошковая смесь/таблетка, составляющая предмет настоящего изобретения, включает в себя по меньшей мере одно фармацевтически активное вещество. Под «фармацевтически активным веществом» подразумевают вещество (например, соединение), которое разрешено или одобрено Управлением по контролю за качеством пищевых продуктов и лекарственных средств США, Европейским агентством лекарственных средств или любым из их правопреемников в качестве средства для перорального лечения при патологическом состоянии или заболевании. Применимые фармацевтически активные вещества включают в себя без ограничений обезболивающие, противовоспалительные вещества, жаропонижающие и антигистаминные средства, антибиотики (например, антибактериальные, противовирусные и противогрибковые средства), антидепрессанты, противодиабетические, спазмолитические средства, средства для подавления аппетита, бронходилататоры, сердечнососудистые лекарственные средства (например, статины), средства для лечения центральной нервной системы, противокашлевые и противозастойные средства, диуретики, отхаркивающие средства, средства для лечения заболеваний желудочно-кишечного тракта, анестетики, муколитические средства, мышечные релаксанты, средства для лечения остеопороза, стимулирующие средства, никотинсодержащие средства и седативные средства.
Примеры применимых средств для лечения желудочно-кишечного тракта включают в себя без ограничений антациды, такие как алюминийсодержащие фармацевтически активные вещества (например, карбонат алюминия, гидроксид алюминия, карбонат дигидроксиалюминия натрия и фосфат алюминия), бикарбонатсодержащие фармацевтически активные вещества, висмутсодержащие фармацевтически активные вещества (например, алюминат висмута, карбонат висмута, субкарбонат висмута, субгаллат висмута и субнитрат висмута), кальцийсодержащие фармацевтически активные вещества (например, карбонат кальция), глицин, магнийсодержащие фармацевтически активные вещества (например, магалдрат, алюмосиликаты магния, карбонат магния, глицинат магния, гидроксид магния, оксид магния и трисиликат магния), фосфатсодержащие фармацевтически активные вещества (например, фосфат алюминия или фосфат кальция), калийсодержащие фармацевтически активные вещества (например, бикарбонат калия), натрийсодержащие фармацевтически активные вещества (например, бикарбонат натрия) и силикаты, слабительные средства, такие как размягчающие стул слабительные средства (например, докузат) и слабительные стимулирующего действия (например, бисакодил); антагонисты H2-рецепторов, такие как фамотидин, ранитидин, циметидин и низатидин; ингибиторы протонового насоса, такие как омепразол, декслансопразол, эзомепразол, пантопразол, рабепразол и лансопразол; желудочно-кишечные цитопротекторы, такие как сукральфат и мизопростол; желудочно-кишечные прокинетики, такие как прукалоприд; антибиотики, активные в отношении H. pylori, такие как кларитромицин, амоксициллин, тетрациклин и метронидазол; противодиарейные средства, такие как субсалицилат висмута, каолин, дифеноксилат и лоперамид; гликопирролат, обезболивающие средства, такие как мезаламин; противорвотные средства, такие как ондансетрон, циклизин, дифенгидрамин, дименгидринат, меклизин, прометазин и гидроксизин; пробиотические бактерии, включающие в себя без ограничений молочнокислые бактерии, лактазу, рацекадотрил; ветрогонные средства, такие как полидиметилсилоксаны (например, диметикон и симетикон, включая описанные в патентах США №№ 4,906,478, 5,275,822 и 6,103,260); их изомеры и фармацевтически приемлемые соли и пролекарства (например, эфиры).
Примеры применимых анальгетиков, противовоспалительных и жаропонижающих средств включают в себя без ограничений нестероидные противовоспалительные лекарственные средства (НПВС), такие как производные пропионовой кислоты (например, ибупрофен, напроксен, кетопрофен, флурбипрофен, фенбуфен, фенопрофен, индопрофен, кетопрофен, флупрофен, пирпрофен, карпрофен, оксапрозин, пранопрофен и супрофен) и ингибиторы циклооксигеназы, такие как целекоксиб; ацетаминофен; ацетилсалициловую кислоту; производные уксусной кислоты, такие как индометацин, диклофенак, сулиндак и толметин; производные фенаминовой кислоты, такие как мефенаминовая кислота, меклофенаминовая кислота и флуфенаминовая кислота; производные бифенилкарбоновой кислоты, такие как дифлунизал и флуфенизал; а также оксикамы, такие как пироксикам, судоксикам, изоксикам и мелоксикам; их изомеры; а также их фармацевтически приемлемые соли и пролекарства.
Примеры антигистаминных средств и противозастойных средств включают в себя без ограничений бромфенирамин, хлорциклизин, дексбромфенирамин, бромгексан, фениндамин, фенирамин, пириламин, тонзиламин, приполидин, эфедрин, фенилэфрин, псевдоэфедрин, фенилпропаноламин, хлорфенирамин, декстрометорфан, дифенгидрамин, доксиламин, астемизол, терфенадин, фексофенадин, нафазолин, оксиметазолин, монтелукаст, пропилгексадрин, трипролидин, клемастин, акривастин, прометазин, оксомемазин, меквитазин, буклизин, бромгексин, кетотифен, терфенадин, эбастин, оксатамид, ксиломеазолин, лоратидин, дезлоратидин и цетиризин; их изомеры; а также их фармацевтически приемлемые соли и эфиры.
Примеры противокашлевых и отхаркивающих средств включают в себя без ограничений дифенгидрамин, декстрометорфан, носкапин, клофедианол, ментол, бензонатат, этилморфон, кодеин, ацетилцистеин, карбоцистеин, амброксол, алкалоиды красавки обыкновенной, собренол, гваякол и гвайфенезин; их изомеры; а также их фармацевтически приемлемые соли и пролекарства.
Примеры мышечных релаксантов включают в себя без ограничений циклобензаприн и хлорзоксазон, метаксалон, орфенадрин и метокарбамол; их изомеры; а также их фармацевтически приемлемые соли и пролекарства.
Примеры стимулирующих средств включают в себя без ограничений кофеин.
Примеры седативных средств включают в себя без ограничений снотворные средства, такие как антигистаминные средства (например, дифенгидрамин), эсзопиклон и золпидем, а также их фармацевтически приемлемые соли и пролекарства.
Примеры средств для подавления аппетита включают в себя без ограничений фенилпропаноламин, фентермин и диэтилкатинон, их фармацевтически приемлемые соли и пролекарства.
Примеры анестетиков (например, при лечении боли в горле) включают в себя без ограничений диклонин, бензокаин и пектин, их фармацевтически приемлемые соли и пролекарства.
Примеры применимых статинов включают в себя без ограничений аторвастин, розувастатин, флувастатин, ловастатин, симвастатин, аторвастатин, правастатин и их фармацевтически приемлемые соли и пролекарства.
В одном варианте осуществления фармацевтически активное вещество, добавляемое в таблетку, выбирают из фенилэфрина, декстрометорфана, псевдоэфедрина, ацетаминофена, цетиризина, аспирина, никотина, ранитидина, ибупрофена, кетопрофена, лоперамида, фамотидина, карбоната кальция, симетикона, хлорфенирамина, метокарбамола, хлорфедианола, аскорбиновой кислоты, пектина, диклонина, бензокаина и ментола, а также их фармацевтически приемлемых солей и пролекарств.
Как описано выше, фармацевтически активные вещества, составляющие предмет настоящего изобретения, могут также присутствовать в форме фармацевтически приемлемых солей, таких как кислотные/анионные или основные/катионные соли. Фармацевтически приемлемые кислотные/анионные соли включают в себя без ограничений ацетат, бензолсульфонат, бензоат, бикарбонат, битартрат, бромид, эдетат кальция, камзилат, карбонат, хлорид, цитрат, дигидрохлорид, эдетат, эдисилат, эстолат, эзилат, фумарат, глицептат, глюконат, глутамат, гликолиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, иодид, изетионат, лактат, лактобионат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напсилат, нитрат, памоат, пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, сульфат, таннат, тартрат, теоклат, тозилат и триэтиодид. Фармацевтически приемлемые основные/катионные соли включают в себя без ограничений соли алюминия, бензатина, кальция, хлорпрокаина, холина, диэтаноламина, этилендиамина, лития, магния, меглумина, калия, прокаина, натрия и цинка.
Как описано выше, фармацевтически активные вещества, составляющие предмет настоящего изобретения, также могут присутствовать в форме пролекарств фармацевтически активных веществ. В целом такие пролекарства будут представлять собой функциональные производные фармацевтически активного вещества, которые легко преобразуются in vivo в необходимое фармацевтически активное вещество. Стандартные процедуры отбора и получения применимых производных пролекарств описаны, например, в работе Design of Prodrugs, под ред. H. Bundgaard, Elsevier, 1985 г. В дополнение к солям, настоящее изобретение предусматривает использование эфиров, амидов и других защищенных или производных форм описанных соединений.
Когда фармацевтически активные вещества в соответствии с настоящим изобретением имеют по меньшей мере один хиральный центр, следовательно, они могут существовать в виде энантиомеров. Когда фармацевтически активные вещества обладают двумя и более хиральными центрами, они могут дополнительно существовать в виде диастереомеров. Следует понимать, что все такие изомеры и их смеси входят в объем настоящего изобретения. Более того, подразумевается, что некоторые кристаллические формы фармацевтически активных веществ могут существовать в виде полиморфов, которые входят в объем настоящего изобретения. Кроме того, некоторые фармацевтически активные вещества могут образовывать сольваты с водой (например, гидраты) или обычными органическими растворителями, и подразумевается, что такие сольваты также входят в объем настоящего изобретения.
В одном варианте осуществления фармацевтически активное вещество или вещества присутствуют в таблетке в терапевтически эффективном количестве, которое представляет собой количество, которое способствует появлению необходимого терапевтического эффекта при пероральном введении и легко может быть определено специалистом в данной области. Как известно специалистам в данной области, при определении таких количеств необходимо принимать во внимание конкретное вводимое фармацевтически активное вещество, его характеристики биодоступности, режим дозирования, возраст и вес пациента, а также другие факторы.
Фармацевтически активное вещество может присутствовать в различных формах. Например, фармацевтически активное вещество может быть диспергировано на молекулярном уровне, например, быть расплавлено внутри таблетки, или может присутствовать в форме частиц, которые в свою очередь могут иметь или не иметь покрытие. Если фармацевтически активное вещество присутствует в форме частиц (с покрытием или без него), то средний размер частиц, как правило, составляет от приблизительно 1 до приблизительно 2000 мкм. В одном варианте осуществления такие частицы представляют собой кристаллы со средним размером частиц от приблизительно 1 до приблизительно 300 мкм. В другом варианте осуществления частицы представляют собой гранулы или пеллеты со средним размером частиц от приблизительно 50 до приблизительно 2000 мкм, как например, от приблизительно 50 до приблизительно 1000 мкм, как например, от приблизительно 100 до приблизительно 800 мкм.
Перед нанесением маскирующего вкус покрытия фармацевтически активное вещество может присутствовать в чисто кристаллической или гранулированной форме. Технологию гранулирования можно использовать для улучшения характеристик сыпучести или размера частиц фармацевтически активных веществ для облегчения прессования или последующего покрытия. Применимые связывающие вещества для использования в технологии гранулирования включают в себя без ограничений крахмал, поливинилпирролидон, полиметакрилаты, гидроксипропилметилцеллюлозу и гидроксипропилцеллюлозу. Частицы, включающие в себя фармацевтически активное(ые) вещество(а), могут быть изготовлены при помощи совместного гранулирования фармацевтически активного(ых) вещества (веществ) с применимыми частицами субстрата при помощи любого из способов гранулирования, известных в данной области. Примеры такого способа гранулирования включают в себя без ограничений влажное гранулирование с большими сдвиговыми усилиями и гранулирование в кипящем слое, такое как ротационное гранулирование в кипящем слое.
Если фармацевтически активное вещество имеет неприятный вкус, то к нему можно добавить маскирующее вкус покрытие, известное в данной области. Примеры применимых маскирующих вкус покрытий описаны в патенте США № 4,851,226, в патенте США № 5,075,114 и патенте США № 5,489,436. Также можно использовать доступные в продаже фармацевтически активные вещества с замаскированным вкусом. Например, в рамках настоящего изобретения можно использовать частицы ацетаминофена, инкапсулированные в покрытие из этилцеллюлозы или других полимеров путем коацервации. Инкапсулированный путем коацервации ацетаминофен можно приобрести у компании Eurand America, Inc. (г. Вандалия, штат Огайо) или компании Circa Inc. (г. Дейтон, штат Огайо).
В одном варианте осуществления таблетка содержит частицы с покрытием, обеспечивающие модифицированное высвобождение (например, частицы, содержащие по меньшей мере одно фармацевтически активное вещество, которое обеспечивает модифицированное высвобождение такого вещества). В настоящем документе термин «модифицированное высвобождение» применяется по отношению к измененному высвобождению или растворению активного вещества в растворяющей среде, такой как жидкости желудочно-кишечного тракта. Типы модифицированного высвобождения включают в себя без ограничений замедленное или отсроченное высвобождение. В целом таблетки с модифицированным высвобождением создают для того, чтобы сделать активное(ые) вещество(а) доступным(и) в течение продолжительного периода времени после их приема, что позволяет снизить частоту приема в сравнении с приемом того (тех) же активного(ых) вещества (веществ) в стандартной таблетке. Таблетки с модифицированным высвобождением также позволяют использовать комбинации активных веществ, в которых продолжительность действия одного фармацевтически активного вещества может отличаться от продолжительности действия другого фармацевтически активного вещества. В одном варианте осуществления таблетка содержит одно фармацевтически активное вещество, которое быстро высвобождается, а также дополнительное активное вещество или вторую часть того же активного вещества с модифицированным высвобождением.
Примеры разбухающих, размываемых гидрофильных материалов для использования в качестве эксципиента, модифицирующего высвобождение для использования в модифицирующем высвобождение покрытии, включают в себя водонабухающие производные целлюлозы, полиалкиленгликоли, термопластичные полиалкиленоксиды, акриловые полимеры, гидроколлоиды, глины и желирующие крахмалы. Примеры водонабухающих производных целлюлозы включают в себя натрий-карбоксиметилцеллюлозу, поперечносшитую гидроксипропилцеллюлозу, гидроксипропилцеллюлозу (ГПЦ), гидроксипропилметилцеллюлозу (ГПМЦ), гидроксиизопропилцеллюлозу, гидроксибутилцеллюлозу, гидроксифенилцеллюлозу, гидроксиэтилцеллюлозу (ГЭЦ), гидроксипентилцеллюлозу, гидроксипропилэтилцеллюлозу, гидроксипропилбутилцеллюлозу и гидроксипропилэтилцеллюлозу. Примеры полиалкиленгликолей включают в себя полиэтиленгликоль. Примеры применимых термопластичных полиалкиленоксидов включают в себя полиэтиленоксид. Примеры акриловых полимеров включают в себя сополимер калия и метакрилатдивинилбензола, полиметилметакрилат, а также гомополимеры и сополимеры с высокой молекулярной массой поперечносшитой акриловой кислоты.
Применимые pH-зависимые полимеры для использования в качестве модифицирующих высвобождение эксципиентов в модифицирующем высвобождение покрытии включают в себя кишечнорастворимые производные целлюлозы, такие как фталат гидроксипропилметилцеллюлозы, ацетатсукцинат гидроксипропилметилцеллюлозы, ацетатфталат целлюлозы; натуральные смолы, такие как шеллак и зеин; кишечнорастворимые ацетатпроизводные, такие как поливинилацетатфталат, ацетатфталат целлюлозы и ацетат ацетальдегиддиметилцеллюлозы; и кишечнорастворимые акрилатпроизводные, например, полимеры на основе полиметакрилата, такие как поли(метакриловая кислота, метилметакрилат) 1:2 (доступные в продаже от компании Rohm Pharma GmbH под торговой маркой EUDRAGIT S) и поли(метакриловая кислота, метилметакрилат) 1:1 (доступные в продаже от компании Rohm Pharma GmbH под торговой маркой EUDRAGIT L).
В одном варианте осуществления фармацевтически активное вещество покрывают комбинацией нерастворимого в воде пленкообразующего полимера (такого как без ограничений ацетат целлюлозы или этилцеллюлоза) и растворимого в воде полимера (такого как без ограничений повидон, полиметакриловые сополимеры, доступные в продаже под торговым названием Eudragit E-100, производство компании Rohm America, и гидроксипропилцеллюлоза). В данном варианте осуществления соотношение нерастворимого в воде пленкообразующего полимера и растворимого в воде полимера составляет от приблизительно 50 до приблизительно 95 процентов от количества нерастворимого в воде полимера и от приблизительно 5 до приблизительно 50 процентов от растворимого в воде полимера, причем весовое соотношение частиц с маскирующим вкус покрытием составляет от приблизительно 5 процентов до приблизительно 40 процентов. В одном варианте осуществления покрытие, используемое в частице с покрытием фармацевтически активного вещества, по существу не содержит материал (такой как полиэтиленгликоль) с температурой плавления ниже 85ºC для предотвращения нарушения целостности покрытия на этапе РЧ-нагрева.
В одном варианте осуществления одно или более фармацевтически активных веществ или часть фармацевтически активного вещества могут быть связаны с ионообменной смолой для маскировки вкуса фармацевтически активного вещества или доставки активного вещества путем модифицированного высвобождения.
В одном варианте осуществления фармацевтически активное вещество способно растворяться при взаимодействии с текучей средой, такой как вода, желудочная кислота, интестинальная жидкость или т.п. В одном варианте осуществления характеристики растворимости фармацевтически активного вещества, входящего в состав таблетки, соответствуют спецификациям Фармакопеи США (USP) на таблетки, содержащие фармацевтически активное вещество, с быстрым высвобождением. Например, для таблеток ацетаминофена в USP 24 уточняется, что в фосфатно-буферном растворе с pH 5,8 с использованием устройства 2 USP (с лопастями) при 50 об/мин по меньшей мере 80% ацетаминофена, содержащегося в таблетке, высвобождается из нее в течение 30 минут после приема, а для таблеток ибупрофена в USP 24 уточняется, что в фосфатно-буферном растворе с pH 7,2 с использованием устройства 2 USP (с лопастями) при 50 об/мин по меньшей мере 80% ибупрофена, содержащегося в таблетке, высвобождается из нее в течение 60 минут после приема. См. USP 24, 2000 Version, 19-20 и 856 (1999 г. ). В другом варианте осуществления характеристики растворимости фармацевтически активного вещества изменены: растворение может быть, например, контролируемым, замедленным, длительным, ретардированным, пролонгированным, отсроченным и т.п.
В одном варианте осуществления размер частиц фармацевтически активного вещества способствует образованию большего количества пустот в таблетке, причем для частиц фармацевтически активного вещества большего размера, соответственно, требуется меньше плавкого связующего вещества. В одном варианте осуществления, в котором фармацевтически активное вещество или фармацевтически активное(ые) вещество(а) с покрытием составляет(ют) более 50 вес.% порошковой смеси/таблетки, а средний размер частиц углевода составляет более 100 мкм, содержание плавкого связующего вещества составляет от приблизительно 10 до приблизительно 30 процентов вес. порошковой смеси/таблетки. В одном варианте осуществления, в котором средний размер частиц порошковой смеси составляет от приблизительно 100 мкм до приблизительно 300 мкм, содержание плавкого связующего вещества составляет от приблизительно 10 до приблизительно 20 процентов вес. порошковой смеси/таблетки.
Температура плавления фармацевтически активного вещества может влиять на температуру на этапе нагревания и тип используемого плавкого связующего вещества. В одном варианте осуществления температура плавления плавкого связующего вещества ниже температуры плавления фармацевтически активного вещества. В другом варианте осуществления температура плавления фармацевтически активного вещества равна или ниже температуры плавления плавкого связующего вещества, в данном случае на этапе плавления или нагрева как фармацевтически активное вещество, так и плавкое связующее вещество могут плавиться и образовывать эвтектическую смесь или различные перемычки, состоящие из фармацевтически активного вещества и плавкого связующего вещества, между другими материалами таблетки при охлаждении. В одном варианте осуществления температура нагревания выше температуры плавления плавкого связующего вещества, но при этом ниже температуры плавления фармацевтически активного вещества. В одном варианте осуществления, в котором фармацевтически активное вещество представляет собой ибупрофен, плавкое связующее вещество нагревают до температуры от приблизительно 30°C до приблизительно 60ºC. В одном варианте осуществления фармацевтически активное вещество представляет собой плавкое связующее вещество.
В одном варианте осуществления фармацевтически активное вещество имеет форму частицы, покрытой связующим веществом. Примеры таких частиц, покрытых связующим веществом, включают в себя без ограничений плавкие материалы, такие как пальмитостеарат глицерила.
Чувствительность фармацевтически активного вещества к РЧ-излучению (например, расплавление или разрушение) может оказывать влияние на тип излучения и/или температуру на этапе нагревания, а также на тип используемого плавкого связующего вещества.
В одном варианте осуществления технологическая обработка таблетки не содержит этап влажного гранулирования или гранулирования из расплава. В данном варианте осуществления материалы смешивают непосредственно перед нагревом. В одном варианте осуществления материалы смешивают и прессуют непосредственно перед нагревом.
Изготовление таблетированной формы
В одном варианте осуществления таблетированную форму предварительно получают путем слабого прессования. В одном варианте осуществления порошковая смесь подается в таблеточную пресс-форму устройства, прилагающего к ней давление для образования таблетированной формы (например, путем слабого прессования, такого как трамбовка). Можно использовать любое применимое устройство прессования, включая без ограничений стандартный цельный или ротационный таблеточный пресс. В одном варианте осуществления таблетированная форма может быть образована путем прессования при помощи ротационного таблеточного пресса (например, такого как пресс, доступный в продаже от компании Fette America Inc., (г. Рокуэй, штат Нью-Джерси) или Manesty Machines LTD (г. Ливерпуль, Великобритания). В одном варианте осуществления таблетированную форму нагревают после извлечения из таблеточного пресса. В другом варианте осуществления таблетированную форму нагревают внутри таблеточного пресса.
В одном варианте осуществления для получения необходимой характеристики таблетки для рассасывания в полости рта ее конструкция может быть высокопористой с использованием минимального количества связующего вещества и/или с низкой плотностью. Следовательно, такие таблетки получаются хрупкими и мягкими. В предпочтительном варианте осуществления, чтобы добиться рассасывания таблетки в полости рта (низкой плотности), необходимо применять минимальную силу трамбовки/прессования. Результаты экспериментов показали, что при прессовании с низкой нагрузкой без приложения излучения получаются очень хрупкие таблетки, которые не выдерживают нагрузок при манипуляциях с материалом в процессе производства.
В большинстве термодинамических технологических процессов или устройств источник тепла и отвод тепла представляют собой два отдельных устройства или этапа, при которых необходимо переносить материал из одного устройства в другое. В процессе производства таблеток, составляющих предмет настоящего изобретения, для достижения связующего эффекта необходимо подвести к таблетке энергию, а затем отвести ее от продукта для его отверждения и приобретения прочности, необходимой для конечных манипуляций, связанных с упаковкой и использованием. Одним из уникальных и неожиданных свойств одного варианта осуществления способа производства, составляющего предмет настоящего изобретения, является то, что источник тепла и теплоотвод представляют собой части одного устройства. Фактически в ранних экспериментах металлическое формовочное устройство (например, пуансон пресс-формы), нагретое до комнатной температуры, отводило столько тепла от обрабатываемой таблетированной формы (из-за высокой теплопроводности), что поверхность полученной таблетки была неприемлемой из-за неравномерного расплавления порошковой смеси. Полученная таблетка имела хорошо образованное ядро, но на поверхности присутствовал в свободном состоянии плохо сформованный порошок, не имевший соединения с остальной частью таблетки. Для устранения данной тепловой потери в одном варианте осуществления к формовочным устройствам подведен нагрев для достижения надлежащего спекания как на поверхности, так и в центре таблетки.
Для использования данного уникального теплового эффекта также можно подобрать порошковые смеси с определенными тепловыми свойствами, теплопроводностью и удельной теплоемкостью таким образом, чтобы частицы порошковой смеси служили теплоотводами. Например, в типичном составе таблеток для рассасывания в полости рта полярные связующие вещества, нагреваемые под воздействием РЧ-поля, могут составлять менее 10% смеси. Остальные 90% материалов служат теплоотводом и быстро отводят тепло от связующих веществ после отключения РЧ-поля. Таким образом, необходимо, чтобы общее время технологической процесса могло составлять всего несколько секунд и чтобы была исключена необходимость переноса таблетки с плиты пресс-формы в ходе критически важного процесса трамбовки и нагрева. Следовательно, плита пресс-формы может работать как устройство для обработки материала, а также как термоформовочное устройство. Это особенно благоприятно с точки зрения успешного производства хрупких таблеток для рассасывания в полости рта.
В одном варианте осуществления на этапе прессования (например, трамбовки) перед добавлением излучения применяют меньшую нагрузку, чем необходимо для прессования жевательной таблетки или таблетки для проглатывания. В одном варианте осуществления нагрузка при прессовании составляет менее приблизительно 6895 кПа (1000 фунтов на кв. дюйм) (например, менее приблизительно 3447 кПа (500 фунтов на кв. дюйм), как например, менее 1379 кПа (200 фунтов на кв. дюйм), как например, менее 345 кПа (50 фунтов на кв. дюйм)). В одном варианте осуществления облучение применяют, когда порошковая смесь находится под указанной нагрузкой.
В одном варианте осуществления этап прессования происходит дискретно при одновременном прессовании одного набора таблеток, после чего происходит поворот к другому блоку делительного стола. В одном варианте осуществления этап прессования происходит на одном блоке делительного стола, а приложение излучения происходит на отдельном блоке делительного стола. В другом варианте осуществления присутствует третий блок делительного стола, в котором происходит выталкивание одной или множества таблеток, причем нижнее формовочное устройство поднимается через пресс-форму к поверхности. В другом варианте осуществления для этапа прессования в верхнюю часть верхних формовочных устройств добавляют пневматический или гидравлический цилиндр. В одном варианте осуществления множество таблеток выталкивают одновременно и по отдельности с поверхности блока делительного стола и удаляют отталкивающей планкой.
В другом варианте осуществления таблетированная форма может быть получена при использовании способов и устройств прессования, описанных в публикации заявки на патент США № 20040156902. В частности, для изготовления таблетированной формы используют ротационный прессующий модуль, включающий в себя зону наполнения, зону поставки, зону прессования, зону выталкивания и зону очистки в одном устройстве с двухрядным расположением пресс-форм. Затем пресс-формы прессующего модуля могут наполняться при помощи вакуума, при этом рядом с каждой пресс-формой или внутри нее установлены фильтры. Зона очистки прессующего модуля включает в себя необязательную систему для регенерации порошковой смеси для извлечения избыточной порошковой смеси из фильтров и возвращения ее в пресс-формы. В одном варианте осуществления источник излучения (например, источник РЧ-излучения) проходит через штамповочный стол ротационного пресса в соответствующий электрод, находящийся в формовочном устройстве или формовочной полости. В одном варианте осуществления штамповочный стол изготовлен из изолирующего материала.
В другом варианте осуществления часть таблетированной формы может быть получена способом влажного гранулирования, который предполагает смешивание и гранулирование эксципиентов и влажного связующего вещества в растворе или дисперсной форме (например, крахмальной пасты на водной основе или раствора поливинилпирролидона). Применимое устройство для влажного гранулирования включает в себя миксеры с низкими сдвиговыми усилиями (например, планетарные миксеры), миксеры с высокими сдвиговыми усилиями и кипящие слои (включая ротационные кипящие слои). Полученный гранулированный материал затем может быть высушен и необязательно всухую смешан с дополнительными ингредиентами (например, эксципиентами, такими как, например, связующие вещества, описанные в настоящем изобретении, смазывающие вещества, красители и т.п.). Затем конечную сухую смесь можно использовать для прессования при помощи способов, описанных в настоящем документе. Способы прямого прессования и влажного гранулирования известны специалистам в данной области.
В одном варианте осуществления таблетированную форму получают при помощи способов и устройств прессования, описанных в опубликованном патенте США № 6,767,200. В частности, для изготовления таблетированной формы используют ротационный прессующий модуль, включающий в себя зону наполнения, зону прессования и зону выталкивания в одном устройстве с двухрядным расположением пресс-форм, как показано на ФИГ. 6. Пресс-формы прессующего модуля предпочтительно наполняются при помощи вакуума, при этом рядом с каждой пресс-формой установлены фильтры.
Таблетированная форма может иметь одну из множества разных форм. Например, таблетированная форма может быть выполнена в форме многогранника, такого как куб, пирамида, призма или т.п., или может иметь геометрию трехмерной фигуры с неплоскими поверхностями, такой как конус, усеченный конус, треугольник, цилиндр, сфера, тор или т.п. В определенных вариантах осуществления таблетированная форма имеет одну или более больших сторон. Например, поверхность таблетированной формы, как правило, имеет противоположные верхнюю и нижнюю стороны, образованные в результате взаимодействия верхней и нижней сторон формовочного устройства (например, пуансонами пресс-формы) в устройстве прессования. В таких вариантах осуществления поверхность таблетированной формы, как правило, дополнительно включает в себя «пояс», размещенный между верхней и нижней сторонами и образованный в результате взаимодействия со стенками пресс-формы в устройстве прессования. Таблетированная форма/таблетка также может быть многослойной. Заявители обнаружили, что острые края устройства, используемого для изготовления таблеток, могут способствовать образованию дуг, и, таким образом, предпочтительными могут являться более закругленные края.
В одном варианте осуществления способ производства таблетированной формы по существу не предполагает использование растворителей. В данном варианте осуществления порошковая смесь по существу не содержит растворителей, и процесс изготовления (например, процесс заполнения пресс-формы) также по существу не предполагает использование растворителей. Растворители могут включать в себя без ограничений воду, органические растворители, такие как без ограничений спирты, хлорсодержащие растворители, гексаны или ацетон; или газообразные растворители, такие как без ограничений азот, диоксид углерода или сверхкритические жидкости.
В одном варианте осуществления используют этап вибрационного воздействия (например, после введения порошковой смеси, но до этапа нагревания или плавления для удаления воздуха из порошковой смеси). В одном варианте осуществления используется вибрация с частотой от приблизительно 1 Гц до приблизительно 50 кГц с амплитудой от 1 мкм до двойной амплитуды 5 мм, что способствует стабилизации сыпучей порошковой смеси в полости плиты пресс-формы («формовочной полости»).
В одном варианте осуществления, как показано на ФИГ. 1A-1F, отмеренный объем порошковой смеси 4 засыпают в плиту пресс-формы 2, изготовленную из Teflon® (или аналогичного материала, обладающего изоляционными свойствами в отношении электрического тока и РЧ-излучения, такого как керамика или ультравысокомолекулярный пластик). Плита пресс-формы 2 имеет формовочную полость 5 с внутренней стенкой 6, верхнее отверстие 7 на верхней поверхности плиты пресс-формы 2 (через которое порошковая смесь 4 и верхнее формовочное устройство 1 входят в формовочную полость 5) и нижнее отверстие 8 на противоположной поверхности плиты пресс-формы 2 (через которое порошковая смесь 4 и нижнее формовочное устройство 3 входят в формовочную полость 5). Порошковая смесь 4 может подаваться из устройства подачи (не показано) под действием силы тяжести или механическим способом. Металлическое электропроводное нижнее формовочное устройство 3 вставлено в плиту пресс-формы для удержания порошковой смеси 4 в плите пресс-формы 2. Аналогичное металлическое электропроводное верхнее формовочное устройство 1 расположено над плитой пресс-формы 2, как показано на ФИГ. 1B. Затем формовочные устройства 1 и 3, плиту пресс-формы 2 и порошковую смесь 4 перемещают в блок прессования и РЧ-нагрева, как показано на ФИГ. 1C, для образования таблетированной формы 4a.
Данный нагревательный блок представляет собой РЧ-генератор 7, генерирующий необходимое высоковольтное, высокочастотное излучение. Генератор 7 имеет электрическое соединение с верхней РЧ-электродной пластиной 8, выполненной с возможностью перемещения, и нижней РЧ-электродной пластиной 6, выполненной с возможностью перемещения. Как показано на ФИГ. 1C, в данном положении порошковую смесь 4 подвергают прессованию между верхним формовочным устройством 1 и нижним формовочным устройством 3 с помощью давления, прилагаемого верхней РЧ-электродной пластиной 8 и нижней электродной пластиной 6 для образования таблетированной формы 4a. Затем таблетированную форму 4a подвергают воздействию РЧ-излучения с помощью РЧ-генератора 7, нагревающего плавкое связующее вещество в таблетированной форме 4a. После отключения РЧ-излучения таблетированная форма 4a остывает для образования таблетки 4b. В одном варианте осуществления, как показано на ФИГ. 1D, таблетку 4b выталкивают верхним формовочным устройством 1 из плиты пресс-формы 2 в блистер 8, используемый для упаковки таблетки 4b. В альтернативном варианте осуществления, как показано на ФИГ. 1E, таблетку 4b выталкивают из плиты пресс-формы 2 нижним формовочным устройством 3 и направляют в отводной лоток стационарной отталкивающей планкой (не показана). На ФИГ. 1F представлено трехмерное изображение формовочных устройств 1 и 4, плиты пресс-формы 2 и таблетки 4b.
На ФИГ. 2A-2H представлен альтернативный вариант осуществления настоящего изобретения, где получают многослойную таблетку. Сначала порошковую смесь 10 засыпают в плиту пресс-формы 2, как показано на ФИГ. 2A. Порошковую смесь 10 утрамбовывают или перемещают вглубь плиты пресс-формы 2 верхним формовочным устройством 1, как показано на ФИГ. 2B, для образования таблетированной формы 10a. Затем поверх таблетированной формы 10а засыпают порошковую смесь 11. После этого формовочные устройства 1 и 3, плиту пресс-формы 2, таблетированную форму 10а и порошковую смесь 11 перемещают в блок прессования и РЧ-нагрева, как показано на ФИГ. 2E. РЧ-нагрев осуществляют так, как описано выше на ФИГ. 1C, для получения многослойной таблетки 12, как показано на ФИГ. 2F и 2G. Хотя на фигуре показана двухслойная таблетка, можно получить множество дополнительных слоев, добавляя дополнительные порошковые смеси на плиту пресс-формы 2.
На ФИГ. 3A-3G представлен другой вариант осуществления настоящего изобретения, где в таблетированную форму 20а вставляют предварительно образованные вставки 30 и 31, как показано на ФИГ. 3A-3D. Затем формовочные устройства 1 и 3, плиту пресс-формы 2, таблетированную форму 20 и предварительно образованные вставки 30 и 31 перемещают в блок прессования и РЧ-нагрева, как показано на ФИГ. 3E. РЧ-нагрев осуществляют так, как описано выше на ФИГ. 1C, для получения многокомпонентной таблетки 40, как показано на ФИГ. 2F и 2G.
На ФИГ. 4A и 4B представлены два вида станка с делительно-поворотным столом 195, выполненного с возможностью создания больших количеств таблеток. В частности, представленное устройство выполнено с возможностью производства хрупких таблеток с минимальным риском их повреждения во время различных этапов производственного процесса. Данный вариант осуществления настоящего изобретения состоит из делительного стола 170, имеющего четыре набора плит пресс-форм 175 с шестнадцатью отверстиями в каждой, устройства подачи порошка 100, РЧ-генератора 150, рамы машины 140, перемещающихся узлов РЧ-электрода 120 и 130, нижнего формовочного узла 110, верхнего формовочного узла 210, блока выталкивания таблеток 160, системы привода делительного устройства 180, блистерного упаковочного полотна 190 и рулона материала для запечатывания блистеров 191.
На ФИГ. 5A представлен вид сверху устройства в положении останова. На ФИГ. 5B представлен вид сверху устройства в момент, когда делительный стол 170 поворачивается между блоками в направлении A. На ФИГ. 6A представлен вид в сечении нижнего формовочного узла 110 в положении, соответствующем началу производственного цикла. Нижние формовочные устройства 111, изготовленные из электропроводного металлического материала, такого как латунь или нержавеющая сталь, зафиксированы в опорной пластине 112 (изготовленной, например, из алюминия или стали). Нагревательный блок 117 прикреплен к опорной пластине 112 и содержит каналы для жидкой среды 117b. Циркуляцию нагревательной (или необязательно охлаждающей) жидкости в нагревательном блоке 117 обеспечивают через соединение с гибкими шлангами 119a и 119b, которые образуют цепь подачи и отвода. Нагревание также может осуществляться с помощью патронных электрических нагревательных элементов или другими применимыми средствами (не показаны). К опорной пластине прикреплен опорный ролик 114 и линейный подшипник 113. К делительному столу 170 прикреплен направляющий ствол 116. Опорная пластина и формовочные устройства 111 выполнены с возможностью перемещения вверх или вниз в соответствии с профилем барабанного кулачка 115, по которому прокатывается опорный ролик 114. Также показана плита пресс-формы 171, изготовленная из электро- и РЧ-изоляционного материала, такого как Teflon, ультравысокомолекулярный пластик или керамика. Это необходимо для предотвращения короткого замыкания в случае размещения электропроводных формовочных устройств в радиочастотном электрическом поле на последующих этапах. Формовочная полость 171a на данной стадии технологического процесса показана пустой.
На ФИГ. 6B представлено сечение блока устройства подачи порошка 100 устройства. В данном блоке порошковая смесь 101 под действием силы тяжести подается в плиту пресс-формы 171. Путем поднятия или опускания кулачкового сегмента 118, выполненного с возможностью перемещения, в направлении B можно регулировать объем формовочной полости 171a, меняя расстояние, на которое нижние формовочные устройства 111 входят в плиту пресс-формы 171. Такая возможность регулировки объема позволяет выбрать точную дозу порошковой смеси для получения таблетки необходимой массы. Когда делительный стол отходит от блока устройства подачи порошка, ободок устройства подачи 102 соскребает порошок с плиты пресс-формы 171 для создания ровной поверхности порошка относительно поверхности плиты пресс-формы 171.
На ФИГ. 7 представлен вид в сечении блока РЧ-излучения устройства. РЧ-генератор 150 на данном фигуре показан символически. В одном варианте осуществления РЧ-генератор 150 представляет собой систему генератора свободных колебаний. Как правило, он состоит из мощной вакуумной лампы (такой как триод) и источника питания постоянного тока от 1000 до 8000 вольт, подключенного между катодом и пластиной (анодом). Колебательный контур подает синусоидальный сигнал на управляющую сетку и электроды, в результате чего генерируется высоковольтное поле необходимой частоты (как правило, от 13,56 МГц до 27,12 МГц). Пример такого РЧ-генератора 150 представляет собой генератор COSMOS модели C10X16G4 (Cosmos Electronic Machine Corporation, г. Фармингдейл, штат Нью-Йорк). В другом варианте осуществления РЧ-излучение может обеспечиваться системой с сопротивлением 50 Ом, состоящей из генератора колебаний заданной формы, подающего радиочастотный сигнал на усилители мощности, подключенные к электродам, и нагрузки в виде цепи согласования полного сопротивления.
На ФИГ. 7 представлен нижний РЧ-электрод 121, выполненный с возможностью перемещения в направлении D. На фигуре он показан в нижнем положении. Линейное перемещение осуществляется приводами линейного перемещения, которые, как правило, представлены такими устройствами, как пневмоцилиндры или сервомоторы. На ФИГ. 7 представлены два пневмоцилиндра. Корпуса пневмоцилиндров 141 и 142 оказывают давление на направляющие штанги 144 и 143. К направляющим штангам прикреплены движущиеся плиты 132 и 122, на которые можно в изоляции от электричества монтировать электродные пластины 131 и 121. РЧ-генератор 150 соединен с электродными пластинами 131 и 121 с помощью проводов 185 и 184. Верхний узел РЧ-электрода 130, выполненный с возможностью перемещения в направлении C, показан в верхнем положении. Верхние формовочные устройства 133, опорная пластина 134 и нагревательный блок 135 прикреплены к РЧ-электродной пластине 131, выполненной с возможностью перемещения, и, следовательно, передвигаются вместе с ней вверх и вниз. Порошковая смесь 101 находится в плите пресс-формы 171.
На ФИГ. 8 представлено сечение того же блока РЧ-излучения, но на фигуре РЧ-электроды 131 и 121 давят на соответствующие формовочные узлы 133 и 111 для прессования и приложения РЧ-излучения к порошковой смеси 101 для создания таблетки 101a. После прекращения приложения РЧ-излучения отводят РЧ-электродные пластины, выполненные с возможностью перемещения, и перемещают делительную пластину 170, плиту пресс-формы 171 и нижний формовочный узел 110 на следующий блок.
На ФИГ. 9 представлен вид в сечении блока выталкивания таблеток 160. Выталкивающие штифты 161 прикреплены к выполненной с возможностью перемещения плите 162 (перемещения в направлении E), приводимой в движение узлом привода 163 (который может быть, например, линейным сервомотором, пневмоцилиндром или другим применимым приводом). Стержень привода 166 соединен с плитой 162, выполненной с возможностью перемещения. Линейный подшипник 164 и направляющая штанга 165 придают жесткость и опору пластине привода 162 и предотвращают разрушительные боковые нагрузки, создаваемые при выталкивающем действии привода 163. Под плитой пресс-формы 171 показана блистерная упаковка 190.
На ФИГ. 10 представлено сечение того же узла после проталкивания готовых таблеток 101a с помощью выталкивающих штифтов 161 через плиту пресс-формы 171. Непосредственное попадание таблетки в блистер позволяет предотвратить разрушение таблетки, вероятность которого существует при использовании стандартных средств, таких как устройства подачи, или путем сброс таблеток в транспортировочные емкости.
В одном варианте осуществления перед введением сыпучей порошковой смеси в формовочную полость добавляют смазывающее вещество. Смазывающее вещество может быть жидким или твердым. Применимые смазывающие вещества включают в себя без ограничений твердые смазывающие вещества, такие как стеарат магния, крахмал, стеарат кальция, стеарат алюминия и стеариновая кислота; или жидкие смазывающие вещества, такие как без ограничений симетикон, лецитин, растительное масло, оливковое масло или минеральное масло. В определенных вариантах осуществления смазывающее вещество добавляют в процентном соотношении к весу таблетки менее 5 процентов, например, менее 2 процентов, например, менее 0,5 процента. В определенных вариантах осуществления недостатком присутствия гидрофобного смазывающего вещества может являться то, что оно может приводить к ухудшению рассасывания или растворения таблетки. В одном варианте осуществления таблетка по существу не содержит гидрофобное смазывающее вещество. Гидрофобные смазывающие вещества включают в себя стеарат магния, стеарат кальция и стеарат алюминия.
Нагревание таблетированной формы для образования таблетки
В ходе технологического процесса для активизации связующего вещества можно использовать различные формы излучения. Применимые источники излучения включают в себя без ограничений конвекцию, радиочастотное излучение, микроволновое излучение, УФ-излучение, инфракрасное, индукционное, лазерное излучение и ультразвук. В одном варианте осуществления используют радиочастотное излучение. Радиочастотное нагревание, как правило, относится к нагреванию электромагнитным полем с частотой от приблизительно 1 МГц до приблизительно 100 МГц. В одном варианте осуществления настоящего изобретения РЧ-излучение имеет частоту в диапазоне от приблизительно 1 МГц до приблизительно 100 МГц (например, от приблизительно 5 МГц до 50 МГц, как например, от приблизительно 10 МГц до приблизительно 30 МГц).
В одном варианте осуществления РЧ-излучение используют для нагревания связующего вещества (например, непосредственно, когда плавкое связующее вещество плавится под действием РЧ-излучения, или опосредованно, когда плавкое связующее вещество не плавится под действием РЧ-излучения, но нагревается входящим в состав порошковой смеси ингредиентом, нагреваемым РЧ-излучением). Твердость и/или тип таблетки (таблетка для рассасывания в полости рта или мягкая жевательная таблетка) может определяться степенью прессования, типом и количеством плавкого связующего вещества, а также дозой РЧ-излучения.
Генераторы РЧ-излучения хорошо известны специалистам в данной области. Примеры применимых РЧ-генераторов включают в себя без ограничений генератор COSMOS модели C10X16G4 (Cosmos Electronic Machine Corporation, г. Фармингдейл, штат Нью-Йорк).
Излучение (например, РЧ-излучение) используют для активизации связующего вещества. Твердость и/или тип таблетки может определяться степенью прессования, типом и количеством связующего вещества, а также дозой излучения.
В одном варианте осуществления при применении РЧ-излучения верхнее и нижнее формовочные устройства являются электродами (например, их подключают к источнику РЧ-излучения в рабочем состоянии), через которые осуществляется подача РЧ-излучения к таблетированной форме. В одном варианте осуществления предусмотрено непосредственное взаимодействие между по меньшей мере одним РЧ-электродом (например, формовочным устройством) и таблетированной формой. В другом варианте осуществления не предусмотрено взаимодействие между любым РЧ-электродом (например, формовочными устройствами) и таблетированной формой. В одном варианте осуществления РЧ-электроды непосредственно соприкасаются с поверхностью таблетированной формы при добавлении РЧ-излучения. В другом варианте осуществления РЧ-электроды не соприкасаются (например, находятся на расстоянии от приблизительно 1 мм до приблизительно 1 см от поверхности таблетированной формы) в процессе добавления РЧ-излучения.
В одном варианте осуществления РЧ-излучение применяют во время образования таблетированной формы. В одном варианте осуществления РЧ-излучение применяют сразу же после образования таблетированной формы. В одном варианте осуществления РЧ-излучение применяют после извлечения таблетированной формы из пресс-формы.
В одном варианте осуществления РЧ-излучение применяют в течение времени, достаточного для размягчения и расплавления по существу всего (например, по меньшей мере 90%, как например, по меньшей мере 95%, как например, всего) связующего вещества в таблетированной форме. В одном варианте осуществления РЧ-излучение применяют в течение времени, достаточного для размягчения и расплавления только части (например, менее 75%, как например, менее 50%, как например, менее 25%) связующего вещества в таблетированной форме, например, только на одной части таблетированной формы, такой как часть снаружи таблетированной формы.
В альтернативных вариантах осуществления настоящего изобретения формовочные устройства могут быть выполнены с возможностью локализованного нагрева, а также могут быть выполнены с возможностью придания определенной формы электрическому полю, образованному между устройствами. На фигуре 11A представлена одна такая конфигурация. РЧ-генератор 200 подключают к пластинам РЧ-электродов 201 и 202. Формовочные устройства 205 и 204 выполнены из электропроводного материала и имеют накладки 207 и 208, изготовленные из электро- и РЧ-изоляционного материала, такого как керамика, Teflon®, полиэтилен или полиэтилен высокой плотности. Плита пресс-формы 203 также изготовлена из электро- и РЧ-изоляционного материала. Данная конфигурация позволяет создать большее расстояние между проводящими формовочными устройствами для ослабления электрического поля, что является предпочтительным для изготовления тонких таблеток без риска образования электрической дуги, которая может повредить продукт и оборудование. На ФИГ. 11B представлена аналогичная конфигурация, но с формовочными устройствами 210 и 211, имеющими углубления со вставками 213 и 212 соответственно, изготовленными из электро- и РЧ-изоляционного материала. При данной геометрии в процессе производства таблетки в области размещения вставок 213 и 212 нагрев будет меньше, поскольку электрическое поле ослабевает из-за увеличения расстояния между проводящими частями 211 и 210. ФИГ. 11C аналогичен ФИГ. 11B, только геометрия обратна, так что при образовании таблетки нагрев будет больше в центральной части, поскольку вставки 216 и 217 расположены на периферии соответствующих формовочных устройств 214 и 215. На фигуре 11D представлен другой вариант осуществления, в котором плита пресс-формы состоит из электропроводного компонента 221 и электроизоляционного компонента 222, изготовленного из электро- и РЧ-изоляционного материала. Формовочные устройства 219 и 218 являются электропроводными, но формовочное устройство 218 дополнительно содержит второй электроизоляционный компонент 220, расположенный вокруг поверхности верхнего формовочного устройства 218, соприкасающегося с таблетированной формой 206. Данная конфигурация создает электрическое поле и соответствующие зоны нагрева, преимущественно относящиеся к проводящим частям плиты пресс-формы.
ФИГ. 12A аналогичен ФИГ. 11D, только плита пресс-формы 233 в данном варианте осуществления полностью выполнена из электропроводного материала. На ФИГ. 12B и 12C представлены два варианта осуществления, где плита пресс-формы содержит соответствующие электропроводные центральные части 245 и 254 и соответствующие внешние части 244/246 и 252/253, изготовленные из электро- и РЧ-изоляционного материала. ФИГ. 12B дополнительно включает в себя изоляционный компонент 220, расположенный вокруг поверхности нижнего формовочного устройства 219. На ФИГ. 12D представлен дополнительный вариант осуществления, где формовочные устройства 263 и 262 изготовлены из электро- и РЧ-изоляционного материала. Части плиты пресс-формы 264 и 265 изготовлены из электро- и РЧ-изоляционного материала, но две соответствующие электропроводные части 267 и 266 подключены к цепи РЧ-генератора 200. При данной конфигурации электрическое поле воздействует в горизонтальном направлении поперек таблетированной формы 206.
Как описано выше, расстояние между электропроводными частями формовочного устройства оказывает существенное влияние на напряженность поля и нагревательный эффект. Для создания таблетки с равномерным нагреванием и структурой необходимо, чтобы формовочные устройства были равноудалены друг от друга. На ФИГ. 13A и 13B представлена такая конфигурация. В данном варианте осуществления показаны волнообразные формовочные устройства 270 и 273, для создания таблетки 272 уникального вида в плите пресс-формы 271. Профили поверхностей формовочных устройств равноудалены друг от друга на расстояние X.
На ФИГ. 14A представлен вариант осуществления, в котором для производства таблетки 282 применяют неравномерный нагрев. В данном варианте осуществления создают таблетку с твердыми и мягкими зонами. Формовочные устройства 280 и 281 выполнены с выступами на поверхности, создающими поле высокой напряженности (и больший нагрев) там, где они находятся ближе всего друг к другу (показано как расстояние Z), и поле более слабой напряженности (и меньший нагрев) там, где они расположены дальше друг от друга (показано как расстояние Y).
В одном варианте осуществления для уменьшения липкости таблетку охлаждают внутри формовочной полости до охлаждения и/или затвердевания связующего вещества. Охлаждение может быть пассивным (например, при комнатной температуре) или активным (например, при помощи охлаждения рециркуляцией охлаждающего вещества). При использовании охлаждения рециркуляцией охлаждающего вещества данное вещество может необязательно циркулировать по каналам внутри формовочных устройств (например, пуансонах или плите пуансона) и/или пресс-форме или плите пресс-формы (например, как описано выше на ФИГ. 6A и 6B). В одном варианте осуществления в ходе технологического процесса используют плиту пресс-формы, имеющую множество полостей пресс-формы, и верхнюю и нижнюю плиты пуансона, имеющие множество верхних и нижних пуансонов для одновременного образования множества таблеток, при котором плиты активно охлаждают.
В одном варианте осуществления присутствует одна порошковая смесь, образующая таблетированную форму, которую затем нагревают под действием РЧ-излучения. В другом варианте осуществления таблетку образуют по меньшей мере из двух разных порошковых смесей, причем по меньшей мере одну порошковую смесь отверждают под действием РЧ-излучения, а по меньшей мере один состав не отверждают под действием РЧ-излучения. В процессе отвердевания под действием РЧ-излучения в такой таблетированной форме образуются две или более зон с разной степенью отверждения. В одном варианте осуществления внешняя область таблетированной формы отверждается, тогда как центральная область таблетированной формы не отверждается. Изменение центра РЧ-нагрева и формы РЧ-электродов способствует концентрации тепла, подводимого к таблетированной форме, для создания специальных более мягких или более твердых областей в готовой таблетке.
В одном варианте осуществления РЧ-излучение сочетают со вторым источником тепла, включая без ограничений инфракрасное, индукционное или конвекционное нагревание. В одном варианте осуществления добавление второго источника нагрева особенно полезно, если в порошковой смеси присутствует вторичное связующее вещество, не расплавляемое РЧ-излучением.
В одном варианте осуществления уровень энергетического воздействия на таблетку регулируется посредством мониторинга и контроля частоты приложения РЧ-излучения. В одном варианте осуществления порошковая смесь герметично закрыта внутри камеры в ходе этапа приложения излучения для обеспечения локализации и возможности распределения воды по порошковой смеси. В одной версии данного варианта осуществления герметичная камера состоит из пресс-формы и по меньшей мере одного источника тепла (например, РЧ-электрода). В одном варианте осуществления при вскрытии герметичной камеры расплавленную таблетку дополнительно высушивают для удаления воды. Этап высушивания может осуществляться с помощью указанного источника излучения или другого источника тепла.
В одном варианте осуществления для производства таблетки используют микроволновое излучение (например, вместо радиочастотного излучения). Микроволновое нагревание по существу относится к нагреванию электромагнитным полем с частотой от приблизительно 100 МГц до приблизительно 300 ГГц. В одном варианте осуществления настоящего изобретения микроволновое излучение находится в диапазоне частот от приблизительно 500 МГц до приблизительно 100 ГГц (например, от приблизительно 1 ГГц до 50 ГГц, как например, от приблизительно 1 ГГц до приблизительно 10 ГГц). Микроволновое излучение используют для нагревания связующего вещества (например, непосредственно, когда плавкое связующее вещество чувствительно к действию микроволнового излучения («связующее вещество, расплавляемое микроволновым излучением»), или опосредованно, когда плавкое связующее вещество не плавится под действием микроволнового излучения, но нагревается входящим в состав порошковой смеси ингредиентом, нагреваемым микроволновым излучением). В данном варианте осуществления в устройстве, используемом для производства дозированной формы, используют источник микроволнового излучения и микроволновые электроды.
Вставки в таблетированной форме
В одном варианте осуществления перед облучением в таблетированную форму встраивают вставку. Примеры включают в себя твердые прессованные формы или шарики, наполненные жидкой композицией. Такое введение вставки показано на ФИГ. 3A-3G.
В одном варианте осуществления фармацевтически активное вещество имеет форму гелевого шарика, наполненного жидким или полужидким содержимым. Гелевый(ые) шарик(и) добавляют в качестве части порошковой смеси. В одном варианте осуществления дополнительное преимущество таблетки, составляющей предмет настоящего изобретения, является то, что при ее производстве не используется этап сильного прессования, что позволяет использовать деформируемые частицы или шарики с жидким или полужидким содержимым, поскольку из-за использования более низкого давления они не будут разрываться на этапе прессования. Стенки данных шариков могут содержать желирующие вещества, такие как желатин, геллановая камедь, ксантановая камедь, агар, камедь бобов рожкового дерева, каррагинан, полимеры или полисахариды, такие как без ограничений альгинат натрия, альгинат кальция, гипромеллоза, гидроксипропилцеллюлоза и пуллулан; полиэтиленоксид, а также крахмалы. Стенки шариков могут дополнительно содержать пластификатор, такой как глицерин, полиэтиленгликоль, пропиленгликоль, триацетин, триэтилцитрат и трибутилцитрат. Фармакологически активное вещество может быть растворено, суспендировано или диспергировано в материале наполнителя, таком как без ограничений кукурузный сироп с высоким содержанием фруктозы, сахара, глицерин, полиэтиленгликоль, пропиленгликоль, или в маслах, таких как без ограничений растительное масло, оливковое масло или минеральное масло.
В одном варианте осуществления вставка по существу не содержит ингредиентов, поглощающих РЧ-излучение, при этом приложение РЧ-излучения не приводит к существенному нагреванию самой вставки. В других вариантах осуществления вставка содержит ингредиенты, нагревающиеся под воздействием РЧ-излучения, и, таким образом, такие вставки могут использоваться для размягчения или расплавления плавкого связующего вещества.
Многослойная таблетка
В определенных вариантах осуществления таблетка включает в себя по меньшей мере два слоя, например, с разными типами и/или концентрациями связующих веществ и/или других ингредиентов или разными концентрациями фармацевтически активных веществ. Такой вариант осуществления представлен на ФИГ. 2A-2D. В одном варианте осуществления таблетка включает в себя два слоя, причем один слой рассасывается в полости рта, а другой слой выполнен с возможностью жевания или проглатывания. В одном варианте осуществления один слой содержит плавкое связующее вещество, а другой слой не содержит плавкое связующее вещество. В одном варианте осуществления один слой подвергается прессованию при более высоком давлении, чем другой слой. В одном варианте осуществления оба слоя содержат одинаковое количество связующего вещества, но разное количество фармацевтически активных веществ и/или других эксципиентов. В одном варианте осуществления все свойства двух слоев идентичны, но они имеют разный цвет и/или вкус. В одном варианте осуществления один слой рассасывается быстрее другого слоя (например, по меньшей мере в два раза быстрее). В одном варианте осуществления таблетка содержит три слоя, причем композиция третьего слоя отличается от композиции первого слоя и второго слоя.
В одном варианте осуществления таблетка содержит два слоя, причем как первый, так и второй слой содержат фармацевтически активное вещество. В одном варианте осуществления первый и второй слой содержат разные фармацевтически активные вещества. В одном варианте осуществления они содержат одно и тот же фармацевтически активное вещество, но в одном слое фармацевтически активное вещество высвобождается модифицированным способом.
Такие многослойные таблетки можно изготавливать различными способами. В одном варианте осуществления способ включает в себя этапы, на которых: (i) добавляют первую порошковую смесь на плиту пресс-формы, причем первая порошковая смесь включает в себя фармацевтически активное вещество и связующее вещество; (ii) добавляют вторую порошковую смесь на плиту пресс-формы, причем вторая порошковая смесь включает в себя связующее вещество, а композиция второй порошковой смеси отличается от композиции первой порошковой смеси; (iii) прессуют первую порошковую смесь и вторую порошковую смесь на плите пресс-формы для образования таблетированной формы; и (iv) прилагают к таблетированной форме излучение в течение периода времени, достаточного для активации связующих веществ внутри таблетированной формы для сплавления таблетированной формы в таблетку. В одном варианте осуществления первая порошковая смесь включает в себя частицы, содержащие фармацевтически активное вещество, причем частицы покрыты связующим веществом. В одном варианте осуществления способ включает в себя прессование указанной ранее добавленной порошковой смеси до добавления следующей порошковой смеси на плиту пресс-формы.
Шипучая пара
В одном варианте осуществления порошковая смесь дополнительно содержит одну или более шипучих пар. В одном варианте осуществления шипучая пара содержит одно вещество из группы, состоящей из бикарбоната натрия, бикарбоната калия, карбоната кальция, карбоната магния и карбоната натрия, и одно вещество, выбранное из группы, состоящей из лимонной кислоты, оксиянтарной кислоты, фумаровой кислоты, винной кислоты, фосфорной кислоты и альгиновой кислоты.
В одном варианте осуществления общее содержание шипучей(их) пары (пар) в порошковой смеси/таблетке составляет от приблизительно 2 до приблизительно 20 процентов вес., как например, от приблизительно 2 до приблизительно 10 процентов вес. от общего веса порошковой смеси/таблетки.
Таблетка для рассасывания в полости рта
В одном варианте осуществления таблетка выполнена с возможностью рассасывания в полости рта после ее помещения на язык в течение менее приблизительно 60 с, например, менее приблизительно 45 с, например, менее приблизительно 30 с, например, менее приблизительно 15 с.
В одном варианте осуществления таблетка соответствует требованиям, предъявляемым к таблеткам для рассасывания в полости рта, как определено в проекте руководства Управления по контролю за продуктами питания и лекарственными средствами, опубликованном в апреле 2007 г. В одном варианте осуществления таблетка соответствует двойному определению таблеток для рассасывания в полости рта, включая следующие критерии: 1) твердая таблетка содержит лекарственные вещества и быстро, как правило, в течение нескольких секунд, рассасывается при помещении на язык; и 2) таблетка может рассматриваться как твердая лекарственная форма для перорального применения, которая быстро рассасывается в полости рта, и время ее рассасывания in vitro составляет приблизительно 30 с или менее при проведении анализа путем тестирования на рассасывание, установленного в Фармакопее США (USP) для конкретного лекарственного средства или средств.
Дополнительная съедобная часть
В одном варианте осуществления таблетка используется с другой съедобной формой. В одном варианте осуществления данная съедобная форма представляет собой карамель или прессованное кольцо, удерживающее порошковую смесь на этапе прессования и/или РЧ-нагрева.
В одном варианте осуществления внешняя форма из карамели может быть изготовлена с использованием универсальной линии для производства карамели с начинкой или леденцовой карамели, включающей последовательное вытягивание карамельной массы, ее раскатывание, последующее разрезание и штамповку, а также размещение в формы. Карамельная часть содержит один или более сахаров, выбранных из группы, состоящей из изомальта, сахарозы, декстрозы, кукурузного сиропа, лактита и ликазина. В одном варианте осуществления карамельная часть содержит по меньшей мере 50 вес.% (как например, по меньшей мере 75%, как например, по меньшей мере 90%) таких сахаров.
В одном варианте осуществления внешняя съедобная форма содержит фармацевтически активное вещество, а находящаяся внутри таблетка содержит вторую часть такого же фармацевтически активного вещества, что и внешняя съедобная форма. В одном варианте осуществления внешняя съедобная форма содержит фармацевтически активное вещество, а находящаяся внутри таблетка содержит другое фармацевтически активное вещество, отличное от того, что находится во внешней съедобной форме. В одном варианте осуществления внешняя съедобная форма рассасывается по меньшей мере в 10 раз, как например, по меньшей мере в 20 раз быстрее находящейся внутри таблетки. Первая и вторая части могут быть одинаковыми или разными.
В одном варианте осуществления таблетка, имеющая внешнюю съедобную форму и находящуюся внутри таблетку, имеет покрытие быстрого высвобождения из сахаров или пленочное покрытие. В одном варианте осуществления при производстве такой таблетки этап, следующий после плавления (нагревания) и последующего охлаждения таблетки, должен включать в себя дополнительное пленочное или сахарное покрытие с использованием поддона для нанесения покрытия.
Твердость/плотность таблетированной формы/таблетки
В одном варианте осуществления таблетку получают таким образом, чтобы она была относительно мягкой (например, способной рассасываться в полости рта или разжевываться). В одном варианте осуществления твердость таблетки предпочтительно составляет менее приблизительно 29,4 Н/см2 (3 тыс. фунтов на кв. см) (тыс. ф/см2) (например, менее приблизительно 19,6 Н/см2 (2 тыс. ф/см2), как например, менее приблизительно 9,8 Н/см2 (1 тыс. ф/см2)).
В данной области термин «твердость» обозначает разрушающую нагрузку в диаметральном направлении, измеряемую при помощи стандартного фармацевтического оборудования для определения твердости, такого как устройство для определения твердости Schleuniger. Для сравнения значений для таблеток различных размеров необходимо нормализовать разрушающую нагрузку к площади излома. Данное нормализованное значение, выраженное в тыс. ф/см2, в данной области иногда называют пределом прочности таблетки. Общее описание процесса оценки твердости таблетки можно найти в публикации Leiberman et al., Pharmaceutical Dosage Forms-Tablets, том 2, 2-е доп. изд., Marcel Dekker Inc., 1990 г., стр. 213-217, 327-329.
Более предпочтительная оценка твердости таблетки, составляющей предмет настоящего изобретения, основана на использовании анализатора текстуры TA-XT2i, оснащенного зондом с плоским торцом диаметром 7 миллиметров и настроенного на измерение компрессионной силы и формирование отчета о результатах в граммах. Зонд перемещается со скоростью 0,05 миллиметра в секунду на глубину 2 мм. Регистрируется максимальное значение компрессионной силы. В одном варианте осуществления измеренные значения силы для таблеток, изготовленных в соответствии с настоящим изобретением, составили менее 10 000 грамм (например, менее приблизительно 1000 грамм, как например, менее приблизительно 700 грамм). В одном варианте осуществления измеренные значения силы для таблеток, изготовленных в соответствии с настоящим изобретением, составили от приблизительно 100 грамм до приблизительно 6000 грамм, как например, от приблизительно 100 грамм до приблизительно 1000 грамм, как например, от приблизительно 75 грамм до приблизительно 700 грамм с погрешностью ±50 грамм. В другом варианте осуществления измеренные значения силы для таблеток составили менее 700 грамм.
В одном варианте осуществления плотность таблетки составляет менее приблизительно 2 г/см3 (например, менее приблизительно 0,9 г/см3, как например, менее приблизительно 0,8 г/см3, как например, менее приблизительно 0,7 г/см3). В одном варианте осуществления различие в плотности порошкового материала после этапа прессования составило менее приблизительно 40 процентов (например, менее приблизительно 25 процентов, как например, менее приблизительно 15 процентов).
В одном варианте осуществления таблетка представляет собой многослойную таблетку. В одной версии данного варианта осуществления, в которой таблетка представляет собой двухслойную таблетку, плотность одного слоя по меньшей мере на 25% больше плотности другого слоя. В другом варианте осуществления, в котором таблетка представляет собой двухслойную таблетку, плотность каждого отдельного слоя составляет менее 2 г/см3 (например, менее приблизительно 0,9 г/см3, как например, менее приблизительно 0,8 г/см3, как например, менее приблизительно 0,7 г/см3). В другой версии данного варианта осуществления, в которой таблетка представляет собой двухслойную таблетку, плотность всей таблетки составляет менее 2 г/см3 (например, менее приблизительно 0,9 г/см3, как например, менее приблизительно 0,8 г/см3, как например, менее приблизительно 0,7 г/см3).
Покрытия таблеток
В одном варианте осуществления таблетка включает в себя дополнительное внешнее покрытие (например, светопроницаемое покрытие, такое как прозрачное покрытие), способствующее снижению хрупкости таблетки. Применимые материалы для светопроницаемых покрытий включают в себя без ограничений гипромеллозу, гидроксипропилцеллюлозу, крахмал, поливиниловый спирт, полиэтиленгликоль, смеси и сополимеры поливинилового спирта и полиэтиленгликоля, а также смеси данных веществ. Таблетки, составляющие предмет настоящего изобретения, могут включать в себя покрытие, составляющее от приблизительно 0,05 до приблизительно 10 процентов или от приблизительно 0,1 до приблизительно 3 процентов от общего веса таблетки.
Обработка поверхности таблетки
В одном варианте осуществления поверхность таблетированной формы и/или таблетки дополнительно обрабатывали излучением (например, конвекционным, инфракрасным или РЧ-излучением) для размягчения или расплавления материала на поверхности таблетки, а затем охлаждали или оставляли охлаждаться для того, чтобы сделать текстуру поверхности еще более гладкой, усилить глянцевый блеск поверхности таблетки, снизить хрупкость таблетки и/или нанести маркировку для идентификации. В одном варианте осуществления поверхность таблетки дополнительно облучали инфракрасным излучением, причем большая часть (по меньшей мере 50 процентов, как например, по меньшей мере 90 процентов, как например, по меньшей мере 99 процентов) длины волны такого инфракрасного излучения составляет от приблизительно 0,5 до приблизительно 5 микрометров, как например, от приблизительно 0,8 до приблизительно 3,5 микрометра (например, с использованием фильтра с определенной длиной волны). В одном варианте осуществления источник инфракрасного излучения представляет собой кварцевую лампу с параболическим рефлектором (например, для усиления излучения) и фильтром для удаления нежелательных частот. Примеры таких источников инфракрасного излучения включают в себя устройство SPOT IR 4150 (доступное в продаже от компании Research, Inc., г. Иден-Прери, штат Миннесота).
Применение таблетки
Для введения фармацевтически активного вещества можно использовать жевательные таблетки, таблетки для проглатывания или рассасывания в полости рта.
В одном варианте осуществления настоящее изобретение относится к способу лечения заболевания, включающему пероральное введение описанной выше таблетки, которая включает в себя количество фармацевтически активного вещества, эффективное для лечения заболевания. Примеры таких заболеваний включают в себя без ограничений боль (такую как головные боли, мигрени, боли в горле, спазмы, боли в спине и миалгии), лихорадочные состояния, воспаление, патологические состояния верхних дыхательных путей (такие как кашель и заложенность носоглотки), инфекции (такие как бактериальные и вирусные инфекции), депрессию, сахарный диабет, ожирение, патологии сердечно-сосудистой системы (такие состояния, как повышение уровня холестерина, триглицеридов и артериального давления), патологические состояния желудочно-кишечного тракта (такие как тошнота, диарея, синдром раздраженного кишечника и повышенное газообразование), нарушения сна, остеопороз, а также никотиновую зависимость.
В одном варианте осуществления раскрывается способ лечения патологического состояния верхних дыхательных путей, в котором фармацевтически активное вещество выбирают из группы, состоящей из фенилэфрина, цетиризина, лоратидина, фексофенадина, дифенгидрамина, декстрометорфана, хлорфенирамина, хлофедианола и псевдоэфедрина.
В данном варианте осуществления «стандартная доза», как правило, сопровождается указаниями относительно дозировки, где пациенту рекомендуется принимать фармацевтически активное вещество в количестве, которое может составлять множество стандартных доз, например, в зависимости от возраста или веса пациента. Как правило, в объем стандартной дозы фармацевтически активное вещество входит в количестве, достаточном для терапевтического эффекта на пациента, соответствующего указанным минимальным параметрам. Например, применимые объемы стандартной дозы могут включать в себя одну таблетку.
Примеры
Отдельные варианты осуществления настоящего изобретения иллюстрируются следующими примерами. Настоящее изобретение не ограничивается конкретными рамками данных примеров.
Пример 1. Производство порошковой смеси, содержащей лоратадин
Порошковую смесь с лоратадином для таблетки для рассасывания в полости рта, содержащей ингредиенты, представленные в таблице 1, производят следующим образом:
2. Производство компании National Starch, г. Бриджуотер, штат Нью-Джерси
3. Производство компании SPI Pharma, г. Уилмингтон, штат Делавэр
Сначала в герметично закрывающийся пластиковый флакон объемом 500 см3 помещали вместе сукралозу, краситель и ароматизатор. Затем смесь вручную перемешивали путем вращения флакона от донышка к крышке в течение приблизительно 2 минут. После этого полученную смесь из моногидрата декстрозы, лоратадина и полиэтиленоксида добавляли в другой герметично закрывающийся пластиковый флакон объемом 500 см3 и вручную перемешивали путем вращения флакона от донышка к крышке в течение приблизительно 5 минут. Затем полученную смесь добавляли на планетарный лабораторный миксер, добавляли симетикон DC100 и перемешивали в течение приблизительно 3 минут. В конце к смеси добавляли полиэтиленгликоль 4000 и мальтодекстрин и перемешивали в течение приблизительно 3 минут.
Пример 2. Производство таблетки для рассасывания в полости рта, содержащей лоратадин
Часть порошковой смеси, представленной в примере 1, помещали в формовочную полость с диаметром 1,27 см (1/2 дюйма) плиты пресс-формы, изготовленной из электроизоляционного материала Teflon. Затем порошковую смесь утрамбовывали между верхней и нижней металлическими формовочными устройствами с плоским торцом, в результате чего она приобрела форму, соответствующую поверхностям формовочных устройств. Значение давления при трамбовке, как правило, составляло от 10 фунтов/кв. дюйм до приблизительно 345 кПа (50 фунтов/кв. дюйм). Затем формовочные устройства, плиту пресс-формы и таблетированную форму поместили между верхним РЧ-электродом и нижним РЧ-электродом, подключенным к нагревательному РЧ-модулю, содержащему РЧ-генератор COSMOS модели C10X16G4 (Cosmos Electronic Machine Corporation, г. Фармингдейл, штат Нью-Йорк) с выходной мощностью 4 кВт, частотой 27 МГц и вакуумным конденсатором, установленным на 140. Формовочные устройства нагревали циркулирующей водой при температуре 57°C. Верхний РЧ-электрод ввели в контакт с верхним формовочным устройством, а нижний РЧ-электрод ввели в контакт с нижним формовочным устройством. Нагревательный РЧ-модуль включали на 2-5 с. Затем полученную таблетку выталкивали из плиты пресс-формы с помощью нижнего формовочного устройства.
Пример 3. Производство таблетки для рассасывания в полости рта, содержащей дифенгидрамин
Дифенгидраминовую порошковую смесь для таблетки для рассасывания в полости рта, содержащей ингредиенты, представленные в таблице 2, производили следующим образом. Сукралозу, желтый краситель, ароматизаторы, полиэтиленгликоль и мальтодекстрин, входящие в формулу, представленную в таблице 2, пропустили через сито с размером ячеек 20. Просеянные материалы поместили в пластиковый флакон объемом 500 см3 и перемешали путем вращения от донышка к крышке с остальными материалами, представленными в таблице 2. Порошковую смесь помещали в формовочную полость, утрамбовывали и активировали РЧ-излучением, как описано в примере 2, в течение от приблизительно 2 до 5 с для образования таблетки для рассасывания в полости рта с последующим извлечением из плиты пресс-формы.
2. Производство компании National Starch, г. Бриджуотер, штат Нью-Джерси
3. Инкапсулированный дифенгидрамин с покрытием, содержащим ацетат целлюлозы и полиметакрилат, с использованием способа, описанного в патенте США № 5,997,905, который включен в настоящий документ путем ссылки
Пример 4. Производство таблетки плацебо для рассасывания в полости рта, содержащей моногидрат декстрозы
Порошковую смесь плацебо для таблетки для рассасывания в полости рта, содержащей ингредиенты, представленные в таблице 3, производили следующим образом. Сукралозу, желтый краситель, ароматизаторы, полиэтиленгликоль и мальтодекстрин, входящие в формулу, представленную в таблице 3, пропустили через сито с размером ячеек 20. Просеянные материалы поместили в пластиковый флакон объемом 500 см3 и перемешали путем вращения от донышка к крышке с остальными материалами, представленными в таблице 3. Порошковую смесь помещали в формовочную полость, утрамбовывали и активировали РЧ-излучением, как описано в примере 2, в течение от приблизительно 2 до 5 с для образования таблетки для рассасывания в полости рта с последующим извлечением из плиты пресс-формы.
3. Производство компании National Starch, г. Бриджуотер, штат Нью-Джерси
Пример 5. Производство таблетки плацебо для рассасывания в полости рта, содержащей эритритол
Порошковую смесь плацебо для таблетки для рассасывания в полости рта, содержащей ингредиенты, представленные в таблице 4, производили следующим образом. Сукралозу, желтый краситель, ароматизаторы, полиэтиленгликоль и мальтодекстрин, входящие в формулу, представленную в таблице 4, пропустили через сито с размером ячеек 20. Просеянные материалы поместили в пластиковый флакон объемом 500 см3 и перемешали путем вращения от донышка к крышке с остальными материалами, представленными в таблице 4. Порошковую смесь помещали в формовочную полость, утрамбовывали и активировали РЧ-излучением, как описано в примере 2, в течение от приблизительно 2 до 5 с для образования таблетки для рассасывания в полости рта с последующим извлечением из плиты пресс-формы.
3. Производство компании National Starch, г. Бриджуотер, штат Нью-Джерси
4. Производство компании Corn Products, г. Уэстчестер, штат Иллинойс
Пример 6. Производство сравнительной прессованной жевательной таблетки плацебо
Порошковую смесь плацебо для сравнительной жевательной таблетки плацебо, содержащей ингредиенты, представленные в таблице 5, производили следующим образом. Сукралозу, желтый краситель и ароматизаторы перед смешиванием пропускали через сито с размером ячеек 20. Просеянные материалы смешивали с остальными материалами, входящими в формулу, представленную в таблице 5, вводили в пластиковый флакон объемом 500 см3 и перемешивали путем вращения от донышка к крышке в течение приблизительно 3 минут, а затем извлекали. Прессование таблеток выполняли с использованием двух разных сил сжатия следующим образом. Таблетки (a) прессовали на отдельном ручном прессе Carver (доступном в продаже от компании Carver Press Corporation, г. Вабаш, штат Индиана) при нагрузке 6,86 килоньютона (0,7 метрической тонны) и таблетки (b) прессовали при нагрузке 2,45 килоньютона (0,25 метрической тонны). Таблетки (b) были чрезвычайно ломкими и хрупкими, учитывая низкое давление, приложенное к составу.
3. Производство компании National Starch, г. Бриджуотер, штат Нью-Джерси
Пример 7. Производство сравнительной прессованной жевательной таблетки, содержащей ацетаминофен
Порошковую смесь плацебо для жевательной таблетки, содержащей ингредиенты, представленные в таблице 6, производили следующим образом. Сукралозу, желтый краситель, ароматизаторы и лимонную кислоту перед смешиванием пропускали через сито с размером ячеек 20. Просеянные материалы смешивали с остальными материалами, входящими в формулу, представленную в таблице 6, вводили в пластиковый флакон объемом 500 см3 и перемешивали путем вращения от донышка к крышке в течение приблизительно 3 минут, а затем извлекали. Прессование таблеток выполняли с использованием двух разных сил сжатия следующим образом. Таблетки (a) несильно прессовали на отдельном ручном прессе Carver при нагрузке 6,86 килоньютона (0,7 метрической тонны) и таблетки (b) прессовали при нагрузке 2,45 килоньютона (0,25 метрической тонны). Таблетки (b) были чрезвычайно ломкими и хрупкими, учитывая низкое давление, приложенное к составу.
2. Производство компании National Starch, г. Бриджуотер, штат Нью-Джерси
3. Инкапсулированный ацетаминофен с покрытием, содержащим ацетат целлюлозы и повидон, с использованием способа, описанного в патенте США № 4,851,226, который включен в настоящий документ путем ссылки
4. Производство компании DOW Corporation, г. Мидленд, штат Мичиган
5. Производство компании BASF Corporation, торговая марка Kollidon CL-M, г. Флорам-Парк, штат Нью-Джерси
Пример 8. Определение плотности таблеток для рассасывания в полости рта и прессованных таблеток
Проводили измерения для трех таблеток из каждого из примеров 3, 4, 5, 6 и 7 и сравнительной таблетки, рассасывающейся в полости рта (таблетка с лоратадином для рассасывания в полости рта Alavert®, компания Wyeth Consumer Healthcare, г. Мэдисон, штат Нью-Джерси, США), чтобы определить плотность прессованных таблеток и таблеток, которые изготавливали с помощью способа, составляющего предмет настоящего изобретения. Плотность рассчитывали как частное объема цилиндра при делении значений ширины и толщины таблетки на массу отдельных таблеток.
Как представлено в таблице 7, таблетки для рассасывания в полости рта, составляющие предмет настоящего изобретения (примеры 3, 4 и 5), имеют плотность в диапазоне 0,541-0,635 мг/мм3, что значительно ниже сравнительных жевательных таблеток, представленных в примерах 6 и 7 (с плотностью в диапазоне 0,890-1,240 мг/мм3) и таблеток для рассасывания в полости рта Alavert® (с плотностью в диапазоне 1,10-1,6 мг/мм3). Таким образом, таблетки для рассасывания в полости рта, составляющие предмет настоящего изобретения, имеют плотность, которая приблизительно вдвое меньше плотности таблеток, представленных в сравнительных примерах.
Пример 9. Тест на рассасываемость с использованием анализатора текстуры TA XT Plus
Следующий тест выполняли с использованием анализатора текстуры TA XT Plus, доступного в продаже от компании Texture Technologies, г. Скарсдейл, штат Нью-Йорк. Анализатор текстуры был оснащен зондом TA-55, а установленная скорость движения зонда составляла 0,1 мм/с. Отдельную таблетку помещали в градуированный цилиндр 5 мм и устанавливали ее по короткой оси. С помощью зонда 5 мм к таблетке прикладывали силу 20 грамм. После приложения силы добавили приблизительно 10 мл деионизированной воды при температуре 25°C для покрытия таблетки. Проводили анализ нагрузки в динамике и проверяли следующие таблетки: таблетки, представленные в примере 6а, и таблетки, представленные в примере 3. Таблетки, составляющие предмет настоящего изобретения (пример 3), быстро рассасывались после добавления воды, на что указывало расстояние, проходимое зондом, которое увеличивалось от 0 мм до более 1 мм за период времени от 10 до 20 с. Жевательные таблетки, представленные в примере 6а, рассасывались через 84, 30 с после добавления воды, на что указывало изменение наклона в анализаторе текстуры, тогда как таблетки, представленные в примере 3, полностью рассасывались за 6,99 с после добавления воды.
Пример 10. Приготовление ядер таблеток и спекание таблетки, содержащей лоратадин
Ядра таблеток, представленных в таблице 8, получали следующим образом. Равные части сукралозы, винной кислоты, клубничного ароматизатора, мальтодекстрина и порошка сорбита Sorbidex Р вручную пропускают через сито с размером ячеек 50. К указанной выше смеси в пластиковом флаконе добавляют лоратадин, ароматизирующую смесь, Sorbidex Р и мальтодекстрин тапиоки, перемешивают путем вращения флакона от донышка к крышке в течение приблизительно трех минут, а затем высыпают. Затем смесь отдельно засыпают в таблеточную пресс-форму в количестве 624 мг смеси на таблетку.
Часть порошковой смеси, представленной в примере 1, помещают в блок пресс-формы из электроизоляционного материала Teflon или керамики с диаметром приблизительно 2,79 см (1,1 дюйма) и толщиной 0,444 см (0,175 дюйма). Затем порошковую смесь утрамбовывают между верхней и нижней металлическими формовочными устройствами, в результате чего она приобретает форму, соответствующую поверхностям формовочных устройств. Значение давления при трамбовке, как правило, составляет от 10 фунтов/кв. дюйм до приблизительно 689 кПа (100 фунтов/кв. дюйм). Формовочные устройства, блок пресс-формы и таблетированную форму затем помещают между верхним электродом и нижним электродом нагревательного РЧ-модуля. Верхний электрод вводят в контакт с верхним формовочным устройством, а нижний электрод вводят в контакт с нижним формовочным устройством. Нагревательный РЧ-модуль включают на 2 с. После охлаждения полученную дозированную таблетированную форму извлекают из блока пресс-формы с помощью нижнего формовочного устройства.
2. Содержит равные части ароматизатора клубника со сливками, сукралозы, винной кислоты, мальтодекстрина, Sorbidex P (порошка сорбита)
3. Производство компании National Starch, г. Бриджуотер, штат Нью-Джерси
Пример 11. Приготовление двухслойной таблетки для рассасывания в полости рта
Двухслойную таблетку для рассасывания в полости рта, содержащую в одном слое лоратадин, а в другом слое дифенгидрамин, производят следующим образом. В формовочную полость помещают и утрамбовывают 265,58 мг порошковой смеси, содержащей лоратадин, представленный в таблице 1. Затем в формовочную полость помещают 360,073 мг порошковой смеси, содержащей дифенгидрамин, представленный в таблице 2, и утрамбовывают для создания таблетки весом 625,65 мг. Затем формовочную полость активируют РЧ-излучением, как описано в примере 2, в течение приблизительно 2-5 с для образования таблетки для рассасывания в полости рта с ее последующим извлечением из плиты пресс-формы.
Пример 12. Приготовление двухслойной таблетки плацебо для рассасывания в полости рта
Двухслойную таблетку плацебо для рассасывания в полости рта, содержащую краситель в одном слое и не содержащую его в другом слое, производят следующим образом. В формовочную полость помещают и слегка утрамбовывают 90,0 мг порошковой смеси, содержащей краситель, представленный в таблице 9. Затем в формовочную полость добавляют и утрамбовывают 90,0 мг порошковой смеси без красителя, представленного в таблице 10. Затем формовочную полость активируют РЧ-излучением, как описано в примере 2, в течение приблизительно 2-5 с для образования таблетки для рассасывания в полости рта весом 180,0 мг с ее последующим извлечением из плиты пресс-формы.
2. Производство компании National Starch, г. Бриджуотер, штат Нью-Джерси
Подразумевается, что, хотя настоящее изобретение описано подробно, приводимое выше описание предназначено для иллюстрации и не ограничивает объем настоящего изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации входят в формулу изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДСТВО ТАБЛЕТКИ С ПОМОЩЬЮ ПРЕСС-ФОРМЫ С ИСПОЛЬЗОВАНИЕМ РАДИОЧАСТОТНОГО ИЗЛУЧЕНИЯ И ПЛАВКОГО СВЯЗУЮЩЕГО ВЕЩЕСТВА | 2010 |
|
RU2545989C2 |
| ПРОИЗВОДСТВО ТАБЛЕТКИ С ПОМОЩЬЮ ПРЕСС-ФОРМЫ С ИСПОЛЬЗОВАНИЕМ ПОРОШКОВОЙ СМЕСИ С ВОДОСОДЕРЖАЩИМ МАТЕРИАЛОМ | 2010 |
|
RU2552941C2 |
| МАШИНА ДЛЯ ПРОИЗВОДСТВА ЛЕКАРСТВЕННЫХ ФОРМ С ИСПОЛЬЗОВАНИЕМ РАДИОЧАСТОТНОГО ИЗЛУЧЕНИЯ | 2010 |
|
RU2532752C2 |
| СПОСОБ ПРОИЗВОДСТВА ТВЕРДОЙ ДОЗИРОВАННОЙ ФОРМЫ | 2013 |
|
RU2648473C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ТАБЛЕТОК С ИСПОЛЬЗОВАНИЕМ РАДИОЧАСТОТНОГО ИЗЛУЧЕНИЯ И ЧАСТИЦ С ПОГЛОЩАЮЩИМ ПОКРЫТИЕМ | 2015 |
|
RU2712267C2 |
| ТВЕРДЫЕ ЧАСТИЦЫ СИМЕТИКОНА И ИХ ДОЗИРОВАННАЯ ФОРМА | 2018 |
|
RU2790260C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДОЗИРОВАННОЙ ФОРМЫ С ПОКРЫТИЕМ | 2017 |
|
RU2771159C2 |
| СПОСОБ ПРОИЗВОДСТВА КОМБИНИРОВАННОЙ АНТИГЕЛЬМИНТНОЙ ТАБЛЕТКИ С СИМБИОТИКОМ ДЛЯ ЛЕЧЕНИЯ МЕЛКОГО РОГАТОГО СКОТА | 2016 |
|
RU2627893C1 |
| ДОЗИРОВАННАЯ ФОРМА ПАСТИЛКИ | 2018 |
|
RU2771806C2 |
| РАСПАДАЮЩАЯСЯ В ПОЛОСТИ РТА ЛЕКАРСТВЕННАЯ ФОРМА | 2008 |
|
RU2482839C2 |
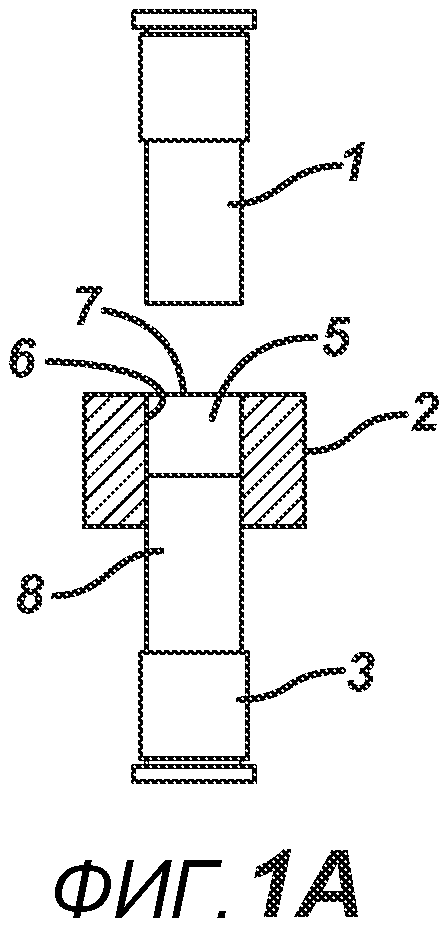
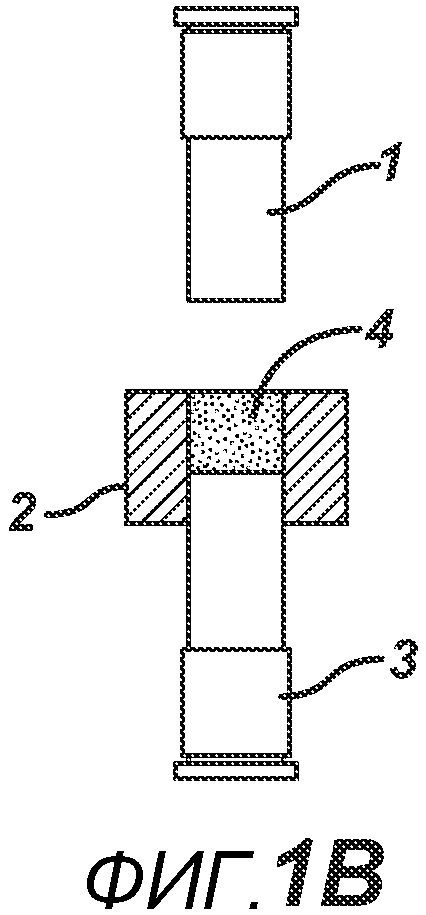
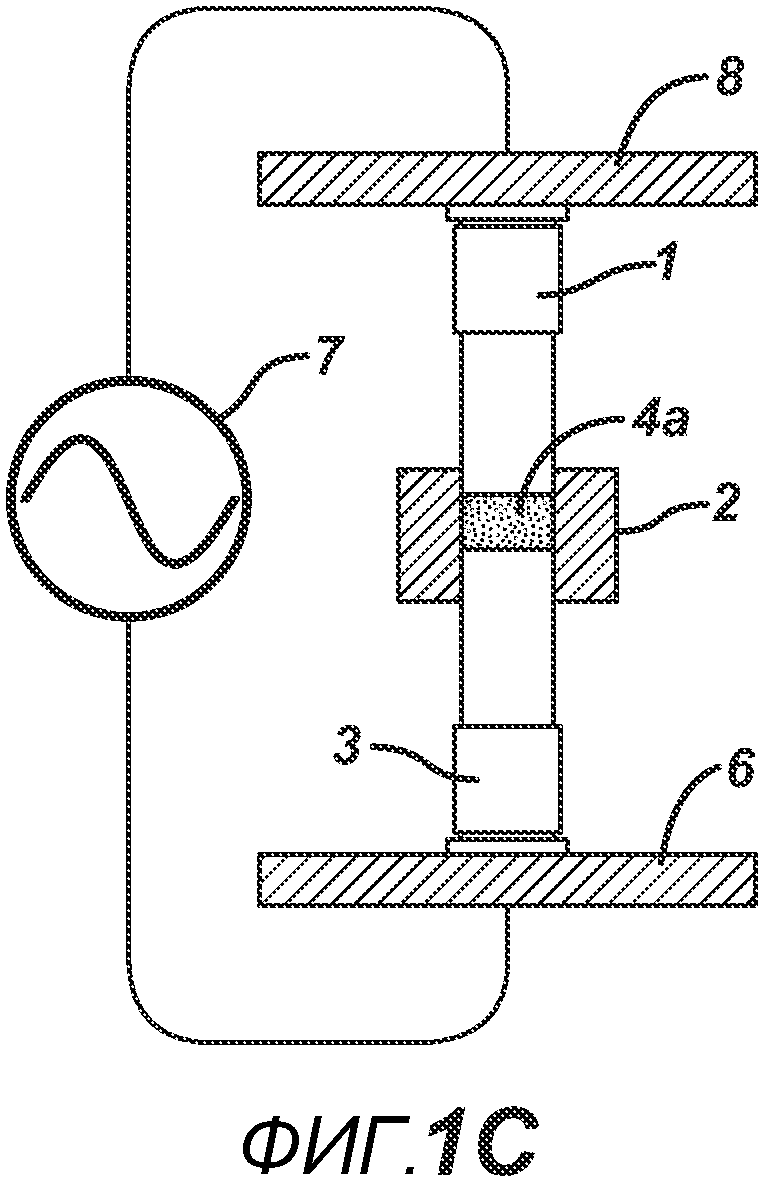
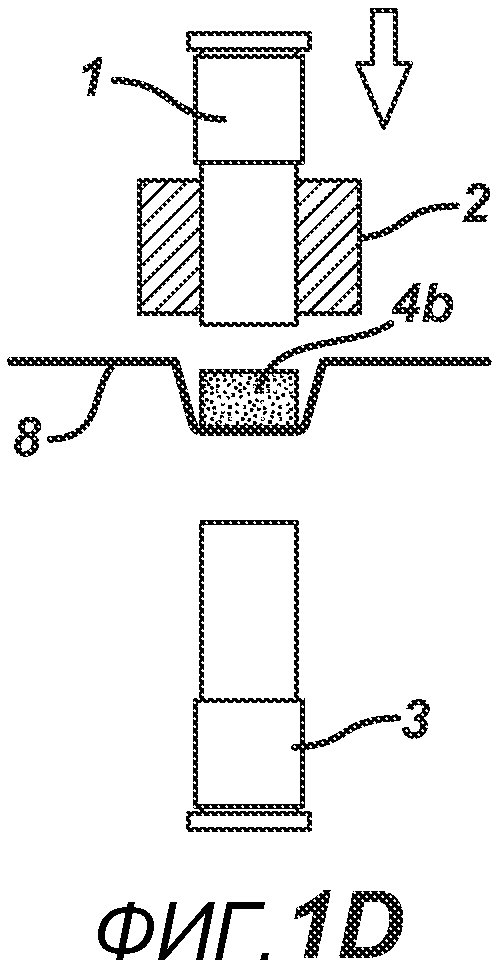
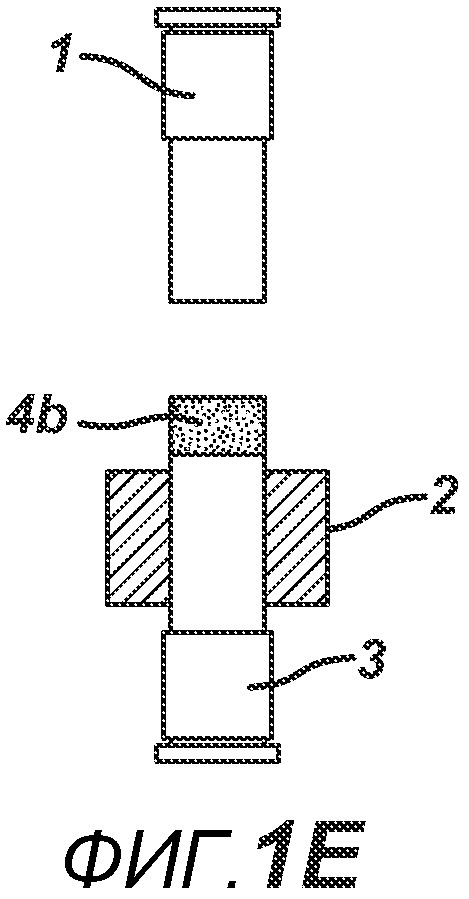
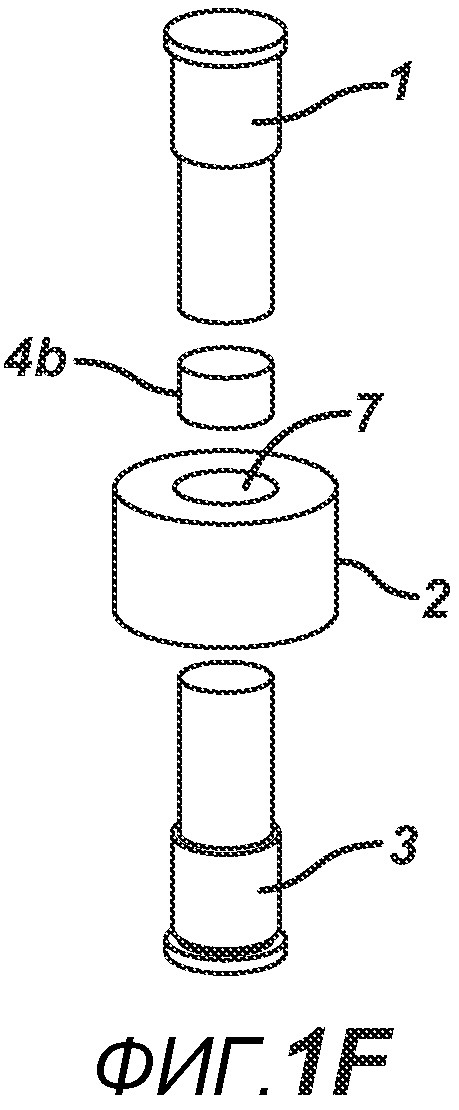
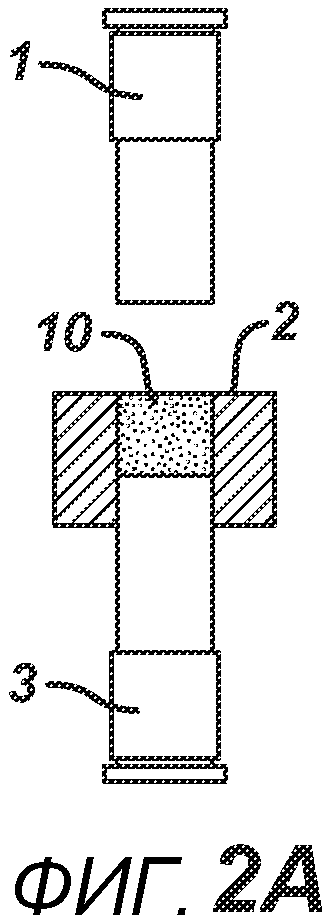
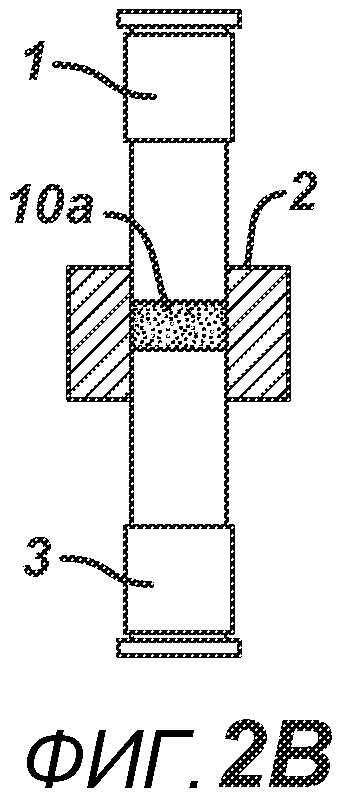
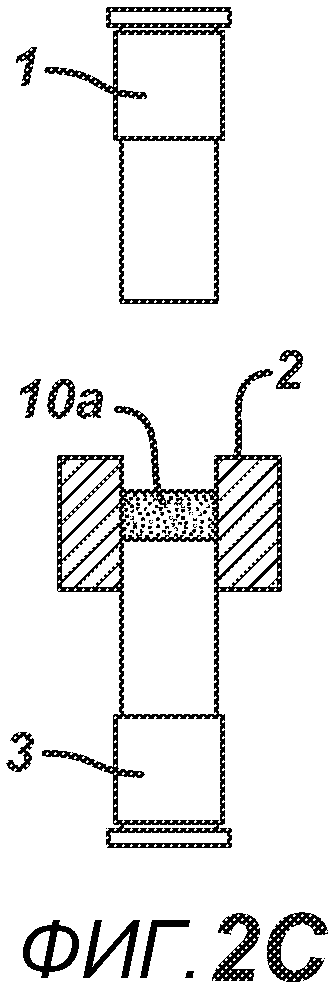
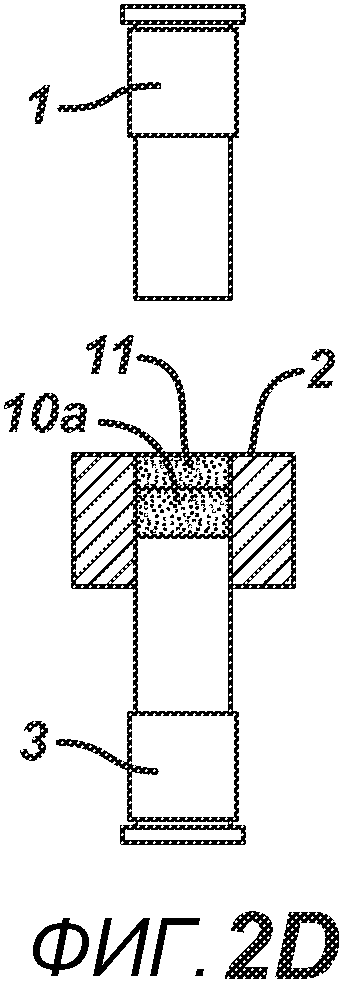
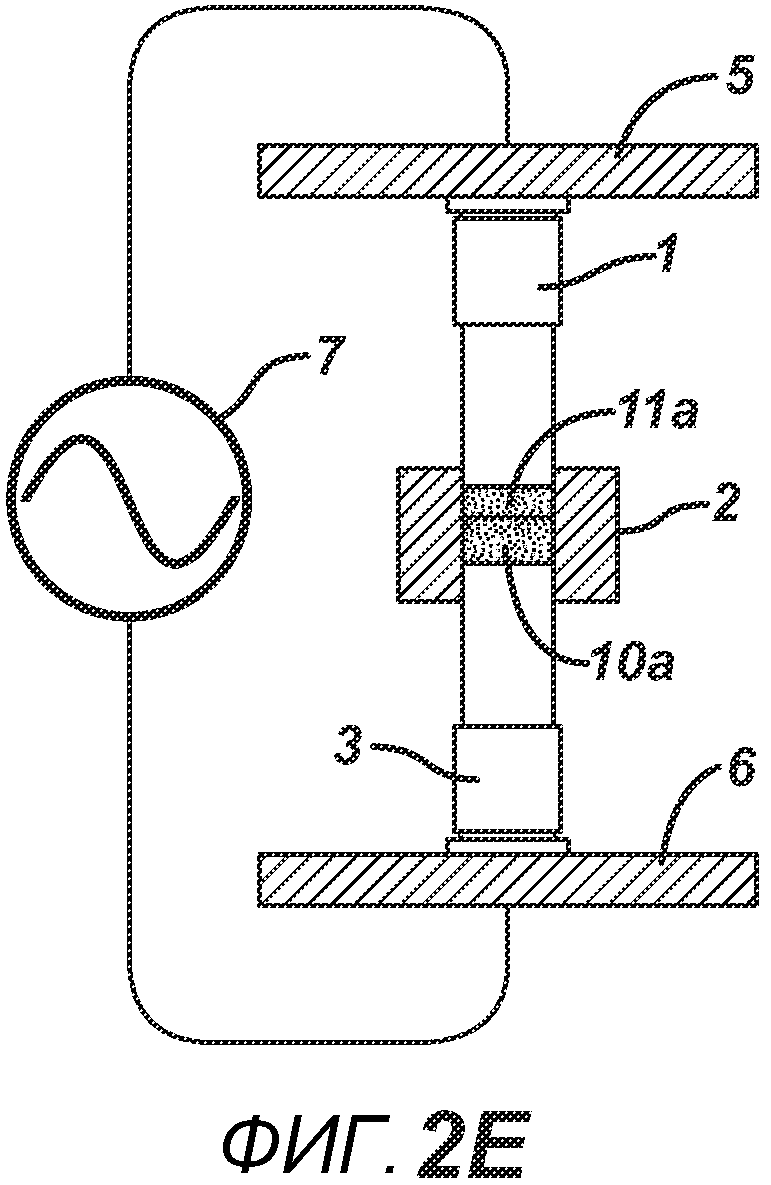
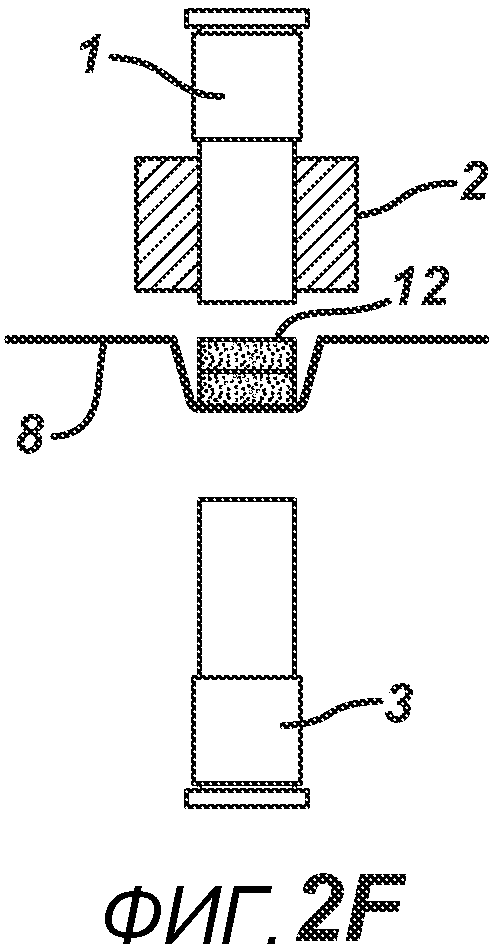
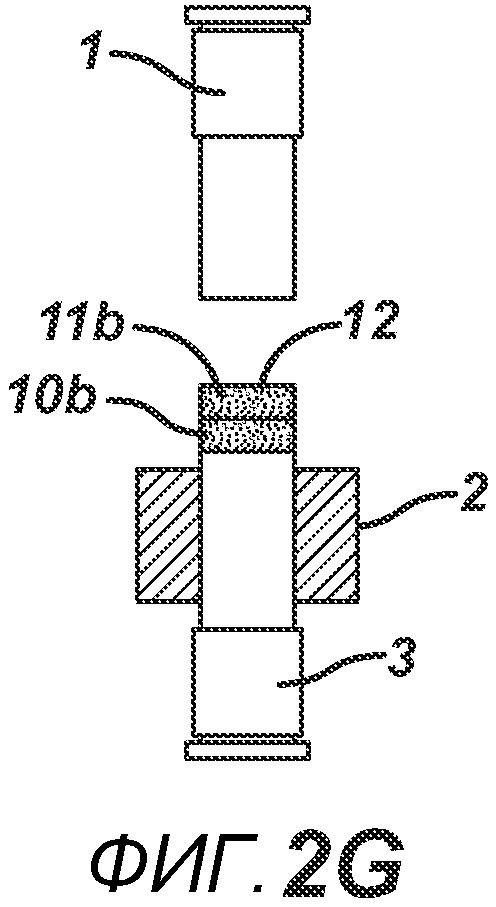
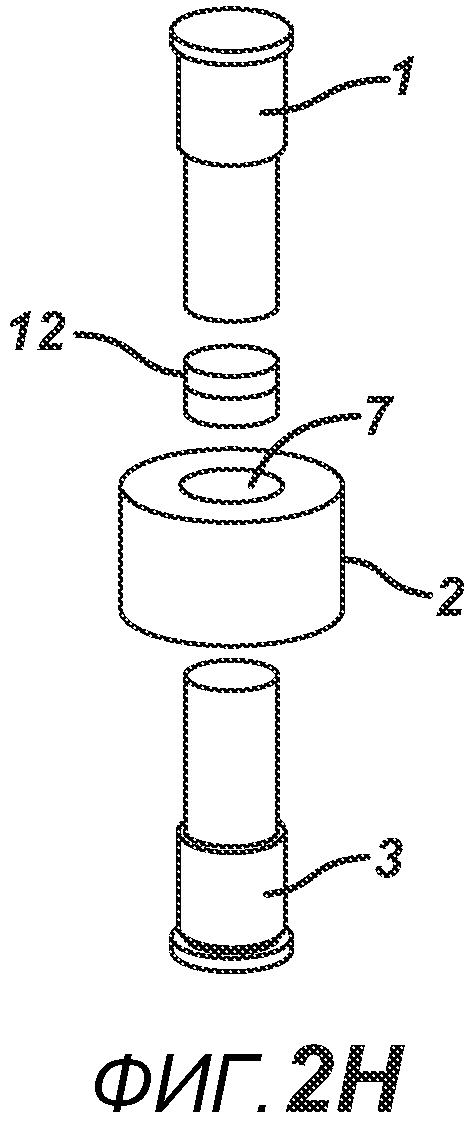
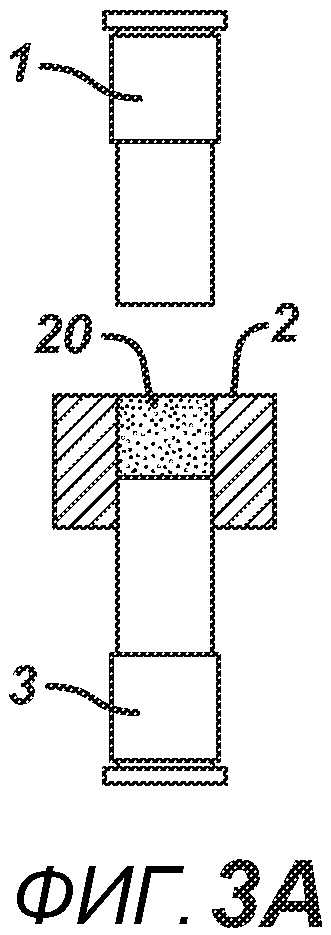
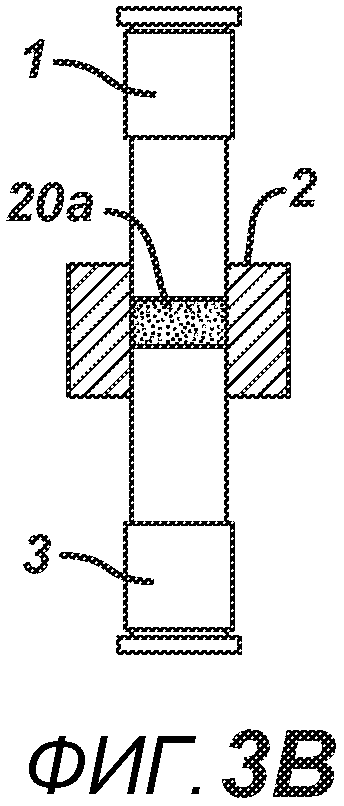
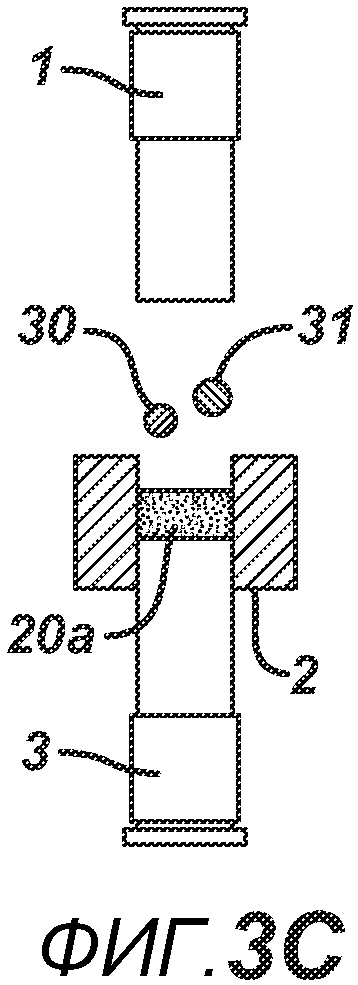
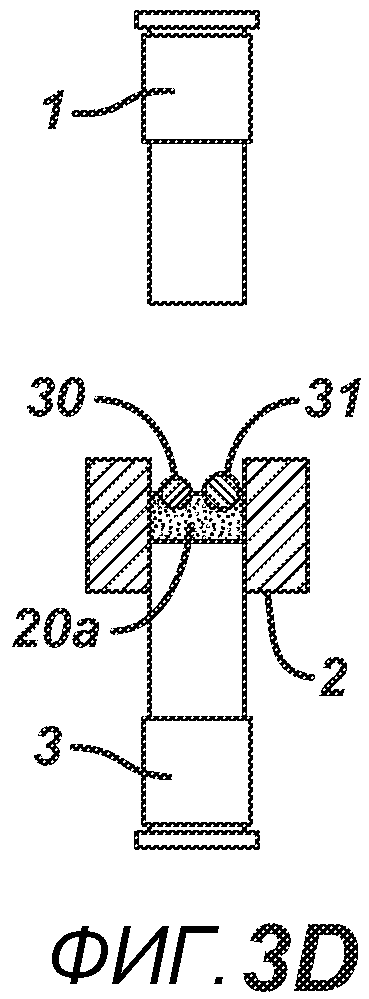
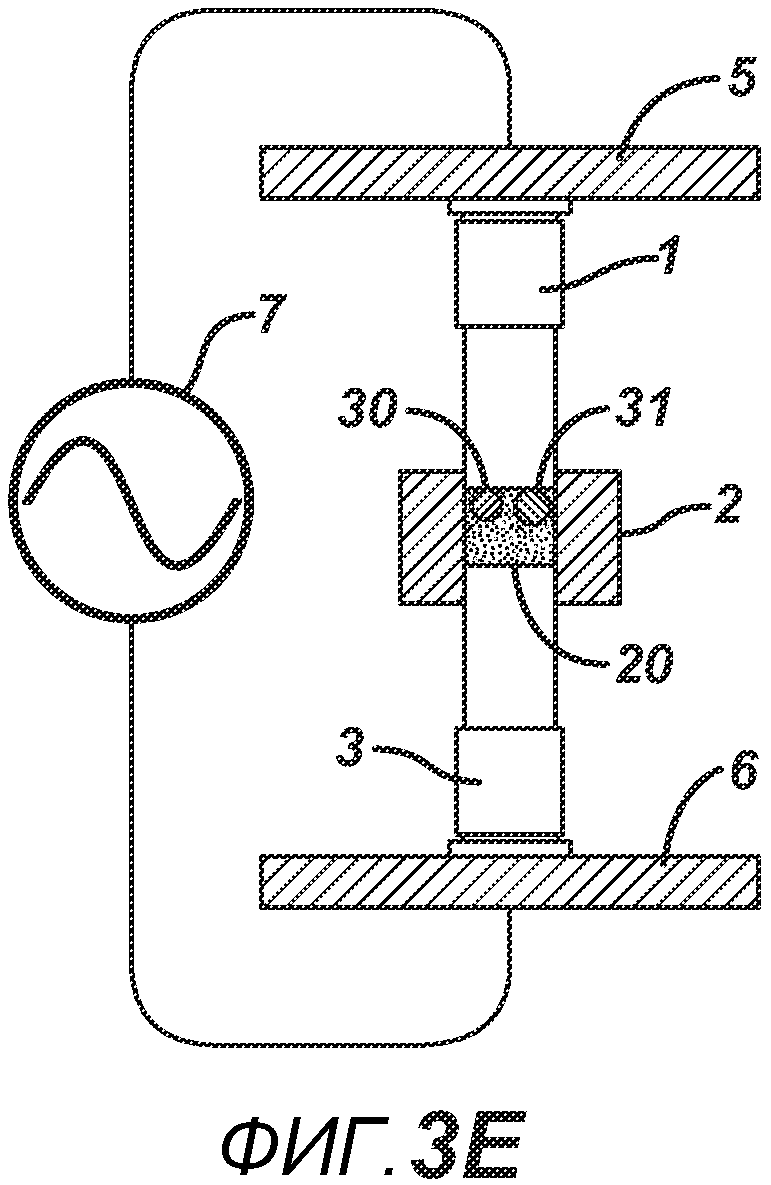
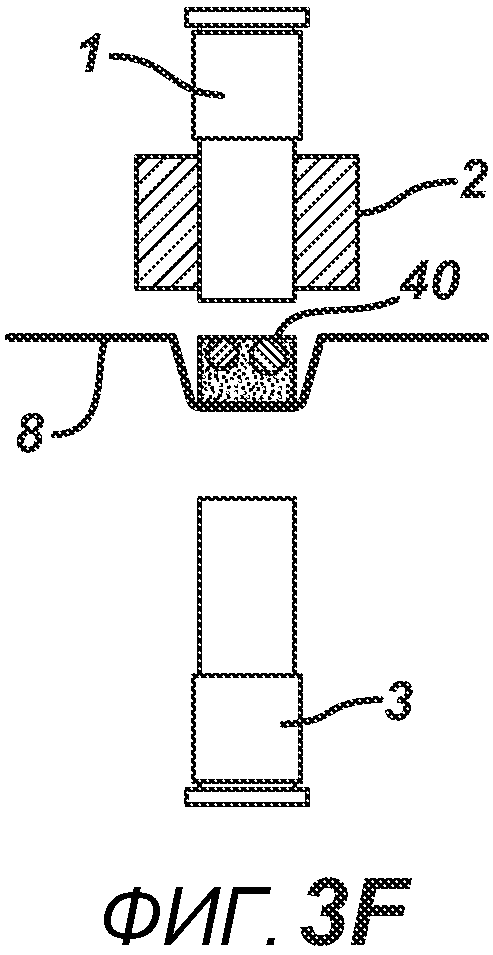
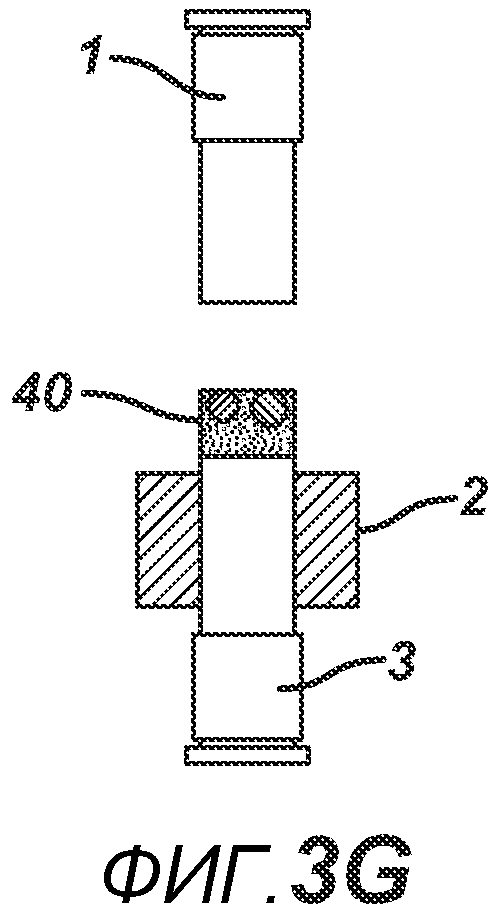
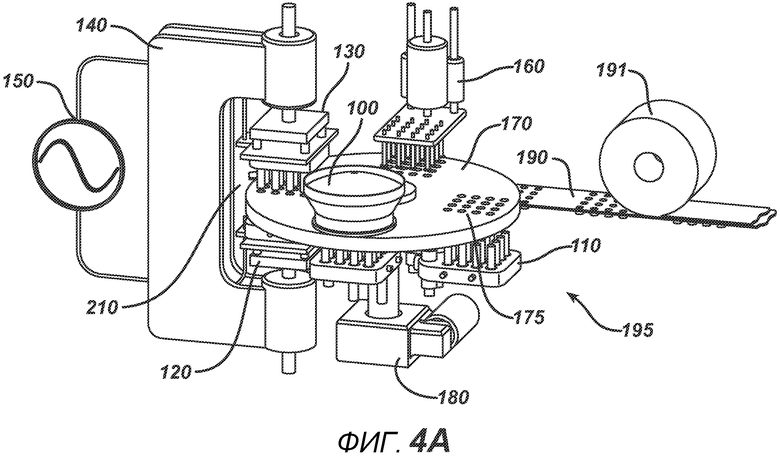
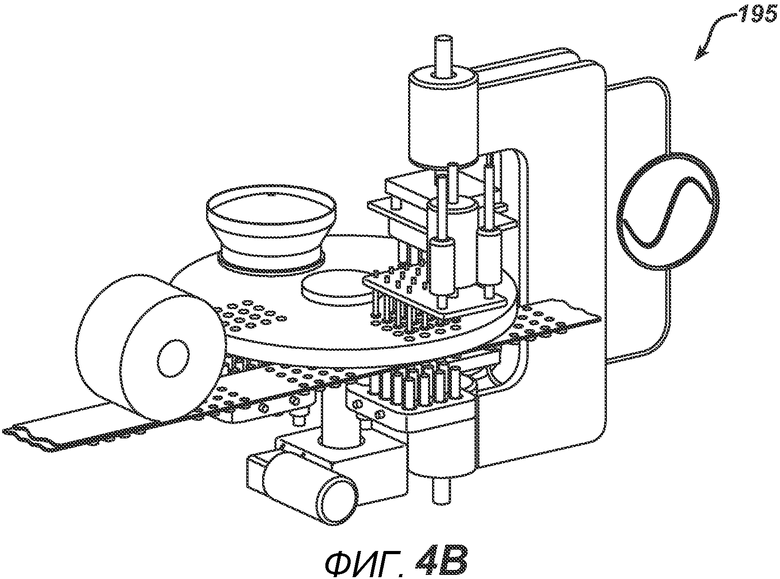
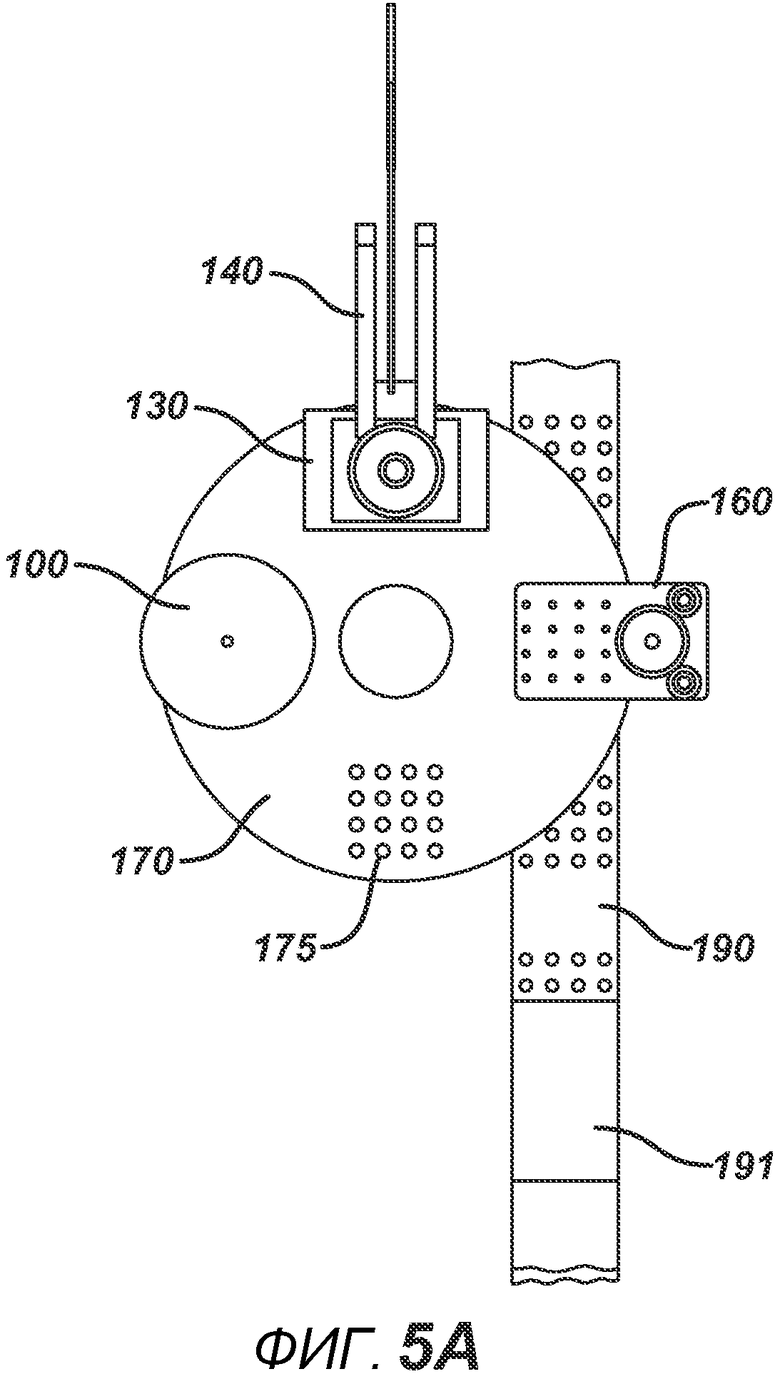
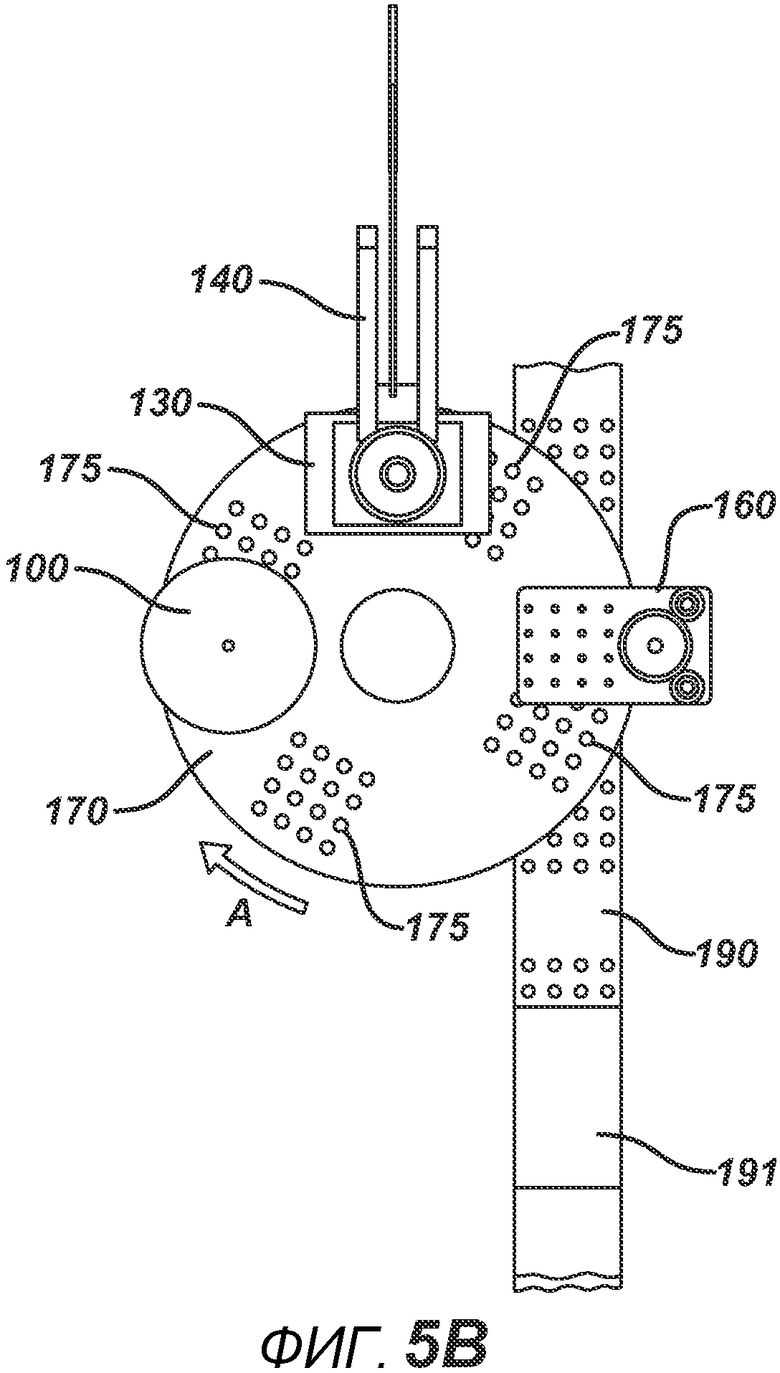
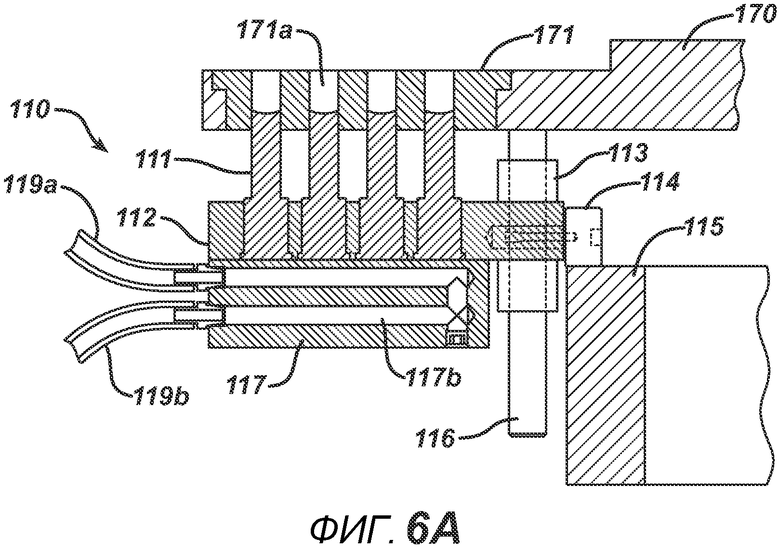
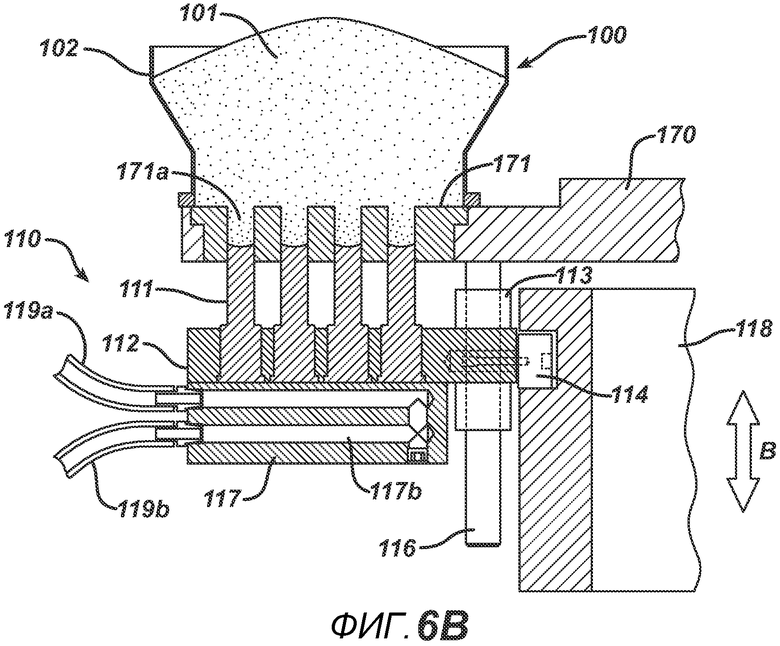
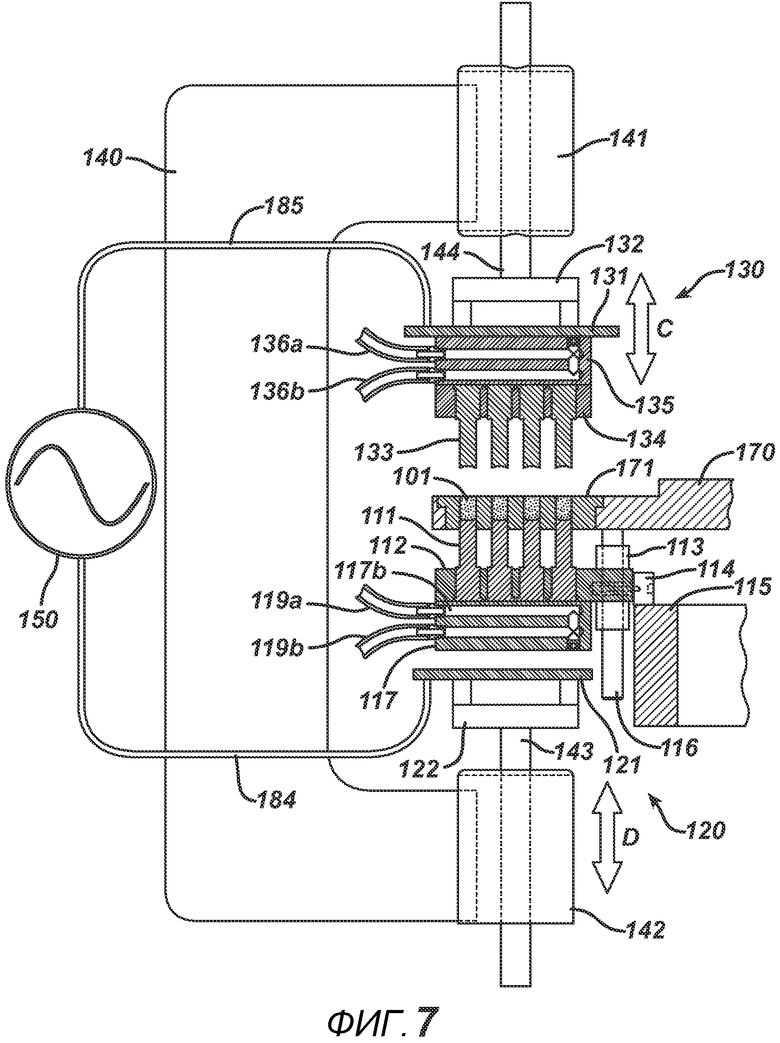
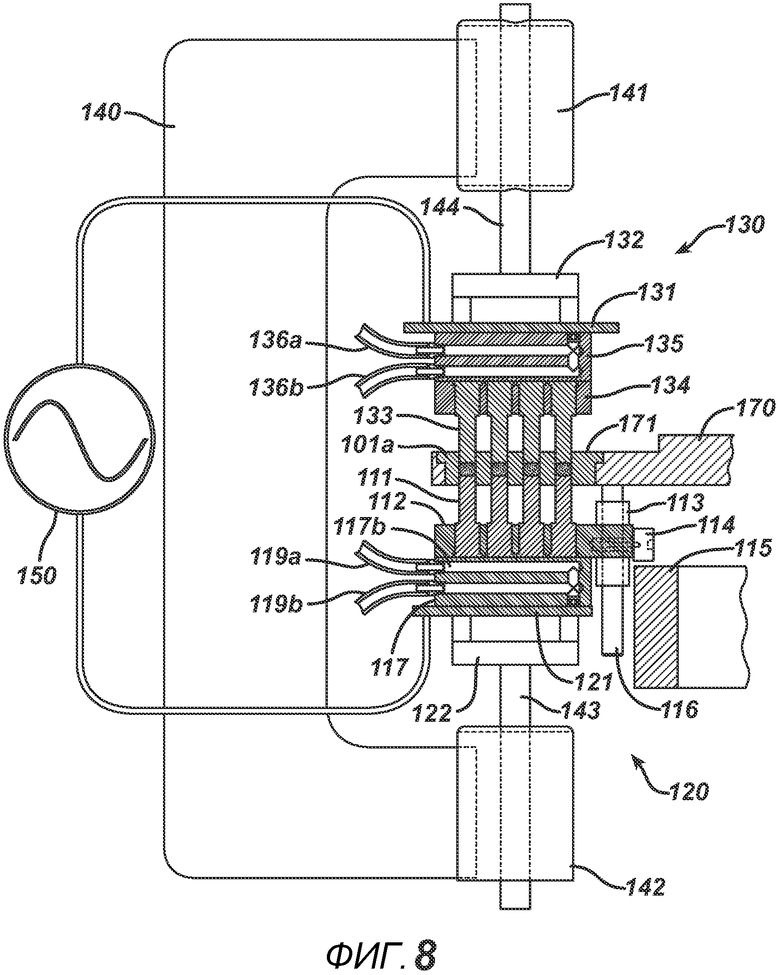
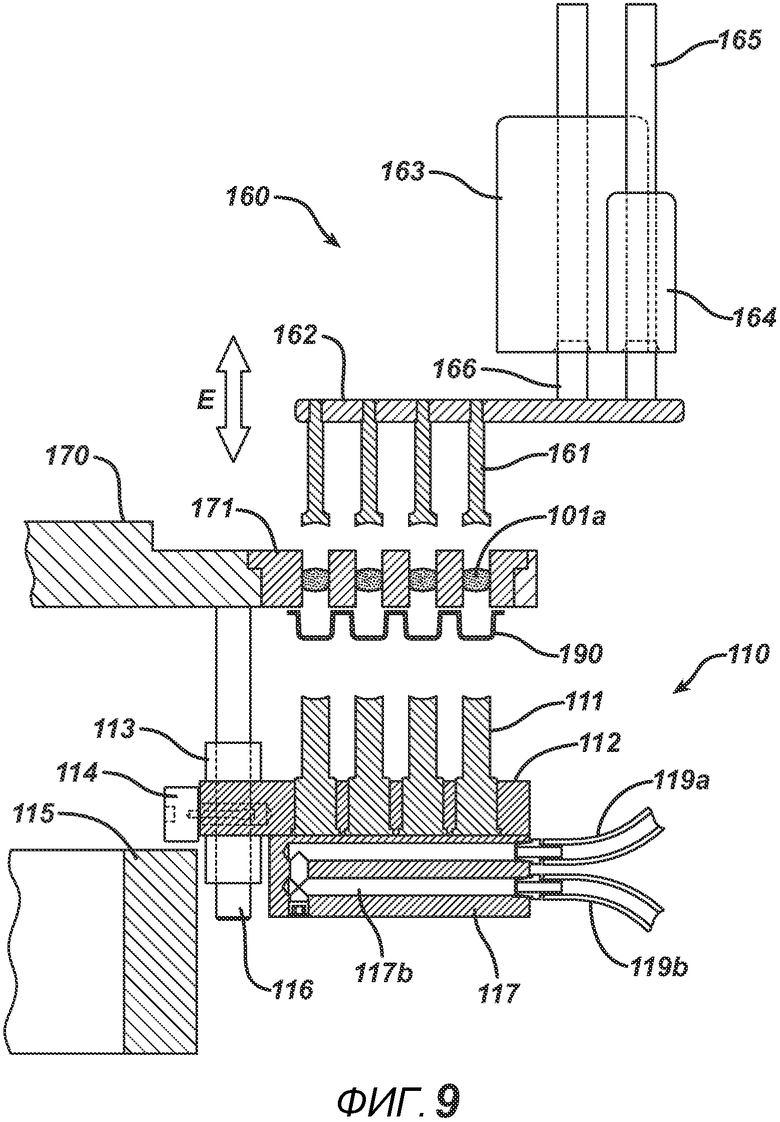
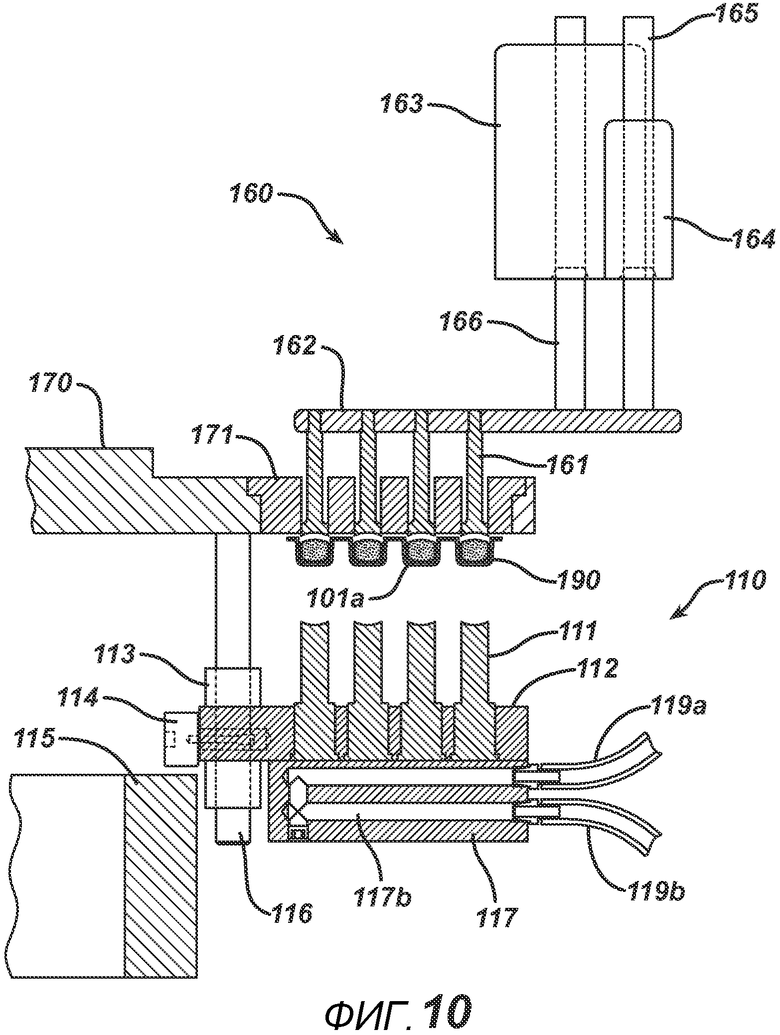
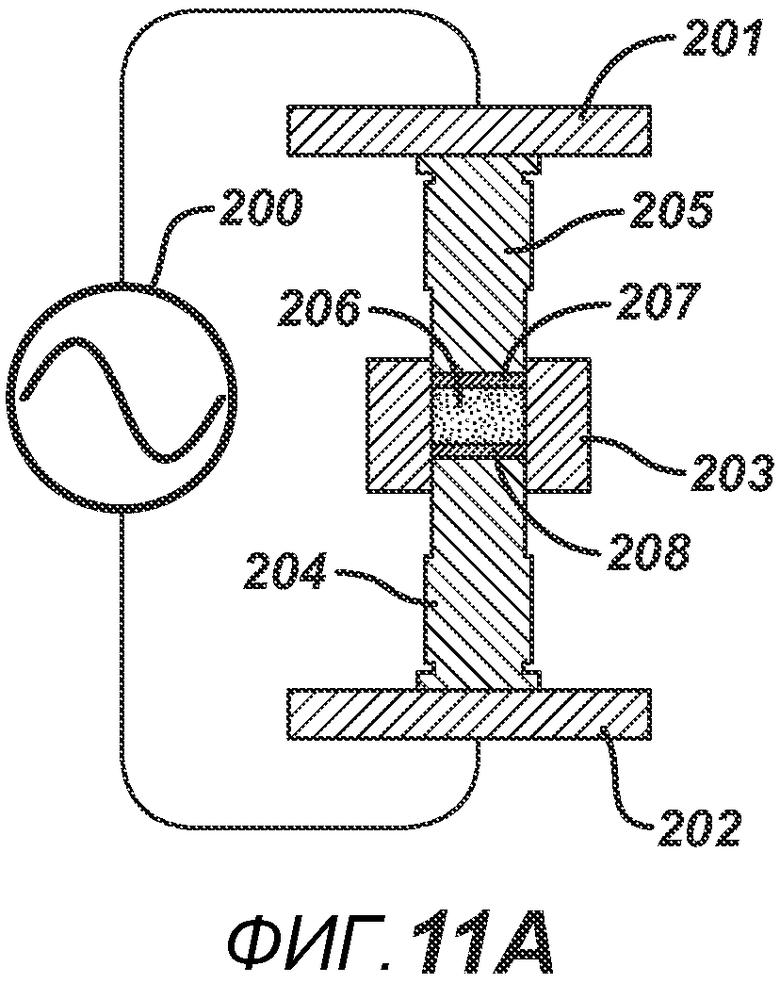
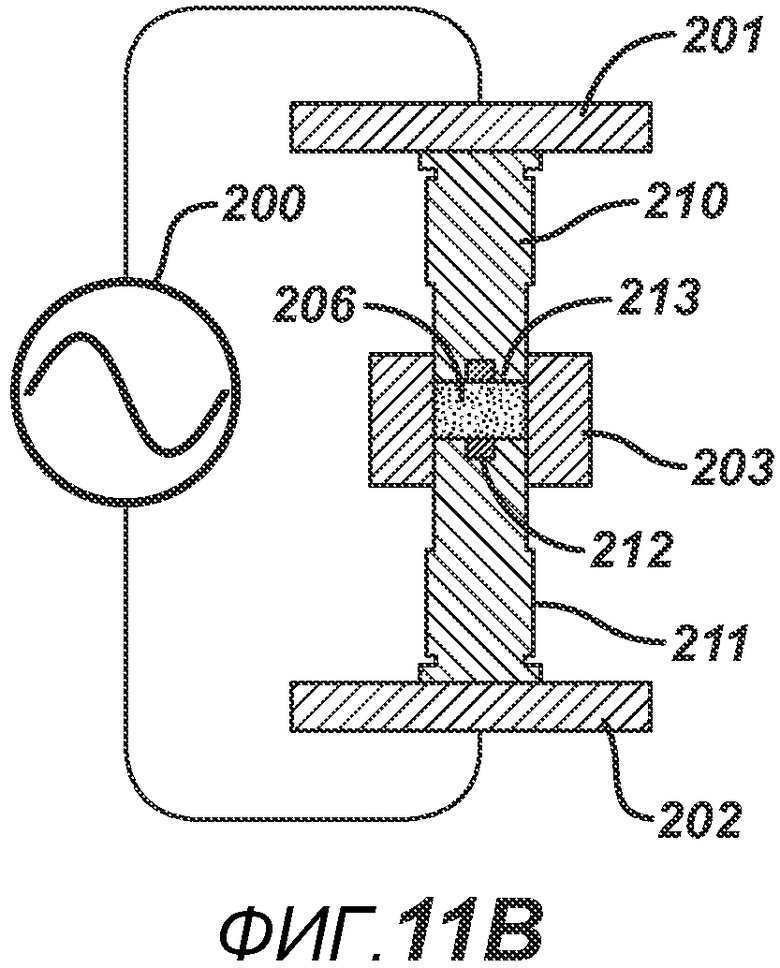
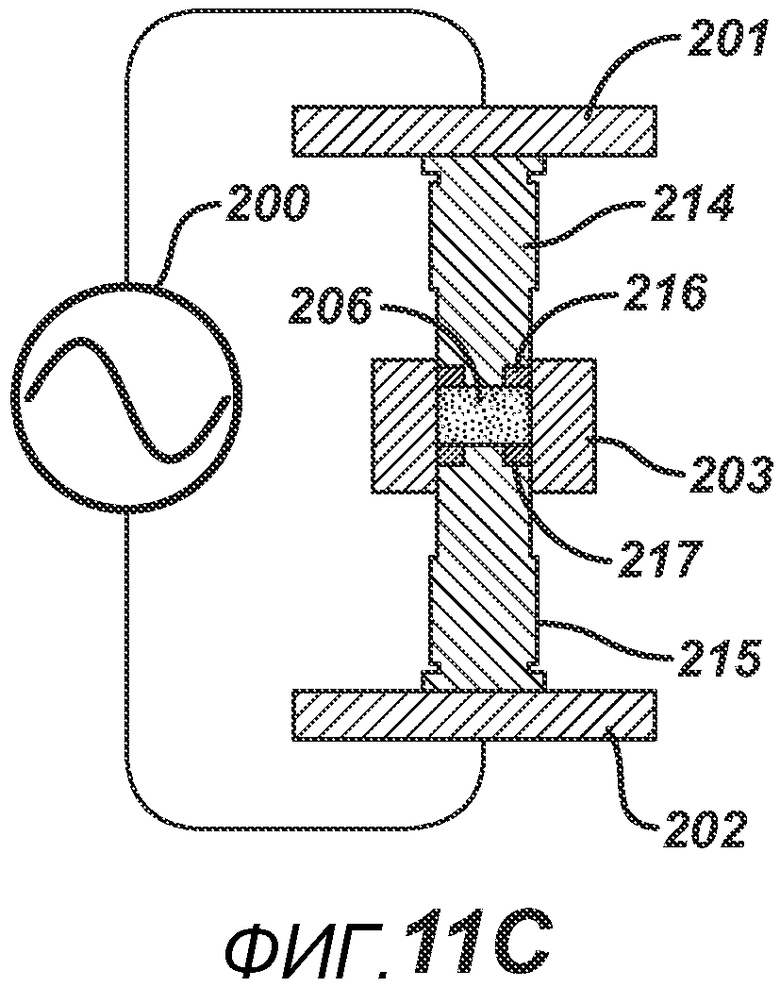
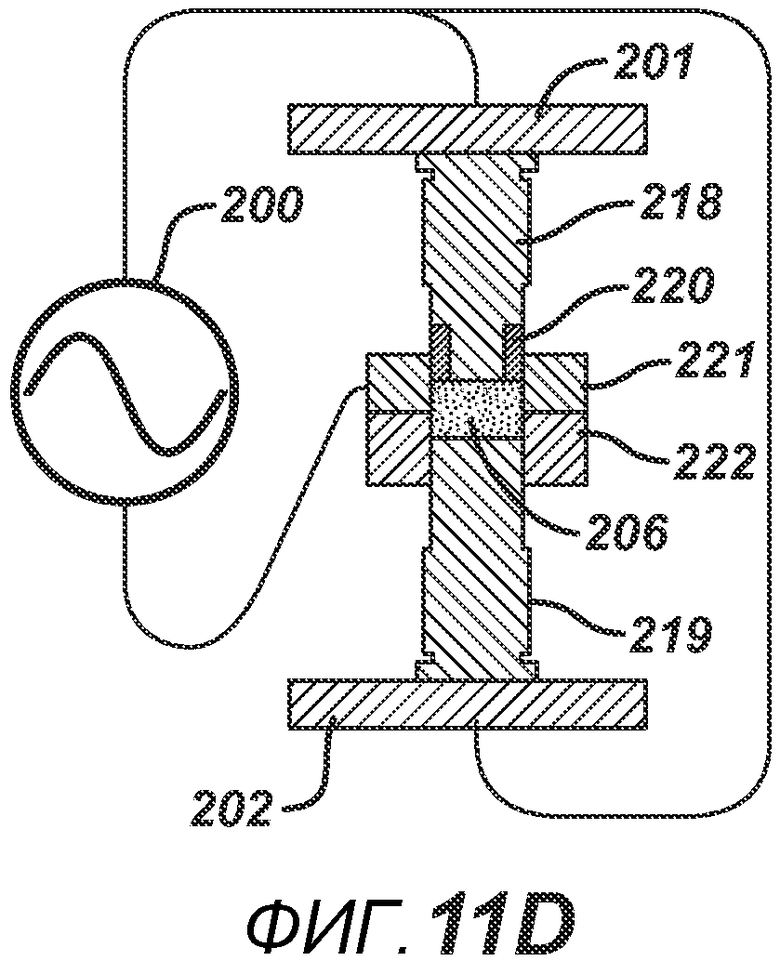
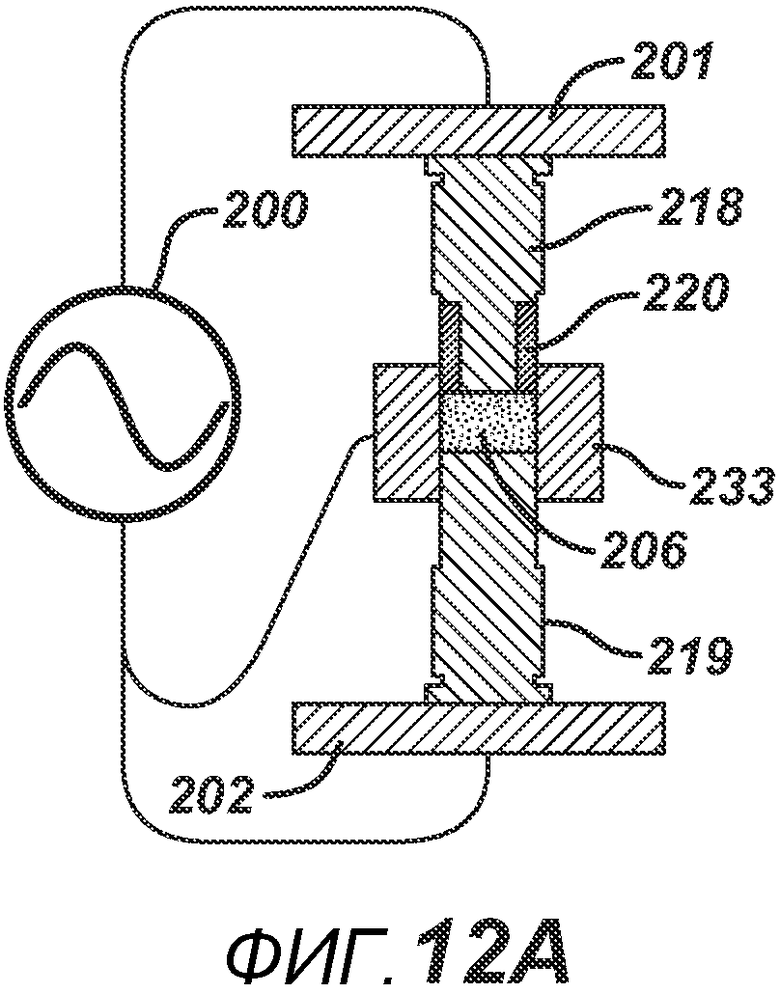
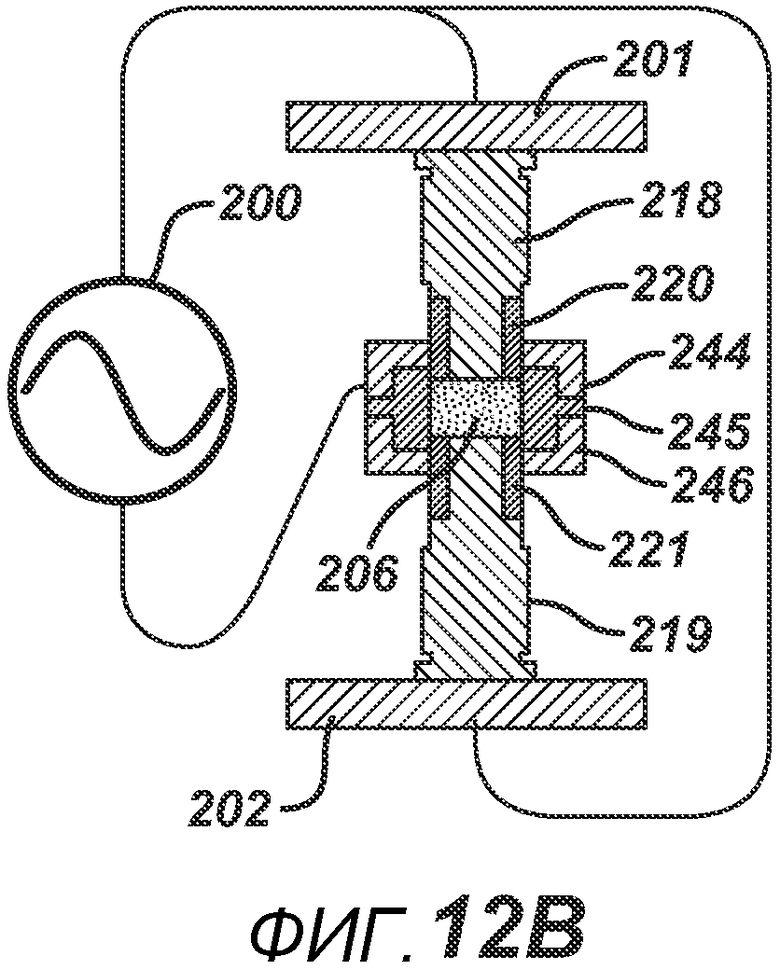
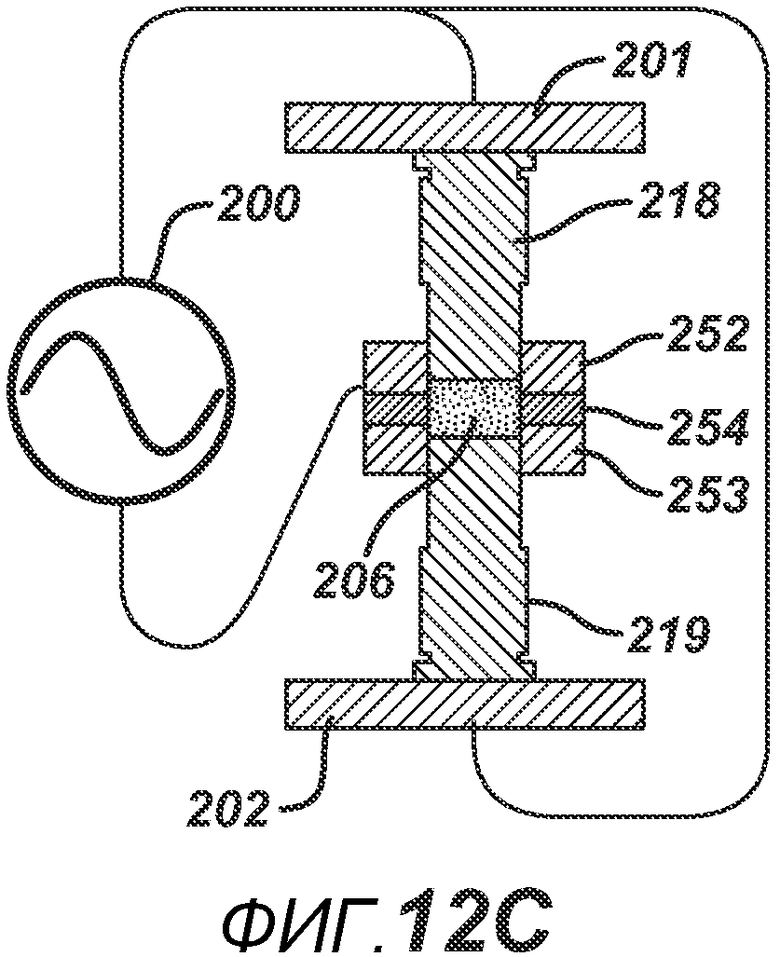
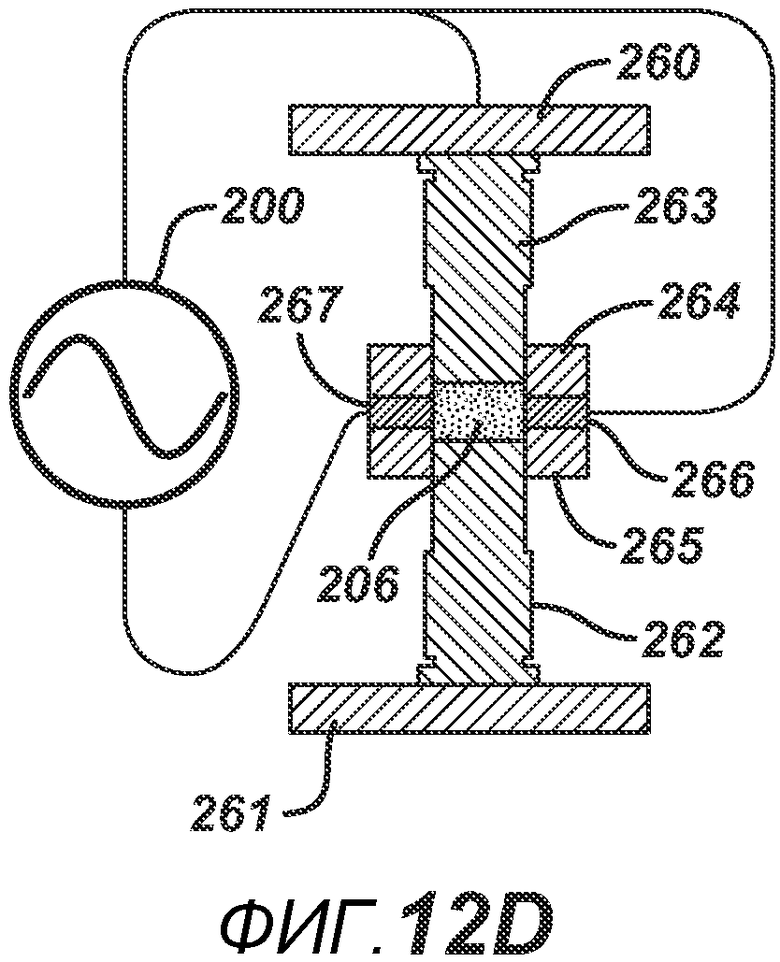
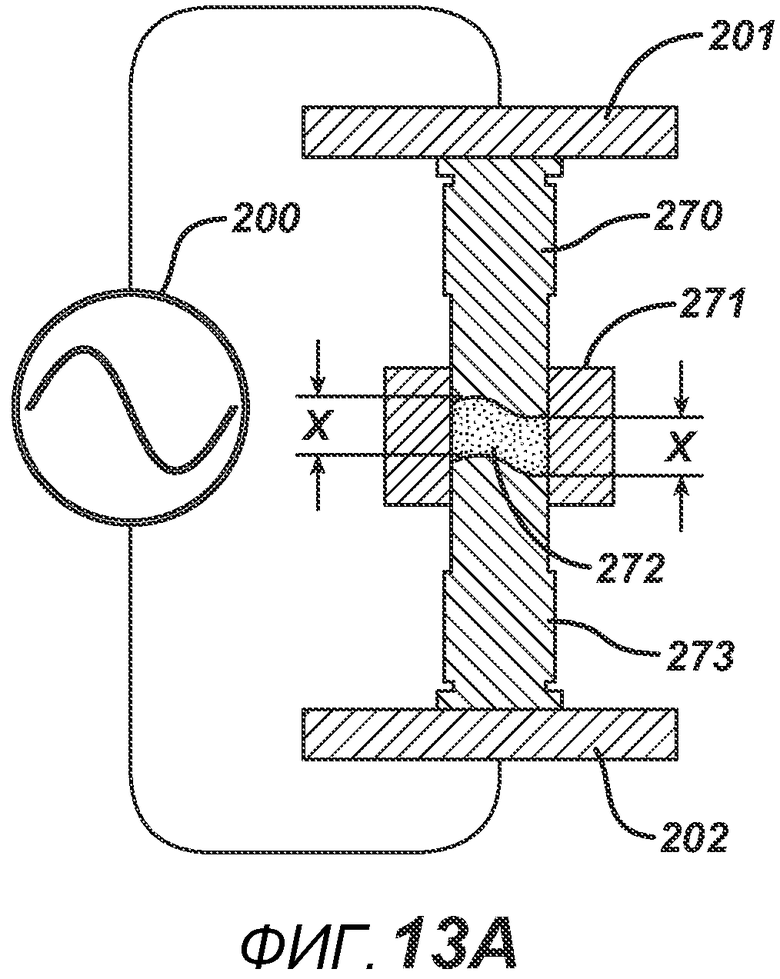
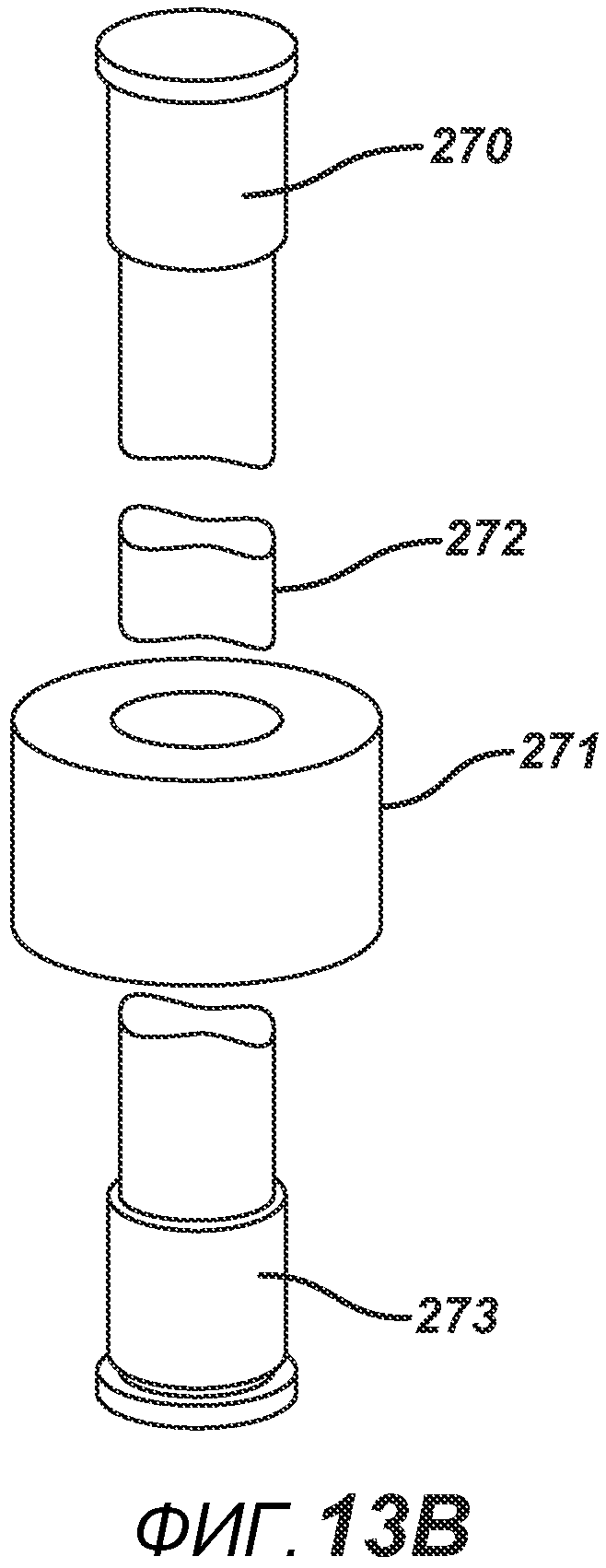
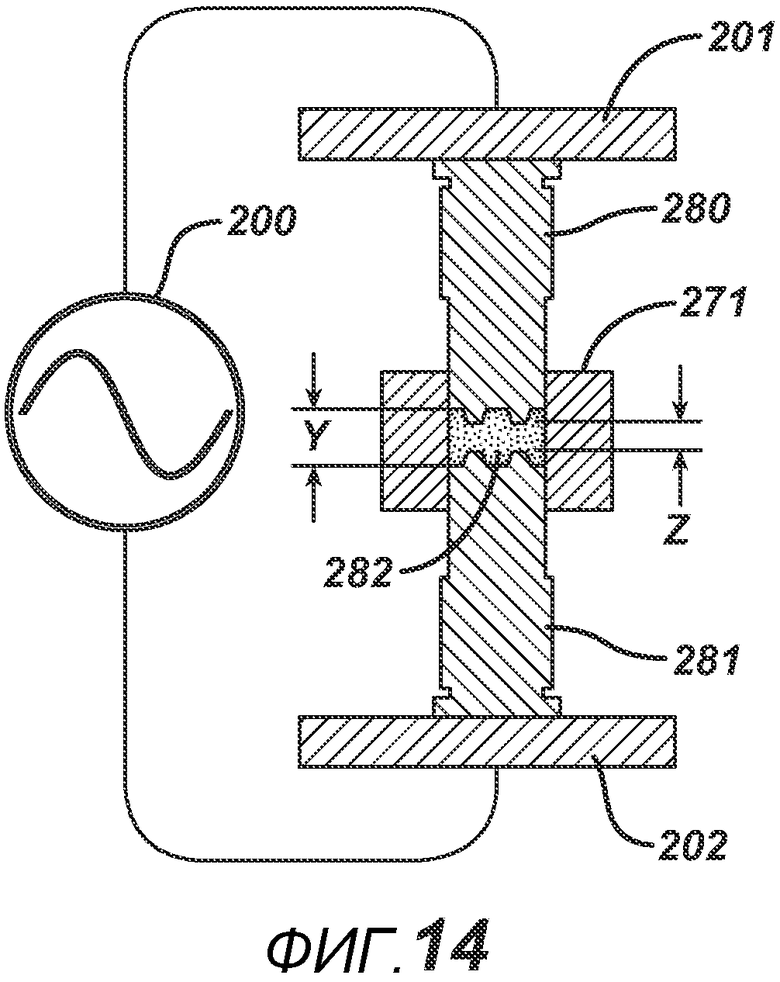
Настоящее изобретение относится к способу изготовления двухслойной таблетки. Для изготовления двухслойной таблетки добавляют на плиту пресс-формы сначала первую порошковую смесь, затем вторую порошковую смесь. Первая порошковая смесь содержит фармацевтически активное вещество и связующее вещество. Вторая порошковая смесь содержит связующее вещество. Композиция второй порошковой смеси отличается от композиции первой порошковой смеси. Далее прессуют первую порошковую смесь и вторую порошковую смесь на плите пресс-формы с образованием таблетированной формы, которую подвергают радиочастотному излучению в течение периода времени, достаточного для активации связующего вещества и сплавления таблетированной формы в двухслойную таблетку. Плотность таблетки составляет менее приблизительно 0,8 г/см3. Время рассасывания таблетки в полости рта при помещении на язык составляет менее приблизительно 30 с. 2 н. и 16 з.п. ф-лы, 14 ил., 10 табл., 12 пр.
1. Способ изготовления таблетки, содержащей первый слой и второй слой, включающий этапы, на которых:
добавляют первую порошковую смесь на плиту пресс-формы, причем указанная первая порошковая смесь содержит фармацевтически активное вещество и связующее вещество;
добавляют вторую порошковую смесь на указанную плиту пресс-формы, причем указанная вторая порошковая смесь содержит связующее вещество, а композиция указанной второй порошковой смеси отличается от композиции указанной первой порошковой смеси;
прессуют первую порошковую смесь и вторую порошковую смесь на указанной плите пресс-формы для образования таблетированной формы; и
подвергают указанную таблетированную форму радиочастотному излучению в течение периода времени, достаточного для активации указанного связующего вещества внутри указанной таблетированной формы для сплавления указанной таблетированной формы в указанную таблетку таким образом, чтобы плотность указанной таблетки составляла менее приблизительно 0,8 г/см3, а указанная таблетка рассасывалась в полости рта при помещении на язык в течение менее приблизительно 30 с.
2. Способ по п.1, в котором указанное связующее вещество в указанной первой порошковой смеси и указанное связующее вещество в указанной второй порошковой смеси представляют собой плавкие материалы с температурой плавления от приблизительно 30°C до приблизительно 140°C, и указанная таблетированная форма подвергается указанному воздействию излучения в течение периода времени, достаточного для плавления или размягчения указанных связующих веществ.
3. Способ по п.1, в котором указанное связующее вещество в указанной первой порошковой смеси представляет собой связующее вещество, расплавляемое РЧ-излучением, и указанная таблетированная форма подвергается воздействию РЧ-излучения в течение времени, достаточного для расплавления или размягчения указанного связующего вещества, расплавляемого РЧ-излучением.
4. Способ по п.1, в котором указанная первая порошковая смесь содержит материал, нагреваемый РЧ-излучением, и указанная таблетированная форма подвергается воздействию РЧ-излучения в течение периода времени, достаточного для нагревания указанного материала, нагреваемого РЧ-излучением, таким образом, чтобы указанный материал, нагреваемый РЧ-излучением, расплавлял или размягчал указанное связующее вещество, входящее в состав указанной первой порошковой смеси.
5. Способ по п.1, в котором указанное связующее вещество в указанной первой порошковой смеси и указанное связующее вещество в указанной второй порошковой смеси представляют собой связующие материалы, активируемые водой, причем указанная первая порошковая смесь и указанная вторая порошковая смесь дополнительно содержат водосодержащие материалы, а указанная таблетированная форма подвергается указанному воздействию излучения в течение периода времени, достаточного для нагревания водосодержащих материалов выше их температуры дегидратации.
6. Способ по п.1, в котором указанная первая порошковая смесь содержит частицы, содержащие указанное первое фармацевтически активное вещество, причем указанные частицы покрыты указанным связующим веществом.
7. Способ по п.1, включающий этап, на котором прессуют указанную первую порошковую смесь перед добавлением указанной второй порошковой смеси на указанную плиту пресс-формы.
8. Способ по п.1, в котором поверхность указанной таблетки дополнительно подвергают воздействию инфракрасного излучения, причем большая часть длины волны указанного инфракрасного излучения составляет от приблизительно 0,5 до приблизительно 5 мкм.
9. Таблетка, полученная в соответствии со способом по пп. 1-8, содержащая первый слой и второй слой, причем:
(i) указанный первый слой содержит фармацевтически активное вещество, и композиция указанного первого слоя отличается от композиции указанного второго слоя;
(ii) плотность указанной таблетки составляет менее приблизительно 0,8 г/см3; и
(iii) рассасывание указанной таблетки в полости рта при помещении на язык занимает менее приблизительно 30 с.
10. Таблетка по п.9, в которой указанный второй слой содержит фармацевтически активное вещество.
11. Таблетка по п.10, в которой указанный первый слой не содержит то же фармацевтически активное вещество, что и указанный второй слой.
12. Таблетка по п.9, в которой указанный первый слой рассасывается по меньшей мере в два раза быстрее, чем указанный второй слой.
13. Таблетка по п.9, в которой цвет указанного первого слоя отличается от цвета указанного второго слоя.
14. Таблетка по п.9, в которой вкус указанного первого слоя отличается от вкуса указанного второго слоя.
15. Таблетка по п.9, содержащая третий слой, причем композиция указанного третьего слоя отличается от композиции указанного первого слоя и указанного второго слоя.
16. Таблетка по п.9, плотность которой составляет менее приблизительно 0,7 г/см3.
17. Таблетка по п.9, в которой указанное связующее вещество содержит полиэтиленгликоль со средним размером частиц менее приблизительно 100 мкм.
18. Таблетка по п.9, содержащая менее приблизительно 1 вес.% суперразрыхлителя.
| Колосоуборка | 1923 |
|
SU2009A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| Устройство для охлаждения водою паров жидкостей, кипящих выше воды, в применении к разделению смесей жидкостей при перегонке с дефлегматором | 1915 |
|
SU59A1 |
| US 4268465 A, 19.05.1981. | |||
Авторы
Даты
2016-03-27—Публикация
2011-03-21—Подача