Предлагаемое изобретение относится к медицине и биологии и предназначено для контрастирования структуры и ультраструктуры биологической ткани и отдельных клеток при ее исследовании с помощью сканирующего электронного микроскопа.
Впервые, сканирующий электронный микроскоп (СЭМ), использующий те же конструктивные принципы, что и современные модели, был предложен в 1942 году. После начала серийного производства с 1965 года эволюция СЭМ происходила непрерывно, вплоть до настоящего момента. С начала этого века на рынке стали появляться модели, позволяющие работать с образцами без напыления, в режиме низкого вакуума в камере микроскопа. Именно такие модели микроскопов сделали возможной работу с образцами биологических тканей в нативном состоянии. Для исследований с помощью СЭМ предыдущих поколений биологические ткани приходилось подготавливать специальным образом.
Первые работы, в которых описывалось применение сканирующего электронного микроскопа для изучения биологических препаратов, стали появляться практически сразу после его создания, в 60-е годы прошлого столетия.
Особенность биологических тканей при наблюдении в СЭМ связана с их химическим составом, в котором преимущественно представлены различные соединения легких химических элементов и вода. Вода, преобладающая в образцах тканей и клеток, исключала изучение препаратов в нативном виде при использовании СЭМ первых поколений. Это было связано с обязательным использованием в камере микроскопа вакуума n·10-3 - n·10-7 Па. Попытки поместить нативную ткань или клеточную культуру в такие условия приводили к ее быстрому обезвоживанию с недопустимым искажением структуры, что делало наблюдения бессмысленными. Именно этот факт послужил основой для классической пробоподготовки биологических образцов и предопределил необходимость либо химической фиксации ткани с последующим высушиванием, либо быстрого замораживания и лиофилизации (Springer Science+Business Media. Electron microscopy: methods and protocols. Third Edition. Kuo J, редактор. New York: Humana Press; Springer; 2014. 799 p.). Подготовленные таким образом образцы также имеют значительные искажения в структуре, связанные с потерей объема при обезвоживании, но эти искажения меньше, чем искажения при неуправляемом обезвоживании в высоком вакууме.
Вторая проблема, связанная с химическим составом биологических образцов, которую пришлось решать при классической подготовке биологических образцов, - низкая контрастность при электронной микроскопии. Разные типы тканей, за исключением костной, по своему преимущественному составу сочетают в себе различные соединения водорода, кислорода и углерода, все остальные химические элементы обнаруживаются в резкоподчиненном количестве. Такой «легкий» в элементном отношении состав, наряду с низкой физической плотностью, определяет низкую эффективность взаимодействия электронного пучка с веществом образца ткани. Этот факт определяет низкую контрастность при изучении нативных тканей с помощью сканирующего электронного микроскопа как во вторичных, так и в обратнорассеянных электронах.
Для увеличения контрастности применялись схемы контрастирования при предварительной подготовке проб к изучению. В основе контрастирования лежал принцип избирательного утяжеления среднего атомного веса структур ткани, достигавшийся либо пропиткой образца солями тяжелых катионов с халькофильными свойствами (чаще всего свинца) или сложных анионов с тяжелым элементом (чаще всего уранил-иона и вольфрамата), либо выдерживанием в парах тетроксида осмия, тропного преимущественно к липидам. Для модификации поверхности при наблюдении в режиме высокого вакуума применялось напыление металлами: золотом, платиноидами, углеродом или медью.
К недостаткам классической схемы подготовки биологической ткани к исследованию при помощи сканирующего электронного микроскопа можно отнести:
1. Очевидную избыточность обезвоживания образцов, так как современные сканирующие микроскопы позволяют наблюдать ткани в режиме низкого вакуума во влажном состоянии, и исключить при этом артефакты, связанные с предварительной лиофилизацией или химическим замещением воды в структурах биологических объектов.
2. Агрессивность контрастирующих веществ по отношению к биологическим тканям. Используемые в классической схеме контрастирующие вещества не являются химически нейтральными по отношению к большинству органических веществ, входящих в состав тканей. При вымачивании тканей растворы или пары этих веществ имеют окислительно-восстановительный потенциал и pH, далеко выходящие за пределы химической устойчивости структур. Это не исключает возникновение артефактов на этапе контрастирования за счет коррозии структур образца.
3. Высокую токсичность и летучесть наиболее популярного красителя - тетроксида осмия, определяющего сложность выполнения подготовки тканей.
4. Избыточность напыления токопроводящего слоя на поверхности при исследовании на современных сканирующих электронных микроскопах в режимах низкого вакуума. Современные микроскопы позволяют отводить заряд с поверхности образца не через напыленный токопроводящий слой, а посредством ионизации газов в камере микроскопа. Напыление приводит как к сглаживанию естественной микроструктуры поверхности наблюдаемых объектов, так и к возникновению артефактов в момент наблюдений за счет реконденсации напыления под электронным пучком.
Известен способ контрастирования препаратов для проведения электронной микроскопии иммуноконьюгированными частицами золота (Richards RG, Stiffanic М, Owen GR, Riehle M, Ар Gwynn I, Curtis AS. Immunogold labelling of fibroblast focal adhesion sites visualised in fixed material using scanning electron microscopy, and living, using internal reflection microscopy. Cell Biol Int. 2001; 25 (12): 1237-49.) Этот способ принят за ближайший аналог.
Схема контрастирования, описанная в этой работе, позволяла, так же как и в предлагаемом способе, добиться насыщения определенных структурных элементов клетки химическим элементом с высоким атомным номером. Однако в этом случае остается открытым вопрос о проницаемости клеточных мембран для частиц золота. Авторы работы сами признают, что избирательность проникновения и распределения наночастиц золота в клетке неоднозначна и может приводить к значительным артефактам.
Таким образом, на текущий момент диапазон методов контрастирования биологической ткани для СЭМ можно определить эволюционным рядом: от методов химического окрашивания, искажающих биологические объекты и пригодных только для классической высоковакуумной микроскопии, до попытки физической избирательной импрегнации образца на основе иммунной реакции.
Задачей изобретения явилась разработка способа подготовки биологической ткани к исследованию при помощи сканирующей электронной микроскопии, позволившего бы изучать структуру и ультраструктуру образца с наименьшими искажениями.
Техническим результатом предлагаемого способа является возможность при проведении сканирующей электронной микроскопии с удовлетворительной контрастностью во вторичных электронах наблюдать микрорельеф биологического объекта и с высокой контрастностью в обратнорассеянных электронах наблюдать структуру и ультраструктуру подповерхностного слоя биологической ткани, не прибегая при этом к предварительному обезвоживанию или фиксации, а также напылению токопроводящим слоем образца.
Технический результат достигается за счет использования в качестве контрастирующего вещества изотонического водного раствора одного из хлоридов редкоземельных элементов или их смеси, при этом нативный образец подвергают суправитальному контрастированию с экспозицией от 20 минут до 6 часов.
Попытки применять в качестве контрастирующего агента соединения редкоземельных элементов предпринимались только в световой микроскопии (Bunzli J-CG. Lighting up cells with lanthanide self-assembled helicates. Interface Focus. 2013; 3 (5): 20130032).
В основе предлагаемого способа лежит представление об иммобилизации редкоземельных элементов (РЗЭ) при обменных процессах на уровне Ca2+-каналов различных мембран, с накоплением редкоземельных элементов в этой позиции. Этот процесс на настоящий момент весьма изучен (Yang J, Liu Q, Wu S, Xi Q, Cai Y. Effects of lanthanum chloride on glutamate level, intracellular calcium concentration and caspases expression in the rat hippocampus. Biometals. 2013 Feb; 26 (1): 43-59.) и (Li X, He P, Xia J, Song S, Lu J, Liu Y. Effect of lanthanum chloride on growth of breast cancer cells and regulation of c-met transcription. Front Med China. 2009 Sep 1; 3 (3): 336-40).
Под группой РЗЭ понимаются лантан, иттрий и лантаноиды, изученные в этих работах в разной степени, однако крайняя близость их химических свойств позволяет экстраполировать эти данные на всю группу (Серебренников В.В. Химия редкоземельных элементов, 1959). В некоторых из отмеченных выше работ было указано, что в присутствии редкоземельных элементов не происходит мгновенной гибели и лизиса клеток, а токсический эффект на клеточном уровне приводит к апоптозу, что подтверждает включенность РЗЭ в метаболические цепочки клетки и позволяет таким образом использовать их соединения в качестве суправитального красителя.
Нейтральные Eh-pH свойства водных растворов хлоридов РЗЭ, наряду с биодоступностью Cl-иона, делают эти соединения оптимальными для окрашивания живых клеточных культур и изолированных тканей. Это вытекает из самой формулы LaCl3. При диссоциации баланс электронов и протонов остается нулевым. Кислые промежуточные продукты диссоциации не образуются, т.к. хлор одновалентен и, кроме того, Cl-анион является общим с главными электролитами тканей.
Дополнительным эффектом от использования РЗЭ в качестве суправитального красителя является стабилизация естественного обезвоживания ткани. Этот эффект не был изучен в полной мере, лишь описан в исследовании цитотоксичности NdCl3 (Huang Р., Li J., Zhang S., Chen C., Han Y., Liu N. et al. Effects of lanthanum, cerium, and neodymium on the nuclei and mitochondria of hepatocytes: accumulation and oxidative damage. Environ Toxicol Pharmacol. 2011 Jan; 31 (1): 25-32.).
Наши исследования подтвердили лучшую сохранность клеток в низком вакууме микроскопа после экспозиции культуры мезенхимальных стволовых клеток в растворе NdCl3 по сравнению с группой контроля. У 50 из 50 наблюдаемых клеток после суправитального окрашивания РЗЭ ядра имели правильную круглую и овальную форму, которая сохранялась в течение 4 часов при нахождении клеток в условиях давления 50 Па, в то же время в группе контроля из 50 клеток, экспонированных в изотоническом растворе хлорида натрия, у 47 за это же время ядра приобрели неправильную форму и уменьшились в размерах.
Кроме того, хлориды РЗЭ не являются опасными веществами, не имеют ограничений по хранению в кристаллическом состоянии, а приготовление изотонических растворов осуществляется простым смешиванием с водой.
Приготовление изотонических концентраций растворов можно проводить по формуле Вант-Гоффа (Еремин В.В., Каргов С.И., Успенская И.А., Кузьменко Н.Е., Лунин В.В. Основы физической химии. Теория и задачи: учеб. пособие для вузов. - М.: Издательство «Экзамен», 2005. - 480 с.).
Однако в ряде случаев в связи с особенностью разных тканей рекомендуется сделать предварительные тесты осмотического контроля с визуальным контролем формы клеток в световой микроскоп.
В связи со схожестью химических свойств тех РЗЭ, которые образуют растворимые хлориды, - не имеет практического значения, какой из хлоридов РЗЭ используется для контрастирования. Результаты будут одинаковы при использовании любого из хлоридов РЗЭ или их произвольной смеси.
Наилучших результатов контрастирования удалось добиться при выдерживании биологической ткани в растворе РЗЭ от 20 минут до 6 часов, в физиологичных для контрастируемой ткани условиях.
Важно, что предварительно перед контрастированием необходимо тщательно промывать образцы в изотоническом растворе NaCl. Иначе часть РЗЭ, будучи тройными к фосфатам, могут связаться с обязательно присутствующими фосфатными компонентами ростовых сред и жидкости основного вещества ткани, сорбировавшейся на поверхность образца. После контрастирования рекомендуется смывать остатки контрастирующего раствора кратковременной (1-10 сек) промывкой в дистиллированной воде. Подготовленные с помощью предлагаемого способа контрастирования образцы биологических тканей можно наблюдать на любых типах сканирующих электронных микроскопов, допускающих наблюдения в режиме низкого вакуума.
После предлагаемого контрастирования возможны наблюдения как в режиме вторичных электронов, так и в режиме обратнорассеянных электронов. Наибольшая контрастность подповерхностного слоя образца достигается в режиме обратнорассеянных электронов при ускоряющем напряжении 15-30 кВ.
Способ осуществляют следующим образом:
1. Образец биологической ткани (культуру клеток, изолированный блок ткани и т.п.) промывают в изотоническом растворе NaCl.
2. После промывки образец биологической ткани размещают в емкости с водным изотоническим раствором одного из хлоридов редкоземельных элементов или их смеси, при этом нативную ткань экспонируют в растворе от 20 минут до 6 часов.
3. Образец изымают из емкости с контрастирующим раствором и кратковременно промывают в дистиллированной воде (1-10 сек).
4. Образец размещают на предметном столике микроскопа.
5. Проводят сканирующую электронную микроскопию в режиме низкого вакуума, при ускоряющем напряжении 15-30 кВ.
Пример 1.
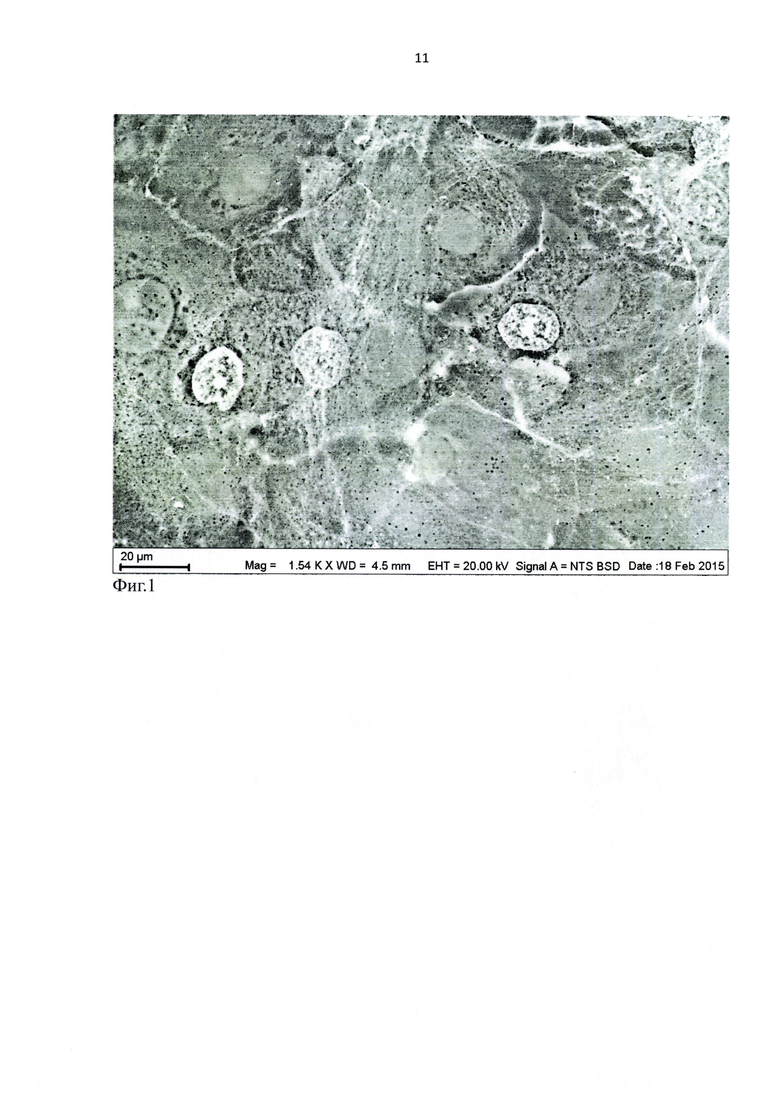
Для изучения методом сканирующей электронной микроскопии был получен образец культуры клеток эпителия роговицы человека на поверхности культурального пластика. Решался вопрос о компактности расположения клеток в монослое. Образец промыли в изотоническом растворе NaCl. После промывки образец разместили в емкости с водным изотоническим раствором хлорида неодима и выдержали в растворе 40 минут. Затем образец переместили в кювету с дистиллированной водой и промыли его в течение 5 секунд. Удалив с поверхности образца избыток воды (чтобы не увеличивать время контакта образца с водой), разместили образец на предметном столике микроскопа.
Сканирующая электронная микроскопия образца в режиме низкого вакуума, при ускоряющем напряжении 20 кВ, позволила получить изображения в обратно-рассеянных электронах с визуализацией не только ядер, ядрышек и Ca-каналов, но и яркими межклеточными контактами (фиг. 1). Последнее доказывает наличие активных межклеточных контактов эпителиальных клеток в монослое на основе контрастированных Ca-насосов.
Пример 2.
Для изучения методом сканирующей электронной микроскопии, хирургически был получены два фрагмента эпителия конъюнктивы человека с подстилающей его базальной мембраной. Была поставлена задача визуализировать методом сканирующей электронной микроскопии в сочетании с контрастированием хлоридами РЗЭ микроворсинки на поверхности эпителиальных клеток. Также ставилась задача сравнить результаты визуализации со вторым фрагментом, подготовленным к микроскопии фиксацией, обезвоживанием и напылением. Образец промыли в изотоническом растворе NaCl. После промывки первый фрагмент разместили в емкости с водным изотоническим раствором хлорида неодима и выдержали в растворе 40 минут. Затем переместили в кювету с дистиллированной водой, промыли его в течение 5 секунд и разместили на предметном столике микроскопа.
Сканирующая электронная микроскопия первого фрагмента в режиме низкого вакуума, при ускоряющем напряжении 20 кВ, позволила получить изображения микроворсинок на поверхности клеток эпителия во вторичных электронах (фиг. 2).
Второй фрагмент ткани, подготовленный классическим способом, не позволил корректно визуализировать элементы микроскульптуры поверхности клеток. Несмотря на большую контрастность изображения второго фрагмента эпителия, при его наблюдении в режиме высокого вакуума видно, что подготовка образца внесла необратимые искажения в его структуру. В частности, микроворсинки сохранились только в периферической зоне клеток, их форма и форма самих клеток сильно исказились (фиг. 3).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ подготовки биологического образца к исследованию при помощи сканирующей электронной микроскопии | 2018 |
|
RU2672356C1 |
| Лантаноидный краситель для контрастирования биологических препаратов при сканирующей электронной микроскопии в обратно-рассеянных электронах и способ его получения и применения | 2023 |
|
RU2837329C1 |
| СПОСОБ ПОДГОТОВКИ ПОВЕРХНОСТИ ОБРАЗЦОВ КОСТНОЙ ТКАНИ ДЛЯ ИЗУЧЕНИЯ ЕЁ МИКРОСТРУКТУРЫ ПРИ ПОМОЩИ СКАНИРУЮЩЕГО ЭЛЕКТРОННОГО МИКРОСКОПА | 2017 |
|
RU2668879C1 |
| Способ подготовки образцов костной ткани человека для исследования методом растровой электронной микроскопии | 2018 |
|
RU2688944C1 |
| Способ подготовки крупных образцов регенерирующей кости для сканирующей электронной микроскопии | 2020 |
|
RU2747640C1 |
| СПОСОБ ПОДГОТОВКИ ПРЕПАРАТА КРОВИ К ЭЛЕКТРОННО-МИКРОСКОПИЧЕСКОМУ ИССЛЕДОВАНИЮ | 2004 |
|
RU2273027C1 |
| Система визуализации и способ получения систем визуализации на основе наночастиц и их применение для повышения эффективности радиологических методов исследования злокачественных новообразований | 2023 |
|
RU2818267C1 |
| СПОСОБ ПОДГОТОВКИ ОБРАЗЦОВ БИОЛОГИЧЕСКИХ ТКАНЕЙ ДЛЯ ИССЛЕДОВАНИЯ В СКАНИРУЮЩЕМ ЭЛЕКТРОННОМ МИКРОСКОПЕ | 2008 |
|
RU2397472C1 |
| ПРИМЕНЕНИЕ ТЕРМОПАСТЫ В КАЧЕСТВЕ КЛЕЯЩЕГО И ТЕПЛОПРОВОДЯЩЕГО СОСТАВА ПРИ ИССЛЕДОВАНИИ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ НА СКАНИРУЮЩЕМ ЭЛЕКТРОННОМ МИКРОСКОПЕ С ИСПОЛЬЗОВАНИЕМ ЗАМОРАЖИВАЮЩЕЙ ПРИСТАВКИ | 2010 |
|
RU2445660C2 |
| СПОСОБ ДОПОЛНИТЕЛЬНОГО ЭЛЕКТРОННОПЛОТНОГО КОНТРАСТИРОВАНИЯ НУКЛЕИНОВЫХ КИСЛОТ В ЯДРЕ И ЦИТОПЛАЗМЕ ПРИ ГИСТОХИМИЧЕСКОМ ВЫЯВЛЕНИИ КАТИОНОВ НАТРИЯ В УЛЬТРАСТРУКТУРАХ КЛЕТОК И ТКАНЕЙ | 2013 |
|
RU2557931C2 |


Изобретение относится к биологии и медицине и может быть использовано для подготовки биологического образца к исследованию при помощи сканирующей электронной микроскопии. Для этого перед контрастированием промывают образцы в изотоническом растворе хлорида натрия. В качестве контрастирующего вещества используют изотонический водный раствор одного из хлоридов редкоземельных элементов или их смеси. При этом нативный образец подвергают суправитальному контрастированию с экспозицией от 20 минут до 6 часов. Изобретение обеспечивает возможность при проведении сканирующей электронной микроскопии с удовлетворительной контрастностью во вторичных электронах наблюдать микрорельеф биологического объекта и с высокой контрастностью в обратнорассеянных электронах наблюдать структуру и ультраструктуру подповерхностного слоя биологической ткани, не прибегая при этом к предварительному обезвоживанию или фиксации, а также напылению токопроводящим слоем образца. 3 ил., 2 пр.
Способ подготовки биологического образца к исследованию при помощи сканирующей электронной микроскопии, включающий использование контрастирующего вещества, отличающийся тем, что перед контрастированием промывают образцы в изотоническом растворе хлорида натрия, а в качестве контрастирующего вещества используют изотонический водный раствор одного из хлоридов редкоземельных элементов или их смеси, при этом нативный образец подвергают суправитальному контрастированию с экспозицией от 20 минут до 6 часов.
| RICHARDS RG et al | |||
| Immunogold labelling of fibroblast focal adhesion sites visualised in fixed material using scanning electron microscopy, and living, using internal reflection microscopy | |||
| Cell Biol Int | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| СКАНИРУЮЩИЙ ЗОНДОВЫЙ МИКРОСКОП | 2011 |
|
RU2461839C1 |
| СПОСОБ ОСАЖДЕНИЯ ЗОЛОТА, СПОСОБ ОПРЕДЕЛЕНИЯ ПРИСУТСТВИЯ КОНКРЕТНОГО ВЕЩЕСТВА НА АКТИВНЫХ ЦЕНТРАХ НА ПОДЛОЖКЕ, СПОСОБ ОПРЕДЕЛЕНИЯ ПРИСУТСТВИЯ АНАЛИЗИРУЕМОГО ВЕЩЕСТВА В ОБРАЗЦЕ И НАБОР СРЕДСТВ, ИСПОЛЬЗУЕМЫЙ В СПОСОБЕ (ВАРИАНТЫ) | 1999 |
|
RU2242005C2 |
| BUNZLI J-CG | |||
| Lighting up cells with lanthanide self-assembled helicates | |||
| Interface Focus | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
Авторы
Даты
2016-03-27—Публикация
2015-05-12—Подача