Родственные заявки
[0001] Настоящая заявка испрашивает приоритет по предварительной заявке США №62/337,005, поданной 16 мая 2016 г.; предварительной заявке США №62/414,146, поданной 28 октября 2016 г.; и предварительной заявки США №62/420,937, поданной 11 ноября 2016 г., содержание каждой из которых включено в настоящий документ посредством ссылки во всей своей полноте.
Область техники изобретения
[0002] Настоящее изобретение относится к выделенным полипептидам, которые являются селективными к рецептору глюкагона аналогами, и их пептидным производным. Такие аналоги и производные пептидов имеют улучшенную растворимость, термическую стабильность, а также физико-химические свойства по сравнению с нативным эндогенным глюкагоном. Настоящее изобретение также относится к способам применения таких полипептидов при различных терапевтических и диагностических показаниях, а также способам получения таких полипептидов. Данные аналоги могут быть использованы в способах лечения ожирения, диабета, нарушений обмена веществ, а также других заболеваний или расстройств.
Уровень техники
[0003] Глюкагон, пептидный гормон, вырабатываемый альфа-клетками поджелудочной железы, и глюкагоноподобный пептид-1 (GLP-1), нейропептид, образуются из препроглюкагона, полипептида-предшественника, состоящего из 158 аминокислот, который процессируется в различных тканях с образованием ряда различных пептидов, происходящих из проглюкагона. Эти происходящие из проглюкагона пептиды, которые включают, например, глюкагон, GLP-1, глюкагоноподобный пептид-2 (GLP-2) и оксинтомодулин (ОХМ), участвуют в широком спектре физиологических функций, включая гомеостаз глюкозы, секрецию инсулина, опорожнение желудка и рост кишечника, а также регуляцию приема пищи.
[0004] Соответственно, существует потребность в терапевтических средствах и способах лечения, которые имитируют активность GLP-1 и/или глюкагона.
Сущность изобретения
[0005] Настоящее изобретение относится к выделенным полипептидам, которые являются селективными к рецептору глюкагона аналогами, и их пептидным производным. Глюкагон представляет собой пептидный гормон, состоящий из 29 аминокислот, который вырабатывается альфа-клетками поджелудочной железы и который взаимодействует с рецептором глюкагона (GCGR).
[0006] В некоторых вариантах осуществления изобретения выделенный полипептид по данному раскрытию является аналогом глюкагона, который связывается с рецептором глюкагона (GCGR) и представляет собой агонист, селективный к рецептору глюкагона. Такие выделенные полипептиды по данному раскрытию являются активными, стабильными и растворимыми. Выделенные полипептиды селективно связываются с рецептором глюкагона, по сравнению с нативным глюкагоном, например человеческим глюкагоном, и по сравнению со способностью связываться с рецептором GLP-1. Выделенные полипептиды обладают улучшенной метаболической стабильностью и скоростью выведения препарата из почек, близкой к скорости клубочковой фильтрации, в сравнении с такими параметрами нативного глюкагона, например, человеческого глюкагона. Выделенные полипептиды демонстрируют улучшенную растворимость по сравнению с нативным глюкагоном, например человеческим глюкагоном. В предпочтительных вариантах осуществления настоящего изобретения выделенные полипептиды демонстрируют улучшенную растворимость по меньшей мере 200 мг/мл. Выделенные полипептиды демонстрируют улучшенную химическую стабильность при комнатной температуре и при более высоких температурах, таких как 37°С или выше.
[0007] Выделенные полипептиды по раскрытию являются производными от типа, который придает селективность, растворимость и улучшенное выделение молекулы из почки. Выбор этого типа основан на (а) определении критической структуры, необходимой для селективности к рецептору глюкагона, (б) идентификации критических аминокислот и мотивов вторичных структур, которые обеспечивают улучшенную растворимость при одновременном повышении или по меньшей мере поддержании активности человеческого глюкагона, и (с) идентификации аминокислотных замен для придания химической стабильности агонистов, селективных к рецептору глюкагона.
[0008] В некоторых вариантах осуществления изобретения выделенный полипептид по данному раскрытию содержит модифицированную аминокислотную последовательность, основанную на аминокислотной последовательности человеческого глюкагона: HSQGTFTSDYSKYLDSRRAQDFVQWLMNT-OH (SEQ ID NO: 140), где модифицированная аминокислотная последовательность включает в себя по меньшей мере одну аминокислотную замену, по меньшей мере две аминокислотные замены, по меньшей мере три аминокислотные замены, по меньшей мере четыре аминокислотные замены, по меньшей мере пять аминокислотных замен, по меньшей мере шесть аминокислотных замен, по меньшей мере семь аминокислотных замен, по меньшей мере восемь аминокислотных замен, по меньшей мере девять аминокислотных замен, по меньшей мере 10 аминокислотных замен, по меньшей мере 11 аминокислотных замен, по меньшей мере 12 аминокислотных замен, по меньшей мере 13 аминокислотным заменам, по меньшей мере 14 аминокислотных замен, по меньшей мере 15 аминокислотных замен, по меньшей мере 16 аминокислотных замен, по меньшей мере 17 аминокислотных замен, по меньшей мере 18 аминокислотных замен, по меньшей мере 19 аминокислотных замен, по меньшей мере 20 аминокислотных замен, по меньшей мере 21 аминокислотная замена, по меньшей мере 22 аминокислотные замены, по меньшей мере 23 аминокислотные замены, по меньшей мере 24 аминокислотные замены, по меньшей мере 25 аминокислотных замен, по меньшей мере 26 аминокислотных замен, по меньшей мере 27 аминокислотных замен, по меньшей мере 28 аминокислотных замен и/или по меньшей мере 29 аминокислотных замен, при условии, что выделенный полипептид, имеющий модифицированную аминокислотную последовательность, сохраняет способность функционировать в качестве селективного аналога глюкагона.
[0009] В некоторых вариантах осуществления изобретения выделенный полипептид по данному раскрытию содержит модифицированную аминокислотную последовательность, основанную на аминокислотной последовательности человеческого глюкагона: HSQGTFTSDYSKYLDSRRAQDFVQWLMNT-OH (SEQ ID NO: 140), где модифицированная аминокислотная последовательность включает в себя по меньшей мере одну аминокислотную замену, по меньшей мере две аминокислотные замены, по меньшей мере три аминокислотные замены, по меньшей мере четыре аминокислотные замены, по меньшей мере пять аминокислотных замен, по меньшей мере шесть аминокислотных замен, по меньшей мере семь аминокислотных замен, по меньшей мере восемь аминокислотных замен, по меньшей мере девять аминокислотных замен, по меньшей мере 10 аминокислотных замен, по меньшей мере 11 аминокислотных замен, по меньшей мере 12 аминокислотных замен, по меньшей мере 13 аминокислотных замен, по меньшей мере 14 аминокислотных замен, по меньшей мере 15 аминокислотных замен, или по меньшей мере 16 аминокислотных замен, где аминокислотные замены выбраны из группы, состоящей из:
(i) аминокислотной замены в положении 1, выбранной из группы, состоящей из Y и W;
(ii) аминокислотной замены в положении 2, выбранной из группы, состоящей из G и T;
(iii) аминокислотной замены в положении 3 на Н;
(iv) аминокислотной замены в положении 10 на Н;
(v) аминокислотной замены в положении 11 на Т;
(vi) аминокислотной замены в положении 12 на R;
(vii) аминокислотной замены в положении 13, выбранной из группы, состоящей из L и W;
(viii) аминокислотной замены в положении 15 на Е;
(ix) аминокислотной замены в положении 16, выбранной из группы, состоящей из 2-аминоизомасляной кислоты (Aib), А, Е, I, K, L и Q;
(x) аминокислотной замены в положении 17, выбранной из группы, состоящей из А, Е, K, S, и Т;
(xi) аминокислотной замены в положении 18, выбранной из группы, состоящей из А, Е, L и Т;
(xii) аминокислотной замены в положении 21 на Е;
(xiii) аминокислотной замены в положении 23 на Т;
(xiv) аминокислотной замены в положении 24, выбранной из группы, состоящей из 2-аминоизомасляной кислоты (Aib), K и L;
(xv) аминокислотной замены в положении 25 на Н; а также
(xvi) аминокислотной замены в положении 30 на Z-хвост, выбранный из группы, состоящей из EEPSSGAPPPS-OH (SEQ ID NO: 4); EPSSGAPPPS-OH (SEQ ID NO: 5); GAPPPS-OH (SEQ ID NO: 6); GGPSSGAPPPS-OH (SEQ ID NO: 7); GPSSGAPPPS-OH (SEQ ID NO: 8); KRNKNPPPS-OH (SEQ ID NO: 9); KRNKNPPS-OH (SEQ ID NO: 10); KRNKPPIA-OH (SEQ ID NO: 11); KRNKPPPA-OH (SEQ ID NO: 150); KRNKPPPS-OH (SEQ ID NO: 12); KSSGKPPPS-OH (SEQ ID NO: 13); PESGAPPPS-OH (SEQ ID NO: 14); PKSGAPPPS-OH (SEQ ID NO: 15); PKSKAPPPS- NH2 (SEQ ID NO: 16); PKSKAPPPS-OH (SEQ ID NO: 17); PKSKEPPPS-NF2 (SEQ ID NO: 18); PKSKEPPPS-OH (SEQ ID NO: 19); PKSKQPPPS-OH (SEQ ID NO: 20); PKSKSPPPS-NF2 (SEQ ID NO: 21); PKSKSPPPS-OH (SEQ ID NO: 22); PRNKNNPPS- OH (SEQ ID NO: 23); PSKGAPPPS-OH (SEQ ID NO: 24); PSSGAPPPSE-OH (SEQ ID NO: 25); PSSGAPPPS-NF2 (SEQ ID NO: 26); PSSGAPPPS-OH (SEQ ID NO: 27); PSSGAPPPSS-OH (SEQ ID NO: 28); PSSGEPPPS-OH (SEQ ID NO: 29); PSSGKKPPS-OH (SEQ ID NO: 30); PSSGKPPPS-NF2 (SEQ ID NO: 31); PSSGKPPPS-OH (SEQ ID NO: 32); PSSGSPPPS-OH (SEQ ID NO: 33); PSSKAPPPS-OH (SEQ ID NO: 34); PSSKEPPPS-OH (SEQ ID NO: 35); PSSKGAPPPS-OH (SEQ ID NO: 36); PSSKQPPPS-OH (SEQ ID NO: 37); PSSKSPPPS-OH (SEQ ID NO: 38); SGAPPPS-OH (SEQ ID NO: 39); и SSGAPPPS-OH(SEQ ID NO: 40); и
(xvii) их комбинации,
при условии, что выделенный полипептид, имеющий модифицированную аминокислотную последовательность, сохраняет способность функционировать в качестве агониста, селективного к рецептору глюкагона.
[0010] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных консенсусной последовательностью SEQ ID NO: 1:
X1X2X3GTFTSDX10X11X12X13LX15X16X17X18AQEFX23X24X25LEDE-Z-хвост-(OH/NH2) (SEQ ID NO: 1), где:
X1 представляет собой Y или W;
X2 представляет собой S, G или T;
Х3 представляет собой Q или Н;
Х10 представляет собой Y или Н;
Х11 представляет собой S или Т;
Х12 представляет собой K или R;
Х13 представляет собой Y, L или W;
Х15 представляет собой D или Е;
X16 представляет собой S, 2-аминоизомасляную кислоту (Aib), А, Е, L, Q, K или I;
Х17 представляет собой K, Е, S, Т или А;
X18 представляет собой A, R, S, Е, L, Т или Y;
Х23 представляет собой Т или V;
Х24 представляет собой K, I, L или Aib;
Х25 представляет собой Н или W; и
концевой сегмент Z отсутствует или выбран из группы, состоящей из EEPSSGAPPPS- ОН (SEQ ID NO: 4); EPSSGAPPPS-OH (SEQ ID NO: 5);
GAPPPS-OH
(SEQ ID NO: 6); GGPSSGAPPPS-OH (SEQ ID NO: 7); GPSSGAPPPS-OH
(SEQ ID NO: 8); KRNKNPPPS-OH (SEQ ID NO: 9); KRNKNPPS-OH
(SEQ ID NO: 10); KRNKPPIA-OH (SEQ ID NO: 11); KRNKPPPA-OH
(SEQ ID NO: 150); KRNKPPPS-OH (SEQ ID NO: 12); KSSGKPPPS-OH
(SEQ ID NO: 13); PESGAPPPS-OH (SEQ ID NO: 14); PKSGAPPPS-OH
(SEQ ID NO: 15); PKSKAPPPS-NH2 (SEQ ID NO: 16); PKSKAPPPS-OH
(SEQ ID NO: 17); PKSKEPPPS-NH2 (SEQ ID NO: 18); PKSKEPPPS-OH
(SEQ ID NO: 19); PKSKQPPPS-OH (SEQ ID NO: 20); PKSKSPPPS-NH2
(SEQ ID NO: 21); PKSKSPPPS-OH (SEQ ID NO: 22); PRNKNNPPS-OH
(SEQ ID NO: 23); PSKGAPPPS-OH (SEQ ID NO: 24); PSSGAPPPSE-OH
(SEQ ID NO: 25); PSSGAPPPS-NH2 (SEQ ID NO: 26); PSSGAPPPS-OH
(SEQ ID NO: 27); PSSGAPPPSS-OH (SEQ ID NO: 28); PSSGEPPPS-OH
(SEQ ID NO: 29); PSSGKKPPS-OH (SEQ ID NO: 30); PSSGKPPPS-NH2
(SEQ ID NO: 31); PSSGKPPPS-OH (SEQ ID NO: 32); PSSGSPPPS-OH
(SEQ ID NO: 33); PSSKAPPPS-OH (SEQ ID NO: 34); PSSKEPPPS-OH
(SEQ ID NO: 35); PSSKGAPPPS-OH (SEQ ID NO: 36); PSSKQPPPS-OH
(SEQ ID NO: 37); PSSKSPPPS-OH (SEQ ID NO: 38); SGAPPPS-OH
(SEQ ID NO: 39); и SSGAPPPS-OH(SEQ ID NO: 40).
[0011] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных консенсусной последовательностью SEQ ID NO: 2:
X1X2X3GTFTSDX10X11X12X13LX15X16X17X18AQEFVX24WLEDE-Z-хвост-(OH/NH2)
(SEQ ID NO: 2), где:
X1 представляет собой Y или W;
X2 представляет собой S или G;
Х3 представляет собой Q или Н;
Х10 представляет собой Y или Н;
Х11 представляет собой S или Т;
Х12 представляет собой K или R;
Х13 представляет собой Y, L или W;
Х15 представляет собой D или Е;
X16 представляет собой 2-аминоизомасляную кислоту (Aib), А или S;
Х17 представляет собой А или K;
X18 представляет собой R, S, L или Y;
Х24 представляет собой K, I или Aib;
Х25 представляет собой Н или W; и
концевой сегмент Z отсутствует или выбран из группы, состоящей из PSSGAPPPS-NH2 (SEQ ID NO: 26); PSSGAPPPS-OH (SEQ ID NO: 27); и PKSKSPPPS- NH2 (SEQ ID NO: 21).
[0012] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных консенсусной последовательностью SEQ ID NO: 3:
YSX3GTFTSDYSKYLDX16X17X18AQEFVX24WLEDE-Z-хвост-(OH/NH2) (SEQ ID NO: 3), где:
Х3 представляет собой Q или Н;
X16 представляет собой 2-аминоизомасляную кислоту (Aib) или А;
Х17 представляет собой А или K;
X18 представляет собой R, S, или Y;
Х24 представляет собой K или Aib;
Z-хвост выбран из группы, состоящей из PSSGAPPPS-OH (SEQ ID NO: 27) и
PKSKSPPPS-NH2 (SEQ ID NO: 21).
[0013] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из YSHGTFTSDYSKYLD(Aib)KYAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 41); также называемую в данном документе соединением А1;
YSHGTFTSDYSKYLD(Aib)KSAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 42); также называемую в данном документе соединением А2;
YSQGTFTSDYSKYLDAARAQEFVKWLEDEPKSKSPPPS-NH2 (SEQ ID NO: 43); также называемую в данном документе соединением A3;
YSHGTFTSDYSKYLD(Aib)KRAQEFVIWLEDEPSSGAPPPS-OH (SEQ ID NO: 44); также называемую в данном документе соединением А4;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPSSGAPPPS-NH2 (SEQ ID NO: 45), также называемую в данном документе соединением А5; и
WSQGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPS S GAPPPS-OH (SEQ ID NO: 46), также называемую в данном документе соединением А6.
[0014] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность
YSHGTFTSDYSKYLD(Aib)KYAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 41). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность
YSHGTFTSDYSKYLD(Aib)KSAQEFV(Aib)WLEDEPSSGAPPPS- ОН (SEQ ID NO: 42). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность
YSQGTFTSDYSKYLDAARAQEFVKWLEDEPKSKSPPPS-NH2 (SEQ ID NO: 43). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность
YSHGTFTSDYSKYLD(Aib)KRAQEFVIWLEDEPSSGAPPPS-OH (SEQ ID NO: 44). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPSSGAPPPS-NH2 (SEQ ID NO: 45). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность
WSQGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 46).
[0015] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию состоит из аминокислотной последовательности
YSHGTFTSDYSKYLD(Aib)KYAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 41). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию состоит из аминокислотной последовательности
YSHGTFTSDYSKYLD(Aib)KSAQEFV(Aib)WLEDEPSSGAPPPS- ОН (SEQ ID NO: 42). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию состоит из аминокислотной последовательности
YSQGTFTSDYSKYLDAARAQEFVKWLEDEPKSKSPPPS-NF2 SEQ ID NO: 43). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию состоит из аминокислотной последовательности
YSHGTFTSDYSKYLD(Aib)KRAQEFVIWLEDEPSSGAPPPS-OH (SEQ ID NO: 44). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию состоит из аминокислотной последовательности
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPSSGAPPPS-NF2 (SEQ ID NO: 45). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию состоит из аминокислотной последовательности
WSQGTFTSDYSKYLD(Ab)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 46).
[0016] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из YSHGTFTSDYSKYLDAARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 143); также называемую в данном документе соединением А97;
YSHGTFTSDYTRLLESKRAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 144); также называемую в данном документе соединением А98;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 145); также называемую в данном документе соединением А99;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDE-OH (SEQ ID NO: 146); также называемую в данном документе соединением А100;
YGHGTFTSDHSKYLD(Aib)KPAQEFVKWLEDE-OH (SEQ ID NO: 147); также называемую в данном документе соединением А101;
YSHGTFTSDYSKWLD(Aib)KRAQEFVKWLEDE-OH (SEQ ID NO: 148), также называемую в данном документе соединением А102; и
YSHGTFTSDYSKYLD(Aib)ARAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 149), также называемую в данном документе соединением А103.
[0017] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность
YSHGTFTSDYSKYLDAARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 143), также называемую в данном документе соединением А97.
[0018] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность
YSHGTFTSDYTRLLESKRAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 144), также называемую в данном документе соединением А98.
[0019] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 145), также называемую в данном документе соединением А99.
[0020] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDE-OH (SEQ ID NO: 146), также называемую в данном документе соединением А100.
[0021] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность
YGHGTFTSDHSKYLD(Aib)KRAQEFVKWLEDE-OH (SEQ ID NO: 147), также называемую в данном документе соединением А101.
[0022] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность
YSHGTFTSDYSKWLD(Aib)KRAQEFVKWLEDE-OH (SEQ ID NO: 148), также называемую в данном документе соединением А102.
[0023] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность
YSHGTFTSDYSKYLD(Aib)ARAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 149), также называемую в данном документе соединением А103.
[0024] В некоторых вариантах осуществления состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 143-149.
[0025] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из YSHGTFTSDYSKYLD(Aib)ARAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 47); также называемую в данном документе соединением А7;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-NH2 (SEQ ID NO: 48); также называемую в данном документе соединением А8;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEEEPSSGAPPPS-OH (SEQ ID NO: 49); также называемую в данном документе соединением А9;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEEPSSGAPPPS-OH (SEQ ID NO: 50); также называемую в данном документе соединением А10;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEEEPSSGAPPPS-OH (SEQ ID NO: 51); также называемую в данном документе соединением АН;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEGAPPPS-OH (SEQ ID NO: 52); также называемую в данном документе соединением А12;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDESGAPPPS-OH (SEQ ID NO: 53); также называемую в данном документе соединением А13;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDESSGAPPPS-OH (SEQ ID NO: 54); также называемую в данном документе соединением А14;
YSHGTFTSDYSKYLD(Aib)SRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 55); также называемую в данном документе соединением А15;
YSHGTFTSDYSKYLD(Aib)TRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 56); также называемую в данном документе соединением А16;
YSHGTFTSDYSKYLD(Aib)ERAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 57); также называемую в данном документе соединением А17;
YSHGTFTSDYSKWLD(Aib)ARAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 58); также называемую в данном документе соединением А18;
YSHGTFTSDYSKWLD(Aib)SRAQEFV(Aib)WLEDEPS SGAPPPS-OH (SEQ ID NO: 59); также называемую в данном документе соединением А19;
YSHGTFTSDYSKYLD(Aib)KPAQEFV(Aib)WLEDEPSSGKPPPS-OH (SEQ ID NO: 60); также называемую в данном документе соединением А20;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGEPPPS-OH (SEQ ID NO: 61); также называемую в данном документе соединением А21;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGSPPPS-OH (SEQ ID NO: 62); также называемую в данном документе соединением А22;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSKAPPPS-OH (SEQ ID NO: 63); также называемую в данном документе соединением А23;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSKGAPPPS-OH (SEQ ID NO: 64); также называемую в данном документе соединением А24;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPSS-OH (SEQ ID NO: 65); также называемую в данном документе соединением А25;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPSE-OH (SEQ ID NO: 66); также называемую в данном документе соединением А26;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEGGPSSGAPPPS-OH (SEQ ID NO: 67); также называемую в данном документе соединением А27;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEGPSSGAPPPS-OH (SEQ ID NO: 68); также называемую в данном документе соединением А28;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPKSGAPPPS-OH (SEQ ID NO: 69); также называемую в данном документе соединением А29;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSKGAPPPS-OH (SEQ ID NO: 70); также называемую в данном документе соединением А30;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPESGAPPPS-OH (SEQ ID NO: 71); также называемую в данном документе соединением A31;
YTHGTFTSDYSKWLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 72); также называемую в данном документе соединением A32;
YSHGTFTSDHSKWLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 73); также называемую в данном документе соединением А33;
YTHGTFTSDHSKWLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 74); также называемую в данном документе соединением А34;
YTHGTFTSDYSKWLD(Aib)ARAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 75); также называемую в данном документе соединением А35;
YSHGTFTSDHSKWLD(Aib)ARAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 76); также называемую в данном документе соединением A36;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 77); также называемую в данном документе соединением A37;
YSHGTFTSDYSKWLDSARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 78); также называемую в данном документе соединением А38;
YTHGTFTSDYSKWLDSARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 79); также называемую в данном документе соединением A39;
YSHGTFTSDHSKWLDSARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 80); также называемую в данном документе соединением А40;
YTHGTFTSDHSKWLDEARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 81); также называемую в данном документе соединением А41;
YTHGTFTSDYSKWLDSKRAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 82); также называемую в данном документе соединением А42;
YSHGTFTSDYSKYLDKARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 83); также называемую в данном документе соединением А43;
YSHGTFTSDYSKYLDQARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 84); также называемую в данном документе соединением А44;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEKRNKPPPA-OH (SEQ ID NO: 85); также называемую в данном документе соединением А45;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEKRNKPPIA-OH (SEQ ID NO: 86); также называемую в данном документе соединением А46;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEKRNKNPPS-OH (SEQ ID NO: 87); также называемую в данном документе соединением А47;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEKRNKNPPPS-OH (SEQ ID NO: 88); также называемую в данном документе соединением А48;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPRNKNNPPS-OH (SEQ ID NO: 89); также называемую в данном документе соединением А49;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEKRNKPPPS-OH (SEQ ID NO: 90); также называемую в данном документе соединением А50;
YSHGTFTSDYSKYLDLKRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 91); также называемую в данном документе соединением А51;
YSHGTFTSDYSKYLDIKRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 92); также называемую в данном документе соединением А52;
YSHGTFTSDYSKYLD(Aib)KRAQEFVLWLEDEPSSGAPPPS-OH (SEQ ID NO: 93); также называемую в данном документе соединением А53;
YSHGTFTSDYSKYLD(Aib)KPAQEFV(Aib)WLEDEPSSKEPPPS-OH (SEQ ID NO: 94); также называемую в данном документе соединением А54;
YSHGTFTSDYSKYLD(Aib)KPAQEFV(Aib)WLEDEPSSKSPPPS-OH (SEQ ID NO: 95); также называемую в данном документе соединением А55;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPKSKAPPPS-OH (SEQ ID NO: 96); также называемую в данном документе соединением А56;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPKSKQPPPS-OH (SEQ ID NO: 97); также называемую в данном документе соединением А57;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPKSKSPPPS-OH (SEQ ID NO: 98); также называемую в данном документе соединением А58;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSKQPPPS-OH (SEQ ID NO: 99); также называемую в данном документе соединением А59;
YTHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGKPPPS-OH (SEQ ID NO: 100); также называемую в данном документе соединением А60;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPSSGKPPPS-OH (SEQ ID NO: 101); также называемую в данном документе соединением А61;
YTHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 102); также называемую в данном документе соединением А62;
YTHGTFTSDYSKYLDSARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 103); также называемую в данном документе соединением А63;
YTHGTFTSDYSKYLD(Aib)ARAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 104); также называемую в данном документе соединением А64;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPKSKEPPPS-NH2 (SEQ ID NO: 105); также называемую в данном документе соединением А65;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPKSKSPPPS-NH2 (SEQ ID NO: 106); также называемую в данном документе соединением А66;
YSHGTFTSDYSKYLD(Aib)ARAQEFV(Aib)WLEDEPKSKSPPPS-NH2 (SEQ ID NO: 107); также называемую в данном документе соединением А67;
YSHGTFTSDYSKYLD(Aib)ARAQEFV(Aib)WLEDEPKSKEPPPS-NH2 (SEQ ID NO: 108); также называемую в данном документе соединением А68;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPKSKEPPPS-OH (SEQ ID NO: 109); также называемую в данном документе соединением А69;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPKSKSPPPS-OH (SEQ ID NO: 110); также называемую в данном документе соединением А70;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPKSKAPPPS-OH (SEQ ID NO: 111); также называемую в данном документе соединением А71;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPKSKEPPPS-NH2 (SEQ ID NO: 112); также называемую в данном документе соединением А72;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPKSKSPPPS-NH2 (SEQ ID NO: 113); также называемую в данном документе соединением А73;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPKSKAPPPS-NH2 (SEQ ID NO: 114); также называемую в данном документе соединением А74;
WSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPS S GAPPPS-OH (SEQ ID NO: 115); также называемую в данном документе соединением А75;
YSHGTFTSDYSKYLD(Aib)KAAQEFV(Aib)WLEDEPS SGAPPPS-OH (SEQ ID NO: 116); также называемую в данном документе соединением А76;
YSHGTFTSDYSKYLD(Aib)KTAQEFV(Aib)WLEDEP S SGAPPPS-OH (SEQ ID NO: 117); также называемую в данном документе соединением А77;
YSHGTFTSDYSKYLD(Aib)KLAQEFV(Aib)WLEDEP S SGAPPPS-OH (SEQ ID NO: 118); также называемую в данном документе соединением А78;
YSHGTFTSDYSKYLD(Aib)KEAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 119); также называемую в данном документе соединением А79;
YSHGTFTSDYSKYLDAARAQEFVKWLEDEPKSKSPPPS-NH2 (SEQ ID NO: 120); также называемую в данном документе соединением А80;
YSQGTFTSDYSKYLDSARAQEFVKWLEDEPKSKSPPPS-OH (SEQ ID NO: 121); также называемую в данном документе соединением А81;
YSQGTFTSDYSKYLDSARAQEFVKWLEDEPKSKAPPPS-OH (SEQ ID NO: 122); также называемую в данном документе соединением А82;
YSHGTFTSDYSKYLDSARAQEFTKWLEDEPKSKSPPPS-OH (SEQ ID NO: 123); также называемую в данном документе соединением А83;
YSHGTFTSDYSKYLDSARAQEFVKHLEDEPKSKSPPPS-OH (SEQ ID NO: 124); также называемую в данном документе соединением А84;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGKPPPS-NH2 (SEQ ID NO: 125); также называемую в данном документе соединением А85;
YSQGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGKPPPS-OH (SEQ ID NO: 126); также называемую в данном документе соединением А86;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEKSSGKPPPS-OH (SEQ ID NO: 127); также называемую в данном документе соединением А87;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGKKPPS-OH (SEQ ID NO: 128); также называемую в данном документе соединением А88;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)HLEDEPSSGKPPPS-OH (SEQ ID NO: 129); также называемую в данном документе соединением А89;
YSHGTFTSDYSKYLD(Aib)KAAQEFV(Aib)WLEDEPSSGKPPPS-OH (SEQ ID NO: 130); также называемую в данном документе соединением А90;
WSQGTFTSDYSKYLD(Ab)KRAQEFV(Aib)WLEDEPS S GKPPPS-OH (SEQ ID NO: 131); также называемую в данном документе соединением А91;
WSQGTFTSDYSKYLD(Aib)KAAQEFV(Aib)WLEDEPS SGAPPPS-OH (SEQ ID NO: 132); также называемую в данном документе соединением А92;
WSQGTFTSDYSKYLD(Aib)KAAQEFV(Aib)WLEDEPS SGKPPPS-OH (SEQ ID NO: 133); также называемую в данном документе соединением А93;
YSQGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 134); также называемую в данном документе соединением А94;
YSQGTFTSDYSKYLD(Aib)KAAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 135); также называемую в данном документе соединением А95; и
YSQGTFTSDYSKYLD(Aib)KAAQEFV(Aib)WLEDEPSSGKPPPS-OH (SEQ ID NO: 136); называемую в данном документе соединением А96; В некоторых вариантах осуществления состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 47-136.
[0026] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных консенсусной последовательностью SEQ ID NO: 137:
YSQGTFTSDYSKYLDSX17RAQX21FVX24WLX27X28T-OH (SEQ ID NO: 137), где:
Х17 представляет собой K*, где K* расположен на лактамном мосту с Е* в положении Х21;
Х21 представляет собой Е*, где Е* расположен на лактамном мосту с K* в положении Х17;
Х24 представляет собой K или K**, где K** расположен на лактамном мосту
с Е** в положении Х28;
Х27 представляет собой Q или D; и
Х28 представляет собой Е или Е**, где Е** расположен на лактамном мосту с
K** в положении Х24
[0027] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из YSQGTFTSDYSKYLDSK*RAQE*FVK**WLDE**T-OH (SEQ ID NO: 138), называемой в данном документе соединением А104 и YSQGTFTSDYSKYLDSK*RAQE*FVK**WLQE**T-OH (SEQ ID NO: 139); называемую в данном документе соединением А105; В некоторых вариантах осуществления состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 138 и 139.
[0028] Выделенные полипептиды по раскрытию содержат мотивы аминокислот, которые позволяют поддерживать характеристики, такие как растворимость и/или стабильность, например, метаболическую стабильность, аналогов, селективных к рецептору глюкагона, по сравнению с нативной молекулой человеческого глюкагона, а также мотивы аминокислот, которые позволяют поддерживать дополнительные характеристики, такие как селективность глюкагона по отношению к GLP-1.
[0029] В некоторых вариантах осуществления С-конец выделенного полипептида по раскрытию продолжается последовательностью, которая связывается с сывороточным альбумином, например, человеческим сывороточным альбумином. В некоторых вариантах осуществления С-конец выделенного полипептида по раскрытию продолжается последовательностью, выбранной из группы, состоящей из EEPSSGAPPPS-OH (SEQ ID NO: 4); EPSSGAPPPS-OH (SEQ ID NO: 5); GAPPPS-OH (SEQ ID NO: 6); GGPSSGAPPPS-OH (SEQ ID NO: 7); GPSSGAPPPS-OH (SEQ ID NO: 8); KRNKNPPPS-OH (SEQ ID NO: 9); KRNKNPPS-OH (SEQ ID NO: 10); KRNKPPIA-OH (SEQ ID NO: 11); KRNKPPPA-OH (SEQ ID NO: 150); KRNKPPPS-OH (SEQ ID NO: 12); KSSGKPPPS-OH (SEQ ID NO: 13); PESGAPPPS-OH (SEQ ID NO: 14); PKSGAPPPS-OH (SEQ ID NO: 15); PKSKAPPPS-NH2 (SEQ ID NO: 16); PKSKAPPPS-OH (SEQ ID NO: 17); PKSKEPPPS-NH2 (SEQ ID NO: 18); PKSKEPPPS- OH (SEQ ID NO: 19); PKSKQPPPS-OH (SEQ ID NO: 20); PKSKSPPPS-NH2 (SEQ ID NO: 21); PKSKSPPPS-OH (SEQ ID NO: 22); PRNKNNPPS-OH (SEQ ID NO: 23); PSKGAPPPS-OH (SEQ ID NO: 24); PSSGAPPPSE-OH (SEQ ID NO: 25); PSSGAPPPS- NH2 (SEQ ID NO: 26); PSSGAPPPS-OH (SEQ ID NO: 27); PSSGAPPPSS-OH (SEQ ID NO: 28); PSSGEPPPS-OH (SEQ ID NO: 29); PSSGKKPPS-OH (SEQ ID NO: 30); PSSGKPPPS-NH2 (SEQ ID NO: 31); PSSGKPPPS-OH (SEQ ID NO: 32); PSSGSPPPS- OH (SEQ ID NO: 33); PSSKAPPPS-OH (SEQ ID NO: 34); PSSKEPPPS-OH (SEQ ID NO: 35); PSSKGAPPPS-OH (SEQ ID NO: 36); PSSKQPPPS-OH (SEQ ID NO: 37); PSSKSPPPS-OH (SEQ ID NO: 38); SGAPPPS-OH (SEQ ID NO: 39); и SSGAPPPS- OH(SEQ ID NO: 40).
[0030] В некоторых вариантах осуществления, карбоксильная группа С-концевого аминокислотного остатка изолированного полипептида по раскрытию является амидированной. В некоторых вариантах осуществления, карбоксильная группа С-концевого аминокислотного остатка изолированного полипептида по раскрытию не модифицирована.
[0031] В некоторых вариантах осуществления изобретения выделенный полипептид, представленный в данном документе, является агонистом активности глюкагона. В некоторых вариантах осуществления изобретения выделенный полипептид, представленный в данном документе, может связываться с рецептором глюкагона. В некоторых вариантах осуществления изобретения рецептор глюкагона является рецептором глюкагона человеком. В некоторых вариантах осуществления изобретения выделенный полипептид по раскрытию связывается с рецептором глюкагона человека с рЕС50 в диапазоне более чем около 9,0 по результатам анализа цАМФ с использованием кривой на основе 11 точек в диапазоне начиная с 1 нМ до 500 микромоль/л (как описано в данном документе). В некоторых вариантах осуществления изобретения выделенный полипептид по раскрытию связывается с рецептором глюкагона человека с рЕС50 в диапазоне более чем около 11,0. по результатам анализа цАМФ с использованием кривой на основе 11 точек в диапазоне начиная с 1 нМ до 500 микромоль/л (как описано в данном документе).
[0032] В некоторых вариантах осуществления изобретения выделенный полипептид по раскрытию связывается с рецептором глюкагона человека, но по существу не связывается с человеческим рецептором GLP-1. В соответствии с использованием в данном описании, термин «по существу не связывается» и его варианты относятся к полипептидам, которые обладают низкой аффинностью к человеческому рецептору GLP-1 или у которых не наблюдается аффинности к данному рецептору В некоторых вариантах осуществления изобретения выделенный полипептид по раскрытию связывается с рецептором глюкагона человека с аффинностью, которая по меньшей мере в 100 раз больше, чем аффинность тот же выделенного полипептида к человеческому рецептору GLP-1. В предпочтительных вариантах осуществления изобретения выделенный полипептид по раскрытию связывается с рецептором глюкагона человека с аффинностью, которая по меньшей мере в 1000 раз больше, чем аффинность тот же выделенного полипептида к человеческому рецептору GLP-1. В некоторых вариантах осуществления изобретения выделенный полипептид по раскрытию связывается с рецептором глюкагона человека с рЕС50 в диапазоне более чем около 9,0 по результатам анализа цАМФ с использованием кривой на основе 11 точек в диапазоне начиная с 1 нМ до 500 микромоль/л (как описано в данном документе), и выделенный полипептид по раскрытию связывается с человеческим рецептором GLP-1 с рЕС50 в диапазоне менее чем около 10,0 по результатам анализа цАМФ. В некоторых вариантах осуществления изобретения выделенный полипептид по раскрытию связывается с рецептором глюкагона человека с рЕС50 в диапазоне более чем около 11,0 по результатам анализа цАМФ с использованием кривой на основе 11 точек в диапазоне начиная с 1 нМ до 500 микромоль/л (как описано в данном документе), и выделенный полипептид по раскрытию связывается с человеческим рецептором GLP-1 с рЕС50 в диапазоне менее чем около 9,0 по результатам анализа цАМФ.
[0033] В некоторых вариантах осуществления изобретения выделенный полипептид, как это предусмотрено в настоящем, документе может дополнительно содержать гетерологичный фрагмент, связанный с полипептидом. В некоторых вариантах осуществления изобретения гетерологичный фрагмент представляет собой белок, пептид, домен белка, линкер, органический полимер, неорганический полимер, полиэтиленгликоль (ПЭГ), биотин, альбумин, человеческий сывороточный альбумин (ЧСА), связывающую часть Ahsa FcRn, антитело, домен антитела, фрагмент антитела, одноцепочечное антитело, доменное антител, связывающий альбумин домен, фермент, лиганд, рецептор, связывающий пептид, не-FnIII каркас, эпитопную метку, рекомбинантный полипептид, полимер, цитокин или любую комбинация двух или более таких фрагментов.
[0034] Выделенные полипептиды, представленные в данном документе, демонстрируют агонистическую активность по отношению к рецептору глюкагона, например, путем связывания с рецептором глюкагона. Выделенные полипептиды, представленные в данном документе, полностью или частично агонизируют или иным образом стимулируют активность глюкагона после связывания с рецептором глюкагона или оного взаимодействия с рецептором глюкагона. Стимуляция или модуляция биологической функции глюкагона является полной или частичной при взаимодействии между агонистом рецептора глюкагона и рецептором глюкагона.
[0035] Такие изолированные полипептиды по раскрытию, которые являются агонистами, селективными к рецептору глюкагона, могут быть использованы отдельно или в комбинации с по меньшей мере вторым веществом. В предпочтительных вариантах осуществления второе вещество представляет собой полипептид. В предпочтительных вариантах осуществления второй полипептид представляет собой инсулинотропный пептид. Например, инсулинотропный полипептид выбран из группы, состоящей из эксенатида, производного эксенатида, аналога эксенатида, глюкагоноподобного пептида-1 (GLP-1), производного GLP-1 и аналога GLP-1.
[0036] В предпочтительных вариантах осуществления настоящего изобретения инсулинотропный полипептид представляет собой эксенатид, производное эксенатида или аналог эксенатида. В предпочтительных вариантах осуществления эксенатид является синтетическим эксенатидом. В предпочтительных вариантах осуществления синтетический эксенатид содержит аминокислотную последовательность H-His-Gly-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Leu-Ser-Lys-Gln-Met-Glu-Glu-Glu-Ala-Val-Arg-Leu-Phe-Ile-Glu-Trp-Leu-Lys-Asn-Gly-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-NH2 (SEQ ID NO: 142).
[0037] В комбинированной терапии, использование селективного аналога глюкагона позволяет выполнять титрование надлежащих терапевтических доз глюкагона и любого агониста рецептора GLP-1. Это позволяет получить желаемые эффекты агонизма глюкагона/GLP-l (например, потерю веса, увеличение расхода энергии) без вредного скачка уровня глюкозы в крови.
[0038] В некоторых вариантах осуществления изобретения выделенный полипептид, как это предусмотрено в настоящем документе, и дополнительное вещество вводят в состав одной терапевтической композиции, и выделенный полипептид и дополнительное вещество вводят одновременно. В некоторых вариантах осуществления изобретения выделенный полипептид и дополнительное вещество отделены друг от друга, например, каждое изготовлено в виде отдельной терапевтической композиции, и выделенный полипептид и дополнительное вещество вводят одновременно, или выделенный полипептид и дополнительное вещество вводят в разное время в течение курса лечения. Например, выделенный полипептид вводят перед введением дополнительного вещества, выделенный полипептид вводят после введения дополнительного вещества или изолированный полипептид и дополнительное вещество вводят в чередующемся порядке. Как описано в данном документе, выделенный полипептид и дополнительное вещество вводят в разовых дозах или в многократных дозах.
[0039] Также в данном документе описаны способы лечения, задержки начала, задержки прогрессирования, или иного облегчения симптомов, вызванных заболеванием или состоянием, характеризующиеся, или иным образом связанные с аберрантной активностью глюкагона. В некоторых вариантах осуществления заболевание или состояние представляет собой сахарный диабет типа 2.
[0040] Также в данном документе описаны способы лечения метаболического расстройства посредством введения выделенного полипептида по раскрытию или любой фармацевтической композиции, описанной в данном документе, субъекту, нуждающемуся в этом.
[0041] Также в данном документе описаны способы лечения ожирения посредством введения выделенного полипептида по раскрытию или любой фармацевтической композиции, описанной в данном документе, субъекту, нуждающемуся в этом.
[0042] Также в данном документе описаны способы лечения, профилактики, задержки начала задержки прогрессирования и/или иного облегчения симптом метаболического заболевания или расстройства, связанного с повышенным уровнем глюкозы в крови у пациента, путем введения выделенного полипептид по раскрытию или любой фармацевтической композиции, описанной в данном документе, пациенту, нуждающемуся в этом.
[0043] Также в данном документе описаны способы лечения, профилактики, задержки начала задержки прогрессирования и/или иного облегчения симптомов заболевания или расстройства, в котором агонизм в отношении рецептора глюкагона является желательным, например, в качестве не ограничивающего примера, хронических болей, гемофилии и других заболеваний крови, эндокринных расстройств, метаболических расстройств, неалкогольной жировой болезни печени (НЖБП), неалкогольного стеатогепатита (НАСГ), болезни Альцгеймера, сердечно-сосудистых заболеваний, нечувствительности к развитию гипогликемии, рестриктивного легочного процесса, хронической обструктивной болезни легких, липоатрофии, метаболического синдрома, лейкоза, гепатита, почечной недостаточности, аутоиммунных заболеваний (например, болезни Грейвса, системной красной волчанки, рассеянного склероза и ревматоидного артрита), шока и расстройств вызванных истощением, панкреатита, а также неврологических расстройств и заболеваний, таких как болезнь Паркинсона.
[0044] Также в данном документе описаны способы лечения, профилактики, задержки начала, задержки прогрессирования, и/или иное облегчение симптомов инфекционного заболевания, требующего длительного лечения.
[0045] В способах, раскрытых в данном документе, выделенные полипептиды в соответствии с раскрытием и/или фармацевтические композиции, описанные в данном документе, вводят по отдельности или в комбинации с фармацевтически приемлемыми носителями и/или вспомогательными веществами и/или полимерами и/или органическим растворителем в виде одной дозы или нескольких доз.
[0046] Фармацевтические композиции в соответствии с изобретением могут включать в себя полипептид по раскрытию вместе с подходящим носителем. Такие фармацевтические композиции могут быть включены в наборы, такие как, например, диагностические наборы.
Краткое описание графических материалов
[0047] Фигуры 1А и 1В представляют собой серию графиков, описывающих профили активации пептидных рецепторов рецептора глюкагона человека (GCGR) и рецептора GLP-1 человека (GLP-1R) при воздействии человеческого глюкагона, GLP-1 (7-37) и двух селективных к рецептору глюкагона пептидных агонистов. Фигура 1А демонстрирует, что пептиды, указанные в данном описании как соединение А2 и соединение А1, и глюкагон активируют GCGR с около равной эффективностью, в то время как GLP-1 (7-37) активирует GCGR с гораздо более низкой активностью. Фигура 1В демонстрирует, что, в отличие от результатов на фигуре 1А, пептиды соединение А2 и соединение А1 неактивны в отношении GLP-1R, что демонстрирует профиль пептидов соединение А2 и соединение А1 в качестве селективных агонистов GCGR.
[0048] Фигуры 2А и 2В представляют собой серию графиков и таблиц, на которых показана график отношения средней концентрации в плазме ко времени различных аналогов глюкагона у самцов крыс после 3-часовой внутривенной инфузии дозы 0,3 мг/кг. Фигура 2А изображает аналоги глюкагона, упомянутые в данном документе как соединение А99 (SEQ ID NO: 145), соединение А102 (SEQ ID NO: 148), соединение A98 (SEQ ID NO: 144), соединение A100 (SEQ ID NO: 146), и соединение A101 (SEQ ID NO: 147), где n равно от 3 до 6, а планки погрешностей на графике представляют собой стандартную ошибку, и где значения CL в таблице приведены в виде среднего значения ± стандартная ошибка (n=3-6). Фигура 2В изображает аналоги глюкагона, упомянутые в данном описании как соединение А2, соединение А1, соединение А5, соединение А6, соединение А4 и соединения A3, где n равно от 3 до 5, а планки погрешностей на графике представляют собой стандартную ошибку, и где значения CL в таблице приведены в виде среднего значения ± стандартная ошибка (n=3-5).
[0049] Фигуры 3А, 3В и 3С представляют собой серию графиков, описывающих эффективность различных аналогов глюкагона, измеренную по изменению массы тела у крыс DIO (крыс с вызванным диетой ожирением) через 13 дней. В частности, фигура 3А изображает эффективность аналога глюкагона, упоминаемого в данном документе как соединение А104, при введении параллельно (т.е., по отдельности) или в комбинации с эксендином-4. На фигуре 3В показана эффективность аналога глюкагона, упоминаемого в данном документе как соединение А2, а на рисунке 3С показана эффективность аналога глюкагона, упоминаемого в данном документе как соединение А1. Для всех графиков р<0,05 по сравнению с контролем носителем.
[0050] Фигуры 4А и 4В представляют собой схематические представления химической структуры циклических пептидов - аналогов глюкагона, упоминаемых в данном документе как соединение А104 (фиг. 4А) и соединение А105 (фиг. 4В).
[0051] Фигура 5 представляет собой график, на котором указаны стационарная концентрация в плазме по оси Y по отношению к скорости внутривенных инфузий по оси X для эксенатида (кружки) и GLP-1 (треугольники), и выполнено сравнение данных корреляций по отношению к соответствующим данным для инулина (который выводится посредством клубочковой фильтрации). Данные на фигуре 5 показывают, что стационарная концентрация в плазме эксенатида приближена к таковой у инулина, что соответствует тому, что эксенатид выводится в основном путем клубочковой фильтрации.
[0052] Фигура 6 представляет график фигуры 5, на котором далее изображены стационарные концентрации в плазме по оси Y по отношению к скорости внутривенных инфузий по оси X глюкагона (перевернутые треугольники), и соединений А1 и А2 (аналоги глюкагона, квадраты) в дополнение к эксенатиду (кружки) и GLP-1 (треугольники). Данные корреляции показаны по отношению к таковым инулина (в виде оценки скорости клубочковой фильтрации). Данные фигуры 6 показывают, что стационарная концентрация в плазме соединений А1 и А2 приближается к таковой у инулина, что соответствует тому, что данные соединения выводятся в основном путем клубочковой фильтрации.
[0053] На фигуре 7 представлена иллюстрация графика значений выведения для глюкагона, соединений A1, А2 и A3 (трех точек ближайших к СКФ) и других аналогов глюкагон. Обратите внимание, что значения выведения уменьшаются вдоль оси у. Для сравнения, верхняя пунктирная линия (ближе к СКФ) показывает скорость выведения эксенатида, а нижняя пунктирная линия (дальше от СКФ) показывает скорость выведения глюкагона. На фигуре 7 показано, что показатели выведения некоторых аналогов глюкагона, в том числе соединений A1, А2 и A3, ниже чем у эксенатида и глюкагона.
[0054] Фигура 8 представляет собой график, который сравнивает зависимость потери веса у самцов крыс линии Спрег-Доули от дозы при подкожном введении эксенатида или соединения А1.
[0055] Фигура 9 представляет собой график, который сравнивает зависимость потери веса у самцов крыс линии Спрег-Доули от дозы при подкожном введении соединений A1, А2 или A3.
[0056] Фигура 10 представляет собой график, который сравнивает потерю веса у крыс LE DIO после введения эксенатида, аналога глюкагона («GCG»), соединения А1, или комбинация эксенатида и аналога GCG, в течение 27 дней в различных дозах.
[0057] Фигура 11 представляет собой гистограмму с альтернативным изображением данных, представленных на фигуре 10.
[0058] На фигуре 12 представлен график, который сравнивает уровни триглицерида в сыворотке у крыс линии Zucker с ожирением (ZDF) через 14 дней после введения соединения А104 отдельно или в комбинации с эксенатидом.
[0059] Фигура 13 представляет собой график, который сравнивает содержание жира в печени (сыворотка) и вес печени у крыс линии Zucker с ожирением (ZDF) крыс через 14 дней после введения различных доз соединения А104. Обратите внимание, что вес печени показан на левой оси Y в виде незаштрихованных кругов. Жир в печени показан на правой оси Y в виде заштрихованных треугольников.
[0060] Фигура 14 представляет трехмерную визуализацию потери веса у крыс LE DIO при продолжительном введении эксенатида или аналога глюкагона.
[0061] Фигура 15 иллюстрирует трехмерную оценку потери веса у крыс LE DIO при продолжительном введении комбинаций эксенатида / аналога глюкагона.
[0062] Фигура 16 иллюстрирует трехмерную оценку потери веса у крыс LE DIO при продолжительном введении фиксированного соотношения комбинаций эксенатида / аналога глюкагона.
[0063] Фигура 17 представляет собой графическую оценку активности in vivo, определенную как эффект на единицу общей массы препарата различного фиксированного соотношения комбинаций эксенатида / аналога глюкагона.
Подробное описание изобретения
[0064] Настоящее изобретение относится к выделенным полипептидам, которые являются селективными к рецептору глюкагона аналогами, и их пептидным производным. Глюкагон вырабатывается в поджелудочной железе и взаимодействует с рецептором глюкагона («GCGR»). В некоторых вариантах осуществления изобретения выделенный полипептид по раскрытию является селективным агонистом рецептора глюкагона. В некоторых вариантах осуществления изобретения выделенный полипептид по раскрытию связывается с рецептором глюкагона.
Определения
[0065] Следует понимать, что терминология, используемая в настоящем документе, предназначена для целей описания конкретных вариантов осуществления и не предназначена для ограничения. Использование в данном описании и в прилагаемой формуле изобретения форм единственного числа включает ссылку на множественное число, если в контексте явно не указано иное. Так, например, ссылка на «растворитель» включает в себя комбинацию из двух или большего количества таких растворителей, ссылка на «пептид» включает в себя один или несколько пептидов или смесь пептидов, ссылка на «препарат» включает в себя один или несколько препаратов, ссылка на «осмотическое устройство доставки» включает в себя одно или более осмотических устройств доставки, и тому подобное. Если специально не оговорено или не очевидно из контекста, при использовании в данном документе термин «или» понимается как включительный и охватывает как «или», так и «и».
[0066] Если специально не оговорено или не очевидно из контекста, при использовании в данном документе термин «около» или «приблизительно» понимается как «в пределах диапазона нормального допуска» в данной области техники, например, в пределах 2 стандартных отклонений от среднего значения. «Около» или «приблизительно» можно понимать как в пределах 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,1%, 0,05%, или 0,01% от указанного значения. Если иное ясно из контекста, все числовые значения, представленные в данном документе, модифицированы термином «около» или «приблизительно».
[0067] Если специально не оговорено или не очевидно из контекста, при использовании в данном документе термин «по существу» понимается как «в узком диапазоне изменения» или иным образом в пределах нормального допуска в данной области техники. По существу, можно понимать как в пределах 5%, 4%, 3%, 2%, 1%, 0,5%, 0,1%, 0,05%, 0,01% или 0,001% от указанного значения.
[0068] Если не определено иное, все технические и научные термины, используемые в данном документе, имеют такое же значение, которое обычно понимается обычным специалистом в области техники, к которой относится изобретение. Хотя в практике настоящего изобретения могут быть использованы другие способы и материалы, аналогичные или эквивалентные описанным в данном документе, описанные в данном документе материалы и способы являются предпочтительными.
[0069] В описании и формуле настоящего изобретения будет использоваться следующая терминология в соответствии с определениями, изложенными ниже.
[0070] Термины «препарат», «препарат», «терапевтическое средство» и «полезное вещество» используются взаимозаменяемо для обозначения любого терапевтически активного вещества, которое доставляется субъекту для получения желаемого положительного эффекта. В одном из вариантов осуществления настоящего изобретения препарат представляет собой полипептид. В другом варианте осуществления настоящего изобретения препарат представляет собой малую молекулу, например, гормоны, такие как андрогены или эстрогены. Устройства и способы по настоящему изобретению хорошо подходят для доставки белков, малых молекул и их комбинаций.
[0071] Термины «пептид», «полипептид» и «белок» используются здесь взаимозаменяемо и обычно относятся к молекуле, содержащей цепь из двух или более аминокислот (например, наиболее типично, L-аминокислот, но также включая, например, D-аминокислоты, модифицированные аминокислоты, аналоги аминокислот и миметики аминокислот). Пептиды могут быть встречающимися в природе, синтетическими или рекомбинантно экспрессироваными. Пептиды также могут содержать дополнительные группы, модифицирующие цепи аминокислот, например, функциональные группы, добавленные посредством посттрансляционной модификации. Примеры посттрансляционных модификаций включают, но не ограничиваются ими, ацетилирование, алкилирование (в том числе метилирование), биотинилирования, глутамилирование, глицилирование, гликозилирование, изопренилирование, липоилирование, фосфопантетеинилирование, фосфорилирование, селенирование и С-концевое амидирование. Термин «пептид» также включает пептиды, содержащие модификации амино-конца и/или карбокси-конца. Модификации концевой аминогруппы включают, но не ограничиваются ими, дезаминирование, модификации с завлечением N-низшего алкила, N-ди-низшего алкила и N-ацила. Модификации карбоксильной группы терминала включают в себя, но не ограничиваются ими, модификации с завлечением амида, низшего алкиламида, диалкиламида и сложного эфира низшего алкила {например, где низший алкил представляет собой С1-С4-алкил). Термин «пептид» также включает модификации, такие как, не ограничиваясь ими, описанные выше, аминокислот, расположенных между амино- и карбокси-концами. В одном варианте осуществления, пептид может быть модифицирован добавлением низкомолекулярного препарата.
[0072] Концевая аминокислота на одном конце пептидной цепи, как правило, имеет свободную аминогруппу (например, амино-конец). Концевая аминокислота на другом конце цепи, как правило, имеет свободную карбоксильную группу (например, карбокси-конец). Как правило, аминокислоты, образующие пептид, пронумерованы в порядке начиная с амино-конца с увеличением значений в направлении карбокси-конца пептида.
[0073] Фраза «аминокислотный остаток», используемая в данном описании, относится к аминокислоте, которая включена в пептид посредством амидной связи или миметика амидной связи.
[0074] Термин «инсулинотропный», используемый в данном описании, как правило, относится к способности соединения, например, пептида, стимулировать или влиять на производство и/или активность инсулина (например, инсулинотропный гормон). Такие соединения, как правило, стимулируют или иным образом влияют на секрецию или биосинтез инсулина у субъекта. Таким образом, «инсулинотропный пептид» представляет собой молекулу, содержащую аминокислоту, способную стимулировать или иным образом влияет на секрецию или биосинтез инсулина.
[0075] Термин «инсулинотропный пептид», используемый в данном документе, включает, но не ограничиваясь ими, глюкагон-подобный пептид 1 (GLP-1), а также его производные и аналоги, эксенатид, эксенатид с аминокислотной последовательностью SEQ ID NO: 1, а также их производные и аналоги.
[0076] Фраза «инкретиновые миметики», используемая в данном описании, включает, но не ограничивается ими, GLP-1 пептид, пептидные производные GLP-1, пептидные аналоги GLP-1; эксенатид, эксенатид с аминокислотной последовательностью SEQ ID NO: 1, пептид эксенатида, пептидные производные эксенатида и пептидные аналоги эксенатида. Примеры предпочтительных инкретиновых миметиков включают эксенатид, эксенатид с аминокислотной последовательностью эксендина-4 (природная формы эксенатида, имеющая аминокислотную последовательность SEQ ID NO: 1), эксенатид-LAR, ликсисенатид, GLP-1 (7-36), лираглутид, семаглутид, дулаглутид, альбиглутид и таспоглутид. Инкретиновые миметики также упоминаются в данном документе как «инсулинотропные пептиды». Инкретиновые миметики, нацеленные на рецепторы GLP-1, также известны в литературе как «агонисты рецептора GLP-1.»
[0077] Термин «эксенатид», используемый в данном описании, включает, но не ограничивается ими, эксенатид, эксенатид с аминокислотной последовательностью SEQ ID NO: 1, природный эксендин-4, пептид эксенатида, пептидные аналоги эксенатида и пептидные производные эксенатида.
[0078] Термин «GLP-1» относится к полипептиду, который вырабатывается L-клетками, расположенными в основном в подвздошной кишке и ободочной кишке, и в меньшей степени L-клетками в двенадцатиперстной кишке и тощей кишке. GLP-1 представляет собой регуляторные пептиды, взаимодействующие с рецептором, сопряженным с G-белком на (3-клетках и посредством аденилциклазной активности и выработки цАМФ стимулирует ответ инсулина на питательные вещества, которые всасываются из кишечника [Baggio 2007, "Biology of incretins: GLP-1 and GIP," Gastroenterology, vol. 132(6):2131-57; Holst 2008, "The incretin system and its role in type 2 diabetes mellitus," Mol Cell Endocrinology, vol. 297(1-2):127-36], эффект агонизма GLP-1R является множественным. GLP-1 поддерживает гомеостаз глюкозы путем усиления зависимой от эндогенной глюкозы секреции инсулина, способствует компетентности и чувствительности β-клеток к глюкозе с завлечением GLP-1, подавляет высвобождение глюкагона, восстанавливает секрецию инсулина во время первой и второй фазы, замедляет опорожнение желудка, снижает потребление пищи, а также увеличение сытость [Holst 2008 Mol. Cell Endocrinology; Kjems 2003 "The influence of GLP-1 on glucose- stimulated insulin secretion: effects on beta-cell sensitivity in type 2 and nondiabetic subjects," Diabetes, vol. 52(2): 380-86; Holst 2013 "Incretin hormones and the satiation signal," Int J Obes (Lond), vol. 37(9): 1161-69; Seufert 2014, "The extra-pancreatic effects of GLP-1 receptor agonists: a focus on the cardiovascular, gastrointestinal and central nervous systems," Diabetes Obes Metab, vol. 16(8): 673-88]. Риск гипогликемии минимален, учитывая способ действия GLP-1.
[0079] Термин «глюкагон» относится к пептидному гормону из 29 аминокислот который вырабатывается в альфа-клетках в поджелудочной железе, и который взаимодействует с GCGR. Аминокислотная последовательность глюкагона представляет собой HSQGTFTSDYSKYLDSRRAQDFVQWLMNT-OH (SEQ ID NO: 140).
[0080] При использовании в данном документе термин «аналог глюкагона» означает структурное сходство с глюкагоном, а термин «агонист рецептора глюкагона» описывает соединение, которое функционально является агонистом рецептора глюкагона. Термины «аналог глюкагона» и «агонисты рецептора глюкагона» используются в качестве альтернативы для описания пептидов, описанных в данном документе.
[0081] Глюкагон происходит от пептида -препроглюкагона, состоящего из 158 аминокислот, который также выступает в качестве предшественника для пептидных гормонов GLP-1, GLP-2, оксинтомодулина, глицентина и родственных глицентину панкреатических полипептидов посредством тканеспецифичного процессирования. Глюкагон соответствует аминокислотным остаткам от 33 до 61 пептида-предшественника и действует посредством взаимодействия с семиспиральным трансмембранным рецептором, сопряженным с G-белком (класса В, расположенным в основном в печени. Иммуноокрашивание также указывает на присутствие рецепторов глюкагона в почках, желудочно-кишечном тракте, сердце, селезенке, головном мозге, на адипоцитах и лимфобластах. В ответ на низкий уровень глюкозы в крови глюкагон высвобождается и стимулирует выработку глюкозы в печени посредством гликогенолиза и глюконеогенеза. Глюкагон противодействует сахароснижающему эффекту инсулина и жесткая регуляция посредством системы обратной связи между двумя гормонами позволяет эффективно поддерживать гомеостаз глюкозы.
[0082] Помимо влияния на уровень глюкозы в крови, глюкагон также, по известным данным, увеличивает расход энергии и термогенез. Повышенная сигнализация оказывает прямое влияние на регулирование триглицеридов, свободных жирных кислот, аполипопротеина и метаболизм желчных кислот. В настоящее время терапевтическое использование глюкагона было сосредоточено главным образом на его использовании в качестве спасательного средства для гипогликемии. Однако в работах последнего времени рассматривалось преимущество способности гормона влиять на энергетический баланс и липидный обмен, что приводит к потенциальному лечению различных нарушений обмена веществ.
[0083] Слабая растворимость глюкагона (<1,0 мг/мл в водном или солевом буфере) предотвращает возможность проведения длительного исследования посредством введения в виде непрерывной инфузии. Краткое описание растворимости и величины рЕС50 глюкагона по отношению к рецептору глюкагона (GLUR) и GLP1, как определено в анализах цАМФ, показано в таблице 1 ниже:

[0084] Термин «носитель», используемый в данном документе, относится к среде, используемой для несения соединения, например, препарата или частицы, содержащей препарат. Носители по настоящему изобретению, как правило, содержат такие компоненты как полимеры и растворители. Носители в виде суспензий по настоящему изобретению обычно содержат растворители и полимеры, которые используются для приготовления суспензионных композиций, дополнительно содержащих составы на основе частиц препарата.
[0085] Фраза «разделение фаз», используемая в данном описании, относится к образованию нескольких фаз (например, жидкой и гелевой фазы) в носителе для суспензии, например, при контакте носителя для суспензии с водной средой. В некоторых вариантах осуществления настоящего изобретения, носитель для суспензии изготовлен таким образом, что он демонстрирует разделение фаз при контакте с водной средой, содержащей менее чем около 10% воды.
[0086] Фраза «однофазный», используемая в данном описании, относится к твердой, полутвердой или жидкой гомогенной системе, которая физически и химически равномерна по всему объему.
[0087] Термин «диспергированный», используемый в данном описании, относится к растворению, диспергированию, суспендированию или иным образом распределению соединения, например препарата, в носителе для суспензии.
[0088] Фраза «химически стабильная», используемая в данном описании, относится к образованию в составе приемлемого процента продуктов разложения, продуцируемых в течение определенного периода времени химическими путями, такими как дезамидирование (обычно путем гидролиза), агрегация или окисление.
[0089] Фраза «физически стабильный», используемая в данном описании, относится к формированию в композиции приемлемого процент агрегатов (например, димеров и других продуктов с более высокой молекулярной массой). Кроме того, физически стабильная композиция не изменяет своего физического состояния, например, от жидкости до твердого вещества или от аморфной до кристаллической формы.
[0090] Термин «вязкость», используемый в данном описании, как правило, относится к значению, определенному на основе отношения напряжения сдвига к скорости сдвига (см., например, Considine, D. М. & Considine, G. D., Encyclopedia of Chemistry, 4th Edition, Van Nostrand, Reinhold, N.Y., 1984), по существу следующим образом:
F/A=μ*V/L (Уравнение 1)
где F/A=напряжение сдвига (сила на единицу площади),
μ=коэффициент пропорциональности (вязкость), и
V/L=скорость в зависимости от толщины слоя (скорость сдвига).
[0091] На основе данного соотношения отношение напряжения сдвига к скорости сдвига определяет вязкость. Измерения напряжения сдвига и скорости сдвига, как правило, определяется с использованием реометра с параллельными пластинами, реометрия была выполнена при выбранных условиях (например, при температуре около 37°С). Другие способы определения вязкости включают в себя измерение кинематической вязкости с использованием вискозиметров, например, вискозиметра Кэннон-Фенске, вискозиметра Уббелоде в непрозрачном растворе Кэннон-Фенске или вискозиметра Оствальда. Как правило, носители для суспензии по настоящему изобретению имеют вязкость, достаточную для предотвращения осаждения взвешенных в ней частиц во время хранения и использования при способе доставки, например, в имплантируемом устройстве доставки препарата.
[0092] Термин «неводный», используемый в данном описании, относится к общему содержанию влаги, например, в композиции в виде суспензии, как правило, менее или равному около 10% масс., например, менее или равному около 7% масс., менее или равному около 5% масс., и/или менее чем около 4% мас. Кроме того, композиция частиц по настоящему изобретению, содержит менее чем около 10% масс., например, менее чем около 5% масс., остаточной влаги.
[0093] Термин «субъект», используемый в данном документе, относится к любому члену подтипа Хордовых, в том числе, без ограничения, людям и других приматам, включая отличных от человека приматов, таких как макак резус и других видов обезьян, шимпанзе и других видов человекообразных обезьян; сельскохозяйственным животным, таким как крупный рогатый скот, овцы, свиньи, козы и лошади; домашние животные, такие как собаки и кошка; лабораторные животные, включая грызунов, таких как мыши, крысы и морские свинки; птицы, включая домашних, диких и промысловых птиц, таких как куры, индейки и других представители отряда курообразных, утки, гуси и тому подобное. Этот термин не обозначает конкретный возраст или пол. Таким образом, предполагается охватить как взрослых, так и новорожденных.
[0094] Термин «осмотическое устройство доставки», используемый в данном документе, как правило, относится к устройству, используемому для доставки препарата (например, выделенного полипептида, являющегося специфическим агонистом глюкагона) субъекту, причем устройство включает в себя, например, резервуар (изготовленный, например, из титанового сплава), имеющий просвет, который содержит состав в виде суспензии, содержащий препарат (например, выделенный полипептид, являющийся специфическим агонистом глюкагона) и состав осмотического вещества. Поршневой узел, расположенный в просвете, изолирует состав в виде суспензии от состава осмотического вещества. Полупроницаемая мембрана, расположенная на первом дистальном конце резервуара, примыкает к составу осмотического вещества; замедлитель диффузии (который определяет отверстие доставки, через которое состав в виде суспензии выходит из устройства) расположен на втором дистальном конце резервуара и примыкает к составу в виде суспензии. Как правило, осмотическое устройство доставки имплантируется субъекту, например, субдермально или подкожно (например, во внутреннюю часть, наружную часть или заднюю часть верхней плеча и в области живота). Примером осмотического устройства доставки является устройство доставки DUROS® (ALZA Corporation, Mountain View, СА). Примеры синонимов терминов «осмотическое устройство доставки» включают, но не ограничиваются ими, «осмотическое устройство доставки препарата», «осмотическая системой доставки препарата», «осмотическое устройство», «осмотическое устройство доставки», «осмотическая система доставки», «осмотический насос » «имплантируемое устройство для доставки препаратов», «система доставки лекарств», «устройство для доставки препаратов», «имплантируемый осмотический насос», «имплантируемая система доставки препаратов», и «имплантируемая система доставки». Другие термины для «осмотического устройства доставки» известны в данной области техники.
[0095] Термин «непрерывная доставка», используемый в данном документе, как правило, относится к по существу, непрерывному высвобождению препарата из осмотического устройства доставки в ткань вблизи места имплантации, например, в субдермальной и подкожной ткани. Например, осмотическое устройство доставки высвобождает препарат по существу при заданной скорости на основании принципа осмоса. Внеклеточная жидкость поступает в осмотическое устройство доставки через полупроницаемую мембрану непосредственно в осмотический двигатель, который расширяется, приводя в действие поршень при низкой и стабильной скорости движения. Движение поршня выталкивает препарат через отверстие замедлителя диффузии. Таким образом, высвобождение препарата из осмотического устройства доставки происходит с низкой, контролируемой и стабильной скоростью.
[0096] Термин «по существу стабильная доставка», используемый в данном документе, как правило, относится к доставке препарата в целевой концентрации или приближенной к целевой концентрации в течение определенного периода времени, при этом количество препарата которое доставляется из осмотического устройства доставки, по существу соответствует доставке нулевого порядка. Доставка активного вещества по существу нулевого порядка (например, выделенного специфичного к глюкагону аналога) означает, что скорость поставки препарата постоянна и не зависит от препарата, доступного в системе доставки; например, для доставки нулевого порядка, если скорость поставки препарата по отношению ко времени изобразить на графике и изображенная линия соответствует данным, то линия имеет наклон около нуля в соответствии с определением с помощью стандартных методов (например, линейной регрессии).
[0097] Фраза «период полураспада препарата», используемая в данном документе, относится к тому, сколько времени понадобится для выведения препарата из плазмы крови до половины его концентрации. Период полураспада препарата обычно измеряется путем мониторинга снижения уровня препарата при его введении посредством инъекций или внутривенно. Препарат обычно определяют с использованием, например, радиоиммуноанализ (РИА), хроматографического способа анализа, электрохемилюминесцентного (ECL) анализа, иммуноферментного твердофазного анализа (ИФА) или иммуноферментного сэндвич-анализа (сэндвич-ИФА).
[0098] Термин «мкг» следует понимать как «микрограммы». Аналогичным образом, термин «мкл» следует понимать как «микролитр», а термин «мкМ» следует понимать как «мкмоль/л».
[0099] Термин «сыворотка» предназначен для обозначения любого продукта крови, в котором может быть обнаружено вещество. Таким образом, термин «сыворотка» включает по меньшей мере цельную кровь, сыворотку и плазму. Например, «количество [вещества] в сыворотке субъекта» будет охватывать «количество [вещества] в плазме субъекта».
[00100] Базовый уровень определяются как последняя оценка в день первичного размещения осмотического устройства доставки (содержащего препарат или плацебо) или до дня первичного размещения.
2.0.0 Общий обзор изобретения
[00101] Перед описанием настоящего изобретения в деталях следует понимать, что данное изобретение не ограничивается конкретными типами устройств доставки препаратов, конкретными источниками препаратов, конкретными растворителями, конкретными полимерами и тому подобное, так как выбор данных конкретных примеров может рассматриваться как приведенный в качестве примера для объяснения данных спецификаций. Кроме того, следует понимать, что терминология, используемая в настоящем документе, используется для только целей описания конкретных вариантов осуществления изобретения и не предназначена для ограничения.
[00102] В первом аспекте настоящее изобретение относится к выделенным полипептидам, которые являются аналогами, селективными к рецептору глюкагона и их пептидными производными. В некоторых вариантах осуществления изобретения выделенный полипептид по раскрытию является селективным агонистом рецептора глюкагона. В некоторых вариантах осуществления изобретения выделенный полипептид по раскрытию связывается с рецептором глюкагона (GCGR).
[00103] В некоторых вариантах осуществления изобретения выделенный полипептид по данному раскрытию содержит модифицированную аминокислотную последовательность, основанную на аминокислотной последовательности человеческого глюкагона: HSQGTFTSDYSKYLDSRRAQDFVQWLMNT-OH (SEQ ID NO: 140), где модифицированная аминокислотная последовательность включает в себя замену по меньшей мере одну аминокислотную замену, по меньшей мере две аминокислотные замены, по меньшей мере три аминокислотные замены, по меньшей мере четыре аминокислотные замены, по меньшей мере пять аминокислотных замен, по меньшей мере шесть аминокислотных замен, по меньшей мере семь аминокислотных замен, по меньшей мере восемь аминокислотных замен, по меньшей мере девять аминокислотных замен, по меньшей мере 10 аминокислотных замен, по меньшей мере 11 аминокислотных замен, по меньшей мере 12 аминокислотных замен, по меньшей мере 13 аминокислотных замен, по меньшей мере 14 аминокислотных замен, по меньшей мере 15 аминокислотных замен, по меньшей мере 16 аминокислотных замен, по меньшей мере 17 аминокислотных замен, по меньшей мере 18 аминокислотных замен, по меньшей мере 19 аминокислотных замен, по меньшей мере 20 аминокислотных замен, по меньшей мере 21 аминокислотную замену, по меньшей мере 22 аминокислотные замены, по меньшей мере 23 аминокислотные замены, по меньшей мере 24 аминокислотные замены, по меньшей мере 25 аминокислотных замен, по меньшей мере 26 аминокислотных замен, по меньшей мере 27 аминокислотных замен, по меньшей мере 28 аминокислотных замен, и/или по меньшей мере 29 аминокислотных замен, при условии, что выделенный полипептид, имеющий модифицированную аминокислотную последовательность, сохраняет способность функционировать в качестве селективного аналога глюкагона.
[00104] В некоторых вариантах осуществления изобретения выделенный полипептид по данному раскрытию содержит модифицированную аминокислотную последовательность, основанную на аминокислотной последовательности человеческого глюкагона: HSQGTFTSDYSKYLDSRRAQDFVQWLMNT-OH (SEQ ID NO: 140), где модифицированная аминокислотная последовательность включает в себя по меньшей мере одну аминокислотную замену, по меньшей мере две аминокислотные замены, по меньшей мере три аминокислотные замены, по меньшей мере четыре аминокислотные замены, по меньшей мере пять аминокислотных замен, по меньшей мере шесть аминокислотных замен, по меньшей мере семь аминокислотных замен, по меньшей мере восемь аминокислотных замен, по меньшей мере девять аминокислотных замен, по меньшей мере 10 аминокислотных замен, по меньшей мере 11 аминокислотных замен, по меньшей мере 12 аминокислотных замен, по меньшей мере 13 аминокислотных замен, по меньшей мере 14 аминокислотных замен, по меньшей мере 15 аминокислотных замен, или по меньшей мере 16 аминокислотных замен, где аминокислотные замены выбраны из группы, состоящей из:
(i) аминокислотной замены в положении 1, выбранной из группы, состоящей из Y и W;
(ii) аминокислотной замены в положении 2, выбранной из группы, состоящей из G и Т;
(iii) аминокислотной замены в положении 3 на Н;
(iv) аминокислотной замены в положении 10 на Н;
(v) аминокислотной замены в положении 11 на Т;
(vi) аминокислотной замены в положении 12 на R;
(vii) аминокислотной замены в положении 13, выбранной из группы, состоящей из L и W;
(viii) аминокислотной замены в положении 15 на Е;
(ix) аминокислотной замены в положении 16, выбранной из группы, состоящей из 2-аминоизомасляной кислоты (Aib), А, Е, I, K, L и Q;
(x) аминокислотной замены в положении 17, выбранной из группы, состоящей из А, Е, K, S, и Т;
(xi) аминокислотной замены в положении 18, выбранной из группы, состоящей из А, Е, L и Т;
(xii) аминокислотной замены в положении 21 на Е;
(xiii) аминокислотной замены в положении 23 на Т;
(xiv) аминокислотной замены в положении 24, выбранной из группы, состоящей из 2-аминоизомасляной кислоты (Aib), K и L;
(xv) аминокислотной замены в положении 25 на Н;
(xvi) аминокислотной замены в положении 30 на Z-хвост, выбранный из группы, состоящей из EEPSSGAPPPS-OH (SEQ ID NO: 4); EPSSGAPPPS-OH (SEQ ID NO: 5); GAPPPS-OH (SEQ ID NO: 6); GGPSSGAPPPS-OH (SEQ ID NO: 7); GPSSGAPPPS-OH (SEQ ID NO: 8); KRNKNPPPS-OH (SEQ ID NO: 9); KRNKNPPS- OH (SEQ ID NO: 10); KRNKPPIA-OH (SEQ ID NO: 11); KRNKPPPA-OH (SEQ ID NO: 150); KRNKPPPS-OH (SEQ ID NO: 12); KSSGKPPPS-OH (SEQ ID NO: 13); PESGAPPPS-OH (SEQ ID NO: 14); PKSGAPPPS-OH (SEQ ID NO: 15); PKSKAPPPS- NH2 (SEQ ID NO: 16); PKSKAPPPS-OH (SEQ ID NO: 17); PKSKEPPPS-NH2 (SEQ ID NO: 18); PKSKEPPPS-OH (SEQ ID NO: 19); PKSKQPPPS-OH (SEQ ID NO: 20); PKSKSPPPS-NH2 (SEQ ID NO: 21); PKSKSPPPS-OH (SEQ ID NO: 22); PRNKNNPPS- OH (SEQ ID NO: 23); PSKGAPPPS-OH (SEQ ID NO: 24); PSSGAPPPSE-OH (SEQ ID NO: 25); PSSGAPPPS-NH2 (SEQ ID NO: 26); PSSGAPPPS-OH (SEQ ID NO: 27); PSSGAPPPSS-OH (SEQ ID NO: 28); PSSGEPPPS-OH (SEQ ID NO: 29); PSSGKKPPS- OH (SEQ ID NO: 30); PSSGKPPPS-NH2 (SEQ ID NO: 31); PSSGKPPPS-OH (SEQ ID NO: 32); PSSGSPPPS-OH (SEQ ID NO: 33); PSSKAPPPS-OH (SEQ ID NO: 34); PSSKEPPPS-OH (SEQ ID NO: 35); PSSKGAPPPS-OH (SEQ ID NO: 36); PSSKQPPPS- OH (SEQ ID NO: 37); PSSKSPPPS-OH (SEQ ID NO: 38); SGAPPPS-OH (SEQ ID NO: 39); И SSGAPPPS-OH(SEQ ID NO: 40); и
(xvii) их комбинации,
при условии, что выделенный полипептид, имеющий модифицированную аминокислотную последовательность, сохраняет способность функционировать в качестве агониста, селективного к рецептору глюкагона.
[00105] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных консенсусной последовательностью SEQ ID NO: 1:
X1X2X3GTFTSDX10X11X12X13LX15X16X17X18AQEFX23X24X25LEDE-Z-хвост-(OH/NH2) (SEQ ID NO: 1), где:
X1 представляет собой Y или W;
X2 представляет собой S, G или T;
Х3 представляет собой Q или H;
Х10 представляет собой Y или Н;
Х11 представляет собой S или Т;
Х12 представляет собой K или R;
Х13 представляет собой Y, L или W;
Х15 представляет собой D или Е;
X16 представляет собой S, 2-аминоизомасляную кислоту (Aib), А, Е, L, Q, K или I;
X17 представляет собой K, Е, S, Т или А;
X18 представляет собой A, R, S, Е, L, Т или Y;
Х23 представляет собой Т или V;
Х24 представляет собой K, I, L или Aib;
Х25 представляет собой Н или W; и
Z-хвост отсутствует; или выбран из группы, состоящей из EEPSSGAPPPS-ОН (SEQ ID NO: 4); EPSSGAPPPS-OH (SEQ ID NO: 5); GAPPPS-OH (SEQ ID NO: 6); GGPS SGAPPP S-OH (SEQ ID NO: 7); GPSSGAPPPS-OH (SEQ ID NO: 8); KRNKNPPPS-OH (SEQ ID NO: 9); KRNKNPPS-OH (SEQ ID NO: 10); KRNKPPIA-OH (SEQ ID NO: 11); KRNKPPPA-OH (SEQ ID NO: 150); KRNKPPPS-OH (SEQ ID NO: 12); KSSGKPPPS-OH (SEQ ID NO: 13); PESGAPPPS-OH (SEQ ID NO: 14); PKSGAPPPS-OH (SEQ ID NO: 15); PKSKAPPPS-NH2 (SEQ ID NO: 16); PKSKAPPPS-OH (SEQ ID NO: 17); PKSKEPPPS-NH2 (SEQ ID NO: 18); PKSKEPPPS-OH (SEQ ID NO: 19); PKSKQPPPS-OH (SEQ ID NO: 20); PKSKSPPPS-NH2 (SEQ ID NO: 21); PKSKSPPPS-OH (SEQ ID NO: 22); PRNKNNPPS-OH (SEQ ID NO: 23); PSKGAPPPS-OH (SEQ ID NO: 24); PSSGAPPPSE-OH (SEQ ID NO: 25); PSSGAPPPS-NH2 (SEQ ID NO: 26); PSSGAPPPS-OH (SEQ ID NO: 27); PSSGAPPPSS-OH (SEQ ID NO: 28); PSSGEPPPS-OH (SEQ ID NO: 29); PSSGKKPPS-OH (SEQ ID NO: 30); PSSGKPPPS-NH2 (SEQ ID NO: 31); PSSGKPPPS-OH (SEQ ID NO: 32); PSSGSPPPS-OH (SEQ ID NO: 33); PSSKAPPPS-OH (SEQ ID NO: 34); PSSKEPPPS-OH (SEQ ID NO: 35); PSSKGAPPPS-OH (SEQ ID NO: 36); PSSKQPPPS-OH (SEQ ID NO: 37); PSSKSPPPS-OH (SEQ ID NO: 38); SGAPPPS-OH (SEQ ID NO: 39); И SSGAPPPS-OH(SEQ ID NO: 40).
[00106] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных консенсусной последовательностью SEQ ID NO: 2:
X1X2X3GTFTSDX10X11X12X13LX15X16X17X18AQEFVX24WLEDE-Z-хвост-(OH/NH2)(SEQ ID NO: 2), где:
X1 представляет собой Y или W;
X2 представляет собой S или G;
Х3 представляет собой Q или Н;
Х10 представляет собой Y или Н;
Х11 представляет собой S или Т;
X12 представляет собой K или R;
X13 представляет собой Y, L или W;
X15 представляет собой D или Е;
X16 представляет собой 2-аминоизомасляную кислоту (Aib), А или S;
X17 представляет собой А или K;
X18 представляет собой R, S, L или Y;
Х24 представляет собой K, I или Aib;
Х25 представляет собой Н или W; и
концевой сегмент Z отсутствует или выбран из группы, состоящей из PSSGAPPPS-NH2 (SEQ ID NO: 26); PSSGAPPPS-OH (SEQ ID NO: 27); и PKSKSPPPS-NH2 (SEQ ID NO: 21).
[00107] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных консенсусной последовательностью SEQ ID NO: 3:
YSX3GTFTSDYSKYLDX16X17X18AQEFVX24WLEDE-Z-хвост-(OH/NH2) (SEQ ID NO: 3), где:
Х3 представляет собой Q или Н;
X16 представляет собой 2-аминоизомасляную кислоту (Aib) или А;
X17 представляет собой А или K;
X18 представляет собой R, S, или Y;
Х24 представляет собой K или Aib;
Z-хвост выбран из группы, состоящей из PSSGAPPPS-OH (SEQ ID NO: 27) и PKSKSPPPS-NH2 (SEQ ID NO: 21).
[00108] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из YSHGTFTSDYSKYLD(Aib)KYAQEFV(Aib)WLEDEPS SGAPPPS-OH (SEQ ID NO: 41), также называемую в данном документе соединением А1;
YSHGTFTSDYSKYLD(Aib)KSAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 42); также называемую в данном документе соединением А2;
YSQGTFTSDYSKYLDAARAQEFVKWLEDEPKSKSPPPS-NH2 (SEQ ID NO: 43); также называемую в данном документе соединением A3;
YSHGTFTSDYSKYLD(Aib)KRAQEFVIWLEDEPSSGAPPPS-OH (SEQ ID NO: 44); также называемую в данном документе соединением А4;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPSSGAPPPS-NH2 (SEQ ID NO: 45), также называемую в данном документе соединением А5; и
WSQGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 46), также называемую в данном документе соединением А6.
[00109] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLD(Aib)KYAQEFV(Aib)WLEDEPS SGAPPPS-OH (SEQ ID NO: 41). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLD(Aib)KSAQEFV(Aib)WLEDEPSSGAPPPS-ОН (SEQ ID NO: 42). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSQGTFTSDYSKYLDAARAQEFVKWLEDEPKSKSPPPS-NH2 (SEQ ID NO: 43). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLD(Aib)KRAQEFVIWLEDEPSSGAPPPS-OH (SEQ ID NO: 44). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLDSARAQEFVKWLEDEPSSGAPPPS-NH2 (SEQ ID NO: 45). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность WSQGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 46).
[00110] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию состоит из аминокислотной последовательности YSHGTFTSDYSKYLD(Aib)KYAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 41). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию состоит из аминокислотной последовательности YSHGTFTSDYSKYLD(Aib)KSAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 42). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию состоит из аминокислотной последовательности YSQGTFTSDYSKYLDAARAQEFVKWLEDEPKSKSPPPS-NH2 (SEQ ID NO: 43). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию состоит из аминокислотной последовательности YSHGTFTSDYSKYLD(Aib)KRAQEFVIWLEDEPSSGAPPPS-OH (SEQ ID NO: 44). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию состоит из аминокислотной последовательности YSHGTFTSDYSKYLDSARAQEFVKWLEDEPSSGAPPPS-NH2 (SEQ ID NO: 45). В некоторых вариантах осуществления выделенный полипептид по данному раскрытию состоит из аминокислотной последовательности WSQGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 46).
[00111] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из YSHGTFTSDYSKYLD(Aib)ARAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 47); также называемую в данном документе соединением А7;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-NH2 (SEQ ID NO: 48); также называемую в данном документе соединением А8;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEEEPSSGAPPPS-OH (SEQ ID NO: 49); также называемую в данном документе соединением А9;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEEPSSGAPPPS-OH (SEQ ID NO: 50); также называемую в данном документе соединением А10;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEEEPSSGAPPPS-OH (SEQ ID NO: 51); также называемую в данном документе соединением А11;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEGAPPPS-OH (SEQ ID NO: 52); также называемую в данном документе соединением А12;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDESGAPPPS-OH (SEQ ID NO: 53); также называемую в данном документе соединением А13;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDESSGAPPPS-OH (SEQ ID NO: 54); также называемую в данном документе соединением А14;
YSHGTFTSDYSKYLD(Aib)SRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 55); также называемую в данном документе соединением А15;
YSHGTFTSDYSKYLD(Aib)TRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 56); также называемую в данном документе соединением А16;
YSHGTFTSDYSKYLD(Aib)ERAQEFV(Aib)WLEDEPS SGAPPPS-OH (SEQ ID NO: 57); также называемую в данном документе соединением А17;
YSHGTFTSDYSKWLD(Aib)ARAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 58); также называемую в данном документе соединением А18;
YSHGTFTSDYSKWLD(Aib)SRAQEFV(Aib)WLEDEPS SGAPPPS-OH (SEQ ID NO: 59); также называемую в данном документе соединением А19;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGKPPPS-OH (SEQ ID NO: 60); также называемую в данном документе соединением А20;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGEPPPS-OH (SEQ ID NO: 61); также называемую в данном документе соединением А21;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGSPPPS-OH (SEQ ID NO: 62); также называемую в данном документе соединением А22;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSKAPPPS-OH (SEQ ID NO: 63); также называемую в данном документе соединением А23;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSKGAPPPS-OH (SEQ IDNO: 64); также называемую в данном документе соединением А24;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPSS-OH (SEQ ID NO: 65); также называемую в данном документе соединением А25;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPSE-OH (SEQ ID NO: 66); также называемую в данном документе соединением А26;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEGGPSSGAPPPS-OH (SEQ ID NO: 67); также называемую в данном документе соединением А27;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEGPSSGAPPPS-OH (SEQ ID NO: 68); также называемую в данном документе соединением А28;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPKSGAPPPS-OH (SEQ ID NO: 69); также называемую в данном документе соединением А29;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSKGAPPPS-OH (SEQ ID NO: 70); также называемую в данном документе соединением А30;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPESGAPPPS-OH (SEQ ID NO: 71); также называемую в данном документе соединением A31;
YTHGTFTSDYSKWLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 72); также называемую в данном документе соединением А32;
YSHGTFTSDHSKWLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 73); также называемую в данном документе соединением А33;
YTHGTFTSDHSKWLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 74); также называемую в данном документе соединением А34;
YTHGTFTSDYSKWLD(Aib)ARAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 75); также называемую в данном документе соединением A35;
YSHGTFTSDHSKWLD(Aib)ARAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 76); также называемую в данном документе соединением А36;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 77); также называемую в данном документе соединением A37;
YSHGTFTSDYSKWLDSARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 78); также называемую в данном документе соединением A38;
YTHGTFTSDYSKWLDSARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 79); также называемую в данном документе соединением A39;
YSHGTFTSDHSKWLDSARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 80); также называемую в данном документе соединением А40;
YTHGTFTSDHSKWLDEARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 81); также называемую в данном документе соединением А41;
YTHGTFTSDYSKWLDSKRAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 82); также называемую в данном документе соединением А42;
YSHGTFTSDYSKYLDKARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 83); также называемую в данном документе соединением А43;
YSHGTFTSDYSKYLDQARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 84); также называемую в данном документе соединением А44;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEKRNKPPPA-OH (SEQ ID NO: 85); также называемую в данном документе соединением А45;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEKRNKPPIA-OH (SEQ ID NO: 86); также называемую в данном документе соединением А46;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEKRNKNPPS-OH (SEQ ID NO: 87); также называемую в данном документе соединением А47;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEKRNKNPPPS-OH (SEQ ID NO: 88); также называемую в данном документе соединением А48;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPRNKNNPPS-OH (SEQ ID NO: 89); также называемую в данном документе соединением А49;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEKRNKPPPS-OH (SEQ ID NO: 90); также называемую в данном документе соединением А50;
YSHGTFTSDYSKYLDLKRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 91); также называемую в данном документе соединением А51;
YSHGTFTSDYSKYLDIKRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 92); также называемую в данном документе соединением А52;
YSHGTFTSDY SKYLD(Aib)KRAQEFVL WLEDEPSSGAPPPS-OH (SEQ ID NO: 93); также называемую в данном документе соединением А53;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSKEPPPS-OH (SEQ ID NO: 94); также называемую в данном документе соединением А54;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSKSPPPS-OH (SEQ ID NO: 95); также называемую в данном документе соединением А55;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPKSKAPPPS-OH (SEQ ID NO: 96); также называемую в данном документе соединением А56;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPKSKQPPPS-OH (SEQ ID NO: 97); также называемую в данном документе соединением А57;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPKSKSPPPS-OH (SEQ ID NO: 98); также называемую в данном документе соединением А58;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSKQPPPS-OH (SEQ ID NO: 99); также называемую в данном документе соединением А59;
YTHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGKPPPS-OH (SEQ ID NO: 100); также называемую в данном документе соединением А60;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPSSGKPPPS-OH(SEQ ID NO: 101); также называемую в данном документе соединением А61;
YTHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 102); также называемую в данном документе соединением А62;
YTHGTFTSDYSKYLDSARAQEFVKWLEDEPSSGAPPPS-OH (SEQ ID NO: 103); также называемую в данном документе соединением А63;
YTHGTFTSDYSKYLD(Aib)ARAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 104); также называемую в данном документе соединением А64;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPKSKEPPPS-NH2 (SEQ ID NO: 105); также называемую в данном документе соединением А65;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPKSKSPPPS-NH2 (SEQ ID NO: 106); также называемую в данном документе соединением А66;
YSHGTFTSDYSKYLD(Aib)ARAQEFV(Aib)WLEDEPKSKSPPPS-NH2 (SEQ ID NO: 107); также называемую в данном документе соединением А67;
YSHGTFTSDYSKYLD(Aib)ARAQEFV(Aib)WLEDEPKSKEPPPS-NH2 (SEQ ID NO: 108); также называемую в данном документе соединением А68;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPKSKEPPPS-OH (SEQ ID NO: 109); также называемую в данном документе соединением А69;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPKSKSPPPS-OH (SEQ ID NO: 110); также называемую в данном документе соединением А70;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPKSKAPPPS-OH (SEQ ID NO: 111); также называемую в данном документе соединением А71;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPKSKEPPPS-NH2 (SEQ ID NO: 112); также называемую в данном документе соединением А72;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPKSKSPPPS-NH2 (SEQ ID NO: 113); также называемую в данном документе соединением А73;
YSHGTFTSDYSKYLDSARAQEFVKWLEDEPKSKAPPPS-NH2 (SEQ ID NO: 114); также называемую в данном документе соединением А74;
WSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 115); также называемую в данном документе соединением А75;
YSHGTFTSDYSKYLD(Aib)KAAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 116); также называемую в данном документе соединением А76;
YSHGTFTSDYSKYLD(Aib)KTAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 117); также называемую в данном документе соединением А77;
YSHGTFTSDYSKYLD(Aib)KLAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 118); также называемую в данном документе соединением А78;
YSHGTFTSDYSKYLD(Aib)KEAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ IDNO: 119); также называемую в данном документе соединением А79;
YSHGTFTSDYSKYLDAARAQEFVKWLEDEPKSKSPPPS-NH2 (SEQ ID NO: 120); также называемую в данном документе соединением А80;
YSQGTFTSDYSKYLDSARAQEFVKWLEDEPKSKSPPPS-OH (SEQ ID NO: 121); также называемую в данном документе соединением А81;
YSQGTFTSDYSKYLDSARAQEFVKWLEDEPKSKAPPPS-OH (SEQ ID NO: 122); также называемую в данном документе соединением А82;
YSHGTFTSDYSKYLDSARAQEFTKWLEDEPKSKSPPPS-OH (SEQ ID NO: 123); также называемую в данном документе соединением А83;
YSHGTFTSDYSKYLDSARAQEFVKHLEDEPKSKSPPPS-OH (SEQ ID NO: 124); также называемую в данном документе соединением А84;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGKPPPS-NH2 (SEQ ID NO: 125); также называемую в данном документе соединением А85;
YSQGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGKPPPS-OH (SEQ ID NO: 126); также называемую в данном документе соединением А86;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEKSSGKPPPS-OH (SEQ ID NO: 127); также называемую в данном документе соединением А87;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGKKPPS-OH (SEQ ID NO: 128); также называемую в данном документе соединением А88;
YSHGTFTSDYSKYLD(Aib)KRAQEFV(Aib)HLEDEPSSGKPPPS-OH (SEQ ID NO: 129); также называемую в данном документе соединением А89;
YSHGTFTSDYSKYLD(Aib)KAAQEFV(Aib)WLEDEPSSGKPPPS-OH (SEQ ID NO: 130); также называемую в данном документе соединением А90;
WSQGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGKPPPS-OH (SEQ ID NO: 131); также называемую в данном документе соединением А91;
WSQGTFTSDYSKYLD(Aib)KAAQEF V(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 132); также называемую в данном документе соединением А92;
WSQGTFTSDYSKYLD(Aib)KAAQEFV(Aib)WLEDEPS SGKPPPS-OH (SEQ ID NO: 133); также называемую в данном документе соединением А93;
YSQGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 134); также называемую в данном документе соединением А94;
YSQGTFTSDYSKYLD(Aib)KAAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 135); также называемую в данном документе соединением А95; и
YSQGTFTSDYSKYLD(Aib)KAAQEFV(Aib)WLEDEPSSGKPPPS-OH (SEQ ID NO: 136); называемую в данном документе соединением А96; В некоторых вариантах осуществления состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 47-136.
[00112] В некоторых вариантах осуществления изобретения выделенный полипептид выбран из группы, состоящей из соединения А1, соединения А2, соединения A3, соединения А4, соединения А5 и соединения А6. В некоторых вариантах осуществления выделенный полипептид представляет собой соединение А1. В некоторых вариантах осуществления выделенный полипептид представляет собой соединение А2. В некоторых вариантах осуществления выделенный полипептид представляет собой соединение A3. В некоторых вариантах осуществления выделенный полипептид представляет собой соединение А4. В некоторых вариантах осуществления выделенный полипептид представляет собой соединение А5. В некоторых вариантах осуществления выделенный полипептид представляет собой соединение А6.
[00113] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных консенсусной последовательностью SEQ ID NO: 137:
YSQGTFTSDYSKYLDSX17RAQX21FVX24WLX27X28T-OH (SEQ ID NO: 137), где:
X17 представляет собой K*, где K* расположен на лактамном мосту с Е* в положении X21;
X21 представляет собой Е*, где Е* расположен на лактамном мосту с K* в положении X17;
Х24 представляет собой K или K**, где K** расположен на лактамном мосту с Е** В положении Х28;
Х27 представляет собой Q или D; и
Х28 представляет собой Е или Е**, где Е** расположен на лактамном мосту с K** в положении Х24
[00114] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из YSQGTFTSDYSKYLDSK*RAQE*FVK**WLDE**T-OH(SEQ ID NO: 138), называемой в данном документе соединением А 104 и YSQGTFTSDYSKYLDSK*RAQE*FVK**WLQE**T-OH (SEQ ID NO: 139); называемую в данном документе соединением А105; В некоторых вариантах осуществления состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 138 и 139.
Конъюгирование липофильного заместителя с любым из пептидов, необязательно с помощью спейсера
[00115] В некоторых вариантах осуществления пептид по раскрытию необязательно замещен одним или несколькими липофильными заместителями, каждый из которых необязательно присоединен посредством двухвалентного спейсера.
[00116] Конъюгирование одного или нескольких липофильных заместителей, каждый из которых необязательно присоединен посредством двухвалентного спейсера, с пептидом по раскрытию предназначено для продления действия пептида путем облегчения связывания с сывороточным альбумином и замедления выведения конъюгированного пептида из почек. Заявитель обнаружил, что некоторые пептиды по раскрытию, имеющие аффинность к альбумину и длительный период полувыведения у людей, особенно пригодны для раскрытых способов введения с помощью имплантируемого осмотического устройства доставки препарата.
[00117] В некоторых вариантах осуществления пептид по раскрытию имеет период полувыведения (t1/2) у человека по меньшей мере около 5 часов после подкожного введения. В некоторых вариантах осуществления пептид по раскрытию имеет период полувыведения (t1/2) у человека по меньшей мере около 8 часов, 10 часов, 12 часов, 16 часов, 24 часов или дольше после подкожного введения.
[00118] Используемый в настоящем описании термин «липофильный заместитель» содержит заместитель, содержащий от 4 до 40 атомов углерода, от 8 до 25 атомов углерода, или от 12 до 22 атомов углерода. Липофильный заместитель может быть присоединен к аминогруппе пептида (например, ε-аминогруппой остатка лизина) посредством карбоксильной группы липофильного заместителя, или, необязательно, аминогруппой спейсера, данный спейсер в свою очередь образует амидную связь с аминогруппой аминокислотного (например, лизина) остатка, к которому он прикреплен. В некоторых вариантах осуществления пептид содержит три, два, или, предпочтительно, один липофильный заместитель, каждый с необязательным спейсером или без него.
[00119] В некоторых вариантах осуществления изобретения липофильный заместитель содержит линейную или разветвленную алкильную группу. В некоторых вариантах осуществления изобретения липофильный заместитель представляет собой ацильную группу неразветвленной или разветвленной жирной кислоты. В некоторых вариантах осуществления изобретения липофильный заместитель представляет собой ацильную группу формулы СН3(СН2)nCO-, в которой n представляет собой целое число от 4 до 38, целое число от 4 до 24, например, СН3(СН2)6СО-, СН3(СН2)8СО-, СН3(СН2)10СО- СН3(СН2)12СО-, СН3(СН2)14СО- СН3(СН2)16СО-, СН3(СН2)18СО-, СН3(СН2)20СО- или СН3(СН2)22СО-. В некоторых вариантах осуществления n равно 6, 8, 10, 12, 14, 16, 18, 20 или 22. В некоторых вариантах осуществления изобретения липофильный заместитель представляет собой ацильную группу формулы СН3(СН2)14СО-.
[00120] В некоторых вариантах осуществления изобретения липофильный заместитель представляет собой ацильную группу прямоцепочечной или разветвленной жирной кислоты, далее замещенную одной или более из групп карбоновой кислоты и/или гидроксамовой кислоты. В некоторых вариантах осуществления изобретения липофильный заместитель представляет собой ацильную группу формулы НООС(СН2)mCO-, где М представляет собой целое число от 4 до 38, целое число от 4 до 24, например, НООС(CH2)14СО-, HOOC(CH2)16CO- HOOC(CH2)18CO- НООС(СН2)20СО- или НООС(СН2)22СО-. В некоторых вариантах осуществления изобретения липофильный заместитель представляет собой НООС(СН2)16СО-. В некоторых вариантах осуществления m равно 6, 8, 10, 12, 14, 16, 18, 20 или 22.
[00121] В некоторых вариантах осуществления изобретения липофильный заместитель присоединен к исходному пептиду посредством двухвалентного «спейсера». В некоторых вариантах осуществления настоящего изобретения спейсер содержит двухвалентную группу формулы I:
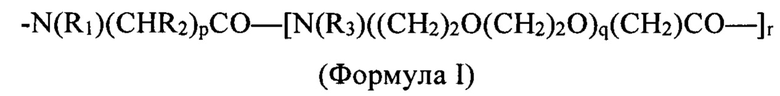
где
каждый R1 и R3 представляет собой водород или C1-C4 алкил;
каждый R2 представляет собой Н или CO2H;
р равно 1, 2, 3, 4, 5 или 6;
q равно 1, 2 или 3;
r равно 0 или 1.
Данный спейсер образует мостик между аминогруппой пептида по раскрытию и группой СО- липофильного заместителя.
[00122] В некоторых вариантах осуществления изобретения каждый R1 представляет собой водород. В некоторых вариантах осуществления изобретения каждый R3 представляет собой водород. В некоторых вариантах осуществления каждый R1 и каждый R3 представляет собой водород.
[00123] В некоторых вариантах осуществления, по меньшей мере один R2 представляет собой CO2H. В некоторых вариантах осуществления один R2 представляет собой CO2H.
[00124] В некоторых вариантах р равно 1. В некоторых вариантах осуществления р равно 2. В некоторых вариантах осуществления р равно 3. В некоторых вариантах осуществления р равно 4. В некоторых вариантах осуществления р равно 5. В некоторых вариантах осуществления р равно 6.
[00125] В некоторых вариантах осуществления q равно 1. В некоторых вариантах осуществления q равно 2. В некоторых вариантах осуществления q равно 3.
[00126] В некоторых вариантах осуществления r равно 0. В некоторых вариантах осуществления г равно 1.
[00127] В некоторых вариантах осуществления спейсер представляет собой γ-глутамил, например,
-NH(CHCO2H)(CH2)2CO-. В некоторых вариантах осуществления спейсер представляет собой γ-аминобутаноил, например, -NH(СН2)3СО-. В некоторых вариантах осуществления спейсер представляет собой β-аспарагил, например, -NH(CHCO2H)(CH2)CO-. В некоторых вариантах осуществления изобретения, спейсер представляет собой -NH(CH2)2CO-. В некоторых вариантах осуществления спейсер представляет собой глицил. В некоторых вариантах осуществления спейсер представляет собой β-аланил. В некоторых вариантах осуществления представлен пептид SEQ ID NO: 151, описанный ниже, в котором липофильный заместитель связан с ε-аминогруппой лизина посредством спейсера.
[00128] В некоторых вариантах осуществления изобретения спейеер представляет собой -NHCH(CO2H)(CH2)2CO-[N(R3)((CH2)2O(CH2)2O)q(CH2)CO-]r. В некоторых вариантах осуществления изобретения спейсер представляет собой -NH(CH2)3CO-[N(R3)((CH2)2O(CH2)2O)q(CH2)CO-]r. В некоторых вариантах осуществления изобретения спейсер представляет собой -NHCH(CO2H)(CH2)2CO-NH((CH2)2O(CH2)2O)2(CH2)CO-. В некоторых вариантах осуществления изобретения спейсер представляет собой -NH(CH2)3CO-NH((CH2)2O(CH2)2O)2(CH2)CO-. В некоторых вариантах осуществления изобретения спейсер представляет собой -NHCH(CO2H)CH2CO-[N(R3)((CH2)2O(CH2)2O)q(CH2)CO-]r. В некоторых вариантах осуществления изобретения спейсер представляет собой -NH(CH2)2CO-[N(R3)((CH2)2O(CH2)2O)q(CH2)CO-]r.
[00129] В некоторых вариантах осуществления настоящего изобретения спейсер представляет собой аминокислоту, например, Lys, Glu или Asp, или дипептид, такой как Gly-Lys. В некоторых вариантах осуществления, когда спейсер представляет собой Lys, Glu или Asp, одна карбоксильная группа спейсера может образовывать амидную связь с аминогруппой, пептида по раскрытию, и аминогруппа спейсера может образовывать амидную связь с карбоксильной группой липофильного заместителя.
[00130] В некоторых вариантах осуществления изобретения липофильный заместитель и спейсер объединяют с формированием структуры формулы II:
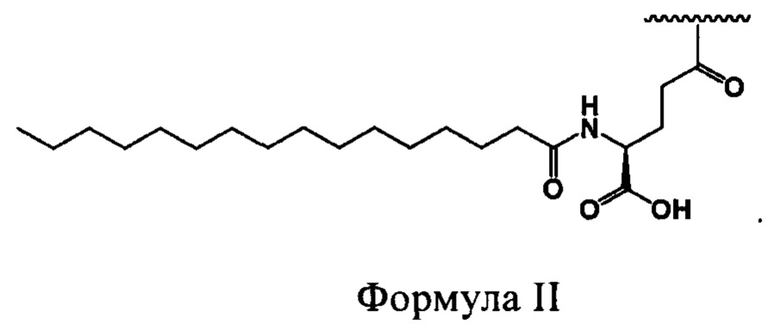
[00131] В некоторых вариантах осуществления изобретения липофильный заместитель и спейсер объединяют с формированием структуры формулы III:
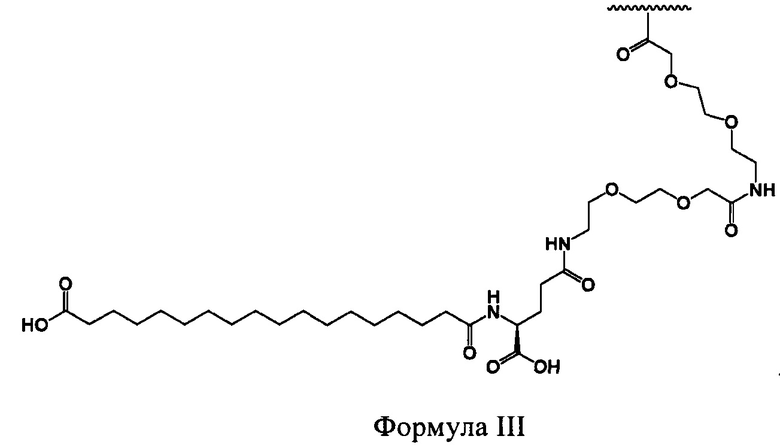
[00132] В некоторых вариантах осуществления изобретения каждый липофильный заместитель присоединен, необязательно посредством спейсера, к ε-аминогруппе остатка лизина, содержащейся в исходном пептиде.
[00133] Например, в некоторых вариантах осуществления представлен выделенный полипептид, в котором выделенный полипептид выбран из группы, состоящей из соединений А1-А105, и выделенный полипептид ковалентно связан с липофильным заместителем, необязательно посредством спейсера.
[00134] В некоторых вариантах осуществления выделенный полипептид выбран из группы, состоящей из соединений А1-А6, и выделенный полипептид ковалентно соединяется с липофильным заместителем, необязательно посредством спейсера.
[00135] В некоторых вариантах осуществления изобретения выделенный полипептид выбран из группы, состоящей из соединений А97-А103, и выделенный полипептид ковалентно соединяется с липофильным заместителем, необязательно посредством спейсера.
[00136] В некоторых вариантах осуществления настоящего изобретения липофильные заместители ковалентно связаны с любым из пептидов соединений А1-А105, такие как любые из соединений А1, А2, A3, А4, А5 или А6, посредством спейсера, и липофильный заместитель и спейсер описаны формулой II.
[00137] В некоторых вариантах осуществления настоящего изобретения липофильные заместители ковалентно связаны с любым из пептидов соединений А1-А105, такие как любые из соединений А1, А2, A3, А4, А5 или А6, посредством спейсера, и липофильный заместитель и спейсер описаны формулой III.
[00138] В некоторых вариантах осуществления настоящего изобретения липофильные заместители ковалентно связаны с любым из пептидов соединений А1-А105, такие как любые из соединений А97, А98, А99, А100, А101, А102 или А103, посредством спейсера, и липофильный заместитель и спейсер описаны формулой II.
[00139] В некоторых вариантах осуществления настоящего изобретения липофильные заместители ковалентно связаны с любым из пептидов соединений А1-А105, такие как любые из соединений А97, А98, А99, А100, А101, А102 или А103, посредством спейсера, и липофильный заместитель и спейсер описаны формулой III.
[00140] В некоторых вариантах осуществления выделенный полипептид содержит лизин, и е-аминогруппа лизина ковалентно связана с липофильным заместителем, необязательно посредством спейсера.
[00141] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных консенсуеной последовательностью SEQ ID NO: 151:
X1SX3GTFTSDX10SKYLDX16X17X18AQX21FVX24WLEDEPX31SX33X34PPPS-OH(SEQ ID NO: 151), где:
[00142] X1=Y или W;
[00143] Х3=H или Q;
[00144] Х10=Y, K или K***;
[00145] Х16=А, S, Aib, K или K***;
[00146] Х17=А, K, Aib или K***;
[00147] Х18=Y, S или K;
[00148] Х21=Е, K или K***;
[00149] Х24=I, Aib, K или K***;
[00150] Х31=S, K или K***;
[00151] Х33=G, K или K***; и
[00152] Х34=А или S;
[00153] где K*** представляет собой лизин, и ε-аминогруппа боковой цепи лизина ковалентно связана с липофильным заместителем, необязательно посредством спейсера, как в обоих случаях определенно в данном описании.
[00154] В некоторых вариантах осуществления. K*** представляет собой лизин, и ε-аминогруппа боковой цепи лизина ковалентно связана с липофильным заместителем посредством спейсера. В некоторых вариантах осуществления, K*** представляет собой лизин, и ε-аминогруппа боковой цепи лизина ковалентно связана с липофильным заместителем, в отсутствии (т.в., без) спейсера.
[00155] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных консенсусной последовательностью SEQ ID NO: 151, где:
[00156] X1=Y или W;
[00157] Х3=H или Q;
[00158] Х10=Y или K***;
[00159] X16=A, S, Aib или K***;
[00160] X17=А, K или Aib;
[00161] Х18=Y, S или K;
[00162] Х21=Е или K***;
[00163] Х24=I, Aib или K***;
[00164] Х31=S или K***;
[00165] Х33=G, K или K***; и
[00166] Х34=А или S;
[00167] где K*** представляет собой лизин, и ε-аминогруппа боковой цепи лизина ковалентно связана с липофильным заместителем, необязательно посредством спейсера, как в обоих случаях определенно в данном описании.
[00168] В некоторых вариантах осуществления, K*** представляет собой лизин, и ε-аминогруппа боковой цепи лизина ковалентно связана с липофильным заместителем посредством спейсера. В некоторых вариантах осуществления. K*** представляет собой лизин, и ε-аминогруппа боковой цепи лизина ковалентно связана с липофильным заместителем, в отсутствии (т.в., без) спейсера.
[00169] В некоторых вариантах осуществления, X1=Y. В некоторых вариантах осуществления, X1=W.
[00170] В некоторых вариантах осуществления, Х3=H. В некоторых вариантах осуществления, Х3=Q.
[00171] В некоторых вариантах осуществления X10=Y. В некоторых вариантах осуществления X10=K. В некоторых вариантах осуществления Х10=K***.
[00172] В некоторых вариантах осуществления X16=А. В некоторых вариантах осуществления X16=S. В некоторых вариантах осуществления, X16=Aib. В некоторых вариантах осуществления X16=K. В некоторых вариантах осуществления Х16=K***
[00173] В некоторых вариантах осуществления X17=А. В некоторых вариантах осуществления X17=K. В некоторых вариантах осуществления X17=Aib. В некоторых вариантах осуществления X17=K***.
[00174] В некоторых вариантах осуществления, X18=Y. В некоторых вариантах осуществления, X18=S. В некоторых вариантах осуществления, X18=Р.
[00175] В некоторых вариантах осуществления Х21=Е. В некоторых вариантах осуществления Х21=K. В некоторых вариантах осуществления Х21=K***.
[00176] В некоторых вариантах осуществления Х24=I. В некоторых вариантах осуществления, Х24=Aib. В некоторых вариантах осуществления Х24=K. В некоторых вариантах осуществления Х24=K***.
[00177] В некоторых вариантах осуществления Х31=S. В некоторых вариантах осуществления, Х31=K. В некоторых вариантах осуществления Х31=K***.
[00178] В некоторых вариантах осуществления, Х33=G. В некоторых вариантах осуществления, Х33=K. В некоторых вариантах осуществления, Х33=K***.
[00179] В некоторых вариантах осуществления X16 представляет собой K***; в некоторых вариантах осуществления, Х21 представляет собой K***; в некоторых вариантах осуществления, Х24 представляет собой K***; в некоторых вариантах осуществления Х33 представляет собой K***, где K*** представляет собой лизин, и ε-аминогруппа лизина ковалентно связана с липофильным заместителем и спейсером формулы II:
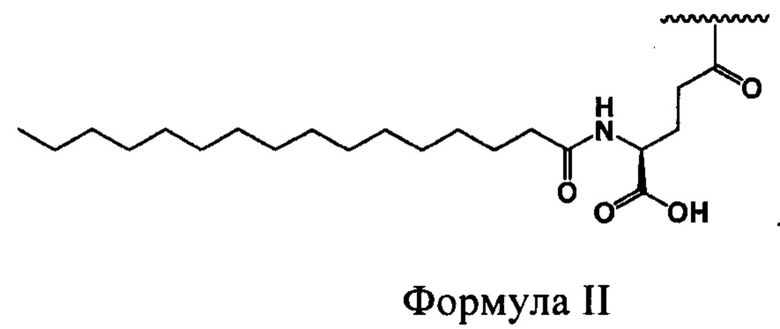
[00180] В некоторых вариантах осуществления Х16 представляет собой K***; в некоторых вариантах осуществления, Х21 представляет собой K***; в некоторых вариантах осуществления, Х24 представляет собой K***; в некоторых вариантах осуществления Х33 представляет собой K***, где K*** представляет собой лизин, и ε-аминогруппа лизина ковалентно связана с липофильным заместителем и спейсером формулы III:

[00181] В некоторых вариантах осуществления один или более из X10, X16, X17, Х21, Х24, Х31 или Х33 представляет собой K***, где K*** представляет собой лизин, и ε-аминогруппа лизина ковалентно связана с липофильным заместителем и спейсером формулы II.
[00182] В некоторых вариантах осуществления один или более из X10, X16, X17, Х21, Х24, Х31 или Х33 представляет собой K***, где K*** представляет собой лизин, и е-аминогруппа лизина ковалентно связана с липофильным заместителем и спейсером формулы III.
[00183] В некоторых вариантах осуществления, один из Х10, Х16, Х17, Х21, Х24, Х31 или Х33 представляет собой K***, где K*** представляет собой лизин, и ε-аминогруппа лизина ковалентно связана с липофильным заместителем и спейсером формулы II.
[00184] В некоторых вариантах осуществления, один из Х10, Х16, Х17, Х21, Х24, Х31 или Х33 представляет собой K***, где K*** представляет собой лизин, и ε-аминогруппа лизина ковалентно связана с липофильным заместителем и спейсером формулы III.
[00185] В некоторых вариантах осуществления представлена фармацевтическая композиция, содержащая любой из описанных пептидов, сформулированных в виде соли трифторуксусной кислоты, соли уксусной кислоты или хлористо во дородной соли. В некоторых вариантах осуществления представлена фармацевтическая композиция, содержащая любой из описанных пептидов, сформулированных в виде соли трифторуксусной кислоты. В некоторых вариантах осуществления представлена фармацевтическая композиция, содержащая любой из описанных пептидов, сформулированных в виде соли уксусной кислоты. В некоторых вариантах осуществления представлена фармацевтическая композиция, содержащая любой из описанных пептидов, сформулированных в виде хлористоводородной соли.
[00186] В некоторых вариантах осуществления представлена фармацевтическая композиция, содержащая любой из описанных пептидов, сформулированных в виде соли трифторуксусной кислоты, соли уксусной кислоты или хлористоводородной соли, и пептид включает аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных консенсусной последовательностью SEQ ID NO: 151. В некоторых вариантах осуществления представлена фармацевтическая композиция, содержащая любой из пептидов по раскрытию, сформулированный в виде соли трифторуксусной кислоты, и пептид содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных консенсусной последовательностью SEQ ID NO: 151. В некоторых вариантах осуществления представлена фармацевтическая композиция, содержащая любой из описанных пептидов, сформулированный в виде ацетатной соли, и пептид содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных консенсусной последовательностью SEQ ID NO: 151. В некоторых вариантах осуществления представлена фармацевтическая композиция, содержащая любой из описанных пептидов, сформулированный в виде хлористоводородной соли, и пептид содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных консенсусной последовательностью SEQ ID NO: 151. В некоторых вариантах осуществления в пептиде SEQ ID NO: 151, один из X10, X16, X17, Х21, Х24, Х31 или Х33 представляет собой K***, где K*** представляет собой лизин, и ε-аминогруппа лизина ковалентно связана с липофильным заместителем и спейсером формулы II. В некоторых вариантах осуществления в пептиде SEQ ID NO: 151, один из X10, X16, X17, Х21, Х24, Х31 или Х33 представляет собой K***, где K*** представляет собой лизин, и ε-аминогруппа лизина ковалентно связана с липофильным заместителем и спейсером формулы III.
[00187] В некоторых вариантах осуществления представлен любой из выделенных полипептидов по раскрытию, причем полипептид содержит один или несколько аминокислотных остатков, каждый из которых ковалентно связан с липофильным заместителем, необязательно посредством спейсера, как в обоих случаях определенно в данном описании. В некоторых вариантах осуществления изобретения каждый из одного или нескольких аминокислотных остатков ковалентно связан с липофильным заместителем и спейсеру формулы II или III.
[00188] В некоторых вариантах осуществления изобретения любые из выделенных полипептидов по настоящему раскрытию, где указанный полипептид содержит по меньшей мере один остаток лизина, в котором е-аминогруппа боковой цепи лизина ковалентно связана с липофильным заместителем, необязательно посредством спейсера, как в обоих случаях определенно в настоящем описании. В некоторых вариантах осуществления изобретения каждый из по меньшей мере одного остатка лизина обладает ε-аминогруппой, которая ковалентно связана с липофильным заместителем и спейсером формулы II или III.
[00189] В некоторых вариантах осуществления выделенный полипептид выбран из группы, состоящей из соединений В1-В48.
[00190] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLD(Aib)KYAQEFV(Aib)WLEDEPSSK****APPPS-OH (SEQ ID NO: 152) также называемую в данном документе соединением В1.
[00191] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLD(Aib)KYAQEFVK****WLEDEPSSGAPPPS-OH (SEQ ID NO: 153) также называемую в данном документе соединением В2.
[00192] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLDK****KYAQEFV(Aib)WLEDEPS SGAPPPS-OH (SEQ ID NO: 153) также называемую в данном документе соединением В3.
[00193] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDK****SKYLD(Aib)KYAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 155) также называемую в данном документе соединением В4.
[00194] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLD(Aib)KYAQEFV(Aib)WLEDEPSSK*****APPPS-OH (SEQ ID NO: 156) также называемую в данном документе соединением В5.
[00195] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLD(Aib)KY AQEFVK*****WLEDEPSSGAPPPS-OH (SEQ ID NO: 157) также называемую в данном документе соединением В6.
[00196] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLDK*****KYAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 158) также называемую в данном документе соединением В7.
[00197] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDK*****SKYLD(Aib)KYAQEFV(Aib)WLEDEPS SGAPPPS-OH (SEQ ID NO: 159) также называемую в данном документе соединением В8.
[00198] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLD(Aib)KSAQEFV(Aib)WLEDEPSSK****APPPS-OH (SEQ ID NO: 160) также называемую в данном документе соединением В9.
[00199] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLD(Aib)KSAQEFVK****WLEDEPSSGAPPPS-OH (SEQ ID NO: 161) также называемую в данном документе соединением В10.
[00200] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLDK****KSAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 162) также называемую в данном документе соединением В11.
[00201] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDK****SKYLD(Aib)KSAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 163) также называемую в данном документе соединением В12.
[00202] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLD(Aib)KSAQEFV(Aib)WLEDEPSSK*****APPPS-OH (SEQ ID NO: 164) также называемую в данном документе соединением В13.
[00203] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLD(Aib)KSAQEFVK*****WLEDEPSSGAPPPS-OH (SEQ ID NO: 165) также называемую в данном документе соединением В14.
[00204] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLDK*****KSAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 166) также называемую в данном документе соединением В15.
[00205] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDK*****SKYLD(Aib)KS AQEFV(Aib)WLEDEPS SGAPPP S-OH (SEQ ID NO: 167) также называемую в данном документе соединением В16.
[00206] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность WSQGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSK****APPPS-OH (SEQ ID NO: 168) также называемую в данном документе соединением В17.
[00207] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность WSQGTFTSDYSKYLD(Aib)KRAQEFVK****WLEDEPSSGAPPPS-OH (SEQ ID NO: 169) также называемую в данном документе соединением В18.
[00208] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность WSQGTFTSDYSKYLDK****KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 170) также называемую в данном документе соединением В19.
[00209] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность WSQGTFTSDK****SKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 171) также называемую в данном документе соединением В20.
[00210] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность WSQGTFTSDYSKYLD(Aib)KRAQEFV(Aib)WLEDEPSSK*****APPPS-OH (SEQ ID NO: 172) также называемую в данном документе соединением В21.
[00211] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность WSQGTFTSDYSKYLD(Aib)KRAQEF VK*****WLEDEPSSGAPPPS-OH (SEQ ID NO: 173) также называемую в данном документе соединением В22.
[00212] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность WSQGTFTSDYSKYLDK*****KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 174) также называемую в данном документе соединением В23.
[00213] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность WSQGTFTSDK*****SKYLD(Aib)KRAQEFV(Aib)WLEDEPSSGAPPPS-OH (SEQ ID NO: 175) также называемую в данном документе соединением В24.
[00214] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLD(Aib)KRAQEFVIWLEDEPSSK****APPPS-OH (SEQ ID NO: 176) также называемую в данном документе соединением В25.
[00215] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLDK****KRAQEFVIWLEDEPSSGAPPPS-OH (SEQ ID NO: 177) также называемую в данном документе соединением В26.
[00216] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDK****SKYLD(Ab)KRAQEFVIWLEDEPSSGAPPPS-OH (SEQ ID NO: 178) также называемую в данном документе соединением В27.
[00217] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLD(Aib)KRAQK****FVIWLEDEPSSGAPPPS-OH (SEQ ID NO: 179) также называемую в данном документе соединением В28.
[00218] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLD(Aib)KRAQEFVIWLEDEPSSK*****APPPS-OH (SEQ ID NO: 180) также называемую в данном документе соединением В29.
[00219] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLD(Aib)KRAQK*****FVIWLEDEPSSGAPPPS-OH (SEQ ID NO: 181) также называемую в данном документе соединением В30.
[00220] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLDK*****KRAQEFVIWLEDEPSSGAPPPS-OH (SEQ ID NO: 182) также называемую в данном документе соединением В31.
[00221] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDK*****SKYLD(Aib)KRAQEFVIWLEDEPSSGAPPPS-OH (SEQ ID NO: 183) также называемую в данном документе соединением В32.
[00222] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSQGTFTSDYSKYLDAARAQEFVKWLEDEPKSK****SPPPS-NH2 (SEQ ID NO: 184) также называемую в данном документе соединением В33.
[0023] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSQGTFTSDYSKYLDAARAQEFVK****WLEDEPKSKSPPPS-NH2 (SEQ ID NO: 185) также называемую в данном документе соединением В34.
[00224] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSQGTFTSDYSKYLDK****ARAQEFVKWLEDEPKSKSPPPS-NH2 (SEQ ID NO: 186) также называемую в данном документе соединением В35.
[0025] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSQGTFTSDK****SKYLDAARAQEFVKWLEDEPKSKSPPPS-NH2 (SEQ ID NO: 187) также называемую в данном документе соединением В36.
[00226] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSQGTFTSDYSKYLDAARAQEFVKWLEDEPKSK*****SPPPS-NH2 (SEQ ID NO: 188) также называемую в данном документе соединением В37.
[00227] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSQGTFTSDYSKYLDAARAQEFVK*****WLEDEPKSKSPPPS-NH2 (SEQ ID NO: 189) также называемую в данном документе соединением В38.
[00228] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSQGTFTSDYSKYLDK*****ARAQEFVKWLEDEPKSKSPPPS-NH2 (SEQ ID NO: 190) также называемую в данном документе соединением В39.
[00229] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSQGTFTSDK*****SKYLDAARAQEFVKWLEDEPKSKSPPPS-NH2 (SEQ ID NO: 191) также называемую в данном документе соединением В40.
[00230] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLDSARAQEFVKWLEDEPSSK****APPPS-NH2 (SEQ ID NO: 192) также называемую в данном документе соединением В41.
[00231] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLDSARAQEFVK****WLEDEPSSGAPPPS-NH2 (SEQ ID NO: 193) также называемую в данном документе соединением В42.
[00232] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLDK****ARAQEFVKWLEDEPSSGAPPPS-NH2 (SEQ ID NO: 194) также называемую в данном документе соединением В43.
[00233] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDK****SKYLDSARAQEFVKWLEDEPSSGAPPPS-NH2 (SEQ ID NO; 195) также называемую в данном документе соединением В44.
[00234] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLDSARAQEFVKWLEDEPSSK*****APPPS-NH2 (SEQ ID NO: 196) также называемую в данном документе соединением В45.
[00235] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLDSARAQEFVK*****WLEDEPSSGAPPPS-NH2 (SEQ ID NO: 197) также называемую в данном документе соединением В46.
[00236] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDYSKYLDK*****ARAQEFVKWLEDEPSSGAPPPS-NH2 (SEQ ID NO: 198) также называемую в данном документе соединением В47.
[00237] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность YSHGTFTSDK*****SKYLDSARAQEFVKWLEDEPSSGAPPPS-NH2 (SEQ ID NO: 199) также называемую в данном документе соединением В48.
[00238] В приведенных выше вариантах осуществления каждая ε-аминогруппа остатка лизина, расположенная на указанном пептидный остатке (K****) в раскрытых соединениях, ковалентно связана с указанным карбонилом формулы II с образованием амида:
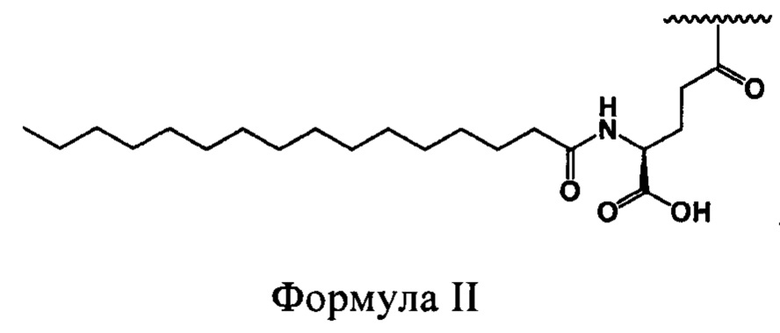
[00239] В приведенных выше вариантах осуществления каждая ε-аминогруппа остатка лизина, расположенная на указанном пептидный остатке (K*****) в раскрытых соединениях, ковалентно связана с указанным карбонилом формулы III с образованием амида:
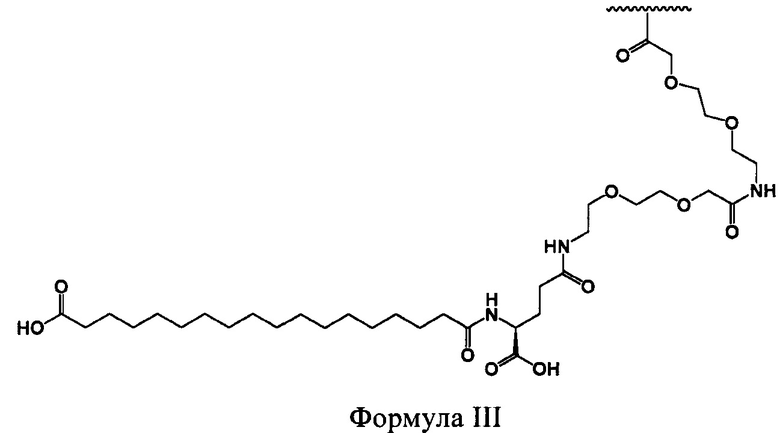
[00240] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных SEQ ID NO: 152-SEQ ID NO: 199.
[00241] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию выбран из группы, состоящей из соединений с В1 до В8.
[00242] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию выбран из группы, состоящей из соединений с В9 до В16.
[00243] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию выбран из группы, состоящей из соединений с В17 до В24.
[00244] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию выбран из группы, состоящей из соединений с В25 до В32.
[00245] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию выбран из группы, состоящей из соединений с В33 до В40.
[00246] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию выбран из группы, состоящей из соединений с В41 до В48.
[00247] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных с SEQ ID NO: 154, SEQ ID NO: 157, SEQ ID NO: 158, SEQ ID NO: 160, SEQ ID NO: 161, SEQ ID NO: 162, SEQ ID NO: 165, SEQ ID NO: 166, SEQ ID NO: 168, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 185, SEQ ID NO: 188, SEQ ID NO: 189, SEQ ID NO: 190 и SEQ ID NO: 192.
[00248] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных с SEQ ID NO: 160, SEQ ID NO: 165, и SEQ ID NO: 166.
[00249] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию выбран из группы, состоящей из соединений с соединения В1 по соединение В48.
[00250] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию выбран из группы, состоящей из соединения В3, соединения В6, соединения В7, соединения В9, соединения В10, соединения В11, соединения В14, соединения В15, соединения В17, соединения В21, соединения В22, соединения В34, соединения В37, соединения В38, соединения В39 и соединения В41.
[00251] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию выбран из группы, состоящей из соединения В9, соединения В14 и соединения В15.
[00252] В некоторых вариантах осуществления изобретения выделенный полипептид по раскрытию представляет собой соединение В9. В некоторых вариантах осуществления изобретения выделенный полипептид по раскрытию представляет собой соединение В14. В некоторых вариантах осуществления изобретения выделенный полипептид по раскрытию представляет собой соединение В15.
[00253] В некоторых вариантах осуществления выделенный полипептид по данному раскрытию содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей, представленных соединениями с соединения В1 по соединение В48.
2.0.2 Пептидные комбинации
[00254] В некоторых вариантах осуществления изобретения выделенный полипептид, являющийся аналогом глюкагона по раскрытию, который представляет собой агонист, селективный к рецептору глюкагона, скомбинирован со вторым веществом, выбранным из группы, состоящий из оксинтомодулина, эксенатида, производного эксенатида, аналога эксенатида, глюкагоноподобного пептида-1 (GLP-1), производного GLP-1 и аналога GLP-1. В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом.
[00255] В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналог глюкагона нековалентно связан с липофильным заместителем и спейсером в соответствии с описанием в данном документе.
[00256] В некоторых вариантах осуществления аналог глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналог глюкагона выбран из группы, состоящей из соединений А1-А105. В некоторых вариантах осуществления аналог глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналог глюкагона выбран из группы, состоящей из соединений А1, А2, A3, А4, А5 и А6. В некоторых вариантах осуществления аналог глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналогом глюкагона является соединение А1. В некоторых вариантах осуществления аналог глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналогом глюкагона является соединение А2. В некоторых вариантах осуществления аналог глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналогом глюкагона является соединение A3. В некоторых вариантах осуществления аналог глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналогом глюкагона является соединение А4. В некоторых вариантах осуществления аналог глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналогом глюкагона является соединение А5. В некоторых вариантах осуществления аналог глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналогом глюкагона является соединение А6.
[00257] В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналог глюкагона имеет по меньшей мере одну аминокислоту, ковалентно связанную с липофильным заместителем и спейсером в соответствии с описанием в данном документе. В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналог глюкагона имеет по меньшей мере один остаток лизина, который имеет ε-аминогруппу, которая ковалентно связана с липофильным заместителем и спейсером формулы II или III.
[00258] В некоторых вариантах осуществления аналог глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналог глюкагона выбран из группы, состоящей из соединений В1-В48. В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналог глюкагона выбран из группы, состоящей из аминокислотных последовательностей, представленной SEQ ID NO: 152-SEQ ID NO: 199.
[00259] В некоторых вариантах осуществления аналог глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналог глюкагона выбран из группы, состоящей из соединения В3, соединения В6, соединения В7, соединения В9, соединения В10, соединения В11, соединения В14, соединения В15, соединения В17, соединения В21, соединения В22, соединения В34, соединения В37, соединения В38, соединения В39 и соединения В41.
[00260] В некоторых вариантах осуществления аналог глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналог глюкагона выбран из группы, состоящей из соединения В9, соединения В14 и соединения В15.
[00261] В некоторых вариантах осуществления аналог глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналогом глюкагона является соединение В9. В некоторых вариантах осуществления аналог глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналогом глюкагона является соединение В14. В некоторых вариантах осуществления аналог глюкагона по раскрытию скомбинирован с эксенатидом, при этом аналогом глюкагона является соединение В15.
[00262] В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом при фиксированном соотношении аналога глюкагона к эксенатиду от 1000:1 до 1:1000. В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом при фиксированном соотношении аналога глюкагона к эксенатиду от 500:1 до 1:500. В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом при фиксированном соотношении аналога глюкагона к эксенатиду от 100:1 до 1:100. В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом при фиксированном соотношении аналога глюкагона к эксенатиду от 50:1 до 1:50. В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом при фиксированном соотношении аналога глюкагона к эксенатиду от 25:1 до 1:25. В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом при фиксированном соотношении аналога глюкагона к эксенатиду от 10:1 до 1:10. В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом при фиксированном соотношении аналога глюкагона к эксенатиду от 1:1 до 1:10. В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом при фиксированном соотношении аналога глюкагона к эксенатиду от 10:1 до 1:1. В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом при фиксированном соотношении аналога глюкагона к эксенатиду от 5:1 до 1:5. В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом при фиксированном соотношении аналога глюкагона к эксенатиду от 1:1 до 1:5. В некоторых вариантах осуществления изобретения любой из аналогов глюкагона по раскрытию скомбинирован с эксенатидом при фиксированном соотношении аналога глюкагона к эксенатиду от 5:1 до 1:1.
[00263] Настоящее изобретение также относится к способу лечения сахарного диабета типа 2 у субъекта, нуждающегося в лечении. Способ включает предоставление одного или более из выделенных полипептидов, являющихся селективными к рецептору глюкагона агонистами по данному раскрытию. В некоторых вариантах осуществления изобретения способ включает обеспечение непрерывной доставки выделенного полипептида, являющегося селективным к рецептору глюкагона агонистом, из осмотического устройства доставки, в котором по существу стабильная доставка выделенного полипептида, являющегося специфическим агонистом глюкагона, в терапевтической концентрации достигается в течение периода времени около 7 дней или менее после имплантации осмотического устройства доставки субъекту. По существу стабильная доставка выделенного полипептида, являющегося специфическим агонистом глюкагона, из осмотического устройства доставки является непрерывной в течение периода введения. Люди являются предпочтительными субъектами для применения настоящего изобретения на практике.
[00264] В некоторых вариантах осуществления настоящего изобретения период введения составляет, например, по меньшей мере около 3 месяцев, по меньшей мере от около 3 месяцев до около одного года, по меньшей мере от около 4 месяцев до около одного года, по меньшей мере от около 5 месяцев до около одного года, по меньшей мере от около 6 месяцев до около одного года, по меньшей мере от около 8 месяцев до около одного года, по меньшей мере от около 9 месяцев до около одного года, по меньшей мере от около 10 месяцев до около одного года, по меньшей мере от около одного года до около двух лет, по меньшей мере от около двух лет до около трех лет.
[00265] В некоторых вариантах осуществления настоящего изобретения по существу стабильная доставка выделенного полипептида, являющегося специфическим агонистом глюкагона в терапевтических концентрациях достигается в течение около 5 дней или менее после имплантации осмотического устройства доставки субъекту, в течение около 4 дней или менее после имплантации осмотического устройства доставки субъекту, в течение около 3 дней или менее после имплантации осмотического устройства доставки субъекту, в течение около 2 дней или менее после имплантации осмотического устройства доставки субъекту, или в течение около 1 дня или менее после имплантации осмотического устройства доставки субъекту. В предпочтительных вариантах осуществления настоящего изобретения по существу стабильная доставка выделенного полипептида, являющегося специфическим агонистом глюкагона, в терапевтических концентрациях достигается в течение около 2 дней или менее, более предпочтительно в пределах около 1 дня или менее после имплантации осмотического устройства доставки субъекту.
[00266] В других вариантах осуществления способы лечения по настоящему изобретению обеспечивают значительное снижение концентрации глюкозы в плазме натощак у субъекта после имплантации осмотического устройства доставки субъекту (по отношению к концентрации глюкозы в плазме натощак у субъекта до имплантации осмотического устройства доставки), которое достигается в течение около 7 дней или менее после имплантации осмотического устройства доставки субъекту в течение около 6 дней или менее после имплантации осмотического устройства доставки субъекту, в течение около 5 дней или менее после имплантации осмотического устройства доставки субъекту, в течение около 4 дней или менее после имплантации осмотического устройства доставки субъекту, в течение около 3 дней или менее после имплантации осмотического устройства доставки субъекту, в течение около 2 дней или менее после имплантации осмотического устройства доставки субъекту, или в течение около 1 дня или менее после имплантации осмотического устройства доставки субъекту. В предпочтительных вариантах осуществления настоящего изобретения, значительное снижение концентрации глюкозы в плазме натощак у субъекта после имплантации осмотического устройства доставки, по отношению к концентрации глюкозы в плазме натощак субъекта до имплантации, достигается в течение около 2 дней или менее, предпочтительно в течение около 1 дня или менее после имплантации осмотического устройства доставки субъекту, или, более предпочтительно, в пределах около 1 дня после имплантации осмотического устройства доставки субъекту. Значительное снижение глюкозы в плазме натощак, как правило, является статистически значимым, как показано путем применения соответствующего статистического теста или признано значимым для субъекта практикующим врачом. Значительное снижение глюкозы в плазме натощак по отношению к базовому уровню перед имплантацией, как правило, сохраняется в течение периода введения.
[00267] В других вариантах осуществления первого аспекта настоящего изобретения, способы лечения дополнительно включают возможность завершить непрерывную доставку полипептида, являющегося специфическим агонистом глюкагона таким образом, что концентрацию полипептида, являющегося специфическим агонистом глюкагона, по существу, невозможно обнаружить в образце крови субъекта в течение около 6 периодов полураспада полипептида, являющегося специфическим агонистом глюкагона или менее после прекращения непрерывной доставки, в течение около 5 периодов полураспада полипептида, являющегося специфическим агонистом глюкагона или менее после прекращения непрерывной доставки, в течение около 4 периодов полураспада полипептида, являющегося специфическим агонистом глюкагона или менее после прекращения непрерывной доставки или менее или в течение около 3 периодов полураспада полипептида, являющегося специфическим агонистом глюкагона или менее после прекращения непрерывной доставки. Полипептид, являющийся специфическим агонистом глюкагона, может быть обнаружен, например, с помощью RIA, хроматографическим способом, при анализе ECL, ИФА или IEMA. Прекращение непрерывной доставки может быть достигнуто, например, путем удаления у субъекта осмотического устройства доставки.
[00268] В родственных вариантах осуществления настоящего изобретения, способы лечения дополнительно включают возможность завершить непрерывную доставку полипептида, являющегося селективным к рецептору глюкагона агонистом, таким образом, что концентрация полипептида, по существу, невозможно обнаружить в пробе крови субъекта менее чем через около 72 часов после прекращения непрерывной доставки, через менее чем около 48 часов после прекращения непрерывной доставки, через менее чем около 24 часов после прекращения непрерывной доставки, через менее чем около 18 часов после прекращения непрерывной доставки, через менее чем около 14 часов после прекращения непрерывной доставка, через менее чем около 12 часов после прекращения непрерывной доставки, через менее чем около 6 часов после прекращения непрерывной доставки или через менее чем около 4 часа после прекращения непрерывной доставки. В предпочтительных вариантах осуществления полипептид, являющийся специфическим агонистом глюкагона, по существу, невозможно обнаружить в пробе крови субъекта через за менее чем около 24 часов после прекращения непрерывной доставки, через менее чем около 18 часов после прекращения непрерывной доставки или, более предпочтительно, через менее чем около 14 часов после прекращения непрерывной доставки.
[00269] В некоторых вариантах осуществления полипептид, являющийся селективным к рецептору глюкагона агонистом формулируются в виде суспензии. В некоторых вариантах осуществления, состав в виде суспензии содержит состав, содержащий частицы полипептида, являющегося селективным к рецептору глюкагона агонистом, и состав-носитель. В некоторых вариантах осуществления полипептид, являющийся селективным к рецептору глюкагона агонистом, включает выделенный полипептид по раскрытию, его пептидный аналог или его пептидное производное. В некоторых вариантах осуществления полипептид, являющийся селективным к рецептору глюкагона агонистом, включает аминокислотную последовательность, включающую аминокислотную последовательность SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, или SEQ ID NO: 137. В некоторых вариантах осуществления с полипептид, являющийся селективным к рецептору глюкагона агонистом, содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 4-139.
[00270] В вариантах осуществления всех аспектов настоящего изобретения, относящихся к способам лечения сахарного диабета типа 2, составы в виде суспензии для использования в способах могут, например, содержать состав из частиц, содержащих выделенный полипептид, являющийся селективным к рецептору глюкагона агонистом, и состав-носитель.
[00271] Резервуар осмотических устройств доставки может, например, содержать титан или титановый сплав.
[00272] В пятом аспекте, настоящее изобретение относится к способу лечения заболевания или состояния у субъекта, нуждающегося в лечении. Способ включает непрерывную доставку препарата из осмотического устройства доставки, в котором по существу стабильная доставка препарата в терапевтических концентрациях достигается в течение периода времени около 7 дней или менее после имплантации осмотического устройства доставки субъекту. По существу стабильная доставки препарата из осмотического устройства доставки непрерывна в течение периода введения по меньшей мере около 3 месяцев. Известен или может быть определен период полураспада у атипичного субъекта. Люди являются предпочтительными субъектами для применения настоящего изобретения на практике. Настоящее изобретение включает препарат, эффективное для лечения заболевания или состояния, а также осмотическое устройство доставки, содержащее препарат для применения в настоящих способах лечения заболевания или состояния у субъекта, нуждающегося в лечении. Преимущества настоящего изобретения включают смягчение токсичности препаратов, связанной с пиками, и ослабление субоптимальной лекарственной терапии, связанной с минимальными остаточными концентрациями.
[00273] В некоторых вариантах осуществления настоящего изобретения период введения составляет, например, по меньшей мере около 3 месяцев, по меньшей мере от около 3 месяцев до около одного года, по меньшей мере от около 4 месяцев до около одного года, по меньшей мере от около 5 месяцев до около одного года, по меньшей мере от около 6 месяцев до около одного года, по меньшей мере от около 8 месяцев до около одного года, по меньшей мере от около 9 месяцев до около одного года или по меньшей мере от около 10 месяцев до около одного года.
[00274] В некоторых вариантах осуществления этого аспекта настоящего изобретения, по существу стабильная доставка препаратов терапевтических концентрациях достигается в течение периода времени около 7 дней или менее после имплантации осмотического устройства доставки субъекту, около 5 дней или менее после имплантации осмотического устройства доставки субъекту, около 4 дней или менее после имплантации осмотического устройства доставки субъекту, около 3 дней или менее после имплантации осмотического устройства доставки субъекту, около 2 дней или менее после имплантации осмотического устройства доставки субъекту или около 1 дня или менее после имплантации осмотического устройства доставки субъекту.
[00275] В некоторых вариантах осуществления данного аспекта настоящего изобретения достижение по существу стабильной доставки препаратов терапевтических концентрациях после имплантации осмотического устройства доставки субъекту может потребоваться более длительный период времени, например, период около 2 недель или менее, или менее чем около 6 периодов полураспада препарата в субъекте после имплантации устройства.
[00276] Изобретение также обеспечивает способ содействия потере веса у субъекта, нуждающегося в этом, способ лечения избыточного веса или ожирения у субъекта, нуждающегося в этом и/или способ подавления аппетита у субъекта, нуждающегося в этом. Способ включает доставку выделенного полипептида, являющегося селективным к рецептору глюкагона агонистом. В некоторых вариантах осуществления выделенный полипептид, являющийся селективным к рецептору глюкагона агонистом, непрерывно высвобождается из осмотического устройства доставки, при этом по существу стабильная доставка выделенного полипептида, являющегося селективным к рецептору глюкагона агонистом, в терапевтической концентрации достигается в течение периода времени около 7 дней или менее после имплантации осмотического устройства доставки субъекту. По существу стабильная доставка выделенного полипептида, являющегося селективным к рецептору глюкагона агонистом, из осмотического устройства доставки непрерывна в течение периода введения. Люди являются предпочтительными субъектами для применения настоящего изобретения на практике. Настоящее изобретение включает в себя выделенный полипептид, являющийся селективным к рецептору глюкагона агонистом, а также осмотическое устройство доставки, содержащее выделенный полипептид, являющийся селективным к рецептору глюкагона агонистом, для использования в способах по настоящему изобретению у субъекта, нуждающегося в лечении. Субъект может иметь диабет 2 типа. Субъекту при необходимости может иметь базовый уровень HbAl с% от более чем 10,0%, т.е., может быть субъектом с высоким базовым уровнем (ВБУ). Субъект мог ранее не получать для лечения сахарного диабета 2 типа.
[00277] В некоторых вариантах осуществления настоящего изобретения период введения составляет, например, по меньшей мере около 3 месяцев, по меньшей мере от около 3 месяцев до около одного года, по меньшей мере от около 4 месяцев до около одного года, по меньшей мере от около 5 месяцев до около одного года, по меньшей мере от около 6 месяцев до около одного года, по меньшей мере от около 8 месяцев до около одного года, по меньшей мере от около 9 месяцев до около одного года или по меньшей мере от около 10 месяцев до около одного года, по меньшей мере от около одного года до около двух лет, или по меньшей мере от около двух лет до около трех лет.
[00278] В других вариантах осуществления способы лечения по настоящему изобретению обеспечивают значительное снижение концентрации глюкозы в плазме натощак у субъекта после имплантации осмотического устройства доставки субъекту (по отношению к концентрации глюкозы в плазме натощак у субъекта до имплантации осмотического устройства доставки), которое достигается в течение около 7 дней или менее после имплантации осмотического устройства доставки субъекту, в течение около 6 дней или менее после имплантации осмотического устройства доставки субъекту, в течение около 5 дней или менее после имплантации осмотического устройства доставки субъекту, в течение около 4 дней или менее после имплантации осмотического устройства доставки субъекту, в течение около 3 дней или менее после имплантации осмотического устройства доставки субъекту, в течение около 2 дней или менее после имплантации осмотического устройства доставки субъекту, или в течение около 1 дня или менее после имплантации осмотического устройства доставки субъекту. В предпочтительных вариантах осуществления настоящего изобретения, значительное снижение концентрации глюкозы в плазме натощак у субъекта после имплантации осмотического устройства доставки, по отношению к концентрации глюкозы в плазме натощак субъекта до имплантации, достигается в течение около 2 дней или менее, предпочтительно в течение около 1 дня или менее после имплантации осмотического устройства доставки субъекту, или, более предпочтительно, в пределах около 1 дня после имплантации осмотического устройства доставки субъекту. Значительное снижение глюкозы в плазме натощак, как правило, является статистически значимым, как показано путем применения соответствующего статистического теста или признано значимым для субъекта практикующим врачом. Значительное снижение глюкозы в плазме натощак по отношению к базовому уровню перед имплантацией, как правило, сохраняется в течение периода введения.
[00279] В вариантах осуществления всех аспектов настоящего изобретения, относящегося к способам лечения заболевания или состояния у субъекта, в качестве примера осмотическое устройство доставки включает в себя следующее: непроницаемый резервуар, содержащий внутреннюю и внешнюю поверхности и первый и второй открытые концы; полупроницаемую мембрану, герметично прикрепленную на первом открытом конце резервуара; осмотический двигатель внутри резервуара, прилегающей к полупроницаемой мембране; поршень, примыкающий к осмотическому двигателю, при этом поршень образует подвижное уплотнение с внутренней поверхностью резервуара, поршень делит резервуар на первую камеру и вторую камеру, первая камера содержит осмотический двигатель; препарат или состав в виде суспензии, содержащий препарат, при этом вторая камера содержит препарат или состав в виде суспензии, и препарат или состав в виде суспензии находятся в жидкой форме; и замедлитель диффузии вставлен во второй открытый конец резервуара, замедлитель диффузии примыкает к составу в виде суспензии. В предпочтительных вариантах воплощения резервуар содержит титан или титановый сплав.
[00280] В вариантах осуществления всех аспектов настоящего изобретения, относящегося к способам лечения заболевания или состояния у субъекта, препарат может содержать препарат и состав-носитель. В качестве альтернативы, в способах используются препараты в виде суспензии, они могут, например, включать в себя состав из частиц, содержащий частицы препарата и состав-носитель. Составы-носители для использования в составе в виде суспензии по настоящему изобретению, могут, например, содержать растворитель и полимер.
[00281] Резервуар осмотических устройств доставки может, например, содержать титан или титановый сплав.
[00282] В вариантах осуществления всех аспектов настоящего изобретения имплантированное осмотическое устройство доставки может быть использовано для обеспечения подкожной доставки.
[00283] В вариантах осуществления всех аспектов настоящего изобретения непрерывная доставка может, например, контролируемой непрерывной доставкой нулевого порядка.
[00284] Любой из указанных выше аспектов и вариантов осуществления может быть объединен с любым другим аспектом или вариантом осуществления в соответствии с описанием в данном документе.
3.0.0 Составы и композиции
[00285] Препараты, предназначенные для использования в практике настоящего изобретения, как правило, равномерно суспендируют, растворяют или диспергируют в носителе для суспензии для формирования состава в виде суспензии.
[00286] Выделенные полипептиды по раскрытию (также называемые в данном описании «активные соединения») и их производные, фрагменты, аналоги и гомологи, могут быть включены в фармацевтические композиции, подходящие для введения. Такие композиции обычно содержат слитый белок и фармацевтически приемлемый носитель. Используемый в данном описании, термин «фармацевтически приемлемый носитель» предназначен для включения любых и всех растворителей, дисперсионных сред, покрытий, антибактериальных и противогрибковых средств, изотонических и задерживающие абсорбцию средств и т.п., совместимых с фармацевтическим введением. Подходящие носители описаны в последнем издании Remington Pharmaceutical Sciences, стандартный справочный текст в данной области, который включен в настоящее описание посредством ссылки. Предпочтительные примеры таких носителей или разбавителей включают, но не ограничиваются ими, воду, солевой раствор, растворы Рингера, раствор декстрозы и 5% сывороточный альбумин человека. Также могут быть использованы липосомы и неводные носители, такие как нелетучие масла. Применение таких сред и средств в отношении фармацевтически активных веществ хорошо известно в данной области техники. За исключением случаев, когда какие-либо традиционные среды или вещества являются несовместимыми с активным соединением, предусматривается их применение в композициях. Также в композиции могут быть включены дополнительные активные соединения.
[00287] Фармацевтическая композиция по настоящему изобретению изготовлена совместимой с предполагаемым путем ее введения. Примеры путей введения включают парентеральное, например, внутривенное, внутрикожное, субдермальное, подкожное, пероральное (например, ингаляционное), трансдермальное (т.е., местное), через слизистую оболочку, ректальное или их комбинации. В некоторых вариантах осуществления фармацевтическая композиция или выделенный полипептид по раскрытию изготавливаются для введения местным путем. В некоторых вариантах осуществления фармацевтическая композиция или выделенный полипептид по раскрытию изготавливается для введения путем ингаляции. В некоторых вариантах осуществления фармацевтическая композиция изготавливается для введения с помощью устройства или другого подходящего механизма доставки, подходящего для субдермальной или подкожной имплантации и доставляющего фармацевтическую композицию, подкожно. В некоторых вариантах осуществления фармацевтическая композиция изготовлена для введения с помощью имплантируемого устройства, которое подходит для субдермальной или подкожной имплантации и доставляет фармацевтическую композицию подкожно. В некоторых вариантах осуществления фармацевтической композиция изготовлена для введения с помощью осмотического устройства доставки, например, имплантируемого осмотического устройства доставки, которое подходит для субдермального или подкожного размещения или другой имплантации и доставляет фармацевтическую композицию подкожно. Растворы или суспензии, используемые для парентерального применение, внутрикожного применение, субдермального применения, подкожного применения или их комбинации могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физиологический раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие средства, такие как этилендиаминтетрауксусная кислота (ЭДТУ); буферы, такие как ацетаты, цитраты или фосфаты, и средства для регулировки тоничности, такие как хлорид натрия или декстроза. РН можно регулировать с помощью кислот или оснований, таких как соляная кислота или гидроксид натрия. Препарат для парентерального применения может быть заключен в ампулы, одноразовые шприцы или сосуды для нескольких доз из стекла или пластмассы.
[00288] Фармацевтические композиции, подходящие для применения в виде инъекций, включают стерильные водные растворы (в случае водорастворимости) или дисперсии и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсий для немедленного приема. Для внутривенного введения подходящие носители включают физиологический солевой раствор, бактериостатическую воду, Cremophor EL™ (BASF, Parsippany, NJ) или фосфатно-солевой буфер (ФСБ). Во всех случаях композиция должна быть стерильной и должна быть жидкой до такой степени, что она должна легко выходить из шприца. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.д.) и их подходящие смеси. Надлежащую текучесть можно поддерживать, например, путем применения материалов для покрытия, таких как лецитин, путем поддержания необходимого размера частиц в случае дисперсий и путем применения поверхностно-активных веществ. Предупреждение действия микроорганизмов можно выполнять посредством различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и т.п. Во многих случаях в композицию предпочтительно включать изотонические вещества, например, сахара, полиспирты, такие как маннит, сорбит, или хлорид натрия. Длительное всасывание инъекционных композиций можно обеспечить путем включения в композицию вещества, которое замедляет всасывание, например, моностеарата алюминия и желатина.
[00289] Стерильные инъекционные растворы можно готовить путем включения активного соединения в необходимом количестве в подходящий растворитель с одним ингредиентом или комбинацией ингредиентов, перечисленных выше, при необходимости, с последующей стерилизацией фильтрацией. Как правило, дисперсии получают путем введения активного соединения в стерильный носитель, который содержит основную дисперсионную среду и требуемые другие ингредиенты из перечисленных выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов способами приготовления являются вакуумная сушка и сублимационная сушка, которые приводят к получению порошка активного ингредиента плюс любой дополнительный активный ингредиент из его ранее стерильно-профильтрованного раствора.
[00290] Пероральные композиции обычно включают в себя инертный разбавитель или съедобный носитель. Они могут быть заключены в желатиновые капсулы или спрессованы в таблетки. Для целей перорального терапевтического введения активное соединение может быть объединено с эксципиентами и использовано в форме таблеток, пастилок или капсул. Пероральные композиции также могут быть получены с использованием жидкости-носителя для использования в качестве жидкости для полоскания рта, при этом соединение в жидком носителе применяют перорально, полоскают им рот и выплевывают или проглатывают. Фармацевтически совместимые связывающие вещества и/или адъювантные материалы могут быть включены в качестве части композиции. Таблетки, пилюли, капсулы, пастилки и тому подобное могут содержать любые из следующих ингредиентов или соединений подобного рода: связующее вещество, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; наполнитель, такой как крахмал или лактоза, дезинтегрирующее вещество, такое как альгиновая кислота, Primogel или кукурузный крахмал; смазывающее вещество, такое как стеарат магния или Sterotes; скользящее вещество, такое как коллоидный диоксид кремния; подслащивающее вещество, такое как сахароза или сахарин; или вкусовое вещество, такое как мята перечная, метилсалицилат или апельсиновый ароматизатор.
[00291] Для введения путем ингаляции соединения доставляются в форме аэрозольного спрея из находящегося под давлением контейнера или дозатора, который содержит подходящий пропеллент, например, газ, такой как диоксид углерода, или из распылителя.
[00292] Системное введение также может быть выполнено через слизистую или через кожу. Для введения через слизистую или трансдермального введения в составе могут использоваться проникающие вещества, подходящие для барьера, через который необходимо проникнуть. Такие смачивающие вещества обычно известны в данной области техники, и включают в себя, например, вещества для введения через слизистую, детергенты, соли желчных кислот и производные фусидовой кислоты. Введение через слизистую может быть осуществлено за счет использования назальных спреев или суппозиториев. Для трансдермального введения активные соединения изготавливают в виде мазей, бальзамов, гелей или кремов, как в целом известно в данной области техники.
[00293] Соединения также могут быть приготовлены в форме суппозиториев (например, с обычными основами для суппозиториев, таких как масло какао и другие глицериды) или клизм с удержанием для ректальной доставки.
[00294] В одном варианте осуществления изобретения активные соединения готовят с носителями, которые будут защищать соединение от быстрого выведения из организма, например, в качестве композиции с контролируемым высвобождением, в том числе имплантатов и микроинкапсулированных систем доставки. Можно использовать биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры и полимолочная кислота. Способы получения таких составов будут очевидны специалистам в данной области техники. Такие материалы также могут быть получены коммерчески от Alza Corporation и Nova Pharmaceuticals, Inc., липосомные суспензии также могут быть использованы в качестве фармацевтически приемлемых носителей. Их можно получить в соответствии со способами, известными специалистам в данной области техники, например, как описано в патенте США №4,522,811.
[00295] В частности, может быть выгодным приготовление композиций для перорального или парентерального введения в единичной дозированной форме для удобства введения и однородности дозировки. В контексте данного документа единичная дозированная форма относится к физически дискретным единицам, подходящим в качестве единичных дозировок для подлежащего лечению субъекта; каждая единица содержит предопределенное количество активного соединения, рассчитанное так, чтобы оказывать необходимое терапевтическое действие, в сочетании с необходимым фармацевтическим носителем. Спецификации для единичных дозированных форм согласно изобретению обусловлены и напрямую зависят от уникальных характеристик активного соединения и конкретного достигаемого терапевтического действия, и ограничений, свойственных области техники составления соединений, например, активного соединения для лечения индивидов.
[00296] Фармацевтические композиции могут быть включены в контейнер, упаковку или диспенсер вместе с инструкцией по применению.
3.1.0 Составы из частиц препарата
[00297] В одном аспекте настоящее изобретение относится к составу из частиц препарата для фармацевтического применения. Состав из частиц, как правило, содержит препарат и включает в себя один или более стабилизирующих компонентов (также называемых в данном документе «вспомогательными веществами»). Примеры стабилизирующих компонентов включают, но не ограничиваются ими, углеводы, антиоксиданты, аминокислоты, буферы, неорганические соединения, а также поверхностно-активные вещества.
[00298] В любом из вариантов осуществления изобретения состав из частиц может содержать от около 50% масс до около 90% масс. препарата, от около 50% масс. до около 85% масс. препарата, от около 55% масс. до % препарата около 90 мас, от около 60% масс до около 90% масс. препарата, от около 65% масс. до около 85% масс. препарата, от около 65% масс. до около 90% масс. препарата, от около 70% масс. до около 90% масс. препарата, от около 70% масс. до около 85% масс. препарата, от около 70% масс. до около 80% масс. препарата или от около 70% масс. до около 75% масс. препарата.
[00299] В любом из вариантов осуществления состав из частиц содержит препарат, как описано выше, и один или более из стабилизаторов. Эти стабилизаторы могут представлять собой, например, углевод, антиоксидант, аминокислоту, буфер, неорганическое соединение или поверхностно-активное вещество. Количества стабилизаторов в составе из частиц могут быть определены экспериментально на основе активности стабилизаторов и желаемых характеристик композиции в соответствии с идеей настоящего описания.
[00300] Как правило, количество углеводов в препарате определяется проблемами агрегации. В общем, количество углеводов не должно быть слишком высоким, чтобы избежать стимулирования роста кристаллов в присутствии воды из-за избытка углеводов, не связанных с препаратом.
[00301] Как правило, количество антиоксиданта в композиции определяется проблемами окисления, в то время как количество аминокислот в препарате определяются проблемами окисления и/или формуемостью частиц во время сушки посредством распыления.
[00302] Как правило, количество буфера в композиции определяется проблемами предварительной обработки, проблемами устойчивости и деформируемостью частиц во время сушки посредством распыления. Буфер может потребоваться для стабилизации препарата в процессе обработки, например, для приготовления раствора и сушки посредством распыления, когда все стабилизаторы солюбилизированы.
[00303] Примерами углеводов, которые могут быть включены в состав из частиц, включают в себя, но не ограничиваются ими, моносахариды (например, фруктоза, мальтоза, галактоза, глюкоза, D-манноза и сорбоза), дисахариды (например, лактоза, сахароза, трегалоза и целлобиоза), полисахариды (например, раффмоза, мелезитоза, мальтодекстрины, декстраны и крахмалы) и полиолы (ациклические полиолы, например, маннит, ксилит, мальтит, лактит, ксилит-сорбит, пиранозил сорбит и миоинозит). Подходящие углеводы включают дисахариды и/или нередуцирующие сахара, такие как сахароза, трегалоза и раффмоза.
[00304] Примеры антиоксидантов, которые могут быть включены в состав из частиц, включают в себя, но не ограничиваются ими, метионин, аскорбиновую кислоту, тиосульфат натрия, каталазу, платину, этилендиаминтетрауксусную кислоту (ЭДТУ), лимонную кислоту, цистеин, тиоглицерин, тиогликолевую кислоту, тиосорбит, бутилгидроксианизол, бутилгидрокситолуол и пропилгаллат. Кроме того, аминокислоты, которые легко окисляются, могут быть использованы в качестве антиоксидантов, например, цистеин, метионин и триптофан.
[00305] Примеры аминокислот, которые могут быть включены в состав из частиц, включают в себя, но не ограничиваются ими, аргинин, метионин, глицин, гистидин, аланин, L-лейцин, глутаминовую кислоту, изолейцин, L-треонин, 2-фениламин, валин, норвалин, пролин, фенилаланин, триптофан, серии, аспарагин, цистеин, тирозин, лизин и норлейцин. Подходящие аминокислоты включают в себя те, которые легко окисляются, например, цистеин, метионин и триптофан.
[00306] Примеры буферов, которые могут быть включены в состав из частиц включают в себя, но не ограничиваются ими, цитрат, гистидин, сукцинат, фосфат, малеат, ТРИС, ацетат, углеводный буфер и gly-gly. Подходящие буфера включают цитрат, гистидин, сукцинат и ТРИС.
[00307] Примеры неорганических соединений, которые могут быть включены в состав из частиц включают в себя, но не ограничиваются ими, NaCl, Na2SO4, NaHCO3, KCl, KH2PO4, CaCl2 и MgCl2.
[00308] Кроме того, состав из частиц может включать другие стабилизаторы/вспомогательные вещества, такие как поверхностно-активные вещества и соли. Примеры поверхностно-активных веществ включают, но не ограничиваются ими, полисорбат 20, полисорбат 80, PLURONIC® (фирма BASF Corporation, Mount Olive, Нью-Джерси) F68, и додецилсульфат натрия (ДСН). Примеры солей включают, но не ограничиваются ими, хлорид натрия, хлорид кальция и хлорид магния.
3.1.1 Примеры препаратов
[00309] Составы из частиц препарата содержат препарат. Препарат может быть любым физиологически или фармакологически активным веществом, в частности, из тех, которые, как известно, могут быть доставлены в организм человека или животного.
[00310] Подходящие препараты включают, но не ограничиваются ими: пептиды, белки, полипептиды или синтетические аналоги данных видов, а также их смеси.
[00311] В одном варианте осуществления предпочтительные препараты включают макромолекулы. Такие макромолекулы включают в себя, но не ограничиваются ими, фармакологически активные пептиды, белки или полипептиды. Многочисленные пептиды, белки или полипептиды, которые являются полезными в практике настоящего изобретения, описаны в данном документе. В дополнение к описанным пептидам, белкам или полипептидам, описанным, модификации таких пептидов, белков или полипептидов также известны специалисту в данной области техники и могут быть использованы в практике настоящего изобретения в соответствии с представленным в данном документе руководством. Такие модификации включают, но не ограничиваются ими, аналоги аминокислот, миметики аминокислот, аналоги полипептидов или производные полипептидов. Кроме того, препараты, описанные в данном документе, могут быть изготовлены или введены по отдельности или в комбинации (например, с использованием смесей препаратов или нескольких устройств; публикация патента США №2009/0202608).
[00312] Некоторые варианты осуществления настоящего изобретения включают в себя применение полипептидов SEQ ID NO: 4-136, 138, 139 и 143-149.
[00313] Некоторые варианты осуществления настоящего изобретения включают в себя применение полипептида, являющегося селективным к рецептору глюкагона агонистом в сочетании со вторым полипептидом, таким как, в порядке не ограничивающего примера, инсулинотропные пептидамы, пептидные гормоны, например, миметики глюкагона и инкретина (например, GLP-1 и эксенатид), а также их пептидные аналоги и производные пептидов; PYY (также известный как пептид YY, тирозин-тирозин пептид), а также его пептидные аналоги и производные пептидов, например, PYY (3-36); оксинтомодулин, а также их пептидные аналоги и пептидные производные); и желудочный ингибирующий пептид (GIP), а также его пептидные аналоги и пептидные производные.
[00314] GLP-1, в том числе три формы пептида, GLP-1 (1-37), GLP-1 (7-37) и GLP-1 (7-36) амид, а также пептидные аналоги GLP-1, как было показано, стимулируют секрецию инсулина (т.е., являются инсулинотропными), который индуцирует поглощение глюкозы клетками и приводит к сокращению концентрации глюкозы в сыворотке крови (см., например, Mojsov, S., Int. J. Peptide Protein Research, 40:333-343 (1992)).
[00315] Многочисленные GLP-1, пептидные производные и пептидные аналоги, демонстрирующие инсулинотропное действие, известны в данной области техники (см, например, патенты США. №№5,118,666; 5,120,712; 5,512,549; 5,545,618; 5,574,008; 5,574,008; 5,614,492; 5,958,909; 6,191,102; 6,268,343; 6,329,336; 6,451,974; 6,458,924; 6,514,500; 6,593,295; 6,703,359; 6,706,689; 6,720,407; 6,821,949; 6,849,708; 6,849,714; 6,887,470; 6,887,849; 6,903,186; 7,022,674; 7,041,646; 7,084,243; 7,101,843; 7,138,486; 7,141,547; 7,144,863 и 7,199,217), а также клинические исследования (например, таспоглутид и альбиглутид). Одним из примеров пептидного производного GLP-1, который может быть использован в практике настоящего изобретения, является препарат Виктоза® (Novo Nordisk A/S, Bagsvaerd D K) (лираглутид; патенты США №№6,268,343, 6,458,924 и 7,235,627). Вводимый раз в день инъекционный препарат Виктоза® (лираглутид) является коммерчески доступным в соединенных Штатах, Европе и Японии. Для простоты ссылки, семейство пептидов GLP-1, пептидные производные GLP-1 и пептидные аналоги GLP-1, обладающие инсулинотропной активностью, называют общим термином «GLP-1».
[00316] Молекула эксенатида имеет аминокислотную последовательность эксендина-4 (Kolterman О.G., et al., J. Clin. Endocrinol. Metab. 88 (7): 3082-9 (2003)) и ее получают путем химического синтеза или рекомбинантной экспрессии. Вводимый дважды в день инъекционный эксенатид коммерчески доступен в соединенных Штатах и Европе и продается под торговым названием Баетта® (Amylin Pharmaceuticals, Inc., San Diego, Calif.). Эксендин-3 и эксендин-4 известны в данной области техники и первоначально были выделены из представителей рода Heloderma (Eng, J., et al., J. Biol. Chem., 265:20259-62 (1990); Eng., J., et al., J. Biol. Chem, 267:7402-05 (1992)). Было предложено использование эксендина-3 и эксендина-4 для лечения сахарного диабета 2 типа и профилактики гипергликемии (см., например, патент США. №5,424,286). Многочисленные пептидные производные и пептидные аналоги эксенатида (включая, например, агонисты эксендина-4), известны в данной области техники (см., например, патенты США. №№5,424,286; 6,268,343; 6,329,336; 6,506,724; 6,514,500; 6,528,486; 6,593,295; 6,703,359; 6,706,689; 6,767,887; 6,821,949; 6,849,714; 6,858,576; 6,872,700; 6,887,470; 6,887,849; 6,924,264; 6,956,026; 6,989,366; 7,022,674; 7,041,646; 7,115,569; 7,138,375; 7,141,547; 7,153,825 и 7,157,555). Одним из примеров производного эксенатида, применяемого в практике настоящего изобретения, является ликсисенатид (также известный как ZP10, AVE0010) (см., например, патент США. №6,528,486), который проходит клинические испытания. Для простоты указания ссылки, семейство пептидов эксенатида (например, включая эксендин-3, эксендин-4 и эксендин-4-амид), пептидные производные эксенатида и пептидные аналоги эксенатид упоминаются под общим названием «эксенатид».
[00317] Пептид YY (PYY) представляет собой амид пептида, состоящий из 36 аминокислотных остатков. PYY подавляет моторику кишечника и кровоток (Laburthe, М., Trends Endocrinol Metab. 1(3): 168-74 (1990), опосредует кишечную секрецию (Сох, Н.М, et al., Br J Pharmacol 101(2):247-52 (1990); Playford, R.J., et al., Lancet 335(8705): 1555-7 (1990)), а также стимулировать чистое поглощение (MacFayden, R.J., et al., Neuropeptides 7(3):219-27 (1986)). Были идентифицированы два основных варианта in vivo, PYY(1-36) и PYY(3-36) (например, Eberlein, G.A., et al., Peptides 10(4), 797-803 (1989)). Последовательность PYY, а также пептидные аналоги и пептидные производные, известны в данной области техники (например, патенты США. №№5,574,010 и 5,552,520).
[00318] Оксинтомодулин является естественным пептидным гормоном, состоящим из 37 аминокислот, который содержится в толстой кишке, и, как было обнаружено, способен подавить аппетит и способствуют потере веса (Wynne K, et al., Int J Obes (Lond) 30(12): 1729-36(2006)). Последовательность оксинтомодулина, а также его пептидных аналогов и пептидных производных, известны в данной области (например, Bataille D, et al., Peptides 2 (Suppl 2):41-44 (1981); и патентные публикации США №№2005/0070469 и 2006/0094652).
[00319] Желудочный ингибиторный пептид (GIP) представляет собой инсулинотропный пептидный гормон (Efendic, S., et al., Horm Metab Res. 36: 742-6 (2004)) и секретируется слизистой оболочкой двенадцатиперстной кишки и тощей кишки в ответ на поглощенный жир и углеводы, которые стимулируют поджелудочную железу секретировать инсулин. GIP циркулирует в качестве биологически активного пептида, состоящего из 42 аминокислот.GIP также известен как глюкозо-зависимый инсулинотропный белок. GIP является регуляторным пептидом желудочно-кишечного тракта, состоящим из 42 аминокислот, который стимулирует секрецию инсулина панкреатическими бета-клетками в присутствии глюкозы (Tseng, С., et al., PNAS 90:1992-1996 (1993)). Последовательность GIP, а также его пептидные аналоги и пептидные производные известны в данной области (e.g., Meier J. iDiabetes Metab Res Rev. 21 (2):91 - 117 (2005) и Efendic S., Horm Metab Res. 36(11-12):742-6 (2004)).
[00320] Глюкагон является пептидным гормоном, который вырабатывается альфа-клетками поджелудочной железы, который повышает концентрацию глюкозы в крови. Его действие противоположно таковому инсулина, который снижает концентрацию глюкозы. Поджелудочная железа вырабатывает глюкагон, когда концентрация глюкозы в крови падает слишком низко. Глюкагон стимулирует печень преобразовывать запасенный гликоген в глюкозу, которая поступает в кровоток. Уровни глюкозы в крови стимулируют высвобождение инсулина. Инсулин позволяет глюкозе проникать внутрь и использоваться инсулин-зависимыми тканями. Таким образом, глюкагон и инсулин являются частью системы обратной связи, которая удерживает уровень глюкозы в крови на стабильный уровне.
[00321] Глюкагон-подобный пептид-2 (GLP-2) представляет собой пептид, состоящий из 33 аминокислот с последовательностью HADGSFSDEMNTILDNLAARDFINWLIQTKITD (SEQ ID NO: 200), находящийся в организме человека. GLP-2 создается путем специфического посттрансляционного протеолитического расщепления проглюкагона в процессе, который также высвобождает родственный глюкагон-подобный пептид-1 (GLP-1). GLP-2 вырабатывается эндокринными L-клетками кишечника и различными нейронами центральной нервной системы. Кишечные GLP-2, секретируются совместно с GLP-1 при приеме внутрь питательных веществ. При введении извне человеку и грызунам GLP-2 приводит к ряду эффектов, включая кишечный рост, улучшение функции кишечника, нейропротективное действие и снижение потери костной массы. GLP-2 может оказывать эндокринное воздействие и связывать кишечный рост и обмен веществ с потреблением питательных веществ.
[00322] Примеры полураспада некоторых пептидов являются следующими: эксенатид - около 2,5 часа; GLP-1 - около 2 минут; GIP - около 5 минут; PYY - около 8 минут; глюкагон - около 6 минут; оксинтомодулин - около 6 минут; и GLP-2 - около 6 минут.
[00323] Такие препараты также могут быть выполнены в различных формах, в том числе, но не ограничиваясь этим, следующее: незаряженные молекулы; компоненты молекулярных комплексов и их фармакологически приемлемые соли, такие как гидрохлорид, гидробромид, сульфат, лаураты, пальмитаты, фосфат, нитрат, борат, ацетат, малеат, тартрат, олеаты или салицилаты. Для кислотных препаратов, солей металлов, аминов или органических катионов, например, может быть использован четвертичный аммоний. Кроме того, простые производные лекарства, такие как сложные эфиры, простые эфиры, амиды и т.п., которые имеют пригодные для целей настоящего изобретения характеристики растворимости, также могут быть использованы в данном документе.
[00324] Вышеуказанные препараты и другие препараты, известные специалистам в данной области, полезны в способах лечения различных состояний, включая, но не ограничиваясь ими, следующие: хронические боли, гемофилия и другие расстройства крови, эндокринные расстройства, нарушения обмена веществ, неалкогольная жировая болезнь печени (НЖБП), неалкогольный стеатогепатит (НАСГ), болезнь Альцгеймера, сердечно-сосудистые заболевания (например, сердечная недостаточность, атеросклероз и острый коронарный синдром), ревматологические расстройства, диабет (включая сахарный диабет 1 типа, сахарный диабет 2 типа, вызванный вирусом иммунодефицита человека, латентный аутоиммунный диабет у взрослых и вызванный стероидами диабет), нечувствительность к развитию гипогликемии, рестриктивный легочный процесс, хроническая обструктивная болезнь легких, липоатрофия, метаболический синдром, лейкоз, гепатит, почечная недостаточность, инфекционные заболевания (включая бактериальную инфекцию, вирусную инфекцию (например, заражение вирусом иммунодефицита человека, вирусом гепатита С, вирусом гепатита В, вирусом желтой лихорадки, вирусом Западного Нила, вирусом денге, вирусом Марбурга и вирусом Эбола) и паразитарную инфекцию), наследственные заболевания (такие как дефицит цереброзидазы и дефицит аденозиндезаминазы), гипертония, септический шок, аутоиммунные заболевания (например, болезнь Грейвса, системная красная волчанка, рассеянный склероз, ревматоидный артрит), шок и расстройства, вызванные истощением, кистозный фиброз, непереносимость лактозы, болезнь Крона, воспалительное заболевание кишечника, рак желудочно-кишечного тракта (включая рак толстой кишки и рак прямой кишки), рак молочной железы, лейкоз, рак легких, рак мочевого пузыря, рак почки, неходжкинская лимфома, рак поджелудочной железы, рак щитовидной железы, рак эндометрия и другие виды рака. Кроме того, некоторые из перечисленных выше средств являются полезными для лечения инфекционных заболеваний, требующих длительного лечения, включая, но не ограничиваясь ими, туберкулез, малярию, лейшманиоз, трипаносомоз (сонная болезнь и болезнь Шагаса) и заражения паразитическими червями.
[00325] Количество препарата в составах из частиц препарата является количество, необходимое для доставки терапевтически эффективного количества средства для достижения желаемого терапевтического результата у субъекта, которому доставляется препарат. На практике это будет варьироваться в зависимости от таких переменных, как, например, конкретное средство, тяжесть состояния и желаемый терапевтический эффект. Полезные средства и их количества единичных доз известно в существующем уровне техники: Goodman & Gilman's The Pharmacological Basis of Therapeutics, 11th Ed., (2005), McGraw Hill; Remington's Pharmaceutical Sciences, 18th Ed., (1995), Mack Publishing Co.; and Martin's Physical Pharmacy and Pharmaceutical Sciences, 1.00 edition (2005), Lippincott Williams & Wilkins. Кроме того, высококонцентрированные частицы препарата описаны в патентной публикации США №2010/0092566. Как правило, для осмотической системы доставки, объем камеры, содержащей препарат, составляет от около 100 мкл до около 1000 мкл, более предпочтительно от около 140 мкл до около 200 мкл. В одном варианте осуществления изобретения объем камеры, содержащей препарат, составляет около 150 мкл.
[00326] Составы из частиц препарата по изобретению предпочтительно являются химически и физически стабильными в течение по меньшей мере 1 месяца, предпочтительно по меньшей мере 3 месяцев, более предпочтительно по меньшей мере 6 месяцев, более предпочтительно по меньшей мере 12 месяцев при температуре доставки. Температура доставки, как правило, представляет собой нормальную температуру человеческого тела, например, около 37°С, или немного выше, например, около 40°С Кроме того, составы из частиц препарата по настоящему изобретению предпочтительно являются химически и физически стабильными в течение по меньшей мере 3 месяцев, предпочтительно по меньшей мере 6 месяцев, более предпочтительно по меньшей мере 12 месяцев при температуре хранения. Примеры температур хранения включают в себя температуру охлаждения, например, около 5°С.; или комнатную температуру, например, около 25°С.
[00327] Состав из частиц препарата можно считать химически стабильным, если менее чем около 25%; предпочтительно менее чем около 20%, более предпочтительно менее чем около 15%, более предпочтительно менее чем около 10% и более предпочтительно менее чем около 5% продуктов распада частиц препарата образуется около через 3 месяца, предпочтительно через около 6 месяцев, предпочтительно через около 12 месяцев при температуре доставки и через около 6 месяцев, через около 12 месяцев, и, предпочтительно, через около 24 месяцев при температуре хранения.
[00328] Состав из частиц препарата можно считать физически стабильным, если менее чем около 10%, предпочтительно менее чем около 5%, более предпочтительно менее чем около 3%, более предпочтительно менее 1% агрегатов препарата образуется около через 3 месяца, предпочтительно через около 6 месяцев при температуре доставки и около 6 месяцев, предпочтительно около 12 месяцев при температуре хранения.
[00329] Когда препарат в составе из частиц препарата представляет собой белок, белковый раствор выдерживают в замороженном состоянии и лиофилизируют или сушат распылением до твердого состояния. Tg (температура стеклования) может быть одним из факторов, которые следует учитывать при достижении стабильных композиций белка. Не желая быть связанными какой-либо конкретной теорией, хотим отметить, что в фармацевтической промышленности используется теория формирования аморфного твердого вещества при высокой Tg для стабилизации пептидов, полипептидов или белков. Как правило, если аморфное твердое вещество имеет более высокую Tg, например, 100°С, пептидные продукты не будут подвижными при хранении при комнатной температуре или даже при 40°С, потому что температура хранения ниже Tg. Расчеты с использованием молекулярной информации, показали, что, если температура стеклования выше температуры хранения 50°С, то подвижность молекул нулевая. Нулевая подвижность молекул коррелирует с более высокой стабильностью. Tg также зависит от концентрации влаги в составе продукта. Вообще, чем больше влаги, тем ниже Tg состава.
[00330] Соответственно, в некоторых аспектах настоящего изобретения, в белковые составы для повышения стабильности могут быть включены наполнители с более высокой Tg, например, сахароза (Tg=75°С) и трегалоза (Tg=110°С). Предпочтительно, составы из частиц могут быть сформированы в виде частиц с использованием способов, таких как сушка распылением, лиофилизация, высыхание, сублимационная сушка, измельчение, гранулирование, распыление ультразвуком, кристаллизация, осаждение, или других методов, доступных в данной области техники для формирования частиц из смеси компонентов. В одном варианте осуществления настоящего изобретения частицы сушат распылением. Частицы предпочтительно имеют по существу одинаковые форму и размер.
[00331] Частицы, как правило, имеют такие размеры, что они могут быть доставлены с помощью имплантируемого осмотического устройства доставки. Сходная форма и размер частиц, как правило, помогают обеспечить последовательную и равномерную скорость высвобождения из такого устройства доставки; однако, может быть также использован препарат, состоящий из частиц, частицы которого имеют ненормальный профиль распределения размеров частиц. Например, в типичном имплантируемом осмотическом устройстве доставки, имеющем отверстие доставки, размер частиц составляет менее чем около 30%, более предпочтительно менее чем около 20%, более предпочтительно менее чем около 10% от диаметра отверстия доставки. В одном варианте осуществления состав из частиц для использования с осмотической системой доставки, в котором диаметр отверстия доставки имплантата составляет около 0,5 мм, размер частиц может составлять, например, от менее чем около 150 микрон до около 50 микрон. В одном варианте осуществления состав из частиц для использования с осмотической системой доставки, в котором диаметр отверстия доставки имплантата составляет около 0,1 мм, размер частиц может составлять, например, от менее чем около 30 микрон до около 10 микрон. В одном варианте осуществления размер отверстия составляет около 0,25 мм (250 микрон), а размер частиц - от около 2 микрон до около 5 микрон.
[00332] Специалистам в данной области техники будут понятно, что популяция частиц соответствует принципам распределения частиц по размерам. Широко используемые, в данной области техники способы описания распределения частиц по размерам включают в себя, например, средние диаметры и значения D, такие как значения D50, которое обычно используется для представления среднего диаметра в диапазоне размеров частиц данного образца.
[00333] Частицы состава из частиц имеют диаметр от около 2 микрон до около 150 микрон, например, менее чем 150 микрон в диаметре, менее 100 микрон в диаметре, менее чем 50 микрон в диаметре, менее чем 30 микрон в диаметре, менее чем 10 микрон в диаметре, менее 5 микрон в диаметре и около 2 микрон в диаметре. Предпочтительно частицы имеют диаметр от около 2 микрон до около 50 микрон.
[00334] Частицы состава из частиц, содержащего выделенный полипептид, являющийся специфическим агонистом глюкагона, имеют средний диаметр в пределах от около 0,3 микрон до около 150 микрон. Частицы состава из частиц, содержащего выделенный полипептид, являющийся специфическим агонистом глюкагона, имеют средний диаметр в пределах от около 2 микрон до около 150 микрон, например, средний диаметр менее 150 микрон, средний диаметр менее 100 микрон, средний диаметр менее чем 50 микрон, средний диаметр менее 30 микрон, средний диаметр менее чем 10 микрон, средний диаметр менее 5 микрон и средний диаметр около 2 микрон. В некоторых вариантах частица имеет средний диаметр от около 0,3 микрон до 50 микрон, например, от около 2 микрон до около 50 микрон. В некоторых вариантах частицы имеют средний диаметр от 0,3 микрон до 50 микрон, например, между около 2 микрон до около 50 микрон, где каждая частица имеет диаметр менее чем около 50 микрон.
[00335] Как правило, частицы составов из частиц при введении в носитель для суспензии не оседают в течение менее чем около 3 месяцев, предпочтительно не оседают в течение менее чем около 6 месяцев, более предпочтительно, не оседает в менее чем около 12 месяцев, более предпочтительно не оседает в течение менее чем 24 месяцев при температуре доставки, и наиболее предпочтительно, не оседает в течение менее чем 36 месяцев при температуре доставки. Носители для суспензий, как правило, имеют вязкость от около 5000 до около 30000 пуаз, предпочтительно от около 8000 до около 25000 пуаз, более предпочтительно от около 10000 до около 20000 пуаз. В одном варианте осуществления носитель для суспензий имеет вязкость около 15000 пуаз, плюс или минус около 3000 пуаз. Вообще говоря, более мелкие частицы, как правило, имеют более низкий уровень оседания в вязких носителях для суспензий, чем более крупные частицы. Соответственно, как правило желательными являются частицы с размерами порядков от микронных до наноразмерных. В вязком носителе для суспензии частицы от около 2 микрон до около 7 микрон по настоящему изобретению не будут оседать в течение по меньшей мере 20 лет при комнатной температуре на основе исследований посредством имитационного моделирования. В одном варианте осуществления состава из частиц по настоящему изобретению для использования в имплантируемом осмотическом устройстве доставки, состав содержит частицы размером менее около 50 микрон, более предпочтительно менее чем около 10 микрон, более предпочтительно в диапазоне от около 2 микрон до около 7 микрон.
[00336] В одном варианте осуществления композиция из частиц препарата содержит препарат, как описано выше, один или несколько стабилизаторов, и, необязательно, буфер. Стабилизаторы могут представлять собой, например, углевод, антиоксидант, аминокислоту, буфер, неорганическое соединение или поверхностно-активное вещество. Количества стабилизаторов и буферов в составе из частиц могут быть определены экспериментально на основе активности стабилизаторов и буферов и желаемых характеристик композиции в соответствии с идеей настоящего описания. Как правило, количество углеводов в составе определяется проблемами агрегации. В общем, количество углеводов не должно быть слишком высоким, чтобы избежать стимулирования роста кристаллов в присутствии воды из-за избытка углеводов, не связанных с препаратом. Как правило, количество антиоксиданта в композиции определяется проблемами окисления, в то время как количество аминокислот в препарате определяются проблемами окисления и/или формуемостью частиц во время сушки посредством распыления. Как правило, количество буфера в композиции определяется проблемами предварительной обработки, проблемами устойчивости и деформируемостью частиц во время сушки посредством распыления. Буфер может потребоваться для стабилизации препарата в процессе обработки, например, для приготовления раствора и сушки посредством распыления, когда все вспомогательные вещества солюбилизированы.
[00337] Примерами углеводов, которые могут быть включены в состав из частиц, включают в себя, но не ограничиваются ими, моносахариды (например, фруктоза, мальтоза, галактоза, глюкоза, D-манноза и сорбоза), дисахариды (например, лактоза, сахароза, трегалоза и целлобиоза), полисахариды (например, раффмоза, мелезитоза, мальтодекстрины, декстраны и крахмалы) и полиолы (ациклические полиолы, например, маннит, ксилит, мальтит, лактит, ксилит-сорбит, пиранозил сорбит и миоинозит). Предпочтительные углеводы включают дисахариды и/или нередуцирующие сахара, такие как сахароза, трегалоза и раффмоза.
[00338] Примеры антиоксидантов, которые могут быть включены в состав из частиц, включают в себя, но не ограничиваются ими, метионин, аскорбиновую кислоту, тиосульфат натрия, каталазу, платину, этилендиаминтетрауксусную кислоту (ЭДТУ), лимонную кислоту, цистеин, тиоглицерин, тиогликолевую кислоту, тиосорбит, бутилгидроксианизол, бутилгидрокситолуол и пропилгаллат. Кроме того, аминокислоты, которые легко окисляются, могут быть использованы в качестве антиоксидантов, например, цистеин, метионин и триптофан.
[00339] Примеры аминокислот, которые могут быть включены в состав из частиц, включают в себя, но не ограничиваются ими, аргинин, метионин, глицин, гистидин, аланин, L-лейцин, глутаминовую кислоту, изолейцин, L-треонин, 2-фениламин, валин, норвалин, пролин, фенилаланин, триптофан, серии, аспарагин, цистеин, тирозин, лизин и норлейцин.
[00340] Примеры буферов, которые могут быть включены в состав из частиц включают в себя, но не ограничиваются ими, цитрат, гистидин, сукцинат, фосфат, малеат, ТРИС, ацетат, углеводный буфер и gly-gly.
[00341] Примеры неорганических соединений, которые могут быть включены в состав из частиц включают в себя, но не ограничиваются ими NaCl, Na2SO4, NaHCO3, KCl, KH2PO4, CaCl2 и MgCl2.
[00342] Кроме того, состав из частиц может включать другие вспомогательные вещества, такие как поверхностно-активные вещества и соль. Примеры поверхностно-активных веществ включают, но не ограничиваются ими, полисорбат 20, полисорбат 80, PLURONIC® (фирма BASF Corporation, Mount Olive, Нью-Джерси) F68, и додецилсульфат натрия (ДСН). Примеры солей включают, но не ограничиваются ими, хлорид натрия, хлорид кальция и хлорид магния.
[00343] Все компоненты, включенные в состав из частиц, как правило, приемлемы для фармацевтического применения у млекопитающих, в частности, у человека.
[00344] Таким образом, выбранный препарат или комбинацию препаратов изготавливают в виде в сухих порошков в твердом состоянии, которые сохраняют максимальную химическую и биологическую стабильность препарата. Состав из частиц обеспечивает долговременную стабильность при хранении при высокой температуре, и, следовательно, позволяет доставлять субъекту стабильный и биологически эффективный препарат в течение длительного периода времени.
3.2.0 Составы-носители и составы для суспензии
[00345] В одном аспекте, носитель для суспензии обеспечивает устойчивую среду, в которой диспергируют состав из частиц препарата. Составы из частиц препарата являются химически и физически стабильными (как описано выше) в носителе для суспензии. Носитель для суспензии, как правило, включает один или более из полимеров и один или более из растворителей, которые образуют раствор с достаточной вязкостью, чтобы равномерно суспендировать частицы, содержащие препарат. Носитель для суспензии может включать дополнительные компоненты, в том числе, но не ограничиваясь ими, поверхностно-активные вещества, антиоксиданты и/или другие соединения, растворимые в носителе.
[00346] Вязкость носителя для суспензии, как правило, достаточна для предотвращения осаждения состава из частиц препарата во время хранения и для использования в способе доставки, например, в имплантируемом, осмотическом устройстве доставки. Носители для суспензии является биоразлагаемым, поскольку носитель для суспензии распадается или разрушается в течение определенного периода времени в ответ на биологическую среду, в то время как частицы препарата растворяются в биологической среде, а активный фармацевтический ингредиент (т.е., препарат) в частице абсорбируются.
[00347] В вариантах осуществления носитель для суспензии является «однофазным» носителем для суспензии, что является твердой, полутвердой или жидкой гомогенной системой, которая физически и химически равномерный по всему объему.
[00348] Растворитель, в котором растворен полимер, может повлиять на характеристики композиции в виде суспензии, такие как поведение состава из частиц препарата во время хранения. Растворитель может быть выбран в комбинации с полимером, так что в результате носитель для суспензии покажет разделение фаз при контакте с водной средой. В некоторых вариантах осуществления настоящего изобретения растворитель может быть выбран в комбинации с полимером, так что в результате носитель для суспензию покажет разделение фаз при контакте с водной средой, имеющей менее чем около 10% воды.
[00349] Растворитель может быть приемлемым растворителем, который не смешивается с водой. Растворитель также может быть выбран таким образом, чтобы полимер был растворим в растворителе в высоких концентрациях, таких как концентрации полимера более чем около 30%. Примеры растворителей, используемых в практике настоящего изобретения, включают, но не ограничиваются ими, лауриловый спирт, бензилбензоат, бензиловый спирт, лауриллактат, деканол (также называемый дециловый спирт), этилгексиллактат и длинноцепочечные (С8-С24) алифатические спирты, сложные эфиры или их смеси. Растворитель, используемый в носителе для суспензии может быть «сухим», то есть, иметь низкое содержание влаги. Предпочтительные растворители для применения при изготовлении носителя для суспензии включают лауриллактат, лауриловый спирт, бензилбензоат и их смеси.
[00350] Примеры полимеров для изготовления носителя для суспензии по настоящему изобретению, включают в себя, но не ограничиваются ими, сложный полиэфир (например, полимолочная кислота и сополимер полимолочной кислоты и полигликолевой кислоты), полимер, содержащий пирролидоны (например, поливинилпирролидон, имеющий молекулярную массу в диапазоне от около 2000 до около 1000000), сложный эфир или простой эфир ненасыщенного спирта (например, винилацетат), блок-сополимер полиоксиэтилена и полиоксипропилена блок-сополимер или их смесь. Поливинилпирролидон можно охарактеризовать по его K-значению (например, K-17), которое является индексом вязкости. В одном варианте осуществления полимер представляет собой поливинилпирролидон, имеющий молекулярную массу от 2000 до 1000000. В предпочтительном варианте осуществления полимер представляет собой поливинилпирролидон K-17 (как правило, имеющий приблизительный диапазон средней молекулярной массы 7900-10800). Полимер, используемый в носителе для суспензии, может включать в себя один или более различных полимеров или могут включать в себя различные типы одного полимера. Полимер, используемый в носителе для суспензии, также может быть сухим или иметь низкое содержание влаги.
[00351] Вообще говоря, носитель для суспензии для использования в настоящем изобретении может отличаться по составу на основании требуемых рабочих характеристик. В одном варианте осуществления носитель для суспензии может содержать от около 40% масс. до около 80% масс. полимера(-ов) и от около 20% масс. до 60% масс. полимера(-ов). Предпочтительные варианты осуществления носителя для суспензии включают носители, выполненные из комбинации полимера(-ов) и растворителя(ей) следующих соотношениях: около 25% масс. растворителя и около 75% масс. полимера; около 50% масс. растворителя и около 50% масс. полимера; около 75% масс. растворителя и около 25% масс. полимера. Соответственно, в некоторых вариантах осуществления носитель для суспензии может содержать выбранные компоненты, а в других вариантах осуществления изобретения состоит в основном из выбранных компонентов.
[00352] Носители для суспензии может демонстрировать ньютоновскую вязкость. Носители для суспензии, как правило, изготовлены с возможностью обеспечения вязкости, которая поддерживает однородную дисперсию частиц состава в течение предварительно определенного периода времени. Это помогает облегчить изготовление состава в виде суспензии с возможностью обеспечения контролируемой доставки препарата, содержащегося в составе из частиц препарата. Вязкость носителя для суспензии может изменяться в зависимости от желаемого применения, размера и типа состава частиц, и нагрузки состава из частиц в носителе для суспензии. Вязкость носителя для суспензии может быть изменена путем изменения типа или относительного количества растворителя или используемого полимера.
[00353] Носитель для суспензии может иметь вязкость в диапазоне от около 100 пуаз до 1000000 пуаз, предпочтительно от около 1000 пуаз до 100000 пуаз. В предпочтительных вариантах осуществления настоящего изобретения носители для суспензий, как правило, имеют вязкость при 33°С от около 5000 до около 30000 пуаз, предпочтительно от около 8000 до около 25000 пуаз, более предпочтительно от около 10000 до около 20000 пуаз. В одном варианте осуществления носитель для суспензии имеет вязкость около 15000 пуаз, плюс или минус около 3000 пуаз, при температуре 33°С. Вязкость может быть измерена при 33°С, при скорости сдвига 10-4/с, с использованием реометра с плоскопараллельным зазором.
[00354] Носитель для суспензии может демонстрировать разделение фаз при контакте с водной средой; однако, как правило, носитель для суспензии не показывает по существу никакого разделения фаз в зависимости от температуры. Так, например, при температуре в диапазоне от около 0°С до около 70°С и при циклическом изменении температуры, например, циклическом изменении температуры от 4°С до 37°С до 4°С, носитель для суспензии, как правило, не показывает разделения фаз.
[00355] Носитель для суспензии может быть получен путем объединения полимера и растворителя в сухих условиях, например, в сухом боксе. Полимер и растворитель, могут быть объединены при повышенной температуре, например, от около 40°С до около 70°С и оставлены для сжижения и образования единой фазы. Ингредиенты могут быть смешаны в вакууме для удаления пузырьков воздуха, выделившихся из сухих ингредиентов. Ингредиенты могут быть объединены с использованием обычного смесителя, такого как смеситель с двойной спиральной лопаткой, или аналогичного смесителя, с установленной скоростью около 40 оборотов в минуту. Однако для смешивания ингредиентов также могут быть использованы более высокие скорости. После получения жидкого раствора из ингредиентов, носитель для суспензии может быть охлажден до комнатной температуры. Данные дифференциальной сканирующей калориметрии (ДСК) могут быть использованы для подтверждения того, что носитель для суспензии представляет собой одну фазу. Кроме того, компоненты носителя (например, растворитель и/или полимер) могут быть обработаны для существенного снижения количества или по существу удаления пероксидов (например, путем обработки метионином, см, например, публикация заявки на патент США №2007-0027105).
[00356] Состав из частиц препарата добавляют в носитель для суспензии для образования состава в виде суспензии. В некоторых вариантах осуществления изобретения состав в виде суспензии может содержать состав из частиц препарата и носитель для суспензии, а в других вариантах осуществления изобретения он состоит в основном из состава из частиц препарата и носителя для суспензии.
[00357] Состав в виде суспензии может быть изготовлен путем диспергирования состава из частиц в носителе для суспензии. Носители для суспензии может быть нагрет и состав из частиц добавлен в носитель для суспензии в сухих условиях. Эти ингредиенты могут быть смешаны в вакууме при повышенной температуре, например, от около 40°С до около 70°С. Ингредиенты могут быть смешаны с достаточной скоростью, например, от около 40 об./мин. до около 120 об./мин., а также в течение достаточного количества времени, например, около 15 минут, для достижения однородной дисперсии состава из частиц в носителе для суспензии. Смеситель может быть смесителем с двойной спиральной лопаткой или другим подходящим смесителем. Полученная смесь может быть удалена из смесителя, запечатана в сухом контейнере, чтобы вода не загрязняла состав в виде суспензии, и оставлена для охлаждения до комнатной температуры до дальнейшего использования, например, введения в имплантируемое устройство доставки лекарств, контейнер с одной дозой или контейнер с несколькими дозами.
[00358] Состав в виде суспензии обычно имеет общее содержание влаги менее чем около 10% масс., предпочтительно менее чем около 5% масс и более предпочтительно менее чем около 4% масс.
[00359] В предпочтительных вариантах осуществления состав в виде суспензии по настоящему изобретению, является по существу однородным и текучим, чтобы обеспечить доставку состава с частицами препарата из осмотического устройства доставки субъекту.
[00360] Таким образом, компоненты носителя для суспензии обеспечивают биосовместимость. Компоненты носителя для суспензии предлагают соответствующие физико-химические свойства для образования стабильных суспензий составов из частиц препарата. Такие свойства включают в себя, но не ограничиваются ими, следующие: вязкость суспензии; чистота носителя; остаточная влажность носителя; плотность носителя; совместимость с сухими порошками; совместимость с имплантируемыми устройствами; молекулярная масса полимера; устойчивость носителя; и гидрофобность и гидрофильность носителя. Такими свойствами можно манипулировать и контролировать, например, путем изменения состава носителя и манипуляции с соотношением компонентов, используемых в носителе для суспензии.
4.0.0 Доставка составов в виде суспензии
[00361] Составы в виде суспензии, описанные в данном документе, могут быть использованы в имплантируемом, осмотическом устройстве доставки для обеспечения непрерывной контролируемой и устойчивой доставки нулевого порядка соединения в течение продолжительного периода времени, например, в течение нескольких недель, месяцев, или до около одного года или более. Такое имплантируемое осмотическое устройство для доставки, как правило, способно доставлять состав в виде суспензии, содержащий препарат, с желаемой скоростью потока в течение требуемого периода времени. Состав в виде суспензии может быть помещен в имплантируемое осмотическое устройство доставки с помощью обычных способов.
[00362] Доза и скорость доставки могут быть выбрана для достижения желаемой концентрации препарата в крови, как правило, в течение менее чем около 6 периодов полураспада препарата в теле субъекта после имплантации устройства. Концентрация препарата в крови выбрана таким образам, чтобы оказывать оптимальный терапевтический эффект препарата, избегая при этом нежелательных побочных эффектов, которые могут быть вызваны избыточной концентрацией препарата, при этом в то же время избегая пиковых и минимальных концентраций, которые могут вызывать побочные эффекты, связанный с пиковыми и минимальными концентрациями препарата в плазме.
[00363] Имплантируемое осмотическое устройство доставки обычно включает в себя резервуар, имеющий по меньшей мере одно отверстие, через которое доставляется состав в виде суспензии. Состав в виде суспензии может храниться в резервуаре. В предпочтительном варианте осуществления имплантируемое устройство доставки препарата представляет собой осмотическое устройство доставки, в котором доставка препарата выполняется посредством осмоса. Некоторые осмотические устройства доставки и их составные части были описаны, например, устройство для доставки DUROS® или аналогичные устройства (см., например, патенты США №№. 5,609,885; 5,728,396; 5,985,305; 5,997,527; 6,113,938; 6,132,420; 6,156,331; 6,217,906; 6,261,584; 6,270,787; 6,287,295; 6,375,978; 6,395,292; 6,508,808; 6,544,252; 6,635,268; 6,682,522; 6,923,800; 6,939,556; 6,976,981; 6,997,922; 7,014,636; 7,207,982 и 7,112,335; 7,163,688; публикации патентов США №№2005/0175701, 2007/0281024, 2008/0091176 и 2009/0202608).
[00364] Осмотическое устройство доставки, как правило, состоит из цилиндрического резервуара, который содержит осмотический двигатель, поршень и состав, содержащий препарат. Резервуар закрыт с одного конца полупроницаемой мембраной с контролируемой скоростью, а с другого конца - замедлителем диффузии, через который состав в виде суспензии, содержащий препарат, высвобождается из резервуара с препаратом. Поршень отделяет препарат от осмотического двигателя и использует уплотнение для предотвращения попадания воды из отсека осмотического двигателя в резервуар с препаратом. Замедлитель диффузии предназначен, в сочетании с составом, содержащим препарат, для предотвращения попадания жидкостей организма в резервуар с препаратом через отверстие.
[00365] Осмотическое устройство высвобождает препарат с заранее определенной скоростью на основании принципа осмоса. Внеклеточная жидкость поступает в осмотическое устройстве для доставки через проницаемую мембрану пола непосредственно в солевом двигатель, который расширяется для приведения в действии поршня в медленной и даже доставках скорости. Движение поршня выталкивает препарат через отверстие или выходное отверстие при заданной скорости сдвига. В одном из вариантов осуществления настоящего изобретения резервуар осмотического устройства заполняется составом в виде суспензии, при этом устройство способно доставлять суспензионную композицию субъекту в течение длительного периода времени {например, около 1, около 3, около 6, около 9, около 10 и около 12 месяцев) с заранее определенной, терапевтически эффективной скоростью доставки.
[00366] Скорость высвобождения препарата из осмотического устройства для доставки, как правило, доставляет субъекту заранее определенную целевую дозу препарата, например, терапевтически эффективная суточная доза доставляется в течение суток; то есть, скорость высвобождения препарата из устройства обеспечивает по существу стабильную доставку субъекту препарата в терапевтической концентрации.
[00367] Как правило, для осмотического устройства доставки, объем полезного камеры для средства, содержащий состав с полезным средством, составляет от около 100 мкл до около 1000 мкл, более предпочтительно от около 120 мкл до 500 мкл, более предпочтительно между около 150 мкл и около 200 мкл.
[00368] Как правило, осмотическое устройство доставки имплантируется субъекту, например, субдермально или подкожно, для обеспечения подкожной доставки препарата. Устройство(-а) могут быть имплантированы субдермально или подкожно в одну или обе руки (например, во внутреннюю часть, наружную часть или заднюю часть плеча) или в брюшную полость. Предпочтительные места в брюшной области находятся под кожей живота в области ниже ребер и выше линии пояса. Для обеспечения количества мест для имплантации одного или более осмотических устройств доставки внутри брюшной полости, брюшная стенка может быть разделена на 4 квадранта следующим образом: верхний правый квадрант расположен по меньшей мере на 2-3 сантиметра ниже правого ребра, например, по меньшей мере на около 5-8 сантиметров ниже правого ребра, и по меньшей мере 2-3 сантиметра вправо от серединной линии живота, например, по меньшей мере на около 5-8 сантиметров вправо от серединной линии живота; нижний правый квадрант расположен по меньшей мере на 2-3 сантиметра выше линии пояса, например, по меньшей мере на около 5-8 сантиметров выше линии пояса, и, по меньшей мере на 2-3 сантиметра вправо от серединной линии живота, например, по меньшей мере на около 5-8 сантиметров вправо от серединной линии живота; верхний левый квадрант расположен по меньшей мере на 2-3 сантиметра ниже левого ребра, например, по меньшей мере на около 5-8 сантиметров ниже левого ребра, и по меньшей мере на 2-3 сантиметра влево от серединной линии живота, например, по меньшей мере на около 5-8 сантиметров влево от серединной линии живота; а нижний левый квадрант расположен по меньшей мере на 2-3 сантиметра выше линии пояса, например, по меньшей мере на около 5-8 сантиметров выше линии пояса, и по меньшей мере на 2-3 сантиметра влево от серединной линии живота, например, по меньшей мере на около 5-8 сантиметров влево от серединной линии живота. Такое деление обеспечивает множество доступных мест для имплантации одного или более устройств за один или более раз. Имплантация и удаление осмотических устройств доставки, как правило, осуществляется медицинскими работниками с использованием местной анестезии (например, лидокаин).
[00369] Прекращение лечения пути удаления осмотического устройства доставки из субъекта является простым и обеспечивает важное преимущество немедленного прекращения доставки препарата субъекту.
[00370] Предпочтительно, осмотическое устройство доставки имеет отказоустойчивый механизм для предотвращения непреднамеренной избыточной или болюсной доставки препарата в такой теоретической ситуации как засорение или закупоривание выходной части (замедлителя диффузии), через которую доставляется препарат. Для предотвращения непреднамеренной избыточной или болюсной доставки препарата осмотического устройство для доставки сконструировано и изготовлено таким образом, что давление, необходимое для частичного или полного вытеснения или отделения замедлителя диффузии из резервуара превышает давление, необходимое для частичного или полного вытеснения или отделения полупроницаемой мембраны в объеме, необходимом для снятия давления в резервуаре. В таком случае давление будет нарастать внутри устройства до тех пор, пока оно не вытолкнет полупроницаемую мембрану на другом конце наружу, тем самым сбрасывая осмотическое давление. Осмотическое устройство доставки затем статичным и больше не будет доставить препарат при условии, что поршень герметично прилегает к резервуару.
[00371] Составы в виде суспензии могут быть также использованы в инфузионных насосах, например, осмотических насосах ALZET® (DURECT Corporation, Cupertino, Calif.), которые представляют собой миниатюрные инфузионные насосы для непрерывного дозированного введения лабораторным животным (например, мышам и крысам).
ПРИМЕРЫ
[00372] Следующие примеры приводятся с тем, чтобы предоставить специалистам в данной области техники полное раскрытие и описание того, как применять на практике настоящее изобретение, однако они не претендуют ни на ограничение объема того, что заявители рассматривают как свое изобретение. Были приняты меры для того, чтобы сохранить точность по отношению к использованным цифрам (например, количествам, концентрациям и процентные изменения), однако следует учитывать некоторые экспериментальные ошибки и отклонения. Если не указано иное, температура указана в градусах по Цельсию, а давление равно атмосферному или близко к нему.
[00373] Композиции, используемые при практике способов по настоящему изобретению, соответствуют требованиям к содержанию и чистоте, необходимым для фармацевтической продукции.
Пример 1. Создание полипептидов, являющихся селективными к рецептору глюкагона агонистами
[00374] Полипептиды глюкагона согласно изобретению, как показано в Таблице 3, были синтезированы на пептидном синтезаторе Prelude (Protein Technologies Inc., Tucson, AZ) посредством твердофазных методов с использованием стратегии Fmoc с активацией 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурангексафторфосфатом (HBTU) или 2-(6-хлор-1-Н-бензотриазол-1-ил)-1,1,3,3-тетраметиламинийгексафторфосфатом (HCTU) (пятикратный молярный избыток) в N, N-диметилформамиде (ДМФ), и N'N-диизопропилэтиламине (DIEA) в качестве основания, 20% пиперидина/ДМФ удаления защитной группы Fmoc. В качестве смолы использовали амидную смолу Ринка МВНА LL (Novabiochem) или N-α-Fmoc-защищенную предварительно загруженную Wang LL (Novabiochem) с загрузками 0,29-0,35 ммоль/г по шкале 20-400 мкмоль. Окончательное снятие защиты и отщепление пептида от твердой подложки осуществляли путем обработки смолы (92,5% TFA, 2,5% фенола, 2,5% воды и 2,5% триизопропилсилана) в течение 2-3 часов. Отщепленный пептид осаждали с помощью холодного диэтилового эфира. Диэтиловый эфир декантировали и твердое вещество снова растирали с холодным диэтиловым эфиром, осаждали центрифугированием и лиофилизировали. Лиофилизированное твердое вещество повторно растворяли в растворе ацетонитрил/вода 1:1 с 0,1% TFA (10-15 мл), очищали посредством обратно-фазовой ВЭЖХ на колонке Waters XBridge™ ВЕН 130, CIS, 10 пм, 130  30 X 250 мм ВД, с использованием градиента 30 с диапазонами ацетонитрил/вода 5-75% с 0,1% TFA в течение 30-45 минут при скорости потока 30 мл/мин, λ - 215 нм. Очищенный продукт лиофилизировали и анализировали с помощью ИЭР-ЖХ/МС и аналитической ВЭЖХ; и было продемонстрировано, что он является чистым (>98%). Все полученные массы соответствовали расчетным значениям.
30 X 250 мм ВД, с использованием градиента 30 с диапазонами ацетонитрил/вода 5-75% с 0,1% TFA в течение 30-45 минут при скорости потока 30 мл/мин, λ - 215 нм. Очищенный продукт лиофилизировали и анализировали с помощью ИЭР-ЖХ/МС и аналитической ВЭЖХ; и было продемонстрировано, что он является чистым (>98%). Все полученные массы соответствовали расчетным значениям.
[00375] Характеризации пептидных аналогов проводились посредством С18 ВЭЖХ, анализа ЖХ/МС (Acquity SQD Waters Corp., Milford, MA) и УФ-детектирования, выполненного двойных сигналов поглощения при 215 нм и 280 нм с использованием одного из трех способов: способа А, способа В или способа С.
[00376] Условия ЖХ/МС. Способ А. Выполнен с использованием колонки Phenomenex УЭЖХ Aeris™ Peptide ХВ С18 35, 1,7 пм, 2,1 X 100 мм или колонки ACQUiTY ВЕН300 или ВЕН130 СТ8, 1,77 пм. 2,1 X 100 мм с использованием 5-65% ацетонитрила/воды с 0,05% TFA в течение 30 минут со скоростью потока 0,5 мл/мин, λ - 215 нм, 280 нм.
[00377] Условия С18 ВЭЖХ. Способ А. Анализ УЭЖХ выполняли на колонке Acquity ВЕН130, С18, 1,7 мкм, 100 X 2,10 мм при температуре 25°С, 5-65% ацетонитрила/воды с 0,05% TFA в течение 30 минут, скорость потока 0,5 мл/мин, λ 215 нм, λ 280 нм.
[00378] Способ В. Анализ УЭЖХ выполняли на колонке Acquity ВЕН 130, С18, 1,7 мкм, 100 X 2,10 мм при температуре 25°С, 5-65% ацетонитрила/воды с 0,05% TFA в течение 20 минут, скорость потока 0,5 мл/мин, λ 215 нм, λ 280 нм.
[00379] Способ С. Анализ УЭЖХ выполняли на колонке Acquity ВЕН130, С18, 1,7 мкм, 100 X 2,10 мм при температуре 25°С, 5-65% ацетонитрила/воды с 0,05% TFA в течение 10 минут, скорость потока 0,5 мл/мин, λ 215 нм, λ 280 нм. 5,0 мкл образца вводили с использованием режима введения PLNO (неполная петля с переполнением иглы).
[00380] Таблица 3 содержит аминокислотную последовательность, и экспериментальные данные для селективных к рецептору глюкагона аналогов по данному раскрытию, включая селективные к рецептору глюкагона аналоги, упомянутые в данном описание как соединение А4 (SEQ ID NO: 44), соединение А5 (SEQ ID NO: 45), соединение А6 (SEQ ID NO: 46), соединение A2 (SEQ ID NO: 42), соединение A1 (SEQ ID NO: 41), соединение A3 (SEQ ID NO: 43), соединение A97 (SEQ ID NO: 143), соединение A98 (SEQ ID NO: 144), соединение A99 (SEQ ID NO: 145), соединение A100 (SEQ ID NO: 146), соединение A101 (SEQ ID NO: 147), соединение A102 (SEQ ID NO: 148), и соединение A97 (SEQ ID NO: 149).
Пример 2. Создание полипептида, являющегося селективным к рецептору глюкагона агонистом, с лактамным мостиком
[00381] Способы синтеза, очистки и аналитические способы соответствовали описанным в примере 1 со следующими изменениями. Полипептиды глюкагона по данному изобретению, как показано в Таблице 3, были синтезированы на пептидном синтезаторе Prelude (Protein Technologies Inc., Tucson, AZ)) посредством твердофазных методов с использованием стратегии Fmoc и с использованием амидной смолы Ринка МВНА LL (Novabiochem) или N-α-Fmoc-защищенную предварительно загруженную Wang LL (Novabiochem) с загрузками 0,29-0,35 ммоль/г по шкале 20-400 мкмоль. Аминокислотные остатки Fmoc (4,0 экв, 1,0 ммоль) активировали с помощью 4,0 экв. HBTU, 4,0 экв. НОВТ, 8,0 экв. DIEA и соединяли со смолой в течение 1 часа. Группу Fmoc удаляли путем обработки 20% (об./об.) пиперидина в диметилформамиде. Использованные защитные группы боковых цепей представляли собой Trt для Asn, Gln, Cys и His; трет-бутил для Ser, Thr и Tyr; Boc для Lys и Trp; Ot-Bu для Asp и Glu; и Pbf для Arg.
[00382] Лактамные мостики между положениями 17-21 и между положениями 24-27 были введены с использованием ортогонально защищенного лизина (аллокс.)17 и Glu (аллил)21; и Glu (аллил)24 и лизин (аллокс.)27 представлены буквой Е в круглых скобках в последовательности лизин (аллокс.) представлен буквой К в круглых скобках в последовательностях, показанных в SEQ ID NO: 19 и SEQ ID NO: 20.
[00383] Синтез проводили от С-конца к N-концу на твердой подложке. Для включения первого лактамного мостика (остаток 17 - остаток 21) синтез был приостановлена на Phe21. Смолу промывали DCM (6×10 мл), который предварительно продували азотом в течение 30 минут. Далее, палладий тетракис, Pd (PPh 3) 3 (3 экв.) добавляли к раствору CHCl3/AcOH/NMM (37:2:1). Азот барботировали через раствор, пока все твердое вещество не растворилось, оставляя раствор темно-янтарного цвета. Этот раствор переносили в бутыль с аминокислотой, в которой ее дегазировали азотом в течение дополнительных 5 минут. Затем он был помещен в синтезатор Prelude. В каждый РФ добавляли 20 мл раствора палладия и реакционную смесь оставляли для перемешивания в течение 3 часов. Синтез был продолжен с использованием стандартного протокола. Для введения второго лактамного мостика (остаток 24 - остаток 28) синтез приостановили на Leu 14 и повторили описанную выше процедуру образования лактамных мостиков.
[00384] Перед отщеплением пептида от смолы аллильные защитные группы удаляют с помощью Pd(PPh3)3 в CHCl3/AcOH/NMM (37:2:1). Циклизация к лактаму была осуществлена с использованием Pybop (6 экв.), НОВТ (6 экв.) и DIEA (12 экв.). Затем смолу промывали ДМФ и сушили под вакуумом в течение 15 мин в атмосфере азота.
[00385] Окончательное снятие защиты и отщепление пептида от твердой подложки осуществляли путем обработки смолы реагентом В (92,5% TFA, 2,5% фенола, 2,5% воды и 2,5% триизопропилсилана) в течение 2-3 часов. Отщепленный пептид осаждали с помощью холодного диэтилового эфира, диэтиловый эфир декантировали и твердое вещество снова растирали с холодным диэтиловым эфиром, осаждали центрифугированием и лиофилизировали. Осадок повторно растворяли в воде (10-15 мл), очищали фильтрованием посредством обратно-фазовой ВЭЖХ на колонке Waters XBridge™ ВЕН 130, CIS, 10 пм, 130  30 X 250 мм ВД, с использованием градиента 30 с диапазонами ацетонитрил/вода 5-75% с 0,1% TFA в течение 30-45 минут при скорости потока 30 мл/мин, λ - 215 нм. В качестве альтернативы, очистку выполняли с использованием системы препаративной ВЭЖХ на системе Gilson посредством обратно-фазовой хроматографии на колонке Waters XBridge ВЕН 130, С18, 10 мкм, 130
30 X 250 мм ВД, с использованием градиента 30 с диапазонами ацетонитрил/вода 5-75% с 0,1% TFA в течение 30-45 минут при скорости потока 30 мл/мин, λ - 215 нм. В качестве альтернативы, очистку выполняли с использованием системы препаративной ВЭЖХ на системе Gilson посредством обратно-фазовой хроматографии на колонке Waters XBridge ВЕН 130, С18, 10 мкм, 130  30 X 250 мм ВД, с диапазоном градиента 5-45% ацетонитрил/вода с 0,1% TFA в течение 30-45 мин при скорости потока 30 мл/мин, λ 215 нм. Очищенный продукт лиофилизировали и анализировали с помощью ИЭР-ЖХ/МС и аналитической ВЭЖХ; и было продемонстрировано, что он является чистым (>98%). Все полученные массы соответствовали расчетным значениям.
30 X 250 мм ВД, с диапазоном градиента 5-45% ацетонитрил/вода с 0,1% TFA в течение 30-45 мин при скорости потока 30 мл/мин, λ 215 нм. Очищенный продукт лиофилизировали и анализировали с помощью ИЭР-ЖХ/МС и аналитической ВЭЖХ; и было продемонстрировано, что он является чистым (>98%). Все полученные массы соответствовали расчетным значениям.
[00386] Характеризации пептидных аналогов проводились посредством С18 ВЭЖХ, анализа ЖХ/МС (Acquity SQD Waters Corp., Milford, MA) и УФ-детектирования, выполненного двойных сигналов поглощения при 215 нм и 280 нм с использованием одного из трех способов: способа А, способа В или способа С.
[00387] Химическая структура соединения А104 показана на фиг. 4А, а химическая структура соединения А105 показана на фиг. 4В.
Пример 3. Стабильность и растворимость полипептидов, представляющих собой агонист, селективный к рецептору глюкагона
[00388] Глюкагон и аналоги, описанные в данном документе, например, соединение А98, соединение А99, соединение А100, соединение А101, соединение А102, соединение А2, соединение А1, соединение А5, соединение А6, соединение A3, соединение А44 и соединение А97 испытывали на стабильность в солевом растворе 5% NaCl в воде (т.е., буфер для биопроб) или в водном (т.е., в воде). Глюкагон и такие аналоги инкубировали при 37°С и при комнатной температуре. Образцы отбирали через регулярные промежутки времени в течение 30 дней и анализировали посредством ЖХ/МС и ВЭЖХ для определения чистоты и массы продукта разложения. Результаты этого анализа представлены в таблице 3.
[00389] Глюкагон и аналоги, описанные в данном документе, например, соединение А98, соединение А99, соединение А100, соединение А101, соединение А102, соединение А2, соединение А1, соединение А5, соединение А6, соединение A3, соединение А44 и соединение А97 испытывали на растворимость в солевом растворе 5% NaCl в воде (т.е., буфер для биопроб) или в водном при комнатной температуре. Образцы визуально осматривали на предмет прозрачности образца и любого проявление мутности или помутнения. Результаты этого анализа представлены в таблице 3.
Пример 4. Скрининг in vitro аналогов, опосредованных пептидным рецептором кумуляции цАМФ
[00390] Активированные промотором ЦМВ плазмиды, кодирующие человеческий GCGR (NM_000160) и человеческий GLP-1 R (NM_002062), трансфицировали в клетки СНО-К1 в течение 36 часов с использованием Липофектамина 2000. После трансфекции клетки удаляли из колбы с помощью разрушающей клетки среды и разливали в белых 384-луночные планшеты в количестве 1000 клеток на лунку в 5 мкл буфера стимуляции. Активность пептидного рецептора определяли с использованием набора для обнаружения цАМФ LANCE Ultra в соответствии с протоколом производителя (Perkin Elmer). Пептиды серийно разводили в буфере для стимуляции и 5 мкл каждого пептидного разведения добавляли к клеткам и инкубировали в течение тридцати минут при комнатной температуре. Для получения результатов, показанных в Таблице 2А, тестируемые концентрации находились в диапазоне от 1 нМ до 15 фМ в анализах GCGR и GLP-1R. Для получения результатов, показанных в Таблице 2 В, тестируемые концентрации находились в диапазоне от 1 мкМ до 0,1 фМ для анализов GCGR и от 500 мкМ до 10 фМ для анализов GLP-1R. После инкубации пептида, 5 мкл меченного европием цАМФ и 5 мкл антитела к цАМФ Ulight™ добавляли в лунки и инкубировали в течение дополнительных 60 минут. Планшеты считывали на флуоресцентном считывателе планшетов Envision® и данные анализировали с использованием GraphPad Prism®. Эффективность была определена на основании построенной по точкам кривой, скорректированной по базовому уровню, по формуле: Y = низ + (верх - низ)/(1+10∧((LogIC50-X) * угл. коэф. Хилла)) с угловым коэффициентом Хилла, ограниченным до -1,0.
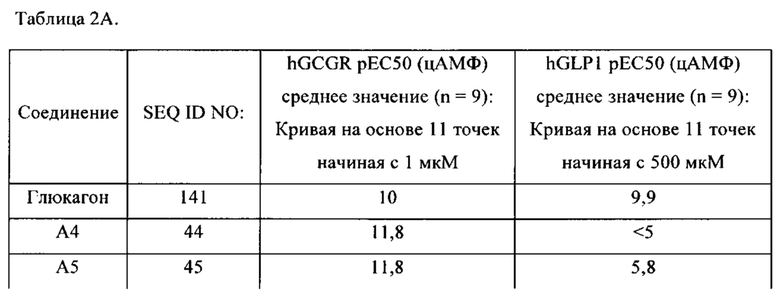

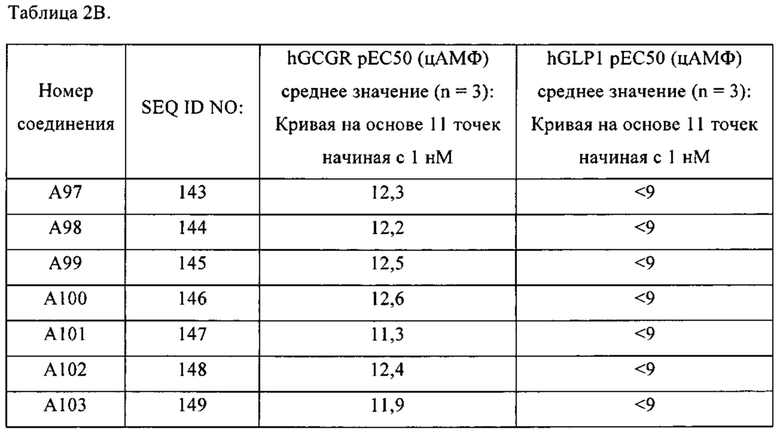
[00391] В некоторых вариантах осуществления представлен выделенный полипептид по раскрытию, соответствующий соединению А97, А98, А99, А100, А101, А102 или А103.
[00392] Профили активации пептидных рецепторов рецептора глюкагона человека (GCGR) и рецептора GLP-1 человека (GLP-1R) при воздействии человеческого глюкагона, GLP-1 (7-37) и двух селективных к рецептору глюкагона пептидных агонистов. Фигура 1А демонстрирует, что пептиды соединение А2, соединение А1 и глюкагон активируют GCGR с около равной эффективностью, в то время как GLP-1 (7-37) активирует GCGR с гораздо более низкой активностью. Фигура 1 В демонстрирует, что, в отличие от результатов, показанных на фигуре 1А, пептиды соединение А2 и соединение А1 неактивны в отношении GLP-1R, что демонстрирует профиль пептидов соединение А2 и соединение А1 в качестве селективных агонистов GCGR. Данные всех аналогов приведены в Таблице 3.
[00393] Последовательности синтезированных пептидов, являющихся агонистами к рецептору глюкагона, и их значения рЕС50, определенные в анализах цАМФ, приведены
ниже в Таблице 3.
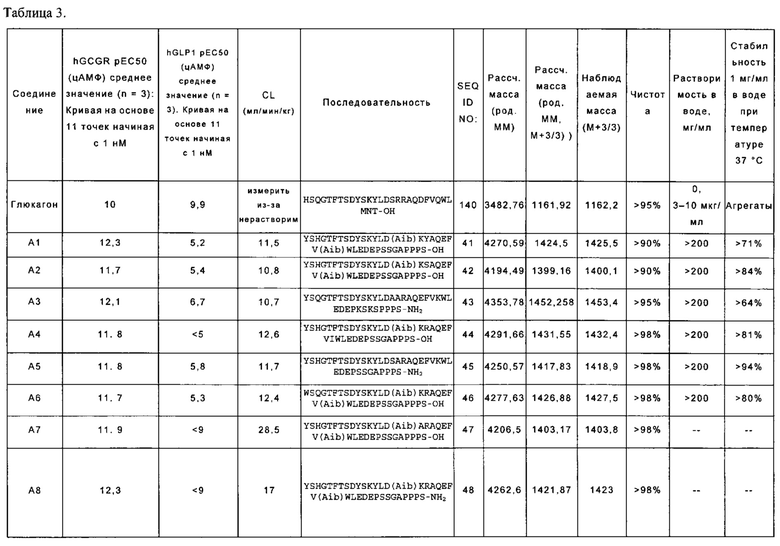
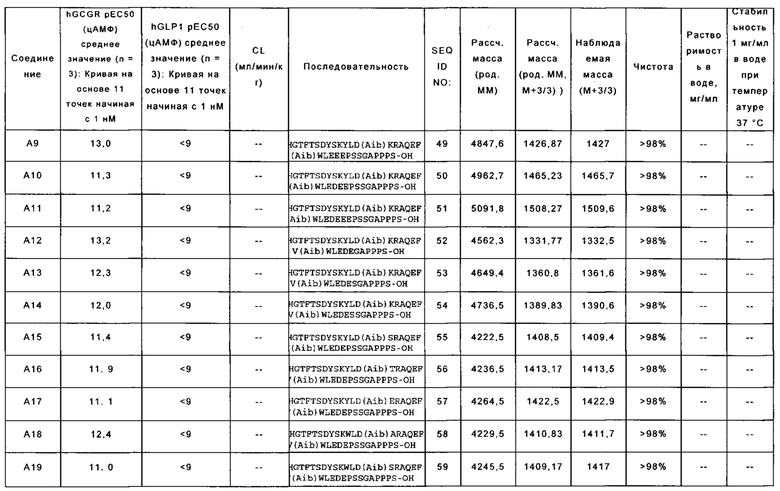
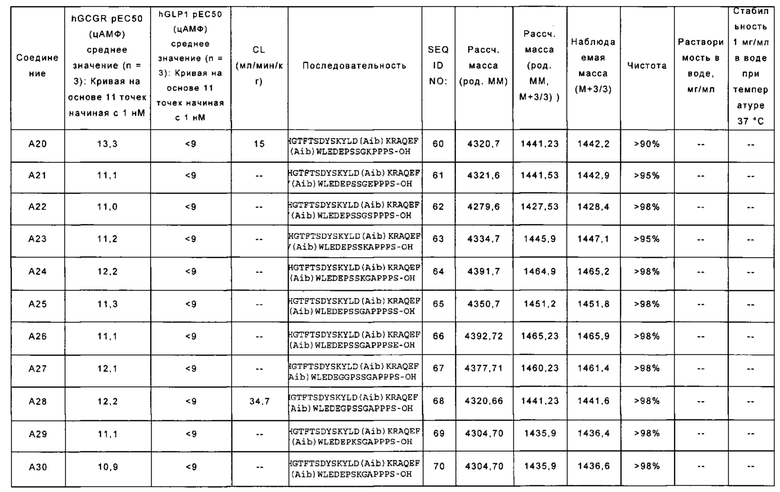
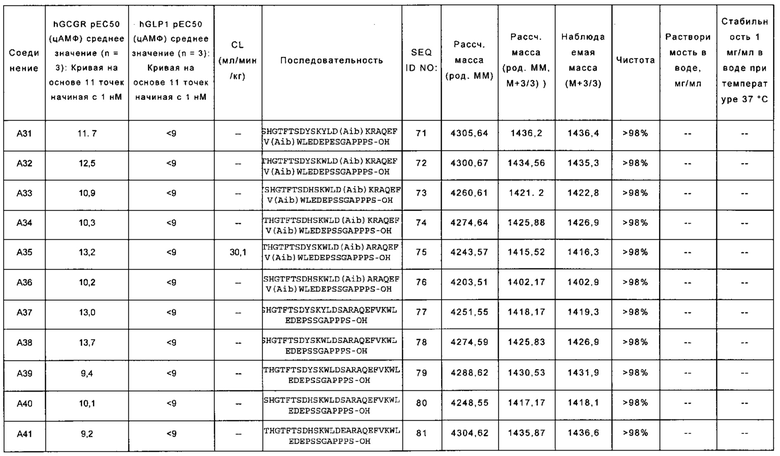
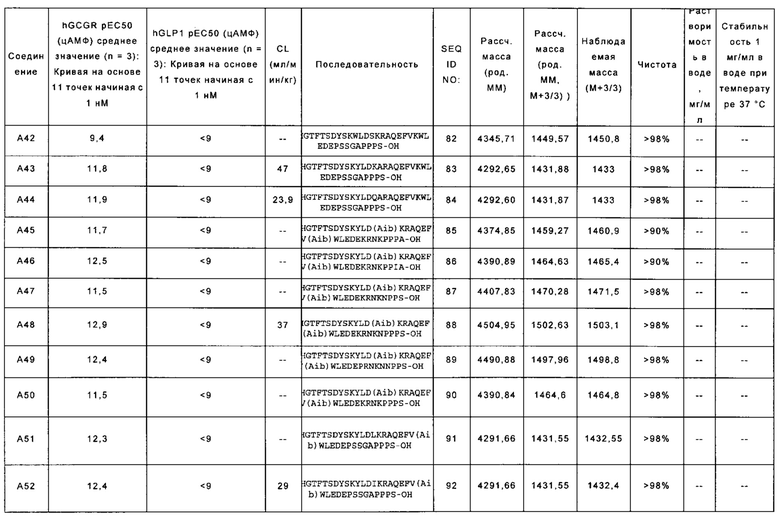
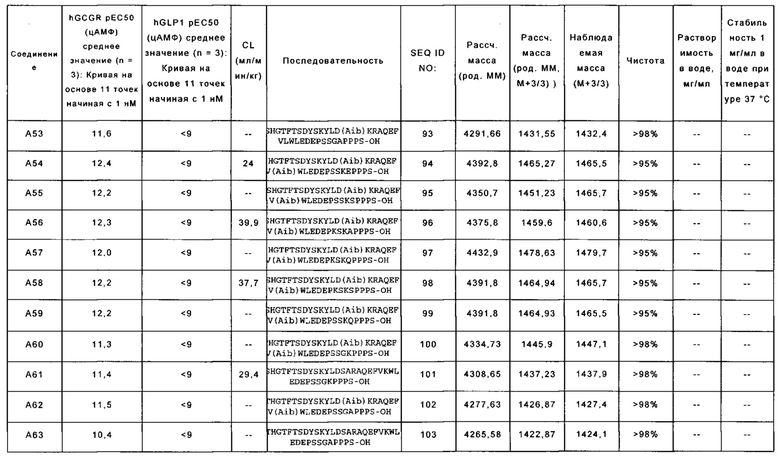
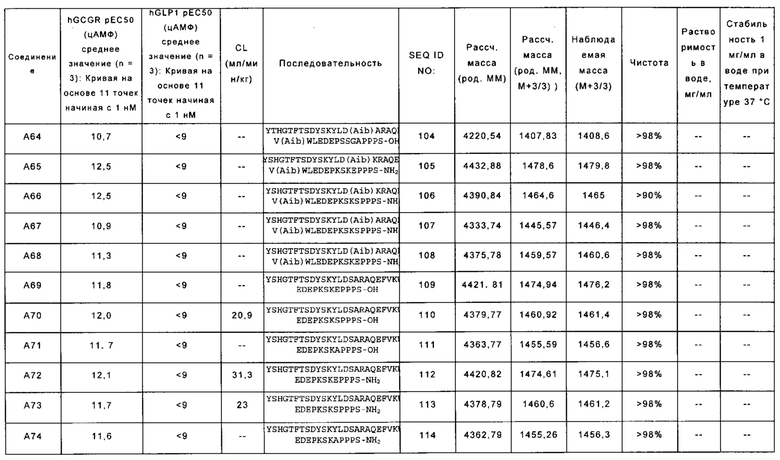
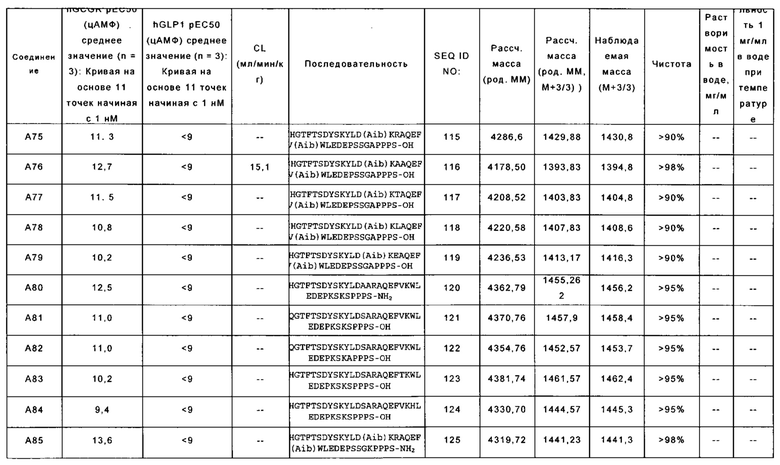
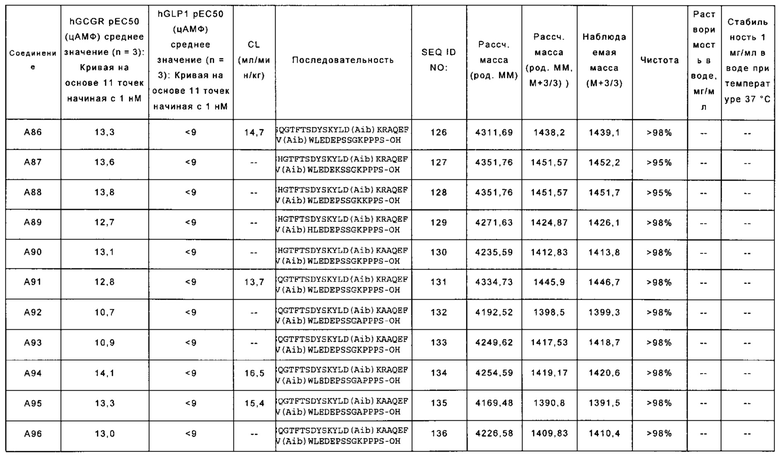
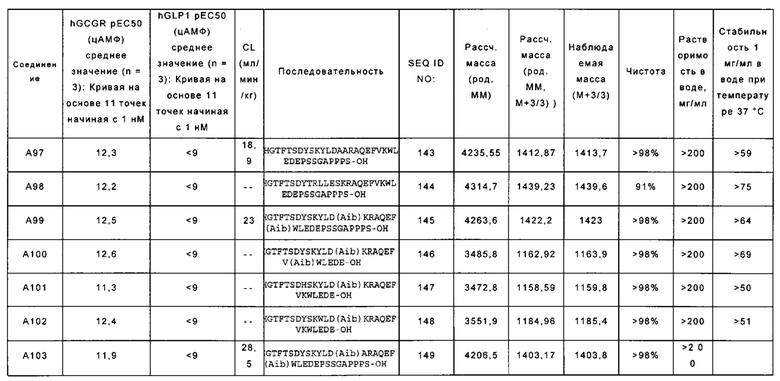
Пример 5. Внутривенное вливание: фармакокинетические исследования для оценки выведения пептида из почек (CL)
[00394] Пептиды приготавливали в стерильном физиологическом растворе и вводили в виде 3-часовой внутривенной инфузии не натощак крысам-самцам Вистар линии Хан или крысам линии Спрег-Доули (n=3 на группу) через канюлю в яремной вене в конечной дозе 0,3 или 0,1 мг/кг. Препараты вводили со скоростью 1,67 мл/кг/час. Образцы крови (около 250 мкл) были собраны для фармакокинетического анализа через канюлю в бедренной вене через 1, 2, 3, 3,17, 3,33, 3,5, 4, 4,5, 5 и 6 ч. после начала инфузии в пробирки Microtainer, содержащие K2EDTA в качестве антикоагулянта и 25 мкл ингибитора протеазы. Плазму получали центрифугированием и хранили при -80°С до анализа.
Пример 6. Подкожное вливание: фармакокинетические исследования для оценки выведения пептида из почек (CL)
[00395] Пептиды изготавливали в стерильном физиологическом растворе и вводили в виде 3-часовой подкожной инфузии не натощак крысам-самцам Вистар линии Хан или крысам линии Спрег-Доули (n=3 на группу) в конечной дозе 0,3 или 0,1 мг/кг через канюлю, помещенную в подкожное пространство между лопатками. Препараты вводили со скоростью 0,145 мл/кг/час. Образцы крови (около 250 мкл) были собраны для фармакокинетического анализа через канюлю в яремной вене через 1, 2, 3, 3,17, 3,33, 3,5, 4, 4,5, 5 и 6 ч после начала инфузии в пробирки Microtainer, содержащие K2EDTA в качестве антикоагулянта и 25 мкл ингибитора протеазы. Плазму получали центрифугированием и хранили при -80°С до анализа. Результаты этого анализа приведены ниже в таблице 3 и на фиг. 2А и 2В.
Пример 7. Внутривенные болюсные инъекции:фармакокинетические исследования для оценки выведения пептида из почек (CL) циклического пептидного аналога глюкагона
[00396] Пептиды вводили в виде однократной внутривенной болюсной дозы не натощак крысам-самцам Вистар линии Хан (n=3 в каждой группе) через канюлю в яремной вене. Соединения изготавливали в виде растворов в любом из следующих растворов: стерильном физиологическом растворе, подкисленном солевой растворе (рН=2,0 или 4,5), или 5% ДМС в воде, и вводили в объеме 1,5 мл/кг с конечной дозой 0,1 мг/кг. Образцы крови (около 250 мкл) были собраны для фармакокинетического анализа через канюлю в бедренной вене через 0,083, 0,167, 0,25, 0,33, 0,5, 1, 2, 4, 8, 12 и 24 ч после введения дозы в пробирки Microtainer, содержащие K2EDTA в качестве антикоагулянта и 25 мкл ингибитора протеазы. Плазму получали центрифугированием и хранили при -80°С до анализа. Результаты этого анализа представлены ниже в таблице 4.

[00397] В некоторых вариантах осуществления представлен выделенный полипептид по раскрытию, соответствующий соединению А104 или А105.
Пример 8. Общий способ приготовления образца плазмы для фармакокинетических исследований
[00398] Осаждение белка. Все 96-луночные планшеты покрывали блокирующим веществом для снижения неспецифического связывания пептидов. Образцы плазмы (75 мкл) добавляли на 96-луночный планшет, содержащий 200 мкл 2:1 этанола:ацетонитрила, содержащего 0,1% TFA и тщательно перемешивают посредством аспирации. Планшеты закрывали, смешивали на вортексе и центрифугировали. Супернатанты (215 мкл) переносили на чистый 96-луночный планшет, выпаривали досуха под потоком азота, а затем разводили в 75 мкл 20% ацетонитрила в воде, содержащей 0,1% муравьиной кислоты.
[00399] Твердофазная экстракция. Образцы 3-кратно разбавляли 5% NH4OH (водн.) и переносили на планшет Oasis MAX microElution (Waters Corp, Milford, MA), предварительно обработанный 200 мкл метанола и 5% NH4OH (водн.). Планшет промывали 200 мкл 5% NH4OH (водн.), затем 200 мкл 20% ацетонитрила в воде. Пептиды элюировали с использованием 200 мкл 5% муравьиной кислоты в метаноле и выпаривали под потоком азота. Образцы разводили в 80 мкл 0,1% муравьиной кислоты в воде.
Пример 9. ЖХ/МС количественный анализ пептидов в плазме
[00400] Все калибровочные стандарты были изготовлены в контрольной крысиной плазме, содержащей смесь K2EDTA и ингибитора протеазы. Образцы и стандарты были проанализированы с помощью TurboIonSpray™ УЭЖХ-МС/МС, с использованием системы, состоящей из автоинжектора СТС HTS PAL (Leap, Carrboro, Северная Каролина), системы Agilent Infinity 1290 с колоночным термостатом (Palo Alto, СА), переключающего клапана Valeo (Houston, ТХ), и масс-спектрометра АВ Sciex API 5600 TripleTOF™ или Sciex API 4000QTrap (Framingham, MA). Образцы вводили в аналитическую колонку С18 2,1×50 мм с обращенной фазой, как правило, Waters ACQUITY UPLC™ HSS Т3, 1,8 пм (Waters Corporation, Milford, MA) или аналогичную. Хроматографическое разделение достигается посредством градиентного метода с использованием воды, содержащей 0,1% муравьиной кислоты (А) и ацетонитрила, содержащего 0,1% муравьиной кислоты (В), в качестве подвижной фазы. Начальные условия состояли из 95% А и 5% В. Органический компонент линейно возрастает до 95% В в течение 3-4 минут в зависимости от пептида. Типичные скорости потока составляли 600 мкл/мин. Температура колонки поддерживалась постоянной на уровне 40 или 45°С. Пептиды были количественно оценены посредством мониторинга одного или несколько ионов продукта, полученных из многозарядного родительского иона.
Пример 10. Эффективность in vivo аналогов глюкагона с уменьшением массы тела
[00401] Долгосрочные (13 дней) исследования эффективности in vivo проводились на модели грызунов с ожирением (крысы Лонг-Эванс с вызванным рационом ожирением (DIO)) для исследования эффективности и долговечности примеров 11 и 12 по отдельности и в сочетании с эксендином-4 в качестве средства от ожирения.
[00402] Использовали самцов крыс Лонг-Эванс (LE) с вызванным рационом ожирением (DIO) крысы (Harlan Laboratories, Inc., Indianapolis, IN), начиная с отъема (около 3-недельного возраста) крысы получали рацион с высоким содержанием жира (Teklad TD 95217, 40% ккал из жиров, Harlan Laboratories, Madison, WI). Возраст крыс на начало исследования составлял 15-17 недель. Крыс содержали по одной на клетку, предоставляли неограниченный доступ к рациону с высоким содержанием жиров (Harlan TD.95217, 4,3 ккал/г) и воде, поддерживали цикл свет/темнота по 12 ч. с 5:00 до 17:00 при температуре 21°С и относительной влажности 50%, и давали возможность акклиматизироваться в течение по меньшей мере 10 дней до начала операций. Измерения исходного уровня измерений массы жировой ткани и массы не жировой ткани были взяты за 3 дня до начала инфузии пептида с использованием прибора QMR (Echo Medical Systems, Houston, TX). Измерения массы тела проводились 2 раза в неделю, начиная за три дня до операции. Крысы были рандомизированы в различные группы лечения (n=4-6 крыс/группа) в соответствии с процентом массы жировой ткани в теле и/или массы тела. Миниатюрные осмотические насосы Alzet (2 недели; Model 2002, Durect Corporation, Cupertino, CA) были заполнены в стерильных условиях носителем или пептидом один день до операции. В день операции крысы анестезировали под изофлураном и выбривали и очищали поверхность кожи на спине. Крысам подкожно вводили флунексин (2,5 мг/кг). Между лопатками выполняли хирургический разрез 1-2 см. Посредством тупой диссекции создавали подкожный туннель 2-3 см, в который вводили стерильный заполненный осмотический миниатюрный насос. Разрез на коже закрывали скрепками для кожи. Каждой крысе имплантировали один или два осмотических насоса, содержащие носитель или пептид в соответствии с их группой лечения. Все данные представлены в виде среднего значения ±SEM. Данные были проанализированы в Excel и/или Prism (GraphPad Software, Inc., La Jolla, CA) с использованием однофакторного дисперсионного анализа для сравнения каждой группы с соответствующей контрольной группой. Значения Р<0,05 считались такими, что указывают на существенное различие между группами лечения.
[00403] Размещение животных и уход за ними выполнялись в соответствии с международными программами по аккредитации содержания и использования AAALAC. Все процедуры были выполнены в соответствии с Законом о защите животных, правилами USDA и одобрены комитетом по содержанию и использованию лабораторных животных GlaxoSmithKline или Mispro.
Пример 11. Эффективность: изменение массы тела у крыс DIO через 13 дней.
[00404] У крыс LE DIO непрерывное дозированное введение соединения А2 и соединения А1 привело к зависимому от дозы снижению массы через 13 дней. Значительная эффективность 3,7, 3,9, 8,6 и 23,7% потери веса была достигнута при дозах соединения А2 0,01, 0,03, 0,1 и 0,3 мг/кг/сут. по сравнению с контрольным носителем (р<0,05) соответственно (фиг. 3В). В то время при применении соединения А1 достигается потеря веса 5,6, 3,5, 10 и 22,6% при дозе 0,01, 0,03, 0,1 и 0,3 мг/кг/сут. по сравнению с контрольным носителем (р<0,05) соответственно (фиг. 3С).
Пример 12. Эффективность соединения А104 по отдельности или в комбинации с эксендином-4 у крыс LE DIO
[00405] Непрерывное дозирование соединения А104 привело к зависимому от дозы уменьшению массы тела через 13 дней дозирования у крыса LE DIO. Значительная эффективность 4,2%, 16,5% и 25,2% потери веса была достигнута при дозах соединения А104 0,1, 0,3 и 1,0 мг/кг/сут. по сравнению с контрольным носителем (р<0,05) соответственно (фиг. 3А, левая панель). Циклические аналоги пептида глюкагона были затем использованы в комбинации с эксендином-4, полипептидом, содержащим аминокислотную последовательность H-His-Gly-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Leu-Ser-Lys-Gln-Met-Glu-Glu-Glu-Ala-Val-Arg-Leu-Phe-Ile-Glu-Trp-Leu-Lys-Asn-Gly-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-NH2 (SEQ ID NO: 142). В сочетании с эксендином-4 при 0,01 мг/кг/сут. (2,5% потери массы по отдельности), при дозах соединения А104 0,03, 0,1, 0,3 и 1 мг/кг/сут. достигается потеря веса 6,7, 11,7, 24,3 и 29,7% по отношению к контрольному носителю (р<0,05) через 13 дней у крыс LE DIO (фиг. 3А, правая панель).
Пример 13. Стационарная концентрация в плазме и скорости внутривенной инфузии эксенатида и GLP-1
[00406] Способы. Со ссылкой на график на фиг. 5, самцы крыс линии Спрег-Доули (Harlan, Indianapolis, IN) с массой 350-370 имели доступ ad libitum к воде и доступ ad libitum к пище (рацион LM-485, Teklad, Madison, WI) до момента за 18 часов до эксперимента.. Животное анестезировали галотаном во время катетеризации правой подкожной вены (для пептидных инфузий) и правой бедренной артерии (для забора крови и мониторинга артериального давления). Температуру в толстой кишке измеряли и контролировали. Эксенатид или GLP-1-(7-36)амид непрерывно вливали в течение 3 часов при одной из 3-х скоростей инфузии, 0,5, 5 или 50 нмоль/ч (n=4-6 для каждой группы). Артериальные образцы собирали каждые 30 мин в гепаринизированные капилляры Natelson, плазму отделяли на настольной центрифуге и затем замораживали при -20°С до анализа. Ингибиторы протеазы добавляли к образцам крови, собранным для измерения GLP-1, который анализировали с помощью Linco, набор №EGLP-35K. Эксенатид анализировали с использованием двойного сэндвич-анализа.
[00407] Результаты. Концентрации в плазме эксендина-4 и GLP-1 во время инфузии 0,05, 0,5, 5 и 50 нмоль/ч. приблизились к стационарному состоянию в пределах -30 мин. Каждая из стационарных концентраций обоих пептидов в плазме зависела от скорости введения. Соотношение между скоростью инфузии и стационарной концентрацией в плазме (среднее значений в последних 2 часов) показана тремя точками данных, которые находятся ниже всего относительно СКФ, а соотношение эксенатида показано тремя точками данных, наиболее приближенными к СКФ (обратите внимание что значения на оси X и оси Y отложены в логарифмических единицах). Данные отношения позволили рассчитать выведение каждого вещества. Скорости выведения из плазмы для эксенатида находятся в диапазоне от 3,7±0,5 до 8,3±0,7 мл/мин. Выведение GLP-1 находится в диапазоне от 34±4 до 38±3 мл/мин и 12-кратно превышает таковое у эксенатида. Выведение эксенатида приближено к задокументированному выведению инулина (маркер скорости клубочковой фильтрации). Соотношение между стационарной концентрацией и скоростью инфузии, ожидаемых для инсулина (выведение только путем клубочковой фильтрации, СКФ) показано черной пунктирной линией.
Пример 14. Стационарная концентрация в плазме и скорости внутривенной инфузии выделенных аналогов глюкагона
[00408] Со ссылкой на график, показанный на фиг. 6, эти данные включают в себя показанные на графике на фиг. 5, и дополнительно содержат стационарные концентрации (перевернутые треугольники) нативного глюкагона при его введении внутривенно при 2-х различных скоростях введения в анестезированным крысам (с использованием процедур, описанных в примере 13). Обозначенные квадратами точки данных, ближайшие к СКФ, обозначают измеренные концентрации в плазме 2-х аналогов глюкагона (Соединений А1 и А2) при их непрерывном введении в подкожное пространство посредством миниатюрного осмотического насоса. Близость обозначенных квадратами точек данных на пунктирной линии СКФ указывает на то, что (а) подкожная биодоступность была высокой, и что (б) выведение из сосудистого отделения согласуется с таковым посредством клубочковой фильтрации.
Пример 15. Значения выведения для выбранных аналогов глюкагона
[00409] Со ссылкой на иллюстрации на фиг. 7, выведение определяли в многочисленных экспериментах, выполненных как описано выше (в примере 14), за исключением того, что скорость внутривенной инфузии была равномерной и составляла 10 мкг/кг/час. Выбранные значения для выделения, выраженные в мл/мин на кг массы тела, полученных при таких экспериментах, приведены в таблице 5 ниже.
[00410] Три темные точки в верхней части распределения, ближе всего к СКФ, взяты из рядов 1, 2 и 5 в таблице 5 и соответствуют соединениям Al, А2 и A3. Повторяющиеся эксперименты в строках 3 и 4 возвращают значения, очень похожие на таковые в строках 1 и 2. Обратите внимание, что вертикальные оси являются логарифмическими и обратными, так что лиганды с наименьшим выведением находятся в верхней части графика рассеяния. Помеченная сплошной линией СКФ представляет собой опубликованные значения у крыс. Значения из строк 1, 2 и 5 близки к этой границе, что соответствует тому, что такие аналоги выводятся из плазмы посредством клубочковой фильтрации. Другая темная точка на пунктирной линии с надписью «глюкагон», наиболее далекая от СКФ, представляет собой значение, полученное для нативного (человеческого/крысиного) глюкагона в данном исследовании. Другая пунктирная линия, наиболее близкая к СКФ, помеченная «эксенатид», построена на основе опубликованных значений для эксенатида, полученных в этой модельной системе. Оказывается, что выведение эксенатида близко к клубочковой фильтрации, с небольшой долей выведения иными способами, отличными от клубочковой фильтрации. Значения нескольких аналогов превысили значения относительно приближения к клубочковой фильтрации в качестве предельного режима выведения. Не будучи связаны теорией, мы полагаем, что эти аналоги могут быть еще более устойчивыми к пептидазному расщеплению чем эксенатид. Несколько аналогов имели более высокую скорость выведения относительно нативного глюкагона. Данный факт является иллюстрацией того, что все изменения в последовательности не обязательно являются полезными.
Пример 16. Сравнение зависимости потери веса от доз у крыс при непрерывном введении эксенатида или выбранного аналога глюкагона
[00411] Со ссылкой на график на фиг. 8, черные кружки на графике означают изменения массы тела в течение 13 дней, выраженные в виде процента от исходной массы тела у крыс с вызванным рационом ожирением, которым были имплантированы миниатюрные насосы, доставляющие соединение А1 (как описано в примере 10). Числа обозначают средние величины ±SEM (n=4 / группу дозы). Скорости доставки в подкожное пространство составляли 10, 30, 100, 200, 300 и 1000 мкг/кг/день. Процентное изменение массы тела взят относительно группы, которым вводили носитель (на «ноль» по оси абсцисс). Кривая, основанная на кругах точек данных, является наиболее подходящей 4-параметрической сигмоидной функцией, ограничивающей ответ носителя до 0 и максимальный ответ до -28%. Полученный ED50 составлял 65,7 мкг/кг/сут. Угловой коэффициент Хилла составлял -1,26.
[00412] Данные для эксенатида, протестированные на одной и той же модели, показаны в виде перевернутых треугольников. Скорости введения эксенатида составляли 3, 10, 40, 100, 150 и 500 мкг/кг/сут. Полученная в результате кривая, основанная на треугольных точках данных, является наиболее подходящей 4-параметрической сигмоидной функцией, ограничивающей ответ носителя до 0. Полученный максимальный ответ составлял потерю веса -12,2%. ED50 составлял 10,4 мкг/кг/сут. и угловой коэффициент Хилла составлял -1,85.
[00413] Как проиллюстрировано данными в таблице 6 ниже, введенное отдельно соединение А1 был почти таким же активным in vivo, как и эксенатид, и вызывало в 2,3 раза большую максимальную потерю веса по сравнению с эксенатидом.
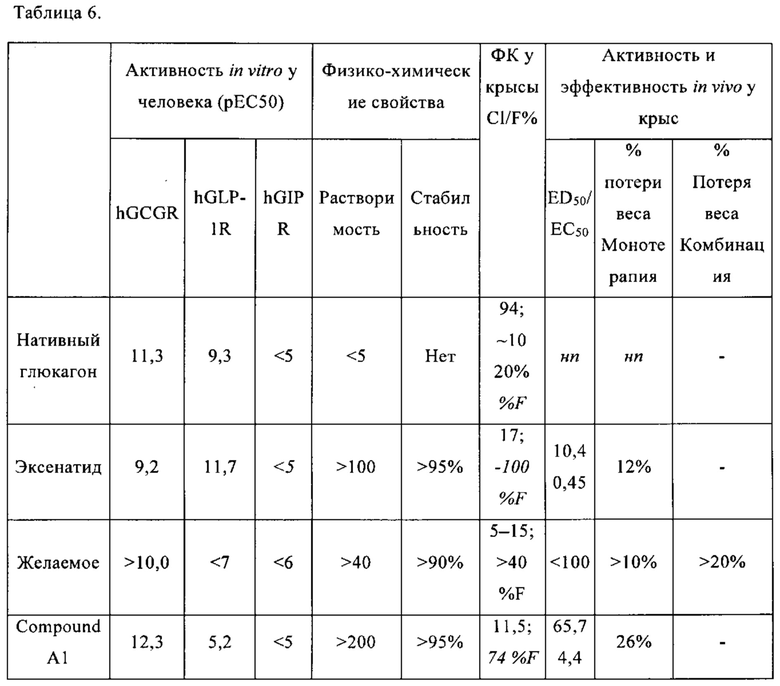
Пример 17. Сравнение зависимости потери веса от доз у крыс при непрерывном введении выбранных аналогов глюкагона
[00414] Со ссылкой на график, показанный на фиг. 9, символы обозначают среднее значение ± SEM изменения массы тела в процентах инфузии в течение 13 дней введения соединения А1 (кружки), соединения А2 (квадраты) или соединения A3 (треугольники) у крыс с ожирением, вызванным рационом (как показано на фиг. 8). Скорости введения для соединения А1 составляли 0, 10, 30, 100, 200, 300 и 1000 мкг/кг/сут. Для соединения А2 они составляли 0, 3, 10,30, 100, 200 и 300 мкг/кг/сут., а для соединения A3, 0,3, 10,30, 100 и 300 мкг/кг/сут.
[00415] Три кривые представляют собой наиболее подходящие 4-параметрические сигмоидные кривые для каждого набора данных. Приближения были ограничены до общего процентного изменения веса у групп носителя. Поскольку все вещества функционировали посредством общего пути (сигнализация глюкагон), они были ограничены до общей максимальной результирующей потери веса, составляющей 27,2% в течение 13 дней. Для соединений A1, А2 и A3, ED50 составляли 51, 271 и 535 мкг/кг/сут. соответственно. Угловые коэффициенты Хилла составляли -1,43, -1,25 и -1,12 соответственно. Эксперимент показывает, что, несмотря на то, что каждый аналог был оптимизирован относительно фармакокинетических свойств, активности in vivo были разными и что для экспериментов необходимо выбрать аналог с самой высокой эффективностью in vivo.
Пример 18. Сравнение зависимости потери веса от доз у крыс при непрерывном введении выбранных аналогов глюкагона, в виде монотерапии или в комбинации с эксенатидом
[00416] Данные графика на фиг. 10 иллюстрируют среднее значение (±SEM) процентного изменения веса тела у крыс с ожирением, вызванным рационом, в течение 27 дней лечения. Средний начальный вес тела составлял 564±4 г. Животным (n=8 / группа дозы) имплантировали миниатюрный осмотической насос, доставляющий соединения А1 с сопутствующей доставкой эксенатида в дозе 10 мкг/кг/сут. или без нее (как описано в примере 10). Соединение А1 было доставлено со скоростями 0, 7, 5, 24 или 50 мкг/кг/сут. Таким образом было проведено 2 эксперимента на оценку ответа на дозу соединения А1, один без эксенатида и один с эксенатидом. Было дополнительная группа, получающая такое же кормление, которой каждый день предлагали то же самое количество пищи, которое группа, получавшая соединение А1 50 мкг/кг/сут. + эксенатид 10 мкг/кг/сут., потребляла в предыдущий день. Суть группы, получавшей такое же кормление, в возможности оценки количества потери веса в последней группе, обусловленного уменьшением потребления калорий по сравнению с таковым посредством других механизмов.
[00417] Черные кружки на графике отображают изменения за 27 дней массы тела у животных, получавших только соединение А1 (или носитель). Животные, которым вводили носитель или соединение А1 в дозе 7,5 и 24 мкг/кг/сут., показали небольшое увеличение массы тела-4%, в то время как наиболее высокая скорость инфузии показала снижение на 16,8%.
[00418] Треугольники обозначают процентное изменение за 27 дней массы тела у групп животных, получавших схожее лечение, но с добавлением эксенатида в дозе 10 мкг/кг/сут. Такое введение само по себе приводит к снижению массы тела на 4,2%, что показывает относительное отличие от групп, получавших только носитель (7,9%). Квадраты представляют собой ожидаемую от монотерапии эксенатидом потерю веса в 7,9%, добавленную к наблюдаемым изменениям веса у групп, получавших монотерапию соединением А1, представляя арифметическую сумму ответов каждого компонента.
[00419] Пунктирная линия представляет собой сигмовидную кривую, проведенную через точки, представляющие собой арифметические суммы, полученные данным способом. В отличии от ожидаемого ответа (являющегося арифметической суммой ответов на монотерапии средствами), наблюдаемые реакции от введения комбинации соединения А1 (24 и 50 мкг/кг/сут.) с эксенатидом при 2 наивысших скоростях введения дали потерю веса, что была больше чем предполагалось. То есть, имел место сверхаддитивный (синергический) эффект.Максимальная ответная потеря веса, составила ~47% вместо ~27%.
Пример 19. Воздействие аналога глюкагона на потерю веса у крыс LE DIO после 27 дней.
[00420] Описанные выше процедуры были использованы для контроля потери веса у крыс LE DIO при введении эксенатида, аналога глюкагона («GCG») при определенных значениях ED10, ED30 и ED50, или комбинации эксенатида и аналога GCG при определенных ED10, ED30 и ED50. Процентные значения потери веса были рассчитаны в течение 27 дней после лечения (Фиг. 11). Фигура 11 представляет собой гистограмму с альтернативным изображением данных, представленных на фигуре 10.
Пример 20. Воздействие аналога глюкагона на триглицеридов в сыворотке крови, содержание жира в печени и вес печени у крыс линии Zucker с ожирением (ZDF) после 14 дней.
[00421] Самцы крыс линии Zucker с ожирением (ZDF) были получены в возрасте 6 недель (Charles River, Raleigh, NC) и используются в исследовании в возрасте 8 недель. После получения крыс помещали по 1 в клетку с подстилкой alpha dri ((Shepherd Specialty Papers, Inc., Kalamazoo, MI) со свободным доступе к рациону Purina 5008 (Lab Diet, St. Louis, МО) и воде, и поддерживали цикл свет/темнота по 12 ч. с 5:00 до 17:00 при температуре 21°С и относительной влажности 50%, и давали возможность акклиматизироваться в течение по меньшей мере 9 дней до начала операций.
[00422] Крысам вводили эксенатид (0,01 мг/кг/сут. в 10% ДМСО/вода) и/или аналог глюкагона, соединение А104, (0,03, 0,1, 0,3, 1,0 или 3,0 мг/кг/сут. в 10% ДМСО/вода) посредством размещенных подкожно (подкожн.) осмотических насосов Alzet, модель 2002 (DURECT Corporation, Cupertino, СА). Насосы Alzet в стерильных условиях заполняли либо носителем (10% ДМСО/стерильна вода), либо эксенатидом в день операции. Крыс анестезировали изофлураном, поверхность кожи на спине брили и очищали хлоргексидином и стерильной водой. Крысам внутрикожно вводили лидокаин (анальгетик, 0,1 мл 0,125% лидокаина). Между лопатками выполняли хирургический разрез 1-2 см. Посредством тупой диссекции создавали подкожный туннель 2-3 см, в который вводили стерильный заполненный осмотический миниатюрный насос. Разрез на коже закрывали скрепками для кожи. После операции отслеживали восстановление крыс от изофлурановой анестезии.
[00423] Образцы крови были взяты из крови на базовом уровне (день -3) из хвостовой вены для измерения уровня триглицеридов. Конечные образцы крови собирали путем пункции сердца под анестезией изофлураном (день 14). Сыворотки изготавливали в соответствии с протоколом производителя с использованием пробирок T-MG и ЭДТУ соответственно [Terumo Medical Corporation, Elkton, MD], после окончательного слива крови печень собирали, взвешивали и гомогенизировали для биохимического анализа (фиг. 13). Биохимический анализ образцов сыворотки и гомогената печени выполняли с использованием биохимического анализатора Olympus AU640 (Olympus America Inc., Melville, NY) с параметрами протокола и способа в соответствии с описанием производителя для анализа триглицеридов.
[00424] Размещение животных и уход за ними выполнялись в соответствии с международными программами по аккредитации содержания и использования AAALAC. Все процедуры были выполнены в соответствии с Законом о защите животных, правилами USDA и одобрены комитетом по содержанию и использованию лабораторных животных GlaxoSmithKline или Mispro.
[00425] У крыс ZDF непрерывное дозирование соединения А104 в качестве монотерапии и в сочетании с эксенатидом (Ех4) привело к дозозависимому снижению триглицеридов в сыворотке после 14 дней (фиг. 12). Соединение А104 также дозозависимо снижало содержание жира в печени и вес печени после 14 дней (фиг. 13).
Пример 21. Общий способ синтеза для введения липофильных заместителей и спейсеров формулы II
[00426] Липофильный заместитель и спейсер формулы II были включены в множество раскрытых пептидов:
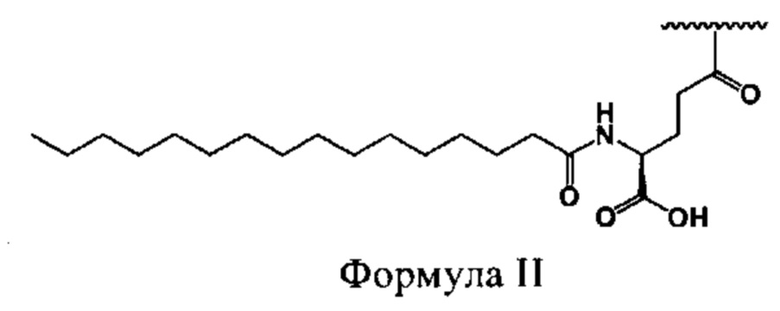
где указанный карбонил в структуре формулы II был ковалентно связан с ε-аминогруппой лизинового остатка пептида по раскрытию с образованием амидной связи.
[00427] Линейная последовательность пептида синтезировали на пептидном синтезаторе Prelude (Protein Technologies Inc., Tucson, AZ) с помощью твердофазных методов с использованием стратегии Fmoc с активацией 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурангексафторфосфатом (HBTU) или 2-(6-хлор-1-Н-бензотриазол-1-ил)-1,1,3,3-тетраметиламинийгексафторфосфатом (HCTU) (5-кратный молярный избыток) в N,N-диметилформамиде (ДМФ), и N'N-диизопропилэтиламине (DIEA) в качестве основания, 20% пиперидина/ДМФ удаления защитной группы Fmoc В качестве смолы использовали амидную смолу Ринка МВНА LL (Novabiochem) или N-α-Fmoc-защищенную предварительно загруженную Wang LL (Novabiochem) с загрузками 0,29-0,35 ммоль/г по шкале 20-400 мкмоль. В желаемом положении для замещения на цепи в пептидной цепи преимущественно был замещен FMOC-Lys(аллокс.)- ОН. Далее в качестве остатка N-концевой аминокислоты использовали Boc-Tyr(tbu)-OH или Вос-Trp(Вос)-ОН. После завершения синтеза смолу промывали дихлорметаном (ДХМ) и сушили под вакуумом в течение 30 минут. Затем защитную группу аллилоксикарбонила удаляли с использованием раствора тетракис в (CHCl3/уксусной кислоте/N-метилморфолине в соотношении 37:2:1). Смолу последовательно промывали 0,5% раствором диэтилдитиокарбамата натрия тригидрата в ДМФ, а затем 0,5% раствором DIEA в ДМФ, и, наконец, ДМФ. Далее FMOC-Glu(Otbu)-OH связывали со свободной боковой цепью лизина с использованием нормальных условий твердофазного способа. Боковую цепь С-16 ацила добавляли с использованием пальмитиновой кислоты в соответствии с обычными твердофазными способами. Окончательное снятие защиты и отщепление пептида от твердой подложки осуществляли путем обработки смолы (92,5% TFA, 2,5% фенола, 2,5% воды и 2,5% триизопропилсилана) в течение 2-3 часов. Отщепленный пептид осаждали с помощью холодного диэтилового эфира. Диэтиловый эфир декантировали и твердое вещество снова растирали с холодным диэтиловым эфиром, осаждали центрифугированием и лиофилизировали. Лиофилизированное твердое вещество повторно растворяли в растворе ацетонитрил/вода 1:1 с 0,1% TFA (10-15 мл), очищали посредством обратно-фазовой ВЭЖХ на колонке Waters XBridge™ ВЕН 130, CI8, 10 пм, 130  , 30 X 250 мм ВД, с использованием градиента с диапазонами ацетонитрил/вода 5-75% с 0,1% TFA в течение более 30 минут при скорости потока 30 мл/мин, λ - 215 нм. Нагреватель колонки установили на 60°С. Очищенный продукт лиофилизировали и анализировали с помощью ИЭР-ЖХ/МС и аналитической ВЭЖХ; и было продемонстрировано, что он является чистым (>98%). Все полученные массы соответствовали расчетным значениям,
, 30 X 250 мм ВД, с использованием градиента с диапазонами ацетонитрил/вода 5-75% с 0,1% TFA в течение более 30 минут при скорости потока 30 мл/мин, λ - 215 нм. Нагреватель колонки установили на 60°С. Очищенный продукт лиофилизировали и анализировали с помощью ИЭР-ЖХ/МС и аналитической ВЭЖХ; и было продемонстрировано, что он является чистым (>98%). Все полученные массы соответствовали расчетным значениям,
[00428] Условия анализа ВЭЖХ: 4,6×250 мм XBridge ВЕН130, 5 мкм, колонка С18 с использованием аналитической Agilent 1100 со следующим градиентом: от 20% до 100% в течение 15 мин и удержании при 100% до 20 минут. Температура колонки была установлена на уровне 40°С. Скорость потока была установлена на уровне 1,0 мл/мин. Растворители состоял из А=H2O+0,1% TFA и Б=ацетонитрил+0,1% TFA. Наблюдали необработанные и окончательные ЖХМС и массу продукта идентифицировали с использованием следующих условий: УФ-детектор установлен на уровне 215 и 280 нм.
[00429] Условия анализа ЖХМС: 4,6×250 мм XBridge ВЕН130, 5 мкм, колонка С18 с использованием аналитической Agilent 1100 в комбинации с системой ЖХ/МС/МС API-4000 Sciex со следующим градиентом: от 20% В до 95% В в течение 10 мин, удержание при 95% для промывания колонки в течение 1,2 мин. Уравновешивание колонки при 5% В, 95% А до 12,5 мин. Температура колонки была установлена на уровне 40°С. Скорость потока была установлена на уровне 1,5 мл/мин. Растворители состоял из А=H2O+0,1% TFA и Б=ацетонитрил+0,1% TFA. УФ-детектор установлен на уровне 215 и 280 нм. Способ = Q1 МС. Размер шприца 100 мкл, УФ-диапазон 190-400 нм, ширина зазора = 4mm, частота проб = >20 Гц., источник ионов: Turbo spray, полярность = положительная.
Пример 22. Общий способ синтеза для введения липофильных заместителей и спейсеров формулы III
[00430] Липофильный заместитель и спейсер формулы III были включены в множество раскрытых пептидов:
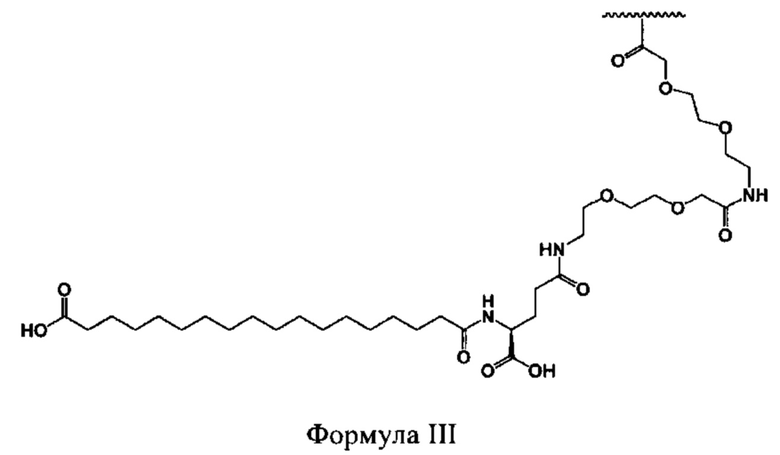
где указанный карбонил в структуре формулы III был ковалентно связан с ε-аминогруппой лизинового остатка пептида по раскрытию с образованием амидной связи.
[00431] Линейная последовательность пептида синтезировали на пептидном синтезаторе Prelude (Protein Technologies Inc., Tucson, AZ) с помощью твердофазных методов с использованием стратегии Fmoc с активацией 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурангексафторфосфатом (HBTU) или 2-(6-хлор-1-Н-бензотриазол-1-ил)-1,1,3,3-тетраметиламинийгексафторфосфатом (HCTU) (5-кратный молярный избыток) в N, N-диметилформамиде (ДМФ), и N'N-диизопропилэтиламине (DIEA) в качестве основания, 20% пиперидина/ДМФ удаления защитной группы Fmoc В качестве смолы использовали амидную смолу Ринка МВНА LL (Novabiochem) или N-α-Fmoc-защищенную предварительно загруженную Wang LL (Novabiochem) с загрузками 0,29-0,35 ммоль/г по шкале 20-400 мкмоль. В желаемом месте для замещения на цепи в пептидной цепи преимущественно был замещен FMOC-Lys(аллокс.)- ОН. Далее в качестве остатка N-концевой аминокислоты использовали Boc-Tyr(TBU)-OH или Вос-Trp(Вос)-ОН. После завершения синтеза смолу промывали дихлорметаном (ДХМ) и сушили под вакуумом в течение 30 минут. Затем защитную группу аллилоксикарбонила удаляли с использованием раствора тетракис в (CHCl3/уксусной кислоте/N-метилморфолине в соотношении 37:2:1). Смолу последовательно промывали 0,5% раствором диэтилдитиокарбамата натрия тригидрата в ДМФ, а затем 0,5% раствором DIEA в ДМФ, и, наконец, ДМФ. Далее, удлинение спейсерной области выполняли посредством связывания {2-[2-(Fmoc-амино)этокси}уксусной кислот с последующим FMOC-Glu (Otbu) -ОН, используя нормальные твердофазные условия. С-18, концевую боковую цепь кислоты, добавляли с использованием октадекандиоевой кислоты, используя нормальные твердофазные условия. Окончательное снятие защиты и отщепление пептида от твердой подложки осуществляли путем обработки смолы (92,5% TFA, 2,5% фенола, 2,5% воды и 2,5% триизопропилсилана) в течение 2-3 часов. Отщепленный пептид осаждали с помощью холодного диэтилового эфира. Диэтиловый эфир декантировали и твердое вещество снова растирали с холодным диэтиловым эфиром, осаждали центрифугированием и лиофилизировали. Лиофилизированное твердое вещество повторно растворяли в 1:1 ацетонитриле/воде с 0,1% TFA (10-15 мл), очищали посредством обратно-фазовой ВЭЖХ на колонке Waters XBridge™ ВЕН 130, С18, 10 пм, 130  , 30 X 250 мм ВД, с использованием градиента с диапазонами ацетонитрил/вода 5-75% с 0,1% TFA в течение более 30 минут при скорости потока 30 мл/мин, λ - 215 нм. Нагреватель колонки установили на 60°С. Очищенный продукт лиофилизировали и анализировали с помощью ИЭР-ЖХ/МС и аналитической ВЭЖХ; и было продемонстрировано, что он является чистым (>98%). Все полученные массы соответствовали расчетным значениям.
, 30 X 250 мм ВД, с использованием градиента с диапазонами ацетонитрил/вода 5-75% с 0,1% TFA в течение более 30 минут при скорости потока 30 мл/мин, λ - 215 нм. Нагреватель колонки установили на 60°С. Очищенный продукт лиофилизировали и анализировали с помощью ИЭР-ЖХ/МС и аналитической ВЭЖХ; и было продемонстрировано, что он является чистым (>98%). Все полученные массы соответствовали расчетным значениям.
[00432] Условия анализа ВЭЖХ: 4,6 X 250 мм XBridge ВЕН130, 5 мкм, колонка С18 с использованием аналитической Agilent 1100 со следующим градиентом: от 5% до 70% в течение 15 мин и удержании при 70% до 20 минут. Температура колонки была установлена на уровне 40°С. Скорость потока была установлена на уровне 1,5 мл/мин. Растворители состоял из А=H2O+0,1% TFA и Б=ацетонитрил+0,1% TFA. Наблюдали необработанные и окончательные ЖХМС и массу продукта идентифицировали с использованием следующих условий: УФ-детектор установлен на уровне 215 и 280 нм.
[00433] Условия анализа ЖХМС: 4,6×250 мм XBridge ВЕН 130, 5 мкм, колонка С18 с использованием аналитической Agilent 1100 в комбинации с системой ЖХ/МС/МС API-4000 Sciex со следующим градиентом: от 5% до 65% в течение 10 минут с наращиванием до 95% до промывки колонки в течение 1 минуты и уравновешивания обратно до 5% органического до 12,5 минут. Температура колонки была установлена на уровне 40°С. Скорость потока была установлена на уровне 1,5 мл/мин. Растворители состоял из А=H2O+0,1% TFA и Б=ацетонитрил+0,1% TFA. УФ-детектор установлен на уровне 215 и 280 нм. Способ = Q1 МС. Размер шприца 100 мкл, УФ-диапазон 190-400 нм, ширина зазора = 4mm, частота проб=>20 Гц., источник ионов: Turbo spray, полярность = положительная.
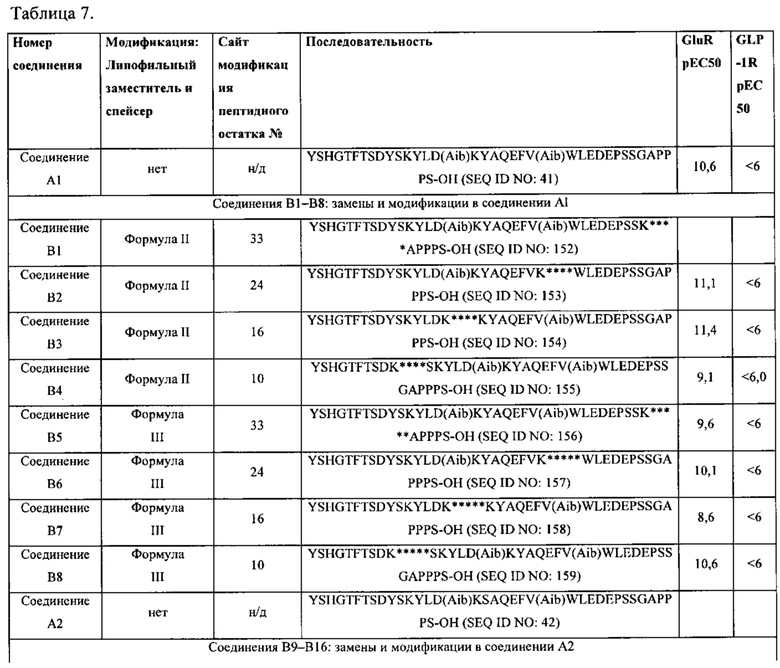

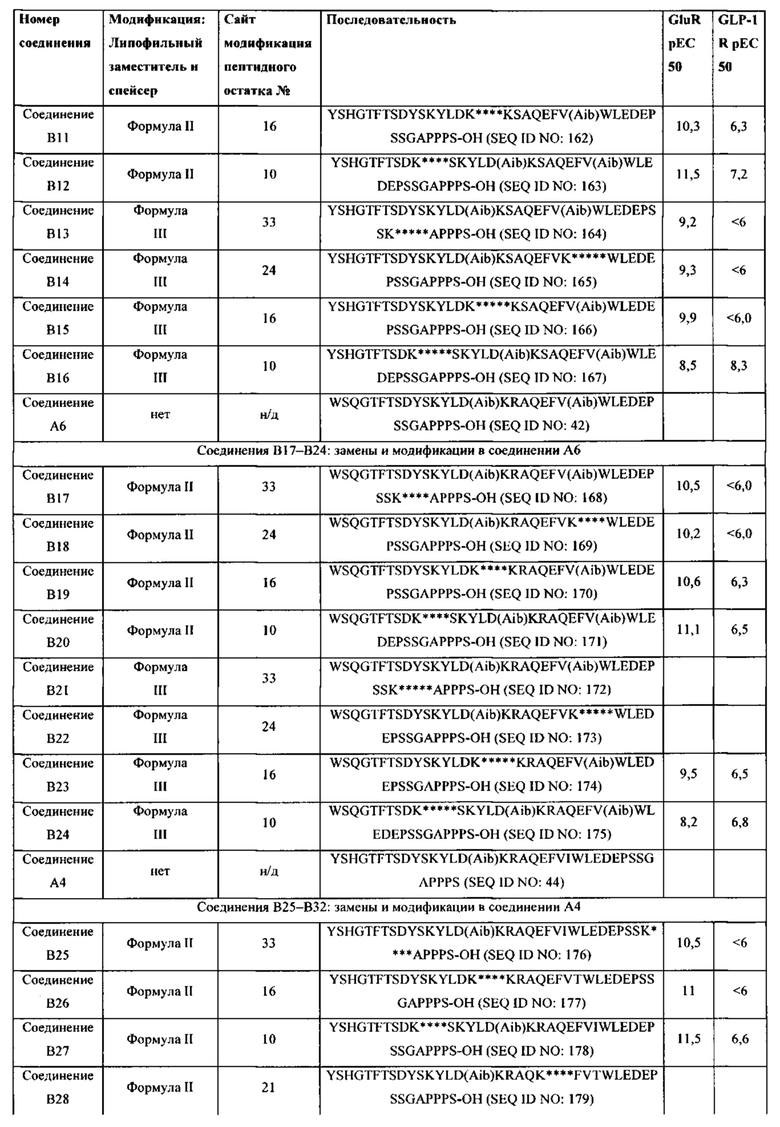

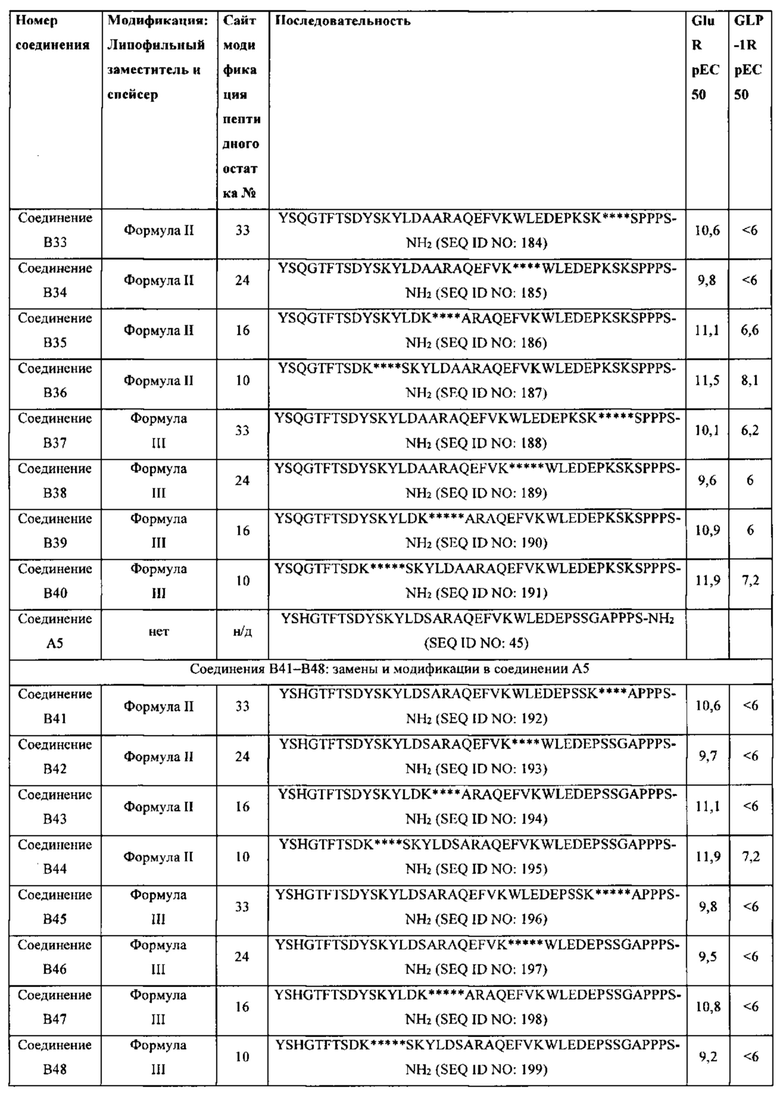
[00434] Каждая ε-аминогруппа остатка лизина, расположенная на указанном пептидный остатке (K****) в раскрытых соединениях, ковалентно связана с указанным карбонилом структуры формулы II с образованием амида:
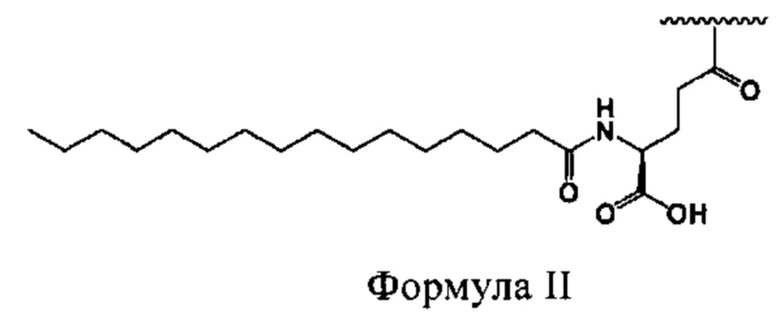
[00435] Каждая ε-аминогруппа остатка лизина, расположенная на указанном пептидный остатке (K*****) в раскрытых соединениях, ковалентно связана с указанным карбонилом структуры формулы III с образованием амида:
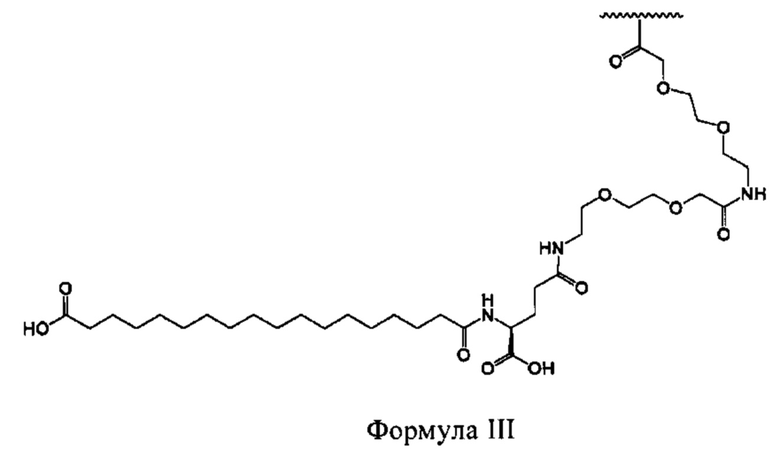
Пример 23. Выведение пептида из почек (CL) после внутривенной инфузии
[00436] Пептиды приготавливали в стерильном физиологическом растворе и вводили в виде 3-часовой внутривенной инфузии не натощак крысам-самцам Вистар линии Хан или крысам линии Спрег-Доули (n=3 на группу) через канюлю в яремной вене в конечной дозе 0,3 или 0,1 мг/кг. Препараты вводили со скоростью 1,67 мл/кг/час. Образцы крови (около 250 мкл) были собраны для фармакокинетического анализа через канюлю в бедренной вене через 1, 2, 3, 3,17, 3,33, 3,5, 4, 4,5, 5 и 6 ч. после начала инфузии в пробирки Microtainer, содержащие K2EDTA в качестве антикоагулянта и 25 мкл ингибитора протеазы. Плазму получали центрифугированием и хранили при -80°С до анализа.
[00437] Ацилированные пептиды приготавливали в стерильном физиологическом растворе и вводили в виде 1-часовой внутривенной инфузии не натощак крысам-самцам линии Спрег-Доули (n=3 на группу) через канюлю в яремной вене в конечной дозе 0,033 мг/кг. Препараты вводили со скоростью 1,67 мл/кг/час. Образцы крови (около 250 мкл) были собраны для фармакокинетического анализа через канюлю в бедренной вене через 0, 0,25, 0,5, 1, 1,17, 1,33, 1,5, 2, 4, 6, 8, 24, 30 и 48 ч. после начала инфузии в пробирки Microtainer, содержащие K2EDTA в качестве антикоагулянта и 25 мкл ингибитора протеазы. Плазму получали центрифугированием и хранили при -80°С до анализа. Показательные результаты представлены в Таблице 8 ниже.

Пример 24. Потеря веса у крыс при непрерывном введении эксенатида или аналога глюкагона
[00438] Каждой из крыс LE с вызванным рационом ожирением с начальным весом тела 586±86 (среднее значение±СО) имплантировали 2 миниатюрных осмотических насоса (Alzet), доставляющих, соответственно, эксенатид или аналог глюкагон, т.е. селективный агонист рецептора глюкагона (как описано в примере 10). Группы лечения составили 30 различные комбинации эксенатида и аналога глюкагона с 10-20 животными в каждой группе.
[00439] Вес тела измеряли каждые 7 дней. Результаты показаны на фиг. 14 в виде трехмерного графика потери веса на вертикальных (Z) осях, представленного в виде процента от начальной массы тела после 21 дня непрерывного дозирования. Положительная потеря веса, показанная в виде круга на вершине столбика, поднимающегося из базовой плоскости, таким образом, представляет собой уменьшение веса тела относительно массы тела до лечения. Для поддержания ясности, планки погрешностей не показаны.
[00440] Горизонтальные оси на рисунке 14, относятся к логарифму суточной дозы в единицах мкг на кг массы тела в сутки для одиночных точек эксенатида и аналога глюкагона. Десятичный логарифм дозы эксенатида -1 обозначает процедуры, в которых доза эксенатида была нулевой (лечение только аналогом глюкагона), и -1 на оси десятичного логарифма дозы глюкагона обозначают процедуры, в которых где глюкагон не дозировали (лечение только эксенатидом). Серия точек слева на переднем плане и справа на переднем плане таким образом изображают соотношение доза-реакция для монотерапии эксенатидом и для монотерапии аналогом глюкагона соответственно.
[00441] Потеря веса в ответ на монотерапию эксенатидом через 21 день лечения может быть описана 4-параметрической сигмоидной с максимальной потерей веса в ответ на лечение 12,5%, с ED50 9,6 мкг/кг/сут., и угловым коэффициентом Хилла 0,88. При монотерапии аналогом глюкагона, параметры 21-дневной потери веса составляли не более 28,5%, с ED50 45 мкг/кг/сут., и угловым коэффициентом Хилла 2,7.
Пример 25. Оценка комбинаций эксенатида и аналога глюкагона
[00442] На основании необработанных данных фиг. 14 была построена непрерывная функция для обеспечения возможности характеризации некоторых ключевых особенностей ответа на лечение комбинациями эксенатида и аналога глюкагона. Общая форма поверхности непрерывного ответа была следующей:
Ответ на комбинацию = (а*RespEX)+(b*RespGGN)+(с*RespEX*RespGGN), где RespEX и RespGGN представляют дозозависимые ответы, наблюдаемые на каждой одиночной точке.
[00443] Ответ на сочетание был дополнительно ограничен гиперболическим отношением таким образом, что он не может превышать 100% потерю веса, был получен лучше облегающие непрерывной поверхности отклика (R=0,9) по методу наименьших квадратов итерационным аппроксимация указанного выше определенного пользователем уравнения с использованием GraphPad Prism v7.0 (программное обеспечение GraphPad, San Diego, CA). Значения C>0 показывают наличие мультипликативного (сверхаддитивного) компонента.
[00444] Символы, представляющие каждую группу лечения, показаны в виде сфер, встроенных в сетку наиболее подходящей поверхности на фиг. 15. Соединяющие плоскости 4 ломаные кривые, отображающие монотерапию эксенатидом и монотерапию аналогом глюкагона представляют собой линии одинакового эффекта (изоболы), которые были бы получены при аддитивном взаимодействии в случае, когда одно вещество использовалось вместо эквивалентных эффективных доз других (показаны изоболы ожидаемых потерь веса 2%, 4%, 6% и 8%). Реально наблюдаемый ответ изображают 4 толстые сплошные линии, и они соответствуют поверхности отклика, соответствующей такому замещению дозы. Различия между сплошной линией (наблюдаемый ответ) и пунктирной линией (ожидаемый ответ) определяют синергическое взаимодействие. Для каждого уровня предсказанного эффекта существовало отношение доз, при которых эффект достиг максимума, а синергия была максимальной.
Пример 26. Оценка комбинаций с фиксированным соотношением эксенатида и аналога глюкагона
[00445] Поскольку комбинированный продукт может содержать вещества, вводимые в фиксированном соотношении, поверхность отклика была проанализирована с точки зрения возрастающих доз смесей с фиксированным соотношением.
[00446] Фиксированные соотношения доз изображены на фиг. 16 в виде параллельных диагональных плоскостей над базовой плоскостью соотношения десятичного логарифма эксенатида («ЕХ») с десятичным логарифмом аналога глюкагона («GGN»). Соотношение доза-реакция для каждой смеси показана в виде ряда черных кривых, где поверхность отклика пересекает каждую плоскость. На поверхности 4 серые кривые (показаны в виде толстых черных линий на фиг. 15) являются наблюдаемыми реакциями при использовании одного вещества вместо эквиэффективной дозы других, так называемого «отображение соотношения доз».
[00447] Толстая черная линия в месте пересечения серой плоскости фиксированного соотношения доз с поверхностью отклика, по-видимому, пересекается с 4 серыми линиями возле соответствующего оптимального соотношения доз. Серая плоскость определяет соотношение доз GGN:EX 3:1. Смеси GGN: ЕХ 10:1 и 1:1 также показали хорошие результаты.
Пример 27. Оценка активности in vivo
[00448] Оценка активности in vivo, которая определяется как эффект на единицу общей массы препарата, была выполнена для различного фиксированного соотношения комбинаций эксенатида / аналога глюкагона.
[00449] Для некоторых применений, такие как миниатюрный осмотический насос, в которых объем резервуара с препаратом ограничен, смесь с наиболее высокой проявленной активностью in vivo является наиболее полезной. Проявленная in vivo активность различных смесей может быть определена как эффект на единицу общей массы препарата (или более строго, на объем состава).
[00450] Ответы на смеси, показанные в виде поверхностей на фиг. 15 и фиг. 16, таким образом, могут быть сведены к двумерному ответу на дозы, показанному на фиг. 17. По оси X на фиг. 17 отложены не доза одного вещества, а масса обоих веществ в смеси с фиксированным соотношением.
[00451] Семейство ответов на дозы для различных смесей включает в себя один, где наименьшая комбинированная доза вызывает определенный эффект (примером может служить потеря веса на 20%, как указано горизонтальной стрелкой). Таким образом была определена перспективная смесь, представляющая собой смесь GGN:EX 3:1. Ответ на эту смесь, демонстрирующий самую высокую видимую активность, показан в виде пунктирной линии.
Другие варианты осуществления изобретения
[00452] Хотя данное изобретение было изложено в сочетании с его подробным описанием, вышеприведенное описание предназначено для иллюстрации, но не для ограничения объема изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в рамках следующих пунктов формулы изобретения.
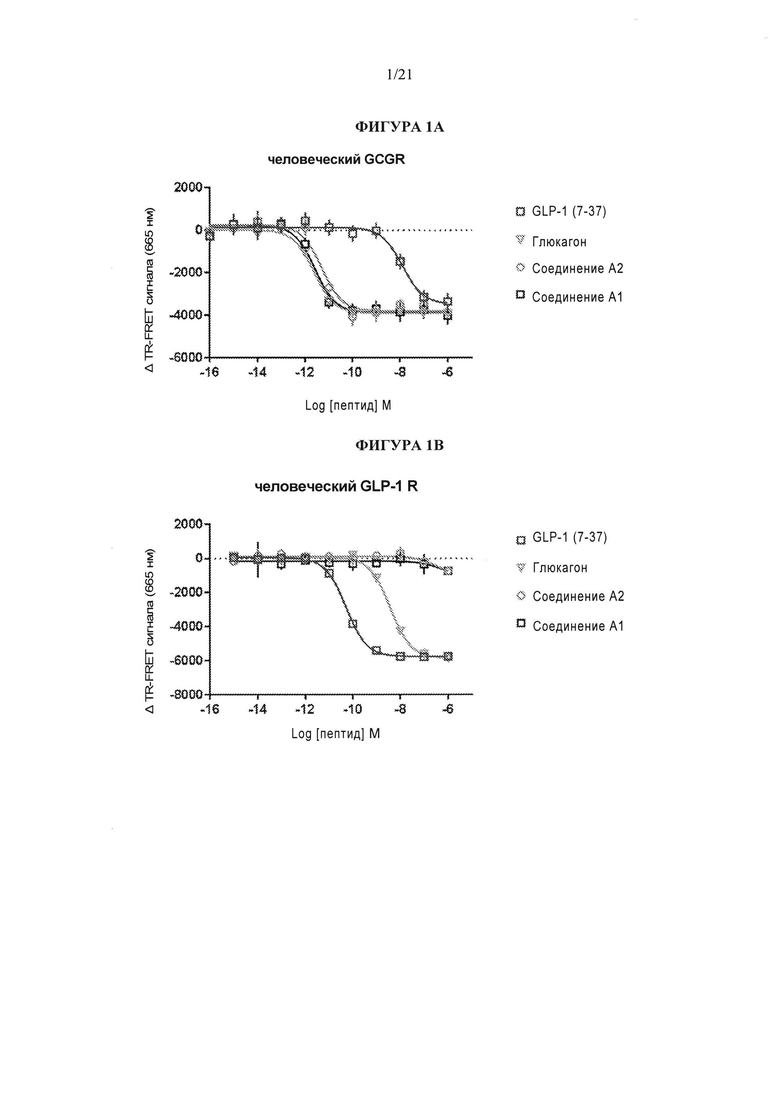
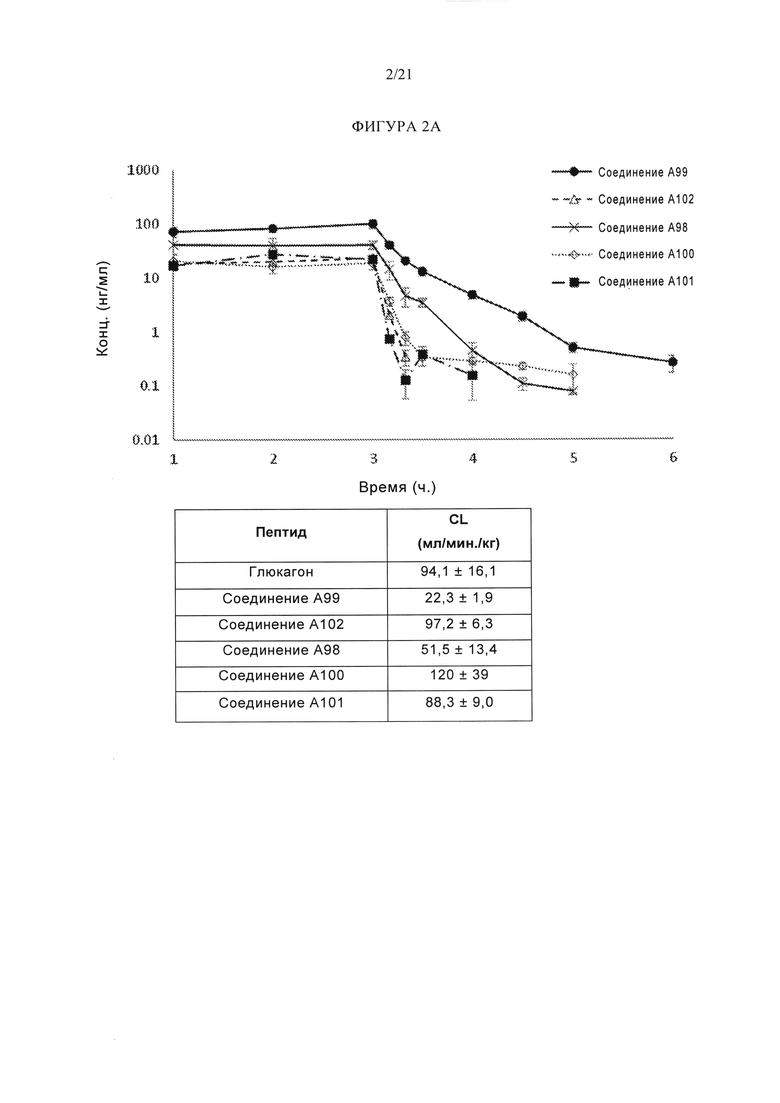
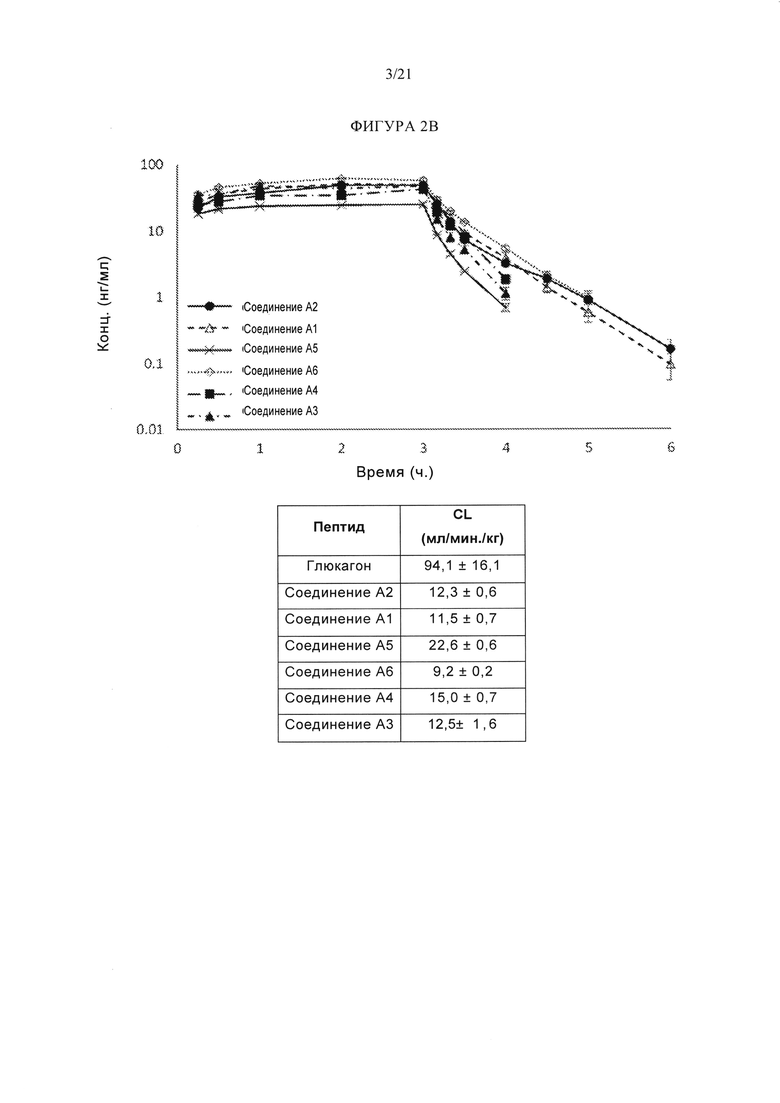
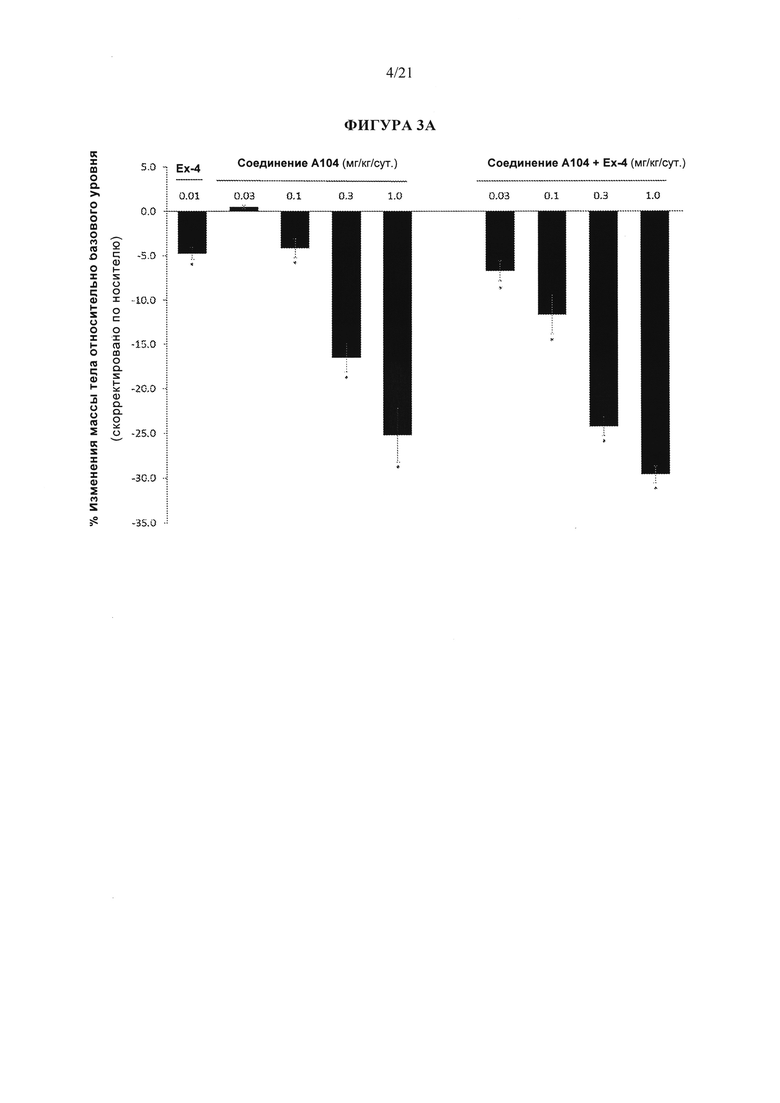
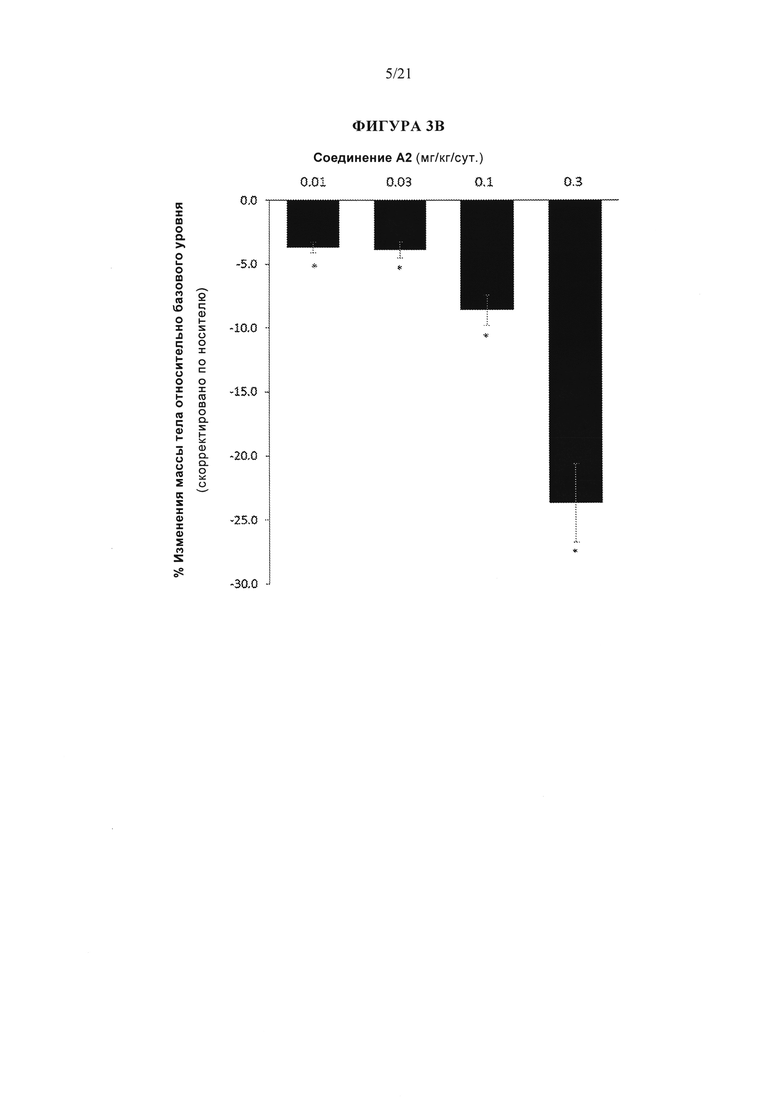
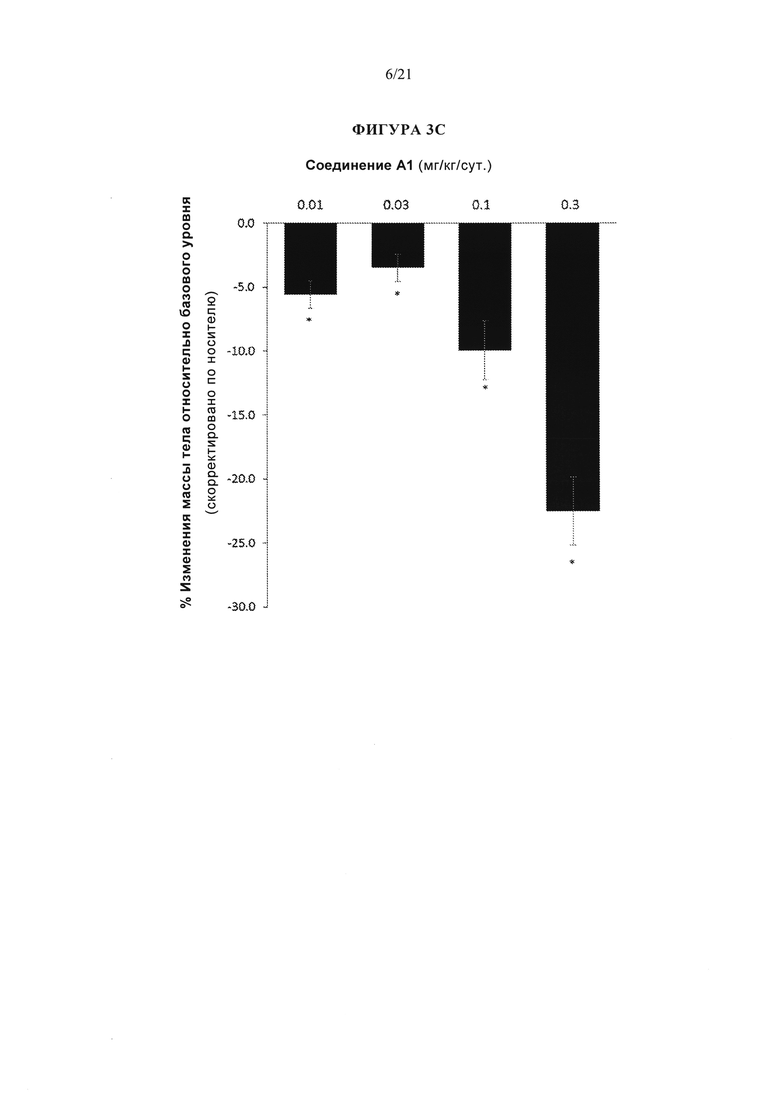
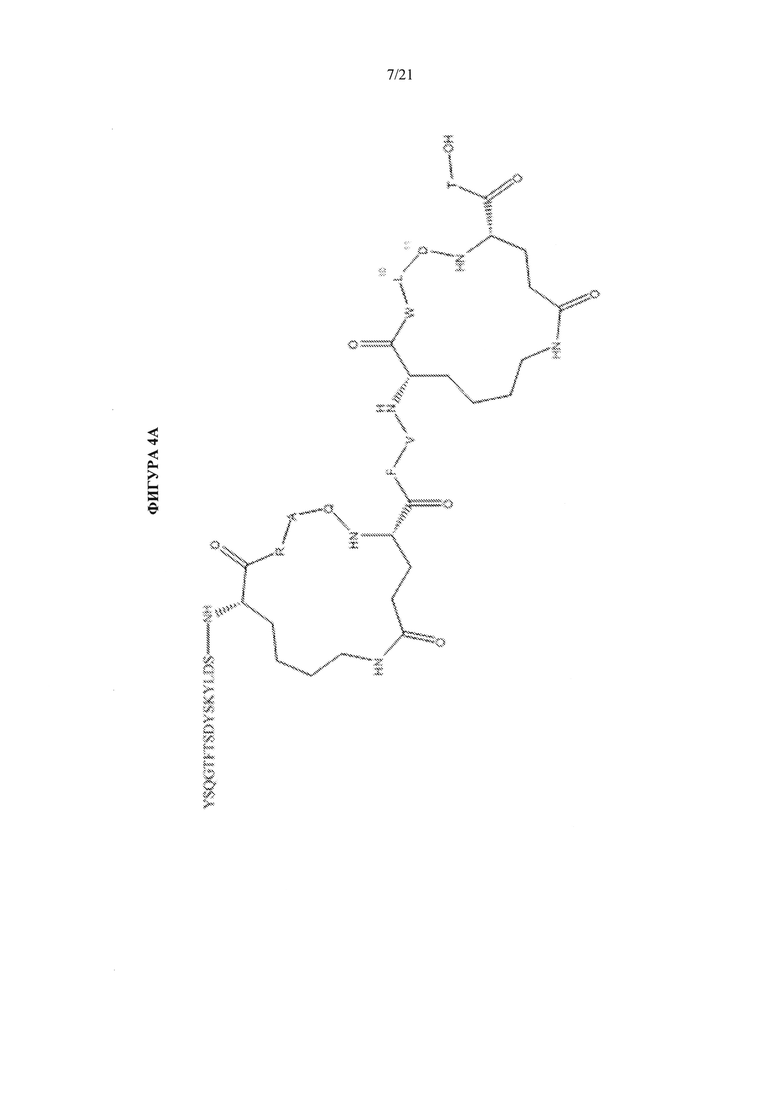
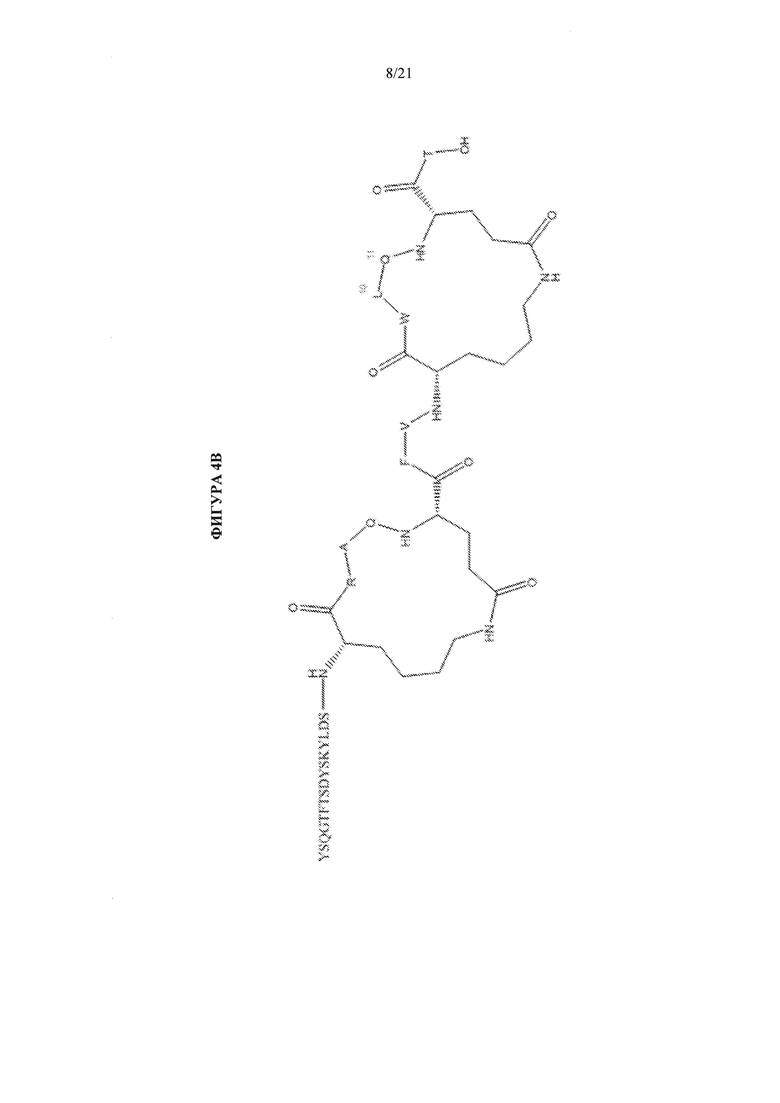
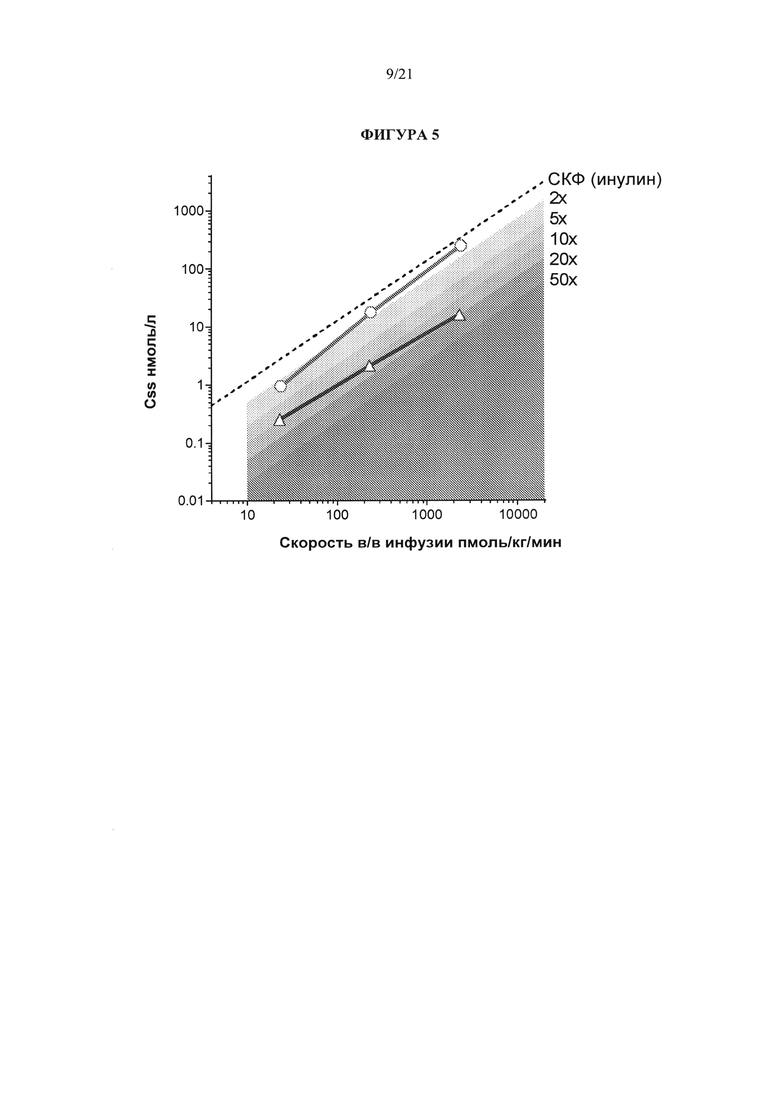
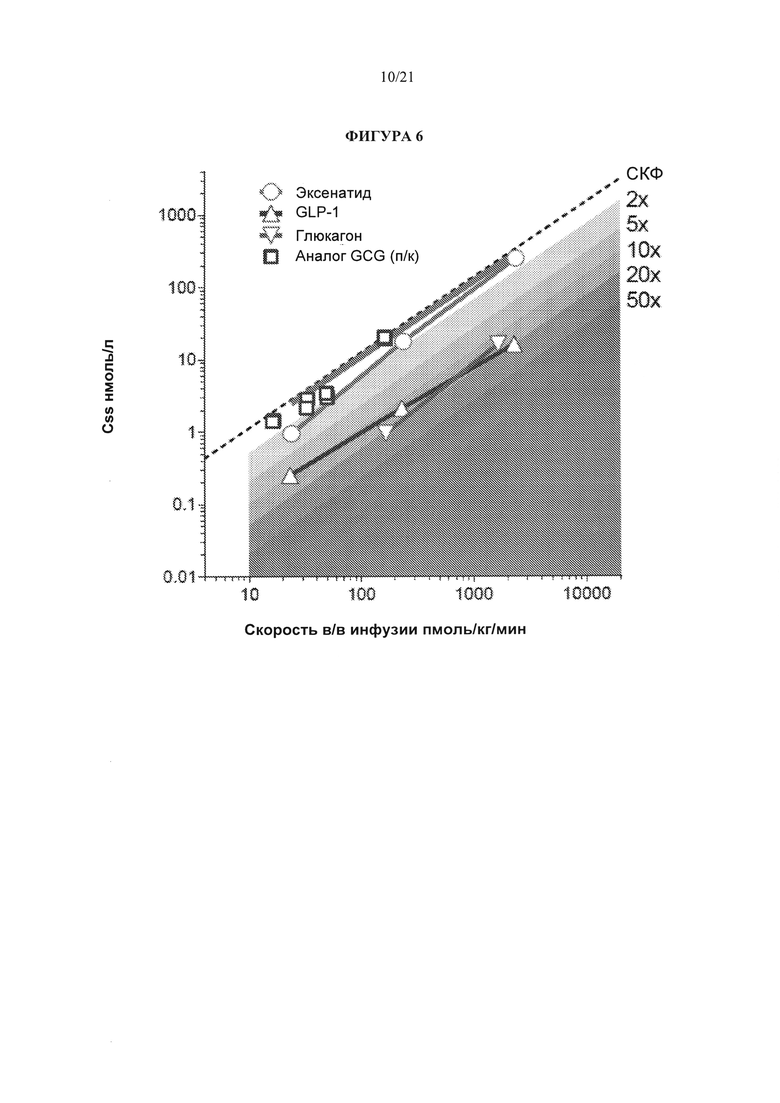
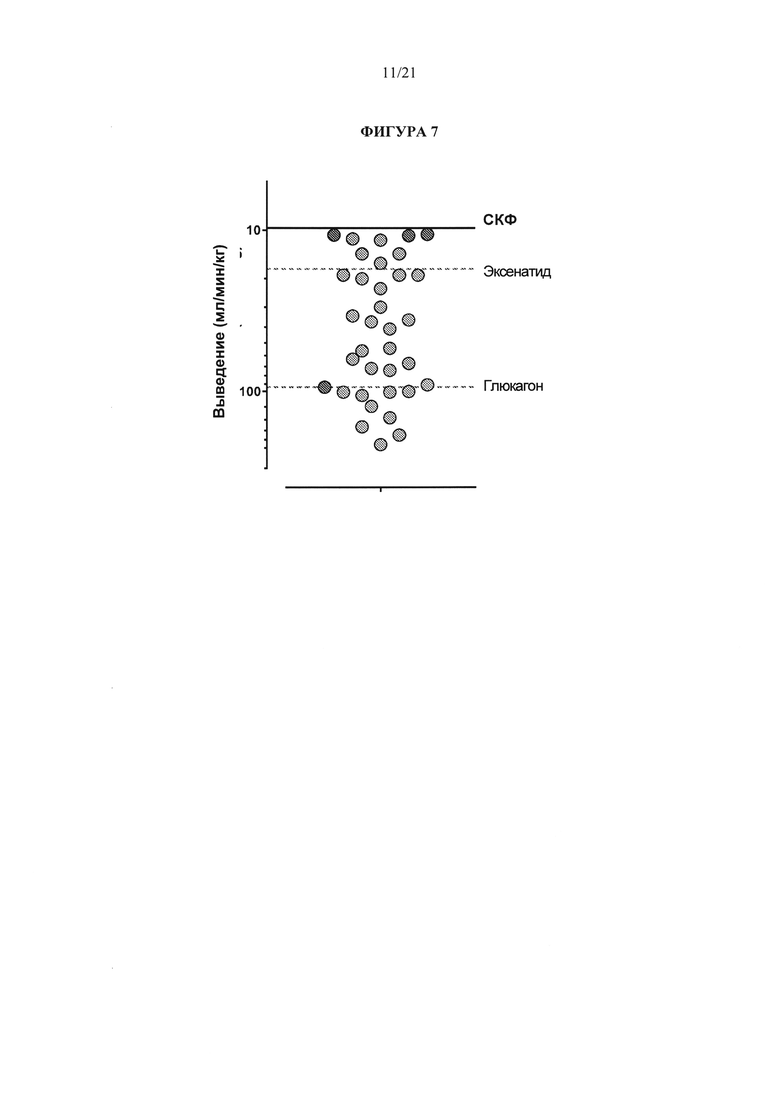
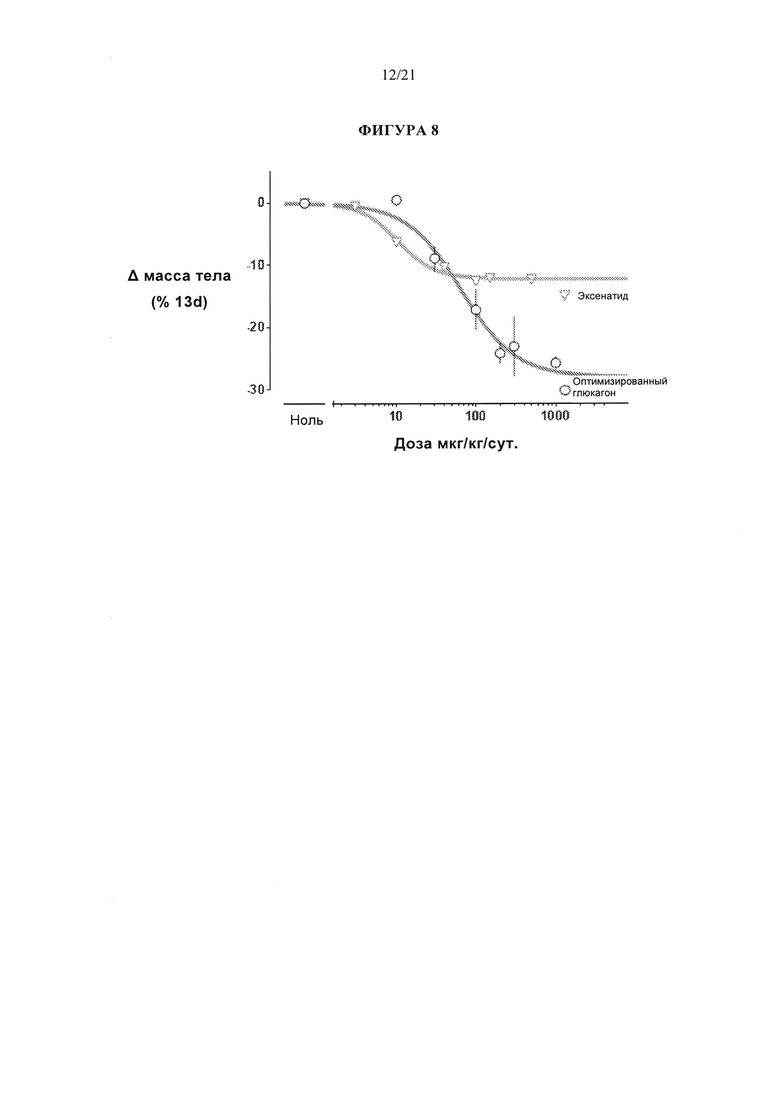
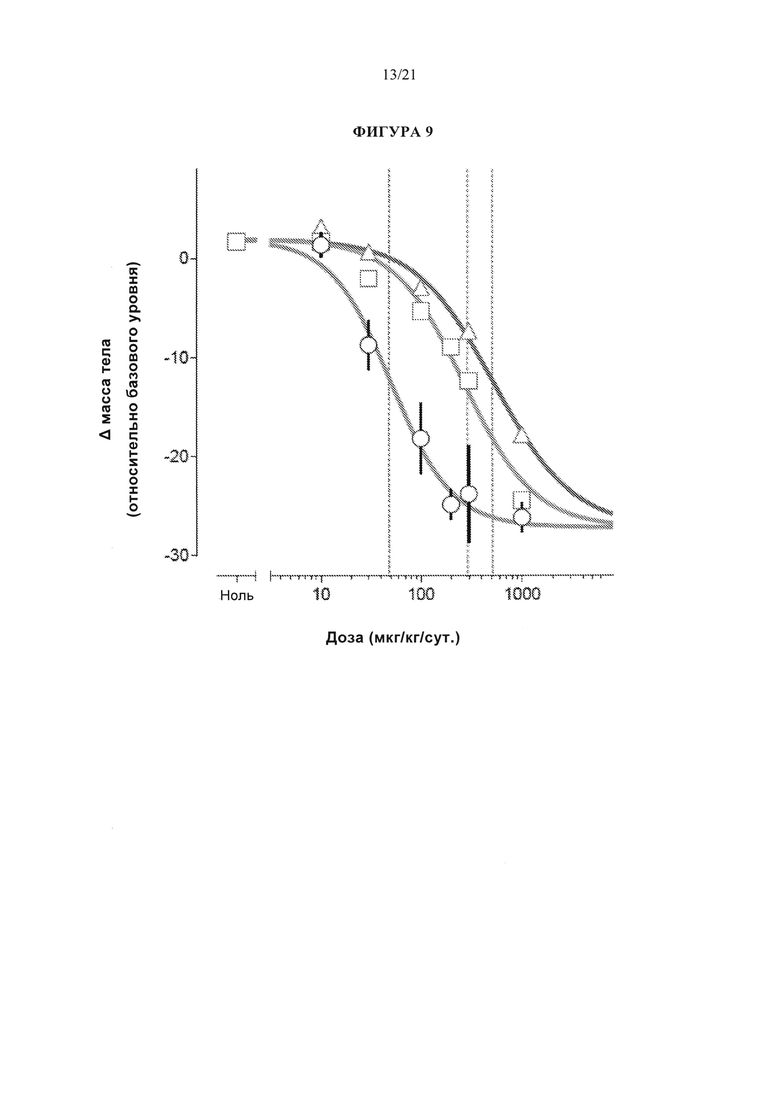
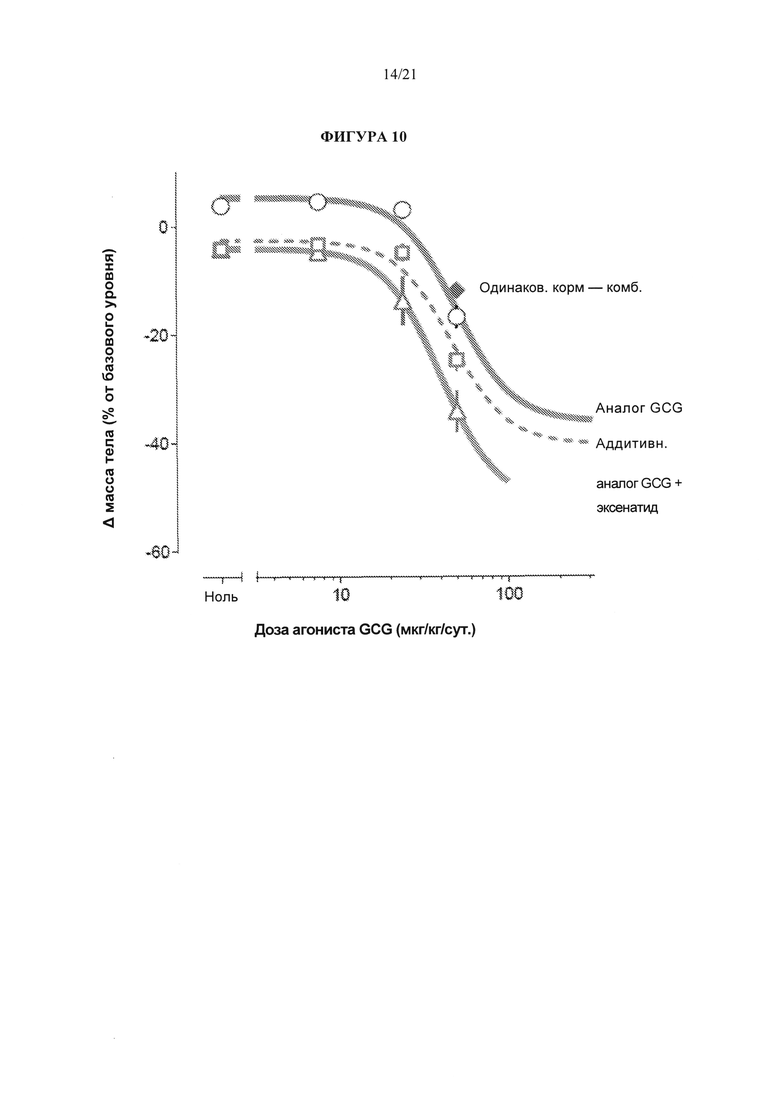
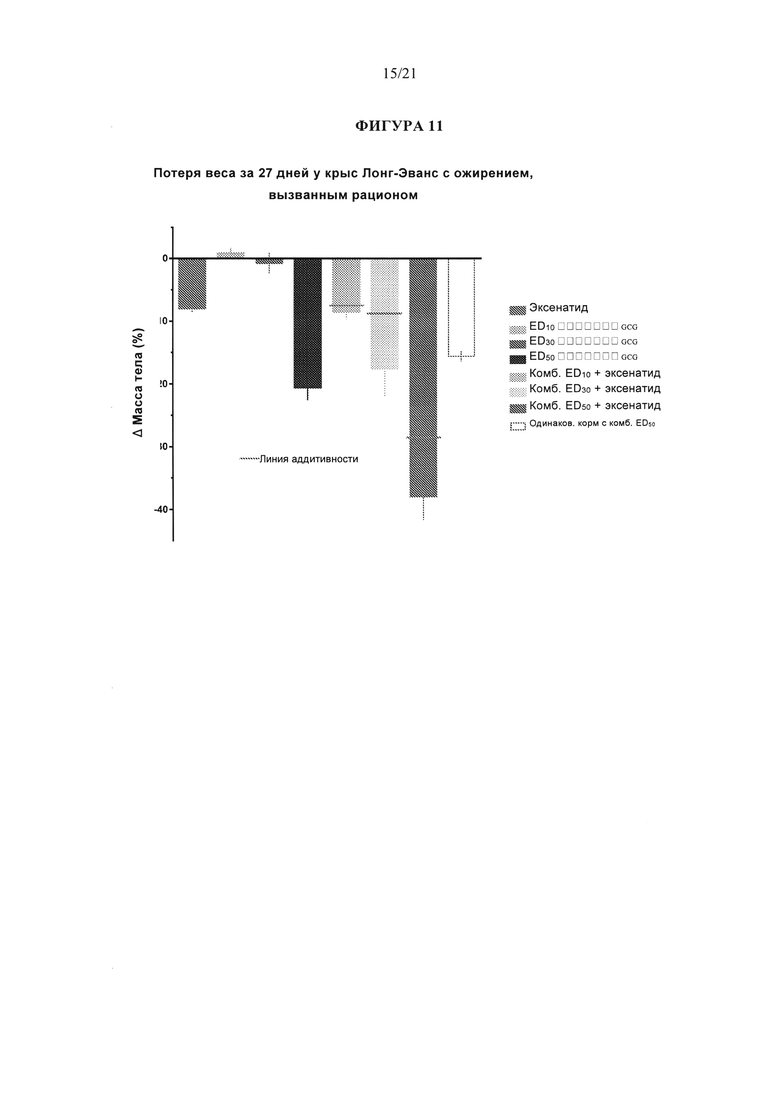
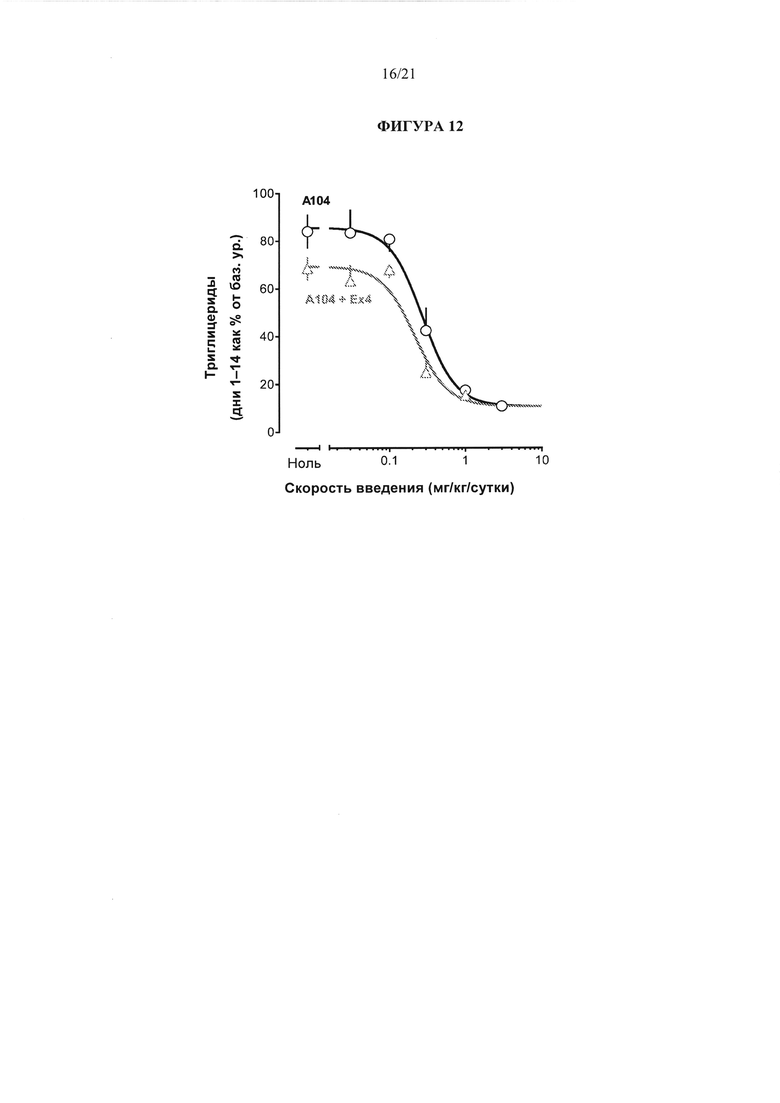
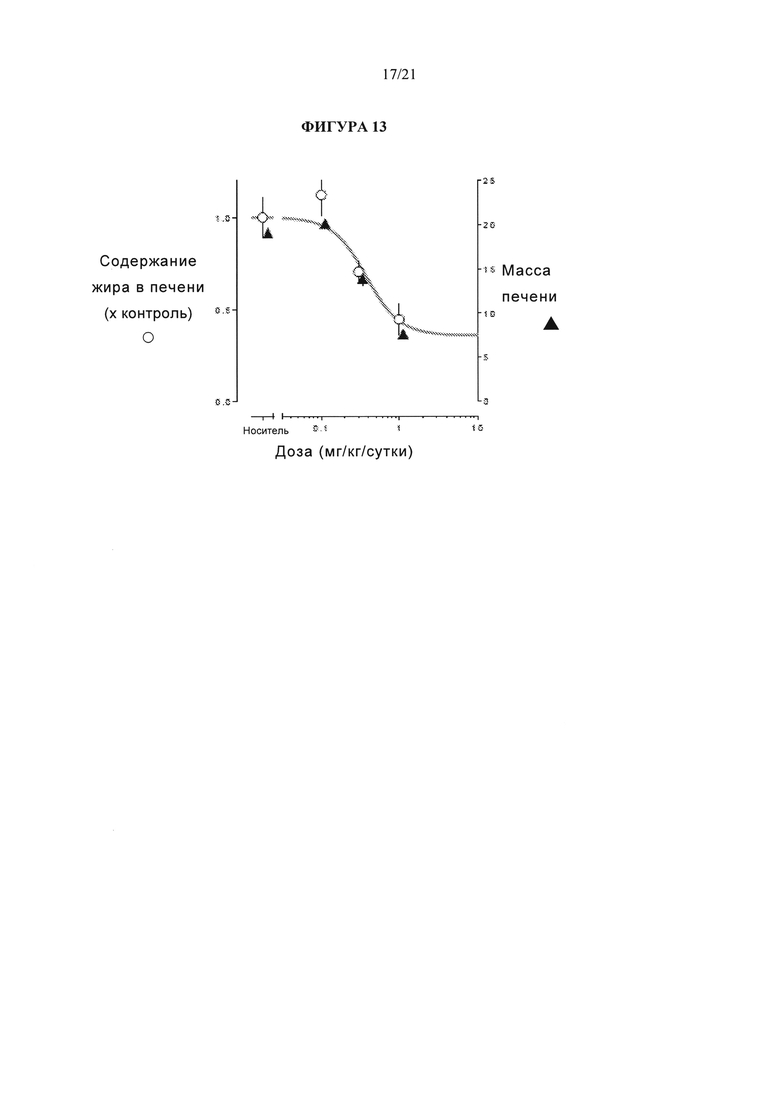
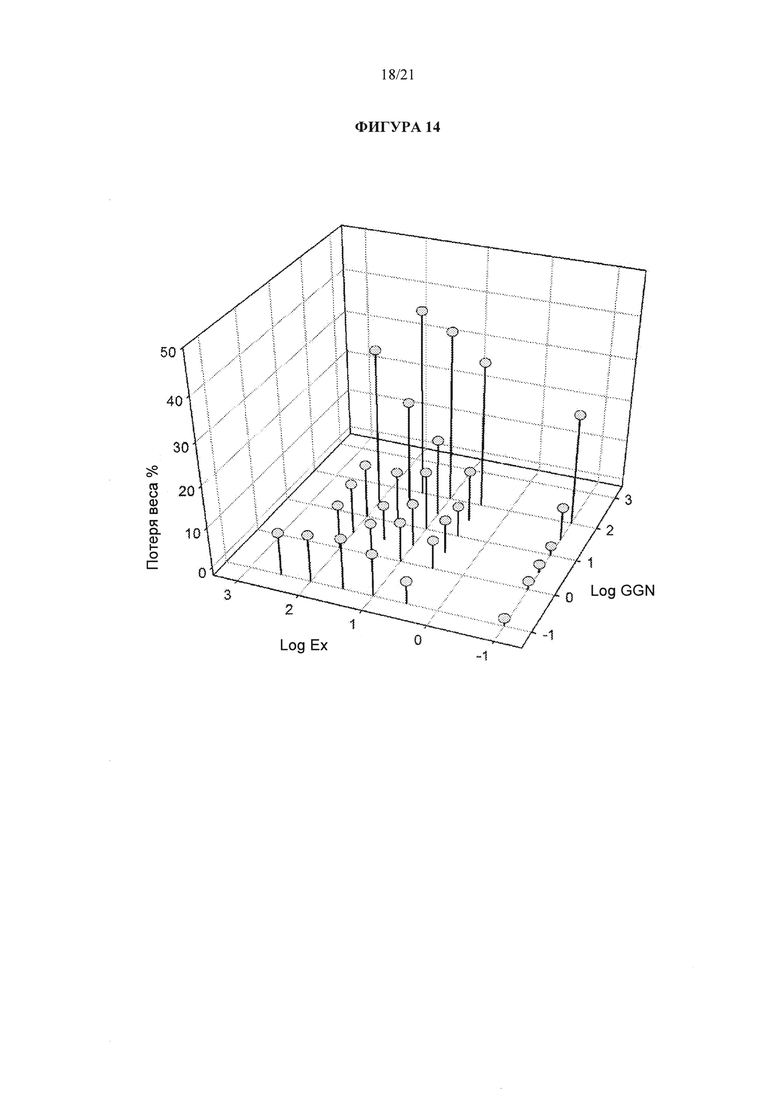
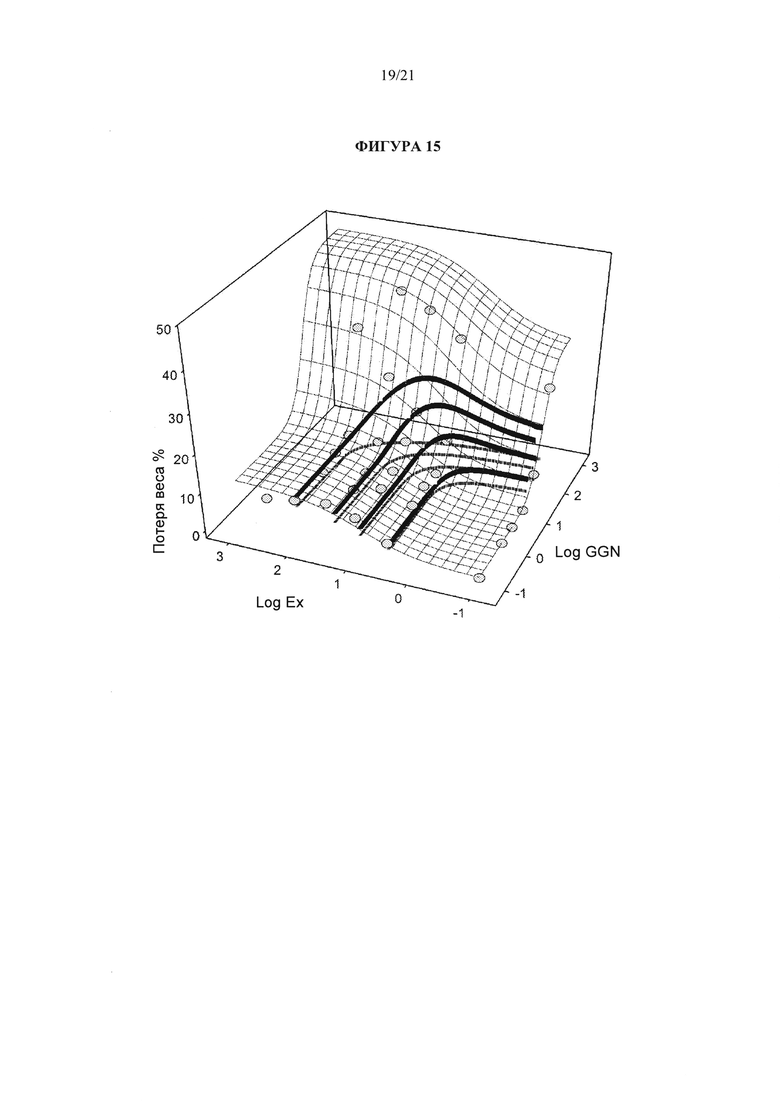
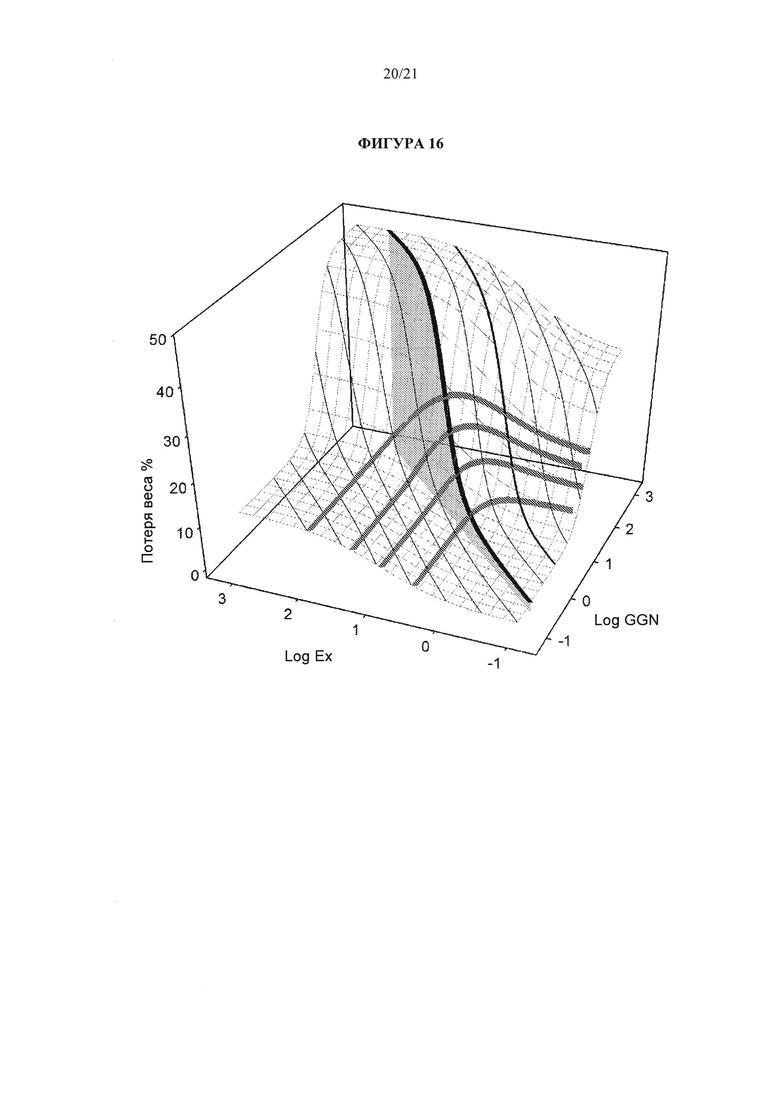
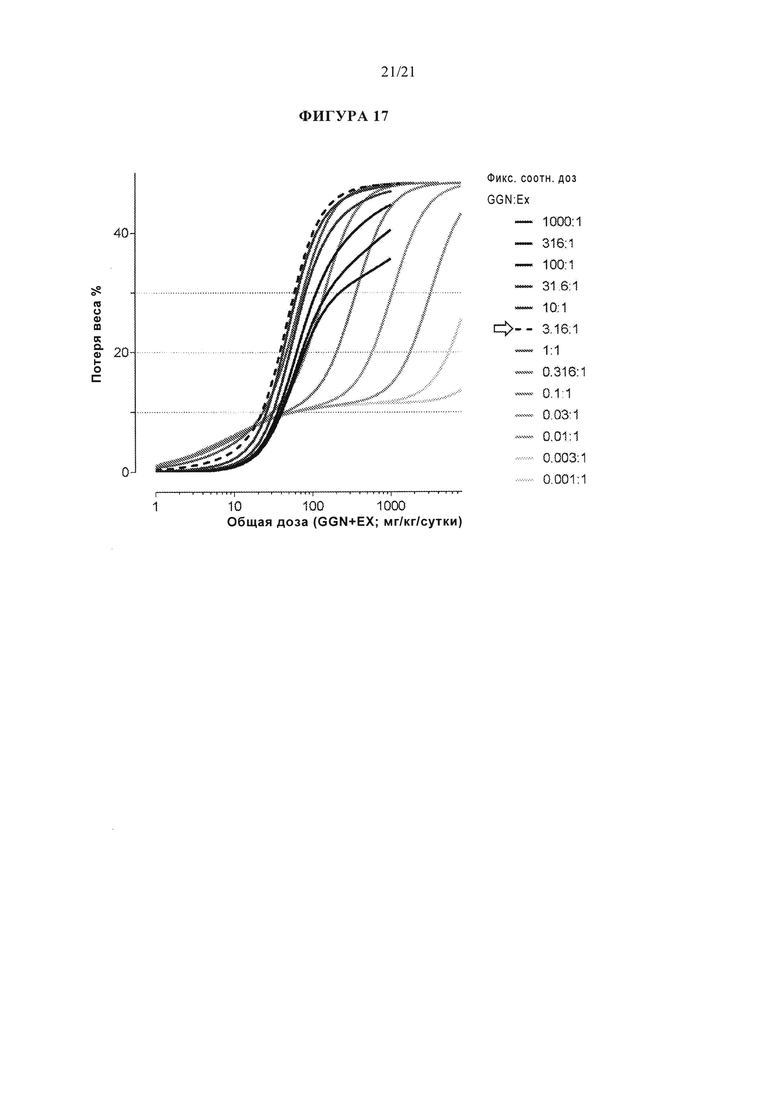
Изобретение относится к выделенным полипептидам, которые являются селективными к рецептору глюкагона аналогами, и их пептидным производным. Такие аналоги являются селективными к рецептору глюкагона человека с улучшенной растворимостью, термической стабильностью, а также физико-химическим свойствам по сравнению с нативным эндогенным глюкагоном. Настоящее изобретение также относится к способам применения таких полипептидов при различных терапевтических и диагностических показаниях, а также способам получения таких полипептидов. Такие аналоги полезны в виде монотерапии или в комбинации с другими терапевтическими пептидами в способах лечения ожирения, разных видов диабета, метаболических расстройств или заболеваний. 6 н. и 12 з.п. ф-лы, 21 ил., 8 табл., 27 пр.
1. Выделенный полипептид, содержащий аминокислотную последовательность:
X1X2X3GTFTSDX10X11X12X13LX15X16X17X18AQEFX23X24X25LEDE-Z-хвост-(OH/NH2) (SEQ ID NO: 1), где:
X1 представляет собой Y или W;
X2 представляет собой S, G или T;
X3 представляет собой Q или H;
X10 представляет собой Y или H;
X11 представляет собой S или T;
X12 представляет собой K или R;
X13 представляет собой Y, L или W;
X15 представляет собой D или E;
X16 представляет собой S, 2-аминоизомасляную кислоту (Aib), A, E, L, Q, K или I;
X17 представляет собой K, E, S, T или A;
X18 представляет собой A, R, S, E, L, T или Y;
X23 представляет собой T или V;
X24 представляет собой K, I, L или Aib;
X25 представляет собой H или W; и
Z-хвост отсутствует или выбран из группы, состоящей из EEPSSGAPPPS-OH (SEQ ID NO: 4); EPSSGAPPPS-OH (SEQ ID NO: 5); GAPPPS-OH (SEQ ID NO: 6); GGPSSGAPPPS-OH (SEQ ID NO: 7); GPSSGAPPPS-OH (SEQ ID NO: 8); KRNKNPPPS-OH (SEQ ID NO: 9); KRNKNPPS-OH (SEQ ID NO: 10); KRNKPPIA-OH (SEQ ID NO: 11); KRNKPPPA-OH (SEQ ID NO: 150); KRNKPPPS-OH (SEQ ID NO: 12); KSSGKPPPS-OH (SEQ ID NO: 13); PESGAPPPS-OH (SEQ ID NO: 14); PKSGAPPPS-OH (SEQ ID NO: 15); PKSKAPPPS-NH2 (SEQ ID NO: 16); PKSKAPPPS-OH (SEQ ID NO: 17); PKSKEPPPS-NH2 (SEQ ID NO: 18); PKSKEPPPS-OH (SEQ ID NO: 19); PKSKQPPPS-OH (SEQ ID NO: 20); PKSKSPPPS-NH2 (SEQ ID NO: 21); PKSKSPPPS-OH (SEQ ID NO: 22); PRNKNNPPS-OH (SEQ ID NO: 23); PSKGAPPPS-OH (SEQ ID NO: 24); PSSGAPPPSE-OH (SEQ ID NO: 25); PSSGAPPPS-NH2 (SEQ ID NO: 26); PSSGAPPPS-OH (SEQ ID NO: 27); PSSGAPPPSS-OH (SEQ ID NO: 28); PSSGEPPPS-OH (SEQ ID NO: 29); PSSGKKPPS-OH (SEQ ID NO: 30); PSSGKPPPS-NH2 (SEQ ID NO: 31); PSSGKPPPS-OH (SEQ ID NO: 32); PSSGSPPPS-OH (SEQ ID NO: 33); PSSKAPPPS-OH (SEQ ID NO: 34); PSSKEPPPS-OH (SEQ ID NO: 35); PSSKGAPPPS-OH (SEQ ID NO: 36); PSSKQPPPS-OH (SEQ ID NO: 37); PSSKSPPPS-OH (SEQ ID NO: 38); SGAPPPS-OH (SEQ ID NO: 39); и SSGAPPPS-OH (SEQ ID NO: 40).
2. Выделенный полипептид по п. 1, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 41–136 и 143-149.
3. Выделенный полипептид по п. 1, содержащий аминокислотную последовательность: YSX3GTFTSDYSKYLDX16X17X18AQEFVX24WLEDE-Z-хвост-(OH/NH2) (SEQ ID NO: 3), где:
X3 представляет собой Q или H;
X16 представляет собой 2-аминоизомасляную кислоту (Aib) или A;
X17 представляет собой A или K;
X18 представляет собой R, S или Y;
X24 представляет собой K или Aib; и
Z-хвост выбран из группы, состоящей из PSSGAPPPS-OH (SEQ ID NO: 27) и PKSKSPPPS-NH2 (SEQ ID NO: 21).
4. Выделенный полипептид по п. 3, содержащий аминокислотную последовательность SEQ ID NO: 41.
5. Выделенный полипептид по п. 3, содержащий аминокислотную последовательность SEQ ID NO: 42.
6. Выделенный полипептид по п. 3, содержащий аминокислотную последовательность SEQ ID NO: 43.
7. Выделенный полипептид, выбранный из группы, состоящей из последовательностей SEQ ID NO: 41-136, 138, 139 и 143-149, причем указанный выделенный полипептид ковалентно связан с липофильным заместителем, необязательно посредством спейсера, причем указанный липофильный заместитель, необязательно посредством спейсера, присоединен к ε-аминогруппе остатка лизина указанного выделенного полипептида.
8. Фармацевтическая композиция для лечения или облегчения симптома болезни или расстройства, связанных с аберрантной активностью глюкагона у субъекта, представляющего собой человека, содержащая терапевтически эффективное количество выделенного полипептида по любому из пп. 1–7 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
9. Фармацевтическая композиция по п. 8, в которой фармацевтически приемлемая соль представляет собой соль трифторуксусной кислоты, соль уксусной кислоты или хлористоводородную соль.
10. Фармацевтическая композиция по п. 8 или 9, в которой выделенный полипептид выбран из группы, состоящей из последовательностей SEQ ID NO: 41, 42, 43, 44, 45 и 46.
11. Фармацевтическая композиция по любому из пп. 8-10, дополнительно содержащая инсулинотропный полипептид.
12. Фармацевтическая композиция по п. 11, в которой инсулинотропный полипептид представляет собой эксенатид.
13. Фармацевтическая композиция по п. 11 или 12, в которой выделенный полипептид изготовлен в комбинации с эксенатидом в фиксированном соотношении выделенного полипептида к эксенатиду от 100:1 до 1:100.
14. Фармацевтическая композиция по п. 11 или 12, в которой выделенный полипептид изготовлен в комбинации с эксенатидом в фиксированном соотношении выделенного полипептида к эксенатиду от 10:1 до 1:10.
15. Устройство осмотической доставки, содержащее выделенный полипептид по любому из пп. 1–7 или фармацевтическую композицию по любому из пп. 8–14.
16. Способ лечения или облегчения симптома болезни или расстройства, связанных с аберрантной активностью глюкагона у субъекта, представляющего собой человека, причем указанный способ включает введение указанному субъекту, представляющему собой человека, выделенного полипептида по любому из пп. 1–7 или фармацевтической композиции по любому из пп. 8–14.
17. Способ по п. 16, в котором болезнь или расстройство представляют собой сахарный диабет 2 типа.
18. Способ лечения ожирения у субъекта, представляющего собой человека, включающий введение указанному субъекту, представляющему собой человека, выделенного полипептида по любому из пп. 1–7 или фармацевтической композиции по любому из пп. 8–14.
| WO 2013051938 A2, 11.04.2013 | |||
| RU 2013154066 A, 20.07.2015. |
Авторы
Даты
2021-11-22—Публикация
2017-05-15—Подача