Перекрестная ссылка на родственную заявку
[0001] Данная заявка утверждает приоритет заявки США с серийным номером 61/436441, зарегистрированной 7 февраля 2011 г, раскрытие которой включено в данную работу ссылкой.
Область техники, к которой относится изобретение
[0002] Настоящее изобретение в общем относится к консервации клеток и более конкретно к консервации эукариотных, образующих ядро клеток in vitro.
Уровень изобретения
[0003] Хранение биологического материала, содержащего живые клетки в течение как короткого так и длинного периодов времени, представляет собой один из самых значительных стимулов в современной медицинской науке. Охлаждение до температуры внутри интервала от -20°С до -176°С в присутствии криозащитных веществ до сих пор представляет собой самый широко применяемый способ хранения живых клеток. Механизм криозащиты включает защитное действие на образование кристаллов льда, которые разрушают клетки и/или клеточные компоненты. Однако данные и другие общепринятые способы консервации клеток вызывают стресс в клетках, которые хранятся, и апоптоз почти всегда индуцирован в части клеток, которые подвержены манипуляциям, возникшим при хранении. (См., например, de Boer F., et al. J. Hematother. Stem Cell Res. 2002 Dec; 11(6):951-63; Shapiro AM, et al. Diabetes Technol. Ther. 2000 Autumn; 2(3):449-52; Cookson P., et al. Transfus Med. 2010 Dec; 20(6):392-402). Кроме того, клетки, которые получены непосредственно от органов и тканей и не культивировались, часто повреждаются в течение хранения и транспортировки. Таким образом, существует постоянная и нереализованная потребность в улучшенных способах для консервации клеток и защиты их от летальных событий, таких как апоптоз, в течение хранения и/или транспортировки. Настоящее изобретение удовлетворяет данной и другим потребностям.
Сущность изобретения
[0004] Настоящее изобретение относится к способу снижения апоптоза. Способ включает основные стадии, включающие: i) хранение клеток, образующих ядро, в контейнере и добавление газа, содержащего ксенон, в контейнер, так что давление внутри контейнера достигает 0,5-4,0 атм выше давления окружающей среды; ii) хранение контейнера из i) при 0,5-4,0 атм выше давления окружающей среды в продолжение периода времени, в течение которого температура в контейнере равна 22°С-37°С; iii) снижение температуры в контейнере до 0,1°С-10°С с одновременным установлением давления 0,5-4,0 атм выше давления окружающей среды; iv) хранение контейнера при 0,1°С-10°С и давлении 0,5-4,0 атм выше давления окружающей среды в течение периода времени; и v) последовательно снижение давления в контейнере до давления окружающей среды и повышение температуры до 22°С-37°С. Клетки, обработанные согласно данной процедуре, претерпевают меньше апоптоза чем эталон.
[0005] В различных вариантах осуществления, период времени, в течение которого контейнер хранится при 0,5-4,0 атм выше давления окружающей среды при 22°С-37°С, составляет от 15 минут до 24 часов. Период времени, в течение которого контейнер хранится при 0,1°С-10°С и давлении 0,5-4,0 атм выше давления окружающей среды составляет от 2 часов до трех недель, который включает, но не обязательно ограничен, периодом от 2 часов до 24 часов, или по меньшей мере до 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 14 суток, и т.д., вплоть до трех недель. Способ включает снижение апоптоза в клетках млекопитающего, которые могут быть клетками человека.
[0006] Изобретение также относится к охлажденной композиции, содержащей клетки, образующие ядро, где клетки присутствуют в контейнере и хранятся при температуре 0,1°С-10°С и где давление внутри контейнера составляет 0,5-4,0 атм выше давления окружающей среды из-за введения в контейнер газа, содержащего ксенон.
Краткое описание чертежей
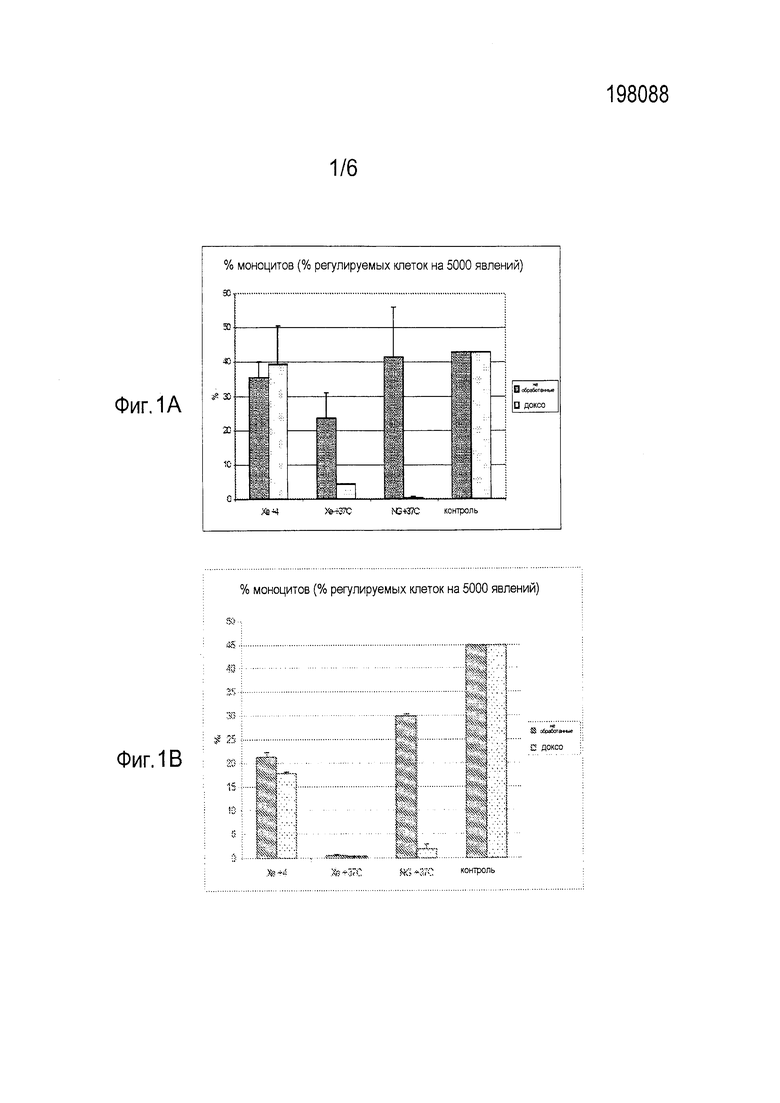
[0007] Фиг. 1 показывает процентное содержание клеток U-937 клеточной линии лейкемической моноцитной лимфомы человека, определенное методом поточной цитометрии после 24 часов (фиг. 1А) и 7 суток (фиг. 1В) хранения в чашках Петри в течение указанного периода либо в контейнере либо в стандартном инкубаторе с СО2 при 37°С, сделанном для культивирования клеток (“контроль”). После удаления из хранилища, клеткам постепенно снижали давление в продолжение периода в 60 минут, окрашивали с помощью антиCD14 антитела и сортировали поточной цитометрией. АнтиCD14 антитело является маркером моноцитов и макрофагов. Наносили на график процент общих клеток, которые положительно окрашивали АнтиCD14 антитело.
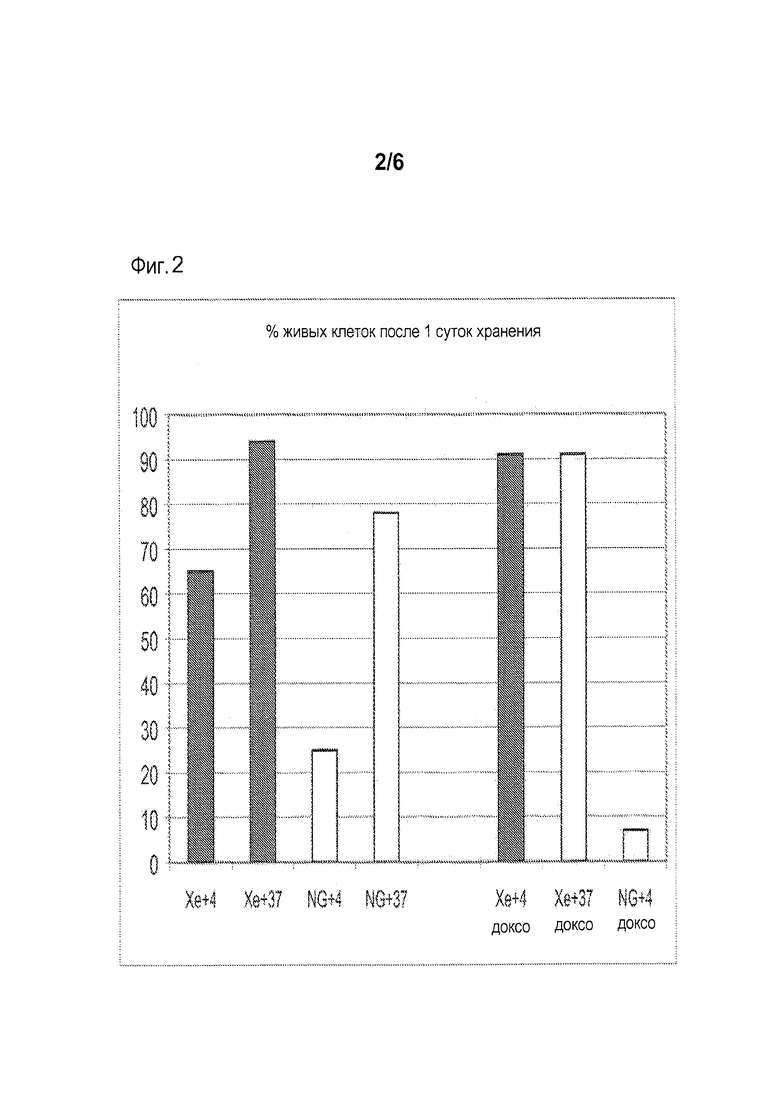
[0008] Фиг. 2 показывает процентное содержание живых клеток Jurkat клеточной линии лейкемической моноцитной лимфомы по отношению к общему числу клеток за 24 часа хранения при давлении в 4 атм избыточного ксенона. Клетки обрабатывали, как описано для фиг. 1. Клетки хранили в присутствии или в отсутствие апоптического индуктора доксорубицина (доксо) при указанных температурах. Живые клетки отличали от погибших клеток, используя стандартный метод исключения голубого трипана.
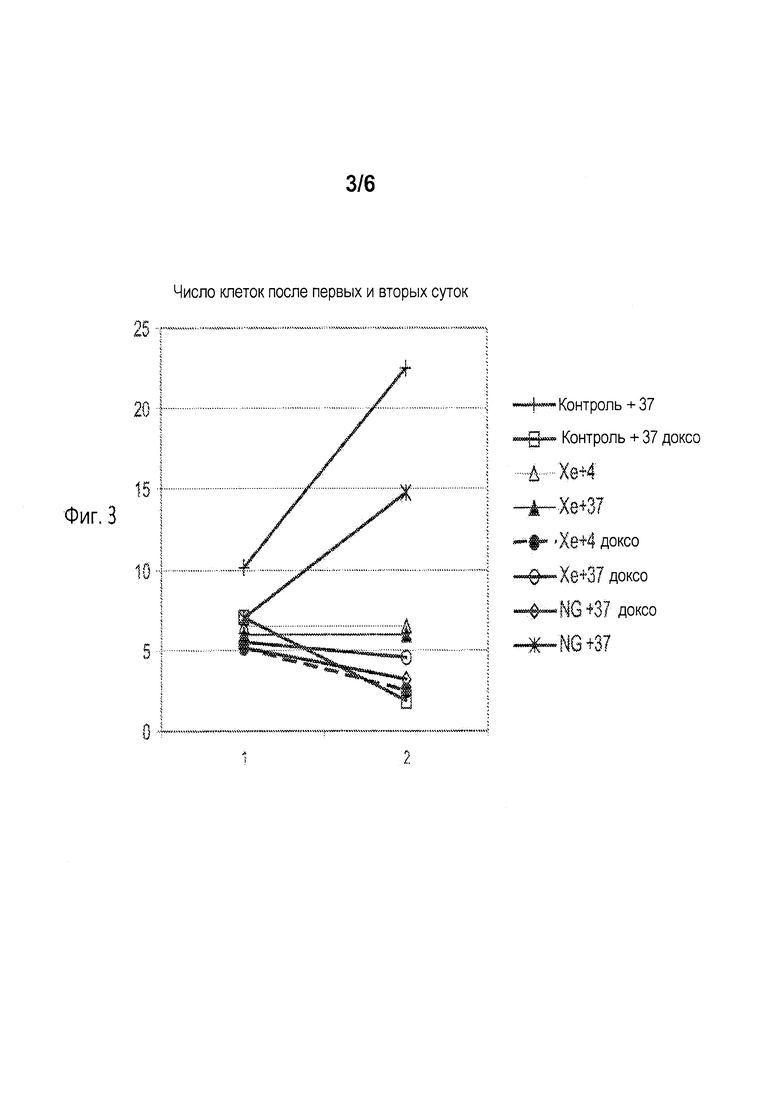
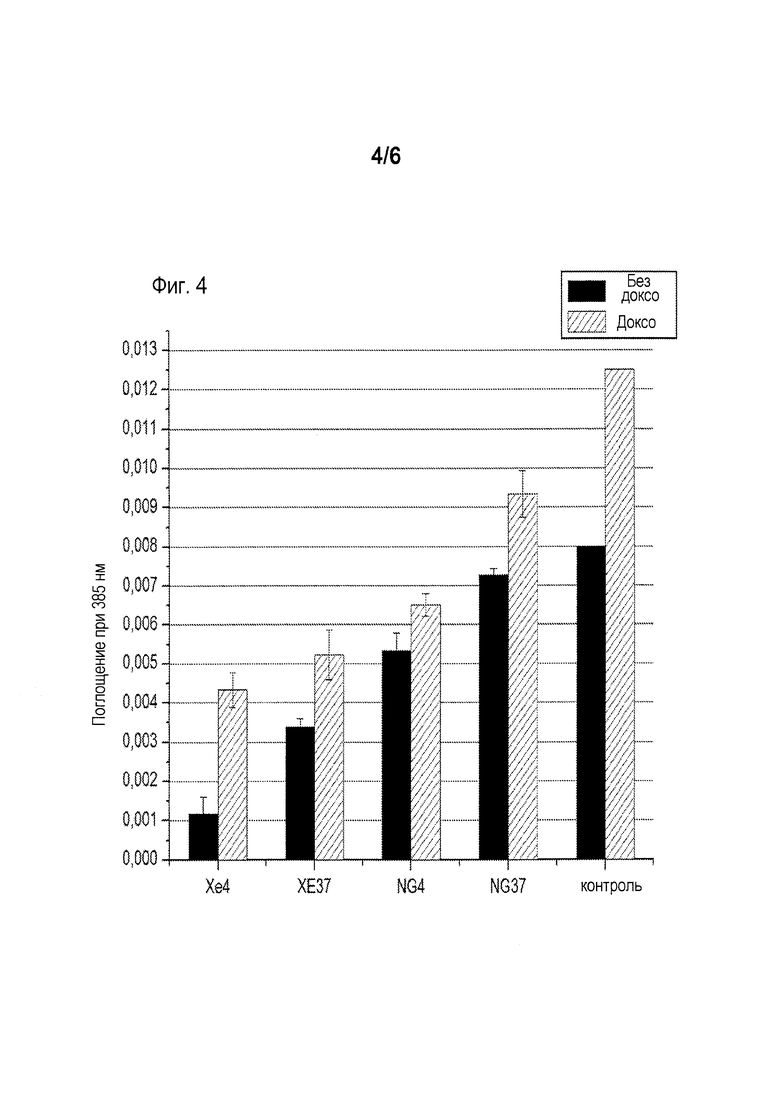
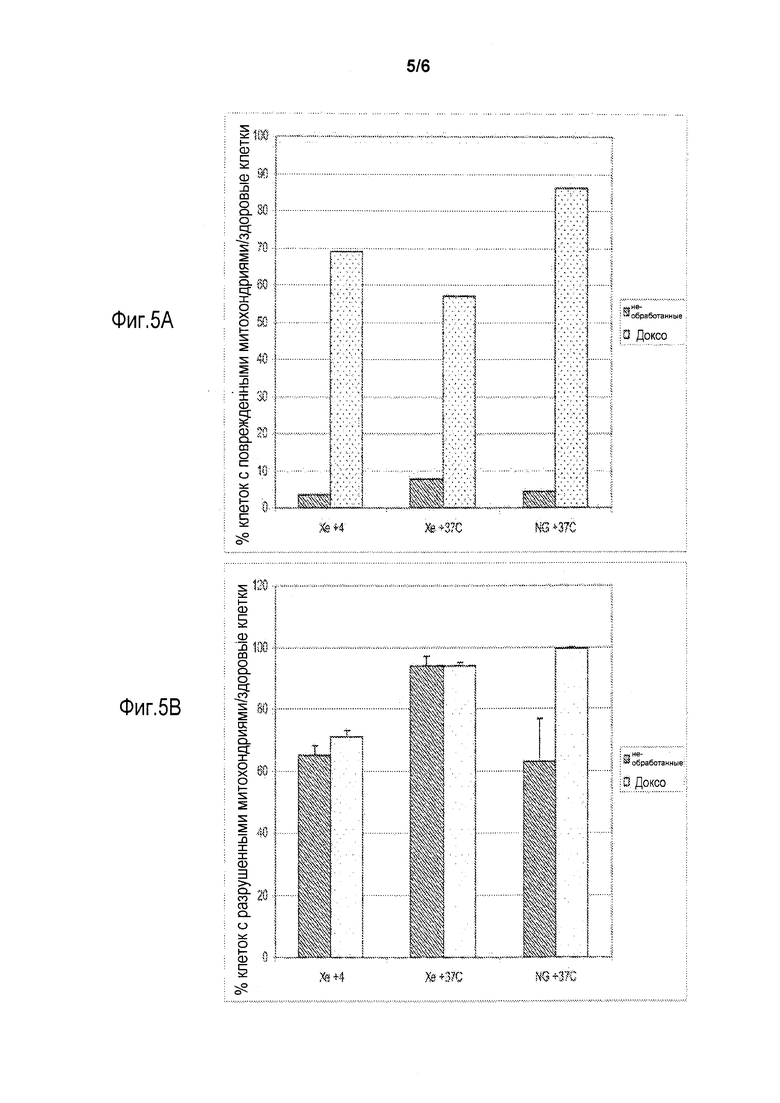
[0009] Фиг. 3 показывает изменение в количествах живых клеток Jurkat в культуре после переноса их из условий хранения и помещения их в стандартные условия культивирования (37°С в воздухе с 5% СО2). Клетки окрашивали красителем трипаном голубым перед и после 24 часов инкубирования при стандартном условии для определения числа клеток. Клетки контрольной группы культивировали в стандартных условиях культивирования при давлении окружающей среды, включая период хранения. Клетки контроля брали в нулевые сутки эксперимента из той же самой колбы, что и экспериментальные клетки и помещали в чашки Петри. Фиг. 4 показывает, что избыточное давление в 4 атм, полученное введением газа, содержащего ксенон, в контейнер препятствовало развитию как спонтанного (серии no Doxo на диаграмме) так и индуцированного (серии Doxo на диаграмме) апоптоза в клетках Jurkat. В данном наборе опытов контролировали активность каспазы 3 после 24 часов хранения. Фиг.5 показывает окрашивание клеток U-937 клеточной линии лейкемической моноцитной лимфомы (хранившихся согласно вышеописанному методу в течение 24 часов (фиг. 5А) и 7 суток (фиг. 5В) под давлением на 4 атм выше окружающего давления Хе) с красящим агентом JC-1, что делает возможной оценку состояния митохондрий с помощью поточной цитометрии.
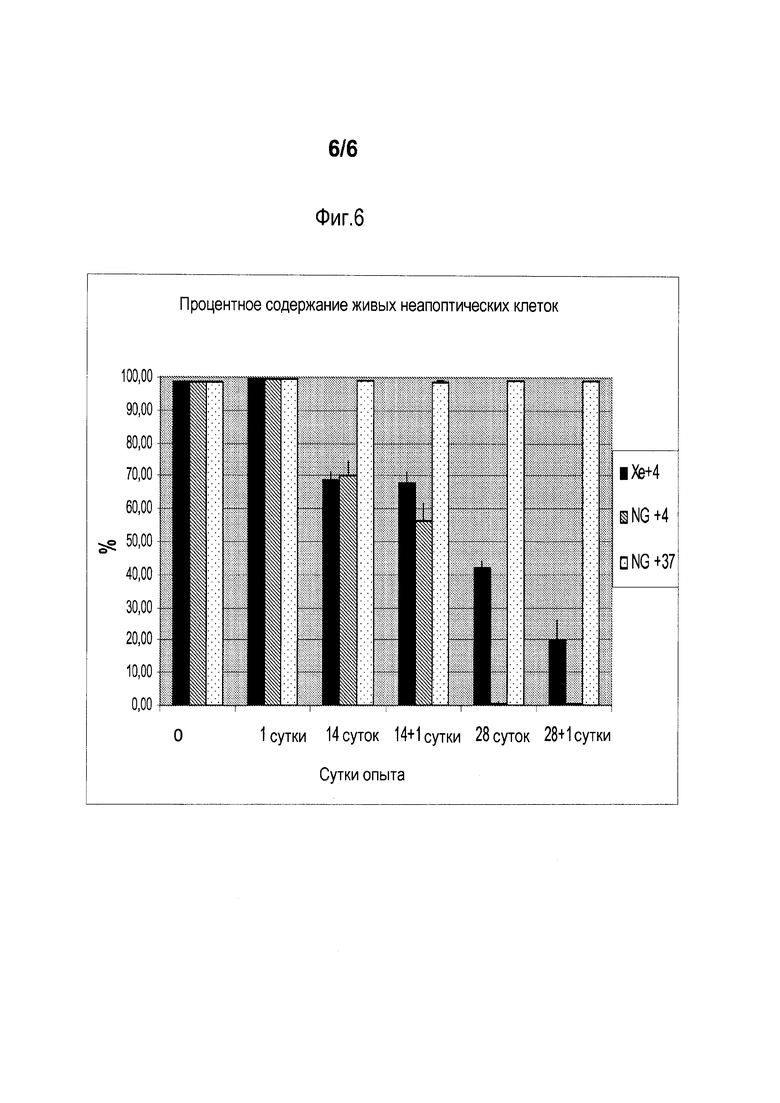
[0010] Фиг. 6 показывает окрашивание клеток U-937 клеточной линии лейкемической моноцитной лимфомы, сохраняемых в соответствии со способом изобретения, в 1, 14, и 28 сутки хранения. Клетки окрашивали, используя красящий комплект аннексин-FITC/иодид пропидия, который позволяет провести различие между живыми, некротическими, апоптическими клетками на ранней и поздней стадиях. После окончания периода хранения, среду заменяли и клетки дополнительно культивировали в течение 1 суток в обычных условиях для оценки степени восстановления. 'Xe+4': газовая смесь из 95% Хе+5% СО2 (избыточное давление 4 атм) при +4С, 'NG+4': хранение при давлении окружающей среды и при температуре +4С; NG+37 сделанные эталонные образцы, которые культивировали при 37°С, 5% СО2 с замещением культуральной среды каждые трое суток.
Подробное описание изобретения
[0011] Настоящее изобретение относится к способам ингибирования апоптоза. Способ основан на открытии авторов, состоящего в том, что обработка образующих ядро клеток, имеющихся в атмосфере, содержащей ксенон, при определенных давлениях и температурах, как далее описано в данной заявке, приводит к пониженному апоптозу в клетках. Данное изобретение особенно пригодно для снижения апоптоза в клетках при хранении и/или транспортировке. В различных вариантах воплощения, обработанные клетки с использованием способа изобретения можно хранить под давлением при температуре от 0,1°С до +10°С в течение периода вплоть до двух недель. Данное изобретение можно практиковать без применения обычных средств для предотвращения замораживания.
[0012] В целом, изобретение включает следующие последовательные стадии: i) хранение клеток, образующих ядро, в контейнере и добавление в контейнер ксенона или газовой смеси, содержащей Хе, так что давление внутри контейнера достигает 0,5-4,0 атм выше давления окружающей среды (абсолютное давление 1,5-5,0 атм); ii) хранение контейнера из i) при давлении 0,5-4,0 атм выше давления окружающей среды в продолжение периода времени, в течение которого температура в контейнере равна 22°С-37°С; iii) снижение температуры в контейнере до 0,1°С-10°С с одновременным установлением давления 0,5-4,0 атм выше давления окружающей среды; iv) хранение контейнера при 0,1°С-10°С и давлении 0,5-4,0 атм выше давления окружающей среды в течение периода времени; и v) снижение давления в контейнере в iv) до давления окружающей среды и повышение температуры до 22°С-37°С. При выполнении данных стадий, клетки из v) претерпевают меньше апоптоза чем эталон.
[0013] Эталон, по которому можно сравнивать клетки, обработанные согласно способу изобретения, может быть любым подходящим эталоном. Например, эталон может быть контролем для клеток, которые не были подвергнуты воздействию одного или нескольких параметров, использованных для обработки клеток, применяющихся по способу изобретения. Эталон может представлять собой типовую кривую, площадь под кривой, график, таблицу, или любое другое изображение данных, по которым можно делать сравнение эффектов способа изобретения.
[0014] В одном варианте воплощения, давление для хранения клеток представляет собой 0,5-4,0 атм выше давления окружающей среды, и все давления до десятичной доли располагаются между данными значениями. Все давления, указанные в данном описании, если не отмечено особо, означают избыточную атм (гипербарная или гиператмосферная). Давление окружающей среды означает нормальное атмосферное давление без дополнительного давления, которое обычно находится в интервале 0,84-1,07 атм, со средним давлением окружающей среды, принятым равным 1 атм.
[0015] Изобретение, как ожидают, будет подходящим для ингибирования апоптоза в любой клетке(ах), образующей ядро. В различных вариантах воплощения, клетки, предназначенные для данного способа изобретения, способны к пролиферации. Клетки могут иметь потенциал, чтобы различаться по одному или многократным происхождениям. Таким образом, клетки могут иметь тотипотентность, плюрипотентность, мультипотентность или унипотентность. Соответственно клетки могут быть стволовыми клетками, включающими но без ограничения только ими, стволовые клетки взрослых особей, тканевые определенные стволовые клетки, фетальные стволовые клетки, зародышевые стволовые клетки, индуцированные плюрипотентные стволовые клетки, такие как мезенхимные стволовые клетки или кроветворные стволовые клетки. Например, миобласты и кардиомицеты могут быть произведены из мезенхимных стволовых клеток, в то время как кроветворные стволовые клетки могут быть произведены из стволовых клеток костного мозга. В одном варианте воплощения, клетки могут быть гаплоидными, такими как неоплодотворенные ооциты.
[0016] В некоторых вариантах воплощения, клетки могут быть иммортализированы, такие как клеточные линии, которые обычно устанавливаются размножением и/или пассированием клеток, отделенных от первоначального источника. В других вариантах воплощения использован способ для ингибирования апоптоза в клетках, которые были выделены из первичной ткани, а именно, в одноразовых суспензиях клеток, полученных от образца первичной ткани. В другом варианте воплощения, клетки, обработанные согласно способу изобретения, могут быть частью ткани, включающей, но без ограничения, биопсию ткани, срез ткани, или культуру ткани. В одном варианте воплощения, клетки, обработанные с применением способов изобретения, представляют собой свободные пластинки. В другом варианте воплощения, клетки, обработанные с применением способа изобретения, не присутствуют в органе. Клетки можно получать или производить от любого животного. В одном варианте воплощения, животное является млекопитающим. В одном варианте воплощения, млекопитающее является человеком.
[0017] Как обсуждено выше, способ изобретения первоначально включает хранение клеток, образующих ядро, в контейнере и добавление в контейнер ксенона (или газовой смеси, содержащей Хе), так что давление внутри контейнера достигает 0,5-4,0 атм выше давления окружающей среды, включительно, и при этом включаются все значения до десятичной доли, которые располагаются между данными значениями. В данном отношении, контейнер может быть любым контейнером, который подходит для хранения сосуда, в котором клетки выращивают и/или хранят in vitro. В частности, любой сосуд, такой как тест-пробирка, чашка Петри, пробирка Эппендорфа, чашка для культуры ткани, многолуночный планшет для культуры, и т.д., в котором присутствуют клетки, может быть помещен в контейнер. Следует осознавать, что когда сосуд, в котором присутствуют клетки, помещают в контейнер, сосуд располагают так, чтобы клетки в нем подвергались действию добавленного ксенона и давлению в контейнере. Например, если сосуд, в котором присутствуют клетки, является тест-пробиркой, то тест-пробирку не запаивают, что позволяет ксенону, добавленному в контейнер, осуществлять давление на клетки и быть включенным в клетки.
[0018] Контейнер, в который добавлен ксенон и который защищает сосуд, в котором присутствуют клетки, может представлять собой любой подходящий контейнер. Подходящие контейнеры могут быть твердыми, такими как банка, колба, резервуар или пробирка. Контейнер должен обладать способностью к поддержанию герметичной для газа окружающей среды. Таким образом, контейнер может обладать способностью к тому, чтобы быть герметично запаянным. Контейнер также может быть эластичным, способным к запечатыванию контейнером, пример которого включает, но без ограничения, пакет. Его предпочитают для контейнера, и ксенон (или газовая смесь с Хе), который добавляют в него, должен быть стерильным. При осуществлении способа изобретения, можно использовать любую подходящую систему для установления атмосферы, в которой клетки сохраняются, чтобы обеспечивать атмосферу при требуемом парциальном или общем давлении ксенона. Общие черты такой системы включают резервуар для газа, в силу чего резервуар предпочтительно реально присоединен к контейнеру. Подходящие газовые системы могут содержать компоненты, включающие, но без ограничения, клапаны, насосы, насадки, входные и выходные отверстия, и их комбинации, а также контролирующее устройство для контроля компонентов системы и тем самым количества газа, доставленного в контейнер, и скорости, с которой доставляется газ. Данная система может дополнительно включать один или несколько компонентов, применяемых для удаления ксенонсодержащей атмосферы из контейнера и/или для создания вакуума в контейнере. Вся система или любой компонент или порция компонента могут быть запущены вручную, или могут быть автоматизированы, чтобы управляться компьютерами и компьютерными программами.
[0019] В одном варианте воплощения, клетки хранят или подвергают экспозиции газовой смесью ксенона СО2 и необязательно содержащей азот. Таким образом, газовая смесь может содержать от 9% ксенона, 5% СО2 и остаток N2 до 95% ксенона и 5% СО2. В одном варианте воплощения, ксенон (или газовую смесь, содержащую ксенон), вводят в атмосферу внутри контейнера с удалением или без удаления загрязнителя имеющегося газа/воздуха до тех пор, пока концентрация ксенона в газовой атмосфере внутри контейнера не составляет по меньшей мере 9%. В одном варианте воплощения, атмосфера в контейнере состоит из ксенона. В альтернативном варианте воплощения, атмосфера может состоять из ксенона и следовых примесей. Таким образом, в одном варианте воплощения, атмосфера может состоять в основном из ксенона и по меньшей мере из 5% СО2.
[0020] Температура, при которой ксенон на начальной стадии добавляют в контейнер, является изменчивой и будет зависеть от типа клеток, которые подвергаются обработке. В целом, температура может находиться в интервале от 22°С до 37°С, включительно, и при этом включаются все целые числа между данными значениями и все числа между следующими друг за другом целыми числами до значения десятичных долей. Не зависимые от температуры в течение добавления ксенона или газовой смеси, содержащей Хе, как только давление внутри контейнера достигает 0,5-4 атм выше давления окружающей среды, клетки сохраняются в контейнере под давлением в продолжение периода времени, в течение которого температура в контейнере составляет от 22°С до 37°С, включительно, и при этом включаются все значения до десятичных долей между ними. Период времени, в течение которого клетки сохраняются при данной температуре и интервале давления, может изменяться от 15 минут до 24 часов, включая все интервалы времени между ними. В связи с этим, и без намерения ограничиваться любой конкретной теорией полагают, что сохранение клеток при 22°С-37°С и 0,5-4 атм выше давления окружающей среды приводит к клеткам, которые становятся насыщенными ксеноном, и что это, вместе с проведением оставшихся стадий данного способа приводит к ингибированию апоптоза в клетках, что улучшает долговечность клеток в течение хранения и транспортировки.
[0021] После того как клетки сохранялись при 0,5-4 атм выше давления окружающей среды при 22°С-37°С в течение от 15 минут до 24 часов, температуру в контейнере снижали до 0,1°С-10°С, включительно, и при этом включаются все целые числа между данными значениями и все числа между следующими друг за другом целыми числами до значения десятичных долей, в то же время устанавливается давление 0,5-4 атм выше давления окружающей среды. В одном варианте воплощения, температуру в контейнере снижали помещением контейнера в охлаждаемый кожух. Данный интервал температуры и давления поддерживают в течение периода времени, который мог изменяться от 2 часов до 3 недель, включая все интервалы времени между ними, но не меньшего времени, чем требуется для клеток внутри контейнера для достижения температуры от 0,1°С до 10°С. Таким образом, данное изобретение применимо для хранения клеток при пониженной температуре и повышенном давлении в течение 7, 8, 9, 10, 11, 12, 13, 14, или более суток.
[0022] После хранения клеток при 0,5-4 атм выше давления окружающей среды и от 0,1°С до 10°С, давление в контейнере снижают до давления окружающей среды (как, например, открытием клапана или крышки) и температуру контейнера поднимают до 22°С-37°С, включительно, и при этом включаются все целые числа между данными значениями и все числа между следующими друг за другом целыми числами до значения десятичных долей. Данные клетки претерпевают меньший апоптоз чем эталон.
[0023] Контейнер, содержащий клетки, обработанные в соответствии со способом изобретения, можно перевозить в местность и/или индивидууму или в хозяйственный объект для применения во множестве процедур, и клетки еще будут претерпевать меньший апоптоз чем эталон.
[0024] Изобретение также относится к охлаждаемой композиции, содержащей клетки, образующие ядро, которые подвержены воздействию повышенной концентрации ксенона или газовой смеси, содержащей Хе под давлением, но претерпевают меньший апоптоз чем клетки, которые не были подвержены воздействию повышенной концентрации ксенона под давлением.
[0025] Следующий пример предназначен для того, чтобы иллюстрировать, но не ограничивать данное изобретение.
[0026] Для получения данных, представленных в этих примерах, клетки U-937 лейкемической моноцитной лимфомы культивировали в среде RPMI-1640, снабженной 15% эмбриональной бычьей сывороткой и 10 мкг/мл гентамицина в атмосфере 5% СО2 при 37°С. Чашки Петри, содержащие культуру клеток в фазе экспоненциального роста, помещали на удерживающую подставку и переносили в контейнеры, имеющие внутренний объем приблизительно в 1,5 л, которые были сделаны для сохранения гипербарных условий. Смесь газов Хе-СО2 (95% и 5% соответственно) использовали для создания давления от 0,5 до 4,0 атм выше давления окружающей среды в течение периода из 5-10 минут, с конкретными параметрами, представленными на фигурах, присутствующих в данном описании. Температуру выдерживали от 22°С до 37°С в данном варианте воплощения изобретения. Газы смешивали в отдельном сосуде (или в контейнере/пробирке) на основе расчета их парциального давления. Контейнер с чашками Петри выдерживали при данной температуре и данном давлении в течение 2 часов. Затем контейнер переносили в холодильник с пониженной температурой (от 0,1°С до +5°С), с одновременным сохранением давления. Контейнер выдерживали при данных условиях в течение приблизительно 4 недель. После этого, давление снимали и контейнер, содержащий клетки, выдерживали в течение 7 суток в помещении при температуре от +4°С до +10°С и атмосферном давлении.
[0027] Авторы выбрали для обработки клетки Jurkat и клетки U-937 согласно вышеприведенной процедуре, потому что они обладают ядерным и полномасштабным апоптическим каскадным механизмами. В соответствии с этим, данные клетки отвечают за большое число как внеклеточных так и внутриклеточных проапоптических сигналов и использовались в качестве модельных клеток для анализа апоптоза (Pimentel-Muinos FX, Seed B. Regulated commitment of TNF receptor signaling: a molecular switch for death or activation. Immunity. 1999 Dec; 11(6):783-93; Karas M, Zaks TZ, Liu JL, LeRoith D. T cell receptor-induced activation and apoptosis in cycling human T cells occur throughout the cell cycle. Mol. Biol. Cell. 1999 Dec; 10(12):4441-50; Valavanis C, Hu Y, Yang Y, Osborne BA, Chouaib S, Greene L, Ashwell JD, Schwartz LM. Model cell lines for the study of apoptosis in vitro. Methods Cell Biol. 2001; 66:417-36).
[0028] После осуществления на клетках способа данного изобретения, авторы анализировали количество живых клеток (фиг. 1), активность каспазы-3, которая является указанием на интенсивность апоптоза (фиг. 2). Данные, представленные на фиг. 1 и 2, показали, что способ изобретения ингибирует спонтанную гибель клеток.
[0029] Обработка ксеноном также улучшала рост клеток после экспозиции доксорубицина (фиг. 3). В частности, клетки эталона (контроля) продолжали претерпевать гибель, вызванную доксорубицином, в то время как наблюдалось повышение числа живых клеток в образцах, обработанных ксеноном (Хе+37 доксо, Хе+4 доксо). Ксенон предотвращал развитие как спонтанного (не доксо и необработанного) так и индуцированного (доксо) апоптоза как в клетках Jurkat (фиг. 4), так и в клетках U-937 (фиг. 5).
[0030] Доксорубицин, будучи известным индуктором апоптоза, вызывает поражение митохондрального мембранного потенциала. Ксенон (как в комбинации с охлаждением так и без охлаждения) оказывает защитное действие на клеточные митохондрии. Например, в присутствии ксенона процентное содержание обработанных доксорубицином клеток с неповрежденными митохондриями было существенно выше, чем в клетках, хранившихся без ксенона (фиг. 5) как после 24 ч так и 7 суток хранения. После 7 суток хранения, ксенон также значительно снижал поражение митохондрий по сравнению с контролем (без газа, 37°С), что обусловлено ростом клеток без клеточного деления в среде - обычно данные клетки делятся каждые 2-3 суток. Полагают, что защита митохондрий происходит из-за того, что присутствие ксенона защищает органеллы от действия холода (фиг. 2, группы Хе+4 и NG+4 с доксо и без доксо).
[0031] Хотя данное изобретение описано подробно с целями иллюстрации, понятно, что такая подробность дается исключительно для такой цели, и варианты могут быть сделаны здесь специалистами в данной области без отклонения от сути и охвата изобретения, которое определено следующими пунктами формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КУЛЬТИВИРОВАНИЯ КЛЕТОК ЗЛОКАЧЕСТВЕННЫХ ЛИМФОИДНЫХ ОПУХОЛЕЙ | 2019 |
|
RU2728266C1 |
| СПОСОБ КРИОКОНСЕРВАЦИИ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК | 2010 |
|
RU2433173C1 |
| СПОСОБ КОНСЕРВАЦИИ КЛЕТОК, ТКАНЕЙ ИЛИ ОРГАНОВ ПОСРЕДСТВОМ ГИПОТЕРМИИ | 2016 |
|
RU2722044C2 |
| Способ хранения клеточных культур в суспензии | 2017 |
|
RU2660075C1 |
| Композиция для хранения или транспортировки мезенхимальных стволовых клеток и способы ее приготовления и применения | 2020 |
|
RU2836320C1 |
| СПОСОБ КОНСЕРВАЦИИ ТРОМБОЦИТОВ | 2012 |
|
RU2690450C2 |
| Способ трансплантации аутологичных гемопоэтических стволовых клеток периферической крови | 2019 |
|
RU2734121C1 |
| Способ in vitro пролиферации стволовых клеток и применение устройства для усиления пролиферации стволовых клеток in vitro | 2015 |
|
RU2688444C1 |
| СПОСОБ КОНСЕРВАЦИИ БИОМАТЕРИАЛА | 2014 |
|
RU2577996C2 |
| СПОСОБ ИНДУЦИРОВАНИЯ ДИФФЕРЕНЦИАЦИИ СТВОЛОВЫХ КЛЕТОК В ДОФАМИНЕРГИЧЕСКИЕ НЕРВНЫЕ КЛЕТКИ-ПРЕДШЕСТВЕННИКИ | 2020 |
|
RU2800840C1 |
Изобретение относится к консервации клеток, образующих ядро, а именно к способу снижения апоптоза хранящихся клеток и к охлажденной композиции, содержащей клетки, образующие ядро, где клетки находятся в контейнере и хранятся с помощью указанного выше способа. Способ включает: 1) хранение клеток, образующих ядро, в контейнере; 2) добавление газа в указанный контейнер таким образом, чтобы давление внутри контейнера достигало 0,5 атм - 4 атм выше давления окружающей среды, где указанный газ представляет собой или включает газ ксенона; 3) сохранение указанного давления в указанном контейнере в продолжение первого периода времени, в течение которого температура в указанном контейнере равна 22°C-37°C; 4) после указанного первого периода времени снижение указанной температуры в контейнере до 0,1°C-10°C с одновременным сохранением указанного давления на 0,5 атм - 4 атм выше давления окружающей среды; 5) сохранение указанного контейнера при указанной более низкой температуре и при давлении на 0,5 атм - 4 атм выше давления окружающей среды в течение второго периода времени, где указанный второй период времени больше чем указанный первый период времени; и 6) после указанного второго периода времени, снижение давления в указанном контейнере до давления окружающей среды и повышение температуры в указанном контейнере до 22°C-37°C. Осуществление способа позволяет снизить апоптоз клеток. 2 н. и 12 з.п. ф-лы, 6 ил.
1. Способ снижения апоптоза, включающий:
i) хранение клеток, образующих ядро, в контейнере;
ii) добавление газа в указанный контейнер, так что давление внутри контейнера достигает 0,5 атм - 4 атм выше давления окружающей среды, где указанный газ представляет собой или включает газ ксенона;
iii) сохранение указанного давления в указанном контейнере в продолжение первого периода времени, в течение которого температура в указанном контейнере равна 22°C-37°C;
iv) после указанного первого периода времени, снижение указанной температуры в контейнере до 0,1°C-10°C с одновременным сохранением указанного давления на 0,5 атм - 4 атм выше давления окружающей среды;
v) сохранение указанного контейнера при указанной более низкой температуре и при давлении на 0,5 атм - 4 атм выше давления окружающей среды в течение второго периода времени, где указанный второй период времени больше, чем указанный первый период времени; и
vi) после указанного второго периода времени, снижение давления в указанном контейнере до давления окружающей среды и повышение температуры в указанном контейнере до 22°C-37°C.
2. Способ по п. 1, где указанный первый период времени равен от 15 минут до 24 часов.
3. Способ по п. 1, где указанный второй период времени равен от 2 часов до трех недель.
4. Способ по п. 1, где указанный второй период времени равен по меньшей мере 2 суткам, предпочтительно, по меньшей мере 7 суткам, еще более предпочтительнее, по меньшей мере 14 суткам.
5. Способ по п. 1, где указанное давление в указанном контейнере в течение указанного второго периода времени на 3 атм - 4 атм выше давления окружающей среды.
6. Способ по п. 1, где указанная температура в течение указанного второго периода времени равна 4°C-10°C.
7. Способ по п. 1, где указанное давление постепенно снижают в указанном контейнере после второго периода времени на протяжении третьего периода времени, причем указанный третий период времени составляет вплоть до 60 минут.
8. Способ по любому из пп. 1-7, где указанный газ представляет собой газ ксенона.
9. Способ по любому из пп. 1-7, где указанный газ представляет собой смесь газов, которая включает газ ксенона, газ диоксида углерода и газ азота, причем содержание указанного газа ксенона больше, чем содержание указанного газа диоксида углерода и меньше, чем содержание указанного газа азота.
10. Способ по любому из пп. 1-7, где указанный газ представляет собой смесь газов, которая включает газ ксенона, газ диоксида углерода, причем содержание указанного газа ксенона больше, чем содержание указанного газа диоксида углерода.
11. Способ по любому из пп. 1-7, где указанные клетки представляют собой клетки млекопитающего или клетки человека.
12. Охлажденная композиция, содержащая клетки, образующие ядро, где клетки присутствуют в контейнере и хранятся с помощью способа, определенного в любом из пп. 1-11.
13. Охлажденная композиция, определенная в п. 12, где указанный контейнер содержит газ под давлением, который включает ксенон.
14. Охлажденная композиция, определенная в п. 12 или 13, где указанные клетки представляют собой клетки человека.
| US 20080031971 A1, 07.02.2008 | |||
| US 20100009334 A1, 14.01.2010 | |||
| US 20090081785 A1, 26.03.2009. |
Авторы
Даты
2016-05-10—Публикация
2012-02-03—Подача