ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу индуцирования дифференциации стволовых клеток в специфичные для среднего мозга дофаминергические нервные клетки-предшественники и массовой продукции происходящих от стволовых клеток специфичных для среднего мозга дофаминергических нервных клеток-предшественников.
Настоящее изобретение было поддержано грантом (номер проекта HI18C0096) от Министерства здоровья и благосостояния, Корея. Данный проект проводится в проекте с названием «Разработка на основе функции и эффективности продукта клеточной терапии болезни Паркинсона, происходящего от плюрипотентных стволовых клеток» в качестве исследования под названием «Разработка передовой медицинской методики» управляющей компанией.
В данной патентной заявке испрашивается приоритет и преимущество Корейской патентной заявки №10-2019-0118370, поданной 25 сентября 2019 г., полное содержание которой включается в данный документ посредством ссылки.
Описание предшествующего уровня техники
Термин «стволовые клетки» относится к клеткам, остающимся в фазе преддифференциации, и они подвергаются дифференциации в специфические клетки при воздействии специфичных стимулов (среды) дифференциации. В отличие от полностью дифференцированных клеток, которые далее не дифференцируются, стволовые клетки также могут демонстрировать характерную пролиферацию (размножение) для деления при самообновлении с получением более, чем того же самого типа стволовых клеток. Кроме того, стволовые клетки, которые дифференцируются в специфические клетки в ответ на стимулы дифференциации, характеризуются пластичностью дифференциации в том, что типы клеток, в которые дифференцируются стволовые клетки, зависят от сред или стимулов, воздействию которых подвергаются стволовые клетки.
В настоящее время большое внимание уделяется стволовым клеткам для применения в качестве продуктов клеточной терапии. Также проводили много исследований по применению стволовых клеток в качестве продуктов клеточной терапии для разных неврологических заболеваний, вызванных повреждением нервов. Среди других заболеваний заболевания черепных нервов считаются самой подходящей мишенью для терапии на основе транспланации клеток, так как ткани в нервной системе мозга почти не демонстрируют ответов иммунного отторжения, в отличие от других тканей, и, таким образом, ожидается, что она обеспечивает долговременное выживание клеток, пересаженных извне.
Тем временем, требуется методика эффективной дифференциации стволовых клеток в специфические клетки и поставки специфических клеток в желательное время для того, чтобы увеличивать эффективность стволовых клеток в качестве продуктов клеточной терапии.
Однако до сих пор не было разработано методик дифференциации стволовых клеток в специфические клетки (среди прочих - дофаминергические нервные клетки) с такой высокой эффективностью, чтобы обеспечивать клиническое применение и хранение данных клеток на подходящих стадиях.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Приводящее к настоящему раскрытию интенсивное и тщательное исследование по индукции дифференциации стволовых клеток в специфичные для среднего мозга дофаминергические нервные клетки-предшественники, проведенное авторами настоящего изобретения с целью разработки продуктов клеточной терапии для внутричерепных нервных болезней, привело к предложению способа, обеспечивающего массовую продукцию специфичных для среднего мозга дофаминергических нервных клеток-предшественников с такой высокой эффективностью, чтобы обеспечивать клиническое применение.
Следовательно, целью настоящего раскрытия является предложение способа индуцирования дифференциации стволовых клеток в дофаминергические нервные клетки-предшественники.
Другой целью настоящего раскрытия является предложение способа массовой продукции дофаминергических нервных клеток-предшественников.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Приведенные выше и другие аспекты, характеристики и преимущества настоящего раскрытия будут более очевидными из следующего подробного описания, взятого в сочетании с сопровождающими графическими материалами, в которых:
ФИГ. 1 представляет собой схематический вид, иллюстрирующий способ индуцирования дифференциации в дофаминергические нервные клетки-предшественники согласно одному воплощению настоящего раскрытия;
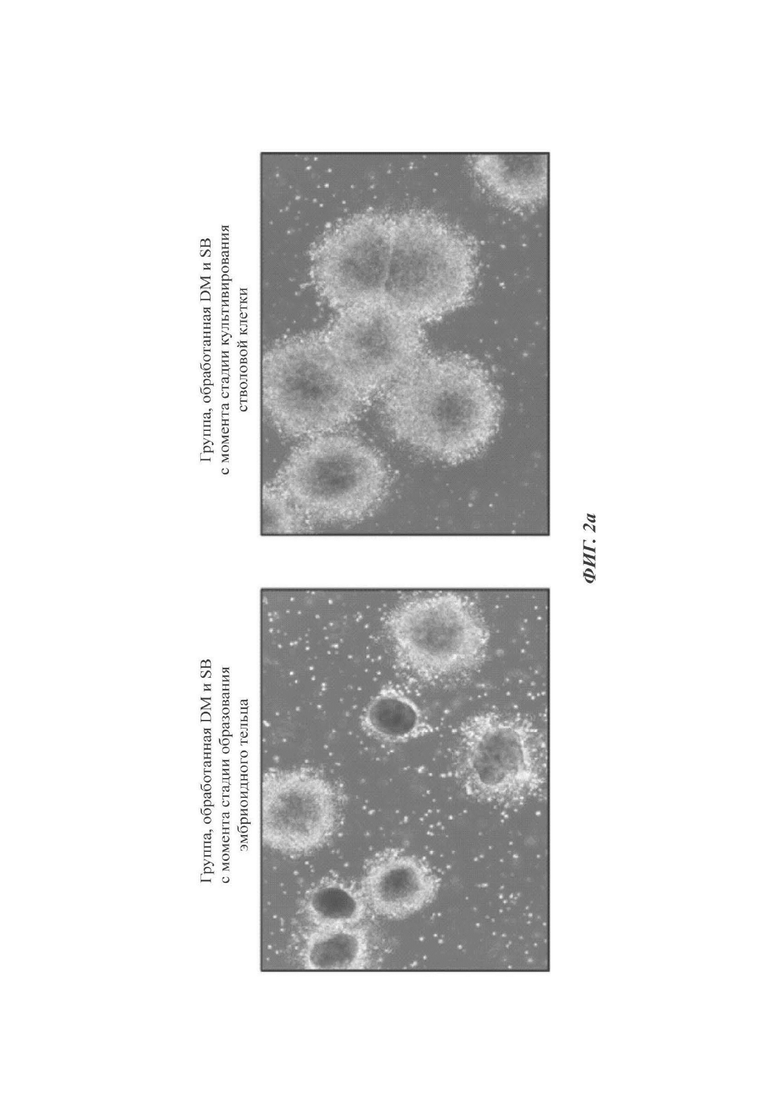
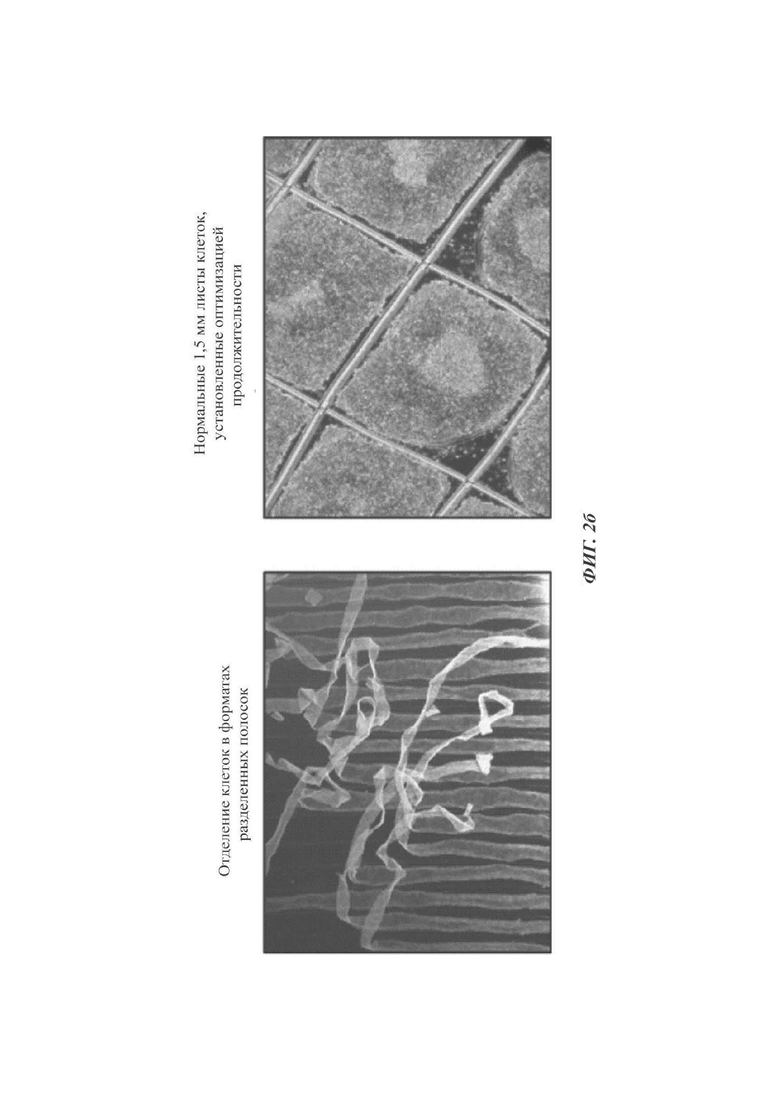
ФИГ. 2а и 2б представляют собой изображения, показывающие оптимальную продолжительность культивирования стволовых клеток согласно одному воплощению настоящего изобретения (происходящих от эмбриональных стволовых клеток);
ФИГ. 3 представляет собой изображение, показывающее оптимальную продолжительность культивирования эмбриоидных телец согласно одному воплощению настоящего изобретения (происходящих от эмбриональных стволовых клеток);
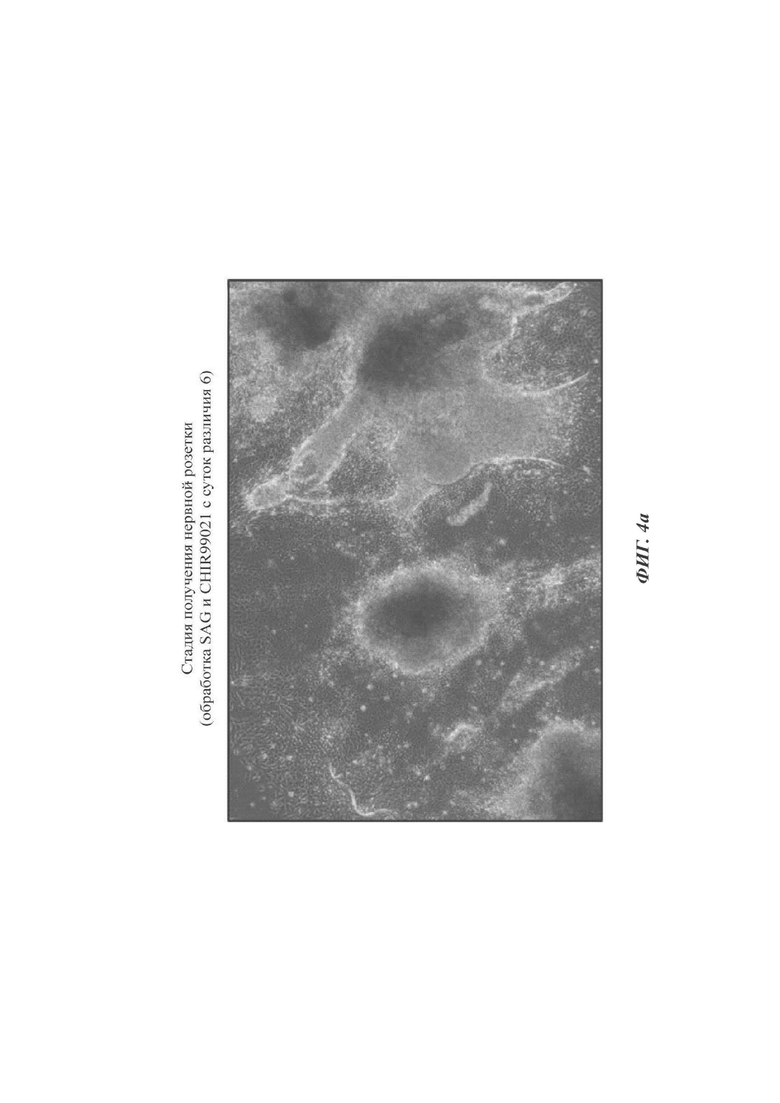
ФИГ. 4а-4в представляют собой изображения, показывающие оптимальное время обработки SAG и CHIR99021 для культивирования эмбриоидных телец согласно одному воплощению настоящего раскрытия (происходящих от эмбриональных стволовых клеток);
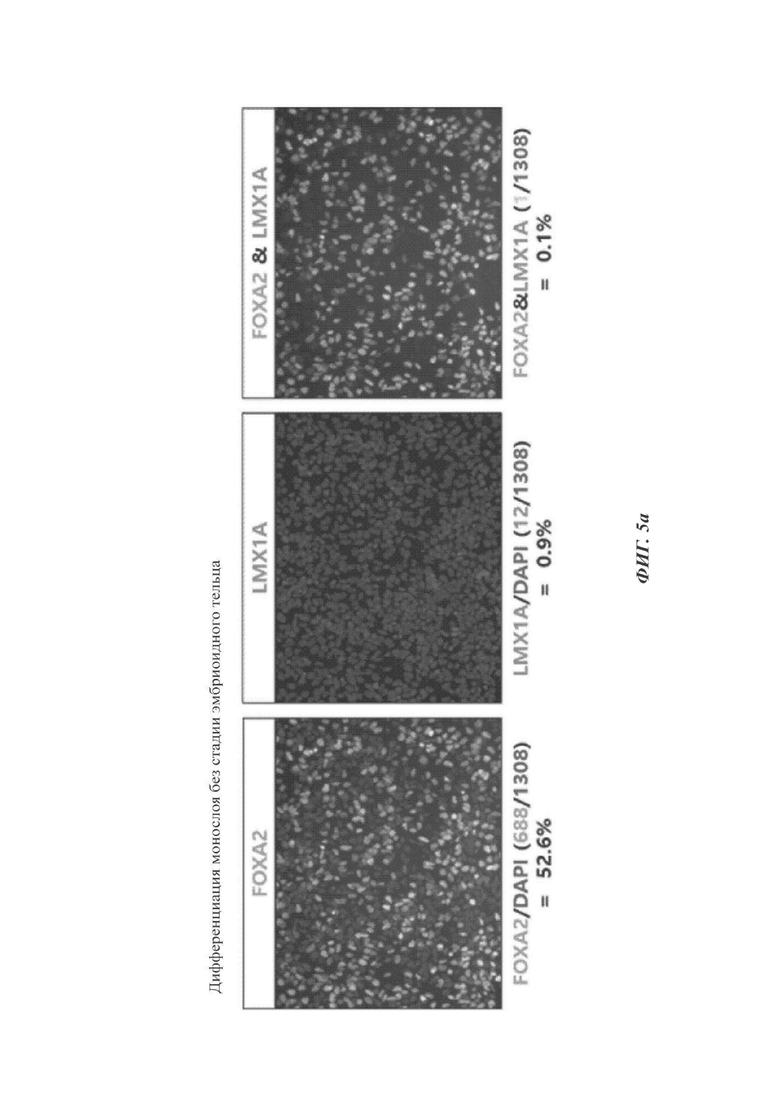
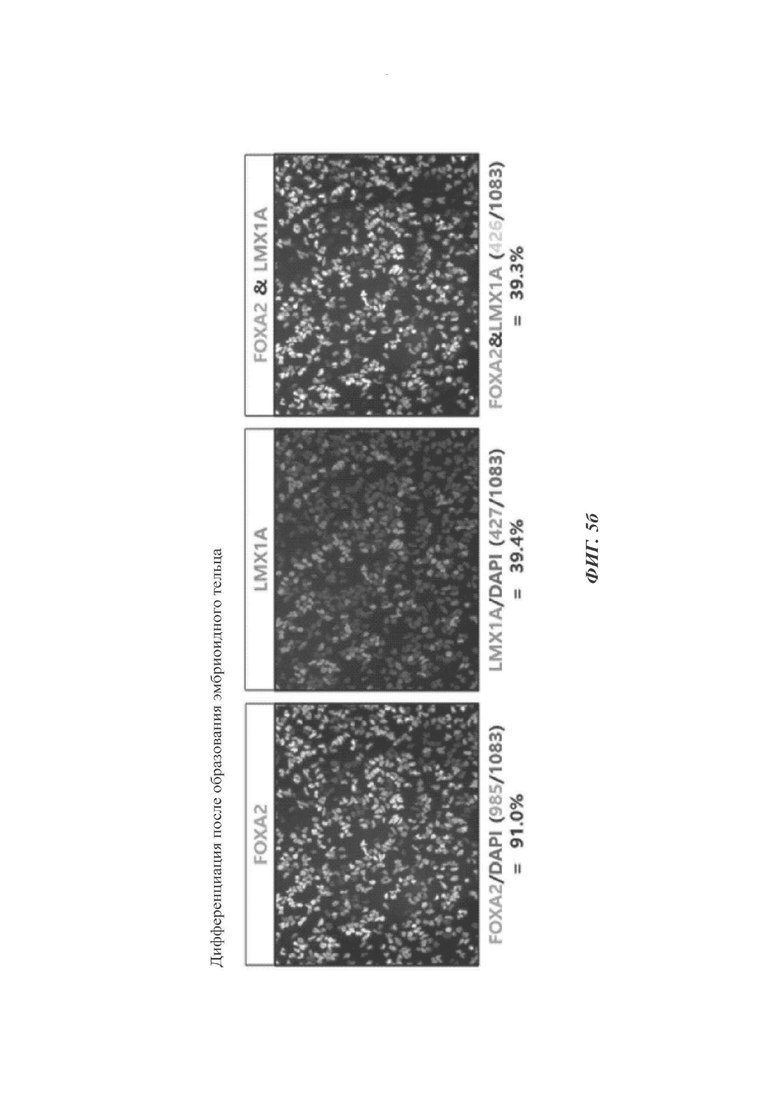
ФИГ. 5а и 5б представляют собой изображения, показывающие, является ли необходимой или нет стадия образования эмбриоидных телец согласно одному воплощению настоящего изобретения (происходящих от эмбриональных стволовых клеток);
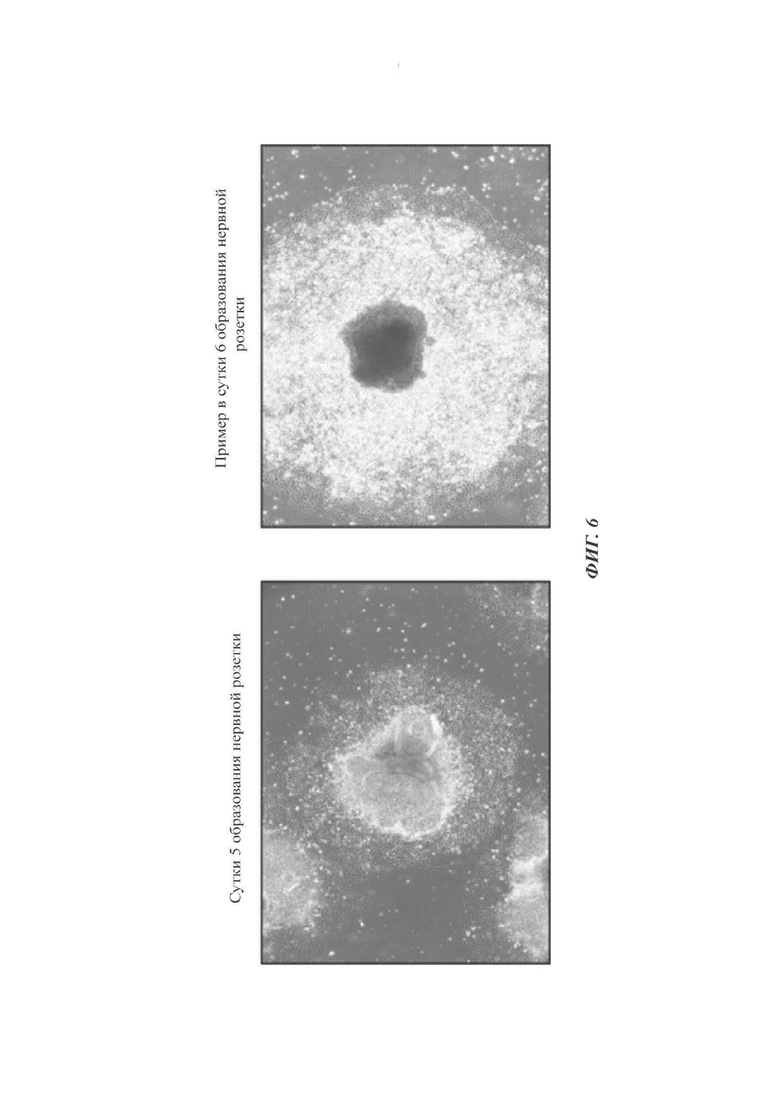
На ФИГ. 6 показаны изображения, иллюстрирующие оптимальную продолжительность культивирования для получения нервной розетки (происходящей от эмбриональных стволовых клеток);
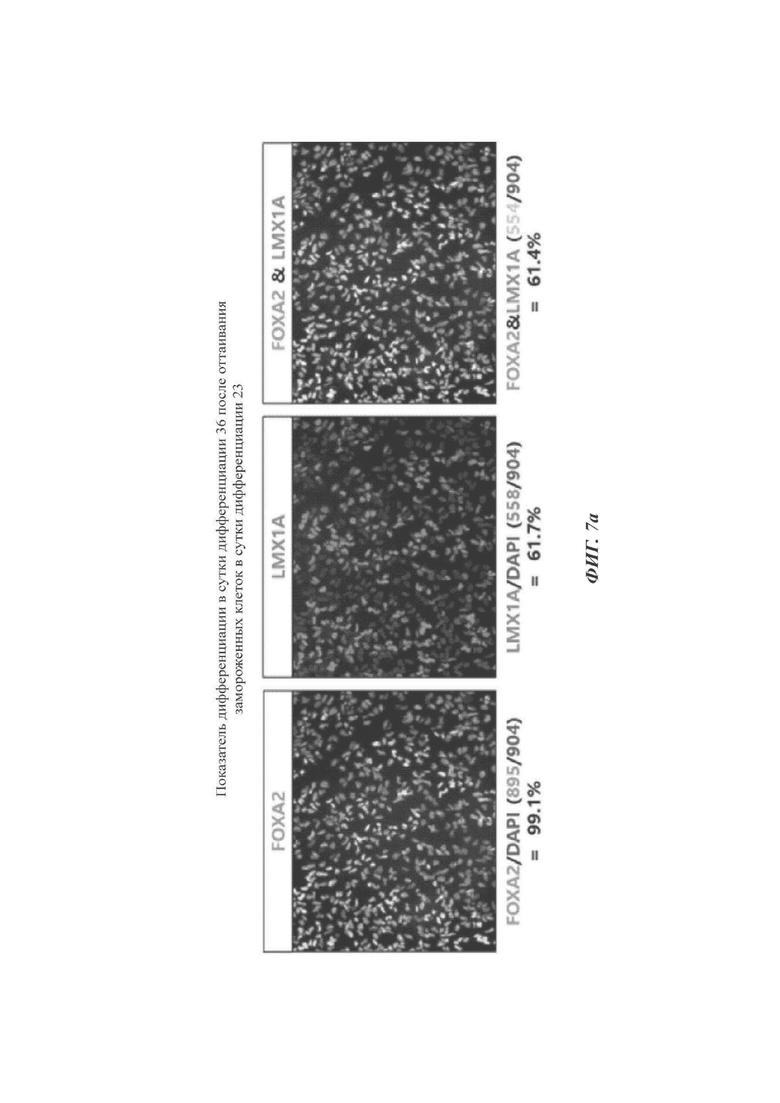
ФИГ. 7а и 7б представляют собой изображения, показывающие оптимальную продолжительность культивирования для дифференциации в дофаминергические нервные клетки-предшественики согласно одному воплощению настоящего раскрытия (происходящие от эмбриональных стволовых клеток);
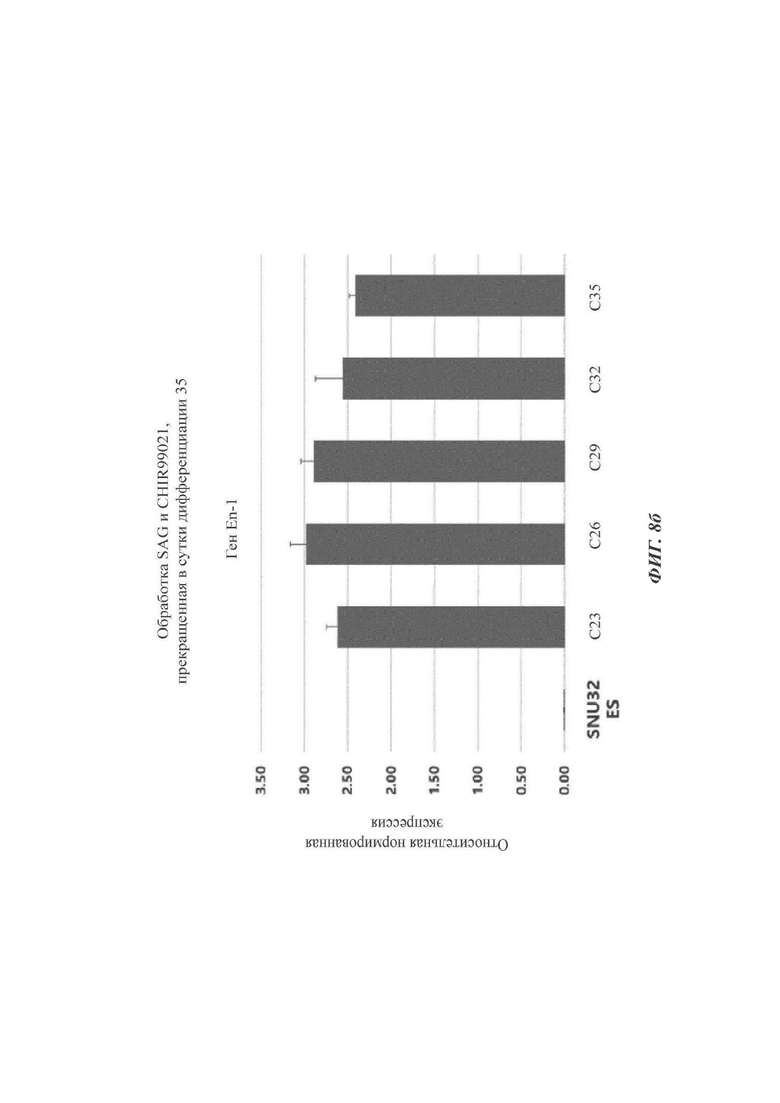
ФИГ. 8а-8г представляют собой графики и изображения, показывающие оптимальную продолжительность обработки SAG и CHIR99021 для дифференциации в дофаминергические нервные клетки-предшественики согласно одному воплощению настоящего раскрытия (происходящие из эмбриональных стволовых клеток);
ФИГ. 9а-9в представляют собой изображения, показывающие оптимальные концентрации обработки SAG и CHIR99021 согласно одному воплощению настоящего раскрытия (происходящие из эмбриональных стволовых клеток);
ФИГ. 10а и 10б представляют собой изображения, показывающие оптимальные концентрации обработки ЕСМ согласно одному воплощению настоящего раскрытия (происходящие из эмбриональных стволовых клеток);
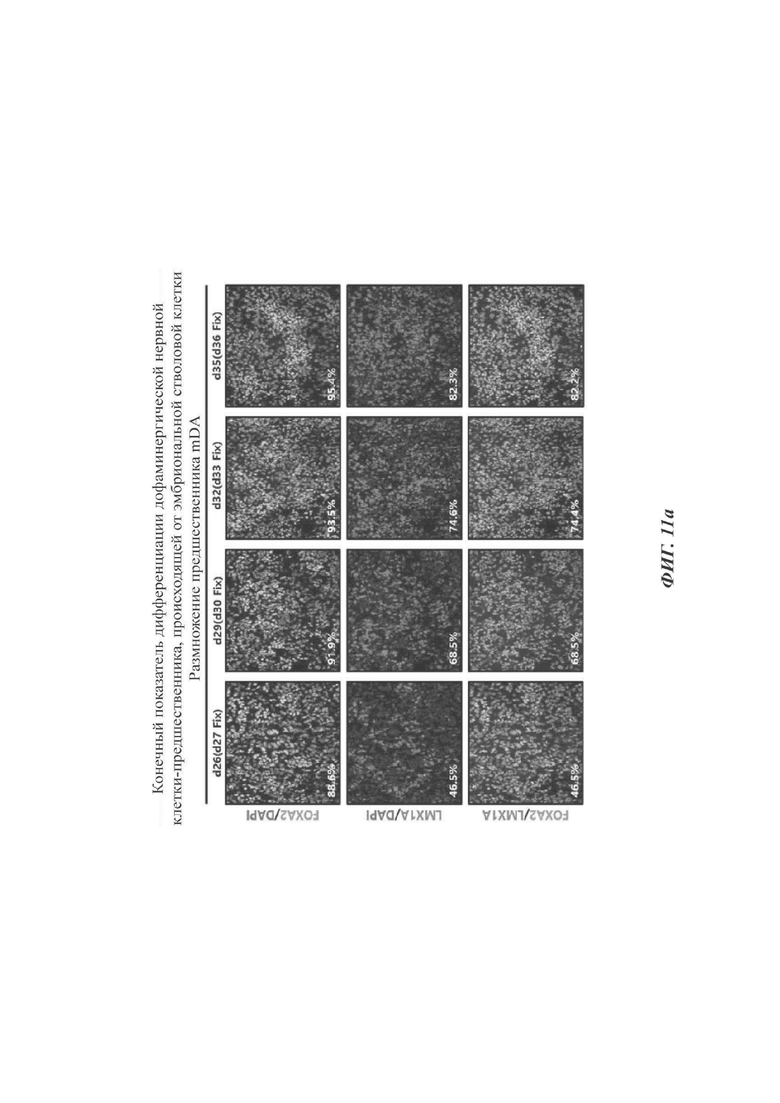
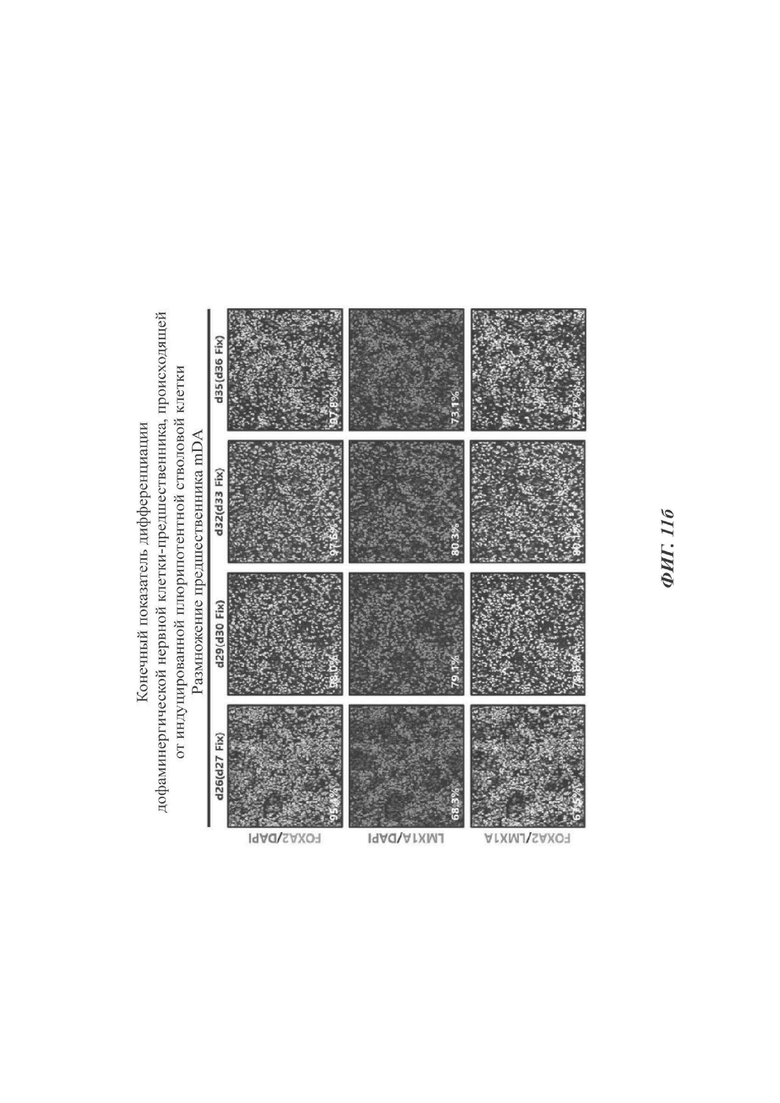
ФИГ. 11а и 11б представляют собой изображения, показывающие конечный показатель дифференциации дофаминергических нервных клеток-предшественников согласно одному воплощению настоящего раскрытия (11а: происходящие от эмбриональных стволовых клеток, 11б: происходящие от индуцированных плюрипотентных стволовых клеток);
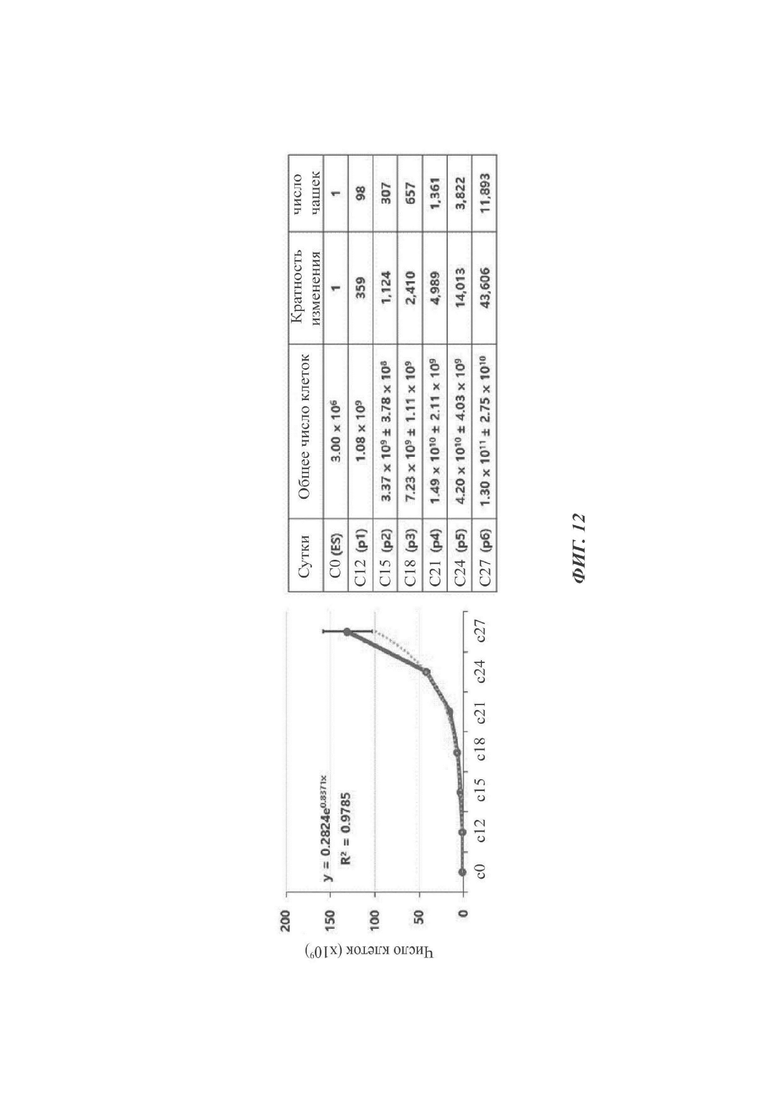
На ФИГ. 12 показан график, наряду с таблицей, показывающий массовую продукцию дофаминергических нервных клеток-предшественников согласно одному воплощению настоящего раскрытия (происходящих от эмбриональных стволовых клеток); и
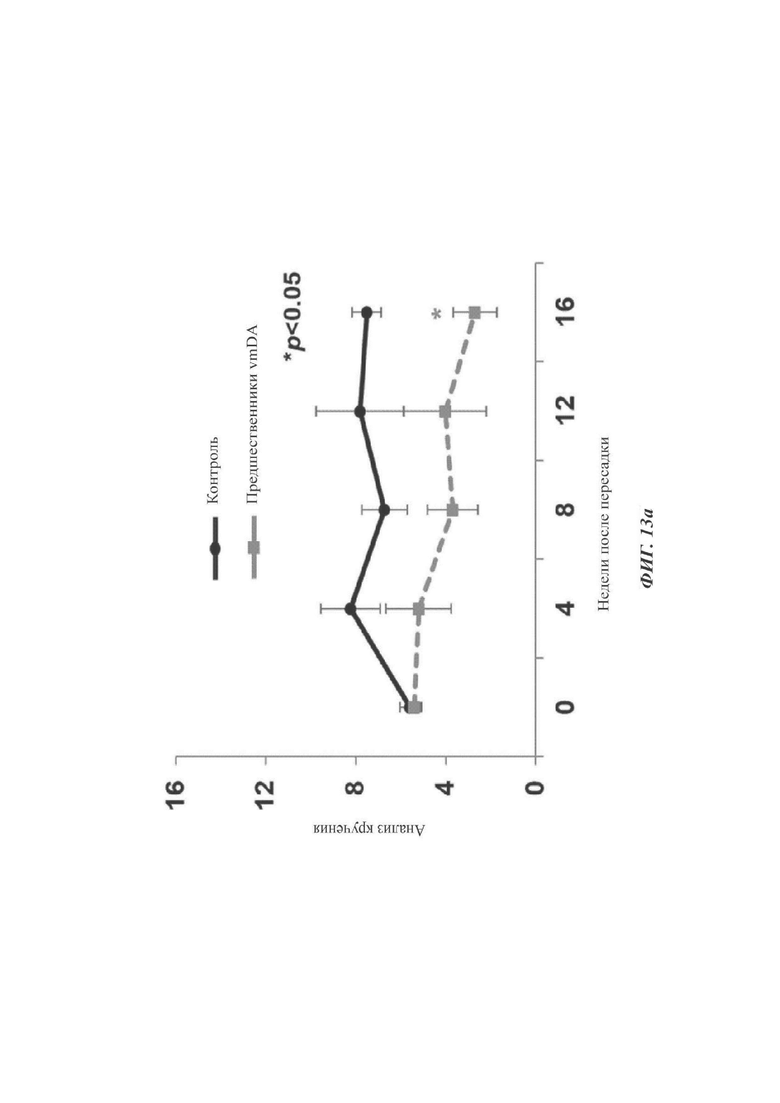
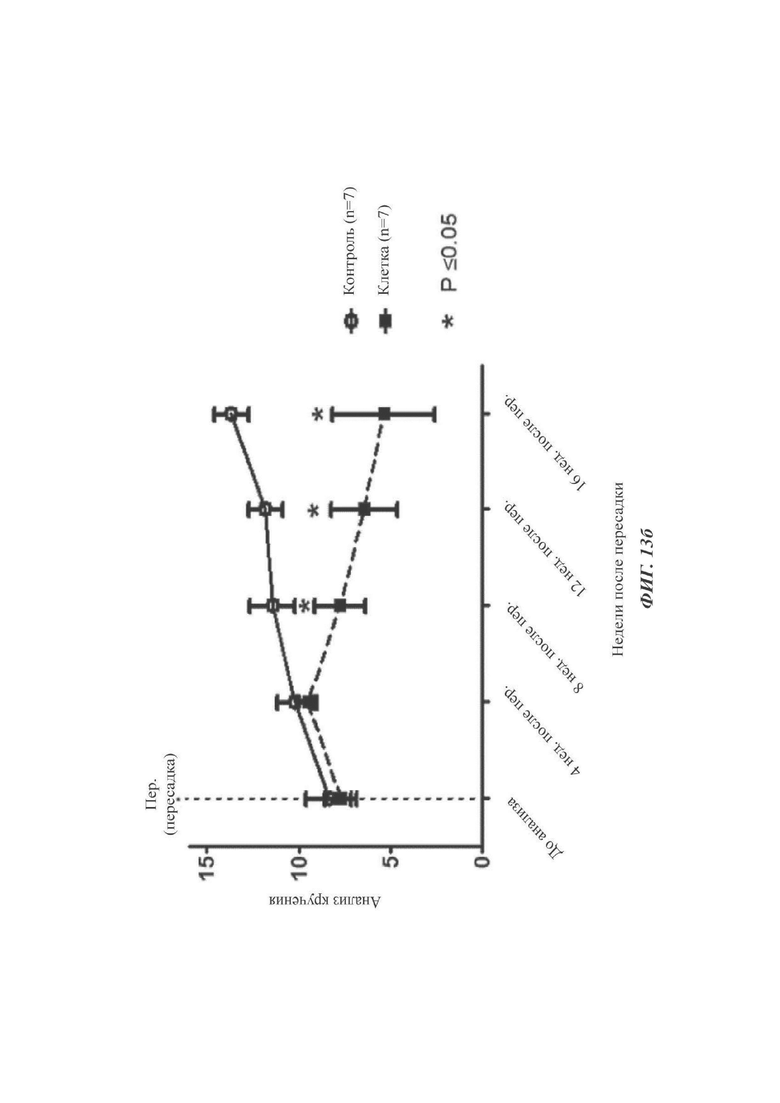
ФИГ. 13а и 13б представляют собой графики, показывающие эффективность in vivo дофаминергических нервных клеток-предшественников согласно одному воплощению настоящего раскрытия (происходящих от эмбриональных стволовых клеток).
ПОДРОБНОЕ ОПИСАНИЕ ТИПИЧНЫХ ВОПЛОЩЕНИЙ
Для того чтобы разработать продукт клеточной терапии для внутричерепного нервного заболевания, авторы настоящего изобретения предприняли усилия для разработки способа индуцирования дифференциации стволовых клеток в специфичные для среднего мозга дофаминергические нервные клетки-предшественники. В результате вводится способ массовой продукции специфичных для среднего мозга дофаминергических нервных клеток-предшественников в такой высокой эффективности, чтобы обеспечивать клиническое применение.
Кроме того, авторы настоящего изобретения установили эффективный способ, обеспечивающий хранение индуцированных к дифференциации специфичных для среднего мозга дофаминергических нервных клеток-предшественников в виде рабочего банка клеток (WCB) на подходящей стадии.
Настоящее раскрытие относится к способу индуцирования дифференциации стволовых клеток в дофаминергические нервные клетки-предшественники и продуцирования дофаминергических нервных клеток-предшественников в массовом масштабе.
Ниже будет приведено подробное описание настоящего раскрытия.
Согласно одному его аспекту настоящее раскрытие относится к способу индуцирования дифференциции стволовых клеток в дофаминергические нервные клетки-предшественники, включающему следующие стадии:
а) культивирование стволовых клеток в формате монослоя;
б) образование и поддержание эмбриоидного тельца;
в) получение нервной розетки; и
г) дифференциация данной нервной розетки в дофаминергические нервные клетки-предшественники.
Далее будет подробно описан способ получения дофаминергических нервных клеток.
Стадия а)
Данная стадия представляет собой способ, в котором недифференцированные стволовые клетки стимулируются посредством обработки ингибитором сигнализации BMP (морфогенетический белок кости) и ингибитором сигнализации активина/nodal. В данном способе стволовые клетки дифференцируются в эктодермальные клетки, особенно нейроэктодермальные клетки, с более высокой эффективностью по сравнению с клетками, которые не были обработаны такими веществами.
Данные стволовые клетки могут представлять собой эмбриональные стволовые клетки, индуцированные плюрипотентные стволовые клетки (iPSC), стволовые клетки взрослых, соматические клетки с переносом ядра из эмбриональных стволовых клеток или стволовые клетки, полученные прямым перепрограммированием.
Данная стадия может проводиться в течение 5-9 суток или 8 суток, но не ограничиваясь ими.
Дифференциация в пределах данного интервала обеспечивает образование эмбриоидных телец без коллагеназы. При отклонении от данного интервала дифференциация не гарантирует получения желательных клеток, но может идти до природной дифференциации или может создавать проблемы на следующей стадии образования эмбриоидного тельца. Тем временем, могут быть установлены соответствующие оптимальные периоды времени для индивидуальных типов стволовых клеток в пределах данного интервала, так как время работы ингибиторов отличается от одного типа стволовых клеток к другому.
На данной стадии ежесуточно могут добавляться ингибитор сигнализации BMP и ингибитор сигнализации активина/nodal от 1-3 суток до окончания данной стадии, но не ограничиваясь ими.
При условии, что он известен в данной области, может быть доступен любой ингибитор сигнализации BMP без ограничений. Примеры ингибитора сигнализации BMP включают дорзоморфин, Smad6, Smad7, ноггин, хордин, гремлин, Sog (короткая гаструляция), фоллистатин, DAN (дифференциальный скрининг - отобранный ген, поврежденный при нейробластоме), церберус, данте и/или PRDC (белок, родственный DAN и церберус).
В настоящем раскрытии «дорзоморфин» представляет собой ингибитор против пути сигнализации BMP, действующий, ингибируя сам BMP или подавляя связывание BMP с рецептором BMP.
Дорзоморфин представлен следующей химической Формулой 1:
[Химическая Формула 1]

На данной стадии ингибитор сигнализации BMP может использоваться в концентрации от 1,0 до 20,0 мкМ, в концентрации от 4,0 до 6,0 мкМ или в концентрации от 5,0 мкМ, но не ограничиваясь ими.
Концентрация, отклоняющаяся от данного интервала, может вызывать клеточную гибель. Тем временем, в пределах данного интервала могут быть установлены соответствующие оптимальные концентрации для индивидуальных типов стволовых: клеток, так как рабочие концентрации данного ингибитора отличаются от одного типа стволовых клеток к другому.
Может быть сделан выбор разных ингибиторов сигнализации активина/nodal без ограничений. В частности, полезным в настоящем раскрытии ингибитором сигнализации активина/nodal может быть 4-(5-бензо[1,3]диоксол-5-ил-4-пиридин-2-ил-1Н-имидазол-2-ил)-бензимид, Smad6, Smad7 и/или фоллистатин.
В настоящем раскрытии «4-(5-бензо[1,3]диоксол-5-ил-4-пиридин-2-ил-1Н-имидазол-2-ил)-бензимид», известный в данной области как SB431542, ингибирует путь сигнализации активина/nodal посредством подавления самого активина/nodal или предотвращения связывания активина/nodal а с его рецептором.
4-(5-Бензо[1,3]диоксол-5-ил-4-пиридин-2-ил-1Н-имидазол-2-ил)-бензимид представлен следующей Химической Формулой 2:
[Химическая Формула 2]
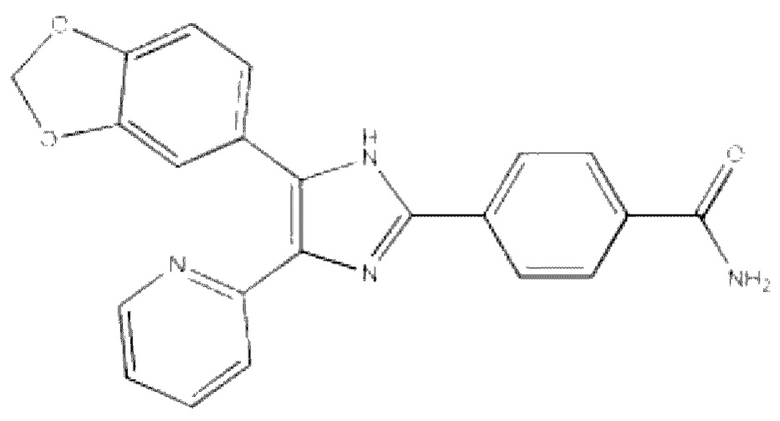
В настоящем раскрытии соединение, представленное Химической Формулой 1, используется в комбинации c SB431542.
На данной стадии ингибитор сигнализации активина/nodal может использоваться в концентрации от 1,0 до 50,0 мкМ, в концентрации от 4,0 до 6,0 мкМ или в концентрации от 5,0 мкМ, но не ограничиваясь ими.
При отклонении от данного интервала концентрация ингибитора сигнализации активина/nodal может вызывать гибель клеток. Тем временем, в пределах данного интервала могут быть установлены соответствующие оптимальные концентрации для индивидуальных типов стволовых клеток, так как рабочие концентрации данного ингибитора отличаются от одного типа стволовой клетки к другому.
На данной стадии клетки могут культивироваться в культуральной среде TeSR2. Это предназначено для применения клеток для поступления в клинические испытания и в качестве продуктов клеточной терапии. Помимо среды для культуры клеток TeSR2, может селективно применяться без ограничений любая среда для культуры стволовых клеток, которая обеспечивает поступление в клинические испытания.
Стадия б)
Данная стадия представляет собой процесс, в котором эмбриоидное тельце формируется и затем стимулируется обработкой активатором сигнализации sonic hedgehog (SHH) и ингибитором GSK-3 (киназа гликогенсинтазы 3) при культивировании. В данном процессе эмбриоидное тельце дифференцируется в дофаминергические нервные клетки-предшественники с более высокой эффективностью по сравнению с эмбриоидными тельцами, которые не обрабатывали такими веществами.
Термин «эмбриоидное тельце» в том виде, в котором он используется в данном документе, относится к трехмерному агрегату плюрипотентных стволовых клеток, представителями которых являются эмбриональные стволовые клетки. Плюрипотентные стволовые клетки в пределах эмбриоидных телец могут подвергаться дифференциации на исходной стадии эмбрионального развития и детерминации клеток по трем зародышевым линиям эндодермы, эктодермы и мезодермы, которые содержат все типы соматических клеток.
Данная стадия может осуществляться в течение 3-6 суток, 4 суток, 5 суток или 6 суток, но не ограничиваясь ими.
Образование и поддержание эмбриоидного тельца в пределах данного интервала может обеспечивать максимальный показатель дифференциации (выход) дофаминергических нервных клеток-предшественников. При осуществлении данной стадии за пределами данного интервала эмбриоидное тельце подвергается плохому влиянию и, таким образом, дифференцируется с плохим показателем. Тем временем, в пределах данного интервала могут быть установлены соответствующие оптимальные периоды времени для индивидуальных типов стволовых клеток, так как рабочие периоды времени отличаются от одного типа стволовой клетки к другому.
На данной стадии ингибитор сигнализации BMP и ингибитор сигнализации активина/nodal могут ежесуточно добавляться с исходных суток данной стадии, при этом может дополнительно улучшаться эффективность дифференциации в нейроэктодерму.
Кроме того, на данной стадии ежесуточно с 2-6 суток после начала стадии, но не ограничиваясь ими, можно добавлять активатор сигнализации SHH и ингибитор GSK-3.
Может осуществляться выбор разных активаторов сигнализации SHH, известных в данной области, без ограничений. Примеры активатора сигнализации SHH включают анонист smoothened (SAG), пурморфамин, галцинонид, флутиказон, клобетазол и/или флуоцинонид.
Термин «агонист smoothened» (SAG) в том виде, в котором он используется в данном документе, относится к низкомолекулярному соединению, активирующему путь сигнализации sonic hedgehog (SHH). SHH играет критическую роль в дифференциации и распространении дофаминергических нейронов вентрального среднего мозга на нейроэктодермальной стадии развития.
Кроме того, как объясняется в следующем разделе Примеры, SAG действует в повышающей регуляции экспрессии FOXA2, который является одним из важных маркеров дофаминергических нервных клеток-предшественников. FOXA2 (крылатая спираль/forkhead box А2) (HNF3beta) представляет собой транскрипционный фактор, который играет важную роль в развитии центральной нервной системы (ЦНС) и имеет влияние на экспрессию разных генов, участвующих в специфичном для среднего мозга развитии, и на образование специфичных для среднего мозга дофаминергических нейронов.
В то же самое время, применение одного активатора сигнализации SHH делает невозможной дифференциацию стволовых клеток в специфичные для среднего мозга дофаминергические клетки-предшественники, так как в дифференциации с высоким выходом специфичных для среднего мозга дофаминергических клеток-предшественников участвует активатор сигнализации SHH в сочетании с ингибитором GSK-3, как будет описано ниже.
SAG представлен следующей Химической Формулой 3:
[Химическая Формула 3]
На данной стадии активатор сигнализации SHH может использоваться в концентрации от 0,1 до 5,0 мкМ, в концентрации от 0,6 до 5,0 мкМ или в концентрации 1,0 мкМ, но не ограничиваясь ими.
При превышении концентрацией данного интервала активатор может индуцировать дифференциацию в нежелательные клетки. Тем временем, в пределах данного интервала могут быть установлены соответствующие концентрации для индивидуальных типов стволовых клеток, так как рабочая концентрация отличается от одного типа стволовой клетки к другому.
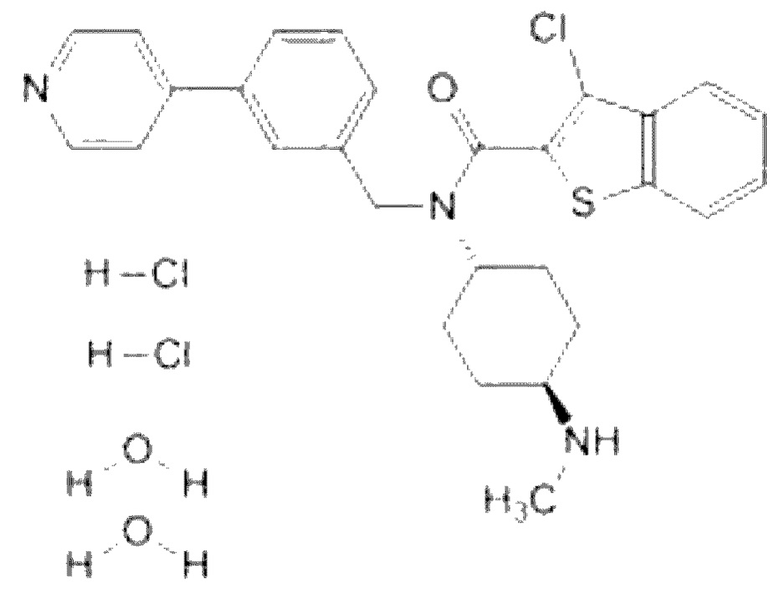
Может быть сделан выбор разных ингибиторов GSK-3, известных в данной области, без ограничений. Конкретные примеры ингибитора GSK-3 включают 6-[[2-[[4-(2,4-дихлорфенил)-5-(5-метил-1Н-имидазол-2-ил)-2-пиримидинил]амино]этил]амино]-3-пиридинкарбонитрил (CHIR99021), 3-(2,4-дихлорфенил)-4-(1-метил-1Н-индол-3-ил)-1Н-пиррол-2,5-дион (SB216763), N6-[2-[[4-(2,4-дихлорфенил)-5-(1Н-имидазол-2-ил)-2-пиримидинил]амино]этил]-3-нитро-2,6-пиридиндиамин (CHIR98014), TWS119, тидеглусиб, 3-[(3-хлор-4-гидроксифенил)амино]-4-(2-нитрофенил)-1Н-пиррол-2,5-дион (SB415286), (2'Z,3'E)-6-броминдирубин-3'-оксим(BIO), вальпроевую кислоту, 5-йод-7-β-D-рибофуранозил-7Н-пирроло[2,3-d]пиримидин-4-амин(йодтуберцидин), 1-азакенпауллон, куркумин, оланзапин и/или пиримидин.
Термин «CHIR99021» в том виде, в котором он используется в данном документе, представляет низкомолекулярное соединение, активирующее путь сигнализации Wnt/бета-катенина (ингибитор GSK-3). Путь сигнализации Wnt/бета-катенина контролирует стадию эктодермы и нейрогенеза и, наряду с SHH, играет важную роль в дифференциации дофаминергических нейронов среднего мозга.
Кроме того, CHIR99021 действует в повышающей регуляции экспрессии LMX1A и En-1, которые являются важными маркерами дофаминергических нервных клеток-предшественников, как проиллюстрировано в разделе Примеры ниже.
При использовании одиночно ингибитор GSK-3 не может дифференцировать эмбриоидные тельца в дофаминергические нервные клетки-предшественники, так как ингибитор GSK-3, в сочетании с активатором SHH, участвует в дифференциации специфичных для среднего мозга дофаминергических нервных клеток-предшественников с высоким выходом. Применение одного ингибитора GSK-3 может стимулировать усиленное развитие эмбриоидных телец в клетки заднего мозга. При непрерывном применении ингибитор GSK-3 участвует в пролиферации клеток, но может вызвать проблему с безопасностью при трансплатации.
CHIR99021 представлен следующей Химической Формулой 4:
[Химическая Формула 4]
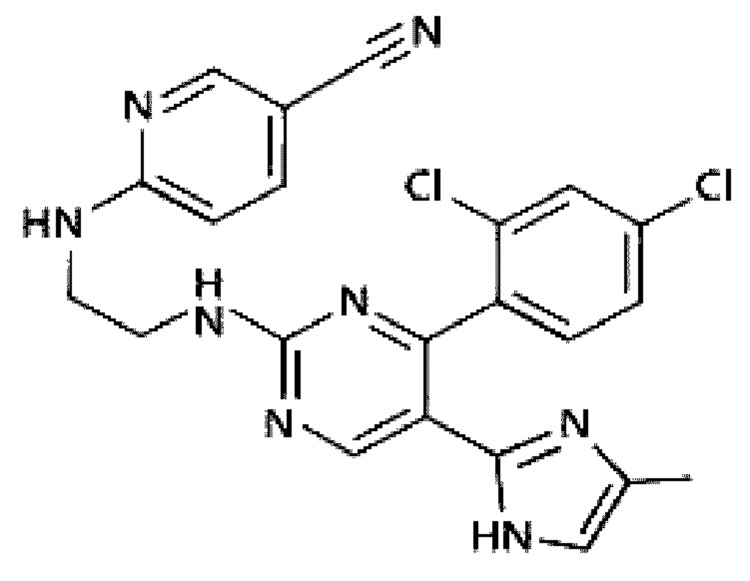
На данной стадии ингибитор GSK-3 может быть добавлен в концентрации от 0,1 до 5,0 мкМ, в концентрации от 1,6 до 5,0 мкМ или в концентрации 2,0 мкМ, но не ограничиваясь ими.
При отступлении от данного интервала концентрация ингибитора GSK-3 может вызывать дифференциацию эмбриоидных телец в нежелательные клетки. Тем временем, в пределах данного интервала могут быть установлены соответствующие концентрации для индивидуальных типов стволовых клеток, так как рабочая концентрация отличается от одного типа стволовой клетки к другому.
На данной стадии эмбриоидные тельца могут культивироваться в культуральной среде клеток ES, не содержащей bFGF (основной фактор роста фибробластов). Однако, при условии, что она обеспечивает культивирование в ней ЕВ (эмбриоидные тельца), можно селективно использовать любую культуральную среду без ограничений.
Стадия в)
Данная стадия представляет собой процесс, в котором образуются нервные розетки. В данном процессе среди нейроэктодермальных клеток может осуществляться отбор клеток, которые предопределены к дифференциации в нервные клетки.
Термин «нервная розетка» в том виде, в котором он используется в данном документе, относится к кластеру клеток, которые предопределены к развитию в разные типы нервных клеток.
Данную стадию можно проводить в течение 3-6 суток, 4 суток или 5 суток, но не ограничиваясь ими.
При проведении данной стадии в течение периода времени, отклоняющегося от данного интервала, нервные розетки не сохраняются для того, чтобы прекращать дифференциацию или вызывать продолжение дифференциации в нежелательном направлении. Тем временем, в пределах данного интервала могут быть установлены соответствующие оптимальные периоды времени для индивидуальных типов стволовых клеток, так как данные рабочие периоды времени отличаются от одного типа стволовой клетки к другому.
На данной стадии с начала данной стадии можно ежесуточно добавлять активатор сигнализации SHH и ингибитор GSK-3. В данном процессе клетки предопределены к дифференциации в дофаминергические нервные клетки-предшественники, отличные от обычных нервных розеток, которые могут дифференцироваться в разные типы нервных клеток, которые могут быть получены в большом количестве.
На данной стадии клетки культивируются в среде для культуры клеток DMEM (среда Игла, модифицированная по Дульбекко)/F12. Однако, при условии, что она обеспечивает образование/поддержание нервных розеток, можно селективно, без ограничений использовать любую среду.
Среда для культуры клеток может дополнительно содержать N2 добавку CTS, человеческий инсулин и bFGF.
Стадия г)
Данная стадия представляет собой процесс, в котором нервные розетки дифференцируются в дофаминергические нервные клетки-предшественники. В данном процессе осуществляется отбор только нервных розеток, за исключением дифференцированных клеток, отличных от нервных клеток, усиливая, посредством этого, дифференциацию в дофаминергические нервные клетки-предшественники.
Термин «нервная клетка» в том виде, в котором он используется в данном документе, относится к клетке, которая является компонентом нервной системы и взаимозаменяемо используется с нейроном.
Термин «дофаминергическая нервная клетка» в том виде, в котором он используется в данном документе, относится к нервной клетке, секретирующей нейромедиатор дофамин.
Термин «клетка-предшественник» в том виде, в котором он используется в данном документе, относится к клетке, которая может делиться непосредственно перед проявлением признаков клетки, которая подверглась полной дифференциации, и взаимозаменяемо используется с термином «прародитель» или «предшественник».
В настоящем раскрытии, следовательно, «дофаминергические нервные клетки-предшественники» представляют собой клетки, которые могут делиться до нервных клеток, секретирующих дофамин, после того, как они подверглись стадии созревания с момента пересадки in vivo.
Данная стадия может проводиться в течение 8-10 суток или 9 суток, но не ограничиваясь ими.
При проведении данной стадии в течение меньшего времени, чем нижняя граница данного интервала, скорость дифференциации дофаминергических клеток-предшественников может снижаться. Период времени, больший, чем верхняя граница данного интервала, может сделать невозможной массовую продукцию. Тем временем, в пределах данного интервала могут быть установлены соответствующие оптимальные периоды времени для индивидуальных типов стволовых клеток, так как рабочие периоды времени отличаются от одного типа стволовой клетки к другому.
На данной стадии активатор сигнализации SHH и ингибитор GSK-3 могут добавляться ежесуточно с начала данной стадии. В данном процессе большинство (примерно 80% или больше) клеток могут дифференцироваться в дофаминергические нервные клетки-предшественники с течением суток дифференциации.
Данная стадия проводится посредством замены среды на свежую среду каждые сутки и пассированием клеток каждые трое суток с начала данной стадии, при этом дофаминергические нервные клетки-предшественники могут пролиферировать в большом масштабе, поддерживаться в наилучшем состоянии, и скорость дифференциации может улучшаться.
На данной стадии клетки культивируются в среде для культуры клеток DMEM/F12. Однако, при условии, что она обеспечивает образование/поддержание дофаминергических клеток-предшественников, может селективно использоваться любая среда без ограничений.
Среда для культуры клеток может дополнительно содержать N2 добавку CTS и В-27 добавку CTS.
Данный способ может дополнительно включать следующую стадию:
д) пролиферация дофаминергических нервных клеток-предшественников посредством пассирования.
Стадия д)
Данная стадия представляет собой процесс, в котором в большом количестве продуцируются дофаминергические нервные клетки-предшественники посредством пролиферации. Данный процесс может сделать возможной стабильную поставку клеток, а также увеличение скорости дифференциации дофаминергических нервных клеток-предшественников.
Показатель дифференциации до дофаминергических нервных клеток-предшественников, индуцированной данным способом, может составлять 80% или больше, но не ограничивается им.
Дофаминергические нервные клетки-предшественники, индуцированные данным способом, могут улучшать уровень экспрессии FOXA2, LMX1A и/или En1.
Согласно одному воплощению настоящего раскрытия дофаминергические нервные клетки-предшественники, индуцированные данным способом, могут облегчать симптомы болезни Паркинсона.
Культура клеток на каждой стадии данного способа может дополнительно содержать внеклеточный матрикс (ЕСМ). Это обусловлено тем, что недифференцированные стволовые клетки и нервные клетки не могут сами присоединяться к культуральной чашке, но могут поддерживаться и культивироваться с помощью внеклеточного матрикса или питающих клеток.
Внеклеточный матрикс, например, может представлять собой ламинин, но не ограничивается им. Помимо ламинина, можно использовать другие внеклеточные матриксы - одни или в комбинации. Подходящие внеклеточные матриксы могут отличаться от одного типа стволовых клеток к другому.
Внеклеточный матрикс может использоваться в концентрации 3,5-5,5 мкг/мл, 4,0 мкг/мл или 5,0 мкг/мл, но не ограничиваясь ими.
При превышении концентрацией внеклеточного матрикса данного интервала дифференциация в дофаминергические нервные клетки-предшественники может быть невозможной, или может происходить проблема с адгезией, вызывая проблемы в способе продукции.
Нервные клетки-предшественники, полученные данным способом, можно использовать для лечения нейродегенеративных заболеваний, например, болезни Альцгеймера, болезни Гентингтона, болезни Паркисона и бокового амиотрофического склероза.
Другой аспект настоящего раскрытия относится к способу массовой продукции дофаминергических нервных клеток-предшественников, включающему следующие стадии:
а) культивирование стволовых клеток;
б) образование и поддержание эмбриоидного тельца;
в) получение нервной розетки;
г) дифференциация нервной розетки в дофаминергические нервные клетки-предшественники; и
д) пролиферация дофаминергических нервных клеток-предшественников посредством пассирования.
Что касается способа массовой продукции дофаминергических нервных клеток-предшественников, его описания, общие со способом индуцирования дифференциации в дофаминергические нервные клетки-предшественники, опускаются для того, чтобы избежать нежелательной избыточности, приводящей к сложности данного описания изобретения.
Лучшее понимание настоящего раскрытия может быть получено посредством следующих примеров, которые излагаются для иллюстрации, но их не следует истолковывать как ограничивающие настоящее раскрытие.
Культивирование человеческих эмбриональных стволовых клеток (hESC)
Недифференцированные hESC (SNU32, Корейский банк линий клеток), подлежащие дифференциации в дофаминергические нервные клетки, культивировали в чашке, покрытой CELLstart, содержащей среду TeSR2 (STEMCELL, SCR5860).
В данном отношении недифференцированные стволовые клетки культивировали в однослойном формате. Согласно принципу 7-суточного культивирования клетки отбирали с использованием скребка после инкубации с Versene (GIBCO, 15040-066) в течение 4 минут в инкубаторе при 37°С при достижении конфлюентности 90-95% и затем переносили в 15 мл пробирку. Клетки впускали и выпускали из пипетки примерно 8-12 раз с использованием пипетки 1000Р перед пассированием в соотношении 1:7 (на основе чашки, покрытой CELLstart-CTS) и затем поддерживали с заменой среды на свежую среду ежесуточно в пределах 24 часов каждые сутки в течение 7 суток.
Культивирование индуцированных плюрипотентных стволовых клеток (iPSC)
Недифференцированные iPSC (hFSiPS1, Национальный банк стволовых клеток, депонирующий орган: Подразделение хронических заболеваний в Корейском национальном институте здоровья), подлежащие дифференциации в дофаминергические нервные клетки, культивировали таким же способом, как и способ культивирования hESC.
Иммуногистохимический анализ
Клетки фиксировали в течение 10 мин в 4%-ном растворе параформальдегида.
Для легкого проникновения в цитоплазму каждое антитело инкубировали с 0,1% Triton Х-100 (в PBS (фосфатно-солевой буферный раствор)) в течение 15 мин и затем с 2%-ным бычьим сывороточным альбумином (BSA, в PBS) в течение 1 часа при комнатной температуре.
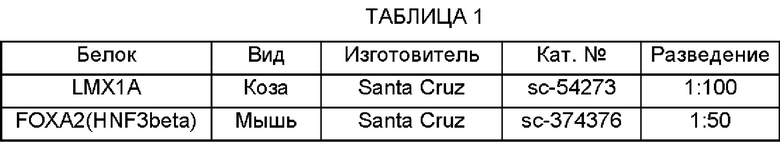
Затем первичным антителам (см. Таблицу 1, ниже) давали связываться с клетками при 4°С. Вторичные антитела, подходящие для соответствующих видов первичных антител (см. Таблицу 1, ниже), использовали для подтверждения клеток, связавшихся с первичными антителами.
Наконец, визуализировали ядра клеток. В связи с этим клетки инкубировали с 4',6-диамино-2-фенилиндолом (DAPI) в PBS в течение 10 мин для окрашивания ядер, которые затем визуализировали под флуоресцентным микроскопом. Идентифицировали и анализировали важные маркеры.
Анализ экспрессии генов (кПЦР-ОТ) (количественная полимеразная цепная реакция, сопряженная с обратной транскрипцией)
Отбирали клетки, из которых затем выделяли общую РНК с использованием набора для выделения РНК Easy-Spin®Total (iNtRON Biotechnology). кДНК синтезировали из 1 мкг общей РНК с использованием мастер-микса PrimeScript™RT (TAKARA Bio Inc.). Уровни мРНК количественно измеряли ПЦР-ОТ в реальном времени с использованием системы реального времени SYBR®Premix Ex Taq™(TAKARA Bio Inc.) и CFX96 (Bio-Rad). Последовательности праймеров, используемые в анализе экспрессии генов, приводятся в Таблиц 2 ниже.

ПРИМЕР: протокол дифференциации в дофаминергическую нервную клетку-предшественник
После стабилизации посредством двух циклов пассажей со времени оттаивания МСВ (главный банк клеток), hESC или iPSC, культивированные ранее, подвергали 3-му пассажу для индукции дифференциации в дофаминергические нервные клетки-предшественники на культуральной чашке для пассирования.
Начиная с суток (с0), в которые готовили культуральную чашку для 3-го пассажа, клетки предобрабатывали 5 мкМ дорзоморфина (далее именуется «DM») (Millipore, 171260) и 5 мкМ SB431542 (далее именуется "SB") (Sigma, S4317) в культуральной среде для hESC (TeSR2, STEMCELL, SCR5860) в течение двух суток с суток дифференциации 6 (с6) до суток дифференциации 8 (с8) для увеличения возможности дифференциации в нейроэктодерму.
В сутки дифференциации 8 (с8) hESC, которые культивировались в однослойном формате, подразделяли на формат 1,5 мм сеток с использованием 1 мл шприца 26-G и затем оставляли примерно на 30 мин в инкубаторе при 37°С или инкубировали с 2 мл коллагеназы в течение примерно 5 мин в инкубаторе при 37°С с образованием 1,5 мм квадратного листа клеток, который действует как основа для эмбриоидных телец, образуя, посредством этого, эмбриоидные тельца (далее именуемые «ЕМ»). ЕМ, индуцированные таким образом, культивировали в культуральной среде для hESC, не содержащей bFGF (среда ЕВ). В связи с этим, будучи инкубируемыми в течение 4 суток до суток дифференциации 12 (с12), клетки, предобработанные 5 мкМ DM и 5 мкМ SB, дополнительно предобрабытывали факторами образования паттерна: 1,0 мкМ SAG (Millipore, 566661, далее именуемый "SAG") и 2,0 мкМ CHIR99021 (Milteny, 130-106-539) для увеличения степени населенности дофаминергическими нервными клетками-предшественниками среднего мозга.
В сутки дифференциации 12 (с12) использовали среду DMEM/F12, дополненную 20 мкг/мл человеческого инсулина и 20 нг/мл bFGF (mN2+b) для присоединения ЕВ, образовавшихся на предыдущем этапе, к культуральной чашке, покрытой ламинином-521 (стадия рЕВ), с последующей инкубацией с факторами образования паттерна: 1,0 мкМ SAG (агонист Smoothened) и 2,0 мкМ CHIR99021 в течение 5 суток.
В сутки дифференциации 17 (с17) нервные розетки, образовавшиеся из прикрепившихся ЕВ, отделяли посредством обработки аккутазой (Millipore, SCR003) в течение 2 мин или используя способ, в котором пользователь обрабатывал стеклянную пипетку и непосредственно отделял ей клетки. Нервные розетки были затем повторно присоединены к отдельной культуральной чашке, покрытой ламинином-521. Для применения в повторном присоединении добавляли с 1,0 мкМ SAG и 2,0 мкМ CHIR99021 среду DMEM/F12, дополненную N2 (добавка N-2, уровень качества CTS, GIBCO, А1370701, далее именуемая "N2") и В-27 (добавка В-27, не содержащая ксенокомпонентов, уровень качества CTS, GIBCO, А1486701, далее именуемая "В27") (среда N2B27), которая используется в качестве среды для культивирования дофаминергических нервных клеток-предшественников. Для повторного присоединения в данную среду дополнительно добавляли 10 мкМ Y27632 и затем использовали для помощи в присоединении клеток в течение одного часа. Через один час данную среду заменяли на среду, не содержащую Y27632. До суток 20 (с20) данную среду ежесуточно заменяли на свежую среду в пределах 24 часов для непрерывной индукции дифференциации в дофаминергические нервные клетки-предшественники. При обработке аккутазой все клетки, за исключением нервных розеток, отделяли и удаляли. Только кластеры нервных розеток переносили в 15 мл пробирки с использованием скребка и диссоциировали посредством впускания и выпускания из пипетки примерно 40 раз с использованием пипетки 200Р до повторного присоединения на культуральной чашке, покрытой ламинином-521.
В сутки дифференциации 20 (с20) дофаминергические нервные клетки-предшественники разделяли на одиночные клетки в присутствии аккутазы и повторно присоединяли при плотности 4,0×106 клеток/35 мм чашку на культуральную чашку, покрытую ламинином-521, содержащую среду N2B27, дополненную 1,0 мкМ SAG и 2,0 мкМ CHIR99021. В то время как данную среду каждые сутки заменяли на свежую среду, клетки повторно прикреплялись в плотности 4,0×106 клеток/35 мм чашку каждые трое суток в культуральной чашке, покрытой ламинином-521, для пролиферации клеток в большом количестве перед получением рабочего банка клеток (WCB) в сутки 26 (с26).
[Перед клиническим испытанием] Дофаминергические нервные клетки-предшественники в WCB, полученные в сутки 26, диссоциировали на одиночные клетки с использованием аккутазы таким же способом, как и в способе повторного прикрепления. Диссоциированные одиночные клетки аликвотировал и во флаконы при плотности 3,0×106 клеток/флакон или в интервале, гарантированном криопротектором.
[Получение пересаживаемых клеток] WCB использовали через 9 суток после оттаивания. Для 35 мм культуральной чашки необходимо 4,0×106 клеток. Таким образом, 2 флакона (3,0×106 клеток для каждого флакона) объединяли, и живые клетки подсчитывали с использованием раствора трипанового синего. Среди них 4,0×106 клеток прикреплялись к 35 мм культуральной чашке, покрытой ламинином-521, содержащей среду N2B27, и культивировались до суток дифференциации 35 (с35) с заменой среды на свежую каждые сутки. Также индукцию дифференциации и пролиферацию проводили посредством повторного прикрепления каждые трое суток до суток 35 (с35).
Конкретный протокол иллюстрируется на ФИГ. 1.
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 1: стадия культивирования стволовой клетки 1-1. Оптимальное время обработки DM и SB431542
Проводили такую же процедуру, что и в способе согласно настоящему раскрытию, за исключением обработки DM и SB431542 с суток культивирования 8 вместо суток культивирования 6.
Как можно видеть на ФИГ. 2а, обработка DM и SB431542 с суток культивирования 6, составляющая стадию культивирования стволовых клеток (способ по настоящему раскрытию), гарантировала лучшие результаты в показателях состояния и выхода нервной розетки, чем обработка DM и SB431542 с суток культивирования 8, составляющая стадию образования эмбриоидных телец (традиционный способ).
Данный результат свидетельствует о том, что предобработка DM и SB431542 со стадии недифференцированных клеток до образования эмбриоидных телец может увеличивать осуществимость дифференциации в нейроэктодерму при образовании эмбриоидных телец, а также исключительно улучшая конечный показатель дифференциации в дофаминергические нервные клетки-предшественники.
1-2. Оптимальная продолжительность культивирования
Проводили такую же методику, что и в способе согласно настоящему раскрытию, за исключением того, что после предобработки DM и SB431542 с суток культивирования 7 до суток культивирования 9 сетки для образования эмбриоидных телец устанавливали в сутки культивирования 9, вместо установки сеток для образования эмбриоидных телец в сутки культивирования 8.
Как можно видеть на ФИГ. 2б, при вытягивании полос после образования эмбриоидных телец в сутки культивирования 9 клетки плавали на среде, так как их адгезия становилась очень слабой. Данные клетки отделялись от дна культуральной чашки до установки сеток, и было сложно образовать из них 1,5 мм квадратные листы клеток (левая панель на ФИГ. 2б). В отличие от этого, при установке сеток для образования эмбриоидных телец в сутки культивирования 8 (способ по настоящему раскрытию), 1,5 мм листы клеток могли быть нормально получены (правая панель на ФИГ. 2б).
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 2: стадия образования и поддержания эмбриоидного тельца
2-1. Оптимальная продолжительность культивирования
Проводили такую же процедуру, что и в способе согласно настоящему раскрытию, за исключением того, что образование ЕВ индуцировалось обработкой DM и SB431542 до суток культивирования 13 вместо прикрепления ЕВ к культуральной чашке в сутки культивирования 12 (в сутки 4 образования/поддержания ЕМ).
Как показано на ФИГ. 3, эмбриоидные тельца, главным образом, хорошо поддерживались индивидуально до суток 4 (сутки культивирования 12), но с суток 5 (сутки культивирования 13) эмбриоидные тельца присоединялись друг к другу с образованием больших агрегатов с высокой частотой.
2-2. Оптимальное время обработки SAG и CHIR99021
Проводили такую же процедуру, что и в способе согласно настоящему раскрытию, за исключением обработки SAG и CHIR99021 с суток культивирования 6 или 8 вместо обработки SAG и CHIR99021 с суток культивирования 10.
Как можно видеть на ФИГ. 4а-4в, нервные розетки не формировались нормальными, и после обработки SAG и CHIR99021 с суток дифференциации 6 с избытком обнаруживались разные морфологии дифференцированных клеток (ФИГ. 4а). Нервные розетки, которые были обработаны SAG и CHIR99021 с суток дифференциации 8, были морфологически нарушенными и демонстрировали плохое состояния (ФИГ. 4б) по сравнению с нервными розетками, обработанными SAG и CHIR99021 с суток 10 (ФИГ. 4в).
2-3. Сравнение дифференциации монослоя
Осуществляли проверку для демонстрации того, мог ли быть упрощен или нет способ культивирования/дифференциации. В связи с этим, дифференциацию в дофаминергические нервные клетки-предшественники проводили с использованием того же самого протокола, что и способ данного Примера, за исключением опускания процедуры образования эмбриоидного тельца (сутки культивирования 8-12). Сравнение между традиционным способом и способом по настоящему раскрытию делали по отношению к экспрессии FOXA2 и/или LMX1A в сутки дифференциации 27.
Как видно на ФИГ. 5а и 5б, дифференциация в нейроэктодерму в однослойном формате без образования эмбриоидных телец (ФИГ. 5а) приводила к значительно меньшим уровням экспрессии FOXA2 и/или LMX1A по сравнению с дифференциацией с образованием эмбриоидного тельца (способ по настоящему раскрытию, ФИГ. 5б).
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 3: стадия получения нервной розетки
3-1. Оптимальная продолжительность дифференциации
Проводили ту же самую процедуру, что и в способе по настоящему раскрытию, за исключением того, что нервные розетки генерировались до суток культивирования 18 (сутки 6 генерации нервных розеток) вместо повторного прикрепления нервных розеток на отдельную культуральную чашку в сутки культивирования 17 (сутки 5 генерации нервных розеток).
Как показано на ФИГ. 6, нервные розетки поддерживались и пролиферировали в хорошем состоянии до суток 5 генерации нервных розеток (способ по настоящему раскрытию). В сутки 6, однако, нервные розетки с высокой частотой подвергались явлению побеления, начинающемуся с их наружной части. Кроме того, центральная часть каждой розетки становилась черной, в то время как клетки изменялись морфологически. То есть, большинство клеток были мертвыми и спонтанно отделялись при промывке PBS или при замене среды. Следовательно, существует сложность в предоставлении нервных розеток.
Тем временем образование нервных розеток во время пролиферации нервных клеток-предшественников представляет собой исходную контрольную точку определения того, была ли успешно индуцирована дифференциация в нейроэктодерму и дофаминергические нервные клетки среднего мозга. Количество розеток и продолжительность поддержания розеток являются очень важными в образовании и количественном сохранении дофаминергических нервных клеток-предшественников среднего мозга в будущем.
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 4: стадия дифференциации в дофаминергические нервные клетки-предшественники
4-1. Оптимальная продолжительность дифференциации
Для того чтобы установить время получения WCB, которое гарантирует наивысший показатель дифференциации в дофаминергические нервные клетки-предшественники, WCB получали в сутки культивирования 23, вместо суток культивирования 26. По отношению к конечному показателю дифференциации в дофаминергические нервные клетки-предшественники было сделано сравнение между данным способом и способом по настоящему раскрытию.
Как можно видеть на ФИГ. 7а и 7б, меньший показатель дифференциации измерялся в случае, когда WCB получали и оттаивали в сутки 23 (ФИГ. 7а), по сравнению со случаем, когда WCB получали и оттаивали в сутки 26 (способ по настоящему раскрытию, ФИГ. 7б).
4-2. Оптимальная продолжительность обработки SAG и CHIR99021
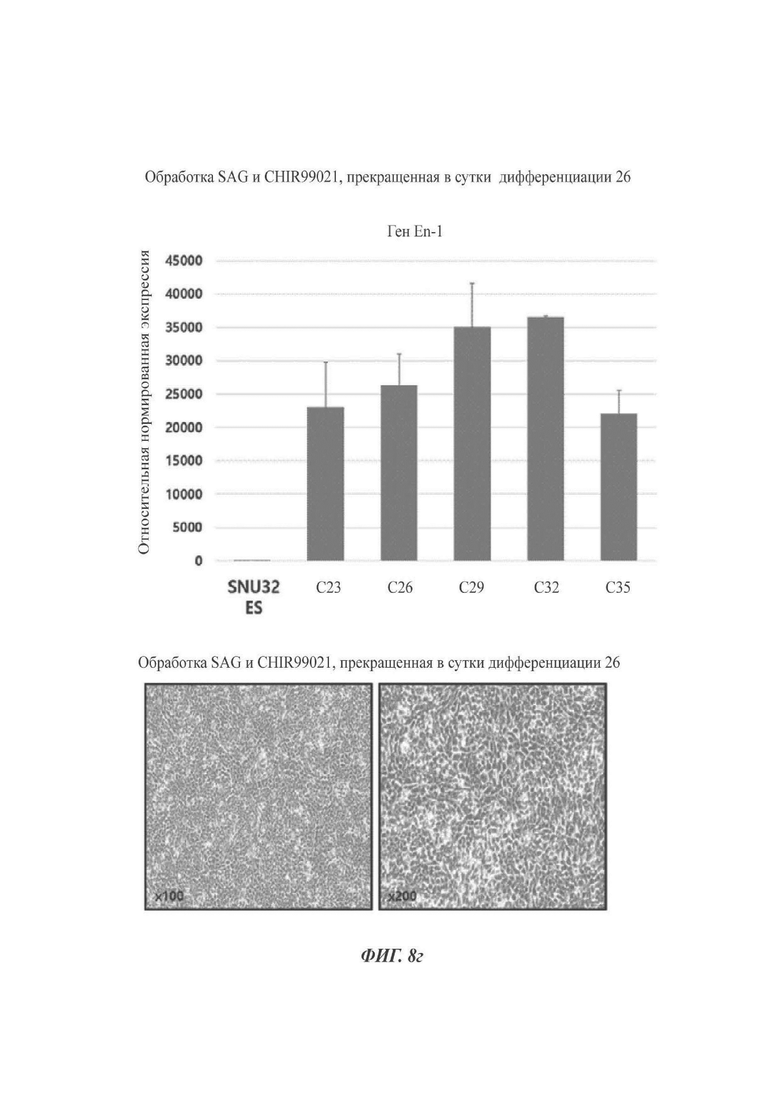
Клетки дифференцировались в дофаминергические нервные клетки-предшественники в той же самой процедуре, что и проведенный способ по настоящему раскрытию, за исключением обработки SAG и CHIR99021 до суток культивирования 20 или 35, вместо обработки SAG и CHIR99021 до суток культивирования 26. В отношении экспрессии En1 и клеточной морфологии, данный способ сравнивали со способом по настоящему раскрытию.
Как показано на ФИГ. 8а-8г, клетки, обработанные SAG и CHIR99021 до суток 20 (ФИГ. 8а), измерялись как быстрее снижающие уровень экспрессии En1 с продвижением дифференциации по сравнению с клетками, обработанными SAG и CHIR99021 до суток 35 (ФИГ. 8б). Кроме того, как можно видеть на ФИГ. 8в, клетки, обработанные SAG и CHIR99021 до суток 35, начинали приобретать более зрелую морфологию, при которой дифференциация шла дальше от дофаминергических нервных клеток предшественников без уменьшения скорости пролиферации. В отличие от этого, было обнаружено то, что клетки, обработанные SAG и CHIR99021 до суток 26 (способ по настоящему раскрытию, ФИГ. 8 г), демонстрируют меньший пониженный уровень экспрессии En1 и приобретают морфологию клеток-предшественников. Следовательно, был сделан выбор способа, при котором клетки обрабатываются SAG и CHIR99021 до суток 26 (ФИГ. 8 г).
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 5: оптимальная концентрация SAG и CHIR99021
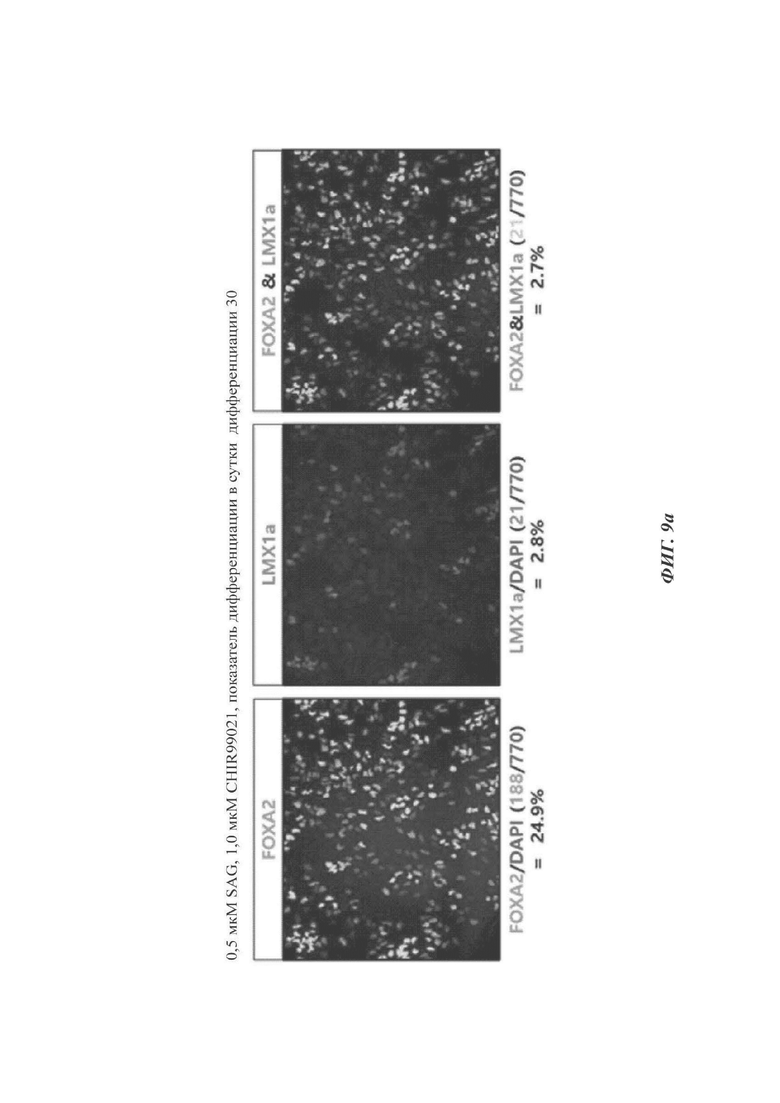
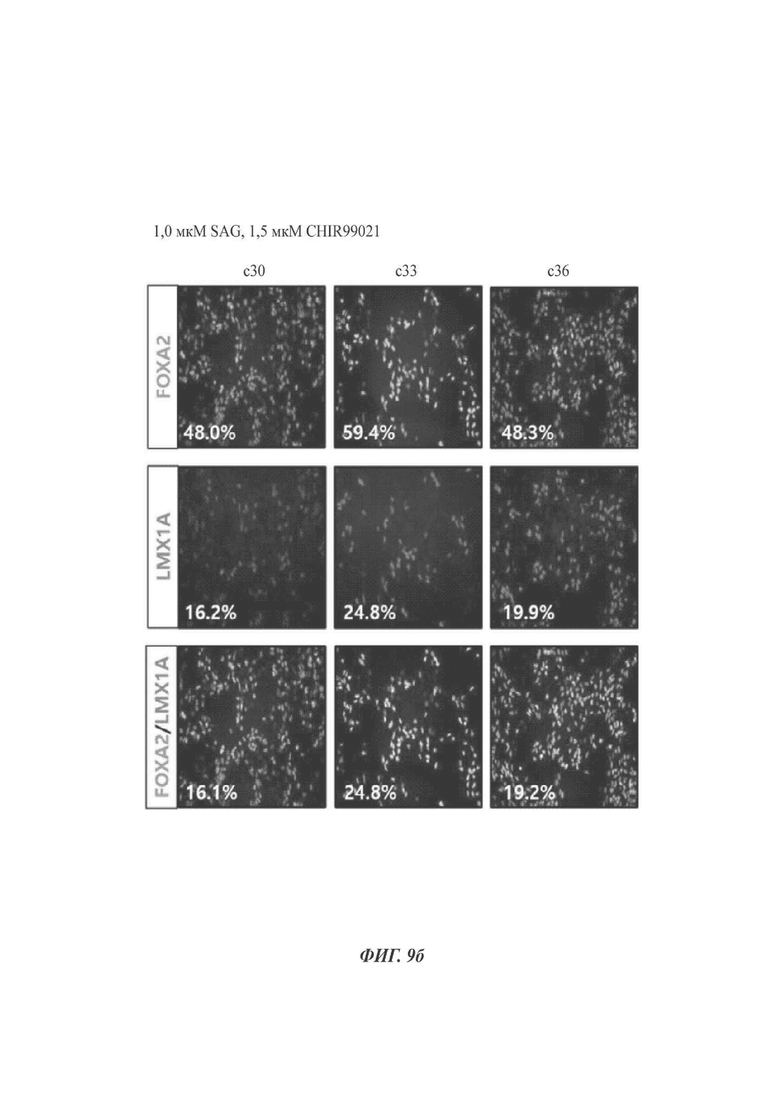
Клетки дифференцировались в дофаминергические нервные клетки-предшественники таким же способом, как и в способе по настоящему изобретению, за исключением обработки клеток SAG и CHIR99021 в соответствующих концентрациях 0,5 мкМ и 1,0 мкМ или 1,0 мкМ и 1,5 мкМ, вместо 1,0 мкМ и 2,0 мкМ. При использовании экспрессии FOXA2 и/или LMX1A данный способ сравнивали со способом по настоящему раскрытию.
Как видно на ФИГ. 9а-9в, более высокие уровни экспрессии FOXA2 и/или LMX1A были выявлены в клетках, обработанных SAG и CHIR99021 в соответствующих концентрациях 1,0 мкМ и 2,0 мкМ (способ по настоящему раскрытию, ФИГ. 9в), по сравнению с клетками, обработанными SAG и CHIR99021 в соответствующих концентрациях 0,5 мкМ и 1,0 мкМ (ФИГ. 9а) или 1,0 мкМ и 1,5 мкМ (ФИГ. 9б).
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 6: оптимальная концентрация ЕСМ
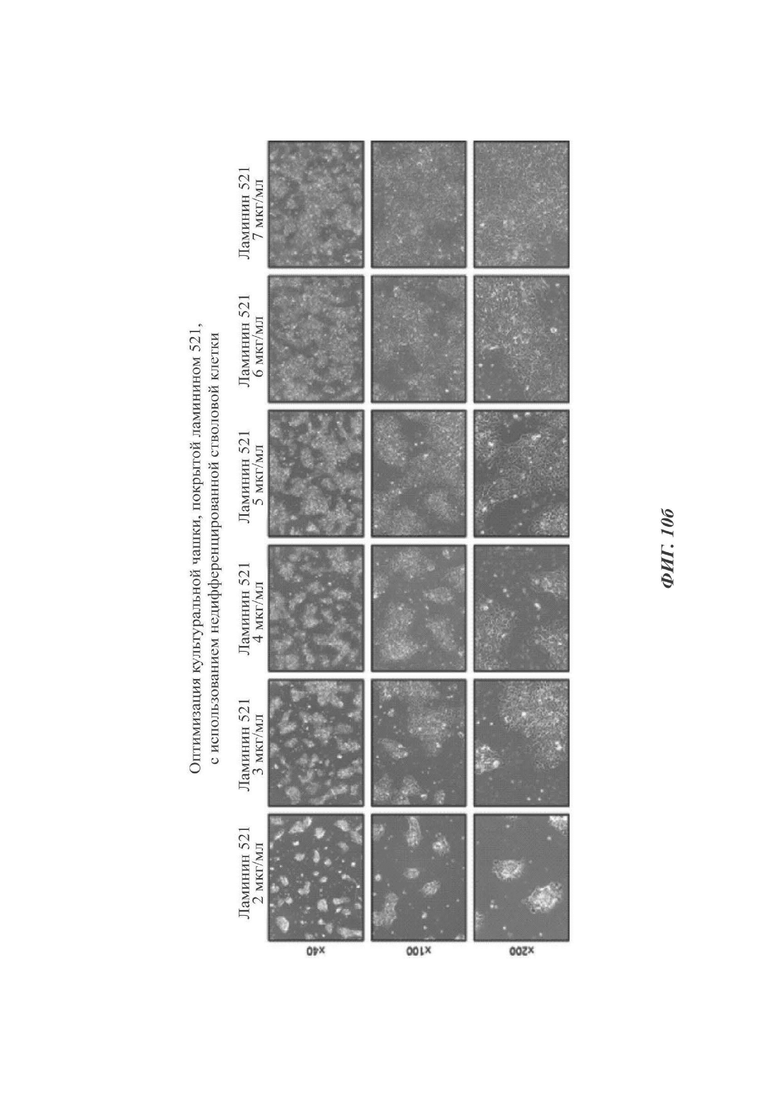
В отношении CELLstart и разных концентраций (2-7 мкг/мл) ЕСМ (ламинин 521) стволовые клетки культивировали с использованием того же самого протокола, что и в приведенных выше Примерах, для проведения анализа адгезии клеток.
Результаты демонстрируются на ФИГ. 10а и 10б. В CELLstart не происходило проблем до стадий культивирования клеток и поддержания нервных розеток. Однако данные клетки едва ли оставались прикрепленными, но плавали или росли в картине сети на стадии дифференциации в дофаминергические клетки-предшественники и их пролиферации (ФИГ. 10а). При концентрациях ламинина-521 2 мкг/мл и 3 мкг/мл данные клетки демонстрировали слишком плохую адгезию для проведения анализа. При использовании ламинина-521 в концентрациях 6 мкг/мл и 7 мкг/мл данные клетки подвергались спонтанной дифференциации с высокой частотой. В отличие от этого, концентрации ламинина-521 4 мкг/мл и 5 мкг/мл гарантировали относительно высокую адгезию с наибольшим предпочтением для 5 мкг/мл в показателях морфологии и числа клеток при тех же самых временных условиях (ФИГ. 10б).
На основании данных результатов наиболее рациональным было применение CELLstart на стадии культивирования стволовых клеток и ламинина-521 в концентрации 5 мкг/мл на всех последующих стадиях, за исключением стадии образования эмбриоидных телец.
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 7: массовая пролиферация дофаминергических нервных клеток-предшественников (увеличение показателя дифференциации)
Как правило, при массовом производстве в помещениях, удовлетворяющих GMP (надлежащая производственная практика), применяются отдельные протоколы для МСВ (главный банк клеток), полученного посредством пролиферации и хранения большого количества недифференцированных стволовых клеток, и для WCB (рабочий банк клеток), полученного посредством пролиферации и хранения большого количества дофаминергических нервных клеток-предшественников для трансплантации. Следовательно, моменты времени получения WCB из МСВ и оттаивания WCB для пролиферации дофаминергических клеток-предшественников в большом количестве являются очень важными в увеличении показателя дифференциации при уменьшении в некоторой степени скоростей пролиферации клеток для гарантии устойчивости против пролиферации при пересадке.
В данном отношении стволовые клетки дифференцировались в дофаминергические клетки-предшественники с использованием протоколов приведенных выше Примеров при отслеживании уровней экспрессии FOXA2 и/или LMX1A. Как показано на ФИГ. 11а и 11б, уровни экспрессии FOXA2 и/или LMX1A измеряли до все большего и большего увеличения с суток дифференциации 27 до суток 36. В то время как при проведении дифференциации за пределы суток 35, скорость дифференциации скорее снижалась, и клеточная морфология все более и более отступала от морфологического охвата предшественников (та же самая морфология, что и при прекращении обработки SAG и CHIR99021 в сутки дифференциации 35 на ФИГ. 8в). По этой причине определяли то, что клетки в сутки дифференциации 35 подвергались конечной дифференциации.
Соответственно, сутки дифференциации 26 были изложены в настоящем раскрытии как момент времени получения WCB (так как должен быть измерен одинаковый показатель дифференциации между способом, в котором клетки не замораживаются, но дифференцируются непрерывно, и способом, в котором клетки замораживаются и оттаивают перед дифференциацией на основе результата Экспериментального Примера 4-1). В сутки 35 был сделан выбор клеток, полученных оттаиванием WCB в сутки 26 и их пролиферацией в течение 9 суток.
Следовательно, как можно видеть на ФИГ. 12, протокол по настоящему раскрытию может дать примерно 130 миллиардов дофаминергических нервных клеток-предшественников из одного флакона (примерно 3×106 клеток) МСВ (главный банк клеток) посредством дифференциации.
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 8: пересадка in vitro клеток, полученных с использованием протокола по изобретению
8-1. Создание модели болезни Паркинона (PD) при повреждении 6-OHDA
В качестве субъектов использовали самок крыс линии Sprague-Dawley (Orient Bio Inc.), каждая из которых весит 200-250 г. Их анестезировали смесью 30 мг/кг золетила (Virbac) и 10 мг/кг ромпуна (Bayer). Согласно координатам (АР -0,40; ML -0,13; DV -0,70; ТВ -0,45) в медиальный пучок переднего мозга каждой крысы инъецировали 3 мкл 30 мМ 6-OHDA для создания полупаркинсоновой модели.
8-2. Восстановление поведения PD-модели после пересадки клеток, полученных с использованием протокола по изобретению
Стволовые клетки дифференцировались согласно протоколам дифференциации приведенных выше Примеров. Дифференцированные клетки в сутки дифференциации 35 (с35) суспендировали в конечной концентрации 8,75×104 клеток/мкл в PBS (CTS) для получения суспензии клеток для пересадки. Для контроля использовали группу, которой пересаживали один PBS. Через четыре недели после повреждения 6-OHDA в Экспериментальном Примере 8-1 животных делили на группы и затем подвергали иммунодепрессии посредством внутрибрюшинного инъецирования им циклоспорина A (Chong Kun Dang Pharmaceutical Corp) в суточной дозе 10 мг/кг. Суспензию клеток, полученную таким образом, пересаживали в количестве 4 мкл каждой крысе стереотактическим способом согласно координатам (АР +0,08; ML -0,30; DV -0,40 и -0,50; ТВ -0,24).
Перед пересадкой или в 4, 8, 12 или 16 недель после пересадки внутрибрюшинно инъецировали амфетамин (2,5 мг/кг, Sigma-Aldrich), с последующим отслеживанием того, кружились ли крысы в пределах 30 мин после инъекции. Для сравнения такой же эксперимент проводили с дофаминергическими нервными клетками-предшественниками, происходящими из человеческих эмбриональных стволовых клеток Н9 (Н9 hESC, WiCell Inc., США).
По сравнению с контролем, как показано на ФИГ. 13а и 13б, у крыс, которым пересаживали клетки, дифференцированные традиционным способом (дофаминергические нервные клетки-предшественники, происходящие из эмбриональных стволовых клеток Н9), наблюдали значимое улучшение моторной функции только через 16 недель после пересадки (ФИГ. 13а), тогда как наблюдалось то, что у всех крыс, которым были пересажены клетки, дифференцированные согласно способу (протоколу) по настоящему раскрытию, моторная функция значимо улучшалась через 8, 12 и 16 недель после пересадки (ФИГ. 13б).
Данные результаты подразумевают то, что клетки, полученные согласно способу (протоколу) по настоящему раскрытию, могут выживать in vivo при более высокой эффективности и имеют больший эффект улучшения моторных функций.
Промышленная применимость
Настоящее изобретение относится к способу индуцирования дифференциации стволовых клеток в специфичные для среднего мозга дофаминергические нервные клетки-предшественники и массовой продукции происходящих из стволовых клеток специфичных для среднего мозга дофаминергических нервных клеток-предшественников.
Как описано выше, настоящее раскрытие относится к способу индуцирования дифференциации стволовых клеток в дофаминергические нервные клетки-предшественики и к способу массовой продукции дофаминергических нервных клеток-предшественников. Имея способность эффективно дифференцировать стволовые клетки в нервные клетки-предшественники, способы по настоящему раскрытию могут находить полезные применения в исследовании, разработке и ассоциированной с ними коммерциализации.
--->
Перечень последовательностей
<110> С-Биомедикс
<120> Способ дифференциации дофаминергических нервных клеток-
предшественников из стволовых клеток
<130> PP200019
<150> KR 10-2019-0118370
<151> 2019-09-25
<160> 4
<170> KoPatentIn 3.0
<210> 1
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> En1-F
<400> 1
cgtggcttac tccccattta
20
<210> 2
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> En1-R
<400> 2
tctcgctgtc tctccctctc
20
<210> 3
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> GAPDH-F
<400> 3
caatgacccc ttcattgacc
20
<210> 4
<211> 20
<212> ДНК
<213> Искусственная последовательность
2
<220>
<223> GAPDH-R
<400> 4
ttgattttgg agggatctcg
20
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ РЕНАЛЬНЫХ КЛЕТОК-ПРЕДШЕСТВЕННИКОВ И СОДЕРЖАЩЕЕ ИХ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2014 |
|
RU2696315C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДИФФЕРЕНЦИРОВАННЫХ КЛЕТОК ИЗ СТВОЛОВЫХ КЛЕТОК | 2009 |
|
RU2576003C2 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОК, ПРОДУЦИРУЮЩИХ ПАНКРЕАТИЧЕСКИЕ ГОРМОНЫ | 2011 |
|
RU2576000C2 |
| СПОСОБ ДИФФЕРЕНЦИАЦИИ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК В КЛЕТКИ СОСУДИСТОГО РУСЛА | 2012 |
|
RU2618871C2 |
| ДИФФЕРЕНЦИРОВАНИЕ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА | 2011 |
|
RU2620938C2 |
| ПОЛУЧЕНИЕ ТЕРМИНАЛЬНО ДИФФЕРЕНЦИРОВАННЫХ ДОФАМИНЕРГИЧЕСКИХ НЕЙРОНОВ ИЗ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА | 2004 |
|
RU2345133C2 |
| ДИФФЕРЕНЦИРОВАНИЕ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК | 2011 |
|
RU2599420C2 |
| ДИФФЕРЕНЦИРОВАНИЕ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК | 2011 |
|
RU2673946C1 |
| Способ оценки нейропротекторных свойств веществ in vitro и тест-система для его осуществления | 2016 |
|
RU2646446C1 |
| ДИФФЕРЕНЦИРОВАНИЕ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА | 2011 |
|
RU2627168C2 |









Изобретение относится к области биотехнологии, а именно к способу индуцирования дифференциации стволовых клеток в дофаминергические клетки-предшественники. Также раскрыт способ массовой продукции дофаминергических нервных клеток-предшественников. Изобретение эффективно для применения в клеточной терапии. 2 н. и 12 з.п. ф-лы, 13 ил., 2 табл., 8 пр.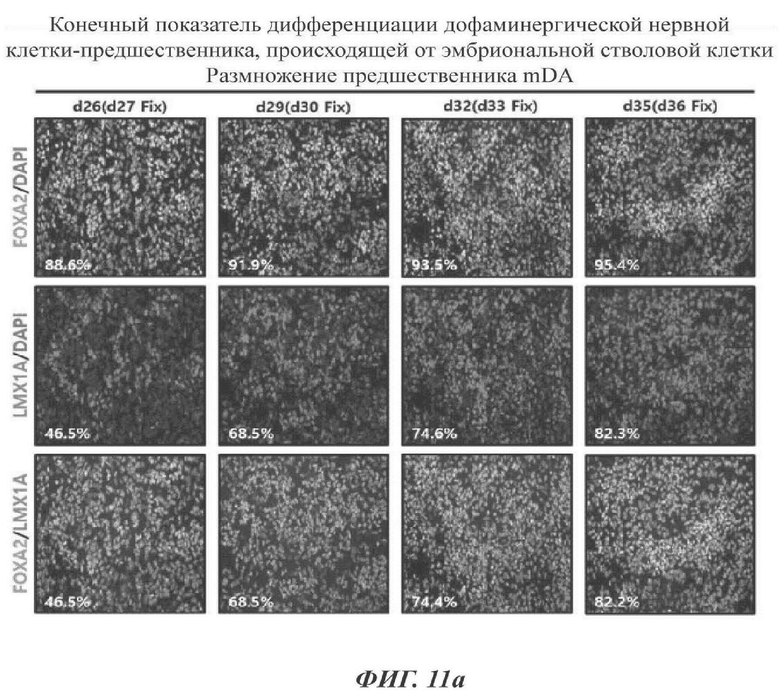
1. Способ индуцирования дифференциации стволовых клеток в дофаминергические нервные клетки-предшественники, включающий следующие стадии, на которых:
а) культивируют стволовые клетки в однослойном формате посредством добавления ингибитора сигнализации BMP и ингибитора сигнализации активина/nodal;
б) образуют и поддерживают эмбриоидное тельце посредством добавления ингибитора сигнализации морфогенетического белка кости (BMP) и ингибитора сигнализации активина/nodal и добавления активатора сигнализации sonic hedgehog (SHH) и ингибитора киназа гликогенсинтазы 3 (GSK-3);
в) получают нервную розетку посредством добавления активатора сигнализации SHH и ингибитора GSK-3; и
г) дифференцируют нервную розетку в дофаминергичские нервные клетки-предшественники посредством добавления активатора сигнализации SHH и ингибитора GSK-3;
при этом указанные стволовые клетки представляют собой индуцированные плюрипотентные стволовые клетки (iPSCs), стволовые клетки взрослых или стволовые клетки, полученные прямым перепрограммированием.
2. Способ по п. 1, дополнительно включающий следующую стадию, на которой:
д) осуществляют пролиферацию дофаминергических нервных клеток-предшественников посредством пассирования.
3. Способ по п. 1, в котором стволовые клетки культивируются в среде, содержащей внеклеточный матрикс.
4. Способ по п. 1, в котором стадия а) проводится посредством ежесуточного добавления ингибитора сигнализации BMP и ингибитора сигнализации активина/nodal с 1-3 суток до завершения данной стадии.
5. Способ по п. 1, в котором стадия б) проводится посредством добавления ингибитора сигнализации BMP и ингибитора сигнализации активина/nodal ежесуточно с исходных суток данной стадии и добавления активатора сигнализации SHH и ингибитора GSK-3 ежесуточно с 2-6 суток после исходных суток данной стадии.
6. Способ по п. 1, в котором стадия в) проводится посредством добавления активатора сигнализации SHH и ингибитора GSK-3 ежесуточно с исходных суток данной стадии.
7. Способ по п. 1, в котором стадия г) проводится посредством добавления активатора сигнализации SHH и ингибитора GSK-3 ежесуточно с исходных суток данной стадии.
8. Способ по п. 1, в котором стадия г) проводится посредством замены среды на свежую среду каждые сутки и пассирования клеток каждые трое суток.
9. Способ по п. 4 или 5, в котором ингибитор сигнализации BMP представляет собой дорзоморфин, и ингибитор сигнализации активина/nodal представляет собой 4-(5-бензо[1,3]диоксол-5-ил-4-пиридин-2-ил-1Н-имидазол-2-ил)-бензимид (SB431542).
10. Способ по любому из пп. 5-7, в котором активатор сигнализации SHH представляет собой агониста smoothened (SAG), и ингибитор GSK-3 представляет собой CHIR99021.
11. Способ по п. 1, где данный способ имеет показатель дифференциации в дофаминергические нервные клетки-предшественники 80% или больше.
12. Способ по п. 1, в котором дофаминергические нервные клетки-предшественники имеют повышенные уровни экспрессии FOXA2 и/или LMX1A.
13. Способ по п. 1, в котором дофаминергические нервные клетки-предшественники облегчают симптомы болезни Паркинсона.
14. Способ массовой продукции дофаминергических нервных клеток-предшественников, включающий следующие стадии, на которых:
а) культивируют стволовые клетки в однослойном формате посредством добавления ингибитора сигнализации BMP и ингибитора сигнализации активина/nodal;
б) образуют и поддерживают эмбриоидное тельце посредством добавления ингибитора сигнализации BMP и ингибитора сигнализации активина/nodal и добавления активатора сигнализации SHH и ингибитора GSK-3;
в) получают нервную розетку посредством добавления активатора сигнализации SHH и ингибитора GSK-3;
г) дифференцируют нервную розетку в дофаминергические нервные клетки-предшественники посредством добавления активатора сигнализации SHH и ингибитора GSK-3; и
д) пролиферируют дофаминергическую нервную клетку-предшественника посредством пассажа;
при этом указанные стволовые клетки представляют собой индуцированные плюрипотентные стволовые клетки, стволовые клетки взрослых или стволовые клетки, полученные прямым перепрограммированием.
| SUJOY K DHARA et al., Neural differentiation of human embryonic stem cells, J Cell Biochem, 2008, 105, 3 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| АНИСИМОВ С.В | |||
| Клеточная терапия болезни Паркинсона: II | |||
| Применение соматических стволовых клеток, Успехи геронтологии, 2009, т | |||
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2023-07-31—Публикация
2020-03-25—Подача