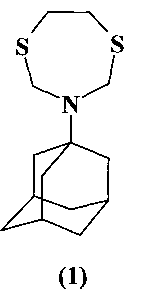
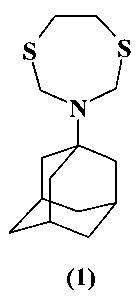
Предлагаемое изобретение относится к области синтеза соединений с биологической активностью, конкретно к способу получения 3-(1-адамантил)-1,5,3-дитиазепана (1) на основе каталитической реакции 1-аминоадамантана с 1-окса-3,6-дитиациклогептаном. Соединение (1), in vitro полностью подавляющее развитие Rhizoctonia solani, может быть использовано для борьбы с болезнями сельскохозяйственных растений, вызываемыми этим фитопатогенным грибом.
Известен способ (U. Wellmar. J. Heterocyclic Chem. 1998, 35, 1531) получения 3-(трет-бутил)пергидро-1,5,3-дитиазепина (2) с выходом 45% взаимодействием 5-(гарет-бутил)-2-оксогексагидро-1,3,5-триазина с 1,2-этандитиолом в присутствии BF3·2CH3COOH.
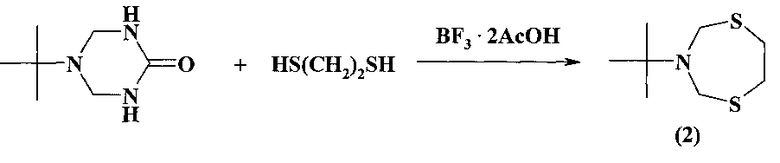
Известным способом не может быть получен 3-(1-адамантил)-1,5,3-дитиазепан (1).
Известен способ (Дорохов В.И., Вовк М.В. Известия высших учебных заведений. Химия и химическая технология. 1993, 36, 82.) получения 1,5,3-дитиазепан-4-она (3) с выходом 72% взаимодействием изоцианата с 1,2-этандитиолом в присутствии Et3N.
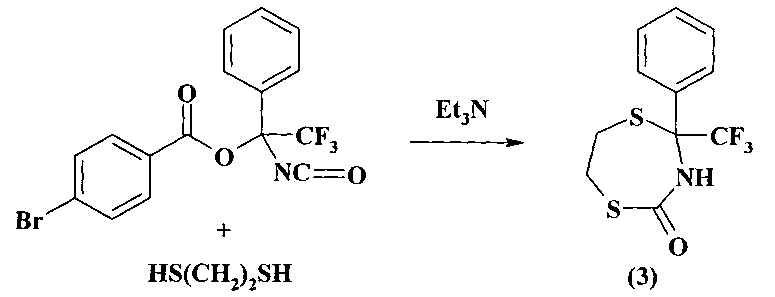
Известным способом не может быть получен 3-(1-адамантил)-1,5,3-дитиазепан (1).
Известен способ (Tsotinis Α., Eleutheriades Α., Bari L. Di, Pescitelli G.J. Org. Chem. 2007, 72, 8928) получения конденсированного пергидро-1,5,3-дитиазепана (4) реакцией N-ацил индолов с 1,2-этандитиолом под действием катализатора BF3·Et2O.
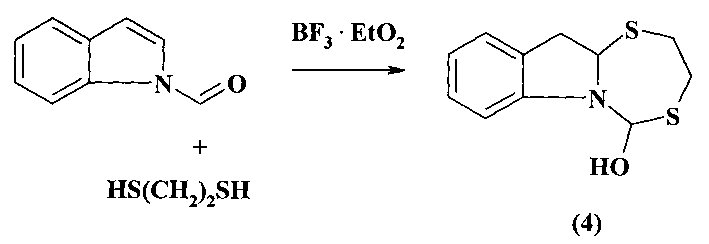
Известным способом не может быть получен 3-(1-адамантил)-1,5,3-дитиазепан (1).
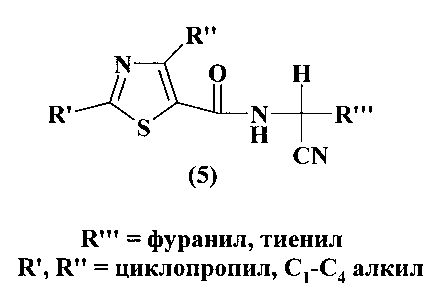
Известно фунгицидное средство для борьбы с грибковыми заболеваниями растений на основе производных тиазолил-5-карбонамида формулы (5) (Адольф Хубеле, Патент РФ №2070197, 1996).
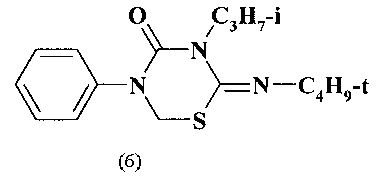
Известен (H. Kanno. Pure&Appl. Chem. 1987. Vol.59. №8. P.1027-1032) фунгицид бупрофезин общей формулы (6), структура которого содержит 1,3,5-тиадиазинановый цикл, предназначенный для борьбы с грибковыми заболеваниями сельскохозяйственных культур. Производство известного фунгицида (6) осуществляется 2-стадийным синтезом и базируется на использовании труднодоступных исходных реагентов.
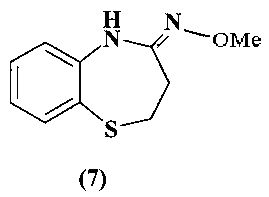
Известна фунгицидная активность для производных на основе 1,5-тиазепина (7) [Ambrogi V. et al. European Journal of Medicinal Chemistry, 1990, 25,5,403-411].
Синтезы указанных соединений или многостадийны или базируются на использовании дорогостоящих исходных реагентов.
Предлагается новый способ получения 3-(1-адамантил)-1,5,3-дитиазепана (1) в одну препаративную стадию из доступных исходных реагентов. Соединение формулы (1) может быть использовано в качестве средства с фунгицидной активностью.
Сущность способа заключается во взаимодействии 1-аминоадамантана (лекарственное средство «Мидантан») с 1-окса-3,6-дитиациклогептаном в присутствии катализатора SmCl3·6H2O, взятых в мольном соотношении 1-аминоадамантан:1-окса-3,6-дитиациклогептан: SmCl3·6H2O=1:1:(0.03-0.07), предпочтительно 1:1:0.05, в среде этанол-хлороформ (1:1, объемные) в течение 2.5-3.5 ч при комнатной температуре (~20°C) и атмосферном давлении. Выход 3-(1-адамантил)-1,5,3-дитиазепана (1) составляет 69-77%. Реакция протекает по схеме
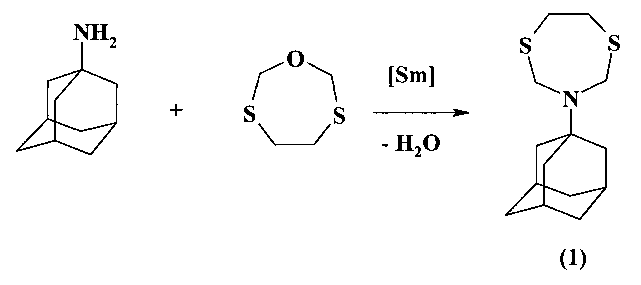
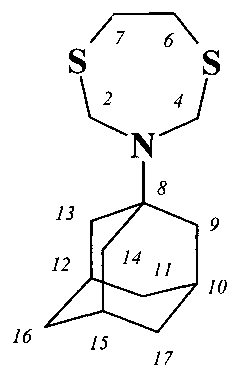
3-(1-Адамантил)-1,5,3-дитиазепан (1) образуется только лишь с участием 1-аминоадамантана и 1-окса-3,6-дитиациклогептана, взятых в мольном соотношении 1:1 (стехиометрические количества). При другом соотношении исходных реагентов снижается выход целевого продукта (1).
Без катализатора реакция идет с выходом, не превышающим 15%. Проведение указанной реакции в присутствии катализатора SmCl3·6H2O больше 7 мол.% не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора SmCl3·6H2O менее 3 мол.% снижает выход (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при комнатной температуре ~20°C. При температуре выше 20°C (например, 60°C) увеличиваются энергозатраты, а при температуре ниже 20°C (например, при 0°C) снижается скорость реакции. Опыты проводили в среде растворителей этанол-хлороформ, т.к. в них хорошо растворяются исходные соединения.
Выявление фунгицидной активности осуществлено с использованием микроскопического гриба Rhizoctonia solani. Rhizoctonia solani фитопатогенный гриб, возбудитель бурой и сухой гнили (ризоктониоза), поражающий 230 видов сельскохозяйственных растений (картофель, томат, капуста, редис, свекла, фасоль, чечевица, люцерна, лен и др.). (Микроорганизмы-возбудители болезней растений. // Под ред. Билай В.И. - Киев: Наукова думка, 1988, 552 с.). Микроскопические грибы поддерживаются в коллекции микроорганизмов Института биологии УНЦ РАН. Для испытаний использовали растворы (1) в ДМФА. Растворитель ДМФА не оказывал негативного воздействия на развитие Rhizoctonia solani.
Общая методика оценки фунгицидной активности соединения (1).
Оценку фунгицидной активности проводили методом диффузии в агар (Практикум по микробиологии. // Под ред. Егорова Н.С. - М.: Изд-во МГУ, 1976, 307 с.). Поверхность питательной среды (картофельно-глюкозный агар), разлитой по 15 мл в чашки Петри d 70 мм, засевали суспензией спор тест-культур грибов. Затем в среде сверлом диаметром 10 мм вырезали 3 лунки, в которые помещали по 100 мкл испытываемых растворов. Фунгицидную активность оценивали по диаметру зоны подавления роста микромицетов, а также наблюдая за развитием тест-культур с использованием светового микроскопа Leica DM 1000 при увеличении ×10. Повторность трехкратная. Контролем служило развитие гриба на питательной среде. Время инкубации 7 суток при 28°C.
Раствор 3-(1-адамантил)-1,5,3-дитиазепана (1) в изученных концентрациях полностью подавлял развитие Rhizoctonia solani (таблица 1).

Таким образом, 3-(1-адамантил)-1,5,3-дитиазепан (1) проявляет фунгицидный эффект по отношению к Rhizoctonia solani во всех изученных концентрациях.
Существенные отличия предлагаемого способа.
В известном способе для получения 1,5,3-дитиазепана (2) в качестве исходных реагентов применяются 1,3,5-триазин и 1,2-этандитиол. Реакция осуществляется в присутствии катализатора BF3·2CH3COOH.
В предлагаемом способе исходными реагентами являются 1-аминоадамантан и 1-окса-3,6-дитиациклогептан. Реакция осуществляется в присутствии катализатора SmCl3·6H2O. В отличие от известного, предлагаемый способ позволяет получать 3-(1-адамантил)-1,5,3-дитиазепан (1) с фунгицидной активностью.
Способ поясняется примерами.
Пример 1. В сосуд Шленка, установленный на магнитной мешалке, в атмосфере аргона при температуре ~20°C помещают 0.14 г (1 ммоль) 1-окса-3,6-дитиациклогептана в 10 мл хлороформа и 0.018 г (0.05 ммоль) SmCl3·6H2O, затем по каплям добавляют 0.15 г (1 ммоль) 1-аминоадамантана в 10 мл этанола. Реакционную смесь перемешивают при температуре ~20°C в течение 3 ч, очищают колоночной хроматографией на SiO2 и выделяют 3-(1-адамантил)-1,5,3-дитиазепинан с выходом 74%.
Другие примеры, подтверждающие способ, приведены в таблице 2.
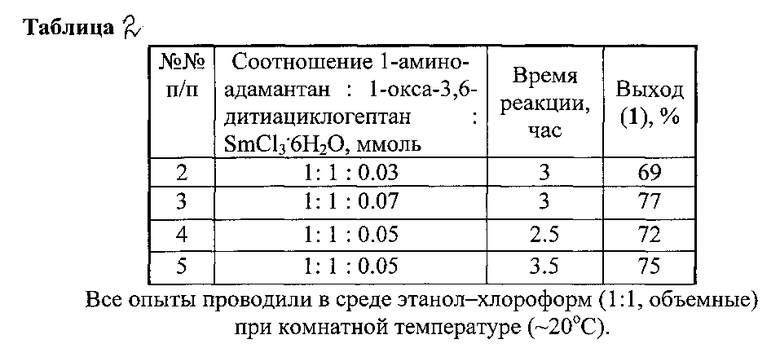
Спектральные характеристики 3-(1-адамантил)-1,5,3-дитиазепинана1 (1Контроль реакции осуществляли методом ТСХ на пластинах Silufol W-254, проявляли парами I2. Для колоночной хроматографии использовали силикагель КСК (100-200 мкм). Температура плавления определена на приборе РНМК 80/2617. Спектры ЯМР 1D (1H 13C) и 2D (COSY, NOESY, HSQC, НМВС) сняты на спектрометре Bruker Avance 400 (100.62 МГц для 13С и 400.13 МГц для 1H) по стандартным методикам фирмы Bruker, внутренний стандарт Me4Si, растворитель -CDCl3. Масс-спектры получены на приборе MALDI TOF/TOF AUTOFLEX III фирмы Bruker.):
Т.пл. 79-81°C. Элюент гексан: этилацетат (4:3), Rf 0.5. MALDI TOF/TOF, m/z: 268.280 [М-Н]+. C14H23NS2. M 269.471. Спектр ЯМР 1H, δ, м.д.: 1.60-1.68 (м, 6Н, СН2 (11, 16, 17)); 1.82 (уш.с, 6Н, СН2 (9, 13, 14)); 2.10 (уш.с, 3Н, СН (10, 12, 15)); 2.99 (уш.с, 4Н, СН2 (6, 7)); 4.48 (уш.с, 4Н, СН2 (2, 4)). Спектр ЯМР 13С, δ, м.д.: 29.7 (С-10, С-12, С-15), 36.5 (С-11, С-16, С-17), 37.0 (С-6, С-7), 40.5 (С-9, С-13, С-14), 52.7 (С-2, С-4), 55.7 (С-8).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 3-[1-(1-АДАМАНТИЛ)ЭТИЛ]-1,5,3-ДИТИАЗЕПАНА И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ СРЕДСТВА С ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2574292C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-АДАМАНТИЛ-1,5,3-ДИТИАЗЕПАНОВ | 2015 |
|
RU2605447C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ЦИКЛОАЛКИЛЗАМЕЩЕННЫХ 1, 5, 3-ДИТИАЗЕПАНОВ | 2015 |
|
RU2601313C1 |
| СПОСОБ ПОЛУЧЕНИЯ (1,5,3-ДИТИАЗЕПАН-3-ИЛ)-АЛКАНДИОЛОВ | 2013 |
|
RU2559359C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-ЦИКЛОГЕКСИЛЗАМЕЩЕННЫХ 1,5,3-ДИТИАЗЕПАНОВ | 2014 |
|
RU2574074C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-(1,5,3-ДИТИАЗЕПАН-3-ИЛ)-ХИНОЛИНА И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ СРЕДСТВА С ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2565783C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ЦИКЛОПЕНТИЛЗАМЕЩЕННЫХ 1,5,3-ДИТИАЗЕПАНОВ | 2014 |
|
RU2565790C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛ 2-(1,5,3-ДИТИАЗЕПАН-3-ИЛ)АЛКАНОАТОВ | 2015 |
|
RU2605448C1 |
| СПОСОБ ПОЛУЧЕНИЯ N,N-БИС-[(1,5,3-ДИТИАЗЕПАН-3-ИЛ)АЛКИЛ]АМИНОВ | 2014 |
|
RU2591196C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3, 3'-[ОКСА(ТИА)АЛКАН-альфа, омега-ДИИЛ]-БИC-1, 5, 3-ДИТИАЗЕПИНАНОВ | 2012 |
|
RU2518482C2 |
Изобретение относится к способу получения 3-(1-адамантил)-1,5,3-дитиазепана формулы (1)
Сущность способа заключается во взаимодействии 1-аминоадамантана с 1-окса-3,6-дитиациклогептаном в присутствии катализатора SmCl3·6H2O при мольном соотношении 1-аминоадамантан:1-окса-3,6-дитиациклогептан:SmCl3·6H2O=1:1:(0.03-0.07) при температуре ~20°C и атмосферном давлении в течение 2.5-3.5 ч. Выход 3-(1-адамантил)-1,5,3-дитиазепана (1) составляет 69-77%. Полученное соединение обладает фунгицидной активностью против Rhizoctonia solani. 2 н. и 1 з.п. ф-лы, 2 табл., 1 пр.
1. Способ получения 3-(1-адамантил)-1,5,3-дитиазепана (1)

отличающийся тем, что 1-аминоадамантан подвергают взаимодействию с 1-окса-3,6-дитиациклогептаном в среде этанол-хлороформ в присутствии катализатора SmCl3·6H2O при мольном соотношении 1-аминоадамантан:1-окса-3,6-дитиациклогептан:SmCl3·6H2O = 1:1:(0.03-0.07) при комнатной температуре (~20°C) и атмосферном давлении в течение 2.5-3.5 ч.
2. Способ по п. 1, отличающийся тем, что реакцию проводят в среде этанол-хлороформ при объемном соотношении компонентов, равном 1:1.
3. Применение 3-(1-адамантил)-1,5,3-дитиазепана (1) в качестве средства с фунгицидной активностью для борьбы с заболеваниями сельскохозяйственных культур, вызываемыми грибами Rhizoctonia solani.
| Мурзакова Н., Прокофьев К.И., Тюмкина Т.В., Ибрагимов А.Г | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| JP 0063208837, A,30.08.1988. | |||
Авторы
Даты
2016-05-20—Публикация
2014-07-22—Подача