ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] В настоящей заявке заявляется приоритет по предварительной заявке на патент США №61/715138, поданной 17 октября 2012 года, полное содержание которой включено в настоящий документ посредством отсылки.
УРОВЕНЬ ТЕХНИКИ
[0002] S-аденозил-L-метионин («SAM-е» или «SAMe») представляет собой природное соединение, которое содержится практически во всех тканях организма. Не считая воды, SAMe представляет собой вторую наиболее распространенную метаболическую молекулу после аденозинтрифосфата (АТФ), который является самым распространенным. В ряде стран SAMe имеется в продаже в качестве безрецептурной пищевой добавки, а в Европе продается по рецептам. Было протестировано и показана эффективность добавления экзогенного SAMe для лечения различных заболеваний, включая артрит, болезнь Альцгеймера, болезнь печени и депрессию. Однако, к сожалению, всасывание экзогенного SAMe является очень низким (<5%), поэтому ежедневно необходимы большие дозы. Таким образом, существует необходимость в улучшении доставки и, следовательно, эффективности экзогенного SAMe.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0003] В настоящем документе представлены композиции, составы, лекарственные средства, применение и способы улучшения доставки экзогенного S-аденозил-L-метионина («SAMe»). В настоящем документе представлены также композиции, составы, лекарственные средства, применение и способы увеличения уровней SAMe в плазме. В некоторых вариантах реализации изобретения композиции, составы, лекарственные средства, применение и способы, описанные в настоящем документе, увеличивают уровни SAMe in vivo, по сравнению с обычными дозированными формами SAMe.
[0004] В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, составы или лекарственные средства, содержащие экзогенный SAMe и один или более сложных эфиров галловой кислоты. В некоторых вариантах реализации изобретения сложный эфир галловой кислоты, представленный в настоящем документе, выбран из группы, состоящей из метилгаллата, этилгаллата, пропилгаллата, бутилгаллата, изобутилгаллата, изоамилгаллата, октилгаллата, додецилгаллата, лаурилгаллата, гексадецилгаллата, цетилгаллата, галлокатехола, галлокатехина и эпигаллокатехина. В некоторых вариантах реализации изобретения сложный эфир галловой кислоты, представленный в настоящем документе, представляет собой этилгаллат, изоамилгаллат, пропилгаллат или октилгаллат.
[0005] В некоторых вариантах реализации изобретения сложный эфир галловой кислоты, представленный в настоящем документе, представляет собой этилгаллат.
[0006] В некоторых вариантах реализации изобретения сложный эфир галловой кислоты, представленный в настоящем документе, представляет собой изоамилгаллат.
[0007] В некоторых вариантах реализации изобретения сложный эфир галловой кислоты, представленный в настоящем документе, представляет собой октилгаллат.
[0008] В предпочтительном варианте реализации сложный эфир галловой кислоты, представленный в настоящем документе, представляет собой пропилгаллат.
[0009] В некоторых вариантах реализации изобретения композиции, составы, лекарственные средства, применение и способы, описанные в настоящем документе, обеспечивают увеличенные уровни SAMe in vivo по сравнению с обычными дозированными формами SAMe, не содержащими сложных эфиров галловой кислоты.
[00010] В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, составы или лекарственные средства, содержащие экзогенный SAMe и один или более сложных эфиров галловой кислоты, при этом соотношение (масса:масса) указанного сложного эфира галловой кислоты к S-аденозилметионину составляет от 5:1 до 1:400. В некоторых вариантах реализации изобретения соотношение (масса:масса) указанного сложного эфира галловой кислоты к S-аденозилметионину составляет от 5:1 до 1:400. В некоторых вариантах реализации изобретения соотношение (масса:масса) указанного сложного эфира галловой кислоты к S-аденозилметионину составляет от 5:1 до 1:100. В некоторых вариантах реализации изобретения соотношение (масса:масса) указанного сложного эфира галловой кислоты к S-аденозилметионину составляет от 1:1 до 1:100. В некоторых вариантах реализации изобретения соотношение (масса:масса) указанного сложного эфира галловой кислоты к S-аденозилметионину составляет от 1:2 до 1:80. В некоторых вариантах реализации изобретения соотношение (масса:масса) указанного сложного эфира галловой кислоты к S-аденозилметионину составляет от 1:4 до 1:64. В некоторых вариантах реализации изобретения соотношение (масса:масса) указанного сложного эфира галловой кислоты к S-аденозилметионину составляет от 4:1 до 1:80. В некоторых вариантах реализации изобретения соотношение (масса:масса) указанного сложного эфира галловой кислоты к S-аденозилметионину составляет от 3:1 до 1:60. В некоторых вариантах реализации изобретения соотношение (масса:масса) указанного сложного эфира галловой кислоты к S-аденозилметионину составляет от 2:1 до 1:40. В некоторых вариантах реализации изобретения соотношение (масса:масса) указанного сложного эфира галловой кислоты к S-аденозилметионину составляет от 1:1 до 1:16. В некоторых вариантах реализации изобретения авторы настоящего изобретения неожиданно обнаружили, что соотношения сложного эфира галловой кислоты к SAMe может быть оптимизировано для различных сложных эфиров галловой кислоты. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие экзогенный SAMe и этилгаллат, изоамилгаллат или октилгаллат, при этом массовое отношение этилгаллата, изоамилгаллата или октилгаллата к SAMe составляет от 1:1 до 1:16. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие экзогенный SAMe и этилгаллат, при этом массовое отношение этилгаллата:SAMe составляет примерно от 1:1 до 1:100. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие экзогенный SAMe и изоамилгаллат, при этом массовое отношение изоамилгаллата:SAMe составляет примерно от 1:1 до 1:100. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие экзогенный SAMe и октилгаллат, при этом массовое отношение октилгаллата:SAMe составляет примерно от 1:1 до 1:100. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие экзогенный SAMe и пропилгаллат, при этом массовое отношение пропилгаллата:SAMe составляет примерно от 1:1 до 1:100. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие экзогенный SAMe и пропилгаллат, при этом массовое отношение пропилгаллата:SAMe составляет примерно от 1:2 до 1:80. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие экзогенный SAMe и пропилгаллат, при этом массовое отношение пропилгаллата:SAMe составляет примерно от 1:4 до 1:64. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие экзогенный SAMe и пропилгаллат, при этом массовое отношение пропилгаллата:SAMe составляет примерно от 1:1 до 1:16. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие экзогенный SAMe и пропилгаллат, при этом массовое отношение пропилгаллата:SAMe составляет примерно от 1:1 до 1:2, от 1:2 до 1:3, от 1:3 до 1:4, от 1:4 до 1:5, от 1:5 до 1:6, от 1:6 до 1:7, от 1:7 до 1:8, от 1:8 до 1:9, от 1:9 до 1:10, от 1:10 до 1:11, от 1:11 до 1:12, от 1:12 до 1:13, от 1:13 до 1:14, от 1:14 до 1:15 или от 1:15 до 1:16. В некоторых вариантах реализации изобретения сложный эфир галловой кислоты представляет собой пропилгаллат, а массовое отношение пропилгаллата:SAMe составляет примерно 1:16.
[00011] В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие экзогенный SAMe и пропилгаллат, при этом массовое отношение пропилгаллата:SAMe составляет примерно от 1:4 до 1:64.
[00012] В некоторых вариантах реализации изобретения отношение (масса:масса) указанного сложного эфира галловой кислоты к S-аденозилметионину составляет от 1:1 до 1:64.
[00013] В некоторых вариантах реализации изобретения отношение (масса:масса) указанного сложного эфира галловой кислоты к S-аденозилметионину составляет от 1:1 до 1:16.
[00014] В некоторых вариантах реализации изобретения в настоящем документе представлены составы, содержащие экзогенный SAMe и один или более сложных эфиров галловой кислоты, содержащие примерно от 1 примерно до 200 мг сложного эфира галловой кислоты. В некоторых вариантах реализации изобретения указанные составы содержат примерно от 1 примерно до 150 мг сложного эфира галловой кислоты. В некоторых вариантах реализации изобретения указанные составы содержат примерно от 5 примерно до 100 мг сложного эфира галловой кислоты. В некоторых вариантах реализации изобретения указанные составы содержат примерно от 1 примерно до 5 мг сложного эфира галловой кислоты. В некоторых вариантах реализации изобретения указанные составы содержат примерно от 5 примерно до 10 мг, примерно от 10 примерно до 50 мг, примерно от 50 примерно до 100 мг, примерно от 100 примерно до 150 мг, примерно от 150 примерно до 200 мг, примерно от 200 примерно до 250 мг, примерно от 250 мг примерно до 300 мг, примерно от 300 примерно до 350 мг, примерно от 350 примерно до 400 мг или более чем примерно 400 мг сложного эфира галловой кислоты.
[00015] В некоторых вариантах реализации изобретения указанные составы содержат примерно от 1 примерно до 100 мг сложного эфира галловой кислоты.
[00016] В некоторых вариантах реализации изобретения указанные составы содержат примерно от 1 примерно до 50 мг сложного эфира галловой кислоты.
[00017] В некоторых вариантах реализации изобретения указанные составы содержат примерно от 10 примерно до 50 мг сложного эфира галловой кислоты.
[00018] В некоторых вариантах реализации изобретения указанные составы содержат примерно 25 мг сложного эфира галловой кислоты.
[00019] В некоторых вариантах реализации изобретения в настоящем документе представлены композиции и составы, содержащие экзогенный SAMe и один или более сложных эфиров галловой кислоты, при этом указанная композиция содержит от 0,1 до 80 мас. % сложного эфира галловой кислоты. В некоторых вариантах реализации изобретения указанные композиции или составы содержат от 0,1 до 70 мас. % сложного эфира галловой кислоты. В некоторых вариантах реализации изобретения указанные композиции или составы содержат от 0,1 до 60 мас. % сложного эфира галловой кислоты. В некоторых вариантах реализации изобретения указанные композиции или составы содержат от 0,1 до 50 мас. % сложного эфира галловой кислоты. В некоторых вариантах реализации изобретения указанные композиции или составы содержат от 0,1 до 40 мас. % сложного эфира галловой кислоты. В некоторых вариантах реализации изобретения указанные композиции или составы содержат от 0,1 до 30 мас. % сложного эфира галловой кислоты. В некоторых вариантах реализации изобретения указанные композиции или составы содержат от 0,1 до 20 мас. % сложного эфира галловой кислоты. В некоторых вариантах реализации изобретения указанные композиции или составы содержат от 0,1 до 10 мас. % сложного эфира галловой кислоты. В некоторых вариантах реализации изобретения указанные композиции или составы содержат от 0,5 до 10 мас. % сложного эфира галловой кислоты. В некоторых вариантах реализации изобретения указанные композиции или составы содержат от 0,5 до 5 мас. % сложного эфира галловой кислоты. В некоторых вариантах реализации изобретения указанные композиции или составы содержат от 0,5 до 2,5 мас. % сложного эфира галловой кислоты. Другие иллюстративные варианты реализации содержат от 0,25 до 1 мас. %, от 1 до 2 мас. %, от 2 до 3 мас. %, от 3 до 4 мас. %, от 4 до 5 мас. %, от 5 до 10 мас. %, от 10 до 15 мас. %, от 15 до 20 мас. %, от 20 до 25 мас. %, от 25 до 30 мас. %, от 30 до 35 мас. %, от 35 до 40 мас. %, от 40 до 50 мас. %, от 50 до 60 мас. %, от 60 до 70 мас. %, от 70 до 80 мас. % или более 80 мас. % сложного эфира галловой кислоты. Массовый процент базируется на общей массе дозированной формы.
[00020] В некоторых вариантах реализации изобретения указанные композиции или составы содержат от 0,5 до 5 мас. % сложного эфира галловой кислоты.
[00021] В некоторых вариантах реализации изобретения указанные композиции или составы содержат от 0,5 до 2,5 мас. % сложного эфира галловой кислоты.
[00022] В некоторых вариантах реализации изобретения в настоящем документе представлены композиции и составы, содержащие экзогенный SAMe и один или более сложных эфиров галловой кислоты, содержащие примерно от 10 примерно до 1200 мг SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно от 100 примерно до 1000 мг SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно от 100 примерно до 800 мг SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно от 100 примерно до 600 мг SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно от 100 примерно до 500 мг SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно от 100 примерно до 400 мг SAMe.
[00023] В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно 100 мг SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно 200 мг SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно 400 мг SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно 600 мг SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно 800 мг SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно 1000 мг SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно 1200 мг SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно 1600 мг SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно 3200 мг SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно 3600 мг SAMe. При упоминании количества SAMe подразумевается ион SAMe.
[00024] В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно 400 мг SAMe.
[00025] В некоторых вариантах реализации изобретения в настоящем документе представлены композиции и составы, содержащие экзогенный SAMe и один или более сложных эфиров галловой кислоты, при этом указанная композиция содержит по меньшей мере 10 мас. % SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат по меньшей мере 20 мас. % SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат по меньшей мере 30 мас. % SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат по меньшей мере 40 мас. % SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат по меньшей мере 50 мас. % SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат по меньшей мере 60 мас. % SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат по меньшей мере 70 мас. % SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат по меньшей мере 80 мас. % SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат по меньшей мере 90 мас. % SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно от 10 до 90 мас. % SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно от 20 до 80 мас. % SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно от 30 до 70 мас. % SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно от 30 до 60 мас. % SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно от 30 до 50 мас. % SAMe. В некоторых вариантах реализации изобретения указанные композиции или составы содержат примерно от 30 до 40 мас. % SAMe. При упоминании массового процента SAMe подразумевается ион SAMe.
[00026] В некоторых вариантах реализации изобретения SAMe представляет собой дисульфат-тозилатную соль SAMe или 1,4-бутандисульфонатную соль SAMe.
[00027] В предпочтительных вариантах реализации изобретения SAMe представляет собой дисульфат-тозилатную соль SAMe.
[00028] В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, которые обеспечивают повышенные уровни SAMe в плазме. В некоторых вариантах реализации изобретения такая композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю максимальную концентрацию SAMe в плазме крови (среднюю Cmax), составляющую по меньшей мере примерно 120 нг/мл на каждые 100 мг иона SAMe, или по меньшей мере примерно 130 нг/мл на каждые 100 мг иона SAMe, или по меньшей мере около 150 нг/мл на каждые 100 мг иона SAMe, или по меньшей мере примерно 175 нг/мл на каждые 100 мг иона SAMe, или по меньшей мере примерно 200 нг/мл на каждые 100 мг иона SAMe, или по меньшей мере примерно 225 нг/мл на каждые 100 мг иона SAMe, или по меньшей мере примерно 250 нг/мл на каждые 100 мг иона SAMe, или по меньшей мере примерно 300 нг/мл на каждые 100 мг иона SAMe. В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 120 нг/мл на каждые 100 мг иона SAMe. В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 130 нг/мл на каждые 100 мг иона SAMe. В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 135 нг/мл на каждые 100 мг иона SAMe. В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 140 нг/мл на каждые 100 мг иона SAMe. В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 145 нг/мл на каждые 100 мг иона SAMe.
[00029] В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю максимальную концентрацию SAMe в плазме крови (среднюю Cmax), составляющую по меньшей мере примерно 120 нг/мл на каждые 100 мг иона SAMe.
[00030] В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 12 нг/мл, по меньшей мере примерно 13 нг/мл, по меньшей мере примерно 15 нг/мл, по меньшей мере примерно 17,5 нг/мл, по меньшей мере примерно 20 нг/мл, по меньшей мере примерно 22,5 нг/мл, по меньшей мере примерно 25 нг/мл или по меньшей мере примерно 30 нг/мл на каждые 10 мг иона SAMe. В других вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 1,2 нг/мл, по меньшей мере 1,3 нг/мл, по меньшей мере 1,35 нг/мл, по меньшей мере 1,5 нг/мл, по меньшей мере 1,75 нг/мл, по меньшей мере 2,0 нг/мл, по меньшей мере 2,25 нг/мл, по меньшей мере 2,5 нг/мл или по меньшей мере 3,0 нг/мл на каждый 1 мг иона SAMe. В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 12 нг/мл на каждый 1 мг иона SAMe. В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 13 нг/мл на каждый 1 мг иона SAMe. В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 14 нг/мл на каждый 1 мг иона SAMe. В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 14,5 нг/мл на каждый 1 мг иона SAMe.
[00031] В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 12 нг/мл на каждые 10 мг иона SAMe.
[00032] В предпочтительных вариантах реализации изобретения сложный эфир галловой кислоты представляет собой пропилгаллат. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 1,2 нг/мл, по меньшей мере примерно 1,3 нг/мл, по меньшей мере примерно 1,35 нг/мл, по меньшей мере примерно 1,5 нг/мл, по меньшей мере примерно 1,75 нг/мл, по меньшей мере примерно 2,0 нг/мл, по меньшей мере примерно 2,25 нг/мл, по меньшей мере примерно 2,5 нг/мл или по меньшей мере примерно 3,0 нг/мл на каждый 1 мг иона SAMe. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 12 нг/мл на каждый 1 мг иона SAMe. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 13 нг/мл на каждый 1 мг иона SAMe. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 14 нг/мл на каждый 1 мг иона SAMe. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 14,5 нг/мл на каждый 1 мг иона SAMe.
[00033] В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 1,2 нг/мл на каждый 1 мг иона SAMe.
[00034] В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, которые при введении указанной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 800 нг·ч/мл на каждую 100 мг дозу иона SAMe или по меньшей мере примерно 850 нг·ч/мл на каждую 100 мг дозу иона SAMe, или по меньшей мере примерно 900 нг·ч/мл на каждую 100 мг дозу иона SAMe, или по меньшей мере примерно 950 нг·ч/мл на каждую 100 мг дозу иона SAMe, или по меньшей мере примерно 1000 нг·ч/мл на каждую 100 мг дозу иона SAMe. В некоторых вариантах реализации изобретения указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 800 нг·ч/мл на каждую 100 мг дозу иона SAMe. В некоторых вариантах реализации изобретения указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 850 нг·ч/мл на каждую 100 мг дозу иона SAMe. В некоторых вариантах реализации изобретения указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 900 нг·ч/мл на каждую 100 мг дозу иона SAMe. В некоторых вариантах реализации изобретения указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 950 нг·ч/мл на каждую 100 мг дозу иона SAMe. В некоторых вариантах реализации изобретения указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 1000 нг·ч/мл на каждую 100 мг дозу иона SAMe.
[00035] В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, которые при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 800 нг·ч/мл на каждую 100 мг дозу иона SAMe.
[00036] В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю AUC SAMe, составляющую по меньшей мере примерно 80 нг·ч/мл, по меньшей мере примерно 85 нг·ч/мл, по меньшей мере примерно 90 нг·ч/мл, по меньшей мере примерно 95 нг·ч/мл или по меньшей мере примерно 100 нг·ч/мл на каждые 10 мг иона SAMe.
[00037] В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю AUC SAMe, составляющую по меньшей мере примерно 80 нг·ч/мл на каждые 10 мг иона SAMe.
[00038] В других вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю AUC SAMe, составляющую по меньшей мере примерно 8 нг·ч/мл, по меньшей мере примерно 8.5 нг·ч/мл, по меньшей мере примерно 9 нг·ч/мл, по меньшей мере примерно 9,5 нг·ч/мл или по меньшей мере примерно 10 нг·ч/мл на каждый 1 мг иона SAMe. В некоторых вариантах реализации изобретения указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 8 нг·ч/мл на каждую 1 мг дозу иона SAMe. В некоторых вариантах реализации изобретения указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 8,5 нг·ч/мл на каждую 1 мг дозу иона SAMe. В некоторых вариантах реализации изобретения указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 9 нг·ч/мл на каждую 1 мг дозу иона SAMe. В некоторых вариантах реализации изобретения указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 9,5 нг·ч/мл на каждую 1 мг дозу иона SAMe. В некоторых вариантах реализации изобретения указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 10 нг·ч/мл на каждую 1 мг дозу иона SAMe.
[00039] В других вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю AUC SAMe, составляющую по меньшей мере примерно 8 нг·ч/мл на каждый 1 мг иона SAMe.
[00040] В предпочтительных вариантах реализации изобретения сложный эфир галловой кислоты представляет собой пропилгаллат. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгалла, при этом указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC SAMe, составляющую по меньшей мере примерно 8 нг·ч/мл, по меньшей мере примерно 8,5 нг·ч/мл, по меньшей мере примерно 9 нг·ч/мл, по меньшей мере примерно 9,5 нг·ч/мл или по меньшей мере примерно 10 нг·ч/мл на каждый 1 мг иона SAMe. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 8 нг·ч/мл на каждую 1 мг дозу иона SAMe. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 8,5 нг·ч/мл на каждую 1 мг дозу иона SAMe. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 9 нг·ч/мл на каждую 1 мг дозу иона SAMe. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 9,5 нг·ч/мл на каждую 1 мг дозу иона SAMe. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 10 нг·ч/мл на каждую 1 мг дозу иона SAMe.
[00041] В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом указанные композиции при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю AUC SAMe, составляющую по меньшей мере примерно 8 нг·ч/мл на каждый 1 мг иона SAMe.
[00042] В некоторых вариантах реализации изобретения введенная доза экзогенного иона SAMe составляет по меньшей мере 10 мг. В некоторых вариантах реализации изобретения введенная доза экзогенного иона SAMe составляет от 10 до 3600 мг. В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 120 нг/мл, и среднюю AUC, составляющую по меньшей мере примерно 800 нг·ч/мл на каждые 100 мг иона SAMe для доз иона SAMe, составляющих по меньшей мере 100 мг. В других вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 130 нг/мл, и среднюю AUC, составляющую по меньшей мере примерно 850 нг·ч/мл на каждые 100 мг иона SAMe для доз иона SAMe, составляющих по меньшей мере 100 мг. В других предпочтительных вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 12 нг/мл, и среднюю AUC, составляющую по меньшей мере примерно 90 нг·ч/мл на каждые 10 мг иона SAMe для доз иона SAMe, составляющих по меньшей мере 10 мг. В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 13 нг/мл, и среднюю AUC, составляющую по меньшей мере примерно 90 нг·ч/мл на каждые 10 мг иона SAMe для доз иона SAMe, составляющих по меньшей мере 10 мг. В других вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 1,2 нг/мл, и/или среднюю AUC, составляющую по меньшей мере примерно 9 нг·ч/мл на каждый 1 мг иона SAMe. В некоторых вариантах реализации изобретения указанная композиция при введении выбранной группе субъектов обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 1,3 нг/мл, и/или среднюю AUC, составляющую по меньшей мере примерно 9 нг·ч/мл на каждый 1 мг иона SAMe. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, которые при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 1,4 нг/мл, и/или среднюю AUC, составляющую по меньшей мере примерно 9 нг·ч/мл на каждый 1 мг иона SAMe. В других вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, которые при введении указанных композиций выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 1,5 нг/мл, и/или среднюю AUC, составляющую по меньшей мере примерно 9 нг·ч/мл на каждый 1 мг иона SAMe. В дополнительных вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, которые при введении указанных композиций выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 1,3 нг/мл, и/или среднюю AUC, составляющую по меньшей мере примерно 9,5 нг·ч/мл на каждый 1 мг иона SAMe. В других вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, которые при введении указанных композиций выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей примерно 1,3 нг/мл, и/или среднюю AUC, составляющую по меньшей мере примерно 10,0 нг·ч/мл на каждый 1 мг иона SAMe.
[00043] В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, которые обеспечивают у субъекта одну из средней Tmax и Cmax со сниженной вариацией или сниженной эффективной дозой, по сравнению с контрольной группой SAMe. Контрольные группы SAMe представляют собой те, в которых субъекту или выбранной группе субъектов вводят такой же или похожий состав SAMe, за исключением того, что в нем не содержится один или более сложных эфиров галловой кислоты.
[00044] В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, которые при введении выбранной группе субъектов обеспечивают в указанной выбранной группе субъектов улучшенный фармакокинетический профиль SAMe, так что введение один раз в сутки дозы композиций, описанных в настоящем документе, эквивалентно (или лучше), чем введение два раза в сутки дозы обычных композиций SAMe, которые не содержат по меньшей мере одного сложного эфира галловой кислоты. «Улучшенный фармакокинетический профиль SAMe» может быть измерен, например, по эквивалентной или более высокой AUC или Cmax SAMe, сниженному отклонению Tmax SAMe, сниженному профилю побочных эффектов и/или увеличенной скорости начала действия. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом введение указанных композиций выбранной группе субъектов один раз в сутки обеспечивает в указанной выбранной группе субъектов улучшенный фармакокинетический профиль SAMe, по сравнению с контрольной группой SAMe.
[00045] В некоторых иллюстративных вариантах реализации изобретения функциональное покрытие действует для совместной доставки экзогенного SAMe и сложного эфира галловой кислоты в верхнюю часть тонкого кишечника, где SAMe абсорбируется лучше. В других вариантах реализации изобретения функциональное покрытие приводит к доставке экзогенного SAMe и сложного эфира галловой кислоты в толстый кишечник и/или в область толстой и ободочной кишок.
[00046] В некоторых вариантах реализации изобретения в настоящем документе представлены композиции, содержащие единичную лекарственную форму, которая содержит функциональное покрытие. Предпочтительно, указанное функциональное покрытие составляет 1-20% относительно общей массы единичной дозированной формы. В некоторых вариантах реализации изобретения указанное функциональное покрытие содержит более одного слоя покрытия. В некоторых вариантах реализации изобретения указанное функциональное покрытие содержит защитное покрытие и один или более дополнительных слоев покрытия. Предпочтительно, указанный один или более дополнительных слоев покрытия представляют собой энтеросолюбильное покрытие, покрытие для модифицированного высвобождения, не зависящее от рН, или зависящее от рН покрытие. В некоторых вариантах реализации изобретения указанный один или более дополнительных слоев покрытия составляют по меньшей мере 3%, 3,5%, 4%, 4,5%, 5% или 5,5% относительно общей массы стандартной дозированной формы. Более предпочтительно, указанный один или более дополнительных слоев покрытия представляют собой энтеросолюбильное покрытие, которое составляет от 3 до 5% относительно общей массы единичной дозированной формы. Наиболее предпочтительно, в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом указанные композиции содержат энтеросолюбильное покрытие, покрытие для модифицированного высвобождения, не зависящее от рН, или зависящее от рН покрытие, которое составляет по меньшей мере 3%, 3,5%, 4%, 4,5%, 5% или 5,5% от общей массы дозированной формы.
[00047] В некоторых вариантах реализации изобретения композиция, представленная в настоящем документе, содержит пероральную дозированную форму или систему доставки. Предпочтительно, указанная пероральная дозированная форма или система доставки представляет собой капсулу или некапсульную форму. Наиболее предпочтительно, указанная некапсульная дозированная форма представляет собой таблетку. В других вариантах реализации изобретения указанная композиция содержит трансдермальную, трансмукозальную или внутримышечную дозированную форму. В некоторых других вариантах реализации изобретения указанная композиция содержит дозированную форму для внутривенного введения.
[00048] В некоторых вариантах реализации изобретения композиции, представленные в настоящем документе, содержат минитаблетку. «Минитаблетка» или «мини-таблетки», при использовании в настоящем документе, представляют собой таблетки меньшего диаметра, как правило, <3 мм в диаметре. Мини-таблетки содержат такие же вспомогательные вещества, что и таблетки большего размера. Как правило, их также получают по таким же способам, которые известны для получения более крупных таблеток, таким как прессование таблеток, нанесение защитного покрытия и нанесение энтеросолюбильного покрытия. В некоторых вариантах реализации изобретения мини-таблетками наполняют капсулу или осторожно прессуют их с получением более крупной таблетки вместе с одним или более рН-регуляторами. В некоторых вариантах реализации изобретения мини-таблетками наполняют капсулу. В некоторых вариантах реализации изобретения мини-таблетки прессуют в таблетку большего размера. В некоторых вариантах реализации изобретения мини-таблетки прессуют в таблетку, распадающуюся в ротовой полости или «ODT». В некоторых вариантах реализации изобретения мини-таблетки используют для уменьшения удерживания таблетки в желудке. В некоторых вариантах реализации изобретения мини-таблетки используют для уменьшения побочных эффектов, связанных с противоионом(-ами) SAMe.
[00049] В некоторых вариантах реализации изобретения мини-таблетки используют для введения после еды. В некоторых вариантах реализации изобретения мини-таблетки используют для введения натощак. В некоторых вариантах реализации изобретения введение более крупных таблеток демонстрирует задержку Tmax SAMe (или других лекарств). В некоторых вариантах реализации изобретения введение композиции мини-таблеток после еды уменьшает задержку Tmax SAMe. В некоторых вариантах реализации изобретения введение композиции мини-таблеток после еды снижает удерживание в желудке или задержку опорожнения желудка.
[00050] В некоторых вариантах реализации изобретения композиция мини-таблетки содержит примерно от 10 до 80% SAMe. В некоторых вариантах реализации изобретения композиция мини-таблетки содержит примерно от 10 до 70% SAMe. В некоторых вариантах реализации изобретения композиция мини-таблетки содержит примерно от 10 до 60% SAMe. В некоторых вариантах реализации изобретения композиция мини-таблетки содержит примерно от 10 до 50% SAMe. В некоторых вариантах реализации изобретения композиция мини-таблетки содержит примерно от 15 до 45% SAMe.
[00051] В некоторых вариантах реализации изобретения заболевания и/или расстройства, которые можно лечить при помощи препаратов SAMe и сложных эфиров галловой кислоты, представленных в настоящем документе, выбраны из группы, состоящей из, но не ограничиваясь ими, душевного или психиатрического расстройства (например, психотических/настроенческих или непсихотических душевных расстройств, примерами которых являются депрессия и расстройства, связанные с приемом различных веществ, соответственно), заболевания/расстройства нервной системы (например, заболевания центральной нервной системы, примером которого является болезнь Альцгеймера), других неврологических заболеваний/расстройств (например, головных болей и расстройств сна), состояний, связанных с повреждением центральной нервной системы, заболевания/расстройства печени (например, алкогольной болезни печени), рака (например, солидных видов рака и раковых заболеваний крови), заболевания/расстройства сустава (например, артрита), воспалительного заболевания/расстройства (например, неспецифического язвенного колита), аутоиммунного заболевания/расстройства (например, системной красной волчанки и ревматоидного артрита), дегенеративного заболевания/расстройства (например, амиотрофического латерального склероза), заболевания/расстройства мягких тканей (например, фибромиалгии), болевого заболевания/расстройства, генетического расстройства, связанного с гипер- или гипометилированием, желудочно-кишечного заболевания/расстройства, сердечно-сосудистого заболевания/расстройства, атеросклероза, болезни Леши-Нихана, метаболического заболевания/расстройства (например, диабета 2 типа), расстройства, полностью или частично вызванного окислительным или свободно-радикальным повреждением. В предпочтительных вариантах реализации изобретения указанная композиция содержит SAMe и один из этилгаллата, изоамилгаллата, пропилгаллата или октилгаллата, как описано в настоящем документе. В наиболее предпочтительных вариантах реализации изобретения указанная композиция содержит SAMe и пропилгаллат.
[00052] Дополнительные варианты реализации, представленные в настоящем документе, относятся к комбинациям экзогенного SAMe и одного или более сложных эфиров галловой кислоты вместе с одним или более активными ингредиентами, которые обычно прописывают или используют для лечения и/или профилактики различных заболеваний или расстройств у субъекта. В предпочтительных вариантах реализации изобретения указанная композиция содержит SAMe и один из этилгаллата, изоамилгаллата, пропилгаллата или октилгаллата, как описано в настоящем документе. В наиболее предпочтительных вариантах реализации изобретения указанная композиция содержит SAMe и пропилгаллат.
[00053] В настоящем документе представлены также способы лечения или предупреждения и/или профилактики у субъекта заболевания или расстройства, выбранного из группы, состоящей из, но не ограничиваясь ими, душевного или психиатрического расстройства (например, психотических/настроенческих или непсихотических душевных расстройств, примерами которых являются депрессия и расстройства, связанные с приемом различных веществ, соответственно), заболевания/расстройства нервной системы (например, заболевания центральной нервной системы, примером которого является болезнь Альцгеймера), других неврологических заболеваний/расстройств (например, головных болей и расстройств сна), состояний, связанных с повреждением центральной нервной системы, заболевания/расстройства печени (например, алкогольной болезни печени), рака (например, солидного рака и раковых заболеваний крови), заболевания/расстройства сустава (например, артрита), воспалительного заболевания/расстройства (например, неспецифического язвенного колита), аутоиммунного заболевания/расстройства (например, системной красной волчанки и ревматоидного артрита), дегенеративного заболевания/расстройства (например, амиотрофического латерального склероза), заболевания/расстройства мягких тканей (например, фибромиалгии), болевого заболевания/расстройства, генетического расстройства, связанного с гипер- или гипометилированием, желудочно-кишечного заболевания/расстройства, сердечно-сосудистого заболевания/расстройства, атеросклероза, болезни Леши-Нихана, метаболического заболевания/расстройства (например, диабета 2 типа), расстройства, полностью или частично вызванного окислительным или свободно-радикальным повреждением, включающие введение композиции, содержащей SAMe и один или более сложных эфиров галловой кислоты, так что происходит лечение или предотвращение указанного заболевания. В предпочтительных вариантах реализации изобретения указанная композиция содержит SAMe и один из этилгаллата, изоамилгаллата, пропилгаллата или октилгаллата, как описано в настоящем документе. В наиболее предпочтительных вариантах реализации изобретения указанная композиция содержит SAMe и пропилгаллат. Предпочтительно, указанное заболевание или расстройство представляет собой депрессию. Еще более предпочтительно, указанная депрессия представляет собой глубокое депрессивное расстройство (известное также как глубокая депрессия, клиническая депрессия), дистимическое расстройство (упоминаемое также как дистимия), биполярное расстройство (ранее упоминавшееся как маниакальная депрессия), послеродовую депрессию, сезонное аффективное расстройство (SAD), депрессию, связанную с чувством неполноценности, атипичную депрессию, меланхолическую депрессию, инволюционную застывающую депрессию и психогенную депрессию, реактивную депрессию, депрессию в пожилом возрасте (и подобные), депрессию Паркинсона, ВИЧ-ассоциированную депрессию, рецидивирующую кратковременную депрессию, легкую степень депрессии, малую депрессию, терапевтически резистентную депрессию (TRD), сопутствующую депрессию или не уточненную депрессию (NOS).
[00054] В некоторых вариантах реализации изобретения любую из композиций, представленных в настоящем документе, используют для лечения заболеваний и расстройств, описанных в настоящем документе.
[00055] В настоящем документе представлены также способы введения композиции, содержащей SAMEe и сложный эфир галловой кислоты, включающие введение указанной композиции пациенту или выбранной группе субъектов в состоянии натощак перед введением указанной композиции. «Натощак», как правило, означает отсутствие приемов пищи в течение ночи, так что таким пациентам (или субъектам) вводят указанную композицию по меньшей мере да один час до первого дневного приема пищи (т.е., как правило, завтрака). Предпочтительно, состояние «натощак» является таким, что субъекты не принимали пищу по меньшей мере в течение 10 или 12 часов до введения лекарства, и отсутствие приема пищи продолжается в течение 1 или 4 часов после введения лекарства. В настоящем документе представлены также способы введения композиции, содержащей SAMe и сложный эфир галловой кислоты, включающие введение указанной композиции пациенту или выбранной группе субъектов в состоянии после еды. Состояние «после еды», как правило, является таким, что указанные пациенты/субъекты принимали пищу приблизительно за 1-2 часа до введения композиции согласно настоящему изобретению. Предпочтительно, в состоянии «после еды» субъекты не принимают пищу в течение по меньшей мере 12 часов перед утренним завтраком, а затем принимают пищу (зачастую стандартную пищу с высоким содержанием жиров, с высоким содержанием калорий) приблизительно за 30 минут до введения лекарства.
[00056] В некоторых вариантах реализации изобретения композиции и составы, представленные в настоящем документе, демонстрируют слабые тендерные фармакокинетические эффекты или не демонстрируют их. Было описано, что после введения экзогенного SAMe при помощи составов, описанных ранее в данной области техники, некоторые из указанных эффектов SAMe различаются среди субъектов мужского и женского пола. Существует множество теорий относительно причины таких тендерных эффектов. Неожиданно, композиции и составы, представленные в настоящем документе, демонстрируют такие фармакокинетические профили, в которых отсутствует статистически значимое различие значений между субъектами мужского и женского пола. В некоторых вариантах реализации изобретения в настоящем документе представлены композиции и составы, которые демонстрируют одинаковые фармакокинетические профили для субъектов мужского и женского пола.
[00057] В настоящем документе представлены также способы улучшения всасывания SAMe, включающие введение субъекту иллюстративной композиции, которая обеспечивает физиологически эффективное количество экзогенного SAMe, в комбинации с одним или более сложными эфирами галловой кислоты. Предпочтительно, указанный сложный эфир галловой кислоты выбран из этилгаллата, изоамилгаллата, пропилгаллата или октилгаллата. Наиболее предпочтительно, указанный сложный эфир галловой кислоты представляет собой пропилгаллат.
[00058] В настоящем документе дополнительно представлен способ получения состава для улучшенного всасывания SAMe, включающий смешивание экзогенного SAMe и сложного эфира галловой кислоты, и составление их в капсулу или не капсулу с дополнительными вспомогательными веществами или без них. Предпочтительно, указанный сложный эфир галловой кислоты выбран из этилгаллата, изоамилгаллата, пропилгаллата или октилгаллата. Наиболее предпочтительно, указанный сложный эфир галловой кислоты представляет собой пропилгаллат.
[00059] Так, в некоторых вариантах реализации изобретения в настоящем документе представлен способ улучшения всасывания SAMe, включающий введение указанному субъекту иллюстративной композиции, которая обеспечивает физиологически эффективное количество экзогенного SAMe, в комбинации с пропилгаллатом. В некоторых вариантах реализации изобретения представлен также способ получения состава для улучшенного всасывания SAMe, включающий смешивание экзогенного SAMe и пропилгаллата и составление их в капсулу или не капсулу с дополнительными вспомогательными веществами или без них. В других вариантах реализации изобретения представлен способ введение композиции, содержащей экзогенный SAMe и пропилгаллат, включающий введение указанной композиции пациенту, не принимавшему пищу в течение по меньшей мере 10 часов до введения указанной композиции.
[00060] Подробности одного или более вариантов реализации изложены в представленном ниже описании. Другие особенности, задачи и преимущества станут понятны из указанного описания, чертежей и формулы изобретения. Кроме того, описание всех патентов и патентных заявок, упомянутых в настоящем документе, включено в настоящий документ посредством ссылки в полном объеме.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[00061] ФИГУРА 1 представляет собой диаграмму средней максимальной концентрации SAMe в плазме (Cmax) биглей, которым вводили однократную дозу 400 мг ионов SAMe в виде одного из десяти различных составов: (1) имеющийся в продаже пероральный препарат SAMe, (2) препарат MSI SAMe без пропилгаллата («контрольный SAMe»); (3) препарат MSI SAMe, введенный совместно с отдельной 25 мг таблеткой пропилгаллата («контрольный SAMe с отдельным пропилгаллатом»); (4) препарат MSI SAMe, смешанный с 25 мг метилгаллата; (5) препарат MSI SAMe, смешанный с 25 мг этилгаллата; (6) препарат MSI SAMe, смешанный с 25 мг пропилгаллата; (7) препарат MSI SAMe, смешанный с 25 мг бутилгаллата; (8) препарат MSI SAMe, смешанный с 25 мг изобутилгаллата; (9) препарат MSI SAMe, смешанный с 25 мг изоамилгаллата; или (10) препарат MSI SAMe, смешанный с 25 мг октилгаллата.
[00062] ФИГУРА 2А представляет собой диаграмму, иллюстрирующую среднюю максимальную концентрацию SAMe в плазме (Cmax) биглей, которым вводили одну капсулу, содержащую 100 мг только ионов SAMe («контрольный SAMe») или смешанных с 100 мг одного из следующих: бутилированного гидрокситолуола («ВНТ»), пропилпарабена или галловой кислоты.
[00063] ФИГУРА 2В представляет собой диаграмму, иллюстрирующую среднюю площадь под кривой SAMe в плазме (AUC) биглей, которым вводили одну капсулу, содержащую 100 мг только ионов SAMe («контрольный SAMe») или смешанных с 100 мг одного из следующих: бутилированного гидрокситолуола («ВНТ»), пропилпарабена или галловой кислоты.
[00064] ФИГУРА 3А представляет собой диаграмму, иллюстрирующую среднюю максимальную концентрацию SAMe в плазме (Cmax) субъектов-людей, которым вводили однократную дозу либо 400 мг, 800 мг или 1600 мг препарата MSI (SAMe и пропилгаллат), либо 1600 мг дозу коммерческого продукта SAMe.
[00065] ФИГУРА 3В представляет собой диаграмму, иллюистрирующую среднюю площадь под кривой SAMe в плазме (AUC) субъектов-людей, которым вводили однократную дозу либо 400 мг, 800 мг или 1600 мг препарата MSI (SAMe и пропилгаллат), либо 1600 мг дозу коммерческого продукта SAMe.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[00066] Авторы настоящего изобретения неожиданно обнаружили, что доставка экзогенного SAMe может быть значительно улучшена при введении по меньшей мере одного сложного эфира галловой кислоты в комбинации с экзогенно вводимым SAMe. Так, некоторые варианты реализации относятся к составам, содержащим SAMe и один или более сложных эфиров галловой кислоты. Другие варианты реализации относятся к композициям и способам, которые улучшают всасывание экзогенного SAMe, и к способам их применения, например, для лечения различных заболеваний или расстройств у субъекта и/или для улучшения статуса питания субъекта. Дополнительные варианты реализации относятся к комбинациям SAMe и одного или более сложных эфиров галловой кислоты с одним или более активными ингредиентами, которые обычно прописывают или используют для лечения и/или профилактики различных заболеваний или расстройств у субъекта. Не ограничиваясь каким-либо одним конкретным вариантом реализации, в настоящем документе представлен способ увеличения абсорбции SAMe, при этом один или более сложных эфиров галловой кислоты связываются и/или взаимодействуют с указанным SAMe и/или желудочно-кишечным трактом, увеличивая посредством этого абсорбцию SAMe через слизистую стенку или эпителиальные клетки кишечника.
[00067] При использовании в настоящем документе термин «SAMe» относится к S-аденозил-L-метионину (или, проще говоря, «S-аденозилметионину»), включая все возможные соли SAMe. При упоминании дозы или процентов, количество (обычно в мг) относится к дозе введенных ионов SAMe. Как упомянуто выше, SAMe чаще всего доступен в виде стабильной солевой формы, например, с п-толуолсульфоновой кислотой (см. US 3893999, который включен в настоящий документ посредством ссылки в полном объеме). Другие стабильные соли SAMe описаны, например, в US 5128249, где описаны отдельные стабильные соли SAMe. Для применения в некоторых вариантах реализации изобретения, представленных в настоящем документе, подходят различные морфологии SAMe. Так, при использовании в настоящем документе «SAMe» относится к стабильным солям, аморфным формам, полукристаллическим формам и кристаллическим формам SAMe, а также к ионной форме SAMe, находящегося in vivo. Аморфные формы SAMe могут быть использованы при любом размере частиц и любом распределении частиц по размеру.
[00068] Составы для перорального введения экзогенного SAMe, как правило, представлены в виде твердых или полутвердых продуктов, лекарственных форм или систем для пероральной доставки, примерами которых являются капсулы или некапсульные дозированные формы, которые включают таблетки, пастилки для рассасывания, камеди, пасты, пеллеты или гранулы, и они обычно состоят из ядра «материала матрицы», а также одного или более покрытий. «Продукт» или «дозированная форма», или «система для пероральной доставки» при использовании в настоящем документе относится к любому твердому или полутвердому составу или препарату, используемому для перорального введения, примеры которого представляют собой капсулы, таблетки, пасты, гранулы, капсуловидные таблетки, пастилки для рассасывания и т.п.; все из которых общеизвестны и широко освещены в данной области техники. Указанные составы могут быть введены при помощи клинического, фармацевтического или ветеринарного режима введения доз. Пероральные дозированные формы также могут быть представлены в виде диетических или пищевых добавок, или в виде продукта лечебного питания.
[00069] «Галлаты», «алкилгаллаты» или «сложные эфиры галловой кислоты» при использовании в настоящем документе относятся к солям и сложным эфирам галловой кислоты и имеют общую формулу I (см. ниже), где R1 представляет собой углеводородную цепь, которая может быть прямой или разветвленной. Необязательно, группа R1 может представлять собой алкил, алкенил, алкинил, арил, бензил, фенил, алициклическую или гетероциклическую группу, и все из этих групп могут быть замещенными или незамещенными. R1 предпочтительно представляет собой С1-С22 алкильную группу, С2-С22 алкенильную группу или С2-С22 алкинильную группу, и все из этих групп могут быть замещенными или незамещенными и могут представлять собой прямые, циклические, циклические ненасыщенные или разветвленные цепи. Кроме того, указанная углеводородная цепь может быть насыщенной, мононенасыщенной или полиненасыщенной. Предпочтительно, R1 представляет собой насыщенную углеводородную цепь в диапазоне С1-С22.
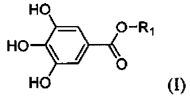
[00070] Предпочтительные сложные эфиры галловой кислоты для применения в соответствии с настоящим изобретением представляют собой метилгаллат, этилгаллат, пропилгаллат, изопропилгаллат, бутилгаллат, изобутилгаллат, амилгаллат, изоамилгаллат, гексилгаллат, изогексилгаллат, гептилгаллат, изогептилгаллат, октилгаллат, изооктилгаллат, нонилгаллат, изононилгаллат, децилгаллат, ундецилгаллат, изоундецилгаллат, додецилгаллат (лаурилгаллат), изододецилгаллат, тридецилгаллат, изотридецил, тетрадецилгаллат, изотетрадецилгаллат, пентадецилгаллат, изопентадецилгаллат, гексадецилгаллат (цетилгаллат), изогексадецилгаллат, гептадецилгаллат, изогептадецилгаллат, октадецилгаллат, изоктадецилгаллат, цис-9-гексадеценил(пальмитолеил)галлат, цис-9-октадеценил(олеил)галлат, цис,цис-9,12-октадекадиенил(линолеил)галлат,транс,транс-9,12-октадекадиенил(линолелаидил)галлат, цис,цис,цис-9,12,15-октадекатриенил (линоленил)галлат, транс,транс,транс-9,12,15-октадекатриенил(линоленелаидил)галлат, цис,цис,цис-6,9,12-октадекатриенил (гамма-линоленил)галлат, транс-9-октадеценилцис(элаидил)галлат или /транс-9-гексадеценил(пальмителаидил)галлат, катехингаллат, эпикатехингаллат, галлокатехингаллат, эпигаллокатехингаллат, галлокатехолгаллат, 2-этилгексилгаллат, 2-гидроксиэтилгаллат, 6-О-галлоилглюкозу, гамамелитаннин, метоксиэтоксиэтоксиэтил-м-дигаллат, теафлавина моногаллат А и В, теафлавина дигаллат. Более предпочтительно, сложный эфир галловой кислоты выбран из этилгаллата, изоамилгаллата, пропилгаллата или октилгаллата. Еще более предпочтительно, сложный эфир галловой кислоты признан Управлением по контролю пищевых продуктов и лекарственных средств США (FDA) GRAS (признанным безопасным) веществом. Предпочтительно также, что сложный эфир галловой кислоты получил одобрение в качестве нового пищевого продукта либо Европейским управлением по безопасности пищевых продуктов (EFSA), либо Европейским агентством лекарственных средств (ЕМА). Наиболее предпочтительно, сложный эфир галловой кислоты представляет собой пропилгаллат. Так, в настоящем документе представлены составы, содержащие SAMe и пропилгаллат. Пропилгаллат представляет собой предпочтительный сложный эфир галловой кислоты, поскольку авторы настоящего изобретения впервые показали, что пропилгаллат имеет дозозависимую взаимосвязь с всасыванием SAMe in vivo.
[00071] В некоторых иллюстративных вариантах реализации изобретения соотношение (масса:масса) сложного эфира галловой кислоты к экзогенному SAMe составляет от 5:1 до 1:400. Предпочтительно, соотношение (масса:масса) сложного эфира галловой кислоты к S-аденозилметионину составляет от 5:1 до 1:100, от 4:1 до 1:80 или от 1:1 до 1:16. В некоторых предпочтительных вариантах реализации изобретения сложный эфир галловой кислоты представляет собой этилгаллат, изоамилгаллат или октилгаллат, а массовое отношение этилгаллата, изоамилгаллата или октилгаллата к SAMe составляет от 1:1 до 1:16. В различных вариантах реализации изобретения сложный эфир галловой кислоты представляет собой пропилгаллат, а массовое отношение пропилгаллата:SAMe составляет от 1:1 до 1:100. В некоторых предпочтительных вариантах реализации изобретения сложный эфир галловой кислоты представляет собой пропилгаллат, а массовое отношение пропилгаллата:SAMe составляет от 1:1 до 1:16. В более предпочтительных вариантах реализации изобретения сложный эфир галловой кислоты представляет собой пропилгаллат, а массовое отношение пропилгаллата:SAMe составляет от 1:1 до 1:2, от 1:2 до 1:3, от 1:3 до 1:4, от 1:4 до 1:5, от 1:5 до 1:6, от 1:6 до 1:7, от 1:7 до 1:8, от 1:8 до 1:9, от 1:9 до 1:10, от 1:10 до 1:11, от 1:11 до 1:12, от 1:12 до 1:13, от 1:13 до 1:14, от 1:14 до 1:15 или от 1:15 до 1:16. Наиболее предпочтительно, сложный эфир галловой кислоты представляет собой пропилгаллат, а массовое отношение пропилгаллата:SAMe составляет около 1:16. Так, в некоторых вариантах реализации изобретения представлена композиция, содержащая SAMe и пропилгаллат, при этом массовое отношение пропилгаллата:SAMe составляет от 1:1 до 1:16. Так, в некоторых других вариантах реализации изобретения в настоящем документе представлена композиция, содержащая SAMe и пропилгаллат, при этом массовое отношение пропилгаллата:SAMe составляет примерно 1:16.
[00072] В некоторых вариантах реализации изобретения указанная композиция, содержащая экзогенный SAMe и сложный эфир галловой кислоты, содержит примерно от 1 примерно до 5 мг или примерно от 5 примерно до 10 мг сложного эфира галловой кислоты. Некоторые другие иллюстративные варианты реализации содержат примерно 10-50 мг сложного эфира галловой кислоты. Другие иллюстративные варианты реализации содержат примерно от 50 примерно до 100 мг, примерно от 100 примерно до 150 мг, примерно от 150 примерно до 200 мг, примерно от 200 примерно до 250 мг, примерно от 250 примерно до 300 мг, примерно от 300 примерно до 350 мг или примерно от 350 примерно до 400 мг сложного эфира галловой кислоты. Предпочтительные иллюстративные варианты реализации содержат примерно 5-100 мг этилгаллата, изоамилгаллата, пропилгаллата или октилгаллата. Более предпочтительные иллюстративные варианты реализации содержат примерно 5-100 мг пропилгаллата. Наиболее предпочтительно, композиции настоящего изобретения вводят так, что суточное количество доз пропилгаллата не превышает допустимое суточное поступление («ADI») пропилгаллата, установленное совместным Экспертным комитетом ФАО/ВОЗ по пищевым добавкам (JECFA).
[00073] В некоторых вариантах реализации изобретения указанная композиция, содержащая экзогенный SAMe и сложный эфир галловой кислоты, содержит от 0,25 до 1 мас. %, от 1 до 2 мас. %, от 2 до 3 мас. %, от 3 до 4 мас. %, от 4 до 5 мас. %, от 5 до 6 мас. % или от 6 до 7 мас. % сложного эфира галловой кислоты, при этом массовый процент выражен относительно массы всей дозированной формы. В некоторых других иллюстративных вариантах реализации изобретения указанная композиция, содержащая SAMe и сложный эфир галловой кислоты, содержит от 7 до 10 мас. %, от 10 до 15 мас. %, от 15 до 20 мас. %, от 20 до 25 мас. %, от 25 до 30 мас. %, от 30 до 35 мас. %, от 35 до 40 мас. %, от 40 до 50 мас. %, от 50 до 60 мас. %, от 60 до 70 мас. %, от 70 до 80 мас. % или более 80 мас. % сложного эфира галловой кислоты.
[00074] Некоторые иллюстративные варианты реализации относятся к «низко дозированным» композициям SAMe. Благодаря увеличению всасывания экзогенного SAMe в присутствии сложного эфира галловой кислоты, вводимая суточная эффективная доза SAMe может быть значительно снижена за счет введения композиций с улучшенным всасыванием SAMe по сравнению с контрольными составами, которые не содержат по меньшей мере одного сложного эфира галловой кислоты. Указанные иллюстративные «низко дозированные» лекарства обеспечивают возможность уменьшения суточного количества пилюль, обеспечивая при этом такую же или улучшенную фармакокинетику по сравнению с имеющимися до настоящего времени продуктами SAMe, вводимыми два раза в сутки или чаще. Некоторые варианты реализации относятся к введению выбранной улучшенной дозы один раз в сутки. В некоторых вариантах реализации изобретения доза, вводимая один раз в сутки, может быть введена в виде однодозовой формы, примерами которой являются одна таблетка, капсула или капсуловидная таблетка. В других иллюстративных вариантах реализации изобретения однократная доза может быть введена в виде нескольких таблеток, капсул или капсуловидных таблеток, принимаемых одновременно. В некоторых вариантах реализации изобретения, например, доза, составляющая от 400 до 3600 мг иона SAMe в сутки, может быть разделена на две, три, четыре или более таблеток, капсул или капсуловидных таблеток примерно по 50-2000 мг, предпочтительно примерно по 100-1600 мг SAMe на единицу. В некоторых предпочтительных вариантах реализации изобретения суточная доза может составлять две, три или четыре единицы (например, таблетки, капсулы или капсуловидные таблетки) примерно по 100-800 мг иона SAMe на единицу. Подходящие схемы введения доз представляют собой: четыре единицы примерно по 50-400 мг иона SAMe на единицу, например, 50, 100, 150, 200, 250, 300, 350 или 400 мг иона SAMe на единицу; три единицы примерно по 50-1000 мг иона SAMe на единицу, например, 50, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950 или 1000 мг иона SAMe на единицу; две единицы примерно по 50-1600 мг иона SAMe на единицу, например, примерно 50, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1050, 1100, 1150, 1200, 1250, 1300, 1350, 1400, 1450, 1500, 1550 или 1600 мг иона SAMe на единицу.
[00075] Иллюстративные составы SAMe, содержащие сложный эфир галловой кислоты, могут быть получены с возможностью обеспечения более высокой биодоступности экзогенного SAMe. Составы с «высокой биодоступностью» представляют собой те, которые обеспечивают более высокую среднюю максимальную концентрацию SAMe в плазме крови (Cmax) и/или средние значения площади под кривой (AUC) SAMe в плазме по сравнению с такими же дозированными формами SAMe без сложного эфира галловой кислоты или по сравнению с другими составами SAMe, имеющимися в настоящее время в продаже. При введении доз составов с высокой биодоступностью выбранной группе субъектов они обеспечивают среднюю Сmах, составляющую по меньшей мере примерно от 100 до 130 нг/мл (и/или среднюю AUC, составляющую по меньшей мере 500 нг·ч/мл) на каждую 100 мг дозу иона SAMe. Так, в некоторых предпочтительных вариантах реализации изобретения составы SAMe, содержащие один или более сложных эфиров галловой кислоты, представлены в виде составов SAMe с высокой биодоступностью.
[00076] Так, в некоторых иллюстративных вариантах реализации изобретения при введении выбранной группе субъектов указанная композиция обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe (среднюю максимальную концентрацию в плазме), составляющую примерно 100 нг/мл на каждые 100 мг иона SAMe, по меньшей мере примерно 110 нг/мл на каждые 100 мг иона SAMe или по меньшей мере примерно 120 нг/мл на каждые 100 мг иона SAMe, или по меньшей мере примерно 130 нг/мл на каждые 100 мг иона SAMe, или по меньшей мере примерно 150 нг/мл на каждые 100 мг иона SAMe, или по меньшей мере примерно 175 нг/мл на каждые 100 мг иона SAMe, или по меньшей мере примерно 200 нг/мл на каждые 100 мг иона SAMe, или по меньшей мере примерно 225 нг/мл на каждые 100 мг иона SAMe, или по меньшей мере 250 нг/мл на каждые 100 мг иона SAMe, или по меньшей мере примерно 300 нг/мл на каждые 100 мг иона SAMe. В некоторых вариантах реализации изобретения при введении выбранной группе субъектов указанная композиция обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 12 нг/мл, по меньшей мере примерно 13 нг/мл, по меньшей мере примерно 15 нг/мл, по меньшей мере примерно 17,5 нг/мл, по меньшей мере примерно 20 нг/мл, по меньшей мере примерно 22,5 нг/мл, по меньшей мере примерно 25 нг/мл, по меньшей мере примерно 30 нг/мл на каждые 10 мг иона SAMe. В других вариантах реализации изобретения при введении выбранной группе субъектов указанная композиция обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 1,2 нг/мл, по меньшей мере примерно 1,3 нг/мл, по меньшей мере примерно 1,35 нг/мл, по меньшей мере примерно 1,5 нг/мл, по меньшей мере примерно 1,75 нг/мл, по меньшей мере примерно 2,0 нг/мл, по меньшей мере примерно 2,25 нг/мл, по меньшей мере примерно 2,5 нг/мл или по меньшей мере примерно 3,0 нг/мл на каждый 1 мг иона SAMe. В предпочтительных вариантах реализации изобретения сложный эфир галловой кислоты представляет собой пропилгаллат. Так, в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом при введении выбранной группе субъектов указанные композиции обеспечивают в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 1,2 нг/мл, по меньшей мере примерно 1,3 нг/мл, по меньшей мере примерно 1,35 нг/мл, по меньшей мере примерно 1,5 нг/мл, по меньшей мере примерно 1,75 нг/мл, по меньшей мере примерно 2,0 нг/мл, по меньшей мере примерно 2,25 нг/мл, по меньшей мере примерно 2,5 нг/мл или по меньшей мере примерно 3,0 нг/мл на каждый 1 мг иона SAMe.
[00077] В некоторых вариантах реализации изобретения при введении выбранной группе субъектов указанная композиция обеспечивает в указанной выбранной группе субъектов среднюю AUC, составляющую по меньшей мере примерно 800 нг·ч/мл на каждую 100 мг дозу иона SAMe или по меньшей мере примерно 850 нг ч/мл на каждую 100 мг дозу иона SAMe, или по меньшей мере примерно 900 нг·ч/мл на каждую 100 мг дозу иона SAMe, по меньшей мере примерно 950 нг·ч/мл на каждую 100 мг дозу иона SAMe или по меньшей мере примерно 1000 нг·ч/мл на каждую 100 мг дозу иона SAMe. В некоторых вариантах реализации изобретения при введении выбранной группе субъектов указанная композиция обеспечивает в указанной выбранной группе субъектов среднюю AUC SAMe, составляющую по меньшей мере примерно 80 нг·ч/мл, по меньшей мере примерно 85 нг·ч/мл, по меньшей мере примерно 90 нг·ч/мл, по меньшей мере примерно 95 нг·ч/мл или по меньшей мере примерно 100 нг·ч/мл на каждые 10 мг иона SAMe. В других вариантах реализации изобретения при введении выбранной группе субъектов указанная композиция обеспечивает в указанной выбранной группе субъектов среднюю AUC SAMe, составляющую по меньшей мере примерно 8 нг·ч/мл, по меньшей мере примерно 8,5 нг·ч/мл, по меньшей мере примерно 9 нг·ч/мл, по меньшей мере примерно 9,5 нг·ч/мл или по меньшей мере примерно 10 нг·ч/мл на каждый 1 мг иона SAMe. В предпочтительных вариантах реализации изобретения сложный эфир галловой кислоты представляет собой пропилгаллат. Так, в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, при этом при введении выбранной группе субъектов указанные композиции обеспечивают в указанной выбранной группе субъектов среднюю AUC SAMe, составляющую по меньшей мере примерно 8 нг·ч/мл, по меньшей мере примерно 8,5 нг·ч/мл, по меньшей мере примерно 9 нг·ч/мл, по меньшей мере примерно 9,5 нг·ч/мл или по меньшей мере примерно 10 нг·ч/мл на каждый 1 мг иона SAMe. В некоторых вариантах реализации изобретения доставленная доза иона SAMe составляет по меньшей мере 10 мг. В предпочтительных вариантах реализации изобретения доставленная доза иона SAMe составляет от 10 до 1600 мг.
[00078] В некоторых вариантах реализации изобретения термин «выбранная группа субъектов» представляет собой группу выбранных людей-субъектов. В некоторых вариантах реализации изобретения подходящая «выбранная группа субъектов» содержит шесть или более субъектов, принимавших дозу натощак. В некоторых вариантах реализации изобретения все члены «выбранной группы субъектов» имеют фармакокинетические параметры для SAMe, которые входят в статистически нормальные диапазоны (т.е. без выпадающих точек), и в такую группу не могут быть включены члены с нестандартной или необычной абсорбцией или метаболизмом SAMe. В некоторых вариантах реализации изобретения все члены «выбранной группы субъектов» являются субъектами мужского пола. В других вариантах реализации изобретения выбранная группа субъектов представляет собой группу выбранных субъектов, не являющихся человеком. Предпочтительно, субъекты, не являющиеся человеком, представляют собой основных мясомолочных животных, домашних животных или животных второстепенных видов. Подразумевается, что «домашние животные» включают таких животных, но не ограничиваясь ими, как лошади, собаки и коты, согласно рекомендациям FDA. В некоторых предпочтительных вариантах реализации изобретения при введении выбранной группе субъектов, не являющихся человеком, указанная композиция обеспечивает в указанной выбранной группе субъектов, не являющихся человеком, среднюю Cmax SAMe, составляющую по меньшей мере примерно 1000 нг/мл, по меньшей мере примерно 1500 нг/мл, по меньшей мере примерно 2000 нг/мл, по меньшей мере примерно 2500 нг/мл, по меньшей мере примерно 3000 нг/мл или по меньшей мере примерно 3500 нг/мл на каждые 100 мг иона SAMe. Так, в настоящем документе представлены композиции, содержащие SAMe и пропилгаллат, которые при введении указанных композиций выбранной группе субъектов, не являющихся человеком, обеспечивают в указанной выбранной группе субъектов, не являющихся человеком, среднюю Cmax SAMe, составляющую по меньшей мере примерно 1000 нг/мл, по меньшей мере примерно 1500 нг/мл, по меньшей мере примерно 2000 нг/мл, по меньшей мере примерно 2500 нг/мл, по меньшей мере примерно 3000 нг/мл или по меньшей мере примерно 3500 нг/мл на каждые 100 мг иона SAMe.
[00079] В других предпочтительных вариантах реализации изобретения при введении выбранной группе субъектов указанная композиция обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 120 нг/мл, и среднюю AUC, составляющую по меньшей мере примерно 800 нг·ч/мл на каждые 100 мг иона SAMe для доз иона SAMe, составляющих по меньшей мере 100 мг. В некоторых других предпочтительных вариантах реализации изобретения при введении выбранной группе субъектов указанная композиция обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 130 нг/мл, и среднюю AUC, составляющую по меньшей мере примерно 800 нг·ч/мл на каждые 100 мг иона SAMe для доз иона SAMe, составляющих по меньшей мере 100 мг. В других предпочтительных вариантах реализации изобретения при введении выбранной группе субъектов указанная композиция обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 12 нг/мл, и среднюю AUC, составляющую по меньшей мере примерно 80 нг·ч/мл на каждые 10 мг иона SAMe для доз иона SAMe, составляющих по меньшей мере 10 мг. В некоторых других предпочтительных вариантах реализации изобретения при введении выбранной группе субъектов указанная композиция обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 13 нг/мл, и среднюю AUC, составляющую по меньшей мере примерно 80 нг·ч/мл на каждые 10 мг иона SAMe для доз иона SAMe, составляющих по меньшей мере 10 мг. В других предпочтительных вариантах реализации изобретения при введении выбранной группе субъектов указанная композиция обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 1,2 нг/мл, и среднюю AUC, составляющую по меньшей мере примерно 8 нг·ч/мл на каждый 1 мг иона SAMe. В некоторых других предпочтительных вариантах реализации изобретения при введении выбранной группе субъектов указанная композиция обеспечивает в указанной выбранной группе субъектов среднюю Cmax SAMe, составляющую по меньшей мере примерно 1,3 нг/мл, и среднюю AUC, составляющую по меньшей мере примерно 8 нг·ч/мл на каждый 1 мг иона SAMe. В некоторых вариантах реализации изобретения доставленная доза иона SAMe составляет по меньшей мере 10 мг. В предпочтительных вариантах реализации изобретения доставленная доза иона SAMe составляет от 10 до 3600 мг.
[00080] Иллюстративные составы SAMe, содержащие сложный эфир галловой кислоты, также могут быть получены с возможностью обеспечения пролонгированного высвобождения SAMe из указанного состава. В заявке на патент США того же заявителя 2009/0088404, которая включена в настоящий документ посредством ссылки, представлены новые составы препаратов SAMe с пролонгированным высвобождением.
[00081] В некоторых предпочтительных вариантах реализации изобретения указанная композиция содержит систему для пероральной доставки или систему трансдермальной, или трансмукозальной доставки. В некоторых вариантах реализации изобретения указанная композиция содержит одну из капсул или не капсул (таких как таблетки, пасты, гранулы, капсуловидные таблетки, пастилки для рассасывания, пасты, пластыри и суппозитории). В некоторых вариантах реализации изобретения указанная композиция представляет собой диетическую или пищевую добавку. В некоторых вариантах реализации изобретения указанная композиция представляет собой продукт лечебного питания.
[00082] В некоторых иллюстративных вариантах реализации изобретения композиция представлена в дозированной форме, которая содержит функциональное покрытие, и указанное функциональное покрытие составляет от 1 до 20% относительно общей массы дозированной формы. В некоторых вариантах реализации изобретения функциональное покрытие состоит из одного или более отдельных оболочек или слоев, каждый из которых представляет собой энтеросолюбильное покрытие, покрытие для модифицированного высвобождения, зависящее от рН покрытие, защитное покрытие или иное, а также их комбинации. В предпочтительных вариантах реализации изобретения одно или более отдельных покрытий или слоев составляют от 1 до 5%, от 2 до 5%, от 3 до 5% или от 4 до 5% от общей массы дозированной формы. Наиболее предпочтительно, один или более дополнительных слоев покрытия представляют собой энтеросолюбильное покрытие, которое составляет 3-5% от общей массы единичной дозированной формы.
[00083] Предпочтительно, экзогенный SAMe и сложный эфир галловой кислоты вводят одновременно. Еще более предпочтительно, SAMe и сложный эфир галловой кислоты составлены в один препарат. В некоторых иллюстративных вариантах реализации изобретения композиция содержит SAMe и сложный эфир галловой кислоты, при этом указанный SAMe и сложный эфир галловой кислоты находятся в ядре препарата. В других вариантах реализации изобретения композиция содержит SAMe и сложный эфир галловой кислоты, при этом указанный сложный эфир галловой кислоты содержится в одном или более слоях покрытия препарата.
[00084] В настоящем документе представлен также способ улучшения фармакокинетических параметров экзогенного SAMe, введенного субъекту, включающий введение указанному субъекту непарентеральной композиции, содержащей по меньшей мере одну физиологически эффективную дозу SAMe в комбинации по меньшей мере с одним сложным эфиром галловой кислоты, выбранным для улучшения фармакокинетических параметров указанного SAMe в организме субъекта, указанные фармакокинетические параметры могут быть измерены в организме субъекта по одному из Cmax, AUC и их комбинациям в сравнении с контрольной группой, получавшей такой же или похожий препарат SAMe, не содержащий сложного эфира галловой кислоты. Для большей ясности все упоминания доз в настоящем патенте относятся к дозе, выраженной как доза иона SAMe. Фармакокинетические параметры, такие как средняя максимальная концентрация SAMe в плазме (Cmax), определяют при помощи биоаналитического способа с подходящей чувствительностью, специфичностью, надежностью, стабильностью и воспроизводимостью (например, проверенный способ, основанный на жидкостной тройной квадрупольной хроматомасс-спектрометрии, комбинированный с подходящим экстракционным методом отделения аналита от плазмы). Значения AUC предпочтительно рассчитывают для 0-24 часов, используя трапецеидальный метод, и не выполняют поправку на исходные значения, эндогенные уровни SAMe. Подходящая «выбранная группа субъектов» или «выбранная группа субъектов, не являющихся человеком» содержит шесть или более субъектов. В некоторых вариантах реализации изобретения указанной «выбранной группе субъектов» или «выбранной группе субъектов, не являющихся человеком», дозу вводят натощак (предпочтительно, все субъекты представляют собой субъектов мужского пола). Все члены «выбранной группы субъектов» или «выбранной группы субъектов, не являющихся человеком», имеют фармакокинетические параметры для SAMe, которые входят в статистические нормальные диапазоны (т.е. без выпадающих точек), и в такую группу не могут быть включены члены с нестандартной или необычной абсорбцией или метаболизмом SAMe, которые могут быть или не быть обусловлены другим генетическим профилем. Средние значения Cmax получают усреднением концентрации в каждой точке времени для всех членов группы субъектов. Применение способов in vivo обеспечивает превосходные значения Cmax и/или AUC по сравнению со стандартными дозированными формами SAMe.
[00085] Некоторые варианты реализации относятся также к композициям и способам, которые обеспечивают более низкую эффективную дозу и/или сниженное отклонение фармакокинетических параметров (таких как значения Tmax со сниженным отклонением) по сравнению с обычными препаратами экзогенного SAMe или другими препаратами SAMe, которые не содержат сложного эфира галловой кислоты («контрольный SAMe»). «Более низкая эффективная доза» или «уменьшенная эффективная доза» означает физиологически приемлемую дозу экзогенного SAMe, которая обеспечивает фармакокинетические параметры, которые эквивалентны (или лучше) значительно более высокой дозе другого препарата SAMe, такие как параметры, которые получают при введении более высокой дозы одного или более имеющихся в продаже или «контрольных» препаратов SAMe. Составы, такие как те, которые представлены в настоящем документе, которые демонстрируют такие же значения Cmax и AUC при более низких дозах SAMe, имеют много преимуществ, включая меньшее количество принимаемых единиц препарата, увеличенную скорость начала действия и/или потенциально улучшенную переносимость и/или соблюдение предписанного режима терапии.
[00086] Дополнительные варианты реализации относятся также к композициям и способам, которые обеспечивают улучшенный профиль побочных эффектов по сравнению с обычными препаратами SAMe. Профиль «улучшенного побочного эффекта» или «сниженного побочного эффекта», или «благоприятного побочного эффекта» означает улучшенную переносимость введения экзогенного SAMe, такую как меньшая частота и/или уменьшенная интенсивность побочных эффектов, связанных с введением добавки SAMe. Авторами настоящего изобретения дополнительно подразумевается, что любые отрицательные побочные эффекты, связанные с введением добавки иона экзогенного SAMe, могут быть приписаны противоиону(-ам) SAMe, содержащемуся в солях SAMe. При снижении суточной дозы иона экзогенного SAMe, необходимой для достижения положительного терапевтического результата, соответствующее существенное снижение противоиона(-ов) SAMe может способствовать улучшению профиля побочных эффектов.
[00087] Некоторые иллюстративные варианты реализации относятся также к режиму дозирования экзогенного SAMe один раз в сутки или QD введению, которое приводит к улучшенным фармакокинетическим профилям SAMe по сравнению со стандартным введением доз два раза в сутки или чаще. В некоторых вариантах реализации изобретения влияние введения дозы один раз в сутки предположительно приводит к наиболее подходящим измерениям фармакокинетических параметров, в частности, Cmax и Tmax. Менее изменчивые фармакокинетические профили, которые обусловлены введением доз составов, представленных в настоящем документе, один раз в сутки обеспечивают возможность более точного дозирования и вмешательства лечащего врача, а также улучшенные профили побочных эффектов для субъектов. Побочные эффекты включают, например, тошноту или раздражение желудка, расстройство желудочно-кишечного тракта, бессонницу, головные боли, раздражение или возможно учащенное сердцебиение.
[00088] В некоторых вариантах реализации изобретения составы, которые демонстрируют превосходные фармакокинетические профили по сравнению с обычными дозированными формами SAMe, обеспечивают улучшенную скорость начала действия SAMe, что может приводить к улучшенным терапевтическим результатам. Улучшенная скорость начала действия означает скорость, с которой субъект испытывает положительный результат. Например, при депрессии начало действия антидепрессанта обычно составляет 4-6 недель. Препараты SAMe с улучшенными фармакокинетическими профилями могут быть связаны с соответствующим улучшением терапевтического эффекта (например, антидепрессантного эффекта) за меньший период времени, чем обычные или ожидаемые 4-6 недель.
[00089] Другие иллюстративные варианты реализации относятся к способам лечения заболевания или расстройства у субъекта и/или улучшения статуса питания у субъекта, включающим введение указанному субъекту композиций, содержащих физиологически эффективные дозы экзогенного SAMe в комбинации с одним или более сложными эфирами галловой кислоты, улучшая посредством этого фармакокинетический профиль SAMe. Улучшенные фармакокинетические профили определяют, например, по увеличению значений Cmax и/или AUC; или альтернативно по снижению эффективной дозы; или по фармакокинетическим параметрам с уменьшенным отклонением. Достижение одного или более из этих критериев представляет собой улучшение фармакокинетического профиля SAMe. Предпочтительно, сложный эфир галловой кислоты представляет собой пропилгаллат.
[00090] В некоторых вариантах реализации изобретения представлен способ лечения или предупреждения болезненного состояния или расстройства, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества композиции, описанной в настоящем документе. В некоторых вариантах реализации изобретения представлен способ лечения у пациента заболевания или расстройства, выбранного из группы, состоящей из душевных или психиатрических расстройств, заболеваний и расстройств нервной системы, неврологических заболеваний и расстройств, состояний, связанных с повреждением центральной нервной системы, заболеваний и расстройств печени, рака, заболеваний и расстройств сустава, воспалительных заболеваний и расстройств, аутоиммунных заболеваний и расстройств, дегенеративных заболеваний и расстройств, болезней и расстройств мягких тканей, болевых заболеваний и расстройств, сердечно-сосудистых заболеваний и расстройств, связанных с гипер-гомоцистеинемией и гипо-гомоцистеинемией, генетических расстройств, связанных с гипер-метилированием и гипо-метилированием, желудочно-кишечных заболеваний и расстройств, атеросклероза, болезни Леши-Нихана и расстройств, полностью или частично вызванных окислительным или свободно-радикальным повреждением, включающий введение пациенту, нуждающемуся в этом, композиции, описанной в настоящем документе. В некоторых вариантах реализации изобретения субъектом является человек.
ВСПОМОГАТЕЛЬНЫЕ ВЕЩЕСТВА И ТЕХНОЛОГИЧЕСКИЕ ПАРАМЕТРЫ, ПОДХОДЯЩИЕ ДЛЯ ПРИМЕНЕНИЯ СОГЛАСНО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
[00091] Характеристики продукта или дозированной формы, которые являются результатом способов и/или параметров переработки для получения препаратов, таких как таблетки, включают, но не ограничиваясь ими, твердость, плотность, содержание воды, истираемость, распадаемость, профиль(-и) растворения, форму, размер, массу, однородность и состав. Эти характеристики продукта можно изменять многими способами и влиять на конечные in vitro и/или in vivo показатели составов. Например, таблетки, полученные в процессе прессования или формования, могут обладать разной степенью плотности или твердости в зависимости от технологических параметров, при которых они были получены. Характеристики продукта или дозированной формы могут быть следствием выбора вспомогательного вещества, состава вспомогательного вещества, используемых способов производства или их комбинации. Комбинация вспомогательных веществ, а также характеристики продукта (включая способы переработки или технологические параметры) готовой дозированной формы в конечном итоге определяют фармакокинетический профиль активного ингредиента in vivo. Препараты SAMe согласно настоящему изобретению могут быть переработаны или изготовлены в определенных условиях, таких как, например, способы смешивания (включая размер сита, скорость вращения и измельчение), время высушивания, условия прессования, параметры окружающей среды (например, температура и влажность) и их комбинации. Для количественного сравнения одной таблетки с другой обычно измеряют несколько из этих характеристик продукта или дозированной формы. Это также необходимо при попытке повторного получения нескольких партий.
[00092] Вспомогательные вещества обычно группируют по их функции на такие вещества, как: дезинтеграторы, разбавители, связующие вещества, смазывающие вещества, скользящие вещества, покрытия, красители или ароматизаторы, и одно и то же вспомогательное вещество может быть использовано более чем для одной функции в данном пероральном препарате. Общепринятые фармацевтически приемлемые вспомогательные вещества включают воду, стеарат магния, крахмал, лактозу, микрокристаллическую целлюлозу, стеариновую кислоту, сахарозу, тальк, диоксид кремния, желатин, гуммиарабик и двухосновной фосфат кальция (Baldrick, Р. (2000) Regul. Toxicol. Pharmacol. Oct. 32(2):210). Вспомогательные вещества смешивают с активными ингредиентами, например, для улучшения внешнего вида, увеличения растворимости, облегчения переработки или облегчения расщепления после введения, но в данной области техники известны многие другие функции вспомогательных веществ, которые могут быть использованы в пероральных дозированных формах SAMe. Классы вспомогательных веществ, которые часто используются и подходят для применения в соответствии с настоящим изобретением, включают, но не ограничиваясь ими, природные, модифицированные природные или синтетические моно-, олиго- или полисахариды, при этом олиго- и полисахариды могут быть или не быть физически или химически поперечно-сшитыми; природные, модифицированные природные или синтетические моно-, олиго- и полипептиды или белки, при этом олиго- и полипептиды и белки могут быть или не быть физически или химически поперечно-сшитыми; синтетические олигомеры и полимеры, которые могут быть или не быть физически или химически поперечно-сшитыми; мономерные, гидрофобные, гидрофильные или амфотерные органические молекулы; неорганические соли или металлы; и их комбинации.
Дезингтеграторы
[00093] Дезинтеграторы добавляют к непарентеральным составам для инициации разрушения продукта или дозированной формы (т.е. таблетки или капсулы) при ее соприкосновении с водной жидкостью для облегчения высвобождения лекарства. Помимо их добавления в качестве дезинтеграторов, они служат для увеличения площади поверхности фрагментов продукта и для преодоления когезивных сил, которые удерживают вместе эти частицы в препарате. Это происходит за счет ускорения увлажнения и набухания такой дозированной формы, в результате чего она разрушается в желудочно-кишечном тракте. Некоторые связующие вещества, такие как крахмал и целлюлоза, также действуют в качестве дезинтеграторов. Другие дезинтеграторы представляют собой глины, производные целлюлозы, альгины, камеди и поперечно-сшитые полимеры. Часто используют другую группу дезинтеграторов, называемых «супер-дезинтеграторы». Такие материалы эффективны при низких (2-5%) концентрациях. «Супер-дезинтеграторы», которые могут быть пригодны для применения в соответствии с настоящим изобретением, включают, но не ограничиваются ими, крахмалгликолят натрия (SSG), кроскармеллозу натрия или кросповидон.
[00094] В некоторых вариантах реализации изобретения композиции, представленные в настоящем документе, содержат SAMe и один или более сложных эфиров галловой кислоты, а также один или более дезинтеграторов или «супердезинтеграторов», которые улучшают фармакокинетический профиль SAMe in vivo.
Связующие вещества
[00095] Связующий материал, который удерживает вместе массу продукта и способствует сохранению продукта в заданной форме, известен как «связующее вещество» или «гранулятор». Примеры связующих веществ, подходящих для применения в соответствии с настоящим изобретении, представляют собой, но не ограничиваются ими, сахара, желатин, камеди, микрокристаллическую целлюлозу и модифицированные целлюлозы, воски или синтетические полимеры, такие как полиэтиленгликоль или поливинилпирролидон. Некоторые варианты реализации могут включать композиции с улучшенной фармакокинетикой, содержащие SAMe и один или более сложных эфиров галловой кислоты, а также одно или более связующих веществ.
Смазывающие вещества
[00096] Дополнительные вспомогательные вещества, часто используемые в готовых препаратах, представляют собой смазывающие вещества. Они представляют собой вещества, которые облегчают процесс производства, поскольку они способствуют минимизации комкования продуктов, а также облегчают их высвобождение из производственного оборудования. Наиболее распространенное «смазывающее вещество», используемое для пероральных составов, представляет собой стеарат магния. Однако другие широко распространенные смазывающие вещества для таких продуктов включают тальк, стеарат кальция, стеариновую кислоту (стеарин), гидрогенированные растительные масла, бензоат натрия, лейцин, карбовакс 4000 и стеарилфумарат натрия, которые все могут быть пригодны для применения в соответствии с настоящим изобретением.
Дополнительные иллюстративные варианты реализации относятся также к композициям с улучшенной фармакокинетикой, содержащим SAMe и один или более сложных эфиров галловой кислоты, а также одно или более смазывающих веществ.
Скользящие добавки
[00097] Скользящие добавки, упоминаемые также как «добавки для повышения текучести», способствуют сохранению сыпучести порошка, из которого получают готовые продукты, при их изготовлении, препятствуя образованию комков. Примеры широко распространенных скользящих добавок, которые могут быть пригодны для применения в соответствии с настоящим изобретением, включают коллоидный диоксид кремния, тальк, силикат кальция и силикат магния. Дополнительные варианты реализации относятся к композициям с улучшенной фармакокинетикой, содержащим SAMe и один или более сложных эфиров галловой кислоты, а также одну или более скользящих добавок.
[00098] Пригодность конкретного вспомогательного вещества, такого как, например, «материал матрицы», «дезинтегратор», «супер-дезинтегратор», «связующее вещество», «смазывающее вещество», «скользящая добавка» или «покрытие», может быть определена анализом in vivo фармакокинетики составов, содержащих указанное вспомогательное вещество, сложный эфир галловой кислоты и SAMe. Альтернативно, для предварительной проверки вспомогательных веществ и получения в конечном итоге данных для предсказания in vivo фармакокинетических профилей могут быть использованы in vitro анализы одного или более вспомогательных веществ с использованием серии стандартных in vitro приемов, общеизвестных в данной области техники. Кроме того, применение существующих в данной области техники эталонов также может обеспечивать информацию о потенциально подходящих, приемлемых в фармацевтическом или пищевом отношении вспомогательных веществах (таких как «материал матрицы», «дезинтегратор», «связующее вещество», «смазывающее вещество», «скользящая добавка» или «покрытие»), для применения в соответствии с настоящим изобретением. Предпочтительно, in vitro анализы одного или более вспомогательных веществ с применением испытаний растворения, выполняемых с буферным рН 6,8 или менее, могут быть использованы для предварительной проверки вспомогательных веществ и получения в конечном итоге данных для предсказания in vivo фармакокинетических профилей.
Способы и параметры переработки
[00099] Способы и/или параметры переработки, которые могут быть модифицированы для улучшения фармакокинетического профиля и/или для изменения профиля растворения составов, содержащих SAMe и сложный эфир галловой кислоты, включают, но не ограничиваются ими: относительную влажность, температуру, время высушивания и другие параметры окружающей среды.
[000100] Представленные варианты реализации дополнительно описаны с помощью следующих примеров. Эти примеры, иллюстрирующие некоторые конкретные аспекты представленных вариантов реализации, не следует толковать как ограничение или определение границ объема описанных вариантов реализации.
ПРИМЕРЫ
ПРИМЕР 1
Пропилгаллат существенно увеличивает уровни экзогенно введенного SAMe в плазме.
[000101] Таблетки, содержащие SAMe и различные алкилгаллаты с разными химическими структурами, получили смешиванием SAMe с метилгаллатом, этилгаллатом, бутилгаллатом, изобутилгаллатом, изоамилгаллатом или октилгаллатом (см. структуры, представленные ниже). Затем таблетки вводили собакам породы бигль и с течением времени брали образцы крови. Анализ концентраций SAMe в плазме использовали для сравнения влияния этих сложных эфиров галловой кислоты на всасывание перорально введенного SAMe в крови.

[000102] Таблетки получали смешиванием 400 мг иона SAMe (из дисульфат-тозилата SAMe) с 25 мг сложного эфира галловой кислоты вместе со вспомогательными веществами (микрокристаллической целлюлозой, крахмалгликолятом натрия, диоксидом кремния и стеаратом магния) с получением ~1025 мг таблетки. Затем на таблетки наносили коммерчески доступное защитное покрытие, а затем коммерчески доступное энтеросолюбильное покрытие перед проведением испытания растворения. Для каждой группы таблеток выполняли подробный анализ растворения в соответствии со стандартами Фармакопеи США при рН 6,8 или 6,0, чтобы удостовериться, что перед in vivo фармакокинетическим анализом было достигнуто надлежащее растворение.
[000103] Для in vivo испытаний использовали самцов собак породы бигль (7-10 кг) в состоянии натощак. Протокол испытания был одобрен Институциональным комитетом по содержанию животных, и всех животных содержали в соответствии с правилами, предложенными Министерством сельского хозяйства Канады и Министерством сельского хозяйства США. Каждой группе (состоящей из 6 собак) перорально вводили одну таблетку с энтеросолюбильным покрытием в состоянии натощак, затем перорально 5 мл очищенной воды через шприц для облегчения проглатывания. Образцы крови (по 2 мл каждый) для анализа SAMe отбирали из яремной вены, используя следующие временные точки: до введения дозы, через 20 и 40 минут, 1, 1,5, 2, 3, 4, 6 и 8 часов после введения дозы. Образцы крови, полученные венепункцией, собирали в пробирки, содержащие антикоагулянт K2-ЭДТА, и хранили на влажном льду до начала переработки. После сбора образцы центрифугировали (при 4°С) для отделения фракции плазмы от кровяных клеток. Полученную фракцию плазмы восстанавливали и хранили в замороженном состоянии (при -80°С) в полипропиленовых пробирках до начала биоаналитического анализа.
[000104] Концентрацию SAMe в плазме собак определяли при помощи общепринятого метода жидкостной хроматографии с тандемной масс-спектрометрией (ЖХ/МС/МС). В этом методе используют жидкостную хроматографию с разбавлением стабильным изотопом в сочетании с тандемной масс-спектрометрией с ионизацией электрораспылением (ЖХ-ИЭР-МС/МС) для определения SAMe и SAH в плазме. Этот анализ, использованный для расчета основных фармакокинетических параметров (Cmax, Tmax и AUC), выполняли при помощи программы GraphPad Prism® 5.
[000105] В представленном исследовании испытывали десять различных составов. 400 мг SAMe, смешанного с 25 мг пропилгаллата, сравнивали: с контрольными таблетками SAMe (т.е. без пропилгаллата); с таблетками SAMe, которые вводили вместе с отдельными 25 мг таблетками пропилгаллата; с имеющимся в продаже продуктом SAMe (400 мг); или с 400 мг SAMe с 25 мг метилгаллата, этилгаллата, бутилгаллата, изобутилгаллата, изоамилгаллата или октилгаллата.
[000106] Диаграмма на Фигуре 1 наглядно показывает превосходное сочетание SAMe и этилгаллата, пропилгаллата, изоамилгаллата или октилгаллата. Максимальная концентрация SAMe для этих 10 составов в первую очередь определяет, что SAMe, смешанный с этилгаллатом, пропилгаллатом, изоамилгаллатом или октилгаллатом, обладает превосходным всасыванием в плазме по сравнению с другими испытанными составами, содержащими сложный эфир галловой кислоты. Неожиданно было обнаружено, что введение SAMe с алкилгаллатами, алкильный фрагмент которых отличается лишь на один атом углерода (например, бутилгаллат), не приводит к получению фармакокинетики, близкой к значениям составов, содержащих SAMe и пропилгаллат.
ПРИМЕР 2
Уровни SAMe в плазме биглей в присутствии молекул, родственных галлату
[000107] Выполняли также in vivo эксперименты, описанные в Примере 1, используя композиции SAMe, содержащие бутилированный гидрокситолуол (ВНТ), пропилпарабен или галловую кислоту, которые представляют собой общеизвестные агенты, структурно родственные пропилгаллату. ВНТ, пропилпарабен и пропилгаллат представляют собой пищевые антиоксиданты, которые часто используют в комбинации. Эти агенты структурно похожи, как можно видеть ниже:

[000108] Получали капсулы, содержащие 100 мг бутилированного гидрокситолуола, пропилпарабена, галловой кислоты или пропилгаллата, используя желатиновые капсулы размера №000, каждая из которых содержала 100 мг иона SAMe. Капсулы содержали также дополнительные вспомогательные вещества (микрокристаллическую целлюлозу, крахмалгликолят натрия, коллоидный диоксид кремния и стеарат магния). Капсулы заполняли вручную и в некоторых вариантах реализации изобретения на капсулы наносили слой коммерчески доступного защитного покрытия, используя аппарат для нанесения покрытий в псевдоожиженном слое.
[000109] Собакам биглей вводили одну перорально доставляемую дозу, как описано выше. Контрольные капсулы SAMe содержали 100 мг SAMe и не содержали пропилгаллата.
[000110] Диаграммы на Фигурах 2А и 2В иллюстрируют Cmax и AUC SAMe в плазме, соответственно, для каждого состава, и наглядно демонстрируют превосходную и неожиданную способность пропилгаллата увеличивать всасывание SAMe в кровь по сравнению со структурно похожим бутилированным гидрокситолуолом (ВНТ), пропилпарабеном и галловой кислотой.
ПРИМЕР 3
Влияние дозы пропилгаллата на всасывание SAMe при переносе через клетки Сасо-2
[000111] Проводили in vitro испытания проницаемости SAMe через монослои клеток Сасо-2, обработанные пропилгаллатом, для определения уровней пропилгаллата, которые увеличивают количество SAMe, абсорбированного клетками Сасо-2, по сравнению с не обработанными монослоями клеток Сасо-2. Клеточную линию Сасо-2 получили из карциномы толстой и прямой кишок человека, которую широко используют для in vitro моделей клеточных культур для испытаний абсорбции лекарства в желудочно-кишечном тракте (Stewart, В., (1995) Pharm. Res. 12:693). В этих моделях чистые клеточные линии выращивали на полупроницаемой мембране. Лекарственные смеси помещали на апикальную или базолатеральную сторону монослоя клеток и определяли перенос путем измерения концентраций лекарства на другой стороне мембраны.
[000112] Клеточную линию Сасо-2, использованную в этом примере, получали от компании American Type Culture Collection (АТСС). Клетки Сасо-2 выращивали в модифицированной по способу Дульбекко среде Игла (DMEM, Gibco) с добавлением 20% FBS (эмбриональной бычьей сыворотки, Gibco), 100 мкМ заменимых аминокислот (NEAA, Gibco) и 2 мМ L-глутамина (Gibco). Использовали набор системы для анализа Сасо-2 BIOCOAT® HTS производства Beckton Diskinson, в результате чего получили плотность высевания 6,6×10 клеток/см2 (BIOCOAT является зарегистрированной торговой маркой компании Collaborative Biomedical Products, Inc., Бедфорд, штат Массачусетс, США). Клетки, использованные в испытаниях переноса, выращивали в течение 3 дней до начала экспериментов. Условиями выращивания были 37°С в атмосфере 5% СО2 и 100% влажности.
[000113] Для оценки проницаемости через монослои клеток Сасо-2 использовали транспортную среду, которая представляла собой буферный солевой раствор Хенкса (HBSS; приобрели у Gibco), содержащий D-глюкозу, с рН, доведенным при помощи HEPES до 7,4. Добавляли 2 мМ водный раствор дисульфат-тозилата SAMe на апикальную или базолатеральную сторону по инструкциям производителя для набора Сасо-2. Образцы измеряли после 120-минутной инкубации при помощи жидкостной хроматомасс-спектрометрии (ЖХ/МС). Целостность монослоев контролировали при помощи анализа с красителем Lucifer yellow.
[000114] Проницаемость (Рэфф) SAMe рассчитывали по следующей формуле:
[000115] Где dQ/dt представляет собой скорость проникновения, Co представляет собой исходную концентрацию исследуемого агента, а А представляет собой площадь монослоя.
[000116] Абсорбцию SAMe в клетках Сасо-2 измеряли для двух широко распространенных солей SAMe. Абсорбция была низкой для обеих солей SAMe (дисульфат-тозилат SAMe; 1,4-бутандисульфонат SAMe), что демонстрируется низкими коэффициентами эффективной проницаемости (Рэфф=0,41×10-6 и 0,50×10-6 см·с-1, соответственно, в направлении от апикальной к базолатеральной и от базолатеральной к апикальной поверхности, соответственно, для дисульфат-тозилата SAMe; и Рэфф=0,50×10-6 и 0,60×10-6 см·с-1, соответственно, в направлении от апикальной к базолатеральной и от базолатеральной к апикальной поверхности, для 1,4-бутандисульфоната SAMe. Результаты, представленные в Таблице 1, демонстрируют абсорбцию дисульфат-тозилата SAMe в присутствии различных концентраций пропилгаллата.

[000117] Как показано в Таблице 1, пропилгаллат увеличивает перенос SAMe в клетках Сасо-2 с хорошим восстановлением TEER при повышенной концентрации.
ПРИМЕР 4
Влияние пропилгаллата на перенос SAMe с использованием модели РАМРА
[000118] Используя модель РАМРА (параллельный анализ проницаемости искусственных мембран), измеряли проницаемость SAMe в присутствии и в отсутствие пропилгаллата. Модели РАМРА разработаны так, что они демонстрируют высокую степень корреляции с проницаемостью через различные барьеры, включая желудочно-кишечный тракт. Они имеют большое значение, поскольку такие мембраны не содержат плотных сочленений, в отличие от монослоя клеток Сасо-2 и, следовательно, не допускают параклеточного транспорта.
[000119] Приемы РАМРА использовали для определения проницаемости веществ из донорного отдела, через пропитанную липидом искусственную мембрану в акцепторный отдел. Для донора использовали многолуночный микротитровальный планшет, а мембрану/акцепторный отдел расположили сверху. В начале испытания дисульфат-тозилат SAMe (с различными концентрациями пропилгаллата или без него, как показано в Таблице 2) добавляли в донорный отдел, а акцепторный отдел оставался без лекарства. После периода инкубации отделы разделяли и измеряли количество SAMe в каждом отделе. Материальный баланс позволял рассчитать SAMe, оставшийся в мембране.
[000120] Как видно из Таблицы 2, SAMe по сути не переносится через мембрану РАМРА, и наличие пропилгаллата в концентрации 2,0 мМ не оказывает влияния на транспорт SAMe. Это противоположно влиянию пропилгаллата на SAMe с использованием модели транспорта с клетками Сасо-2.
[000121] Искусственная мембрана РАМРА представляет собой неклеточный липидный двойной слой, выполненный как барьер, а эксперименты с РАМРА позволяют измерять пассивный перенос молекул через этот барьер, с одной стороны на другую. Тот факт, что пропилгаллат не усиливает проницаемость SAMe через мембрану РАМРА, означает, что механизм такого усиления не обусловлен пассивным внутриклеточным транспортом. Следовательно, более вероятно, что этот механизм затрагивает клеточные компоненты, которых нет в модели РАМРА, такие как плотные сочленения или активный транспорт. Участие активного переноса за счет клеточных транспортеров не было подтверждено в модели на клетках Сасо-2, которая показала, что проницаемость SAMe с апикальной на базолатеральную сторону была такой же, что и проницаемость с базолатеральной на апикальную сторону (см. Таблицу 1). Поскольку экспрессия транспортера эпителиальных клеток, как правило, локализована в одном или другом направлении, то недостаток благоприятного направления для проницаемости действует против внутриклеточного активного переноса. Однако эти данные согласуются с параклеточным (за счет плотных сочленений) механизмом переноса SAMe.
[000122] Тот факт, что пропилгаллат не усиливает перенос других лекарств, для которых известен параклеточный перенос (например, метформин или ранитидин - см. Пример 5, представленный ниже), подразумевает, что взаимодействие пропилгаллата и SAMe является специфическим. Не ограничиваясь какой-либо конкретной теорией, на основании этих данных пропилгаллат усиливает абсорбцию SAMe специфическим образом, при этом способ переноса затрагивает плотные сочленения.

ПРИМЕР 5
Влияние пропилгаллата на in vitro перенос ранитидина и метформина
[000123] Такие же эксперименты, как описаны в Примере 3, выполняли также с использованием пропилгаллата и либо ранитидина, либо метформина, которые обладают известным параклеточным механизмом транспорта в желудочно-кишечном тракте (Bourdet and Thakker, Pharm, Res., июнь (2006); 23(6): 1165-77, и Proctor, W.R. er al., Drug. Metab. Dispos., Август (2008); 36(8): 1650-8).
[000124] Для проницаемости через монослои клеток Сасо-2 использовали такую же транспортную среду, буферный солевой раствор Хенкса (HBSS; приобрели у Gibco), содержащий D-глюкозу, с рН, доведенным при помощи HEPES до 7,4. Водные растворы ранитидина или метформина (2 мМ), содержащие 0 мМ, 0,2 мМ или 2,0 мМ пропилгаллата, добавляли на апикальную или базолатеральную сторону в соответствии с инструкцией производителя для набора Сасо-2. Образцы измеряли через 120 минут инкубации, используя жидкостную хроматомасс-спектрометрию (ЖХ/МС). Целостность монослоев контролировали при помощи анализа с красителем Lucifer Yellow.
[000125] Как показано в Таблице 3, наличие пропилгаллата не привело к увеличению скорости транспорта через монослой клеток Сасо-2 ни для ранитидина, ни для метформина, как это происходило с тозилатом SAMe.

ПРИМЕР 6
Уровни SAMe в плазме биглей увеличиваются в присутствии различных доз пропилгаллата
[000126] Таблетки, содержащие SAMe и различные количества пропилгаллата, получили смешиванием гранул дисульфат-тозилата S-аденозил-L-метионина (эквивалентно 400 мг ионов SAMe) с различными количествами пропилгаллата, перечисленными в Таблице 4. Каждую смесь спрессовали в таблетку и нанесли покрытие, затем выполняли анализ профиля растворения и in vivo фармакокинетический анализ с использованием собак породы бигль.
[000127] Анализ растворения выполняли в соответствии со стандартами Фармакопеи США с буферами при рН 6,0 или 6,8, чтобы удостовериться в надлежащем растворении таблеток перед их введением собакам.
[000128] Как правило, использовали следующий способ испытания растворения:
- Прибор USP II, эксплуатируемый при 100 об/мин.
- Жидкая фаза: 1 л USP искусственного желудочного сока без фермента, рН 1,2,37°С.
- Водная буферная фаза - 1 л USP искусственного кишечного сока без фермента, рН 6,8 или рН 6,0, 37°С.
- Таблетки подвергали действию кислой фазы в течение двух часов, затем переносили в буферную фазу.
- Аликвоты брали после воздействия кислой фазы в течение 2 часов, затем в заданные интервалы из буферной фазы.
- Образцы разбавляли 1→10 при помощи 10н. HCl.
- Концентрацию лекарства определяли спектрофотометрически при 258 мм.
[000129] Для in vivo испытаний использовали самцов собак породы бигль (7-10 кг) в состоянии натощак, как описано выше. Каждой группе (6 собак для SAMe/пропилгаллата и 6 собак для контрольного SAMe без пропилгаллата) перорально вводили одну таблетку с энтеросолюбильным покрытием, в состоянии натощак, затем перорально 5 мл очищенной воды через шприц для облегчения проглатывания. Фармакокинетические образцы крови (по 2 мл каждый) для анализа SAMe отбирали из яремной вены, используя следующие временные точки: до введения дозы, через 20 и 40 минут, 1, 1,5, 2, 3, 4, 6 и 8 часов после введения дозы. Образцы крови, полученные венепункцией, собирали в пробирки, содержащие антикоагулянт K2-ЭДТА, и хранили на влажном льду до начала переработки. После сбора образцы центрифугировали (при 4°С) для отделения фракции плазмы от кровяных клеток. Полученную фракцию плазмы восстанавливали и хранили в замороженном состоянии (при -80°С) в полипропиленовых пробирках до начала биоаналитического анализа.
[000130] Концентрацию SAMe в плазме собак определяли при помощи общепринятого метода ЖХ/МС/МС. В этом методе используют жидкостную хроматографию с разбавлением стабильным изотопом в сочетании с тандемной масс-спектрометрией с ионизацией электрораспылением (ЖХ-ИЭР-МС/МС) для определения SAMe и SAH в плазме. Этот анализ, использованный для расчета основных фармакокинетических параметров (Cmax, Tmax и AUC), выполняли при помощи программы GraphPad Prism® 5.
[000131] Как видно из Таблицы 4, уровни максимальной концентрации SAMe в плазме (Cmax) и AUC были существенно выше в составах, содержащих все концентрации пропилгаллата, по сравнению с контрольными таблетками, содержащими только соль SAMe. Неожиданно было обнаружено, что уровни концентрации SAMe в плазме также существенно увеличиваются при смешивании 400 мг иона SAMe лишь с 6,25 мг пропилгаллата, где массовое отношение пропилгаллата к SAMe составляет 1:64.

[000132] Эти результаты демонстрируют неожиданное и резкое увеличение всасывания SAMe в присутствии минимальных количеств пропилгаллата.
ПРИМЕР 7
Пропилгаллат существенно увеличивает концентрации экзогенного SAMe в плазме человека.
[000133] Выполняли клинические испытания I фазы, используя таблетки, содержащие SAMe и пропилгаллат. Повышение дозы SAMe с 400 мг до 1600 мг выполняли на здоровых добровольцах. Эти препараты SAMe и пропилгаллата сравнивали с одним из наиболее распространенных на рынке коммерчески доступных продуктов SAMe, который всесторонне исследован в других клинических испытаниях SAMe.
[000134] 1025 мг таблетки получили смешиванием 400 мг иона SAMe с 25 мг пропилгаллата вместе со вспомогательными веществами (микрокристаллической целлюлозой, крахмалгликолятом натрия, диоксидом кремния и стеаратом магния) для получения 1025 мг. На таблетки наносили защитное покрытие, а затем энтеросолюбильное покрытие, затем проводили испытание растворения и вводили субъектам-людям, иллюстративный состав упоминается в настоящем документе как «препарат MSI». Эти таблетки, содержащие SAMe и пропилгаллат, показали значительно более высокие значения Сmах и AUC по сравнению с коммерческим продуктом.
[000135] В Таблице 5 показаны значения Cmax в плазме и AUC для пациентов, принимавших 400 мг, 800 мг или 1600 мг препарата MSI.

1. С использованием 6 поддающихся оценке субъектов.
2. С использованием 7 поддающихся оценке субъектов.
[000136] Значения Cmax в плазме человека и AUC для 400, 800 и 1600 мг доз препарата MSI наносили на график в сравнении с 800 и 1600 мг дозой имеющегося в продаже продукта SAMe, который не содержит пропилгаллата. Как показано на Фигурах 3А и 3В, при 400 мг и 1600 мг дозах значения Сmах и AUC препарата MSI были существенно выше, чем эти значения имеющегося в продаже продукта SAMe. Кроме того, доза 400 мг препарата MSI (содержащего SAMe и пропилгаллат) обеспечивала результаты, сравнимые с 1600 мг дозой коммерческого продукта. Следовательно, необходимы более низкие дозы препаратов SAMe и пропилгаллата для достижения фармакокинетики, эквивалентной имеющимся в продаже продуктам SAMe.
[000137] Эти результаты дополнительно демонстрируют неожиданные и значительные преимущества применения еще более низких доз пропилгаллата в препаратах SAMe.
ПРИМЕР 8
Оценка тендерного эффекта композиций SAMe
[000138] Существует несколько эффектов от введения экзогенного SAMe, и многие из них, как известно, зависят от пола. Существуют различные другие теории для объяснения тендерного различия фармакокинетики экзогенного SAMe, включая, в целом, более крупный размер тела и больший объем крови у субъектов мужского пола; более высокий индекс массы тела (BMI) и различные состояния метилирования между двумя полами, а также наличие некоторых генетических полиморфизмов.
[000139] Для оценки влияния пола на препарат MSI выполняли клинические испытания I фазы, используя таблетки, содержащие SAMe и пропилгаллат. 800 мг вводили здоровым добровольцам (7 мужчин, 17 женщин), как описано выше. Фармакокинетический профиль этих препаратов SAMe и пропилгаллата сравнивали также с контрольным коммерческим продуктом, как описано выше.
[000140] 1025 мг таблетки получали смешиванием 400 мг иона SAMe с 25 мг пропилгаллата вместе со вспомогательными веществами (микрокристаллической целлюлозой, крахмалгликолятом натрия, диоксидом кремния и стеаратом магния) для получения 1025 мг. На таблетки наносили защитное покрытие, а затем энтеросолюбильное покрытие, затем выполняли испытание растворения и вводили субъектам-людям, иллюстративный состав упоминается в настоящем документе как «препарат MSI». Эти таблетки, содержащие SAMe и пропилгаллат, показали значительно более высокие значения Сmах по сравнению с коммерческим продуктом.
[000141] Средние максимальные концентрации SAMe в плазме (Cmax) для субъектов-мужчин и субъектов-женщин, принимавших 800 мг препарата MSI, составили 3832±927 нг/мл и 3054±580 нг/мл, соответственно (средняя Cmax ± стандартное отклонение). Неожиданно было обнаружено, что препарат MSI не демонстрирует существенного различия значений между двумя группами, указывая на то, что препарат MSI может преодолевать известные тендерные различия фармакокинетических значений SAMe и, следовательно, одинаково хорошо и существенно повышать уровни SAMe в плазме мужчин и женщин.
[000142] Различные варианты реализации, описанные выше, можно комбинировать с получением дополнительных вариантов реализации изобретения. Все патенты США, публикации патентных заявок США, патентные заявки США, зарубежные патенты, зарубежные патентные заявки и не патентные публикации, упомянутые в настоящем описании и/или перечисленные в инструкции по применению, включены в настоящий документ посредством ссылки в полном объеме. Аспекты указанных вариантов реализации могут быть при необходимости модифицированы с учетом концепций различных пациентов, применений и публикаций, с получением дополнительных вариантов реализации изобретения.
[000143] Эти и другие изменения могут быть сделаны в отношении представленных вариантов реализации изобретения в свете подробного описания, представленного выше. Как правило, в следующей формуле изобретения использованные термины не следует толковать как ограничение указанной формулы изобретения до конкретных вариантов реализации, раскрытых в описании и формуле изобретения, а следует понимать как включающие все возможные варианты реализации вместе с полным охватом эквивалентов, к которым относятся указанные пункты формулы изобретения. Соответственно, формула изобретения не ограничена представленным описанием.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОЛЕКАРСТВА АМФЕТАМИНОВ С ЗАЩИТОЙ ОТ НЕПРАВИЛЬНОГО УПОТРЕБЛЕНИЯ | 2006 |
|
RU2445085C2 |
| ТАКРОЛИМУС ДЛЯ УЛУЧШЕННОГО ЛЕЧЕНИЯ ПАЦИЕНТОВ С ТРАНСПЛАНТАТАМИ | 2009 |
|
RU2574006C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ 15-HEPE, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2737089C2 |
| ЛЕКАРСТВЕННАЯ ФОРМА И СПОСОБ ДЛЯ ДОСТАВКИ ВЫЗЫВАЮЩИХ ЗАВИСИМОСТЬ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ | 2007 |
|
RU2433817C2 |
| ДЛИННОЦЕПОЧЕЧНЫЕ ЛИПОСБАЛАНСИРОВАННЫЕ СЛОЖНЫЕ ЭФИРЫ ТЕСТОСТЕРОНА ДЛЯ ПЕРОРАЛЬНОЙ ДОСТАВКИ | 2014 |
|
RU2722592C2 |
| ТРАНСДЕРМАЛЬНЫЙ ПЛАСТЫРЬ ДЛЯ ВВЕДЕНИЯ ФЕНТАНИЛА | 2007 |
|
RU2351318C2 |
| ПРЕПАРАТЫ МЕТАКСАЛОНА | 2014 |
|
RU2684914C2 |
| КОМПОЗИЦИИ ХИНОЛИНОНОВ | 2006 |
|
RU2433826C2 |
| ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ НА ОСНОВЕ ГУАНФАЦИНА, ПОДХОДЯЩИЕ ДЛЯ ЕЖЕДНЕВНОГО ВВЕДЕНИЯ В ВИДЕ ЕДИНИЧНОЙ ДОЗИРОВАННОЙ ФОРМЫ | 2006 |
|
RU2435573C2 |
| Композиции, содержащие триптановые соединения | 2019 |
|
RU2762725C2 |


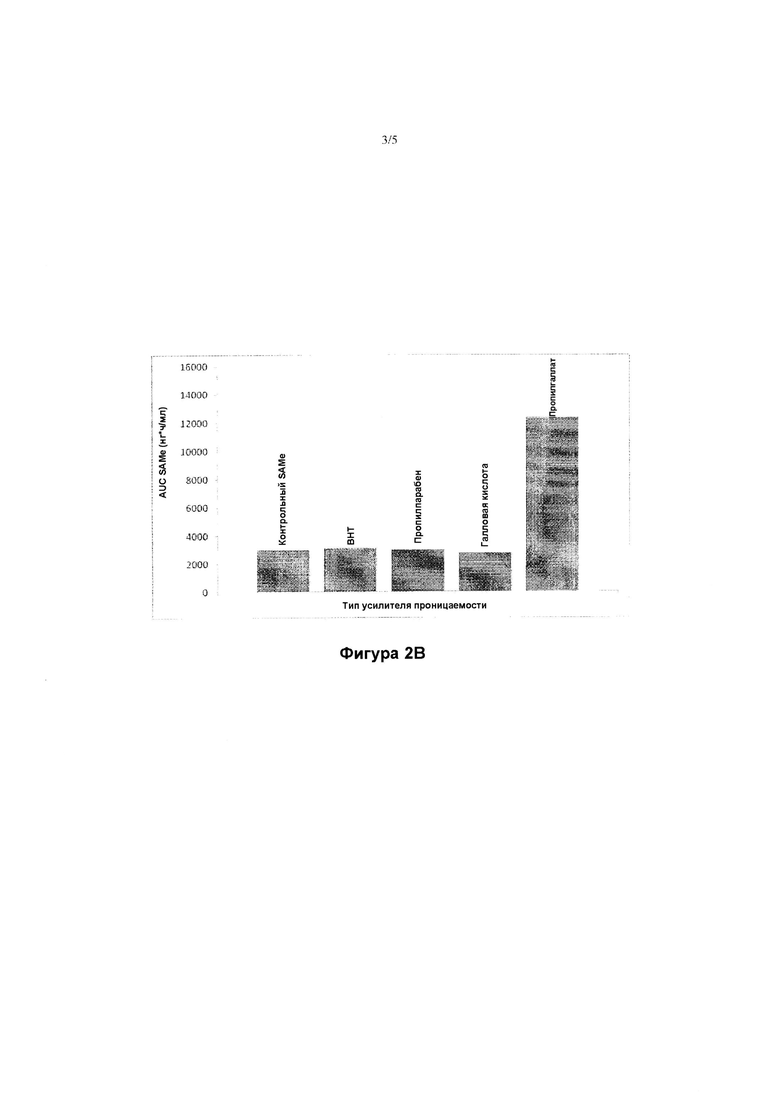
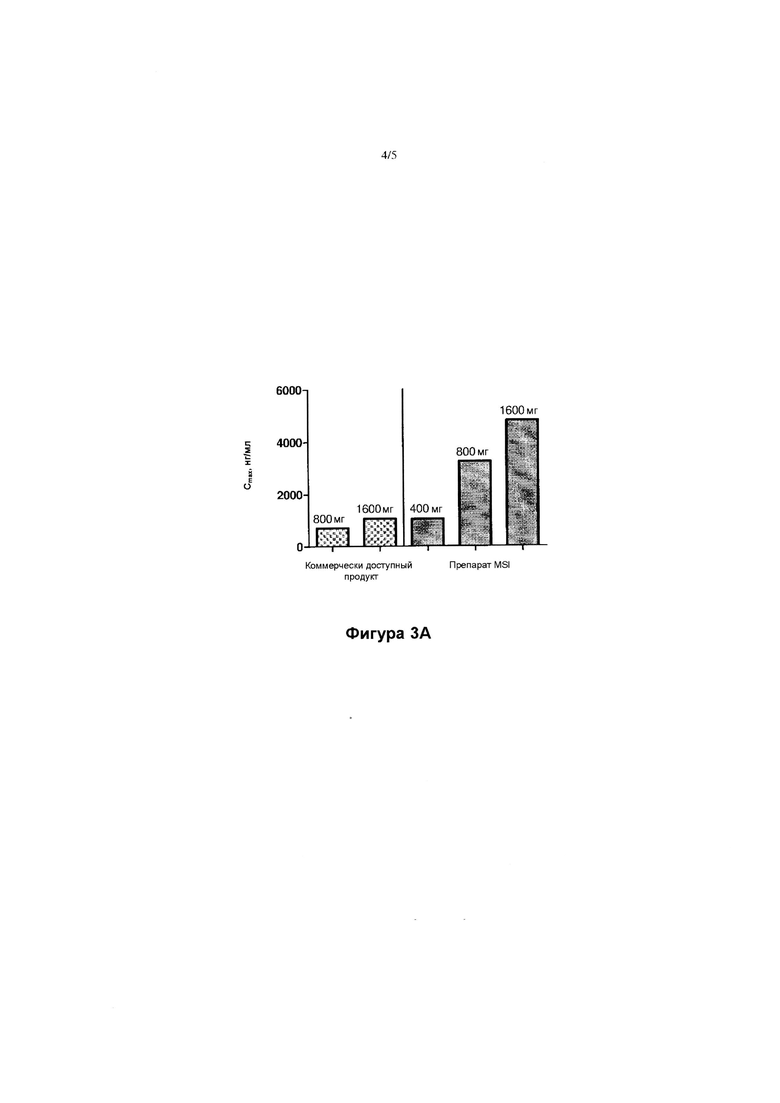

Предложена пероральная композиция для лечения заболеваний и/или расстройств, которые можно лечить при помощи S-аденозил-L-метионина. Композиция содержит S-аденозил-L-метионин («SAM-е» или «SAMe») и один или более сложных эфиров галловой кислоты, выбранных из этилгаллата, изоамилгаллата, пропилгаллата и октилгаллата, причем соотношение (масса:масса) сложного эфира галловой кислоты к S-аденозилметионину составляет от 1:1 до 1:80. Технический результат состоит в улучшении доставки SAMe, в частности в увеличении концентрации SAMe в плазме и площади под фармацевтической кривой (AUC) SAMe. 7 з.п. ф-лы, 3 ил., 5 табл.
1. Композиция в форме пероральной дозированной формы для лечения заболеваний и/или расстройств, которые можно лечить при помощи S-аденозилметионина, содержащая экзогенный S-аденозилметионин и по меньшей мере один сложный эфир галловой кислоты, выбранный из группы, состоящей из этилгаллата, изоамилгаллата, пропилгаллата и октилгаллата, причем отношение (масса : масса) сложного эфира галловой кислоты к S-аденозилметионину составляет от 1:1 до 1:80.
2. Композиция по п. 1, в которой отношение (масса: масса) сложного эфира галловой кислоты к S-аденозилметионину составляет от 1:1 до 1:64.
3. Композиция по п. 1, где указанная композиция содержит примерно от 1 до 400 мг указанного сложного эфира галловой кислоты.
4. Композиция по п. 3, где указанная композиция содержит примерно от 5 до 200 мг пропилгаллата.
5. Композиция по п. 4, где указанная композиция содержит примерно от 5 до 100 мг пропилгаллата.
6. Композиция по п. 1, где указанная композиция содержит от 0,1 до 40 мас. %, от 0,1 до 25 мас. % или от 0,1 до 10 мас. % сложного эфира галловой кислоты.
7. Композиция по п. 1, где доза экзогенного S-аденозилметионина составляет от примерно 50 мг до примерно 1600 мг.
8. Композиция по п. 1, где пероральная дозированная форма содержит функциональное покрытие.
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ПАНКРЕАТИТА И ПРЕДУПРЕЖДЕНИЯ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ И СПОСОБ ПРЕДУПРЕЖДЕНИЯ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ | 1990 |
|
RU2014837C1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| ПОЛУЧЕННЫЕ ИЗ РАСТЕНИЙ СИНТЕТИЧЕСКИЕ ФЕНОЛЬНЫЕ СОЕДИНЕНИЯ И РАСТИТЕЛЬНЫЕ ЭКСТРАКТЫ, ЭФФЕКТИВНЫЕ ПРИ ЛЕЧЕНИИ И ПРОФИЛАКТИКЕ ХЛАМИДИЙНЫХ ИНФЕКЦИЙ | 2001 |
|
RU2246939C2 |
| LOPEZ-ALARCON C | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| J | |||
| Nanosci | |||
| Nanotechnol | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2016-06-10—Публикация
2013-10-16—Подача