Настоящее изобретение относится к биомаркеру и способу диагностики/прогнозирования для распознавания наступления эпителиально-мезенхимального перехода (EMT). В частности, изобретение относится к способам диагностики, прогнозирования и лечения, содержащим экспрессию и/или активность Axl (рецепторной тирозинкиназы).
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Axl является элементом подсемейства рецепторных тирозинкиназ. При сходстве с другими рецепторными тирозинкиназами, Axl является уникальной структурой внеклеточной области, которая объединяют повторы IgL и FNIII и содержит внутриклеточную область с внутриклеточным доменом, часть которого является киназным доменом. Axl трансдуцирует сигналы из внеклеточного матрикса в цитоплазму путем связывания фактора роста типа гена 6 (Gas6) блокировки роста витамин-K-зависимых белков. Внеклеточный домен Axl может расщепляться, и может секретироваться растворимый внеклеточный домен массой 65 кДа. Расщепление улучшает обновление рецепторов и формирует частично активированную киназу (O'Bryan JP, et al, (1995) J Biol Chem. 270(2):551-557). Однако, функция расщепленного домена не известна.
Структурная информация, относящаяся к гену человека и генному продукту Axl, описана в публикации WO 03/068983. Нижеследующие патентные публикации также относятся к Axl или другим рецепторам тирозинкиназ: США 5468634; США 6087144; США 5538861; США 5968508; США 6211142; США 6235769; WO 99/49894; WO 00/76309; WO 01/16181 и WO 01/32926.
Axl участвует в стимуляции клеточной пролиферации. В частности, Axl является онкогеном, связанным с хроническим миелолейкозом, который также связан с раком толстой кишки и меланомой. Данный онкоген находится вблизи онкогена bcl3, который локализован в 19q13.1-q13.2. Ген Axl эволюционно консервативен среди позвоночных видов и экспрессируется во время развития в мезенхиме.
Взаимодействие с лигандом Gas6 делает Axl автофосфорилируемым, и происходит каскад событий трансдукции сигналов. Известно, что в упомянутом каскаде событий участвуют каждая из молекул PI3K (фосфатидилинозитол-3-киназы), AKT (протеинкиназы B), src (киназ src-семейства), Bad (белка), 14-3-3 (белка), PLC (фосфолипазы C), ERK (внеклеточной сигнал-регулируемой киназы), S6K (митоген-активируемой киназы) и STAT (фактора). Gas6 содержит область с большим содержанием гамма-карбоксиглутаминовой кислоты (GLA-домен), которая обеспечивает Ca++-зависимое связывание с мембранными фосфолипидами. Gas6 является слабым митогеном и оказывает антиапоптотическое действие в фибробластах NIH3T3, подвергаемых стрессу вследствие TNF-индуцированной цитотоксичности или удаления фактора роста. В NIH3T3, связывание Gas6 с Axl приводит к активации PI3K, AKT, src и Bad.
Исследования показали, что Axl выполняет несколько разных функций в образовании опухоли. Axl является основным регулятором ангиогенных реакций, включая миграцию, пролиферацию эндотелиальных клеток и формирование ими трубок. Axl требуется также клеткам рака молочной железы человека для формирования опухоли in vivo, и данная потребность указывает, что Axl регулирует процессы, которые жизненно необходимы как для неоваскуляризации, так и для образования опухоли (Holland S. et al, Cancer Res 2005; 65 (20), Oct 15, 2005).
Активность рецепторной тирозинкиназы Axl положительно коррелируется с метастазами опухолей. В частности, исследования показали, что Axl усиливает экспрессию гена MMP-9, который необходим для Axl-опосредованной инвазии. Axl активирует клеточную инвазию посредством индуцирования активности MMP-9 путем активации NF-BK и Brg-1 (Tai, K-Y et al, Oncogene (2008), 27, 4044-4055).
Axl избыточно экспрессируется в клетках глиомы человека и может служить для неблагоприятного прогноза в отношении пациентов с мультиформной глиобластомой (GBM) (Vajkoczy P. et al, PNAS, April 11, 2006, vol 103, no. 15, 5799-5804; Hutterer M. et al, Clinical Cancer Res 2008; 14 (1) Jan 1, 2008;). Кроме того, Axl сравнительно избыточно экспрессируется в высокоинвазивных линиях клеток линиях рака легких, по сравнению с их минимально инвазивными аналогами (Shieh, Y-S et al, Neoplasia, vol 7, no. 12, Dec 2005, 1058-1064). Поэтому полагают, что Axl играет значительную роль в инвазии и прогрессировании опухолей.
Аналогично, Axl экспрессируется в высокоинвазивных клетках рака молочной железы, но не в клетках рака молочной железы с низкой инвазивностью. В частности, ингибирование передачи сигналов Axl (посредством доминантно-негативной мутации Axl, антитела к внеклеточному домену Axl, или посредством нокдауна Axl короткошпилечными РНК) снижало подвижность и инвазивность высокоинвазивных клеток рака молочной железы. Низкомолекулярные ингибиторы Axl препятствовали подвижности и инвазивности клеток рака молочной железы. Таким образом, понятно, что Axl является существенным элементом в сигнальной сети, которая определяет подвижность/инвазивность клеток рака молочной железы (Zhang, Y-X et al, Cancer Res 2008; 68 (6), March 15, 2008).
Ранее установлено, что, в мезангиальных клетках, Gas6 оказывает митогенное действие, являющееся признаком возможной роли в прогрессировании гломерулосклероза. Данные подсказали, что метаболический путь Gas6/Axl играет также значительную роль при глумерулонефрите (Yanagita M. at al, The Journal of Clinical Investigation, 2002, 110 (2) 239-246). Дополнительные исследования показали, что Gas6 способствует выживанию эндотелиальных клеток в модели нарушений артериального кровообращения. Установлено, что Ангиотензин II, посредством его AT1-рецептора, повышает уровни мРНК и белкового рецептора Axl в гладкомышечных клетках сосудов (Melaragno M. G. et al, Circ Res., 1998, 83(7):697-704).
Ранее также установлено, что Axl участвует в клеточной адгезии, клеточной пролиферации и регуляции гомеостаза в иммунной системе (Lu Q., 2001) Science 293 (5528):306-311). После активации Axl, наблюдались следующие явления: ингибирование апоптоза, повышение степени выживаемости «нормальных» (нетрансформированных) клеток фибробластов и эндотелиальных клеток, миграции гладкомышечных клеток сосудов (VSMC) (подавление миграции блоков киназы Axl), ускорение образования неоинтимы в стенках кровеносных сосудов (Melaragno M. G. et al, Trends Cardiovasc Med., 1999, (Review) 9 (8): 250-253) и участие в формировании поражения атеросклерозом и его прогрессировании.
Целью настоящего изобретения является создание новых применений Axl в диагностике, прогнозировании и терапии. В частности, целью изобретения является создание способов распознавания наступления эпителиально-мезенхимального перехода (EMT), который имеет терапевтическое значение при лечении рака, в частности, метастатического и лекарственно-устойчивых форм рака.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Первый аспект изобретения относится к применению Axl в качестве биомаркера для распознавания наступления эпителиально-мезенхимального перехода (EMT) у субъекта.
Настоящее изобретение основано на полученных данных о том, что экспрессия Axl коррелируется с событием эпителиально-мезенхимального перехода (EMT). Насколько известно авторам изобретения, настоящее изобретение представляет первый наглядный случай применения упомянутой корреляции. Упомянутые данные открывают новые полезные возможности создания способов диагностики, прогнозирования и лечения в области раковых заболеваний, в частности, метастатических и лекарственно-устойчивых раковых заболеваний.
Авторы настоящего изобретения показали ранее неосознаваемую роль рецепторной тирозинкиназы Axl, как необходимого EMT-индуцированного эффектора в инвазивно-метастатическом каскаде. Результаты показывают, что активация программы EMT приводит к повышающей регуляции Axl, которая существенна для инвазивности и спонтанного метастазирования злокачественных клеток опухоли молочной железы и лекарственно-устойчивого фенотипа. Экспрессия Axl показывает сильную корреляцию со смертностью пациенток, пораженных раком молочной железы от интервальных опухолей, выявленных при маммографии, и клинически идентифицированных опухолей молочной железы, что предполагает связь между активацией Axl и развитием метастатического заболевания.
Второй аспект изобретения относится к способу распознавания наступления эпителиально-мезенхимального перехода (EMT) в образце, при этом упомянутый способ включает следующие стадии:
(i) выделение образца из клетки, группы клеток, модельного животного или человека;
(ii) определение экспрессии Axl в упомянутом образце в сравнении с контрольным образцом, причем, повышающая регуляция экспрессии Axl относительно контрольного образца показывает наступление эпителиально-мезенхимального перехода (EMT).
Определение экспрессии Axl обеспечивает полезный «устойчивый» маркер для распознавания наступления EMT, который, сам по себе, является переходным по характеру. Таким образом, распознавание экспрессии Axl обеспечивает однозначное и устойчивое показание, произошло ли событие EMT.
Исследования, выполненные подателями настоящей заявки, показали, что вышеизложенное обусловлено тем, что EMT-зависимая активация устанавливает петлю аутокринной передачи сигналов Axl-Gas6, которая благоприятна для злокачественных клеток. Axl может также активироваться посредством паракринных механизмов.
Распознавание опухолевых клеток, которые претерпели EMT, осложняется тем, что современные маркеры (например, виментин, N-кадгерин, отсутствие E-кадгерина) основаны на мезенхимальных цитоскелетных и соединительных белках, которые присутствуют в нормальных стромальных клетках. Распознавание опухолевых клеток среди окружающих клеток стромы является трудной задачей. Экспрессия Axl, вероятно, должна ограничиваться опухолевыми клетками в солидных опухолях, обеспечивающих отличительный признак для злокачественных опухолевых клеток.
Обратимость EMT имеет большое значение для образования метастазов в удаленных местах. Экспрессию Axl можно использовать для распознавания метастаза.
Третий аспект изобретения относится к способу диагностики метастатического рака у субъекта посредством распознавания наступления эпителиально-мезенхимального перехода (EMT), при этом упомянутый способ включает определение уровня полипептида рецептора Axl в образце от субъекта, причем, повышенный уровень полипептида по сравнению с уровнем у субъекта, не страдающего от метастатического рака, показывает наступление эпителиально-мезенхимального перехода (EMT).
Четвертый аспект изобретения относится к применению Axl или гена, кодирующего Axl, при контроле активности вещества, способного ингибировать или обращать эпителиально-мезенхимальный переход (EMT).
Пятый аспект изобретения относится к способу идентификации вещества, способного ингибировать или обращать эпителиально-мезенхимальный переход (EMT), при этом упомянутый способ включает стадию введения упомянутого вещества в клетку, группу клеток, модельному животному или человеку и этап контроля активности и/или экспрессии Axl.
Шестой аспект изобретения относится к способу распознавания способности вещества ингибировать или обращать эпителиально-мезенхимальный переход (EMT), при этом упомянутый способ включает следующие стадии:
(i) введение вещества в клетку, группу клеток, модельному животному или человеку;
(ii) измерение экспрессии Axl в образцах, полученных из обработанных и необработанных клеток, животного или человека; и
(iii) распознавание повышения или снижения экспрессии или активности Axl в обработанном образце, в сравнении с необработанным образцом, в качестве признака способности ингибировать или обращать эпителиально-мезенхимальный переход (EMT).
Седьмой аспект изобретения относится к способу контроля активности ингибитора Axl, при этом, упомянутый способ, включает распознавание наступления эпителиально-мезенхимального перехода (EMT) посредством выполнения следующих стадий:
(i) введение упомянутого ингибитора Axl в клетку, группу клеток, модельному животному или человеку; и
(ii) измерение экспрессии Axl в образцах, полученных из обработанных и необработанных клеток, животного или человека; и
(iii) распознавание повышения или снижения экспрессии или активности Axl в обработанном образце, в сравнении с необработанным образцом, в качестве признака ингибиторной активности Axl.
Восьмой аспект изобретения относится к способу идентификации вещества, способного ингибировать или обращать эпителиально-мезенхимальный переход (EMT), при этом, упомянутый способ включает следующие стадии:
(i) введение вещества в контакт с рецептором Axl или клетками, экспрессирующими рецептор Axl;
(ii) измерение активности рецептора Axl в присутствии вещества; и
(iii) сравнение активности, измеренной на стадии (ii), с активностью, измеренной в контролируемых условиях, где снижение идентифицирует вещество как способное ингибировать или обращать эпителиально-мезенхимальный переход (EMT).
Девятый аспект изобретения относится к способу идентификации вещества, способного ингибировать или обращать эпителиально-мезенхимальный переход (EMT) посредством скрининга множества веществ, при этом упомянутый способ включает следующие стадии:
(i) введение множества веществ в контакт с рецептором Axl или клетками, экспрессирующими рецептор Axl;
(ii) измерение активности рецептора Axl в присутствии множества веществ;
(iii) сравнение активности, измеренной на стадии (ii), с активностью, измеренной в контролируемых условиях, где снижение идентифицирует множество веществ как способное ингибировать или обращать эпителиально-мезенхимальный переход (EMT); и
(iv) отдельное определение, какое(ие) вещество или вещества, присутствующие во множестве, ингибируют или обращают эпителиально-мезенхимальный переход (EMT).
Десятый аспект относится к применению вещества, идентифицированного способом в соответствии с изобретением, при приготовлении лекарственного препарата для лечения метастатического рака.
Одиннадцатый аспект относится к фармацевтической композиции, содержащей вещество, идентифицированное способом в соответствии с изобретением, смешанное с фармацевтически допустимым разбавителем, формообразующим или носителем.
Двенадцатый аспект относится к способу приготовления композиции, который включает следующие стадии:
(i) идентифицирование вещества, способного ингибировать или обращать эпителиально-мезенхимальный переход (EMT), с использованием способа в соответствии с изобретением; и
(ii) смешивание упомянутого вещества с фармацевтически приемлемым разбавителем, носителем или эксципиентом.
Тринадцатый аспект изобретения относится к способу ингибирования или обращения эпителиально-мезенхимального перехода (EMT) у субъекта, нуждающегося в этом, при этом упомянутый способ включает введение ингибитора Axl упомянутому субъекту.
Четырнадцатый аспект изобретения относится к способу лечения метастатического рака у субъекта, нуждающегося в этом, при этом упомянутый способ включает ингибирование или обращение эпителиально-мезенхимального перехода (EMT) посредством введения ингибитора Axl упомянутому субъекту.
Пятнадцатый аспект изобретения относится к применению ингибитора Axl при приготовлении лекарственного препарата для ингибирования или обращения эпителиально-мезенхимального перехода (EMT).
Шестнадцатый аспект изобретения относится к применению ингибитора Axl при приготовлении лекарственного препарата для лечения метастатического рака посредством ингибирования или обращения эпителиально-мезенхимального перехода (EMT).
Семнадцатый аспект изобретения относится к набору для оценки способности вещества ингибировать или обращать эпителиально-мезенхимальный переход (EMT), при этом упомянутый набор содержит антитела к Axl, нуклеиново-кислотный зонд для Axl или праймер QPCR (количественной полимеразной цепной реакции) для Axl.
Восемнадцатый аспект относится к применению вышеупомянутого набора по способу в соответствии с изобретением.
ПОДРОБНОЕ ОПИСАНИЕ
Метастазирование является причиной большей части смертных случаев, связанных с раком. Следовательно, более глубокое понимание молекулярных механизмов, которые делают возможным распространение опухолевых клеток, является очень важным вопросом здравоохранения. Эпителиально-мезенхимальные переходы (EMT) сообщают опухолевым клеткам повышенные миграционную способность и выживаемость, которые способствуют злокачественному прогрессированию. Определение характеристик EMT-индуцированных эффекторов может дать новую информацию о метастазировании и новых способах лечения. Податель настоящей заявки показал, что присутствие рецепторной тирозинкиназы Axl при первичных раковых заболеваниях молочной железы, выявленных методом маммографии, независимо прогнозирует резкое снижение общей выживаемости пациенток, и сопутствующие метастатические поражения пациентки показывают повышение экспрессии Axl. Авторы изобретения показали также, что Axl интенсивно индуцируется эпителиально-мезенхимальным переходом в предраковых эпителиальных клетках молочной железы, который устанавливает петлю аутокринной передачи сигналов с его лигандом, Gas6. При применении эпителиального анализа РНК-интерференции в метастатических клетках рака молочной железы, автор изобретения определил отчетливый порог экспрессии Axl для клеточной инвазивности in vitro, подобной мезенхимальной, и для образования опухолей в in vivo чужеродных микросредах и микросредах, созданных методом тканевой инженерии. Следует отметить, что нокдаун Axl полностью предотвращал распространение опухолевых клеток молочной железы с высокой степенью метастаза из молочной железы в лимфатические узлы и отдельные важные органы и повышал общую выживаемость для двух разных моделей рака молочной железы, основанных на оптической визуализации. Таким образом, Axl представляет новый нисходящий эффектор EMT опухолевых клеток, который необходим для метастазирования рака молочной железы. Распознавание и прицельное лечение опухолей, экспрессирующих Axl, представляет собой важную новую стратегию лечения рака молочной железы.
Роль Axl при EMT и метастазировании
Приобретение характеристик мезенхимальных клеток придает эпителиальным раковым клеткам подвижность отдельных инвазивных клеток, связанную с метастазированием (Theirry, 2002 Weinberg, 2007).
Как упоминалось выше, авторы настоящего изобретения показали, что Axl является необходимым EMT-индуцированным эффектором в инвазивно-метастатическом каскаде. Результаты показывают, что активация программы EMT приводит к повышающей регуляции Axl, которая существенна для инвазивности и спонтанного метастазирования злокачественных клеток опухоли молочной железы. Экспрессия Axl показывает сильную корреляцию со смертностью пациенток, страдающих от рака молочной железы от интервальных опухолей, выявленных при маммографии, что предполагает связь между активацией Axl и развитием метастатического заболевания.
Первоначально, Axl идентифицировали как основной регулятор миграции инвазивных клеток при функциональном генетическом скрининге (Holland et al 2005). Авторы настоящего изобретения показали, что экспрессия Axl в злокачественных клетках рака молочной железы необходима для инвазивности в трехмерных матриксах в ответ на разные хемотактические индукторы (сыворотку крови, SDF-1). Напротив, авторы настоящего изобретения наблюдали слабое влияние нокдауна Axl при 2-мерных анализах на планшетах (пролиферация, scratch) или на клеточную адгезию. Ингибирование Axl ингибирует также миграцию клеток глиомы и карциномы легкого, без воздействия на пролиферацию (Angelillo-Scherrer et al., 2005; Shieh et al., 2005). Следовательно, общая идея состоит в том, что передача сигналов Axl имеет существенное значение для мезенхимального подвижного фенотипа в злокачественных опухолевых клетках.
В соответствии с этим, авторы настоящего изобретения доказывают, что Axl представляет собой новый маркер EMT, индуцируемый несколькими факторами транскрипции, включая Twist, Snail, Slug и ZEP2. Экспрессия упомянутых факторов транскрипции в эпителиальных клетках вызывает нормальную программу развития, которая временно выполняет повышающую регуляцию мезенхимальные характеристики в эпителиальных клетках. Полагают, что предраковые эпителиальные клетки активируют EMT контекстуальными сигналами, например, TGF-бета, вырабатываемыми локальными клетками стромы (Weinberg, 2007). Упомянутый процесс динамически происходит in vivo, в то время как экспрессия маркера, связанного с EMT, например, E-кадгерина, значительно изменяется в опухолях. Действительно, в наших исследованиях, Axl оказывается независимым прогностическим признаком и не коррелируется с изменениями E-кадгерина. Упомянутое отсутствие клинических признаков EMT подтверждено документально и много обсуждалось. Авторы заявки показали, что экспрессия Axl представляет более долговременное EMT-индуцированное изменение.
Для определения, имеет ли Axl существенное значение для метастазирования из микросреды молочной железы, авторы настоящего изобретения имплантировали высокометастатическую (пересеянную в условиях in vivo) линию клеток рака молочной железы (MDA-231-DH2LN) в молочные железы и контролировали распространение посредством in vivo оптической визуализации биолюминесценции люциферазы. Оптическая визуализация всего тела во времени выявила широкое распространение MDA-231-DH2LN в лимфатические узлы, легкие, яичники и почки в течение 28 суток после имплантации во всех контрольных мышах. Спонтанные метастазы лимфатических узлов распознавались первоначально на 4 неделе у всех животных. Метастазы органов распознавались в течение последующего 9-недельного наблюдения. После умерщвления подопытных животных, отдельное сканирование иссеченных органов выявило содержание метастазов, впоследствии подтвержденное гистологическим анализом. Напротив, никаких метастазов не выявлено при биолюминесценции или гистологическом анализе органов мышей, содержащих клетки с нокдауном Axl (MDA-231-DHLN-AxlshRNA). Данное мощное ингибирование распространения из ортотопического места молочной железы показывает, что Axl имеет существенное значение для метастазирования.
В совокупности, результаты авторов настоящего изобретения показывают, что распознавание и прицельное лечение опухолей молочной железы, экспрессирующих Axl, представляет собой важную новую стратегию разработки лечения рака молочной железы.
Диагностический инструмент
Один аспект изобретения относится к диагностическому инструменту для распознавания наступления эпителиально-мезенхимального перехода (EMT).
Таким образом, в соответствии с первым аспектом, изобретение относится к применению Axl в качестве биомаркера для распознавания наступления эпителиально-мезенхимального перехода (EMT) у субъекта.
В одном предпочтительном варианте осуществления, Axl является биомаркером для распознавания индуцирования эпителиально-мезенхимального перехода (EMT).
Метастазирование в удаленные места является наиболее общим случаем смертности от солидных опухолей (Gupta 2006, Sporn 1996). При этом опухолевые клетки сбрасывают ограничения, налагаемые на эпителиальные клетки, переопределяют соединительные комплексы и приобретают инвазивную подвижность для прорыва границы базальной мембраны. Затем, данные метастатические клетки инвазируют в системы циркуляции лимфы и крови, с распространением в отдаленные места в теле. Незначительное число упомянутых метастатических клеток выходят через капиллярную стенку и, в редких случаях, образует колонию в строме чужеродной ткани (Weinberg et al). Вышеописанный злокачественный процесс происходит быстрее при эпителиально-мезенхимальном переходе (EMT), представляющем программу развития, при котором эпителиальные клетки временно принимают мезенхимальный фенотип во время гаструляции и органогенеза, что позволяет единичной клетке совершать инвазивное перемещение из эпителиального слоя (Hall, 1985; Thierry, 2002). Программа EMT запускается контекстуальной активацией морфогенетических сигнальных путей, которые индуцируют экспрессию транскрипционных регуляторов, включая Twist, Snail, Slug и Zeb2, которые изменяют экспрессию белков соединительных комплексов (Thiery and SLeeman 2006). Профиль экспрессии гена EMT отражает смену фенотипа, подавление экспрессии E-кадгерина и цитокератинов, вместе с индуцированием виментина и N-кадгерина (Weinberg et al 2007).
Другой аспект изобретения относится к применению Axl в качестве биомаркера для распознавания и контроля злокачественного развития.
Другой аспект изобретения относится к применению Axl в качестве биомаркера для распознавания метастазирования опухоли. В предпочтительном варианте, опухоль является карцинома, в более предпочтительном варианте, раком молочной железы.
В одном варианте осуществления, изобретение обеспечивает способ диагностики для определения, будет ли субъект подходящим кандидатом для получения лечения ингибитором Axl. Например, если выявлена повышающая регуляция экспрессии Axl, то данный результат можно использовать в качестве руководства для вариантов выбора и проведения лечения, т.е. прогностического признака при индивидуальном применении лекарственных препаратов, для выбора субъектов, которые, вероятно, должны быть восприимчивы к лечению ингибитором Axl. Например, если показано, что в первичной опухоли имеет место повышающая регуляция экспрессии Axl, то данный результат можно использовать для заключения о повышенной вероятности метастазирования. Приведенную информацию можно использовать в качестве руководства для вариантов выбора лечения, т.е. прогностического признака при индивидуальном применении лекарственных препаратов, для выбора субъектов, которые, вероятно, нуждаются в более энергичном противораковом лечении методами хирургии, химиотерапии или лучевой терапии, например, в радикальной мастэктомии.
Таким образом, другой аспект изобретения относится к способу определения, будет ли субъект восприимчив к лечению ингибитором Axl, при этом, способ включает следующие стадии:
(i) выделение образца из клетки, группы клеток, модельного животного или человека;
(ii) определение экспрессии Axl в упомянутом образце в сравнении с контрольным образцом, где повышающая регуляция экспрессии Axl относительно контрольного образца показывает восприимчивость к лечению ингибитором Axl.
Термин «маркер» или «биомаркер» применяется в настоящей заявке для указания на ген или белок, экспрессия которого в образце, полученном из клетки или млекопитающего, изменяется или модулируется, например, подвергается повышающей или понижающей регуляции, когда имеет место эпителиально-мезенхимальный переход (EMT). Когда биомаркер представляет собой белок, модуляция или изменение экспрессии заключает в себе модуляцию посредством разных посттрансляционных модификаций.
Посттрансляционные модификации являются актами процесса ковалентных взаимодействий, которые изменяют свойства белка посредством протеолитического расщепления или добавления модифицирующей группы к, по меньшей мере, одной аминокислоте. Посттрансляционные модификации, обычно, содержат фосфорилирование, ацетилирование, метилирование, ацилирование, гликозилирование, якорь GPI (гликозилфосфатидилинизитол), убиквитинилирование и т.д. Обзор данных модификаций и способов распознавания можно найти в работе Mann et al. Nature Biotechnology March 2003, Vol. 21, pages 255-261.
В одном предпочтительном варианте осуществления, повышающая регуляция Axl показывает на наступление эпителиально-мезенхимального перехода (EMT).
Другой аспект изобретения относится к способу распознавания наступления эпителиально-мезенхимального перехода (EMT) в образце, при этом упомянутый способ включает следующие стадии:
(i) выделение образца из клетки, группы клеток, модельного животного или человека;
(ii) определение экспрессии Axl в упомянутом образце в сравнении с контрольным образцом, где повышающая регуляция экспрессии Axl относительно контрольного образца показывает наступление события эпителиально-мезенхимального перехода (EMT).
Другой аспект изобретения относится к способу диагностики метастатического рака у субъекта посредством распознавания наступления события эпителиально-мезенхимального перехода (EMT), где упомянутый способ включает стадию определения уровня полипептида рецептора Axl в образце от субъекта, причем повышенный уровень полипептида по сравнению с уровнем у субъекта, не страдающего от метастатического рака, показывает наступление эпителиально-мезенхимального перехода (EMT).
В частности, раковые заболевания, представляющие интерес, включают любую карциному, более предпочтительно, раковые заболевания молочной железы, легких, желудка, головы и шеи, толстой и прямой кишок, почек, поджелудочной железы, матки, печени, мочевого пузыря, эндометрия и предстательной железы и лейкозы. В более предпочтительном варианте, рак является метастатическим раком молочной железы.
В предпочтительном варианте, экспрессию гена Axl или уровня полипептида рецептора Axl измеряют с использованием антитела к Axl или аффинного вещества.
Диагностика новых лечебных веществ
Другой аспект изобретения относится к диагностическому анализу для идентификации веществ, которые способны ингибировать или обращать эпителиально-мезенхимальный переход (EMT) и, вследствие этого, имеют потенциальные лечебные применения при лечении таких пролиферативных нарушений, как рак.
Таким образом, один аспект изобретения относится к применению Axl или гена, кодирующего Axl, при контроле активности вещества, способного ингибировать или обращать эпителиально-мезенхимальный переход (EMT).
В одном предпочтительном варианте осуществления, присутствие Axl контролируют после введения вещества, способного ингибировать или обращать эпителиально-мезенхимальный переход (EMT) в клетке, группе клеток, модельном животном или человеке.
Другой аспект изобретения относится к способу идентификации вещества, способного ингибировать или обращать эпителиально-мезенхимальный переход (EMT), при этом упомянутый способ включает стадию введения упомянутого вещества в клетку, группу клеток, модельному животному или человеку и этап контроля активности и/или экспрессии Axl.
В одном предпочтительном варианте осуществления, способ включает стадию введения вещества в клетку, группу клеток, модельному животному или человеку и стадию распознавания измененной экспрессии Axl в упомянутом обработанном образце, в сравнении с необработанным контрольным образцом.
Под «измененной экспрессией» подразумевают повышение, снижение или иную модификацию уровня или характера экспрессии в образце, полученном из обработанной клетки, при сравнении с необработанным контрольным образцом.
Термин «экспрессия» относится к транскрипции матрицы ДНК гена, с синтезом соответствующей мРНК, и трансляции данной мРНК, с синтезом соответствующего генного продукта (т.е. пептида, полипептида или белка), а также к «экспрессии» белка в, по меньшей мере, одной форме, которая может быть модифицирована после трансляции.
Распознавание измененной экспрессии, включая экспрессию гена, можно выполнить любым из способов, известных в данной области, в частности, по технологии анализа микроматриц, вестерн-блоттинга или методами PCR (полимеразной цепной реакции), например, QPCR (количественной полимеразной цепной реакции). Измененную экспрессию можно также распознавать посредством анализа содержания белка в образцах, с использованием таких способов, как ELISA (твердофазный иммуноферментный анализ), PET (позитронная эмиссионная томография) или SELDI-TOF MS (времяпролетная масс-спектрометрия с лазерной десорбцией/ионизацией усиленной поверхности), как поясняется в настоящем описании, и с использованием дополнительных аналитических методов, например, 2-мерного гель-электрофореза. Методы, подобные вышеупомянутому, могут быть особенно полезны для распознавания измененной экспрессии в виде альтернативных посттрансляционно модифицированных форм белка.
Другой аспект изобретения относится к способу распознавания способности вещества ингибировать или обращать эпителиально-мезенхимальный переход (EMT), при этом упомянутый способ включает следующие стадии:
(i) введение вещества в клетку, группу клеток, модельному животному или человеку; и
(ii) измерение экспрессии Axl в образцах, полученных из обработанных и необработанных клеток, животного или человека; и
(iii) распознавание повышения или снижения экспрессии Axl в обработанном образце, в сравнении с необработанным образцом, в качестве признака способности ингибировать или обращать эпителиально-мезенхимальный переход (EMT).
Ингибирование может быть на любом уровне (например, на уровне экспрессии генов или уровне белка).
Еще один аспект изобретения относится к способу контроля активности ингибитора Axl, при этом упомянутый способ, включает распознавание наступления эпителиально-мезенхимального перехода (EMT) посредством;
(i) введения упомянутого ингибитора Axl в клетку, группу клеток, модельному животному или человеку; и
(ii) измерения экспрессии Axl в образцах, полученных из обработанных и необработанных клеток, животного или человека; и
(iii) распознавания повышения или снижения экспрессии или активности Axl в обработанном образце, в сравнении с необработанным образцом, в качестве признака ингибиторной активности Axl.
В отношении данного аспекта, образец анализируют, предпочтительно, посредством анализа белков, более предпочтительно, посредством ELISA, PET, проточного цитометрического анализа, SELDI-TOF MS или 2-D PAGE (2-мерный электрофорез в полиакриламидном геле).
В контексте настоящего изобретения, образец, полученный из обработанной или необработанной клетки, может быть образцом лизата, экстракта или нуклеиновой кислоты, полученной из группы клеток, которые могут быть из культуры клеток тканей, или от животного или человека. Для анализа белков, образец может быть супернатантом культур тканевых клеток. Клетка может быть выделена из человека (например, целые клетки из образцов крови, сыворотки или плазмы) или может быть частью образца ткани, например, биопсии.
В предпочтительном варианте, группа клеток является культурой клеток.
Предпочтительные типы клеток выбирают из линий клеток опухолей толстой кишки, например, HT29, линий клеток опухолей легких, например, A549, линий клеток опухолей почек, например, A498, линий клеток опухолей мочевого пузыря, например, HT13, линий клеток опухолей молочной железы, например, MDA-MB-231, линий клеток опухолей эндометрия, например, AN3CA, линий клеток опухолей матки, например, клеток саркомы матки MESSA DH6, линий клеток опухолей печени, например, Hep2G, линий клеток опухолей предстательной железы, например, DU145, линий клеток T-клеточных опухолей, например, Cem T cell, линий клеток опухолей поджелудочной железы, например, MiaPaCa2. В альтернативном варианте, клетки могут быть в форме гистологического образца биопсии опухоли (например, образца, взятого методом лазерной захватывающей микрохирургии). Подходящие способы распознавания экспрессии генов в биопсийных образцах содержат применение методов FISH (флуоресцентной гибридизации in situ) или иммуногистохимии, с использованием антител, которые распознают гены, идентифицируемые в настоящем случае, а также способы анализа белкового состава образцов.
В другом альтернативном варианте, клетки могут быть культурами клеток крови, например, PBMC. В контексте настоящего изобретения, термин «PBMC» относится к мононуклеарным клеткам периферической крови и содержит PBL (лимфоциты периферической крови).
В подходящих случаях, изменения экспрессии, содержащие изменения экспрессии генов, контролируются в образцах, взятых из млекопитающих или человека. Подходящие образцы содержат, но без ограничения, образцы тканей, например, биопсию, кровь, мочу, соскобы щеки и т.п. В одном варианте осуществления, экспрессию генов, предпочтительно, определяют в опухолевых клетках, в частности, клетках, полученных из опухоли, например, из раковых тканей молочной железы, легких, желудка, головы и шеи, толстой и прямой кишок, почек, поджелудочной железы, матки, печени, мочевого пузыря, эндометрия и предстательной железы и лейкозных тканей, или клеток крови, например, лимфоцитов и, предпочтительно, периферических лимфоцитов, например, PBMC.
В другом варианте осуществления, измененную экспрессию белка определяют в образцах из сыворотки или плазмы, или из супернатанта культур тканей от млекопитающего или человека.
При распознавании белков в сыворотке и, в частности, в образцах плазмы пациентов, образцы отбирают и исследуют методами анализа белков, например, проточного цитометрического анализа, ELISA, PET и SELDI-TOF MS, как поясняется в настоящем описании.
В одном предпочтительном варианте осуществления, способ включает выделение РНК из упомянутого образца и распознавание экспрессии генов посредством QPCR (количественной полимеразной цепной реакции).
В другом варианте осуществления, экспрессию генов определяют посредством распознавания белковых продуктов, например, вестерн-блотингом.
Другой аспект изобретения относится к способу идентификации вещества, способного ингибировать или обращать эпителиально-мезенхимальный переход (EMT), при этом упомянутый способ включает следующие стадии:
(i) введение вещества в контакт с рецептором Axl или клетками, экспрессирующими рецептор Axl;
(ii) измерение активности рецептора Axl в присутствии вещества; и
(iii) сравнение активности, измеренной на стадии (ii), с активностью, измеренной в контролируемых условиях, где снижение идентифицирует вещество как способное ингибировать или обращать эпителиально-мезенхимальный переход (EMT).
В предпочтительном варианте, измеряемая активность является тирозиновым фосфорилированием субстрата рецептора Axl.
В более предпочтительном варианте, измеряемая активность является автофосфорилированием рецептора Axl.
Для данного конкретного варианта осуществления, клетки на стадии (i) ввода в контакт, предпочтительно, предварительно трансфицированы геном Axl.
В еще более предпочтительном варианте, трансфицированные клетки трансфицированы либо временно, либо устойчиво.
В одном предпочтительном варианте осуществления, контролируемые условия на стадии (iii) включают контактирование вещества с клетками, в которых отсутствует активный ген Axl. В еще более предпочтительном варианте, клетки содержат мутированную неактивную форму гена Axl.
В другом предпочтительном варианте осуществления, контролируемые условия на стадии (iii) включают сравнение активности с активностью, измеренной в отсутствие вещества.
В одном особенно предпочтительном варианте осуществления, рецептор Axl содержит биологически активный участок внутриклеточного домена.
В одном предпочтительном варианте осуществления, рецептор Axl иммобилизован, например, прикреплением к твердой фазе.
Другой аспект изобретения относится к способу идентификации вещества, способного ингибировать или обращать эпителиально-мезенхимальный переход (EMT) посредством скрининга множества веществ, при этом упомянутый способ включает следующие стадии:
(i) введение множества веществ в контакт с рецептором Axl или клетками, экспрессирующими рецептор Axl;
(ii) измерение активности рецептора Axl в присутствии множества веществ;
(iii) сравнение активности, измеренной на этапе (ii), с активностью в контролируемых условиях, где снижение идентифицирует множество веществ как способных ингибировать или обращать эпителиально-мезенхимальный переход (EMT); и
(iv) отдельного определения, какое(ие) вещество или вещества, присутствующие во множестве, ингибируют или обращают эпителиально-мезенхимальный переход (EMT).
В предпочтительном варианте, в вышеописанных способах по изобретению, вещество предназначено для лечения метастатического рака.
Вещества, идентифицированные с использованием способа
Другой аспект относится к применению вещества, идентифицированного по любому из вышеописанных способов, при приготовлении лекарственного препарата для лечения метастатического рака.
В предпочтительном варианте, рак выбирают из раковых заболеваний молочной железы, легких, желудка, головы и шеи, толстой и прямой кишок, почек, поджелудочной железы, матки, печени, мочевого пузыря, эндометрия и предстательной железы и лейкозов. В более предпочтительном варианте, рак является раком молочной железы.
Измерение измененной экспрессии генных/белковых маркеров
Уровни экспрессии гена и белка можно определять с использованием нескольких разных методов.
(a) на уровне РНК
Экспрессию гена можно распознавать на уровне РНК. РНК можно извлекать из клеток с использованием методов экстракции РНК, содержащих, например, применение кислотной экстракции фенолом/гуанидинизотиоцианатом (RNAzol B; Biogenesis), наборы RNeasy для приготовления РНК (Qiagen) или PAXgene (PreAnalytix, Switzerland). Типичные форматы анализов, использующие гибридизацию рибонуклеиновых кислот, содержат нуклеарные кинетические анализы (nuclear run-on assays), RT-PCR (полимеразную цепную реакцию с обратной транскриптазой), анализы защиты от РНКазы (Melton et al., Nuc. Acids Res. 12:7035), нозерн-блоттинг и гибридизация in situ. Экспрессию генов можно также распознавать нижеописанным анализом микроматриц.
Для нозерн-блоттинга, образцы РНК сначала фракционируют по размерам посредством электрофореза в агарозном геле в денатурирующих условиях. Затем, РНК переносятся на мембрану, сшиваются и подвергаются гибридизации с меченым зондом. Применимы радиоактивно меченые пятна с неизотопической или высокоспецифической активностью, включая ДНК зонды с рассеянным праймером, с ник-трансляцией или ДНК зонды, полученные методом PCR (полимеразной цепной реакции), РНК зонды, транскрибированные in vitro, и олигонуклеотиды. Кроме того, в качестве зондов можно использовать последовательности, имеющие только частичную гомологию, (например, кДНК из разных видов или фрагменты геномной ДНК, которые могут содержать эксон).
Анализы защиты от нуклеазы (включая как анализы защиты от рибонуклеазы, так и анализы с нуклеазой S1) обеспечивают высокочувствительный способ распознавания и количественного определения специфических мРНК. Основой NPA (анализов защиты от нуклеазы) является гибридизация в растворе антисмыслового зонда (радиоактивно меченого или неизотопического) с образцом РНК. После гибридизации, одноцепочечные негибридизированные зонд и РНК разрушают нуклеазой. Остающиеся защищенные фрагменты фракционируют в акриламидном геле. NPA (анализы защиты от нуклеазы) позволяют одновременно распознавать несколько видов РНК.
Гибридизация in situ (ISH) является мощным и универсальным инструментом для локализации специфических мРНК в клетках или тканях. Гибридизация зонда происходит внутри клетки или ткани. Поскольку клеточная структура сохраняется на протяжении всей процедуры, то ISH (гибридизация in situ) обеспечивает информацию о локализации мРНК внутри образца ткани.
Процедура начинается с фиксации образцов в нейтральном забуференном формалине и заливки ткани в парафин. Затем, образцы разрезают на тонкие срезы и закрепляют на предметных стеклах микроскопа. В альтернативном варианте, ткань можно разрезать на срезы в замороженном состоянии, после фиксации в параформальдегиде. После серии промывок для депарафинирования и регидратирования срезов, выполняют расщепление протеиназой K для повышения доступности зонда, и, затем, меченый зонд гибридизируют со средами образца. Радиоактивно меченые зонды визуализируют жидкостной пленкой, высушиваемой на предметных стеклах, а неизотопически меченые зонды удобно распознавать колориметрическим или флуоресцентным реагентами. Данный последний способ распознавания является основой флуоресцентной гибридизации in situ (FISH).
Способы распознавания, которые можно использовать, содержат радиоактивные метки, ферментные метки, хемилюминесцентные метки, флуоресцентные метки и другие подходящие метки.
Обычно, для амплификации РНК мишеней используют RT-PCR (полимеразную цепную реакцию с обратной транскриптазой). В данном процессе используют фермент обратную транскриптазу для превращения РНК в комплементарную ДНК (кДНК), которая, затем, может быть амплифицирована для облегчения распознавания. Относительно количественная RT-PCR (полимеразная цепная реакция с обратной транскриптазой) заключается в амплификации внутреннего контроля одновременно с геном, представляющим интерес. Внутренний контроль служит для нормирования образцов. После нормирования можно выполнять прямые сравнения относительной копийности специфической мРНК по всем образцам. Обычно применяемые внутренние контроли содержат, например, GAPDH, HPRT, актин и циклофилин.
Известно много способов амплификации ДНК, большинство из которых основаны на цепной ферментативной реакции (например, полимеразной цепной реакции, лигазной цепной реакции или самоподдерживающаяся последовательная репликация) или на репликации всего или части вектора, в который она клонировалась.
В литературе описано много способов амплификации мишени и сигнала (TAS), например, общие описания упомянутых способов приведены в публикациях Landegren, U. et al., Science 242:229-237 (1988) и Lewis, R., Genetic Engineering News 10:1, 54-55 (1990).
PCR (полимеразная цепная реакция) является способом амплификации нуклеиновых кислот, описанным, в частности, в патентах США 4683195 и 4683202. PCR можно применять для амплификации любой известной нуклеиновой кислоты в диагностике (Mok et al., 1994, Gynaecologic Oncology 52:247-252). Самоподдерживающаяся последовательная репликация (3SR) является вариантом TAS (амплификации мишени и сигнала), которая заключается в изотермической амплификации матрицы нуклеиновой кислоты через последовательные циклы активности обратной транскриптазы (RT), полимеразы и нуклеазы, которые поддерживаются смесью ферментов и подходящими олигонуклеотидными праймерами (Guatelli et al., 1990, Proc. Natl. Acad. Sci. USA 87:1874). Реакция амплификации путем лигирования или система амплификации путем лигирования использует ДНК лигазу и четыре олигонуклеотида, по два на цепочку-мишень. Данный метод описан в публикации Wu, D. Y. and Wallace, R. B., 1989, Genomics 4:560. В методе Qβ-репликазы РНК репликаза бактериофага Qβ, который реплицирует одноцепочечную РНК, применяют для амплификации ДНК-мишени, как поясняется в публикации Lizardi et al., 1988, Bio/Technology 6:1197.
Количественная PCR (QPCR) представляет собой метод, который позволяет определить относительные количества транскриптов в образце. Ниже приведено описание подходящего способа для выполнения QPCR.
В настоящем изобретении можно использовать альтернативную технологию амплификации. Например, амплификация по типу катящегося кольца (Lizardi et al., 1998, Nat Genet 19:225) является коммерчески доступной технологией амплификации (RCAT™), которая катализируется ДНК полимеразой и может реплицировать кольцевые олигонуклеотидные зонды с кинетикой, подчиняющейся либо линейному закону, либо закону геометрической прогрессии, в изотермических условиях. Дополнительный метод, амплификация с перемещением цепочки (SDA; Walker et al., 1992, Proc. Natl. Acad. Sci. USA 80:392) начинается со специально заданной последовательности, однозначной для специфической мишени.
Подходящие зонды для распознавания экспрессии Axl, идентифицированные в данном случае, можно удобно упаковывать в форме тест-набора в подходящем контейнере. В упомянутых наборах, зонд может быть связан с твердофазным носителем, когда формат анализа, для которого предназначен набор, требует упомянутого связывания. Набор может также содержать подходящие реагенты для обработки образца, подлежащего зондированию, гибридизации зонда с нуклеиновой кислотой в образце, контрольные реагенты, инструкции и т.п. Подходящие наборы могут содержать, например, праймеры для реакции QPCR (количественной полимеразной цепной реакции) или меченые зонды для выполнения FISH (флуоресцентной гибридизации in situ).
(b) на пептидном уровне
Измененную экспрессию гена или белка можно также распознавать посредством измерения полипептидов, кодированных геном Axl. Данную задачу можно решать с использованием молекул, которые связываются с полипептидами, кодированными геном Axl. Подходящие молекулы/вещества, которые связываются либо непосредственно, либо косвенно с полипептидами, чтобы распознавать присутствие белка, содержат встречающие в природе молекулы, например, пептиды и белки, например, антитела, или могут быть синтетическими молекулами.
Антитела к генам или белкам Axl можно получать из коммерческих источников или посредством методов, которые известны специалистам в данной области. В одном варианте осуществления, и когда измененная экспрессия проявляется в виде экспрессии изменения посттрансляционно-модифицированных форм белкового биомаркера, можно применить антитела, специфические к упомянутым разным формам.
Способы получения антител известны специалистам в данной области. Если требуются поликлональные антитела, то выбранное млекопитающее (например, мышь, кролика, козу, лошадь и т.п.) иммунизируют иммуногенным полипептидом, содержащим эпитоп(ы) полипептида. Отбирают сыворотку из иммунизированного животного и обрабатывают в соответствии с известными процедурами. Если сыворотка, содержащая поликлональные антитела к эпитопу от полипептида, содержит антитела к другим антигенам, то поликлональные антитела можно очистить посредством иммуноаффинной хроматографии. Методы получения и обработки поликлональных антисывороток известны в технике. Для формирования интенсивной иммуногенной реакции, полипептиды или их фрагменты можно гаптенилировать в другой полипептид для использования в качестве иммуногенов у животных или людей.
Моноклональные антитела, направленные против эпитопов в полипептидах, также могут быть легко получены специалистом в данной области. Общая методология создания моноклональных антител гибридомами широко известна. Бессмертные линии клеток, продуцирующие антитела, можно создавать слиянием клеток, а также другими методами, например, прямой трансформацией B-лимфоцитов с онкогенной ДНК или трансфекцией вирусом Эпштейна-Барр. Панели моноклональных антител, продуцированных против эпитопов в полипептидах в соответствии с изобретением, можно скринировать по различным свойствам; т.е. по аффинности к изотопам и эпитопам.
Альтернативный метод содержит скрининг библиотеки фаговых отображений, когда, например, фаги экспрессируют scFv-фрагменты на поверхности их оболочки с множеством определяющих комплементарность областей (CDRs). Данный метод широко известен в данной области.
В контексте настоящего изобретения, термин «антитело», если не указано обратное, содержит полные антитела или фрагменты полных антител, которые сохраняют их связующую активность к антигену-мишени. Данные фрагменты содержат Fv-, F(ab')- и F(ab')2-фрагменты, а также одноцепочечные антитела (scFv). Кроме того, антитела и их фрагменты могут быть гуманизированными антителами, например, описанными в патенте EP 239400A. Термин «антитело» в контексте настоящей заявки включает в себя также аффинные реагенты, подобные антителу. Например: моноклональные и поликлональные антитела, рекомбинантные антитела, протеолитические и рекомбинатные фрагменты антител (Fab, Fv, scFv, диатела), однодоменные антитела (VHH, sdAb, нанотела, IgNAR, VNAR) и белки, не родственные антителам, которые сконструированы с расчетом на наличие свойства антителоподобного специфического связывания, например, следующие:
Для распознавания измененных уровней активности Axl, в сравнении с необработанными клетками в той же самой клеточной популяции, можно применить стандартные лабораторные методы, например, вышеупомянутый иммуноблоттинг.
Экспрессию генов можно также определять посредством распознавания изменений в ходе посттрансляционного процессинга полипептидов или посттранскрипционной модификации нуклеиновых кислот. Например, можно измерять дифференциальное фосфорилирование полипептидов, расщепление полипептидов или альтернативный сплайсинг РНК и т.п. Уровни экспрессии генных продуктов, например, полипептидов, а также их посттрансляционной модификации, можно распознавать с использованием фирменных анализов белков или таких методов, как 2-мерный электрофорез в полиакриламидном геле.
Антитела можно использовать для распознавания экспрессии Axl по способу, который включает: (a) стадию обеспечения антитела в соответствии с изобретением; (b) стадию инкубирования биологического образца с упомянутым антителом в условиях, которые допускают формирование комплекса антитело-антиген; и (c) стадию определения, сформирован ли комплекс антитело-антиген, содержащий упомянутое антитело.
Подходящие образцы содержат экстракты тканей, например тканей головного мозга, молочной железы, яичников, легких, прямой кишки, поджелудочной железы, яичка, печени, мышц и костей или из опухолевых образований, полученных из упомянутых тканей. Другие подходящие примеры содержат образцы крови или мочи.
Антитела, которые специфически связываются с белками Axl, можно использовать в способах диагностики или прогнозирования и наборах, которые широко известны специалистам со средним уровнем компетентности в данной области, чтобы распознавать или количественно оценивать экспрессию белка Axl в жидкости или ткани тела. Результаты данных испытаний можно использовать для диагностики или прогнозирования проявления или повторного проявления рака и другой клеточной подвижности или заболеваний, опосредованных выживанием клеток, или для оценки эффективности дозы лекарственного средства и лечения.
Антитела можно анализировать на иммуноспецифическое связывание любым способом, известным в данной области. Иммунологические анализы, которые можно применять, содержат, но без ограничения, системы конкуретного и неконкурентного анализа, использующие такие методы, как вестерн-блоттинг, иммуногистохимию, радиоиммунологические анализы, ELISA, сэндвичевые иммуноанализы, иммунопреципитационные анализы, реакции преципитации, гель-диффузионные реакции преципитации, иммунодиффузионные анализы, агглютинационные анализы, анализы фиксации комплементов, иммунорадиометрические анализы, флуоресцентные иммуноанализы и иммуноанализы на белок A.
Упомянутые анализы повседневно выполняются в данной области (см., например, публикацию Ausubel et al., eds, 1994, Current Protocols in Molecular Biology, Vol. 1 , John Wiley & Sons, Inc., New York, которая полностью включена в настоящее описание путем отсылки).
В предпочтительном варианте, антитела для использования в настоящем изобретении связаны с твердофазным носителем и/или упакованы в наборы в подходящем контейнере вместе с подходящими реагентами, контрольными материалами, инструкциями и т.п.
Другие способы содержат, но без ограничения, 2-мерный электрофорез в полиакриламидном геле (2D-PAGE), хотя данный способ менее пригоден при крупномасштабном скрининге. Более поздние методы содержат времяпролетную масс-спектрометрию с матрично-усиленной лазерной десорбцией/ионизацией (MALDI-TOF MS). При анализе методом MALDI-TOF, белки в сложной смеси фиксируют в твердофазной металлической матрице, дезорбируют импульсным лазерным пучком для формирования газофазных ионов, которые перемещаются по пролетной трубке, свободной от действия электромагнитного поля, и, затем, разделяют по их скоростям, зависящим от массы. Отдельные белки и пептиды можно идентифицировать посредством применения инструментальных средств обработки информации для просмотра баз данных белковых и пептидных последовательностей. Времяпролетная масс-спектрометрия с усиленной поверхностью лазерной десорбцией/ионизацией (SELDI-TOF MS) является способом аффинной масс-спектрометрии, при котором белки селективно адсорбируют к химически модифицированной твердофазной поверхностью, примеси удаляют промывкой, накладывают энергопоглощающую матрицу, и белки идентифицируют методом массового анализа с лазерной десорбцией.
Метод SELDI-TOF-MS можно применять для распознавания признаков/утраты либо неповрежденных белков или фрагментов специфических белков. Кроме того, SELDI-TOF-MS можно также применять для распознавания посттрансляционных модификаций белков вследствие разности масс, вызываемой добавлением/удалением химических групп. Следовательно, фосфорилирование единственного остатка будет вызывать изменение массы на 80 Да из-за фосфатной группы. База данных молекулярных масс, которые можно присваивать посттрансляционным модификациям свободно доступна на Internet-сайте (http://www.abrf.org/index.cfm/dm.home?avgmass=all). Кроме того, специфические полипептиды могут улавливаться аффинными способами с использованием метода SELDI-TOF-MS путем применения антител, который специально распознает посттрансляционно модифицированную форму белка, или который может одинаково надежно распознавать все формы белка.
Матрицы
Технология матриц и различные методы и области применения, связанные с данной технологией, описаны в общем виде в многочисленных учебниках и документах. Упомянутые учебники и документы включают Lemieux et al., 1998, Molecular Breeding 4:277-289; Schena and Davis, Parallel Analysis with Biological Chips, в PCR Methods Manual (eds. M. Innis, D. Gelfand, J. Sninsky); Schena and Davis, 1999, Genes, Genomes and Chips. В DMA Microarrays: A Practical Approach (ed. M. Schena), Oxford University Press, Oxford, UK, 1999); The Chipping Forecast (Nature Genetics special issue; January 1999 Supplement); Mark Schena (Ed.), Microarray Biochip Technology, (Eaton Publishing Company); Cortes, 2000, The Scientist 14(17):25; Gwynne and Page, Microarray analysis: the next revolution in molecular biology, Science, 1999, August 6; Eakins and Chu, 1999, Trends in Biotechnology, 17:217-218, а также сайты Интернета.
Технология матриц преодолевает недостатки традиционных способов в молекулярной биологии, которые, обычно, работают по принципу «один ген в одном эксперименте», что снижает производительность и возможность получения «полной картины» функции генов. В настоящее время, главные применения технологии матриц содержат идентификацию последовательности (ген/генная мутация) и определение уровня экспрессии (копийности) генов. Профилирование экспрессии генов можно выполнять с использованием технологии матриц, необязательно, в комбинации с протеомическими методами (Celis et al., 2000, FEBS Lett, 480(1):2-16; Lockhart and Winzeler, 2000, Nature 405(6788):827-836; Khan et al., 1999, 20(2):223-9). В данной области известны также другие применения технологии матриц; например, обнаружение генов, исследования в области раковых заболеваний (Marx, 2000, Science 289: 1670-1672; Scherf et alet al., 2000, Nat Genet 24(3):236-44; Ross et al., 2000, Nat Genet 2000, 24(3):227-35), анализ SNP (однонуклеотидного полиморфизма) (Wang et al., 1998, Science 280(5366): 1077-82), обнаружение лекарственных средств, фармакогеномика, диагностика заболеваний (например, использование микродиспергаторов: Chemical & Engineering News, February 22, 1999, 77(8):27-36), токсикология (Rockett and Dix (2000), Xenobiotica 30(2): 155-77; Afshari et al., 1999, Cancer Res 59(19):4759-60) и токсигеномика (сочетание функциональной геномики и молекулярной токсикологии). Цель токсикогеномики состоит в определении корреляций между токсическими реакциями на токсины и изменениями генетических профилей объектов, испытывающих воздействия упомянутых токсинов (Nuwaysir et al., 1999, Molecular Carcinogenesis 24:153-159).
В контексте настоящего изобретения, технологию матриц можно применять, например, при анализе экспрессии белка Axl. В одном варианте осуществления, технологию матриц можно применять для анализа влияния подходящего соединения на активность Axl.
В общем, любую библиотеку или группу образцов можно упорядоченно расположить в виде матрицы посредством пространственного разделения элементов библиотеки или группы. Примеры подходящих библиотек для составления матрицы содержат библиотеки нуклеиновых кислот (содержащих библиотеки ДНК, кДНК, олигонуклеотидов и т.п.), пептидов, полипептидов и белков, а также библиотеки, содержащие любые молекулы, например, среди прочего, библиотеки лигандов. Соответственно, если в настоящем документе дается ссылка на «библиотеку», то, контекст не требует иного, следует понимать, что такая ссылка содержит ссылку на библиотеку в форме матрицы.
Образцы (например, элементы библиотеки) обычно фиксируют или иммобилизуют в твердой фазе, предпочтительно, на твердофазной подложке, чтобы ограничить диффузию и смешение образцов. В предпочтительном варианте осуществления можно подготовить библиотеки ДНК-связывающих лигандов. В частности, библиотеки могут быть иммобилизованы на, по существу, планарной твердой фазе, в том числе, на мембранах и непористых подложках, например, пластике и стекле. Кроме того, образцы располагают, предпочтительно, таким образом, что индексация (т.е. обращение или доступ к конкретному образцу) упрощается. Обычно образцы наносятся как пятна, образующие координатную сетку. Для приведенной цели можно адаптировать обычные системы матриц. Например, матрица может быть иммобилизована на поверхности микропластины, либо с несколькими образцами в лунке, либо с единственным образцом в каждой лунке. Кроме того, твердофазная подложка может быть мембраной, например, нитроцеллюлозной или нейлоновой мембраной (например, мембранами, применяемыми в блоттинг-экспериментах). Альтернативные подложки содержат стеклянные или кварцевые подложки. Таким образом, образцы иммобилизуют любым подходящим способом, известным в данной области, например, при посредстве взаимодействия зарядов или химическим связыванием со стенками или дном лунок или поверхностью мембраны. Применимы другие средства размещения или фиксации, например, капание из пипетки, касание капли, пьезоэлектрические средства, струйная и струйно-капельная технология, электростатическое нанесение и т.п. В случае кремниевых кристаллов можно использовать фотолитографию для расположения и фиксации образцов на кристалле.
Образцы можно размещать путем «нанесения пятен» на твердофазную подложку; упомянутое нанесение можно производить вручную или с использованием роботизированного оборудования для нанесения образца. В общем, матрицы можно характеризовать как макроматрицы или микроматрицы, при этом, различие состоит в размере пятен образцов. Макроматрицы содержат пятна образцов с размерами, обычно, около 300 микрометров или более и могут легко отображаться существующими сканерами для гелей и блотов. Размеры пятен образцов на микроматрицах, как правило, меньше, чем 200 микрометров в диаметре, и данные матрицы содержат, обычно, тысячи пятен. Следовательно, микроматрицы могут нуждаться в специализированном роботизированном и визуализирующем оборудовании, которое, возможно, требуется изготавливать на заказ. Измерительные приборы описаны, в общем, в обзоре Cortese, 2000, The Scientist 14(11):26.
Методы создания библиотек иммобилизованных молекул ДНК описаны в известной технической литературе. В общем, большинство существующих способов относятся к тому, как синтезировать библиотеки молекул одноцепочечных нуклеиновых кислот, с использованием, например, методов маскирования для накопления различных пермутаций последовательностей в различных дискретных позициях на твердофазной подложке. В патенте США 5837832, содержание которого включено в настоящую заявку путем ссылки, описан усовершенствованный способ получения ДНК-матриц, иммобилизованных на кремниевых подложках, изготовленных по технологии сверхбольших интегральных схем. В частности, в патенте США 5837832 описана стратегия, называемая «размещение мозаикой», для синтеза специфических наборов зондов в пространственно заданных местоположениях на подложке, которую можно применить для получения библиотек иммобилизованных ДНК в соответствии с настоящим изобретением. В патенте США 5837832 приведены также ссылки на более ранние методы, которые также можно применять.
Матрицы пептидов (или пептидомиметиков) можно также синтезировать на поверхности таким образом, чтобы помещать каждый отдельный элемент библиотеки (например, уникальную пептидную последовательность) в отдельное, предварительно заданное местоположение в матрице. Идентичность каждого элемента библиотеки определяют по его пространственному местоположению в матрице. Местоположения в матрице, в которых происходят взаимодействия связывания между предварительно заданной молекулой (например, мишенью или зондом) и реакционноспособными элементами библиотеки, определяют, с идентификацией, тем самым, последовательностей реакционноспособных элементов библиотеки на основе пространственного местоположения. Упомянутые способы описаны в патенте США 5,143,854; и публикациях WO 90/15070, WO 92/10092; Fodor et al, 1991 , Science 251:767; Dower and Fodor, 1991, Ann. Rep. Med. Chem. 26:271.
Для облегчения распознавания, мишени и зонды можно метить любым легко распознаваемым репортером, например, флуоресцентным, биолюминесцентным, фосфоресцентным, радиоактивным и т.п. репортером. Данные репортеры, их распознавание, связыванием с мишенями/зондами и т.п. описаны в других местах настоящего документа. Мечение зондов и мишеней описано также в публикации Shalon et al, 1996, Genome Res 6(7):639-45.
Конкретные примеры ДНК-матриц содержат следующие матрицы:
Формат I: зонд кДНК (~500-~5000 оснований в длину) иммобилизуют на поверхности твердой фазы, например, на стекле, с помощью роботизированного оборудования для нанесения пятен и подвергают воздействию набора мишеней, либо по отдельности, либо в смеси. Данный способ широко известен и разработан в Стэнфордском университете (Ekins and Chu, 1999, Trends in Biotechnology, 17:217-218).
Формат II: матрица олигонуклеотидных (на основе ~20-~25-членных олигомеров) или пептидно-нуклеиновокислотных (ПНК) зондов синтезируют либо in situ (на чипе) или путем обычного синтеза, с последующей иммобилизацией на чипе. Матрицу подвергают воздействию меченой ДНК образца, гибридизируют и определяют идентичность/копийности комплементарных последовательностей. Данный ДНК-чип продается компанией Affymetrix Inc. под товарной маркой GeneChip®.
Примеры некоторых коммерчески доступных форматов микроматриц описаны, например, в публикации Marshall and Hodgson, 1998, Nature Biotechnology 16(1):27-31.
Анализ данных также является важной частью эксперимента с использованием матриц. Обычно, исходными данными эксперимента с микроматрицей являются изображения, которые требуется преобразовать в матрицы экспрессии генов, представляющие собой таблицы, в которых строки представляют, например, гены, столбцы представляют, например, различные образцы, например, ткани или условия проведения эксперимента, и числа в каждой ячейке, например, характеризуют уровень экспрессии конкретного гена в конкретном образце. Упомянутые матрицы требуется анализировать дополнительно, если требуется извлечь какое-то знание о биологических процессах, лежащих в основе. Способы анализа данных (содержащие контролируемый и неконтролируемый анализ данных, а также биоинформационные способы) описаны в публикации Brazma and ViIo J, 2000, FEBS Lett 480(1):17-24.
Как изложено выше, в матрицах можно также иммобилизовать белки, полипептиды и т.п. Например, в анализе матрицы протеом с использованием белковых чипов применяли антитела (Borrebaeck CA, 2000, Immunol Today 21(8):379-82). Обзор полипептидных матриц приведен, например, в публикации MacBeath and Schreiber, 2000, Science, 289(5485):1760-1763.
Фармацевтическая композиция
Дополнительный аспект относится к фармацевтической композиции, содержащей вещество, идентифицированное любым из вышеописанных способов, смешанное с фармацевтически приемлемым разбавителем, эксципиентом или носителем.
Другой аспект относится к способу приготовления композиции, который включает следующие стадии:
(i) идентифицирование вещества, способного ингибировать или обращать эпителиально-мезенхимальный переход (EMT), с использованием способа в соответствии с изобретением; и
(ii) смешивание упомянутого вещества с фармацевтически приемлемым разбавителем, эксципиентом или носителем.
Еще один аспект изобретения относится к применению вещества, идентифицированного способами в соответствии с изобретением, при приготовлении лекарственного препарата для лечения пролиферативного нарушения, предпочтительно, рака.
Для применения в соответствии с настоящим изобретением, вещество, идентифицированное вышеописанными способами, может быть представлено в форме фармацевтического препарата, содержащего соединения или физиологически допустимую соль, сложный эфир или другую их физиологически функциональную производную, в сочетании с, по меньшей мере, одним фармацевтически допустимым носителем и, необязательно, другими лечебными и/или профилактическими ингредиентами. Носитель(и) должен(ны) быть приемлемым(и) в смысле совместимости с другими ингредиентами препарата и безвредным(и) для потребителя. Фармацевтические композиции могут быть предназначены для применения человеком или животным в медицине и ветеринарии.
Примеры упомянутых подходящих эксципиентов для различных форм фармацевтических препаратов, описанных в настоящей заявке, можно найти в публикации «Handbook of Pharmaceutical Excipients», 2nd Edition, (1994), Edited by A Wade and PJ Weller.
Допустимые носители или разбавители для лечебного применения широко известны в области фармацевтики и описаны, например, в публикации Remington's Pharmaceutical Sciences, Mack Publishing Co. (A. R. Gennaro edit. 1985).
Примеры подходящих носителей включают лактозу, крахмал, глюкозу, метилцеллюлозу, магний стеарат, маннитол, сорбит и т.п. Примеры подходящих разбавителей включают этанол, глицерин и воду.
Вариант фармацевтического носителя, эксципиента или разбавителя можно выбирать с учетом намеченного пути введения и стандартной фармацевтической практики. Фармацевтические композиции могут содержать, в качестве или кроме носителя, эксципиента или разбавителя, любое(ые) подходящее(ие) связующее(ие) вещество(а), лубрикант(ы), суспендирующее(ие) вещество(а), вещество(а) покрытия, солюбилизирующее(ие) вещество(а), буферное(ые) вещество(а), ароматизатор(ы), поверхностно-активное(ые) вещество(а), загуститель(и), консервант(ы) (содержащий(ие) антиоксиданты) и т.п., и вещества, включенные в препарат для придания ему изотоничности относительно крови намеченного получателя.
Примеры подходящих связующих веществ включают крахмал, желатин, натуральные сахара, например, глюкозу, безводную лактозу, сыпучую лактозу, бета-лактозу, кукурузные подсластители, натуральные и синтетические смолы, например, гуммиарабик, трагакантовую камедь или альгинат натрия, карбоксиметилцеллюлозу и полиэтиленгликоль.
Примеры подходящих лубрикантов содержат олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п.
В фармацевтическую композицию можно включать консерванты, стабилизаторы, красители и даже ароматизаторы. Примеры консервантов включают бензоат натрия, сорбиновую кислоту и сложные эфиры p-оксибензойной кислоты. Возможно также использование антиоксидантов и суспендирующих веществ.
Фармацевтические препараты содержат препараты, подходящие для перорального, местного (в том числе, кожного, трансбуккального и подъязычного), ректального или парентерального (в том числе, подкожного, внутрикожного, внутримышечного и внутривенного), назального и внутрилегочного, например, ингаляционного введения. В подходящих случаях, препарат может быть представлен в виде отдельных единичных доз и может быть приготовлен любым из способов, широко известных в области фармацевтики. Все способы включают стадию объединения активного соединения с жидкими носителями или тонко измельченными твердофазными носителями, или и теми и другими и, затем, необязательно, стадию превращения продукта в требуемый препарат.
Фармацевтические препараты, подходящие для перорального введения, в которых носитель является твердым веществом, в наиболее предпочтительном варианте, представляют собой препараты в форме единичной дозы, например, болюсы, капсулы или таблетки, каждая из которых содержит предварительно заданное количество активного вещества. Таблетку можно изготавливать прессованием или формованием, необязательно, с, по меньшей мере, одним вспомогательным ингредиентом. Прессованные таблетки можно изготавливать на подходящей установке прессованием активного вещества, находящегося в сыпучей форме, например, порошка или гранул, необязательно, смешанного со связующим веществом, лубрикантом, инертным разбавителем, консервантом, поверхностно-активным веществом или диспергирующим веществом. Формованные таблетки можно изготавливать формованием активного вещества вместе с инертным жидким разбавителем. Таблетки необязательно можно покрывать оболочкой и, при изготовлении без покрытия, необязательно можно изготавливать надрезанными. Капсулы можно изготавливать посредством размещения активного вещества, одного или в смеси, по меньшей мере, с одним вспомогательным ингредиентом, в оболочку капсулы и, затем, герметизации включенных веществ обычным способом. Крахмальные облатки являются аналогами капсул, в которых активное вещество вместе с любым(и) вспомогательным(и) ингредиентом(ами) герметизируется в оболочке из рисовой бумаги. Препарат из активного вещества можно также готовить в виде диспергируемых гранул, которые, например, можно суспендировать в воде перед введением или рассыпать на пищу. Гранулы можно упаковывать, например, в пакет-саше. Препараты, подходящие для перорального введения, в которых носитель является жидкостью, могут представлять собой раствор или суспензию в водной или неводной жидкости, или в виде жидкой эмульсии масла в воде.
Препараты для перорального введения включают лекарственные формы с контролируемым высвобождением, например, таблетки, в которых препарат из активного вещества можно составлять в подходящей матрице, контролирующей высвобождение, или покрывать подходящей пленкой, контролирующей высвобождение. Данные препараты могут быть, в частности, подходящими для профилактического применения.
Фармацевтические препараты, подходящие для ректального введения, в которых носитель является твердым веществом, в наиболее предпочтительном варианте, представляют собой однодозовые суппозитории. Подходящие носители включают масло какао и другие материалы, обычно, применяемые в данной области. В подходящем варианте, суппозитории можно формировать смешиванием активного вещества с размягченным(и) или расплавленным(и) носителем(ями), с последующими охлаждением и формовкой в пресс-формах.
Фармацевтические препараты, подходящие для парентерального введения включают стерильные растворы или суспензии активного вещества в водных или масляных основах.
Инъецируемые препараты могут быть предназначены для болюсной инъекции или непрерывного вливания. В подходящем варианте, данные препараты представляют собой однодозовые или многодозовые контейнеры, которые запечатывают после наполнения препаратом, пока не возникает необходимость их применения. В альтернативном варианте, активное вещество может быть в порошковой форме, которую, перед применением, составляют с подходящей основой, например, стерильной апирогенной водой.
Препарат из активного соединения можно готовить также в форме препаратов длительного действия в форме депо, которые можно вводить посредством внутримышечной инъекции или посредством имплантации, например, подкожно или внутримышечно. Препараты замедленного действия могут содержать, например, приемлемые полимерные или гидрофобные материалы, или ионообменные смолы. Данные препараты длительного действия удобны, в частности, для профилактического применения.
Препараты, предназначенные для внутрилегочного введения через ротовую полость, представляют собой такую форму, что частицы, содержащие активное соединение и, желательно, имеющие диаметр в диапазоне от 0,5 до 7 микрометров, доставляются в бронхиальную сеть пациента.
В одном возможном варианте, данные препараты имеют форму тонко измельченных порошков, которые могут быть соответственно выполнены либо в прокалываемой капсуле, соответственно, например, желатиновой, для применения в ингаляционном устройстве или, в альтернативном варианте, в виде самораспыляющегося препарата, содержащего активное вещество, подходящий жидкий или газообразный пропеллент, необязательно, другие ингредиенты, например, поверхностно-активное вещество и/или твердый разбавитель. Приемлемые жидкие пропелленты включают пропан и хлорфторуглероды, и приемлемые газообразные пропелленты включают диоксид углерода. Возможно также использование самораспыляющихся препаратов, в которых активное вещество дозируется в форме капель раствора или суспензии.
Данные самораспыляющиеся препараты аналогичны препаратам, известным в данной области, и могут быть приготовлены с использованием установленных процедур. В приемлемом варианте, упомянутые препараты представляют в контейнере, снабженном либо управляемым вручную, либо автоматически функционирующим клапаном, обладающим требуемыми распылительными характеристиками; в предпочтительном варианте, клапан относится к типу дозирующих клапанов, подающих фиксированный объем, например, 25-100 микролитров, при каждом срабатывании клапана.
В дополнительном возможном варианте, активное вещество может быть в форме раствора или суспензии для применения в аэрозольном ингаляторе или распылителе, в котором используется скоростной воздушный поток или ультразвуковое воздействие для создания мелкокапельного тумана для ингаляции.
Препараты, подходящие для назального введения, включают препараты, в общем, сходные с вышеописанными препаратами для внутрилегочного введения. При дозировании желательно, чтобы упомянутые препараты содержали частицы с диаметрами в диапазоне от 10 до 200 микрометров для создания возможности удерживания их в полости носа; что можно обеспечить посредством применения, в соответствующих случаях, порошка из частиц подходящих размеров или выбора соответствующего клапана. Другие подходящие препараты содержат крупнодисперсные порошки, содержащие частицы с диаметром в диапазоне от 20 до 500 микрометров, для введения быстрым вдыханием через носовой ход из контейнера, удерживаемого поблизости от носа, и назальные капли, содержащие 0,2-5% масс./об. активного вещества в водном(ой) или масляном(ой) растворе или суспензии.
Фармацевтически приемлемые носители широко известны специалистам в данной области и содержат, но без ограничения, 0,1 M и, предпочтительно, 0,05 М фосфатный буфер или 0,8% физиологический раствор. Кроме того, упомянутые фармацевтически приемлемые носители могут быть водными или неводными растворами, суспензиями и эмульсиями. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, например, оливковое масло, и инъецируемые сложные органические эфиры, например, этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, содержащие физиологический раствор и буферные среды. Парентеральные основы включают раствор хлорида натрия, раствор Рингера с декстрозой, декстрозу и хлорид натрия, раствор Рингера с лактозой или нелетучие масла. Возможно также присутствие консервантов и других добавок, например, противобактериальных веществ, антиоксидантов, хелатов, инертных газов и т.п.
Препараты, подходящие в качестве местнодействующих препаратов, могут быть представлены, например, в форме гелей, кремов или мазей. Данные препараты можно наносить, например, на рану или язву, либо непосредственным нанесением на поверхность раны или язвы, либо с предварительным нанесением на подходящую подкладку, например, бинт, марлю, сетку или подобное, что можно наносить на участок, подлежащий лечению, или поверх него.
Можно также предоставить жидкие или порошковые препараты, которые можно распылять или набрызгивать непосредственно на место, подлежащее лечению, например, рану или язву. В альтернативном варианте, носитель, например, бинт, марлю, сетку или что-то подобное, можно покрывать препаратом распылением или набрызгиванием и, затем, накладывать на место, подлежащее лечению.
В соответствии с дополнительным аспектом изобретения, предлагается способ приготовления вышеописанной фармацевтической или ветеринарной композиции, где способ включает стадию объединения активного(ных) соединения(ий) с носителем, например, смешиванием.
В общем, препараты приготавливают посредством равномерного и непосредственного объединения активного вещества с жидкими носителями или тонко измельченными твердыми носителями, или и теми и другими и, затем, при необходимости, формирования продукта. Настоящее изобретение распространяется на способы приготовления фармацевтической композиции, содержащие объединение вещества с фармацевтически или ветеринарно приемлемым носителем или основой.
Лечебные применения
В другом аспекте, изобретение относится к способу ингибирования роста и распространения раковых клеток и других клеток, претерпевших эпителиально-мезенхимальный переход (EMT), у нуждающегося в этом субъекта, где упомянутый способ включает введение ингибитора Axl упомянутому субъекту.
В контексте настоящего изобретения, «ингибирование эпителиально-мезенхимального перехода» относится к уменьшению числа клеток, претерпевающих и претерпевших эпителиально-мезенхимальный переход (EMT), у субъекта.
В одном предпочтительном варианте осуществления, нуждающийся в этом субъект страдает от рака.
В предпочтительном варианте, когда субъект страдает от рака, способ в соответствии с изобретением ингибирует опухолевые клетки, претерпевшие эпителиально-мезенхимальный переход (EMT), в такой степени, что раковые клетки не способны к метастазированию, т.е. ингибирование является таким, что рак не развивается в метастатический рак, или что уже метастазировавшие клетки не способны расти в удаленных места в теле.
В одном особенно предпочтительном варианте осуществления, способ в соответствии с изобретением препятствует клеткам, которые уже совершили эпителиально-мезенхимальный переход (EMT), распространяться в удаленные места в теле, т.е. ингибирование является таким, что распространение метастатических клеток, зависящих от эпителиально-мезенхимального перехода (EMT) исключается.
Другой аспект изобретения относится к способу лечения метастатического рака у нуждающегося в этом субъекта, где упомянутый способ включает ингибирование опухолевых клеток, претерпевающих эпителиально-мезенхимальный переход (EMT) посредством введения ингибитора Axl упомянутому субъекту.
В контексте настоящего изобретения, термин «ингибитор Axl» относится к молекуле, которая способна ингибировать Axl, путей передачи сигналов Axl или любого, по меньшей мере, одного компонента пути передачи сигналов Axl. В одном варианте осуществления, молекула будет способна ослаблять или предотвращать экспрессию Axl или белка Axl.
В одном особенно предпочтительном варианте осуществления, ингибитор Axl является антителом к Axl.
В одном особенно предпочтительном варианте осуществления, ингибитор Axl является низкомолекулярным ингибитором киназ. Примером подобного низкомолекулярного ингибитора является R428, описанный в публикации Holland et al 2010.
В одном особенно предпочтительном варианте осуществления, субъект является млекопитающим, более предпочтительно, человеком.
В предпочтительном варианте, рак является раком молочной железы, предстательной железы, глиомой, раком легких, поджелудочной железы.
Метастазирование является причиной 90% смертных случаев, связанных с раком. Понимание молекулярных механизмов, которые делают возможным метастазирование опухолевых клеток, является очень важным вопросом здравоохранения. Авторы настоящего изобретения показали, что рецепторная тирозинкиназа является мощным прогностическим признаком общей низкой выживаемости пациенток после первичного рака молочной железы, выявленного методом маммографии.
Клетки метастатического рака молочной железы нуждаются в экспрессии Axl для сохранения инвазивного злокачественного фенотипа и для формирования опухолей молочной железы в разных микросредах. Индуцирование эпителиально-мезенхимального перехода (EMT) в эпителиальных клетках молочной железы выполняет повышающую регуляцию экспрессии Axl, устанавливающую петлю аутокринной передачи сигналов в/из его лиганда, Gas6. Ингибирование экспрессии Axl предотвращает метастатическое распространение из ортотопических мест в молочной железе в лимфатические узлы и важные органы. Следовательно, нежелательная, EMT-зависимая активация Axl во время ранних злокачественных переходов может спровоцировать метастазирование и отрицательно сказаться на общей выживаемости пациентов. Поэтому, нарушение передачи сигналов Axl с использованием установленных стратегий лечения представляет многообещающую перспективу для разработки терапевтического лечения пролиферативных клеточных нарушений, например, рака молочной железы, и нарушений, опосредованных подвижностью клеток и выживаемостью клеток.
Другой аспект изобретения относится к применению ингибитора Axl при приготовлении лекарственного препарата для ингибирования или обращения эпителиально-мезенхимального перехода (EMT).
Еще один аспект изобретения относится к применению ингибитора Axl при приготовлении лекарственного препарата для лечения метастатического рака посредством ингибирования опухолевых клеток, зависящих от эпителиально-мезенхимального перехода (EMT).
В соответствии с другим аспектом, изобретение относится к способу лечения метастатического рака или рака в последней стадии у нуждающегося в этом субъекта, где упомянутый способ включает введение ингибитора Axl упомянутому субъекту.
В соответствии с другим аспектом, изобретение относится к применению ингибитора Axl при приготовлении лекарственного препарата для лечения метастатического рака или рака в последней стадии.
В соответствии с другим аспектом, изобретение относится к способу ингибирования метастазирования у нуждающегося в этом субъекта, где упомянутый способ включает введение ингибитора Axl упомянутому субъекту.
Другой аспект относится к способу ингибирования EMT-индуцированной инвазивности (индуцированной эпителиально-мезенхимальным переходом) у субъекта, страдающего от рака, где упомянутый способ включает введение ингибитора Axl упомянутому субъекту.
Еще один аспект изобретения относится применению ингибитора Axl при приготовлении лекарственного препарата для ингибирования EMT-индуцированной инвазивности у субъекта, страдающего от рака.
В предпочтительном варианте, ингибитор Axl является антителом к Axl или низкомолекулярным ингибитором.
Введение
Фармацевтические композиции в соответствии с настоящим изобретением могут быть предназначены для ректального, назального, внутрибронхиального, местного (в том числе, трансбуккального и подъязычного), вагинального или парентерального (в том числе, подкожного внутримышечного, внутривенного, внутриартериального и интрадермального), интраперитонеального или внутриоболочечного введения. В предпочтительном варианте, препарат является препаратом для перорального введения. В подходящем варианте исполнения, препараты могут быть представлены в единичной дозированной форме, т.е. в форме дискретных порций, содержащих единичную или множественную дозу или часть единичной дозы. Например, препараты могут в форме таблеток и капсул с пролонгированным действием и могут быть приготовлены любым способом, широко известным в области фармацевтики.
Препараты для перорального введения в настоящем изобретении могут быть представлены в виде: отдельных единиц, например, капсул, желатиновых пилюль, капель, облаток, драже или таблеток, каждая из которых содержит предварительно заданное количество активного вещества; в виде порошка или гранул; в виде раствора, эмульсии или суспензии активного вещества в водной жидкости или неводной жидкости; или в виде жидкой эмульсии масла в воде или жидкой эмульсии воды в масле; или в виде болюса и т.п. В предпочтительном варианте, упомянутые композиции содержат от 1 до, по меньшей мере, 250 мг, предпочтительно, 10-100 мг активного ингредиента на дозу.
Применительно к композициям для перорального введения (например, таблеток и капсул), термин «приемлемая основа» включает такие основы, как обычные эксципиенты, например, связующие вещества, например, сироп, гуммиарабик, желатин, сорбит, трагакантовую камедь, поливинилпирролидон (Повидон), метилцеллюлозу, этилцеллюлозу, натрий-карбоксиметилцеллюлозу, гидроксипропил-метилцеллюлозу, сахарозу и крахмал; наполнители и носители, например, кукурузный крахмал, желатин, лактозу, сахарозу, микрокристаллическую целлюлозу, каолин, маннитол, кислый фосфат кальция, хлорид натрия и альгиновую кислоту; и лубриканты, например, стеарат магния, стеарат натрия и стеараты других металлов, глицерин стеарат, стеариновую кислоту, силиконовую жидкость, тальк, воски, масла и коллоидальную окись кремния. Возможно также использование ароматизаторов, например, перечной мяты, винтергреневого масла, вишневого ароматизатора и т.п. Возможно, потребуется добавление красителя, чтобы сделать лекарственную форму легко отличимой. Таблетки могут быть также покрыты с использованием способов, широко известных в данной области.
Таблетки можно изготавливать прессованием или формованием, необязательно, с, по меньшей мере, одним вспомогательным ингредиентом. Прессованные таблетки можно изготавливать на подходящей установке прессованием активного вещества, находящегося в сыпучей форме, например, порошка или гранул, необязательно, смешанного со связующим веществом, лубрикантом, инертным разбавителем, консервантом, поверхностно-активным веществом или диспергирующим веществом. Формованные таблетки можно изготавливать на подходящей установке формованием смеси порошкового соединения с инертным жидким разбавителем. Таблетки можно, необязательно, покрывать оболочкой или выполнять надрезанными и можно составлять так, чтобы обеспечивать замедленное или контролируемое высвобождение активного вещества.
Другие препараты, подходящие для перорального введения, содержат леденцы, содержащие активное вещество в ароматизированной основе, обычно, сахарозе и гуммиарабике или трагакантовой камеди; пастилки, содержащие активное вещество в инертной основе, например, желатине и глицерине или сахарозе и гуммиарабике; и жидкости для полоскания рта, содержащие активное вещество в подходящем жидком носителе.
Другие формы введения содержат растворы или эмульсии, которые можно вводить посредством внутривенной, внутриартериальной, внутриоболочечной, подкожной, внутрикожной, интраперитонеальной или внутримышечной инъекции, и которые приготовлены из стерильных или стерилизуемых растворов. Инъецируемые формы, обычно, содержат от 10 до 1000 мг, предпочтительно, от 10 до 250 мг активного ингредиента на дозу.
Фармацевтические композиции в соответствии с настоящим изобретением могут быть также в форме суппозиториев, пессариев, суспензий, эмульсий, лосьонов, мазей, кремов, гелей, спреев, растворов или присыпок.
Альтернативные средства чрескожного введения состоят в применении накожного пластыря. Например, активный ингредиент может быть включен в состав крема, состоящего из водной эмульсии полиэтиленгликолей или жидкого парафина. Активный ингредиент может быть также включен в концентрации от 1 до 10% по массе в состав мази, состоящей из белого воска или белой мягкой парафиновой основы, вместе с такими стабилизаторами и консервантами, которые могут потребоваться.
Дозировка
Специалисту со средним уровнем компетентности в данной области может без затруднений определить соответствующую дозу одной из растворимых композиций для введения субъекту, без ненужных экспериментов. Обычно, врач будет определять фактическую дозу, которая будет наиболее подходящей для отдельного пациента, и упомянутая доза будет зависеть от множества различных факторов, включающих активность конкретного используемого вещества, метаболическую стабильность и длительность действия упомянутого вещества, возраст, массу тела, общее состояние здоровья, пол, питание, режим и время введения, скорость выведения из организма, сочетание лекарств, тяжесть конкретного состояния и состояния лица, проходящего терапию. Дозировки, описанные в настоящей заявке, являются примерами усредненных случаев. Разумеется, при этом могут существовать индивидуальные случаи, которые предполагают применение диапазонов с большей или меньшей дозировкой, и данные случаи находятся в пределах объема настоящего изобретения.
В соответствии с настоящим изобретением, для ингибирования Axl можно вводить эффективное количество вещества. Разумеется, упомянутую величину дозировки будут дополнительно модифицировать в соответствии с типом введения вещества. Например, чтобы обеспечить «эффективное количество» для неотложной терапии, предпочтительно парентеральное введение. Наиболее эффективной является внутривенная инфузия соединения в 5% декстрозе в воде или нормальном физиологическом растворе или аналогичного препарата с приемлемыми эксципиентами, хотя, полезна также внутримышечная болюсная инъекция. Обычно, парентеральная доза будет составлять от приблизительно 0,01 до приблизительно 100 мг/кг; предпочтительно, от 0,1 до 20 мг/кг, с таким введением, чтобы поддерживать концентрацию лекарства в плазме на уровне концентрации, эффективной для ингибирования киназы. Вещества можно вводить от одного до четырех раз в сутки, с уровнем, необходимым для обеспечения суммарной ежедневной дозы от приблизительно 0,4 до приблизительно 400 мг/кг/сутки. Точное количество активного вещества, которое является терапевтически эффективным, и путь, по которому лучше всего вводить упомянутое вещество, легко определяются специалистом со средним уровнем компетентности в данной области посредством сравнения уровня вещества в крови с концентрацией, необходимой для получения терапевтического результата.
Вещества в соответствии с настоящим изобретением можно также вводить пациенту перорально, таким образом, чтобы концентрация лекарства была достаточной для обеспечения, по меньшей мере, одного из терапевтических признаков, описанных в настоящей заявке. Обычно, фармацевтическую композицию, содержащую вещество, вводят с пероральной дозой от приблизительно 0,1 до приблизительно 50 мг/кг таким способом, который соответствует состоянию пациента. В предпочтительном варианте, пероральная доза будет составлять от приблизительно 0,5 до приблизительно 20 мг/кг.
Вещества в соответствии с настоящим изобретением можно тестировать путем проведения одного из нескольких биологических анализов, чтобы определять концентрацию вещества, которая необходима для получения данного фармакологического результата.
Набор
Другой аспект изобретения относится к набору для оценки способности вещества ингибировать или обращать эпителиально-мезенхимальный переход (EMT), где упомянутый набор включает антитела к Axl.
Еще один аспект изобретения относится к набору для оценки способности вещества ингибировать или обращать эпителиально-мезенхимальный переход (EMT), где упомянутый набор включает нуклеиново-кислотный зонд для Axl.
Другой аспект изобретения относится к набору для оценки способности вещества ингибировать или обращать эпителиально-мезенхимальный переход (EMT), где упомянутый набор включает, по меньшей мере, один праймер QPCR (количественной полимеразной цепной реакции) для Axl.
Дополнительный аспект изобретения относится к применению вышеупомянутого набора в любом из вышеописанных способов.
Диагностика и прогнозирование
Изобретение относится также к применению Axl в качестве биомаркера при диагностике или прогнозировании заболеваний, характеризуемых пролиферативной активностью, в частности, у лиц, лечение которых проводят ингибиторами Axl.
В контексте настоящего изобретения, термин «способ прогнозирования» означает способ, который позволяет давать прогноз, касающийся прогрессирования заболевания человека или животного, у которого диагностировано заболевание, в частности, рак. В частности, представляющие интерес раковые заболевания включают раковые заболевания молочной железы, легки, желудка, головы и шеи, толстой и прямой кишок, почек, поджелудочной железы, матки, печени, мочевого пузыря, эндометрия и предстательной железы и лейкозы.
Термин «способ диагностики» означает, в контексте настоящего изобретения, способ, который позволяет определять присутствие или тип рака у человека или животного. В подходящем варианте, маркер позволяет оценивать успешность лечения ингибитором Axl. Как изложено выше, подходящие средства диагностики содержат зонды, предназначенные для любых из генов, идентифицированных в настоящем описании, например, праймеры QPCR (количественной полимеразной цепной реакции), зонды FISH (для флуоресцентной гибридизации in situ) и т.д.
Термин «способ прогнозирования» означает, в контексте настоящего изобретения, способ, который позволяет определять вероятность наличия у субъекта восприимчивости к лечению конкретным веществом/в конкретном режиме или способности поддаваться такому лечению. Данные способы прогнозирования обеспечивают информацию о вероятном результате конкретного режима лечения, например, вероятность реагирования субъекта на упомянутое лечение, и/или информацию о том, насколько интенсивно следует лечить человека при конкретном режиме лечения, и/или насколько интенсивно следует лечить человека с использованием обычных способов лечения, например, лучевой терапии/химиотерапии. Поэтому, способы прогнозирования, описанные в настоящей заявке, важны для применения в области индивидуализированного применения лекарственных средств.
Следовательно, один предпочтительный вариант осуществления относится к применению вышеописанного биомаркера при индивидуализированном применении лекарственных средств.
В одном предпочтительном варианте осуществления, индивидуализированное применение лекарственных средств предназначено для определения, будет ли субъект восприимчивым или поддающимся лечению ингибитором Axl.
В одном предпочтительном варианте осуществления, индивидуализированное применение лекарственных средств предназначено для определения, возможно ли, в частности, что субъект страдает от метастатического рака.
Другой аспект изобретения относится к способу прогнозирования для определения, будет ли субъект восприимчив к лечению ингибитором Axl, где упомянутый способ включает распознавание наступления эпителиально-мезенхимального перехода (EMT) у упомянутого субъекта.
Другой аспект изобретения относится к применению Axl в качестве биомаркера в прогностическом веществе для определения, будет ли субъект восприимчивым или поддающимся лечению ингибитором Axl.
Другой аспект изобретения относится к способу прогнозирования для определения, возможно ли, в частности, что субъект страдает от метастатического рака, где упомянутый способ включает распознавание наступления эпителиально-мезенхимального перехода (EMT) у упомянутого субъекта.
В предпочтительном варианте, вышеописанный способ прогнозирования включает следующие стадии:
(i) получение образца от упомянутого субъекта; и
(ii) определение экспрессии Axl в упомянутом образце, в сравнении с контрольным образцом, где повышающая регуляция экспрессии Axl относительно контрольного образца показывает восприимчивость к лечению ингибитором Axl и повышенную вероятность заболевания метастатическим раком.
В предпочтительном варианте, способы, описанные в настоящей спецификации, выполняют ex vivo.
В предпочтительном варианте, образец анализируют методом анализа белков, более предпочтительно, методами ELISA (твердофазного иммуноферментного анализа), PET (позитронной эмиссионной томографии), проточного цитометрического анализа, SELDI-TOF MS (времяпролетной масс-спектрометрии с лазерной десорбцией/ионизацией усиленной поверхности) или 2-D PAGE ((2-мерного электрофореза в полиакриламидном геле).
Настоящее изобретение дополнительно поясняется на нижеприведенных неограничивающих примерах и со ссылкой на нижеперечисленные фигуры, при этом:
На фиг. 1 показано, что экспрессия Axl является отрицательным прогностическим фактором в отношении выживаемости при раке молочной железы. (A) слабая (60%) и значительная экспрессия Axl по иммунохимическим данным. (B) Анализ Каплана-Мейера данных 8-летнего клинического последующего наблюдения. (C) Многомерный анализ. (D) Экспрессия Axl в согласованных парах (n=16) первичного и метастатического рака молочной железы у человека: первичные опухоли слева (верхняя: Axl-негативная, нижняя: Axl-позитивная), метастазы справа (верхний: в печени, нижний: костный). Экспрессия Axl, обычно, сильнее в метастазах, по сравнению с соответствующими первичными опухолями (p=0,11, тест МакНемара).
На фиг. 2 показано, что Axl необходима для инвазивности клеток рака молочной железы. (A) анализ методом FACS (флуоресцентно-активированной сортировки клеток) и (B) верстерн-блоттинга экспрессии Axl в эпиаллельных сериях клеток MB-MDA-231 рака молочной железы. (C) эпиаллельный анализ с фосфорилированием Axl посредством анализа инвазии в матригель (Matrigel), индуцированной сывороткой (D) или SDF-1 (E). 3-мерный анализ в матригеле (F, G) с MB-MDA-231/shLuc (верхние панели) и MB-MDA-231/shAxl2 (нижние панели).
На фиг. 3 показано, что активность Axl испытывает повышающую регуляцию индукторами EMT (эпителиально-мезенхимального перехода) в эпителиальных клетках молочной железы. (A) Проточный цитометрический анализ поверхностных уровней Axl на клеточной линии MCF10a, которые стабильно экспрессируют Twist. (B) Экстракты из контрольных (wt) и Twist-экспрессирующих клеток MCF10a анализировали на изменения эпителиальных (E-кадгерин, β-катенин) и мезенхимальных (N-кадгерин) маркеров. *Кондиционированную среду анализировали методами SDS-PAGE (электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия) и иммуноблоттинга, с использованием антитела к Gas6. (C) Клетки MCF10a, трансдуцированные ретровирусными векторами, кодирующие Twist, Zeb2, Slug, Snail, или контрольным вектором (GFP (зеленым флуоресцентным белком)), анализировали методом проточной цитометрии на поверхностную экспрессию Axl (слева) и средней геометрической интенсивностью флуоресценции (справа). (D) Экстракты из клеток MCF10a, трансдуцированных ретровирусными векторами Twist, Zeb2, Slug или Snail, анализировали методом иммуноблоттинга на изменения эпителиальных (E-кадгерин, β-катенин) и мезенхимальных (N-кадгерин, виментин) маркеров. (E) Морфология клеток MCF10a, трансдуцированных ретровирусными векторами Twist, Zeb2, Slug или Snail, через 72 часа после посева.
На фиг. 4 показано, что опухоли молочной железы, полученные методами тканевой инженерии, нуждаются в экспрессии Axl. (A) Визуализация in vivo имплантатов MDA-MB-231/GFP-Luc тканевой инженерии опухолей в NODSCID мыши. Рост опухоли во времени контролировали посредством оптической визуализации in vivo биолюминесценции люциферазы клеток MDA-MB-231/GFP-Luc (i). Данные измерений числа опухолевых клеток (суммарное число фотонов) и протяжение радиальной инфильтрации (диаметр сигнала), полученные от контрольных имплантатов (сплошная линия) и клеточных имплантатов, экспрессирующих MDA-MB-231/GFP-Luc-shAxl2 (пунктирная линия), показывают зависимость от Axl для роста опухоли и колонизации в клеточных каркасах тканевой инженерии из полимолочной кислоты (ii). Вид двухстороннего клеточного каркаса после эксцизии (iii). Иммуногистохимический анализ опухолей, полученных тканевой инженерией, с помощью антител к Axl человека, на 28 сутки после имплантации (левая панель, контрольный вектор; правая панель, shAxl2) (iv). Имплантаты тканевой инженерии опухолей с контрольным образцом немутантного типа (левая панель) и клетки, экспрессирующие shAxl2, (правая панель) анализировали иммуногистохимическим методом с помощью антител к Axl человека (v). Черные квадраты разграничивают колонизацию и радиальное распространение клеток MDA-MB-231/GFP Luc. *p<0,05, **p<0,005 (парный t-тест) в сравнении с контрольным образцом. N=6 мышей/группа. (B) Визуализация in vivo во времени трехклеточных имплантатов, содержащих первичные клетки микрососудов человека (EC), гладкомышечные клетки сосудов (SMC) и клетки MDA-MB-231/GFP Luc (i). Данные измерений роста (суммарное число фотонов) и радиального распространения (диаметр) опухоли в контрольном образце (сплошная линия) и имплантаты клеток MDA-MB-231, экспрессирующих shAxl2, (прерывистая линия), исследованные в присутствии сосудистой сети, созданной методом тканевой инженерии (ii). Вырезанные опухоли (на 28 сутки) сильно васкуляризированы сконструированными микрососудами человека (iii). Иммуногистохимический анализ показывает, что сконструированные сосуды, окрашивающие античеловеческие антитела CD31, содержат интралюминальные эритроциты (вкладка), указывающие на раскрытое состояние и перфузию (iv: левая панель, контрольный вектор; правая панель, shAxl-2). *p<0,05, **p<0,005, ***p<0,0005 (парный t-тест), в сравнении с контрольным образцом. N=7 мышей/группу. Диаметр сосудов (слева) внутри клеточного каркаса остается неизменным, а плотность микрососудов (справа) немного увеличена в опухолях MDA-MB-231, созданных методом тканевой инженерии, ингибированных экспрессией shAxl2.
На фиг. 5 показано, что эпиаллельный анализ in vivo обнаруживает отчетливый порог экспрессии Axl, необходимый для образования опухоли молочной железы. (A) Визуализация in vivo во времени биолюминесценции подкожных ксенотрансплантатов эпиаллельных MDA-MB-231/GFP-Luc у мышей NOD/SCID/B2mnull, содержащих экспрессию Axl, подвергнутую изменениям с помощью нацеленных на Axl короткошпилечных РНК shAxl278 (i), shAxl280 (ii) и shAxl2 (iii), в сравнении с контрольной, неэффективной, нацеленной на Axl короткошпилечной РНК (shAxl279). (C) Гистограммы отражают средние изменения числа фотонов и диаметров опухолей на основании анализа методом оптической визуализации опухолей. Данные измерений роста опухолей из эпиаллельных MDA-MB-231/GFP-Luc (суммарное число фотонов) и радиальной инфильтрации (диаметр сигнала) нормировали относительно shAxl279 (неэффективной короткошпилечной РНК) (ii). (D) График зависимости роста опухоли (по данным 28-суточных измерений) от нокдауна Axl показывает терапевтический порог (80% снижение экспрессии). *p<0,05, **p<0,005 (парный t-тест), в сравнении с контрольным образцом. N=6 мышей/группа.
На фиг. 6 показано, что Axl необходима для метастазирования клеток рака молочной железы. (A) Первичная опухоль и метастаз, контролируемые in vivo, I. Ортотропный рост (верхняя панель) и метастаз в лимфатический узел со временем (нижняя панель). II, Рост первичной опухоли, контролируемый методом оптической визуализации in vivo (GE Explore Optix), немутантного типа (сплошная линия) и имплантатов РНК-интерференции (RNAi) Axl (пунктирная линия). (B) Обнаружение метастазирования в разные органы. (C) Обнаружение ex vivo клеток рака молочной железы. I, Изображения вырезанных органов. II, Гистологический анализ тех же тканей подтвердил метастазирование (стрелка) в разные органы. (D) Сравнение по (логранговому) критерию Манна-Уитни между контрольными (вектор) мышами и мышами с ортотопической инъекцией shAxl2 показывает повышение выживаемости мышей с опухолью MDA-MB-231-D3H2LN/GFP-Luc-shAxl2 (P=0,013).
На фиг. 7 показано, что Axl необходима для рецидива после иммунной реакции и метастазирования сингенных клеток рака молочной железы у мышей BALB/c. (A) Клетки 4T1-GFP-Luc рака молочной железы мыши, экспрессирующие нацеленную на Axl мыши короткошпилечную РНК (shmAxl2) или нацеленную на Axl человека короткошпилечную РНК (shAxl279), анализировали методом проточной цитометрии для поверхностной экспрессии Axl мыши или изотипного контрольного образца. (B) Визуализация in vivo во времени биолюминесценции от введенных в мышей BALB/c посредством ортотропической инъекции (в жировую подушку молочной железы) клеток 4T1-GFP-Luc, экспрессирующих либо нацеленную на Axl мыши короткошпилечную РНК (4T1-GFP-LucshmAxl2), либо отрицательную контрольную, специфическую к человеку короткошпилечную РНК (4T1-GFP-Luc-shAxl279) (i). Количественная оценка биолюминесценции всего тела (суммарное число фотонов) в образцах контрольном (4T1-GFP-Luc shAxl279, сплошная линия) и с нокдауном Axl (4T1-GFP-Luc-shmAxl2, серая линия), введенных в мышей BALB/c инъекцией, через 8-недельный период (ii). *p<0,05 (t-тест), N=7 мышей/группа. (C) Обследование спонтанного метастазирования (через 8 недель после ортотопической имплантации) в разные органы, контролируемые посредством обнаружения биолюминесценции ex vivo клеток 4T1-GFP-Luc в вырезанных органах из контрольного образца или мышей BALB/c, содержащих опухоли с нокдауном Axl.
На фиг. 8 показана последовательность для вектора L383 pCSI Puro2AGFP2ALuc2.
На фиг. 9, панели A, показан проточный цитометрический анализ клеток MCF10a, трансдуцированных конструкциями Slug или Ha-Ras (pBABE puro H-Ras V12, Addgene), анализируемых с использованием совместной экспрессии GFP (зеленого флуоресцентного белка); экспрессия Ha-Ras выбрана посредством обработки пуромицином в течение 48 часов. Экспрессия Slug и Ha-Ras в клетках MCF10a приводила к резкому повышению поверхностной экспрессии маркера CD44 раковых стволовых клеток.
На фиг. 9, панели B, показана поверхностная экспрессия Axl в клетках MCF10a, кодирующих Lsug, Ras. Поверхностная экспрессия Axl коррелируется с присутствием CD44 и мезенхимальными признаками как при Slug-, так и при Ha-Ras-индуцированном EMT (эпителиально-мезенхимальном переходе).
На фиг. 9, панели C, показана мезенхимальная морфология клеток MCF10a, экспрессирующих Slug или Ha-Ras, через 72 часа после посева, сортированных методом FACS (флуоресцентно-активированной сортировки клеток) для субпопуляций, экспрессирующих CD44 с высоким (CD44+) и низким (CD44-) содержанием CD44. Клетки CD44- демонстрируют эпителиальную морфологию, а клетки MCF10 CD44+ демонстрируют удлиненную мезенхимальную морфологию.
На фиг. 9, панели D, показан анализ вестерн-блоттинг клеток MCF10a CD44- и CD44+, трансдуцированных ретровирусными векторами, кодирующими Slug, Ras. Клетки MCF10a CD44- сохраняли экспрессию белка эпителия соединительной связки и цитоскелета. Напротив, клетки CD44+ показали интенсивную экспрессию мезенхимального маркера (виментин, N-кадгерин) и недостаток E-кадгерина, что свидетельствует о EMT (эпителиально-мезенхимальном переходе).
На фиг. 9, панели E, показан рост клеток MCF10a CD44+ и CD44-, экспрессирующих Slug и Ha-Ras, в 3-мерном матригеле. Клетки MCF10a CD44+, экспрессирующие Axl, являются инвазивными соответственно мезенхимальному фенотипу.
На фиг. 10 показано, что клетки MCF10a экспрессируют, соответственно, (сверху, вестерн-блот, общий лизат) и секретируют (середина, вестерн-блот, кондиционированная среда) Gas6, который становится клеточно-ассоциированным (внизу, антитело к Gas6, проточный цитометрический анализ) при Slug- и Snail-индуцированной экспрессии Axl.
На фиг. 11 показано, что клетки MDA-MB-231 экспрессируют, соответственно, лиганд Axl, Gas6. (сверху, вестерн-блот, общий лизат, который является, в основном, клеточно-ассоциированным; середина, вестьерн-блот, кондиционированная среда; внизу, антитело к Gas6, проточный цитометрический анализ). Нокдаун Axl снижет клеточно-ассоциированный Gas6, при повышении уровней в кондиционированной среде (Gas6*), без влияния на общую экспрессию.
ПРИМЕРЫ
МАТЕРИАЛЫ И МЕТОДЫ
Плазмиды и антитела
Все короткошпилечные РНК (shRNA) экспрессировали из модифицированного промотора гена U6 человека в LTR (большом концевом повторе) ретровирусных векторов RRI-Red/ L087 (Genbank: EU424173), используемых для трансформации клеток MDA-MB-231 с помощью ретровирусного инфицирования. RRI-Red экспрессирует также Puro2AmRed1, приводящего к резистентности к пуромицину и красной флуоресценции в успешно трансформированных клетках. Все нуклеотиды кДНК Axl нумеруются как в Genbank: BC032229.
Использовали следующие последовательности: Axl2; (шпильки обозначены строчными буквами)
GACATCCTCTTTCTCCTGCGAAGCCCATctggtcATGGGCTTCGCAGGAGAAAGAGGATGTC, shAxl278;
ACGGGTCTCCTTCTTTCGCCGttggatccctggtcggatccaaCGGCGAAAGAAGGAGACCCG, shAxl279;
GCTTCAGGCGATTTCCCCGGCGttggatccctggtcggatccaaCGCCGGGGAAATCGCCTGAAGC, shAxl280;
ATGCACGCCCAGCCGCACAGCGttggatccctggtcggatccaaCGCTGTGCGGCTGGGCGTGCAT shLuc;
GATTATGTCCGGTTATGTAAACAATCCGGctggtcCCGGATTGTTTACATAACCGGACATAATC.
Ретровирусный вектор экспрессии L383 pCSI Puro2AGFP2ALuc2 (см. фиг. 8) создавали в несколько стадий путем клонирования кодирующих последовательностей пуромицин-N-ацетилтрансферазы, EGFP (предшественника эпидермального фактора роста) и люциферазы светляков в ретровирусный вектор экспрессии CRU5 (Blø et al., 2007). Каждую открытую рамку считывания отделяли от следующей линкером, кодирующим область 2A (XXSGLRSGQLLNFDLLKLAGDVESNPGP) из вируса ящура. Данная последовательность подвергалась котрансляционному расщеплению, приводящему к образованию, приблизительно, стехиометрических количеств каждого белка (Lorens 2004). Плазмиды, экспрессирующие hSnail, hSlug и hZEB2, конструировали клонированием соответствующих фрагментов из конструкций BC012910, BC015895 и BC060819 (Open Biosystem), соответственно, в ретровирусный вектор CRU5-IRES-GFP (Lorens et al 2000). Использовали два антитела к Axl человека; мышиное моноклональное антитело к Axl человека (MAB154, R&D Systems) и козье антитело к Axl человека (M-20, Santa Cruz). Кроме того, использовали следующие антитела; кроличье антитело к pAxl человека (Y779, R&D), крысиное антитело к Snail человека (SN9H2, Cell Signaling), мышиное антитело к Slug человека (L40Cb, Cell Signaling), кроличье антитело к E-кадгерину человека (24E10, Cell Signaling), кроличье антитело к N-кадгерину человека (ab18203, Abeam), актин, мышиное антитело к бета-катенину человека (L54E2, Cell Signaling), мышиное антитело к Gas6 человека (R&D Systems), кроличье антитело к Twist человека (Twist2C1a, Abeam).
Культура клеток, ретровирусные трансдукции и анализ клеточной пролиферации
Все клетки культивировали при 37°C, 5% CO2. Клетки Phoenix A (Dr. Gary Nolan, Stanford), клетки эпителиального рака молочной железы человека MDA-MB-231 (American Type Culture Collection, Rockville, MD), эндотелиальные клетки микрососудов человеческой кожи (HMVEC), и гладкомышечные клетки легочных артерий (PASMC) (Cambrex, Walkersville, MD, USA) выдерживали, как описано выше (Holland 2005). Клональную клеточную линию MDA-MB-231-DH3L2N (Xenogen Corporation, Alameda, CA, USA) культивировали в среде MEM/EBSS, минимально необходимой среде со сбалансированным солевым раствором Ирла, дополненным 10% FBS (фосфатным буферным раствором), 1% заменимых аминокислот, 1% L-глютамином и 1% пирувата натрия. Клетки Phoenix A трансфицировали с использованием способа на основе фосфата кальция (Swift, 1999). Приблизительно, через 30 часов после трансфицирования, среду изменили на питательную среду для клеток, подлежащих инфицированию, дополненную 10% FBS. Инфицирующий супернатант собрали через ~48 часов после трансфицирования. На клетки-мишени воздействовали супернатантом, содержащим 5 мг/мл сульфата протамина, в течение ночи. Инфицированные клетки собрали 1-мкг/мл пуромицином. Выполнили анализ клеточной пролиферации, чтобы проанализировать пролиферативный потенциал разных клеток с нокдауном Axl, в сравнении с контрольной линией клеток, с использованием анализа MTS (гена) от компании Promega. Клетки высевали на 96-луночные культуральные планшеты, либо без обработки, либо с покрытием 20 мкл коллагена (из Rat tail, Roche), либо фибронектина (Sigma), либо матригеля (BD Biosciences). По 2000 клеток в 100 мкл среды высевали в трех экземплярах на 96-луночные планшеты и анализировали через каждые 24 часа, с использованием анализа MTS от компании Promega в соответствии с инструкциями производителя.
Иммунное окрашивание, проточная цитометрия и клеточный сортинг
Клетки MDA-MB-231 трипсинизировали с использованием стандартных процедур и промывали в PBS-0,2% BSA перед окрашиванием антителом к Axl (#MAB154, R&D Systems), при конечной концентрации 5 мг/мл в PBS-0,2 % BSA, в течение 40 минут, при комнатной температуре. Клетки промывали дважды в PBS-0,2% BSA и инкубировали с вторичным антителом (козьим антителом к APC мыши) (аллофикоцианин сшитый, молекулярные зонды), при конечной концентрации 0,2 мг/мл, в течение 30 минут при комнатной температуре, в темноте. Клетки промывали дважды в PBS-2 % BSA и повторно суспендировали в 300 мл PBS-0,2 % BSA перед анализом на проточном цитометре FacsCalibur (BD Biosciences). Анализы данных выполняли с использованием программного обеспечения FlowJo (Tree Star, Inc., Ashland, OR, USA). Клетки, экспрессирующие высокие уровни GFP (зеленого флуоресцентного белка), RFP (красного флуоресцентного белка) и низкий уровень Axl (короткоцепочечную РНК), выделяли с помощью средства FACSAria SORP, с длинами волн лазера 488 нм, 532 нм, 638 нм и 407 нм для создания стабильных, однородных популяций клеток.
Экстракты белков, SDS-PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия), иммуноблоттинг и иммунопреципитация
Клетки лизировали в буфере для RIPA (радиоиммунопреципитационного анализа) (PBS с 1% (об./об.) Nonidet P-40 (NP-40), 0,5% (мас./об.) деоксихолата натрия, 0,1% (мас./об.) SDS (додецилсульфата натрия)), с добавлением ингибитора протеазы (Complete Mini, без EDTA (этилендиаминтетрауксусной кислоты), Roche #13457200) и 0,2-мМ PMSF (фенилметилсульфонилфторида). SDS-PAGE и иммуноблоттинг выполняли в соответствии со стандартными процедурами. Для иммунопреципитации, клетки лизировали в буфере NP-40 (10% глицерина, 1% NP-40, 50-мМ Трис (трис(гидроксиметил)аминометана) с уровнем pH 7,4, 0,2-М NaCl, 2,5-мМ MgCI2) с добавлением смеси из ингибитора протеазы и ингибитора фосфатазы, PhosSTOP (Roche). Экстракты инкубировали с антителом, связанные с гранулами A/G-белков, в течение 1 часа при 4°C, и гранулы промывали в буфере NP-40 четыре раза перед элюированием.
Анализ инвазии и 3-мерный анализ в матригеле
Анализ по хемоинвазии в камере Бойдена (Albini et al 2004) выполняли с использованием культуральных вставок BDFalcon (8 мкм) компании Becton Dickinson, 24-луночного планшета Falcon multiwellTM и матригеля с пониженным содержанием факторов роста от компании BD. Вставки покрывали изнутри матригелем, разведенным бессывороточной средой до окончательной концентрации 30 мкг матригеля на каждую вставку. Работу с матригелем выполняли при 4°C до отвердения в течение 30 минут при 37°C. 5×105 клеток, повторно суспендированных в бессывороточной клеточной среде с 0,1% BSA (альбумином бычьей сыворотки), добавили сверху каждой вставки. Клеточная среда, обогащенная FBS, действует как хемоаттрактант. Через 20 часов инкубирования при 37°C с 5% CO2, клетки внутри камеры удалили ватным тампоном. Клетки с другой стороны мембраны фиксировали и, затем, окрашивали реактивом DAPI (4,6-диамидин-2-фенилиндол; йодидом пропидия). Изображения получали с использованием флуоресцентного микроскопа, и клетки считали с использованием ImageJ (http://rsb.info.nih.gov/nih-imageJ, Wayne Rasband.National).
3-мерные анализы модифицировали по Sandal et al 2007; 30000 клеток высевали на гель, и культуры оставляли для роста на 10-12 суток перед их анализом.
Клинические образцы
Настоящую серию заболеваний раком молочной железы выбрали из Программы скрининга рака молочной железы населения Норвегии (Hordaland County), которая была начата в 1996 г. с использованием маммографии в двух проекциях, выполняемой через каждый 24 месяца. Вкратце, во время первых двух интервалов скрининга обнаружилось 95 инвазивных интервальных раковых заболеваний (1996-2001), и данные заболевания согласовали по размеру с 95 обнаруженными скринингом опухолями из общего числа 317 инвазивных опухолей во время первых двух циклов (медианный диаметр 15,6 и 15,7 мм, соответственно). После согласования, средние размеры опухолей для обнаруженных скринингом и интервальных случаев составляли 25,1 и 23,1 мм, соответственно, и соответствующий средний возраст в данных группах составлял 62 года и 59 лет. Кроме возраста и диаметра опухоли (по данным патологического исследования), при диагностике записывали такие основные характеристики, как плотность молочной железы, гистологический тип, гистологическую степень, метастазы лимфатических узлов и удаленные метастазы. Медианное время от последней маммограммы до диагностики интервального рака составляло 17,1 месяцев. Датой последнего наблюдения было 31 ноября 2004 г., и медианное время последующего наблюдения (выживших наблюдаемых) составило 72 месяца. В период последующего наблюдения, 31 пациенток умерло от рака молочной железы.
Иммуногистохимическое исследование
В настоящем исследовании использовали слайды тканевых микроматриц. Метод тканевых микроматриц сберегает ткани и апробирован в ходе нескольких исследований. Иммуногистохимическое исследование выполняли на 5-мкм по толщине срезах тканей, зафиксированных в формалине и залитых в парафин. Извлечение антигенов выполняли кипячением в течение 10 минут при мощности 750 Вт и 20 мин при мощности 350 Вт в буферированном TRS (растворе для выявления антигенов; DakoCytomation, Denmark, AS), с уровнем pH 6,0, в микроволновой печи. Для окрашивания использовали образцы DakoCytomation Autostainer.
Слайды инкубировали всю ночь при комнатной температуре с поликлональным антителом к Axl (H-124; cat. # 20741), с разбавлением 1:200 (Santa Cruz, USA). Иммунопероксидазное окрашивание выполняли с использованием набора DakoCytomation Envision Kit (DakoCytomation, Denmark AS) с пероксидазой, обработанной диаминобензидинтетрахлоридом, в качестве субстрата, перед докрашиванием гематоксилином Майера (DakoCytomation, Denmark AS).
Оценка окрашивания
Окрашивание было, преимущественно, цитоплазматическим, хотя, в цитоплазматической мембране существовала некоторая концентрация окрашивания. Окрашивание записывали по полуколичественной и субъективной шкале оценки, с учетом того, что интенсивность окрашивания и доля опухолевых клеток показывают положительную реакцию. Оценивали все три ядра из каждого случая. Интенсивность записывали по шкале от 0 (отсутствие окрашивания) до 3 (интенсивное окрашивание); процентное значение площади окрашивания мембраны записывали как 0 (отсутствие положительной реакции на опухолевые клетки), 1 (<10%), 2 (10%-50%) и 3 (>50% опухолевых клеток). Индекс окрашивания (Sl) вычисляли как произведение интенсивности окрашивания на площадь. Иммуногистохимическую регистрацию выполняли без учета характеристик пациентки и результата.
Статистическая обработка
Сравнения групп выполняли по критерию χ2 Пирсона. В ходе всех статистических анализов, статистически малозначимые величины для категорий индекса окрашивания (Sl) основывались на медианных значениях. Одномерные анализы выживаемости (с использованием смерти от эндометриального рака в качестве конечной точки; смерти от других случаев не учитывались) выполняли с использованием процедуры расчета произведения пределов (метод Каплана-Мейера), с использованием времени первичной операции в качестве начальной даты.
Для сравнения кривых выживаемости для разных категорий каждого переменного параметра использовали логарифмический ранговый критерий (Мантеля-Кокса). Переменные параметры, влияющие на выживаемость при одномерном анализе, (P≤0,15) исследовали по графику в двойном логарифмическом масштабе, для определения, каким образом упомянутые переменные параметры можно включать в регрессионные модели пропорционального риска Кокса.
Линия мышей и обслуживание животных
В настоящем исследовании, авторы изобретения использовали самок мышей PrkdcSCID/B2mnull (сокращенно, NOD/SCID/B2mnull), мышей с тяжелым комбинированным иммунодефицитом (GADES Institute, Norway), в возрасте 8-10 недель и весом 20-25g. Мышей содержали в стандартных условиях, с 12-часовым циклом чередования света и темноты, и давали, по меньшей мере, 7 суток на акклиматизацию к новому состоянию их окружающей среды, до начала эксперимента. Данное исследование, рассчитанное на минимизацию числа и страданий животных, выполняли в соответствии с норвежскими правилами проведения экспериментов на животных, Европейской конвенцией по защите позвоночных животных, используемых для научных целей, и правилами Норвежской администрации по исследованиям на животных.
Биолюминесцентная визуализация (BLI)
BLI выполняли с использованием камеры eXplore Optix (GE Healtcare), установленной в бокс для препаратов. Визуализацию и количественную оценку сигналов выполняли с использованием программного обеспечения eXplore Optix. Для визуализации in vivo, животные получали посредством интраперитонеальной инъекции (i.p) субстрат D-люциферин (Biosynth), 150 мг/кг в PBS (фосфатно-солевом буферном растворе) и анестезировались изофлураном. Мышей помещали на нагреваемый столик внутри бокса камеры, при непрерывном воздействии 1-2% изофлурана, и получали изображения их разных видов, в зависимости от модели опухоли. Представляющую интерес область идентифицировали и количественно оценивали по суммарному числу фотонов/сек, с использованием программного обеспечения eXplore Optix (GE Explore Optix). Фоновая биолюминесценция in vivo была в диапазоне 2-3×10 сосчитанных фотонов. Для визуализации ex vivo, мышам делали инъекцию 150 мг/кг D-люциферина непосредственно перед аутопсией. Представляющие интерес ткани иссекали, помещали на чашки и визуализировали.
In vivo модели опухолей
Тканевая инженерия
1×106 клеток MDA-MB 231, которые экспрессировали биомаркер GFP-Luc и разные интерферирующие РНК, которые регулируют экспрессию Axl, суспендировали в смеси 1:1 среды F-12 Кейна (Invitrogen) : матригеля (BD Biosciences) и высевали на 6×6 мм клеточные каркасы из полимолочной кислоты (PLLA).
Самок NOD/SCID/B2mnull анестезировали воздействием 1-2% изофурана (Isoba vet.-Schering-Plough A/S) во время процедуры имплантации и в последующие дни визуализации. Два клеточных каркаса имплантировали подкожно (s.c) каждой мыши в соответствии с публикацией Nor et al. Lab Invest.; 81 (4) 453; 2001. Клеточные каркасы с клетками, которые экспрессировали Axl, имплантировали с левой стороны каждой мыши, при этом, клеточные каркасы с правой стороны были с клетками, в которых имел место нокдаун Axl. После хирургической операции, анестезированных мышей помещали в систему визуализации, и получали изображения как левой, так и правой сторон через 10-15 мин после интраперитонеальной инъекции 150 мг/кг D-люциферина (Biosynth). Развитие опухоли контролировали in vivo визуализацией один раз в неделю в течение 4 недель.
Анализ с использованием ксенотрансплантата
1×106 клеток MDA-MB-231, инфицированных векторами, экспрессирующими короткошпилечные РНК, и GFP-Luc, суспендировали в 100 мкл среды F12K+10% FBS/матригель (в отношении 1:1, BD Biosciences) и ввели путем подкожной инъекции иглой калибра 29 для введения инсулина в оба бока самки NOD/SCID/B2m. Слева сделали инъекцию клеток, положительных по экспрессии Axl, а справа сделали инъекцию клеток, отрицательных по экспрессии Axl.
Для трехклеточного имплантата, клетки MDA-MB-231, инфицированные векторами, экспрессирующими короткошпилечные РНК, и GFP-Luc, смешивали с эндотелиальными клетками микрососудов человеческой кожи (HMVEC) и гладкомышечными клетками легочных артерий (PASMC) в отношении 1:2:2. Рост опухоли контролировали in vivo визуализацией один раз в неделю в течение 4 последовательных недель.
Модель спонтанного метастазирования в жировую подушку молочной железы
Сублинию клеток MDA-MB-231 человека (называемую MDA-MB 231 DH3L2N-Xenogen), которая экспрессировала биомаркер GFP-Luc и разные интерферирующие РНК, которые регулируют экспрессию Axl, ввели путем инъекции в подушку молочной железы мышей. Мышей NOD/SCID/B2mnull анестезировали воздействием 1-3% изофурана, и сделали им инъекцию 50 мл суспензии из 2×106 клеток MDA-MB-231 DH3L2N в среде MEM/EBSS (минимально необходимой среде со сбалансированным солевым раствором Ирла)/матригеле (1:1) в абдоминальную жировую подушку молочной железы. Через 10-15 мин после инъекции D-люциферина (Biosynth), мышей помещали в систему визуализации eXplore Optix, и формировали изображения их вида снизу. Рост опухоли и распространение метастазов контролировали с периодичностью один раз в две недели методом биолюминесцентной визуализации в течение до 9 недель. Нижнюю часть каждого животного закрывали перед повторной визуализацией, чтобы минимизировать биолюминесценцию от первичной опухоли, так что сигналы от областей метастазирования можно наблюдать in vivo.
Сбор тканей
В конце каждого эксперимента, от мышей отбирали имплантаты опухолевых тканей и разные органы и консервировали в 10% параформальдегиде (Sigma-Aldrich) для дальнейшего анализа. Ткани подготавливали для гистопатологического исследования (заливали парафином, получали срезы и окрашивали) и анализировали под микроскопом.
Статистический анализ результатов на модельных животных
Для каждого эксперимента определяли среднюю интенсивность биолюминесценции (число фотонов/сек), диаметр опухоли и соответствующие стандартные ошибки. Для описания зависимости между биолюминесценцией, числом клеток и диаметром опухоли применяли регрессионные кривые. Статистические анализы основывались на парном t-тесте.
РЕЗУЛЬТАТЫ
Экспрессия Axl является мощным прогностическим фактором для общей выживаемости пациенток, страдающих от рака молочной железы
Для оценки роли Axl в патогенезе рака молочной железы, авторы настоящего изобретения исследовали экспрессию Axl в опухолях из группы пациенток, страдающих от рака молочной железы, идентифицированных в ходе Норвежской программы скрининга рака молочной железы, которая была начата в 1996 г. и включала в себя дважды в год маммографию в двух проекциях (Wang et al 2001). Вкратце, во время первых двух интервалов скрининга обнаружилось 95 инвазивных интервальных раковых заболеваний (1996-2001), и данные заболевания согласовали по размеру с 95 обнаруженными скринингом опухолями из общего числа 317 инвазивных опухолей во время первых двух циклов (медианный диаметр 15,6 и 15,7 мм, соответственно) (Collett et al., 2005). После согласования, средние размеры опухолей для обнаруженных скринингом и интервальных случаев составляли 25,1 и 23,1 мм, соответственно, и соответствующий средний возраст в данных группах составлял 62 года и 59 лет. Кроме возраста и диаметра опухоли (по данным патологического исследования), при диагностике записывали такие основные характеристики, как плотность молочной железы, гистологический тип, гистологическую степень, метастазы лимфатических узлов и удаленные метастазы. Медианное время от последней маммограммы до диагностики интервального рака составляло 17,1 месяцев. Датой последнего наблюдения было 31 ноября, 2004 г., и медианное время последующего наблюдения (выживших наблюдаемых) составило 72 месяца. В период последующего наблюдения, 31 пациенток умерло от рака молочной железы. Клинические параметры контролировали, последней датой наблюдения было 31 ноября, 2004 г., и медианное время последующего наблюдения (выживающих наблюдаемых) составило 72 месяца. В период последующего наблюдения, 31 пациенток умерло от рака молочной железы.
Между экспрессией Axl (разбитой на две группы по медианному индексу окрашивания; фиг. 1A) и существенными клиникопатологическими признаками, например, гистологической степенью, диаметром опухоли, экспрессией рецепторов эстрогенов и прогестерона и состоянием подмышечных лимфатических узлов, не существовало значительных связей. Кроме того, экспрессия Axl не была связана с HER2, E-кадгерином, маркерами базальной дифференцировки (цитокератина 5/6, P-кадгерина), EZH2 или пролиферацией опухолевых клеток по экспрессии Ki-67.
Однако, при одномерном анализе выживаемости (метод Каплана-Мейера, логарифмический ранговый критерий), экспрессия Axl имела существенную связь с пониженной выживаемостью пациентов (p=0,035; фиг. 1B). При многомерном анализе (способ пропорциональных рисков), включающем в себя основные прогностические факторы, подобные диаметру опухоли, гистологической степени и состоянию лимфатических узлов, в дополнение к экспрессии Axl (этап один), состояние экспрессии Axl оставалось независимым отрицательным прогностическим фактором в конечной модели (p=0,021), в дополнение к гистологической степени и состоянию лимфатических узлов (см. фиг. 1C). Таким образом, экспрессия Axl является мощным прогностическим признаком плохого клинического результата у пациентов, страдающих раком молочной железы.
Затем, авторы настоящего изобретения исследовали экспрессию Axl в согласованных парах (n=16) биопсий пациентов с первичным и метастатическим раковыми заболеваниями молочной железы. Экспрессия Axl имела тенденцию к дополнительному повышению в метастазах, при сравнении с первичными раковыми заболеваниями молочной железы человека (p=0,11, тест МакНемара; фиг. 1d; метастазы справа, в печени (сверху) и кости (снизу)), что предполагает, что экспрессия Axl является мощным прогностическим признаком плохого клинического результата у пациентов, страдающих раком молочной железы, и связана с распространением метастазов.
Axl необходима для инвазивности клеток рака молочной железы
Сильная корреляция экспрессии Axl в ранних стадиях раковых заболеваний молочной железы с низкой выживаемостью указывает на значительную роль Axl в общем патогенезе заболевания. Так как смертность, сопутствующая раку молочной железы, всегда является следствием осложнений метастатического заболевания, авторы настоящего изобретения оценили, необходима ли экспрессия Axl для инвазивности клеток злокачественной опухоли молочной железы. Axl экспрессируется в нескольких высокометастатических линиях клеток рака молочной железы человека, включая MB-MDA-231. Часто имеет место совместная экспрессия лиганда Axl, Gas6, приводящая к аутокринной активации (Holland et al., 2005). Для эффективной корреляции уровней экспрессии Axl в клетках MB-MDA-231 со специфическими клеточными свойствами, авторы настоящего изобретения разработали эпиаллельные серии короткошпилечных РНК, нацеленных на Axl, которые подавляют экспрессию Axl в зависимости от дозы, с использованием недавно разработанного подхода с использованием РНК-интерференции на основе FACS (флуоресцентно-активированной сортировки клеток), CellSelectRNAi (фиг. 2A; Micklem et al., в стадии подготовки). Упомянутый набор короткошпилечных РНК Axl использовали для создания эпиаллельных серий клеток MB-MDA-231, экспрессирующих Axl, с подвергнутыми изменениям уровнями общего (фиг. 2B) и фосфорилированного (фиг. 2C) белка Axl.
Клетки злокачественной опухоли проявляют инвазивность мезенхимальных клеток в трехмерных гелях белков внеклеточного матрикса (Matrigel (матригель)), которая коррелируется с метастатическим потенциалом in vivo (Bissell). Эпиаллельный анализ показал дозозависимую потребность в экспрессии Axl для инвазии клеток MB-MDA-231 в ответ на сыворотку (фиг. 2D) или хемокин SDF-1 (фиг. 2E), значительный фактор при метастазировании рака молочной железы. Напротив, нокдаун Axl не влиял на пролиферацию клеток MB-MDA-231 и лишь ограничено влиял на двумерную миграцию (вторичное заживление эпителиальных ран). Приведенные особенности указали на специфическую потребность в Axl при трехмерном росте и инвазивности. Поэтому, авторы настоящего изобретения оценили влияние нокдауна Axl на клетки MB-MDA-231 при анализе в 3-мерном матригеле. Нормальные эпителиальные клетки молочной железы самоорганизуются в поляризованные сфероидные гроздевидные структуры в 3-мерном матригеле, а злокачественные клетки MB-MDA-231 пролиферируют с формированием больших неорганизованных колоний с инвазивными, звездчатыми выростами, которые свидетельствуют об агрессивных опухолях (Bissell). Нокдаун экспрессии Axl резко обращал злокачественный фенотип клеток MB-MDA-231 в 3-мерном матригеле, с созданием небольших круглых колоний без злокачественных выростов (фиг. 2F, G). Совместно, приведенные данные предполагают, что для поддержания инвазивности, подобной мезенхимальной, клеток метастастического рака молочной железы требуется передача сигналов Axl.
Axl испытывает повышающую регуляцию при посредстве EMT-индуцирующих транскрипционных факторов в эпителиальных клетках молочной железы
Приобретение мезенхимальной инвазивности, способности к миграции и инвазии в ECM (внеклеточный матрикс) является функциональной особенностью EMT (эпителиально-мезенхимального перехода). EMT-индуцирующий транскрипционный фактор Twist необходим для метастазирования клеток рака молочной железы (Yang et al 2004). Поэтому, авторы настоящего изобретения исследовали, приводит ли экспрессия Twist к повышающей регуляции Axl в эпителиальных клетках молочной железы. Экспрессия Twist в нормальных эпителиальных клетках молочной железы (MCF10A) индуцирует EMT (фиг. 3A; Glackin et al., в стадии подготовки). Кроме того, Axl также выполняет значительную повышающую регуляцию в Twist-экспрессирующих клетках MCF10A (фиг. 3A-B). Кроме того, так как Gas6, соответственно, экспрессируется нормальными эпителиальными клетками молочной железы, упомянутая экспрессия Axl, индуцированная посредством Twist, устанавливает петлю аутокринной активации, о чем свидетельствует повышение клеточно-ассоциированного Gas6, и Axl, фосфорилированной тирозином, (фиг. 3A, C). Для определения, существуют ли другие EMT-индуцирующие транскрипционные факторы, аналогичным образом выполняющие повышающую регуляцию экспрессии Axl, авторы настоящего изобретения выполнили анализ клеток MCF10A, экспрессирующих ZEB2, Snail и Slug. Каждый из упомянутых транскрипционных факторов EMT индуцировал мезенхимальный переход в клетках MCF10A и выполнял повышающую регуляцию экспрессии Axl. Приведенные результаты предполагают, что индуцирование EMT приводит к экспрессии Axl и может устанавливать аутокринную передачу сигналов.
Экспрессия Axl необходима для образования опухоли в экспериментальных опухолях молочной железы, созданных методом тканевой инженерии
Для оценки потребности в Axl для злокачественного роста in vivo, авторы настоящего изобретения применили метод тканевой инженерии, содержащий клетки MB-MDA-231, которые экспрессируют конструкцию GFP (зеленый флуоресцентный белок) - люциферазу для эффективной оптической визуализации in vivo (CSI; Tiron et al., неопубликованные результаты), высеянные с матригелем в клеточные каркасы из полимолочной кислоты для тканевой инженерии и имплантированные подкожно в мышей NOD-SCID с ослабленным иммунитетом. Рост внутри микросред, созданных методом тканевой инженерии, соответствует мезенхимальным характеристикам опухолевых клеток, когда опухолевые клетки колонизируют клеточный каркас (Mooney). Клетки MB-MDA-231 быстро формируют опухоли в упомянутой биомиметической микросреде, что отражает энергичную колонизацию клеточного каркаса (фиг. 4A). Нокдаун Axl резко ингибировал образование опухоли, поперечное распространение и злокачественную морфологию (фиг. 4A).
Чтобы удостовериться, влияет ли Axl на способность клеток рака молочной железы привлекать и ассимилировать кровеносные сосуды, авторы настоящего изобретения разработали метод трехклеточного имплантата, содержащий клетки MB-MDA-231, высеянные совместно с первичными эндотелиальными клетками микрососудов человека (HuMVEC) и гладкомышечными клетками сосудов (vSMC) для создания опухолевой сосудистой сети. Имплантаты клеток EC-vSMC человека легко формируют снабжаемую кровью микрососудистую сеть человека внутри клеточного каркаса в мышах NOD-SCID в течение двух недель (Hegen et al., в стадии подготовки). Как показано на фиг. 4B, клетки MB-MDA-231 формируют агрессивные, сильно васкуляризированные опухоли в данной трехклеточной модели имплантата. Разработанная опухолевая сосудистая сеть человека равномерно распределена и снабжается интралюминальными эритроцитами. Напротив, нокдаун Axl блокировал образование опухоли, без влияния на развитие снабжаемой кровью микрососудистой сети человека. Такой результат показывает, что Axl требуется для образования опухоли даже в присутствии микрососудистой сети, которая, очевидно, обходит потребность в индуцированном ангиогенезе.
Для образования опухоли молочной железы необходим отчетливый порог экспрессии Axl
Для оценки уровня экспрессии Axl, необходимой для образования опухоли, авторы настоящего изобретения провели эпиаллельный анализ in vivo Axl в подкожных опухолях MDA-MB-231. Эпиаллельные серии клеток MDA-MB-231, экспрессирующих Axl, (фиг. 1) вводили подкожной инъекцией, и осуществляли контроль во времени за образованием опухоли с помощью биолюминесцентного сканирования. Данный подход показал зависимость доза Axl - результат для роста опухоли (фиг. 5). Корреляция с поверхностными уровнями Axl показала порог экспрессии Axl, необходимой для образования опухоли (фиг. 5B, C). Упомянутая зависимость доза - результат соответствует дозозависимым результатам ингибирования Axl по инвазивности (фиг. 2).
Axl необходима для метастазирования клеток рака молочной железы
Для оценки потребности в Axl для метастазирования рака молочной железы, авторы настоящего изобретения сделали ортотопическую инъекцию MDA-MB-231-D3H2LN, быстрорастущего и высокометастатического изолята in vivo MDA-231, в жировую подушку молочной железы. С применением биолюминесцентной визуализации всего тела, авторы настоящего изобретения контролировали во времени развитие спонтанного метастазирования в течение 9-недельного периода. Контрольные клетки MDA-MB-231-D3H2LN образовали крупные ортотопические опухоли, которые стали подвергаться некрозу в течение 5-6 недель (фиг. 6A). Нокдаун Axl в MDA-MB-231-D3H2LN снижал скорость образования первичной опухоли молочной железы, но также способствовал образованию значительных первичных опухолей молочной железы (фиг. 6A). Спонтанное метастазирование первоначально обнаруживали в сторожевом лимфатическом узле грудной полости мышей с инъекцией контрольных MDA-MB-231-D3H2LN через 4 недели (фиг. 6A). Напротив, никаких метастазов не обнаружили у мышей с имплантацией MDA-231 DHLN-AxlshRNA. После умерщвления через 9 недель, вырезанные органы сканировали по отдельности для определения биолюминесценции, обусловленной присутствием метастатических клеток. У всех мышей с инъекцией MDA-MB-231-D3H2LN сформировалось обширное спонтанное метастазирование, включая лимфатический узел, легкие, яичник и почки. Напротив, клетки MDA-MB-231-DHLN-AxlshRNA не сформировали обнаружимого метастаза (за исключением единственного образования в почке одной мыши). Гистологический анализ биопсий тканей из органов мышей с инъекцией MDA-MB-231-D3H2LN подтвердил присутствие нескольких микро- и макрометастазов во всех органах, как прогнозировалось данными измерений суммарного числа фотонов при биолюминесценции (фиг. 6C). Никаких микро- или макрометастазов не наблюдалось в биопсиях тканей мышей с инъекцией MDA-MB-231 DHLN-AxlshRNA, что подтверждает, что отсутствие наблюдаемой биолюминесценции было обусловлено ингибированием образования метастазов. Приведенные результаты показывают, что Axl необходима для метастазирования рака молочной железы.
Авторы настоящего изобретения оценили функциональный вклад Axl в общую выживаемость мышей NOD-SCID с ортотопической инъекцией контроля MDA-MB-231-D3H2LN/GFP-Luc или клеток с нокдауном Axl. Общая выживаемость была значительно повышена у мышей с опухолью MDA-MB-231-D3H2LN/GFP-Luc-shAxl2 (P=0,013, логарифмический ранговый тест; фиг. 6d). Приведенные результаты, совместно с данными клинических наблюдений, полученными авторами настоящего изобретения, поддерживают вывод, что Axl имеет существенное значение для развития метастатического заболевания и общей выживаемости пациентов.
Для подтверждения результатов на отличающейся метастатической модели, авторы настоящего изобретения трансдуцировали высокометастатическую линию клеток 4T1 рака молочной железы мышей конструкцией CSI и выбрали для экспрессии GFP-люциферазы методом FACS (флуоресцентно-активированной сортировки клеток) (4T1-GFP-Luc). Клетки 4T1 зависят от экспрессии Twist для метастазирования и характеризуются высокими уровнями экспрессии Axl (фиг. 7a).
Авторы настоящего изобретения разработали ретровирусный вектор, который экспрессирует нацеленную на Axl мыши короткошпилечную РНК (shmAxl2), которая эффективно снижает поверхностные уровни Axl мыши в клетках 4T1 (фиг. 7a). Несогласованная, нацеленная на Axl человека короткошпилечная РНК (shAxl279) не влияет на экспрессию Axl мыши. Аналогично нокдауну Twist в клетках 4T1 и результатам с клетками MDA-MB-231, экспансия культуры тканевых клеток, содержащая клетки 4T1 с нокдауном Axl не испытывала значительных изменений (данные не представлены).
При введении в молочную железу самок нормальных мышей BALB/c, сингенные опухолевые клетки 4T1 демонстрируют двухфазный характер роста, обусловленный сильной иммунной реакцией, которая приводит к регрессии опухоли, ассоциируемой с инфильтрацией лейкоцитов и некрозом, за которыми следует возобновление роста в первичном месте, которое совпадает с обширными метастазами в несколько органов. Клетки 4T1-GFPLuc показывают только монофазный рост у мышей NOD-SCID с ослабленным иммунитетом (данные не показаны). Авторы настоящего изобретения ввели инъекцией в жировую подушку молочной железы самок мышей BALB/c клетки 4T1-GFP-Luc, экспрессирующие либо нацеленную на Axl мыши короткошпилечную РНК (4T1-GFP-Luc-shmAxl2), либо отрицательную контрольную, специфическую к человеку короткошпилечную РНК (4T1-GFP-LucshAxl279), и количественно оценили рост опухоли и метастазирование посредством оптической визуализации in vivo во времени всего тела (фиг. 7b). Контрольные клетки 4T1-GFP-Luc-shmAxl2 показали быстрый первичный рост, с достижением максимума через одну неделю. За данным ростом следовала крутая регрессия, которая длилась в течение пяти недель (фиг. 7b). На 6 неделе, наблюдались рецидив в первичном месте и множественные удаленные метастазы, которые затем быстро росли, что приводило к агонии и летальному исходу для всех мышей к 8 неделе. Клетки 4T1-GFP-Luc, экспрессирующие нацеленную на Axl мыши короткошпилечную РНК (4T1-GFP-Luc-shmAxl2), первоначально вели себя сходным образом: быстрый рост первичной опухоли, некоторое ослабление вследствие супрессии Axl, с последующим рецидивом (фиг. 7b). Однако, последующий рецидив первичной опухоли и возникновение быстро растущего удаленного метастаза совершенно отсутствовали (фиг. 7b). Действительно, все мыши с инъекцией клеток 4T1-GFP-Luc-shmAxl2 оставались здоровыми к моменту умерщвления (через 8 недель). У мышей, содержащих опухоли с нокдауном Axl, ослаблена также спленомегалия, связанная с характеристикой лейкемоидной реакции модели 4T1, (данные не показаны). После умерщвления через 8 недель, визуализировали отдельные вырезанные органы и количественно оценили общее световое излучение, которое подтвердило присутствие метастазов в обычных местах диссеминации у всех мышей, содержащих опухоли 4T1-GFP-Luc-shAxl279 (фигуры 7c-d). Напротив, никаких биолюминесцентных опухолевых клеток не было обнаружено в органах от мышей с опухолями 4T1-GFP-LucshmAxl2 (фиг. 7d-e). Данные результаты поддерживают вывод, что Axl является необходимым регулятором метастазирования опухолей молочной железы.
Аутокринная регуляция при посредстве Gas6
Лиганд Axl, Gas6, часто совместно экспрессируется с Axl, согласованно с аутокринной активацией. Уровни клеточно-ассоциированного Gas6 и фосфорилированной Axl, указывающие на аутокринную передачу сигналов, снижаются после нокдауна Axl в клетках MDA-MB-231 (фиг. 11). В клетках MCF10A, Gas6 экспрессировался соответственно строению и становился клеточно-ассоциированным при EMT-индуцированной экспрессии Axl (фиг. 11). Приведенные результаты предполагают, что вступление программы EMT приводит к экспрессии Axl и может установить аутокринную передачу сигналов в эпителиальных клетках молочной железы. Так как Axl, часто совместно экспрессируемая с Gas6, обнаруживается при многих метастатических раковых заболеваниях, то аутокринная передача сигналов Axl может быть частым следствием EMT в опухолях многих типов. EMT-индуцирующие транскрипционные факторы, например, Snail, Slug и Twis, активно индуцируют экспрессию Axl, что предполагает, что Axl может участвовать в контуре положительной обратной связи, который поддерживает злокачественный мезенхимальный фенотип опухолевых клеток. Данное представление согласуется с наблюдением авторами изобретения повышенной экспрессии Axl в метастатических опухолевых образованиях.
Фенотип CD44+ соответствует экспрессии Axl
Клетки MCF10a трансдуцировались конструкциями Slug или Ha-Ras (pBABE puro H-Ras V12, Addgene). Slug-трансдуцированные клетки анализировали методом проточной цитометрии, с использованием совместной экспрессии GFP (зеленого флуоресцентного белка); экспрессия Ha-Ras выбиралась обработкой пиромицином в течение 48 часов. Как показано проточной цитометрией (фиг. 9, панель A), экспрессия Slug и Ha-Ras в клетках MCF10a приводила к резкому повышению поверхностной экспрессии маркера CD44 раковых стволовых клеток. Проточный цитометрический анализ клеток MCF10a, трансдуцированных посредством Slug или Ha-Ras, дополнительно показал резкое повышение поверхностной экспрессии Axl. Клетки MCF10a, экспрессирующие Slug или Ha-Ras, сортировали методом FACS (флуоресцентно-активированной сортировки клеток) для субпопуляций, экспрессирующих CD44 с высоким (CD44+) и низким (CD44-) содержанием CD44. Клетки CD44- демонстрируют эпителиальную морфологию, а клетки MCF10 CD44+ демонстрируют удлиненную мезенхимальную морфологию (фиг. 9, панель C). Анализ методом вестерн-блоттинга данных клеток (фиг. 9, панель D) показал, что клетки MCF10a CD44- сохраняли экспрессию белка эпителия соединительной связки и цитоскелета. Напротив, клетки CD44+ показали интенсивную экспрессию мезенхимального маркера (виментина, N-кадгерина) и недостаток E-кадгерина, что свидетельствует о EMT (эпителиально-мезенхимальном переходе). Экспрессия Axl коррелируется с присутствием CD44 и мезенхимальными признаками как при Slug-, так и при Ha-Ras-индуцированном EMT (фиг. 9, панели B, D). Рост клеток MCF10a с CD44+ и CD44-, экспрессирующих Slug и Ha-Ras, в 3-мерном матригеле (фиг. 9, панель E) показал, что клетки MCF10a CD44+, экспрессирующие Axl, являются инвазивными соответственно мезенхимальному фенотипу. Приведенные результаты показывают, что Axl испытывает повышающую регуляцию при экспрессии Slug и Ha-Ras в клетках MCF10a и коррелируется с признаками мезенхимальных и раковых стволовых клеток.
Специалистам в данной области будут очевидны различные модификации и варианты описанных аспектов настоящего изобретения, не выходящих за пределы объема и существа изобретения. Выше настоящее изобретение описано в связи с конкретными предпочтительными вариантами осуществления, однако, следует понимать, что заявленное изобретение не следует резко ограничивать приведенными конкретными вариантами осуществления. Действительно, предполагается, что различные модификации вышеописанных вариантов осуществления изобретения, которые очевидны специалистам в соответствующих областях, должны быть в пределах объема притязаний нижеследующей формулы изобретения.
ЛИТЕРАТУРА
Camp, R.L., V. Neumeister, and D.L. Rimm, A Decade of Tissue Microarrays: Progress in the Discovery and Validation of Cancer Biomarkers. J Clin Oncol, 2008.
Collett, K., et al., A basal epithelial phenotype is more frequent in interval breast cancers compared with screen detected tumors. Cancer Epidemiol Biomarkers
Elston, CW. and I. O. Ellis, Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up. Histopathology, 1991. 19(5): p. 403-10.Prev, 2005. 14(5): p. 1108-12.
Gupta PB, Mani S, Yang J, Hartwell K, Weinberg RA. The evolving portrait of cancer metastasis. Cold Spring Harb Symp Quant Biol. 2005;70:291-7.
Holland S. J., Friera A.M., Franci C, Chan E., Atchison R., McLaughlin J., Swift S. E., Pali E., Yam G., Wong S., Lasaga J., Shen M., Yu S., Xu W., Hitoshi Y., Payan D.G, Nor J. E., Powell M.J, and Lorens J. B. (2005) The Receptor Tyrosine Kinase Axl Regulates Angiogenesis and Tumor Growth. Cancer Research 65:9294-9303.
Kononen, J., et al., Tissue microarrays for high-throughput molecular profiling of tumor specimens. Nat Med, 1998. 4(7): p. 844-7.
Sun, W., Fujimoto, J. & Tamaya, T. Coexpression of Gas6/Axl in human ovarian cancers. Oncology 66, 450-7 (2004).
Thiery JP. Epithelial-mesenchymal transitions in tumour progression. Nat Rev Cancer. 2002 Jun;2(6):442-54
Vajkoczy P, Knyazev P, Kunkel A, Capelle HH, Behrndt S, von Tengg-Kobligk H, Kiessling F, Eichelsbacher U, Essig M, Read TA, Erber R, Ullrich A Dominant-negative inhibition of the Axl receptor tyrosine kinase suppresses brain tumor cell growth and invasion and prolongs survival. Proc Natl Acad Sci U S A. (2006)103:5799-804. Yang J, Mani SA, Weinberg RA Exploring a new twist on tumor metastasis. Cancer Res 2006 66:4549-52.
Yang J, Mani SA, Donaher JL1 Ramaswamy S, Itzykson RA, Come C, Savagner P, Gitelman I, Richardson A, Weinberg RA.Twist, a master regulator of morphogenesis, plays an essential role in tumor metastasis. Cell. 2004 117:927-39.
Yang J, Weinberg RA. Epithelial-mesenchymal transition: at the crossroads of development and tumor metastasis. Dev Cell. 2008 Jun;14(6):818-29.
Wang, H., et al., Mammography screening in Norway: results from the first screening round in four counties and cost-effectiveness of a modeled nationwide screening. Cancer Causes Control, 2001. 12(1): p. 39-45.
Holland et al. R428, a selective small molecule inhibitor of Axl kinase, blocks tumour spread and prolongs survival in models of metastatic cancer. Cancer Research; 70(4), February 15, 2010.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИРОВАНИЕ AXL СИГНАЛИЗАЦИИ В АНТИМЕТАСТАТИЧЕСКОЙ ТЕРАПИИ | 2011 |
|
RU2556822C2 |
| ИСПОЛЬЗОВАНИЕ БИОГЕНЕЗА МИКРОРНК В ЭКЗОСОМАХ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ | 2014 |
|
RU2644247C2 |
| СПОСОБЫ ЛЕЧЕНИЯ МЕТАСТАТИЧЕСКИХ ВИДОВ РАКА С ИСПОЛЬЗОВАНИЕМ РЕЦЕПТОРОВ-ЛОВУШЕК AXL | 2018 |
|
RU2785866C2 |
| РЕЦЕПТОР-НАПРАВЛЕННЫЕ КОНСТРУКЦИИ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2682335C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, СПОСОБНЫЕ СВЯЗЫВАТЬСЯ С БЕЛКОМ AXL, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2559530C2 |
| СПОСОБ IN VITRO ОПРЕДЕЛЕНИЯ ПРОГНОЗА РАЗВИТИЯ ЗАБОЛЕВАНИЯ У БОЛЬНОГО РАКОМ И СПОСОБ IN VITRO МОНИТОРИНГА ЭФФЕКТА ТЕРАПИИ, НАЗНАЧАЕМОЙ БОЛЬНОМУ РАКОМ | 2006 |
|
RU2434946C2 |
| АНТИТЕЛА ПРОТИВ AXL И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2577986C2 |
| ИНГИБИРОВАНИЕ МЕТАСТАЗИРОВАНИЯ ОПУХОЛИ ПРИ ПОМОЩИ АНТАГОНИСТОВ Bv8 ИЛИ G-CSF | 2010 |
|
RU2567803C2 |
| ПОПУЛЯЦИЯ СТВОЛОВЫХ КЛЕТОК ШЕЙКИ МАТКИ ЧЕЛОВЕКА И ЕЕ ПРИМЕНЕНИЕ | 2014 |
|
RU2679500C2 |
| АНТИТЕЛА ПРОТИВ AXL И КОМПОЗИЦИИ | 2021 |
|
RU2837590C1 |
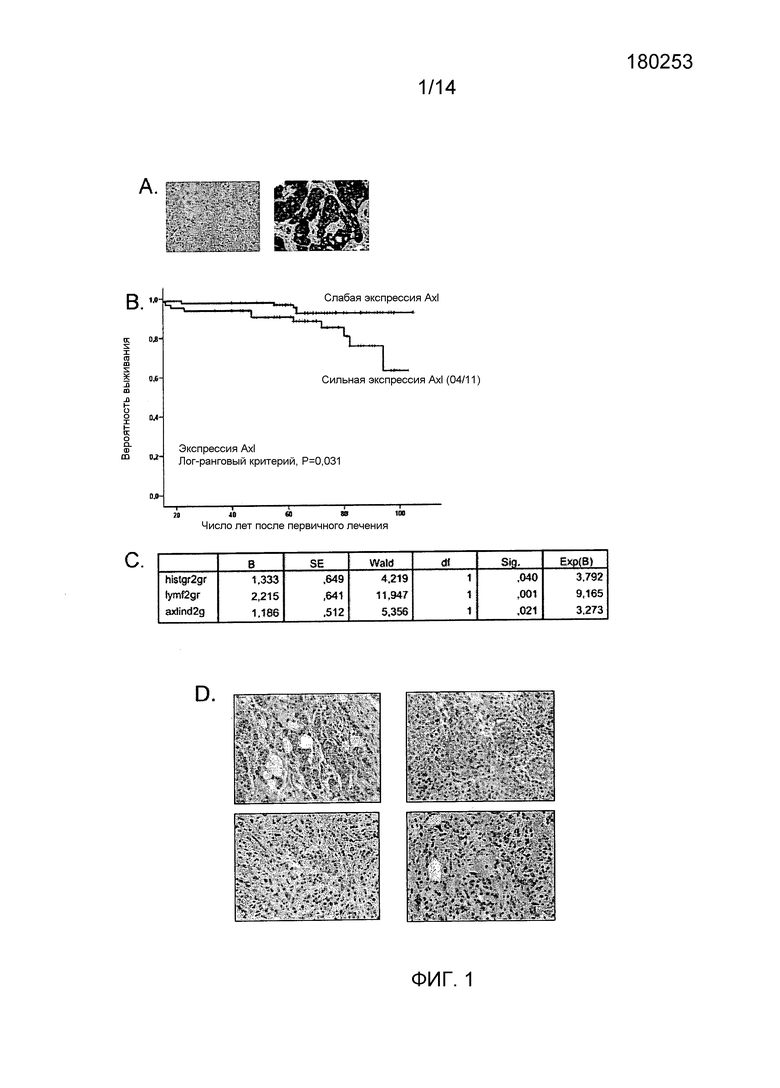
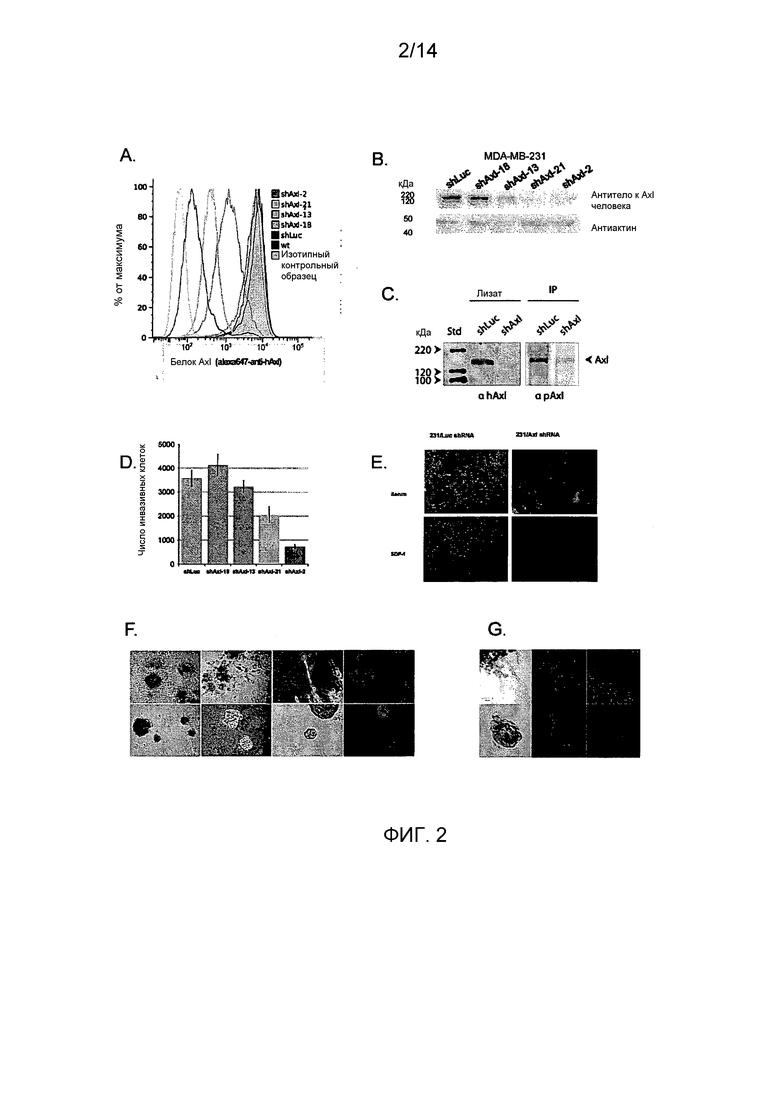
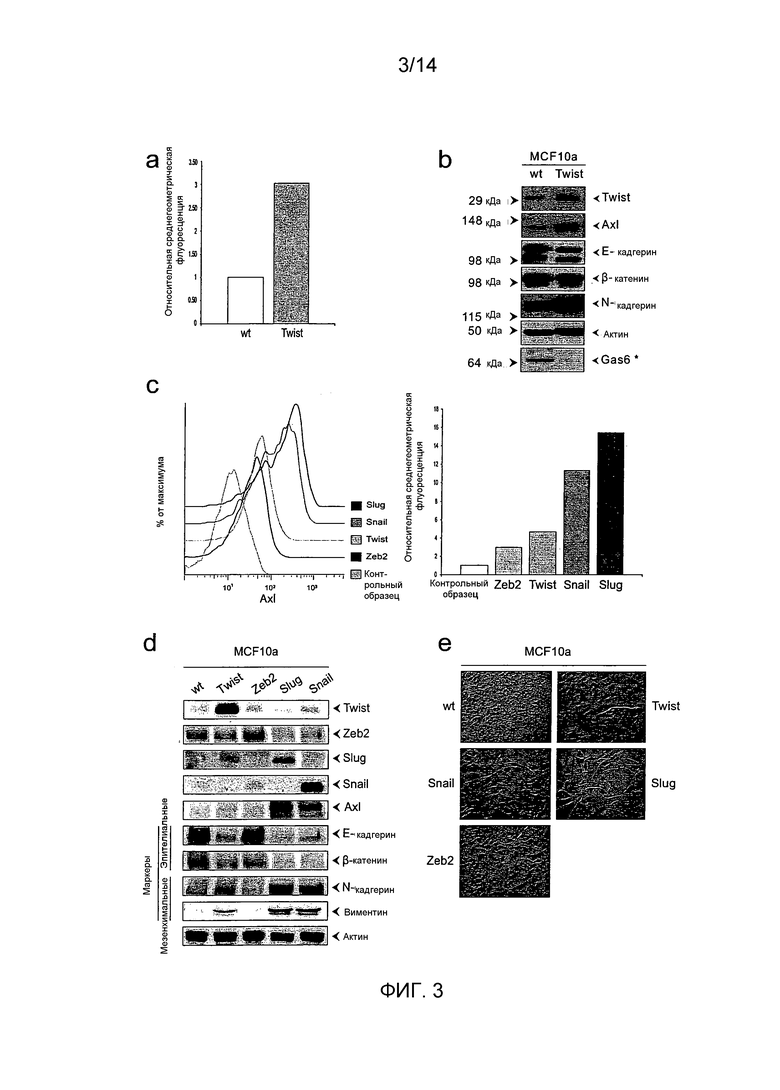
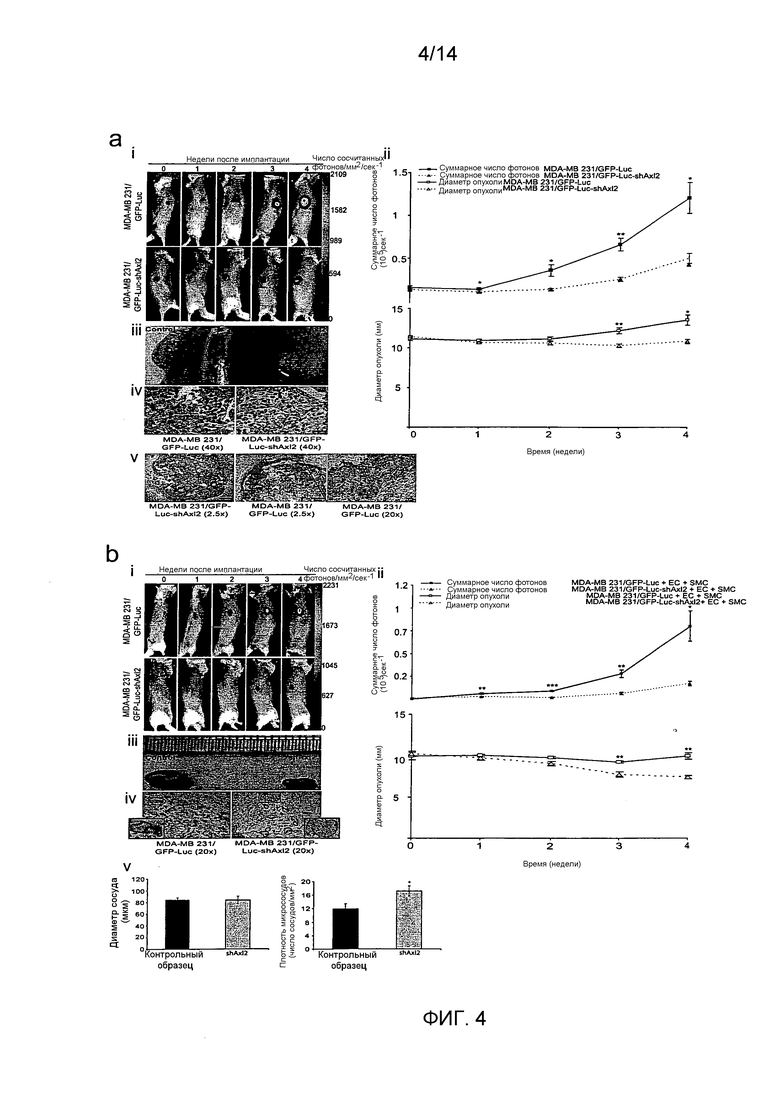
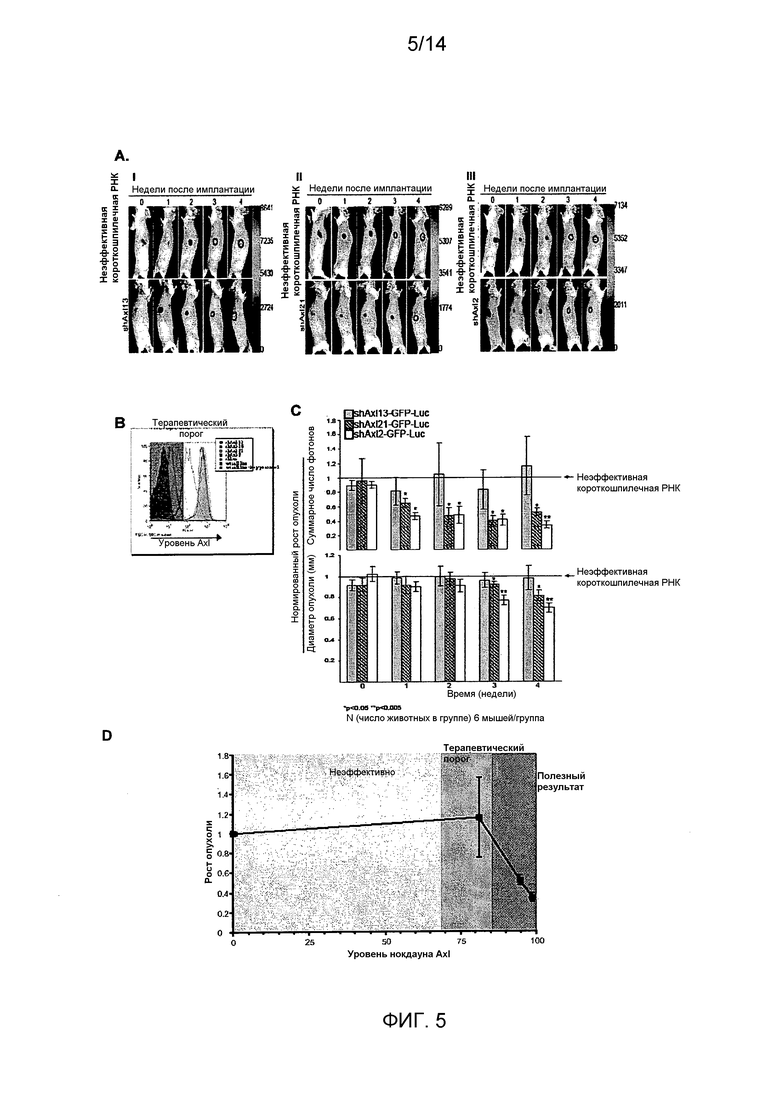
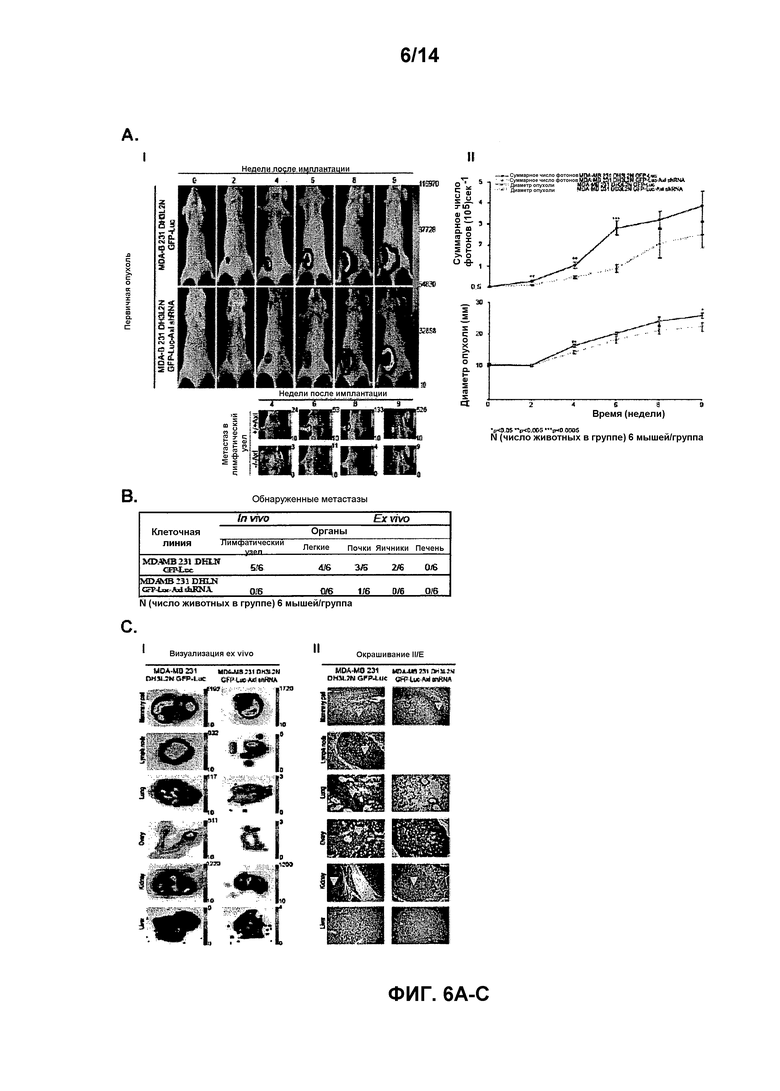
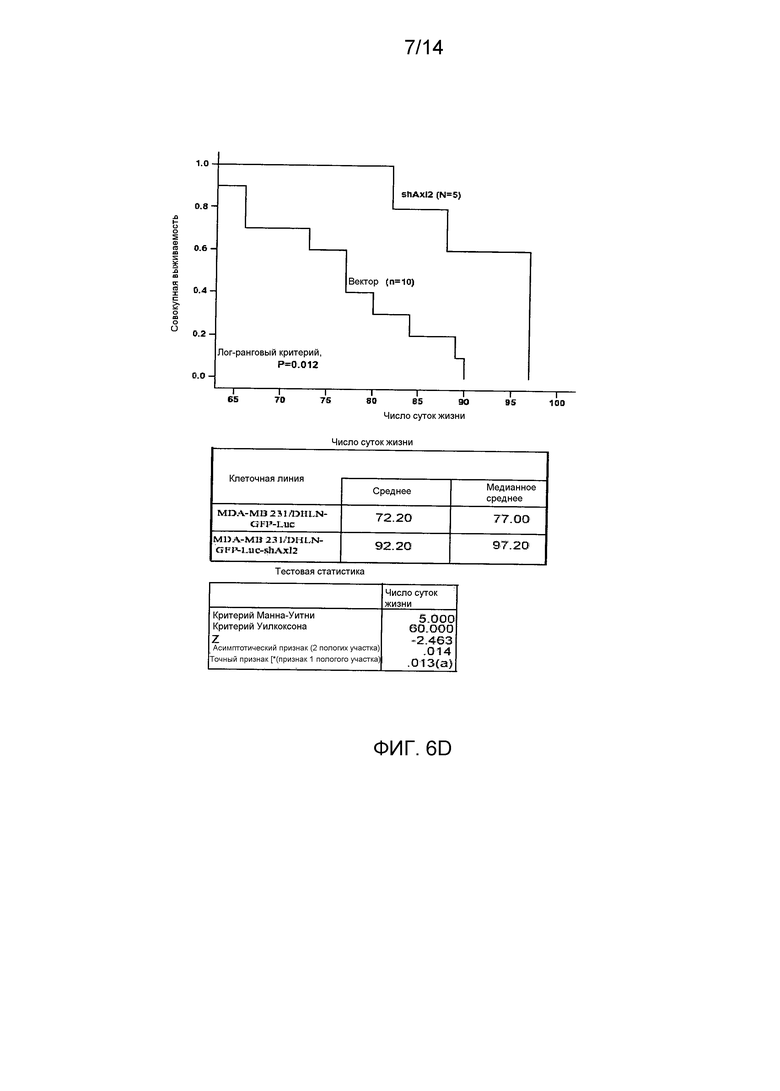
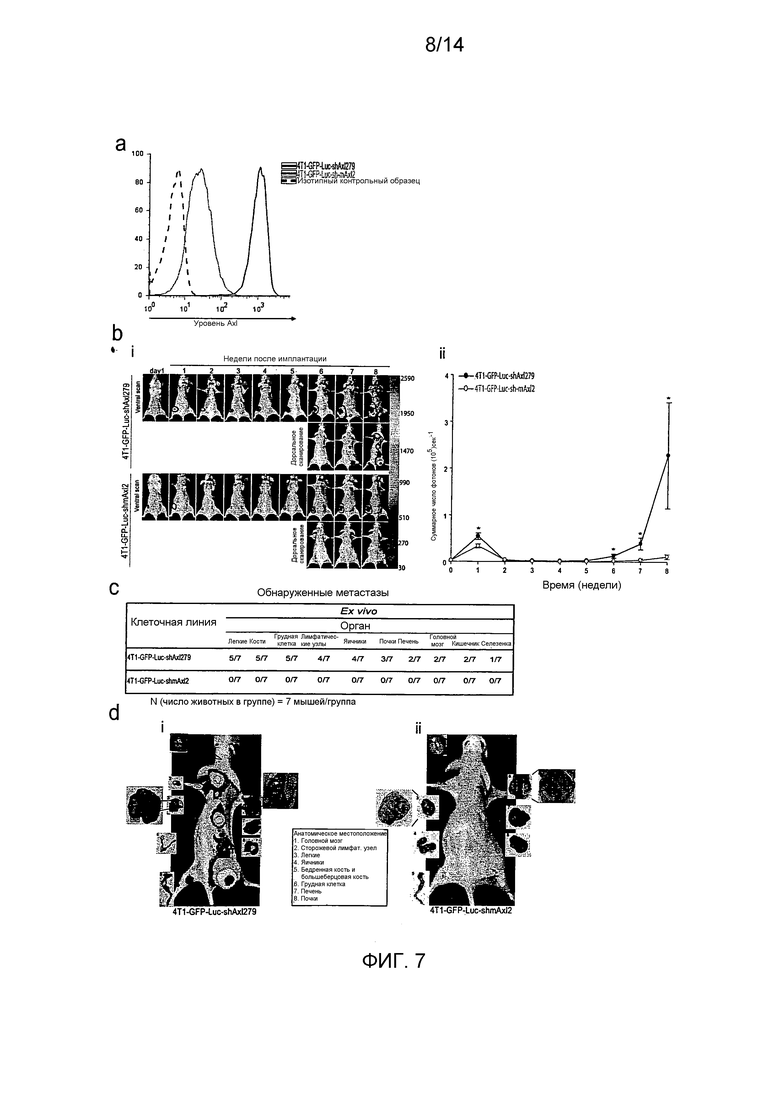



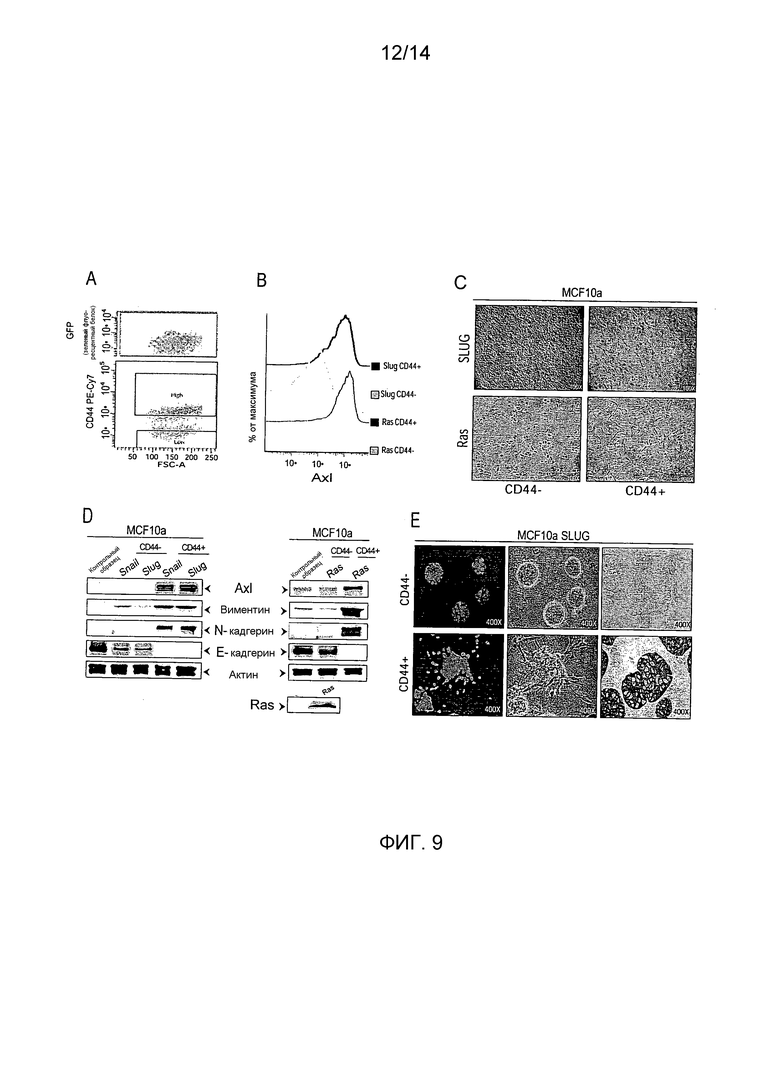

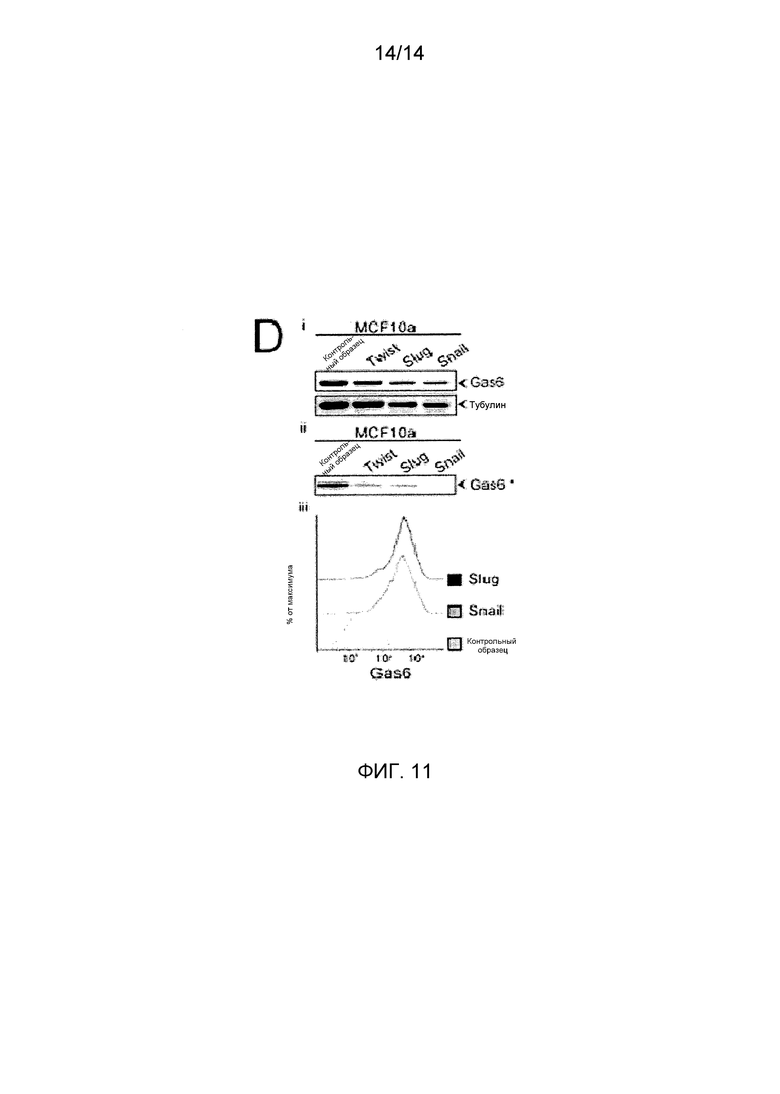
Изобретение относится к области биохимии, в частности к применению Axl в качестве биомаркера для распознавания наступления эпителиально-мезенхимального перехода (EMT) у субъекта, где показателем наступления EMT является повышающая регуляция экспрессии Axl. Также изобретение относится к способу распознавания наступления эпителиально-мезенхимального перехода (EMT) у субъекта посредством измерения экспрессии Axl, к идентификации веществ, способных ингибировать или обращать EMT, к способу прогнозирования восприимчивости субъекта к лечению ингибитором Axl. Изобретение позволяет использовать определение экспрессии Axl как полезный маркер для распознавания наступления EMT, что может быть использовано для диагностики, прогнозирования и терапии рака. 7 н. и 11 з.п. ф-лы, 12 ил.
1. Применение Axl в качестве биомаркера для распознавания наступления эпителиально-мезенхимального перехода (ЕМТ) у субъекта, где повышающая регуляция экспрессии Axl является показателем наступления эпителиально-мезенхимального перехода (ЕМТ).
2. Применение по п.1, где Axl является биомаркером для распознавания индуцирования эпителиально-мезенхимального перехода (ЕМТ).
3. Применение по п.1 или 2, где повышающая регуляция Axl является показателем наступления эпителиально-мезенхимального перехода (ЕМТ).
4. Способ распознавания наступления эпителиально-мезенхимального перехода (ЕМТ) в образце, при этом указанный способ включает следующие стадии:
(i) выделение образца из клетки, группы клеток, модельного животного или человека;
(ii) определение экспрессии Axl в указанном образце в сравнении с контрольным образцом, где повышающая регуляция экспрессии Axl относительно контрольного образца показывает наступление эпителиально-мезенхимального перехода (ЕМТ).
5. Способ идентификации вещества, способного ингибировать или обращать эпителиально-мезенхимальный переход (ЕМТ), при этом указанный способ включает введение указанного вещества в клетку, группу клеток, модельному животному или человеку и контроль экспрессии Axl,
где способ включает:
(i) введение вещества в клетку, группу клеток, модельному животному или человеку; и
(ii) измерение экспрессии Axl в образцах, полученных из обработанных и необработанных клеток, животного или человека; и
(iii) распознавание снижения экспрессии Axl в обработанном образце, в сравнении с необработанным образцом, в качестве признака способности ингибировать или обращать эпителиально-мезенхимальный переход (ЕМТ).
6. Способ по п.5, где образец анализируют посредством анализа белков.
7. Способ по п.6, где анализ белков выполняют посредством ELISA, PET, проточного цитометрического анализа, SELDI-TOF MS или 2-D PAGE.
8. Способ по п.4 или 5, где группа клеток является культурой клеток.
9. Способ по п.4 или 5, где клетки является опухолевыми клетками, РВМС или лимфоцитами.
10. Способ по п.4 или 5, где образец является кровью.
11. Способ по п.4 или 5, где образец является сывороткой, плазмой или супернатантом культур тканевых клеток.
12. Применение набора для оценки способности вещества ингибировать или обращать эпителиально-мезенхимальный переход (ЕМТ), где указанный набор включает антитела к Axl вместе с подходящими реагентами, контрольными реагентами и инструкциями;
где обнаружение уменьшения экспрессии Axl в обработанном веществом образце по сравнению с необработанным образцом является показателем способности ингибировать или обращать эпителиально-мезенхимальный переход (ЕМТ).
13. Применение набора для оценки способности вещества ингибировать или обращать эпителиально-мезенхимальный переход (ЕМТ), где указанный набор включает нуклеиново-кислотный зонд для Axl вместе с подходящими реагентами, контрольными реагентами и инструкциями;
где обнаружение уменьшения экспрессии Axl в обработанном веществом образце по сравнению с необработанным образцом является показателем способности ингибировать или обращать эпителиально-мезенхимальный переход (ЕМТ).
14. Применение набора для оценки способности вещества ингибировать или обращать эпителиально-мезенхимальный переход (ЕМТ), где указанный набор включает, по меньшей мере, один праймер QPCR для Axl вместе с подходящими реагентами, контрольными реагентами и инструкциями;
где обнаружение уменьшения экспрессии Axl в обработанном веществом образце по сравнению с необработанным образцом является показателем способности ингибировать или обращать эпителиально-мезенхимальный переход (ЕМТ).
15. Применение набора по любому из пп.12-14 в способе по любому из пп.5-11.
16. Способ прогнозирования для определения, будет ли субъект восприимчив к лечению ингибитором Axl, где указанный способ включает распознавание наступления эпителиально-мезенхимального перехода (ЕМТ) у указанного субъекта;
где способ включает следующие стадии:
(i) получение образца от указанного субъекта; и
(ii) определение экспрессии Axl в указанном образце, в сравнении с контрольным образцом, где повышающая регуляция экспрессии Axl относительно контрольного образца показывает восприимчивость к лечению ингибитором Axl.
17. Способ прогнозирования по п.16, для применения в индивидуализированном медицинском применении для определения, возможно ли, в частности, что субъект страдает от метастатического рака.
18. Применение набора по любому из пп.12-14 в способе определения, будет ли субъект восприимчив к лечению ингибитором Axl.
| RU 2006134850 A, 10.04.2008 | |||
| WO 2008098139 A2, 14.08.2008 | |||
| US 20050267021 A1, 01.12.2005 | |||
| US 0006699983 B1, 02.03.2004 | |||
| Способ получения кофейного экстракта | 1989 |
|
SU1709976A1 |
| WO 2004008147 A2, 22.01.2004. | |||
Авторы
Даты
2016-06-10—Публикация
2010-03-01—Подача