Изобретение относится к области биотехнологии, а именно генной инженерии, и может быть использовано для создания микробиологического дрожжевого продуцента рекомбинантного поверхностного антигена вируса гепатита В серотипа «ayw» (HBsAg/ayw).
Гепатит В - одна из самых распространенных вирусных инфекций, которая ведет к таким тяжелым последствиям как хронический гепатит, цирроз печени и гепатокарцинома. Успешное применение вакцин против гепатита В существенно улучшило эпидемиологическую ситуацию по гепатиту В, прежде всего в странах с широкой распространенностью данной инфекции, к которым относится и Россия. В настоящее время используемые для вакцинации препараты содержат поверхностный антиген вирусного гепатита В, полученный рекомбинантным путем. Такие вакцины эффективны и более безопасны, чем вакцины, приготовленные с использованием природного вируса.
Известны различные рекомбинантные штаммы, способные продуцировать поверхностный антиген вируса гепатита В.
Так, в патенте RU 2088664 описано получение HBsAg (ayw) с использованием штамма дрожжей Saccharomyces cerevisiae ВКПМ Y-2203, содержащим рекомбинантную плазмидную ДНК pDES20. При всех известных преимуществах - эффективность, безопасность, система экспрессии HBsAg на основе S. cerevisiae имеет недостатки, связанные с проблемой достижения высокого выхода и низкой себестоимости целевого белка. Для увеличения уровня экспрессии, как правило, используют автономно реплицирующиеся мультикопийные векторы, требующие специальных селективных сред для предотвращения накопления бесплазмидных клеток в процессе культивирования штамма-продуцента. Это осложняет получение достаточного количества биомассы на единицу объема культуры. Другой проблемой использования автономно реплицирующегося экспрессионного вектора является существенная вариабельность его копийности в отдельных клетках культуры. В результате в клетках с низкой копийностью вектора уровень экпрессии гена оказывается недостаточно высоким, а слишком высокая копийность может приводить к неспособности белка принять правильную конформацию из-за его гиперпродукции, и только часть клеток культуры содержит оптимальное количество копий экспрессионного вектора, способное обеспечить максимальный выход целевого белка. В качестве индуцируемого промотора, обеспечивающего высокий уровень экспрессии рекомбинантного белка, как правило, применяют промотор гена GAL1, требующий для индукции использования больших количеств хорошо очищенной галактозы, являющейся достаточно дорогим веществом.
Известно использование рекомбинантных метилотрофных дрожжей для получения поверхностного антигена вируса гепатита В. Например, для получения HBsAg серотипа adw был создан штамм Pichia pastoris PS, содержащий рекомбинантную плазмидную ДНК pHBS, обеспечивающую биосинтез HBsAg (RU 2201452). HBsAg в виде иммуногенных частиц размером 22 mn и молекулярной массой 24000 Da выделен при культивировании штамма дрожжей Pichia pastoris С226, трансформированных плазмидой ТАО 906 (ЕР 0864649).
В ближайшем аналоге (RU 2230782) описано создание трансформированного штамма дрожжей Pichia augusta - продуцента рекомбинантного HBsAg/ayw. Штамм был получен трансформацией штамма-реципиента DLT плазмидой, содержащей фрагмент ДНК с рекомбинантным геном, кодирующим HBsAg, под контролем промотора гена метанолоксидазы H. polymorpha (МОХ) и селективным маркером TRP3 H. polymorpha. Полученный штамм обладал высоким выходом HBsAg серотипа «ayw». Однако в процессе культивирования штамма в качестве индуктора добавляется метиловый спирт, относящийся к 3-му классу опасности, при работе с которым необходимо соблюдать соответствующие требования безопасности и охраны окружающей среды.
Задачей изобретения является создание эффективного микробиологического дрожжевого штамма-продуцента поверхностного антигена вируса гепатита В серотипа ayw, антигенные свойства которого позволяли бы использовать его в качестве вакцины для защиты от вируса гепатита В. Под эффективностью понимается возможность получения целевого продукта, обладающего необходимыми биологическими свойствами (правильная конформация, иммуногенность, чистота) и низкой себестоимостью, при этом штамм должен обеспечивать улучшение технологических условий процесса культивирования.
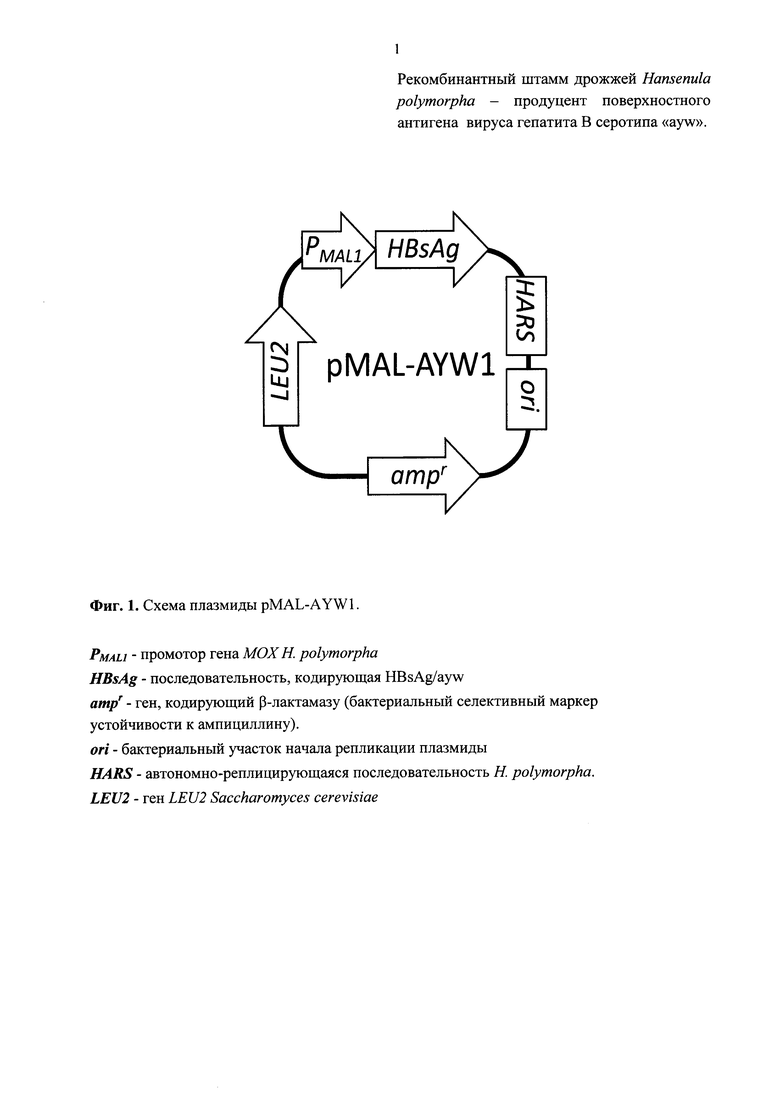
Согласно изобретению, для получения рекомбинантного штамма Н. polymorpha - продуцента поверхностного антигена вируса гепатита В серотипа «ayw», плазмиду, содержащую фрагмент ДНК с рекомбинантным геном, кодирующим HBsAg серотипа «ayw», под контролем промотора гена мальтазы К polymorpha (MALI) и селективным маркером (ген LEU2 S. cerevisiae) интегрируют в геном реципиентного штамма H.polymorpha DL1-L (Sohn J.H. et al., J Bacteriol. 1996, 178(15):4420-8). Для получения клонов, содержащих в геноме несколько копий плазмиды, применена процедура селекции множественной интеграции. По результатам проверки полученных в результате этой процедуры клонов на способность синтезировать белок поверхностного антигена вируса гепатита В был выделен трансформант, наиболее отвечающий требуемым свойствам. В процессе культивирования штамма в качестве индуктора добавляется сахароза. Полученный рекомбинантный штамм, содержащий несколько копий целевого гена под контролем промотора MALI, депонирован 24.03.2014 в коллекции микроорганизмов ЗАО НПК «Комбиотех» под номером КБТ-14/pAYmalt-l. Штамм является новым и ни в патентной, ни в научно-технической литературе не описан.
Штамм позволяет получать HBsAg, обладающий высокими антигенными и иммуногенными свойствами, обеспечивает улучшение технологических условий процесса культивирования, благодаря возможности избежать использование метилового спирта, имеющего 3-й класс опасности, обеспечивает соблюдение требований по защите окружающей среды.
Изобретение может быть проиллюстрировано следующими примерами.
В приводимых примерах все генно-инженерные операции производили согласно стандартным методикам и инструкциям компаний-производителей ферментов и наборов для манипуляций с ДНК in vitro. Трансформацию клеток Escherichia coli и H. polymorpha осуществляли согласно ранее описанным методам (Inoue H. et. al., Gene, 1990, 96:23-28; Bogdanova A.I. et. al., Yeast, 1995, 11(4):343-53). Для полимеразной цепной реакции (ПНР) использовали полимеразу Pwo (Roche). Синтез олигонуклеотидов, а также определение последовательности нуклеотидов производились ЗАО "Евроген" г. Москва.
Пример 1. Получение штамма Н. polymorpha, содержащего несколько копий рекомбинантного гена, кодирующего полипептид HBsAg/ayw, под контролем промотора MALI.
Получали плазмиду pMAL-AYW1 (Фиг. 1; SEQ ID ΝΟ:1), которая содержала рекомбинантный ген, кодирующий полипептид HBsAg/ayw, под контролем промотора MALI (SEQ ID NO: 1, нуклеотидные позиции 1-2024). Помимо этого гена плазмида pMAL-AYWl состояла из: (а) фрагмента плазмиды рАМ619 (Agaphonov M., Alexandrov Α., FEMS Yeast Res., 2014, 14(7): 1048-54), включающего бактериальный селективный маркер устойчивости к ампициллину и дрожжевой селективный маркер - модифицированный ген LEU2 S. cerevisiae (SEQ ID NO: 1, нуклеотидные позиции 2913-6326), (б) фрагмента плазмиды AMIpSLl (Agaphonov et al., Yeast. 1999, 15(7):541-51), несущего терминатор транскрипции и автономно-реплицирующуюся последовательность Н. polymorpha, (SEQ ID NO: 1, нуклеотидные позиции 2025-2912) и (в) линкерной последовательности (SEQ ID NO: 1, нуклеотидные позиции 6327-6403).
Штамм DL1-L трансформировали плазмидой pMAL-AYW1. Трансформантов отбирали на среде, не содержащей лейцин. Несколько выросших трансформантов посеяли на твердую среду без лейцина истощающим штрихом, чтобы получить отдельные колонии. Среди выросших колоний отобрали самые крупные и снова посеяли на твердую среду без лейцина истощающим штрихом. Эту процедуру повторяли до тех пор, пока вырастающие при рассеве колонии не стали одинаковыми по скорости роста. По одному такому субклону нескольких независимых трансформантов отобрали для анализа продукции белка HBsAg/ayw. Трансформант с лучшей продуктивностью был обозначен КБТ-14/pAYmalt-1.
Пример 2. Культивирование штамма Н. polymorpha КБТ-14/pAYmalt-1.
Ферментацию штамма-продуцента Н. polymorpha осуществляли в два этапа. На первом этапе культивирования в режиме фед-бэтч при температуре 30°С наращивали биомассу в культуральной среде, содержащей 4% дрожжевого экстракта, 2% бактопептона и 4% глицерина. Процесс вели до истощения источника углерода в питательной среде и прекращения роста биомассы. На втором этапе культивирование проводили с подпиткой культуры путем непрерывной подачи 30%-ного раствора дрожжевого экстракта. Одновременно с подпиткой добавляли индуктор (раствор сахарозы, 40% вес/объем), который добавляли порциями по 0.5% (вес сахарозы / объем культуральной жидкости) через каждые два часа в течение 48-72 часов. Продолжительность всего процесса составляла около 96 часов.
Пример 3. Выделение и очистка рекомбинантного белка HBsAg/ayw из клеток Н. polymorpha.
После ферментации белок HBsAg/ayw (SEQ ID NO: 2) выделяли согласно опубликованной методике (Lunsdorf H. et al., Microbial Cell Factories, 2011, 10:48) с небольшими изменениями. Клетки из культуральной жидкости осаждали центрифугированием при 4000g в течение 30 минут при 4°С. Осажденную биомассу ресуспендировали до исходного объема в карбонатно-солевом буферном растворе для экстракции (50 mM NaHCO3, 150 mM NaCl, рН 8.0) и снова осаждали центрифугированием при 4000g в течение 30 минут при 4°С. Полученную таким образом отмытую биомассу ресуспендировали в буферном растворе для экстракции с добавлением 1.7mM EDTA и 2 mM PMSF до концентрации 400 г влажных клеток на литр суспензии. Далее клетки разрушали в проточном дезинтеграторе Dyno-Mill типа KDL при температуре 5-10°С, используя стеклянные шары диаметром 0.5-0.7 мм. Для удаления клеточного дебриса полученный гомогенизат центрифугировали при 4000g в течение 60 минут при 4°С.
Полученный осветленный гомогенизат подвергали ультрафильтрации в тангенциальном потоке на системе Sartocon через мембрану с порогом отсечения 300 kDa (Sartorius, Германия), одновременно концентрировали и переводили в фосфатно-солевой буферный раствор (10mM NaH2PO4, 150 mM NaCl, 1.7 mM EDTA, рН 6.8). При этом отделяется большая часть примесных низкомолекулярных белков.
Дальнейшую очистку проводили методом адсорбционной хроматографии на колонке с макропористым стеклом (МПС) с использованием технологии Streamline (хроматография в восходящем потоке). Концентрированный раствор HBsAg/ayw, полученный после ультрафильтрации, наносили на колонку при скорости 1 мл/мин, промывали 3-4 объемами фосфатно-солевого буферного раствора (рН 6.8) и элюировали карбонатным буфером (50mM NaHCO3, 150 mM NaCl, 1.7 mM EDTA, рН 9.5).
Объединенные фракции, содержащие HBs антиген (определяли по иммуноблоту и SDS-PAGE), концентрировали ультрафильтрацией в тангенциальном потоке на мембране 300 KDa и разделяли при помощи зонального ультрацентрифугирования (Beckman Coulter, USA) в градиенте плотности сахарозы (20-50% вес./вес.). Фракции, содержащие целевой белок, объединяли, а затем очищали гель-фильтрацией на сорбенте Toyopearl HW-65 (Tosoh Bioscience, Japan) в фосфатном буферном растворе (10mM NaH2PO4, 0.03% Tween-20, рН 7.2).
Если чистота белка на данной стадии была недостаточна (менее 95%), производили дополнительную очистку при помощи анионообменной хроматографии на сорбенте Toyopearl DEAE-650M (Tosoh Bioscience, Japan).
В результате этих операций удается выделить около 30% антигена, присутствующего в осветленном клеточном лизате. Выход очищенного HBsAg/ayw составлял не менее 50 мг/л культуральной жидкости.
Пример 4. Анализ рекомбинантного HBsAg/ayw.
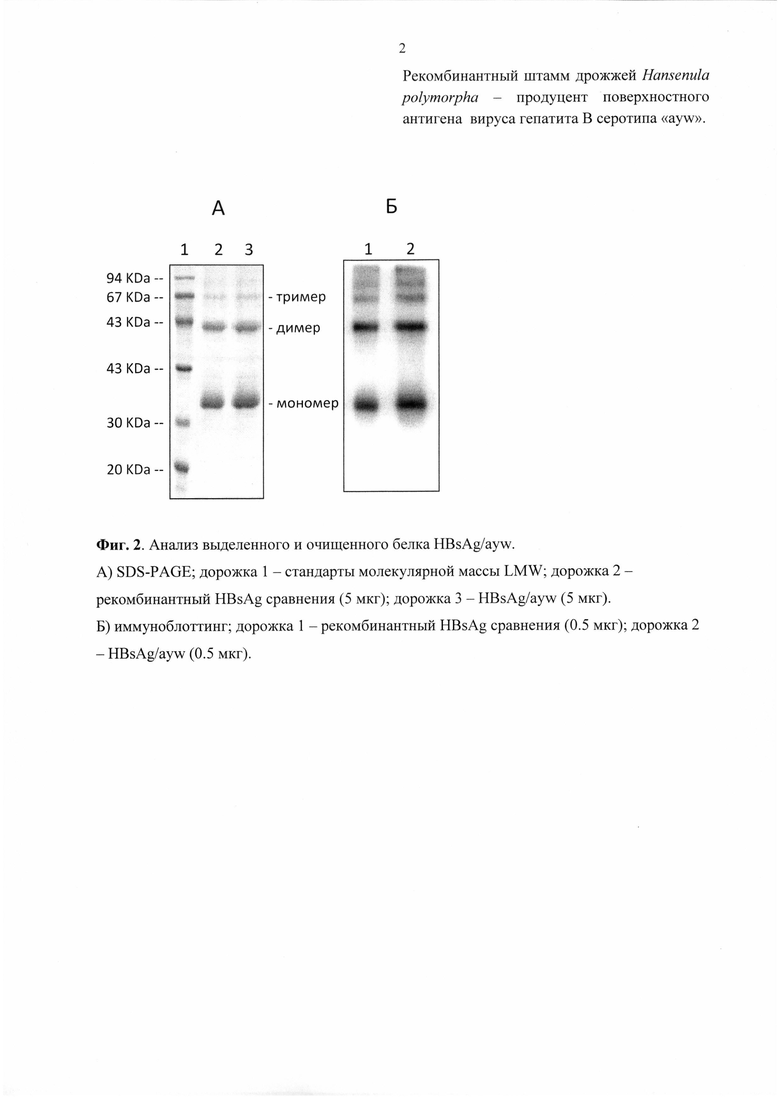
1) Чистота рекомбинантного HBsAg/ayw определяется электрофорезом в полиакриламидном геле в восстанавливающих условиях (SDS-PAGE) путем окрашивания с Coomassie Brilliant Blue R-250 и/или серебром (Фиг. 2A). Анализ интенсивности полос отсканированных гелей проводится посредством компьютерной программы NIH Image.
2) Иммуноспецифичность рекомбинантного HBs антигена определяют методом иммуноблотинга. Первичные антитела для этой цели получали иммунизацией кроликов рекомбинантным HBsAg (ЗАО НПК «Комбиотех»), восстановленным в присутствии 2% SDS и 5% β-меркаптоэтанола. Из полученных высокоиммуных сывороток специфические поликлональные антитела выделяли на афинном сорбенте с конъюгированным рекомбинантным HBsAg (Крымский М.А. et. al., Биофармацевтический Журнал, 2010, 2(5):8-15). Этими антителами окрашивали иммуноблот с последующей визуализацией при помощи специфических антител к иммуноглобулинам кроликов, конъюгированными с пероксидазой хрена, по методике улучшенной хемилюминисценции ECL (Amersham, UK). Рекомбинантный антиген HBsAg/ayw представлен в виде полосы мономера белка размером 22-25 кДа и полос димера и тримера (Фиг. 2Б).
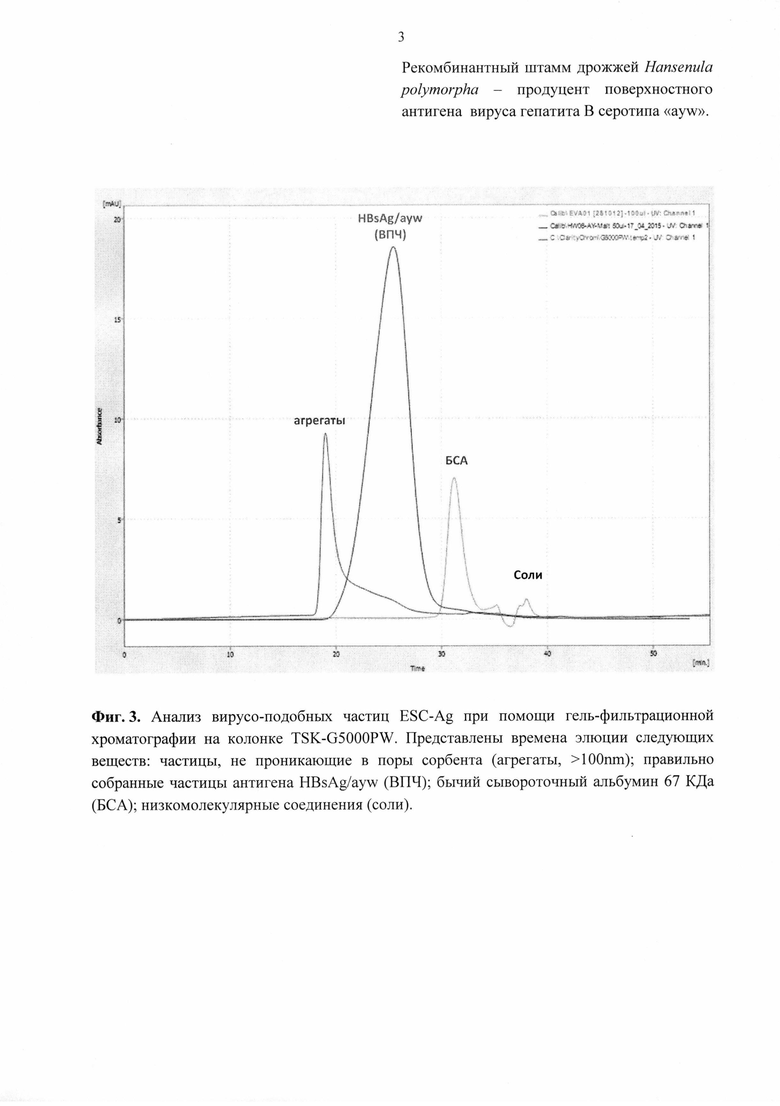
3) Образование вирусоподобных частиц (ВПЧ) рекомбинантного белка HBsAg/ayw подтверждали методом гель-фильтрационной хроматографии на полимерной колонке TSK G5000PW диаметром 7.5 мм и длиной 60 см, соединенной с предколонкой PrePW диаметром 7.5 мм и длиной 7.5 см (Tosoh Bioscience, Japan). Разделение проводили в фосфатном буферном растворе (10mM КН2РО4, (рН 7.2), 0.03% Tween-20) при скорости потока 0.6 мл/мин. Мониторинг процесса осуществляли по поглощению на 280 нм. Размер пор сорбента 1000 Å позволяет отделить правильно собранные ВПЧ от мономеров и агрегатов HBs-антигена. Время элюции очищенного препарата HBsAg/ayw соответствует времени элюции вирусоподобных частиц 23-26 мин (Фиг. 3).
4) Иммуногенность рекомбинантного антигена HBsAg/ayw, определенная в тесте "in vivo" на мышах линии Balb/c с массой 12-14 г в расчете на ED50 (доза антигена, вызывающая сероконверсию у 50% мышей), составляет 0.05-0.1 мкг.
Культурально-морфологические особенности штамма: клетки округлой формы, небольшие по размеру, на агаризованной среде YPD образуют крупные круглые колонии с выраженной выпуклой серединой. Хранение штамма - при -70°С в виде суспензии клеток в стерильном 30-50%-ном растворе глицерина.
Генетические особенности: штамм не является зоопатогенными или фитопатогенными.
Способ, условия и состав сред для размножения штамма: инкубирование прокачиванием при 30°С в питательной среде состава: 2% пептона, 1% дрожжевого экстракта, 2% глюкозы.
Условия и состав среды для ферментации: прокачивание при 30°С и рН 5.5-6.0 в питательной среде, содержащей до 4% глицерина.
Выделенный белок HBsAg/ayw может быть использован в тест-системах, а также для создания на его основе вакцин для профилактики заболеваний, ассоциированных с вирусом гепатита В.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ ВИРУСНОГО ГЕПАТИТА В (ВАРИАНТЫ) | 2015 |
|
RU2603729C2 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ Hansenula polymorpha - ПРОДУЦЕНТ МУТАНТНОГО ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСА ГЕПАТИТА В (ВАРИАНТЫ) | 2015 |
|
RU2586513C1 |
| РЕКОМБИНАНТНАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ ВИРУСНОГО ГЕПАТИТА Е У ЖИВОТНЫХ | 2012 |
|
RU2501568C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО КАПСИДНОГО БЕЛКА ВИРУСА ГЕПАТИТА Е И РЕКОМБИНАНТНАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ ВИРУСНОГО ГЕПАТИТА Е | 2012 |
|
RU2501809C1 |
| ТРАНСФОРМИРОВАННЫЙ ШТАММ ДРОЖЖЕЙ PICHIA ANGUSTA - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСА ГЕПАТИТА В - HBSAG/AYW | 2003 |
|
RU2230782C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ PICHIA ANGUSTA - ПРОДУЦЕНТ КАПСИДНОГО БЕЛКА L1 ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА ТИПА 18 | 2011 |
|
RU2445358C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ HANSENULA POLYMORPHA - ПРОДУЦЕНТ КАПСИДНОГО БЕЛКА ВИРУСА ГЕПАТИТА Е | 2012 |
|
RU2493249C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ Hansenula polymorpha - ПРОДУЦЕНТ ГЛАВНОГО КАПСИДНОГО БЕЛКА L1 ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА ТИПА 56 | 2014 |
|
RU2546240C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ PICHIA ANGUSTA - ПРОДУЦЕНТ КАПСИДНОГО БЕЛКА L1 ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА ТИПА 16 | 2011 |
|
RU2445357C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ Hansenula polymorpha - ПРОДУЦЕНТ ГЛАВНОГО КАПСИДНОГО БЕЛКА L1 ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА ТИПА 18 | 2014 |
|
RU2546242C1 |



Изобретение относится к биотехнологии, а именно генной инженерии. Предложен штамм дрожжей Hansenula polymorpha - продуцент рекомбинантного поверхностного антигена вируса гепатита В серотипа «ayw». Штамм был получен путем введения в геном клетки дрожжей нескольких копий последовательности ДНК, кодирующей HBsAg/ayw, под контролем промотора MAL1 H. polymorpha. Штамм обеспечивает высокий выход рекомбинантного белка HBsAg/ayw, обладающего антигенными и иммуногенными свойствами природного антигена, в улучшенных технологических условиях процесса культивирования на средах, не содержащих токсичных и огнеопасных компонентов, и обеспечивает соблюдение требований по защите окружающей среды. Изобретение может быть использовано для микробиологического получения рекомбинантного белка HBsAg. 3 ил., 4 пр.
Рекомбинантный штамм дрожжей Hansenula polymorpha КБТ-14/pAYmalt-1, содержащий интегрированные в геном несколько копий фрагмента ДНК с рекомбинантным геном, кодирующим полипептид HBsAg/ayw, под контролем промотора гена MALI H. polymorpha (SEQ ID NO:1, нуклеотидные позиции 1-2024) - продуцент рекомбинантного поверхностного антигена вируса гепатита В серотипа «ayw».
Авторы
Даты
2016-06-10—Публикация
2015-04-24—Подача