Молекулы микроРНК представляют класс малых не кодирующих белки РНК, которые могут ингибировать трансляцию. Такие типы РНК, которые экспрессируются со специализированных генов, играют важную роль в регуляции экспрессии генов в клетке, включая регуляцию развития, дифференциацию стволовых клеток кроветворения, апоптоз и развитие рака. МикроРНК транскрибируются индивидуально или в комбинации в виде длинных первичных транскриптов (primary - pri-микроРНК) с помощью РНК-полимеразы II или III. Принято считать, что геном человека содержит по меньшей мере 500 разных генов микроРНК, которые первоначально экспрессируются в виде 5'-кэпированных и полиаденилированных транскриптов РНК полимеразы II. Они экспрессируются или в качестве отдельно регулируемых генов, или в качестве кластеров микроРНК, и затем процессируются с одного первичного транскрипта, который может содержать несколько микроРНК. Фермент Drosha расщепляет pri-микроРНК на предшественников микроРНК (precursor - рге-микроРНК) длиной 70-100 нуклеотидов, формируя вторичные структуры шпилька-петля. Затем происходит цитоплазматический процессинг, в ходе которого под действием фермента Dicer образуются зрелые одноцепочечные формы длиной примерно 16-29 нуклеотидов. Сформированные таким образом молекулы двухцепочечной РНК, которые содержат зрелую микроРНК и ее антисмысловую цепь, затем раскручиваются геликазой и зрелая микроРНК загружается на заглушающий комплекс (комплекс сайленсинга), индуцированный РНК (RNA induced silencing complex - RISC), а антисмысловая цепь разрушается.
Глушение трансляции (сайленсинг) вызывается или подавлением синтеза белка после связывания через неполное спаривание оснований с 3'-нетранслируемыми областями (3' untranslated region - 3'-UTR) целевых мРНК, и/или за счет связывания с мРНК с безупречной комплементарностью, что приводит к расщеплению целевых мРНК. Таким образом, опосредованное микроРНК подавление генной экспрессии потенциально может регулировать много клеточных мишеней, и на отдельные гены могут нацеливаться множественные микроРНК.
Краткое описание изобретения
Адаптивный рост кровеносных сосудов является важным защитным механизмом при сердечно-сосудистом заболевании, однако лежащие в основе регуляторные механизмы этого процесса поняты лишь частично. Ранее были обнаружены малые эндогенные молекулы РНК, которые играют важную роль в эмбриональном и постнатальном развитии кровеносных сосудов. Транскриптомный анализ микроРНК применяют для скрининга miRNA, дифференциально экспрессирующихся после индукции ишемии задней конечности у мышей, для идентификации miRNA, участвующих в ангиогенной и артериогенной регуляции. Установлено, что микроРНК-100 с пониженной регуляцией модулирует пролиферацию, формирование трубочек и активность по прорастанию эндотелиальных клеток и функционирует в качестве эндогенного репрессора сериновой/треониновой протеинкиназы mTOR. Сверхэкспрессия miR-100 ослабляет пролиферацию клеток, и это нарушение может быть преодолено путем одновременной трансфекции с конструкцией mTOR, утратившей сайт связывания miRNA. Ингибирование miR-100 специфическими антагомирами in vivo приводит к индукции ангиогенеза после окклюзии бедренной артерии у мышей, а лечение рапамицином - ингибитором mTOR, приводит к противоположному эффекту. Снижение регуляции miR-100 в клетках эндотелия индуцируется повышенными уровнями про-артериогенного цитокина TNF-альфа, экспрессия которого обратно коррелирует с уровнями miR-100 в ишемической ткани.
Показана анти-ангиогенная функция miR-100, которая по меньшей мере частично осуществляется через репрессию mTOR-передачи сигнала. Соответственно, подавление или повышение miR-100 представляет новый подход к положительному или отрицательному моделированию роста кровеносных сосудов и других mTOR-зависимых процессов.
Кроме того, установлено, что олигонуклеотидные соединения, основанные на последовательности микроРНК-100, могут применяться для подавления по меньшей мере трех молекул эндотелиальной адгезии. Таким образом, такая микроРНК сильно ослабляет адгезию циркулирующих лейкоцитов на стенках сосудов, которая является принципиальной составляющей широкого круга воспалительных заболеваний. Соединения, основанные на последовательности микроРНК-100, могут применяться для ослабления сосудистого воспалительного ответа на различные стимулы.
Предшествующий уровень техники: адаптивный рост кровеносных сосудов
Адаптивный рост кровеносных сосудов является важным защитным механизмом у пациентов с хроническим окклюзионным поражением сосудов. Прогрессирующая окклюзия крупной артерии приводит к гемодинамическим изменениям и ишемии расположенных ниже по кровотоку тканей, что вызывает и пролиферацию малых ранее существовавших коллатеральных артерий (артериогенез), и прорастание капилляров в ишемическую ткань (ангиогенез). В недавнем прошлом профилирование транскрипции применяли для исследования принципов регуляции, что облегчает и ангиогенез, зависимый от напряжения сдвига, и индуцированный гипоксией ангиогенез, а также выявлено несколько ключевых регуляторов.
Первые исследования подтвердили важную регуляторную функцию микроРНК в эмбриональном и постнатальном развитии кровеносных сосудов. Мультидоменный белок Dicer ответственен за процессинг молекул-предшественниц микроРНК в зрелые микроРНК, и мыши с гомозиготной мутацией Dicer умирают на ранней стадии эмбрионального развития из-за дефектов сосудов, подтверждая принципиально важную роль микроРНК в эмбриональном процессе формирования сосудов. Dews и др., Nat. Genet., 38, 2006, сс.1060-1065, показывают, что трансдукция клеток карциномы miR-17-92 приводит к повышенной перфузии опухоли, и что модуляция молекул микроРНК может применяться для повышения (в данном случае физиологическом) перфузии ткани.
Несколько исследовательских групп по всему миру в настоящее время исследуют регуляцию молекулами микроРНК ангиогенеза опухолей, но профиль экспрессии микроРНК во время роста ненеопластических кровеносных сосудов в качестве компенсаторного механизма при сосудистых окклюзионных заболеваниях до настоящего времени мало изучен. Описаны изменения в экспрессии микроРНК при адаптивной неоваскуляризации после сосудистой окклюзии и функциональное участие молекул микроРНК в моделировании ангиогенеза и артериогенеза в модели периферического сосудистого окклюзионного заболевания у мышей.
Mowelatos и др., Genes Dev. 16, 2002, сс.720-728, описали miR-100 в качестве малой эндогенной РНК и затем установили ее дифференциальную регуляцию в нескольких исследованиях особенностей экспрессии в опухолях.
Последовательность микроРНК-100 локализована на хромосоме 11 в кластере с let7a-2 и формирует семейство микроРНК с последовательностью, близкой miR-99. В области сердечно-сосудистых исследований miR-100 был впервые упомянут в работе Sucharov и др., J. Mol. Cell Cardiol, 45, 2008, сс.185-192, показавшей существенное повышение регуляции miR-100 в образцах тканей пациентов с сердечной недостаточностью с идиопатической дилатационной кардиомиопатией. За исключением этих результатов по дифференциальной экспрессии, регуляция и функция miR-100 исследованы мало. Ранее Henson и др., Genes Chromosomes Cancer, 48, 2009, сс.569-582, описали пониженную экспрессию miR-100 при плоскоклеточной карциноме ротовой полости и впервые провели функциональные исследования этой микроРНК в культивируемых раковых клетках. Они сообщили о существенном снижении пролиферации клеток после трансфекции pre-miR-100, обнаруживая хорошее соответствие с результатами, представленными в настоящем изобретении.
Потенциальное функциональное значение miR-100 в биологии рака было дополнительно подтверждено предшествующим сообщением Shi и др.. Int. J. Cancer, 2009 (Int J Cancer. 2009 Sep 8. [Epub ahead of print], PMID: 19739117), показывая, что сниженные уровни экспрессии miR-100 в клетках карциномы носоглотки человека приводят к прогрессированию заболевания. Показано, что miR-100 коррелирует с повышенными уровнями митотического регулятора поло-подобной киназы 1; однако воздействие на другие потенциальные гены-мишени, например, mTOR, не исследовали.
Manegold и др., Clin. Cancer Res., 2008, сс.892-900, описывают антиангиогенную терапию, посредством которой ингибитор mTOR, обозначаемый RAD001 (эверолимус), комбинируют с радиотерапией.
Wang и др., Journal of Virology, 2008, сс.9065-9074, сообщают, что инфекция цитомегаловирусом человека может изменить экспрессию клеточных типов микроРНК, в связи с чем miR-100 исследовали более подробно.
В WO 2005/013901 описывают олигомерные соединения и композиции, применяемые для модулирования малых некодирующих РНК.
Предшествующий уровень техники относится к потенциальным эффектам, которые микроРНК-100 могут оказывать на рост опухолевых клеток. Однако настоящее изобретение относится к положительным или отрицательным модуляциям роста кровеносных сосудов, которые отличаются от опухолей.
Сосудистые воспаления
Воспаление является важным компонентом защитной реакции организма-хозяина от внешних патогенов и повреждений, но также может индуцировать и поддерживать вредные состояния, например атеросклероз, васкулит или миокардит. Слой эндотелиальных клеток кровеносных сосудов является решающей модулирующей структурой в этом процессе, поскольку циркулирующие иммунные клетки должны присоединиться к эндотелию и мигрировать в стенку сосуда или периваскулярное пространство для осуществления своих функции. По сути повышенную регуляцию молекул эндотелиальной адгезии из-за изменений перемещения жидкостей в организме, гипертонии или повышенных уровней липопротеида низкой плотности-холестерина является одной из ранних стадий в инициации атеросклероза, который в настоящее время обычно рассматривается в качестве хронического воспалительного заболевания (1).
Много усилий по модулированию взаимодействий эндотелия-лейкоцитов по предупреждению или снижению чрезмерных воспалительных реакций было достигнуто в прошлом; однако основные регуляторные принципы процесса воспаления эндотелия остаются мало исследованными. Полагают, что ингибирование отдельных компонентов воспалительного каскада, например, одним антителом против молекулы адгезии, может оказаться недостаточным для достижения устойчивого эффекта в плане сосудистого воспаления.
Хотя мало известно о роли эндотелиальных молекул микроРНК в сосудистом воспалении, первые исследования показывают потенциально важную регуляторную функцию таких малых РНК. Показано, что MiR-126 регулируется факторами транскрипции Ets-1 и Ets-2 (3) в клетках эндотелия и приводит в действие противовоспалительный эффект путем репрессии VCAM-1, ослабляя адгезию лейкоцитов к стенке сосуда. MiR-21, который на высоком уровне экспрессируется в клетках гладкой мускулатуры сосудов, выявляют в качестве возможной мишени для предупреждения формирования неоинтимы после ангиопластики. Хотя наши знания о сосудистых микроРНК в этом контексте все еще недостаточны, исследования уже сфокусированы на функции малых РНК в циркуляции иммунных клеток и установлено несколько про- и антивоспалительных микроРНК. Предположительно особенно miR-155 играет принципиальную роль в дифференциации и функционировании почти всех субпопуляций лейкоцитов.
Описана функциональная роль miR-100 в модулировании взаимодействий лейкоцитов-эндотелия путем репрессии молекул эндотелиальной адгезии. Биологическое действие miR-100 позволяет применять его для лечения заболеваний, связанных с сосудистой системой, в частности васкулита, атеросклероза, васкулярной коррекции в ответ на повреждение или рестеноз.
Предпочтительные варианты осуществления настоящего изобретения
Функция miR-100 в сосудистой системе до настоящего времени не исследована. В настоящем изобретении изложено первое исследование, применяющее результаты дифференциальной экспрессии по данным in vivo для идентификации новой микроРНК - регулятора ангиогенеза. В настоящем изобретении описано снижение регуляции микроРНК-100 после индукции ишемии in vivo и функция указанной микроРНК в качестве анти-ангиогенного репрессора.
Хотя ген miR-100 не является микроРНК с наиболее сильной нарушенной регуляцией после индукции ишемии в задней конечности и его экспрессия не является специфичной для сосудов, исследование было сфокусировано на этом гене из-за устойчивого снижения его экспрессии на протяжении периода ангиогенеза и его подающий надежду выбор прогнозированных генов-мишеней. Ген miR-100 экспрессируется и в эндотелии, и в клетках гладкой мускулатуры сосудов in vivo и в культуре. Подходы по утрате функции, а также подходы к усилению функции, применяют для подтверждения важной регуляторной функции такой микроРНК в нескольких моделях ангиогенеза in vitro, а также по более общим клеточным функциям, например, пролиферации. Интересно отметить, что разброс эффекта подавления miR-100 на пролиферацию в клетках разных типов коррелирует с исходными уровнями микроРНК в этих клетках.
Используя комбинацию анализа экспрессии генома дикого типа в клетках эндотелия после сверхэкспрессии miR-100 и прогнозов по биоинформатике сайтов связывания микроРНК, мишенью рапамицина у млекопитающих была определена непосредственно мРНК-мишень гена miR-100. Ранее было показано, что mTOR необходим для ангиогенеза и пролиферации клеток эндотелия в ответ на гипоксию и является одной из обнадеживающих мишеней для новой анти-ангиогенной противораковой терапии.
Было показано, что ген miR-100 способен репресировать mTOR-зависимую клеточную пролиферацию и что этот эффект может быть нейтрализован путем экспрессии mTOR, утратившей сайт связывания miR-100. Хотя другие гены-мишени miR-100 не могут быть исключены в качестве медиаторов наблюдаемых воздействий на неоваскуляризацию, это показывает, что экспрессия mTOR является важной стадией медиатора функции miR-100 в клетках сосудов. Кроме того, гистологический анализ показывает повышенную экспрессию mTOR в растущих коллатеральных артериях и лечение рапамицином - ингибитором mTOR, приводит к противоположному эффекту, оказываемому на восстановление перфузии в задней конечности по сравнению с лечением miR-100-специфическим антагомиром.
Настоящее изобретение добавляет нового кандидата к списку описанных молекул «антаго-miR» и показывает роль miR-100 в регуляции клеточной пролиферации и ангиогенезе и его функцию в качестве эндогенного mTOR-модулятора. Отсюда следует важная роль такой микроРНК также в других физиологических и патофизиологических процессах. Ген miR-100 является новой обнадеживающей мишенью для фармакологической терапии при сердечно-сосудистом заболевании.
Фармацевтическую композицию, описанную в настоящем изобретении, предпочтительно применяют для лечения сердечно-сосудистых заболеваний и заболеваний сосудистой системы. В особенно предпочтительном варианте осуществления настоящего изобретения фармацевтическую композицию применяют для какого-либо из следующих заболеваний, выбранных из группы, включающей окклюзионное заболевание периферических сосудов, коронарную болезнь сердца, цереброваскулярное заболевание, васкулит, атеросклероз, сосудистое ремоделирование в ответ на повреждение и рестеноз.
Настоящее изобретение предусматривает фармацевтическую композицию, которая включает молекулу микроРНК или комплементарную ей последовательность, или ее вариант, и в частности один или несколько антагомиров. Антагомиры являются химически сконструированными олигонуклеотидами, которые применяют для глушения эндогенной микроРНК. Антагомир является малой синтетической молекулой РНК, которая совершенным образом комплементарна специфической микроРНК-мишени либо с ошибочным спариванием по сайту расщепления Ago2, либо с некоторым типом модификации оснований для ингибирования расщепления Ago2. Обычно антагомиры обладают некоторым видом модификации для придания большей устойчивости к разрушению. Неясно, каким образом действует антагомиризация (процесс, с помощью которого антагомир ингибирует действие микроРНК), но полагают, что она необратимо ингибирует связывание микроРНК. Антагомиры применяют для конститутивного подавления действия специфических микроРНК.
Действующая молекула основана на последовательности микроРНК-100, имеющей следующую последовательность: GUGUUCAAGCCUAGAUGCCCAA (SEQ ID No.1).
Последовательность РНК также может быть представлена в виде последовательности ДНК, в соответствии с чем урацил (U) замещен тимидином (Т). В результате последовательность читается следующим образом: GTGTTCAAGCCTAGATGCCCAA (SEQ ID No.2).
Предполагают, что молекула miR-100 является производной от более длинной молекулы-предшественницы, так называемой молекулы pre-miR, которая процессируется в молекулы зрелой miR-100. В экспериментах применяют молекулу pre-miR-100, имеющую следующую последовательность:
CCUGUUGCCACAAACCCGUAGAUCCGAACUUGUGGUAUUAGUCCGCACAAGCUUGUAUCUAUAGGUAUGUGUCUGUUAGG (SEQ ID No.8).
Полагают, что молекула pre-miR складывается в следующую структуру:

Указанная выше структура имеет нуклеотидную последовательность SEQ ID No.8, в соответствии с чем показаны спаривания оснований.
Молекула pre-miR процессируется в молекулы зрелой микроРНК-100, имеющую следующую последовательность:
AACCCGUAGAUCCGAACUUGUG (SEQ ID No:9).
Последовательность SEQ ID No:9 является ревертированной последовательностью SEQ ID No:l.
Для фармацевтического лекарственного средства предпочтительно применяют следующую последовательность антагомира:
Antag-100: 5'-cacaaguucggaucuacggguu-3' (SEQ ID No.3). Последовательность SEQ ID No:3 применяют в экспериментах, в которых применяют обозначение «анти-miR».
В качестве контроля применяют последовательности SEQ ID NO:4 и NO:5:
Antag-cont1: 5'-aaggcaagcugacccugaaguu-3' (SEQ ID No.4) и
Antag-cont2: 5'-caccaguuaggcucuacggauu-3' (SEQ ID No.5).
Настоящее изобретение также относится к вариантам указанных выше последовательностей SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3, причем понятие «вариант» означает, что один или два нуклеотида могут быть делегированы или замещены другими нуклеотидами.
Предпочтительные варианты последовательности SEQ ID NO:1 и/или SEQ ID NO:2 гомологичны по меньшей мере на 85%, предпочтительно на 90% и более предпочтительно на 95% последовательности SEQ ID NO:1 и/или SEQ ID NO:2.
Предпочтительные варианты последовательности антагомира SEQ ID NO:3 гомологичны по меньшей мере на 85%, предпочтительно на 90% и более предпочтительно на 95% последовательности SEQ ID NO:3. Это означает, что в вариантах до трех нуклеотидов могут быть замещены другими нуклеотидами, предпочтительно только двумя и более предпочтительно только одним нуклеотидом. Понятие гомологии означает идентичность. То есть, например, по меньшей мере 85% нуклеотидов идентичны, несмотря на то, что оставшиеся нуклеотиды могут быть изменены. Для определения гомологии последовательности по настоящему изобретению сравнивают с гомологичными последовательностями, которые имеют то же число нуклеотидов. Предпочтительные варианты осуществления настоящего изобретения имеют последовательности 1, 2, 3, 8 и/или 9 при условии, что не более 2, предпочтительно 1 нуклеотид делегирован, добавлен или замещен другим нуклеотидом.
В особенно предпочтительном варианте осуществления настоящего изобретения антагомир-100 имеет последовательность SEQ ID No:3, согласно указанному выше, причем некоторые из нуклеотидов модифицированы. Предпочтительный антагомир-100 имеет следующую последовательность:
c*a*caaguucggaucuacgg*g*u*u*,
которая соответствует последовательности SEQ ID No:3.
Все основания синтезируют в виде 2-O-метил-РНК. Значок «*» показывает а фосфотиоатную модификацию. С 3'-конца с молекулой конъюгируют холестерин для лучшего потребления клеткой.
Специалистам в данной области очевидно, что возможны незначительные модификации молекулы. Например, остаток холестерина также может быть присоединен к 5'-концу. В другом варианте дополнительные основания могут иметь фосфотиоатную модификацию.
В предпочтительном варианте осуществления настоящего изобретения неполная последовательность: "UACGGGU (SEQ ID No.6) не изменяется. Следовательно, изменения в последовательности ID NO:3 происходят только в положениях последовательности ID NO:3, которые не соответствуют последовательности SEQ ID NO:6.
Это также справедливо для комплементарной последовательности соответствующей дезоксирибонуклеотидной последовательности. В предпочтительных вариантах осуществления настоящего изобретения основания в положениях 5, 9, 12 и 20 не являются мутантными, что означает, что основания в указанных положениях в последовательностях SEQ ID No.1, или SEQ ID NO:3, или в комплементарных им последовательностях остаются неизмененными.
Структуры биологического действия, согласно описанному в настоящем изобретении, могут быть интродуцированы в организм для лечения в виде нуклеиновой кислоты в составе вектора, который реплицируется в клетках-хозяевах и вырабатывает олигонуклеотиды. В другом варианте нуклеотидные последовательности по настоящему изобретению могут вводиться пациенту в соответствующем носителе.
Варианты также могут включать указанные выше последовательности и модифицированные олигонуклеотиды, конъюгированные с одной или несколькими частями молекулы, которые повышают действие, клеточное распределение или клеточное потребление получаемых антисмысловых олигонуклеотидов. Предпочтительной частью молекулы является часть молекулы холестерина или липида. Дополнительными частями молекулы для конъюгации могут быть углеводы, фосфолипиды, биотин, феназин, фолат, фенантридин, антрахинон, акридин, флуоресцеины, родамины, кумарины и красители. В некоторых вариантах конъюгируемая группа присоединена непосредственно к модифицированному олигонуклеотиду. В некоторых вариантах конъюгируемая группа присоединена к модифицированному олигонуклеотиду связывающей частью молекулы, выбранной из аминогруппы, гидроксила, карбоновой кислоты, тиольной группы, ненасыщенных соединений (например, с двумя или тремя связями), 8-амино-3,6-диоксаоктановой кислоты (dioxaoctanoic acid - ADO), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилата (SMCC), 6-аминокапроевой кислоты (ALEX или AHA), замещенного С1-С10 алкила, замещенного или незамещенного С2-С10 алкенила и замещенного или незамещенного С2-С10 алкинила. В некоторых вариантах осуществления настоящего изобретения группа заместителя выбрана из гидроксила, аминогруппы, карбоксигруппы, бензила, фенила, нитро-группы, тиола, тиоалкокси-группы, галогена, алкила, арила, алкенила и алкинила.
В некоторых вариантах осуществления настоящего изобретения соединение включает модифицированный олигонуклеотид, содержащий одну или несколько стабилизирующих групп, которые присоединены к одному или обоим концам модифицированного олигонуклеотида для усиления таких, например, свойств, как устойчивость к нуклеазам. Включенными в стабилизирующие группы являются кэповые структуры. Такие концевые модификации защищают модифицированный олигонуклеотид от разрушения экзонуклеазой и могут способствовать доставке в клетку и/или локализации в клетке. Кэп может быть с 5'-конца (5'-кэп), или с 3'-конца (3'-кэп), или может быть с обоих концов. Кэповые структуры включают, например, инвертированные дезокси абазические кэпы.
Соответствующие кэповые структуры включают 4',5'-метиленовый нуклеотид, 1-(бета-D-эритрофуранозил)нуклеотид, 4'-тионуклеотид, карбоциклический нуклеотид, 1,5-ангидрогекситольный нуклеотид, L-нуклеотид, альфа-нуклеотид, модифицированный основной нуклеотид, фосфородитиоатную связь, треопентофуранозильный нуклеотид, ациклический 3',4'-зесо-нуклеотид, ациклический 3,4-дигидроксибутиловый нуклеотид, ациклический 3,5-дигидроксипентильный нуклеотид, 3'-3'-инвертированную нуклеотидную часть молекулы, 3'-3'-инвертированную абазическую часть молекулы, 3'-2'-инвертированную нуклеотидную часть молекулы, 3'-2'-инвертированную абазическую часть молекулы, 1,4-бутандиол фосфат, 3'-фосфорамидат, гексилфосфат, аминогексил фосфат, 3'-фосфат, 3'-фосфортиоат, фосфордитиоат, связывающая метилфосфонатная часть молекулы и несвязывающая метилфосфонатная часть молекулы 5'-амино-алкил фосфат, 1,3-диамино-2-пропил фосфат, 3-аминопропил фосфат, 6-аминогексил фосфат, 1,2-аминододецил фосфат, гидроксипропил фосфат, 5'-5'-инвертированную нуклеотидную часть молекулы, 5'-5'-инвертированную абазическую часть молекулы, 5'-фосфорамидат, 5'-фосфоротиоат, 5'-амино, связывающий и/или несвязывающий 5'-фосфорамидат, фосфоротиоат и 5'-меркапто-часть молекулы.
Настоящее изобретение относится к молекуле микроРНК-100, ее антагомиру или ее вариантам, согласно описанному выше, которые применяют в фармацевтических композициях и для получения соответствующих лекарственных средств. Такие фармацевтические композиции применяют для положительного или отрицательного модулирования роста кровеносных сосудов.
В предпочтительном варианте осуществления настоящего изобретения молекула микроРНК-100 или ее варианты применяют для модуляции пролиферации, формирования трубочек и активности по прорастанию клеток эндотелия. Их действие заключается в формировании новых кровеносных сосудов, в частности применимом для лечения сердечно-сосудистых заболеваний.
Соединение, включающее модифицированный олигонуклеотид, комплементарный микроРНК, его предшественник, описанный в настоящем изобретении, получают в качестве фармацевтической композиции для модуляции эндотелиальных клеток. К соответствующим способам введения относятся, но ими перечень не ограничивается, пероральное, ректальное, трансмукозальное, кишечное, энтеральное, местное, через суппозитории, путем ингаляции, подоболочечное, внутрижелудочковое, внутрибрюшинное, интраназальное, внутриглазничное и парентеральное (например, внутривенное, внутримышечное, интрамедуллярное и подкожное) введение. Дополнительный соответствующий способ введения включает хемоэмболизацию. В некоторых вариантах осуществления настоящего изобретения фармацевтические подоболочечные средства вводят для достижения скорее локальной, чем системной экспозиции. Например, фармацевтические композиции могут быть внесены инъекцией непосредственно в область, где требуется вызвать определенный эффект.
В некоторых вариантах осуществления настоящего изобретения фармацевтическую композицию по настоящему изобретению вводят в форме дозированной единицы (например, таблетки, капсулы, болюса и др.). В некоторых вариантах осуществления настоящего изобретения такие фармацевтические композиции включают модифицированный олигонуклеотид в дозе, выбранной из 25-800 мг. В предпочтительных вариантах осуществления настоящего изобретения фармацевтическая композиция по настоящему изобретению включает дозу модифицированного олигонуклеотида, выбранную из 25 мг, 50 мг, 75 мг, 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 500 мг, 600 мг, 700 мг и 800 мг.
Фармацевтический агент может быть стерильным лиофилизированным модифицированным олигонуклеотидом, который восстанавливают соответствующим растворителем, например, стерильной водой для инъекций или стерильным физиологическим раствором для инъекций. Восстановленный продукт вводят путем подкожной инъекции или внутривенной инфузии после разведения в физиологическом растворе. Лиофилизированный лекарственный продукт состоит из модифицированного олигонуклеотида, который получают в воде для инъекций или в физиологическом растворе для инъекций, с величиной рН, доведенной до 7,0-9,0 кислотой или основанием при приготовлении и затем лиофилизируют. Лиофилизированный модифицированный олигонуклеотид может составлять 25-800 мг модифицированного олигонуклеотида.
Композиции настоящего изобретения могут дополнительно содержать другие дополнительные компоненты, обычно присутствующие в фармацевтических композициях на уровнях дозирования, принятых в данной области. Таким образом, например, композиции могут содержать дополнительные совместимые фармацевтически действующие материалы, например, средства от зуда, вяжущие средства, местные анестетики или противовоспалительные агенты, или могут содержать дополнительные материалы, применимые при переработке различных дозированных форм композиций по настоящему изобретению, например, красители, вкусовые агенты, консерванты, антиоксиданты, опалесцирующие агенты, уплотняющие агенты и стабилизаторы. Однако такие материалы при добавлении могут нежелательным образом влиять на биологическое действие компонентов композиций по настоящему изобретению. Составы могут быть стерилизованы и при необходимости перемешаны со вспомогательными агентами, например, смазывающими, консервирующими, стабилизирующими, увлажняющими агентами, эмульгаторами, солями для поддержания осмотического давления, буферами, красителями, вкусовыми и/или ароматизирующими веществами и другими агентами, которые в составе не вступают в разрушительные взаимодействия с олигонуклеотидом (олигонуклеотидами).
Фармацевтические композиции настоящего изобретения могут включать один или несколько модифицированных олигонуклеотидов и один или несколько эксципиентов. В некоторых таких вариантах осуществления настоящего изобретения эксципиенты выбраны из воды, солевых растворов, спирта, полиэтиленгликолей, желатина, лактозы, амилазы, магния стеарата, талька, салициловой кислоты, вязкого парафина, гидроксиметилцеллюлозы и поливинилпирролидона.
Фармацевтическую композицию по настоящему изобретению получают, используя известные методы, включая, но ими не ограничиваясь, смешивание, растворение, гранулирование, штамповку драже, растирание в порошок, эмульгирование, инкапсулирование, инкапсулирование или таблетирование.
Фармацевтическая композиция по настоящему изобретению может быть жидкой (например, суспензией, эликсиром и/или раствором). В некоторых вариантах осуществления настоящего изобретения жидкую фармацевтическую композицию получают, используя ингредиенты, известные в данной области, включая, но ими не ограничиваясь, воду, гликоли, масла, спирты, ароматизаторы, консерванты и красители.
Фармацевтическая композиция по настоящему изобретению может быть твердой (например, порошком, таблеткой и/или капсулой). В некоторых из таких вариантов осуществления настоящего изобретения твердую фармацевтическую композицию, включающую один или несколько олигонуклеотидов, получают, используя ингредиенты, известные в данной области, включая, но ими не ограничиваясь, крахмалы, сахара, разбавители, гранулирующие агенты, смазывающие агенты, связующие агенты и разрыхлители.
В некоторых вариантах осуществления настоящего изобретения фармацевтическую композицию по настоящему изобретению перерабатывают в качестве пролонгированных препаратов. Некоторые такие пролонгированные препараты обычно действуют дольше, чем непролонгированные препараты. В некоторых вариантах осуществления настоящего изобретения такие препараты вводят путем имплантации (например, подкожно или внутримышечно) или внутримышечной инъекцией. В предпочтительных вариантах осуществления настоящего изобретения пролонгированные препараты получают, применяя соответствующие полимерные или гидрофобные материалы (например, эмульсию в соответствующем масле), или ионообменные смолы, или слаборастворимые производные, например, слаборастворимую соль.
В некоторых вариантах осуществления настоящего изобретения фармацевтическая композицию по настоящему изобретению включает систему доставки. К примерам систем доставки относятся, но ими не ограничиваются, липосомы и эмульсии. Определенные системы доставки применимы для получения определенных фармацевтических композиций, в том числе включающих гидрофобные соединения. В некоторых вариантах осуществления настоящего изобретения применяют определенные органические растворители, например диметилсульфоксид.
В предпочтительных вариантах осуществления настоящего изобретения фармацевтическая композицию по настоящему изобретению включает одну или несколько тканеспецифичных молекул доставки, разработанных для доставки одного или нескольких фармацевтических агентов по настоящему изобретению, к определенным тканям или типам клеток. Например, в некоторых вариантах осуществления настоящего изобретения фармацевтические композиции включают липосомы, покрытые тканеспецифичным антителом.
В некоторых вариантах осуществления настоящего изобретения фармацевтическая композицию по настоящему изобретению включает систему сопутствующего растворителя. Некоторые из таких систем сопутствующего растворителя включают, например, бензиловый спирт, неполярное поверхностно активное вещество, водорастворимый органический полимер и водную фазу. В некоторых вариантах осуществления настоящего изобретения такие системы сопутствующего растворителя применяют для гидрофобных соединений. Примером такой системы сопутствующего растворителя, которой перечень не ограничивается, является система сопутствующего растворителя VPD, представляющая раствор абсолютного этанола, включающего 3 мас.% бензилового спирта, 8 мас.% неполярного поверхностно активного продукта Polysorbate 80™ и 65 мас.% полиэтиленгликоля 300. Пропорции таких систем сопутствующего растворителя могут существенно варьировать без существенного изменения их растворимости и токсичности. Кроме того, идентичность компонентов системы сопутствующего растворителя могут варьировать: например, другие поверхностно активные вещества могут применяться вместо продукта Polysorbate 80; размер фракции полиэтиленгликоля может варьировать; другие биосовместимые полимеры могут заменить полиэтиленгликоль, например, поливинилпирролидон; другие сахара или полисахариды могут быть замещены на декстрозу.
В предпочтительных вариантах осуществления настоящего изобретения фармацевтическая композицию по настоящему изобретению включает систему устойчивого высвобождения. Одним из примеров такой системы устойчивого высвобождения является полупроницаемый матрикс плотных гидрофобных полимеров. В некоторых вариантах осуществления настоящего изобретения системы устойчивого высвобождения могут в зависимости от их химической природы высвобождать фармацевтические агенты на протяжении часов, суток, недель или месяцев.
В некоторых вариантах осуществления настоящего изобретения фармацевтическую композицию по настоящему изобретению получают для перорального введения. В некоторых подобных вариантах осуществления настоящего изобретения фармацевтическая композиция переработана путем комбинирования одного или нескольких соединений, включающих модифицированный олигонуклеотид с одним или несколькими фармацевтически приемлемыми носителями. Некоторые из этих носителей позволяют перерабатывать фармацевтические композиции в таблетки, пилюли, драже, капсулы, растворы, гели, сиропы, гидросмеси, суспензии и др. для применения субъектами через рот. В некоторых вариантах осуществления настоящего изобретения фармацевтические композиции для перорального применения получают перемешиванием олигонуклеотида и одного или нескольких твердых эксципиентов. К соответствующим эксципиентам относятся, но ими не ограничиваются, наполнители, например сахара, включая лактозу, сахарозу, маннит или сорбит; препараты целлюлозы, например, картофельный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрий карбоксиметилцеллюлоза и/или поливинилпирролидон (ПВП). В некоторых вариантах осуществления настоящего изобретения такую смесь необязательно измельчают и необязательно добавляют вспомогательные агенты. В некоторых вариантах осуществления настоящего изобретения фармацевтические композиции формируют для получения сердцевин таблеток или драже. В некоторых вариантах осуществления настоящего изобретения добавляют разрыхлители (например, перекрестно связанный поливинилпирролидон, агар или альгиновую кислоту или ее соль, например альгинат натрия).
В некоторых вариантах осуществления настоящего изобретения сердцевины драже предусмотрены с покрытием. В некоторых подобных вариантах осуществления настоящего изобретения применяют концентрированные растворы сахаров, которые могут необязательно содержать гуммиарабик, тальк, поливинилпирролидон, карболовый гель, полиэтиленгликоль и/или диоксид титана, растворы глазури и соответствующие органические растворители или смеси растворителей. Красящие материалы или пигменты могут добавляться к покрытиям таблеток или драже.
В других вариантах осуществления настоящего изобретения фармацевтические композициями для перорального введения заполняют капсулы, сделанные из желатина. Некоторые из таких заполненных капсул включают один или несколько фармацевтических агентов по настоящему изобретению в смеси с одним или несколькими наполнителями, например, с лактозой, связующими, например, крахмалами и/или смазывающими агентами, например тальком или стеаратом магния, и необязательно со стабилизаторами. В некоторых вариантах осуществления настоящего изобретения фармацевтические композиции для перорального введения являются мягкие запаянные капсулы, сделанные из желатина и смягчителя, например глицерина или сорбита. В некоторых мягких капсулах растворяют или суспендируют один или несколько фармацевтических агентов по настоящему изобретению в соответствующих жидкостях, например жидких маслах, жидком парафине или жидких полиэтиленгликолях. Также могут добавляться стабилизаторы.
В некоторых вариантах осуществления настоящего изобретения фармацевтические композиции получают для буккального введения. Некоторые из этих фармацевтических композиций являются таблетками или пастилами, полученными традиционными методами.
В предпочтительных вариантах осуществления настоящего изобретения фармацевтические композиции получают для введения инъекцией (например, внутривенной, подкожной, внутримышечной и др.). В некоторых подобных вариантах осуществления настоящего изобретения фармацевтическая композиция включает носитель и переработана в водном растворе, например, в воде или в физиологически совместимых буферах, например в растворе Hanks, растворе Рингера или физиологическом солевом буфере. В некоторых вариантах осуществления настоящего изобретения включены другие ингредиенты (например, ингредиенты, которые способствуют растворимости или служат консервантами). В некоторых вариантах осуществления настоящего изобретения получают инъекционные суспензии, используя соответствующие жидкие носители, суспендирующие агенты и др. Определенные фармацевтические композиции для инъекции представляют в единичных формах дозирования, например в ампулах или многодозовых контейнерах. Некоторыми фармацевтическими композициями для инъекции являются суспензии, растворы или эмульсии в масле или водных растворителях и могут содержать агенты для переработки, например агенты суспендирования, стабилизирования и/или дисперсии. Определенные растворители, применимые для использования в фармацевтических композициях для инъекции, включают, но ими не ограничиваются, липофильные растворители и жирные масла, например кунжутное масло, синтетические сложные эфиры жирных кислот, например этилолеат или триглицериды, и липосомы. Водные инъекционные суспензии могут содержать вещества, которые повышают вязкость суспензии, например, натриевую соль карбоксиметилцеллюлозы, сорбит или декстран. Необязательно такие суспензии также могут включать соответствующие стабилизаторы или агенты, которые повышают растворимость фармацевтических агентов, что позволяет получать растворы высокой концентрации.
В некоторых вариантах осуществления настоящего изобретения фармацевтическую композицию получают для трансмукозального введения. В некоторых подобных вариантах осуществления настоящего изобретения в составе применяют агентов проникновения, соответствующих преграде, которую следует преодолеть. Такие агенты проникновения в целом известны в данной области.
В некоторых вариантах осуществления настоящего изобретения фармацевтическую композицию получают для введения путем ингаляции. Некоторые из таких фармацевтических композиций для ингаляции получают в форме аэрозольного спрея в герметичной упаковке или небулайзере. Некоторые из таких фармацевтических композиций включают расширяющийся газ, например дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода и другие соответствующие газы. В некоторых вариантах осуществления настоящего изобретения, используя сжатый аэрозоль, единица дозирования может быть отмерена с помощью клапана для высвобождения определенного количества. В некоторых вариантах осуществления настоящего изобретения могут быть переработаны капсулы и катриджи для применения в ингаляторе или инсуффляторе. Некоторые из таких составов включают порошковую смесь фармацевтического агента по настоящему изобретению и соответствующую порошковую основу, например лактозу или крахмал.
В некоторых вариантах осуществления настоящего изобретения получают фармацевтическую композицию для ректального введения, например в виде суппозиториев или удерживающих клизм. Некоторые из таких фармацевтических композиций включают известные ингредиенты, например кокосовое масло и/или другие глицериды.
В других вариантах осуществления настоящего изобретения получают фармацевтическую композицию для местного применения. Некоторые из таких фармацевтических композиций включают обычные увлажняющие основы, например, мази или кремы. К примерам соответствующих мазей относятся, но ими перечень не ограничивается, вазелин, вазелин с летучим силиконом, ланолин и вода в масляных эмульсиях. К примерам соответствующих мазей относятся, но ими перечень не ограничивается, кольдкрем и гидрофильная мазь.
В некоторых вариантах осуществления настоящего изобретения фармацевтическая композиция по настоящему изобретению включает модифицированный олигонуклеотид в терапевтически эффективном количестве. Обычно терапевтически эффективное количество достаточно для предупреждения, облегчения или улучшения симптомов заболевания или для пролонгирования выживания субъекта, подвергаемого лечению. Специалист в данной области способен определить терапевтически эффективное количество.
В особенно предпочтительном варианте осуществления настоящего изобретения фармацевтическую композицию по настоящему изобретению используют для стента, который применяют для лечения внутрисосудистых расстройств и/или заболеваний. Стенты обычно включают поддерживающую структуру, состоящую из инертного материала и/или пластмассы, которые не вызывают осложнений при контакте с клетками тела человека. На такой поддерживающий материал, известный специалистам в данной области, часто наносят покрытие. Такое покрытие должно быть совместимым с иммунной системой при контакте с клетками и тканями тела человека. Покрытие служит матриксом, включающим фармацевтическую композицию по настоящему изобретению. Матрикс может или постоянно поддерживаться, или также матрикс может разрушаться по прошествии времени. В зависимости от выбранного материала, разрушение матрикса может варьировать. Такой тип матрикса может быть сформирован, используя биоразрушаемые полимеры, например полилактиды, полилактид/полигликоль и др.
В некоторых вариантах осуществления настоящего изобретения один или несколько модифицированных олигонуклеотидов по настоящему изобретению перерабатывают в качестве пролекарства. В некоторых вариантах осуществления настоящего изобретения при введении in vivo пролекарство является химически конвертируемым в биологически, фармацевтически или терапевтически более действующую форму модифицированного олигонуклеотида. В некоторых вариантах осуществления настоящего изобретения пролекарства являются полезными, поскольку их легче вводить по сравнению с действующей формой. Например, в некоторых обстоятельствах пролекарство может быть в большей степени биодоступным (например, при пероральном введении), чем соответствующая действующая форма. В некоторых вариантах осуществления настоящего изобретения пролекарства менее растворимы, чем соответствующие действующие формы. В некоторых случаях такие пролекарства легче проходят через мембраны, если водная растворимость препятствует подвижности. В некоторых вариантах осуществления настоящего изобретения пролекарством является сложный эфир. В некоторых подобных вариантах осуществления настоящего изобретения сложный эфир метаболически гидролизируется в карбоновую кислоту при введении. В некоторых вариантах соединение, содержащее карбоновую кислоту, является соответствующей действующей формой. В некоторых вариантах осуществления настоящего изобретения пролекарство включает короткий пептид (полиаминокислоту), связанный с кислотной группой. В некоторых подобных вариантах осуществления настоящего изобретения пептид расщепляется при введении с формированием соответствующей действующей формы.
В некоторых вариантах осуществления настоящего изобретения пролекарство получают модификацией фармацевтически действующего соединения, например таким образом, что действующее соединение может регенерировать при введении in vivo. Пролекарство может быть разработано для изменения метаболической стабильности или транспортных свойств лекарства для сокрытия побочных эффектов, или токсичности для улучшения вкуса и запаха лекарственного средства, или для изменения других свойств лекарственного средства. На основании знаний о процессах фармакодинамики и метаболизма лекарственного средства in vivo, те специалисты в данной области, которым известно фармацевтически действующее соединение, могут разработать пролекарства данного соединения (см., например, кн.: Nogrady «Medicinal Chemistry A Biochemical Approach», 1985, изд-во Oxford University Press, Нью-Йорк, сс.388-392).
Настоящее изобретение дополнительно иллюстрируется приводимыми ниже примерами.
Пример 1. Результаты микрочипирования и характер экспрессии miR-100
Анализ микроРНК-микрочипа проводят с суммарными изолятами РНК ткани задней конечности из дистальной части бедра на исходном уровне и по пяти временным точкам после окклюзии бедренной артерии.
Суммарную РНК выделяют из дистальных аддукторных мышц с помощью фенола-хлороформа (продукт TRIzol, фирма Invitrogen) по шести временным точкам после лигирования бедренной артерии от пяти мышей на каждую точку. РНК объединяют в равных количествах и проводят исследование с микрочипированием для всех выявленных микроРНК мыши в определенное время (miRBase 9.0), используя сервисный провайдер (фирма LC Sciences, Houston, Техас).
Поскольку основная часть исследуемых образцов РНК происходит не от растущей сосудистой сети, а из окружающей ткани, комбинированный анализ всех пяти временных точек после лигирования бедренной артерии выбирают для отбора мишени. Вместо выбора молекул микроРНК с сильно измененной экспрессией по одной временной точке для последующего анализа для первого подхода к скринингу сосредотачиваются конкретно на молекулах микроРНК с устойчивой тенденцией к дифференциальной экспрессии на протяжении нескольких временных точек. Идентифицировано в целом 19 микроРНК с повышенной регуляцией и 16 микроРНК с пониженной регуляцией со статистически значимым (р<0,01) изменением экспрессии и четкой тенденцией на протяжении нескольких временных точек.
Среди молекул микроРНК с постоянно снижающейся экспрессией до 3 суток с последующим восстановлением экспрессии до примерно исходных уровней на 14 сутки имеется микроРНК miR-100. ПЦР реального времени, используя микроРНК праймеры stem loop для miR-100 на отдельных образцах РНК, показывает хорошее соответствие с данными по микрочипированию (фиг.1).
Используя гибридизацию in situ в комбинации с иммунофлуоресцирутощим окрашиванием на сосудистый маркер, определяют экспрессию miR-100 и в эндотелиальных клетках, и в клетках гладкой мускулатуры сосудов, а также в периваскулярных клетках различных типов.
Из-за качественного подхода в методе гибридизации in situ изменения в уровнях экспрессии после окклюзии бедренной артерии нельзя с точностью оценивать количественно. Для того чтобы исследовать, действительно ли изменение экспрессии связано с сосудистыми структурами, выделяют коллатеральные артерии, включая адвентициальную ткань из задней конечности мыши на 3 сутки после окклюзии бедренной артерии для анализа методом ПЦР-РВ. Экспрессия miR-100 происходит и в растущих коллатеральных артериях (пролиферацию подтверждают Ri-экспрессией), и в окружающей мускулатуре без видимых артерий. Однако экспрессия miR-100 существенно снижается в растущих коллатеральных артериях по сравнению с неактивными кровеносными сосудами из противоположной не оперированной стороны.
Экспрессии miR-100 не происходит в определенных органах, а выявляется методом ПЦР реального времени типа Stem loop при широком выборе тканей.
Пример 2. Модулирование экспрессии miR-100 в культивируемых клетках эндотелия и в сосудистых клетках гладкой мускулатуры
Для подтверждения экспрессии miR-100 в чистых популяциях клеток сосудистой стенки применяют метод ПЦР реального времени типа Stem loop для анализа суммарных изолятов РНК из культивируемых клеток эндотелия человека (ККЭЧ) и клеток гладкой мускулатуры аорты человека.
Экспрессию микроРНК подтверждают количественной ПЦР типа stem-loop (TaqMan MicroRNA Assays, фирма Applied Biosystems, Foster City, Калифорния). Применение специфичных в отношении мишени праймеров обратной транскрипции и зондов гибридизации TaqMan позволяет специфически выявлять зрелые молекулы микроРНК. Экспрессию микроРНК нормализуют по экспрессии малых РНК rnu19 и rnu48.
Экспрессия miR-100 происходит на высоком уровне в клетках обоих типов. Для изучения потенциальной роли miR-100 в ангиогенезе производят сверхэкспрессию miR-100 и глушение в клетках этого типа путем трансфекции специфическими предшественниками miR-100 (miR-100 precursors - pre-miR) или антисмысловыми молекулами (анти-miR), соответственно. Оптимизированный протокол трансфекции, использующий флуоресцентный контроль молекул pre- и анти-микроРНК, показывает эффективность трансфекции, составляющей более чем 90%. Количественная ПЦР реального времени показывает сильное повышение выявляемого miR-100 через 24 ч после трансфекции pre-miR-100, хотя трансфекция анти-miR-100 приводит к существенному снижению уровней miR-100 (фиг.2). Молекулы pre- и анти-miR с несоответствующей нуклеотидной последовательностью служат отрицательными контролями. Нет существенного различия в выживании клеток после трансфекции разными соединениями.
Сверхэкспрессия miR-100 обладает существенным ингибирующим эффектом и на формирование эндотелиальной сети при исследовании в плоском матригеле, и на прорастание эндотелия в исследовании трехмерной сфероидной культуры. В обоих исследованиях снижение уровней miR-100 за счет трансфекции молекул анти-miR обладает стимулирующим эффектом, приводящим к повышенному формированию сети эндотелия и удлинению общей сети прорастания. Существенного различия в скорости миграции не было обнаружено в исследовании миграции при лечении плоских ран.
Для того чтобы оценить, действительно ли наблюдаемые различия вторичны по отношению к воздействиям на жизнеспособность клеток, проверяют апоптоз клеток эндотелия и пролиферацию после модуляции miR-100. Используя жидкостной цитометрический подсчет Annexin V-окрашивание, устанавливают небольшое повышение апоптоза клеток эндотелия после сверхэкспрессии miR-100 по сравнению с посторонней контрольной последовательностью. Сайленсинг miR-100 путем трансфекции анти-miR однако не вызывает значительного эффекта по сравнению с соответствующим контролем, следовательно, получение анти-апоптического эффекта от miR-100-ингибирования является маловероятным объяснением наблюдаемым различиям в ангиогенезе in vitro. Уровень синтеза ДНК дополнительно исследуют путем измерения BrdU-включения, которое хорошо коррелирует с клеточной пролиферацией. Установлено существенное ослабление пролиферации клеток эндотелия путем трансфекции pre-miR-100, хотя подавление miR-100 с помощью молекул анти-miR обладает постоянным стимулирующим эффектом (фиг.3). Ингибирующий эффект трансфекции pre-miR-100 более выражен в клетках эндотелия, чем в клетках гладкой мускулатуры, возможно из-за более низких исходных уровней miR-100 в этих клетках (фиг.4).
Пример 3. miR-100 модулирует пролиферацию путем нацеливания на mTOR
Используя в комбинации алгоритмы прогноза в области биоинформатики и основанный на микрочипе анализ экспрессии гена клеток эндотелия после сверхэкспрессии miR-100, исследуют потенциальные гены-мишени miR-100, которые могут быть ответственны за наблюдаемые эффекты. Выявляют мишень рапамицина у млекопитающих (mTOR, кодируемый геном FRAP1), регуляция которой снижается после трансфекции pre-miR-100, и которая согласно прогнозу является прямой мишенью этой микроРНК по трем разным алгоритмам (фирма PicTar, Targetscan, Miranda).
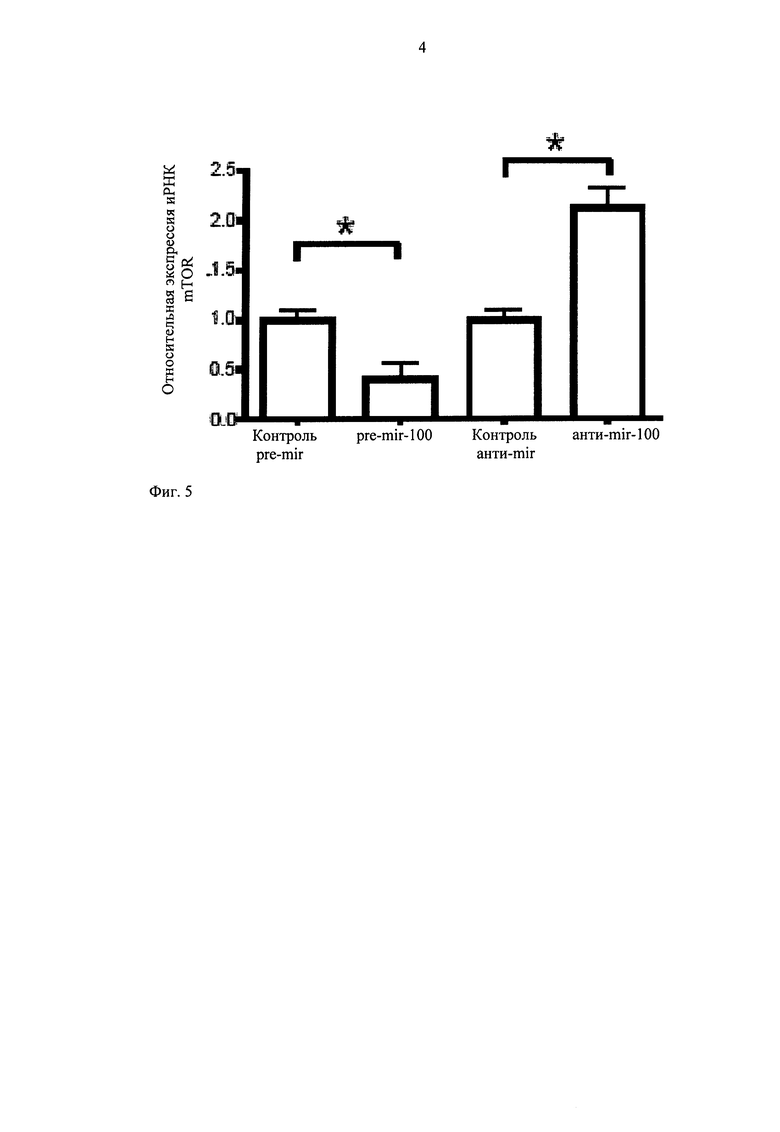
Установлено, что сверхэкспрессия miR-100 существенно подавляет экспрессию mTOR и на уровне мРНК, и на уровне белка, в клетках эндотелия, хотя ингибирование miR-100 приводит к существенному снижению регуляции (фиг.5). Сайт связывания miR-100 в области 3'-UTR в mTOR показан на фиг.6. На фиг.6 последовательность, обозначенная hsa-miR-100, соответствует последовательности SEQ ID NO:1, и последовательность, обозначаемая mTOR 3'UTR, соответствует последовательности SEQ ID NO:7.
Пример 4. Взаимодействие между mTOR и микроРНК-100
Чтобы исследовать, ответственна ли репрессия mTOR за наблюдаемое ослабление клеточной пролиферации под действием miR-100, проводят эксперимент спасения путем трансфекции mTOR-кодирующих плазмид в комбинации с pre-miR-100.
Для трансфекции молекул-предшественниц микроРНК pre-miR или молекул-ингибиторов микроРНК анти-miR (все соединения фирмы Ambion) клетки культивируют до 70% слияния и трансфецируют 8 нМ олигонуклеотидов pre-miR-100 или анти-miR-100, используя Lipofectamin RNAiMax (фирма Invitrogen) по инструкциям производителя. Для трансфекции клеток НЕК293 плазмидами mTOR трансфецируют 2 мкг ДНК на 3×105 клеток с помощью реагента для трансфекции Fugene 6 (фирма Roche). Для двойной трансфекции плазмидами с предшественниками микроРНК и ингибиторами, молекулы pre- и анти-miR добавляют к плазмидам/смеси для трансфекции Fugene в тех же конечных концентрациях, что и указанные выше. mTOR (Acc. NM004958) полной длины (SKU SC124066) и ORF-конструкции (SKU RC220457) получают из коллекции Origene (фирма Origene, Rockville, Мэриленд).
Из-за большого размера плазмиды mTOR, невозможно достичь достаточной степени трансфекции в клетках эндотелия без сопутствующих токсических эффектов, и поэтому легко трансфецируемые клетки НЕК выбирают в качестве модельной культуры, в которой воздействие miR-100 на пролиферацию, наблюдаемую в клетках эндотелия, может быть воспроизводимым (фиг.7). Хотя сверхэкспрессия mTOR полной длины, включая 3'UTR, способна частично спасти анти-пролиферативный эффект трансфекции pre-miR-100, полное спасение может быть достигнуто путем экспрессии ORF-клона, утратившего сайт связывания miR-100. Сопоставляя пониженную экспрессию miR-100 в ишемической задней конечности, иммунофлуоресцентное окрашивание показывает на высоком уровне экспрессию mTOR, преимущественно в CD31-положительных клетках эндотелия в ишемической задней конечности.
Пример 5. Подавление in vivo miR-100 обработкой антагомиром стимулирует восстановление кровотока у мышей
Модель ишемии задней конечности мыши соответствует правилам, изложенным в кн.: «Guide for the Care and Use of Laboratory Animals», опубликованной Национальным институтом здравоохранения США, и ее используют после получения соответствующего разрешения. Одностороннюю окклюзию бедренной артерии осуществляют на мышах линии C57/B16J (фирма Charles River Lab., Suizfeld, Германия) путем двойного лигирования поверхностной бедренной артерии, проксимальной по отношению к глубокой бедренной артерии, и дистальной бедренной артерии непосредственно над коленным суставом. Мнимую операцию без артериальной окклюзии проводят на противоположной конечности. Для молекулярно-биологических, гистологических исследований и гибридизации in situ ткань тщательно рассекают и быстро замораживают в жидком азоте для последующего анализа. Для рассечения выделенных коллатеральных артерий, сосудистую систему задней конечности перерабатывают с жидким латексом, что позволяет идентифицировать и выделять отдельные артериальные сосуды.
Мышиная модель хорошо разработана и обеспечивает надежный прогноз для ситуаций, возникающих у людей (Seiler и др., Circulation, 104, 2001, сс.2012-2017 или Limbourg и др., Nature Protocols, 4(12) 2009, сс.1737-1748).
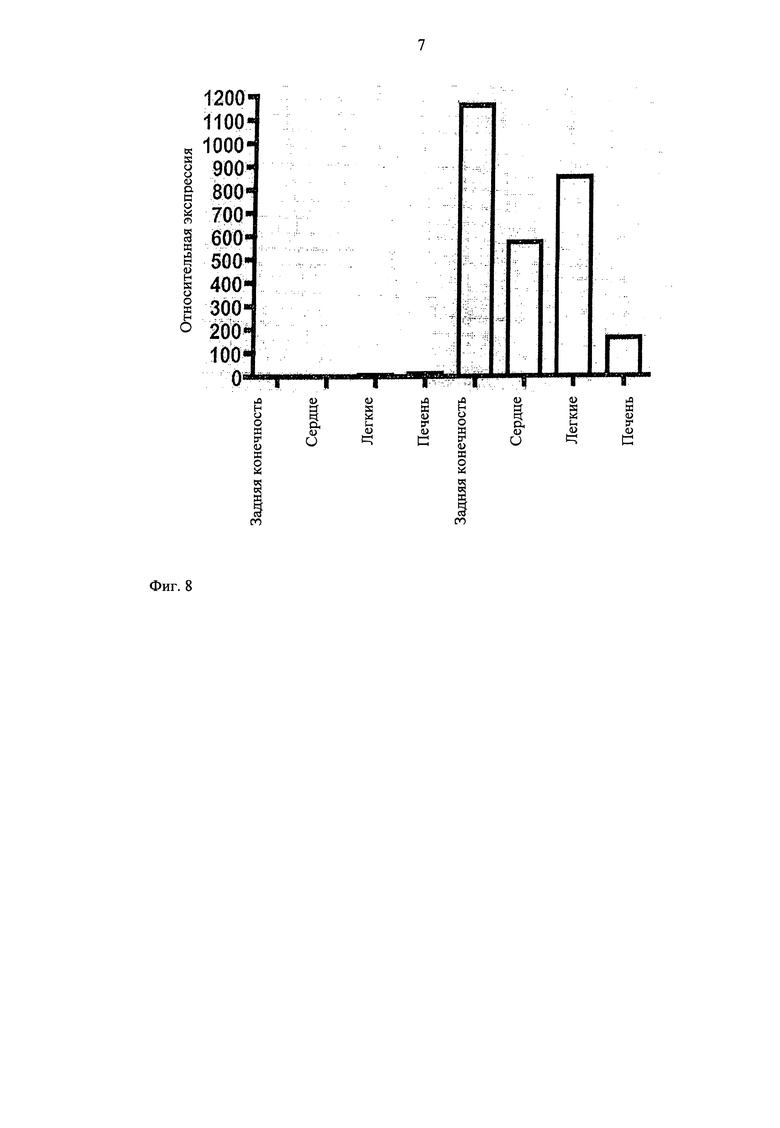
Чтобы оценить, действительно ли ингибирование miR-100 может применяться для стимуляции реваскуляризации in vivo, мышей лечат специфическим антагомиром против miR-100 после индукции односторонней ишемии задней конечности. Три дозы антагомира приводят к сильной и устойчивой супрессии экспрессии miR-100 при широком выборе тканей (фиг.8) и флуоресцентно меченый антагомир может быть обнаружен в слое эндотелия кровеносных сосудов. Наиболее выраженная аккумуляция обнаружена в срезах печени и легких.
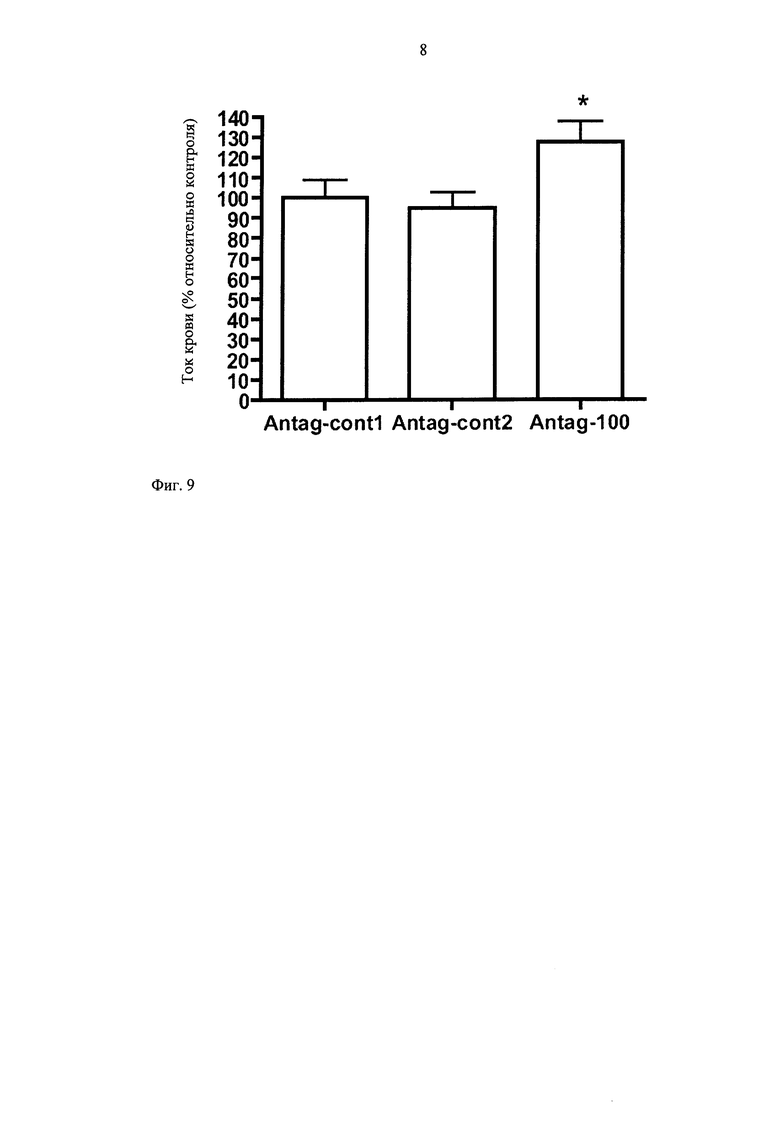
Лечение антагомиром приводит к существенной стимуляции восстановления кровотока с повышенным соотношением тока крови на 7 сутки после индукции ишемии по сравнению с лечением двумя контрольными антагомирами, из которых один разработан для подавления зашифрованной версии анти-miR-100 антагомира, а для другого ранее было установлено, что он не оказывает воздействия на восстановление кровотока в этой модели (фиг.9). Такое функциональное различие также выявляется на морфологическом уровне, где подавление miR-100 приводит к повышению плотности капилляров в дистальной ткани задней конечности. Данный пример сопоставления ясно показывает специфическую эффективность антагомиров по настоящему изобретению.
Пример 6. Подавление mTOR ослабляет ангиогенез у мышей. Кроме того, две отдельные группы мышей обрабатывают суточными инъекциями рапамицина - ингибитора mTOR, или растворителя для исследования длительности периода восстановления кровотока в задней конечности в условиях эндогенного снижения регуляции гена miR-100, но ослабляет передачу сигнала этого гена-мишени mTOR. Обработка рапамицином приводит к существенному ослаблению восстановления кровотока на 7 сутки после лигирования бедренной артерии и снижения плотности капилляров в ишемической ткани.
Пример 7. В эндотелиальных клетках снижается регуляция miR-100 в ответ на TNF-альфа NFKannaB-зависимом образом
Для поиска предполагаемых индукторов снижения регуляции гена miR-100 в клетках эндотелия проводят скрининг про-ангиогенных или про-артериогенных цитокинов для воздействия на экспрессию гена miR-100. Хотя VEGF, TGF-бета1 и FGF2 не обладают устойчивым и воспроизводимым эффектом в исследуемых концентрациях, TNF-альфа приводит к существенному снижению регуляции miR-100 после пролонгированного воздействия в зависимости от времени. Статистически значимой дозовой зависимости в исследуемых концентрациях не обнаружено, но проявляется тенденция к более выраженному снижению экспрессии miR-100 с повышенными дозами TNF-альфа. Блокада метаболического пути NF-каппаВ путем предварительного инкубирования с ингибитором PS1145 киназы IkB упраздняет эффект TNF-альфа. Существенно повышается регуляция экспрессии TNF-альфа в ткани задней конечности после лигирования бедренной артерии у мышей, что соответствует выявленному снижению регуляции miR-100 in vivo. С помощью иммуногистохимии показывают, что сильное накопление F4/80 положительных клеток, предположительно макрофагов, в периваскулярном пространстве в пережатой задней конечности, может служить эндогенным источником TNF-альфа в ишемической ткани.
Пример 8. Взаимодействие лейкоцитов-ККЭЧ в зависимости от условий тока крови
ККЭЧ выращивают до слияния, трансфецируют или олигонуклеотидами анти-miR-100, или npe-Mir-100, или зашифрованными контролями и стимулируют с помощью TNF-альфа в количестве 30 нг/мл в течение 24 ч. Мононуклеарные клетки периферической крови (МКПК) человека получают из лейкоцитных пленок здоровых доноров центрифугированием в градиенте плотности Ficoll-Hypaque. Проточную камеру собирают и помещают на платформу инвертированного микроскопа, и свежевыделенные МКПК человека (1×106/мл) проникают через слои эндотелия. Во всех экспериментах взаимодействия лейкоцитов определяют в течение 105 мин в режиме 1 дин/см2. Взаимодействие клеток на поверхности эндотелия визуализируют и регистрируют, используя фазово-контрастную микроскопию.
Предварительные результаты по экспрессии микроРНК-100 на протяжении сосудистого воспаления, регуляции этой микроРНК воспалительным цитокином TNF-альфа и статинами и по функциональной роли miR-100 в модулировании взаимодействия лейкоциты-эндотелий получают путем репрессии молекул эндотелиальной адгезии.
Экспрессия микроРНК-100
Ген miR-100 представляет интерес в связи с тем, что экспрессируется на высоком уровне в клетках сосудов и происходит снижение его регуляции в клетках эндотелия при индукции пролиферации сосудов в модели ишемии задней конечности мыши. Ген miR-100 человека локализован на хромосоме 11 в кластере с let7a-2 и формирует семейство микроРНК с последовательностью, связанной с miR-99. Он экспрессируется на высоком уровне в клетках эндотелия и установлено, что дифференциально регулируется при нескольких злокачественных заболеваниях, включая рак яичника и гепатоклеточную карциному. Функция miR-100 в клетках эндотелия была неизвестна и до настоящего времени данная микроРНК не применялась при воспалительных процессах.
Фиг.10 показывает гибридизацию in situ экспрессии miR-100 (красный сигнал) при двойном окрашивании с маркером клеток эндотелия CD31 в капиллярах в срезах ткани скелетной мускулатуры мыши. Зонд против miR-159, который не экспрессируется у мышей, используют в качестве отрицательного контроля.
Интересно отметить, что существенное снижение регуляции miR-100 обнаруживают после сосудистого повреждения, вызванного лигированием сонной артерии у мышей. Эта процедура представляет хорошо обоснованную модель вызванной воспалением сосудистой коррекции.
Фиг.11 показывает, что повреждение сосудов приводит к снижению экспрессии miR-100. Сонные артерии у мышей C57BL6 (n=3) в возрасте 10 недель односторонне лигируют. Через трое суток сонные артерии удаляют. Количественно определяют уровень экспрессии miR-100, используя тип ПЦР реального времени Stem loop Taqman. Нелегированную артерию с противоположной стороны используют в качестве контроля. (*=Р<0,05).
Пример 9. Функция микроРНК-100
После открытия высокого исходного уровня экспрессии miR-100 в клетках эндотелия и понижения регуляции экспрессии в ответ на сосудистое повреждение и ишемию, исследуют функцию данной микроРНК в клетках эндотелия (КЭ). Таким образом, miR-100 сверхэкспрессируют в КЭ путем трансфекции синтетической молекулы-предшественника miR-100 (precursor molecule - pre-mir) и анализируют изменения общей генной экспрессии по суммарной мРНК по сравнению с трансфекцией контрольным олигонуклеотидом через 48 ч после трансфекции на платформе микроматрицы человека Agilent 4x44k.
Результаты микроматрицы анализируют и по уровню отдельного гена, и по анализу биологического метаболического пути, используя метод «Panther Pathways Analysis», позволяющий исследовать изменения в генной экспрессии для обогащения специфических биологических метаболических путей или клеточных функций.
На уровне отдельного гена открыто сильное снижение регуляции нескольких молекул адгезии, в том числе Е-селектина (SELE) и VCAM-1, на уровень отдельных генов. Напротив, установлено, что прямой miR-100 ген-мишень mTOR (обозначение гена: FRAP1) дифференцированно регулируется в этих экспериментах. Эти гены не содержат сайта связывания miR-100 в их мРНК-последовательности, и, следовательно, должен представлять непрямые мишени (фиг.12).
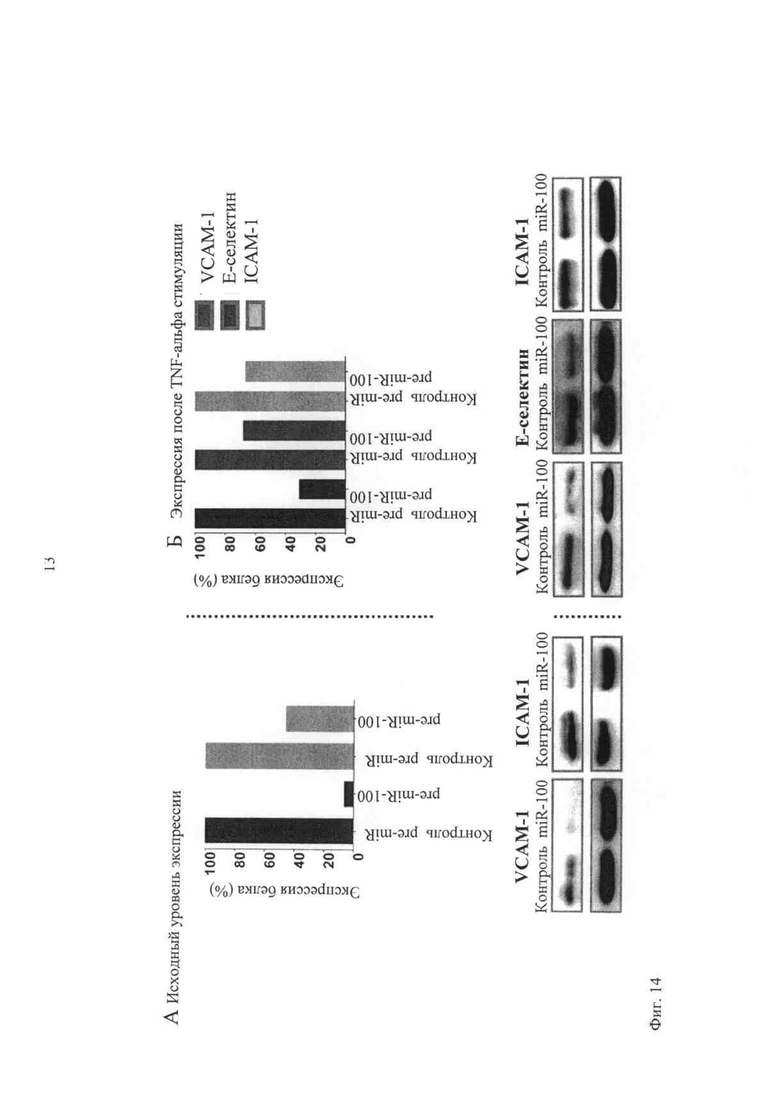
Регуляцию этих двух молекул адгезии оценивают также по ICAM-1 с помощью miR-100 и по мРНК (фиг.13), и по уровню белка (фиг.14). Сверхэкспрессия miR-100 притупляет повышенную регуляцию этих молекул адгезии после активирования эндотелия с помощью воспалительного цитокина TNF-альфа (фиг.14Б).
Фиг.12 показывает транскриптомный анализ после сверхэкспрессии miR-100 в клетках эндотелия, который показывает снижение регуляции молекул эндотелиальной адгезии. Эндотелиальные клетки трансфецируют олигонуклеотидами-предшественниками miR-100. Суммарную РНК выделяют через 48 ч для анализа микрочипированием общей генной экспрессии. На фиг.12 перечислены 20 генов, у которых в наибольшей степени проявляется снижение регуляции после сверхэкспрессии miR-100.
Фиг.13 показывает снижение экспрессии VCAM-1, ICAM-1 и Е-селектина после сверхэкспрессии miR-100. Клетки эндотелия человека трансфецируют рге-miR-100 и зашифровывают контрольными олигонуклеотидами pre miR. После выделения РНК относительную степень экспрессии мРНК разных молекул адгезии измеряют, используя тип ПЦР реального времени Stem loop Taqman (P≤0,005).
Фиг.14 показывает, что сверхэкспрессия miR-100 снижает исходный уровень экспрессии VCAM-1, Е-селектина и ICAM-1 на уровень белка и притупляет повышенную регуляцию в ответ на воспалительный стимул. МикроРНК-100 сверхэкспрессируют в клетках эндотелия человека с последующим выделением белка. Методом вестерн-блоттинга определяют экспрессию белков VCAM-1, ICAM-1 и Е-селектина. Фиг.14А и Б показывают соотношение между интенсивностью объема образцов белка и загружаемого контроля (В-тубулина) для [А] исходного уровня экспрессии и [Б] экспрессии после 24 ч стимуляции TNF-α.
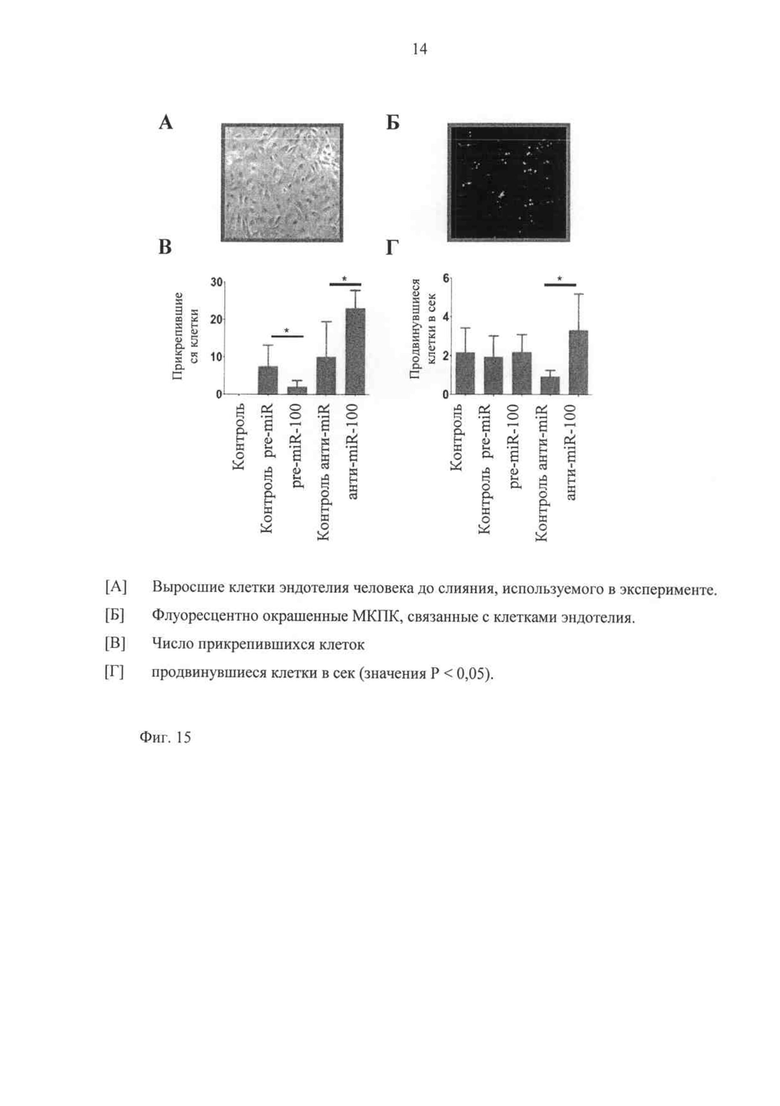
Для того чтобы исследовать, действительно ли изменение в экспрессии приводит к функциональному отличию в прохождении лейкоцитов и адгезии к поверхности эндотелия, присоединение выделенных мононуклеарных клеток периферической крови (МКПК) к трансфецированным клеткам эндотелия исследуют в условиях физиологического тока в аппарате с проточной камерой. Результаты показывают, что сверхэкспрессия miR-100 действительно существенно ослабляет адгезию лейкоцитов, хотя ингибирование miR-100 обладает стимулирующим эффектом и на прохождение лейкоцитов, и на адгезию циркулирующих клеток (фиг.15).
Фиг.15 показывает, что экспрессия miR-100 в клетках эндотелия модулирует адгезию лейкоцитов в условиях физиологического тока. Трансфецированные клетки эндотелия человека стимулируются TNF-α.
Физиологический венозный кровоток (1 дин/см2) индуцируют с помощью прибора с проточной камерой и подсчитывают количество двигающихся или прикрепленных мононуклеарных клеток периферической крови (МКПК).
Поскольку полученные результаты показывают на сильный эффект, оказываемый miR-100 на взаимодействие лейкоцитов-эндотелия, была проведена проверка предполагаемого воздействия про- и антивоспалительных раздражителей на уровни экспрессии такой микроРНК в клетках эндотелия. В качестве первой попытки ответить на этот вопрос исследуют воздействия нескольких цитокинов воспаления на потенциальный эффект экспрессии miR-100. Результаты по-прежнему действительно показывают устойчивое снижение регуляции miR-100 после активации эндотелия фактором некроза опухолей альфа (TNF-альфа), сильного про-воспалительного цитокина. Этот эффект предположительно опосредуется NF-каппаВ в качестве ингибитора данного фактора транскрипции путем ослабления специфическим ингибитором PS1145 регуляторного эффекта TNF-альфа на уровни miR-100 (фиг.16).
Фиг.16 показывает, что снижается регуляция miR-100 в клетках эндотелия под действием провоспалительного цитокина TNF-α в NF-каппаВ-зависимой манере. Фиг.16 [А]: клетки эндотелия человека стимулируют с помощью 10 нг/мл TNF-α для разных временных точек. РНК выделяют и количественно подсчитывают, используя тип ПЦР реального времени Stem loop Taqman.
Фиг.16 [Б]: NF-каппаВ ингибитор PS1145 (10 мкМ) добавляют к клеткам эндотелия человека, простимулированных TNF-α (10 нг/мл), и уровень экспрессии гена miR-100 по сравнению с контролями без PS1145 измеряют, используя тип ПЦР реального времени Stem loop Taqman. (*=P<0,05).
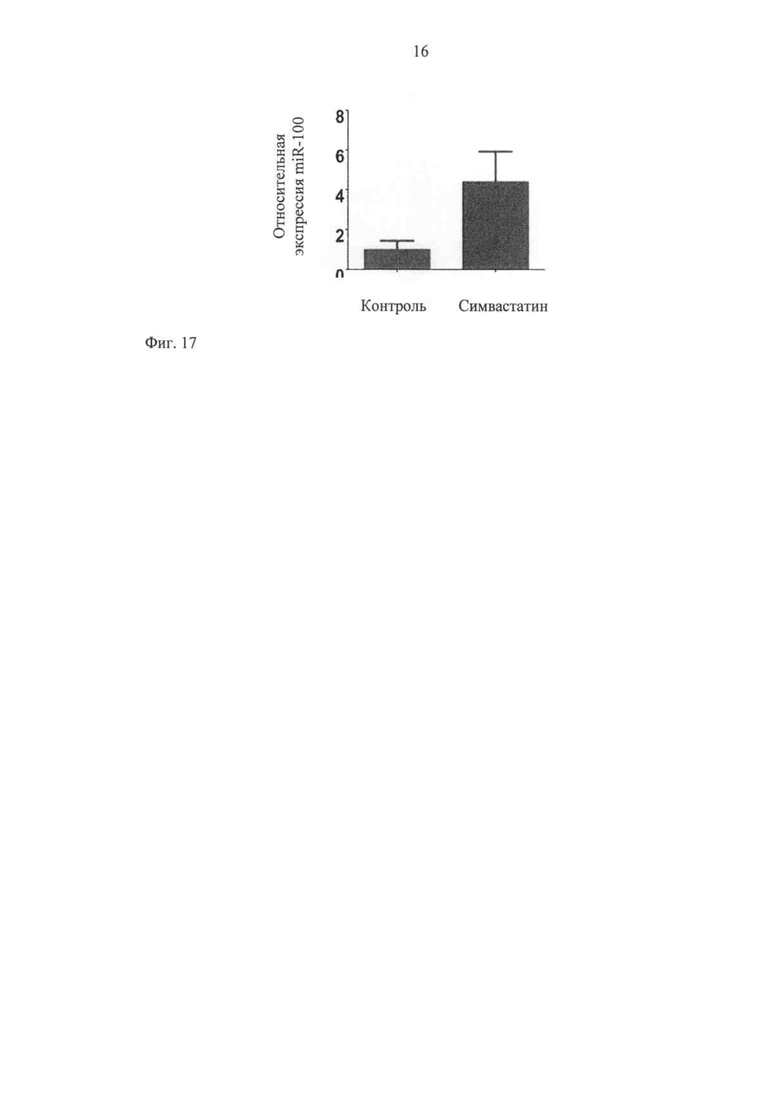
Поскольку было показано, что ингибиторы HMG-CoA-редуктазы (статины) ослабляют реакции воспаления сосудов в качестве части их, так называемого спектра плейотропного эффекта, и снижают экспрессию молекул эндотелиальной адгезии, высказано предположение, что на экспрессию miR-100 может повлиять обработка статином. Результаты показывают, что действительно повышается регуляция miR-100 путем инкубирования клеток эндотелия с симвастатином (фиг.17).
Эти данные указывают на фармакологическое модулирование данной микроРНК статинами также in vivo и даже на возможную роль miR-100 в качестве медиатора анти-воспалительного плейотропного эффекта статинов в сосудистой системе.
Фиг.17 подтверждает, что симвастатин повышает регуляцию экспрессии miR-100. Клетки эндотелия человека стимулируют с помощью 1 мкМ симвастатина в течение 48 ч. Суммарную РНК выделяют и количественно подсчитывают, используя тип ПЦР реального времени Stem loop Taqman (P<0,05).
| название | год | авторы | номер документа |
|---|---|---|---|
| ДВОЙНОЕ НАЦЕЛИВАНИЕ НП MIR-208 И MIR 499 В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ СЕРДЦА | 2010 |
|
RU2515926C2 |
| РЕГУЛЯЦИЯ МЕТАБОЛИЗМА С ПОМОЩЬЮ MIR-378 | 2011 |
|
RU2585491C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИНКАПСУЛИРОВАННЫЙ АНТАГОМИР | 2014 |
|
RU2668794C2 |
| Рекомбинантная плазмидная ДНК, кодирующая микроРНК hsa-miR-145-3p, и ее применение в качестве положительного контроля при ПЦР-РВ для диагностики сердечно-сосудистых заболеваний и выявления риска их развития | 2025 |
|
RU2837873C1 |
| Рекомбинантная плазмидная ДНК, кодирующая микроРНК hsa-miR-143-5p, и ее применение в качестве положительного контроля при ПЦР-РВ для диагностики сердечно-сосудистых заболеваний и выявления риска их развития | 2025 |
|
RU2837872C1 |
| ИНГИБИТОРЫ MIR-155 ДЛЯ ЛЕЧЕНИЯ КОЖНОЙ T-КЛЕТОЧНОЙ ЛИМФОМЫ (CTCL) | 2016 |
|
RU2718534C2 |
| Рекомбинантная плазмидная ДНК, кодирующая микроРНК hsa-mir-143-3p, и ее применение в качестве положительного контроля при ПЦР-РВ для диагностики сердечно-сосудистых заболеваний и выявления риска их развития | 2025 |
|
RU2837882C1 |
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ХАНТИНГТОНА | 2015 |
|
RU2711147C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ ГЕМОГЛОБИНОПАТИЙ | 2015 |
|
RU2707540C2 |
| Способ ингибирования метастазирования опухолей путем подавления дедифференцировки опухолевых клеток | 2023 |
|
RU2840966C1 |













Изобретение относится к области биотехнологии, конкретно к получению антагомиров микроРНК, и может быть использовано в медицине для лечения сосудистого заболевания, выбранного из группы, включающей периферическое сосудистое окклюзионное заболевание, коронарную болезнь сердца, цереброваскулярное заболевание, васкулит, атеросклероз, ремоделирование сосудов в ответ на повреждение или рестеноз. Получают фармацевтическую композицию с антагомиром молекулы микроРНК-100 для положительного модулирования роста кровеносных сосудов, в связи с этим для применения в модулировании пролиферации, формирования трубочек и активности по прорастанию эндотелиальных клеток или модуляции экспрессии молекул адгезии этими клетками. Изобретение позволяет повысить эффективность ангиогенной терапии. 2 н. и 5 з.п. ф-лы, 17 ил., 9 пр.
1. Фармацевтическая композиция, включающая антагомир молекулы микроРНК-100, который характеризуется нуклеотидной последовательностью SEQ ID NO:3, для применения для положительного модулирования роста кровеносных сосудов, в связи с этим для применения в модулировании пролиферации, формирования трубочек и активности по прорастанию эндотелиальных клеток или модуляции экспрессии молекул адгезии этими клетками, что связано с лечением сосудистого заболевания, выбранного из группы, включающей периферическое сосудистое окклюзионное заболевание, коронарную болезнь сердца, цереброваскулярное заболевание, васкулит, атеросклероз, ремоделирование сосудов в ответ на повреждение или рестеноз.
2. Фармацевтическая композиция по п. 1 для применения в модулировании пролиферации, формирования трубочек и активности по прорастанию эндотелиальных клеток.
3. Фармацевтическая композиция по п. 1, отличающаяся тем, что антагомир молекулы микроРНК-100 модифицирован путем конъюгации за счет ковалентного связывания с олигонуклеотидом.
4. Фармацевтическая композиция по п. 1, отличающаяся тем, что последовательность микроРНК-100 содержится в векторе, реплицируемом в организме пациента.
5. Фармацевтическая композиция по п. 1, отличающаяся тем, что ее применяют в стенте или в покрытии стента, применяемого для лечения внутрисосудистых состояний.
6. Применение антагомира молекулы микроРНК-100 для модуляции пролиферации, формирования трубочек и активности по прорастанию эндотелиальных клеток или модуляции экспрессии молекул адгезии этими клетками, что связано с лечением сосудистого заболевания, выбранного из группы, включающей периферическое сосудистое окклюзионное заболевание, коронарную болезнь сердца, цереброваскулярное заболевание, васкулит, атеросклероз, ремоделирование сосудов в ответ на повреждение или рестеноз, где антагомир молекулы микроРНК-100 характеризуется нуклеотидной последовательностью SEQ ID NO:3.
7. Применение по п. 6, причем модулируется пролиферация, формирование трубочек, активность прорастания или экспрессия молекул адгезии эндотелиальными клетками.
Авторы
Даты
2016-06-10—Публикация
2010-11-18—Подача