Область техники, к которой относится изобретение
RNAi (РНК-интерференция) направляет последовательность-специфический сайленсинг генов с помощью двухцепочечной РНК (dsRNA), которая процессируется на функциональные малые ингибирующие РНК (~21 нуклеотид). В природе RNAi для регуляции генной экспрессии происходит в первую очередь посредством малых РНК, известных как микроРНК (miRNA). Зрелые микроРНК (~19-25 нуклеотидов) процессируются из более крупных первичных транскриптов miRNA (pri-miRNA), которые содержат участки «петля-на-стебле». Посредством серии событий процессинга, катализируемого рибонуклеазами Drosha и Dicer, область дуплекса miRNA освобождается и одна цепь (антисмысловая «направляющая» цепь) затем встраивается в индуцированный РНК комплекс сайленсинга (RISC), генерируя, таким образом, функциональный комплекс, способный к спариванию оснований и сайленсингу целевых транскриптов. Способ целевой репрессии в первую очередь зависит от степени комплементаности; для расщепления транскрипта обычно требуется высокая степень спаривания оснований, тогда как репрессия трансляции и дестабилизация мРНК происходят при неполном связывании малых РНК с целевыми транскриптами (чаще всего в 3'UTR). Действительно, короткие участки комплементарности - только 6 пар оснований - могут быть достаточными для того, чтобы вызвать сайленсинг генов.
Раскрытие изобретения
В настоящем изобретении предлагается шаттл-вектор, несуший выделенную miRNA, который экспрессирует терапевтическую siRNA с ограниченной нецелевой токсичностью. В некоторых вариантах осуществления встраивание siRNA, которая проявляет нецелевую токсичность в контексте шаттл-вектора, несущего miRNA, согласно настоящему изобретению, ограничивает нецелевую токсичность siRNA. В некоторых вариантах осуществления шаттл-вектор, несущий miRNA, экспрессирует терапевтическую siRNA в головном мозге с ограниченной нецелевой токсичностью. В некоторых вариантах осуществления шаттл-вектор, несущий miRNA, экспрессирует терапевтическую siRNA в стриатуме с ограниченной нецелевой токсичностью. В некоторых вариантах осуществления шаттл-вектор, несущий miRNA, экспрессирует терапевтическую siRNA в большом мозге с ограниченной нецелевой токсичностью.
В настоящем изобретении предлагается выделенная нуклеиновая кислота, кодирующая первичный транскрипт (pri-miRNA), включающая, в порядке расположения, 5'-фланкирующую область, ненаправляющую (пассажирскую) область, петлевую область, направляющую область и 3'-фланкирующую область, при этом направляющая область состоит из SEQ ID NO: 37 (miHDss3), SEQ ID NO: 6 (miHDS1v5U) или SEQ ID NO: 7 (miHDS1v6A), и ненаправляющая область по меньшей мере на 80% комплементарна направляющей области. В некоторых вариантах осуществления ненаправляющая область по меньшей мере на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% комплементарна направляющей области. В некоторых вариантах осуществления 5'-фланкирующая область непрерывно связана с ненаправляющей областью, петлевая область расположена между ненаправляющей областью и направляющей областью, и направляющая область непрерывно связана с 3'-фланкирующей областью. Используемый здесь термин «направляющая область siRNA» означает одноцепочечную последовательность РНК, которая комплементарна последовательности-мишени. Используемый здесь термин «ненаправляющая область siRNA» означает одноцепочечную последовательность РНК, которая комплементарна «направляющей области siRNA». Таким образом, в надлежащих условиях направляющая область siRNA и ненаправляющая область siRNA связываются с образованием дуплекса РНК. Все использумые в настоящем документе последовательности нуклеиновых кислот представлены, как это принято, в направлении 5'-3'.
В некоторых вариантах осуществления 5'-фланкирующая область содержит 5'-соединяющую последовательность, непрерывно связанную с ненаправляющей областью. Используемый здесь термин «участок соединения» или «соединяющая последовательность» представляет собой короткую нуклеотидную последовательность длиной менее чем 60 нуклеотидов, которая соединяет две другие нуклеотидные последовательности. В некоторых вариантах осуществления участок соединения имеет длину, равную любому целому числу от 4 до 50 включительно. В некоторых вариантах осуществления 5'-соединяющая последовательность состоит из 5-8 нуклеотидов (например, состоит из 6 нуклеотидов). В некоторых вариантах осуществления 5'-соединяющая последовательность кодирует GUGAGCGA (SEQ ID NO: 13) или GUGAGCGC (SEQ ID NO: 14).
В некоторых вариантах осуществления 5'-фланкирующая область, кроме того, содержит 5'-выступающую последовательность, расположенную выше (в 3'-направлении) 5'-соединяющей последовательности. Используемый здесь термин «выступающая последовательность» представляет собой область нуклеиновой кислоты, которая некомплементарна нуклеиновой кислоте на противоположной стороне в дуплексе. Например, дуплекс будет содержать область комплементарных нуклеиновых кислот, затем область некомплементарных нуклеиновых кислот, а затем вторую область комплементарных нуклеиновых кислот. Области комплементарных нуклеиновых кислот будут связываться друг с другом, тогда как центральная некомплементарная область не будет связываться, образуя тем самым «выступ». В некоторых вариантах осуществления две цепи нуклеиновой кислоты, расположенные между двумя комплементарными областями, будут иметь различную длину, образуя тем самым «выступ». В некоторых вариантах осуществления 5'-выступающая последовательность будет содержать от 2 до 15 нуклеотидов. В некоторых вариантах осуществления 5'-выступающая последовательность состоит примерно из 1-10 нуклеотидов. В некоторых вариантах осуществления 5'-выступающая последовательность кодирует UAAACUCGA (SEQ ID NO: 15). В некоторых вариантах осуществления 5'-выступающая последовательность на 0-50% комплементарна 3'-выступающей последовательности.
В некоторых вариантах осуществления 5'-фланкирующая область, кроме того, содержит 5'-спейсерную последовательность, расположенную выше (в 3'-направлении) 5'-выступающей последовательности. В некоторых вариантах осуществления 5'-спейсерная последовательность состоит из 9-12 нуклеотидов, например, 10-12 нуклеотидов. В некоторых вариантах осуществления 5'-спейсерная последовательность на 60-100% комплементарна 3'-спейсерной последовательности. В некоторых вариантах осуществления 5'-выступающая последовательность содержит сайт клонирования, такой как сайт XhoI. В некоторых вариантах осуществления 5'-спейсерная последовательность представляет собой UGGUACCGUU (SEQ ID NO: 16).
В некоторых вариантах осуществления 5'-фланкирующая область, кроме того, содержит 5'-апстрим последовательность, расположенную выше (в 3'-направлении) 5'-спейсерной последовательности. В некоторых вариантах осуществления 5'-апстрим последовательность имеет длину около 5-5000 нуклеотидов, например, 30-2000 нуклеотидов.
В некоторых вариантах осуществления 3'-фланкирующая область содержит 3'-соединяющую последовательность, непрерывно связанную с направляющей областью. В некоторых вариантах осуществления участок соединения имеет длину, равную любому целому числу от 4 до 50 включительно. В некоторых вариантах осуществления 3'-соединяющая последовательность состоит из 5-8 нуклеотидов (например, состоит из 6 нуклеотидов). В некоторых вариантах осуществления 3'-соединяющая последовательность по меньшей мере примерно на 85% комплементарна 5'-соединяющей последовательности. В некоторых вариантах осуществления 3'-соединяющая последовательность кодирует CGCYUAC (SEQ ID NO: 17), где Y представляет собой С или U. В некоторых вариантах осуществления 3'-соединяющая последовательность кодирует CGCCUAC (SEQ ID NO: 18).
В некоторых вариантах осуществления 3'-фланкирующая область, кроме того, содержит 3'-выступающую последовательность, расположенную ниже (в 5'-направлении) 3'-соединяющей последовательности. В некоторых вариантах осуществления 3'-выступающая последовательность содержит сайт клонирования, такой как сайт SpeI/XbaI или сайт SpeI. В некоторых вариантах осуществления 3'-выступающая последовательность состоит примерно из 1-15 нуклеотидов (например, 2-15 нуклеотидов или 1-10 нуклеотидов). В некоторых вариантах осуществления 3'-выступающая последовательность кодирует UAG (SEQ ID NO: 30). В некоторых вариантах осуществления 5'-выступающая последовательность комплементарна 3'-выступающей последовательности только при одном нуклеотиде на каждом конце последовательности.
В некоторых вариантах осуществления 3'-фланкирующая область, кроме того, содержит 3'-спейсерную последовательность, расположенную ниже (в 5'-направлении) 3'-выступающей последовательности. В некоторых вариантах осуществления 3'-спейсерная последовательность состоит из 9-12 нуклеотидов, например, 10-12 нуклеотидов. В некоторых вариантах осуществления 3'-спейсерная последовательность представляет собой AGCGGCCGCCA (SEQ ID NO: 19). В некоторых вариантах осуществления 3'-спейсерная последовательность по меньшей мере примерно на 70% комплементарна 5'-спейсерной последовательности.
В некоторых вариантах осуществления 3'-фланкирующая область, кроме того, содержит 3'-даунстрим последовательность, расположенную ниже (в 5'-направлении) 3'-спейсерной последовательности. В некоторых вариантах осуществления 5'-апстрим последовательность значительно не спаривается с 3'-даунстрим последовательностью. Используемый здесь термин «значительно не спаривается» означает, что две цепи являются гомологичными менее чем на 20%. В некоторых вариантах осуществления 3'-даунстрим последовательность имеет длину примерно 5-5000 нуклеотидов, например, 30-2000 нуклеотидов.
В некоторых вариантах осуществления петлевая область имеет длину 4-20 нуклеотидов, например, длину 15-19 нуклеотидов. 0-50% петлевой области может быть комплементарным другой части петлевой области. Используемый здесь термин «петлевая область» означает последовательность, которая соединяет две комплементарные цепи нуклеиновой кислоты. В некоторых вариантах осуществления 1-3 нуклеотидов петлевой области, непосредственно примыкающие к комплементарным цепям нуклеиновой кислоты, могут быть комплементарными последним 1-3 нуклеотидам петлевой области. Например, первые две нуклеиновых кислоты в петлевой области могут быть комплементарными последним двум нуклеотидам указанной петлевой области. В некоторых вариантах осуществления петлевая область имеет длину 17 нуклеотидов. В некоторых вариантах осуществления петлевая область кодирует CUNNNNNNNNNNNNNNNGG (SEQ ID NO: 20) или CCNNNNNNNNNNNNNNNGG (SEQ ID NO: 21). В некоторых вариантах осуществления петлевая область кодирует CUGUGAAGCCACAGAUGGG (SEQ ID NO: 22) или CCGUGAAGCCACAGAUGGG (SEQ ID NO: 23).
Кроме того в настоящем изобретении предлагается РНК, кодируемая описанной здесь нуклеиновой кислотой.
Кроме того в настоящем изобретении предлагается экспрессионная кассета, содержащая промотор, непрерывно связанный с описанной здесь нуклеиновой кислотой. В некоторых вариантах осуществления промотор представляет собой промотор polII или polIII, например, промотор U6 (например, промотор U6 мыши). В некоторых вариантах осуществления экспрессионная кассета, кроме того, содержит маркерный ген. В некоторых вариантах осуществления промотор представляет собой промотор polII. В некоторых вариантах осуществления промотор представляет собой тканеспецифический промотор. В некоторых вариантах осуществления промотор представляет собой индуцибельный промотор. В некоторых вариантах осуществления промотор представляет собой промотор polIII.
В некоторых вариантах осуществления экспрессионная кассета, кроме того, содержит маркерный ген.
В настоящем изобретении предлагается вектор, содержащий экспрессионную кассету, описанную здесь. В некоторых вариантах осуществления вектор представляет собой вектор на основе аденоассоциированного вируса (AAV). В некоторых вариантах осуществления AAV представляет собой AAV1, AAV2, AAV5, AAV6 и/или AAV9. В некоторых вариантах осуществления AAV представляет собой AAV2. В некоторых вариантах осуществления AAV представляет собой AAV2/1. Примеры таких AAV можно найти в работе Davidson et al., PNAS (2000) 97: 3428-3432. В некоторых вариантах осуществления AAV представляет собой AAV2/1. В некоторых вариантах осуществления AAV представляет собой AAV2/5. Используемый здесь термин AAV2/1 означает ITR AAV2 и капсид AAV1, термин AAV2/2 означает ITR AAV2 и капсид AAV2, термин AAV2/4 означает ITR AAV2 и капсид AAV4 и т.д. В некоторых вариантах осуществления AAV представляет собой AAV1, AAV2, AAV5, AAV6 и/или AAV9. В некоторых вариантах осуществления AAV представляет собой AAV1. В некоторых вариантах осуществления AAV представляет собой AAV2. В некоторых вариантах осуществления AAV представляет собой AAV5. В некоторых вариантах осуществления AAV представляет собой AAV6. В некоторых вариантах осуществления AAV представляет собой AAV8. В некоторых вариантах осуществления AAV представляет собой AAV9. В некоторых вариантах осуществления AAV представляет собой AAVrh10.
В некоторых вариантах осуществления капсид AAV является по меньшей мере на 80% гомологичным любому капсидному белку референсного серотипа AAV - VP1, VP2 и/или VP3, например, капсидному белку AAV1 - VP1, VP2 и/или VP3, или, например, капсидному белку AAV2 - VP1, VP2 и/или VP3, или, например, капсидному белку AAV3 -VP1, VP2 и/или VP3, или, например, капсидному белку AAV4 - VP1, VP2 и/или VP3, или, например, капсидному белку AAV5 - VP1, VP2 и/или VP3, или, например, капсидному белку AAV6 - VP1, VP2 и/или VP3, или, например, капсидному белку AAV7 - VP1, VP2 и/или VP3, или, например, капсидному белку AAV8 - VP1, VP2 и/или VP3, или, например, капсидному белку AAV9 - VP1, VP2 и/или VP3, или, например, капсидному белку AAVrh10 - VP1, VP2 и/или VP3, или, например, капсидному белку AAVrh74 - VP1, VP2 и/или VP3.
В некоторых вариантах осуществления капсид AAV является по меньшей мере на 100% гомологичным любому капсидному белку референсного серотипа AAV - VP1, VP2 и/или VP3, например, капсидному белку AAV1 - VP1, VP2 и/или VP3, или, например, капсидному белку AAV2 - VP1, VP2 и/или VP3, или, например, капсидному белку AAV3 - VP1, VP2 и/или VP3, или, например, капсидному белку AAV4 - VP1, VP2 и/или VP3, или, например, капсидному белку AAV5 - VP1, VP2 и/или VP3, или, например, капсидному белку AAV6 - VP1, VP2 и/или VP3, или, например, капсидному белку AAV7 - VP1, VP2 и/или VP3, или, например, капсидному белку AAV8 - VP1, VP2 и/или VP3, или, например, капсидному белку AAV9 - VP1, VP2 и/или VP3, или, например, капсидному белку AAVrh10 - VP1, VP2 и/или VP3, или, например, капсидному белку AAVrh74 - VP1, VP2 и/или VP3.
В настоящем изобретении предлагается животное, отличное от человека, несущее нуклеиновую кислоту, экспрессионную кассету, вектор или дуплекс, описанный здесь.
В настоящем изобретении предлагается выделенная нуклеиновая кислота длиной 80-4000 нуклеотидов, включающая нуклеиновую кислоту, кодирующую искусственный первичный транскрипт miRNA (pri-miRNA), состоящую, в порядке расположения, из 5'-фланкирующей области, ненаправляющей области, петлевой области, направляющей области и 3'-фланкирующей области, при этом направляющая область состоит из SEQ ID NO: 37 (miHDss3), SEQ ID NO: 6 (miHDS1v5U) или SEQ ID NO: 7 (miHDS1v6A), и ненаправляющая область по меньшей мере на 80% комплементарна направляющей области.
Настоящее изобретение обеспечивает выделенную нуклеиновую кислоту, состоящую из Pri-miHDS1v5U (SEQ ID NO: 8), Pri-miHDS1v6A (SEQ ID NO: 9), Pre-miHDS1v5U (SEQ ID NO: 10) или Pre-miHDS1v6A (SEQ ID NO: 11). В одном варианте осуществления miHDS1 полной длины (SEQ ID NO: 12) имеет следующую последовательность:
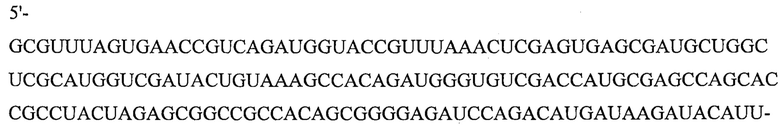
 (SEQ ID NO: 12)
(SEQ ID NO: 12)
В настоящем изобретении предлагается дуплекс выделенной РНК, содержащий направляющую область нуклеиновой кислоты и ненаправляющую область нуклеиновой кислоты, при этом направляющая область представляет собой SEQ ID NO: 37 (miHDss3), SEQ ID NO: 6 (miHDS1v5U) или SEQ ID NO: 7 (miHDS1v6A), и ненаправляющая область по меньшей мере на 80% комплементарна направляющей области. В некоторых вариантах осуществления дуплекс выделенной РНК имеет длину 19-30 пар оснований. Некоторые варианты осуществления включают экспрессионную кассету, кодирующую выделенную нуклеиновую кислоту, описанную выше. В некоторых вариантах осуществления экспрессионная кассета, кроме того, содержит маркерный ген.
В настоящем изобретении предлагается способ индукции интерференции РНК путем введения субъекту нуклеиновой кислоты, экспрессионной кассеты, вектора или композиции, описанной здесь.
В настоящем изобретении предлагается вектор, содержащий промотор U6, оперативно связанный с нуклеиновой кислотой, кодирующей miRNA. Предсказанные сайты начала транскрипции конструкций согласно настоящему изобретению отличаются от тех, которые использовали исследователи в прошлом. В некоторых вариантах осуществления настоящего изобретения U6miRNA имеет удлиненный 5'-конец. Если 5'-конец является укороченным для сходства с предшествующей стратегией на основе CMV, эффективность сайленсинга является значительно сниженной. В настоящем изобретении также предлагаются улучшенные фланкирующие последовательности, которые показали улучшенную эффективность по сравнению с фланкирующими последовательностями природных miR-30. Оказалось, что использование стратегии на основе miRNA согласно настоящему изобретению уменьшает токсичность, ассоциированную с традиционными подходами на основе shRNA. Стратегия на основе miRNA, как правило, не вызывает чрезмерной RNAi, как это происходит в подходах на основе U6shRNA.
Используемый здесь термин «стеблевая последовательность» означает последовательность, которая комплементарна другой последовательности в той же самой молекуле, при этом две комплементарные цепи подвергаются отжигу с образованием дуплекса (например, ненаправляющая и направляющая области). Образованный дуплекс может быть полностью комплементарным или может быть менее чем полностью комплементарным, например, на 99%, 98%, 97%, 96%, 95,%, 94%, 93%, 92%, 91%, 90%, 89%, 88%, 87%, 86%, 85%, 84%, 83%, 82%, 81%, 80%, 75% или 70% комплементарным. Кроме того, в некоторых вариантах осуществления одна цепь может содержать больше нуклеотидов, чем другая цепь, обеспечивая возможность формирования боковой петли.
В настоящем изобретении также предлагаются векторы, содержащие экспрессионные кассеты, описанные здесь. Примеры подходящих векторов включают векторы на основе аденовируса, лентивируса, аденоассоциированного вируса (AAV), полиовируса, вируса простого герпеса (HSV) или вируса мышей Малони. В одном варианте осуществления вектор представляет собой вектор на основе аденоассоциированного вируса. Эти кассеты и векторы могут содержаться в клетке, такой как клетка млекопитающего. Млекопитающее, отличное от человека, может нести кассету или вектор.
В настоящем изобретении предлагаются клетки (такие как клетка млекопитающего), содержащие молекулы нуклеиновой кислоты, экспрессионные кассеты или векторы, описанные здесь. В настоящем изобретении также предлагается млекопитающее, отличное от человека, несущее молекулы нуклеиновой кислоты, экспрессионные кассеты или векторы, описанные здесь.
В настоящем изобретении предлагается нуклеиновая кислота, экспрессионная кассета, вектор или композиция, описанная здесь, для применения в терапии, например, для лечения нейродегенеративного заболевания.
В настоящем изобретении предлагается выделенная молекула RNAi, содержащая микроРНК, имеющую выступ на 3'-конце. В некоторых вариантах осуществления выступ представляет собой 2-5 нуклеотидный повтор. В некоторых вариантах осуществления выступ представляет собой последовательность UU (SEQ ID NO: 24), UUU (SEQ ID NO: 25), UUUU (SEQ ID NO: 26), CUU (SEQ ID NO: 27), CUUU (SEQ ID NO: 28) или CUUUU (SEQ ID NO: 29). В некоторых вариантах осуществления микроРНК представляет собой природную микроРНК. В некоторых вариантах осуществления микроРНК представляет собой искусственную микроРНК. В некоторых вариантах осуществления молекула RNAi вызывает пониженный уровень нецелевой токсичности.
В настоящем изобретении предлагается способ индукции РНК-интерференции с низкой токсичностью путем введения субъекту нуклеиновой кислоты, экспрессионной кассеты, вектора или композиции, описанной здесь. В некоторых вариантах осуществления экспрессионная кассета содержит промотор polII.
В настоящем изобретении предлагается способ индукции РНК-интерференции с низкой токсичностью путем введения субъекту экспрессионной кассеты, кодирующей промотор polII, оперативно связанный с нуклеиновой кислотой, кодирующей miRNA. В некоторых вариантах осуществления miRNA содержит 5'- или 3'-выступ из 2 или 3 нуклеотидов. В некоторых вариантах осуществления miRNA содержит 3'-выступ из 2 нуклеотидов. В некоторых вариантах осуществления miRNA представляет собой, искусственную miRNA.
В настоящем изобретении предлагается способ лечения субъекта, имеющего болезнь Хантингтона, путем введения субъекту нуклеиновой кислоты, экспрессионной кассеты, вектора или композиции, описанной здесь, для лечения болезни Хантингтона.
В настоящем изобретении предлагается способ подавления накопления хантингтина в клетке путем введения описанных здесь молекул нуклеиновой кислоты (например, рибонуклеиновой кислоты (РНК)) в клетку в количестве, достаточном для подавления накопления хантингтина в клетке. В некоторых вариантах осуществления накопление хантингтина является подавленным по меньшей на 10%. В некоторых вариантах осуществления накопление хантингтина является подавленным по меньшей на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 95% или 99%. В некоторых вариантах осуществления подавление накопления белка происходит в количестве, достаточном для того, чтобы вызвать терапевтический эффект, например, чтобы уменьшить образование сплетений.
В настоящем изобретении предлагается способ предупреждения возникновения цитотоксических эффектов мутантного хантингтина в клетке путем введения описанных здесь молекул нуклеиновой кислоты (например, рибонуклеиновой кислоты (РНК)) в клетку в количестве, достаточном для подавления накопления хантингтина. В некоторых вариантах осуществления молекулы нуклеиновой кислоты предупреждают возникновение цитотоксических эффектов хантингтина, например, в нервной клетке.
В настоящем изобретении предлагается способ ингабирования экспрессии гена хантингтина в клетке путем введения описанной здесь молекулы нуклеиновой кислоты (например, рибонуклеиновой кислоты (РНК)) в клетку в количестве, достаточном для ингибирования экспрессии хантингтина, и при этом РНК ингибирует экспрессию гена хантингтина. В некоторых вариантах осуществления ингибирование хантингтина происходит по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 99%.
В настоящем изобретении предлагается способ ингибирования экспрессии гена хантингтина у млекопитающего (например, человека или млекопитающего, отличного от человека) путем (а) обеспечения млекопитающего, несущего нервную клетку, при этом нервная клетка содержит ген хантингтина и подвержена РНК-интерференции, и ген хантингтина экспрессируется в нервной клетке; и (b) приведения в контакт млекопитающего с рибонуклеиновой кислотой (РНК) или вектором, описанным здесь, ингибируя тем самым экспрессию гена хантингтина. В некоторых вариантах осуществления накопление хантингтина является подавленным по меньшей мере на 10%. В некоторых вариантах осуществления накопление хантингтина является подавленным по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 99%. В некоторых вариантах осуществления клетка локализована in vivo у млекопитающего.
В настоящем изобретении предлагается вектор на основе вируса, содержащий промотор и шаттл микроРНК (miRNA), содержащий встроенную siRNA, специфическую для последовательности-мишени. В некоторых вариантах осуществления промотор представляет собой индуцибельный промотор. В некоторых вариантах осуществления вектор представляет собой вектор на основе аденовируса, лентивируса, аденоассоциированного вируса (AAV), полиовируса, вируса простого герпеса (HSV) или вируса мышиной лейкемии Малони. В некоторых вариантах осуществления последовательность-мишень представляет собой последовательность, ассоциированную с болезнью Хантингтона. Последовательность-мишень в некоторых вариантах осуществления представляет собой последовательность, кодирующую хантингтин.
В настоящем изобретении предлагается способ предупреждения цитотоксических эффектов нейродегенеративного заболевания у млекопитающего, нуждающегося в этом, путем введения описанного здесь вектора, кодирующего miRNA, в клетку в количестве, достаточном для подавления накопления белка, ассоциированного с болезнью Хантингтона, при этом РНК предупреждает цитотоксические эффекты болезни Хантингтона (также названной HD, и белок хантингтин также назван htt).
В настоящем изобретении также предлагается способ ингибирования экспрессии белка, ассоциированного с болезнью Хантингтона, у млекопитающего, нуждающегося в этом, путем введения описанного здесь вектора, кодирующего miRNA, в клетку в количестве, достаточном для ингибирования экспрессии белка хантингтина, при этом РНК ингибирует экспрессию белка хантингтина. Белок хантингтин ингибируется по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 99%.
Данное изобретение относится к соединениям, композициям и способам, полезным для модулирования экспрессии гена болезни Хантингтона, с использованием молекул короткой интерферирующей нуклеиновой кислоты (siRNA). Данное изобретение также относится к соединениям, композициям и способам, полезным для модулирования экспрессии и активности других генов, вовлеченных в пути экспрессии и/или активности гена HD путем интерференции РНК (RNAi) с использованием малых молекул нуклеиновой кислоты. В частности, в настоящем изобретении предлагаются малые молекулы нуклеиновой кислоты, такие как молекулы короткой интерферирующей нуклеиновой кислоты (siNA), короткой интерферирующей РНК (siRNA), двухцепочечной РНК (dsRNA), микроРНК (miRNA) и короткой шпилечной РНК (shRNA), а также способы, используемые для модулирования экспрессии генов HD. Молекула siRNA согласно настоящему изобретению может быть, например, химически синтезированной, экспрессируемой из вектора или синтезированной ферментативно.
Как используется здесь, когда в формуле изобретения указано, что РНК «соответствует», это означает РНК, имеющую такую же последовательность, как ДНК, за исключением того, что урацил заменен на тимин.
Настоящее изобретение, кроме того, обеспечивает способ по существу выключения (сайленсинга) представляющего интерес гена-мишени или аллеля-мишени для представляющего интерес гена для обеспечения терапевтического эффекта. Используемый здесь термин «по существу выключения (сайленсинга)» или «по существу выключенный» относится к уменьшению, сокращению или ингибированию экспрессии гена-мишени или аллеля-мишени по меньшей мере примерно на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80% и от 85% до 100%. Используемый здесь термин «терапевтический эффект» относится к изменению связанных с заболеванием нарушений, включая патологические и поведенческие дефициты; изменению интервала времени до прогрессирования заболевания; уменьшению, ослаблению или изменению симптома заболевания; или улучшению качества жизни индивидуума, пораженного заболеванием. Терапевтические эффекты могут быть измерены количественно терапевтом или качественно пациентом, пораженным заболеванием, на которое направленно воздействует siRNA. В некоторых вариантах осуществления, в которых мутантный аллель и аллель дикого типа являются по существу выключенными, термин терапевтический эффект относится к состоянию, при котором сайленсинг экспрессии аллеля дикого типа не оказывает пагубного или вредного воздействия на нормальные функции, вследствие чего у пациента не будет наблюдаться терапевтический эффект.
В одном варианте осуществления в изобретении предлагается способ лечения или предупреждения болезни Хантингтона у субъекта или организма, включающий приведение в контакт субъекта или организма с siRNA согласно изобретению в условиях, подходящих для модулирования экспрессии гена HD у субъекта или организма, чтобы тем самым достигнуть лечения или предупреждения болезни Хантингтона. В одном варианте осуществления мишень гена HD включает аллель HD (например, аллель, содержащий удлинение тринуклеотидного (CAG) повтора и аллель дикого типа). Молекула siRNA согласно изобретению может экспрессироваться из векторов, как описано здесь или известно в данной области, для направленного воздействия на соответствующие ткани или клетки у субъекта или организма.
В одном варианте осуществления в изобретении предлагается способ лечения или предупреждения болезни Хантингтона у субъекта или организма, включающий приведение в контакт субъекта или организма с молекулой siRNA согласно изобретению путем локального введения в соответствующие ткани или клетки, такие как клетки или ткани головного мозга (например, базальные ганглии, стриатум или кортекс), например, путем введения векторов или экспрессионных кассет согласно изобретению, обеспечивающих молекулы siRNA согласно изобретению, в соответствующие клетки (например, базальные ганглии, стриатум или кортекс). В одном варианте осуществления siRNA, вектор или экспрессионную кассету вводят субъекту или организму путем стереотаксической или конвекционной доставки в головной мозг. Например, в патенте США 5720720 описаны способы и устройства, используемые для стереотаксической или конвекционной доставки реагентов в головной мозг. Такие способы и устройства могут быть легко использованы для доставки siRNA, векторов или экспрессионных кассет согласно изобретению субъекту или организму, и указанный патент США 5720720 включен в настоящий документ полностью посредством ссылки. Заявки на патент США 2002/0141980; 2002/0114780; и 2002/0187127, все обеспечивают способы и устройства, используемые для стереотаксической или конвекционной доставки реагентов, которые легко могут быть адаптированы для доставки siRNA, векторов или экспрессионных кассет согласно изобретению субъекту или организму, и включены здесь полностью посредством. ссылки. Конкретные устройства, которые могут быть использованы для доставки siRNA, векторов или экспрессионных кассет согласно изобретению субъекту или организму, описаны в заявке на патент США 2004/0162255, полное содержание которой включено в настоящий документ посредством ссылки. Молекула siRNA согласно изобретению может экспрессироваться из векторов, как описано здесь или известно в данной области, для направленного воздействия на соответствующие ткани или клетки у субъекта или организма.
Способы доставки вирусных векторов включают, но без ограничения, внутриартериальную, внутримышечную, внутривенную, интраназальную и пероральную доставку. Как правило, вирионы AAV могут быть введены в клетки CNS с использованием методов трансдукции in vivo или in vitro. В случае трансдукции in vitro, у субъекта удаляют подходящую реципиентную клетку, трансдуцируют вирионами и вновь вводят субъекту. Альтернативно могут быть использованы сингенные или ксеногенные клетки, причем указанные клетки не генерируют несоответствующий иммунный ответ у субъекта.
Подходящие способы для доставки и введения трансдуцированных клеток субъекту были описаны. Например, клетки могут быть трансдуцированы in vitro путем объединения рекомбинантных AAV-вирионов с клетками CNS, например, в подходящей среде, и скрининга клеток, которые содержат представляющую интерес ДНК, с использованием общепринятых методов, таких как Саузерн-блоттинг и/или PCR, или путем использования селектируемых маркеров. Затем трансдуцированные клетки могут быть составлены в фармацевтические композиции, более подробно описанные ниже, и композиции введены субъекту различными способами, такими как прививание, внутримышечная, внутривенная, подкожная и интраперитонеальная инъекции.
В одном варианте осуществления для доставки in vivo вирионы AAV составляют в фармацевтические композиции и обычно вводят парентерально, например, путем внутримышечной инъекции непосредственно в скелетную или сердечную мышцу, или путем инъекции в CNS.
В одном варианте осуществления вирусные векторы согласно изобретению доставляются в CNS посредством систем конвекционной доставки (CED), которые могут эффективно доставлять вирусные векторы, например, AAV, в обширные области головного мозга субъекта (например, стриатум и/или кортекс). Как описано подробно и проиллюстрировано ниже, эти методы являются подходящими для разнообразных вирусных векторов, например, векторов на основе AAV, несущих терапевтические гены (например, siRNA).
Любое устройство для конвекционной доставки может быть подходящим для доставки вирусных векторов. В одном варианте осуществления устройство представляет собой осмотический насос или инфузионную помпу. Осмотический насос и инфузионная помпа являются коммерчески доступными от различных поставщиков, например, Alzet Corporation, Hamilton Corporation, Aiza, Inc., Palo Alto, Calif. Как правило, доставку вирусного вектора посредством устройств CED осуществляют следующим образом. Катетер, канюлю или другое инъекционное устройство вставляют в ткань CNS выбранного субъекта. Принимая во внимание учения в настоящем документе, специалист а данной области легко определит, какая общая область CNS является подходящей мишенью. Например, в случае доставки AAV-вектора, кодирующего терапевтический ген для лечения HD, стриатум является подходящей областью головного мозга для направленного воздействия. Стереотаксические карты и позиционирующие устройства являются доступными, например, от фирмы ASI Instruments, Warren, Mich. Позиционирование может быть также выполнено путем использования анатомических карт, полученных с помощью изображений СТ и/или MRI головного мозга субъекта для содействия направлению инъекционного устройства в выбранную мишень. Кроме того, так как описанные здесь способы могут быть осуществлены на практике таким образом, что сравнительно большие области головного мозга поглощают вирусные векторы, может потребоваться меньшее количество инфузионных канюль. Поскольку хирургические осложнения связаны с числом проникновений, описанные здесь способы способствуют также уменьшению побочных эффектов, наблюдаемых при использовании обычных методов доставки.
В одном варианте осуществления фармацевтические композиции будут содержать достаточное количество генетического материала для получения терапевтически эффективного количества представляющей интерес siRNA, то есть количества, достаточного для снижения или ослабления симптомов рассматриваемого в настоящем документе заболевания, или количества, достаточного для обеспечения желаемого благоприятного эффекта. Фармацевтические композиции могут также содержать фармацевтически приемлемое вспомогательное вещество. Такие вспомогательные вещества включают любой фармацевтический агент, который сам по себе не вызывает выработку антител, вредных для индивидуума, получающего композицию, и который можно вводить без возникновения неспецифической токсичности. Фармацевтически приемлемые вспомогательные вещества включают, но без ограничения, сорбитол, Tween80 и жидкости, такие как вода, солевой раствор, глицерин и этанол. Могут быть включены фармацевтически приемлемые соли, например, соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты, сульфаты и т.п.; и соли органических кислот, такие как ацетаты, пропионаты, малонаты, бензоаты и т.п. Кроме того, в таких носителях могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие агенты, pH буферные вещества и т.п. Подробное описание фармацевтически приемлемых вспомогательных веществ содержится в REMINGTON'S PHARMACEUTICAL SCIENCES (Mack Pub. Co., N.J. 1991).
Специалистам в данной области будет очевидно, что в свете учений данного описания эффективное количество вирусного вектора, которое должно быть добавлено, может быть определено эмпирически. Введение можно осуществлять одной дозой, непрерывно или с перерывами в течение курса лечения. Способы определения наиболее эффективных средств и доз введения хорошо известны специалистам в данной области и варьируют в зависимости от вирусного вектора, состава терапии, клеток-мишеней и субъекта, получающего лечение. Однократное и многократное введения могут быть проведены при уровнях доз и схеме введения, выбранных лечащим врачом.
Следует понимать, что более чем один трансген может экспрессироваться введенным вирусным вектором. Альтернативно, отдельные векторы, каждый, экспрессирующий один или несколько различных трансгенов, также могут быть доставлены в CNS, как описано в настоящем документе. Кроме того, предполагается также, что вирусные векторы, доставленные с помощью способов согласно настоящему изобретению, могут быть комбинированы с другими подходящими композициями и терапиями.
Кроме того, в настоящем изобретении предлагается miRNA или shRNA, экспрессионная кассета и/или вектор, как описано здесь, для применения в терапевтическом лечении или диагностике.
В настоящем изобретении предлагается применение miRNA или shRNA, экспрессионной кассеты и/или вектора, как описано здесь, для изготовления лекарственного средства, полезного для лечения заболевания, восприимчивого к RNAi, у животного, например, полезного для лечения болезни Хантингтона.
Кроме того, в настоящем изобретении предлагается нуклеиновая кислота, экспрессионная кассета, вектор или композиция согласно изобретению для применения в терапии.
В настоящем изобретении предлагается также нуклеиновая кислота, экспрессионная кассета, вектор или композиция согласно изобретению для лечения, например, для применения в профилактическом или терапевтическом лечении болезни Хантингтона.
В некоторых вариантах осуществления агент вводят в головной мозг субъекта. В некоторых вариантах осуществления агент вводят напрямую в головной мозг или посредством кровотока. В некоторых вариантах осуществления терапевтический агент вводят интракраниально. В некоторых вариантах осуществления терапевтический агент вводят в мостомозжечковую цистерну, стриатум, кортекс или желудочек, субарахноидальное пространство и/или интратекальное пространство. В некоторых вариантах осуществления субъектом является человек. В некоторых вариантах осуществления субъектом является млекопитающее, отличное от человека. В некоторых вариантах осуществления агент инъецируют в 1-5 локализаций в головном мозге, например, в одну, две или три локализации в головном мозге. В некоторых вариантах осуществления способ, кроме того, включает дополнительное введение rAAV в желудочек, субарахноидальное пространство и/или интратекальное пространство головного мозга примата, отличного от человека. В частности, в настоящем изобретении предлагается способ доставки нуклеиновой кислоты в клетку посредством контакта с циркулирующей спинномозговой жидкостью (CSF), такую как эпендимная клетка, пиальная клетка, менингеальная клетка, эндотелиальная клетка головного мозга, при этом способ включает введение в клетку частицы AAV, содержащей вектор, несущий нуклеиновую кислоту, вставленную между парой инвертированных концевых повторов AAV, осуществляя тем самым доставку нуклеиновой кислоты в клетку.
В настоящем изобретении также предлагается способ приведения в контакт клетки с нуклеиновой кислотой, экспрессионной кассетой, вектором или дуплексом, описанным здесь, для лечения болезни Хантингтона, при этом клетка представляет собой эпендимальную, пиальную, эндотелиальную клетку, клетку желудочка головного мозга и/или менингеальную клетку.
Краткое описание фигур
Фигуры 1A-1G: Сверхэкспрессия miHDS1 - вызывает побочные эффекты в головном мозге мыши, а) спаривание miHDS1 с мРНК хантингтина мыши и человека (miHDS1 представляет собой SEQ ID NO: l; Htt мыши представляет собой SEQ ID NO: 2; и Htt человека представляет собой SEQ ID NO: 3). b) Изображение, на котором показаны шаттл-векторы AAV/спейсер, содержащие экспрессионные кассеты miHDS1 и miCtl. с) Экспериментальная стратегия для оценки in vivo переносимости miHDS1. d) Данные результатов теста на вращающемся стержне, проведенного на мышах, инъецированных miHDS1 (n=13) или miCtl (n=11). Данные представлены в виде среднего значения 2 лучших испытаний для каждой мыши в день, проводимых в течение четырех последовательных дней, через 7 недель (Исходный уровень), 16 недель и 24 недели. Интервал времени до падения представлен в виде среднего значения ± s.e.m. (*p>0,05, критерий Стьюдента для одной выборки в указанные моменты времени), е) Анализ увеличения массы тела мышей, инъецированных miHDS1 и miCtl. Данные представлены в виде увеличения массы тела относительно исходного момента времени, составляющего 7 недель, f) Анализ на схватывание у мышей, инъецированных miHDs1 и miCtl. Данные представлены в виде процента и количества мышей, показывающих схватывание в указанные моменты времени, g) Смещение цепи вектора U6/miHDS1. Смещение цепи оценивали путем измерения активности люциферазы из репортерных конструкций, содержащих последовательности-мишени, комплементарные пассажирским (смысловым) или направляющим (антисмысловым) цепям miHDS1. Результаты представлены в виде результата иллюстративного эксперимента, состоящего из 3 различных экспериментов (n=4 на группу). Данные представлены в виде среднего значения ± sem относительно клеток, трансфицированных miCtl, и демонстрируют, что miHDS1 преимущественно нагружает смысловую цепь miHDS1.
Фигуры 2A-2D: Характеристика нецелевых генов miHDS1. а) Перечень генов из 25-го процентиля предсказанных нецелевых генов miHDS1. Показана следующая информация: идентификационный номер (ID) гена, референсная последовательность, тип сайта связывания miRNA, положение нуклеотидов в 3'UTR, показатель, предсказанный алгоритмом Target Scan, показатель ddG, предсказанный алгоритмом PITA, b) Изображение, на котором показаны сайты связывания miHDS1 : mRNA (miHDS1 представляет собой SEQ ID NO: 1) на предсказанных нецелевых генах (Bcl2 представляет собой SEQ ID NO: 31; Smad9 представляет собой SEQ ID NO: 32; Sdf4 представляет собой SEQ ID NO: 33; Map2k6 представляет собой SEQ ID NO: 34). с) Анализ с помощью количественной полимеразной цепной реакции (Q-PCR) уровней мРНК Htt, Bcl2, Smad9, Sdf4 и Map2k6 в образцах стриатума через 4 месяца после инъекции miHDS1. Все образцы нормализованы по β-актину и результаты представлены в виде среднего значения ± sem относительно мышей, инъецированных miCtl. (n=6 мышей на группу; *p<0,05, **p<0,01, тест Манна-Уитни). d) Анализ с помощью Q-PCR уровней мРНК Htt, Bcl2, Smad9, Sdf4 и Map2k6 в клетках SthdhQ7 после электропорации miHDS1. Все образцы нормализованы по β-актину и результаты представлены в виде среднего значения ± sem относительно клеток, подвергнутых электропорации плазмидой, содержащей промотор U6 или экспрессионную кассету miCtl. (n=8 подвергнутых электропорации лунок; **p<0,01, однофакторный дисперсионный анализ (ANOVA) с последующим применением поправки Бонферрони).
Фигуры 3А-3С: Генерирование однонуклеотидных вариантов затравок miHDS1. а) Изображение, на котором показана локализация однонуклеотидных модификаций в затравочной области последовательности miHDS1 (Pri-miHDS1 представляет собой SEQ ID NO: 4; Pre-miHDS1 представляет собой SEQ ID NO: 5; нагруженная RISC последовательность miRNA представляет собой SEQ ID NO: 1). b) Влияние на показатель SPS в зависимости от положения нуклеотидного несоответствия (мисмэтча) по немишеням miHDS1. с) В таблице показано количество предсказанных нецелевых генов (все и стриатум-специфические) для вариантов miHDS1 и miHDS1, а также количество общих для вариантов miHDS1 и miHDS1 немишеней.
Фигуры 4A-4I: Эффективность сайленсинга однонуклеотидных вариантов затравок miHDS1. а) Количественный анализ уровней мРНК hHtt в клетках HEK293, трансфицированных экспрессионными кассетами U6/miHDS1. Тотальную РНК собирали через 24 часа после трансфекции и уровни hHtt определяли с помощью Q-PCR. Все образцы нормализованы по β-актину и результаты представлены в виде среднего значения ± sem относительно клеток, трансфицированных miHDS1 (n=12 лунок; **p<0,01, ***p<0,001, однофакторный дисперсионный анализ (ANOVA) с последующим применением поправки Бонферрони). b) Экспрессионные кассеты miHDS1, miHDS1v5u, miHDS1v6a и miHDS1v7u трансфицировали в человеческие клетки HEK293, и уровни эндогенного белка хантингтина определяли через 48 часов после трансфекции. miCtl использовали в качестве контроля без сайленсинга и β-катенин служил в качестве контроля назгрузки. с) Количественное определение уровней белка hHtt через 48 часов после трансфекции miHDS1, miHDS1v5u, miHDS1v6a и miHDS1v7u. Данные представлены в виде среднего значения ± sem относительно клеток, трансфицированных miCtl (n=6, три различных вестерн-блота, *p<0,01, тест Манна-Уитни). d) Спаривание miHDS1v5u и miHDS1v6a с мРНК хантингтина мыши (miHDS1v5U представляет собой SEQ ID NO: 6; Htt мыши представляет собой SEQ ID NO: 2; miHDS1v6A представляет собой SEQ ID NO: 7). е) Экспрессионные кассеты miHDS1, miHDS1v5u и miHDS1v6a подвергали электропорации в мышиные клетки SthdhQ7, и уровни эндогенного белка хантингтина определяли через 48 часов после электропорации. miCtl использовали в качестве контроля без сайленсинга и β-катенин служил в качестве контроля нагрузки, f) Количественное определение уровней белка mHtt через 48 часов после электропорации miHDS1, miHDS1v5u и miHDS1v6a. Данные представлены в виде среднего значения ± sem относительно клеток, трансфицированных miCtl (n=6, три различных вестерн-блота, *p<0,01, тест Манна-Уитни). g-h-i) Количественный анализ уровней мРНК mHtt, Bcl2 и Smad9 в клетках SthdhQ7. подвергнутых электропорации экспрессионными кассетами U6/miHDS1, U6/miHDS1v5u и U6/miHDS1v6a. Тотальную РНК собирали через 24 часа после электропорации, и уровни mHtt, Bcl2 и Smad9 определяли с помощью Q-PCR. Все образцы нормализованы по β-актину и результаты представлены в виде среднего значения ± sem относительно клеток, трансфицированных промотором, содержащим U6, и экспрессионной кассетой U6/miCtl (n=12 лунок; #p<0,01, однофакторный дисперсионный анализ (ANOVA) с последующим применением поправки Бонферрони).
Фигуры 5A-5F: Генерирование последовательностей miHDss1-4 для направленного воздействия на экспрессию хантингтина человека, а). Генерировали четыре искусственных miRNA-триггера, содержащих затравочную последовательность miCtl, допуская однонуклеотидное несоответствие между затравочной областью и мРНК целевого Htt человека. Сайты связывания MiHDss1 и miHDss4 локализованы в 3'UTR, тогда как miHDss2 и 3 связываются на границе экзона 7-8 и экзона 33 мРНК hHtt, соответственно. b) Пара связывания miRNA/mRNA между miHDss1-4 и мРНК хантингтина человека. Однонуклеотидные несоответствия были обнаружены в положениях 7, 6, 5 и 4 затравочной области для последовательностей 1, 2, 3 и 4 miHDss, соответственно (miHDss1 представляет собой SEQ ID NO: 35; miHDss2 представляет собой SEQ ID NO: 36; miHDss3 представляет собой SEQ ID NO: 37; miHDss4 представляет собой SEQ ID NO: 38). На фигуре также показана SEQ ID NOS 40-43, соответственно, в порядке встречаемости, с) Количественный анализ уровней мРНК hHtt в клетках HEK293, трансфицированных экспрессионными кассетами U6/miHDss1-4. Тотальную РНК собирали через 24 часа после трансфекции и уровни hHtt определяли с помощью Q-PCR. Все образцы нормлизованы по β-актину и результаты представлены в виде среднего значения ± sem относительно клеток, трансфицированных miCtl (n=8 лунок; *p<0,001, однофакторный дисперсионный анализ (ANOVA) с последующим применением поправки Бонферрони). d) Экспрессионную кассету miHDss3 трансфицировали в человеческие клетки HEK293, и уровни эндогенного белка хантингтина определяли через 48 часов после трансфекции. miCtl использовали в качестве контроля без сайленсинга, и β-катенин служил в качестве контроля нагрузки. е) Количественное определение уровней белка hHtt через 48 часов после трансфекции miHDss3. Данные представляют собой среднее значение ± sem относительно клеток, трансфицированных miCtl (n=6, два различных вестерн-блота, *p<0,01, тест Манна-Уитни). f) Алгоритм PITA использовали для определения стабильности связывания miHDss3 (SEQ ID NO: 37) и miCtl (SEQ ID NO: 39) по предсказанным незапланированным сайтам связывания мРНК. Затравочная область miCtl и miHDss3 выделена жирным шрифтом. Данные представлены в виде показателя ddG (ккал/моль) для каждого нецелевого гена относительно miCtl или miHDss3. Согласно предсказанию 3' последовательность miHDss3 обеспечивает более высокую стабильность связывания с нецелевыми генами, по сравнению с miCtl.
Фигуры 6А-6Е: Переносимость in vivo miHDS1-вариантов и последовательностей miHDss3. а) Экспериментальная стратегия для оценки переносимости in vivo новых последовательностей miRNA. b) Изображение, на котором показаны шаттл-векторы AAV/спейсер, содержащие варианты miHDS1 и экспрессионные кассеты miHDss3. с) Результаты прохождения теста на вращающемся стержне мышей, инъецированных рецептурным буфером (n=7), miCtl (n=8), miHDS1 (n=9), miHDS1v5u (n=10), miHDS1v6a (n=11) или miHDss3 (n=10). Данные представлены в виде среднего значения лучших 2 испытаний каждой мыши в день, проводимых в течение четырех последовательных дней, через 7 недель (исходный уровень), 16 недель и 24 недели. Интервал времени до падения представлен в виде среднего значения ± s.e.m относительно мышей, инъецированных miCtl. (*p<0,05, однофакторный дисперсионный анализ (ANOVA) с последующим применением поправки Бонферрони). d) Анализ увеличения массы тела у мышей, инъецированных рецептурным буфером, miCtl, miHDS1, miHDS1v5u, miHDS1v6a или miHDss3. Данные представлены в виде увеличения массы тела относительно исходного состояния, измеренного через 7 недель, е) Анализ на схватывание мышей, инъецированных miHDs1 и miCtl. Данные представлены в виде процента и количества мышей, демонстрирующих схватывание в указанные моменты времени.
Подробное описание изобретения
РНК-интерференция (RNAi) представляет собой процесс регуляции экспрессии генов, опосредованный малыми dsRNA. RNAi используют в качестве стандартного биологического инструмента идентификации функции генов и исследуют в качестве терапевтического средства для лечения различных заболеваний. Доставка или экспрессия RNAi может осуществляться посредством введения экзогенных siRNA (транзиентный сайленсинг генов) или посредством введения векторов, экспрессирующих РНК типа «петля-на-стебле» (персистентный сайленсинг генов). Абсолютная специфичность RNAi является неясной. Ряд вопросов, которые необходимо рассмотреть, включают клеточные ответы на dsRNA (IFN-b, PKR, OAS1) и нецелевые эффекты вследствие насыщения механизма RNAi или частичной комплементарности с незапланированными мРНК. Существует постоянная потребность в оптимизации RNAi-векторов и потенциально в разработке тканеспецифических и регулируемых экспрессию стратегий.
Использование RNAi в качестве терапевтического средства зависит от пояснения некоторых факторов, включающих: i) доставку и персистенцию конструкции RNAi для эффективного сайленсинга последовательности гена-мишени; ii) конструирование siRNA для достижения эффективного нокдауна или генной супрессии последовательности-мишени, и iii) оптимальную экспрессионную систему siRNA (shRNA или miRNA) для доставки терапевтической siRNA. Несмотря на то, что во многих исследованиях оценивали использование RNAi, доставляемой в виде химически синтезированных олигонуклеотидных структур, для многих клинических состояний и заболеваний, таких как болезнь Хантингтона, полагают, что для достижения терапевтического эффекта необходима длительная и/или устойчивая экспрессия на высоком уровне терапевтической siRNA, достигаемая путем эндогенной продукции экспрессируемой siRNA. На сегодняшний день получены противоречивые результаты сравнения стратегий на основе shRNA и искусственной miRNA. Терапевтическая польза экспрессируемой RNAi является неподтвержденной из-за опасений, связанных с безопасностью вследствие нецелевой токсичности, возникающей в результате клеточных ответов на dsRNA (IFN-b, PKR, OAS1), насыщения механизма RNAi или сайленсинга немишеней посредством частичной комплементарности с незапланированными mRNA. Таким образом, существует постоянная потребность в оптимизации экспрессируемых векторов RNAi, которые являются безопасными и эффективными.
shRNA состоят из структур типа «петля-на-стебле», которые сконструированы таким образом, что они содержат 5'-фланкирующую область, сегменты области siRNA, петлевую область, 3'-область siRNA и 3'-фланкирующую область. Большинство стратегий на основе экспрессии RNAi используют короткие шпилечные РНК (shRNA) под контролем сильных промоторов на основе polIII. Многие shRNA продемонстрировали эффективный нокдаун последовательностей-мишеней in vitro, а также in vivo, однако было также обнаружено, что некоторые shRNA, которые продемонстрировали эффективный нокдаун гена-мишени, обладают токсичностью in vivo. Недавно открытым альтернативным подходом является использование искусственных miRNA (каркасы pri-miRNA, несущие последовательности siRNA) в качестве RNAi-векторов. Искусственные miRNA по своей природе больше напоминают эндогенные субстраты RNAi и больше подвержены Pol-II-транскрипции (например, обеспечивают возможность тканеспецифической экспрессии RNAi) и полицистронным стратегиям (например, обеспечивают возможность доставки множества последовательностей siRNA). На сегодняшний день получены противоречивые результаты в отношении эффективности векторных систем на основе miRNA по сравнению с shRNA. Важно, что не был рассмотрен вопрос, касающийся нецелевой токсичности, вызываемой двумя системами.
Важным фактором для разработки экспрессирующейся siRNA является идея «дозирования» клетки-хозяина конструкцией, экспрессирующей siRNA. «Дозирование» в отношении экспрессирующейся siRNA в контексте настоящего изобретения относится и может зависеть от доставляющего носителя (например, вирусного или невирусного), относительных количеств или концентрации доставляющего носителя, а также силы и специфичности промотора, используемого для управления экспрессией последовательности siRNA.
Авторы разработали искусственные шаттл-векторы miRNA, которые встраивают последовательности типа «петля-на-стебле», содержащиеся в shRNA, в пределы модификаций природной человеческой последовательности микроРНК 30 или последовательности mi30, которая служит для переноса последовательностей этих малых интерферирующих РНК (siRNA). Смотри, например, РСТ публикацию WO 2008/150897, которая включена здесь посредством ссылки.
Авторы разработали искусственные miRNA, pri-miRNA, pre-miRNA, экспрессионные векторы, дуплексы и способы лечения болезни Хантингтона. Смотри, например, РСТ публикацию WO 2012/109667, которая включена здесь посредством ссылки.
Микро-РНК-шаттлы для RNAi
miRNA представляют собой малые клеточные РНК (~22 нуклеотида), которые процессируются из транскриптов предшественников типа «петля-на-стебле». Известные структуры miRNA «петля-на-стебле» могут быть модифицированы таким образом, чтобы они содержали последовательности RNAi, специфические для представляющих интерес генов. Молекулы miRNA могут быть предпочтительнее, чем молекулы shRNA, так как miRNAs эндогенно экспрессируются. Таким образом, маловероятно, что молекулы miRNA будут индуцировать dsRNA-чувствительные пути продукции интерферона, они процессируются более эффективно, чем shRNA и показали сайленсинг, который является на 80% более эффективным.
Также, роли промотора для молекул miRNA отличаются от молекулам shRNA. Тканеспецифическая индуцибельная экспрессия shRNA включает усечение промоторов polII до сайта начала транскрипции. Напротив, miRNA могут экспрессироваться из любого промотора polII, так как сайты начала и остановки транскрипции могут быть относительно условными.
Лечение болезни Хантингтона
Доминирующие болезни полиглутаминовой экспансии, которые включают спиноцеребеллярную атаксию типа 1 (SCA1) и болезнь Хантингтона (HD), представляют собой прогрессирующие, неизлечимые нейродегенеративные нарушения. В индуцируемых мышиных моделях HD подавление экспрессии мутантного аллеля улучшает фенотип заболевания. Таким образом, терапии, разработанные для ингибирования экспрессии пораженного заболеванием гена, будут оказывать благоприятное воздействие. В настоящем изобретении предлагаются способы использования RNAi in vivo для лечения болезни Хантингтона. Используемый здесь термин «лечение» относится к ослаблению по меньшей мере одного симптома, излечению и/или предупреждению развития заболевания или состояния.
В некоторых вариантах осуществления изобретения молекулы RNAi используют для ингибирования экспрессии целевого гена. Выражение «ингибирование экспрессии» означает уменьшение, ослабление или подавление экспрессии целевого гена. Экспрессия целевого гена может быть ингибирована путем «сайленсинга гена». Сайленсинг гена относится к подавлению экспрессии гена, например, экспрессии трансгена, гетерологичного гена и/или эндогенного гена, которая может быть опосредована посредством процессов, влияющих на транскрипцию, и/или посредством процессов, влияющих на посттранскрипционные механизмы. В отдельных вариантах осуществления сайленсинг гена возникает, когда молекула RNAi инициирует ингибирование или деградацию мРНК, транскрибированную из представляющего интерес гена последовательность-специфическим образом посредством РНК-интерференции, предотвращая тем самым трансляцию генного продукта.
Ссылка на siRNAs в настоящем документе означает включение shRNA и других малых РНК, которые могут или способны модулировать экспрессию целевого гена, например, гена HD, например, посредством РНК-интерференции. Такие малые РНК включают, без ограничения, shRNA и miroRNA (miRNA).
В настоящем документе раскрыта стратегия, которая приводит к значительному сайленсингу целевых генов посредством RNAi. Использование этой стратегии приводит к значительно ослабленной экспрессии in vitro и in vivo целевых генов. Эта стратегия полезна для уменьшения экспрессии целевых генов с целью моделирования биологических процессов или обеспечения терапии для заболеваний человека. Например, эту стратегию можно применять для болезни Хантингтона. Используемый здесь термин «по существу сайленсинг» означает, что mRNA целевого гена является ингибированной и/или деградированной посредством присутствия введенной siRNA, таким образом, что экспрессия целевого гена уменьшается примерно на 10%-100% по сравнению с уровнем экспрессии, наблюдаемым в случае отсутствия siRNA. Как правило, когда ген является по существу выключенным, экспрессия будет снижена по меньшей мере на 40%, 50%, от 60% до 70%, например, 71%, 72%, 73%, 74%, 75%, 76%, 77%, от 78% до 79%, обычно по меньшей мере на 80%, например, 81%-84%, по меньшей мере на 85%, например, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или даже на 100% по сравнению с экспрессией в случае отсутствия siRNA. Используемый здесь термин «по существу нормальная активность» означает уровень экспрессии гена при отсутствии введения siRNA в клетку.
Болезнь Хантингтона (HD) является сильным кандидатом для терапии на основе siRNA. Болезнь Хантингтона (HD) возникает в результате увеличения цитозин-аденин-гуанин (CAG) повторов, кодирующих polyQ в пораженном заболеванием белке. Расширение полиглютаминовых (polyQ) областей наделяет мутантный белок доминантным свойством токсичности, которое связано с аберрантным накоплением пораженного заболеванием белка в нейронах. Болезнь Хантингтона (HD) является прогрессирующим, в конечном итоге фатальным нарушением, которое обычно начинается в зрелом возрасте. Экспансия CAG-повторов/polyQ-домена наделяет декодированный белок доминантным токсическим свойством. Таким образом, в качестве терапевтической стратегии, попытки понизить экспрессию мутантного генного продукта до клеточной гибели могут быть в высокой степени благоприятным для пациентов.
Молекулы РНК-интерференции (RNAi)
Молекула «РНК-интерференции», «RNAi», «малой интерферирующей РНК» или «короткой интерферирующей РНК», или «siRNA», или «короткой шпилечной РНК» или «shRNA», или «miRNA» представляет собой РНК-дуплекс нуклеотидов, который направленно воздействует на представляющую интерес нуклеотидную последовательность, например, хантингтин (htt). Используемый здесь термин «siRNA» является родовым термином, который охватывает поднабор shRNAs и miRNAs. «РНК-дуплекс» относится к структуре, образованной путем комплементарного спаривания между двумя областями молекулы РНК. siRNA «направленно воздействует» на ген в нуклеотидной последовательности части дуплекса siRNA, которая комплементарна нуклеотидной последовательности целевого гена. В некоторых вариантах осуществления siRNA направленно воздействуют на последовательность, кодирующую атаксин-1 или хантингтин. В некоторых вариантах осуществления длина дуплекса siRNA составляет менее чем 30 пар оснований. В некоторых вариантах осуществления дуплекс может иметь длину 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11 или 10 пар оснований. В некоторых вариантах осуществления длина дуплекса составляет от 19 до 25 пар оснований. В некоторых вариантах осуществления длина дуплекса составляет от 19 до 21 пары оснований. Часть РНК-дуплекса siRNA может являться частью шпилечной структуры. Дополнительно к части дуплекса, шпилечная структура может содержать петлевую часть, расположенную между двумя последовательностями, которые формируют дуплекс. Петля может варьировать по длине. В некоторых вариантах осуществления петля имеет длину 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов. В некоторых вариантах осуществления петля имеет длину 18 нуклеотидов. Шпилечная структура также может содержать выступающие выступающие части 3'-конце и/или 5'-конце. В некоторых вариантах осуществления выступ представляет собой 3'-выступ и/или 5'-выступ длиной 0, 1, 2, 3, 4 или 5 нуклеотидов.
Единица транскрипции «shRNA» состоит из смысловых и антисмысловых последовательностей, соединенных петлей из непарных нуклеотидов. shRNA экспортируются из ядра с помощью белка экспортина-5 (Exportin-5) и после того как оказываются в цитоплазме процессируются дайсером с образованием функциональных siRNA. «miRNA» типа «петля-на-стебле» состоят из смысловых и антисмысловых последовательностей, соединенных петлей из непарных нуклеотидов, обычно экспрессирующихся как часть более крупных первичных транскриптов (pri-miRNA), которые вырезаются комплексом Drosha-DGCR8 с образованием промежуточных форм, известных как pre-miRNA, которые затем экспортируются из ядер с помощью белка экспортина-5, и после того как оказываются в цитоплазме процессируются дайсером с образованием функциональных siRNA. Термины «искусственная miRNA» или «шаттл-вектор, содержащий искусственную miRNA», используемые здесь взаимозаменяемо, относятся к первичному транскрипту miRNA, который имеет область дуплекса «петля-на-стебле» (по меньшей мере около 9-20 нуклеотидов), которая вырезана путем процессинга с помощью Drosha и Dicer, заменена на последовательности siRNA для целевого гена, при этом сохраняя структурные элементы в пределах петли-на-стебле, необходимые для эффективного процессинга с помощью Drosha. Термин «искусственный» происходит из того факта, что фланкирующие последовательности (~35 нуклеотидов выше (в 3'-направлении) и ~40 нуклеотидов ниже (в 5'-направлении)) образуются из сайтов рестрикции фермента в пределах сайта множественного клонирования siRNA. Используемый здесь термин «miRNA» охватывает природные последовательности miRNA, а также искусственно созданные шаттл-векторы, содержащие miRNA.
siRNA может быть кодирована нуклеотидной последовательностью и указанная нуклеотидная последовательность также может включать промотор. Нуклеотидная последовательность может также включать сигнал полиаденилирования. В некоторых вариантах осуществления сигнал полиаденилирования представляет собой синтетический минимальный сигнал полиаденилирования или последовательность из шести Ts.
«Нецелевая токсичность» относится к вредным, нежелательным или незапланированным фенотипическим изменениям клетки-хозяина, которая экспрессирует или содержит siRNA. Нецелевая токсичность может привести к утрате желательной функции, приобретению нежелательной функции или даже гибели на клеточном или организменном уровне. Нецелевая токсичность может возникнуть сразу же после экспрессии siRNA или постепенно со временем. Нецелевая токсичность может возникнуть как прямой результат экспрессии siRNA, или как результат индукции иммунного ответа хозяина на клетку, экспрессирующую siRNA. Без привязки к какой-либо теории полагают, что нецелевая токсичность возникает из-за высоких уровней или переизбытка субстратов RNAi в клетке. Эти избыточные или сверхэкспрессирующие субстраты RNAi, включая, без ограничения, субстраты pre- или pri RNAi, а также избыточные зрелые антисмысловые РНК, могут конкурировать за эндогенный механизм RNAi, разрушая, таким образом, природный биогенез и функцию miRNA. Нецелевая токсичность может также возникать в результате повышенной вероятности сайленсинга незапланированных mRNA (то есть нецелевых) вследствие частичной комплементарности последовательности. Нецелевая токсичность может также возникать в результате ненадлежащего смещения цепи ненаправляющей области, таким образом, что существует преимущественная нагрузка ненаправляющей области по сравнению с направляющей областью RNAi. Нецелевая токсичность может также возникать в результате стимуляции клеточных ответов на dsRNA, которые включают dsRNA (IFN-b, PKR, OAS1). «Пониженная нецелевая токсичность» относится к уменьшению, сокращению, аннулированию или ослаблению нецелевой токсичности, таким образом, что терапевтический эффект является более благоприятным для хозяина, чем токсичность, которая является ограничивающей или пагубной, как оценено по улучшенной продолжительности или качеству жизни, или улучшенному признаку или симптому заболевания или состояния, подвергнутого направленному воздействию siRNA. Используемое выражение «ограниченная нецелевая токсичность» или «низкая нецелевая токсичность» относится к незапланированным нежелательным фенотипическим изменениям в клетке или организме, обнаруживаемым или необнаруживаемым, которые не устраняют или не сводят на нет, или не ограничивают терапевтический эффект для хозяина, получавшего лечение с помощью siRNA, и могут рассматриваться как «побочный эффект» терапии. Пониженная или ограниченная нецелевая токсичность может быть определена или спрогнозирована путем сравнения анализа in vitro, такого как Нозерн-блоттинг или QPCR, в отношении уровней субстратов siRNA, или эффектов in vivo, сравнивающих эквивалентный shRNA-вектор с шаттл-вектором, содержащим miRNA, согласно настоящему изобретению.
«Нокдаун», «технология нокдауна» относится к технологии сайленсинга гена, в которой экспрессия целевого гена является сниженной по сравнению с экспрессией гена до введения siRNA, что может привести к ингибированию продукции целевого генного продукта. Используемый здесь термин "сниженная» означает, что экспрессия целевого гена является сниженной на 1-100%. Другими словами, количество РНК, доступное для трансляции в полипептид или белок, является сокращенным до минимума. Например, количество белка может быть снижено на 10, 20, 30, 40, 50, 60, 70, 80, 90, 95 или 99%. В некоторых вариантах осуществления экспрессия является сниженной примерно на 90% (то есть только около 10% белка наблюдается в клетке по сравнению с клеткой, в которую молекулы siRNA не были введены). Нокладун экспрессии гена может быть направлен путем использования dsRNA или siRNA.
«Интерференция РНК (RNAi)» представляет собой процесс последовательность-специфического посттранскрипционного сайленсинга генов, опосредованный малыми интерферирующими РНК (siRNA). Во время RNAi, siRNA индуцирует деградацию целевой мРНК путем последовательного последовательность-специфического ингибирования экспрессии генов.
В соответствии со способом согласно настоящему изобретению экспрессия хантингтина может быть модифицирована посредством RNAi. Например, накопление хантингтина может быть подавлено в клетке. Термин «подавление» относится к ослаблению, снижению или устранению по числу или количеству транскриптов, присутствующих в конкретной клетке. Например, накопление мРНК, кодирующей хантингтин, может быть подавлено в клетке путем РНК-интерференции (RNAi), например, ген является выключенным последовательность-специфической двухцепочечной РНК (dsRNA), которая также называется короткой интерферирующей РНК (siRNA). Эти (siRNA) могут представлять собой две отдельные молекулы РНК, которые гибридизованы вместе, или они могут представлять собой одну шпилькообразную структуру, в которой две части молекулы РНК гибридизованы вместе с формированием дуплекса.
Мутантный белок относится к белку, кодируемому геном, несущим мутацию, например, миссенс-мутацию или несмысловую мутацию в хантингтине. Мутантный хантингтин может вызывать заболевание, то есть может привести к заболеванию, связанному с присутствием хантингтина у животного, несущего один или два мутантных аллеля.
Термин «ген» широко используется для обозначения любого сегмента нуклеиновой кислоты, связанного с биологической функцией. Таким образом, ген включает в себя кодирующие последовательности и/или регуляторные последовательности, необходимые для их экспрессии. Например, «ген» относится к фрагменту нуклеиновой кислоты, который экспрессирует мРНК, функциональную РНК или специфический белок, включая регуляторные последовательности. «Гены» также включают неэкспрессирующиеся сегменты ДНК, например, образуют последовательности узнавания для других белков. «Гены» могут быть выделены из различных источников, включая клонирование из представляющего интерес источника или синтез исходя из известной или предсказанной информации о последовательности, и могут включать последовательности, разработанные таким образом, чтобы содержать желательные параметры. «Аллель» представляет собой одну из нескольких альтернативных форм гена, занимающий данный локус на хромосоме.
Термин «нуклеиновая кислота» относится к дезоксирибонуклеиновой кислоте (ДНК) или рибонуклеиновой кислоте (РНК) и ее полимерам в одноцепочечной или двухцепочечной форме, состоящим из мономеров (нуклеотидов), содержащих сахар, фосфат и основание, которое представляет собой пурин или пиримидин. Если не оговорено особо, термин охватывает нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, которые обладают такими же свойствами связывания, как и референсная нуклеиновая кислота и подвергаются метаболизму в соответствии с таким же механизмом, как и природные нуклеотиды. Если не оговорено особо, то конкретная нуклеотидная последовательность также, безусловно, охватывает ее обратимо модифицированные варианты (например, замены вырожденных кодонов) и комплементарные последовательности, а также конкретно указанную последовательность. В частности, замены вырожденных кодонов могут быть осуществлены путем генерирования последовательностей, в которых один или более выбранных (или всех) кодонов в третьем положении заменены смешанными основаниями и/или дезоксиинозиновыми остатками. «Фрагмент нуклеиновой кислоты» представляет собой часть заданной молекулы нуклеиновой кислоты.
«Нуклеотидная последовательность» представляет собой полимер ДНК или РНК, которая может быть одноцепочечной или двухцепочечной, необязательно содержащей синтетические неприродные или измененные нуклеотидные основания, способные встраиваться в полимеры ДНК или РНК.
Термины «нуклеиновая кислота», «молекула нуклеиновой кислоты», «фрагмент нуклеиновой кислоты», «последовательность или сегмент нуклеиновой кислоты» или «полинуклеотид» используются взаимозаменяемо и могут также быть использованы взаимозаменяемо с геном, кДНК, ДНК и РНК, кодируемую геном.
Изобретение охватывает выделенную или по существу очищенную нуклеиновую кислоту, молекулы нуклеиновой кислоты и композиции, содержащие эти молекулы. В контексте настоящего изобретения «выделенная» или «очищенная» молекула ДНК или молекула РНК представляет собой молекулу ДНК или молекулу РНК, которая существует независимо от своего природного окружения и, следовательно, не является природным продуктом. Выделенная молекула ДНК или молекула РНК может существовать в очищенной форме или может существовать в неприродном окружении, таком как, например, трансгенная клетка-хозяин. Например, «выделенная» или «очищенная» молекула нуклеиновой кислоты или ее биологически активная часть по существу не содержит другой клеточный материал или клеточную среду в случае получения рекомбинатными способами, или по существу не содержит химических предшественников или других химических веществ в случае химического синтеза. В одном варианте осуществления «выделенная нуклеиновая кислота» не содержит последовательностей, которые в природе фланкируют нуклеиновую кислоту (то есть последовательностей, расположенных на 5'- и 3'-концах нуклеиновой кислоты) в геномной ДНК организма, являющегося источником нуклеиновой кислоты. Например, в различных вариантах осуществления, выделенная молекула нуклеиновой кислоты может содержать менее чем около 5 kb (т.п.н.), 4 kb, 3 kb, 2 kb, 1 kb, 0,5 kb или 0,1 kb нуклеотидных последовательностей, которые в природе фланкируют молекулу нуклеиновой кислоты в геномной ДНК клетки, являющейся источником нуклеиновой кислоты. Фрагменты и варианты раскрытых нуклеотидных последовательностей также охвачены настоящим изобретением. Термин «фрагмент» или «часть» означает полную длину или менее чем полную длину нуклеотидной последовательности.
Термины «природная», «нативная» или «дикого типа» используют для описания объекта, который может быть обнаружен в природе, отличающийся от полученного искусственным путем. Например, белковая или нуклеотидная последовательность, присутствующая в организме (включая вирус), которая может быть выделена из природного источника и которая не была специально модифицирована человеком в лаборатории, является природной.
«Вариант» молекулы представляет собой последовательность, которая является по существу сходной с последовательностью нативной молекулы. Для нуклеотидных последовательностей варианты включают такие последовательности, которые вследствие вырождения генетического кода кодируют идентичную аминокислотную последовательность нативного белка. Природные аллельные варианты представляют собой такие варианты, которые могут быть идентифицированы с помощью методов молекулярной биологии, таких как, например, полимеразная цепная реакция (PCR) и методы гибридизации. Вариантные нуклеотидные последовательности также включают синтетически полученные нуклеотидные последовательности, такие как последовательности, генерированные, например, путем использования сайт-направленного мутагенеза, которые кодируют нативный белок, а также такие, которые кодируют полипептид, имеющий аминокислотные замены. В целом, варианты нуклеотидной последовательности согласно изобретению будут по меньшей мере на 40%, 50%, от 60% до 70%, например, на 71%, 72%, 73%, 74%, 75%, 76%, 77%, от 78% до 79%, как правило, по меньшей мере на 80%, например, 81%-84%, по меньшей мере на 85%, например, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, от 97% до 98% идентичны нативной (эндогенной) нуклеотидной последовательности.
«Трансген» относится к гену, который был встроен в геном путем трансформации. Трансгены включают, например, ДНК, которая является гетерологичной или гомологичной ДНК конкретной клетки, подлежащей трансформации. Кроме того, трансгены могут включать нативные гены, вставленные в ненативный организм или химерные гены.
Термин «эндогенный ген» относится к нативному гену в его природной локализации в геноме организма.
Термин «белок», «пептид» и «полипептид» используются взаимозаменяемо в настоящем документе.
«Дикого типа» относится к нормальному гену или организму, обнаруживаемому в природе.
«Геном» относится к полному генетическому материалу организма.
Термин «вектор» включает, в частности, любой вирусный вектор, а также любую плазмиду, космиду. фаг или бинарный вектор в двухцепочечной или одноцепочечной линейной или кольцевой форме, который может являться или не являться самопередающимся или мобилизуемый, и который может трансформировать прокатиотического или эукариотического хозяина либо путем интеграции в геном клетки, либо существовать внехромосомно (например, автономно реплицирующаяся плазмида, содержащая точку начала репликации).
Используемый здесь термин «экспрессионная кассета» означает нуклеотидную последовательность, способную направлять экспрессию определенной нуклеотидной последовательности в надлежащую клетку-хозяина, содержащую промотор, оперативно связанный с представляющей интерес нуклеотидной последовательностью, которая оперативно связана с сигналами терминации. Кодирующая область обычно кодирует представляющую интерес функциональную РНК, например, siRNA. Экспрессионная кассета, содержащая представляющую интерес нуклеотидную последовательность, может быть гибридной. Экспрессионная кассета может также представлять собой экспрессионную кассету, которая, хотя и встречается в природе, была получена в рекомбинантной форме, пригодной для гетерологичной экспрессии. Экспрессия нуклеотидной последовательности в экспрессионной кассете может находиться под контролем конститутивного промотора или регулируемого промотора, который начинает транскрипцию только после того, как клетка-хозяин подвергается действию определенного внешнего раздражителя. В случае многоклеточного организма промотор также может быть специфичным для определенной ткани, органа или стадии развития.
Такие экспрессионные кассеты могут включать область инициации транскрипции, связанную с представляющей интерес нуклеотидной последовательностью. Такая экспрессионная кассета содержит множество сайтов рестрикции для вставки представляющего интерес гена, чья транскрипция будет находиться под управлением регуляторных областей. Кассета экспрессии может дополнительно содержать селектируемые маркерные гены.
«Кодирующая последовательность» относится к последовательности ДНК или РНК, которая кодирует специфическую аминокислотную последовательность. Она может составлять «непрерывную кодирующую последовательность», то есть лишенную интрона, например как в кДНК, или может включать один или несколько интронов, связанных соответствующими границами сплайсинга. «Интрон» представляет собой последовательность РНК, которая содержится в первичном транскрипте, но удалена посредством расщепления и повторного лигирования РНК в пределах клетки для создания зрелой мРНК, которая может быть транслирована в белок.
Термин «открытая рамка считывания» (ORF) относится к последовательности между кодонами инициации трансляции и терминации кодирующей последовательности. Термины «кодон инициации» и «кодон терминации» относятся к звену из трех соседних нуклеотидов («кодон») в кодирующей последовательности, которое определяет инициацию и терминацию цепи, соответственно, белкового синтеза (трансляция мРНК).
«Функциональная РНК» относится к смысловой РНК, антисмысловой РНК, рибозимной РНК, siRNA или другой РНК, которая может быть нетранслируемой, но при этом влиять по меньшей мере на один клеточный процесс.
Термин «РНК-транскрипт» или «транскрипт» относится к продукту, получаемому в результате катализируемой РНК-полимеразой транскрипции последовательности ДНК. В том случае, когда РНК-транскрипт является точной комплементарной копией последовательности ДНК, его называют первичным транскриптом, или РНК-транскрипт может представлять собой последовательность РНК, полученную в результате посттранскрипционного процессинга первичного транскрипта, и его называют зрелой РНК. «Матричная РНК» (мРНК) относится к РНК, которая не имеет интронов и которая может быть транслирована клеткой с образованием белка.
«кДНК» относится к одноцепочечной или двухцепочечной ДНК, которая комплементарна и синтезируется на матрице мРНК.
«Регуляторные последовательности» представляют собой нуклеотидные последовательности, расположенные выше (5'-некодирующие последовательности) в пределах или ниже (3'-некодирующие последовательности) кодирующей последовательности, которые влияют на транскрипцию, процессинг или стабильность РНК, или трансляцию связанной кодирующей последовательности. Регуляторные последовательности включают усилители, промоторы, лидерные последовательности трансляции, интроны и последовательности распознавания полиаденилирования. Они включают природные и синтетические последовательности, а также последовательности, которые могут представлять собой комбинацию синтетической и природной последовательностей. Как отмечается в настоящем документе, термин «подходящие регуляторные последовательности» не ограничиваются промоторами. Однако некоторые подходящие регуляторные последовательности, полезные в настоящем изобретении, буду включать, но без ограничения, конститутивные промоторы, тканеспецифические промоторы, эволюционно-специфические промоторы, регулируемые промоторы и вирусные промоторы.
«5'-некодирующая последовательность» относится к нуклеотидной последовательности, расположенной в 5'-направлении (выше) от кодируемой последовательности. Она присутствует в полностью процессированной мРНК в 5'-направлении от кодона инициации и может оказывать влияние на процессинг первичного транскрипта мРНК, стабильность мРНК или эффективность трансляции.
«3'-некодирующая последовательность» относится к нуклеотидной последовательности, расположенной в направлении 3' (ниже) от кодируемой последовательности и может включать узнаваемые последовательности полиаденилирования и другие последовательности, кодирующие регуляторные сигналы, способные влиять на процессинг мРНК или экспрессию генов. Сигнал полиаденилирования обычно характеризуют по влиянию добавления участков полиадениловой кислоты к 3'-концу предшественника мРНК.
Термин «лидерная последовательность трансляции» относится к части последовательности ДНК гена между промотором и кодирующей последовательностью, которая транскрибируется в РНК и присутствует в полностью процессированной мРНК выше (5') кодона начала трансляции. Лидерная последовательность трансляции может влиять на процессинг первичного транскрипта мРНК, стабильность мРНК или эффективность трансляции.
Термин «зрелый» белок относится к посттрансляционно процессированному полипептиду без его сигнального пептида. Белок-«предшественник» относится к первичному продукту трансляции мРНК. «Сигнальный пептид» относится к амино-концевому удлинению полипептида, которое транслируется в сочетании с полипептидом, образуя предшественник пептида, и которое требуется для его вхождения на секреторный путь. Термин «сигнальная последовательность» относится к нуклеотидной последовательности, которая кодирует сигнальный пептид.
«Промотор» относится к нуклеотидной последовательности, обычно расположенной выше (5') от его кодирующей последовательности, который направляет и/или контролирует экспрессию кодирующей последовательности путем обеспечения узнавания РНК-полимеразой и других факторов, необходимых для надлежащей транскрипции. «Промотор» включает минимальный промотор, который представляет собой короткую последовательность ДНК, состоящую из ТАТА-бокса и других последовательностей, которые служат для определения сайта инициации транскрипции, к которой добавляются регуляторные элементы для контроля экспрессии. «Промотор» также относится к нуклеотидной последовательности, содержащей минимальный промотор и регуляторные элементы, которая способна контролировать экспрессию кодирующей последовательности или функциональную РНК. Этот тип последовательности промотора состоит из проксимальных и более удаленных элементов в 5'-направлении, которые часто называют энхансерами. Таким образом, «энхансер» представляет собой последовательность ДНК, которая может стимулировать активность промотора, и может представлять собой естественный элемент промотора или гетерологичный элемент, введенный для повышения уровня или тканеспецифичности промотора. Энхансер способен функционировать в обеих ориентациях (нормальной или перевернутой), и способен даже функционировать, если он расположен в 5'-направлении или 3'-направлении относительно промотора. Оба энхансера и другие расположенные в 5'-направлении элементы промотора специфично в отношении последовательности связывают ДНК-связывающие белки, которые опосредуют их эффекты. Промоторы могут целиком происходить из нативного гена или состоять из различных элементов, происходящих из различных промоторов, существующих в природе, или даже включать синтетические сегменты ДНК. Промотор может также содержать последовательности ДНК, которые вовлечены в связывание белковых факторов, контролирующих эффективность инициации транскрипции в ответ на физиологические или эволюционные условия. Примеры промоторов, которые могут быть использованы в настоящем изобретении, включают РНК-промоторы U6 мыши, синтетические РНК-промоторы H1 человека, промоторы для РНК-полимеразы II и РНК-полимеразы III SV40, CMV, RSV.
«Сайт инициации» представляет собой положение, окружающее первый нуклеотид, который является частью транскрибируемой последовательности, которая также определяется как положение +1. Относительно этого сайта пронумерованы все другие последовательности гена и его контрольные области. Последовательности в 3'-направлении (то есть другие кодирующие белок последовательности в 3'-направлении) обозначены как положительные, тогда как последовательности в 5'-направлении (в основном контролирующие области в 5'-направлении) обозначены как отрицательные.
Элементы промотора, в частности, ТАТА-элемент, которые являются неактивными или которые в значительной степени снижают промоторную активность в отсутствии активации против хода транскрипции, называются «минимальными или коровыми промоторами». В присутствии подходящего фактора транскрипции минимальный промотор функционирует, обеспечивая транскрипцию. «Минимальный или коровый промотор», таким образом, состоит только из всех исходных элементов, необходимых для инициации транскрипции, например, ТАТА-бокса и/или инициатора.
«Конститутивная экспрессия» относится к экспрессии с использованием конститутивного или регулируемого промотора. «Условная» и «регулируемая экспрессия» относится к экспрессии, контролируемой регулируемым промотором.
«Оперативно связанный» относится к связи нуклеотидных последовательностей на одиночном фрагменте нуклеиновой кислоты, так что функция одной из последовательностей находится под влиянием другой. Например, регуляторная последовательность ДНК считается «оперативно связанной» или «ассоциированной» с последовательностью ДНК, которая кодирует РНК или полипептид, если две последовательности расположены таким образом, что регуляторная последовательность ДНК влияет на экспрессию кодирующей последовательности ДНК (то есть, когда кодирующая последовательность или функциональная РНК находится под транскрипционным контролем промотора). Кодирующие последовательности могут быть оперативно связаны с регуляторными последовательностями в смысловой или антисмысловой ориентации.
«Экспрессия» относится к транскрипции и/или трансляции эндогенного гена, гетерологичного гена или сегмента нуклеиновой кислоты, или трансгена в клетках. Например, в случае конструкций siRNA экспрессия может относиться к транскрипции только siRNA. Кроме того, экспрессия относится к транскрипции и стабильному накоплению смысловой (мРНК) или функциональной РНК. Экспрессия может также относиться к продукции белка.
«Измененные уровни» относятся к уровню экспрессии в трансгенных клетках или организмах, которая отличается от уровня экспрессии в нормальных или нетрансформированных клетках или организмах.
«Сверхэкспрессия» относится к уровню экспрессии в трансгенных клетках или организмах, который превышает уровни экспрессии в нормальных или нетрансформированных клетках или организмах.
«Ингибирование антисмысловой молекулы» относится к продукции антисмысловых транскриптов РНК, способных подавлять экспрессию белка из эндогенного гена или трансгена.
«Фрагмент остановки транскрипции» относится к нуклеотидным последовательностям, которые содержат один или несколько регуляторных сигналов, таких как последовательности сигнала полиаденилирования, способные прекращать транскрипцию. Примеры включают 3'-нерегуляторные области генов, кодирующих нопалинсинтазу и малую субъединицу рибулозобифосфаткарбоксилазы.
«Фрагмент остановки трансляции» относится к нуклеотидным последовательностям, которые содержат один или несколько кодонов терминации во всех трех рамках, способных прекращать трансляцию. Вставка фрагмента остановки трансляции в непосредственной близости или рядом с ко доном инициации на 5'-конце кодирующей последовательности будет приводить к отсутствию трансляции или ненадлежащей трансляции. Вырезание фрагмента остановки трансляции путем сайт-специфической рекомбинации будет оставлять сайт-специфическую последовательность в кодирующей последовательности, которая не препятствует надлежащей трансляции с использованием кодона инициации.
Термины «цис-действующая последовательность» и «цис-действующий элемент» относятся к последовательностям ДНК и РНК, функции которых требуют, чтобы они находились на одной и той же молекуле. Примером цис-действующей последовательности на репликон является репликация вирусного происхождения.
Термины «транс-действующая последовательность» и «транс-действующий элемент» относятся к последовательностям ДНК или РНК, чьи функции не требуют их нахождения на одной и той же молекуле.
«Хромосомно-интегрированный» относится к интеграции чужеродного гена или конструкции нуклеиновой кислоты в ДНК хозяина при помощи ковалентных связей. Там, где гены не являются «хромосомно-интегрированными», они могут быть «транзиентно экспрессируемыми». Транзиентная экспрессия гена относится к экспрессии гена, который не интегрирован в хромосому хозяина, но функционирует независимо, либо как часть автономно реплицирующейся плазмиды или кассеты экспрессии, например, или как часть другой биологической системы, такой как вирус.
Следующие термины используются для описания взаимной связи между двумя или более нуклеиновыми кислотами или полинуклеотидами в последовательности: (а) «референсная последовательность», (b) «окно сравнения», (с) «идентичность последовательностей», (d) «процент идентичности последовательностей» и (с) «по существу идентичная».
(a) Используемая здесь «референсная последовательность» представляет собой установленную последовательность, используемую в качестве основы для сравнения последовательностей. Референсная последовательность может представлять собой поднабор или полную указанную последовательность; например, сегмент полноразмерной последовательности кДНК или гена, или полная последовательность кДНК или гена.
(b) Используемое здесь «окно сравнения» ссылается на непрерывный и установленный сегмент полинуклеотидной последовательности, при этом полинуклеотидная последовательность в окне сравнения может содержать добавки или делеции (то есть гэпы) по сравнению с референсной последовательностью (которая не содержит добавки или делеции) для оптимального выравнивания двух последовательностей. Как правило, окно сравнения содержит по меньшей мере 20 непрерывных нуклеотидов в длину и необязательно может иметь длину 30, 40, 50, 100 или более нуклеотидов. Специалистам в данной области будет понятно, что для того, чтобы избежать высокого сходства с референсной последовательностью за счет введения гэпов в полинуклеотидную последовательность, обычно вводят штраф за пропуск в последовательности и вычитают из числа совпадений.
Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Таким образом, определение процентной идентичности между двумя последовательностями может быть выполнено с применением математического алгоритма.
Компьютерные реализации этих математических алгоритмов могут быть использованы для сравнения последовательностей для определения идентичности последовательностей. Такие реализации включают, но без ограничения: CLUSTAL в составе программы PC/Gene (доступной от фирмы Intelligenetics, Mountain View, California); программу ALIGN (версия 2.0) и GAP, BESTFIT, BLAST, FASTA, и TFASTA в составе пакете программного обеспечения Wisconsin Genetics Software Package, версия 8 (доступной от фирмы Genetics Computer Group (GCG), 575 Science Drive, Madison, Wisconsin, USA). Выравнивание с использованием этих программ может быть выполнено с использованием параметров по умолчанию.
Программное обеспечение для осуществления анализов с помощью BLAST может быть предоставлено Национальным центром биотехнологической информации (National Center for Biotechnology Information). В этом алгоритме сначала производится идентификация пар последовательностей с высокими баллами (HSP) путем идентификации коротких «слов» длины W в запрашиваемой последовательности, которые или совпадают, или удовлетворяют определенной положительной пороговой оценке (баллу) Т при сравнении со «словом» такой же длины в последовательности из базы данных. Т называется пороговой оценкой (баллом) близкого «слова». Эти исходные совпадения близких «слов» используются в качестве «затравки» для инициации поиска, предназначенного для нахождения включающих эти «слова» более длинных HSP. Затем выборки «слова» удлиняются в обоих направлениях вдоль каждой последовательности до тех пор, пока может происходить увеличение кумулятивного (накопительного) балла при сравнительном анализе. Кумулятивные баллы для нуклеотидных последовательностей вычисляют с использованием параметров М (призовой балл за пару совпадающих остатков; всегда >0) и N (штрафной балл за несовпадающие остатки; всегда <0). Для аминокислотных последовательностей для вычисления кумулятивного балла используют матрицу баллов. Удлинение совпадающих «слов» в каждом направлении прекращается в том случае, если кумулятивный балл при сравнительном анализе снижается на величину X от своего максимально достигнутого значения; если кумулятивный балл снижается до нуля или ниже из-за накопления одного или нескольких отрицательных баллов при сравнительном анализе остатков, или если достигается конец какой-либо последовательности.
В дополнение к вычислению процентной идентичности последовательностей алгоритм BLAST также производит статистический анализ сходства двух последовательностей. Одним из критериев степени сходства, который позволяет получать алгоритм BLAST, является наименьшая суммарная вероятность (P(N)), которая характеризует вероятность, с которой может произойти случайным образом совпадение между двумя нуклеотидными последовательностями. Например, считается, что тестируемая нуклеотидная последовательность является сходной с референсной последовательностью, если наименьшая суммарная вероятность при сравнении тестируемой нуклеотидной последовательности с референсной нуклеотидной последовательностью меньше приблизительно 0,1, более предпочтительно меньше приблизительно 0,01, и наиболее предпочтительно меньше приблизительно 0,001.
Для получения выравниваний с разрывами в целях сравнения может быть использован Gapped BLAST (в BLAST 2.0). Альтернативно, для осуществления повторного поиска может быть использован PSI-BLAST (в BLAST 2.0), выявляющий отдаленное родство молекул. При использовании программ BLAST, Gapped BLAST, PSI-BLAST могут быть использованы параметры по умолчанию для указанных программ (например, BLASTN для нуклеотидных последовательностей). В программе BLASTN (для нуклеотидных последовательностей) по умолчанию применяются длина слова (W), равная 11, ожидание (Е), равное 10, уровень отсечения, равный 100, М=5, N=-4, и сравнение обеих цепей. Выравнивание может быть также выполнено вручную путем просмотра.
Для целей настоящего изобретения сравнение нуклеотидных последовательностей для определения процентной идентичности последовательностей с последовательностями промотора, описанными здесь, предпочтительно осуществляют с использованием программы BlastN (версия 1.4.7 или более поздняя) с применением параметров по умолчанию или любой эквивалентной программы. Под «эквивалентной программой» подразумевают любую программу сравнения последовательностей, которая для любых двух исследуемых последовательностей производит выравнивание, имеющее идентичные совпадения нуклеотидных остатков и идентичный процент сходства последовательностей по сравнению с соответствующим выравниванием, произведенным предпочтительной программой.
(c) Применяемый здесь термин «идентичность последовательности» или «идентичность» в контексте двух последовательностей нуклеиновой кислоты относится к определенному проценту нуклеотидов в двух последовательностях, которые совпадают при выравнивании с максимальным соответствием посредством конкретного окна сравнения, измеренному с помощью алгоритмов сравнения последовательностей или путем визуального наблюдения.
(d) Применяемый здесь термин «процент идентичности последовательностей» означает величину, определяемую путем сравнения двух оптимальным образом выровненных последовательностей в окне сравнения, где фрагмент полинуклеотидной последовательности в окне сравнения может иметь добавления или делеции (то есть гэпы) по отношению к референсной последовательностью (которая не имеет добавлений или делеций) для оптимального выравнивания двух последовательностей. Процент рассчитывают путем определения количества положений, в которых в обеих последовательностях встречается идентичное нуклеотидное основание или идентичный аминокислотный остаток, в результате чего получают количество совпадающих положений, деления количества совпадающих положений на общее количество положений в окне сравнения, и умножения результата на 100 для получения процента идентичности последовательностей.
(е) Термин «по существу идентичные» полинуклеотидные последовательности означает, что полинуклеотид включает последовательность, которая по меньшей мере на 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78% или 79%, предпочтительно по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88% или 89%, более предпочтительно по меньшей мере на 90%, 91%, 92%, 93% или 94%, и более всего предпочтительно по меньшей мере на 95%, 96%, 97%, 98% или 99% идентична референсной последовательности, что устанавливают с использованием одной из описанных программ для выравнивания с применением стандартных параметров.
Другим признаком того, что нуклеотидные последовательности являются по существу идентичными, является то, что две молекулы гибридизуются друг с другом в жестких условиях. Как правило, жесткие условия выбирают так, чтобы они были приблизительно на 5°C ниже, чем температура плавления (Tm) для конкретной последовательности при определенной ионной силе и значении pH. Однако жесткие условия охватывают температуры в диапазоне примерно от 1°C до 20°C в зависимости от желаемой степени жесткости, как оговаривается в настоящем документе.
При сравнении последовательностей, как правило, одна последовательность представляет собой референсную последовательность, с которой сравнивают тестируемые последовательности. При использовании алгоритма сравнения данные о тестируемой последовательности и референсной последовательности вводят в компьютер, затем задают координаты подпоследовательности и параметры алгоритмической программы сравнения последовательностей. После этого алгоритм сравнения последовательностей рассчитывает на основе параметров программы процент идентичности для тестируемой последовательности(ей) и референсной последовательности.
Как указано в настоящем документе, еще одним указанием на то, что две последовательности нуклеиновых кислот являются по существу идентичными, служит то, что две молекулы гибридизуются друг с другом в жестких условиях. Выражение «гибридизуются специфически с» относится к связыванию, образованию дуплексов или гибридизации молекулы только со специфической нуклеотидной последовательностью в жестких условиях, когда эта последовательность представлена в сложной смеси (например, тотальной клеточной) ДНК или РНК. Понятие «связывается(связываются) по существу» относится к комплементарной гибридизации между нуклеиновой кислотой-зондом и целевой нуклеиновой кислотой, и охватывает незначительные несоответствия, которые могут наблюдаться при уменьшении жесткости среды для гибридизации в целях желательного выявления последовательности целевой нуклеиновой кислоты.
«Жесткие условия гибридизации» и «жесткие условия гибридизационной отмывки» в контексте экспериментов по гибридизации нуклеиновых кислот, таких как гибридизация с использованием Саузерн-блоттинга и Нозерн-блоттинга, находятся в зависимости от последовательности и различаются при различных параметрах окружающей среды. Более длинные последовательности специфически гибридизуются при более высоких температурах. Tm представляет собой температуру (при определенной ионной силе и pH), при которой 50% целевой последовательности гибридизуется с идеально соответствующей пробой. Специфичность, как правило, является функцией постгибридизационных промывок, критическими факторами являются ионная сила и температуру раствора для заключительной промывки. Для гибридов ДНК-ДНК Tm может быть приближена к уравнению: Tm 81,5°C + 16,6 (log М) + 0,41 (%GC) - 0,61 (% форм.) - 500/L; где М представляет собой молярность одновалентных катионов, %GC представляет собой процент нуклеотидов гуанозина и цитозина в ДНК, % форм, представляет собой процент формамида в растворе гибридизации, и L представляет собой длину гибрида в парах азотистых оснований. Tm уменьшается приблизительно на 1°C с каждым 1% несоответствия; таким образом, Tm, условия гибридизации и/или промывки могут быть отрегулированы для гибридизации с последовательностями желательной идентичности. Например, если требуется найти последовательности с  идентичностью, Tm может быть уменьшена на 10°C. Обычно жесткие условия выбирают так, чтобы температура была примерно на 5°C ниже, чем температура плавления (Tm) для специфической последовательности и комплементарной ей при определенной ионной силе и pH. Однако при очень жестких условиях гибридизация и/или промывка могут проводиться при температуре на 1, 2, 3 или 4°C ниже, чем температура плавления (Tm); при умеренно жестких условиях гибридизация и/или промывка могут проводиться при температуре, которая на 6, 7, 8, 9 или 10°C ниже, чем температура плавления (Tm); в условиях низкой жесткости гибридизация и/или промывка могут проводиться при температуре, которая на 11, 12, 13, 14, 15 или 20°C ниже, чем температура плавления (Tm). Применяя уравнение, гибридизации и составы промывки, и желательную Т, специалистам в данной области будет понятно, что разнообразие в жесткости гибридизации и/или растворов промывки по сути описано. Если желательная степень несоответствия приводит к Tm меньше, чем 45°C (водный раствор) или 32°C (формамидный раствор), предпочтительно увеличить концентрацию SSC таким образом, чтобы можно было использовать более высокую температуру. Как правило, высоко жесткие условия гибридизации и промывок выбирают равными примерно на 5°C ниже, чем температура плавления (Tm) для конкретной последовательности при определенной ионной силе и pH.
идентичностью, Tm может быть уменьшена на 10°C. Обычно жесткие условия выбирают так, чтобы температура была примерно на 5°C ниже, чем температура плавления (Tm) для специфической последовательности и комплементарной ей при определенной ионной силе и pH. Однако при очень жестких условиях гибридизация и/или промывка могут проводиться при температуре на 1, 2, 3 или 4°C ниже, чем температура плавления (Tm); при умеренно жестких условиях гибридизация и/или промывка могут проводиться при температуре, которая на 6, 7, 8, 9 или 10°C ниже, чем температура плавления (Tm); в условиях низкой жесткости гибридизация и/или промывка могут проводиться при температуре, которая на 11, 12, 13, 14, 15 или 20°C ниже, чем температура плавления (Tm). Применяя уравнение, гибридизации и составы промывки, и желательную Т, специалистам в данной области будет понятно, что разнообразие в жесткости гибридизации и/или растворов промывки по сути описано. Если желательная степень несоответствия приводит к Tm меньше, чем 45°C (водный раствор) или 32°C (формамидный раствор), предпочтительно увеличить концентрацию SSC таким образом, чтобы можно было использовать более высокую температуру. Как правило, высоко жесткие условия гибридизации и промывок выбирают равными примерно на 5°C ниже, чем температура плавления (Tm) для конкретной последовательности при определенной ионной силе и pH.
Примером промывки в условиях высокой жесткости является 0,15М NaCl при 72°C в течение примерно 15 минут. Примером промывки в жестких условиях является промывка 0,2Х SSC при 65°C в течение 15 минут (описание буфера SSC смотри в Sambrook and Russell 2001). Часто отмывке в жестких условиях предшествует отмывка в условиях низкой жесткости для удаления фонового сигнала пробы. Для коротких нуклеотидных последовательностей (например, примерно от 10 до 50 нуклеотидов), жесткими являются условия, в которых концентрация солей составляет величину меньше чем примерно 1,5 М, более предпочтительно примерно от 0,01 до 1,0 М концентрации ионов Na (или других солей) при pH от 7,0 до 8,3, и температура обычно составляет около 30°C. Жесткие условия также могут быть достигнуты путем добавления дестабилизирующих агентов, например, формамида. Как правило, отношение сигнала к фону, превышающее в 2 (или большее число) раза значение, полученное для несвязанной пробы в конкретном образце для гибридизации, свидетельствует об обнаружении специфической гибридизации. Очень жесткие условия выбирают равными Tm для конкретной молекулы нуклеиновой кислоты.
Очень жесткие условия выбирают равными Tm для конкретной пробы. Примером жестких условий для гибридизации комплементарных нуклеиновых кислот, которые содержат более 100 комплементарных остатков на фильтре при Саузерн- или Нозерн-блоттинге, является 50% формамид, например, гибридизация в 50% формамиде, 1 М NaCl, 1% SDS при 37°C, и промывка в 0,1Х SSC при температуре от 60 до 65°C. Иллюстративные условия гибридизации низкой жесткости включают гибридизацию буферным раствором, содержащим от 30 до 35% формамида, 1 М NaCl, 1% SDS (додецилсульфат натрия) при 37°C, и промывку в 1Х-2Х SSC (20Х SSC = 3,0 М NaCl/0,3 М тринатрия цитрат) при температуре от 50 до 55°C. Пример условий умеренной жесткости включает гибридизация в 40-45% формамиде, 1,0 М NaCl, 1% SDS при 37°C, и промывку в 0,5Х-1Х SSC при температуре от 55 до 60°C.
Термин «трансформация» относится к переносу фрагмента нуклеиновой кислоты в геном клетки-хозяина, что приводит к стабильной наследственности. «Клетка-хозяин» представляет собой клетку, которая была трансформирована или является способной к трансформации с помощью экзогенной молекулы нуклеиновой кислоты. Клетки-хозяева, содержащие трансформированные фрагменты нуклеиновой кислоты, называются как «трансгенные» клетки.
«Трансформированная», «трансдуцированная», «трансгенная» и «рекомбинантная» относятся к клетке-хозяину, в которую была введена гетерологичная молекула нуклеиновой кислоты. Используемый здесь термин «трансфекция» относится к доставке ДНК в эукариотические (например, млекопитающего) клетки. Используемый здесь термин «трансформация» относится к доставке ДНК в прокариотические клетки (например, Е. coli). Используемый здесь термин «трансдукция» относится к инфицированию клеток вирусными частицами. Молекула нуклеиновой кислоты может быть стабильно интегрирована в геном, обычно известный в данной области. Известные способы PCR включают, но без ограничения, способы с использованием спаренных праймеров, вложенных праймеров, единичных специфических праймеров, вырожденных праймеров, ген-специфичных праймеров, вектор-специфичных праймеров, частично «mismatched» праймеров и т.п. Например, «трансформированные», «трансформант» и «трансгенные» клетки прошли через процесс трансформации и содержат чужеродный ген, интегрированный в их хромосому. Термин «нетрансформированные» относится к нормальным клеткам, которые не проходили через процесс трансформации.
«Генетически измененные клетки» означают клетки, которые были модифицированы путем введения рекомбинантных или гетерологичных нуклеиновых кислот (например, одной или нескольких конструкций ДНК или контрпартнеров РНК) и, кроме того, включает потомство таких клеток, которые сохраняют часть или все из таких генетических модификаций.
Используемый здесь термин «полученный» или «направленный на» в отношении нуклеотидной молекулы означает, что молекула обладает идентичностью по комплементарной последовательности с конкретной представляющей интерес молекулой.
siRNA согласно настоящему изобретению может быть генерирована с помощью любого способа, известного в данной области, например, путем транскрипции in vitro, рекомбинантно или с помощью синтетических способов. В одном примере siRNA могут быть генерированы in vitro путем использования рекомбинантного фермента, такого как РНК-полимераза Т7 и олигонуклеотидных ДНК-темплатов.
Молекулы нуклеиновой кислоты согласно изобретению
Термины «выделенная и/или очищенная» относятся к выделению in vitro нуклеиновой кислоты, например, молекулы ДНК или РНК из ее природного клеточного окружения и из ассоциации с другими компонентами клетки, такими как нуклеиновая кислота или полипептид, таким образом, что ее можно подвергнуть секвенированию, репликации и/или экспрессии. РНК или ДНК является «выделенной» в том смысле, что она не содержит по меньшей мере одну контаминирующую нуклеиновую кислоту, с которой она обычно связана в природном источнике РНК или ДНК, и предпочтительно по существу не содержит какой-либо другой РНК или ДНК млекопитающего. Выражение «не содержит по меньшей мере одну контаминирующую исходную нуклеиновую кислоту, с которой она обычно связана» включает случай, когда нуклеиновая кислота повторно вводится в исходную или природную клетку, но находится в другом положении на хромосоме или иным образом фланкирована нуклеотидными последовательностями, обычно не обнаруживаемыми в исходной клетке, например, в векторе или плазмиде.
Дополнительно к ДНК-последовательности, кодирующей siRNA, молекулы нуклеиновой кислоты согласно изобретению включат молекулы двухцепочечной интерферирующей РНК, которые также являются полезными для ингибирования экспрессии целевого гена.
Используемый здесь термин «рекомбинантная нуклеиновая кислота», например, «рекомбинантная ДНК-последовательность или сегмент» относится к нуклеиновой кислоте, например, ДНК, полученной или выделенной из любого подходящего клеточного источника, которая может быть в дальнейшем химически изменена in vitro таким образом, что ее последовательность является неприродной или соответствует природным последовательностям, которые расположены не так, как они были бы расположены в геноме, не трансформированном экзогенной ДНК. Примером предварительно отобранной ДНК, «полученной» из источника, будет являться последовательность ДНК, которая идентифицирована как полезный фрагмент в пределах заданного организма, и которую затем химически синтезируют по существу в чистой форме. Примером такой ДНК, «выделенной» из источника, будет являться полезная последовательность ДНК, которая вырезана или удалена из источника химическими способами, например, путем использования эндонуклеаз рестрикции, так что может быть затем подвергнута манипуляциям, например, амплифицирована с помощью методов генетической инженерии для использования в изобретении. «Рекомбинантная ДНК» включает полиностью синтетические последовательности ДНК, полусинтетические последовательности ДНК, последовательности ДНК, выделенные из биологических источников, и последовательности ДНК, полученные из РНК, а также их смеси.
Экспрессионные кассеты согласно изобретению
Для получения экспрессионных кассет сегмент или последовательность рекомбинантной ДНК может быть циклической или линейной, двухцепочечной или одноцепочечной. Как правило, последовательность или сегмент ДНК находится в форме химерной ДНК, такой как плазмидная ДНК или вектор, который также может содержать кодирующие области, фланкированные контрольными последовательностями, которые способствуют экспрессии рекомбинантной ДНК, присутствующей в конечной трансформированной клетке.
Используемый здесь «химерный» вектор или экспрессионная кассета означает вектор или кассету, включающую последовательности нуклеиновой кислоты по меньшей мере от двух разных видов, или содержащую последовательность нуклеиновой кислоты от одних и тех же видов, которая связана или ассоциирована таким образом, что не существует у «нативных» видов или видов дикого типа.
Помимо рекомбинантных ДНК-последовательностей, которые служат в качестве транскрипционных единиц для РНК-транскрипта, или ее частей, часть рекомбинантной ДНК может быть нетранскрибированной, выполняя регуляторную или структурную функцию. Например, рекомбинантная ДНК может иметь промотор, который является активным в клетках млекопитающего.
Другие элементы, функциональные в клетках-хозяевах, такие как интроны, энхансеры, последовательности полиаденилирования и т.п., также могут являться частью рекомбинантной ДНК. Такие элементы могут являться или не являться необходимыми для функционирования ДНК, но могут обеспечивать улучшенную экспрессию ДНК путем воздействия на транскрипцию, стабильность siRNA или т.п. Такие элементы могут быть включены в ДНК при необходимости для получения оптимального функционирования siRNA в клетке.
Контрольные последовательности представляют собой ДНК-последовательности, необходимые для экспрессии оперативно связанной кодирующей последовательности в конкретном организме-хозяине. Контрольные последовательности, которые являются подходящими для прокариотических клеток, например, включают промотор и необязательно последовательность оператора, и сайт связывания рибосом. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры.
Оперативно связанные нуклеиновые кислоты представляют собой нуклеиновые кислоты, находящиеся в функциональной связи с другой нуклеотидной последовательностью. Например, промотор или энхансер оперативно связан с кодирующей последовательностью, если он воздействует на транскрипцию последовательности; или сайт связывания рибосом оперативно связан с кодирующей последовательностью, если он расположен таким образом, чтобы способствовать трансляции. Как правило, оперативно связанные последовательности ДНК представляют собой последовательности ДНК, которые связаны непрерывно. Однако энхансеры необязательно должны быть непрерывными. Связывание выполняется путем лигирования в подходящих сайтах рестрикции. Если такие сайты не существуют, используют синтетические олигонуклеотидные адапторы или линкеры в соответствии с общепризнанной практикой.
Рекомбинантная ДНК, подлежащая введению в клетки, может содержать селектируемый маркерный ген или репортерный ген, или оба для содействия идентификации и селекции экспрессирующих клеток из популяции клеток, которые подлежат трансфекции или инфицированию посредством вирусных векторов. В других вариантах осуществления селектируемый маркер может быть перенесен на отдельную часть ДНК и использован в процедуре котрансфекции. Селектируемые маркеры и репортерные гены могут быть фланкированы соответствующими регуляторными последовательностями для обеспечения экспрессии в клетках-хозяевах. Полезные селектируемые маркеры известны в данной области и включают, например, устойчивые к антибиотикам гены, такие как neo, и т.п.
Репортерные гены используют для идентификации потенциально трансфицированных клеток и для оценки функциональных свойств регуляторных последовательностей. Репортерные гены, кодирующие легко анализируемые белки, хорошо известны в данной области. Как правило, репортерный ген представляет собой ген, отсутствующий или не экспрессирующийся в организме или ткани реципиента, и кодирующий белок, экспрессия которого обнаруживается по некоторому легко выявляемому свойству, например, ферментативной активности. Например, репортерный ген включает ген хлорамфеникол-ацетилтрансферазы (cat) транспозона Tn9 Е. coli и ген люциферазы огневки Photinus pyralis. Экспрессию репортерного гена оценивают в подходящий момент времени после введения ДНК в клетки реципиента.
Общие способы конструирования рекомбинантной ДНК, которая может трансфицировать целевые клетки, хорошо известны специалистам в данной области, и эти же композиции и способы конструирования могут быть использованы для получения ДНК, полезной в настоящем документе.
Рекомбинантная ДНК может быть легко введена в клетки-хозяева, например, клетки млекопитающего, бактериальные клетки, клетки дрожжей и насекомых путем трансфекции экспрессионным вектором, состоящим из ДНК, кодирующей siRNA, с помощью любой процедуры, используемой для введения в конкретную клетку, например, физических или биологических способов для получения клетки, содержащей рекомбинантную ДНК, стабильно интегрированную в ее геном или существующую в виде эписомального элемента, таким образом, что молекулы ДНК или последовательности согласно настоящему изобретению экспрессируются клеткой-хозяином. Предпочтительно ДНК вводят в клетки-хозяева посредством вектора. Клетка-хозяин предпочтительно имеет эукариотическое происхождение, например, растение, млекопитающее, насекомое, дрожжи или грибы в качестве источника, но также могут быть использованы клетки-хозяева неэукариотического происхождения.
Физические способы введения предварительно выбранной ДНК в клетку-хозяина включают осаждение фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию и т.п. Биологические способы введения представляющей интерес ДНК в клетку-хозяина включают использование вирусных векторов на основе ДНК и РНК. Для генной терапии млекопитающего, как описано здесь ниже, желательно использовать эффективные средства для вставки копии гена в геном хозяина. Вирусные векторы, а особенно ретровирусные векторы применяют в широком спектре процедур по внедрению генов в клетки млекопитающего, например, человека. Другие вирусные векторы могут быть получены из поксвирусов, вируса простого герпеса I, аденовирусов и аденоассоциированных вирусов и т.п. Смотри, например, патенты США 5350674 и 5585362.
Как описано здесь, «трансфицированная» или «трансдуцированная» клетка-хозяин или клеточная линия представляет собой такую клетку-хозяина или клеточную линию, в которой геном был изменен или дополнен по меньшей мере одной гетерологичной или рекомбинантной нуклеотидной последовательностью. Клетки-хозяева согласно настоящему изобретению обычно получают путем трансфекции последовательности ДНК в плазмидный экспрессионный вектор, вирусный экспрессионный вектор или в виде изолированной линейной последовательности ДНК. Трансфицированная ДНК может стать хромосомно интегрированной рекомбинантной последовательностью ДНК, которая состоит из последовательности, кодирующей siRNA.
Для подтверждения присутствия рекомбинантной ДНК-последовательности в клетке-хозяине могут быть выполнены различные анализы. Такие анализы включают, например, «молекулярные биологические» анализы, хорошо известные специалистам в данной области, такие как Саузерн и Нозерн блоттинг, RT-PCR и PCR; «биохимические» анализы, такие как обнаружение присутствия или отсутствия конкретного пептида, например, с помощью иммунологических способов (ELISA и Вестерн-блоты) или с помощью анализов, описанных здесь, для идентификации агентов, подпадающих в объем настоящего изобретения.
Для обнаружения и количественного определения РНК, продуцируемой из введенных сегментов рекомбинантной ДНК, может быть использован анализ методом RT-PCR. В этом применении PCR сначала необходимо обратимо транскрибировать РНК в ДНК с использованием ферментов, таких как обратная транскриптаза, а затем посредством использования стандартных методов PCR амплифицировать ДНК. В большинстве случаев методы PCR, несмотря на свою пользу, не будут демонстрировать целостность продукта РНК. Дополнительная информация о природе продукта РНК может быть получена с помощью Нозерн-блоттинга. Этот метод демонстрирует присутствие видов РНК и дает информацию о целостности этой РНК. Присутствие или отсутствие видов РНК может быть также определено с использованием дот- или слот-блот-Нозерн гибридизаций. Эти методы являются модификациями Нозерн-блоттинга и только демонстрируют присутствие или отсутствие видов РНК.
Несмотря на то, что Саузерн-блоттинг и PCR могут быть использованы для обнаружения интересующего сегмента рекомбинантной ДНК, они не дают информацию об экспрессии предварительно выбранного сегмента ДНК. Экспрессия может быть оценена путем специфической идентификации пептидных продуктов введенных последовательностей рекомбинантной ДНК или оценки фенотипических изменений, привнесенных экспрессией введенного сегмента рекомбинантной ДНК, в клетке-хозяине.
Настоящее изобретение обеспечивает клеточную экспрессионную систему для экспрессии материала экзогенной нуклеиновой кислоты в реципиенте-млекопитающем. Экспрессионная система, также называемая как «генетически модифицированная клетка», содержит клетку и экспрессионный вектор для экспрессии материала экзогенной нуклеиновой кислоты. Генетически модифицированные клетки являются подходящими для введения реципиенту-млекопитающему, где они заменяют эндогенные клетки реципиента. Таким образом, предпочтительные генетически модифицированные клетки являются неиммортализованными и неканцерогенными.
В соответствии с одним вариантом осуществления клетки трансфицировали или иным образом генетически модифицировали ex vivo. Клетки изолировали от млекопитающего (предпочтительно человека), нуклеиновую кислоту вводили (то есть трансдуцировали или трансфицировали in vitro) с помощью вектора для экспрессии гетерологичного (например, рекомбинантного) гена, кодирующего терапевтический агент, а затем вводили реципиенту-млекопитающему для доставки терапевтического агента in situ. Реципиент-млекопитающее может представлять собой человека, и клетки, подлежащие модификации, представляют собой аутологичные клетки, то есть клетки изолированы от реципиента-млекопитающего.
В соответствии с другим вариантом осуществления клетки трансфицировали или трансдуцировали, или иным образом генетически модифицировали in vivo. Клетки от реципиента-млекопитающего трансдуцировали или трансфицировали in vivo с помощью вектора, содержащего материал экзогенной нуклеиновой кислоты, для экспрессии гетерологичного (например, рекомбинантного) гена, кодирующего терапевтический агент, и терапевтический агент доставляли in situ.
Используемый здесь «материал экзогенной нуклеиновой кислоты» относится к нуклеиновой кислоте или олигонуклеотиду, природному или синтетическому, который не обнаруживается естественным образом в клетках; или, если он обнаруживается естественным образом в клетках, является модифицированным из его первоначальной или нативной формы. Таким образом, «материал экзогенной нуклеиновой кислоты» включает, например, неприродную нуклеиновую кислоту, которая может быть транскрибирована в антисмысловую РНК, siRNA, а также "гетерологичный ген» (то есть ген, кодирующий белок, который не экспрессируется или экспрессируется на биологически значимых уровнях в природной клетке такого же типа). Для иллюстрации, синтетический или природный ген, кодирующий человеческий эритропоэтин (ЕРО), будет считаться «материалом экзогенной нуклеиновой кислоты» в отношении человеческих перитонеальных мезотелиальных клеток, поскольку указанные клетки по своей природе не экспрессируют ЕРО. Еще одним примером «материала экзогенной нуклеиновой кислоты» является введение только части гена для создания рекомбинантного гена, например, комбинирование регулируемого промотора с эндогенной кодирующей последовательностью путем гомологичной рекомбинации.
Состояние, восприимчивое к терапии, основанной на ингибировании экспрессии генов, может представлять собой профилактический процесс, то есть процесс, предназначенный для предупреждения заболевания или нежелательного медицинского, состояния. Таким образом, настоящее изобретение включает систему для доставки siRNA, которая обладает профилактической функцией (то есть профилактического агента), реципиенту-млекопитающему.
Способы введения экспрессионных кассет согласно изобретению в клетки
Ингибирующий материал нуклеиновой кислоты (например, экспрессионная кассета, кодирующая siRNA, направленная на представляющий интерес ген) может быть введен в клетку ex vivo или in vivo с помощью способов генетического переноса, таких как трансфекция или трансдукция, для обеспечения генетически модифицированной клетки. Различные экспрессионные векторы (то есть носители для содействия доставке экзогенной нуклеиновой кислоты в целевую клетку) известны специалисту в данной области.
Используемая здесь «трансфекция клеток» относится к приобретению клеткой нового материала нуклеиновой кислоты путем встраивания добавленной ДНК. Таким образом, трансфекция относится к вставке нуклеиновой кислоты в клетку с использованием физических или химических способов. Некоторые методы трансфекции известны специалистам в данной области, включающие соосаждение ДНК с фосфатом кальция, DEAE-декстран, электропорацию, опосредованную катионной липосомой трансфекцию, бомбардировку микрочастицами с использованием частиц вольфрама, и соосаждение ДНК с фосфатом стронция.
В противоположность этому, «трансдукция клеток» относится к процессу переноса. нуклеиновой кислоты в клетку с использованием ДНК- или РНК-вируса. РНК-вирус (то есть ретровирус) для переноса нуклеиновой кислоты в клетку называется в настоящем документе как трансдуцирующий химерный ретровирус. Материал экзогенной нуклеиновой кислоты, содержащийся в пределах ретровируса, встраивается в геном трансдуцированной клетки. Клетка, которая была трансдуцирована химерным ДНК-вирусом (например, аденовирусом, несущим кДНК, кодирующую терапевтический агент), не будет содержать материал экзогенной нуклеиновой кислоты, встроенный в свой геном, но сможет экспрессировать материал экзогенной нуклеиновой кислоты, который удерживается внехромосомно в пределах клетки.
Материал экзогенной нуклеиновой кислоты может включать нуклеиновую кислоту, кодирующую siRNA, вместе с промотором для контроля транскрипции. Промотор обычно имеет специфическую нуклеотидную последовательность, необходимую для инициации транскрипции. Материал экзогенной нуклеиновой кислоты может, кроме того, включать дополнительные последовательности (то есть энхансеры), необходимые для получения желательной транскрипционной активности гена. Для целей данного описания «энхансер» представляет собой любую нетранслируемую последовательность ДНК, которая работает вместе с кодирующей последовательностью (в цис) для изменения исходного уровня транскрипции, обусловленного промотором. Материал экзогенной нуклеиновой кислоты может быть введен в клеточный геном непосредственно ниже (в 3'-направлении) от промотра таким образом, что промотор и кодирующая последовательность оперативно связаны таким образом, чтобы обеспечивать транскрипцию кодирующей последовательности. Экспрессионный вектор может включать экзогенный промотрный элемент для контроля транскрипции вставленного экзогенного гена. Такие экзогенные промоторы включают как конститутивные, так и регулируемые промоторы.
Природные конститутивные промоторы контролируют экспрессию основных клеточных функций. В результате, последовательность нуклеиновой кислоты под контролем конститутивного промотора экспрессируется во всех условиях клеточного роста. Конститутивные промоторы включают промоторы для следующих генов, которые кодируют определенные конститутивные функции или функции «домашнего хозяйства»: гипоксантин фосфорибозилтрансфераза (HPRT), дигидрофолатредуктаза (DHFR), аденозиндеаминаза, фосфоглицеролкиназа (PGK), пируваткиназа, фосфоглицеролмутаза, промотор бета-актина и другие конститутивные промоторы, известные специалистам в данной области. Кроме того, множество вирусных промоторов функционируют конститутивно в эукариотических клетках. Они включают: ранние и поздние промоторы SV40; длинные концевые повторы (LTR) вируса лейкоза мышей Молони и другие ретровирусы; и тимидинкиназный промотор вируса простого герпеса, помимо многих других.
Нуклеотидные последовательности, которые находятся под контролем регулируемых промоторов, экспрессируются только или в большей или меньшей степени в присутствии индуцирующего или подавляющего агента (например, транскрипция под контролем металлотионеинового промотора значительно увеличивается в присутствии определенных ионов металлов). Регулируемые промоторы включают чувствительные элементы (RE), которые стимулируют транскрипцию при связывании их индуцирующих факторов. Например, существуют RE для сывороточных факторов, стероидных гормонов, ретиноевой кислоты, циклической AMP и тетрациклина и доксициклина. Промоторы, содержащие конкретный RE, могут быть выбраны для получения регулируемого ответа, и в некоторых случаях сам RE может быть присоединен к другому промотору, делая кодируемую нуклеотидную последовательность регулируемой. Таким образом, путем выбора подходящего промотора (конститутивного или регулируемого; сильного или слабого) можно контролировать наличие и уровень экспрессии нуклеотидной последовательности в генетически модифицированной клетке. Если нуклеотидная последовательность находится под контролем регулируемого промотора, доставка терапевтического агента in situ запускается путем воздействия на генетически модифицированную клетку in situ условий, обеспечивающих транскрипцию нуклеотидной последовательности, например, путем интраперитонеальной инъекции специфических индукторов регулируемых промоторов, которые контролируют транскрипцию агента. Например, экспрессия in situ нуклеотидной последовательности под контролем металлотионеинового промотора в генетически модифицированных клетках усиливается путем приведения в контакт генетически модифицированных клеток с раствором, содержащим подходящие (то есть индуцирующие) ионы металлов in situ.
Таким образом, количество siRNA, генерированное in situ, регулируется путем контроля таких факторов, как природа промотора, используемого для направленной транскрипции нуклеотидной последовательности (то есть является ли промотор конститутивным или регулируемым, сильным или слабым) и количества копий экзогенной нуклеотидной последовательности, кодирующей последовательность siRNA, которые содержатся в клетке.
В дополнение к по меньшей мере одному промотору и по меньшей мере одной гетерологичной нуклеотидной последовательности, кодирующей siRNA, экспрессионный вектор может включать ген селектируемых маркеров, например, ген устойчивости к неомицину, для содействия отбору клеток, которые были трансфицированы или трансдуцированы экспрессионным вектором.
Клетки также могут быть трансфицированы двумя или более экспрессионными векторами, по меньшей мере одним вектором, содержащим нуклеотидную последовательностей), кодирующую siRNA, еще одним вектором, содержащим ген селектируемого маркера. Выбор подходящего промотора, энханера, гена селектируемого маркера и/или сигнальной последовательности находится в пределах компетенции специалиста в данной области без проведения экспериментов.
Следующее далее описание направлено на различные применения настоящего изобретения. Например, настоящее изобретение находит применение в качестве экспрессионной системы, подходящей для сайленсинга экспрессии представляющего интерес гена(ов).
Настоящее изобретение также обеспечивает способы генетической модификации клеток реципиента-млекопитающего in vivo. В соответствии с одним вариантом осуществления способ включает введение экспрессионного вектора для экспрессии последовательности siRNA в клетках реципиента-млекопитающего in situ путем, например, инъецирования вектора реципиенту.
Носители для доставки экспрессионных кассет согласно изобретению
Доставка соединений в ткани и через гематоэнцефалический барьер может быть ограничена размером и биохимическими свойствами соединений. В настоящее время эффективная доставка соединений в клетки in vivo может быть достигнута только тогда, когда молекулы имеют малый размер (обычно менее 600 Дальтон). Генный перенос для коррекции врожденных нарушений обмена веществ и нейродегенеративных заболеваний центральной нервной системы (CNS), а также для лечения рака осуществляли с помощью рекомбинантных аденовирусных векторов.
Отбор и оптимизация конкретного экспрессионного вектора для экспрессии специфической siRNA в клетке могут быть осуществлены путем получения нуклеотидной последовательности siRNA, возможно с одной или несколькими подходящими контрольными областями (например, промотором, последовательностью вставки); получения конструкции вектора, содержащей вектор, в который вставлена нуклеотидная последовательность, кодирующая siRNA; трансфекции или трансдукции культивированных клеток in vitro конструкцией вектора; и определения присутствия siRNA in vitro в культивированных клетках.
Векторы для генной терапии клеток включают вирусы, такие как вирусы, дефектные по репликации (описанные подробно ниже). Иллюстративные вирусные векторы получены из вируса саркомы Харви, вируса саркомы Рауса, MPSV (полисахаридная менингококковая вакцина), вируса мышиного лейкоза Молони и ДНК-вирусов (например, аденовируса).
Ретровирусы, дефектные по репликации, способны направлять синтез всех вирионных белков, но неспособны вызывать образование инфекционных частиц. Таким образом, эти генетически измененные ретровирусные экспрессионные векторы обычно применяются для высокоэффективной трансдукции нуклеотидных последовательностей в культивированные клетки, и являются особенно полезными в способе согласно настоящему изобретению. Такие ретровирусы, кроме того, можно применять для эффективной трансдукции in vivo нуклеотидных последовательностей в клетки. Ретровирусы широко используют для переноса материала нуклеиновой кислоты в клетки. Протоколы для получения ретровирусов, дефектных по репликации (включая стадии встраивания материала экзогенной нуклеиновой кислоты в плазмиду, трансфекции пакующей клеточной линии плазмидой, продукции рекомбинантных ретровирусов пакующей клеточной линии, сбора вирусных частиц из тканевой культуральной среды и инфицирования клеток-мишеней вирусными частицами), хорошо известны в данной области.
Преимуществом использования ретровирусов для генной терапии является то, что вирусы осуществляют вставку нуклеотидной последовательности, кодирующей siRNA, в геном клетки-хозяина, обеспечивая тем самым возможность передачи нуклеотидной последовательности, кодирующей siRNA, потомству клетки при ее делении. Последовательности промотора в области LTR могут усиливать экспрессию вставленной кодирующей последовательности в различных типах клеток. Некоторые недостатки использования ретровирусных жкспрессионных векторов включают: (1) мутагенез методом микроинъекций, то есть вставку нуклеотидной последовательности, кодирующей siRNA, в нежелательное положение в геноме клетки-мишени, что приводит, например, к нерегулируемому клеточному росту; и (2) необходимость пролиферации клетки-мишени для интеграции в целевой геном кодирующей siRNA нуклеотидной последовательности, которую несет вектор.
Другим вирусным кандидатом, полезным в качестве экспрессионного вектора для трансформации клеток, является аденовирус, вирус на основе двухцепочечной ДНК. Аденовирус является инфекционным в различных типах клеток, включая, например, клетки мышц и эндотелиальные клетки.
Аденовирусы (Ad) представляют собой вирусы на основе двухцепочечной линейной ДНК с геномом длиной 36 kb. Некоторые особенности аденовируса делают его полезным в качестве носителей для доставки трансгена для терапевтических применений, таких как содействие доставке генов in vivo. Рекомбинантные аденовирусные векторы доказали свою способность осуществлять эффективный перенос генов in situ в паренхимальные клетки различных органов, включая легкие, головной мозг, поджелудочную железу, желчный пузырь и печень. Это позволило использовать эти векторы в способах для лечения наследственных генетических заболеваний, таких как муковисцидоз, где векторы могут быть доставлены в целевой орган. Кроме того, способность аденовирусного вектора осуществлять трансдукцию опухоли in situ позволило разработать разнообразные способы противораковой генной терапии для недиссеминированных поражений. В этих способах включение вектора способствует специфической к клеткам опухоли трансдукции.
Подобно ретровирусам, аденовирусный геном может быть адаптирован к использованию в качестве экспрессионного вектора для генной терапии, то есть путем удаления генетической информации, которая контролирует продукцию самого вируса. Так как аденовирус функционирует внехромосомным образом, рекомбинантный аденовирус не имеет теоретических проблем, связанных с инсерционным мутагенезом.
Для создания рекомбинантных вирусов обычно используют несколько подходов. Один из подходов включает прямое лигирование фрагментов эндонуклеаз рестрикции, содержащих представляющую интерес нуклеотидную последовательность, в части аденовирусного генома. Альтернативно, представляющая интерес нуклеотидная последовательность может быть вставлена в дефектный аденовирус в результате гомологичной рекомбинации. Желательные рекомбинанты идентифицировали путем скрининга отдельных пятен, образовавшихся на газоне комплементационных клеток.
Большинство аденовирусных векторов основано на остове аденовируса 5-го серотипа (Ad5), в который введена экспрессионная кассета, содержащая представляющую интерес нуклеотидную последовательность, вместо ранней области 1 (Е1) или ранней области 3 (Е3). Вирусы, в которых Е1 была удалена, являются дефектными по репликации и размножаются в человеческих комплементационных клетках (например, клетки 293 или 911), которые поставляют пропущенный ген Е1 и pIX in trans.
В одном варианте осуществления настоящего изобретения siRNA может быть генерирована в клетке головного мозга или ткани головного мозга. Подходящим для такого применения вектором является FIV-вектор или AAV-вектор. Например, может быть использован AAV5. Также, можно использовать векторы на основе полиовируса или HSV.
Применение siRNA обычно осуществляют путем трансфекции синтетических siRNA, синтезированных in vitro РНК или плазмид, экспрессирующих shRNA или miRNA. В последнее время вирусы используют для исследований in vitro и для генерирования трансгенных мышиных нокдаунов целевых генов. Рекомбинантные аденовирусы, аденоассоциированный вирус (AAV) и кошачий вирус иммунодефицита (FIV) могут быть использованы для доставки генов in vitro и in vivo. Каждый из них имеет свои преимущества и недостатки. Аденовирусы представляют собой двухцепочечные вирусы ДНК с геномом большого размера (36 kb) и были сконструированы в лаборатории авторов настоящего изобретения и в других местах для направления экспрессионных кассет в различные области.
Аденоассоциированные вирусы имеют заключенные в капсид геномы, сходные с Ad, но имеют меньший размер и пакующую емкость (~30 нм по сравнению с ~100 нм; пакующий предел ~4,5 kb). Геном AAV представляет собой одноцепочечную молекулу ДНК, состоящую из + и - цепи. Исследовано восемь серотипов AAV (1-8), три из которых были изучены в головном мозге. Важным для настоящего изобретения является то, что AAV5 трансдуцирует стриарные и кортикальные нейроны, и не связан с какими-либо известными патологиями.
Аденоассоциированный вирус (AAV) представляет собой малый непатогенный вирус семейства parvoviridae. AAV отличается от других членов этого семейства своей независимостью от хелперного вируса для репликации. В отсутствие хелперного вируса AAV может интегрироваться локус-специфическим образом в q-плечо хромосомы 19. Геном AAV размером приблизительно 5 kb состоит из одного сегмента одноцепочечной ДНК плюс или минус полярности. Концы генома представляют собой короткие инвертированные концевые повторы, которые могут сворачиваться в шпилечные структуры и служить в качестве начала вирусной ДНК репликации. Физически, парвовирусный вирион является необолочечным и его икасаэдрический капсид имеет диаметр приблизительно 20 нм.
Кроме того, в настоящем изобретении предлагаются химерные вирусы, в которых AAV может быть комбинирован с вирусом герпеса, ампликонами вируса герпеса, бакуловирусом или другими вирусами для достижения желаемого тропизма, связанного с другим вирусом. Например, ITR AAV4 могут быть вставлены в вирус герпеса и клетки могут быть инфицированы. После инфицирования ITR AAV4 могут действовать с помощью AAV4 rep, обеспеченного в системе или в отдельном носителе для освобождения AAV4 из генома. Таким образом, клеточный тропизм вируса простого герпеса может быть объединен с опосредованной AAV4 rep направленной интеграцией. Другие вирусы, которые могут быть использованы для конструирования химерных вирусов, включают лентивирус, ретровирус, псевдотипированные ретровирусные векторы и аденовирусные векторы.
Также, в настоящем изобретении предлагаются вариантные AAV-векторы. Например, последовательность нативного AAV, такого как AAV5, может быть модифицирована при индивидуальных нуклеотидах. Настоящее изобретение включает нативные и мутантные AAV-векторы. Кроме того, настоящее изобретение включает все серотипы AAV.
FIV представляет собой оболочечный вирус с сильным профилем безопасности у человека; индивидуумы, укушенные или поцарапанные FIV-инфицированными кошками, не видоизменяют серологическую специфичность и согласно некоторым сообщениям демонстрируют признаки заболевания. Подобно AAV, FIV обеспечивает длительную экспрессию трансгена в мышиных нейронах и нейронах приматов, отличных от человека, и трансдукция может быть направлена на различные типы клеток путем псевдотипирования, процесса обмена нативной оболочки вируса на оболочку из другого вируса.
Таким образом, как будет очевидно специалисту с данной области, разнообразные подходящие вирусные экспрессионные векторы являются доступными для переноса материала экзогенной нуклеиновой кислоты в клетки. Отбор подходящего экспрессионного вектора для экспрессии терапевтического агента для конкретного состояния, восприимчивого к терапии путем сайленсинга гена, и оптимизация условий для вставки отобранного экспрессионного вектора в клетку, находятся в компетенции специалиста в данной области без необходимости проведения экспериментов.
В другом варианте осуществления экспрессионный вектор находится в форме плазмиды, которая переносится в клетки-мишени с помощью различных способов; физического (например, микроинъекции, электропорации, введения при соскабливании, бомбардировки микрочастицами) или путем клеточного захвата в виде химического комплекса (например, соосаждение кальция или стронция, образование комплекса с липидом, образование комплекса с лигандом). Некоторые коммерческие продукты являются доступными для комплексообразования с катионными липосомами, включая Lipofectin™ (Gibco-BRL, Gaithersburg, Md.) и Transfectam™ (Promega®, Madison, Wis.). Однако эффективность трансфекции с помощью этих способов сильно зависит от природы клетки-мишени и, соответственно, условия для оптимальной трансфекции нуклеиновых кислот в клетки с помощью указанных здесь процедур должны быть оптимизированы. Такая оптимизация находится в пределах компетенции специалиста в данной области без необходимости в проведении экспериментов.
Аденоассоциированный вирус (AAV)
Аденоассоциированный вирус (AAV) представляет собой малый непатогенный вирус семейства parvoviridae. AAV отличается от других членов этого семейства своей независимостью от хелперного вируса для репликации. В отсутствие хелперного вируса AAV может интегрироваться локус-специфическим образом в q-плечо хромосомы 19. Геном AAV размером приблизительно 5 kb состоит из одного сегмента одноцепочечной ДНК плюс или минус полярности. Концы генома представляют собой короткие инвертированные концевые повторы, которые могут сворачиваться в шпилечные структуры и служить в качестве начала вирусной ДНК репликации. Физически, парвовирусный вирион является безоболочечным и его икасаэдрический капсид имеет диаметр приблизительно 20 нм.
На сегодняшний день было идентифицировано множество AAV различного серотипа, и более десятка было выделено от человека или приматов. Геном AAV2 содержит 4680 нуклеотидов в длину и две открытые рамки считывания (ORF). Левая ORF кодирует неструктурные белки Rep, Rep 40, Rep 52, Rep 68 и Rep 78, которые вовлечены в регуляцию репликации и транскрипции дополнительно к продукции одноцепочечных геномов потомства. Кроме того, два белков из белков Rep связаны с преимущественной интеграцией геномов AAV в область q-плеча хромосомы 19 человека. Также, было доказано, что Rep68/78 обладает NTP-связывающей активностью, а также активностями ДНК- и РНК-хеликазы. Белки Rep обладают клеточным сигналом внутриядерной локализации, а также несколькими возможными сайтами фосфорилирования. Мутация одного из этих киназных сайтов приводит к утрате репликационной активности.
Концы генома представляют собой короткие инвертированные концевые повторы (ITR), которые обладают потенциалом к сворачиванию в шпилечные структуры в Т-форме, которые служат в качестве начала вирусной ДНК-репликации. В пределах ITR-области описано два элемента, которые являются центральными для функционирования ITR, мотив GAGC-повтора и сайт концевого разрешения (trs). Было продемонстрировано, что мотив повтора связывается с Rep, когда ITR находится в линейной или шпилечной конформации. Это связывание служит для расположения Rep68/78 для расщепления при trs, которое возникает сайт- и цепь-специфическим образом. Дополнительно к их роли в репликации, оказалось, что эти два элемента являются ключевыми для вирусной интеграции. Содержащийся в пределах хромосомы 19 локус интегрирования представляет собой участок связывания Rep с соседним trs. Было показано, что эти элементы являются функциональными и необходимыми для локус-специфической интеграции.
Вирион AAV представляет собой безоболочечную частицу в форме икосаэдра с диаметром приблизительно 25 нм, состоящую из трех родственных белков, названных VP1, VP2 и VP3. Правая ORF кодирует капсидные белки VP1, VP2 и VP3. Эти белки обнаруживаются в соотношении 1:1:10, соответственно, и все происходят из правой ORF. Капсидные белки отличаются друг от друга использованием альтернативного сплайсинга и нетипичного инициирующего кодона. Делеционный анализ показал, что удаление или изменение VP1, который транслируется из альтернативно сплайсированного транскрипта, приводит к уменьшенному выходу инфицированных частиц. Мутации в пределах кодирующей области VP3 приводят к неспособности продуцировать любую одноцепочечную ДНК потомства или инфекционные частицы. Частица AAV представляет собой вирусную частицу, содержащую капсидный белок AAV. Капсидный полипептид AAV может кодировать весь полипептид VP1, VP2 и VP3. Частица может представлять собой частицу, содержащую AAV2 и другие капсидные белки AAV (то есть химерный белок, такой как AAV1 и AAV2). Вариации в аминокислотной последовательности капсидного белка AAV2 рассматриваются в настоящем документе, при условии, что вирусная частица, содержащая капсид AAV2, остается антигенетически или иммунологически отличной от AAV1, что может быть легко определено с помощью стандартных способов. В частности, например, ELISA и Вестерн-блоттинг могут быть использованы для определения, является ли вирусная частица антигенетически или иммунологически отличной от AAV1. Кроме того, вирусная частица AAV2 предпочтительно сохраняет тканевый тропизм, отличный от AAV1.
Частица AAV2 представляет собой вирусную частицу, содержащую капсидный белок AAV2. Капсидный полипептид AAV2, кодирующий весь полипептид VP1, VP2 и VP3, может быть по меньшей мере на 63% гомологичным (или идентичным) полипептиду, имеющему аминокислотную последовательность, кодируемую нуклеотидами, представленными в NC_001401 (нуклеотидная последовательность, кодирующая капсидный белок AAV2). Капсидный белок может быть примерно на 70% гомологичным, примерно на 75%, 80%, 85%, 90%, 95%, 98%, 99% или даже 100% гомологичным белку, кодируемому нуклеотидной последовательностью, представленной в NC_001401. Капсидный белок может быть примерно на 70%, примерно на 75%, 80%, 85%, 90%, 95%, 98%, 99% или даже 100% идентичным белку, кодируемому нуклеотидной последовательностью, представленной в NC_001401. Частица может представлять собой частицу, содержащую другой капсидный белок AAV и AAV2, то есть химерный белок. Вариации в аминокислотной последовательности капсидного белка AAV2 рассмотрены в настоящем документе, при условии, что полученная в итоге вирусная частица, содержащая капсид AAV2, остается антигенетически или иммунологически отличающейся от AAV4, что может быть легко определено с помощью стандартных способов. В частности, например, ELISA и Вестерн-блоттинг могут быть использованы для определения, является ли вирусная частица антигенетически или иммунологически отличной от AAV1. Кроме того, вирусная частица AAV2 предпочтительно сохраняет тканевый тропизм, отличный от AAV1, например такой, который проиллюстрирован здесь в примерах, однако химерная частица AAV2, содержащая по меньшей мере один белок оболочки AAV2, может обладать тканевым тропизмом, отличным от тропизма частицы AAV2, состоящей только из белков оболочки AAV2.
В определенных вариантах осуществления изобретение, кроме того, обеспечивает частицу AAV2, содержащую, то есть инкапсидирующую, вектор, содержащий пару инвертированных концевых повторов AAV2. Нуклеотидная последовательность ITR AAV2 известна в данной области. Кроме того, частица может представлять собой частицу, содержащую капсидный белок AAV1 и AAV2, то есть химерный белок. Кроме того, частица может представлять собой частицу, инкапсидирующую вектор, содержащий пару инвертированных концевых повторов AAV из других AAV (например, AAV1-AAV9 и AAVrh10). Вектор, инкапсидированный в частицу, может, кроме того, содержать экзогенную нуклеиновую кислоту, вставленную между инвертированными концевыми повторами.
Следующие отличительные признаки AAV делают его привлекательным вектором для генного переноса. Было показано, что AAV-векторы стабильно интегрируются in vitro в клеточный геном; имеют широкий диапазон хозяев; трансдуцируют как делящиеся, так и неделящиеся клетки in vitro и in vivo, и поддерживают высокие уровни экспрессии трансдуцированных генов. Вирусные частицы являются устойчивыми к воздействию тепла, стойкими к действию растворителей, детергентов, изменениям pH, температуры и могут быть концентрированы на градиентах CsCl или другими способами. В настоящем изобретении предлагаются способы введения частиц AAV, рекомбинантных AAV-векторов и рекомбинантных вирионов AAV. Например, частица AAV2 представляет собой вирусную частицу, содержащую капсидный белок AAV2, или частица AAV1 представляет собой вирусную частицу, содержащую капсидный белок AAV1. Рекомбинантный вектор AAV2 представляет собой конструкцию нуклеиновой кислоты, которая содержит по меньшей мере одну единственную в своем роде нуклеиновую кислоту AAV2. Рекомбинантный вирион AAV2 представляет собой частицу, содержащую рекомбинантный вектор AAV2. Термин «ITR AAV2» означает, что нуклеотидная последовательность содержит один или оба признака, описанных здесь, которые отличают ITR AAV2 от ITR AAV1: (1) три (скорее чем четыре, как в AAV1) «GAGC»-повторов, и (2) в участке связывания ITR Rep AAV2 четвертый нуклеотид в первых двух «GAGC»-повторах представляет собой скорее С, а не Т.
Промотор для управления экспрессией белка или последовательности, кодирующей другой агент, подлежащий доставке, может представлять собой любой подходящий промотор, выбранный исходя из известных соображений, таких как уровень экспрессии нуклеиновой кислоты, функционально связанной с промотором, и типа клетки, в которой вектор подлежит использованию. Промоторы могут представлять собой экзогенные или эндогенные промоторы. Промоторы могут включать, например, известные сильные промоторы, такие как SV40, или индуцибельный металлотионеиновый промотор, или промотор AAV, такой как промотор р5 AAV. Дополнительные примеры промоторов включают промоторы, полученные из генов актина, генов иммуноглобулина, цитомегаловируса (CMV), аденовируса, вируса папилломы крупного рогатого скота, аденовирусных промоторов, таких как аденовирусный главный поздний промотор, индуцибельный промотор гена теплового шока, респираторно-синцитиальный вирус, вирус саркомы Рауса (RSV) и т.д. Дополнительные примеры включают регулируемые промоторы.
AAV-вектор, кроме того, может содержать экзогенную (гетерологичную) нуклеиновую кислоту, функционально связанную с промотором. Выражение «гетерологичная нуклеиновая кислота» означает, что любая гетерологичная или экзогенная нуклеиновая кислота может быть вставлена в вектор для переноса в клетку, ткань или организм. Нуклеиновая кислота может, например, кодировать полипептид или белок, или антисмысловую РНК. Выражение «функционально связанная» означает, что промотор может способствовать экспрессии гетерологичной нуклеиновой кислоты, как известно в данной области, например, надлежащей ориентации промотора относительно гетерологичной нуклеиновой кислоты. Кроме того, гетерологичная нуклеиновая кислота предпочтительно содержит все соответствующие последовательности для экспрессии нуклеиновой кислоты, как известно в данной области, для функционального кодирования, то есть обеспечивает экспрессию нуклеиновой кислоты. Нуклеиновая кислота может включать, например, контролирующие экспрессию последовательности, такие как энхансер, и необходимые сайты обработки информации, такие как сайты связывания рибосом, сайты сплайсинга РНК, сайты полиаденилирования и последовательности терминации транскрипции. Нуклеиновая кислота может кодировать более чем один генный продукт, ограниченный только размером нуклеиновой кислоты, которая может быть упакована.
В определенных вариантах осуществления настоящего изобретения гетерологичная нуклеиновая кислота может кодировать предпочтительные белки, которые заменяют пропущенные или дефектные белки, требуемые субъекту, в которые переносится вектор, такие как Rheb или Rhes.
Частица AAV1 представляет собой вирусную частицу, содержащую капсидный белок AAV1. Вариации в аминокислотной последовательности капсидного белка AAV1 рассматриваются в настоящем документе, при условии, что полученная в итоге вирусная частица, содержащая капсид AAV1, остается антигенетически или иммунологически отличной от других капсидов AAV1, что может быть легко определено с помощью стандартных способов. В частности, например, могут быть использованы ELISA и Вестерн-блоттинг для определения, является ли вирусная частица антигенетически или иммунологически отличной от других серотипов AAV.
Используемый здесь термин «полипептид» относится к полимеру аминокислот и включает полноразмерные белки и их фрагменты. Таким образом, в настоящем документе термины «белок» и «полипептид» часто используются взаимозаменяемо. Замены могут быть выбраны с помощью известных параметров, которые должны быть нейтральными. Специалистам в данной области будет понятно, что изобретение также включает такие полипептиды, которые имеют незначительные вариации в аминокислотных последовательностях или другие свойства. Такие изменения могут возникать естественным образом в виде аллельных вариаций (например, вследствие генетического полиморфизма), или могут быть получены путем вмешательства человека (например, путем мутагенеза клонированных последовательностей ДНК), например, индуцированные точечные, делеционные, инсерционные мутации и мутации замены оснований. Как правило, предпочтительными являются незначительные изменения в аминокислотной последовательности, такие как консервативные аминокислотные замены, малые внутренние делеции или вставки, и добавления или делеции на концах молекул. Эти модификации могут привести к изменениям в аминокислотной последовательности, обеспечить молчащие мутации, модифицировать сайт рестрикции или обеспечить другие специфические мутации.
В настоящем изобретении предлагается способ доставки нуклеиновой кислоты в клетку, включающий введение в клетку частицы AAV, содержащей вектор, содержащий нуклеиновую кислоту, вставленную между парой инвертированных концевых повторов AAV, доставляя тем самым нуклеиновую кислоту в клетку. Введение в клетку может быть осуществлено различными способами, включая простое приведение в контакт частицы, необязательно содержащейся в подходящей жидкости, такой как тканевая культуральная среда или буферный солевой раствор, с клетками. Частица может находиться в контакте с клетками в течение любого желаемого периода времени и, как правило, частицу вводят и оставляют на неопределенное время. Для таких способов in vitro вирус может быть введен в клетку с помощью стандартных методов трансдукции вируса, известных в данной области, как проиллюстрировано в настоящем документе. Титры вируса, подлежащего введению, могут различаться, в частности, в зависимости от типа клетки, но обычно представляют собой типичные титры, используемые для трансдукции AAV. Кроме того, титры, используемые для трансдукции конкретных клеток в примерах согласно изобретению, могут быть использованы. Клетки могут включать любую желательную клетку человека, а также других крупных млекопитающих (не грызунов), таких как приматы, лошади, овцы, козы, свиньи и собаки.
В частности, в настоящем изобретении предлагается способ доставки нуклеиновой кислоты в клетку головного мозга, в частности, средние шипиковые нейроны, содержащую нуклеиновую кислоту, вставленную между парой инвертированных концевых повторов AAV, доставляя тем самым нуклеиновую кислоту в клетку.
Кроме того, в настоящем изобретении предлагается способ доставки нуклеиновой кислоты в клетку субъекта, включающий введение субъекту частицы AAV, содержащей нуклеиновую кислоту, вставленную между парой инвертированных концевых повторов AAV, доставляя тем самым нуклеиновую кислоту в клетку субъекта.
Также, предлагается способ доставки нуклеиновой кислоты в клетку головного мозга, такую как нейрон с стриатуме или кортексе, субъекта, включающий введение субъекту частицы AAV, содержащей нуклеиновую кислоту, вставленную между парой инвертированных концевых повторов AAV, доставляя тем самым нуклеиновую кислоту в нейрон или другую клетку субъекта.
Некоторые варианты осуществления настоящего изобретения обеспечивают клетку, содержащую вирусный вектор, как описано здесь.
AAV-векторы
В одном варианте осуществления вирусный вектор согласно изобретению представляет собой вектор на основе AAV. Вектор на основе «AAV» относится к аденоассоциированному вирусу и может быть использован в отношении самого природного вируса дикого типа или его производных. Термин охватывает все подтипы, серотипы и псевдотипы, а также как природные, так и рекомбинантные формы, за исключением случаев, когда требуется иное. Используемый здесь термин «серотип» относится к AAV, который был идентифицирован и отличается от других AAV по реактивности капсидного белка по отношению к установленной антисыворотке, например, существует восемь известных серотипов AAV приматов, с AAV-1 по AAV-9 и AAVrh10. Например, серотип AAV2 используют для обозначения AAV, который содержит капсидные белки, кодируемые геном cap AAV2, и генома, содержащего 5' и 3' ITR-последовательности из такого же серотипа AAV2. Используемый здесь, rAAV1, например, может быть использован для обозначения AAV, содержащего капсидные белки и 5'-3' ITR из одного и того же серотипа, или может относиться к AAV, содержащему капсидные белки из одного серотипа и 5'-3' ITR из другого серотипа AAV, например, капсид из AAV серотипа 2 и ITR из AAV серотипа 5. Для каждого примера, проиллюстрированного здесь, в описании конструкции и получения вектора указывается серотип капсида и 5'-3' ITR-последовательности. Сокращение «rAAV» относится к рекомбинантному аденоассоциированному вирусу, также называемому рекомбинантным AAV-вектором (или «rAAV-вектором»).
«AAV-вирус» или «AAV-вирусная частица» относится к вирусной частице, состоящей из по меньшей мере одного капсидного белка AAV (предпочтительно из всех капсидных белков AAV дикого типа) и инкапсидированного полинуклеотида. Если частица содержит гетерологичный полинуклеотид (то есть полинуклеотид, отличный от генома AAV дикого типа, такого как трансген, подлежащий доставке в клетку млекопитающего), он обычно называется «rAAV».
В одном варианте осуществления экспрессионные векторы на основе AAV сконструированы с использованием известных методов, чтобы, как минимум, обеспечить в виде оперативно связанных компонентов в направлении транскрипции контрольные элементы, включая область инициации транскрипции, представляющую интерес ДНК и область терминации транскрипции. Контрольные элементы выбирают таким образом, чтобы они были функциональными в клетке млекопитающего. Полученная конструкция, которая содержит оперативно связанные компоненты, является фланкированной (5' и 3') функциональными последовательностями ITR AAV.
Под «инвертированными концевыми повторами аденоассоциированного вируса» или «ITR AAV» понимаются общепризнанные области, обнаруживаемые на каждом конце генома AAV, которые функционируют вместе в цис в качестве точек начала репликации ДНК и в качестве сигналов упаковки для вируса. ITR AAV вместе с кодирующей областью rep AAV обеспечивают эффективное вырезание и высвобождение, и интеграцию нуклеотидной последовательности, расположенной между двумя фланкирующими ITR, в геном клетки млекопитающего.
Нуклеотидные последовательности областей ITR AAV являются известными. Как используется в настоящем документе, «ITR AAV» не требуют отображения нуклеотидной последовательности дикого типа, но могут быть изменены, например, путем вставки, делеции или замены нуклеотидов. Кроме того, ITR AAV может происходить из любого из нескольких серотипов AAV, включая, без ограничения, AAV1, AAV2, AAV3, AAV4, AAV5, AAV7 и т.п. Кроме того, 5'- и 3'-ITR, которые фланкируют выбранную нуклеотидную последовательность в AAV-векторе, необязательно должны быть идентичными или происходить из одного и того же серотипа или изолята AAV, пока они функционируют надлежащим образом, то есть обеспечивают вырезание и освобождение представляющей интерес последовательности из генома клетки-хозяина или вектора, и обеспечивают интеграцию гетерологичной последовательности в геном реципиентной клетки, когда продукты гена Rep AAV присутствуют в клетке.
В одном варианте осуществления ITR AAV могут происходить из любого из нескольких серотипов AAV, включая, без ограничения, AAV1, AAV2, AAV3, AAV4, AAV5, AAV7 и т.д. Кроме того, 5'- и 3'-ITR, которые фланкируют выбранную нуклеотидную последовательность в экспрессионном векторе AAV, необязательно должны быть идентичными или происходить из одного и того же серотипа или изолята AAV, пока они функционируют надлежащим образом, то есть обеспечивают вырезание и высвобождение представляющей интерес последовательности из генома клетки-хозяина или вектора, и обеспечивают интеграцию молекулы ДНК в геном реципиентной клетки, когда продукты гена Rep AAV присутствуют в клетке.
В одном варианте осуществления капсиды AAV могут быть получены из AAV2. Подходящие молекулы ДНК для использования в AAV-векторах имеют размер менее чем около 5 тысячи пар нуклеотидов (kb), менее чем около 4,5 kb, менее чем около 4 kb, менее чем около 3,5 kb, менее чем около 3 kb, менее чем около 2,5 kb, и являются известными в данной области.
В одном варианте осуществления выбранная нуклеотидная последовательность оперативно связана с контрольными элементами, которые направляют их транскрипцию или экспрессию у субъекта in vivo. Такие контрольные элементы могут содержать контрольные последовательности, обычно связанные с выбранным геном. Альтернативно, могут быть использованы гетерологичные контрольные последовательности. Полезные гетерологичные контрольные последовательности обычно включают такие последовательности, которые получены из последовательностей, кодирующих гены млекопитающего или вирусные гены. Примеры включают, но без ограничения, ранний промотор SV40, промотор LTR мышиного вируса опухоли молочной железы; главный поздний промотор аденовируса (Ad MLP); промотор вируса простого герпеса (HSV), промотор цитомегаловируса (CMV), такой как область немедленно-раннего промотора CMV (CMVIE), промотор вируса саркомы Рауса (RSV), промоторы polII, промоторы polIII, синтетические промоторы, гибридные промоторы и т.п. Кроме того, последовательности, полученные из невирусных генов, таких как мышиный ген металлотионеина, также будут находить здесь применение. Такие промоторные последовательности являются коммерчески доступными, например, от фирмы Stratagene (San Diego, Calif.).
В одном варианте осуществления особенно полезными будут являться гетерологичные промоторы и другие контрольные элементы, такие как CNS-специфические и индуцибельные промоторы, энхансеры и т.п. Примеры гетерологичных промоторов включают промоторы CMV. Примеры CNS-специфических промоторов включают такие промоторы, которые выделены из генов из основного миелинового белка (МВР), глиального фибриллярного кислого белка (GFAP), и нейрон-специфической енолазы (NSE). Примеры индуцибельных промоторов включают элементы ДНК, восприимчивые к экдизону, тетрациклину, гипоксии и ауфину.
В одном варианте осуществления экспрессионный вектор на основе AAV, который содержит представляющую интерес молекулу ДНК, связанную ITR AAV, может быть сконструирован путем прямой вставки выбранной последовательности(ей) в геном AAV, из которого вырезаны главные открытые рамки считывания AAV ("ORF"). Другие части генома AAV также могут быть удалены, поскольку остается достаточная часть ITR для обеспечения функций репликации и упаковки. Такие конструкции могут быть разработаны с использованием методов, хорошо известных в данной области.
Альтернативно, ITR AAV можно вырезать из вирусного генома или из вектора AAV, содержащие такие же или слитые 5' и 3' выбранной конструкции нуклеиновой кислоты, которая присутствует в другом векторе, с использованием стандартных технологий лигирования. Например, лигирование можно осуществлять в 20 мМ Tris-Cl, pH 7,5, 10 мМ MgCl2, 10 мМ DTT, 33 мкг/мл BSA, 10 мМ-50 мМ NaCl, и или 40 мкМ АТР, 0,01-0,02 (Weiss) единиц ДНК-лигазы Т4 при 0°C (для лигирования «липких концов»), или 1 мМ АТР, 0,3-0,6 (Weiss) единиц ДНК-лигазы Т4 при 14°C (для лигирования «тупых концов»). Межмолекулярное лигирование «липких концов» обычно осуществляют при общей концентрации ДНК 30-100 мкг/мл (5-100 нМ общая конечная концентрация). Векторы AAV, которые содержат ITR, описаны.
Кроме того, химерные гены могут быть получены синтетически для включения последовательностей ITR AAV расположенных на 5'- и 3'-концах одной или нескольких выбранных последовательностей нуклеиновой кислоты. Могут быть использованы предпочтительные кодоны для экспрессии последовательности химерного гена в клетках CNS млекопитающего. Полная химерная последовательность собрана из перекрывающихся олигонуклеотидов, полученных стандартными способами.
Для получения вирионов rAAV экспрессионный вектор на основе AAV вводят в подходящую клетку-хозяина с использованием известных методов, например, путем трансфекции. Много методов трансфекции в целом известно в данной области. Смотри, например, Sambrook et al. (1989) Molecular Cloning, a laboratory manual, Cold Spring Harbor Laboratories, New York. Особенно подходящие методы трансфекции включают соосаждение фосфатом кальция, прямую микроинъекцию в культивированные клетки, электропорацию, опосредованный липосомами перенос генов, липид-опосредованную трансдукцию и доставку нуклеиновых кислот с использованием высокоскоростных микроснарядов.
В одном варианте осуществления подходящие клетки-хозяева для получения вирионов rAAV включают клетки микроорганизмов, дрожжей, насекомых и млекопитающих, которые можно использовать или которые были использованы в качестве реципиентов гетерологичной молекулы ДНК. Термин включает потомство, исходной клетки, которая была трансфицирована. Таким образом, «клетка-хозяин», используемая здесь, как правило, относится к клетке, которая была трансфицирована ДНК с экзогенной последовательностью. Клетки из стабильной клеточной линии человека 293 (легко доступны, например, в American Type Culture Collection под номером доступа АТСС CRL1573), могут быть использованы при практическом осуществлении настоящего изобретения. В частности, клеточная линия 293 человека представляет собой линию эмбриональных клеток почки человека, которая была трансформирована фрагментами ДНК аденовируса 5 типа и которая экспрессирует аденовирусные гены Е1а и Elb. Клеточная линия 293 легко трансфицируется и обеспечивает особенно удобную платформу для получения вирионов rAAV.
Под «кодирующей областью rep AAV» понимают принятую в данной сфере область генома AAV, которая кодирует белки репликации Rep 78, Rep 68, Rep 52 и Rep 40. Показано, что эти продукты экспрессии Rep обладают многими функциями, включая распознавание, связывание и внесение одноцепочечного разрыва в точку начала репликации ДНК AAV, активность ДНК-хеликазы и модулирование транскрипции с промоторов AAV (или других гетерологичных промоторов). Продукты экспрессии Rep в совокупности необходимы для репликации генома AAV. Подходящие гомологи кодирующей области rep AAV включают ген rep вируса герпеса 6 человека (HHV-6), о котором также известно, что он опосредует репликацию ДНК AAV-2.
Под «кодирующей областью cap AAV» понимают принятую в данной сфере область генома AAV, которая кодирует капсидные белки VP1, VP2 и VP3, или их функциональные гомологи. Эти продукты экспрессии Сар обеспечивают функции упаковки, которые в совокупности необходимы для упаковывания вирусного генома.
В одном варианте осуществления функции хелпера AAV вводят в клетку-хозяина посредством трансфицирования клетки-хозяина хелперной конструкцией AAV или до трансфекции экспрессионным вектором AAV, или одновременно с ней. Таким образом, хелперные конструкции AAV используют для обеспечения по меньшей мере временной экспрессии генов rep и/или cap AAV для восполнения отсутствующих функций AAV, которые необходимы для продуктивной инфекции AAV. Хелперные конструкции AAV не содержат ITR AAV и не могут осуществлять ни репликацию, ни упаковку самих себя. Эти конструкции могут быть в форме плазмиды, фага, транспозона, космиды, вируса или вириона. Описано множество хелперных конструкций AAV, таких как обычно используемые плазмиды pAAV/Ad и рIМ29+45, которые кодируют продукты экспрессии Rep и Сар. Описано множество других векторов, которые кодируют продукты экспрессии Rep и/или Сар.
Способы доставки вирусных векторов включают инъекцию AAV субъекту. Как правило, вирионы rAAV вводят в клетки CNS, используя способы трансдукции in vivo или in vitro. В случае трандукции in vitro, желаемую клетку-реципиента забирают у субъекта, трансдуцируют вирионами rAAV и повторно вводят субъекту. Альтернативно, можно использовать сингенные или ксеногенные клетки, при этом указанные клетки не вызывают у субъекта ненадлежащего иммунного ответа.
Подходящие способы для доставки и введения трансдуцированных клеток субъекту описаны. Например, клетки можно трансдуцировать in vitro, объединяя рекомбинантные вирионы AAV с клетками CNS, например, в соответствующей среде, и можно осуществлять скрининг клеток для обнаружения тех клеток, которые несут представляющую интерес ДНК, используя способы, такие как Саузерн-блоттинг и/или PCR, или используя селективные маркеры. Затем трансдуцированные клетки можно вводить в фармацевтические композиции, описанные более подробно ниже, и указанные композиции вводить субъекту различными способами, такими как прививание, внутримышечная, внутривенная, подкожная и интраперитонеальная инъекция.
В одном варианте осуществления фармацевтические композиции содержат достаточно генетического материала для получения терапевтически эффективного количества представляющей интерес нуклеиновой кислоты, то есть количества, достаточного для уменьшения или ослабления симптомов рассматриваемого заболевания, или количества, достаточного для получения желаемого терапевтического эффекта. Фармацевтические композиции будут также содержать фармацевтически приемлемое вспомогательное вещество. Такие вспомогательные вещества включают любые фармацевтические агенты, которые сами по себе не вызывают продукцию антител, вредных для индивидуума, получающего композицию, и которые могут быть введены без чрезмерной токсичности. Фармацевтически приемлемые вспомогательные вещества включают, но без ограничения, сорбит, твин-80, и жидкости, такие как вода, солевой раствор, глицерин и этанол. Фармацевтически приемлемые соли могут быть включены, например, соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты, сульфаты и т.п.; и соли органических кислот, такие как ацетаты, пропионаты, малонаты, безоаты и т.п. Кроме того, вспомогательные вещества, такие как смачивающие или эмульгирующие агенты, pH буферные вещества и т.п., могут присутствовать в таких носителях. Более подробное описание фармацевтически приемлемых вспомогательных веществ можно найти в Remington's Pharmaceutical Sciences (Mack Pub. Co., N.J. 1991).
Следует понимать, что более чем один трансген может экспрессироваться доставленным вирусным вектором. Альтернативно, отдельные векторы, каждый, экспрессирующий один или несколько различных трансгенов, также могут быть доставлены субъекту, как описано здесь. Кроме того, также предполагается, что вирусные векторы, доставленные способами согласно настоящему изобретению, могут быть объединены с другими подходящими композициями и терапиями.
Для специалистов в данной области будет очевидно, что в свете учений данного описания эффективное количество вирусного вектора, которое должно быть добавлено, может быть определено эмпирически. Введение может быть осуществлено с помощью одной дозы, непрерывно или периодически на протяжении курса лечения. Способы определения наиболее эффективных средств и доз введения хорошо известны специалистам в данной области и будут изменяться в зависимости от вирусного вектора, композиции терапии, клеток-мишеней и субъекта, подвергаемого лечению. Однократное и многократные введения могут быть выполнены при уровне дозы и по схеме, выбранной терапевтом.
В некоторых вариантах осуществления rAAV вводят в дозе примерно 0,3-2 мл 1×105 - 1×1016 vg/мл. В некоторых вариантах осуществления rAAV вводят в дозе примерно 1-3 мл 1×107 - 1×1014 vg/мл. В некоторых вариантах осуществления rAAV вводят в дозе примерно 1-2 мл 1×108 - 1×1013 vg/мл.
Составы, содержащие частицы rAAV, будут содержать эффективное количество частиц rAAV в носителе, при этом эффективное количество может быть легко определено специалистом в данной области. Частицы rAAV обычно составляют примерно от 1% до 95% (масса/масса) композиции, или даже выше или ниже при необходимости. Количество, подлежащее введению, зависит от таких факторов, как возраст, вес и физическое состояние животного или субъект-человека, подлежащего лечению. Эффективные дозы могут быть установлены специалистом в данной области посредством обычных экспериментов, определяющих кривые доза-ответ. Лечение субъекта осуществляют путем введения частиц rAAV в виде одной или нескольких доз. Может быть введено множество доз, требуемых для поддержания адекватной ферментативной активности.
Носители, включая воду, водный солевой раствор, искусственную CSF и другие известные вещества, могут быть использованы в настоящем изобретении. Для изготовления препарата очищенную композицию можно изолировать, лиофилизировать и стабилизировать. Затем композицию можно довести до соответствующей концентрации, необязательно объединить с противовоспалительным агентом и упаковать для применения.
Настоящее изобретение обеспечивает способ повышения уровня целевого белка в клетке путем введения белка, или молекулы нуклеиновой кислоты, кодирующей белок, описанный выше, в клетку в количестве, достаточном для повышения уровня целевого белка в клетке. В некоторых вариантах осуществления накопление целевого белка увеличилось по меньшей мере на 10%. Накопление целевого белка увеличилось по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 95% или 99%.
Кроме того, AAV-вектор может быть выбран/разработан в соответствии с желательным способом введения, например, и без ограничения, для системного введения, при этом может быть использован AAV-вектор, способный проходить через гематоэнцефалический барьер (например, AAV9, или химерный AAV-вектор, содержащий капсидные белки AAV9). Настоящее изобретение также обеспечивает способ введения AAV в кровоток, поскольку некоторые серотипы способны проходить через гематоэнцефалический барьер.
Нацеливающие пептиды
Были идентифицированы пептиды, функция которых состоит в нацеливании агентов, таких как вирусные векторы, на сосудистые эндотелиальные клетки центральной нервной системы. В настоящем изобретении описан способ использования этих новых пептидов для перенаправления, например, вирусных капсидов в клетку представляющего интерес типа. В этом случае эндотелиальные клетки, выстилающие кровеносные сосуды, являются нацеленными идентифицированными пептидами. Векторы, несущие капсидные белки, модифицированные для включения таких пептидов, могут быть использованы для доставки терапевтических агентов в центральную нервную систему (например, головной мозг).
Используемый здесь термин «нацеливает» означает, что капсидный белок вируса, такого как аденоассоциированный вирус (AAV), преимущественно связывается с одним типом ткани (например, тканью головного мозга), чем с другим типом ткани (например, тканью печени), и/или связывается с тканью в определенном состоянии (например, дикого типа или пораженной заболеванием). В определенных вариантах осуществления генетически модифицированный капсидный белок может «нацеливать» сосудистую эпителиальную ткань головного мозга путем связывания на уровне, который на 10-1000% выше, чем аналогичный немодифицированный капсидный белок. Например, AAV, содержащий генетически модифицированный капсидный белок, может связываться с сосудистой эпителиальной тканью головного мозга на уровне, который на 50-100%» выше, чем немодифицированный AAV-вирус. В определенных вариантах осуществления нуклеиновые кислоты, кодирующие капсидные белки вируса, модифицированы таким образом, что вирусные капсиды преимущественно связываются с сосудистым эндотелием головного мозга млекопитающего, страдающего лизосомной болезнью накопления, или, используя другие последовательности, с сосудистым эндотелием головного мозга дикого типа в головном мозге таких же видов.
Настоящее изобретение обеспечивает модифицированный капсидный белок аденоассоциированного вируса (AAV), содержащий нацеливающий пептид, при этом нацеливающий пептид имеет длину от 3 до 10 аминокислот и при этом нацеливающий пептид нацеливает AAV на сосудистый эндотелий головного мозга. В определенных вариантах осуществления нацеливающий пептид имеет 3, 4, 5, 6 или 7 аминокислот в длину. В определенных вариантах осуществления AAV представляет собой AAV2, хотя тропизм является модифицированным, поэтому такие модификации будут изменять тропизм любого AAV.
В определенных вариантах осуществления настоящего изобретения предлагается вирусный вектор, содержащий модифицированный капсид, при этом модифицированный капсид содержит по меньшей мере одну аминокислотную последовательность, которая нацеливает вирусный вектор на сосудистый эндотелий головного мозга.
В определенных вариантах осуществления вирусный вектор представляет собой аденоассоциированный вирусный вектор (AAV). В определенных вариантах осуществления AAV представляет собой AAV2.
В определенных вариантах осуществления нацеливающий пептид нацеливает на сосудистый эндотелий головного мозга дикого типа. В определенных вариантах осуществления нацеливающий пептид представляет собой PXXPS (SEQ ID NO: 44), SPXXP (SEQ ID NO: 45), TLH (SEQ ID NO: 46) или QSXY (SEQ ID NO: 47), экспрессирующийся в ориентации от амино к карбокси или от карбокси к амино. В определенных вариантах осуществления нацеливающий пептид представляет собой PYFPSLS (SEQ ID NO: 48), YAPLTPS (SEQ ID NO: 49), PLSPSAY (SEQ ID NO: 50), DSPAHPS (SEQ ID NO: 51), GTPTHPS (SEQ ID NO: 52), PDAPSNH (SEQ ID NO: 53), TEPHWPS (SEQ ID NO: 54), SPPLPPK (SEQ ID NO: 55), SPKPPPG (SEQ ID NO: 56), NWSPWDP (SEQ ID NO: 57), DSPAHPS (SEQ ID NO: 58), GWTLHNK (SEQ ID NO: 59), KIPPTLH (SEQ ID NO: 60), ISQTLHG (SEQ ID NO: 61), QSFYILT (SEQ ID NO: 62) или TTQSEYG (SEQ ID NO: 63), экспрессирующийся в ориентации от амино к карбокси или от карбокси к амино. Следует иметь в виду, что ориентация последовательности не является важной. Например, пептид может быть ориентирован от амино-терминального конца к карбокси-терминальному концу пептида TTQSEYG (SEQ ID NO: 63) или может быть от амино-терминального конца к карбокси-терминальному концу пептида GYESQTT (SEQ ID NO: 65).
В некоторых вариантах осуществления нацеливающий пептид нацеливает на пораженный заболеванием сосудистый эндотелий головного мозга. В некоторых вариантах осуществления нацеливающий пептид нацеливает на сосудистый эндотелий головного мозга у субъекта, который имеет лизосомную болезнь накопления. В некоторых вариантах осуществления нацеливающий пептид нацеливает на мукополисахарид (MPS) VII сосудистого эндотелия головного мозга. В некоторых вариантах осуществления нацеливающий пептид представляет собой LXSS (SEQ ID NO: 66), PFXG (SEQ ID NO: 67) или SIXA (SEQ ID NO: 68), экспрессирующийся в ориентации от амино к карбокси или от карбокси к амино. В некоторых вариантах осуществления нацеливающий пептид представляет собой MLVSSPA (SEQ ID NO: 69), LPSSLQK (SEQ ID NO: 70), PPLLKSS (SEQ ID NO: 71), PXKLDSS (SEQ ID NO: 72), AWTLASS (SEQ ID NO: 73), WPFYGTP (SEQ ID NO: 74), GTFPFLG (SEQ ID NO: 75), GQVPFMG (SEQ ID NO: 76), ANFSILA (SEQ ID NO: 77), GSIWAPA (SEQ ID NO: 78) или SIAASFS (SEQ ID NO: 79), экспрессирующийся в ориентации от амино к карбокси или от карбокси к амино.
В некоторых вариантах осуществления нацеливающий пептид нацеливает на ТРР1 сосудистый эндотелий головного мозга. В некоторых вариантах осуществления нацеливающий пептид представляет собой GMNAFRA (SEQ ID NO: 64), экспрессирующуюся в ориентации от амино к карбокси или от карбокси к амино.
В некоторых вариантах осуществления аминокислотная последовательность, которая нацеливает на сосудистый эндотелий головного мозга, содержит по меньшей мере одну из SEQ ID NO 44-47.
В некоторых вариантах осуществления аминокислотная последовательность, которая нацеливает на сосудистый эндотелий головного мозга, содержит по меньшей мере одну из SEQ ID NO 66-68.
В некоторых вариантах осуществления аминокислотная последовательность, которая нацеливает на сосудистый эндотелий головного мозга, содержит по меньшей мере одну из SEQ ID NO 48-63.
В некоторых вариантах осуществления аминокислотная последовательность, которая нацеливает на сосудистый эндотелий головного мозга, содержит по меньшей мере одну из SEQ ID NO 69-79.
В некоторых вариантах осуществления аминокислотная последовательность, которая нацеливает на ткань головного мозга, выбрана из последовательностей, указанных в таблице 1 ниже:
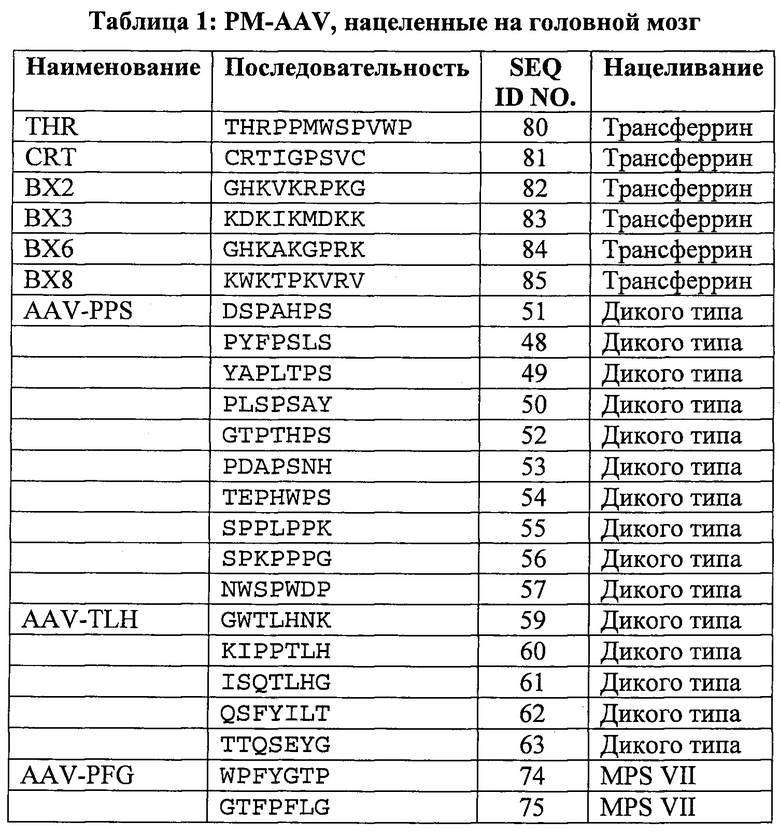
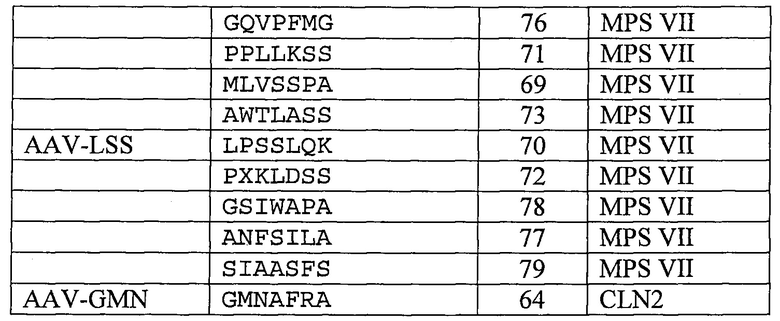
В некоторых вариантах осуществления аминокислотная последовательность, которая нацеливает на сосудистый эндотелий головного мозга, нацеливает на сосудистый эндотелий головного мозга у субъекта, имеющего заболевание, например, лизосомную болезнь накопления.
В некоторых вариантах осуществления аминокислотная последовательность, которая нацеливает на сосудистый эндотелий головного мозга, нацеливает на сосудистый эндотелий головного мозга у субъекта, который не имеет лизосомной болезни накопления.
В некоторых вариантах осуществления вирусный вектор содержит нуклеотидную последовательность, кодирующую терапевтический агент. В некоторых вариантах осуществления терапевтический агент представляет собой β-глюкуронидазу.
В некоторых вариантах осуществления аминокислотная последовательность, которая нацеливает на сосудистый эндотелий головного мозга, имеет длину не более десять аминокислот.
В некоторых вариантах осуществления аминокислотная последовательность, которая нацеливает на сосудистый эндотелий головного мозга, имеет длину 3, 4, 5, 6 или 7 аминокислот.
В некоторых вариантах осуществления настоящего изобретения предлагается нуклеотидная последовательность, кодирующая вирусный вектор, описанный здесь.
В некоторых вариантах осуществления настоящего изобретения предлагается нуклеотидная последовательность, кодирующая модифицированный капсид, описанный здесь. В некоторых вариантах осуществления настоящего изобретения предлагается модифицированный капсид, кодируемый нуклеотидной последовательностью, описанной здесь.
В некоторых вариантах осуществления настоящего изобретения предлагается клетка, содержащая вирусный вектор, описанный здесь.
В некоторых вариантах осуществления настоящего изобретения предлагается клетка, трансдуцированная вирусным вектором, описанным здесь.
В некоторых вариантах осуществления клетка представляет собой клетку млекопитающего. В некоторых вариантах осуществления клетка представляет собой клетку человека. В некоторых вариантах осуществления клетка представляет собой клетку нечеловеческую клетку. В некоторых вариантах осуществления клетка представляет собой клетку in vitro. В некоторых вариантах осуществления клетка представляет собой клетку in vivo. В некоторых вариантах осуществления клетка представляет собой эндотелиальную клетку. В некоторых вариантах осуществления клетка представляет собой сосудистую эндотелиальную клетку.
Дозы, лекарственные формы и способы введения агентов согласно изобретению
Агенты согласно изобретению предпочтительно вводят таким образом, чтобы в конечном итоге достигнуть уменьшения по меньшей мере одного симптома, связанного с заболеванием. Вводимое количество может изменяться в зависимости от различных факторов, включая, но без ограничения, выбранную композиция, конкретное заболевание, вес, физическое состояние и возраст млекопитающего, а также в зависимости от того, должно ли быть достигнуто предупреждение заболевания или его лечение. Такие факторы могут быть легко определены клиницистом с использованием животных моделей или других тестовых систем, которые хорошо известны в данной области. Используемый здесь термин «терапевтическая siRNA» относится к любой siRNA, которая оказывает благоприятный эффект на реципиента. Таким образом, «терапевтическая siRNA» охватывает как терапевтическую, так и профилактическую siRNA.
Введение siRNA может быть осуществлено посредством введение молекулы нуклеиновой кислоты, кодирующей siRNA. Фармацевтические препараты, дозы и способы введения нуклеиновых кислот в целом являются известными.
В настоящем изобретении рассматривается лечение болезни Гентингтона у млекопитающего путем введения агента, например, композиции нуклеиновой кислоты, экспрессионного вектора или вирусной частицы согласно изобретению. Введение терапевтических агентов в соответствии с настоящим изобретением может быть непрерывным или периодическим, в зависимости, например, от физиологического состояния реципиента, независимо от того, осуществляется ли введение с терапевтической или профилактической целью, и других факторов, известных опытным практикующим врачам. Введение агентов согласно изобретению может быть по существу непрерывным в течение предварительно выбранного периода времени или может быть осуществлено в виде серий доз, вводимых с определенными интервалами. Рассматриваются как местное, так и системное введение.
Одна или несколько подходящих единичных лекарственных форм, содержащих терапевтический агент(ы) согласно изобретению, которые, как описано ниже, могут необязательно быть составлены для замедленного высвобождения (например, с использованием микроинкапсулирования, смотри WO 94/07529, и патент США 4962091, полное описание которых включено здесь посредством ссылки), могут быть введены различными путями, включая парентеральное введение, в том числе внутривенное и внутримышечное введение, а также путем прямой инъекции в пораженную заболеванием ткань. Например, терапевтический агент может быть напрямую инъецирован в головной мозг. Альтернативно, терапевтический агент может быть введен интратекально для заболеваний головного мозга и позвоночника. В другом примере терапевтический агент может быть введен внутримышечно для вирусов, которые возвращаются обратно в пораженные нейроны из мышц, таких как AAV, лентивирус и аденовирус. Препараты могут быть при необходимости представлены удобным образом в виде дискретных стандартных лекарственных форм и могут быть получены любым способом, известным в области фармацевтики. Такие способы могут включать стадию приведения в контакт терапевтического агента с жидким носителем, твердыми матрицами, полутвердыми носителями, тонкоизмельченными твердыми носителями или их комбинациями, а затем, при необходимости, введения или формования продукта в желаемую систему доставки.
Когда терапевтические агенты согласно изобретению готовят для введения, их предпочтительно объединяют с фармацевтически приемлемым носителем, разбавителем или вспомогательным веществом с образованием фармацевтического состава или стандартной лекарственной формы. Общее содержание активных ингредиентов в таких составах составляет от 0,1% до 99,9% по массе состава. «Фармацевтически приемлемый» является носитель, разбавитель, вспомогательное вещество и/или соль, который совместим с другими ингредиентами состава и не оказывает вредного воздействия на реципиента. Активный ингредиент для введения может присутствовать в виде порошка или в виде гранул, в виде раствора, суспензии или эмульсии.
Фармацевтические составы, содержащие терапевтический агент согласно изобретению, могут быть получены с помощью процедур, хорошо известных в данной области и легкодоступных ингредиентов. Терапевтические агенты согласно изобретению могут быть также составлены в виде растворов, подходящих для парентерального введения, например, путем внутримышечного, подкожного или внутривенного введения.
Фармацевтические составы терапевтических агентов согласно изобретению могут быть также представлены в форме водного или безводного раствора или дисперсии, или альтернативно в форме эмульсии или суспензии.
Таким образом, терапевтический агент может быть составлен для парентерального введения (например, путем инъекции, например, болюсной инъекции или непрерывной инфузии) и может быть представлен в виде стандартной лекарственной формы в ампулах, предварительно заполненных шприцах, контейнерах для инфузии малого объема или контейнерах для множества доз с добавленным консервантом. Активные ингредиенты могут быть представлены в форме суспензий, растворов или эмульсий в масляных или водных носителях, и могут содержать агенты, способствующие составлению, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активные ингредиенты могут быть представлены в форме порошка, полученного путем асептического изолирования стерильного твердого вещества или путем лиофилизации из раствора, для восстановления с помощью подходящего носителя, например, стерильной апирогенной воды, перед использованием.
Следует учесть, что количество активного ингредиента или ингредиентов, содержащееся в единичной дозе аэрозоля каждой лекарственной формы само по себе не должно составлять эффективное количество для лечения конкретного признака или заболевания, поскольку необходимое эффективное количество может быть достигнуто путем введения множества единичных доз. Кроме того, эффективное количество может быть достигнуто с использованием меньшей дозы, чем доза, содержащаяся в лекарственной форме, индивидуально или в сериях введений.
Фармацевтические составы согласно настоящему изобретению могут включать в виде необязательных ингредиентов, фармацевтически приемлемые носители, разбавители, солюбилизаторы или эмульгирующие агенты, и соли типа, которые хорошо известны в данной области. Специфические неограничивающие примеры носителей и/или разбавителей, которые являются полезными в фармацевтических составах настоящего изобретения, включают воду и физиологически приемлемые буферные солевые растворы, такие как фосфатные буферные солевые растворы, pH 7,0-8,0 солевые растворы и воду.
Изобретение сейчас будет проиллюстрировано с помощью следующих неограничивающих примеров.
Пример 1
Однонуклеотидная модификация затравки восстанавливает переносимость in vivo токсической последовательности miRNA в мышином головном мозге
Болезнь хантингтона (HD) представляет собой фатальное нейродегенеративное заболевание, вызванное экспрессией расширенной полиглутамином формы хантингтина (НТТ). В недавней работе показано, что подходы, основанные на сайленсинге генов, включая интерференцию РНК (RNAi), улучшают показатели заболевания в мышиных моделях HD. Для продвижения применения нацеленной на HTT RNAi в клинических условиях разработали конструкцию RNAi, HDS1, с устойчивой эффективностью целевого сайленсинга и минимальным сайленсингом незапланированных человеческих транскриптов (McBride et al., Mol Ther. Dec 2011; 19(12): 2152-2162). У макак-резусов доставка AAV.miHDS1 в путамен уменьшила экспрессию НТТ без побочного эффекта на неврологический статус, включая мелкую и крупную моторику, без иммунной активации и без невропатологии в течение 6 недель после инъекции. Другие продемонстрировали безопасность различных нацеленных на HTT RNAi у обезьян в течение 6 месяцев после инъекции.
Применение HDS1 у пациентов с HD требует дополнительного тестирования безопасности на грызунах, несмотря на тот факт, что была проведена оптимизация для применения у человека. Для выполнения этого нормативного требования была проведена оценка мышей после инъекции AAV.miHDS1. В отличие от обезьян, неврологические дефициты возникали остро в головном мозге мышей и могли быть связаны с нецелевым сайленсингом посредством взаимодействий miHDS1 с 3'-нетранслируемой областью других транскриптов. Хотя была решена проблема, связанная с токсичностью miHDS1 в головном мозге мышей и сохранялась эффективность сайленсинга miHDS1, в этих исследованиях обращается внимание на то, что оптимизация лекарственных средств на основе нуклеиновых кислот в отношении безопасности для применения у человека представляет проблемы безопасного тестирования на грызунах или других отдаленно родственных видах.
Болезнь Хантингтона (HD) вызвана экспансией СAG-повторов ( повторов) в пределах первого экзона хантингтина. Хотя мутантный хантингтин (mHTT) убиквитарно экспрессируется, головной мозг и, в частности, стриатум, показывает устойчивую и раннюю дегенерацию. Частота случаев возникновения HD составляет ~5-10 случаев на 100000 индивидуумов в Европе и США, с началом, как правило, на 3-ем или 4-ом десятке лет жизни. В настоящее время управление HD включает лекарственные средства, которые уменьшают двигательные или психиатрические симптомы.
повторов) в пределах первого экзона хантингтина. Хотя мутантный хантингтин (mHTT) убиквитарно экспрессируется, головной мозг и, в частности, стриатум, показывает устойчивую и раннюю дегенерацию. Частота случаев возникновения HD составляет ~5-10 случаев на 100000 индивидуумов в Европе и США, с началом, как правило, на 3-ем или 4-ом десятке лет жизни. В настоящее время управление HD включает лекарственные средства, которые уменьшают двигательные или психиатрические симптомы.
В предшествующей работе, в которой использовали индуцируемые модели HD, было показано, что симптомы заболевания улучшаются, как только выключается экспрессии mHTT, даже через несколько недель после начала заболевания и после стриарной атрофии. На основании этого можно сделать вывод о том, что существует удачная возможность лечения HD после возникновения ранних симптомов. Таким образом, способы уменьшения генной экспрессии с использованием технологий сайленсинга генов, включая RNAi, должны быть исследованы в качестве терапевтической альтернативы.
RNAi представляет собой эволюционно сберегающий процесс посттрансляционного сайленсинга генов, посредством которого двухцепочечные малые некодирующие РНК (например, miRNA) вызывают последовательность-специфическую деградацию целевых последовательностей мРНК. Эндогенные пути RNAi начинаются с экспрессии более крупного первичного транскрипта РНК (pri-miRNA), который последовательно расщепляется в ядре ферментом Drosha, компонентом микророцессорного комплекса, с образованием прекурсора miRNA (pre-miRNA). pre-miRNA экспортируются в цитоплазму и последовательно расщепляются ферментом Dicer, высвобождая зрелую miRNA. Из двух цепей последовательности miRNA одна (антисмысловая «направляющая» цепь), как правило, преимущественно встраивается в РНК-индуцированный комплекс сайленсинга (RISC), где она будет направлять связывание с целевой мРНК и ингибировать экспрессию. Как правило, miRNA подавляют экспрессию мРНК посредством частичной комплементарности. Когда одна цепь dsRNA, образующаяся в результате расщепления ферментом Dicer, полностью комплементарна своей мишени, полученная малая интерферирующая РНК (siRNA) направляет эндонуклеотидное расщепление мишени по основанию между нуклеотидам 10 и 11 «направляющей» цепи, запуская деструкцию мРНК. Ученые разработали различные системы на основе экспрессии для кооптирования эндогенного пути RNAi и подавления экспрессии определенных генов. Например, экспрессионные системы на основе RNAi могут быть сконструированы так, чтобы они могли экспрессировать последовательности коротких шпилечных РНК с одной из ее цепей, комплементарных целевой мРНК, и входить на путь на стадиях pre-miRNA (короткая шпилечная РНК; shRNA) или pri-miRNA (искусственная miRNA).
Для экспрессионных систем или siRNA, которые остро трансфицированы в клетки, активная направляющая цепь сконструирована так, чтобы она была специфической, насколько это возможно, с минимальным сайленсингом нецелевой последовательности. Сайленсинг нецелевой последовательности, возникающий в результате взаимодействия направляющей последовательности с другими транскриптами с полной комплементарностью, можно избежать с использованием стандартных алгоритмов исследования. Более трудный тип нецелевого сайленсинга, который следует избегать, возникает вследствие частичной комплементарности последовательности затравки RNAi, оснований 2-7 на 5'-конце нагруженной цепи, с другими 3'UTR последовательностями. мРНК. В этом случае подавление экспрессии происходит посредством механизма, подобного миРНК. В предыдущих исследованиях был разработан алгоритм siSPOTR для конструирования сильных последовательностей RNAi с сильным смещением цепи для нагрузки RISC, и сведена к минимуму вероятность нецелевого сайленсинга незапланированных человеческих транскриптов. Когда siSPOTR использовали для конструирования инициаторов для сайленсинга НТТ, было обнаружено, что miHDS1, экспрессирующийся из AAV векторов, показал безопасность на нескольких уровнях после доставки в путамен примата, отличного от человека.
В качестве необходимого требования для применения у человека были проведены последующие эксперименты с целью оценки безопасности у нормальных грызунов. В частности, было обнаружено, что конструкция HDS1 индуцировала устойчивые двигательные дефициты после стриарных инъекций, что может быть связано с незапланированным сайленсингом Bcl2. Кроме того, было показано, что нецелевая токсичность может быть урегулирована с помощью нескольких стратегий, сохраняя при этом эффективность сайленсинга НТТ. В целом эти исследования выявляют трудность оптимизации лекарственных средств на основе нуклеиновых кислот в отношении специфичности и безопасности для применения у человека, которые при применении у отдаленно родственных видов будут показывать разные и возможно индуцирующие заболевание нецелевые профили.
Результаты
miHDS1 индуцирует неврологические дефициты в головном мозге мышей
В предшествующей работе была сконструирована miHDS1, искусственная последовательность miRNA против хантингтина с высокой эффективностью целевого сайленсинга и минимальным нецелевым потенциалом (фигура 1А). Когда AAV-векторы, экспрессирующие miHDS1, вводили в путамен приматов, отличных от человека, уровни НТТ были значительно снижены, и не было признаков дегенерации нейронов, иммунных ответов или двигательных дефицитов. В целом, эти исследования выявили потенциал miHDS1 для лечения HD. Однако в качестве необходимого требования для применения у человека требуется дополнительное тестирование на других видах, таких как грызуны. Таким образом, было принято решение о проведении тестирования AAV.miHSDl на нормальных мышах на безопасность, несмотря на то, что он был сконструирован для безопасного применения в человеческих клетках.
В качестве первого шага в построении доклинической конструкции был переделан вектор AAV.miHSDl так, чтобы он содержал спейсерную последовательность, а не экспрессионную кассету eGFP, которую использовали в предыдущих исследованиях по визуализации трансдуцированных областей. Спейсерная последовательность была сконструирована так, чтобы она не содержала энхансерных или репрессорных последовательностей, активаторов или супрессоров сплайсинга и антисмысловых или других некодирующих РНК, и имела достаточный размер для оптимальной упаковки малой RNAi-экспрессионной кассеты. Конечные AAV2/1-векторы экспрессировали miHDS1 или miCtl, контроль использовали ранее во многих из исследований in vivo, проведенных авторами настоящего изобретения (фигура 1В).
Мышей дикого типа взвешивали, и исходное тестирование на вращающемся стержне проводили в возрасте 7 недель до распределения животных на группы с равными способностями (для того, чтобы избежать различий между группами, которые могут возникнуть до лечения). AAV.miHDS1 или AAV.miCtl инъецировали билатерально в стриатум в возрасте 8-недель с вирусом AAVmiHDS1 /Stuffer (n=13) и AAVmiCtl/Stuffer (n=11) (фигура 1С, D). Уже через 2 месяца после доставки AAV мыши, экспрессирующие miHDS1, имели значительные дефициты на вращающемся стержне и показали меньший временной интервал до падения по сравнению с обработанными контролем однопометниками (фигура 1D). И в то время как все животные прибавили в весе за период исследования, мыши, обработанные HDS1, прибавили в весе значительно меньше, чем мыши, обработанные miCtl (фигура 1Е).
Характеристика нецелевых генов miHDS1 в головном мозге мышей
Последовательность miHDS1 была сконструирована так, чтобы она имела минимальный нецелевой сайленсинг человеческих транскриптов, но не была оптимизирована для безопасного применения у мыши, и ранее не была проведена оценка указанной последовательности на потенциальную токсичность в отношении мышиных транскриптов мыши in silico. Хотя конструкция AAV.miHDS1.eGFP, используемая ранее на мартышках, показала надлежащую нагрузку цепи, следующим шагом тестировали точность экспрессионной кассеты miHDS1.stuffer на смещение цепи, поскольку любая цепь, если она нагружена, может вызывать нецелевой сайленсинг. Для этого были разработаны репортерные конструкции, состоящие из мишеней miHDS1, клонированных ниже (в 3'-направлении) репортера люциферазы. Была обнаружена репрессия из направляющей цепи, и отсутствие репрессии из ненаправляющей цепи (фигура 1G). Это согласуется с проведенными ранее in vitro анализами экспрессии экспрессионных кассет HDS1.eGFP, и подтверждается тем фактом, была сконструирована последовательность miHDS1 с низкой термодинамической стабильностью на 5'-конце для содействия надлежащей загрузке направляющей «антисмысловой» цепи в RISC-комплексе. Таким образом, дефициты нейронов, наблюдаемые по экспрессии miHDS1, по-видимому, обусловлены связыванием направляющей «антисмысловой» цепи с 3'UTR незапланированных мРНК и подавлением экспрессии с помощью механизма, подобного miRNA.
Так как предыдущие исследования продемонстрировали, что большинство нецелевых эффектов обусловлено связыванием, опосредованным затравкой, с другими 3'-нетранслируемыми участками (3'UTR) мРНК, сначала идентифицировали возможные немишени miHDS1 с использованием общего подхода in silico. Множество различных программ предсказания мишени описано для идентификации предполагаемых сайтов связывания miRNA, такие как алгоритмы TargetScan (TS) и PITA. TargetScan прогнозирует биологические мишени для специфических miRNA путем поиска последовательностей 3'UTR на присутствие сайтов 8mer и 7mer, комплементарных затравочной последовательности miRNA. Алгоритм повышает точность прогнозирования мишени путем приоритизации сайтов мишени с компенсаторным 3'-спариванием оснований, текстом локальной последовательности и консервацией сильной последовательности, которая, как известно, способствует miRNA-опосредованной регуляции. Так как предыдущая работа показала, что опосредованные затравкой нецелевые эффекты являются видо-специфическими, был использован алгоритм TargetScan для прогнозирования мишеней исходя из комплементарности затравочной последовательности в мышином 3'UTR-транскриптоме. Алгоритм PITA включает доступность сайта мишени для прогнозирования сайтов связывания miRNA. Для заданного сайта мишени PITA определяет величину показателя ddG, разности между свободной энергией связывания miRNA с мишенью (dGduplex) и распариванием нуклеотидов сайта-мишени (dGopen). На основании PITA показатели ddG ниже -10 вероятнее всего будут функциональными для эндогенных мишеней miRNA, хотя пороговое значение для сверхэкспрессирующейся последовательности miRNA может быть выше (от 0 до -10). Таким образом, в своем подходе авторы использовали TargetScan для идентификации всех потенциальных сайтов связывания с затравкой, а затем с помощью алгоритма PITA определяли показатель ddG, и ранжировали все потенциальные сайты miHDS1. Используя этот подход в отношении мышой 3'UTRome было предсказано 197 транскриптов в качестве потенциальных немишеней для miHDS 1, при этом 170 экспрессировались в стриатуме (фигура 3с). Как ожидалось, прогнозирование немишеней miHDS1 в ортологичных человеческих и резус 3'UTR выявило, что нецелевые эффекты miHDS1 у мышей не сохраняется
Были идентифицированы Bcl2, Sdf4, Smad9, Bmi1, Mettl2, Lancl1 и Map2k6 из наибольшего 25-го процентиля перечня генов-немишеней (фигура 2а, b). Были подвергнуты анализу образцы стриатума, полученные от мышей, обработанных miCtl или miHDS1, с помощью Q-PCR в отношении этих предсказанных немишеней и мышиного Htt. Как ожидалось, экспрессия мышиного Htt была значительно снижена (до 70%) у мышей, обработанных miHDS1, по сравнению с мышами, обработанными miCtl (фигура 2с). Из набора подвергнутых анализу нецелевых транскриптов Bcl2, Sdf4 и Map2k6 были значительно снижены на образцах тканей, полученных от мышей, обработанных AAV.miHDS1 (фигура 2с). Прогнозировалось, чтобы ни на один из этих транскриптов не будет воздействовать miCtl. Эти результаты были подтверждены с использованием иммортализованной линии клеток нейронов стриатума мышей, которая имеет нормальную аллель Htt (клетки SthdhQ7). Клетки SthdhQ7 подвергали электропорации плазмидами, экспрессирующими miHDS1, miCtl или без транскрипта (содержали только промотор U6), и через 24 часа транскрипты анализировали с помощью Q-PCR. Как наблюдалось в головном мозге мышей, экспрессия Bcl2 была снижена в клетках, экспрессирующих miHDS1, а не в клетках, экспрессирующих miCtl или контрольную плазмиду U6 (фигура 2d). Напротив, экспрессия Sdf4 и Map2k6 не была снижена путем сверхэкспрессии miHDS1 (фигура 2d), на основании чего можно предположить, что эти гены могут не быть прямыми немишенями in vivo, и могут отражать непрямые эффекты супрессии Htt во времени или нецелевую супрессию в не-нейрональных клетках; хотя AAV2/1 трансдуцирует в первую очередь нейроны. Интересно то, что экспрессия Smad9 была значительно увеличена в клетках SthdhQ7, и была повышена, хотя и не столь значительно, в стриатуме, обработанном miHDS1 (фигура 2d). Таким образом, скриниг выявил, что Bcl2 является потенциально вредной немишенью HDS1 в мышином 3'UTRome.
Освобождение miHDS1 в отношении безопасности в головном мозге мыши
Когда последовательность miRNA загружена в RISC, содержащий каталитический белок Argonaute (Ago2), полная комплементарность связывания между miRNA и ее последовательностью-мишенью требуется для опосредования эндонуклеотического расщепления мРНК. Однако могут допускаться несоответствия (мисмэтчи) в результате точечных мутаций в последовательности miRNA. Таким образом, для модификации нецелевого профиля miHDS1, который направляется в первую очередь затравочной областью, вводили точечные мутации, разработанные для изменения затравки без воздействия на эффективность сайленсинга (фигура 3А).
В качестве первой стадии для идентификации, какие мутации затравки (i) эффективно изменяют нецелевой профиль, (ii) сохраняют низкий общий нецелевой потенциал и (iii) выключают человеческий НТТ, повторяли анализ прогнозирования немишени с использованием всех вариантов затравки с единичным нуклеотидом (положения 2-7) miHDS1 (фигура 3С). Мутанты в положении 8 были забракованы, так как нецелевой профиль широко перекрывался с профилем miHDS1. Это ожидалось, так как спаривание в положении 8 необязательно для miRNA-опосредованного сайленсинга. Мутанты затравки в положениях 3 и 4 также были забракованы, так как эти мутации значительно увеличили число предсказанных немишеней. Что касается остальных вариантов затравки, общий нецелевой потенциал был сопоставим с miHDS1, при этом менее 10% немишеней miHDS1 являлись общими для вариантов miHDS1 (фигура 3С).
Таким образом, были введены точечные мутации в положениях 2, 5, 6 и 7 области затравки miHDS1 для генерирования вариантов miHDS1. Так как целью является сайленсинг человеческого НТТ, сначала подвергали скринингу все варианты в линии клеток HEK293 человека и определяли эффективность сайленсинга с помощью Q-PCR (фигура 4А). Не все варианты miHDS1 понижали экспрессию НТТ эквивалентно исходной miHDS1. По сравнению с miHDS1, варианты miHDS1 с мисмэтчами в положениях 2 и 7 нарушали эффективность сайленсинга miHDS1. Однако значительных различий для вариантов miHDS1, содержащих мисмэтчи в положении 5 или 6, не наблюдалось. Следует отметить, что среди различных вариантов miHDS1 с мисмэтчем в положении 7 только вариант с заменой C>U обладал эквивалентной эффективностью сайленсинга, чем miHDS1, вероятно вследствие термодинамической стабильности колебания G:U. Были выбраны miHDS1v6A и miHDS1v5U для последующих экспериментов, исходя из: (1) их более высокой эффективности сайленсинга по сравнению с другими вариантами miRNA, содержащими мисмэтч в таком же положении в затравке, и (2) типа генерированного ошибочного спаривания нуклеотидов (мисмэтча) (U:U, miHDS1v5U; A:G, miHDS1v6A, фигура 4D), которые имеют умеренный нецелевой профиль, который значительно отличается от HDS1 (фигуры 4В, 4С, 4Е, 4F).
Нагруженные в RISC последовательности miRNA представляют собой следующие (Примечание: 3'→5'):
miHDS1v5U: 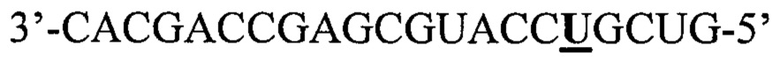 (SEQ ID NO: 6);
(SEQ ID NO: 6);
miHDS1v6A: 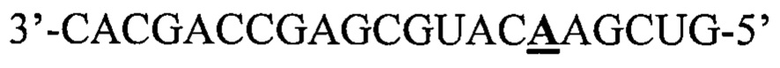 (SEQ ID NO: 7).
(SEQ ID NO: 7).
Pri-miHDS1 представляют собой следующие (5'→3'):
Pri-miHDS1v5U (SEQ ID NO: 8):

Pri-miHDS1v6A (SEQ ID NO: 9):
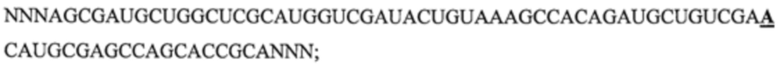
Pre-miHDS1 представляют собой следующие (5'→3'):
Pre-miHDS1v5U (SEQ ID NO: 10):

Pre-miHDS1v6A (SEQ ID NO: 11):
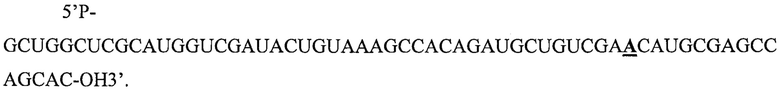
Как ожидалось, экспрессия miHDS1v6A и miHDS1v5U понижала уровни белка Htt в мышиной (SthdhQ7) и человеческой (HEK293) линии клеток без значительных различий в miHDS1 (фигуры 4А-4Е).
Затем оценивали эффект miHDS1v6A и miHDS1v5U по валидированным нецелевым мышиным транскриптам miHDS1. Стабильность спаривания затравок (Seed pairing stability, SPS), свободная энергия связывания между miRNA-затравкой и ее мРНК-мишенью влияет на способность последовательности miRNA вызывать эффекты нецелевого сайленсинга. Хотя варианты miHDS1 имели сходную величину SPS в отличие от исходной miHDS1 в отношении ее собственных мишеней, мисматчи в затравочной области вариантов miHDS1 уменьшили величину SPS по сравнению с немишенями miHDS1 (фигура 3b). На основе PITA введение мисмэтча в затравочную область уменьшило величину показателя ddG по всем предсказанным нецелевым генами HDS1, являясь более значительным для miHDS1v6A, чем miHDS1v5U. Интересно отметить, что затравочная последовательность вариантов miHDS1 генерировала отличающийся целевой сайт на некоторой из такой же немишени miHDS 1.
Ранее был продемонстрирован сайленсинг Bcl2 in vivo и in vitro с помощью miHDS1. На основе TargetScan, miHDS1v6A и miHDS1v5U более не будут нацелены на 3'UTR Bcl2, и PITA прогнозирует пониженный показатель ddG на сайте miHDS1, на основании чего можно предположить, что сайленсинг Bcl2 будет ослаблен miHDS1v6A или miHDS1v5U. Для проверки этого, клетки SthdhQ7 подвергали электропорации плазмидами, содержащими кассеты экспрессии miRNA, или контрольной плазмидой, содержащей только промотор U6, и через 24 часа определяли экспрессию Bcl2, Htt и Smad9 с помощью Q-PCR. По сравнению с контролями (miCtl и U6), уровни мРНК Htt были значительно снижены в клетках, подвергнутых электропорации miHDS1 и вариантом miHDS1 (фигура 4g). Но важно, что miHDS1 значительно снизила экспрессию Bcl2 на 40%, тогда как сайленсинга не наблюдалось после электропорации miHDS1v6A. Экспрессия miHDS1v5 была по-прежнему активной в отношении Bcl2, сохраняя уровни сайленсинга до 20% (фигура 4h). Интересно, что избыточной экспрессии Smad9, связанной с экспрессией miHDS1, не наблюдалось в клетках, подвергнутых электропорации miHDS1v5U или miHDS1v6 (фигура 4i).
Перенаправление miCtl против мРНК хантингтина человека
Предыдущие эксперименты продемонстрировали токсичность miHDS1 вследствие ее внецелевых эффектов, а также выявили, что miCtl является переносимой при экспрессии в головном мозге мышей. MiCtl была сконструирована с профилем низкого нецелевого сайленсинга, но не была предназначена для нацеливания на мРНК хантингтина. Таким образом, было проведено тестирование возможности использовать преимущество относительной безопасности затравки miCtrl в стриатуме мыши и сконструировать вокруг этой затравки RNAi-триггер, нацеленный на НТТ.
В качестве первой стадии был проведен скрининг мРНК НТТ человека или клинической мишени на последовательности, полностью комплементарные затравочной области miCtl, но ни одной не было обнаружено. Следуя этой же стратегии для дизайна вариантов miHDS1, был повторен этот анализ in silico, допускающий единичные мисмэтчи между нуклеотидами со 2 по 7 последовательности miRNA. Было обнаружено, что четыре комплементарные последовательности (miHDss1-4): MiHDss1 (мисмэтч в положении 7) и miHDss4 (мисмэтч в положении 4) нацеливают на НТТ в 3'UTR, тогда как miHDss2 (мисмэтч в положении 6) и miHDss3 (мисмэтч в положении 5) нацеливают на НТТ в кодирующей области, охватывающей сочленение в экзоне 7-8 или в экзоне 33, соответственно (фигуры 5а, b). При тестировании в клетках HEK293, только miHDss3 подавляла экспрессию НТТ до 40-50% обработанных контролем клеток, как определено с помощью Q-ПЦР (фигура 5с) и Вестерн-блоттинг (фигура 5d, e).
Поскольку miCtl и miHDSS3 совместно используют одну и ту же затравочную последовательность, можно предположить, что обе miRNA будут иметь одинаковый профиль нецелевых эффектов. Однако, как наблюдается на эндогенных miRNA из специфического семейства miRNA, эффективность сайленсинга может измениться из-за различий в последовательностях в 3'-области каждой miRNA. Использовали алгоритм PITA для сравнения стабильности связывания miRNA и потенциала сайленсинга между немишенями miCtl и miHDss3. С помощью подхода in silico было предсказано 89 внецелевых сайтов для обоих miCtl и miHDss3, при этом 67 экспрессировалось в стриатуме. Интересно отметить, что 3'-область miHDss3 увеличивает стабильность связывания miRNA с немишенью по сравнению с miCtl (фигура 5f).
Характеристика переносимости вариантов miHDS1 и miHDss3 в головном мозге мыши
Для определения переносимости in vivo новых последовательностей, кассеты экспрессии miRNA клонировали в шаттл-вектор AAV (фигура 6b). Мышей дикого типа в возрасте семи недель разделяли на группы, исходя из эквивалентного веса и исходных показателей выполнения теста на вращающемся стержне, и затем инъецировали билатерально в стриатум вирус, экспрессирующий miHDS1v6A, miHDS1v5U, miHDss3 или miHDS1, miCtl, и рецептурный буфер (FB) в качестве экспериментальных контролей. Через два и четыре месяца после инъекции мышей взвешивали и определяли неврологические побочные эффекты путем использования тестов на ускоренное вращение на стержне, схватывание и «открытое поле» (фигура 6а).
В соответствии с полученными ранее результатами, мыши, экспрессирующие miHDS1, показали двигательные дефициты на аппарате ускоренного вращения на стержне (фигура 6с). Кроме того, различий не наблюдалось между мышами, которым инъецировали только FB-буфер или miCtl. Этот результат является важным, потому что из него следует, что побочные эффекты не являются результатом кооптации эндогенного пути, а результатом специфических нецелевых эффектов miHDS1. Что примечательно и находится в согласии с проведенными исследованиями in vitro, дефициты были также продемонстрированы miHDS1v5U в тесте на вращающемся стержне. Это может являться отражением того, что мисмэтчи пиримидин : пиримидин (U:U, микроРНК : мРНК) проявляют умеренную дискриминационную мощность и этот вариант все еще частично подавляет экспрессию Bcl2 (фигура 4Н). Также, в работе in vitro было предсказано, что miHDS1v6A улучшает miHDS1-опосредованную токсичность без значительных различий, наблюдаемых между miHDS1v6A и miCtl через 2 или 4 месяца после инъекции AAV. Помимо сайленсинга хантингтина человека, miHDss3 имеет такой же профиль внецелевых эффектов, как miCtl. Однако алгоритм PITA предполагает, что miHDss3 обладает большей склонностью к сайленсингу внецелевого репертуара miCtl путем увеличения стабильности связывания пары микроРНК : мРНК (фигура 5f). Однако существенных различий в тесте ускоренного вращения на стержне не наблюдалось через 2 или 4 месяца (фигура 6с).
За исключением мышей, инъецированных miHDS1v5U, которые потеряли через некоторое время вес (-1,7 г, снижение на 8% через 4 месяца), увеличение массы тела было зафиксировано во всех других группах. Кроме того, наращивание массы было значительно снижено с помощью терапии miHDS1, как и ранее. Через 4 месяца мыши, инъецированные miHDS1, увеличили массу на 1,3 г (5%), тогда как в других группах увеличение массы составило от 3,6 г до 5,2 г (увеличение на 15-22% через 4 месяца) (фигура 6d).
Обсуждение
В этой работе был проведен тест на безопасность для нормальных мышей RNAi-триггера, сконструированного таким образом, что он является безопасным для человека и, как показано в предыдущих работах, для приматов, отличных от человека. Тестирование лекарственных средств на применение у человека на двух видах, как правило, грызунах и более крупном млекопитающем, является стандартной процедурой для получения одобрения регуляторным органом для переноса на начальные фазы исследований. Несмотря на то, что заметной токсичности у мартышек не было обнаружено, что также было описано в другом более позднем исследовании, при тестировании предполагаемой конструкции на грызунах наблюдалась острая токсичность.
Было обнаружено, что можно уменьшить токсичность тестируемой последовательности, miHDS1, путем введения точечных мутаций в затравку для изменения внецелевого профиля. Одна модификация затравочной последовательности изменила нецелевой профиль исходной miHDS1, сохраняя при этом эффективность сайленсинга. miHDS1v6, но не miHDS1v5, восстановила переносимость miHDS1 в мышином головном мозге. miHDS1v5U генерировала мисмэтч U:U, который представляет собой мисмэтч пиримидин : пиримидин, тогда как miHDS1v6A, генерировала мисмэтч A:G, который представляет собой мисмэтч пурин : пиримидин и, как было обнаружено, является наиболее эффективным для дискриминации.
В качестве альтернативы изменению затравки HDS1, ранее отмечалось, что контрольная последовательность, которая также была сконструирована так, чтобы она обладала низким потенциалом внецелевых эффектов, может быть переделана для нацеливания на НТТ человека. Обе последовательности при тестировании на мышах хорошо переносились и не вызывали невропатологии или неврологических дефицитов, которые отмечались ранее для родительской HDS1.
Эти обнаружения подчеркивают различие между разработкой традиционных лекарственных средств и новой зарождающейся областью лекарственных средств на основе нуклеиновых кислот. Хотя целью всех разработок лекарственных средств для применения у человека является безопасность и эффективность в целевой популяции, в случае лекарственных средств на основе нуклеиновых кислот предполагаемое лекарственное средство напрямую взаимодействует с геномом и/или экспрессирующимися транскриптами. Таким образом, лекарственные средства, которые основаны на специфичности последовательности и оптимизированы в отношении безопасности для человека, будут вероятно иначе взаимодействовать с геномами других видов и, в частности, отдаленно родственных видов, таких как грызуны. С другой стороны, если последовательности оптимизированы в отношении безопасного применения у грызунов, риск возникновения проблем в контексте генома человека является более высоким.
Полученные результаты свидетельствуют о том, что (1) профиль безопасности и переносимости miRNA является видо-специфическим, подчеркивая осторожность интерпретации первоначальных исследований, в которых были использованы мышиные модели заболевания, и (2) одна модификация затравочной последовательности является эффективной стратегией для решения пробелемы, связанной с нецелевой токсичностью последовательности miRNA, сохраняя при этом эффективность сайленсинга.
Материалы и способы
Линии клеток и трансфекции
НЕК293 получали от АТСС и культивировали в условиях согласно инструкциям изготовителя. SthdhQ7 были любезно предоставлены Marcy MacDonald. Все трансфекции HEK293 плазмидной ДНК проводили с использованием липофектамина 2000 (Invitrogen) согласно инструкциям изготовителя. Трансфекцию клеток SthdhQ7 ДНК осуществляли с помощью системы для трансфекции Invitrogen Neon с использованием условий электропорации и следуя руководствам изготовителя.
Конструирование вектора и получение AAV
Искусственные последовательности miRNA (miCtl, варианты miHDss, miHDS1 и варианты miHDS1) генерировали путем удлинения полимеразой перекрывающихся олигонуклеотидов ДНК (IDT, Coralville). Удлиненные полимеразой продукты очищали с использованием набора Qiaquick PCR purification kit, расщепляли с помощью XhoI-SpeI и клонировали в сайт XhoI-XbaI на экспрессионной кассете Pol-III, содержащей мышиный промотор U6, MCS и Pol-III-терминатор (6T's).
RNAi-векторы, несущие репортерный ген люциферазы, конструировали с использованием вектора psiCheck2 (Promega). ДНК с наращенными концевыми олигонуклеотидами, содержащая единичный высоко комплементарный целевой сайт RNAi для смысловой или антисмысловой цепи miHDS1, отжигали и клонировали в сайты XhoI-NotI ниже стоп-кодона последовательности кДНК люциферазы Renilla.
Для исследований in vivo экспрессионные кассеты miRNA переносили в шаттл-плазмиду ААВ выше спейсерной последовательности ДНК. Экспрессионную кассету miRNA и спейсерную последовательность фланкировали на каждом конце последовательностями инвертированного концевого повтора AAV серотипа 2 размером 145 пар оснований.
Анализы люциферазы in vitro
Клетки НЕК293 с конфлюэнтностью 70%, выращенные в 24-луночном планшете, котрансфицировали плазмидой, экспрессирующей miRNA, и RNAi-плазмидой, несущей репортерный ген люциферазы. Через 24 часа клетки промывали ледяным PBS и измеряли активности люцифераз Renilla и светлячка с помощью Dual-Luciferase Reporter Assay System (Promega) согласно инструкциям производителя, используя 20 мкл клеточного лизата. Измерение люминесценции проводили на люминометре Monolight 3010 (Pharmigen, США). Относительные световые единицы рассчитывали в виде соотношения относительных световых единиц Renilla/светлячка и результаты выражали относительно контрольной miRNA.
Вестерн-блоттинг
Клетки НЕК293 трансфицировали экспрессионными кассетами miRNA, как указано. Через 48 часов клетки промывали один раз ледяным PBS и лизировали буфером Passive lysis buffer (PBL, Promega). Концентрацию белка определяли по методу Брэдфорда-Лоури (BioRad) и 10 мкг белка наносили на 3-8% трис-ацетатный гель NuPAGE (Novex Life technologies). Белки переносили на PVDF-мембраны и инкубировали с мышиным антителами против Htt (1:5000, Millipore, СА) или кроличьими антителами против бета-актина (1:40000, Sigma), а затем антителами, конъюгированными с пероксидазой хрена (1:10000, мышиные; или 1:50000, кроличьи, Jackson ImmunoResearch, West Grove, PA). Блоты визуализировали реагентами ECL-Plus (Amersham Pharmacia). Эффективность сайленсинга определяли путем денситометрического определения (n=4 независимых эксперимента) уровней белка относительно бета-актина с помощью системы визуализации VersaDocTM Imaging System (Biorad) и программного обеспечения Quantity OneR.
Выделение РНК и анализ методом количественной полимеразной цепной реакции (QPCR)
Тотальную РНК выделяли с помощью реагента Trizol (Life Technologies, Grand Island, NY) согласно протоколу изготовителя, за исключением добавления 1 мкл Glycoblue к водной фазе на стадии осаждения изопропанолом и одной промывки холодным 70% этанолом. Образцы РНК количественно оценивали с помощью спектрофотометрии, а затем кДНК синтезировали из 500 нг тотальной РНК с использованием метода случайных гексамеров (реактивы TaqMan RT, Applied Biosystems). SyBrGreen Q-PCR пары праймеров для мышиных нецелевых генов разрабатывали с использованием web-сервера RealTime PCR Custom Assay Design webserver (IDT, Coralville). Строили стандартную кривую по семи точкам, и выполняли анализ кривой плавления по конечным результатам для подтверждения каждой пары праймеров. Только пары праймеров с эффективностью амплификации 100±5% и одним продуктом амплификации использовали для определения относительной генной экспрессии с помощью метода ddCt.
Исследования на мышах
Все протоколы исследований на животных были одобрены University of Iowa Animal Care и Use Committee. Мышей дикого типа FBV и BACHD получали из Jackson Laboratories (Bar Harbor, ME, USA). Мышей генотипировали с использованием праймеров, специфических к мутантному человеческому трансгену хантингтину, фланкирующих CAG-повтор, и трансгенных и подобранных по возрасту однопометников дикого типа использовали для указанных экспериментов. Мышей содержали в помещении с регулируемой температурой с 12-часовым циклом свет/темнота. Животным предоставляли неограниченный доступ к пище и воде. В определенные моменты времени мышам инъецировали вирус AAV2/1-mU6-miRNA/Stuffer. Для инъекций AAV мышей анестезировали смесью кетамина и ксилазина, и 5 мкл AAV инъецировали билатерально в стриатум со скоростью 0,2 мкл/мин (координаты: +0,86 мм ростральнее брегмы +/- 1,8 мм латерально медиальной стороны, -2,5 мм вентрально от поверхности головного мозга). Мышей, используемых для анализов генной экспрессии, анестезировали смесью кетамина и ксилазина, и перфузировали 18 мл 0,9%-ного охлажденного солевого раствора, смешанного с 2 мл раствора RNAlater (Ambion). В определенные моменты времени мышей умерщвляли и головной мозг удаляли, блокировали, и разрезали на коронарные срезы толщиной 1 мм. Образцы ткани из стриатума брали с использованием ножа (tissue corer) (1,4 мм в диаметре; Zivic Instruments, Pittsburgh, PA, USA). Все образцы ткани быстро замораживали в жидком азоте и хранили при -80°C до использования.
Поведенческий анализ
Двигательную координацию инъецированных мышей определяли с помощью аппарата Rotarod (модель 47600; Ugo Basile, Comerio, Italy). Исходное тестирование на аппарате Rotarod выполняли в возрасте 7 недель, и повторно через 2 и 4 месяца после инъекции AAV. Мышей тестировали в течение четырех последовательных дней, три испытания в день с 30-минутным периодом отдыха между испытаниями и 5-минутным периодом привыкания, каждый день, начиная за шестьдесят минут до первого испытания. Интервал времени до падения каждой мыши рассчитывали путем усреднения двух лучших испытаний каждой мыши в день из четырех последовательных дней тестирования. Для теста на схватывание каждую мышь подвешивали за хвост на одну минуту и оценивали как схватывание, если мышь держала свои передние лапы вместе около своего туловища.
Все публикации, патенты и патентные заявки включены в настоящий документ посредством ссылки. Несмотря на то, что в вышеуказанном описании данное изобретение описано в отношении определенных предпочтительных вариантов его осуществления и многие детали изложены с целью иллюстрации, для специалиста в данной области будет очевидно, что изобретение подвержено дополнительным вариантам осуществления и что некоторые детали, описанные здесь, могут значительно варьировать без отступления от основных принципов настоящего изобретения.
Использование терминов «а» и «an» и «the», и сходных объектов в контексте описания изобретения интерпретируется как относящееся к единственному и множественному числу, если не указано иное в данном описании или явно противоречащее контексту. Термины «включающий», «имеющий», «включающий в себя» и «содержащий» интерпретируются как неограничивающие термины (то есть означающие «включая, но без ограничения»), если не указано иное. Перечисление диапазонов значений в настоящем документе предназначено только для использования в качестве способа краткого обозначения, индивидуально к каждому отдельному значению, попадающему в диапазон, если не указано иное в данном документе, и каждое отдельное значение включено в описание, как если бы оно индивидуально цитировалось в данном документе. Все способы, описанные здесь, могут быть выполнены в любом приемлемом порядке, если не указано иное в данном документе или явно противоречащее контексту. Использование любого и всех примеров или примерного языка (например, «такой как»), представляемого в данном документе, предназначается только для лучшего освещения изобретения и не представляет ограничения объема изобретения, если не заявлено иное. Отсутствие языка в описании должно быть интерпретировано как указывающее на каждый не заявленный элемент как существенный для практического осуществления изобретения
Варианты осуществления настоящего изобретения описаны в данном документе, включая лучшие методы, известные изобретателям для осуществления изобретения. Вариации этих вариантов осуществления станут очевидными для специалистов в данной области при чтении вышеизложенного описания. Авторы изобретения предполагают, что специалисты в данной области используют такие вариации как подходящие, и авторы изобретения предназначают для практического осуществления изобретения способы, другие, чем те, которые конкретно описаны в данном документе.
Таким образом, данное изобретение включает все модификации и эквиваленты предмета изобретения, перечисленного в пунктах формулы изобретения, прилагаемой к данному документу, как разрешенные действующим законодательством. Кроме того, любая комбинация вышеописанных элементов во всех их возможных вариациях охватывается изобретением, если не указано иное в данном документе или четко противоречащее контексту.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАРИАНТ СРЕДСТВА ДЛЯ RNAi | 2018 |
|
RU2789647C2 |
| АДЕНОАССОЦИИРОВАННЫЕ ВИРУСНЫЕ ВЕКТОРЫ ДЛЯ ЛЕЧЕНИЯ МИОЦИЛИНОВОЙ (MYOC) ГЛАУКОМЫ | 2015 |
|
RU2746991C2 |
| ВЕКТОРНЫЕ КОМПОЗИЦИИ С МОДИФИЦИРОВАННЫМ АДЕНОАССОЦИИРОВАННЫМ ВИРУСОМ | 2013 |
|
RU2679843C2 |
| АДЕНОАССОЦИИРОВАННЫЕ ВИРУСНЫЕ ВЕКТОРЫ ДЛЯ ЛЕЧЕНИЯ МИОЦИЛИНОВОЙ (MYOC) ГЛАУКОМЫ | 2015 |
|
RU2718047C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ БОКОВОГО АМИОТРОФИЧЕСКОГО СКЛЕРОЗА (ALS) | 2015 |
|
RU2716422C2 |
| Двухцепочечная РНК, способная снижать экспрессию мутантного аллеля с.607GA гена GNAO1 человека | 2022 |
|
RU2816137C1 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНЕЙ МОЗГА | 2014 |
|
RU2664471C2 |
| ГЕННОЕ РЕДАКТИРОВАНИЕ ГЛУБОКИХ ИНТРОННЫХ МУТАЦИЙ | 2016 |
|
RU2759335C2 |
| ЛЕЧЕНИЕ HBV ИНФЕКЦИИ | 2011 |
|
RU2620966C2 |
| ВЕКТОР АДЕНОАССОЦИИРОВАННОГО ВИРУСА | 2015 |
|
RU2743382C2 |





















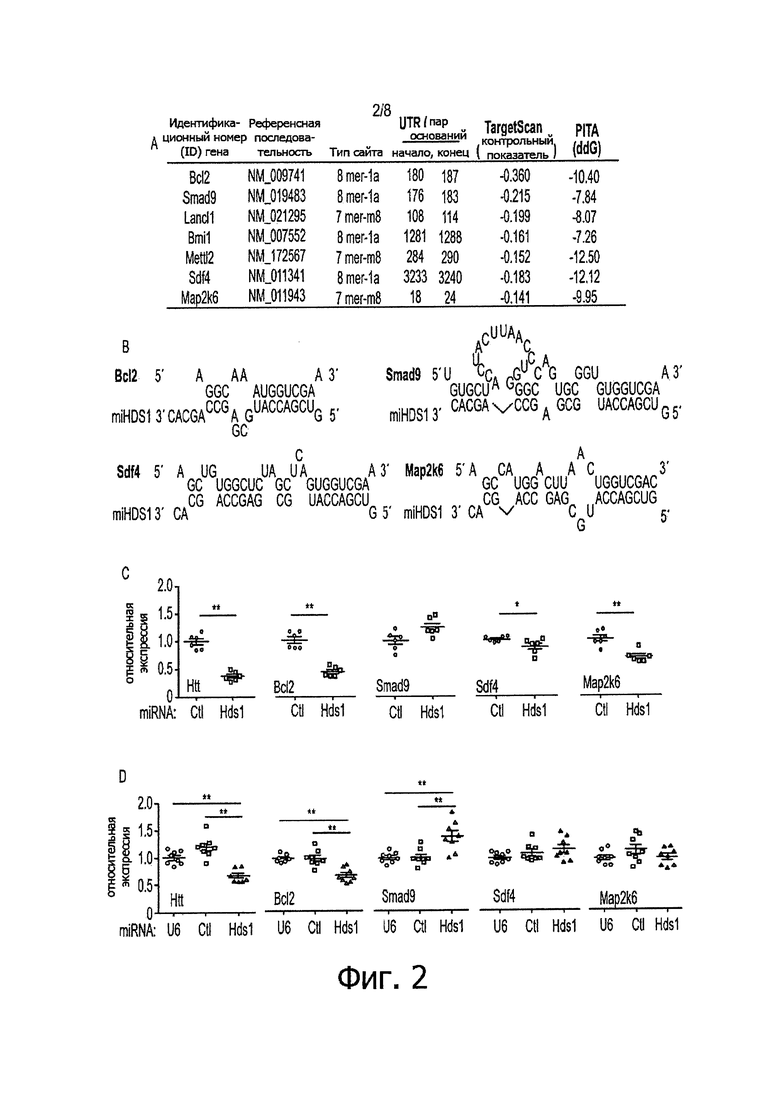
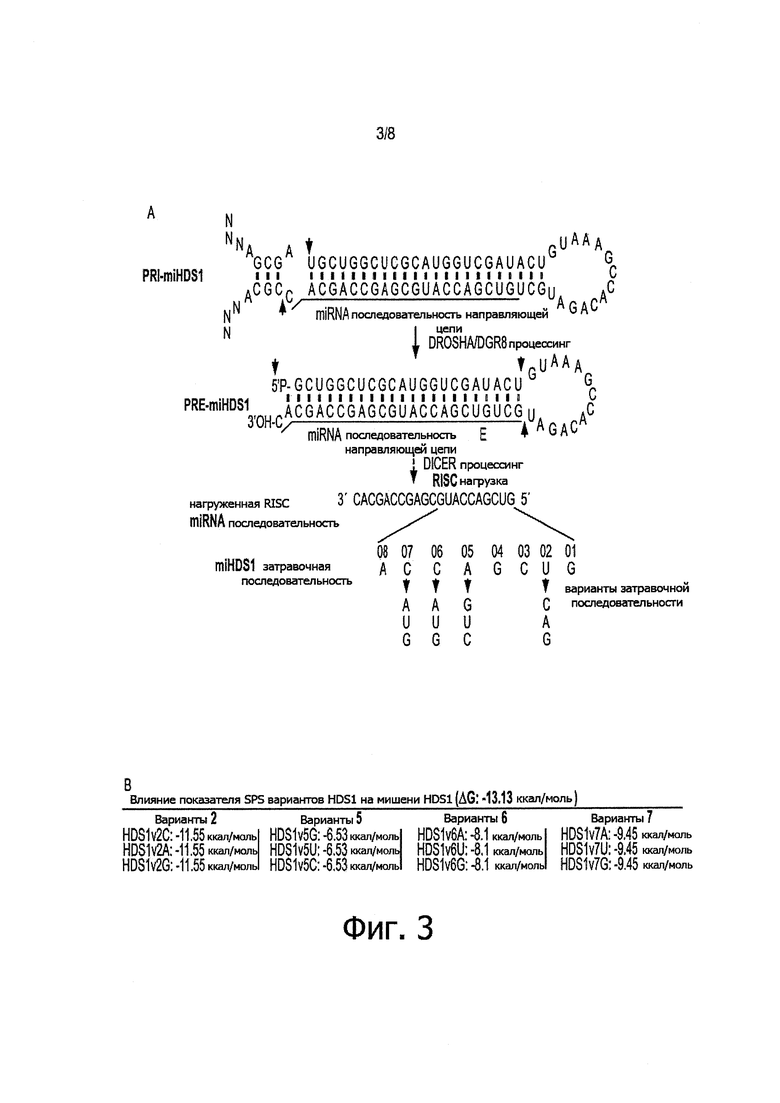

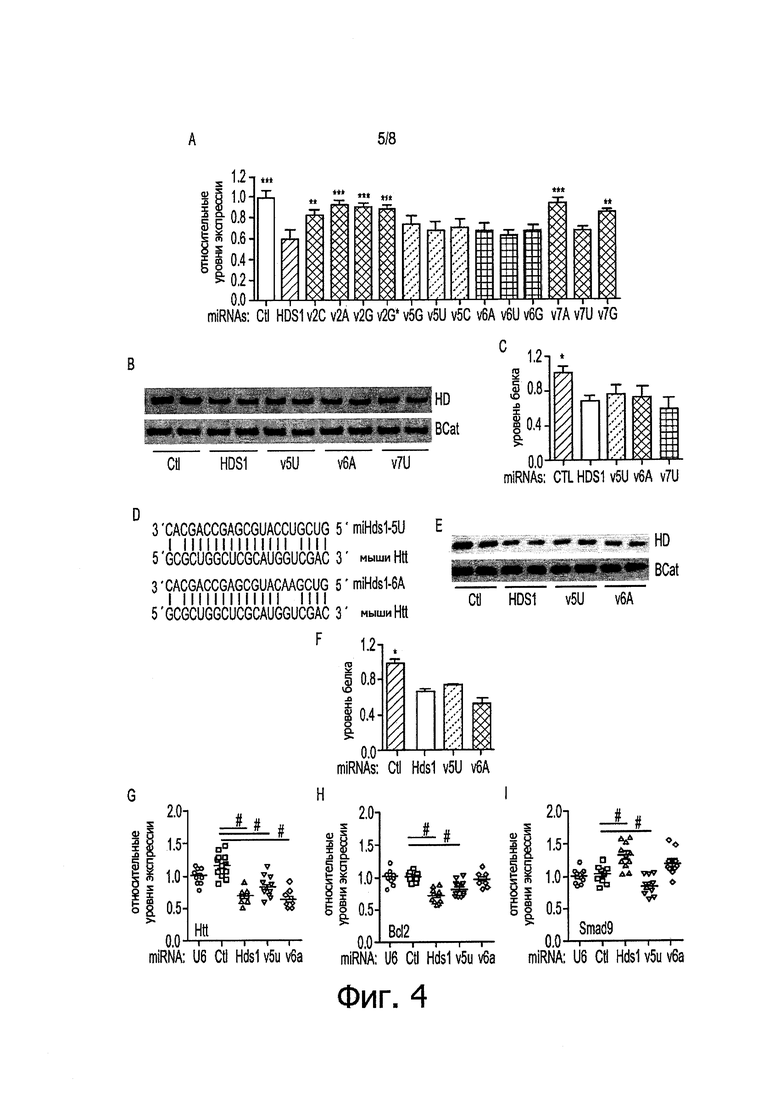



Изобретение относится к биотехнологии, конкретно к молекулам РНК-интерференции (RNAi), нацеленным против нуклеотидной последовательности при болезни Хантингтона, и способам применения этих молекул RNAi для лечения болезни Хантингтона. Описана нуклеиновая кислота для использования при лечении субъекта с болезнью Хантингтона, указанная нуклеиновая кислота кодирует искусственный первичный транскрипт miRNA (pri-miRNA), состоит из, в порядке расположения, 5′-фланкирующей области, ненаправляющей области, петлевой области, направляющей области и 3′-фланкирующей области, при этом направляющая область состоит из SEQ ID NO: 37 (miHDss3), SEQ ID NO: 6 (miHDS1v5U) или SEQ ID NO: 7 (miHDS1v6A) и ненаправляющая область является по меньшей мере на 80% комплементарной направляющей области. Изобретение может быть использовано при лечении болезни Хантингтона. 12 н. и 62 з.п. ф-лы, 6 ил., 1 пр.
1. Нуклеиновая кислота для использования при лечении субъекта с болезнью Хантингтона, указанная нуклеиновая кислота кодирует искусственный первичный транскрипт miRNA (pri-miRNA), состоящая из, в порядке расположения, 5′-фланкирующей области, ненаправляющей области, петлевой области, направляющей области и 3′-фланкирующей области, при этом направляющая область состоит из SEQ ID NO: 37 (miHDss3), SEQ ID NO: 6 (miHDS1v5U) или SEQ ID NO: 7 (miHDS1v6A) и ненаправляющая область является по меньшей мере на 80% комплементарной направляющей области.
2. Нуклеиновая кислота по п. 1, в которой 5′-фланкирующая область непрерывно связана с ненаправляющей областью, петлевая область расположена между ненаправляющей областью и направляющей областью и направляющая область непрерывно связана с 3′-фланкирующей областью.
3. Нуклеиновая кислота по п. 1 или 2, в которой 5′-фланкирующая область содержит 5′-соединяющую последовательность, непрерывно связанную с ненаправляющей областью.
4. Нуклеиновая кислота по п. 3, в которой 5′-соединяющая последовательность состоит из 5-8 нуклеотидов.
5. Нуклеиновая кислота по п. 4, в которой 5′-соединяющая последовательность состоит из 7 нуклеотидов.
6. Нуклеиновая кислота по п. 3, в которой 5′-соединяющая последовательность кодирует GUGAGCGA (SEQ ID NO: 13) или GUGAGCGC (SEQ ID NO: 14).
7. Нуклеиновая кислота по любому из пп. 3-6, в которой 5′-фланкирующая область дополнительно содержит 5′-выступающую последовательность, расположенную выше по ходу транскрипции от 5′-соединяющей последовательности.
8. Нуклеиновая кислота по п. 7, в которой 5′-выступающая последовательность содержит сайт клонирования.
9. Нуклеиновая кислота по п. 7, в которой 5′-выступающая последовательность состоит примерно из 1-10 нуклеотидов.
10. Нуклеиновая кислота по п. 7, в которой 5′-выступающая последовательность кодирует UAAACUCGA (SEQ ID NO: 15).
11. Нуклеиновая кислота по любому из пп. 7-10, в которой 5′-фланкирующая область, кроме того, содержит 5′-спейсерную последовательность, расположенную выше по ходу транскрипции от 5′-выступающей последовательности.
12. Нуклеиновая кислота по п. 11, в которой 5′-спейсерная последовательность состоит из 10-12 нуклеотидов.
13. Нуклеиновая кислота по п. 11, в которой 5′-спейсерная последовательность кодирует UGGUACCGUU (SEQ ID NO: 16).
14. Нуклеиновая кислота по любому из пп. 11-13, в которой 5′-фланкирующая область, кроме того, содержит 5′-апстрим последовательность, расположенную выше по ходу транскрипции от 5′-спейсерной последовательности.
15. Нуклеиновая кислота по п. 14, в которой 5′-апстрим последовательность имеет длину примерно 30-2000 нуклеотидов.
16. Нуклеиновая кислота по любому из пп. 1-15, в которой 3′-фланкирующая область содержит 3′-соединяющую последовательность, непрерывно связанную с направляющей областью.
17. Нуклеиновая кислота по п. 16, в которой 3′-соединяющая последовательность состоит из 5-8 нуклеотидов.
18. Нуклеиновая кислота по п. 16, в которой 3′-соединяющая последовательность является по меньшей мере на 85% комплементарной 5′-соединяющей последовательности.
19. Нуклеиновая кислота по п. 16, в которой 3′-соединяющая последовательность кодирует CGCCUAC (SEQ ID NO: 18).
20. Нуклеиновая кислота по любому из пп. 16-19, в которой 3′-фланкирующая область, кроме того, содержит 3′-выступающую последовательность, расположенную ниже по ходу транскрипции от 3′-соединяющей последовательности.
21. Нуклеиновая кислота по п. 20, в которой 3′-выступающая последовательность содержит сайт клонирования.
22. Нуклеиновая кислота по п. 20, в которой 3′-выступающая последовательность состоит примерно из 1-10 нуклеотидов.
23. Нуклеиновая кислота по п. 20, в которой 3′-выступающая последовательность кодирует UAG (SEQ ID NO: 30).
24. Нуклеиновая кислота по п. 20, в которой 5′-выступающая последовательность является комплементарной 3′-выступающей последовательности только по одному нуклеотиду на каждом конце выступающей последовательности.
25. Нуклеиновая кислота по любому из пп. 20-24, в которой 3′-фланкирующая область дополнительно содержит 3′-спейсерную последовательность, расположенную ниже по ходу транскрипции от 3′-выступающей последовательности.
26. Нуклеиновая кислота по п. 25, в которой 3′-спейсерная последовательность состоит из 10-12 нуклеотидов.
27. Нуклеиновая кислота по п. 25, в которой 3′-спейсерная последовательность кодирует AGCGGCCGCCA (SEQ ID NO: 19).
28. Нуклеиновая кислота по любому из пп. 25-27, в которой 3′-спейсерная последовательность является по меньшей мере примерно на 70% комплементарной 5′-спейсерной последовательности.
29. Нуклеиновая кислота по любому из пп. 25-28, в которой 3′-фланкирующая область дополнительно содержит 3′-даунстрим последовательность, расположенную ниже по ходу транскрипции от 3′-спейсерной последовательности.
30. Нуклеиновая кислота по п. 29, в которой 5′-апстрим последовательность не спаривается значительно с 3′-даунстрим последовательностью.
31. Нуклеиновая кислота по п. 29 или 30, в которой 3′-даунстрим последовательность имеет длину примерно 30-2000 нуклеотидов.
32. Нуклеиновая кислота по любому из пп. 1-31, в которой петлевая область имеет длину 15-25 нуклеотидов.
33. РНК, кодируемая нуклеиновой кислотой по любому из пп. 1-32.
34. Экспрессионная кассета, кодирующая нуклеиновую кислоту, описанную в любом из пп. 1-32.
35. Экспрессионная кассета по п. 34, дополнительно содержащая промотор, непрерывно связанный с нуклеиновой кислотой.
36. Экспрессионная кассета по п. 35, в которой промотор представляет собой промотор polII или polIII.
37. Экспрессионная кассета по п. 36, в которой промотор polIII представляет собой промотор U6.
38. Экспрессионная кассета по п. 36, в которой промотор polIII представляет собой промотор U6 мыши.
39. Экспрессионная кассета по п. 36, в которой промотор представляет собой промотор polII.
40. Экспрессионная кассета по п. 35, в которой промотор представляет собой тканеспецифический промотор.
41. Экспрессионная кассета по п. 35, в которой промотор представляет собой индуцибельный промотор.
42. Экспрессионная кассета по любому из пп. 35-41, дополнительно содержащая маркерный ген.
43. Экспрессирующий вектор, содержащий экспрессионную кассету по любому из пп. 34-42.
44. Вектор по п. 43, который представляет собой вектор на основе аденоассоциированного вируса (AAV).
45. Вектор по п. 44, в котором AAV представляет собой AAV1, AAV2, AAV5, AAV6 и/или AAV9.
46. Вектор по п. 45, в котором AAV представляет собой AAV2.
47. Вектор по п. 45, в котором AAV представляет собой AAV2/1.
48. Выделенная нуклеиновая кислота для использования при лечении субъекта с болезнью Хантингтона, где нуклеиновая кислота имеет длину 80-4000 нуклеотидов, включающая нуклеиновую кислоту, кодирующую искусственный первичный транскрипт miRNA (pri-miRNA), состоящую из, в порядке расположения, 5′-фланкирующей области, ненаправляющей области, петлевой области, направляющей области и 3′-фланкирующей области, при этом направляющая область состоит из SEQ ID NO: 37 (miHDss3), SEQ ID NO: 6 (miHDS1v5U) или SEQ ID NO: 7 (miHDS1v6A) и ненаправляющая область является по меньшей мере на 80% комплементарной направляющей области.
49. Нуклеиновая кислота по любому из пп. 1-32, где нуклеиновая кислота состоит из Pri-miHDS1v5U (SEQ ID NO: 8), Pri-miHDS1v6A (SEQ ID NO: 9), Pre-miHDS1v5U (SEQ ID NO: 10) или Pre-miHDS1v6A (SEQ ID NO: 11).
50. Дуплекс РНК для использования при лечении субъекта с болезнью Хантингтона, где дуплекс РНК содержит направляющую область нуклеиновой кислоты и ненаправляющую область нуклеиновой кислоты, при этом направляющая область состоит из SEQ ID NO: 37 (miHDss3), SEQ ID NO: 6 (miHDS1v5U) или SEQ ID NO: 7 (miHDS1v6A) и ненаправляющая область является по меньшей мере на 80% комплементарной направляющей области.
51. Дуплекс выделенной РНК по п. 50, который имеет длину 19-30 пар оснований.
52. Модельное животное, отличное от человека, несущее нуклеиновую кислоту по любому из пп. 1-33 или 48, 49, экспрессионную кассету по любому из пп. 34-42, вектор по любому из пп. 43-47 или дуплекс по любому из пп. 50, 51 для применения при ингибировании экспрессии гена хангтинтина в модельном животном, отличным от человека.
53. Способ индукции РНК-интерференции, включающий введение субъекту эффективного количества нуклеиновой кислоты по любому из пп. 1-33 или 48, 49, экспрессионной кассеты по любому из пп. 34-42, вектора по любому из пп. 43-47 или дуплекса по любому из пп. 50, 51.
54. Применение нуклеиновой кислоты по любому из пп. 1-33 или 48, 49, экспрессионной кассеты по любому из пп. 34-42, вектора по любому из пп. 43-47 или дуплекса по любому из пп. 50, 51 для лечения болезни Хантингтона.
55. Выделенная молекула микроРНК, содержащая нуклеиновую кислоту по п. 1, имеющую нуклеотидный выступ на 3′-конце.
56. Выделенная молекула микроРНК по п. 55, в которой выступ представляет собой повтор, содержащий от 2 до 5 нуклеотидов.
57. Выделенная молекула микроРНК по п. 55 или 56, которая представляет собой природную микроРНК.
58. Выделенная молекула микроРНК по п. 55 или 56, которая представляет собой искусственную микроРНК.
59. Выделенная микроРНК по любому из пп. 55-58, которая обеспечивает пониженный уровень нецелевой токсичности.
60. Выделенная микроРНК по п. 55, в которой выступ представляет собой последовательность UU (SEQ ID NO: 24), UUU (SEQ ID NO: 25) или UUUU (SEQ ID NO: 26).
61. Выделенная микроРНК по п. 55, в которой выступ представляет собой последовательность CUU (SEQ ID NO: 27), CUUU (SEQ ID NO: 28) или CUUUU (SEQ ID NO: 29).
62. Способ индукции РНК-интерференции с низкой токсичностью, включающий введение субъекту нуклеиновой кислоты по любому из пп. 1-33 или 48, 49, экспрессионной кассеты по любому из пп. 34-42, вектора по любому из пп. 43-47 или дуплекса по любому из пп. 50, 51.
63. Способ по п. 62, в котором экспрессионная кассета содержит промотор polII.
64. Способ индукции РНК-интерференции с низкой токсичностью, включающий введение субъекту экспрессионной кассеты по п. 35, кодирующей промотор polII, оперативно связанный с нуклеиновой кислотой, кодирующей miRNA.
65. Способ по п. 64, в котором miRNA содержит выступ на 5′- или 3′-конце размером 2 или 3 нуклеотида.
66. Способ по п. 64 или 65, в котором miRNA содержит выступ на 3′-конце размером 2 нуклеотида.
67. Способ по любому из пп. 64-66, в котором miRNA представляет собой искусственную miRNA.
68. Способ лечения субъекта, имеющего болезнь Хантингтона, включающий введение субъекту нуклеиновой кислоты по любому из пп. 1-33 или 48, 49, экспрессионной кассеты по любому из пп. 34-42, вектора по любому из пп. 43-47 или дуплекса по любому из пп. 50, 51 для лечения болезни Хантингтона.
69. Способ по любому из пп. 53 или 62-68, в котором терапевтический агент вводят в головной мозг субъекта напрямую или посредством кровотока.
70. Способ по п. 69, в котором терапевтический агент вводят интракраниально.
71. Способ по п. 70, в котором терапевтический агент вводят в мостомозжечковую цистерну, стриатум, кортекс или желудочек, субарахноидальное пространство и/или интратекальное пространство.
72. Способ по любому из пп. 69-71, в котором субъектом является человек.
73. Способ по любому из пп. 69-72, в котором агент инъецируют в 1-5 локализаций в центральной нервной системе (CNS).
74. Способ по любому из пп. 69-72, в котором агент инъецируют в одну локализацию в головном мозге.
| НОВАЯ ПОЛНОРАЗМЕРНАЯ ГЕНОМНАЯ PHK ВИРУСА ЯПОНСКОГО ЭНЦЕФАЛИТА, ПОЛУЧЕННАЯ ИЗ НЕЕ ИНФЕКЦИОННАЯ кДНК JEV И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2307872C2 |
| WO 2012109667 A1, 16.08.2012 | |||
| US20090130751 A1, 21.05.2009 | |||
| US20130281372 A1, 24.10.2013. | |||
Авторы
Даты
2020-01-15—Публикация
2015-05-20—Подача