Изобретение относится к медицине и касается применения синтетического тетрапептида Ac-His-Ala-Glu-Glu-NH2 с N-терминальной ацетильной группой и С-терминальной амидной группой (НАЕЕ) или его фармацевтически приемлемых солей, или его комплексов, или их смесей для восстановления функции нейронов человека секретировать физиологически активное вещество с брутто-формулой C21H31N7O9 (химическое наименование в соответствие с номенклатурой ИЮПАК (4S,7S,10S,13S)-4-((1H-имидазол-4-ил)метил)-13-карбамоил-10-(2-карбоксиэтил)-7-метил-2,5,8,11-тетраоксо-3,6,9,12-тетраазагексадекан-16-овая кислота) и точной молекулярной массой 525.218328 атомных единиц массы, именуемой здесь и далее как SRFM.
Предшествующий уровень техники
Нейродегенеративные заболевания имеют ряд общих факторов развития и целый ряд других обобщающих механизмов (Litvinenko I.V., Krasakov I.V., Bisaga G.N. et al. Modern conception of the pathogenesis of neurodegenerative diseases and therapeutic strategy. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2017; 117(6-2): 3-10. (In Russ.). doi: 10.17116/jnevro2017117623-10), что может связывать болезнь Альцгеймера (БА), сосудистую деменцию, нейродегенерацию при рассеянном склерозе (PC), болезнь Паркинсона, а также болезнь Альцгеймера в условиях активации системного воспаления (Williams-Gray С.Н., Wijeyekoon R., Yarnall A.J. et al. ICICLE-PD study group. Serum immune markers and disease progression in an incident Parkinson's disease cohort (ICICLE-PD). Movement Disorders. 2016; 31(7):995-1003. https://doi.org/10.1002/mds.26563). Воспаление относится к типовым патологическим процессам организма человека. Типовой патологический процесс проявляется определенным набором характерных признаков. В настоящее время считается, что нейродегенеративный процесс является вторичным по отношению к воспалительному (Mostafa A., Jalilvand S., Shoja Z. Et al. Multiple sclerosis-associated retrovirus, Epstein-barr virus, and vitamin D status in patients with relapsing remitting multiple sclerosis. Journal of Medical Virology. 2017. doi: 10.1002/jmv.24774; Litvinenko I.V., Krasakov I.V., Bisaga G.N. et al. Modern conception of the pathogenesis of neurodegenerative diseases and therapeutic strategy. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2017; 117(6-2):3 -10. (In Russ.). doi: 10.17116/jnevro2017117623-10).
Болезнь Альцгеймера является одним из наиболее распространенных нейродегенеративных заболеваний среди людей пожилого возраста и характеризуется нейритными бляшками, основным компонентом которых является пептид бета-амилоид (Аβ). N-концевая область 1-16 бета-амилоида является металл-связывающим доменом, где цинк (Zn) и медь (Cu) присоединяются к пептиду Аβ (Guilloreau L., Damian L., Coppel Y., et al. (2006). Stractural and thermodynamical properties of Cull amyloid-β16/28 complexes associated with Alzheimer's disease. JBIC Journal of Biological Inorganic Chemistry, 11(8), 1024-1038, doi: 10.1007/s00775-006-0154-1). Снижение уровня ионов цинка в крови за счет связывания ионов цинка специфическими хелатирующими агентами и/или блокирование взаимодействий пептида Аβ с ионами цинка может предотвратить патологии, связанные с этими взаимодействиями (Ayton S., Lei P., Bush A. Biometals and Their Therapeutic Implications in Alzheimer's Disease. Neurotherapeutics. 2015. 12(1): p.109-120). Высокие концентрации цинка вызывают преципитацию пептида Аβ и влияют на образование в специфических отделах мозга (гиппокамп, кортекс, таламические ядра) внеклеточных агрегатов Аβ (амилоидных бляшек), которые ассоциированы с развитием болезни Альцгеймера ((Frederickson С.J., Bush A.I. (2001). Synaptically released zinc: physiological functions and pathological effects. Biometals, 14(3), 353-366, doi: 10.1023/A: 1012934207456).
При болезни Паркинсона (БП) также происходит накопление агрегатов бета-амилоида в тканях мозга пациентов (Нерр DH, Vergoossen DL, Huisman Е, et al. (2016) Distribution and Load of Amyloid-βPathology in Parkinson Disease and Dementia with Lewy Bodies. Journal of neuropathology and experimental neurology 75 (10):936-945. doi:10.1093/jnen/nlw070; Lim EW, Aarsland D, Ffytche D, Taddei RN, et al,. J Neurol 266 (11):2605-2619. doi: 10.1007/s00415-018-9100-8; Mihaescu A, Masellis M, Graff-Guerrero A, et al (2022) Amyloid beta deposition and cognitive decline in Parkinson's disease: a study of the PPMI cohort (P1-1.Virtual). Neurology 98 (18 Supplement): 1467). В статье (Yedlapudi D, Xu L, Luo D, Marsh GB, et al (2019) Targeting alpha synuclein and amyloid beta by a multifunctional, brain-penetrant dopamine D2/D3 agonist D-520: Potential therapeutic application in Parkinson's disease with dementia. Sci Rep 9 (1): 19648. doi: 10.1038/s41598-019-55830-3) предложено потенциальное терапевтическое использование бета-амилоида в качестве лекарственной мишени для лечения БП.
В статье (Yoon EJ, Park H-J, Kim G-Y, et al(2009) Intracellular amyloid beta interacts with SOD1 and impairs the enzymatic activity of SOD1: implications for the pathogenesis of amyotrophic lateral sclerosis. Experimental & Molecular Medicine 41 (9): 611-617. doi: 10.3858/emm.2009.41.9.067) показано, что бета-амилоид может участвовать в патогенеза бокового амиотрофического склероза (БАС).
Из литературы известно, что нейродегенеративные нарушения вследствие черепно-мозговой травмы (ЧМТ) характеризуются наличием агрегатов бета-амилоида и могут приводить к развитию болезни Альцгеймера (Faden AI, Loane DJ (2015) Chronic neurodegeneration after traumatic brain injury: Alzheimer disease, chronic traumatic encephalopathy, or persistent neuroinflammation? Neurotherapeutics 12 (1): 143-150. doi:10.1007/s13311-014-0319-5; Johnson VE, Stewart W, Smith DH (2010) Traumatic brain injury and amyloid-β pathology: a link to Alzheimer's disease? Nat Rev Neurosci 11 (5): 361-370. doi: 10.1038/nrn2808; Ramos-Cejudo J, Wisniewski T, Marmar C, et al (2018) Traumatic Brain Injury and Alzheimer's Disease: The Cerebrovascular Link. EBioMedicine 28:21-30. doi:10.1016/j.ebiom.2018.01.021).
Таким образом, помимо болезни Альцгеймера, патологическая агрегация бета-амилоида в тканях мозга происходит при патогенезе болезни Паркинсона (БП) и бокового амиотрофического склероза (БАС), а также ассоциированы с нейродегенеративными нарушениями вследствие черепно-мозговых травм (ЧМТ). Все эти нейродегенеративные заболевания и нарушения имеют и другие общие черты: гибель нейронов, агрегация специфических белков, деменция (Golde ТЕ, Borchelt DR, Giasson BI, Lewis J (2013) Thinking laterally about neurodegenerative proteinopathies. The Journal of Clinical Investigation 123 (5): 1847-1855. doi:10.1172/JCI66029).
В качестве нейротоксичного агента, инициирующего патологическую агрегацию эндогенных молекул бета-амилоида при болезни Альцгеймера и включающего патологический каскад фосфорилирования внутриклеточных белков, выступает бета-амилоид с изо мер изо ванным аминокислотным остатком Asp7 (Kozin SA, Cheglakov IB, Ovsepyan AA, et al (2013) Peripherally applied synthetic peptide isoAsp7-Abeta(1-42) triggers cerebral beta-amyloidosis. Neurotoxicity research 24 (3):370-376. doi: 10.1007/s 12640-013-9399-y; Zatsepina OG, Kechko OI, Mitkevich VA, et al (2018) Amyloid-β with isomerized Asp7 cytotoxicity is coupled to protein phosphorylation. Scientific Reports 8 (1):3518. doi:10.1038/s41598-018-21815-x; Gnoth K, Piechotta A, Kleinschmidt M, et al (2020) Targeting isoaspartate-modified Aβ rescues behavioral deficits in transgenic mice with Alzheimer's disease-like pathology. Alzheimer's research & therapy 12 (1): 149. doi: 10.1186/s 13195-020-00719-x).
Из научной и патентной литературы известны ряд пептидов, которые могли бы применяться при лечении нейродегенеративных заболеваний и нарушений.
Из CN 109369780 известен тетрапептид Ile-Gly-Phe-His, который предотвращает агрегацию Аβ 1-42, обеспечивая улучшение памяти и замедляя развитие болезни Альцгеймера.
Из US 2011312873 известно применение модифицированных тетрапептидов, имеющих С-концевой миметик аргинина, действие которого основано на ингибировании сериновой протеазы фурина и других пропротеиновых конвертаз, которые гидролизуют свои субстраты в виде фурина на С конце, при этом данный тетрапептид может быть использован для лечения нейродегенеративных заболеваний, в том числе, и болезни Альцгеймера.
Из WO 2012/056157 и патента РФ №2679080 известно синтетическое соединение, представляющее собой тетрапептид Ac-HAEE-NH2 (далее - НАЕЕ). В аббревиатуре НАЕЕ буквы означают: Н - гистидин, А - аланин, Е - глутаминовая кислота. Синтетический тетрапептид НАЕЕ способен ингибировать взаимодействие пептидов Аβ с ионами Zn (II), вызывая уменьшение или предотвращение агрегации пептида Аβ в присутствии ионов Zn (II) при физиологических концентрациях ионов Zn (II) 100-400 мкМ. Более высокие концентрации ионов Zn (II), порядка 1 ммоль (мМ), подавляют взаимодействия между НАЕЕ и 1-16 областью Аβ. Было показано, что инкубация агрегатов Аβ с НАЕЕ в течение минимум 1 часа при 20, 40, 80, 100 и 150 мкМ НАЕЕ приводит к дезагрегации таких агрегатов.
Из патента РФ №2679059 известно, что несмотря на ингибирование образования амилоидных бляшек, влияние известных препаратов, в частности НАЕЕ, на улучшение когнитивных функций при болезни Альцгеймера в среднем является очень ограниченным и существует необходимость получения альтернативных эффективных средств для лечения болезни Альцгеймера, в том числе за счет снижения или предотвращения связывания ионов Zn(II) с пептидом Аβ. В качестве альтернативного средства для лечения болезни Альцгеймера было предложено использовать пептид с аминокислотной последовательностью (в стандартных однобуквенных кодах) H[isoD][pS]GYEVHH (где isoD обозначает изомеризованный остаток аспарагиновой кислоты, a pS относится к фосфорилированному остатку серина) с открытыми или защищенными концами основной полипептидной цепи.
Из патента РФ №2709539 известно, что короткие заряженные пептиды типа НАЕЕ имеют очень короткое время жизни в плазме крови (от нескольких секунд до нескольких минут) и с трудом проходят через гематоэнцефалический барьер (ГЭБ), что существенно ослабляет эффективность их терапевтического воздействия. С целью преодоления этих недостатков авторы патента РФ №2709539 разработали фармацевтическую композицию для доставки НАЕЕ через ГЭБ для лечения нейродегенеративных заболеваний, включая деменцию Альцгеймеровского типа (болезнь Альцгеймера), которая позволяет улучшить фармакокинетические характеристики и увеличить биодоступность НАЕЕ.
Данная композиция содержит эффективное количество субстанции в виде комплекса синтетического тетрапептида НАЕЕ с цинком и человеческим сывороточным альбумином (HAEE-Zn-HSA) в форме раствора для введения с фармацевтически приемлемым носителем, выбранным из круга нейтральных носителей и разбавителей, например, в физиологическом растворе. Полученная фармацевтическая композиция позволяет увеличить в пять раз биодоступность субстанции в мозге, увеличить время полувыведения из организма в два раза; улучшить когнитивные функции экспериментальных животных на 20%.
Наиболее близким аналогом является применение синтетического тетрапептида НАЕЕ для возможности восстановления функции нейронов при болезни Альцгеймера за счет взаимодействия НАЕЕ с образовавшейся амилоидной матрицей вокруг нейрона (Козин С.А., Макаров А.А. Конвергенция концепций патогенеза болезни Альцгеймера. Молекулярная биология, 2019, Т. 53, №6, с. 1020-1028) за счет специфического связывания с участками 11EVHH14 агрегированных молекул Аβ.
Отличиями заявленного изобретения от наиболее близкого аналога являются альтернативный механизм действия, связанный с возможностью восстановления функции нейронов секретировать физиологически активное вещество SRFM под воздействием синтетического тетрапептида НАЕЕ, а также применение производных синтетического тетрапептида НАЕЕ, показывающих высокую эффективность.
Таким образом ранее была известна только способность синтетического тетрапептида НАЕЕ ингибировать образование агрегатов пептидов Аβ, которые ассоциированы с развитием болезни Альцгеймера.
Авторы настоящего изобретения подчеркивают, что с момента описания синтетического тетрапептида НАЕЕ в WO 2012/056157 на протяжении более десяти лет он рассматривался как разработанный терапевтический агент, которое можно вводить в организм для препятствования агрегации Аβ.
Из научной и патентной литературы ранее не была известна способность нейронов человека секретировать SRFM, которая обнаружена в данном изобретении. Также было неизвестно, что добавление нейротоксичных веществ (например, таких, которые ассоциированы с развитием нейродегенеративных нарушений при болезни Альцгеймера, болезни Паркинсона, бокового амиотрофического синдрома, или которые ассоциированы с последствиями черепно-мозговых травм) в околонейрональное пространство приводит к нарушению секреции SRFM нейронами. Также было неизвестно, что воздействие синтетического тетрапептида НАЕЕ на нейроны с нарушенной функцией секретировать SRFM приводит к восстановлению этой функции.
Техническая проблема, на решение которой направлено изобретение, заключается в применении синтетического тетрапептида НАЕЕ или его фармацевтически приемлемых солей, или комплексов, или их смесей для восстановления функции нейронов человека секретировать SRFM.
Технический результат изобретения заключается в обеспечении возможности восстановления функции нейронов при нейродегенеративных нарушениях, связанных с частичной или полной утратой функции нейронов человека секретировать SRFM, которая приводит к значительному падению уровня секретируемого SRFM в крови по сравнению с физиологической нормой, за счет восстановления этой функции под воздействием синтетического тетрапептида НАЕЕ и/или производных синтетического тетрапептида НАЕЕ, показывающих высокую эффективность. Под физиологической нормой, в соответствие с определением Медицинского словаря (Medical Dictionary for the Health Professions and Nursing. Farlex Partner Medical Dictionary. (2012), https://www.medicinenet.com/normal_range/definition.htm), понимается диапазон значений, характерный для 95% процентов значений от нормальной популяции. Остальные нормальные результаты выходят за пределы нормального диапазона, как и любые действительно ненормальные результаты. В тоже время, нормальный диапазон может варьировать для конкретного от возраста, роста, пола, этнической принадлежности или культуры пациента.
Заявленный технический результат обеспечивается путем применения синтетического тетрапептида НАЕЕ или его фармацевтически приемлемых солей или комплексов или их смесей для восстановления функции нейронов человека секретировать SRFM.
Фармацевтически приемлемыми солями синтетического тетрапептида НАЕЕ могут быть одно- или двузамещенные соли натрия, калия или аммония.
Фармацевтически приемлемыми комплексами синтетического тетрапептида НАЕЕ могут быть комплексы с цинком, медью, кальцием, магнием или другими катионами, способными взаимодействовать с молекулой НАЕЕ за счет электростатических и/или донорно-акцепторным взаимодействием.
Применение синтетического тетрапептида НАЕЕ в виде солей или комплексов предпочтительно, поскольку они имеют повышенную стабильность и сохраняют «развернутую» конформацию синтетического тетрапептида НАЕЕ после введения НАЕЕ в кровь, что увеличивает возможность взаимодействия НАЕЕ со своими биологическими мишенями.
Это подтверждается экспериментальным введением синтетического тетрапептида НАЕЕ и/или его производных (солей или комплексов) в организм экспериментальных животных. Было обнаружено, что 3D-структура НАЕЕ, который в виде водного раствора был помещен на 2 минуты в плазму крови мышей дикого типа, отличается от 3D-структуры НАЕЕ в исходном водном растворе, что подтверждается методом ВЭЖХ по изменению времени выхода с хроматографической колонки пробы синтетического тетрапептида НАЕЕ, экстрагированной из плазмы крови, относительно времени выхода пробы НАЕЕ, экстрагированной из исходного водного раствора. В то же время 3D-структура синтетического тетрапептида НАЕЕ, который вводился в виде солей или комплексов, оставалась неизменной в аналогичных экспериментальных условиях (то есть после экстрагирования из исходного водного раствора солей или комплексов синтетического тетрапептида НАЕЕ и после экстрагирования из плазмы крови мышей дикого типа после 2-х минутной экспозиции) и соответствовала 3D-структуре синтетического тетрапептида НАЕЕ, экстрагированного из исходного водного раствора. По данным масс-спектрометрии химическая структура синтетического тетрапептида НАЕЕ во всех экспериментальных пробах сохранялась неизменной как для НАЕЕ в свободном состоянии, так и для НАЕЕ в составе комплексов или солей. Изменение времени выхода НАЕЕ в свободном состоянии или в виде солей или комплексов с хроматографической колонки связано в основном с различиями в гидрофобных взаимодействиях НАЕЕ с материалом колонки, а эти взаимодействия в свою очередь определяются превалирующей 3D-структурой НАЕЕ в конкретной пробе. Таким образом, из полученных экспериментальных данных следует, что 3D-структура синтетического тетрапептида НАЕЕ, которая соответствует «развернутой» конформации НАЕЕ (Barykin Е. P., Garifulina A.I., Tolstova А. P., Anashkina A. A., Adzhubei A. A., Mezentsev Y. V., Shelukhina I. V., Kozin S. A., Tsetlin V. L, Makarov A. A. Tetrapeptide Ac-HAEE-NH(2) Protects α4β2 nAChR from Inhibition by Aβ // International journal of molecular sciences. 2020. - T. 21, №17. - C. 6272; Zolotarev YA, Mitkevich VA, Shram SI, Adzhubei AA, Tolstova AP, Talibov OB, Dadayan AK, Myasoyedov NF, Makarov AA, Kozin SA. Pharmacokinetics and Molecular Modeling Indicate nAChRα4-Derived Peptide HAEE Goes through the Blood-Brain Barrier. Biomolecules. 2021 Jun 18; 11 (6): 909) и является превалирующей для НАЕЕ в исходном водном растворе, соответствует 3D-структуре солей и комплексов НАЕЕ в водном растворе и остается неизменной в случае введения солей или комплексов НАЕЕ в плазме крови, в то время как НАЕЕ в плазме крови утрачивает «развернутую» конформацию, что может снижать его терапевтическую эффективность (Sikora, K., Jaskiewicz, М., Neubauer, D., Migon, D., & Kamysz, W. (2020). The role of counter-ions in peptides-an overview. Pharmaceuticals, 13(12), 442).
В данном случае термин 3D-структур а используется как синоним пространственной структуры или взаимного расположения атомов в молекуле НАЕЕ в трехмерном пространстве. Метод ВЭЖХ основан на преимущественно межмолекулярных взаимодействиях на границе раздела фаз. Изменение времени выхода молекулы НАЕЕ с хроматографической колонки отражает изменение межмолекулярных взаимодействий молекулы НАЕЕ с сорбентом, что является следствием различий пространственной структуры молекул НАЕЕ в свободном состоянии и в виде солей или комплексов.
Авторами настоящего изобретения показано, что культивируемые нейроны человека секретируют физиологически активное вещество SRFM в культуральную среду, где концентрация SRFM достигает значения насыщения на уровне около ста пикограммов на миллилитр. Таким образом, секреция SRFM является нормальной функцией нейронов человека.
Зрелые нейроны были получены из фибробластов кожи здорового человека через индуцируемые плюрипотентные стволовые клетки (In English: induced pluripotent stem cells, iPS cells) и долгоживущие самообновляющиеся нейроэпителиоподобные стволовые клетки (In English: long-term self-renewing neuroepithelial-like stem cells, lt-NES cells) no нижеследующей схеме.
Индуцируемые плюрипотентные стволовые (iPS) клетки (iPS-клетки) были получены репрограммированием фибробластов с использованием SENDAI вируса согласно протоколу производителя (STEMCELL Techonogies). Затем iPS-клетки были дифференцированы согласно опубликованному методу (Koch Р, Opitz Т, Steinbeck JA, Ladewig J, Brüstle О (2009) A rosette-type, self-renewing human ES cell-derived neural stem cell with potential for in vitro instruction and synaptic integration. Proc Natl Acad Sci USA 106: 3225-3230) в долгоживущие самообновляющиеся нейроэпителиоподобные стволовые клетки (lt-NES-клетки). Полученные lt-NES-клетки далее по протоколу (Falk, А., P. Koch, J. Kesavan, Y. Takashima, J. Ladewig, M. Alexander, O. Wiskow, J. Tailor, M. Trotter, S. Pollard, A. Smith and O. Brüstle (2012). Capture of Neuroepithelial-Like Stem Cells from Pluripotent Stem Cells Provides a Versatile System for in Vitro Production of Human Neurons. PLOS ONE 7(1): e29597) были с помощью удаления факторов роста индуцированы для дифференцирования в функциональные нейроны GABA-эргического фенотипа (около 90% от общего числа клеток) и в астроциты (около 10% от общего числа клеток). После окончания процессов дифференцирования полученная культура (нейронов и астроцитов) поддерживалась в течение 30 сут. Смена культуральной среды проводилась через каждые три дня, и в удаляемой среде определяли концентрацию секретируемого SRFM методом ВЭЖХ-МС. Было установлено, что в культуральной среде концентрация секретируемого SRFM оставалась на уровне в среднем около 100 пикограммов на миллилитр в течение всего срока наблюдений (30 сут).
В изобретении продемонстрировано, что добавление к нейронам человека нейротоксичного вещества (синтетического аналога бета-амилоида с изомеризованным остатком Asp7) подавляет нормальную функцию нейронов секретировать SRFM.
Нейротоксичное вещество представляло собой синтетический аналог бета-амилоида с изомеризованным остатком Asp7 (isoAβ). При введении в организм трансгенных мышей, используемых в качестве животной модели болезни Альцгеймера, isoAβ вызывает патологические процессы, характерные для болезни Альцгеймера (Kozin SA, Cheglakov IB, Ovsepyan AA, et al 2013) Peripherally applied synthetic peptide isoAsp7-Abeta(1-42) triggers cerebral beta-amyloidosis. Neurotoxicity research 24 (3):370-376. doi:10.1007/s12640-013-9399-y; Gnoth K, Piechotta A, Kleinschmidt M, et al (2020) Targeting isoaspartate-modified Aβ rescues behavioral deficits in transgenic mice with Alzheimer's disease-like pathology. Alzheimer's research & therapy 12 (1): 149. doi: 10.1186/sl3195-020-00719-х). Было показано, что под воздействием isoAβ концентрация секретируемого SRFM в культуральной среде нейронов снижалась до нуля пикограммов на миллилитр и оставалась на этом уровне в течение всего времени наблюдений (30 дней).
Авторами обнаружено, что подавленная под действием нейротоксичного вещества способность нейронов секретировать SRFM с достаточной степенью эффективности восстанавливается после сериального добавления в среду, в которой культивируются нейроны, синтетического тетрапептида НАЕЕ или фармацевтически приемлемой соли или комплекса синтетического тетрапептида НАЕЕ.
К нейронам человека, полученным в данной работе и подвергнутым воздействию нейротоксичного вещества (isoAβ), что приводило к потере способности нейронов полноценно секретировать SRFM, добавляли синтетический тетрапептид НАЕЕ или его фармацевтически приемлемые соли или комплексы. Показано, что сериальное добавление синтетического тетрапептида НАЕЕ, солей или комплексов синтетического тетрапептида НАЕЕ к таким нейронам приводило к восстановлению способности нейронов секретировать SRFM до уровня 65-70 пг/мл, 85-104 пг/мл или 76-107 пг/мл в случае использования синтетического тетрапептида НАЕЕ, комплексов синтетического тетрапептида НАЕЕ или солей синтетического тетрапептида НАЕЕ, соответственно.
Поскольку обнаруженная у нейронов функция секретировать физиологически активное вещество SRFM должна проявляться в организме людей присутствием молекул SRFM, наряду с экспериментами in vitro и in vivo авторами настоящего изобретения было проведено измерение уровня секретируемого SRFM в плазме крови здоровых и больных людей с подтвержденными диагнозами.
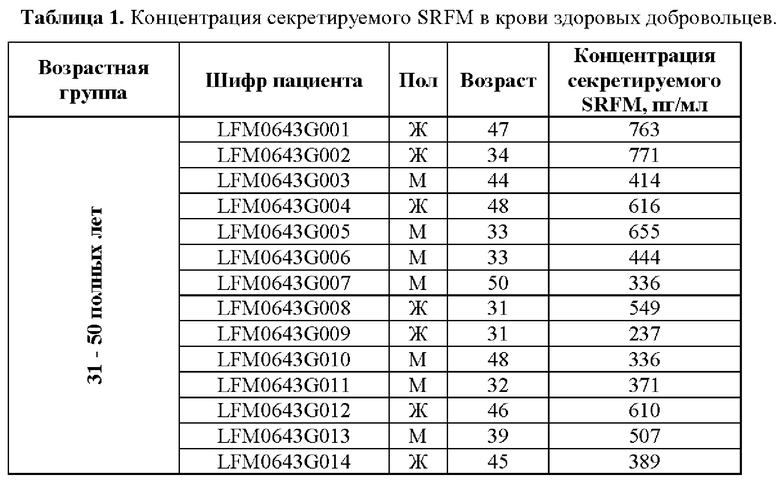
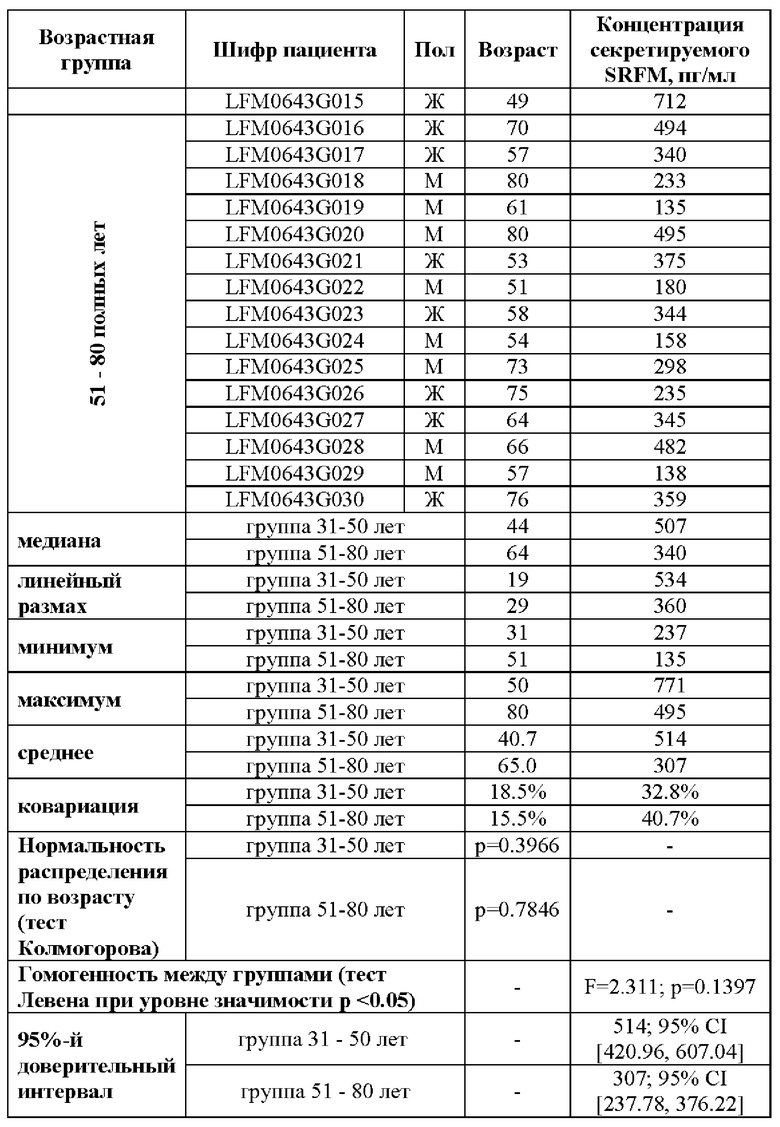
Было определено, что уровень секретируемого вещества SRFM в плазме крови здоровых людей находится на уровне 237-771 пг/мл в возрастной группе от 31 до 50 полных лет и на уровне 135-495 пг/мл в возрастной группе от 51 до 80 полных лет (Таблица 1). Широкий разброс значений обусловлен вариацией возраста, генетикой, перенесенными ранее заболеваниями, образом жизни и другими биологическими и социокультурными факторами, поэтому физиологические пределы концентрации вещества SRFM в крови могут быть больше и составлять от 1 до 5000 пг/мл.
Определение концентрации SRFM в плазме крови двух возрастных групп (от 31 года до 50 полных лет и от 51 года до 80 полных лет) здоровых людей обусловлен особенностями дебюта, проявления и манифестации нейродегенеративных заболеваний и нарушений. Так, болезнь Альцгеймера (БА) и болезнь Паркинсона (БП) проявляются в возрасте после 60 лет и лишь у 5% - 10% людей дебют может проявляться в более раннем возрасте, однако в таком случае чаще всего он обусловлен наследственными причинами (данные по всему миру от Национального Института Старения (США) NIH National Institute on Aging в последней редакции от 14 апреля 2022 года и Медицинского Институт Джона Хопкинса (США)). В тоже время возраст диагностики и дебюта бокового амиотрофического склероза (БАС) составляет от 40 лет и в некоторых случаях (до 10%) даже ранее этого возраста (данные специалистов Национальной Клиники Специальной Хирургии США (HSS, Hospital for Special Surgery of the USA), дата доступа 02 марта 2023 года, https://www.hss.edu/condition-list_amyotrophic-lateral-sclerosis.asp) и Медицинского Институт Джона Хопкинса (США), дата доступа 02 марта 2023 года, сhttps://www.hopkinsmedicine.org/health/conditions-and-diseases/amvotrophic-lateral-sclerosis-als). Причины черепно-мозговых травм (ЧМТ) лежат за пределами возрастных ограничений, так как они возникают вследствие либо механических травм и повреждение, либо как следствие инфекционных заболеваний, в том числе, перенесенных субклинических инфекций. Таким образом, ЧМТ охватывает широкий круг возрастных групп и укладывается в общий диапазон от 31 до 80 лет целевой потенциальной аудитории.
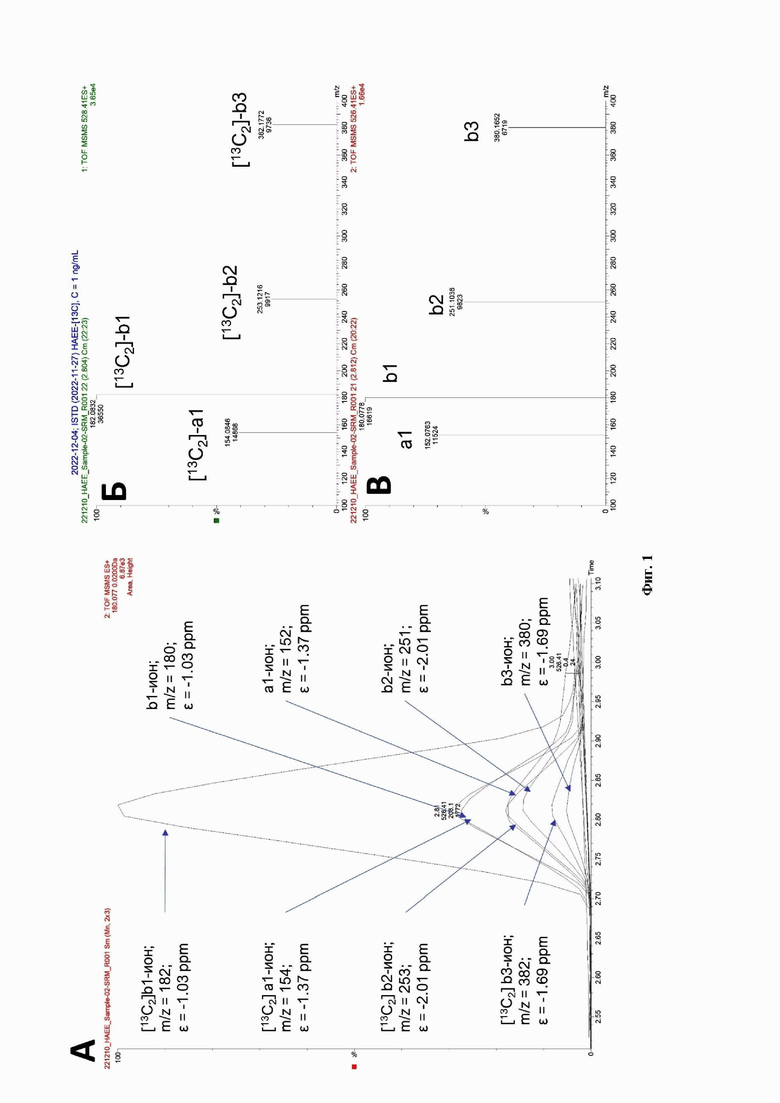
Измерение уровня секретируемого SRFM в плазме крови основано на применении метода ВЭЖХ-МС с детектированием молекулярных ионов SRFM и его характеристичных фрагментов (Фиг. 1Б и Фиг. 1В). Пробоподготовка заключается в выделении SRFM из плазмы крови. Предварительно в пробу плазмы крови добавляют химически идентичный молекуле SRFM, но отличный по изотопной композиции, внутренний стандарт (Фиг. 1А и 1Б) в известной концентрации до конечной концентрации от 500 пг/мл до 1000 пг/мл. К образцу плазму крови с внутренним стандартом добавляют семь объемов смеси органический растворителей (метанол, ацетонитрил и вода в объемных отношениях 7:2:1) и инкубируют в течение 10 минут при температуре 40°С в течение 10 минут. Затем полученную взвесь центрифугируют при 15000 g при температуре 10°С в течение 10 минут, полученную надосадочную жидкость (органический слой) переносят к 5 мл охлажденного 2,5% водного раствора гидроксида аммония для получения первичного экстракта. Из полученного раствора экстрагируют SRFM вместе с внутренним стандартом (Фиг. 1 и Фиг. 2) метод твердофазной экстракции на смешанном анион-обменном крупнопористом носителе (количеств носителя не должно быть менее 30 мг), который предварительно кондиционируют последовательно в метаноле, затем в ацетонитриле, затем в воде (все растворители однократно по 1 мл), затем сенсибилизируют в 2 мл водного раствора 2,5% гидроксида аммония (не охлажденный), после чего наносят первичный экстракт на сенсибилизированный носитель. Затем носитель промывают последовательно в 1 мл 2,5% гидроксида аммония (не охлажденный), в 1 мл воды, в 2 мл 60% метанола (охлажденного). Носитель немного подсушивают при -5 мм рт.ст., а затем проводят элюция SRFM и внутреннего стандарта в 700 мкл 3% муравьиной кислоты в ацетонитриле. Полученный экстракт переводится в водную фазу через выпаривание органической фазы (ацетонитрила) под вакуумом при температуре не выше 45°С, затем восстановленный в водном растворе 0,5% муравьиной кислоты сухой остаток можно использовать для ВЭЖХ-МС анализа. Нижним пределом количественного обнаружения SRFM в условиях ВЭЖХ-МС является 25 пг/мл, нижним пределом обнаружения сигнала (предел детекции) является 10 пг/мл.
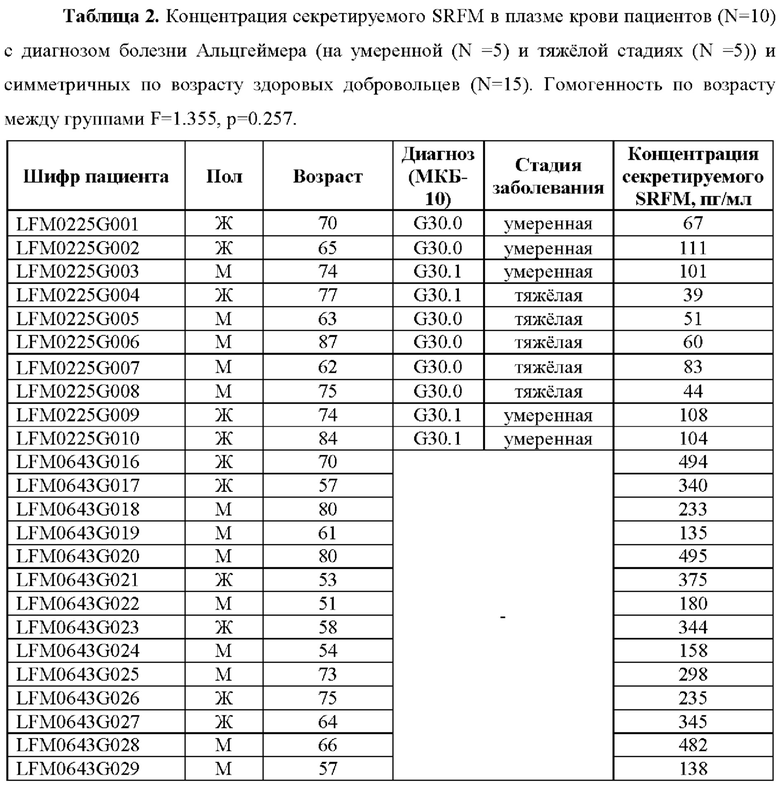
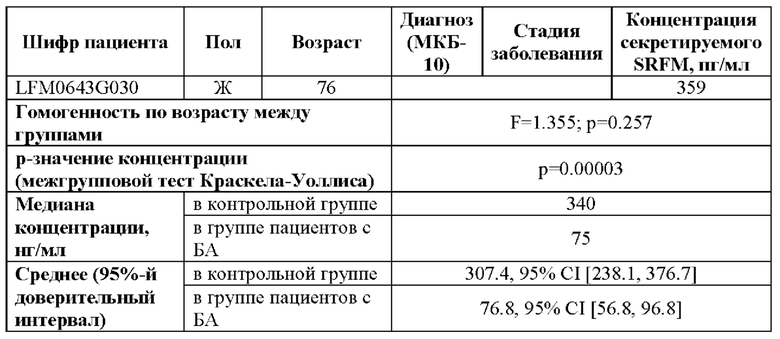
В проведенном исследовании уровень секретируемого SRFM в плазме крови у пациентов в возрасте от 62 до 84 лет с диагнозом болезни Альцгеймера определяли в диапазоне 39-111 пг/мл (Таблица 2). На умеренной стадии развития болезни Альцгеймера уровень секреции SRFM в плазме крови определяли в диапазоне 67-111 пг/мл. На тяжелой стадии развития болезни Альцгеймера уровень секреции SRFM в плазме крови определялся в диапазоне 39-83 пг/мл. При этом уровень секретируемого SRFM в плазме крови недементных добровольцев в возрасте от 51 до 80 лет определялся в диапазоне от 135 до 495 пг/мл.
Таким образом, показано, что концентрация секретируемого SRFM в крови дементных пациентов с прижизненным диагнозом болезни Альцгеймера значительно снижена по сравнению с недементными добровольцами из симметричной возрастной когорты, и при этом возможно выявить степень тяжести данного заболевания.
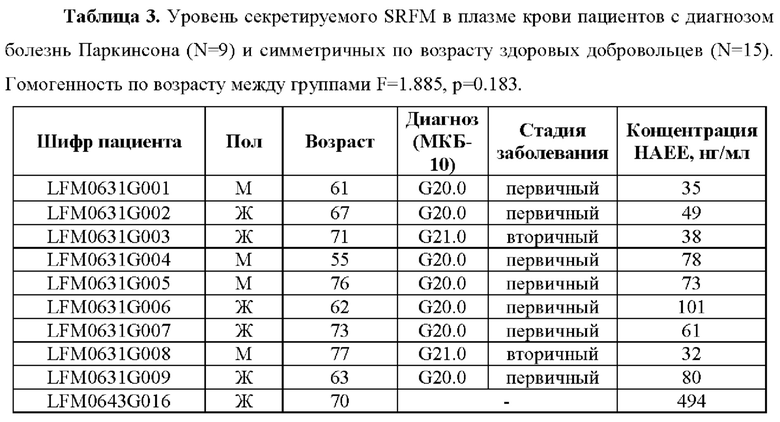
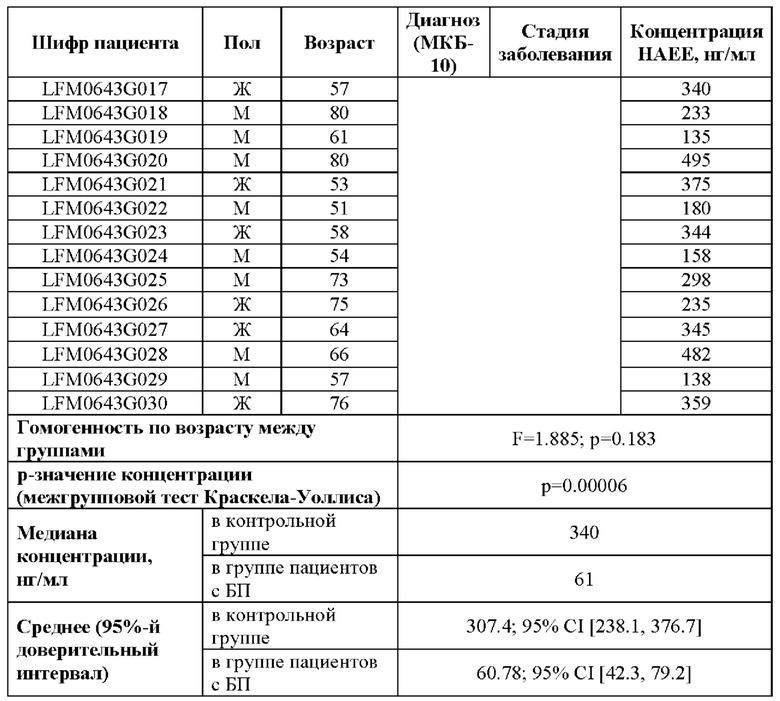
В проведенном исследовании уровень секретируемого SRFM у пациентов с диагнозом болезнь Паркинсона в возрасте от 55 до 77 лет составлял от 35 до 101 пг/мл (Таблица 3). При этом уровень SRFM в плазме крови недементных добровольцев в возрасте от 51 до 80 лет составлял от 135 до 495 пг/мл.
Таким образом, показано, что концентрация секретируемого SRFM в крови пациентов с прижизненным диагнозом болезни Паркинсона значительно снижена по сравнению с недементными добровольцами из симметричной возрастной когорты.
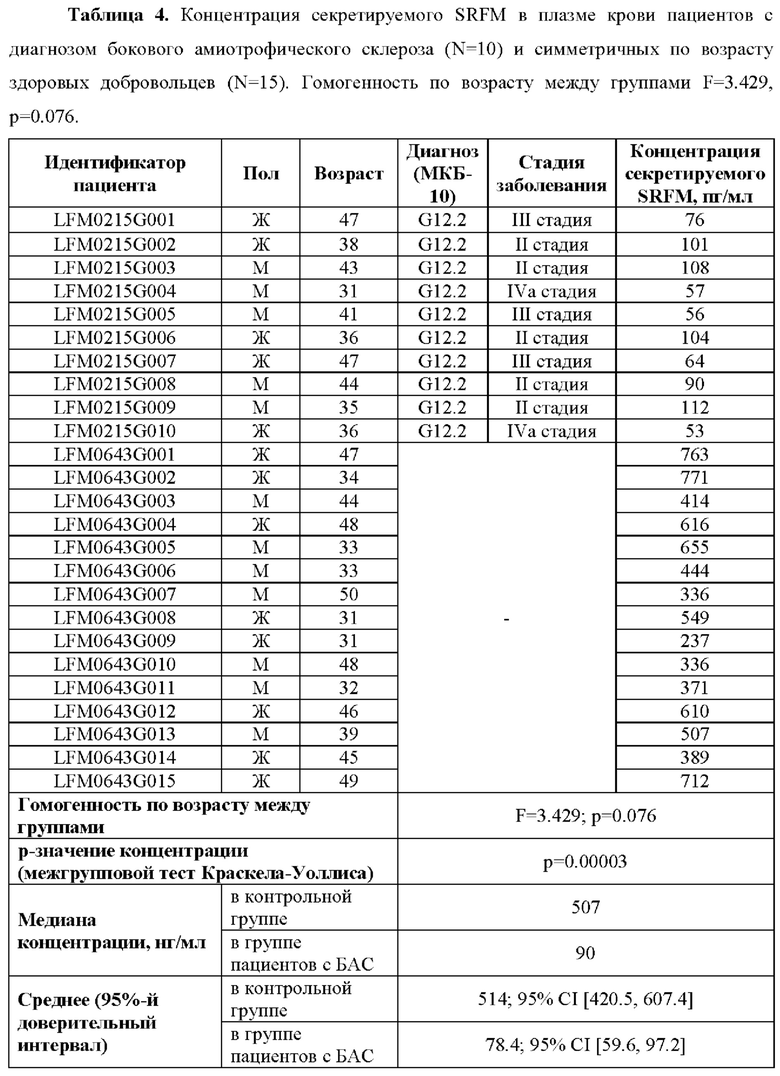
В проведенном исследовании уровень секретируемого SRFM у пациентов с диагнозом бокового амиотрофического склероза (БАС) в возрасте от 31 до 47 лет составлял от 51 до 118 пг/мл (Таблица 4). У пациентов на II стадии БАС уровень концентрации SRFM был выше 90 пг/мл, а у пациентов на III и IVa стадиях БАС этот уровень не превышал 76 пг/мл. При этом уровень секретируемого SRFM в плазме крови здоровых добровольцев в возрасте от 31 до 50 лет составил от 237 до 771 пг/мл.
Таким образом, показано, что концентрация секретируемого SRFM в крови пациентов с клиническим диагнозом БАС значительно снижена по сравнению со здоровыми добровольцами, и при этом имеется различие в уровне концентрации SRFM между стадиями заболевания чем выше стадия БАС, тем меньше уровень SRFM.
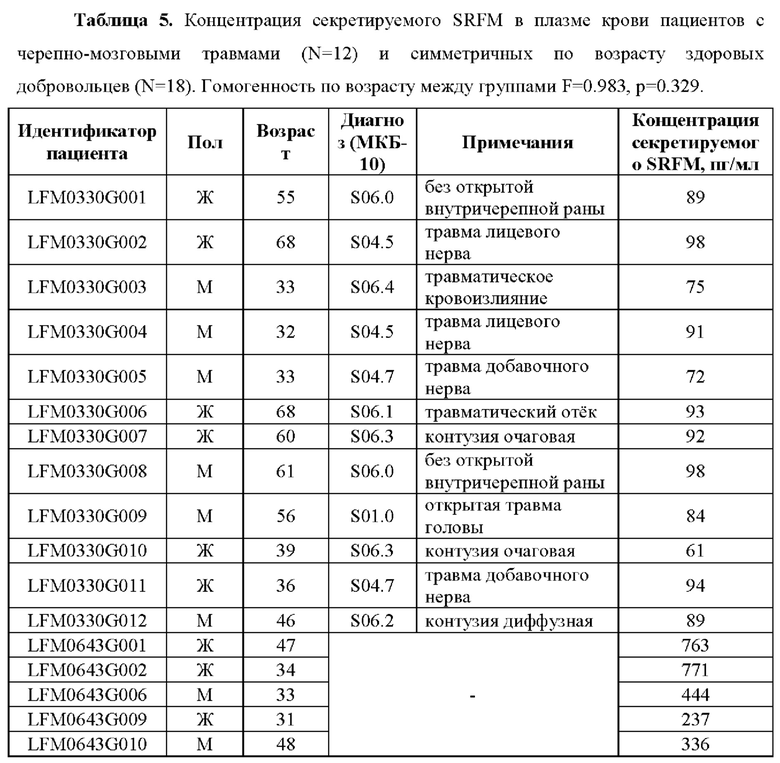
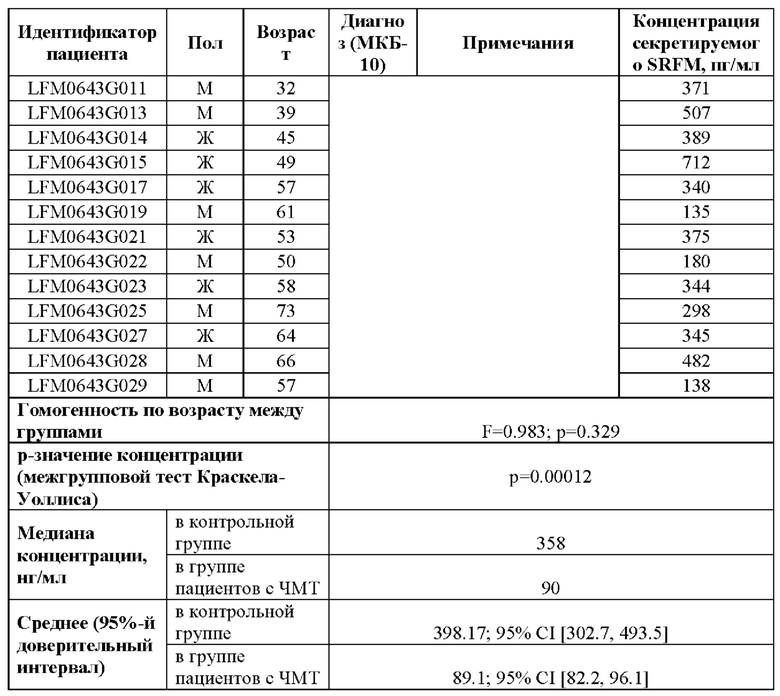
В проведенном исследовании уровень секретируемого SRFM у пациентов с черепно-мозговыми травмами в возрасте от 32 до 68 лет уровень секреции SRFM составлял от 61 до 98 пг/мл (Таблица 5). При этом уровень SRFM в плазме крови здоровых добровольцев в возрасте от 31 до 73 лет составил 135 до 771 пг/мл.
Таким образом, показано, что концентрация секретируемого SRFM в крови пациентов с черепно-мозговыми травмами значительно снижена по сравнению со здоровыми добровольцами.
В проведенном исследовании четырех пациентов с первоначальным диагнозом синдрома мягкого когнитивного снижения (МКС) определяли концентрацию секретируемого SRFM в образцах плазмы крови на протяжении пяти лет каждые полгода (всего 10 визитов с допустимым окном в 20 (двадцать) календарных дней, или ±10 (десять) календарных дней от даты очередного планового визита). Через пять лет двум пациентам из этой когорты был поставлен диагноз болезни Альцгеймера, другие два пациента оставались с диагнозом МКС. Из анализа изменений уровня секреции SRFM у пациентов с диагнозом МКС с течением времени (Таблица 6) установлено, что монотонное падение уровня концентрации SRFM в крови пациентов ассоциировано с прогрессированием деменции от мягкого когнитивного снижения (МКС) до ранних стадий болезни Альцгеймера. Показано, что по уровню SRFM можно выявить динамику развития заболевания и тяжесть его течения.
Таким образом, было показано, что нейроны способны к секреции SRFM, а секретируемый SRFM обнаруживается в крови человека, и уровень секретируемого SRFM зависит от состояния человека. Под действием нейротоксичного вещества происходит частичная или полная утрата способности нейронов секретировать SRFM, однако, эту способность можно восстановить с помощью сериальной доставки синтетического тетрапептида НАЕЕ к нейронам человека.
Таким образом, применение синтетического тетрапептида НАЕЕ для восстановления функции нейронов человека секретировать SRFM может использоваться для коррекции нейродегенеративных нарушений и заболеваний человека, ассоциированных с падением уровня SRFM в организме.
Неожиданно было обнаружено, что физиологически активное секретируемое вещество SRFM присутствует в крови только у человека и, предположительно, у высших приматов, как в норме, так и при патологии, в отличии от других млекопитающих, в частности грызунов, Зайцевых, псовых, кошачьих и др.
В проведенном исследовании установлено отсутствие секреции SRFM в крови здоровых мышей и крыс дикого типа, кроликов, а также в крови трансгенных мышей линии APP/PS1 с повышенной экспрессией бета-амилоида человека и используемых в качестве животной модели болезни Альцгеймера.
Таким образом, вещество SRFM не присутствует в крови исследованных лабораторных животных, и данные животные не могут быть использованы для исследования нейрональной дисфункции, ассоциированной с секрецией SRFM.
Описание фигур
Фиг. 1. Измерения уровня секретируемого SRFM методом ВЭЖХ-МС в плазме крови. (А) композитный сигнал внутреннего стандарта [13С2]-НАЕЕ и секретируемого SRFM, зарегистрированные в пробе плазмы крови ЭДТА-2К+ пациента ПЕА (идентификатор пациента LFM0643G004, возраст 60 лет, Ж) в режиме мониторинга множественных реакций (SRM). Концентрация внутреннего стандарта [13С2]-НАЕЕ, внесенного в пробу перед началом аналитической подготовки, составляла Cs=1 нг/мл; измеренная концентрация секретируемого SRFM в пробе плазмы крови пациента LFM0643G004 составил Се=0.789 нг/мл. (Б) спектр фрагментный ионов b1, 2, b3 и a1 внутреннего стандарта [13С2]-НАЕЕ со сдвигом массы в Δm= +2.0067 u. (В) к соответствующим фрагментным ионам секретируемого SRFM, обнаруженного и измеренного в пробе плазмы крови пациента LFM0643G004.
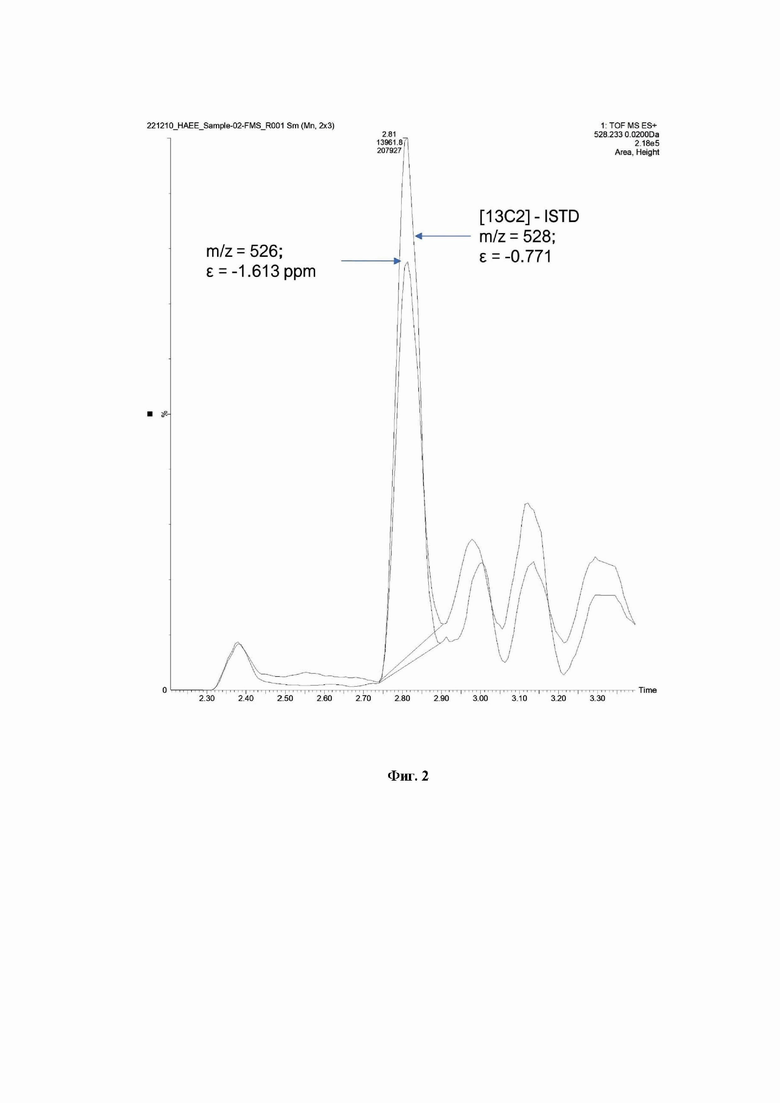
Фиг. 2. Хроматограммы изолированного ионного тока родительского иона внутреннего стандарта [13С2-НАЕЕ] с m/z=528.2329 в концентрации 1 нг/мл и родительского иона секретируемого SRFM с m/z=526.2256 в концентрации С=0.789 нг/мл, измеренной в пробе плазмы крови пациента LFM0643G004.
Изобретение иллюстрируется нижеприведенными примерами, но не ограничивается ими.
Пример 1. Получение комплексов и солей синтетического тетрапептида НАЕЕ
Для приготовления всех комплексов синтетического тетрапептида НАЕЕ готовили первоначальный раствор НАЕЕ с концентрацией 10-5 М. Далее готовили растворы ацетата цинка (патент РФ №2784319, дата государственной регистрации от 23 ноября 2022 года), хлорида кальция (патент РФ №2785354, дата государственной регистрации от 06 декабря 2022 года), хлорида магния (патент РФ №2784746, дата государственной регистрации от 29 ноября 2022 года) и хлорида меди (патент РФ №2784732, дата государственной регистрации от 29 ноября 2022 года) с концентрацией 10-3 М.
Для получения соответствующих комплексов в стехиометрическом молярном соотношении 1:1 смешивали 1 мл раствора НАЕЕ и 10 мкл соли цинка (патент РФ №2784319) или кальция (патент РФ №2785354) или магния (патент РФ №2784746) или меди (патент РФ №2784732) и перемешивали в течение 5-10 мин.
Полученные растворы НАЕЕ с каждым из катионов медленно замораживали в холодильной установке при -20°С и затем осуществляли лиофильную сушку в стандартном режиме (давление 0,2 мбар, время 24 ч).
Для приготовления всех солей НАЕЕ готовили первоначальный раствор НАЕЕ с концентрацией 10-5 М. Далее готовили растворы гидроксида натрия (патент РФ №2784326, дата государственной регистрации от 23 ноября 2022 года), гидроксида калия (патент РФ №2784425, дата государственной регистрации от 24 ноября 2022 года), гидроксида аммония (патент РФ №2784249, дата государственной регистрации от 23 ноября 2022 года) с концентрацией 10-4 М.
Для получения соответствующих однозамещенных солей смешивали 1 мл раствора НАЕЕ и 100 мкл соответствующего раствора гидроксида натрия (патент РФ №2784326) или гидроксида калия (патент РФ №2784425) или гидроксида аммония (патент РФ №2784249) и перемешивали в течение 5-10 мин.
Для получения соответствующих двузамещенных солей смешивали 1 мл раствора НАЕЕ и 200 мкл соответствующего раствора гидроксида натрия (патент РФ №2784326) или гидроксида калия (патент РФ №2784425) или гидроксида аммония (патент РФ №2784249) и перемешивали в течение 5-10 мин.
Полученные растворы НАЕЕ с каждым из катионов медленно замораживали в холодильной установке при -20°С и затем осуществляли лиофильную сушку в стандартном режиме (давление 0,2 мбар, время 24 ч).
Таким образом, были получены цинковый (HAEE-Zn; патент РФ №2784319, дата государственной регистрации от 23 ноября 2022 года), кальциевый (НАЕЕ-Са; патент РФ №2785354, дата государственной регистрации от 06 декабря 2022 года), магниевый (HAEE-Mg; патент РФ №2784746, дата государственной регистрации от 29 ноября 2022 года) и медный (НАЕЕ-Cu; патент РФ №2784732, дата государственной регистрации от 29 ноября 2022 года) комплексы НАЕЕ, однозамещенные (HAEE-Na, HAEE-K, HAEE-NH4) и двузамещенные (HAEE-Na2, НАЕЕ-K2, HAEE-(NH4)2,) натриевая (патент РФ №2784326, дата государственной регистрации от 23 ноября 2022 года), калиевая (патент РФ №2784425, дата государственной регистрации от 24 ноября 2022 года) и аммониевая (патент РФ №2784249, дата государственной регистрации от 23 ноября 2022 года) соли НАЕЕ.
Пример 2. Определение концентрации секретируемого SRFM в плазме крови здоровых добровольцев
Забор венозной крови проводили у здоровых добровольцев (возрастные группы от 31 до 50 полных лет и от 51 до 80 полных лет; возрастной интервал генерализованной выборки от 31 до 80 полных лет) и затем готовили аликвоты плазмы крови (ЭДТА-2К+), которые замораживали для длительного хранения.
Регистрацию сингала секретируемого SRFM в плазме крови (ЭДТА-2К+) проводили методом высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрией (ВЭЖХ-МС) в режиме положительной электростатической ионизации и тандемного или адресного сканирования по прекурсорному и фрагментным ионам. Количественную оценку проводили по площади или высоте хроматографического пика изолированного ионного тока прекурсорного иона или базового фрагментного иона-квантора секретируемого SRFM и внутреннего стандарта [13С2]-НАЕЕ, отличающегося от SRFM по изотопному составу из-за включения двух изотопов [13С2] атома углерода, то есть отличного от SRFM на +2.00671 атомных единиц массы (Фиг. 1, 2).
Выделение секретируемого SRFM проводили из плазмы крови, предварительно добавив в нее внутренний стандарт [13С2]-НАЕЕ в известной концентрации (в пределах от 100 пг/мл до 1000 пг/мл). Выделение секретируемого SRFM вместе с внутренним стандартом [13С2]-НАЕЕ осуществляли последовательно путем жидкостной экстракции в смеси растворителей (метанол, ацетонитрил, вода) и твердофазной экстракции на смешанном анион-обменном крупнопористом носителе с конечной элюцией в закисленном органическом растворителе (ацетонитриле). Полученный экстракт переводили в водную фазу через выпаривание органической фазы в вакууме, затем восстановленный в слабом кислом водном растворе сухой остаток использовали для ВЭЖХ-МС анализа.
Таким образом, аликвота плазмы крови после необходимых лабораторных процедур, направленных на получение обогащенной по SRFM и внутреннему стандарту фракции, анализировалась количественным методом масс-спектрометрии с использованием высокоэффективной жидкостной хроматографии и внутреннего изотопно-меченного стандарта.
Было определено, что концентрация секретируемого SRFM в исследованных образцах (N=30) составляла от 135 до 771 пг/мл (Таблица 1). Погрешность всех измерений составляла не более 10% на нижних уровнях измерение (от 25 до 100 пг/мл) и не более 5% на средних и верхних уровнях измерений (более 100 пг/мл, но менее 5000 пг/мл).
Пример 3. Концентрация секретируемого SRFM в крови пациентов с диагнозом болезнь Альцгеймера
С использованием количественного метода анализа концентрации секретируемого SRFM в соответствии с Примером 2 установлено, что у десяти пациентов с диагнозом болезни Альцгеймера в возрасте от 62 до 84 лет уровень концентрации SRFM составил от 39 до 111 пг/мл (Таблица 2). При этом у пациентов на умеренной стадии болезни Альцгеймера уровень концентрации SRFM составлял от 67 до 111 пг/мл, а у пациентов с тяжелой стадией (Таблица 2) этот уровень составлял от 39 до 83 пг/мл.
Аналогичный анализ концентрации SRFM в крови пятнадцати здоровых добровольцев в возрасте от 51 года до 80 лет выявил, что у таких добровольцев концентрация секретируемого SRFM составляла от 135 до 495 пг/мл.
Таким образом, показано, что концентрация секретируемого SRFM в крови дементных пациентов с прижизненным диагнозом болезни Альцгеймера значительно снижена по сравнению с недементными добровольцами из симметричной возрастной когорты, и при этом имеется существенное различие между альцгеймеровскими пациентами на умеренной и тяжелой стадиях заболевания.
Пример 4. Концентрация секретируемого SRFM в крови пациентов с диагнозом болезнь Паркинсона
С использованием количественного метода анализа концентрации секретируемого SRFM в соответствии с Примером 2 установлено, что у девяти пациентов с диагнозом болезни Паркинсона в возрасте от 55 до 77 лет уровень концентрации SRFM составил от 35 до 101 пг/мл (Таблица 3). Аналогичный анализ концентрации секретируемого SRFM в крови пятнадцати недементных добровольцев в возрасте от 51 года до 80 лет выявил, что концентрация НАЕЕ составляла от 135 до 495 пг/мл.
Таким образом, показано, что концентрация секретируемого SRFM в крови пациентов с прижизненным диагнозом болезни Паркинсона значительно снижена по сравнению с недементными добровольцами из симметричной возрастной когорты.
Пример 5. Уровень секретируемого SRFM в крови пациентов с клиническим диагнозом бокового амиотрофического склероза (БАС)
С использованием количественного метода анализа концентрации SRFM в соответствии с Примером 2 установлено, что у десяти пациентов с диагнозом БАС в возрасте от 31 до 47 лет уровень концентрации SRFM составил от 51 до 108 пг/мл (Таблица 4). При этом у пациентов на II стадии БАС (N=5) уровень секреции SRFM был выше 90 пг/мл, а у пациентов на III и IVa стадиях БАС (N=5) этот уровень не превышал 76 пг/мл.
Аналогичный анализ концентрации SRFM в крови пятнадцати здоровых добровольцев в возрасте от 31 до 50 лет выявил, что у таких добровольцев концентрация SRFM составляла от 237 до 771 пг/мл.
Таким образом, показано, что концентрация секретируемого SRFM в крови пациентов с клиническим диагнозом БАС значительно снижена по сравнению со здоровыми добровольцами, и при этом имеется различие в уровне концентрации секретируемого SRFM между стадиями заболевания - чем выше стадия БАС, тем меньше уровень SRFM.
Пример 6. Уровень секретируемого SRFM в крови пациентов с черепно-мозговыми травмами (ЧМТ)
С использованием количественного метода анализа концентрации SRFM в соответствии с Примером 2 установлено, что у двенадцати пациентов с ЧМТ в возрасте от 32 до 68 лет уровень концентрации SRFM составлял от 61 до 98 пг/мл (Таблица 5).
Аналогичный анализ концентрации секретируемого SRFM в крови восемнадцати здоровых добровольцев в возрасте от 31 до 73 лет выявил, что у таких добровольцев концентрация НАЕЕ составляла от 135 до 771 пг/мл.
Таким образом, показано, что концентрация секретируемого SRFM в крови пациентов с ЧМТ значительно снижена по сравнению со здоровыми добровольцами.
Пример 7. Уровень секреции НАЕЕ во времени (лонгитудинальное исследование) в крови пациентов с синдромом мягкого когнитивного снижения (МКС)
С использованием метода ВЭЖХ-МС аналогично Примеру 2 определяли уровень секреции SRFM во времени в плазме крови у пациентов с синдромом МКС (Таблица 6).
Были отобраны четверо пациентов с установленным синдромом МКС, которых наблюдали в течение 5 лет (всего 10 визитов) с интервалом 6 месяцев (с допустимым окном в 20 дней от даты очередного планового визита). Во время каждого планового визита у каждого пациента проверяли уровень SRFM и наличие прогрессирования синдрома МКС. Оценивали память, внимание, концентрация, восприятие информации, логическое мышление и др.
У двух пациентов (LFM0163G001, LFM0163G003) с синдромом МКС при их осмотре когнитивные функции не снижались с течением времени на протяжении 5 лет обследования. При этом у пациента LFM0163G001 уровень секреции SRFM упал с 141 до 120 пг/мл за все время наблюдения. У пациента LFM0163G003 уровень SRFM упал с 125 до 96 пг/мл. Изменения уровня секреции SRFM для пациентов составила примерно не более 20% за каждые 6 месяцев наблюдения.
У двух пациентов (LFM0163G002, LFM0163G004) с синдромом МКС при их осмотрах на протяжении 5 лет когнитивные функции были снижены по сравнению с нулевым (контрольным) обследованием, при этом уровень секреции SRFM падал более чем на 20% между обследованиями. Через 2 года исследования в 2019 году пациентам был поставлен диагноз болезнь Альцгеймера (G30.0 по МКБ-10), а уровень секретируемого SRFM за это время снизился в 2 раза для пациента LFM0163G002 и в 1,5 раза для пациента LFM0163G004. Причем концентрация секретируемого SRFM продолжила снижаться при дальнейшем наблюдении, а на полугодовых осмотрах наблюдалось прогрессивное снижение когнитивных функций.
Таким образом, по изменению уровня секреции SRFM во времени можно выявить динамику развития заболевания и тяжесть его течения.
Пример 8. Определение концентрации секретируемого SRFM в культуральной среде нейрональных клеток человека в норме
Зрелые нейроны были получены из фибробластов кожи здорового человека через индуцируемые плюрипотентные стволовые клетки (In English: induced pluripotent stem cells, iPS cells) и долгоживущие самообновляющиеся нейроэпителиоподобные стволовые клетки (ш English: long-term self-renewing neuroepithelial-like stem cells, lt-NES cells) no нижеследующей схеме.
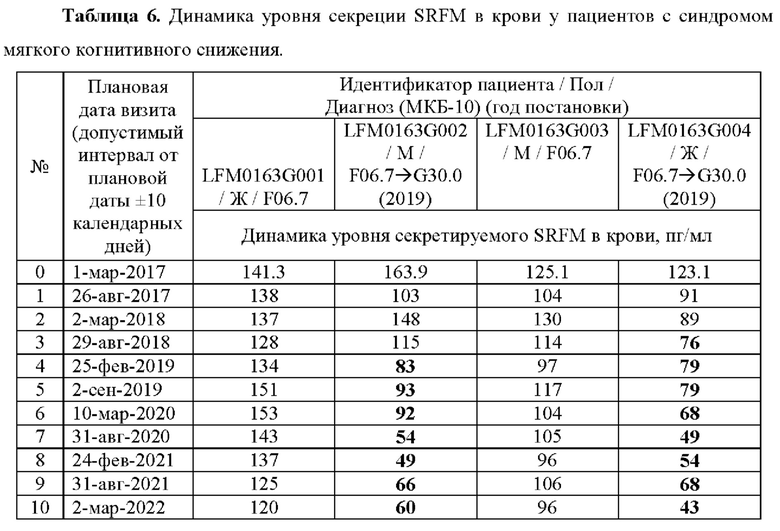
Индуцируемые плюрипотентные стволовые (iPS) клетки (iPS-клетки) были получены репрограммированием фибробластов с использованием SENDAI вируса согласно протоколу производителя (STEMCELL Techonogies). Затем iPS-клетки были дифференцированы согласно опубликованному методу (Koch Р, Opitz Т, Steinbeck JA, Ladewig J, Brüstle О (2009) A rosette-type, self-renewing human ES cell-derived neural stem cell with potential for in vitro instruction and synaptic integration. Proc Natl Acad Sci USA 106: 3225-3230) в долгоживущие самообновляющиеся нейроэпителиоподобные стволовые клетки (lt-NES-клетки). Полученные lt-NES-клетки далее по протоколу (Falk, А., P. Koch, J. Kesavan, Y. Takashima, J. Ladewig, M. Alexander, O. Wiskow, J. Tailor, M. Trotter, S. Pollard, A. Smith and O. Brüstle (2012). Capture of Neuroepithelial-Like Stem Cells from Pluripotent Stem Cells Provides a Versatile System for in Vitro Production of Human Neurons. PLOS ONE 7(1): e29597) были с помощью удаления факторов роста индуцированы для дифференцирования в функциональные нейроны GABA-эргического фенотипа (около 90% от общего числа клеток) и в астроциты (около 10% от общего числа клеток). После окончания процессов дифференцирования полученная культура (нейронов и астроцитов) поддерживалась в течение 30 сут. Смена культуральной среды проводилась через каждые три дня, и в удаляемой среде определяли концентрацию секретируемого в культуральную среду SRFM методом ВЭЖХ-МС. Было установлено, что в культуральной среде концентрация SRFM оставалась на уровне в среднем около 100 пикограммов на миллилитр в течение всего срока наблюдений (30 сут).
Смена культуральной среды проводилась через каждые три дня, и для проведения измерений концентрации секретируемого в культуральную среду SRFM удаляемая среда анализировалась на содержание в ней SRFM методом ВЭЖХ-МС (в соответствии с Примером 2).
Было установлено, что в культуральной среде концентрация SRFM оставалась на уровне около 100 пикограммов на миллилитр в течение всего срока наблюдений (30 дней) (Таблица 7).
Таким образом, показано, что физиологически активное вещество SRFM является продуктом, секретируемым нейронами человека в норме.
Таблица 7. Уровень SRFM, секретируемого клетками нейронов в культуральную среду
Пример 9. Определение концентрации SRFM, секретируемого в культуральную среду нейрональными клетками человека после воздействия нейротоксичным веществом isoAβ
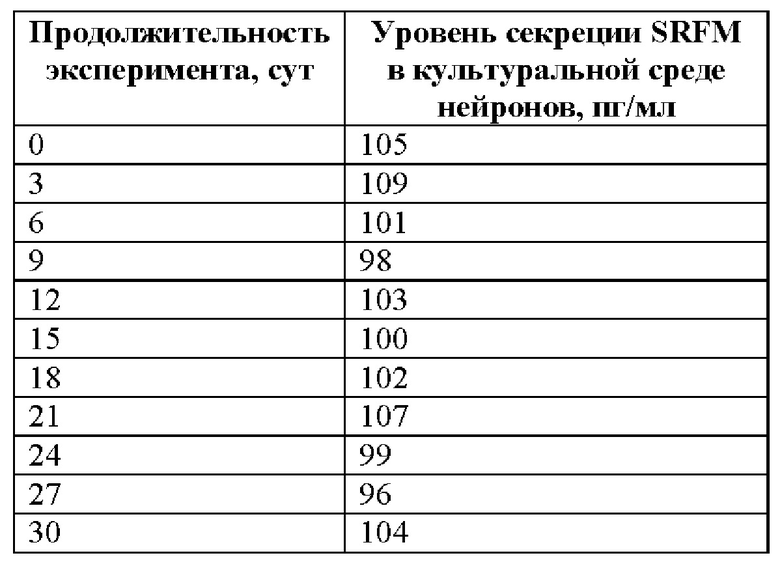
Нейроны человека, полученные в соответствии с Примером 8 настоящего изобретения, были использованы для анализа возможных изменений в секреции SRFM при добавлении в культуральную среду синтетического аналога бета-амилоида с изомеризованным остатком Asp7 (isoAβ) так, чтобы концентрация isoAβ в растворе составляла 100 нанограммов в миллилитре.
Было показано, что под воздействие isoAβ уровень концентрации SRFM, секретируемого нейронами в культуральную среду, снижался ниже пределов количественного обнаружения (ниже 25 пг/мл) и не восстанавливался в течение всего времени наблюдений (30 дней) (Таблица 8).
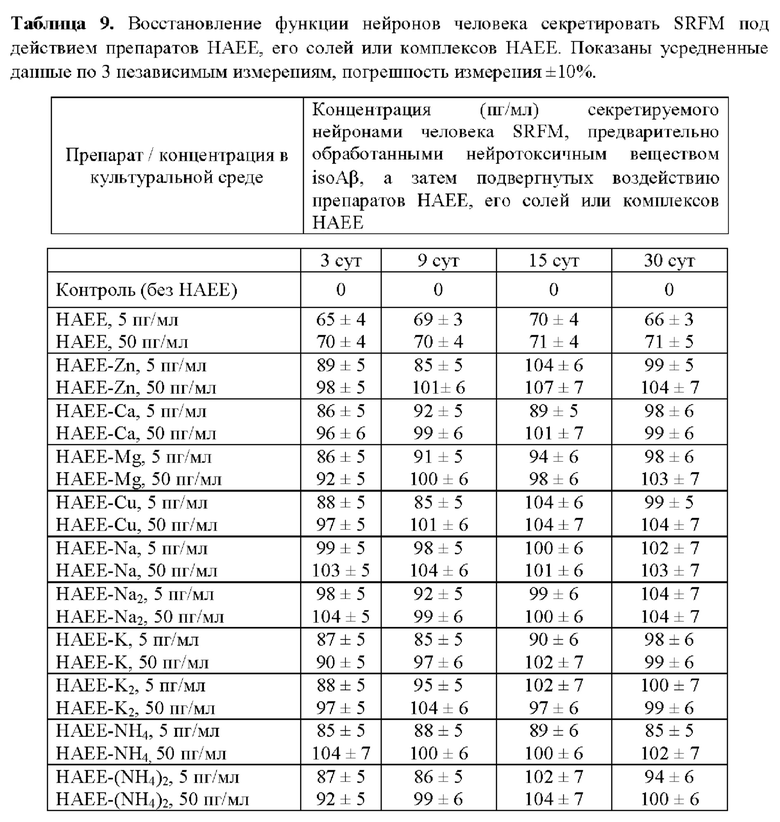
Пример 10. Влияние синтетического тетрапептида НАЕЕ, его солей или его комплексов или их смесей на способность нейронов человека восстанавливать свою функцию секреции SRFM, нарушенную под действием нейротоксичного вещества
Было оценено влияние синтетического тетрапептида НАЕЕ, его солей или его комплексов или их смесей на нейроны человека с нарушенной функцией секреции SRFM.
Схема эксперимента заключалась в следующем. Человеческие нейроны с нарушенной функцией секреции SRFM (приготовленные в соответствии с Примером 9) обрабатывались препаратами водных растворов, содержащих синтетический тетрапептид НАЕЕ или его комплексы или его соли, так, чтобы конечная концентрация экзогенного НАЕЕ в культуральной среде сразу после добавления одного из вышеуказанных препаратов составляла 5 пг/мл или 50 пг/мл, соответственно (Таблица 9). Каждый препарат последовательно добавляли к нейронам три раза (при трех последовательных сменах культуральной среды) и затем (после смены культуральной среды, содержащей НАЕЕ или его соли или его комплексы, на свежую культуральную среду) определяли концентрацию секретируемого SRFM методом ВЭЖХ-МС (в соответствии с Примером 2).
Показано, что сериальное добавление синтетического тетрапептида НАЕЕ, его солей или его комплексов к нейронам с дисфункцией секреции SRFM приводило к восстановлению способности таких нейронов секретировать SRFM до уровня 65-70 пг/мл, 85-104 пг/мл или 76-107 пг/мл в случае использования синтетического тетрапептида НАЕЕ, комплексов синтетического тетрапептида НАЕЕ или солей синтетического тетрапептида НАЕЕ, соответственно (Таблица 9).
Таким образом, добавление в культуральную среду НАЕЕ, солей или комплексов НАЕЕ позволяет частично или полностью восстановить нарушенную функцию нейронов секретировать SRFM.
Пример 11. Уровень секретируемого SRFM в крови лабораторных животных
С использованием метода ВЭЖХ-МС в соответствии с Примером 2 определяли концентрации секретируемого SRFM в плазме крови лабораторных животных четырех экспериментальных групп, в каждой из которой самки и самцы были представлена в равных пропорциях (50% самок, 50% самцов) для исключения возможности тендерной специфичности секреции SRFM: здоровые мыши (N=6), крысы (N=6), кролики (N=6) породы Советская Шиншилла и группа трансгенных мышей линии APP/PS1 (N=6) с повышенной экспрессией бета-амилоида человека и используемых в качестве животной модели болезни Альцгеймера.
В каждой из четырех групп экспериментальных животных уровень НАЕЕ оказался ниже нижнего предела количественного обнаружения (ниже 25 пг/мл).
Таким образом, физиологически активное секретируемое вещество SRFM не присутствует в крови исследованных лабораторных животных, и данные животные не могут быть использованы для исследования восстановления нейрональной дисфункции, ассоциированной с секрецией SRFM.
Изобретение относится к медицине и касается применения синтетического тетрапептида Ac-His-Ala-Glu-Glu-NH2 с N-терминальной ацетильной группой и С-терминальной амидной группой (НАЕЕ) или его фармацевтически приемлемых солей, или комплексов для восстановления функции нейронов человека секретировать физиологически активное химическое вещество (4S, 7S, 10S, 13S)-4-((1Н-имидазол-4-ил)метил)-13-карбамоил-10-(2-карбоксиэтил)-7-метил-2,5,8,11-тетраоксо-3,6,9,12-тетраазагексадекан-16-овая кислота (SRFM). Изобретение обеспечивает возможность восстановления функции нейронов при нейродегенеративных нарушениях, связанных с частичной или полной утратой нейронов человека способности секретировать SRFM, что приводит к сильному падению уровня SRFM в крови по сравнению с физиологической нормой или полному прекращению секреции SRFM. 15 з.п. ф-лы, 2 ил., 9 табл., 11 пр.
1. Применение синтетического тетрапептида Ac-His-Ala-Glu-Glu-NH2 c N-терминальной ацетильной группой и C-терминальной амидной группой (HAEE) или его фармацевтически приемлемых солей, или комплексов, или их смесей для восстановления функции нейронов человека секретировать вещество (4S,7S,10S,13S)-4-((1H-имидазол-4-ил)метил)-13-карбамоил-10-(2-карбоксиэтил)-7-метил-2,5,8,11-тетраоксо-3,6,9,12-тетраазагексадекан-16-овая кислота (SRFM).
2. Применение по п. 1, по которому синтетический тетрапептид HAEE находится в нативной форме.
3. Применение по п. 1, по которому синтетический тетрапептид HAEE находится в форме цинкового комплекса.
4. Применение по п. 1, по которому синтетический тетрапептид HAEE находится в форме кальциевого комплекса.
5. Применение по п. 1, по которому синтетический тетрапептид HAEE находится в форме магниевого комплекса.
6. Применение по п. 1, по которому синтетический тетрапептид HAEE находится в форме медного комплекса.
7. Применение по п. 1, по которому синтетический тетрапептид HAEE находится в форме однозамещенной натриевой соли.
8. Применение по п. 1, по которому синтетический тетрапептид HAEE находится в форме двузамещенной натриевой соли.
9. Применение по п. 1, по которому синтетический тетрапептид HAEE находится в форме однозамещенной калиевой соли.
10. Применение по п. 1, по которому синтетический тетрапептид HAEE находится в форме двузамещенной калиевой соли.
11. Применение по п. 1, по которому синтетический тетрапептид HAEE находится в форме однозамещенной аммониевой соли.
12. Применение по п. 1, по которому синтетический тетрапептид HAEE находится в форме двузамещенной аммониевой соли.
13. Применение по п. 1, которое показано при сниженном уровне секреции (4S,7S,10S,13S)-4-((1H-имидазол-4-ил)метил)-13-карбамоил-10-(2-карбоксиэтил)-7-метил-2,5,8,11-тетраоксо-3,6,9,12-тетраазагексадекан-16-овая кислота (SRFM) по сравнению с нормой.
14. Применение по п. 13, при котором сниженный уровень секреции вещества SRFM связан с нейродегенеративными заболеваниями и нарушениями у человека.
15. Применение по п. 14, по которому нейродегенеративные заболевания представляют собой болезнь Альцгеймера, болезнь Паркинсона, синдром мягкого когнитивного снижения, синдром бокового амиотрофического склероза.
16. Применение по п. 14, по которому нейродегенеративные нарушения представляют собой черепно-мозговые травмы.
| КОЗИН С.А | |||
| и др | |||
| Конвергенция концепций патогенеза болезни Альцгеймера | |||
| Молекулярная биология, 2019, т.53, N 6, с.1020-1028 | |||
| Фармацевтическая композиция на основе пептида HAEE для лечения нейродегенеративных заболеваний | 2019 |
|
RU2709539C1 |
| СРЕДСТВО, НОРМАЛИЗУЮЩЕЕ ФУНКЦИИ ГОЛОВНОГО МОЗГА, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2302871C1 |
| ПЕПТИД, СТИМУЛИРУЮЩИЙ РЕГЕНЕРАЦИЮ НЕЙРОНОВ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ И СПОСОБ ЕЕ ПРИМЕНЕНИЯ | 2006 |
|
RU2301678C1 |
| BARYKIN E.P | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Int J Mol Sci., 2020, 21(17):6272, doi: | |||
Авторы
Даты
2024-07-09—Публикация
2023-03-03—Подача