Изобретение относится к медицинской и молекулярной генетике, а именно к генетическим конструкциям, экспрессирующим РНК-последовательности и гены, кодирующие белки, обладающие антивирусной активностью в отношении вируса иммунодефицита человека, и могут быть использованы в научных исследованиях.
Из уровня техники (патент РФ №2426788, опубликован 20.08.2011; МПК C12N 15/86) известны генетические конструкции на основе модифицированного ленти-вирусного вектора, содержащие последовательность, кодирующую модифицированный белок TRIM5α человека, где модификация включает изменение аминокислотной последовательности TRIM5α в области SPRY домена, которое обеспечивает распознавание модифицированным белком TRIM5α вирусного капсида ВИЧ. TRIM5α (tripartite motif 5α) - белковый фактор, обуславливающий устойчивость резус-макак к ВИЧ, содержащий С-концевой SPRY домен, связывающийся с капсидом ВИЧ и отвечающий за устойчивость клетки к заражению ВИЧ. Различие в аминокислотном составе этого домена между приматами определяет различие в наборе ретровирусов, к которым устойчив данный вид. Предложенное изобретение направлено на создание более эффективных антиВИЧ препаратов на основе РНК и белков, продуцируемых в клетках, с помощью введенных генетических конструкций, предложенных по изобретению. В RU 2426788 также продемонстрировано, что комбинирование двух и более антивирусных агентов, перечисленных ниже, в одной генетической конструкции обеспечивает синергетический эффект: каждый агент по отдельности в различной степени подавляет репродукцию ВИЧ (от 50% до 90%); одновременное использование нескольких противовирусных агентов замедляет образование мутантных штаммов, а комбинация противовирусных агентов с агентами, придающими резистентность клеткам к ВИЧ, позволяет получить 100% антивирусную активность препарата и предотвратить появление устойчивых мутантов.
Частные варианты выполнения изобретения включают генетические конструкции для антиВИЧ терапии на основе лентивирусного вектора, в том числе и самоинактивирующегося лентивирусного вектора, где лентивирусный вектор создан на основе одного или нескольких из лентивирусов: ВИЧ-1, ВИЧ-2, ВИО, вирус иммунодефицита крупного рогатого скота, лентивирус артрита-энцефалита коз, вирус инфекционной анемии лошадей, вирус иммунодефицита кошек и проч.
Также из патента РФ №2533817 (опубликован 20.11.2014; МПК C12N 15/86, А61Р 31/18) известны усовершенствованные генетические конструкции, содержащие последовательность, кодирующую модифицированный белок TRIM5α человека, с целью повышения уровня экспрессии гена, и, следовательно, количества белка, что приведет к повышению противовирусной эффективности данных конструкций в отношении ВИЧ. Предлагаемые генетические конструкции, кодирующие модифицированный белок TRIM5α, отличаются от известных генетических конструкций тем, что в последовательности модифицированного гена TRI5a размером 1488 п.н. (496 кодонов) было произведено около 200 синонимичных замен нуклеотидов по всей длине таким образом, что процентный состав суммы всех гуанинов (G) и цитозинов (С) по отношению к общему числу нуклеотидов (GC-состав) последовательности увеличился. Согласно результатам исследования, антиВИЧ активность конструкции, включающей последовательность, кодирующую модифицированный белок TRIM5α человека с множественными синонимичными заменами, почти в 40 раз выше по сравнению с активностью аналогичной конструкции, включающей последовательность, кодирующую модифицированный белок TRIM5α человека, описанной в патенте RU 2426788 (без синонимичных замен). Кроме того, увеличилась жизнеспособность клеток в присутствии ВИЧ.
Наиболее близким к настоящему изобретению аналогом следует считать способ, раскрытый в работе Андерсона и его коллег (J.S. Anderson, J. Javien, J.A. Nolta, and G. Bauer "Preintegration HIV-1 Inhibition by a Combination Lentiviral Vector Containing a Chimeric TRIM5α Protein, a CCR5 shRNA, and a TAR Decoy" // Molecular Therapy, 2009, Vol. 17(12), pp. 2103-2114), где описан способ определения уровня экспрессии химерного гена TRIM5a с использованием набора кДНК обратной транскрипции с высокой производительностью (High Capacity cDNA Reverse Transcription Kit). Для измерения уровня экспрессии методом количественной ПЦР с обратной транскрипцией в режиме реального времени (QRT-PCR) использовали интеркалирующий краситель SYBR Green. Однако использование интеркалирующего красителя не позволяет с высокой точностью проводить количественные измерения, поскольку такой краситель детектирует любую двухцепочечную ДНК, в том числе любые неспецифические продукты амплификации и праймер-димеры. Только специфическая детекция с использованием олигонуклеотидных зондов позволит проводить количественные измерения исключительно специфических продуктов амплификации.
Задачей настоящего изобретения является создание эффективного способа измерения уровня экспрессии, который позволил бы одновременно определять количество мРНК химерного гена TRIM5a (далее - TRIM5a-ch) и количество мРНК человеческого гена TRIM5a (далее - TRIM5a-hum), сравнивать уровень экспрессии этих генов в разных условиях и подбирать условия экспрессии таким образом, чтобы транскрипция находилась в пределах физиологических значений и была безопасна для клетки.
Технический результат - расширение функциональных возможностей способа определения уровня экспрессии гена TRIM5α-ch, которое позволяет не только измерять количество мРНК химерного гена TRIM5a-ch в клетке, но и сравнивать его с уровнем экспрессии гена TRIM5a человека и изучать воздействие одного гена на экспрессию другого.
Поставленная задача решается, а технический результат достигается путем создания способа определения уровня экспрессии генов Trim5a-ch (SEQ ID NO: 1) и Trim5a-hum (SEQ ID NO: 2) в образцах клеточной суспензии, предварительно обработанных генотерапевтическим лекарственным средством, в состав которого входит химерный ген Trim5a, причем упомянутый способ включает следующие этапы.
1. Выделение нуклеиновых кислот из образцов клеточной суспензии.
2. Обработка выделенных нуклеиновых кислот с помощью ДНКазы с получением тотальной клеточной РНК без примеси ДНК.
3. Проведение полимеразной цепной реакции, совмещенной с обратной транскрипцией, с использованием полученной тотальной клеточной РНК с детекцией продуктов в режиме реального времени с получением кривых накопления флуоресцентного сигнала по двум каналам.
4. Расчет нормализованных концентраций мРНК TRIM5a-ch и мРНК TRIM5a-hum в исследуемых образцах, характеризующих уровень экспрессии, на основании значений копий кДНК TRIM5a-ch и кДНК TRIM5a-hum и кДНК гена бета-глюкоронидазы в пробе ПЦР, полученных из кривых накопления флуоресцентного сигнала, причем расчет проводят по формуле: нормализованная концентрация мРНК TRIM5a = Число копий кДНК TRIM5a/число копий кДНК gus,
где gus - это "house-keeping" ген бета-глюкоронидазы человека.
Согласно предпочтительным вариантам реализации указанный технический результат также достигается тем, что:
- получают кривые накопления флуоресцентного сигнала по двум каналам - каналу для флуорофора FAM, свидетельствующему о накоплении продукта амплификации кДНК гена бета-глюкоронидазы, и каналу для флуорофора JOE, свидетельствующему о накоплении продукта амплификации фрагментов кДНК гена TRIM5a-ch и кДНК TRIM5a-hum;
- на стадии проведения полимеразной цепной реакции используют праймеры Trm qrt for, Trm qrt rev, LK-GUS-11-s, LK-GUS-12-as2 и зонды Trim probe, Trim hum probe и LK-GUS-12-FB.
Разработанный способ предполагает использование универсальных праймеров, которые позволяют выявлять как химерный ген, так и человеческий. Для дифференциации генов используются TaqMan зонды, каждый из которых специфичен либо химерному гену, либо человеческому. Одновременное и/или параллельное использование двух зондов позволяет одновременно определять количество мРНК химерного гена TRIM5a-ch и количество мРНК человеческого гена TRIM5a. Это дает возможность сравнивать уровень экспрессии этих генов в разных условиях и подбирать условия экспрессии (силу промотора, регуляцию промотора) таким образом, чтобы транскрипция была достаточной для проявления антивирусной активности гена, но при этом находилась в пределах физиологических значений (и была безопасна для клетки). Кроме того, способ позволяет выявлять возможное влияние экспрессии гибридного гена на экспрессию эндогенного человеческого TRIM5a.
Таким образом, способ позволяет не только измерять количество мРНК химерного гена TRIM5a-ch в клетке, но и сравнивать его с уровнем экспрессии гена TRIM5a человека и изучать воздействие одного гена на экспрессию другого. Это способствует более глубокому пониманию роли вводимого в клетку гена и всесторонней оценке его активности.
Раскрытие изобретения
В ФБУН Центральный НИИ эпидемиологии Роспотребнадзора (ЦНИИЭ) налажено производство генотерапевтического препарата «Динавир», включающего генетические конструкции для антиВИЧ терапии, описанные в упомянутом выше патенте РФ №2426788. Препарат «Динавир» является генотерапевтическим лекарственным средством, представляющим собой псевдовирусные частицы, в состав которых входит молекула векторной РНК, кодирующая два терапевтических гена: ген микроРНК, направленный на подавление экспрессии гена рецептора CCR5 человека, и модифицированный ген человека TRIM5a. Контроль экспрессии обоих генов регулируется промотором гена EF1a человека, который также входит в состав векторной РНК и вместе с генами образует терапевтическую экспрессионную кассету. Белки, входящие в состав псевдовирусной частицы, обеспечивают проникновение РНК в клетку, обратную транскрипцию РНК в кДНК и встраивание кДНК, кодирующей экспрессионную кассету, в геном человека. Каждая псевдовирусная частица обуславливает доставку одной копии экспрессионной кассеты в одну клетку.
Псевдовирусные частицы получены на клетках линии НЕК293Т при помощи транзиентной трансфекции этих клеток векторной плазмидой (оригинальная рекомбинантная плазмида, несущая два терапевтических гена) совместно с упаковочными плазмидами (коммерческие плазмиды, входящие в набор Lenti-X™ НТХ Packaging System (Clontech)). После проникновения плазмид в клетку происходит несколько внутриклеточных процессов:
а) экспрессия генов, входящих в состав упаковочных плазмид, которая приводит к наработке структурных белков и ферментов, а также оболочечного гликопротеина;
б) транскрипция векторной плазмиды, в результате которой происходит образование векторной РНК;
в) связывание векторной РНК со структурными белками;
г) отпочковывание псевдовирусной частицы, включающей РНК и белки, с захватом клеточной оболочки от клетки производителя.
В результате отпочковывания псевдовирусные частицы накапливаются в клеточной ростовой среде. Ростовую среду собирают, содержащиеся в ней псевдовирусные частицы очищают и концентрируют с помощью тангенциальной проточной ультрафильтрации.
Одним из этапов производства является контроль качества препарата, в частности контроль биологической активности.
Для контроля биологической активности проводятся:
1. Определение титра вирусных частиц.
2. Определение числа копий интегрированного вектора после обработки клеток готовым препаратом.
3. Определение нуклеотидной последовательности встроенных генов и сравнение с исходными последовательностями.
4. Определение уровня экспрессии гена Trim5a-ch после обработки клеток готовым препаратом.
Оптимальным подходом для оценки уровня мРНК на сегодняшний день считается подход на основе метода ПЦР с детекцией продуктов в режиме "реального времени" (Real-Time PCR). Данный подход позволяет проводить количественные измерения в широком линейном диапазоне для нескольких матриц одновременно в одной пробирке. Это особенно актуально для оценки уровня экспрессии, т.к. данный показатель весьма вариабелен и зависит от множества факторов. Для того чтобы исключить влияние различных факторов, необходимо одновременно оценивать уровень мРНК одного или нескольких конститутивных генов, которые экспрессируются во всех клетках организма (т.н. house-keeping генов), и далее полученные результаты использовать для нормализации уровня мРНК исследуемого гена. В качестве эндогенного контроля был выбран house-keeping ген - ген бета-глюкоронидазы.
Для ПЦР-амплификации генов TRIM5a-ch, TRIM5a-hum и бета-глюкоронидазы были выбраны олигонуклеотидные праймеры, а также зонды для детекции продуктов амплификации в режиме реального времени. Для выбора праймеров и зондов была использована программа «BLAST». При выборе праймеров принимали во внимание возможность образования вторичных структур, используя программы «01igos» и «Mfold». Нуклеотидные последовательности выбранных олигонуклеотидов представлены в таблице 1.

Для проведения количественных измерений необходимо было разработать ДНК-калибраторы, которые используются для построения калибровочных кривых. Для генов TRIM5a-ch и TRIM5a-hum в качестве калибраторов были использованы плазмидные конструкции, несущие данные гены. Из исходного препарата сделана серия 10-кратных разведений. Разведения с концентрациями порядка 105, 106, 107 на 1 мл выбраны в качестве ДНК-калибраторов.
Важным этапом в разработке калибраторов является их количественная характеристика. Для оценки концентрации ДНК-калибраторов использовали специально разработанную для этих целей и валидированную на производстве ЦНИИЭ методику с использованием ПЦР-комплекта «CQS-Bla». Данный комплект реагентов позволяет проводить амплификацию ДНК области гена устойчивости к ампициллину (ген bla, кодирующий белок beta-лактамазу), входящего в состав большинства плазмидных конструкций. Порядок измерения концентрации ДНК в контрольных образцах проводили согласно СОП-УКО-015.
Для гена бета-глюкоронидазы были использованы готовые ДНК-калибраторы производства ЦНИИЭ из набора реагентов «АмплиСенс® Лейкоз Квант M-bcr-FRT».
Далее приводятся примеры осуществления изобретения со ссылками на прилагаемые фигуры.
Примеры осуществления изобретения и реализации назначения
Пример 1. Методика для количественной оценки экспрессии гена Trim5a-ch и гена TRIM5a-hum
Для проведения исследования требуются следующие реагенты:
1. Для выделения нуклеиновых кислот (НК) из образцов клеточной суспензии требуется комплект реагентов «РИБО-преп» вариант 50 (ЦНИИЭ), включающий: раствор для лизиса, раствор для преципитации, раствор для отмывки 3, раствор для отмывки 4, РНК-буфер, отрицательный контрольный образец (ОКО).
2. Для обработки НК с помощью ДНКазы:
2.1 ДНКаза, свободная от РНКаз («DNase I, RNase-free», lu/ml, Fermentas)
2.2 10-кратный буфер, содержащий MgCl2 («10xReaction Buffer with MgCl2», Fermentas)
3. Для проведения полимеразной цепной реакции, совмещенной с обратной транскрипцией (ОТ-ПЦР) с детекцией продуктов в режиме реального времени:
3.1 Праймеры и зонды (Trim qrt for, Trim qrt rev, Trim probe, Trim hum probe, LKgus 11S, LKgus 12aS2, LKgus 12fb)
3.2 dNTP-oligos (Биосан, 100 mM)
3.4 Random-праймеры (ЦНИИЭ)
3.5 H2O (Ambion) - вода, свободная от РНКаз
3.6 ОТ-ПЦР-смесь-2-FEP/FRT (ЦНИИЭ)
3.7 Полимераза TaqF (ЦНИИЭ)
3.8 Ревертаза TM-MLV (ЦНИИЭ)
3.9 Дитиотрейтол DTT (Promega, 25 мМ)
3.10 ТЕ-буфер (ЦНИИЭ)
3.11 ДНК-калибраторы (K1 bcr-abl/gus, К2 bcr-abl/gus, К3 bcr-abl/gus, TRIM 1, TRIM 2, TRIM 3).
Дополнительные материалы и оборудование, требуемые для проведения ПЦР-анализа.
Для этапа выделения НК требуются:
1. Стерильный ламинарный шкаф (например, «БАВп-«Ламинар-С»-1,2», «Ламинарные системы», Россия).
2. Термостат для пробирок типа «Эппендорф» от 25 до 100°С (например, «ТЕРМО 24-15», «Биоком», Россия).
3. Вакуумный отсасыватель медицинский с колбой-ловушкой для удаления надосадочной жидкости (например, «ОМ-1», г. Ульяновск, Россия).
4. Микроцентрифуга для пробирок типа «Эппендорф» до 16 тыс.об/мин (например, «MiniSpin», «Eppendorf», Германия).
5. Вортекс (например «ТЭТА-2», «Биоком», Россия).
6. Отдельный набор автоматических пипеток переменного объема (например, «Ленпипет», Россия).
7. Одноразовые полипропиленовые завинчивающиеся или плотно закрывающиеся микропробирки объемом 1,5 мл (например, «Axygen», США).
8. Штативы для микропробирок объемом 1,5 мл (например, «ИнтерЛабСер-вис», Россия) и наконечников (например, «Axygen», США).
9. Одноразовые наконечники для пипеток переменного объема с аэрозольным барьером до 200 мкл и до 1000 мкл (например, фирмы «Axygen», США).
10. Одноразовые наконечники для пипеток переменного объема до 200 мкл и до 1000 мкл (например, «Axygen», США).
11. Холодильник от 2 до 8°С с морозильной камерой не выше минус 16°С.
12. Отдельный халат и одноразовые резиновые перчатки.
13. Емкость с дезинфицирующим раствором.
Для проведения реакций обратной транскрипции и амплификации, а также детекции продуктов амплификации требуются:
1. Амплификатор «Rotor-Gene» 3000/6000 («Corbett Research», Австралия), «iQ iCycler» («Bio-Rad», США), «Мх3000Р» («Stratagene», США) и «ABIPrism» 7x00 («Applied Biosystem», США).
Для прибора «Rotor-Gene»: Одноразовые полипропиленовые микропробирки для ПЦР объемом 0,2 мл (плоская крышка, нестрипованные) (например, «Axygene», США) для постановки в ротор на 36 пробирок или 0,1 мл («Corbett Research», Австралия) для постановки в ротор на 72 пробирки.
Для прибора «iQ iCycler»: Одноразовые полипропиленовые микропробирки для ПЦР объемом 0,2 мл (куполообразная крышка) (например, «Axygene», США), стрипованные пробирки с куполообразной крышкой или 96-луночный планшет для ПЦР, снабженный термостабильными оптически прозрачными пленками (например, «Bio-Rad», США).
Для прибора «Мх3000Р»: Одноразовые полипропиленовые микропробирки для ПЦР объемом 0,2 мл (куполообразная крышка, стрипованные или нет) (например, «Ах-ygen», США) или плашки для ПЦР с оптически прозрачными термостабильными клейкими пленками.
Для прибора «ABIPrism»: Одноразовые полипропиленовые микропробирки для ПЦР объемом 0,2 мл (куполообразная крышка, стрипованные или нет) (например, «Ах-ygen», США) или плашки для ПЦР с оптически прозрачными термостабильными клейкими пленками
2. ПЦР-бокс (например, «БАВ-ПЦР-«Ламинар-С», «Ламинарные системы», Россия).
3. Термостат для пробирок типа «Эппендорф» от 25 до 100°С (например, «ТЕРМО 24-15», «Биоком», Россия).
4. Отдельный набор автоматических пипеток переменного объема (например, «Ленпипет», Россия).
5. Одноразовые наконечники для микропипеток до 200 мкл (например, «Axygene», США).
6. Одноразовые наконечники с аэрозольным барьером до 200 мкл (например, «Axygene», США).
7. Штативы для наконечников (например, «Axygene», США) и микропробирок объемом 0,2 мл (например, «ИнтерЛабСервис», Россия).
8. Холодильник от 2 до 8°С, с морозильной камерой не выше минус 16°С для реагентов и выделенных ДНК.
9. Отдельный халат и одноразовые перчатки.
10. Емкость для сброса наконечников.
Проведение анализа.
Этап 1. Выделение НК из образца клеточной суспензии с использованием комплекта реагентов «Рибо-преп» вариант 50.
Объем образца для выделения НК - 10 мкл.
Порядок работы.
1. Раствор для лизиса (если он хранился при температуре от 2 до 8°С) прогревали при температуре до 65°С до полного растворения кристаллов.
2. Отобирали необходимое количество одноразовых пробирок на 1,5 мл (включая отрицательный контроль экстракции). Маркировали пробирки.
3. В пробирки вносили по 300 мкл раствора для лизиса.
4. В пробирки вносили по 10 мкл исследуемых образцов, используя наконечники с фильтром, и 90 мкл ОКО, закрывали крышки и перемешивали на вортексе. Осаждали на центрифуге для сброса капель жидкости с крышки.
5. Для каждой панели ставили отрицательный контроль (ОК). Для этого в пробирку с раствором для лизиса добавляли 100 мкл ОКО, перемешивали на вортексе и осаждали капли жидкости с крышки.
6. Содержимое пробирок прогревали 5 мин при 65°С в термостате, перемешивали на вортексе и осаждали капли жидкости с крышки.
7. В пробирки добавляли по 400 мкл раствора для преципитации, перемешивали переворачиванием несколько раз.
8. Пробирки центрифугировали на микроцентрифуге в течение 5 мин при 12 тыс g (например, 13 400 об/мин для центрифуги «MiniSpin», Eppendorf).
9. Надосадочную жидкость аккуратно отобирали, не задевая осадок, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
10. В пробирки добавляли по 500 мкл раствора для отмывки 3, плотно закрывали крышки, осторожно промывали осадок, переворачивая пробирки 3-5 раз.
11. Центрифугировали при 12000 g в течение 1-2 мин на микроцентрифуге.
12. Осторожно, не захватывая осадок, отбирали надосадочную жидкость, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
13. В пробирки добавляли по 200 мкл раствора для отмывки 4, плотно закрывали крышки, осторожно промывали осадок, переворачивая пробирки 3-5 раз.
14. Центрифугировали при 12000g в течение 2 мин на микроцентрифуге.
15. Осторожно, не захватывая осадок, отбирали надосадочную жидкость, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
16. Пробирки помещали в термостат при температуре 65°С на 5 мин для подсушивания осадка (при этом крышки пробирок оставляли открытыми).
17. В пробирки добавляли по 70 мкл РНК-буфера, перемешивали на вортексе, помещали в термостат при температуре 65°С на 5 мин, периодически встряхивая на вортексе.
18. Пробирки центрифугировали при 12000 g в течение 1 мин на микроцентрифуге. Надосадочная жидкость содержит очищенные НК.
Этап 2. Обработка нуклеиновых кислот, выделенных из образца, с помощью ДНКазы
1. В каждую реакционную пробирку вносили по 4 мкл 10xReaction Buffer with MgCl2, по 2 мкл DNase I (lu/ml) и по 36 мкл НК. Содержимое пробирок необходимо тщательно перемешать пипетированием, не допуская появления пузырьков воздуха.
2. Инкубировать пробирки с закрытыми крышками при температуре +37°С в течение 20 минут, затем при температуре +70° в течение 10 минут.
Этап 3. Постановка реакции обратной транскрипции и проведение ПЦР.
1. До начала работы все реагенты размораживали, тщательно перемешивали на вортексе, капли осаждали с крышек пробирок.
2. Отобирали необходимое количество пробирок для амплификации с учетом количества исследуемых, контрольных образцов и калибраторов.
3. Готовили реакционную смесь для проведения (ОТ-ПЦР) смеси-1 из расчета на 1 мл: праймеры Trm qrt for и Trm qrt rev, LK-GUS-11-s и LK-GUS-12-as2 - по 700 pmol, зонды Trim probe (или Trim hum prob) и LK-GUS-12-FB - по 500 pmol, dNTP-oligos (конечная концентрация 0,660 mM), Random-праймеры (конечная концентрация 0,2125 ОЕ/мл).
4. Для приготовления реакционной смеси в пробирку с DTT лиофилизированным добавляли 200 мкл ОТ-ПЦР-смесь-2-FEP/FRT. Смесь тщательно перемешивали на вортексе, осаждали капли с крышки пробирки кратковременным центрифугированием. Из расчета на 1 реакцию смешивали: 10 мкл ОТ-ПЦР смеси-1, 5 мкл смеси ОТ-ПЦР-смеси-2-FEP/FRT и DTT лиофилизированного, 0,5 мкл полимеразы (TaqF) и 0,25 мкл ТМ-Ревертазы (MMlv), - все компоненты тщательно перемешивали на вортек-се, капли осаждали с крышки пробирки кратковременным центрифугированием.
5. В пробирки вносили по 15 мкл готовой реакционной смеси.
6. Используя наконечник с фильтром, в пробирки с реакционной смесью вносили по 10 мкл проб РНК, полученных в результате экстракции из исследуемых образцов и обработанных с помощью ДНКазы. Содержимое пробирок тщательно перемешивали пипетированием.
7. Ставили контрольные реакции:
- отрицательный контроль экстракции (ОК) - в пробирку вносили 10 мкл ОК.
- отрицательный контроль ПЦР (К-) - внести в пробирку 10 мкл ТЕ-буфера.
- положительный контроль ПЦР (K+1) - в пробирку вносили 10 мкл ДНК-калибратора K1 bcr-abl/gus,
- положительный контроль ПЦР (К+2) - в пробирку вносили 10 мкл ДНК-калибратора К2 bcr-abl/gus,
- положительный контроль ПЦР (К+3) - в пробирку вносили 10 мкл ДНК-калибратора К3 bcr-abl/gus,
- положительный контроль ПЦР (K+1) - в пробирку вносили 10 мкл ДНК-калибратора TRIM 1,
- положительный контроль ПЦР (К+2) - в пробирку вносили 10 мкл ДНК-калибратора TRIM 2,
- положительный контроль ПЦР (К+3) - в пробирку вносили 10 мкл ДНК-калибратора TRIM 3.
Содержимое пробирок с добавленными контрольными образцами тщательно перемешивали пипетированием, не допуская появления пузырьков воздуха.
8. Готовили дополнительные контроли качества обработки ДНКазой:
8.1. Реакционную смесь готовили согласно п. 4, за исключением ревертазы.
8.2. В пробирки вносили по 15 мкл готовой реакционной смеси.
8.3. Используя наконечник с фильтром, в пробирки с реакционной смесью вносили по 10 мкл проб РНК.
9. Амплификатор с системой детекции в режиме «реального времени» программировали согласно таблице 2.
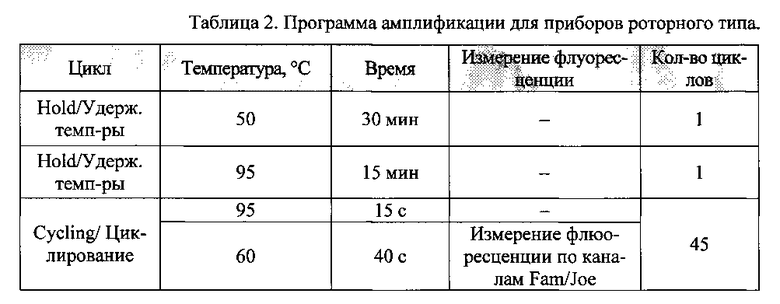
Анализ результатов
Полученные данные - кривые накопления флуоресцентного сигнала анализировали с помощью программного обеспечения используемого прибора для проведения ПЦР в режиме «реального времени» в соответствии с инструкцией к прибору.
Кривые накопления флуоресцентного сигнала анализировали по двум каналам:
- по каналу для флуорофора FAM регистрировали сигнал, свидетельствующий о накоплении продукта амплификации кДНК гена бета-глюкоронидазы,
- по каналу для флуорофора JOE регистрировали сигнал, свидетельствующий о накоплении продукта амплификации фрагмента кДНК гена TRIM5a-ch и кДНК TRIM5a-hum.
Результаты интерпретировали на основании наличия (или отсутствия) пересечения кривой флуоресценции с пороговой линией (устанавливается в середине линейного участка прироста флуоресценции положительного контроля в логарифмической шкале), что соответствует наличию (или отсутствию) значения порогового цикла Ct в соответствующей графе в таблице результатов.
На основании значений порогового цикла Ct (пересечение кривой флуоресценции с установленной на соответствующем уровне пороговой линией) и исходя из заданных значений калибраторов происходит автоматическое построение калибровочного графика и расчет значений копий кДНК TRIM (по каналу JOE/HEX) и кДНК гена бета-глюкоронидазы (по каналу FAM) в пробе ПЦР. Полученные значения использовали для расчета нормализованной концентрации мРНК TRIM5a-ch и мРНК TRIM5a-hum в исследуемых образцах по формуле:
нормализованная концентрация мРНК TRIM5a = Число копий кДНК TRIM5a/число копий кДНК gus
Результаты не подлежат учету если:
- Значение концентрации кДНК гена бета-глюкоронидазы менее 30 копий / реакция: результат для данного образца считается не валидным, требуется перестановка данного образца, начиная с первого этапа анализа.
- Для отрицательного контроля экстракции НК (ОК) по каналу JOE/Yellow/HEX и/или отрицательного контроля ПЦР (К-) по каналам FAM/Green и JOE/Yellow/HEX получено значение порогового цикла Ct, необходимо повторить исследование, начиная с этапа экстракции РНК, а также предпринять меры по выявлению и ликвидации источника контаминации.
- Коэффициент корреляции R2 при построении калибровочной прямой менее 0.98, требуется перестановка ПЦР для всех проб.
- Отличие между нормализованными концентрациями мРНК TRIM5a-ch (или мРНК TRIM5a-hum), полученными в двух повторах, составляет более 1,5 раз, требуется перестановка данного образца, начиная с первого этапа анализа.
- Разница между значениями Ct, полученными для кДНК и ДНК одной пробы, не превышает 5 циклов, требуется перестановка всех проб, начиная с первого этапа анализа, а также предпринять меры по выявлению причин недостаточной эффективности этапа обработки проб с помощью ДНКазы.
Пример 2. Исследование динамики экспрессии гена Trim5a-ch в клетках, обработанных генотерапевтическим лекарственным средством «Динавир», и сравнение с экспрессией эндогенного TrimSa-hum.
С помощью представленной методики было измерено количество мРНК в нескольких клеточных образцах. Были использованы клетки перевиваемой клеточной линии SupTl. Результаты приведены в таблице 3.
Опытные клетки были обработаны генотерапевтическим лекарственным средством «Динавир» разных серий. В качестве контроля использовали необработанные клетки.
Целью исследования являлось измерение соотношения в опытных клетках мРНК нативного гена Trim5a человека (Trim5a-hum) и мРНК модифицированного гена (Trim5a-ch) и изучение стабильности этого соотношения в процессе культивирования.
Таблица 3. Уровень экспрессии генов Trim5a-hum и Trim5a-ch в исследуемых образцах.
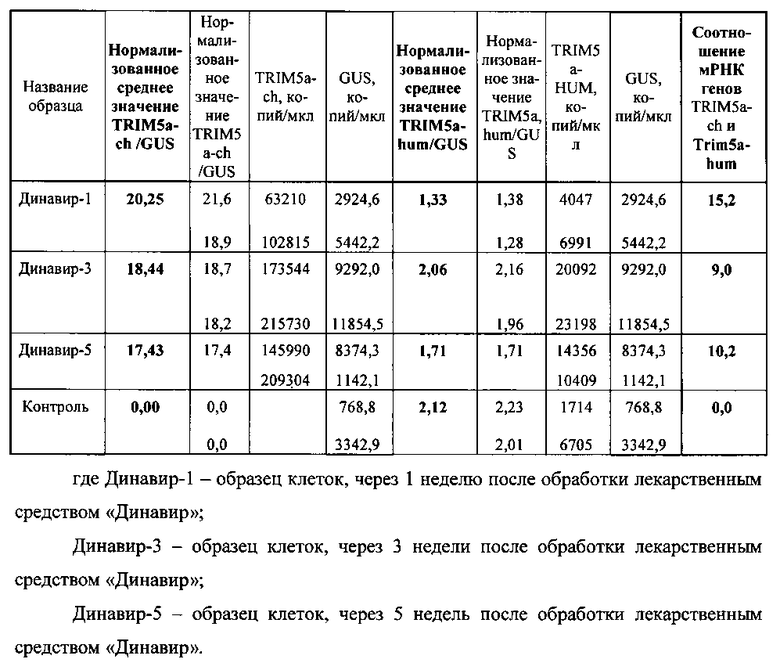
Таким образом, настоящими экспериментальными данными продемонстрировано, что нормализованное среднее значение уровня экспрессии модифицированного гена Trim5a-ch составляло в разные дни 20,25, 18,44 и 17,43, что примерно в 10 раз выше, чем значение уровня экспрессии эндогенного гена Trim5a-hum человека (1,3, 2,1 и 1,7). Кроме того, показано, что экспрессия является стабильной и не меняется при культивировании клеток в течение месяца (см. табл.3).
Также можно видеть, что уровень экспрессии эндогенного гена Trim5a человека не меняется после обработки клеток генотерапевтическим препаратом «Динавир» (2,0 - без обработки препаратом, от 1,3 до 2,1 в разные дни после обработки препаратом).
Перечень последовательностей
<110> Федеральное бюджетное учреждение науки "Центральный научно-исследовательский институт эпидемиологии" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ЦНИИЭ Роспотребнадзора)
<120> Способ оценки биологической активности генотерапевтического лекарственного средства для лечения ВИЧ-инфекции «Динавир»: определение уровня экспрессии химерного гена Trim5a, входящего в состав лекарственного средства
<160> 2
<210> 1
<211> 1488
<212> ДНК
<213> Искусственная последовательность
<223> Модифицированная (химерная) последовательность гена TRIM5a человека
<400> 1


<210> 2
<211> 1482
<212> ДНК
<213> Искусственная последовательность
<223> Последовательность гена TRIM5a человека
<400> 2


Изобретение относится к области медицинской и молекулярной генетики, а именно к генетическим конструкциям. Способ определения уровня экспрессии генов Trim5a-ch и Trim5a-hum в образцах клеточной суспензии, предварительно обработанных генотерапевтическим лекарственным средством, в состав которого входит химерный ген Trim5a, предусматривает: выделение нуклеиновых кислот из образцов клеточной суспензии; обработку выделенных нуклеиновых кислот с помощью ДНКазы с получением тотальной клеточной РНК без примеси ДНК; проведение полимеразной цепной реакции, совмещенной с обратной транскрипцией, с использованием полученной тотальной клеточной РНК с детекцией продуктов в режиме реального времени с получением кривых накопления флуоресцентного сигнала; расчет нормализованных концентраций мРНК TRIM5a-ch и мРНК TRIM5a-hum в исследуемых образцах, характеризующих уровень экспрессии, на основании значений копий кДНК TRIM5a-ch и кДНК TRIM5a-hum и кДНК гена бета-глюкоронидазы в пробе ПЦР, полученных из кривых накопления флуоресцентного сигнала, причем расчет проводят по формуле: нормализованная концентрация мРНК TRIM5a = Число копий кДНК TRIM5a/число копий кДНК gus, где gus, - это "house-keeping" ген бета-глюкоронидазы человека. Данный способ позволяет определять количество мРНК химерного гена TRIM5a и количество мРНК человеческого гена TRIM5a, сравнивать уровень экспрессии этих генов в разных условиях и подбирать условия экспрессии таким образом, чтобы транскрипция была достаточной для проявления антивирусной активности гена, но при этом находилась в пределах физиологических значений и была безопасна для клетки. 2 з.п. ф-лы, 3 таб., 2 пр.
1. Способ определения уровня экспрессии генов Trim5a-ch (SEQ ID NO: 1) и Trim5a-hum (SEQ ID NO: 2) в образцах клеточной суспензии, предварительно обработанных генотерапевтическим лекарственным средством, в состав которого входит химерный ген Trim5a, включающий:
a) выделение нуклеиновых кислот из образцов клеточной суспензии;
b) обработку выделенных нуклеиновых кислот с помощью ДНКазы с получением тотальной клеточной РНК без примеси ДНК;
c) проведение полимеразной цепной реакции, совмещенной с обратной транскрипцией, с использованием полученной тотальной клеточной РНК с детекцией продуктов в режиме реального времени с получением кривых накопления флуоресцентного сигнала;
d) расчет нормализованных концентраций мРНК TRIM5a-ch и мРНК TRIM5a-hum в исследуемых образцах, характеризующих уровень экспрессии, на основании значений копий кДНК TRIM5a-ch и кДНК TRIM5a-hum и кДНК гена бета-глюкуронидазы в пробе ПЦР, полученных из кривых накопления флуоресцентного сигнала, причем расчет проводят по формуле:
нормализованная концентрация мРНК TRIM5a = Число копий кДНК TRIM5a/число копий кДНК gus,
где gus - это "house-keeping" ген бета-глюкуронидазы человека.
2. Способ по п. 1, отличающийся тем, что получают кривые накопления флуоресцентного сигнала по двум каналам:
каналу для флуорофора FAM, свидетельствующему о накоплении продукта амплификации кДНК гена бета-глюкуронидазы; и
каналу для флуорофора JOE, свидетельствующему о накоплении продуктов амплификации фрагментов кДНК генов TRIM5a-ch и кДНК TRIM5a-hum).
3. Способ по п. 1, отличающийся тем, что на стадии проведения полимеразной цепной реакции используют праймеры Trm qrt for, Trm qrt rev, LK-GUS-11-s, LK-GUS-12-as2 и зонды Trim probe, Trim hum probe и LK-GUS-12-FB.
| ANDERSON J.S | |||
| et al., "Preintegration HIV-1 Inhibition by a Combination Lentiviral Vector Containing a Chimeric TRIM5a Protein, a CCR5 shRNA, and a TAR Decoy" // Molecular Therapy, 2009, Vol | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| Машина для удаления мякоти с растений с волокнистыми листьями | 1925 |
|
SU2103A1 |
| УСОВЕРШЕНСТВОВАНИЕ ГЕНЕТИЧЕСКИХ КОНСТРУКЦИЙ ДЛЯ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ АНТИВИЧ ТЕРАПИИ | 2013 |
|
RU2533817C1 |
| WO 2011060534 A1 26.05.2011. | |||
Авторы
Даты
2016-07-27—Публикация
2015-06-11—Подача