СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Изобретение содержит Список Последовательностей, который представлен в электронном виде в формате ASCII и включен в настоящее описание в качестве ссылке в полном объеме. Указанная копия ASCII, созданная 7 марта 2014, называется 209262-0001-00-WO-(509735)_SL.txt и имеет размер 10,335 байтов.
ОБЛАСТЬ ТЕХНИКИ
Антитела или их антиген-связывающие фрагменты сконструированы для связывания трансформирующего фактора роста-β (TGFβ). Предоставлены композиции, включающие антитела или их фрагменты, и способы их применения для лечения заболеваний, в которые вовлечена активность TGFβ.
УРОВЕНЬ ТЕХНИКИ
Многие тяжелые заболевания связаны с нарушением сигнальных путей, индуцируемых TGFβ. Увеличение уровня TGFβ в ткани считается фактором развития, например, идиопатического легочного фиброза и фиброза миокарда. Более того, локальные высокие уровни TGFβ в тканях могут обеспечивать поддержание и прогрессирование некоторых типов клеток злокачественных опухолей. Ингибирование сигнального пути TGFβ, таким образом, может снизить жизнеспособность таких опухолевых клеток.
Изоформы TGFβ представляют собой ~25 кДа гомодимерные молекулы со сходным структурным строением, в которых два мономера ковалентно связаны при помощи дисульфидного мостика. Изоформы млекопитающих имеют идентичность последовательности 70-82%, но их активность в развитии сосудов и в регуляции клеток иммунной системы не пересекается. Три изоформы TGFβ представлены у людей: TGFβ1, TGFβ2 и TGFβ3 (номера доступа Swiss Prot P01137, P08112 и P10600, соответственно). TGFβ1 и TGFβ3 запускают каскад передачи сигнала при связывании с внеклеточными доменами двух трансмембранных рецепторов, известных как рецепторы TGFβ типов I и II. Считается, что связывание TGFβ2 вовлекает рецепторы TGFβ типов I и II, а также рецептор TGFβ типа III.
Были созданы молекулы антитела, которые могут связываться с TGFβ1, TGFβ2 и TGFβ3 человека (например, патент США № 7723486, Genzyme). В документе Grütter et al. (2008) Proc. Nat’l Acad. Sci. USA 105(51), 20251-56, например, описан GC1008, моноклональное антитело IgG4 (MAb) человека в клиническом испытании для лечения злокачественных и фиброзных заболеваний. GC1008 представляет собой «пан-специфическое» нейтрализующее антитело TGFβ, поскольку оно может нейтрализовать все три изоформы TGFβ человека. GC1008 связывается с TGFβ1, TGFβ2 и TGFβ3 человека со сходной аффинностью. Эпитоп TGFβ, распознаваемый GC1008, перекрывает связывающую область TGFβ рецепторов TGFβ типов I и II, что считается основой нейтрализующей способности GC1008. В статье Grütter et al. описана трехмерная структура Fab-фрагмента GC1008 в комплексе с TGFβ3 с разрешением 3,1Å. Комплекс состоит из гомодимера TGFβ3, фланкированного Fab-фрагментами GC1008. См. также Proteopedia 3eo0, «Structure of the Transforming Growth Factor Beta Neutralizing Antibody GC-1008» в интернете на сайте proteopedia.org/wiki/index.php/3eo0 (последнее изменение 20 октября 2012); и Proteopedia 3eo1, «Structure of the Fab fragment of GC-1008 in Complex with Transforming Growth Factor-Beta3» в интернете на сайте proteopedia.org/wiki/index.php/3eo1 (последнее изменение 20 октября 2012).
СУЩНОСТЬ
Настоящее изобретение относится к TGFβ-связывающим антителам или их антиген-связывающим фрагментам. TGFβ-связывающие антитела или их антиген-связывающие фрагменты могут быть пан-специфичными для всех изоформ TGFβ (TGFβ1, TGFβ2 и TGFβ3). Такие антитела или их антиген-связывающие фрагменты могут нейтрализовать все изоформы TGFβ. Альтернативно или кроме того, TGFβ-связывающие антитела или их антиген-связывающие фрагменты могут селективно связываться с TGFβ1 человека по сравнению с TGFβ2 человека и TGFβ3 человека, или селективно связываться с TGFβ3 по сравнению с TGFβ1 человека и TGFβ2 человека. Специфические по изоформам TGFβ антагонисты могут демонстрировать меньше возможных побочных эффектов. Структура антител или их антиген-связывающих фрагментов облегчена со-кристаллической структурой рекомбинантного Fab-фрагмента моноклонального антитела GC1008, GC1008 (Fab) в настоящем описании, связанного с TGFβ2, и другой со-кристаллической структурой scFv версии GC1008, известной как GC1009 или GC1009 (scFv) в настоящем описании, связанной с TGFβ1.
Выделенное антитело или его антиген-связывающий фрагмент может включать вариант вариабельного домена тяжелой цепи (VH) PET1073G12 (SEQ ID NO:1), имеющий TGFβ паратопные и непаратопные остатки, и вариабельного домена легкой цепи (VL) PET1073G12 (SEQ ID NO:2), имеющий TGFβ1 паратопные и непаратопные остатки,
где домен VH включает вплоть до 20 замен паратопных остатков и вплоть до 20 замен непаратопных остатков;
где домен VL включает вплоть до 20 замен паратопных остатков и вплоть до 20 замен непаратопных остатков; и
указанное антитело или его антиген-связывающий фрагмент способны связываться с TGFβ человека (TGFβ1, TGFβ2 и TGFβ3).
Антитело или его антиген-связывающий фрагмент могут связываться со всеми тремя изоформами TGFβ, включая TGFβ1 человека, TGFβ2 человека и TGFβ3 человека. Антитело или его антиген-связывающий фрагмент могут связываться со всеми тремя изоформами TGFβ человека с аффинностью, которая в 2 раза, в 2,4 раза, в три раза, в пять раз, в десять раз выше или выше, чем аффинность GC1008 (Fab) или GC1009 (scFv). Антитело или его антиген-связывающий фрагмент могут включать замены остатков Y27, S30, S31, N32, I52, I54, V55, D56, N59, E74 и/или G101. Y27 может быть замещен Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp. S30 может быть замещен Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Tyr или Trp. S31 может быть замещен Ala, Glu, Gly, His, Lys, Leu, Pro, Gln, Arg, Thr, Val или Trp. N32 может быть замещен Ala, Asp, Glu, Gly, Leu, Met, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr. I52 может быть замещен Val. I54 может быть замещен Ala, Phe, His, Leu, Met, Pro, Thr, Val или Trp. V55 может быть замещен Phe или Gly. D56 может быть замещен Cys, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Gln, Arg, Ser, Tyr или Val. N59 может быть замещен Arg или Tyr. E74 может быть замещен Ala, Cys, Asp, Phe, Gly, His, Leu, Pro, Gln, Arg, Ser, Thr, Trp или Tyr. G101 может быть замещен Tyr. Домен VH и/или домен VL могут включать вплоть до 19 замен паратопных остатков. Предпочтительно, домен VH и/или домен VL могут включать вплоть до замен паратопных остатков. Паратопные замены могут быть выбраны из замен, указанных далее в таблице 5. Домен VH и/или домен VL могут включать вплоть до 18 замен непаратопных остатков. Предпочтительно, домен VH и/или домен VL могут включать вплоть до 12 замен непаратопных остатков.
Альтернативно, антитело или его антиген-связывающий фрагмент могут селективно связываться с TGFβ1 человека по сравнению с TGFβ2 человека и TGFβ3 человека. Антитело или его антиген-связывающий фрагмент могут селективно связываться с TGFβ1 с аффинностью, которая в 2 раза, в 2,4 раза, в три раза, в пять раз, в десять раз выше или выше, чем GC1008 (Fab) или GC1009 (scFv). Домен VH и/или домен VL могут включать вплоть до 20 замен паратопных остатков, предпочтительно вплоть до 19 замен паратопных остатков и более предпочтительно вплоть до 12 замен паратопных остатков. Паратопные замены могут быть выбраны из замен, указанных далее в таблице 5. Домен VH и/или домен VL могут включать вплоть до 20 замен непаратопных остатков, предпочтительно вплоть до 18 замен непаратопных остатков и более предпочтительно вплоть до 12 замен непаратопных остатков.
Альтернативно, антитело или его антиген-связывающий фрагмент могут селективно связываться с TGFβ3 человека по сравнению с TGFβ1 человека и TGFβ2 человека. Антитело или его антиген-связывающий фрагмент могут селективно связываться с TGFβ3 с аффинностью, которая в 2 раза, в 2,4 раза, в три раза, в пять раз, в десять раз выше или выше, чем GC1008 (Fab) или GC1009 (scFv). Домен VH и/или домен VL могут включать вплоть до 20 замен паратопных остатков, предпочтительно вплоть до 19 замен паратопных остатков и более предпочтительно вплоть до 12 замен паратопных остатков. Паратопные замены могут быть выбраны из замен, указанных далее в таблице 5. Домен VH и/или домен VL могут включать вплоть до 20 замен остатков непаратопных остатков, предпочтительно вплоть до 18 замен непаратопных остатков и более предпочтительно вплоть до 12 замен непаратопных остатков.
В любом из случаев, указанных выше, антитело может представлять собой антитело IgG1, IgG2 или IgG4, например, вариант моноклонального антитела GC1008. Его антиген-связывающий фрагмент может представлять собой scFv, например, вариант GC1009 (scFv) или ди-scFv, например. Альтернативно, домен VH может дополнительно включать константный домен тяжелой цепи человека, например, константный домен IgG1, IgG2 или IgG4, и домен VL может дополнительно включать константный домен легкой цепи человека, например, константный домен легкой цепи κ. Константный домен тяжелой цепи может иметь последовательность SEQ ID NO:3 и константный домен легкой цепи может иметь последовательность SEQ ID NO:4. Антиген-связывающий фрагмент по этому варианту осуществления может представлять собой Fab, Fab’ или F(ab’)2, например, вариант GC1008 (Fab).
Выделенная нуклеиновая кислота может включать последовательность нуклеотидов, кодирующую антитело или его антиген-связывающий фрагмент. Выделенная нуклеиновая кислота может представлять собой кДНК. Клетка-хозяин может включать выделенную нуклеиновую кислоту. Способ получения антитела или его антиген-связывающего фрагмента может включать культивирование клетки-хозяина в подходящих условиях для продукции антитела или его антиген-связывающего фрагмента. Антитело или его антиген-связывающий фрагмент, продуцируемые этим способом, могут быть очищенными.
Композиция может включать одно из вышеуказанных антител или их антиген-связывающих фрагментов. Композиция может представлять собой фармацевтическую композицию. Фармацевтическая композиция может включать терапевтически эффективное количество антитела или его антиген-связывающего фрагмента. Композиция может дополнительно включать один или более биологически активных компонентов.
Способ лечения заболевания или состояния, возникающих в результате, непосредственно или опосредованно, активности TGFβ человека, может включать введение фармацевтической композиции, включающей терапевтически эффективное количество антитела или его антиген-связывающего фрагмента. Заболевание или состояние могут быть выбраны из группы, состоящей из фиброзного заболевания, злокачественного новообразования или иммунно-опосредованного заболевания. Лечение заболевания или расстройства может предусматривать нейтрализацию TGFβ1, TGFβ2 и/или TGFβ3. Лечение заболевания или расстройства может предусматривать ингибирование сигнального пути TGFβ1, TGFβ2 и/или TGFβ3. Лечение заболевания или расстройства может предусматривать ингибирование TGFβ1-, TGFβ2- и/или TGFβ3-опосредованной продукции фибронектина, продукции сосудистого эндотелиального фактора роста (VEGF), пролиферацию эпителиальных клеток, пролиферацию эндотелиальных клеток, пролиферацию гладкомышечных клеток, или иммуносупрессию. Лечение заболевания или расстройства может включать повышение активности натуральных клеток-киллеров.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг. 1 отображает со-кристаллическую структуру GC1008(Fab) и TGFβ2 человека (SEQ ID NO:6).
Фиг. 2 отображает со-кристаллическую структуру GC1009 (scFv) и TGFβ1 человека (SEQ ID NO:5).
Фиг. 3 отображает часть со-кристаллической структуры GC1009(scFv) VH домена (SEQ ID NO:1) и TGFβ1 человека (SEQ ID NO:5).
Фиг. 4 отображает часть со-кристаллической структуры GC1008(Fab) VH домена (SEQ ID NO:1) и TGFβ3 человека (SEQ ID NO:7).
Фиг. 5 отображает часть со-кристаллической структуры GC1008(Fab) и TGFβ человека. Анализ тепловой карты в ТАБЛИЦЕ 7 визуализируют в отношении остатков Y27, S30, S31, N32, I52, P53, I54, V55, D56, N59, E74, G101, V103 и L104 тяжелой цепи (SEQ ID NO:1) и остатка A93 легкой цепи (SEQ ID NO:2).
ПОДРОБНОЕ ОПИСАНИЕ
TGFβ-связывающие антитела или их антиген-связывающие фрагменты по настоящему изобретению представляют собой варианты, которые включают модифицированный домен VH антитела GC1008, где варианты включают аминокислотную замену домена VH и/или VL (SEQ ID NO:1 и SEQ ID NO:2, соответственно). Например, антитела против TGFβ или их антиген-связывающие фрагменты могут включать домен VH с аминокислотной заменой, что обеспечивает сравнительное или улучшенное связывание с TGFβ человека (TGFβ1, TGFβ2 и TGFβ3) по сравнению с тем, которое наблюдается с антителом GC1008. Селективные по изоформе TGFβ антитела или их антиген-связывающие фрагменты могут селективно связываться с TGFβ1 человека по сравнению с TGFβ2 человека и TGFβ3 человека, или они могут селективно связываться с TGFβ3 человека по сравнению с TGFβ1 человека и TGFβ2 человека. Селективное связывание может быть достигнуто путем замены одной или более аминокислот антител или их антиген-связывающих фрагментов, включающих домен VH (SEQ ID NO:1).
«Селективное связывание» означает, что антитело или его антиген-связывающий фрагмент (i) могут связываться со специфической изоформой TGFβ человека с более высокой аффинностью, чем аффинность антитела или его антиген-связывающего фрагмента, которые включают немодифицированный домен VH антитела GC1008, и/или (ii) могут связываться с другими изоформами TGFβ с более низкой аффинностью, чем аффинность антитела или его антиген-связывающего фрагмента, которые включают немодифицированный домен VH антитела GC1008. Например, антитело или его антиген-связывающий фрагмент, которые селективно связываются с изоформой TGFβ1, могут связываться с TGFβ1 с более высокой аффинностью, чем аффинность GC1008 (Fab) или GC1009 (scFv), например, в два раза, в три раза, в пять раз, в десять раз выше или больше. Антитело или его антиген-связывающий фрагмент, альтернативно или кроме того, могут связываться с TGFβ2 и TGFβ3 с более низкой аффинностью, чем у GC1008 (Fab) или GC1009 (scFv), например, в два раза, в три раза, в пять раз, в десять раз ниже или больше.
Как используется в настоящей заявке, первый элемент «и/или» второй элемент означает специфическое раскрытие первого и второго элемента по-отдельности, или первый и второй элементы в комбинации. Единственное число включает множественное число, если из контекста не следут иное.
Антитела или их антиген-связывающие фрагменты
Антитела или их антиген-связывающие фрагменты, включающие модифицированный домен VH антитела GC1008, включают, но ими не ограничиваются, полноразмерные антитела, например, IgG, такие как IgG1, IgG2 или IgG4, или их антиген-связывающие фрагменты, например, полипептиды F(ab’)2, scFv, Fab или dAb. Моновалентные антиген-связывающие фрагменты могут включать Fab, Fv, scFv и ди-scFv, который представляет собой две молекулы scFv, связанные пептидной связью. Антиген-связывающие фрагменты могут быть мультивалентными, например, направленными против TGFβ и другого антигена. Мультивалентные фрагменты включают F(ab’)2 и ди-scFv, где два компонента scFv состоят из различных вариабельных доменов, направленных против различных антигенов. Антитело или его антиген-связывающий фрагмент по настоящему изобретению, например, могут представлять собой модифицированное GC1008 (полноразмерное антитело IgG4 человека), GC1008(Fab) (Fab-фрагмент GC1008) или GC1009 (scFv) (scFv версия GC1008). GC1009 (scFv) представляет собой рекомбинантно продуцируемый антиген-связывающий фрагмент, включающий домен VH тяжелой цепи человека PET1073G12 (SEQ ID NO:1) и домен VL легкой цепи человека PET1073G12 (SEQ ID NO:2), связанные пептидной связью, которая обеспечивает соединение двух доменов в антиген-связывающей области. GC1008 и GC1009 подробно описаны в патенте США № 7723486 и в документе Grütter (2008). Аминокислотная последовательность GC1009(scFv) показана ниже, где пептидная связь (Gly4/Ser)n мотива (SEQ ID NO:10) выделена полужирным и курсивом, а сигнальный пептид выделен серым:
KYLLPTAAAGLLLLAAQPAMAQVQLVQSGAEVKKPGSSVKVSCKASGYTFSSNVISWVRQAPGQGLEWMGGVIPIVDIANYAQRFKGRVTITADESTSTTYMELSSLRSEDTAVYYCASTLGLVLDAMDYWGQGTLVTVSSGGGGSGGGGSGGGGSALETVLTQSPGTLSLSPGERATLSCRASQSLGSSYLAWYQQKPGQAPRLLIYGASSRAPGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYADSPITFGQGTRLEIKRHHHHHH (SEQ ID NO: 9).
«Модифицированный» вариабельный домен или его «вариант» включает аминокислотные замены по сравнению с эталонной последовательностью. «Вариант домена VH антитела GC1008», например, может включать аминокислотные замены по сравнению с доменом VH PET1073G12 с аминокислотной последовательностью SEQ ID NO:1.
Домен VH и/или домен VL могут включать вплоть до 20 замен паратопных остатков, предпочтительно вплоть до 19 замен паратопных остатков и более предпочтительно вплоть до 12 замен паратопных остатков. Например, один из двух доменов может включать замену паратопного остатка, в то время, как другой домен немодифицирован, или оба домена могут включать замены паратопных остатков. Паратопная замена может быть выбрана из замен, указанных в таблице 5. Паратопные замены могут вызывать селективное связывание модифицированного антитела или антиген-связывающего фрагмента с изоформой TGFβ, или замены могут сохранять пан-специфическое связывание антитела или антиген-связывающего фрагмента с изоформами TGFβ. Также могут быть получены оба типа паратопных замен. Например, паратопная замена может вызывать селективное связывание антитела или антиген-связывающего фрагмента с изоформой TGFβ, в то время как другая паратопная замена, которая сохраняет пан-специфическое связывание, получена для деиммунизации антитела или антиген-связывающего фрагмента. Деиммунизация может быть осуществлена в соответствии со способом Harding et al. (2010) mAbs 2: 256-265, например.
Домен VH и/или домен VL, альтернативно или кроме того, могут включать вплоть до 20 замен непаратопных остатков, предпочтительно вплоть до 18 замен непаратопных остатков и более предпочтительно вплоть до 12 замен непаратопных остатков. Непаратопные остатки могут быть заменены по различным причинам, например, для увеличения термостабильности антиген-связывающего фрагмента, для удаления аминокислотного остатка, который чувствителен к окислению и дезаминированию, для добавления аминокислоты, которая может быть легко конъюгирована с лекарственным средством или молекулами PEG, например, или для удаления возможной области карбоксилирования.
Модификации могут также включать делеции аминокислот. Например, одна или более непаратопных аминокислот могут быть удалены из варианта домена VH и/или VL. Аминокислоты могут быть удалены из карбоксильных или амино-концевых областей доменов VH и/или VL.
Вариабельный домен антител и их антиген-связывающих фрагментов по настоящему изобретению включает три определяющих комплементарность участка (CDR), каждый из которых имеет фланкированный каркасный участок (FW). Например, домен VH может включать набор из трех тяжелых цепей CDR: HCDR1, HCDR2 и HCDR3. Домен VL может включать набор из трех легких цепей CDR: LCDR1, LCDR2 и LCDR3. Набор HCDR, описанный в настоящей заявке, может быть предоставлен в домене VH, который используют в комбинации с доменом VL. В домен VH может быть введен набор HCDR, как описано в настоящем изобретении, и если такой VH домен находится в паре с доменом VL, тогда в домен VL может быть введен набор LCDR, описанный в настоящем изобретении. Структуры и расположение областей иммуноглобулин-вариабельного домена CDR и FW определяют в настоящем изобретении ссылкой на статью Kabat et al. (1987) Sequences of Proteins of Immunological Interest, 4th ed., U.S. Department of Health and Human Services.
Антитела или их антиген-связывающие фрагменты по настоящему изобретению содержат «паратопные» и «непаратопные» аминокислотные остатки. "Паратопная" аминокислота антитела или его антиген-связывающего фрагмента по настоящему изобретению имеет атомное ядро в пределах 4 Å атомного ядра изоформы TGFβ человека. Поскольку каждая изоформа TGFβ человека образует структурно различный комплекс с антителами или их антиген-связывающими фрагментами по настоящему изобретению, паратопные радикалы могут отличаться у каждой формы. «Паратопный остаток TGFβ», например, имеет атомное ядро в пределах 4 Å атомного ядра TGFβ1 человека. В таблице 3 показаны паратопные остатки антител и их антиген-связывающих фрагментов по настоящему изобретению для каждой изоформы TGFβ1, TGFβ2 и TGFβ3 человека. «TGFβ-паратопный» остаток имеет атомное ядро в пределах 4 Å атомного ядра всех трех изоформ TGFβ человека.
Радикал, обозначающий паратопный остаток, независит от положения в областях CDR или FW, как определено по номенклатуре Kabat. Многие паратопные остатки расположены в пределах областей CDR, как показано в таблице 4, например. Тем не менее, некоторые паратопные остатки располагаются в пределах областей FW. «Непаратопная» аминокислота представляет собой любую аминокислоту антитела или его антиген-связывающего фрагмента, которая не является «паратопной» аминокислотой, независимо от того, расположен ли остаток в области CDR или FW.
Антитела или их антиген-связывающие фрагменты могут включать аминокислотные замены тяжелой цепи и легкой цепи, выбранные из различных зародышевых линий человека. Например, набор HCDR может быть введен в репертуар вариабельных доменов, лишенных CDR, используя методики рекомбинантной ДНК. Каркасы зародышевых клеток включают последовательности тяжелой цепи зародышевых клеток человека DP-10 (VH 1-69) или DP-88 (VH 1-e) семейства VH-1. Последовательности легкой цепи могут быть последовательностями семейства Vκ3, например, DPK-22 (А27) человека. Аминокислотные последовательности вариабельных доменов зародышевой линии человека раскрыты VBASE2 в интернете, например, на vbase2.org/vbstat.php. Например, набор HCDR и набор LCDR могут быть спарены вместе в антителах PET1073G12, PET1074B9 или PET1287A10. Антитело, таким образом, может представлять собой молекулу антитела IgG4, включающую, например, модифицированный домен VH PET1073G12 и/или домен VL PET1073G12. Аминокислотные последовательности PET1073G12, PET1074B9 или PET1287A10, включающие наборы HCDR и LCDR, раскрыты в патенте США № 7723486.
Антиген-связывающие фрагменты могут дополнительно включать константные участки антитела или его части. Например, домен VL может быть присоединен на своей С-концевой области к константным доменам легкой цепи антитела, включающим цепи Сκ или Сλ человека. Аналогично, антитело или его антиген-связывающий фрагмент, включающие домен VH, могут дополнительно включать присоединенный к С-концевой области всю цепь или часть тяжелой цепи иммуноглобулина (например, домен CH1), полученные из любого изотопа антитела, например, IgG, IgA, IgE и IgM, или любого подкласса изотопа, в частности, IgG1, IgG2 или IgG4. IgG4 является предпочтительным для некоторых вариантов применения, поскольку он не связывается с комплементом и не проявляет эффекторные функции. Если желательны эффекторные функции, то предпочтителен IgG1. Во всех случаях константные участки антитела или его частей могут представлять собой последовательности человека.
В константных областях антитела можно проводить модификации для улучшения различных свойств антител или их антиген-связывающих фрагментов. Например, рекомбинантные аминокислотные модификации можно использовать для снижения структурной гомогенности экспрессируемых полипептидов. Характерным примером является документ Peters et al. (2012) J. Biol. Chem. 287(29): 24525-33, в котором описаны замены Cys на Ser в шарнирной области IgG4, которые снижают гетерогенность дисульфидной связи и повышают термальную стабильность домена Fab. Аналогично, в документе Zhang et al. (2010) Anal. Chem. 82: 1090-99 описано конструирование шарнирной области IgG2 для ограничения сцепления дисульфидной связи и образования структурных изомеров в терапевтических вариантах применения. Аминокислотные модификации в домене CH3 также можно использовать для удаления остатков Lys в карбоксильных концевых областях для снижения числа вариантов, отличающихся зарядами. Аминокислотные модификации также можно использовать для улучшения фармакологических функций рекомбинантных антител или их антиген-связывающих фрагментов. Если антитела и их антиген-связывающие фрагменты включают участок Fc, например, то аминокислотные модификации можно использовать для повышения активации комплемента, усиления антителозависимой клеточной цитотоксичности (ADCC) путем усиления связывания FcγRIIIA или снижения связывания FcγRIIIB и/или увеличения периода полувыведения в сыворотке за счет увеличения связывания FcRn. Такие аминокислотные модификации рассмотрены, например, Beck et al. (2010) Nature 10: 345-52.
В таблице 1 ниже показаны аминокислотные последовательности немодифицированного домена VH PET1073G12 (SEQ ID NO: 1); домена CH1 (SEQ ID NO:3); домена VL PET1073G12 (SEQ ID NO: 2); и домена Cκ (SEQ ID NO:4), которые присутствуют в GC1008(Fab). Различные CDR и каркасные области (FW) помечены; остатки CDR также выделены.

Антитела или их антиген-связывающие фрагменты могут быть моно-специфичными в отношении TGFβ человека, или могут быть би-специфичными. Би-специфичные антитела или их антиген-связывающие фрагменты могут быть получены различными путями, как раскрыто, например, в документе Hollinger et al. (1993) Current Opinion Biotechnol. 4, 446-449. Примеры би-специфичных антител включают методику двойных вариабельнымх доменов IgG (DvD-IgG) или методику BiTE™, где связывающие домены двух антител с различной специфичностью можно использовать и непосредственно связывать через короткие гибкие пептиды.
Рекомбинантно модифицированные домены VH и/или VL
Вариабельный домен тяжелой цепи и/или легкой цепи антител или их антиген-связывающих фрагментов по настоящему изобретению можно рекомбинантно модифицировать для изменения аминокислотной последовательности последовательности линии клеток. Например, можно модифицировать один или более CDR в наборе CDR тяжелой цепи, можно модифицировать один или более CDR в наборе CDR легкой цепи и/или можно модифицировать одну из каркасных областей в доменах VH и/или VL. Замены могут быть сделаны в паратопных аминокислотах, например, что усиливает или ослабляет аффинность связывания изоформы TGFβ, или аффинность связывания может быть сравнительно неизменена. Другие замены могут быть сделаны в непаратопных остатках аминокислот для придания различных свойств антителам или их антиген-связывающим фрагментам, например, для улучшения стабильности или для введения реакционноспособной группы на поверхности домена, которая может быть ковалентно модифицирована. Соответственно, следующие четыре категории аминокислотных замен в доменах VH и/или VL антител или их антиген-связывающих фрагментов по настоящему изобретению находятся среди замен, которые включены в настоящую заявку: (1) замены, которые придают свойства селективного связывания с изоформой TGFβ человека; (2) замены, которые поддерживают пан-специфическое связывание со всеми тремя изоформами TGFβ человека; (3) замены на непаратопные аминокислоты; и (4) множественные аминокислотные замены. Эти категории аминокислотных замен не являются взаимоисключающими.
1. Замены, обеспечивающие селективное связывание
Антитела, селективные в отношении изоформы TGFβ, и их антиген-связывающие фрагменты могут включать аминокислотные замены в пределах домена VH (SEQ ID NO:1). Например, антитела или их антиген-связывающие фрагменты могут селективно связываться с TGFβ1 человека по сравнению с TGFβ2 человека и TGFβ3 человека, или могут селективно связываться с TGFβ3 человека по сравнению с TGFβ1 человека и TGFβ2 человека. Селективности связывания можно достичь путем замены одной или нескольких паратопных аминокислот.
Прогнозированию того, как замена аминокислоты повлияет на способность антитела или его антиген-связывающего фрагмента взаимодействовать с изоформой TGFβ, способствует со-кристаллическая структура каждой изоформы TGFβ. Со-кристаллическая структура GC1008(Fab) и TGFβ3 раскрыта в документе Grütter (2008). Со-кристаллическая структура GC1008(Fab) и TGFβ2 отображена на фиг. 1. Со-кристаллическая структура GC1009(scFv) и TGFβ1 отображена на фиг. 2.
В таблице 2 приведена аминокислотная последовательность изоформ TGFβ1, TGFβ2 и TGFβ3 человека. Сравнение со-кристаллических структур выявляет различия в паратопах этих трех изоформ. Остатки TGFβ в каждой изоформе, которые взаимодействуют с GC1008, выделены полужирным в таблице 2.
ТАБЛИЦА 2
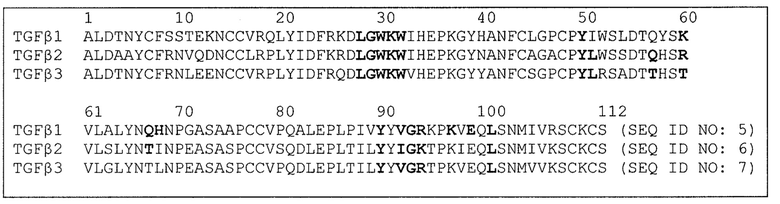
В таблице 3 ниже перечислены паратопные остатки домена VH (SEQ ID NO:1) и домена VL (SEQ ID NO:2), как определено по со-кристаллическим структурам каждой изоформы TGFβ человека. Паратопные остатки GC1008, выделенные полужирным, присутствуют у всех трех изоформ TGFβ. Три участка эпитопа TGFβ обозначены как «верхушка», «гидрофобный участок» и «трехспиральный» участок. Остатки доменов VH и VL, имеющие атомное ядро в пределах 4 Å атомных ядер в «гидрофобном участке» TGFβ, который имеет последовательность L28GWKW32 (SEQ ID NO:8), являются консервативными для всех трех изоформ. Остатки GC1008, взаимодействующие с «верхушкой» и «трехспиральным» участком, демонстрируют, тем не менее, большую вариабельность. При сравнении всех трех со-кристаллических структур становится очевидным, что GC1008 переключает ориентацию и корректирует положения петли CDR и конформации боковых цепей для размещения всех трех изоформ TGFβ со сходной аффинностью. См. фиг. 1 и фиг. 2. Например, в документе Grütter (2008) описано, что GC1008 отражают сходную аффинность для трех изоформ: величины IC50 1±2 нмоль, 14±5 нмоль и 7±2 нмоль против TGFβ1, TGFβ2 и TGFβ3, соответственно, в анализе пролиферации эпителиальных клеток легкого норки (MLEC). Кроме того, остатки 67 и 68 трех изоформ TGFβ отличаются по своему взаимодействию от паратопного остатка Y27 VH. Остаток Y27 VH образует водородные взаимодействия с остатками Q67 и H68 TGFβ1. Напротив, остаток Y27 VH образует гидрофобные взаимодействия с T67 и Y50 TGFβ2 и TGFβ3. Это вызывает реорганизацию петли HCDR1 в комплексе TGFβ1 по сравнению с комплексами TGFβ2 и TGFβ3.
VL: G30, Y33, A93
VL: Y33, Y92, A93
Информация, приведенная в таблице 3, изменена в таблице 4 для того, чтобы показать остатки доменов VH и VL, которые находятся в пределах 4 Å атомного ядра TGFβ3 в со-кристалле. Паратопные остатки выделены полужирным. Большая часть, но не все паратопные остатки расположены в пределах HCDR.

Сравнение со-кристаллических структур может указать на замены остатков доменов VH и/или VL, которые изменяют аффинность GC1008 изоформ TGFβ. В частности, аминокислотные замены могут основываться на расположении каждого остатка VH и/или VL в трех кристаллических структурах, учитывая при этом взаимодействует ли остаток с антигеном или он вовлечен во взаимодействия с другим CDR или структурными элементами, которые стабилизируют петли CDR. Например, I97 на LCDR3 напрямую не взаимодействует с TGFβ в любой из трех структур; тем не менее, I97 располагается наружу антитела и в гидрофобном кармане, который также состоит из V103 и L104 HCDR3. Поскольку V103 и L104 являются паратопами, важными для связывания с TGFβ, то замена I97 на остаток со средней или малой гидрофобностью или на остаток с низкой полярностью может допускаться без значительного изменения аффинности по отношению к TGFβ, например, более, чем в 10 раз.
В трехспиральном участке показана наибольшая вариабельность в последовательности эпитопа. Лизин и аргинин в положении 60 TGFβ1 и TGFβ2 вызывают вращение GC1008, связанного с TGFβ1 и TGFβ2 по сравнению с TGFβ3. В остатках 67 и 68 TGFβ1 расположены глутамин и гистидин, соответственно, вместо треонина и изолейцина/лейцина, как в TGFβ2 и TGFβ3 (фигура 3). Если S30 мутирован по гидрофобным остаткам, таким, как A, W, то желательны дополнительные гидрофобные взаимодействия с консервативным L64 TGFβ, что, таким образом, повышает аффинность всех трех типов TGFβ. Повышение аффинности больше заметно для TGFβ2 и 3 из-за вышеупомянутых треонина и изолейцина/лейцина в остатках 67 и 68 TGFβ2 и TGFβ3, которые являются предпочтительными гидрофобными остатками по сравнению с Q и H TGFβ1. В TGFβ1 и TGFβ2 положительно заряженные боковые цепи в положении 60 осуществляют ионные взаимодействия с E74 тяжелой цепи. Замена E74 положительно заряженными остатками менее желательна для связывания GC1008 с TGFβ1, но более желательна для TGFβ3, который имеет треонин в положении 60 (Фигура 4). Из-за низкого размера боковой цепи Е60 TGFβ3, большая часть мутаций может допускаться в E74 тяжелой цепи. Из-за частично гидрофобной природы Т60 гидрофобные замены в E74 также могут серьезно повышать аффинность связывания TGFβ3, что часто приводит к увеличению соотношений kdvar: kdwt более, чем в два раза.
Для быстрого выбора антител против TGFβ или их антиген-связывающих фрагментов с большей аффинностью в отношении конкретной изоформы TGFβ или селективностью в отношении одной изоформы по сравнению с другими, перечисленные в таблице 3 положения, можно рандомизировать по другим 19 аминокислотам. Это можно достичь путем in vitro “дисплея” GC1009(scFv), Fab-фрагмента GC1008 или библиотек GC1008, используя методики, хорошо известные в данной области (Bradbury et al. (2011) Nature Biotechnol. 29(3): 245-254). Без кристаллических структур TGFβ1 и TGFβ2 в комплексе с GC1009 и Fab GC1008, соответственно, только антитела или их антиген-связывающие фрагменты с высокой аффинностью против TGFβ3 можно определить при помощи этой методики in vitro “дисплея”, основанной на TGFβ-контактирующих аминокислотах, полученных их комплексной структуры TGFβ3, описанной в документе Grütter (2008). Что касается TGFβ1 и TGFβ2 в комплексе с определенными Fab-структурами GC1009 и GC1008, то было обнаружено, что также можно быстро определить антитела или их антиген-связывающие фрагменты с более высокой аффинностью в отношении TGFβ1 и TGFβ2 при помощи техники дисплея. Более того, имея информацию обо всех трех структурах можно создать более направленные библиотеки для определения вариантов, селективных для изоформ. Направленные библиотеки для TGFβ1, например, могли бы только требовать рандомизации положений 27 и 30 домена VH (SEQ ID NO: 1). 322 (1024) возможных мутанта могут быть охвачены фаговыми библиотеками с размером библиотеки лишь ~105 видов. (20 аминокислот могут быть представлены 32 кодонами с последовательностью NNG/c с любой из четырех нуклеиновых кислот в первых двух положениях и G или C в третьем положении). Без кристаллических структур TGFβ1 и TGFβ2 в комплексе с GC1009/GC1008 специалисту придется рандомизировать все 14 TGFβ3-контактирующие аминокислоты, полученные из TGFβ3 комплексной структуры, описанной в документе Grütter (2008). Фаговая библиотека с разнообразием в 3214 (1021) не будет представлена полностью даже в лучшей из всех известных библиотек, которые представляют не более, чем ~1011 видов. Таким образом, структурные данные, предоставленные в настоящем описании, обеспечивают быстрый скрининг и определение селективных антагонистов TGFβ.
2. Замены, сохраняющие пан-специфическое связывание.
Можно осуществить замены, которые значительно не влияют на аффинность связывания в отношении изоформы TGFβ. Замена, которая «значительно не влияет» представляет собой аффинность связывания в отношении изоформы TGFβ, которая не повышает соотношение скорости диссоциации варианта (kdvar) по сравнению со скоростью диссоциации дикого типа (kdwt) более, чем на 2,4 (т.е., kdvar/kdwt составляет меньше или равно 2,4). Антитела или их антиген-связывающие фрагменты, которые проявляют «пан-специфическое» связывание для этих целей имеют кажущуюся константу связывания для TGFβ (TGFβ1, TGFβ2 и TGFβ3), равную по меньшей мере 10 нмоль, 30 нмоль или 100 нмоль. Аффинность изоформ TGFβ можно измерить любой подходящей методикой, известной в области изобретения, например, путем анализа пролиферации MLEC, раскрытого в документе Grütter (2008) или путем анализа связывания Biacore® 3000 (GE Healthcare). Антитела или их антиген-связывающие фрагменты, которые проявляют «пан-специфическое связывание», для этих целей могут иметь кажущуюся константу связывания kdvar:kdwt в отношении TGFβ (TGFβ1, TGFβ2 и TGFβ3), меньше или равную 2,4 раза, меньше или равную 3 раза, менее или равную 5 раз или менее или равную 10 раз по сравнению с диким типом, предпочтительно меньше или равную 2,4 раза по сравнению с диким типом (kdvar:kdwt). Эти замены могут быть указаны со-кристаллическими структурами между GC1008/GC1009 и тремя изоформами TGFβ. См. Oberlin et al. (2012) J. Chem. Inf. Model. 52: 2204-2214.
Ожидается, что замены, которые сохраняют пан-специфическое связывание с TGFβ, создают нестерическую преграду для аминокислотных остатков TGFβ или оказывают значительное отрицательное влияние на стабильность антител или их антиген-связывающих фрагментов. Замены, оказывающие значительное отрицательное влияние на стабильность, могут вызывать агрегацию и инактивацию антител или их антиген-связывающих фрагментов, вызывая локальное раскручивание или неправильное скручивание. Дестабилизированные агрегированные антитела или их антиген-связывающие фрагменты могут вызывать иммуногенность, поскольку иммунная система пациента распознает такие агрегаты как чужеродные молекулы.
Примером замены, сохраняющей пан-специфическое связывание, является R24 на LCDR1. R24 ориентирован от сайта связывания с TGFβ и располагается на поверхности домена VL. Это положение может вмещать замещны наиболее полярными остатками, кроме Pro и Cys, которых обычно избегают. С другой стороны I52 на HCDR2 обеспечивает близкое гидрофобное взаимодействие с «гидрофобным участком» на TGFβ (L28GWKW32 (SEQ ID NO: 8)), поэтому замены I52 ограничены гидрофобными остатками среднего размера с возможностью замены на Val, в то время, как замены более крупными остатками можгут создавать стерическое препятствие в связанном комплексе.
На таблице 5 приведены неограничивающие примеры аминокислотных замен домена VL SEQ ID NO:2 (таблица 5А) и домена VH SEQ ID NO:1 (таблица 5В). В некоторых случаях аминокислотные замены можно осуществлять в каркасных участках в пределах паратопа, например, остаток Y50 VL в участке FW2. Ожидается, что антитела или антиген-связывающие фрагменты с одной или несколькими заменами, как указано ниже, имеют сходную пан-специфичность и улучшенную аффинность в отношении TGFβ как GC1008/GC1009, т.е., для связывания всех изоформ TGFβ с изоформами с аффинностью связывания (kdvar:kdwt) менее или равную 2,4 раза, менее или равную 3 раза, менее или равную 5 раз или менее или равную 10 раз по сравнению с диким типом.
3. Замена непаратопных аминокислотных остатков
Непаратопные аминокислоты могут быть заменены рекомбинантным способом, создавая вариабельную область легкой или тяжелой цепи со сходными или отличающимися свойствами по сравнению с вариабельной областью эмбриональной клеточной линии. «Модифицированные» вариабельные домены также включают аминокислотные делеции, а также замены. Например, N-концевой или С-концевой аминокислотный остаток может быть удален в модифицированном вариабельном домене.
Непаратопные аминокислотные замены могут быть осуществлены, например, для повышения стабильности и/или уменьшения способности к агрегации. Низкая стабильность может влиять на способность антиген-связывающего фрагмента, например, правильной сборке при рекомбинантной экспрессии, что приводит к фракции экспрессированных фрагментов, которая является нефункциональной. Низкая стабильность антител или их антиген-связывающих фрагментов также может усиливать образование потенциально иммуногенных агрегатов или может иметь слабую авидность или уменьшенный срок хранения. Полипептиды scFv, в частности, могут иметь проблемы стабильности, растворимости, экспрессии, агрегации, иметь продукты распада и в целом проблемы с возможностью получения как в бактериальных системах экспрессии, так и в системах экспрессии млекопитающих. Аминокислотные замены в каркасном участке, которые, как полагают, увеличивают стабильность и/или снижают тенденцию к агрегации домена VH и/или VL, например, в полипептиде scFv, описаны, например, в WO 2007/109254. Ожидается, что замены в соответствующих остатках в доменах VH и VL, как описано в настоящем описании, сходным образом увеличивают стабильность и/или снижают способность к агрегации.
Ожидается, что допустимые замены, включают замены, при которых происходит замена непаратопной аминокислоты SEQ ID NO: 1 или 2 на соответствующую аминокислоту, которая присутствует в другой эмбриональной последовательности доменов VH или VL человека. В настоящее время в настоящей области известно приблизительно 40 вариабельных эмбриональных последовательностей тяжелой цепи, как приблизительно 40 эмбриональных последовательностей вариабельных областей каппа и приблизительно 30 эмбриональных последовательностей вариабельных областей лямбда. Ожидается, что возможна замена непаратопной аминокислоты аминокислотой, находящейся в любой из этих последовательностей клеточной линии. Например, остаток домена VH SEQ ID NO:1 может быть заменен аминокислотой, присутствующей в соответствующем положении любой эмбриональной последовательности VH, например, эмбриональной последовательности DP-10 (VH 1-69) или DP-88 (VH 1-e). Соответствующие положения в этом случае определяются при выравнивании последовательностей различных эмбриональных последовательностей, используя способы выравнивания, хорошо известные в данной области, например, ClustalW.
Дополнительные замены, которые как ожидается, будут допустимы, представляют замены аминокислотой, большая часть боковой цепи которой, подвергается действию растворителя, что определяет анализ трех со-кристаллических структур. Доступный для растворителя участок остатка можно расчитать методиками, хорошо известными в данной области. Дополнительно ожидается, что замены на аминокислоты, погруженные в вариабельный домен, будут допустимы в большей степени, если боковая цепь аминокислоты не создает стерическую помеху примыкающим остаткам. По этой причине погруженные аминокислоты обычно заменяют на аминокислоты с боковой цепью, сходного или меньшего размера. Например, считается, что допустима замена погруженного остатка Ile на Leu, Val, Ala или Gly. Возможное стерическое препятствие, создаваемое заменой, можно предсказать путем анализа трех со-кристаллических структур. Дополнительные замены, которые, как полагают, будут допустимы, представляют собой замены, которые сохраняют существующие электростатические взаимодействия в вариабельном домене, например, взаимодействия диполь-диполь, взаимодействия индуцированный диполь, водородные связи или ионные связи.
Дополнительные аминокислотные замены вариабельных доменов включают замены, которые, как ожидается, проявляют новые эффективные свойства антител или их антиген-связывающих фрагментов. Например, гипотетические области N-гликозилирования в доменах VH и/или VL можно удалить для предотвращения или снижения образования N-гликоформ. Амино-концевой остаток может быть замещен радикалом Gln, вызывая пироглутамилирование, которое может снижать число вариантов, отличающихся зарядами. Аминокислотные замены можно использовать для снижения изоэлектрической точки, что может снижать уровень элиминации, например, полипептидных антител IgG.
Поверхностные остатки вариабельных доменов могут быть заменены остатками Cys или Lys, например, которые затем могут быть ковалентно модифицированы и слиты с молекулами, имеющими полезные свойства в отношении антител или их антиген-связывающих фрагментов, например, с определяемым метками, токсином, нацеливающим веществом или белком. Например, остаток Cys может быть слит с цитотоксичным лекарственным средством с образованием конъюгата с лекарственным средством. Остатки Cys также могут быть слиты с молекулами, которые повышают период полувыведения в сыворотке, например с полиэтиленгликолем (PEG) или альбумином сыворотки. Такие аминокислотные модификации рассмотрены, например, в документе Beck et al. (2010) Nature 10: 345-52.
Определяемые метки включают радиоактивные метки, такие, как 131I или 99Tc, которые могут быть прикреплены к антителам или их антиген-связывающим фрагментам способами, известными в данной области. Метки также включают ферментные метки, такие, как пероксидаза хрена. Метки дополнительно включают химические вещества, такие, как биотин, который может быть определен путем связывания со специфическим родственным определяемым веществом, например, меченным авидином. Могут быть прикреплены другие вещества, которые облегчают очищение. Например, антитела или их антиген-связывающие фрагменты могут быть His-меченными хорошо известными способами рекомбинантной модификации и экспрессии.
4. Множественные аминокислотные замены в вариабельных доменах
Множественные аминокислотные замены могут быть осуществлены в антителах или их антиген-связывающих фрагментах. В качестве общего правила, ожидается, что антитела или их антиген-связывающие фрагменты сохраняют стабильность и функциональность после по меньшей мере нескольких случайным образом выбранных аминокислотных замен. См., например, Wells, Biochemistry 29: 8509-17 (1990). Тем не менее, чем больше замещений случайным образом привносят в вариабельный домен, например, тем больше снижается общая стабильность, увеличивается способность к агрегации, снижается аффинность к TGFβ и увеличивается возможная иммуногенность. Таким образом, если производят множественные аминокислотные замены, предпочтительные замены выбирают из замен, описанных выше, при которых ожидают сохранение стабильности и функциональности. Функциональность модифицированных доменов может быть протестирована стандартными способами, известными в данной области, включая, но ими не ограничиваясь, анализ пролиферации MLEC, описанный в документе Grütter (2008).
Нуклеиновые кислоты и способы получения антител и антиген-связывающих фрагментов
В еще одном аспекте настоящее изобретение относится к нуклеиновым кислотам, кодирующим антитела или их антиген-связывающие фрагменты, как описано в настоящем описании. Выделенная нуклеиновая кислота может быть, например, синтетической ДНК, неприродной РНК или кДНК. Нуклеиновая кислота может быть встроена в плазмидную, векторную или транскрипционную кассету экспрессии. Рекомбинантная клетка-хозяин может включать один или несколько вышеуказанных компонентов. «Выделенную» нуклеиновую кислоту (или антитело или его антиген-связывающий фрагмент) удаляют из природного окружения, и она может быть дополнительно практически в чистой форме, например, по меньшей мере на 90% чистой или может находиться в гомогенной форме.
Способы получения антител или их антиген-связывающих фрагментов включают экспрессию кодирующей нуклеиновой кислоты в клетке-хозяине в условиях, обеспечивающих получение антител или их антиген-связывающих фрагментов, и восстановление антител и их антиген-связывающих фрагментов. Процесс восстановления антител или их антиген-связывающих фрагментов может включать выделение и/или очистку антител или их антиген-связывающих фрагментов. Способ получения может включать включение антител или их антиген-связывающих фрагментов в состав композиции, включающей по меньшей мере один дополнительный компонент, такой, как фармацевтически приемлемый эксципиент.
Подходящие векторы, включающие нуклеиновую кислоту, кодирующую антитела или их антиген-связывающие фрагменты, могут быть выбраны или сконструированы как содержащие подходящие регуляторные последовательности, включая промотерные последовательности, концевые последовательности, полиаденилирующие последовательности, последовательности энхансеров, гены маркеры и другие подходящие последовательности. Векторы могут представлять собой, например, плазмиды, фаги, фагемиды, аденовирусы, AAV (адено-ассоциированные вирусы), лентивирусы. Методики и протоколы осуществления манипуляций с нуклеиновой кислотой, например, для получения конструкций нуклеиновых кислот, мутагенеза, секвенирования, введения ДНК в клетки, и для экспрессии генов, хорошо известны в данной области.
Введение таких нуклеиновых кислот в клетку-хозяин может быть осуществлено при помощи методик, хорошо известных в данной области. Для эукариотических клеток подходящие методики могут включать, например, трансфекцию с фосфатом кальция, DEAE-декстран, электропорацию, опосредуемую липосомами трансфекцию и трансдукцию при помощи ретровирусов или других вирусов. Для бактериальных клеток подходящие методики могут включать трансформацию с хлоридом кальция, электропорацию и трансфекцию при помощи бактериофага. Введение может следовать вслед за началом или прохождением экспрессии нуклеиновой кислоты, например, путем культивирования клетки-хозяина в условиях экспрессии гена. В одном из вариантов осуществления нуклеиновая кислота по изобретению встраивается в геном, например, хромосому клетки-хозяина. Встраивание может обеспечиваться включением последовательности, которая обеспечивает рекомбинацию с геномом в соответствии со стандартными техниками.
Системы клонирования и экспрессии полипептида в множестве различных клеток-хозяев хорошо известны. Подходящие клетки-хозяева включают бактерии, клетки млекопитающих, клетки растений, клетки насекомых, грибы, плесень и трансгенные растения и животных. Линии клеток млекопитающих, доступные в данной области для экспрессии гетерологичного пептида, включают клетки яичника китайского хомяка (CHO), клетки HeLa, клетки почек новорожденного хомяка, клетки меланомы мыши, клетки меланомы крысы, клетки почек эмбриона человека, клетки сетчатки эмбриона человека и многие другие. Экспрессия антител или фрагментов антител в прокариотических клетках, таких, как E. coli, хорошо описано в данной области. Обзор приведен, например, в Plückthun Bio/Technology 9: 545-551 (1991). Экспрессия в культивируемых эукариотических клетках также описана для специалистов в данной области, как раскрыто в документе Andersen et al. (2002) Curr. Opin. Biotechnol. 13: 117-23, например.
Антитела или их антиген-связывающие фрагменты могут быть гликозилированы либо естественным путем, либо путем выбора экспрессируемого хозяина, например, клетки CHO или NSO (ECACC 85110503), или они могут быть не гликозилированы, например, если получение проходит экспрессией в прокариотической клетке. Гликозилирование также может быть намеренно изменено, например, путем ингибирования фукозилирования, для повышения активности ADCC получаемого антитела.
Способы использования антител или их антиген-связывающих фрагментов
Антитела или их антиген-связывающие фрагменты по настоящему изобретению можно использовать в способе лечения или диагностики человека или животного, таком, как способ лечения (который может включать профилактическое лечение) заболевания или расстройства пациента-человека, который включает введение эффективного количества пациенту. Состояния, лечение которых эффективно, включают любые состояния, при которых играет роль TGFβ, например, фиброзное заболевание, злокачественная опухоль, иммунно-опосредованное заболевание и заживление ран.
Антитела или их антиген-связывающие фрагменты по настоящему изобретению являются эффективными для лечения заболевания и состояния, возникающего напрямую или косвенно, в результате активности TGFβ. Антитела или их антиген-связывающие фрагменты по настоящему изобретению могут селективно ингибировать активность изоформы TGFβ человека in vitro или in vivo. Активность изоформ TGFβ включает, но ими не ограничивается, TGFβ-опосредованный сигнальный путь, отложение внеклеточного матрикса (ECM), ингибирование пролиферации эпителиальных и эндотелиальных клеток, пролиферацию гладкомышечных клеток, включая экспрессию коллагена III типа, индуцирование фибронектина TGFβ, экспрессия VEGF и IL-6, связыванием пептида, связанного с латентностью, иммуносупрессию, вызванную опухолью, усиление ангиогенеза, активацию миофибробластов, усиление метастазирования и ингибирование активности NK-клеток. Например, антитела или их антиген-связывающие фрагменты по настоящему изобретению являются эффективными для лечения фокального сегментарного гломерулосклероза (FSGS), гепатофиброза (HF), острого инфаркта миокарда (AMI), идиопатического легочного фиброза (IPF), склеродермы (Ssc) и синдрома Марфана.
Антитела или их антиген-связывающие фрагменты являются эффективными для лечения заболеваний и состояний, включая, но ими не ограничиваясь, фиброзные заболевания (такие, как гломерулонефрит, рубцы в нервной системе, рубцы кожи, легочный фиброз, фиброз легких, фиброз, вызванный облучением, фиброз печени, миелофиброз), ожоги, иммунно-опосредованные заболевания, воспалительные заболевания (включая ревматоидный артрит), отторжение трансплантата, злокачественная опухоль, конктрактура Дюпюитрена и язвы желудка. Они также могут быть эффективны для лечения, профилактики и снижения риска развития почечной недостаточности, включая, но ими не ограничиваясь, диабетическая (тип I и тип II) нефропатия, нефропатия, вызванная облучением, обструктивная нефропатия, диффузный системный склероз, легочный фиброз, отторжение аллотрансплантата, наследственные заболевания почек (например, поликистоз почек, спонгиозная почка, подковообразная почка), гломерулонефрит, нефросклероз, нефрокальциноз, системная красная волчанка, синдром Шегрена, болезнь Бергера, системная или гломерулярная гипертензия, тубулоинтерстициальная нефропатия, почечный тубулярный ацидоз, туберкулез почек и инфаркт почки. В частности, они являются эффективными в сочетании с антагонистами ренин-ангиотензин-альдостероновой системы, включая, но ими не ограничиваясь, ингибиторы ренина, ингибиторы ангиотензин-превращающего фермента (иАПФ, ACE), антагонисты Ang II-рецепторов (также известны как «блокаторы Ang II рецепторов) и антагонисты альдостерона. Способы применения антител или их антиген-связывающих фрагментов в комбинации с такими антагонистами описаны, например, в WO 2004/098637.
Антитела или их антиген-связывающие фрагменты также являются эффективными для лечения заболеваний и состояний, связанных с отложением внеклеточного матрикса, включая системный склероз, послеоперационные спайки, келоидные и гипертрофические рубцы, пролиферативная витреоретинопатия, операция дренирования глаукомы, повреждение роговицы, катаракта, болезнь Пейрони, респираторный дистресс синдром взрослых, цирроз печени, постинфарктный рубец, рестеноз после ангиопластики, рубцы после субарахноидального кровотечения, рассеянный склероз, фиброз после ляминэктомии, фиброз после восстановления сухожилий и тому подобные, рубцы после удаления татуировки, билиарный цирроз (включая склерозирующий холангит), перикардит, плеврит, трахеостомию, проникающее ранение центральной нервной системы, эозинофильный миалгический синдром, сосудистый рестеноз, веноокклюзионная болезнь, панкреатит и псориатическая артропатия.
Антитела или их антиген-связывающие фрагменты являются, кроме того, эффективными для усиления ре-эпителизации при таких заболеваниях и состояниях, как венозные язвы, ишемические язвы (пролежни от давления), диабетические язвы, области трансплантата, области донорства трансплантата, царапины и ожоги, заболевания бронхиального эпителия, таких, как астма, ОРДС (острый респираторный дистресс синдром, ARDS), заболевания кишечного эпителия, таких, как мукозит, связанный с цитотоксическим лечением, язвы пищевода (рефлюксная болезнь), язвы желудка, повреждения тонкого и толстого кишечника (воспалительное заболевание кишечника).
Антитела или их антиген-связывающие фрагменты также можно использовать для усиления пролиферации эндотелиальных клеток, например, при стабилизации атеросклеротических бляшек, для усиления заживления сосудистых анастомозов или для ингибирования пролиферации гладкомышечных клеток, таких, как при заболевании артерий, рестенозе и астме.
Антитела или их антиген-связывающие фрагменты являются эффективными для усиления иммунного ответа на опосредуемые макрофагами инфекции. Они также эффективны для снижения иммуносупрессии, вызываемой, например, опухолями, СПИДом или гранулематозными заболеваниями. Антитела или их антиген-связывающие фрагменты являются эффективными для лечения гиперпролиферативных заболеваний, таких, как злокачественная опухоль, включая, но ими не ограничиваясь, рак груди, простаты, яичника, желудка, почки, поджелудочной железы, колоректальный рак, рак кожи, легких, рак шейки матки и мочевого пузыря, глиома, мезотелиома, а также различными лейкозоми и саркомами, такими, как саркома Капоши, и являются эффективными для лечения или профилактики рецидивов таких опухолей. Антитела или их антиген-связывающие фрагменты также являются эффективными для ингибирования опосредованных циклоспорином метастазов.
В контексте терапии злокачественных опухолей «лечение» включает любое медицинское вмешательство, приводящее к замедлению роста опухоли или к уменьшению метастазов опухоли, а также к частичной ремиссии злокачественной опухоли с целью пролонгирования средней продолжительности жизни пациента.
Способы лечения включают введение антитела или его антиген-связывающего фрагмента или фармацевтических композиций, содержащих антитело или его антиген-связывающий фрагмент. Антитело или его антиген-связывающий фрагмент можно использовать для получения лекарственного средства для введения. Например, способ получения лекарственного средства или фармацевтической композиции включает введение в состав композиции антитела или его антиген-связывающего фрагмента вместе с фармацевтически приемлемым эксципиентом. Композицию можно вводить самостоятельно или в комбинации с другими лекарственными средствами, как одновременно, так и последовательно в зависимости от состояния, на которое нацелено лечение.
Введение осуществляют, предпочтительно, в «терапевтически эффективном количестве», достаточном для положительного эффекта у пациента. Такой положительный эффект может означать по меньшей мере облегчение по меньшей мере одного симптома конкретного заболевания или состояния. Конкретное вводимое количество, а также уровень и период действия введения зависят от природы и тяжести заболевания или состояния, на которое нацелено лечение. Назначение лечения, например, решения в отношении дозировки и тому подобное, можно определить на основании доклинических и клинических испытаний, схема которых находится в пределах знаний специалиста в данной области.
Точная дозировка зависит от нескольких факторов, в том числе от того для чего предназначено антитело или его антиген-связывающий фрагмент - для диагностики или для лечения, от размера и локализации области, на которые направлено лечение, от конкретной природы антитела или его антиген-связывающего фрагмента, например, полноразмерное антитело, фрагменты Fab или scFv, и от природы определяемой метки или другой молекулы, прикрепленной к антителу или его антиген-связывающему фрагменту. Обычная дозировка полноразмерного антитела, например, может составлять от 100 мкг до 1 г при системной доставки и от 1 мкг до 1 мг при местном нанесении. Доза для единичного введения взрослому пациенту может быть скорректирована пропорционально для детей и новорожденных, а также скорректирована для другого формата антитела пропорционально молекулярному весу и активности. Введение можно повторять ежедневно, дважды в неделю, еженедельно, ежемесячно или через другие интервалы времени с разрешения врача. Введение может быть периодическим, и период между введениями может составлять приблизительно две недели или больше, предпочтительно приблизительно три недели или больше, более предпочтительно приблизительно четыре недели или больше или приблизительно раз в месяц.
Уровни доз, равные приблизительно 0,1, 0,3, 1, 3, 10 или 15 мг на кг веса тела пациента считаются эффективными и безопасными. Например, 0,5-5 мг/кг у крысы и мыши представляют собой эффективную дозу в острой ситуации. Таким образом, для долгосрочного дозирования людям можно вводить 0,3-10 мг/кг на основании ожидаемого периода полувыведения, равного 21 день. Дозы могут быть достаточными для эффекта и в то же время достаточно низкими для облегчения оптимального введения. Например, доза меньше 50 мг облегчает подкожное введение. Внутривенное введение можно использовать в качестве пути доставка при тяжелых заболеваниях, если могут потребоваться высокие дозы и длительные интервалы между введениями доз. Подкожные инъекции могут повышать возможный иммунный ответ на продукт. Местное нанесение для локализованного заболевания может снизить количество вводимого продукта и увеличить концентрацию в области действия, что может улучшить безопасность.
Антитело или его антиген-связывающий фрагмент можно вводить путем инъекции, например, подкожно, внутривенно, в полость (например, после резекции опухоли), внутрь пораженных тканей, интраперитонеально или внутримышечно. Антитело или его антиген-связывающий фрагмент также можно доставлять ингаляционно или местно (например, интраокулярно, интраназально, ректально, внутрь раны, на кожу) или перорально.
Антитела или их антиген-связывающие фрагменты обычно вводят в форме фармацевтической композиции, которая может содержать по меньшей мере один компонент кроме антитела или его антиген-связывающего фрагмента. Таким образом, фармацевтическая композиция может содержать фармацевтически приемлемый эксципиент, носитель, буфер, стабилизатор или другие вещества, хорошо известные специалисту в данной области. Такие вещества должны быть нетоксичными и не должны влиять на эффективность активного ингредиента. Такие вещества могут включать, например, всевозможные растворители, диспергенты, покрытия, антибактериальные и противогрибковые средства, изотонические средства и средства, замедляющие абсорбцию. Некоторыми примерами фармацевтически приемлемых носителей являются вода, физиологический раствор, натрий-фосфатный буфер, декстроза, глицерин, этанол и тому подобное, а также их комбинации. Во многих случаях предпочтительно вводить в композицию изотонические агенты, например, сахара, полиспирты, такие, как маннит, сорбит или хлорид натрия. Дополнительные примеры фармацевтически приемлемых веществ включают смачивающие средства или вспомогательные материалы, такие, как эмульгаторы, консерванты или буферы, которые повышают срок хранения или эффективность.
Точная природа носителя или другого вещества зависит от пути введения. В случае внутривенной инъекции или инъекции в поврежденную область активный ингредиент находится в форме парентерально приемлемого водного раствора, который не является пирогенным и имеет подходящие pK, изотоничность и стабильность. Средние специалисты в данной области смогут получить подходящие растворы, используя, например, изотонические носители, такие, как раствор для инъекций хлорида натрия, раствор для инъекций Рингера и раствор для инъекций Рингера с лактатом. Также могут быть включены консерванты, стабилизаторы, буферы, антиоксиданты и/или другие вспомогательные вещества.
Антитело или его антиген-связывающий фрагмент могут быть получены в жидкой, полутвердой и твердой формах, таких, как жидкие растворы (например, растворы для инъекции и инфузии), дисперсии или суспензии, порошки, липосомы и суппозитории. Предпочтительная форма зависит от ожидаемого пути введения, терапевтического применения, физико-химических свойств молекулы и пути доставки. Составы могут включать эксципиенты или комбинации эксципиентов, например: сахара, аминокислоты и сурфактанты. Жидкие составы могут включать антибиотики в различных концентрациях и pH. Твердые составы могут быть получены, например, путем лиофилизации, высушивания воздухом или высушивания по технологии суперкритической жидкости.
Терапевтические композиции могут быть получены как раствор, микроэмульсия, дисперсия, липосома или другая упорядоченная структура, подходящая для высокой концентрации лекарственного средства. Стерильные растворы для инъекций могут быть получены путем введения антитела или его антиген-связывающего фрагмента в подходящий растворитель с одним ингредиентом или с комбинацией ингредиентов, перечисленных выше, с последующей стерилизацией фильтрованием. В целом, дисперсии получают путем включения активного соединения в стерильный носитель, который содержит основную дисперсионную среду и другие ингредиенты из перечисленных выше. В случае стерильных порошков для полученияя стерильных растворов для инъекции предпочтительными способами получения являются вакуумная сушка и лиофилизация, которые дают порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из его предварительно стерильной фильтрацией раствора. Подходящую текучесть раствора можно поддерживать, например, благодаря использованию покрытия, такого, как лецитин, путем поддерживания размера частиц дисперсии или путем использования сурфактантов. Пролонгированную абсорбцию инъецируемых композиций можно обеспечить путем включения в композицию агента, который замедляет абсорбцию, например, солей моностеарата и желатина.
В конкретных вариантах осуществления активное соединение может быть получено с носителем, который защищает антитело или его антиген-связывающий фрагмент от быстрого высвобождения, например, в виде состава контролируемого высвобождения, включая импланты, трансдермальные пластыри и микроинкапсулированные системы доставки. Можно применять биодеградируемые, биосовместимые полимеры, такие, как этиленвинилацетат, полиангидриды, полигликолиевую кислоту, коллаген, полиортоэфиры и полимолочную кислоту. Большое число способов получения таких препаратов запатентованы или в целом хорошо известны специалистам в данной области.
Способ применения антитела или его антиген-связывающего фрагмента может быть причиной связывания с TGFβ или обеспечивать связывание с TGFβ и тому подобное. Такое связывание может иметь место in vivo, например, после введения антитела или его антиген-связывающего фрагмента пациенту, или может иметь место in vitro, например, в ELISA (иммуноферментном анализе), Вестерн-блоттинге, иммуноцитохимии, иммунопреципитации, аффинной хроматографии или анализах клеток, или ex vivo с антителом или его антиген-связывающим фрагментом, с последующим введением пациенту.
Изобретение относится к набору, включающему антитело или его антиген-связывающий фрагмент. Антитело или его антиген-связывающий фрагмент могут быть помечены для определения его реактивности в образце. Наборы можно использовать, например, для диагностических анализов. Набор может содержать инструкции для применения соединений. Вспомогательные материалы для содействия или для обеспечения такого способа могут быть включены в набор.
Реактивность антитела или его антиген-связывающего фрагмента в образце может быть определена любыми подходящими средствами, например, радиоиммунологического анализа (RIA). Радиоактивно меченный антиген можно смешивать с немеченным антигеном (тестовым образцом) и обеспечить связывание с антителом или его антиген-связывающим фрагментом. Связанный антиген физически отделен от несвязанного антигена, и определяют количество радиоактивного антигена, связанного с антителом или его антиген-связывающим фрагментом. Анализ на конкурентное связывание также можно использовать с нерадиоактивным антигеном, используя антиген или аналог, связанный с репортерной группой. Репортерная группа может представлять собой фторохром, фосфор или краситель. Подходящие фторохромы включают флуоресцеин, родамин, фикоэритрин и техасский красный. Подходящие хромогенные красители включают диаминобензидин.
Другие репортеры включают макромолекулярные коллоидные частицы или зернистый материал, такой, как латексные частицы, которые окрашены, магнитные или парамагнитные и биологически или химически активные средства, которые могут прямо или косвенно вызывать определяемые сигналы, наблюдаемые визуально, определяемые электронно или записываемые другим путем. Эти молекулы могут представлять собой ферменты, которые катализируют реакции, которые проявляют или меняют цвета или вызывают изменения электрических свойств, например. Они могут быть молекулярно возбудимыми, так, что электронные переходы между энергетическими состояниями приводят к особенностям спектральных абсорбций или эмиссий. Они могут включать химические структурные элементы, применяемые параллельно с биосенсорами. Можно использовать системы определения биотин/авидин или биотин/стрептавидин и алкалинфосфатазы. Сигналы, генерируемые конъюгатами антитело-репортер, можно применять для получения поддающихся количественному определению абсолютных или относительных данных о соответствующем связывании антитела в образцах.
Настоящее изобретение также относится к применению антитела или его антиген-связывающего фрагмента для измерения уровней антигена в конкурентном анализе. Связывание молекулы репортерной группы с антителом или его антиген-связывающим фрагментом так, что развиваются физические или оптические изменения при связывании, является одной возможностью. Репортерная группа может прямо или опосредованно генерировать определяемые и предпочтительно измеряемые сигналы. Связь репортерных групп может осуществляться прямо или опосредованно, ковалентно, например, через пептидную связь, или нековалентно. Антитело или его антиген-связывающий фрагмент и белок-репортер могут быть связаны пептидной связью и рекомбинантно экспрессированы как слитый белок.
Дополнительные аспекты и варианты осуществления настоящего изобретения будут очевидны специалистам в данной области в свете настоящего описания, включая следующие экспериментальные примеры.
ПРИМЕР 1
Анти-TGFβ одинарная цепь Fv (scFv) может быть получена в соответствии со следующим неограничивающим примером, раскрытым в Примере 1 Патента США № 7723486. Нейтрализующие способности в отношении TGFβ1, TGFβ2 и/или TGFβ3 могут быть повышены при помощи мутагенеза и/или комбинаторных методик. scFv с улучшенными способностями для TGFβ1, TGFβ2 и/или TGFβ3 могут быть получены путем отбора и скринингофаговых библиотек антител, как описано в Примере 1 патента США № 7723486. scFv, созданные в этом примере, сравнивают с 1D11.16, который раскрыт в патенте США № 7723486 в анализе пролиферации MLEC.
В Примере 1 патента США № 7723486 было обнаружено, что конкретные зародышевые линии оказываются высоко представленными среди популяции с высокой активностью TGFβ-нейтрализации scFv. Существуют DP-10/1-69 и DP-88/1-e (оба являются членами семейства VH1 зародышевой линии) для тяжелой цепи и DPK22/A27 (семейство Vκ3) для легкой цепи. Эти зародышевые линии, как оказывается, предоставляют структурный каркасный участок, в частности, подходящий для высокой эффективности TGFβ пан-нейтрализующих антител. PET1073G12, PET1074B9 и PET1287A10 scFv демонстрируют активность, сходную или превышающую активность 1D11.16 и всех трех изоформ TGFβ в анализе пролиферации MLEC.
Полученные аминокислотные последовательности PET1073G12, PET1074B9 и PET1287A10 генных сегментов VH и VL были выравнены с известными последовательностями зародышевой линии человека в базе данных VBASE (Tomlinson, каталог последовательностей V-BASE, MRC Center for Protein Engineering, Cambridge, UK, протокол переноса гипертекста vbase.mrc-cpe.cam.ac.uk (1997)), и наиболее близкий ген зародышевой линии человека определяют по схожести последовательностей. Ближайший ген зародышевой линии человека для генного сегмента VH PET1073G12 и PET1074B9 определен как DP-10/1-69 (семейство зародышевой линии VH1), и наиболее близкий ген зародышевой линии человека для генного сегмента VH PET1287A10 определен как DP-88/1-e (семейство зародышевой линии VH1). Ближайший ген зародышевой линии генного сегмента VL PET1073G12, PET1074B9 и PET1287A10 определен как DPK22/A27 (семейство Vκ3). Сайт-направленный мутагенез использовали для замены остатков каркасной области, которые отличаются от зародышевой последовательности, на остаток зародышевой линии, при условии, что такие изменения не вызывают потерю эффективности в анализе пролиферации MLEC более, чем в три раза у полученного антитела любой изоформы TGFβ. Если такая потеря эффективности наблюдается, то в антителе сохраняют аминокислоту каркасной области не из зародышевой линии.
В PET1073G12, модифицированном на уровне генов зародышевой линии, и PET1074B9, модифицированном на уровне генов зародышевой линии, все аминокислоты каркасной области представляют собой аминокислоты зародышевой линии за исключением двух остатков в VH и одного остатка в VL. Аминокислотные последовательности PET1073G12, модифицированного на уровне генов зародышевой линии, описаны в SEQ ID NO: 2 для VH и в SEQ ID NO: 7 для VL в патенте США № 7723486. Аминокислотные последовательности PET1074B9, модифицированного на уровне генов зародышевой линии, описаны в SEQ ID NO: 12 для VH и в SEQ ID NO: 17 для VL в патенте США № 7723486. Аминокислотные последовательности для PET11287A10, модифицированного на уровне генов зародышевой линии, описаны в SEQ ID NO: 22 для VH и в SEQ ID NO: 27 для VL в патенте США № 7723486.
ПРИМЕР 2А
Нейтрализующая активность антител против TGFβ или их антиген-связывающих фрагментов может быть оценена, используя TGFβ-зависимый анализ пролиферации MLEC, раскрытый в примере 4 патента США № 7723486. Анализ пролиферации MLEC основан на анализе, описанном Danielpour et al., J. cell. Physiol., 138:79-86 (1989). Этот анализ основан на принципе, что добавление TGFβ1, TGFβ2 или TGFβ3 к эпителиальным клеткам легкого норки ингибирует вызванную сывороткой пролиферацию клеток. Антитела тестировали на способность к нейтрализации TGFβ1, TGFβ2 или TGFβ3, ведущей к восстановлению клеточной пролиферации. Пролиферацию измеряли по захвату [3H]-тимидина. Активность антитела определяли как концентрацию антитела, которая нейтрализует одну концентрацию TGFβ1, TGFβ2 или TGFβ3 на уровне 50% (IC50) в нМ.
Протокол анализа пролиферации MLEC: MLEC линию получали из American Type Culture Collection (Cat.# CCL-64). Клетки выращивали в минимально обогащенной среде (MEM, Gibco), содержащей 10% фетальной бычьей сыворотки (FBS) (Gibco), 1% пенициллина/стрептомицина (Gibco) и 1% MEM раствор заменимых аминокислот (Gibco). Конфлюентные клетки из флаконов T-175 выделяли из флаконов, центрифугировали, промывали и ресуспендируовали в среде MLEC для количественного анализа, которую получали из MEM, содержащей 1% FBS, 1% пенициллина/стрептомицина и 1% MEM раствора заменимых аминокислот. Аликвоту клеток затем метили трипановым синим, подсчитывают в счетной камере и начальный раствор клеток растворяли до 1,75×105 клеток на мл, используя среду для количественного анализа. 100 мкл этой суспензии добавляли в каждую лунку тканевой культуры плоскодонного 96-луночного планшета и инкубировали в течение 3-5 часов.
Получение растворов TGFβ/антитело: рабочие растворы TGFβ1, TGFβ2 или TGFβ3 при 6 нг/мл (шестикратная концентрация от конечной концентрации для количественного анализа) и антител (включая контроли, такие, как 1D11.16) в три раза больше конечной максимальной концентрации для количественного анализа получали в среде MLEC для количественного анализа. Конечная концентрация TGFβ в анализе (1 нг/мл или 40 пмоль) соответствует концентрации, которая индуцирует приблизительно 80% ингибирование клеточной пролиферации по сравнению с контролем без TGFβ (т.е. величина EC80).
Разведение в планшете: образцы тестируемых и контрольных антител титровали в трехкратных стадиях разведения в среде MLEC для количественного анализа и инкубировали в присутствии и отсутствии TGFβ1, TGFβ2 или TGFβ3. Все соответствующие контроли включали в каждом эксперименте: тестирование 1D11.16 и/или эталонного антитела, как полагается, и выполнение титрований TGFβ1, TGFβ2 или TGFβ3. Конечные планшеты оставляли во влажной камере для культивирования тканей в течение 1 часа ± 15 минут.
Добавление растворов TGFβ/антитело к клеткам в планшете: через соответствующее время инкубирования 100 мкл из каждой лунки планшетов для разведения переносили в MLEC планшеты, и планшеты возвращали в инкубатор на 44±2 часа. 25 мкл из 10 мкКи/мл [3H]-тимидина, разведенного в натрий-фосфатном буфере (PBS), добавляли к каждой лунке (0,25 мкКи/лунка). Планшеты затем возвращали в инкубатор на 4 часа ± 30 минут.
Сбор клеток: 100 мкл трипсин-EDTA (0,25%, Gibco) добавляли в каждую лунку, планшеты инкубировали в течение 10 минут в инкубаторе, и клетки собирали, используя 96-луночный коллектор клеток Tomtec или Packard.
Сбор данных и анализ: данные, полученные от собранных клеток, считывают при помощи бета-планшета-ридера (TopCount, Packard). Данные анализируют для получения IC50 и стандартных величин отклонений. Величины IC50 получены при помощи программы Prism 2.0 (GraphPad).
Результаты: очищенные PET1073G12, PET1074B9 и PET1287A10, модифицированные на уровне генов зародышевого типа IgG4, теcтировали параллельно с 1D11.16 в анализе пролиферации MLEC. IgG4 получали, как описано в Примере 3 патента США № 7723486. Средние данные IC50 для IgG4 PET1073G12 и PET1287A10 показали, что эти антитела имеют активность, сходную или приближающуюся к активности 1D11.16 в отношении TGFβ1, TGFβ2 и TGFβ3.
Средние данные IC50 предполагают, что IgG4 PET1074B9 является более активным в отношении TGFβ1, хотя кривая ответа на полную дозировку в анализе MLEC не получена. При сравнении 1D11.16 показала 12% нейтрализацию TGFβ1 при концентрации 91 пмоль, и PET1074B9 показала 78% нейтрализацию при сходной концентрации 92 пмоль.
ПРИМЕР 2В
Кроме того, аффинность связывания изоформы TGFβ GC1008 антителом измеряли, используя аппарат Biacore® 3000 (GE Healthcare). TGFβ1 и TGFβ2, полученные в лаборатории, разводили до ~1 мкг/мл в 10 ммоль ацетата, pH 4,5, и TGFβ3 (R&D Systems) разводили до ~2 мкг/мл в 10 ммоль ацетата, pH 4,0. Проточные лунки 2, 3 и 4 CM5 сенсорного чипа ковалентно иммобилизуют при помощи 50-100 RU TGFβ1, TGFβ2 и TGFβ3, соответственно, используя стандартный набор амино-соединений от GE Healthcare. Проточную лунку 1 используют в качестве контрольной поверхности. Для анализа кинетического связывания GC1008 серийно разводят 1:3 с 33,3 нмоль до 1,2 нмоль в буфере HBS-EP и вводят в тройном повторении во все четыре проточные лунки на 5 минут, а затем диссоциируют 5 минут в буфере при скорости потока 30 мкл/мин. Поверхность регенерируют в течение 30 сек инъекцией 40 мМ HCl при 75 мкл/мин. Сенсорграммы подгоняют, используя модели связывания 1:1 после извлечения буфера и контроля изменений рефракционного индекса проточной лунки при помощи BIA Evaluation Software Kit (GE Healthcare). KD, показанные в ТАБЛИЦЕ 6, представляют собой среднее значение более, чем 25 независимых анализов.
ПРИМЕР 3
Биологическая эффективность антител или их антиген-связывающих фрагментов для лечения хронических заболеваний почек и других клинических показаний может быть определена на модели унилатеральной обструкции мочеточника (UUO), показанной в примере 7 патента США № 7723486. Взрослых крыс Spraque Dawley (Taconic Farms, Germantown, N.Y.), весом 250-280 грамм (возрастом приблизительно 6 недель), содержали при контроле воздуха, температуры и света. Крысам, которым проводили UO, производили небольшой разрез по средней линии передней части брюшной стенки для обнажения левой почки и верхней части мочеточника. Мочеточник перевязывали на уровне нижнего полюса почки шелковым швом и второй раз - приблизительно на 0,2 см ниже первого шва. Ложно оперированные мыши получали такой же хирургический протокол, но без перевязывания мочеточника.
Крысам с обструкцией вводили PBS, пан-нейтрализующие моноклональные антитела мыши (1D11), совпадающим по изотипу контрольные антитела (13С4) или моноклональные антитела против TGFβ человека, как раскрыто в патенте США № 7723486. Антитела вводили крысам интраперитонеально, начиная со дня перевязки мочеточника курсом в течение 3 недель. 13С3 и 1D11 вводят в количестве 5 мг/кг (3 раза/неделю), пан-нейтрализующее антитело человека вводили крысам в количестве 5 мг/кг (каждые 5 дней). В конце 3 недели крыс умерщвляли, почки перфузировали PBS в течение 3 минут, и перфузированные почки собирали для анализа на мРНК, определения содержания коллагена и гистологического исследования.
Для оценки распространенности фиброза ткани определяли общее содержание коллагена в ткани при помощи биохимического анализа на гидроксипролин в экстрактах гидролизата в соответствии с Kivirikko et al. Анализ Sircol коллагена также производили для общего содержания коллагена. Анализ Sircol коллагена измеряет количество общих растворимых в кислоте/пепсине коллагенов на основании специфического связывания красителя Sirius красного с боковой цепью коллагена ткани.
Крысы с UUO, получающие пан-нейтрализующее моноклонального антитело человека, показали 43,4% снижение содержания гидроксипролина (1,98±0,26 мкг/мг сухой ткани) по сравнению с группой, получающей PBS (3,5±0,3 мкг/мг сухой ткани, p<0,05). Уменьшение почечного фиброза дополнительно поддерживается снижением общего солюбилизированного коллагена в пораженных почках, что определено анализом на основе красителя Sirius красный (ложное: 18,5±2,6, PBS: 69,3±3,8 и пан-нейтрализующей моноклональное антитело человека: 35,6±5,2 мкг/100 мг ткани, p<0,05 против PBS).
Также оценивали способность анти-TGF-β пан-нейтрализующего моноклонального антитела человека снижать фиброз ткани с помощью иммуногистохимического исследования. У контрольных животных перевязка мочеточника в течение трех недель вызывала обширный разрыв архитектуры почечных канальцев со значимым расширением, атрофию клеток и некроз/апоптоз, воспаление тканей и тубулоинтерстициальное растяжение с очевидным фиброзом. Существует небольшое свидетельство повреждения гломерул. Крысы, получавшие 1D11 или пан-нейтрализующее моноклональное антитело человека, с другой стороны демонстрировали сохранение архитектуры почки, что оценивали при помощи слабой дилятации канальцев и дезорганизации, снижения воспалительных инфильтратов (насыщенность клетками) и уменьшения тубулоинтерстициального расширения и фиброза.
Также измеряли эффект лечения пан-нейтрализующего анти-TGF-β моноклонального антитела на TGF-β-регулируемую экспрессию гена. TGF-β1 мРНК снижено у UUO крыс, получающих пан-нейтрализующее моноклональное антитело человека, по сравнению как с получающими PBS, так и с 13С4 животными, получающими контрольное антитело. Значительное снижение уровней мРНК для коллагена III типа также наблюдали при обструкции почек при лечении анти-TGF-β антителами человека или мышей по сравнению с теми, кто получает PBS или 13С4, показывая снижение синтеза коллагена.
Эффективность анти-TGF-β пан-нейтрализующего моноклонального антитела человека в отношении снижения ауто-индуцированного TGF-β синтеза дополнительно подтверждали благодаря измерению общего почечного TGF-β1 белка. По сравнению с ложно-оперированными животными перекрытые почки демонстрируют значительное повышение общего тканевого TGF-β1. Крысы с обструкцией, получающие пан-нейтрализующее моноклональное антитело человека, тем не менее, показывали 75% снижение уровней тканевого TGF-β1, ниже уровней, регистрируемых для обеих контрольных групп. Для сравнения антитело 1D11 мыши снижало уровни тканевого TGF-β1 на 45% по сравнению с контрольными группами. Описанные выше результаты продемонстрировали, что TGF-β нейтрализация анти-TGF-β пан-нейтрализующим моноклональным антителом человека прерывает TGF-β аутокринную регуляционную петлю, одновременно, препятствуя продукции TGF-β1 и экспрессии мРНК коллагена III.
Эффект анти-TGF-β пан-нейтрализующего моноклонального антитела на экспрессию гладкомышечного актина (α-SMA) дополнительно определяли как непрямой показатель ингибирования TGF-β. Экспрессия гладкомышечного актина является индикатором активированных миофибробластов, которые связаны с фиброзом ткани и продукцией фиброзной соединительной ткани. TGF-β является стимулятором активации и фенотипической трансформации стромальных фибробластов и резидентных эпителиальных клеток в миофибробласты. α-SMA белок определяют при помощи стандартного анализа Вестерн-блоттинга.
При сравнении с ложно-оперированными животными крысы с перевязанными почками демонстрировали критическую стимуляцию α-SMA белка, как измерено при помощи вестерн-блоттинга гомогенатов ткани. Крысы с перевязанными почками, получающие пан-нейтрализующее анти-TGF-β моноклональное антитело демонстрируют значительное снижение (75% по сравнению с контролями PBS) измеряемой экспрессии α-SMA.
Эти результаты показали эффективность пан-нейтрализующего анти-TGF-β моноклонального антитела для снижения отложения коллагена в фиброзных почках, что ясно указывает на то, что антитело является активным ингибитором продукции почечного коллагена и отложения в этой модели серьезного повреждения почек и тубулоинтерстициального фиброза. Поскольку процесс фиброза ткани в органах, таких, как легкие, печень или почки, захватывает общие механизмы и каскады реакций, специалисты в данной области оценят, что антитело является полезным в лечении хронических почечных заболеваний, а также других клинических показаний, характеризующихся патогенным фиброзом.
ПРИМЕР 4
Структуру комплекса GC1008(Fab)-TGFβ2 определяли следующим образом. Рекомбинантный GC1008(Fab) с C-конечным His6 концом (SEQ ID NO: 11) временно экспрессировали в клетках HEK293FS и очищали на аффинной смоле Nickel-NTA с последующей гель-хроматографией. Очищенный GC1008(Fab) смешивали с гомодимером TGFβ2, и комплекс выделяли гель-хроматографией. Комплекс GC1008(Fab)-TGFβ2 кристаллизовали в 35% PEG400, 100 ммоль 2-(N-морфолино)этансульфоновой кислоте (pH 6,0) при 20°С и дополнительно оптимизировали путем затравливания и оптимизации pH. Конечный объем данных собирали для 2,83 Å в пространственной группе Р21212, и структуру выясняли при помощи молекулярного замещения GC1008(Fab)-TGFβ3 структурой, описанной в документе Grütter (2008). Структура комплекса GC1008(Fab)-TGFβ2 отображена на фиг. 1.
ПРИМЕР 5
Структуру комплекса GC1009(scFv)-TGFβ1 определяли следующим образом. Рекомбинантный GC1009(scFv) с C-конечным His6 концом (SEQ ID NO: 11) сверхэкспрессировали в E. coli и очищали над аффинной смолой Nickel-NTA с последующей гель-хроматографией. Очищенный GC1009(scFv) смешивали с гомодимером TGFβ1, и комплекс выделяли гель-хроматографией. Комплекс GC1009(scFv)-TGFβ21 кристаллизовали в 16% PEG400, 0,1 моль цитрата (pH 5,0), 4% 2-пропаноле при 21°С. Определяли структуру для 3,00 Å в пространственной группе С2, и структуру выясняли при помощи молекулярного замены GC1008(Fab)-TGFβ2 структурой, определенной в примере 4. Структура комплекса GC1009(scFv)-TGFβ1 отображена на фиг. 2.
ПРИМЕР 6
Плазмиды, кодирующие как тяжелую цепь GC1008, так и легкую цепь, использовали в качестве шаблона для реакций мутагенеза на основе ПЦР. Мутации в кодирующей ДНК проводили для создания 155 одиночных аминокислотных замен кодируемой аминокислотной последовательности тяжелой цепи и одной одиночной аминокислотной замены кодируемой аминокислотной последовательности легкой цепи. Набор QuikChange® Lightning Site-Directed Mutagenesis (Agilent Technologies, Santa Clara CA) применяли в соответствии с инструкциями производителя для создания мутаций ДНК при помощи набора прямых и обратных праймеров, как созданных для конкретной аминокислоты, так и для всех 20 аминокислот с вырожденным кодоном (NNK). После подтверждения последовательности определенную мутантную ДНК спаривали с легкой или тяжелой цепью ДНК дикого типа для трансфекции в суспензии клеток-хозяев Expi293F™ (Life Technologies Corp., Grand Island, NY). На 4 день после трансфекции кондиционированную среду (1 мл) собирали и очищали при помощи 1 мл колонки Protein A PhyTip® (PhyNexus, Inc., San Jose, CA) и 12-канальной пипетки PureSpeed™ (Rainin Instrument LLC, Oakland, CA). Образцы очищенных вариант антитела анализировали в двух повторениях на Biacore® 3000 (GE Healthcare) при концентрации 50 нМ при помощи 100 RU уровня иммобилизованных поверхностей TGFβ1, 2 и 3. Скорость диссоциации (kd) вариант делят kd контроля дикого типа для получения кратного изменения kd. Увеличение аффинности отмечали, если (kdvar:kdwt) составляет менее 1, и снижение отмечали, если величина превышала 1. Создали тепловую карту для визуализации результатов. Варианты, которые полностью утратили аффинность к TGFβ показаны черным без цифр. Результаты показаны в таблицах 7А, 7В и 7С.

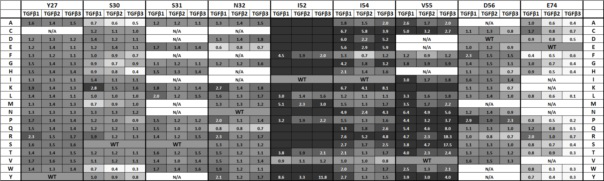
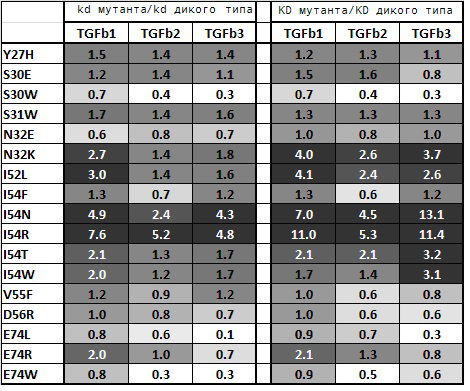
Семнадцать мутантов выбрали и их количество увеличивали для продукции достаточного количества очищенного белка для анализа KD Biacore (константа равновесия = kd/ka). Множество концентраций (90, 30, 10 и 3,33 нмоль) использовали в двойном количестве на уровне 150 RU иммобилизованных поверхностей TGFβ1, 2 и 3. KD подсчитывали при помощи общего анализа вычерчивания кривой для 1-to-1 Langmuir модели связывания. Данные эксперимента от всех четырех концентраций применяли для подсчета за исключением I54N и I54R мутантов, где применяли только две максимальные концентрации. Кратные изменения KD сравнивали с кратными изменениями в kd (скорости диссоциации), представленной в таблице 7В, и создают тепловую карту для визуализации. Сходные кратные изменения наблюдали в двух объемах данных, подтверждающих эффективность применения kd в качестве параметра для скрининга 155 единичных мутантов, как показано в таблице 7В.
Анализ тепловой карты таблицы 7 визуализирован на фиг. 5, которая показывает 3D структуру GC1008, связанную с TGFβ. Серая цепь представляет GC1008, и черная цепь представляет TGFβ2. Радикалы I52, I54 и V55 помечены черными буквами; радикалы Y27, S31, N32 и D56 помечены серым; и радикалы S30 и E74 помечены белым в соответствии с цветовой схемой, применяемой для анализа тепловой карты, показанного в нижней части таблицы 7А. Дополнительные 6 радикалов, помеченных меньшим шрифтом, P53, N59, G101, V103, L104 и A93 (легкая цепь) окрашены сходным образом в соответствии с анализом тепловой карты. На основании анализа мутагенеза наиболее чувствительные положения (I52, I54, V55 черными буквами) представляют собой паратопные радикалы, взаимодействующие с ядром полностью сохраненной области TGFβ гидрофобного участка, где наиболее устойчивые положения (S30, E74 белыми букавами) дополнительно удалены и взаимодействуют с TGFβ трехспиральным участком.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИМЕРЫ SCFV-FC, КОТОРЫЕ СВЯЗЫВАЮТСЯ С ТРАНСФОРМИРУЮЩИМ ФАКТОРОМ РОСТА β1 С ВЫСОКОЙ АФФИННОСТЬЮ, АВИДНОСТЬЮ И СПЕЦИФИЧНОСТЬЮ | 2016 |
|
RU2733286C2 |
| МОДИФИЦИРОВАННЫЕ АНТИТЕЛА IGG, КОТОРЫЕ СВЯЗЫВАЮТСЯ С ТРАНСФОРМИРУЮЩИМ ФАКТОРОМ РОСТА БЕТА-1 С ВЫСОКОЙ АФФИННОСТЬЮ, АВИДНОСТЬЮ И СПЕЦИФИЧНОСТЬЮ | 2016 |
|
RU2728858C2 |
| СЕЛЕКТИВНЫЕ В ОТНОШЕНИИ ИЗОФОРМЫ АНТИТЕЛА К TGF-БЕТА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2021 |
|
RU2839151C1 |
| АНТИГЕН, АССОЦИИРОВАННЫЙ С РЕВМАТОИДНЫМ АРТРИТОМ | 2013 |
|
RU2649368C2 |
| РЕКОМБИНАНТНЫЕ АНТИТЕЛА ПРОТИВ ФАКТОРА РОСТА ЭНДОТЕЛИЯ СОСУДОВ (VEGF), ПОЛУЧЕННЫЕ ПОСРЕДСТВОМ МУТАГЕНЕЗА ВАРИАБЕЛЬНОЙ ОБЛАСТИ | 2011 |
|
RU2557309C2 |
| Антигены, ассоциированные с воспалительным заболеванием кишечника | 2012 |
|
RU2612878C2 |
| АНТИ-LRP6 АНТИТЕЛА | 2011 |
|
RU2587625C2 |
| СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ VEGF | 2016 |
|
RU2648152C2 |
| ПОЛИПЕПТИДЫ ДЛЯ СВЯЗЫВАНИЯ С "РЕЦЕПТОРОМ КОНЕЧНЫХ ПРОДУКТОВ ГЛИКИРОВАНИЯ", А ТАКЖЕ ИХ КОМПОЗИЦИИ И СПОСОБЫ, В КОТОРЫХ ОНИ ПРИНИМАЮТ УЧАСТИЕ | 2010 |
|
RU2558301C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2011 |
|
RU2774414C2 |









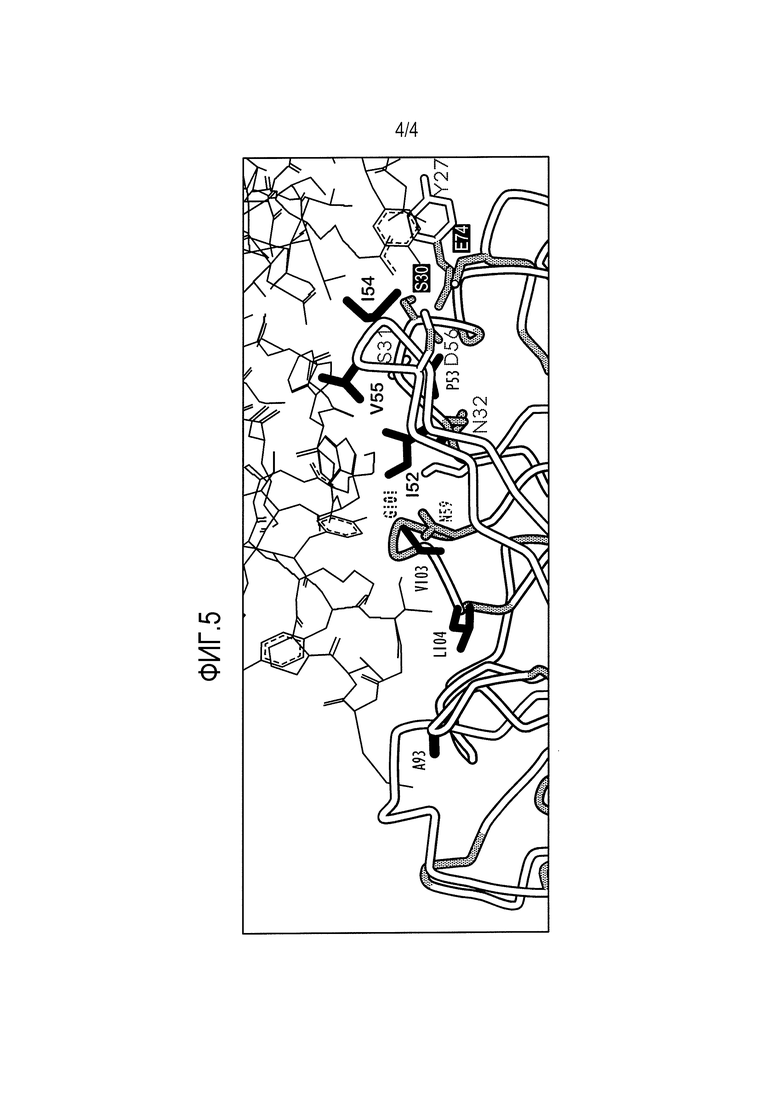
Изобретение относится к области биотехнологии, конкретно к антителам и их антиген-связывающим фрагментам, сконструированным для связывания трансформирующего фактора роста-β (TGFβ1, TGFβ2 и TGFβ3), что может быть использовано в медицине. Получают выделенные антитела, нуклеиновую кислоту, кодирующую указанные антитела, вектор экспрессии, содержащий указанную нуклеиновую кислоту и клетку-хозяина для получения указанного антитела или антиген-связывающего фрагмента, а также фармацевтическую композицию для лечения пациента, нуждающегося в ингибировании одного или более из TGFβ1, TGFβ2 и TGFβ3. Изобретение позволяет получить антитела к TGFβ1, TGFβ2 и TGFβ3 с улучшенной аффинностью, что увеличивает сродство их связывания и, следовательно, повышает эффективность лечения заболеваний, при которых необходимо ингибировать один или более из TGFβ1, TGFβ2 и TGFβ3. 7 н. и 15 з.п. ф-лы, 5 ил., 9 табл., 6 пр.
1. Выделенное антитело человека или его антиген-связывающий фрагмент, которые связываются и нейтрализуют TGFβ1, TGFβ2 и TGFβ3 человека, содержащие
вариабельный домен тяжелой цепи (VH), содержащий SEQ ID NO:1, имеющий замену, выбранную из группы, состоящей из S30A, S30H, S30W, E74A, E74C, E74D, E74F, E74G, E74H, E74L, E74P, E74Q, E74R, E74S, E74T, E74W и E74Y; и
вариабельный домен легкой цепи (VL), содержащий SEQ ID NO:2.
2. Выделенное антитело по п.1, где антитело дополнительно содержит константную область IgG человека.
3. Выделенное антитело по п.2, где константная область IgG представляет собой константную область IgG4 человека.
4. Выделенное антитело по п.3, где антитело дополнительно содержит константную область κ человека.
5. Выделенное антитело по п.4, где константная область IgG4 человека содержит SEQ ID NO:3, и константная область κ человека содержит SEQ ID NO:4.
6. Антиген-связывающий фрагмент по п.1, где антиген-связывающий фрагмент содержит Fab, Fab’, F(ab’)2, scFv или ди-scFv.
7. Выделенная нуклеиновая кислота, кодирующая тяжелую цепь или обе тяжелую и легкую цепь антитела человека или его антиген-связывающего фрагмента, которые связываются и нейтрализуют TGFβ1, TGFβ2 и TGFβ3 человека, содержащие
вариабельный домен тяжелой цепи (VH), содержащий SEQ ID NO:1, имеющий замену, выбранную из группы, состоящей из S30A, S30H, S30W, E74A, E74C, E74D, E74F, E74G, E74H, E74L, E74P, E74Q, E74R, E74S, E74T, E74W и E74Y; и
вариабельный домен легкой цепи (VL), содержащий SEQ ID NO:2.
8. Вектор экспрессии, содержащий выделенную нуклеиновую кислоту по п.7.
9. Клетка-хозяин для получения антитела или антиген-связывающего фрагмента по любому из пп.1-6, содержащая вектор по п.8.
10. Способ получения антитела или его антиген-связывающего фрагмента по любому из пп.1-6, включающий
получение клетки-хозяина, содержащей нуклеотидные последовательности, кодирующие тяжелую цепь и легкую цепь, соответственно, антитела или антиген-связывающего фрагмента;
культивирование клетки-хозяина в условиях, позволяющих экспрессию нуклеиновой кислоты; и
выделение антитела или его антиген-связывающего фрагмента.
11. Способ лечения пациента, нуждающегося в ингибировании одного или более из TGFβ1, TGFβ2 и TGFβ3, включающий введение пациенту антитела или его антиген-связывающего фрагмента по любому из пп.1-6.
12. Способ по п.11, где пациент имеет фиброзное заболевание, злокачественная опухоль или иммунно-опосредованное заболевание.
13. Способ по п.11, где пациент имеет почечную недостаточность.
14. Способ по п.11, где пациент имеет фокальный сегментарный гломерулосклероз.
15. Способ по п.11, где пациент имеет идиопатический легочный фиброз.
16. Способ по п.11, где пациент имеет системный склероз.
17. Фармацевтическая композиция для лечения пациента, нуждающегося в ингибировании одного или более из TGFβ1, TGFβ2 и TGFβ3, содержащая эффективное количество антитело или его антиген-связывающий фрагмент по любому из пп.1-6.
18. Фармацевтическая композиция по п.17, где пациент имеет фиброзное заболевание, злокачественная опухоль или иммунно-опосредованное заболевание.
19. Фармацевтическая композиция по п.17, где пациент имеет почечную недостаточность.
20. Фармацевтическая композиция по п.17, где пациент имеет фокальный сегментарный гломерулосклероз.
21. Фармацевтическая композиция по п.17, где пациент имеет идиопатический легочный фиброз.
22. Фармацевтическая композиция по п.17, где пациент имеет системный склероз.
| US 8383780 B2, 26.02.2013 | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| НОВЫЙ ФАКТОР РОСТА/ДИФФЕРЕНЦИАЦИИ TGF-β-СЕМЕЙСТВА | 1994 |
|
RU2157406C2 |
Авторы
Даты
2019-03-06—Публикация
2014-03-11—Подача