Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к области биохимии и, более конкретно, протеомики. В частности, изобретение относится к способу получения аналитической тест-системы для мультиплексной идентификации и количественного измерения содержания интересующих белков в биологическом образце по содержанию соответствующих им протеотипических маркерных пептидов.
Описание предшествующего уровня техники настоящего изобретения
Основной задачей протеомики - сравнительно молодого направления современных биохимических исследований - является проведение инвентаризации белков, которые экспрессируются в клетке, что подразумевает их максимально точное качественное и количественное определение.
Наиболее современным подходом к преодолению недостаточной специфичности и производительности анализов белков, основанных на применении антител и их аналогов, является использование уникальных возможностей масс-спектрометрической технологии мониторинга множественных (выбранных) реакций (Multiple (Selected) Reaction Monitoring, MRM, SRM). Этот метод заключается в мониторинге фрагментации пептидных ионов в гидролизованной пробе биологического происхождения [Anderson L., Hunter C.L.. Quantitative mass spectrometric multiple reaction monitoring assays for major plasma proteins. Mol Cell Proteomics. 2006; 5(4):573-588]. По методу MRM измерения проводятся на масс-спектрометре с детектором типа тройного квадруполя, обладающем высокими показателями чувствительности и превосходящем конкурентные технологии параметрами по диапазону измеряемых концентраций. Метод MRM основан на регистрации заряженных молекул, образующихся в результате ионизации и фрагментации конкретных пептидных молекул, происходящих из интересующего белка и характеризующих исключительно его. Иными словами, отдельные пептиды служат «прообразом» целого белка после его искусственного гидролиза. Такие пептиды называются протеотипическими. Для целей настоящего изобретения термины «протеотипический», «маркерный» или их сочетание взаимозаменяемы.
В отличие от традиционных иммунохимических методов регистрации белков при использовании этого подхода принципиально отсутствует возможность перекрестных реакций с другими белками, поскольку биоинформационный выбор протеотипического пептида основан, в первую очередь, на уникальности последовательности и масс-спектрометрических параметров теста [Picotti P., Aebersold R. Selected reaction monitoring-based proteomics: workflows, potential, pitfalls and future directions. Nat Methods. 2012; 9(6):555-566].
Из уровня техники известно достаточное количество работ на эту тему, однако наиболее близким к настоящему изобретению аналогичным решением авторам представляется изобретение согласно международной патентной публикации WO 2009/141141, в которой раскрыт способ идентификации и количественного определения белков и пептидов с помощью масс-спектрометрии с использованием технологии мониторинга множественных реакций.
Более конкретно, указанный прототип относится к способу формирования MRM-теста для детекции и/или количественного определения одного или нескольких пептидов и/или белков, предусмативающему следующие стадии:
(1) интересующий белок/пептид, группу интересующих белков/пептидов, субпротеом или целый протеом необязательно расщепляют с последующей необязательной очисткой/разделением/обогащением с получением смеси пептидов, из которой методом масс-спектрометрии по меньшей мере один пептид по существу уникально ассоциируется с интересующим белком или целевым белком из указанной группы интересующих белков или из указанного целого протеома, причем он ассоциируется по дифференциальному количественному поведению в различных экспериментальных условиях;
(2) этот по меньшей мере один пептид синтезируется и/или генерируется по существу без последующей очистки;
(3) этот по меньшей мере один неочищенный пептид анализируется методом необязательно сопряженного с жидкостной хроматографией мониторинга множественных реакций;
(4) разработка, валидация и/или оптимизация соответствующего теста по меньшей мере одного пептида с определением MRM-координат интересующего пептида/белка и/или интересующего регулятора.
Однако указанный прототип характеризуется рядом недостатков.
Так, из текущего уровня техники следует, что использование независимого от данных режима всегда предшествует зависимому от данных (информационно-зависимому, таргетному) режиму регистрации масс-спектров. Это отражено в большом количестве публикаций, где перед разработкой MRM-теста предлагается проводить анализ баз данных масс-спектров, полученных в независимом от данных режиме [Picotti P, Aebersold R. Selected reaction monitoring-based proteomics: workflows, potential, pitfalls and future directions. Nat Methods. 2012; 9(6):555-566; Gallien S, Duriez E, Demeure K, Domon B. Selectivity of LC-MS/MS analysis: implication for proteomics experiments. J Proteomics. 2013; 81:148-158]. Согласно международной патентной публикации WO 2009/141141 также предусматривается стадия масс-спектрометрического анализа биологического материала, предшествующая стадии разработки MRM-теста. В примере, приведенном в патенте, а также в варианте применения изобретения, изложенном авторами патента в публикации [Picotti P, Rinner O, Stallmach R, Dautel F, Farrah T, Domon B, Wenschuh H, Aebersold R. High-throughput generation of selected reaction-monitoring assays for proteins and proteomes. Nat Methods. 2010 Jan; 7(1):43-6], указывается, что в качестве первичного масс-спектрометрического анализа используется независимая от данных МС/МС фрагментация пептида, тогда как последующая разработка теста выполняется с использованием информационно-зависимого мониторинга ионов.
Как уже было сказано, основной задачей протеомики является точное качественное и количественное определение экспрессируемых в клетке белков, и естественно, что чем выше будет чувствительность метода определения, тем более достоверные и ценные результаты могут быть получены исследователем. Таким образом, в уровне техники сохраняется потребность в способе идентификации и количественного определения белков и пептидов с помощью масс-спектрометрии, который характеризовался бы большей чувствительностью.
Кроме того, осуществление способа согласно международной патентной публикации WO 2009/141141 весьма затратно по времени и другим ресурсам, и в уровне техники сохраняется потребность в более быстром и дешевом способе идентификации и количественного определения белков и пептидов с помощью масс-спектрометрии.
Раскрытие настоящего изобретения
Принципиальным отличием настоящего изобретения является то, что уже на предварительном этапе также применяется информационно-зависимый мониторинг ионов на детекторе типа тройной квадруполь. Полученные результаты позволяют говорить о том, что «таргетное», прицельное определение содержание пептидов на всех стадиях существенно повышает чувствительность метода. Следовательно, настоящее изобретение обеспечивает повышение чувствительности по отношению к общепринятым методам за счет использования информационно-зависимого режима на первом этапе формирования MRM-теста.
Сокращение временных затрат на получение результата также достигается за счет того, что все измерения выполняются в информационно-зависимом режиме. Поскольку современные приборы ограничены в количестве измеряемых переходов в определенный промежуток времени (до 100-150), то использование информационно-зависимого режима обеспечивает оптимальную по времени загрузку прибора. Сначала, прибор производит измерения всех переходов, относящихся к одному или нескольким пептидам. То есть для каждого пептида измеряются 15-20 переходов, что позволяет в силу технических ограничений получить данные не более чем для 5-10 пептидов за 5-20 минут. Далее, из результатов измерений отбирают наиболее интенсивные переходы (по 3-5 на пептид) и объединяются в один измерительный протокол, который при ограничении, например, 100 переходов может теперь теоретически насчитывать до 100/5=20, а в реальных условиях до 40-50 пептидов. Измерения для этого количества пептидов проводят в увеличенном градиенте 20-40 минут, что позволяет определить значения времени выхода с хроматографической колонки, реально соотносящиеся со значениями в сложном биообразце. Таким образом, согласно настоящему изобретению раскрыто формирование и использование MRM-теста, в ходе осуществления которого между операциями производится перенастройка прибора с изменением количества измеряемых переходов, осуществляемым одновременно с увеличением количества соответствующих этим переходам пептидов.
В соответствии с настоящим изобретением разработан способ, преодолевающий недостатки прототипа за счет проведения измерений в информационно-зависимом режиме на всех стадиях способа, предусматривающих использование масс-спектрометрии.
Итак, авторы настоящего изобретения разработали усовершенствованный, более эффективный способ получения аналитической тест-системы для мультиплексной идентификации и количественного измерения содержания интересующих белков в биологическом образце по содержанию соответствующих им протеотипических маркерных пептидов. Такой способ предусматривает выполнение ряда стадий:
1) биоинформационное выявление уникальных для белка протеотипических маркерных пептидных последовательностей;
2) отбор по меньшей мере двух маркерных протеотипических пептидных последовательностей белка, наиболее пригодных для исследования методом мониторинга множественных реакций;
3) предсказание фрагментов пептидов;
4) предсказание MRM-теста в виде перечня маркерных пептидов, их фрагментов и наилучших параметров детекции методом мониторинга множественных реакций;
5) синтез одного или нескольких маркерных пептидов;
6) определение профиля переходов одного или нескольких синтетических маркерных пептидов методом мониторинга множественных реакций в условиях ускоренного хроматографического градиента;
7) оптимизация MRM-теста в соответствии с полученными профилями, удаление из набора пептидных фрагментов, характеризующихся наименьшими значениями интенсивности в масс-спектре;
8) очистка пептидов, синтезированных на стадии 5);
9) подготовка биологического образца, предусматривающая удаление мажорных белков;
10) идентификация белка в биологическом образце с вводом синтетических пептидов методом мониторинга множественных реакций в условиях нормального хроматографического градиента на основании профилей, полученных на стадии 6);
11) определение значений времени удержания маркерных пептидов с внесением установленных значений в MRM-тесты;
12) проведение мультиплексных калибровочных измерений в условиях нормального хроматографического градиента в буферном растворе очищенных синтетических пептидов на фоне смеси не имеющих отношения к ним белков и/или пептидов; и
13) количественное измерение содержания маркерных пептидов в биологическом образце в условиях нормального хроматографического градиента с вводом синтетических пептидов;
14) суждение о содержании интересующих белков в биологическом образце по содержанию соответствующих им протеотипических маркерных пептидов, количественно определенных на стадии 13).
Таким образом, вклад авторов настоящего изобретения в уровень техники определяется, прежде всего, тем, что ими создан способ, предусматривающий проведение измерений в информационно-зависимом режиме на всех стадиях способа, предусматривающих использование масс-спектрометрии, и за счет этого обеспечивающий повышение чувствительности и снижение временных завтрат на осуществление определения протеотипических пептидов и, соответственно, целевых интересующих белков, содержание которых в исходном биологическом образце и определяет содержание содержание протеотипических пептидов.
Примеры осуществления способа согласно настоящему изобретению приведены ниже.
Краткое описание фигур
На фиг.1 проиллюстрирован отбор протеотипических пептидов и их фрагментов для белков O60543 и O95427 при помощи программного обеспечения Skyline.
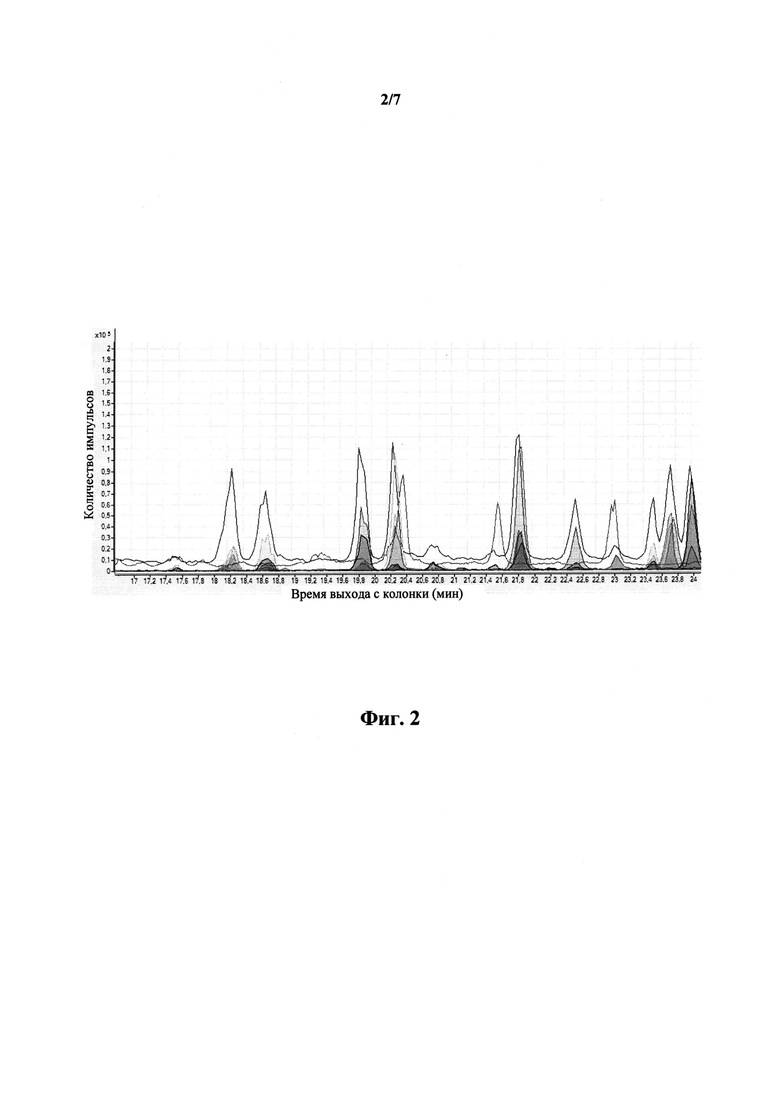
На фиг.2 приведена хроматограмма целевых пептидов, полученная в изократическом режиме.
На фиг.3 приведен фрагмент таблицы интенсивностей пиков фрагментов пептидов. Затемнением выделены фрагменты, дающие наиболее интенсивный сигнал.
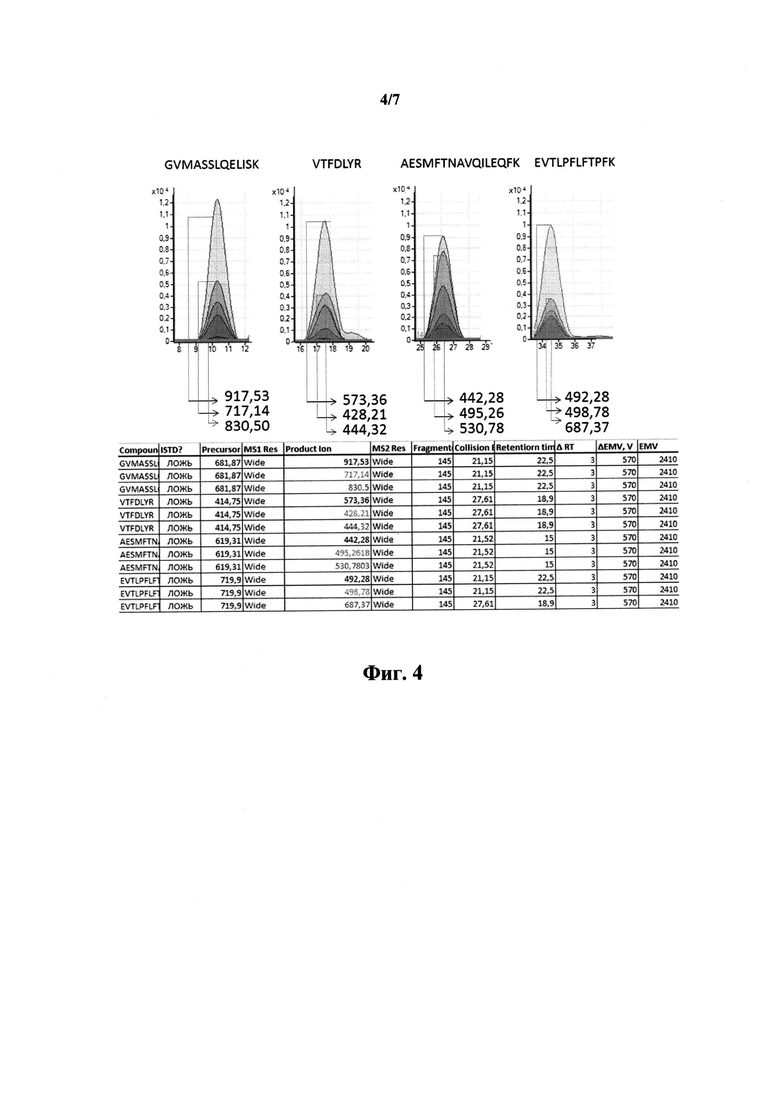
На фиг.4 проиллюстрирован отбор наиболее интенсивных переходов целевых пептидов для создания мультиплексного метода. На графиках по оси абсцисс отложено время выхода с колонки в минутах, а по оси ординат - количество импульсов.
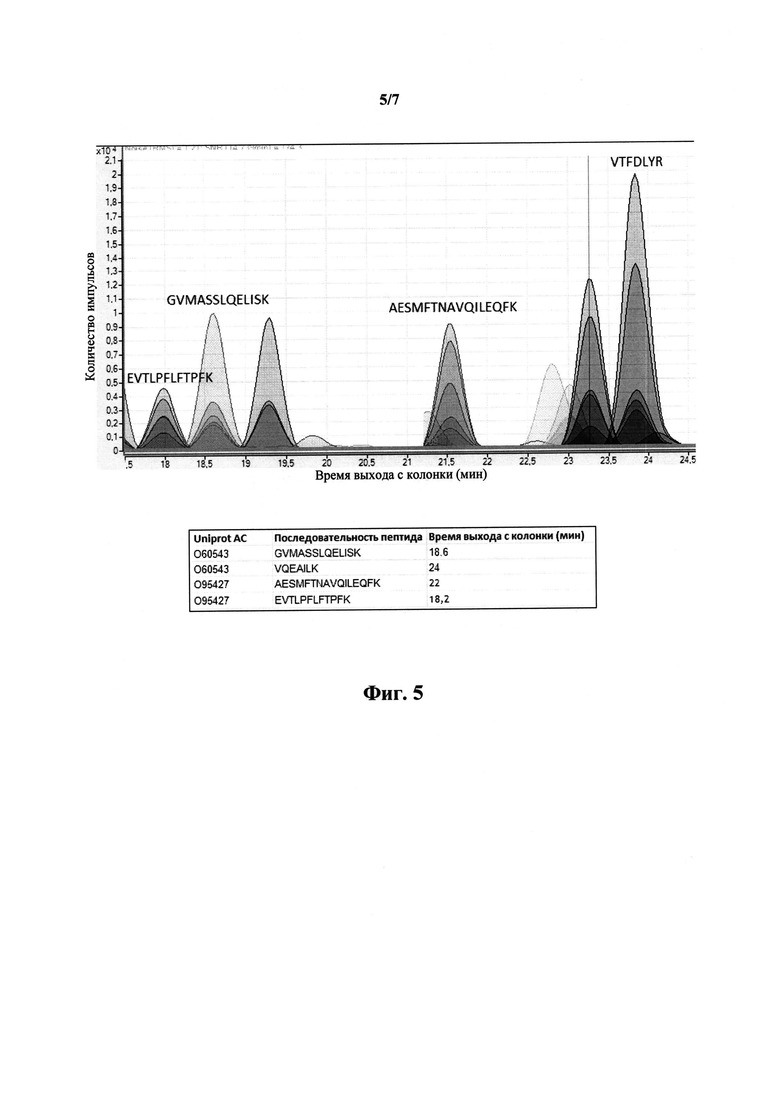
На фиг.5 приведена хроматограмма целевых пептидов, полученная в режиме градиентого элюирования для установления времени удержания.
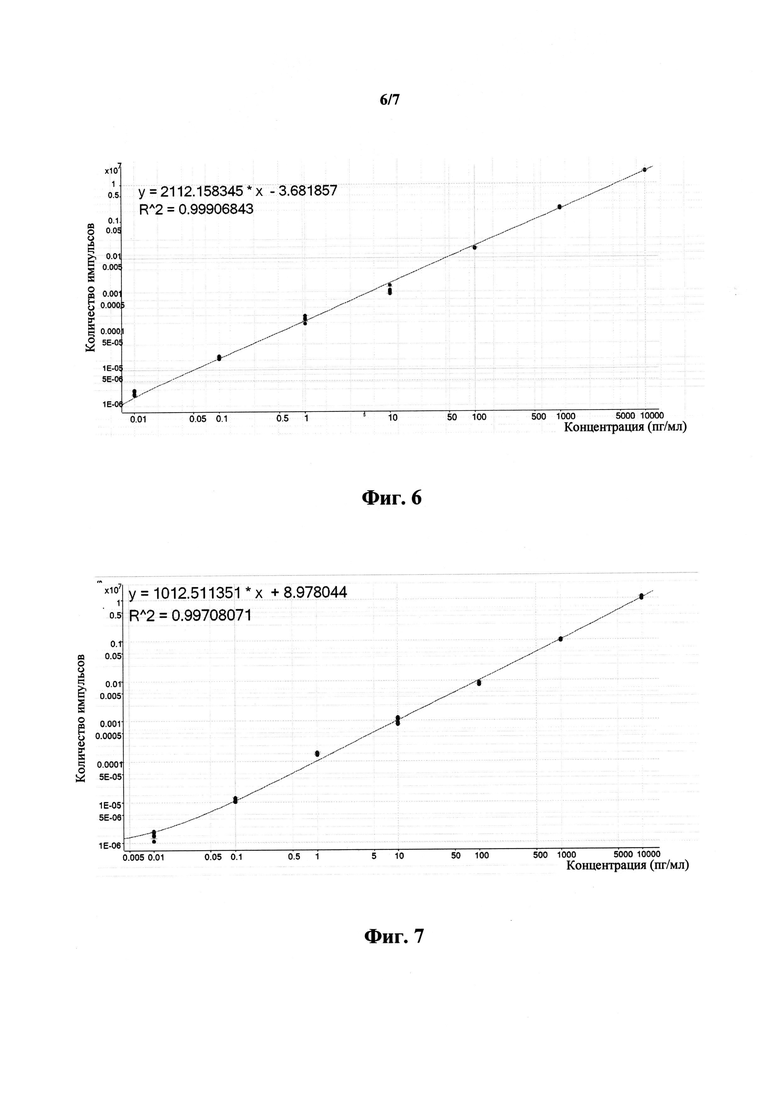
На фиг.6 приведена калибровочная кривая пептида GVMASSLQELISK.
На фиг.7 приведена калибровочная кривая пептида VTFDLYR.
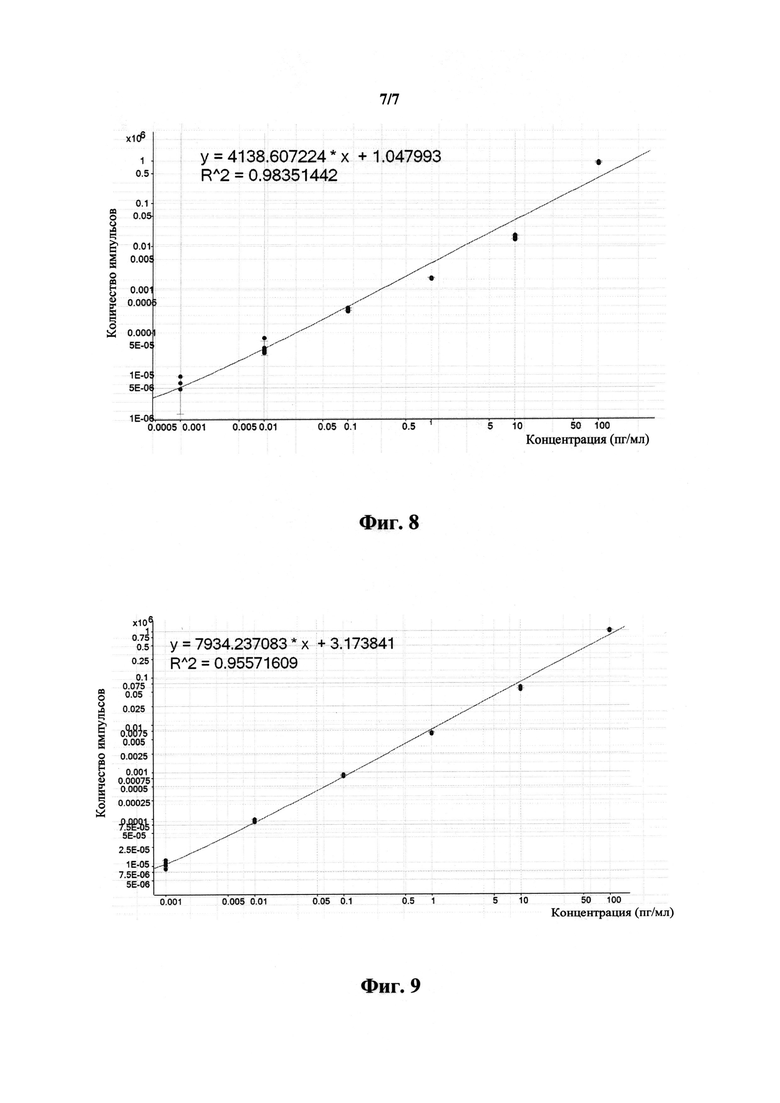
На фиг.8 приведена калибровочная кривая пептида AESMFTNAVQILEQFK.
На фиг.9 приведена калибровочная кривая пептида EVTLPFLFTPFK.
Примеры реализации настоящего изобретения
Пример 1. Предсказание аминокислотной последовательности протеотипических пептидов
Предсказание производили с помощью свободного программного обеспечения Skyline на основе аминокислотных последовательностей белков O60543 и O95427 из базы данных Uniprot. Отбор двух протеотипических пептидов производили с учетом физико-химических свойств. Для белка O60543 отбирали пептиды GVMASSLQELISK и VTFDLYR, для белка O95427 - AESMFTNAVQILEQFK и EVTLPFLFTPFK. Для каждого пептида составляли список из 6-10 b- и y-ионов с зарядными состояниями +1, +2 и +3, формируемых при распаде прекурсорного пептидного иона. Отбор протеотипических пептидов и их фрагментов проиллюстрирован на фиг.1.
Пример 2. Синтез протеотипических пептидов
Пептиды получали в соответствии с протоколом твердофазного пептидного синтеза на автоматическом пептидном синтезаторе Overture (Protein Technologies, Inc.) с использованием защищенных 9-флуоренилметилоксикарбонилом (Fmoc) по α-аминогруппам производных аминокислот. В качестве твердой фазы использовали смолы с низкой загрузкой (0,35 ммоль/г активных групп) производства Novabiochem с присоединенной первой аминокислотой лизин Fmoc-Lys(Boc)-Wangresin LL или аргинин Fmoc-Arg(Pbf)-Wangresin LL. Для синтеза использовали следующие (α-N-Fmoc-L-) аминокислоты (Novabiochem):
1) аланин (Fmoc-Ala-OH);
2) метионин (Fmoc-Met-OH);
3) аспарагин (Fmoc-Asn(Trt)-OH);
4) фенилаланин (Fmoc-Phe-OH);
5) аспарагиновая кислота (Fmoc-Asp(OtBu)-OH);
6) пролин (Fmoc-Pro-OH);
7) глутамин (Fmoc-Gln(Trt)-OH);
8) серин (Fmoc-Ser(tBu)-OH);
9) глутаминовая кислота (Fmoc-Glu(OtBu)-OH);
10) треонин (Fmoc-Thr(tBu)-OH);
11) глицин (Fmoc-L-Gly-OH)
12) тирозин (Fmoc-Tyr(tBu)-OH);
13) изолейцин (Fmoc-Ile-OH);
14) лейцин (Fmoc-Leu-OH);
15) валин (Fmoc-Val-OH).
Аминокислоты были выбраны со следующими защитными группами боковых функциональных групп с учетом их конечного деблокирования трифторуксусной кислотой: аспарагиновая кислота (D), глутаминовая кислота (E) - трет-бутокси (OtBu'); глутамин (Q), аспарагин (N); аргинин (R) - 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил (Pbf); серин (S), треонин (Т) и тирозин (Y) - трет-бутил (tBu). Для конденсации Fmoc-аминокислот использовали диизопропилкарбодиимид (DIC) в присутствии 1-гидроксибензотриазола (HOBt) и гексафторфосфат (1-циано-2-этокси-2-оксоэтилдезаминоокси)диэтиламиноморфолинокарбения (COMU) в присутствии 2,4,6-триметилпиридина (ТМР). В качестве растворителя в пептидном синтезе использовали N,N-диметилформамид (ос.ч) (DMF) производства «Спектр-хим», Россия.
Пример 3. Определение профиля переходов синтетических маркерных пептидов методом MRM в условиях ускоренного хроматографического градиента
В ходе одного анализа исследовали четыре пептида, разнесенных по экспериментальным аналитическим сегментам времени, где в каждом сегменте анализировали один пептид за короткий интервал времени (не более 180 секунд). Анализ проводили с помощью тройного квадрупольного масс-спектрометра Agilent 6490 TripleQuadrupole LC/MS system в изократическом режиме, позволяющем использовать только одноканальный насос, автоматический инжектор пробы и колонку. Длительность сегмента зависела от задаваемых параметров, таких как скорость забора пробы, скорость инъекции пробы, длительность промывки иглы, мертвый объем капиллярной системы, объем седла, скорость потока изократического насоса. В ходе анализа регистрировали значения интенсивности сигнала, полученного от прибора при регистрации каждого фрагмента. Полученная хроматограмма приведена на фиг.2.
Пример 4. Отбор пептидных фрагментов с оптимальными значениями интенсивности
На основе полученных данных для каждого пептида отбирали по 3-5 фрагментов с наибольшей интенсивностью и составляли один мультиплексный измерительный тест для программирования работы масс-спектрометра типа тройного квадруполя. Отбор проиллюстрирован на фиг.3 и 4.
Пример 5. Определение значений времени удержания маркерных пептидов
Проводили сочетанный анализ всех пептидов в течение одного анализа. Анализ проводили с помощью тройного квадрупольного масс-спектрометра Agilent 6490 TripleQuadrupole LC/MS system, настроенного на регистрацию 3-5 фрагментов для каждого пептида, в режиме градиентного элюирования (в течение 47 минут). Для каждого пептида устанавливали время удержания. Определение значений времени удержания проиллюстрировано на фиг.5.
Пример 6. Проведение мультиплексных калибровочных измерений
Создавали измерительный способ для детектирования и/или количественного измерения четырех указанных пептидов с использованием профиля переходов, полученного на стадии 6), и времени выхода с колонки, установленного на стадии 11). Проведение мультиплексных калибровочных измерений проиллюстрировано на фиг.6.
Пример 7. Измерение концентрации 4 исследуемых пептидов и расчет концентрации содержащих их белков в образце плазмы крови человека и в образце клеток стандартной линии HepG2
Измерительный способ для четырех указанных пептидов применяли для измерения их концентрации в биообразцах плазмы крови и иммортализованных клеток стандартной линии гепатоцеллюлярной карциномы HepG2.
Кровь человека собирали в вакуумированные пробирки с ЭДТА. Для получения плазмы пробирки центрифугировали в течение 15 мин при 2500 g. Образцы плазмы центрифугировали при 10000 g в течение 10 минут. Надосадочную жидкость фильтровали через 0,22 мкм ацетатные фильтры (Whatman, США) и хранили при -80°C. Концентрацию общего белка определяли с использованием анализа белка с применением бицинхоновой кислоты Micro BCA (Thermo Scientific, США). Из полученных образцов плазмы удаляли преобладающие 14 белков с использованием колонок MARS (мультиаффинной системы удаления) Hu-14 columns (10×100 мм) (Agilent, США) по протоколу производителя. Собранные фракции, содержащие не связанные с колонкой белки, обессоливали с использованием центрифужных колонок из ацетата целлюлозы 5K MWCO (Agilent, США) и концентрировали до конечного объема 50 мкл (из исходного объема 0,5 мкл плазмы). Концентрацию белка в конечной аликвоте измеряли с использованием анализа белка Micro ВСА, и она составляла 24,9 г/л. Клеточную культуру HepG2 выращивали на среде Игла, модифицированной по Дульбекко, дополненной 10% фетальной бычьей сывороткой и гентамицином в концентрации 30 мкг/мл и пенициллином в концентрации 25 мкг/мл (Invitrogen, США). Клеточный осадок, отделенный центрифугированием при 300 g в течение 5 минут, замораживали в жидком азоте и хранили при -80°C. Клетки промывали в фосфатно-солевом буфере (PBS) при pH 7,4 три раза и лизировали в буфере, содержащем 10 мМ PBS, 5 мМ ЭДТА, 10 мкМ E-64, 50 мМ PMSF, 2% SDS и 1% NP-40. Лизаты обрабатывали ультразвуком с использованием устройства типа Branson и затем осветляли центрифугированием при 10000 g в течение 20 мин при 4°C. Концентрация общей белковой фракции составляла 15,7 г/л.
Далее осуществляли восстановление и алкилирование SH-групп белков, и исчерпывающее расщепление белков модифицированным свиным трипсином (Promega, США), как описано ранее [Zgoda VG, Moshkovskii SA, Ponomarenko EA, Andreewski TV, Kopylov AT, Tikhonova OV, Melnik SA, Lisitsa AV, Archakov AI. Proteomics of mouse liver microsomes: performance of different protein separation workflows for LC-MS/MS. Proteomics. 2009; 9(16):4102-4105]. Гидролизаты анализировали на масс-спектрометре типа тройного квадруполя с использованием настроек, используемых в примерах выше.
Для иллюстрации изобретения были использованы по 2 пептида из белков активатора клеточной гибели CIDE-A (инвентарный номер Uniprot O60543) и GPI-этаноламинфосфаттрансферазы-1 (инвентарный номер Uniprot O95427). В настоящей области техники общепринято, что белок в исходном образце и полученные в результате его расщепления пептиды в гидролизате находятся в эквимолярных концентрациях. Следовательно, для определения концентрации белка следует усреднить измеренные концентрации относящихся к нему пептидов. Таким образом, расчетная концентрация активатора клеточной гибели CIDE-A (Uniprot O60543) по таблице 1 составляет в плазме крови 3,6×10-12 моль/л, а в клетках линии HepG2 - 3,6×10-8 моль/л. Для GPI-этаноламинфосфаттрансферазы-1 эти концентрации составляют 5,6×10-12 и 2,8×10-9 моль/л, соответственно.
Несмотря на то что настоящее изобретение проиллюстрировано конкретными примерами его реализации, среднему специалисту в данном уровне техники будет очевидно, что множество признаков раскрытого способа (носители, колонки, системы растворителей, режимы элюции и детекции и т.д.) могут быть изменены, модифицированы, заменены на эквивалентные без выхода за пределы объема настоящего изобретения. Подразумевается, что все подобные изменения, модификации и замены подпадают под объем настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫЯВЛЕНИЯ САХАРНОГО ДИАБЕТА ПЕРВОГО ТИПА | 2020 |
|
RU2752372C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ДИАБЕТИЧЕСКОЙ ФЕТОПАТИИ ПЛОДА | 2020 |
|
RU2742801C1 |
| ПРОТЕОТИПИЧЕСКИЙ ПЕПТИД Q9Y4W6-02 И СПОСОБ МАСС-СПЕКТРОМЕТРИЧЕСКОГО АНАЛИЗА СОДЕРЖАНИЯ AFG3-ПОДОБНОГО БЕЛКА ЧЕЛОВЕКА НА ЕГО ОСНОВЕ | 2012 |
|
RU2673551C2 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ТИПА САХАРНОГО ДИАБЕТА | 2021 |
|
RU2788106C1 |
| Способ оценки риска развития болезни Альцгеймера с использованием панели белков крови | 2021 |
|
RU2794040C1 |
| Способ детектирования вируса SARS-CoV-2 методом масс-спектрометрии | 2021 |
|
RU2748540C1 |
| МУЛЬТИПЛЕКСНЫЙ АНАЛИЗ СТОПОЧНОГО ТРАНСГЕННОГО БЕЛКА | 2010 |
|
RU2561458C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ХАРАКТЕРИСТИК ПО МЕНЬШЕЙ МЕРЕ ОДНОГО МИКРООРГАНИЗМА С ПОМОЩЬЮ МАСС-СПЕКТРОМЕТРИИ | 2010 |
|
RU2604199C2 |
| СПОСОБ ОЦЕНКИ БИОАКТИВНОСТИ ХИМИЧЕСКИХ СОЕДИНЕНИЙ | 2013 |
|
RU2556823C2 |
| БИОМАРКЕРЫ, АССОЦИИРОВАННЫЕ С ПРЕДИАБЕТОМ, ДИАБЕТОМ И СВЯЗАННЫМИ С ДИАБЕТОМ СОСТОЯНИЯМИ | 2011 |
|
RU2596486C2 |


Изобретение относится к области биохимии и касается способа получения аналитической тест-системы (MRM-теста) для мультиплексной идентификации и количественного измерения содержания интересующих белков в биологическом образце по содержанию соответствующих им протеотипических маркерных пептидов, включающего выявление уникальных для белка протеотипических маркерных пептидных последовательностей; отбор по меньшей мере двух маркерных протеотипических пептидных последовательностей белка; предсказание фрагментов пептидов; предсказание MRM-теста в виде перечня маркерных пептидов, их фрагментов и наилучших параметров детекции; синтез маркерных пептидов; определение профиля переходов синтетических маркерных пептидов; оптимизацию MRM-теста в соответствии с полученными профилями; очистку пептидов; подготовку биологического образца; идентификацию белка в биологическом образце с заколом синтетических пептидов; определение значений времени удержания маркерных пептидов с внесением установленных значений в MRM-тесты; проведение мультиплексных калибровочных измерений; количественное измерение содержания маркерных пептидов в биологическом образце; и суждение о содержании интересующих белков в биологическом образце. Изобретение обеспечивает повышение чувствительности и снижение временных затрат на осуществление определения протеотипических пептидов и, соответственно, целевых интересующих белков. 3 з.п. ф-лы, 9 ил., 1 табл., 7 пр.
1. Способ получения аналитической тест-системы (MRM-теста) для мультиплексной идентификации и количественного измерения содержания интересующих белков в биологическом образце по содержанию соответствующих им протеотипических маркерных пептидов, предусматривающий следующие стадии:
1) выявление уникальных для белка протеотипических маркерных пептидных последовательностей;
2) отбор по меньшей мере двух маркерных протеотипических пептидных последовательностей белка, наиболее пригодных для исследования методом мониторинга множественных реакций;
3) предсказание фрагментов пептидов;
4) предсказание MRM-теста в виде перечня маркерных пептидов, их фрагментов и наилучших параметров детекции методом мониторинга множественных реакций;
5) синтез одного или нескольких маркерных пептидов;
6) определение профиля переходов одного и нескольких синтетических маркерных пептидов методом мониторинга множественных реакций в условиях ускоренного хроматографического градиента;
7) оптимизация MRM-теста в соответствии с полученными профилями, удаление из набора пептидных фрагментов, характеризующихся наименьшими значениями интенсивности в масс-спектре;
8) очистка пептидов, синтезированных на стадии 5);
9) подготовка биологического образца, предусматривающая удаление мажорных белков;
10) идентификация белка в биологическом образце с заколом синтетических пептидов методом мониторинга множественных реакций в условиях нормального хроматографического градиента на основании профилей, полученных на стадии 6);
11) определение значений времени удержания маркерных пептидов с внесением установленных значений в MRM-тесты;
12) проведение мультиплексных калибровочных измерений в условиях нормального хроматографического градиента в буферном растворе очищенных синтетических пептидов на фоне смеси не имеющих к ним отношения белков и/или пептидов;
13) количественное измерение содержания маркерных пептидов в биологическом образце в условиях нормального хроматографического градиента с вводом синтетических пептидов; и
14) суждение о содержании интересующих белков в биологическом образце по содержанию соответствующих им протеотипических маркерных пептидов, количественно определенных на стадии 13).
2. Способ по п. 1, в котором выявление уникальных для белка протеотипических маркерных пептидных последовательностей и отбор маркерных протеотипических пептидных последовательностей белка, наиболее пригодных для исследования методом мониторинга множественных реакций, производятся с использованием литературных данных, данных репозиториев и/или программного обеспечения.
3. Способ по п. 1, в котором предсказание фрагментов пептидов и создание MRM-тестов в виде перечней маркерных пептидов, их фрагментов и наилучших параметров детекции методом мониторинга множественных реакций производятся с помощью программного обеспечения.
4. Способ по п. 1, в котором проведение мультиплексных калибровочных измерений в условиях нормального хроматографического градиента в буферном растворе очищенных синтетических пептидов производится на фоне матрицы Е. coli или любой другой матрицы.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| KUZYK MA., et al., Multiple reaction monitoring-based, multiplexed, absolute quantitation of 45 proteins in human plasma | |||
| Mol Cell Proteomics | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| PERCY AJ., et al., Comparison of standard- and nano-flow liquid | |||
Авторы
Даты
2016-08-27—Публикация
2013-07-26—Подача