Изобретение относится к области медицины, а именно к клинической диагностике, к способу раннего выявления риска возникновения болезни Альцгеймера по характерному протеомному профилю плазмы крови. Изобретение создано в рамках выполнения работ по мегагранту Министерства науки и высшего образования Российской Федерации, Соглашение #075-10-2019-083 от 11.12.2019.
Болезнь Альцгеймера (БА) является наиболее распространенной социально-значимой нейро-дегенеративной патологией, касающейся ~35 миллионов пожилых людей по всему миру; прогнозируется, что к 2050 году число пациентов может превысить 115 миллионов [1]. Поскольку используемые на сегодняшний день методы терапии БА являются малоэффективными в отношении диагностированного заболевания, создание достоверных методов ранней диагностики является одной из глобальных задач, решение которой будет способствовать своевременному выявлению повышенного риска развития БА, до наступления необратимых когнитивных изменений.
В настоящее время к методам клинической диагностики БА относятся исследования мозга методами магнитно-резонансной томографии (МРТ) и позитронно-эмиссионной томографии (ПЭТ), а также анализ содержания β-амилоидных пептидов (Аβ) и tau/P-tau белков в цереброспинальной жидкости (ЦЖ) [2-5]. Несмотря на то, что комплексный анализ этими методами в действительности может выявить риск возникновения БА в течение нескольких последующих лет [6,7], высокая стоимость этих исследований, как и их низкая доступность, а также высокая инвазивность исследований ЦЖ, существенно ограничивают применение перечисленных методов для первичного широкомасштабного скрининга [8]. Таким образом, есть большая необходимость в создании методов, более доступных для широкого применения.
Плазма крови является более традиционным объектом клинических исследований с минимально инвазивным способом получения, в сравнении с ЦЖ. Кровь гораздо более доступный и удобный объект для широкомасштабного скрининга и, поэтому, представляет особый интерес в качестве объекта для поиска новых биомаркеров БА. В настоящее время изменение уровней Aβ1-42 и Aβ1-40 пептидов является единственным общепринятым белковым маркером плазмы, имеющим хорошие диагностические показатели [8,9]. Применение прогрессивных высокочувствительных подходов позволяет сегодня также анализировать в плазме и другие маркеры БА, характерные для ЦЖ, tau/p-tau белки и легкий нейрофиламент (NfL) [10]. Однако текущие исследования белковых маркеров БА в плазме далеко не ограничиваются перечисленными компонентами патологических процессов при БА, и все больше внимания уделяется исследованиям характерных изменений протеома плазмы. На сегодняшний день, число потенциальных белковых маркеров плазмы, предложенных хотя бы в одном исследовании, уже превышает 400, а ~70 из них были выявлены при исследовании как минимум двух независимых когорт [11,12]. Лишь для 23-х белков было показано ассоциированное с БА изменение уровня как минимум на 3-х когортах: альфа-2-макроглобулин, аполипопротеины Е, А-I и A-IV, комплемент С3, альфа-1-антитрипсин, факторы комплемента Н и В, панкреатический прогормон, С1 ингибитор протеаз плазмы, Р-компонент сывороточного амилоида, альфа и гамма цепи фибриногена, сывороточный альбумин, витронектин, интерлейкины 3 и 10, комплемент C4-A, афамин, фибронектин, инсулино-подобный связывающий фактор роста протеин 2, воспалительный белок макрофагов-1-альфа и бета-2-гликопротеин 1 [11,12].
Особенно важным аспектом является прогнозирование развития БА у пациентов с синдромом мягкого когнитивного снижения (МКС), как и очень раннее выявление прогностических маркеров у когнитивно-здоровых индивидуумов. Несколько классификаторов и дифференцирующих панелей были созданы с использованием иммунологических подходов, включая иммуно-ферментные анализы (ИФА, ELISA) [13], мульти-панельные иммуноанализы [14], белковые микромассивы [15], анализы на иммуно-частицах [16], как и наиболее передовых подходов для мультиплексного анализа тысяч белков, протеомной технологии на основе аптамеров SomaScan™ [17,18] и технологии Olink™, использующей антитела, конъюгированные с олигонуклеотидами для сопряженного анализа ПЦР [19,20]. Масс-спектрометрические (МС) исследования, тем не менее, остаются более объективными, чем самые передовые иммуно-технологии. Высокоэффективная жидкостная хроматография, сопряженная с тандемной МС (ВЭЖХ-МС/МС) может использоваться для относительного и абсолютного количественного определения белков в комбинации с различными технологиями мечения и мультиплексирования образцов. Например, подходы с использованием изобарных меток (iTRAQ), либо тандемных меток (ТМТ), широко используются для нецелевого поиска потенциальных маркеров, в том числе БА, так как позволяют проводить мультиплексный анализ десятка проб одновременно и при этом идентифицировать тысячи белков в каждой пробе [21-27]. В целом же, несмотря на использование самых передовых и высокочувствительных технологий на базе ИФА и МС, как и на определенные успехи в создании нескольких маркерных панелей с хорошими диагностическими характеристиками [15,17,28-32], результаты разных исследований очень сильно варьируют, даже при использовании схожих аналитических подходов. В частности, процедура удаления мажорных белков (деплеция), часто используемая в пробоподготовке при МС анализе с изобарными и тандемными метками, может вносить неопределенные коррективы в конечный результат. Помимо того, что из рассмотрения удаляются такие потенциальные маркеры как фибриноген и альбумин, не представляется возможным контролировать по крайней мере частичное со-удаление каких-либо минорных белков, состав которых тоже может варьировать при разных методах деплеции [21-23,25-27].
В то же время, объем накопленных на сегодняшний день данных представляется вполне достаточным для их дальнейшего целенаправленного использования в мультиплексном целевом (таргетном) количественном МС анализе, который может способствовать созданию согласованной маркерной панели белков плазмы, которую можно было бы валидировать на разных когортах. В частности, МС подходы на основе мониторинга множественных/параллельных реакций (MRM/PRM) с использованием внутренних стандартов, меченных стабильными изотопами (SIS), позволяют быстро разрабатывать количественные анализы с наиболее высокой специфичностью, точностью и надежностью [33,34]. К преимуществам таргетных подходов также относятся быстрота получения результатов, хорошая воспроизводимость данных, быстрая пробоподготовка, ввиду отсутствия необходимости деплеции мажорных белков, и как результат - возможность широкомасштабного анализа большого количества клинических образцов с использованием масс-спектрометра типа тройной квадруполь, как наиболее распространенного МС прибора в клинических лабораториях.
На сегодняшний день среди множества работ по теме поиска ассоциированных с БА белковых маркеров плазмы крайне мало работ с применением таргетных МС подходов. Например, одна из работ посвящена единственному, но важному при БА белку, аполипопротеину Е, тагетный МС анализ которого показал существенное снижение его уровня в плазме при БА [35]. В статье Dey K.K. и др. 2019 года [24] в рамках поиска белковых биомаркеров БА был проведен ультра-глубокий сравнительный анализ 11-ти образцов сыворотки крови (6 - БА, 5 - контрольные) без дополнительной деплеции белков. Сначала из 4826 белковых компонентов были выявлены 30 потенциальных маркеров БА (у 26 уровень экспрессии снижался, у 4 - повышался). Затем для валидации изменения уровня двух из этих белков был применен таргетный подход в комбинации с изобарными метками. Тем не менее, несмотря на применение современных чувствительных технологий, результаты этой работы ставят ряд вопросов, указывающих на сомнительность возможности их успешного использования в дальнейшем. Во-первых, сыворотка крови как объект исследования представляется менее удачным, чем плазма, поскольку в процессе свертывания крови теряется фибриноген (один из потенциальных маркеров БА) и могут теряться другие белки, ассоциированные с формированием фибрина. Во-вторых, общее количество проанализированных образцов (всего 11) - очень небольшое, и оно продиктовано использованной 11-плексной платформой ТМТ. В-третьих, ни один из выявленных 30-ти белков не проявлялся как потенциальный маркер БА ни в одном из других исследований. Наконец, в-четвертых, количественный таргетный анализ был проведен только в отношении 2-х белков-кандидатов в маркеры БА, выявленных в этом исследовании и, следовательно, не сопоставимых с результатами других работ.
Таким образом, несмотря на публикацию большого количества работ по созданию маркерных панелей белков плазмы для дифференциации БА, есть существенные проблемы с согласованностью результатов. Кроме того, до сих пор никто не проводил исследований с применением мультиплексных таргетных МС подходов для абсолютного количественного анализа перечисленных выше 23-х наиболее вероятных маркеров БА для их валидации, а также создания дифференцирующих белковых панелей для раннего прогнозирования БА.
Раскрытие изобретения
Задачей, решаемой изобретением, является разработка способа оценки риска развития болезни Альцгеймера, основанного на мультиплексном целевом (таргетном) количественном хромато-масс-спектрометрическом анализе панели белков плазмы крови.
Поставленная задача решается при осуществлении способа оценки риска развития болезни Альцгеймера с использованием панели двадцати двух белков, включающего следующие этапы:
(а) забор и пробоподготовка биологического образца пациента для получения смеси белков и дальнейшего хромато-масс-спектрометрического анализа;
(б) хромато-масс-спектрометрический анализ полученной на стадии (а) смеси белков с целью количественного анализа белков в биологическом образце на основе мониторинга множественны или выбранных, или параллельных реакций (MRM/SRM/PRM) с использованием внутренних пептидных стандартов;
(в) расчет вероятности отнесения пациента к группе пациентов с риском развития болезни Альцгеймера, с использованием обученного классификатора на основе панели из двадцати двух белков в биологическом образце, где двадцать два белка представляют собой афамин, тромбоспондин-1, биотинидазу, аполипопротеин Е, сывороточную параоксоназу/арилэстеразу 1, комплемент C1q субкомпонент субъединицы B, альфа-2-антиплазмин, витронектин, аполипопротеин А-IV, фибронектин, белок зоны беременности, антимикробный пептид кателицидина, тенасцин, бета-цепь фибриногена, гамма-цепь фибриногена, аполипопротеин(а), ингибитор активатора плазминогена 1, аполипопротеин C-IV, церулоплазмин, аполипопротеин А-II и белок адгезии сосудистых клеток 1.
В частных вариантах воплощения изобретения внутренние пептидные стандарты мечены стабильными изотопами (SIS).
В частных вариантах воплощения изобретения для количественного анализа белков могут использоваться готовые коммерческие наборы, содержащие внутренние пептидные стандарты, меченные стабильными изотопами (SIS), для мониторинга указанной панели значимых белков с использованием хромато-масс-спектрометрического анализа.
В частных вариантах воплощения изобретения количественный хромато-масс-спектрометрический анализ осуществляется с использованием внутренних пептидных стандартов, меченных стабильными изотопами (SIS); изобарных и тандемных меток (™T, iTRAQ и др.); либо с использованием безметкового (label-free) подхода.
В частных вариантах воплощения изобретения биологический образец представляет собой кровь, плазму крови, сухую каплю крови, сыворотку крови, цереброспинальную жидкость пациента.
В частных вариантах воплощения изобретения хромато-масс-спектрометрический анализ относится к типу мониторинга параллельных реакций (PRM), мониторинга множественных реакций (MRM), MRM3, мониторинга выбранных реакций (SRM), DDA (сбор данных в зависимости от данных), DIA (сбор данных независимо от данных) или иммуно-MALDI (iMALDI).
В частных вариантах воплощения изобретения пробоподготовка биологического образца осуществляется с использованием фермента трипсина, для гидролиза белков и получения смеси полипептидов.
В частных вариантах воплощения изобретения хромато-масс-спектрометрический анализ концентрации двадцати двух белков осуществляется с использованием соответствующих уникальных триптических пептидов для дифференциации групп здоровых доноров и пациентов с БА. В более конкретных вариантах может быть использован по меньшей мере один пептид для одного белка. В еще более конкретных вариантах может быть использовано два пептида для одного белка.
В частных вариантах воплощения изобретения хромато-масс-спектрометрический анализ концентрации двадцати двух белков осуществляется с использованием внутренних пептидных стандартов с последовательностями SEQ ID NO: 1-22.
В частных вариантах воплощения изобретения в результате количественного анализа белков на стадии б) измеряют концентрацию белков.
В результате осуществления способа достигаются следующие технические результаты:
- разработан способ оценки риска развития болезни Альцгеймера, основанный на мультиплексном целевом (таргетном) количественном хромато-масс-спектрометрическом анализе панели 22-х белков плазмы крови;
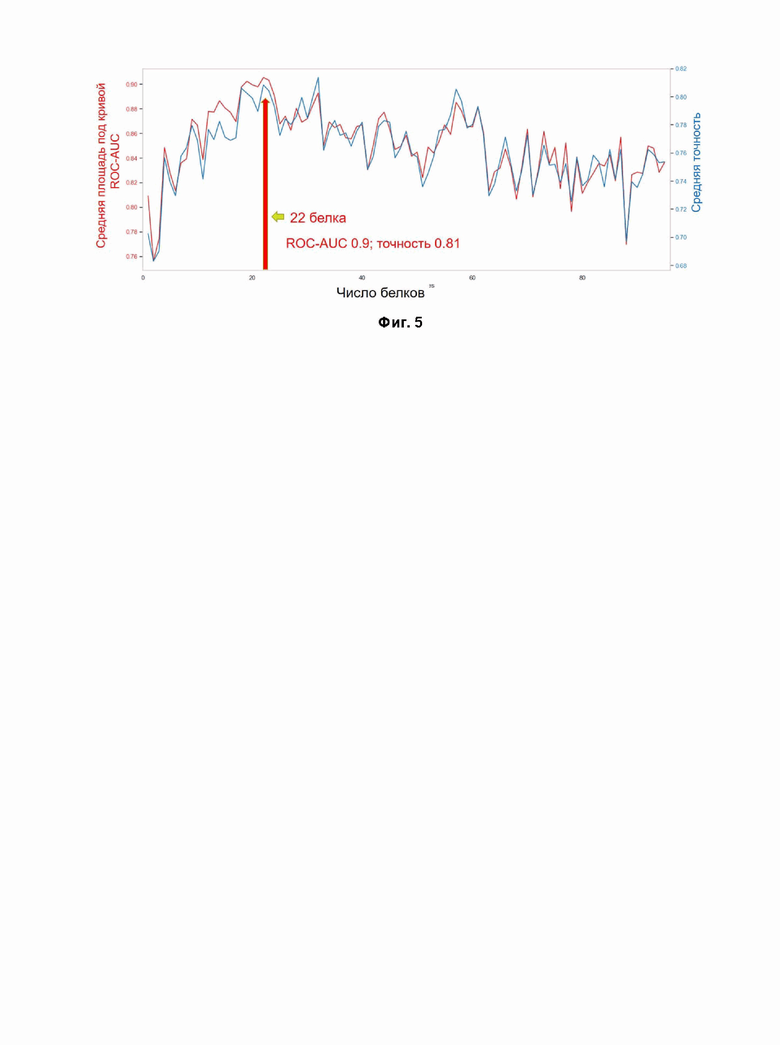
- предлагаемый способ имеет высокую чувствительность (73%) и специфичность (72%), обеспечиваемые за счет использования специфической панели из 22-х белков плазмы крови (Фиг. 5);
- для проведения предлагаемого способа оценки риска развития болезни Альцгеймера (БА), могут быть использованы биологические образцы, в частности образцы плазмы (сыворотки) крови пациента;
- способ является широкодоступным для проведения в лабораторных и клинических условиях, быстро внедряемым и реализуемым;
- предлагаемый способ обеспечивает сокращение снижение стоимости проведения диагностики (особенно по сравнению с МРТ и ПЭТ), а также обеспечивает минимальную инвазивность исследований (особенно по сравнению ЦЖ), существенно расширяя возможности использования применение перечисленных методов для первичного широкомасштабного скрининга;
- разработанный способ может быть использован для ранней диагностики риска развития болезни Альцгеймера (БА), особенно важным аспектом является прогнозирование развития БА у пациентов с синдромом мягкого когнитивного снижения (МКС), разработанный способ позволяет своевременно осуществить выявление пациентов группы риска до наступления необратимых когнитивных нарушений;
- разработанный способ может быть использован как дополнение/подтверждение существующих методов диагностики болезни Альцгеймера (БА): магнитно-резонансной томографии (МРТ) и позитронно-эмиссионной томографии (ПЭТ), анализ содержания β-амилоидных пептидов (Аβ) и tau/P-tau белков в цереброспинальной жидкости (ЦЖ), а также как самостоятельное исследование;
- разработанный способ расширяет арсенал доступных средств для первичного широкомасштабного скрининга пациентов с целью выявления риска развития болезни Альцгеймера.
Подробное описание изобретения
Определения и термины
Следующие термины и определения применяются в данном документе, если иное не указано явно. Ссылки на методики, используемые при описании данного изобретения, относятся к хорошо известным методам, включая изменения этих методов и замену их эквивалентными методами, известными специалистам.
В описании данного изобретения термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
Термин «и/или» означает один, несколько или все перечисленные элементы.
Также здесь перечисление числовых диапазонов по конечным точкам включает все числа, входящие в этот диапазон.
Термин «целевой» или «таргетный» относится к масс-спектрометрическому анализу одним из выбранных способов: мониторинг параллельных реакций (PRM), мониторинг множественных (MRM), мониторинг выбранных реакций (SRM).
Термин «количественный» относится к хромато-масс-спектрометрическому анализу или анализу с помощью иммунологических подходов.
Термин «биологический образец» («биообразец») относится к полученной или выделенной от пациента крови, плазмы крови, сухую каплю крови (DBS), сыворотку крови, цереброспинальную жидкость (ЦЖ) пациента.
Используемый здесь термин «пациент» относится к животному или человеку, предпочтительно к человеку. Пациентом может быть животное, такое как птица или млекопитающее. Конкретные животные включают крысу, мышь, собаку, кошку, корову, овцу, лошадь, свинью или приматов. Пациент также может быть трансгенным животным.
Термин «изотопно-меченые пептиды» («стандартные пептиды, меченные стабильными изотопами (SIS)») относится к пептидам, которые были синтезированы с использованием меченых стабильными изотопами аминокислот для получения пептида, который имеет бóльшую массу, чем соответствующий немеченый целевой пептид, для использования в качестве внутреннего стандарта для определения количества целевого пептида в образце. Подходящие изотопы - это нерадиоактивные химические изотопы, которые не распадаются спонтанно. Например, стабильные изотопы, которые могут использоваться для исследования биологических систем, включают изотопы 18O, 13C, 15N, 2H и 32S.
Используемый здесь термин «болезнь Альцгеймера» означает дегенеративное заболевание головного мозга, которое приводит к гибели нервных клеток в коре головного мозга до их атрофии или уменьшению извилин (гребней на коре головного мозга) в лобных и височных долях головного мозга. В настоящее время статус болезни оценивается по возрасту ее начала (развитие заболевания в пресенильном (до 65 лет) возрасте чаще ассоциировано с генетическими особенностями) и стадии деменции (мягкая, умеренная и тяжелая), которая определяется согласно критериям оценки с применением клинических когнитивных тестов (продолжительность каждой стадии сугубо индивидуальна и, в том числе, может зависеть от эффективности базисной терапии).
Используемый здесь термин «диагноз» означает идентификацию наличия или признаков патологического состояния. Применительно к объектам настоящего изобретения «диагностика» означает определение риска развития болезни Альцгеймера на основе анализа 22-х белков в биологическом образце.
Используемый здесь термин «биомаркер» означает вещество, способное указывать на болезненное состояние. В контексте настоящего изобретения, направленного на диагностику болезни Альцгеймера, «биомаркер» означает вещество, указывающее на риск развития заболевания. «Биомаркер» включает белки и их полипептиды, количество которых увеличивается или уменьшается у субъектов, страдающих болезнью Альцгеймера или склонных к заболеванию болезнью Альцгеймера, по сравнению с нормальными здоровыми субъектами. Используемый здесь термин «биомаркер AD» относится к биомаркеру, который является биомаркером диагностики AD. Используемый здесь термин «прогнозирование» относится к обнаружению того, что у человека значительно повышена вероятность развития заболевания.
Если не определено отдельно, технические и научные термины в данной заявке имеют стандартные значения, общепринятые в научной и технической литературе.
Краткое описание чертежей
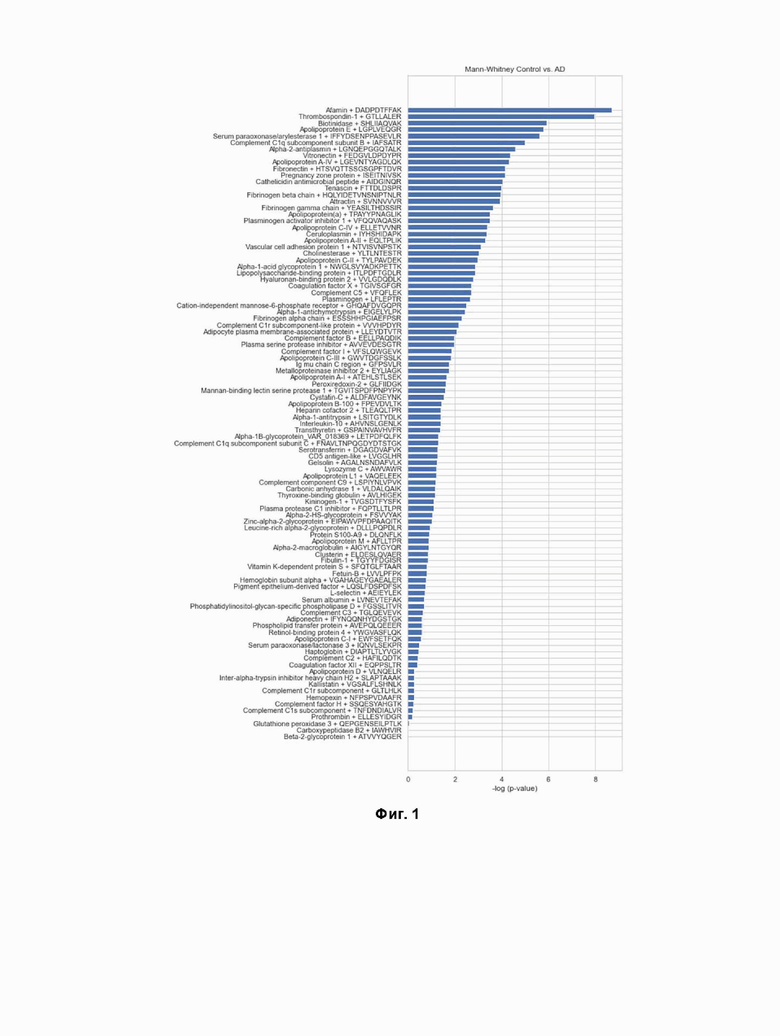
Фигура 1. Сортировка интенсивности белка по увеличению p-значения.
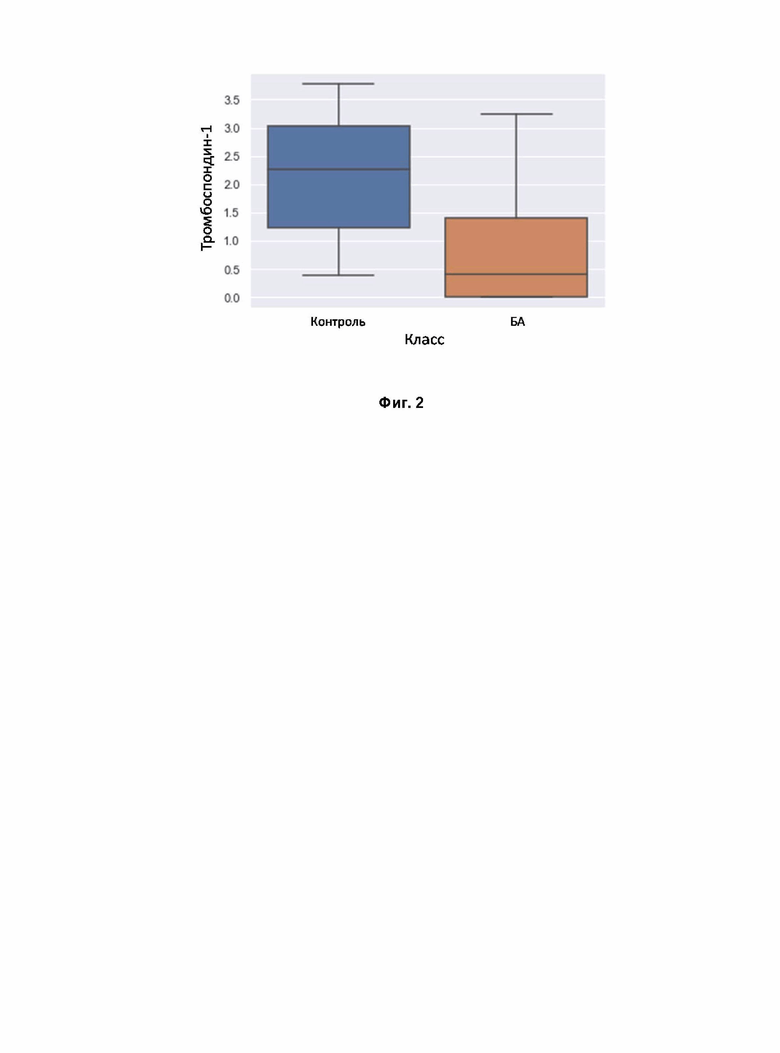
Фигура 2. Распределение концентрации Тромбосподина-1 в группах БА и контроля.
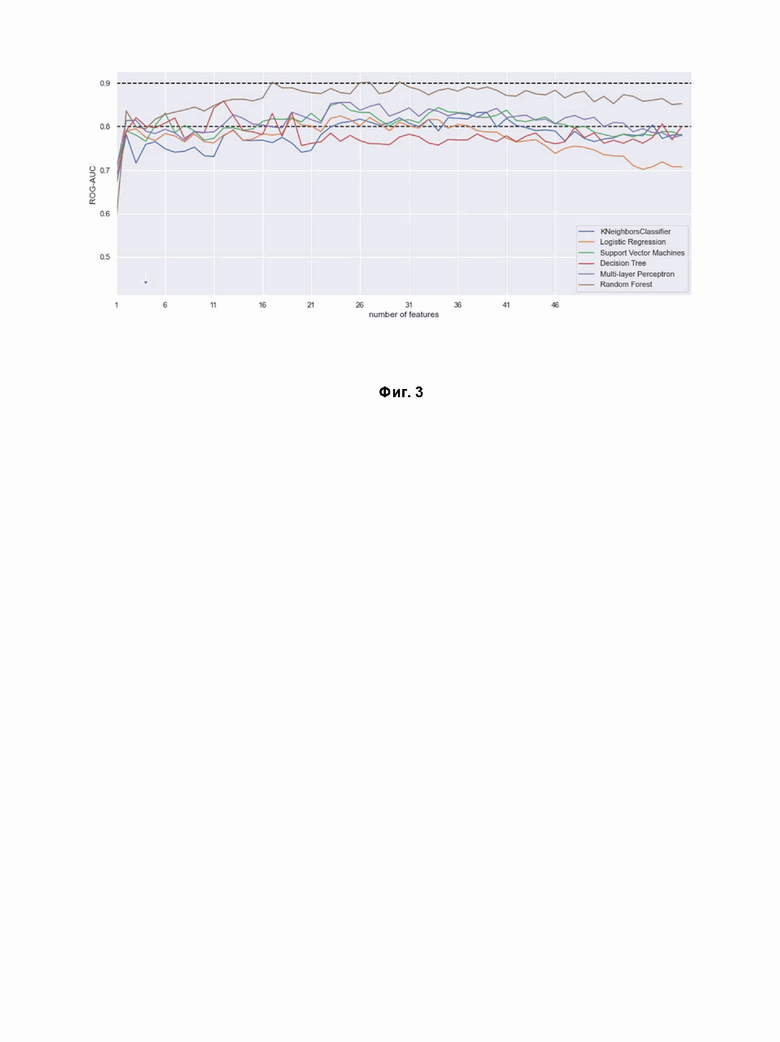
Фигура 3. Средняя оценка площади по кривой ROC-AUC, полученная различными классификаторами по наборам признаков, отсортированных путем увеличения p-значения.
Фигура 4. Средние относительные значения признаков, оцененные классификатором Random forest.
Фигура 5. Средние оценки площади по кривой ROC-AUC по классификатору случайных лесов для наборов объектов, отсортированных по уменьшению относительной важности.
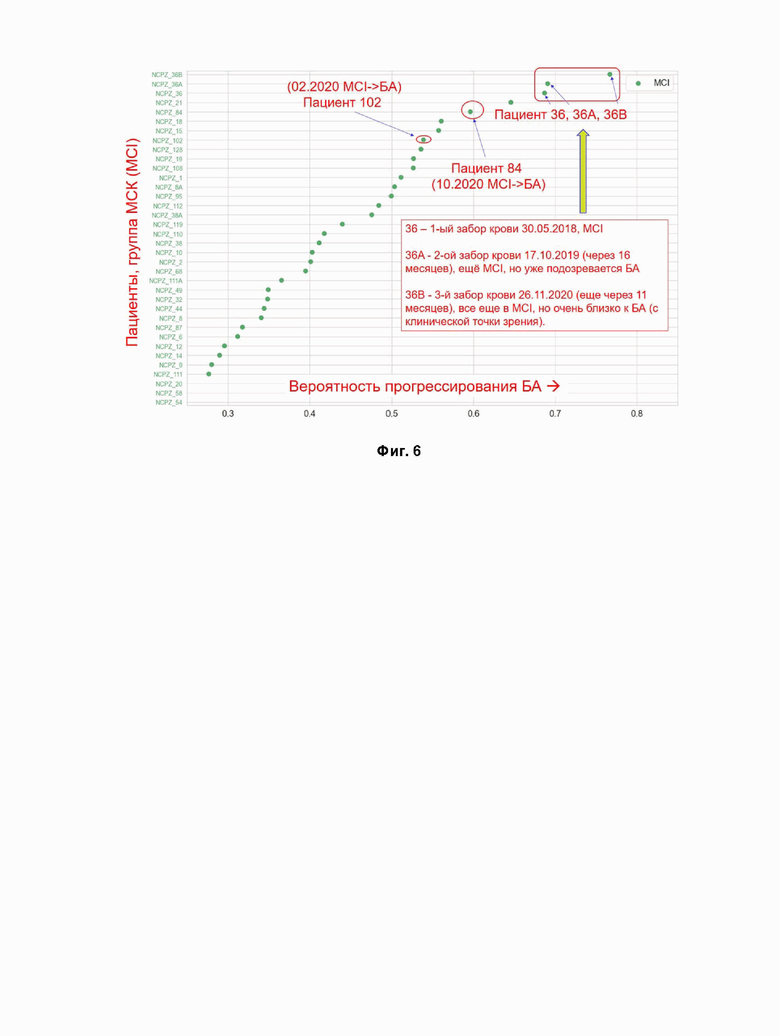
Фигура 6. Прогнозирование возможного перехода пациентов с MCI в группу AD по классификатору.
Предполагаемый подход оценки риска развития болезни Альцгеймера, основан на мультиплексном целевом (таргетном) количественном хромато-масс-спектрометрическом анализе панели 22-х белков плазмы крови. Поставленная задача решается при осуществлении предлагаемого способа оценки риска развития болезни Альцгеймера у пациентов с использованием модели разработанной авторами настоящего изобретения на основе панели 22-х белков плазмы крови. Преимуществом данного метода является возможность быстрого получения результатов, хорошая воспроизводимость данных, быстрая пробоподготовка, ввиду отсутствия необходимости деплеции мажорных белков, и как результат - возможность широкомасштабного анализа большого количества клинических образцов с использованием масс-спектрометра типа тройной квадруполь, как наиболее распространенного МС прибора в клинических лабораториях.
Предлагаемый способ включает следующие этапы:
(а) забор и пробоподготовка образцов крови пациентов для дальнейшего хромато-масс-спектрометрического анализа;
(б) хромато-масс-спектрометрический анализ полученной смеси белков с целью измерения концентрации белков в плазме крови на основе мониторинга множественны/выбранных/параллельных реакций (MRM/SRM/PRM) с использованием внутренних стандартов (для 22-х белков), меченных стабильными изотопами (SIS);
(в) расчет вероятности отнесения пациентов к группе БА, с использованием обученного бинарного классификатора на основе панели наиболее значимых белков плазмы крови (22 белка).
Сбор образца крови может быть проведен следующим образом:
• Произвести взятие венозной крови пациента в вакутейнер с крышкой фиолетового цвета (ЭДТА), объем крови должен быть не менее 4 мл.
• Перемешать, переворачивая, 8-10 раз;
• Промаркировать вакутейнер согласно номеру пациента в исследовании;
• В течение часа с момента забора крови центрифугировать образец (2000-4000g) в течение 10 мин;
• Отобрать пипеткой полученную плазму 2-3 аликвоты объемом 200 мкл, в пробирки типа eppendorf (0.5 мл), промаркировать аликвоты;
• Поместить на хранение в морозильную камеру с температурным режимом от -20°С до -80°С.
В результате такой процедуры может быть получен образец плазмы крови для дальнейшего протеомного анализа.
На следующем этапе проводят осаждение общего белка и его гидролиз трипсином. Использование трипсина (а также других специфических протеаз, например, Arg-C, Arg-C, Glu-C, Lys-C) с целью гидролиза белков при проведении хромато-масс-спектрометрического анализа хорошо известно в данной области. Выбор фермента для проведения гидролиза зависит от многих параметров, в том числе, от структуры анализируемого белка, наличия в образах других белков.
Подготовка образцов может быть проведена согласно «стандартному» протоколу трипсинолиза, который включает следующие этапы: (1) денатурация/восстановление, (2) алкилирование; (3) гидролиз в течении 18 часов при 37 С; (4) остановка гидролиза добавлением муравьиной кислоты до конечной концентрации 0,5%.
Также возможны и другие варианты пробоподготовки. В частности, может быть использовано ускоренное расщепление трипсином.
«Быстрый» протокол (3) (см. выше) может быть реализован с использованием иммобилизированного трипсина. Иммобилизацию трипсина можно проводить на поверхности магнитных микросфер, например, могут использоваться карбоксильные функционализированные магнитные микросферы (BioMag Plus carboxyl). Иммобилизация проводится путем реакции между сукцинимидной группой на поверхности микросфер и аминной группой на трипсине. Использование такого протокола позволяет провести трипсинолиз в течение 15 минут. Применение «быстрого» протокола трипсинолиза (3) (см. выше) или других известных быстрых протоколов позволяет существенно ускорить общее время проведения анализа.
На следующем этапе проводят хромато-масс-спектрометрический анализ и измерение концентрации белков в плазме крови на основе мониторинга множественны/выбранных/параллельных реакций (MRM/SRM/PRM) с использованием внутренних стандартов, меченных стабильными изотопами (SIS).
Масс-спектрометрия широко известна специалистам в данной области как мощный инструмент для анализа, идентификации и количественного определения различных типов молекул (классов соединений). Основой метода служит ионизация молекулы, приводящая к образованию «молекулярного иона», на основе которого проводится анализ и идентификация путем измерения отношения массы к заряду и интенсивности ионного тока, от соответствующего молекулярного иона. В зависимости от природы обнаруживаемой молекулы (например, белкового или небелкового происхождения), сложности образца (смесь или чистое вещество) и задачи исследования (например, качественный или количественный анализ), выбирается подходящий метод ионизации и масс-спектрометрии.
Последние достижения в области пептидного и белкового анализа с помощью масс-спектрометрии (MS) являются результатом разработок передовых методик ионизации, таких как электрораспылительная ионизация (ESI) и лазерная десорбция-ионизация в присутствии матрицы (MALDI). Электрораспылительная ионизация (ESI) предусматривает ионизацию при атмосферном давлении жидкого образца. В ходе процесса электрораспыления создаются высокозаряженные капли, которые при испарении создают ионы, характерные для содержащихся в растворе молекул. С помощью метода ESI стало возможным использовать масс-спектрометрию в тандеме с жидкостной хроматографией.
Жидкостная хроматография в сочетании с масс-спектрометрией (хромато-масс-спектрометрический анализ - LC-MS или ВЭЖХ-МС) является мощным инструментом для анализа и количественной оценки белка в сложных биообразцах. Поскольку пептиды, полученные в результате расщепления представляющего интерес белка и других белков биообразца, могут обладать одинаковой или сходной номинальной массой, то дополнительная фрагментация (MS/MS или MS2) зачастую дает уникальный фрагмент представляющего интерес пептида. Сочетание конкретного исходного пептида и его уникального фрагмента используется для избирательного мониторинга и количественной оценке концентрации пептида и соответствующего ему белка. Такой подход называется «мониторинг множественных реакций» (MRM), также используется термин «мониторинг выбранных реакций» (SRM), и является наиболее широко используемым способом количественной оценки белка. Еще одним подходом является мониторинг параллельных реакций (PRM).
Для разработки количественного метода под определенную панель белков выбираются и синтезируются соответствующие им триптические пептиды. Обычно синтезируется пара пептидов-стандартов: немеченый «легкий» пептид (NAT), полностью аналогичный природному пептиду, и парный ему меченный стабильными изотопами «тяжелый» пептид (SIS). Для количественного анализа проводится построение калибровочной кривой для каждой пары пептидов (NAT/SIS) путем разведения переменного количества легкого пептида в необходимом диапазоне концентраций, с добавлением одинакового количества SIS-пептида, как внутреннего стандарта для нормализации сигнала и количественной оценки концентрации немеченных пептидов. Для контроля точности калибровочной кривой используются дополнительные образцы контроля качества (QC), подготовленные при разведении пептидов-стандартов. Полученные калибровочные кривые для всех пептидных пар могут использоваться в дальнейшем для количественного анализа соответствующих природных белков и пептидов. Все перечисленные подходы могут быть использованы для идентификации и количественного анализа выбранной панели белков в образце крови. Например, может быть использована соответствующая панель изотопно-меченных пептидов, в которой С-концевой лизин или аргинин помечены изотопами 13С и 15N: K (+8 Да; 6x 13C, 2x 15N), R (+10 Да; 6x 13C, 4x 15N).
В частном варианте осуществления изобретения пептиды, полученные в результате гидролиза трипсином на предыдущем этапе, могут быть проанализированы с помощью системы ВЭЖХ-МС, состоящей из системы ExionLC ™ (UHPLC (ThermoFisher Scientific, США), подключенной онлайн к тройному квадрупольному масс-спектрометру SCIEX QTRAP 6500+ (SCIEX, Канада). Параметры ВЭЖХ-МС, такие как градиент ВЭЖХ и параметры MRM (сканирование Q1 и MRM), могут быть адаптированы и оптимизированы на основе инструкции-приложения к коммерческому набору PeptiQuant™ Plus Proteomics Kit (MRM Proteomics Inc.).
Для количественного анализа может использоваться программное обеспечение Skyline, как наиболее распространенный программный продукт для количественного анализа. Калибровочные кривые могут быть сгенерированы с использованием методов линейной регрессии с взвешиванием 1/ (x*x) для расчета концентраций пептидов в измеренных образцах (фмоль на мкл плазмы).
Специалисту понятно, что могут быть использованы и другие методы количественного анализа при помощи масс спектрометрии.
Создание модели для построения бинарного классификатора для дифференциации групп здоровых доноров и пациентов с БА, и определение панели наиболее значимых белков плазмы крови может осуществляться с использование стандартных методов статистической обработки и машинного обучения (тест Манна-Уитни, Линейная регрессия, SVC, k-ближайшие соседи и др.).
В результате проведенных исследований, более подробно описанных в разделе «примеры» ниже, была разработана модель для построения бинарного классификатора для дифференциации групп здоровых доноров (n=43) и пациентов с БА (n=47), и определена панель наиболее значимых 22-х белков плазмы крови, которая может быть использована для оценки риска развития болезни Альцгеймера и расчета вероятности отнесения пациентов группы контроля и группы МСК к группе БА, с использованием классификатора на основе панели 22-х значимых белков плазмы крови. Предложенная модель с хорошей клинической чувствительностью и специфичностью (Фиг.5).
В результате проведенных исследований, более подробно описанных в разделе «примеры» ниже, была разработана панель из 22-х значимых белков, которая может быть использована в качестве панели биомаркеров для проведения оценки риска развития болезни Альцгеймера у пациентов, с хорошей клинической чувствительностью и специфичностью.
В таблице 1 приведен перечень всех белков, входящих в разработанную авторами настоящего изобретения панель, а также список уникальных триптических пептидов (частный вариант воплощения изобретения), используемых для проведения количественного анализа указанных белков и дифференциации групп здоровых доноров и пациентов с БА и характеризующихся последовательностями SEQ ID NO: 1-22.
Таким образом, в результате проведенных исследований была разработана панель легко обнаруживаемых 22-х белков плазмы крови, которая может быть использована для оценки риска развития болезни Альцгеймера. Разработанная панель может использоваться для создания широкомасштабного скрининга пациентов, с использованием масс-спектрометра типа тройной квадруполь, как наиболее распространенного МС прибора в клинических лабораториях.
Предлагаемый способ оценки риска развития болезни Альцгеймера на основе количественного анализа белков крови, является широко доступным для проведения в лабораторных и клинических условиях, быстро внедряемым и реализуемым, обеспечивающий сокращение снижение стоимости проведения диагностики (особенно по сравнению с МРТ и ПЭТ), а также обеспечивает минимальную инвазивность исследований (особенно по сравнению ЦЖ). Разработанный способ может быть использован для ранней диагностики риска развития болезни Альцгеймера (БА), особенно важным аспектом является прогнозирование развития БА у пациентов с синдромом мягкого когнитивного снижения (МКС).
Нижеследующие примеры осуществления способа приведены в целях раскрытия характеристик настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения.
Пример 1. Количественный анализ белков плазмы крови у пациентов и построение и выбор наилучшего бинарного классификатора для оценки риска развития болезни Альцгеймера
Все процедуры по сбору и подготовке образцов плазмы крови здоровых доноров (n=43) и пациентов с БА (n=47) проводились в соответствии с методикой, описанной выше.
Для количественного ВЭЖХ-МС анализа, полученный гидролизат белков (с целью измерения концентрации белков в биологическом образце), загружали на колонку в количестве 10 мкл образца. Разделение ВЭЖХ проводили с использованием колонки Acquity UPLC пептид BEH (С18, 300Å, 1,7 мкм, 2,1 мм ×150 мм, 1/пкг) (Waters, США) с градиентным элюированием. Подвижная фаза А составляла 0,1% муравьиной кислоты в воде; подвижная фаза В составляла 0,1% муравьиной кислоты в ацетонитриле. Разделение ЖК проводили при расходе 0,4 мл/мин с использованием 53-минутного градиента от 2 до 45% подвижной фазы B. Масс-спектрометрические измерения проводили с использованием метода регистрации MRM. Настройки источника ионизации электрораспылением (ESI) были следующими: напряжение ионного распыления 4000 В, температура 450°С, газ источника ионов 40 л/мин. Соответствующий список переходов для экспериментов MRM со значениями времени удержания и массами Q1/Q3 для каждого пептида, были адаптированы и оптимизированы на основе инструкции-приложения к коммерческому набору PeptiQuant™ Plus Proteomics Kit (MRM Proteomics Inc.).
Предобработка полученных данных, в результате количественного анализа целевых белков, для обучения бинарного классификатора, а также для работы бинарного классификатора на реальных данных. Из исходных данных были исключены белки с встречаемостью менее чем в 30 измерениях (ВЭЖХ-МС) и концентрациями ниже порога обнаружения. Общее количество белков для анализа составило 97. Недостающие значения были заполнены гауссовым распределением с оценкой параметров как выборочная медиана и выборочная дисперсия для каждой группы отдельно. Выбросы были обнаружены с помощью проекции на две главные компоненты методом PCA и 6 образцов были отброшены. Для проверки статистической гипотезы о равенстве средних использовался U-критерий Манна-Уитни с FDR (альфа <0,05), основанный на поправке Бенджамини-Иекутиели (Фиг. 1). Однако только Тромбоспондин-1 показал статистически значимую разницу между группами контроля и БА (Фиг. 2).
Все модели машинного обучения были взяты из пакета Scikit-Learn [36], результаты были нанесены на график с помощью Matplotlib [37,38]. Для классификаторов, плохо работающих с коррелированными и немасштабированными данными (линейная регрессия, SVC, многослойный персептрон, k-ближайших соседей), вместо интенсивностей использовалась z-оценка, и все сильно коррелированные (коэффициент корреляции Пирсона > 0,8) были удалены.
Для выбора наилучшего классификатора все алгоритмы были обучены с перебором широкого множества значений гиперпараметров алгоритмов для каждого типа классификатора с k-кратной перекрестной проверкой (k=5). Классификаторы обучались на множестве признаков, при котором новые признаки добавляются последовательно с увеличением p-value в U-тесте Манна-Уитни. Почти по всем наборам признаков (белков) наилучший результат был достигнут классификатором случайных лесов (Random forest) по метрикам ROC-AUC (Фиг. 3). Данный классификатор был выбран для определения оценки риска развития болезни Альцгеймера.
Пример 2. Обучение бинарного классификатора и его оптимизация для выявления наиболее значимой панели белков
Для настройки бинарного классификатора для дифференциации групп здоровых доноров (n=43) и пациентов с БА (n=47), и выявления признаков (белков) бинарный классификатор Random forest был обучен 200 раз по всем признакам, определяя на каждой итерации важность признака для классификации. Итоговая таблица важности включает средние значения (Фиг. 4). Для поиска наиболее оптимальных значений гиперпараметров (число деревьев (n_estimators), максимальная глубина (max_depth), бутстрэп (bootstrap), критерий (criterion)) осуществлялся “поиск по сетке” из широкого диапазона параметров алгоритма. Для “поиска по секте” использовалась функция GridSearchCV из библиотеки scikit-learn. Реализация алгоритма Random forest была взята из той же библиотеки. Ранжирование алгоритмов (K-ближайших соседей, логистическая регрессия, метод опорных векторов, классификация с помощью решающего дерева, классификация с помощью многослойного перцептрона, Random Forest) при различных гиперпараметрах осуществлялась на основе метрики ROC-AUC. Затем авторы настоящего изобретения обучили классификатор последовательному набору признаков на основе таблицы средних значений. Наилучший результат (Фиг. 5) был достигнут на наборе из 22 белков (Таблица 1) с площадью 0,9 для кривой ROC-AUC, с чувствительностью 73% и специфичностью 72%.
Обучение бинарного классификатора Random forest включает следующие этапы.
1) Осуществляют предобработку образцов плазмы крови здоровых доноров и пациентов с БА, как было описано выше.
2) Предобработанные данные случайным образом делятся на обучающую и тестовую выборку, с пропорцией 0,2:0,8.
3) Классификатор с подобранными значениями гиперпараметров обучался на обучающей выборке с помощью встроенного метода fit для определения важности белка для классификации. Из всех белков, содержащихся в образцах, определялись белки, которые являются важными для классификации. Белок является важным, если качество классификации (по метрике AUC-ROC) при учете этого белка значительно улучшается). Алгоритм Random forest представляет собой ансамбль алгоритмов решающего дерева. Алгоритм решающего дерева можно представить, как построение плоскости в пространстве признаков, поэтому наибольшую важность имеют признаки лучше всего разделяющиеся получаемой плоскостью по классам (0 - контрольная группа, 1 - пациенты с БА). Фигура 4 отражает важность каждого белка для классификации.
4) После получения значений важности белков происходило упорядочивание белков по убыванию полученных значений. Из данного упорядоченного множества составлялись наборы признаков по правилу: набор i содержит i самых важных признака.
5) Осуществляют оценку значений метрики качества ROC-AUC на полученном наборе белков, с помощью метода predict_proba предсказывались вероятности принадлежности каждого экземпляра набора признакам к классам “1” и “0”.
6) После обучения классификатора на обучающей выборке, происходит оценка метрики качества на тестовой выборке. После обучения на тестовой выборке данных с помощью метода predict_proba предсказывались вероятности принадлежности каждого экземпляра тестовой выборки к классам “1” и “0”. Метрика качества ROC-AUC рассчитывалась с помощью функции roc_auc_score использующая классы тестовой части метрики и полученные вероятности.
Пример 3. Оценка риска развития болезни Альцгеймера на основе количественного анализа белков крови у пациентов МСК (MCI)
Прогнозирование возможного перехода пациентов с MCI в группу БА осуществлялось с помощью вероятности присваивания группы БА пациентам группы MCI классификатором на основе панели 22-х белков плазмы крови. Метод вероятностного прогнозирования строился с использованием классификаторов с наилучшей производительности (Random forest).
На первом этапе получают биологические образцы, осуществляют количественный анализ целевых белков как описано выше в примере 1 и осуществляют предобработку данных, полученных в результате анализа целевых белков, как описано выше в примере 1.
Предобработанные данные поступают на вход обученного бинарного классификатора для оценки риска развития болезни Альцгеймера, на выходе классификатор выдает значение 1 - если есть вероятность риска развития болезни Альцгеймера или 0 - если нет вероятности риска развития болезни Альцгеймера.
На основании полученной вероятности и возможных других данных (демографические и клинические параметры, а также при наличии данные МРТ/ПЭТ, содержание β-амилоидных пептидов (Аβ) и tau/P-tau белков в цереброспинальной жидкости), специалист может поставить диагноз.
На Фиг. 6 приведены результаты расчета вероятности перехода пациентов с MCI в группу БА на подготовленных данных MCI. На диаграмме каждый пациент из группы MCI (n=39) отмечен отдельной точкой и пациенты отсортированы по вертикальной оси Y в соответствии с ростом вероятности развития БА, то есть пациенты с самой высокой вероятностью размещены в правом верхнем углу диаграммы. В качестве примера выделены три MCI пациента (102, 84, 36) с высокой вероятностью перехода в БА. Важно, отметить, что в течение того же года два пациента (102, 84) в итоге перешли в группу БА, а у третьего пациента (36) через 2 года врачами были выявлены ухудшения в сторону БА. Для всех пациентов ежегодно проводились клиническое неврологическое тестирование в Научный центр психического здоровья РАН (НЦПЗ РАН).
Вычислительная система, обеспечивающая обработку данных, необходимую для реализации заявленного решения, в общем случае содержат такие компоненты, как: один или более процессоров, по меньшей мере одну память, средство хранения данных, интерфейсы ввода/вывода, средство ввода, средства сетевого взаимодействия.
При исполнении машиночитаемых команд, содержащихся в оперативно памяти, конфигурируют процессор устройства для выполнения основных вычислительные операции, необходимых для функционирования устройства или функциональности одного, или более его компонентов.
Память, как правило, выполнена в виде ОЗУ, куда загружается необходимая программная логика, обеспечивающая требуемый функционал. При осуществлении работы предлагаемого решения выделяют объем памяти, необходимы для осуществления предлагаемого решения.
Средство хранения данных может выполняться в виде HDD, SSD дисков, рейд массива, сетевого хранилища, флэш-памяти и т.п. Средство позволяет выполнять долгосрочное хранение различного вида информации, например, вышеупомянутых файлов с наборами данных пользователей, базы данных, содержащих записи измеренных для каждого пользователя временных интервалов, идентификаторов пользователей и т.п.
Интерфейсы представляют собой стандартные средства для подключения и работы периферийных и прочих устройств, например, USB, RS232, RJ45, COM, HDMI, PS/2, Lightning и т.п.
Выбор интерфейсов зависит от конкретного исполнения устройства, которое может представлять собой персональный компьютер, мейнфрейм, серверный кластер, тонкий клиент, смартфон, ноутбук и т.п.
В качестве средств ввода данных в любом воплощении системы, реализующей описываемый способ, может использоваться клавиатура. Аппаратное исполнение клавиатуры может быть любым известным: это может быть, как встроенная клавиатура, используемая на ноутбуке или нетбуке, так и обособленное устройство, подключенное к настольному компьютеру, серверу или иному компьютерному устройству. Подключение при этом может быть, как проводным, при котором соединительный кабель клавиатуры подключен к порту PS/2 или USB, расположенному на системном блоке настольного компьютера, так и беспроводным, при котором клавиатура осуществляет обмен данными по каналу беспроводной связи, например, радиоканалу, с базовой станцией, которая, в свою очередь, непосредственно подключена к системному блоку, например, к одному из USB-портов. Помимо клавиатуры, в составе средств ввода данных также может использоваться: джойстик, дисплей (сенсорный дисплей), проектор, тачпад, манипулятор мышь, трекбол, световое перо, динамики, микрофон и т.п.
Средства сетевого взаимодействия выбираются из устройства, обеспечивающий сетевой прием и передачу данных, например, Ethernet карту, WLAN/Wi-Fi модуль, Bluetooth модуль, BLE модуль, NFC модуль, IrDa, RFID модуль, GSM модем и т.п. С помощью средств обеспечивается организация обмена данными по проводному или беспроводному каналу передачи данных, например, WAN, PAN, ЛВС (LAN), Интранет, Интернет, WLAN, WMAN или GSM.
Компоненты устройства сопряжены посредством общей шины передачи данных.
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные эксперименты приведены лишь в целях иллюстрирования настоящего изобретения и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.
Список литературы
[1] Alzheimer’s Association. 2016 Alzheimer’s disease facts and figures. (2016) Alzheimers Dement,12:459-509. https://doi.org/10.1016/j.jalz.2016.03.001
[2] Perrin J, Fagan AM, and Holtzman DM. Multimodal techniques for diagnosis and prognosis of Alzheimer's disease. (2009) Nature, 461:916-922. doi:10.1038/nature08538
[3] Ritchie C, Smailagic N, Ladds EC, Noel-Storr AH, Ukoumunne O, and Martin S. CSF tau and the CSF tau/ABeta ratio for the diagnosis of Alzheimer’s disease dementia and other dementias in people with mild cognitive impairment (MCI). (2013) Cochrane Database of Systematic Reviews, Issue 10, Art. No.:CD10803. DOI:10.1002/14651858.CD010803
[4] Galozzi S, Marcus K, and Barkovits K. Amyloid-β as a biomarker for Alzheimer’s disease: quantification methods in body fluids. (2015) Expert Rev Proteomics, 12(4):343. https://doi.org/10.1586/14789450.2015.1065183
[5] Lehallier B, Essioux L, Gayan J, Alexandridis R, Nikolchaeva T, Wyss-Coray T, and Britschgi M. Combined plasma and cerebrospinal fluid signature for the prediction of midterm progression from mild cognitive impairment to Alzheimer disease. (2016) JAMA Neurol, 73(2):203-212. doi:10.1001/jamaneurol.2015.3135
[6] Zhang S, HanD, Tan X, Feng J, Guo Y, Ding Y. Diagnostic accuracy of 18 F-FDG and 11 C-PIB-PET for prediction of short-term conversion to Alzheimer’s disease in subjects with mild cognitive impairment. (2012) Int J Clin Pract, 66(2):185-198.
[7] ShawLM, VandersticheleH, Knapik-CzajkaM, et al; Alzheimer’s Disease Neuroimaging Initiative. Cerebrospinal fluid biomarker signature in Alzheimer’s Disease Neuroimaging Initiative subjects. (2009) AnnNeurol, 65(4):403-413.
[8] Hampel H, O’Bryant SE, Molinuevo JL, Zetterberg H, Masters C, Lista S, Kiddle SJ, Batrla R, and Blennow K. Blood-based biomarkers for Alzheimer disease: mapping the road to the clinic. (2018) Nature Rev Neurol, 14:639-652. https://doi.org/10.1038/s41582-018-0079-7
[9] Nakamura A, Kaneko N, Villemagne VL, Kato T, Doecke J, Dore V, Fowler C, Li QX, Martins R, Rowe C, et al. High performance plasma amyloid-beta biomarkers for Alzheimer's disease. (2018) Nature, 554(7691):249-54. doi: 10.1038/nature25456
[10] Zetterberg, H., Blennow, K. Moving fluid biomarkers for Alzheimer’s disease from research tools to routine clinical diagnostics. Mol Neurodegeneration 16, 10 (2021). https://doi.org/10.1186/s13024-021-00430-x
[11] Kiddle SJ, Sattlrcker M, Proitsi P, Simmons A, Westman E, Bazenet C, Nelson SK, Williams S, Hodges A, Johnston C, Soininen H, Kloszewska I, Mecocci P, Tsolaki M, Vellas B, Newhouse S, Lovestone S, and Dobson RJB. Candidate blood proteome markers of Alzheimer’s disease onset and progression: a systematic review and replication study. (2014) J Alzheimer’s Dis, 38(3):515-531. DOI: 10.3233/JAD-130380
[12] Rehiman SH, Lim SM, Neoh CF, Majeed ABA, Chin A-V, Tan MP, Kamaruzzaman SB, Ramasamy K. Proteomics as a reliable approach for discovery of blood-based Alzheimer’s disease biomarkers: A systematic review and meta-analysis. Ageing Research Reviews. 2020;60:101066. https://doi.org/10.1016/j.arr.2020.101066.
[13] Morgan AR, Touchard S, Leckey C, O’Hagan C, Nevado-Holgado AJ, et al. Inflammatory biomarkers in Alzheimer’s disease plasma. (2019) Alzheimer’s and Dementia, 15:776-787. https://doi.org/10.1016/j.jalz.2019.03.007
[14] Doecke JD, Laws SM, Faux NG, Wilson W, Burnham SC, Lam CP, Mondal A, Bedo J, Bush AI, Brown B, De Ruyck K, Ellis KA, Fowler C, Gupta VB, Head R, Macaulay SL, Pertile K, Rowe CC, Rembach A, Rodrigues M, Rumble R, Szoeke C, Taddei K, Taddei T, Trounson B, Ames D, Masters CL, Martins RN, Alzheimer’s Disease Neuroimaging Initiative, Australian Imaging Biomarker and Lifestyle Research Group. Blood-based protein biomarkers for diagnosis of Alzheimer disease. (2012) Arch Neurol, 69:1318-1325.
[15] Ray S, Britschgi M, Herbert C, Takeda-Uchimura Y, Boxer A, Blennow K, Friedman LF, Galasko DR, Jutel M, Karydas A, Kaye JA, Leszek J, Miller BL, Minthon L, Quinn JF, Rabinovici GD, Robinson WH, Sabbagh MN, So YT, Sparks DL, Tabaton M, Tinklenberg J, Yesavage JA, Tibshirani R, Wyss-Coray T. Classification and prediction of clinical Alzheimer’s diagnosis based on plasma signaling proteins. (2007) Nat Med, 13:1359-1362. http://www.nature.com/doifinder/10.1038/nm1653
[16] Hye A, Riddoch-Contreras J, Baird AL, Ashton NJ, Bazenet C, Leung R, Westman E, Simmons A, Dobson R, Sattlecker M, Lupton M, Lunnon K, Keohane A, Ward M, Pike I, Zucht HD, Pepin D, Zheng W, Tunnicliffe A, Richardson J, Gauthier S, Soininen H, Kloszewska I, Mecocci P, Tsolaki M, Vellas B, Lovestone S. Plasma proteins predict conversion to dementia from prodromal disease. (2014) Alzheimer’s and Dementia, 10:799-807. http://dx.doi.org/10.1016/j.jalz.2014.05.1749
[17] Henkel AW, Muller K, Lewczuk P, Muller T, Marcus K, Kornhuber J, Wiltfang J. Multidimensional plasma protein separation technique for identification of potential Alzheimer’s disease plasma biomarkers: A pilot study. (2012) J Neural Transm, 119:779-788. https://doi.org/10.1007/s00702-012-0781-3
[18] Walker, K.A., Chen, J., Zhang, J. et al. Large-scale plasma proteomic analysis identifies proteins and pathways associated with dementia risk. Nat Aging 1, 473-489 (2021). https://doi.org/10.1038/s43587-021-00064-0
[19] Whelan, C.D., Mattsson, N., Nagle, M.W. et al. Multiplex proteomics identifies novel CSF and plasma biomarkers of early Alzheimer’s disease. acta neuropathol commun 7, 169 (2019). https://doi.org/10.1186/s40478-019-0795-2
[20] Jiang Y, Zhou X, Ip FC, Chan P, Chen Y, et al. Large-scale proteomic profiling identifies a high-performance biomarker panel for Alzheimer’s disease screening and staging. Alzheimer’s and Dementia. 2021;1-15. DOI: 10.1002/alz.12369
[21] Song F, Poljak A, Kochan NA, Raftery M, Brodaty H, Smythe GA, and SchdevPS. Plasma protein profiling of mild cognitive impairment and Alzheimer’s disease using iTRAQ quantitative proteomics. (2014) Proteome Science, 12:5. http://www.proteomesci.com/content/12/1/5
[22] Muenchhoff J, Poljak A, Song F, Raftery M, Brodaty H, Duncan M, McEvoy M, Attia J, Schofield PW, and Sachdev PS. Plasma protein profiling of mild cognitive impairment and Alzheimer’s disease across two independent cohorts. (2015) J Alzheimers Dis, 43:1355-1373. DOI 10.3233/JAD-141266
[23] Dayon L, Wojcik J, Galindo N, Corthesy J, Cominetti O, Oikonomidi A, Henry H, Migliavacca E, Bowman GL, and Popp J. Plasma proteomic profiles of cerebrospinal fluid-defined Alzheimer’s disease pathology in older adults. (2017) J Alzheimers Dis, 60:1641-1652. DOI: 10.3233/JAD-170426
[24] Dey KK, Wang H, Niu M, Bai B, Wang X, Li Y, Cho J-H, Tan H, Mishra A, High AA, Chen P-C, Wu Z, Beach TG, and Peng J. Deep undepleted human serum proteome profiling toward biomarker discovery for Alzheimer’s disease. (2019) Clin Proteom, 16:16. https://doi.org/10.1186/s12014-019-9237-1
[25] Ashton NJ, Nevado-Holgado AJ, Barber IS, Lynham S, Gupta V, et al. A plasma protein classifier for predicting amyloid burden for preclinical Alzheimer’s disease. Sci Adv. 2019;5:eaau7220. https://doi.org/10.1126/sciadv.aau7220
[26] Chen M., Xia W. Proteomic profiling of plasma and brain tissue from Alzheimer’s disease patients reveals candidate network of plasma biomarkers. J Alzheimers Dis. 2020;():349 - 368. DOI: 10.3233/JAD-200110
[27] Khan MJ, Desaire H, Lopez OL, Kamboh MI, Robinson RAS. Why Inclusion Matters for Alzheimer’s Disease Biomarker Discovery in Plasma. J Alzheimers Dis. 2021;79:1327 - 1344. DOI 10.3233/JAD-201318
[28] Kitamura Y, Usami R, Ichichara S, Kida H, Satoh M, Tomimoto H, Murata M, and Oikawa S. Plasma protein profiling for potential biomarkers in the early diagnosis of Alzheimer’s disease. (2017) Neurol Res, 39(3):231-238. https://doi.org/10.1080/01616412.2017.1281195
[29] Kumar A, Singh S, Verma A, Mishra VN. Proteomics based identification of differential plasma proteins and changes in white matter integrity as markers in early detection of mild cognitive impaired subjects at high risk of Alzheimer’s disease. Neurosci. Lett. 2018; 676:71-77.
[30] Soares HD, Potter WZ, Pickering E, Kuhn M, Immermann FW, Shera DM, Ferm M, Dean RA, Simon AJ, Swenson F, Siuciak JA, Kaplow J, Thambisetty M, Zagouras P, Koroshetz WJ, Wan HI, Trojanowski JQ, Shaw LM, Biomarkers Consortium Alzheimer’s Disease Plasma Proteomics Project. Plasma biomarkers associated with the apolipoprotein E genotype and Alzheimer. (2012) Arch Neurol, 69:1310-1317.
[31] Thambisetty M, Tripaldi R, Riddoch-Contreras J, Hye A, An Y, Campbell J, Sojkova J, Kinsey A, Lynham S, Zhou Y, Ferrucci L, Wong DF, Lovestone S, Resnick SM Proteome-based plasma markers of brain amyloid-β deposition in non-demented older individuals. (2010) J Alzheimers Dis, 22:1099-1109.
[32] Zhao X, Lejnine S, Spond J, Zhang C, Ramaraj TC, Holder DJ, Dai H, Weiner R, and Lacterza OF. A candidate plasma protein classifier to identify Alzheimer’s disease. (2015) J Alzheimers Dis, 43:549-563. DOI: 10.3233/JAD-141149
[33] Gaither c, Popp R, Mohammed Y, Bochers CH. Determination of the concentration range for 267 proteins from 21 lots of commercial human plasma using highly multiplexed multiple reaction monitoring mass spectrometry. Analyst. 2020;145:3634-3644. https://doi.org/10.1039/C9AN01893J
[34] Gaither C, Popp R, Bochers SP, Skarphedinsson K, Eiriksson FF, et al. Performance assessment of a 125 human plasma peptide mixture stored at room temperature for multiple reaction monitoring-mass spectrometry. J Proteome Res. 2021;20(9):4292-4302. https://doi.org/10.1021/acs.jproteome.1c00249
[35] Han, S.H.; Kim, J.S.; Lee, Y.; Choi, H.; Kim, J.W.; Na, D.L.; Yang, E.G.; Yu, M.H.; Hwang, D.; Lee, C.; et al. Both targeted mass spectrometry and flow sorting analysis methods detected the decreased serum apolipoprotein E level in Alzheimer’s disease patients. Mol. Cell. Proteom. 2014, 13, 407-419.
[36] Scikit-learn: Machine Learning in Python, Pedregosa et al., JMLR 12, pp. 2825-2830, 2011.
[37] J. D. Hunter, "Matplotlib: A 2D Graphics Environment", Computing in Science & Engineering, vol. 9, no. 3, pp. 90-95, 2007.
[38] J. D. Hunter, "Matplotlib: A 2D Graphics Environment", Computing in Science & Engineering, vol. 9, no. 3, pp. 90-95, 2007.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> АВТОНОМНАЯ НЕКОММЕРЧЕСКАЯ ОБРАЗОВАТЕЛЬНАЯ ОРГАНИЗАЦИЯ ВЫСШЕГО
ОБРАЗОВАНИЯ "СКОЛКОВСКИЙ ИНСТИТУТ НАУКИ И ТЕХНОЛОГИЙ"
(СКОЛКОВСКИЙ ИНСТИТУТ НАУКИ И ТЕХНОЛОГИЙ)
<120> Способ оценки риска развития болезни Альцгеймера с
использованием панели белков крови
<130> 458858
<160> 22
<170> BiSSAP 1.3.6
<210> 1
<211> 10
<212> PRT
<213> Homo sapiens
<400> 1
Asp Ala Asp Pro Asp Thr Phe Phe Ala Lys
1 5 10
<210> 2
<211> 8
<212> PRT
<213> Homo sapiens
<400> 2
Gly Thr Leu Leu Ala Leu Glu Arg
1 5
<210> 3
<211> 10
<212> PRT
<213> Homo sapiens
<400> 3
Ser His Leu Ile Ile Ala Gln Val Ala Lys
1 5 10
<210> 4
<211> 9
<212> PRT
<213> Homo sapiens
<400> 4
Leu Gly Pro Leu Val Glu Gln Gly Arg
1 5
<210> 5
<211> 16
<212> PRT
<213> Homo sapiens
<400> 5
Ile Phe Phe Tyr Asp Ser Glu Asn Pro Pro Ala Ser Glu Val Leu Arg
1 5 10 15
<210> 6
<211> 7
<212> PRT
<213> Homo sapiens
<400> 6
Ile Ala Phe Ser Ala Thr Arg
1 5
<210> 7
<211> 13
<212> PRT
<213> Homo sapiens
<400> 7
Leu Gly Asn Gln Glu Pro Gly Gly Gln Thr Ala Leu Lys
1 5 10
<210> 8
<211> 12
<212> PRT
<213> Homo sapiens
<400> 8
Phe Glu Asp Gly Val Leu Asp Pro Asp Tyr Pro Arg
1 5 10
<210> 9
<211> 13
<212> PRT
<213> Homo sapiens
<400> 9
Leu Gly Glu Val Asn Thr Tyr Ala Gly Asp Leu Gln Lys
1 5 10
<210> 10
<211> 18
<212> PRT
<213> Homo sapiens
<400> 10
His Thr Ser Val Gln Thr Thr Ser Ser Gly Ser Gly Pro Phe Thr Asp
1 5 10 15
Val Arg
<210> 11
<211> 10
<212> PRT
<213> Homo sapiens
<400> 11
Ile Ser Glu Ile Thr Asn Ile Val Ser Lys
1 5 10
<210> 12
<211> 8
<212> PRT
<213> Homo sapiens
<400> 12
Ala Ile Asp Gly Ile Asn Gln Arg
1 5
<210> 13
<211> 9
<212> PRT
<213> Homo sapiens
<400> 13
Phe Thr Thr Asp Leu Asp Ser Pro Arg
1 5
<210> 14
<211> 18
<212> PRT
<213> Homo sapiens
<400> 14
His Gln Leu Tyr Ile Asp Glu Thr Val Asn Ser Asn Ile Pro Thr Asn
1 5 10 15
Leu Arg
<210> 15
<211> 8
<212> PRT
<213> Homo sapiens
<400> 15
Ser Val Asn Asn Val Val Val Arg
1 5
<210> 16
<211> 13
<212> PRT
<213> Homo sapiens
<400> 16
Tyr Glu Ala Ser Ile Leu Thr His Asp Ser Ser Ile Arg
1 5 10
<210> 17
<211> 12
<212> PRT
<213> Homo sapiens
<400> 17
Thr Pro Ala Tyr Tyr Pro Asn Ala Gly Leu Ile Lys
1 5 10
<210> 18
<211> 10
<212> PRT
<213> Homo sapiens
<400> 18
Val Phe Gln Gln Val Ala Gln Ala Ser Lys
1 5 10
<210> 19
<211> 9
<212> PRT
<213> Homo sapiens
<400> 19
Glu Leu Leu Glu Thr Val Val Asn Arg
1 5
<210> 20
<211> 10
<212> PRT
<213> Homo sapiens
<400> 20
Ile Tyr His Ser His Ile Asp Ala Pro Lys
1 5 10
<210> 21
<211> 8
<212> PRT
<213> Homo sapiens
<400> 21
Glu Gln Leu Thr Pro Leu Ile Lys
1 5
<210> 22
<211> 11
<212> PRT
<213> Homo sapiens
<400> 22
Asn Thr Val Ile Ser Val Asn Pro Ser Thr Lys
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ детектирования вируса SARS-CoV-2 методом масс-спектрометрии | 2021 |
|
RU2748540C1 |
| ПЕПТИДНАЯ ВАКЦИНА ДЛЯ ПРЕДУПРЕЖДЕНИЯ И ИММУНОТЕРАПИИ ДЕМЕНЦИИ АЛЬЦГЕЙМЕРОВСКОГО ТИПА | 2013 |
|
RU2811687C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АПОЛИПОПРОТЕИНА Е4 | 2017 |
|
RU2779197C2 |
| АНТИТЕЛО, КОТОРОЕ РАСПОЗНАЕТ ПЕПТИД Т14 АСНЕ | 2016 |
|
RU2729491C2 |
| ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ НЕЙРОДЕГЕНЕРАТИВНОГО НАРУШЕНИЯ ИЛИ ИНСУЛЬТА | 2018 |
|
RU2757932C2 |
| ФИЗИОЛОГИЧЕСКИ АКТИВНОЕ ВЕЩЕСТВО SRFM КАК БИОМАРКЕР КРОВИ ДЛЯ ДИАГНОСТИКИ НЕЙРОДЕГЕНЕРАТИВНЫХ НАРУШЕНИЙ И ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА | 2023 |
|
RU2822604C1 |
| ГИСТОНЫ И/ИЛИ PROADM В КАЧЕСТВЕ МАРКЕРОВ, СВИДЕТЕЛЬСТВУЮЩИХ ОБ ОРГАННОЙ ДИСФУНКЦИИ | 2017 |
|
RU2764766C2 |
| ЛЕЧЕНИЕ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2017 |
|
RU2755997C2 |
| СПОСОБ ДИАГНОСТИКИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2024 |
|
RU2837964C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ДИАБЕТИЧЕСКОЙ ФЕТОПАТИИ ПЛОДА | 2020 |
|
RU2742801C1 |

Изобретение относится к медицине, а именно к клинической диагностике, и может быть использовано для оценки риска развития болезни Альцгеймера с использованием панели двадцати двух белков. Осуществляют следующие этапы: (а) забор и пробоподготовку биологического образца пациента для получения смеси белков и дальнейшего хромато-масс-спектрометрического анализа. (б) Хромато-масс-спектрометрический анализ полученной на стадии (а) смеси белков с целью количественного анализа белков в биологическом образце на основе мониторинга множественных или выбранных, или параллельных реакций (MRM/SRM/PRM) с использованием внутренних пептидных стандартов. (в) Расчет вероятности отнесения пациента к группе пациентов с риском развития болезни Альцгеймера, с использованием обученного классификатора на основе панели из двадцати двух белков в биологическом образце, представляющих собой афамин, тромбоспондин-1, биотинидазу, аполипопротеин Е, сывороточную параоксоназу/арилэстеразу 1, комплемент C1q субкомпонент субъединицы B, альфа-2-антиплазмин, витронектин, аполипопротеин А-IV, фибронектин, белок зоны беременности, антимикробный пептид кателицидина, тенасцин, бета-цепь фибриногена, аттрактин, гамма-цепь фибриногена, аполипопротеин(а), ингибитор активатора плазминогена 1, аполипопротеин C-IV, церулоплазмин, аполипопротеин А-II и белок адгезии сосудистых клеток 1. Способ обеспечивает возможность оценки риска развития болезни Альцгеймера с высокой чувствительностью и специфичностью для широкомасштабного клинического анализа плазмы крови возрастных пациентов, как в качестве самостоятельного исследования, так и в качестве основы для создания целевых методов, за счет мультиплексного целевого (таргетного) количественного хромато-масс-спектрометрического анализа панели 22-х изотопно-меченных белков плазмы крови. 8 з.п. ф-лы, 6 ил., 1 табл., 3 пр.
1. Способ оценки риска развития болезни Альцгеймера с использованием панели двадцати двух белков, включающий следующие этапы:
(а) забор и пробоподготовка биологического образца пациента для получения смеси белков и дальнейшего хромато-масс-спектрометрического анализа;
(б) хромато-масс-спектрометрический анализ полученной на стадии (а) смеси белков с целью количественного анализа белков в биологическом образце на основе мониторинга множественных или выбранных или параллельных реакций (MRM/SRM/PRM) с использованием внутренних пептидных стандартов, где белки представляют собой афамин, тромбоспондин-1, биотинидазу, аполипопротеин Е, сывороточную параоксоназу/арилэстеразу 1, комплемент C1q субкомпонент субъединицы B, альфа-2-антиплазмин, витронектин, аполипопротеин А-IV, фибронектин, белок зоны беременности, антимикробный пептид кателицидина, тенасцин, бета-цепь фибриногена, аттрактин, гамма-цепь фибриногена, аполипопротеин(а), ингибитор активатора плазминогена 1, аполипопротеин C-IV, церулоплазмин, аполипопротеин А-II и белок адгезии сосудистых клеток 1;
(в) определение вероятности отнесения пациента к группе пациентов с риском развития болезни Альцгеймера на основе полученных на стадии б) данных и с помощью обученного классификатора посредством отнесения биологического образца к классу 1 – если присутствует вероятность риска развития болезни Альцгеймера или к классу 0 – если вероятность риска развития болезни Альцгеймера отсутствует.
2. Способ по п.1, в котором внутренние пептидные стандарты мечены стабильными изотопами (SIS).
3. Способ по п.1, в котором для количественного анализа белков могут использоваться готовые коммерческие наборы, содержащие внутренние пептидные стандарты, меченные стабильными изотопами (SIS), для мониторинга указанной панели значимых белков с использованием хромато-масс-спектрометрического анализа.
4. Способ по п.1, в котором количественный хромато-масс-спектрометрический анализ осуществляется с использованием внутренних пептидных стандартов, меченных стабильными изотопами (SIS); изобарных и тандемных меток: TMT, iTRAQ и др.; либо с использованием безметкового (label-free) подхода.
5. Способ по п.1, в котором биологический образец представляет собой кровь, плазму крови, сухую каплю крови, сыворотку крови пациента.
6. Способ по п.1, в котором хромато-масс-спектрометрический анализ относится к типу мониторинга параллельных реакций (PRM), мониторинга множественных реакций (MRM), MRM3, мониторинга выбранных реакций (SRM), DDA - сбор данных в зависимости от данных, DIA - сбор данных независимо от данных, или иммуно-MALDI (iMALDI).
7. Способ по п.1, в котором пробоподготовка биологического образца осуществляется с использованием фермента трипсина, для гидролиза белков и получения смеси полипептидов.
8. Способ по п.1, в котором хромато-масс-спектрометрический анализ концентрации двадцати двух белков осуществляется с использованием внутренних пептидных стандартов с последовательностями SEQ ID NO: 1-22.
9. Способ по п.1, в котором в результате количественного анализа белков на стадии б) измеряют концентрацию белков.
| СПОСОБ ДИАГНОСТИКИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА НА ОСНОВЕ ОПРЕДЕЛЕНИЯ ОТНОСИТЕЛЬНОГО СОДЕРЖАНИЯ ХИМИЧЕСКИ МОДИФИЦИРОВАННЫХ ФОРМ МЕТАЛЛ-СВЯЗЫВАЮЩЕГО ДОМЕНА БЕТА-АМИЛОИДА В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ | 2013 |
|
RU2548759C2 |
| WO 2019213612 A1, 07.11.2019 | |||
| WO 2016059453 A1, 21.04.2016 | |||
| US 20100167937 A1, 01.07.2010 | |||
| WO 2006110621 A2, 19.10.2006 | |||
| WO 2010012828 A2, 04.02.2010 | |||
| FEDOROVA Y | |||
| et al | |||
| Подвесная канатная дорога | 1920 |
|
SU381A1 |
| European Neuropsychopharmacology | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
Авторы
Даты
2023-04-11—Публикация
2021-12-23—Подача