Родственные заявки
По настоящей заявке испрашивается приоритет по предварительной заявке Соединенных Штатов с серийным номером 61/315,109, поданной 18 марта 2010, и предварительной заявке Соединенных Штатов с серийным номером 61/436,964, поданной 27 января 2011. Описание этих предварительных заявок включено в настоящий документ посредством ссылки, как если бы они были изложены в полном объеме.
Область техники
Настоящее изобретение относится к системе разделения клеток и в частности, к системе для извлечения определенных компонентов крови из обычной крови, плацентарной крови/пуповинной крови, костного мозга или клеток стромальной сосудистой фракции, выделенной из жировой ткани.
Уровень техники
Нормальная кровь человека в основном содержит тромбоциты, плазму, эритроциты, лейкоциты, и, в очень маленьких количествах, стволовые клетки и клетки-предшественники. В среднем (известные колебания среди индивидуумов и, с течением времени, у одного и того же индивидуума) эритроциты составляют в среднем приблизительно 99,9% от числа всех клеток крови индивидуума и составляют приблизительно 45% всего объема крови индивидуума. Эритроциты выполняют жизненно важную функцию в качестве основного средства доставки кислорода тканям организма. Почти весь оставшийся объем крови индивидуума составляет плазма, неклеточный липидный компонент крови, составляющий приблизительно 55% всего объема крови, в котором суспендированы все клетки крови.
Таким образом, свыше 99% объема обычной крови состоит из плазмы и эритроцитов. Остальное приблизительно <0,6% объема обычной крови состоит из других типов клеток крови и тромбоцитов. Тромбоциты представляют собой небольшие безъядерные клетки неправильной формы, которые численно превосходят лейкоциты в ~10 раз. Тромбоциты играют фундаментальную роль в заживлении ран путем остановки кровотечения и высвобождения многочисленных факторов роста, которые репарируют и регенерируют поврежденную ткань.
Следующими наиболее преобладающими клетками крови являются лейкоциты, численно составляющие только примерно одну десятую одного процента всех клеток крови в типичном образце крови. Однако, лейкоциты являются крайне необходимыми для иммунной системы организма и защищают организм как от инфекционных заболеваний, так и от чужеродных веществ. Лейкоциты дополнительно можно разделить на более мелкие подгруппы. Наиболее крупную, такую подгруппу как гранулоциты, составляющую приблизительно 60% всех лейкоциты, и другую, приблизительно 40%, представляющую собой мононуклеарные клетки. По всему тексту заявки использование термина лейкоциты может указывать ссылку исключительно на гранулоциты, исключительно мононуклеарные клетки, или некоторое сочетание обеих подгрупп.
Мононуклеарные клетки дополнительно можно разбить на лимфоциты и моноциты, но совместно их можно назвать мононуклеарными клетками вследствие наличия в каждой клетке одного круглого ядра. Мононуклеарные клетки являются необходимыми элементами иммунной системы, включающими Т-клетки, В-клетки и NK клетки, которые мигрируют к местам инфицирования в ткани организма и затем делятся и дифференцируются в макрофаги и дендритные клетки для запуска иммунного ответа. Наконец, сами мононуклеарные клетки дополнительно могут быть разделены на еще более мелкие подклассы - включая чрезвычайно малые количества мультипотентных гематопоэтических (кроветворных) стволовых клеток и клеток-предшественников и мезенхимальных (образующих костную, жировую, хрящевую, мышечную и кожную ткань) стволовых клеток и клеток-предшественников, и тех, и других, необходимых для здоровья человека. Другим источником мононуклеарных клеток являются клетки стромальной сосудистой фракции, которые были выделены из адипоцитов, удаленных у индивидуумов во время липосакции.
Образцы обычной крови, плацентарной/пуповинной крови или костного мозга получают свыше 25 миллионов раз в год в промышленно развитых странах мира. Поскольку образцы в основном берут либо как часть исследования при лечении заболевания, либо для непосредственного клинического лечения, наиболее часто выделяемыми клетками крови являются лейкоциты, за которыми следуют мононуклеарные клетки. Мононуклеарные клетки включают все стволовые клетки и клетки-предшественники и, приблизительно, 40% крайне важных иммунных клеток. Таким образом, клетки, в которых наиболее часто имеется необходимость, представляют только очень небольшую фракцию клеток, взятых для типичного образца.
Таким образом, если требуется относительно очищенная популяция клеток, содержащая по существу все стволовые клетки или клетки-предшественники, и по существу истощенные все эритроциты, существует необходимость в разделении компонентов крови или костного мозга, описанных выше, с тем, чтобы выделить лейкоциты или, если требуется большая чистота, мононуклеарные клетки. Эта необходимость в соответствующих эффективных процессах разделения этих клеточных популяций и сбора целевых клеток является особенно актуальной вследствие возрастающей потребности в стволовых клетках и клетках-предшественниках для исследований, клинических испытаний и мест оказания медицинской помощи.
Поразительным является интерес к стволовым клеткам и клеткам-предшественникам и проводимым на них исследованиям. По состоянию на ноябрь 2010 свыше 100800 статей по исследованию стволовых клеток было опубликовано по всему миру. В настоящее время существует по меньшей мере 7000 основных исследователей, сфокусированных на стволовых клетках и клетках-предшественниках по всему миру. Только в Соединенных Штатах существует 300 центров по исследованию стволовых клеток и приблизительно 10000 отдельных лабораторий. Поскольку в результате такого обширного исследования имеется 199 клинических испытаний со стволовыми клетками пуповинной крови, 34 клинических испытания с использованием жировой ткани и 1405 клинических испытаний с использованием стволовых клеток костного мозга в настоящее время находятся в стадии реализации по данным clinicaltrials.gov, интернет-ресурса национального института здоровья (NIH).
Обычные способы выделения и сбора определенных типов клеток из цельной крови или образца аспирата костного мозга в основном включают в себя центрифугирование образца. Во время центрифугирования популяции клеток имеют тенденцию мигрировать к относительному положению вдоль оси от меньшего к большему ускорению в соответствии с их плотностью, и концентрироваться в слоях, вытесняя другие типы клеток большей и меньшей плотности и плазму во время этого процесса.
Фиг. 1 показывает плотность и средний диаметр различных типов клеток, находящихся в крови человека. Физические различия между различными типами клеток являются важными в тех случаях, когда кровь центрифугируют. В тех случаях, когда кровь центрифугируют, клетки начинают двигаться к новым положениям со скоростями, которые согласуются со многими динамическими факторами жидкостей, в том числе, законом Стокса. Тот факт, что все клетки сохраняют слабый отрицательный заряд, препятствует прямому контакту клетка-мембрана-клетка-мембрана. В окружении, включающем главным образом плазму, с относительно малым числом клеток, чем крупнее клетка, тем быстрее она перемещается. Однако, поскольку концентрация клеток возрастает, эффект клеточного заряда начинает существенно определять скорость клеток.
Однако, во всех случаях, чем плотнее клетка, тем ниже в контейнере (то есть, дальше от оси центрифужного вращения) она будет, в конечном счете, перемещаться и оседать. Таким образом, как показано на Фиг. 2, наиболее плотные клетки, эритроциты (имеющие плотность от 1,08 до 1,12), будут перемещаться ко дну контейнера при центрифугировании. В слое эритроцитов содержащие ядра эритроциты (которые существуют как в пуповинной крови, так и в костном мозге, но не в обычной крови) будут находиться наверху эритроцитарной фракции. Сверху эритроцитов будут находиться гранулоциты (плотность 1,07-1,11), затем, в порядке движения ближе к оси вращения в контейнере, лимфоциты (плотность 1,05-1,09), моноциты (плотность 1,045-1,0750) и тромбоциты (1,03-1,065). Известно, что стволовые клетки и клетки-предшественники имеют плотность наиболее близкую к моноцитам и лимфоцитам и, следовательно, могут быть захвачены, если захватываются эти более многочисленные клетки. Используя преимущество известных пластов, которые образуются в определенных условиях, сбор одного типа клеток может быть облегчен посредством сбора только их пласта. Фиг. 2 также показывает относительную частоту встречаемости типов клеток крови в характерных образцах обычной крови, пуповинной крови и костного мозга, и, наконец, показывает, что существует некоторое перекрывание клеточных популяций, выстроенных по плотности, как будет рассмотрено ниже.
Хотя создание разделенных клеточных слоев в основном не требует ничего кроме приложения высоких ускорений сил тяжести на протяжении определенного срока, точное удаление определенного слоя клеток является проблематичным. Для иллюстрации редкости и небольшого объема некоторых клеточных популяций в данном примере, Фигуры 3, 4 и 5 подробно демонстрируют соответствующие средние объемы каждой клеточной популяции в обычной крови (НК), пуповинной крови (ПК) и костном мозге (КМ) после центрифугирования и расслоения.
Фигуры 3 и 4 иллюстрируют, что подавляющее большинство клеток представляют собой эритроциты, тогда как Фиг. 5 ясно показывает, что объемы не эритроцитарных клеточных компонентов настолько малы, что даже с 200 мл образцом пуповинной крови суммарный объем всех гранулоцитов (верхняя линия), мононуклеарных клеток средняя линия) и тромбоцитов (нижняя линия) составляет примерно 1 мл. В пуповинной крови менее 1 из каждой 1000 клеток крови (приблизительно 0,08% всех клеток) представляют собой мононуклеарные клетки. В образце пуповинной крови, включающем 10000 эритроцитов, ожидается обнаружить 40-200 тромбоцитов, 3-6 мононуклеарных клеток и 5-10 гранулоцитов.
Как объяснялось, подавляющее большинство крови как по числу клеток, так и по объему, составляет клетки, отличные от лейкоцитов. Вследствие скудности этих лейкоцитов и их нахождения в жидких растворах, заселенных огромными количествами эритроцитов, существующие в настоящее время способы выделения лейкоцитов являются (А) очень трудоемкими и отнимают много времени, требуя превосходных лабораторных методов, (В) обычно не могут осуществляться в стерильной среде, (С) обычно имеют только 50-75% показатель эффективности при захвате лейкоцитов (потеря от 25% до 50% лейкоцитов), и (D) включают процессы, которые могут оказывать неблагоприятное воздействие на функцию клеток. Принимая во внимание небольшой размер образцов крови и тот факт, что стволовые клетки и клетки-предшественники являются чрезвычайно редкими в обычной крови, может вовсе не быть стволовых клеток и клеток-предшественников при обычном сборе лейкоцитов из обычной крови и, хотя стволовые клетки и клетки-предшественники являются более многочисленными в пуповинной крови, чем в обычной крови, они все же редко встречаются в пуповинной крови.
Для дальнейшей иллюстрации трудности получения лейкоцитов из обычной крови, схематичная 50 мл тест-пробирка, обычно используемая в общепринятых способах разделения компонентов крови вручную, показана на Фиг. 6. Ширина этих пробирок обычно составляет 28 мм. После центрифугирования разделенные компоненты крови представляют собой плазму (верх) и эритроциты (дно) и почти невидимый тонкий слой, называемый «лейкотромбоцитарным слоем», расположенный между ними (увеличенный в размере на Фиг. 6 в целях иллюстрации). Этот «лейкотромбоцитарный слой» содержит почти все лейкоциты, стволовые клетки и клетки-предшественники и тромбоциты.
Хотя некоторые полуавтоматические системы для сбора лейкоцитов из цельной крови в настоящее время представлены на рынке, их преимущество в эффективности выделения клеток по сравнению с ручными способами является незначительным, и их выход на рынок сбыта является небольшим. Преобладающие в настоящее время способы выделения и захвата лейкоцитов в образце крови или костного мозга используют два технологических процесса ручной обработки (А) метод гранул с градиентом плотности и (В) метод дисков с градиентом плотности. Для диагностических и исследовательских целей оценивается, что девяносто девять раз из ста, когда лейкоциты выделяют из крови или костного мозга их выделяют с использованием этих технологий. В обоих случаях обычно используют цилиндрические пробирки для этих процессов, и оба способа основаны на точной манипуляции плотностями. Например, если целью является выделение мононуклеарных клеток, в пробирку помещают тысячи крошечных гранул или диск (чуть меньшего диаметра, чем внутренний диаметр пробирки) с плотностью приблизительно 1,08. Выбрано это конкретное значение плотности, поскольку оно является равноудаленным между средними плотностями гранулоцитов и лимфоцитов (смотри Фиг. 2). Для правильной работы обе эти технологии требуют, чтобы образец крови сначала был разбавлен количеством буфера, кратным 2-4 объемам крови.
Обращаясь сначала к методу гранул, после перемешивания забуференного образца крови с гранулами в тест-пробирке, начинают центрифугирование. Во время центрифугирования плотность гранул вызывает их объединение таким образом, что они отделяют эритроциты/гранулоциты от мононуклеарных клеток/тромбоцитов. Фиг. 7 иллюстрирует этот процесс с гранулами градиента плотности Ficoll, отделяющими мононуклеарные клетки от эритроцитов/гранулоцитов.
Способ использования дисков с градиентом плотности является аналогичным и проиллюстрирован на Фиг. 8. Здесь диски плотностью 1,08 перемещаются под действием центрифугирования к границе раздела фаз между лимфоцитами и гранулоцитами. Однако, диски с наибольшим градиентом плотности имеют одну особенность, которой нет у описанных выше гранул: они содержат полость между верхним и нижним дисками, где предположительно будут оседать мононуклеарные клетки, таким образом до некоторой степени упрощая стадию сбора мононуклеарных клеток через гибкую трубку, которая проходит между полостью и верхом пробирки.
Эти способы вручную выделять и захватывать мононуклеарные клетки из образца крови требуют терпения и отличной ловкости рук. Эти способы обычно требуют от 1 1/2 до 2 часов выполнения и даже с наработанными методами, выход мононуклеарных клеток зачастую составляет менее 60%. Таким образом, немеханизированные методы, обычно используемые для сбора и захвата мононуклеарных клеток в образце крови, являются менее оптимальными по точности и скорости, вследствие многочисленных ограничений в этой методике.
Во-первых, растворы с градиентом плотности осуществляют выделение популяции лейкоцитов из крови или костного мозга, основываясь только на физическом факторе - плотности. С началом центрифугирования среда с градиентом плотности перемещается в положение, в котором она всплывает в клеточном растворе и останавливается. Обычно это перемещение клеточных популяций к их конечным положениям происходит во время ускорения и периода времени, каждый из которых является фиксированным, и таким образом, в редких случаях оптимальным для индивидуального образца крови.
Главным образом эффективность сбора лейкоцитов или мононуклеарных клеток обеих методик с использованием градиента плотности ограничена необходимостью установки в центре расхождения между средней плотностью кривых нормального распределения гранулоцитов и лимфоцитов (т.е., 1,08), как упомянуто выше в отношении Фиг. 2. Как поясняет Фиг. 2, эта фиксированная плотность безусловно не исключает все гранулоциты или даже все эритроциты и к тому же удаляла некоторое количество необходимых лимфоцитов.
Этот упрощенный подход также не учитывает тот факт, что даже у здоровых людей существует значительное колебание числа и плотности клеток каждого типа и скорости седиментации среди образцов могут различаться на целый порядок величин. Далее, если пациент имеет определенные заболевания, изменения относительно клеточных популяций и скоростей седиментации клеток может быть значительно больше - вплоть до двух порядков величины. Следовательно, эти примитивные методики выделения лейкоцитов или мононуклеарных клеток крайне редко являются оптимальными для какого-либо конкретного образца крови.
Наилучший путь осознать серьезность этого ограничения - понять, что клетки в образце крови, равномерно распределенные по всему объему до центрифугирования, начинают быстрое движение к новому местоположению, когда начинается центрифугирование. Эффективность методики выделения лейкоцитов или мононуклеарных клеток зависит от того, насколько точно все лейкоциты оказываются в одном и том же пласте в конце движения - и насколько хорошо лабораторный работник может экстрагировать лейкоциты из их местоположения пипеткой при нормальных условиях 1 G, при которых клетки начнут снова перемешиваться только при малейшем движении контейнера или малейшем движении наконечника пипетки.
Ученые в течение длительного времени изучали скорость, при которой эритроциты из обычной крови перемещаются вниз контейнера в условиях 1 G. Это измерение называют скоростью осаждения эритроцитов, или СОЭ. Хотя центрифужное ускорение, используемое в обычных процессах выделения мононуклеарных клеток, ускоряет эту скорость осаждения, они не изменяют процентного изменения скоростей седиментации различных типов клеток. Далее, поскольку эритроциты в 1000 раз более многочисленны, чем лейкоциты и в 2000 раз более многочисленны, чем мононуклеарные клетки, и все клетки сохраняют слабый отрицательный заряд, миграция эритроцитов оказывает наибольшее влияние на выделение популяций лейкоцитов.
СОЭ (измеренная в миллиметрах в час - мм/час) у взрослых различных возрастов показана на Фиг. 9. Было обнаружено, что у детей нормальные значения СОЭ составляют от 1 до 2 мм/час при рождении, повышаясь до 4 мм/час через 8 дней после родов, а затем до 17 мм/час к 14 дню (изменение более чем на порядок величины менее чем за две недели). СОЭ настолько изменчива, что ее используют для диагностики злокачественных заболеваний, таких как множественная миелома, различные аутоиммунные заболевания, такие как ревматоидный артрит, и хронических заболеваний почек, при которых СОЭ может превышать 100 мм/час, в пять раз, чем у здорового взрослого человека.
Далее, отмечено, что лейкоциты на дне контейнера могут только двигаться вверх, чтобы присоединиться к тем, которые опускаются сверху контейнера, как результат нахождения на поверхности поднимающейся плазмы, перемещенной опускающимися эритроцитами. Следует отметить, что очень небольшое число лейкоцитов в растворе должно реализовать свой путь наверх против потока эритроцитов, в тысячу раз более многочисленных, двигающихся в противоположном направлении через один и тот же вертикальный канал. Далее, поскольку ускорение и длительность центрифугирования программируют в начале движения, длительность, которая является достаточной для перемещения всех клеток в конкретном образце, может быть недостаточной для многих других образцов крови в том смысле, что большинство эритроцитов могут не достичь дна пробирки, и, следовательно, многие целевые лейкоциты могут не подняться на поверхность «лейкотромбоцитарного» пласта поднимающейся плазмой. Поскольку этот процесс имеет место в закрытой центрифуге в быстро вращающемся роторе, лаборант не может наблюдать истинное движение клеток.
Таким образом, существует необходимость в системе, которая оптически отслеживает в режиме реального времени перемещение клеточных популяций в каждом отдельном образце крови во время центрифугирования. Такая система позволила бы индивидуально обрабатывать каждый отдельный образец крови в соответствии с конкретным размером и плотностью составляющих образец крови популяций клеток. Это улучшенное решение также сильно увеличило бы эффективность сбора целевых клеточных популяций лейкоцитов или мононуклеарных клеток.
Еще одним недостатком сред с градиентом плотности является то, что для них требуются буферы, которые занимают большую часть объема данной пробирки для сбора клеток, сводя к минимуму объем крови, из которого собирают лейкоциты. Буфер зачастую занимает от 70% до 90% 50 мл объема обычной пробирки для сбора клеток, оставляя пространство только для 5 - 15 мл крови. Следовательно, лабораторный работник, которому надо собрать лейкоциты из 100 мл крови должен использовать от 7 до 20 тест-пробирок, дополнительно увеличивая трудозатраты, необходимые для достижения цели. Кроме того, для достижения соответствующей очистки от загрязнений в конечной популяции лейкоцитов, гранулярные среды с градиентом плотности и буферы необходимо будет вымывать, неизбежно вызывая дополнительную потерю целевых клеток.
Таким образом, существует необходимость в средствах для истощения нежелательных клеток в образце крови или костного мозга, для которых не требуются объемные среды с градиентом плотности или буферы. Эти средства необязательно могут позволить собрать лейкоциты из образов большого объема, дополнительно увеличивая число составляющих клеток, которые могут быть извлечены для диагностического или клинического применения.
Третьим недостатком способов разделения крови, основанных на градиенте плотности, описанных выше, является то, что параллельные вертикальные стенки пробирки для сбора клеток с помощью градиента плотности не способствуют подъему лейкоцитов во время центрифугирования таким образом, чтобы они располагались поверх эритроцитов. Тест-пробирки для сбора клеток с помощью градиента плотности в обычных системах имеют вертикальные параллельные стенки, означающие, что во время центрифугирования все клетки либо падают, либо поднимаются вертикально вдоль оси пробирки. Как описано выше, каждый восходящий лимфоцит должен преодолеть тысячи эритроцитов, двигающихся в противоположном направлении. Параллельные вертикальные стенки тест-пробирок для сбора клеток не обеспечивают латерального движения для движения эритроцитов вниз и движения лейкоцитов вверх, что могло способствовать подъему лейкоцитов во время центрифугирования. В результате центрифугирования часть лейкоцитов, которые начинают цикл вращения на дне пробирки, могут не подняться к собираемому «лейкотромбоцитарному» слою на протяжении выбранного режима центрифугирования.
Таким образом, существует необходимость преодолеть перехватывание лейкоцитов на дне тест-пробирки путем использования камеры для сбора клеток в форме воронки, которая полностью сужена на дне, так, чтобы большинство опускающихся эритроцитов толкались к центру, усиливая вихревое движение во главе с наиболее легкими из эритроцитов, поднимаясь вверх объема эритроцитов. В свою очередь эти вихревые потоки способствуют подъему гораздо менее многочисленных, но более плавучих лейкоцитов.
Четвертым недостатком способов разделения, основанных на градиенте плотности, является постоянная большая площадь поперечного сечения тест-пробирки для сбора клеток с использованием градиента плотности в том месте, где мононуклеарные клетки собирают вручную при 1 G.
Поскольку стенки стандартной 50 мл пробирки для сбора клеток с использованием градиента плотности являются фиксированными ~28 мм в стороны, очень маленький объем мононуклеарных клеток из 10 мл образца периферической крови (~0,028 мл) распределяется по всей площади поперечного сечения пробирки (~615 мм2) в тонком слое (~0,023 мм), который является почти невидимым. Вследствие этой широкой площади поперечного сечения и получающегося в результате тонкого слоя мононуклеарных клеток, расслаивающие эффекты разности плотностей между клеточными популяциями являются очень маленькими. Следовательно, для сбора мононуклеарных клеток при 1 G требуется высококвалифицированный лаборант, чтобы медленно и осторожно ввести наконечник пипетки в этот очень тонкий слой клеток, который плавает между градиентом плотности (снизу) и плазмой (сверху), а затем осторожно втянуть мононуклеарные клетки в пипетку. Однако, очень небольшие колебания плотности между клеточными популяциями, в тех случаях, когда не увеличена существенными центробежными силами, и огромная площадь поперечного сечения пробирки объединяют усилия для удерживания мононуклеарных клеток/тромбоцитов по существу всех в одном и том же тонком вертикальном слое. Следовательно, никакие старания во время процесса аспирации вручную, не предотвращают взмучивания слоя мононуклеарных клеток/тромбоцитов и среды с градиентом плотности, поэтому в результате происходит потеря мононуклеарных клеток и существенное загрязнение клеток гранулами с градиентом плотности. Таким образом, не является редкостью потеря ~25-40% мононуклеарных клеток во время той методики.
Таким образом, существует необходимость избежать потерь во время сбора мононуклеарных клеток путем истощения эритроцитов и большинства гранулоцитов за счет использования узкой площади поперечного сечения выхода воронки, в то время как основное центрифугирование поддерживает целостность и чистоту клеточных пластов и расширяет их вертикально, при их опускании по конусовидной воронке.
Пятый недостаток обычных систем, основанных на гранулах с градиентом плотности, имеет место вследствие непосредственного контакта между гранулами с градиентом плотности и клетками. Сообщалось, что всесторонний прямой контакт между этими гранулами и собираемыми клетками повреждает клеточную функцию вследствие образования токсичности. Например, Yuhan Chang, et al недавно сообщали в статье «The Efficiency of Percoll and Ficoll Density Gradient Media in the Isolation of Marrow Derived Human Mesenchymal Stem Cells with Osteogenic Potential)) (Chang Gung Med J 2009; 32:264-75), что при проведении тестов на цитотоксичность на CFU-Fs (один пассаж) путем культивирования со смесью контрольной среды и Percoll или Ficoll в серийных разведениях для определения ингибирующих рост или цитотоксических эффектов этих двух градиентных сред, CFU-Fs демонстрировали увеличенную клеточную гибель по мере увеличения отношения градиентной среды в обеих группах.
Таким образом, существует необходимость в обеспечении истощения эритроцитов или эритроцитов и гранулоцитов, или эритроцитов, гранулоцитов и тромбоцитов, или эритроцитов, гранулоцитов и мононуклеарных клеток, не требующего добавления гранул с градиентом плотности или любого другого чужеродного вещества, которое может изменить или нарушить функцию клеток.
Шестым недостатком общепринятых способов разделения крови с использованием или без использования гранул с градиентом плотности, является вероятность того, что значительное число эритроцитов может оставаться в конечном продукте вследствие различий в профессиональных навыках лаборантов и легкого повторного перемешивания клеток по неосторожности при 1 G. Некоторые недавние исследования особо подчеркнули важность минимизации эритроцитарного загрязнения, поскольку такое загрязнение снижает эффективность медицинской помощи с использованием эти мононуклеарных клеток.
Большое количество примеров таких неблагоприятных эффектов эритроцитарного загрязнения смотри, например, в «Red Blood Cell Contamination of the Final Cell Product Impairs the Efficacy of Autologous Bone Marrow Mononuclear Cell Therapy)), Assmus et al., Journal of the American College of Cardiology, 55.13, 2010, где описано, что контаминирующие эритроциты неблагоприятно воздействуют на функциональность выделенных клеток костного мозга и определяют степень восстановления фракции выброса левого желудочка после интракоронарной инфузии клеток костного мозга у пациентов с острым инфарктом миокарда. Смотри, также, uPacked Red Blood Cells Suppress T-Cell Proliferation Through a Process Involving Cell-Cell Contact», Bernard et al., The Journal of Trauma, Injury, Infection, and Critical Care, 69.2, Aug. 2010, где описывается, что сохраненные эритроциты оказывают мощное ингибирующее действие на пролиферацию Т-клеток и вероятно, что аналогичная суппрессия Т-клеточной пролиферации могла иметь место in vivo после переливания крови, и может являться основным вкладом в связанную с трансфузией иммуномодуляцию.
Таким образом, существует необходимость обеспечить большее и более предсказуемое извлечение эритроцитов, гранулоцитов и, возможно, тромбоцитов из собранного образца обычной или пуповинной крови, костного мозга или клеток сосудистой стромальной фракции из жировой ткани для получения более чистого раствора, содержащего стволовые клетки и клетки-предшественники.
Несколько коммерчески доступных систем, которые автоматизировали этот процесс разделения и истощения клеток (такие как Hemonetics V50, Cobe Spectra, Sepax System от Biosafe SA, Швейцария, и Thermogenesis АХР от Thermogenesis Corp., Калифорния) также имеют существенные недостатки и не осуществляли улучшенного извлечения очищенных лейкоцитов по сравнению с общепринятыми средствами вручную. Дополнительным недостатком является то, что эти коммерчески доступные автоматизированные системы для работы требуют дорогостоящего производственного оборудования. Эти автоматизированные устройства стоят десятки тысяч долларов и занимают значительное пространство лаборатории, если требуется значительная продукция единиц очищенных лейкоцитов - например, с банками стволовых клеток пуповинной крови, которые могут перерабатывать от 40 до 200 единиц в день. Фиг. 10 иллюстрирует стоимость обработки четырех единиц крови двумя системами, известными из уровня техники и системой по настоящему изобретению.
Вторым недостатком коммерчески доступных в настоящее время автоматизированных систем является то, что для них требуются сложные, дорогие, трудные для производства наборы мешков для одноразового использования, соединенные вместе с прочными соединительными трубками для обработки клеток, как показано на Фиг. 11. Эти наборы мешков занимают приблизительно пять минут для правильной загрузки в специализированные устройства и для готовности системы для обработки крови или костного мозга. Эти наборы мешков, известные из уровня техники, являются сложными и дорогостоящими для производства. Как показано на Фиг. 11, эти наборы мешков, известные из уровня техники требуют более 20 отдельно сформированных клеевых соединений.
Таким образом, существует необходимость в более простой, менее дорогостоящей, более быстрой и более простой в использовании автоматизированной системе, которая также способна осуществлять более высокое извлечение лейкоцитов с меньшим загрязнением эритроцитами. Дополнительно существует необходимость в системе, в которой используется простой, недорогой для производства одноразовый контейнер для переработки, для которого не требуются многочисленные мешки и сложные соединительные трубки.
Фиг. 12 иллюстрирует простоту настоящего изобретения, в котором предлагается единый цилиндрический картридж, в котором происходит вся обработка клеток и в котором располагаются все компоненты, относящиеся к расслоению и истощению клеток. Всего через одну или две секунды этот картридж может фиксироваться наверху специализированного блока управления и быть готов для вставки в чашу центрифуги. Блок управления содержит оптические и гравитационные сенсорные устройства, а также средства для контроля активности в картридже.
Этот единый картридж выигрывает от точности производства литьевым прессованием и является гораздо более простым и рациональным по трудозатратам для конструирования, чем общепринятые для обработки изделия одноразового использования для автоматизированных систем предшествующего уровня техники, обычно содержащие многочисленные наборы мешков и сложные соединяющие трубки, соединенные с ними.
Таким образом, первой целью настоящего изобретения является оптическое отслеживание миграции клеточных популяций для каждого отдельного образца крови, и затем истощение определенных типов клеток путем перенаправления их во второй контур и отдельный отсек в том же самом картридже во время центрифугирования.
Второй целью настоящего изобретения является обеспечение селективного истощения по существу всех нежелательных типов клеток, не требующего занимающих объем сред с градиентом плотности и буферов.
Третьей целью настоящего изобретения является предоставление жесткой воронкообразной камеры для сбора клеток, которая значительно уже в донной части, так, чтобы опускающиеся эритроциты вынуждены были двигаться к центру воронки, тем самым усиливая вертикальные вихревые потоки, которые двигают наиболее легкие эритроциты, поднимая наверх объема эритроцитов, что способствует подъему гораздо менее многочисленных, но более плавучих лейкоцитов к исходному уровню расслоения и концентрации.
Четвертой целью настоящего изобретения является предоставление единого картриджа, в котором происходит вся обработка клеток и в котором расположены все компоненты, относящиеся к расслоению и истощению клеток при завершении центрифугирования. Этот картридж можно легко, быстро и с возможностью снятия фиксировать на контрольном модуле, который при центрифугировании для опоры основывается на своей собственной прочности, а не на прочности структуры, в которую он вставлен. Этот картридж предпочтительно содержит по меньшей мере три жестких отсека: (1) эритроцитарный отсек, в который направляется масса эритроцитов и, при выборе оператора, нежелательные гранулоциты; (2) отсек для стволовых клеток (SC), в который направляются целевые лейкоциты, которые могут включать, по выбору оператора, гранулоциты, лимфоциты, моноциты, стволовые клетки и клетки-предшественники и/или тромбоциты; и (3) собирающую воронку, которая первоначально содержит весь образец крови или костного мозга и удерживает после обработки любое избыточное количество плазмы.
Пятой целью настоящего изобретения является создание слоя лейкоцитов в воронке, который при вынужденном движении сверху вниз под действием центробежной силы, сталкивается с частью воронки уменьшенного диаметра, тем самым вызывая вертикальное увеличение толщины указанного лейкоцитарного слоя.
Шестой целью настоящего изобретения является предоставление способа расслоения образца крови на эритроциты, гранулоциты, мононуклеарные клетки, тромбоциты и плазму, и точного открытия и закрытия определенных клапанов на границе раздела между определенными клеточными слоями.
Седьмой целью настоящего изобретения является предоставление способа сбора более высокого процента лейкоцитов при одновременном истощении более высокого процента эритроцитов, чем получают с использованием общепринятых ручных или автоматизированных систем и без необходимости использования средств, осаждающих эритроциты, таких как гидроксиэтилкрахмал.
Восьмой целью настоящего изобретения является обеспечение достижения указанных выше семи целей со сниженной стоимостью по сравнению с существующими общепринятыми ручными или автоматизированными системами.
Эти и другие цели, преимущества, существенные признаки и аспекты настоящего изобретения станут очевидны по ходу следующего описания. Для осуществления указанных выше и связанных с ними целей, настоящее изобретение, следовательно, включает в себя существенные признаки здесь и далее описанные полностью и, в частности, указанные в формуле изобретения, следующем описании и прилагаемых чертежах, излагающих подробно некоторые иллюстрирующие варианты осуществления настоящего изобретения, служащие признаком, однако, лишь нескольких различных путей, в которых может быть использована сущность настоящего изобретения.
Сущность изобретения
Настоящее изобретение относится к способу и устройству для извлечения эритроцитов из образца крови и, в некоторых случаях, извлечения гранулоцитов и, в других случаях, тромбоцитов, указанный способ включает в себя центрифугирование держателя на основе картриджа и сепаратора клеточных растворов. На Фиг. 13 показан простой схематический обзор процесса, описанного в настоящем изобретении. В настоящем изобретении селективно извлекаются по существу все нежелательные эритроциты и, по желанию лаборанта, также извлекаются некоторые лейкоциты (предпочтительно гранулоциты), а также, по желанию лаборанта, извлекаются тромбоциты из образца крови или костного мозга, таким образом, чтобы оптимально выделить, а затем собрать очищенные мононуклеарные клетки. Настоящее изобретение в предпочтительном варианте осуществления включает одноразовый жесткий пластиковый картридж, в котором происходит вся обработка и в котором все клеточные популяции, тромбоциты и плазма могут быть распределены во время центрифугирования. В настоящем изобретении устраняется необходимость в гранулах или дисках с градиентом плотности. В настоящем изобретении также устраняется необходимость в наборах непрочных тонкопленочных пластиковых мешков и их усложненное и трудоемкое соединение трубками, что приводит к протечкам во многих склеенных соединениях, и в которых неизбежно застревают мононуклеарные клетки и стволовые клетки-предшественники, которые не могут быть впоследствии извлечены. Настоящее изобретение дополнительно относится к простому в использовании фиксирующему картриджу, содержащему внутреннюю воронку с определенным образом сужающемся поперечным сечением для оптимизации протока клеток в гравитационном колодце и для вертикального расслоения клеточных популяций.
Как показано на Фиг. 13, при использовании при высоком ускорении силы тяжести, лейкоциты могут первыми выделяться слоями из образца периферической или пуповинной крови, костного мозга или раствора клеток сосудистой стромальной фракции, удаленных из жировой ткани. Затем, дополнительно, более низкое ускорение силы тяжести, указанное устройство и способ дают возможность центробежной силе толкать клетки от оси вращения и направлять эритроциты от дна воронки в содержащийся отсек. В силу того, что расслоенные лейкоциты входят в пространство уменьшающегося диаметра ранее занятое уходящими эритроцитами, формируется диск лейкоцитов и мононуклеарных клеток уменьшающегося радиуса и вертикально увеличивающейся толщины.
Удаляя эритроциты во время центрифугирования, слой лейкоцитов между слоем эритроцитов и слоем плазмы движется вниз в эту узкую часть воронки к той точке, в которой лейкоциты и мононуклеарные клетки находятся в верхней секции сужающейся воронки. В дальнейшем по мере удаления эритроцитов либо в отсек для извлечения эритроцитов, либо предварительного захвата лейкоцитов в отсек стволовых клеток, стратифицированные слои вертикально удлиняются, тем самым облегчая удаление только желаемых типов клеток.
Должно быть понятно, что могут быть использованы концевые части воронок различных окружностей и геометрических форм, как показано на Фиг. 14. Эти различные окружности и геометрические формы изменяют скорость потока и плотность клеток, и, как следствие, оптические считывания инфракрасных датчиков, по мере движения клеток в направлении выхода из воронки.
В предпочтительном варианте осуществления система оптического измерения идентифицирует каждый тип клеточной популяции по мере их выхода из воронки. Система оптического измерения связана с одним или более клапанных приспособлений для направления и контроля потока определенных популяций клеток в одно или два местоположения. Например, и как проиллюстрировано на Фиг. 13, по мере прохождения стратифицированного слоя лейкоцитов системы оптического измерения, лейкоциты могут быть направлены во вторичный отсек, извлекающий стволовые клетки в одноразовом картридже. Затем лейкоциты можно заставлять двигаться под действием давления жидкости, и клетки позади/выше лейкоцитов сначала перпендикулярно оси вращения, а затем выше в направлении оси вращения в вертикальную трубу в отсек, извлекающий стволовые клетки.
Настоящее изобретение дополнительно может включать средства для наблюдения за гравитационным полем с течением времени и для предоставления данных, крайне необходимых как для извлечения эритроцитов, так и, необязательно, гранулоцитов и/или тромбоцитов из образца.
Краткое описание чертежей
Вышеизложенные аспекты и многие преимущества, присущие настоящему изобретению станут более понятными со ссылкой на следующее подробное описание, взятое в сочетании с прилагаемыми схемами и фигурами, на которых:
Фиг. 1 представляет собой график зависимости плотности и среднего диаметра различных типов клеток, находящихся в крови человека;
Фиг. 2 представляет собой график, показывающий различные плотности разных типов клеток, находящихся в крови человека;
На Фиг. 3 представлена таблица пропорционального объема клеточных популяций после центрифугирования;
На Фиг. 4 представлена таблица объема клеток в различных объемах антикоагулированной крови;
Фиг. 5 представляет собой график зависимости объема центрифугированных клеточных популяций от объема антикоагулированной крови;
На Фиг. 6 представлена диаграмма, показывающая слои, на которые разделяется кровь человека во время центрифугирования в стандартной тест-пробирке;
На Фиг. 7 представлена диаграмма, показывающая слои, на которые смесь крови человека и добавки Фиколла разделяется после центрифугирования;
На Фиг. 8 представлена диаграмма, показывающая, как кровь человека разделяется при центрифугировании с дисками для разделения крови в стандартной тест-пробирке;
На Фиг. 9 представлена таблица значений СОЭ в среднем у мужчин и женщин разных возрастов.
Фиг. 10 представляет собой графическое изображение, которое иллюстрирует сравнительную стоимость обработки четырех образцов крови несколькими системами предшествующего уровня техники с системой по настоящему изобретению;
Фиг. 11 представляет собой графическое изображение, показывающее сравнительную сложность одноразового компонента систем разделения крови предшествующего уровня техники и в соответствии с настоящим изобретением;
Фиг. 12 представляет собой детальное графическое изображение одноразового картриджа и блока управления в соответствии с настоящим изобретением;
На Фиг 13 показано графическое изображение, представляющее в общих чертах процесс в соответствии с настоящим изобретением;
На Фиг. 14 представлен вид в поперечном разрезе нескольких вариантов выполнения носика воронки по настоящему изобретению;
На Фиг. 15 представлено частичное перспективное изображение каркаса одноразового картриджа, блока управления и различных характеристик блока управления и картриджа по настоящему изобретению;
На Фиг. 16 представлено изображение в разобранном виде одноразового картриджа, блока управления и приводимой в качестве примера чаши центрифуги по настоящему изобретению;
На Фиг. 17 представлено перспективное изображение блока управления по настоящему изобретению.
На Фиг. 18а представлен боковой вид каркаса одноразового картриджа с отмеченной линией разреза А-А;
На Фиг. 18b представлено перспективное изображение одноразового картриджа, разрезанного вдоль линии А-А.
На Фиг. 19 представлено перспективное изображение поперечного среза одноразового картриджа с узким дном воронки;
На Фиг. 20 представлено изображение поперечного сечения в предпочтительном варианте осуществления до центрифугирования;
На Фиг. 21 представлено изображение поперечного сечения в предпочтительном варианте осуществления во время центрифугирования;
Фиг. 22 представляет вид в поперечном разрезе части клапанной системы по настоящему изобретению предпочтительного варианта осуществления в соответствии с настоящим изобретением во время центрифугирования;
Фиг. 23 представляет подробный вид консольной конструкции клапанной системы альтернативного варианта осуществления настоящего изобретения;
Фиг. 24 представляет подробное изображение в перспективе кулачковой части в соответствии с предпочтительным вариантом осуществления настоящего изобретения;
Фиг. 25 представляет вид в поперечном разрезе гибкого шланга в соответствии с предпочтительным вариантом осуществления настоящего изобретения, показывающий относительный размер различных клеток, находящихся в крови человека, и гибкого шланга;
Фиг. 26 представляет вид в поперечном разрезе предпочтительного варианта осуществления настоящего изобретения после 10 минутного центрифугирования;
Фиг. 27 представляет подробный вид в поперечном разрезе оптической считывающей части предпочтительного варианта осуществления настоящего изобретения;
Фиг. 28 представляет подробный вид в поперечном разрезе системы клапанов, напорной трубы, камеры для сбора эритроцитов и камеры для сбора стволовых клеток в предпочтительном варианте осуществления настоящего изобретения во время истощения эритроцитов;
Фиг. 29 представляет подробный вид в поперечном разрезе системы клапанов, напорной трубы, камеры для сбора эритроцитов и камеры для сбора стволовых клеток' в предпочтительном варианте осуществления настоящего изобретения во время истощения эритроцитов и гранулоцитов;
Фиг. 30 представляет подробный вид в поперечном разрезе системы клапанов, напорной трубы, камеры для сбора эритроцитов и камеры для сбора стволовых клеток в предпочтительном варианте осуществления настоящего изобретения после истощения эритроцитов и гранулоцитов;
Фиг. 31 представляет нанесенные на график величины, измеренные с помощью 1-го положения пары излучение/улавливание в предпочтительном варианте осуществления настоящего изобретения во время истощения мононуклеарных клеток;
Фиг. 32 представляет подробный вид в поперечном разрезе системы клапанов, напорной трубы, камеры для сбора эритроцитов и камеры для сбора стволовых клеток в предпочтительном варианте осуществления настоящего изобретения во время истощения мононуклеарных клеток долива плазмы;
Фиг. 33 представляет подробный вид в поперечном разрезе воронки, системы клапанов, напорной трубы, камеры для сбора эритроцитов и камеры для сбора стволовых клеток в альтернативном варианте осуществления, где центрифугирование останавливают после истощения эритроцитов и гранулоцитов;
Фиг. 34 представляет подробный вид в поперечном разрезе воронки, системы клапанов, напорной трубы, камеры для сбора эритроцитов и камеры для сбора стволовых клеток в альтернативном варианте осуществления, где центрифугирование останавливают после истощения эритроцитов и гранулоцитов и картридж целиком встряхивают таким образом, чтобы смешать оставшуюся плазму, мононуклеарные клетки и тромбоциты;
Фиг. 35 представляет подробный вид в поперечном разрезе воронки, системы клапанов, напорной трубы, камеры для сбора эритроцитов и камеры для сбора стволовых клеток в альтернативном варианте осуществления, где картридж центрифугируют второй раз при низком ускорении силы тяжести и в течение меньшего времени, таким образом, чтобы собрать по существу все мононуклеарные клетки, но только малую часть тромбоцитов;
Фиг. 36 представляет подробный вид в поперечном разрезе воронки, системы клапанов, напорной трубы, камеры для сбора эритроцитов и камеры для сбора стволовых клеток в альтернативном варианте осуществления после остановки центрифугирования и сбора мононуклеарных клеток, плазмы и небольшой части тромбоцитов в отсеке для сбора стволовых клеток;
Фиг. 37 представляет подробный вид в поперечном разрезе воронки, системы клапанов, напорной трубы, камеры для сбора эритроцитов и камеры для сбора стволовых клеток в альтернативном варианте осуществления, в котором желательно, чтобы гранулоциты находились в отсеке для сбора стволовых клеток; и
Фиг. 38 представляет изображение в перспективе картриджа в предпочтительном варианте осуществления настоящего изобретения, показывающее пробирку для сбора стволовых клеток и пробирку для сбора эритроцитов/гранулоцитов.
Подробное описание изобретения
Последующее описание приводится для того, чтобы позволить специалисту в данной области изготовить и применить разнообразные аспекты и примеры настоящего изобретения. Описание конкретных материалов, методик и областей применения приводится только в качестве примеров. Специалисту в данной области будут очевидны различные модификации для описанных в настоящем документе примеров, и общие принципы, определенные в настоящем документе, могут быть применены по отношению к другим примерам и областям применения без отступления от существа и объема изобретения. Таким образом, настоящее изобретение не ограничивается описанными и показанными примерами, но оно согласуется с объемом, соответствующим прилагаемой формуле изобретения.
Заявителем раскрываются способ и устройство для удаления из образца крови эритроцитов, в некоторых обстоятельствах - удаления из образца крови конкретных гранулоцитов, а в других обстоятельствах - тромбоцитов. В предпочтительном варианте осуществления настоящего изобретения это фактическое полное удаление достигается посредством центрифугирования таким образом, чтобы оптимально изолировать и затем выделить лейкоциты, включая практически все стволовые клетки и клетки-предшественники.
Более конкретно, изобретение относится к способу извлечения по меньшей мере одного из следующего: эритроцитов, гранулоцитов или тромбоцитов из образца, содержащего кровь, костный мозг или клетки стромальной сосудистой фракции, выделенные из жировой ткани, при этом указанный способ включает:
a. размещение жесткого картриджа в центрифуге, при этом указанный жесткий картридж содержит жесткую камеру, имеющую край, который соединен по текучей среде с системой клапанов, которая сначала закрыта, первый жесткий отсек для хранения, и второй жесткий отсек для хранения;
b. перенос указанного образца в указанную жесткую камеру, при этом указанный образец содержит тромбоциты, плазму, клетки высокой плотности и клетки низкой плотности;
c. центрифугирование указанного жесткого картриджа таким образом, что указанный образец вынужден двигаться в направлении указанного края под действием первой динамической нагрузки по меньшей мере 10 G, а затем под действием второй динамической нагрузки, меньшей чем первая динамическая нагрузка;
d. обеспечение первого пути для указанных клеток высокой плотности через указанный край и в указанный первый жесткий отсек для хранения;
e. наблюдение за миграцией указанных клеток высокой плотности через указанный край; и
f. обеспечение второго пути для указанных клеток низкой плотности и некоторого количества тромбоцитов и плазмы через указанный край и в указанный второй жесткий отсек для хранения.
В одном аспекте изобретения в указанном способе наблюдение осуществляют оптически.
В другом аспекте изобретения в указанном способе на стадии обеспечения используют указанную систему клапанов.
Еще в одном аспекте изобретения в указанном способе указанная жесткая камера обычно имеет коническую форму.
В другом аспекте изобретения указанный способ дополнительно включает определение указанной первой и второй динамической нагрузки.
В другом аспекте изобретения указанный способ дополнительно включает извлечение по меньшей мере одного дополнительного типа клеток из указанного образца.
В другом аспекте изобретения указанный способ дополнительно включает стадии: (а) замедления вращения указанного жесткого картриджа до динамической нагрузки 1 G после указанной стадии центрифугирования и где часть указанного образца остается в указанной жесткой камере; (b) встряхивания указанного жесткого картриджа для перемешивания указанной части; и (с) центрифугирования указанного жесткого картриджа до динамической нагрузки превышающей 1 G для последующей обработки.
Еще в одном аспекте изобретения в указанном способе множество гибких трубок соединяют указанную жесткую камеру с указанными первым и вторым жесткими отсеками, и где указанные гибкие трубки имеют соотношение длины к диаметру не превышающее 20.
В другом аспекте изобретения в указанном способе система клапанов включает эксцентрик и гибкую трубку.
В другом аспекте изобретения в указанном способе бусину с антителом вводят в указанный образец до указанной стадии обеспечения. При этом, указанная бусина с антителом может иметь приблизительно такую же плотность, как эритроциты. Кроме того, указанная бусина с антителом способна держаться на поверхности плазмы.
В другом аспекте изобретения в указанном способе указанный образец дополнительно содержит флуоресцентное вещество.
В другом аспекте изобретения указанный способ дополнительно включает стадию слежения за указанным флуоресцентным веществом. Кроме того, указанный способ дополнительно может включать стадии: (а) замедления вращения указанного жесткого картриджа до динамической нагрузки 1 G после указанной стадии центрифугирования и где часть указанного образца остается в указанной жесткой камере; (b) встряхивания указанного жесткого картриджа для перемешивания указанной части; и (с) центрифугирования указанного жесткого картриджа до динамической нагрузки превышающей 1 G для последующей обработки. При этом, указанный способ может предусматривать введение бусины с антителом указанный образец до указанной стадии обеспечения, где указанная бусина с антителом приблизительно может иметь такую же плотность, как эритроциты. При этом, указанная бусина с антителом способна держаться на поверхности плазмы. Кроме того, в указанном способе указанный образец дополнительно может содержать флуоресцентное вещество. При этом, указанный способ может дополнительно включать стадию слежения за указанным флуоресцентным веществом.
Еще в одном другом аспекте изобретения, указанный способ дополнительно включает стадию добавления вещества, ускоряющего седиментацию эритроцитов.
В другом воплощении настоящее изобретение также обеспечивает способ извлечения по меньшей мере одного из следующего: эритроцитов, гранулоцитов или тромбоцитов из образца, содержащего кровь, костный мозг или клетки стромальной сосудистой фракции, выделенные из жировой ткани, при этом указанный способ включает:
a. предоставление:
i. центрифуги, имеющей ось вращения; и
ii. образца, содержащего плазму и первую часть с высокой плотностью и оставшуюся часть с низкой плотностью;
iii. жесткий картридж, содержащий:
1. внутреннюю жесткую камеру, имеющую выходное отверстие;
2. первый жесткий отсек для хранения и второй жесткий отсек для хранения;
3. входное отверстие;
4. систему клапанов, обеспечивающую сообщение между указанным выходным отверстием и указанными жесткими отсеками для хранения; и
iv. датчик;
b. расположение указанного образца в указанном жестком картридже путем переноса указанного образца через указанное входное отверстие и в указанную жесткую камеру;
c. центрифугирование указанного жесткого картриджа таким образом, чтобы указанная первая часть сначала была вынуждена двигаться в направлении указанного выходного отверстия под действием центробежной силы, направляемая указанной системой клапанов, а затем была вынуждена двигаться в направлении указанной оси вращения и в указанный первый жесткий отсек для хранения; и
d. направление с помощью указанной системы клапанов некоторого количества указанной оставшейся части в направлении указанной оси вращения и в указанный второй жесткий отсек для хранения.
В одном аспекте изобретения в указанном способе система клапанов включает эксцентрик и гибкую трубку.
В другом аспекте изобретения в указанном способе указанный датчик представляет собой оптический датчик.
В еще одном аспекте изобретения указанный способ дополнительно включает наблюдение с помощью указанного датчика за движением указанной первой части через выходное отверстие.
В еще одном другом аспекте изобретения в указанном способе указанная жесткая камера дополнительно содержит суженный конец и указанное выходное отверстие расположено на указанном суженном конце.
Согласно еще одному воплощению изобретения указанный способ дополнительно включает расслоение указанного образца, тем самым образуя по меньшей мере одну поверхность раздела. Указанный способ также может дополнительно включать обнаружение указанного по меньшей мере на одной поверхности раздела с использованием указанного датчика. При этом, указанная стадия расслоения образует первую и вторую границу раздела.
В другом аспекте изобретения, указанный способ дополнительно включает обнаружение указанной первой и второй границы раздела с помощью указанного датчика. При этом, указанная стадия направления имеет место после того, как указанный датчик обнаружит указанную первую границу раздела, или после того, как указанный датчик обнаружит указанную вторую границу раздела.
В еще одном другом аспекте изобретения указанный способ дополнительно включает наблюдение с помощью указанного датчика за движением указанной первой части через выходное отверстие.
В другом аспекте изобретения указанный способ дополнительно включает стадии: (е) замедления вращения указанного жесткого картриджа с динамической нагрузки превышающей 10 G до динамической нагрузки приблизительно 1 G после указанной стадии центрифугирования и где: (i) подавляющее большинство указанной части находится в указанном первом жестком отсеке для хранения; и (ii) подавляющее большинство указанной оставшейся части находится в указанной жесткой камере; (f) перемешивания указанной оставшейся части путем встряхивания указанного жесткого картриджа; и (g) возвращения указанного жесткого картриджа к динамической нагрузке превышающей 1 G для последующей обработки.
Указанный способ по изобретению также может дополнительно включать наблюдение с помощью указанного датчика за движением указанной первой части или второй части через указанное выходное отверстие. При этом, указанный датчик может представлять собой оптический датчик, где указанный оптический датчик может содержать по меньшей мере одну пару инфракрасный эмиттер/детектор.
В другом воплощении настоящее изобретение обеспечивает способ извлечения по меньшей мере одного из следующего: эритроцитов, гранулоцитов или тромбоцитов из образца, содержащего кровь, костный мозг или клетки стромальной сосудистой фракции, выделенные из жировой ткани, при этом указанный способ включает:
a. предоставление жесткого картриджа, содержащего:
i. жесткий наружный корпус;
ii. внутреннюю жесткую камеру обычно в форме воронки, имеющую узкий конец, содержащий выходное отверстие, и широкий конец, содержащий входное отверстие;
iii. первый и второй жесткий отсек для хранения, изначально не находящийся в соединении по текучей среде с указанным узким концом;
iv. первый клапан в соединении с указанным выходным отверстием и указанным первым жестким отсеком для хранения, где указанный первый клапан изначально находится в закрытом состоянии; и
v. второй клапан в соединении с указанным выходным отверстием и указанным вторым жестким отсеком для хранения, где указанный второй клапан изначально находится в закрытом состоянии;
b. предоставление центрифуги, выполненной с возможностью установки указанного жесткого картриджа;
c. предоставление образца, содержащего смесь клеток высокой плотности, клеток низкой плотности, тромбоцитов и плазмы;
d. перенос указанного образца в указанный жесткий картридж через указанное входное отверстие;
e. помещение указанного жесткого картриджа в указанную центрифугу;
f. приложение центробежной силы, чтобы заставить указанный образец двигаться в направлении указанного узкого конца;
g. расслоение указанного образца таким образом, чтобы подавляющее большинство указанных клеток высокой плотности образовывало слой компонента высокой плотности и подавляющее большинство указанных клеток низкой плотности образовывали слой компонента низкой плотности; и
h. открытие указанного первого клапана, таким образом, чтобы указанные слои компонентов перемещались в направлении указанного узкого конца, и где указанное подавляющее большинство указанных клеток высокой плотности были вынуждены под действием центробежной силы течь сначала в направлении от указанной оси вращения, а затем в направлении указанной оси вращения и в указанный первый жесткий отсек для хранения.
При этом, в одном аспекте изобретения в указанном способе первый клапан активируется эксцентриком.
Еще в одном аспекте изобретения в указанном способе указанный первый жесткий отсек для хранения содержит входное отверстие первого жесткого отсека для хранения, расположенное ближе к указанной оси вращения, чем указанное выходное отверстие, и где указанные клетки высокой плотности проходят через указанное входное отверстие первого жесткого отсека для хранения.
Кроме того, указанный способ может дополнительно включать определение с использованием датчика присутствия по меньшей мере одного из указанных слоев компонентов в указанном узком конце.
В другом аспекте изобретения указанный способ может дополнительно включать определение с использованием первого и второго датчика присутствия указанных первого и второго слоев компонентов, проходящих через указанный узкий конец.
Еще в одном аспекте изобретения указанный способ дополнительно включает закрытие указанного первого клапана и открытие указанного второго клапанов таким образом, чтобы указанное подавляющее большинство указанных клеток низкой плотности и плазма были вынуждены под действием центробежной силы течь сначала в направлении от указанной оси вращения а затем в направлении к указанной оси вращения и в указанный второй жесткий отсек для хранения.
В другом аспекте изобретения указанный способ дополнительно включает стадию перед открытием указанного второго клапана предварительного определения конечного объема клеток низкой плотности и плазмы, добавляемого в указанный второй жесткий отсек для хранения.
Еще в одном другом аспекте изобретения указанный способ дополнительно включает: (j) вычисление количества времени после обнаружения указанного слоя второго компонента, которое указанный второй клапан будет оставаться открытым для заполнения указанного второго жесткого отсека для хранения плазмой, таким образом, чтобы указанный конечный объем был по существу равен указанному предварительно определенному конечному объему; и (k) закрытие указанного второго клапана после указанного количества времени. При этом, указанная стадия вычисления основана на времени, прошедшем между обнаружением первого из указанных слоев компонентов указанным первым датчиком, и указанным вторым датчиком.
В другом аспекте изобретения способ дополнительно включает (l) устранение центробежной силы после указанной стадии открытия; (m) встряхивание указанного жесткого картриджа для перемешивания указанных клеток низкой плотности, указанных тромбоцитов и указанной плазмы после указанной стадии устранения центробежной силы; и (n) повторное приложение центробежной силы для дополнительной обработки указанных клеток низкой плотности, указанных тромбоцитов и указанной плазмы.
Еще в одном аспекте изобретения указанный слой компонентов высокой плотности содержит эритроциты и где указанный слой компонентов низкой плотности содержит лейкоциты. Кроме того, указанный слой компонентов низкой плотности может дополнительно содержать мононуклеарные клетки. Или указанный слой компонентов низкой плотности дополнительно содержит гранулоциты. Кроме того, указанный слой компонентов высокой плотности может дополнительно содержать гранулоциты.
Согласно еще одному воплощению изобретение обеспечивает способ сбора по существу чистого раствора по меньшей мере одного типа клеток из образца, содержащего клетки высокой плотности, клетки низкой плотности, тромбоциты и плазму, при этом указанный способ включает:
a. предоставление жесткого картриджа, содержащего:
i. внутреннюю жесткую камеру обычно в форме воронки, имеющую первое и второе выходное отверстие, указанные отверстия изначально закрыты; и
ii. по меньшей мере два жестких отсека для хранения;
b. расположение жидкого биологического образца, содержащего клетки высокой плотности, клетки низкой плотности в указанной жесткой камере;
c. центрифугирование указанного жесткого картриджа таким образом, чтобы подавляющее большинство указанных клеток высокой плотности из формировали слой компонентов высокой плотности, а подавляющее большинство указанных клеток низкой плотности формировали слой компонентов низкой плотности; и
d. во время указанной стадии центрифугирования:
i. открытие указанного первого выходного отверстия, позволяющего проходить части указанного компонента высокой плотности;
ii. закрытие указанного первого отверстия; и
iii. открытие указанного второго отверстия, позволяющего проходить части указанного слоя компонентов низкой плотности.
В одном аспекте изобретения в указанном способе один из указанных слоев компонентов вынужден под действием центробежной силы течь сначала через одно из указанных выходных отверстий и в направлении от оси вращения, а затем в направлении к указанный оси вращения и в указанный жесткий отсек для хранения.
При этом, указанный образец может содержать по меньшей мере одно из следующего: кровь, костный мозг или клетки стромальной сосудистой фракции, выделенной из жировой ткани.
Согласно другому воплощению изобретение также обеспечивает способ сбора мононуклеарных клеток из образца крови, костного мозга или клеток стромальной сосудистой фракции, выделенной из жировой ткани, где все стадии происходят в одном жестком картридже, при этом указанный способ включает:
a. предоставление центрифуги, имеющей ось вращения;
b. предоставление жесткого картриджа, содержащего внутреннюю жесткую камеру;
c. расположение указанного образца в указанной жесткой камере, этот образец содержит по меньшей мере два биологических компонента, выбранных из группы эритроцитов, гранулоцитов, мононуклеарных клеток, стволовых клеток, тромбоцитов и плазмы;
d. установление указанного жесткого картриджа в указанную центрифугу;
e. приложение с помощью указанной центрифуги центробежной силы к указанному образцу, указанная центробежная сила:
i. сначала перемещает большинство указанных эритроцитов в указанном образце в направлении от указанной оси вращения, из указанной жесткой камеры, в направлении к указанной оси вращения, и в первый жесткий отсек для хранения; и
ii. затем перемещает большинство указанных мононуклеарных клеток в указанном образце в направлении от указанной оси вращения, из указанной жесткой камеры, в направлении к указанной оси вращения, и во второй жесткий отсек для хранения.
В одном аспекте изобретения в указанном способе указанная внутренняя жесткая камера имеет переменный радиус, указанный радиус является наибольшим в расположении, ближайшем к указанной оси вращения и наименьшем в расположении, удаленном от указанной оси вращения.
При этом, во время указанной второй стадии перемещения большинство указанных мононуклеарных клеток концентрируется в стратифицированном слое, толщина которого увеличивается по мере движения указанного стратифицированного слоя в направлении от указанной оси вращения.
Согласно другому воплощению изобретение обеспечивает способ селективного извлечения клеток различной плотности из образца, включающий:
а. расположение жесткого картриджа в центрифуге, указанный жесткий картридж содержит жесткую камеру, имеющую конец, соединенный текучей средой с системой клапанов, которая изначально закрыта, и по меньшей мере один жесткий отсек для хранения;
b. помещение указанного образца в указанную жесткую камеру, указанный образец содержит клетки относительно высокой и низкой плотности и жидкость;
c. центрифугирование указанного жесткого картриджа таким образом, чтобы указанный образец был вынужден двигаться в направлении ks указанного конца под действием первой динамической нагрузки;
d. центрифугирование указанного жесткого картриджа таким образом, чтобы указанный образец был вынужден двигаться в направлении указанного конца под действием второй динамической нагрузки, меньшей, чем указанная первая динамическая нагрузка, но большей, чем 1 G и обеспечение открытого пути через указанную систему клапанов по меньшей мере для части указанных клеток относительно высокой плотности через указанный конец и в указанный по меньшей мере один жесткий отсек для хранения;
e. отслеживание миграции указанных клеток через указанный конец; и
f. закрытие указанного открытого пути.
Кроме того, настоящее изобретение обеспечивает также устройство для извлечения по меньшей мере одно из следующего: эритроцитов, гранулоцитов или тромбоцитов из образца, включающего кровь, костный мозг или клетки стромальной сосудистой фракции, выделенные из жировой ткани, при этом устройство включает:
a. центрифугу, имеющую ось вращения:
b. жесткий картридж, содержащий:
i. жесткую внутреннюю камеру, имеющую радиус обычно обратно пропорциональный расстоянию от указанной оси вращения, когда указанный картридж центрифугируют в указанной центрифуге, входное отверстие, и выходное отверстие;
ii. систему клапанов;
iii. первый жесткий отсек для хранения ближе к указанной оси вращения, когда указанный картридж центрифугируют в указанной центрифуге, чем указанное выходное отверстие; и
iv. второй жесткий отсек для хранения ближе к указанной оси вращения, когда указанный картридж центрифугируют в указанной центрифуге, чем указанное выходное отверстие; и
c. блок управления.
В одном аспекте изобретения в указанном устройстве по меньшей мере часть указанной системы клапанов расположена дальше от указанной оси вращения, когда указанный картридж центрифугируют в указанной центрифуге, чем указанный входные отверстия первого и второго отсека.
При этом, указанное устройство дополнительно может включать эксцентрик в функциональной связи с клапаном.
Еще в одном другом воплощении настоящее изобретение обеспечивает устройство для извлечения по меньшей мере одного из следующего: эритроцитов, гранулоцитов или тромбоцитов из образца, содержащего кровь, костный мозг или клетки стромальной сосудистой фракции, выделенной из жировой ткани, при этом устройство включает:
a. жесткий контейнер, содержащий:
i. наружный корпус;
ii. жесткую камеру в форме воронки, содержащую выходное отверстие, расположенное на узком конце указанной жесткой камеры, и входное отверстие, расположенное на широком конце указанной жесткой камеры;
iii. по меньшей мере два жестких отсека, исходно изолированные по текучей среде от указанной жесткой камеры;
iv. клапан, соединенный текучей средой с указанным выходным отверстием и расположенный между указанной жесткой камерой и и указанными по меньшей мере двумя жесткими отсеками, указанный клапан имеет первую конфигурацию, где соединение с возможностью переноса текучей среды не существует между указанной жесткой камерой и одним из жестких отсеков, вторую конфигурацию, где соединение с возможностью переноса текучей среды существует только между указанной жесткой камерой и указанным первым жестким отсеком, и третью конфигурацию, где соединение с возможностью переноса текучей среды существует только между указанной жесткой камерой и указанным вторым жестким отсеком; и
b. блок управления.
В одном аспекте изобретения каждый из указанных отсеков содержит входное отверстие в отсек, и где указанные входные отверстия в отсек расположены ближе к оси вращения, чем указанное выходное отверстие.
Кроме того, устройство может дополнительно включать оптический датчик, который может быть расположен в указанном блоке управления.
Еще в одном аспекте изобретения указанное устройство может дополнительно включать гравитационный датчик и батарею питания.
Еще в одном другом аспекте изобретения указанное устройство дополнительно включает средство управления клапанами для определения, находится ли указанный клапан в указанной первой, второй или третьей конфигурации.
Еще в одном аспекте изобретения в указанном устройстве указанный оптический датчик функционально связан с указанным средством управления клапанами.
Кроме того, указанное устройство может дополнительно включать центрифугу, выполненную с возможностью установки указанного жесткого картриджа и генерирования центробежной силы.
Еще в одном аспекте изобретения указанное устройство дополнительно включает первый и второй датчик, функционально соединенные с регулятором клапанов, указанные датчики и регулятор клапанов выполнены с возможностью собирать заранее определенный конечный объем жидкости в указанный второй жесткий отсек.
В другом аспекте изобретения в указанном устройстве указанный блок управления выполнен с возможностью измерять первое значение времени, прошедшего между измерением заданного показания указанным первым датчиком и указанным вторым датчиком, и приводить в действие указанный регулятор клапанов в рассчитанное время, на основании указанного первого значения затраченного времени, для сбора указанного предварительно определенного конечного объема жидкости в указанном втором жестком отсеке.
Еще в одном другом аспекте настоящего изобретение указанное устройство содержит третий датчик, и где указанный блок управления выполнен с возможностью:
a. измерять первое значение времени, прошедшее между измерением заданного параметра указанным первым датчиком и указанным вторым датчиком;
b. измерять второе значение времени, прошедшее между измерением заданного параметра указанным вторым датчиком и указанным третьим датчиком; и
c. приводить в действие указанный регулятор клапанов в рассчитанное время, основанное на указанном первом и втором значении времени, для сбора указанного предварительно определенного конечного объема жидкости в указанном втором жестком отсеке.
Согласно еще одному воплощению настоящее изобретение обеспечивает также устройство для отделения по существу чистого раствора по меньшей мере одного типа клеток из образца, содержащего биологическую жидкость, при этом устройство включает:
а. блок управления, содержащий:
i. средство управления клапанами;
ii. гравитационный датчик;
iii. оптический датчик; и
iv. батарею питания;
а. жесткий картридж, съемно соединенный с указанным блоком управления,
указанный жесткий картридж содержит:
i. жесткий наружный корпус;
ii. жесткую камеру обычно в форме воронки, имеющую узкий конец, содержащий выходное отверстие и широкий конец, содержащий входное отверстие;
iii. первый и второй жесткий отсек для хранения исходно не находящийся в соединении текучей средой с указанным выходным отверстием;
iv. первый клапан в соединении с указанным выходным отверстием и указанным первым жестким отсеком для хранения, где указанный первый клапан имеет закрытую конфигурацию и открытую конфигурацию; и
v. второй клапан в соединении с указанным выходным отверстием и указанным вторым жестким отсеком для хранения, где указанный второй клапан имеет закрытую конфигурацию и открытую конфигурацию.
При этом, в указанном устройстве указанное средства управления клапанами могут содержать эксцентрик.
Кроме того, в указанном устройстве указанное соединение может осуществляться через гибкую трубку.
Согласно другому воплощению настоящее изобретение обеспечивает жесткий картридж для отделения по существу чистого раствора по меньшей мере одного типа клеток из образца, содержащего биологическую жидкость, при этом жесткий картридж содержит:
a. жесткий наружный корпус;
b. жесткую камеру обычно в форме воронки, имеющую узкий конец, содержащий выходное отверстие и широкий конец, содержащий входное отверстие;
c. первый и второй жесткий отсек для хранения исходно не находящийся в соединении текучей средой с указанным выходным отверстием;
d. первый клапан в соединении с указанным выходным отверстием и указанным первым жестким отсеком для хранения, где указанный первый клапан имеет закрытую конфигурацию и открытую; и
а. второй клапан в соединении с указанным выходным отверстием и указанным вторым жестким отсеком для хранения, где указанный второй клапан имеет закрытую конфигурацию и открытую конфигурацию.
Обращаясь вначале к Фиг. 15, способ и устройство 1, как предложено заявителем в предпочтительном варианте осуществления, содержат жесткий одноразовый картридж 10, который может вмещать вплоть до 250 мл жидкости, является цилиндрическим, одноразовым и который предпочтительно выполнен из жесткого пластика, а более предпочтительно из оптически прозрачного поликарбоната. Блок управления 40, в котором располагается одноразовый картридж, является работающим от аккумуляторной батареи, электромеханическим устройством с оптическим и гравитационным датчиком. Предпочтительный вариант осуществления также содержит мембранный переключатель 41, семисегментный цифровой индикатор 42 и три светодиода 43 для информирования и помощи пользователю. Показанное на Фиг. 15 слева представляет собой универсальный значок батареи 44, который предупреждает пользователя о состоянии заряда батареи. Показанное в центре представляет собой двухпозиционный выключатель 45 для блока управления и светодиод, а показанное справа представляет собой цифровой индикатор 42 и светодиод, который указывает, был ли цикл сбора клеток осуществлен как запланировано и, если нет, какие ошибки в работе могли произойти.
Обращаясь к Фиг. 16, в соответствии предпочтительным вариантом осуществления показано изображение одноразового картриджа 10, блока управления 40, а также стандартной чаша центрифуги 70 на 750 мл в разобранном виде. При работе одноразовый картридж 10 и блок управления 40 разъемно соединяются друг с другом. Одноразовый картридж содержит множество отсеков, один из которых представляет собой воронку или жесткую камеру 11. Предпочтительно чаша центрифуги 70 вмещает блок управления 40, который предназначен для многократного использования совместно и в соединении с вышеупомянутым стерильным одноразовым картриджем 10.
Блок управления 40 и картридж 10 в совокупности предпочтительно весят приблизительно 450 грамм. Наряду с прочими компонентами, которые будут описаны позднее, картридж сверху содержит входное отверстие 12, которое служит для входа поступающей жидкости. Этот вход может быть подсоединен к трубке, которая может переходить в иглу или шип для кровоизвлечения для соединения с клеточным раствором и также может быть соединена с встраиваемым фильтром, который удаляет любые сгустки, которые тем или иным образом могут повредить другим компонентам системы в процессе оставшихся стадий обработки. Верх одноразового картриджа также может содержать 0,2-микронный фильтр 13, для того чтобы обеспечить проход для воздуха, вытесняемого из внутреннего пространства воронки, когда в нее вводят кровь или костный мозг. Верх картриджа также может содержать приспособление для стерильной фильтрации крови (не показано), костного мозга и других жидкостей, таких как разбавители, по мере того как они вводятся в воронку.
Обращаясь к Фиг. 17, показано электронное оборудование монтажной схемы двигателя, расположенное внутри нижней части блока управления 40. Для питания блока управления, который следит и контролирует оборудование для гравитационного и оптического измерения и непосредственную активность в одноразовом картридже, электромеханической частью устройства предпочтительно используется система перезаряжаемых батарей. Приспособление для определения силы динамической нагрузки может быть любым известным из уровня техники, например, вычисляющим упомянутую силу посредством измерения количества об/мин центрифуги или посредством прямого измерения ускорения или силы.
На Фиг. 18 показан схематичный вид сбоку одноразового картриджа 10 с сечением, обозначенным А-А. На Фиг. 18b показан вид продольного разреза А-А одноразового картриджа 10 в перспективе. Как описано в процессе ниже, биологическая жидкость, содержащая клетки, например, обычная кровь, пуповинная кровь или костный мозг, доставляется в большой отсек в форме воронки, имеющий открытый конец, который первоначально закрыт клапанным приспособлением (не показано). Картридж содержит большое первый жесткий отсек для хранения или отсек для извлечения эритроцитов 14 и меньший второй жесткий отсек или отсек для стволовых клеток 15, в который переносятся лейкоциты и практически все стволовые клетки и клетки-предшественники. Отсек для извлечения эритроцитов 14 значительно больше отсека для сбора стволовых клеток 15, поскольку объем эритроцитов, извлекаемых из образца крови, всегда намного больше объема собираемых лейкоцитов. Все отсеки отделены одно от другого, но являются смежными с точки зрения воздушного потока. Отсек для извлечения эритроцитов 14 и отсек для сбора стволовых клеток 14 подсоединены к исходной камере маленькими вытяжными трубками таким образом, чтобы позволить вытеснить воздух по мере того, как клеточный раствор движется из исходной камеры в отсеки.
Обращаясь к Фиг. 19, показан вид в перспективе поперечного сечения одноразового картриджа 10 с узкой нижней частью воронки 11. Отсек большего размера для извлечения эритроцитов 14 виден на поперечном сечении с левой стороны воронки. Как будет подробно описано ниже, при работе эритроциты первоначально перемещаются в направлении нижней части первоначального отсека в форме воронки, двигаясь наружу от оси вращения центрифуги до достижения клапанной системы 16 в нижней части устройства. Здесь напор жидкости над клапанной системой побуждает истечение в один из двух отсеков. В какой отсек направляется жидкость, зависит от положения клапанов (открыто, закрыто) для этих отсеков. В каждом случае, после прохождения через клапанную систему 16 в нижней части картриджа 10, жидкость течет в основном в направлении оси вращения, что вызывается давлением жидкости (чаще всего плазмы), оставшейся в первоначальном отсеке. Жидкость, которая прошла через клапанную систему затем задерживается в отсеке для извлечения эритроцитов 14 или в отсеке для сбора стволовых клеток 15. С помощью точной регулировки клапанов ненужные клеточные растворы могут быть извлечены и могут быть выделены желаемые клеточные растворы.
Обращаясь к Фиг. 20, изображен предпочтительный вариант осуществления настоящего изобретения в процессе использования. Как показано, 100 мл пуповинной крови помещают внутрь основного отсека 11 в форме воронки. Затем оператор прикрепляет к блоку управления 40 картридж 10 и затем загружает картридж в центрифугу, предпочтительно центрифугу с подвешивающими стаканами, например, настольную центрифугу Thermo Fisher Sorvall ST-40, предназначенную для установки четырех 750 мл цилиндрических стаканов. Могут быть использованы альтернативные центрифуги, обеспечивающие центрифугирование более или менее четырех картриджей одновременно.
Обращаясь к Фиг. 21, показано, что происходит, когда картридж 10 подвергается большой динамической нагрузке. Здесь, при центрифугировании при 2000 G эритроциты начинают перемещаться вниз, а лейкоциты начинают перемещаться вверх из нижней части воронки и вниз из верхней части объема жидкости в положение над эритроцитами. Затем вышеупомянутые эритроциты, очень тонкий слой лейкоцитов и тромбоцитов начинают расслаиваться и над ними образуется слой плазмы, которая имеет желтый цвет. Под действием большой динамической нагрузки эритроциты все больше уплотняются ближе к нижней части воронки для обработки 11 с ниже расположенными наиболее тяжелыми эритроцитами и более легкими эритроцитами ближе к верхней части объема эритроцитов. Следует заметить, что поскольку в процессе центрифугирования картридж, изображенный на фигуре, как показано, вращается вокруг оси, перпендикулярной и расположенной выше картриджа, динамическая нагрузка, испытываемая картриджем повышается пропорционально расстоянию от оси вращения и приблизительно в два раза выше в нижней части чаши центрифуги (2000 G) чем в верхней части (1000 G).
Обращаясь к Фиг. 22, подробно показан разрез вида сбоку в предпочтительном варианте осуществления. В этом предпочтительном варианте осуществления воронка остается отделенной от отсека для извлечения эритроцитов 14 и отсека для сбора стволовых клеток 14 клапанной системой 16. Хотя предусматривается множество приспособлений для регулирования клапанов, в предпочтительном варианте осуществления используют систему пережимных клапанов, в которых эксцентриковые кулачки 17 регулируют зажимы 18 трубок, через которые, в конечном счете, жидкость из нижней части воронки перетекает в отсек для извлечения клеток 14 и в отсек для сбора клеток 15. Здесь, пережимные клапаны содержат два противостоящих зажима, имеющих прижимную поверхность шириной приблизительно 0,088 дюйма и для которых необходимо прижимное усилие приблизительно 1,6 фунта для того, чтобы полностью блокировать прохождение жидкости по уретановой трубке с внутренним диаметром 0,062 дюйма и внешним диаметром 0,088 дюйма, если гидравлическое давление в трубке составляет около 325 фунт/дюйм2. При более высоких давлениях могут потребоваться прижимные усилия, превышающие 1,6 фунта, а при более низких давлениях может быть достаточно уменьшенных прижимных усилий.
Обращаясь к Фиг. 23, показана система консольно закрепленных рычагов для достижения этих требуемых пережимных усилий сжатия. Система консольно закрепленных рычагов 19 может по мере необходимости открывать и закрывать клапаны (пережимать и высвобождать трубки). Пружины 20 для каждого консольно закрепленного рычага 21 предпочтительно располагаются на дальнем конце консольно закрепленного рычага. Привод преодолевает сопротивление пружин для перемещения рычага. Как только привод перестает прилагать нагрузку, смещающее напряжение пружин понуждает рычаг вернуться в его первоначальное положение.
Обращаясь к Фиг. 24, показан подробный вид эксцентриковой части пережимающего трубки механизма или клапанного запорного механизма. Эксцентрик преобразует вращательное движение двигателя клапана в линейное движение, которое используют для того чтобы закрыть или пережать трубку. Как раскрыто выше, система консольно закрепленных рычагов может применяться совместно с эксцентриком. Поскольку эксцентрик 22 вращается приблизительно на 90 градусов по часовой стрелке, большая часть эксцентрика оказывает непрерывное действующее по часовой стрелке крутящее усилие на ротор и мотор вследствие большого гравитационного поля действующей в основном вниз через все устройство силы. Показанный вырез 23 и противовес 24, расположенный на противоположной стороне эксцентрика дают возможность маленькому двигателю обеспечить достаточное усилие, чтобы повернуть эксцентрик против часовой стрелки на 90 градусов в его начальную позицию. Таким образом эксцентрик специально предназначен не только для того, чтобы снизить количество внеосевого материала и подвергаться потенциально обездвиживающим гравитационным нагрузкам, но также для того, чтобы уравновесить оставшуюся часть эксцентрика в виду таких нагрузок. То есть, поскольку эксцентриковый вал вращается вокруг своей центральной оси, его конструкция обеспечивает то, что не будет никакого увеличения или уменьшения вращения в результате воздействующих на эксцентрик динамических нагрузок.
На Фиг. 25 показан относительный размер различных клеток по отношению к соединительным трубкам или гибким трубопроводам (большой внешний круг) по типичному варианту осуществления, которые располагаются между первоначальным отсеком 11 и отсеком для извлечения эритроцитов 14 или отсеком для сбора стволовых клеток 15. Внутренний диаметр трубок в типичном варианте осуществления составляет 0,062 дюйма (1,575 мм). Могут использоваться трубки другого внутреннего и внешнего диаметров, поскольку полное отсечение всех клеток и жидкости возможно посредством клапанных приспособлений. В типичном варианте осуществления эти гибкие трубопроводы имеют отношение длины к диаметру, не превышающее 20.
Возвращаясь к описанию типичного процесса, на Фиг. 26 показан типичный картридж после приблизительно 10 минут центрифугирования при 2000 G. Лейкотромбоцитарный слой образуется на поверхности раздела между эритроцитами и плазмой. Клетки в самой нижней части воронки 11 могут достигать НСТ (гематокрита -соотношения объема крови, занятого эритроцитами) приближающегося к 90, но около верхней части слоя эритроцитов НСТ может быть только 60-70 вследствие более низкой силы центрифугирования на удалении от оси вращения и большой площади воронки в этом положении.
Обращаясь к Фиг. 27, показан подробный вид узкой части воронки 11. Когда одноразовый картридж 10 прикреплен к блоку управления 40 в этой узкой части первоначального отсека располагается по меньшей мере один, но предпочтительно два или больше оптических или других датчиков 48, которые определяют тип клеток, протекающих через эту часть воронки для обработки. В этой узкой части первоначальной камеры также находится по меньшей мере один, но предпочтительно два или больше оптических или других эмиттеров 49. В типичном показанном варианте осуществления четыре пары инфракрасный эмиттер/инфракрасный датчик располагаются вертикально. В предпочтительном варианте осуществления инфракрасный датчик располагается непосредственно напротив парных ему инфракрасных эмиттеров. Во втором предпочтительном варианте осуществления излучатели, испускающие излучение с длинами волн, которое преимущественно абсорбируется эритроцитами, располагаются непосредственно напротив датчиков, чувствительных к такой частоте излучения. В третьем варианте осуществления используются датчики, которые идентифицируют клетки, которые содержат абсорбированные флуоресцентные красители. В первом предпочтительном варианте осуществления присутствие клеток служит препятствием для испускаемого инфракрасного света и инфракрасный датчик количественно оценивает амплитуду сигнала, проникающего через жидкость. В предпочтительном варианте осуществления датчики могут присваивать уровню пропускания значение от 0 до 1000. Для чистой плазмы, которая аналогична воде, не блокирующей инфракрасный свет, будет зарегистрировано значение примерно 1000. В случае прохождения через уплотненные эритроциты, фактически весь инфракрасный свет блокируется, и датчик регистрирует значение 0.
Обращаясь к Фиг. 28, показана следующая стадия процесса. После того как образец был отцентрифугирован в течение определенного времени (в типичном варианте осуществления 20 минут), центрифугу можно замедлить до скорости, создающей 100 G в нижней части стакана центрифуги (т.е. на наибольшем удалении от оси вращения). В ходе процесса встроенный акселерометр может отслеживать динамическое усилие. Как только акселерометр обнаружит, что центрифуга достигла 100 G, устройство делает выдержку определенного количества времени (для того чтобы обеспечить постоянные 100G на центрифуге и не допустить переход к несколько более низкой динамической нагрузке, если аппарат сломался или утратил часть мощности) и затем открывает первый клапан 25, соединяющий первоначальный отсек 11 с отсеком для извлечения эритроцитов 14, позволяя пройти высококонцентрированным эритроцитам и некоторому количеству плазмы. Поступление эритроцитов в отсек для извлечения 14 можно увидеть по первоначальному наполнению напорной трубки 26 (которая предпочтительно имеет объем 1 мл, как будет описано ниже). В процессе использования, эритроциты будут продолжать перетекать в отсек для извлечения 14, до тех пор, пока напорная трубка 26 не наполнится. В этот момент времени эритроциты переполнят ее и наполнят большую часть отсека для извлечения 14.
На Фиг. 29 показано переполнение напорной трубки 26 и наполнение эритроцитами большей части камеры для извлечения. Поверхность раздела между эритроцитами и плазмой, выраженная лейкотромбоцитарным слоем 2, теперь ясно выражена. Поскольку воронка 11 сужается, тот же объем клеток должен занять меньшую горизонтальную поверхность. В результате этого занимаемая вертикальная поверхность увеличивается, и это дает возможность легче отличить каждый образовавшийся слой типов клеток.
Обращаясь к Фиг. 30, показано поступление лейкоцитов в узкую часть воронки 11. Поскольку лейкоциты поступают в эту более узкую часть, их расслоение продолжается, с гранулоцитами в нижней части (не обозначены), мононулеарными клетками в середине 3 и тромбоцитами 4, остающимися сверху мононуклеарных клеток. Объем плазмы 5 показан выше тромбоцитов.
Пары эмиттер/детектор, как показано на Фиг. 27, отслеживают прохождение клеток через узкую часть первоначального отсека. На Фиг. 31 показан инфракрасный оптический подсчет групп клеток крови в ходе перемещения под действием 100 G от расположенной первой пары эмиттер/датчик (самой верхней). Горизонтальная линия отображает оптический подсчет, наблюдаемый в свободной от клеток плазме. Более низкие оптические подсчеты означают, что лейкоциты и тромбоциты по-прежнему присутствуют в образце, обследуемом парой эмиттер/детектор. Первоначальное повышение от 0 внизу слева на графике показывает, когда лейкотромбоцитарный слой, расположенный выше эритроцитов проходит расположенную первой пару эмиттер/детектор. Увеличение значения указывает на то, что раствор, проходящий между парами эмиттер/детектор, становится прозрачнее, что означает, что он содержит меньше эритроцитов. Поскольку приближаются более прозрачные слои, значение повышается, например, до 50, затем до 100, 200 и т.д.
В некоторых обстоятельствах, значения оптического подсчета показываются на Фиг. 31 увеличивающимися, по мере того, как клетки извлекаются, могут, если извлечение останавливается, начать падать, указывая на то, что больше клеток поступает в область обнаружения. Причины этого являются комплексными. Во-первых, оптические измерения проводятся в жидкости, испытывающей турбулентность и завихрение, поскольку частицы различной плотности перестраиваются вследствие их удаления через нижнюю часть воронки уменьшающегося радиуса. Эритроциты и лейкоциты оседают с различными скоростями вследствие их различающихся размеров. Следовательно, если скорость удаления эритроцитов больше, чем скорость седиментации для определенных частиц (например, тромбоцитов - меньшего размера относительно прочих), то эти частицы будут не успевать оседать за прочими частицами, имеющими более высокие скорости седиментации. Тщательно расслоенные смеси становятся частично смешанными в ходе процесса удаления. Не только эритроциты оседают с одной скоростью, в то время как лейкоциты оседают с другой скоростью, но также движение лейкоцитов может быть замедлено движением весьма более многочисленных эритроцитов. Кроме того, плотность эритроцитов меняется на протяжении их жизненного цикла. Следовательно, более легкие эритроциты будут подниматься с замещаемой плазмой, в то время как более плотные эритроциты собираются в нижней части воронки. Таким образом, лейкоциты, которые находились в нижней части воронки и которые двигались в направлении поверхности раздела фаз эритроциты/плазма, сопровождаются намного более многочисленными «более легкими» эритроцитами. Эти восходящие клетки двигаются вокруг эритроцитов более низкой плотности вследствие того факта, что все клетки имеют слабо отрицательный заряд и таким образом склонны отталкиваться одна от другой.
Чтобы противодействовать этому смешению, которое обязательно происходит в процессе извлечения, в типичном варианте осуществления системы после удаления в течение заданного времени закрывают трубку, через которую проходят клетки, и дают поднимающимся клеткам повторно уплотниться и расслоиться. При повторном открытии трубки смешение внутри воронки снова начинает происходить смешение. Таким образом, настоящее изобретение позволяет применить подход «старт-стоп», при котором процесс удаления периодически останавливают, если такое смешение неприемлемо для данной области применения.
Обращаясь к Фиг. 32, показана более поздняя стадия процесса. В определенный момент процесса трубку в отсек для извлечения эритроцитов 14 закрывают и открывают трубку в отсек для сбора стволовых клеток 15. На Фиг. 32 изображен более поздний момент времени в процессе, в который путь в отсек для сбора стволовых клеток 15 был открыт, а путь в отсек для извлечения эритроцитов закрыт.Поскольку напорная трубка 26 отсека для извлечения эритроцитов содержит последний 1 мл эритроцитов перед входом в отсек для извлечения эритроцитов 15, напорная трубка 26 содержит менее плотные эритроциты, а, следовательно, более высокие концентрации гранулоцитов и ядросодержащих эритроцитов, чем во всем отсеке для извлечения эритроцитов 15 в целом. Техник позднее может выделить содержимое напорной трубки 26 и Таким образом получить гранулоциты и ядросодержащие эритроциты для HLA-типирования без необходимости жертвовать выходом стволовых клеток и клеток-предшественников из меньшего отсека для стволовых клеток 15. Поскольку центрифугирование продолжается, клетки с большей плотностью продолжают вынужденно удаляться от оси вращения. Плазма 5, остающаяся в первоначальном отсеке, продолжает оказывать давление на жидкость и клетки ниже нее, и двигает мононуклеарные клетки 3 и тромбоциты 4 вверх по трубке, ведущей в отсек для сбора стволовых клеток 15. Как показано, даже после того как мононуклеарные клетки и тромбоциты по большей части удаляются из первоначального отсека, плазма 5 затем дает возможность им перетекать в отсек для сбора стволовых клеток 15, промывая соединительную трубку в процессе и обеспечивая то, что все стволовые клетки и клетки-предшественники соберутся в отсеке для сбора 15.
Синхронизация регулирования клапанной системы 16 по времени с тем, чтобы направить жидкость (и клетки) в отсек для сбора стволовых клеток 15, в отличие от направления в отсек для извлечения эритроцитов, является крайне важной. Если клапаны переключатся слишком рано, эритроциты могут попасть в отсек для сбора стволовых клеток и клеток-предшественников, повышая НСТ и уменьшая чистоту собранного образца. Если клапаны переключатся слишком поздно, некоторое количество мононуклеарных клеток может переместиться в отсек для извлечения эритроцитов 14, тем самым уменьшая выход выделяемых мононуклеарных клеток, стволовых клеток и клеток-предшественников.
Одна из сложностей, присутствующих в уровне техники, которая преодолевается приводимым в качестве примера вариантом осуществления настоящего изобретения, состоит в проблеме сбора заданного конечного объема жидкости, перемещенной в процессе центрифугирования. Это является важным, например, потому, что различные другие типы приспособлений, в которых, как предполагается, будут использованы образцы крови по настоящему изобретению, предназначены вмещать заданные объемы жидкости, например 20 мл. Хотя определение, был ли собран определенный объем жидкости в процессе центрифугирования, является возможным с помощью с помощью специализированных шкал измерения массы собранной жидкости, в целях надежности предпочтителен твердый раствор. Во-первых, известно, что жидкость над клетками, проходящими через область датчиков основного отсека, создает действующее вниз давление на эти клетки и вызывает их удаление через нижнюю часть воронки. Поскольку жидкость продолжает удаляться при постоянном ускорении, скорость удаления падает, поскольку на клетки оказывается меньшее давление вследствие снижения объема плазмы над ними. Также известно, что хотя вязкость клеток может меняться от гематокрита к гематокриту и от индивида к индивиду, плазма имеет соответствующую вязкость. Следовательно, как только все целевые клетки прошли, и только плазма продолжает переноситься через трубку в отсек для стволовых клеток, она будет течь с предсказуемой скоростью, пропорциональной динамическому напору плазмы над ней.
В настоящем изобретении вышеупомянутые факты сопрягаются со способом, в котором используется множество пар эмиттер/детектор, через которые проходят удаляемые клетки. Например, лейкотромбоцитарный слой приближается к верхнему датчику, оптический счет, обнаруживаемый верхней или расположенной первой парой эмиттер/детектор, начинает расти, как описано выше. Задается произвольное значение оптического счета (в данном случае 4) и делается временная метка, когда расположенная первой пара эмиттер/детектор обнаруживает произвольное значение. Поскольку удаление продолжается, вторая временная метка устанавливается, когда вторая пара эмиттер/детектор (та, что расположена непосредственно под самой верхней парой) считывает то же самое произвольное значение. Посредством расчета, в котором принимается во внимание расстояние между положением первой и второй парами эмиттер/детектор и время, за которое произвольное значение достигает второго положения, может быть рассчитана скорость течения компонентов крови между двумя парами детекторов. Тот же самый процесс может быть использован для определения времени, которое занимает прохождение любого произвольного значения от одного датчика к любому другому датчику, расположенному ниже него.
Для дальнейшего определения объема крови между датчиками, может быть вычислена скорость объемного извлечения. Например, известно, что в одном варианте осуществления настоящего изобретения объем в узком конце воронки, ниже датчика, расположенного первым, составляет 6 мл, в то время как объем ниже датчика, расположенного вторым, составляет 4 мл. Таким образом, скорость потока может быть вычислена на основе понимания того, что в промежутке между первой и второй отметкой времени удаляется 2 мл крови. Скорость может быть дополнительно уточнена с помощью определения тех моментов, когда третья и четвертая пары эмиттер/детектор считывают то же самое произвольное значение. В ходе этого процесса следует учитывать имеющую место вышеуказанную методику «старт-стоп» и действие полного закрытия клапана на скорость удаления. В заключение, посредством экстраполяции на основе наблюдаемой скорости потока через расположенные друг над другом пары эмиттер/детектор, может быть установлен лимит времени, на которое клапан в отсек для сбора стволовых клеток открывается затем, чтобы раствор лейкоцитов, содержащий стволовые клетки, покрылся сверху плазмой до желаемого объема. Лимит изменяется в зависимости от скорости потока, который в весьма значительной степени преобладающе зависит от давления, оказываемого столбом жидкости над точкой удаления, и в некоторой степени зависит от вязкости плазмы, которая используется для «долива» раствора стволовых клеток до заданного конечного объема.
В альтернативных вариантах осуществления изобретения эритроциты могут собираться при более высоком или более низком ускорениях, чем в настоящий момент выбранное 100 G, например, в гравитационном поле от 50 до 200 G.
Альтернативный вариант осуществления изобретения включает способ для того чтобы значительно снизить количество тромбоцитов 4, собираемых совместно с мононуклеарными клетками 5.
Как показано на Фиг. 33, в ходе процесса центрифугирования мононуклеарные клетки 3 и тромбоциты 4 концентрируются в нижней узкой части первоначального отсека 11. В этот момент в процессе, если пережимной клапан в отсек для сбора стволовых клеток 15 открывается, мононуклеарные клетки вначале будут побуждаться массой плазмы двигаться в направлении, перпендикулярном оси вращения, а затем подниматься по расположенной с правой стороны трубки в направлении оси вращения и в отсек для сбора стволовых клеток 15. Без использования дополнительных этапов, плазма будет последовательно выдавливать тромбоциты в отсек для сбора стволовых клеток до тех пор пока они не будут извлечены, за это время поток плазмы заполнит отсек для сбора стволовых клеток.
Чтобы снизить число тромбоцитов, которые попадают в отсек для сбора стволовых клеток 15, техник может запрограммировать блок управления поставить процесс на паузу в конце цикла извлечения эритроцитов/гранулоцитов (путем закрывания клапана для эритроцитов и не открывания клапана для мононуклеарных клеток) и позволить центрифуге остановиться. В этом способе техник затем удаляет картридж из стакана центрифуги и осторожно встряхивает картридж для того чтобы перераспределить мононуклеарные клетки 3 и тромбоциты 4 по плазме 5 в воронке, диспергируя их, как изображено на Фиг. 34.
Как показано на Фиг. 35, картридж затем центрифугируют меньшее количество времени и при меньшем ускорении. Меньшее количество времени и меньшее ускорение являются достаточными для того чтобы вызвать более интенсивное и быстрое движение мононуклеарных клеток 3, чтобы повторно сконцентрировать их в нижней части воронки, но недостаточны для того чтобы вызвать тоже самое для тромбоцитов. Тромбоциты имеют более низкую плотность и меньший размер и таким образом требуют больше времени для того чтобы переместить их в нижнюю часть воронки. Не обеспечивая данного времени, большая часть мононуклеарных клеток может быть отделена от большей части тромбоцитов, как показано.
Обращаясь к Фиг. 36, когда зажимной клапан в отсек для сбора стволовых клеток 15 открывается, мононуклеарные клетки перетекают первыми, за ними плазма и малая фракция тромбоцитов 4, и затем трубка для сбор стволовых клеток закрывается. Хотя некоторое количество тромбоцитов по-прежнему проникает в отсек для сбора стволовых клеток, фракция пропорциональна объему плазмы, который был перенесен в отсек для сбора стволовых клеток, по сравнению с общим объемом плазмы в одноразовом картридже. Например, 100 мл крови обычно будут содержать около 55 мл плазмы. Если 5 мл плазмы перенесли в отсек для сбора стволовых клеток, оставив 50 мл плазмы в первоначальном отсеке, то соотношение тромбоцитов совместно с мононуклеарными клетками будет 10% от общего количества тромбоцитов - составляя приблизительно 90% снижение тромбоцитов в собранных мононуклеарных клетках.
Обращаясь к Фиг. 37, проиллюстрирован другой альтернативный вариант осуществления. В этом альтернативном варианте осуществления может быть желательным присутствие гранулоцитов в отсеке для сбора стволовых клеток. Например, при сборе пуповинной крови общее количество лейкоцитов часто определяет, какая из двух единиц пуповинной крови соответствует выбранному пациенту. Таким образом, может быть желательным включить большую часть гранулоцитов с мононуклеарными клетками. Чтобы достичь этого результата, техник может запрограммировать блок управления открыть клапан в отсек для сбора стволовых клеток раньше, чем в других (раскрытых выше) вариантах осуществления, тем самым позволив верхнему слою эритроцитов (содержащему большинство гранулоцитов) проникнуть в отсек для сбора. Должно быть очевидным, что посредством регулирования времени, в отсеке для сбора стволовых клеток могут быть получены различные количества гранулоцитов. Собранный в отсеке для сбора образец затем пополняется плазмой таким образом, что образец остается относительно низко (с гематокритом приблизительно 2-10%).
Обращаясь к Фиг. 38, в любом из вышеупомянутых вариантов осуществления, действуют механизмы для удаления содержимого из отсека для сбора стволовых клеток, а также из напорной трубки, содержащей по меньшей мере 1 мл эритроцитов, переносимых в отсек для эритроцитов. На Фиг. 38 показан одноразовый картридж с трубкой для сбора стволовых клеток 27 и трубкой для сбора эритроцитов/гранулоцитов 28, предназначенными для их объединения. Трубка для сбора эритроцитов/гранулоцитов присоединяется к внешней поверхности картриджа с помощью известных из уровня техники средств и создает соединение с возможностью переноса текучих сред с нижней частью напорной трубки, тем самым обеспечивая простое средство для извлечения по меньшей мере из 1 мл клеточного раствора ядросодержащих эритроцитов и гранулоцитов для отбора образцов, например для типирования лейкоцитарного антигена человека (HLA). Затем, в случае необходимости, может быть также удалена оставшаяся часть эритроцитов/гранулоцитов.
В любом варианте осуществления настоящего изобретения в образец перед сбором для того чтобы связать клетки, известные как непригодные для какой-либо специфической исследовательской или клинической цели, могут быть введены бусы с антителами, плавающие в плазме или имеющие приблизительно туже плотность что и эритроциты.
В любом варианте осуществления настоящего изобретения должно быть понятно, что в образец перед сбором может быть введено флуоресцентное вещество, абсорбируемое определенной группой клеток, чтобы отследить упомянутые группы клеток в ходе процесса выделения и после этого.
Хотя изобретение было продемонстрировано и описано применительно к конкретным вариантам осуществления, очевидно, что равноценные изменения и модификации придут на ум другом специалисту в данной области при прочтении; и осознании описания. В частности, в отношении выполняемых вышеописанными компонентами функций, термины (включая любые указания на «средство»), используемые для описания таких компонентов предназначаются для того чтобы соответствовать, до тех пор пока не указано иначе, любому компоненту, который выполняет специфическую функцию описанного компонента (например, который функционально эквивалентен) даже если он структурно не эквивалентен раскрываемому компоненту, который выполняет эти функции в приводимых в качестве примера в настоящем документе вариантах осуществления изобретения. В дополнение, хотя конкретный признак изобретения может быть раскрыт в отношении только одного варианта осуществления, такой признак может быть скомбинирован с одним или несколькими другими признаками других вариантов осуществления, поскольку может быть желателен или может обеспечивать преимущества для любой заданной или конкретной области применения.
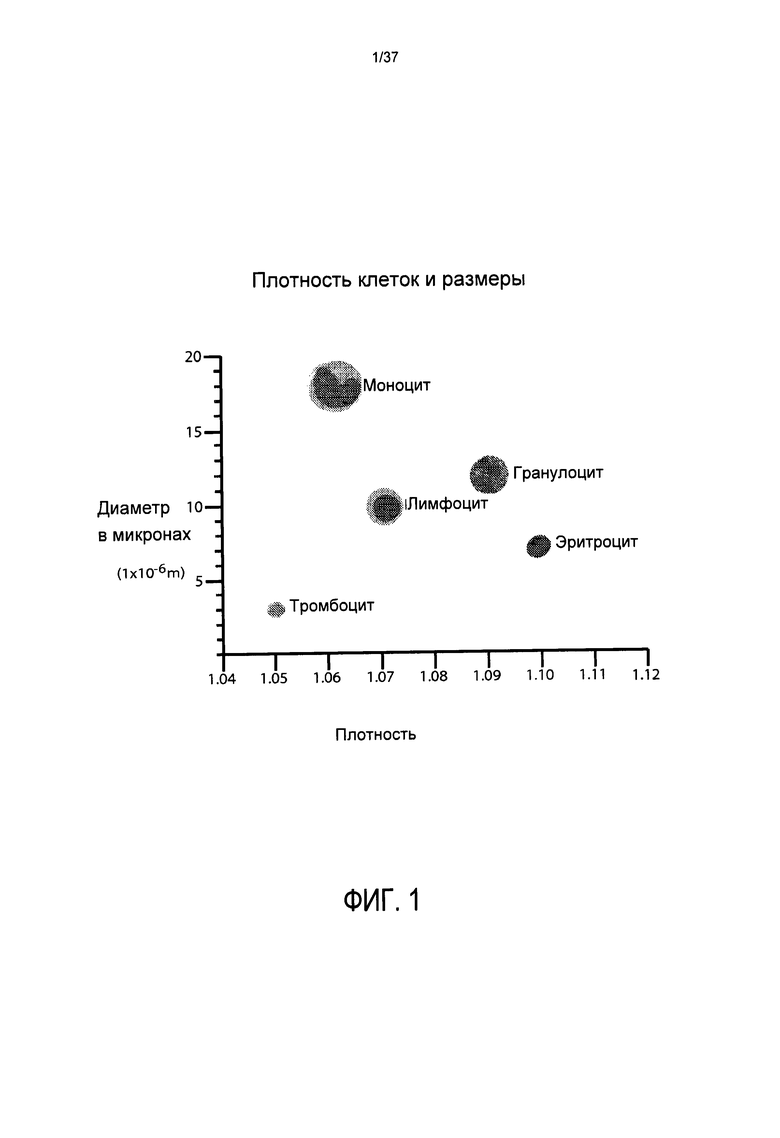
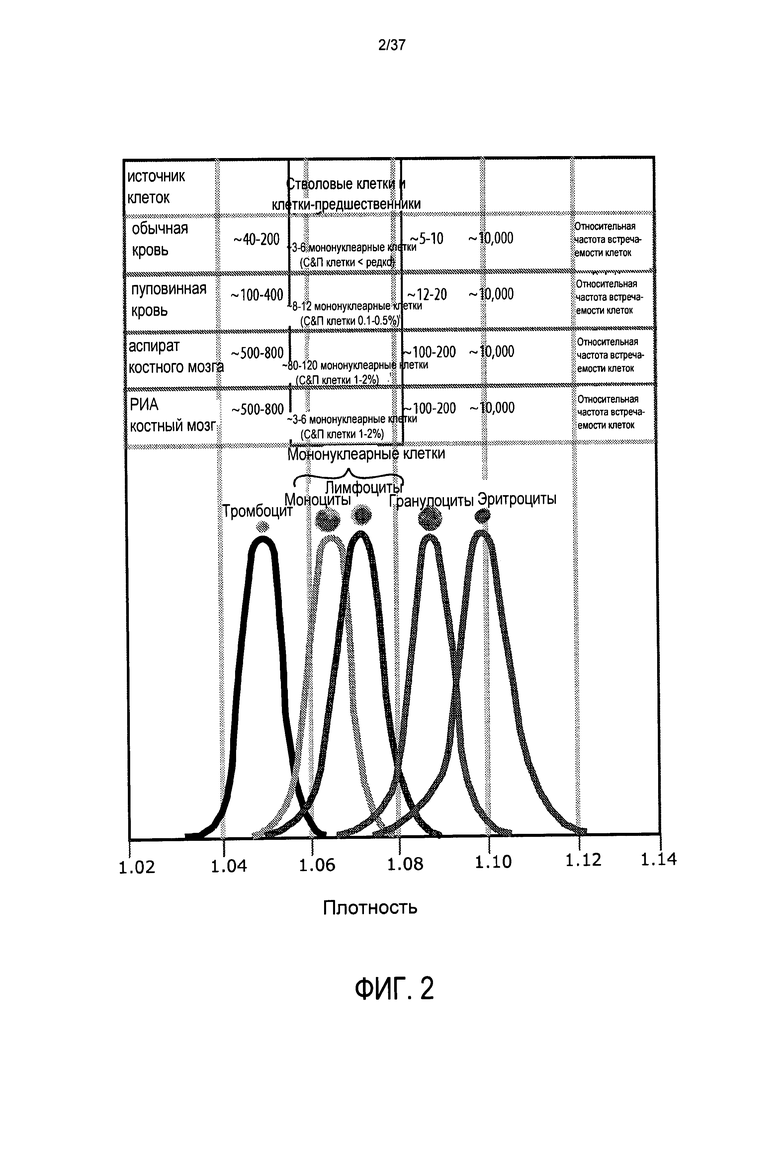
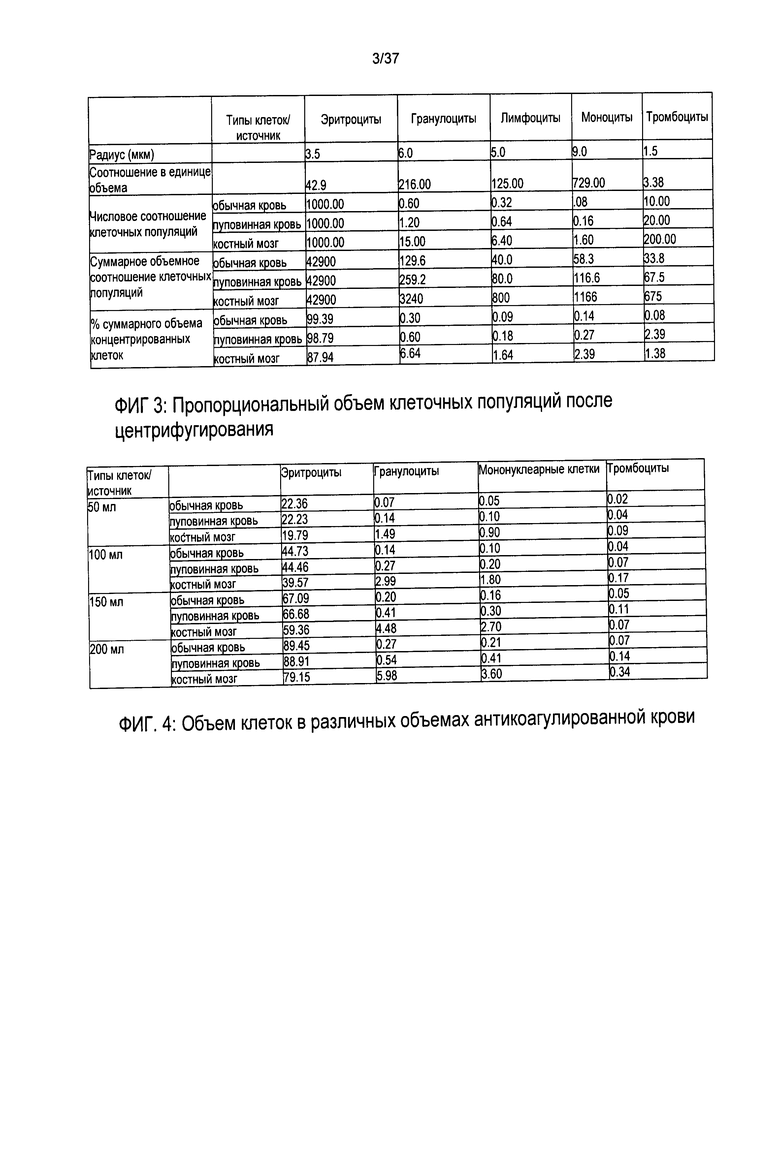
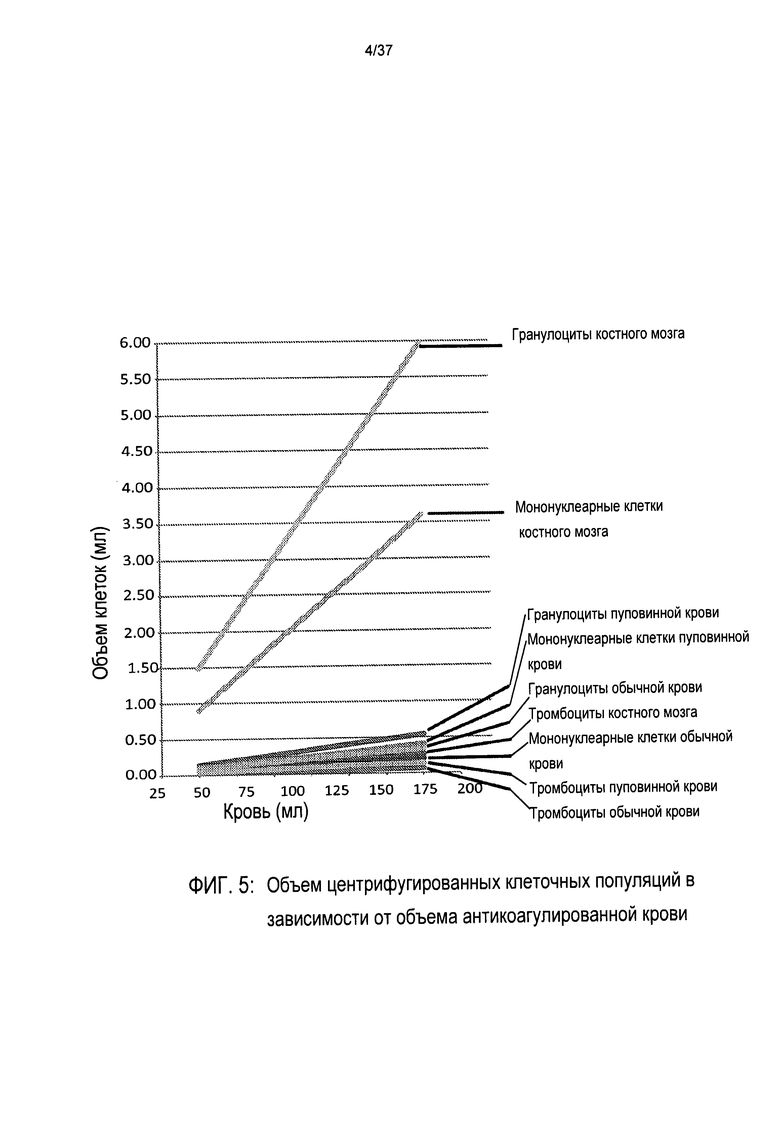

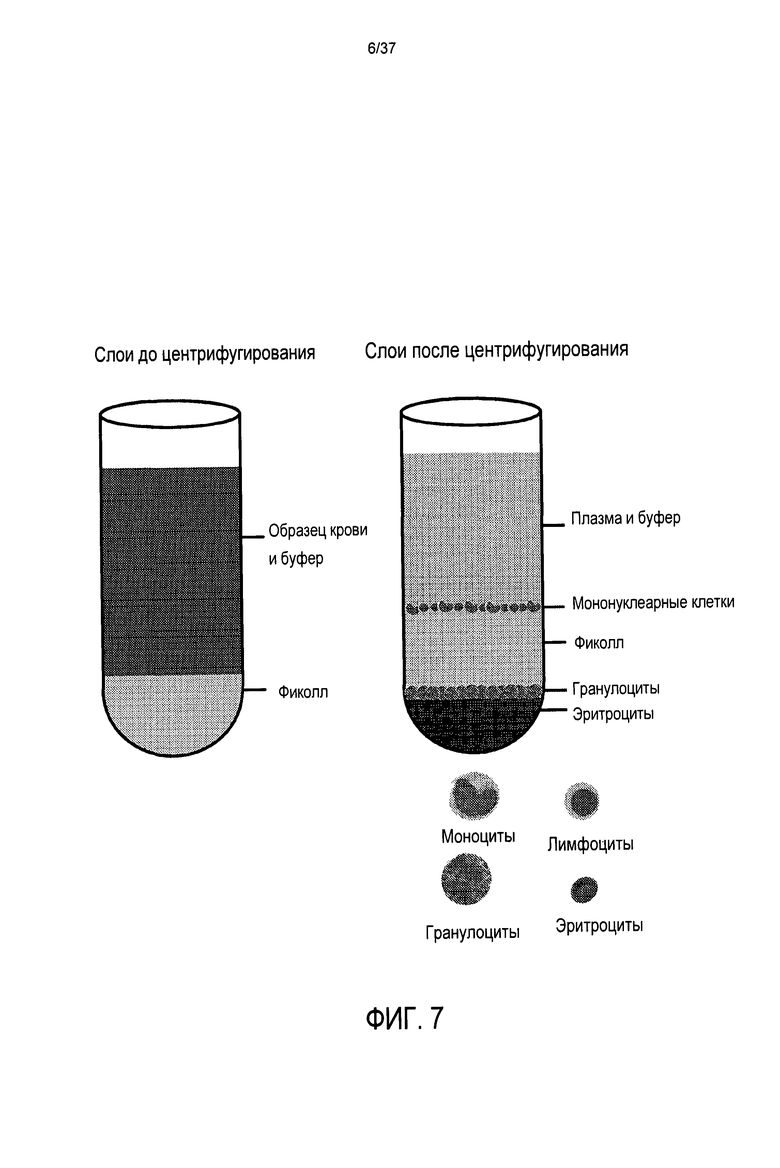
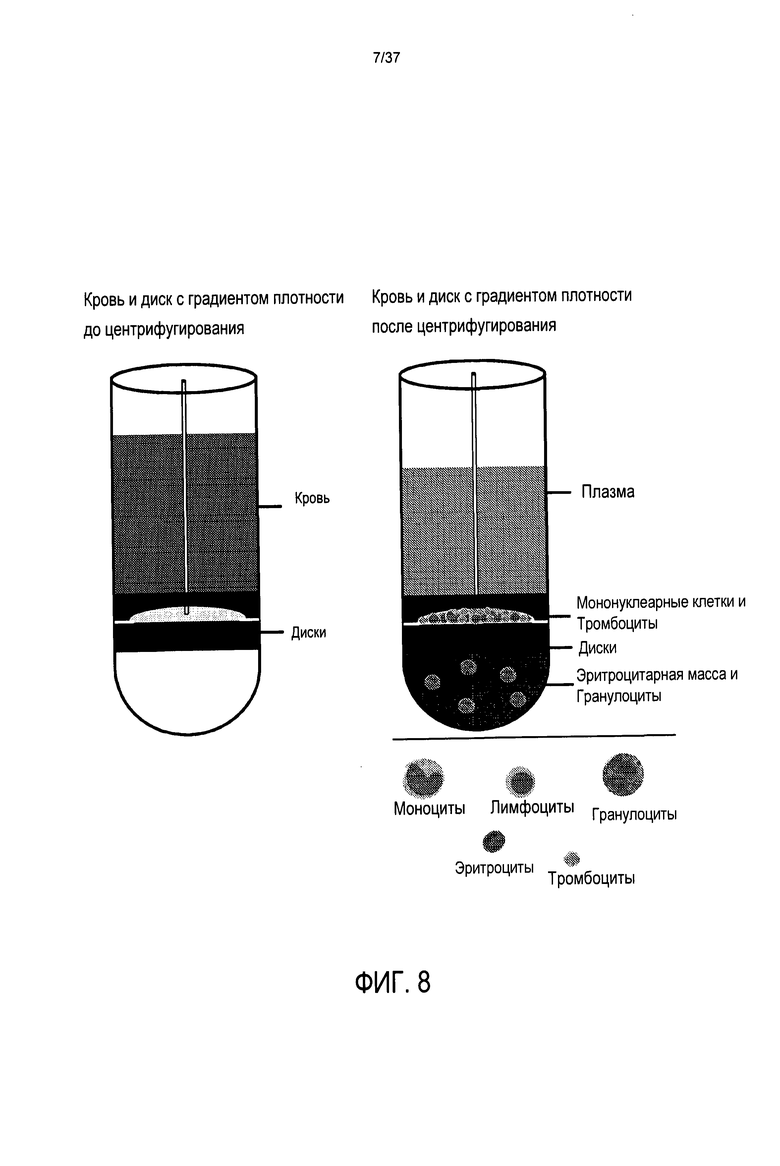

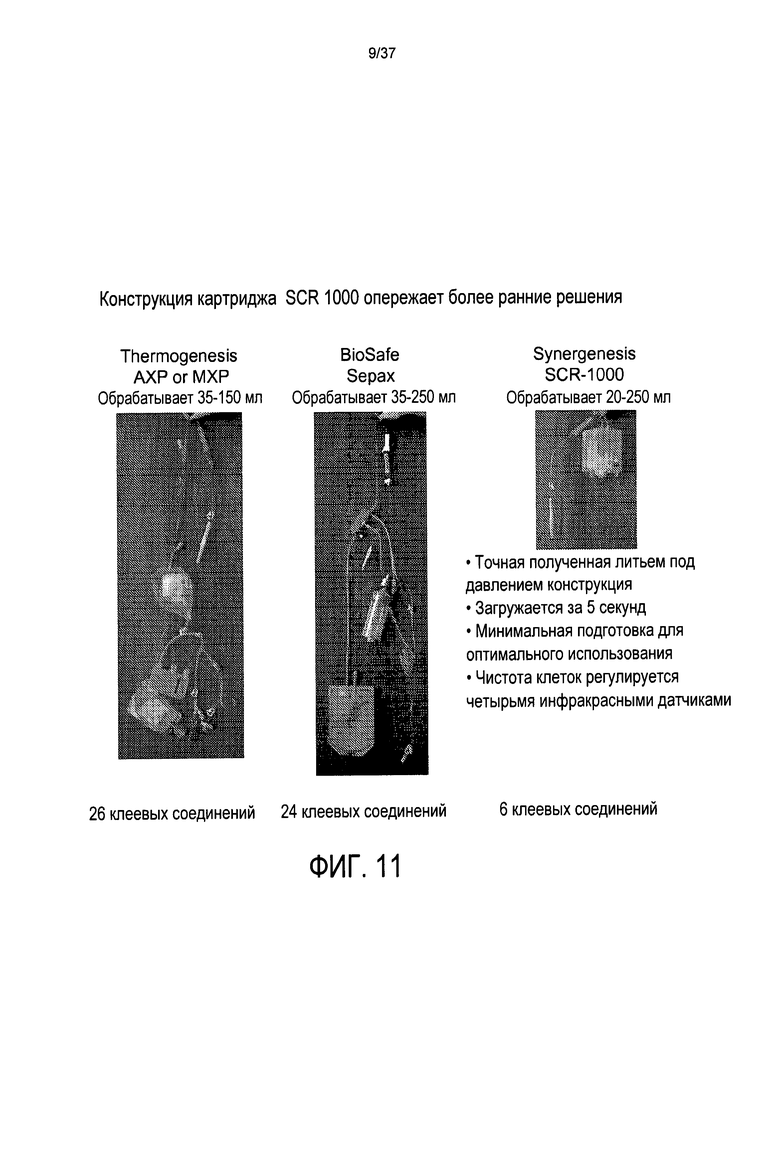

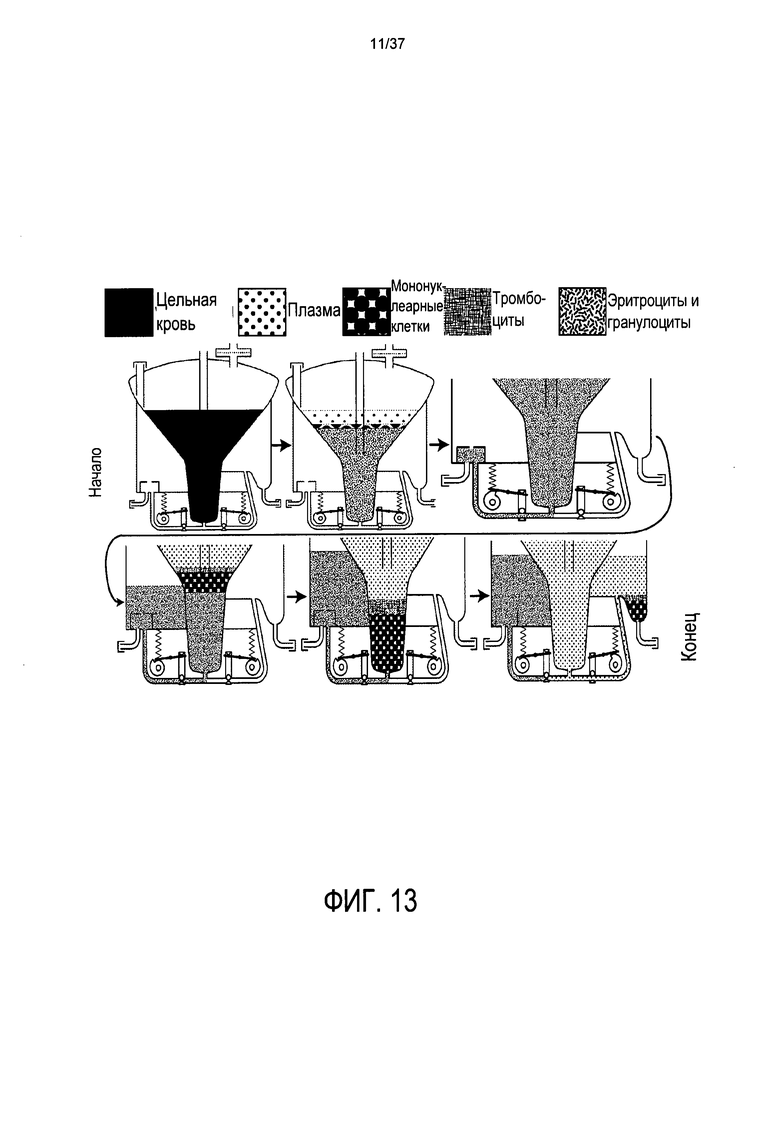
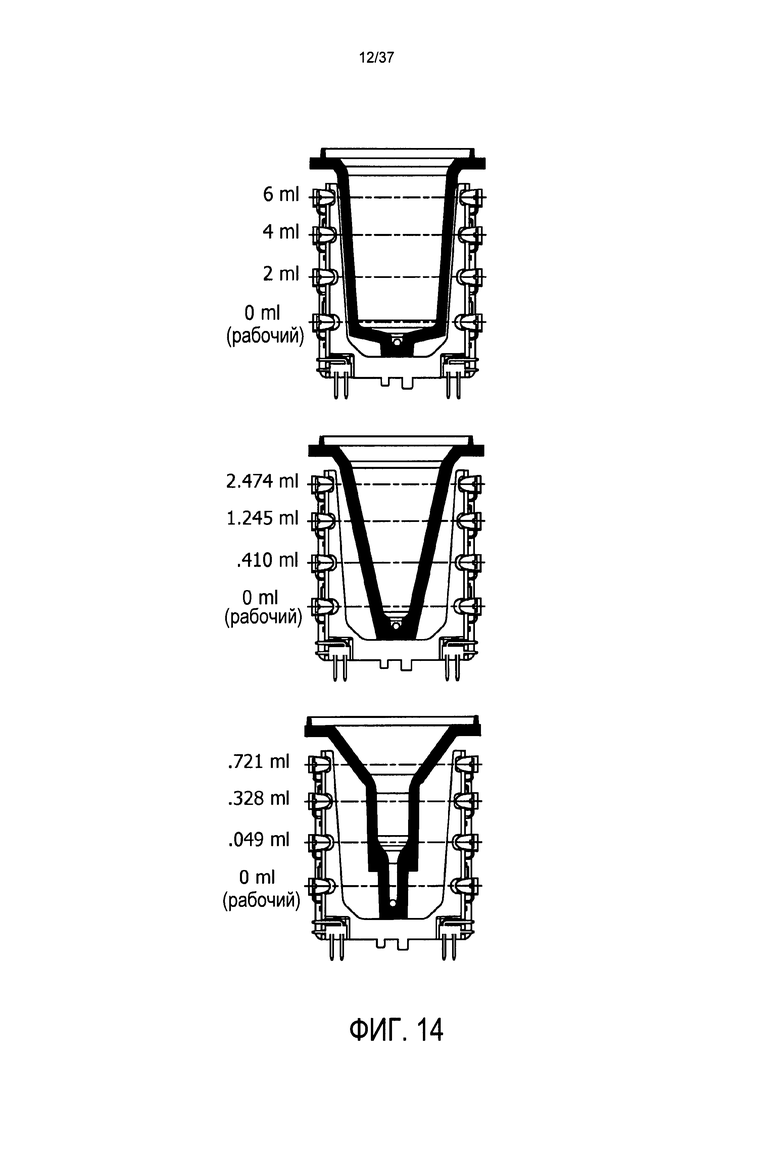

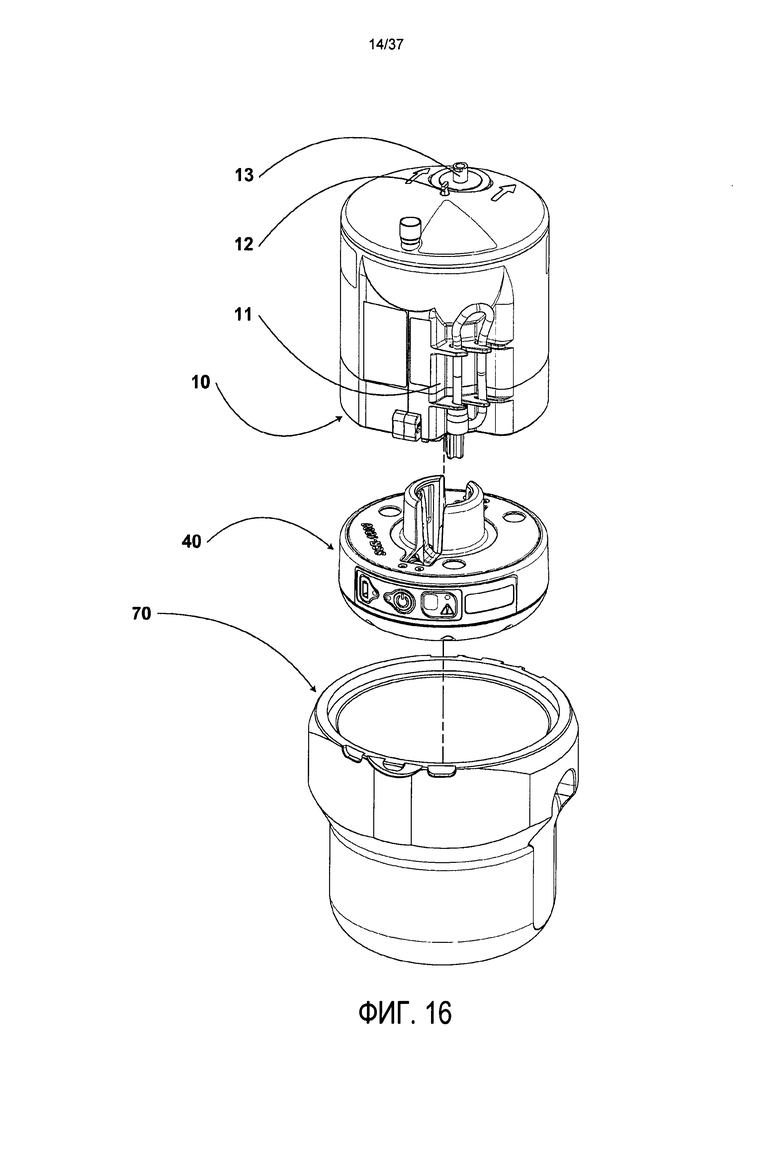


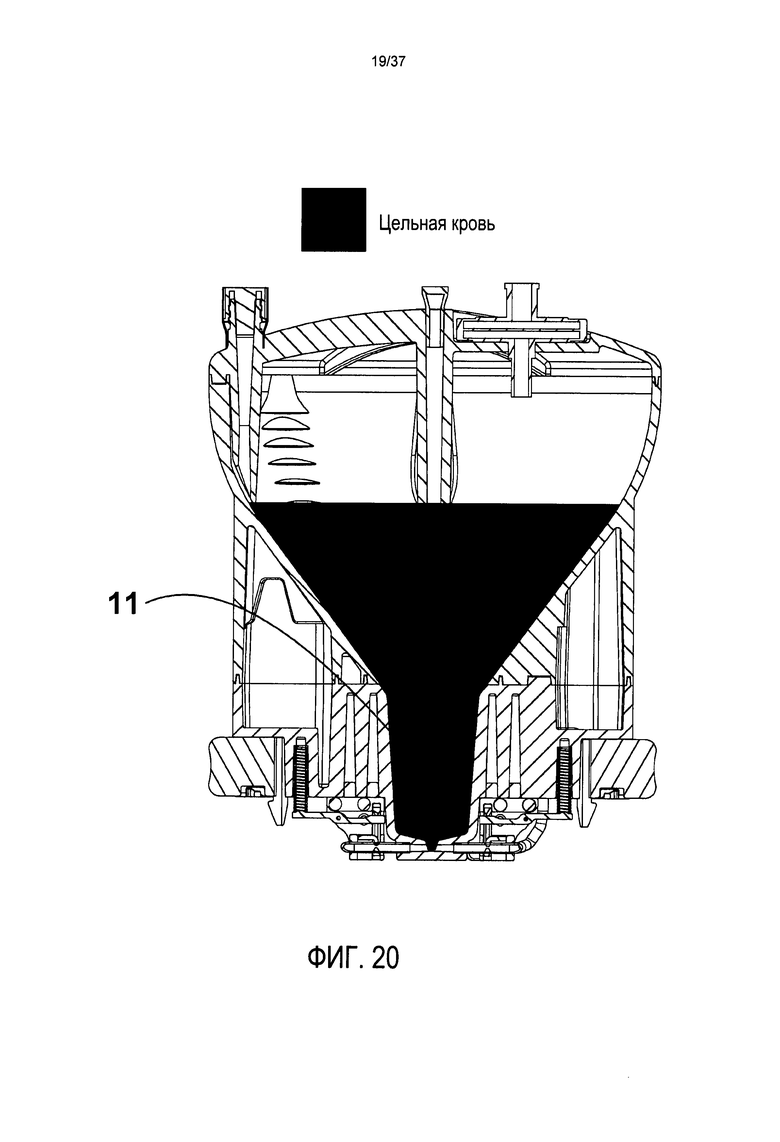
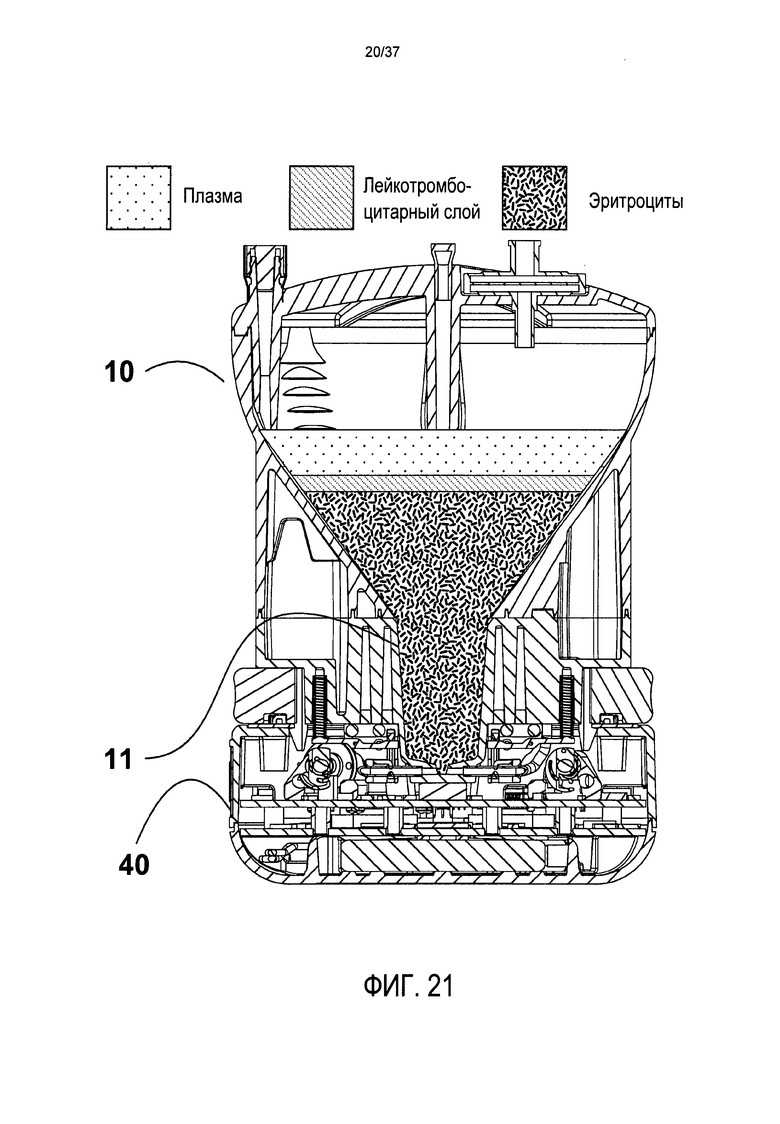

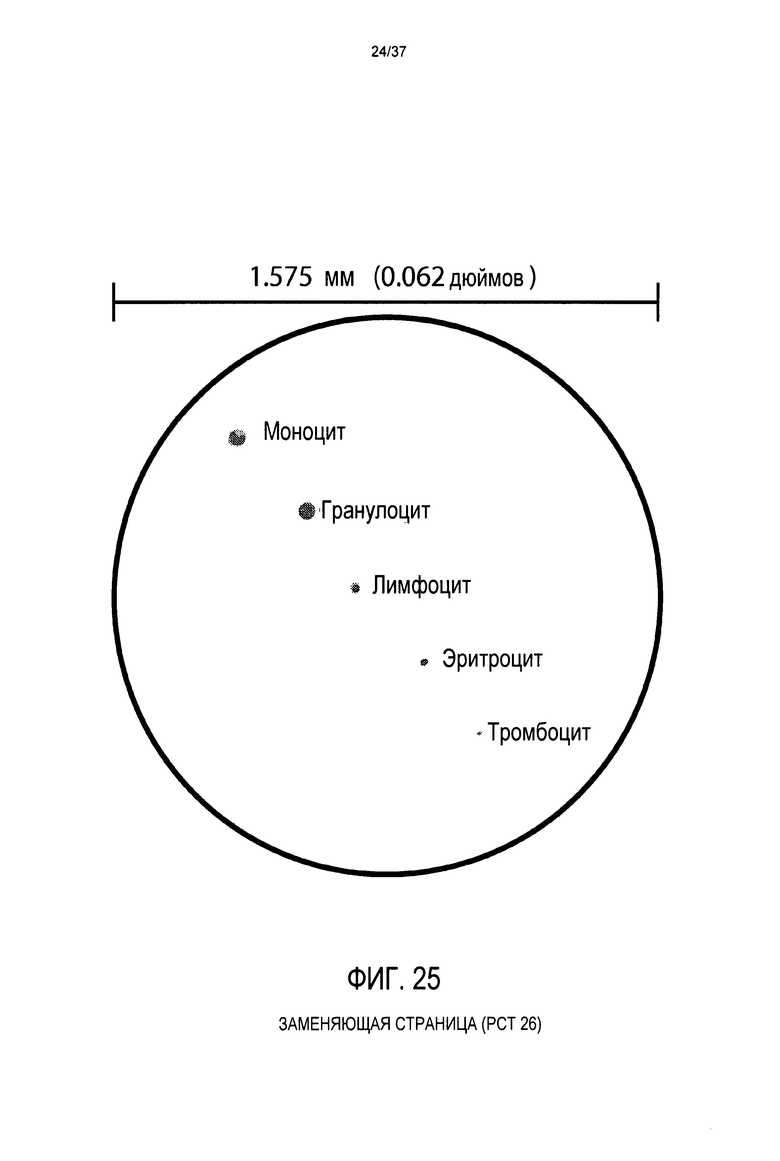
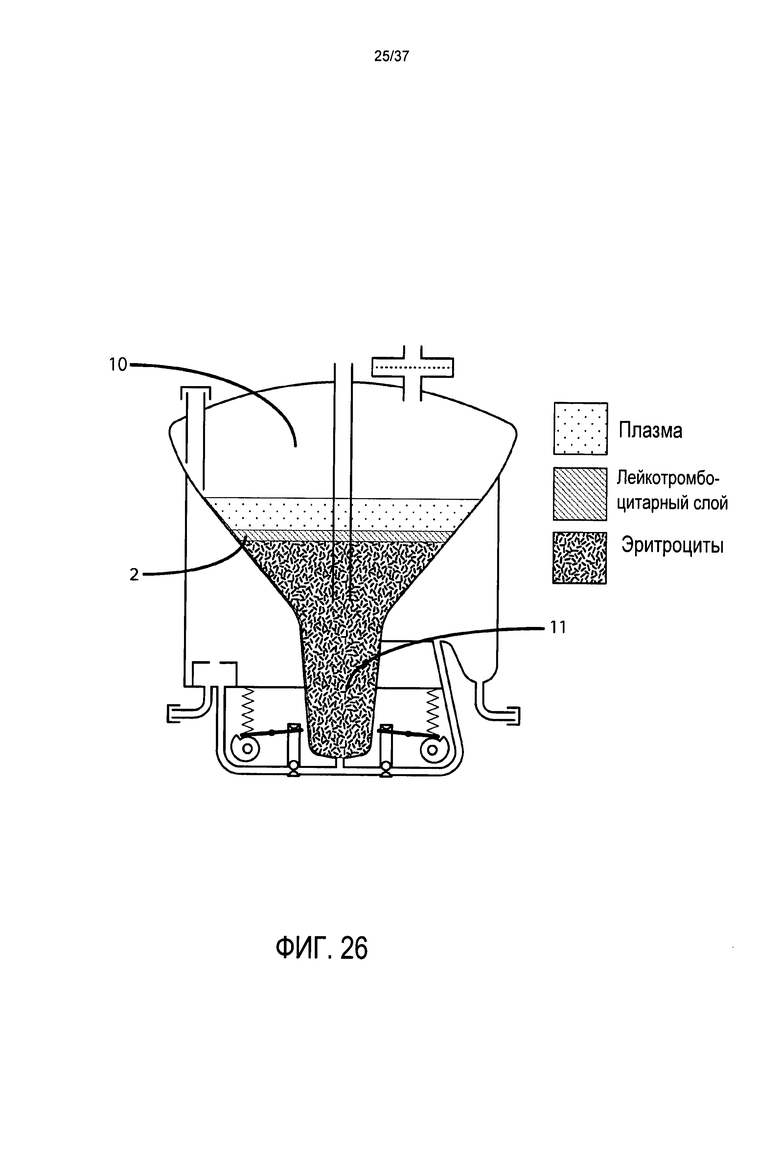
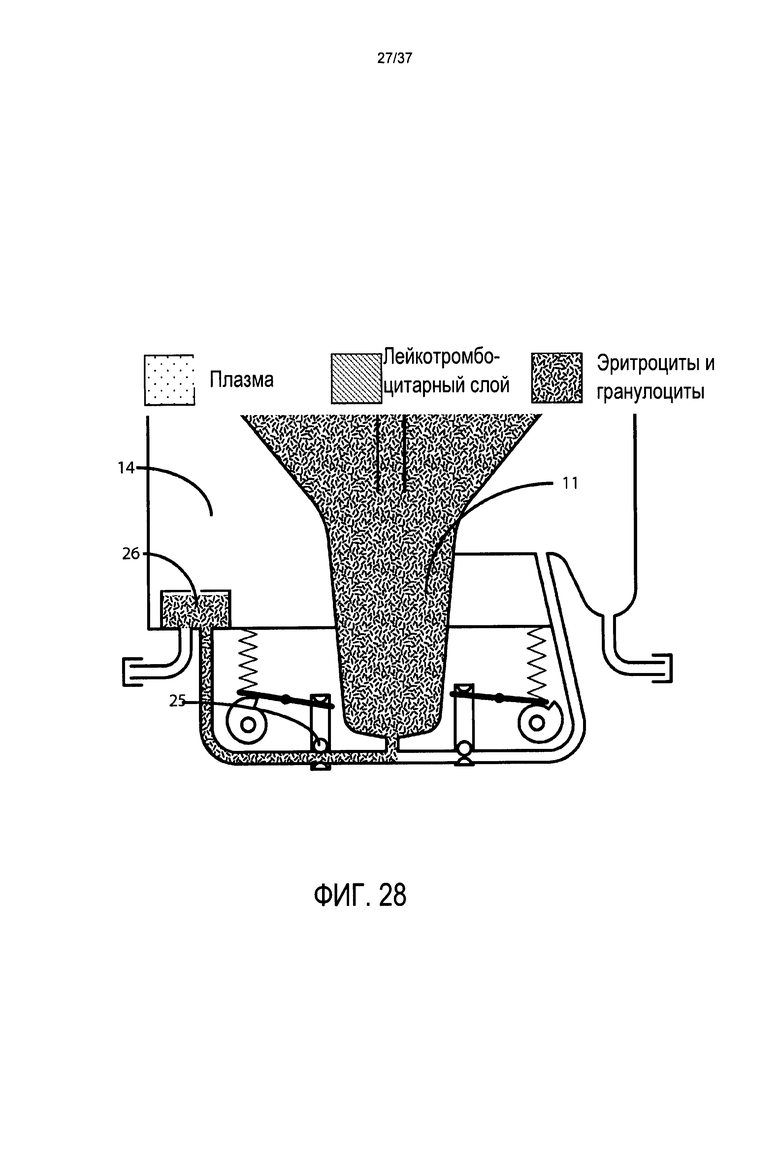

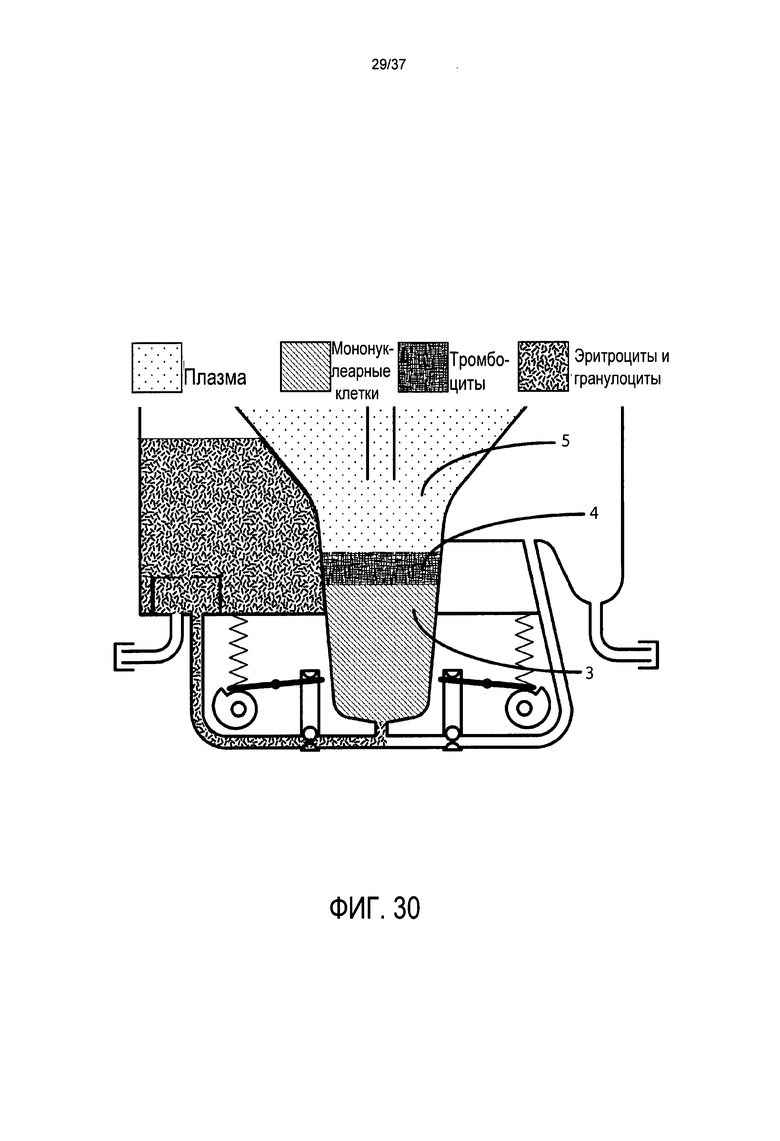
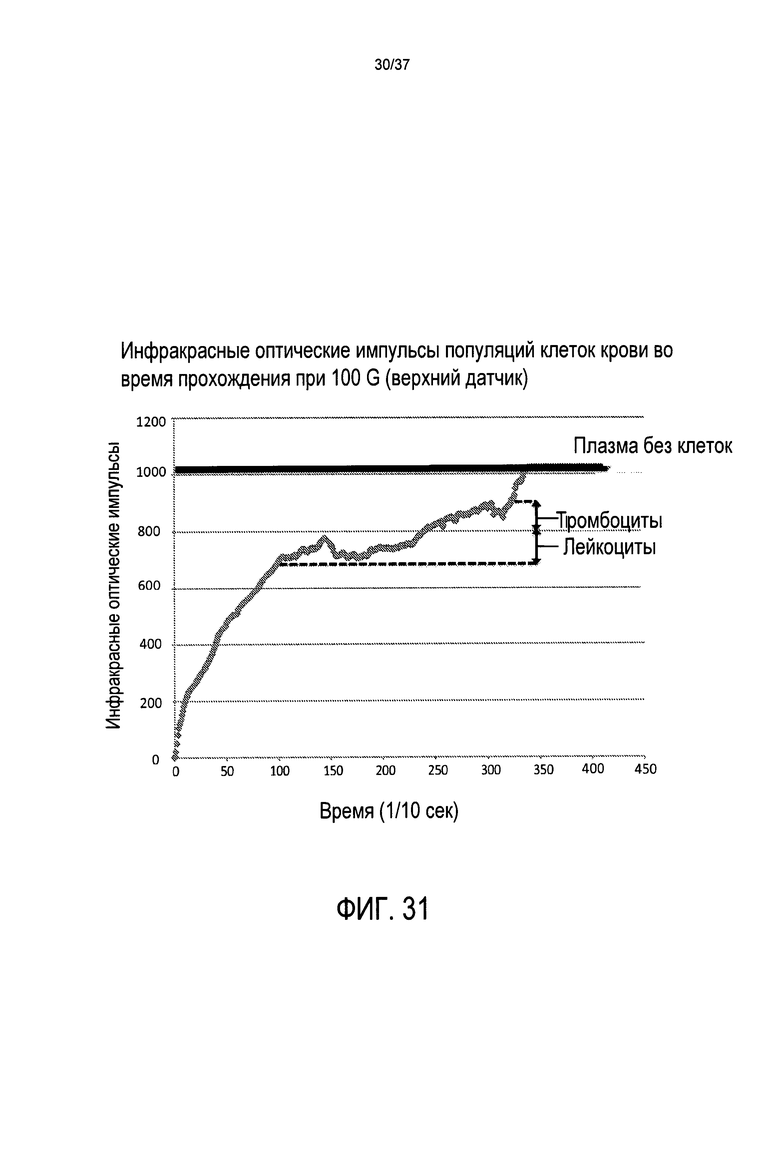

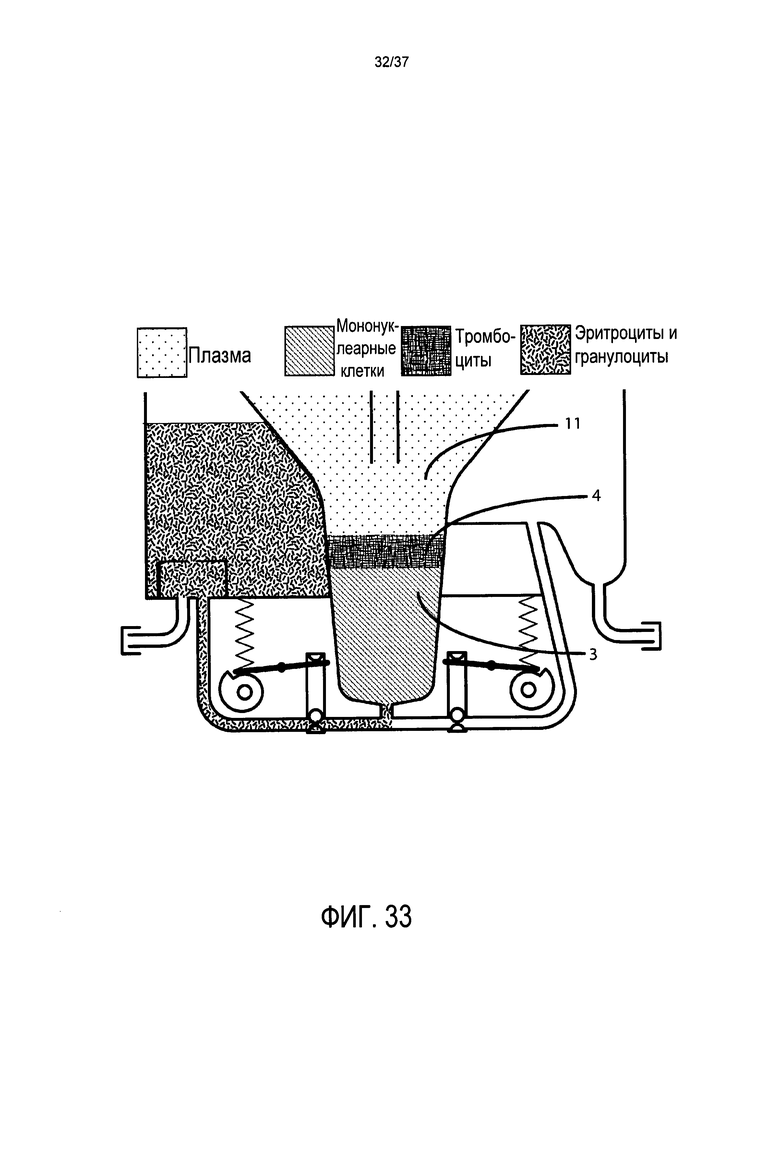

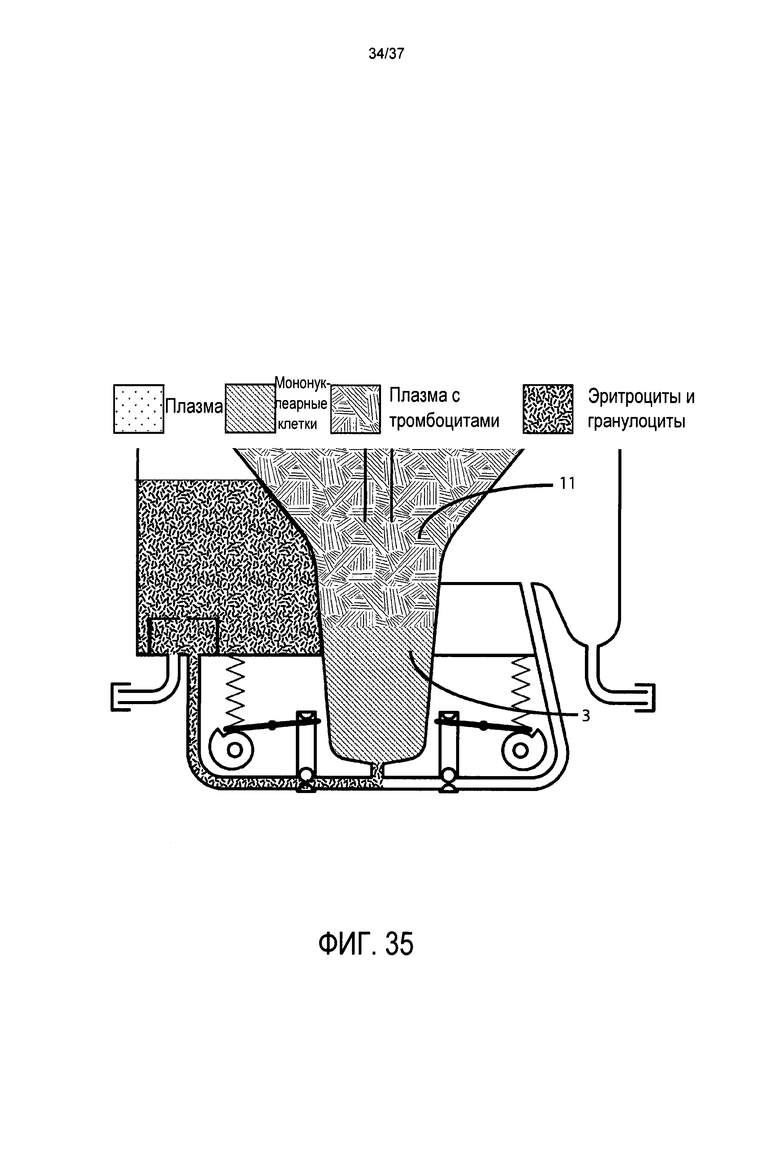
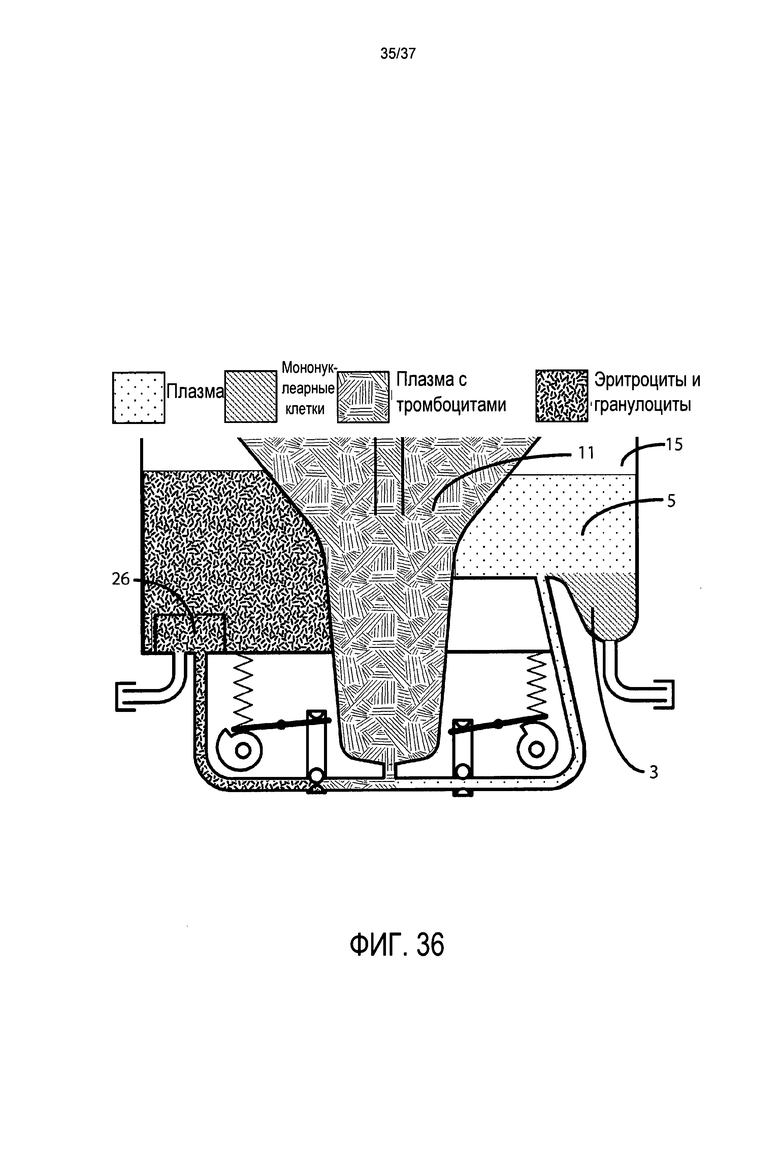
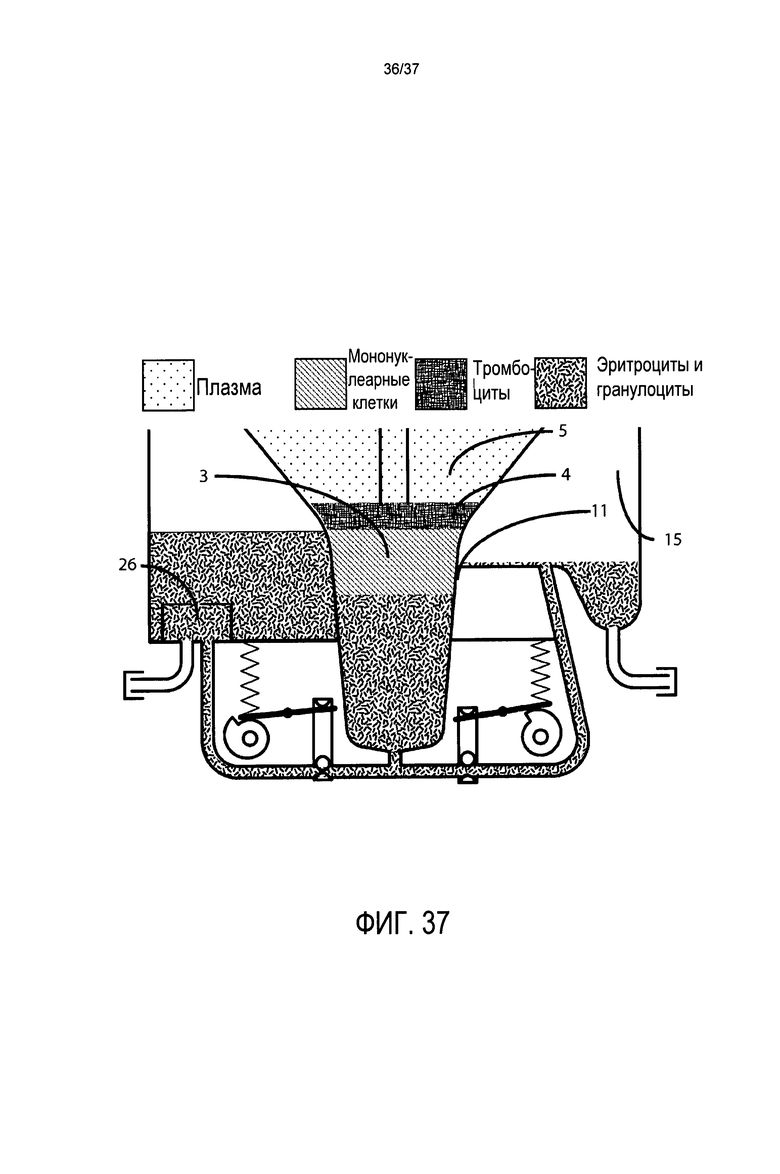
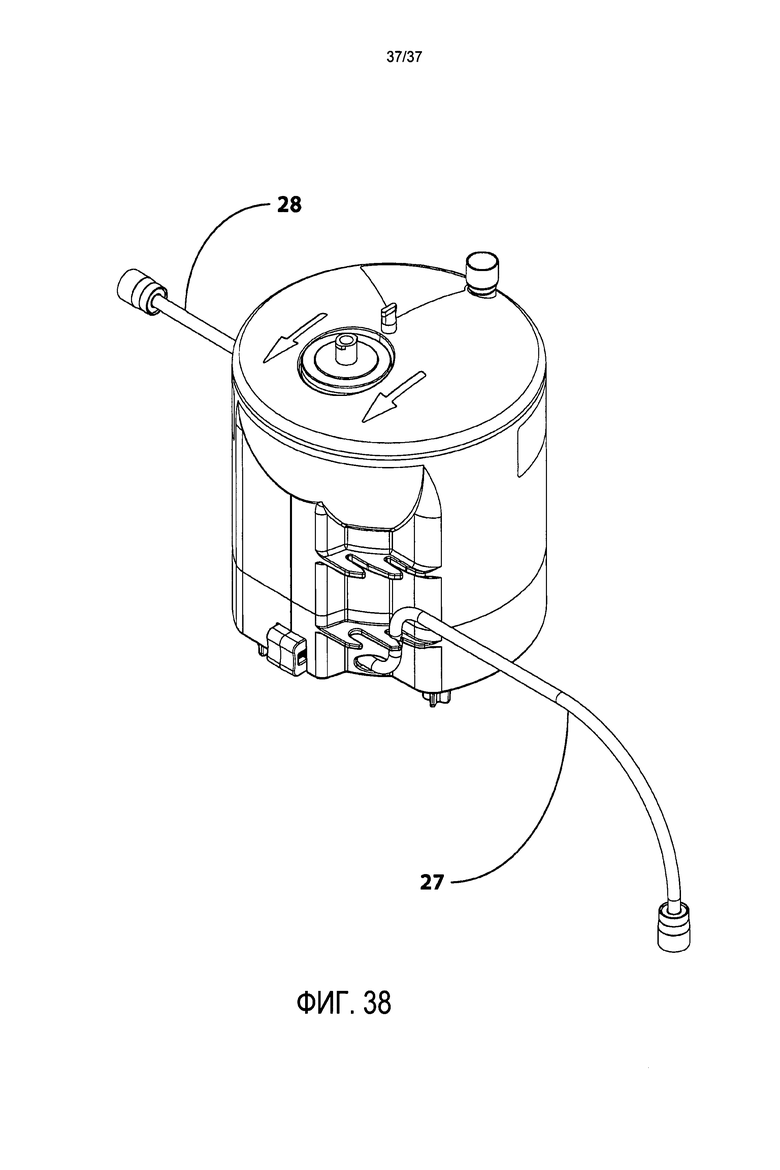
Группа изобретений относится к области разделения клеток, в частности к разделению компонентов крови. Способ разделения клеток высокой плотности и клеток низкой плотности из образца крови включает: размещение жесткого картриджа в центрифуге; перенос образца в жесткую камеру картриджа; центрифугирование жесткого картриджа; обеспечение первого пути для клеток высокой плотности через конец жесткой камеры в первый жесткий отсек картриджа для хранения; наблюдение за миграцией клеток высокой плотности через конец жесткой камеры; обеспечение второго пути для клеток низкой плотности и некоторого количества плазмы через конец жесткой камеры во второй жесткий отсек картриджа для хранения. При этом центрифугирование происходит таким образом, что указанный образец вынужден двигаться в направлении указанного конца под действием первой динамической нагрузки по меньшей мере 10 G, а затем под действием второй динамической нагрузки, меньшей, чем первая динамическая нагрузка, но большей, чем 1 G. Также раскрываются варианты способа разделения клеток высокой плотности и клеток низкой плотности из образца крови, устройства для разделения клеток высокой плотности и клеток низкой плотности из образца крови, а также жесткого картриджа для разделения клеток высокой плотности и клеток низкой плотности из образца крови. Группа изобретений обеспечивает увеличение эффективности сбора целевых клеточных популяций, характеризующихся низкой плотностью. 10 н. 71 з.п. ф-лы, 38 ил.
1. Способ разделения клеток высокой плотности и клеток низкой плотности из образца крови, при этом указанный способ включает:
a. размещение жесткого картриджа в центрифуге, при этом указанный жесткий картридж содержит жесткую камеру, имеющую конец, который соединен по текучей среде с системой клапанов, которая сначала закрыта, первый жесткий отсек для хранения и второй жесткий отсек для хранения;
b. перенос указанного образца в указанную жесткую камеру, при этом указанный образец содержит плазму, клетки высокой плотности и клетки низкой плотности, где клетки высокой плотности представляют собой эритроциты и гранулоциты, и где клетки низкой плотности представляют собой лимфоциты, моноциты, тромбоциты, стволовые клетки и клетки-предшественники;
c. центрифугирование указанного жесткого картриджа таким образом, что указанный образец вынужден двигаться в направлении указанного конца под действием первой динамической нагрузки по меньшей мере 10 G, а затем под действием второй динамической нагрузки, меньшей, чем первая динамическая нагрузка, но большей, чем 1 G;
d. обеспечение первого пути для указанных клеток высокой плотности через указанный конец и в указанный первый жесткий отсек для хранения:
e. наблюдение за миграцией указанных клеток высокой плотности через указанный конец; и
f. обеспечение второго пути для указанных клеток низкой плотности и некоторого количества плазмы через указанный конец и в указанный второй жесткий отсек для хранения.
2. Способ по п. 1, где указанное наблюдение осуществляют оптически.
3. Способ по п. 1, где на указанной стадии обеспечения используют указанную систему клапанов.
4. Способ по п. 1, где указанная жесткая камера имеет по существу коническую форму.
5. Способ по п. 1, дополнительно включающий определение указанной первой и второй динамической нагрузки.
6. Способ по п. 1, дополнительно включающий извлечение по меньшей мере одного дополнительного типа клеток из указанного образца.
7. Способ по п. 6, дополнительно включающий стадии:
a. замедления вращения указанного жесткого картриджа до динамической нагрузки 1 G после указанной стадии центрифугирования и где часть указанного образца остается в указанной жесткой камере;
b. встряхивания указанного жесткого картриджа для перемешивания указанной части; и
c. центрифугирования указанного жесткого картриджа до динамической нагрузки, превышающей 1 G,для последующей обработки.
8. Способ по п. 1, где множество гибких трубок соединяют указанную жесткую камеру с указанными первым и вторым жесткими отсеками, и где указанные гибкие трубки имеют соотношение длины к диаметру, не превышающее 20.
9. Способ по п. 1, где система клапанов включает эксцентрик и гибкую трубку.
10. Способ по п. 1, где бусину с антителом вводят в указанный образец до указанной стадии обеспечения.
11. Способ по п. 10, где указанная бусина с антителом приблизительно имеет такую же плотность, как эритроциты.
12. Способ по п. 10, где указанная бусина с антителом способна держаться на поверхности плазмы.
13. Способ по п. 1, где указанный образец дополнительно содержит флуоресцентное вещество.
14. Способ по п. 13, дополнительно включающий стадию слежения за указанным флуоресцентным веществом.
15. Способ по п. 1, дополнительно включающий стадии:
a. замедления вращения указанного жесткого картриджа до динамической нагрузки 1 G после указанной стадии центрифугирования и где часть указанного образца остается в указанной жесткой камере;
b. встряхивания указанного жесткого картриджа для перемешивания указанной части; и
c. центрифугирования указанного жесткого картриджа до динамической нагрузки, превышающей 1 G, для последующей обработки.
16. Способ по п. 15, где бусину с антителом вводят в указанный образец до указанной стадии обеспечения.
17. Способ по п. 16, где указанная бусина с антителом приблизительно имеет такую же плотность, как эритроциты.
18. Способ по п. 16, где указанная бусина с антителом способна держаться на поверхности плазмы.
19. Способ по п. 15, где указанный образец дополнительно содержит флуоресцентное вещество.
20. Способ по п. 19, дополнительно включающий стадию слежения за указанным флуоресцентным веществом.
21. Способ по п. 1, дополнительно включающий стадию добавления вещества, ускоряющего седиментацию эритроцитов.
22. Способ разделения клеток высокой плотности и клеток низкой плотности из образца крови, при этом указанный способ включает:
a. предоставление:
i. центрифуги, имеющей ось вращения; и
ii. образца, содержащего плазму и первую часть с высокой плотностью и оставшуюся часть с низкой плотностью, где клетки высокой плотности представляют собой эритроциты и гранулоциты, и где клетки низкой плотности представляют собой лимфоциты, моноциты, тромбоциты, стволовые клетки и клетки-предшественники;
iii. жесткого картриджа, содержащего:
1. внутреннюю жесткую камеру, имеющую выходное отверстие;
2. первый жесткий отсек для хранения и второй жесткий отсек для хранения;
3. входное отверстие;
4. систему клапанов, обеспечивающую сообщение между указанным выходным отверстием и указанными жесткими отсеками для хранения; и
iv. датчика;
b. расположение указанного образца в указанном жестком картридже путем переноса указанного образца через указанное входное отверстие и в указанную жесткую камеру;
c. центрифугирование указанного жесткого картриджа таким образом, чтобы указанная первая часть сначала была вынуждена двигаться в направлении указанного выходного отверстия под действием центробежной силы, направляемая указанной системой клапанов, а затем была вынуждена двигаться в направлении указанной оси вращения и в указанный первый жесткий отсек для хранения; и
d. направление с помощью указанной системы клапанов некоторого количества указанной оставшейся части в направлении указанной оси вращения и в указанный второй жесткий отсек для хранения.
23. Способ по п. 22, где система клапанов включает эксцентрик и гибкую трубку.
24. Способ по п. 22, где указанный датчик представляет собой оптический датчик.
25. Способ по п. 22, дополнительно включающий наблюдение с помощью указанного датчика за движением указанной первой части через выходное отверстие.
26. Способ по п. 22, где указанная жесткая камера дополнительно содержит узкий конец и где указанное выходное отверстие расположено на указанном узком конце.
27. Способ по п. 22, дополнительно включающий расслоение указанного образца, тем самым образуя по меньшей мере одну поверхность раздела.
28. Способ по п. 27, дополнительно включающий обнаружение указанной по меньшей мере одной поверхности раздела с использованием указанного датчика.
29. Способ по п. 27, где указанная стадия расслоения образует первую и вторую поверхность раздела.
30. Способ по п. 29, дополнительно включающий обнаружение указанных первой и второй поверхностей раздела с помощью указанного датчика.
31. Способ по п. 30, где указанная стадия направления имеет место после того как указанный датчик обнаружит указанную первую поверхность раздела.
32. Способ по п. 30, где указанная стадия направления имеет место после того как указанный датчик обнаружит указанную вторую поверхность раздела.
33. Способ по п. 32, дополнительно включающий наблюдение с помощью указанного датчика за движением указанной первой части через выходное отверстие.
34. Способ по п. 22, дополнительно включающий стадии:
а. замедления вращения указанного жесткого картриджа с динамической нагрузкой, превышающей 10 G, до динамической нагрузки приблизительно 1 G после указанной стадии центрифугирования и где:
i. подавляющее большинство указанной части находится в указанном первом жестком отсеке для хранения; и
ii. подавляющее большинство указанной оставшейся части находится в указанной жесткой камере;
b. перемешивания указанной оставшейся части путем встряхивания указанного жесткого картриджа; и
c. возвращения указанного жесткого картриджа к динамической нагрузке, превышающей 1 G, для последующей обработки.
35. Способ по п. 34, дополнительно включающий наблюдение с помощью указанного датчика за движением указанной первой части или второй части через указанное выходное отверстие.
36. Способ по п. 35, где указанный датчик представляет собой оптический датчик.
37. Способ по п. 36, где указанный оптический датчик содержит по меньшей мере одну пару инфракрасный эмиттер/детектор.
38. Способ разделения клеток высокой плотности и клеток низкой плотности из образца крови, при этом указанный способ включает:
a. предоставление жесткого картриджа, содержащего:
i. жесткий наружный корпус;
ii. внутреннюю жесткую камеру по существу в форме воронки, имеющую узкий конец, содержащий выходное отверстие, и широкий конец, содержащий входное отверстие;
iii. первый и второй жесткие отсеки для хранения, изначально не находящиеся в жидкостной связи с указанным узким концом;
iv. первый клапан в соединении с указанным выходным отверстием и указанным первым жестким отсеком для хранения, где указанный первый клапан изначально находится в закрытом состоянии; и
v. второй клапан в соединении с указанным выходным отверстием и указанным вторым жестким отсеком для хранения, где указанный второй клапан изначально находится в закрытом состоянии;
b. предоставление центрифуги, выполненной с возможностью установки указанного жесткого картриджа;
c. предоставление образца, содержащего смесь клеток высокой плотности, клеток низкой плотности и плазмы, где клетки высокой плотности представляют собой эритроциты и гранулоциты, и где клетки низкой плотности представляют собой лимфоциты, моноциты, тромбоциты, стволовые клетки и клетки-предшественники;
d. перенос указанного образца в указанный жесткий картридж через указанное входное отверстие;
e. помещение указанного жесткого картриджа в указанную центрифугу;
f. приложение центробежной силы, чтобы заставить указанный образец двигаться в направлении указанного узкого конца;
g. расслоение указанного образца таким образом, чтобы подавляющее большинство указанных клеток высокой плотности образовывало слой компонента высокой плотности и подавляющее большинство указанных клеток низкой плотности образовывали слой компонента низкой плотности;
h. открытие указанного первого клапана, таким образом, чтобы указанные слои компонентов перемещались в направлении указанного узкого конца, и где указанное подавляющее большинство указанных клеток высокой плотности было вынуждено под действием центробежной силы течь сначала в направлении от указанной оси вращения, а затем в направлении указанной оси вращения и в указанный первый жесткий отсек для хранения; и
i. снятие указанной центробежной силы.
39. Способ по п. 38, где первый клапан активируется эксцентриком.
40. Способ по п. 38, где указанный первый жесткий отсек для хранения содержит входное отверстие первого жесткого отсека для хранения, расположенное ближе к указанной оси вращения, чем указанное выходное отверстие, и где указанные клетки высокой плотности проходят через указанное входное отверстие первого жесткого отсека для хранения.
41. Способ по п. 38, дополнительно включающий определение с использованием датчика присутствия по меньшей мере одного из указанных слоев компонентов в указанном узком конце.
42. Способ по п. 38, дополнительно включающий определение с использованием первого и второго датчиков присутствия указанных слоев компонентов, проходящих через указанный узкий конец.
43. Способ по п. 42, дополнительно включающий закрытие указанного первого клапана и открытие указанного второго клапана таким образом, чтобы указанное подавляющее большинство указанных клеток низкой плотности и плазма были вынуждены под действием центробежной силы течь сначала в направлении от указанный оси вращения, а затем в направлении к указанный оси вращения и в указанный второй жесткий отсек для хранения.
44. Способ по п. 43, дополнительно включающий стадию перед открытием указанного второго клапана предварительного определения конечного объема клеток низкой плотности и плазмы, добавляемого в указанный второй жесткий отсек для хранения.
45. Способ по п. 44, дополнительно включающий:
j. вычисление количества времени после обнаружения указанного слоя компонента низкой плотности, при этом указанный второй клапан будет оставаться открытым для заполнения указанного второго жесткого отсека для хранения с плазмой, таким образом, чтобы указанный конечный объем был по существу равен указанному предварительно определенному конечному объему; и
k. закрытие указанного второго клапана после указанного количества времени.
46. Способ по п. 45, где указанная стадия вычисления основана на времени, прошедшем между обнаружением первого из указанных слоев компонентов указанным первым датчиком и указанным вторым датчиком.
47. Способ по п. 40, дополнительно включающий:
l. встряхивание указанного жесткого картриджа для перемешивания указанных клеток низкой плотности и указанной плазмы после указанной стадии устранения центробежной силы; и
m. повторное приложение центробежной силы для дополнительной обработки указанных клеток низкой плотности и указанной плазмы.
48. Способ по п. 40, где указанный слой компонентов высокой плотности содержит эритроциты, и где указанный слой компонентов низкой плотности содержит лейкоциты.
49. Способ по п. 48, где указанный слой компонентов низкой плотности дополнительно содержит мононуклеарные клетки.
50. Способ по п. 48, где указанный слой компонентов низкой плотности дополнительно содержит гранулоциты.
51. Способ по п. 48, где указанный слой компонентов высокой плотности дополнительно содержит гранулоциты.
52. Способ разделения клеток высокой плотности и клеток низкой плотности из образца, содержащего клетки высокой плотности, клетки низкой плотности и плазму, при этом указанный способ включает:
a. предоставление жесткого картриджа, содержащего:
i. внутреннюю жесткую камеру по существу в форме воронки, имеющую первое и второе выходные отверстия, указанные отверстия изначально закрыты; и
ii. по меньшей мере два жестких отсека для хранения;
b. расположение жидкого биологического образца, содержащего клетки высокой плотности, клетки низкой плотности и плазму в указанной жесткой камере, где клетки высокой плотности представляют собой эритроциты и гранулоциты, и где клетки низкой плотности представляют собой лимфоциты, моноциты, тромбоциты, стволовые клетки и клетки-предшественники;
c. центрифугирование указанного жесткого картриджа таким образом, чтобы подавляющее большинство указанных клеток высокой плотности формировали слой компонентов высокой плотности, а подавляющее большинство указанных клеток низкой плотности формировали слой компонентов низкой плотности; и
d. во время указанной стадии центрифугирования:
i. открытие указанного первого выходного отверстия, позволяющего проходить части указанного компонента высокой плотности;
ii. закрытие указанного первого отверстия; и
iii. открытие указанного второго отверстия, позволяющего проходить части указанного слоя компонентов низкой плотности.
53. Способ по п. 52, где один из указанных слоев компонентов вынужден под действием центробежной силы течь сначала через одно из указанных выходных отверстий и в направлении от оси вращения, а затем в направлении к указанной оси вращения и в указанный жесткий отсек для хранения.
54. Способ по п. 52, где указанный образец содержит по меньшей мере одно из следующего: кровь, костный мозг или клетки стромальной сосудистой фракции, выделенной из жировой ткани.
55. Способ сбора мононуклеарных клеток из образца крови, где все стадии происходят в одном жестком картридже, при этом указанный способ включает:
a. предоставление центрифуги, имеющей ось вращения;
b. предоставление жесткого картриджа, содержащего внутреннюю жесткую камеру;
c. расположение указанного образца в указанной жесткой камере, при этом образец содержит эритроциты, мононуклеарные клетки, плазму и необязательно по меньшей мере один биологический компонент, выбранный из группы гранулоцитов, стволовых клеток и тромбоцитов;
d. установление указанного жесткого картриджа в указанную центрифугу;
e. приложение с помощью указанной центрифуги центробежной силы к указанному образцу, указанная центробежная сила:
i. сначала перемещает большинство указанных эритроцитов в указанном образце в направлении от указанной оси вращения, из указанной жесткой камеры, в направлении к указанной оси вращения, и в первый жесткий отсек для хранения; и
ii. затем перемещает большинство указанных мононуклеарных клеток в указанном образце в направлении от указанной оси вращения, из указанной жесткой камеры, в направлении к указанной оси вращения, и во второй жесткий отсек для хранения.
56. Способ по п. 55, где указанная внутренняя жесткая камера имеет переменный радиус, при этом указанный радиус является наибольшим в расположении, ближайшем к указанной оси вращения, и наименьшем в расположении, удаленном от указанной оси вращения.
57. Способ по п. 56, где во время указанной второй стадии перемещения большинство указанных мононуклеарных клеток концентрируется в стратифицированном слое, толщина которого увеличивается по мере движения указанного стратифицированного слоя в направлении от указанной оси вращения.
58. Способ разделения клеток высокой плотности и клеток низкой плотности из образца, включающий:
a. расположение жесткого картриджа в центрифуге, при этом указанный жесткий картридж содержит жесткую камеру, имеющую конец, соединенный текучей средой с системой клапанов, которая изначально закрыта, и по меньшей мере один жесткий отсек для хранения;
b. помещение указанного образца в указанную жесткую камеру, при этом указанный образец содержит клетки относительно высокой и низкой плотности и биологическую жидкость;
c. центрифугирование указанного жесткого картриджа таким образом, чтобы указанный образец был вынужден двигаться в направлении указанного конца под действием первой динамической нагрузки;
d. центрифугирование указанного жесткого картриджа таким образом, чтобы указанный образец был вынужден двигаться в направлении указанного конца под действием второй динамической нагрузки, меньшей, чем указанная первая динамическая нагрузка, но большей, чем 1 G, и обеспечение открытого пути через указанную систему клапанов по меньшей мере для части указанных клеток относительно высокой плотности через указанный конец и в указанный по меньшей мере один жесткий отсек для хранения;
e. отслеживание в указанном жестком картридже миграции указанных клеток через указанный конец; и
f. закрытие указанного открытого пути.
59. Устройство для разделения клеток высокой плотности и клеток низкой плотности из образца, включающего кровь, костный мозг или клетки стромальной сосудистой фракции, выделенные из жировой ткани, при этом устройство включает:
a. центрифугу, имеющую ось вращения;
b. жесткий картридж, содержащий:
i. жесткую внутреннюю камеру, имеющую радиус, по существу обратно пропорциональный расстоянию от указанной оси вращения, когда указанный картридж центрифугируют в указанной центрифуге, входное отверстие, и выходное отверстие;
ii. систему клапанов;
iii. первый жесткий отсек для хранения ближе к указанной оси вращения, когда указанный картридж центрифугируют в указанной центрифуге, чем указанное выходное отверстие; и
iv. второй жесткий отсек для хранения ближе к указанной оси вращения, когда указанный картридж центрифугируют в указанной центрифуге, чем указанное выходное отверстие; и
с. блок управления.
60. Устройство по п. 59, где по меньшей мере часть указанной системы клапанов расположена дальше от указанной оси вращения, когда указанный картридж центрифугируют в указанной центрифуге, чем указанные входные отверстия первого и второго отсека.
61. Устройство по п. 59, дополнительно включающее эксцентрик в функциональной связи с клапаном.
62. Устройство для разделения клеток высокой плотности и клеток низкой плотности из образца, содержащего кровь, костный мозг или клетки стромальной сосудистой фракции, выделенной из жировой ткани, при этом устройство включает:
a. центрифугу, выполненную с возможностью установки указанного жесткого картриджа и генерирования центробежной силы;
b. жесткий контейнер, содержащий:
i. наружный корпус;
ii. жесткую камеру в форме воронки, содержащую выходное отверстие, расположенное на узком конце указанной жесткой камеры, и входное отверстие, расположенное на широком конце указанной жесткой камеры;
iii. по меньшей мере два жестких отсека, исходно изолированных по текучей среде от указанной жесткой камеры;
iv. клапан, соединенный текучей средой с указанным выходным отверстием и расположенный между указанной жесткой камерой и указанными по меньшей мере двумя жесткими отсеками, при этом указанный клапан имеет первую конфигурацию, где соединение с возможностью переноса текучей среды не существует между указанной жесткой камерой и одним из жестких отсеков, вторую конфигурацию, где соединение с возможностью переноса текучей среды существует только между указанной жесткой камерой и указанным первым жестким отсеком, и третью конфигурацию, где соединение с возможностью переноса текучей среды существует только между указанной жесткой камерой и указанным вторым жестким отсеком; и
c. блок управления.
63. Устройство по п. 62, при этом каждый из указанных отсеков содержит входное отверстие в отсек, и где указанные входные отверстия в отсек расположены ближе к оси вращения, чем указанное выходное отверстие.
64. Устройство по п. 62, дополнительно включающее оптический датчик.
65. Устройство по п. 64, дополнительно включающее гравитационный датчик и батарею питания.
66. Устройство по п. 64, где указанный оптический датчик расположен в указанном блоке управления.
67. Устройство по п. 64, дополнительно включающее средство управления клапанами для определения, находится ли указанный клапан в указанной первой, второй или третьей конфигурации.
68. Устройство по п. 67, где указанный оптический датчик функционально связан с указанным средством управления клапанами.
69. Устройство по п. 62, дополнительно включающее первый и второй датчики, функционально соединенные с регулятором клапанов, при этом указанные датчики и регулятор клапанов выполнены с возможностью собирать заранее определенный конечный объем жидкости в указанный второй жесткий отсек.
70. Устройство по п. 69, где указанный блок управления выполнен с возможностью измерять первое значение времени, прошедшего между измерением заданного показания указанным первым датчиком и указанным вторым датчиком, и приводить в действие указанный регулятор клапанов в рассчитанное время, на основании указанного первого значения затраченного времени, для сбора указанного предварительно определенного конечного объема жидкости в указанном втором жестком отсеке.
71. Устройство по п. 69, содержащее третий датчик, и где указанный блок управления выполнен с возможностью:
a. измерять первое значение времени, прошедшее между измерением заданного параметра указанным первым датчиком и указанным вторым датчиком;
b. измерять второе значение времени, прошедшее между измерением заданного параметра указанным вторым датчиком и указанным третьим датчиком; и
c. приводить в действие указанный регулятор клапанов в рассчитанное время, основанное на указанном первом и втором значении времени, для сбора указанного предварительно определенного конечного объема жидкости в указанном втором жестком отсеке.
72. Устройство для разделения клеток высокой плотности и клеток низкой плотности из образца, содержащего биологическую жидкость, при этом устройство включает:
a. центрифугу, имеющую ось вращения;
b. блок управления, содержащий:
i. средство управления клапанами;
ii. гравитационный датчик;
iii. оптический датчик; и
iv. батарею питания;
с. жесткий картридж, съемно соединенный с указанным блоком управления, при этом указанный жесткий картридж содержит:
i. жесткий наружный корпус;
ii. жесткую камеру по существу в форме воронки, имеющую узкий конец, содержащий выходное отверстие ,и широкий конец, содержащий входное отверстие;
iii. первый и второй жесткие отсеки для хранения, исходно не находящиеся в соединении текучей средой с указанным выходным отверстием;
iv. первый клапан в соединении с указанным выходным отверстием и указанным первым жестким отсеком для хранения, где указанный первый клапан имеет закрытую конфигурацию и открытую конфигурацию; и
v. второй клапан в соединении с указанным выходным отверстием и указанным вторым жестким отсеком для хранения, где указанный второй клапан имеет закрытую конфигурацию и открытую конфигурацию.
73. Устройство по п. 72, где указанное средство управления клапанами содержит эксцентрик.
74. Устройство по п. 72, где указанное соединение осуществляется через гибкую трубку.
75. Жесткий картридж для разделения клеток высокой плотности и клеток низкой плотности из образца, содержащего биологическую жидкость, при этом жесткий картридж содержит:
a. жесткий наружный корпус;
b. жесткую камеру по существу в форме воронки, имеющую узкий конец, содержащий выходное отверстие, и широкий конец, содержащий входное отверстие;
c. первый и второй жесткие отсеки для хранения, исходно не находящиеся в соединении текучей средой с указанным выходным отверстием;
d. первый клапан в соединении с указанным выходным отверстием и указанным первым жестким отсеком для хранения, где указанный первый клапан имеет закрытую конфигурацию и открытую конфигурацию; и
e. второй клапан в соединении с указанным выходным отверстием и указанным вторым жестким отсеком для хранения, где указанный второй клапан имеет закрытую конфигурацию и открытую конфигурацию.
76. Способ по п. 1, где не используются буферы.
77. Способ по п. 22, где не используются буферы.
78. Способ по п. 38, где не используются буферы.
79. Способ по п. 52, где не используются буферы.
80. Способ по п. 55, где не используются буферы.
81. Способ по п. 58, где не используются буферы.
| US 5866071 A, 02.02.1999 | |||
| US 4751001 A, 14.06.1988 | |||
| US 5646004 A, 08.06.1997 | |||
| US 4919537 A, 24.04.1990. |
Авторы
Даты
2016-09-10—Публикация
2011-03-17—Подача