Область техники
Настоящее изобретение относится к области регенерации биологических тканей. Оно касается, в частности, новых способов, пробирок и устройств для получения тромбина, тромбоцитарного концентрата и средств для заживления ран, а также композиций и их применения.
Уровень техники
Важность биологических аутологичных материалов в процессе заживления ран хорошо изучена и описана. В частности, известно, что два биологических аутологичных материала напрямую вовлечены в процесс образования структуры кровяных сгустков, создающих гемостатический барьер, роль которого заключается в обеспечении гемостаза и запечатывании раны: (1) фибрин, получаемый в процессе разделения фибриногена на две цепочки под действием тромбина, и (2) активированные мембраны тромбоцитов. Процесс заживления раны в целом представляет собой продолжение фазы коагуляции, воспалительный процесс и процесс регенерации. Фаза коагуляции (свертывание крови или образование сгустка) является сложным процессом, в рамках которого фибриновый сгусток закрывает поврежденную стенку кровеносного сосуда для остановки кровотечения, а восстановление поврежденного сосуда инициируется с помощью высвобождения цитокинов и факторов роста из альфа-гранул тромбоцитов в больших количествах. Образование кровяных сгустков (формируемых в физиологических условиях фибрином, тромбоцитами и красными кровяными клетками среди прочих компонентов крови) является естественным симптомом, возникающим в результате травмы ткани, и его роль в процессе заживления раны, а также сращивании переломов костей, хорошо известна.
Коагуляция крови является результатом комплексного взаимодействия нескольких белковых факторов свертывания в рамках коагуляционного каскада. В целом, повреждение сосудистого эндотелия обнажает эндотелиальные структуры, которые привлекают тромбоциты и индуцируют их для обратной агрегации. Белок тромбин, формируемый в течение активации пути коагуляции, вырабатывает связанные между собой нерастворимые фибриллы белка фибрина и вызывает обратную агрегацию тромбоцитов. Образующийся в результате этого тромбоцитарно-фибриновый сгусток является эффективным барьером, предотвращающим потерю крови из сосудистой системы, а также служит каркасом для последующего восстановления выстилания кровеносного сосуда.
Воспалительный процесс, который следует за образованием кровяного сгустка, стимулируется многочисленными вазоактивными медиаторами и хемотаксическими факторами (специфическими сигналами в форме белков), вырабатываемыми белыми кровяными клетками и тромбоцитами. Данные сигналы привлекают макрофаги, которые «очищают» место повреждения от бактерий и инородных частиц, а также красных кровяных клеток до миграции новых клеток. Фаза регенерации ткани затрагивает хемоаттракцию и митоз недифференцированных клеток в каркасе (или матриксе роста), формируемом кровяным сгустком. Новые клетки, которые размножаются под воздействием стимуляции тромбоцитарных факторов роста, должны заместить поврежденные или уничтоженные клетки, задержанные макрофагами. Факторы роста и многочисленные белки плазмы, также называемые сигнальными молекулами, которые способствуют миграции клеток и их делению в кровяных сгустках, играют важнейшую роль в процессе заживления ран.
Биоадгезивные запечатывающие материалы и фибриновые клеи представляют собой относительно новое техническое достижение, которое воспроизводит биологический процесс заключительной стадии коагуляции крови. Клинические отчеты описывают использование фибринового клея в таких областях хирургии, как сердечно-сосудистая, торакальная, трансплантационная, хирургия головы и горла, оральная, желудочно-кишечная, ортопедическая, неврологическая и пластическая хирургия. Во время проведения хирургии два основных компонента, включающих фибриновый клей, фибриноген и тромбин, смешиваются для образования сгустка. Сгусток прикрепляется к необходимым тканям, кости или нерву в течение нескольких секунд, но затем медленно реабсорбируется организмом в течение приблизительно 10 дней в рамках фибринолиза. Важными свойствами фибринового клея является его способность: (1) достигать гемостаза при срастаниях сосудов, в частности, в труднодоступных для наложения швов зонах, или в тех зонах, в которых расположение швов представляет чрезмерный риск; (2) контролировать кровотечения из шприцевых проколов или кровотечения в результате разрыва артерий, которые невозможно остановить исключительно с помощью наложения швов; и (3) достигать гемостаза у пациентов, проходящих курс лечения гепарином, или страдающих коагулопатией. См. Borst, Н.G., et al., J. Thorac. Cardiovasc. Surg., 84:548-553 (1982); Walterbusch, G. J, et al., Thorac Cardiovasc. Surg., 30:234-235 (1982) и Wolner, F. J, et al., Thorac. Cardiovasc. Surg., 30:236-237(1982).
Теоретически возможно усилить эффекты данных первоначальных фаз в каскадном процессе заживления с помощью отделения красных кровяных клеток и увеличения концентрации факторов роста.
Усиление свертывания крови может быть определено как образование «обогащенного сгустка (ЕС)». ЕС получают путем использования тромбоцитарных концентратов; ЕС описаны в Platelets and Megacaryocytes 2004, ч. 1 и 2 как "Структуры и сигналы", Ed. Gibbins and Mahaut-Smith, Humana Press, New Jersey. Обогащенная тромбоцитами плазма (PRP) может быть определена как аутологичный концентрат тромбоцитов в малом объеме плазмы; она была создана как аутологичный биоматериал и доказала свою применимость при заживлении ран и регенерации тканей (Marx et al., 2004, J. Oral Maxillofac. Surg., 62, 489-496). PRP состоит не только из тромбоцитарного концентрата, но также содержит факторы роста (такие как фактор роста, полученный из тромбоцитов): PDGF, сосудистый эндотелиальный фактор роста: VEGF, трансформирующий фактор роста: TGF и эпидермальный фактор роста: EGF и другие), которые активно вырабатываются тромбоцитами и известны своей фундаментальной ролью в инициации процесса заживления ран.
Например, известно, что PDGF инициирует соединительное заживление тканей, включая регенерацию и восстановление костей. PDGF также увеличивает митогенез (заживляющие клетки), ангиогенез (митоз эндотелия с образованием функционирующих капилляров) и активацию макрофагов. Известно, что VEGF, высвобождаемый лейкоцитами, обладает заметными ангиогенными, митогенными и улучающими проницаемость кровеносных сосудов свойствами по отношению к эндотелиальным клеткам. TGF-[beta] способствует клеточному митозу и дифференциации для сращивания тканей и костей, воздействует на мезенхимные стволовые клетки, остеобластные клетки-предшественники и фибробласты, а также ингибирует образование остеокластов. Известно, что EGF индуцирует эпителиальное развитие и способствует ангиогенезу. Тромбоцитарные концентраты в основном используют в дентальной импланталогии и костной хирургии, в частности в США. Были разработаны разнообразные техники получения PRP с помощью процесса центрифугирования. Тем не менее в связи с чувствительностью тромбоцитарных клеток и вариабельностью эффективности методов отделения тромбоцитов от красных кровяных клеток, существуют заметные различия среди способов приготовления тромбоцитарных концентратов. Автоматизированные установки Biomet PCCS & GPS (Marx et al., 2004, выше) обладают недостатком, заключающимся в сложности способа и чрезмерной стоимости обработки значительного по объему образца крови. В данных системах также присутствует значительная потеря ценной биологической ткани, получаемой от пациентов; таким образом, существует потребность в разработке надежного метода сбора клеток плазмы с высоким уровнем выхода, простотой использования и экономической эффективностью.
Кроме того, получение тромбоцитарных концентратов все еще требует использования относительно сложных наборов и дорогостоящего специализированного оборудования и столь же дорогостоящих трудозатрат специализированного персонала. Данный недостаток делает известные в настоящее время способы приготовления PRP неподходящими для использования на месте оказания помощи.
Далее, получение клеток в аспекте клеточной и тканевой регенерации для использования в целях трансплантации, послеоперационного восстановления или для эстетических целей сталкивается с проблемой долгосрочной консервации клеток и тканей. Криоконсервация тканей или клеток, как правило, используется для долгосрочного поддержания жизнеспособности тканей или клеток, особенно тромбоцитов, однако данная методика связана с серьезными недостатками и проблемами, такими как образование кристаллов, осмотические затруднения, агрегация, способность ингибирования синтеза белков, нагрузка на белковые экспрессии в ответ на температурный стресс. Таким образом, известно, что криоконсервация тканей или клеток оказывает влияние на жизнеспособность и стабильность клеток (Agence  de
de  sanitaire, 2003; Arnaud et al., 1999, Cryobiology, 38, 192-199; Tablin et al., 2001, Cryobiology, 43(2), 114-23). Некоторые из побочных эффектов криоконсервации могут быть ограничены с помощью антифризных агентов, таких как DMSO или глицерин или другие криоконсерванты (US 5, 5891, 617, Oh et al., Cornea, 26, 840-846), однако концентрация данных агентов должна быть адаптирована для ограничения их токсичности и побочных эффектов. Таким образом, существует потребность в новом или альтернативном способе получения клеток или тканей, подходящих для немедленного использования с одновременным сохранением их целостности, в частности в рамках способности выделения факторов роста и жизнеспособности.
sanitaire, 2003; Arnaud et al., 1999, Cryobiology, 38, 192-199; Tablin et al., 2001, Cryobiology, 43(2), 114-23). Некоторые из побочных эффектов криоконсервации могут быть ограничены с помощью антифризных агентов, таких как DMSO или глицерин или другие криоконсерванты (US 5, 5891, 617, Oh et al., Cornea, 26, 840-846), однако концентрация данных агентов должна быть адаптирована для ограничения их токсичности и побочных эффектов. Таким образом, существует потребность в новом или альтернативном способе получения клеток или тканей, подходящих для немедленного использования с одновременным сохранением их целостности, в частности в рамках способности выделения факторов роста и жизнеспособности.
Сущность изобретения
Изобретение относится к области регенерации биологических тканей. Оно касается, в частности, новых способов, пробирок и устройств для приготовления тромбина, тромбоцитарного концентрата и средства для заживления ран, а также композиций и их применения. Изобретение также относится к новым композициям клеток, новым композициям обогащенной тромбоцитами плазмы (PRP), способам приготовления новых композиций клеток или композициям PRP, вариантам использования данных композиций клеток или PRP, по выбору смешанным с клеточным экстрактом, таким как аутологичный экстракт кератиноцитов, клеток костного мозга, фибробластов, надкостницы или клеток роговицы, меланоцитов и клеток Лангерганса, жировых клеток, жировой ткани, мышечных клеток, таких как миобласты и сателлитные клетки, остеобластов, хондроцитов, клеток пуповины, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, шванновских клеток или клеток ахиллового сухожилия.
Кроме того, изобретение предусматривает способ приготовления композиции полностью аутологичного и готового для немедленного приема средства для заживления ран или средства для заживления тканей. Все компоненты крови, предназначенные для использования в композиции аутологичного средства для заживления ран или средства для заживления тканей, получают от того же пациента, по отношению к которому будут применяться композиции аутологичного средства для заживления ран или средства для заживления тканей (один и тот же пациент).
Кроме того, изобретение предусматривает способ приготовления сыворотки с тромбином, состоящий из следующих стадий:
a) Забор цельной крови в пробирку, содержащую тиксотропный гель,
b) Центрифугирование пробирки до высвобождения сыворотки с тромбином и
c) Сбор сыворотки с тромбином.
Другая особенность изобретения заключается в том, что изобретение предусматривает способ приготовления композиции средства для заживления ран или композиции средства для заживления тканей, состоящий из следующих стадий:
a) Забор цельной крови предпочтительно в пробирку, содержащую гиалуроновую кислоту, тиксотропный гель и/или антикоагулянт, предпочтительно цитрат натрия,
b) Центрифугирование пробирки, предпочтительно до миграции красных кровяных клеток под тиксотропный гель и, предпочтительно, до миграции гиалуроновой кислоты выше обогащенной плазмы,
c) Необязательное смешивание гиалуроновой кислоты и обогащенной плазмы, предпочтительно путем переворачивания пробирки,
d) Сбор супернатанта, содержащего гиалуроновую кислоту и обогащенную плазму.
Другая особенность заключается в том, что изобретение предусматривает пробирку для забора и сепарирования жидкого образца, состоящую из:
i) двух отдельных частей, отличающихся по размеру и диаметру,
ii) фильтра, разделяющего две части, и
iii) необязательно тиксотропного геля и антикоагулянта.
В предпочтительном варианте изобретения пробирка характеризуется признаками, проиллюстрированными на Фиг. 1-14.
Другая особенность заключается в том, что изобретение относится к системе контейнеров для крови или устройству с пробирками для забора крови, состоящему из нескольких контейнеров или пробирок, подходящих для забора, хранения, использования и доставки компонентов крови.
Предпочтительной особенностью изобретения является система контейнеров для крови или устройство с пробирками для забора крови в соответствии с Фиг. 15.
Другая особенность заключается в том, что изобретение предусматривает систему контейнеров для крови или устройство с пробирками для забора крови, состоящее из единственной входной трубки, соединенной с разветвителем и трубок разветвителя, соединенных, по меньшей мере, с двумя контейнерами или пробирками, причем каждая трубка разветвителя соединена с единственным контейнером или пробиркой.
Пробирки для забора крови предпочтительно вакуумируют, запечатывают и заполняют тиксотропным гелем и антикоагуляном.
Краткое описание чертежей
Чертежи, которые представлены здесь, и которые представляют собой часть описания, иллюстрируют предпочтительные варианты данного изобретения и, наряду с описанием, служат для раскрытия принципов изобретения.
Фиг. 1А и 1В являются схематическими изображениями пробирки в соответствии с данным изобретением.
Фиг. 2 и 3 являются схематическими изображениями внутренней части пробирки в соответствии с данным изобретением.
Фиг. 4 является схематическим изображением внутренней части фильтра пробирки в соответствии с данным изобретением. Фильтр состоит из внутреннего слоя с воронками и внешнего слоя с трапециевидными конструкциями.
Фиг. 5A является схематическим изображением внутренней части пробирки в соответствие с данным изобретением.
Фиг. 5B является схематическим изображением колпачка и стыка пробирки. Фиг. 6 является схематическим изображением колпачка.
Фиг. 7А и 7В являются двумя детальными изображениями фильтра и пробирки в соответствии с данным изобретением.
Фиг. 8 является нижележащим изображением фильтра пробирки в соответствии с данным изобретением. Фиг. 8 также изображает четыре симметричных набора, состоящих из 3 диапазонов отверстий внешнего слоя или нижнего слоя в соответствии с данным изобретением.
Фиг. 9 изображает внешний вид фильтра пробирки в соответствии с данным изобретением. Фиг. 9 также изображает четыре симметричных набора, состоящих из 2 диапазонов отверстий внешнего слоя или верхнего слоя в соответствии с данным изобретением.
Фиг. 10 и 11 являются детальными изображениями фильтра пробирки в соответствии с данным изобретением.
Фиг. 12 является детальным изображением центральной части фильтра пробирки в соответствии с данным изобретением.
Фиг. 13 является детальным изображением внутренней части фильтра пробирки в соответствие с данным изобретением. Фильтр состоит из внутреннего слоя с воронками и внешнего слоя с трапециевидными конструкциями. Каждая воронка и трапеция встраивается в фильтр поочередно (первая трапеция, затем первая воронка, затем вторая трапеция, затем вторая воронка и, наконец, третья трапеция). Фиг. 14 является детальным изображением фильтра, включающего воронки и трапеции в пробирке в соответствии с данным изобретением.
Фиг. 15 является изображением системы контейнеров для крови или устройства с пробирками для забора крови в соответствии с данным изобретением. Фиг. 16 является схематическим изображением способа приготовления средства для заживления ран или тканей, включающего PRP и гиалуроновую кислоту.
Подробное описание изобретения
Нижеследующие параграфы содержат определения терминов в соответствии с данным изобретением и предназначены для единообразного применения по всему объему описания и формулы изобретения, за исключением случаев приведения более широких определений.
Термин «тиксотропный» означает гель, который становится более жидким в результате встряхивания или давления, т.е. гель, вязкость которого снижается в результате встряхивания или давления. Термин «вязкость» относится к тем характеристикам указанного материала(ов), которые определяют степень гелеобразования, такие как, например, жесткость или твердость материала, степень, в рамках которой материал сопротивляется жидкотекучести. В соответствии с данным изобретением, тиксотропный гель содержит полиэфирный гель или их смеси на его основе, который нерастворим в воде и химически инертен по отношению к компонентам крови, которые могут быть использованы в соответствии с данным изобретением. Типичные тиксотропные гели используются для отбора кровяных клеток в диагностических и протеомных целях. Тиксотропный гель также называется здесь гелем для отделения клеток. В настоящем изобретении могут быть использованы другие гели. Термин «место оказания помощи» означает все услуги, предоставляемые пациентам при постельном режиме.
Термин «инструменты для флеботомии» или «инструменты для осуществления венепункции» означает инструменты, которые позволяют осуществлять прокол вены иглой в целях забора крови.
Альтернативные термины «средство для заживления ран» или «запечатывающий раны материал» или «средство для заживления тканей» или «запечатывающий ткани материал» или «композиция для заживления ран» или «композиция для заживления тканей» означают «биоадгезивный запечатывающий материал» или «фибриновый клей».
Термин «средство для заживления ран» или «запечатывающий раны материал» или «средство для заживления тканей» или «запечатывающий ткани материал» или «композиция для заживления ран» или «композиция для заживления тканей» или «биоадгезивный запечатывающий материал» или «фибриновый клей» означает агент или композицию, которая способствует и/или увеличивает скорость и/или качество заживления раны. Средства для заживления ран или запечатывающие материалы способствуют регенерации ткани. Термин «рана» означает любую поврежденную ткань, например поврежденную в результате травмы или хирургии. У млекопитающих раны включают, например, пролежни, язвы, рваные раны и ожоги, места имплантации (места взятия и пересадки имплантатов), фистулы, повреждение периодонтальной ткани, хронические диабетические язвы, последствия травм или любого хирургического вмешательства. В общем случае, данный термин также используется для обозначения повреждений кожи, при которых поверхность кожи обладает некоторыми негативными признаками без непосредственного повреждения ее поверхности как, например, возрастные повреждения ткани (например, морщины) и рубцы как, например, акне (в частности, после дермабразии) или рубцы от краснухи. Термин «PRP» означает богатую тромбоцитами плазму, предпочтительно млекопитающего или человека, более предпочтительно аутологичную, приготовленную в рамках способа данного изобретения в целях осаждения и удаления эритроцитов и концентрирования лейкоцитов, тромбоцитов и адгезивных белков в плазме по сравнению с нативной цельной кровью. Термин «аутологичный» или «аутогенный» или «аутогенезный» означает in vivo способ, в рамках которого используется кровь, ткань и/или клетки одного пациента и при котором кровь, ткань и/или клетки забираются у этого донора и предназначаются для использования у того же донора. Противоположно, «аллогенные» способы предусматривают использование крови, ткани и/или клеток, забранных у одной или более третьих сторон для использования у донора («гомологично» или «гетерологично»). Аутологичный продукт позволяет избежать некоторых типичных проблем, связанных с использованием биологических материалов, полученных от третьих сторон, таких как, например, скрининг в целях подтверждения того, что донор являлся биологически и иммунологически совместимым с пациентом и что возможно потенциальное заражение гепатитом, ВИЧ, прионом, болезнью Крейтцфельдта-Якоба и им подобными заболеваниями. Термин «активатор коагуляции» означает агент, например энзим, который способен инициировать и активировать коагуляцию плазмы и агрегацию тромбоцитов. Активатор коагуляции представляет собой активатор тромбина и/или активатор фибриногена и/или тромбин и/или аутологичный тромбин и/или аутологичную сыворотку с тромбином и/или хлорид кальция и/или глюконат кальция. Коагуляция может быть комбинированной в целях изменения плотности композиций.
Термин «активатор тромбина» означает агент, который способен активировать тромбин и инициировать коагуляцию. Типичными активаторами тромбина являются определенные кофакторы, такие как натрий или кальций. В данном изобретении активация тромбина предпочтительно происходит в присутствии ионов кальция. Ионы кальция, как правило, добавляют в тромбоцитарный концентрат в виде солевого раствора для достижения итоговой концентрации, как правило, около 0.1 мг/мл тромбоцитарного концентрата. Подходящие соли кальция включают, без ограничения, СаСО3, CaSO4 или CaCl2. Предпочтительной кальциевой солью для использования в данном изобретении является глюконат кальция (CaGL). CaGL доступен в виде инъекции кальциевого геля, USP 10% (Regen Lab, Switzerland). Термин «активатор фибриногена» означает агент, который способен активировать превращение фибриногена в фибрин и инициировать образование сгустка. Типичными активаторами фибриногена являются тромбин или батроксобин. Термин «тромбин» может включать кальцинированный тромбин, в частности от около 100 до около 10 единиц тромбина на 1 мл 10% водного раствора глюконата кальция; он может включать кальцинированный бычий тромбин, аллогенный тромбин или рекомбинантный тромбин человека, предпочтительно аутологичный тромбин. Активатор фибриногена может быть обогащенной тромбином композицией, такой как композиции тромбина, описанные в US 6,472.162, или аутологичной сывороткой с тромбином в соответствии с данным изобретением. Термин «терапевтически эффективное количество» означает количество или количества компонентов или их комбинации, необходимые для стимулирования заживления ран, такого как, например, уменьшения размера или площади раны, увеличения объема гранулирующей ткани или другого биологического материала, облегчающего выстилание коллагена, развитие кровеносных сосудов, пролиферацию фибробластов или общее заживление. Предполагается, что все варианты изобретения, описанные здесь, включают терапевтически эффективные количество(а) компонентов или их комбинаций. Термин «фармацевтически приемлемый носитель» предназначено для определения фармацевтически приемлемого дополнительного ингредиента, такого как стабилизаторы, антимикробные агенты, буферы, вспомогательные лекарственные вещества, анестетики, кортикостероиды и им подобные. Термин «косметически приемлемый носитель» предназначено для определения косметически приемлемого дополнительного ингредиента, такого как стабилизаторы, буферы, красители, отдушки, вспомогательные лекарственные вещества и им подобные.
Термин «циклический сополимер олефина» (СОС) или «циклический полимер олефина» (СОР) означает аморфный полимер, сополимер этилена, СОС, СОР, циклический сополимер олефина, циклический полимер олефина, сополимер типа этилен/норборнен. В СОР используется единственный тип мономера, в то время как в СОС используются различные типы мономеров. Изобретение включает циклические сополимеры олефина, основанные на различных типах циклических мономеров и методах полимеризации. Циклические сополимеры олефина или полимеры настоящего изобретения могут быть получены с помощью кольцевой кополимеризации циклических мономеров, таких как 8,9,10-тринорборн-2-ен (норборнен) или 1,2,3,4,4а,5,8,8а-октагидро-1,4:5,8-диметанофталин с этеном, препарат TOPAS компании Ticona, APEL™™ компании Mitsui Chemicals, или с помощью раскрывающей кольцо обменной полимеризации различных циклических мономеров с последующей гидрогенизацией (например, с помощью Japan Synthetic Rubber's ARTON, Zeon Chemical's Zeonex и Zeonor).
Термин «гиалуроновая кислота» (также называемая гиалуронаном или гиалуронатом) означает анионный несульфированный гликозаминогликан, широко встречающийся во всех соединительных, эпителиальных и невральных тканях. Уникальное свойство гликозаминогликанов заключается в их способности, являясь несульфированными, образовывать плазматическую мембрану вместо аппарата Гольджи и достигать очень большого размера и молекулярного веса, зачастую достигающего миллиона. Один из основных компонентов экстраклеточного матрикса, гиалуронан оказывает заметное влияние на пролиферацию и миграцию клеток.
Термин «хитозан» означает линейный полисахарид, состоящий из произвольно распределенного β-(1-4)-связанного D-глюкозамина (деацетилированная единица) и N-ацетил-D-глюкозамина (ацетилированная единица). Для коммерческих целей хитозан получают путем деацетилирования хитина, который является структурным элементом экзоскелета ракообразных (крабов, креветок и так далее) и клеточных стенок грибов. Степень деацетилирования (%DD) может быть определена с помощью ЯМР спектроскопии, %DD в коммерчески доступных хитозанах находится в диапазоне 60-100%. В среднем, молекулярный вес коммерчески производимого хитозана находится в границах между 3800 и 20000 а. е. м. Типичным способом синтеза хитозана является деацетилирование хитина с помощью избытка гидроксида натрия в избытке в качестве реагента и воды в качестве растворителя. Данный путь течения реакции при завершении (полном деацетилировании) дает выход до 98% продукта. Аминогруппа хитозана имеет значение pKa ~6.5, что приводит к протонированию в кислых и нейтральных растворах с плотностью заряда, зависящей от рН и значения %DA. Это делает хитозан растворимым в воде и биоадгезивным, что обеспечивает немедленное прикрепление к отрицательно заряженным поверхностям, таким как слизистые оболочки. Хитозан улучшает транспорт полярных лекарственных веществ по эпителиальным поверхностям и является биосовместимым и поддающимся биологическому разложению.
Кроме того, изобретение предусматривает способ приготовления сыворотки с тромбином, состоящий из следующих стадий:
a) Забор цельной крови, предпочтительно в пробирку, предпочтительно содержащую тиксотропный гель,
b) Центрифугирование пробирки до высвобождения сыворотки с тромбином и
c) Сбор сыворотки с тромбином.
Забор крови инициирует реакции свертывания крови, и, если не предприняты превентивные меры для остановки данного процесса, сгусток образуется естественным путем.
Предпочтительно, тиксотропный гель расположен рядом с дном пробирки. В течение центрифугирования красные кровяные клетки будут мигрировать под действием геля. В то же время, происходит полимеризация фибриногена с образованием сгустка на геле. Под действием значительной силы центрифугирования и/или значительного времени центрифугирования данный сгусток далее выпадет в осадок, формируя фибриновую сетку, которая высвободит жидкий супернатант, называемый сывороткой, содержащей обогащенный активированный тромбин. Тромбин является энзимом, стимулирующим коагуляцию.
Преимущественно сыворотка с тромбином, в соответствии с данным изобретением, может быть получена в несколько стадий исключительно с помощью центрифугирования пробирки содержащей цельную кровь и тиксотропный гель, в течение значительного времени центрифугирования. Преимущественно способ приготовления сыворотки с тромбином в соответствии с данным изобретением предусматривает получение готовой к использованию сыворотки с тромбином. К сыворотке с тромбином здесь также относится препарат, обогащенный тромбином; сыворотка, обогащенная тромбином; обогащенная активированная сыворотка с тромбином; обогащенный активированный препарат с тромбином; обогащенная тромбином активированная сыворотка; активированный обогащенный тромбином препарат.
Другая особенность заключается в том, что изобретение предусматривает способ приготовления сыворотки с тромбином, состоящий из следующих стадий:
a) Забор цельной крови, предпочтительно в пробирку, предпочтительно содержащую тиксотропный гель,
b) Центрифугирование пробирки до тех пор, когда красные кровяные клетки мигрируют под тиксотропный гель и, предпочтительно, до образования фибриновой сетки на тиксотропном геле и
c) Сбор супернатанта или сыворотки с тромбином.
В одном из предпочтительных вариантов изобретения стадия центрифугирования выполняется при величине ускорения 1000 g в течение приблизительно 30 минут. В следующем варианте изобретения стадия центрифугирования выполняется при величине ускорения от около 1000 g до около 2000 g в течение периода времени, выбранного в диапазоне от около 20 минут до около 40 минут, предпочтительно при 1500 g в течение периода времени, выбранного в диапазоне от около 25 минут до около 35 минут, предпочтительно при 1500 g в течение около 30 минут.
Предпочтительно, стадия центрифугирования выполняется в течение значительного времени до высвобождения сыворотки с тромбином.
Преимущественно способы настоящего изобретения позволяют осуществлять консервацию жидкой сыворотки при сохранении тромбина в растворимом состоянии. Стандартные способы заключаются в измельчении сгустка до высвобождения сыворотки с тромбином. Преимущественно данный способ является необязательным для приготовления сыворотки с тромбином в соответствии с настоящим изобретением. Данная альтернативная сыворотка с тромбином может быть также использована в качестве препарата, обогащенного тромбином в контексте изобретения. Преимущественно агент коагуляции не используется, и коагуляция происходит самопроизвольно. Это имеет преимущества, заключающиеся в снижении стоимости и упрощении способа. Поскольку в пробирке отсутствует цитрат, агент коагуляции (также называемый агентом восстановления) преимущественно не требуется для начала коагуляции. Преимущественно не требуется раствор этилового спирта и/или хлорид кальция.
Преимущественно способ приготовления сыворотки с тромбином, описанный здесь, является простым, требующим меньшего времени присутствия человека, поскольку измельчение сгустка не требуется, что обеспечивает экономическое преимущество по сравнению с прежними способами приготовления.
Альтернативная аутологичная сыворотка с тромбином, предназначенная для использования в контексте изобретения в качестве препарата, обогащенного тромбином, приготовляется с помощью устаревшего способа, который включает добавление 95% раствора этилового спирта (например, 1 мл) и хлорида кальция 10% (например, 1 мл) в пробу цельной крови пациента (например, 10 мл), отобранную в пробирку. Затем смеси позволяют осесть в течение около 30 минут при комнатной температуре. После 30 минут почти 80% антитромбина (наряду с другими белками, такими как фибриноген) выпадает в осадок, затем пробирку центрифугируют при около 1500 g в течение от около 8 до 10 минут, после чего аутологичная сыворотка с тромбином становится готовой для использования в комбинации с тромбоцитарно-обогащенным концентратом.
Предпочтительно, изобретение предусматривает способ приготовления аутологичной сыворотки с тромбином. Предпочтительно, все аспекты и/или варианты настоящего изобретения предназначены для аутологичного использования. Соответственно, настоящее изобретение предусматривает способ приготовления полностью аутологичной сыворотки с тромбином, причем донор и реципиент являются одним и тем же человеком или животным.
В одном варианте изобретения пробирка для приготовления сыворотки с тромбином изготовлена из стекла, предпочтительно является стеклянной пробиркой для отбора клеток (пробиркой-сепаратором), содержащей тиксотропный гель на основе сложного полиэфира.
В наиболее предпочтительном варианте способ приготовления сыворотки с тромбином включает использование пробирки в соответствии с данным изобретением, в которую не добавляют цитрат.
Другая особенность заключается в том, что изобретение предусматривает способ приготовления композиции для заживления ран или тканей, включающий следующие стадии:
a) Забор цельной крови, предпочтительно в пробирку, предпочтительно содержащую тиксотропный гель,
b) Центрифугирование пробирки, предпочтительно до высвобождения сыворотки с тромбином,
c) Сбор супернатанта и сыворотки с тромбином и
d) Смешивание сыворотки с тромбином с PRP композицией или выделенной композицией тромбоцитарного концентрата.
Другая особенность заключается в том, что изобретение предусматривает способ приготовления композиции для заживления ран или тканей, клеточную композицию и/или клеточный препарат, включающий следующие стадии:
a) Забор цельной крови, предпочтительно в пробирку, предпочтительно содержащую тиксотропный гель,
b) Центрифугирование пробирки, предпочтительно до высвобождения сыворотки с тромбином,
c) Сбор сыворотки с тромбином,
d) Смешивание сыворотки с тромбином с PRP композицией или выделенной композицией тромбоцитарного концетрата и
e) Добавление полученной композиции по пункту d) в клеточный экстракт, клеточную композицию, TCP, хитозан, гиалуроновую кислоту, крем, кремовую маску, жировые клетки, жировую ткань, концентрат клеток костного мозга, любрицин, cd-желатин, ботулотоксин и/или стволовые клетки.
В одном из вариантов осуществления изобретения цельная кровь забирается, по меньшей мере, в одну пробирку. Пробирка может быть обозначена здесь как пробирка для отбора клеток (пробирка-сепаратор). Предпочтительно все способы настоящего изобретения могут включать использование одной или нескольких пробирок в соответствии с изобретением.
В одном из вариантов осуществления изобретения все способы настоящего изобретения могут включать использование цельной крови, собранной в систему контейнеров для крови или устройство с пробирками для забора крови в соответствии с данным изобретением или устройство или набор, состоящий из такой системы контейнеров для крови или устройства с пробирками для забора крови.
Термин «пустая» пробирка относится здесь к пробирке, в которую не были помещены и/или добавлены никакие вещества или композиции.
Любой способ настоящего изобретения может быть воспроизведен с использованием, по меньшей мере, одной пробирки в соответствии с данным изобретением.
Другая особенность заключается в том, что изобретение предусматривает способ приготовления композиции для заживления ран или композиции для заживления тканей, состоящий из следующих стадий:
a) Забор цельной крови в пробирку,
b) Центрифугирование пробирки,
c) Сбор сгустка.
Агент коагуляции преимущественно не используется для приготовления композиции для заживления ран или композиции для заживления тканей. Композиция для заживления ран или композиция для заживления тканей является преимущественно готовой к использованию композицией. Такая композиция может быть непосредственно нанесена на диабетические язвы.
Предпочтительно способ приготовления композиции для заживления ран или композиции для заживления тканей предназначен для использования в стоматологии и/или ортопедии.
Другая особенность заключается в том, что изобретение предусматривает композицию для заживления ран или композицию для заживления тканей, состоящую из сгустка, предназначенного для использования в стоматологии, ортопедии; лечении артрита, псевдоартрита и подобных им заболеваний. В одном из вариантов осуществления изобретения композиция для заживления ран или композиция для заживления тканей включает сгусток, предназначенный для помещения в кариозную полость, на диабетическую язву, сквозную язву, диабетическую сквозную язву или подобные им. Способ или лечение и использование композиции для заживления ран или композиции для заживления тканей, включающие сгусток, также описаны в данном изобретении.
В одном из вариантов осуществления изобретения композиция для заживления ран или композиция для заживления тканей может быть совмещена с трикальцийфосфатом (TCP) или с любым костным заменителем, предпочтительно до образования сгустка.
Композиция для заживления ран, включающая TCP, может быть приготовлена, предпочтительно, во флаконе.
В одном из вариантов осуществления изобретения композиция для заживления ран или композиция для заживления тканей может быть совмещена с гиалуроновой кислотой (НА), предпочтительно до образования сгустка.
Другая особенность заключается в том, что изобретение предусматривает способ приготовления композиции тромбоцитарного концентрата или композиции обогащенной тромбоцитами плазмы, включающий данные стадии:
a) Центрифугирование цельной крови в пробирке в соответствии с изобретением, предпочтительно содержащей цитрат натрия и/или тиксотропный гель и
b) Сбор обогащенной тромбоцитами плазмы.
Стадия центрифугирования позволит исключить красные кровяные клетки (RBC) из плазмы. Верхняя фаза является обогащенной тромбоцитами плазмой (PRP), а нижняя фаза является антикоагулированной цельной кровью за исключением обогащенной тромбоцитами плазмы.
Предпочтительно стадия центрифугирования выполняется при ускорении от около 1500 g до около 2000 g. Предпочтительно стадия центрифугирования выполняется в течение достаточного времени для формирования барьера между плазмой, содержащей тромбоциты, лимфоциты и моноциты, и гелем, содержащим эритроциты. Предпочтительно стадия отбора клеток b) осуществляется путем сбора супернатанта с верхней части указанного барьера. В одном из вариантов осуществления изобретения обогащенная тромбоцитами плазма отделяется от цельной плазмы с помощью удаления половины супернатанта, содержащего бедную тромбоцитами плазму. Предпочтительно обогащенная плазма обогащена лейкоцитами, тромбоцитами и адгезивными белками (например, фибронектином (растворимый белок) или витронектином (белок, вырабатываемый тромбоцитами)) по сравнению с нативной цельной кровью. В одном из вариантов осуществления изобретения используется пробирка для приготовления обогащенной тромбоцитами плазмы, выбранная из:
i) стеклянной пробирки для отбора клеток, содержащей тиксотропный гель на основе полиэфира и буферный раствор цитрата натрия с молярной концентрацией 0.10 М,
ii) полиэтилентерефталатовой пробирки для отбора клеток, содержащей высокотиксотропный гель, образованный полимерной смесью, и безводный цитрат натрия при концентрации 3.5 мг/мл,
iii) пробирки для отбора клеток, изготовленной из циклического сополимера олефина (СОС) или циклического полимера олефина (СОР), содержащей тиксотропный гель на основе полиэфира и буферный раствор цитрата натрия при молярной концентрации 0.10 М или
iv) фильтровальной пробирки для отбора клеток (фильтровальной пробирки-сепаратора), изготовленной из циклического сополимера олефина (СОС) или циклического полимера олефина (СОР), содержащей буферный раствор цитрата натрия с молярной концентрацией 0.10 М или безводный цитрат натрия при концентрации 3.5 мг/мл.
В наиболее предпочтительном варианте осуществления изобретения способ приготовления тромбоцитарного концентрата включает использование пробирки в соответствии с данным изобретением с добавлением цитрата (например буферного раствора цитрата натрия при молярной концентрации 0.10 М или безводного цитрата натрия при концентрации 3.5 мг/мл).
Другая особенность заключается в том, что настоящее изобретение предусматривает способ приготовления композиции для заживления ран или композиции для заживления тканей, состоящего из следующих стадий:
a) Центрифугирования цельной крови в пробирке в соответствии с данным изобретением, предпочтительно включающей цитрат натрия и/или тиксотропный гель,
b) Сбор обогащенной тромбоцитами плазмы и
c) добавление обогащенной тромбоцитами плазмы к клеточному экстракту, клеточной композиции, TCP, хитозану, гиалуроновой кислоте, крему, кремовой маске, жировым клеткам, жировой ткани, концентрату клеток костного мозга, любрицину, cd-желатину, ботулотоксину и/или стволовым клеткам.
Другая особенность заключается в том, что настоящее изобретение предусматривает композицию для заживления ран или тканей, включающую:
a) обогащенную тромбоцитами плазму или концентрат плазмы в соответствии с данным изобретением и
b) TCP, хитозан, гиалуроновую кислоту, крем, кремовую маску, жировые клетки, жировую ткань, концентрат клеток костного мозга, любрицин, cd-желатин, ботулотоксин и/или стволовые клетки.
Другая особенность заключается в том, что настоящее изобретение предусматривает композицию для заживления ран или тканей, включающую:
a) сыворотку с тромбином в соответствии с данным изобретением,
b) обогащенный тромбоцитами плазму или концентрат плазмы, предпочтительно в соответствии данным изобретением, и
c) TCP, хитозан, гиалуроновую кислоту, крем, кремовую маску, жировые клетки, жировую ткань, концентрат клеток костного мозга, любрицин, cd-желатин, ботулотоксин и/или стволовые клетки.
Образование сгустка является многостадийным процессом или каскадом, и каждая из данных стадий требует присутствия ионов кальция. Образование сгустка в крови может быть предотвращено путем удаления ионов кальция, присутствующих в цельной крови, поскольку их присутствие является следствием забора крови в присутствии цитрата. Хелатный агент кальция является химикатом, который взаимодействует с кальцием, присутствующим в крови, таким образом, что кальций теряет способность принимать участие в коагуляции крови. Наиболее типичным хелатным агентом является соль лимонной кислоты (цитрат), поскольку она обладает наименьшими побочными эффектами по отношению к компонентам системы образования сгустков. Путем помещения крови в среду, содержащую хелатный агент кальция, такой как цитрат, забор образца и дальнейшие действия по подготовке нитратного образца могут быть выполнены в течение периода времени до нескольких часов. Предпочтительным хелатным агентом кальция является цитрат натрия.
Несмотря на то, что среда, состоящая из цитрата натрия при концентрации 3.5 мг/мл, часто используется для забора и консервирования крови, квалифицированный специалист обнаружит, что отношение объема цитрата натрия к цельной крови может лежать в ином диапазоне.
Другая особенность заключается в том, что настоящее изобретение предусматривает выделенную композицию тромбоцитарного концентрата, состоящую из:
a) плазмы;
b) тромбоцитов при минимальном содержании 300×109 клеток/л;
c) белых кровяных клеток при минимальном содержании 7×109 клеток/л;
d) фибриногена при минимальной концентрации 3 мг/л;
и в которой содержание эритроцитов составляет менее чем 0.6×1012 клеток/л.
Композиция обогащенной тромбоцитами плазмы также называется здесь композицией плазменного концентрата.
В одном из вариантов осуществления изобретения композиция тромбоцитарного концентрата или композиция обогащенной тромбоцитами плазмы в соответствии с данным изобретением может быть соединена с трикальцийфосфатом (TCP) и/или любым заменителем для использования в качестве корректора объема (при размере ТСР10-30 микрон), в стоматологии, ортопедии (при размере TCP 50 микрон).
Другая особенность заключается в том, что настоящее изобретение предусматривает способ приготовления композиции для заживления ран или композиции для заживления тканей, состоящий из следующих стадий:
a) Центрифугирование цельной крови в пробирке, содержащей гиалуроновую кислоту,
b) Необязательный отбор обогащенной тромбоцитами плазмы и гиалуроновой кислоты из цельной плазмы, и
c) Необязательное смешивание обогащенной тромбоцитами плазмы и гиалуроновой кислоты.
Предпочтительно пробирка содержит гиалуроновую кислоту, предпочтительно на дне пробирки, далее тиксотропный гель и затем антикоагулянт, предпочтительно цитрат натрия (Фиг. 16).
Предпочтительно стадия отбора клеток b) совершается путем сбора супернатанта, содержащего обогащенную богатую тромбоцитами плазму и гиалуроновую кислоту с верхней части указанного барьера. В одном из вариантов осуществления изобретения обогащенная богатая тромбоцитами плазма и гиалуроновая кислота отделяются от цельной плазмы с помощью удаления половины супернатанта, содержащего бедную тромбоцитами плазму. Предпочтительно обогащенная плазма обогащена лейкоцитами, тромбоцитами и адгезивными белками (например, фибронектином (растворимый белок) или витронектином (белок, выделяемый тромбоцитами)) по сравнению с нативной цельной кровью.
Другая особенность заключается в том, что изобретение предусматривает способ приготовления композиции для заживления ран или композиции для заживления тканей, состоящий из следующих стадий:
a) Забор цельной крови, предпочтительно в пробирку, содержащую гиалуроновую кислоту, тиксотропный гель и/или антикоагулянт, предпочтительно цитрат натрия,
b) Центрифугирование пробирки, предпочтительно до миграции красных кровяных клеток под действием тиксотропного геля и предпочтительно до миграции гиалуроновой кислоты выше обогащенной плазмы,
c) Необязательное смешивание гиалуроновой кислоты и обогащенной плазмы, предпочтительно путем переворачивания пробирки,
d) Сбор супернатанта, содержащего гиалуроновую кислоту и обогащенную плазму, и
e) Необязательное дальнейшее смешивание указанной гиалуроновой кислоты и указанной обогащенной плазмы.
Другая особенность заключается в том, что изобретение предусматривает способ приготовления композиции для заживления ран или композиции для заживления тканей, включающий следующие стадии:
a) Забор цельной крови, предпочтительно в пробирку, содержащую гиалуроновую кислоту, тиксотропный гель и/или ангикоагулянт, предпочтительно цитрат натрия.
b) Центрифугирование пробирки, предпочтительно до образования слоя гиалуроновой кислоты в качестве первого верхнего слоя пробирки с последующим вторым слоем, состоящим из обогащенной плазмы или PRP,
c) Необязательное смешивание гиалуроновой кислоты и обогащенной плазмы, предпочтительно путем переворачивания пробирки.
d) Сбор супернатанта, содержащего гиалуроновую кислоту и обогащенную плазму, и
e) Необязательное дальнейшее смешивание указанной гиалуроновой кислоты и указанной обогащенной плазмы.
Стадия центрифугирования удаляет красные кровяные клетки (RBC) из плазмы. После центрифугирования верхняя фаза является гиалуроновой кислотой с нижележащей обогащенной тромбоцитами плазмой (PRP) с последующим тиксотропным гелем, а нижняя фаза является антикоагулированной цельной кровью, содержащей красные кровяные клетки за исключением богатой тромбоцитами плазмы (Фиг. 16). В течение центрифугирования гиалуроновая кислота мигрирует выше плазмы (Фиг. 16).
Предпочтительно пробирка содержит от около 1 мл до около 2 мл гиалуроновой кислоты, около 2 г клеточного сепаратора или тиксотропного геля и около 1 мл цитрата натрия при молярной концентрации 0.109 М.
Схематическое изображение способа приготовления композиции для заживления ран, состоящей из гиалуроновой кислоты и PRP, приведено на Фиг. 16.
Предпочтительно обогащенная богатая тромбоцитами плазма и гиалуроновая кислота смешиваются путем простого переворачивания пробирки.
Преимущественно при смешивании обогащенной богатой тромбоцитами плазмы и гиалуроновой кислоты, гиалуроновая кислота увеличивается в объеме за счет плазмы и клеток.
Преимущественно композицию для заживления ран или композицию для заживления тканей получают в виде готовой для использования композиции. Преимущественно композицию для заживления ран или композицию для заживления тканей получают в виде вязкого геля или биологического клея, подходящего для инъецирования и который, к примеру, может быть использован в качестве механического суппорта или фильтра. Преимущественно способ приготовления композиции для заживления ран, композиции для заживления тканей или вязкого геля является экономичным, простым и быстрым. Предпочтительно стадия центрифугирования выполняется в течение достаточного периода времени до миграции красных кровяных клеток под действием тиксотропного геля и предпочтительно до миграции гиалуроновой кислоты выше обогащенной плазмы.
В одном из предпочтительных вариантов осуществления изобретения стадия центрифугирования выполняется при ускорении от около 1500 g в течение приблизительно 5 минут. В другом варианте осуществления изобретения стадия центрифугирования выполняется при ускорении от около 1000 g до 2000 g в течение времени, выбранного от около 3 минут до около 7 минут, предпочтительно при ускорении 1500 g в течение времени, выбранного от около 3 минут до около 7 минут.
Другая особенность заключается в том, что изобретение предусматривает пробирку, содержащую гиалуроновую кислоту и антикоагулянт. Другая особенность заключается в том, что изобретение предусматривает пробирку, содержащую гиалуроновую кислоту, антикоагулянт и цельную кровь. Предпочтительно антикоагулянт является цитратом натрия.
Другая особенность заключается в том, что изобретение предусматривает пробирку, содержащую гиалуроновую кислоту и гель для отбора клеток. Другая особенность заключается в том, что изобретение предусматривает пробирку, содержащую гиалуроновую кислоту, гель для отбора клеток и цельную кровь. Предпочтительно гель для отбора клеток является тиксотропным гелем.
Другая особенность заключается в том, что изобретение предусматривает пробирку, содержащую гиалуроновую кислоту, антикоагулянт и гель для отбора клеток. Другая особенность заключается в том, что изобретение предусматривает пробирку, содержащую гиалуроновую кислоту, антикоагулянт, гель для отбора клеток и цельную кровь. Предпочтительно антикоагулянт является цитратом натрия. Предпочтительно гель для отбора клеток является тиксотропным гелем. Предпочтительно гиалуроновая кислота располагается на дне пробирки с последующим тиксотропным гелем и антикоагулянтом, расположенным выше, предпочтительно цитратом натрия (Фиг. 16).
Другая особенность заключается в том, что изобретение предусматривает пробирку, содержащую гиалуроновую кислоту и PRP. Другая особенность заключается в том, что изобретение предусматривает пробирку, содержащую гиалуроновую кислоту, PRP и гель для отбора клеток. Другая особенность заключается в том, что изобретение предусматривает пробирку, содержащую гиалуроновую кислоту, PRP и антикоагулянт. Другая особенность заключается в том, что изобретение предусматривает пробирку, содержащую гиалуроновую кислоту, PRP, антикоагулянт и гель для отбора клеток. Предпочтительно антикоагулянт является цитратом натрия. Предпочтительно гель для отбора клеток является тиксотропным гелем.
Предпочтительно используется пробирка в соответствии с данным изобретением в способе в соответствии с данным изобретением.
Другая особенность заключается в том, что изобретение предусматривает композицию, включающую гиалуроновую кислоту и PRP. Другая особенность заключается в том, что изобретение предусматривает композицию, включающую гиалуроновую кислоту и PRP, причем композицию получают с помощью способа приготовления композиции для заживления ран или композиции для заживления тканей в соответствии с данным изобретением.
Другая особенность заключается в том, что изобретение предусматривает набор или медицинское устройство, включающее пробирку в соответствии с данным изобретением.
В дальнейших вариантах осуществления изобретение предусматривает пробирку, которая может быть использована для приготовления композиции для заживления ран или композиции для заживления тканей, выбранную из:
i) стеклянной пробирки для отбора клеток, содержащей тиксотропный гель на основе полиэфира, буферный раствор цитрата натрия с молярной концентрацией 0.10 М и гиалуроновую кислоту,
ii) полиэтилентерефталатовой пробирки для отбора клеток, содержащей высокотиксотропный гель, образованный полимерной смесью, безводный цитрат натрия при концентрации 3.5 мг/мл и гиалуроновую кислоту,
iii) пробирки для отбора клеток, изготовленной из циклического сополимера олефина (СОС) или циклического полимера олефина (СОР), содержащей тиксотропный гель на основе полиэфира, буферный раствор цитрата натрия при молярной концентрации 0.10 М и гиалуроновую кислоту, или
iv) фильтровальной пробирки для отбора клеток, изготовленной из циклического сополимера олефина (СОС) или циклического полимера олефина (СОР), содержащей гиалуроновую кислоту и буферный раствор цитрата натрия с молярной концентрацией 0.10 М или безводный цитрат натрия при концентрации 3.5 мг/мл.
В дальнейших предпочтительных вариантах осуществления изобретение предусматривает пробирку в соответствии с данным изобретением, которая может быть использована для приготовления композиции для заживления ран или композиции для заживления тканей, содержащей цитрат и гиалуроновую кислоту (например гиалуроновую кислоту и буферный раствор цитрата натрия с молярной концентрацией 0.10 М или безводный цитрат натрия при концентрации 3.5 мг/мл).
Предпочтительно фталат не используется для применения в отношении людей.
Также гирудин, бензолсульфонил-(1-Arg-Pro-4-амидино-бензиламид (ВАРА), гепарин, цитрат, кислота-цитрат-декстроза (кислый цитратный раствор на основе декстрозы) (ACD), цитрат-теофиллин-аденозин-дипиридамол (CTAD) или калий-этилендиаминтетрауксусная кислота (калиевая соль этилендиаминтетрауксусной кислоты) (EDTA) могут быть использованы в качестве антикоагулянтов.
Другая особенность заключается в том, что настоящее изобретение предусматривает композицию для заживления ран или композицию для заживления тканей, включающую:
a) плазму;
b) тромбоциты при содержании от 300×109 клеток/л;
c) белые кровяные клетки при содержании от 7×109 клеток/л;
d) фибриноген при концентрации от 3 мг/л;
e) от около 1 мл до около 2 мл гиалуроновой кислоты;
и в которой содержание эритроцитов составляет менее 0.6×1012 клеток/л.
В одном из вариантов осуществления изобретения композиция для заживления ран или композиция для заживления тканей в соответствии с данным изобретением может быть соединена с трикальцийфосфатом (TCP) и/или любым заменителем для использования в качестве корректора объема (при размере TCP 10-30 микрон), в стоматологии, ортопедии (при размере TCP 50 микрон).
В одном из вариантов осуществления изобретения композиция для заживления ран, композиция для заживления тканей, гемостатический агент, композиция тромбоцитарного концентрата, композиция богатой тромбоцитами плазмы в соответствии с данным изобретением может быть соединена в пробирке для забора крови с гиалуроновой кислотой.
Другая особенность заключается в том, что изобретение предусматривает способ приготовления гемостатического агента, композиции для заживления ран или композиции для заживления тканей, включающий стадию смешивания сыворотки с тромбином или сыворотки с тромбином в соответствии с данным изобретением с композицией богатой тромбоцитами плазмы, композицией для заживления ран или композицией для заживления тканей в соответствии с данным изобретением.
Другая особенность заключается в том, что настоящее изобретение предусматривает способ приготовления композиции для заживления ран, композиции для заживления тканей или гемостатического агента, включающий:
a) Получение тромбоцитарного концентрата или тромбоцитарного концентрата изобретения,
b) Смешивание тромбоцитарного концентрата с активатором коагуляции, сывороткой с тромбином или сывороткой с тромбином в соответствии с данным изобретением,
и
c) Необязательное добавление клеточного экстракта, такого как экстракт кератиноцитов, костного мозга, фибробластов, надкостницы или клеток роговицы, меланоцитов и клеток Лангерганса, жировых клеток, мышечных клеток, таких как миобласты и сателлитные клетки, остеобластов, хондроцитов, прогениторных клеток крови, клеток пуповины, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, шванновских клеток или клеток ахиллового сухожилия.
Предпочтительно используют аутологичный тромбоцитарный концентрат, аутологичный тромбин и/или аутологичный клеточный экстракт. Более предпочтительно используют аутологичный тромбоцитарный концентрат и аутологичный тромбин и аутологичный клеточный экстракт. Предпочтительно используют пробирки в соответствии с данным изобретением.
Другая особенность заключается в том, что настоящее изобретение предусматривает способ приготовления композиции для заживления ран или композиции для заживления тканей или гемостатического агента, включающий:
a) Смешивание тромбоцитарного концентрата с аутологичной сывороткой с тромбином в соответствии с любым аспектом изобретения и
b) Необязательное добавление, по меньшей мере, одного аутологичного клеточного экстракта, такого как экстракт кератиноцитов, костного мозга, фибробластов, надкостницы или клеток роговицы, меланоцитов и клеток Лангерганса, жировых клеток, мышечных клеток, таких как миобласты и сателлитные клетки, остеобластов, хондроцитов, клеток пуповины, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, шванновских клеток или клеток ахиллового сухожилия.
Другая особенность заключается в том, что настоящее изобретение предусматривает способ приготовления композиции для заживления ран или композиции для заживления тканей или гемостатического агента, включающий:
a) Смешивание аутологичного тромбоцитарного концентрата с сывороткой с тромбином, причем аутологичный тромбоцитарный концентрат и/или сыворотка с тромбином приготовлены с использованием пробирок в соответствии с данным изобретением,
и
b) Необязательное добавление, по меньшей мере, одного аутологичного клеточного экстракта, такого как экстракт кератиноцитов, костного мозга, фибробластов, надкостницы или клеток роговицы, меланоцитов и клеток Лангерганса, жировых клеток, мышечных клеток, таких как миобласты и сателлитные клетки, остеобластов, хондроцитов, клеток пуповины, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, шванновских клеток или клеток ахиллового сухожилия.
Другая особенность заключается в том, что настоящее изобретение предусматривает способ приготовления композиции для заживления ран или композиции для заживления тканей или гемостатического агента, включающий:
a) Получение тромбоцитарного концентрата, предпочтительно аутологичного тромбоцитарного концентрата в соответствии с данным изобретением,
b) Смешивание тромбоцитарного концентрата с сывороткой с тромбином, предпочтительно с аутологичной сывороткой с тромбином в соответствии с данным изобретением, и
c) Необязательное добавление, по меньшей мере, одного клеточного экстракта, предпочтительно аутологичного клеточного экстракта, такого как экстракт кератиноцитов, костного мозга, фибробластов, надкостницы или клеток роговицы, меланоцитов и клеток Лангерганса, жировых клеток, мышечных клеток, таких как миобласты и сателлитные клетки, остеобластов, хондроцитов, клеток пуповины, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, шванновских клеток или клеток ахиллового сухожилия.
Предпочтительно изобретение предусматривает способ приготовления аутологичной композиции для заживления ран или композиции для заживления тканей или гемостатического агента. «Аутологичная композиция для заживления ран» или «композиция для заживления тканей» или «гемостатический агент» означает здесь композицию, в которой либо тромбоцитарный концентрат, либо сыворотка с тромбином является аутологичной.
Наиболее предпочтительной особенностью изобретения является способ приготовления полностью аутологичной композиции для заживления ран или композиции для заживления тканей или гемостатического агента. «Полностью аутологичная композиция для заживления ран» или «композиция для заживления тканей» или «гемостатический агент» означает здесь композицию, в которой тромбоцитарный концентрат или сыворотка с тромбином одновременно являются аутологичными. В данной предпочтительной особенности изобретения все компоненты крови, используемые в композиции для заживления ран или композиции для заживления тканей или гемостатическом агенте, получены от того же пациента или животного, по отношению к которому будет применяться композиция для заживления ран или композиция для заживления тканей или гемостатический агент.
Другая особенность заключается в том, что изобретение предусматривает способ приготовления полностью аутологичной композиции для заживления ран или композиции для заживления тканей или гемостатического агента в комбинации с, по меньшей мере, одним аутологичным клеточным экстрактом. В данном аспекте тромбоцитарный концентрат, сыворотка с тромбином и клеточный экстракт(ы) являются аутологичными и, таким образом, все они являются полученными от того же пациента или животного.
Другая особенность заключается в том, что настоящее изобретение предусматривает способ приготовления аутологичной композиции для заживления ран или аутологичной композиции для заживления тканей или аутологичного гемостатического агента, включающий:
a) Смешивание аутологичного тромбоцитарного концентрата, предпочтительно аутологичного тромбоцитарного концентрата в соответствии с данным изобретением, с аутологичной сывороткой с тромбином, предпочтительно с аутологичным тромбином в соответствии с данным изобретением, и
b) Необязательное добавление, по меньшей мере, одного клеточного экстракта, такого как экстракт кератиноцитов, костного мозга, фибробластов, надкостницы или клеток роговицы, меланоцитов и клеток Лангерганса, жировых клеток, мышечных клеток, таких как миобласты и сателлитные клетки, остеобластов, хондроцитов, клеток пуповины, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, шванновских клеток или клеток ахиллового сухожилия.
причем аутологичный тромбоцитарный концентрат и аутологичный тромбин одновременно являются полученными от того же пациента или животного.
Другая особенность заключается в том, что настоящее изобретение предусматривает способ приготовления аутологичной композиции для заживления ран или аутологичной композиции для заживления тканей или аутологичного гемостатического агента, включающий:
a) Смешивание аутологичного тромбоцитарного концентрата, предпочтительно аутологичного тромбоцитарного концентрата в соответствии с данным изобретением, с аутологичной сывороткой с тромбином, предпочтительно с аутологичным тромбином в соответствии с данным изобретением, и
b) Необязательное добавление, по меньшей мере, одного аутологичного клеточного экстракта, такого как экстракт кератиноцитов, костного мозга, фибробластов, надкостницы или клеток роговицы, меланоцитов и клеток Лангерганса, жировых клеток, мышечных клеток, таких как миобласты и сателлитные клетки, остеобластов, хондроцитов, клеток пуповины, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, шванновских клеток или клеток ахиллового сухожилия,
причем аутологичный тромбоцитарный концентрат, аутологичный тромбин и аутологичный клеточный экстракт одновременно являются полученными от того же пациента или животного.
Обогащенная тромбоцитами плазма, аутологичная обогащенная тромбоцитами плазма, сыворотка с тромбином, аутологичная сыворотка с тромбином, композиция для заживления ран или композиция для заживления тканей или гемостатический агент, описанные в настоящем изобретении, могут быть соединены с одним или более клеточными экстрактами. В одном из вариантов осуществления изобретения клеточный экстракт выбран из экстракта кератиноцитов, костного мозга, фибробластов, надкостницы или клеток роговицы, меланоцитов и клеток Лангерганса, жировых клеток, мышечных клеток, таких как миобласты и сателлитные клетки, остеобластов, хондроцитов, клеток пуповины, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, шванновских клеток или клеток ахиллового сухожилия.
Композиция для заживления ран или композиция для заживления клеток или гемостатический агент, описанные в данном изобретении, стимулируют клеточную регенерацию, действуя в качестве биологического клея для осуществления адгезии ткани.
В одном из вариантов осуществления изобретения вместо сыворотки с тромбином можно использовать альтернативный активатор коагуляции, такой как хлорид кальция, предпочтительно глюконат кальция.
В одном из вариантов осуществления изобретения может использоваться комбинация из нескольких активаторов коагуляции, предпочтительно сыворотка с тромбином с глюконатом кальция.
Предпочтительно активатор коагуляции или сыворотка с тромбином смешивают с тромбоцитарным концентратом при соотношении объема (тромбоцитарный концентрат : активатор коагуляции) от около 10:1 до около 10:3.
В предпочтительном варианте осуществления изобретения жидкая сыворотка собирается в соотношении 1:1, 3:1 или 10:1 к богатой тромбоцитами плазме. Использование конкретного соотношения оказывает влияние на степень твердости гемостатического агента. При соотношении 3:1 получают твердый гемостатический агент. При соотношении 10:1 получают мягкий агент.
В одном из вариантов осуществления изобретения PRP или концентрат плазмы самостоятельно или в составе комбинации с клеточным экстрактом, наряду с препаратами или композициями настоящего изобретения, может быть соединен или интегрирован в ацеллюлярный кожный матрикс для прямого нанесения на рану, или может быть культивирован в лаборатории перед нанесением. Может использоваться коллагеновый матрикс или синтетический матрикс, например матрикс INTEGRA™.
Другой вариант осуществления изобретения касается прямого смешивания рекомбинантного тромбопластина человека с богатой тромбоцитами плазмой для формирования композиции для заживления ран или композиции для заживления тканей или гемостатического агента. Также рекомбинантный тромбопластин человека используется для получения тромбина в малой аликвоте плазмы с последующим соединением полученного тромбина с богатой тромбоцитами плазмой для формирования композиции для заживления ран или композиции для заживления тканей или гемостатического агента.
В одном из вариантов осуществления изобретения, используемые пробирки могут обладать смачивающимися поверхностями (изготовленные из таких материалов как диоксид кремния, кизельгур, каолин и так далее) или несмачивающимися поверхностями (такие как пластик, кварцевое стекло и так далее). Поскольку поверхности играют роль в активации коагуляции крови, материал поверхности пробирки для отбора клеток выбирается в зависимости от желаемой скорости образования сгустка. Химические активаторы, такие как каолин, также могут использоваться для ускорения времени образования сгустка; тем не менее, их последующее удаление также потребуется.
Преимущественно приготовление богатой тромбоцитами плазмы, тромбоцитарного концентрата, сыворотки с тромбином, средства для заживления ран, композиции или композиции для заживления тканей или гемостатического агента настоящего изобретения не требует присутствия этанола и/или кальция. Посредством использования аутологичного тромбина в соответствии с данным изобретением, данное изобретение не требует восстановления процесса образования сгустка. Таким образом, для нейтрализации действия агента антикоагуляции не требуется использование агента (или восстановительного агента), такого как хлорид кальция или глюконат кальция (в восстановлении коагуляционного свойства цитратной крови).
Несмотря на то, что хлорид кальция является хорошо известной солью кальция для использования в качестве восстановительного агента, любая соль кальция, действующая таким же образом, как и хлорид кальция, может рассматриваться в качестве восстановительного агента. Подобным образом, несмотря на то, что, как считается в настоящее время, многие химические реакции, связанные с коагуляцией крови, требуют присутствия ионов кальция в качестве кофакторов, любое соединение, обладающее известной или обнаруженной впоследствии ролью, эквивалентной роли кальция в данных реакциях коагуляции, может рассматриваться в качестве восстановительного агента, или индивидуально, или в комбинации с кальцием. Если в качестве агента антикоагуляции используют гепарин, то для нейтрализации действия агента антикоагуляции в качестве восстановительного агента должна использоваться гепариназа.
Преимущественно изобретение предусматривает богатую тромбоцитами плазму, тромбоцитарный концентрат, сыворотку с тромбином, композицию для заживления ран или композицию для заживления тканей или гемостатический агент, причем риски, связанные с использованием бычьего тромбина и рекомбинантного тромбина человека, нейтрализуются.
Преимущественно с использованием способов данного изобретения получают более высокую концентрацию PRP, факторов роста, лейкоцитов, фибриногена и/или других белков. Преимущественно получают 2-кратную концентрацию PRP, факторов роста, лейкоцитов, фибриногенов и/или других белков по сравнению с обычными гематологическими уровнями.
Преимущественно способы настоящего изобретения обеспечивают оптимальную продуктивность клеток в рамках разрастания клеток.
Преимущественно способы настоящего изобретения позволяют проводить манипуляции с кровью в полностью замкнутом контуре в течение всего процесса: от забора крови, манипуляций до нанесения или инъецирования пациенту. Все устройства и наборы, таким образом, адаптированы для манипулирования в рамках полностью замкнутого контура в целях предотвращения прямого контакта крови с воздухом.
Преимущественно способы настоящего изобретения снижают окислительный стресс и снижают время, требующееся для манипулирования ex vivo.
Преимущественно способы настоящего изобретения делают возможным образование целостной аутологичной закрывающей рану мембраны, состоящей из агрегированных тромбоцитов и активированного полимерного фибриногена.
Препараты настоящего изобретения (например, препарат на основе клеток костного мозга) могут использоваться самостоятельно или с последующим смешиванием с тромбоцитарным конкентратом в соответствии с данным изобретением или могут быть подвергнуты повторному центрифугированию с глюконатом кальция для образования закрывающей рану мембраны и нанесения или инъецирования в поврежденный участок тела пациента с помощью аппликатора.
Препарат на основе клеток костного мозга в соответствии с данным изобретением может использоваться для лечения повреждения кости или повреждения хряща. Препарат на основе костных клеток может использоваться самостоятельно или в комбинации с концентратом плазмы в соответствии с данным изобретением. Хрящевая мембрана может использоваться также с глюконатом кальция.
В одном из предпочтительных вариантов осуществления изобретения стадия центрифугирования (например, для закрывающей рану мембраны) выполняется при ускорении около 3000 g в течение от 15 до 25 минут. В одном из вариантов осуществления изобретения стадия центрифугирования выполняется при ускорении от около 2500 g до около 3500 g в течение времени, выбранного из от около 10 минут до около 30 минут.
В одном из вариантов осуществления изобретения цельная кровь забирается у человека или животного. Предпочтительный вариант осуществления изобретения касается забора цельной крови у человека.
Другая особенность заключается в том, что изобретение предусматривает композицию для заживления ран или тканей или гемостатический агент, приготовленные в соответствии с данным изобретением, состоящие из:
a) плазмы;
b) тромбоцитов при минимальном содержании 300×109 клеток/л;
c) белых кровяных клеток при минимальном содержании 7×109 клеток/л;
d) фибриногена при минимальной концентрации 3 мг/л;
e) активатора коагуляции, аутологичной сыворотки с тромбином или аутологичной сыворотки с тромбином в соответствии с данным изобретением,
f) необязательного аутологичного клеточного экстракта, такого как экстракт кератиноцитов, костного мозга, остеобластов, хондроцитов: фибробластов, клеток надкостницы или роговицы, меланоцитов и клеток Лангерганса, жировых клеток, мышечных клеток, таких как миобласты и сателлитные клетки, клеток пуповины, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, шванновских клеток, клеток ахиллового сухожилия или клеток панкреатических островков; причем содержание эритроцитов составляет менее 0.6×1012 клеток/л.
Другая особенность заключается в том, что изобретение предусматривает композицию для заживления ран или тканей или гемостатический агент, приготовленные в соответствии с данным изобретением, состоящие из:
a) плазмы;
b) тромбоцитов при минимальном содержании 300×109 клеток/л;
c) белых кровяных клеток при минимальном содержании 7×109 клеток/л;
d) фибриногена при минимальной концентрации 3 мг/л;
e) аутологичной сыворотки с тромбином в соответствии с данным изобретением;
f) необязательного аутологичного клеточного экстракта, такого как экстракт кератиноцитов, костного мозга, остеобластов, хондроцитов; фибробластов, клеток надкостницы или роговицы, меланоцитов и клеток Лангерганса, жировых клеток, мышечных клеток, таких как миобласты и сателлитные клетки, клеток пуповины, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, шванновских клеток, клеток ахиллового сухожилия или клеток панкреатических островков; причем содержание эритроцитов составляет менее 0.6×1012 клеток/л.
Предпочтительно активатор коагуляции или аутологичная сыворотка с тромбином находятся в объемном соотношении (тромбоцитарный концентрат : активатор коагуляции) от около 10:1 до около 10:3.
Преимущественно плазма в соответствии с настоящим изобретением представляет собой идеальную клеточную питательную среду по сравнению с известными аналогами. Преимущественно плазма в соответствии с данным изобретением представляет собой идеальную среду для транспорта клеток. Соответственно, плазма в соответствии с данным изобретением содержит все клетки и факторы роста для оптимального роста и выживаемости клеток. Соответственно, плазма в соответствии с данным изобретением представляет собой крайне подходящую среду для имплантации клеток пациенту, например в качестве атопического средства для хирургических ран, для анти возрастных инъекций, внутрисуставных инъекций, внутримышечных инъекций или для панкреатической регенерации (регенерации панкреатических островков).
Другая особенность заключается в том, что настоящее изобретение предусматривает устройство для приготовления композиции тромбоцитарного концентрата или композиции богатой тромбоцитами плазмы или гемостатического агента или композиции для заживления ран или тканей или аутологичной сыворотки с тромбином в соответствии с данным изобретением.
Другая особенность заключается в том, что настоящее изобретение предусматривает устройство, состоящее из, по меньшей мере, одной пробирки в соответствии с данным изобретением.
Предпочтительно устройство обладает входным отверстием для ввода указанной цельной крови под воздействием вакуума в целях аспирирования образца цельной крови, является стерильным, обладает предназначенным для использования объемом вакуума от около 8 до около 10 мл и подходит для проведения центрифугирования.
Другая особенность заключается в том, что настоящее изобретение предусматривает применение композиции тромбоцитарного концентрата или композиции богатой тромбоцитами плазмы или гемостатического агента или композиции для заживления ран или тканей или сыворотки с тромбином в соответствии с данным изобретением для производства лекарственного средства для заживления ран или для стимуляции роста костей или периодонта и/или регенерации костей и/или тканей.
Другая особенность заключается в том, что настоящее изобретение предусматривает применение композиции тромбоцитарного концентрата или композиции богатой тромбоцитами плазмы или гемостатического агента или композиции для заживления ран или тканей или сыворотки с тромбином в соответствии с данным изобретением для производства косметического препарата для использования в качестве антивозрастного агента или агента для восстановления кожи, такого как агента для устранения рубцов, заполнителя морщин и/или восстанавливающего агента.
Другая особенность заключается в том, что настоящее изобретение предусматривает применение композиции тромбоцитарного концентрата или композиции богатой тромбоцитами плазмы или гемостатического агента или композиции для заживления ран или композиции для заживления тканей или сыворотки с тромбином в соответствии с данным изобретением для использования в качестве косметического препарата, эстетического препарата, контроля старения, корректора объема; для заполнения морщин, удаления пигментных пятен и/или стимуляции волос. В одном из вариантов осуществления изобретения композиция тромбоцитарного концентрата или композиция богатой тромбоцитами плазмы или гемостатический агент или композиция для заживления ран или композиция для заживления тканей в соответствии с данным изобретением наносится на и/или вокруг глаз, губ, век, лица, шеи, груди, волосистой части кожи головы, волос, кистей рук и все остальные части тела и/или мужские и женские гениталии.
Другая особенность заключается в том, что изобретение предусматривает композицию тромбоцитарного концентрата или композицию богатой тромбоцитами плазмы или гемостатический агент или композицию для заживления ран или композицию для заживления тканей или сыворотку с тромбином в соответствии с данным изобретением для использования для восстановления связок и/или наращивания хрящей. Преимущественно время восстановления связок и/или наращивания хрящей с использованием композиции в соответствии с данным изобретением уменьшается в 2 или 3 раза по сравнению с известными способами.
В одном из вариантов осуществления изобретения косметический препарат и/или эстетический препарат совмещают с косметическим агентом, косметическим кремом или косметической маской.
Другая особенность заключается в том, что настоящее изобретение предусматривает фармацевтическую композицию, включающую композицию тромбоцитарного концентрата или композицию богатой тромбоцитами плазмы или гемостатический агент или композицию для заживления ран или тканей или сыворотку с тромбином в соответствии с данным изобретением и фармацевтически приемлемый носитель.
Другая особенность заключается в том, что настоящее изобретение предусматривает косметическую композицию, включающую композицию тромбоцитарного концентрата или композицию богатой тромбоцитами плазмы или гемостатический агент или композицию для заживления ран или тканей или сыворотку с тромбином в соответствии с данным изобретением и косметически приемлемый носитель.
Другая особенность заключается в том, что настоящее изобретение предусматривает подходящее для имплантации устройство для использования в целях терапии, связанной с регенерацией тканей, включающее:
a) проницаемое ядро, включающее композицию тромбоцитарного концентрата или композицию богатой тромбоцитами плазмы или гемостатический агент или композицию для заживления ран в соответствии с данным изобретением необязательно в комбинации и гиалуроновой кислотой и
b) необязательно внешнюю оболочку, окружающую указанное ядро, причем указанная оболочка состоит из биосовместимого материала, предпочтительно саморассасывающегося, предпочтительно гиалуроновой кислоты.
Другая особенность заключается в том, что изобретение предусматривает набор, включающий, по меньшей мере, одну пробирку в соответствии с данным изобретением. Другая особенность заключается в том, что изобретение предусматривает набор, включающий пробирку для приготовления тромбоцитарного концентрата в соответствии с данным изобретением и/или пробирку для приготовления сыворотки с тромбином в соответствии с данным изобретением.
Другая особенность заключается в том, что изобретение предусматривает набор, включающий, по меньшей мере, одну пробирку для приготовления композиции тромбоцитарного концентрата или композиции богатой тромбоцитами плазмы или гемостатического агента или композиции для заживления ран или тканей или сыворотки с тромбином в соответствии с данным изобретением.
В одном из вариантов осуществления изобретение набор далее включает одну или несколько пробирок для приготовления композиции тромбоцитарного концентрата или композиции богатой тромбоцитами плазмы или гемостатического агента или композиции для заживления ран или тканей или сыворотки с тромбином в соответствии с данным изобретением.
В одном из вариантов осуществления изобретения набор далее включает инструменты для флеботомии для приготовления средства для заживления ран или тканей и устройство для нанесения (например, двойной шприц) для одновременного распределения по площади раны композиции тромбоцитарного концентрата или композиции богатой тромбоцитами плазмы или гемостатического агента или композиции для заживления ран или тканей или сыворотки с тромбином в соответствии с данным изобретением.
В одном из вариантов осуществления изобретения набор приспособлен для регенерации тканей.
Другая особенность заключается в том, что изобретение предусматривает способ стимуляции заживления ран или заживления тканей и/или запечатывания и/или регенерации тканей и/или костей в ране или ткани человека или животного, включающий:
a) Получение композиции средства для заживления ран или средства для заживления тканей или гемостатического агента в соответствии с данным изобретением
и
b) Нанесение терапевтически эффективного количества средства для заживления ран или тканей или гемостатического агента на рану, поврежденную ткань или поврежденную кость.
Другая особенность заключается в том, что изобретение предусматривает способ лечения, включающий:
a) Получение композиции средства для заживления ран или средства для заживления тканей или гемостатического агента в соответствии с данным изобретением и
b) Нанесение терапевтически эффективного количества средства для заживления ран или тканей или гемостатического агента на рану, поврежденную ткань или поврежденную кость.
Другая особенность заключается в том, что изобретение предусматривает способ индуцирования регенерации периодонта в ране или в месте повреждения периодонта у млекопитающего, страдающего периодонтальным заболеванием или находящегося в ином состоянии, требующем регенерации периодонта, включающий:
а) Получение средства для заживления ран или тканей или гемостатического агента в соответствии с данным изобретением,
b) Нанесение терапевтически эффективного количество композиции средства для заживления ран или тканей или гемостатического агента на рану или ткань или место повреждения периодонта или периодонтальную полость,
c) Необязательную вставку периодонтального барьера и
d) Закрытие раны или ткани.
Предпочтительно барьер располагают между гингивальной тканью и раной или тканью, подвергающейся лечению в соответствии со стадиями а) и b). В одном из вариантов осуществления изобретения барьер выбран из мембраны, поддающегося биологическому разложению полимера и/или биосовместимого пористого материала. Мембрана может быть получена путем соединения PRP и глюконата кальция 10% в соотношении 30 к 70 или 50 к 50, соответственно. Центрифугирование выполняется в течение приблизительно 30 минут.
Другая особенность заключается в том, что изобретение предусматривает способ стимуляции регенерации кожи в рубце или морщине у человека или животного, включающий:
a) Получение композиции средства для заживления ран или тканей или гемостатического агента в соответствии с данным изобретением и
b) Заполнение кожного рубца или морщины указанной композицией средства для заживления ран или тканей или гемостатическим агентом.
Другая особенность заключается в том, что настоящее изобретение предусматривает способ приготовления клеточной композиции, включающий:
a) Центрифугирования цельной крови в пробирке в соответствии с данным изобретением,
b) Необязательно отделение обогащенной богатой тромбоцитами плазмы от цельной плазмы и
c) Ресуспендирование обогащенной плазмы,
d) Приготовление клеточного экстракта, такого как экстракт дермальных клеток, таких как кератиноцитов, фибробластов, меланоцитов и клеток Лангерганса, жировых клеток, клеток костного мозга, мышечных клеток, таких как миобласты и сателлитные клетки, остеобластов, хондроцитов, клеток надкостницы, клеток роговицы, клеток пуповины, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, шванновских клеток, клеток ахиллового сухожилия или клеток панкреатических островков, и
е) Смешивание тромбоцитарного концентрата, полученного на стадии с), с клеточным экстрактом, полученным на стадии d).
Предпочтительно стадия центрифугирования выполняется при ускорении от около 1500 g до около 2000 g. Предпочтительно стадия центрифугирования выполняется в течение достаточного периода времени для формирования барьера между плазмой, содержащей тромбоциты, лимфоциты и моноциты, и осадком, содержащим эритроциты.
Предпочтительно стадия отбора клеток b) выполняется путем сбора супернатанта с верхней части указанного барьера. В одном из вариантов осуществления изобретения обогащенная богатая тромбоцитами плазма отделяется от цельной плазмы путем удаления половины супернатанта, содержащего бедную тромбоцитами плазму. Предпочтительно обогащенная плазма обогащена лейкоцитами, тромбоцитами и адгезивными белками (например, фибронектином) по сравнению с нативной цельной кровью.
Другая особенность заключается в том, что настоящее изобретение предусматривает способ приготовления композиции для заживления ран или тканей, включающий:
a) Центрифугирование цельной крови в пробирке или пробирке для отбора клеток в соответствии с данным изобретением,
b) Необязательное отделение обогащенной богатой тромбоцитами плазмы от цельной плазмы,
c) Ресуспендирование обогащенной плазмы,
d) Смешивание тромбоцитарного концентрата, полученного на стадии с), с активатором коагуляции, сывороткой с тромбином, аутологичной сывороткой с тромбином или аутологичной сывороткой с тромбином в соответствии с данным изобретением,
e) Получение клеточного экстракта, такого как экстракт дермальных клеток, таких как кератиноцитов, фибробластов, меланоцитов и клеток Лангерганса, жировых клеток, клеток костного мозга, мышечных клеток, таких как миобласты и сателлитные клетки, остеобластов, хондроцитов, клеток надкостницы, клеток роговицы, клеток пуповины, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, шванновских клеток, клеток ахиллового сухожилия или клеток панкреатических островков;
f) Смешивание смеси тромбоцитарного концентрата, полученной на стадии d) с клеточным экстрактом, полученным на стадии е).
Предпочтительно стадия центрифугирования выполняется при ускорении от около 1500 g до около 2000 g. Предпочтительно стадия центрифугирования выполняется в течение достаточного периода времени для формирования барьера между плазмой, содержащей тромбоциты, лимфоциты и моноциты, и осадком, содержащим эритроциты.
Предпочтительно стадия отделения b) выполняется путем сбора супернатанта с верхней части указанного барьера. В одном из вариантов осуществления изобретения обогащенная богатая тромбоцитами плазма отделяется от цельной плазмы путем удаления половины супернатанта, содержащего бедную тромбоцитами плазму. Предпочтительно обогащенная плазма обогащена лейкоцитами, тромбоцитами и адгезивными белками (например, фибронектином) по сравнению с нативной цельной кровью.
Предпочтительно активатор коагуляции и аутологичная сыворотка с тромбином находятся в объемном соотношении (тромбоцитарный концентрат : активатор коагуляции) от около 10:1 до около 10:3.
Другая особенность заключается в том, что изобретение предусматривает выделенную клеточную композицию, приготовленную в соответствии с данным изобретением, включающую:
a) плазму,
b) тромбоциты при минимальном содержании 300×109 клеток/л,
c) белые кровяные клетки при минимальном содержании 7×109 клеток/л,
d) фибриноген при минимальной концентрации 3 мг/л,
e) клеточный экстракт, такой как экстракт дермальных клеток, таких как кератиноцитов, фибробластов, меланоцитов и клеток Лангерганса, жировых клеток, клеток костного мозга, мышечных клеток, таких как миобласты и сателлитные клетки, остеобластов, хондроцитов, клеток надкостницы, клеток роговицы, клеток пуповины, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, шванновских клеток, клеток ахиллового сухожилия или клеток панкреатических островков.
Предпочтительно клетки находятся при концентрации от около 105 до около 106 клеток/мл плазмы или обогащенной плазмы, а концентрация эритроцитов составляет менее чем 0.6×1012 клеток/л.
Другая особенность заключается в том, что изобретение предусматривает выделенную клеточную композицию, приготовленную в соответствии с данным изобретением, включающую:
a) плазму,
b) тромбоциты при минимальной концентрации 300×109 клеток/л,
c) белые кровяные клетки при минимальной концентрации 7×109 клеток/л,
d) фибриноген при минимальной концентрации 3 мг/л,
e) активатор коагуляции, сыворотку с тромбином, аутологичную сыворотку с тромбином или аутологичную сыворотку с тромбином в соответствии с данным изобретением,
f) клеточный экстракт, такой как экстракт дермальных клеток, таких как кератиноцитов, фибробластов, меланоцитов и клеток Лангерганса, жировых клеток, клеток костного мозга, мышечных клеток, таких как миобласты и сателлитные клетки, остеобластов, хондроцитов, клеток надкостницы, клеток роговицы, клеток пуповины, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, шванновских клеток, клеток ахиллового сухожилия или клеток панкреатических островков.
Предпочтительно активатор коагуляции и аутологичная сыворотка с тромбином находятся в объемном соотношении (тромбоцитарный концентрат : активатор коагуляции) от около 10:1 до около 10:3.
Предпочтительно клетки находятся при концентрации от около 105 до около 106 клеток/мл плазмы или обогащенной плазмы, а содержание эритроцитов составляет менее чем 0.6×1012 клеток/л.
Другая особенность заключается в том, что изобретение предусматривает композицию для заживления ран или тканей или гемостатический агент, включающий выделенную клеточную композицию в соответствии с данным изобретением.
Другая особенность заключается в том, что изобретение предусматривает способ стимуляции заживления ран или тканей и/или запечатывания и/или регенерации ткани и/или хряща и/или кости и/или нерва у человека или животного, включающий:
a) Получение композиции для заживления ран или тканей, гемостатического агента или клеточной композиции в соответствии с данным изобретением и
b) Нанесение терапевтически эффективного количества композиции для заживления ран или тканей, гемостатического агента или клеточной композиции на рану, поврежденную ткань или поврежденный хрящ или поврежденную кость.
Другая особенность заключается в том, что изобретение предусматривает способ увеличения объема жировой ткани у млекопитающего с имплантатом из подкожного жира или находящегося в другом состоянии, требующем регенерации жировой ткани, включающий:
a) Приготовление композиции жировых клеток в соответствии с данным изобретением,
b) Нанесение терапевтически или косметически эффективного количества композиции жировых клеток в комбинации с PRP или концентратом плазмы в соответствии с данным изобретением на имплантат из подкожного жира или жировую ткань, требующую регенерации, и
c) Необязательно вставку хирургического лоскута или имплантата, причем хирургический лоскут или имплантат располагают в месте, требующем регенерации или увеличения объема, а указанный хирургический лоскут или имплантат состоит из комбинации препарата из жировых клеток в соответствии с данным изобретением и PRP, концентратом плазмы или материалом из обогащенной плазмы.
Другая особенность заключается в том, что изобретение предусматривает способ индуцирования миокардиальной регенерации у млекопитающего, страдающего миокардиальной недостаточностью или находящегося в другом состоянии, требующем регенерации миокардиальной ткани, включающий:
a) Получение композиции мышечных клеток или клеток костного мозга в соответствии с данным изобретением и
b) Нанесение терапевтически эффективного количества композиции мышечных клеток в комбинации с PRP или концентратом плазмы в соответствии с данным изобретением на миокардиальную ткань, требующую регенерации.
Другая особенность заключается в том, что изобретение предусматривает способ индуцирования регенерации роговицы у млекопитающего, страдающего недостатком ткани роговицы или находящегося в другом состоянии, требующем регенерации роговицы, включающий:
a) Получение композиции клеток роговицы в соответствии с данным изобретением,
b) Нанесение терапевтически эффективного количества композиции клеток роговицы в комбинации с PRP или концентратом плазмы в соответствии с данным изобретением на ткань роговицы, требующую регенерации.
Другая особенность заключается в том, что изобретение предусматривает способ индуцирования регенерации суставов или хрящей у млекопитающего, страдающего недостатком ткани суставов или хрящей или находящегося в другом состоянии, требующем регенерации ткани суставов или хрящей, включающий:
a) Приготовление композиции хондроцитов или клеток костного мозга в соответствии с данным изобретением,
b) Нанесение терапевтически эффективного количества композиции хондроцитов или клеток костного мозга в комбинации с PRP или концентратом плазмы в соответствии с данным изобретением на ткань суставов или хрящей, требующую регенерации.
c) Необязательно вставку хирургического лоскута или имплантата, причем хирургический лоскут или имплантат располагают в месте повреждения хряща или под периостальным лоскутом, а хирургический лоскут или имплантат состоит из комбинации композиции хондроцитов или клеток костного мозга в соответствии с данным изобретением и PRP, концентратом плазмы или материалом из обогащенной плазмы.
Другая особенность заключается в том, что изобретение предусматривает способ индуцирования регенерации кожи в рубце, морщине или при недостатке жировой ткани у субъекта, от человека до низшего животного, включающий:
a) Получение композиции для заживления ран или тканей, гемостатического агента или клеточной композции в комбинации с PRP или концентратом плазмы в соответствии с данным изобретением и
b) Заполнение кожного рубца, морщины или участка с недостатком жировой ткани композицией для заживления ран или тканей, гемостатическим агентом или клеточной композицией в комбинации с PRP или концентратом плазмы в соответствии с данным изобретением.
Другая особенность заключается в том, что изобретение предусматривает способ индуцирования регенерации периферических нервов у млекопитающего с повреждением периферических нервов, подвергнутого сшиванию нервов, или с повреждением спинного мозга или находящимся в другом состоянии, требующем регенерации периферических нервов, включающий:
a) Получение композиции шванновских клеток в комбинации с PRP или концентратом плазмы в соответствии с данным изобретением и
b) Нанесение терапевтически эффективного количества композиции шванновских клеток в комбинации с PRP или концентратом плазмы на периферический нерв, требующий регенерации.
Другая особенность заключается в том, что изобретение предусматривает способ индуцирования регенерации костей у млекопитающего с повреждением костей, недостатком костной ткани или находящегося в другом состоянии, требующем регенерации костей, включающий:
a) Получение композиции клеток костного мозга или остеобластов в комбинации с PRP или концентратом плазмы в соответствии с данным изобретением и
b) Нанесение терапевтически эффективного количества композиции клеток костного мозга или остеобластов в комбинации с PRP или концентратом плазмы на кость, требующую регенерации.
Другая особенность заключается в том, что изобретение предусматривает способ лечения диабета I типа, инсулинозависимого диабета или гипергликемии у млекопитающего, включающий:
a) Получение композиции клеток панкреатических островков в комбинации с PRP или концентратом плазмы в соответствии с данным изобретением и
b) Введение терапевтически эффективного количества композиции клеток панкреатических островков в комбинации с PRP или концентратом плазмы пациенту, например с помощью инъекции.
Другая особенность заключается в том, что изобретение предусматривает способ лечения недержания мочи у млекопитающего или при другом состоянии, требующем регенерации мочевого пузыря, включающий:
a) Получение композиции миобластных клеток в комбинации с PRP или концентратом плазмы в соответствии с данным изобретением и
b) Нанесение терапевтически эффективного количества композиции миобластных клеток в комбинации с PRP или концентратом плазмы в соответствии с данным изобретением на шейку мочевого пузыря, требующей регенерации.
Другая особенность заключается в том, что изобретение предусматривает способ лечения недержания кала у млекопитающего или другого состояния, требующего регенерации анальной мышцы, включающий:
a) Получение композиции миобластных клеток в комбинации с PRP или концентратом плазмы в соответствии с данным изобретением и
b) Нанесение терапевтически эффективного количества композиции миобластных клеток в комбинации с PRP или концентратом плазмы в соответствии с данным изобретением на параанальную зону, требующую регенерации.
Другая особенность заключается в том, что изобретение предусматривает способ лечения желудочно-пищеводного рефлюкса или гастроэзофагеальных рефлюксных заболеваний у млекопитающих или другого состояния, требующего регенерации пищеводного сфинктера, включающий:
a) Получение композиции миобластных клеток в комбинации с PRP или концентратом плазмы в соответствии с данным изобретением и
b) Нанесение терапевтически эффективного количества композиции миобластных клеток в комбинации с PRP или концентратом плазмы в соответствии с данным изобретением на пищеводный сфинктер, требующую регенерации.
Другая особенность заключается в том, что настоящее изобретение предусматривает применение композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата в соответствии с данным изобретением для производства лекарства для заживления ран или тканей, мезотерапии, мышц, или для стимулирования роста костей или периодонта и/или костей и/или регенерации тканей, таких как кожа, хрящ, мышца, сухожилие, жировая ткань, роговица, периферические нервы, регенерации спинного мозга или костей.
Другая особенность заключается в том, что настоящее изобретение предусматривает применение композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата в соответствии с данным изобретением для производства косметического препарата для использования в качестве антивозрастного агента или агента для восстановления кожи, такого как агент для устранения рубцов, агент для устранения липоатрофии или агент для заполнения и/или устранения морщин.
Другая особенность заключается в том, что настоящее изобретение предусматривает фармацевтическую композицию, включающую композицию для заживления ран или тканей, гемостатический агент, клеточную композицию или клеточный препарат в соответствии с данным изобретением и фармацевтически приемлемый носитель.
Другая особенность заключается в том, что настоящее изобретение предусматривает косметическую композицию, включающую композицию для заживления ран или тканей, гемостатический агент, клеточную композицию или клеточный препарат в соответствии с данным изобретением и косметически приемлемый носитель.
Другая особенность заключается в том, что настоящее изобретение предусматривает подходящее для имплантации устройство для использования в терапии, связанной с регенерацией тканей, включающее:
a) проницаемое ядро, включающее композицию для заживления ран или тканей, гемостатический агент, клеточную композицию или клеточный препарат в соответствии с данным изобретением необязательно в комбинации с гиалуроновой кислотой, и
b) внешнюю оболочку, окружающую указанное ядро, причем указанная оболочка состоит из биосовместимого материала, предпочтительно саморассасывающегося, предпочтительно гиалуроновой кислоты.
В одном из вариантов осуществления изобретения композиции, композиции для заживления ран или тканей, клеточные экстракты, клеточные композиции, концентрат плазмы и препараты с тромбином в соответствии с данным изобретением используют аллогенные компоненты, композиции, кровь или клетки.
Варианты применения, способы и композиции в соответствии с данным изобретением являются полезными для регенерации и/или и/или омоложения тканей, костей и/или хрящей. Варианты применения, способы и композиции в соответствии с данным изобретением особенно полезны при лечении диабетических невропатических язв или пролежней; повреждений костей или хрящей, таких как обширные повреждения суставных хрящей или обширные повреждения хрящей, такие как хирургическое восстановление разорванных сухожилий, суставный артрит, вызванный травмами или старением; заболеваний ротаторной манжеты; не поддающихся лечению ран, таких как не поддающиеся лечению раны, вызванные васкулитом, расположенные, например, на голенях лошадей; периодонтальных заболеваний; последствий имплантационной хирургии; последствий сердечно-сосудистой, грудной, трансплантационной хирургии; последствий хирургии в области головы и горла; последствий оральной, желудочно-кишечной, ортопедической, неврологической и пластической хирургии; мезотерапии и/или мезотерапевтических инъекций; повреждений сердечной мышцы, таких как хроническая сердечная недостаточность, сердечная недостаточность, ишемические и неишемические заболевания, кардиомиопатия; гастроэзофагеального рефлюкса; недержания кала или мочи; последствий лицевой хирургии, такой как лицевая хирургия, являющаяся резальтатом лечения алопеции (алопеции, вызванной потерей волосяных фолликулов в привисочных областях), потеря волос, алопеция, хирургия, связанная с подтяжкой лица (ритидэктомия), ринопластика, установка кожных имплантатов из подкожного жира (при коррекции контуров лица; лечении врожденной гемиатрофии лица, такой как врожденная атрофия носового хряща и липоатрофия у таких пациентов, как страдающие ВИЧ/СПИДом, дисфункцией гениталий, эрозией и при проведении артроскопии); осложнений, связанных с заживлением ран, таких как последствия блефаропластики; заболеваний роговицы, таких как помутнение роговицы, такое как вызванное химическими ожогами, синдромом Стивенса-Джонсона и язвами роговицы; эрозии роговицы; ксерофтальмии; гематологическими заболеваниями, такими как талассемия; повреждений периферических нервов, подвергнутых сшиванию нервов и повреждений спинного мозга; дефектов и заболеваний костей, таких как пересадка костной ткани или переломы костей, повреждений кожи или кожных расстройств, таких как акне (в частности являющегося результатом дермабразии), ожогов, краснухи или рубцов, связанных с кожной сыпью, витилиго, липоатрофии, саркомы Капоши, кожных келоидов или болезни Дюпюитрена (ладонного фиброматоза).
Варианты применения, способы композиции в соответствии с данным изобретением полезны при заживлении тканей, включая регенерацию и восстановление костей, митогенез, ангиогенез и/или активацию макрофагов.
Дополнительные преимущества и новые свойства этого изобретения будут частично изложены в последующей части описания и частично станут ясны специалистам при проведении анализа данного описания, или могут быть изучены путем осуществления данного изобретения. Объекты и преимущества данного изобретения могут стать наглядными и достигнутыми в результате воспроизведения средств, комбинаций, композиций и способов, в частности тех, которые указаны в пунктах формулы изобретения.
Композиции, варианты применения и способы в соответствии с данным изобретением, в частности, полезны при гемостазе, проведении регенерации, биологической активации, гидратации и/или стимуляции тканей в виде биологического клея, биоадгезивного запечатывающего материала или биологического заполнителя.
Преимущественно сильный биологический клей в соответствии с настоящим изобретением обладает большей механической силой, чем другие известные клеи, в частности, используемые в рамках инвазивных хирургических вмешательств. Такие биологические клеи в соответствии с данным изобретением обладают большей вместимостью, включая подходящие клетки, тромбоциты, лейкоциты, факторы роста и другие факторы, снижающие/препятствующие возникновению возможных инфекций, для лечение поврежденных тканей.
Композиции, варианты применения и способы в соответствии с данным изобретением, в частности, полезны при уходе за ранами, хирургии, осуществлении инъекций для ортопедических и эстетических, косметических коррекций и коррекций объема.
Другая особенность заключается в том, что варианты применения, способы и композиции в соответствии с данным изобретением полезны при регенерации и/или омоложении кожных тканей, в частности при стимулировании и/или инициации регенерации кожи, такой как уменьшение морщин, глубоких морщин, акне (в частности являющегося результатом дермабразии), ожогов, краснухи или рубцов, связанных с кожной сыпью, витилиго, липоатрофии (например антивозрастные композиции или композиции для регенерации кожи), уменьшения носогубных морщин и лечения повреждений кожи или повреждений, таких как ожоги кожи, саркома Капоши, кожные келоиды или болезнь Дюпюитрена (ладонный фиброматоз), при снижении боли, связанной с регенерацией кожи или тканей, для геморроидальных узлов, эректильной дисфункции, кариеса, полостного фиброза, болезни Пейрони, вагины и/или половых губ.
Композиции, варианты применения и способы в соответствии с данным изобретением, в частности, полезны при заживлении ран или тканей, лечении, связанном с регенерацией или спортивной медициной для лечения колена, локтя, (разорванных) мышц, позвоночника, позвоночного диска, сухожилия, связки, лечении травматических или хирургических ран, таких как раны, являющиеся результатом установки и/или закрепления и/или запечатывания нативных или протетических имплантатов (в частности, кожных, костных имплантатов и/или ортопедических зубных протезов или имплантатов или им подобных, включая также места забора имплантата); лечении артрита, гонита, тендинитов, ротаторной манжеты, лечении васкулита, язв, таких как диабетические невропатические язвы или пролежни; лучевого дерматита (например после облучения при эпидермоидной карциноме) и закрытии фистул (для, например, велосипедистов).
Кроме того, композиции, варианты применения и способы, согласно настоящему изобретению, в частности, полезны при лечении сердечных заболеваний, сердечной регенерации, такой как лечение сердечной недостаточности, хронической сердечной недостаточности, ишемической и неишемической сердечной недостаточности и кардиомиопатии.
Кроме того, композиции, варианты применения и способы, согласно настоящему изобретению, в частности, полезны при лечении недержания мочи и/или кала. Кроме того, композиции, варианты применения и способы, согласно настоящему изобретению, в частности, полезны при лечении желудочно-пищеводного рефлюкса и/или гастроэзофагеальной рефлюксной болезни.
Кроме того, композиции, варианты применения и способы, согласно настоящему изобретению, в частности, полезны при лечении повреждений кожи, таких как повреждения кожи, вызванные радиацией (лучевой дерматит или повреждения кожи, вызванные воздействием солнца), старение кожи или ожоги кожи и/или при обработке лицевых морщин, морщин, акне (в частности являющегося результатом дермабразии), ожогов, краснухи или рубцов, связанных с кожной сыпью, вигилию, липоатрофии или липодистрофии, саркомы Капоши, кожные келоиды или болезни Дюпюитрена (ладонный фиброматоз) и/или при лечении, связанном с омоложением кожи.
Кроме того, композиции, варианты применения и способы, согласно настоящему изобретению, в частности, полезны при лечении липоатрофии, такой как у пациентов, страдающих ВИЧ/СПИДом и при врожденной гемиатрофии лица, такой как врожденная атрофия носового хряща. Кроме того, композиции, варианты применения и способы, согласно настоящему изобретению, в частности, полезны при лечении костей, заболеваний хрящей и суставов, таких как повреждение хряща, артрит, повреждение хряща и/или кости, такое как обширное повреждение хряща и/или эрозия и/или являющееся результатом проведения артроскопии, разрыв сухожилия и ротаторной манжеты плеча.
Кроме того, композиции, варианты применения и способы, согласно настоящему изобретению, в частности, полезны при лечении гематологических заболеваний, таких как талассемия.
Кроме того, композиции, варианты применения и способы, согласно настоящему изобретению, в частности, полезны при лечении заболеваний роговицы, таких как ксерофтальмия; помутнение роговицы, такое как вызванное химическими ожогами, синдромом Стивенса-Джонсона; эрозия роговицы и язвы роговицы.
Кроме того, композиции, варианты применения и способы, согласно настоящему изобретению, в частности, полезны при лечении повреждений периферических нервов; нервов, подвергнутых сшиванию и повреждений спинного мозга.
Кроме того, композиции, варианты применения и способы, согласно настоящему изобретению, в частности, полезны при лечении диабета I типа, инсулинозависимого диабета и/или гипергликемии.
Кроме того, композиции, варианты применения и способы, согласно настоящему изобретению, в частности, полезны при лечении дефектов и заболеваний костей, таких как пересадка костной ткани или переломы кости.
Варианты применения результирующей композиции данного изобретения могут быть далее модифицированы перед нанесением и в соответствии с терапевтической задачей. Композиции данного изобретения могут использоваться совместно с материалами для заполнения костей, особенно с саморассасывающимися заполняющими материалами, такими как гидроксиапатит (фосфатно-кальциевая керамика, используемая в качестве биоматериала) или деминерализованная костная ткань, или могут использоваться в виде смеси с костными вытяжками в процессе наращивания кости, например при черепно-лицевых и ортопедических процедурах.
В зависимости от варианта использования или заболевания, композиции данного изобретения могут использоваться совместно с гиалуроновой кислотой 10%, гиалуроновой кислотой 20%, гиалуроновой кислотой 30%, гиалуроновой кислотой 40% и/или гиалуроновой кислотой 50%.
Композиции изобретения могут быть использованы в качестве материала для запечатывания ран в пластической хирургии, включая пересадку ткани, подвергнутую ожогам, и другие виды применения свободных кожных имплантатов, включая ускорение (ново)образования кровеносных сосудов. Композиции в соответствии с данным изобретением, в частности, полезны при лечении, связанным с заживлением ран на участках забора донорских кожных имплантатов. Удаление кожного имплантата со здоровой кожи создает новую рану на участке забора, которая обычно заживает самопроизвольно в течение периода от 12 до 14 дней. Тем не менее, данная цикатризация оказывает чрезвычайную нагрузку на тело, особенно в том случае, если место забора обладает большой площадью или пациент ослаблен (например, жертвы ожогов; люди, страдающие от множественных травм; люди, проходящее лечение кортикоидами; дети или пожилые люди) и энергетические потери еще более увеличиваются за счет потери минералов, следовых элементов и белков, вызванной потерями жидкости из новой раны. В дополнение, в течение первых 8 дней часто присутствуют значительные болевые ощущения на участке забора имплантата. Часто применяется лечение, связанное со снижением болевых ощущений, такое как использование анальгетиков (например, морфина) и/или гидрополимерных раневых повязок, тем не менее болевые ощущения остаются, особенно в течение процесса смены повязки, который осуществляется на обязательной основе каждые 48 часов и длится до 1 недели после удаления имплантата. В дополнение, гидрополимерные раневые повязки обладают недостатками, заключающимися не только в относительно высокой стоимости, но также в необходимости поддержания увлажненности поверхности раны для предотвращения ее пересыхания, увеличении глубины раны, благоприятствовании распространению бактериальных инфекций и появлении неэстетичных рубцов. Таким образом, стимулирование заживления донорского участка кожного имплантата является очень желательным.
Композиции данного изобретения, в частности, адаптированы для хронических ран, которые могут обладать недостатком необходимого уровня циркуляции крови для поддержания каскада заживления раны.
Композиции и способы в соответствии с данным изобретением могут быть также использованы при лечении периодонтального заболевания, при котором наблюдается потеря и/или повреждение периодонтальных тканей, таком как лечение, состоящее, например, в помещении композиции в соответствии с данным изобретением на периодонтальный участок или в полость у человека или низшего животного в целях регенерации периодонтальной ткани.
Композиции в соответствии с данным изобретением обладают эффективностью, заключающейся в устранении или заметном снижении постоперационного кровотечения и кровоизлияния или потери сыворотки или другой жидкости при данных вариантах применения; в снижении риска инфицирования, вызванного большинством бактерий и/или образовании соединительной ткани по сравнению с естественным заживлением (т.е. без добавления экзогенного агента) или для заживления путем использования других тромбоцитарных концентратов, приготовленных с помощью известных способов. Композиции в соответствии с данным изобретением, в частности, полезны для приготовления лекарственного препарата для стимулирования или инициации заживления ран и/или регенерации тканей или для приготовления косметических композиций для регенерации кожи, такой как уменьшение морщин, акне (в частности являющегося результатом дермабразии), последствий краснухи или рубцов, связанных с кожной сыпью, витилиго и липоатрофии (например антивозрастные композиции или композиции для регенерации кожи).
Композиции в соответствии с настоящим изобретением могут быть назначены для местного применения или могут быть инъецированы в рану или в/рядом с имплантированным органом или могут быть инъецированы подкожно. Местное применение может быть осуществлено с помощью инъецирования в поврежденный участок или участок, обладающий дефектом, или с помощью вставки или прикладывания твердого носителя к участку, или с помощью смешивания с кремом или эмульсией, или с помощью включения в ткань или бумагу или носитель на основе гидрогеля, или с помощью прямого местного нанесения композиции в соответствии с данным изобретением в такой форме, как капли для глаз. Предпочтительно композиции являются композициями, подходящими для немедленного инъецирования. Режим назначения, назначаемая дозировка, использование единственной или множественных доз для субъекта зависит от множества факторов, включая фармакокинетические свойства, состояния пациента и его характеристики (пол, возраст, масса тела, уровень здоровья, размер), выраженность симптомов, сопутствующее лечение, частоту лечения и желаемый эффект.
Композиции в соответствии с настоящим изобретением могут быть назначены в комбинации с коагентом, полезным при лечении, связанном с регенерацией тканей, таким как заживляющий агент, заполнитель морщин, антивозрастной агент, такой как антивозрастной витаминный комплекс, антибактериальный агент, антибиотический агент, кортикостероидный агент, болеутоляющий и анальгетический агент, или анестезирующий агент, такой как адреналин, и так далее. Изобретение включает композиции, соединенные с коагентом. полезным при лечении, связанным с регенерацией тканей, для одновременного, раздельного или последовательного использования в терапии, связанной с регенерацией тканей, такой как заживление ран, восстановление роста костей и периодонта.
Композиции в соответствии с данным изобретением, устройство и процедуры для приготовления аутологичного тромбоцитарных концентратов или клеточных композиций в соответствии с данным изобретением, в частности, полезны при терапевтическом использовании, в частности, в качестве аутогенного биологического клея в гемостатической системе, предназначенного для ускорения физиологического процесса или регенерации тканей, например в области стоматологической имплантологии, кожной и костной хирургии, хирургии хрящей и сухожилий, регенерации роговицы и периферических нервов, и хирургии сердца. Композиции в соответствии с данным изобретением, устройства и процедуры для приготовления тромбоцитарных концентратов и клеточных композиций в соответствии с данным изобретением, в частности, полезны при косметическом использовании, в частности, в качестве аутогенного омолаживающего материала, предназначенного для использования, например, в качестве заполнителя морщин, рубцов или жировой ткани, самостоятельно или в комбинации с, по меньшей мере, одним антивозрастным агентом. Тромбоцитарный концентрат в соответствии с изобретением может быть соединен с аутологичным препаратом на основе клеточного экстракта, такого как экстракт кератиноцитов, костного мозга, остеобластов, хондроцитов, фибробластов, надкостницы, меланоцитов и клеток Лангерганса, жировых клеток, клеток костного мозга, мышечных клеток, таких как миобласты и сателлитные клетки, клеток надкостницы, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, клеток роговицы, клеток пуповины, клеток сухожилий или клеток панкреатических островков. Кератиноциты могут быть собраны с помощью способа, описанного у Reinwald and Green, 1975, Cell, 6(3): 331-43. Другие упомянутые клетки могут быть собраны с помощью способов, описанных в "Culture de cellules animales;  ", 2003, Ed. Barlovatz-Meimom and Adolphe, INSERM editions, Paris. Также клеточные экстракты получают из банка клеток или культуры клеток, или собирают, как описано в Примерах, приведенных выше.
", 2003, Ed. Barlovatz-Meimom and Adolphe, INSERM editions, Paris. Также клеточные экстракты получают из банка клеток или культуры клеток, или собирают, как описано в Примерах, приведенных выше.
Была доказана реальная польза использования тромбоцитарного концентрата и клеточных композиций в соответствии с данным изобретением в процессе ускорения и/или стимулирования процесса заживления ран, даже хронических не поддающихся лечению ран, с их последующим закрытием, а также снижения риска возникновения инфекций, улучшений в процессе восстановления и степени комфорта пациента, снижения затрат на лечение и достижения лучшего эстетического результата, при этом традиционные способы лечения, применявшиеся в течение недель, окончились неудачей.
Композиции в соответствии с данным изобретением, разумеется, могут быть также приготовлены из плазмы, полученной от нескольких известных доноров. Данное изобретение не ограничивается аутологичными биологическими материалами, такими как набор концентрированных тромбоцитов, полученных из биологического материала раненого субъекта. Данное изобретение включает использование биологических материалов, полученных от одного или более третьих субъектов, которые могут не являться представителями того же вида, что и пациент, чья рана подвергается лечению с помощью композиции для заживления ран, описанной здесь, если результатом использования таких биологических материалов третьих субъектов не является биологическая несовместимость. В одном из вариантов осуществления изобретение предусматривает способ приготовления композиции тромбоцитарного концентрата или клеточной композиции в соответствии с описанием.
В другом варианте осуществления настоящее изобретение предусматривает устройство для приготовления композиции тромбоцитарного концентрата из цельной крови, как описано здесь.
В другом варианте осуществления данное изобретение предусматривает способ приготовления сыворотки с тромбином и/или композиции тромбоцитарного концентрата, причем стадию центрифугирования выполняют при ускорении от около 1500 g до около 1700 g в течение периода времени, выбранного от около 3 минут до около 15 минут, предпочтительно при 1500 g в течение около 8 минут.
В другом варианте осуществления данное изобретение предусматривает способ приготовления композиции тромбоцитарного концентрата, причем пробирка обладает входным отверстием для ввода указанной цельной крови и содержит вакуум, предназначенный для аспирации образца цельной крови, является стерильной, содержит вакуум в объеме от 8 до 10 мл и является подходящей для центрифугирования.
В другом варианте осуществления данное изобретение предусматривает способ приготовления композиции тромбоцитарного концентрата, причем пробирка является пробиркой, изготовленной из полиэтилентерефталата, содержит высокотиксотропный гель, сформированный полимерной смесью, и безводный цитрат натрия при концентрации 3.5 мг/мл.
В другом варианте осуществления настоящее изобретение предусматривает выделенную композицию тромбоцитарного концентрата, полученную в рамках способа в соответствии с данным изобретением.
В другом варианте осуществления данное изобретение предусматривает выделенную композицию тромбоцитарного концентрата, полученную в рамках способа в соответствии с данным изобретением, включающую:
a) плазму,
b) тромбоциты при минимальном содержании 300×109 клеток/л, предпочтительно при минимальном содержании 350×109 клеток/л, более предпочтительно при минимальном содержании 400×109 клеток/л,
c) белые кровяные клетки при минимальном содержании 7×109 клеток/л, предпочтительно при минимальном содержании 8×109 клеток/л и
d) фибриноген при минимальной концентрации 3 мг/л.
Предпочтительно содержание эритроцитов составляет менее 0.4X1012 клеток/л или 0.5×1012 клеток/л.
В другом варианте осуществления настоящее изобретение предусматривает композицию для заживления ран или тканей, включающую:
а) плазму,
b) тромбоциты при минимальном содержании 300×109 клеток/л, предпочтительно при минимальном содержании 350×109 клеток/л, более предпочтительно при минимальном содержании 400×109 клеток/л,
c) белые кровяные клетки при минимальном содержании 7×109 клеток/л, предпочтительно при минимальном содержании 8×109 клеток/л и
d) фибриноген при минимальном содержании 3 мг/л,
e) сыворотку с тромбином в соответствии с данным изобретением и
f) необязательно аутологичный клеточный экстракт, такой как экстракт кератиноцитов, клеток костного мозга, фибробластов, надкостницы, меланоцитов и клеток Лангерганса, жировых клеток, клеток костного мозга, мышечных клеток, таких как миобласты и сателлитные клетки, остеобластов, хондроцитов, мезенхимных стволовых клеток (MSC), преадипоцитов, эндотелиальных клеток-предшественников, клеток надкостницы, клеток роговицы, клеток пуповины, клеток сухожилий или клеток панкреатических островков.
Предпочтительно активатор коагуляции или сыворотка с тромбином находится в объемном соотношении (тромбоцитарный концентрат : активатор коагуляции) от около 10:1 до около 10:3.
Предпочтительно содержание клеток составляет от около 105 до около 106 клеток/мл плазмы или обогащенной плазмы, а содержание эритроцитов составляет менее 0.4×1012 клеток/л или 0.5×1012 клеток/л.
В другом варианте осуществления данное изобретение предусматривает способ приготовления композиции для заживления ран или тканей, как описано здесь.
В другом варианте осуществления данное изобретение предусматривает способ приготовления композиции для заживления ран или тканей, причем добавленный активатор коагуляции является глюконатом кальция или 10% хлоридом кальция.
В другом варианте осуществления данное изобретение предусматривает способ приготовления композиции для заживления ран или тканей, причем активатор коагуляции, который смешивается с тромбоцитарным концентратом (PRP), является препаратом, обогащенным тромбином, который может быть далее смешан с глюконатом кальция или хлоридом кальция. Способ приготовления тромбина для использования в качестве биологического клея описан в US 6,472,162 и выполняется с помощью добавления от 8 до 20% этилового спирта в объем плазмы; затем данный препарат может быть использовать в качестве препарата, обогащенного тромбином, в контексте данного изобретения. Также аутологичная сыворотка с тромбином (АТС) может быть использована в качестве препарата, обогащенного тромбином, в контексте данного изобретения. Альтернативную аутологичную сыворотку с тромбином в соответствии с данным изобретением получают в рамках способа, включающего (i) добавление к образцу цельной крови пациента (например, 8 мл), забранного в пробирку для отбора клеток в соответствии с данным изобретением 10% конечного объема хлорида кальция 10% (например. 1 мл) и 10% конечного объема препарата, являющегося 95% раствором этанола (например, 1 мл) и (ii) осаждение в течение около 30 минут при комнатной температуре. Спустя 30 минут выполняется центрифугирование при ускорении около 1500 g в течение от около 8 до около 10 минут. В другом предпочтительном варианте осуществления препарат, обогащенный тромбином, и предпочтительно аутологичная сыворотка с тромбином в соответствии с данным изобретением смешиваются с тромбоцитарным концентратом (PPR) напрямую в ране. В другом варианте осуществления данное изобретение предусматривает способ приготовления композиции для заживления ран или тканей в соответствии с данным изобретением, далее включающий стадию b'), в рамках которой активированная композиция богатого тромбоцитами препарата (полученная путем смешивания тромбоцитарного концентрата с активатором коагуляции или аутологичной сывороткой с тромбином) полученная на стадии b) может быть частично обезвожена путем контакта раневой повязки, покрытой мягким гидрофобным слоем в целях предотвращения контаминации микроволокнами от повязки для получения полутвердого геля, подходящего для введения с помощью соответствующих инструментов, например для заполнения полости или недостатка ткани, или в качестве матрикса роста («каркаса») во время ожидания наращивания аутогенного экстраклеточного матрикса. Полученное средство для заживления ран или тканей, в частности, полезно в рамках способа индуцирования периодонтальной регенерации в ране, ткани или периодонтальном дефекте или полости.
В другом варианте осуществления тромбоцитарный концентрат, композиция для заживления ран или тканей, клеточные композиции в соответствии с данным изобретением могут быть соединены с гидрогелем, таким как Albugel (ЕР1543846). Препарат из 100% Альбумина или другого гидрогеля, полученного в результате ретикуляции Альбумина и другого химического соединения, такого как полиэтиленгликоль или любой другой ингредиент, с использованием высокогидрофильного носителя на основе бумаги для поддержания контакта с кожей пока не абсорбируется богатая тромбоцитами плазма.
Степень эластичности композиции для заживления ран или тканей в соответствии с данным изобретением может быть изменена путем добавления ионов кальция. Таким образом, если требуется более сильная композиция для заживления ран или тканей, ионы кальция могут быть добавлены в момент смешивания сыворотки с тромбоцитарным концентратом. Также ионы кальция могут быть введены непосредственно в тромбоцитарный концентрат и композиции для заживления ран или тканей, соответственно.
В соответствии с более детальным описанием, приведенным ниже, период времени, необходимый для формирования композиций для заживления ран или тканей в соответствии с данным изобретением зависит от количества добавляемой сыворотки. Величины отношения сыворотки к тромбоцитарному концентрату 1:4, 1:2 и 3:4 приводят к образованию композиций для заживления ран или тканей в течение, приблизительно, 90, 55 и 30 секунд, соответственно. Кроме того, тромбин предпочтительно используется в течение пяти часов от момента приготовления, предпочтительно в течение двух часов и идеально немедленно. Поскольку тромбин продолжает оставаться активным при комнатной температуре после 10 суток, тромбин может быть использован на поздней стадии. Также сыворотка может быть охлаждена или полностью заморожена, предпочтительно использована при хранении в течение не более чем 1 месяц.
Композиции для заживления ран или тканей в соответствии с этим изобретением могут быть использованы для запечатывания хирургических ран путем нанесения подходящего количества тромбоцитарного концентрата на рану непосредственно при начале его превращения в гель. Более того, в связи с тем, что композиции средства для заживления ран или тканей в соответствии с данным изобретением могут быть приготовлены исключительно из компонентов крови, полученной от пациента, по отношению к которому будут применяться композиции для заживления ран или тканей, вероятность передачи пациенту нового заболевания, передающегося через кровь, является нулевой.
Способы настоящего изобретения могут быть далее модифицированы для обеспечения функционирования композиции для заживления ран или тканей не только в качестве гемостатического агента, но также в качестве вспомогательного средства для заживления ран и в качестве матрикса для доставки лекарственных препаратов и белков, обладающих другими биологическими свойствами. Например, хорошо известно, что фибриновый клей обладает значительной аффинностью, позволяющей связывать фрагменты кости, что является полезным при восстановлении костей в такой области, как пластическая хирургия, или для восстановления обширных переломов костей. Таким образом, в целях сохранения аутологичной природы композиции средства для заживления ран или тканей в соответствии с данным изобретением, аутологичная кость, полученная от пациента, может быть растолчена в порошок или измельчена в пудру или их подобие, затем добавлена в тромбоцитарный концентрат в соответствии с данным изобретением. Сыворотка, содержащая тромбин, затем смешивается с тромбоцитарным концентратом и фрагментами кости в количестве, достаточном для нанесения результирующего геля на желаемый участок, на котором он застывает.
В случаях, при которых желаемая композиция для заживления ран или тканей в соответствии с данным изобретением предназначена для дальнейшего функционирования в качестве средства для доставки лекарственных препаратов или белков, обладающих другими биологическими свойствами, способы настоящего изобретения могут быть подвергнуты изменениям, описанным ниже. Перед добавлением сыворотки, содержащей тромбин, в тромбоцитарный концентрат, широкий набор лекарственных препаратов или белков, обладающих другими биологическими свойствами, могут быть добавлены в тромбоцитарный концентрат. Примеры агентов, которые могут быть добавлены в тромбоцитарный концентрат перед добавлением сыворотки, включают, но не только анальгезирующие соединения, антибактериальные соединения, включая бактерицидные и бактериостатические соединения, антибиотики (например адриамицин, эритромицин, гентимицин, пенициллин, тобрамицин), противогрибковые соединения, противовоспалительный, антипаразитарные соединения, антивирусные соединения, энзимы, ингибиторы энзимов, гликопротеины, факторы роста, рекомбинированные (например лимфокины, цитокины), гормоны, стероиды, глюкокортикостероиды, иммуномодуляторы, иммуноглобулины, минералы, нейролептики, белки, пептиды, липопротеины; соединения, уничтожающие опухолевые клетки; соединения, препятствующие росту опухолевых клеток; токсины и витамины (например, витамин А, витамин Е, витамин В, витамин С, витамин В или их производные). Также представляется, что могут быть использованы выбранные фрагменты, порции, производные или аналоги некоторых или всех указанных выше соединений.
Существуют некоторые различные медицинские приборы и способы тестирования для измерения и определения коагуляции и свойств крови, связанных с коагуляцией. Данные приборы и способы могут быть использованы для облегчения определения оптимальной технологии приготовления активатора, поскольку тромбин, тромбоцитарный концентрат и плазма являются необходимыми для формирования композиция для заживления ран или тканей в соответствии с данным изобретением. Некоторые из наиболее известных способов оценки степени свертывания крови и коагуляции являются способами с использованием поршня, проиллюстрированными US 4,599,219 Cooper et al., 4, 752,449 Jackson et al., и 5,174,961 Smith, каждый из которых приведен здесь в качестве ссылки.
В концентрат плазмы, PRP, композиции в соответствии с настоящим изобретением могут быть добавлены трикальцийфосфат (TCP), гиалуроновая кислота (НА), хитозан, крем, кремовая маска, клеточные экстракты, жировые клетки, любрицин, cd-желатин и/или ботулотоксин.
В одном из вариантов осуществления в концентрат плазмы или композицию PRP в соответствии с настоящим изобретением может быть добавлен трикальцийфосфат (TCP), гиалуроновая кислота (НА), хитозан, крем, кремовая маска, клеточные экстракты, жировые клетки, любрицин, cd-желатин и/или ботулотоксин.
В одном из вариантов осуществления в концентрат плазмы или композицию PRP, предпочтительно в соответствии с настоящим изобретением, может быть добавлен трикальцийфосфат (TCP), гиалуроновая кислота (НА), хитозан, крем, кремовая маска, клеточные экстракты, жировые клетки, любрицин, cd-желатин и/или ботулотоксин.
В одном из вариантов осуществления в концентрат плазмы или композицию PRP, предпочтительно в соответствии с настоящим изобретением, может быть добавлен тромбин, предпочтительно сыворотка с тромбином в соответствии с настоящим изобретением, и далее добавлен трикальцийфосфат (TCP), гиалуроновая кислота (НА), хитозан, крем, кремовая маска, клеточные экстракты, жировые клетки, любрицин, cd-желатин и/или ботулотоксин.
В одном из вариантов осуществления в концентрат плазмы или композицию PRP, предпочтительно в соответствии с настоящим изобретением, может быть добавлен тромбин, предпочтительно сыворотка с тромбином в соответствии с настоящим изобретением, а далее добавлен клеточный экстракт и трикальцийфосфат (TCP), гиалуроновая кислота (НА), хитозан, крем, кремовая маска, клеточные экстракты, жировые клетки, любрицин, cd-желатин и/или ботулотоксин.
Автоматизированный прибор, осуществляющий поршневой способ измерения и определения коагуляции и свойств, связанных с коагуляции, как правило, включает сенсорный картридж поршня или картриджи, и микропроцессор, управляющий прибором, в который вставлен картридж. Прибор выполняет работу рядом с картриджем, а проба крови, расположенная в нем, служит для индуцирования и определения события, связанного с коагуляцией. Картридж включает множество тестовых клеток, каждая из которых представляет собой элемент конструкции, подобный пробирке, обладающий верхней реакционной камерой, в которой располагается поршень, и в которой выполняется аналитический тест, и реагентной камерой, которая содержит реагент или реагенты. Для выполнения теста на активное время свертывания (ACT), к примеру, реагенты включают реагент для активирования свертывания крови. Закрывающий элемент конструкции запечатывает нижнюю часть реагентной камеры. При выполнении теста содержимое реагентной камеры поступает в реакционную камеру для смешивания с образцом жидкости, обычно кровью человека или ее компонентами. Привод, являющийся частью прибора, поднимает поршень и опускает его, обеспечивая, таким образом, возвратно-поступательные движения поршня, движущегося в объеме жидкости в реакционной камере. Поршень опускается под действием гравитации, испытывая сопротивление жидкости, находящейся в реакционной камере, такое как ее вязкость. Когда свойство образца меняется заранее установленным образом в результате действия или наступления события, связанного с коагуляцией, степень спуска поршня, таким образом, меняется. При значительном изменении степени спуска, событие, связанное с коагуляцией, фиксируется и индицируется прибором.
Композиции для заживления ран или тканей, гемостатические агенты, клеточные композиции, выделенные клеточные композиции, клеточные препараты или клеточные экстракты, описанные здесь, могут быть соединены с тромбоцитарным концентратом (PRP).
В другом варианте осуществления изобретение предусматривает способ приготовления композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата, причем клеточный экстракт является экстрактом кератиноцитов.
В другом варианте осуществления изобретение предусматривает способ приготовления композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата, причем клеточный экстракт является аутологичным экстрактом кератиноцитов.
В другом варианте осуществления изобретение предусматривает способ приготовления композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата, причем клеточный экстракт является экстрактом скелетных мышц, таких как мышечные клетки-предшественники или стволовые сателлитные клетки.
В другом варианте осуществления изобретение предусматривает способ приготовления композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата, причем клеточный экстракт является экстрактом фибробластов.
В другом варианте осуществления изобретение предусматривает способ приготовления композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата, причем клеточный экстракт является экстрактом адипоцитов, преадипоцитов, эндотелиальных клеток-предшественников, мезенхимных стволовых клеток.
В другом варианте осуществления изобретение предусматривает способ приготовления композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата, причем клеточный экстракт является экстрактом хондроцитов.
В другом варианте осуществления изобретение предусматривает способ приготовления композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата, причем клеточный экстракт является экстрактом стволовых клеток, таких как стволовые клетки пуповины.
В другом варианте осуществления изобретение предусматривает способ приготовления композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата, причем клеточный экстракт является экстрактом клеток сухожилия.
В другом варианте осуществления изобретение предусматривает способ приготовления композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата, причем клеточный экстракт является экстрактом клеток надкостницы или клеток десны.
В другом варианте осуществления изобретение предусматривает способ приготовления композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата, причем клеточный экстракт является экстрактом клеток роговицы.
В другом варианте осуществления изобретение предусматривает способ приготовления композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата, причем клеточный экстракт является экстрактом клеток костного мозга.
В другом варианте осуществления изобретение предусматривает способ приготовления композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата, причем клеточный экстракт является экстрактом остеобластных клеток.
В другом варианте осуществления изобретение предусматривает способ приготовления композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата, причем клеточный экстракт является экстрактом шванновских клеток.
В другом варианте осуществления изобретение предусматривает способ приготовления композиции для заживления ран или тканей, гемостатического агента, клеточной композиции или клеточного препарата, причем клеточный экстракт является экстрактом клеток панкреатических островков.
В другом варианте осуществления выделенная композиция тромбоцитарного концентрата, композиция средства для заживления ран или тканей, сыворотка, обогащенная тромбином, клеточный экстракт, композиция для заживления ран или тканей, гемостатический агент, клеточная композиция и/или клеточный препарат в соответствии с данным изобретением является/являются аутологичными. В другом варианте осуществления настоящее изобретение предусматривает набор для регенерации тканей в соответствии с данным изобретением, причем комлпект далее включает отдельные флаконы, содержащие глюконат кальция, Альбумин, хитозан, крем, любрицин, TCP, этиловый спирт и/или CaCl2, держатели шприца, фиксатор и/или наконечный аппликатор со сдвоенным выходом. Варианты применения аутологичной сыворотки с тромбином в соответствии с данным изобретением обладают преимуществом, заключающимся в том, что такие добавки, как этиловый спирт, CaCl2 не требуются для приготовления препарата для заживления ран или препарата PRP. В другом варианте осуществления изобретение предусматривает способ приготовления клеточной композиции в соответствии с данным изобретением, причем клеточный экстракт, полученный на стадии d) или е) получен с помощью способ, включающего:
(A) Получение указанных клеток в тромбоцитарном концентрате в соответствии с данным изобретением,
(B) Необязательную культивацию клеток и
(C) Ресуспендиорвания культивированных клеток, полученных на стадии (В) в тромбоцитарный концентрат в соответствии с данным изобретением.
В следующем варианте осуществления изобретение предусматривает способ приготовления клеточной композиции в соответствии с данным изобретением, причем клеточная экспансия на стадии (А) осуществляется в тромбоцитарном концентрате в соответствии с данным изобретением таким образом, что конечная концентрация тромбоцитов составляет от около 5% до около 40% объема питательной среды.
В другом следующем варианте осуществления изобретение предусматривает способ приготовления клеточной композиции в соответствии с данным изобретением, причем культура клеток на связанной с культурой клеток стадии (В) включает, по меньшей мере, одну стадию, заключающуюся в посеве клеток, например на поверхность для культур клеток, такую как чашка Петри, или во флакон для культивирования клеток.
В другом следующем варианте осуществления изобретение предусматривает способ приготовления клеточной композиции в соответствии с данным изобретением, включающий, по меньшей мере, одну дополнительную стадию сбора клеток после связанной с культурой клеток стадии (В).
В другом следующем варианте осуществления изобретение предусматривает способ приготовления клеточной композиции в соответствии с данным изобретением, причем связанную с культурой клеток стадию (В) выполняют при 37°С.
В другом следующем варианте осуществления изобретение предусматривает способ приготовления клеточной композиции в соответствии с данным изобретением, причем связанную с культурой клеток стадию (В) выполняют при потоке газа, включающего кислород или воздух или углекислый газ, обычно поток газа включает 95% кислорода или воздуха и 5% углекислого газа.
В другом следующем варианте осуществления изобретение предусматривает способ приготовления клеточной композиции в соответствии с данным изобретением, причем связанная с культурой клеток стадия (В) длится в течение от около 3 до около 4 недель. В другом следующем варианте осуществления изобретение предусматривает способ приготовления клеточной композиции в соответствии с данным изобретением, причем в течение связанной с культурой клеток стадии (В) осуществляют регулярную смену питательной среды в течение периода культивации, обычно примерно каждые 3 дня.
В другом следующем варианте осуществления изобретение предусматривает способ приготовления клеточной композиции в соответствии с данным изобретением, причем связанная с культурой клеток стадия (В) включает, по меньшей мере, одну стадию, заключающуюся в подвергании клеток воздействию видимого света, обычно при длине волны 633 нм, в течение около 10 минут. Другая особенность заключается в том, что стадию подвергания воздействию видимого света повторяют раз в неделю в течение периода культивирования.
В другом следующем варианте осуществления изобретение предусматривает способ приготовления клеточной композиции в соответствии с данным изобретением, причем клеточная композиция является клеточной композицией кератиноцитов или фибробластов, а связанная с культурой клеток стадия (В) включает, по меньшей мере, одну стадию, заключающуюся в подвергании клеток воздействию видимого света, обычно при длине волны 633 нм, в течение около 10 минут. Другая особенность заключается в том, что стадию подвергания воздействию видимого света повторяют раз в неделю в течение периода культивирования.
В другом следующем варианте осуществления изобретения предусматривает способ приготовления клеточной композиции в соответствии с данным изобретением, причем связанная с культурой клеток стадия (В) включает, по меньшей мере, одну стадию, заключающуюся в добавлении разбавленного тромбоцитарного концентрата в соответствии с данным изобретением, причем конечная концентрация тромбоцитов составляет от около 5% до около 40% объема питательной среды.
В другом следующем варианте осуществления изобретение предусматривает способ приготовления клеточной композиции в соответствии с данным изобретением, причем клеточная композиция является клеточной композицией кератиноцитов или фибробластов, а связанная с культурой клеток стадия (В) включает, по меньшей мере, одну стадию, заключающуюся в добавлении разбавленного тромбоцитарного концентрата в соответствии с данным изобретением, причем конечная концентрация тромбоцитов составляет от около 5% до около 40% объема питательной среды. В другом варианте осуществления настоящее изобретение предусматривает выделенную клеточную композицию, которую возможно получить с помощью способ в соответствии с данным изобретением.
В другом варианте осуществления настоящее изобретение предусматривает выделенную клеточную композицию, причем выделенная клеточная композиция является композицией жировых клеток, такой как клеточная композиция адипоцитов.
В другом варианте осуществления настоящее изобретение предусматривает выделенную клеточную композицию, причем выделенная клеточная композиция является композицией мышечных клеток, такой как клеточная композиция миобластов или стволовых сателлитных клеток.
В другом варианте осуществления настоящее изобретение предусматривает выделенную клеточную композицию, причем выделенная клеточная композиция является композицией клеток роговицы.
В другом варианте осуществления настоящее изобретение предусматривает выделенную клеточную композицию, причем выделенная клеточная композиция является композицией хрящевых клеток, такой как клеточная композиция хондроцитов. В другом варианте осуществления настоящее изобретение предусматривает выделенную клеточную композицию, причем выделенная клеточная композиция является композицией клеток кожи, такой как клеточная композиция фибробластов или кератиноцитов.
В другом варианте осуществления настоящее изобретение предусматривает выделенную клеточную композицию, причем выделенная клеточная композиция является композицией клеток надкостницы или клеток десны.
В другом варианте осуществления настоящее изобретение предусматривает выделенную клеточную композицию, причем выделенная клеточная композиция является композицией клеток сухожилия, такой как клеточная композиция клеток сухожилия.
В другом варианте осуществления настоящее изобретение предусматривает выделенную клеточную композицию, причем выделенная клеточная композиция является композицией стволовых клеток, такой как клеточная композиция стволовых клеток пуповины.
В другом варианте осуществления настоящее изобретение предусматривает выделенную клеточную композицию, причем выделенная клеточная композиция является композицией клеток костного мозга.
В другом варианте осуществления настоящее изобретение предусматривает выделенную клеточную композицию, причем выделенная клеточная композиция является композицией шванновских клеток.
В другом варианте осуществления настоящее изобретение предусматривает выделенную клеточную композицию, причем выделенная клеточная композиция является композицией клеток панкреатических островков.
В другом варианте осуществления настоящее изобретение предусматривает выделенную клеточную композицию, причем выделенная клеточная композиция является клеточной композицией остеобластов.
В другом варианте осуществления настоящее изобретение предусматривает выделенную клеточную композицию, причем клетки находятся при концентрации от около 3×105 до около 106 клеток/мл плазмы или обогащенной плазмы.
В другом варианте осуществления настоящее изобретение предусматривает композиции, способы и варианты применения для стимулирования запечатывания ран или тканей и/или регенерации тканей и/или костей в ране у человека или низшего животного, как описано здесь.
В другом следующем варианте осуществления настоящее изобретение предусматривает композиции, способы и варианты применения для стимулирования запечатывания ран или тканей и/или регенерации тканей и/или костей в ране у млекопитающего, предпочтительно человека. В другом варианте осуществления настоящее изобретение предусматривает композиции, способы и варианты применения для индуцирования регенерации периодонта в ране или дефекте периодонта млекопитающего, страдающего заболеванием периодонта или находящегося в другом состоянии, как описано здесь.
В другом следующем варианте осуществления настоящее изобретение предусматривает способ индуцирования регенерации периодонта в ране или дефекте периодонта или полости млекопитающего, страдающего заболеванием периодонта или находящегося в другом состоянии, причем млекопитающим является человек.
В другом следующем варианте осуществления настоящее изобретение предусматривает способ индуцирования регенерации периодонта в ране или дефекте периодонта или полости в соответствии с данным изобретением, причем указанное терапевтически эффективное количество указанной композиции средства для заживления ран или тканей наносится в форме полутвердого геля или матрикса роста на указанную рану или указанный дефект периодонта или полость, такую как описанную, например, в Garg et al., 2000, Dental Implantology Update, 11(6), 41-44.
В другом варианте осуществления настоящее изобретение предусматривает способ стимулирования регенерации кожной ткани в рубце или морщине, как описано здесь.
В другом варианте осуществления изобретение предусматривает способ индуцирования миокардиальной регенерации в соответствии с данным изобретением, причем указанное терапевтически эффективное количество указанной композиции мышечных клеток в соответствии с данным изобретением инъецируют в комбинации с тромбоцитарным концентратом (PRP) в миокард, обычно в миокард левого желудочка. Инъекция может быть осуществлена в виде прямой инъекции или множественной инъекции, выполняемой с помощью зонда. Миобласты или сателлитные клетки могут быть нанесены ex vivo, как описано в настоящем описании, на лишенный эпителия и облученный ультрафиолетовым излучением биологический амнион человека и биокомпозитную конструкцию в виде монослоя, как указано в настоящем описании. Амнион затем подсаживают к эпикарду, подверженному ишемии в целях переноса стволовых клеток на нижележащую ткань для увеличения сократительной силы стенки желудочка и миоцитов.
В другом варианте осуществления настоящее изобретение предусматривает способ индуцирования миокардиальной регенерации в соответствии с данным изобретением, причем указанное терапевтически эффективное количество указанной композиции мышечных клеток в соответствии с данным изобретением инъецируют в комбинации с тромбоцитарным концентратом (PRP) в миокард, вместе с терапевтически эффективным количеством клеточной композиции фибробластов в соответствии с данным изобретением в комбинации с тромбоцитарным концентратом (PRP). В другом варианте осуществления настоящее изобретение предусматривает способ индуцирования миокардиальной регенерации в соответствии с данным изобретением, причем указанное терапевтически эффективное количество указанной композиции мышечных клеток в соответствии с данным изобретением наносится в комбинации с тромбоцитарным концентратом (PRP) на поверхность желудочка в виде амнионного лоскута предпочтительно с клеточной композицией культивированных миобластов и сателлитных стволовых клеток в соответствии с данным изобретением.
В другом варианте осуществления настоящее изобретение предусматривает способ индуцирования регенерации роговицы в соответствии с данным изобретением, причем указанное терапевтически эффективное количество указанной композиции клеток роговицы в соответствии с изобретением в комбинации с тромбоцитарным концентратом (PRP) наносится на ткань роговицы для формирования амнионного лоскута, предпочтительно распределенного на поверхности растворимых контактных линз.
Указанный способ лечения раны, ткани или заболевания может включать использования любой композиции, описанной здесь; он может также включать использование композиции, полученной с помощью любого из способов, описанных здесь.
Способы, устройства и набор в соответствии с данным изобретением обладают преимуществами, заключающимися в создании быстрого и относительно низкозатратного способа получения тромбоцитарных концентратов в рамках одной операции, который легко реализовать и адаптировать для применения на месте оказания помощи. Способы изобретения обладают преимуществом, заключающимся не только в получении обогащенных препаратов, в которых выходная концентрация тромбоцитов находится на столь высоком уровне, но и также и в том, что содержание эритроцитов является низким. Композиции данного изобретение обладают преимуществом, заключающимся в содержании тромбоцитов в большом количестве, эритроцитов в малом количестве, а также полном сохранении свойств для их последующего терапевтического применения in vivo. Более конкретно, сохраняется способность тромбоцитов высвобождать основные факторы роста, связанные с регенерацией тканей (PDGF, TGF-beta, IGF, VEGF и EGF) на достаточном уровне в течение нескольких дней (или в течение 30 дней жизненного периода тромбоцитов). Кроме того, в целях расширения композиции в соответствии с данным изобретением изготовлены из аутологичной крови, изобретение, описанное здесь, снижает передачу заболеваний и иммунореактивные риски, связанные с использованием лечебных материалов, изготовленных из биологических материалов, полученных от одного или более третьих субъектов. Изобретение, таким образом, предусматривает улучшенный биологический материал, предназначенный для заживления ран и регенерации тканей, предпочтительно аутологичный, стимулирующий регенерацию таких тканей, как кожа, хрящ и костная ткань, и, в частности, цикатризацию и/или омоложение. Преимущества изобретения включают простой и быстрый способ приготовления улучшенных материалов для заживления ран и регенерации тканей, адаптированных для обслуживания в местах оказания помощи, чья способность снижать продолжительность периода заживления, степень связанных с этим болевых ощущений и медицинских затрат является доказанной. Далее, материал, предназначенный для заживления ран и регенерации тканей, снижает риски отторжения имплантатов и улучшает показатели успешного проведения имплантации. Далее, использование улучшенных материалов, предназначенных для заживления ран и регенерации тканей, приводит к образованию рубцов, обладающих намного лучшими конечными эстетическими свойствами, и к долговременному заполнению рубцов и морщин.
Обычно клеточные экстракты получают с помощью биопсии тканей, причем биопсия предпочтительно осуществляется в тот же день, когда производится смешивание с тромбоцитарным концентратом. Размеры образцов, забранных в результате осуществления биопсии, адаптируется в зависимости от требуемой терапевтической цели и типов клеток, используемых в препарате на основе клеточной композиции в соответствии с данным изобретением. Примеры проведенных операций по осуществлению биопсии приведены в Примерах ниже для различных типов тканей. Другая особенность заключается в том, что изобретение предусматривает пробирку, включающую, по меньшей мере, один фильтр, разделяющий пробирку на две части.
Другая особенность заключается в том, что изобретение предусматривает пробирку, разделенную на две части с помощью, по меньшей мере, и предпочтительно одного фильтра.
В одном из вариантов осуществления используется пробирка для забора и сепарирования жидкого образца.
Предпочтительно две части отличаются размерами и/или диаметром.
Другая особенность заключается в том, что изобретение предусматривает пробирку для сбора и сепарирования жидкого образца, включающую:
i) две отдельные части, отличающиеся размерами и диаметром,
ii) по меньшей мере, один фильтр, разделяющий две части, и
iii) необязательно антикоагулянт.
В предпочтительном варианте осуществления изобретения пробирка обладает характерными деталями, указанными на Фиг. 1-14.
В предпочтительном варианте осуществления пробирка изготовлена из циклического полимера олефина (СОР) или циклического сополимера олефина (СОС).
В одном из вариантов осуществления пробирка содержит анти коагулянт, предпочтительно буферный раствор цитрата натрия или безводный цитрат натрия.
В предпочтительном варианте осуществления изобретения пробирка содержит буферный раствор цитрата натрия при молярной концентрации 0.10 М или безводный цитрат натрия при концентрации 3.5 мг/мл.
В предпочтительном варианте осуществления изобретения фильтр прикрепляется к пробирке. Предпочтительно фильтр является вертикально удлиненным в целях получения большей площади контакта его поверхности с пробиркой (увеличенной по вертикальной оси пробирки). Это создает преимущество, заключающееся в увеличении стабильности фильтра, в дальнейшем устраняя любые перемещения фильтра. В предпочтительном варианте осуществления пробирка включает фильтр, состоящий из двух слоев. Предпочтительно 2 слоя расположены один над другим (один сверху другого; Фиг. 4, Фиг. 10-14). Предпочтительно внешний слой вертикально удлинен в целях получения большей площади контакта его поверхности с пробиркой (увеличенной по вертикальной оси пробирки, Фиг. 2, 3, и 5А). Предпочтительно внутренний слой также удлинен в целях совмещения с внешним слоем. В одном из вариантов осуществления внутренний слой не является удлиненным (только по горизонтальной оси). В предпочтительном варианте осуществления пробирка включает 2, 3, 4, 5 или более фильтров.
В предпочтительном варианте осуществления изобретения первая часть пробирки, расположенная в верхней или в самой верхней части пробирки, имеет значительно больший объем, чем вторая часть, расположенная в нижней или наиболее низкой части пробирки. В следующих предпочтительных вариантах осуществления первая часть пробирки, включающая фильтр, имеет объем около 9.5 см3, а вторая часть пробирки имеет объем около 3.5 см3 (Фиг. 5А).
В предпочтительном варианте осуществления изобретения объем первой части пробирки, расположенной выше части пробирки, включающей фильтр, составляет около 70% полного объема пробирки. В одном из вариантов осуществления объем первой части пробирки, расположенной выше части пробирки, включающей фильтр, составляет около 51%, 55%, 60%, 65%, 68%, 70%, 73%, 75%, 80%, 90%, 95% или боле полного объема пробирки. В следующем предпочтительном варианте осуществления объем второй части пробирки, расположенной в нижней части пробирки, составляет около 30% полного объема пробирки. В одном из вариантов осуществления объем второй части пробирки, расположенной в нижней части пробирки составляет около 49%, 45%, 40%, 35%, 32%, 30%, 27%, 25%, 20%, 15%, 10% или 5% или менее полного объема пробирки.
В одном из предпочтительных вариантов осуществления пробирка имеет полный объем около 13 см3 (Фиг. 5А).
В предпочтительном варианте осуществления изобретения вторая часть пробирки, расположенная в нижней части пробирки, имеет меньший диаметр, чем первая часть пробирки, расположенная в верхней части пробирки. Это создает преимущество, заключающееся в том, что фильтр останется на своей позиции при проведении центрифугирования или под воздействием любого другого механического воздействия. В предпочтительном варианте осуществления, внешний диаметр первой части пробирки, расположенной в верхней части пробирки, составляет около 15.5 мм или около 15.4 мм (Фиг. 3). В предпочтительном варианте осуществления внутренний диаметр первой части пробирки, расположенной в верхней части пробирки составляет около 13.32 мм или 13.31 мм (Фиг. 3).
В предпочтительном варианте осуществления внешний диаметр второй части пробирки, расположенной в нижней части пробирки, составляет около 13.7 мм (Фиг. 5А). В предпочтительном варианте осуществления внутренний диаметр второй части пробирки, расположенной в нижней части пробирки составляет около 11.6 мм.
В предпочтительном варианте осуществления фильтр изготовлен из двух слоев, разделяющих две части пробирки. Предпочтительно 2 слоя расположены один над другим (один сверху другого; Фиг. 4, Фиг. 10-14).
Предпочтительный фильтр изображен на Фиг. 4 и Фиг. 7-14. Предпочтительно фильтр включает внешний и внутренний слои (Фиг. 10, 11 и 13).
В предпочтительном варианте осуществления фильтр прикрепляется к пробирке. В другом варианте осуществления изобретения фильтр не прикрепляется к пробирке. В одном из вариантов осуществления фильтр включает симметричные наборы диапазонов отверстий, расположенных как показано на Фиг. 7А, 7В, 8 и 9. Предпочтительно, фильтр включает 4 симметричных набора диапазонов с 2 диапазонами на серию, при этом каждый диапазон состоит из отверстия. Расстояние между внутренней частью одного отверстия и внутренней частью другого отверстия составляет около 5.13 мм для первого диапазона отверстий, расположенного ближе к центру пробирки (Фиг. 4, объект 4). Расстояние между внешней частью одного отверстия и внешней частью другого отверстия составляет около 5.67 мм для первого диапазона отверстий, расположенного по центру пробирки (Фиг. 4, точка 3). Расстояние между внутренней частью одного отверстия и внутренней частью другого отверстия составляет около 7.73 мм для второго диапазона отверстий, расположенного ближе к краям пробирки (Фиг. 4, объект 2). Расстояние между внешней частью одного отверстия и внешней частью другого отверстия составляет около 8.27 мм для второго диапазона отверстий, расположенного ближе к краям пробирки (Фиг. 4, объект 2). В одном из вариантов осуществления длина каждого отверстия составляет около 0.53 или 0.54 мм (Фиг. 9 и Фиг. 14, объект 21).
Предпочтительно верхний или внутренний слой состоит из 4 симметричных наборов диапазонов с 2 диапазонами на серию (Фиг. 9, 13 и 14), при этом каждый диапазон состоит из подходящего количества воронок, расположенных с постоянным шагом (Фиг. 13 и 14). Предпочтительно длина промежутка или отверстия, расположенного на дне каждой пробирки, составляет около 0.27 мм (Фиг. 13, объект 26). Предпочтительно расстояния от одной крайней точки пробирки до другой составляет около 1 мм, в зависимости от толщины верхнего слоя (Фиг. 14, объект 24). Предпочтительно толщина верхнего слоя составляет около 1 мм (Фиг. 12, объект 24 и Фиг. 14, объект 24). Количество воронок зависит от размера слоя. Предпочтительно воронка включает закрытое отверстие в своем основании (объект 26 Фиг. 14).
Предпочтительно нижний или внешний слой состоит из 4 симметричных наборов диапазонов с 3 диапазонами на серию (Фиг. 8, 13 и 14), при этом каждый диапазон состоит из подходящего количества трапеций, расположенных с постоянным шагом (Фиг. 13 и 14). Количество трапеций зависит от замера слоя. Предпочтительно трапеции находятся на расстоянии около 0.53 мм друг от друга (Фиг. 14). Длина основания каждой трапеции составляет около 0.77 мм (Фиг. 14). Предпочтительно высота каждой трапеции составляет около 0.5 мм (Фиг. 14). Предпочтительно толщина нижнего слоя составляет около 1 мм (Фигуры 12 и 14).
Предпочтительно размер диапазонов верхних и нижних слоев всегда чередуется. Предпочтительно за первым диапазоном трапеций нижнего слоя следует первый диапазон воронок верхнего слоя, за которым следует второй диапазон трапеций нижнего слоя, за которым следует второй диапазон воронок верхнего слоя, за которым, в итоге, следует третий диапазон трапеций нижнего слоя (Фиг. 4, 13 и 14).
Предпочтительно каждая воронка верхнего слоя расположена таким образом, что подъем центра воронки приходится примерно между двумя трапециями нижнего слоя (Фиг. 4, 13 и 14). Более предпочтительно каждая воронка верхнего слоя расположена таким образом, что подъем центра воронки приходится точно между двумя трапециями нижнего слоя (Фиг. 4, 13 и 14). Предпочтительно трапеция последовательно следует за воронкой.
При проведении центрифугирования пробирки в соответствии с настоящим изобретением закрытое отверстие в основании воронки (объект 26 Фиг. 14) открывается под действием силы центрифугирования, делая возможным прохождение красных кровяных клеток, движение которых направлено между двух трапеций и. наконец, в нижнюю часть пробирки. Непосредственно при остановке центрифугирования отверстия воронок закрываются, препятствуя обратному току красных кровяных клеток в верхнюю часть пробирки. Трапеции нижнего слоя, расположенные под каждой из воронок обеспечивают прохождения красных кровяных клеток в нижнюю часть пробирки и предотвращают обратный ток красных кровяных клеток.
Предпочтительно объем верхнего слоя составляет около 0.26 см3. Предпочтительно объем нижнего слоя составляет около 0.29 см3.
Предпочтительно верхний слой изготовлен из полипропилена (РР). Предпочтительно нижний слой изготовлен из термопластичного эластомера (ТРЕ). Могут быть использованы другие компоненты, как описано в настоящем изобретении, или известные специалистам, владеющим уровнем техники.
Предпочтительно центр фильтра является выпуклым (Фиг. 4, 10-13). Это создает преимущество, заключающееся в направлении тока цельной крови к воронкам. Предпочтительно фильтр является выпуклым, причем его длина составляет около 0.5 мм от центра пробирки до основания нижнего слоя (Фиг. 12, объект 36).
Предпочтительно высота нижнего слоя составляет около 8 мм (Фиг. 2 и Фиг. 10, объект 14). Предпочтительно внешний диаметр нижнего слоя составляет около 12.74 мм (Фиг. 10, объект 17). Предпочтительно внутренний диаметр верхнего слоя составляет около 9.6 мм (Фиг. 10, объект 16). Предпочтительно высота слоя от верхней невыпуклой поверхности верхнего слоя составляет около 6 мм (Фиг. 10, объект 9). Предпочтительно высота слоя от центра выпуклой верхней поверхности верхнего слоя составляет около 5.5 мм (Фиг. 10, объект 11).
В одном из вариантов осуществление изобретения пробирка включает только фильтр с воронками.
В другом варианте осуществления изобретения количество воронок и/или трапеций может отличаться. В другом варианте осуществления изобретения количество диапазонов воронок и/или трапеций может отличаться. В другом варианте осуществления изобретения количество симметричных наборов диапазонов воронок и/или трапеций может отличаться. В другом варианте осуществления изобретения пробирка состоит из 2 симметричных наборов диапазонов воронок и/или трапеций.
Настоящее изобретение также включает пробирку, причем длины всех компонентов отличается от указанных здесь. Настоящее изобретение также включает пробирку, причем длины всех компонентов отличаются от указанных здесь на 0.1 мм, 0.2 мм, 0.3 мм, 0.5 мм, 1 мм, 1.5 мм, 2 мм, 5 мм. 8 мм, 10 мм, 15 мм, 20 мм, 50 мм, 75 мм, 1 см, 2 см, 5 см, 10 см или более.
В одном из вариантов осуществления используют лазер для формирования формы фильтра или его моделирования.
Пробирки в соответствии с настоящим изобретением обладают преимуществом, заключающимся в отделении красных кровяных клеток от плазмы с высокой эффективностью. Использование пробирки в соответствии с настоящим изобретением, позволяет снизить величину содержания красных кровяных клеток в плазме более чем на 99%, 98%, 95%, 93%, 90%, 85%, 80%, 75%, 70%, 65% или 60% по сравнению с величиной содержания красных кровяных клеток, находящихся в цельной крови.
СОС и СОР, являясь жесткими и крепкими медицинскими материалами, наряду экономичностью, обладают преимуществом, заключающимся в степени их прозрачности, аналогичной степени прозрачности стекла в его естественном виде. Типичный СОС-материал обладает более высоким коэффициентом, чем HDPE (высокоплотный полиэтилен (HDPE) или полиэтилен высокой плотности (PEHD) является термопластичным полиэтиленом, изготовленным из нефти) и РР (полипропилен или полипропен (РР) является термопластичным полимером). СОС, являясь чистым полимером, также обладает высоким барьером смачивания, наряду с низкой степенью абсорбции. При медицинском применении СОС заметен тем, что является продуктом высокой степени чистоты с низким содержанием примесей. СОС также является не содержащим галоген продуктом.
СОС обладает отличной оптической прозрачностью и высокой устойчивостью к запотеванию. Он обладает замечательными свойствами, обладает высокой четкостью, выдерживает любые типичные способы стерилизации, а также обладает сопротивлением по отношению к гидролизу и широкому спектру химических веществ. СОС также обладает сопротивлением по отношению к нагреву, механическими свойствами, жесткостью, стабильностью формы и электроизоляционными свойствами. Благодаря низкому содержанию примесей и отличной in vivo и in vitro-биосовместимости, он соответствует требованиям USP Class VI и ISO 10993; также ему были присвоены номера в мастер-файле Drug and Device управления FDA.
Также СОС, благодаря своей прозрачности твердости, легкости, сопротивлению нагреву и воздействию химических веществ, биосовместимости, стабильности формы по отношению к барьеру смачивания (низкой проницаемостью), пластичностью и отсутствию галогенов, обладает многими полезными преимуществами при использовании. Он снижает количество повреждений в устройствах и при упаковывании по сравнению со стеклом, увеличивает срок хранения лекарств, позволяет осуществлять проведение диагностики, связанной с использованием ультрафиолетового излучения, а также делает возможным создание диагностического оборудования с меньшим весом и большим быстродействием. Кроме того, СОС-материалы способны проходить стерилизацию, осуществляемую гамма-излучением, паром и оксидом этилена и, таким образом, могут быть стерилизованы всеми стандартными способами.
Другая особенность заключается в том, что изобретение предусматривает систему контейнеров для крови или устройство с пробирками для забора крови в соответствии с Фиг. 15.
Кровь, забранная и/или хранимая в системе контейнеров для крови или устройстве с пробирками для забора крови в соответствии с данным изобретением, может быть использована в любом из способов, композиций, продуктов, вариантов использования в соответствии с настоящим изобретением.
Пробирки или контейнеры для забора крови могут быть подвергнуты вакуумированию и/или запечатаны. Пробирки или контейнеры для забора крови могут быть наполнены тиксотропным гелем и/или антикоагулянтом.
Система контейнеров для крови или устройство с пробирками для забора крови в соответствии с данным изобретением включает коллектор для крови, делающий возможным доставку плазмы и клеточных компонентов во множество контейнеров или пробирок.
Другая особенность заключается в том, что изобретение предусматривает систему контейнеров для крови или устройство с пробирками для забора крови, включающее единственную входную трубку, соединенную с помощью разветвителя с трубками разветвителя, соединенными с, по меньшей мере, двумя контейнерами или пробирками, прочем каждая трубка разветвителя соединена с одним контейнером или пробиркой.
Другая особенность заключается в том, что изобретение предусматривает систему контейнеров для крови или устройство с пробирками для забора крови, включающее:
a) единственную входную трубку,
b) разветвитель с трубками и
c) по меньшей мере, два контейнера или пробирки,
причем единственная входная трубка соединена с разветвителем, причем каждая трубка разветвителя соединена с одним контейнером или пробиркой.
В одном из вариантов осуществления изобретение предусматривает систему контейнеров для крови или устройство с пробирками для забора крови в соответствии с данным изобретением для хранения компонентов крови.
Предпочтительно система контейнеров для крови или устройство с пробирками для забора крови включает входную трубку (1), разветвитель (2), трубки разветвителя (3), и, по меньшей мере, два контейнера или пробирки (4), как показано на Фиг. 15.
В одном из вариантов осуществления система контейнеров для крови или устройство с пробирками для забора крови далее включает один или более фиксатор (5) (Фиг. 15). Предпочтительно, фиксаторы присутствуют для каждой трубки разветвителя. В одном из вариантов осуществления два или более фиксатора присутствуют для каждой трубки разветвителя.
Предпочтительно каждый контейнер системы контейнеров для крови или устройство с пробирками для забора крови далее включает колпачок. Фиг. 15 иллюстрирует систему контейнеров для крови или устройство с пробирками для забора крови, причем каждый контейнер (4) включает колпачок (6). Предпочтительно колпачок может быть открыт или откручен для подсоединения стерильного шприца. Колпачок обладает преимуществом, заключающимся в возможности легкого осуществления аспирации содержимого контейнера в стерильных условиях. В одном из вариантов осуществления может быть использован шприц типа "Луер Лок". Также вместо колпачка может использоваться игла.
Предпочтительно входная трубка и трубки разветвителя являются гибкими. Предпочтительно входная трубка и трубки разветвителя выполнены в форме трубки.
В одном из вариантов осуществления система контейнеров для крови или устройство с пробирками для забора крови включает 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20 или более контейнеров или пробирок. Предпочтительно система контейнеров для крови или устройство с пробирками для забора крови включает 8 контейнеров или пробирок.
Предпочтительно изобретение предусматривает одноразовые контейнеры или пробирки для одноразового использования.
В одном из вариантов осуществления каждый контейнер может содержать до и около 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 14, 16, 18, 20, 25, 30 мл крови или более. Предпочтительно каждый контейнер содержит около 10 мл крови. Предпочтительно объем каждого контейнера предназначен для одноразового использования. Предпочтительно количество крови, забранной в каждый из контейнеров, является достаточным для одного единственного использования.
Предпочтительно система контейнеров для крови или устройство с пробирками для забора крови предусматривает ток в рамках замкнутого сообщения. Более предпочтительно система контейнеров для крови или устройство с пробирками для забора крови предусматривает ток в рамках замкнутого сообщения и стерильных условий.
Предпочтительно каждый контейнер может быть индивидуально запечатан непосредственно после наполнения контейнеров или пробирок. Это предоставляет преимущество, заключающееся в наличии индивидуальных готовых к использованию одноразовых контейнеров или пробирок.
Предпочтительно каждый контейнер подвергают прохождению стадии вакуумирования. Предпочтительно систему контейнеров для крови или устройство с пробирками для забора крови подвергают прохождению стадии вакуумирования. В одном предпочтительном варианте осуществления каждый контейнер помещают во второй защитный контейнер или оболочку. Это создает преимущество, заключающееся в предоставлении двойной защиты в соответствии со стандартами ISO в области упаковки (ISO 11607-1 и/или ISO 11607-2).
Предпочтительно каждый контейнер помещают во вторую оболочку после вакуумирования. Предпочтительно вторую оболочку подвергают вакуумированию и запечатывают. Стерилизация, стадии вакуумирования и применения двойной защиты делают возможным получение контейнеров или пробирок, которые очень безопасны для использования.
В одном из вариантов осуществления ток жидкости может контролироваться с помощью традиционных клапанных средств, таких как ограничители с фиксированным шагом, съемные ограничители или скользящие ограничители тока.
Система контейнеров или пробирок для крови может обладать традиционной конструкцией, будучи изготовленной из пластикового материала, который является совместимым с кровью, гибким, светопрозрачным и пригодным для стерилизации. Пластик может быть поливинилхлоридом, полиэфиром, полиолефином, полиуретаном и так далее и может включать смеси указанных выше материалов. Входная трубка и/или трубки разветвителя могут быть изготовлены из пластикового материала, являющимся тем же или иным пластиковым материалом, из которого изготовлены контейнеры или пробирки для крови.
В одном из вариантов осуществления средства для фильтрации могут быть встроены в систему контейнеров для крови или устройство с пробирками для забора крови в соответствии с данным изобретением. Средства для фильтрации могут включать корпус, изготовленный из жесткого поливинилхлорида и подобных ему материалов, и фитинги для пробирок. Средства для фильтрации могут быть наполнены фильтровальной средой, такой как хлопковое волокно или ацетилцеллюлоза или другие синтетические волокна, такие как полиэфир, полиамиды и им подобные. Количество фильтровальной среды зависит от количества красных кровяных клеток, подлежащих фильтрации. Обычно используют около 20-50 граммов фильтровальной среды на 200-250 мл концентрата красных кровяных клеток.
В одном из вариантов осуществления добавляют дополнительный раствор для пролонгации срока хранения красных кровяных клеток. Данный дополнительный раствор может являться, например, общеизвестным раствором для хранения красных кровяных клеток, таким как описанный в Ginzburg et al., Bibl. Haemotol., 1971, No. 3, Pt. 2, 217-220; Wood et al., Blood, Vol. 42, No. 1, 1973, 17-25; Beutler, "The Red Cell in Vitro", Grum and Stratton, New York, N.Y., 1974, p.201; Lovric et al., Medical Journal of Australia, Vol. 2, 183-186, 1977; US 4,267,269; в количестве около 50-100 мл на 200-250 мл концентрата красных кровяных клеток.
В одном из вариантов осуществления контейнеры или пробирки системы контейнеров для крови или устройство с пробирками для забора крови в соответствии с данным изобретением может содержать антикоагулянт, такой как Аденин-Цитрат-Декетроза (ACD), Цитрат-Фосфат-Декстроза (CPD), Цитрат-Фосфат (227 ммоль)-Декстроза (CP2D), CPD плюс аденин или другой общеизвестный антикоагулянт, с которым смешивают забранную кровь. Забранная кровь может быть также обработана напрямую или храниться обычно при около 4°-6°С. Во время обработки система контейнеров может быть подвергнута центрифугированию, являющемуся общепринятой практикой в данной области, вызывающему осаждение красных кровяных клеток, содержащихся в крови, на дне контейнера. Плазму крови подвергают эксирессированию с использованием общепринятых техник с помощью свежей плазмы и тромбоцитарного концентрата.
Кровь, содержащаяся в контейнерах или пробирках, может использоваться в любых аспектах или вариантах осуществления настоящего изобретения.
Система контейнеров для крови или устройство с пробирками для забора крови легко изготавливается и производится, при этом обладая высоким уровнем применимости в области медицины. С помощью использования данного изобретения заборы крови выполняются легко, становятся более безопасными и эффективными. Преимущественно изобретение предусматривает возможность более легкого отслеживания. Преимущественно изобретение предусматривает систему контейнеров для крови или устройство с пробирками для забора крови и/или набор и/или устройство, включающее систему контейнеров для крови или устройство с пробирками для забора крови, позволяющее выполнять легкий, быстрый и безопасный забор, хранение и доставку любого компонента крови. Дальнейшее преимущество заключается в том, что сбор, хранение и доставка компонента крови выполняются в стерильных условиях в соответствии со стандартами ISO. Дельнейшее преимущество заключается в том, что система контейнеров для крови или устройство с пробирками для забора крови и/или набор и/или устройство, в частности, адаптированные для использования на месте оказания помощи.
Предпочтительно сбор, хранение и доставка компонента крови выполняется в стерильных условиях.
В одном из вариантов осуществления предусматривается клапан, который может являться одноразовым, изготовленный из такого материала как акриловая смола в традиционной форме ее производства.
Другая особенность заключается в том, что изобретение предусматривает стерильный набор и/или устройство, включающее, по меньшей мере, одну систему контейнеров для крови или устройство с пробирками для забора крови в соответствии с данным изобретением. Каждый прибор, требующийся для хранения компонентов крови, получен в составе стерильного набора, что делает хранение компонентов крови безопасным и экономичным.
Кровь, полученная с помощью системы контейнеров для крови или устройства с пробирками для забора крови и/или набора и/или устройства в соответствии с данным изобретением, может использоваться для приготовления тромбина, богатой тромбоцитами плазмы, тромбоцитарного концентрата, клеточного экстракта, клеточной композиции, агента для заживления ран или агента для заживления тканей или гемостатического агента или биологического клея согласно любому аспекту или варианту осуществления, описанному здесь.
Кровь, полученная с помощью системы контейнеров для крови или устройства с пробирками для забора крови и/или набор и/или устройства в соответствии с данным изобретением, может использоваться в рамках всех вариантов применения, описанных здесь. Например, кровь, полученная с помощью системы контейнеров для крови или устройства с пробирками для забора крови и/или набора в соответствии с данным изобретением, может использоваться в области хирургии, в амбулаторных условиях или для хронических ран.
Кровь, полученная с помощью системы контейнеров для крови или устройства с пробирками для забора крови и/или набора и/или устройства в соответствии с данным изобретением, может использоваться в качестве гомологического или аутологичного компонента.
При использовании в качестве гомологического компонента, кровь и/или компоненты крови, полученные с помощью системы контейнеров для крови или устройства с пробирками для забора крови и/или набора и/или устройства в соответствии с данным изобретением, обладают преимуществом, заключающимся в создании эффективной, простой и низкозатратной альтернативы известным системам. Они также обладают преимуществом при невозможности осуществления забора аутологичной крови. Примеры, иллюстрирующие данное изобретение, будут описаны ниже более детально и со ссылкой на варианты осуществления данного изобретения, приведенные в разделе, содержащем Фигуры.
Примеры
Следующие аббревиатуры относятся, соответственно, к определениям, изложенным ниже:
ATS (аутологичная сыворотка с тромбином); BU (единица батроксобина); DMEM (питательная среда DMEM); DMSO (диметилсульфоксид); ЕС (обогащенный сгусток); FCS (фетальная бычья сыворотка); НТ (время заживления); IU (международная единица); PBS (натрий-фосфатный буфер): PET (полиэтилентерефталат); PRP (богатая тромбоцитами плазма); РРР (бедная тромбоцитами плазма); USP (фармакопея США); см (сантиметр); дкл (декалитр); г (грамм); Гр (грей); Дж (джоуль); л (литр); мин (минута); мм (миллиметр); М (молярная концентрация 1 ммоль/л); мл (миллилитр): нм (нанометр); об/м (обороты в минуту); об. (объем).
ОБЩИЕ ПРОЦЕДУРЫ И УСЛОВИЯ
Для определения эффективности композиций данного изобретения в стимулировании заживления ран и/или регенерации костей и/или тканей выполняются следующие эксперименты. Образцы цельной крови человека забирают в пробирку для отбора клеток в соответствии с данным изобретением. Пробирка, которая также может быть использована, является, например, стеклянной пробиркой с объемом приблизительно от 10 до 15 мл (с диаметром 16 мм и высотой от 120 до 130 мм), содержащей от 2 до 3 мл тиксотропного геля на основе полиэфира, а также 1 мл раствора цитрата натрия при молярной коцентрации 0.1 М и содержащей подходящий для использования объем вакуума от около 8.0 до 10 мл. Данная пробирка составляет готовое для использование устройство для приготовления композиции тромбоцитарного концентрата в соответствии с данным изобретением.
Другой пример пробирки, которая может использоваться, является пробирка объемом приблизительно 10 мл, изготовленная из PET (полиэтилентерефталата), содержащая 2 мл тиксотропного геля, включающего полимерную смесь и раствор цитрата натрия (при молярной концентрации около 0.1 М) и содержащая подходящий для использования объем вакуума от около 8.0 до 10 мл, составляя готовое для использование устройство для приготовления тромбоцитарного концентрата в соответствии с данным изобретением. Другое пример пробирки, которая может использоваться, является пробирка в соответствии с данным изобретением. Данные пробирки заполняют 2-мя компонентами, вакуумируют, стерилизуют с помощью облучения (такого как описанное стандартами ISO 11137. UNI EN ISO 11737-2, UNI EN 552, UNI EN 556) и герметично запечатывают с помощью традиционного колпачка, такого как пробка для стеклянных пробирок, изготовленная из традиционного ребристого бромбутилового каучука, и хлорбутиловая пробка с полиэтиленовой крышкой для безопасности. Далее пробирку центрифугируют при ускорении от около 1500 g до около 2000 g в течение от около 3 до 10 минут, т.е. при или от около 2500 об/мин до около 3800 об/мин с помощью центрифуги с качающимся ротором, имеющим радиус 14 см. В случае, если центрифуга обладает ротором с фиксированным углом наклона в 45°, время центрифугирования должно составлять от 5 до около 15 минут. Кроме того, пробирка может подвергаться центрифугированию в соответствии с данным изобретением.
После центрифугирования собирают тромбоцитарный концентрат для терапевтического или косметического применения в соответствии с данным изобретением или для приготовления дальнейших композиций, содержащих полученный тромбоцитарный концентрат путем смешивания с дальнейшими агентами, такими как клеточные экстракты, предпочтительно аутологичные (например, кератиноциты, фибробласты, клетки костного мозга, остеобласты, хондроциты, миобласты, клетки роговицы, шванновские клетки, пуповинные стволовые клетки, клетки сухожилия, клетки панкреатических островков, клетки связок и клетки десны, клетки надкостничной мембраны) и/или костными заместителями и/или активаторами коагуляции.
Концентрат плазмы, PRP, композиции настоящего изобретения могут быть соединены с трикальцийфосфатом (TCP), гиалуроновой кислотой (НА), хитозаном, кремом, кремовой маской, клеточными экстрактами, жировыми клетками, любрицином, cd-желатином и/или ботулотоксином.
Для приготовления клеточных композиций в соответствии с данным изобретением клетки приготовляют в соответствии со стандартным протоколом, включающим:
a) Биопсию
Биопсия соответствующей ткани выполняется в стерильных условиях с помощью стандартных способов, адаптированных для конкретных клеток, подлежащих забору. Клетки могут быть очищены с помощью мойки, центрифугирования или седиментации. Клетки могут быть выделены с помощью центрифугирования, энзимного расщепления (с помощью трипсина, коллагеназы или рекомбинантного трипсина). Клетки используются немедленно или необязательно после ex vivo культивирования и пролиферации, как описано ниже.
b) Ex vivo культивирования и пролиферация клеток
Клетки, используемые для приготовления клеточных композиций, такие как, кератиноциты, клетки костного мозга, фибробласты; клетки надкостници или клетки роговицы, такие как лимбальные стволовые клетки роговицыж меланоциты и клетки Лангерганса; жировые клетки; мышечные клетки, такие как миобласты и сателлитные клетки; остеобласты; хондроциты; клетки пуповины; шванновские клетки, мезенхимные стволовые клетки (MSC), преадипоциты, эндотелиальные клетки-предшественники, клетки сухожилия или панкреатические клетки традиционно; выращиваются на питательной среде (например, DMEM или Ham's) на чашках (например, на чашках Петри или в культуральных флаконах), покрытые тромбоцитарным концентратом, предпочтительно аутологичным, обогащенные фибронектином. Преимущественно питательная среда, такая как DMEM или Ham's не требует использования концентрата плазмы или PRP в соответствии с настоящим изобретением при концентрации от около 5% до около 20%. Дополнительно, преимущественно это делает 20% клеточные препараты более эффективными. Клеточные препараты могут быть обогащены фибронектином на конечной стадии. Питательная среда может быть обогащена предпочтительно DMEM, например в случае кератиноцитов. Для клеток, таких как костные остеобласты, хондроциты и миобласты, энзимное расщепление соответствующей ткани в присутствии, например, коллагеназы или трипсина является необходимым перед проведением посева на чашки. Культивирование на чашках выполняется при 37°С под воздействием потока газа, состоящего из 95% кислорода или воздуха и 5% углекислого газа.
Обычно время культивирования варьируется от 10 до 20 минут. Экспансия клеток в итоге может быть увеличена (как, например, в случае миобластов, фибробластов и хондроцитов) с помощью фототерапии (например с помощью подвергания воздействию света при длине волны 633 нм в течение около 10 минут при 2 Дж/см2 раз в неделю в течение стадии культивирования).
Экспланты могут быть культивированы в чашках Петри или культуральных флаконах с помощью эрлифта (Molnar et al., 1996, Tissue & Cell, 28:547-556) и способа воздушной границы раздела фаз (Meller et al., 2002, Br. J. Opht., 86, 463-471) при нахождении половины экспланта в воздушной среде. Питательную среду меняют в течение периода культивирования в регулярностью в 3 дня. Экспансию клеток в 2-мерной форме в виде планарных монослоев получают, например, в случае миобластов, фибробластов и хондроцитов. 3-мерный паттерн роста может быть получен, например, в случае клеток роговицы, миобластов, фибробластов, хондроцитов, адипоцитов и кератиноцитов с помощью добавления разбавленной композиции аутологичного тромбоцитарного концентрата в соответствии с данным изобретением при от около 5% до около 40% соотношении объема плазмы или обогащенной плазмы к объему питательной среды. Обычно добавление разбавленной композиции аутологичного тромбоцитарного концентрата в соответствии с данным изобретением может быть выполнено два или три раза в течение времени культивации. Полученный затем 3-мерный биологический каркас позволяет улучшить экстраклеточный матрикс, который полезен для переноса аутологичных стволовых клеток.
После культивирования клетки могут быть удалены с чашек с помощью аккуратного расщепления трипсином, которое позволяет отделить клетки и сформировать клеточные скопления. Также клетки являются термочувствительными и могут быть отделены с помощью нагрева (может использоваться чашка Петри, покрытая термочувствительным полимером).
с) Проверка качества и безопасности клеток
Жизнеспособность клеток в получаемом таким образом клеточном препарате проверяют с помощью подсчета количества клеток под микроскопом, проточной цитометрии наряду с иммунохимией на наличие маркеров ткани с помощью стандартных способов. Жизнеспособность клеток также проверяют с помощью трипанового синего сразу же после отделения клеток с помощью трипсина. Безопасность препарата также проверяется с помощью проверки на загрязнение путем микробиологического анализа в целях исключения заражения вирусами или бактериями и для избежания передачи зоонозных инфекций. Использование фетальной бычьей сыворотки (FCS) не требуется, что предотвращает, таким образом, передачу коровьего бешенства.
d) Назначение клеточного препарата
На конечной стадии клеточный препарат, способ получения которого описан выше, размещают в аутологичной композиции тромбоцитарного концентрата в соответствии с данным изобретением в качестве носителя клеток для транспорта перед применением у пациента. Затем клеточный препарат, способ получения которого описан выше, инъецируют или пересаживают пациенту. Форма инъекции или пересадки должна быть адаптирована в зависимости от типа клеток, содержащихся в клеточном препарате в соответствии с данным изобретением, и желаемого терапевтического или эстетического эффекта. Более подробное описание способа приготовления и использования клеточных композиций в соответствии с данным изобретением, в частности, в зависимости от типа клеток и желаемого терапевтического или эстетического эффекта, дано в разделе Примеры ниже.
Препараты на основе кератиноцитов или фибробластов в соответствии с данным изобретением могут использоваться сразу же после забора или после формирования клеточной культуры как описано выше. Тем не менее клеточные препараты в соответствии с данным изобретением могут быть приготовлены после формирования клеточной культуры, как описано выше.
Клеточные препараты в соответствии с данным изобретением обладают лучшей жизнеспособностью и стабильностью (включая сохранение таких свойств консервированных клеток, как способность синтезировать белки или осуществлять доставку факторов роста) по сравнению с клетками, приготовленными в среде без аутологичной композиции тромбоцитарного концентрата в соответствии с данным изобретением. Далее улучшается пролиферация полученных таким путем клеток: клетки растут быстрее (быстрее на от около 2 до 5 дней) и имеет большую плотность по сравнению с контрольными средами и средами с недостатком сыворотки. Преимущество способа приготовления клеточной композиции в соответствии с данным изобретением заключается в том, что используется та же аутологичая среда в качестве вектора для клеточной культуры, консервирования клеток, инъекции клеток, вектора для био-стимуляции клеток и регенерации тканей.
Пример 1: Терапевтическое применение аутологичного тромбоцитарного концентрата в соответствии е данным изобретением в комбинации с аутологичной сывороткой, обогащенной тромбином
Аутологичная сыворотка с тромбином, предназначенная для использования в качестве препарата, обогащенного тромбином, готовится в соответствии с данным изобретением. Один из оригинальных аспектов данного способа заключается в том, что пробирки для отбора клеток в соответствии с изобретением, содержащие, соответственно, аутологичный препарат сыворотки с тромбином и препарат тромбоцитарного концентрата, могут быть приготовлены одновременно. Стеклянную пробирку для приготовления аутологичной сыворотки с тромбином (ATS) центрифугируют в течение от около 8 минут до около 10 минут. Пластиковую пробирку (изготовленную из СОС или СОР) или стеклянную пробирку для приготовления концентрата плазмы или композиции PRP центрифугируют в течение от около 8 минут до около 10 минут. Таким образом, удачно, что композиции ATS и PRP являются готовыми для использования практически одновременно.
Для обеспечения полимеризации фибриногена с образованием фибриновой сетки (что происходит в течение процесса коагуляции) исключительно в момент нанесения богатого тромбоцитами препарата на рану, композиция тромбоцитарного концентрата и аутологичная сыворотка с тромбином (активатор коагуляции) наносятся одновременно в объемном соотношении от около 10:1, 10:3 до около 10:10 (соотношение объема концентрата к объему активатора коагуляции) на рану, в зависимости от типа нанесения. Разница в пропорции оказывает влияние на скорость коагуляции для достижения эффекта приклеивания.
Одновременная доставка обоих препаратов достигается, например, с помощью устройства, включающего два шприца (например, 10 мл шприц для композиции тромбоцитарного концентрата и 1 мл или 3 мл шприца для сыворотки с тромбином), которые обеспечивают выпуск препаратов одновременно таким образом, что они смешиваются и полимеризуются на месте контакта с раной.
Пример 2: Косметическое применение аутологичного тромбоцитарного концентрата в соответствии с данным изобретением
Примеры косметического применения аутологичного тромбоцитарного концентра настоящего изобретения включают:
Смешивание тромбоцитарного концентрата в соответствии с данным изобретением с кремом, предпочтительно эмульсией, перед нанесением на рану, после хирургии или на здоровую кожу. В течение процесса абсорбции тромбоцитарный препарат проникает в кожу с помощью крема или эмульсии в целях усиления эффекта увлажнения и биостимуляции регенерации или омоложения кожи. Инъекция в дермальный слой может быть осуществлена с помощью метода мезотерапии путем повторяющихся инъекций вручную или с помощью устройства без иглы. Инъекция может быть осуществлена подкожно в морщину для коррекции объема. Инъекция тромбоцитарного концентрата, смешанного в объемном соотношении 10:1 или 10:3 с аутологичной сывороткой с тромбином с целью достижения эффекта заполнения и/или стойкой коррекции объема может быть осуществлена в морщину, лоб, челюсти, зону больших коренных зубов, щек, подбородка и/или груди. При необходимости, инъекция концентрата плазмы, смешанного со свежеполученной жировой тканью в объемном соотношении около 10:10, может быть осуществлена подкожно для существенной коррекции объема лица. При необходимости, инъекция концентрата плазмы, смешанного со свежеполученной жировой тканью в объемном соотношении около 10:3 или около 10:2, может быть осуществлена подкожно для существенной коррекции объема груди или корректирования контуров тела.
С помощью гидрогеля, такого как препарат Albugel (HP 1 543 846) 100% Альбумина или любого другого гидрогеля, получаемого в результате ретикуляции Альбумина и любого другого химического соединения, такого как полиэтиленгликоль, или любого другого ингредиента, с помощью высокогидрофильного носителя на бумажной основе достигается его контакт с кожей до тех пор, пока не будет достигнута абсорбция богатой тромбоцитами плазмы.
Настоящее изобретение включает следующие способы осуществления мезотерапевтических инъекций:
- в папиллярную дерму,
- подкожно в ретикулярную дерму или
- глубоко над надкостницей.
Три уровня инъецирования, также называемые «Медицинской подтяжкой лица» могут осуществляться с использованием плазмы, плазмы и жировой ткани и/или плазмы и трикальцийфосфата.
Пример 3: Получение аутологичной ассоциации мышечных клеток
Образец аутологичной клеточной ассоциации в соответствии с данным изобретением может быть приготовлен с помощью способа согласно данному изобретению, причем клетки скелетных мышц (мышечные клетки-предшественники или сателлитные стволовые клетки) получают на стадии (d) или (е).
а) Стволовые миобластные клетки-предшественники
Выполняют биопсию скелетных мышц 7×3 см из Vastus lateralis. Выполняют примирование мышцы за день до проведения биопсии с помощью внутримышечной инъекции декадрона и маркаина (лигнокаина длительного действия) на предполагаемом участке биопсии (участок кожи 10 на 15 см на боковой поверхности бедра, лежащий выше мышцы). Мышцу режут на кубики и энзимно расщепляют с помощью комбинации коллагеназы, проназы и трипсина (Worthington). Мышечные экспланты наносят на чашки Петри, покрытые композицией аутологичного тромбоцитарного концентрата, в соответствии с данным изобретением, и культивируют в присутствии 95% кислорода и 5% углекислого газа при 37°С в течение от 3 до 4 недель. Десмин или экспрессию CD-56 применяют в качестве маркеров миобластов для различения миобластов и фибробластов. Пролиферация клеток-предшественников миобластов в 3-мерной форме показана на Фиг. 3. Клеточная пролиферация может быть усилена с помощью подвергания воздействию света при длине волны 633 нм и 2 Дж/см2 в течение 10 минут в процессе культивирования. В день трансплантации (например, после от 3 до 4 недель культивирования) клетки скелетных мышц могут быть отделены с помощью трипсина или любого другого способа, как описано здесь, и помещены в композицию аутологичного тромбоцитарного концентрата в соответствии с данным изобретением. Инъекции в миокард могут быть осуществлены в виде прямого инъецирования или множественных инъекций, осуществляемых с помощью зонда, в левый желудочек миокарда. Приготовление миобластных клеток в соответствии с данным изобретением полезно для лечения кардиологических заболеваний, таких как регенерация сердечной ткани, лечение сердечной недостаточности, хронической сердечной недостаточности, ишемической или неишемической сердечной недостаточности и неишемической кардиомиопатии. Объем фракции выброса может быть увеличен на 9% для реципиентов скелетных миобластов, страдающих кардиологическими заболеваниями.
Указанный выше клеточный препарат может быть также полезен при лечении недержания мочи (экстракты миобластных клеток, приготовленные как описано выше и инъецируемые в шейку мочевого пузыря), желудочно-пищеводного рефлюкса или гастроэзофагеальной рефлюксной болезни (экстракты миобластных клеток, приготовленные как описано выше и инъецируемые в нижний пищеводный сфинктер) и недержания кала (экстракты миобластных клеток, приготовленные как описано выше и инъецируемые в параанальную зону).
Также может быть приготовлен комбинированный препарат фибробластов и миобластов (фибробласты присутствуют в мышечной биопсии и являются отростками из перимизия с другой стороны мышечных трубочек и сателлитных стволовых клеток). В случае лечения кардиологических заболеваний, в миокард помещают смесь препарата фибробластных клеток и препарата миобластных клеток (полученных как указано выше) при соотношении фибробласты/миобласты около 30:70.
Для лечения недержания шейки мочевого пузыря готовят отдельную культуру фибробластов в то же самое время, что и миобласты, как описано выше, причем клеточный препарат фибробластов инъецируют парауретрально, а клеточный препарат миобластов инъецируют в рабдосфинктер под ультразвуковым контролем.
b) Сателлитные стволовые клетки
Миобласты и сателлитные стволовые клетки культивируют ex vivo в присутствии композиции аутологичного тромбоцитарного концентрата в соответствии с данным изобретением. Прайминг клеточной пролиферации наблюдают после 7 дней первичной культуры.
После культивирования в течение 3-4 недель клетки собирают и помещают в тканевую питательную среду (DMEM и 5-20% объема композиции аутологичного тромбоцитарного концентрата в соответствии с данным изобретением), включающую лишенный эпителия амнионный лоскут человека размером 4×4 см и композицию аутологичного тромбоцитарного концентрата в соответствии с изобретением. Также могут использовать лоскут аутологичного активированного фибринового полимера. Аутологичный активированный фибриновый полимер готовят с помощью центрифугирования плазмы с глюконатом кальция при объемном соотношении около 10:3 до около 10:10. Затем препарат подвергают облучению ультрафиолетом в течение 10 минут. В течение культивирования (обычно в течение от около 2 до около 3 недель) клетки распространяются по амнионовой конструкции и формируют монослой. Жизнеспособность и разрастание монослоя оценивается с помощью осуществления биопсии края лоскута дважды в неделю и гистологической оценки толщины монослоя.
В день трансплантации (например, после от около 3 до 4 недель культивирования) поверхность желудочка покрывают композицией аутологичного тромбоцитарного концентрата в соответствии с данным изобретением и затем размещают лоскут, способ получения которого описан выше, клетками вниз на поверхность желудочка сердца в целях заселения стволовыми клетками, находящимися на лоскуте, сегмента сердца после инъецирования в желудочек. Ретенция клеток осуществляется с помощью амниона, который является инертным и не вызывает иммунологической реакции.
Препарат сателлитных стволовых клеток в соответствии с данным изобретением полезен при кардиологической регенерации и лечении сердечной недостаточности в качестве препарата для формирования ткани в области кардиомиопластики.
Пример 4: Получение аутологичной ассоциации фибробластных клеток
Образец аутологичной ассоциации фибробластных клеток в соответствии с данным изобретением может быть приготовлен с использованием способа в соответствии с данным изобретением, причем дермальные фибробластные клетки получают на стадии (d) или (е).
Дермальные фибробласты выделяют и культивируют в соответствии со следующей процедурой: За один месяц до осуществления биопсии основной участок кожи донора (за передней подмышечной складкой, например в области, не подверженной старению под воздействием солнца) обрабатывают кремом с витамином А для активации дермальных фибробластов. Выполняют биопсию кожи площадью 10×6 мм при полной толщине и иссечение под микроскопом для удаления всего эпителия. Подвергнутую эпителизации биопсию (дерму) затем разрезают на квадраты размером 3×3 мм в качестве эксплантов. Затем папиллярную дерму располагают сверху и культивируют ее с помощью эрлифта (Molnar et al., 1996, выше) и способа воздушной границы раздела фаз (Metier et al., 2002, выше) при нахождении половины экспланта в воздушной среде. Экспланты наносят на чашки (например 6 эксплантов на одну секцию) в DMEM и культивируют при 37°С в присутствии 95% кислорода и 5% СО2 в течение от около 3-5 до около 9 дней в чашках Петри или флаконе для культивирования клеток. Питательную среду меняют каждые 3 дня. В течение культивирования наблюдают непрерывный рост при экспансии клеток в 2-мерной форме в виде планарных монослоев. На от 7 до 9 дне после начала культивирования достигают изменения в пролиферации и смены типа паттерна на 3-мерный путем добавления разбавленной 5-20% композиции аутологичного тромбоцитарного концентрата в соответствии с данным изобретением в питательную среду: клетки примируют композицией аутологичного тромбоцитарного концентрата (0.2 мл на секцию чашки) для минимального покрытия основания. Затем клетки растут в виде 3-мерного матрикса фибринового геля. Затем клетки подвергают дифференциации для формирования биологического каркаса или сети в фибриновом геле. Количество клеток измеряют с помощью ежедневного подсчета на решетке и в целях оценки апоптоза: используют инвертированный микроскоп (Olympus®).
После от 3 до 6 недель культивирования клетки собирают с фибринового геля. Жизнеспособность клеток анализируют с помощью классического способа с использованием трипанового синего и бактериологической оценки, включая проверку на вирусное заражение. Увеличенный в объеме экстракт фибробластных клеток, способ получения которого описан выше, помещают в шприц в присутствии композиции аутологичного тромбоцитарного концентрата в соответствии с данным изобретением и инъецируют препарат в лицевые морщины, более конкретно под морщины. Инъекции должны осуществляться по всему лицу, включая лоб, челюсти, зону больших коренных зубов, щеки, подбородок и горло. Степень экспансии клеток может быть увеличена с помощью подвергания клеточной культуры воздействию света при длине волны 633 нм. Препарат фибробластных клеток в соответствии с данным изобретением полезен для омоложения лица, обработки лицевых морщин и морщин, лечения кожи, поврежденной различными видами излучения (поврежденной в результате лучевого дерматита или поврежденной в результате воздействия солнца кожи); кожи, подвергающейся старению, и/или обожженной кожи и/или обработки лицевых морщин, морщин, акне (в частности являющегося результатом дермабразии), ожогов, краснухи или рубцов, связанных с кожной сыпью, витилиго, липоатрофии или липодистрофии, такой как липодистрофия, вызванная СПИДом; саркомы Капоши, кожных келоидов или болезни Дюпюитрена (ладонный фиброматоз) и/или при лечении, связанном с омоложением кожи.
Пример 5: Получение аутологичной жировой ткани и ассоциации жировых клеток
Жировую ткань аспирируют предпочтительно из нижней зоны брюшной полости, очищают с помощью промывания PBS, центрифугируют до седиментации для выделения жировой ткани от триглицерида и инородных остатков. В то же время производят забор и центрифугирование крови для приготовления концентрата плазмы или композиции PRP в соответствии с данным изобретением. Комбинирование жировой ткани и композиции PRP осуществляют в шприце, используемом для аспирации жира сразу же после удаления триглицеридов с помощью стерильного устройства для аспирации композиции PRP. Соотношение концентрата плазмы и жировой ткани составляет 10:10 для лица и 10:3 для груди и в случае корректирования контуров тела.
Предпочтительно инъекция выполняется немедленно, в течение минимального периода после времени приготовления обоих клеточных концентратов в целях минимизации времени манипуляции с клетками ex vivo.
Образец аутологичной ассоциации клеток в соответствии с данным изобретением может быть приготовлен с помощью способа в соответствии с данным изобретением, причем, например, стволовые клетки жировой ткани, мезенхимные стволовые клетки (MSC) получают на стадии (d) или (е). MSC могут быть выделены с помощью коллагеназы (преадипоцитов, предшественников эндотелиальных клеток) и помещены в суспензию с PRP при инъецировании препарата, включая подкожное, внутрисуставное инъецирование или в целях ортопедической хирургии. Препарат может быть соединен с ацеллюлярным кожным матриксом для непосредственного нанесения на рану, или может быть подвергнут культивированию в лаборатории перед нанесением. Взрослые стволовые клетки жировой ткани выделяют с помощью стандартного способа в 5-20% композиции аутологичного тромбоцитарного концентрата в соответствии с данным изобретением. Затем препарат инъецируют с помощью аппликатора пациентам, страдающим недостатком ткани, таким как травматический недостаток или возрастной недостаток для пациентов в возрасте около 40 лет. Препарат жировых клеток в соответствии с данным изобретением полезен при лечении липоатрофии у таких пациентов, как страдающие ВИЧ/СПИДом пациенты и других пациентов, таких как пациенты, страдающие врожденной гемиатрофией лица.
Пример 6: Получение аутологичной ассоциации хондроцитов
Образец аутологичной ассоциации клеток в соответствии с данным изобретением может быть приготовлен с помощью способа в соответствии с данным изобретением, причем хондроциты получают на стадии (d) или (е).
Хрящевую ткань выделяют из колена донора (при размере биопсии 10×5 мм) и режут на кубики. Хондроциты хрящевой ткани культивируют в течение 4-6 недель в питательной среде, обогащенной разбавленной 5-20% композицией аутологичного тромбоцитарного концентрата в соответствии с данным изобретением. Хрящевые клетки затем отделяют с помощью энзимного расщепления (с помощью коллагеназы и проназы). Клеточный препарат затем хирургически подсаживают пациенту, страдающему обширными дефектами и повреждениями хрящей.
Клеточный препарат хондроцитов в соответствии с данным изобретением полезен при лечении обширного повреждения и эрозии хрящей и при проведении артроскопии.
Другой пример применения клеточного препарата хондроцитов в соответствии с данным изобретением представляет собой использование в области ринопластики без проведения хирурги и с помощью единственной инъекции: пациенту, страдающему врожденной атрофией носового хряща.
За день перед проведением инъекции выполняют биопсию ушного хряща в размере 0.4×0.4 мм и помещают ее в стерильную среду, включающую DMEM и антибиотик. Биопсию подвергают энзимному расщеплению с применением трипсина и коллагеназы. Отделенные хондроциты затем ресуспендируют в композиции аутологичного тромбоцитарного концентрата в соответствии с данным изобретением. Пациент сначала проходит локальную анестезию и дезинфекцию носа. Затем указанный выше препарат хондроцитов инъецируют на поверхность хряща и надкостной мембраны участка, требующего увеличения объема или подъема. На второй стадии композицию аутологичного тромбоцитарного концентрата в соответствии с данным изобретением инъецируют в поверхностную часть кожи носа в целях биостимулирования регенерации t и омоложения кожи. Спустя один час выполняется инъекция, и пациент может возвращаться домой. Наблюдают исключительную степень восстановления жизнеспособности клеток: количество восстановленных и инъецированных хондроцитов и клеток плазмы достигало около 109 клеток. Клеточный препарат хондроцитов в соответствии с данным изобретением, таким образом, полезен при лечении дефектов носового хряща без проведения хирургической процедуры, всего лишь с помощью инъекции.
Пример 7: Получение аутологичной ассоциации стволовых клеток пуповины
Образец аутологичной ассоциации клеток в соответствии с данным изобретением может быть приготовлен с помощью способа в соответствии с данным изобретением, причем стволовые клетки пуповины получают на стадии (d) или (е). Стволовые клетки пуповины выделяют и затем криоконсервируют и используют при лечении заболеваний крови.
Препарат стволовых клеток пуповины в соответствии с данным изобретением полезен при лечении гематологических заболеваний (таких как талассемия).
Процесс инъецирования включает ресуспендирование стволовых клеток в концентрате плазмы с последующим реинъецированием.
Пример 8: Получение аутологичной ассоциации клеток сухожилия
Образец аутологичной ассоциации клеток в соответствии с данным изобретением может быть приготовлен с помощью способа в соответствии с данным изобретением, причем клетки сухожилия получают на стадии (d) или (е).
Фибробластные клетки сухожилия выделяют в соответствии со стандартной процедурой в 5-20% композиции аутологичного тромбоцитарного концентрата в соответствии с данным изобретением. Фибробластные клетки сухожилия культивируют в течение от около 1 до около 3 недель в питательной среде, обогащенной композицией аутологичного тромбоцитарного концентрата в соответствии с данным изобретением. Перед проведением инъекции клетки ресуспендируют в свежеполученном концентрате плазмы. Клеточный препарат затем инъецируют пациенту в поврежденный участок (например, место разрыва сухожилия, область сустава). Инъекция может быть осуществлена при контроле с помощью ультразвуковой эхографии в целях локализации поврежденного участка и лучшего проведения пересадки и имплантации.
Инъецирование препарата фибробластных клеток сухожилия может быть также осуществлено в участок рядом с ротаторной манжетой плеча: сначала разрыв ротаторной манжеты восстанавливают с помощью артроскопии, затем проводят инъекцию препарата фибробластных клеток сухожилия с помощью длинного зонда в восстанавливаемый участок. Это стимулирует заживления фибробластов сухожилия на крае ротаторной манжеты, предотвращает образование гематомы в ограниченном пространстве под акромионом, а также предотвращает онемение плеча за счет ускорения заживления и стимулирования процесса реабилитации и подвижности сустава. Препарат клеток сухожилия в соответствии с данным изобретением полезен при лечении разрыва сухожилия, суставного артрита, вызванного травмами или являющегося результатом старения, ротаторной манжеты плеча.
Пример 9: Получение аутологичной ассоциации клеток связок и десен
Образец аутологичной ассоциации клеток в соответствии с данным изобретением может быть приготовлен с помощью способа в соответствии с данным изобретением, причем клетки надкостничной мембраны и десны получают на стадии (d) или (е). Под действием общей и местной анестезии при асептических условиях выполняют сбор ткани надкостницы (приблизительно 10×10 мм) с внутренней нижнечелюстной поверхности щеки у четырех здоровых сук породы бигль. Собранную надкостницу разрезают на части размером 3×3 мм. Ткани помещают непосредственно на чашку с 6 сегментами и культивируют (в течение от около 3 до около [beta] недель) во влажной атмосфере, состоящей из 5% СО2 и 95% воздуха при 37°С в питательной среде, обогащенной 5-20% композицией аутологичного тромбоцитарного концентрата в соответствии с данным изобретением. Клетки надкостничной мембраны и десны выделяют с помощью энзимного расщепления и культивируют статическим методом. Обычно культивирование в течение 6 недель является достаточным для получения подходящей толщины надкостничной мембраны для имплантации. Композицию аутологичного тромбоцитарного концентрата и клеточного препарата инъецируют пациенту в поврежденный участок после ресуспендирования.
Пример 10: Получение аутологичной ассоциации клеток роговицы
Работали на чашках Петри с термочувствительной покрывающей мембраной для сбора клеток без применения энзимного раствора, такого как коллагеназа или трипсин.
Образец аутологичной ассоциации клеток в соответствии с данным изобретением может быть приготовлен с помощью способа в соответствии с данным изобретением, причем клетки роговицы получают на стадии (d) или (е).
Биопсия была взята из эпикантуса на краю роговицы, и лимбальные стволовые клетки роговицы культивировали для проведения аутологичной трансплантации тому же субъекту спустя 4 недели культивирования в чашках Петри или флаконах, покрытых композицией аутологичного тромбоцитарного концентрата в соответствии с данным изобретением.
Культивированные стволовые клетки роговицы (лимбального происхождения) могут быть ex vivo нанесены на поверхность лишенного эпителия амниона человека в монослое после посева суспензии культивированных и жизнеспособных кератиноцитов роговицы в соответствии с данным изобретением на конструкцию. Для посева используют около 500000 клеток и дают им возможность покрыть поверхность конструкции с клетками после дальнейшего культивирования в течение около 3 недель. Нанесение клеток производят после около трех недель культивирования примарной клеточной культуры, при этом может потребоваться повторное проведение посева. Полученная в результате биологическая клеточно-биокомпозитная конструкция, включающая коллаген, волокна амниона и кератиноциты роговицы, состоит из мембраны и монослоев клеток. Препарат клеток роговицы в соответствии с данным изобретением может быть нанесен на поверхность растворимых контактных линз, помещаемых на поврежденную роговицу. Контактные линзы растворяются и клетки закрывают дефект роговицы. Препарат клеток роговицы в соответствии с данным изобретением может быть назначен в форме глазных капель пациентам, страдающим ксерофтальмией. Также указанный выше амнион может использоваться самостоятельно для поцарапанной роговицы или в составе конструкции, а клеточный препарат в соответствии с данным изобретением может быть прикреплен на внутреннюю поверхность биологических или искусственных контактных линз и затем нанесен на роговицу и покрыт повязкой для глаз.
Также клетки роговицы ресуспендируют в свежеполученном концентрате плазмы перед нанесением.
Препарат клеток роговицы в соответствии с данным изобретением полезен для облегчении боли, вызванной ксерофтальмией, при лечении синдрома Стивенса-Джонсона и роговичной слепоты, являющейся результатом кислотных или щелочных ожогов на производстве, язв роговицы, таких как трудно поддающиеся лечению язвы роговицы нейротрофического, герпетического и иммунологического происхождения.
Пример 11: Получение аутологичной ассоциации клеток костного мозга
Образец аутологичной ассоциации клеток в соответствии с данным изобретением может быть приготовлен с использованием способа в соответствии с данным изобретением, причем клетки костного мозга получают на стадии (d) или (е).
Костный мозг бедра аспирируют, собирают и центрифугируют в готовом к использованию устройстве для приготовления концентрата костного мозга в целях отделения красных кровяных клеток.
Препарат клеток костного мозга используют самостоятельно или затем смешивают его с тромбоцитарным концентратом в соответствии с данным изобретением или заново центрифугируют с глюконатом кальция для формирования способной к наложению мембраны и наносят или инъецируют с помощью аппликатора на поврежденный участок пациента. Препарат клеток костного мозга согласно данному изобретению полезен при лечении дефекта кости или хряща. Препарат клеток костного мозга может использоваться самостоятельно или в комбинации с концентратом плазмы в соответствии с данным изобретением. Также может использоваться хрящевая мембрана с глюконатом кальция.
Пример 12: Получение аутологичной ассоциации шванновских клеток
Образец аутологичной ассоциации шванновских клеток в соответствии с данным изобретением может быть приготовлен с помощью способа согласно изобретению, причем шванновские клетки получают на стадии (d) или (е).
Под воздействием местной анестезии выполняют биопсию N. Saphenous или N. SURALIS в их нижней точке. Биопсию нерва режут на маленькие блоки, при этом индуцируют примарные культуры в чашках Петри, обогащенные композицией аутологичного тромбоцитарного концентрата в соответствии с данным изобретением. Монослои увеличиваются в 3-мерной форме, при этом клетки собирают с помощью расщепления трипсином и ресуспендируют в свежесобранном тромбоцитарном концентрате в шприце, предназначенном для локального прокола открытого хирургически или поврежденного спинного мозга. Было установлено, что культивируемые клетки содержат миелин. Препарат шванновских клеток в соответствии с данным изобретением полезен при лечении повреждения периферических нервов, сшивании нервов и повреждении спинного мозга.
Пример 13: Аутологичный клеточный препарат панкреатических островков человека
Образец аутологичной ассоциации клеток в соответствии с данным изобретением может быть приготовлен с помощью способа в соответствии с данным изобретением, причем клетки панкреатических островков получают на стадии (d) или (е).
Панкреатические островки собирают с помощью открытой биопсии и отбирают с помощью энзимного расщепления и Ficol или Hypaqe (Page et al., 2007, Diba. Vas. Dis. Res., 7-12), затем ресуспендируют в питательной среде, обогащенной композицией тромбоцитарного концентрата в соответствии с данным изобретением. Затем инъецируют клеточный препарат панкреатических островков через воротную вену в печень.
Клеточный препарат панкреатических островков в соответствии с данным изобретением полезен при лечении диабета I типа или инсулинозависимого диабета и для снижения гипергликемии, связанной с сахарным диабетом.
Пример 14: Получение аутологичных остеобластных клеток человека
Образец аутологичной ассоциации клеток в соответствии с данным изобретением может быть приготовлен с помощью способа в соответствии с данным изобретением, причем остеобластные клетки получают на стадии (d) или (е).
Пункционную биопсию компактной костной ткани получают из подвздошного гребня или эквивалентного участка (верхней челюсти) под действием местной анестезии. Специалист, практикующийся в области культивирования костных и остеобластных клеток, располагает костную биопсию в среде DMEM при 4°С в асептических условиях или в аналогичной транспортной среде ex vivo. Затем биопсию кости разрезают и расщепляют в 10% разбавленной коллегеназе типа 1 (Sigma или Boehringer) при 37°С в течение 15 минут в ламинар-боксе. Также в качестве альтернативы могут использовать расщепление трипсином (Worthington). Энзимное расщепление останавливают с помощью трехкратного промывания композицией аутологичного тромбоцитарного концентрата в соответствии с данным изобретением в 10% DMEM при 4°С. Препарат центрифугируют, осаждают и ресуспендируют. Костные фрагменты нанося! на чашки j Петри или помещают во флаконы в виде эксплантов с помощью эрлифта в композиции аутологичного тромбоцитарного концентрата в соответствии с данным изобретением. Препарат культивируют при 37°C с антибиотиками, гентимицином и амфотерицином В при токе газа, состоящим из 95% воздуха и 5% СО2. Питательную среду меняют три раза в течение недели, при этом каждый раз в среду DMEM добавляют 10-20% композиции аутологичного тромбоцитарного концентрата в соответствии с данным изобретением. Жизнеспособность и морфологию клеток оценивают три раза в течение недели для оценки степени подвижности, апоптоза и 3-мерного разрастания монослоев. Образование микрофиламента и дифференциацию оценивают с помощью инвертированного микроскопа (Olympus®). Проверяют отсутствие бактериального и вирусного заражения. Остеобласты могут быть внесены в свежесобранную аутологичную полимерную фибриновую мембрану, приготовленную с помощью центрифугирования тромбоцитарного концентрата с глюконатом кальция при соотношении от около 10:3 до около 10:10. Полимер фибрин обладает способностью закрывать поврежденные кровеносные сосуды. Остеобласты могут быть нанесены на амнион человека для создания клеточного биокомпозитного каркаса и носителя/конструкции монослоев клеток после посева 100,000 клеток на мембрану, как описано выше, и обеспечения экспансии монослойной мембраны в течение более 3-4 недель, что позволяет создать уникальную конструкцию, состоящую из остеобластов, амниона и мембраны, для использования и переноса в целях нанесения на дефект кости или зону имплантации после несрастания перелома на любом участке. Остеобласты могут быть также смешаны со свежим концентратом костного мозга и тромбоцитарным коцентратом перед инъецированием/нанесением и далее соединены с аутологичной сывороткой с тромбином при отсутствии необходимости в наличии мягкого геля. Клеточный препарат остеобластов в соответствии с данным изобретением полезен при лечении дефектов костей, костной имплантации или лечении заболеваний костей.
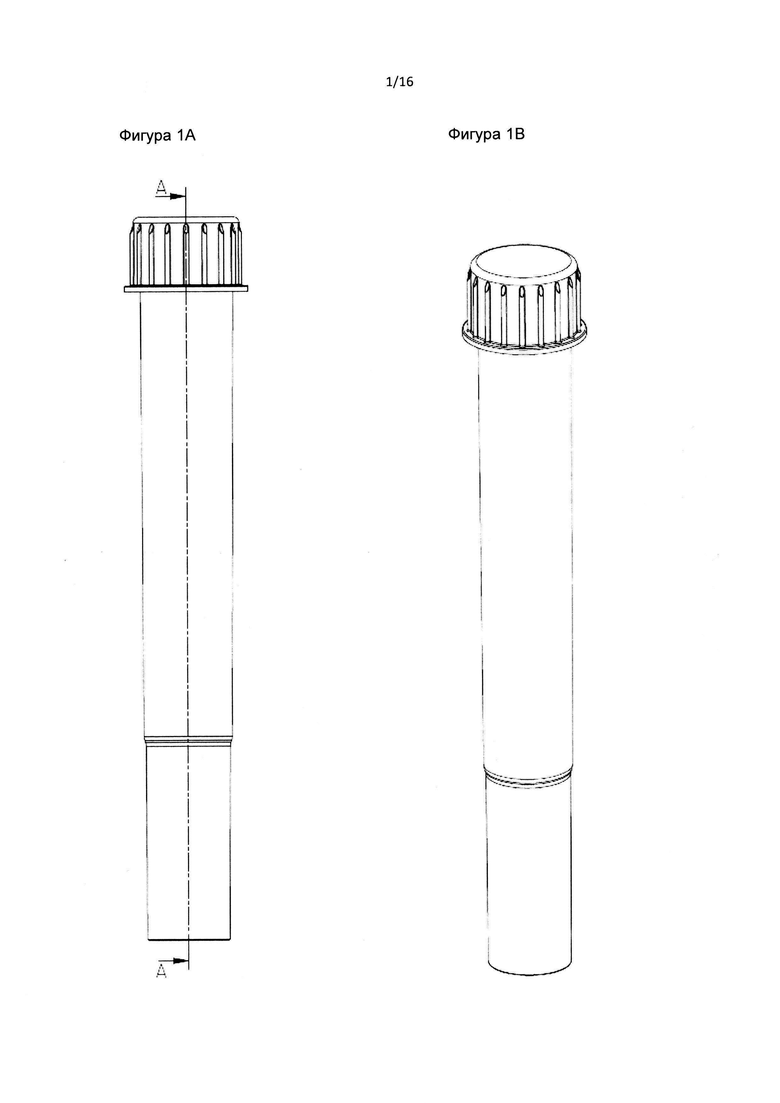
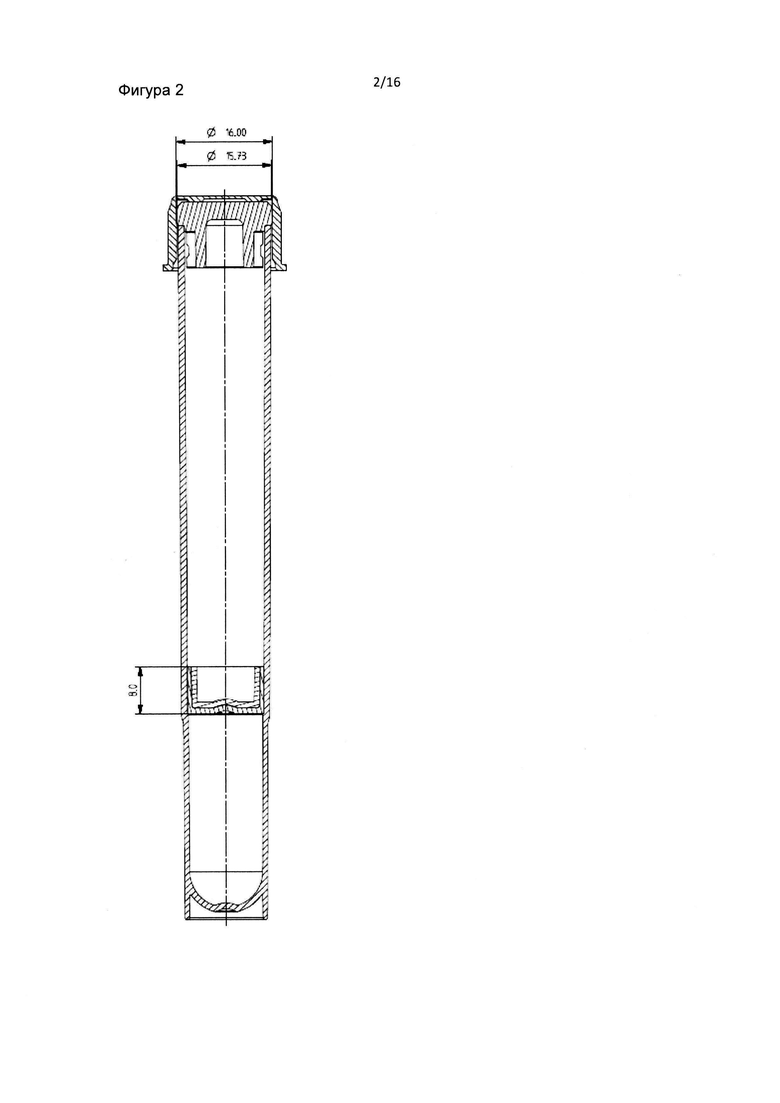
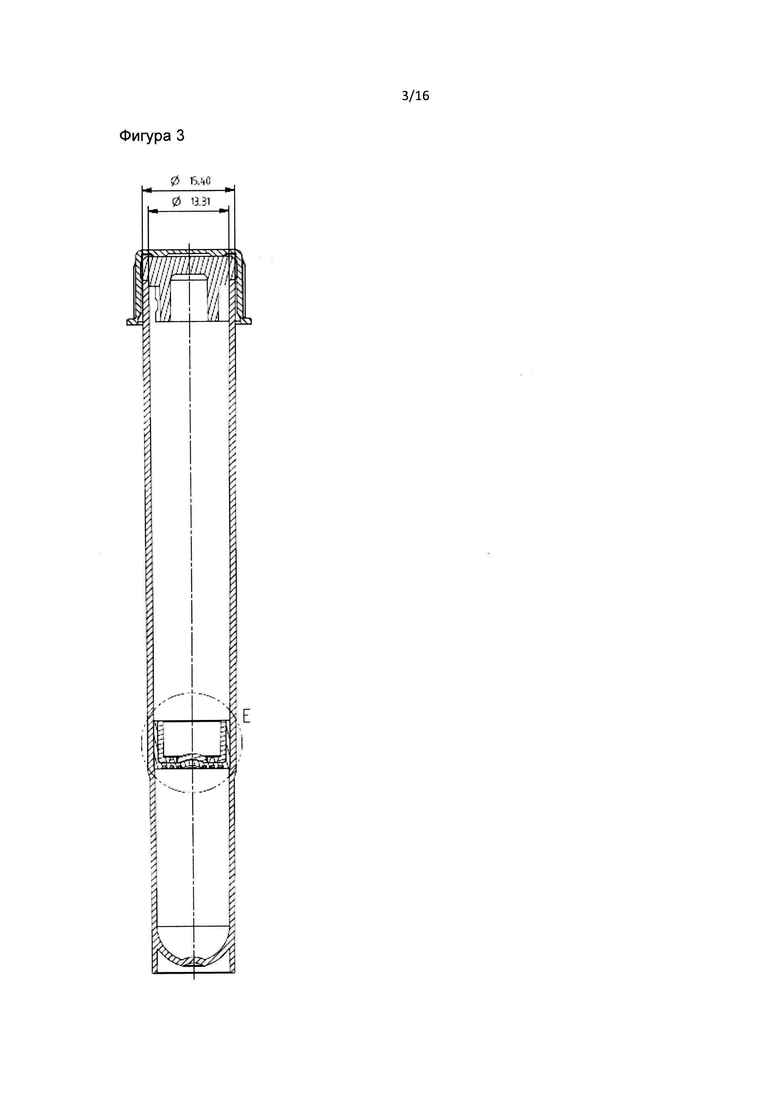
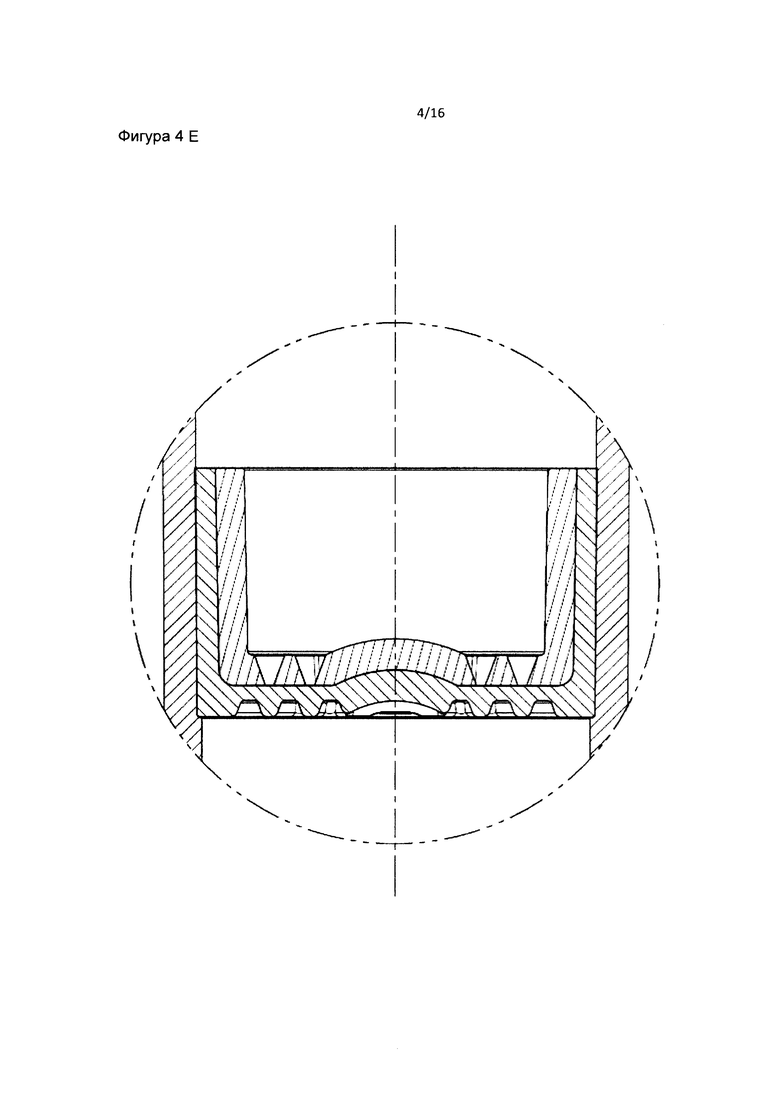
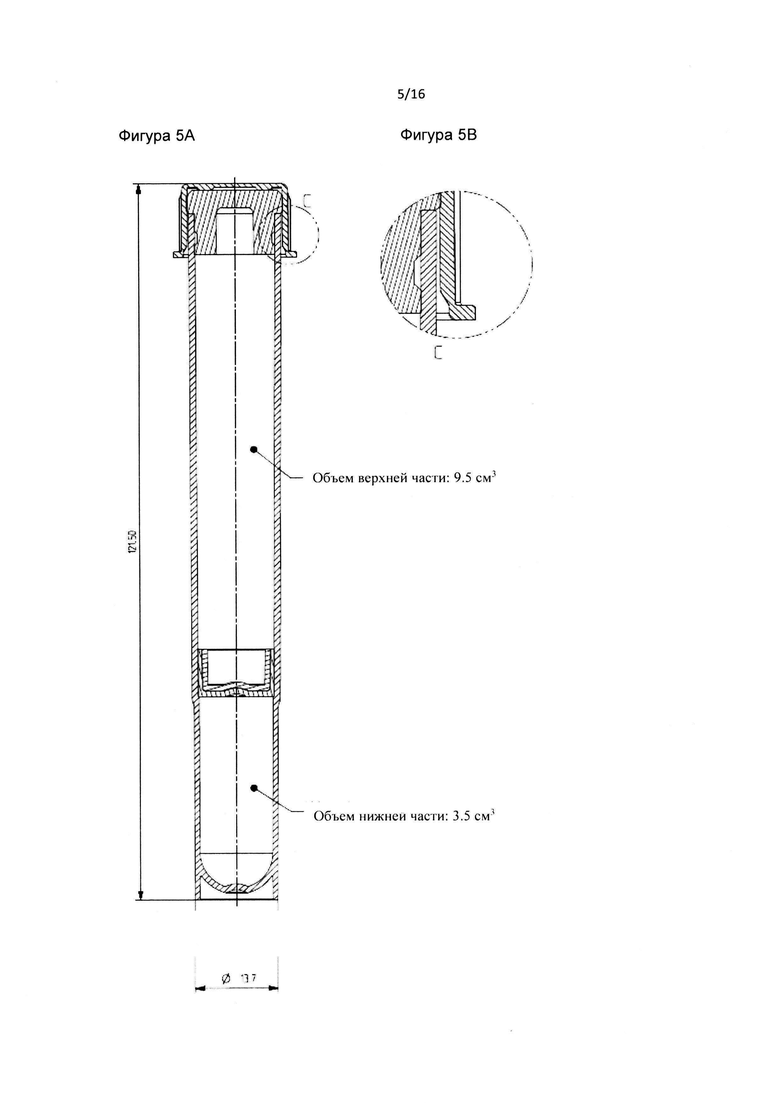
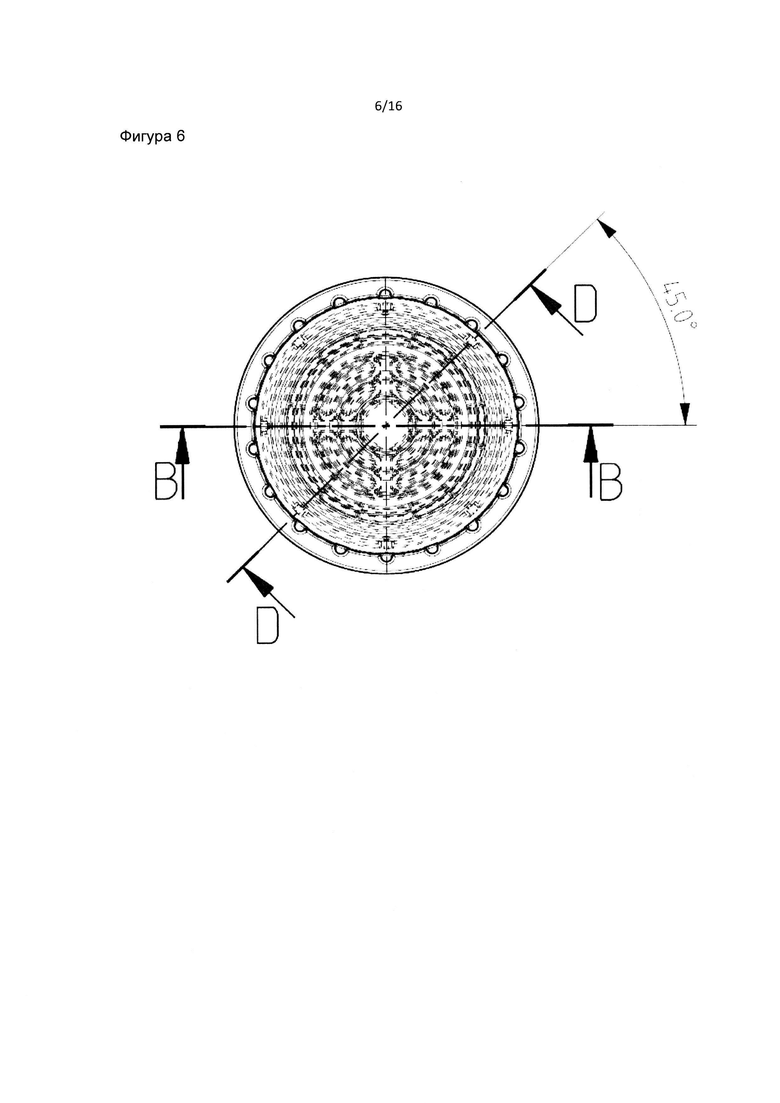
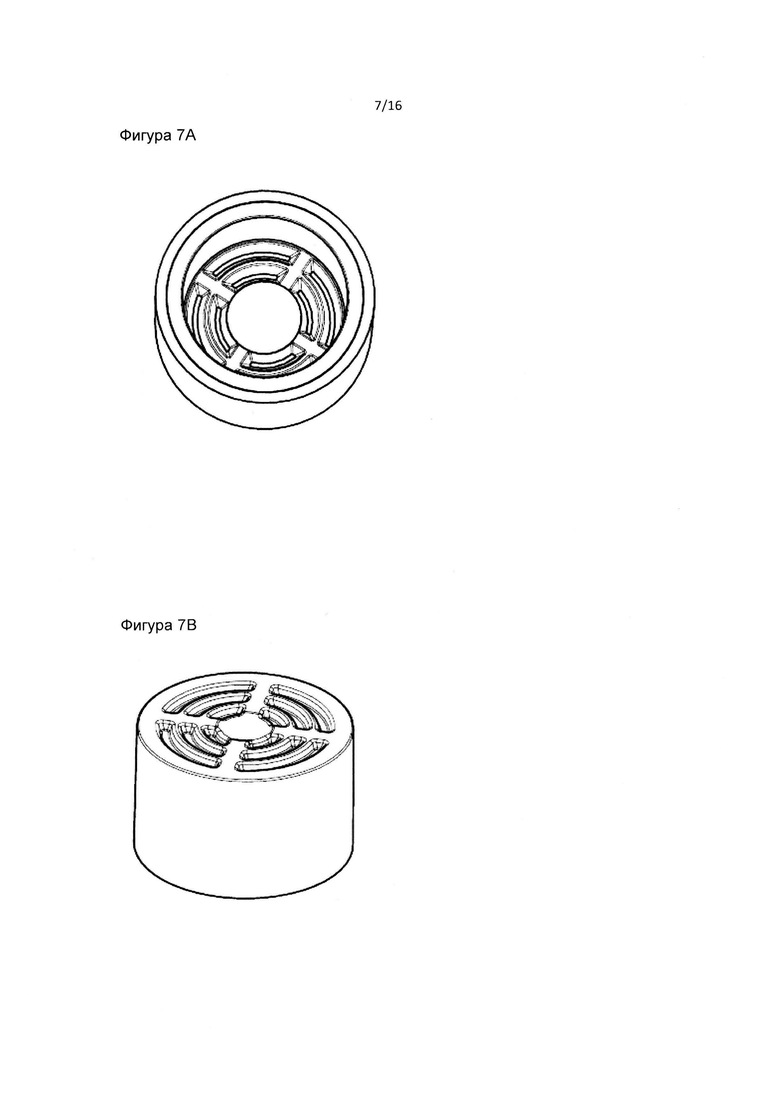
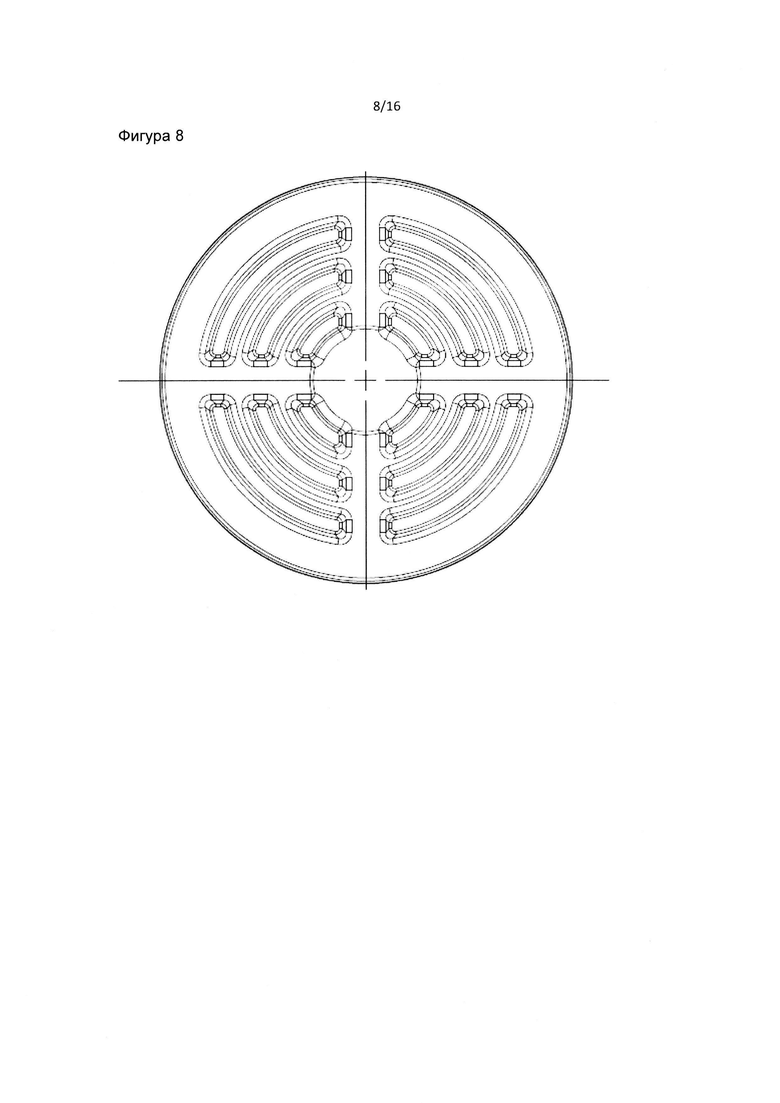
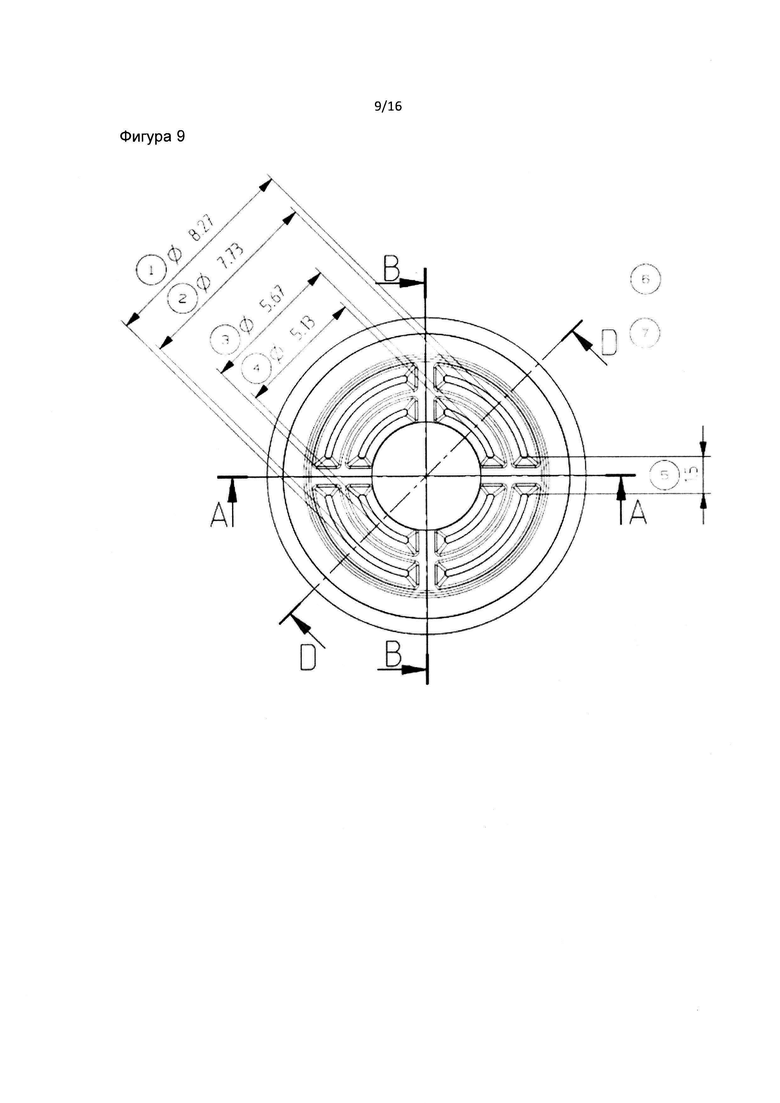
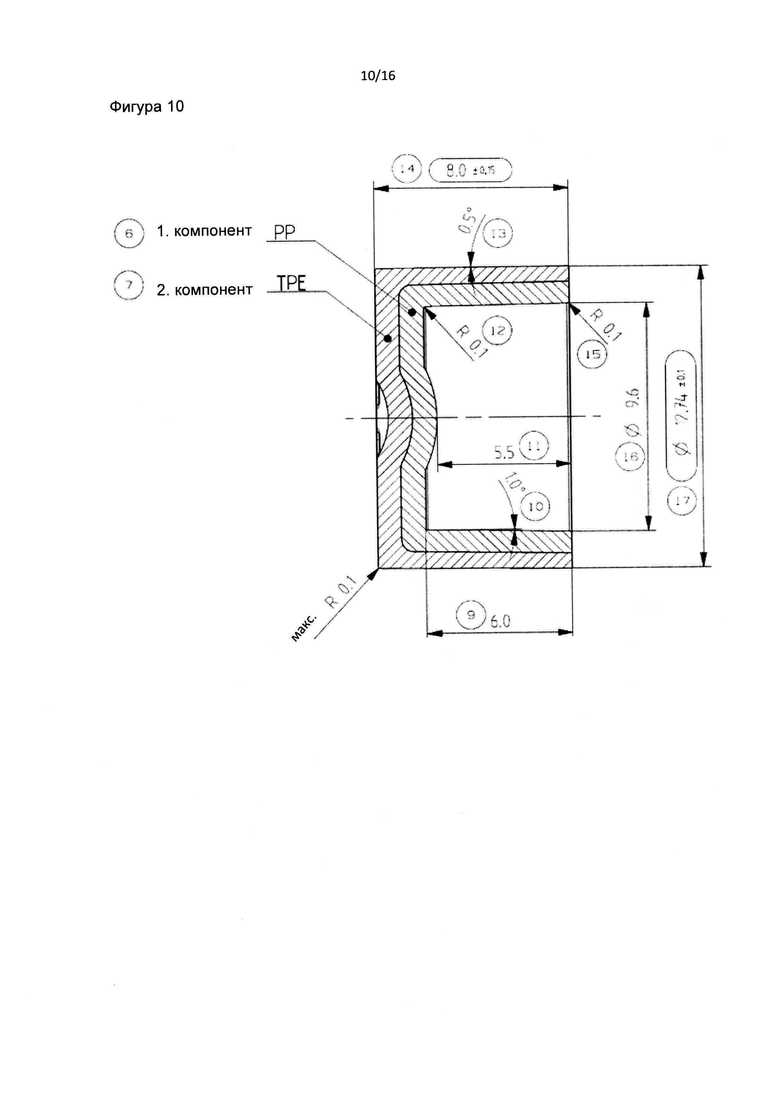
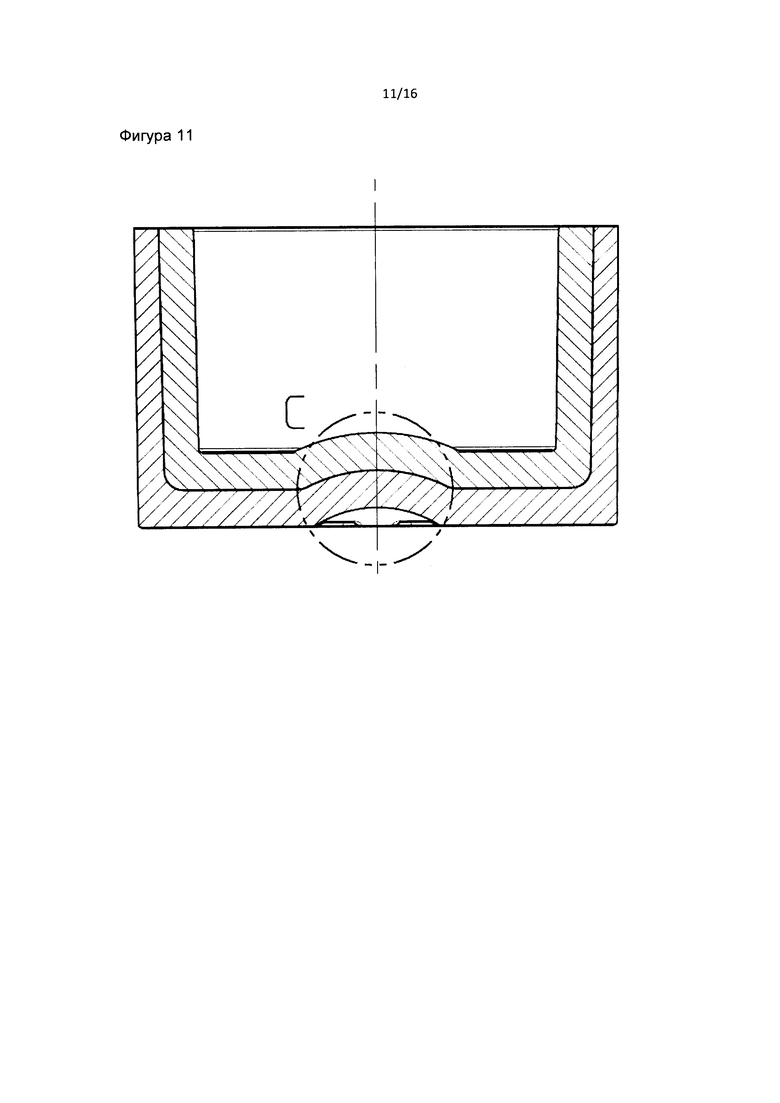
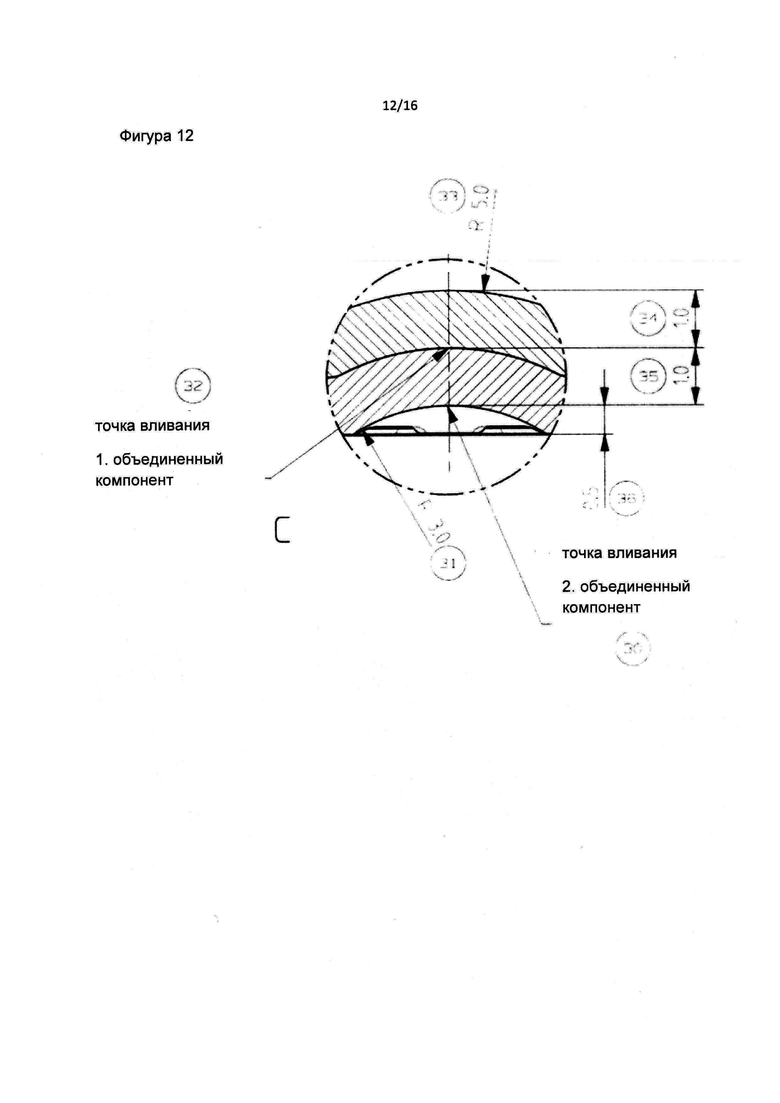
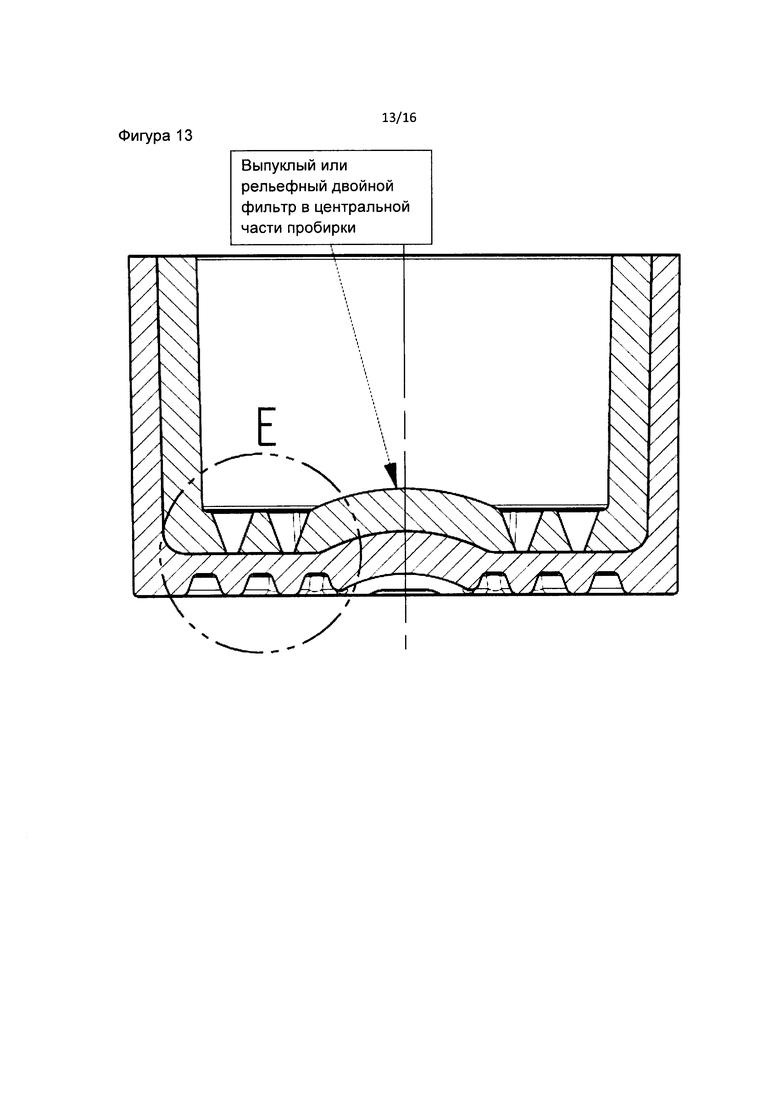
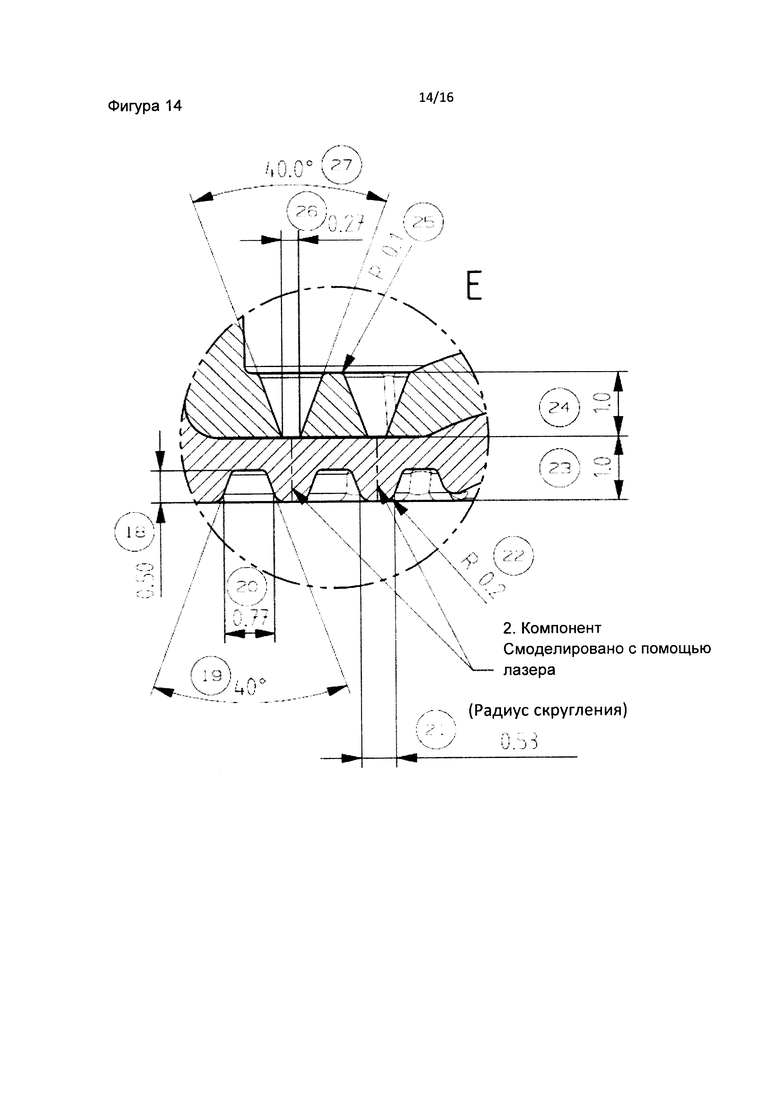
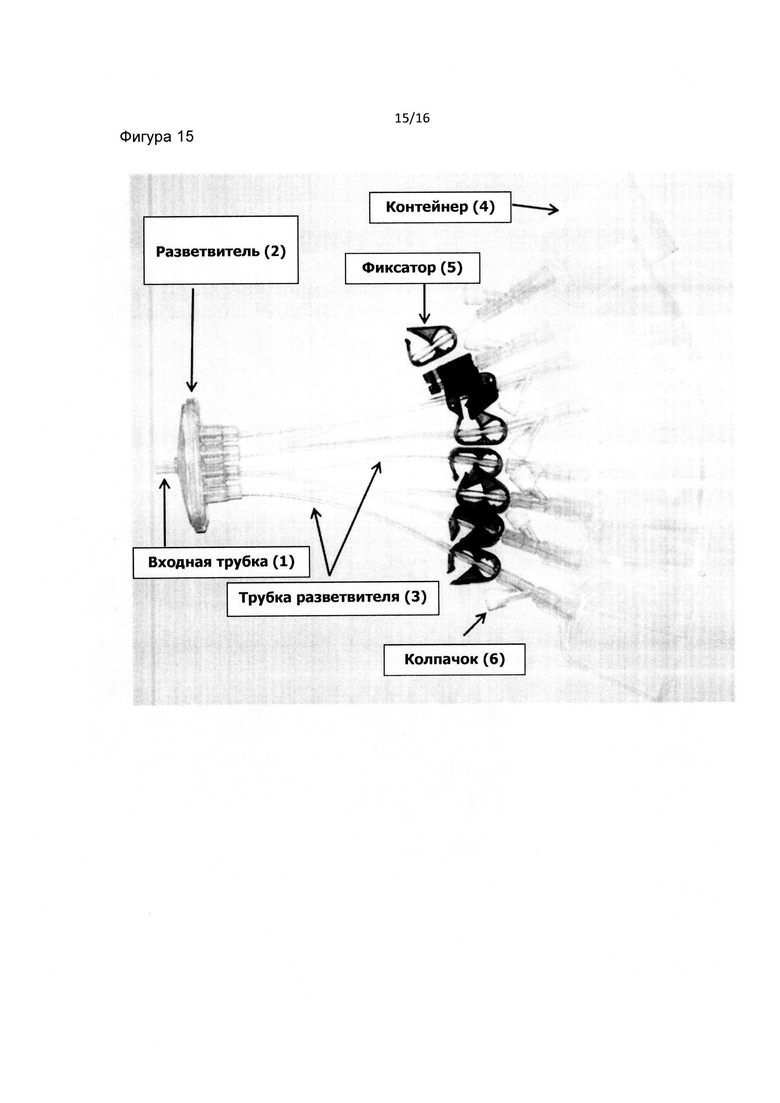
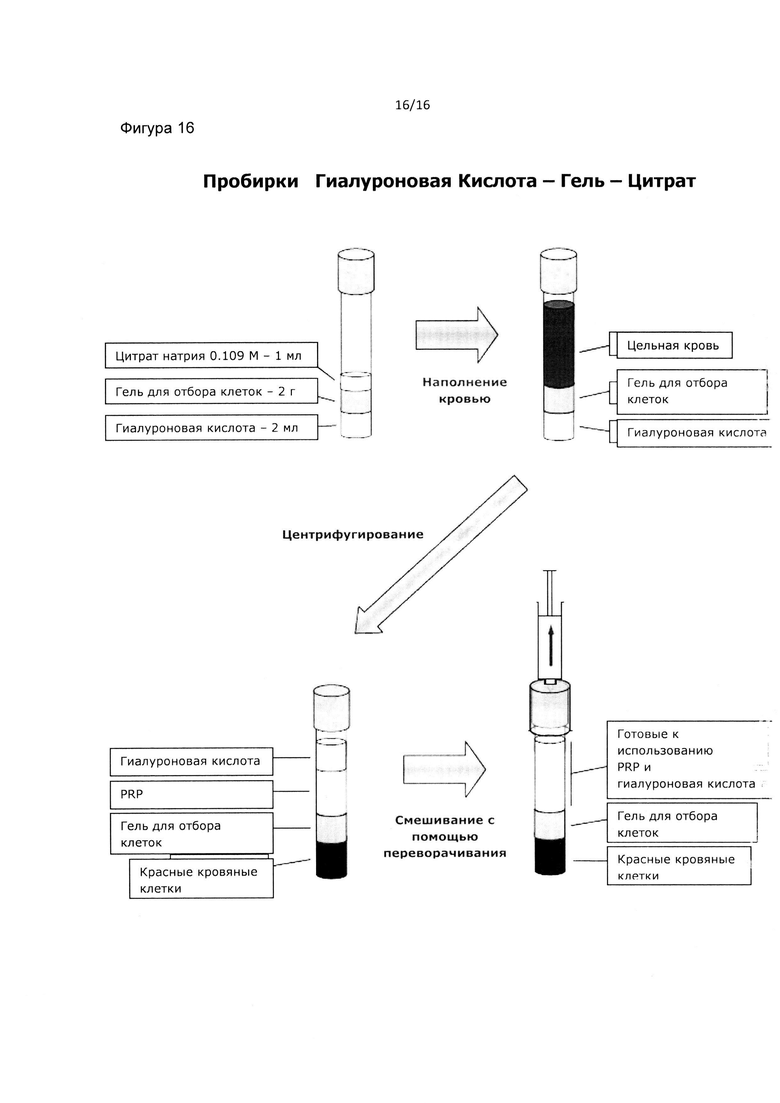
Группа изобреетний относится к химико-фармацевтической промышленности и представляет собой способ приготовления композиции, содержащей обогащенную тромбоцитами плазму и гиалуроновую кислоту, причем способ включает стадии: забора цельной крови в устройство, содержащее гиалуроновую кислоту и антикоагулянт; центрифугирования указанного устройства и сбора супернатанта, содержащего указанную гиалуроновую кислоту и обогащенную тромбоцитами плазму. Данное устройство для забора крови имеет входное отверстие для ввода цельной крови; содержит вакуум, предназначенный для аспирации образца цельной крови; имеет предназначенный для использования вакуум, составляющий от 8 до 10 мл; и является стерильным. Данное устройство включено в изделие и набор для заживления ран и тканей. Изобретения включают способы заживления ран и тканей посредством композиций, полученных способом, описанным ранее. Группа изобретений обеспечивает немедленное использование полученных аутологичных клеток крови с одновременным сохранением их целостности для заживления ран и тканей. К тому же клеточные препараты в соответствии с данными изобретениями обладают лучшей жизнеспособностью и стабильностью. 8 н. и 13 з.п. ф-лы, 16 ил., 14 пр.
1. Устройство, содержащее гиалуроновую кислоту и антикоагулянт, для заживления ран и тканей, где указанное устройство и указанная гиалуроновая кислота являются подходящими для центрифугирования, и где указанное устройство:
имеет входное отверстие для ввода цельной крови;
содержит вакуум, предназначенный для аспирации образца цельной крови; имеет предназначенный для использования вакуум, составляющий от 8 до 10 мл; и является стерильным.
2. Устройство по п. 1, где указанное устройство дополнительно содержит тиксотропный гель.
3. Устройство по п. 2, где указанный тиксотропный гель представляет собой тиксотропный гель на основе сложного полиэфира.
4. Устройство по пп. 2 или 3, где указанная гиалуроновая кислота расположена под указанным тиксотропным гелем и/или указанный тиксотропный гель расположен под указанным антикоагулянтом.
5. Устройство по п. 2 или 3, где указанный тиксотропный гель расположен в слое под слоем указанного антикоагулянта и над слоем указанной гиалуроновой кислоты, и где слои указанной гиалуроновой кислоты, указанного тиксотропного геля и указанного антикоагулянта проходят друг через друга при центрифугировании устройства.
6. Устройство по любому из пп. 1-3, где указанное устройство дополнительно содержит активатор коагуляции и/или сыворотку с тромбином.
7. Устройство по любому из пп. 1-3, где указанное устройство дополнительно содержит по меньшей мере один клеточный экстракт, клеточную композицию, трикальция фосфат (TCP), костный заменитель, хитозан, косметический крем, косметическую маску, жировую ткань, концентрат клеток костного мозга, любрицин, cd-желатин, ботулотоксин и/или глюконат кальция.
8. Устройство по любому из пп. 1-3, где указанное устройство дополнительно содержит цельную кровь и/или обогащенную тромбоцитами плазму.
9. Устройство по любому из пп. 1-3, где указанный антикоагулянт выбран из анигирудина, бензилсульфонил-d-Arg-Pro-4-амидинобензиламида (ВАРА), гепарина, цитрата натрия, цитрата, кислого цитратного раствора на основе декстрозы (ACD), цитрат-теофиллин-аденозин-дипиридамола (CTAD), калиевой соли
этилендиаминтетрауксусной кислоты (EDTA) и их комбинации.
10. Устройство по п. 1, где указанное устройство:
i) герметично закрыто и/или
ii) предназначено для работы полностью в замкнутом цикле.
11. Устройство по п. 1, где указанное устройство является пробиркой для центрифугирования.
12. Устройство по п. 11, где пробирка для центрифугирования представляет собой стеклянную пробирку-сепаратор, полиэтилентерефталатную пробирку-сепаратор, пробирку-сепаратор из сополимера циклического олефина (СОС) или полимера циклического олефина (СОР) или фильтровальную пробирку-сепаратор из сополимера циклического олефина (СОС) или полимера циклического олефина (СОР).
13. Устройство по любому из пп. 10-12, где указанная гиалуроновая кислота находится на дне указанного устройства и включает от 1 мл до 2 мл указанной гиалуроновой кислоты.
14. Устройство по любому из пп. 10-12, где указанная гиалуроновая кислота присутствует в количестве от 1 мл до 2 мл, указанный тиксотропный гель присутствует в количестве 2 г, а указанный антикоагулянт представляет собой 0,109 М цитрат натрия, присутствующий в количестве 1 мл.
15. Изделие для заживления ран и тканей, включающее устройство по любому из пп. 1-14.
16. Набор для заживления ран и тканей, причем указанный набор включает устройство по любому из пп. 1-14 и инструкции по применению указанного устройства.
17. Способ приготовления композиции, содержащей обогащенную тромбоцитами плазму и гиалуроновую кислоту, причем способ включает стадии:
a) забора цельной крови в устройство по любому из пп. 1-14, содержащее гиалуроновую кислоту и антикоагулянт,
b) центрифугирования указанного устройства и
c) сбора супернатанта, содержащего указанную гиалуроновую кислоту и обогащенную тромбоцитами плазму.
18. Композиция для заживления тканей, содержащая гиалуроновую кислоту и обогащенную тромбоцитами плазму, полученная способом по п. 17.
19. Композиция для заживления ран, содержащая гиалуроновую кислоту и обогащенную тромбоцитами плазму, полученная способом по п. 17.
20. Способ заживления ткани, предусматривающий:
a) обеспечение композиции для заживления тканей по п. 18 и
b) нанесение терапевтически эффективного количества композиции для заживления тканей на поврежденную ткань.
21. Способ заживления раны, предусматривающий:
a) обеспечение композиции для заживления ран по п. 19 и
b) нанесение терапевтически эффективного количества композиции для заживления ран на рану.
| WO 2008022651 A1, 28.02.2008 | |||
| EP 1547606 A1, 29.06.2005 | |||
| ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ОСНОВЕ ГИАЛУРОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩЕЕ АНТИМИКРОБНЫМ, РАНОЗАЖИВЛЯЮЩИМ И ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕЙСТВИЕМ | 1999 |
|
RU2195262C2 |
| US 2004151709 A1, 05.08.2004 | |||
| WO 2009016451 A2, 05.02.2009. | |||
Авторы
Даты
2018-09-25—Публикация
2011-03-11—Подача