Изобретение относится к фармакологии.
Изобретение позволяет проводить оценку наличия цито- и эмбриотоксических свойств у соединений, представляющих фармакологический интерес.
Одной из актуальных проблем современной фармакологии и медицины является создание эффективных и безопасных лекарственных препаратов, направленных на лечение тех или иных заболеваний. Для их создания необходимы адекватные, высокопроизводительные и воспроизводимые, а также относительно дешевые технологии скрининга потенциальных лекарственных соединений. Разработка технологии репрограммирования соматических клеток и получения индуцированных плюрипотентных стволовых (ИПС) клеток млекопитающих, включая человека, открыла новые перспективы в трансплантологии и изучении молекулярных и клеточных основ тяжелых болезней человека in vitro [1, 2]. Не случайно, что именно за эти работы была присуждена Нобелевская премия по физиологии и медицине за 2012 г. Развитие технологии репрограммирования соматических клеток человека в ИПС клетки открывает новые возможности для создания моделей ряда тяжелых патологий человека, в том числе нейродегенеративных, а также тест-систем, позволяющих проводить масштабный скрининг и выяснять свойства лекарственных средств, направленных на лечение конкретных заболеваний in vitro, учитывая при этом индивидуальные особенности пациента [3, 4]. Тот факт, что технология репрограммирования позволяет получать ИПС-клетки из индивидуальных дифференцированных соматических клеток больных и здоровых пациентов, дает ей существенные преимущества перед технологией эмбриональных стволовых клеток, что, в свою очередь, открывает большие перспективы в развитии персонализированной медицины [5, 6]. Развитие такой технологии позволит существенным образом сократить эксперименты по тестированию перспективных для фармакологии соединений на животных. Возможность дифференцировки ИПС клеток в кардиомиоциты, гепатоциты, фибробласты и нейроны позволит проводить прицельный доклинический токсикологический скрининг соединений in vitro [7, 8].
Известны первичные культуры эукариотических клеток, которые используются для скрининга соединений с различными свойствами [9].
Однако использование данных клеток обладает следующими недостатками. Во-первых, тестирование проводится на культурах нервных и глиальных клеток различных животных, но не человека. Во-вторых, невозможно получать клетки из мозга взрослого человека в достаточных количествах для проведения скрининга фармакологических соединений.
Преимущества использования репрограммированных клеток, а именно ИПС клеток представлены в таблице 1.
Таким образом, задача эффективного скрининга соединений, представляющих интерес для фармакологии, является в настоящее время чрезвычайно актуальной. Актуальна также задача выявления соединений, обладающих нежелательными (токсическими) эффектами на различные соматические клетки человека.
Раскрытие изобретения
Применение индуцированных плюрипотентных стволовых (ИПС) клеток человека позволяет оценивать цитотоксические эффекты тестируемых соединений.
Применение индуцированных плюрипотентных стволовых (ИПС) клеток человека и их производных также позволяет оценивать эмбриотоксичность тестируемых соединений по влиянию на образование эмбриоидных тел и формирование клеток трех зародышевых листков.
Осуществление изобретения
Техническим результатом, достигаемым при реализации настоящего изобретения, является ускорение тестирования соединений, представляющих фармакологический интерес, на наличие цитотоксической и эмбриотоксической активностей. Указанный технический результат достигается за счет использования индуцированных плюрипотентных стволовых клеток, полученных репрограммированием фибробластов кожи человека.
Определение терминов
Под культурой ИПС клеток понимается клеточная культура, полученная репрограммированием фибробластов кожи взрослого человека по описанной ранее методике [1, 2, 10].
Под цитотоксичностью понимается способность фармакологического соединения вызывать гибель ИПС клеток по сравнению с контролем (отсутствие добавленного соединения).
Под эмбриотоксичностью понимается способность фармакологического соединения ингибировать образование эмбриоидных тел и влиять на их размеры по сравнению с контролем (отсутствие добавленного соединения), а также влиять на формирование клеток трех зародышевых листков (эктодермы, мезодермы, энтодермы).
Примеры собственных экспериментов
Ниже приведены примеры, иллюстрирующие изобретение:
Пример 1. Получение репрограммированных клеток, а именно ИПС клеток из фибробластов кожи взрослого донора
Фибробласты кожи взрослого донора были разморожены и посеяны на лунки 12-луночного планшета с плотностью 30% монослоя в среде DMEM+P/S+L-Glu+10% FBS+bFGF 2нг/мкл. Через 2 дня после рассева клетки достигли плотности 60% монослоя и в этот момент были инфицированы всеми четырьмя вирусами в следующем количестве LeGO-hOct4-MOI 5, LeGO-hSox2-MOI5, LeGO-hc-Myc-MOI2.5, LeGO-hKlf4-MOI5. Через 4 дня клетки были пересеяны на пластик 1 к 22,5 в среде DMEM+P/S+L-Glu+10% FBS. На следующий день среда была заменена на среду ESmed. Затем клетки культивировали в этой среде в течение 8-10 дней, среду меняли раз в 2 дня. К этому моменту на чашках образовалось множество клонов с различной морфологией. Эти клоны были механически пересеяны 1 к 1 на матригель в среде mTeSRl. Через несколько дней некоторые из колоний стали расти и морфологически становиться более похожими на ЭСК, другие же дифференцировались и перестали расти.
Через неделю был произведен отбор клонов на 24-луночный планшет на матригель, в среде mTeSRl было посеяно 15 различных клонов, после чего их культивировали раздельно. В итоге 6 клонов показали способность к стабильному росту на подложке матригель в среде mTeSRl. Два клона были использованы для дальнейшей работы, оставшиеся заморожены в жидком азоте.
Пример 2. Оценка цитотоксичности исследуемых соединений
Культивирование ИПС клеток проводили в среде mTeSr (Stem Cell Technologies, Канада). В качестве подложки для культивирования использовался матригель (BD Biosciences, США). Смену среды производили каждый день.
Клетки пассировали каждые 5-7 дней с использованием lmg/ml диспазы (Invitrogen). Среду сливали и промывали 1 раз средой DMEM + антибиотик пенициллин/стрептомицин (50 ЕД/мл; 50 мкг/мл) (п/с), заливали теплой диспазой и ставили в СО-2 инкубатор на 5-7 мин. Затем диспазу удаляли и промывали 5 раз средой DMEM+п/с. В чашку заливали 1 мл среды mTeSR и аккуратно счищали все колонии пластиковым наконечником на 5-200 мкл. Отбирали аликвоту 100 мкл, переносили ее в чашку Петри и добавляли 900 мкл среды. Клетки тщательно ресуспендировали и проводили подсчет в камере Горяева. Полученное количество клеток экстраполировали на общее количество клеток в суспензии. Аккуратно покачивая в руках чашку с суспензией клеток, рассевали их на 24-луночный планшет в концентрации 40 тыс. клеток на лунку. На следующий день делали смену среды с одновременным добавлением пептидов. На следующий день вносили исследуемые вещества.
На следующий день делали смену среды с одновременным добавлением тестируемых соединений. В качестве таких соединений использовали пептиды семакс (Met-Glu-His-Phe-Pro-Gly-Pro), альфа-меланоцитстимулирующий гормон (МСГ) и PGP (Pro-Gly-Pro) в концентрациях от 1 нМ до 10 мкМ и антибиотик генецитин G418 (50-200 мкг/мл) с известным цитотоксическим действием.
На 3 сутки после внесения исследуемых соединений проводили оценку пролиферативной активности клеток, используя МТТ тест. Для этого в лунку вносили свежеприготовленный раствор МТТ (3-(4,5-диметилтиазолил-2)-2,5-дифенил тетразолиум бромид) в концентрации 0,3 мг/мл по 400 мкл/лунку и инкубировали 3 часа в СО-2 инкубаторе. Удаляли раствор МТТ и вносили 400 мкл/лунку раствора ДМСО (диметилсульфоксид) и инкубировали 2 часа при комнатной температуре на шейкере. Оптическую плотность измеряли при 600 нм.
Методом МТТ (3-(4,5-диметилтиазол-2-ил-2,5 дифенилтетразолиум бромид) было показано, что семакс и МСГ незначительно влияли на пролиферативную активность репрограммированных клеток, полученных от «здорового» донора. Метод определения пролиферативной активности с помощью МТТ был использован из-за своей быстроты и технологичности. Пептид PGP незначительно снижал пролиферативную активность только репрограммированных клеток от «здорового» донора. Здесь и в дальнейшем представлены данные по одной линии клеток от каждого донора. На других линиях были получены сходные результаты.
Как видно из представленных данных (рис. 1), антибиотик G418 обладал сильным цитотоксическим действием на ИПС клетки. Семакс и МСГ повышали жизнеспособность ИПС клеток, полученных от «здорового» донора.
Пример 3. Оценка эмбриотоксичности исследуемых соединений
Для получения эмбриоидных тел (ЭТ), колонии ИПС клеток снимали с подложки с использованием диспазы. Клетки промывали средой ДМЕМ с п/с и заливали 1 мл диспазы, инкубировали в СО-2 инкубаторе 7 мин. Удаляли диспазу и 5 раз промывали средой ДМЕМ с п/с. Заливали 1 мл среды mTeSr и счищали колонии пласиковым наконечником на 5-200 мкл. Отбирали аликвоту 100 мкл, переносили ее в чашку Петри и добавляли 900 мкл среды. Клетки тщательно ресуспендировали и проводили подсчет в камере Горяева. Полученное количество клеток экстраполировали на общее количество клеток в суспензии. Далее кусочки колоний ИПС клеток переносили в 24-х луночную плашку с ультранизкой адгезией по 160 тыс.клеток /лунку в 1 мл ростовой среде для недифференцированных клеток mTeSr с одновременным добавлением исследуемых веществ и культивировали в течение 24 часов, после этого делали половинную смену среды на среду для роста ЭТ. Среда для культивирования ЭТ имела следующий состав: ДМЕМ/Р12 (Hyclone), 20% фетальная бычья сыворотка (Hyclone ЕС), 2 мМ L-глутамин, 0.1 мМ β-меркаптоэтанол, 1% смесь аминокислот, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл) (все - Hyclone). Еще через 24 часа среду полностью заменяли ростовой для ЭТ. Подсчет ЭТ осуществляли под микроскопом через 24-48 часов после посева, для чего всю суспензию переносили в 96-луночный круглодонный планшет по 100 мкл на лунку. Это позволило максимально точно определить количество ЭТ в каждом варианте.
Данные по влиянию пептидов на процесс образования эмбриоидных тел (ЭТ) представлены на рис. 2. Пептиды добавлены до конечных концентраций, указанных на рис. 2
Было показано, что пептид семакс и МСГ не оказывали достоверного влияния на количество образующихся ЭТ в линиях ИПС клеток, полученных от «здорового» донора ИПС клеток. Антибиотик G418 обладал сильным токсическим действием на образование ЭТ.
Пример 4. Влияние исследуемых соединений на развитие трех зародышевых листов
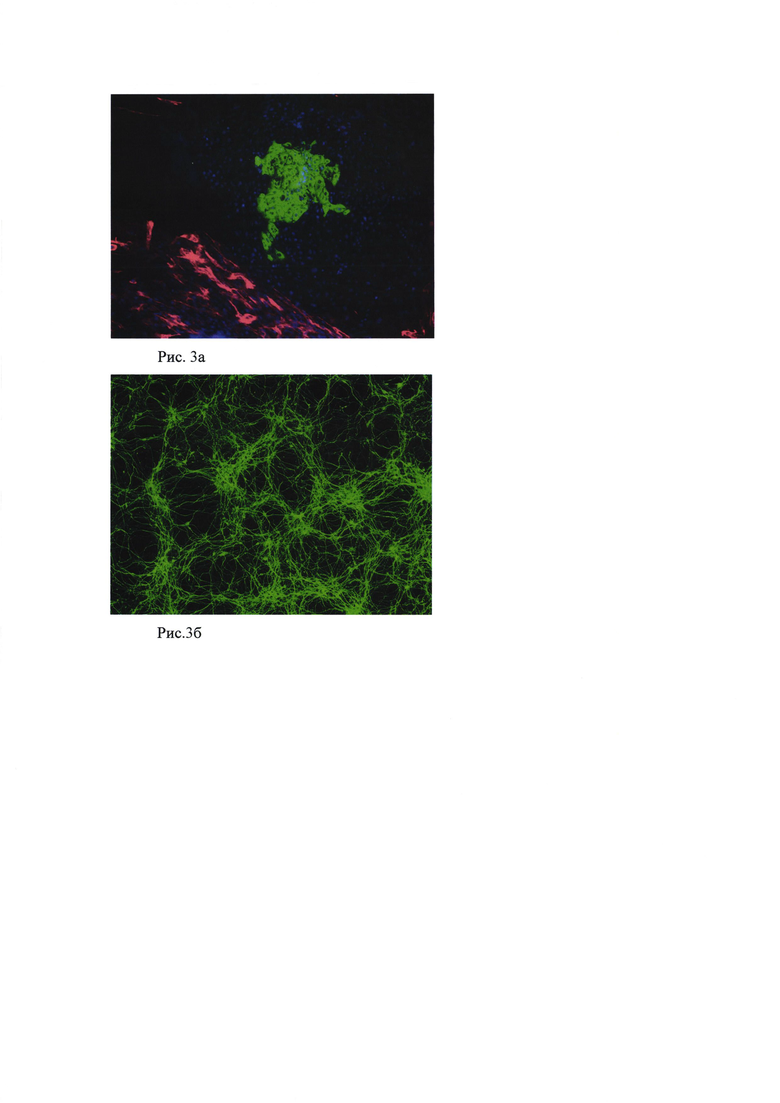
Для получения дифференцированных клеток 3-5-дневные ЭТ, сформированные в присутствии исследуемых соединений (семакс, альфа-МСГ и PGP), высевали по 10-15 штук на желатинизированную чашку 35 мм в ростовой среде для ЭТ. Клетки культивировали в течение 21 дня. Смену среды осуществляли каждые 2-3 суток. Через 21 день проводили окрашивание специфическими антителами. Клетки промывали 1 раз PBS и вносили 4% ПФА в 20 мМ фосфатно-солевом буфере (PBS), pH 7,3, инкубировали в течение 30 мин при комнатной температуре. После чего отмывали 20 мМ PBS, pH 7,3, 3 раза по 10 мин. Затем обрабатывали раствором PBS, содержащим 0,1% Triton Х100, 5% FCS (эмбриональная телячья сыворотка) (PBS-Triton-FCS) в течение 15 минут при комнатной температуре для блокирования мест неспецифического связывания антител. После этого добавляли первичные антитела к βIII- тубулину в разведении 1:2000, α-1 фетопротеину (1:200), десмину (1:200) (все антитела - Abeam) и инкубировали в течение ночи при +4°C. После трехкратной отмывки PBS-Triton-FCS наносили вторичные антитела и инкубировали в течение 2 часов при комнатной температуре, снова отмывали 20 мМ PBS, pH 7,3, 3 раза по 10 мин. Оценивали специфическое связывание антител под флуоресцентным микроскопом.
На рис. 3а и 3б отражено иммуноцитохимическое окрашивание антителами, где а) мезодерма - десмин (красный), энтодерма α-1 фетопротеин (зеленый), Dapi (синий); б) эктодерма β-III тубулин (зеленый). X100.
Во всех вариантах мы наблюдали клетки, относящиеся к мезодерме, эктодерме и энтодерме без существенных морфологических изменений, следовательно, можно заключить, что исследуемые пептиды в разных концентрациях не блокируют развитие трех зародышевых листов.
Таким образом представленные данные наглядно показывают возможность использования предлагаемой нами модели для оценки цито- и эмбриотоксических свойств фармакологических соединений.

Литература
1. Takahashi, K., Yamanaka, S. (2006) Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors, Cell, 126, 663-676.
2. Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, Т., Tomoda, K., Yamanaka, S. (2007) Induction of pluripotent stem cells from adult human fibroblasts by defined factors, Cell, 131, 861-872.
3. Лебедева O.C. Лагарькова M.A. Гривенников И.А. Индуцированные плюрипотентные стволовые клетки: получение и перспективы применения. В Сборнике «Стволовые клетки и регенеративная медицина» 2011, 304-318. МАКС Пресс, ISBN 978-5-317-03583-9.
4. Е.В. Новосадова, И.А. Гривенников. Индуцированные плюрипотентные стволовые клетки: от получения до применения в биохимических и биомедицинских исследованиях. Успехи биологической химии. (2014), 54, 3-38.
5. Grskovic, М., Javaherian, A., Strulovici, В., Daley, G.Q.(2011) Induced pluripotent stem cells-opportunities for disease modeling and drug discovery, Nature Reviews Drug Discovery, 10, 915-929.
6. Mackay-Sim, A. (2013) Patient-derived stem cells: pathways to drug discovery for brain diseases, Frontiers in Cellular Neuroscience, 7, Article 29, 1-10.
7. Maury, Y., Gauthier, M., Peschanski, M., Martinat, C. (2012) Human pluripotent stem cells for disease modelling and drug screening, Bioessays, 34, 61-71.
8. Гривенников И.А. (2008) Эмбриональные стволовые клетки и проблема направленной дифференцировки, Успехи биологической химии, 48, 181-220.
9. Гривенников И.А., О.В. Долотов, Н.Ф. Мясоедов. «Способ скрининга фармакологических соединений на нейропротекторную активность». Патент РФ №2383615. Зарегистрирован в Государственном реестре изобретений РФ 10.03.2010 г. Приоритет от 12 марта 2009 г.
10. Гривенников И.А., О.С. Лебедева, Е.В. Новосадова, С.Л. Киселев, М.А. Лагарькова, С.Н. Иллариошкин, С.А. Клюшников. «Способ получения индуцированных плюрипотентных стволовых клеток из фибробластов пациентов с болезнью Гентингтона». Патент №2458983. Зарегистрирован в Государственном реестре изобретений РФ 20 августа 2012 г. Приоритет от 18 июля 2011 г.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оценки нейропротекторных свойств веществ in vitro и тест-система для его осуществления | 2016 |
|
RU2646446C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПАЦИЕНТ (ДОНОР)-СПЕЦИФИЧЕСКИХ ФИБРОБЛАСТОПОДОБНЫХ КЛЕТОК ИЗ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА | 2014 |
|
RU2568059C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ПАЦИЕНТОВ С СИНДРОМОМ ДАУНА | 2012 |
|
RU2492233C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЛЮРИПОТЕНТНЫХ КЛЕТОК | 2009 |
|
RU2399667C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ИЗ ФИБРОБЛАСТОВ ПАЦИЕНТОВ С БОЛЕЗНЬЮ ХАНГИНГТОНА | 2011 |
|
RU2458983C1 |
| СПОСОБ ОЦЕНКИ МОРФОФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ДИФЕРЕНЦИРОВАННЫХ В ДОФАМИНЕРГИЧЕСКИЕ НЕЙРОНЫ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК БОЛЬНЫХ ПАРКИНСОНИЗМОМ | 2012 |
|
RU2501853C1 |
| КОНВЕРСИЯ СОМАТИЧЕСКИХ КЛЕТОК В ИНДУЦИРОВАННЫЕ РЕПРОГРАМИРОВАННЫЕ НЕЙРОНАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ (ИРНСК) | 2011 |
|
RU2562111C2 |
| Способ получения ноотропной композиции на основе полипептидных комплексов, выделенных из нейронов и глиальных клеток, полученных методом направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека | 2018 |
|
RU2690498C1 |
| Ноотропная композиция на основе полипептидных комплексов, выделенных из нейронов и глиальных клеток, полученных методом направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека | 2018 |
|
RU2690846C1 |
| Ноотропная композиция на основе полипептидных комплексов, выделенных из нейрональных прогениторных клеток в условиях гипоксии, и способ ее получения | 2019 |
|
RU2732600C1 |


Изобретение относится к медицине, а именно к биотехнологии и фармакологии, и может быть использовано для оценки цито- и эмбриотоксических свойств фармакологических соединений. Для этого применяют индуцированные плюрипотентные стволовые клетки, полученные репрограммированием фибробластов кожи человека. Использование данного способа позволяет проводить оценку наличия цито- и эмбриотоксических свойств, соединений, представляющих фармакологический интерес. 4 пр., 3 ил.
Применение индуцированных плюрипотентных стволовых клеток, полученных репрограммированием фибробластов кожи человека для оценки цито- и эмбриотоксических свойств фармакологических соединений.
| НОВОСАДОВА И ДР | |||
| Индуцированные плюрипотентные стволовые клетки: от получения до применения в биохимических и биомедицинских исследованиях // Успехи биологической химии, 2014, т.54,стр | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| MAURY Y | |||
| et al | |||
| Human pluripotent stem cells for disease modelling and drug screening // Bioessays, 2012, 34, р.61-71. | |||
Авторы
Даты
2016-10-20—Публикация
2015-09-10—Подача