Изобретение относится к области биотехнологии и медицины, и может быть использовано для характеристики репрограммированных клеточных линий и проверки их способности дифференцироваться в определенный фенотип нейронов in vitro, в частности ИПСК больных паркинсонизмом в дофаминергические нейроны.
Эмбриональные стволовые клетки являются плюрипотентными. Это означает, что они могут дифференцироваться во все три первичных зародышевых листка: эктодерму, энтодерму и мезодерму. Таким образом образуется более 220 видов клеток. Свойство плюрипотентности отличает эмбриональные стволовые клетки от полипотентных клеток, которые могут давать начало лишь ограниченному количеству видов клеток. В отсутствие стимулов к дифференциации in vitro, эмбриональные стволовые клетки могут поддерживать плюрипотентность в течение многих клеточных делений. Наличие плюрипотентных клеток у взрослого организма остается объектом научных дискуссий, хотя исследования показали, что существует возможность образования плюрипотентных клеток из широкого спектра типов клеток: зрелых В-лимфоцитов, β-клеток поджелудочной железы, эпителия кишечника, стволовых клеток спинного мозга, нейрональных предшественников, клеток почки и мышц. Но наиболее широко применяемым для репрограммирования типом клеток, являются эмбриональные фибробласты мыши и фибробласты кожи человека. (Takahashi K., Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell., 2006, V.126, P.663-676).
Взятие биопсии кожи у пациента не причиняет ему страданий и не сопряжено с косметологическими дефектами. А сам процесс взятие биопсии кожи достаточно дешевый и методологически простой.
Индуцированные плюрипотентные стволовые клетки (induced pluripotent stem cells, iPSC (ИПСК) или iPS (ИПС)) из клеток фибробластов кожи человека получают с помощью их перепрограммирования методами генетической инженерии.
Это осуществляется путем введения в них «эмбриональных» генов (в первую очередь генов транскрипционных факторов Oct4, Sox2, Klf4, с-Мус и Nanog) с помощью аденовирусов и других векторов (Matthias Stadtfeld, Masaki Nagaya, Jochen Utikal, Gordon Weir, Konrad Hochedlinger Induced Pluripotent Stem Cells Generated Without Viral Integration., Science, 2008, V.322. P.945-949), а также не вирусными способами (RU 2399667 от 20.09.2010).
Получение нигральных нейронов из ИПСК, дедифференцируемых из зрелых соматических клеток человека (фибробластов), имеет принципиальное значение для решения фундаментальных вопросов патогенеза нейродегенерации и патологии центрального дофаминового обмена при болезни Паркинсона, тестирования новых лекарственных противопаркинсонических препаратов и получения адекватного клеточного материала с целью нейротрансплантации.
В настоящее время в мире десятки миллионов людей страдают от таких неизлечимых нейродегенеративных заболеваний, как болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона. Их медикаментозное лечение успеха не приносит, а лишь замедляет развитие заболевания или компенсирует симптомы, так как никакие лекарства вернуть к жизни погибшие клетки не могут. Наиболее перспективным направлением здесь признается клеточная терапия, т.е. пересадка донорских клеток в организм больного. Однако проблема получения пригодного для трансплантации клеточного материала по-прежнему остается очень острой. Как и в случае пересадки органов, клеточный трансплантат может не прижиться, вызвать иммунный ответ в организме реципиента и, как следствие, не оказать нужный терапевтический эффект.
Как представляется в настоящее время, ИПСК, полученные от пациента и дифференцированные в определенный фенотип нейронов, утраченных в результате той или и иной формы церебральной патологии, могут служить практически идеальным источником материала для клеточной трансплантации.
На сегодняшний день известен способ получения дифференцированных дофаминергических нейронов из эмбриональных стволовых клеток человека путем культивирования клеток в присутствии TGF-β3 или интерлейкина-1β, или при их совместном использовании и N-ацетилцистеина. (RU 2345133 С2, 27.01.2009).
Известен также способ дифференциации плюрипотентных стволовых клеток в нервные клетки путем приведения плюрипотентных стволовых клеток в контакт с веществом, способным ингибировать ИПСК в нервные клетки. (WO 2011007847 A1, 20.01.2011).
Однако все эти способы не позволяют оценивать нейрональную направленность функциональной дифференцировки ИПСК больных паркинсонизмом в дофаминергические нейроны.
Известен также способ прогнозирования пригодности ИПСК для дифференцировки их в нужную линию нервных клеток путем измерения экспрессии генов и/или уровня метилирования ДНК генов из ИПСК в сравнении с нормальным уровнем экспрессии генов и/или метилирования ДНК из ЭСК. (WO 2012037456 А1, 22.03.2012)
Однако данный способ трудоемок и не обеспечивает динамического контроля за нейрональной направленностью дифференцировки ИПСК больных паркинсонизмом в дофаминергические нейроны.
Технический результат предложенного способа заключается в возможности осуществления с высокой точностью динамического контроля за нейрональной направленностью дифференцировки ИПСК больных паркинсонизмом в дофаминергические нейроны.
Технический результат достигается тем, что для оценки морфофункционального состояния дифференцированных в дофаминергические нейроны индуцированных плюрипотентных стволовых клеток больных паркинсонизмом, проводят воздействие на ИПСК факторами, индуцирующими их дифференцировку в нейроны, а затем высадку их на мультиэлектродную матрицу (МЭМ), предварительно обработанную опорным субстратом матригель/фибронектин в соотношении 100:1, с последующей, начиная с 3-5 дня, динамической регистрацией сетевой спонтанной биоэлектрической активности. Наличие к 3-5 дню сетевой спонтанной биоэлектрической активности в виде одиночных спайков, а к 8-10 дню, с сформированного на микроэлектродах монослоя, упорядоченной пачечной спайковой активности оценивают морфофункциональное состояние как нейрональную направленность дифференцировки ИПСК больных паркинсонизмом в дофаминергические нейроны. При этом воздействие на ИПСК для индуцирования их дифференцировки в ИПСК больных паркинсонизмом в дофаминергические нейроны используют рекомбинантные белки: noggin (антагонист ВМР4), факторы экспансии нейрональных предшественников основной фактор роста фибробластов (bFGF) или эпидермальный фактор роста (EGF), а также фактор ингибирования лейкемии (LIF) для увеличения количества дофаминергических нейронов.
Способ осуществляется следующим образом.
Спонтанную биоэлектрическую активность культур индуцированных плюрипотентных стволовых клеток (ИПСК), полученных из фибробластов кожи пациентов с болезнью Паркинсона и культивированных на мультиэлектродной матрице (MEM) системы (Multichannel systems, Germany) исследуют следующим образом.
Регистрация спонтанной биоэлектрической активности клеток производилась с использованием внеклеточной регистрации сигналов с помощью MEM системы (Multichannel systems, Germany) при стандартных условиях (температура - 35,5°C, газовой смеси: 95% воздуха с содержанием 5% углекислого газа и влажности 100%). В данной работе использовались 60 электродные матрицы MEM (рис.1А, Б)). На данном рисунке показан на А - внешний вид 60-электродной матрицы (MEM); на Б - схема расположения электродов мультиэлектродной матрицы MEM системы (Multichannel systems, Germany).
Дифференцировка ИПСК пациентов с болезнью Паркинсона в дофаминергические нейральные клетки.
ИПСК получали от пациентов с болезнью Паркинсона путем забора образцов кожи с помощью биопсии. Затем образцы кожи сохраняли до 12 часов в среде для выделения фибробластов по методике, описанной в источнике информации RU 2399667 от 20.09.2010.
Для индукции дофаминергической нейрональной дифференцировки клетки ИПСК больных паркинсонизмом обрабатывали диспазой (Invitrogen, США) и переносили в чашку Петри, покрытую желатином. Затем клетки ресуспендировали в бессывороточной среде DMEM/ F12 (Hyclone, США) в комплексе с 1% N2 (Invitrogen, США), 2% Serum replacement (заменитель сыворотки) (Invitrogen, США), 50 нг/мл noggin (антагонистом ВМР4) (PeproTech, США) или 20 нг/мл bFGF или 20 нг/мл EGF (факторами экспансии нейрональных предшественников). Дифференцировку проводили в течение двух недель. Для увеличения количества дофаминэргических нейронов на 7 день диффренцировки добавляли LIF (фактор ингибирования лейкемии) (Peprotech) в концентрации 100нг/мл. Рекомбинантный LIF - белок с молекулярной массой 20 кДа, содержащий 180 аминокислотных остатков, в том числе три дисульфидные связи. Добавление LIF увеличивало количество ТН - положительных нейронов (положительных на тирозингидроксилазу) на 50-70%. После проведения процедуры дифференцировки по нейрональному пути клетки пересаживали на мультиэлектродные матрицы, предварительно покрытые опорным субстратом, который представлял собой комбинацию матригель/фибронектин в соотношении 100:1. Культивировали клетки в питательной среде, состоящей из 92,5% нейробазальной среды NeurobasalTM (Invitrogen), 2% супплемента В27 (Invitrogen), 2 мМ глутамина (Sigma), 2нг/мл GDNF (Sigma) и 2 нг/мл BDNF (Sigma) в течение 28 суток in vitro. Среду меняли через день после посадки ИПСК больных паркинсонизмом на матрицу. Поддержание жизнеспособности культуры в течение 2 недель осуществлялось в условиях CO2-инкубатора при температуре 35,5°C и газовой смеси: 95% воздуха с содержанием 5% CO2 и 100% влажности.
Регистрацию спонтанной биоэлектрической активности клеток производили с использованием системы внеклеточной регистрации сигналов MEM (Multichannel systems, Germany) в условиях CO2-инкубатора при стандартных условиях: температура 35,5°C, газовой смеси: 95% воздуха с содержанием 5% углекислого газа и влажности 100%.
После прикрепления нейросфер к опорному субстрату, на 2-3-й день in vitro из них начиналась миграция клеток (рис.2А), а к 7-му дню последние формировали монослой, располагавшийся на микроэлектродах и связывавший нейросферы между собой. Так, на рис.2Б в центре поля зрения хорошо заметно формирование отростками клеток связи между двумя нейросферами. На рисунке 2А, Б. показана культура ИПСК больных паркинсонизмом на мультиэлектродной матрице. А-3 дня in vitro. Б-7 дней in vitro. Живая культура, фазовый контраст. Масштаб 200 мкм (А), 100 мкм (Б).
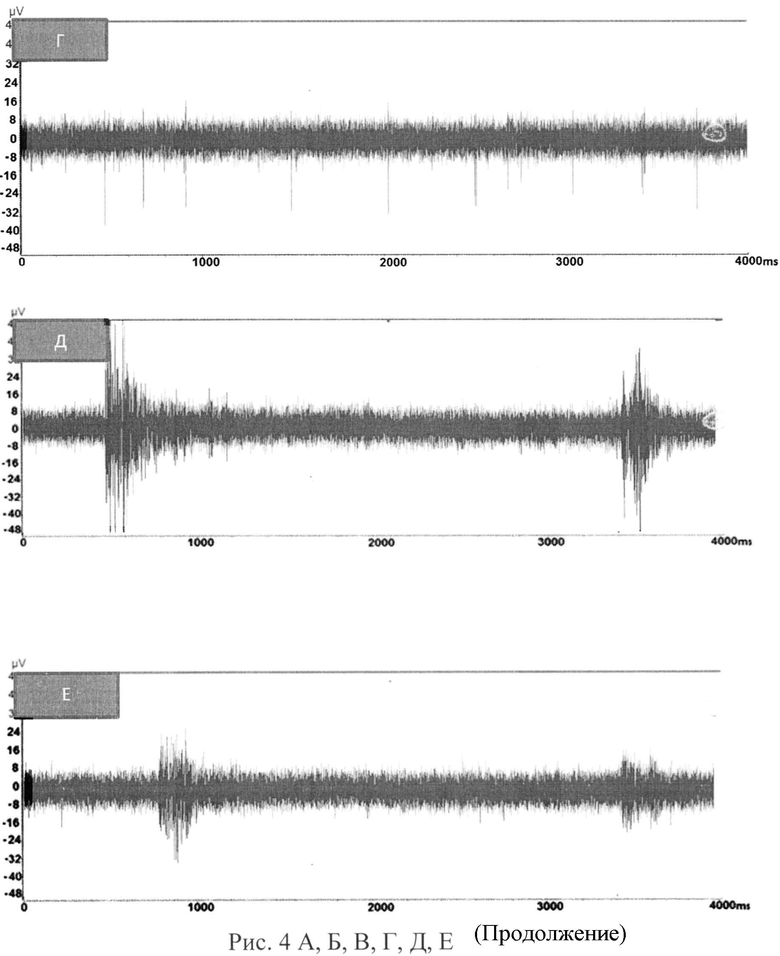
В полученных таким образом на МЭМ культурах с 3-5 дня in vitro регистрировалась сетевая спонтанная биоэлектрическая активность (рис.3А, Б). На рисунке 3А, Б видна спонтанная биоэлектрическая активность нейронов, дифференцированных из ИПСК больных паркинсонизмом и культивируемых на мультиэлектродной матрице (MEM). А-5 дней in vitro, одиночные спайки; Б - 10 дней in vitro, пачечная активность. То есть в данном случае наличие, сетевой спонтанной биоэлектрической активности в виде одиночных спайков (рис.3А), а с 8-10 дня с сформированного на микроэлектродах монослоя - более сложной и упорядоченной пачечной спайковой активности (рис.3Б) характеризует нейрональную направленность дифференцировки ИПСК больных паркинсонизмом в дофаминергические нейроны.
В ходе работы была исследована способность клеток адгезироваться на различных адгезивных субстратах. В качестве подложек использовались: полиэтиленимин (ПЭИ), матригель, полиорнитин, полилизин и комбинация матригель/фибронектин (100:1).
Исследование культур, выращенных на ПЭИ и матригеле показало, что, несмотря на одинаковую способность ИПСК больных паркинсонизмом адгезироваться на этих двух субстратах, ИПСК больных паркинсонизмом, посаженные на отрицательно-заряженный полиэтиленимин и матригель, не выпускают островков в течение 3 дней культивирования, а после 5 дней клетки в культуре с данным покрытием умирают либо открепляются от субстрата.
На матрицы, покрытые полизином, прикреплялось около 1/3 от общего числа клеток, а также небольшие сферы, в то время как крупные сферы оставались неприкрепленными. На матрицы, покрытые полиорнитином, прикреплялось 1/4 единичных клеток, при этом данные единичные клетки выпускали отростки и начинали распластываться лишь к 5-7 дню культивирования и вследствие их малой плотности сетевых структур не образовывали. И только на матрицы покрытые комбинацией матригель/фибронектин (100:1) через 2 часа после посадки прикреплялось большинство клеток, а также крупных сфер. Некоторые из клеток спустя 2 часа после культивирования выпускали отростки. Через день после посадки на культурах, опорным субстратом, которых являлась комбинация матригель-фибронектин 100:1 наблюдалось образование связей между соседними клетками и сферами, а спустя неделю образование монослойных сетей.
Таким образом, предложенный способ обеспечивает высокую точность подтверждения направленности дифференцировки ИПСК больных паркинсонизмом в дофаминергические нейроны в динамике биоэлектрической активности и постадийного развития сложной нейронной сети и формированием новых межнейронных связей.
Отличие данного метода от других методов заключается в том, что доказательством принадлежности вновь полученных клеток к дофаминэргическим нейронам является не иммуноцитохимическое маркирование и получение потенциалов действия от единичных нейронов (метод патч-клампа) (это было сделано ранее в других лабораториях), а оценка способности вновь сформированных клеток предложенным способом образовывать нейронные сети, генерирующие спонтанную активность в виде отдельных спайков и сетевых пачек, что наиболее близко к условиям in vivo отражает функциональность нейронов, их способность интегрироваться в сети мозга при нейротрансплантации.
Примеры осуществления способа.
Исследования проведены на базе лаборатории клеточных технологий Научно-исследовательского института прикладной и фундаментальной медицины ГБОУ ВПО НижГМА Минздравсоцразвития России.
Объектом исследования явились индуцированные плюрипотентные клетки линии, полученной из фибробластов кожи трех доноров с болезнью Паркинсона (линия Ку Парк). Клеточная линии индуцированных плюрипотентных клеток и их последующая дифференцировка были получены сотрудниками института Общей Генетики им. Н.И.Вавилова РАН, Москва.
У больных под местной новокаиновой блокадой срезали расщепленные лоскуты кожи предплечья толщиной 0,2-0,3 мм. После взятия биопсии кожи эксплантаты сохраняли до 12 часов в среде для выделения фибробластов, содержавшую DMEM (ПанЭко или Hyclone, High glucose) с добавлением 15% FBS (Hyclone), 2 мМ L-глутамина (Hyclone), пенициллин-стрептомицина (50 ЕД/мл; 50 мкг/мл) (ПанЭко) и сохранявшуюся до 3 месяцев при температуре +8°C.
Затем эксплантаты указанных больных в капле среды помещали на крышку чашки Петри и острым скальпелем разрезали на небольшие фрагменты объемом порядка 0,3-1,5 мм3.
На следующем этапе исследования каждый из полученных фрагментов эксплантатов помещали в отдельную чашку Петри диаметром 35 мм или по 3-4 фрагмента в чашку Петри диаметром 60 мм и прижимали сверху стерильным покровным стеклом. На стекло наливали среду для выделения фибробластов (5 мл в чашку 35 мм или 10 мл в чашку 60 мм). В течение трех недель раз в неделю меняли среду следующим образом: аккуратно, не сдвигая покровное стекло, отбирали старую среду и в тех же количествах наливали свежую среду для выделения фибробластов. Примерно через 3 недели вокруг фрагментов формировался монослой фибробластов.
Для индукции нейрональной дифференцировки клетки ИПСК больных паркинсонизмом обрабатывали диспазой (Invitrogen, США) и переносили в чашку Петри, покрытую желатином. Затем клетки ресуспендировали в бессывороточной среде DMEM/ F12 (Hyclone, США) в комплексе с 1% N2 (Invitrogen, США), 2% Serum replacement (заменителем сыворотки) (Invitrogen, США) и с 50 нг/мл noggin (антагонистом ВМР4) (PeproTech, США) клетки первого больного. Клетки второго больного ресуспендировали в бессывороточной среде DMEM/F12 (Hyclone, США) в комплексе с 1% N2 (Invitrogen, США), 2% Serum replacement (заменителем сыворотки) (Invitrogen, США) и с 20 нг/мл bFGF. А клетки третьего больного ресуспендировали в бессывороточной среде DMEM/ F12 (Hyclone, США) в комплексе с 1% N2 (Invitrogen, США), 2% Serum replacement (заменителем сыворотки) (Invitrogen, США) и с 20 нг/мл EGF. Дифференцировку проводили в течение двух недель. Для увеличения количества дофаминэргических нейронов на 7 день диффренцировки добавляли LIF (фактор ингибирования лейкемии) (Peprotech) в концентрации 100нг/мл. После проведения процедуры дифференцировки по нейрональному пути клетки пересаживали на мультиэлектродные матрицы, предварительно покрытые опорным субстратом - комбинация матригель/фибронектин в соотношении 100:1.
Культивирования дифференцированных ИПСК осуществлялось на мультиэлектродных матрицах (Multichannel systems, Germany). Клетки в виде нейросфер, полученных из ИПСК пациентов с болезнью Паркинсона, пересаживались на специальные подложки мультиэлектродной системы, предварительно покрытые адгезирующим субстратом матригель/фибронектин (100:1).
Перед посадкой культуры подложка с электродами промывалась в проточной воде в течение 2 минут, а затем выдерживалась в 0,25% растворе трипсина (Sigma) для очистки от адгезированных на ней нейрональных клеток. Затем мультиэлектродная матрица стерилизовалась УФ-облучением. Затем матрицы и стекла покрывались адгезирующим субстратом, служащим опорой для клеток матригель/фибронектин 100:1.
После пересадки дифференцированных клеток на мультиэлектродные матрицы, клетки культивировались в питательной среде, состоящей из 92,5% нейробазальной среды Neurobasal™ (Invitrogen), 2% супплемента В27 (Invitrogen), 2 мМ глутамина (Sigma), 2нг/мл GDNF (Sigma) и 2 нг/мл BDNF (Sigma), 50 ЕД/мл антибиотика (pen/strep).
Поддержание жизнеспособности культуры в течение двух недель осуществлялось в условиях CO2 инкубатора при температуре 35,5°C, газовой смеси: 95% воздуха с содержанием 5% С02, 100% влажности.
Регистрация спонтанной биоэлектрической активности клеток производилась с использованием внеклеточной регистрации сигналов с помощью MEM системы (Multichannel systems, Germany) при стандартных условиях (температура 35,5°C, газовой смеси: 95% воздуха с содержанием 5% углекислого газа и влажности 100%).
Для получения и анализа данных использовался набор программного обеспечения МС Rack (Multichannel systems, Germany).
Спонтанная электрофизиологическая активность культур, полученных от ИПСК линии КУ Парк от трех пациентов с болезнью Паркинсона регистрировалась в течение двух недель. В эксперименте участвовали 12 мультиэлектродных матриц с культурой дифференцированных ИПСК, полученных из фибробластов кожи трех пациентов с болезнью Паркинсона. На девяти матрицах из двенадцати наблюдалась спонтанная электрофизиологическая активность. На 3-5 день динамической регистрации спонтанной электрофизиологической активности появлялась сетевая спонтанная биоэлектрическая активность в виде одиночных спайков, а к 8-10 дню, с сформированного на микроэлектродах монослоя, появлялась упорядоченная пачечная спайковая активность, которые являлись доказательством наличия зрелых функционально активных дофаминергических нейронов. На рисунке 4 (А, Б) представлены микрофотографии культур ИПСК двух первых пациентов с болезнью Паркинсона с одиночными спайками (В, Г) на 4-й день развития на МЭМ и пачечной активностью (Д, Е) на 10-й день развития.
Таким образом, предложенный нами метод дифференцировки ИПСК в нейроны с помощью использования рекомбинантного белка noggin и нейротрофических факторов bFGF, EGF и LIF (фактор ингибирования лейкемии) и культивирования дифференцированных ИПСК на мультиэлектродных матрицах покрытых адгезирующим субстратом матригель/фибронектин (100:1), обеспечивает образование нейросфер и дифференцировку ИПСК в дофаминергические нейроны. При этом используемая в наших исследованиях методика непрерывного культивирования нейронных сетей на мультиэлектродной матрице обеспечивает уникальную возможность проследить динамику дифференцировки ИПСК в дофаминергические нейроны. Методика также позволяет осуществлять неинвазивную, не повреждающую клетки, длительную (в течение нескольких недель) регистрацию потенциалов действия и электростимуляцию культивируемых клеток мозга в одной и той же нейронной сети. Появление спонтанной и вызванной биоэлектрической активности служить прямым доказательством дифференцировки культивируемых ИПСК в функционально полноценные нервные клетки.
Дофаминергические нейроны, полученные с применением технологии ИПСК от больных паркинсонизмом с известными «нейродегенерятивными» мутациями, в дальнейшем могут послужить идеальным материалом для заместительной клеточной терапии, поскольку они представляют собой адекватный клеточный материал, в котором в перспективе с помощью гомологичной рекомбинации можно скорректировать нарушенный генотип.
Кроме того, этот материал лишен иммуногенных свойств и его получение не связано с этическими проблемами, присущими использованию ЭСК.
| название | год | авторы | номер документа |
|---|---|---|---|
| УЛУЧШЕННЫЙ СПОСОБ ДИФФЕРЕНЦИРОВКИ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА В ДОФАМИНЭРГИЧЕСКИЕ НЕЙРОНЫ | 2023 |
|
RU2823290C1 |
| ПОЛУЧЕНИЕ ТЕРМИНАЛЬНО ДИФФЕРЕНЦИРОВАННЫХ ДОФАМИНЕРГИЧЕСКИХ НЕЙРОНОВ ИЗ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА | 2004 |
|
RU2345133C2 |
| Способ оценки нейропротекторных свойств веществ in vitro и тест-система для его осуществления | 2016 |
|
RU2646446C1 |
| Способ получения ноотропной композиции на основе полипептидных комплексов, выделенных из нейронов и глиальных клеток, полученных методом направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека | 2018 |
|
RU2690498C1 |
| СПОСОБ ИСПОЛЬЗОВАНИЯ СТВОЛОВЫХ КЛЕТОК В ТКАНЕЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ | 2009 |
|
RU2422514C1 |
| Ноотропная композиция на основе полипептидных комплексов, выделенных из нейронов и глиальных клеток, полученных методом направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека | 2018 |
|
RU2690846C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ИЗ ФИБРОБЛАСТОВ ПАЦИЕНТОВ С БОЛЕЗНЬЮ ХАНГИНГТОНА | 2011 |
|
RU2458983C1 |
| ПОЛУЧЕНИЕ ГАМКергических НЕЙРОНОВ in vitro ИЗ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ НЕВРОЛОГИЧЕСКИХ РАССТРОЙСТВ | 2004 |
|
RU2380410C2 |
| Ноотропная композиция на основе полипептидных комплексов, выделенных из нейрональных прогениторных клеток в условиях гипоксии, и способ ее получения | 2019 |
|
RU2732600C1 |
| СПОСОБ ЧАСТИЧНОГО ВОССТАНОВЛЕНИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ НЕЙРОННЫХ СЕТЕЙ IN VITRO В УСЛОВИЯХ ИХ ЗНАЧИТЕЛЬНОГО ПОВРЕЖДЕНИЯ | 2015 |
|
RU2594065C1 |



Изобретение относится к области биотехнологии и медицины. Предложен способ оценки морфофункционального состояния индуцированных плюрипотентных стволовых клеток (ИПСК) больных паркинсонизмом путем проведения их дифференцировки в дофаминергические нейроны, для чего воздействуют на ИПСК факторами, индуцирующими их дифференцировку в дофаминергические нейроны, а затем высаживают их на мультиэлектродную матрицу, обработанную опорным субстратом матригель/фибронектин, после чего, начиная с 3-5 дня вплоть до 8-10 дня, проводят динамическую регистрацию сетевой спонтанной биоэлектрической активности и при наличие к 3-5 дню сетевой спонтанной биоэлектрической активности в виде одиночных спайков, а к 8-10 дню упорядоченной пачечной спайковой активности на сформированном на микроэлектродах монослое оценивают морфофункциональное состояние как нейрональную направленность дифференцировки ИПСК в дофаминергические нейроны. Изобретение может быть использовано для характеристики репрограммированных клеточных линий больных паркинсонизмом и проверки их способности дифференцироваться в определенный фенотип нейронов в целях транспланталогии и при тестировании лекарств. 1 з.п. ф-лы, 4 ил, 1 пр.
1. Способ оценки морфофункционального состояния индуцированных плюрипотентных стволовых клеток (ИПСК) больных паркинсонизмом путем проведения их дифференцировки в дофаминергические нейроны, для чего воздействуют на ИПСК факторами, индуцирующими их дифференцировку в дофаминергические нейроны, а затем высаживают их на мультиэлектродную матрицу (МЭМ), предварительно обработанную опорным субстратом матригель/фибронектин в соотношении 100:1, после чего динамически регистрируют сетевую спонтанную биоэлектрическую активность в период, начиная с 3-5 дня и заканчивая 8-10 днем, и в случае наличия к 3-5 дню сетевой спонтанной биоэлектрической активности в виде одиночных спайков и наличия к 8-10 дню упорядоченной пачечной спайковой активности на сформированном на микроэлектродах монослое оценивают морфофункциональное состояние как нейрональную направленность дифференцировки ИПСК в дофаминергические нейроны.
2. Способ по п.1, отличающийся тем, что для воздействия на ИПСК для индуцирования их дифференцировки в дофаминергические нейроны используют рекомбинантные белки: noggin (антагонист ВМР4), факторы экспансии нейрональных предшественников bFGF, EOF и фактор ингибирования лейкемии LIF.
| СПОСОБ МОРФОЛОГИЧЕСКОЙ ДИАГНОСТИКИ СОСТОЯНИЯ НЕРВНОЙ СИСТЕМЫ ДЛЯ БИОЛОГИЧЕСКОГО ОБЪЕКТА В КОНКРЕТНЫЙ ПЕРИОД ОНТОГЕНЕЗА | 2005 |
|
RU2299021C2 |
| SU 146141619890228 А1, 28.02.1989 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ ЖИЗНЕСПОСОБНОСТИ НЕРВНОЙ ТКАНИ | 1995 |
|
RU2103914C1 |
Авторы
Даты
2013-12-20—Публикация
2012-09-17—Подача