Приоритет
Настоящая заявка претендует на приоритет предварительной заявки США номер 61/390,899, поданной 7 октября 2010 года, содержание которой полностью включено в настоящую заявку путем ссылки.
Область техники, к которой относится изобретение
Раскрыты способы лечения заболеваний или состояний глаз, особенно ретинопатий, глазных отеков и глазной неоваскуляризации. Неограничивающие примеры таких заболеваний или состояний включают диабетический макулярный отек, возрастную макулодистрофию (влажную форму), хориоидальную неоваскуляризацию, диабетическую ретинопатию, окклюзию вены сетчатки (центральной или периферической), глазную травму, отек, вызванный операцией, неоваскуляризацию, вызванную операцией, кистозный макулярный отек, глазную ишемию, увеит, и т.п. Такие заболевания или состояния характеризуются изменениями в глазной сосудистой системе, прогрессирующими или непрогрессирующими, которые либо являются результатом острого заболевания или состояния, либо являются хроническим заболеванием или состоянием.
Уровень техники
Глаз содержит несколько структурно и функционально различных сосудистых лож, которые поставляют глазные компоненты, критические для сохранения зрения. Они включают сосудистые системы сетчатки и сосудистой оболочки глаза, которые обеспечивают внутреннюю и внешнюю части сетчатки, соответственно, и лимбальную сосудистую систему, расположенную на периферии роговицы. Травмы и заболевания, которые препятствуют нормальной структуре и функции данных сосудистых лож, являются одними из основных причин нарушения зрения и слепоты. Например, диабетическая ретинопатия является наиболее распространенным заболеванием, поражающим сосудистую систему сетчатки, и является ведущей причиной потери зрения среди населения трудоспособного возраста в Соединенных Штатах. Васкуляризация роговицы, вторичной по отношению к травме или болезни, является еще одной категорией глазных сосудистых заболеваний, которые могут привести к серьезному ухудшению зрения.
«Макулодистрофия» является общим медицинским термином, который относится к любому из нескольких синдромов заболевания, которые включают постепенную потерю или ухудшение зрения из-за клеточной и тканевой дегенерации желтой макулярной области в центре сетчатки. Макулодистрофия часто характеризуется как один из двух типов, неэкссудативная (сухая форма) или экссудативная (влажная форма). Хотя оба типа являются двусторонними и прогрессирующими, каждый тип может отражать различные патологические процессы. Влажная форма возрастной макулодистрофии (AMD) является наиболее распространенной формой хориоидальной неоваскуляризации и основной причиной слепоты у пожилых людей. AMD затрагивает миллионы американцев в возрасте старше 60 лет, и является ведущей причиной слепоты среди пожилых людей.
Хориоидальная неоваскулярная мембрана (CNVM) является проблемой, которая связана с самыми разнообразными заболеваниями сетчатки, но наиболее часто связана с возрастной макулодистрофией. При CNVM, патологические кровеносные сосуды, выходящие из сосудистой оболочки (тканевой слой со множеством кровеносных сосудов непосредственно под сетчаткой), растут вверх через слои сетчатки. Эти новые сосуды очень хрупкие и легко ломаются, в результате чего кровь и жидкость разливаются внутри слоев сетчатки.
Диабет (сахарный диабет) является метаболическим заболеванием, вызываемым неспособностью поджелудочной железы вырабатывать инсулин или использовать инсулин, который вырабатывается. Наиболее распространенными типами диабета являются диабет 1-го типа (часто называемый ювенильным сахарным диабетом) и диабет 2-го типа (часто называемый взрослым сахарным диабетом). Диабет 1-го типа вызван отказом организма вырабатывать инсулин из-за потери клеток, продуцирующих инсулин, и в настоящее время требует от человека введения инсулина. Диабет 2 типа обычно возникает в результате резистентности к инсулину, это состояние, при котором клетки не используют инсулин должным образом. Диабет 2 типа также имеет компонент дефицита инсулина.
Диабет непосредственно отвечает за большое количество болезненных состояний, в том числе состояний или заболеваний глаз, включая диабетическую ретинопатию (DR) и диабетический макулярный отек (DME), которые являются основными причинами потери зрения и слепоты в большинстве развитых стран. Все большее количество людей с диабетом во всем мире показывает, что DR и DME будут по-прежнему основными причинами потери зрения и связанных с ними функциональных нарушений на долгие годы.
Диабетическая ретинопатия является осложнением диабета, которое возникает в результате повреждения кровеносных сосудов светочувствительной ткани в задней части глаза (сетчатка). Сначала, диабетическая ретинопатия может не вызывать никаких симптомов или только умеренные проблемы со зрением. В итоге, однако, диабетическая ретинопатия может привести к слепоте. Диабетическая ретинопатия может развиваться у тех, кто имеет диабет 1-го типа или диабет 2-го типа.
На самой ранней стадии непролиферативной ретинопатии микроаневризмы происходят в крошечных кровеносных сосудах сетчатки. По мере прогрессирования заболевания, большинство этих кровеносных сосудов повреждаются или блокируются, и эти области сетчатки посылают сигналы в региональные ткани, чтобы прорастали новые кровеносные сосуды для питания. Эта стадия называется пролиферативной ретинопатией. Новые кровеносные сосуды растут вдоль сетчатки и вдоль поверхности прозрачного, стекловидного геля, который заполняет внутреннюю часть глаза.
Сами по себе эти кровеносные сосуды не вызывают симптомов или потери зрения. Однако, они имеют тонкие, хрупкие стенки, и без своевременного лечения, эти новые кровеносные сосуды могут привести к утечке крови (цельной крови или некоторых ее компонентов), которые могут привести к серьезной потере зрения и даже слепоте.
Также, жидкость может просочиться в центр макулы, часть глаза, где происходит четкое прямолинейное зрение. Жидкость и связанный белок начинают осаждаться на или под вздутием макулы и центральное зрение пациента искажается. Это состояние называется макулярным отеком. Он может происходить на любой стадии диабетической ретинопатии, хотя более вероятно он происходит по мере прогрессирования заболевания. Приблизительно половина людей с пролиферативной ретинопатией также имеют макулярный отек.
Увеит - это состояние, при котором воспаляется сосудистая оболочка глазного яблока. Глаз имеет форму, напоминающую теннисный мяч, полый внутри, с тремя различными слоями тканей, окружающих центральную полость. Внешний слой представляет собой склеру (белая оболочка глаза) и внутренний слой представляет собой сетчатку. Промежуточный слой между склерой и сетчаткой называется сосудистой оболочкой глазного яблока. Сосудистая оболочка глазного яблока содержит большое количество кровеносных сосудов, которые питают глаз. Осложнения увеита включают глаукому, катаракты или образование новых кровеносных сосудов (неоваскуляризацию).
Существующие в настоящее время вмешательства для экссудативной (влажной формы) макулодистрофии, диабетической ретинопатии, диабетического макулярного отека, хориоидальной неоваскулярной мембраны и осложнений после увеита или травмы, включают лазерную фотокоагуляционную терапию, облучение низкими дозами (дистанционную лучевую терапию) и хирургическое удаление неоваскулярной мембраны (витрэктомию). Лазерная терапия имеет ограниченный успех, и отдельные хориоидальные неоваскулярные мембраны, которые первоначально отвечают на терапию лазером высокой частоты, имеют высокую частоту рецидивов заболевания. Существует также потенциальная потеря зрения в результате лазерной терапии. Низкая доза облучения была применена неэффективно, чтобы вызвать регресс хориоидальной неоваскуляризации. Недавно ранибизумаб и пегаптиниб, которые являются антагонистами фактора роста васкулярного эндотелия (VEGF), были одобрены для использования при возрастной макулодистрофии.
Окклюзия вены сетчатки (RVO) является наиболее распространенным заболеванием сосудов сетчатки после диабетической ретинопатии. В зависимости от области сетчатки, где венозный отток эффективно окклюзирован, она широко классифицируется как окклюзия центральной вены сетчатки (CRVO), окклюзия полусферической вены сетчатки (HRVO) или окклюзия периферической вены сетчатки (BRVO). Было обнаружено, что каждый из них имеет два подтипа. Проявление RVO в общем сопровождается вариабельной безболезненной потерей зрения с любой комбинацией данных о глазном дне, состоящих из извилистости сосудов сетчатки, кровоизлияний в сетчатку (пятна и формы пламени), ватных пятен, набухания дисков зрительного нерва и макулярного отека. При CRVO, кровоизлияния в сетчатку будут найдены во всех четырех квадрантах глазного дна, в то время как они ограничены либо верхней, либо нижней полусферой в глазном дне при HRVO. При BRVO, кровоизлияния в основном локализуются в области, которая дренируется закупоренной периферической веной сетчатки. Потеря зрения происходит вторично по отношению к макулярному отеку или ишемии.
Следовательно, существует давно ощущаемая и значительная потребность в способах лечения заболеваний глаз, которые характеризуются сосудистой нестабильностью, сосудистой утечкой и неоваскуляризацией.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1А представляет собой гистограмму, показывающую среднюю площадь альбуминовых отложений, которые образуются в сетчатках родопсина/VEGF у трансгенных мышей (контроль) по сравнению с животными, которых лечили 10 мг/кг/доза соединения из Таблицы XXI.
Фигура 1В представляет собой гистограмму, показывающую среднюю площадь альбуминовых отложений, которые образуются в сетчатках у контрольных животных по сравнению с животными, которых лечили 3 мг/кг/доза соединения из Таблицы XXI.
Фигура 2А представляет собой микрофотографию, показывающую наличие значительных фокальных периваскулярных альбуминовых отложений (туманные белые скопления отмечены стрелками) в сетчатке родопсина/VEGF у контрольных трансгенных мышей.
Фигура 2В представляет собой микрофотографию, показывающую относительное отсутствие периваскулярных альбуминовых отложений в сетчатке родопсина/VEGF у трансгенных мышей, которых лечили 3 мг/кг/доза соединения из Таблицы XXI.
Фигура 3А представляет собой микрофотографию, показывающую значительный уровень прорастания новых кровеносных сосудов (неоваскулярные пучки; белые области указаны стрелками) в сетчатке контрольных животных (лечили основой) на Р21.
Фигура 3В представляет собой микрофотографию, показывающую относительное отсутствие новых кровеносных сосудов в сетчатке животных на Р21, которых лечили дважды в день 3 мг/кг/доза соединения из Таблицы XXI в течение 7 дней.
Фигура 4 показывает среднюю площадь неоваскулярных пучков сетчатки, образованных в сетчатке контрольных мышей, мышей, получавших низкую дозу (3 мг/кг/инъекция) соединения из Таблицы XXI, и мышей, получавших высокую дозу (10 мг/кг/инъекция) соединения из Таблицы XXI.
Фигуры 5А-5I показывают микрофотографии сетчатки мышей C57BL/6 с индуцированной кислородом ишемической ретинопатией. Сетчатки были иммуноокрашены для VE-PTP/HPTP-β, контрастно окрашены пектином FITC-меченой Griifbnia Simplicifolia (GSA), и из них были получены плоские препараты. Флуоресцентная микроскопия с зеленым каналом показала сгустки GSA-окрашенных NV на поверхности сетчатки с некоторым слабым окрашиванием сосудов сетчатки в фоновом режиме (Фигуры А и D). Сетчатка от контрольной мыши комнатного воздуха (RA) показала нормальные сосуды сетчатки, без неоваскуляризации (Фигура G). Как показано на Фигурах В и С, было сильное окрашивание для HPTP-β в сгустках неоваскуляризации сетчатки на поверхности сетчатки и слабое окрашивание некоторых основных сосудов сетчатки, в первую очередь питающих сосудов, что приводило к неоваскуляризации. Как показано на Фигурах Н и I, там не было обнаружено окрашивание сосудов сетчатки в неишемических сетчатках RA контрольных мышей. Эти данные позволяют предположить, что VE-PTP/HPTP-β повышающе регулируется в эндотелиальных клетках, участвующих в неоваскуляризации.
Фигуры 6А-6F показывают микрофотографии сетчаток гемизиготных rho/VEGF трансгенных мышей, где мышам давали одинарные подкожные инъекции основы или 10 мг/кг соединения из Таблицы XXI на Р21. Через двенадцать часов после инъекции мышей умервщляли, сетчатки удаляли, окрашивали FITC-меченым Griffonia Simplicifolia (GSA) пектином, и иммуногистохимически окрашивали анти-фосфо-Tie2. Как показано на Фигурах В и С, флуоресцентная микроскопия плоских препаратов сетчатки от мышей, которых лечили основой, показала многочисленные зачатки субретинальной неоваскуляризации, визуализированой с пектином GSA (Фигура А) и слабое фоновое окрашивание для анти-фосфо-Tie2, которое было немного больше в неоваскуляризации. Как показано в Рамке D, мыши, которых лечили соединением из Таблицы XXI, показали GSA-окрашенные зачатки субретинальной неоваскуляризации. Фигуры Е и F показывают, что эти зачатки также сильно окрашены для фосфо-Tie2.
Фигура 7А и 7В показывают результаты, когда мышам с индуцированной кислородом ишемической ретинопатией давали внутриглазную инъекцию 3 мкг соединения из Таблицы XXI в один глаз и основы в парный глаз. На Р17, in vivo окрашивание для PECAM-I показало небольшую неоваскуляризацию на поверхности сетчатки глаза, который лечили соединением из Таблицы XXI (Фигура 7А), по сравнению с сетчаткой глаза, который лечили основой (Фигура 7В).
Фигура 7С представляет собой график, иллюстрирующий измерение средней площади неоваскуляризации сетчатки на поверхности сетчатки обработанного глаза по сравнению с необработанным глазом, как измерено способом анализа изображений. Эти данные подтверждают, что внутриглазная обработка соединением из Таблицы XXI приводит к уменьшению неоваскуляризации сетчатки.
Фигура 8А - Фигура 8G показывают результаты для гемизиготных rho/VEGF трансгенных мышей, которым давали ежедневно подкожные инъекции основы, содержащей 0, 3 или 10 мг/кг соединения из Таблицы XXI, начиная с дня после рождения (Р) 15. На Р21 мышей подвергали перфузии меченым флуоресцеином декстраном и плоские препараты сетчатки были исследованы с помощью флуоресцентной микроскопии. Микрофотографии Фигуры 8А-8С показывают результаты этого эксперимента. Сетчатка мыши, которую лечили основой, показывала много зачатков субретинальной неоваскуляризации (Фигура 8А), а сетчатки мышей, которых лечили 3 мг/кг (Фигура 8В) или 10 мг/кг соединения из Таблицы XXI (Фигура 8С), имела меньшее количество зачатков неоваскуляризации. Фигура 8D представляет собой график, иллюстрирующий измерение средней площади субретинальной неоваскуляризации, как измерено способом анализа изображений. Как показано на Фигуре 8D, по сравнению с мышами, которых лечили основой, средняя площадь субретинальной неоваскуляризации была меньше у мышей, которых лечили дозой соединения в Таблице XXI. Фигуры 8Е и 8F являются микрофотографиями последующих экспериментов, где rho/VEGF мышам давали инъекции 3 мкг соединения из Таблицы XXI в один глаз и основу в парный глаз. Как видно из этих двух фотографий, было еще много зачатков субретинальной неоваскуляризации в глазах, в которые впрыскивали основу (Фигура 8Е), затем им вводили 3 мкг соединения из Таблицы XXI (Фигура 8F). Фигура 8G представляет собой график, иллюстрирующий измерение средней площади неоваскуляризации сетчатки на поверхности сетчатки обработанного глаза по сравнению с необработанным глазом, как измерено способом анализа изображений. Эти данные подтверждают, что внутриглазная обработка соединением из Таблицы XXI приводит к снижению неоваскуляризации сетчатки.
Фигуры 9А и 9В показывают результаты, когда мыши C57BL/6 имели разрыв мембраны Бруха при лазерной коагуляции в 3 местах в каждом глазу, а затем получали подкожные инъекции основы (n=8), 20 мг/кг (n=10) либо 40 мг/кг соединения из Таблицы XXI (n=10), два раза в день в течение 14 дней. В другом эксперименте мыши (n=6 для каждой дозы) получали инъекцию 1, 3 или 5 мкг соединения из Таблицы XXI в один глаз и основу в парный глаз непосредственно после и через 7 дней после лазера. Через четырнадцать дней после разрыва мембраны Бруха, мышей подвергали перфузии меченым флуоресцеином декстраном и сосудистые оболочки плоского препарата были исследованы с помощью флуоресцентной микроскопии. Фигура 9А показывает, что хориоидальные плоские препараты мышей, которых лечили основой, показывали большое хориоидальное неоваскуляризационное поражение в месте разрыва мембраны Бруха, а хориоидальная неоваскуляризация была меньшей в хориоидальном плоском препарате мыши, которую лечили 20 мг/кг соединения из Таблица XXI, как показано на Фигуре 9В.
Фигура 9С показывает результаты, когда взрослые мыши C57BL/6 имели разрыв мембраны Бруха при лазерной коагуляции в 3 местах в каждом глазу, а затем получали подкожные инъекции основы, 20 мг/кг соединения из Таблицы XXI или 40 мг/кг соединения из Таблицы XXI два раза в день в течение 14 дней. По сравнению с мышами, которых лечили основой, средняя площадь неоваскуляризации сосудистой оболочки была значительно меньше у мышей, которых лечили 20 мг/кг или 40 мг/кг соединения из Таблицы XXI. Фигура 9D показывает, что мыши, получавшие внутриглазную инъекцию 3 мкг или 5 мкг соединения из Таблицы XXI, но не мыши, которым вводили 1 мкг, имели значительное снижение средней площади неоваскуляризации сосудистой оболочки по сравнению с парным глазом, в который вводили основу.
Фигура 10А показывает микрофотографии выделенных сетчаток rho/VEGF у мышей, которым делали Р20 подкожную инъекцию 3 или 10 мг/кг соединения из Таблицы XXI или основы, которую повторяли через 12 часов. На Р21, давали третью инъекцию, а затем через 2 часа мышей умерщвляли, сетчатки иссекали, иммунофлуоресцентно окрашивали на альбумин, и сосуды метили контрастным окрашиванием пектином GSA. Как видно из Фигуры 10А, Рамки А-С, небольшую альбуминовую иммунореактивность наблюдали в сетчатке мышей, получавших 10 мг/кг соединения из Таблицы XXI, в то время как показано на Фигуре 10А, Рамки D-F, сетчатки мышей, которых лечили основой, показали сильное окрашивание для альбумин окружающих новых сосудов и были причиной красного тумана по всей сетчатке. Фигура 10В представляет собой график, который показывает, что средняя площадь альбуминового окрашивания была значительно снижена у мышей, инъецированных 3 мг/кг или 10 мг/кг соединения из Таблицы XXI по сравнению с соответствующими контролями.
Фигуры 11А и 11В показывают результаты Tet/opsin/VEGF мышей, которым дважды в день давали подкожные инъекции 3, 10 или 50 мг/кг соединения из Таблицы XXI или основы, и через 3 дня давали дополнительно ежедневно подкожно 50 мг/кг доксициклина. Еще через 4 дня мышей умерщвляли, и замороженные окулярные срезы через зрительный нерв окрашивали Hoechst (синий) и некоторые окрашивали анти-PECAM-I (зеленый). Как видно из Фигуры 11А, колонка 1, окрашенные Hoechst сетчатки от 2 других мышей, получавших основу, показывали полную отслойку сетчатки, и Фигура 11В, Рамка 1, показывает, что PECAM-I окрашенная сетчатка от другой мыши, которую лечили основой, указывает на отслоившиеся, дезорганизованные сетчатки с тяжелой NV во внешней сетчатке.
Фигура 11А, колонка 2, показывает, Hoechst окрашенные сетчатки от 2 мышей, которым вводили 10 мг/кг соединения из Таблицы XXI, одна не показывает отслоение, а другая показывает полное отслоение. Фигура 11В, Рамка 2, показывает PECAM-I окрашенную сетчатку от мыши, которую лечили 10 мг/кг соединения из Таблицы XXI, и показывает присоединенную сетчатку, но есть заметная неовасуляризация в наружной сетчатке.
Фигура 11А, Колонка 3, показывает, Hoechst окрашенные сетчатки от 2 разных мышей, которым вводили 50 мг/кг соединения из Таблицы XXI, где показаны полностью прикрепленные сетчатки, и Фигура 11В, Рамка 3, показывает PECAM-I окрашенные сетчатки от других 50 мг/кг обработанных мышей, где сетчатка прилагается без каких-либо новых сосудов в наружной сетчатке.
Фигура 11С показывает график результатов анализа изображений. Все контрольные мыши, которых лечили основой, имели полную или почти полною отслойку сетчатки. По сравнению с мышами, которых лечили основой, было зависимое от дозы уменьшение отслоения сетчатки у мышей, которых лечили с увеличением дозы соединения из Таблицы XXI. Все мыши, получавшие 50 мг/кг соединения из Таблицы XXI, имели полностью прикрепленную сетчатку.
Фигура 12А показывает неоваскуляризацию сетчатки у rho/VEGF мышей, которых лечили основой, начиная с Р21, и Фигура 12В показывает неоваскуляризацию сетчатки у rho/VEGF мышей, которым вводили 10 мг/кг подкожно два раза в день соединения из Таблицы XXII. Фигура 12С показывает среднюю площадь неоваскуляризации сетчатки на 27-й день для каждой группы.
Фигура 13А показывает неоваскуляризацию сетчатки у rho/VEGF мышей, которых лечили местно основой, начиная с Р21, и Фигура 13В показывает неоваскуляризацию сетчатки у rho/VEGF мышей, получавших местно 30 мг/мл подкожно три раза в день соединения из Таблицы XXII. На Фигуре 13С показана средняя площадь неоваскуляризации сетчатки после 7 дней лечения для каждой группы.
Подробное описание
Материалы, соединения, композиции, изделия и способы, описанные в данной заявке, могут быть легче поняты путем ссылки на последующее подробное описание конкретных аспектов раскрытого объекта изобретения и Примеров, включенных в него. В данной заявке раскрыты и описаны соединения, композиции, изделия, устройства и способы, и должно быть понятно, что аспекты, описанные ниже, не ограничиваются конкретными способами синтеза или специфическими реагентами, поскольку таковые могут, конечно, варьироваться. Дополнительно, следует понимать, что используемая в данной заявке терминология предназначена только для цели описания конкретных аспектов и не предназначена для ограничения.
Также, в данном описании, приведены ссылки на различные публикации. Описания этих публикаций во всей их полноте включены посредством ссылки в данную заявку в целях более полного описания состояния области, к которой относятся раскрытые вещества. Раскрытые ссылки также индивидуально и конкретно включены в данную заявку посредством ссылки на материал, содержащийся в них, что обсуждается в предложении, в котором приведена ссылка.
Общие определения
В данном описании и в формуле изобретения, будут сделаны ссылки на ряд терминов, которые должны быть определены, чтобы иметь следующие значения: Все проценты, соотношения и пропорции в данной заявке приведены по массе, если не указано иное. Все температуры приведены в градусах Цельсия (°С), если не указано иное.
Под «фармацевтически приемлемый» подразумевается материал, который не является биологически или иным образом нежелательным, т.е. материал можно вводить индивидууму вместе с соответствующим активным соединением, не вызывая клинически неприемлемых биологических эффектов или взаимодействия вредным образом с любыми другими компонентами фармацевтической композиции, в которой он содержится.
Диапазоны могут быть выражены в данной заявке как от «приблизительно» одного конкретного значения, и/или до «приблизительно» другого конкретного значения. При выражении такого диапазона, другой аспект включает от одного конкретного значения и/или до другого конкретного значения. Аналогичным образом, когда значения выражены как приблизительные, путем использования предшествующего «приблизительно», следует понимать, что конкретное значение образует другой аспект. Дополнительно следует понимать, что конечные значения каждого из диапазонов являются значительными как по отношению к другой конечной точке, так и независимо от другой конечной точки.
Массовый процент компонента, если специально не указано иное, приведен в расчете на общую массу состава или композиции, в которые компонент включен.
Под «эффективным количеством», как используют в данной заявке, подразумевают «количество одного или более из описанных соединений, эффективных в дозировках и в течение периодов времени, необходимых для достижения желаемого или терапевтического результата». Эффективное количество может варьироваться в зависимости от факторов, известных из уровня техники, таких как болезненное состояние, возраст, пол и масса тела человека или животного, которых лечат. Хотя конкретные режимы дозировки могут быть описаны в примерах в данной заявке, специалисту в данной области техники должно быть понятно, что режимы дозировки могут быть изменены, чтобы обеспечить оптимальную терапевтическую реакцию. Например, несколько раздельных доз можно вводить ежедневно, или доза может быть пропорционально уменьшена в зависимости от нужд терапевтической ситуации. Дополнительно, композиции в соответствии с настоящим изобретением могут вводиться так часто, как необходимо для достижения терапевтического количества.
«Примесь» или «смесь» обычно используют в данной заявке для обозначения физической комбинации из двух или более различных компонентов.
«Эксципиент» используют в данной заявке для включения любого другого соединения, которое может содержаться в, или в комбинации с одним или более описанных ингибиторов, которые не являются терапевтически или биологически активными соединениями. Как таковой, эксципиент должен быть фармацевтически или биологически приемлемым, или соответствующим (например, эксципиент как правило, должен быть нетоксичным для субъекта). «Эксципиент» включает одно такое соединение, а также предназначен для включения множества эксципиентов.
«НРТР бета» или «НРТР-β» используют в данной заявке взаимозаменяемо и они представляют собой аббревиатуры для человеческой бета тирозин белковой фосфатазы.
«Эксципиент», как используют в данной заявке, включает любое другое соединение, которое может содержаться в, или в комбинации с одним или более описанных ингибиторов, которые не представляют собой терапевтически или биологически активное соединение. Как таковой, эксципиент должен быть фармацевтически или биологически приемлемым или соответствующим (например, эксципиент, как правило, должен быть нетоксичным для субъекта). «Эксципиент» включает одно такое соединение, а также предназначен для включения множества эксципиентов.
Как используют в данной заявке, под «субъектом» подразумевают индивидуума. Таким образом, «субъект» может включать одомашненных животных (например, кошек, собак и т.д.), сельскохозяйственных животных (например, крупный рогатый скот, лошадей, свиней, овец, коз и т.д.), лабораторных животных (например, мышь, кролика, крысу, морскую свинку и т.п.), птиц. «Субъект» может также включать млекопитающих, таких как приматы или человек.
Под «уменьшить» или другими формами этого слова, такими как «уменьшение», подразумевают уменьшение события или характеристики (например, сосудистой утечки). Понятно, что это, как правило, относится к некоторому стандартному или ожидаемому значению, иными словами, оно относительно, но это не всегда необходимо для стандартного или относительного значения, которое должно быть передано.
Термин «лечить» или другие формы слова, такие как «пролеченный» или «лечение», используемые в данной заявке, означает, что введение соединения в соответствии с настоящим изобретением облегчает заболевание или расстройство у хозяина и/или снижает, ингибирует или устраняет конкретную характеристику или событие, связанные с расстройством (например, сосудистую утечку). Таким образом, термин «лечение» включает профилактику расстройства, происходящего у хозяина, в частности, если хозяин предрасположен к приобретению заболевания, но до сих пор не поставлен диагноз заболевания; ингибирование расстройства и/или ослабление или реверсию расстройства. Поскольку способы в соответствии с настоящим изобретением направлены на профилактику расстройства, следует понимать, что термин «профилактика» не требует, чтобы болезненное состояние было полностью предупреждено. Скорее, как используют в данной заявке, термин «профилактика» относится к способности специалиста в данной области идентифицировать популяцию, которая подвержена расстройствам, таким образом, что введение соединений в соответствии с настоящим изобретением может происходить до наступления заболевания. Этот термин не означает, что болезненное состояние будет полностью предотвращено.
Описанные соединения влияют на сосудистую утечку путем ингибирования НРТР-β (и эквивалент у грызунов, VE-PTP). Если не указано иное, диабетическая ретинопатия включает все стадии непролиферативной ретинопатии и пролиферативной ретинопатии.
По всему описанию и формуле изобретения данной заявки слово «содержать» и другие формы этого слова, такие как «содержащий» и «содержит» означает, включая, но не ограничиваясь приведенным, и не предназначено для исключения, например, других добавок, компонентов, целых чисел или стадий.
Как используют в описании и прилагаемой формуле изобретения, формы единственного числа включают и множественное число, если из контекста явно не следует иное. Таким образом, например, ссылка на «композицию» включает смеси двух или более таких композиций, ссылка на «фенилсульфаминовую кислоту» включает смеси двух или более таких фенилсульфаминовых кислот, ссылка на «соединение» включает смеси двух или более таких соединений, и т.п.
«Необязательный» или «необязательно» означает, что последовательно описанное событие или условие может или не может иметь место и что описание включает случаи, когда событие или обстоятельство имеют место, и случаи, когда этого не происходит.
Диапазоны могут быть выражены в данной заявке как от «приблизительно» одного конкретного значения, и/или до «приблизительно» другого конкретного значения. Если выражен такой диапазон, другой аспект включает от одного конкретного значения и/или до другого конкретного значения. Аналогичным образом, когда значения выражены как приближения, путем использования предшествующего «приблизительно», следует понимать, что конкретное значение образует другой аспект. Дополнительно, следует понимать, что конечные значения каждого из диапазонов являются значимыми как по отношению к другой конечной точке, так и независимы от другой конечной точки. Понятно также, что существует целый ряд значений, описанных в данной заявке, и что каждое значение также раскрыто в данной заявке как «приблизительно» такое конкретное значение в дополнение к самому значению. Например, если описано значение «10», то «приблизительно 10» также раскрыто. Также следует понимать, что, когда значение раскрывается, то «меньше или равно» значения, «больше или равно значения», и возможные диапазоны между значениями раскрыты также, как соответствующим образом понятно специалисту в данной области техники. Например, если значение «10», раскрыто, то «меньше или равно 10», а также «больше или равно 10» также раскрыто. Понятно также, что во всей заявке данные представлены в ряде различных форматов, и что эти данные представляют конечные точки и начальные точки и диапазоны для любой комбинации экспериментальных точек. Например, если описаны конкретная экспериментальная точка «10» и конкретная экспериментальная точка «15», следует понимать, что больше, больше или равно, меньше, меньше или равно, и равное 10 и 15 считаются раскрытыми, а также диапазон между 10 и 15. Понятно также, что каждая единица между двумя конкретными единицами также раскрыта. Например, если описаны 10 и 15, то 11, 12, 13 и 14 также раскрыты.
Следующая химическая иерархия используется в данной заявке для описания и использования в объеме настоящего изобретения, и для того, чтобы конкретно указать и отчетливо заявить фрагменты, которые содержат соединения в соответствии с настоящим изобретением, однако, если иное не определено, то термины, используемые в данной заявке, являются такими же, как термины специалиста в данной области техники. Термин «гидрокарбил» обозначает любой фрагмент, содержащий атом углерода (органическая молекула), причем фрагменты необязательно содержат одну или более органических функциональных групп, включая соли, содержащие неорганический атом, в частности, соли карбоновых кислот, соли четвертичного аммония. В широком значении термин «гидрокарбил» представляет собой классы «ациклический гидрокарбил» и «циклический гидрокарбил», где данные термины используются для разделения гидрокарбильных фрагментов на циклические и нециклические классы.
Как относится к следующим определениям, «циклические гидрокарбильные» фрагменты могут содержать только атомы углерода в кольце (т.е., карбоциклические и арильные кольца) или могут содержать один или более гетероатомов в кольце (т.е., гетероциклические и гетероарильные кольца). Для «карбоциклических» колец наименьшее количество атомов углерода в кольце составляет 3 атома углерода; циклопропил. Для «арильных» колец наименьшее количество атомов углерода в кольце составляет 6 атомов углерода; фенил. Для «гетероциклических» колец наименьшее количество атомов углерода в кольце составляет 1 атом углерода; диазиринил. Этиленоксид содержит 2 атома углерода и является С2 гетероциклом. Для «гетероарильных» колец наименьшее количество атомов углерода в кольце составляет 1 атом углерода; 1,2,3,4-тетразолил. Приведенное ниже является неограничивающим описанием терминов «ациклический гидрокарбил» и «циклический гидрокарбил», как используется в данной заявке.
А. Замещенный и незамещенный ациклический гидрокарбил:
Для целей настоящего раскрытия термин «замещенный и незамещенный ациклический гидрокарбил» включает 3 категории фрагментов:
1) линейный или разветвленный алкил, неограничивающие примеры которого включают метил (C1), этил (С2), н-пропил (C3), изо-пропил (C3), н-бутил (C4), втор-бутил (C4), изо-бутил (C4), трет-бутил (C4), и т.п; замещенный линейный или разветвленный алкил, неограничивающие примеры которого включают гидроксиметил (C1), хлорметил (C1), трифторметил (C1), аминометил (C1), 1-хлорэтил (С2), 2-гидроксиэтил (С2), 1,2-дифторэтил (С2), 3-карбоксипропил (C3), и т.п.
2) линейный или разветвленный алкенил, неограничивающие примеры которого включают этенил (С2), 3-пропенил (C3), 1-пропенил (также 2-метилэтенил) (C3), изопропенил (также 2-метилэтен-2-ил) (C3), бутен-4-ил (C4), и т.п; замещенный линейный или разветвленный алкенил, неограничивающие примеры которого включают 2-хлорэтенил (также 2-хлорвинил) (C2), 4-гидроксибутен-1-ил (C4), 7-гидрокси-7-метилокт-4-ен-2-ил (С9), 7-гидрокси-7-метилокт-3,5-диен-2-ил (С9), и т.п,
3) линейный или разветвленный алкинил, неограничивающие примеры которого включают этинил (C2), проп-2-инил (также пропаргил) (C3), пропин-1-ил (C3), и 2-метил-гекс-4-ин-1-ил (С7); замещенный линейный или разветвленный алкинил, неограничивающие примеры которого включают 5-гидрокси-5-метилгекс-3-инил (С7), 6-гидрокси-6-метилгепт-3-ин-2-ил (C8), 5-гидрокси-5-этилгепт-3-инил (С9) и т.п.
В. Замещенный и незамещенный циклический гидрокарбил:
Для целей настоящего раскрытия термин «замещенный и незамещенный циклический гидрокарбил» включает 5 категорий фрагментов:
1) Термин «карбоциклический» определен в данной заявке как «включающий кольца, содержащие от 3 до 20 атомов углерода, при этом атомы, которые содержат указанные кольца, ограничены атомами углерода, и кроме того каждое кольцо может быть независимо замещено одной или более группами, способными замещать один или более атомом водорода». Приведенное ниже является неограничивающими примерами «замещенных и незамещенных карбоциклических колец», которые включают следующие категории фрагментов:
i) карбоциклические кольца, содержащие единичное замещенное или незамещенное углеводородное кольцо, неограничивающие примеры которых включают циклопропил (C3), 2-метил-циклопропил (C3), циклопропенил (C3), циклобутил (C4), 2,3-дигидроксициклобутил (C4), циклобутенил (C4), циклопентил (C5), циклопентенил (C5), циклопентадиенил (C5), циклогексил (С6), циклогексенил (С6), циклогептил (С7), циклооктанил (C8), 2,5-диметилциклопентил (C5), 3,5-дихлорциклогексил (С6), 4-гидроксициклогексил (С6) и 3,3,5-триметилциклогекс-1-ил (С6),
ii) карбоциклические кольца, содержащие два или более замещенных или незамещенных конденсированных углеводородных колец, неограничивающие примеры которых включают октагидропенталенил (C8), октагидро-1H-инденил (С9), 3а,4,5,6,7,7а-гексагидро-3Н-инден-4-ил (С9), декагидроазуленил (C10),
iii) карбоциклические кольца, которые являются замещенными или незамещенными бициклическими углеводородными кольцами, неограничивающие примеры которых включают бицикло-[2.1.1]гексанил, бицикло[2.2.1]гептанил, бицикло[3.1.1]гептанил, 1,3-диметил[2.2.1]гептан-2-ил, бицикло[2.2.2]октанил и бицикло[3.3.3]ундеканил.
2) Термин «арил» определен в данной заявке как «фрагменты, содержащие, по меньей мере, одно фенильное или нафтильное кольцо и при этом не являются гетероарильними или гетероциклическими кольцами, конденсированными с фенильным или нафтильным кольцом, и кроме того каждое кольцо может быть независимо замещено одним или более компонентами, способными замещать один или более атомом водорода». Приведенное ниже является неограничивающими примерами «замещенных и незамещенных арильных колец», которые включают следующие категории фрагментов:
i) С6 или C10 замещенные или незамещенные арильные кольца; фенильные и нафтильные кольца, как замещенные, так и незамещенные, неограничивающие примеры которых включают фенил (С6), нафтилен-1-ил (C10), нафтилен-2-ил (C10), 4-фторфенил (С6), 2-гидроксифенил (С6), 3-метилфенил (С6), 2-амино-4-фторфенил (С6), 2-(N,N-диэтиламино)фенил (С6), 2-цианофенил (С6), 2,6-ди-трет-бугилфепил (С6), 3-метоксифенил (С6), 8-гидроксинафтилен-2-ил (C10), 4,5-диметоксинафтилен-1-ил (C10) и 6-циано-нафтилен-1-ил (C10),
ii) С6 или C10 арильные кольца, конденсированные 1 или 2 насыщенными кольцами с образованием C8-C20 кольцевых систем, неограничивающие примеры которых включают бицикло[4.2.0]окта-1,3,5-триенил (C8) и инданил (С9).
3) Термины «гетероциклический» и/или «гетероцикл» определены в данной заявке как «фрагменты, содержащие одно или более колец, имеющих от 3 до 20 атомов, при этом, по меньшей мере, один атом в, по меньшей мере, одном кольце является гетероатомом, выбранным из азота (N), кислорода (О) или серы (S), или смесей N, О и S, и при этом, кроме того, кольцо, которое содержит гетероатом, также не является ароматическим кольцом». Приведенное ниже является неограничивающими примерами «замещенных и незамещенных гетероциклических колец», которые включают следующие категории фрагментов:
i) гетероциклические фрагменты, имеющие единичное кольцо, содержащее один или более гетероатомов, неограничивающие примеры которых включают диазиринил (C1), азиридинил (С2), уразолил (С2), азетидинил (C3), пиразолидинил (C3), имидазолидинил (C3), оксазолидинил (C3), изоксазолинил (C3), тиазолидинил (C3), изотиазолинил (C3), оксатиазолидинонил (C3), оксазолидинонил (C3), гидантоинил (C3), тетрагидрофуранил (C4), пирролидинил (C4), морфолинил (C4), пиперазинил (C4), пиперидинил (C4), дигидропиранил (C5), тетрагидропиранил (C5), пиперидин-2-онил (валеролактам) (C5), 2,3,4,5-тетрагидро-1Н-азепинил (С6), 2,3-дигидро-1H-индол (C8) и 1,2,3,4-тетрагидрохинолин (С9),
ii) гетероциклические фрагменты, имеющие 2 или более кольца, одно из которых является гетероциклическим кольцом, неограничивающие примеры которого включают гексагидро-1Н-пирролизинил (С7), 3а,4,5,6,7,7а-гексагидро-1Н-бензо[d]имидазолил (C7), 3а,4,5,6,7,7а-гексагидро-1Н-индолил (C8), 1,2,3,4-тетрагидрохинолинил (С9) и декагидро-1Н-циклоокта[b]пирролил (C10).
4) Термин «гетероарил» определен в данной заявке как «содержащий одно или более колец, содержащих от 5 до 20 атомов, при этом, по меньшей мере, один атом в, по меньшей мере, одном кольце является гетероатомом, выбранным из азота (N), кислорода (О) или серы (S), или смесей N, О и S, и при этом, кроме того, по меньшей мере, одно из колец, которые содержат гетероатом, является ароматическим кольцом». Приведенное ниже является неограничивающими примерами «замещенных и незамещенных гетероциклических колец», которые включают следующие категории фрагментов:
i) гетероарильные кольца, содержащие единичное кольцо, неограничивающие примеры которого включают 1,2,3,4-тетразолил (C1), [1,2,3]триазолил (С2), [1,2,4]триазолил (С2), триазинил (C3), тиазолил (C3), 1Н-имидазолил (C3), оксазолил (C3), изоксазолил (C3), изоотиазолил (C3), фуранил (C4), тиофенил (C4), пиримидинил (C4), 2-фенилпиримидинил (C4), пиридинил (C5), 3-метилпиридинил (C5) и 4-диметиламинопиридинил (C5),
ii) гетероарильные кольца, содержащие 2 или более конденсированных кольца, одно из которых является гетероарильным кольцом, неограничивающие примеры которых включают: 7Н-пуринил (C5), 9Н-пуринил (C5), 6-амино-9Н-пуринил (C5), 5Н-пирроло[3,2-d]пиримидинил (С6), 7Н-пирроло[2,3-d]пиримидинил (С6), пиридо[2,3-d]пиримидинил (C7), 2-фенилбензо[d]тиазолил (C7), 1H-индолил (C8), 4,5,6,7-тетрагидро-1-Н-индолил (C8), хиноксалинил (C8), 5-метилхиноксалинил (C8), хиназолинил (C8), хинолинил (С9), 8-гидрокси-хинолинил (С9) и изохинолинил (С9).
5) C1-С6 связанные циклические гидрокарбильные фрагменты (либо карбоциклические фрагменты, С6 или C10 арильные фрагменты, гетероциклические фрагменты, либо гетероарильные фрагменты), которые присоединены к другому компоненту, фрагменту или остатку молекулы при помощи C1-С6 алкиленового фрагмента. Неограничивающие примеры связанных циклических гидрокарбильных фрагментов включают бензил C1-(С6), имеющий формулу:
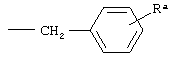 ,
,
где Ra является необязательно одним или более независимо выбранными заместителями для водорода. Дополнительные примеры включают другие арильные фрагменты, в том числе, (2-гидроксифенил)гексил С6-(С6); нафтален-2-илметил C1-(C10), 4-фторбензил C1-(С6), 2-(3-гидроксифенил)этил С2-(С6), а также замещенные и незамещенные C3-C10 алкиленкарбоциклические фрагменты, например, циклопропилметил C1-(C3), циклопентилэтил С2-(C5), циклогексилметил C1-(С6). В эту категорию включены замещенные и незамещенные C1-C10 алкилен-гетероарильные фрагменты, например 2-пиколил C1-(С6) фрагмент, имеющий формулу:
 ,
,
где Ra является таким же, как определено выше. Кроме того, C1-C12 связанные циклические гидрокарбильные фрагменты включают C1-C10 алкиленгетероциклические фрагменты и алкилен-гетероарильные фрагменты, неограничивающие примеры которых включают, азиридинилметил C1-(C2) и оксазол-2-илметил C1-(C3).
Для целей настоящего раскрытия карбоциклические кольца являются от C3 до С20; арильные кольца С6 или C10; гетероциклические кольца от C1 до С9; и гетероарильные кольца от C1 до С9.
Для целей настоящего изобретения, а также чтобы обеспечить согласованность в определении настоящего изобретения, конденсированные циклические фрагменты, а также спироциклические кольца, бициклические кольца и т.п., которые содержат один гетероатом, будут характеризоваться и также упоминаться в данной заявке как охваченные циклическим семейством, соответствующим гетероатом-содержащему кольцу, хотя специалист может иметь альтернативные характеристики. Например, считают, что 1,2,3,4-тетрагидрохинолин, имеющий формулу:
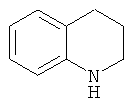 ,
,
для целей настоящего раскрытия, является гетероциклическим фрагментом. Считают, что 6,7-дигидро-5Н-циклопентапиримидин, имеющий формулу:
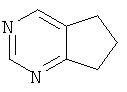 ,
,
для целей настоящего раскрытия, является гетероарильным фрагментом. Когда конденсированный кольцевой фрагмент содержит гетероатомы в насыщенном кольце (гетероциклическое кольцо) и арильном кольце (гетероарильное кольцо), арильное кольцо будет доминировать и определять тип категории, к которой относится кольцо в данной заявке с целью описания настоящего изобретения. Например, считают, что 1,2,3,4-тетрагидро-[1,8]нафтпиридин, имеющий формулу:
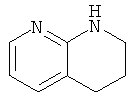 ,
,
для целей настоящего раскрытия, является гетероарильным фрагментом.
Термин «замещенный» используют по всему описанию. Термин «замещенный» применяется к фрагментам, описанным в данной заявке, поскольку «замещенный фрагмент или группа представляет собой гидрокарбильный фрагмент или группу, ациклический или циклический, который имеет один или более атомов водорода, замещенных заместителем или несколькими заместителями, как определено в данной заявке ниже». Фрагменты, при замещении атомов водорода, способны заменить один атом водорода, два атома водорода или три атома водорода гидрокарбильной группы одновременно. Дополнительно, эти заместители могут заменить два атома водорода на двух соседних атомах углерода с образованием указанного заместителя, новой группы или фрагмента. Например, замещенный фрагмент, который требует замещения одного атома водорода, включает галоген, гидроксил, и т.п. Замещение двух атомов водорода включает карбонил, оксимино, и т.п. Замещение двух атомов водорода соседних атомов углерода включает эпокси, и т.п. Замещение трех атомов водорода включает циано, и т.п. Термин «замещенный» используется в настоящем описании, чтобы указать, что гидрокарбильная группа, в частности, ароматическое кольцо, алкильная цепь, могут иметь один или несколько атомов водорода, замещенных заместителем. Если группа описана как «замещенная», то любое количество атомов водорода может быть замещено. Например, 4-гидроксифенил является «замещенным ароматическим карбоциклическим кольцом (арильным кольцом)», (N,N-диметил-5-амино)октанил является «замещенным C8 линейным алкильным фрагментом», 3-гуанидинопропил является «замещенным C3 линейным алкильным фрагментом» и 2-карбоксипиридинил является «замещенным гетероарильным фрагментом».
Приведенное ниже является неограничивающими примерами фрагментов, которые могут замещать атомы водорода на карбоциклическом, арильном, гетероциклическом или гетероар ильном фрагменте:
i) C1-C12 линейный, разветвленный или циклический алкил, алкенил и алкинил; метил (C1), этил (С2), этенил (C2), этинил (С2), н-пропил (C3), изо-пропил (C3), циклопропил (C3), 3-пропенил (C3), 1-пропенил (также 2-метилэтенил) (C3), изопропенил (также 2-метилэтен-2-ил) (C3), проп-2-инил (также пропаргил) (C3), пропин-1-ил (C3), н-бутил (C4), втор-бутил (C4), изо-бутил (C4), трет-бутил (C4), циклобутил (C4), бутен-4-ил (C4), циклопентил (C5), циклогексил (С6);
ii) замещенный или незамещенный С6 или C10 арил; например, фенил, нафтил (также называемый в данной заявке нафтилен-1-ил (C10) или нафтилен-2-ил (C10));
iii) замещенный или незамещенный С6 или C10 алкиленарил; например, бензил, 2-фенилэтил, нафтилен-2-илметил;
iv) замещенные или незамещенные C1-С9 гетероциклические кольца; как описано в данной заявке ниже;
v) замещенные или незамещенные C1-С9 гетероарильные кольца; как описано в данной заявке ниже;
vi) -(CR102aR102b)aOR101; например, -ОН, -CH2OH, -ОСН3, -CH2OCH3, -ОСН2СН3, -CH2OCH2CH3, -ОСН2СН2СН3 и -CH2OCH2CH2CH3;
vii) -(CR102aR102b)aC(O)R101; например, -СОСН3, -СН2СОСН3, -СОСН2СН3, -СН2СОСН2СН3, -СОСН2СН2СН3 и -СН2СОСН2СН2СН3;
viii) -(CR102aR102b)aC(O)R101; например, -CO2CH3, -CH2CO2CH3, -CO2CH2CH3, -CH2CO2CH2CH3, -CO2CH2CH2CH3 и -CH2CO2CH2CH2CH3;
ix) -(CR102aR102b)aC(O)N(R101)2; например, -CONH2, -CH2CONH2, -CONHCH3, -CH2CONHCH3, -CON(CH3)2 и -CH2CON(СН3)2;
х) -(CR102aR102b)aN(R101)2; например, -NH2, -CH2NH2, -NHCH3, -CH2NHCH3, -N(CH3)2 и -CH2N(СН3)2;
xi) галоген; -F, -Cl, -Br и -I;
xii) -(CR102aR102b)aCN;
xiii) -(CR102aR102b)aNO2;
xiv) -CHjXk; где Х представляет собой галоген, индекс j означает целое число от 0 до 2,j+k=3; например, -CH2F, -CHF2, -CF3, -CCl3 или -CBr3;
xv) -(CR102aR102b)aSR101; -SH, -CH2SH, -SCH3, -CH2SCH3, -SC6H5 и -CH2SC6H5;
xvi) -(CR102aR102b)aSO2R101; например, -SO2H, -CH2SO2H, -SO2CH3, -CH2SO2CH3, -SO2C6H5 и -CH2SO2C6H5; И
xvii) -(CR102aR102b)aSO3R101; например, -SO3H, -CH2SO3H, -SO3CH3, -CH2SO3CH3, -SO3C6H5 и -CH2SO3C6H5;
где каждый R101 независимо представляет собой водород, замещенный или незамещенный C1-С6 линейный, разветвленный или циклический алкил, фенил, бензил, гетероцикл или гетероарил; или два R1 фрагмента могут быть взяты вместе с образованием кольца, содержащего 3-7 атомов; R102a и R102b каждый независимо представляет собой водород или C1-C4 линейный или разветвленный алкил; индекс «а» означает от 0 до 4.
Для целей настоящего раскрытия термины «соединение», «аналог» и «смесь химически связанных веществ» являются эквивалентными друг для друга и используются взаимозаменяемо в описании. Раскрытые соединения включают все энантиомерные формы, диастереомерные формы, соли и т.п.
Соединения, описанные в данной заявке, включают все солевые формы, например, соли основных групп, в том числе, аминов, а также соли кислотных групп, в том числе, карбоновых кислот. Приведенное ниже является неограничивающими примерами анионов, которые могут образовывать соли с протонированными основными группами: хлорид, бромид, йодид, сульфат, бисульфат, карбонат, бикарбонат, фосфат, формиат, ацетат, пропионат, бутират, пируват, лактат, оксалат, малонат, малеат, сукцинат, тартрат, фумарат, цитрат, и т.п. Приведенное ниже является неограничивающими примерами катионов, которые могут образовывать соли с кислотными группами: аммоний, натрий, литий, калий, кальций, магний, висмут, лизин и т.п.
Раскрытые соединения имеют Формулу (I):
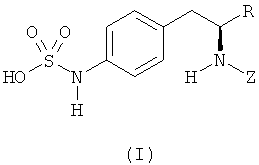
где атом углерода, имеющий аминофрагмент, имеет (S) стереохимию, как указано в следующей формуле:
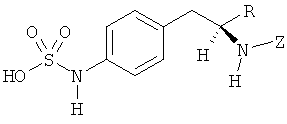
Фрагменты, которые содержат R и Z, могут включать фрагменты, имеющую любую конфигурацию и, соответственно, раскрытые соединения могут находиться в форме отдельных энантиомеров, диастереомерных пар или их комбинаций. Кроме того, соединения могут быть выделены в виде солей или гидратов. В случае солей, соединения могут содержать более, чем один катион или анион. В случае гидратов, может присутствовать любое количество молекул воды или их дробная часть (например, менее чем 1 молекула воды присутствует для каждой молекулы аналога).
R фрагменты
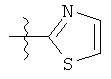
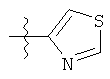
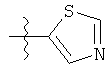
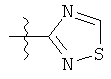
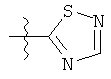
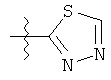
R представляет собой замещенный или незамещенный тиазолильный фрагмент, имеющий формулу:
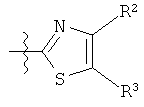 или
или 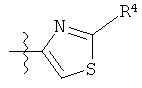 или
или 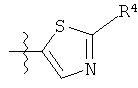
R2, R3 и R4 представляют собой замещающие группы, которые независимо могут быть выбраны из большого разнообразия фрагментов, содержащих неуглеродные атомы (например, водород, гидроксил, амино, галоген, нитро и т.п) или органические замещающие фрагменты, такие как замещенные и незамещенные ациклические гидрокарбильные и циклические гидрокарбильные фрагменты, как описано в данной заявке. Фрагменты, содержащие углерод, могут содержать от 1 до 12 атомов углерода, или от 1 до 10 атомов углерода, или от 1 до 6 атомов углерода.
Пример соединений Формулы (I) включает соединения, в которых R фрагменты представляют собой тиазол-2-ильные фрагменты, имеющие формулу:
 ,
,
где R2 и R3 каждый независимо выбран из:
i)водорода;
ii) замещенного или незамещенного C1-С6 линейного, C3-С6 разветвленного или C3-С6 циклического алкила;
iii) замещенного или незамещенного С2-С6 линейного, C3-С6 разветвленного или C3-С6 циклического алкенила;
iv) замещенного или незамещенного С2-С6 линейного или C3-С6 разветвленного алкинила;
v) замещенного или незамещенного С6 или C10 арила;
vi) замещенного или незамещенного C1-С9 гетероарила;
vii) замещенного или незамещенного C1-С9 гетероцикла; или
viii) R2 и R3 могут быть взяты вместе с образованием насыщенного или ненасыщенного кольца, имеющего от 5 до 7 атомов; где от 1 до 3 атомов необязательно могут быть гетероатомами, выбранными из кислорода, азота и серы.
Приведенное ниже является неограничивающими примерами фрагментов, которые могут замещать один или более атомов водорода в R2 и R3 фрагментах. Следующие заместители, а также другие, не описанные в данной заявке, каждый независимо, выбраны:
i) C1-C12 линейный, C3-C12 разветвленный или C3-C12 циклический алкил, алкенил и алкинил; метил (C1), этил (С2), этенил (С2), этинил (С2), н-пропил (C3), изо-пропил (C3), циклопропил (C3), 3-пропенил (C3), 1-пропенил (также 2-метилэтенил) (C3), изо-пропенил (также 2-метилэтен-2-ил) (C3), проп-2-инил (также пропаргил) (C3), пропин-1-ил (C3), н-бутил (C4), втор-бутил (C4), изо-бутил (C4), трет-бутил (C4), циклобутил (C4), бутен-4-ил (C4), циклопентил (C5), циклогексил (С6);
ii) замещенный или незамещенный C6 или C10 арил; например, фенил, нафтил (также называемый в данной заявке нафтилен-1-ил (C10) или нафтилен-2-ил (C10));
iii) замещенный или незамещенный С6 или C10 алкиленарил; например, бензил, 2-фенилэтил, нафтилен-2-илметил;
iv) замещенные или незамещенные C1-С9 гетероциклические кольца; как описано в данной заявке;
v) замещенные или незамещенные C1-С9 гетероарильные кольца; как описано в данной заявке;
vi) -(CR21aR21b)pOR20; например, -ОН, -СН3ОН, -ОСН3, -СН3ОСН3, -ОСН2СН3, -CH2OCH2CH3, -ОСН2СН2СН3 и -CH2OCH2CH2CH3;
vii) -(CR21aR21b)pC(O)R20; например, -СОСН3, -СН2СОСН3, -СОСН2СН3, -СН2СОСН2СН3, -СОСН2СН2СН3 и -СН2СОСН2СН2СН3;
viii) -(CR21aR21b)pC(O)OR20; например, -CO2CH3, -CH2CO2CH3, -CO2CH2CH3, -CH2CO2CH2CH3, -CO2CH2CH2CH3, и -CH2CO2CH2CH2CH3;
ix) -(CR21aR21b)pC(O)N(R20)2; например, -CONH2, -CH2CONH2, -CONHCH3, -CH2CONHCH3, -CON(СН3)2 и -CH2CON(CH3)2;
х) -(CR21aR21b)pN(R20)2; например, -NH2, -CH2NH2, -NHCH3, -CH2NHCH3, -N(СН3)2 и -CH2N(СН3)2;
xi) галоген; -F, -Cl, -Br и -I;
хп) -(CR21aR21b)pCN;
xiii) -(CR21aR21b)pNO2;
xiv) -(CHj'Xk')hCHjXk; где X представляет собой галоген, индекс j означает целое число от 0 до 2, j+k=3, индекс j' означает целое число от 0 до 2, j'+k'=2, индекс h означает от 0 до 6; например, -CH2F, -CHF2, -CF3, -CH2CF3, -CHFCF3, -CCl3 или -CBr3;
xv) -(CR21aR21b)pSR20; -SH, -CH2SH, -SCH3, -CH2SCH3, -SC6H5 и -CH2SC6H5;
xvi) -(CR21aR21b)pSO2R20; например, -SO2H, -CH2SO2H, -SO2CH3, -CH2SO2CH3, -SO2C6H5 и -CH2SO2C6H5; и
xvii) -(CR21aR21b)pSO3R20; например, -SO3H, -CH2SO3H, -SO3CH3, -CH2SO3CH3, -SO2C6H5 и -CH2SOC6H5;
где каждый R20 независимо представляет собой водород, замещенный или незамещенный C1-C4 линейный, C3-C4 разветвленный, или C3-C4 циклический алкил, фенил, бензил, гетероцикл или гетероарил; или два R20 фрагмента могут быть взяты вместе с образованием кольца, содержащего 3-7 атомов; R21a и R21b каждый независимо представляет собой водород или C1-C4 линейный или C3-C4 разветвленный алкил; индекс р означает от 0 до 4. Пример соединений Формулы (I) включает R фрагменты, имеющие формулу:
 ,
,
где R представляет собой водород и R2 представляет собой фрагмент, выбранный из метила (C1), этила (С2), н-пропила (C3), изо-пропила (C3), н-бутила (C4), втор-бутила (C4), изо-бутила (C4), трет-бутила (C4), н-пентила (C5), 1-метилбутила (C5), 2-метилбутила (C5), 3-метилбутила (C5), циклопропила (C3), н-гексила (С6), 4-метилпентила (С6) и циклогексила (С6).
Другой пример соединений Формулы (I) включает R фрагменты, имеющие формулу:
 ,
,
где R2 представляет собой фрагмент, выбранный из метила (C1), этила (C2, н-пропила (C3), изо-пропила (C3), н-бутила (C4), втор-бутила (C4), изо-бутила (C4) и трет-бутила (C4); и R3 представляет собой фрагмент, выбранный из метила (C1) или этила (С2). Неограничивающие примеры этого аспекта R включают 4,5-диметилтиазол-2-ил, 4-этил-5-метилтиазол-2-ил, 4-метил-5-этилтиазол-2-ил и 4,5-диэтилтиазол-2-ил.
Дополнительный пример соединений Формулы (I) включает R фрагменты, в которых R3 представляет собой водород и R2 представляет собой замещенный алкильный фрагмент, при этом указанные замещения выбраны из:
i) галогена: -F, -Cl, -Br и -I;
ii) -N(R11)2; и
iii) -OR11;
где каждый R11 независимо представляет собой водород или C1-C4 линейный или C3-C4 разветвленный алкил. Неограничивающие примеры фрагментов, которые могут быть заместителем для R2 или R3 атома водорода в R фрагментах, включают -CH2F, -CHF2, -CF3, -CH2CF3, -CH2CH2CF3, -CH2Cl, -CH2OH, -СН2ОСН3, -CH2CH2OH, -CH2CH2OCH3, -CH2NH2, -CH2NHCH3, -CH2N(СН3)2 и -CH2NH(СН2СН3).
Дополнительные неограничивающие примеры фрагментов, которые могут быть заместителем для R2 или R3 атома водорода в R фрагментах, включают 2.2-дифторциклопропил, 2-метоксициклогексил и 4-хлорциклогексил.
Еще в дополнительном примере соединений Формулы (I), R фрагменты включают фрагменты, в которых R3 представляет собой водород и R2 представляет собой фенил или замещенный фенил, при этом неограничивающие примеры R2 фрагментов включают фенил, 3,4-диметилфенил, 4-трет-бутилфенил, 4-циклопропилфенил, 4-диэтиламинофенил, 4-(трифторметил)фенил, 4-метоксифенил, 4-(дифторметокси)-фенил, 4-(трифторметокси)фенил, 3-хлорфенил, 4-хлорфенил и 3,4-дихлор-фенил, которые, когда они включены в определение R, обеспечивают следующие R фрагменты 4-фенилтиазол-2-ил, 3,4-диметилфенилтиазол-2-ил, 4-трет-бутилфенилтиазол-2-ил, 4-циклопропилфенилтиазол-2-ил, 4-диэтиламинофенилтиазол-2-ил, 4-(трифторметил)-фенилтиазол-2-ил, 4-метоксифенилтиазол-2-ил, 4-(дифторметокси)фенилтиазол-2-ил, 4-(трифторметокси)фенилтиазол-2-ил, 3-хлорфенилтиазол-2-ил, 4-хлорфенилтиазол-2-ил и 3,4-дихлорфенилтиазол-2-ил.
Еще дополнительный пример соединений Формулы (I) включает R фрагменты, в которых R2 выбран из водорода, метила, этила, н-пропила и изопропила, и R3 представляет собой фенил или замещенный фенил. Неограничивающий пример R фрагмента в соответствии с пятым аспектом первой категории R фрагменов включает
4-метил-5-фенилтиазол-2-ил и 4-этил-5-фенилтиазол-2-ил.
Другой дополнительный пример соединений Формулы (I) включает R фрагменты, в которых R представляет собой водород и R2 представляет собой замещенный или незамещенный гетероарильный фрагмент, выбранный из 1,2,3,4-тетразол-1-ила, 1,2,3,4-тетразол-5-ила, [1,2,3]триазол-4-ила, [1,2,3]триазол-5-ила, [1,2,4]триазол-4-ила, [1,2,4]триазол-5-ила, имидазол-2-ила, имидазол-4-ила, пиррол-2-ила, пиррол-3-ила, оксазол-2-ила, оксазол-4-ила, оксазол-5-ила, изоксазол-3-ила, изоксазол-4-ила, изоксазол-5-ила, [1,2,4]оксадиазол-3-ила, [1,2,4]оксадиазол-5-ила, [1,3,4]оксадиазол-2-ила, фуран-2-ила, фуран-3-ила, тиофен-2-ила, тиофен-3-ила, изотиазол-3-ила, изотиазол-4-ила, изотиазол-5-ила, тиазол-2-ила, тиазол-4-ила, тиазол-5-ила, [1,2,4]тиадиазол-3-ила, [1,2,4]тиадиазол-5-илаи [1,3,4]тиадиазол-2-ила.
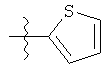
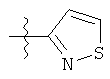
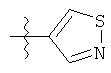
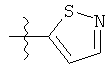
Дополнительный неограничивающий пример соединений Формулы (I) включает R фрагменты, в которых R2 представляет собой замещенный или незамещенный тиофен-2-ил, например тиофен-2-ил, 5-хлортиофен-2-ил и 5-метилтиофен-2-ил.
Еще дополнительный пример соединений Формулы (I) включает R фрагменты, в которых R2 представляет собой замещенный или незамещенный тиофен-3-ил, например тиофен-3-ил, 5-хлортиофен-3-ил и 5-метилтиофен-3-ил.
Другой пример соединений Формулы (I) включает R фрагменты, в которых R2 и R3 взяты вместе с образованием насыщенного или ненасыщенного кольца, имеющего от 5 до 7 атомов. Неограничивающие примеры шестого аспекта первой категории R фрагментов включают 5,6-дигидро-4Н-циклопента[d]тиазол-2-ил и 4,5,6,7-тетрагидробензо[d]тиазол-2-ил.
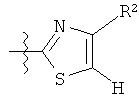
Дополнительные примеры соединений Формулы (I) включают R фрагменты, которые представляют собой тиазол-4-ильный или тиазол-5-ильный фрагменты, имеющие формулу:
 или
или 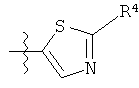 ,
,
где R4 представляет собой фрагмент, выбранный из:
i) водорода;
ii) замещенного или незамещенного C1-С6 линейного, C3-С6 разветвленного или C3-С6 циклического алкила;
iii) замещенного или незамещенного С2-С6 линейного, C3-С6 разветвленного или C3-С6 циклического алкенила;
iv) замещенного или незамещенного C3-С6 линейного или разветвленного алкинила;
v) замещенного или незамещенного С6 или C10 арила;
vi) замещенного или незамещенного C1-С9 гетероарила; или
vii) замещенного или незамещенного C1-С9 гетероцикла.
Приведенное ниже является неограничивающими примерами фрагментов, которые могут замещать один или более атомов водорода в R4 фрагментах. Следующие заместители, а также другие, не описанные в данной заявке, каждый независимо, выбраны:
i) C1-C12 линейный, C3-C12 разветвленный или C3-C12 циклический алкил, алкенил и алкинил; метил (C1), этил (C2), этенил (C2), этинил (C2), н-пропил (C3), изо-пропил (C3), циклопропил (C3), 3-пропенил (C3), 1-пропенил (также 2-метилэтенил) (C3), изопропенил (также 2-метилэтен-2-ил) (C3), проп-2-инил (также пропаргил) (C3), пропин-1-ил (C3), н-бутил (C4), втор-бутил (C4), изо-бутил (C4), трет-бутил (C4), циклобутил (C4), бутен-4-ил (C4), циклопентил (C5), циклогексил (С6);
ii) замещенный или незамещенный С6 или C10 арил; например, фенил, нафтил (также называемый в данной заявке нафтилен-1-ил (C10) или нафтилен-2-ил (C10));
iii) замещенный или незамещенный С6 или C10 алкиленарил; например, бензил, 2-фенилэтил, нафтилен-2-илметил;
iv) замещенные или незамещенные C1-С9 гетероциклические кольца; как описано в данной заявке ниже;
v) замещенные или незамещенные C1-С9 гетероарильные кольца; как описано в данной заявке ниже;
vi) -(CR21aR21b)pOR20; например, -ОН, -СН2ОН, -ОСН3, -CH2OCH3, -ОСН2СН3, -CH2OCH2CH3, -ОСН2СН2СН3 и -CH2OCH2CH2CH3;
vii) -(CR21aR21b)pC(O)R20; например, -СОСН3, -СН2СОСН3, -СОСН2СН3, -СН2СОСН2СН3, -СОСН2СН2СН3 и -СН2СОСН2СН2СН3;
viii) -(CR21aR21b)pC(O)OR20; например, -CO2CH3, -CH2CO2CH3, -CO2CH2CH3, -CH2CO2CH2CH3, -CO2CH2CH2CH3 и -CH2CO2CH2CH2CH3;
ix) -(CR21aR21b)pC(O)N(R20)2; например, -CONH2, -CH2CONH2, -CONHCH3, -CH2CONHCH3, -CON(СН3)2 и -CH2CON(CH3)2;
х) -(CR21aR21b)pN(R20)2; например, -NH2, -CH2NH2, -NHCH3, -CH2NHCH3, -N(СН3)2 и -CH2N(СН3)2;
xi) галоген; -F, -Cl, -Br и -I;
xii) -(CR21aR21b)pCN;
xiii) -(CR21aR21b)pNO2;
xiv) -(CHj'Xk')hCHjXk; где X представляет собой галоген, индекс j означает целое число от 0 до 2, j+k=3, индекс j' означает целое число от 0 до 2, j'+k'=2, индекс h означает от 0 до 6; например, -CH2F, -CHF2, -CF3, -CH2CF3, -CHFCF3, -CCl3 или -CBr3;
xv) -(CR21aR21b)pSR20; -SH, -CH2SH, -SCH3, -CH2SCH3, -SC6H5 и -CH2SC6H5;
xvi) -(CR21aR21b)pSO2R20; например, -SO2H, -CH2SO2H, -SO2CH3, -CH2SO2CH3, -SO2C6H5 и -CH2SO2C6H5; И
xvii) -(CR21aR21b)pSO3R20; например, -SO3H, -CH2SO3H, -SO3CH3, -CH2SO3CH3, -SO3C6H5 и -CH2SO3C6H5;
где каждый R20 независимо представляет собой водород, замещенный или незамещенный C1-C4 линейный, C3-C4 разветвленный или C3-C4 циклический алкил, фенил, бензил, гетероцикл или гетероарил; или два R20 фрагмента взяты вместе с образованием кольца, содержащего 3-7 атомов; R21a и R21b каждый независимо представляет собой водород или C1-C4 линейный или C3-C4 разветвленный алкил;
индекс р означает от 0 до 4.
Пример соединений Формулы (I) включает R фрагменты, в которых R4 представляет собой водород.
Дополнительный пример соединений Формулы (I) включает R фрагменты, в которых R4 представляет собой фрагмент, выбранный из метила (C1), этила (C2), н-пропила (C3), изо-пропила (C3), н-бутила (C4), втор-бутила (C4), изо-бутила (C4) и трет-бутила (C4). Неограничивающие примеры этого аспекта R включают 2-метилтиазол-4-ил, 2-этилтиазол-4-ил, 2-(н-пропил)тиазол-4-ил и 2-(изо-пропил)тиазол-4-ил.
Еще дополнительный пример соединений Формулы (I) включает R фрагменты, в которых R4 представляет собой замещенный или незамещенный фенил, неограничивающие примеры которого включают фенил, 2-фторфенил, 2-хлорфенил, 2-метилфенил, 2-метоксифенил, 3-фторфенил, 3-хлорфенил, 3-метилфенил, 3-метоксифенил, 4-фторфенил, 4-хлорфенил, 4-метилфенил и 4-метоксифенил.
Еще дополнительный пример соединений Формулы (I) включает R фрагменты, в которых R4 представляет собой замещенный или незамещенный гетероарил, неограничивающие примеры которого включают тиофен-2-ил, тиофен-3-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, 2,5-диметилтиазол-4-ил, 2,4-диметилтиазол-5-ил, 4-этилтиазол-2-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил и 3-метил-1,2,4-оксадиазол-5-ил.
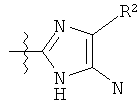
Другой пример 5-членного кольца R фрагментов включает замещенные или незамещенные имидазолильные фрагменты, имеющие формулу:
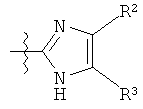 или
или 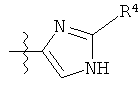
Один пример имидазолильных R фрагментов включает имидазол-2-ильные фрагменты, имеющие формулу:
 ,
,
где R2 и R3 каждый независимо выбран из:
i) водорода;
ii) замещенного или незамещенного C1-С6 линейного, C3-С6 разветвленного или C3-C6 циклического алкила;
iii) замещенного или незамещенного C3-C6 линейного, C3-C6 разветвленного или C3-C6 циклического алкенила;
iv) замещенного или незамещенного C3-C6 линейного или разветвленного алкинила;
v) замещенного или незамещенного С6 или C10 арила;
vi) замещенного или незамещенного C1-С9 гетероарила;
vii) замещенного или незамещенного C1-С9 гетероцикла; или
viii) R2 и R3 могут быть взяты вместе с образованием насыщенного или ненасыщенного кольца, имеющего от 5 до 7 атомов; где от 1 до 3 атомов необязательно могут быть гетероатомами, выбранными из кислорода, азота и серы.
Приведенное ниже является неограничивающими примерами фрагментов, которые могут замещать один или более атомов водорода в R2 и R3 фрагментах. Следующие заместители, а также другие, не описанные в данной заявке, каждый независимо, выбраны:
i) C1-C12 линейный, C3-C12 разветвленный или C3-C12 циклический алкил, алкенил и алкинил; метил (C1), этил (C3), этенил (C3), этинил (C3), н-пропил (C3), изо-пропил (C3), циклопропил (C3), 3-пропенил (C3), 1-пропенил (также 2-метилэтенил) (C3), изопропенил (также 2-метилэтен-2-ил) (C3), проп-2-инил (также пропаргил) (C3), пропин-1-ил (C3), н-бутил (C4), втор-бутил (C4), изо-бутил (C4), трет-бутия (C4), циклобутил (C4), бутен-4-ил (C4), циклопентил (C5), циклогексил (С6);
ii) замещенный или незамещенный С6 или C10 арил; например, фенил, нафтил (также называемый в данной заявке нафтилен-1-ил (C10) или нафтилен-2-ил (C10));
iii) замещенный или незамещенный С6 или C10 алкиленарил; например, бензил, 2-фенилэтил, нафтилен-2-илметил;
iv) замещенные или незамещенные C1-С9 гетероциклические кольца; как описано в данной заявке;
v) замещенные или незамещенные C1-С9 гетероарильные кольца; как описано в данной заявке;
vi) -(CR21aR21b)zOR20; например, -ОН, -CH2OH, -ОСН3, -CH2OCH3, -ОСН2СН3, -СН2ОСН2СН3, -ОСН2СН2СН3 и -CH2OCH2CH2CH3;
vii) -(CR21aR21b)zC(O)R20; например, -СОСН3, -СН2СОСН3, -СОСН2СН3, -СН2СОСН2СН3, -СОСН2СН2СН3 и -СН2СОСН2СН2СН3;
viii) -(CR21aR21b)zC(O)OR20; например, -CO2CH3, -CH2CO2CH3, -CO2CH2CH3, -CH2CO2CH2CH3, -CO2CH2CH2CH3 и -CH2CO2CH2CH2CH3;
ix) -(CR21aR21b)zC(O)N(R20)2; например, -CONH2, -CH2CONH2, -CONHCH3, -CH2CONHCH3, -CON(СН3)2 и -CH2CON(СН3)2;
х) -(CR21aR21b)zN(R20)2; например, -NH2, -CH2NH2, -NHCH3, -CH2NHCH3, -N(CH3)2 и -CH2N(СН3)2;
xi) галоген; -F, -Cl, -Br и -I;
xii) -(CR21aR21b)zCN;
xiii) -(CR21aR21b)zNO2;
xiv) -(CHj'Xi^)hCHjXk; где Х представляет собой галоген, индекс j означает целое число от 0 до 2, j+k=3, индекс j' означает целое число от 0 до 2, j'+k'=2. индекс h означает от 0 до 6; например, -CH2F, -CHF2, -CF3, -CH2CF3, -CHFCF3, -CCl3 или -CBr3;
xv) -(CR21aR21b)zSR20; -SH, -CH2SH, -SCH3, -CH2SCH3, -SC6H5 и -CH2SC6H5;
xvi) -(CR21aR21b)zSO2R20; например, -SO2H, -CH2SO2H, -SO2CH3, -CH2SO2CH3, -SO2C6H5 и -CH2SO2C6H5; И
xvii) -(CR21aR21b)zSO3R20; например, -SO3H, -CH2SO3H, -SO3CH3, -CH2SO3CH3, -SO3C6H5 и -CH2SO3C6H5;
где каждый R20 независимо представляет собой водород, замещенный или незамещенный C1-C4 линейный, C3-C4 разветвленный или C3-C4 циклический алкил, фенил, бензил, гетероцикл или гетероарил; или два R20 фрагмента могут быть взяты вместе с образованием кольца, содержащего 3-7 атомов; R21a и R21b каждый независимо представляет собой водород или C1-C4 линейный или C3-C4 разветвленный алкил;
индекс z означает от 0 до 4. Один пример R фрагментов включает соединения, в которых R фрагменты имеют формулу:
 ,
,
где R3 представляет собой водород и R2 представляет собой фрагмент, выбранный из метила (C1), этила (C2), н-пропила (C3), изо-пропила (C3), н-бутила (C4), втор-бутила (C4), изо-бутила (C4) и трет-бутила (C4).
Другой пример R фрагментов включает соединения, в которых R2 представляет собой фрагмент, выбранный из метила (C1), этила (С2), н-пропила (C3), изо-пропила (C3), н-бутила (C4), втор-бутила (C4), изо-бутила (C4) и трет-бутила (C4); и R3 представляет собой фрагмент, выбранный из метила (C1) или этила (С2). Неограничивающие примеры этого аспекта R включают 4,5-диметилимидазол-2-ил, 4-этил-5-метилимидазол-2-ил, 4-метил-5-этилимидазол-2-ил и 4,5-диэтилимидазол-2-ил.
Пример R2 фрагментов включает соединения, в которых R3 представляет собой водород и R2 представляет собой выбранный замещенный алкильный фрагмент, при этом указанные замещения выбраны из:
i) галогена: -F, -Cl, -Br и -I;
ii) -N(R11)2; и
iii) -OR11;
где каждый R11 независимо представляет собой водород или C1-C4 линейный или C3-C4 разветвленный алкил.
Неограничивающие примеры фрагментов, содержащие это осуществление R, включают: -CH2F, -CHF2, -CF3, -CH2CF3, -CH2Cl, -СН2ОН, -СН2ОСН3, -СН2СН2ОН, -CH2CH2OCH3, -CH2NH2, -CH2NHCH3, -CH2N(СН3)2 и -CH2NH(СН2СН3).
Еще дополнительный пример R фрагментов включает фрагменты, в которых R3 представляет собой водород и R2 представляет собой фенил.
Еще дополнительный пример R фрагментов включает фрагменты, в которых R3 представляет собой водород и R представляет собой гетероарильный фрагмент, выбранный из 1,2,3,4-тетразол-1-ила, 1,2,3,4-тетразол-5-ила, [1,2,3]триазол-4-ила, [1,2,3]триазол-5-ила, [1,2,4]триазол-4-ила, [1,2,4]триазол-5-ила, имидазол-2-ила, имидазол-4-ила, пиррол-2-ила, пиррол-3-ила, оксазол-2-ила, оксазол-4-ила, оксазол-5-ила, изоксазол-3-ила, изоксазол-4-ила, изоксазол-5-ила, [1,2,4]оксадиазол-3-ила, [1,2,4]оксадиазол-5-ила, [1,3,4]оксадиазол-2-ила, фуран-2-ила, фуран-3-ила, тиофен-2-ила, тиофен-3-ила, изотиазол-3-ила, изотиазол-4-ила, изотиазол-5-ила, тиазол-2-ила, тиазол-4-ила, тиазол-5-ила, [1,2,4]тиадиазол-3-ила, [1,2,4]тиадиазол-5-ила и [1,3,4]тиадиазол-2-ила.
Z фрагменты
Z представляет собой фрагмент, имеющий формулу:
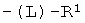 ,
,
R1 выбран из:
i) водорода;
ii) гидроксила;
iii) амино;
iv) замещенного или незамещенного C1-C6 линейного, C3-C6 разветвленного или C3-C6 циклического алкила;
v) замещенного или незамещенного C1-C6 линейного, C3-C6 разветвленного или C3-C6 циклического алкокси;
vi) замещенного или незамещенного С6 или C10 арила;
vii) замещенных или незамещенных C1-С9 гетероциклических колец; или
viii) замещенных или незамещенных C1-С9 гетероарильных колец.
Приведенное ниже является неограничивающими примерами фрагментов, которые могут замещать один или более атомов водорода в R1 фрагментах. Следующие заместители, а также другие, не описанные в данной заявке, каждый независимо, выбраны:
i) C1-C12 линейный, C3-C12 разветвленный или C3-C12 циклический алкил, алкенил и алкинил; метил (C1), этил (C2), этенил (C3), этинил (C3), н-пропил (C3), изо-пропил (C3), циклопропил (C3), 3-пропенил (C3), 1-пропенил (также 2-метилэтенил) (C3), изопропенил (также 2-метилэтен-2-ил) (C3), проп-2-инил (также пропаргил) (C3), пропин-1-ил (C3), н-бутил (C4), втор-бутил (C4), изо-бутил (C4), трет-бутил (C4), циклобутил (C4), бутен-4-ил (C4), циклопентил (C5), циклогексил (С6);
ii) замещенный или незамещенный С6 или C10 арил; например, фенил, нафтил (также называемый в данной заявке нафтилен-1-ил (C10) или нафтилен-2-ил (C10));
iii) замещенный или незамещенный С6 или C10 алкиленарил; например, бензил, 2-фенилэтил, нафтилен-2-илметил;
iv) замещенные или незамещенные C1-С9 гетероциклические кольца; как описано в данной заявке;
v) замещенные или незамещенные C1-С9 гетероарильные кольца; как описано в данной заявке;
vi) -(CR31aR31b)qOR30; например, -ОН, -CH2OH, -ОСН3, -CH2OCH3, -ОСН2СН3, -СН2ОСН2СН3, -ОСН2СН2СН3 и -СН2ОСН2СН2СН3;
vii) -(CR31aR31b)qC(O)R30; например, -СОСН3, -СН2СОСН3, -СОСН2СН3, -СН2СОСН2СН3, -СОСН2СН2СН3 и -СН2СОСН2СН2СН3;
viii) -(CR31aR31b)qC(O)OR30; например, -CO2CH3, -CH2CO2CH3, -CO2CH2CH3, -CH2CO2CH2CH3, -CO2CH2CH2CH3 и -CH2CO2CH2CH2CH3;
ix) -(CR31aR31b)qC(O)N(R3O)2; например, -CONH2, -CH2CONH2, -CONHCH3, -CH2CONHCH3, -CON(СН3)2 и -CH2CON(CH3)2;
х) -(CR31aR31b)qN(R30)2; например, -NH2, -CH2NH2, -NHCH3, -CH2NHCH3, -N(СН3)2 и -CH2N(CH3)2;
xi) галоген; -F, -Cl, -Br и -I;
xii) -(CR31aR31b)qCN;
xiii) -(CR31aR31b)qNO2;
xiv) -(CHj'Xk')hCHjXk; где Х представляет собой галоген, индекс j означает целое число от 0 до 2, j+k=3, индекс j' означает целое число от 0 до 2, j'+k'=2, индекс h означает от 0 до 6; например, -CH2F, -CHF2, -CF3, -CH2CF3, -CHFCF3, -CCl3 или -CBr3;
xv) -(CR31aR31b)qSR3O; -SH, -CH2SH, -SCH3, -CH2SCH3, -SC6H5 и -CH2SC6H5;
xvi) -(CR31aR31b)qSO2R3O; например, -SO2H, -CH2SO2H, -SO2CH3, -CH2SO2CH3, -SO2C6H5 и -CH2SO2C6H5; И
xvii) -(CR31aR31b)qSO2R3O; например, -SO3H, -CH2SO3H, -SO3CH3, -CH2SO2CH3, -SO3C6H5 и -CH2SO3C6H5;
где каждый R30 независимо представляет собой водород, замещенный или незамещенный C1-C6 линейный, C3-C6 разветвленный или C3-C6 циклический алкил, фенил, бензил, гетероцикл или гетероарил; или два R30 фрагмента могут быть взяты вместе с образованием кольца, содержащего 3-7 атома; R31a и R31b каждый независимо представляет собой водород или C1-C4 линейный или C3-C4 разветвленный алкил; индекс q означает от 0 до 4.
Один пример R1 фрагментов включает замещенные или незамещенные фенильные (С6 арил) фрагменты, при этом каждое замещение независимо выбрано из: галогена, C1-C4 линейного, разветвленного алкила или циклического алкила, -OR11, -CN, -N(R11)2, -CO2R11, -C(O)N(R11)2, -NR11C(O)R11, -NO2 и -SO2R11; каждый R11 независимо представляет собой водород; замещенный или незамещенный C1-C4 линейный, C3-C4 разветвленный, C3-C4 циклический алкил, алкенил или алкинил; замещенный или незамещенный фенил или бензил; или два R11 фрагмента могут быть взяты вместе с образованием кольца, содержащего от 3-7 атомов.
Другой пример R1 фрагментов включает замещенные С6 арильные фрагменты, выбранные из фенила, 2-фторфенила, 3-фторфенила, 4-фторфенила, 2,3-дифторфенила, 3,4-дифторфенила, 3,5-дифторфенила, 2-хлорфенила, 3-хлорфенила, 4-хлорфенила, 2,3-дихлорфенила, 3,4-дихлорфенила, 3,5-дихлорфенила, 2-гидроксифенила, 3-гидроксифенила, 4-гидроксифенила, 2-метоксифенила, 3-метоксифенила, 4-метоксифенила, 2,3-диметоксифенила, 3,4-диметоксифенила и 3,5-диметоксифенила.
Дополнительный пример R1 фрагментов включает замещенные или незамещенные С6 арильные фрагменты, выбранные из 2,4-дифторфенила, 2,5-дифторфенила, 2,6-дифторфенила, 2,3,4-трифторфенила, 2,3,5-трифторфенила, 2,3,6-трифторфенила, 2,4,5-трифторфенила, 2,4,6-трифторфенила, 2,4-дихлорфенила, 2,5-дихлорфенила, 2,6-дихлорфенила, 3,4-дихлорфенила, 2,3,4-трихлорфенила, 2,3,5-трихлорфенила, 2,3,6-трихлорфенила, 2,4,5-трихлорфенила, 3,4,5-трихлорфенила и 2,4,6-трихлорфенила.
Еще дополнительный пример R1 фрагментов включает замещенные С6 арильные фрагменты, выбранные из 2-метилфенила, 3-метилфенила, 4-метилфенила, 2,3-диметилфенила, 2,4-диметилфенила, 2,5-диметилфенила, 2,6-диметилфенила, 3,4-диметилфенила, 2,3,4-триметилфенила, 2,3,5-триметилфенила, 2,3,6-триметилфенила, 2,4,5-триметилфенила, 2,4,6-триметилфенила, 2-этилфенила, 3-этилфенила, 4-этилфенила, 2,3-диэтилфенила, 2,4-диэтилфенила, 2,5-диэтилфенила, 2,6-диэтилфенила, 3,4-диэтилфенила, 2,3,4-триэтилфенила, 2,3,5-триэтилфенила, 2,3,6-триэтилфенила, 2,4,5-триэтилфенила, 2,4,6-триэтилфенила, 2-изопропилфенила, 3-изопропилфенила и 4-изопропилфенила.
Еще другой дополнительный пример R' фрагментов включает замещенный С6 арильные фрагменты, выбранные из 2-аминофенила, 2-(N-метиламино)фенила, 2-(N,N-диметиламино)фенила, 2-(N-этиламино)фенила, 2-(N,N-диэтиламино)фенила, 3-аминофенила, 3-(N-метиламино)фенила, 3-(N,N-диметиламино)фенила, 3-(N-этиламино)фенила, 3-(N,N-диэтиламино)фенила, 4-аминофенила, 4-(N-метиламино)фенила, 4-(N,N-диметиламино)фенила, 4-(N-этиламино)фенила и 4-(N,N-диэтиламино)фенила.
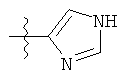
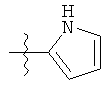
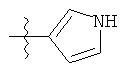
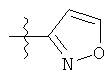
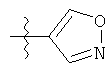
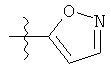
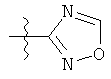
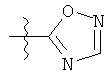
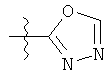
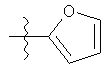
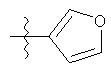
R1 может содержать гетероарильные фрагменты. Неограничивающие примеры C1-С9 гетероарильных фрагментов включают:
i)
 ;
; 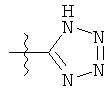 ;
;
ii)
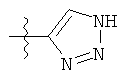 ;
; 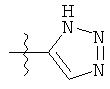 ;
; 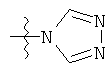 ;
; 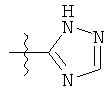 ;
;
iii)
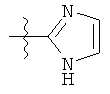 ;
;  ;
;
iv)
 ;
;  ;
;
v)
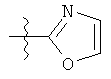 ;
; 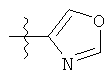 ;
; 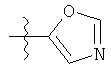 ;
;
vi)
 ;
;  ;
;  ;
;
vii)
 ;
;  ;
;
viii)
 ;
;
ix)
 ;
;  ;
;
x)
 ;
;  ;
;
xi)
 ;
;  ;
;  ;
;
xii)
 ;
;  ;
;  ;
;
xiii)
 ;
;  ; и
; и
xiv)
 .
.
R1 гетероарильные фрагменты могут быть замещенными или незамещенными. Неограничивающие примеры фрагментов, которые могут замещать водород, включают фрагменты, выбранные из:
i) C1-C6 линейного, C3-C6 разветвленного и C3-C6 циклического алкила;
ii) замещенного или незамещенного фенила и бензила;
iii) замещенного или незамещенного C1-С9 гетероарила;
iv) -C(O)R9; и
v) -NHC(O)R9;
где R9 представляет собой C1-C6 линейный и разветвленный алкил; C1-C6 линейный и C3-C6 разветвленный алкокси; или -NHCH2C(O)R10; R10 выбран из водорода, метила, этила и трет-бутила.
Пример R1 относится к фрагментам, замещенным алкильным фрагментом, выбранным из метила, этила, н-пропила, изо-пропила, н-бутила, изо-бутила. втор-бутила и трет-бутила.
Другой пример R1 включает фрагменты, которые замещены замещенным или незамещенным фенилом и бензилом, при этом фенильное и бензильное замещения выбраны из одного или более:
i) галогена;
ii) C1-C3 алкила;
iii) C1-C3 алкокси;
iv) -CO2R11; и
v) -NHCOR16;
где R11 и R16 каждый независимо представляет собой водород, метил или этил.
Другой пример R1 относится к фенильному и бензильному фрагментам, замещенным карбоксифрагментом, имеющим формулу -C(O)R9; R9 выбран из метила, метокси, этила и этокси.
Дополнительный пример R1 включает фенильный и бензильный фрагменты, замещенные амидным фрагментом, имеющим формулу -NHC(O)R9; R9 выбран из метила, метокси, этила, этокси, трет-бутила и трет-бутокси.
Еще дополнительный пример R1 включает фенильный и бензильный фрагменты, замещенные одним или более фтор- или хлорфрагментами.
L фрагменты
L представляет собой соединяющий фрагмент, который присутствует, когда индекс п равен 1, но отсутствует, когда индекс n равен 0. L фрагменты имеют формулу:
-[Q]y[C(R5aR5b)]x[Q1]z[C(R6aR6b)]w-,
где Q и Q1 каждый независимо представляет собой:
i) -С(O)-;
ii) -NH-;
iii) -C(O)NH-;
iv) -NHC(O)-;
v) -NHC(O)NH-;
vi) -NHC(O)O-;
vii) -C(O)O-;
viii) -C(O)NHC(O)-;
ix) -O-;
x) -S-;
xi) -SO2-;
xii) -C(=NH)-;
xiii) -C(=NH)NH-;
xiv) -NHC(=NH)-; или
xv) -NHC(=NH)NH-.
Когда индекс y равен 1, Q присутствует. Когда индекс y равен 0, Q отсутствует. Когда индекс z равен 1, Q1 присутствует. Когда индекс z равен 0, Q1 отсутствует.
R5a и R5b каждый независимо представляет собой:
i) водород;
ii) гидрокси;
iii) галоген;
iv) замещенный или незамещенный C1-C6 линейный или C3-C6 разветвленный алкил; или
v) фрагмент, имеющий формулу:
-[C(R7aR7b)]tR8,
где R7a и R7b каждый независимо представляет собой:
i) водород; или
ii) замещенный или незамещенный C1-C6 линейный, C3-C6 разветвленный или C3-C6 циклический алкил.
R8 представляет собой:
i)водород;
ii) замещенный или незамещенный C1-C6 линейный, C3-C6 разветвленный или C3-C6 циклический алкил;
iii) замещенный или незамещенный С6 или C10 арил;
iv) замещенный или незамещенный C1-С9 гетероарил; или
v) замещенный или незамещенный C1-С9 гетероцикл.
R6a и R6b каждый независимо представляет собой:
i) водород; или
ii) C1-C4 линейный или C3-C4 разветвленный алкил.
Индексы t, w и х, каждый независимо, означает от 0 до 4.
Приведенное ниже является неограничивающими примерами фрагментов, которые могут замещать один или более атомов водорода в R5a, R5b, R7a, R7b и R8 фрагментах. Следующие заместители, а также другие, не описанные в данной заявке, каждый независимо, выбраны:
i) C1-C12 линейный, разветвленный или циклический алкил, алкенил и алкинил; метил (C1), этил (C2), этенил (C3), этинил (C2), н-пропил (C3), изо-пропил (C3), циклопропил (C3), 3-пропенил (C3), 1-пропенил (также 2-метилэтенил) (C3), изопропенил (также 2-метилэтен-2-ил) (C3), проп-2-инил (также пропаргил) (C3), пропин-1-ил (C3), н-бутил (C4), втор-бутил (C4), изо-бутил (C4), трет-бутил (C4), циклобутил (C4), бутен-4-ил (C4), циклопентил (C5), циклогексил (С6);
ii) замещенный или незамещенный С6 или C10 арил; например, фенил, нафтил (также называемый в данной заявке нафтилен-1-ил (C10) или нафтилен-2-ил (C10));
iii) замещенный или незамещенный С6 или C10 алкиленарил; например, бензил, 2-фенилэтил, нафтилен-2-илметил;
iv) замещенные или незамещенные C1-С9 гетероциклические кольца; как описано в данной заявке ниже;
v) замещенные или незамещенные C1-C9 гетероарильные кольца; как описано в данной заявке ниже;
vi) -(CR41aR41b)rOR40; например, -ОН, -CH2OH, -ОСН3, -CH2OCH3, -ОСН2СН3, -CH2OCH2CH3, -ОСН2СН2СН3 и -CH2OCH2CH2CH3;
vii) -(CR41aR41b)rC(O)R40; например, -СОСН3, -СН2СОСН3, -СОСН2СН3, -СН2СОСН2СН3, -СОСН2СН2СН3 и -СН2СОСН2СН2СН3;
viii) -(CR41aR41b)rC(O)OR40; например, -CO2CH3, -CH2CO2CH3, -CO2CH2CH3, -CH2CO2CH2CH3, -CO2CH2CH2CH3 и -CH2CO2CH2CH2CH3;
ix) -(CR41aR41b)rC(O)N(R40)2; например, -CONH2, -CH2CONH2, -CONHCH3, -CH2CONHCh3, -CON(CH3)2 и -CH2CON(СН3)2;
х) -(CR41aR41b)rN(R40)2; например, -NH2, -CH2NH2, -NHCH3, -CH2NHCH3, -N(CH3)2 и -CH2N(CH3)2;
xi) галоген; -F, -Cl, -Br и -I;
xii) -(CR41aR41b)rCN;
xiii) -(CR41aR41b)rNO2;
xiv) -(CHj'Xk')hCHjXk; где X представляет собой галоген, индекс j означает целое число от 0 до 2, j+k=3, индекс j' означает целое число от 0 до 2, j'+k'=2, индекс h означает от 0 до 6; например, -CH2F, -CHF2, -CF3, -CH2CF3, -CHFCF3, -CCl3 или -CBr3;
xv) -(CR41aR41b)rSR40; -SH, -CH2SH, -SCH3, -CH2SCH3, -SC6H5 и -CH2SC6H5;
xvi) -(CR41aR41b)rSO2R40; например, -SO2H, -CH2SO2H, -SO2CH3, -CH2SO2CH3, -SO2C6H5 и -CH2SO2C6H5; и
xvii) -(CR41aR41b)rSO3R40; например, -SO3H, -CH2SO3H, -SO3CH3, -CH2SO3CH3, -SO3C6H5 и -CH2SO3C6H5;
где каждый R4 независимо представляет собой водород, замещенный или незамещенный C1-C6 линейный, C3-C6 разветвленный или C3-C6 циклический алкил, фенил, бензил, гетероцикл или гетероарил; или два R40 фрагменты могут быть взяты вместе с образованием кольца, содержащего 3-7 атомов; R41a и R41b каждый независимо представляет собой водород или C1-C4 линейный или C3-C4 разветвленный алкил; индекс r означает от 0 до 4.
Один аспект L фрагментов относится к фрагментам, имеющим формулу:
-C(O)[C(R5aR5b)]xNHC(O)-,
где R5a представляет собой водород, замещенный или незамещенный C1-C4 алкил, замещенный или незамещенный фенил, и замещенный или незамещенный гетероарил; и индекс х означает 1 или 2. Одно осуществление относится к соединяющим фрагментам, имеющим формулу:
i) -C(O)[C(R5aH)]NHC(O)O-;
ii) -C(O)[C(R5aH)][CH2]NHC(O)O-;
iii) -C(O)[CH2][C(R5aH)]NHC(O)O-;
iv) -C(O)[C(R5aH)]NHC(O)-;
v) -C(O)[C(R5aH)][CH2]NHC(O)-; или
vi) -C(O)[CH2][C(R5aH])NHC(O)-;
где R5a представляет собой:
i) водород;
ii) метил;
iii) этил;
iv) изопропил;
v) фенил;
vi) бензил;
vii) 4-гидроксибензил;
viii) гидроксиметил; или ix) 1-гидроксиэтил.
Когда индекс х равен 1, данное осуществление обеспечивает следующие неограничивающие примеры L фрагментов:
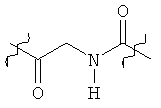 ;
; 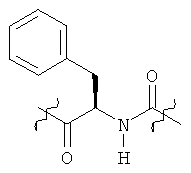 ;
; 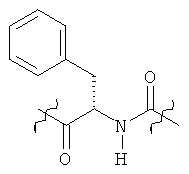 ;
; 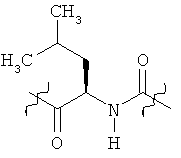 ;
;
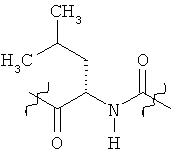 ;
; 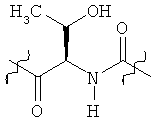 ; и
; и 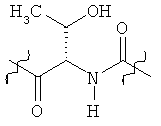 .
.
Когда индекс х равен 2, данное осуществление обеспечивает следующие неограничивающие примеры L фрагментов:
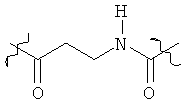 ;
; 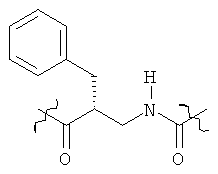 ;
; 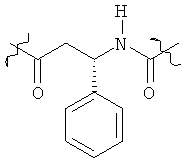 .
.
Другое осуществление L фрагментов включает фрагменты, в которых Q представляет собой -С(О)-, индексы х и z равны 0, w равен 1 или 2, первый R6a фрагмент выбран из фенила, 2-фторфенила, 3-фторфенила, 4-фторфенила, 2,3-дифторфенила, 3,4-дифторфенила, 3,5-дифторфенила, 2-хлорфенила, 3-хлорфенила, 4-хлорфенила, 2,3-дихлорфенила, 3,4-дихлорфенила, 3,5-дихлорфенила, 2-гидроксифенила, 3-гидроксифенила, 4-гидроксифенила, 2-метоксифенила, 3-метоксифенила, 4-метоксифенила, 2,3-диметоксифенила, 3,4-диметоксифенила и 3,5-диметоксифенила; второй R6a фрагмент представляет собой водород и R6b фрагменты представляют собой водород. Например, соединяющий фрагмент имеет формулу:
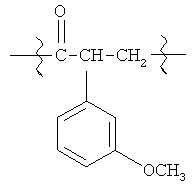 .
.
Дополнительный пример данного осуществления L включает первый R6a фрагмент, как изображено в данной заявке выше, который представляет собой замещенный или незамещенный гетероарильный фрагмент, как описано в данной заявке выше. Еще дополнительный пример данного осуществления L включает фрагменты, имеющие формулу:
-C(O)[C(R6aR6b)]w-;
где R6a и R61b представляют собой водород и индекс w равен 1 или 2; указанные фрагменты выбраны из:
i) -C(O)CH2-; и
ii) -C(O)CH2CH2-.
Другое осуществление L фрагментов включает фрагменты, имеющие формулу:
-C(O)[C(R5aR5b)]xC(O)-;
где R5a и R5b представляют собой водород и индекс х равен 1 или 2; указанные фрагменты выбраны из:
i) -С(O)СН2С(O)-; и
ii) -С(O)СН2СН3С(O)-.
Еще дополнительное осуществление L фрагментов включает фрагменты, имеющие формулу:
-C(O)NH[C(R5aR5b)]x-;
где R5a и R5b представляют собой водород и индекс х равен 0, 1 или 2; указанные фрагменты выбраны из:
i) -C(O)NH-;
ii) -C(O)NHCH2-; и
iii) -С(O)NHCH2CH2-.
Еще дополнительный пример L фрагментов включает фрагменты, имеющие формулу:
-SO2[C(R6aR6b)]w;
где R8a и R8b представляют собой водород или метил и индекс w равен 0, 1 или 2; указанные фрагменты выбраны из:
i) -SO2-;
ii) -SO2CH2-; и
iii) -SO2CH2CH2-.
Раскрытые соединения (аналоги) сгруппированы в несколько категорий, чтобы облегчить производителю применение рациональных стратегий синтеза для получения аналогов, примеры которых явно не приведены в данной заявке. Группировка в категории не подразумевает повышенную или пониженную эффективность любой смеси химически связанных веществ, описанных в данной заявке.
Описанные в данной заявке выше раскрытые соединения включают все фармацевтически приемлемые солевые формы. Соединение, имеющее формулу:
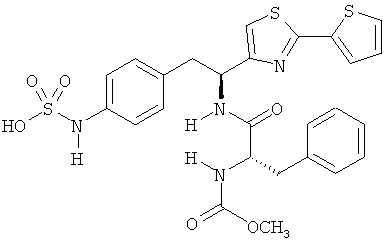 ,
,
может образовывать соли, например, соль с сульфаминовой кислотой:
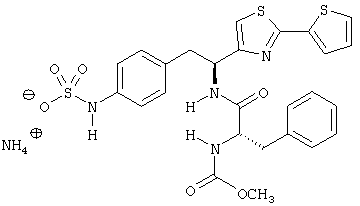 ; и
; и
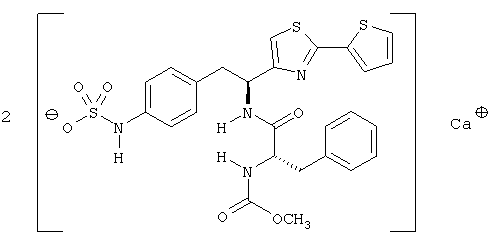 .
.
Соединения также могут существовать в цвиттер-ионной форме, например:
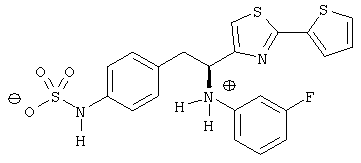 ; или
; или
в форме соли сильной кислоты, например:
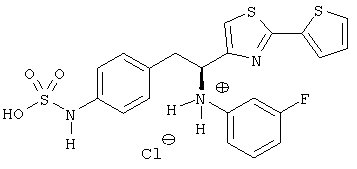 .
.
Первый аспект категории I настоящего раскрытия относится к соединениям, в которых R представляет собой замещенный или незамещенный тиазол-2-ильный фрагмент, имеющий формулу:
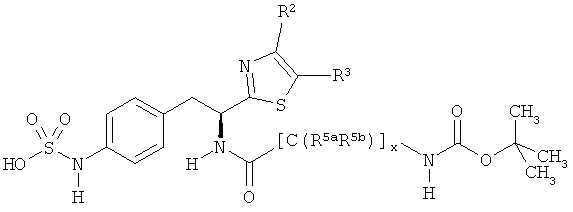 ,
,
одно осуществление которого относится к ингибиторам, имеющим формулу:
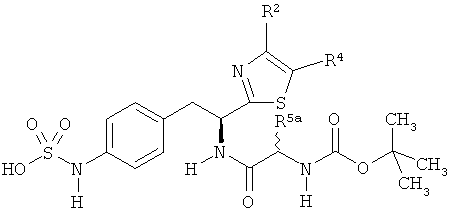 ,
,
где R фрагменты представляют собой тиазол-2-ильные фрагменты, которые, когда они замещены, являются замещенными R2 и R3 фрагментами. R и R5a фрагменты дополнительно описаны в Таблице I.
Соединения, включенные в первый аспект категории I данного раскрытия, могут быть получены с помощью методики, приведенной на Схеме I и описанной в Примере 1, приведенном ниже в данной заявке.
Схема I
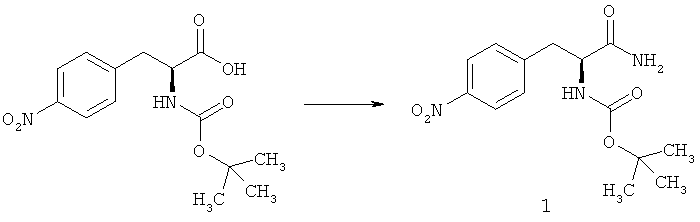
Реагенты и условия: (a)(i) (изо-бутил) OCOCl, NMM, ДМФА; 0°С, 20 мин.
(ii) NH3; 0°С в течение 30 мин.
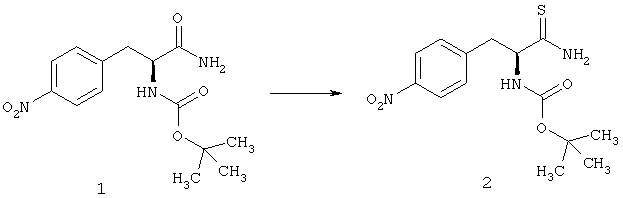
Реагенты и условия: (b) реагент Лавессона, THF; кт, 3 ч.
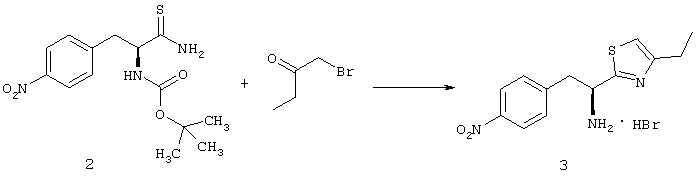
Реагенты и условия: (с) CH3CN; кипячение с обратным холодильником, 3 ч.
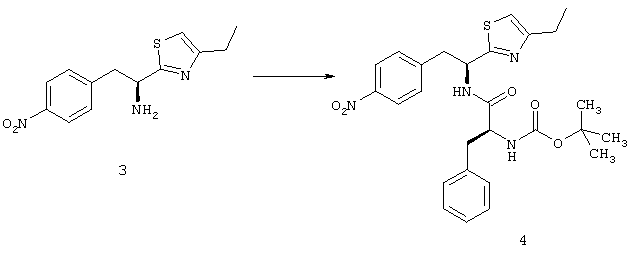
Реагенты и условия: (d) Boc-Phe, EDCI, HOBt, DIPEA, ДМФА; кт, 18 ч.
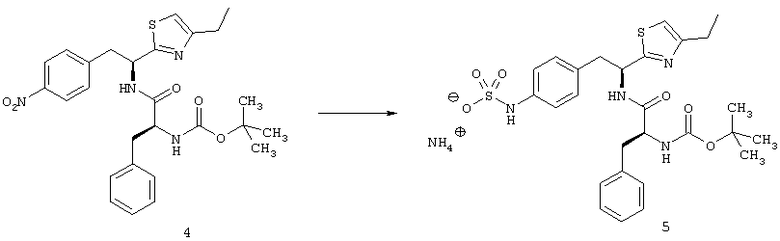
Реагенты и условия: (е) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH; кт, 2 ч.
ПРИМЕР 1
4-{(S)-2-[(S)-2-(трет-Бутоксикарбониламино)-3-фенилпропанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота (5)
Получение трет-бутилового эфира [1-(S)-карбамоил-2-(4-нитрофенил)этил-карбаминовой кислоты (I): К раствору 2-(S)-трет-бутоксикарбониламино-3-(4-нитрофенил)-пропионовой кислоты и N-метилморфолина (1,1 мл, 9,65 ммоль) в ДМФА (10 мл), охлажденному до 0°С, добавляют по каплям изо-бутилхлорформиат (1,25 мл, 9,65 ммоль). Смесь перемешивают при 0°С в течение 20 минут, после чего через реакционную смесь пропускают NH3 (г) в течение 30 минут при 0°С.Реакционную смесь концентрируют и остаток растворяют в EtOAc, последовательно промывают 5% лимонной кислотой, водой, 5% NaHCO3, водой и солевым раствором, сушат (Na2SO4), фильтруют и концентрируют в вакууме до остатка, который растирают со смесью EtOAc/петролейный эфир, получая 2,2 г (74%) желаемого продукта в виде твердого вещества белого цвета.
Получение трет-бутилового эфира [2-(4-нитрофенил)-1-(S)-тиокарбамоилэтил]карбаминовой кислоты (2): К раствору трет-бутилового эфира [1-(S)-карбамоил-2-(4-нитрофенил)этил-карбаминовой кислоты, 1, (0,400 г, 1,29 ммоль) в THF (10 мл) добавляют реагент Лавессона (0,262 г, 0,65 ммоль). Реакционную смесь перемешивают в течение 3 часов и концентрируют до остатка, который очищают через силикагель, получая 0,350 г (83%) желаемого продукта. 1Н ЯМР (300 МГц, CDCl3) δ 8,29 (s, 1H), 8,10 (d, J=8,4 Гц, 2H), 8,01 (s, 1H), 7,42 (d, J=8,4 Гц, 2Н), 5,70 (d, J=1,2 Гц, 1H), 4,85 (d, J=7,2 Гц, 1H), 3,11-3,30 (m, 1H), 1,21 (s, 9H).
Получение 1-(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламина (3): Смесь трет-бутилового эфира [2-(4-нитрофенил)-1-(S)-тиокарбамоилэтил]-карбаминовой кислоты, 2, (0,245 г, 0,753 ммоль), 1-бром-2-бутанона (0,125 г, 0,828 ммоль) в CH3CN (5 мл) кипятят с обратным холодильником в течение 3 часов. Реакционную смесь охлаждают до комнатной температуры и к раствору добавляют диэтиловый эфир, и осадок, который образовался, отделяют фильтрованием. Твердое вещество сушат под вакуумом, получая 0,242 г (выход 90%) желаемого продукта. ESI+ MS 278 (M+1).
Получение трет-бутилового эфира {1-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этилкарбамоил]-2-фенилэтил}карбаминовой кислоты (4): К раствору гидробромида 1-(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламина, 3, (0,393 г, 1,1 ммоль), (S)-(2-трет-бутоксикарбониламино)-3-фенилпропионовой кислоты (0,220 г, 0,828 ммоль) и 1-гидроксибензотриазола (HOBt) (0,127 г, 0,828 ммоль) в ДМФА (10 мл) при 0°С добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCl) (0,159 г, 0,828 ммоль), потом диизопропиламин (0,204 г, 1,58 ммоль). Смесь перемешивают при 0°С в течение 30 минут, потом при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенные органические слои промывают 1 N водной HCl, 5% водным NaHCO3, водой и солевым раствором, и сушат над Na2SO4. Растворитель удаляют в вакууме, получая 0,345 г желаемого продукта, который используют без дополнительного очищения. ЖХ/MS ESI+ 525 (M+1).
Получение аммониевой соли 4-{(S)-2-[(S)-2-(трет-бутоксикарбониламино)-3-фенилпропанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовой кислоты (5):
трет-Бутиловый эфир {1-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этилкарбамоил]-2-фенилэтил}карбаминовой кислоты, 4, (0,345 г) растворяют в МеОН (4 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода в течение 2 часов. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,314 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH (50 мл). Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,222 г желаемого продукта в виде аммониевой соли. 1Н ЯМР (CD6OD): δ 7,50-6,72 (m, 10Н), 5,44-5,42 (d, 1H, J=6,0 Гц), 4,34 (s, 1H), 3,34-2,79 (m, 4H), 2,83-2,76 (q, 2H, J=7,2 Гц), 1,40 (s, 9H), 1,31 (t, 3H, J=1,5 Гц).
Раскрытые ингибиторы также могут быть выделены в виде свободных кислот. Неограничивающий пример этой методики описан в данной заявке ниже в Примере 4.
Приведенное ниже является неограничивающим примером соединений, включенных в данное осуществление первого аспекта категории I настоящего раскрытия.
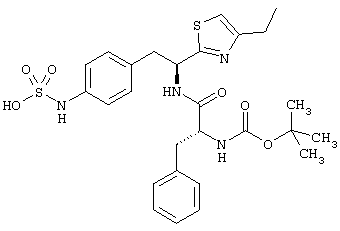
4-{(S)-2-[(R)-2-(трет-бутоксикарбониламино)-3-фенилпропанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,22-7,02 (m, 10H), 5,39 (s, 1H), 4,34 (s, 1H), 3,24-2,68 (m, 6H), 1,37 (s, 9H), 1,30 (t, 3H, J=7,5 Гц).
Другое осуществление этого аспекта категории I относится к ингибиторам, имеющим формулу:
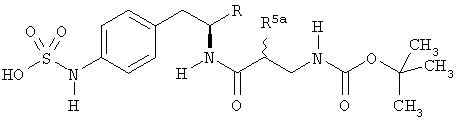 ,
,
где R фрагменты и R5a фрагменты дополнительно описаны в Таблице II.
Соединения данного осуществления могут быть получены в соответствии с методикой, приведенной на Схеме I и описанной в Примере 1, путем замены (S)-(2-трет-бутоксикарбониламино)-3-фенилпропионовой кислоты на соответствующую Вос-β-аминокислоту на стадии (d).
Приведенное ниже является неограничивающими примерами соединений в соответствии с данным осуществлением.
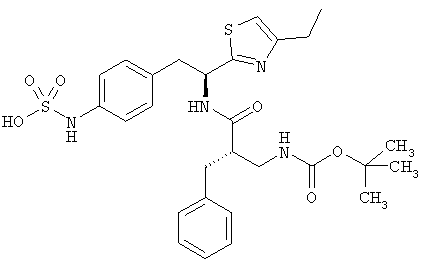
трет-Бутиловый эфир {1-[1-(4-этилтиазол-2-ил)-(S)-2-(4-сульфоаминофенил)этилкарбамоил]-(S)-2-фенилэтил}метилкарбаминовой кислоты: 1Н ЯМР (300 МГц, MeOH-d4) δ 8,36 (d, J=8,1 Гц, 1Н), 7,04-7,22 (m, 9H), 5,45 (s, 1H), 3,01-3,26 (m, 2H), 2,60-2,88 (m, 4H), 2,33 (s, 3H), 1,30 (s, 9H).
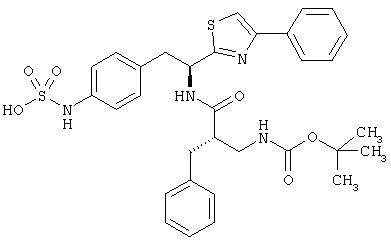
трет-Бутиловый эфир {1-[1-(4-фенилтиазол-2-ил)-(S)-2-(4-сульфоаминофенил)этилкарбамоил]-(S)-2-фенилэтил}метилкарбаминовой кислоты: 1Н ЯМР (300 МГц, MeOH-d4) δ 8,20 (d, J=8,1 Гц, 1Н), 7,96-7,99 (m, 2H), 7,48-7,52 (m, 3H), 7,00-7,23 (m, 7H), 6,89 (s, 1Н), 5,28 (q, J=7,5 Гц, 1Н), 4,33 (t, J=6,6 Гц, 1Н), 3,09-3,26 (m, 2H), 3,34 (dd, J=13,2 и 8,4 Гц, 1Н), 2,82 (dd, J=13,2 и 8,4 Гц, 1Н), 1,38 (s, 9H).
Второй аспект категории I настоящего раскрытия относится к соединениям, в которых R представляет собой замещенный или незамещенный тиазол-4-ил, имеющий формулу:
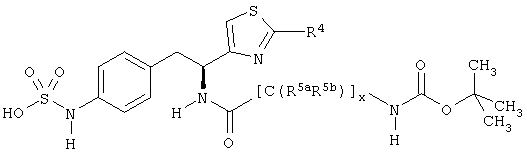 ,
,
одно осуществление которых относится к ингибиторам, имеющим формулу:
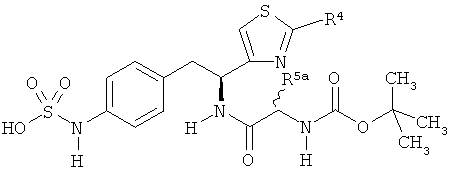 ,
,
где R фрагменты и R5a фрагменты дополнительно описаны в Таблице III.
Соединения, включенные во второй аспект категории I настоящего раскрытия, могут быть получены с помощью методики, приведенной на схеме II и описанной в Примере 2, приведенном ниже.
Схема II
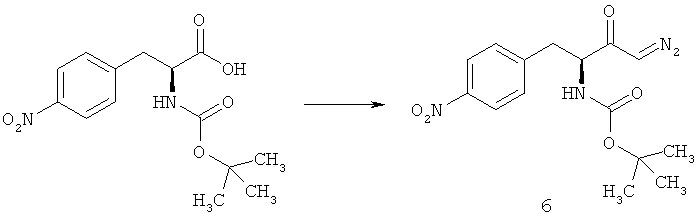
Реагенты и условия: (a)(i) (изо-бутил)OCOCl, Et3N, THF; 0°C, 20 мин.
(ii) CH2N2; комнатная температура в течение 3 часов.
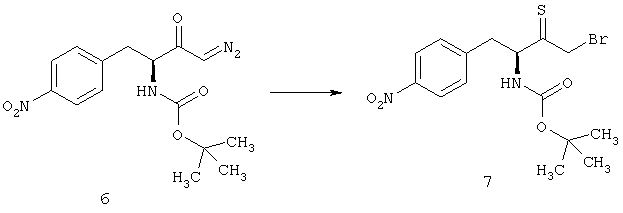
Реагенты и условия: (b) 48% HBr, THF; 0°С, 1,5 ч.
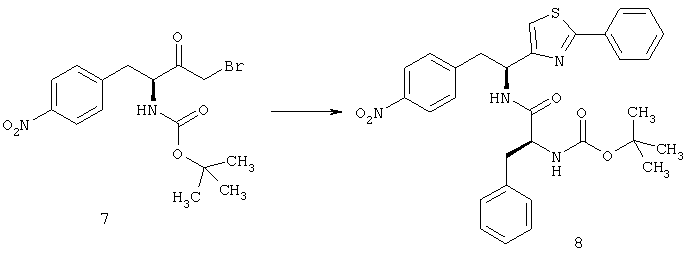
Реагенты и условия: (c)(i) тиобензамид, CH3CN; кипячение с обратным холодильником, 2 ч.
(ii) Boc-Phe, HOBt, DIPEA, ДМФА; кт, 18 ч.
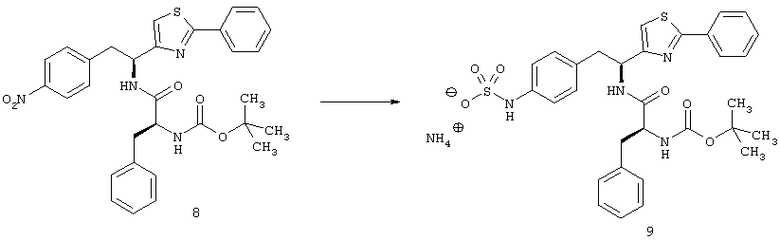
Реагенты и условия: (d) (i) H2:Pd/C, MeOH;
(ii) SO3-пиридин, NH4OH; кт, 12 ч.
ПРИМЕР 2
4-{(S)-2-(S)-2-(трет-Бутоксикарбониламино)-3-фенилпропанамидо-2-(2-фенилтиазол-4-ил)}фенилсульфаминовая кислота (9)
Получение трет-бутилового эфира (S)-[3-диазо-1-(4-нитробензил)-2-оксо-пропил]-карбаминовой кислоты (б): К раствору 2-(S)-трет-бутоксикарбониламино-3-(4-нитрофенил)-пропионовой кислоты (1,20 г, 4,0 ммоль) в THF (20 мл), охлажденному до 0°С, по каплям добавляют триэтиламин (0,61 мл, 4,4 ммоль), потом изо-бутилхлорформиат (0,57 мл, 4,4 ммоль). Реакционную смесь перемешивают при 0°С в течение 20 минут и фильтруют. Фильтрат обрабатывают эфирным раствором диазометана (-16 ммоль) при 0°С Реакционную смесь перемешивают при комнатной температуре в течение 3 часов, потом концентрируют в вакууме. Полученный остаток растворяют в EtOAc и последовательно промывают водой и солевым раствором, сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают через силикагель (гексан/EtOAc 2:1), получая 1,1 г (выход 82%) желаемого продукта в виде твердого вещества слегка желтого цвета. 1Н ЯМР (300 МГц, CDCl3) δ 8,16 (d, J=8,7 Гц, 2Н), 7,39 (d, J=8,7 Гц, 2Н), 5,39 (s, 1H), 5,16 (d, J=6,3 Гц, 1H), 4,49 (s, 1H), 3,25 (dd, J=13,8 и 6,6, 1H), 3,06 (dd, J=13,5 и 6,9 Гц, 1H), 1,41 (s, 9H).
Получение (S)-трет-6утил 4-бром-1-(4-нитрофенил)-3 -оксобутан-2-илкарбамата (7): К раствору трет-бутилового эфира (S)-[3-диазо-1-(4-нитробензил)-2-оксо-пропил]-карбаминовой кислоты, 6, (0,350 г, 1,04 ммоль) в THF (5 мл), охлажденному до 0°С, по каплям добавляют 48% води. HBr (0,14 мл, 1,25 ммоль). Реакционную смесь перемешивают при 0°С в течение 1,5 часов, потом реакционную смесь гасят при 0°С насыщ. Na2CO3. Смесь экстрагируют EtOAc (3×25 мл) и объединенные органические экстракты промывают солевым раствором, сушат (Na2SO4), фильтруют и концентрируют, получая 0,400 г продукта, который используют на следующей стадии без дополнительного очищения. 1Н ЯМР (300 МГц, CDCl3) δ 8,20 (d, J=8,4 Гц, 2Н), 7,39 (d, J=8,4 Гц, 2Н), 5,06 (d, J=7,8 Гц, 1H), 4,80 (q, J=6,3 Гц, 1H), 4,04 (s, 2Н), 1,42 (s, 9H).
Получение трет-бутил (S)-1-(S)-2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этиламино-1-оксо-3-фенилпропан-2-илкарбамата (8): Смесь тиобензамида (0,117 г, 0,85 ммоль) и (S)-трет-бутил 4-бром-1-(4-нитрофенил)-3-оксобутан-2-илкарбамата, 7, (0,300 г, 0,77 ммоль) в CH3CN (4 мл) кипятят с обратным холодильником в течение 2 часов. Реакционную смесь охлаждают до комнатной температуры и добавляют диэтиловый эфир, осаждая промежуточный 2-(нитрофенил)-(S)-1-(4-фенилтиазол-2-ил)этиламин, который выделяют при помощи фильтрования в виде бромистоводородной соли. Бромистоводородную соль растворяют в ДМФА (3 мл) вместе с диизопропилэтиламином (0,42 мл, 2,31 ммоль), 1-гидроксибензотриазолом (0,118 г, 0,79 ммоль) и (S)-(2-трет-бутоксикарбонил-амино)-3-фенилпропионовой кислотой (0,212 г, 0,80 ммоль). Смесь перемешивают при 0°С в течение 30 минут, потом при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1 N водной HCl, 5% водным NaHCO3, водой и солевым раствором, и сушат над Na2SO4. Растворитель удаляют в вакууме, получая 0,395 г (выход 90%) желаемого продукта, который используют без дополнительного очищения. ЖХ/MS ESI+ 573 (М+1).
Получение 4-{(S)-2-(S)-2-(трет-бутоксикарбонил)-3-фенилпропанамидо-2-(2-фенилтиазол-4-ил)}фенилсульфаминовой кислоты (9): трет-бутил (S)-1-(S)-2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этиламино-1-оксо-3-фенилпропан-2-илкарбамат, 8, (0,360 г) растворяют в МеОН (4 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода в течение 12 часов. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,296 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH (10 мл). Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,050 г желаемого продукта в виде аммониевой соли. 1Н ЯМР (300 МГц, MeOH-d4) δ 8,20 (d, J=8,1 Гц, 1Н), 7,96-7,99 (m, 2H), 7,48-7,52 (m, 3H), 7,00-7,23 (m, 7H), 6,89 (s, 1Н), 5,28 (q, J=7,5 Гц, 1Н), 4,33 (t, J=6,6 Гц, 1Н), 3,09-3,26 (m, 2H), 3,34 (dd, J=13,2 и 8,4 Гц, 1Н), 2,82 (dd, J=13,2 и 8,4 Гц, 1Н), 1,38 (s, 9H).
Первый аспект категории II настоящего раскрытия относится к соединениям, в которых R представляет собой замещенный или незамещенный тиазол-4-ильный фрагмент, имеющий формулу:
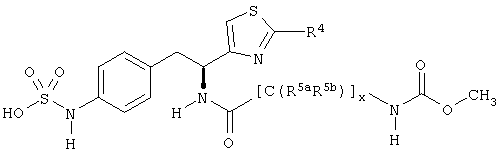 ,
,
одно осуществление которого относится к ингибиторам, имеющим формулу:
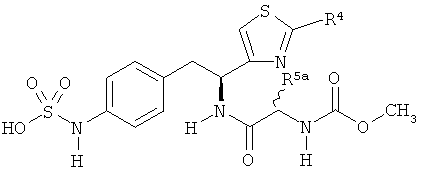 ,
,
в котором R фрагменты представляют собой тиазол-4-ильные фрагменты, которые, когда являются замещенными, замещены R4 фрагментами. R и R5a фрагменты дополнительно описаны в Таблице IV.
Соединения, включенные во второй аспект категории II настоящего раскрытия, могут быть получены с помощью методики, приведенной на схеме III и описанной в Примере 3, приведенном в данной заявке ниже.
Схема III
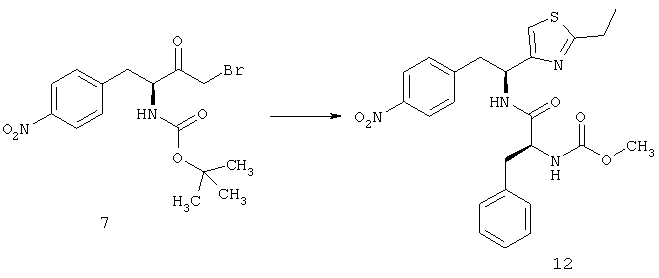
Реагенты и условия: (a)(i) пропантиоамид, CH3CN; кипячение с обратным холодильником, 2 ч.
(ii) Boc-Phe, HOBt, DIPEA, ДМФА; кт, 18 ч.
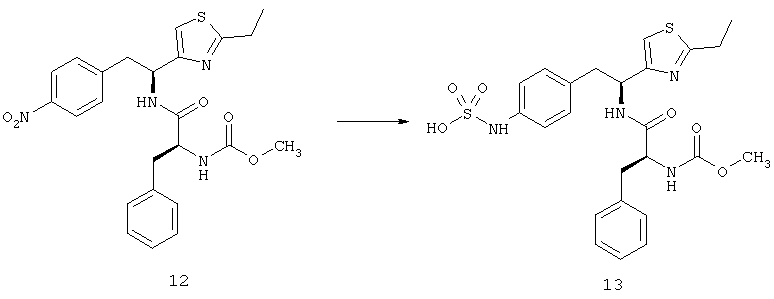
Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH; кт, 18 ч.
ПРИМЕР 3
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-(2-этилтиазол-4-ил)этил}фенилсульфаминовая кислота (13)
Получение метил (S)-1-[(S)-1-(2-этилтиазол-4-ил)-2-(4-нитрофенил)-этил]амино-1-оксо-3-фенилпропан-2-илкарбамата (12): Смесь пропантиоамида (69 мг, 0,78 ммоль) и (S)-трет-бутил 4-бром-1-(4-нитрофенил)-3-оксобутан-2-илкарбамата, 7, (0,300 г, 0,77 ммоль) в CH3CN (4 мл) кипятят с обратным холодильником в течение 2 часов. Реакционную смесь охлаждают до комнатной температуры и добавляют диэтиловый эфир, осаждая промежуточный 2-(нитрофенил)-(S)-1-(4-этилтиазол-2-ил)этиламин, который выделяют при помощи фильтрования в виде бромистоводородной соли. Бромистоводородную соль растворяют в ДМФА (8 мл) вместе с диизопропилэтиламином (0,38 мл, 2,13 ммоль), 1-гидроксибензотриазолом (107 мг, 0,71 ммоль) и (S)-(2-метоксикарбонил-амино)-3-фенилпропионовой кислотой (175 мг, 0,78 ммоль). Смесь перемешивают при 0°С в течение 30 минут, потом при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1 N водной HCl, 5% водным NaHCO3, водой и солевым раствором, и сушат над Na2SO4. Растворитель удаляют к вакууме, получая 0,300 г (выход 81%) желаемого продукта, который используют без дополнительного очищения. ЖХ/MS ESI+ MS 483 (М+1).
Получение аммониевой соли 4-((S)-2-((S)-2-(метоксикарбониламино)-3-фенилпропанамидо)-2-(2-этилтиазол-4-ил)этил)фенилсульфаминовой кислоты (13):
трет-Бутил (S)-1-(S)-2-(4-нитрофенил)-1-(2-этилтиазол-4-ил)этиламино-1-оксо-3-фенилпропан-2-илкарбамат, 12, (0,300 г) растворяют в МеОН (4 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (223 мг, 1,40 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH (12 мл). Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 25 мг желаемого продукта в виде аммониевой соли. 1Н ЯМР (300 МГц, МеОН-d4) δ 7,14-7,24 (m, 6Н), 6,97-7,0 (m, 4H), 6,62 (s, 1H), 5,10-5,30 (m, 1H), 4,36 (t, J=7,2 Гц, 1H), 3,63 (s, 3H), 3,14 (dd, J=13,5 и 6,3 Гц, 1H), 2,93-3,07 (m, 5H), 2,81 (dd, J=13,5 и 6,3 Гц, 1Н), 1,39 (t, J=7,8 Гц, 3H).
В другой итерации способа согласно настоящему раскрытию, соединение 13, а также другие аналоги, которые включены в настоящее раскрытие, могут быть выделены в виде свободной кислоты путем адаптирования методики, описанной в данной заявке ниже.
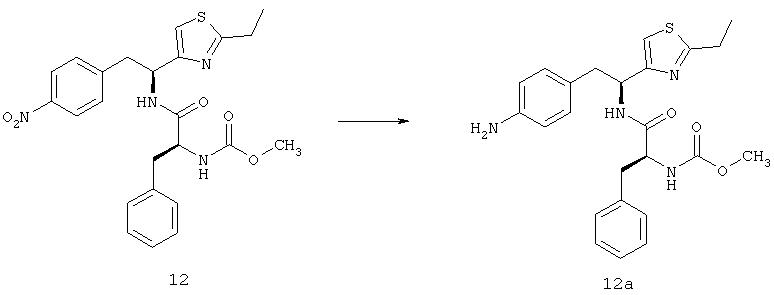
Реагенты и условия: (a) H2:Pd/C, МеОН; кт, 40 ч.
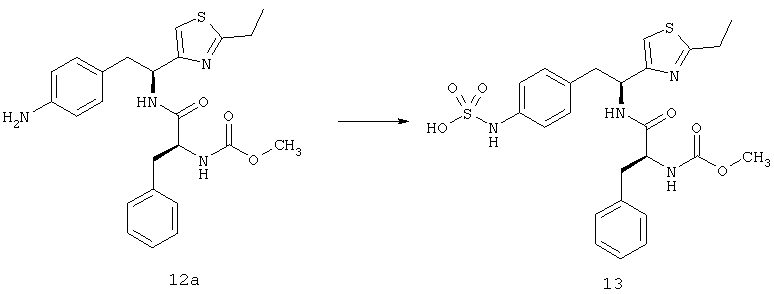
Реагенты и условия: (b) SO3-пиридин, CH3CN; нагревание, 45 мин.
ПРИМЕР 4
4-((S)-2-((S)-2-(Метоксикарбониламино)-3-фенилпропанамидо)-2-(2-этилтиазол-4-ил)этил)фенилсульфаминовая кислота [Форма свободной кислоты] (13)
Получение метилового эфира {1-[2-(S)-(4-(S)-аминофенил)-1-(2-этилтиазол-4-ил)этил-карбамоил]-2-фенилэтил}-карбаминовой кислоты (12a): В сосуд Парра для гидрогенизации помещают трет-бутил (S)-1-(S)-2-(4-нитрофенил)-1-(2-этилтиазол-4-ил)этиламино-1-оксо-3-фенилпропан-2-илкарбамат, 12, (18,05 г, 37,4 ммоль, 1,0 экв.) и Pd/C (10% Pd на С, влажность 50%, Degussa-type E101 NE/W, 2,68 г, 15 масс.%) в виде твердых веществ. Добавляют МеОН (270 мл, 15 мл/г), получая суспензию. Сосуд помещают на аппарат Парра для гидрогенизации. Сосуд закрепляют для процесса наполнения/вакуумирования N2 (3×20 фунт/дюйм2) до инертного состояния, потом проводят такую же процедуру, используя Н2 (3×40 фунт/дюйм2). Сосуд наполняют Н2, и сосуд встряхивают при 40 фунт/дюйм2 Н2 в течение ~40 ч. Сосуд вакуумируют и атмосферу продувают N2 (5×20 фунт/дюйм2). Аликвоту фильтруют и анализируют при помощи ВЭЖХ, чтобы обеспечить полное превращение. Суспензию фильтруют через прокладку целлита, чтобы удалить катализатор, и однородный фильтрат желтого цвета концентрируют при помощи роторного испарителя, получая 16,06 г (выход 95%) желаемого продукта в виде твердого вещества желтовато-коричневого цвета, которое используют без дополнительного очищения.
Получение 4-((S)-2-((S)-2-(метоксикарбонил)-3-фенилпропанамидо)-2-(2-этилтиазол-4-ил)этил)фенилсульфаминовой кислоты (13): В 100 мл RBF помещают метиловый эфир {1-[2-(S)-(4-(S)-аминофенил)-1-(2-этилтиазол-4-ил)этил-карбамоил]-2-фенилэтил}-карбаминовой кислоты, 12a, (10,36 г, 22,9 ммоль, 1,0 экв.), полученный на стадии, описанной в данной заявке выше. Добавляют ацетонитрил (50 мл, 5 мл/г) и суспензию желтого цвета перемешивают при комнатной температуре. Во вторую 3-горлую 500 мл RBF помещают SO3-пиридин (5,13 г, 32,2 ммоль, 1,4 экв.) и ацетонитрил (50 мл 5 мл/г) и суспензию белого цвета перемешивают при комнатной температуре. Обе суспензии медленно нагревают до тех пор, пока реакционный раствор, содержащий метиловый эфир {1-[2-(S)-(4-(S)-аминофенил)-1-(2-этилтиазол-4-ил)этил-карбамоил]-2-фенилэтил}-карбаминовой кислоты не станет красно-оранжевого цвета (обычно для этого примера приблизительно 44°С). Этот субстрат, содержащий раствор, выливают одной порцией в перемешивающуюся суспензию SO3-пиридин при 35°С.Полученную непрозрачную смесь (39°С) энергично перемешивают, одновременно позволяя охлаждаться до комнатной температуры. После перемешивания в течение 45 мин определяют, завершена ли реакция, при помощи ВЭЖХ. К суспензии оранжевого цвета добавляют H2O (200 мл, 20 мл/г), получая однородный раствор желто-оранжевого цвета, имеющий рН примерно 2,4. Медленно в течение 12 минут добавляют концентрированную H3PO4 для снижения рН до примерно 1,4. Во время такой корректировки рН образовывается осадок грязнобелого цвета, и раствор перемешивают при комнатной температуре в течение 1 ч. Суспензию фильтруют и осадок на фильтре промывают фильтратом. Осадок сушат на воздухе на фильтре в течение ночи, получая 10,89 г (выход 89%) желаемого продукта в виде твердого вещества желтовато-коричневого цвета.
Приведенное ниже является дополнительными неограничивающими примерами второго аспекта категории II настоящего раскрытия.
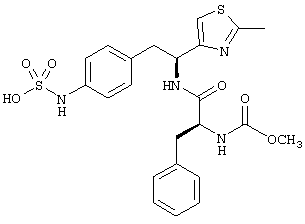
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-(2-метилтиазол-4-ил)этил}фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 8,15 (d, J=8,4 Гц, 1Н), 7,16-7,25 (m, 5H), 6,97-7,10 (m, 4H), 6,61 (s, 1H), 5,00-5,24 (m, 1H), 4,36 (t, J=7,2 Гц, 1H), 3,64 (s, 2H), 3,11-3,19 (s, 1H), 2,92-3,04 (s, 2H), 2,81 (dd, J=13,5 и 8,1 Гц, 1H), 2,75 (s, 3H).
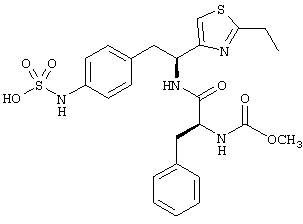
4-{(S)-2-(2-Этилтиазол-4-ил)-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,16-7,29 (m, 5Н), 7,02-7,12 (m, 4H), 6,83 (s, 1H), 5,10-5,35 (m, 1H), 3,52-3,67 (m, 3H), 3,18-3,25 (m, 2H), 3,05 (q, J=7,5 Гц, 2H), 2,82-2,95 (m, 2H), 2,65 (s, 3H), 1,39 (t, J=7,5 Гц, 3H).
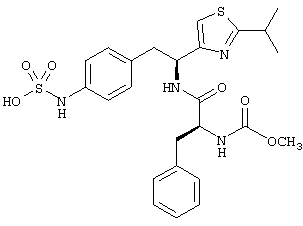
4-{(S)-2-(2-Изопропилтиазол-4-ил)-2-[(S)-2-(метоксикарбониламино)-3-фенилпропан-амидо]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,16 (d, 1H, J=8,7 Гц), 7,22-7,13 (m, 3H), 7,07 (d, 1H, J=8,4 Гц), 6,96 (d, 1H, J=8,1 Гц), 6,62 (s, 1H), 5,19 (t, 1H, J=7,2 Гц), 4,36 (t, 1H, J=7,8 Гц), 3,63 (s, 3H), 3,08 (1H, А в АВХ, J=3,6, 14,5 Гц), 2,99 (1H, В в АВХ, J=7,2, 13,8 Гц), 2,85-2,78 (m, 1H), 1,41 (d, 6H, J=6,9 Гц).
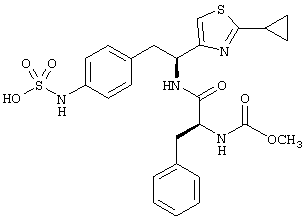
4-{(S)-2-(2-Циклопропилтиазол-4-ил)-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,15-7,02 (m, 5Н), 6,96-6,93 (d, 2H, J=8,4 Гц), 6,86-6,83 (d, 2H, J=8,3 Гц), 6,39 (s, 1H), 5,01 (t, 1H, J=5,0 Гц), 4,22 (t, 1H, J=7,4 Гц), 3,51 (s, 3H), 2,98-2,69 (m, 2H), 2,22-2,21 (m, 1H), 1,06-1,02 (m, 2H), 0,92-0,88 (m, 2H).
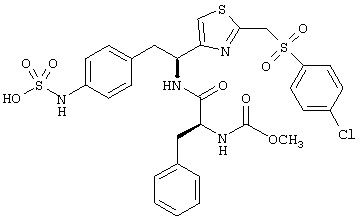
4-{(S)-2-{2-[(4-Хлорфенилсульфонил)метил]тиазол-4-ил}-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,96-7,93 (d, 2H, J=8,6 Гц), 7,83-7,80 (d, 2H, J=8,6 Гц), 7,44-7,34 (m, 5Н), 7,29-7,27 (d, 2H, J=8,4 Гц), 7,14-7,11 (d, 2H, J=8,4 Гц), 6,97 (s, 1H), 5,31 (t, 1H, J=6,8 Гц), 5,22-5,15 (m, 2H), 4,55 (t, 1H, J=7,3 Гц), 3,84 (s, 3H), 3,20-2,96 (m, 4H).
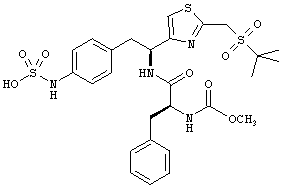
4-{(S)-2-[2-(трет-Бутилсульфонилметил)тиазол-4-ил]-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота: 1 Н ЯМР (CD3OD): δ 7,40-7,30 (m, 5Н), 7,21-7,10 (m, 4H), 7,02 (s, 1H), 5,37 (t, 1H, J=6,9 Гц), 5,01-4,98 (m, 2H), 4,51 (t, 1H, J=7,1 Гц), 3,77 (s, 3H), 3,34-2,91 (m, 4H), 1,58 (s, 9H).
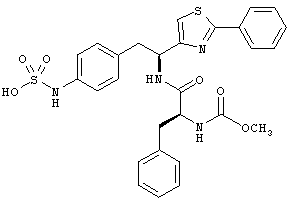
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропионамидо]-2-(2-фенилтиазол-4-ил)этил} фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, DMSO-d6) δ 7,96-7,99 (m, 2H), 7,51-7,56 (m, 3H), 7,13-7,38 (m, 6H), 6,92-6,95 (m, 4H), 5,11-5,16 (m, 1H), 4,32-4,35 (m, 1H), 3,51 (s, 3H), 3,39-3,40 (m, 2H), 3,09-3,19 (m, 1H), 2,92-3,02 (m, 2H), 2,75 (dd, J=10,5 Гц и 9,9 Гц, 1H).
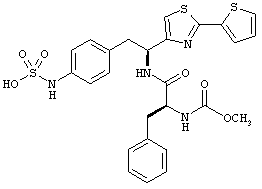
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,61-7,56 (m, 2H), 7,25-7,01 (m, 10H), 6,75 (s, 1H), 5,24-5,21 (q, 1H, J=7,2 Гц), 4,38 (t, 1H, J=7,2 Гц), 3,60 (s, 3H), 3,23-3,14 (m, 1H), 3,08-3,00 (m, 2H), 2,87-2,80 (m, 1H).
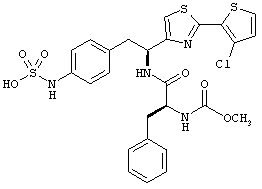
4-{(S)-2-[2-(3-Хлортиофен-2-ил)тиазол-4-ил_)-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,78-7,76 (d, 1H, J=5,4 Гц), 7,36-7,14 (m, 10H), 7,03 (s, 1H), 5,39 (t, 1H, J=6,9 Гц), 4,54 (t, 1H, J=7,3 Гц), 3,80 (s, 3H), 3,39-2,98 (m, 4H).
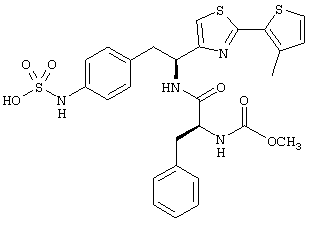
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-[2-(3-метилтиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,38 (d, 1H, J=5,1 Гц), 7,15-6,93 (m, 10H), 6,73 (s, 1H), 5,17 (t, 1H, J=6,9 Гц), 4,31 (t, 1H, J=7,3 Гц), 3,57 (s, 3H), 3,18-3,11 (m, 1H), 3,02-2,94 (m, 2H), 2,80-2,73 (m, 1H), 2,46 (s, 3H).
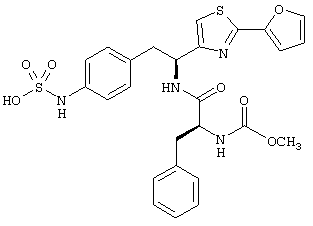
4-{[(S)-2-(2-(Фуран-2-ил)тиазол-4-ил]-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,54-7,46 (m, 1H), 7,02-6,79 (m, 10H), 6,55-6,51 (m, 1H), 6,44-6,41 (m, 1H), 5,02-5,00 (q, 1H, J=6,4 Гц), 4,16-4,14 (q, 1H, J=7,1 Гц), 3,43 (s, 3H), 2,96-2,58 (m, 4H).
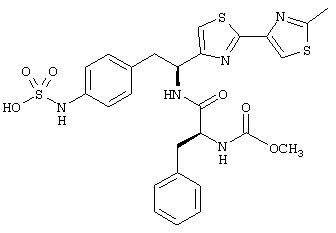
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-[2-(2-метилтиазол-4-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 8,27 (d, J=5,4 Гц, 1H), 7,97 (s, 1H), 6,99-7,21 (m, 8H), 5,18-5,30 (m, 1H), 4,30-4,39 (m, 1H), 3,64 (s, 3H), 3,20 (dd, J=14,1 и 6,6 Гц, 1H), 2,98-3,08 (m, 2H), 2,84 (dd, J=14,1 и 6,6 Гц, 1H), 2,78 (s, 3H).
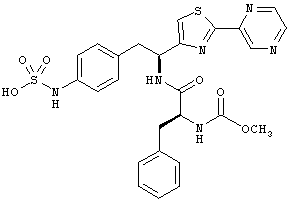
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-[(2-пиразин-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота: 1H ЯМР (300 МГц, MeOH-d4) δ 9,34 (s, 1H), 8,65 (s, 2H), 8,34 (d, J=8,1 Гц, 1Н), 7,00-5,16 (m. 9H), 5,30 (q, J=7,2 Гц, 1Н), 4,41 (t, J=7,2 Гц, 1Н), 3,65 (s, 3H), 3,23 (dd, J=13,8 и 6,9 Гц, 1Н), 2,98-3,13 (m, 2H), 2,85 (dd, J=13,8 и 6,9 Гц, 1Н).
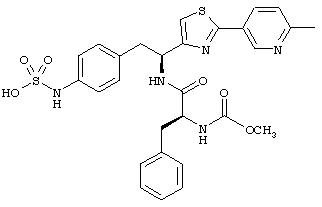
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-[2-(6-метилпиридин-3-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD4OD): δ 8,90 (s, 1Н), 8,19-8,13 (m, 1Н), 7,39-7,36 (d, 1Н, J=8,2 Гц), 7,07-6,88 (m, 9H), 6,79 (s, 1Н), 5,17 (t, 1Н, J=7,0 Гц), 4,29 (t, 1Н, J=7,4 Гц), 3,54 (s, 3H), 3,10-2,73 (m, 4H), 2,53 (s, 3H).
Категория III настоящего раскрытия относится к соединениям, в которых R представляет собой замещенный или незамещенный тиазол-2-ильный фрагмент, имеющий формулу:
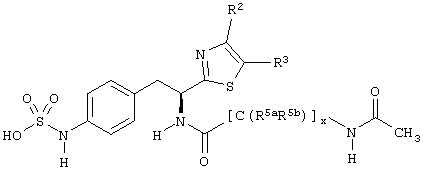 ,
,
одно осуществление которого относится к ингибиторам, имеющим формулу:
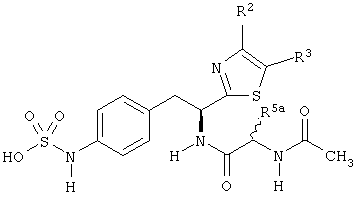 ,
,
где R фрагменты представляют собой тиазол-2-ильные фрагменты, которые, когда являются замещенными, замещены R2 и R3 фрагментами. R и R5a фрагменты дополнительно описаны в Таблице V.
Соединения, включенные в категорию III настоящего раскрытия, могут быть получены с помощью методики, приведенной на схеме IV и описанной в Примере 5, приведенном в данной заявке ниже.
Схема IV
Реагенты и условия: (a) Ac-Phe, EDCI, HOBt, DIPEA, ДМФА; кт, 18 ч.
Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH.
ПРИМЕР 5
4-[(S)-2-((S)-2-Ацетамидо-3-фенилпропанамидо)-2-(4-этилтиазол-2-ил)этил]фенилсульфаминовая кислота (15)
Получение (S)-2-ацетамидо-N-[(S)-1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)-этил]-3-фенилпропанамида (14): К раствору 1-(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламин гидробромида, 3, (0,343 г, 0,957 ммоль), N-ацетил-L-фенилаланина (0,218 г), 1-гидроксибензотриазола (HOBt) (0,161 г), диизопропил-этиламина (0,26 г), в ДМФА (10 мл) при 0°С добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,201 г). Смесь перемешивают при 0°С в течение 30 минут, потом при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1 N водной HCl, 5% водным NaHCO3, водой и солевым раствором, и сушат над Na2SO4. Растворитель удаляют в вакууме, получая 0,313 г (выход 70%) желаемого продукта, который используют без дополнительного очищения. ЖХ/MS ESI+ 467 (М+1).
Получение 4-((S)-2-((S)-2-ацетамидо-3-фенилпропанамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовой кислоты (15): (S)-2-Ацетамидо-N-[(S)-1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-3-фенилпропанамид, 14, (0,313 г) растворяют в MeOH (4 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода в течение 2 часов. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,320 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH (30 мл). Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,215 г желаемого продукта в виде аммониевой соли. 1Н ЯМР (CD3OD): δ 7,23-6,98 (m, 10H), 5,37 (t, 1H), 4,64 (t, 1H, J=6,3 Гц), 3,26-2,74 (m, 6H), 1,91 (s, 3H), 1,29 (t, 3H, J=7,5 Гц).
Следующее является дополнительными неограничивающими примерами соединений, включенных в категорию III настоящего раскрытия.
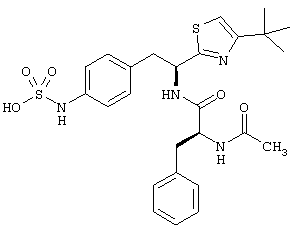
4-[(S)-2-((S)-2-Ацетамидо-3-фенилпропанамидо)-2-(4-трет-бутилтиазол-2-ил)этил]фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, CD3OD): δ 7,22-7,17 (m, 5H), 7,06 (dd, J=14,1, 8,4 Гц, 4Н), 6,97 (d, J=0,9 Гц, 1H), 5,39 (dd, J=8,4, 6,0 Гц, 1H), 4,65 (t, J=7,2 Гц, 1H), 3,33-3,26 (m, 1H), 3,13-3,00 (m, 3H), 2,80 (dd, J=13,5, 8,7 Гц, 1H), 1,91 (s, 3H), 1,36 (s, 9H).
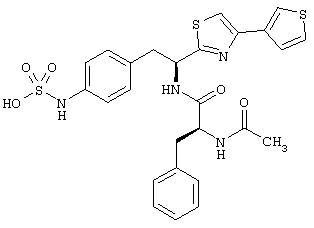
4-{(S)-2-((S)-2-Ацетамидо-3-фенилпропанамидо)-2-[4-(тиофен-3-ил)тиазол-2-ил]этил)фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, CD3OD): δ 8,58 (d, J=8,1 Гц, 1H), 7,83-7,82 (m, 1H), 7,57-7,46 (m, 3H), 7,28-6,93 (m, 11H), 5,54-5,43 (m, 1H), 4,69-4,55 (m, 2H), 3,41-3,33 (m, 1H), 3,14-3,06 (3H), 2,86-2,79 (m, 1H), 1,93 (s, 3H).
Первый аспект категории IV настоящего раскрытия относится к соединениям, в которых R представляет собой замещенный или незамещенный тиазол-2-ильный фрагмент, имеющий формулу:
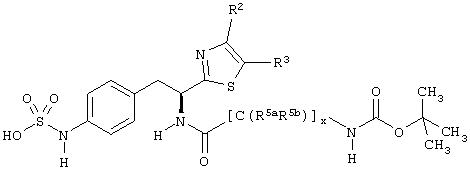 ,
,
одно осуществление которого относится к ингибиторам, имеющим формулу:
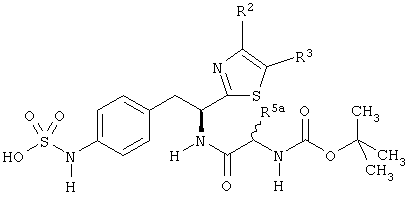 ,
,
где R фрагменты и R5a фрагменты дополнительно описаны в Таблице VI.
Соединения, включенные в категорию IV настоящего раскрытия, могут быть получены с помощью методики, приведенной на схеме V и описанной в Примере 6, приведенном в данной заявке ниже.
Схема V
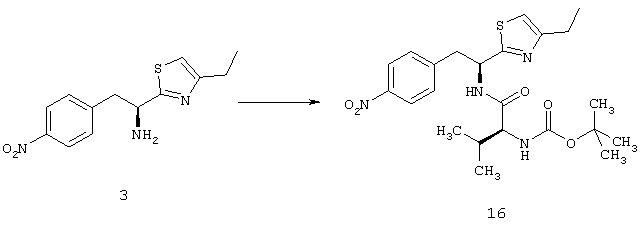
Реагенты и условия: (a) Boc-Val; EDCI, HOBt, DIPEA, ДМФА; кт, 18 ч.
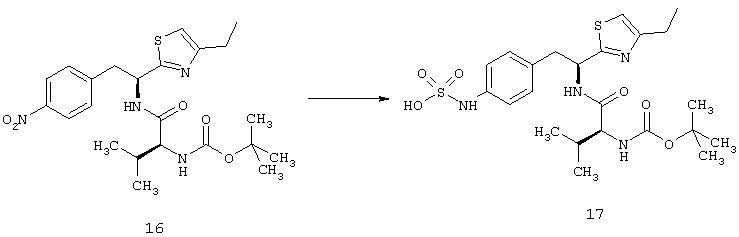
Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH, кт, 2 ч.
ПРИМЕР 6
4-{(S)-2-[(S)-2-(трет-Бутоксикарбониламино)-3-метилбутанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота (17)
Получение трет-бутил (S)-1-[(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламино]-3-метил-1-оксобутан-2-илкарбамата (16): К раствору 1-(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламин гидробромида, 3, (0,200 г, 0,558 ммоль), (S)-(2-трет-бутоксикарбониламино)-3-метилбутановой кислоты (0,133 г) и 1-гидроксибензо-триазола (HOBt) (0,094 г) в ДМФА (5 мл) при 0°С добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,118 г), потом диизопропиламин (0,151 г). Смесь перемешивают при 0°C в течение 30 минут, потом при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1 N водной HCl, 5% водным NaHCO3, водой и солевым раствором, и сушат над Na2SO4. Растворитель удаляют в вакууме, получая 0,219 г (выход 82%) желаемого продукта, который используют без дополнительного очищения. ЖХ/MS ESI+ 477 (М+1).
Получение 4-{(S)-2-[(S)-2-(трет-бутоксикарбониламино)-3-метилбутанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовой кислоты (17): трет-Бутил (S)-1-[(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламино]-3-метил-1-оксобутан-2-илкарбамат, 16, (0,219 г) растворяют в МеОН (4 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода в течение 2 часов. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (5 мл) и обрабатывают SO3-пиридином (0,146 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH (30 мл). Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,148 г желаемого продукта в виде аммониевой соли. 1Н ЯМР (CD3OD): δ 7,08 (s, 4Н), 7,02 (s, 1H), 5,43 (s, 1H), 3,85 (s, 1H), 3,28-2,77 (m, 4Н), 1,94 (s, 1H), 1,46 (s, 9H), 1,29 (s, 3H, J=13 Гц), 0,83 (s, 6H).
Следующее является дополнительными неограничивающими примерами второго аспекта категории IV настоящего раскрытия.
(S)-4-{2-[2-(трет-Бутоксикарбонил)ацетамид]-2-(4-этилтиазол-2-ил)этил}фенил-сульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,09-6,91 (m, 5H), 5,30 (t, 1H, J=8,4 Гц), 3,60-2,64 (m, 6H), 1,34 (s, 9H), 1,16 (t, 3H, J=7,5 Гц).
4-{(S)-2-[(S)-2-(трет-Бутоксикарбониламино)-4-метилпентанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,19-7,00 (m, 4Н), 5,50-5,40 (m, 1H), 4,13-4,06 (m, 1H), 3,32 (1H, А в ABX, J=7,5, 18 Гц), 3,12 (1H, В в ABX, J=8,1, 13,8 Гц), 2,79 (q, 2H, J=7,8, 14,7 Гц), 1,70-1,55 (m, 1H), 1,46 (s, 9H), 1,33 (t, 3H, J=2,7 Гц), 0,92 (q, 6H, J=6, 10,8 Гц).
4-{(S)-2-[(S)-2-(трет-Бутоксикарбониламино)-4-метилпентанамидо]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,06 (d, 1H, J=8,4 Гц), 7,61-7,58 (m, 1H), 7,57 (s, 1H), 7,15 (t, 1H, J=0,6 Гц), 7,09-6,98 (m, 6H), 5,30-5,20 (m, 1H), 4,10-4,00 (m, 1H), 3,19-3,13 (m, 2H), 1,63-1,55 (m, 2H), 1,48-1,33 (m, 10H), 0,95-0,89 (m, 6H).

(S)-4-{2-[2-(трет-Бутоксикарбонил)ацетамид]-2-(4-этилтиазол-2-ил)этил}-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,09-6,91 (m, 5H), 5,30 (t, 1H, J=8,4 Гц), 3,60-2,64 (m, 6H), 1,34 (s, 9H), 1,16 (t, 3H, J=7,5 Гц).
Дополнительное осуществление категории IV относится к ингибиторам, имеющим формулу:
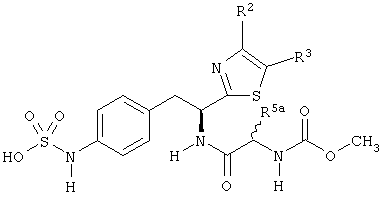 ,
,
где R фрагменты и R5a фрагменты дополнительно описаны в Таблице VII.
Соединения, включенные в данное осуществление категории IV, могут быть получены в соответствии с методикой, приведенной на схеме V и описанной в Примере 6, путем замены Вос-защищенных регентов на соответствующие метилкарбаматы. Приведенное ниже является неограничивающими примерами данного осуществления.
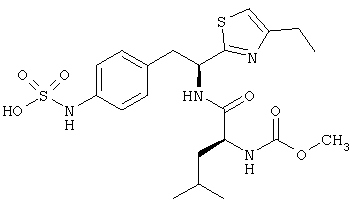
4-{(S)-2-(4-Этилтиазол-2-ил)-2-[(S)-2-(метоксикарбонил)-4-метилпентан-амидо]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,12-7,03 (m, 5H), 6,84 (d, 1H, J=8,4 Гц), 5,40 (t, 1H, J=5,7 Гц), 4,16 (t, 1H, J=6,3 Гц), 3,69 (s, 3H), 3,61-3,55 (m, 1H), 3,29-3,27 (m, 1H), 3,14-3,07 (m, 1H), 2,81 (q, 2H, J=3,9, 11,2 Гц), 1,66-1,59 (m, 1H), 1,48-1,43 (m, 2H), 1,31 (t, 3Н, J=4,5 Гц), 0,96-0,90 (m, 6H).
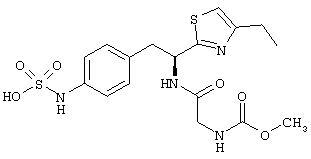
(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(метоксикарбонил)ацетамидо]этил}-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,12-7,07 (m, 4H), 7,03 (s, 1H), 5,42 (t, 1H, J=5,7 Гц), 3,83-3,68 (q, 2H, J=11,4 Гц), 3,68 (s, 3H), 3,34-3,04 (m, 2H), 2,83-2,76 (q, 2H, J=7,8 Гц), 1,31 (t, 3Н, J=7,5 Гц).
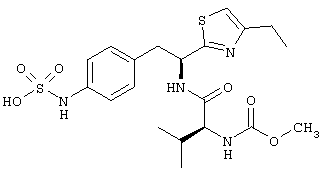
4-{(S)-2-(4-Этилтиазол-2-ил)-2-[(S)-2-(метоксикарбонил)-3-метилбутанамидо]-этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,56 (d, 1H, J=7,8 Гц), 7,09 (s, 4H), 7,03 (s, 1H), 5,26-5,20 (m, 1H), 3,90 (d, 1H, J=7,8 Гц), 3,70 (s, 3H), 3,30 (1H, А в АВХ, перекрытый растворителем), 3,08 (1H, В в АВХ, J=9,9, 9 Гц), 2,79 (q, 2H, J=11,1, 7,2 Гц), 2,05-1,97 (m, 1H), 1,31 (t, 3Н, J=7,5 Гц), 0,88 (s, 3H), 0,85 (s, 3H), 0,79-0,75 (m, 1H).
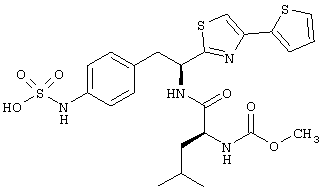
4-{(S)-2-[(S)-2-(Метоксикарбонил)-4-метилпентанамидо]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,22 (d, 1H, J=9 Гц), 7,62-7,57 (m, H), 7,15 (t, 1H, J=0,6 Гц), 7,10-6,97 (m, 4H), 5,30-5,20 (m, 1H), 4,16-4,11 (m, 1H), 3,67 (s, 2H), 3,22 (1H, А в АВХ, J=6,9, 13,5 Гц), 3,11 (1H, В в АВХ, J=7,8, 13,6 Гц), 1,65-1,58 (m, 1H), 1,50-1,45 (m, 2H), 0,95-0,88 (m, 6H).
Категория IV настоящего раскрытия относится к соединениям, имеющим формулу:
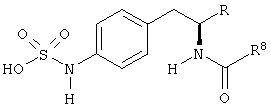 ,
,
где R представляет собой замещенный или незамещенный тиофен-2-ильный или тиофен-4-ильный фрагмент и неограничивающие примеры R2 дополнительно описаны в Таблице VIII.
Соединения, включенные в категорию IV настоящего раскрытия, могут быть получены с помощью методики, приведенной на Схеме VI и описанной в Примере 7, приведенном в данной заявке ниже.
Схема VI
Реагенты и условия: (a)(i) CH3CN; кипячение с обратным холодильником, 1,5 ч. (ii) Boc2O, пиридин, CH3Cl2; кт, 2 ч.
Реагенты и условия: (b)(i) H2:Pd/C, MeOH; кипячение с обратным холодильником
(ii) SO3-пиридин, NH4OH; кт, 12 ч.
ПРИМЕР 7
трет-Бутиловый эфир [1-(S)-(фенилтиазол-2-ил)-2-(4-сульфоаминофенил)этил]-карбаминовой кислоты (19)
Получение тре/и-бутилового эфира [2-(4-нитрофенил)-1-(S)-(4-фенилтиазол-2-ил)этил]-карбаминовой кислоты (18): Смесь трет-бутилового эфира [2-(4-нитрофенил)-1-(S)-тиокарбамоилэтил]-карбаминовой кислоты, 2, (0,343 г, 1,05 ммоль), 2-бромацетофенона (0,231 г, 1,15 ммоль) в CH3CN (5 мл) кипятят с обратным холодильником в течение 1,5 часов. Растворитель удаляют при пониженном давлении и остаток повторно растворяют в CH2Cl2, потом добавляют пиридин (0,24 мл, 3,0 ммоль) и BoC3O (0,24 мл, 1,1 ммоль). Рекционную смесь перемешивают в течение 2 часов и к раствору добавляют диэтиловый эфир и осадок, который образовался, удаляют при помощи фильтрования. Органический слой сушат (Na2SO4), фильтруют и концентрируют до остатка, который очищают через силикагель, получая 0,176 г (39%) желаемого продукта. ESI+ MS 426 (М+1).
Получение трет-бутилового эфира [1-(S)-(фенилтиазол-2-ил)-2-(4-сульфоаминофенил)этил]-карбаминовой кислоты (19): трет-Бутиловый эфир [2-(4-нитрофенил)-1-(S)-(4-фенилтиазол-2-ил)этил]-карбаминовой кислоты, 18, (0,176 г, 0,41 ммоль) растворяют в МеОН (4 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода 12 часов. Реакционную смесь фильтруют через прокладку СБЫТЕ™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,195 г, 1,23 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NI-LtOH (10 мл). Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,080 г желаемого продукта в виде аммониевой соли. 1Н ЯМР (300 МГц, MeOH-d4) δ 7,93 (d, J=6,0 Гц, 2Н), 7,68 (s, 1H), 7,46-7,42 (m, 3H), 7,37-7,32 (m, 1H), 7,14-7,18 (m, 3H), 5,13-5,18 (m, 1H), 3,40 (dd, J=4,5 и 15,0 Гц, 1H), 3,04 (dd, J=9,6 и 14,1 Гц, 1H), 1,43 (s, 9H).
Следующее является дополнительными неограничивающими примерами категории IV настоящего раскрытия.
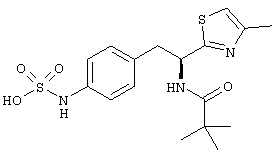
(S)-4-(2-(4-Метилтиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:
1Н ЯМР (CD3OD): δ 7,31 (s, 4H), 7,20 (s, 1H), 5,61-5,56 (m, 1H), 3,57-3,22 (m, 2Н), 2,62 (s,3H),l,31 (s,3H).
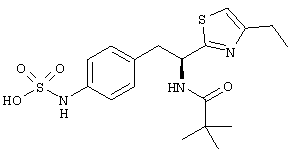
(S)-4-(2-(4-Этилтиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:
1H ЯМР (300 МГц, MeOH-d4) δ 7,92 (d, J=8,1 Гц, 1H), 7,12-7,14 (m, 4H), 7,03 (s, 1H), 5,38-5,46 (m, 1H), 3,3-3,4 (m, 1H), 3,08 (dd, J=10,2 и 13,8 Гц, 1H), 2,79 (q, J=7,2 Гц, 2Н), 1,30 (t, J=7,2 Гц, 3H), 1,13 (s, 9H).
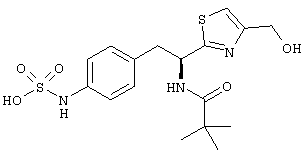
(S)-4-(2-(4-(Гидроксиметил)тиазол-2-ил)-2-пиваламидоэтил)-фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,92 (d, J=8,1 Гц, 1H), 7,24 (s, 1H), 7,08 (d, J=8,7 Гц, 2Н), 7,00 (d, J=8,7 Гц, 2Н), 5,29-5,37 (m, 1H), 4,55 (s, 2Н), 3,30 (dd, J=4,8 и 13,5 Гц, 1H), 2,99 (dd, J=10,5 и 13,5 Гц, 1H), 0,93 (s, 9H).
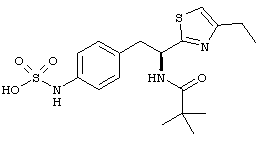
(S)-4-(2-(4-(Этоксикарбонил)тиазол-2-ил)-2-пиваламидоэтил)-фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 8,30 (s, 1H), 8,04 (d, J=8,1 Гц, 1H), 7,13 (s, 4H), 5,41-5,49 (m, 1H), 4,41 (q, J=1,2 Гц, 2Н), 3,43 (dd, J=5,1 и 13,8 Гц, 1H), 3,14 (dd, J=5,7 и 9,9 Гц, 1H), 1,42 (t, J=1,2 Гц, 3H), 1,14 (s, 9H).
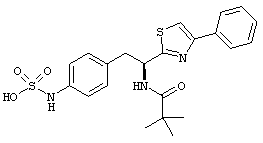
(S)-4-(2-(4-Фенилтиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:
1Н ЯМР (300 МГц, MeOH-d4) δ 7,94-8,01 (m, 3H), 7,70 (s, 1H), 7,42-7,47 (m, 2Н), 7,32-7,47 (m, 1H), 7,13-7,20 (m, 3H), 5,48-5,55 (m, 1H), 3,50 (dd, J=5,1 и 14,1 Гц, 1Н), 3,18 (dd, J=10,2 и 14,1 Гц, 1H), 1,17 (s, 9H).
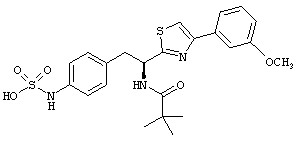
4-((S)-2-(4-(3-Метоксифенил)тиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,96-7,93 (d, 1H, J=SA Гц), 7,69 (s, 1H), 7,51-7,49 (d, 2Н, J=1,9 Гц), 7,33 (t, 1H, J=8,0 Гц), 7,14 (s, 4H), 6,92-6,90 (d, 1H, J=7,8 Гц), 5,50 (t, 1H, J=5,1 Гц), 3,87 (s, 3H), 3,50-3,13 (m, 2Н), 1,15 (s, 9H).
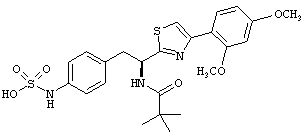
4-((S)-2-(4-(2,4-Диметоксифенил)тиазол-2-ил)-2-пиваламидоэтил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 8,11-8,09 (d, 1H, J=7,8 Гц), 7,96-7,93 (d, 1H, J=8,4 Гц), 7,74 (s, 1H), 7,18-7,16 (m, 4H), 6,67-6,64 (d, 2Н, J=9,0 Гц), 5.55-5,47 (m, 1H), 3,95 (s, 3H), 3,87 (s, 3H), 3,52-3,13 (m, 2Н), 1,17 (s, 9H).
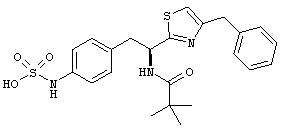
(S)-4-(2-(4-Бензилтиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:
1Н ЯМР (CD3OD) δ 7,85 (d, 1H, J=8,4 Гц), 7,38-7,20 (m, 4H), 7,11-7,02 (m, 1H), 7,00 (s, 1H), 5,42-5,37 (m, 1H), 4,13 (s, 2H), 3,13-3,08 (m, 2H), 1,13 (s, 9H).
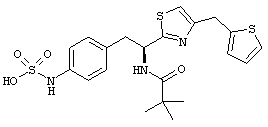
(S)-4-(2-Пиваламидо-2-(4-(тиофен-2-илметил)тиазол-2-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,88-7,85 (d, 1H), 7,38-7,35 (m, 1H), 7,10-7,01 (m, 4H), 7,02 (s, 1H), 5,45-5,38 (m, 1H), 4,13 (s, 2H), 3,13-3,05 (m, 2H), 1,13 (s, 9H).
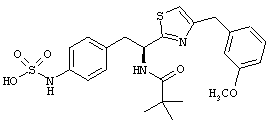
(S)-4-(2-(4-(3-Метоксибензил)тиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,85 (d, 1H, J=8,4 Гц), 7,25-7,20 (m, 1H), 7,11-7,02 (m, 4H), 7,01 (s, 1H), 6,90-6,79 (m, 2H), 5,45-5,40 (m, 1H), 4,09 (s, 2H), 3,79 (s, 3H), 3,12-3,08 (m, 2H), 1,10 (s, 9H).
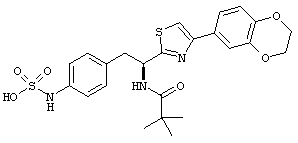
4-((S)-2-(4-(2,3-Дигидробензо[и][1,4]диоксин-6-ил)тиазол-2-ил)-2-пиваламидоэтил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,53 (s, 1H), 7,45 (s, 1H), 7,42-7,40 (d, 1H, J=8,4 Гц), 7,19-7,15 (m, 4H), 6,91-6,88 (d, 2H, J=8,4 Гц), 5,51-5,46 (m, 1H), 4,30 (s, 4H), 3,51-3,12 (m, 2H), 1,16 (s, 9H).
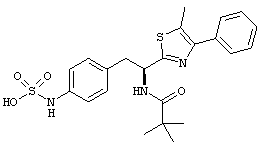
(S)-4-(2-(5-Метил-4-фенилтиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,63-7,60 (d, 2H, J=7,1 Гц), 7,49-7,35 (m, 3H), 7,14 (s, 4H). 5,43-5,38 (m, 1H), 3,42-3,09 (m, 2H), 2,49 (s, 3H), 1,14 (s, 9H).
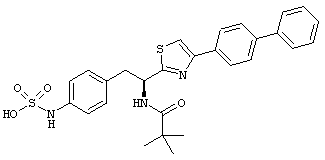
(S)-4-(2-(4-(Бифен-4-ил)тиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота: 1H ЯМР (CD3OD): δ 8,04-8,01 (m, 2H), 7,72-7,66 (m, 5H), 7,48-7,35 (m, 3H), 7,15 (s, 4H), 5,50 (t, 1H, J=5,0 Гц), 3,57-3,15 (d, 2H), 1,16 (s, 9H).
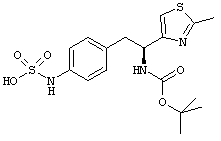
(S)-4-(2-трет-Бутоксикарбонил-2-(2-метилтиазол-4-ил)-фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, D2O) δ 6,99-7,002 (m, 4H), 6,82 (s, 1H), 2,26 (dd, J=13,8 и 7,2 Гц, 1H), 2,76 (dd, J=13,8 и 7,2 Гц, 1H), 2,48 (s, 3H), 1,17 (s, 9H).
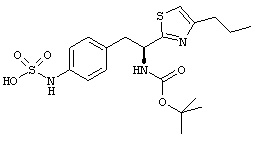
(S)-4-(2-(трет-Бутоксикарбонил)-2-(4-пропилтиазол-2-ил)этил)-фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, CD3OD): δ 7,18-7,02 (m, 5H), 5,06-5,03 (m, 1H), 3,26 (dd, J=13,8, 4,8 Гц, 1H), 2,95 (dd, J=13,8, 9,3 Гц, 1H), 2,74 (dd, J=15,0, 7,2 Гц, 2H), 1,81-1,71 (m, 2H), 1,40 (s, 7H), 1,33 (bs, 2H), 0,988 (t, J=7,5 Гц 3H).
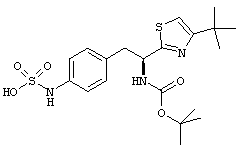
(S)-4-(2-(трет-Бутоксикарбонил)-2-(4-трет-бутилтиазол-2-ил)этил)-фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, CD3OD): δ 7,12 (s, 4H), 7,01 (s, 1H), 5,11-5,06 (m, 1H), 3,32-3,25 (m, 1H), 2,96 (m, 1H), 1,42 (s, 8H), 1,38 (s, 9H), 1,32 (s, 1H).
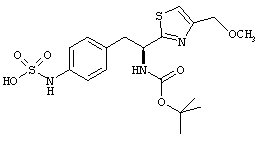
(S)-4-(2-(трет-Бутоксикарбониламино)-2-(4-(метоксиметил)тиазол-2-ил)этил)-фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, CD3OD): δ ,36 (s, 1H), 7,14-7,05 (m, 4Н), 5,06 (dd, J=9,0, 5,1 Гц, 1H), 4,55 (s, 2H), 3,42 (s, 3H), 3,31-3,24 (m, 1H), 2,97 (dd, J=13,8, 9,9 Гц, 1H), 1,47-1,31 (m, 9H).
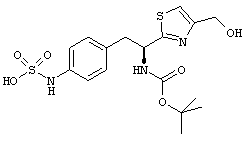
(S)-4-(2-трет-Бутоксикарбониламино)-2-(4-(2-гидроксиметил)тиазол-2-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,22-7,25 (m, 1H), 7,09-7,15 (m, 4Н), 5,00-5,09 (m, 1H), 4,32-4,35 (m, 1H), 3,87 (t, J=6,6 Гц, 2H), 3,23-3,29 (m, 1H), 3,09-3,18 (m, 1H), 2,98 (t, J=6,6 Гц, 2H), 1,41 (s, 9H).
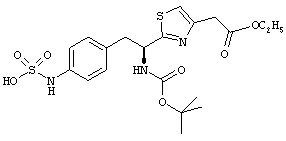
(S)-4-(2-трет-Бутоксикарбониламино)-2-(4-(2-этокси-2-оксоэтил)-тиазол-2-ил)-этил)фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,29 (s, 1H), 7,09-7,16 (m, 4Н), 5,04-5,09 (m, 1H), 4,20 (q, J=6,9 Гц, 2H), 3,84 (s, 2H), 3,30 (dd, J=4,8 и 14,1 Гц, 1H), 2,97 (dd, J=9,6 Гц и 13,8 Гц, 1H), 1,41 (s, 9H), 1,29 (t, J=7,2 Гц, 3H).
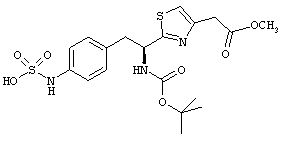
(S)-4-(2-(трет-Бутоксикарбониламино)-2-(4-(2-метокси-2-оксоэтил)тиазол-2-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,31 (s, 1H), 7,01-7,16 (m, 4Н), 5,04-5,09 (m, 1H), 4,01 (s, 2H), 3,78 (s, 2H), 3,74 (s, 3H), 3,29 (dd, J=5,1 и 13,8 Гц, 1H), 2,99 (dd, J=9,3 и 13,8 Гц, 1H), 1,41 (s, 9H).
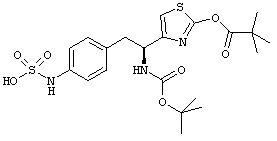
(S)-4-(2-(трет-Бутоксикарбониламино)-2-(2-(пивалоилокси)тиазол-4-ил)этил)-фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, D2O) δ 6,95 (s, 4Н), 6,63 (s, 1H), 2,94 (dd, J=13,5 и 4,8 Гц, 1H), 2,75 (dd, J=13,5 и 4,8 Гц, 1H), 1,16 (s, 9H), 1,13 (s, 9H).
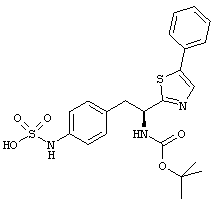
(S)-4-(2-(трет-Бутоксикарбониламино)-2-(5-фенилтиазол-2-ил)этил)-фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, CD3OD): δ 7,98 (s, 1H), 7,62 (d, J=7,2 Гц, 2Н), 7,46-7,35 (m, 4Н), 7,14 (s, 4H), 5,09 (bs, 1H), 3,07-2,99 (m, 2H), 1,43 (s, 9H).
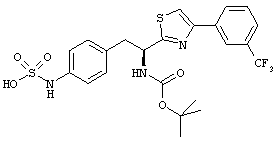
4-((S)-2-(трет-Бутоксикарбониламино)-2-(4-(3-(трифторметил)фенил)тиазол-2-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, CDsOD): δ 8,28 (s, 1H), 8,22-8,19 (m, 1H),7,89 (s, 1H), 7,65 (d, J=5,1 Гц, 2H), 7,45 (d, J=8,1 Гц, 1H), 7,15 (s, 4H), 5,17-5,14 (m, 1H), 3,43-3,32 (m, 1H), 3,05 (dd, J=14,1, 9,6 Гц, 1H), 1,42 (s, 9H).
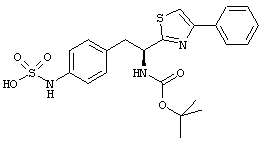
(S)-4-(2-(трет-Бутоксикарбониламино)-2-(4-фенилтиазол-2-ил)этил)-фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, CD3OD): δ 7,98 (s, 1H), 7,94 (d, J=7,2 Гц, 2H), 7,46-7,35 (m, 4H), 7,14 (s, 4H), 5,09 (bs, 1H), 3,07-2,99 (m, 2H), 1,43 (s, 9H).
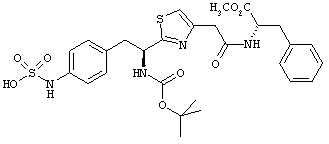
Метиловый эфир (8,8)-2-(2-{2-[2-трет-бутоксикарбониламино-2-(4-сульфоаминофенил)этил]тиазол-4-ил}ацетиламидо)-3-фенилпропионовой кислоты: 1Н ЯМР (300 МГц, MeOH-d4) δ 6,85-6,94 (m, 9H), 6,64 (s, 1H), 4,83 (s, 1H), 4,54-4,58 (m, 1H), 3,49 (s, 3H), 3,39 (s, 2H), 2,80-2,97 (m, 1H), 2,64-2,78 (m, 1H), 1,12 (s, 9H).
трет-Бутиловый эфир (S)-[1-{1-оксо-4-[2-(1-фенил-1Н-тетразол-5-сульфонил)этил]-1Н-1λ4-тиазол-2-ил}-2-(4-сульфамино-фенил)-этил]-карбаминовой кислоты: 1Н ЯМР (300 МГц, МеОН-d4) δ 7,22-7,75 (m, 2H), 7,62-7,69 (m, 2H), 7,55 (s, 1Н), 7,10-7,20 (m, 5H), 5,25 (m, 1H), 4,27-4,36 (m, 1H), 4,11-4,21 (m, 1H), 3,33-3,44 (m, 4H), 2,84-2,90 (m, 1H), 1,33 (s, 9H).
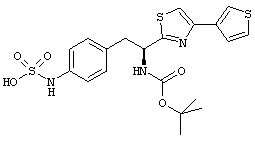
4-((S)-2-(трет-Бутоксикарбониламино)-2-(4-(тиофен-3-ил)тиазол-2-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, CD3OD): δ 7,84 (dd, J=3,0, 1,5 Гц, 1H), 7,57-7,55 (m, 2H), 7,47 (dd, J=4,8, 3,0 Гц, 1H), 7,15 (s, 4H), 5,15-5,10 (m, 1H), 3,39-3,34 (m, 1H), 3,01 (dd, J=14,1, 9,6 Гц, 1H), 1,42 (s, 8H), 1,32 (s, 1H).
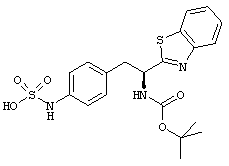
(S)-4-(2-(Бензо[d]тиазол-2-иламино)-2-(трет-бутоксикарбонил)этил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,86-7,82 (m, 2H), 7,42 (t, 2H, J=7,1 Гц), 7,33 (t, 1H, J=8,2 Гц), 7,02 (s, 4H), 5,10-5,05 (m, 1H), 2,99-2,91 (m, 2H), 1,29 (s, 9H).
(S)-4-(2-трет-Бутоксикарбониламино)-2-(2-метилтиазол-4-ил)-фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, В2О) δ 6,99-7,002 (m, 4H), 6,82 (s, 1H), 2,26 (dd, J=13,8 и 7,2 Гц, 1H), 2,76 (dd, J=13,8 и 7,2 Гц, 1H), 2,48 (s, 3H), 1,17 (s, 9H).
Первый аспект категории V настоящего раскрытия относится к 2-(тиазол-2-ил)соединениям, имеющим формулу:
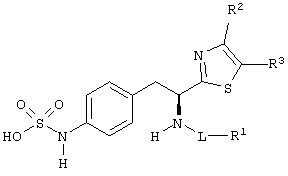
где R1, R2, R3 и L дополнительно описаны в данной заявке в Таблице IX, приведенной ниже.
Соединения, включенные в первый аспект категории V настоящего раскрытия, могут быть получены с помощью методики, приведенной на схеме VII и описанной в Примере 8, приведенном в данной заявке ниже.
Схема VII
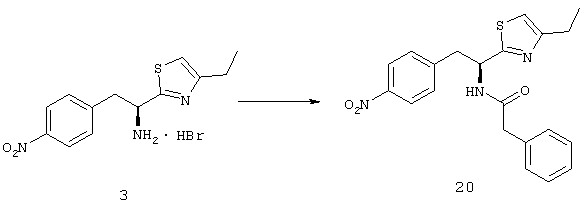
Реагенты и условия: (а) C6H4CO2H, EDCI, HOBt, DIPEA, ДМФА; кт, 18 ч.
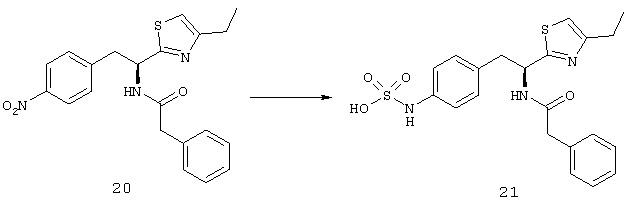
Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH, кт, 18 ч.
ПРИМЕР 8
{4-[2-(S)-(4-Этилтиазол-2-ил)-2-(2-фенилацетиламидо)этил]фенил}сульфаминовая кислота (21)
Получение N-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-2-фенил-ацетамида (20): К раствору 1-(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламин гидробромида, 3, (0,393 г, 1,1 ммоль), фенилуксусной кислоты (0,190 г, 1,4 ммоль) и 1-гидроксибензотриазола (HOBt) (0,094 г, 0,70 ммоль) в ДМ ФА (10 мл) при 0°С добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,268 г, 1,4 ммоль), потом триэтиламин (0,60 мл, 4,2 ммоль). Смесь перемешивают при 0°С в течение 30 минут, потом при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc, Объединенную органическую фазу промывают 1 N водной HCl, 5% водным NaHCO3, водой и солевым раствором, и сушат над Na2SO4. Растворитель удаляют в вакууме, получая 0,260 г (выход 60%) желаемого продукта, который используют без дополнительного очищения. ESI+ MS 396 (M+1).
Получение {4-[2-(S)-(4-этилтиазол-2-ил)-2-(2-фенилацетиламидо)этил]-фенил}сульфаминовой кислоты (21): N-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-2-фенил-ацетамид, 20, (0,260 г) растворяют в MeOH (4 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода 18 часов. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,177 г, 1,23). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH (10 мл). Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,136 г желаемого продукта в виде аммониевой соли. 1Н ЯМР (CD3OD) δ 8,60 (d, 1H, J=8,1 Гц), 7,33-7,23 (m, 3H), 7,16-7,00 (m, 6H), 5,44-5,41 (m, 1H), 3,28 (1H, А в АВХ, перекрытый растворителем), 3,03(1H, В в ABX, J=14,1, 9,6 Гц), 2,80 (q, 2H, J=10,5, 7,8 Гц) 1,31 (t, 3H, J=4,6 Гц).
Приведенное ниже является неограничивающими примерами первого аспекта категории V настоящего раскрытия.
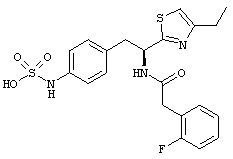
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(2-(2-фторфенил)ацетамидо)этил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,65 (d, 1H, J=8,4 Гц), 7,29-7,15 (m, 1H), 7,13-7,03 (m, 7H), 5,46-5,42 (m, 1H), 3,64-3,51 (m, 2H), 3,29 (1H), 3,04 (1H, В в АВХ, J=13,8, 9,6 Гц), 2,81 (q, 2H, J=15,6, 3,9 Гц), 1,31 (t, 3H, J=7,8 Гц). 19F ЯМР (CD3OD) δ 43,64.
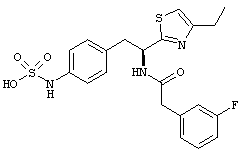
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(2-(3-фторфенил)ацетамидо)этил)-фенилсульфаминовая кислота: 1H ЯМР (CD3OD) δ 8,74 (d, 1H, J=8,4 Гц), 7,32 (q, 1H, J=6,6, 14,2 Гц), 7,10-6,91 (m, 8H), 5,47-5,40 (m, 1H), 3,53 (s, 2H), 3,30 (1H), 3,11 (1H, В в АВХ, J=9,6, 14,1 Гц), 2,80 (q, 2H, J=6,6, 15,1 Гц), 1,31 (t, 3H, J=7,8 Гц). 19F ЯМР δ 47,42.
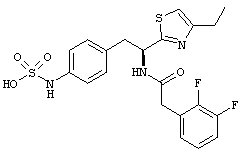
(S)-4-(2-(2-(2,3-Дифторфенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,16-7,05 (m, 5H), 6,85-6,80 (m, 1H), 5,48-5,43 (m, 1H), 3,63 (s, 2H), 3,38 (1H, А в АВХ, перекрытый растворителем), 3,03 (1H), 2,80 (q, H, J=15,1, 7,8 Гц), 1,31 (t, 3H, J=7,5 Гц).
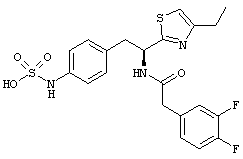
(S)-4-(2-(2-(3,4-Дифторфенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,75 (d, 1H, J=7,8 Гц), 7,23-7,04 (m, 6H), 6,88-6,84 (m, 1H), 5,44-5,40 (m, 1H), 3,49 (s, 2H), 3,34 (1H), 3,02 (1H, В в АВХ, J=14,1, 9,9 Гц), 2,80 (q, 2H, J=15,1, 7,8 Гц), 1,31 (t, 1H, J=7,5 Гц). 19F ЯМР (CD3OD) δ 22,18, 19,45.
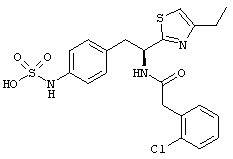
(S)-4-(2-(2-(2-Хлорфенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,39-7,36 (m, 1H), 7,27-7,21 (m, 2H), 7,15-6,98 (m, 5H), 5,49-5,44 (m, 1H), 3,69 (d, 2H, J=11,7 Гц), 3,32 (1H), 3,04 (1H, В в АВХ, J=9,3, 13,9 Гц), 2,80 (q, 2H, J=7,8, 15,3 Гц), 1,31 (t, 3H, J=7,5 Гц).
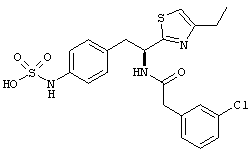
(S)-4-(2-(2-(3-Хлорфенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,33-7,23 (m, 3H), 7,13-7,03 (m, 5H), 5,43 (q, 1H, J=5,1, 9,6 Гц), 3,51 (s, 2H), 3,29 (1H), 3,03 (1H, В в АВХ, J=9,9, 14,1 Гц), 2,80 (q, 2H, J=7,5, 15 Гц), 1,31 (t, 3H, J=7,8 Гц).
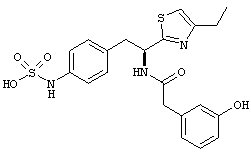
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(2-(3-гидроксифенил)ацетамидо)этил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,16-7,08 (m, 3H), 7,03-7,00 (m, 3H), 6,70-6,63 (m, 2H), 5,42-5,40 (m, 1H), 3,44 (s, 2H), 3,28 (1H, А в АВХ, перекрытый растворителем), 3,04 (В в АВХ, J=14,1, 9,6 Гц), 2,89 (q, 2H, J=15, 7,5 Гц), 1,31 (t, 3H, J=7,5 Гц).
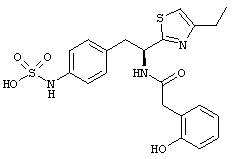
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(2-(2-метоксифенил)ацетамидо)этил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,00 (d, 1H, J=7,8 Гц), 7,26 (t, 1H, J=13,2 Гц), 7,09-7,05 (m, 4H), 7,01 (s, 1H), 6,91-6,89 (m, 4H), 5,44-5,39 (m, 1H), 3,71 (s, 3H), 3,52 (s, 2H), 3,26 (1Н, А в АВХ, J=14,1, 5,1 Гц), 3,06 (1Н В в АВХ, J=13,8, 8,4 Гц), 2,80 (q, 2H, J=8,1, 15,6 Гц), 1,31 (t, 3Н, J=1,2 Гц).
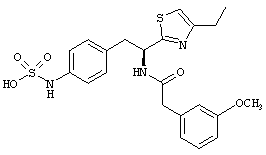
(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(3-метоксифенил)ацетамидо]этил}-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,58 (d, 1Н, J=8,1 Гц), 7,21 (t, 1Н, J=7,8 Гц), 7,12-7,02 (m, 4H), 6,81 (s, 2H), 6,72 (d, 1Н, J=7,5 Гц), 5,45-5,40 (m, 1Н), 3,79 (s, 3H), 3,50 (s, 2H), 3,29 (1Н, А в АВХ, перекрытый растворителем), 3,08 (1Н, В в АВХ, J=11,8, 5,1 Гц), 2,80 (q, 2H, J=15, 7,5 Гц), 1,31 (t, 3Н, J=6,6 Гц).
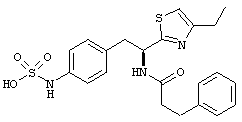
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(3-фенилпропанамидо)этил)фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,56 (d, 1Н, J=8,4 Гц), 7,25-6,98 (m, 9H), 5,43-5,38 (m, 1Н), 3,26 (1Н, А в АВХ, J=14,1, 9,6 Гц), 2,97 (1Н, В в АВХ, J=10,9, 3 Гц), 2,58-2,76 (m, 3H), 2,98 (q, 2H, J=13,8, 7,2 Гц), 1,29 (t, 3Н, J=8,7 Гц).
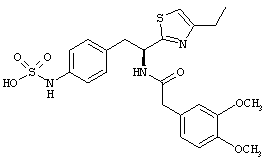
(S)-4-(2-(2-(3,4-Диметоксифенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,12-7,03 (m, 3H), 6,91 (d, 1Н, J=8,4 Гц), 6,82 (s, 1Н), 6,66 (d, 1Н, J=2,1 Гц), 6,63 (d, 1Н, J=2,1 Гц), 5,43 (m, 1Н), 3,84 (s, 3H), 3,80 (s, 3H), 3,45 (s, 2H), 3,30 (1Н), 3,03 (1Н, В в АВХ, J=14,1, 9,6 Гц), 2,79 (q, 2H, J=15,1, 7,2 Гц), 1,30 (t, 3Н, J=7,2 Гц).
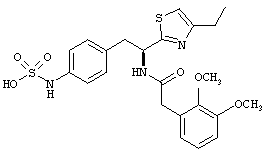
(S)-4-(2-(2-(2,3-Диметоксифенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,31 (d, 1Н, J=7,8 Гц), 7,11-6,93 (m, 6Н), 6,68 (d, 1Н, J=7,5 Гц), 5,49-5,40 (m, 1Н), 3,87 (s, 3H), 3,70 (s, 3H), 3,55 (s, 2H), 3,26 (1Н, А в АВХ, перекрытый растворителем), 3,06 (1Н, В в АВХ, J=13,9, 9 Гц), 2,80 (q, 2Н, J=14,8, 7,5 Гц), 1,31 (t, 3H, J=7,5 Гц).
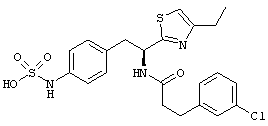
(S)-4-(2-(3-(3-Хлорфенил)пропанамидо)-2-(4-этилтиазол-2-ил)этил)фенил-сульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,27-7,18 (m, 3H), 7,13-7,08 (m, 5H), 7,01 (s, 1Н), 5,39 (q, 1Н, J=5,1, 9,4 Гц), 3,28 (1Н, А в АВХ, J=5,1, 14,1 Гц), 2,97 (1Н, В в АВХ, J=9,3, 13,9 Гц), 2,88-2,76 (m, 4Н), 2,50 (t, 2Н, J=8,1 Гц), 1,31 (t, 3H, J=7,8 Гц).
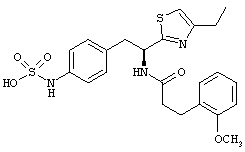
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(3-(2-метоксифенил)пропанамидо)этил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,18-7,08 (m, 6H), 6,92 (d, 1Н, J=8,1 Гц), 6,82 (t, 1Н, J=7,5 Гц), 5,40-5,35 (m, 1Н), 3,25 (1Н, А в АВХ, J=15, 5,4 Гц), 3,00 (1Н, В в АВХ, J=10,5, 7,5 Гц), 2,88-2,76 (m, 4Н), 2,47 (q, 2Н, J=9,1, 6 Гц), 1,31 (t, 3H, J=7,8 Гц).
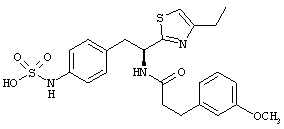
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(3-(3-метоксифенил)пропанамидо)этил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,19-7,00 (m, 5H), 6,75 (s, 1Н), 6,73 (s, 1Н), 5,42-5,37 (m, 1Н), 3,76 (s, 3H), 3,25 (1Н, А в АВХ, J=13,9, 5,4 Гц), 2,98 (1Н, В в АВХ, J=14,1, 9,6 Гц), 2,86-2,75 (m, 4Н), 2,48 (q, 2Н, J=11,7, 1,2 Гц), 1,31 (t, 3H, J=7,5 Гц).

(S)-4-(2-(4-Этилтиазол-2-ил)-2-(3-(4-метоксифенил)пропанамидо)этил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,13-6,99 (m, 7H), 6,82-6,78 (m, 2Н), 5,42-5,37 (m, 1Н), 3,33 (s, 3H), 3,23 (1Н), 2,97 (1Н, В в АВХ, J=13,3, 11,4 Гц), 2,83-2,75 (m, 4Н), 2,49 (q, 2Н, J=6,4, 3,3 Гц), 1,31 (t, 3H, J=7,5 Гц).
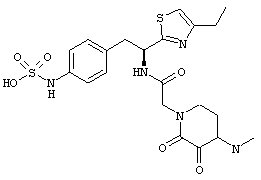
(S)-4-{2-[2-(4-Этил-2,3-диоксопиперазин-1-ил)ацетамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,14 (s, 4H), 7,08 (s, 1H), 5,56-5,51 (m, 1H), 4,34 (d, 2H, J=16,2 Гц), 3,88 (d, 2H, J=17,6 Гц), 3,59-3,40 (m, 3H), 3,26-3,14 (m, 3H), 2,98 (1H, В в АВХ, J=10,8, 13,9 Гц), 2,82 (q, 2H, J=6,9, 15 Гц), 1,32 (t, 3H, J=7,5 Гц), 1,21 (t, 3H, J=7,2 Гц).
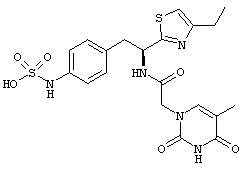
(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(5-метил-2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)ацетамидо]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,13 (s, 1H), 7,06-7,02 (m, 4H), 6,95 (s, 1H), 5,42-5,31 (m, 1H), 4,43-4,18 (dd, 2H, J=16,5 Гц), 3,24-2,93 (m, 2H), 2,74-2,69 (q, 2H, J=7,3 Гц), 1,79 (s, 3H), 1,22 (t, 3H, J=7,5 Гц).
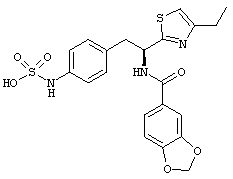
(S)-4-[2-(бензохв][1,3]диоксол-5-карбоксамидо)-2-(4-этилтиазол-2-ил)этил]-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,25 (d, 1H, J=6,5 Гц), 7,13 (s, 1H), 7,06 (d, 2H, J=8,5 Гц), 7,00 (d, 2H, J=8,5 Гц), 6,91 (s, 1H), 6,76 (d, 1H, J=8,1 Гц), 5,90 (s, 2H), 5,48 (q, 1H, J=5,0 Гц), 3,32-3,24 (m, 2H), 3,07-2,99 (m, 2H), 2,72 (q, 2H, J=7,5 Гц), 1,21 (t, 3H, J=7,5 Гц).
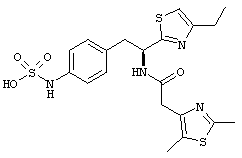
(S)-4-{2-[2-(2,5-Диметилтиазол-4-ил)ацетамидо]-2-(4-этилтиазол-2-ил)этил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,10-7,01 (m, 5H), 5,41 (t, 1H, J=6,9 Гц), 3,58 (s, 2H), 3,33-3,01 (m, 2H), 2,82-2,75 (q, 2H, J=7,5 Гц), 2,59 (s, 3H), 2,23 (s, 3H), 1,30 (t, 3H, J=7,5 Гц).
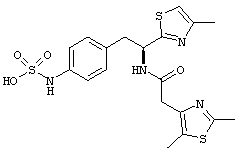
(S)-4-{2-[2-(2,4-Диметилтиазол-5-ил)ацетамидо]-2-(4-метилтиазол-2-ил)этил}-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 8,71-8,68 (d, 1H, J=8,4 Гц), 7,10-7,03 (m, 4H), 7,01 (s, 1H), 5,41 (m, 1H), 3,59 (s, 1H), 3,34-2,96 (m, 2H), 2,59 (s, 3H), 2,40 (s, 3H), 2,23 (s, 3H).
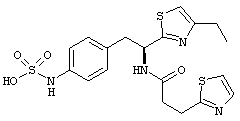
(S)-4-{2-(4-Этилтиазол-2-ил)-2-[3-(тиазол-2-ил)пропанамидо]этил}-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,67-7,65 (m, 1H), 7,49-7,47 (m, 1H), 7,14-7,08 (m, 4H), 7,04 (s, 1H), 5,46-5,41 (q, 1H, J=5,1 Гц), 3,58 (s, 2H), 3,30-3,25 (m, 3H), 3,02-2,67 (m, 5H), 1,31 (t, 3H, J=7,5 Гц).
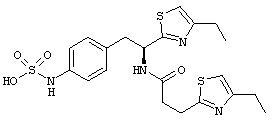
(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(4-этилтиазол-2-ил)ацетамидо]этил}-фенилсульфаминовая кислота: 1H ЯМР (CD3OD): δ 7,04-6,91 (m, 6H), 5,32 (t, 1H, J=5,4 Гц), 3,25-2,90 (m, 2H), 2,71-2,61 (m, 4H) 1,93 (s, 2H) 1,22-1,14 (m, 6H).
Второй аспект категории V настоящего раскрытия относится к 2-(тиазол-4-ил)соединениям, имеющим формулу:
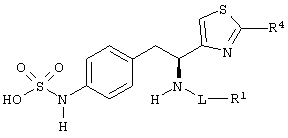
где R1, R4 и L дополнительно описаны в данной заявке в Таблице X, приведенной ниже.
Соединения, включенные во второй аспект категории I настоящего раскрытия, могут быть получены с помощью методики, приведенной на схеме II и описанной в Примере 9, приведенном ниже в данной заявке.
Схема VIII
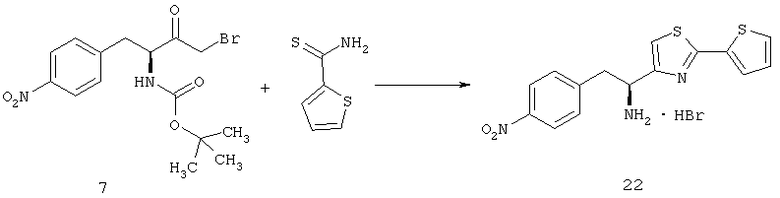
Реагенты и условия: (а) CH3CN; кипячение с обратным холодильником; 5 ч.
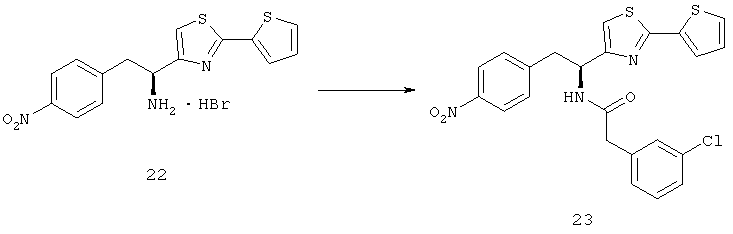
Реагенты и условия: (b) (3-Cl) C6H4CO2H, EDCI, HOBt, DIPEA, ДМФА; кт, 18 ч.
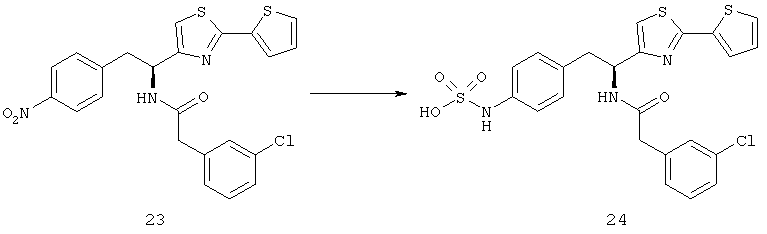
Реагенты и условия: (с) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH, кт, 18 ч.
ПРИМЕР 9
4-((S)-2-(2-(3-хлорфенил)ацетамидо)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота (24)
Получение гидробромидной соли (S)-2-(4-нитрофенил)-1-[(тиофен-2-ил)тиазол-4-ил]этанамина (22): Смесь (S)-трет-6утил 4-бром-1-(4-нитрофенил)-3-оксобутан-2-илкарбамата, 7, (7,74 г, 20 ммоль), и амида тиофен-2-тиокарбоновой кислоты (3,14 г, 22 ммоль) в CH3CN (200 мл) кипятят с обратным холодильником в течение 5 часов. Реакционную смесь охлаждают до комнатной температуры и к раствору добавляют диэтиловый эфир (50 мл). Осадок, который образовался, собирают при помощи фильтрования. Твердое вещество сушат под вакуумом, получая 7,14 г (выход 87%) желаемого продукта. ESI+ MS 332 (M+1).
Получение 2-(3-хлорфенил)-N-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}ацетамида (23): К раствору 2-(4-нитрофенил)-1-(2-тиофен-2-илтиазол-4-ил)этиламина, 22, (0,41 г, 1 ммоль), 3-хлорфенилуксусной кислоты (0,170 г, 1 ммоль) и 1-гидроксибензотриазола (HOBt) (0,070 г, 0,50 ммоль) в ДМФА (5 мл) при 0°С добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,190 г, 1 ммоль), потом триэтиламин (0,42 мл, 3 ммоль). Смесь перемешивают при 0°С в течение 30 минут, потом при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1 N водной HCl, 5% водным NaHCO3, водой и солевым раствором, и сушат над Na2SO4. Растворитель удаляют в вакууме, получая 0,290 г (выход 60%) желаемого продукта, который используют без дополнительного очищения. ESI- MS 482 (M-1).
Получение {4-[2-(3-хлорфенил)ацетиламино]-2-(2-тиофен-2-илтиазол-4-ил)этил]фенил}сульфаминовой кислоты (24): 2-(3-хлорфенил)-N-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}ацетамид, 23, (0,290 г) растворяют в MeOH (4 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода 18 часов. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,157 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH. Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,078 г желаемого продукта в виде аммониевой соли. 1Н ЯМР (CD3OD) δ 7,61 (d, 1Н, J=3,6 Гц), 7,58 (d, 1H, J=5,1 Гц), 7,41-7,35 (m, 1H), 7,28-7,22 (m, 2H), 7,18-6,98 (m, 6H), 5,33 (t, 1H, J=6,6 Гц), 3,70 (d, 2H, J=3,9 Гц), 3,23 (1H, А в АВХ, J=6,6, 13,8 Гц), 3,07 (1H, В в АВХ, J=8,1, 13,5 Гц).
Приведенное ниже является неограничивающими примерами соединений, включенных во второй аспект категории V настоящего раскрытия.
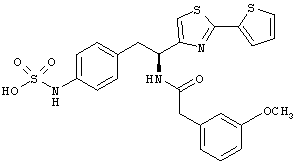
4-((S)-2-(2-(3-Метоксифенил)ацетамидо)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,35 (d, 1H, J=8,7 Гц), 7,61-7,57 (m, 2H), 7,25-7,20 (m, 2H), 7,25-7,20 (m, 2H), 7,09 (s, 1H), 7,05 (d, 2H, J=4,2 Гц), 6,99 (d, 1H, J=8,7 Гц), 6,81 (d, 1H, J=7,8 Гц), 6,77 (s, 1H), 5,30-5,28 (m, 1H), 3,76 (s, 3H), 3,51 (s, 2H), 3,20 (1H, А в АВХ, J=6,3, 13,6 Гц), 3,06 (1H, В в АВХ, J=8,1, 13,8 Гц).
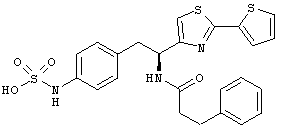
4-((S)-2-(3-Фенилпропанамидо)-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,30 (d, 1H, J=9 Гц), 7,61-7,56 (m, 2H), 7,26-7,14 (m, 7H), 7,12 (d, 1H, J=1,5 Гц), 7,09 (d, 1H, J=2,1 Гц), 6,89 (s, 1H), 5,28-5,26 (m, 1H), 3,18 (1H, А в АВХ, J=6,2, 13,8 Гц), 2,96 (1H, В в АВХ, J=8,4, 13,6 Гц).
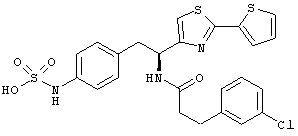
4-{(S)-2-(3-(3-Хлорфенил)пропанамидо)-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,61-7,56 (m, 3H), 7,22-7,14 (m, 6H), 7,08 (d, 1H), 7,00 (d, 1H, J=77,5 Гц), 6,870 (s, 1H), 5,25 (t, 1H, J=7,8 Гц), 3,18 (1H, А в АВХ, J=6,6, 13,8 Гц), 2,97 (1H, В в АВХ, J=7,8, 13,8 Гц), 2,87 (t, 2H, J=7,5 Гц), 2,51 (t, 2H, J=7,2 Гц).
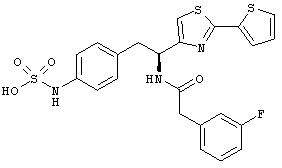
4-{(S)-2-[2-(3-Фторфенил)ацетамидо]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,61-7,57 (m, 2H), 7,32-7,28 (m, 1H), 7,19-7,16 (m, 2H), 7,08 (t, 1H, J=4,5 Гц), 7,02-6,95 (m, 6H), 5,29 (t, 1H, J=8,1 Гц), 3,53 (s, 2H), 3,22 (1H, А в АВХ, J=6,6, 13,9 Гц), 3,06 (1H, В в АВХ, J=8,4, 13,6 Гц).
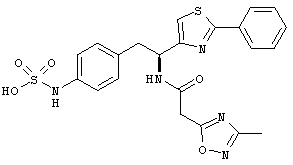
(S)-4-{2-[2-(3-Метил-1,2,4-оксадиазол-5-ил)ацетамидо]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,98-7,95 (m, 2H), 7,48-7,46 (m, 3H), 7,23 (s, 1H), 7,09-7,05 (m, 4H), 5,33 (t, 1H, J=7,2 Гц), 3,33-3,06 (m, 2H), 2,35 (s, 3H).
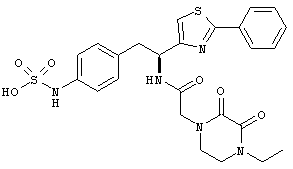
4-{(S)-2-[2-(4-этил-2,3-диоксопиперазин-1-ил)ацетамидо]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,62 (d, 1H, J=3 Гц), 7,58 (d, 1H, J=15,6 Гц), 7,27 (s, 1H), 7,16 (t, 1H, J=1,5 Гц), 5,42-5,32 (m, 1H),4,31 (d, 1H, J=15,6 Гц), 3,91 (d, 1H, J=15,9 Гц), 3,60-3,50 (m, 4H), 3,30-3,23 (m, 2H), 2,98 (1H, В в АВХ, J=9,9, 13,8 Гц), 1,21 (t, 3Н, J=6,9 Гц).
Третий аспект категории V настоящего раскрытия относится к соединениям, имеющим формулу:
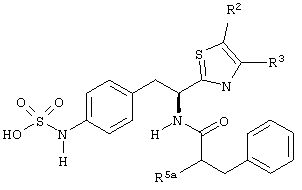 ,
,
где соединяющий фрагмент L содержит фенильный фрагмент, при этом указанная соединяющая группа имеет формулу:
-C(O)[(CR5aH)][(CR6aH)]-,
R' представляет собой водород, R6a представляет собой фенил, R5a представляет собой фенил или замещенный фенил, и неограничивающие примеры фрагментов R2, R3, и R5a дополнительно проиллюстрированы в данной заявке ниже в Таблице XI.
Соединения, включенные в третий аспект категории V настоящего раскрытия, могут быть получены с помощью методики, приведенной на схеме IX и описанной в Примере 10, приведенном в данной заявке ниже.
Схема IX
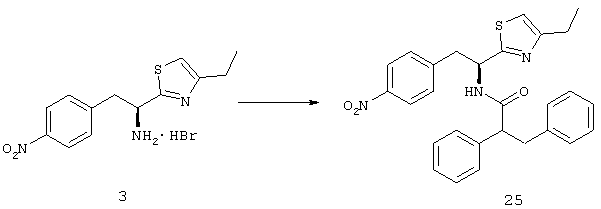
Реагенты и условия: (а) дифенилпропионовая кислота, EDCI, HOBt, TEA, ДМФА; от 0°С до кт, 18 ч.
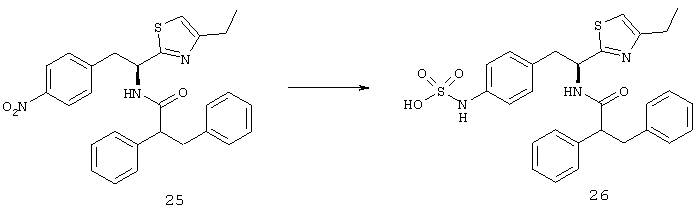
Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH; кт, 18 ч.
ПРИМЕР 10
(S)-4-(2-(2,3-Дифенилпропанамидо)-2-(4-этилтиазол-2-ил)этил)-фенилсульфаминовая кислота (26)
Получение (S)-N-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-2,3-дифенил-пропанамида (25): К раствору 1-(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламин гидробромида, 3, (0,95 г, 2,65 ммоль), дифенилпропионовой кислоты (0,60 г, 2,65 ммоль) и 1-гидроксибензотриазола (HOBt) (0,180 г, 1,33 ммоль) в ДМФА (10 мл) при 0°С добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,502 г, 2,62 ммоль), потом триэтиламин (1,1 мл, 7,95 ммоль). Смесь перемешивают при 0°С в течение 30 минут, потом при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1 N водной HCl, 5% водным NaHCO3, водой и солевым раствором, и сушат над Na2SO4. Растворитель удаляют в вакууме, получая 0,903 г (выход 70%) желаемого продукта, который используют без дополнительного очищения.
Получение (S)-4-(2-(2,3-дифенилпропанамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовой кислоты (26): (S)-N-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-2,3-дифенил-пропанамид, 25, (0,903 г) растворяют в МеОН (10 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (30 мл) и обрабатывают SO3-пиридином (0,621 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH. Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,415 г желаемого продукта в виде аммониевой соли. 1Н ЯМР (CD3OD) δ 8,59-8,52 (m, 1H), 7,37-7,04 (m, 9H), 6,97-6,93 (m, 1H), 6,89-6,85 (m, 2H), 5,36-5,32 (m, 1H), 3,91-3,83 (m, 1H), 3,29 (1H, А в АВХ, перекрытый растворителем), 3,15 (1H, В в АВХ, J=5,4, 33,8 Гц), 2,99-2,88 (m, 2H), 2,81-2,69 (m, 2H), 1,32-1,25 (m, 3H).
Прекурсоры многих Z фрагментов, которые содержит третий аспект категории V, не являются легко доступными. Следующая методика иллюстрирует пример методики, которая может быть использована для получения различных R58 фрагментов в соответствии с настоящим раскрытием. Используя методику, приведенную на схеме Х и описанную в Примере 11, специалист в данной области техники может провести модификации без чрезмерного экспериментирования для получения R53 фрагментов, охваченных настоящим раскрытием.
Схема Х
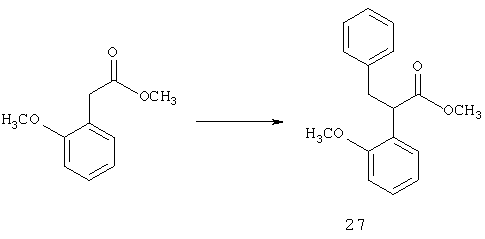
Реагенты и условия: (а) бензил бромид, LDA, THF; от 0°С до кт 18 ч.
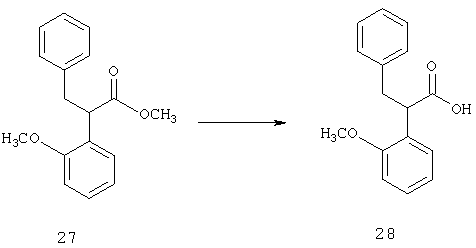
Реагенты и условия: (b) NaOH, THF/MeOH; кт, 18 ч.
ПРИМЕР 11
2-(2-Метоксифенил)-3-фенилпропановая кислота (28)
Получение метил 2-(2-метоксифенил)-3-фенилпропаноата (27): В круглодонную колбу на 500 мл помещают метил 2-(2-метоксифенил)ацетат (8,496 г, 47 ммоль, 1 экв.) и THF (200 мл). Однородную смесь охлаждают до 0°С на ледяной бане. Добавляют диизопропиламид лития (23,5 мл 2,0 М раствора в гептане/THF), поддерживая температуру меньше 3°С. Реакционную смесь перемешивают в течение 45 минут при такой сниженной температуре. По каплям добавляют бензил бромид (5,6 мл, 47 ммоль, 1 экв.). Реакционную смесь оставляют постепенно нагреваться до комнатной температуры и перемешивают в течение 18 часов. Реакционную смесь гасят 1 N HCl и экстрагируют 3 раза равными порциями EtOAc. Объединенные экстракты промывают Н2О и солевым раствором, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают через силикагель, получая 4,433 г (35%) желаемого соединения. ESI+ MS 293 (M+Na).
Получение 2-(2-метоксифенил)-3-фенилпропановой кислоты (28): Метил 2-(2-метоксифенил)-3-фенилпропаноат (4,433 г, 16 ммоль, 1 экв.) растворяют в 100 мл 1:1 (об.:об.) смеси THF и метанола. Добавляют гидроксид натрия (3,28 г, 82 ммоль, 5 экв.) и реакционную смесь перемешивают в течение 18 часов при комнатной температуре. Реакционную смесь потом выливают в H2O и рН корректируют до 2 путем добавления 1 N HCl. Образуется осадок белого цвета, который удаляют при помощи фильтрования. Полученный раствор экстрагируют 3 порциями диэтилового эфира. Экстракты объединяют, промывают Н2О и солевым раствором, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Полученный остаток очищают через силикагель, получая 2,107 г (51%) желаемого соединения. ESI- MS 255 (M-1), 211 (М-СО2Н).
Промежуточное соединение 28 может быть перенесено на следующую стадию в соответствии с методикой, приведенной на схеме IX и описанной в Примере 10, с получением следующего соединения в соответствии с третьим аспектом категории V.
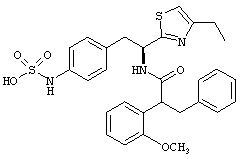
(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(2-метоксифенил)-3-фенилпропанамидо]-этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,32-7,12 (m, 7H), 7,05-7,02 (m, 1Н), 6,99-6,83 (m, 4H), 6,80-6,75 (m, 2H), 5,35-5,31 (m, 1H), 4,31-4,26 (m, 1H), 3,75 (s, 3H), 3,20-2,90 (m, 4H), 2,79-2,74 (m, 2H), 1,32-1,25 (m, 3H).
Следующее является дополнительными неограничивающими примерами соединений в соответствии с третьим аспектом категории I настоящего раскрытия.
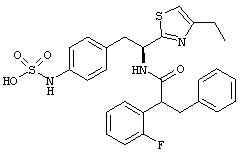
(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(3-фторфенил)-3-фенилпропанамидо]-этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,33-6,87 (m, 14H), 5,39-5,25 (m, 1H), 3,95-3,83 (m, 1H), 3,31-3,10 (m, 1H), 3,05-2,88 (m, 2H), 2,80-2,70 (m, 2H), 1,32-1,23 (m, 3H). 19F ЯМР δ 47,59.
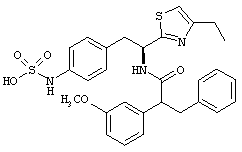
(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(3-метоксифенил)-3-фенилпропанамидо]-этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,85 (d, 1H, J=8,4 Гц), 7,25-7,20 (m, 1H), 7,11-7,02 (m, 4H), 7,01 (s, 1H), 6,90-6,79 (m, 2H), 5,45-5,40 (m, 1H), 4,09 (s, 2H), 3,79 (s, 3H), 3,12-3,08 (m, 2H), 1,10 (s, 9H).
Четвертый аспект категории V настоящего раскрытия относится к соединениям, имеющим формулу:
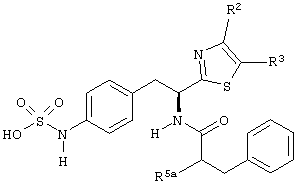
где соединяющий фрагмент L содержит фенильный фрагмент, при этом соединяющая группа имеет формулу:
-С(О)[(CR5aH)][(CR6aH]-,
R1 представляет собой водород, R6a представляет собой фенил, R5a представляет собой замещенный или незамещенный гетероарил, и фрагменты R2, R3 и R5a дополнительно проиллюстрированы в данной заявке ниже в Таблице XII.
Соединения, включенные в четвертый аспект категории V настоящего раскрытия, могут быть получены с помощью методики, приведенной на схеме V и описанной в Примере 5, приведенном в данной заявке ниже.
Схема XI
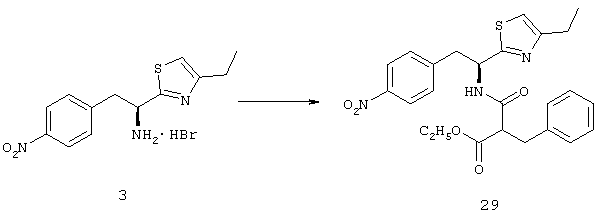
Реагенты и условия: (а) 2-бензил-3-этокси-3-оксопропановая кислота, EDCI, HOBt, DIPEA, ДМФА; кт, 18 ч.
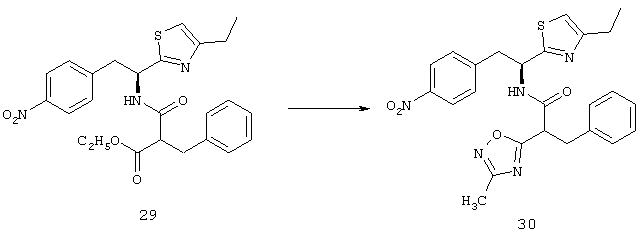
Реагенты и условия: (b) СН3С(=NOH)NH2, К2СО3, толуол; кипячение с обратным холодильником, 18 ч.
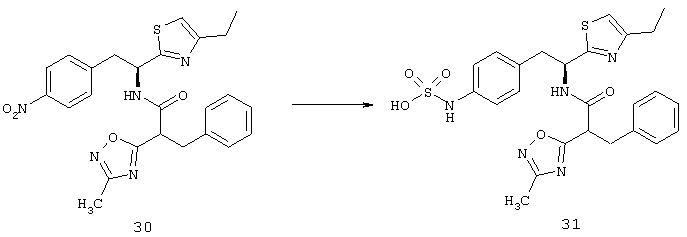
Реагенты и условия: (с) (i) хлорид олова (II), EtOH; (ii) SO3-пиридин, NH4OH; кт, 18 ч.
ПРИМЕР 12
4-{(S)-2-(4-Этилтиазол-2-ил)-2-[2-(3-метил-1,2,4-оксадиазол-5-ил)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота (31)
Получение этил-2-бензил-3-[(S)-1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)-этиламино]-3-оксопропаноата (29): К раствору 1 -(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламин гидробромида, 3, (0,406 г, 1,13 ммоль), 2-бензил-3-этокси-3-оксопропановой кислоты (0,277 г) и 1-гидроксибензотриазола (HOBt) (0,191 г, 1,41 ммоль) в ДМФА (10 мл) при 0°С добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,240 г, 1,25 ммоль), потом диизопропилэтиламин (DIPEA) (0,306 г). Смесь перемешивают при 0°С в течение 30 минут, потом при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1 N водной HCl, 5% водным NaHCO3, водой и солевым раствором, и сушат над Na2SO4. Растворитель удаляют в вакууме, получая 0,169 г (выход 31%) желаемого продукта, который используют без дополнительного очищения.
Получение N-[(S)-1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-2-(3-метил-1,2,4-оксадиазол-5-ил)-3-фенилпропанамида (30): Этил 2-бензил-3-((S)-1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламино)-3-оксопропаноат растворяют в толуоле (5 мл) и нагревают до кипения с обратным холодильником. Добавляют карбонат калия (80 мг) и ацетамид оксим (43 мг) и обрабатывают 80 мг карбоната калия и 43 мг ацетамид оксима при кипении с обратным холодильником. Реакционную смесь охлаждают до комнатной температуры, фильтруют и концентрируют. Остаток хроматографируют через силикагель, получая 0,221 г (94%) желаемого продукта в виде масла желтого цвета.
Получение 4-{(S)-2-(4-этилтиазол-2-ил)-2-[2-(3-метил-1,2,4-оксадиазол-5-ил)-3-фенилпропанамидо]этил}фенилсульфаминовой кислоты (31): N-[(S)-1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-2-(3-метил-1,2,4-оксадиазол-5-ил)-3-фенилпропанамид, 30, (0,221 г) и хлорид олова (II) (507 мг, 2,2 ммоль) растворяют в EtOH (25 мл) и раствор доводят до кипения с обратным холодильником в течение 4 часов. Растворитель удаляют в вакууме и полученный остаток растворяют в EtOAc. Добавляют насыщенный раствор NaHCO3 (50 мл) и раствор перемешивают в течение 1 часа. Органический слой отделяют и водный слой дважды экстрагируют EtOAc. Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют до остатка, который растворяют в пиридине (0,143 г) и обрабатывают SO3-пиридином (0,143 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH. Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,071 г желаемого продукта в виде аммониевой соли. 1Н ЯМР(CD3OD): δ 7,29-6,87 (m, 10H), 5,38-5,30 (m, 1H), 4,37-4,30 (m, 1H), 3,42-2,74 (m, 6H), 2,38-2,33 (m, 3H), 1,34-1,28 (m, 3H).
Категория VI настоящего раскрытия относится к 2-(тиазол-2-ил)соединениям, имеющим формулу:
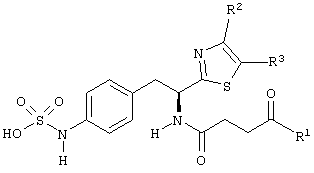
где R1, R2, R3 и L дополнительно описаны в данной заявке в Таблице XIII, приведенной ниже.
Соединения, включенные в категорию VI настоящего раскрытия, могут быть получены с помощью методики, приведенной на схеме XII и описанной в Примере 13, приведенном в данной заявке ниже.
Схема VI
Реагенты и условия: (а) 3-бензоилпропионовая кислота, SOCl2, N-метилимидазол, CH2Cl2; кт, 18 ч.
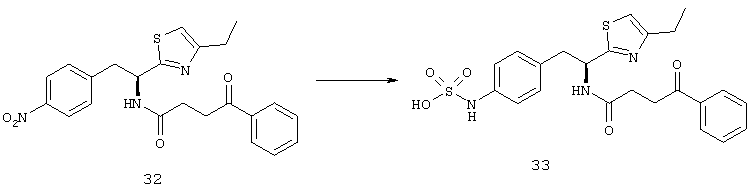
Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH.
ПРИМЕР 13
(S)-4-[2-(4-Этилтиазол-2-ил)-2-(4-оксо-4-фенилбутанамидо)этил]-фенилсульфаминовая кислота (33)
Получение (S)-N-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-4-оксо-4-фенилбутанамида (32): 3-Бензоилпропионовую кислоту (0,250 г) растворяют в СН3Оз (5 мл), добавляют N-метилимидазол (0,333 мл) и полученный раствор охлаждают до 0°С, после чего по каплям добавляют раствор тионилхлорида (0,320 г) в CH2Cl2 (2 мл). Через 0,5 часов добавляют (S)-1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этанамин, 3, (0,388 г). Реакционную смесь перемешивают в течение 18 часов при комнатной температуре и потом концентрируют в вакууме. Полученный остаток растворяют в EtOAc и промывают 1 N HCl и солевым раствором. Раствор сушат над Na2SO4, фильтруют и концентрируют и неочищенное вещество очищают через силикагель, получая 0,415 г желаемого продукта.
Получение (S)-4-[2-(4-этилтиазол-2-ил)-2-(4-оксо-4-фенилбутанамидо)-этил]фенилсульфаминовой кислоты (33): (S)-N-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-2,3-дифенил-пропанамид, 32, (0,2 г) растворяют в МеОН (15 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (5 мл) и обрабатывают SO3-пиридином (0,153 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH. Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,090 г желаемого продукта в виде аммониевой соли. 1Н ЯМР (CD3OD) δ 8,68 (d, 1H, J=8,2 Гц), 8,00 (d, 2H, J=7,2 Гц), 7,80-7,50 (m, 3H), 7,12 (s, 4H), 7,03 (s, 1H), 5,46-5,38 (m, 1H), 3,29-3,14 (m, 2H), 3,06-2,99 (m, 2H), 2,83 (q, 2H, J=7,5 Гц), 2,69-2,54 (m, 2H), 1,33 (t, 3H, J=7,5 Гц).
Приведенное ниже является неограничивающими примерами соединений, включенных в категорию II настоящего раскрытия. Промежуточные нитро-соединения приведенных ниже соединений могут быть получены путем конденсации соответствующей 4-оксо-карбоновой кислоты с промежуточным соединением 3 в условиях, описанных в данной заявке выше для образования промежуточного соединения 4 на схеме I.
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(5-метил-4-оксогексанамидо)этил)фенилсульфаминовая кислота: 1H ЯМР (CD3OD) δ 8,59 (d, 1H, J=8,1 Гц), 7,14 (s, 4H), 7,08 (t, 1H, J=13,0 Гц), 5,40-5,35 (m, 1H), 3,37-3,27 (m, 2H), 3,04-2,97 (m, 1H), 2,83-2,61 (m, 4H), 2,54-2,36 (m, 3H), 1,33 (t, 2H, J=7,3 Гц), 1,09 (dd, 6H, J=7,0, 2,2 Гц).
(S)-4-{2-[4-(3,4-Дигидро-2Н-бензо[b][1,4]диоксепин-7-ил)-4-оксобутанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,64 (d, 1H, J=8,4 Гц), 7,60 (d, 2H, J=10,6 Гц), 7,11 (s, 3H), 7,04 (d, 2H, J=5,5 Гц), 5,42-5,40 (m, 1H), 4,30-4,22 (m, 4H), 3,20-2,98 (m, 4H), 2,82 (q, 2H, J=7,3 Гц), 2,67-2,48 (m, 2H), 2,23 (t, 2H, J=5,5 Гц), 1,32 (t, 3Н, J=7,3 Гц).
(S)-4-{2-[4-(2,3-Диметоксифенил)-4-оксобутанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,64 (d, 1H, J=8,1 Гц), 7,21-7,11 (m, 7H), 7,02 (s, 1H), 5,42 (q, 1H, J=5,9 Гц), 3,90 (d, 3Н, J=3,3 Гц), 3,88 (d, 3Н, J=2,9 Гц), 3,22-3,18 (m, 2H), 3,07-2,99 (m, 2H), 2,83 (q, 2H, J=7,3 Гц), 2,63-2,54 (m, 2H), 1,34 (t, 3H, J=7,69 Гц).
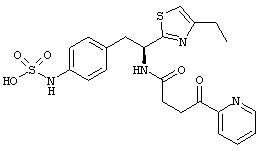
(S)-4-{2-(4-Этилтиазол-2-ил)-2-[4-оксо-4-(пиридин-2-ил)бутанамидо]этил}-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,60 (d, 1H, J=12,8 Гц), 7,91-7,81 (m, 2H), 7,48-7,44 (m, 1H), 7,22-7,21 (m, 1H), 6,99 (s, 3H), 6,91 (s, 1H), 5,30 (q, 1H, J=5,4 Гц), 3,36 (q, 2H, J=7,0 Гц), 3,21-3,15 (m, 1H), 2,91-2,85 (m, 1H), 2,74 (q, 2H, J=10,4 Гц), 2,57-2,50 (m, 2H), 1,20 (t, 3H, J=7,5 Гц).
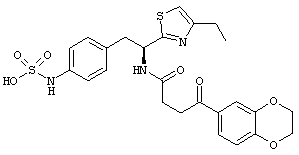
(S)-4-{2-[4-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-4-оксобутанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,52-7,47 (m, 2Н), 7,11 (s,4H), 7,03 (s, 1H), 6,95 (d, 1H, J=8,4 Гц), 5,41 (q, 1H, J=3,7 Гц), 4,31 (d, 4Н, J=5,5 Гц), 3,24-3,12 (m, 2H), 3,06-2,98 (m, 2H), 2,83 (q, 2H, J=7,3 Гц), 2,62-2,53 (m, 2H), 1,33 (t, 3H, J=7,3 Гц).
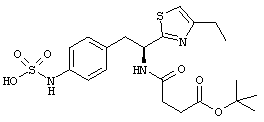
(S)-4-[2-(4-трет-Бутокси-4-оксобутанамидо)-2-(4-этилтиазол-2-ил)этил]фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,10 (s 4Н), 7,02 (s, 1H), 5,41 (q, 1H, J=3,7 Гц), 3,30-3,25 (m, 1H), 3,06-2,99 (m, 1H), 2,83 (q, 2H, J=7,3 Гц), 2,52-2,40 (m, 4Н), 1,42 (s, 9H), 1,33 (t, 3H, J=7,3 Гц).
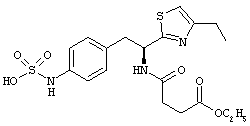
(S)-4-[2-(4-этокси-4-оксобутанамидо)-2-(4-этилтиазол-2-ил)этил]фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 8,62 (d, 1H, J=8,4 Гц), 7,10 (s, 4Н), 7,02 (s, 1H), 5,40 (q, 1H, 3,7 Гц), 4,15 (q, 2H, J=7,3 Гц), 3,28-3,25 (m, 1H), 3,05-3,02 (m, 1H), 2,82 (q, 2H, J=4,4 Гц), 2,54-2,48 (m, 2H), 1,33 (t, 3H, J=7,3 Гц), 1,24 (t, 3H, J=7,0 Гц).
Первый аспект категории VII настоящего раскрытия относится к 2-(тиазол-2-ил)соединениям, имеющим формулу:
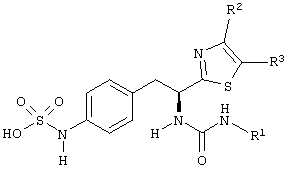 ,
,
где неограничивающие примеры R', R2 и R3 дополнительно описаны в данной заявке ниже в Таблице XIV.
Соединения, включенные в категорию VII настоящего раскрытия, могут быть получены с помощью методики, приведенной на схеме XIII и описанной в Примере 14, приведенном в данной заявке ниже.
Схема XIII
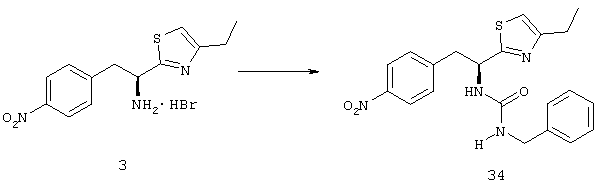
Реагенты и условия: (а) бензилизоцианат, TEA, CH2Cl2; кт, 18 ч.
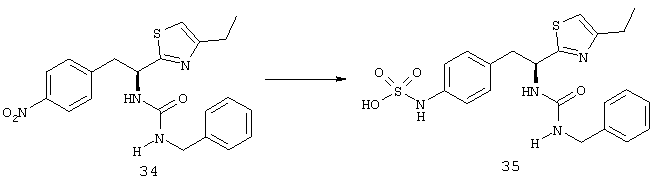
Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH.
ПРИМЕР 14
(S)-4-(2-(3-Бензилуреидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота (35)
Получение (S)-1-бензил-3-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]мочевины (34): К раствору 1-(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламин гидробромида, 3, (0,360 г, 1 ммоль) и Et3N (0,42 мл, 3 ммоль) в 10 мл CH2Cl2 добавляют бензилизоцианат (0,12 мл, 1 ммоль). Смесь перемешивают при комнатной температуре в течение 18 часов. Продукт выделяют при помощи фильтрования, получая 0,425 г (выход 96%) желаемого продукта, который используют без дополнительного очищения.
Получение (S)-4-(2-(3-бензилуреидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовой кислоты (35): (S)-1-бензил-3-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]мочевину, 34, (0,425 г) растворяют в MeOH (4 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,220 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH. Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,143 г желаемого продукта в виде аммониевой соли. 1Н ЯМР (CD3OD) δ 7,32-7,30 (m, 2H), 7,29-7,22 (in, 3H), 7,12-7,00 (m, 4H), 6,84 (d, 1H, J=8,1 Гц), 5,35-5,30 (m, 1H), 4,29 (s, 2H), 3,27-3,22 (m, 3H), 3,11-3,04 (m, 3H), 2,81 (q, 2H, J=10,2, 13,0 Гц), 1,31 (t, 3H, J=4,5 Гц).
Приведенное ниже является неограничивающими примерами соединений, включенных в первый аспект категории VII настоящего раскрытия.
4-{[(S)-2-(2-Этилтиазол-4-ил)-2-(3-(R)-метокси-1-оксо-3-фенилпропан-2-ил)уреидо]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD) δ 7,36-7,26 (m, 3H), 7,19-7,17 (m, 2H), 7,10-7,06 (m, 2H), 6,90-6,86 (m, 3H), 5,12-5,06 (m, 1H), 4,60-4,55 (m, 1H), 3,69 (s, 3H) 3,12-2,98 (m, 6H), 1,44-1,38 (m, 3H).
Второй аспект категории VII настоящего раскрытия относится к 2-(тиазол-4-ил)соединениям, имеющим формулу:
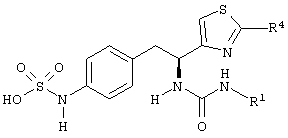
где неограничивающие примеры R1 и R4 дополнительно описаны в данной заявке ниже в Таблице XV.
Соединения, включенные во второй аспект категории VII настоящего раскрытия, могут быть получены с помощью методики, приведенной на схеме XIV и описанной в Примере 14, приведенном в данной заявке ниже.
Схема XIV
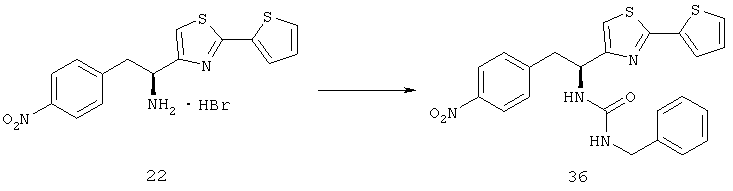
Реагенты и условия (а) бензилизоцианат, TEA, CH2Cl2; кт, 18 ч.
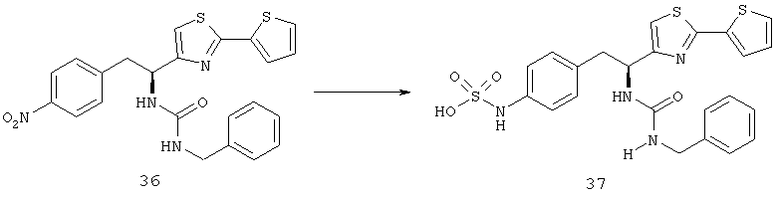
Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH.
ПРИМЕР 15
4-{(S)-2-(3-Бензилуреидо)-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}-фенилсульфаминовая кислота (37)
Получение 1-бензил-3-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}мочевины (36): К раствору гидробромидной соли (S)-2-(4-нитрофенил)-1-[(2-тиофен-2-ил)тиазол-4-ил)этан-амина, 8, и Et3N (0,42 мл, 3 ммоль) в 10 мл DCM добавляют бензил изоцианат (0,12 мл, 1 ммоль). Смесь перемешивают при комнатной температуре в течение 18 часов. Продукт выделяют при помощи фильтрования, получая 0,445 г (выход 96%) желаемого продукта, который используют без дополнительного очищения.
Получение 4-{(S)-2-(3-бензилуреидо)-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовой кислоты (37): 1-Бензил-3-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}мочевину, 36, (0,445 г) растворяют в МеОН (10 мл) и СН3СЧз (5 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через прокладку СБЫТЕ™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,110 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH. Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,080 г желаемого продукта в виде аммониевой соли. 1Н ЯМР (CD3OD) δ 7,61 (d, 1Н, J=2,1 Гц), 7,58 (d, 1Н, J=6 Гц), 7,33-7,22 (m, 4H), 7,17-7,14 (m, 1H), 7,09-6,94 (m, 6H), 5,16 (t, 1Н, J=6,6 Гц), 4,13 (s, 2H), 3,14-3,11 (m, 2H).
Категория VIII настоящего раскрытия относится к 2-(тиазол-4-ил)соединениям, имеющим формулу:
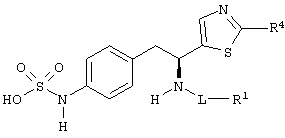 ,
,
где R1, R4 и L дополнительно описаны в данной заявке в Таблице XVI ниже.
Соединения, включенные в категорию VIII настоящего раскрытия, могут быть получены с помощью методики, приведенной на схеме XV и описанной в Примере 16, приведенном в данной заявке ниже.
Схема XV
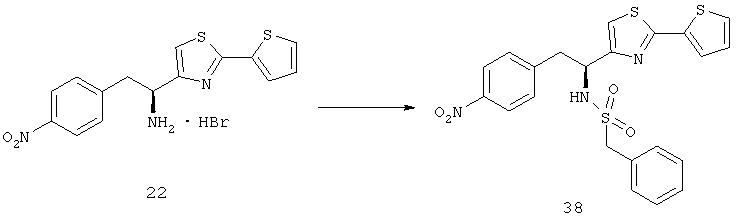
Реагенты и условия: (а) C6H4CH2SO2Cl, DIPEA, CH2Cl2; от 0°С до кт, 14 ч.
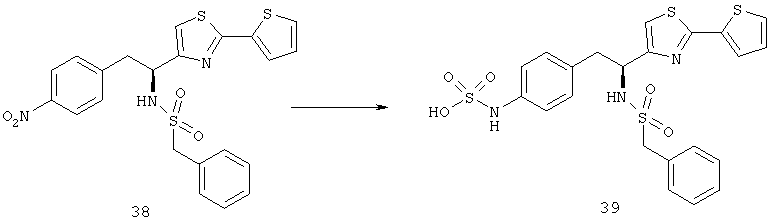
Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин. NH4OH.
ПРИМЕР 16
{4-(S)-[2-Фенилметансульфониламино-2-(2-тиофен-2-илтиазол-4-ил)этил]фенил}сульфаминовая кислота (39)
Получение (S)-N-{2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}-1-фенилметансульфонамида (38): К суспензии 2-(4-нитрофенил)-1-(2-тиофен-2-илтиазол-4-ил)этиламина, 8, (330 мг, 0,80 ммоль) в CH2Cl2 (6 мл) при 0°С добавляют диизопропилэтиламин (0,30 мл, 1,6 ммоль), потом фенилметансульфонил хлорид (167 мг, 0,88 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 14 часов. Смесь разбавляют CH2Cl2 и промывают насыщ. NaHCO3, потом солевым раствором, сушат (Na2SO4), фильтруют и концентрируют в вакууме. Полученный остаток очищают через силикагель, получая 210 мг желаемого продукта в виде твердого вещества белого цвета.
Получение {4-(S)-[2-фенилметансульфониламино-2-(2-тиофен-2-илтиазол-4-ил)этил] фенил }сульфаминовой кислоты (39): (S)-N-{2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}-1-фенилметансульфонамид, 38, (210 мг, 0,41 ммоль) растворяют в МеОН (4 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (197 мг, 1,23 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH. Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,060 г желаемого продукта в виде аммониевой соли. 1Н ЯМР (300 МГц, MeOH-d4) δ 7,52-7,63 (m, 6,70-7,28 (m, 11H), 4,75 (t, J=7,2 Гц, 1Н), 3,95-4,09 (m, 2H), 3,20 (dd, J=13,5 и 7,8 Гц, 1Н), 3,05 (dd, J=13,5 и 7,8 Гц, 1Н).
Промежуточные соединения для использования на Стадии (а) Схемы XV могут быть легко получены с помощью методики, приведенной в данной заявке ниже на Схеме XVI и описанной в Примере 17.
Схема XVI
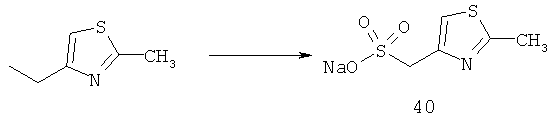
Реагенты и условия: (a) Na2SO3, H2O; микроволновое излучение при 200°С, 20 мин.
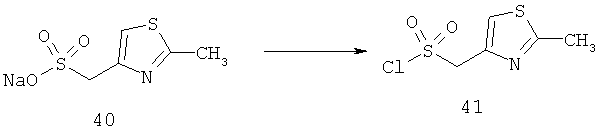
Реагенты и условия: (b) PCl5, POCl3; 50°С, 3 ч.
ПРИМЕР 17
(2-Метилтиазол-4-ил)метансульфонил хлорид (41)
Получение (2-метилтиазол-4-ил)метансульфоната натрия (40): 4-Хлорметил-2-метилтиазол (250 мг, 1,69 ммоль) растворяют в H2O (2 мл) и обрабатывают сульфитом натрия (224 мг, 1,78 ммоль). Реакционную смесь поддают микроволновому излучению в течение 20 минут при 200°С.Реакционную смесь разбавляют H2O (30 мл) и промывают EtOAc (2×25 мл). Водный слой концентрируют, получая 0,368 г желаемого продукта в виде твердого вещества желтого цвета. ЖХ/MS ESI+ 194 (М+1, свободная кислота).
Получение (2-метилтиазол-4-ил)метансульфонил хлорида (41): (2-Метилтиазол-4-ил)метансульфонат натрия, 40, (357 мг, 1,66 ммоль) растворяют в оксихлориде фосфора (6 мл) и обрабатывают пентахлоридом фосфора (345 мг, 1,66 ммоль). Реакционную смесь перемешивают при 50°С в течение 3 часов, потом оставляют охлаждаться до комнатной температуры. Растворитель удаляют при пониженном давлении и остаток повторно растворяют в CH2Cl2 (40 мл) и промывают насыщ. NaHCO3 и солевым раствором. Органический слой сушат над MgSO4, фильтруют и растворитель удаляют в вакууме, получая 0,095 г желаемого продукта в виде масла коричневого цвета. ЖХ/MS ESI+ 211 (М+1).
Промежуточные соединения получают с достаточной степенью чистоты, чтобы их использовать на следующей стадии в соответствии со Схемой IX без необходимости в дополнительной очистке.
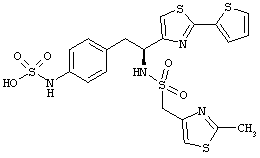
4-{(S)-2-[(2-метилтиазол-4-ил)метилсульфонамидо]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,71-7,66 (m, 2H), 7,27-7,10 (m, 7H), 4,87 (t, 1H, J=7,3 Гц), 4,30-4,16 (q, 2H, J=13,2 Гц), 3,34-3,13 (m, 2H), 2,70 (s, 3H).
Приведенное ниже является неограничивающими примерами соединений, включенных в категорию VIII настоящего раскрытия.
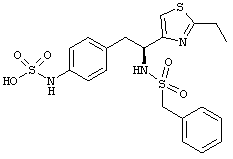
{4-(S)-[2-Фенилметансульфониламино-2-(2-этилтиазол-4-ил)этил]фенил}-сульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,27-7,32 (m, 3H), 7,16-7,20 (m, 3H), 7,05-7,6 (m, 2H), 6,96 (d, J=8,4 Гц, 2H), 4,70 (t, J=9,0 Гц, 1H), 3,91-4,02 (m, 2H), 2,95-3,18 (m, 4H), 1,41 (t, J=7,5 Гц, 3H).
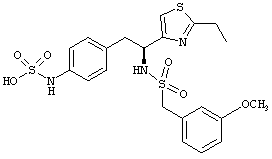
{4-(S)-[2-(3-Метоксифенил)метансульфониламино-2-(2-этилтиазол-4-ил)этил] фенил }сульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,20 (t, J=8,1 Гц. 1H), 6,94-7,08 (m,4H), 6,88-6,94 (m, 3H), 6,75-6,80 (m, 1H), 4,67 (t, J=7,2 Гц, 1H), 3,90-4,0 (m, 2H), 3,76 (s, 3H), 2,95-3,16 (m, 4H), 1,40 (t, J=7,5 Гц, 3H).
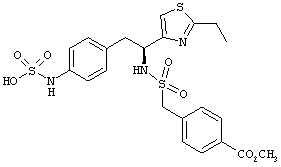
Метиловый эфир (S)-4-{[1-(2-этилтиазол-4-ил)-2-(4-сульфоаминофенил)этилсульфамоил]метил}-бензойной кислоты: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,90-7,94- (m, 2H), 7,27-7,30 (m, 2H), 7,06-7,11 (m, 3H), 6,97-7,00 (m, 2H), 4,71 (t, J=7,2 Гц, 1H), 3,95-4,08 (4, 2H), 3,92 (s, 3H), 2,80-3,50 (m, 4H), 1,38-1,44 (m, 3H).
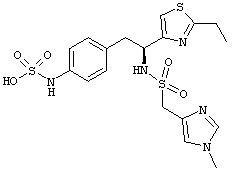
(S)-4-[2-(2-Этилтиазол-4-ил)-2-(1-метил-1Н-имидазол-4-сульфонамидо)этил]-фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, МеОН-d4) δ 7,54 (s, 1H, 7,20 (s, 1H), 7,09 (s, 1H), 6,92-7,00 (m, 4H), 4,62 (t, J=5,4 Гц, 1H), 3,70 (s, 3H), 2,98-3,14 (m,3H), 2,79 (dd, J=9,3 и 15,0 Гц, 1H), 1,39 (q, J=7,5 Гц, 3H).
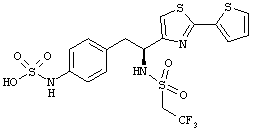
4-{(S)-2-[2-(Тиофен-2-ил)тиазол-4-ил]-2-(2,2,2-трифторэтилсульфонамидо)-этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,62-7,56 (m, 2H), 7,22 (s, 1H), 7,16-7,06 (m, 5H), 4,84 (t, 1H, J=7,6 Гц), 3,71-3,62 (m, 2H), 3,32-3,03 (m, 2H).
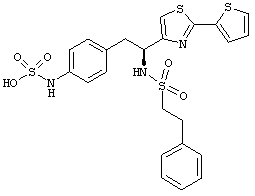
{4-(S)-[2-(Фенилэтансульфониламино)-2-(2-тиофен-2-илтиазол-4-ил)этил]-фенил}сульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,56-7,62 (m, 2H), 7,04-7,19 (m, 9H), 6,94-6,97 (m, 2H), 4,78 (t, J=7,8 Гц, 1H), 3,22-3,30 (m, 2H)), 3,11 (dd, J=13,5 и 7,8 Гц, 1H), 2,78-2,87 (m, 4H).
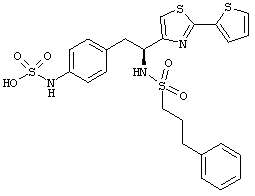
{4-(S)-[3-(Фенилпропансульфониламино)-2-(2 тиофен-2-илтиазол-4-ил)этил]-фенил}сульфаминовая кислота: 1Н ЯМР (300 МГц, МеОН-d4) δ 7,56-7,62 (m, 2H), 6,99-7,17 (m, 10H), 4,72 (t, J=7,8 Гц, 1H), 3,21 (dd, J=13,5 и 7,2 Гц, 1H), 3,02 (dd, J=13,5 и 7,2 Гц, 1H), 2,39-2,64 (m, 4H), 1,65-1,86 (m, 2H).
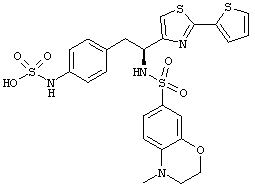
(S)-{4-[2-(4-Метил-3,4-дигидро-2Н-бензо[1,4]оксазин-7-сульфониламино)-2-(2-тиофен-2-илтиазол-4-ил)этил]фенил}сульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,53 (d, J=5,1 Гц, 1H) 7,48 (d, J=5,1 Гц, 1H), 7,13-7,10 (m, 1H), 7,04 (d, J=8,4 Гц, 2H), 6,93-6,88 (m, 3H), 6,75 (d, J=8,1 Гц, 1H), 6,54 (d, J=8,1 Гц, 1H), 4,61 (t, J=7,5 Гц, 1H), 4,20-4,08 (m, 2H), 3,14-3,00 (m, 4H), 2,69 (s, 3H).
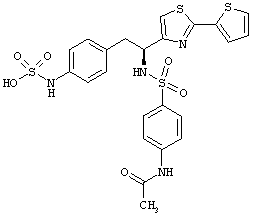
4-{(S)-2-(4-ацетамидофенилсульфонамидо)-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,67-7,52 (m, 6H), 7,24-7,23 (m, 1H), 7,12-7,09 (m, 3H), 7,02-6,99 (m, 2H), 4,70 (t, 1H, J=7,3 Гц), 3,25-3,00 (m, 2H), 2,24 (s, 3H).
Первый аспект категории IX настоящего раскрытия относится к соединениям, имеющим формулу:
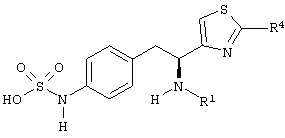
где R1 представляет собой замещенный или незамещенный гетероарил и R4 представляет собой C1-C6 линейный, разветвленный или циклический алкил, как дополнительно описано ниже в данной заявке в Таблице XVII.
Соединения в соответствии с первым аспектом категории IX, которые включают замещенный или незамещенный тиазол-4-ильный фрагмент для R1, могут быть получены с помощью методики, приведенной на схеме XVII и описанной в данной заявке ниже в Примере 18.
Схема XVII
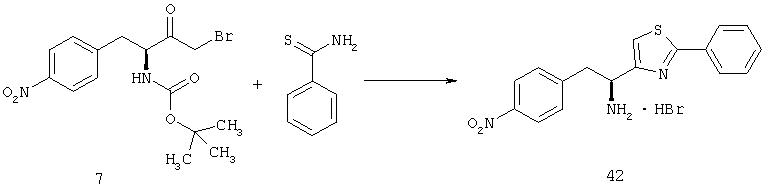
Реагенты и условия: (a) CH3CN, кипячение с обратным холодильником; 24 ч.
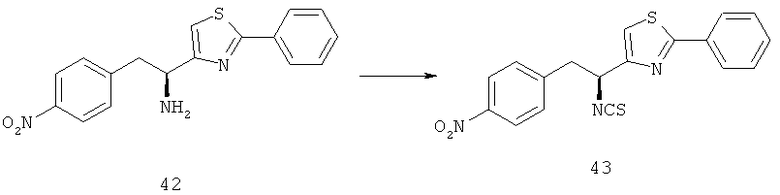
Реагенты и условия: (b) тиофосген, СаСО3, CCl4, Н2О; кт, 18 ч.
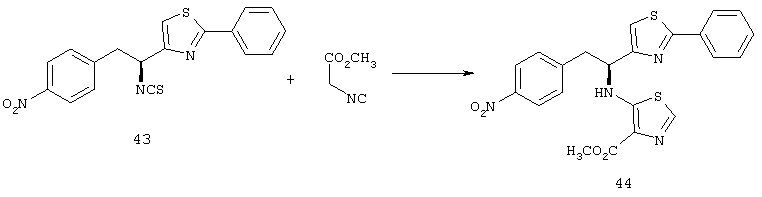
Реагенты и условия: (с) KOtBu, THF; кт, 2 ч.
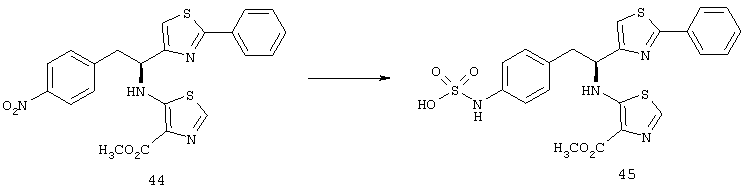
Реагенты и условия: (d) (i) SnCl2-2H2O, EtOH; кипячение с обратным холодильником, 4 часа (ii) SO3-пиридин, NH4OH.
ПРИМЕР 18
(S)-4-(2-(2-Фенилтиазол-4-ил)2-(4-(метоксикарбонил)тиазол-5-иламино)этил)фенилсульфаминовая кислота (45)
Получение гидробромидной соли (S)-2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этанамина (42): Смесь (S)-трет-бутил 4-бром-1-(4-нитрофенил)-3-оксобутан-2-илкарбамат, 7, (1,62 г, 4,17 ммоль) и тиобензамид (0,63 г, 4,60 ммоль) в CH3CN (5 мл) кипятят с обратным холодильником в течение 24 часов. Реакционную смесь охлаждают до комнатной температуры и к раствору добавляют диэтиловый эфир (50 мл). Осадок, который образовался, собирают при помощи фильтрования. Твердое вещество сушат под вакуумом, получая 1,2 г (выход 67%) желаемого продукта. ЖХ/MS ESI+ 326 (М+1).
Получение (S)-4-(1-изотиоцианато-2-(4-нитрофенил)этил)-2-фенилтиазола (43):
К раствору гидробромидной соли (S)-2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этанамина, 42, (726 мг, 1,79 ммоль) и СаСО3 (716 мг, 7,16 ммоль) в H2O (2 мл) добавляют СаСО3 (3 мл), потом тиофосген (0,28 мл, 3,58 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов, потом разбавляют CH2Cl2 и водой. Слои разделяют и водный слой экстрагируют CH2Cl2. Объединенные органические слои промывают солевым раствором, сушат (Na2SO4) и концентрируют в вакууме до остатка, который очищают через силикагель (CH2Cl2), получая 480 мг (73%) желаемого продукта в виде твердого вещества желтого цвета. 1Н ЯМР (300 МГц, CDCl3) δ 8,15 (d, J=8,7 Гц, 2Н), 7,97-7,99 (m, 2H), 7,43-7,50 (m, 3H), 7,34 (d, J=8,7 Гц, 2Н), 7,15 (d, J=0,9 Гц, 1Н), 5,40-5,95 (m, 1H), 3,60 (dd, J=13,8 и 6,0 Гц, 1Н), 3,46 (dd, J=13,8 и 6,0 Гц).
Получение (S)-метил 5-[1-(2-фенилтиазол-4-ил)-2-(4-нитрофенил)-этиламино]тиазол-4-карбоксилата (44): К суспензии трет-бутоксида калия (89 мг, 0,75 ммоль) в THF (3 мл) добавляют метил изоцианоацетат (65 мкл, 0,68 ммоль), потом (S)-2-фенил-4-(1-изотиоцианато-2-(4-нитрофенил)этил)тиазол, 43, (250 мг, 0,68 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 часов, выливают в насыщ. NaHCO3. Смесь экстрагируют EtOAc (3×25 мл) и объединенные органические слои промывают солевым раствором и сушат (Na2SO4) и концентрируют в вакууме. Неочищенный остаток очищают через силикагель, получая 323 мг (выход -100%) желаемого продукта в виде твердого вещества слегка желтого цвета. 1Н ЯМР (300 МГц, CDCl3) δ 8,09-8,13 (m, 2Н), 7,95-7 98 (m, 3H), 7,84 (d, J=1,2 Гц, 1Н), 7,44-7,50 (m, 3H), 7,28-7,31 (m, 2Н), 7,96 (d, J=0,6 Гц, 1Н), 4,71-4,78 (m, 1Н), 3,92 (s, 3H), 3,60 (dd, J=13,8 и 6,0 Гц, 1Н), 3,45 (dd, J=13,8 и 6,0 Гц, 1Н).
Получение (S)-4-(2-(2-фенилтиазол-4-ил)2-(4-(метоксикарбонил)тиазол-5-иламино)этил)фенилсульфаминовой кислоты (45): (S)-метил 5-[1-(2-фенилтиазол-4-ил)-2-(4-нитрофенил)-этиламино]тиазол-4-карбоксилат, 44, (323 мг, 0,68 ммоль) и хлорид олова (II) (612 мг, 2,72 ммоль) растворяют в EtOH и раствор доводят до кипения с обратным холодильником. Растворитель удаляют в вакууме и полученный остаток растворяют в EtOAc. Добавляют насыщенный раствор NaHCO3 и раствор перемешивают в течение 1 часа. Органический слой отделяют и водный слой экстрагируют дважды EtOAc. Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют до остатка, который растворяют в пиридине (10 мл) и обрабатывают SO3-пиридином (130 мг, 0,82 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH. Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,071 г желаемого продукта в виде аммониевой соли. 1Н ЯМР (300 МГц, MeOH-d4) δ 7,97-8,00 (m, 3H), 7,48-7,52 (m, 3H), 7,22 (s, 1H), 7,03-7,13 (m, 4H), 4,74 (t, J=6,6 Гц, 1H), 3,88 (s, 3H), 3,28-3,42 (m, 2H).
Соединения в соответствии с первым аспектом категории IX, которые содержат замещенный или незамещенный тиазол-2-ильный фрагмент для R', могут быть получены с помощью методики, приведенной на схеме XVIII и описанной в данной заявке ниже в Примере 19. Промежуточное соединение 46 может быть получено в соответствии со Схемой II и Примером 2 путем замены амида тиофен-2-тиокарбоновой кислоты на амид циклопропан-тиокарбоновой кислоты.
Схема XVIII
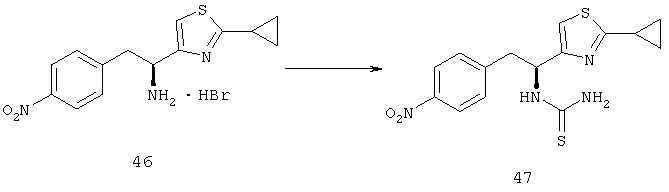
Реагенты и условия: (а) тиофосген, СаСО3, CCl4/Н2О; кт, 18 ч.
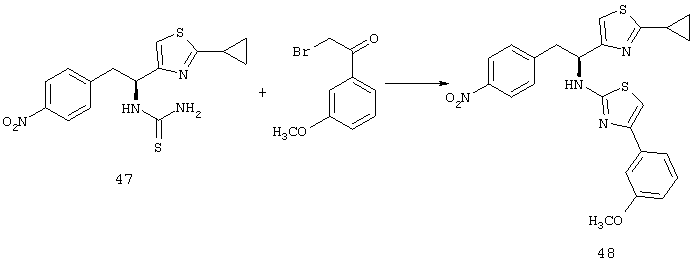
Реагенты и условия: (b) CH3CN, кипячение с обратным холодильником, 24 ч.
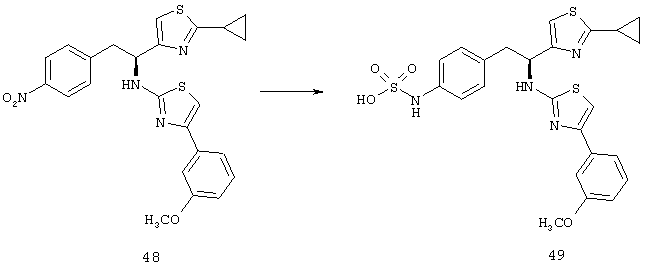
Реагенты и условия: (с) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH.
ПРИМЕР 19
4-{(S)-2-(2-Циклопропилтиазол-4-ил)-2-[4-(3-метоксифенил)тиазол-2-иламино]этил}фенилсульфаминовая кислота (50)
Получение (S)-1-(1-(2-циклопропилтиазол-4-ил)-2-(4-нитрофенил)этил)-тиомочевины (47): К раствору гидробромидной соли (S)-1-(2-циклопропилтиазол-4-ил)-2-(4-нитрофенил)этан-амина, 32, (4,04 г, 10,9 ммоль) и СаСО3 (2,18 г, 21,8 ммоль) в CCl4/вода (25 мл/20 мл) добавляют тиофосген (1,5 г, 13,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов, потом разбавляют CH2Cl2 и водой. Слои разделяют и водный слой экстрагируют CH2Cl2. Объединенные органические слои промывают солевым раствором, сушат (Na2SO4) и концентрируют в вакууме до остатка, который последовательно обрабатывают аммиаком (0,5 М в 1,4-диоксане, 120 мл) и очищают через силикагель, получая 2,90 г желаемого продукта в виде твердого вещества красно-коричневого цвета. ЖХ/MS ESI- 347 (М-1).
Получение (S)-4-(3-метоксибензил)-N-(1-(2-циклопропилтиазол-4-ил)-2-(4-нитрофенил)этил)тиазол-2-амина (48): (S)-1-(1-(2-Циклопропилтиазол-4-ил)-2-(4-нитрофенил)этил)-тиомочевину, 47, (350 мг, 1,00 ммоль) и 2-бром-3'-метокси-ацетофенон (253 мг, 1,10 ммоль) объединяют в 3 мл CH3CN и нагревают до кипения с обратным холодильником в течение 24 часов. Смесь концентрируют и хроматографируют, получая 0,172 г продукта в виде твердого вещества желтого цвета. ЖХ/MS ESI+ 479 (М+1).
Получение 4-{(S)-2-(2-циклопропилтиазол-4-ил)-2-[4-(3-метоксифенил)-тиазол-2-иламино]этил}фенилсульфаминовой кислоты (49): (S)-4-(3-метоксибензил)-N-(1-(2-циклопропилтиазол-4-ил)-2-(4-нитрофенил)этил)тиазол-2-амин, 48, (0,172 г) растворяют в 10 мл MeOH. Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через прокладку СБЫТЕ™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в 5 мл пиридина и обрабатывают SO3-пиридином (114 мг). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 10 мл 7% раствора NH4OH. Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,033 г желаемого продукта в виде аммониевой соли. 1Н ЯМР (CD3OD): δ 7,33-7,22 (m, 3H), 7,10-6,97 (m, 5H), 6,84-6,80 (m, 2H), 5,02 (t, 1H, J=6,9 Гц), 3,82 (s, 1H), 3,18 (q, 2H, J=7,1 Гц), 2,36 (q, 1H, J=4,6 Гц), 1,20-1,13 (m, 2H), 1,04-0,99 (m, 2H).
Приведенное ниже является неограничивающими примерами соединений, включенных в первый аспект категории IX.
(S)-4-(2-(4-((2-Метокси-2-оксоэтил)карбамоил)тиазол-5-иламино)2-(2-этилтиазол-4-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,91 (s, 1H), 7,08-7,10 (m, 3H), 6,99 (d, J=8,7 Гц, 2H), 4,58 (t, J=6,9 Гц, 1H), 4,11 (d, J=2,7 Гц, 2H), 3,78 (s, 3H), 3,14-3,28 (m, 2H), 3,06 (q, J=7,5 Гц, 2H), 1,41 (t, J=7,5 Гц, 3H).
(S)-4-(2-{5-[1-N-(2-Метокси-2-оксоэтилкарбамоил)-1-Н-индол-3-ил]оксазол-2-иламино}-2-(2-метилтиазол-4-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,63 (d, J=7,8 Гц, 1H), 7,37 (s, 1H), 7,18-7,29 (m, 4H), 7,02-7,16 (m, 4H), 6,85 (s, 1H), 5,04-5,09 (m, 1H), 4,85 (s, 3H), 3,27 (dd, J=13,5 и 8,1 Гц, 1H), 3,10 (m, J=13,5 и 8,1 Гц, 1H), 2,69 (s, 3H).
4-((S)-2-(5-(2-Метоксифенил)оксазол-2-иламино)-2-(2-метилтиазол-4-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,52 (dd, J=7,5 и 1,2 Гц, 1H), 6,95-7,24 (m, 10H), 5,04-5,09 (m, 1H), 3,92 (s, 3H), 3,26 (dd, J=13,8 и 8,4 Гц, 1H), 3,10 (dd, J=13,8 и 8,4 Гц, 1H), 2,72 (s, 3H).
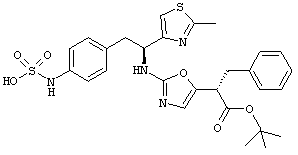
4-((S)-2-(5-((S)-1-(трет-Бутоксикарбонил)-2-фенилэтил)оксазол-2-иламино)-2-(2-метилтиазол-4-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,03-7,27 (m, 10 H), 6,50 (s, 1H), 4,95-5,00 (m, 1H), 4,76 (t, J=6,9 Гц, 1Н), 3,22 (dd, J=14,1 и 6,9 Гц, 1H), 3,00-3,10 (m, 2H), 2,90 (dd, J=14,1 и 6,9 Гц, 1H), 2,72 (s, 3H), 1,37 (s, 9H).
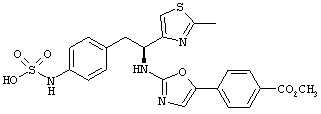
(S)-{4-{2-[5-(4-Метоксикарбонил)фенил]оксазол-2-иламино}-2-(2-метилтиазол-4-ил)этил}фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,99 (d, J=7,5 Гц, 2H), 7,56-7,59 (m, 2H), 7,23-7,24 (m, 1H), 7,08-7,14 (m, 4H), 6,83 (d, J=10,2 Гц, 1H), 5,08 (t, J=6,0 Гц, 1H), 3,91 (s, 3H), 3,25-3,35 (m, 1H), 3,09-3,13 (m, 1H), 2,73 (s, 3H).
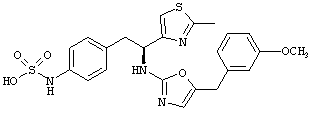
(S)-4-(2-(5-(3-Метоксибензил)оксазол-2-иламино)-2-(2-метилтиазол-4-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,03-7,28 (m, 8Н), 6,79-6,83 (m, 1H), 5,70 (s, 1H), 4,99-5,06 (m, 2H), 4,41 (d, J=2,1 Гц, 2H), 3,80 (s, 3H), 3,27-3,37 (m, 1H), 3,03-3,15 (m, 1H), 2,71 (s, 3H).
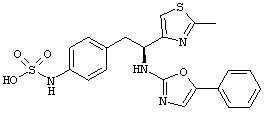
(S)-4-(2-(2-Метилтиазол-4-ил)-2-(5-фенилоксазол-2-иламино)этил)фенил-сульфаминовая кислота: 1Н ЯМР (300 МГц, МеОН-d4) δ 7,45 (d, J=8,7 Гц, 2H), 7,33 (t, J=7,8 Гц, 2H), 7,18-7,22 (m, 1H), 7,10-7,14 (m, 6H), 7,04 (s, 1H), 5,04-5,09 (m, 1H), 3,26 (dd, J=13,8 и 6,3 Гц, 1H), 3,10 (dd, J=13,8 и 6,3 Гц, 1H), 2,70 (s, 3H).
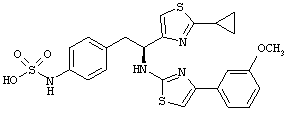
4-((S)-2-(2-Циклопропилтиазол-4-ил)-2-(4-(3-метоксифенил)тиазол-2-иламино)-этил)фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,33-7,22 (m, 3H), 7,10-6,97 (m, 5H), 6,84-6,80 (m, 2H), 5,02 (t, 1H, J=6,9 Гц), 3,82 (s, 1H), 3,18 (q, 2H, J=7,1 Гц), 2,36 (q, 1H, J=4,6 Гц), 1,20-1,13 (m, 2H), 1,04-0,99 (m, 2H).
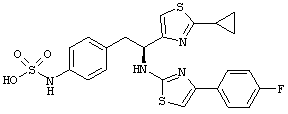
(S)-4-(2-(2-циклопропилтиазол-4-ил)-2-(4-(4-фторфенил)тиазол-2-иламино)этил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,79-7,74 (m, 2H), 7,14-7,03 (m, 7Н), 7,21 (s, 1H), 6,79 (s, 1H), 5,08 (t, 1H, J=6,6 Гц), 3,29-3,12 (m, 2H), 2,40 (q, 2,40, J=5,1 Гц), 1,23-1,18 (m, 2H), 1,08-1,02 (m, 2H).
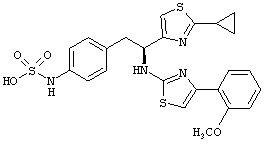
4-((S)-2-(2-циклопропилтиазол-4-ил)-2-(4-(2-метоксифенил)тиазол-2-иламино)-этил)фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,89-7,87 (d, 1H, J=7,6 Гц), 7,28 (t, 1H, J=7,0 Гц), 7,10-6,96 (m, 8H), 5,03 (t, 1H, J=6,9 Гц), 3,90 (s, 1H), 3,19 (q, 2H, J=6,6 Гц), 2,38 (q, 1H, J=4,8 Гц), 1,21-1,14 (m, 2H), 1,06-1,00 (m, 2H).
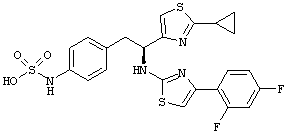
4-((S)-2-(2-циклопропилтиазол-4-ил)-2-(4-(2,4-дифторфенил)тиазол-2-иламино)-этил)фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 8,06-8,02 (q, 2H, J=6,9 Гц), 7,12-6,95 (m, 7Н), 6,88 (s, 1H), 5,11 (t, 1H, J=6,9 Гц), 3,22-3,15 (m, 2H), 2,38 (q, 1H, J=4,8 Гц), 1,22-1,15 (m, 2H), 1,06-1,02 (m, 2H).
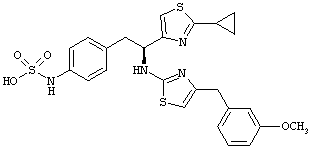
(S)-4-(2-(4-(3-метоксибензил)тиазол-2-иламино)-2-(2-циклопропилтиазол-4-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,22-7,17 (m, 3H), 7,09-6,97 (m, 5H), 6,78-6,66 (m, 3H), 3,77 (s, 2H), 3,75 (s, 3H), 3,20-3,07 (m, 2H), 2,35 (q, 1H, J=4,8 Гц), 1,19-1,13 (m, 2H), 1,03-1,00 (m, 2H).
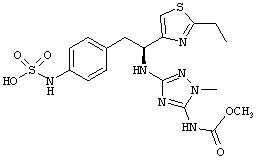
Метиловый эфир (S)-{5-[1-(2-этилтиазол-4-ил)-2-(4-сульфоаминофенил)этиламино]-2-метил-2Н-[1,2,4]триазол-3-ил}карбаминовой кислоты: 1Н ЯМР (300 МГц, MeOH-d4) δ 6,97-7,08 (m, 5H), 3,71 (s, 3H), 3,51 (s, 3H), 3,15 (dd, J=13,5 и 6,3 Гц, 1Н), 3,02-3,07 (m, 3H), 1,40 (t, J=6,6 Гц, 3H).
Второй аспект категории V настоящего раскрытия относится к соединениям, имеющим формулу:
 ,
,
где R1 представляет собой замещенный или незамещенный гетероарил и R4 представляет собой замещенный или незамещенный фенил и замещенный или незамещенный гетероарил, как дополнительно описано в данной заявке ниже в Таблице XVIII.
Соединения, включенные во второй аспект категории IX, которые содержат замещенный или незамещенный тиазол-4-ильный фрагмент для R, могут быть получены с помощью методики, приведенной на схемах XIX, XX и XXI и описанной в данной заявке ниже в Примерах 20, 21 и 22.
Схема XIX
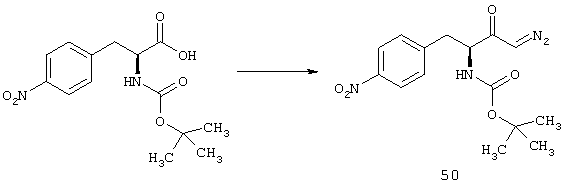
Реагенты и условия: (a)(i) (изо-бутил)OCOCl, Et3N, THF; 0°С, 20 мин.
(ii) CH2N2; от 0°C до комнатной температуры в течение 3 часов.
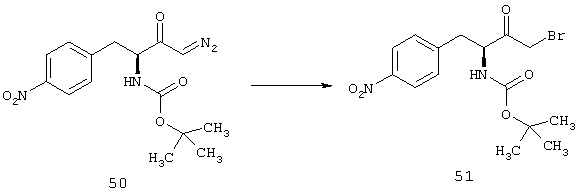
Реагенты и условия: (b) 48% HBr, THF; 0°С, 1,5 ч.
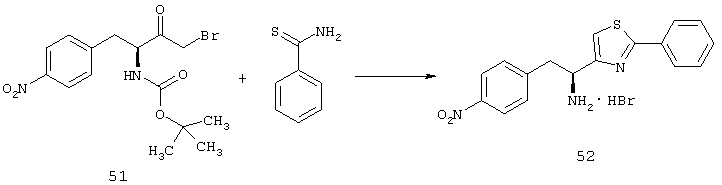
Реагенты и условия: (с) CH3CN; кипячение с обратным холодильником в течение 2 ч.
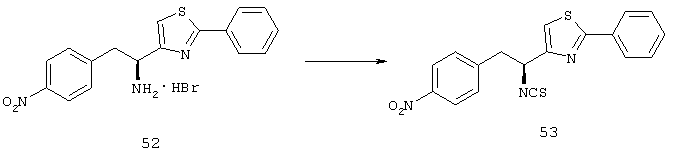
Реагенты и условия: (d) тиофосген, СаСО3, CCl4, H2O; кт, 18 ч.
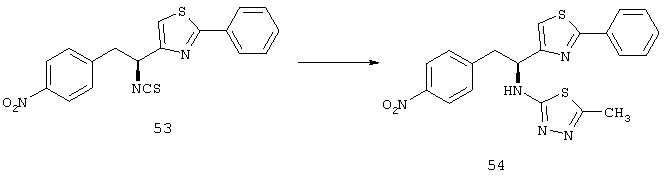
Реагенты и условия: (e)(i) CH3C(O)NHNH2, EtOH; кипячение с обратным холодильником, 2 ч.
(ii) POCl3, кт 18 ч; 50°С 2 ч.
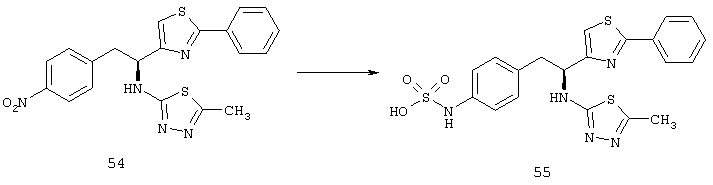
Реагенты и условия: (f) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH.
ПРИМЕР 20
(S)-4-(2-(5-Метил-1,3,4-тиадиазол-2-иламино)-2-(2-фенилтиазол-4-ил)этил)фенилсульфаминовая кислота (55)
Получение трет-бутилового эфира [3-диазо-1-(4-нитробензил)-2-оксо-пропил]-карбаминовой кислоты (50): К раствору 2-(S)-трет-бутоксикарбониламино-3-(4-нитрофенил)-пропионовой кислоты (1,20 г, 4,0 ммоль) в THF (20 мл), охлажденному до 0°С, добавляют по каплям триэтиламин (0,61 мл, 4,4 ммоль), потом изо-бутил хлорформиат (0,57 мл, 4,4 ммоль). Реакционную смесь перемешивают при 0°С в течение 20 минут, потом фильтруют. Фильтрат обрабатывают эфирным раствором диазометана (~16 ммоль) при 0°С. Реакционную смесь перемешивают при комнатной температуре в течение 3 часов и концентрируют. Остаток растворяют в EtOAc и промывают последовательно водой и солевым раствором, сушат (Na2SO4), фильтруют и концентрируют в вакууме. Полученный остаток очищают через силикагель (гексан/EtOAc 2:1), получая 1,1 г (выход 82%) желаемого продукта в виде твердого вещества слегка желтого цвета. 1Н ЯМР (300 МГц, CDCl3) δ 8,16 (d, J=8,7 Гц, 2Н), 7,39 (d, J=8,7 Гц, 2Н), 5,39 (s, 1H), 5,16 (d, J=6,3 Гц, 1H), 4,49 (s, 1H), 3,25 (dd, J=13,8 и 6,6, 1H), 3,06 (dd, J=13,5 и 6,9 Гц, 1H), 1,41 (s, 9H).
Получение трет-бутилового эфира [3-бром-1-(4-нитро-бензил)-2-оксо-пропил]-карбаминовой кислоты (51): К раствору трет-бутилового эфира [3-диазо-1-(4-нитробензил)-2-оксо-пропил]-карбаминовой кислоты, 50, (0,350 г, 1,04 ммоль) в THF (5 мл), охлажденному до 0°С, добавляют по каплям 48% водн. HBr (0,14 мл, 1,25 ммоль). Реакционную смесь перемешивают при 0°С в течение 1,5 часов и гасят при 0°С насыщенным водным Na2CO3. Смесь экстрагируют EtOAc (3×25 мл) и объединенные органические экстракты промывают солевым раствором, сушат (Na2SO4), фильтруют и концентрируют в вакууме, получая 0,400 г желаемого продукта, который используют на следующей стадии без дополнительного очищения. 1Н ЯМР (300 МГц, CDCl3) δ 8,20 (d, J=8,4 Гц, 2Н), 7,39 (d, J=8,4 Гц, 2Н), 5,06 (d, J=7,8 Гц, 1Н), 4,80 (q, J=6,3 Гц, 1Н), 4,04 (s,2H), 1,42 (s, 9H).
Получение гидробромидной соли (S)-2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этанамина (52): Смесь трет-бутилового эфира [3-бром-1-(4-нитро-бензил)-2-оксо-пропил]-карбаминовой кислоты, 51, (1,62 г, 4,17 ммоль) и бензотиоамида (0,630 г, 4,59 ммоль) в CH3CN (5 мл) кипятят с обратным холодильником в течение 24 часов. Реакционную смесь охлаждают до комнатной температуры и к раствору добавляют диэтиловый эфир (50 мл) и осадок, который образовался, собирают при помощи фильтрования. Твердое вещество сушат под вакуумом, получая 1,059 г (63%) желаемого продукта. ESI+ MS 326 (М+1).
Получение (S)-4-[1-изотиоцианато-2-(4-нитрофенил)-этил]-2-фенилтиазола (53):
К раствору гидробромидной соли (S)-2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этанамина, 52, (2,03 г, 5 ммоль) и СаСО3 (1 г, 10 ммоль) в CCl3/вода (10:7,5 мл) добавляют тиофосген (0,46 мл, 6 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов, потом разбавляют CH2Cl2 и водой. Слои разделяют и водный слой экстрагируют CH2Cl2. Объединенные органические слои промывают солевым раствором, сушат (Na2SO4) и концентрируют в вакууме до остатка, который очищают через силикагель (CH2Cl2), получая 1,71 г (выход 93%) желаемого продукта. ESI+ MS 368 (М+1).
Получение (S)-5-метил-N-[2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этил]-1,3,4-тиадиазол-2-амина (54): Раствор (S)-4-[1-изотиоцианато-2-(4-нитрофенил)-этил]-2-фенилтиазола, 53, (332 мг, 0,876 ммоль) и уксусного гидразида (65 мг, 0,876 ммоль) в EtOH (5 мл) кипятят с обратным холодильником в течение 2 часов. Растворитель удаляют при пониженном давлении, остаток растворяют в POCl3 (3 мл) и полученный раствор перемешивают при комнатной температуре в течение 18 часов, после чего раствор нагревают до 50°С в течение 2 часов. Растворитель удаляют в вакууме и остаток растворяют в EtOAc (40 мл) и полученный раствор обрабатывают 1 N NaOH до тех пор, пока рН остается около 8. Раствор экстрагируют EtOAc. Объединенные водные слои промывают EtOAc, органические слои объединяют, промывают солевым раствором, сушат над MgSO4, фильтруют и концентрируют в вакууме, получая 0,345 г (выход 93%) желаемого продукта в виде твердого вещества желтого цвета. Н ЯМР (CDCl3) 8,09 (d, J=8,4 Гц, 2Н), 7,91 (m, 2Н), 7,46 (m, 4H), 7,44 (s, 1H), 5,23 (m, 1H), 3,59 (m, 2Н), 2,49 (s, 3H). ESI+ MS 424 (M+1).
Получение (S)-4-[2-(5-метил-1,3,4-тиадиазол-2-иламино)-2-(2-фенилтиазол-4-ил)этил]фенилсульфаминовой кислоты (55): (S)-5-Метил-N-[2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этил]-1,3,4-тиадиазол-2-амин, 54, (0,404 г, 0,954 ммоль) растворяют в МеОН (5 мл). Добавляют Pd/C (50 мг, 10% масс./масс.) и смесь перемешивают в атмосфере водорода до завершения реакции. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (4 мл) и обрабатывают SO3-пиридином (0,304 г, 1,91 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH (50 мл). Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-4)азовой препаративной ВЭЖХ, получая 0,052 г (выход 11%) желаемого продукта в виде аммониевой соли. 1Н ЯМР (CD3OD): δ 8,00-7,97 (m, 2Н), 7,51-7,47 (m, 3H), 7,23 (s, 1H), 7,11-7,04 (q, 4H, J=9,0 Гц), 5,18 (t, 1H, J=7,2 Гц), 3,34-3,22 (m, 2Н), 2,50 (s, 3H). ESI- MS 472 (M-1).
Схема XX
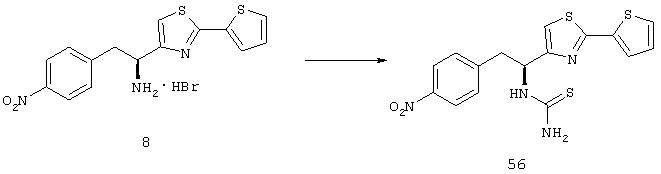
Реагенты и условия: (а) тиофосген, СаСО3, CCl4/H2O; кт, 18 ч.
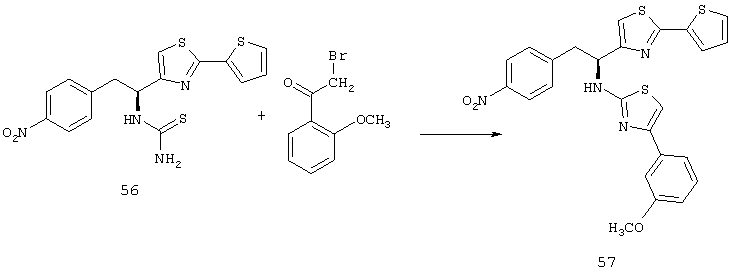
Реагенты и условия: (b) CH3CN, кипячение с обратным холодильником, 5 часов.
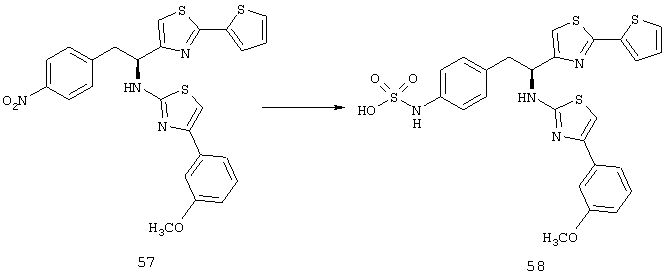
Реагенты и условия: (с) (i) Н2:Pd/С, МеОН; (ii) SO3-пиридин, NH4OH; кт, 18 ч.
ПРИМЕР 21
4-{(S)-2-[4-(2-Метоксифенил)тиазол-2-иламино)-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота (58)
Получение (S)-1-[1-(тиофен-2-илтиазол-4-ил)-2-(4-нитрофенил)этил]-тиомочевины (56): К раствору гидробромидной соли (S)-2-(4-нитрофенил)-1-(тиофен-2-илтиазол-4-ил)этанамина, 8, (1,23 г, 2,98 ммоль) и СаСО3 (0,597 г, 5,96 ммоль) в ССl4/вода (10 мл/5 мл) добавляют тиофосген (0,412 г, 3,58 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов, потом разбавляют CH2Cl2 и водой. Слои разделяют и водный слой экстрагируют CH2Cl2. Объединенные органические слои промывают солевым раствором, сушат (Na2SO4) и концентрируют в вакууме до остатка, который последовательно обрабатывают аммиаком (0,5 М в 1,4-диоксане, 29,4 мл, 14,7 ммоль) и очищают через силикагель, получая 0,490 г желаемого продукта в виде твердого вещества красно-коричневого цвета. ESI+ MS 399 (M+1).
Получение 4-(2-метоксифенил)-N-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}тиазол-2-амина (57): (S)-1-[1-(тиофен-2-илтиазол-4-ил)-2-(4-нитрофенил)этил]-тиомочевину, 56, (265 мг, 0,679 ммоль) обрабатывают бром-2'-метоксиацетофеноном (171 мг, 0,746 ммоль), получая 0,221 г продукта в виде твердого вещества желтого цвета. ESI+ MS 521 (M+1).
Получение 4-{(S)-2-[4-(2-метоксифенил)тиазол-2-иламино)-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовой кислоты (58): 4-(2-метоксифенил)-N-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}тиазол-2-амин, 57, (0,229 г) растворяют в 12 мл МеОН. Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в 6 мл пиридина и обрабатывают SO3-пиридином (140 мг). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 10 мл 7% раствора NH4OH. Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,033 г желаемого продукта в виде аммониевой соли. 1Н ЯМР(CD3OD): δ 7,96-7,93 (m, 1Н), 7,60-7,55 (m, 2H), 7,29-7,23 (m, 1H), 7,18-6,95 (m, 9H), 5,15 (t, 1Н, J=6,9 Гц), 3,90 (s, 3H), 3,35-3,24 (m, 2H).
Соединения в соответствии со вторым аспектом категории IX, которые содержат замещенный или незамещенный оксазол-2-ильный фрагмент для R1, могут быть получены с помощью методики, приведенной на схеме XXI и описанной в данной заявке ниже в Примере 22. Промежуточное соединение 39 может быть получено в соответствии со Схемой XVII и Примером 18.
Схема XXI
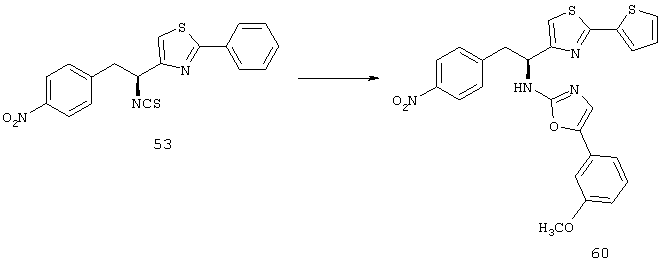
Реагенты и условия: (а) 1-азидо-1-(3-метоксифенил)этанон, PPh3, диоксан, 90°С 20 минут.
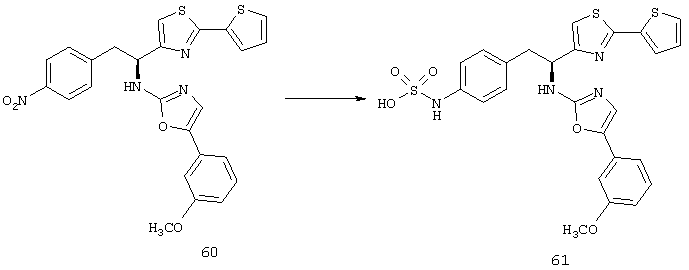
Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH; кт, 18 ч.
ПРИМЕР 22
4-{(S)-2-[5-(3-Метоксифенил)оксазол-2-иламино]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота (61)
Получение [5-(3-метоксифенил)оксазол-2-ил]-[2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этил]амина (60): Смесь (S)-4-(изотиоцианато-2-(4-нитрофенил)этил)-2-фенилтиазола, 53, (300 мг, 0,81 ммоль), 1-азидо-1-(3-метоксифенил)этанона (382 мг, 2,0 ммоль) и PPh3 (0,8 г, полимерносвязанный, ~3 ммоль/г) в диоксане (6 мл) нагревают при 90°С в течение 20 минут.Реакционный раствор охлаждают до комнатной температуры и растворитель удаляют в вакууме и полученный остаток очищают через силикагель, получая 300 мг (выход 74%) желаемого продукта в виде твердого вещества желтого цвета. 1Н ЯМР (300 МГц, MeOH-d4) δ 8,02 (d, J=7,2 Гц, 2Н), 7,92-7,99 (m, 2H), 7,42-7,47 (m, 3H), 7,22-7,27 (m, 3H), 6,69-7,03 (m, 4H), 6,75-6,78 (m, 1H), 5,26 (t, J=6,3 Гц, 1H), 3,83 (s, 4H), 3,42-3,45 (m, 2H).
Получение 4-{(S)-2-[5-(3-метоксифенил)оксазол-2-иламино]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовой кислоты (61): [5-(3-метоксифенил)оксазол-2-ил]-[2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этил]амин, 60, (300 мг, 0,60 ммоль) растворяют в МеОН (15 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (10 мл) и обрабатывают SO3-пиридином (190 мг, 1,2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH. Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая 0,042 г желаемого продукта в виде аммониевой соли. 1Н ЯМР (300 МГц, MeOH-d4) δ 7,99 (d, J=7,5 Гц, 2H), 7,46-7,50 (m, 3H),7,23-7,29 (m, 3H), 7,04-7,12 (m, 6H), 6,78 (dd, J=8,4 и 2,4 Гц, 1H), 5,16 (t, J=6,6 Гц, 1H), 3,81 (s, 3H), 3,29-3,39 (m, 1H), 3,17 (dd, J=13,8 и 8,1 Гц, 1Н).
Приведенное ниже является неограничивающими примерами второго аспекта категории IX настоящего раскрытия.
(S)-4-(2-(5-Фенил-1,3,4-тиадиазол-2-иламино)-2-(2-фенилтиазол-4-ил)этил)-фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,97-7,94 (m, 2H), 7,73-7,70 (m, 2H), 7,44-7,39 (m, 6H), 7,25 (s, 1H), 7,12 (s, 4H), 5,29 (t, 1H, J=6,9 Гц), 3,35-3,26 (m, 2H).
4-((S)-2-(5-Пропил-1,3,4-тиадиазол-2-иламино)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,59-7,54 (m, 2H), 7,17-7,03 (m, 6H), 5,13 (t, 1H, J=7,2 Гц), 3,32-3,13 (m, 2H), 2,81 (t, 2H, J=7,4 Гц), 1,76-1,63 (h, 6H, J=7,4 Гц), 0,97 (t, 3Н, J=7,3 Гц).
4-((S)-2-(5-Бензил-1,3,4-тиадиазол-2-иламино)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ (m, 2H), 7,49-7,45 (m, 2H), 7,26-7,16 (m, 5Н), 7,05-6,94 (m, 6H), 5,04 (t, 1H, J=7,1 Гц), 4,07 (s, 2H), 3,22-3,04 (m, 2H).
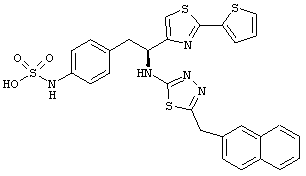
4-((S)-2-(5-(Нафтален-1-илметил)-1,3,4-тиадиазол-2-иламино)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР(CD3OD): δ 8,08-8,05 (m, 1H), 7,89-7,80 (m, 2H), 7,55-7,43 (m, 6H), 7,11-7,00 (m, 6H), 5,08 (t, 1H, J=7,1 Гц), 4,63 (s, 2H), 3,26-3,08 (m, 2H).
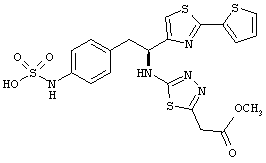
4-((S)-2-(5-((Метоксикарбонил)метил)-1,3,4-тиадиазол-2-иламино)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,48-7,44 (m, 2H), 7,03-6,92 (m, 6H), 5,02 (t, 1H, J=7,2 Гц), 4,30 (s, 2H), 3,55 (s, 3H), 3,22-3,02 (m, 2H).
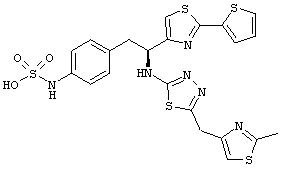
4-((S)-2-(5-((2-Метилтиазол-4-ил)метил)-1,3,4-тиадиазол-2-иламино)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,60-7,56 (m, 2H), 7,19 (s, 1H), 7,15-7,12 (m, 2H), 7,09-7,03 (q, 4H, J=8,7 Гц), 5,14 (t, 1H, J=7,2 Гц), 4,28 (s, 2H), 3,33-3,14 (m, 2H), 2,67 (s, 3H).
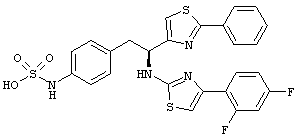
4-{(S)-2-[4-(2,4-Дифторфенил)тиазол-2-иламино]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 8,06-8,02 (q, 1H, J=6,8 Гц), 7,59-7,54 (m, 2H), 7,16-7,08 (m, 6H), 7,01-6,88 (m, 4H), 5,20 (t, 1H, J=7,0 Гц), 3,36-3,17 (m, 2H).
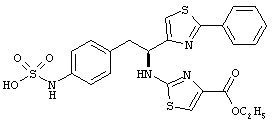
(S)-4-{2-[4-(Этоксикарбонил)тиазол-2-иламино]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 8,02-7,99 (m, 2H), 7,54-7,45 (m, 4H), 7,26 (s, 1H), 7,08 (s, 4H), 5,26 (t, 1H, J=6,9 Гц), 4,35-4,28 (q, 2H, J=6,9 Гц), 3,38-3,18 (m, 2H), 1,36 (t, 3H, J=7,2 Гц).
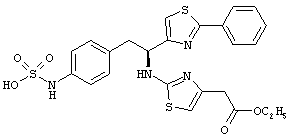
(S)-4-{2-[4-(2-Этокси-2-оксоэтил)тиазол-2-иламино]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,96 (m, 2H), 7,50-7,46 (m, 3H), 7,21 (s, 1H), 7,10-7,04 (m, 4H), 6,37 (s, 1H), 5,09 (t, 1H, J=6,9 Гц), 4,17-4,10 (q, 2H, J=7,1 Гц), 3,54 (s, 2H), 3,35-3,14 (m, 2H), 1,22 (t, 3H, J=7,1 Гц).
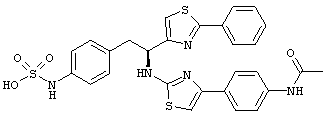
(S)-4-{2-[4-(4-ацетамидофенил)тиазол-2-иламино]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): 6 8,11 (m, 2H), 7,82-7,80 (m, 2H), 7,71-7,61 (m, 6H), 7,40 (s, 1H), 7,23 (s, 4H), 5,32 (t, 1H, J=7,0 Гц), 3,51-3,35 (m, 2H), 2,28 (s, 3H).
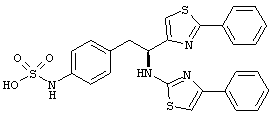
(S)-4-[2-(4-фенилтиазол-2-иламино)-2-(2-фенилтиазол-4-ил)этил]фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 8,03-7,99 (m, 2Н), 7,75-7,72 (d, 2Н, J=8,4 Гц), 7,53-7,48 (m, 3H), 7,42 (m, 4H), 7,12 (s, 4H), 6,86 (s, 1H), 5,23 (t, 1H, J=7,2 Гц), 3,40-3,27 (m, 2Н).
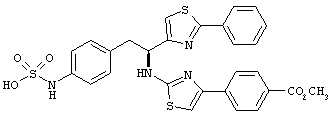
(S)-4-{2-[4-(4-(метоксикарбонил)фенил)тиазол-2-иламино]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 8,04-8,00 (m, 4H), 7,92-7,89 (d, 2Н, J=9,0 Гц), 7,53-7,49 (m, 3H), 7,30 (s, 1H), 7,15 (s, 4H), 7,05 (s, 1H), 5,28 (t, 1H, J=6,9 Гц), 3,93 (s, 3H), 3,35-3,24 (m, 2Н).
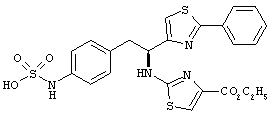
4-{(S)-2-[4-(Этоксикарбонил)тиазол-2-иламино]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота: 1Н ЯМР (CD3OD): δ 7,43-7,38 (m, 2Н), 7,26 (s, 1H), 7,00-6,94 (m, 3H), 6,89 (s, 4H), 5,02 (t, 1H, J=7,0 Гц), 4,16-4,09 (q, 2Н, J=7,1 Гц), 3,14-2,94 (m, 2Н), 1,17 (t, 3H, J=7,1 Гц).
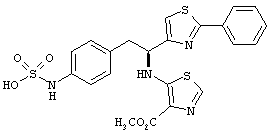
(S)-4-[2-(4-(Метоксикарбонил)тиазол-5-иламино)-2-(2-фенилтиазол-4-ил)этил]фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,97-8,00 (m, 3H), 7,48-7,52 (m, 3H), 7,22 (s, 1H), 7,03-7,13 (m, 4H), 4,74 (t, J=6,6 Гц, 1H), 3,88 (s, 3H), 3,28-3,42 (m, 2Н).
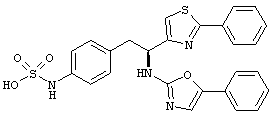
(S)-4-[2-(5-Фенилоксазол-2-иламино)-2-(2-фенилтиазол-4-ил)этил]-фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,94-7,96 (m, 2Н), 7.45-7,49 (m, 5H), 7,32 (t, J=7,8 Гц, 2Н), 7,12 (s, 1H), 7,19 (t, J=7,2 Гц, 1H), 7,12 (s, 4H), 7,05 (s, 1Н), 5,15 (t, J=6,4 Гц, 1Н), 3,34 (dd, J=14,1 и 8,4 Гц, 1Н), 3,18 (dd, J=14,1 и 8,4 Гц, 1Н).
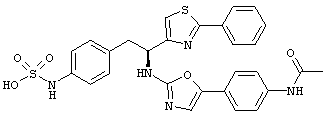
(S)-4-{2-[5-(4-Ацетамидофенил)оксазол-2-иламино]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,92-7,94 (m, 2H), 7,55-7,58 (m, 2H), 7,39-7,50 (m, 5H), 7,26 (s, 1Н), 7,12 (s, 4H), 7,02 (s, 1H0), 5,14 (t, J=7,8 Гц, 1Н), 3,13-3,38 (m, 2H), 2,11 (s, 3H).
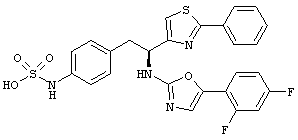
4-((S)-2-(5-(2,4-Дифторфенил)оксазол-2-иламино)-2-(2-фенилтиазол-4-ил)этил)фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,97-7,99 (m, 2H), 7,54-7,62 (m, 1Н), 7,45-7,50 (m, 3H), 7,28 (s, 1Н), 7,12 (s, 4H), 6,97-7,06 (m, 3H), 5,15-5,20 (m, 1Н), 3,28-3,40 (m, 1Н), 3,20 (dd, J=13,8 и 8,4 Гц, 1Н).
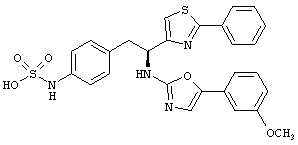
4-{(S)-2-[5-(3-Метоксифенил)оксазол-2-иламино]-2-[(2-тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,55-7,60 (m, 2H), 7,26 (t, J=8,1 Гц, 1Н), 7,21 (s, 1Н), 7,04-7,15 (m, 8H), 6,77-6,81 (m, 1Н), 5,10 (t, J=6,3 Гц, 1Н), 3,81 (s, 3H), 3,29-3,36 (m, 1Н), 3,15 (dd, J=14,1 и 8,4 Гц, 1Н).
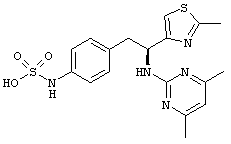
(S)-4-[2-(4,6-Диметилпиримидин-2-иламино)-2-(2-метилтиазол-4-ил)этил]фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,00-7,10 (m, 5H), 6,44 (s, 1Н), 5,50 (t, J=7,2 Гц, 1Н), 3,04-3,22 (m, 2H), 2,73 (s, 3H), 2,27 (s, 6H).
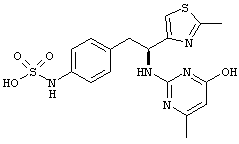
(S)-4-[2-(4-Гидрокси-6-метилпиримидин-2-иламино)-2-(2-метилтиазол-4-ил)этил]фенилсульфаминовая кислота: 1Н ЯМР (300 МГц, MeOH-d4) δ 7,44 (d, J=8,4 Гц, 2H), 6,97-7,10 (m, 4H), 5,61 (s, 1H), 5,40-5,49 (m, 1H), 3,10-3,22 (m, 2H), 2,73 (s, 3H), 2,13 (s,3H).
Первый аспект категории X настоящего раскрытия относится к соединениям, имеющим формулу:
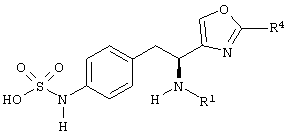
где R1 представляет собой гетероарил и R4 дополнительно описан в данной заявке ниже в Таблице XIX.
Соединения в соответствии с первым аспектом категории Х могут быть получены с помощью методики, приведенной на схеме XXII и описанной в данной заявке ниже в Примере 23.
Схема XXII
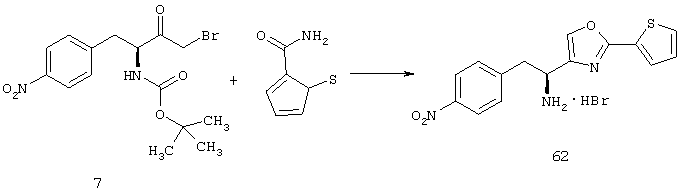
Реагенты и условия: (а) CH3CN; кипячение с обратным холодильником 2 ч.
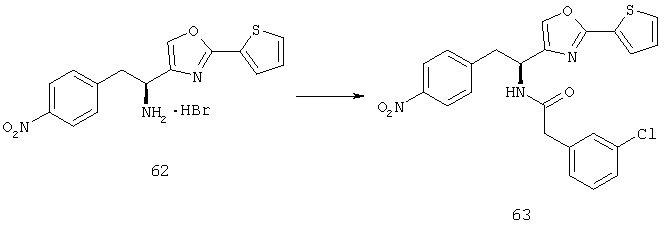
Реагенты и условия: (b) (3-Cl)C6H4CO2H, EDCI, HOBt DIPEA, ДМФА; кт, 18 ч.
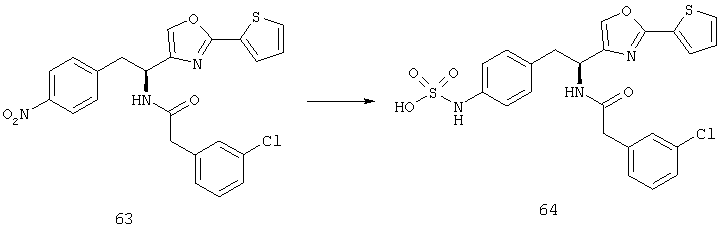
Реагенты и условия: (с) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH, кт, 18 ч.
ПРИМЕР 23
4-((S)-2-(2-(3-Хлорфенил)ацетамидо)-2-(2-(тиофен-2-ил)оксазол-4-ил)этил)фенилсульфаминовая кислота (64)
Получение гидробромидной соли (S)-2-(4-нитрофенил)-1-[(тиофен-2-ил)оксазол-4-ил]этанамина (62): Смесь (S)-трет-бутил 4-бром-1-(4-нитрофенил)-3-оксобутан-2-илкарбамата, 7, (38,7 г, 100 ммоль), и тиофен-2-карбоксамида (14 г, 110 ммоль) (доступен от Alfa Aesar) в CH3CN (500 мл) кипятят с обратным холодильником в течение 5 часов. Реакционную смесь охлаждают до комнатной температуры и к раствору добавляют диэтиловый эфир (200 мл). Осадок, который образовался, собирают при помощи фильтрования. Твердое вещество сушат под вакуумом, получая желаемый продукт, который может быть использован на следующей стадии без очищения.
Получение 2-(3-хлорфенил)-N-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)оксазол-4-ил]этил}ацетамида (63): К раствору (S)-2-(4-нитрофенил)-1-[(тиофен-2-ил)оксазол-4-шфтанамина HBr, 47, (3,15 г, 10 ммоль) 3-хлорфенил-уксусной кислоты (1,70 г, 10 ммоль) и 1-гидроксибензотриазола (HOBt) (0,70 г, 5,0 ммоль) в ДМФА (50 мл) при 0°С, добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (1,90 г, 10 ммоль), потом триэтиламин (4,2 мл, 30 ммоль). Смесь перемешивают при 0°С в течение 30 минут, потом при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1 N водной HCl, 5% водным NaHCO3, водой и солевым раствором и сушат над Na2SO4. Растворитель удаляют в вакууме, получая желаемый продукт, который используют без дополнительного очищения.
Получение-((S)-2-(2-(3-хлорфенил)ацетамидо)-2-(2-(тиофен-2-ил)оксазол-4-ил)этил)фенилсульфаминовой кислоты (64): 2-(3-хлорфенил)-N-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)оксазол-4-ил]этил}ацетамид, 63, (3 г) растворяют в МеОН (4 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,157 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH. Смесь потом концентрируют и полученный остаток может быть очищен при помощи обращенно-фазовой хроматографии с получением желаемого продукта в виде аммониевой соли.
Второй аспект категории Х настоящего раскрытия относится к соединениям, имеющим формулу:
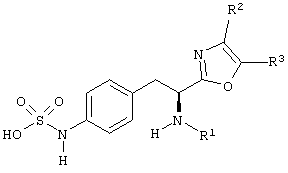
где R1 представляет собой арил и R2 и R3 дополнительно описаны в данной заявке ниже в Таблице XX.
Соединения в соответствии со вторым аспектом категории Х могут быть получены с помощью методики, приведенной на схеме XXIII и описанной в данной заявке ниже в Примере 24.
Схема XXIII
Реагенты и условия: (a) CH3CN; кипячение с обратным холодильником, 2 ч.
Реагенты и условия: (b) C6H4CO2H, EDCI, HOBt, DIPEA, ДМФА; кт, 18 ч.
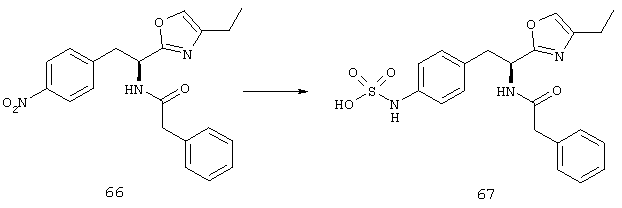
Реагенты и условия: (с) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH, кт, 18 ч.
ПРИМЕР 24
{4-[2-(S)-(4-Этилоксазол-2-ил)-2-фенилацетиламиноэтил]-фенил}сульфаминовая кислота (67)
Получение (S)-1-(4-этилоксазол-2-ил)-2-(4-нитрофенил)этанамина (65): Смесь трет-бутилового эфира [1-(S)-карбамоил-2-(4-нитрофенил)этил-карбаминовой кислоты, 1, (10 г, 32,3 ммоль) и 1-бром-2-бутанона (90%, 4,1 мл, 36 ммоль) в CH3CN (500 мл) кипятят с обратным холодильником в течение 18 часов. Реакционную смесь охлаждают до комнатной температуры и к раствору добавляют диэтиловый эфир и осадок, который образовался, удаляют при помощи фильтрования и используют без дополнительного очищения.
Получение N-[1-(4-этилоксазол-2-ил)-2-(4-нитрофенил)этил]-2-фенил-ацетамида (66): К раствору (S)-1-(4-этилоксазол-2-ил)-2-(4-нитрофенил)этанамина, 65, (2,9 г, 11 ммоль), фенилуксусной кислоты (1,90 г, 14 ммоль) и 1-гидроксибензотриазола (HOBt) (0,94 г, 7,0 ммоль) в ДМФА (100 мл) при 0°С, добавляют 1-(3-диметиламино-пропил)-3-этилкарбодиимид (EDCI) (2,68 г, 14 ммоль), потом триэтиламин (6,0 мл, 42 ммоль). Смесь перемешивают при 0°С в течение 30 минут, потом при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1 N водной HCl, 5% водным NaHCO3. водой и солевым раствором, и сушат над Na2SO4. Растворитель удаляют в вакууме, получая желаемый продукт, который используют без дополнительного очищения.
Получение {4-[2-(S)-(4-этилоксазол-2-ил)-2-фенилацетиламиноэтил]-фенил}сульфаминовой кислоты (67): N-[1-(4-этилоксазол-2-ил)-2-(4-нитрофенил)этил]-2-фенил-ацетамид, 66, (0,260 г) растворяют в МеОН (4 мл). Добавляют каталитическое количество Pd/C (10% масс./масс.) и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через прокладку CELITE™ и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,177 г, 1,23). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH (10 мл). Смесь потом концентрируют и полученный остаток очищают при помощи обращенно-фазовой хроматографии, получая желаемый продукт в виде аммониевой соли.
Неограничивающие примеры HPTP-β (IC50 мкМ) активности для раскрытых соединений приведены в Таблице XXI. HPTP-β ингибирование может быть протестировано с помощью любого метода, выбранного специалистом, например, Amarasinge K.K. et al., «Design и Synthesis of Potent, Non-peptidic Inhibitors ofHPTPbeta» Bioorg Med Chem Lett. 2006 Aug 15; 16(16):4252-6. Epub 2006 Jun 12. Erratum in: BioorgMed Chem Lett. 2008 Aug 15; 18(16):4745. Evidokimov, Artem G [corrected to Evdokimov, Artem Gj: PMID: 16759857; и Klopfenstein S. R. et al. «1,2,3,4-Tetrahydroisoquinolinyl Sulfamic AClds as Phosphatase PTP1B Inhibitors» Bioorg Med Chem Lett. 2006 Mar 15; 16(6): 1574-8, которые оба включены в данную заявку путем ссылки в полном объеме.
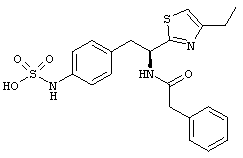
(S)-{4-[2-(4-Этилтиазол-2-ил)-2-(фенилацетиламино)этил]-фенил}сульфаминовая кислота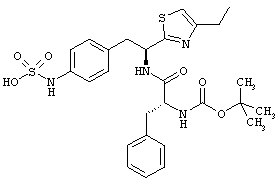
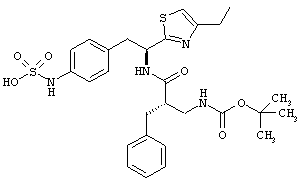
трет-Бутиловый эфир {1-[1-(5-этилтиазол-2-ил)-(S)-2-(4-сульфоаминофенил)этил-карбамоил]-(S)-2-фенилэтил} метилкарбаминовой кислоты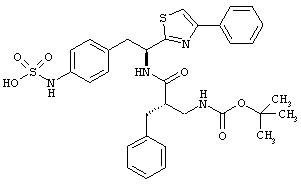
трет-Бутиловый эфир {1-[1-(5-фенилтиазол-2-ил)-(S)-2-(4-сульфоаминофенил)этилкарбамоил]-(S)-2-фенилэтил} метилкарбаминовой кислоты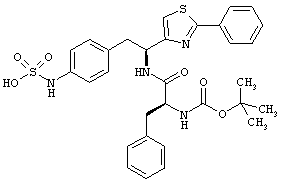
4-{(S)-2-(S)-2-(трет-Бутоксикарбониламино)-3-фенилпропанамидо-2-(2-фенилтиазол-4-ил)}фенилсульфаминовая кислота
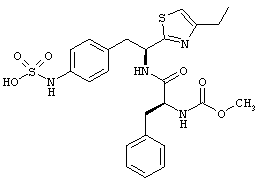
4-{(3)-2-(4-Этилтиазол-2-ил)-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота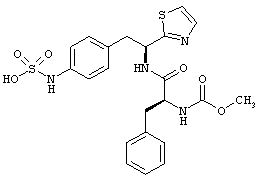
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-(тиазол-2-ил)этил}фенилсульфаминовая кислота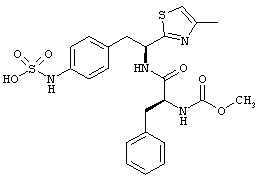
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-(4-метилтиазол-2-ил)этил}фенилсульфаминовая кислота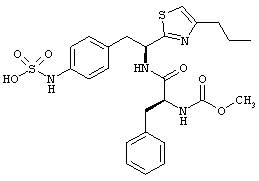
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-

4-{(S)-2-(4-трет-Бутилтиазол-2-ил)-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота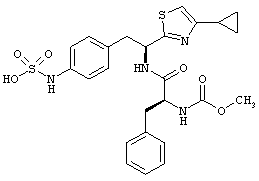
4-{(S)-2-(4-Циклопропилтиазол-2-ил)-2-[(S)-2-(метокси-карбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота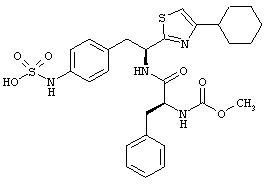
4-{(S)-2-(4-Циклогексилтиазол-2-ил)-2-[(S)-2-(метоксикарбониламино)-3-фенил-пропанамидо]этил}фенилсульфаминовая кислота
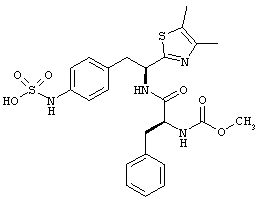
4-{(S)-2-(4,5-Диметилтиазол-2-ил)-2-[(S)-2-(метоксикарбониламино)-3-фенил-пропанамидо]этил}фенилсульфаминовая кислота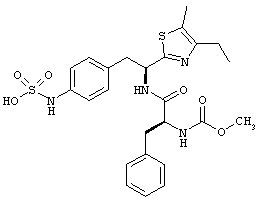
4-{(S)-2-(4-Этил-5-метилтиазол-2-ил)-2-[(S)-2-(метокси-карбониламино)-3-фенил-пропанамидо]этил}фенилсульфаминовая кислота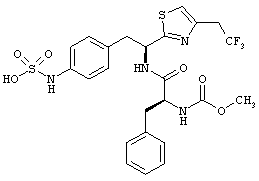
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-[4-(2,2,2-трифторэтил)тиазол-2-ил]этил}фенилсульфаминовая кислота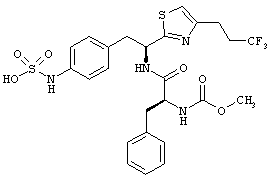
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-
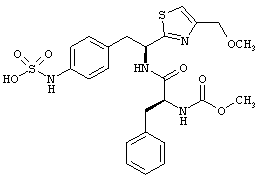
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-[4-(метоксиметил)тиазол-2-ил]этил} фенилсульфаминовая кислота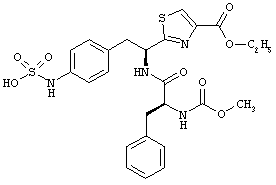
4-{(S)-2-(4-(Этоксикарбонил)тиазол-2-ил)-2-[(S)-2-(метокси-карбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота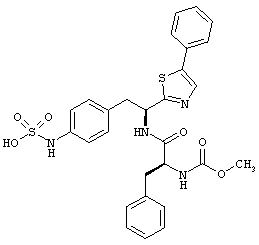
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-(5-фенилтиазол-2-ил)этил}фенилсульфаминовая кислота
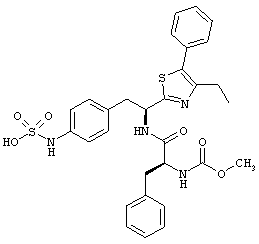
4-{(S)-2-(4-Этил-5-фенилтиазол-2-ил)-2-[(3)-2-(метокси-карбониламино)-3-фенил-пропанамидо]этил}фенилсульфаминовая кислота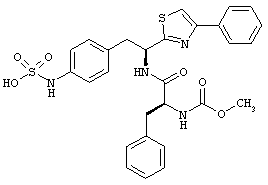
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-(4-фенилтиазол-2-ил)этил}фенилсульфаминовая кислота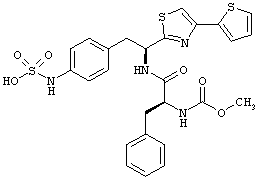
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-[4-(тиофен-2-ил)тиазол-2-ил]этил} фенилсульфаминовая кислота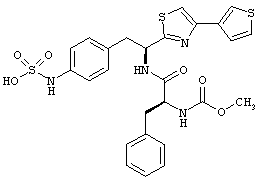
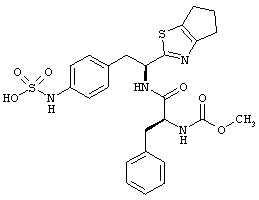
4-{(S)-2-(5,6-Дигидро-4Н-циклопента[сЦтиазол-2-ил)-2-[(3)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил} фенилсульфаминовая кислота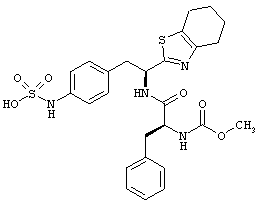
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-(4,5,6,7-тетрагидробензо[d]тиазол-2-ил)этил} фенилсульфаминовая кислота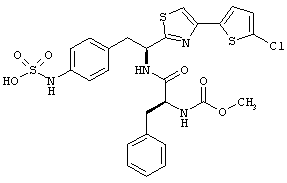
4-{(S)-2-[4-(5-Хлортиофен-2-ил)тиазол-2-ил]-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота
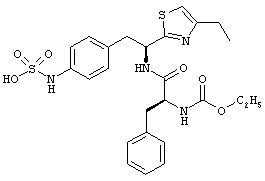
4-{(S)-2-[(S)-2-(Этоксикарбониламино)-3-фенилпропанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота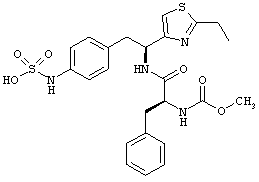
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-(2-этилтиазол-4-ил)этил}фенилсульфаминовая кислота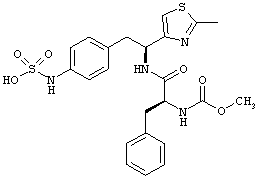
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-(2-метилтиазол-4-ил)этил}фенилсульфаминовая кислота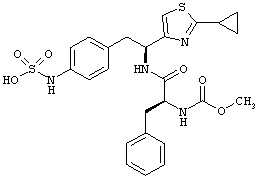
4-{(S)-2-(2-Циклопропилтиазол-4-ил)-2-[(S)-2-(метокси-
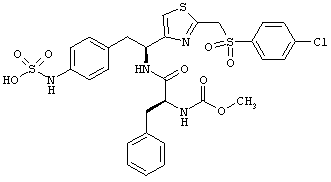
4-{(S)-2-{2-[(4-Хлорфенилсульфонил)метил]тиазол-4-ил}-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота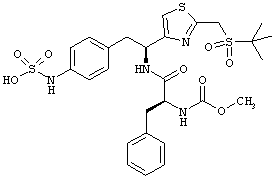
4-{(S)-2-[2-(трет-Бутилсульфонилметил)тиазол-4-ил]-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил} фенилсульфаминовая кислота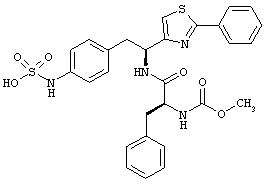
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропионамидо]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота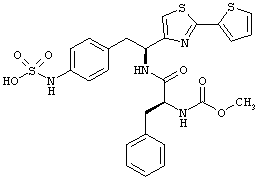
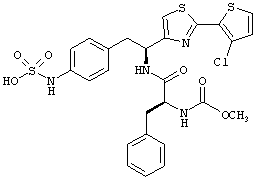
4-{(S)-2-[2-(3-Хлортиофен-2-ил)тиазол-4-ил]-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота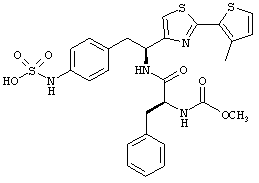
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-[2-(3-метилтиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота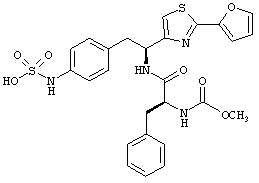
4-[(S)-2-(2-(Фуран-2-ил)тиазол-4-ил]-2-[(S)-2-(метокси-карбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота
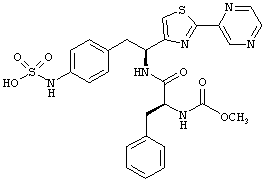
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-[2-(пиразин-2-ил)тиазол-4-ил]этил} фенилсульфаминовая кислота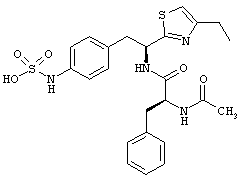
4-[(S)-2-((S)-2-Ацетамидо-3-фенилпропанамидо)-2-(4-этилтиазол-2-ил)этил]фенилсульфаминовая кислота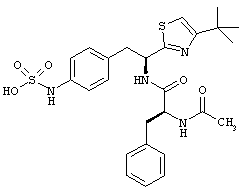
4-[(S)-2-((S)-2-Ацетамидо-3-фенилпропанамидо)-2-(4-трет-бутилтиазол-2-ил)этил]фенилсульфаминовая кислота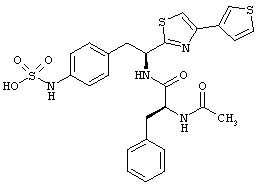
4-{(S)-2-((S)-2-Ацетамидо-3-фенилпропанамидо)-2-[4-(тиофен-3-ил)тиазол-2-ил]этил}фенилсульфаминовая
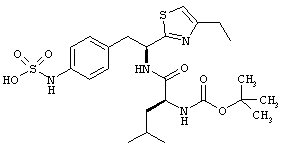
4-{(S)-2-[(S)-2-(трет-Бутоксикарбониламино)-3-метилбутанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота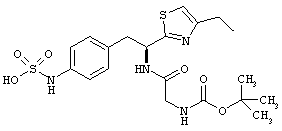
(S)-4-{2-[2-(трет-Бутоксикарбониламино)ацетамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота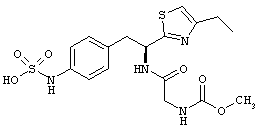
(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(метоксикарбониламино)ацетамидо]этил}-фенилсульфаминовая кислота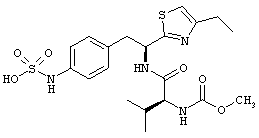
4-{(S)-2-(4-Этилтиазол-2-ил)-2-[(S)-2-(метоксикарбониламино)-3-метилбутанамидо]-этил}фенилсульфаминовая кислота
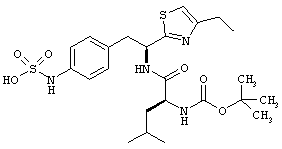
4-{(S)-2-[(S)-2-(трет-Бутоксикарбониламино)-4-метилпентанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота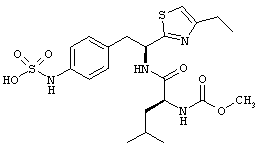
4-{(S)-2-(4-Этилтиазол-2-ил)-2-[(S)-2-(метоксикарбониламино)-4-метилпентанамидо]этил}фенилсульфаминовая кислота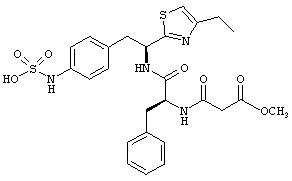
4-((S)-2-(4-Этилтиазол-2-ил)-2-{(S)-2-[2-(метоксикарбониламино)-ацетамидо]-3-фенилпропанамидо} этил)фенилсульфаминовая кислота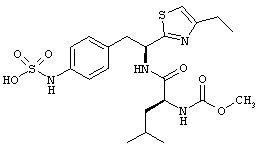
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-4-метилпентанамидо]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота
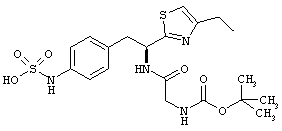
(S)-4-{2-[2-(трет-Бутоксикарбониламино)ацетамидо]-2-(4-этилтиазол-2-ил)этил}-фенилсульфаминовая кислота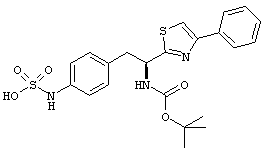
трет-Бутиловый эфир [1-(S)-(фенилтиазол-2-ил)-2-(4-сульфоаминофенил)этил]-карбаминовой кислоты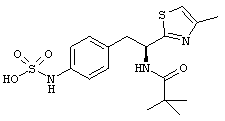
(S)-4-(2-(4-Метилтиазол-2-ил)-2-пиваламидоэтил)-фенилсульфаминовая кислота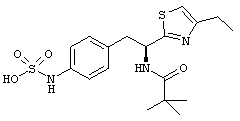
(S)-4-(2-(4-Этилтиазол-2-ил)-2-пиваламидоэтил)-фенилсульфаминовая кислота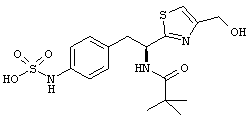
(S)-4-{2-[4-(гидроксиметил)тиазол-2-ил]-2-пиваламидоэтил}фенилсульфаминовая кислота
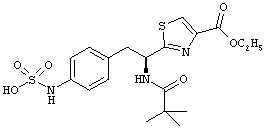
(S)-4-{[2-(4-Этоксикарбонил)тиазол-2-ил]-2-пиваламидоэтил}фенилсульфаминовая кислота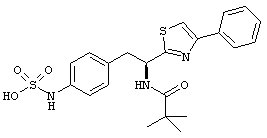
(S)-4-(2-(4-Фенилтиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота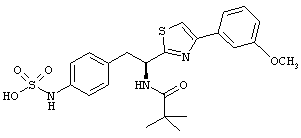
4-((S)-2-(4-(3-Метоксифенил)тиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота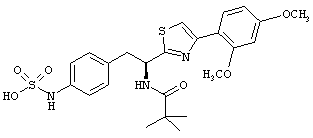
4-((S)-2-(4-(2,4-Диметоксифенил)тиазол-2-ил)-2-пиваламидоэтил)фенил-сульфаминовая кислота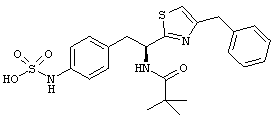
(S)-4-(2-(4-Бензилтиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота
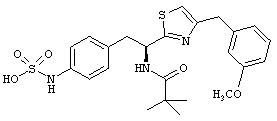
(S)-4-(2-(4-(3-Метоксибензил)тиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота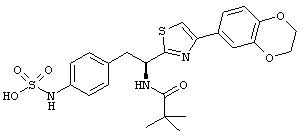
4-((S)-2-(4-(2,3-Дигидробензо[b][1,4]диоксин-6-ил)тиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота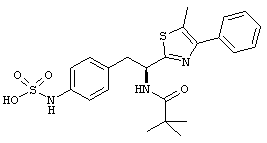
(S)-4-(2-(5-Метил-4-фенилтиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота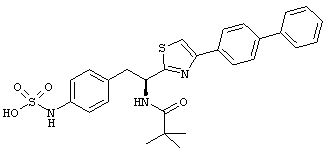
(S)-4-(2-(4-(Бифен-4-ил)тиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота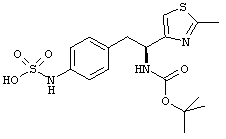
(S)-4-(2-трет-Бутоксикарбониламино)-2-(2-метилтиазол-4-ил)этил)фенилсульфаминовая кислота
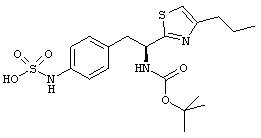
(S)-4-(2-(трет-Бутоксикарбониламино)-2-(4-пропилтиазол-2-ил)этил)фенилсульфаминовая кислота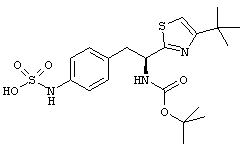
(S)-4-(2-(трет-Бутоксикарбониламино)-2-(4-трет-бутилтиазол-2-ил)этил)фенилсульфаминовая кислота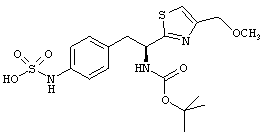
(S)-4-(2-(трет-Бутоксикарбониламино)-2-(4-(метоксиметил)тиазол-2-ил)этил)-фенил сульфаминовая кислота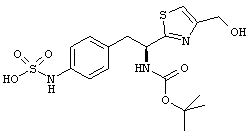
(S)-4-(2-(трет-Бутоксикарбониламино)-2-(4-(гидроксиметил)тиазол-2-ил)этил)фенилсульфаминовая кислота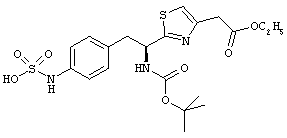
(S)-4-(2-трет-Бутоксикарбониламино)-2-(4-(2-этокси-2-
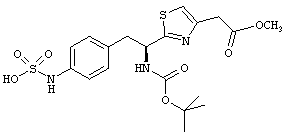
(S)-4-(2-(трет-Бутоксикарбонил)-2-(4-(2-(2-метокси-2-оксоэтиламино)-2-оксоэтил)тиазол-2-ил)этил)фенилсульфаминовая кислота
(S)-4-(2-(трет-Бутоксикарбониламино)-2-(2-пиваламидотиазол-4-ил)этил)фенилсульфаминовая кислота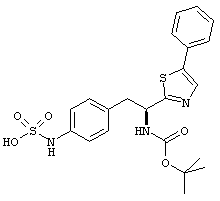
(S)-4-(2-(трет-Бутоксикарбониламино)-2-(5-фенилтиазол-2-ил)этил)-фенилсульфаминовая кислота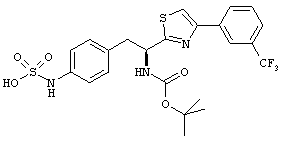
4-((S)-2-(трет-Бутоксикарбониламино)-2-(4-(3-(трифторметил)фенил)тиазол-2-ил)этил)-фенилсульфаминовая кислота
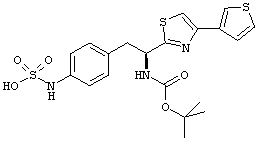
4-((S)-2-(трет-Бутоксикарбониламино)-2-(4-(тиофен-3-ил)тиазол-2-ил)этил)фенилсульфаминовая кислота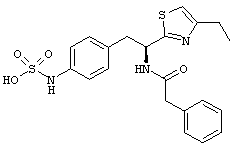
(S)-{4-[2-(4-Этилтиазол-2-ил)-2-(фенилацетиламидо)этил]-фенил}сульфаминовая кислота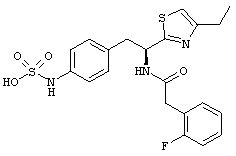
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(2-(2-фторфенил)ацетамидо)-этил)фенилсульфаминовая кислота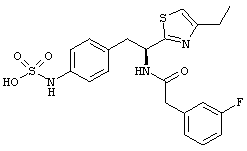
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(2-(3-фторфенил)ацетамидо)этил)фенил-сульфаминовая кислота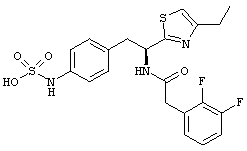
(S)-4-(2-(2-(2,3-Дифторфенил)ацетамидо)-2-(4-этилтиазол-2-
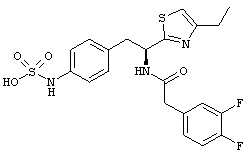
(S)-4-(2-(2-(3,4-Дифторфенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота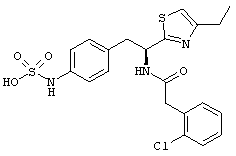
(S)-4-(2-(2-(2-Хлорфенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота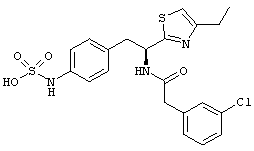
(S)-4-(2-(2-(3-Хлорфенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота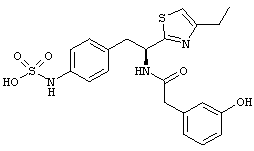
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(2-(3-гидроксифенил)ацетамидо)этил)фенилсульфаминовая кислота
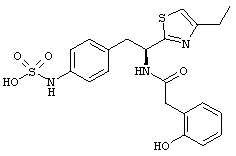
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(2-(2-метоксифенил)ацетамидо)этил)фенилсульфаминовая кислота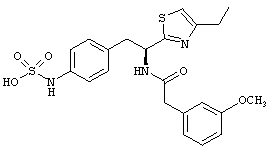
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(2-(3-метоксифенил)ацетамидо)этил)фенилсульфаминовая кислота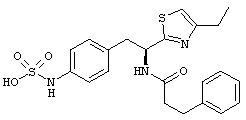
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(3-фенилпропанамидо)этил)фенилсульфаминовая кислота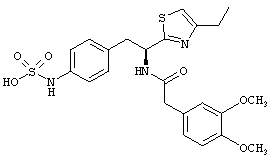
(S)-4-(2-(2-(3,4-Диметоксифенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота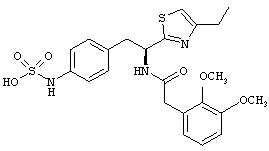
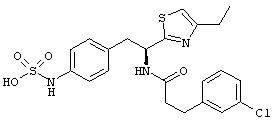
(S)-4-(2-(3-(3-Хлорфенил)пропанамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота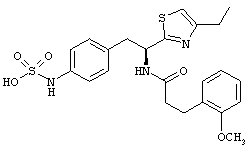
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(3-(2-метоксифенил)пропанамидо)этил)фенилсульфаминовая кислота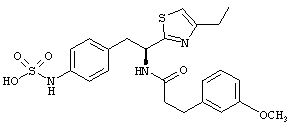
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(3-(3-метоксифенил)пропанамидо)этил)фенилсульфаминовая кислота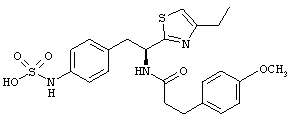
(S)-4-(2-(4-Этилтиазол-2-ил)-2-(3-(4-метоксифенил)-пропанамидо)этил)фенилсульфаминовая кислота
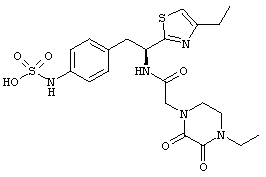
(S)-4-{2-[2-(4-Этил-2,3-диоксопиперазин-1-ил)ацетамид]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота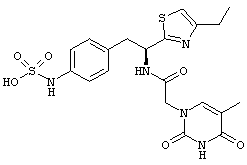
(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(5-метил-2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)ацетамид]этил} фенилсульфаминовая кислота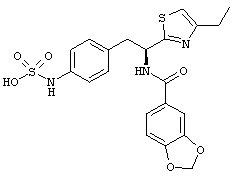
(S)-4-[2-(Бензо[d][1,3]диоксол-5-карбоксамидо)-2-(4-этилтиазол-2-ил)этил]фенилсульфаминовая кислота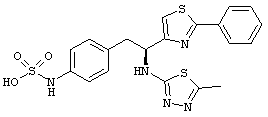
(S)-4-(2-(5-метил-1,3,4-тиадиазол-2-иламино)-2-(2-фенилтиазол-4-ил)этил)фенилсульфаминовая кислота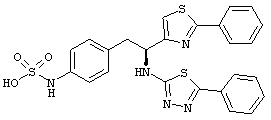
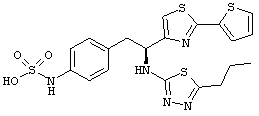
4-((S)-2-(5-Пропил-1,3,4-тиадиазол-2-иламино)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота
4-((S)-2-(5-Бензил-1,3,4-тиадиазол-2-иламино)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота
4-((S)-2-(5-((Метоксикарбонил)метил)-1,3,4-тиадиазол-2-иламино)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота
4-((S)-2-(5-((2-Метилтиазол-4-ил)метил)-1,3,4-тиадиазол-2-иламино)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота
СПОСОБЫ
Раскрыты способы лечения заболеваний или состояний глаз, особенно ретинопатий, глазного отека и глазной неоваскуляризации. Неограничивающие примеры таких заболеваний или состояний включают диабетический макулярный отек, возрастную макулодистрофию (влажная форма), хориоидальную неоваскуляризацию, диабетическую ретинопатию, глазную ишемию, увеит, окклюзию вены сетчатки (центральной или периферической), глазные травмы, отек, вызванный операцией, неоваскуляризацию, вызванную операцией, кистозный макулярный отек, глазную ишемию, увеит, и т.п. Такие заболевания или состояния характеризуются изменениями в глазной сосудистой системе, прогрессирующими или непрогрессирующими, возникшими в результате острого заболевания или состояния или хронического заболевания или состояния.
Один из аспектов раскрытых способов относится к заболеваниям, которые прямо или косвенно являются результатом диабета, в частности, диабетического макулярного отека и диабетической ретинопатий. Глазная сосудистая система при диабете становится неустойчивой с течением времени и приводит к состояниям, таким как непролиферативная ретинопатия, макулярный отек и пролиферативная ретинопатия. Когда жидкость просачивается в центр макулы, часть глаза, где происходит четкое, прямолинейное зрение, накапливает жидкость и связанный белок начинает осаждаться на или под макулу. Это приводит к набуханию, являющемуся причиной постепенного искажения центрального зрения субъекта. Это состояние называют «макулярным отеком». Другое состояние, которое может произойти, представляет собой непролиферативную ретинопатию, когда могут быть обнаружены сосудистые изменения, такие как микроаневризмы, вне макулярной области глаза.
Данные состояния могут или не могут прогрессировать до диабетической пролиферативной ретинопатий, которая характеризуется неоваскуляризацией. Эти новые кровеносные сосуды являются хрупкими и чувствительными к кровотечению. Результатом являются рубцы на сетчатке, а также окклюзия или полная блокировка светового маршрута через глаз из-за чрезмерного образования новых кровеносных сосудов. Обычно субъекты, имеющие диабетический макулярный отек, страдают от непролиферативной стадии диабетической ретинопатий, однако, для субъектов является редкостью только начало проявления макулярного отека в начале пролиферативной стадии.
Диабетическая ретинопатия является наиболее распространенной причиной потери зрения американцев в трудоспособном возрасте (Klein R et al., «The Wisconsin Epidemiologic Study of Diabetic Retinopathy. II. Prevalence and risk of diabetic retinopathy when age at diagnosis is less than 30 years,» Arch. Ophthalmol. 1984, 102:520-526). Тяжелая потеря зрения происходит за счет тяговой отслойки сетчатки, которая усложняет неоваскуляризацию сетчатки (NV), но наиболее распространенной причиной умеренной потери зрения является диабетический макулярный отек (DME). Патогенез диабетического макулярного отека не совсем понятен, но гипоксия является фактором, который этому способствует (Nguyen QD et al., «Supplemental inspired oxygen improves diabetic macular edema; a pilot study,» Invest. Ophthalmol. Vis. SCl. 2003, 45:617-624). Фактор роста эндотелия сосудов (VEGF) является гипоксия-регулируемым геном и VEGF уровни увеличиваются в гипоксической или ишемической сетчатке. Инъекция VEGF в мышиные глаза способствует расщеплению внутреннего барьера кровь-сетчатка (см., Derevjanik NL et al. Quantitative assessment of the integrity of the blood-retinal barrier in mice, Invest. Ophthalmol. Vis. SCl. 2002, 43:2462-2467) и продолжительное высвобождение VEGF в глазах обезьян вызывает макулярный отек (Ozaki H et al., «Intravitreal sustained release of VEGF causes retinal neovascularization in rabbits and breakdown of the blood-retinal barrier in rabbits and primates», Exp Eye Res 1997, 64:505-517). Такое сочетание наблюдений у пациентов и животных моделей привели к предположению, что VEGF играет важную роль в патогенезе диабетического макулярного отека. Эта гипотеза подтверждается рядом клинических испытаний, которые показали, что VEGF антагонисты уменьшают фовеальное утолщение и улучшают зрение у пациентов с диабетическим макулярным отеком (Nguyen QD et al., «Vascular endothelial growth factor is a critical stimulus for diabetic macular edema,» A m. J. Ophthalmol. 2006, 142:961-969; и Nguyen QD et al. «Primary End Point (Six Months) Results of the Ranibizumab for Edema of the mAcula in Diabetes (READ-2) Study,» Ophthalmology 2009, 116:2175-2181).
Эффекты VEGF в эндотелиальных клетках сосудов модулируются Tie-2 рецепторами, которые избирательно экспрессируются на эндотелиальных клетках сосудов и необходимы для эмбрионального сосудистого развития (Dumont DJ et al., «Dominant-negative and targeted null mutations in the endothelial receptor tyrosine kinase, tek, reveal a critical role in vasculogenesis of the embryo,» Genes Dev. 1994, 8:1897-1909). Ангиопоэтин 1 (Angi) связывается с Tie-2 с высоким сродством и инициирует фосфорилирование и передачу сигналов вниз (Davis S et al., «Isolation ofangiopoietin-1, a ligand for the TIE2 receptor, by secretion-trap expression cloning,» Cell 1996, 87:1161-1169). Мыши с дефицитом Ang1 умирают приблизительно Е12.5 с сосудистыми дефектами похожими, но менее серьезными, чем те, которые имеются у бездефицитных мышей. Ангиопоэтин 2 (Ang2) связывается с Tie-2 с высоким сродством, но не стимулирует фосфорилирование в культивируемых эндотелиальных клетках. Он выступает в качестве конкурентного ингибитора Ang1 и трансгенные мыши, чрезмерно экспрессирующие Ang2, имеют фенотип, похожий на Ang1-дефицитных мышей. Некоторые данные показывают, что Ang2 является развивающе- и гипоксия-регулируемым разрешительным фактором VEGF-индуцированной неоваскуляризации сетчатки (Hackett SF et al., «Angiopoietin 2 expression in the retina: upregulation during physiologic and pathologic neovascularization,» J Cell Physiol. 2000, 184:275-284). Двойные трансгенные Tet/opsin/ang2 и Tet/opsin/ang1 мыши с индуцируемой экспрессией Ang2 или Ang1, соответственно, также помогли выяснить роль Tie2 в сетчатке (Nambu H et al., «Angiopoietin I inhibits ocular neovascularization and breakdown of the blood-retinal barrier,» Gene Ther. 2004, 11:865-873). У мышей с ишемической ретинопатией, повышенная экспрессия Ang2, когда VEGF является высоким (PI2-17), увеличивает неоваскуляризацию сетчатки, но повышенная экспрессия при Р20, когда уровни VEGF понижены, ускоряет регресс неоваскуляризации сетчатки, и аналогичные результаты были получены и в других моделях глазной неоваскуляризации. В противоположность этому, повышенная экспрессия неоваскуляризации Ang1 подавляла неоваскуляризацию и снижала сосудистую утечку в нескольких моделях. Таким образом, Ang2 уменьшает стабилизирующие сигналы из матрицы, что делает эндотелиальные клетки зависимыми от VEGF и других растворимых стимуляторов, когда VEGF является высоким, неоваскуляризация стимулируется и, когда VEGF является низким, происходит регресс неоваскуляризации. В противоположность этому, Ang1 увеличивает стабилизирующие сигналы из матрицы и делает сосудистую систему нечувствительной к растворимым стимуляторам, таким как VEGF.
Ангиопоэтин 2 связывает Tie-2, но не стимулирует фосфорилирование и, следовательно, действует как антагонист в большинстве случаев. В глазу, ангиопоэтин 2 повышающе регулируется в местах неоваскуляризации и действует как разрешающий фактор для VEGF. Повышенная экспрессия VEGF в сетчатке не стимулирует прорастание новых сосудов из поверхностного или промежуточного капиллярного ложа сетчатки или хориокапилляров, но она стимулирует прорастание из глубокого капиллярного ложа, где существует конститутивная экспрессия ангиопоэтина 2 (Hackett SF et al., «Angiopoietin-2 plays an important role in retinal angiogenesis,» J Cell Physiol 2002. 192-182-187). Ко-экспрессия VEGF и ангиопоэтина 2 на поверхности сетчатки вызывает прорастание новых сосудов из поверхностных капилляров сетчатки (Oshima Y et al., «Angiopoietin-2 enhances retinal vessel sensitivity to vascular endothelial growth factor,» J Cell Physiol 2004, 199:412-417). У двойных трансгенных мышей с индуцируемой экспрессией ангиопоэтина 2 в сетчатке, экспрессия ангиопоэтина 2, когда уровни VEGF были высокими, заметно повышала неоваскуляризацию, и экспрессия ангиопоэтина 2, когда уровни VEGF была низкими, вызывала регресс неоваскуляризации. У двойных трансгенных мышей с индуцируемой экспрессией ангиопоэтина 1 индуцированная экспрессия ангиопоэтина 1 в сетчатке сильно подавляла VEGF-индуцированную сосудистую утечку или неоваскуляризацию (Nambu H et al., «Angiopoietin 1 inhibits ocular neovascularization and breakdown of the blood-retinal barrier,» Gene Ther. 2004, 11:865-873). На самом деле, у мышей с высокой экспрессией VEGF в сетчатке, у которых развиваются тяжелые NV и отслоение сетчатки, ангиопоэтин 1 способен предотвратить VEGF-индуцированное отслоение.
Регулирование Tie2 также происходит через эндотелиально-специфичные фосфатазы, сосудистую эндотелиальную протеинтирозинфосфатазу (VE-PTP) у мышей (Fachinger G et al., «Functional interaction of vascular endothelial-protein-tyrosine phosphatase with the angiopoietin receptor Tie-2,» Oncogene 1999, 18:5948-5943) и его человеческую ортологическую человеческую протеинтирозинфосфатазу-β (HPTP-β) (Krueger NX et al., «Structural diversity and evolution of human receptor-like protein tyrosine phosphatases,» EMBO J. 1990, 9:3241-3252). Мыши, дефицитные по VE-PTP, умирают при Е10 с тяжелыми нарушениями сосудистого ремоделирования и созреванием развивающейся сосудистой сетки. Сайленсинг НРТР-β в культивированных человеческих эндотелиальных клетках усиливает Angl-индуцированное фосфорилирование Tie-2 и активность, способствующую выживанию, в тоже время при гипоксии усиливает экспрессию HPTP-β и уменьшает Angl-индуцированное фосфорилирование Tie-2 (Yacyshyn OK et al., «Thyrosine phosphatase beta regulates angiopoietin-Tie2 signaling in human endothelial cells,» Angiogenesis 2009, 12:25-33).
Диабетическая ретинопатия, если ее не лечить, может привести в конечном итоге к слепоте. Действительно, диабетическая ретинопатия является основной причиной слепоты у населения трудоспособного возраста.
Таким образом, раскрытые способы относятся к профилактике, лечению, контролю, ослаблению и/или иным образом минимизированию глазной неоваскуляризации у субъекта, имеющего диабет, или у субъекта, у которого диагностировали диабет.Дополнительно, субъекты, имеющие или субъекты, у которых диагностировали диабет, могут быть предупреждены или могут быть поставлены в известность о риске развития связанной с диабетом слепоты, поэтому настоящие способы могут быть использованы для профилактики или замедления наступления непролиферативной ретинопатии у пациентов, которые известны как группа риска. Аналогично, способы настоящего изобретения могут быть использованы для лечения субъектов, имеющих или у которых диагностировали непролиферативную диабетическую ретинопатию, чтобы предотвратить прогрессирование состояния.
Описанные способы относятся к профилактике или контролю глазной неоваскуляризации или лечению заболевания или состояния, связанного с наступлением глазной неоваскуляризации, путем введения субъекту одного или более описанных соединений.
Один аспект этого способа относится к лечению или профилактике глазной неоваскуляризации путем введения субъекту эффективного количества одного или более описанных соединений или их фармацевтически приемлемых солей. Одно осуществление этого аспекта относится к способу лечения глазного отека и неоваскуляризации, включающему стадию, на которой вводят субъекту композицию, содержащую:
a) эффективное количество одного или более описанных соединений или их фармацевтически приемлемых солей; и
b) один или более носителей или совместимых эксципиентов. Раскрытые способы также относятся к профилактике или контролю глазного отека или лечению заболевания или состояния, которое связано с наступлением глазного отека, путем введения субъекту одного или более описанных соединений.
Один аспект этого способа относится к лечению или профилактике глазного отека путем введения субъекту эффективного количества одного или более описанных соединений или их фармацевтически приемлемых солей. Одно осуществление этого аспекта относится к способу лечения глазного отека, включающему стадию, на которой вводят субъекту композицию, содержащую:
a) эффективное количество одного или более описанных соединений или их фармацевтически приемлемых солей; и
b) один или более носителей или совместимых эксципиентов. Другой раскрытый способ относится к профилактике или контролю отека сетчатки или неоваскуляризации сетчатки или лечению заболевания или состояния, которое связано с наступлением отека сетчатки или неоваскуляризации сетчатки, путем введения субъекту одного или более описанных соединений. Один аспект этого способа относится к лечению или профилактике отека сетчатки или неоваскуляризации сетчатки путем введения субъекту эффективного количества одного или более описанных соединений или их фармацевтически приемлемых солей. Одно осуществление этого аспекта относится к способу лечения отека сетчатки или неоваскуляризации сетчатки, включающему стадию, на которой вводят субъекту композицию, содержащую:
a) эффективное количество одного или более описанных соединений или их фармацевтически приемлемых солей; и
b) один или более носителей или совместимых эксципиентов. Дальнейший раскрытый способ относится к лечению, профилактике или контролю диабетической ретинопатии или лечению заболевания или состояния, которое связано с наступлением диабетической ретинопатии, путем введения субъекту одного или более описанных соединений.
Один аспект этого способа относится к лечению или профилактике диабетической ретинопатии путем введения субъекту эффективного количества одного или более описанных соединений или их фармацевтически приемлемых солей. Одно осуществление этого аспекта относится к способу лечения диабетической ретинопатии, включающему стадию, на которой вводят субъекту композицию, содержащую:
a) эффективное количество одного или более описанных соединений или их фармацевтически приемлемых солей; и
b) один или более носителей или совместимых эксципиентов.
Другое осуществление этого аспекта относится к способу лечения или профилактики непролиферативной ретинопатии, включающему стадию, на которой вводят субъекту композицию, содержащую:
a) эффективное количество одного или более описанных соединений или их фармацевтически приемлемых солей; и
b) один или более носителей или совместимых эксципиентов.
Другое осуществление этого аспекта относится к способу лечения или профилактики непролиферативной ретинопатии, включающему стадию, на которой вводят субъекту композицию, содержащую:
a) эффективное количество одного или более описанных соединений или их фармацевтически приемлемых солей; и
b) один или более носителей или совместимых эксципиентов.
Еще дополнительный способ относится к профилактике или контролю диабетического макулярного отека или лечению заболевания или состояния, которое связано с наступлением диабетического макулярного отека, путем введения субъекту одного или более описанных соединений.
Один аспект этого способа относится к лечению или профилактике диабетического макулярного отека путем введения субъекту эффективного количества одного или более описанных соединений или их фармацевтически приемлемых солей. Одно осуществление этого аспекта относится к способу лечения диабетического макулярного отека, включающему стадию, на которой вводят субъекту композицию, содержащую:
a) эффективное количество одного или более описанных соединений или их фармацевтически приемлемых солей; и
b) один или более носителей или совместимых эксципиентов.
Любое из раскрытых заболеваний или состояний, описанных в данной заявке, можно лечить или предотвращать путем введения субъекту от приблизительно 0,01 мг/кг до приблизительно 500 мг/кг описанных соединений или их фармацевтически приемлемых солей. Одна итерация этого осуществления относится к способу лечения глазного отека и/или неоваскуляризации, включающему стадию, на которой вводят субъекту от приблизительно 0,01 мг/кг до приблизительно 50 мг/кг описанных соединений или их фармацевтически приемлемых солей. Другая итерация этого осуществления относится к введению субъекту от приблизительно 0,1 мг/кг до приблизительно 10 мг/кг по массе субъекта, которого лечат, одного или более описанных соединений или их фармацевтически приемлемых солей. Дополнительная итерация этого осуществления относится к способу лечения или профилактики заболеваний или состояний, связанных с глазным отеком и/или неоваскуляризацией, включающему стадию, на которой вводят субъекту от приблизительно 1 мг/кг до приблизительно 10 мг/кг по массе субъекта одного или более описанных соединений или их фармацевтически приемлемых солей. Еще дополнительная итерация этого осуществления относится к способу лечения или профилактики заболеваний или состояний, связанных с глазным отеком и/или неоваскуляризацией, включающему стадию, на которой вводят субъекту от приблизительно 5 мг/кг до приблизительно 10 мг/кг по массе субъекта одного или более описанных соединений или их фармацевтически приемлемых солей. Дополнительная итерация этого осуществления относится к способу лечения или профилактики заболеваний или состояний, связанных с глазным отеком и/или неоваскуляризацией, включающему стадию, на которой вводят субъекту от приблизительно 1 мг/кг до приблизительно 5 мг/кг по массе субъекта одного или более описанных соединений или их фармацевтически приемлемых солей. Еще дополнительная итерация этого осуществления относится к способу лечения или профилактики заболеваний или состояний, связанных с глазным отеком и/или неоваскуляризацией, включающему стадию, на которой вводят субъекту от приблизительно 3 мг/кг до приблизительно 7 мг/кг по массе субъекта одного или более описанных соединений или их фармацевтически приемлемых солей.
Кроме того, раскрыты способы лечения или профилактики одного или более заболеваний или состояний, описанных в данной заявке выше, связанных с глазным отеком и/или неоваскуляризацией, которые являются результатом введения другого фармацевтически активного агента. Как таковой, этот аспект относится к способу, включающему стадию, на которой вводят субъекту композицию, содержащую:
a) эффективное количество одного или более описанных соединений или их фармацевтически приемлемых солей; и
b) один или более фармацевтически активных агентов;
c) один или более носителей или совместимых эксципиентов.
Способы в соответствии с настоящим изобретением могут быть объединены со стандартом лечения, включая, но не ограничиваясь, лазерную терапию.
В данной заявке описаны препараты, содержащие описанные соединения, в виде глазных капель, форма доставки лекарственного средства, которая является фармацевтически приемлемой для пациентов, удобной, безопасной, с началом действия через несколько минут. Стандартные глазные капли, используемые в терапии в соответствии с федеральной нормативной практикой, являются стерильными, изотоническими (т.е. рН приблизительно 7,4 для комфорта пациента), и, если будут использованы более одного раза, содержат консервант, но имеют ограниченный срок хранения после открытия, как правило, один месяц. Если глазные капли упакованы в стерильный, одноразового использования однодозовой дозатор, то консервант может быть не включен.
Один из способов составления капель для глаз включает наиболее чистую форму раскрытого соединения (например, более чем 99% чистоты), и смешивание соединения с очищенной водой и корректирование для физиологического рН и изотоничности. Примеры буферных агентов для поддержания или корректировки рН включают, но не ограничиваются приведенным, ацетатные буферы, цитратные буферы, фосфатные буферы и боратные буферы. Примерами регуляторов тоничности являются хлорид натрия, маннит и глицерин. Также могут быть добавлены другие фармацевтически приемлемые ингредиенты.
Из составленного раствора затем отбирают аликвоты в любое множество дискретных, стерильных одноразовых картриджей, каждый из которых предназначен для стандартной дозы или в один картридж для стандартной дозы. Такой один одноразовый картридж может быть, например, коническим или цилиндрическим дозатором конкретного объема, с контейнером, имеющим боковые стенки, сжимаемые в радиальном направлении к продольной оси для того, чтобы распределить содержимое контейнера оттуда на один конец контейнера. Такие одноразовые контейнеры используют в настоящее время для дозирования глазных капель при от 0,3 до 0,4 мл (например, Lens Plus™ и Refresh Plus™) на стандартную дозировку, и идеально адаптированы для доставки глазных капель.
Офтальмологические растворы глазных капель также упакованы в форму с несколькими дозами, например, как пластиковая бутылка с пипеткой (например, Visine™ Original). В таких композициях необходимы консерванты для предотвращения микробного загрязнения после открытия контейнера. Подходящие консерванты включают, но не ограничиваются приведенным: бензалкония хлорид, тимеросал, хлорбутанол, метилпарабен, пропилпарабен, фенилэтиловый спирт, динатриевую соль этилендиаминтетрауксусной кислоты, сорбиновую кислоту, поликватерний-1 или другие агенты, известные специалистам в данной области техники, и все из которых рассматриваются для использования в настоящем изобретении. Такие консерванты обычно используют в количестве от 0,001 до приблизительно 1,0% мас./объем.
Глазные капли обеспечивают импульсный ввод препарата, но лекарство быстро разбавляется слезами и вымывается из глаза. Полимеры могут быть добавлены в глазные растворы для того, чтобы увеличить вязкость носителя, это увеличивает контакт с роговицей, часто повышая биодоступность. Типы полимеров, разрешенных Федеральной администрацией пищевых продуктов и медикаментов для глазных растворов, определяются концентрациями производных целлюлозы (метилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и карбоксиметилцеллюлоза), декстран 70, желатин, полиолы, глицерин, полиэтиленгликоль 300, полиэтиленгликоль 400, полисорбат 80, пропиленгликоль, поливиниловый спирт и повидон, все из которых (в отдельности или в комбинации) рассматриваются для использования в настоящем изобретении.
В определенных клинических условиях, растворы глазных капель могут быть приготовлены с другими фармацевтическими агентами, для того, чтобы ослабить раздражающее воздействие другого ингредиента и способствовать клинической реакции. Такие агенты могут включать, но, не ограничиваясь приведенным, сосудосуживающие средства, такие как фенилэфрин, оксиметазолин, нафтазолин или тетрагидрозолин; стабилизатор тучных клеток, такой как олопатадин; антигистамин, такой как азеластин; антибиотик, такой как тетрациклин; стероидный противовоспалительный препарат, такой как бетаметазон, нестероидный противовоспалительный препарат, такой как диклофенак, иммуномодулятор, такой как имиквимод или интерфероны; и противовирусные агенты, такие как валацикловир, цидофовир и трифлуридин. Дозы, используемые для описанных выше целей, будут меняться, но будут в количестве, эффективном для подавления дискомфорта, зуда, раздражения или боли в глазу. Когда композиции дозируют местно, «фармацевтически эффективное количество» соединения обычно может быть в диапазоне концентраций от 0,05 мг/мл до приблизительно 500 мг/мл, от 1 до 4 капель, введенных в виде стандартной дозы от 1 до 4 раз в день. Наиболее распространенный способ глазной доставки лекарств представляет собой закапывания капель в нижнее веко (т.е. «глазные капли»). Приблизительно 70% рецептов для глазных лекарств предназначены для глазных капель. Это связано с такими факторами, как расходы, простота объемов производства и соблюдение пациентом режима и схемы лечения, а также эффективной и равномерной доставкой лекарств. Основное требование заключается в том, чтобы композиция была стерильной и была произведена в стерильных условиях. Идеальное раскрытое соединение для использования в глазных растворах должно быть растворимым и/или смешиваемым в водной среде при нормальном глазном рН и тоничности. Дополнительно, описанные соединения должны быть стабильными, нетоксичными, иметь длительное действие, и быть достаточно мощными, чтобы противодействовать разбавлению концентрации лекарственного средства путем мигания и выделения слез.
Также раскрыты способы лечения неоваскуляризации сетчатки. Установленную неоваскуляризации сетчатки можно лечить местно нанесением композиции, содержащей:
a) от приблизительно 0,05 мг/мл до приблизительно 500 мг/мл одного или более описанных соединений; и
b) фармацевтически приемлемый носитель.
В одном осуществлении этого способа, композиция содержит:
a) от приблизительно 0,5 мг/мл до приблизительно 50 мг/мл одного или более описанных соединений; и
b) фармацевтически приемлемый носитель.
В другом осуществлении этого способа, композиция содержит:
a) от приблизительно 0,05 мг/мл до приблизительно 5 мг/мл одного или более описанных соединений; и
b) фармацевтически приемлемый носитель.
В дополнительном осуществлении этого способа, композиция содержит:
a) от приблизительно 1 мг/мл до приблизительно 10 мг/мл одного или более описанных соединений; и
b) фармацевтически приемлемый носитель.
В еще дополнительном осуществлении этого способа, композиция содержит:
a) от приблизительно 5 мг/мл до приблизительно 50 мг/мл одного или более описанных соединений; и
b) фармацевтически приемлемый носитель.
Кроме фармацевтически приемлемого носителя, эти осуществления могут содержать один или более фармацевтически приемлемых вспомогательных ингредиентов. Еще дополнительно, композиции могут содержать:
В одном осуществлении этого способа, композиция содержит:
a) от приблизительно 0,5 мг/мл до приблизительно 50 мг/мл одного или более описанных соединений;
b) эффективное количество одного или более фармацевтически активных ингредиентов; и
c) фармацевтически приемлемый носитель.
Неограничивающие примеры фармацевтически активных агентов, пригодных для комбинации с описанными соединениями, включают антибактериальные средства, т.е. аминогликозиды, противовирусные агенты, противомикробные агенты, и т.п.; антихолинергические/антиспазматические агенты; противодиабетические средства; антигипертензивные агенты; противоопухолевые средства; сердечно-сосудистые средства; агенты центральной нервной системы; модификаторы коагуляции; гормоны; иммунологические агенты; иммунодепрессанты; офтальмологические препараты, и т.п.
Раскрытые способы включают введение описанных соединений в комбинации с фармацевтически приемлемым носителем. Под «фармацевтически приемлемым» подразумевают материал, который не является биологически или иным образом нежелательными, т.е. материал может быть введен субъекту, не вызывая никаких нежелательных биологических эффектов или не взаимодействуя вредным образом с любым из других компонентов фармацевтической композиции, в которой он содержится. Носитель, естественно, будет выбран, чтобы минимизировать любой распад активного ингредиента, и чтобы свести к минимуму нежелательные побочные эффекты у субъекта, как будет хорошо известно специалисту в данной области техники. В другом аспекте, многие из описанных соединений можно использовать профилактически, то есть в качестве профилактического агента, либо в чистом виде, либо вместе с фармацевтически приемлемым носителем. Ионные жидкие композиции, описанные в данной заявке, могут быть удобно введены в фармацевтические композиции, состоящие из чистой ионной жидкости или в комбинации с фармацевтически приемлемым носителем. См., например. Remington's Pharmaceutical Sclences, latest edition, by E.W. Martin Mack Pub. Co., Easton, PA, в котором описаны типичные носители и стандартные способы получения фармацевтических композиций, которые могут быть использованы в комбинации с получением композиций из соединений, описанных в данной заявке, и который включен в данную заявку посредством ссылки. Такие фармацевтические носители, наиболее типично, будут стандартными носителями для введения композиций человеку и не-человеку, включая растворы, такие как стерильная вода, физиологический раствор и буферные растворы при физиологическом рН. Другие соединения могут быть введены в соответствии со стандартными процедурами, используемыми специалистами в данной области техники. Например, фармацевтические композиции также могут включать один или более дополнительных активных ингредиентов, таких как антимикробные агенты, противовоспалительные агенты, анестетики и т.п. Примеры фармацевтически приемлемых носителей включают, но не ограничиваются приведенным, физиологический раствор, раствор Рингера и раствор декстрозы. рН раствора предпочтительно составляет от приблизительно 5 до приблизительно 8, и более предпочтительно от приблизительно 7 до приблизительно 7,5. Дополнительные носители включают препараты замедленного высвобождения, такие как полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие описанные соединения, при этом матрицы находятся в виде формованных изделий, например, пленок, липосом, микрочастиц или микрокапсул. Специалистам в данной области техники должно быть очевидно, что определенные носители могут быть более предпочтительными в зависимости, например, от маршрута введения и концентрации композиции, которую вводят. Другие соединения могут быть введены в соответствии со стандартными процедурами, используемыми специалистами в данной области техники.
Описанный способ также относится к введению описанных соединений и композиций. Введение может быть системным, путем подкожного или внутривенного введения; или HPTP-β ингибитор будут вводить непосредственно в глаз, например, местно. Местные способы введения включают, например, глазные капли, субконъюнктивальные инъекции или имплантанты, инъекции в стекловидное тело или интравитреальные имплантанты, субтеноновые инъекции или имплантаты, включение в хирургические промывочные растворы и т.д.
Описанные способы относятся к введению описанных соединений в составе фармацевтической композиции. Композиции, пригодные для местного введения, известны из уровня техники (см., например, заявку на патент США 2005/0059639, которая включена в данную заявку посредством ссылки в полном объеме). В различных осуществлениях изобретения композиции в соответствии с настоящим изобретением могут содержать жидкость, содержащую активное вещество в растворе, в суспензии, или оба. Как используют в данной заявке, жидкие композиции включают гели. В одном осуществлении, жидкая композиция является водной. Альтернативно, композиция может принимать форму мази. В другом осуществлении, композиция представляет собой in situ гелеобразующую водную композицию. В итерации, композиция представляет собой in situ гелеобразующий водный раствор. Такая композиция может содержать гелеобразующий агент в концентрации, эффективной для стимулирования гелеобразования при контакте с глазом или слезной жидкостью во внешней части глаза. Водные композиции согласно изобретению имеют офтальмологически совместимое значение рН и осмотическое давление. Композиция может содержать офтальмологическую депо-композицию, содержащую активный агент для субконъюнктивального введения. Микрочастицы, содержащие активный агент, могут быть встроены в биосовместимый фармацевтически приемлемый полимер или липид-инкапсулирующий агент. Депо-композиции могут быть адаптированы для высвобождения всего, или практически всего, активного вещества в течение длительного периода времени. Полимер или липидный матрикс, если они присутствуют, могут быть адаптированы к распаду, достаточному для транспортировки от места введения после высвобождения всего, или практически всего, активного агента. Депо-композиция может быть жидкой композицией, содержащей фармацевтически приемлемый полимер и растворенный или диспергированный активный агент. После инъекции полимер образует депо в месте инъекции, например, путем гелеобразования или осаждения. Композиция может содержать твердое изделие, которое может быть вставлено в подходящем месте в глаз, например, между глазом и веком, или в конъюнктивный мешок, где изделие высвобождает активное вещество. Твердые изделия, пригодные для имплантации в глаз таким образом, обычно содержат полимеры и могут быть биоразлагаемыми или не биоразлагаемыми.
В одном осуществлении описанных способов, субъекта-человека с по крайней мере одним визуально пораженным глазом обрабатывают 2-4000 мкг раскрытого соединения с помощью инъекции в стекловидное тело. Улучшение клинических симптомов контролируют одним или несколькими способами, известными в данной области техники, например, непрямой офтальмоскопией, фотографированием глазного дна, флуоресцеиновой ангиопатией, электроретинографией, внешним осмотром глаз, биомикроскопией щелевой лампой, аппланационной тонометрией, пахиметрией, оптической когерентной томографией и ауторефракцией. Последующие дозы можно вводить еженедельно или ежемесячно, например, с частотой 2-8 недель или 1-12 месяцев.
Раскрытые способы включают введение описанных соединений в комбинации с фармацевтически приемлемым носителем. Под «фармацевтически приемлемым» подразумевают материал, который не является биологически или иным образом нежелательными, т.е. материал может быть введен субъекту, не вызывая никаких нежелательных биологических эффектов или не взаимодействуя вредным образом с любым из других компонентов фармацевтической композиции, в которой он содержится. Носитель, естественно, будет выбран, чтобы минимизировать любой распад активного ингредиента, и чтобы свести к минимуму нежелательные побочные эффекты у субъекта, как будет хорошо известно специалисту в данной области техники. В другом аспекте, многие из описанных соединений можно использовать профилактически, то есть в качестве профилактического агента, либо в чистом виде, либо вместе с фармацевтически приемлемым носителем. Ионные жидкие композиции, описанные в данной заявке, могут быть удобно введены в фармацевтические композиции, состоящие из чистой ионной жидкости или в комбинации с фармацевтически приемлемым носителем. См., например. Remington's Pharmaceutical Sclences, latest edition, by E.W. Martin Mack Pub. Co., Easton, PA, в котором описаны типичные носители и стандартные способы получения фармацевтических композиций, которые могут быть использованы в комбинации с получением композиций из соединений, описанных в данной заявке, и который включен в данную заявку посредством ссылки. Такие фармацевтические носители, наиболее типично, будут стандартными носителями для введения композиций человеку и не-человеку, включая растворы, такие как стерильная вода, физиологический раствор и буферные растворы при физиологическом рН. Другие соединения могут быть введены в соответствии со стандартными процедурами, используемыми специалистами в данной области техники. Например, фармацевтические композиции также могут включать один или более дополнительных активных ингредиентов, таких как антимикробные агенты, противовоспалительные агенты, анестетики и т.п. Примеры фармацевтически приемлемых носителей включают, но не ограничиваются приведенным, физиологический раствор, раствор Рингера и раствор декстрозы. рН раствора предпочтительно составляет от приблизительно 5 до приблизительно 8, и более предпочтительно от приблизительно 7 до приблизительно 7,5. Дополнительные носители включают препараты замедленного высвобождения, такие как полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие описанные соединения, при этом матрицы находятся в виде формованных изделий, например, пленок, липосом, микрочастиц или микрокапсул. Специалистам в данной области техники должно быть очевидно, что определенные носители могут быть более предпочтительными в зависимости, например, от маршрута введения и концентрации композиции, которую вводят. Другие соединения могут быть введены в соответствии со стандартными процедурами, используемыми специалистами в данной области техники.
Фармацевтические композиции могут содержать дополнительные носители, а также загустители, разбавители, буферные вещества, консерванты, поверхностно-активные вещества и т.п., помимо описанных в данной заявке соединений. Фармацевтические композиции также могут содержать один или более дополнительных активных ингредиентов, таких как антимикробные агенты, противовоспалительные агенты, анестетики и т.п.
Для целей настоящего раскрытия термин «эксципиент» и «носитель» используют взаимозаменяемо по всему описанию настоящего раскрытия и указанные термины определены в данной заявке как «ингредиенты, которые используют в практике составления безопасной и эффективной фармацевтической композиции».
Составители композиций поймут, что эксципиенты используют в основном для обслуживания в обеспечении безопасного, стабильного и функционального фармацевтического препарата, служащего не только как часть общей основы для доставки, а также в качестве средства для достижения эффективного поглощения получателем активного ингредиента. Эксципиент может выполнять простую и прямую роль в качестве инертного наполнителя, или эксципиент, используемый в данной заявке, может быть частью стабилизирующей рН системы или покрытия, чтобы обеспечить доставку ингредиентов в желудок безопасно. Составитель композиций также может воспользоваться тем преимуществом, что соединения в соответствии с настоящим изобретением имеют улучшенную клеточную эффективность, фармакокинетические свойства, а также улучшенную пероральную биодоступность.
Термин «эффективное количество», используемый в данной заявке, означает «количество одного или более описанных соединений, эффективное в дозах и в течение периодов времени, необходимых для достижения желаемого или терапевтического результата». Эффективное количество может варьироваться в зависимости от факторов, известных в данной области техники, таких как болезненное состояние, возраст, пол и масса тела человека, животного, которых лечат, или способа введения. Хотя конкретные режимы дозировки могут быть описаны в примерах, специалисту в данной области техники должно быть понятно, что режим дозирования может быть изменен, чтобы обеспечить оптимальную терапевтическую реакцию. Например, несколько раздельных доз можно вводить ежедневно, или доза может быть пропорционально уменьшена в зависимости от нужд терапевтической ситуации. Дополнительно, композиции в соответствии с настоящим раскрытием могут быть введены так часто, как необходимо для достижения терапевтического количества.
Описанные соединения могут также присутствовать в жидкостях, эмульсиях или суспензиях для доставки активных терапевтических агентов в форме аэрозоля в полости тела, например, нос, горло или бронхи. Соотношение раскрытого соединения и других рецептурных агентов в этих препаратах будет изменяться в соответствии с требованиями лекарственной формы.
В зависимости от предполагаемого способа введения, фармацевтические композиции, вводимые в рамках описанных способов, могут быть в виде твердых, полутвердых или жидких лекарственных форм, таких как, например, таблетки, суппозитории, пилюли, капсулы, порошки, жидкости, суспензии, лосьоны, кремы, гели и т.п., предпочтительно в стандартной лекарственной форме, пригодной дл однократного введения точных доз. Композиции будут содержать, как отмечено выше, эффективное количество одного или более описанных соединений в комбинации с фармацевтически приемлемым носителем и, дополнительно, могут содержать другие медицинские агенты, фармацевтические агенты, носители, адъюванты, разбавители и т.д.
Для твердых композиций, обычные нетоксичные твердые носители включают, например, маннит, лактозу, крахмал, стеарат магния, сахарин натрия, тальк, целлюлозу, глюкозу, сахарозу, карбонат магния и т.п. с фармацевтическрой степенью чистоты.
Жидкие фармацевтически вводимые композиции могут, например, быть приготовлены путем растворения, диспергирования и т.д. активного соединения, как описано в данной заявке, и необязательных фармацевтических адъювантов и эксципиента, таких как, например, вода, физиологический раствор, водный раствор декстрозы, глицерин, этанол и т.п., с образованием раствора или суспензии. При желании фармацевтическая композиция для введения также может содержать небольшие количества нетоксичных вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, рН-буферные агенты и т.п., например, ацетат натрия, монолаурат сорбитана, триэтаноламин ацетат натрия, триэтаноламин олеат и т.д. Практические способы получения таких дозируемых форм известны или будут очевидны специалистам в данной области техники, см., например, Remington's Pharmaceutical Sciences, упомянутый выше.
НАБОРЫ
Описаны также наборы, содержащие соединения и композиции, которые должны быть доставлены в организм человека, млекопитающего или клетку. Наборы могут содержать одну или более упакованных стандартных доз композиции, содержащей одно или более соединений, которые должны быть доставлены в организм человека, млекопитающего или клетку. Стандартные лекарственные ампулы или многодозовые контейнеры, в которых соединения, которые должны быть доставлены, упакованы перед применением, могут содержать герметично закрытый контейнер, включающий количество полинуклеотида или раствора, содержащего вещество, подходящее для фармацевтически эффективной дозы или множества эффективных доз. Соединение может быть упаковано в виде стерильного препарата и герметичный контейнер разработан так, чтобы сохранить стерильность препарата до использования.
ПРОЦЕДУРЫ
Измерение и разбивка на подгруппы отека сетчатки и неоваскуляризации и эффективное ингибирование глазного отека и образования новых кровеносных сосудов с помощью раскрытых HPTP-β ингибиторов
Следующие исследования проводили для оценки влияния описанных соединений на сосудистую утечку и неоваскуляризацию ткани сетчатки.
Исследование 1
Двадцать (20) 21 дневных Родопсин/VEGF трансгенных мышей, имеющих конститутивную экспрессию VEGF в нейронах сетчатки, как описано Tobe Т et al., в «Evolution of neovascularization in mice with over expression of vascular endothelial growth factor in photoreceptors» Invest Ophthalmol Visual Sci. 1998; 39:180-188 мг/кг, были разделены на две равные группы. Каждая группа получала подкожные инъекции следующим образом: Группа 1 получала 10 мг/кг/инъекцию (высокая доза) соединения из Таблицы XXI, и Группа 2 получала инъекции основы. Две инъекции были выполнены каждому животному в День 1, и одна инъекция была произведена каждому животному в День 2.
Через два часа после третьей и последней дозы в День 2, животные были подвергнуты эвтаназии, мышей умерщвляли, сетчатку удаляли и было сделано иммуногистохимическое окрашивание на альбумин. Вкратце, глаза собирали и фиксировали в 10% PBS-буферном формалине в течение 2 часов при комнатной температуре. Сетчатки рассекали и помещали в PBS в пробирку Эппендорфа и блокировали 8% нормальной сывороткой осла с 0,05% тритона в течение 1 часа. Козье антитело против анти-мышиного альбуминового антитела (Abeam) добавляли при разведении 1:150 и окрашивали при комнатной температуре в течение 2 часов. После 3 промываний PBST, добавляли анти-козье антитело осла, конъюгированное с DyLight 593 (от Jackson ImmunoResearch), и окрашивали при комнатной температуре в течение 50 минут, избегая света. После 3 промываний PBST, сетчатки были смонтированы и визуализированы с помощью флуоресцентной микроскопии. Области альбуминового окрашивания оценивали с помощью программного обеспечения анализа изображений (ImagePro Plus 5).
Исследование 2
Двадцать (20) 21 дневных Родопсин/VEGF трансгенных мышей, имеющих конститутивную экспрессию VEGF в нейронах сетчатки, были разделены на две равные группы. Каждая группа получала подкожные инъекции следующим образом: Группа 1 получала 3 мг/кг инъекцию (низкая доза) соединения из Таблицы XXI, и Группа 2 получала инъекции основы. Две инъекции были произведены каждому животному в День 1, а одна инъекция была произведена каждому животному в День 2.
Через два часа после последней дозы в День 2 животных умерщвляли и глазные пробы готовили, как описано в Исследовании 1 выше. Фигура 1В представляет собой гистограмму, показывающую относительные концентрации альбумина, найденного на поверхности сетчатки у контрольных животных по сравнению с животными, которых лечили 3 мг/кг/доза. При сравнении Фигуры 1А и Фигуры 1В мг/кг, эти данные показывают, что у животных, которых лечили более низкой дозой 3 мг/кг/инъекция, была меньшая неоваскуляризация, чем у животных, которым вводили 3 мг/кг/доза.
Фигура 2А и Фигура 2В являются репрезентативными микрофотографиями иммуногистохимически окрашенных сетчаток, полученных от умерщвленных животных, описанных в данной заявке выше. Фигура 2В представляет собой микрофотографию сетчатки, трансгенной мыши, которую лечили основой. Стрелки указывают очаговые, периваскулярные отложения альбумина (показатель сосудистой утечки). Как видно на этих микрофотографиях, контрольные животные показали значительное отложение альбумина в сетчатке, в то время как сетчатки трансгенных мышей, которых лечили 3 мг/кг/доза, показали заметное снижение периваскулярных отложений альбумина. (Фигура 2 В).
Исследование 3
Тридцать (30) Родопсин/VEGF трансгенных мышей, имеющих конститутивную экспрессию VEGF в нейронах сетчатки, были разделены на три равные группы. На 14-й день после рождения каждая группа получала подкожные инъекции следующим образом: Группа 1 получала 10 мг/кг/инъекцию (высокая доза) соединения из Таблицы XXI; Группа 2 получала 3 мг/кг/инъекцию (низкая доза) соединения из Таблицы XXI, и Группа 3 получала инъекции основы. Каждое животное получало две инъекции в день в течение 7 дней.
На Р21 мышей умерщвляли, глаза собирали и фиксировали в 10% PBS-буферном формалине в течение 2 часов при комнатной температуре. Сетчатки расссекали и помещали в PBS в пробирку Эппендорфа и окрашивали GSA-лектином, конъюгированным с FITC, в течение 2 часов при комнатной температуре. После 3 промываний PBST, сетчатки были смонтированы и визуализированы с помощью флуоресцентной микроскопии. Области неоваскуляризации сетчаток оценивали с помощью программного обеспечения анализа изображений (ImagePro Plus 5).
Фигура 3А (стрелки) показывает значительный уровень прорастания новых кровеносных сосудов (неоваскулярные пучки) в сетчатке получавших основу животных, а Фигура 3В показывает заметное снижение неоваскулярных пучков в сетчатке животных, которых лечили соединением D91.
Фигура 4 сравнивает относительные количества новых сосудов, найденных в этом исследовании, между животными, которых лечили 10 мг/кг/инъекция, 3 мг/кг/инъекция и основой. В соответствии с данными, показанными на Фигурах 1А и 1В, животные, которым вводили 3 мг/кг/инъекция, имели значительно сниженные уровни неоваскуляризации сетчатки, чем животные, которым вводили 10 мг/кг/инъекция и основу.
VE-PTP (HPTP-β) активируется в эндотелиальных клетках сетчатки, участвующих в неоваскуляризации
C57BL/6 мышей лечили в соответствии с Association for Research in Vision and Ophthalmology Guidelines on the care and use of animals in research. Мышей помещали в 75% кислорода в день после рождения (Р) 7 и возвращали в комнатный воздух на Р12, чтобы создать ретинопатию недоношенных (ROP). В день после рождения (Р) 17 мыши с индуцированной кислородом ишемической ретинопатией имели области ишемической сетчатки и у них развивались новые сосуды на поверхности сетчатки. Мышей умерщвляли и глаза фиксировали в 4% параформальдегиде при комнатной температуре в течение 4 часов и сетчатки рассекали. После блокирования 10% нормальной козьей сывороткой в течение 1 часа, сетчатки инкубировали с 1:200 кроличьим анти-VE-PTP (мышиная ортология НРТРβ) антителом в течение 3 часов. После промывания сетчатки инкубировали с 1:800 козьим анти-кроличьим антителом, конъюгированным с Су-3 (Jackson Immuno Laboratory), а затем докрашивали FITC-конъюгированным Griffonia Simplicifolia пектином (GSA). Получали плоские препараты сетчаток и изучали с помощью флуоресцентной микроскопии (Axioskop; Zeiss, Thomwood, NY).
На P17, сетчатки у мышей с ROP и неоваскуляризацией сетчатки (NV) рассекали и окрашивали иммунофлуоресцентно на VE-PTP/HPTP-β, а также окрашивали FITC-меченым Griffonia Simplicifolia (GSA) пектином. Как видно на Фигурах А и D, окрашивание GSA показывает сгустки новых сосудов на поверхности сетчатки с некоторым слабым окрашиванием сосудов сетчатки в фоновом режиме. Как показано на Фигурах В и С, происходило сильное окрашивание для HPTP-β в сгустках неоваскуляризации сетчатки на поверхности сетчатки и слабое окрашивание некоторых основных сосудов сетчатки, в первую очередь питающих сосудов, что приводит к неоваскуляризации.
Флуоресцентная микроскопия с зеленым каналом показала сгустки GSA-окрашенных новых сосудов на поверхности сетчатки с некоторым слабым окрашиванием сосудов сетчатки в фоновом режиме (Фигуры А и D). Сетчатка от контрольной мыши комнатного воздуха (RA) показала нормальные сосуды сетчатки, без неоваскуляризации (Фигура G). Происходило сильное окрашивание для HPTP-β в сгустках неоваскуляризации сетчатки на поверхности сетчатки и слабое окрашивание некоторых основных сосудов сетчатки, в первую очередь питающих сосудов, что приводит к неоваскуляризации (Фигуры В и С). Не было обнаружено окрашивание сосудов сетчатки в неишемической сетчатке РА контрольных мышей (Фигуры Н и I). Таким образом, VE-PTP/HPTP-β повышающе регулируется в эндотелиальных клетках, участвующих в неоваскуляризации.
Блокада VE-PTP (HPTP-β) с описанным НРТР-β ингибитором способствует фосфорилированию Tie-2 в эндотелиальных клетках сетчатки in vivo
Трансгенные мыши, у которых промотор родопсина управляет экспрессией Vegf в фоторецепторах (rho/VEGF мыши), были использованы в качестве модели субретинальной неоваскуляризации. На Р7, повышенные уровни VEGF обнаруживаются в фоторецепторах, на Р14 есть ростки неоваскуляризации, которые простираются от глубокого капиллярного ложа сетчатки в субретинальное пространство, а на Р21 существует несколько сгустков неоваскуляризации в субретинальном пространстве. Rho/VEGF мышам делали подкожную инъекцию основы или 10 мг/кг соединения из Таблицы XXI на Р21. Через двенадцать часов после инъекции мышей умерщвляли. Глаза фиксировали в 4% параформальдегиде при комнатной температуре в течение 4 часов и сетчатки рассекали. После блокирования с 10% нормальной козьей сывороткой в течение 1 часа, сетчатки инкубировали с 1:200 кроличьим анти-фосфо-TiE-2-антителом (R&D, Minneapolis, MN, USA) при комнатной температуре в течение 3 часов. После промывания сетчатки инкубировали с козьим антикроличьим антителом, конъюгированным с Су-3. Сетчатки иммуноокрашивали на фосфорилированный Tie-2 и контрастно окрашивали Griffonia Simplicifolia (GSA) пектином, который метит клетки сосудов. Сетчатки от контроля (обработанные основой rho/VEGF мыши) показали легкое фосфоТ1е окрашивание в неоваскуляризации (Фигуры 6А-6С). Сетчатки от rho/VEGF мышей, которых лечили соединением из Таблицы XXI, показали сильное фосфо-Tie2 окрашивание в неоваскуляризации и слабое окрашивание некоторых сосудов в сетчатке (Фигуры 6D-6F). Эти результаты показывают, что соединение из Таблицы XXI способствует фосфорилированию Tie-2 в эндотелиальных клетках сетчатки, особенно в тех, которые участвуют в неоваскуляризации.
Подавление вызванной ишемией неоваскуляризации сетчатки Мышам с индуцированной кислородом ишемической ретинопатией, модель, прогнозирующая эффекты в пролиферативной диабетической ретинопатии, давали внутриглазные инъекции 3 мкг соединения из Таблицы XXI в один глаз и основы в парный глаз. На Р17, была небольшая неоваскуляризация на поверхности сетчатки в глазах, обработанных соединением из Таблицы XXI (Фигура 7А), по сравнению с сетчаткой глаз, обработанных основой (Фигура 7В). Измерение средней площади неоваскуляризации сетчатки на поверхности сетчатки при помощи анализа изображения подтвердило, что внутриглазное нанесение соединений из Таблицы XXI вызвало значительное снижение неоваскуляризации сетчатки (Фигура 7С) (р=0,019 по непарному т-тесту).
Подавление субретинальной неоваскуляризации у rho/VEGF трансгенных мышей
Субретинальная неоваскуляризация, которая происходит у rho/VEGF мышей, аналогична тому, что было названо ретинальной ангиоматической пролиферацией (RAP), которая происходит у 30% пациентов с неоваскулярной AMD (см., Yannuzzi LA et al., «Retinal angiomatous proliferation in age-related macular degeneration,» Retina 2001, 21:416-434). Эффективность в этой модели предсказала хорошие результаты у пациентов с неоваскулярной возрастной макулярной дегенерацией. Гемизиготным rho/VEGF трансгенным мышам ежедневно давали подкожную инъекцию основы, содержащую 0, 3 или 10 мг/кг соединения из Таблицы XXI, начиная с дня после рождения (Р) 15. На Р21, мыши, которых лечили основой, показали множество сгустков субретинальной неоваскуляризации (Фигура 8А), в то время как мыши, которых лечили 3 мг/кг (Фигура 8В) или 10 мг/кг соединения из Таблицы XXI (Фигура 8С), имели меньшее количество зачатков неоваскуляризации. По сравнению с мышами, которых лечили основой, средняя площадь субретинальной неоваскуляризации была значительно меньше у мышей, которых лечили любой дозой соединения из Таблицы XXI (Фигура 8D). Внутриглазная инъекция соединения из Таблицы XXI также сильно подавляла субретинальную неоваскуляризацию у rho/VEGF мышей (Фигура 8, Рамки E-G).
Описанные соединения подавляют хориоидальную неоваскуляризацию
В мышиной модели хориоидальной неоваскуляризации, которая позволяет прогнозировать эффект соединений у пациентов с неоваскулярной AMD, подкожные инъекции 20 или 40 мг/кг соединения из Таблицы XXI значительно снижали хориоидальную неоваскуляризацию (Фигура 9, Рамки А-С). Внутриглазная инъекция 3 мкг (р=0,0009) или 5 мкг соединения из Таблицы XXI (р=0,022), но не 1 мкг, существенно подавляла хориоидальную неоваскуляризацию по сравнению с инъекцией основы (Фигура 9D). (См., Saishin Y et al., «VEGF-TRAPpiRs suppresses choroidal neovascularization and VEGF-induced breakdown of the blood-retinal barrier,» J. Cell. Physiol. 2003, 195:241-248 and Heier JS et al., «The 1-year results of CLEAR-IT 2, a phase 2 study of vascular endothelial growth factor trap-eye dosed as needed after 12-week fixed dosing,» Ophthalmology 2011, 118:1098-1106.).
Описанные соединения снижают VEGF-индуцированную утечку сосудов сетчатки
Продолжительная доставка VEGF в полость стекловидного тела приматов вызывает макулярный отек (Ozaki, 1997) и VEGF была утверждена в качестве критической мишени при диабетическом макулярном отеке (Nguyen, 2006 и Nguyen, 2009). У rho/VEGF трансгенных мышей, избыточное продуцирование VEGF в фоторецепторах вызывает утечку плазмы и белков сыворотки в сетчатку. В здоровой сетчатке, мало белка сыворотки, например, альбумина. Поэтому, иммуногистохимическое окрашивание на альбумин было использовано для оценки для разрушения барьера кровь-сетчатка. Происходило небольшое окрашивание на альбумин, как видно в сетчатках rho/VEGF мышей, которых лечили 10 мг/кг соединения из Таблицы XXI (Фигура 10, Рамки А-С), в то время как сетчатки мышей, которых лечили основой, показывали сильное окрашивание на альбумин окружающих новых судов и мягкое диффузное окрашивание в других местах (Фигура 10, Рамки D-F). Средняя площадь альбуминового окрашивания была значительно снижена у rho/VEGF мышей, которым вводили при помощи инъекции 3 мг/кг (n=10, р=0,03) или 10 мг/кг (n=10, p=0,04) соединения из Таблицы XXI, по сравнению с соответствующими контролями (n=8 для каждого. Фигура 10В).
Описанные соединения предотвращают отслойку сетчатки у Tet/opsin/VEGF двойных трансгенных мышей
Tet/opsin/VEGF двойные трансгенные мыши представляют собой чрезвычайно агрессивную модель глазной неоваскуляризации и сосудистой утечки. При обработке доксициклином они развивают тяжелую неоваскуляризацию и экссудативную отслойку сетчатки. При инъекции доксициклина, двойные трансгенные мыши с доксициклин-индуцируемой экспрессией VEGF экспрессируют 10-кратно увеличенные уровни VEGF, чем rho/VEGF трансгенные мыши, и развивают тяжелую неоваскуляризацию и экссудативные отслойки сетчатки в течение 3-5 дней.
Двойных гемизиготных Tet/opsin/VEGF мышей предварительно лечили в течение 3 дней дважды в день путем подкожных инъекций 3 (n=10), 10 (n=8) или 50 мг/кг (n=10) соединения из Таблицы XXI или основы (n=10), а затем лечение продолжали в течение 4 дней, в течение которых также вводили при помощи инъекции 50 мг/кг доксициклина. Через 4 дня мышей умерщвляли и глаза замораживали при температуре оптической резки (ОСТ) в заливочном растворе. Глазные сечения по десять микрон зрительного нерва окрашивали Hoechst (1:1000; Sigma, St. Louis, МО). Срезы исследовали с помощью оптического микроскопа, а общую длину сетчатки и длину сетчатки, которая была отделена, измеряли с помощью анализа изображений с исследователем, замаскированным в отношении группы лечения. Вычисляли процент сетчатки, которая была отслоена.
Практически полное отслоение сетчатки происходило у всех мышей, которых лечили основой (Фигура 11А, колонка 1 и Фигура 11В, колонка 1) и было небольшое отличие у мышей, которых лечили 3 мг/кг соединения из Таблицы XXI (Фигура 11С). Как показано на Фигуре 11А, колонка 2 и 3, и на Фигуре 11С у мышей, которых лечили 10 и 50 мг/кг, было значительное уменьшение в процентах отслойки сетчатки на секцию (р=0,04295, р<0,0001). Все мыши, получавшие 50 мг/кг соединения из Таблицы XXI, имели полностью прикрепленные сетчатки.
Описанные соединения вызывают регрессию VEGF индуцированной неоваскуляризации сетчатки.
Используя те же процедуры, как описано выше, глаза rho/VEGF мышей обрабатывали подкожно два раза в день в дозе 10 мг/кг соединения из Таблицы XXI или основой, начиная с Р21 и заканчивая на Р27. Фигура 12А изображает сетчатку контрольного животного, получавшего только основу, а Фигура 12В изображает сетчатки животных, которых лечили соединением из Таблицы XXI. Как видно на фотографиях и как суммировано на Фигуре 12С, у животных, которых лечили соединением из Таблицы XXI, отмечалось уменьшение площади неоваскуляризации сетчатки.
Описанные соединения предотвращают VEGF индуцированную неоваскуляризации сетчатки при местном введении.
Используя те же процедуры, как описано выше, глаза rho/VEGF мышей обрабатывали местно наносимой композицией, как описано в данной заявке, три раза в день таким образом, что 30 мг/мл соединения из Таблицы XXI поставляли, начиная с Р21 и заканчивая на Р27. Контрольных мышей обрабатывали местно только основой. Фигура 13А показывает сетчатку контрольного животного, получавшего только основу, а Фигура 13В показывает сетчатку животного, которого лечили соединением из Таблицы XXI. Как видно на фотографиях и как суммировано на Фигуре 13С, у животных, которых лечили соединением из Таблицы XXI, отмечалось уменьшение площади неоваскуляризации сетчатки.
Мышиная модель индуцированной кислородом ишемической ретинопатии
Ишемическая ретинопатия была вызвана у мышей C57BL/6 по методике, описанной Smith LEH et al., «Oxygen-induced retinopathy in the mouse,» Invest. Ophthalmol. Vis. Sci. 1994, 35:101-111, которая включена в данную заявку в качестве ссылки в полном объеме. В день после рождения (Р) 7 мышей и их матерей размещали в герметичном инкубаторе и подвергали воздействию атмосферы 75±3% кислорода в течение 5 дней. Кислород постоянно контролировали при помощи модели 110 PROOX кислородного контроллера (Reming Bioinstruments Co., Redfield, NY). Ha PI 2, мышей возвращали в комнатный воздух и под препаровальную лупу, использовали Harvard Pump Microinjection System и стеклянные пипетки на вылив, чтобы выполнить 1 мкл внутриглазную инъекцию 3 мкг соединения из Таблицы XXI в один глаз и основы в парный глаз. На Р17, площадь неоваскуляризации на поверхности сетчатки измеряли на Р17, как описано ранее Shen J et al., «In vivo immunostaining demonstrates macrophages associate with growing and regressing vessels,» Invest. Ophthalmol. Vis. Sci. 2007, 48:4335-4341, которая включена в данную заявку в качестве ссылки в полном объеме. Вкратце, мышам производили внутриглазную инъекцию 1 мкл, содержащую 0,5 мкг крысиного анти-мышиного РЕСАМ антитела (Pharmingen, San Jose, CA), и через 12 часов их умерщвляли и глаза фиксировали в 10% формалине в течение 4 часов. Сетчатки рассекали, инкубировали в течение 40 минут в 1:500 козьим антикрысиным IgG, конъюгированным с Alexa488 (Invitrogen, Carlsbad, CA), промывали и полностью монтировали. Наблюдатель, замаскированный по отношению к группе лечения, исследовал слайды с помощью флуоресцентного микроскопа Nikon и измерял площадь новых сосудов в сетчатке при помощи компьютерного анализа изображения с помощью программного обеспечения ImagePro Plus (Media Cybernetics, Silver Spring, MD).
Трансгенные мыши с повышенной экспрессией VEGF в фоторецепторах Трансгенные мыши, у которых промотор родопсина запускает экспрессию VEGF в фоторецепторах (rho/VEGF мыши), имеют начало VEGF экспрессии на Р7 и, начиная с Р10, развиваются ростки новых сосудов из глубокого капиллярного ложа сетчатки, которые растут через слой фоторецептора и образуют разветвленную сеть новых сосудов в субретинальном пространстве. Между Р15 и Р21, гемизиготным rho/VEGF мышам давали подкожную инъекцию 3 мг/кг или 10 мг/кг соединения из Таблицы XXI или основы дважды в день. В другом эксперименте на Р15 и Р17, мышам давали внутриглазную инъекцию 3 мкг соединения из Таблицы XXI в один глаз и основы в парный глаз. На Р21, мышей умерщвляли и глаза фиксировали в 4% параформальдегиде в течение 6 часов. Сетчатки рассекали и блокировали 3% бычьего сывороточного альбумина в PBS в течение одного часа. FITC конъюгированный GSA использовали для окрашивания сетчатки при комнатной температуре в течение 2 часов и затем получали плоские препараты сетчатки с фоторецептором стороной вверх и исследовали с помощью флуоресцентной микроскопии. Площадь субретинальной неоваскуляризации измеряли методом анализа изображений с исследователем, замаскированным в отношении группы лечения.
Модель лазер-индуцированной хориоидальной неоваскуляризации Хориоидальная неоваскуляризация была сгенерирована, как описано выше. Взрослые мыши C57BL/6 имели разрыв мембраны Бруха в 3 местах в каждом глазу, а затем делали подкожные инъекции 10 или 30 мг/кг соединения из Таблицы XXI или основы дважды в день в течение 14 дней. В другом эксперименте мышам делали внутриглазную инъекцию 1 мкл, содержащую 3 или 5 мкг соединения из Таблицы XXI, в один глаз и основы в парный глаз непосредственно после разрыва мембраны Бруха и через 7 дней. Через четырнадцать дней после лазера мышам делали перфузию меченым флуоресцеином декстраном (2*106 средняя молекулярная масса, Sigma, St. Louis, МО) и плоские препараты сосудистой оболочки были исследованы с помощью флуоресцентной микроскопии. Площадь неоваскуляризации сосудистой оболочки в каждом месте разрыва мембраны Бруха измеряли методом анализа изображений наблюдателем, замаскированным в отношении группы лечения. Площадь неоваскуляризации сосудистой оболочки при 3 местах разрыва в одном глазу была усреднена, чтобы дать одно экспериментальное значение.
Иммунофлуоресцентное окрашивание сывороточного альбумина для оценки сосудистой утечки
На Р20, rho/VEGF мышам давали подкожные инъекции 3 или 10 мг/кг соединения из Таблицы XXI или основы, которые повторяли через 12 часов. На Р21, производили третью инъекцию, а затем через 2 часа мышей умерщвляли, сетчатки рассекали и иммунофлуоресцентно окрашивали на альбумин, как описано ранее Lima e Silva R et al., «Agents that bind annexin A2 suppress ocular neovascularization,» J. Cell. Physiol. 2010, 225:855-864, которая включена в данную заявку в качестве ссылки в полном объеме. Сосуды метили путем контрастного окрашивания пектином GSA. Из сетчаток были выполнены плоские препараты, их исследовали с помощью флуоресцентной микроскопии, а площадь альбуминового окрашивания измеряли методом анализа изображений с исследователем, замаскированным в отношении группы лечения.
Другие преимущества, которые являются очевидными и которые присущи настоящему изобретению, будут очевидны специалистам в данной области техники. Следует иметь в виду, что некоторые признаки и подкомбинации являются полезными и могут быть использованы без ссылки на другие признаки и подкомбинации. Это предусмотрено и находится в пределах объема формулы настоящего изобретения. Поскольку многие возможные осуществления могут быть выполнены из изобретения, не выходя за его объем, следует понимать, что все объекты настоящего изобретения, которые указаны или показаны в прилагаемых чертежах, следует интерпретировать в иллюстративном, а не в ограничивающем смысле.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ ПРЕДУПРЕЖДЕНИЯ МЕТАСТАЗОВ РАКОВЫХ КЛЕТОК | 2010 |
|
RU2519123C2 |
| ИНГИБИТОРЫ ТИРОЗИНФОСФАТАЗЫ БЕЛКА ЧЕЛОВЕКА И СПОСОБЫ ПРИМЕНЕНИЯ | 2007 |
|
RU2435763C2 |
| СПОСОБЫ ЛЕЧЕНИЯ СИНДРОМА СОСУДИСТОЙ УТЕЧКИ | 2010 |
|
RU2539917C2 |
| ИНГИБИТОРЫ ПРОТЕИНТИРОЗИНФОСФАТАЗЫ ЧЕЛОВЕКА И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2007 |
|
RU2447065C2 |
| ИНГИБИТОРЫ БЕЛОК-ТИРОЗИН-ФОСФАТАЗЫ ЧЕЛОВЕКА И СПОСОБЫ ПРИМЕНЕНИЯ | 2007 |
|
RU2430101C2 |
| НОВЫЕ 1,2-БИС-СУЛЬФОНАМИДНЫЕ ПРОИЗВОДНЫЕ КАК МОДУЛЯТОРЫ ХЕМОКИНОВОГО РЕЦЕПТОРА | 2011 |
|
RU2654213C9 |
| ФТОРИРОВАННОЕ СОЕДИНЕНИЕ ЦИКЛОПРОПИЛАМИНА, СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЕЕ ИСПОЛЬЗОВАНИЕ | 2017 |
|
RU2746323C2 |
| ТИАЗОЛЬНОЕ ПРОИЗВОДНОЕ И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРА VAP-1 | 2009 |
|
RU2496776C9 |
| АРИЛКАРБОНИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2003 |
|
RU2340605C2 |
| АРИЛ- И ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ТЕТРАГИДРОИЗОХИНОЛИНЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ БЛОКИРОВАНИЯ ОБРАТНОГО ЗАХВАТА НОРЭПИНЕФРИНА, ДОПАМИНА И СЕРОТОНИНА | 2005 |
|
RU2388751C2 |
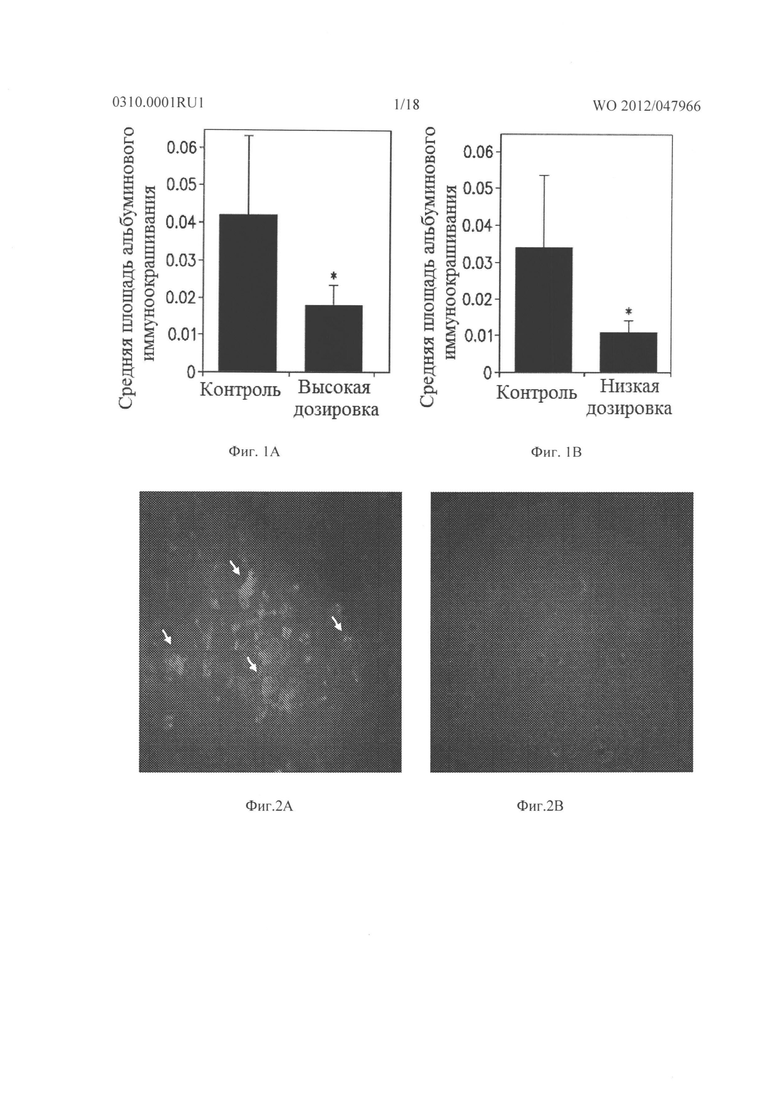
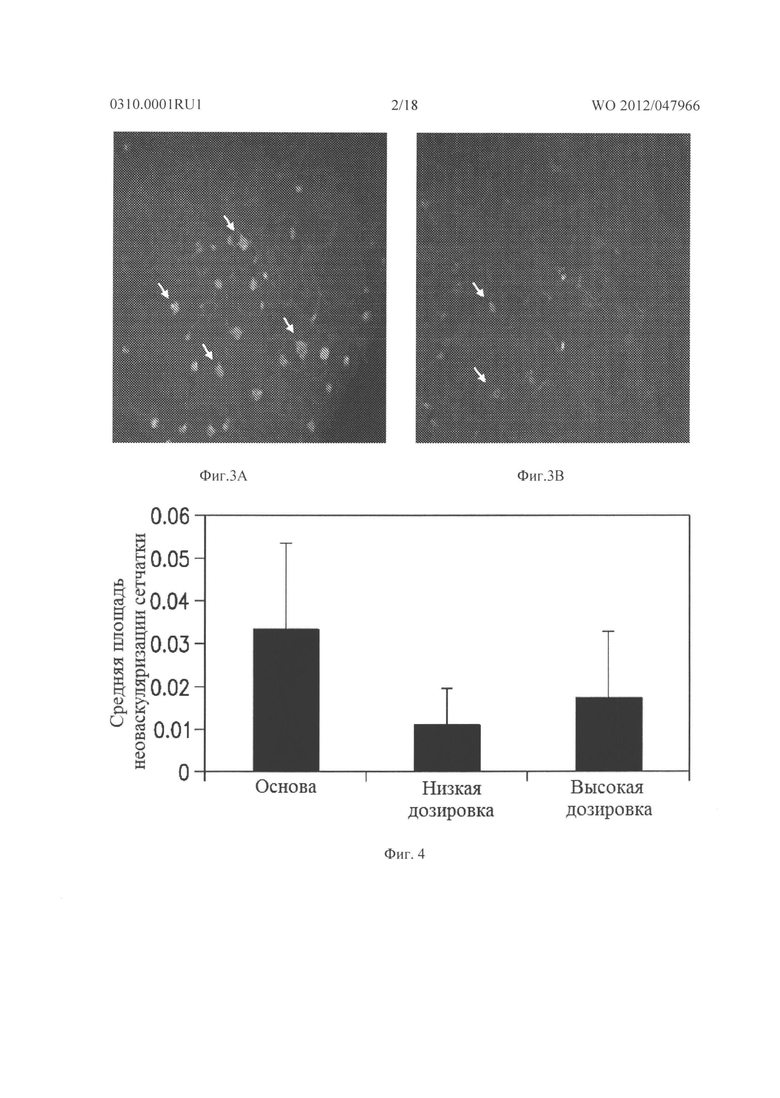
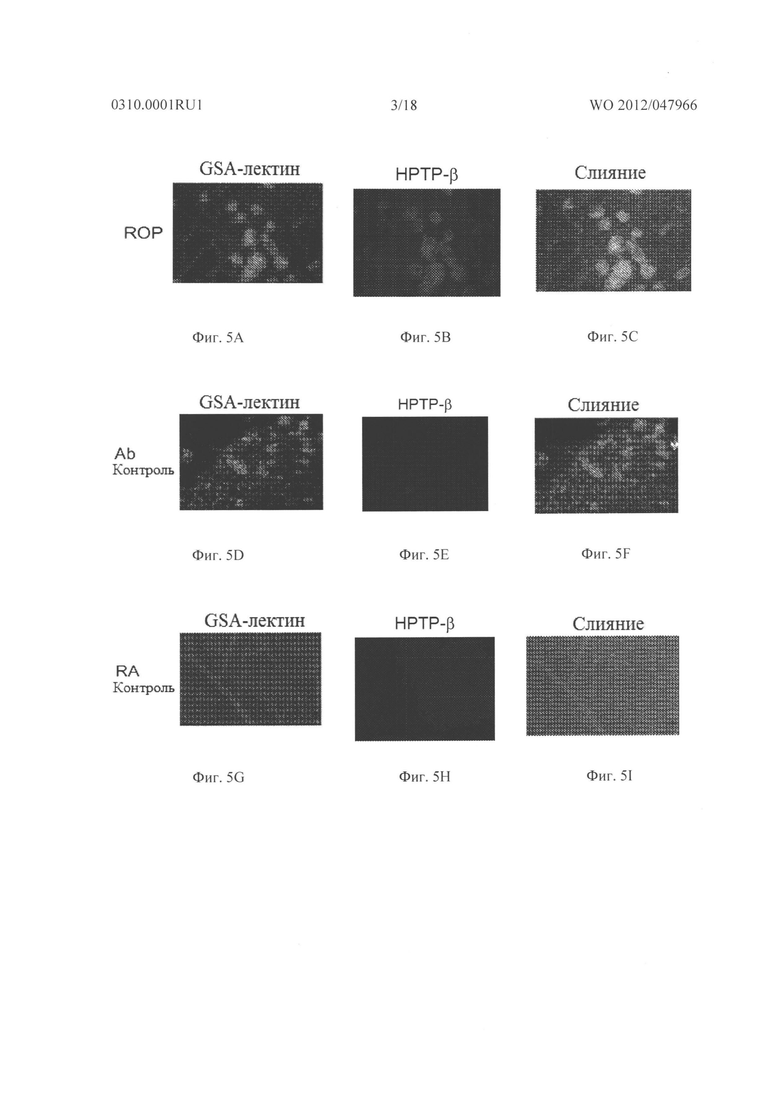

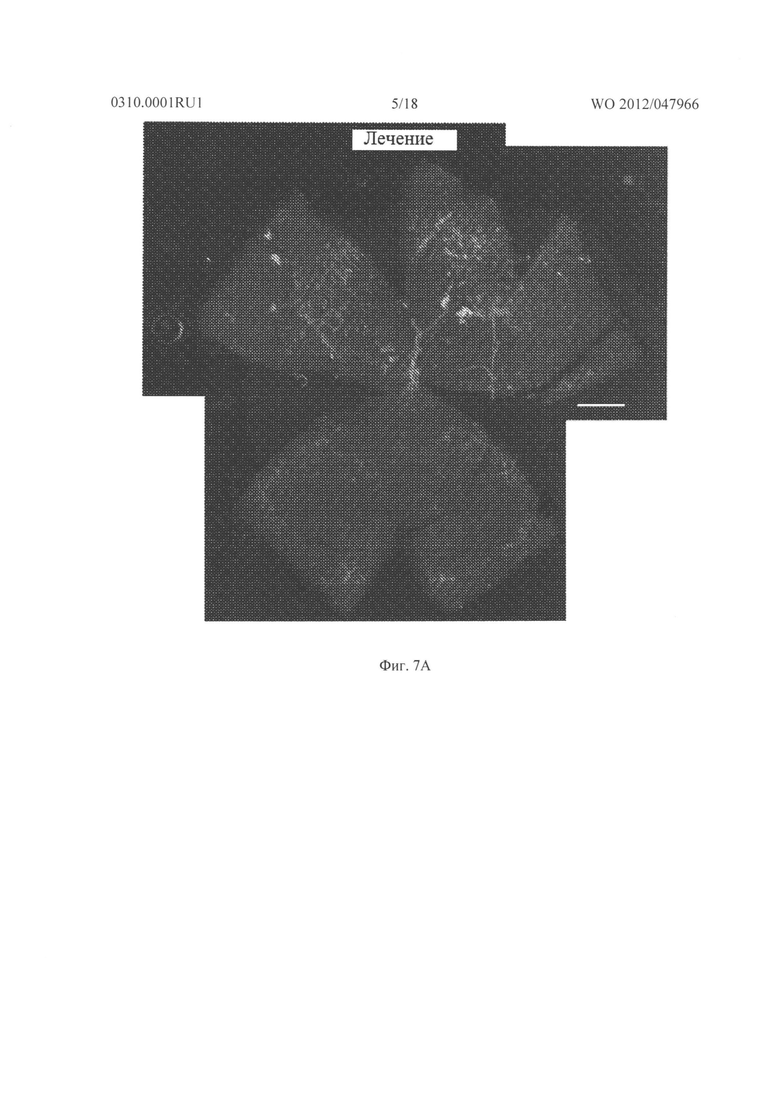
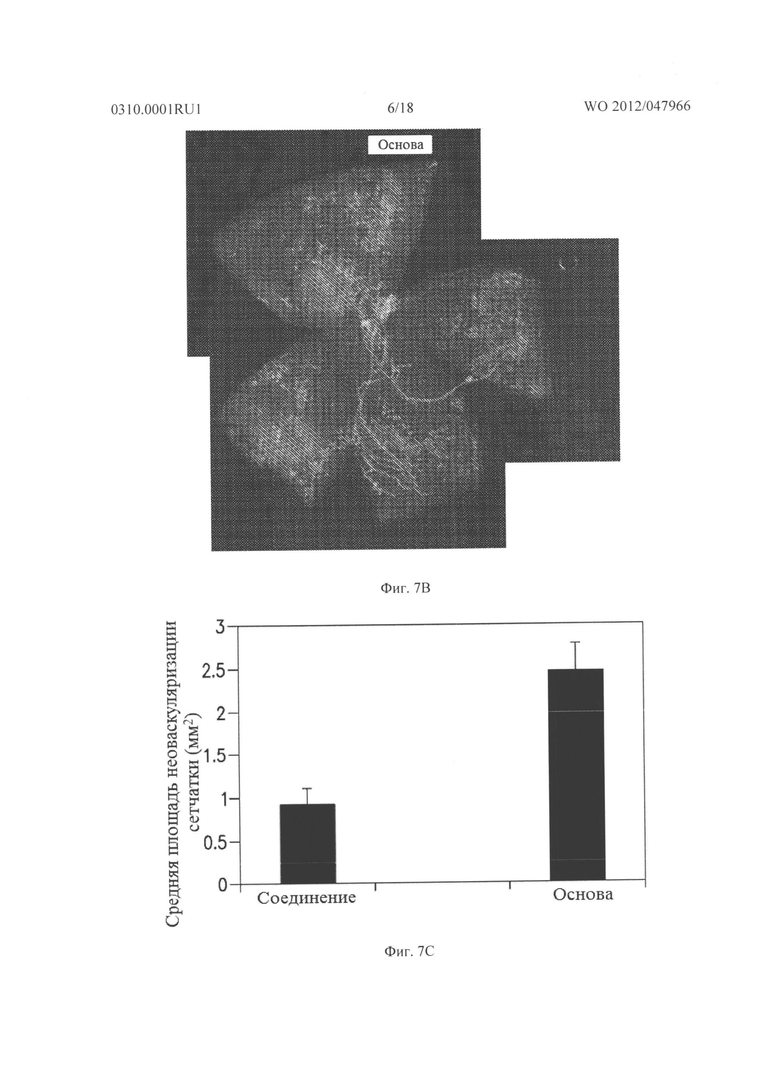
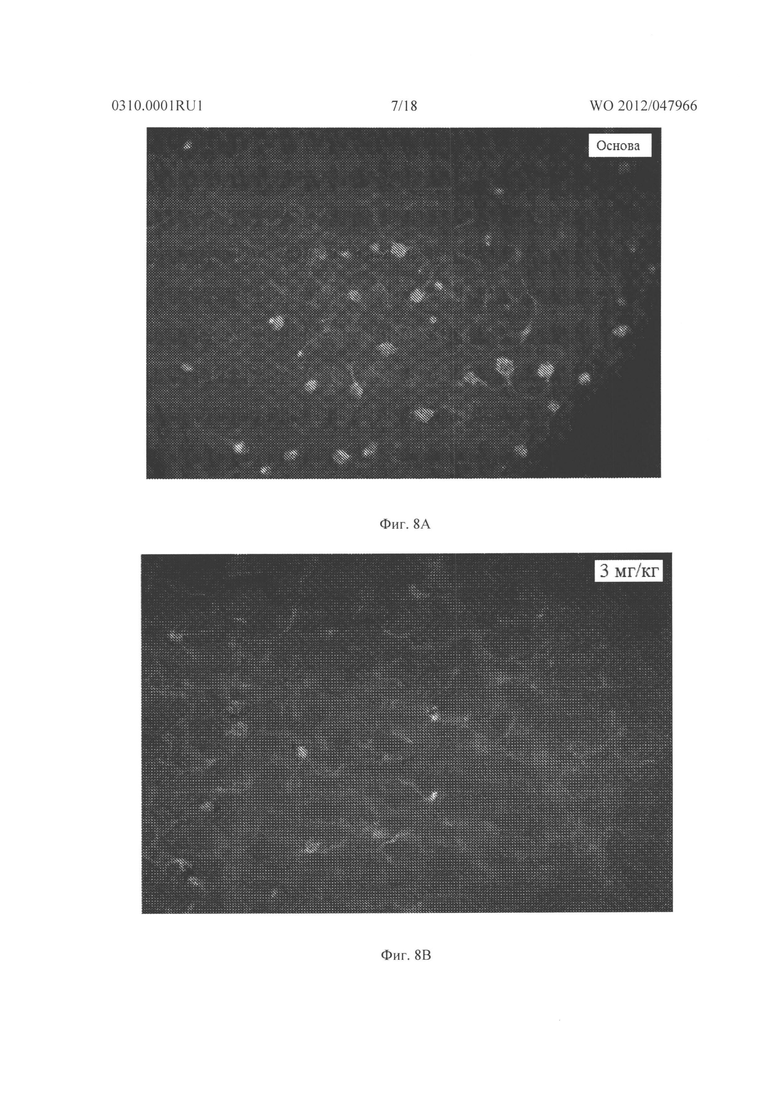
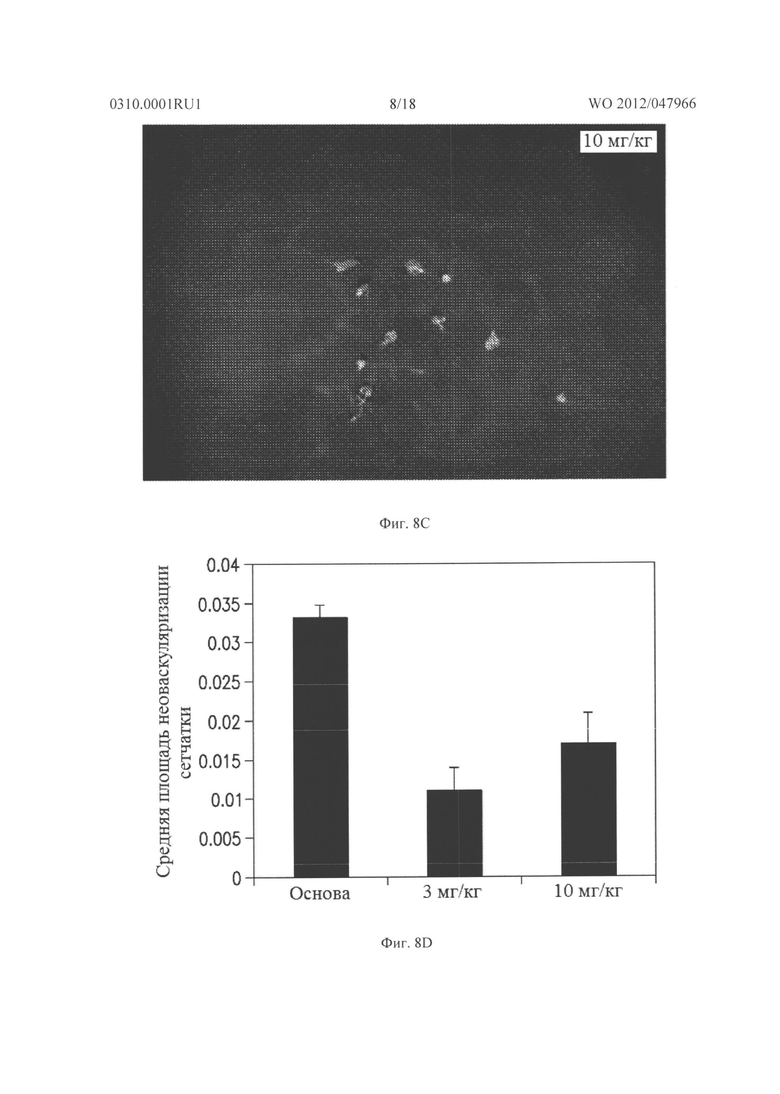
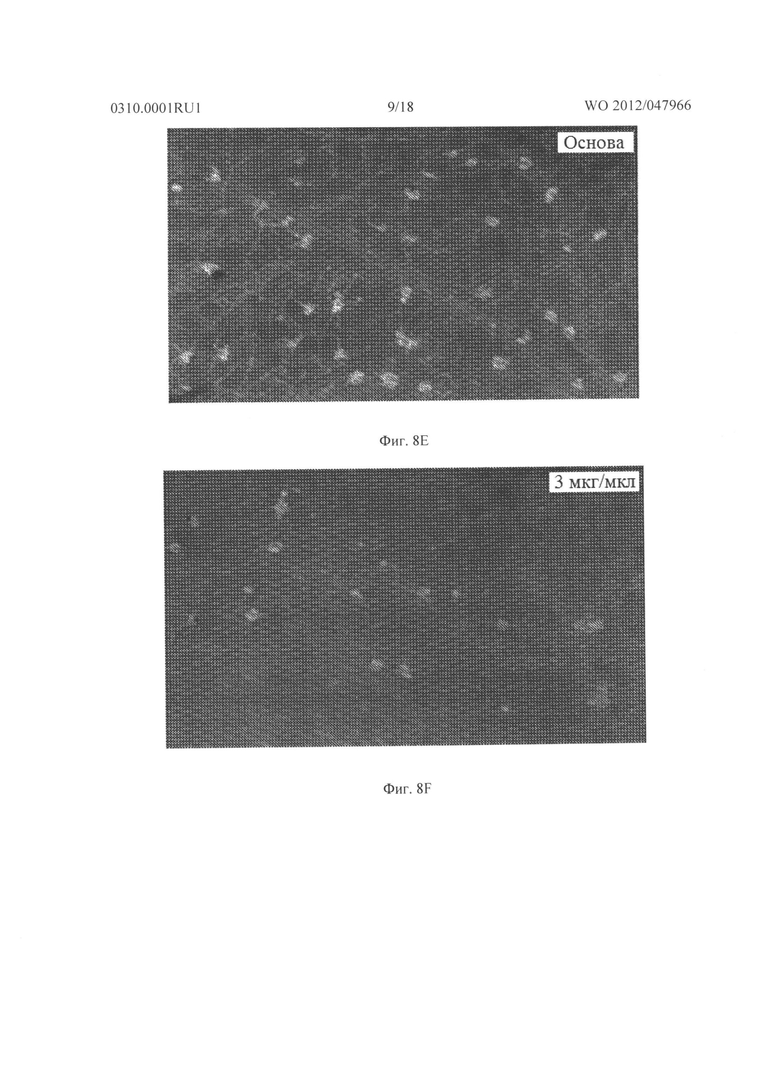
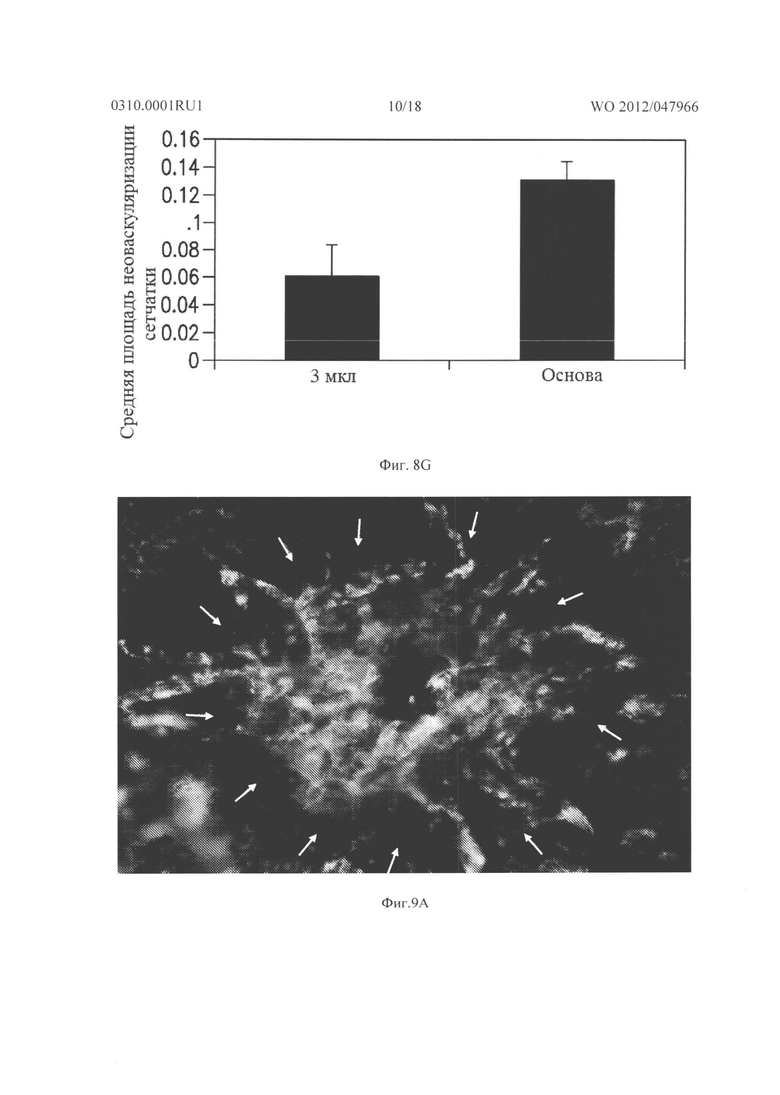

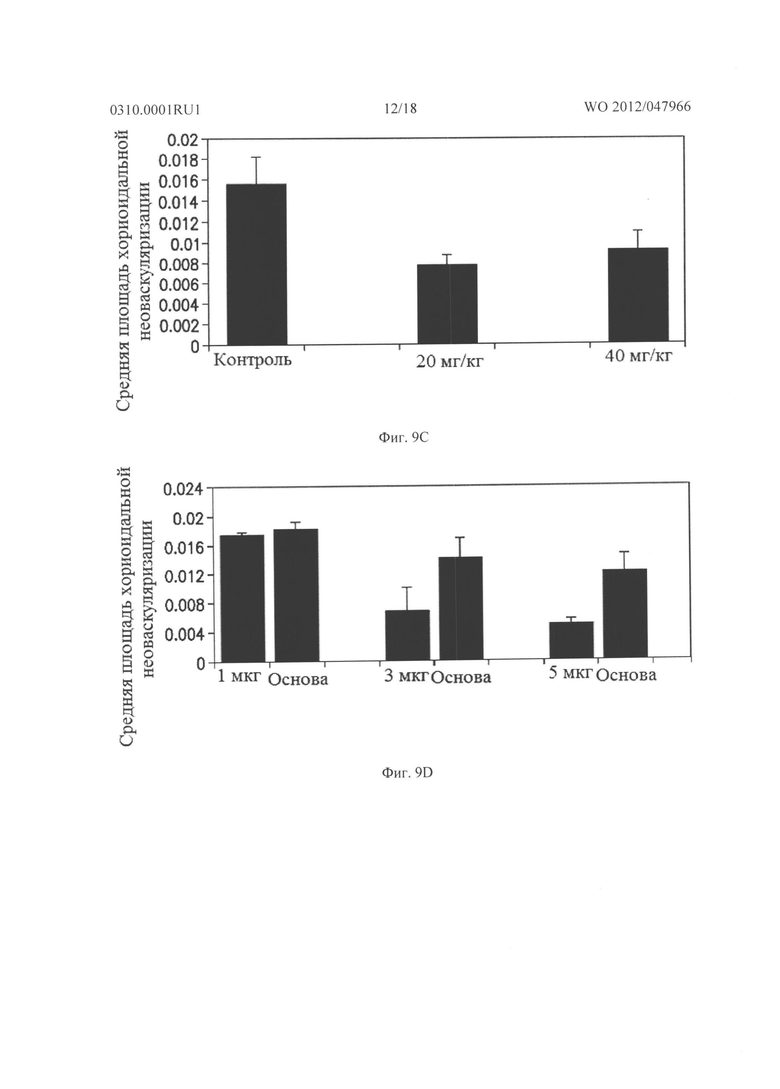
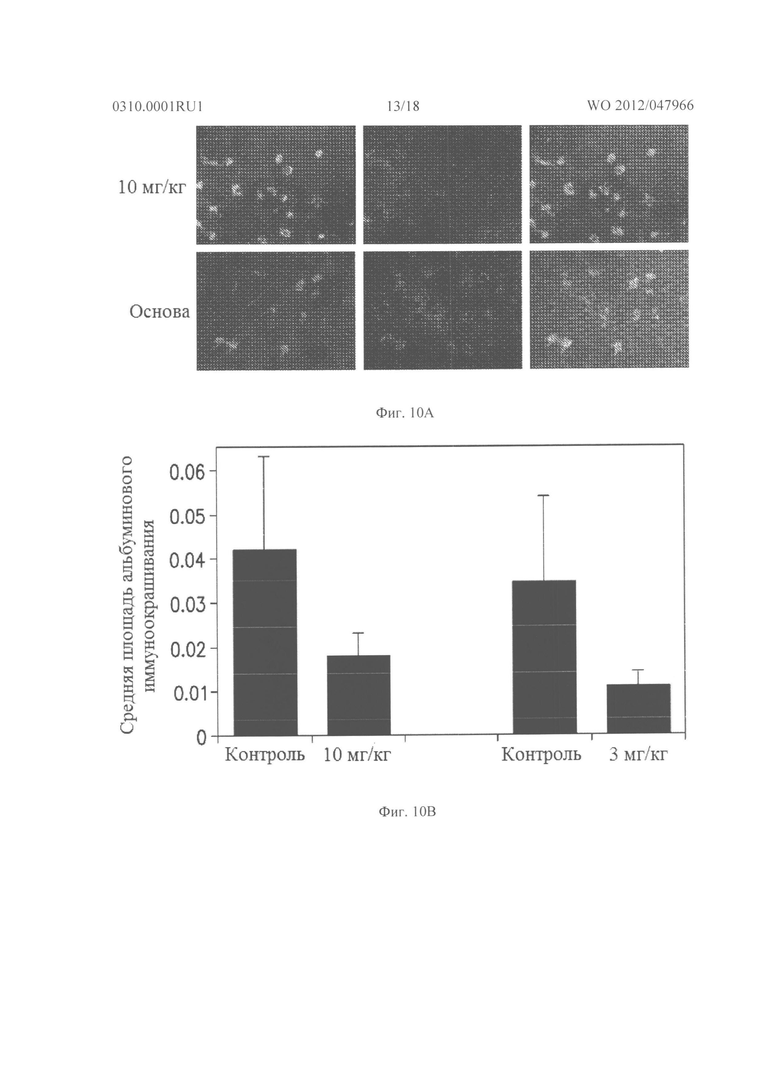

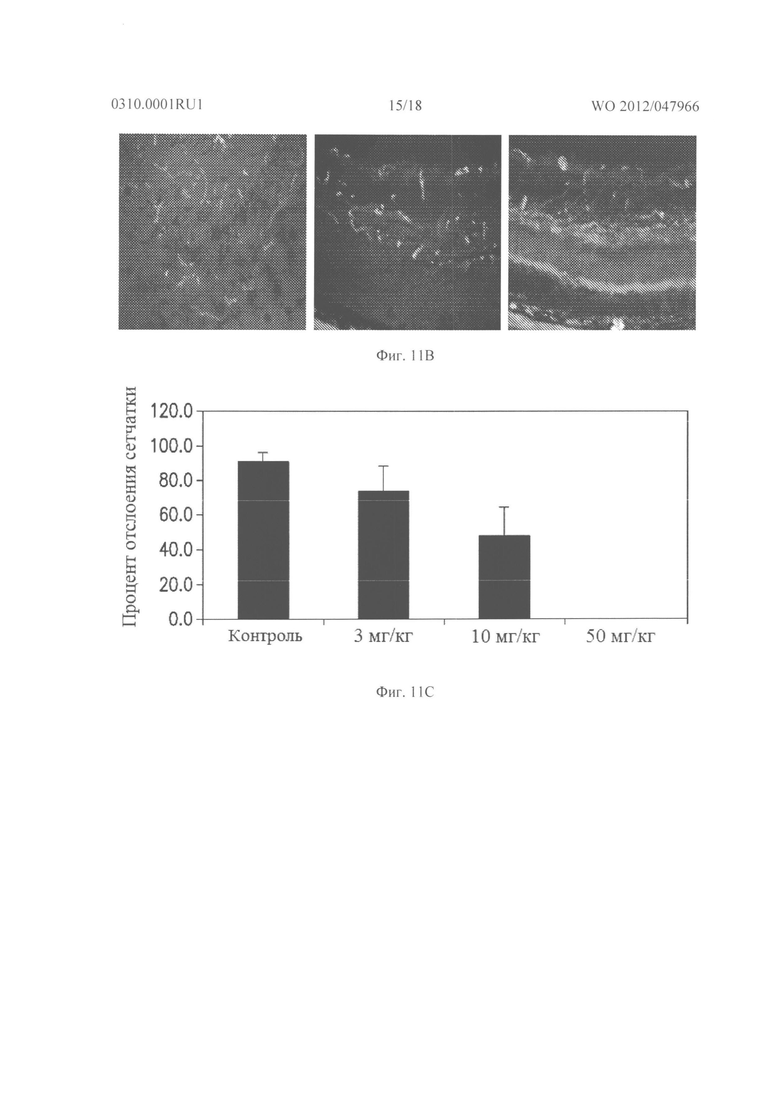

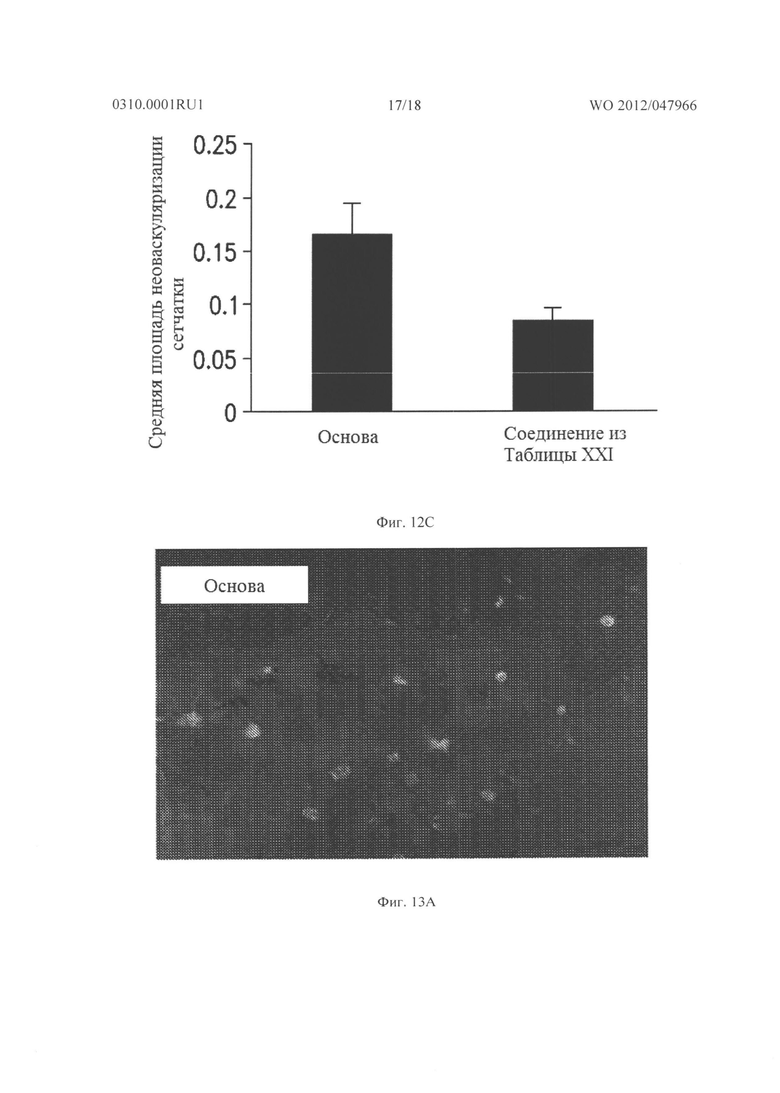
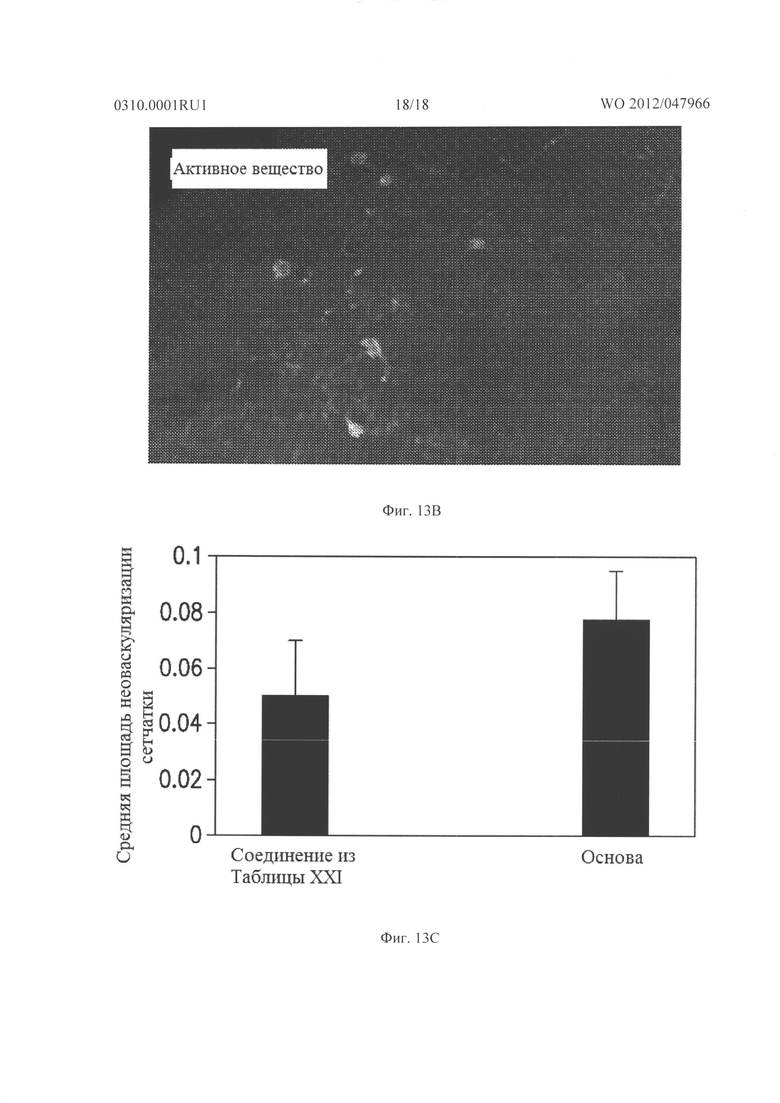
Группа изобретений относится к медицине, а именно к офтальмологии, и может быть использована для изготовления лекарственного средства для лечения диабетического макулярного отека, при этом соединение представляет собой 4-{(S)-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовую кислоту или ее фармацевтически приемлемую соль. Также предложены применение соединения для изготовления лекарственного средства для предотвращения диабетического макулярного отека и фармацевтическая композиция для лечения диабетического макулярного отека. Группа изобретений обеспечивает лечение заболеваний или состояний глаза, в частности ретинопатий, глазного отека и глазной неоваскуляризации, при таких заболеваниях глаз, как: диабетический макулярный отек, возрастная макулодистрофия (влажная форма), хориоидальная неоваскуляризация, диабетическая ретинопатия, окклюзия вены сетчатки (центральная или периферическая), глазная травма, отек, вызванный операцией, неоваскуляризация, вызванная операцией, кистозный макулярный отек, глазная ишемия, увеит. 3 н. и 3 з.п. ф-лы, 13 ил., 21 табл., 24 пр.
1. Применение соединения для изготовления лекарственного средства для лечения диабетического макулярного отека, при этом соединение имеет формулу:
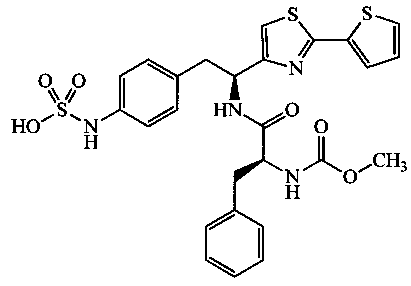
или
его фармацевтически приемлемая соль.
2. Применение по п. 1, отличающееся тем, что лекарственное средство используют для лечения диабетического макулярного отека у субъекта с диабетом.
3. Применение соединения для изготовления лекарственного средства для предотвращения диабетического макулярного отека, при этом соединение имеет формулу
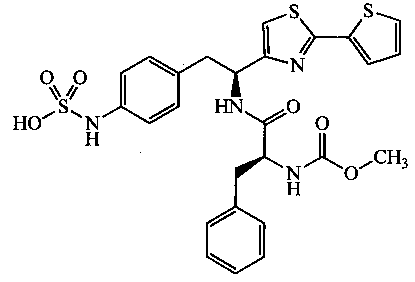
или
его фармацевтически приемлемая соль.
4. Применение по п. 3, отличающееся тем, что лекарственное средство предотвращает диабетический макулярный отек у субъекта с диабетом.
5. Применение по любому из пп. 1-4, отличающееся тем, что соединение представляет собой фармацевтически приемлемую соль, содержащую катион, представляющий собой аммоний, натрий, литий, калий, кальций, магний, висмут или лизин.
6. Фармацевтическая композиция для лечения диабетического макулярного отека, содержащая:
А) соединение, имеющее формулу:
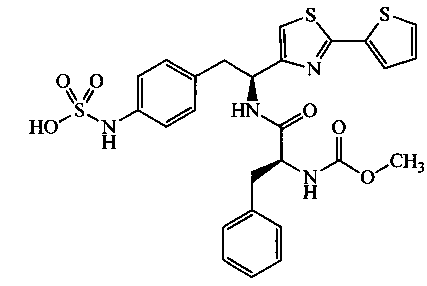
или
его фармацевтически приемлемую соль; и
В) один или более фармацевтически приемлемых носителей или совместимых эксципиентов.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| WO 2005090329 A1, 29.09.2005 | |||
| СПОСОБЫ И КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ИНГИБИРОВАНИЯ αβ-ОПОСРЕДОВАННОГО АНГИОГЕНЕЗА | 1997 |
|
RU2195312C2 |
| KLOPFENSTEIN SR et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
Авторы
Даты
2016-10-27—Публикация
2011-10-05—Подача