РОДСТВЕННЫЕ ЗАЯВКИ
[1] Эта заявка претендует на приоритет предварительной заявки США серийный №61/358400, поданной 24 июня 2010 года, а также содержит предмет, который может быть в связи с тем, что раскрыто и/или заявлено в заявке на патент США №11/575846, поданной 22 марта 2007 года, заявке на патент США №11/691748, поданной 27 марта 2007, заявке на патент США №11/576060, поданной 27 марта 2007 года, в настоящее время предоставленных в качестве патента США №7925330, заявки на патент США №12/519040, поданной 12 июня 2009 года, заявки на патент США №12/519213, поданной 15 июня 2009 года, и заявки на патент США №12/669292, поданной 15 января 2010 года, раскрытия которых включены в настоящий документ с помощью ссылки и сделаны его частью.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[2] Следующая информация предоставляется, чтобы помочь читателю понять технологию, описанную ниже, и некоторые внешние условия, в которых такая технология может быть использована. Термины, используемые в настоящем документе, не предназначены для ограничения какой-либо конкретной узкой интерпретации, если четко не указано иное в данном документе. Ссылки, изложенные в настоящем документе, могут способствовать пониманию технологии или ее предпосылок. Раскрытия всех ссылок, приведенных в настоящем документе, включены с помощью ссылки.
[3] Введение контрастного вещества (с помощью, например, механизированного инъектора) для радиологических исследований, как правило, начинается с заполнения клиницистом пустого одноразового шприца определенным объемом фармацевтического контрастного агента. В других процедурах используется шприц, предварительно заполненный контрастным агентом. Затем клиницист определяет объемный расход и объем контраста, который нужно ввести пациенту для создания возможности диагностической визуализации. Инъекция физиологического раствора, имеющего объем и скорость потока, определенные оператором, часто следует завведением контрастного агента в вены или артерии. Ряд доступных в настоящее время инъектров позволяет оператору программировать множество отдельных фаз объемных скоростей потока и объемов для доставки. Например, инъекторы SPECTRIS SOLARIS® и STELLANT® доступны от Medrad Inc., Индианола, штат Пенсильвания, предусматривают ввод вплоть до шести отдельных пар или фаз объемной скорости потока и объема для доставки пациенту (например, для контраста и/или физиологического раствора). Такие инъекторы и протоколы управления инъекторами для применения с ними раскрыты, например, в патенте США №6643537 и опубликованной публикации заявки на патент США №2004-0064041, раскрытие которых включено в настоящий документ с помощью ссылки. Значения или параметры в пределах областей для таких фаз, как правило, вводятся вручную оператором для каждого типа процедуры и для каждого пациента, подвергающегося процедуре инъекции/визуализации. Альтернативно, ранее введенные вручную значения объема и скорости потока могут быть сохранены и позднее вызваны из памяти компьютера. Однако метод, которым такие параметры бывают определены для конкретной процедуры для конкретного пациента, продолжает подвергаться развитию.
[4] В связи с этим были признаны различия в требованиях дозирования контраста для различных пациентов во время визуализации и других процедур. Например, патент США №5840026, раскрытие которого включено в настоящий документ с помощью ссылки, раскрывает устройства и способы для настройки инъекции пациенту с использованием конкретных данных пациента, полученных перед или во время инъекции. Хотя различия в требованиях дозирования для медицинских процедур визуализации на основе различий пациентов были признаны, обычные медицинские процедуры визуализации продолжают применять заданные дозы или стандартные протоколы доставки для инъекции контрастного вещества во время медицинских процедур визуализации. Учитывая возросшую скорость сканирования последних доступных КТ сканеров, включая MDCT (или MSCT) сканеры, однофазные инъекции доминируют над двухфазными или другими многофазными инъекциями в регионах мира, где используются такие быстрые сканеры. Хотя использование стандартных, фиксированных или заданных протоколов (однофазных, двухфазных или многофазных) для доставки упрощает процедуру, предоставление одинакового количества контрастного вещества различным пациентам по одинаковому протоколу может давать очень разные результаты контраста и качества изображения. Кроме того, с внедрением новейших MDCT сканеров открытый вопрос клинической практики и КТ литературы, используются ли стандартные протоколы контрастирования с однослойными спиральными сканерами, будет хорошо переводиться на процедуры с использованием MDCT машин.
[5] Несколько исследований попытались произвести количественный анализ процесса инъекции во время КТ ангиографии (КТА) для улучшения и прогнозирования артериального усиления. Например, Вае и его коллеги разработали фармакокинетические (ФК) модели поведения контраста и решили связанную систему дифференциальных уравнений с целью обнаружения задающей функции, которая вызывает наиболее равномерное артериальное усиление. К.Т.Вае, J.P.Heiken, J.А.Brink, "Aortic and hepatic contrast medium enhancement at CT. Part I. Prediction with a computer model," Radiology, vol. 207, pp.647-55 (1998); К.Т.Bae, "Peak contrast enhancement in CT and MR angiography: when does it occur and why? Pharmacokinetic study in a porcine model," Radiology, vol. 227, pp.809-16 (2003); К.T.Bae et al., "Multiphasic Injection Method for Uniform Prolonged Vascular Enhancement at CT Angiography: Pharmacokinetic Analysis and Experimental Porcine Method," Radiology, vol. 216, pp.872-880 (2000); патент США №№5583902, 5687208, 6055985, 6470889 и 6635030, раскрытия которых включены в настоящий документ с помощью ссылки. Решение обратной задачи набора дифференциальных уравнений упрощенной компартментальной модели, изложенной Вае et al., показывает, что экспоненциальное снижение скорости потока контрастного вещества может приводить к оптимальному/постоянному усилению в процедуре КТ визуализации. Однако профили инъекций, рассчитанные с помощью решения обратной задачи ФК модели, являются профилями, с трудом реализуемыми большинством автоматических КТ инъекторов без существенной модификации.
[6] В моделях Вае не рассматривается осуществление ФК моделей в контроллерной структуре. Например, при преобразовании системы дифференциальных уравнений в представление в пространстве состояний ранг полученной матрицы состояния меньше порядка системы из-за числа свободных параметров в составе системы. Этот недостаток ранга проявляется как сингулярность при попытке инвертирования матрицы и является проблематичным для цифрового представления системы для прогнозирования и управления. Кроме того, модели Вае прямо не учитывают транспортные задержки контрастного вещества, но моделируют транспортную задержку с помощью введения множественных последовательных суб-компартментов по всей сердечно-легочной модели. Множественные суб-компартменты обеспечивают задержку распространения в воспроизведенном выходе, поскольку новая фаза ответа системы отличается (аддитивна) из-за дополнительных компартментов. Введение множественных компартментов несколько произвольно, хотя и основано на физическом понимании сосудистой системы. Например, компартмент легких разделен на 30 суб-компартментов из-за дисперсии болюса контраста и задержки по сердечно-легочной системе.
[7] Wada and Ward, "The hybrid model: a new pharmacokinetic model for computer-controlled infusion pumps", IEEE Trans. Biomed Eng, vol. 41(2), pp.134-142, 1994, раскрытие которых включено в настоящий документ с помощью ссылки, получили 3-компартментную фармакокинетическую модель, подобную подходу, принятому Вае, и использовали эту модель в схеме управления в попытке регулировать концентрацию анестетика в плазме (нагрузка отчуждения). Они пытались моделировать эффект рециркуляции агента через кровоток, а также смоделировали это с помощью транспортной задержки в их воспроизведениях. Они были способны генерировать воспроизведение с ошибками прогноза до 5%.
[8] Wada and Ward "Open loop control of multiple drug effects in anesthesia", IEEE Trans. Biomed Eng, vol. 42(7), pp.666-677, 1995, раскрытие которых включено в настоящий документ с помощью ссылки, также применяли их фармакокинетическую (ФК) модель для управления множественными эффектами анестезирующих средств. Их схема управления требует анестезиолога для установки допустимых уровней побочных эффектов (выраженных как концентрация в плазме).
[9] В другом подходе Fleischmann и коллеги рассматривали сердечно-сосудистую физиологию и контрастную кинетику в качестве «черного ящика» и определяли ее импульсную характеристику с помощью форсирования системы коротким болюсом контраста (аппроксимируя единичный импульс). В этом методе выполняют преобразование Фурье импульсной характеристики и манипулируют этой оценкой передаточной функции для определения оценки более оптимальной траектории инъекции, чем практиковалась ранее. D.Fleischmann и К.Hittmair, "Mathematical analysis of arterial enhancement and optimization of bolus geometry for CT angiography using the discrete Fourier transform," J Comput Assist Tomogr, vol. 23, pp.474-84 (1999), раскрытие которого включено в настоящий документ с помощью ссылки.
[10] Однофазное введение контрастного агента (как правило, от 100 до 150 мл контраста при одной скорости потока) приводит к неоднородному повышению кривой, например, D.Fleischmann и К.Hittmair, supra; и К.Т.Вае, "Peak contrast enhancement in CT and MR angiography: when does it occur and why? Pharmacokinetic study in a porcine model," Radiology, vol. 227, pp.809-16 (2003), раскрытия которых включены в настоящий документ с помощью ссылки. Fleischmann и Hittmair таким образом представили схему, которая пыталась адаптировать введение контрастного агента в двухфазной инъекции, приспособленной к индивидуальному пациенту, с намерением оптимизации визуализации аорты. Основная трудность с управлением представления КТ контрастного агента, это то, что гиперосмолярный препарат диффундирует быстрее из центрального кровяного компартмента. Кроме того, контраст смешивается и разбавляется кровью, которая не содержит контраст.
[11] Fleischmann предписал, чтобы небольшая болюсная инъекция, пробная болюсная инъекция контрастного агента (16 мл контраста при 4 мл/с) вводилась до диагностического сканирования. Сканирование динамического усиления выполняли по интересующему сосуду. Полученные обработанные данные сканирования (пробного сканирования) интерпретировали как импульсную характеристку системы пациент/контрастное вещество. Fleischmann получал преобразование Фурье передаточной функции пациента путем деления преобразования Фурье пробного сканирования на преобразование Фурье пробной инъекции. Предполагая, что система была инвариантной во времени линейной (LTI) системой, и что желаемый выходной сигнал временной области известен (плоское диагностическое сканирование на заранее определенном уровне усиления), Fleischmann получал входной временной сигнал путем деления частотной области представлений желаемого выхода на таковую из передаточной функции пациента. Поскольку способ Fleischmann et al. вычисляет входные сигналы, которые не реализуемы в действительности как результат ограничений инъекционной системы (например, ограничения скорости потока), необходимо обрезать и аппроксимировать рассчитанный непрерывный временной сигнал.
[12] В дополнение к проблемам управления существующими инъекторными системами многим подобным системам не хватает удобства и гибкости в способе, которым действуют эти инъекторные системы. В связи с этим, сложность медицинских инъекционных процедур и лихорадочный темп во всех аспектах отрасли здравоохранения стимулируют время и навыки оператора.
[13] Во многих современных методах количественного анализа клиническая практичность уменьшает шансы принятия для регулярного применения. Доступные в настоящее время физиологические модели могут требовать оценки многих физиологических параметров априори (например, сердечный выброс, объемы крови органа и крупных сосудов, факторы проницаемости). Кроме того, модели могут быть недостаточно хорошо ориентированы для адаптации по отношению к каждому пациенту на основе пробного болюсного усиления из-за определенных математических ограничений.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
[14] В одном аспекте способ моделирования распространения контрастного вещества (который включает агент контрастного усиления для применения в процедуре визуализации), введенного пациенту с использованием физиологически обоснованной фармакокинетической модели, включает: включение в физиологически обоснованную фармакокинетическую модель по меньшей мере одного нелинейного периода насыщения в периферическом венозном компартменте, или по меньшей мере один конфигурируемый период транспортной задержки через по меньшей мере один компартмент.Физиологически обоснованная фармакокинетическая модель может, например, быть адаптирована для моделирования, прогнозирования или оценки кривой времени усиления для одной или нескольких зон интереса пациента. В ряде вариантов осуществления физиологически обоснованная фармакокинетическая модель является дискретизируемой.
[15] По меньшей мере одна конфигурируемая транспортная задержка может, например, быть конфигурируемой, по меньшей мере, частично на основе по меньшей мере одной конкретной переменной пациента (например, рост, возраст, вес, пол и т.д.).
[16] Физиологически обоснованная фармакокинетическая модель может, например, быть адаптирована для моделирования распространения контрастного вещества после того, как инъекция контрастного вещества прекратилась. Модель может, например, прогнозировать, оценивать или моделировать объемную скорость потока крови и ее эффект на распространение контрастного вещества. Физиологически обоснованная фармакокинетическая модель может, например, прогнозировать, оценивать или моделировать эффект распространения контрастного вещества после инъекции жидкости, не содержащей агент контрастного усиления, после инъекции контрастного вещества. Жидкость, не содержащая агент контрастного усиления, может, например, включать физиологический раствор (например, как в случае промывки физиологическим раствором после инъекции контрастного вещества).
[17] По меньшей мере один параметр для физиологически обоснованной фармакокинетической модели может, например, быть определен из данных от множества лиц. По меньшей мере один параметр для физиологически обоснованной фармакокинетической модели может, например, быть определен по меньшей мере частично на основе по меньшей мере одной переменной для конкретного пациента. По меньшей мере один параметр для физиологически обоснованной фармакокинетической модели может, например, быть определен по меньшей мере частично на основе по меньшей мере одной кривой времени усиления пациента, полученной при инъекции контрастного вещества. Кривые времени усиления для более чем одной зоны интереса могут быть использованы в определении одного или нескольких параметров модели.
[18] Способ может дополнительно включать понижение порядка физиологически обоснованной фармакокинетической модели. В ряде вариантов осуществления модели с понижением порядка по меньшей мере один параметр определяется по меньшей мере частично на основе по меньшей мере одной кривой времени усиления пациента. Кривые времени усиления для более чем одной зоны интереса могут быть использованы в определении одного или нескольких параметров модели.
[19] Физиологически обоснованная фармакокинетическая модель может, например, быть включена в систему, содержащую инъекторную систему и систему визуализации. Модель может, например, быть использована в генерировании по меньшей мере одного параметра для инъекционной процедуры.
[20] В ряде вариантов осуществления способ может дополнительно включать использование физиологически обоснованной фармакокинетической модели для оценки кривой времени усиления для пациента и для определения по меньшей мере одного параметра инъекционной процедуры по меньшей мере частично по расчетной кривой времени усиления. Способ может дополнительно включать использование кривой времени усиления во время диагностической инъекции контрастного вещества (например, в методологии болюсного контрастирования) для корректировки модели (например, в методологии управления с прогнозирующими моделями) и, например, для изменения по меньшей мере одного параметра инъекционной процедуры.
[21] В другом аспекте способ моделирования распространения контрастного вещества, введенного пациенту с использованием физиологически обоснованной фармакокинетической модели включает: моделирование объемной скорости потока крови и ее эффекта на распространение контрастного вещества после того, как инъекция контрастного вещества прекращается. Физиологически обоснованная фармакокинетическая модель может, например, прогнозировать, оценивать или моделировать эффект распространения контрастного вещества после инъекции жидкости, не содержащей агент контрастного усиления, после инъекции контрастного вещества. Жидкость, не содержащая агент контрастного усиления, может, например, включать физиологический раствор. Физиологически обоснованная фармакокинетическая модель может, например, быть дискретизируемой.
[22] Физиологически обоснованная фармакокинетическая модель может, например, быть адаптирована для прогнозирования, оценки или моделирования кривой времени усиления для одной или нескольких зон интереса пациента.
[23] Физиологически обоснованная фармакокинетическая модель может, например, включать по меньшей мере один нелинейный период насыщения в периферическом венозном компартменте, или по меньшей мере один конфигурируемый период транспортной задержки через по меньшей мере один компартмент.По меньшей мере одна конфигурируемая транспортная задержка может, например, быть конфигурируемой по меньшей мере частично на основе по меньшей мере одной конкретной переменной пациента.
[24] По меньшей мере один параметр для физиологически обоснованной фармакокинетической модели может, например, быть определен по меньшей мере частично на основе данных от множества лиц. По меньшей мере один параметр для физиологически обоснованной фармакокинетической модели может, например, быть определен по меньшей мере частично на основе по меньшей мере одной конкретной переменной пациента. По меньшей мере один параметр для физиологически обоснованной фармакокинетической модели может, например, быть определен по меньшей мере частично на основе по меньшей мере одной кривой времени усиления пациента, полученной при инъекции контрастного вещества.
[25] Способ может дополнительно включать понижение порядка физиологически обоснованной фармакокинетической модели (например, устранение или объединение одного или нескольких параметров, компартментов и/или подсистем). В ряде вариантов осуществления по меньшей мере один параметр для такой физиологически обоснованной фармакокинетической модели с понижением порядка определяется по меньшей мере частично на основе по меньшей мере одной кривой времени усиления пациента.
[26] Физиологически обоснованная фармакокинетическая модель может, например, быть включена в систему, содержащую инъекторную систему и систему визуализации (которая может быть отдельной, частично интегрированной или полностью интегрированной). Модель может, например, быть использована в генерировании по меньшей мере одного параметра для инъекционной процедуры.
[27] В ряде вариантов осуществления физиологически обоснованная фармакокинетическая модель используется для оценки кривой времени усиления для пациента и для определения по меньшей мере одного параметра инъекционной процедуры по расчетной кривой времени усиления.
[28] В ряде вариантов осуществления способ дополнительно включает использование кривой времени усиления во время диагностической инъекции контрастного вещества для корректировки модели и для изменения по меньшей мере одного параметра инъекционной процедуры.
[29] Любая из моделей, описанных в данном документе, может, например, быть включена в систему (например, включая по меньшей мере один процессор и по меньшей мере одну систему памяти в связи с по меньшей мере одним процессором) как программное обеспечение, техническое обеспечение или их комбинация.
[30] В другом аспекте система включает систему генерирования параметров для определения по меньшей мере одного параметра для инъекционной процедуры (например, параметр инъекционного протокола или параметр системы визуализации), система генератора параметров включает физиологически обоснованную фармакокинетическую модель для моделирования распространения контрастного вещества, введенного пациенту, включая по меньшей мере один нелинейный период насыщения в периферическом венозном компартменте, по меньшей мере один конфигурируемый период транспортной задержки через по меньшей мере один компартмент, или адаптацию для моделирования объемной скорости потока крови и ее эффекта на распространение контрастного вещества после того, как инъекция контрастного вещества прекращается. Физиологически обоснованная фармакокинетическая модель может, например, быть дискретизируемой.
[31] По меньшей мере один параметр для физиологически обоснованной фармакокинетической модели может, например, быть определен по меньшей мере частично из по меньшей мере одной кривой времени усиления пациента. Как и во всех моделях настоящего документа, один или несколько параметров (включая все параметры) может быть определен по меньшей мере частично из по меньшей мере одной кривой времени усиления пациента.
[32] Порядок физиологически обоснованной фармакокинетической модели может, например, быть понижен. По меньшей мере один параметр для такой модели с понижением порядка может, например, быть определен по меньшей мере частично из по меньшей мере одной кривой времени усиления пациента.
[33] Система может дополнительно включать непараметрическую модель для оценки, моделирования или прогнозирования распространения контрастного вещества, введенного пациенту. Непараметрическая модель может, например, быть основана по меньшей мере частично на по меньшей мере одной кривой времени усиления для зоны интереса пациента. Непараметрическая модель может, например, быть основана по меньшей мере частично на усеченном деконволюционном методе разложения по сингулярным числам матрицы (tSVD).
[34] По меньшей мере один параметр может, например, быть определен с использованием способа оптимизации на основе физиологически обоснованной фармакокинетической модели. Способ оптимизации может, например, быть ограниченным способом оптимизации.
[35] По меньшей мере один параметр может, например, быть определен с использованием способа оптимизации на основе по меньшей мере одной физиологически обоснованной фармакокинетической модели или непараметрической модели.
[36] Модели, способы и системы, описанные в данном документе, могут, например, быть использованы в связи с различными контрастными веществами для применения в ряде процедур радиологической визуализации. Кроме того, модели, способы и системы, описанные в данном документе, могут также быть использованы в связи с фармацевтическими препаратами, которые не являются контрастными веществами.
[37] Преимущества, предоставляемые различными вариантами осуществления, включают, но не ограничиваясь: более плотное усиление для последующей обработки изображений, сниженную загрузку контраста или жидкости для некоторых пациентов, увеличенную дозу контраста для достижения достаточного контраста изображения при необходимости, сниженную вероятность кровоизлияния, сниженные артефакты изображения, сниженное число повторных съемок, все срезы, содержащие оптимальный контраст изображения, увеличенную согласованность между сканированиями, наблюдающими прогрессирование заболевания или лечение во времени, и факультативно, более быстрое время визуализации.
[38] Технология, описанная в настоящем документе, наряду с ее атрибутами и сопутствующими преимуществами лучше всего будет оценена и понята в силу следующего подробного описания, данного в сочетании с прилагаемыми изображениями.
КРАТКОЕ ОПИСАНИЕ ИЗОБРАЖЕНИЙ
[39] Фигура 1А иллюстрирует вариант осуществления модельной структуры новой фармакокинетической модели (иногда называемой в данном документе как гибридная модель), описывающей распространение фармацевтического препарата, такого как контрастное вещество.
[40] Фигура 1В иллюстрирует вариант осуществления инъекционной системы.
[41] Фигура 1С иллюстрирует вариант осуществления настройки экрана управления для параметров пациента, параметров сканирования и параметров инъекционного протокола.
[42] Фигура 2 иллюстрирует вариант осуществления полно-интеграторного вида физиологически обоснованной фармакокинетической модели, в которой толстые линии в секции "CP" отмечают векторные величины, и матричные значения в которой определяются в уравнениях с 18 по 26, изложенных ниже.
[43] Фигура 3 иллюстрирует воспроизведенные контрастные усиления для нормального субъекта.
[44] Фигура 4 иллюстрирует воспроизведенные пиковые усиления аорты и моменты времени для пикового усиления аорты, построенные как функции от сердечного выброса в гибридной модели.
[45] Фигура 5 иллюстрирует воспроизведенные результаты, демонстрирующие способность модели воспроизводить эффект инъекций промывки физиологическим раствором.
[46] Фигура 6А и 6В иллюстрирует сравнение данных, сообщенных Bae et al., с выходом гибридной модели, (а) Фигура 6а в Bae et al. от группы пациентов с использованием инъекции 5 мл/с (b) прогнозируемый выход новой модели в брюшной аорте с использованием такого же протокола контрастирования и демографических данных пациентов, как и для данных эмпирического исследования.
[47] Фигура 7 иллюстрирует профиль контрастного усиления одного субъекта (1-го субъекта), полученный из нисходящей части дуги аорты. Планки погрешностей показывают стандартное отклонение контрастного усиления в каждом расположении измерения.
[48] Фигура 8 иллюстрирует данные клинической визуализации одного субъекта (11-го субъекта), воспроизведение прогноза гибридной модели и прогнозы модели Вае.
[49] Фигура 9А и 9В иллюстрирует прогнозы модели по сравнению с клиническими данными для (а) субъекта 6 (b) субъекта 8. Субъект 6 был 47-летней женщиной весом 110 фунтов, тогда как пациент 8 был 53-летним мужчиной весом 246 фунтов.
[50] Фигуры с 10А по 10С иллюстрируют ящичковые диаграммы с усами суммарных результатов для (a) RMSE (b) PDME и (с) EDI.
[51] Фигуры с 11А по 11С иллюстрируют диаграммы рассеяния воспроизведенных испытаний (х-=модель Вае, о--=гибридная модель) - (a) RMSE (b) PDME (с) EDI.
[52] Фигура 12 иллюстрирует осевое КТ изображение, полученное при процедуре пробного болюсного сканирования.
[53] Фигура 13 иллюстрирует кривую времени усиления, генерированную от пациента после анализа пробного болюсного сканирования, являющегося результатом пробной болюсной инъекции контраста (набор данных из фигуры 12).
[54] Фигура 14 иллюстрирует вариант осуществления уменьшенной структуры гибридной модели, использованной для оценивания параметров с данными пробного болюсного сканирования. Пунктирные линии представляют модельные подсистемы, объединенные для идентификации модели.
[55] Фигура 15 иллюстрирует вариант осуществления переформулированной модельной структуры правых отделов сердца и периферических компартментов (He1) для применения в оценке параметров. Элементы массовой скорости потока, QPER и QCO транспортируют контраст из периферического компартмента один к два и от периферического компартмента два в правые отделы сердца.
[56] Фигура 16 иллюстрирует вариант осуществления переформулированной модельной структуры левых отделов сердца и компартмента легких (Не2) для применения в оценивании параметров. Сердечный выброс (QCO) транспортирует болюс контраста из компартмента легких в компартмент левых отделов сердца.
[57] Фигура 17 иллюстрирует блок-схему варианта осуществления дискретной модели, использованной для определения параметров с оценкой максимального правдоподобия.
[58] Фигура 18 иллюстрирует контурные графические отображения функции стоимости Jlh для пар параметров для подсистемы He2D.
[59] Фигура 19 иллюстрирует контурные графические отображения, показывающие проекцию функции стоимости Jrh как функции от пар параметров.
[60] Фигура 20 иллюстрирует воспроизведение гибридной модели для диагностической инъекции с использованием данных субъекта 6 и расчетной кривой усиления с использованием методологии MLE. Задержка сканирования и значения продолжительности сканирования также были получены из набора клинических данных для субъекта 6.
[61] Фигуры с 21А по 21С иллюстрируют результаты воспроизведения гибридной модели, установленные с использованием Оценки Максимального Правдоподобия (MLE). а) Среднеквадратичная Ошибка от 20 пациентов воспроизведена с помощью гибридной модели и прогнозированного усиления Ь) Прогнозированная Разница Максимального Усиления (PDME) между данными воспроизведения гибридной модели и расчетным ответом с) Результаты Индекса Разницы Усиления (EDI). Пунктирные линии представляют среднее значение для каждого набора данных.
[62] Фигуры 22А и 22В иллюстрируют результаты воспроизведения с использованием методологии MLE по данным гибридной модели. Каждая полоса представляет среднее по всем 20 субъектам при оценке генерированных параметров данных болюсов с различной длиной хронометража. Планки погрешностей показывают одно стандартное отклонение от среднего, а) Среднеквадратичная Ошибка (RMSE) между воспроизведенными и прогнозированными усилениями b) Процентная Разница Максимального Усиления (PDME) между воспроизведением и данными прогнозированного усиления.
[63] Фигуры 23А и 23В иллюстрируют результаты, демонстрирующие влияние пробного болюса уменьшенной длины на определение и вклад шумов в оценочную характеристику a) RMSE между выходами воспроизведения гибридной модели и прогнозами оценки для данных пробного болюса, заканчивающегося в 25 и 35 секунд b) PDME между выходами воспроизведения гибридной модели и прогнозами оценки для данных пробного болюса, усеченного в 25 и 35 секунд.
[64] Фигуры с 24А по 24С иллюстрируют исходные параметры производительности методологии MLE с использованием набора клинических данных. Пунктирные горизонтальные линии показывают среднее значение.
[65] Фигуры 25А и В иллюстрируют результаты прогноза MLE с использованием клинических данных для (а) субъекта 6 и (b) субъекта 8. Планки погрешностей показывают плюс/минус одно стандартное отклонение от среднего, как измерено в аорте при специфическом расположении оси z.
[66] Фигуры с 26А по 26С иллюстрируют ящичковые диаграммы с усами для результатов прогнозированных усилений с использованием гибридной модели (Hybrid) и методологии MLE (MLE) для прогноза контрастного усиления в наборе клинических данных (a) RMSE (b) PDME (с) EDI.
[67] Фигура 27 иллюстрирует решение для импульсной характеристика, hsys, с использованием данных субъекта 7 и деления матриц (решение методом наименьших квадратов).
[68] Фигура 28 иллюстрирует расчетную импульсную характеристику для данных субъекта 7 с использованием способа tSVD.
[69] Фигуры с 29А по 29С иллюстрируют исходные параметры производительности для tSVD оценки усиления в левых отделах сердца с использованием данных гибридной модели. Горизонтальная пунктирная синяя линия представляет среднее (а) Среднеквадратичная Ошибка (b) Процентная Разница Максимального Усиления (с) Индекс Разницы Усиления.
[70] Фигуры 30А и 30В иллюстрируют результаты воспроизведения гибридной модели по сравнению с характеристикой методологий оценки MLE и tSVD, как длины векторов пробных болюсов в диапазоне от 20 до 40 секунд. Во всех воспроизведениях не было никакого дополнительного шума в данных пробных болюсов (a) RMSE результаты (b) PDME результаты.
[71] Фигура 31 иллюстрирует результаты воспроизведения для пробных болюсов длиной 35 секунд, но при добавлении AWGN (sigma) к данным пробных болюсов, варьировавшим от 0 до 20 HU. Каждая точка данных является средним от 20 субъектов, воспроизведенных с использованием гибридной модели.
[72] Фигуры с 32А по 32С иллюстрируют результаты двух методологий оценки, MLE и tSVD, с использованием набора клинических данных векторов пробных болюсов и диагностических данных усиления (a) RMSE (b) PDME (с) EDI.
[73] Фигуры с 33А по 33С иллюстрируют ящичковые диаграммы с усами, сравнивающие два метода оценки с использованием набора клинических данных в качестве основы для сравнения, (a) RMSE (b) PDME (с) EDI.
[74] Фигура 34 иллюстрирует пробный болюс для одного субъекта (субъект 15) в наборе клинических данных. Кривая, отмеченная "х", является ТЕС легочной артерии, а кривая, помеченная кругами, является ТЕС восходящей части дуги аорты.
[75] Фигура 35 иллюстрирует изображение желаемого результата генерирования индивидуального протокола. Сплошная изогнутая линия является профилем контрастного усиления, рассчитанным с помощью гибридной ФК модели, вертикальные линии представляют окно получения КТ сканирования, а пунктирные горизонтальные линии представляют желаемые уровни усиления.
[76] Фигуры с 36А по 36D иллюстрируют 3D графики поверхности предполагаемой функции стоимости с использованием данных воспроизведения и различных характеристик процедуры (а) Функция стоимости для субъекта 6 с 250 HU цели и 2 секундами продолжительности сканирования (b) Функция стоимости для субъекта 6 с 250 HU цели и 8 секундами продолжительности сканирования (с) Функция стоимости для субъекта 6 с 350 HU цели и 2 секундами продолжительности сканирования (d) Функция стоимости для субъекта 6 с 350 HU цели и 8 секундами продолжительности сканирования.
[77] Фигуры с 37А по 37D иллюстрируют 2D контурные графики функции стоимости для воспроизведенных данных субъекта 6 и предполагаемой функции стоимости. Крест показывает истинный минимум каждой проекции, (а) Функция стоимости для субъекта 6 с 250 HU цели и 2 секундами продолжительности сканирования (b) Функция стоимости для субъекта 6 с 250 HU цели и 8 секундами продолжительности сканирования (с) Функция стоимости для субъекта 6 с 350 HU цели и 2 секундами продолжительности сканирования (d) Функция стоимости для субъекта 6 с 350 HU цели и 8 секундами продолжительности сканирования.
[78] Фигура 38 иллюстрирует образец ответа пробного болюса, измеренного у субъекта в нисходящей части дуги аорты.
[79] Фигуры с 39А по 39D иллюстрируют рассчитанные инъекционные протоколы с использованием деконволюционного способа Фурье, описанного в [9], Ts=2 с/изображение. Общий объем контраста инъекции перечислен на каждой подфигуре. (А) Необработанный протокол. Поскольку допускается отрицательная скорость потока инъекции, общий объем контраста ниже, чем B-D. (В) Неотрицательный протокол (С) Неотрицательный протокол фиксируют при 7 мл/с и команды инъекции при времени >34 с удаляют (D) Тот же протокол, что и С, но образцы через 32 секунды удаляют.
[80] Фигуры с 40А по 40D иллюстрируют прогнозируемые (синие) и желаемые (зеленые) уровни усиления, генерированные с помощью инъекционных протоколов, представленных в (А) Идеальный профиль усиления с использованием необработанного протокола (В) Усиление, генерированное с помощью неотрицательного инъекционного протокола (С) Усиление, когда неотрицательная инъекция фиксируется на 7 мл/с и инъекция не допускается через 34 секунды (D) Профиль усиления, как в С, но с образцами, игнорируемыми через 32 секунды.
[81] Фигура 41 иллюстрирует сравнительный результат между желательным профилем усиления (сплошная линия) и прогнозируемым усилением с использованием алгоритма генерирования протокола в Таблице 18 (пунктирная линия). Объем контраста 115 мл и скорость потока 4,1 мл/с рассчитывали с помощью алгоритма для генерирования профиля усиления, показанного в фигуре. Желательная продолжительность сканирования составила 30 секунд.
[82] Фигура 42 иллюстрирует вариант осуществления экспериментов по проверке генерирования протоколов.
[83] Фигура 43 иллюстрирует результат воспроизведения гибридной модели с использованием данных инъекционного протокола субъекта 8, рассчитанного с помощью способа, представленного в этом разделе. Субъект 8 из набора клинических данных использовался для параметризации гибридной модели. "Точка-тире" ТЕС (с пиками при ~130 HU) является кривой усиления пробного болюса для левых отделов сердца. Пунктирную ТЕС генерировали с помощью инъекционного протокола (скорость потока 4,52 мл/с, 67,8 мл, 15 с), визуализированного с помощью сплошного прямоугольника внизу слева на фигуре (скорость потока умножена на 10). "Точка-тире" горизонтальная линия, пересекающая вершину диагностической ТЕС, является целевым усилением Мни 300 HU. Две сплошные вертикальные линии представляют окно продолжительности сканирования, начиная с TSDiy, рассчитанное с помощью алгоритма и длящееся в течение 4 секунд.
[84] Фигура 44 иллюстрирует значения усиления, большие, чем целевые 350 HU для продолжительности сканирования, построенные на графике для всех 20 воспроизведенных субъектов. Горизонтальная пунктирная линия на 2 секунды является продолжительностью сканирования для всех серий.
[85] Фигура 45 иллюстрирует значения усиления, большие, чем целевые 250 HU для продолжительности сканирования, построенные на графике для всех 20 воспроизведенных субъектов. Горизонтальная пунктирная линия на 8 секунд является продолжительностью сканирования для всех серий.
[86] Фигура 46 иллюстрирует пример графика Пикара с использованием клинических данных. Ось х является индексом значений, а ось у является логарифмическим преобразованием коэффициентов Фурье |uib|. Единичные значения построены на графике с ромбами и соединены сплошной линией.
[87] Фигура 47 иллюстрирует пример "L-кривой", построенной с помощью набора клинических данных.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРТЕНИЯ
[88] Как используется в настоящем документе и в прилагаемой формуле изобретения, формы единственного числа включают множественные ссылки, если содержание ясно не диктует иное. Таким образом, например, ссылка на "некий параметр" включает множество таких параметров и их эквивалентов, известных специалистам в данной области техники, и так далее, а ссылка на "конкретный параметр" является ссылкой на один или несколько таких параметров и эквивалентов, известных специалистам в данной области техники, и так далее.
[89] В нескольких показательных вариантах осуществления используется парадигма физиологически обоснованного или РВРК моделирования. В ряде вариантов осуществления РВРК модели могут, например, быть преобразованы в область с дискретным временем. Кроме того, ряд вариантов осуществления моделей предусматривают точное введение транспортных задержек в динамику лекарственных препаратов (то есть, время распространения, например, контраста через легочную сосудистую систему). Распределение препарата в сосудистых структурах тела может быть описано. Хотя модели, описанные в настоящем документе, могут быть использованы в моделировании распределения фармацевтических препаратов в целом, в нескольких показательных вариантах осуществления субъектом для моделей является КТ ангиография во время артериальной фазы распределения контраста. Поскольку модели, описанные в настоящем документе, сочетают ряд моделируемых топологий и включают параметризацию некоторым образом контрастной модели Вае, такие модели собирательно называются в настоящем документе как «гибридная» модель. Как описано выше, однако, в отличие, например, от модели Вае, гибридная модель может быть преобразована в область с дискретным временем. Более того, в дополнение к введению конфигурируемых периодов транспортной задержки в структуру модели и нелинейности насыщения в компартменте ввода (периферические вены), ряд вариантов осуществления гибридной модели предусматривает воспроизведение инъекционных фаз различных концентраций контрастного агента, включая инъекционную фазу или фазы, в которых вводится жидкость с минимумом или отсутствием агента контрастного усиления (например, инъекционная фаза растворителя или физиологического раствора, которая иногда называется как фаза промывки или вытеснения после инъекции контраста). Предыдущие физиологически обоснованные фармакокинетические модели для распространения, например, контрастного вещества, не моделируют эффекты, например, такой фазы физиологического раствора или другой «промывки» (которая обычно используется во время КТА процедур визуализации) при контрастном усилении in vivo. Гибридная модель из этого документа способна моделировать, например, транспорт контраста даже после того, как инъекция контраста прекращается, поскольку объемная скорость потока крови в периферическом компартменте увеличивается объемной скоростью потока контраста или физиологического раствора или другого болюса, включая агент, не усиливающий контраст.Объемная скорость потока крови и массовая скорость потока агента контрастного усиления обрабатывается независимо. В ряде вариантов осуществления гибридная модель включает уменьшенное число состояний по сравнению с моделью Вае для всего тела, в то время как сравнения между результатами гибридной модели и модели Вае для всего тела являются благоприятными. Например, низкие ошибки прогноза измерены с использованием гибридной модели. В некоторых случаях гибридная модель превосходит модель Вае, когда клинические данные используются для сравнения характеристики обеих моделей.
[90] В ряде вариантов осуществления используются способы с управлением данными для прогнозирования или моделирования распространения фармацевтического препарата с использованием одной или нескольких кривых времени усиления контраста (TECs) из, например, пробной инъекции контрастного вещества. В ряде вариантов осуществления основанный на модели или параметрический метод идентификации используется для определения одного или нескольких параметров для модели РВРК, такой как гибридная модель, обсужденная выше. В ряде таких вариантов осуществления применяется стратегия предварительной обработки модели, когда наиболее важные компартменты гибридной модели рассматриваются во время первого прохода контрастного агента (например, периферический венозный компартмент, компартмент правых отделов сердца, компартмент легких и компартмент левых отделов сердца/аорты). В показательных исследованиях в этом документе не делалось попыток подогнать все параметры гибридной модели, рассматривая ограниченную длину данных, доступных из пробных болюсных ТЕС.Однако при обеспечении достаточного количества данных все параметры гибридной модели могут быть определены.
[91] Непараметрические методы или методы независимой идентификации модели также могут быть использованы для генерирования непараметрической оценки распространения фармацевтического препарата. В некоторых вариантах осуществления непараметрическую оценку системы фармацевтический препарат/пациент генерировали путем решения обратной задачи с использованием усеченного деконволюционного метода разложения по сингулярным числам матрицы (tSVD).
[92] Модели, описанные в настоящем документе, могут быть использованы не только для прогноза фармакокинетики фармацевтического препарата (такого как контрастное вещество или материал) в человеческой сердечно-сосудистой системе, но могут обеспечить системы и/или способы для генерирования или вычисления одного или нескольких параметров инъекционной процедуры (например, одного или нескольких параметров инъекционного протокола и/или сканирования), которая достигает, например, предполагаемые выбранные цели усиления для индивидуального пациента и процедуры при использовании уменьшенного или минимального объема контрастного вещества.
[93] Например, в ряде вариантов осуществления, способы прогноза контрастного усиления с управлением данными, как описано выше, использовали в способах генерирования протокола/параметров, системах или алгоритмах для успешного генерирования профилей контрастного усиления по всему диапазону процедур и переменных пациента.
[94] Как используется в настоящем документе, что касается инъекционной процедуры, термины «инъекционный протокол» или «протокол» относится к группе инъекционных переменных или параметров, таких как скорость потока, введенный объем, продолжительность инъекции, концентрация контрастного агент и т.д., которые определяют, например, хронометраж, количество и/или природу жидкости(ей), которые должны быть доставлены пациенту во время инъекционной процедуры. Такие параметры могут меняться в ходе инъекционной процедуры. Как используется в настоящем документе, термин «фаза» относится в целом к группе параметров, которые определяют, например, хронометраж, количество и/или природу жидкости(ей), которые должны быть доставлены пациенту в течение периода времени (или продолжительности фазы), который может быть меньше, чем общая продолжительность инъекционной процедуры. Таким образом, параметры фазы предоставляют описание инъекции в течение образца времени соответственно времени продолжительности фазы. Инъекционный протокол для отдельной инъекционной процедуры может, например, быть описан как однофазный (единственная фаза), двухфазный (две фазы) или многофазный (две или более фаз, но, как правило, более, чем две фазы). Многофазные инъекции также включают инъекции, в которых параметры могут меняться непрерывно в течение, по меньшей мере, части инъекционной процедуры.
[95] Параметры сканера, которые могут быть определены, включают, но не ограничиваясь, количество излучения, пропускаемого через пациента, энергозатраты (например, напряжение или сила тока), хронометраж (например, время начала сканирования, время остановки, время задержки и/или продолжительность).
[96] В некоторых вариантах осуществления система, включающая модель, как описано в настоящем документе, может включать инъекционную систему, включая, например, двойную шприц-инъекторную систему 100, как проиллюстрировано на фигуре 1 В. Двойная шприц-инъекторная система, например, раскрыта в патенте США №6643537, опубликованной публикации заявки на патент США №2004-0064041 и РСТ заявке на международный патент PCT/US2007/026194. Инъекторная система 100 может, например, включать источники доставки двух жидкостей (иногда называемые как источник "А" и источник "В" в настоящем документе; такие как шприцы), действующие для введения первой жидкости и/или второй жидкости (например, жидкость контрастного усиления, физиологический раствор и т.д.) пациенту независимо (например, одновременно, одновременно в различных пропорциях объемного потока относительно друг друга, или последовательно, или следом друг за другом (то есть, А затем В, или В затем А)). В варианте осуществления Фигуры 1В, источник А функционально связан с нагнетательным механизмом, таким как элемент привода 110А, а источник В функционально связан с нагнетательным механизмом, таким как элемент привода 100В. Инъекционная система включает систему 200 управления в функциональной связи с инъекторной системой 100, действующую для управления работой элементами привода 110А и 110В для управления инъекцией жидкости А (например, контрастного вещества) из источника А и инъекцией жидкости В (например, физиологического раствора) из источника В, соответственно. Система 200 управления может, например, включать или быть в связи с интерфейсом пользователя, содержащим дисплей 210. В проиллюстрированном варианте осуществления фигуры 1В, проиллюстрирована часть одного варианта осуществления экранного дисплея, который показывает область параметров для скорости потока инъекции, объема инъекции и продолжительности инъекции для, например, трех фаз инъекции жидкости А и/или жидкости В. Параметры для одной или нескольких таких фаз могут быть заполнены с использованием систем генерирования параметров и способов из этого документа. Фигура 1С иллюстрирует другой вариант осуществления экранного дисплея.
[97] Пользователю может быть предоставлено право выбора регулировать и/или отменять протокол или генерированные параметры (например, с помощью системы 205 ручного ввода, включая вспомогательную клавиатуру, клавиатуру, мышь и т.д., как известно в области компьютерной техники). Система 200 управления может включать процессор 220 (например, цифровой микропроцессор, как известно в данной области техники) в функциональной связи с памятью или системой 230 памяти.
[98] Как ясно специалисту в данной области техники, многие инъекторы или системы доставки жидкости, включая системы для одновременной доставки жидкости нескольким пациентам, как, например, раскрыто в патентах США №№7326186, 7094216, 6866654, 6972001, 6699219, 6471674, 6306117, 6149627, 6063052, 5920054, 5843037, 5827219, 5739508 и 5569181, также подходят для применения в связи с моделями настоящего документа.
[99] Система 300 визуализации может, например, быть системой КТ, системой магнитно-резонансного формирования изображений (МРТ), системой ультразвуковой визуализации, или системой позитронно-эмиссионной томографии (PET) или системой однофотонной эмиссионной компьютерной томографии (SPECT), как описано выше. Инъекторная система может быть в коммуникативной связи с, или частично, или полностью интегрирована с системой 300 визуализации. Система 300 визуализации и инъекторная система 100 может, например, быть в коммуникативной связи через порты ввода/вывода (представлены окончаниями стрелок в фигуре 2В), как известно в данной области техники. В фигуре 1 В система 300 визуализации и инъекторная система 100, например, проиллюстрированы в коммуникативной связи через общий коммуникационный узел 400. Альтернативно, может быть установлена прямая линия связи. Дополнительные данные из одной из систем 300 визуализации и инъекционной системы 100 могут быть введены вручную с использованием одной или нескольких систем ручного ввода (например, вспомогательных клавиатур, клавиатур, мыши и т.д.), как известно в области компьютерной техники. Система 300 визуализации и инъекторная система или инъектор 100 также могут быть частично или полностью интегрированы, как описано, например, в публикации РСТ Международной патентной заявки WO 2008/011401, раскрытие которой включено в настоящий документ с помощью ссылки. Один, множество всех проиллюстрированных компонентов инъекционной системы и системы 300 визуализации могут также или альтернативно быть интегрированы с, или включены в другой, отдельный компонент, который размещается в коммуникативной связи с другими компонентами системы.
[100] Программное и/или аппаратное обеспечение, заключающее в себе системы и способы, как описано в настоящем документе, или любую их часть, может, например, быть заключено или быть включено в пределах одного или нескольких компонентов системы (например, в пределах инъекторной системы 100 и/или в пределах системы 300 визуализации) или в пределах одной или нескольких отдельных или автономных систем, представленных системой 500, которая может, например, включать по меньшей мере один процессор (например, цифровой микропроцессор), систему 520 памяти, дисплей 510 и систему 505 ручного ввода. В варианте осуществления, проиллюстрированном в фигуре 1В, система 500 показана в коммуникативной связи с коммуникационным узлом 400. Как описано выше, прямая линия связи также может быть установлена. Дополнительные данные из одной или нескольких систем могут быть введены вручную в одну или несколько других систем с использованием одной или нескольких систем ручного ввода (например, вспомогательных клавиатур, клавиатур, мыши и т.д.) как известно в области компьютерной техники. Программное обеспечение, заключающее в себе системы и способы настоящего изобретения (включая, например, один или несколько исполняемых компьютерных алгоритмов для них) может, например, сохраняться в памяти 530 и исполняться процессором 520. Как ясно специалисту в данной области техники, вся или часть функциональности моделирования и/или генерирования параметров способов и/или систем могут альтернативно находиться в системе 300 визуализации (которая может, например, включать, по меньшей мере, один процессор 320, систему 330 памяти, дисплей 310 и систему ручного ввода 305) и/или в инъекторной системе 100.
[101] В некоторых показательных вариантах осуществления способы и системы, описанные в настоящем документе, используются в связи с КТ сосудистой сети грудной клетки и сердца. Однако способы и/или системы, описанные в настоящем документе, для контрастного усиления КТ сосудистой сети грудной клетки и сердца у конкретного пациента также применимы к другим анатомическим зонам тела. В частности, периферическая артериальная ангиография артерий нижних конечностей является сложной задачей в результате скорости сбора данных современными КТ сканерами. Во многих случаях сканер должен быть замедлен для учета физиологических процессов транспортировки контрастного болюса через сосудистую сеть. Обычно пациенты, нуждающиеся в периферических артериальных КТА исследованиях, также являются диабетическими или имеют другую почечную недостаточность и потенциально восприимчивых к почечному повреждению из-за больших объемов контрастного вещества. Таким образом, вычисление уменьшенного или минимального объема дозы контраста у пациентов, как описано в настоящем документе, могут, например, быть желательными.
[102] Способы и/или системы, как описано в настоящем документе, также могут быть использованы в неврологическом КТ визуализировании. Короткий болюс контраста, точно и индивидуально рассчитанный во времени, важен для КТА артерий мозга. Важно в этих исследованиях синхронизировать сканирование до заполнения вен головы контрастом.
[103] Способы и/или системы, описанные в настоящем документе, также могут быть использованы в сценарии прогнозирующего контрастного усиления, в котором не вводится пробный болюс.Некоторые радиологи предпочитают программное обеспечение болюсного отслеживания методологии пробного болюса для синхронизации получения сканирования с поступлением контраста. В этих случаях гибридная модель (допуская, что демографические данные пациента доступны) может быть использована для определения априори протокола инъекции контраста для достижения желаемых целей в итерационном виде. Реальный гемодинамический статус пациента как правило недоступен при построении протокола контрастирования. Также из-за транспортных задержек в распространении контраста через сердечно-легочную циркуляцию после введения болюса нет «управления», которое может быть приложено к болюсу для конкретного пациента. Тем не менее, использование модели в этом подходе без обратной связи все же превосходит дозирование без какого либо рассмотрения габитуса и физиологии пациента. Более того, можно применять гибридную модель и данные, собранные во время получения болюсного отслеживания сканером в рамках Управления с Прогнозирующими Моделями.
[104] Контрастные агенты на основе гадолиния (Gd) в плановом порядке доставляются в течение МРТ-осмотров для обеспечения усиленной визуализации артериальных и венозных структур (MP-ангиография). Способы и/или системы, описанные в настоящем документе, могут, например, быть использованы для MP (и других применений визуализации), в то же время, например, признавая, что отношение между интенсивностью сигнала и концентрации в плазме крови, например, Gd контрастного агента не линейное, как при КТ контрастными агентами.
[105] Гибридная модель
[106] Физиологически обоснованное фармакокинетическое моделирование (РВРК), является подходом моделирования, который рассматривает релевантную физиологию и функцию при определении структуры модели. В модели РВРК тело разделяется на ряд взаимосвязанных компартментов, соответствующих анатомическим зонам. Каждый компартмент параметризуется (объем, кровоток, перфузия) на основе физиологического и анатомического рассмотрений организма, и каждый связан сосудистыми компартментами, которые облегчают конвективный транспорт групп в и от компартмента. Преимуществом такого подхода является возможность регулирования объема модели по группам без изменения структуры модели. Математической основой модели РВРК является сохранения массы между различными компартментами.
[107] Компартменты варианта осуществления контрастного вещества гибридной модели настоящего документа показаны в фигуре 1А. Каждая подсистема в модели представляет анатомическую зону тела. Подсистемы в модели РВРК делятся на три компартмента - внутриклеточное, внеклеточное и внутрисосудистое пространства. Контрастное вещество не входит во внутриклеточное пространство, и поэтому это не учитывается в ряде вариантов РВРК моделей распространения контрастного вещества.
[108] Переменная состояния, х, для некоторых вариантов осуществления гибридной модели РВРК является массой контрастного вещества в компартменте (xi). Объемная скорость потока крови/контраста в i-том компартменте обозначается Qi а объемы обозначаются переменной Vi. Выведение контрастного вещества из подсистемы, Cl, происходит путем необратимого процесса. Извлечение контрастного вещества происходит путем клубочковой фильтрации через почки.
[109] В вариантах осуществления, где модель предназначена для изучения и прогнозирования распространения контрастного вещества во время КТ-ангиографии, количественная оценка концентрации в плазме крови во время первого прохода агента в теле является первоочередной задачей, и меньше интереса в описании поглощения и распределения контрастного вещества, когда оно диффундирует через системные органы и паренхиму, за исключением подсистемы легких. В таких вариантах осуществления модели необходимо рассмотреть только сосудистые компартменты периферических вен, правых и левых отделов сердце и большой круг кровообращения.
[110] Массовый "поток" (J) в или из компартмента модели составляет:
[111 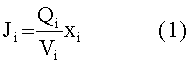
[112] В уравнении 1 Q является объемной скоростью потока и V является видимым объемом компартмента. Фракции потока fBODY и fPER определяют объем сердечного выброса через соответствующие сегменты тела. Суммирование фракций потока должно
равняться сердечному выбросу, QCO: fPERQCO+fBODYQCO=Qco. Для сосудистых компартментов в этой модели видимый объем является внутрисосудистым объемом крови. Применение баланса масс в подсистемах модели приводит к следующему общему выражению для подсистем в фигуре 1А, Периферическое, Легкие, Правые отделы сердца, Левые отделы сердца, и Тело (i=1:5)
[113] 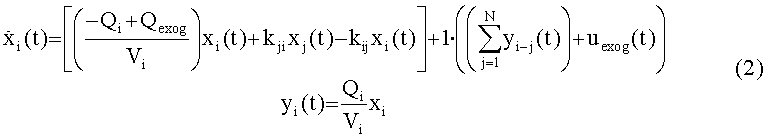
[114] В уравнении 2 uexog(t) является экзогенным введением контрастного вещества. Оно не равно нулю только в периферическом компартменте и определяется по:
[115] 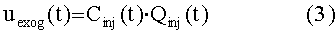
[116] поскольку скорость потока введения Qinj(t), или концентрация введенного контрастного агента Cinj(t), может меняться как функция от времени. Произведение объемной скорости потока и концентрации контраста называется скорость введения йода.
[117] Контрастный агент вводят в периферическую вену в левую или правую руку человека. Эндогенная скорость потока крови, протекающей через периферические вены на руке, колеблется от 2-4 мл/с.Вполне вероятно, что высокая скорость потока контраста в небольших периферических венах увлекает поток крови и, таким образом, скорость инъекции является добавкой к эндогенной скорости потока крови в периферической вене. Скорости потока с КТА осмотром, как правило больше, чем эндогенная скорость потока крови, протекающей через периферические вены. Инъекция контраста в периферические вены приводит к аддитивному вкладу в эндогенную скорость потока через вены. Математически, периферическая венозная подсистема является линейной меняющейся во времени формулировкой баланса массы в периферической подсистеме, тогда, в результате инъекции контраста:
[118] 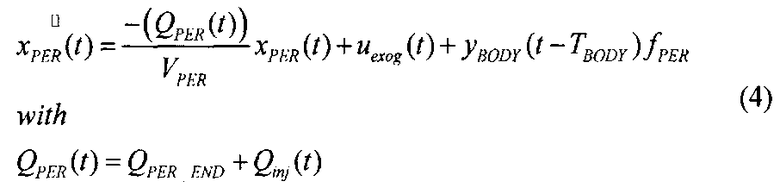
[119] В уравнении 4 Qperend является эндогенной скоростью потока крови через периферическую вену и Tbody является транспортной задержкой контраста, рециркулирующего через все тело обратно по периферическим венам. Чтобы избежать формулирования изменяющейся во времени модели для полной модели, уравнение 4 может быть перестроено, учитывая, что после инъекции QPER(t)=QPER_END, и что во время инъекции скорость потока равна сумме QPER_END+QInj. Транспортные задержки, введенные системой кровообращения, обозначены Tper и TBody и представляют задержки выхода контрастного агента из периферических подсистем и тела. Временные задержки могут быть константами или функциями объема и скорости потока крови в соответствующих системах. Подробности относительно временных задержек обсуждается дополнительно ниже. В последующем развитии Tinj представляет продолжительность инъекции контраста. При этих предположениях динамика периферических подсистем может быть выражена в стандартном LTI, в формулировке в пространстве состояний, как:
[120] 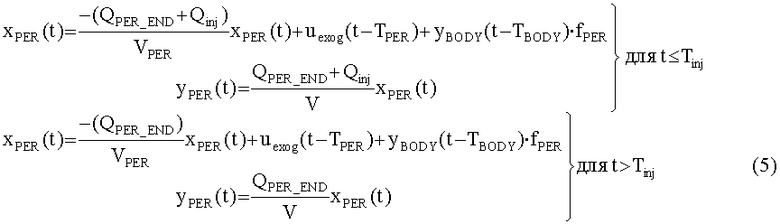
[121] В уравнении 5 yPER(t) является массовым потоком (единицы гI/c) контраста, выходящего из периферической подсистемы. Концентрация в периферической подсистеме xPER(t) делится на объем крови в периферических венах.
[122] Общим решением уравнения 4 является:
[123] 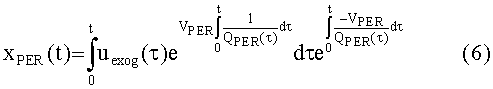
[124] Поведение насыщения влияет на скорость потока инъекции в периферический компартмент. Эмпирические данные свидетельствуют о том, что инъекции, большие, чем 8-10 мл/с, насыщают из-за податливой природы периферических вен или из-за рефлюкса контраста через правое предсердие в нижнюю полую вену. Обобщенное описание динамики периферического компартмента, поэтому:
[125] 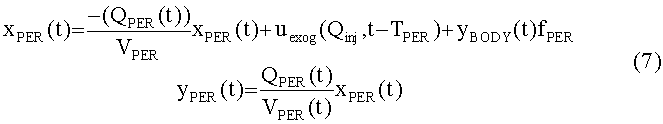
[126] где нелинейная функция экзогенного ввода является:
[127] 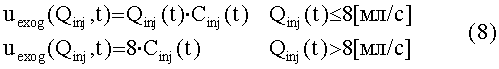
[128] Сохранение массы, приложенной к подсистеме правых отделов сердца в фигуре 1, составляет:
[129] 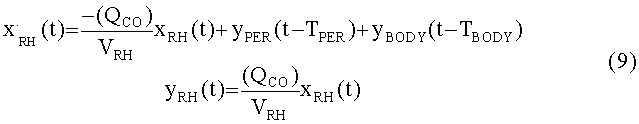
[130] Подсистема легких отличается от чистых сосудистых подсистем тем, что роль проницаемости между капиллярным руслом и легкими моделируется. Рассмотрение тканевого компартмента сделано для полноты и для вариантов осуществления, в которых эффект рециркуляции и накопления контраста в ткани будет интересовать.
[131] 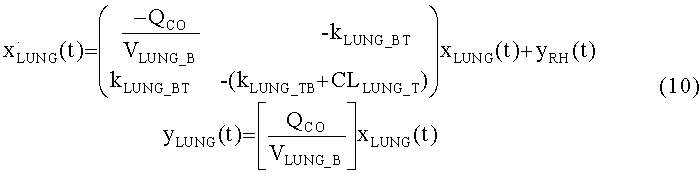
[132] В уравнении 10 QCO является сердечным выбросом, KLUNG_BT - коэффициент скорости переноса контраста из компартмента крови в компартмент ткани, kLUNG_TB -коэффициент скорости переноса из компартмента ткани обратно в компартмент крови, и CLLUNG_T представляет элемент необратимого выведения из компартмента ткани.
[133] Задержка контраста через легочную сосудистую сеть моделируется как элемент задержки ввода в динамике подсистемы левых отделов сердца:
[134] 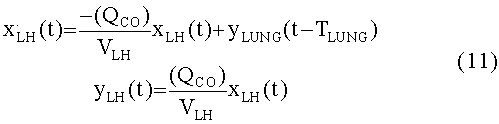
[135] и yLUNG(t) является массовым потоком контраста, выходящим из подсистемы легких. TLUNG является временем задержки прохождения болюса через легочную сосудистую сеть. Оно может быть скалярной константой или функцией сердечного выброса и объема крови в легких.
[136] Первый проход распределения и распространения контрастного болюса представляет значительный интерес для применений КТ ангиографии. Поскольку компартменты органов, мышц и жира влияют на распределение контраста после нескольких раз рециркуляции, они не рассматриваются в нескольких вариантах осуществления. Другие складывают большой круг кровообращения в один, крупный сосудистый компартмент, и большой круг кровообращения моделируется таким образом в ряде вариантов осуществления.
[137] 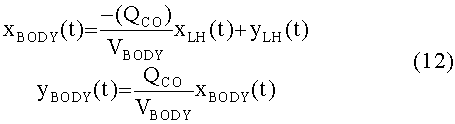
[138] Объединенная формулировка модели, объединяющая уравнения с 4 по 12, может быть изложена для облегчения выполнения в численных воспроизведениях. Для удобства обозначения и обеспечения того, чтобы транспортные задержки появлялись только в качестве входных и выходных задержек, определяется расширенный вектор состояния, содержащий переменные состояния для каждого из разделов модели. Подсистемы правых отделов сердца, легких и левых отделов сердца объединяются в сердечно-легочный (CP) вектор состояния:
[139] 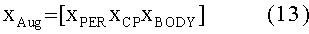
[140] где сердечно-легочный (CP) вектор состояния состоит из переменных состояния правых отделов сердца, легких и левых отделов сердца:
[141] 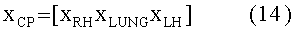
[142] Общая система выражается как:
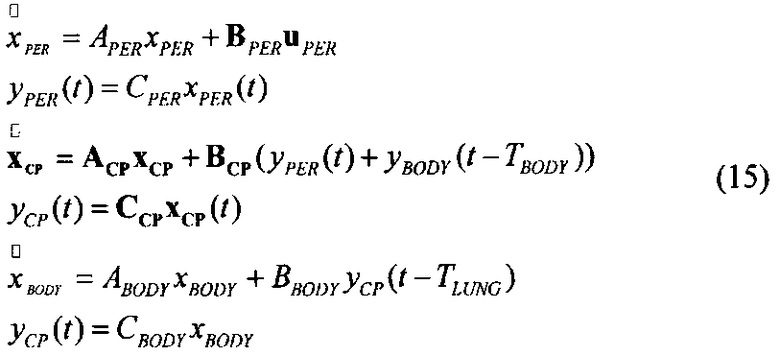
[144] Вектор входа в периферическую подсистему состоит из экзогенной инъекции контрастного вещества через периферическую вену и рециркулированного контраста из подсистемы тела:
[145] 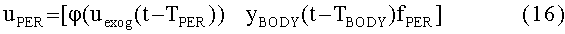
[146] Концентрация контраста в плазме крови в подсистеме тела регулируется фракцией потока, fPER. Скалярная функция, φ(Uexog) в уравнении 16 определяет поведение нелинейности насыщения венозной системы между местом инъекции и правыми отделами сердца, описанными в уравнении 8.
[147] 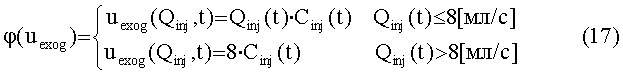
[148] Матрица состояния:
[149] 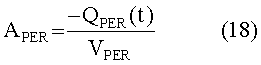
[150] 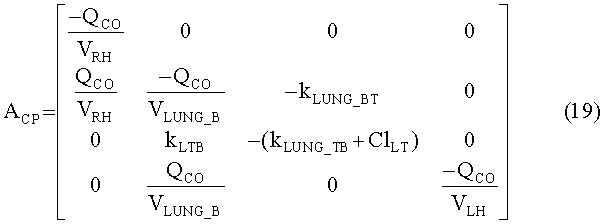
[151] 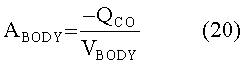
[152] изменяющийся во времени поток через периферическое кровообращение QPER(t) определен в уравнении 4. Контрольные матрицы(В):
[153] 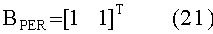
[154] 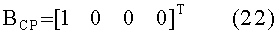
[155] 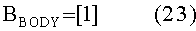
[156] 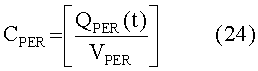
[157] 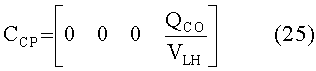
[158] 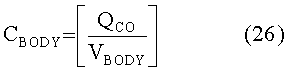
[159] Вариант осуществления полно-интеграторного вида модели показан на фигуре 2.
[160] При выборе значений параметра модели для численных воспроизведений баланс между точностью и разумной реализуемостью может быть выполнен. Может быть трудно вывести значения параметров для каждого суб-компартмента, которые соответствуют истинным физиологическим параметрам индивидуума. В ряде вариантов осуществления стандартные физиологические "справочные" таблицы и отношения, определенные с помощью регрессионного анализа популяционных данных, были использованы для определения одного или нескольких параметров. Любое число отношений может, например, быть использовано для определения одного или нескольких параметров. Как обсуждается ниже, различные РВРК способы идентификации моделей с использованием данных пробного болюсного усиления от пациентов также могут быть использованы для определения параметров. В ряде модельных исследований были использованы значения параметров на основе исключительно демографических данных (рост, вес, пол, возраст) и специфические процедурные значения, такие как скорость потока, объем и концентрация контрастного вещества.
[161] Формула регрессии с поправкой на возраст может быть использована для оценки сердечного выброса и объема крови, как изложено в Guyton A., Circulatory physiology:cardiac output and its regulation. 1963, Philadelphia PA: Saunders. В ряде вариантов осуществления эта оценка сердечного выброса используется здесь и предоставляет оценку сердечного выброса при воспроизведении модели. Оценочная функция является:
[162] 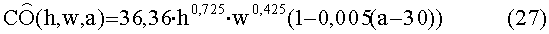
[163] где параметры h, w, и а являются ростом [дюймы], весом [фунты] и возрастом [годы]. Оценка или измерение сердечного выброса обсуждается также в опубликованной заявке на патент США №2010/0030073. Основная оценочная функция объема крови в модели также получена из опубликованной формулы регрессии и является функцией роста, веса и пола. Расчетный объем крови для мужчин составляет:
[164] 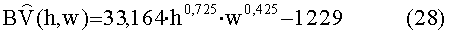
[165] и для женщин:
[166] 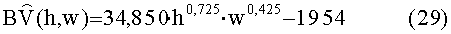
[167] Параметры регионального объема крови по всей модели равны общему объему крови, рассчитанному по уравнению 28 или уравнению 29. Объемная скорость потока крови через каждый суб-компартмент, за исключением периферических, является сердечным выбросом, вычисленным по уравнению 27. Объемы крови в различных подсистемах могут, например, быть установлены в соответствии с отношениями, изложенными в Вае, К.Т., J.P.Heiken, and J.A.Brink, Aortic and hepatic contrast medium enhancement at CT. Part I. Prediction with a computer model. Radiology, 1998. 207(3): p.647-55. Вместо устанавливания объема крови левых отделов сердца на 3,6% от общего объема крови, как согласно Вае et al., тем не менее, дополнительные 100 мл крови добавляются в нескольких вариантах осуществления модели РВРК в настоящем документе, для включения восходящей части дуги аорты в вычисления. В ряде вариантов осуществления процедурой для конфигурирования объема крови для данного субъекта является вычисление оценки сердечного выброса и объема крови с использованием роста, веса, возраста и пола. Региональные объемы крови затем вычисляют с использованием отношений в Таблице 1.
[168] Дополнительные параметры модели включают коэффициенты скорости переноса между компартментами легких, крови и тканей и выведения контраста из основного компартмента крови. Поскольку извлечение контрастного вещества из компартментов кровоснабжения и тканей происходит минуты после болюсной инъекции, период выведения (CLUNG_T) может быть установлен в ноль. Таким же образом, на первом проходе контрастного вещества существует небольшой перенос контрастного вещества через легочное капиллярное русло, и последующее накопление в ткани минимально. Константы скорости легочного переноса поэтому могут быть установлены в ноль.
[169] Последними рассматриваемыми параметрами являются задержки распространения контрастного болюса через периферическую венозную циркуляцию (TPER), время распространения через легочную систему (TLUNG) и задержка рециркуляции болюса во всей системе кровообращения (TBODY).
[170] В ряде вариантов осуществления задержка системы рециркуляции остается постоянной на, например, 30 секунд. Рассмотрение одной или нескольких переменных или значений на одного пациента или конкретных для пациента, однако, делается для двух других задержек распространения. TPER является функцией объема крови в периферической венозной подсистеме и суммой скорости инъекции и эндогенного венозного потока. Таким же образом, задержка распространения через легочный компартмент является функцией легочного объема крови и расчетного сердечного выброса для каждого субъекта. Задержка системы рециркуляции может также быть сделана зависимой от одной или нескольких конкретных переменных пациента. В некоторых вариантах осуществления делается допущение жесткого течения для задержек TPER и TLUNG. Описание задержек распространения, использованных в модели, даны в Таблице 2.
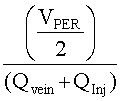
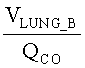
[171] Производительность модели в зависимости от различных параметров и входов представляется ниже и сравнивается с прогнозами модели Вае (как опубликованными, так и в результате выполнения модели в Simulink). Способность новой модели для прогноза контрастного усиления на наборе данных человека описывается, а также сравнивается с прогнозами модели Вае.
[172] В ряде модельных исследований параметры инъекции и параметры модели были изменены для демонстрации способности модели имитировать известные поведения динамики контраста. Проводились воспроизведения, демонстрирующие способность модели воспроизводить эффект различных сердечных выбросов на контрастное усиление. Поведение насыщения контрастного усиления, как увеличение скоростей инъекции было продемонстрировано с помощью воспроизведения модели, также как и эффекты промывки физиологическим раствором после инъекции контрастного вещества.
[173] Фигура 3 представляет воспроизведение контрастного усиления в легочной артерии и восходящей части дуги аорты для виртуального пациента с номинальными атрибутами. Эта модель была выполнена и воспроизведена в MATLAB (R2008b). Параметры пациента для данного примера были, вес =170 фунтов, рост =68 дюймов, пол = мужской, возраст =35 лет. Используя уравнение 27, расчетный сердечный выброс составил 6,60 л/мин. Протокол инъекции контраста состоял из контраста с концентрацией контрастного агента 370 мгI/мл, введенного при объемной скорости потока (Qinj(t)) 5 мл/с в течение 20 секунд (объем =100 мл). Объем 30 мл физиологического раствора вводили при 5 мл/с в течение 6 секунд. Отмечаются пики усиления в восходящей части дуги аорты 5-6 секунд после максимального усиления в легочной артерии, как и ожидалось. Таким же образом, уровень усиления в компартменте восходящей части дуги аорты ~100 HU ниже, чем в легочной артерии, как ожидалось, поскольку болюс разбавлялся между легочным стволом и восходящей частью дуги аорты. Можно оценить системную рециркуляцию контрастного вещества, отметив вторичный пик усиления контраста в легочной артерии на 50 секунд, и появление в восходящей части дуги аорты вторичного пика около 60 секунд.
[174] Был проведен другой эксперимент, в котором проводился ряд воспроизведений. Для одного воспроизведенного пациента параметры инъекции контраста удерживались постоянными по набору для демонстрации возможности модели реплицировать влияния сердечного выброса на контрастное усиление. Параметры инъекции: концентрация введенного контраста 370 мгI/мл при 5 мл/с в течение 10 секунд (объем =50 мл), с последующей фазой промывки физиологическим раствором 30 мл при 5 мл/с.Сердечный выброс виртуального пациента был скорректирован от низкого значения (3 л/мин) до высокого значения (8 л/мин) с шагом 1 л/мин. В этом эксперименте допускалось, что сердечным выбросом можно манипулировать независимо от объема крови. Объем крови для виртуального пациента удерживался постоянным для каждого из значений сердечного выброса (используя те же параметры, как и в предыдущем эксперименте: 170 фунтов, 68 дюймов, 35-летний мужчина). Более короткая продолжительность инъекции, чем в предыдущем примере, была использована, чтобы избежать феномена рециркуляции при низких значениях сердечного выброса.
[175] Пиковый уровень контрастного усиления в восходящей части дуги аорты и время максимального контрастного усиления были записаны и представлены графически на фигуре 4. Мы ожидаем, что поскольку сердечный выброс увеличивается, время поступления контрастного болюса в сосудистую область уменьшается. Таким же образом, поскольку сердечный выброс увеличивается, мы ожидаем уменьшение контрастного усиления в сосудистой структуре, как показано теоретически и эмпирически в предыдущих исследованиях.
[176] Гибридная модель также была воспроизведена в MATLAB/Simulink с использованием виртуального 35-летнего мужчины 68 см в высоту и весом 170 фунтов.
Три различных инъекционных протокола были использованы в этом наборе воспроизведений -5 мл/с 370 мгI/мл контраста в течение 10 секунд (объем =50 мл) с последующим вытеснением физиологическим раствором при 5 мл/с в течение 6 секунд (объем =30 мл), вытеснение физиологическим раствором при скорости потока 2,5 мл/с в течение 6 секунд (объем =15 мл), или без вытеснения физиологическим раствором. Полученные кривые времени усиления показаны на фигуре 5. Воспроизведения показали 14% увеличение пика усиления в аорте для протокола, в котором промывку физиологическим раствором вводили при такой же скорости потока, что и контрастный болюс. Время до пика усиления также было задержано на 0,8 секунды. Для инъекции, в которой физиологический раствор вводят при половине скорости потока контрастного болюса, увеличение пика усиления составило на 7% больше, чем при отсутствии введения промывки физиологическим раствором. Время пика усиления было смещено на 0,6 секунды. Эти результаты не могут быть реплицированы с моделями Вае, поскольку модели Вае не сформулированы так, чтобы позволить рассмотрение эффектов вытеснения физиологическим раствором или разбавления фазой промывки после введения контрастного болюса. Результаты продемонстрировали качественное совпадение ответа модели с результатами, продемонстрированными другими на животных моделях и людях.
[177] Как описано выше, результаты гибридной РВРК модели были сравнены с результатами моделей Вае. Совокупные данные из испытуемой когорты, опубликованные в Вае, К.Т., J.P.Heiken, and J.A.Brink, Aortic and hepatic contrast medium enhancement at CT. Part I. Prediction with a computer model. Radiology, 1998. 207(3): p.647-55, облегчили сравнение производительности. Пациенты были зачислены в три группы на основе протокола инъекции контраста. Были три протокола контрастирования, используемых в исследовании: двухфазный протокол с низкой скоростью потока, однофазный протокол с низкой скоростью потока, и однофазный протокол с высокой скоростью потока. Фаза промывки физиологическим раствором не была использована ни в одной из групп этого исследования.
[178] Данные однофазной с высокой скоростью потока когорты были использованы для вычисления новой модели. В этой группе средний вес тела 27 субъектов был 177 фунтов, а диапазон значений составил от 44,1 до 135,0 фунтов. Протокол контрастирования состоял из введения 320 мгI/мл контраста при 5,0 мл/с в течение 25 секунд (объем =125 мл). Не были представлены данные относительно ростового, полового или возрастного состава когорты, но авторы используют средний рост 68 дюймов и мужской пол при воспроизведении их модели. Сканирование одиночного уровня было выполнено на каждом из субъектов в середине брюшной аорты каждые 15 секунд в течение 120 секунд, а затем каждые 60 секунд до 300 секунд. ТЕС были созданы исследователями после размещения 1 см2 ROI на брюшной аорте по брюшной оси, а еще одного на паренхиме печени.
[179] Гибридная РВРК модель была выполнена в MATLAB/Simulink. Поскольку эмпирические результаты были собраны до 300 секунд, контраст имеет достаточно времени для рециркуляции через сосудистую систему. Элементы выведения были добавлены в модель для обеспечения адекватной динамики выведения/рециркуляции в кривых времени усиления или ТЕС. Типичная скорость гломерулярной фильтрации (GFR) была установлена при воспроизведении модели Вае (номинально 50-70 мл/мин), поскольку элемент выведения установлен до 19% объемного расхода крови в воспроизводимой почечной артерии.
[180] Ряд вариантов осуществления гибридной модели не содержит компартмент почек и механизм для имитации вывода в таких вариантах может, например, быть через компартмент легких. При сравнении воспроизведения опубликованных Вае эмпирических данных использовался коэффициент переноса кровь-ткань (kLUNG_BT) от 0,08 сек-1 и значение выведения компартмента (CLLUNG_T) от 0,1 сек для аппроксимации скорости выведения 60 мл/мин, поскольку нет значимого физиологического процесса для этой задачи, имеющего шкалу времени короче, чем 1 секунда. Слишком короткий временной шаг приводит к неэффективному воспроизведению, поскольку избыток времени берется для доставки таких же результатов, какие можно было бы получить с более длинным временным шагом. Воспроизведение, проведенное с временными шагами 0,01 и 0,001, не выявило никакой разницы в прогнозируемых усилениях.
[181] Результаты воспроизведения гибридной модели с использованием совокупных данных пациента из исследования Вае показаны в фигуре 6 следом за результатами совокупных данных усиления. Воспроизведение модели было выполнено с помощью решателя с фиксированным шагом (Рунге-Кутта) и временным шагом 0,1 секунды. Данные усиления были отобраны по нисходящей для лучшего визуального сравнения с эмпирическими данными.
[182] Среднее арифметическое пикового усиления группы с высокой скоростью потока у Вае, К.Т., J.P.Heiken, and J.A.Brink, Aortic and hepatic contrast medium enhancement at CT. Part I. Prediction with a computer model. Radiology, 1998. 207(3): p.647-55 сообщалось как 313,7 HU, а новая модель генерировала кривую усиления аорты с пиковым усилением 317,3 HU, процентная разница 1,15%. Модель Вае для всего тела генерировала кривую усиления с пиковым усилением 321,3 HU, процентная разница 2,42%. Время до пикового усиления, прогнозированное моделью, составило 31 секунду, время до пикового усиления, прогнозированное моделью Вае для всего тела составило 31 секунду, и эмпирические данные имели среднее время пикового усиления 32 секунды.
[183] Результаты проверки, представленные в Вае, К.Т., J.P.Heiken, and J.A.Brink, Aortic and hepatic contrast medium enhancement at CT. Part I. Prediction with a computer model. Radiology, 1998. 207(3): p.647-55, не оценивают полезность модели в воспроизведении индивидуальных профилей контрастного усиления. Для определения способности модели Вае для всего тела и модели РВРК настоящего документа предсказать индивидуальные профили контрастного усиления, результаты воспроизведения представляются с использованием индивидуальных признаков пациента (рост, вес, возраст, пол) от субъектов из клинического испытания КТА визуализаций для параметризации обеих моделей. Соответствующие профили усиления (данные, извлеченные из клинических изображений) по данным визуализации тех пациентов затем используется для сравнения результатов двух моделей.
[184] Три показателя были использованы для оценки прогнозирующей возможности обеих моделей - среднеквадратическая ошибка (RMSE), процентная разница в максимальном усилении (PDME), и показатель, описанный в Вае, К.Т., J.P.Heiken, and J.A.Brink, Aortic and hepatic contrast medium enhancement at CT. Part I. Prediction with a computer model. Radiology, 1998. 207(3): p.647-55, как «индекс разницы усиления (EDI)» (сумма разницы между воспроизведенными и эмпирическими кривыми усиления, полученными из наборов данных клинической визуализации, деленная на площадь под кривой эмпирических данных:
[185] 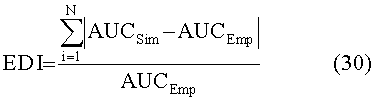
[186] где подписи "Sim" и "Emp" установлены для данных воспроизведенного ответа и эмпирических данных, соответственно.
[187] Набор данных исследования КТ-ангиографии был использован для сравнения характеристики гибридной модели и модели Вае для всего тела. Цель исследования заключалась в оценке для конкретного пациента оптимизированного алгоритма доставки контраста с использованием особенностей хронометража болюсного сканирования на уровне легочного ствола. 70 субъектов, подвергающихся рутинной коронарной КТА (кКТА) были включены в исследование, но данные от 20 из всех были использованы в сравнительных испытаниях, представленных здесь, поскольку данные пробного болюсного усиления и данные нисходящей части дуги аорты могут быть получены только для этого числа в связи с неполным хранением и передачей набора данных аксиальной КТ.
[188] Демографические данные от 20 субъектов, используемых в этом анализе, суммированы в Таблице 3. Средний вес в этом образце был средним арифметическим для взрослых в Соединенных Штатах (как изложено во Flegal, К.М., et al., Prevalance and trends in obesity among US adults, 1999-2000. JAMA, 2002. 288: p.4), а средний возраст является репрезентативным для населения, обычно требующего кКТА.
[189] Все субъекты в исследовании были отсканированы с помощью Dual Source КТ сканера (Definition DS, Siemens Medical, и Malvern РА) с использованием стандартных параметров сканирования. Всем субъектам вводили 20 мл пробного болюса из 300 мгI/мл контрастного вещества с последующими 30 мл промывки физиологическим раствором со скоростью потока 5 мл/с. Хронометраж болюсного сканирования был начат, приблизительно, (вариация возникает из-за программного обеспечения сканера) через 5 секунд после начала инъекции контраста, и одноуровневые сканирования были получены каждые 2 секунды до, приблизительно, 5 секунд после пикового усиления в восходящей части дуги аорты. Оператор сканера осмотрительно использовал остановку получения данных для уменьшения чрезмерного воздействия излучения на субъект, и согласованная длина собранных данных не была получена.
[190] ТЕС были созданы программным обеспечением сканера на основе зон интереса, или ROI, выделенных из легочного ствола и восходящей части дуги аорты оператором сканера. Моменты времени до пика и пиковые усиления в этих двух областях были использованы исследуемым программным обеспечением для вычисления у конкретного пациента скорости потока контраста, объема, контраста/добавки физиологического раствора, а также персонализированной задержки сканирования для диагностического КТ сканирования. Краткое изложение конкретных результатов процедуры представлены в Таблице 3 и Таблице 4. Многие факторы влияют на продолжительность сканирования при КТА осмотре, включая настройки сканера, частоту сердечных сокращений пациента, длину структуры, которая визуализируется. Задержка сканирования в этом наборе данных была вычислена с помощью исследуемого программного обеспечения, описанного в опубликованной РСТ заявке №WO 2009/012023.
[191] Протокол контрастирования, вычисляемый с помощью исследуемого программного обеспечения, состоял из 3 фаз - контраст только в части, фаза контраста и добавки физиологического раствора, и, наконец, только фаза «промывки» физиологическим раствором. Объем, приведенный в Таблице 4 для фазы 2, относится к объему контраста в фазе, тогда как объем фазы 3 является количеством физиологического раствора, доставленного в промывке. Поскольку контраст разбавляли в фазе 2, концентрация, представленная в Таблице 4, не является концентрацией исходного раствора (300 мгI/мл).
[192] Программный инструмент полуавтоматической сегментации был использован для извлечения данных времени усиления из наборов визуализации 20 субъектов (данные спиральной визуализации взяты из диагностического сканирования). Каждое осевое КТ изображение было отделено 0,375 мм. Время между блоками получения данных варьировало от 0,75 до 1 секунды. Пример набора данных представлен (субъект 1) на фигуре 7. Задержка сканирования для данного специфического получения составила 23 секунды, и поэтому временная ось начинается в 23 секунды. Поскольку данные усиления являются функцией от времени и пространства, соответствующая размерность пространства по всему набору данных накладывается на Х-оси фигур. Поскольку ФК модели генерируют прогнозы по времени в дискретных "компартментах", сравнения, используемые здесь, являются изображением данных с временным видом, извлеченных из аорты 20 субъектов.
[193] Для определения отношения между значением HU и концентрацией контрастного вещества в плазме крови, эксперимент с разбавленными количествами контрастного вещества проводили на сканере, использованном до клинического исследования. Разведенное контрастное вещество помещают в рентгеноконтрастные контейнеры и сканируют с использованием тех же параметров, используемых во время клинических испытаний. Коэффициент преобразования между HU и мгI/мл вычисляли с помощью линейной регрессии, что составляет 27,1 HU/(MGI/мл). Эта константа используется в воспроизведениях гибридной модели и модели Вае для преобразования концентрации йода в плазме в HU.
[194] Для обеспечения сравнения гибридной модели с моделью Вае с использованием данных клинической визуализации, было сделано осуществление ФК модели Вае для всего тела в MATLAB/Simulink. Параметры модели, описанной в Вае, К.Т., J.P.Heiken, and J.A.Brink, Aortic and hepatic contrast medium enhancement at CT. Part I. Prediction with a computer model. Radiology, 1998. 207(3): p.647-55 и получившие дальнейшее развитие в патенте США №5583902, были использованы при конфигурировании модели. Решатель с фиксированным временным шагом (Рунге-Кутта) выполнял модель каждые 0,1 секунды. Индивидуальные демографические данные субъектов (рост, вес, пол и возраст), вычисленные с помощью уравнений 27, 28 и 29, были использованы для вычисления сердечного выброса и оценок общего центрального объема крови для каждого воспроизведенного субъекта. Поскольку модель Вае, как опубликовано, не позволяет моделирования фазы промывки физиологическим раствором, протоколы контрастирования, используемые в воспроизведении модели, включают только контраст.Коэффициент пересчета 27,1 Ни/(мгI/мл) был использован в преобразовании концентрации в плазме крови в значения HU.
[195] Гибридная модель была воспроизведена с использованием параметров и способов, представленных в разделе 4.1.2. Как и в модели Вае, демографические данные субъектов и отношения, определенные по уравнениям 27, 28 и 29, обеспечили значения для сердечного выброса и объема крови. Значения параметров в Таблицах с 1 по 3 были использованы для конфигурирования модели. MATLAB/Simulink (R2008b) был использован для воспроизведения модели для каждого пациента с использованием клинических данных для параметров пациента и диагностической фазы протокола инъекции контраста, включая фазу промывки физиологическим раствором. Как и в модели Вае, коэффициент пересчета 27,1 Ни/(мгI/мл) преобразовывал концентрации в плазме в значения HU.
[196] Прогностические значения HU для каждого субъекта были субдискретизированы для соответствия временному разрешению кривых усиления из данных визуализации (1 с/отсчет). Только часть прогностических кривых усиления, охватывающих временной отрезок данных визуализации, была использована в вычислении сравнения показателей (MSE, PDME, EDI).
[197] Все 20 наборов демографических, процедурных данных и данных визуализации были достаточными для того, чтобы позволить воспроизведение моделей и вычисление показателей. Выход примера воспроизведения с использованием демографических и процедурных данных субъекта 11 построен на графике с использованием профиля контрастного усиления из данных визуализации на фигуре 8. Планки погрешностей на каждой точке данных визуализации являются стандартными отклонениями контрастного усиления, как это определено с помощью анализа всех пикселей в аорте на каждом расположении получения. Вклад в шум на каждой точке является внутренним шумом визуализации КТ сканера, динамики потока контраста, механизмов обработки изображения и движения структуры.
[198] Гибридная модель с использованием данных субъекта 11, 60-летней женщины, весящей 280 фунтов, ростом 68 дюймов, генерировала кривую усиления, благоприятно соответствующую - RMSE 15 HU - кривой усиления, полученной из данных визуализации аорты для этого пациента. Результаты для данного пациента показаны на фигуре 8, поскольку прогнозируемые кривые усиления очень благоприятно соответствуют измеренным данным, а также, поскольку более тяжелые пациенты представляют проблемы для обычных протоколов дозирования контраста. В общей сложности 61 мл из 300 мгI/мл контраста был доставлен при 4,1 мл/с и продолжительность сканирования составила 11 секунд.
[199] Модель Вае производит адекватную кривую усиления, но не дотягивает до эмпирических данных на 20-40 HU. Гибридная модель прогнозировала более высокое пиковое усиление, чем модель Вае. Линейная экстраполяция клинических данных предполагает, что фактическое (при условии возможности измерения контрастного усиления в in vivo в аорте в течение 10-20 секунд и больше) пиковое значение усиления должно быть больше, чем модель Вае может предположить, в согласии с прогнозом гибридной модели. Больше примеров, сравнивающих прогнозы усиления от моделей, и два набора данных визуализации даются в фигурах 9А и 9В. Сравнение фигуры 9А для субъекта 6, который был 37-летней женщиной весом 110 фунтов, ростом 61 дюйм, с частотой сердечных сокращений 80 ударов в минуту. 77 мл 300 мгI/мл контрастного вещества было доставлено при скорости потока 5,9 мл/с для сканирования, которое длилось 9 секунд. Субъект 8 из фигуры 9 В был 53-летним мужчиной весом 223 фунта, ростом 70 дюймов. Его средняя частота сердечных сокращений - 58 ударов в минуту. 74 мл 300 мгI/мл контраста вводили при 4,1 мл/с, а его продолжительность сканирования составила 12 секунд.
[200] Как модель Вае, так и гибридная модель прогнозируют профиль контрастного усиления, который в некоторых случаях отличается от эмпирических данных. Для субъекта 6, как Вае, так и гибридные модели прогнозируют максимальные значения усиления на 200 HU меньше, чем эмпирические данные. Для субъекта 8 гибридная модель прогнозирует максимальное усиление на 79 HU меньше, чем максимум эмпирических данных. Прогноз максимума Вае был на 111 HU меньше, чем максимум эмпирических данных. Как Вае, так и гибридные модели прогнозируют максимальные значения усиления на 200 HU меньше, чем эмпирические данные.
[201] Статистические результаты сравнения прогнозов гибридной и Вае моделей представлены в таблицах и графических отображениях ниже. Для каждого субъекта данные пациента и процедуры были использованы в обеих моделях. В каждом случае выходы усиления модели для компартмента аорты сравнивали с набором данных визуализации. Сегменты данных воспроизведения, начиная с момента времени, соответствующего задержке сканирования и длящиеся до завершения сканирования, были включены в вычисления среднеквадратичной ошибки и индекса разницы усиления. Табличные результаты представлены в Таблице 5. В то время как три показателя сравнения меньше для воспроизведения гибридной модели, U-тест Манна-Уитни не выявил существенных различий между медианами для всех измерений (RMSE- U=455, р=0,229; PDME-U=445, р=0,351; EDI-U=470, р=0,064).
[202] Ящичковые диаграммы с усами для трех сравнительных испытаний показывают неравномерное распределение данных и эквивалентность медиан. Ящичковые диаграммы с усами в фигуре 10 выделены с усами, растянутыми от точки данных на 1,5 межквартильных размаха (IQR) больше или меньше, чем медиана. Кресты в фигуре 10 указывают контуры, которые являются точками данных, большими, чем 1,5*IQR от медианы.
[203] Другая визуализация данных дается в виде серии диаграмм рассеяния на фигуре 11. Визуальный осмотр графиков, показывающих результаты для субъектов 6, 8, 12, 16 и 19, показывает наибольшие изменения в характеристике воспроизведения. Прогнозы гибридной модели для субъектов 15-20 показывают несколько лучшую согласованность с клиническими данными, чем данные Вае. Гибридная модель генерировала более низкие значения RMSE у 14 из 20 субъектов, более низкие результаты PDME у 13 из 20 субъектов, и более низкие EDI у 17 из 20 субъектов.
[204] По сравнению с опубликованной физиологический обоснованной фармакокинетической для всего тела моделью Вае et al. гибридная модель настоящего документа имеет пониженный порядок, является дискретизируемой, ясно моделирует задержки распространения контраста, моделирует эффекты инъекций промывки физиологическим раствором, обычно выполняемых в течение КТА процедур, и моделирует меняющиеся во времени эффекты взаимодействий плазма крови/контраст в периферическом венозном кровообращении. Как описано выше, сравнение выхода гибридной модели с клиническими данными, опубликованным Вае et al., показывает благоприятное совпадение. Дополнительное сравнение гибридной модели с профилями контрастного усиления, полученными из данных спиральной КТА, показали хорошее совпадение с моделью Вае, а во многих случаях лучшую способность соответствовать клиническим данным.
[205] Применение гибридной модели для испытания способов определения моделей по наборам данных пробного болюса описывается ниже. В ряде исследований применяются стратегии сокращения вместо попытки соответствовать всем параметрам гибридной модели. Это сокращение модели может, например, быть сделано для уменьшения нагрузки вычислений и надежности численных прогнозов.
[206] Способы с управлением данными
[207] В ряде вариантов осуществления, способы, системы и модели, описанные в настоящем документе, использованы для разработки у конкретного пациента прогнозов контрастного усиления с использованием данных контрастного усиления, полученных в пробной болюсной инъекции. Были оценены два метода, один предполагающий модельную структуру (параметрический) и другой с использованием непараметрического подхода "черный ящик". В подходе на основе модели стратегия предварительной обработки модели была применена к гибридной фармакокинетической модели, описанной выше, для облегчения вычислительной нагрузки при определении параметров модели и для преодоления проблем моделирования изменяющихся во времени систем.
[208] Другие подходы, включая параметрические и непараметрические подходы, например, обсуждаются в опубликованной заявке на патент США №2007/0255135, опубликованной заявке на патент США №2007/0282263, опубликованной заявке на патент США №2008/0097197, опубликованной заявке на патент США №20080097197, опубликованной заявке на патент США №2010/0113887, опубликованной заявке на патент США №2010/0030073, и опубликованной заявке на международный РСТ патент № WO 2009/012023, раскрытия которых включены в настоящий документ с помощью ссылки.
[209] Параметрическая (на основе модели) идентификация
[210] В ряде вариантов осуществления для построения информационно-зависимой, для конкретного пациента модели распространения контраста с формой понижения порядка гибридной РВРК модели, описанной выше, параметры модели оценивают после получения, например, двух время-усиление КТ кривых (последовательные низкоуровневые КТ сканирования на уровне легочного ствола), являющихся результатом инъекции небольшого «идентификационного» болюса контрастного вещества (10-20 мл).
[211] Контрастный агент вливают в периферическую систему кровообращения, как правило, через внутрисосудистый доступ в вену предплечья или в подключичную ямку. Несколько секунд спустя болюс контраста поступает в правые отделы сердца. Затем, правый желудочек толкает контрастный болюс через легочный круг кровообращения. В этот момент транспорт контрастного болюса управляется параметрами центрального кровообращения, а именно, сердечным выбросом. От 6 до 20 секунд спустя контраст поступает в левую сторону сердца и выбрасывается левым желудочком в главную артериальную и коронарную сосудистую сеть. Путем позиционирования аксиального КТ получения на уровне легочного ствола и получения КТ изображений на этом уровне каждые n секунд, генерируется численное и графическое изображение транспорта контраста.
[212] Фигура 12 представляет аксиальный «срез» данных поперечного изображения, полученного от пациента, подвергающегося КТ-ангиографии. Небольшой пробный болюс контраста (20 мл 350 мгI/мл) был введен периферически, и сканирования были выполнены на уровне легочного ствола каждые 2 секунды. При протекании контраста через структуру увеличивается качество или яркость изображения в сосудистых структурах. После получения аксиальных изображений сканер или автономная программа обработки выполняет интегрирование поверхности в пределах зон интереса (ROI) на каждом изображении и строит графики усредненного значения затухания по времени. Стандартной клинической практикой является начало получения через 5-10 секунд после начала инъекции контраста и получение изображений в течение 20-30 секунд при стандартном напряжении (120 кВ) трубки, но при низком значении произведения ток трубки-время (10-30 мАс).
[213] Типичные кривые времени усиления или ТЕС для человеческих субъектов показаны в Фигуре 13. Маркер зоны интереса (ROI) размещают над стволом легочной артерии субъекта и восходящей частью дуги аорты, как продемонстрировано в Фигуре 12.
[214] Попытка подогнать все параметры гибридной модели в отношении этого с использованием ограниченной длины данных, доступных из ТЕС пробных болюсов не выполнялась. Предпочтительнее, применялась стратегия предварительной обработки модели, когда наиболее релевантные компартменты гибридной модели рассматривают во время первого прохода контрастного средства - периферический венозный компартмент, компартмент правого отдела сердца, компартмент легких и компартмент левого отдела сердца/аорты. Этот подход подтверждается путем опознавания того, что КТА визуализация выполняется во время первого прохода контрастного вещества и, как правило, заканчивается через 30 секунд после начала контрастной инъекции из-за короткого времени получения сканирования сканером. Существуют также внутренние проблемы, присущие технологиям статистической идентификации, когда в системе присутствует обратная связь. Рециркуляция контраста может рассматриваться как тип обратной связи в гибридной модели.
[215] Фигура 14 является иллюстрацией подсистем гибридной модели, используемых для оценки параметров. Компартменты PER и RH свернуты в одну передаточную функцию, He1, где инфузия инъекции контраста является входной функцией Uinj(n) и измеренная TEC (ROI1 на Фигуре 13) является иллюстрацией подсистем гибридной модели, используемых для оценивания параметров. Компартменты PER и RH свернуты в одну передаточную функцию, He1, где инфузия инъекции контраста является входной функцией Uinj(n) и измеренная TEC (ROI1 на Фигуре 13) в легочном стволе, yRH(n), является выходным сигналом. yRH(n) преобразуется в концентрацию плазмы крови с использованием коэффициента масштабирования, зависящего от конфигурации сканера и определенного с помощью калибровки. Поскольку линейность предполагается по всей модели, транспортная задержка, описывающая задержку распространения болюса контраста из места инъекции в легочную артерию, может быть расположена в любом месте в пределах блока He1. Таким же образом, подсистемы LUNGB и LH объединены в одну подсистему с передаточной функцией Не2. Функцией ввода для блока Не2 является yRH(n), и выходным сигналом является измеренная концентрация ТЕС yLH(n), полученная из ROI (ROI2 на Фигуре 13), расположенной в аорте во время пробного болюсного сканирования в легочном стволе, yRH(n) является выходным сигналом. yRH(n) преобразуется в концентрацию плазмы крови с использованием коэффициента масштабирования, зависящего от конфигурации сканера и определенного с помощью калибровки. Поскольку линейность предполагается по всей модели, транспортная задержка, описывающая задержку распространения контрастного болюса из места инъекции в легочную артерию, может быть расположена в любом месте в пределах блока He1. Таким же образом, подсистемы LUNG В и LH объединены в одну подсистему с передаточной функцией Не2. Функцией ввода для блока Не2 является yRH(n), и выходным сигналом является измеренная концентрация ТЕС yLH(n) полученная из ROI (ROI2 в Фигуре 13), расположенной в аорте во время пробного болюсного сканирования.
[216] Посредством выполнения оценки параметров в двух различных операциях вычислительная сложность уменьшается. Помимо понижения вычислительной сложности теоретическое понижение дисперсии параметров может быть реализовано, когда меньше параметров определено с помощью входных/выходных данных. Кроме того, понижение общего числа параметров, определенных с парой входных/выходных данных, помогает предотвратить сверхподгонку.
[217] Включение только RH и PER компартменты в систему НЕ1 во время предварительного оценивания параметров привело к не сходимости и плохой подгонке экспериментальных данных. Увеличение порядка системы He1 посредством введения "промежуточного" компартмента между компартментом периферических вен и компартментом правого отдела сердца привел к сходимости оценочных функций параметров. Этот промежуточный компартмент также обеспечивает средства для моделирования эффектов скорости потока инъекции в пределах периферического компартмента, поскольку массовый поток между периферическими компартментами управляется новым элементом объемной скорости потока, QPER, который не является ни скоростью потока инъекции, ни скоростью потока крови, поступающей в правом отделе сердца. Структура модели представлена в Фигуре 15, которая показывает uinj(t), контрастную болюсную инъекцию в периферическую вену, и yRH(t), ТЕС, измеренную в легочной артерии (и преобразованную в единицы концентрации из HU).
[218] Формулировка пространства состояний в непрерывном времени для Не1:
[219] 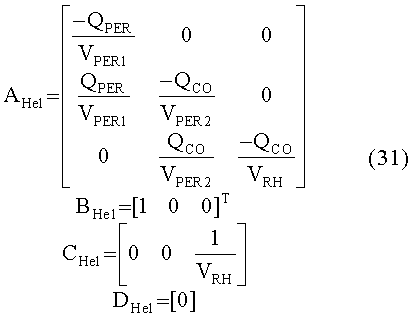
[220] 
[221] и напоминая, что yHe1(t)=yRH(t), когда измеренные данные доступны из данных КТ, собранных в структуре правого отдела сердца, такой как легочная артерия. Транспортная задержка контраста через периферическое венозное кровообращение является TPER. Функция ввода в уравнении 32 параметризуется посредством введения скорости потока (Qinj), концентрации пробного болюса (Cinj) и продолжительности контрастного болюса TDUR:
[222] 
[223] где u(t) это единичная ступенчатая функция.
[224] Скорость потока инъекции (Qinj) контраста опущена в формулировке уравнения 31, поскольку предполагается, что набор идентификационных данных получают, когда болюсная промывка физиологическим раствором следует за объемом пробного болюсного контраста. Инфузия физиологического раствора, следующая за пробным болюсом, поддерживает скорость потока в периферических компартментах (QPER) продолжительностью 10-14 секунд (объем контраста и физиологического раствора, деленный на скорость потока). Типичный диагностический болюс имеет продолжительность 10-14 секунд (контраст), так что предполагается, что периферическая скорость потока во время диагностической инъекции будет такой же, как во время пробной болюсной инъекции.
[225] Поскольку данные КТ получены посредством одноуровневого сканирования при дискретных временных шагах, были дискретизированы модели, используемые для идентификации шага. Дискретизация непрерывной в пространстве состояний системы, определенной в уравнении 31, была получена стандартным преобразованием теории линейных систем:
[226] 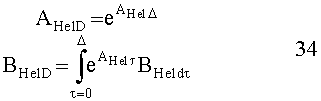
[227] Индекс "D" относится к дискретизированной в пространстве состояний матричной форме, и Δ является интервалом выборки, определенными по времени между одноуровневыми сканами. Такой подход дает следующие матрицы пространства состояний:
[228] 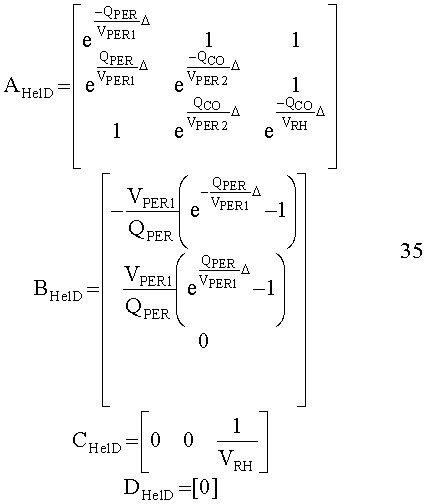
[229] Вторая подсистема модели является комбинацией компартментов легких и левого отдела сердца, обозначенной как Не2 на Фигуре 14. Поскольку при первом проходе циркуляторные эффекты при прогнозировании контрастного усиления для КТ-ангиографии преобладают, транспорт контраста из сосудистой зоны в ткани легкого может быть проигнорирован. Как и при получении формул гибридной модели, задержка распространения контрастного вещества через сердечно-легочное кругообращение соединена в транспортную задержку, TLUNG. Графическое изображение изолированной подсистемы Не2 представлено на Фигуре 16.
[230] Динамики пространства состояний в непрерывном времени для Не2:
[231] 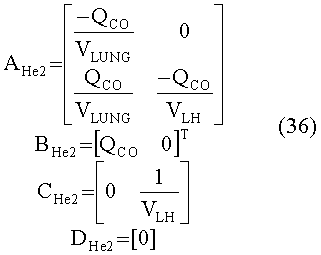
[232] 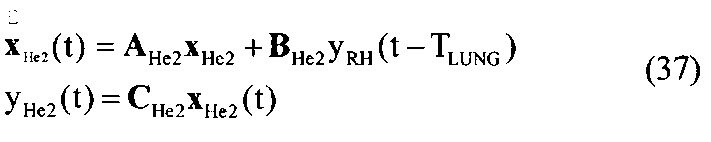
[233] и yHe2(t)=yLH(t), когда данные ТЕС доступны из структуры левого отдела сердца, такой как восходящая часть дуги аорты. Применение уравнения 34 к системе уравнений приводит к представлению в дискретном времени для матриц А и В (матрицы С и D являются эквивалентами варианта в непрерывном времени) с Δ, представляющей время выборки:
[234] 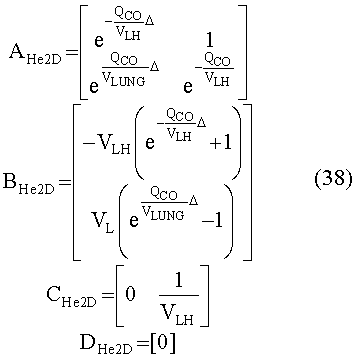
[235] Две дискретные системы служат основой для вариантов осуществления технологии оценивания параметров с управлением данными, разработанной в данном документе. Входом в первую дискретную систему (He1D) является дискретизованный инъекционный входной сигнал, uinj(n) (дискретный вариант уравнения 33) и выходом является ТЕС, измеренная в легочном стволе, yRH(n) (ROI1 на Фигуре 13). Входом во вторую дискретную систему, He2D, является yRH(n) и выходным вектором является ТЕС, измеренная в восходящей части дуги аорты, yLH(n) (ROI2 на Фигуре 13). Фигура 17 представляет блок-схему вида двух дискретных систем и соответствующие входы и выходы для этих систем. Этими двумя дискретными системами в пространстве состояний, использованными при оценивании параметров, являются:
[236] 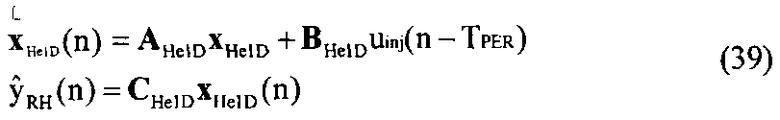
[237] 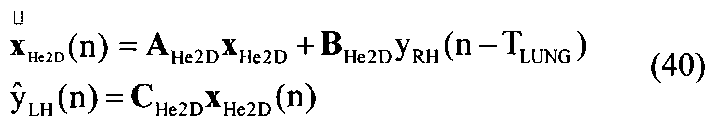
[238] Параметрами, подлежащими оценке в первой системе, He1D, являются: VPER1,VPER2,VRH,QPER,QCO, и транспортная задержка TPER. Параметрами, подлежащими оценке во второй системе, являются: VLH, VLUNG, QCO и транспортная задержка через легочную систему TLUNG.
[239] Оценка максимального правдоподобия
[240] В ряде вариантов осуществления оценки параметров из данных сканирования, полученных после инъекции небольшого болюса контрастной среды или вещества пациенту, оценивание параметров происходит в два этапа. При использовании двух измеренных сигналов, yRH(n) и yLH(n), и оценке двух систем последовательно, время сходимости, вычислительная нагрузка и изменчивость параметров уменьшаются, поскольку несколько параметров должны быть определены на одном идентификационном этапе путем численной оптимизации. Например, вместо оценки 10 параметров с использованием дискретных данных пробного болюсного усиления, шесть параметров определяют в He1D с использованием известной функции ввода Uinj(n) и выходного сигнала yRH(n) (который может иметь только 10 точек данных), и затем только 4 параметра для He2D определяются в другом отдельном этапе оценивания параметров (используя уян(n) и уьн(n) как данные входа/выхода).
[241] Во-первых, система "Не2" параметризуется с использованием данных сканирования из пробной болюсной инъекции и полученных ТЕС, измеренных в легочной артерии и восходящей части дуги аорты - yRH(n) и yLH(n). Далее, система "He1" параметризуется с использованием сигналов uinj(n) и yRH(n), функцией входа инъекции и ТЕС, измеренной в легочной артерии. После оценки параметров строится индивидуальная модель для этого пациента с использованием уравнений 39 и 40. Качество подгонки определяется путем сравнения прогнозируемого усиления в восходящей части дуги аорты (с пробной болюсной инъекцией) относительно измеренных данных.
[242] Поскольку большое число источников шума влияет на процесс измерения, включая выборочный контроль нулевого порядка, можно, например, предположить, что ошибки распределены по системе нормально. С предположением распределенной по Гауссу ошибки и независимых шумовых процессов максимальная оценка правдоподобия (MLE) может использоваться для оценки неизвестных параметров модели. Другие способы могут, например, быть использованы для оценки неизвестных параметров, как это ясно специалисту в данной области техники. Функция стоимости, использованная в MLE при оценке параметров He1D и He2D, является суммой квадратов разностей между измеренными данными ТЕС пробного болюса yRH(n) и yLH(n) и расчетного ответа пробного болюса в этих структурах, 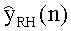
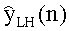
[243] 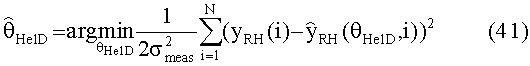
[244] 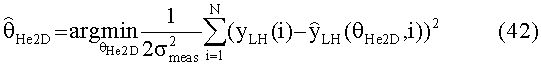
[245] где векторы оценки параметров (символ "шляпа", ^, показывает расчетные параметры):
[246] 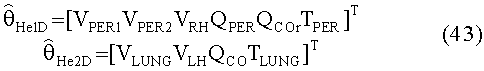
[247] учитывая, что оценка максимального правдоподобия эквивалентна подбору методом наименьших квадратов, когда шумовые процессы являются гауссовскими. Элемент дисперсии, 
[248] В матричном представлении задача формулируется как минимизация суммы квадратов невязок через функцию расчетных параметров:
[249] 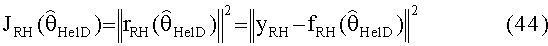
[250] 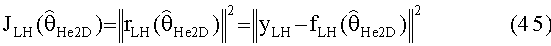
[251] где 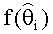
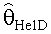
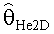
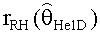
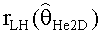
[252] 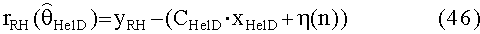
[253] 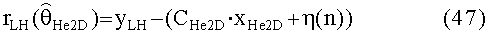
[254] причем η(n) представляет неопределенность модели и измерений.
[255] Матрицы Якоби n x p, VRH(θHe1D) и VLH(θHe2D) построены из первых производных векторов невязки относительно векторов параметров. Отметьте, что жирный символ V используется для якобианов, тогда как V (не жирный) используется для объема. I-й и j-й элементы матриц Якоби являются:
[256] 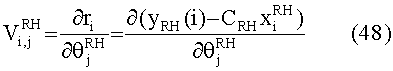
[257] 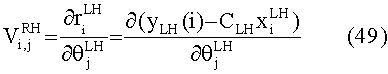
[258] Оценки максимального правдоподобия векторов параметров являются нормально распределенными с ковариацией Z=a2(VTV), где оценочными функциями дисперсии являются [55]:
[259] 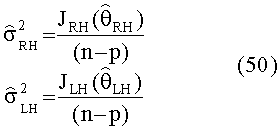
[260] Дисперсия оценок параметров также может быть выражена как обратная информационная матрица Фишера (обратная от Гессе), которая часто доступна из цифровых вычислительных пакетов, таких как MATLAB Optimization Toolbox.
[261] Аппроксимированное выражение для смещения параметра, которое является разницей между расчетным и истинным параметром, может быть выражено через матрицы Якоби:
[262] 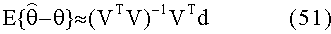
[263] где 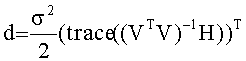
[264] Поскольку модель, как определено уравнением 39 и уравнением 40, является нелинейной по параметрам, минимизация функции стоимости является задачей нелинейного метода наименьших квадратов (NLS). Существует множество итерационных методов для решения задач NLS. Схема оптимизации для этой задачи может обеспечить ограничения неотрицательности на параметры. Кроме того, целесообразно обеспечить физиологические ограничения на оценки параметров. Поскольку эта задача является условной оптимизацией, методы линейного поиска, такие как Гауса-Ньютона, простые или гибридные методы, такие как классический Левенберга-Марквардта, не могут быть применены. По этой причине метод доверительной области подпространства, основанный на методе внутренних отражений Ньютона, реализованный в MATLAB Optimization Toolbox (nonlinsq), был использован для оценки векторов параметра в уравнении 43. Алгоритм вычисляет аппроксимированное решение на каждой итерации решателя, используя метод предварительных сопряженных градиентов (PCG). Аппроксимации конечной разницы были использованы для построения матриц Якоби и Гессе во время решении процесса.
[265] В экспериментах, описанных ниже, минимизации были проведены с критериями сходимости 10-5 по оценке функции стоимости и допуском в пределах 10-5 по параметрам. Было установлено максимальное число оценок функции 400 и максимальное число итераций на каждом шаге решения - 500. Границы параметров для 
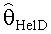
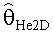
[266] Параметры были инициализированы перед началом оценивания на 50% середин от верхней и нижней границ параметров. Для исследования чувствительности решателя к выбору начальных условий, пять проходов решателя были выполнены на одно оценивание параметров. Вектор инициализации с наиболее подходящей кривой выхода был выбран в качестве исходной оценки. Расчетный вектор выхода для системы He1D, 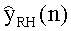
[267] Способы анализа параметрической оценочной функции.
[268] Для демонстрации эффективности метода оценивания параметров было проведено три различных эксперимента. В первых двух экспериментах использовали синтезированные данные для определения свойств оценочной функции (смещение, дисперсия) и ее устойчивость к усеченным данным ввода/вывода и изменениям временной выборки данных. Ретроспективные клинические данные были затем использованы для определения производительности оценочной функции в прогнозировании контрастного усиления аорты у испытуемых людей на основании хронометража ТЕС болюсного сканирования, измеренного в легочном стволе и восходящей части дуги аорты.
[269] Сравнения модель-к-модели. Для характеристики оценочной функции набор синтезированных данных был создан с использованием системы, определенной уравнениями 39 и 40, те же уравнения использовались оценочной функцией. Гибридная модель, следовательно, не генерировала данные, использованные в этих экспериментах. Целью этой методологии было изолировать производительность оценочной функции независимо от данных измерения. Этот тип сравнения был назван в литературе сравнение "модель-к-модели" и является полезным для изучения поведения оценочной функции независимо от других факторов, таких как точность модели, шум выборки и изменчивость шумовых процессов. Терминология модель-к-модели указывает, что одна и та же модель используется для оценки параметров, генерирующих данные. Это также полезно для визуализации пространства решений и оценки производительности оценочных функций, поскольку «истинные» параметры 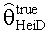

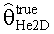
[270] Функция ввода, uinj(t) уравнения 33, была параметризована с помощью концентрации контраста 370 мгI/мл (Cinj) продолжительностью 5 секунд (TDUR), при скорости потока 5 мл/с (Qinj). Воспроизведения выполняли в MATLAB с использованием временного шага 0,10 с/образец. Воспроизведенные ТЕС были субдискретизированы со значениями скорости 1 с/образец, 2 с/образец и 5 с/образец с тем, чтобы имитировать эффект выборки на ТЕС посредством КТ сканера.
[271] Воспроизведения также были выполнены с "истинными" параметрами, искаженными с помощью синтезированного шума измерения (AWGN), имеющего стандартные отклонения 0,1 и 2 HU (η (n) в уравнениях 46 и 47) для разработки оценок смещения и дисперсии. Для каждой комбинации уровня шума и времени выборки были выполнены 30 оцениваний параметров. Для каждого прохода воспроизведения начальные оценки параметров изменялись на 25% от номинальных значений. Пять оценок параметров были рассчитаны, и лучший набор параметров был определен путем выбора набора, который генерировал минимальную разность среднеквадратичной ошибки между прогнозированной кривой усиления из оценивания параметров и той, которая генерирована моделью, 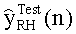
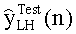
[272] Наконец, бесшумные моделирования выполняли с истинными значениями параметров, менявшихся в пределах +/- 20% с 2% шагом для генерирования графических иллюстраций функции стоимости JRH(θHe1D) и JLH(θHe2D). Эти моделирования также позволяют осуществить анализ чувствительности оценочной функции к выбору начальных условий. Пять моделирований с использованием начальных условий, случайно менявшихся в пределах 25% от значений в Таблице 7, были выполнены. Среднеквадратические ошибки между прогнозированным пробным болюсным и воспроизведенным пробным болюсным усилением для каждого набора начальных условий были записаны и проанализированы.
[273] Производительность оценочной функции с использованием данных гибридной модели. Производительность оценочной функции была определена в присутствии шума и чувствительности к усеченным данным пробного болюсного усиления с использованием данных гибридной модели. Гибридная модель была смоделирована с использованием параметров и способов, представленных выше, в которой смоделированные демографические данные субъекта, и отношения, определенные в уравнениях 27, 28 и 29, обеспечивали значения для сердечного выброса и объема крови. Значения параметров в Таблицах 1-3 конфигурировали модель. MATLAB/Simulink (R2008b) была использована для моделирования модели для каждого пациента с использованием клинических данных для параметров пациента и протокола диагностической фазы контрастной инъекции, включая фазу промывки физиологическим раствором. Тот же набор параметров был использован для создания синтезированных дискретных данных пробного болюса 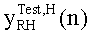
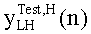
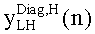
[274] Оцениванием параметров было выполнено с векторами гауссовского шума со стандартными отклонениями: 0,1, 0,25, 0,5, 1,0, 2,0, 5,0, 10, и 20 HU, добавленными к данным пробного болюса гибридной модели. Производительность предсказанного усиления против "истинного" усиления, которое моделировано с помощью гибридной модели для двадцати наборов данных, было оценено с использованием показателей, показанных в 4.0 - RMSE, процентной разницы в максимальном усилении (PDME), и индекса разницы усиления (EDI).
[275] Обычной практикой для технолога, выполняющего исследование, является остановка сбора данных пробного болюсного сканирования вскоре после пикового контрастного усиления. Причины для остановки получения данных включают беспокойство об избыточной лучевой нагрузке на пациента и желание сделать время исследования коротким. Поскольку запись данных пробного болюса может содержать только несколько образцов данных после пикового усиления, алгоритмы доставки контраста для конкретного пациента должны работать в присутствии усеченных наборов данных.
[276] Эксперименты были проведены с векторами усеченных данных пробного болюса, созданными с помощью смоделированной гибридной модели, для определения эффекта усеченных данных пробного болюсного сканирования на оценочную функцию параметров MLE. Векторы были усечены при продолжительности 20, 25, 30 и 35 секунд без присутствия дополнительного шума. Затем смоделированные ТЕС пробного болюса были усечены в 25 и 35 секунд, и шум был добавлен. AWGN был создан со стандартными отклонениями 0,1, 0,25, 0,5, 1,0, 2,0, 5,0, 10 и 20 HU. Во всех случаях точки первых данных 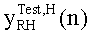
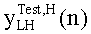
[277] Производительность оценочной функции с использованием ретроспективно собранных клинических данных. Производительность оценочной функции была оценена в зависимости от клинических данных, собранных во время утвержденного IRB клинического испытания в Медицинском Университете Южной Каролины (Somatom Definition DS, Siemens Healthcare Malvern PA). Набор данных и способы, использованные для сбора данных, описаны выше. ТЕС пробного болюса, собранные во время клинического испытания, были использованы для получения оценивания параметров, и данные полуавтоматического контрастного усиления аорты были использованы для сравнения прогнозируемого выхода оценочной функции идентично способам, описанным выше.
[278] Во время клинического испытания операторы сканера получили данные пробного болюсного сканирования посредством размещения ROI на легочном стволе и восходящей части дуги аорты. Сбор данных начался через 5 секунд после того, как началась инъекция контраста. Одноуровневое получение данных сканирования было остановлено оператором через две или четыре секунды после наблюдения пика контрастного усиления в восходящей части дуги аорты. Программное обеспечение сканера затем обработало данные и создало ТЕС, которые были экспортированы в файлы данных и сохранены. Данные профиля усиления диагностического сканирования были извлечены, как описано выше.
[279] План экспериментальной методологии: (1) Извлечь данные ТЕС пробного болюса; (2) Выполнить параметрическое оценивание с помощью технологии MLE; (3) Генерировать прогнозированное контрастное усиление с использованием протокола диагностической инъекции из набора клинических данных и определенных параметров из 2; (4) Извлечь кривую усиления из набора клинических данных; (5) Сравнить прогнозированное контрастное усиление с клиническими данными (от задержки сканирования до конца получения данных сканирования).
[280] Прогнозированные выходы из оценочной функции с управлением данными сравнивали с действительными клиническими данными с использованием RMSE, PDME и EDI.
[281] Все воспроизведения и анализы были проведены с помощью MATLAB (r2008b), Optimization Toolbox (v4.1) и Simulink (v7.2).
[282] Производительность оценочной функции с использованием сравнений модель к модели. Результаты моделирования модель-модель представлены в Таблицах 9-12. Полученное среднее смещение оценочной функции для каждого параметра в сердечно-легочной системе, He2D, перечислено в Таблице 9. Качество подгонки критерия, использованного для проверки производительности оценочных функций,
является среднеквадратической ошибкой между прогнозированной 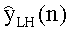
[283] Смещение оценивания параметров увеличилось независимо от аддитивного шума в подсистеме He2D, за исключением параметров QCO и TLUNG в периоды выборки 0,5 и 1 с/образец. MSE из подгонки представляется независимой от периода выборки, поскольку она увеличивается подобно функции шума сигма для всех трех периодов выборки. Смещение оценивания параметров увеличилось в подсистеме He1D, когда данные периодов выборки превысили одну с/образец. MSE невязки между прогнозом оценочной функции и истинными значениями увеличилась, так как увеличился вклад шума, и для периодов выборки, больших чем 1 с/образец.
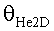
Значения являются процентным смещением от номинальных значений. MSE является среднеквадратической ошибкой остаточной ошибки для расчетного и действительного сигнала усиления, yLH
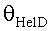
Значения являются процентным смещением от номинальных значений. MSE является среднеквадратической ошибкой остаточной ошибки для расчетного и действительного сигнала усиления, yRH
[284] Дисперсия оценок параметров для обеих систем показана в Таблице 8 и Таблице 9. Дисперсия оценивания параметров была самой большой для всех времен выборки, когда стандартное отклонение вклада шума составил 2 HU. Дисперсия параметра транспортной задержки, TLung, была самой большой среди всех параметров.
[285] Контурные графические отображения свободных от шумов функций стоимости для оценочных функций левого отдела сердца и правого отдела сердца (уравнения 44 и 45) были созданы для диапазона параметров и показаны на Фигуре 18 и Фигуре 19. В каждом графическом отображении два параметра менялись относительно номинального значения, тогда как другие параметры в модели были фиксированными. Полученные в результате графические отображения являются 2D проекциями «-мерных гиперплоскостей, определяющих пространство параметров в заданном диапазоне. Когда эллипсоиды вблизи минимума пространства решений удлиненные, это указывает, что у численных решателей могут возникнуть проблемы, сходящиеся на истинном минимуме и повышенной дисперсии. Контурные графические отображения показывают один минимум. Многие из пар параметров демонстрируют длинные и узкие эллипсы вблизи минимума - в частности, VLH, VLUNG пара для подсистемы He2D.
[286] Результаты оценивания параметров гибридной модели. Результаты экспериментов по оцениванию параметров с использованием гибридной модели как источника данных усиления для 20 субъектов представлены ниже. У всех 20 субъектов данные пробного болюсного усиления генерировали в компартментах гибридной модели левого и правого отделов сердца с использованием входной инъекции 20 мл контраста концентрацией 350 мгI/мл, введенного при 5 мл/с с последующими 40 мл физиологического раствора. AWGN (стандартное отклонение =2,5 HU) добавляли к векторам ответа моделирования, и сигналы пробного болюсного усиления усекали на 35 секундах.
[287] Диагностическая инъекция для набора смоделированных данных составила 75 мл болюса 350 мгI/мл при 5 мл/с и последующими 40 мл физиологического раствора при 5 мл/с.Только данные между задержкой сканирования и окончанием сканирования были использованы в сравнениях между расчетными и смоделированными данными (задержка сканирования и продолжительность сканирования для каждого субъекта получены из набора клинических данных) как проиллюстрировано на Фигуре 20. Для всех субъектов точки данных между двумя вертикальными линиями были включены в сравнения RMSE, PDME и EDI, как определено выше.
[288] Среднее среднеквадратической ошибки между смоделированным и расчетным ответом составило 7,78+/-4,40 HU. Средняя максимальная процентная разница между максимальным усилением (PDME) для обеих кривых по 20 субъектам составил 1,29+/-1,12%, и среднее индекса разницы усиления составило 1,57+/-1,16%.
[289] Влияние длины данных пробного болюса и аддитивного шума на производительность оценочной функции показаны на Фигуре 22. Моделирование гибридной модели двадцати субъектов в клиническом наборе выполнили с использованием одинаковой диагностической инъекции для всех субъектов (75 мл контраста концентрацией 350 мгI/мл при 5 мл/с с последующими 40 мл физиологического раствора).
[290] В экспериментах, которые генерировали Фигуру 22, аддитивный шум был равен нулю. Так как вектор данных пробного болюса уменьшался, RMSE и PDME увеличивались. Не ожидалось, что операторы сканера будут получать данные пробного болюса несколько секунд после появления пикового контрастирования контраста из-за увеличенной лучевой нагрузки на пациента. Типичные моменты времени пиков в восходящей части дуги аорты при пробной болюсной инъекции составляли от 17 до 24 секунд. Среднее время для пика в смоделированной когорте составило 21,1+/-2,1 секунд. Когда кривые пробного болюса усекали на 20 секундах, пиковое усиление в большинстве случаев упускалось. Тем не менее, оценочная функция все еще была способна генерировать оценивания динамики системы с RMS ошибкой 12 HU.
[291] Фигура 23 иллюстрирует производительность оценочной функции, когда аддитивный шум между 0,1 и 20 HU добавляется к данным пробного болюсного усиления, усеченным на 25 и 35 секундах. Там есть удовлетворяющий интервал приблизительно 3 HU для RMSE, и есть меньшая RMSE для более длинных кривых пробного болюсного усиления. Прогноз максимального контрастного усиления является менее чувствительным к длине вектора измеренных данных пробного болюса. Типичный шум на клинических данных пробного болюсного усиления колеблется между 2 и 10 HU. Разница PDME между 25 и 35 секундными векторами пробного болюса составляет менее чем 0,5%. Оба сравниваемые показателя остаются постоянными до тех пор, пока сигма аддитивного шума не превышает 2 HU. Затем ошибки линейно увеличиваются.
[292] Результаты оценивания методом максимального подобия с клиническими данными. Этот раздел представляет возможности оценочной функции прогнозировать контрастное усиление с использованием набора ретроспективных клинических данных. Для каждого субъекта данные ТЕС пробного болюса, измеренные в легочном стволе и восходящей части дуги аорты использовали как входы в алгоритм MLE. Выполняли сравнения между расчетной моделью (на основе MLE подгонки) и контрастным усилением диагностического сканирования в аорте. Инъекционный протокол и параметры сканирования из набора клинических данных использовали при выполнении сравнений и только точки данных между задержкой сканирования и окончанием сканирования включали в вычисление RMSE, PDME и EDI (как показано на Фигуре 20).
[293] Фигура 24 представляет результаты для всех 20 субъектов, рассчитанные с использованием данных пробного болюса и метода MLE. Горизонтальные пунктирные линии указывают выборочное среднее для каждого показателя производительности. Субъекты семь, девять и пятнадцать имели самые большие ошибки по всем трем категориям. Численные результаты анализа с использованием MLE находятся в Таблице 13 вместе с результатами прогноза при использовании гибридной модели, параметризованной только демографическими данными субъекта. Метод MLE привел к снижению среднего значения RMSE, PDME и EDI (PDME существенно отличался, p<0,05), уменьшению диапазона данных для всех 3 метрик и снижению значений стандартных отклонений. Максимальная RMSE для гибридного воспроизведения составила 142,3 HU, тогда как RMSE составила 70,5 HU с использованием MLE.
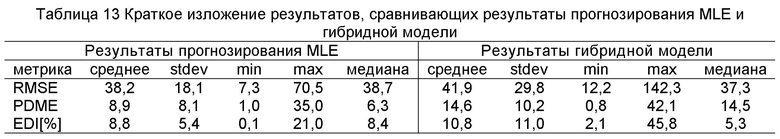
[294] Фигура 25 графически отображает прогнозированное контрастное усиление и диагностическое контрастное усиление для двух субъектов (6 и 8). Прогнозированные с использованием гибридной модели контрастные усиления для этих пациентов были представлены на Фигуре 9. Их производительность прогноза была худшей среди всех 20 субъектов. Используя ТЕС пробного болюса из клинических данных и методологию MLE, лучший прогноз контрастного усиления был достигнут для этих двух субъектов (RMSE 39 HU против 160 HU для субъекта 6, и 21 HU против 57 HU для субъекта 8 -MLE и гибридные результаты).
[295] Фигура 26 представляет диаграммы типа «ящик с усами», графически сравнивающие результаты гибридной модели и MLE по 20 субъектам. Горизонтальная линия в каждой рамке указывает значение медианы данных, и края вертикальных рамок указывают 1ю и 3ю квартиль данных.
[296] Непараметрическая идентификаций
[297] Методология и результаты (воспроизведение и клинические данные) для вариантов осуществления непараметрического идентификационного метода для прогноза контрастного усиления с использованием парадигмы пробного болюса излагаются ниже. Усеченный метод разложения по сингулярным числам матрицы вводится, представлены его производительность по воспроизведению и ретроспективные клинические данные, и представлено сравнение с методологией MLE.
[298] Как описано выше, параметрическая методология идентификации была разработана для оценки и прогнозирования контрастного усиления на индивидуальной основе с использованием данных пробного болюсного усиления для параметризации фармакокинетической модели пониженного порядка. Альтернативно, непараметрический (или модельно-независимый) подход, который также зависит от данных пробной болюсной инъекции и сканирования, но, например, требует данные только с одного расположения сканирования, может быть использован. В нескольких исследованиях восходящая часть дуги аорты используется в качестве расположения сканирования. Одно из преимуществ непараметрического подхода в том, что предположения, такие как модельная структура и порядок, не требуются. Предположение, что основная динамика системы может быть смоделирована как система LTI, может, например, быть, однако сделано.
[299] Непараметрическая методология ставит задачу контрастного усиления как обратную задачу, в которой выход (данные изображения из восходящей части дуги аорты при введении пробного болюса) и вход (профиль введения пробного болюса йода) известны. Метод регуляризации, усеченное разложение по сингулярным числам матрицы (tSVD), как описано ниже, используется для оценки импульсной характеристики (или функции вычета) лекарственного препарата и сердечно-легочной системы. Специалисту в данной области ясно, что другие способы могут быть использованы для оценки импульсной характеристики.
[300] Индекс усечения, который адаптирует к измерению шума и который уравновешивает остаточную ошибку и погрешность решения, может быть выбран для tSVD для производства желаемых результатов. Как обсуждается в приложении 1 настоящего документа в конце этого описания, адаптивный индекс усечения и tSVD является более устойчивым к изменению данных, чем деконволюционная методология Фурье Fleischmann/Hittmair, поскольку в этом подходе использовался только фильтр низких частот с фиксированной частотой среза.
[301] Преимущества метода регуляризации, подобного tSVD, при создании прогнозирующих методов контрастного усиления демонстрируются на примере. Расчетную импульсную характеристику, hsys, для субъекта 7 в наборе клинических данных (данные ТЕС пробного болюса) генерировали с использованием стандартных линейных наименьших квадратов (оператор матрицы левого деления в MATLAB). Динамика усиления была определена путем матричного произведения импульсной характеристики и нижне-треугольной матрицы Теплица, образованной из входной функции А1 из Приложения 1: yLH=Uinjhsys. Фигура 27 графически отображает линейное решение наименьших квадратов для hsys, с использованием клинических данных усиления из левого отдела сердца, генерированных в пробной болюсной инъекции при 5 мл/с в течение 20 секунд (концентрация контраста 350 мгI/мл). Очевидными являются колебания, введенные шумом измерения. Невозможность фильтровать шум линейным методом наименьших квадратов препятствует надежной оценке импульсной характеристики системы.
[302] Противоположностью оценке импульсной характеристики с использованием простых наименьших квадратов является график в Фигуре 28, который является расчетной импульсной характеристикой для субъекта 7 с использованием методологии tSVD, разработанной в этом разделе. Подробный алгоритм для создания прогноза контрастного усиления с использованием tSVD представлен ниже в Таблице 14.
[303] Таблица 10 Алгоритм непараметрической оценки

[304] Два подхода для выбора индекса усечения, к, в разложении по сингулярным числам матрицы было исследовано и выполнено - способ кусочно-линейной аппроксимации Koh et al. и критерий адаптивной обрезки L-кривой Hansen et al. Koh TS, W.X., Cheong LH, Lim CCT, Assesment of Perfusion by Dynamic Contrast-Enhanced Imaging Using a Deconvolution Approach Based on Regression and Singular Value Decomposition. IEEE Trans Med Imaging, 2004. 23(12): p.1532-1542. Hansen, P.C., The truncated SVD as a method for regularization. BIT, 1987. 27: p.534-55. Усеченный способ разложения по сингулярным числам матрицы, предоставленный в инструментарии регуляризации, свободно распространяемый в сети Интернет, (tsvd.m) был использован для создания оценок импульсной характеристики. Hansen, Р.С., Regularization tools: а MATLAB package for analysis and solution of discrete ill-posed problems. Numer. Algorithms, 1994. 6: p.35.
[305] Как представлено в Приложении 1, способ Koh вычисляет индекс усечения путем аппроксимации графика Пикара с помощью кусочно-линейной функции. График Пикара является логарифмическим графиком коэффициентов Фурье относительно индекса переменной в диапазоне длины выборки данных в векторе результата
наблюдения, 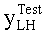
[306] 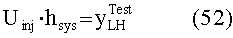
[307] которая сходна со стандартным обозначением Ax=b для линейной системы. Коэффициенты Фурье являются абсолютными значениями произведения левых сингулярных векторов (столбцы левой сингулярной матрицы из разложения по сингулярным числам матрицы) и вектора результата наблюдения 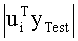
[308] 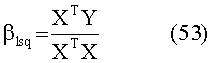
[309]где Y это вектор коэффициентов Фурье, 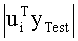
[310] 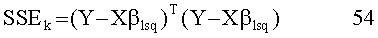
[311] За алгоритм Koh оптимальный индекс усечения был выбран как индекс, относящийся к элементу массива SSE с наименьшим значением.
[312] Алгоритм адаптивной обрезки для определения индекса усечения полностью описан в Hansen, Р.С., Т.К. Jensen, and G. Rodriguez, An adaptive pruning algorithm for the discrete L-curve criterion. Journal of Comput and Appl Math, 2007. 198: p.9. Таким образом, метод строит дискретную L-кривую, которая является простым графиком норм решения 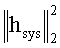
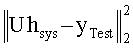
[313] Воспроизведения гибридной модели были использованы для определения предпочтительной методологией вычисления индекса усечения. Те же самые двадцать субъектов, воспроизведенные в разделе 5.1.4.2, были воспроизведены с использованием фиксированной скорости потока и объема контраста (5 мл/с 350 мгI/мл контраста в течение 4 секунд), в качестве инъекции для всех моделирований. Две серии моделирования были завершены. Первая использовала алгоритм адаптивной обрезки L-кривой для определения оптимального индекса усечения для tSVD, и вторая использовала метод Koh для выбора индекса усечения. Сравнение RMSE между двумя методологиями было выполнено для определения предпочтительного способа.
[314] Средние значения для трех показателей производительности, RMSE, PDME и EDI по 20 субъектам даны в Таблице 15. Способ Koh производит прогнозированное усиление с 11% меньшей RMS ошибкой, на 22% меньшей ошибкой максимальной разницы, и на 10% меньшим средним EDI процентом. Кроме того, полученные импульсные характеристики и реконструированные пробные болюсные кривые были более гладкими, когда метод Koh вычислял индекс усечения. Кроме того, способ Koh вычислял более низкие значения индексов усечения, чем алгоритм адаптивный обрезки для этой задачи. Способ Koh был выбран, основываясь на этих результатах, для последующих экспериментов.
[315] Способы оценки
[316] Один набор экспериментов использовал гибридную модель РВРК для генерирования данных усиления и был проведен для определения производительности непараметрической оценочной функции в присутствии аддитивного шума и с усеченными векторами пробного болюсного измерения. Затем, ретроспективные клинические данные (тот же набор, что использовался с параметрическим методом MLE, описанным выше) были использованы для выяснения производительности непараметрического метода с данными испытуемого человека. Метрики производительности затем сравнивали с таковыми из параметрического способа, описанного выше.
[317] Эксперименты воспроизведения гибридной модели Еще раз, набор из 20 субъектов был численно воспроизведен с помощью гибридной модели РВРК и демографические данные из клинических данных установлены с использованием той же методологии, описанной выше. Только ответ пробного болюса в компартменте левого отдела сердца, 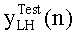
[318] Эксперименты с клиническими данными. Эксперименты с использованием набора ретроспективных клинических данных были проведены также с использованием способов, описанных выше. Те же метрики производительности, RMSE, PDME и EDI, были использованы для описания выполнения метода оценки и прогноза. Сравнение с результатами, используя MLE методологию, также было проведено.
[319] Средние результаты RMSE, PDME и EDI для всех 20 субъектов с использованием tSVD для прогнозирования контрастного усиления с использованием воспроизведенных данных из воспроизведения гибридной модели, представлены на фигуре 29. Сравнения были сделаны между воспроизведенным и прогнозированным усилением в компартменте левого отдела сердца, когда тот же протокол диагностической инъекции был доставлен всем 20 воспроизведенным пациентам. Эти результаты сопоставимы с таковыми на фигуре 21, где способом MLE оценивали контрастное усиление для этих 20 субъектов. RMSE (среднее +/- стандартное отклонение) между значениями усиления составила 7,3+/-5,1 HU, PDME составила 1,8+/-1,3%, a EDI составил 1,6+/-1,3%. Использование MLE с этими же данными привело к RMSE, PDME, и EDI 7,78+/-4,40 HU, 1,29+/-1,1%, и 1,57+/-1,2% (см. фигуру 21).
[320] Влияние изменяемой длины данных пробного болюсного усиления (от 20 до 40 секунд) на производительность tSVD оценочной функции представлено на фигуре 30. Эти данные являются средними значениями, взятыми по всем 20 субъектам при каждой длине вектора пробного болюсного усиления. Никакой шум не был добавлен к данным пробного болюсного усиления для этих экспериментов.
[321] Производительность tSVD оценочной функции, когда данные пробного болюсного усиления были искажены с помощью AWGN, представлены на фигуре 31. Двадцать воспроизведений было выполнено с использованием демографических данных из набора клинических данных. Векторы пробного болюса были усечены на 35 секунд для всех воспроизведений. Аддитивный гауссовский шум со стандартными отклонениями 0, 0,1, 0,25, 0,5, 1,0, 2,5, 5,0, 10 и 20 HU был добавлен к данным пробного болюса для каждого блока из 20 субъектов. Средние значения RMSE для tSVD и MLE оценочных функций строились графически совместно на фигуре. Следует отметить, что когда аддитивный шум был больше, чем 2,5 HU, MLE выполнялся лучше. Для низких уровней аддитивного шума (0,1, 0,2, 0,5 и 1,0 HU сигма), tSVD выполнен немного лучше.
[322] Сравнительные результаты для tSVD и MLE методологий с использованием клинических данных в качестве источника данных пробного болюса и диагностического усиления даны на фигуре 31. Метод оценки MLE производит оценки усиления с более низкими RMSE, PDME и EDI у 14/20, 13/20, и 13/20 субъектов, соответственно. Суммарные результаты для трех метрик эффективности RMSE, PDME, и EDI были (среднее +/- SD): 49,1+/-24,7 HU, 14,9+/-10,5% и 13,6+/-9,6%.
[323] Диаграмма вида «ящик с усами» на фигуре 33 показывает, что способ MLE производит более низкие RMSE, PDME и EDI по 20 субъектам, но различия не были статистически значимыми. Как видно из диаграммы вида «ящик с усами», расчетные усиления с использованием tSVD приводили в более широкой вариабельности вокруг медианы. U-тесты Манна-Уитни по трем наборам метрик показали значительные различия только для результатов PDME (p<0,05).
[324] В некоторых случаях, однако, статистическая значимость для всех трех метрик была продемонстрирована между этими двумя способами. Субъекты 5, 12, и 19, имели значительно большие средние RMSE и PDME с tSVD, чем с MLE (p<0,05, ранговый критерий знаков). Эти субъекты показали наибольшее расхождение между двумя методами оценки с управлением данными.
[325] Результаты указывают, что способ MLE превосходит способ tSVD для прогнозирования контрастного усиления у конкретного пациента, особенно при рассмотрении проблем и практических аспектов реальной клинической практики. В частности, MLE является более устойчивым к изменениям длины вектора данных пробного болюсного усиления, он имеет благоприятные характеристики шумоподавления и обеспечивает параметрические оценки физиологических переменных, которые могут быть полезны для количественной оценки состояния пациента (например, оценка сердечного выброса). Если доступны данные пробного болюсного усиления, которые проходят несколько секунд после достижения пика контрастного усиления, то способы tSVD и MLE выполняются аналогично. В клинической практике, однако, трудно гарантировать, что получение данных во время пробного болюсного сканирования будет регулярно содержать точки данных после достижения пика.
[326] В то время как у tSVD, кажется, есть отличная помехоустойчивость относительно низких уровней AWGN, MLE имеет лучшую помехоустойчивость, когда данные пробного болюса искажаются при больших значениях AWGN. tSVD имеет главное преимущество в том, что только одна кривая ТЕС требуется для оценки, и он является вычислительно менее обременительным. Тем не менее, оптимизация в пределах MLE была выполнена в считанные секунды с использованием Pentium III (не исключительное оборудование) и широкодоступных численных методов.
[327] Параметрическое смещение и дисперсия были благоприятными с использованием MLE. Визуализация пространства решений также показала четко определенные минимумы, хотя они были длинными и широкими в некоторых случаях. Поэтому существует доказательство для поддержки того, что функция стоимости, используемая в MLE, является адекватной для вычисления требуемых параметрических оценок для прогноза контрастного усиления конкретного пациента, основанное на метриках производительности, когда данные воспроизведения гибридной модели испытывали способ MLE.
[328] Плохое соответствие в некоторых случаях между прогнозируемыми и клиническими данными может быть связано с шумом и/или неполными пробными болюсными ТЕС из клинических данных. Большая ошибка для субъекта 15 одновременно в MLE и tSVD экспериментах может быть непосредственно отнесена к неполной пробной болюсной кривой. ТЕС субъекта 15 построены на фигуре 24. Пиковые значения усиления в легочной артерии и восходящей части дуги аорты не были захвачены. Несмотря на эти недостающие признаки MLE еще был в состоянии производить усиление контраста с морфологией, не слишком отличающейся от клинических данных, хотя и сдвинутое во времени. Три метрики производительности с использованием tSVD у этого субъекта, однако, были значительно выше среднего значения выборки, иллюстрируя влияние ограниченных данных пробного болюса на tSVD производительность.
[329] Вторая худшая EDI оценка MLE результата была у субъекта 7. Проверка данных диагностического усиления и прогнозированного профиля усиления показывает, что прогноз усиления отслеживает диагностические клинические данные, но компенсируется 40-80 HU. Возможно, базовое затухание для этого субъекта было ниже, чем о 50 HU.
[330] Субъект пять имел самую высокую RMSE ошибку для MLE данных. Существует общее совпадение между прогнозированным усилением контраста и клиническими данными для этого субъекта, но прогнозированный профиль усиления имеет наклон вверх, который начинается на несколько секунд раньше. Возможно, данные пробного болюса были ненадлежащим образом хронометрированы, или задержка сканирования набора клинических данных была записана неправильно. Самые высокие результаты RMSE с tSVD прогнозами наблюдались у субъектов 5, 12 и 16. Субъект 15 имел худшую производительность для всех трех показателей, связанную с плохими пробными болюсными данными у этого субъекта.
[331] В целом, данные клинического сканирования, используемые в этой главе, не являются идеальными для испытания способов идентификации, поскольку они были сгенерированы с помощью протоколов диагностической инъекции, имеющих различные скорости потока с протоколами пробных болюсных инъекций. Как обсуждалось выше, скорости потока инъекции меняют скорость потока периферического компартмента. Динамика для модели, выполненная путем подгонки пробного болюса на одной скорости потока во время пробной болюсной инъекции и сканирования могут незначительно отличаться для диагностической инъекции с разной скоростью потока. Идеальный протокол диагностической инъекции для сравнения способов идентификации будет аналогичен тому, который используется со сравнениями гибридной модели - фиксированная скорость потока и тот же объем для всех пациентов.
[332] Способ, которым данные диагностического усиления были сгенерированы, должен также учитывать ограничения анализа, поскольку ТЕС не были сгенерированы по одноуровневому скану на том же уровне, из которого построена ТЕС болюсного хронометража. Скорее всего, данные были построены из пространственно-временного распределения контраста в аорте. Генерирование данных усиления из набора спиральных данных может приводить к непредвиденной ошибке и вариабельности. Осмотр планок погрешностей на ТЕС диагностического сканирования в графиках показывает, что присутствует значительная вариабельность данных ТЕС (в основном, в результате выбора данных СТ тонких срезов для этих анализов). К сожалению, идеальный сценарий проверки, в котором одноуровневое сканирование выполняется на восходящей части дуги аорты во время диагностической инъекции, не представляется возможным с людьми из-за избытка излучения и контрастного вещества, которым субъекты будут подвергаться. По этим причинам, животные и фантомные модели необходимы для адекватного изучения моделей прогнозирования контрастирования и методов генерирования протоколов контрастирования. Испытания на животных могут быть дорогими, так что подтвержденный и реалистичный сердечно-сосудистый фантом, который имитирует транспорт и распределение контрастного вещества имеет большое значение. Такой фантом, например, описан в заявке на патент США №12/397,713.
[333] Поскольку методы идентификации оценки с управлением данными применяют данные, полученные из системы (с использованием пробного болюса), они должны производить большую точность прогноза. Как и ожидалось, ошибка прогноза у субъектов 6, 8 и 12, которые имели наибольшие ошибки прогноза с использованием гибридной модели, как описано выше, снизилась, поскольку оценочные функции опираются на данные изображения, полученные у субъектов. С большим набором клиническим данных, статистически значимое уменьшение ошибки прогноза может быть реализовано.
[334] В то время как способ MLE был обнаружен как лучший подход, например, когда две ТЕС были доступны, рассмотрение должно быть выполнено в клиническом алгоритме, когда две ROIs не могут быть размещены или когда данные из первой ROI искажены. Предполагается поэтому, что клинический алгоритм должен использовать tSVD или другую непараметрическую методологию в качестве вторичного подхода к оценке контрастного усиления в только что упомянутом сценарии. Классификация может, например, быть использована для определения, являются ли данные ТЕС адекватными для применения метода MLE.
[335] Таким образом, сравнение двух способов контрастного усиления с управлением данными показало, что MLE была более устойчива применительно к реальным условиям, встречающимся в клинике. В частности, MLE может лучше прогнозировать контрастное усиление, когда доступны более короткие сегменты данных пробного болюсного усиления. Способ tSVD, однако, требует размещения только одной ROI и является потенциально вычислительно менее обременительным. Оценка максимального правдоподобия была успешно использована в определении модели РВРК с понижением порядка, разработанной для облегчения прогнозов контрастного усиления у конкретного пациента. Сравнительные испытания с использованием гибридной модели и ретроспективных клинических данных показали, что MLE была лучше tSVD. Как обсуждалось выше, клиническая система, способ или алгоритм может, например, рассматривать оба метода с управлением данными (параметрический и не параметрический) для оценки контрастного усиления у конкретного пациента, поскольку могут возникнуть ситуации, в которых достаточные или подходящие данные (например, две ТЕС) не могут быть генерированы из пробной болюсной инъекции для определения параметров в параметрическом методе. В таких случаях алгоритм может, например, пытаться генерировать прогноз контрастного усиления с использованием способа tSVD.
[336] Генерирование протокола/параметров контрастирования для конкретного пациента
[337] Методы с управлением данными и для конкретного пациента для определения и прогнозирования фармакокинетики контраста в сердечно-сосудистой системе человека были изложены выше. Такие методы подходят не только для прогноза контрастного усиления, но обеспечивают способ вычисления инъекционного протокола, который предположительно достигает выбранные цели усиления для индивидуального пациента, и процедуры при использовании минимального объема контрастного вещества. В ряде показательных вариантов осуществления описаны системы и способы для вычисления индивидуализированных инъекционных протоколов для контрастно-усиленной КТ-ангиографии грудного отдела и сердца. Такие системы и способы были испытаны с использованием гибридной РВРК модели, описанной выше, как заменитель для данных человека.
[338] Задача может, например, быть поставлена как нелинейная задача минимизации с ограничением неотрицательности, помещенным на входную функцию. Четкое различие между подходом, разработанным здесь, и ранее опубликованными усилиями для вычисления индивидуализированных протоколов усиления в том, что не сделаны усилия, чтобы навязать прогнозированному контрастному усилению конкретную трапециевидную функцию. В числе таких подходов был получен протокол контрастной инъекции, который пытался достичь постоянного, равномерного контрастного усиления по всей продолжительности сканирования. Неблагоприятным эффектом таких подходов является то, что избыток управляемой энергии (объем контраста) прилагался для достижения равномерного пикового усиления по сравнению с попыткой сфокусироваться на достижении пикового усиления.
[339] В прошлом типичное время получения для КТА сканов колебалось между 20-40 секундами. С нынешним поколением КТ сканеров окно получения для КТА данных редко превышает 10 секунд. Не столь важно с очень короткими получениями сканирования конструировать инъекционные протоколы, которые минимизируют или предотвращают скошенные, остроконечные профили усиления. Скорее, современный метод генерирования инъекционных протоколов может, например, попытаться обеспечить, чтобы сканирование происходило во время пика контрастного усиления и чтобы значительное контрастное усиление достигалось в начале получения данных и в конце получения сканирования. Продолжительности сканирования для набора клинических данных, использованных для сравнений, описанных выше, в среднем 10 секунд, были собраны в 2006 и 2007 годах. В последние несколько лет КТ технологии продвинулись так, что эти периоды времени сканирования сейчас больше, чем типичная продолжительность сканирования.
[340] Некоторые цели контрастного усиления КТА и ведущие методологии генерирования протоколов, описанные здесь, графически изображены на фигуре 35. Воспроизведение гибридной РВРК модели, производящее профиль контрастного усиления, показано на этой фигуре. Вертикальные линии представляют 4 секундное окно получения КТА - продолжительность сканирования, типичная для современных КТ сканеров. Сканирование синхронизировано так, что оно расположено на профиле усиления для обеспечения того, чтобы пик контрастирования контраста получали во время получения сканирования. В начале получения сканирования (задержка сканирования) и в конце сканирования затухание контрастности больше, чем 350 HU. Если продолжительность сканирования в этом примере составляет 8 секунд, и желаемое целевое усиление составляет 300 HU, то задача также будет выполнена с помощью профиля инъекции при условии, что задержка сканирования будет скорректирована соответствующим образом для обеспечения начала сканирования при 300 HU. Алгоритм генерирования индивидуального протокола может также вычислить индивидуальную задержку сканирования, поскольку оптимальное время получения сканирования меняется как функция от инъекционного протокола, гемодинамики пациента и выбранной цели контрастного усиления.
[341] Уровень контрастного усиления является параметром, который может, например, быть свободным для выбора рентгенолога, и соответствующая цель усиления будет зависеть от предпочтений рентгенолога, продиктованных предполагаемой патологией и какими либо процедурными ограничениями. Сложилось общее мнение, что минимальное контрастное усиление в 250 HU является приемлемым, чтобы дифференцировать сосудистый просвет от бляшек, тромбов и другой патофизиологии во время КТА сердца и грудной клетки. При КТА коронарной артерии недавно было показано, что необходима повышенная чувствительность для точного обнаружения коронарного стеноза, когда коронарное контрастное усиление составляет более 320 HU. В некоторых случаях, когда у пациента есть почечная недостаточность или болезнь, более низкий уровень усиления может быть допустим, если это означает, что объем контраста минимизирован, чтобы помочь предотвратить или смягчить повреждение почек.
[342] Независимо от конкретной клинической мотивации рациональный алгоритм генерирования протокола контрастирования и алгоритм генерирования протокола контрастирования для конкретного пациента может, например, обеспечить возможность предполагаемого целевого уровня контрастного усиления для индивидуального пациента. Алгоритм может затем попытаться достичь желаемого максимума контрастного усиления и минимального усиления в течение полной продолжительности сканирования.
[343] Важные рассмотрения алгоритма генерирования рационального контрастного протокола обсуждались выше. Для достижения таких задач представлена функция стоимости, которая является компонентом ряда вариантов осуществления способа, системы или алгоритма генерирования протокола контрастирования или параметров. Функция стоимости минимизирована с помощью численной оптимизации. В ряде вариантов осуществления результатом такой минимизации является инъекционный протокол с минимальной скоростью потока и продолжительностью инъекции, достаточной для минимизации стоимости. Функция стоимости, используемая алгоритмом протокола контрастирования, является функцией от 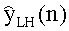
[344] 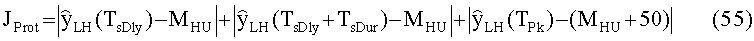
[345] где TsDly является задержкой сканирования КТ исследования, как вычислено с помощью алгоритма генерирования протокола, TsDur является продолжительностью сканирования получения КТА, TPk является временем максимального контрастного усиления, и MHU является желательным уровнем целевого усиления. Все эти параметры определены на фигуре 35. Пятьдесят HU добавляют к пиковому целевому усилению, признавая, что контрастное усиление будет остроконечным и никаких усилий не делается для сглаживания профиля усиления. Пятьдесят HU выбрано в качестве цели, поскольку два участка сосудистой сети аорты, различаясь по контрастному усилению на 50 HU, как правило, не имеют клинического значения. Поскольку воспроизведения и вычисления выполняют в дискретном времени, временные параметры (TsDur, TsDly, и TPk) в функции стоимости являются дискретными значениями времени.
[346] Предсказанное усиление левого сердца является функцией от векторов параметров и контрастной инъекции:
[347] 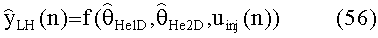
[348] и входная функция для предсказанного усиления, 9LH является импульсной:
[349] 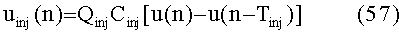
[350] Последний элемент в функции стоимости, определенный в уравнении 55, штрафует отклонения усиления, большие, чем на 50 HU выше целевого уровня усиления, и добавлен в функцию стоимости для предотвращения ситуации, в которой целевое HU достигается, но пик намного выше, чем необходимо (и используя, таким образом, больше контраста, чем необходимо для достижения целевых задач).
[351] Помещенная в контекст генерирования инъекционного протокола, процедура минимизации формулируется как:
[352] 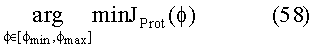
[353] где аргументы в векторе, ϕ, являются скоростью потока инъекционного протокола (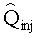
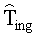
[354] 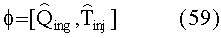
[355] который параметризует входную функцию, уравнение 57.
[356] Минимизация ограничена, поскольку верхний и нижний пределы размещены на скорости потока инъекции и продолжительности инъекции. Очевидно, что нижнее ограничение является неотрицательностью, но верхние пределы являются конкретной задачей. Например, максимальная скорость потока может быть определена как функция от внутреннего диаметра внутривенного катетера или предпочтений медицинского персонала. Максимальная продолжительность инъекции является функцией от максимального объема контраста, доступного в шприце. Поскольку верхний предел скорости потока и объема диктуется клиническими ограничениями и настраивается пользователем, верхний предел продолжительности инъекции является максимальным объемом, деленным на минимальную скорость потока. Нижний предел скорости потока установлен в 3 мл/с, а минимальная продолжительность инъекции составляет восемь секунд. Инъекции при скорости потока менее 3 мл/с не подходят для КТА, поскольку они, вероятно, приведут к усилениям менее 250 HU для большинства пациентов. Длительность инъекции менее чем восемь секунд при самой низкой скорости потока 3 мл/с и может привести к объемам контраста, эквивалентным пробному болюсу.
[357] Присутствие локальных минимумов и разрывов в функции стоимости может, например, быть исследовано до проведения численных экспериментов, и с этой целью несколько графиков поверхности функции стоимости, заданной уравнением 55, были генерированы с использованием данных воспроизведения контрастного усиления, созданных с помощью гибридной РВРК модели. Параметры входной функции колебались от 2 до 7 мл/с (для Qinj) в приращениях 0,1 мл/с и от 6 до 22 секунд в приращениях 0,5 секунды. Демографические данные субъекта 6 из набора клинических данных были использованы для генерирования прогнозов контрастного усиления, yLH(n), на каждой паре инъекционной скорости потока и продолжительности. Цели контрастного усиления и продолжительности сканирования, использованные для генерирования графиков пространства функции стоимости, были 250 HU, 350 HU цели и 2 и 8 секунд, соответственно. Эти значения представляют типичные верхний и нижний пределы, основанные на современной технологии КТ сканирования и клинических предпочтениях. Трехмерные графики поверхности четырех случаев представлены на фигуре 36, и 2D-проекции пространства решений представлены в виде контурных графиков на фигуре 37.
[358] Осмотр поверхностей функции стоимости показал, что даже для одного пациента есть широкое разнообразие морфологии пространства решений, так как процедурные параметры изменяются. 8-секундные сканы отображают два минимума, но один четко определенный глобальный минимум. Для 2-секундных случаев продолжительности сканирования, глобальный минимум отличается, но он лежит в длинном желобе, указывая потенциальные трудности для численного решателя в достижении истинного глобального минимума. Длинный желоб указывает, что может быть множество пар продолжительности инъекции и скорости потока, которые могут удовлетворить целевой критерий (достижение желаемого целевого контрастного усиления в течение интервала, равного продолжительности сканирования). Эти данные повлияли на развитие протокола или методологии генерирования параметров, описанной ниже.
[359] Как обсуждалось выше, надежный алгоритм генерирования контрастного протокола должен адаптироваться к каждому субъекту и длительности сканирования, позволяя рентгенологу выбрать желаемые цели контрастного усиления и обеспечить, чтобы эти цели были выполнены в начале и в конце получения сканирования. Следует также вычислить задержку сканирования для каждого пациента, удовлетворить требования в пределах ограничений параметра нижней и верхней границами, и минимизировать общий объем контраста. Для достижения этих задач была разработана численная минимизационная схема с использованием функции стоимости, определенной в уравнениях 55 и 58 с итерационной процедурой, которая адаптирует начальные условия и верхние границы параметров (если это возможно) и затем испытывает решение относительно задач целевого усиления. Потенциальным для метода генерирования протоколов является применение временного болюса для генерирования оценки контрастного усиления для конкретного пациента. Общими шагами алгоритма являются: (1) Ввести пациенту пробный болюс; (2) Обработать данные сканирования временного болюса для генерирования модели контрастного усиления для конкретного пациента (с использованием методов, описанных выше) с использованием начальных условий в uinj
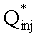
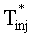
[360] Некоторые параметры в функции стоимости уравнения 55 определяются предпочтением рентгенолога (целевое контрастное усиление, MHU) и процедурой (продолжительность сканирования, TsDur, максимальный объем, Vmax и скорость потока, Qmax), тогда как время максимального контрастного усиления (TPk) определяется прогнозированным контрастным усилением и входной функцией, uinj(n).
[361] Рассмотрение может быть предоставлено параметризации TsDly поскольку это не так легко определяется рентгенологом или оператором сканера. Это время на подъеме контрастного усиления (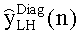
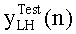
[362] Поскольку пробный болюс имеет более короткую продолжительность инъекции, чем полная диагностическая инъекция, время до достижения максимального пробного болюсного контрастного усиления не должно быть временем для начала получения сканирования во время диагностического сканирования. Обычной практикой является вычисление задержки сканирования для диагностического сканирования как времени максимального усиления ТЕС из пробного болюса плюс период смещения, TOffset. В предыдущих исследованиях Toffset было 4 или 6 секунд на основе продолжительности сканирования. Для коротких сканирований большее время смещения используется в попытке позиционировать короткое окно сканирования на пике контрастного усиления. Когда сканирование длительное, сканирование должно начинаться раньше, чтобы помочь обеспечить поместить пик и целевые пороговые значения внутри окна сканирования. Этот подход выбора времени сканирования выражается как:
[363] 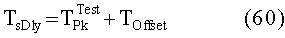
[364] где 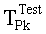
Таблица 16 Алгоритм генерирования протокола


[365] Vmax является максимальной верхней границей ограничения для минимизации и выбирается рентгенологом. Qmax является максимальной скоростью потока для индивидуального пациента, продиктованной венозным доступом или калибром IV катетера. Как Qmax так и Vmax определяют верхнее ограничение программы минимизации.
[366] Сравнение с предварительно опубликованными результатами было сделано путем выполнения алгоритма Fleischmann и Hittmair и использования данных пробного болюсного усиления, опубликованных в Fleischmann, D. and К.Hittmair, Mathematical analysis of arterial enhancement and optimization of bolus geometry for CT angiography using the discrete fourier transform. J Comput Assist Tomogr, 1999. 23(3): p.474-84, в качестве входных и выходных данных. Такие же данные пробного болюсного усиления были также использованы алгоритмом генерирования протокола в Таблице 16, и протоколом контрастирования, генерированным с помощью обоих сравниваемых способов.
[367] Проверка алгоритма генерирования протокола, представленная здесь, была выполнена с использованием таких же 20 воспроизведенных наборов данных, созданных с помощью гибридной модели, как описано выше. Множество комбинаций продолжительностей сканирования и целевых усилений определяют данные процедуры. Генерированные инъекционные протоколы из численной минимизации и алгоритм протокола были использованы в качестве входов для воспроизведений гибридной ФК модели для каждого субъекта. Результат признавался успешным, если профиль контрастного усиления, генерированный алгоритмом, превышал целевое усиление (MHU) для продолжительности сканирования TsDur.
[368] Алгоритм был выполнен и осуществлен в MATLAB (R2008b) с использованием функции инструментария оптимизации fmincon в качестве способа оптимизации. Функция fmincon выполняет нелинейную ограниченную оптимизацию как задачу последовательного квадратичного программирования (SQP). Методы SQP разбивают более крупные задачи на более мелкие, подзадачи квадратичного программирования (QP) на каждую итерацию решателя. Способ использует метод линейного поиска (аппроксимация гессиана сделана на каждой итерации и квазиньютоновский метод корректирует лагранжиан) и функцию качества для решения каждой подзадачи. Более подробная информация о решателе может быть найдена в Coleman and Branch, Optimization Toolbox for Use with MATLAB, User's Guide, T. Mathworks, Editor 2007.
[369] Конкретными ограничениями решателя были: сходимость допуска на параметры (TolX)=1Е-4, сходимость допуска на функцию (TolFun)=1Е-4, минимальное приращение для конечной разницы подпрограммы (DiffMinChange)=0,01, максимальное приращение для конечной разницы подпрограммы (DiffMaxChange)=2,0, максимальное число оценок функции на каждую итерацию составило 400. Максимальное число итераций (maxIter) было установлено на 100.
[370] Выполнение методологии Fleischmann и Hittmair, как суммировано в Приложении 2 настоящего документа, было сделано в MATLAB с использованием опубликованных данных пробного болюсного усиления (как численно табулировано в Приложении к Fleischmann, D. and К.Hittmair, Mathematical analysis of arterial enhancement and optimization of bolus geometry for CT angiography using the discrete fourier transform. J Comput Assist Tomogr, 1999. 23(3): p.474-84), и желаемых уровней усиления. Ответ пробного болюсного усиления у испытуемого человека (значения усиления сообщены в Fleischmann, D. and К.Hittmair, Mathematical analysis of arterial enhancement and optimization of bolus geometry for CT angiography using the discrete fourier transform. J Comput Assist Tomogr, 1999. 23(3): p.474-84.) представлен на фигуре 38 и был использован для генерирования протоколов контрастирования. Ответ пробного болюсного усиления являются типичным для коротких болюсных инъекций, измеренных на нисходящей части дуги аорты с помощью КТ сканера. Желаемое усиление было определено как уровень 200 HU, начиная с пика пробного болюсного усиления. Быстрое линейное увеличение в диапазоне от 0 до 200 HU и быстрое линейное уменьшение от 200 HU до 0 было добавлено к переднему и заднему концам желаемого профиля усиления для генерирования трапециевидного профиля усиления. Уклон переднего и заднего быстрого линейного изменения совпадал с данными полученными Fleischmann и Hittmair.
[371] Фигуры 39A-D представляют вычисленные инъекционные протоколы с использованием метода Fleischmann и Hittmair. Фигура 39А показывает необработанный протокол, вычисленный с помощью алгоритма. Инъекционный протокол является отрицательным в участках и превышает обычно используемую скорость потока, особенно когда вводятся вязкие (13-20 сП), с высокой концентрацией йода контрастные средства. Фигура 39В является тем же вычисленным протоколом, но с отрицательными скоростями потока, усеченными до нуля. Фигура 39С и D представляет вычисленный протокол с максимальной скоростью потока, установленной на 7 мл/с (условно). Протоколы фигур 39С и D усекают входной протокол в различных выборочных точках, как поясняется ниже.
[372] Время до пика усиления в пробном болюсном усилении фигуры 38 составляет 14 секунд и транспортная задержка, или время распространения контраста, для того, чтобы контраст поступил в сосуд (восходящая часть дуги аорты) составляет приблизительно 8-10 секунд. Время распространения контраста ограничивает вклад контраста в инъекционный протокол для образцов меньше, чем за 10 секунд до конца сканирования. Протокол на фигуре 39С усечен до 34 секунд, тогда как протокол фигуры 39D усечен до 32 секунд.
[373] Трапециевидное численное интегрирование было использовано для вычисления общего объема контраста в каждой инъекции и объемов, аннотированных на фигурах 39A-D. Эти объемы контраста были вычислены, чтобы служить в качестве основы для сравнения методов, представленных в этом описании. Общий объем контраста уменьшился, так как протоколы были модифицированы, но существуют явные произвольности в подходе, взятом для генерирования этих результатов. Fleischmann и Hittmair не предлагают алгоритм оптимизации для минимизирования объема контраста.
[374] Прогнозированные профили усиления с использованием расчетной импульсной характеристики из деконволюции Фурье (с использованием метода Fleischmann и Hittmair) и вычисленные протоколы фигур 39A-D показаны на фигурах 40A-D. Наименьшая разность между предсказанным и желаемым усилением существует для протокола А и наибольшая для протокола D.
[375] Протокол контрастирования был также создан с использованием тех же данных пробного болюса и процедуры с использованием алгоритма, описанного в Таблице 16. Поскольку только одна кривая пробного болюса представлена в Fleischmann, D. and К. Hittmair, Mathematical analysis of arterial enhancement and optimization of bolus geometry for CT angiography using the discrete fourier transform. J Comput Assist Tomogr, 1999. 23(3): p.474-84., методология tSVD была использована для определения модели пациента. Полученная кривая контрастного усиления, наложенная на желаемую 30-секундную длительность сканирования, показана на фигуре 41. Объем контраста, рассчитанный с помощью алгоритма для достижения желаемой цели усиления, составил 114,9 мл при скорости потока 4,1 мл/с. Объем составляет на 20 мл меньше, чем прогноз наименьшего объема из алгоритма Fleischmann и Hittmair (фигура 39D), и не требует модуляции скорости потока во времени, что могло привести к нежелательному расширению контрастного болюса в периферической сосудистой сети.
[376] Алгоритм генерирования протокола был испытан в реальных условиях с использованием 20 наборов воспроизведенных данных, генерированных с помощью гибридной РВРК модели. Демографические данные субъектов (рост, вес, пол, возраст) были идентичны таковым из набора ретроспективных клинических данных, использованных в исследованиях, описанных выше. Отношения физиологических параметров, определенные в Таблицах 1 и 2, были использованы, чтобы установить параметры гибридной модели для серии воспроизведений. Для каждого субъекта была выполнена модель (период воспроизведения образца=0,01 с/образец) с 20 мл пробного болюса (с 40 мл фазы промывки физиологическим раствором) при 5 мл/с, входная функция и соответствующие ТЕС пробного болюса (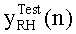
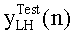
[377] После того, как пробные болюсные кривые усиления были генерированы, они были использованы в качестве входных и выходных данных для алгоритма MLE, разработанного, как описано выше. Параметризованные для конкретного пациента параметры модели (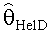
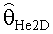
[378] Производительность алгоритма генерирования протокола была оценена с использованием вычисленного инъекционного протокола в качестве входного сигнала в гибридную ФК модель. При воспроизведении модели с рассчитанным инъекционным протоколом была записана продолжительность усиления, большая, чем желаемое MHU. Продолжительности усиления сравнили с продолжительностью сканирования для каждого экспериментального набора, и успех был определен как повышение большее, чем целевое для заданного времени сканирования. Из-за ошибок округления (в основном введены при субдискретизации в ТЕС до 1 сек/образец) и других случайных эффектов, приемлемость была расширена на продолжительность сканирования плюс/минус 0,5 секунды. Блок-схема экспериментальной конфигурации представлена на фигуре 42.
[379] Пример типичного результата из набора экспериментальных данных показан на фигуре 43. В этом случае (субъект 8 из набора клинических данных) продолжительность сканирования составила 4 секунды, и Мни составило 300 HU. Алгоритм вычислил протокол диагностической инъекции 4,52 мл/с в течение 15 секунд (67,8 мл контраста) и полученные в гибридной модели ТЕС превышают целевое усиление для продолжительности сканирования.
[380] Два суммарных графика, отображающих время превышения целевого усиления, Мни, по 20 воспроизведенным субъектам, представлены на фигуре 44 и фигуре 45. На обеих фигурах горизонтальная пунктирная линия представляет продолжительность сканирования для конкретного эксперимента. На фигуре 44 продолжительность сканирования составила 2 секунды, и целевое усиление составило 350 HU. Для всех 20 субъектов усиление превышало Мни Для продолжительности сканирования (начиная с вычисленной задержки сканирования, TsDly).
[381] Фигура 45 показывает результаты всех двадцати субъектов, испытанных, когда продолжительность сканирования составила 8 секунд, и MHU был 250 HU. В этом эксперименте два субъекта имели результирующие времена усиления чуть меньше, чем целевые (субъект 3-7,8 секунды, субъект 8-7,6 секунды), но были в пределах предусмотренного допуска. Другие субъекты имели результирующие кривые усиления большие или равные продолжительности сканирования и, в некоторых случаях, с превышением времени выборки сканирования. По сравнению с двумя секундами продолжительности сканирования и 350 HU цели результатов, однако, представляется, что оптимизация привела к более эффективным (минимальная скорость потока и продолжительность инъекции) протоколам. Табличные результаты всех экспериментов, включая сводные статистические данные вычисленных протоколов диагностических инъекций (скорости потока, объемы), показаны в Таблице 17.
[382] В Таблице 17 дано краткое изложение результатов экспериментов по генерированию протоколов. Каждая строка представляет 20 воспроизведений гибридной ФК модели при целях процедуры, определенных в первых двух столбцах.
[383] Во всех экспериментальных случаях нелинейный оптимизатор нашел возможное решение и сошелся к решению. Среднее время выполнения для оценки каждого субъекта и оптимизация протоколов составила 5,6+/-1,2 секунды (Pentium III PC, windows XPPro, 2 GB RAM).
[384] Испытание алгоритма генерирования протокола с использованием гибридной ФК модели подтвердило методы как надежные для разных типов пациентов и процедурных установок. Результаты в Таблице 17 показывают тенденции в соответствии с принципами контрастного усиления. Например, продолжительность инъекции и увеличение объема контраста как увеличение продолжительностей сканирования для каждой группы целевого усиления. Кроме того, так как продолжительности сканирования уменьшаются, вычисленные скорости потока увеличиваются, что ожидаемо, поскольку с короткими приемами продолжительность сканирования должна быть расположена вблизи пика контрастного усиления. Можно добиться большего пикового усиления путем инъекций с короткой продолжительностью при высокой скорости потока.
[385] В результатах, показанных на фигуре 44, целевое усиление было превышено на несколько секунд во всех случаях. Эти результаты могут указывать, что для коротких продолжительностей сканирования функция стоимости может, например, быть модифицирована для сокращения продолжительности инъекции. Кроме того, для коротких продолжительностей сканирования, позиционирование длительности сканирования на кривой усиления может быть пересмотрено. Например, TsD!y может быть установлено как TPk минус половина продолжительности сканирования. Такой подход не производит идеальных результатов, однако, при временах сканирования 8 секунд или дольше, вследствие морфологии ТЕС стремится получить перекос (справа) для более длительных продолжительностей инъекции.
[386] Вышеупомянутое описание и сопровождающие изображения изложили ряд показательных вариантов осуществления. Различные модификации, дополнения и альтернативные конструкции, конечно, будут очевидны для специалистов в данной области техники в свете вышеупомянутого изложения, без отклонения от объема настоящего документа, который указан в последующей формуле изобретения, а не с помощью вышеупомянутого описания. Все изменения и вариации, которые попадают в пределы смысла и диапазона эквивалентности формулы изобретения должны быть заключены в пределах ее объема.
Приложение 1
[387] Ostergaard et al. применили деконволюцию Фурье и другие деконволюционные подходы к извлечению "остатка" функции, или импульсной характеристики тканей головного мозга между питающей артерией и отводящей веной для оценки ишемического инсульта в Контрастно Усиленной (СЕ) МРТ перфузии. Ostergaard, L., et al., High resolution measurement of cerebral blood flow using intravascular tracer bolus passages. Part I: Mathematical approach and statistical analysis. Magn Reson Med, 1996. 36(5): p.715-25. В то время как применение МРТ перфузии отличается от текущей проблемы, она имеет сходство с проблемой идентификации контрастного вещества/пациента в том, что измерения выполняются на физиологической системе кровообращения с использованием внутрисосудистых средств. Поэтому подобные шумовые процессы можно было бы ожидать. Ostergaard обнаружил, что усеченное разложение по сингулярным числам матрицы (tSVD) было самым надежным способом для решения обратной задачи импульсной характеристики ткани, даже когда SNR<10. Ostergaard, L., et al., High resolution measurement of cerebral blood flow using intravascular tracer bolus passages. Part II: Experimental comparison and preliminary results. Magn Reson Med, 1996. 36(5): p.726-36. Недавно Koh et al. также продемонстрировали надежность tSVD в оценке MP перфузии с использованием нового метода выбора индекса усечения разложения по сингулярным числам матрицы. Koh TS, W.X., Cheong LH, Lim CCT, Assesment of Perfusion by Dynamic Contrast-Enhanced Imaging Using a Deconvolution Approach Based on Regression and Singular Value Decomposition. IEEE Trans Med Imaging, 2004. 23(12): p.1532-1542.
[388] Задачей tSVD (как и других методов деконволюции) является оценка h, данного шумного вектора измерений у и матрицы U, построенной из входных выборок,u.
[389] 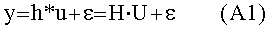
[390] и е предполагается независимым с идентичным распределением случайным процессом. Прежде чем решать для h, Н разлагается на сингулярные векторы (левый U и правый V) и матрицу сингулярных значений (Σ) через разложение по сингулярным числам матрицы:
[391] 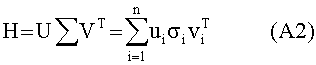
[392] где 2 является квадратной матрицей с неотрицательными сингулярными значениями Н по диагонали. Решение для h может быть найдено путем алгебраической манипуляции при подстановке Н из уравнения А2 в уравнение А1. Очевидным решением для h является:
[393] 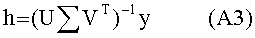
[394] Малые сингулярные значения, однако, могут усиливать шум, присутствующий в векторе измерения. Чтобы ограничить эффект шума ранг уравнения может быть понижен путем игнорирования сингулярных значений Е больших, чем пороговое значение. Вектор решения для h:
[395] 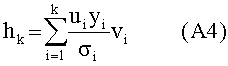
[396] Обоснование правильного выбора индекса усечения, к, для данной задачи должно быть, однако рассмотрено. tSVD является методом регуляризации -непараметрическим подходом к решению плохо обусловленных обратных задач, в котором каждый делает выбор между установкой данных и гладкостью решения. Стандартным методом регуляризации является регуляризация Тихонова, которая решает следующие задачи минимизации (предполагается, что стандартное обозначение линейной системы Ax=b):
[397] 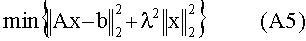
[398] где λ является параметром регуляризации, который взвешивает норму решения 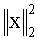
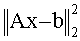
[399] 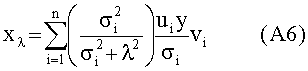
[400] где являются сингулярными значениями, и λ является параметром регуляризации. Первый элемент в сумме известен как фактор фильтрации Тихонова. Hansen, Р.С., The truncated SVD as a method for regularization. BIT, 1987. 27: p.534-55. Если индекс усечения, k, из tSVD известен, тогда параметр регуляризации λ=σk где σk является сингулярным значением на индексе k.
[401] L-кривая является log-log графиком (фигура 47 является примером) нормы решения против нормы невязки для различных значений параметра регуляризации. Точка (индекс) максимальной кривизны L-кривой используется в качестве оценки оптимального компромисса между решением и остаточными ошибками. Недостатком этого метода, однако, является то, что иногда угловая точка затенена шумом.
[402] Koh et al. представил автоматизированный метод нахождения индекса усечения для tSVD (и, следовательно, параметра регуляризации λ=σk) путем установки кусочно-линейных кривых в log график коэффициентов Фурье в SVD (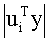
[403] В присутствии шума log коэффициентов Фурье в графике Пикара имеет тенденцию к монотонному уменьшению до точки, в которой наклон линии уменьшается, и начинается выравнивание (см. пример на фигуре 46). Индекс точки перегиба или перехода, таким образом, является индексом усечения для tSVD. Сингулярное значение на индексе используется в факторе фильтрации Тихонова. Koh et al. определили точку перехода путем установки двух различных линейных моделей к данным в графике Пикара и используя критерий суммы квадратов ошибки, чтобы определить точку перехода.
Приложение 2
[404] Fleischmann и Hittmair использовали способы Фурье для выполнения деконволюции, необходимой в оценке передаточной функции пациент/лекарственный препарат. Если ut(n) является пробным болюсом с дискретным временем (единицы мл/с), yt(n) является сигналом с дискретным временем, представляющим ответ пациента и лекарственного препарата, измеренный сканером (Hounsfield Units, единицы Хунсфилда). Предполагая, что контрастное вещество и сосудистая система ведет себя как инвариантная система линейного времени, расчетная импульсная характеристика системы была найдена путем деконволюции:
[405] 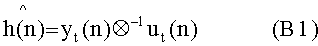
[406] В Z-области деконволюционная операция,⊗-1, является спектральным разделением:
[407] 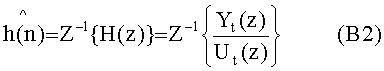
[408] где Z-1 представляет обратный оператор z-преобразования. Операции были выполнены в дискретном времени, поскольку сигнал ответа пациента, yt(n) отбирали каждые 1 или 2 секунды с помощью КТ сканера. Контрастное усиление измеряли с применение круговой Зоны Интереса (ROI) на абдоминальную аорту проксимально к подвздошной артерии.
[409] Для уменьшения влияния высокочастотного шума (предполагается, что нефизиологический) Fleischmann и Hittmair фильтровали выходной спектр путем умножения на экспоненциальное ядро (т является коэффициентом пересчета):
[410] 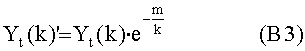
[411] Поскольку нулевое или небольшие значения в знаменателе уравнения могут привести к численной неустойчивости, они обеспечивают Н(k) равняющимся нулю когда Ut(k) было нулевым, путем умножения фильтрованного выходного спектра с помощью маскирующей сигнум функции, sgn(x) определенной как:
[412] 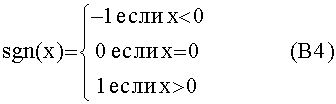
[413] Расчетная передаточная функция системы пациент/лекарственный препарат была:
[414] 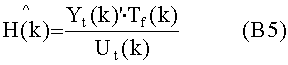
[415] с:
[416] 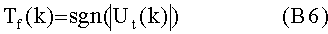
[417] маскирующая функция сигнум предотвращала оценку передаточной функции из растущей неограниченности.
[418] Их задачей было определить необходимый вход для получения желаемого
ответа усиления во время диагностического КТ сканирования. Идеальная входная функция контраста была вычислена путем:
[419]
[420] Обратное, дискретное преобразование Фурье уравнения В7 определило входную функцию, необходимую для достижения желаемого уровня усиления во времени.
[421] В целом, необработанная, вычисленная входная функция является нереализуемой, поскольку были генерированы отрицательные скорости потока и скорости потока часто превышали 8 мл/с.Скорости потока ограничены клиническими и системными ограничениями до 6-7 мл/с из-за пределов прочности материалов шприца, трубок и катетеров. Давление, генерируемое в системе, является функцией от вязкости контрастного вещества, калибра (или внутреннего диаметра) катетера, длины и диаметра трубок, и сосудистого статуса пациента. Поэтому многие рентгенологи уменьшают максимальную скорость потока для пациента в зависимости от состояния места сосудистого доступа, статуса здоровья пациента или уверенности врача, вводящего препарат. Для производства реализуемых профилей инъекции Fleischmann и Hittmair применили эвристическое правило к протоколу контрастной инъекции, что предотвратило отрицательные скорости потока и округлило непрерывно меняющуюся функцию таким образом, что система контрастной инъекции смогла реализовать инъекцию. Не было, однако, описано явного алгоритма, описывающего усечение, в [9] или [36], хотя некоторые коды MATHEMATICA были включены в [8].
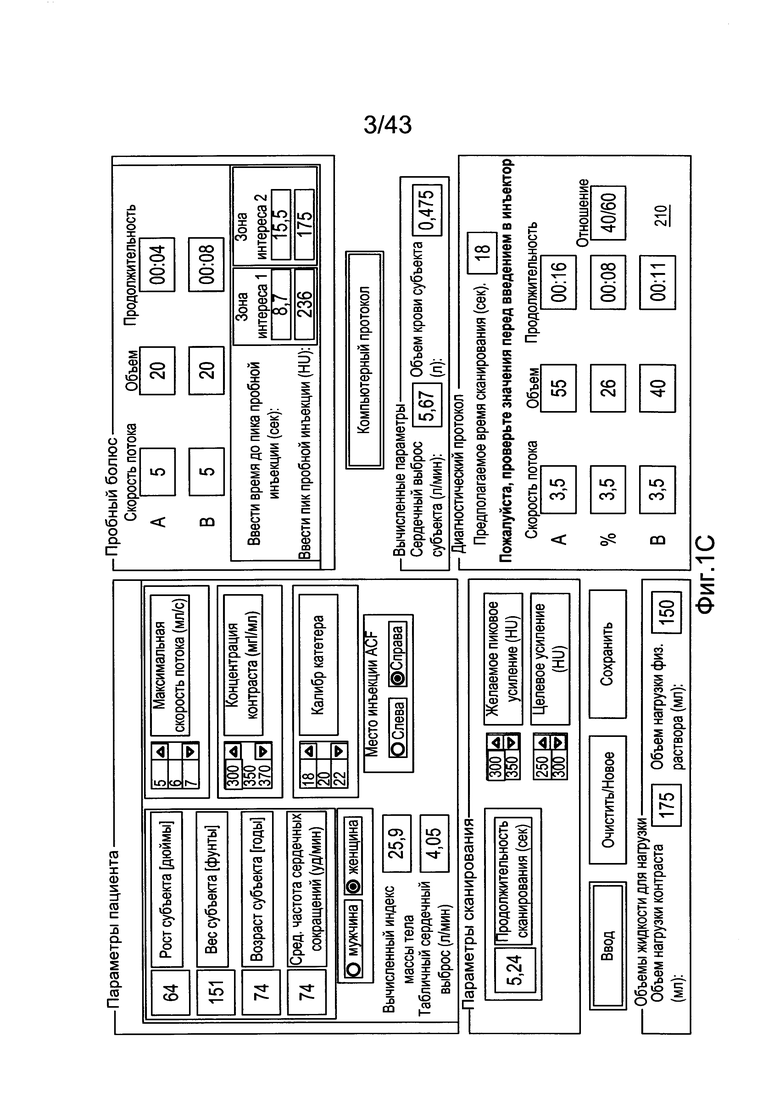
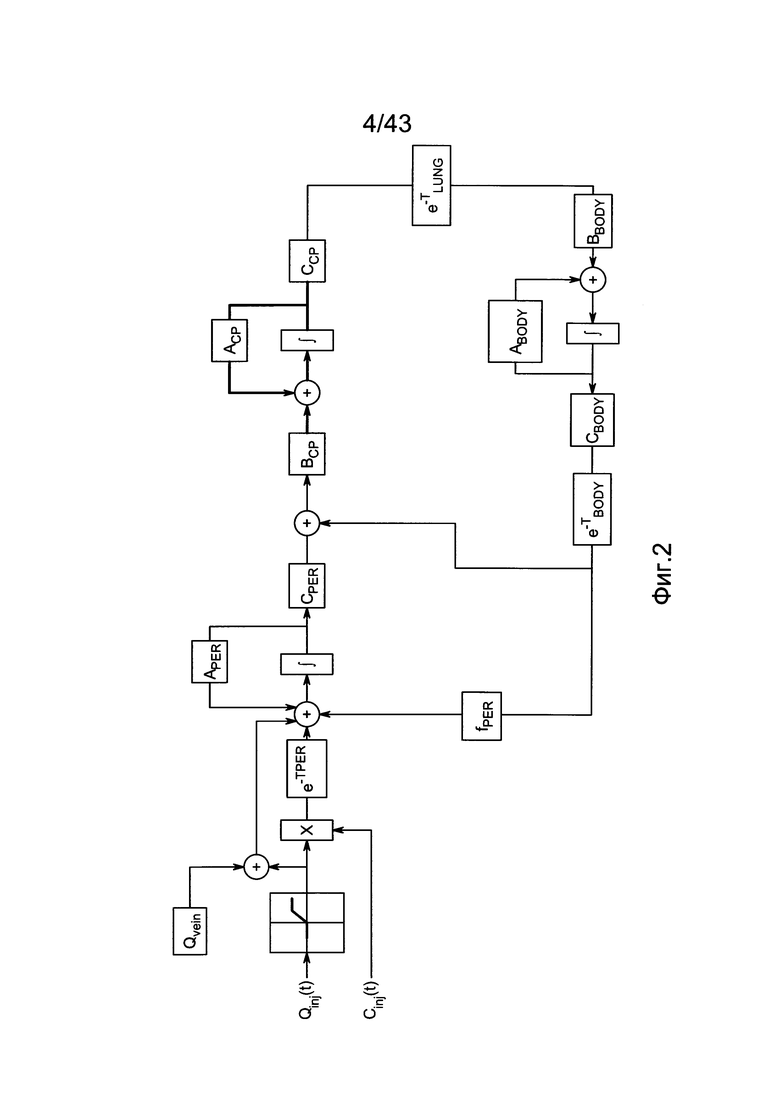
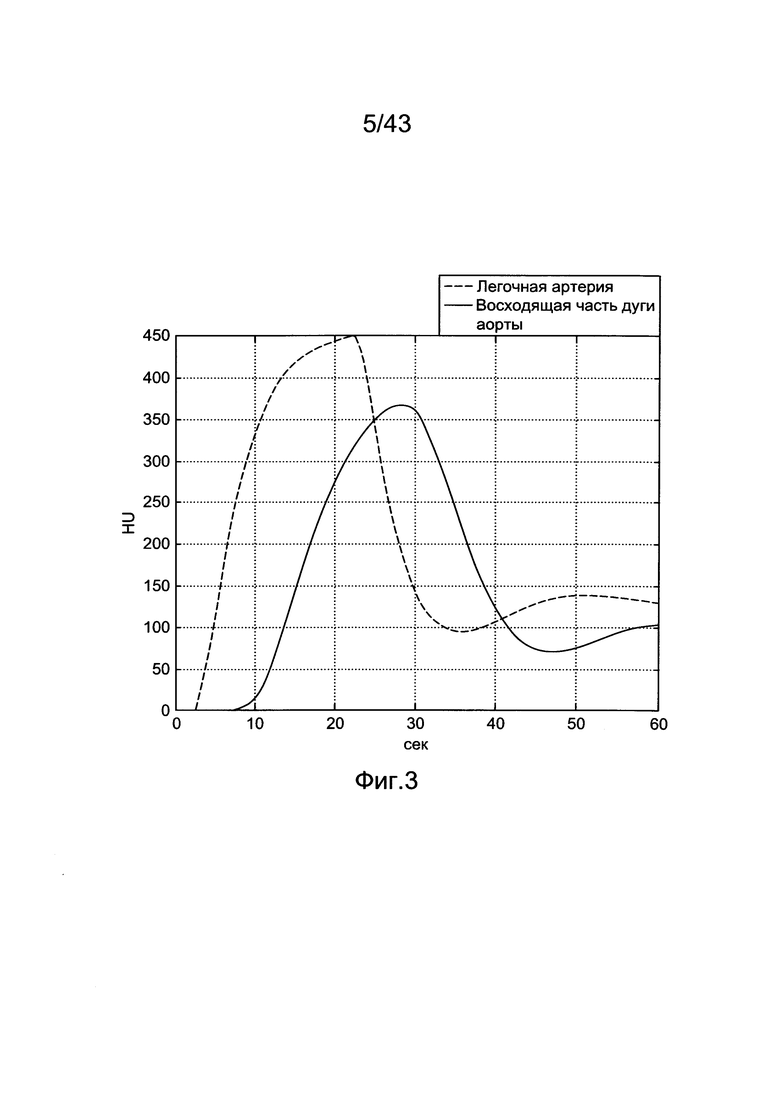
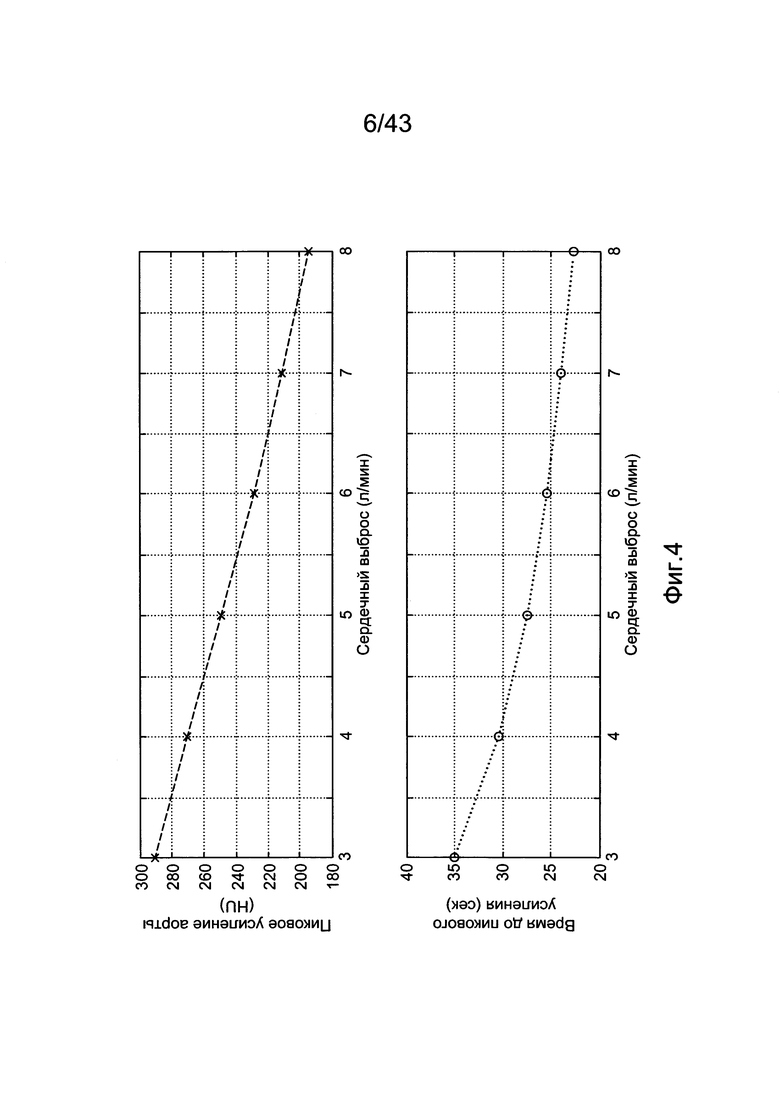
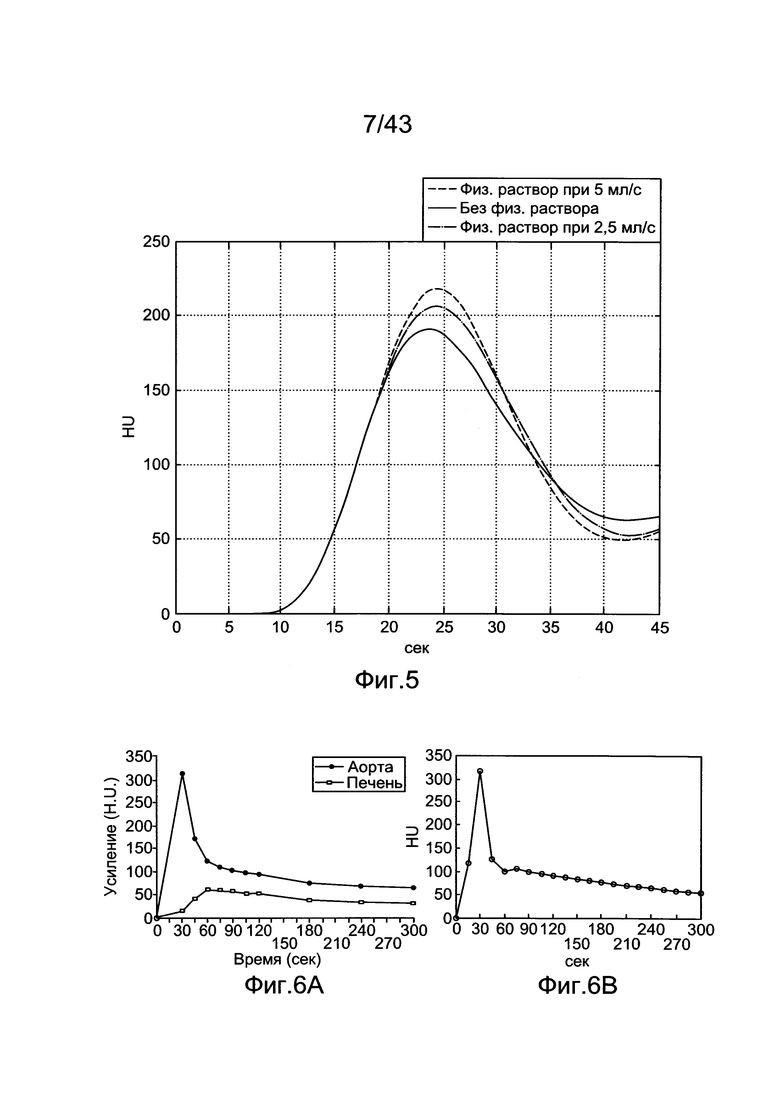
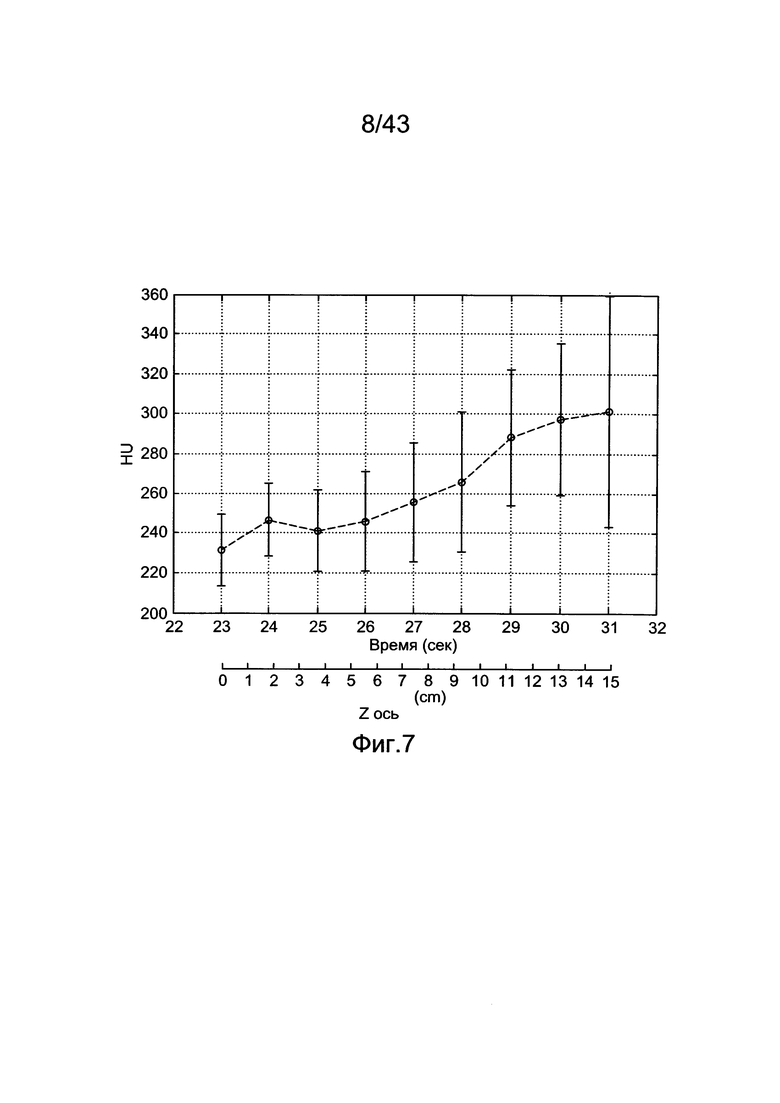
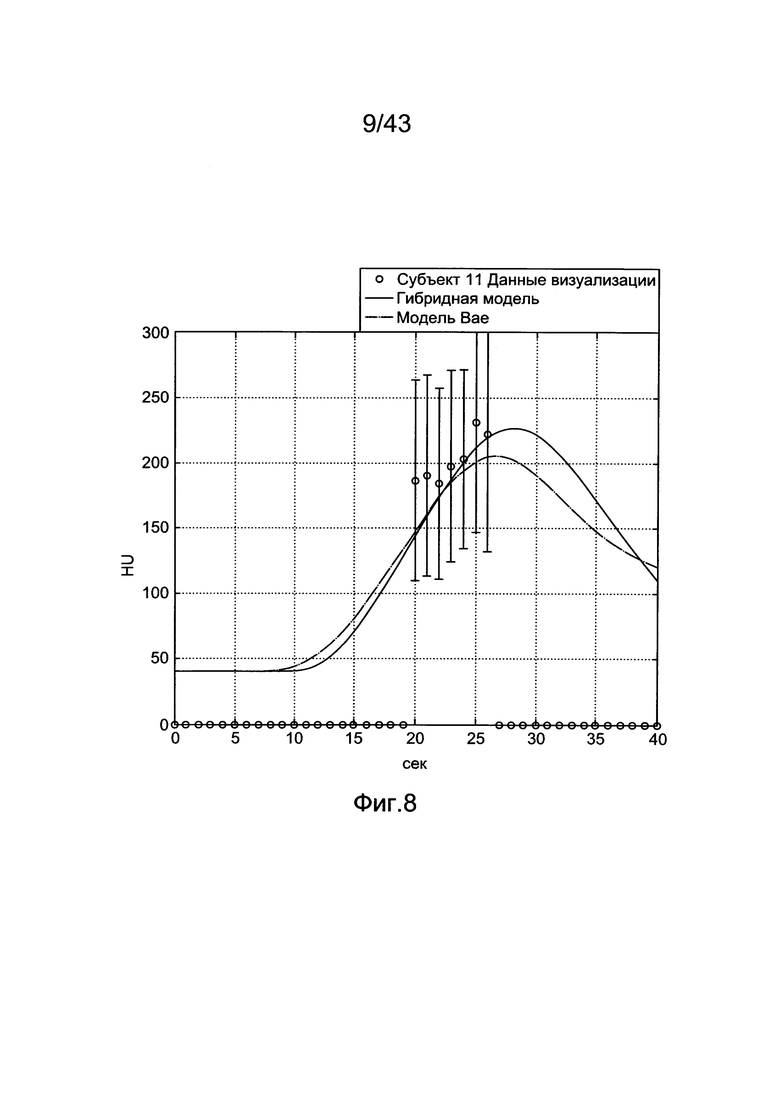
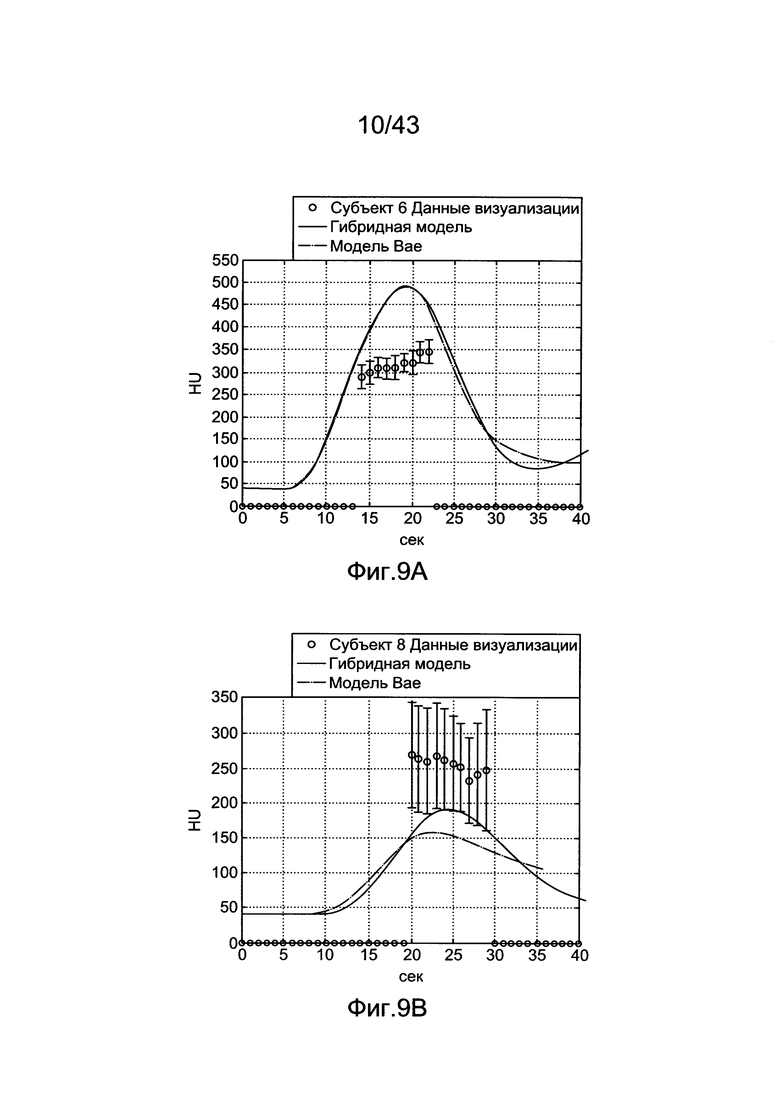
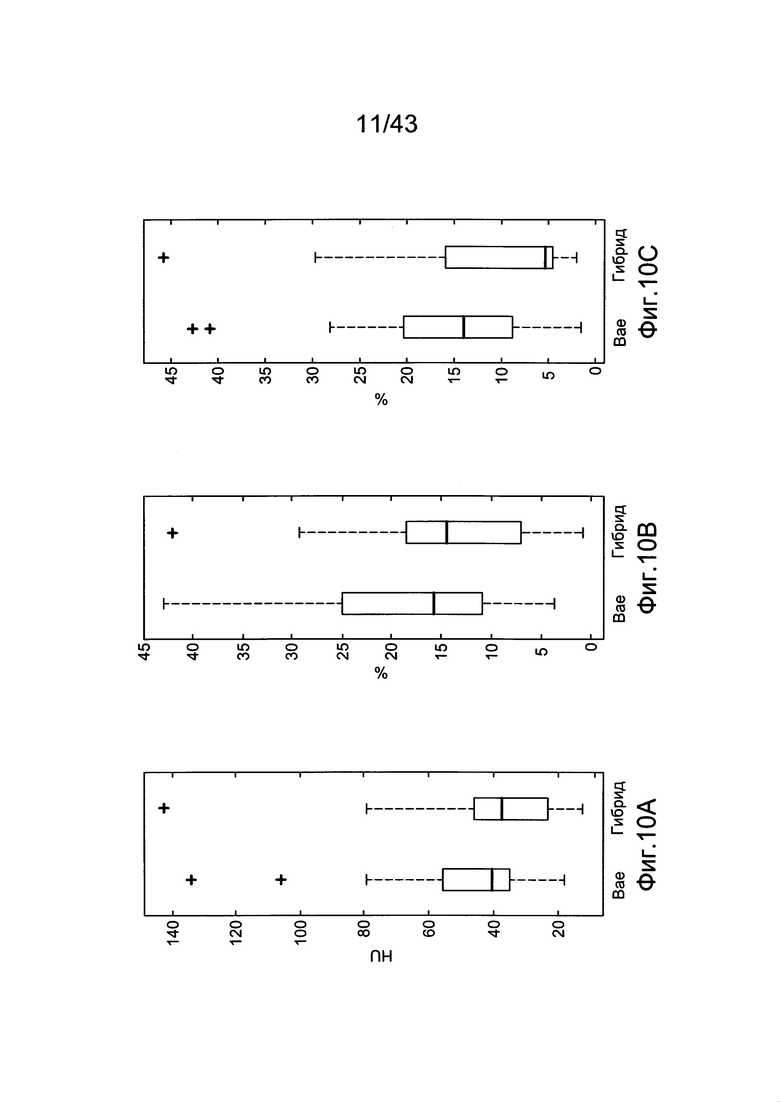
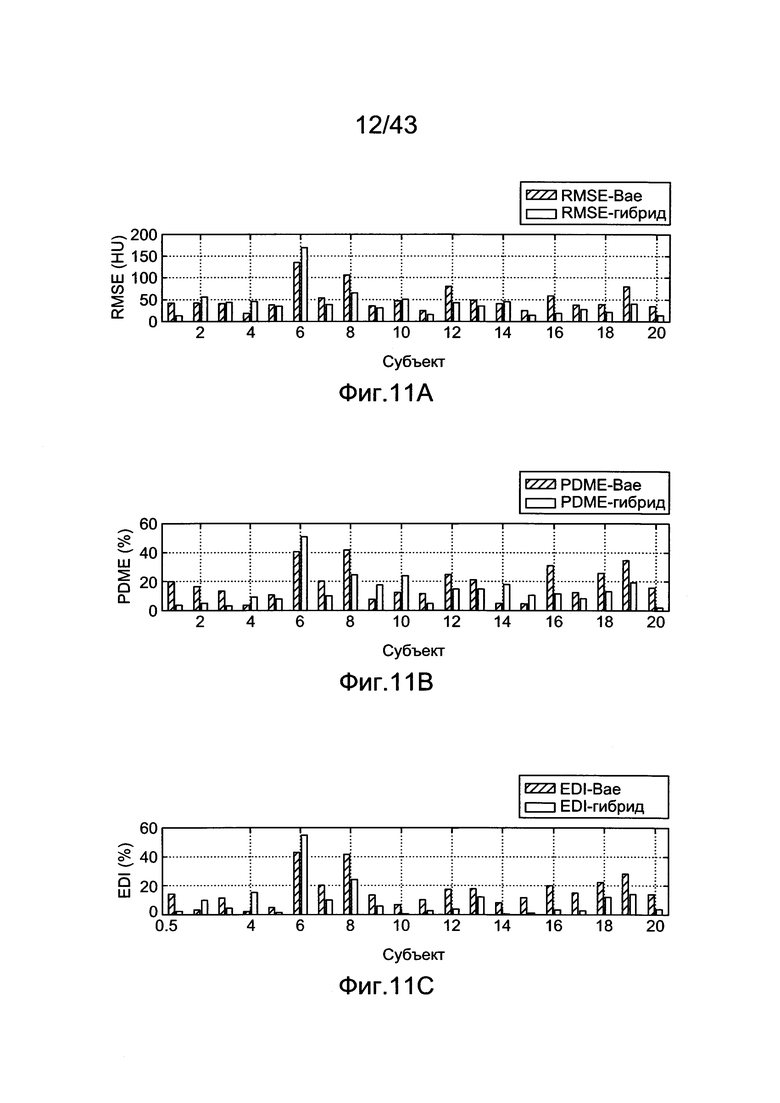
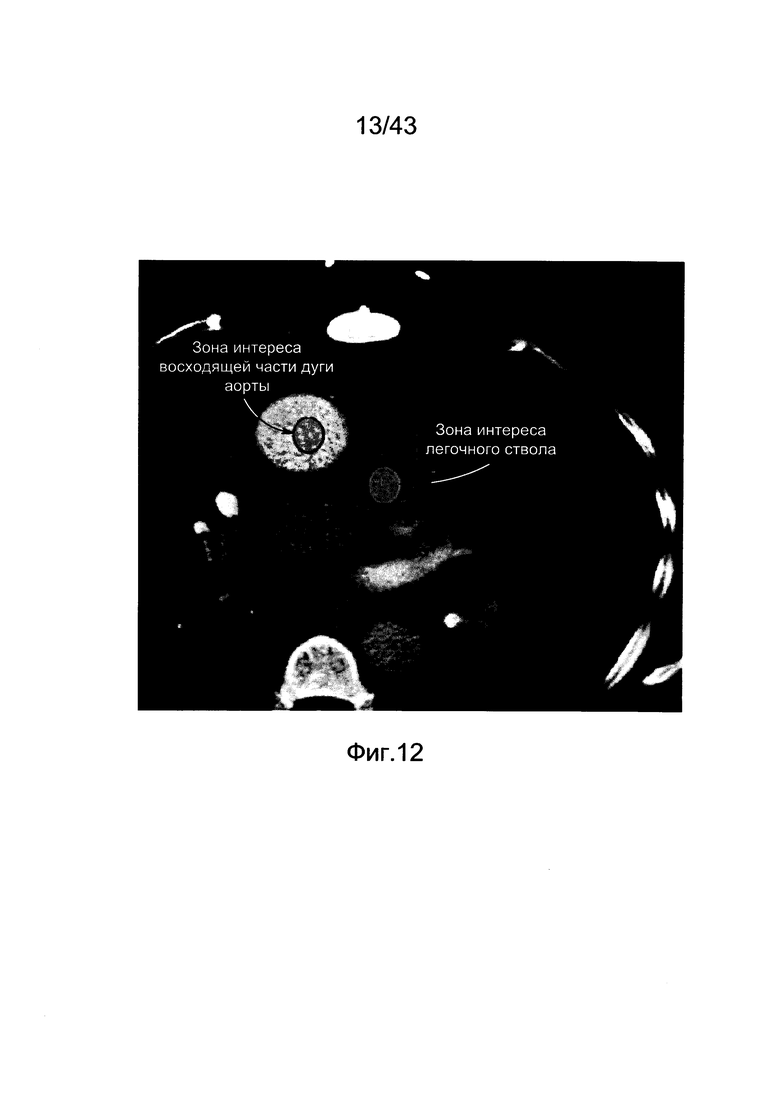
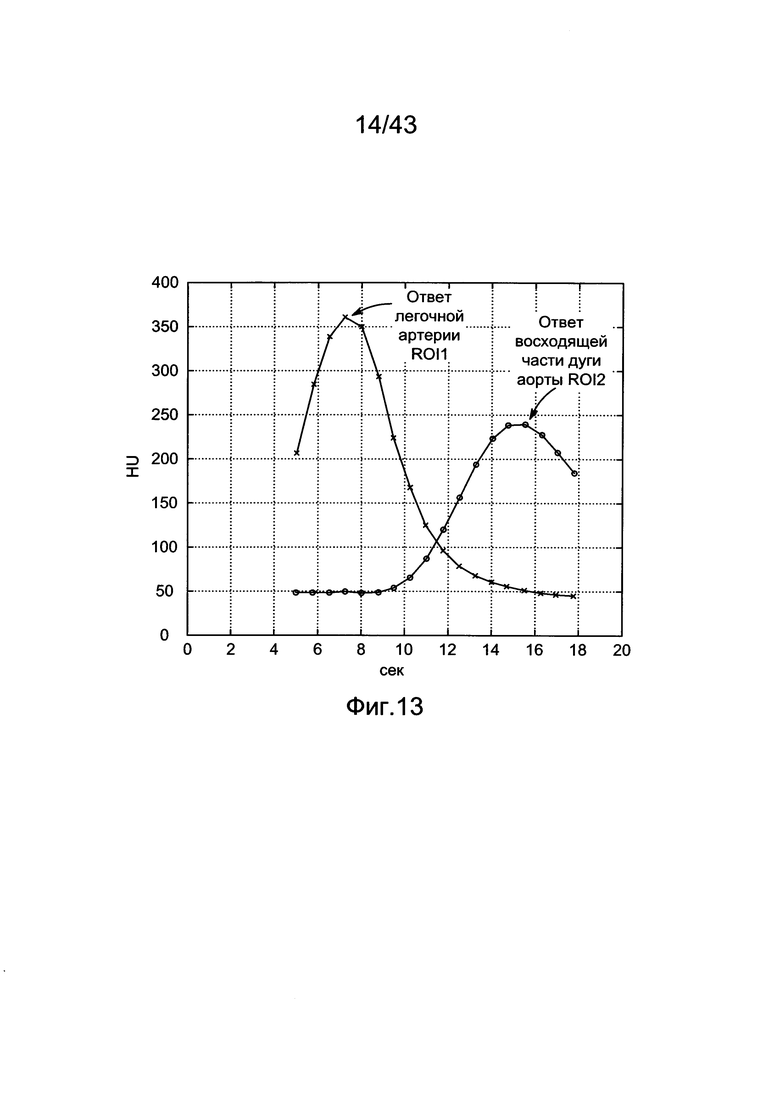
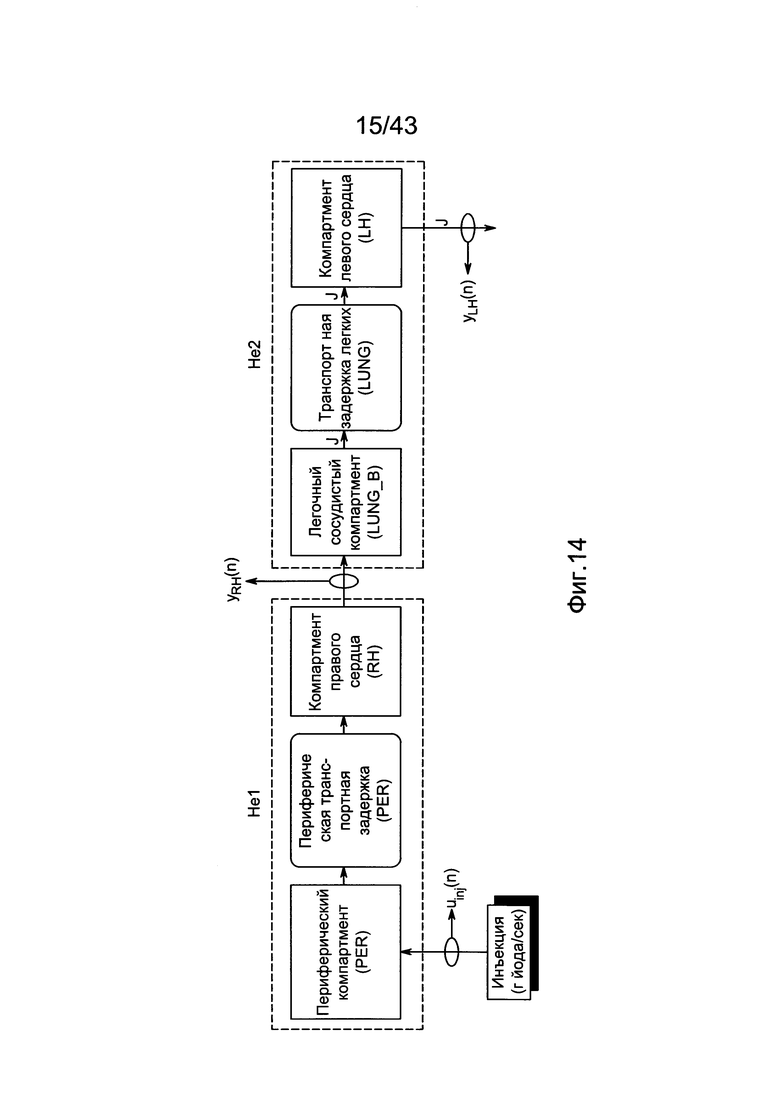
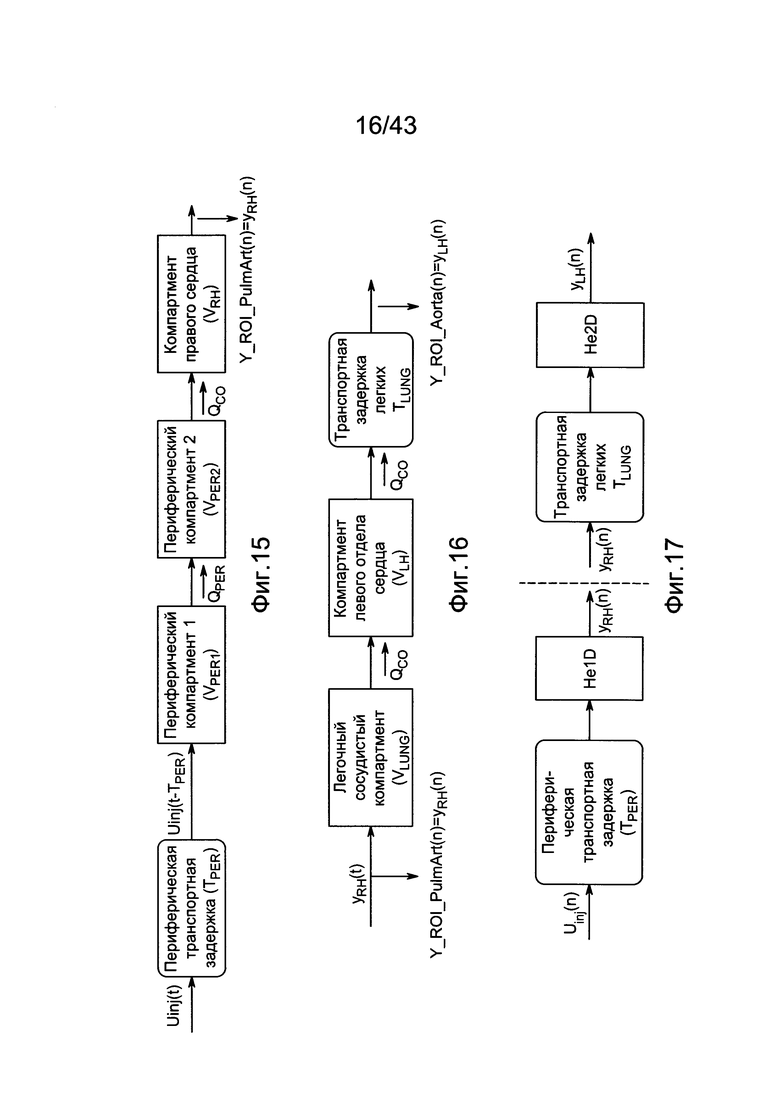
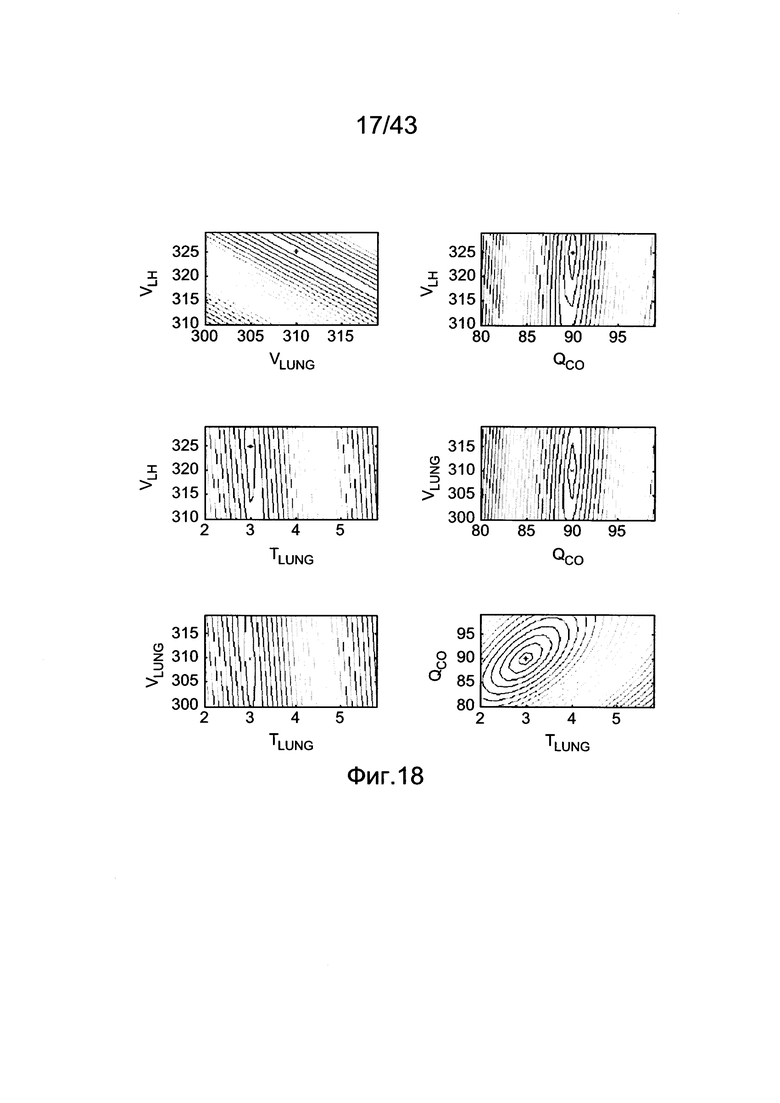
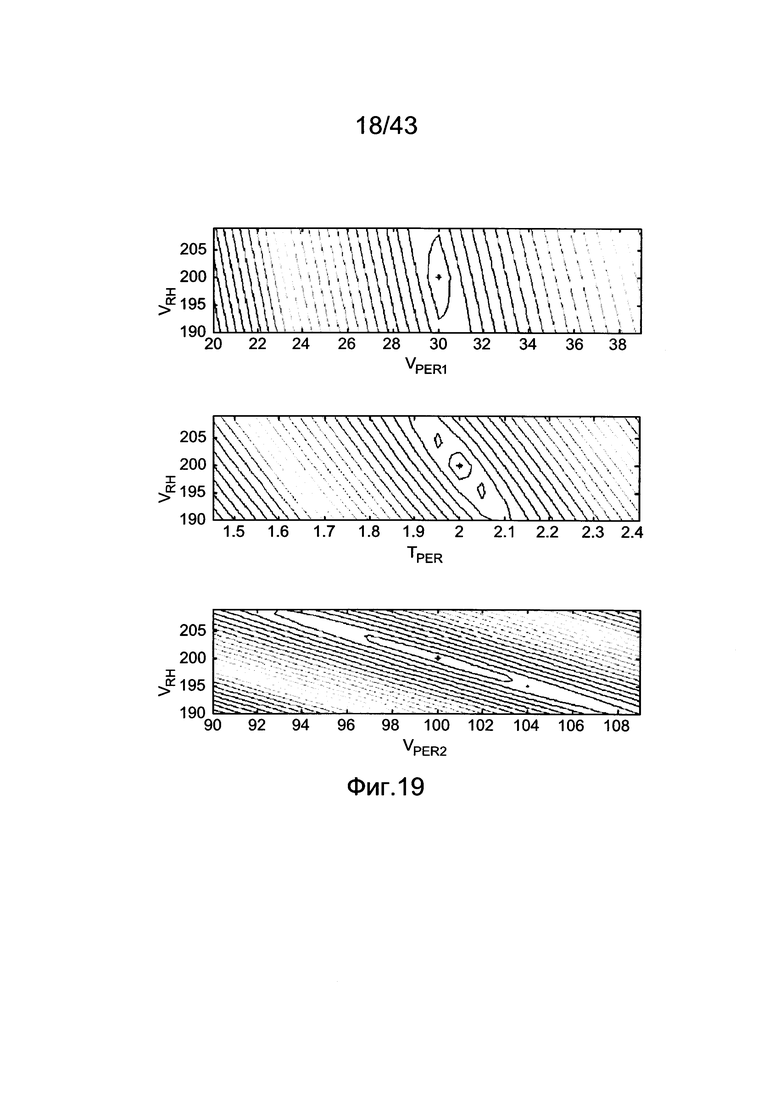
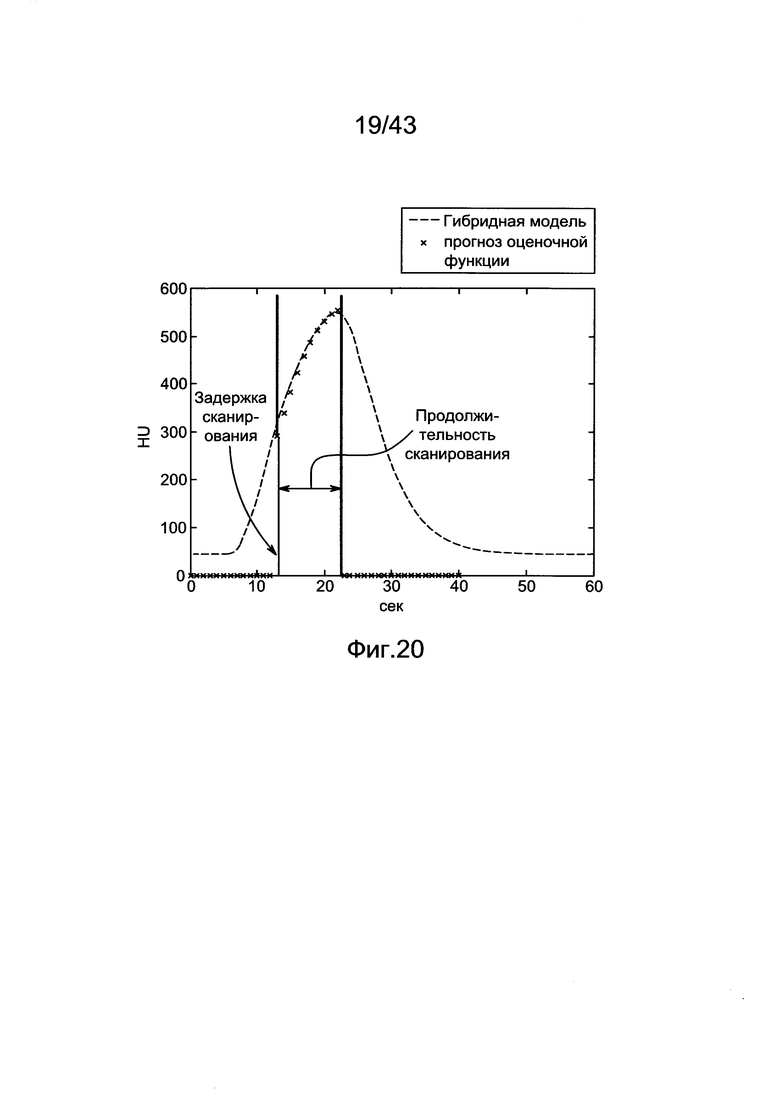
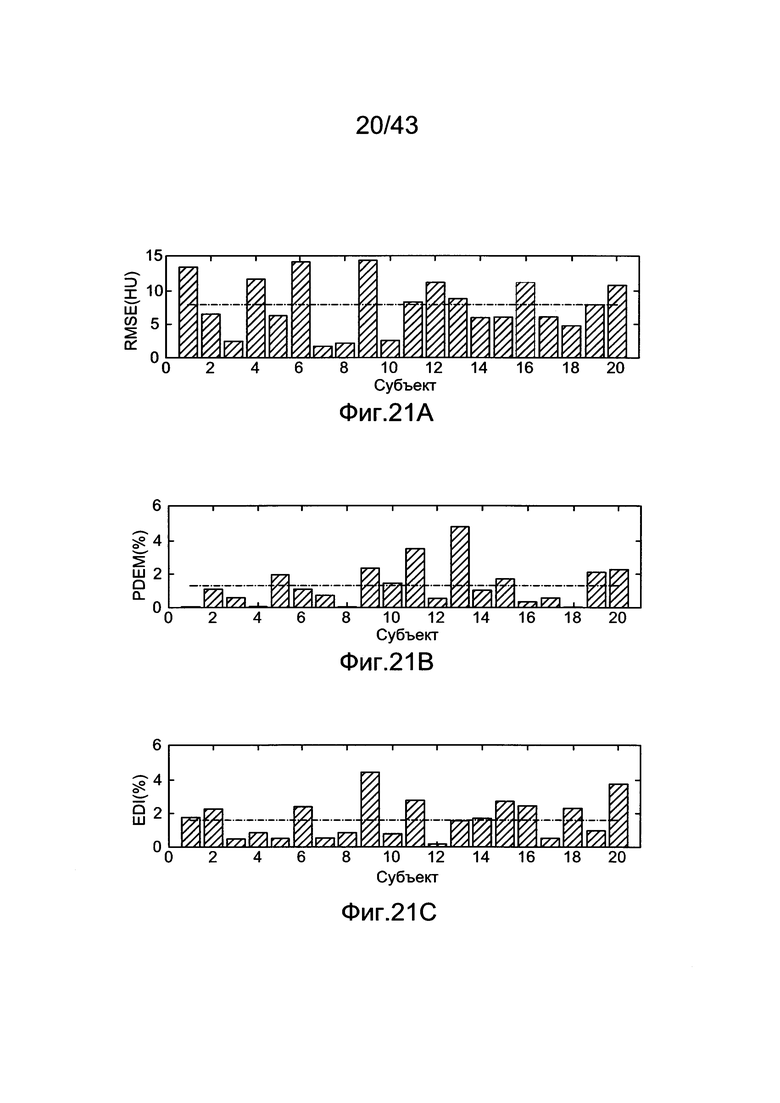
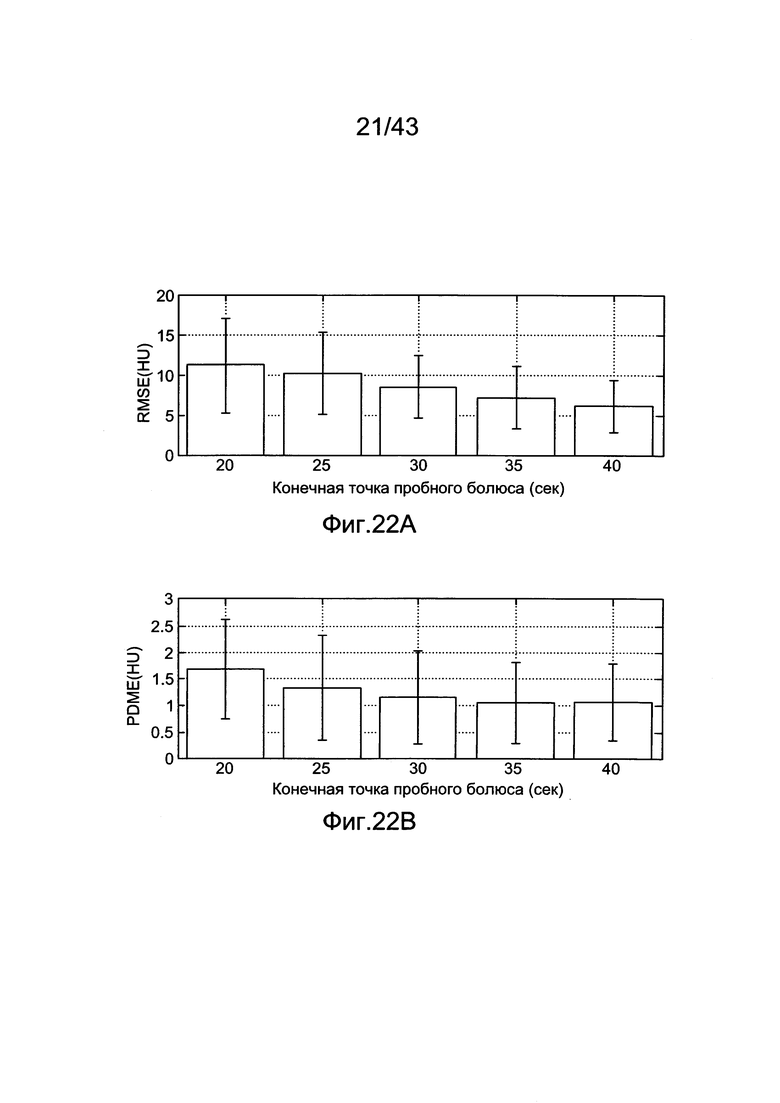
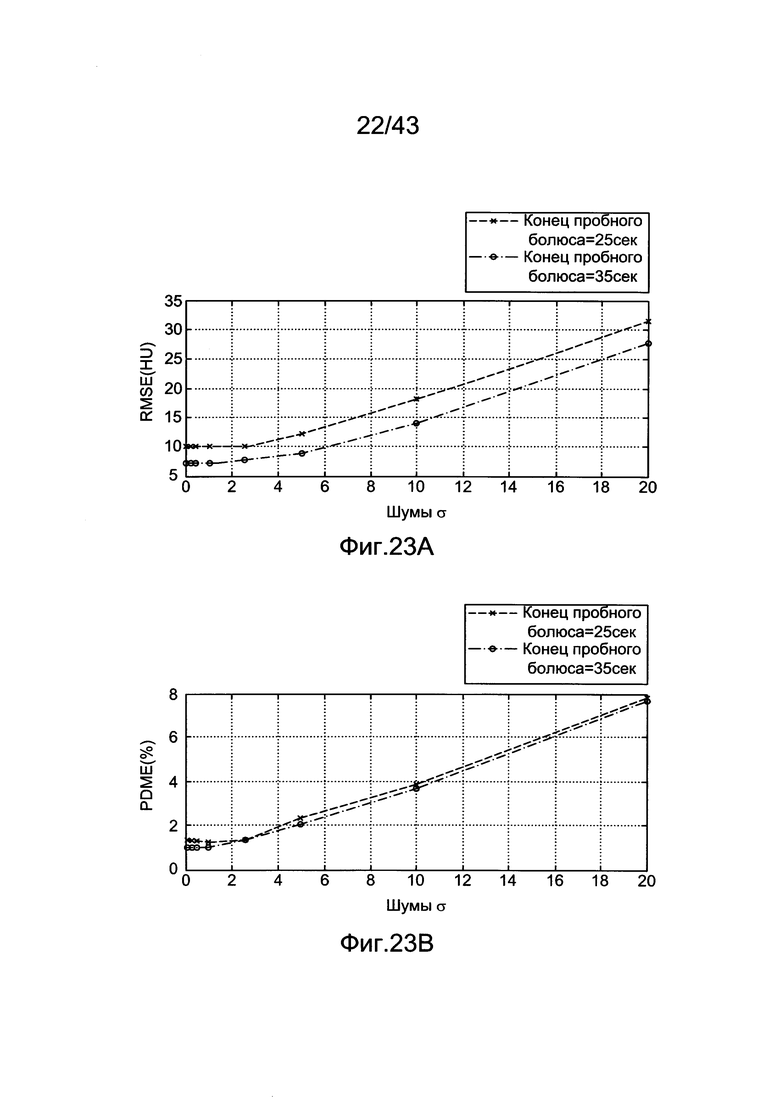
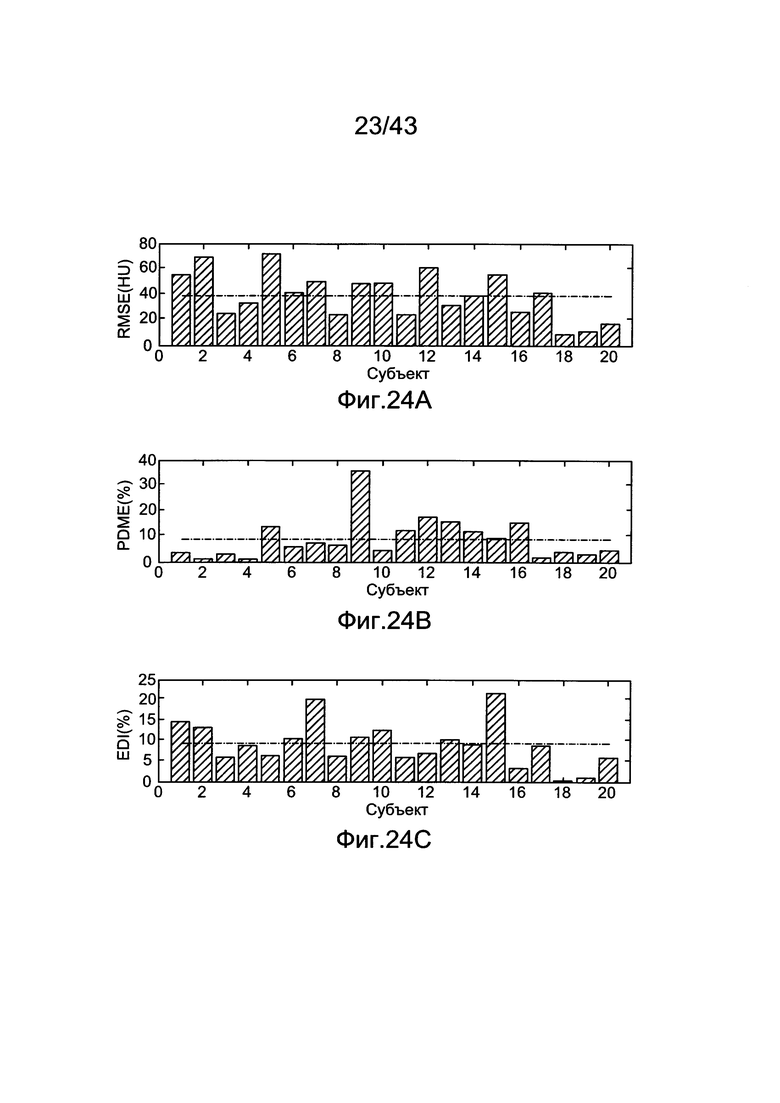
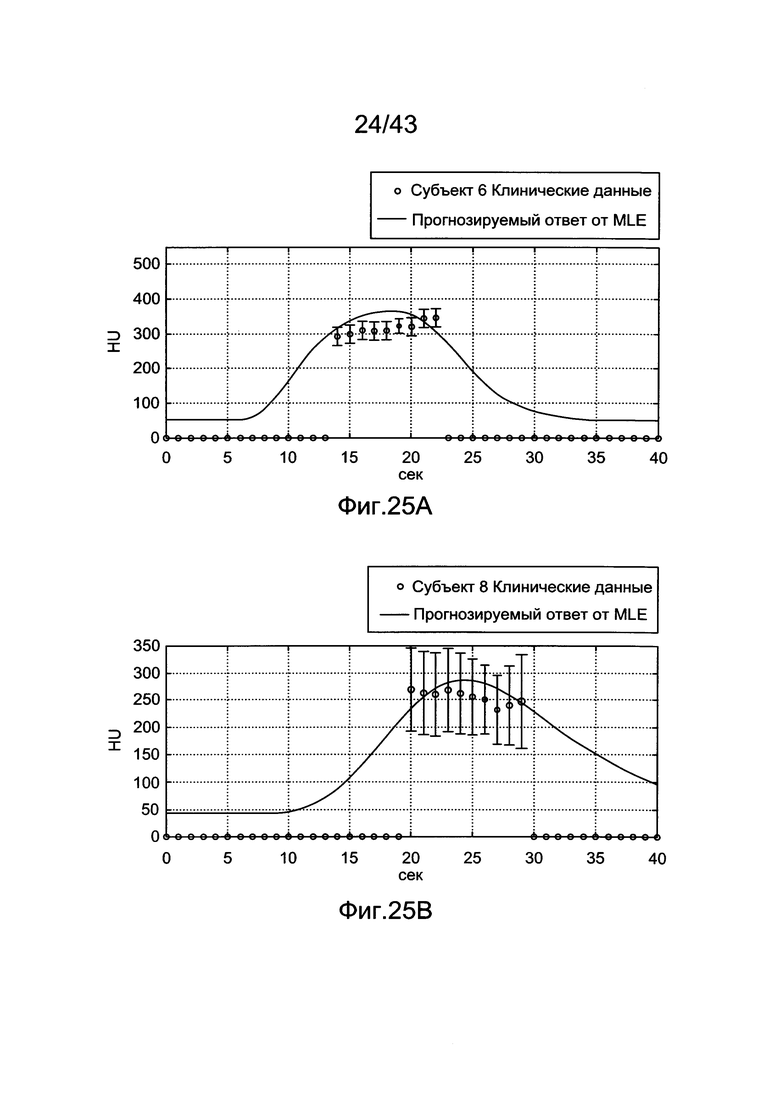
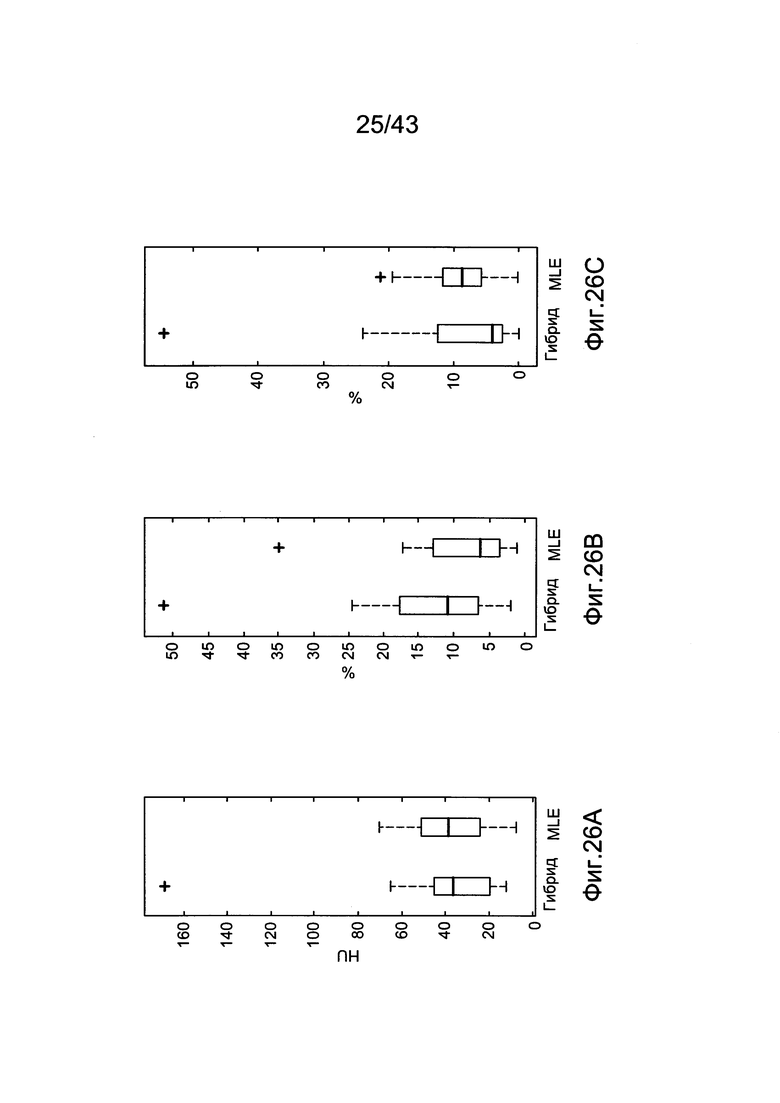
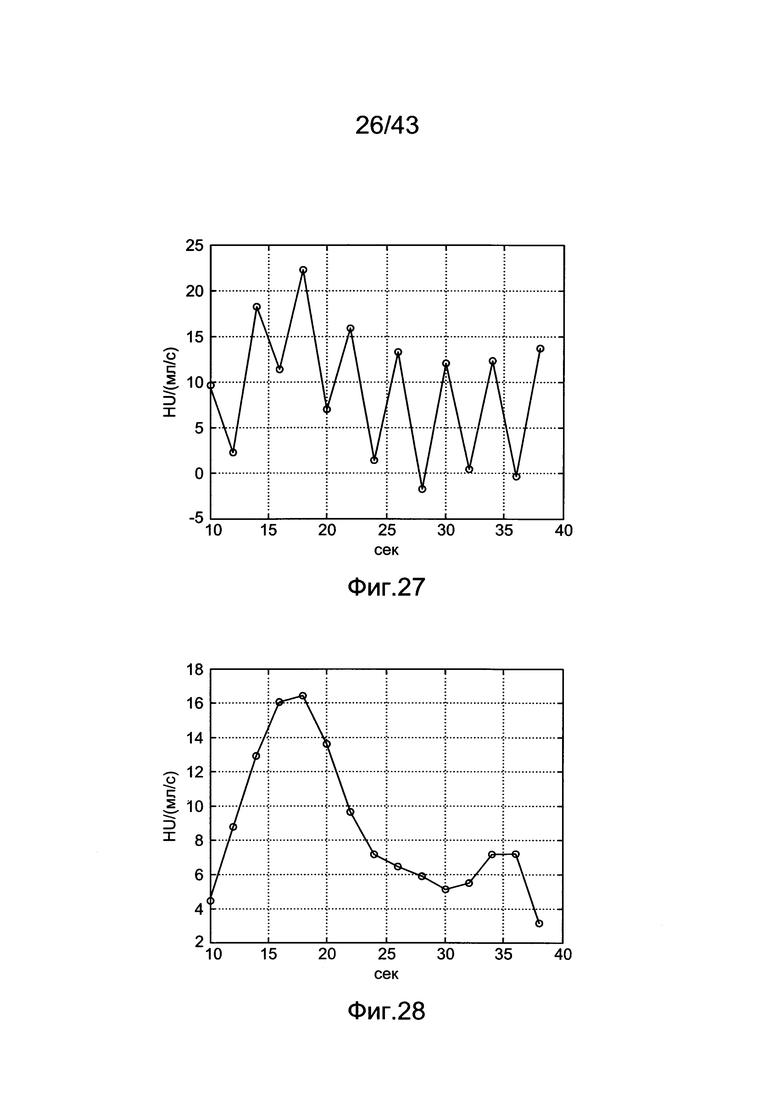
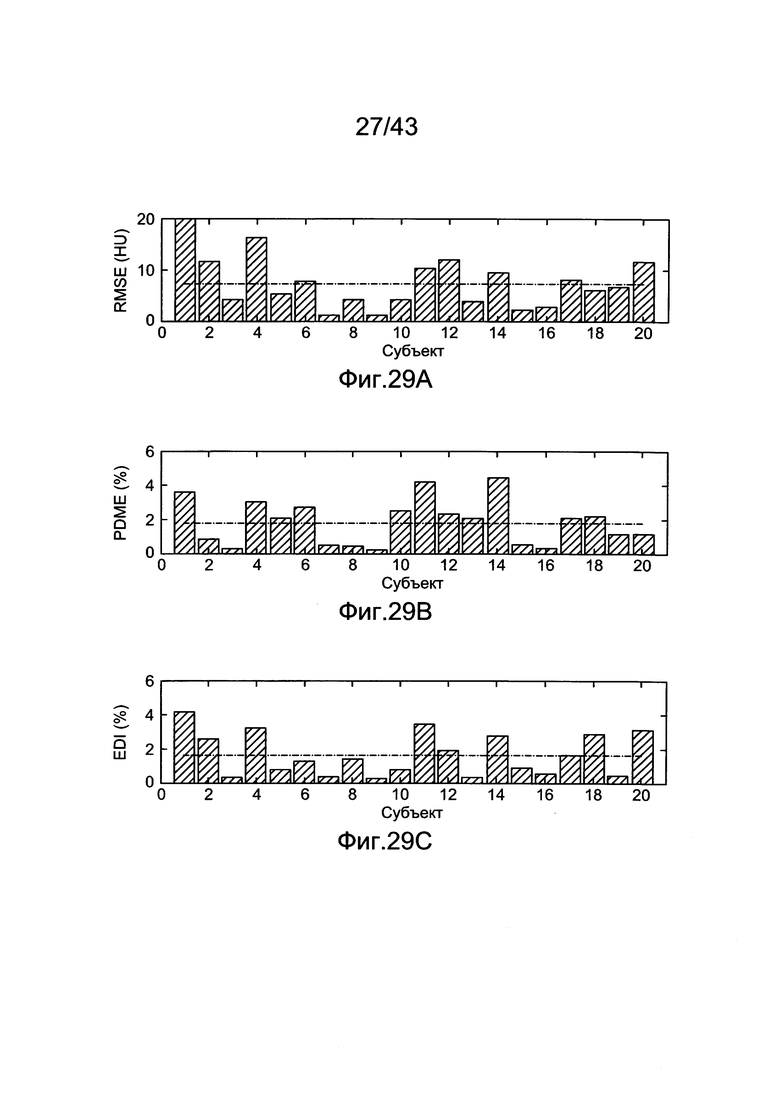
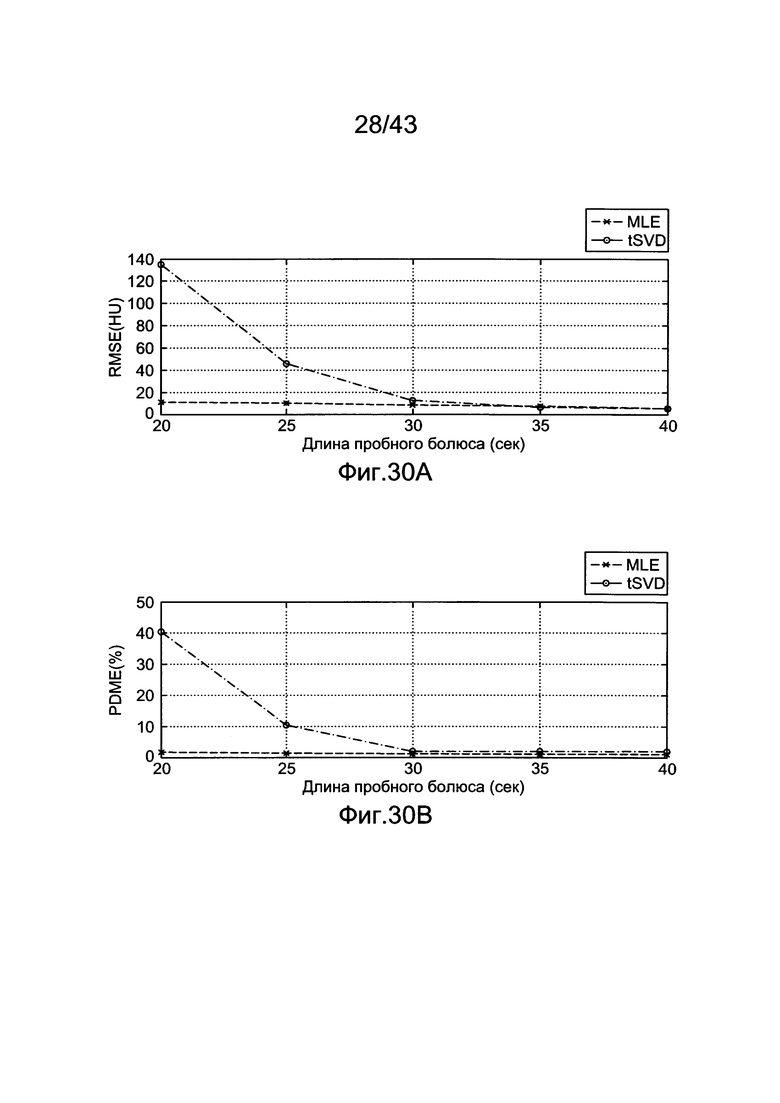
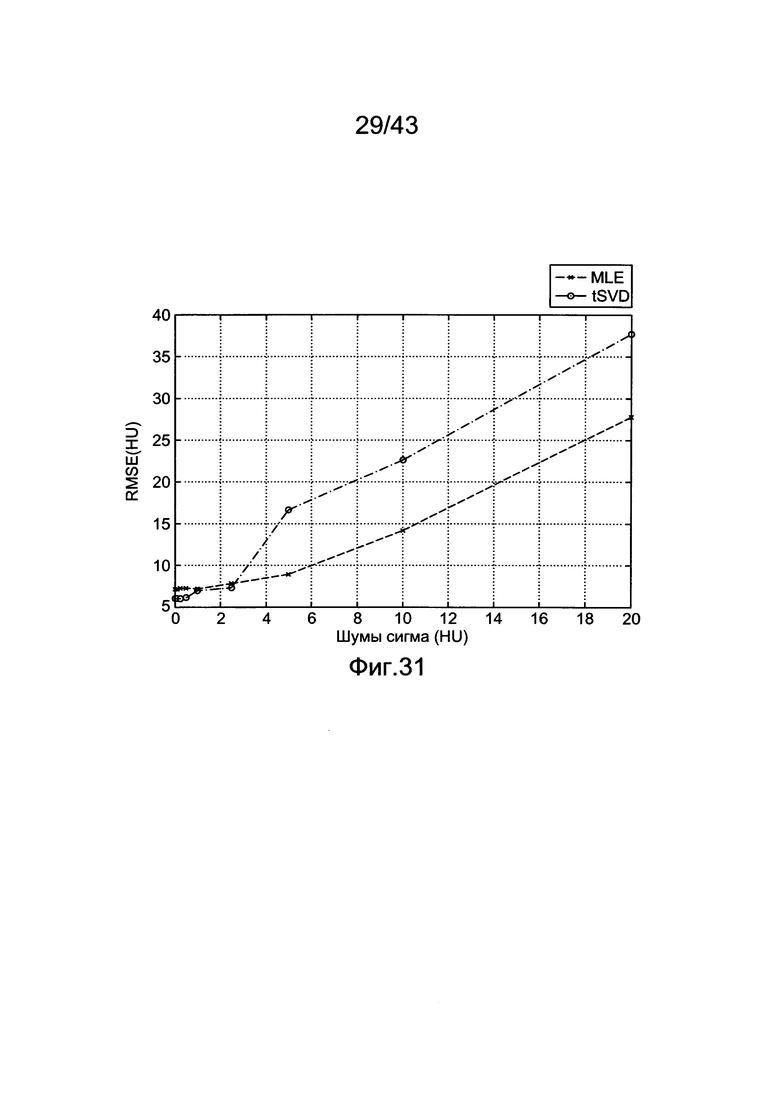
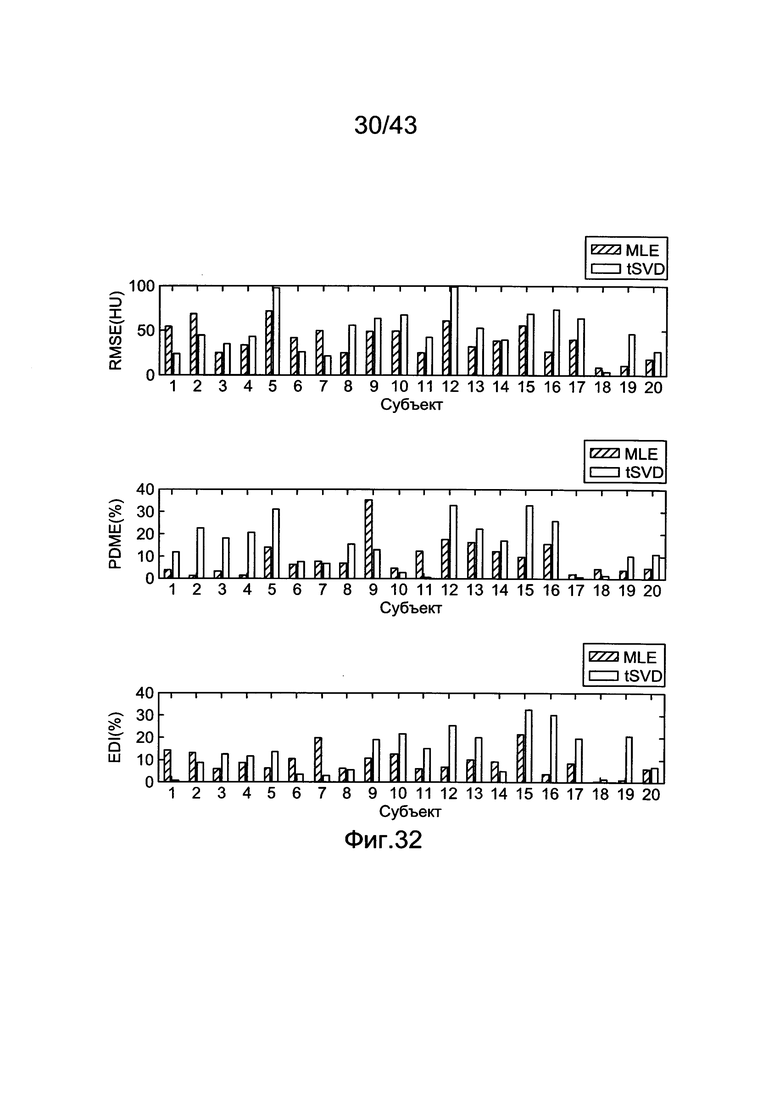
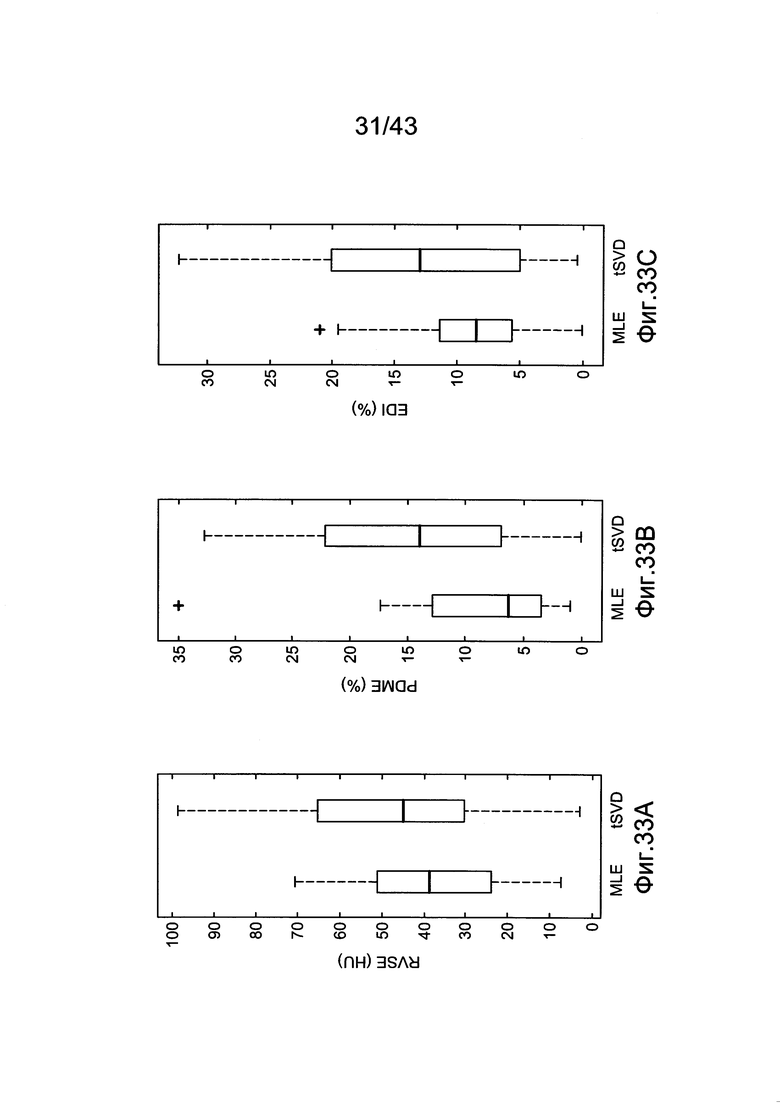
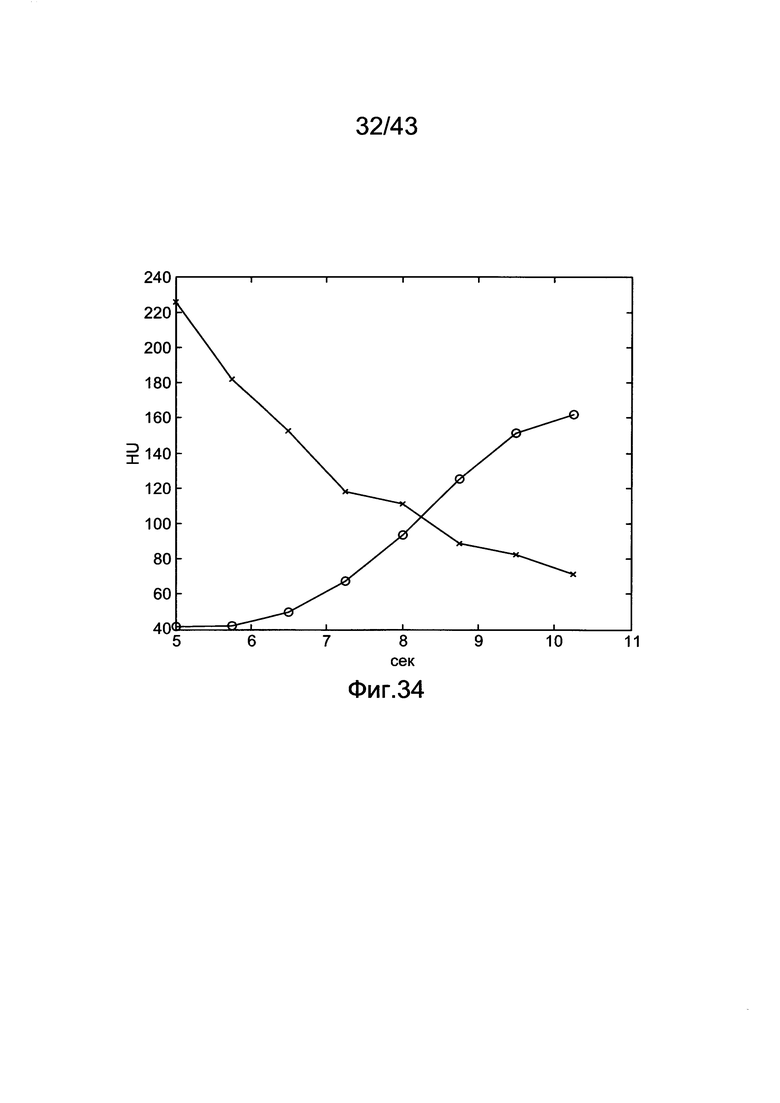
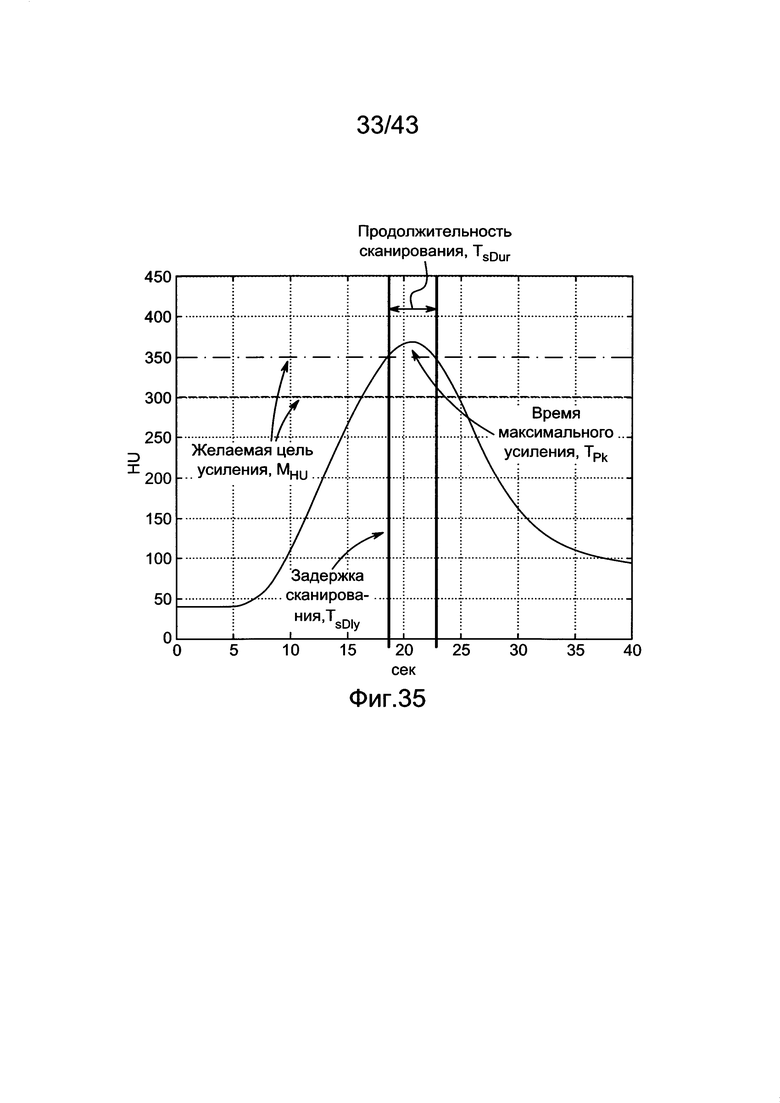
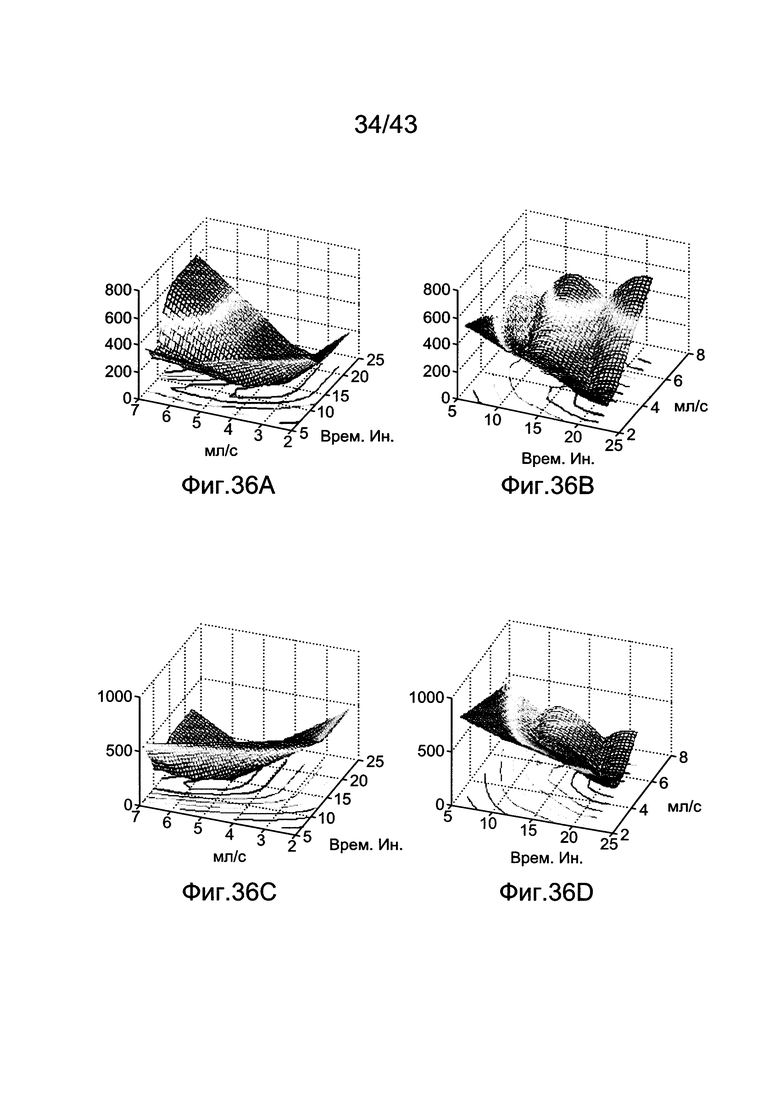
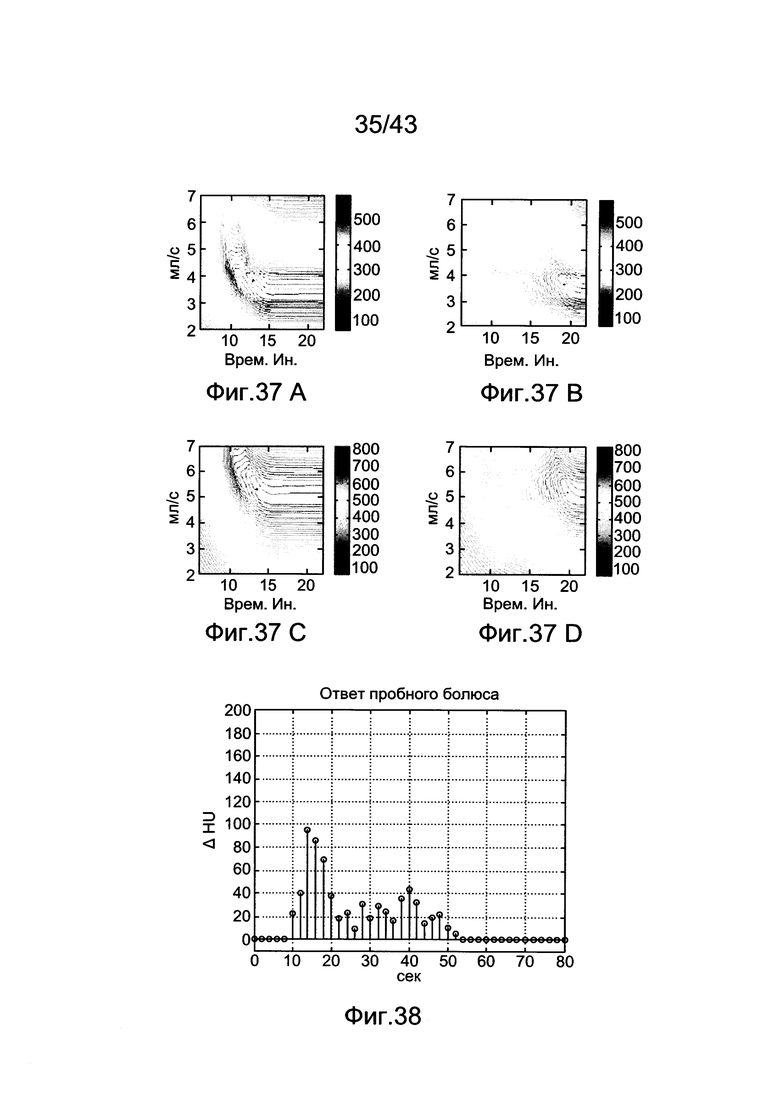
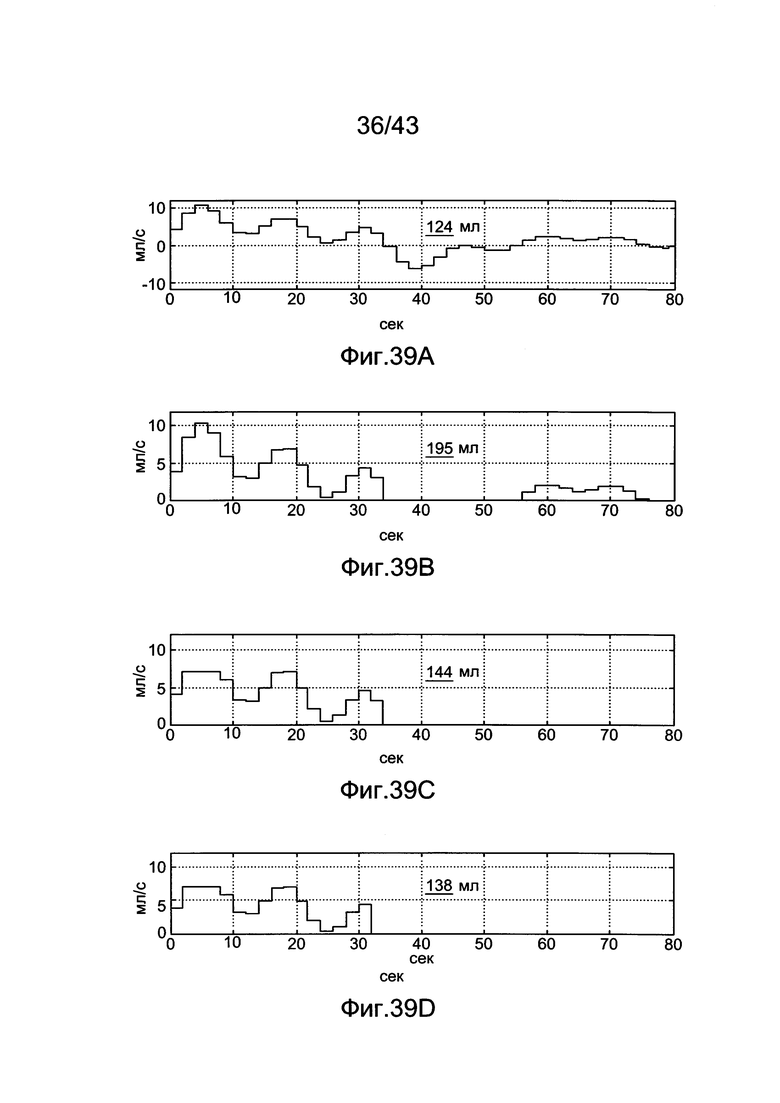
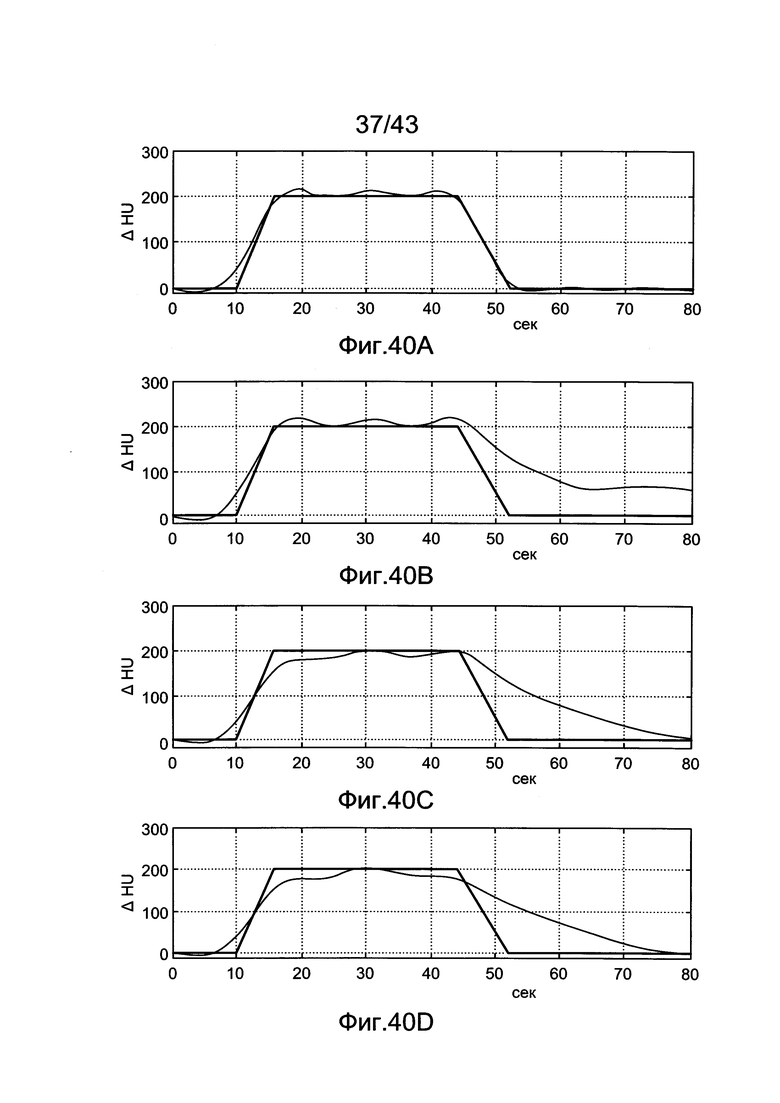
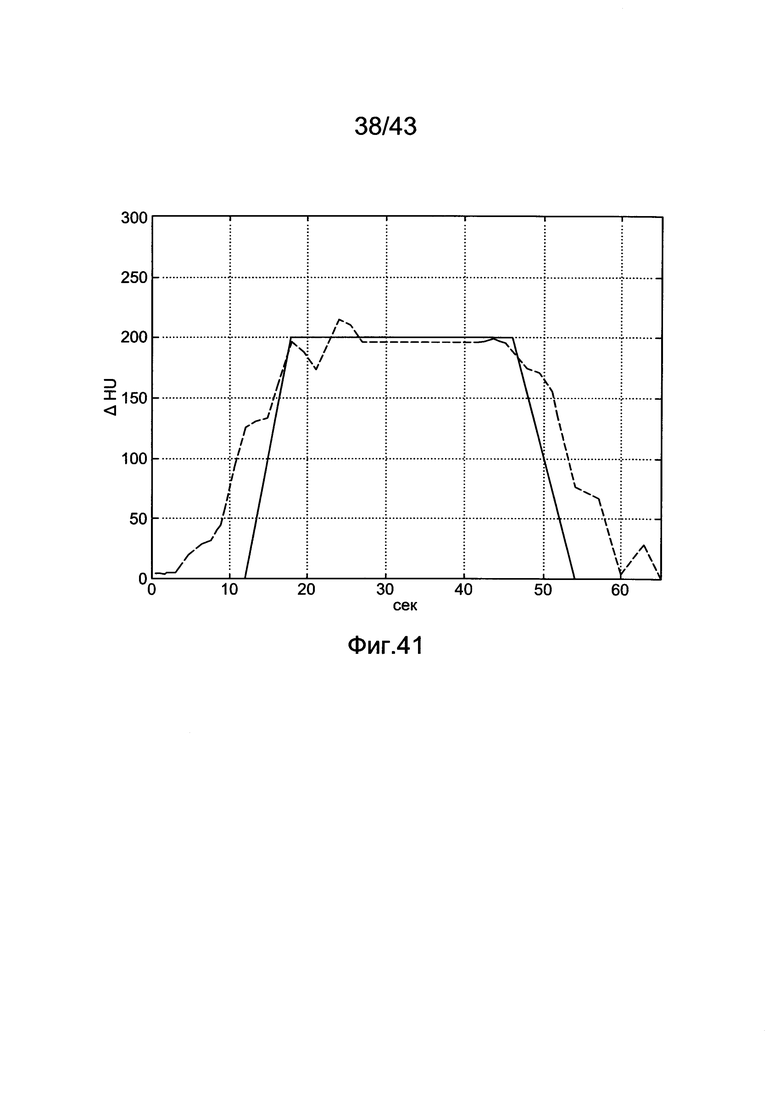
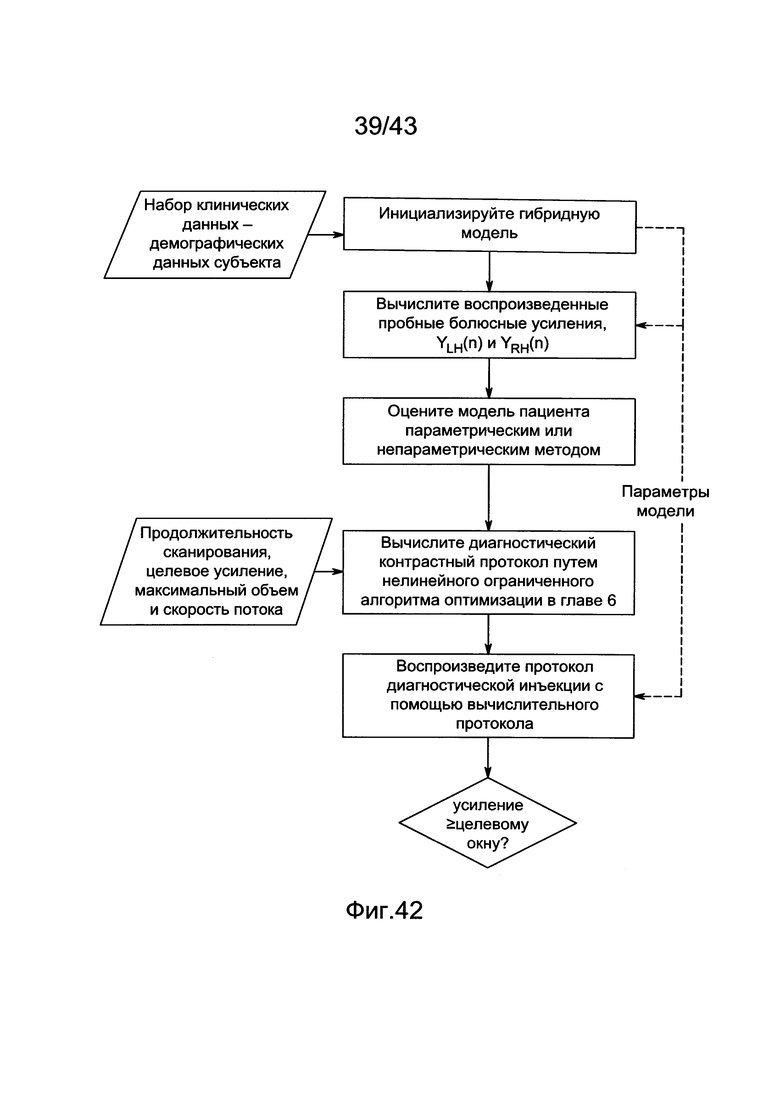
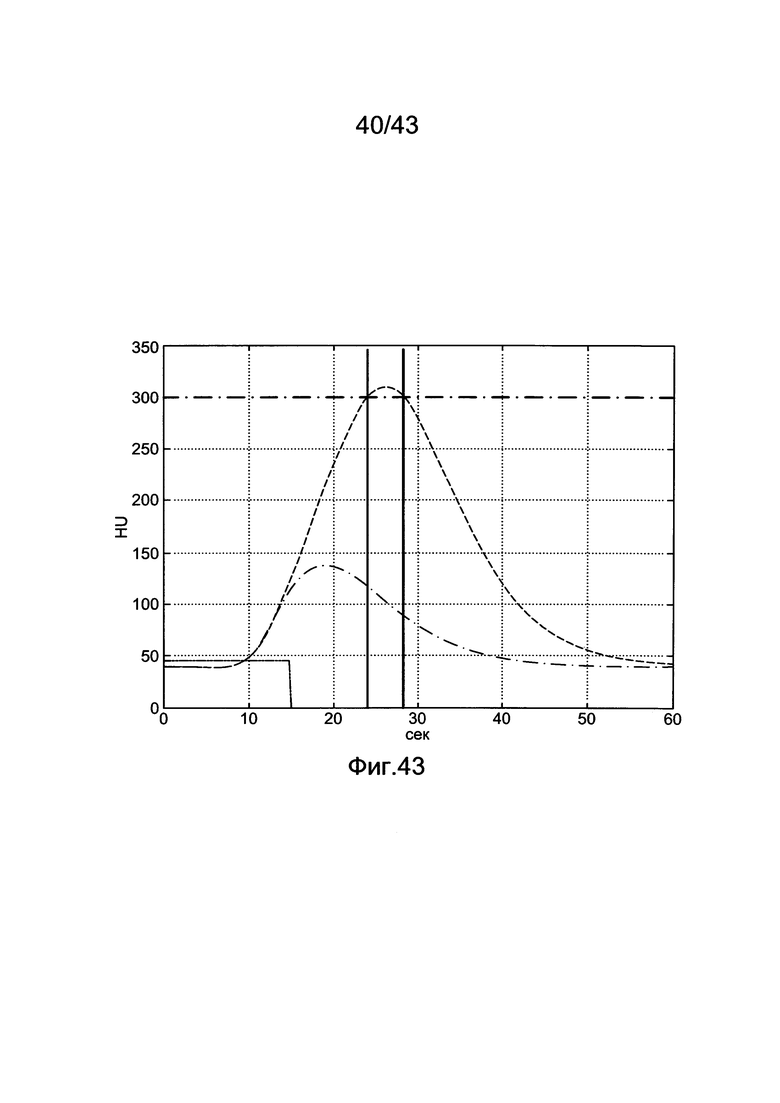
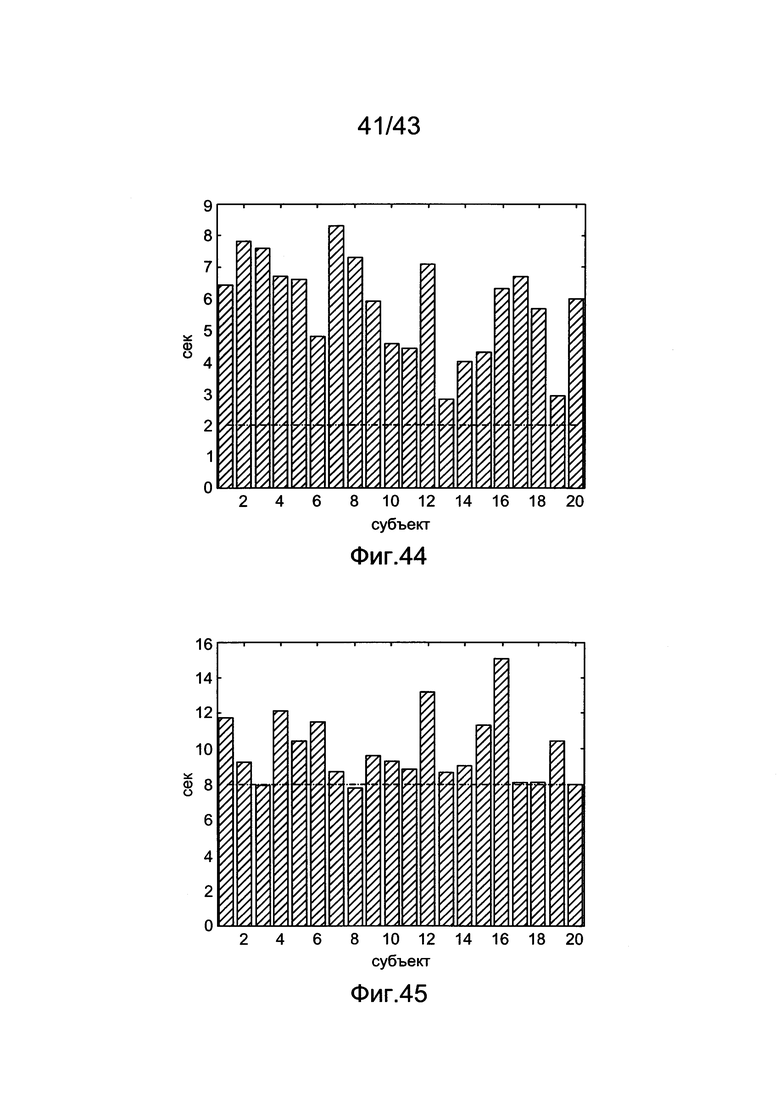
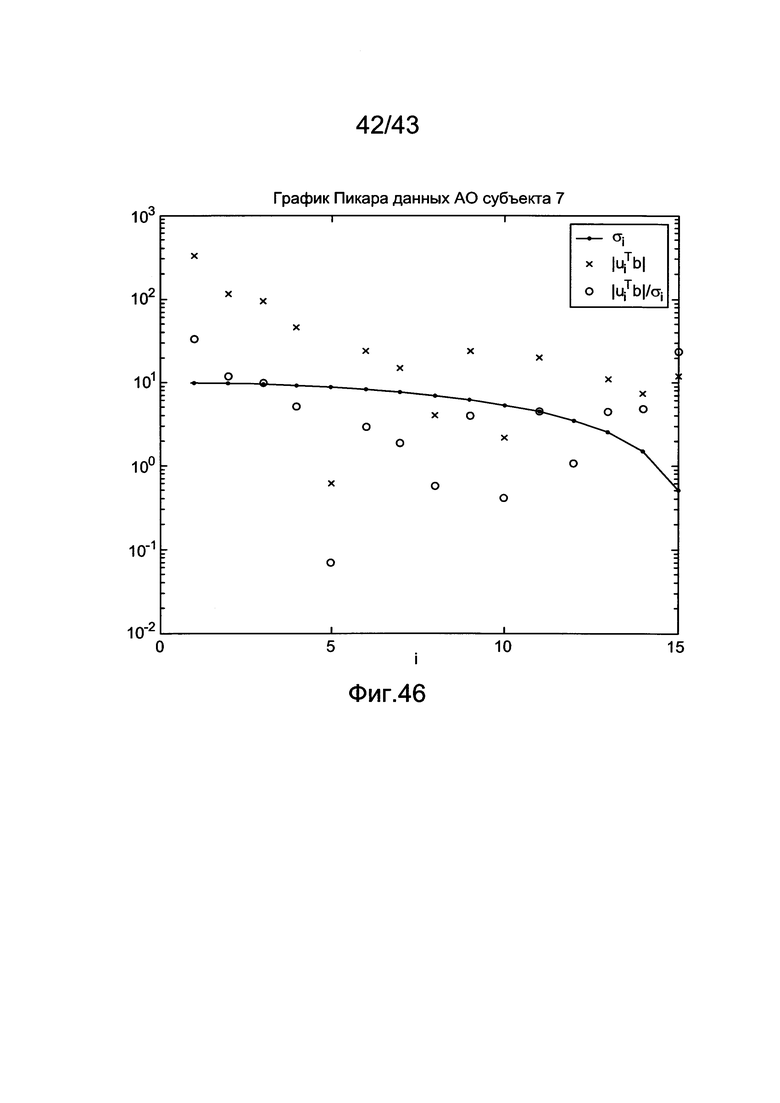
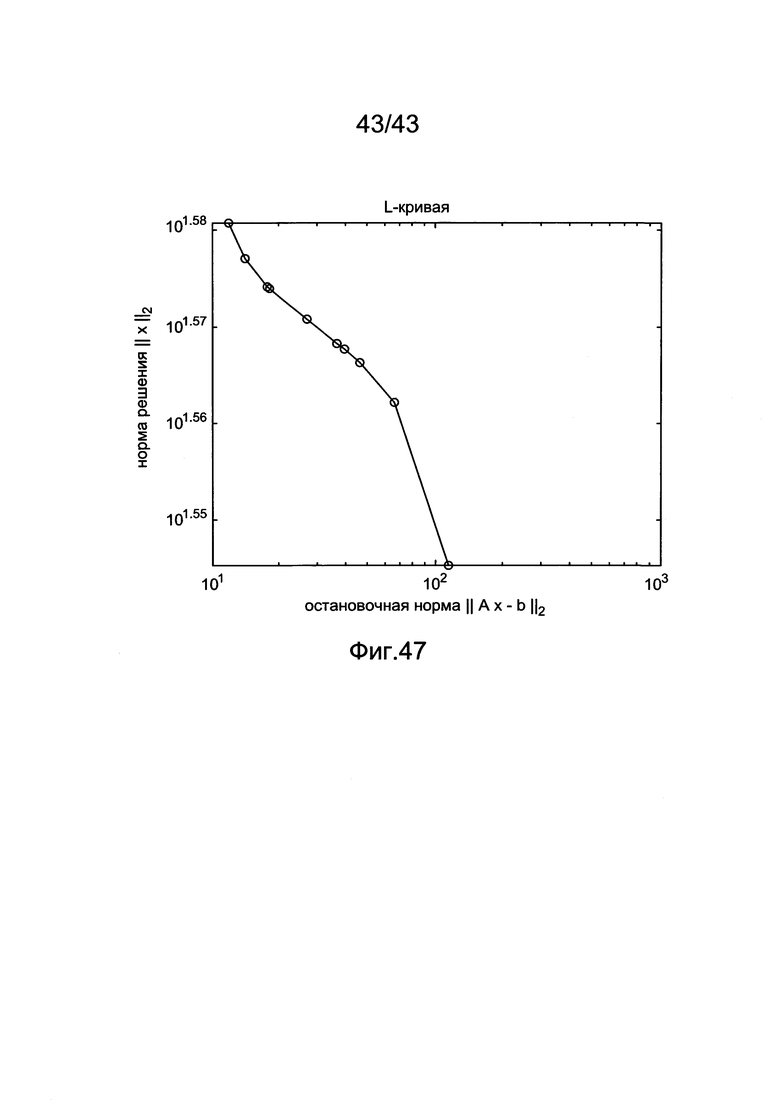
Группа изобретений относится к медицине и может быть использована для моделирования распространения контрастного вещества у пациента. Для этого используют физиологически обоснованную фармакокинетическую модель, содержащую один нелинейный период насыщения в периферическом венозном компартменте. При этом экзогенное введение контрастного вещества определяется нелинейной функцией ввода uexog(t)≡=Cinj(t)·Qinj(t), где Cinj(t) является концентрацией средства усиления контрастности как функция от времени и Qinj(t) является скоростью потока введения контрастного вещества как функция от времени, при этом Qinj(t) является константой, равной заданной предельной скорости потока введения при скоростях потока введения, являющихся равными или больше, чем заданная предельная скорость потока введения. Также предложена система для моделирования распространения контрастного вещества. Группа изобретений позволяет устранить нежелательные побочные эффекты, связанные с избыточным введением контрастного вещества пациенту. 2 н. и 17 з.п. ф-лы, 17 табл., 47 ил.
1. Способ моделирования распространения контрастного вещества, включая средство усиления контрастности, введенное пациенту с использованием физиологически обоснованной фармакокинетической модели, содержащий: включение в физиологически обоснованную фармакокинетическую модель одного нелинейного периода насыщения в периферическом венозном компартменте, где экзогенное введение контрастного вещества определяется нелинейной функцией ввода uexog(t)≡=Cinj(t)·Qinj(t), где Cinj(t) является концентрацией средства усиления контрастности как функция от времени и Qinj(t) является скоростью потока введения контрастного вещества как функция от времени, при этом Qinj(t) является константой, равной заданной предельной скорости потока введения при скоростях потока введения, являющихся равными или больше, чем заданная предельная скорость потока введения.
2. Способ по п. 1, дополнительно включающий кривую времени усиления для зоны интереса пациента с использованием физиологически обоснованной фармакокинетической модели.
3. Способ по п. 1, дополнительно включающий моделирование транспортной задержки в по меньшей мере одном компартменте с использованием по меньшей мере одной конфигурируемой транспортной задержки через по меньшей мере один компартмент с использованием физиологически обоснованной фармакокинетической модели.
4. Способ по п. 1, дополнительно включающий конфигурацию по меньшей мере одной конфигурируемой транспортной задержки, по меньшей мере, частично, на основе по меньшей мере одной переменной конкретного пациента.
5. Способ по п. 1, где физиологически обоснованная фармакокинетическая модель адаптирована для моделирования распространения контрастного вещества после того, как инъекция контрастного вещества прекращена.
6. Способ по п. 5, где физиологически обоснованная фармакокинетическая модель моделирует объемную скорость потока крови и ее эффект на распространение контрастного вещества.
7. Способ по п. 6, дополнительно включающий моделирование эффекта на распространение контрастного вещества при инъекции жидкости, не содержащей средство усиления контрастности, после инъекции контрастного вещества с использованием физиологически обоснованной фармакокинетической модели.
8. Способ по п. 1, дополнительно включающий определение по меньшей мере одного параметра для физиологически обоснованной фармакокинетической модели, по меньшей мере, частично на основе данных от множества индивидуумов.
9. Способ по п. 1, дополнительно включающий определение по меньшей мере одного параметра для физиологически обоснованной фармакокинетической модели, по меньшей мере, частично на основе одной переменной для конкретного пациента.
10. Способ по п. 1, дополнительно включающий определение по меньшей мере одного параметра для физиологически обоснованной фармакокинетической модели, по меньшей мере, частично из по меньшей мере одной кривой времени усиления пациента, полученной при инъекции контрастного вещества.
11. Способ по п. 1, где физиологически обоснованная фармакокинетическая модель включена в систему, содержащую инъекторную систему и систему визуализации, и способ дополнительно включает использование физиологически обоснованной фармакокинетической модели для генерирования по меньшей мере одного параметра для инъекционной процедуры.
12. Способ по п. 1, дополнительно содержащий использование физиологически обоснованной фармакокинетической модели для оценки кривой времени усиления для пациента и для определения по меньшей мере одного параметра инъекционной процедуры по меньшей мере частично по расчетной кривой времени усиления.
13. Система для моделирования распространения контрастного вещества, включая средство усиления контрастности, введенное пациенту, содержащая систему генерирования параметров для определения по меньшей мере одного параметра для инъекционной процедуры, при этом система генерирования параметров содержит процессор, выполненный с возможностью коммуникативного соединения с системой памяти и средство ввода, соединенное с процессором, при этом процессор выполнен с возможностью исполнения физиологически обоснованной фармакокинетической модели для моделирования распространения контрастного вещества, введенного пациенту, сохраненную в системе памяти, при этом физиологически обоснованная фармакокинетическая модель содержит один нелинейный период насыщения в периферическом венозном компартменте, где экзогенное введение контрастного вещества определяется нелинейной функцией ввода uexog(t)≡Cinj(t)·Qinj(t), где Cinj(t) является концентрацией средства усиления контрастности как функция от времени и Qinj(t) является скоростью потока введения контрастного вещества как функция от времени, при этом Qinj(t) является константой, равной заданной предельной скорости потока введения от скоростей потока введения, являющихся равными или больше, чем заданная предельная скорость потока введения.
14. Система по п. 13, где система генерирования параметров выполнена с возможностью определения по меньшей мере одного параметра для физиологически обоснованной фармакокинетической модели, по меньшей мере, частично из по меньшей мере одной кривой времени усиления пациента.
15. Система по п. 13, дополнительно содержащая средство, выполненное для моделирования распространения контрастного вещества, введенного пациенту с использованием непараметрической модели.
16. Система по п. 13, где система генерирования параметров выполнена с возможностью определения по меньшей мере одного параметра с использованием способа оптимизации на основе физиологически обоснованной фармакокинетической модели.
17. Система по п. 13, где процессор выполнен с возможностью исполнения физиологически обоснованной фармакокинетической модели, дополнительно содержащей по меньшей мере один конфигурируемый период транспортной задержки через по меньшей мере один компартмент.
18. Система по п. 13, где процессор выполнен с возможностью исполнения физиологически обоснованной фармакокинетической модели, дополнительно содержащей адаптацию к моделированию объемной скорости потока крови и ее эффекта на распространение контрастного вещества после того, как инъекция контрастного вещества прекращена.
19. Система по п. 15, где система генерирования параметров выполнена с возможностью определения по меньшей мере одного параметра с использованием способа оптимизации на основе по меньшей мере одной физиологически обоснованной фармакокинетической модели или непараметрической модели.
| US 2008097197 A1, 24.04.2008 | |||
| КАРКИЩЕНКО Н.Н | |||
| Альтернативы биомедицины | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Основы биомедицины и фармакомоделирования -; М.: Изд-во ВПК, 2007, глава 5, с.149-154 | |||
| ГРАМОВИЧ В.В | |||
| и др., Количественная оценка перфузии миокарда с помощью магнитно-резонансной томографии у больных хронической ишемической болезнью сердца, Кардиология, 2004, N 8, C.4-12 | |||
Авторы
Даты
2016-10-27—Публикация
2011-06-24—Подача