Изобретение относится к медицине, а именно, к экспериментальной онкологии, и может быть использовано для прижизненной лучевой визуализации органов и тканей модельных организмов мелких лабораторных грызунов для изучения в экспериментальных условиях особенностей их анатомических систем с опухолями различной локализации, уточнения параметров их кровоснабжения, обнаружения метастатических очагов и уточнения анатомо-топографических особенностей животного для дальнейших манипуляций [Pandharipande PV, Krinsky GA, Rusinek H, Lee VS. Perfusion imaging of the liver: current challenges and future goals. Radiology. 2005;234(3):661-73. doi:10.1148/radiol.2343031362].
Методы лучевой визуализации дают достаточно четкую картину состояния внутренних органов и их систем у живых мелких лабораторных животных, чей клинический осмотр и/или применение ультразвуковой диагностики затруднено из-за размера изучаемого объекта. Однако существует сложность определения контуров органов брюшной полости, в частности, печени и селезенки, так как все существующие на сегодняшний день ангио-контрасты являются неспецифическими для этих органов [Lauber DT, Fülöp A, Kovács Т, Szigeti K, Máthé D, Szijártó A. State of the art in vivo imaging techniques for laboratory animals. Lab Anim. 2017;51(5):465-78. doi:10.1177/0023677217695852]. В настоящее время разработаны методологические подходы, позволяющие приблизительно выявить эти анатомические структуры индивидуально. Один из наиболее значимых для контрастирования любым из современных доступных методов органов брюшной полости является печень. Для ее обнаружения и изучения анатомических структур in vivo используют наночастицы и/или липосомы/мицеллы/флуоресцентно-меченные молекулы или пептиды -адресные направляющие молекулы, меченные радиоизотопным веществом [Topcu О, Kurt A, Nadir I, Arici S, Koyuncu A, Aydin C. Effects of contrast media on the hepato-pancreato-biliary system. World J Gastroenterol. 2009;15(38):4788-93. doi:10.3748/wjg.15.4788; Cuenod C, Leconte I, Siauve N, Resten A, Dromain C, Poulet B, Frouin F, Clément O, Frija G. Early changes in liver perfusion caused by occult metastases in rats: detection with quantitative CT. Radiology. 2001;218(2):556-61. doi:10.1148/radiology.218.2.r01fel0556; Torchilin VP, Frank-Kamenetsky MD, Wolf GL. CT visualization of blood pool in rats by using long-circulating, iodine-containing micelles. Acad Radiol. 1999;6(l):61-5. doi: 10.1016/sl076-6332(99)80063-4; Ehling J, Theek B, Gremse F, Baetke S, Möckel D, Maynard J, Ricketts SA, Grüll H, Neeman M, Knuechel R, Lederle W, Kiessling F, Lammers T. Micro-CT imaging of tumor angiogenesis: quantitative measures describing micromorphology and vascularization. Am J Pathol. 2014; 184(2):431-41. doi: 10.1016/j.ajpath.2013.10.014].
Современные технологии упрощают определение зон интереса для исследователя. Единственной проблемой является особенность физиологии выделения желчи из организма мелких лабораторных животных. Как только объем циркулирующей жидкости (водной фракции крови) увеличивается, одномоментно уменьшается и вязкость желчи, и она вместе с введенным контрастным соединением наполняет петли кишечника, которые прилегают к печени вплотную. Через 3-5 минут после введения классических КТ контрастов провести дифференциацию петель кишки от печени не представляется возможным.
В настоящее время введение рентгеноконтрастных средств в организм лабораторных грызунов проводится болюсной техникой [Ting Liu, Sheng Wang, Wei Zhao Hao Liu, Yi Zhang, Juan Han, Xia Chen. Experimental Analysis of the Utility of Liquid Metal Gallium as a Contrast Agent for CT Hepatic Artery Angiography in Living Rabbits, 30 December 2020, PREPRINT (Version 1) available at Research Square, doi: 10.21203/rs.3.rs-135998/v1; Ehling J, Theek B, Gremse F, Baetke S, Möckel D, Maynard J, Ricketts SA, Grüll H, Neeman M, Knuechel R, Lederle W, Kiessling F, Lammers T. Micro-CT imaging of tumor angiogenesis: quantitative measures describing micromorphology and vascularization. Am J Pathol. 2014; 184(2):431-41. doi: 10.1016/j.ajpath.2013.10.014; Starosolski Z, Villamizar CA, Rendon D, Paldino MJ, Milewicz DM, Ghaghada KB, Annapragada AV. Ultra High-Resolution In vivo Computed Tomography Imaging of Mouse Cerebrovasculature Using a Long Circulating Blood Pool Contrast Agent. Sci Rep.2015;5:10178. doi: 10.1038/srep10178; Ghanavati S, Yu LX, Lerch JP, Sled JG. A perfusion procedure for imaging of the mouse cerebral vasculature by X-ray micro-CT. J Neurosci Methods. 2014;221:70-7. doi: 10.1016/j.jneumeth.2013.09.002; Hlushchuk R, Haberthür D, Soukup P, Barre SF, Khoma OZ, Schittny J, Haghayegh Jahromi N, Bouchet A, Engelhardt B, Djonov V. Innovative high-resolution microCT imaging of animal brain vasculature. Brain Struct Funct. 2020;225(9):2885-95. doi: 10.1007/s00429-020-02158-8]. Данные доступной для анализа литературы указывают, что рентгеноконтрастные средства можно вводить в хвостовую вену животного достаточно длительно и в высоких концентрациях [Akladios CY, Bour G, Raykov Z, Mutter D, Marescaux J, Aprahamian M. Structural imaging of the pancreas in rat using micro-CT: application to a non-invasive longitudinal evaluation of pancreatic ductal carcinoma monitoring. J Cancer Res Ther. 2013; 1 (2):70-6. doi: 10.14312/2052-4994.2013-11; Toy R, Hayden E, Camann A, Berman Z, Vicente P, Tran E, Meyers J, Pansky J, Peiris PM, Wu H, Exner A, Wilson D, Ghaghada KB, Karathanasis E. Multimodal in vivo imaging exposes the voyage of nanoparticles in tumor microcirculation. ACS Nano. 2013;7(4):3118-29. doi: 10.1021/nn3053439; Clark DP, Badea CT. Micro-CT of rodents: state-of-the-art and future perspectives. Phys Med. 2014;30(6):619-34. doi: 10.1016/j.ejmp.2014.05.011; Lee YC, Fullerton G, Goins B. Comparison of multimodality image-based volumes in preclinical tumor models using In-Air micro-CT image volume as reference tumor volume. Open Journal of Medical Imaging. 2015;5(03):117-32. doi: 10.4236/ojmi.2015.53016].
Этот метод имеет недостаток - распределение контрастного соединения происходит практически с первой секунды введения, и качество получаемых изображений не может быть достаточным ввиду быстрого выведения его из организма животного. Поэтому приходится вводить сразу большое количество соединения, что может провоцировать токсические поражения органов выведения, прежде всего почек.
Существуют зарегистрированные лекарственные средства гепатоспецифические контрасты, которые предназначаются исключительно для МРТ-визуализации (например, «Примовист») https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=533a3325-f30f-4d7b-9132-c5638371dd7f). Их можно адаптировать для использования у экспериментальных животных в целях проведения КТ-исследований, поскольку действующее вещество субстанции препарата является рентгеноплотным соединением. Если предполагается использовать такой метод, то животному необходимо постоянно вводить сильно разбавленный рентгеноконтрастный препарат внутривенно во время исследования непосредственно в КТ-аппарате на очень низкой скорости. Этот метод не является оптимальным.
Возможно использовать иной вариант: концентрированный официнальный препарат (например, «Примовист») вводят животному в максимально допустимой дозе по весу, после чего определяется динамика накопления его в органе интереса, строится калибровочная кривая с учетом временных стандартных точек и проводятся исследования однотипных по весу животных [Döhr О, Hofmeister R, Treher М, Schweinfurth Н. Preclinical safety evaluation of Gd-EOB-DTPA (Primovist). Invest Radiol. 2007;42(12):830-41. doi: 10.1097/RLI.0b013e318137a471; Schmitz SA, Wagner S, Schuhmann-Giampieri G, Krause W, Wolf KJ. A prototype liver-specific contrast medium for CT: preclinical evaluation of gadoxetic acid disodium, or Gd-EOB-DTPA. Radiology. 1997;202(2):407-12. doi: 10.1148/radiology.202.2.9015066]. Этот вариант не обеспечивает исследователю при проведении современных КТ исследованиях возможность проследить динамику распределения препарата у одного животного в течение длительного времени наблюдения, так как необходимое и достаточное количество препарата при наркотизации не выводится с необходимой скоростью и повреждает почки
Использование гепатоспецифического лекарственного средства для MP-контрастирования на основе гадоксетовой кислоты - «Примовист» у человека [https://mrtsurgut.ru/wp-content/uploads/2017/02/Primovist-slide-kit-l-1.pdf] нами было принято за прототип.
Задача изобретения:
адаптация применения гепатоспецифического лекарственного средства для MP-контрастирования на основе гадоксетовой кислоты у мелких лабораторных грызунов, обеспечение рентгенологического контрастирования их печени для проведения экспериментальных исследований.
Задача решается тем, что создан новый способ получения контрастированного КТ-изображения печени мелких лабораторных грызунов при прижизненной лучевой визуализации для оценки наличия и динамики роста злокачественных новообразований на основе использования калибровочных фантомов. Способ заключается в том, что у экспериментальных животных инициируют наркозный сон, обеспечивают доступ к периферической вене, в которой устанавливают внутривенную канюлю/иглу для инъекций и обеспечивают возможность бесперебойного поступления лекарственного средства в кровоток. По завершении данного этапа проводят введение исследуемого животного в гентри компьютерного томографа, далее обеспечивают введение готовой лекарственной формы, гепатоспецифического рентгеноконтрасного средства для МР-контрастирования на основе гадоксетовой кислоты с концентрацией 181,430 мг/мл в максимально переносимой дозе при однократном введении мышам в течение 1,5 минуты, 5,5 мкл/сек или 0,33 мл/мин и проводят сканирование зоны интереса, в том числе с возможностью динамического сканирования. Полученные КТ-изображения печени сопоставляют с калибровочной кривой, которую получают путем последовательного разбавления контрастного средства в микропробирках фантомной модели с последующей их съемкой в КТ-аппарате. Если динамика распределения и удержания контрастного средства в органе значимо отличается от калибровочной кривой, то необходимо проанализировать наличие злокачественных новообразований
Предварительные экспериментальные данные позволили сделать вывод, что введение гепатоспецифического контрастного средства, которое предназначено для MP-визуализации может использоваться для экспериментальной визуализации печени мыши при проведении КТ-сканирования. Для проверки качества визуализации и для оценки возможности применения гепатоспецифического MP-контрастного средства был использован фантом, состоявший из микропробирок с содержимым, имеющим разные рентгенологические свойства, и имитирующие изолированный орган, в котором произошло накопление и/или удержание гепатоспецифического контраста.
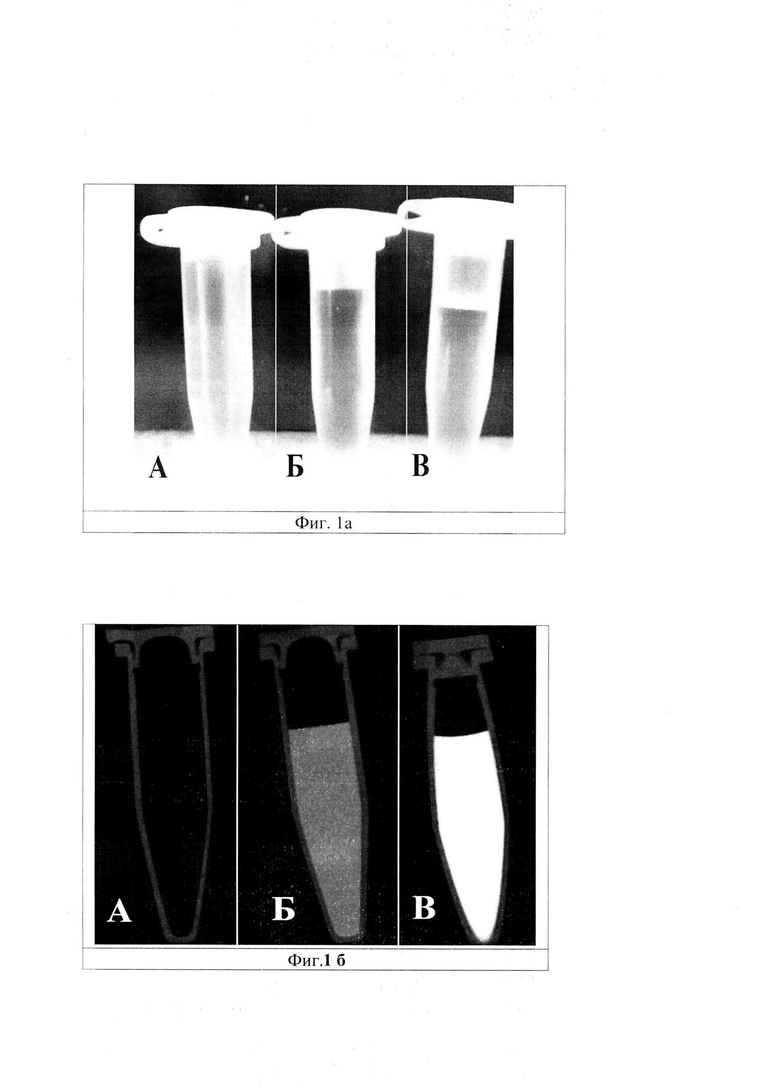
На фигуре 1а изображено расположение микропробирок: А - микропробирка с воздухом, Б - микропробирка с дистиллированной водой, В - микропробирка с «Примовистом» 0,25М, которые были сняты в режиме оптической черно-белой фотографии.
На фигуре 1б - КТ-изображения этих же микропробирок. Динамический диапазон изображения: -1500÷2000 HU. А - микропробирка с воздухом-1000±4 HU; Б - микропробирка с дистиллированной водой - 2±3 HU; В -микропробирка с «Примовистом» 0,25 М по действующему веществу - 1743±6 HU). Таким образом, были получены типичные 3 варианта КТ-изображений, различающихся по значению рентгеноплотности: (1) воздух (значение рентгеноплотности принято в данном исследовании за 0); (2) контраст в максимальной концентрации (значение рентгеноплотности принято в данном исследовании за 1) без разбавления; (3) вода (в том числе, любая жидкость без контрастирующего агента, может иметь значение 1). При необходимости, по условной прямой «воздух-препарат» или «воздух-вода» или «препарат-жидкость» можно провести серийные измерения, получающихся рентгеноплотностей в микропробирках и по их данным откалибровать прибор так, чтобы его рабочие характеристики удовлетворяли требованиям исследования.
В данном случае, оптимальными были выбраны следующие параметры проведения сканирования:
Напряжение рентгеновской трубки - 50 кВ;
Ток рентгеновской трубки - 0,21 мА;
Время экспозиции проекции - 75 мс;
Угол шага рентгеновской трубки - 0,5°;
Фильтр рентгеновской трубки - Al 100+400 мкм.
Параметры реконструкции и обработки изображения:
Размер вокселя - 60 мкм;
Фильтр изображения - Gaussian Smooth 0.18 мм.
Используя встроенное программное обеспечение прибора, основанное на стандартных методах восстановления КТ-изображений, были получены объемные карты линейного коэффициента рентгеновского поглощения (стандартные КТ-изображения).
Таким образом, было принято решение о проведении исследования с целью получения изображения печени лабораторных грызунов (мыши, крысы) методом компьютерной томографии в первые 3-5 минут сканирования при постоянной подаче гепатоспецифического рентгеноконтрастного средства через системы регулируемого протока (можно получать необходимую степень накопления в органе с постоянным мониторированием по минутам).
Технический результат. Предложенный нами способ контроля скорости поступления контрастного средства в организм животного позволяет обеспечить исследователю возможность оценить накопление контрастного средства в зонах интереса (печень), определить динамику поступления его в паренхиму органа и/или опухоль, определить локализацию, степень и распространенность патологических изменений печени в том случае, если это необходимо. Отличием от прототипа является возможность контроля скорости поступления препарата в организм изучаемого животного, что позволяет подробно рассмотреть основные зоны паренхимы печени, сохранившие свои физиологические функции.
Заявляемый способ иллюстрируется следующими фигурами:
На фиг. 1 - черно-белая фотография (а) и КТ-изображение (б) микропробирок, составляющих основу фантомной модели, в которых находится воздух, вода и рентгенологический контраст «Примовист» 0,25М для контрастирования печени.
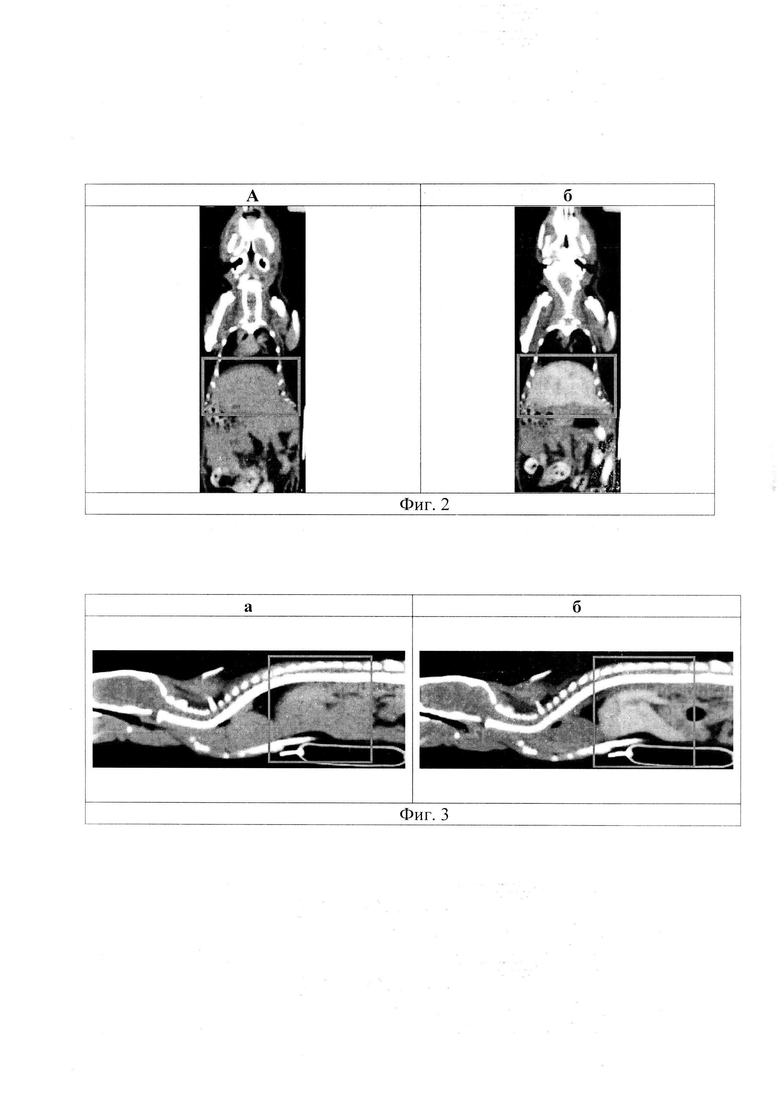
На фиг. 2 - компьютерная томограмма тела мыши: а - корональная проекция до введения контраста; б - корональная проекция после введения контраста, прямоугольником выделена зона интереса - печень.
На фиг. 3 - компьютерная томограмма тела мыши: а - саггитальная проекция до введения контраста; б - саггитальная проекция после введения контраста, прямоугольником выделена зона интереса - печень.
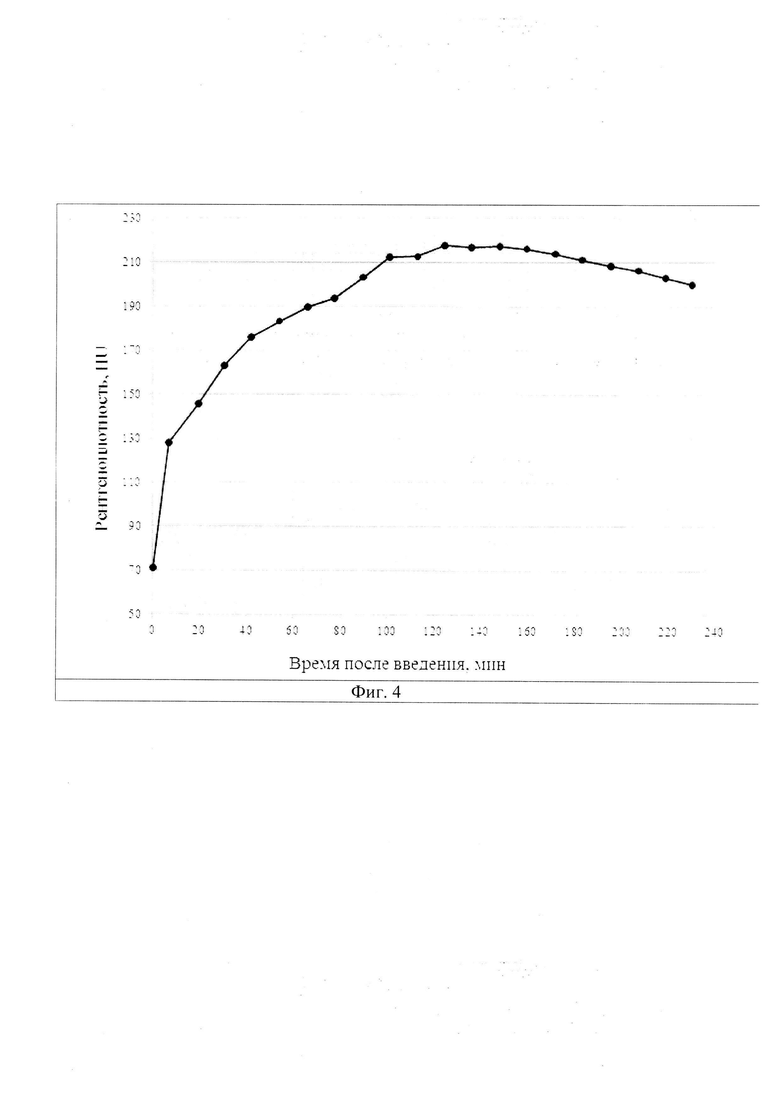
На фиг. 4 - динамика изменения рентгеноплотности паренхимы печени мыши после однократного введения контрастного лекарственного средства. Рентгеноплотность в момент времени t=0 мин на графике соответствует средней рентгеноплотности печени до введения «Примовиста». Погрешность средней рентгеноплотности обусловлена приборной погрешностью и неоднородностью исследуемого объема.
Способ осуществляется следующим образом. У экспериментальных животных инициируют наркозный сон, обеспечивают доступ к периферической вене, в которой устанавливают внутривенную канюлю/иглу для инъекций и обеспечивают возможность бесперебойного поступления лекарственного средства в кровоток. По завершении данного этапа проводят введение исследуемого животного в гентри компьютерного томографа.
Далее обеспечивают введение готовой лекарственной формы -гепатоспецифического рентгеноконтрасного средства для МР-контрастирования на основе гадоксетовой кислоты с концентрацией 181,430 мг/мл в объеме 500 мкл (максимально переносимая доза при однократном введении мышам) [Döhr О, Hofmeister R, Treher М, Schweinfurth Н. Preclinical safety evaluation of Gd-EOB-DTPA (Primovist). Invest Radiol. 2007;42(12):830-41. doi: 10.1097/RLI.0b013e318137a471; Schmitz SA, Wagner S, Schuhmann-Giampieri G, Krause W, Wolf KJ. A prototype liver-specific contrast medium for CT: preclinical evaluation of gadoxetic acid disodium, or Gd-EOB-DTPA. Radiology. 1997;202(2):407-l2. doi: 10.1148/radiology.202.2.9015066] в течение 1,5 минуты (5,5 мкл/сек или 0,33 мл/мин) и проводят сканирование зоны интереса, в том числе с возможностью динамического сканирования. Сканирование проводили в следующих условиях: компьютерная томография (КТ) в томографе MiLabs VECTor6 (Нидерланды). Постобработка и анализ изображений проводится в программе PMod.
Результат получаемых томограмм - фигуры 2-3;
Динамические характеристики - фигура 4.
Основанием для предлагаемого способа являются результаты экспериментальных исследований на фантомных моделях и выполненных на мышах, массой 20-25 г. После получения КТ-изображения гепатоспецифического контрастного средства и расчетов, возможных для введения доз лекарственного средства, мыши были отобраны и помещены в бокс для ингаляционной подачи изофлурана. Далее обеспечивали доступ к периферической вене для введения контрастного агента, после чего укладывали животное в специализированное удерживающее устройство - кроватку - для компьютерной томографии с постоянным притоком изофлурана и начинали сканирование.
Таким образом, был разработан и апробирован способ получения изображения печени мышей при прижизненной лучевой визуализации, в том числе и для оценки наличия и динамики роста злокачественных новообразований. Этот подход, применяемый для нужд экспериментальной онкологии, позволил решить следующие задачи:
(1) выявить и оконтурить печень, точно визуализировав границы органа от прилежащих селезенки и петель кишечника (Фиг. 2 и 3);
(2) установить динамику накопления MP-контрастного средства на основе гадоксетовой кислоты с концентрацией 181,430 мг/мл при введении его в максимально допустимых для мышей данного веса объемах (Фиг. 4);
(3) получить изображение печени целиком и определить время максимального накопление препарата в органе - с сороковой и до девяностой минуты наблюдения, что соответствовало рентгеноплотности 220-235 HU (Фиг. 2-4).
Рентгеноплотность паренхимы печени (фиг. 4) в момент времени 0 мин соответствует средней рентгеноплотности печени до введения «Примовиста». С течением времени происходит накопление препарата (с 0 мин до 90 мин), потом следует фаза его удержания (с 91 мин до 160 мин), после чего выведения (с 161 мин до конца наблюдения). Таким образом, при необходимости можно получить динамические характеристики движения препарата по рабочей ткани печени, ориентируясь на данные, представленные на фиг. 4. Если же динамика распределения и удержания препарата в органе каким-либо образом значимо отличается от калибровочной кривой такого типа, то стоит говорить о том, что паренхима имеет неоднородную структуру и необходимо проанализировать наличие злокачественных новообразований.
Данный способ позволяет получать данные без выведения животных из экспериментальной работы, что актуально для отработки методик экспериментальной онкологии, а именно при моделировании органотропных злокачественных новообразований, их метастазов и, в частности, первичных опухолей печени.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ введения рентгеноконтрастных веществ в организм лабораторных грызунов для прижизненной лучевой визуализации внутренних органов для оценки динамики роста злокачественных органотропных новообразований в экспериментальной онкологии | 2022 |
|
RU2794034C1 |
| Способ определения топографического положения поджелудочной железы у лабораторных мышей методом прижизненной лучевой визуализации в трехмодальной системе | 2023 |
|
RU2821746C1 |
| Способ получения стабильного высококонцентрированного коллоидного раствора на основе лазерно-аблированных наночастиц золота диаметром до 10 нм для биомедицинского применения | 2023 |
|
RU2834959C2 |
| Способ дифференциальной диагностики доброкачественных и злокачественных образований в печени у детей | 2020 |
|
RU2748530C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ТИПА РАКА ЖЕЛУДКА ПО КЛАССИФИКАЦИИ LAUREN МЕТОДОМ КОМПЬЮТЕРНОЙ ТОМОГРАФИИ | 2020 |
|
RU2743221C1 |
| СПОСОБ ПОСЛЕОПЕРАЦИОННОЙ ОЦЕНКИ ЗОНЫ КРИОАБЛАЦИИ ПРИ ЛЕЧЕНИИ РАКА ПОЧКИ | 2022 |
|
RU2780366C1 |
| СПОСОБ ДИАГНОСТИКИ ИНФИЛЬТРАТИВНЫХ ОПУХОЛЕЙ ПОЧЕК | 2020 |
|
RU2726589C1 |
| СПОСОБ И СИСТЕМА ДЛЯ ВЫЯВЛЕНИЯ ОБЪЕМНЫХ ОБРАЗОВАНИЙ ПОЧЕК НА КОМПЬЮТЕРНЫХ ТОМОГРАММАХ БРЮШНОЙ ПОЛОСТИ | 2024 |
|
RU2839531C1 |
| Способ получения Gd-связывающего белка | 2019 |
|
RU2713792C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ПЕЧЕНИ | 1998 |
|
RU2134067C1 |
Изобретение относится к медицине, а именно к экспериментальной онкологии, и может быть использовано для проведения экспериментальной прижизненной компьютерной (КТ) томографии печени мышей. У мыши инициируют наркозный сон. Далее вводят мыши МР-контрастное вещество на основе гадоксетовой кислоты «Примовист» в объеме 500 мкл в течение 1,5 мин. Проводят КТ печени мыши. На полученных изображениях печени определяют рентгенологическую плотность в зоне интереса и строят кривую «рентгенологическая плотность – время исследования». Сопоставляют полученную кривую с калибровочной кривой «рентгенологическая плотность – время исследования», которую строят так, что в момент времени 0 мин рентгенологическая плотность соответствует средней рентгенологической плотности печени до введения «Примовиста», на 90 мин рентгенологическая плотность достигает максимального значения 220-235 HU, с 91 мин до 160 мин наступает фаза удержания, на которой рентгенологическая плотность равна 220-235 HU, с 161 мин до конца времени исследования наступает фаза выведения, на которой рентгенологическая плотность снижается. Способ обеспечивает оценку динамики роста злокачественных новообразований за счет сопоставления калибровочной и экспериментальной кривых «рентгенологическая плотность – время исследования». 5 ил.
Способ проведения экспериментальной прижизненной компьютерной (КТ) томографии печени мышей, заключающийся в том, что у мыши инициируют наркозный сон, далее вводят мыши МР-контрастное вещество на основе гадоксетовой кислоты «Примовист» в объеме 500 мкл в течение 1,5 мин и проводят КТ печени мыши, на полученных изображениях печени определяют рентгенологическую плотность в зоне интереса и строят кривую «рентгенологическая плотность – время исследования», сопоставляют полученную кривую с калибровочной кривой «рентгенологическая плотность – время исследования», которую строят так, что в момент времени 0 мин рентгенологическая плотность соответствует средней рентгенологической плотности печени до введения «Примовиста», на 90 мин рентгенологическая плотность достигает максимального значения 220-235 HU, с 91 мин до 160 мин наступает фаза удержания, на которой рентгенологическая плотность равна 220-235 HU, с 161 мин до конца времени исследования наступает фаза выведения, на которой рентгенологическая плотность снижается.
| Способ создания экспериментальной модели опухолевого роста в условиях гипотиреоза | 2021 |
|
RU2779358C1 |
| Способ дифференциальной диагностики диффузных и очаговых заболеваний печени | 2020 |
|
RU2771257C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОПЕРАТИВНОГО ВМЕШАТЕЛЬСТВА НА ВНУТРЕННИХ ОРГАНАХ | 2000 |
|
RU2202276C2 |
| CHAU J | |||
| et al | |||
| Use of gadoxetic acid for computed tomographic cholangiography in healthy dog | |||
| American Journal of Veterinary Research | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Мяльно-трепальный станок | 1923 |
|
SU828A1 |
| VON FALCK C | |||
| et al | |||
| Combined microPET/CT for imaging of hepatocellular carcinoma in mice | |||
Авторы
Даты
2023-10-06—Публикация
2022-09-19—Подача