Изобретение относится к области биотехнологии, молекулярно-генетической диагностики, ветеринарной медицины, в частности к набору олигодезоксирибонуклеотидов для амплификации и детекции видоспецифичного фрагмента ДНК Anaplasma marginale методом полимеразной цепной реакции (ПЦР) в режиме «реального времени», содержащему два олигодезоксирибонуклеотидных праймера (прямой и обратный) и один флуоресцентно-меченый ДНК-зонд.
Anaplasma marginale (Род Anaplasma, отряд Rickettsiales, семейство Anaplasmatacea) является возбудителем анаплазмоза крупного рогатого скота (далее - КРС). A. marginale - облигатный внутриклеточный паразит, поражающий эритроциты. Анаплазмоз, вызванный A. marginale, протекает с признаками лихорадки, анемии, атонии желудочно-кишечного тракта и истощения. Смертность больных животных по разным оценкам составляет от 30 до 100%. Источником возбудителя являются инфицированные животные, переносчиками - около 20 видов клещей, а также кровососущие насекомые (Kocan, К.М., de la Fuente, J., Blouin, E.F., Garcia-Garcia, J.C., 2004. Anaplasma marginale (Rickettsiales: Anaplasmataceae): recent advances in defining host-pathogen adaptations of a tick-borne rickettsia. Parasitology 129, S285-S300. Сайт Интернет: http://www.ncbi.nlm.nih.gov/pubmed/15938516, 2015 г.; Scoles, G.A., Broce, A.B., Lysyk, T.J., Palmer, G.H., 2005. Relative efficiency of biological transmission of Anaplasma marginale (Rickettsiales: Anaplasmataceae) by Dermacentor andersoni (Acari: Ixodidae) compared with mechanical transmission by Stomoxys calcitrans (Diptera:Muscidae). J. Med. Entomol. 42, 668-675. Сайт Интернет: http://www.ncbi.nlm.gov/pubmed/16119558 2015 г.). Возможна также механическая передача возбудителя от зараженных животных к здоровым через нестерильные инструменты при проведении зоотехнических мероприятий.
Анаплазмоз крупного рогатого скота широко распространен во всем мире и приводит к значительным экономическим потерям вследствие уменьшения мясомолочной продуктивности скота, ущерба от недополучения молодняка и гибели животных. Анаплазмоз КРС, вызванный A. marginale, зарегистрирован во многих тропических и субстропических странах. Анаплазмоз КРС является эндемичным для Мексики, Центральной и Южной Америки, Карибских островов, Африки и Азии. Энзоотическими очагами анаплазмоза являются все страны Латинской Америки (Guglielmone, А.А., 1995. Epidemiology of babesiosis and anaplasmosis in South and Central America. Vet. Parasitol. 57, 109-119. Сайт Интернет: http://www.ncbi.nlm.gov/pubmed/7597777, 2015 г.). Анаплазмоз КРС распространен фактически по всей территории США и Канады, также в некоторых странах Европы, главным образом, средиземноморских (De la Fuente, J., Lew, A., Lutz, H., Meli, M.L., Hofmann-Lehmann, R., Shkap, V., et al., 2005. Genetic diversity of Anaplasma species major surface proteins and implications for anaplasmosis serodiagnosis and vaccine development. Anim. Health Res. Rev. 6, 75-89. Сайт Интернет: http://www.ncbi.nlm.gov/pubmed/16164010, 2015 г.). Это заболевание регистрируют в Украине, Белоруссии, Молдавии, Казахстане, государствах Средней Азии и Закавказья. Согласно ветеринарной отчетности в Российской Федерации неблагополучными по анаплазмозу являются субъекты Центрального, Северо-Западного и Приволжского федеральных округов (Гулюкин М.И. Мониторинг эпизоотической ситуации по протозойным кровепаразитарным болезням домашних животных в Российской Федерации (2007-2012) / М.И. Гулюкин, В.Т. Заблоцкий, В.В. Белименко // РВЖ.СХЖ. - 2013. - №2. - С.36-40. Сайт Интернет: http://cyberleninka.ru/article/n/monitoring-epizooticheskoy-situatsii-po-protozoynym-kroveparazitarnym-boleznyam-domashnih-zhivotnyh-v-rossiyskoy-federatsii-2007-2012, 2015 г.).
Своевременная диагностика играет решающую роль в предотвращении распространения инфекционных заболеваний. Многообразие клинических проявлений анаплазмоза затрудняет его диагностику, поэтому проблема создания надежных тест-систем для выявления патогенных видов анаплазм остается актуальной. На сегодняшний день для диагностики анаплазмоза применяют в основном микроскопические и серологические методы исследования, однако эти методы имеют ряд существенных недостатков, а именно недостаточно высокую чувствительность и специфичность. Так, результаты микроскопических исследований мазков крови ненадежны на ранних стадиях инфицирования и в случаях заболеваний, сопровождающихся тяжелой формой анемии. Серологические методы, основанные на использовании антител к антигенам A. marginale, имеют недостаточно высокую чувствительность и не позволяют дифференцировать A. marginale от других видов анаплазм (Dreher, U.М., J. Fuente, R. Hofmann-Lehmann, М.L. Meli, N. Pusterla, К.М. Kocan, Z. Woldehiwet, U. Braun, G. Regula, К.D. Staerk, and H. Lutz, 2005: Serologic crossreactivity between Anaplasma marginale and Anaplasma phagocytophilum. Clin. Diagn. Lab. Immunol. 12, 1177-1183. Сайт Интернет: http://www.ncbi.nlm.nih.gov/pubmed/16210480, 2015 г.).
Наиболее оперативную и точную диагностическую информацию позволяет получить выявление ДНК возбудителей анаплазмоза в крови КРС с помощью полимеразной цепной реакции (ПЦР). Суть метода заключается в многократном копировании (амплификации) специфического фрагмента ДНК с помощью термостабильной ДНК-полимеразы и пары геноспецифичных олигонуклеотидных праймеров до количеств, достаточных для его детекции любым из известных методов - электрофоретическим, гибридизационно-ферментным или гибридизационно-флуоресцентным. Преимуществом ПЦР-диагностики является высокая чувствительность и специфичность - она позволяет обнаружить возбудителя на самых ранних стадиях заболевания, в том числе и во время латентной фазы, и надежно дифференцировать анаплазмоз от ряда сходных по клиническим проявлениям заболеваний. Другими достоинствами метода являются небольшие затраты времени на проведение анализа и возможность автоматизации процесса.
ПЦР является единственным средством для диагностики анаплазмоза при носительстве в отсутствии клинических симптомов (Kocan KM, de la Fuente J, Blouin EF, Coetzee JF, Ewing SA. The natural history of Anaplasma marginale. Vet Parasitol. 2010 Feb 10; 167(2-4):95-107. Сайт Интернет: http://www.ncbi.nlm.nih.gov/pubmed/19811876, 2015 г.)
Согласно рекомендациям Всемирной организации здравоохранения животных (OIE, the World Organisation for Animal Health), изложенным в «Руководстве по диагностическим тестам и вакцинам для наземных животных 2015 г.» (Сайт Интернет: http://www.oie.int/en/intermational-standard-setting/terrestrial-manual/access-online, 2015 г.), ПЦР-диагностику A. marginale следует применять перед каждым перемещением животного на новое место и для подтверждения диагноза.
На сегодняшний день описаны разные методы ПЦР для детекции A. marginale, однако ни один из них не лишен недостатков, которые в связаны с выбором мишени для ПЦР и способа получения и анализа результатов. Сложность выбора олигодезоксирибонуклеотидов для ПЦР состоит в том, что они должны обладать строгой видовой специфичностью. В случае использования в ПЦР праймеров и флуоресцентно-меченого зонда, не имеющих видовой специфичности, возможны ложноотрицательные результаты исследования. В случае же, если выбранные олигодезоксирибонуклеотидные праймеры и ДНК-зонд имеют сродство к нецелевым последовательностям ДНК, то возможны ложноположительные результаты исследования. Правильный выбор сочетания пары праймеров и флуоресцентно-меченого ДНК-зонда позволяет осуществить амплификацию и детекцию методом ПЦР в режиме «реального времени» строго целевого фрагмента ДНК.
Ближайшим аналогом является набор из трех праймеров к гену msp1α:
MSPa733F1 - TGTGCTTATGGCAGACATTTCC,
MSPa2957Pv2 - AAACCTTGTAGCCCCAACTTATCC,
MSPa3134R1 - TCACGGTCAAAACCTTTGCTTACC
(прототип - Lew, A.E., Bock, R.E., Minchin, С.M. and Masaka, S. 2002. A msplalpha polymerase chain reaction assay for specific detection and differentiation of Anaplasma marginale isolates. Vet. Microbiol. 86: 325-335. Сайт Интерент: http://www.ncbi.nlm.nih.gov/pubmed/11955782, 2015 г.).
Недостатком этого метода является то, что в качестве мишени для ПЦР выбран высоковариабельный участок гена, что приводит к необходимости проведения двух последовательных ПЦР и получению фрагментов ДНК переменной длины (272-983 п.н.) для разных изолятов A. marginale.
Задачей изобретения является создание набора синтетических олигодезоксирибонуклеотидов для амплификации и детекции фрагмента гена msp1α A. marginale методом полимеразной цепной реакции в режиме «реального времени», который может быть использован для дифференциального выявления риккетсий A. marginale в крови крупного рогатого скота и других жвачных животных, а также в кровососущих членистоногих.
Технический результат, обеспечиваемый изобретением, заключается в повышении надежности детекции A. marginale, упрощении анализа и сокращении времени его проведения до 1.5 часов (не включая подготовку пробы), а также в уменьшении стоимости анализа.
Технический результат достигается тем, что набор синтетических олигодезоксирибонуклеотидов для детекции гена msp1α риккетсий Anaplasma marginale методом полимеразной цепной реакции в режиме «реального времени» содержит два олигодезоксирибонуклеотидных праймера и флуоресцентно-меченый ДНК-зонд, которые имеют следующую структуру:
Прямой праймер:
F: 5′-TGTTTGGAACCTAGGCTTATAG-3′
Обратный праймер:
R: 5′-CTTCTGCTGATCTTCCTGTCTC-3′
Флуоресцентно-меченый ДНК-зонд:
Probe: 5′-VIC-CGCTGATTTGGGGCTGCCTGGCACT-BHQ2
Преимуществом использования в ПЦР флуоресцентно-меченого ДНК-зонда Probe: 5′-VIC-CGCTGATTTGGGGCTGCCTGGCACT-BHQ2 является отсутствие необходимости проведения дополнительной стадии анализа - электрофоретическую детекцию результатов ПЦР, поскольку регистрация накопления ДНК происходит непосредственно в ходе самой реакции, что приводит к значительному сокращению времени исследования (до 1.5 часов, не включая подготовку пробы), а использование флуоресцентно-меченого зонда повышает надежность исследования.
В рамках патентуемого технического решения разработанные олигодезоксирибонуклеотиды являются видоспецифичными для A. marginale и позволяют достоверно выявлять методом полимеразной цепной реакции в режиме «реального времени» фрагмент гена msp1α, и, следовательно, наличие риккетсий A. marginale в крови крупного рогатого скота и других жвачных животных, а также у кровососущих членистоногих.
Характеристика набора олигодезоксирибонуклеотидов и участка амплифицируемой ДНК. Предлагаемые к патентованию олигодезоксирибонуклеотидные праймеры фланкируют участок гена msp1α A. marginale длиной 207 пар нуклеотидов. Использование в наборе с патентуемыми олигодезоксирибонуклеотидными праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продукта амплификации в режиме «реального времени».
Перечень графических материалов.
На фиг. 1 представлена нуклеотидная последовательность фрагмента гена msp1α A. marginale и отмечены участки гена, к которым подобраны патентуемые олигодезоксирибонуклеотиды.
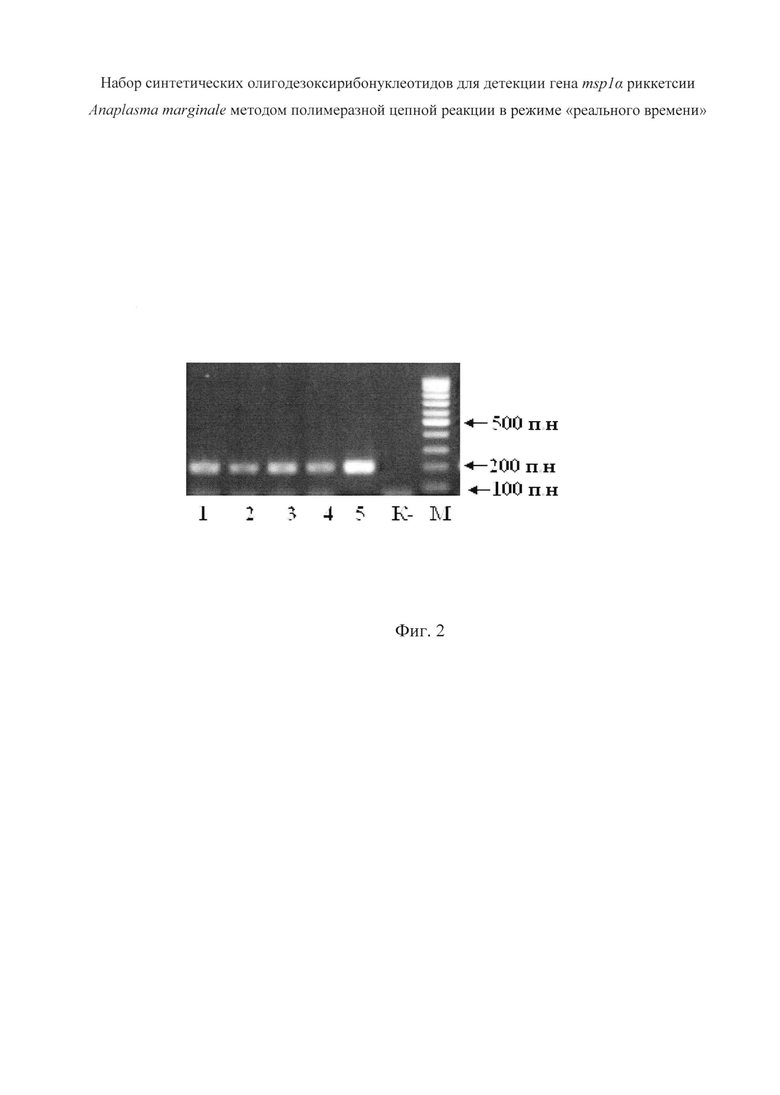
На фиг. 2 представлен результат электрофоретического разделения ДНК, полученной в результате ПЦР с использованием патентуемых олигодезоксирибонуклеотидных праймеров, и ДНК, выделенной из крови неинфицированной (К-) и инфицированных (1-5) коров. М - маркер длин ДНК 100-1000 п.н.
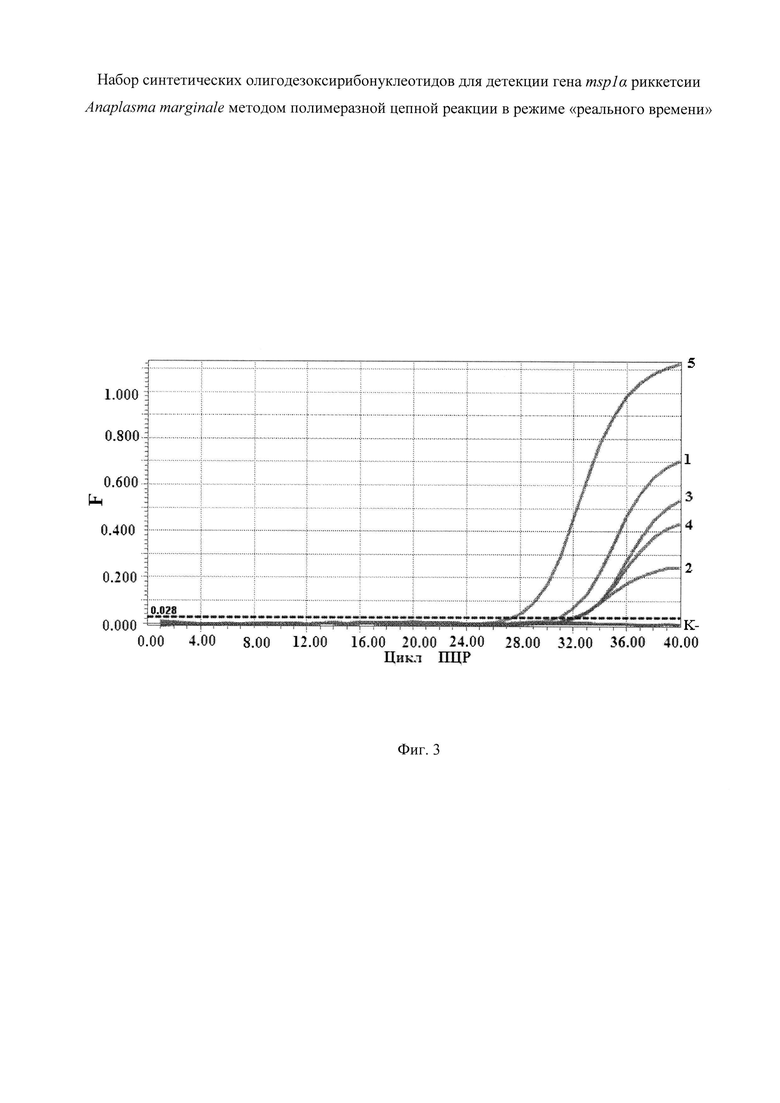
На фиг. 3 представлены графики накопления продукта ПЦР в режиме «реального времени» с использованием патентуемых олигодезоксирибонуклеотидов и ДНК, выделенной из крови неинфицированной (К-) и инфицированных (1-5) коров. По оси абсцисс отображено количество циклов ПЦР, по оси ординат - интенсивность флуоресценции (F).
Методика конструирования набора олигодезоксирибонуклеотидов. В качестве мишени для ПЦР был выбран ген msp1α, кодирующий иммунодоминантный поверхностный белок msp1α, характерный исключительно для риккетсий вида А. marginale. Анализ нуклеотидной последовательности генома A. marginale показал, что этот ген представлен в одной копии (Brayton КА, Kappmeyer LS, Herndon DR, Dark MJ, Tibbals DL, Palmer GH, McGuire TC, Knowles DP Jr. Complete genome sequencing of Anaplasma marginale reveals that the surface is skewed to two superfamilies of outer membrane proteins. Proc Natl Acad Sci USA. 2005 Jan 18; 102(3):844-9, Сайт Интернет: http://www.ncbi.nlm.nih.gov/pubmed/15618402, 2015 г.). N-концевой участок белка MSP1α состоит из тандемных пептидных повторов длиной 23-31 аминокислотных остатков, количество которых отличается у разных изолятов A. marginale, в то время как структура С - концевого участка является высоко консервативной (Functional and Immunological Relevance of Anaplasma marginale Major Surface Protein la Sequence and Structural Analysis. Published: June 11, 2013 DOI: 10.1371/journal.pone.0065243. Сайт Интернет: http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0065243, 2015 г.).
Выбор синтетических олигодезоксирибонуклеотидов для амплификации и детекции фрагмента гена msp1α A. marginale длиной 207 пар нуклеотидов методом полимеразной цепной реакции в режиме «реального времени» осуществляли на основе последовательностей полноразмерного гена msp1α разных изолятов A. marginale, имеющихся в международной базе данных Генбанк (Сайт Интернет: http://www.ncbi.nlm.nih.gov/genbank/, 2015 г.). Выявление характерного для A. marginale консервативного участка гена msp1α для подбора праймеров проводили с помощью сервера ClustalW2 (Сайт Интернет: http://www.ebi.ac.uk/Tools/msa/clustalw2/, 2015 г.). Видоспецифичность праймеров была проверена с использованием алгоритма BLASTN (Сайт Интернет: http://blast.ncbi.nlm.nih.gov/Blast.cgi, 2015 г.). Выбор олигодезоксирибонуклеотидов основывался на следующих критериях: длина 18-25 пар нуклеотидов; температура отжига олигодезоксирибонуклеотидных праймеров сходная и находится в диапазоне 60-65°C; температура отжига ДНК-зонда выше температур отжига олигодезоксирибонуклеотидных праймеров; отсутствие в последовательности олигодезоксирибонуклеотида вторичных структур с температурой плавления выше его температуры отжига; отсутствие само- и взаимокомплементарности между 3′-концами выбранных олигонуклеотидов; отсутствие идентичности с участками геномов других видов анаплазм. В результате сравнительного анализа структуры гена msp1α разных изолятов A. marginale были разработаны и синтезированы олигодезоксирибонуклеотидные праймеры и флуоресцентно-меченый ДНК-зонд для проведения полимеразной цепной реакции в режиме «реального времени» (табл. 1, фиг. 1), которые позволяют проводить дифференциальное выявление A. marginale.
Экстракция ДНК. Экстракцию ДНК из цельной крови коров проводили с использованием набора реагентов с помощью набора Sorb-M (Синтол, Россия) согласно рекомендациям производителя.
Проведение полимеразной цепной реакции в режиме «реального времени». Реакцию амплификации проводили в 10 мкл смеси для ПЦР, содержащей 1 × буфер для амплификации, 3 мМ MgCl2, 0.2 мМ каждого из нуклеозидтрифосфатов, 1 активную единицу HS Taq ДНК-полимеразы (все реактивы производства ЗАО «Евроген», Россия), 2 мкл ДНК, 0.2 мкМ прямого и 0.2 мкМ обратного олигодезоксирибонуклеотидного праймера, 0.1 мкМ флуоресцентно-меченого ДНК-зонда.
Отработка условий амплификации проводилась при использовании ДНК, выделенной из крови коров, инфицированных A. marginale. Амплификация проводилась по следующей схеме: денатурация при 95°C - 3 мин (1 цикл); затем 45 циклов: денатурация при 95°C - 15 с, отжиг при 62°C - 15 с, синтез при 72°C - 15 с; синтез при 72°C - 2 мин (1 цикл). Детекцию интенсивности флуоресценции проводили по каналу красителя VIC на приборе «LightCycler 98» (Roche, Швейцария). Результаты ПЦР оценивали методом электрофореза в 2% агарозном геле по наличию продукта реакции длиной 207 пар нуклеотидов (фиг. 2) и экспоненциальному росту флюоресценции (фиг. 3).
Апробация патентуемых олигодезоксирибонуклеотидов. Апробацию патентуемых олигодезоксирибонуклеотидов проводили на образцах ДНК, выделенной из цельной крови коров, инфицированных A. marginale. Экспериментально было показано, что выбранные олигодезоксирибонуклеотиды обеспечивают синтез и детекцию целевого фрагмента гена msp1α A. marginale длиной 207 пар нуклеотидов (фиг. 2, 3). Для подтверждения амплификации фрагмента целевого гена полученный фрагмент ДНК был лигирован в вектор pGEM-T Easy (Promega, США) и клонирован в клетках Escherichia coli DH5α. Выделенные плазмиды были секвенированы по методу Сэнгера. Анализ полученных нуклеотидных последовательностей с помощью программы BLAST (Сайт Интернет: http://blast.ncbi.nlm.nih.gov/Blast.cgi, 2015 г.) показал, что они имеют 100% идентичности с фрагментом гена msp1α разных изолятов A. marginale.
Для испытания аналитической специфичности праймеров и зонда использовались образцы ДНК овец, зараженных близкородственным видом риккетсий - A. ovis, а также образцы ДНК коров, содержащие ДНК бактерий, не относящихся к роду Anaplasma - Sanguibacter keddieii, Propionibacterium acnes, Pseudomonas aeruginosa, Stenotrophomonas maltophilia. Анализ результатов ПЦР в режиме «реального времени» показал отсутствие роста флуоресценции, характерного для A. marginale, и отсутствие каких-либо продуктов ПЦР при анализе результатов методом электрофореза в 2%-ном агарозном геле. Это свидетельствует об аналитической специфичности ПЦР с патентуемыми олигодезоксирибонуклеотидами.
Таким образом, заявляемый набор синтетических олигодезоксирибонуклеотидов обеспечивает амплификацию и детекцию фрагмента гена msp1α A. marginale методом ПЦР в режиме «реального времени».

Изобретение относится к области биохимии. Представлен набор синтетических олигодезоксирибонуклеотидов для детекции гена msp1α риккетсии Anaplasma marginale методом полимеразной цепной реакции в режиме «реального времени». Набор содержит два олигодезоксирибонуклеотидных праймера и флуоресцентно-меченый ДНК-зонд. Прямой праймер имеет структуру 5′-TGTTTGGAACCTAGGCTTATAG-3′; обратный праймер имеет структуру 5′-CTTCTGCTGATCTTCCTGTCTC-3′; флуоресцентно-меченый ДНК-зонд имеет структуру 5′-VIC-CGCTGATTTGGGGCTGCCTGGCACT-BHQ2. Изобретение позволяет повысить надежность детекции A. marginale, упростить анализ и сократить время его проведения. 3 ил., 1 табл.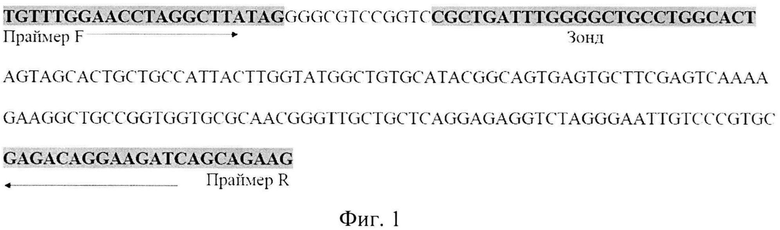
Набор синтетических олигодезоксирибонуклеотидов для детекции гена msp1α риккетсии Anaplasma marginale методом полимеразной цепной реакции в режиме «реального времени», содержащий два олигодезоксирибонуклеотидных праймера и флуоресцентно-меченый ДНК-зонд, которые имеют следующую структуру:
Прямой праймер:
F: 5′-TGTTTGGAACCTAGGCTTATAG-3′
Обратный праймер:
R: 5′-CTTCTGCTGATCTTCCTGTCTC-3′
Флуоресцентно-меченый ДНК-зонд:
Probe: 5′-VIC-CGCTGATTTGGGGCTGCCTGGCACT-BHQ2
| LEW A.E | |||
| et al., A msp1a polymerase chain reaction assay for specific detection and differentiation of Anaplasma marginale isolates, Veterinary Microbiology, 2002, vol.86, pp.325-335; | |||
| MOLAD T | |||
| et al., Genetic diversity of major surface protein 1a of Anaplasma marginale in beef cattle, Veterinary Microbiology, 2009, vol.136, pp.54-60; | |||
| McGAREY |
Авторы
Даты
2016-11-27—Публикация
2015-09-11—Подача