Изобретение относится к соединениям, которые являются активаторами АМР-активируемой протеинкиназы (АМРК) и которые полезны в лечении или профилактике заболеваний, связанных с регуляцией АМРК, таких как ожирение, дислипидемия, гипергликемия, диабет типа 1 или типа 2 и раковые заболевания.
В частности, изобретение относится к соединению формулы (I)
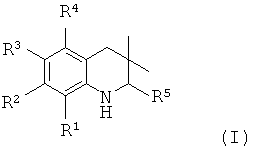
где
R1 представляет собой водород, галоген, карбоксил, алкоксикарбонил, алкилсульфониламинокарбонил или циклоалкилсульфониламинокарбонил;
R2 представляет собой водород, галоген или карбоксил;
R3 представляет собой водород, галоген, карбоксил, галогеноалкил, циано, алкоксикарбонил, алкилсульфонил, алкилсульфониламинокарбонил, циклоалкилсульфониламинокарбонил, карбоксилалкиламино(алкил)карбонил, алкил(гидрокси)пирролидинилкарбонил или карбоксилпирролидинилкарбонил;
R4 представляет собой водород, карбоксил, алкилсульфониламинокарбонил или циклоалкилсульфониламинокарбонил;
R5 представляет собой пиридинил, замещенный пиридинил, морфолинилпиридинил, фенил или замещенный фенил, где замещенный пиридинил и замещенный фенил представляют собой пиридинил и фенил, замещенные одним или двумя заместителями, независимо выбранными из галогена, галогенофенила, алкила, циклоалкила, алкокси, циано, карбоксила, циклоалкилкарбониламино, алкилсульфониламино, фенилсульфониламино, фениламиносульфонила, галогенофенилсульфониламино, фенила, алкилфенила, алкоксифенила, цианофенила, алкиламинокарбонилфенила, алкилсульфонилфенила, пирролидинила, пиридинилкарбониламино, морфолинила, алкилморфолинила, пиперазинила, алкилпиперазинила, алкилкарбонилпиперазинила, алкилфенилпиперазинила, галогенофенилпиперазинила, оксопирролидинила, диоксоимидазолидинила, оксоимидазолидинила, алкилоксоимидазолидинила, фенилоксоимидазолидинила, 2-оксо-оксазолидин-3-ила, алкил-2-оксо-оксазолидин-3-ила, фенилалкил-2-оксо-оксазолидин-3-ила, диоксопиперазинила, алкилдиоксопиперазинила, аминокарбонила, алкиламинокарбонила, алкоксиалкиламинокарбонила, алкиламиноалкиламинокарбонила, циклоалкиламинокарбонила, алкилпирролидиниламинокарбонила, тетрагидрофураниламинокарбонила, алкилпирролидинилалкиламинокарбонила, алкоксикарбонилазетидиниламинокарбонила, пирролидинилкарбонила, пиперидинилкарбонила, алкилсульфониламинокарбонила, циклоалкилсульфониламинокарбонила, фенилсульфониламинокарбонила, алкилазетидиниламинокарбонила, галогеноазетидинила, алкилпирролидиниламинокарбонила, фениламинокарбонила, пиразиниламинокарбонила, аминоалкоксиалкила, аминоалкокси, карбоксилалкокси, карбоксилалкоксиалкила, алкилтетразолила, фенилалкилтетразолила, алкиламиносульфонила, алкилфенилсульфониламино, алкилкарбониламино, циклоалкенилкарбониламино, фенилкарбониламино, фенилалкилкарбониламино, алкиламиноалкиламино, 7-бензил-4-оксо-5,6,7,8-тетрагидро-4Н-пиридо[3,4-d]пиримидин-3-ила, алкиламинофенила, алкиламино, гидроксиалкиламино, карбоксилалкиламино, карбоксилциклоалкиламино, алкиламинокарбонилалкиламино, аминокарбонил(алкил)амино, морфолинилкарбонилалкиламино, алкилпиперазинилкарбонилалкиламино, алкиламиносульфониламино, алкилкарбониламинофенилсульфониламино, алкиламинокарбониламино, аминокарбониламино, морфолинилкарбониламино, пирролидинилкарбониламино, пиперидинилкарбониламино, алкилпиперазинилкарбониламино, фенилалкиламинокарбониламино, галогенофенилкарбониламино, галогенофениламинокарбониламино, пиразинилкарбониламино, алкилпиперазинила, пирролидинилсульфонила и алкилпирролидиниламиносульфонила;
или его фармацевтически приемлемой соли или сложному эфиру.
Изобретение также относится к способу получения этих новых соединений и содержащих их лекарственных средств. Соединения по изобретению оказывают воздействие на AMP (аденозинмонофосфат)-активируемую протеинкиназу, которое приводит в результате к снижению уровней глюкозы и липидов в крови. Соответственно, изобретение также относится к применению таких соединений для лечения или профилактики заболеваний, связанных с регуляцией АМРК, таких как ожирение, дислипидемия, гипергликемия, диабет типа 1 или типа 2 и раковые заболевания.
Ожирение и диабет типа 2, гипертензия и сердечно-сосудистое заболевание являются заболеваниями, которые характеризуются серьезными нарушениями метаболизма глюкозы или липидов, что серьезно отражается на здоровье и качестве жизни лиц, страдающих такими заболеваниями. Кроме того, известно, что метаболизм при раке отличается от нормального клеточного метаболизма. Растущий уровень распространения этих заболеваний делает выявление новых мишеней для лекарственных средств для лечения этих синдромов неотложной задачей.
АМР-активируемая протеинкиназа действует как сенсор и регулятор энергетического баланса клетки. Она активируется в результате увеличения клеточного соотношения АМР:АТР, индуцированного метаболическим стрессом, сигналами гормонов и питательных веществ и другими клеточными механизмами, такими как фосфорилирование и взаимодействие "белок-белок". Сразу после активации АМРК запускает катаболические пути, которые генерируют АТР, и отключает АТР-потребляющие анаболические пути посредством острой регуляции активности ключевых ферментов в метаболизме и хронической регуляции экспрессии основных факторов транскрипции (Hardie, DG. Nature reviews 8 (2007b), 774-785; Woods, A et al. Molecular and cellular biology 20 (2000), 6704-6711). Возрастающее количество данных по регуляторным эффектам АМРК в отношении метаболизма глюкозы и липидов свидетельствует о ее потенциале в качестве лекарственной мишени для лечения диабета, метаболического синдрома и рака (Carling, D. Trends Biochem Sci 29 (2004), 18-24; Hardie, DG. Annual review of pharmacology and toxicology 47 (2007a), 185-210; Kahn, BB et al. Cell metabolism 1 (2005), 15-25; Long, YC et al. The Journal of clinical investigation 116 (2006), 1776-1783).
На физиологическом уровне эта концепция подтверждается тем, что два адипокина, лептин и адипонектин, оба оказывают превосходные эффекты на метаболизм глюкозы и липидов (Friedman, JM and Halaas, JL. Nature 395 (1998), 763-770; Muoio, DM et al. Diabetes 46 (1997), 1360-1363; Yamauchi, Т et al. Nature medicine 7 (2001), 941-946). Недавние исследования свидетельствуют о том, что лептин и адипонектин оказывают противодиабетические эффекты посредством активации АМРК. Лептин стимулирует окисление мышечных жирных кислот посредством активации АМРК напрямую и через гипоталамический-адренергический путь (Minokoshi, Y et al. Nature 415 (2002), 339-343). Адипонектин стимулирует всасывание глюкозы и окисление жирных кислот in vitro посредством активации АМРК. Кроме того, он оказывает гипогликемический эффект за счет снижения экспрессии РЕРСК и G6Pase, несмотря на то, что введение доминантного негативного а1 аденовируса реверсирует эффект in vivo (Yamauchi, Т et al. Nature medicine 8 (2002), 1288-1295).
На фармакологическом уровне концепция использования АМРК в качестве потенциальной мишени для лечения метаболического синдрома получила дополнительное подтверждение в результате открытия двух основных классов имеющихся противодиабетических лекарственных средств, а именно тиазолидиндионов (росиглитазон, троглитазон и пиоглитазон) и бигуанидов (метформин и фенформин), которые активируют АМРК в культивированных клетках и in vivo. Росиглитазон традиционно считается агонистом PPARγ, и он оказывает противодиабатическое действие посредством дифференцировки адипоцитов (Semple, RK et al. The Journal of clinical investigation 116 (2006), 581-589). Недавно полученные данные указывают на то, что АМРК может быть вовлечена в противодиабетические эффекты росиглитазона (Brunmair, В et al. The Journal of biological chemistry 277 (2002), 25226-25232; Kadowaki, T et al. The Journal of clinical investigation 116(2006), 1784-1792). В случае метформина, известного противодиабетического агента без определенного механизма действия, недавние исследования демонстрируют, что он может активировать АМРК in vitro и in vivo посредством ингибирования комплекса I (EI-Mir, MY et al. The Journal of biological chemistry 275 (2000), 223-228; Owen, MR et al. The Biochemical journal 348 Pt 3 (2000), 607-614; Zhou, G et al. The Journal of clinical investigation 108 (2001), 1167-1174), и гипогликемический эффект может быть полностью блокирован посредством нокаутирования ее вышестоящей киназы LKB1, что подтверждает ключевую роль АМРК в опосредовании противодиабетического эффекта метформина (Shaw, RJ et al. Science (New York) N.Y. 310 (2005), 1642-1646).
Совсем недавно Cool с соавторами идентифицировали имеющий небольшую молекулу прямой активатор АМРК, А-769662, который оказывает противодиабетические эффекты in vivo (Cool, В et al. Cell metabolism 3 (2006), 403-416). В лаборатории Li также идентифицирован имеющий небольшую молекулу активатор АМРК, РТ1, который активирует неактивные формы АМРК α2398 и α1394 с микромолярной активностью и оказывает некоторые клеточные эффекты (Pang, Т et al. The Journal of biological chemistry 283 (2008), 16051-16060).
Было обнаружено, что соединения по настоящему изобретению являются мощными активаторами АМРК. Таким образом, соединения по изобретению полезны в лечении или профилактике заболеваний, связанных с регуляцией АМРК, таких как ожирение, дислипидемия, гипергликемия, диабет типа 1 или типа 2 и раковые заболевания.
Использованный здесь термин "алкил", один или в комбинации, означает насыщенную алкильную группу с линейной или разветвленной цепью, содержащую от 1 до 8, предпочтительно от 1 до 6, более предпочтительно от 1 до 4 атомов углерода, например метил, этил, пропил, изопропил, 1-бутил, 2-бутил, трет-бутил и т.п.Предпочтительными "алкильными" группами являются метил, этил, изопропил, трет-бутил.
Термин "циклоалкенил", один или в комбинации, означает моноциклический алкил, имеющий пять, шесть или семь атомов углерода и одну двойную связь. Предпочтительными циклоалкенилами являются циклопентенил и циклогексенил.
Термин "алкокси", один или в комбинации, означает группу алкил-O-, где "алкил" такой, как определено выше, например метокси, этокси, пропокси, изопропокси, н-бутокси, изобутокси, 2-бутокси, трет-бутокси и т.п. Предпочтительными алкоксигруппами являются метокси и этокси и более предпочтительно метокси.
Термин "циклоалкил", один или в комбинации, относится к насыщенному углеродному кольцу, содержащему от 3 до 7 атомов углерода, предпочтительно от 3 до 6 атомов углерода, например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.п. Предпочтительными циклоалкильными группами являются циклопропил и циклопентил, причем циклопропил является особенно предпочтительным.
Термин "галоген" означает фтор, хлор, бром или йод. Галоген предпочтительно представляет собой фтор, хлор или бром.
Термин "галогенофенил" означает фенил, замещенный галогеном.
Термин "карбоксил", один или в комбинации, относится к группе -СООН.
Термин "карбонил", один или в комбинации, относится к группе -С(O)-.
Термин "амино", один или в комбинации, относится к первичной (-NH2-), вторичной (-NH-) или третичной аминогруппе (-N-).
Термин "гидрокси", один или в комбинации, относится к группе -ОН.
Термин "сульфонил", один или в комбинации, относится к группе -S(O)2-.
Соединения по настоящему изобретению могут существовать в форме их фармацевтически приемлемых солей. Термин "фармацевтически приемлемая соль" относится к обычным солям присоединения кислоты или солям присоединения основания, которые сохраняют биологическую эффективность и свойства соединений формулы (I) и образованы с подходящими нетоксичными органическими или неорганическими кислотами или органическими или неорганическими основаниями. Соли присоединения кислоты включают, например, соли, образованные с неорганическими кислотами, такими как соляная кислота, бромоводородная кислота, йодоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота и азотная кислота, и соли, образованные с органическими кислотами, такими как пара-толуолсульфоновая кислота, салициловая кислота, метансульфоновая кислота, щавелевая кислота, янтарная кислота, лимонная кислота, малоновая кислота, молочная кислота, фумаровая кислота и т.п. Соли присоединения основания включают соли, образованные с гидроксидами аммония, калия, натрия и четвертичного аммония, такого как, например, гидроксид тетраметиламмония. Химическая модификация фармацевтического соединения путем превращения его в соль является известным специалистам в области фармацевтической химии методом достижения улучшения характеристик физической и химической стабильности, гигроскопичности, текучести и растворимости соединений. Это описано, например, в Bastin R.J., et. al. Organic Process Research and Development 2000, 4, 427-435; или в Ansel, H., et al., In: Pharmaceutical Dosage Forms and Drug Delivery Systems, 6th ed. (1995), pp.196 и 1456-1457. Предпочтительными являются натриевые соли соединений формулы (I).
"Фармацевтически приемлемые сложные эфиры" означает, что соединения общей формулы (I) могут быть дериватизированы по функциональным группам с получением производных, которые in vivo способны превращаться назад в родительские соединения. Примеры таких соединений включают физиологически приемлемые и метаболически лабильные сложноэфирные производные, такие как метоксиметиловые эфиры, метилтиометиловые эфиры и пивалоилоксиметиловые эфиры. Дополнительно, любые физиологически приемлемые эквиваленты соединений общей формулы (I), такие как метаболически лабильные сложные эфиры, которые способны продуцировать родительские соединения общей формулы (I) in vivo, входят в объем данного изобретения. Предпочтительными являются метиловые и этиловые сложные эфиры соединений формулы (I).
В частности, изобретение относится к соединению формулы (I), где R1 представляет собой водород, карбоксил или алкоксикарбонил.
Изобретение также относится, в частности, к соединению формулы (I), где R1 представляет собой водород, карбоксил или метоксикарбонил.
Изобретение также относится к соединению формулы (I), где R2 представляет собой водород.
Соединение формулы (I), где R3 представляет собой галоген, карбоксил, галогеноалкил, циано, алкилсульфонил, алкилсульфониламинокарбонил или циклоалкилсульфониламинокарбонил, также является объектом изобретения.
Соединение формулы (I), где R3 представляет собой фторо, хлоро, карбоксил, трифторметил, циано, метилсульфонил, метилсульфониламинокарбонил или циклопропилсульфониламинокарбонил, также является объектом изобретения.
Кроме того, изобретение относится к соединению формулы (I), где R4 представляет собой водород, карбоксил, метилсульфониламинокарбонил или циклопропилсульфониламинокарбонил.
Более того, изобретение относится, в частности, к соединению формулы (I), где R5 представляет собой замещенный фенил, где замещенный фенил представляет собой фенил, замещенный одним или двумя заместителями, независимо выбранными из галогена, алкила, алкилсульфониламино, фенилсульфониламино, галогенофенилсульфониламино, алкилфенила, пирролидинила, морфолинила, алкилпиперазинила, алкилфенилпиперазинила, алкилоксоимидазолидинила, алкил-2-оксо-оксазолидин-3-ила, аминокарбонила, алкиламиноалкиламинокарбонила, алкилпирролидиниламинокарбонила, фенилсульфониламинокарбонила, алкилкарбониламино, алкиламиноалкиламино, алкиламино, карбоксилалкиламино, карбоксилциклоалкиламино и алкиламинокарбонилалкиламино.
Кроме того, изобретение также относится к соединению формулы (I), где R5 представляет собой замещенный фенил, где замещенный фенил представляет собой фенил, замещенный одним или двумя заместителями, независимо выбранными из фторо, метила, метилсульфониламино, фенилсульфониламино, фторфенилсульфониламино, трет-бутилфенила, пирролидинила, морфолинила, метилпиперазинила, диметилфенилпиперазинила, метилфенилпиперазинила, метилоксоимидазолидинила, изопропил-2-оксо-оксазолидин-3-ила, аминокарбонила, диметиламиноэтиламинокарбонила, метилпирролидиниламинокарбонила, фенилсульфониламинокарбонила, изопропилкарбониламино, метиламино(этил)(метил)амино, диметиламино, карбоксилпропиламино, карбоксилциклопропиламино и метиламинокарбонилпропиламино.
Конкретные соединения формулы (I) по изобретению могут быть выбраны из
2-[3-(3-бензил-уреидо)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[3-(6-хлор-8-циклопропансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фенил]-амида пиразин-2-карбоновой кислоты;
3,3-диметил-2-{3-[(пиридин-3-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-{3-[(пиридин-2-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-{3-[(пиразин-2-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(3-фтор-бензоиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-карбонил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-N-фенил-бензамида;
[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида пропан-2-сульфоновой кислоты;
[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фенил]-амида пиразин-2-карбоновой кислоты;
2-(3-бензоиламино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-{3-[3-(3-фтор-фенил)-уреидо]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-фенилкарбамоил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-[3-(3-метил-2-оксо-имидазолидин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-[3-(2-оксо-имидазолидин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(2,5-диоксо-пиперазин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(2,4-диоксо-имидазолидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(4-фтор-бензоиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-{3-[(морфолин-4-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-{3-[(пиперидин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
{[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксил]-метил-амино}-уксусной кислоты;
1-[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксил]-пирролидин-2-карбоновой кислоты;
2-(3-(N,N-диметилсульфамоиламино)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-[3-(2-оксо-3-фенил-имидазолидин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-{3-[(4-метил-пиперазин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-[3-(2-гидрокси-1,1-диметил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-[3-(триметил-уреидо)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-[3-(1-метил-уреидо)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(1-изопропил-уреидо)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(2-амино-1,1-диметил-этокси)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(4,4-диметил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-{3-[(пирролидин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(3,3-диэтил-уреидо)-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-[3-(6-циано-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2,N-диметил-пропионамида;
2-[3-(1-диметилкарбамоил-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(1,1-диметил-2-морфолин-4-ил-2-оксо-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-{3-[1,1-диметил-2-(4-метил-пиперазин-1-ил)-2-оксо-этиламино]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-изопропил-2-[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионамида;
2-[3-(1-карбокси-циклопропиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(3,3-диметил-6-трифторметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-[5-(4-трел7-бутил-фенил)-пиридин-3-ил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(6-циклопропансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2,N-диметил-пропионамида;
2-[3-(6-метансульфонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
N-[2-(4'-трет-бутил-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
N-[2-(3-диметиламино-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
2-(4'-циано-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[2-(3,5-дифтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида цикпопропансульфоновой кислоты;
2-(2-фтор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[2-(2-фтор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
2-(3-хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[2-(3-хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
N-[2-(3-хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
[2-(4-фтор-3-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
N-[2-(4-фтор-3-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
[2-(5-фтор-2-метил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
N-[2-(3-фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
[2-(3-фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
3,3-диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[3,3-диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
N-[3,3-диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
2-(3-метокси-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[2-(3-метокси-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
N-[2-(3-метокси-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
N-[2-(3-циано-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
[2-(3-циклогексил-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
2-(3-фтор-5-пиперазин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[3,3-диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
N-[3,3-диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
N-{2-[3-фтор-5-(4-изопропил-пиперазин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
2-[3-фтор-5-(2-оксо-пирролидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-{2-[3-фтор-5-(2-оксо-пирролидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
метилового эфира 2-[3-(1-карбокси-1-метил-этиламино)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
6-хлор-3,3-диметил-2-[3-(1-метил-1-метилкарбамоил-этиламино)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
2-[3-(1-карбокси-1-метил-этиламино)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
2-[3-(4-ацетил-пиперазин-1-ил)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
6-хлор-3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
N-[2-(4'-трет-бутил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
2-(4'-изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-[2-(4'-изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
[2-(4'-изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида цикпопропансульфоновой кислоты;
2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-(2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил)-метансульфонамида;
2-{3-[4-(2,4-диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-(2-{3-[4-(2,4-диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил)-метансульфонамида;
(2-{3-[4-(2,4-диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил)-амида циклопропансульфоновой кислоты;
6-фтор-3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
N-(6-хлор-2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил)-метансульфонамида;
3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты;
N-{3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
[3,3-диметил-2-(3-пиперазин-1-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида этансульфоновой кислоты;
3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
[6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбонил]-амида циклопропансульфоновой кислоты;
3,3-диметил-2-(3-пиперазин-1-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-[3,3-диметил-2-(3-пиперазин-1-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
N-[6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбонил]-метансульфонамида;
{2-[3-(2,6-диметил-морфолин-4-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты;
2-[3-(2,6-диметил-морфолин-4-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
(3-гидрокси-3-метил-пирролидин-1-ил)-[2-(3-метокси-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-ил]-метанона;
3,3-диметил-2-пиридин-3-ил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4'-хлор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-{3,3-диметил-2-[3-(2-оксо-оксазолидин-3-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты;
8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-хлор-4-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[3,3-диметил-2-(5-морфолин-4-ил-пиридин-3-ил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида цикпопропансульфоновой кислоты;
N-[8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
{3,3-диметил-2-[3-(2-оксо-оксазолидин-3-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты;
[6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амида циклопропансульфоновой кислоты;
N-[6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамида;
2-[3-((S)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-{3-[метил-(2-метиламино-этил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты;
2-[3-(R)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-{2-[3-((R)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
2-[3-((S)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
{2-[3-((R)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты
3,3-диметил-2-[3-(4-метил-2,3-диоксо-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-((R)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-{2-[3-((R)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
{3,3-диметил-2-[3-(4-метил-2,3-диоксо-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты;
{2-[3-((R)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты;
N-{3,3-диметил-2-[3-(4-метил-2,3-диоксо-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
{2-[3-((S)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты;
[8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амида циклопропансульфоновой кислоты;
7-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты;
N-[7-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамида;
2-[3-(7-бензил-4-оксо-5,6,7,8-тетрагидро-4Н-пиридо[3,4-d]пиримидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
8-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-7-карбоновой кислоты;
[7-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амида циклопропансульфоновой кислоты;
{6-хлор-3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбонил}-амида циклопропансульфоновой кислоты;
6-хлор-2-(4'-изопропил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
[6-хлор-2-(4'-диметиламино-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил]-амида циклопропансульфоновой кислоты;
2-(4'-трет-бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
[2-(4'-трет-бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил]-амида циклопропансульфоновой кислоты;
N-[2-(4'-трет-бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил]-метансульфонамида;
{2-[3-(5-этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты;
N-{2-[3-(5-этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
2-[3-(5-бензил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(5-этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-[7-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамида;
[8-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амида циклопропансульфоновой кислоты;
2-(4'-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты;
3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
{2-[3-(3-фтор-азетидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты;
N-{2-[3-(3-фтор-азетидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
N-{3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
[2-(4'-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбонил]-амида циклопропансульфоновой кислоты;
N-[2-(4'-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамида;
3,3-диметил-2-фенил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4'-изопропилкарбамоил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
трет-бутиламида 3'-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-бифенил-4-карбоновой кислоты;
[2-(4'-метансульфонил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
2-(4'-трет-бутилкарбамоил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[2-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[2-(1-карбокси-циклопропиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(1-метилэтилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(1-метилэтилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(тетрагидрофуран-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(4-(фенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(4-ацетамидофенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклопропилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(пирролидин-1-карбонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклобутилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(изопропилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-фтор-3-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(фенилсульфонилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклопропилсульфонилкарбамоил)-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-хлор-3-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(метилсульфонилкарбамоил)-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-фтор-3-(пиколинамидо)-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-(4-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-(4-фторбензамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(4-(4-метилфенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-бензамидо-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-бензамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(4-(пиколинамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(метилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклопропанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклопропанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(2-хлор-4-фторбензамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(пиперидин-1-карбонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(2-метоксиэтилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(4-(2-фенилацетамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклобутанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-хлор-3-(циклогексанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклопентанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
метил-3,3-диметил-2-(3-(пиразин-2-илкарбамоил)-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата;
2-(4-(циклогексанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(2-фенилацетамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-карбамоилфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(метилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-бензамидо-5-хлорофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(2-(диметиламино)этилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-ацетамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-((1-этилпирролидин-2-ил)метилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-фтор-3-(3-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(1-(трет-бутоксикарбонил)азетидин-3-илкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(1-метилазетидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-фтор-3-(2-фторфенилсульфонамидо)фенил)-,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(3-фенилпропанамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклогексанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-(3-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-(2-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(2-(циклопропанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-(циклобутанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(2-(циклобутанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-(циклогекс-1-енкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(2-(4-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(2-(2-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(2-(фенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(N-изопропилсульфамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(2-(3-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(2-(метилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(1-метилпирролидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-N-(1-метилпирролидин-3-ил)бензамида;
3,3-диметил-2-(4-(N-метилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(пирролидин-1-илсульфонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(N-метилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(N-(1-метилпирролидин-3-ил)сульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(N-фенилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(N,N-диметилсульфамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(2-(пиколинамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты; и
2-(3-(2-карбоксипропан-2-илокси)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты.
Дополнительные конкретные соединения формулы (I) могут быть выбраны из
2-[2-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(4-ацетил-пиперазин-1-ил)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
[2-(4'-изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
2-[3-(1-карбокси-циклопропиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(6-метансульфонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-(2-(2-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(2-(4-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-[3-(3,3-диметил-6-трифторметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
N-[2-(4'-трет-бутил-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
2-[3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-[3-(6-циано-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-(2-(3-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(2-(метилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(2-(фенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
метилового эфира 2-[3-(1-карбокси-1-метил-этиламино)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
2-[2-(1-карбокси-циклопропиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(1-карбокси-1-метил-этиламино)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
[6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амида циклопропансульфоновой кислоты;
2-(4'-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты;
[2-(4'-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбонил]-амида циклопропансульфоновой кислоты;
3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-N-(1-метилпирролидин-3-ил)бензамида;
N-[6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамида;
N-[2-(3-фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
N-[2-(3-диметиламино-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
[2-(3-фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
3,3-диметил-2-[3-(3-метил-2-оксо-имидазолидин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-карбамоилфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты;
3,3-диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4'-трет-бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
2-(4-фтор-3-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(1-метилэтилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(2-(диметиламино)этилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
6-хлор-3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
2-[3-((S)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-{3-[метил-(2-метиламино-этил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(фенилсульфонилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты; и
N-{3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида.
Соединения по настоящему изобретению могут быть получены любыми общепринятыми способами. Подходящие способы синтеза этих соединений представлены в примерах. В общем, соединения формулы (I) могут быть получены по схемам, проиллюстрированным ниже. На этих схемах R6-R33 определены соответственно, a R представляет собой метил или этил. Если на приведенных ниже схемах конкретно не указано иное, то замещенный фенил на схемах 1-23 представляет собой фенил, замещенный одним или двумя заместителями, независимо выбранными из галогена, галогенофенила, алкила, циклоалкила, алкокси, циано, карбоксила, циклоалкилкарбониламино, алкилсульфониламино, фенилсульфониламино, фениламиносульфонила, галогенофенилсульфониламино, фенила, алкилфенила, алкоксифенила, цианофенила, алкиламинокарбонилфенила, алкилсульфонилфенила, пирролидинила, пиридинилкарбониламино, морфолинила, алкилморфолинила, пиперазинила, алкилпиперазинила, алкилкарбонилпиперазинила, алкилфенилпиперазинила, галогенофенилпиперазинила, оксопирролидинила, диоксоимидазолидинила, оксоимидазолидинила, алкилоксоимидазолидинила, фенилоксоимидазолидинила, 2-оксо-оксазолидин-3-ила, алкил-2-оксо-оксазолидин-3-ила, фенилалкил-2-оксо-оксазолидин-3-ила, диоксопиперазинила, алкилдиоксопиперазинила, аминокарбонила, алкиламинокарбонила, алкоксиалкиламинокарбонила, алкиламиноалкиламинокарбонила, циклоалкиламинокарбонила, алкилпирролидиниламинокарбонила, тетрагидрофураниламинокарбонила, алкилпирролидинилалкиламинокарбонила, алкоксикарбонилазетидиниламинокарбонила, пирролидинилкарбонила, пиперидинилкарбонила, алкилсульфониламинокарбонила, циклоалкилсульфониламинокарбонила, фенилсульфониламинокарбонила, алкилазетидиниламинокарбонила, галогеноазетидинила, алкилпирролидиниламинокарбонила, фениламинокарбонила, пиразиниламинокарбонила, аминоалкоксиалкила, аминоалкокси, карбоксилалкокси, карбоксилалкоксиалкила, алкилтетразолила, фенилалкилтетразолила, алкиламиносульфонила, алкилфенилсульфониламино, алкилкарбониламино, циклоалкенилкарбониламино, фенилкарбониламино, фенилалкилкарбониламино, алкиламиноалкиламино, 7-бензил-4-оксо-5,6,7,8-тетрагидро-4Н-пиридо[3,4-d]пиримидин-3-ила, алкиламинофенила, алкиламино, гидроксиалкиламино, карбоксилалкиламино, карбоксилциклоалкиламино, алкиламинокарбонилалкиламино, аминокарбонил(алкил)амино, морфолинилкарбонилалкиламино и алкилпиперазинилкарбонилалкиламино, алкиламиносульфониламино, алкилкарбониламинофенилсульфониламино, алкиламинокарбониламино, аминокарбониламино, морфолинилкарбониламино, пирролидинилкарбониламино, пиперидинилкарбониламино, алкилпиперазинилкарбониламино, фенилалкиламинокарбониламино, галогенофенилкарбониламино, галогенофениламинокарбониламино, пиразинилкарбониламино, алкилпиперазинила, пирролидинилсульфонила и алкилпирролидиниламиносульфонила.
В настоящем описании изобретения использованы следующие сокращения:
Сокращения:
APCI: химическая ионизация при атмосферном давлении
д.: день или дни
DMF: диметилформамид
DMSO: диметилсульфоксид
экв.: эквивалент
г: грамм
мкг: микрограмм
ч: час или часы
HATU: гексафторфосфат о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония
HPLC: высокоэффективная жидкостная хроматография
мг: миллиграмм
мин: минута или минуты
мл: миллилитр
ммоль: миллимоль
мМ: миллимоль на литр
MS (ESI): масс-спектроскопия (электрораспылительная ионизация)
М.м.: молекулярная масса
NMP: N-метилморфолин
к.т. или К.Т.: комнатная температура
колич.: количественный
мкл: микролитр
мкМ: микромоль на литр
Схема 1
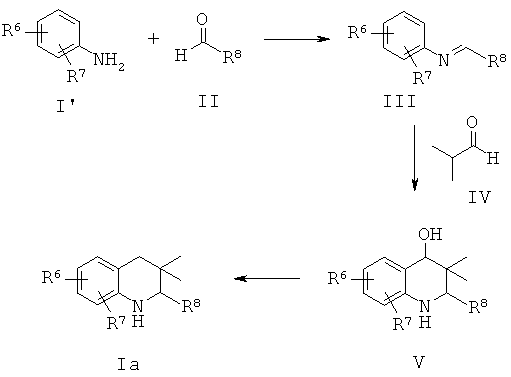
R6 и R7 независимо выбраны из водорода, галогена, трифторметила, алкилсульфонила, циано и алкоксикарбонила; R8 представляет собой пиридинил, фенил или замещенный фенил.
Соединения формулы Ia могут быть получены по Схеме 1. Анилин I' подвергают взаимодействию с альдегидами II до образования имина III. Аза-реакция Дильса-Альдера между имином III и изобутилальдегидом IV приводит к получению 4-гидрокситетрагидрохинолина V. После удаления гидроксигруппы тетрагидрохинолина V образуется соединение Ia.
В способе, который в общих чертах представлен на Схеме 1, соединения имина IV могут быть получены в результате реакции конденсации замещенного анилина I и замещенных альдегидов II в органическом растворителе, таком как толуол, метанол или этанол и их смесь, при температуре от 80 до 140°С в течение 2-16 часов.
Реакция Дильса-Альдера между имином III и изобутилальдегидом IV может быть проведена в присутствии кислоты Льюиса, такой как трифторметансульфонат иттербия(III) (Yb(OTf)3), трифторметансульфонат скандия(III) (Sc(OTf)3), трифторметансульфонат лантана(III) (La(OTf)3), трифторметансульфонат индия(III) (In(OTf)3), трихлорид индия (InCl3) или диэтилэфират трифторида бора (BF3·Et2O), или протонной кислоты, такой как трифторуксусная кислота (TFA) или пара-толуолсульфоновая кислота, в растворителе, таком как ацетонитрил, дихлорметан, тетрагидрофуран, нитрометан, N,N-диметилформамид, 2,2,2-трифторэтанол или их смесь, при температуре от 25 до 100°С в течение нескольких часов (ссылка: Kiselyov, A.S. et al., Tetrahedron 54 (1998) 5089).
Восстановление гидроксильной группы в соединении V может быть осуществлено в присутствии триэтилсилана в трифторуксусной кислоте при комнатной температуре в течение нескольких часов с получением в результате соединения Ia.
Схема 2
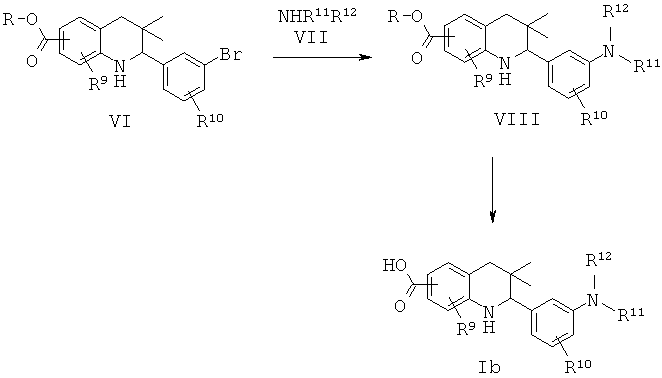
R9 представляет собой водород или галоген; R10 представляет собой водород, галоген, циано, метил, алкокси; R11 и R12 представляют собой алкил; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют гетероциклил.
Соединения формулы Ib могут быть получены по Схеме 2. В этом способе соединения формулы VI могут быть синтезированы, как проиллюстрировано на Схеме 1. В результате катализируемой медным катализатором реакции сочетания Ульмана с последующим гидролизом сложного эфира образуются соединения формулы Ib.
Реакция сочетания Ульмана, которая в общих чертах представлена на Схеме 2, может быть осуществлена в присутствии источника меди, такого как йодид меди(I) (CuI) или трифторметансульфонат меди(II), и лиганда, такого как 2,2'-бипиридин, пролин, N,N'-диметилглицин или этиленгликоль, в присутствии подходящего основания, такого как триэтиламин, карбонат натрия, карбонат калия, карбонат цезия, метоксид натрия, трет-бутоксид натрия, трет-бутоксид калия. Эта реакция может быть осуществлена в подходящем растворителе, таком как 1,4-диоксан, N,N-диметилформамид, диметилсульфоксид или N-метилпирролидинон, при температуре от 100 до 130°С в течение 10-16 часов (ссылка: Ley, S.V. et al., Angew. Chem. Int. Ed. 42 (2003) 5400).
Гидролиз сложных эфиров VIII с получением в результате продуктов формулы Ib может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан или тетрагидрофуран, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Схема 3
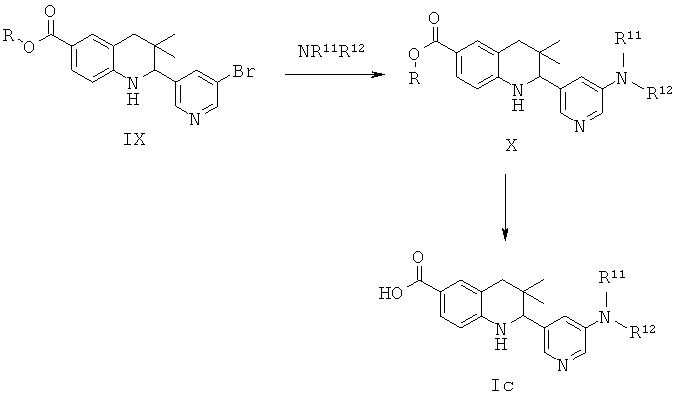
R11 и R12 представляют собой алкил; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют циклический амин или амид.
Соединения формулы Ic могут быть получены по Схеме 3. В этом способе соединения формулы IX могут быть синтезированы, как проиллюстрировано на Схеме 1, в результате катализируемой медным катализатором реакции сочетания Ульмана с последующим гидролизом сложного эфира с образованием соединений формулы Ic.
Реакция сочетания Ульмана, которая в общих чертах представлена на Схеме 3, может быть осуществлена в присутствии источника меди, такого как йодид меди(I) (CuI) или трифторметансульфонат меди(II), и лиганда, такого как 2,2'-бипиридин, пролин, N,N'-диметилглицин или этиленгликоль, в присутствии подходящего основания, такого как триэтиламин, карбонат натрия, карбонат калия, карбонат цезия, метоксид натрия, трет-бутоксид натрия, трет-бутоксид калия. Реакция может быть осуществлена в подходящем растворителе, таком как 1,4-диоксан, N,N-диметилформамид, диметилсульфоксид или N-метилпирролидинон, при температуре от 100 до 130°С в течение 10-16 часов (ссылка: Ley, S.V. et al., Angew. Chem. Int. Ed. 42 (2003) 5400).
Гидролиз сложных эфиров формулы Х с образованием в результате продуктов формулы Ic может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан или тетрагидрофуран, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Схема 4
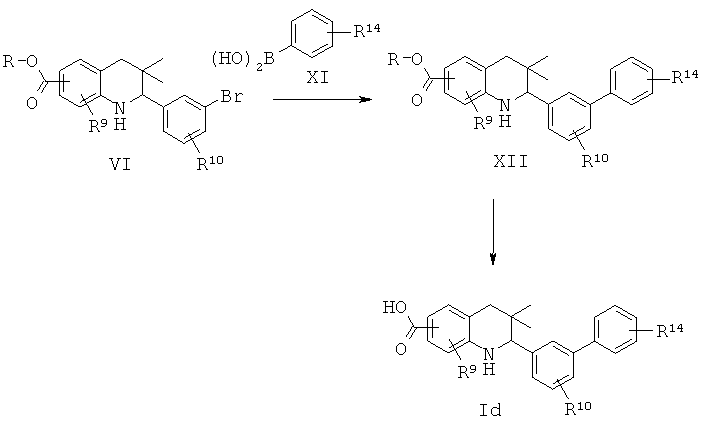
R9 представляет собой водород или галоген; R10 представляет собой водород, галоген, циано, метил или алкокси; R14 представляет собой галоген, алкил, алкокси, циано, алкилсульфонил, алкиламино или аминокарбонил.
Соединения формулы Id могут быть получены по Схеме 4. В этом способе соединения формулы VI могут быть синтезированы, как проиллюстрировано на Схеме 1. В результате реакции сочетания Сузуки с использованием палладия в качестве катализатора с последующим гидролизом сложного эфира образуется соединение формулы Id.
Реакции сочетания Сузуки легко протекают в присутствии палладиевого катализатора, такого как [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (PdCl2(dppf)) или тетракис(трифенилфосфин)палладий(0), и основания, такого как трет-бутоксид калия, карбонат натрия, карбонат цезия или гидроксид натрия, в инертном растворителе, таком как N,N-диметилформамид или диметилсульфоксид, при температуре от 100 до 180°С в течение 15-30 минут под воздействием микроволнового излучения (Lee S. et al., Bioorg. Med. Chem. Lett. 15 (2005) 2998). Альтернативно, эти реакции могут быть осуществлены без использования микроволнового излучения при нагревании, например при температуре 130°С, в течение более продолжительного времени реакции.
Гидролиз сложных эфиров формулы XII с образованием продуктов формулы Id может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Схема 5
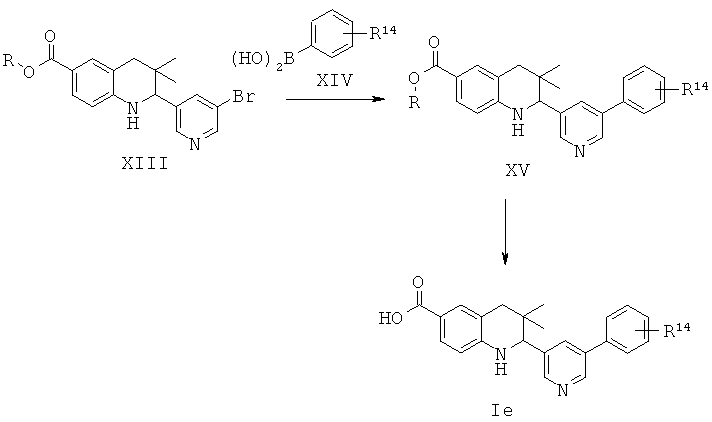
R14 представляет собой галоген, алкил, алкокси, циано, алкилсульфонил, алкиламино или аминокарбонил.
Соединения формулы Ie могут быть получены по Схеме 5. В этом способе соединения формулы XIII могут быть синтезированы, как проиллюстрировано на Схеме 1. В результате реакции сочетания Сузуки с использованием палладия в качестве катализатора с последующим гидролизом сложного эфира образуется соединение формулы Id.
Реакции сочетания Сузуки легко протекают в присутствии палладиевого катализатора, такого как [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (PdCl2(dppf)) или тетракис(трифенилфосфин)палладий(0), и основания, такого как трет-бутоксид калия, карбонат натрия, карбонат цезия или гидроксид натрия, в инертном растворителе, таком как N,N-диметилформамид или диметилсульфоксид, при температуре от 100 до 180°С в течение 15-30 минут под воздействием микроволнового излучения (Lee S. et al., Bioorg. Med. Chem. Lett. 15 (2005) 2998). Альтернативно, эти реакции могут быть осуществлены без использования микроволнового излучения при нагревании, например при температуре 130°С, в течение более длительного периода времени реакции.
Гидролиз сложных эфиров формулы XV до образования продуктов формулы Ie может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Схема 6
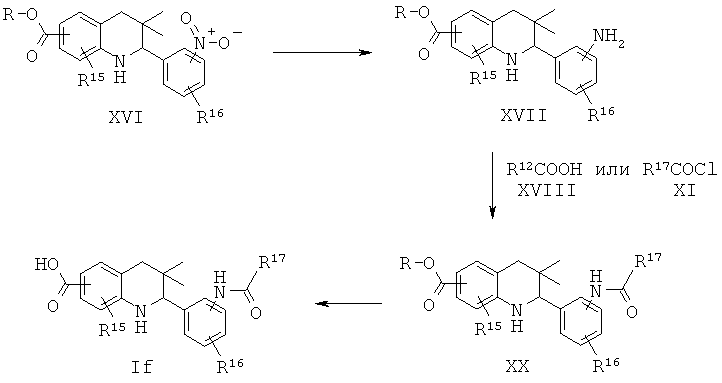
R15 представляет собой водород или галоген; R16 представляет собой водород или галоген; R17 представляет собой алкил, фенил, галогенофенил или пиридинил.
Соединения формулы If могут быть получены по Схеме 6. В этом способе соединения формулы XVI могут быть синтезированы, как проиллюстрировано на Схеме 1. В результате восстановления нитрогруппы до амина, образования амида в присутствии реагента сочетания и последующего гидролиза сложного эфира образуется соединение формулы If.
Восстановление нитросоединений формулы XVI до соответствующих аминопроизводных формулы XVII может быть осуществлено способами, известными специалисту в данной области. Эту реакцию обычно проводят в кислотных условиях с использованием соляной кислоты или хлорида аммония в смеси этанола и воды при нагревании в условиях дефлегмации в течение нескольких часов.
Превращение амина формулы XVII в соответствующие амиды формулы XIX с использованием подходящей карбоновой кислоты формулы XVIII или карбонилхлорида формулы XIX легко может быть осуществлено способами, известными специалисту в данной области. Эту реакцию обычно проводят в присутствии реагента сочетания, такого как дициклогексилкарбодиимид (DCC), гексафторфосфат бензотриазол-1-ил-окси-трис-пирролидинофосфония (РуВор), гексафторфосфат о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), гексафторфосфат о-(1Н-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU) или гидрохлоридная соль 1-этил-3-(3'-диметиламино)карбодиимида (EDCI), в отсутствие или в присутствии гидроксибензотриазола (HOBt), в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин или N,N-диметиламинопиридин (DMAP). Реакция может быть осуществлена в растворителе, таком как дихлорметан или N,N-диметилформамид, при комнатной температуре в течение нескольких часов (ссылка: Montalbetti, С.A. G. N. et al., Tetrahedron 61 (2005) 10827).
Гидролиз сложных эфиров формулы XX с образованием в результате продуктов формулы If может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Схема 7
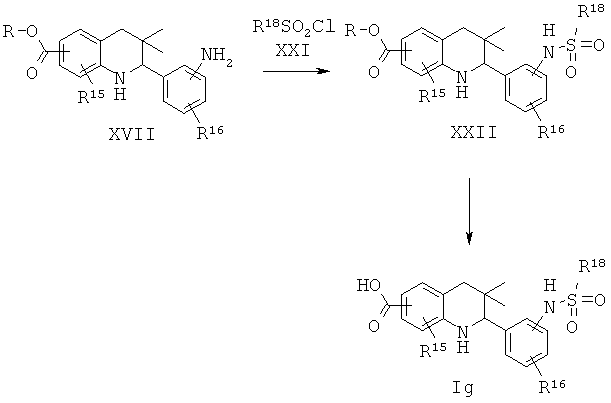
R15 представляет собой водород или галоген; R16 представляет собой водород или галоген; R18 представляет собой алкил, фенил или галогенофенил.
Соединение формулы Ig может быть синтезировано, как проиллюстрировано на Схеме 7. Образование сульфонамида с последующим гидролизом сложного эфира приводит к получению соединения формулы Ig.
Получение соединений формулы XXII легко может быть осуществлено способами, известными специалисту в данной области. Реакцию обычно проводят в присутствии основания, такого как триэтиламин, пиридин, метоксид натрия, трет-бутоксид натрия, трет-бутоксид калия, гидрид натрия или диметил-пиридин-4-ил-амин, в подходящем инертном растворителе, таком какдихлорметан, ацетонитрил, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре в течение нескольких часов.
Гидролиз сложных эфиров формулы XXII с получением в результате продуктов формулы Ig может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Схема 8
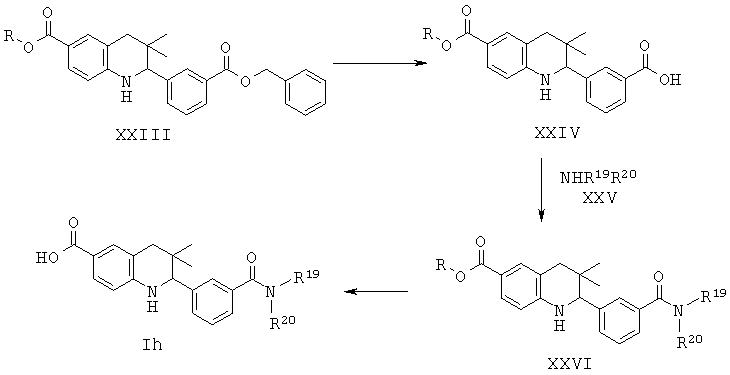
R19 и R20 независимо выбраны из водорода, алкила, аминоалкила, фенила, галогенофенила, пиридинила и пиразинила при условии, что R19 и R20 не являются водородом одновременно.
Соединения формулы Ih могут быть получены по Схеме 8. В этом способе соединения формулы XXIII могут быть синтезированы, как проиллюстрировано на Схеме 1. Удаление бензильной группы, образование амида в присутствии реагента сочетания и последующего гидролиза сложного эфира приводят к получению в результате соединения формулы Ih.
Удаление бензильной группы в соединениях формулы XXIII может быть осуществлено способами, известными специалисту в данной области. Реакцию обычно проводят в присутствии палладиевого катализатора в кислотных условиях с использованием уксусной кислоты, соляной кислоты или хлорида аммония в подходящем растворителе, таком как метанол, этанол, тетрагидрофуран, вода или их смесь, при температуре от комнатной температуры до температуры дефлегмации растворителя в течение нескольких часов.
Превращение карбоновой кислоты формулы XXIV в соответствующие амиды формулы XXV с использованием подходящих аминов формулы XXVI легко может быть осуществлено способами, известными специалисту в данной области. Реакцию обычно проводят в присутствии реагента сочетания, такого как дициклогексилкарбодиимид (DCC), гексафторфосфат бензотриазол-1-ил-окси-трис-пирролидинофосфония (РуВор), гексафторфосфат о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), гексафторфосфат о-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU) или гидрохлоридная соль 1-этил-3-(3'-диметиламино)карбодиимида (EDCI), в отсутствие или в присутствии гидроксибензотриазола (HOBt), в присутствии основания, такого как триэтиламин, или N,N-диизопропилэтиламин, или N,N-диметиламинопиридин (DMAP). Реакция может быть осуществлена в растворителе, таком как дихлорметан или N,N-диметилформамид, при комнатной температуре в течение нескольких часов (ссылка: Montalbetti, С. A. G. N. et al., Tetrahedron 61 (2005) 10827).
Гидролиз сложных эфиров XXVI с получением в результате продуктов формулы Ih может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Схема 9
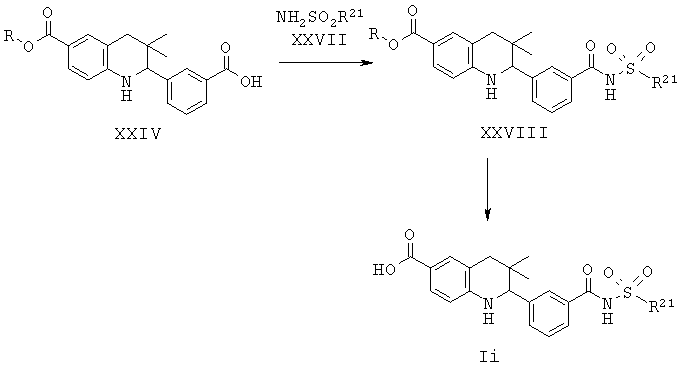
R21 представляет собой алкил или фенил.
Соединение формулы Ii может быть синтезировано, как проиллюстрировано на Схеме 9, начиная с соединения формулы XXIV. Образование ацетилсульфонамида с последующим гидролизом сложного эфира приводит к получению соединения формулы Ii.
Соединения формулы XXVIII могут быть синтезированы путем обработки ацетилимидазола, образованного из карбоновой кислоты формулы XXIV и 1,1'-карбонилдиимидазола, натриевой солью, образованной из сульфонамидов и натрия, в N,N-диметилформамиде при комнатной температуре в течение нескольких часов.
Гидролиз сложных эфиров XXVIII с получением в результате продуктов формулы Ii может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Схема 10
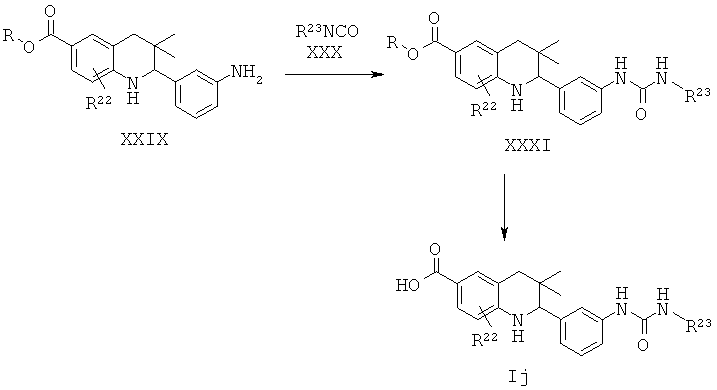
R22 представляет собой водород или галоген; R23 представляет собой фенил.
Соединения формулы Ij могут быть получены по Схеме 10. В этом способе соединения формулы XXVI могут быть синтезированы, как проиллюстрировано на Схеме 6. В результате реакции амина формулы XXIX с изоцианидом формулы XXX с последующим гидролизом сложного эфира образуются соединения формулы Ij.
Превращение амина формулы XXIX в мочевину формулы XXXI может быть осуществлено в присутствии триэтиламина в тетрагидрофуране при комнатной температуре в течение нескольких часов.
Гидролиз сложных эфиров XXXI с получением в результате продуктов формулы Ij может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Схема 11
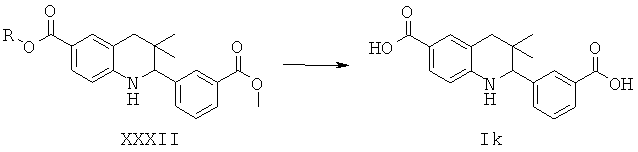
Соединения формулы Ik могут быть получены по Схеме 11. В этом способе соединения формулы XXXII могут быть синтезированы, как проиллюстрировано на Схеме 1. Гидролиз сложного эфира приводит к получению соединений формулы Ik.
Гидролиз сложных эфиров XXXII с получением в результате продуктов формулы Ik может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Схема 12
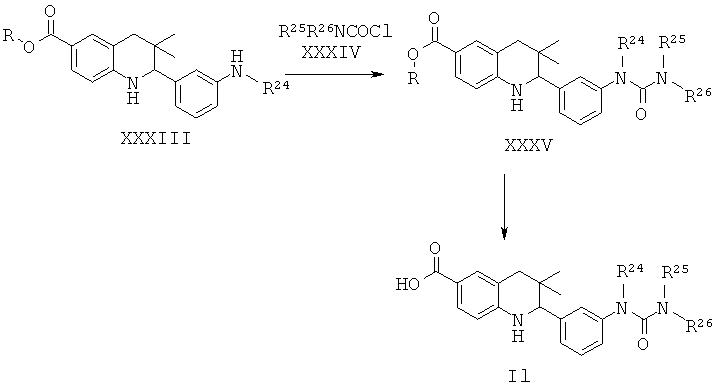
R24 представляет собой алкил; R25 и R26 представляют собой алкил; или R25 и R26 вместе с атомом азота, к которому они присоединены, образуют гетероциклоалкил.
Соединения формулы II могут быть получены по Схеме 12. В этом способе соединения формулы XXXIII могут быть синтезированы, как проиллюстрировано на Схеме 2. Образование мочевины с последующим гидролизом сложного эфира приводит к получению соединений формулы II.
Мочевины формулы XXXV легко могут быть синтезированы путем обработки амина формулы XXXIII карбонилхлоридом формулы XXXIV в присутствии пиридина в дихлорметане при комнатной температуре в течение нескольких часов.
Гидролиз сложных эфиров XXXV с получением в результате продуктов формулы II может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Схема 13
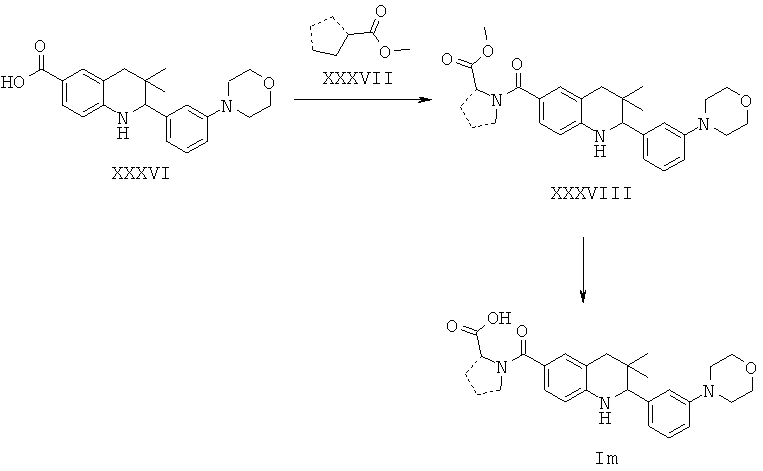
Соединения формулы Im могут быть получены по Схеме 13. В этом способе соединения формулы XXXVI могут быть синтезированы, как проиллюстрировано на Схеме 2. Образование амида с последующим гидролизом сложного эфира приводит к получению соединений формулы Im.
Превращение карбоновой кислоты формулы XXXVI в соответствующие амиды формулы XXXVIII с использованием подходящих аминоэфиров формулы XXXVII легко может быть осуществлено способами, известными специалисту в данной области. Реакцию обычно проводят в присутствии реагента сочетания, такого как дициклогексилкарбодиимид (DCC), гексафторфосфат бензотриазол-1-ил-окси-трис-пирролидинофосфония (РуВор), гексафторфосфат о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), гексафторфосфат о-(1Н-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU) или гидрохлоридная соль 1-этил-3-(3'-диметиламино)карбодиимида (EDCI), в отсутствие или в присутствии гидроксибензотриазола (HOBt), в присутствии основания, такого как триэтиламин, или N,N-диизопропилэтиламин, или N,N-диметиламинопиридин (DMAP). Реакция может быть осуществлена в растворителе, таком как дихлорметан или N,N-диметилформамид, при комнатной температуре в течение нескольких часов (ссылка: Montalbetti, С. A. G. N. et al., Tetrahedron 61 (2005) 10827).
Гидролиз сложных эфиров XXXVIII с получением в результате продуктов формулы Im может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Схема 14
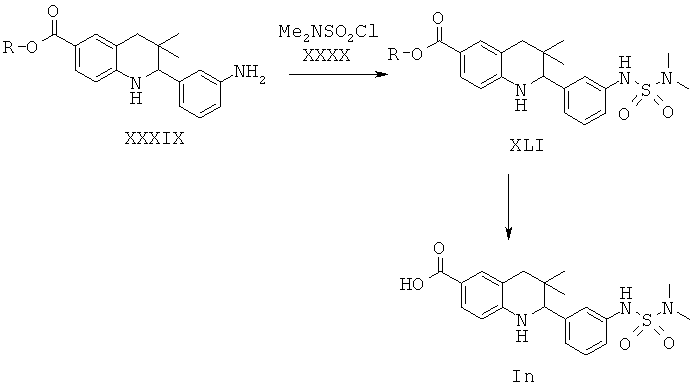
Соединения формулы In могут быть получены по Схеме 14. В этом способе соединения формулы XXXIX могут быть синтезированы, как проиллюстрировано на Схеме 6. Образование сульфамида с последующим гидролизом сложного эфира приводит к получению соединений формулы In.
Сульфамид формулы XLI легко может быть синтезирован путем обработки амина формулы XXXIX диметилсульфамоилхлоридом формулы XL в присутствии пиридина в дихлорметане при комнатной температуре в течение нескольких часов.
Гидролиз сложных эфиров XLI с получением в результате продуктов формулы In может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов
Схема 15
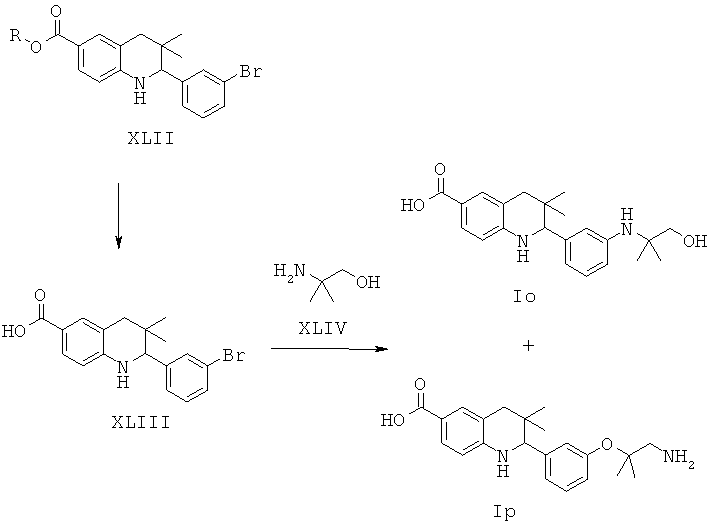
Соединения формул Io и Ip могут быть получены по Схеме 15. В этом способе соединения формулы XLII могут быть синтезированы, как проиллюстрировано на Схеме 1. Гидролиз сложного эфира и последующая реакция сочетания Ульмана приводят к получению соединений формул Io и Ip.
Гидролиз сложных эфиров формулы XLII с получением в результате продуктов формулы XLIII может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов
Реакция сочетания Ульмана может быть осуществлена в присутствии источника меди, такого как йодид меди(I) (CuI) или трифторметансульфонат меди(II), и лиганда, такого как 2,2'-бипиридин, пролин, N,N'-диметилглицин или этиленгликоль, в присутствии подходящего основания, такого как триэтиламин, карбонат натрия, карбонат калия, карбонат цезия, метоксид натрия, трет-бутоксид натрия, трет-бутоксид калия. Реакция может быть осуществлена в подходящем растворителе, таком как 1,4-диоксан, N,N-диметилформамид, диметилсульфоксид или N-метилпирролидинон, при температуре от 100 до 130°С в течение 10-16 часов (ссылка: Ley, S.V. etal., Angew. Chem. Int. Ed. 42 (2003) 5400).
Схема 16
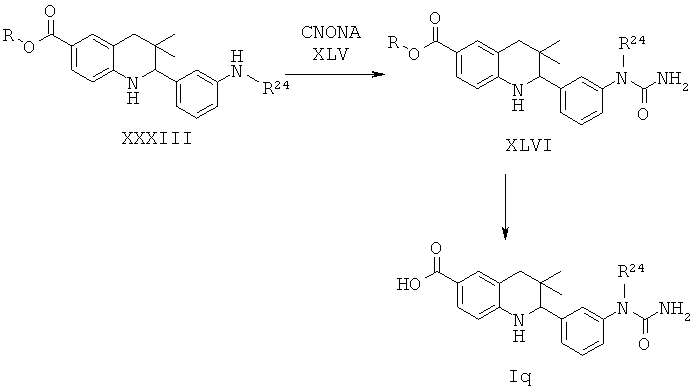
R24 представляет собой алкил.
Соединения формулы Iq могут быть получены по Схеме 16. В этом способе соединения формулы XXXIII могут быть синтезированы, как проиллюстрировано на Схеме 2. Образование мочевины с последующим гидролизом сложного эфира приводит к получению соединений формулы Iq.
Мочевины формулы XLVI легко могут быть синтезированы путем обработки амина формулы XXXIII цианатом натрия формулы XLV в присутствии уксусной кислоты в воде при температуре от 30 до 50°С в течение нескольких часов.
Гидролиз сложных эфиров формулы XLVI с получением в результате продуктов формулы Iq может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Схема 17
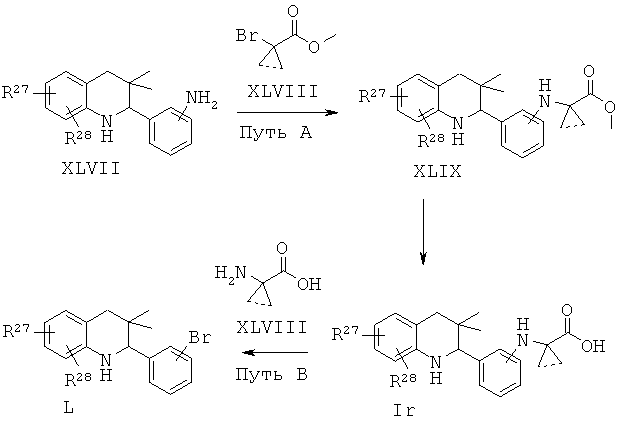
R27 и R28 независимо выбраны из галогена, циано, трифторметила, алкилсульфонила и алкоксикарбонила.
Соединения формулы Ir могут быть получены по Схеме 16. Алкилирование соединения формулы XLVII с последующим гидролизом сложного эфира приводит в результате к получению соединения Ir (Путь А). Соединения формулы Ir могут быть также синтезированы напрямую в результате реакции сочетания соединений формулы L с аминокислотами формулы LI. Соединения формулы XLVII могут быть синтезированы, как проиллюстрировано на Схеме 6. Соединения формулы L могут быть синтезированы, как проиллюстрировано на Схеме 1.
Алкилирование соединений формулы XLVII легко может быть осуществлено способами, известными специалисту в данной области. Реакцию обычно проводят в присутствии основания, такого как триэтиламин, пиридин, метоксид натрия, трет-бутоксид натрия, трет-бутоксид калия, гидрид натрия или диметил-пиридин-4-ил-амин, в подходящем инертном растворителе, таком как дихлорметан, ацетонитрил, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре в течение нескольких часов.
Реакция сочетания Ульмана может быть осуществлена в присутствии источника меди, такого как йодид меди(I) (CuI) или трифторметансульфонат меди(II), и лиганда, такого как 2,2'-бипиридин, пролин, N,N'-диметилглицин или этиленгликоль, в присутствии подходящего основания, такого как триэтиламин, карбонат натрия, карбонат калия, карбонат цезия, метоксид натрия, трет-бутоксид натрия, трет-бутоксид калия. Реакция может быть осуществлена в подходящем растворителе, таком как 1,4-диоксан, N,N-диметилформамид, диметилсульфоксид или N-метилпирролидинон, при температуре от 100 до 130°С в течение 10-16 часов (ссылка: Ley, S.V. et al., Angew. Chem. Int. Ed. 42 (2003) 5400).
Гидролиз сложных эфиров формулы XLIX с получением в результате продуктов формулы Ir может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов
Схема 18
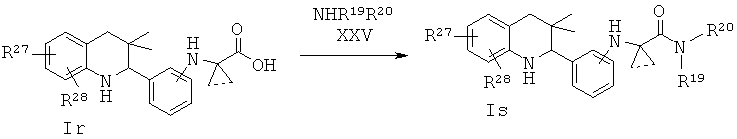
R27 и R28 независимо выбраны из галогена, циано, трифторметила, алкилсульфонила и алкоксикарбонила; R19 и R20 независимо выбраны из водорода, алкила, аминоалкила, фенила, галогенофенила, пиридинила и пиразинила, при условии, что R19 и R20 не являются водородом одновременно.
Соединения формулы Is могут быть получены в результате образования амидов по Схеме 18. В этом способе соединения формулы Ir могут быть синтезированы, как проиллюстрировано на Схеме 17.
Превращение карбоновой кислоты формулы Ir в соответствующие амиды формулы Is с использованием подходящих аминов формулы XXV легко может быть осуществлено способами, известными специалисту в данной области. Реакцию обычно проводят в присутствии реагента сочетания, такого как дициклогексилкарбодиимид (DCC), гексафторфосфат бензотриазол-1-ил-окси-трис-пирролидинофосфония (РуВор), гексафторфосфат о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), гексафторфосфат о-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU) или гидрохлоридная соль 1-этил-3-(3'-диметиламино)карбодиимида (EDCI), в отсутствие или в присутствии гидроксибензотриазола (HOBt), в присутствии основания, такого как триэтиламин, или N,N-диизопропилэтиламин, или N,N-диметиламинопиридин (DMAP). Реакция может быть осуществлена в растворителе, таком как дихлорметан или N,N-диметилформамид, при комнатной температуре в течение нескольких часов (ссылка: Montalbetti, С. A. G. N. et al., Tetrahedron 61 (2005) 10827).
Схема 19
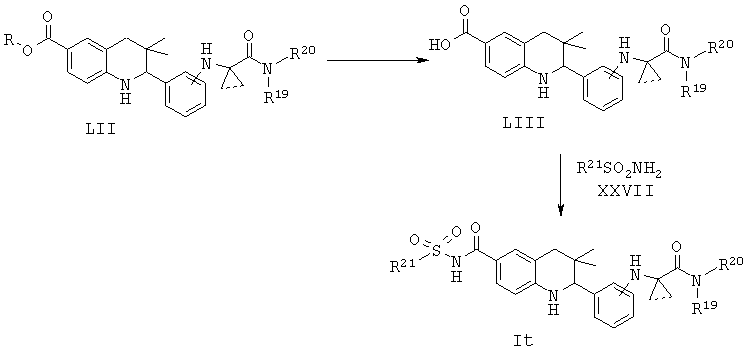
R19 и R20 независимо выбраны из водорода, алкила, аминоалкила, фенила, галогенофенила, пиридинила и пиразинила, при условии, что R19 и R20 не являются водородом одновременно; R21 представляет собой алкил или фенил.
Соединение формулы It может быть синтезировано, как проиллюстрировано на Схеме 19. Соединения формулы LII могут быть синтезированы по Схеме 18. Гидролиз сложноэфирной группы в соединениях формулы LII и последующее образование ацетилсульфонамида приводят к получению соединения формулы It.
Гидролиз сложных эфиров формулы LII с получением в результате продуктов формулы LIII может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Превращение карбоновых кислот формулы LIII в ацетилсульфонамиды формулы It может быть осуществлено в результате обработки ацетилимидазолов, образованных из карбоновых кислот формулы LIII и 1,1'-карбонилдиимидазола, натриевыми солями, образованными из сульфонамидов и гидрида натрия, в N,N-диметилформамиде, при комнатной температуре в течение нескольких часов.
Схема 20
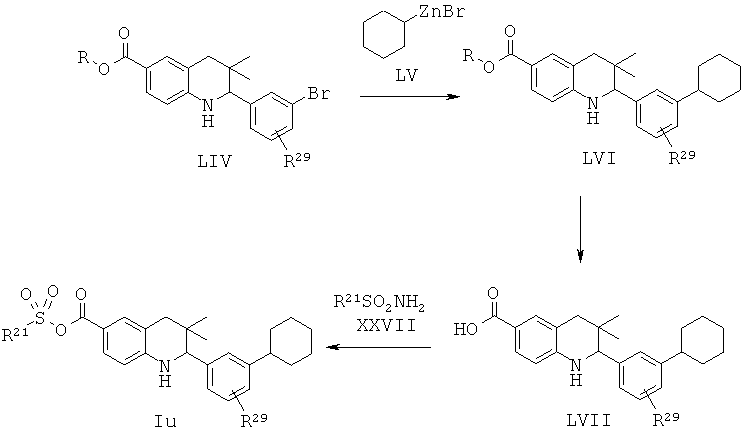
R21 представляет собой алкил или фенил; R29 представляет собой водород или галоген.
Соединение формулы Iu может быть синтезировано, как проиллюстрировано на Схеме 20. Соединения формулы LIV могут быть синтезированы по Схеме 1. Реакция сочетания Негуши, гидролиз сложного эфира и последующее образование ацетилсульфонамида приводят к получению соединения формулы Iu.
Реакция сочетания Негуши может быть осуществлена в присутствии палладиевого катализатора, такого как [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (PdCl2(dppf)) или тетракис(трифенилфосфин)палладий(0), в инертном растворителе, таком как N,N-диметилформамид или диоксан, при температуре от 70 до 100°С в течение 15-30 минут под воздействием микроволнового излучения.
Гидролиз сложных эфиров формулы LVI с получением в результате продуктов формулы LVII может быть осуществлен в присутствии водного неорганического основания, таком как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Превращение карбоновых кислот формулы LVII в ацетилсульфонамиды формулы Iu может быть осуществлено в результате обработки ацетилимидазолов, образованных из карбоновых кислот формулы LVII и 1,1'-карбонилдиимидазола, натриевыми солями, образованными из сульфонамидов и гидрида натрия, в N,N-диметилформамиде при комнатной температуре в течение нескольких часов.
Схема 21
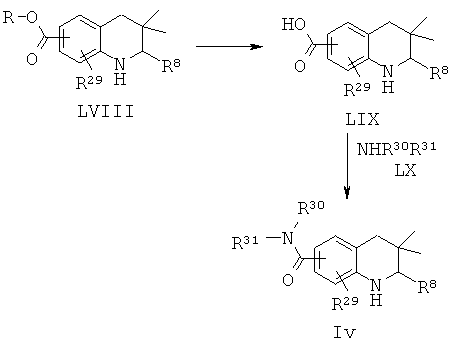
R8 представляет собой пиридинил, фенил или замещенный фенил; R29 представляет собой водород или галоген; R30 и R31 независимо представляют собой алкил; или R30 и R31 вместе с атомом азота, к которому они присоединены, образуют гетероциклил.
Соединение формулы Iv может быть синтезировано, как проиллюстрировано на Схеме 21. Соединения формулы LVIII могут быть синтезированы по Схеме 1. Гидролиз сложных эфиров и последующее образование амидов приводят к получению соединения формулы Iv.
Гидролиз сложных эфиров LVIII с получением в результате продуктов формулы LIX может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Превращение карбоновой кислоты формулы LIX в соответствующие амиды формулы Iv с использованием подходящих аминов формулы LX легко может быть осуществлено способами, известными специалисту в данной области. Реакцию обычно проводят в присутствии реагента сочетания, такого как дициклогексилкарбодиимид (DCC), гексафторфосфат бензотриазол-1-ил-окси-трис-пирролидинофосфония (РуВор), гексафторфосфат о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), гексафторфосфат о-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU) или гидрохлоридная соль 1-этил-3-(3'-диметиламино)карбодиимида (EDCI), в отсутствие или в присутствии гидроксибензотриазола (HOBt), в присутствии основания, такого как триэтиламин, или N,N-диизопропилэтиламин, или N,N-диметиламинопиридин (DMAP). Эта реакция может быть осуществлена в растворителе, таком как дихлорметан или N,N-диметилформамид, при комнатной температуре в течение нескольких часов (ссылка: Montalbetti, С. A. G. N. et al., Tetrahedron 61 (2005) 10827).
Схема 22
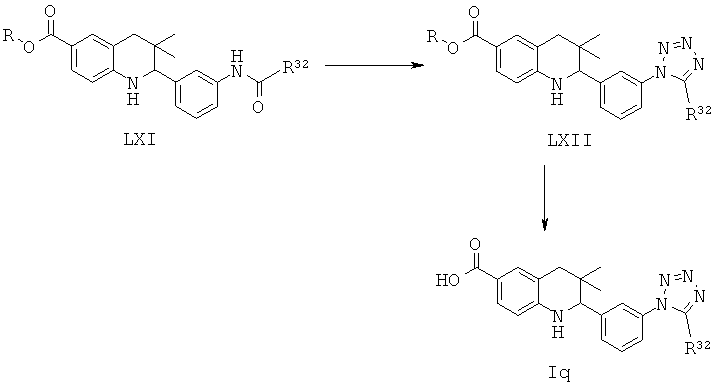
R32 представляет собой алкил или фенилалкил.
Соединение формулы Iw может быть синтезировано, как проиллюстрировано на Схеме 22. Соединения формулы LXI могут быть синтезированы по Схеме 6. Образование тетразола с последующим гидролизом сложных эфиров приводит к получению соединения формулы Iw.
Превращение обратимых амидов формулы LXI в тетразолы формулы LXII может быть осуществлено в результате обработки обратимых амидов азидом натрия и тетрахлорсиланом в ацетонитриле при комнатной температуре в течение нескольких часов.
Гидролиз сложных эфиров формулы LXII с получением в результате продуктов формулы Iw может быть осуществлен в присутствии водного неорганического основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол, 1,4-диоксан, тетрагидрофуран или их смесь, при комнатной температуре или при нагревании в условиях дефлегмации в течение нескольких часов.
Схема 23
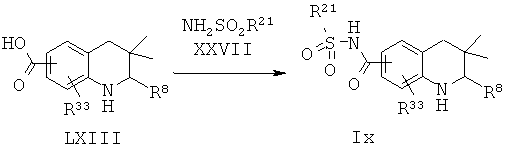
R8 представляет собой пиридинил, фенил или замещенный фенил; R21 представляет собой алкил или фенил; R33 представляет собой водород или галоген.
Соединение формулы Iх может быть синтезировано путем образования ацетилсульфонамида, как проиллюстрировано на Схеме 23. Соединения формулы LXIII могут быть синтезированы по Схемам 2, 3, 4, 5, 6, 8, 10, 12 и 22.
Превращение карбоновых кислот формулы LXIII в ацетилсульфонамиды формулы Iх может быть осуществлено в результате обработки ацетилимидазолов, образованных из карбоновых кислот формулы LXIII и 1,1'-карбонилдиимидазола, натриевыми солями, образованными из сульфонамидов и гидрида натрия, в N,N-диметилформамиде при комнатной температуре в течение нескольких часов.
Изобретение также относится к способу получения соединения формулы (I), включающему одну из следующих стадий:
а) реакция соединения формулы (А)
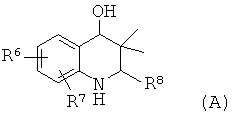
в присутствии триэтилсилана и кислоты;
b) реакция соединения формулы (В)
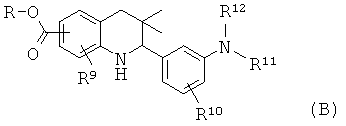
в присутствии основания;
c) реакция соединения формулы (С)
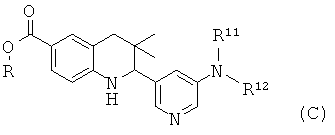
в присутствии основания;
d) реакция соединения формулы (D)
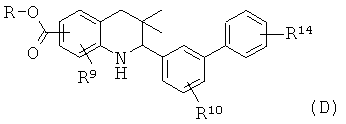
в присутствии основания;
e) реакция соединения формулы (Е)
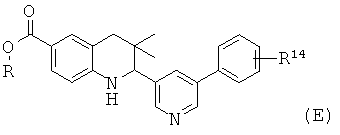
в присутствии основания;
f) реакция соединения формулы (F)
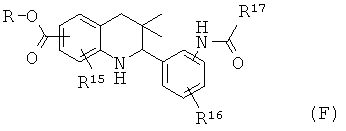
в присутствии основания;
g) реакция соединения формулы (G)
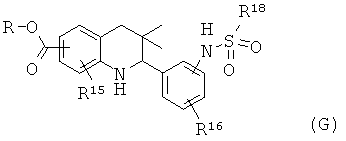
в присутствии основания;
h) реакция соединения формулы (Н)
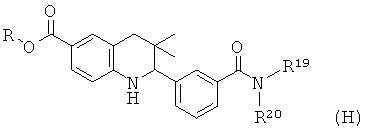
в присутствии основания;
i) реакция соединения формулы (IA)
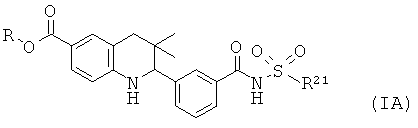
в присутствии основания;
j) реакция соединения формулы (J)
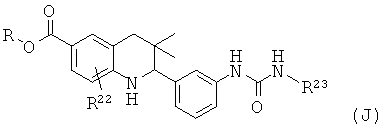
в присутствии основания;
k) реакция соединения формулы (К)
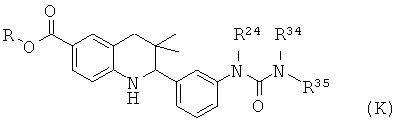
в присутствии основания;
l) реакция соединения формулы (L)
в присутствии источника меди, лиганда и основания;
m) реакция соединения формулы (М1) или (М2)
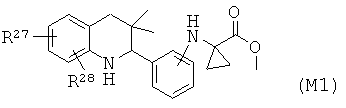 или
или
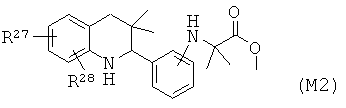
в присутствии основания;
n) реакция соединения формулы (N1) или (N2)
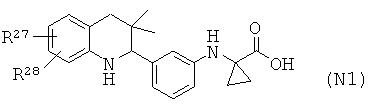 или
или
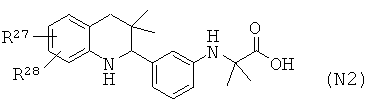
в присутствии of NHR19R20, реагента сочетания и основания;
о) реакция соединения формулы (O1) или (O2)
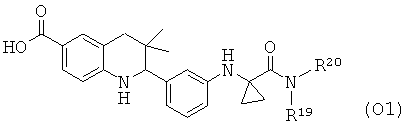 или
или
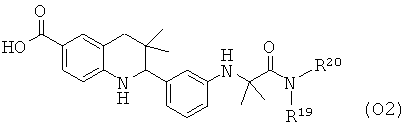
с R21SO2NH2 в присутствии 1,1'-карбонилдиимидазола и основания;
р) реакция соединения формулы (Р)
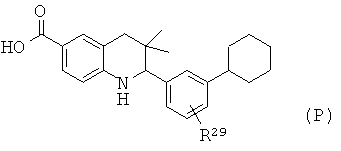
с R21SO2NH2 в присутствии 1,1'-карбонилдиимидазола и основания;
q) реакция соединения формулы (Q)

с NHR30R31 в присутствии реагента сочетания и основания;
r) реакция соединения формулы (R)
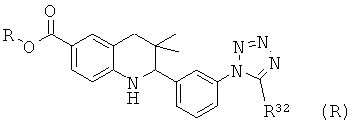
в присутствии основания;
s) реакция соединения формулы (S)
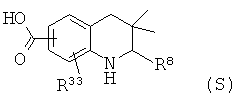
с NH2SO2R21 в присутствии 1,1'-карбонилдиимидазола и основания;
t) реакция соединения формулы (Т)
в присутствии основания;
u) реакция соединения формулы (U1) или (U2)
 или
или
в присутствии основания;
v) реакция соединения формулы (V)

в присутствии основания; или
w) реакция соединения формулы (W)
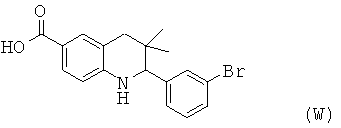
с H2NC(СН3)2CH2OH в присутствии источника меди, лиганда и основания;
где R6 и R7 независимо выбраны из водорода, галогена, трифторметила, алкилсульфонила, циано и алкоксикарбонила; R8 представляет собой пиридинил, фенил или замещенный фенил; R9, R15, R16, R22, R29 и R33 независимо выбраны из водорода и галогена; R10 представляет собой водород, галоген, циано, метил или алкокси; R11 и R12 независимо выбраны из алкила, или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют циклический амин или амид; R14 представляет собой галоген, алкил, алкокси, циано, алкилсульфонил, алкиламино или аминокарбонил; R17 представляет собой алкил, фенил, фенил, замещенный галогеном, или пиридинил; R18 представляет собой алкил, фенил или фенил, замещенный галогеном; R19 и R20 независимо выбраны из алкила, аминоалкила, фенила, галогенофенила, пиридинила и пиразинила; R21 представляет собой алкил или фенил; R23 представляет собой фенил; R24 представляет собой алкил; R27 и R28 независимо выбраны из галогена, циано, трифторметила, алкилсульфонила и алкоксикарбонила; R30 и R31 независимо выбраны из алкила, или R30 и R31 вместе с атомом азота, к которому они присоединены, образуют циклический амин; R32 представляет собой алкил или фенилалкил; R34 и R35 независимо выбраны из водорода и алкила; R34 и R35 вместе с атомом азота, к которому они присоединены, образуют циклический амин; и R представляет собой метил или этил.
На стадии (а) кислота может представлять собой, например, трифторуксусную кислоту.
На стадиях (b)-(k), (m), (r) и (t)-(v) основание может быть независимо выбрано, например, из гидроксида лития, гидроксида натрия или гидроксида калия.
На стадии (I) источник меди может представлять собой, например, йодид меди(I) (CuI) или трифторметансульфонат меди(II). Лигандом может быть, например, 2,2'-бипиридин, пролин, N,N'-диметилглицин или этиленгликоль. Реакция может быть осуществлена в растворителе, таком как 1,4-диоксан, N,N-диметилформамид, диметилсульфоксид или N-метилпирролидинон, при температуре от 100 до 130°С в течение 10-16 часов. Основание может представлять собой, например, триэтиламин, карбонат натрия, карбонат калия и т.п.
На стадии (n) реагент сочетания может представлять собой, например, дициклогексилкарбодиимид (DCC), гексафторфосфат бензотриазол-1-ил-окси-трис-пирролидинофосфония (РуВор), гексафторфосфат о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), гексафторфосфат о-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU) или гидрохлоридную соль 1-этил-3-(3'-диметиламино)карбодиимида (EDCI). Реакция может быть осуществлена в растворителе, таком как дихлорметан или N,N-диметилформамид, при комнатной температуре в течение нескольких часов. Основание может представлять собой, например, триэтиламин, или N,N-диизопропилэтиламин, или N,N-диметиламинопиридин (DMAP).
На стадии (о), (р), (s) основание может представлять собой, например, гидрид натрия.
На стадии (q) реагент сочетания может представлять собой, например, дициклогексилкарбодиимид (DCC), гексафторфосфат бензотриазол-1-ил-окси-трис-пирролидинофосфония (РуВор), гексафторфосфат о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), гексафторфосфат о-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU) или гидрохлоридную соль 1-этил-3-(3'-диметиламино)карбодиимида (EDCI). Реакция может быть осуществлена в растворителе, таком как дихлорметан или N,N-диметилформамид, при комнатной температуре в течение нескольких часов. Основание может представлять собой, например, триэтиламин, или N,N-диизопропилэтиламин, или N,N-диметиламинопиридин (DMAP).
На стадии (w) источник меди может представлять собой, например, йодид меди(I) (CuI) или трифторметансульфонат меди(II). Лиганд может представлять собой, например, 2,2'-бипиридин, пролин, N,N'-диметилглицин или этиленгликоль. Реакция может быть осуществлена в растворителе, таком как 1,4-диоксан, N,N-диметилформамид, диметилсульфоксид или N-метилпирролидинон, при температуре от 100 до 130°С в течение 10-16 часов. Основание может представлять собой, например, триэтиламин, карбонат натрия, карбонат калия и т.п.
Изобретение также относится к соединению формулы (I) для применения в качестве терапевтически активного вещества.
Изобретение также относится к фармацевтической композиции, содержащей соединение формулы (I) и терапевтически инертный носитель.
Применение соединения формулы (I) для изготовления лекарственных средств, полезных в лечении или профилактике заболеваний, связанных с регуляцией АМРК, является объектом данного изобретения.
В частности, изобретение относится к применению соединения формулы (I) для изготовления лекарственного средства для лечения или профилактики ожирения, дислипидемии, гипергликемии, диабета типа 1 или типа 2, в частности диабета типа 2.
Указанные лекарственные средства, например в форме фармацевтических препаратов, можно вводить перорально, например в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение можно осуществлять также ректально, например в форме суппозиториев, или парентерально, например в форме инъекционных растворов с эффективным количеством соединения, как определено выше.
Вышеупомянутая фармацевтическая композиция может быть получена в результате переработки соединений по данному изобретению с фармацевтически инертными неорганическими или органическими носителями. Лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и т.п. могут быть использованы, например, в качестве таких носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полужидкие и жидкие полиолы и т.п. Однако в зависимости от природы активного вещества, носители обычно не требуются в случае мягких желатиновых капсул. Подходящими носителями для изготовления растворов и сиропа являются, например, вода, полиолы, глицерин, растительное масло и т.п. Подходящими носителями для суппозиториев являются, например, природные или отверждаемые масла, воски, жиры, полужидкие или жидкие полиолы и т.п.
Фармацевтическая композиция может содержать также консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, корригенты, соли для варьирования осмотического давления, буферные агенты, маскирующие агенты или антиоксиданты. Они могут также содержать другие дополнительные терапевтически ценные вещества.
Дозировка зависит от различных факторов, таких как способ введения, вид, возраст и/или индивидуальное состояние здоровья. Дозы, которые предназначены для ежесуточного введения, составляют примерно 5-400 мг/кг, предпочтительно примерно 10-100 мг/кг, и их можно принимать однократно или можно разделить на несколько введений.
Соединение формулы (I), полученное вышеописанным способом, также является объектом изобретения.
Кроме того, изобретение также относится к способу лечения или профилактики заболеваний, связанных с регуляцией АМРК, включающему введение эффективного количества соединения формулы (I).
Изобретение также относится к способу лечения или профилактики ожирения, дислипидемии, гипергликемии, диабета типа 1 или типа 2, в частности диабета типа 2, включающему введение эффективного количества соединения формулы (I).
Кроме того, изобретение также относится к соединению формулы (I) для изготовления лекарственных средств, полезных в лечении раковых заболеваний, связанных с регуляцией АМРК, и обеспечивает способ лечения или профилактики раковых заболеваний, связанных с регуляцией АМРК.
Изобретение иллюстрируется приведенными ниже примерами, которые не имеют ограничительный характер. Если в прямой форме не указано иное, все реакции, реакционные условия, сокращения и символы имеют значения, известные специалисту в области органической химии.
Примеры
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
Промежуточные соединения и конечные соединения очищали флэш-хроматографией с использованием одного из следующих приборов: 1) система Biotage SP1 и картриджный модуль Quad 12/25; 2) прибор для комби-флэш-хроматографии ISCO. Марка силикагеля и размер пор: 1) KP-SIL 60 Å, размер частиц: 40-60 мкм; 2) силикагель регистрационный номер CAS: 63231-67-4, размер частиц силикагеля: 47-60 микрон; 3) ZCX от Qingdao Haiyang Chemical Co., Ltd, размер пор: 200-300 или 300-400.
Промежуточные соединения и конечные соединения очищали препаративной HPLC на обращеннофазовой колонке с использованием колонки Х BridgeTM Perp C18 (5 мкм, OBDTM 30×100 мм) или колонки SunFireTM Perp C18 (5 мкм, OBDTM 30×100 мм).
LC/MS-спектры получали с использованием MicroMass Plateform LC (Waters™ alliance 2795-ZQ2000). Стандартные условия LC/MS были следующие (время прогона 6 мин):
Кислотные условия: А: 0,1%-ный раствор муравьиной кислоты в H2O; В: 0,1%-ный раствор муравьиной кислоты в ацетонитриле;
Щелочные условия: А: 0,01% NH3·H2O в H2O; В: ацетонитрил;
Нейтральные условия: А: H2O; В: ацетонитрил.
Масс-спектры (MS): обычно приведены только ионы, которые показывают родительскую массу, и если не указано иное, то указанная масса иона представляет собой массу положительного иона (М+Н)+.
Реакции под воздействием микроволнового излучения проводили в Biotage Initiator Sixty.
ЯМР-спектры получали с использованием Bruke Avance 400 MHz.
Все реакции с участием чувствительных к воздуху реагентов осуществляли в атмосфере аргона. Реагенты использовали в том виде, в котором они были получены от коммерческих поставщиков, без дополнительной очистки, если не указано иное.
Пример 1
2-[3-(3-Бензил-уреидо)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
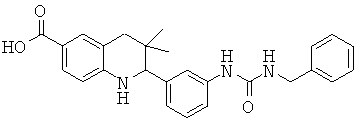
Смесь этилового эфира 4-амино-бензойной кислоты (16,5 г, 100 ммоль), 3-нитро-бензальдегида (16,6 г, 110 ммоль) и пара-толуолсульфоновой кислоты (380 мг, 2 ммоль) в толуоле (300 мл) нагревали в условиях дефлегмации в течение 3 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-[(3-нитро-бензилиден)-амино]-бензойной кислоты (28,4 г, 95%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C16H14N2O4 (М+Н)+: 299,30; найдено: 299,0.
К смеси этилового эфира 4-[(3-нитро-бензилиден)-амино]-бензойной кислоты (28,4 г, 95 ммоль) и гидрата трифлата иттербия(III) (5,9 г, 9,5 ммоль) в сухом тетрагидрофуране (200 мл) при 25°С по каплям добавляли изобутиральдегид (9,6 мл, 105 ммоль) и воду (1,7 мл, 95 ммоль). Реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 4-гидрокси-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (30 г, 85%) в виде светло-желтого масла. LC/MS m/e: вычислено для C20H22N2O5 (М+Н)+: 371,41; найдено: 353,0.
К смеси этилового эфира 4-гидрокси-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (30 г, 81 ммоль) и триэтилсилана (60 мл) при 25°С по каплям добавляли трифторуксусную кислоту (30 мл). Полученную смесь перемешивали при 25°С в течение 3 ч. Затем реакционную смесь концентрировали в вакууме, остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали и сушили в вакууме с получением этилового эфира 3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (12 г, 41%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H22N2O4 (М+Н)+: 355,41; найдено: 355,1.
К смеси этилового эфира 3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (10 г, 28 ммоль) в 95%-ном этаноле (150 мл) и 10%-ного раствора соляной кислоты (20 мл) добавляли железо (4,74 г, 85 ммоль). Эту реакционную смесь перемешивали при 95°С в течение 4 ч. Затем нерастворимое твердое вещество отфильтровывали, и фильтрат концентрировали в вакууме. Остаток экстрагировали этилацетатом (2×200 мл), промывали 30%-ным раствором гидроксида натрия в воде (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (8,7 г, 95%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C20H24N2O2 (М+Н)+: 325,43; найдено: 325,2.
Смесь этилового эфира 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (8,7 г, 26,8 ммоль) в метаноле (80 мл) и тетрагидрофуране (100 мл) и 30%-ного раствора гидроксида натрия в воде (50 мл) перемешивали при 60°С в течение 16 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (7 г, 88%) в виде коричневого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C18H20N2O2 (M+H)+: 297,37; найдено: 297,2.
К раствору 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (500 мг, 1,69 ммоль) в тетрагидрофуране (5 мл) и триэтиламине (0,47 мл, 3,38 ммоль) по каплям добавляли изоцианатометил-бензол (0,25 мл, 2,03 ммоль). Реакционную смесь перемешивали при 25°С в течение 3 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×50 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, система отбора проб, впрыскивания проб и сбора фракций Sample Manager 2767, насос 2525, детектор: масс-детектор ZQ и УФ-детектор UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(3-бензил-уреидо)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (215 мг, 29%) в виде белого твердого вещества. LC/MS m/e: вычислено для C26H27N3O3 (М+Н)+: 430,52; найдено: 430,1.
Пример 2
[3-(6-Хлор-8-циклопропансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фенил]-амид пиразин-2-карбоновой кислоты
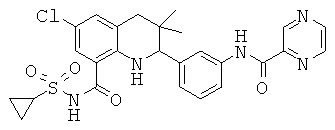
Смесь метилового эфира 2-амино-5-хлор-бензойной кислоты (5,55 г, 30 ммоль) и 3-нитро-бензальдегида (4,99 г, 33 ммоль) в этаноле (100 мл) нагревали в условиях дефлегмации в течение 2 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением метилового эфира 5-хлор-2-[(3-нитро-бензилиден)-амино]-бензойной кислоты (7,2 г, 75%) в виде белого твердого вещества. LC/MS m/e: вычислено для C15H11ClN2O4 (M+H)+: 319,72; найдено: 319,0.
К смеси метилового эфира 5-хлор-2-[(3-нитро-бензилиден)-амино]-бензойной кислоты (7,2 г, 23 ммоль) и гидрата трифлата иттербия(III) (1,43 г, 2,3 ммоль) в сухом тетрагидрофуране (50 мл) при 25°С по каплям добавляли изобутиральдегид (2,27 мл, 25 ммоль) и воду (0,42 мл, 23 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 6-хлор-4-гидрокси-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (7,8 г, 86%) в виде светло-желтого масла. LC/MS m/e: вычислено для C19H19ClN2O5 (М+Н)+: 391,83; найдено: 373,0.
К смеси метилового эфира 6-хлор-4-гидрокси-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (7,8 г, 20 ммоль) и триэтилсилана (30 мл) при 25°С по каплям добавляли трифторуксусную кислоту (15 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (смесь 10% этилацетата/гексаны) получили метиловый эфир 6-хлор-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (1 г, 13%) в виде белого твердого вещества. LC/MS m/e: вычислено для C19H19ClN2O4 (M+H)+: 375,83; найдено: 375,1.
К смеси метилового эфира 6-хлор-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (1 г, 2,7 ммоль) в 95%-ном этаноле (100 мл) и 10%-ного раствора соляной кислоты (5 мл) добавляли железо (0,23 г, 4 ммоль). Реакционную смесь перемешивали при 95°С в течение 4 ч. Затем нерастворимое твердое вещество отфильтровывали, фильтрат концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали 30%-ным раствором гидроксида натрия в воде (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 2-(3-амино-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (0,8 г, 86%) в виде белого твердого вещества. LC/MS m/e: вычислено для C19H21ClN2O2 (M+H)+: 345,84; найдено: 345,1.
Смесь метилового эфира 2-(3-амино-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (0,8 г, 2,3 ммоль) в метаноле (50 мл) и тетрагидрофуране (100 мл) и 30%-ного раствора гидроксида натрия в воде (20 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты, экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением 2-(3-амино-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (0,75 г, 65%) в виде коричневого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C18H19ClN2O2 (M+H)+: 331,82; найдено: 331,1.
Раствор пиразин-2-карбоновой кислоты (0,412 г, 3,3 ммоль) и 1,1'-карбонилдиимидазола (0,7 г, 4,3 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при 70°С в течение 1 ч. Добавляли раствор 2-(3-амино-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (0,75 г, 2,3 ммоль) в N,N-диметилформамиде (5 мл), и смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 6-хлор-3,3-диметил-2-{3-[(пиразин-2-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-8-карбоновую кислоту (228 мг, 15%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C23H21ClN4O3 (М+Н)+: 437,90; найдено: 437,1.
К суспензии амида циклопропансульфоновой кислоты (182 мг, 1,5 ммоль) в N,N-диметилформамиде (2 мл) добавляли гидрид натрия (57 мг, 1,43 ммоль). Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 6-хлор-3,3-диметил-2-{3-[(пиразин-2-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (65 мг, 0,15 ммоль) и 1,1'-карбонилдиимидазола (49 мг, 0,3 ммоль) в N,N-диметилформамиде (1,5 мл) перемешивали при 70°С в течение 1 ч, добавляли вышеуказанную суспензию амида циклопропансульфоновой кислоты и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [3-(6-хлор-8-циклопропансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фенил]-амид пиразин-2-карбоновой кислоты (40 мг, 49%) в виде белого твердого вещества. LC/MS m/e: вычислено для C26H26ClN5O4S (М+Н)+: 541,05; найдено: 540,0.
Пример 3
3,3-Диметил-2-{3-[(пиридин-3-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
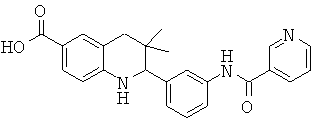
Раствор никотиновой кислоты (42 мг, 0,34 ммоль) и 1,1'-карбонилдиимидазола (72 мг, 0,44 ммоль) в N,N-диметилформамиде (1,5 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли раствор 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,34 ммоль) в N,N-диметилформамиде (2 мл), и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-{3-[(пиридин-3-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (21 мг, 15%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H23N3O3 (М+Н)+: 402,47; найдено: 402,1.
Пример 4
3,3-Диметил-2-{3-[(пиридин-2-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
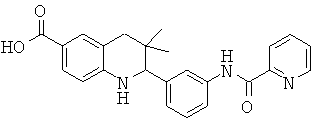
Раствор пиридин-2-карбоновой кислоты (1,26 г, 10 ммоль) и 1,1'-карбонилдиимидазола (2,14 г, 13 ммоль) в N,N-диметилформамиде (8 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли раствор 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2,4 г, 8 ммоль) в N,N-диметилформамиде (5 мл), и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-{3-[(пиридин-2-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (1,85 г, 57%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C24H23N3O3 (М+Н)+: 402,47; найдено: 402,5.
Пример 5
3,3-Диметил-2-{3-[(пиразин-2-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
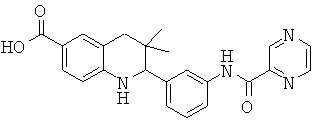
Раствор пиразин-2-карбоновой кислоты (1,26 г, 10 ммоль) и 1,1'-карбонилдиимидазола (2,14 г, 13 ммоль) в N,N-диметилформамиде (8 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли раствор 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3 г, 10 ммоль) в N,N-диметилформамиде (5 мл), и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-{3-[(пиразин-2-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (1,82 г, 45%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C23H22N4O3 (М+Н)+: 403,46; найдено: 403,5.
Пример 6
2-[3-(3-фтор-бензоиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
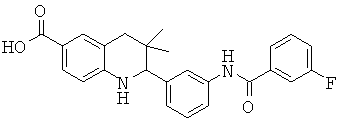
Раствор 3-фтор-бензойной кислоты (119 мг, 0,85 ммоль) и 1,1'-карбонилдиимидазола (179 мг, 1,1 ммоль) в N,N-диметилформамиде (1,5 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли раствор 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (200 мг, 0,68 ммоль) в N,N-диметилформамиде (1,5 мл), и эту смесь перемешивали при 50°С в течение 3 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(3-фтор-бензоиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (40 мг, 14%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H23FN2O3 (М+Н)+: 419,47; найдено: 419,1.
Пример 7
2-(3-Карбонил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
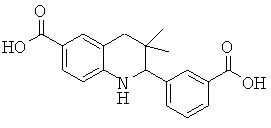
Смесь этилового эфира 4-амино-бензойной кислоты (16,5 г, 100 ммоль), метилового эфира 3-формил-бензойной кислоты (18 г, 110 ммоль) и пара-толуолсульфоновой кислоты (380 мг, 2 ммоль) в толуоле (300 мл) нагревали в условиях дефлегмации в течение 4 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением (Е)-метил-3-((4-(этоксикарбонил)фенилимино)метил)бензоата (26,9 г, 86%) в виде белого твердого вещества. LC/MS m/e: вычислено для C18H17NO4 (М+Н)+: 312,34; найдено: 312,0.
К смеси (Е)-метил-3-((4-(этоксикарбонил)фенилимино)метил)бензоата (12,44 г, 40 ммоль) и гидрата трифлата иттербия(III) (2,48 г, 4 ммоль) в сухом тетрагидрофуране (60 мл) при 25°С по каплям добавляли изобутиральдегид (3,66 мл, 40 ммоль) и воду (0,72 мл, 40 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 3 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 4-гидрокси-2-(3-метоксикарбонил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (13 г, 84%) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C22H25NO5 (М+Н)+: 384,35; найдено: 366,1.
К смеси этилового эфира 4-гидрокси-2-(3-метоксикарбонил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (13 г, 34 ммоль) и триэтилсилана (20 мл) при 25°С по каплям добавляли трифторуксусную кислоту (10 мл). Полученную смесь перемешивали при 25°С в течение 2 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали и сушили в вакууме с получением этилового эфира 2-(3-метоксикарбонил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,16 г, 25%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H25NO4 (М+Н)+: 368,45; найдено: 368,1.
Смесь этилового эфира 2-(3-метоксикарбонил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2 г, 5,45 ммоль) в метаноле (20 мл) и тетрагидрофуране (50 мл) и 30%-ного раствора гидроксида натрия в воде (20 мл) перемешивали при 50°С в течение 24 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-(3-карбонил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (500 мг, 28%) в виде белого твердого вещества. LC/MS m/e: вычислено для C19H19NO4 (М+Н)+: 326,27; найдено: 326,0.
Пример 8
N-[3,3-Диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид
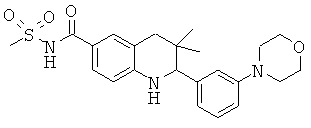
Смесь этилового эфира 4-амино-бензойной кислоты (33 г, 200 ммоль), 3-бром-бензальдегида (25,7 мл, 220 ммоль) и пара-толуолсульфоновой кислоты (760 мг, 4 ммоль) в толуоле (600 мл) нагревали в условиях дефлегмации в течение 12 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-[(3-бром-бензилиден)-амино]-бензойной кислоты (34 г, 51%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C16H14BrNO2 (М+Н)+: 333,20; найдено: 332,0.
К смеси этилового эфира 4-[(3-бром-бензилиден)-амино]-бензойной кислоты (29 г, 87 ммоль) и гидрата трифлата иттербия(III) (5,4 г, 8,7 ммоль) в сухом тетрагидрофуране (200 мл) при 25°С по каплям добавляли изобутиральдегид (8,8 мл, 96 ммоль) и воду (1,6 мл, 87 ммоль). Реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(3-бром-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (30 г, 85%) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C20H22BrNO3 (М+Н)+: 405,31; найдено: 388,0.
К смеси этилового эфира 2-(3-бром-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (30 г, 74 ммоль) и триэтилсилана (50 мл) при 25°С по каплям добавляли трифторуксусную кислоту (15 мл). Полученную смесь перемешивали при 25°С в течение 4 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали, сушили в вакууме с получением этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (15 г, 78%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H22BrNO2 (М+Н)+: 389,31; найдено: 390,0.
Смесь этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (5,7 г, 14,7 ммоль), морфолина (12,8 мл, 147 ммоль), йодида меди(I) (1,68 г, 8,8 ммоль), гидрохлорида N,N-диметилглицина (1,58 г, 11,8 ммоль) и карбоната калия (6,1 г, 44,1 ммоль) в диметилсульфоксиде (30 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (5,6 г, 96%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C24H30N2O3 (М+Н)+: 395,52; найдено: 395,2.
Смесь этилового эфира 3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (5,6 г, 14,2 ммоль) в метаноле (50 мл) и тетрагидрофуране (100 мл) и 30%-ного раствора гидроксида натрия в воде (30 мл) перемешивали при 60°С в течение 6 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением 3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,6 г, 69%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H26N2O3 (M+H)+: 367,46; найдено: 367,1.
К суспензии метансульфонамида (4,75 г, 50 ммоль) в N,N-диметилформамиде (15 мл) добавляли гидрид натрия (1,98 г, 49,5 ммоль). Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,66 г, 10 ммоль) и 1,1'-карбонилдиимидазола (3,24 г, 20 ммоль) в N,N-диметилформамиде (7 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид (0,99 г, 22%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H29N3O4S (М+Н)+: 444,57; найдено: 444,1.
Пример 9
3-(6-Метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-N-фенил-бензамид
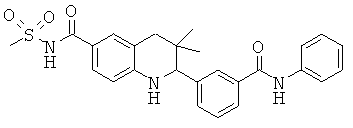
К суспензии метансульфонамида (237 мг, 2,5 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли гидрид натрия (100 мг, 2,48 ммоль). Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-(3-фенилкарбамоил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (200 мг, 0,5 ммоль) и 1,1'-карбонилдиимидазола (162 мг, 1 ммоль) в N,N-диметилформамиде (1 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-N-фенил-бензамид (100 мг, 18%) в виде белого твердого вещества. LC/MS m/e: вычислено для C26H27N3O4S (M+H)+: 478,59; найдено: 478,2.
Пример 10
[3,3-Диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид пропан-2-сульфоновой кислоты

К суспензии амида пропан-2-сульфоновой кислоты (168 мг, 1,37 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли гидрид натрия (52 мг, 1,3 ммоль). Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,27 ммоль) и 1,1'-карбонилдиимидазола (89 мг, 0,55 ммоль) в N,N-диметилформамиде (1 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли вышеуказанную суспензию амида пропан-2-сульфоновой кислоты и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид пропан-2-сульфоновой кислоты (23 мг, 18%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H33N3O4S (М+Н)+: 472,62; найдено: 472,1.
Пример 11
[3-(6-Метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фенил]-амид пиразин-2-карбоновой кислоты
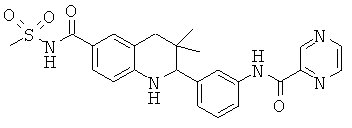
Смесь этилового эфира 3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2 г, 5,65 ммоль) в метаноле (15 мл) и тетрагидрофуране (30 мл) и 30%-ного раствора гидроксида натрия в воде (15 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением 3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,79 г, 97%) в виде коричневого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C18H18N2O4 (M+H)+: 327,37; найдено: 327,1.
К суспензии метансульфонамида (2,6 г, 27,2 ммоль) в N,N-диметилформамиде (5 мл) добавляли гидрид натрия (1,1 г, 27,5 ммоль). Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,79 г, 5,5 ммоль) и 1,1'-карбонилдиимидазола (1,78 г, 11 ммоль) в N,N-диметилформамиде (5 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. Реакционную смесь экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением N-[3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида (2 г, 90%) в виде коричневого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C19H21N3O5S (М+Н)+: 404,46; найдено: 404,1.
К смеси N-[3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида (2 г, 5 ммоль) в 95%-ном этаноле (100 мл) и 10%-ного раствора соляной кислоты (20 мл) добавляли железо (0,84 г, 15 ммоль). Эту реакционную смесь перемешивали при 95°С в течение 1 ч. Затем нерастворимое твердое вещество отфильтровывали, фильтрат концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали 30%-ным раствором гидроксида натрия в воде (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением N-[2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида (1,5 г, 80%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C19H23N3O3S (M+H)+: 374,48; найдено: 374,1.
Раствор пиразин-2-карбоновой кислоты (42 мг, 0,34 ммоль) и 1,1'-карбонилдиимидазола (72 мг, 0,44 ммоль) в N,N-диметилформамиде (1,5 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли раствор N-[2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида (130 мг, 0,34 ммоль) в N,N-диметилформамиде (1 мл), и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили [3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фенил]-амид пиразин-2-карбоновой кислоты (12 мг, 7%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H25N5O4S (М+Н)+: 480,56; найдено: 480,2.
Пример 12
2-(3-Бензоиламино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
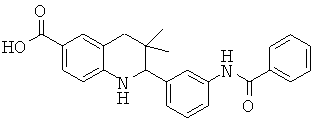
Смесь этилового эфира 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (745 мг, 2,3 ммоль), бензойной кислоты (337 мг, 2,76 ммоль) и гексафторфосфата о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (1,31 г, 3,45 ммоль) в дихлорметане (10 мл) и триэтиламине (0,8 мл, 5,75 ммоль) перемешивали при 25°С в течение 12 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(3-бензоиламино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (984 мг, 100%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C27H23N2O3 (М+Н)+: 429,54; найдено: 429,1.
Смесь этилового эфира 2-(3-бензоиламино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (984 мг, 2,3 ммоль) в метаноле (15 мл) и тетрагидрофуране (20 мл) и 30%-ного раствора гидроксида натрия в воде (10 мл) перемешивали при 50°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-(3-бензоиламино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (494 мг, 44%) в виде белого твердого вещества. LC/MS m/e: вычислено для C26H24N2O3 (М+Н)+: 401,48; найдено: 401,2.
Пример 13
2-{3-[3-(3-Фтор-фенил)-уреидо]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
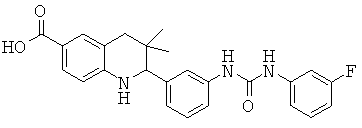
К раствору 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (220 мг, 0,74 ммоль) в тетрагидрофуране (5 мл) и триэтиламине (0,2 мл, 1,48 ммоль) по каплям добавляли 3-фторфенилизоцианат (0,1 мл, 0,89 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×30 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-{3-[3-(3-фтор-фенил)-уреидо]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (67 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H24FN3O3 (М+Н)+: 434,49; найдено: 434,1.
Пример 14
3,3-Диметил-2-(3-фенилкарбамоил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
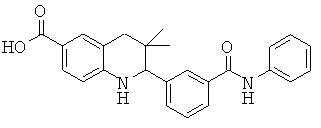
Смесь этилового эфира 2-(3-метоксикарбонил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,16 г, 1 ммоль) в тетрагидрофуране (40 мл) и 2М гидроксида лития в воде (20 мл) перемешивали в течение 48 ч при 25°С. Смесь нейтрализовали 3 н. водным раствором соляной кислоты, разбавляли этилацетатом (100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением этилового эфира 2-(3-карбонил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,1 г, 98%) в виде белого твердого вещества. LC/MS m/e: вычислено для C21H23NO4 (M+H)+: 354,42; найдено: 354,0.
Смесь этилового эфира 2-(3-карбонил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (720 мг, 2 ммоль), фениламина (224 мг, 2,4 ммоль) и гексафторфосфата о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (1,14 г, 3 ммоль) в дихлорметане (5 мл) и триэтиламине (0,7 мл, 5 ммоль) перемешивали при 25°С в течение 12 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-(3-фенилкарбамоил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,8 г, 93%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C27H28N2O3 (М+Н)+: 429,54; найдено: 429,1.
Смесь этилового эфира 3,3-диметил-2-(3-фенилкарбамоил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,8 г, 1,87 ммоль) в метаноле (15 мл) и тетрагидрофуране (20 мл) и 30%-ного раствора гидроксида натрия в воде (10 мл) перемешивали при 45°С в течение 48 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-(3-фенилкарбамоил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (350 мг, 46%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H24N2O3 (М+Н)+: 401,48; найдено: 401,1.
Пример 15
2-[3-(1-Карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
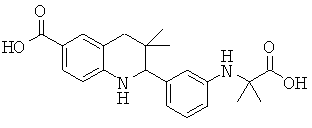
Смесь этилового эфира 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,52 г, 1,6 ммоль), метилового эфира 2-бром-2-метил-пропионовой кислоты (0,58 г, 3,2 ммоль) и карбоната калия (1,1 г, 8 ммоль) в N,N-диметилформамиде (6 мл) перемешивали при 25°С в течение 72 ч. Затем реакционную смесь экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-[3-(1-метоксикарбонил-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (678 мг, 100%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C25H32N2O4 (М+Н)+: 425,54; найдено: 425,2.
Смесь этилового эфира 2-[3-(1-метоксикарбонил-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (678 мг, 1,6 ммоль) в метаноле (10 мл) и тетрагидрофуране (30 мл) и 30%-ного раствора гидроксида натрия в воде (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (30 мг, 4%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H26N2O4 (М+Н)+: 383,46; найдено: 383,1.
Пример 16
3,3-Диметил-2-[3-(3-метил-2-оксо-имидазолидин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
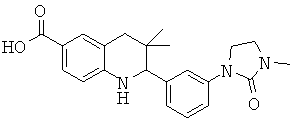
Смесь этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (7 г, 18 ммоль) в метаноле (25 мл) и тетрагидрофуране (100 мл) и 30%-ного раствора гидроксида натрия в воде (20 мл) перемешивали при 60°С в течение 56 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (6,4 г, 88%) в виде коричневого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C18H18BrNO2 (M+H)+: 361,25; найдено: 360,2.
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (360 мг, 1 ммоль), 1-метил-имидазолидин-2-она (300 мг, 3 ммоль), йодида меди(I) (115 мг, 0,6 ммоль), гидрохлорида N,N-диметилглицина (112 г, 0,8 ммоль) и карбоната калия (415 мг, 3 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 12 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-[3-(3-метил-2-оксо-имидазолидин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (4 мг, 1%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H25N3O3 (М+Н)+: 380,46; найдено: 380,1.
Пример 17
3,3-Диметил-2-[3-(2-оксо-имидазолидин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
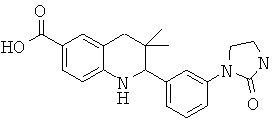
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (360 мг, 1 ммоль), имидазолидин-2-она (430 мг, 5 ммоль), йодида меди(I) (115 мг, 0,6 ммоль), гидрохлорида N,N-диметилглицина (112 г, 0,8 ммоль) и карбоната калия (415 мг, 3 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 12 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-[3-(2-оксо-имидазолидин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (22 мг, 6%) в виде белого твердого вещества. LC/MS m/e: вычислено для C21H23N3O3 (M+H)+: 366,44; найдено: 366,1.
Пример 18
2-[3-(2,5-Диоксо-пиперазин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
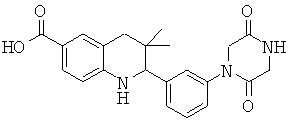
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (360 мг, 1 ммоль), пиперазин-2,5-диона (570 мг, 5 ммоль), йодида меди(I) (115 мг, 0,6 ммоль), гидрохлорида N,N-диметилглицина (112 г, 0,8 ммоль) и карбоната калия (415 мг, 3 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 12 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(2,5-диоксо-пиперазин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (46 мг, 11%) в виде серого твердого вещества. LC/MS m/e: вычислено для C22H23N3O4 (М+Н)+: 394,45; найдено: 394,1.
Пример 19
2-[3-(2,4-Диоксо-имидазолидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
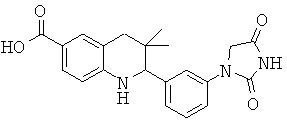
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (360 мг, 1 ммоль), имидазолидин-2,4-диона (500 мг, 5 ммоль), йодида меди(I) (115 мг, 0,6 ммоль), гидрохлорида N,N-диметилглицина (112 г, 0,8 ммоль) и карбоната калия (415 мг, 3 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 12 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(2,4-диоксо-имидазолидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (145 мг, 38%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C21H21N3O4 (М+Н)+: 380,42; найдено: 380,0.
Пример 20
2-[3-(4-Фтор-бензоиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
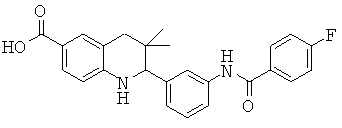
Раствор 4-фтор-бензойной кислоты (119 мг, 0,85 ммоль) и 1,1'-карбонилдиимидазола (179 мг, 1,1 ммоль) в N,N-диметилформамиде (1,5 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли раствор 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (200 мг, 0,68 ммоль) в N,N-диметилформамиде (1,5 мл), и эту смесь перемешивали при 50°С в течение 3 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(4-фтор-бензоиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (44 мг, 15%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H23FN2O3 (М+Н)+: 419,47; найдено: 419,1.
Пример 21
3,3-Диметил-2-{3-[(морфолин-4-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
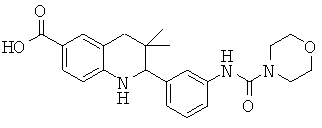
К раствору этилового эфира 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (324 мг, 1 ммоль) в дихлорметане (5 мл) и пиридине (0,5 мл, 6 ммоль) по каплям добавляли раствор морфолин-4-карбонилхлорида (0,12 мл, 1 ммоль) в дихлорметане (2 мл) при 0°С. Реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-{3-[(морфолин-4-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (437 мг, 100%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C25H31N3O4 (М+Н)+: 438,54; найдено: 438,2.
Смесь этилового эфира 3,3-диметил-2-{3-[(морфолин-4-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (437 мг, 1 ммоль) в метаноле (10 мл) и тетрагидрофуране (20 мл) и 30%-ного раствора гидроксида натрия в воде (10 мл) перемешивали при 55°С в течение 32 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-{3-[(морфолин-4-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (90 мг, 22%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H27N3O4 (М+Н)+: 410,49; найдено: 410,2.
Пример 22
3,3-Диметил-2-{3-[(пиперидин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
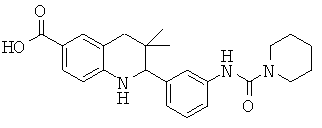
К раствору этилового эфира 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонового кислоты (648 мг, 2 ммоль) в дихлорметане (5 мл) и пиридине (1 мл, 12 ммоль) по каплям добавляли раствор пиперидин-1-карбонилхлорида (0,275 мл, 2,2 ммоль) в дихлорметане (2 мл) при 0°С. Эту реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-{3-[(пиперидин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (870 мг, 100%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C26H33N3O3 (М+Н)+: 436,57; найдено: 436,2.
Смесь этилового эфира 3,3-диметил-2-{3-[(пиперидин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (870 мг, 2 ммоль) в метаноле (15 мл) и тетрагидрофуране (20 мл) и 30%-ного раствора гидроксида натрия в воде (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-{3-[(пиперидин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (365 мг, 44%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H29N3O3 (М+Н)+: 408,52; найдено: 408,2.
Пример 23
{[3,3-Диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксил]-метил-амино}-уксусная кислота
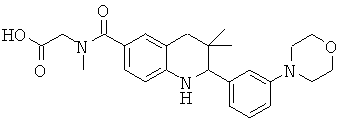
Смесь 3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,27 ммоль), этилового эфира метиламиноуксусной кислоты (51 мг, 0,33 ммоль) и гексафторфосфата о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (156 мг, 0,41 ммоль) в дихлорметане (3 мл) и триэтиламине (0,12 мл, 0,82 ммоль) перемешивали при 25°С в течение 12 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира {[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксил]-метил-амино}-уксусной кислоты (120 мг, 95%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C27H35N3O4 (М+Н)+: 466,60; найдено: 466,2.
Смесь этилового эфира {[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксил]-метил-амино}-уксусной кислоты (120 мг, 0,26 ммоль) в метаноле (2 мл) и тетрагидрофуране (10 мл) и 2М гидроксида лития в воде (8 мл) перемешивали при 50°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили {[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксил]-метил-амино}-уксусную кислоту (45 мг, 39%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H31N3O4 (М+Н)+: 438,54; найдено: 438,5.
Пример 24
1-[3,3-Диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксил]-пирролидин-2-карбоновая кислота
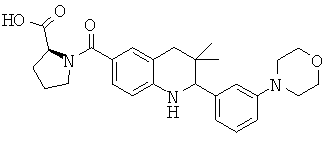
Готовили смесь 3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,27 ммоль), метилового эфира пирролидин-2-карбоновой кислоты (55 мг, 0,33 ммоль) и гексафторфосфата о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (156 мг, 0,41 ммоль) в дихлорметане (3 мл) и триэтиламине (0,12 мл, 0,82 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 12 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 1-[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксил]-пирролидин-2-карбоновой кислоты (125 мг, 96%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C28H35N3O4 (М+Н)+: 478,61; найдено: 478,2.
Смесь метилового эфира 1-[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксил]-пирролидин-2-карбоновой кислоты (125 мг, 0,26 ммоль) в тетрагидрофуране (10 мл) и 2М гидроксида лития в воде (8 мл) перемешивали при 50°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 1-[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксил]-пирролидин-2-карбоновую кислоту (65 мг, 54%) в виде белого твердого вещества. LC/MS m/e: вычислено для C27H33N3O4 (М+Н)+: 464,58; найдено: 463,9.
Пример 25
2-(3-(N,N-диметилсульфамоиламино)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
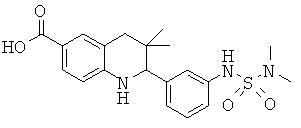
К раствору этилового эфира 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (648 мг, 2 ммоль) в дихлорметане (5 мл) и пиридине (0,97 мл, 2,2 ммоль) по каплям добавляли раствор диметилсульфамоилхлорида (0,24 мл, 2,2 ммоль) в дихлорметане (2 мл) при 0°С. Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этил-2-(3-(N,N-диметилсульфамоиламино)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (862 мг, 100%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C22H29N3O4S (М+Н)+: 432,56; найдено: 432,2.
Готовили смесь этил-2-(3-(N,N-диметилсульфамоиламино)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (862 мг, 2 ммоль) в метаноле (10 мл) и тетрагидрофуране (20 мл) и 30%-ного раствора гидроксида натрия в воде (10 мл). Эту реакционную смесь перемешивали при 60°С в течение 5 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-(3-(N,N-диметилсульфамоиламино)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (45 мг, 5%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H25N3O4S (М+Н)+: 404,50; найдено: 404,1.
Пример 26
3,3-Диметил-2-[3-(2-оксо-3-фенил-имидазолидин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
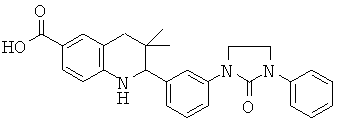
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (720 мг, 2 ммоль), имидазолидин-2-она (861 мг, 10 ммоль), йодида меди(1) (229 мг, 1,2 ммоль), гидрохлорида N,N-Диметилглицина (224 г, 1,6 ммоль) и карбоната калия (829 мг, 6 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 12 ч. Затем реакционную смесь охлаждали до комнатной температуры. Добавляли йод-бензол (2,17 мл, 20 ммоль), йодид меди(1) (229 мг, 1,2 ммоль), гидрохлорид N,N-диметилглицина (224 г, 1,6 ммоль) и карбонат калия (829 мг, 6 ммоль). Реакционную смесь перемешивали при 120°С в течение 12 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×200 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-[3-(2-оксо-3-фенил-имидазолидин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (82 мг, 9%) в виде белого твердого вещества. LC/MS m/e: вычислено для C27H27N3O3 (М+Н)+: 442,53; найдено: 442,1.
Пример 27
3,3-Диметил-2-{3-[(4-метил-пиперазин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
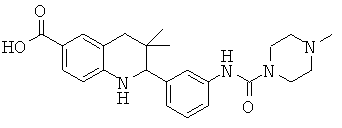
К раствору этилового эфира 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (441 мг, 1,36 ммоль) в дихлорметане (5 мл) и пиридине (1,1 мл, 13,6 ммоль) добавляли гидрохлорид 4-метил-пиперазин-1-карбонилхлорида (297 мг, 1,49 ммоль) при 0°С. Эту реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-{3-[(4-метил-пиперазин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (612 мг, 100%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C26H34N4O3 (М+Н)+: 451,59; найдено: 451,2.
Смесь этилового эфира 3,3-диметил-2-{3-[(4-метил-пиперазин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (612 мг, 1,36 ммоль) в метаноле (15 мл) и тетрагидрофуране (20 мл) и 30%-ного раствора гидроксида натрия в воде (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-{3-[(4-метил-пиперазин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (90 мг, 22%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H30N4O3 (М+Н)+: 423,53; найдено: 423,2.
Пример 28
2-[3-(6-Метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовая кислота
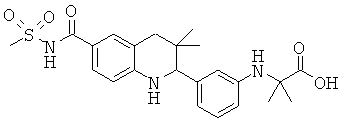
Смесь N-[2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида (0,37 г, 1 ммоль), метилового эфира 2-бром-2-метил-пропионовой кислоты (0,39 мл, 3 ммоль) и карбоната калия (690 мг, 5 ммоль) в N,N-диметилформамиде (6 мл) перемешивали при 25°С в течение 96 ч. Затем реакционную смесь экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты (47 мг, 10%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C24H31N3O5S (М+Н)+: 474,60; найдено: 474,1.
Смесь этилового эфира 2-[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты (47 мг, 0,1 ммоль) в метаноле (10 мл) и тетрагидрофуране (30 мл) и 30%-ного раствора гидроксида натрия в воде (5 мл) перемешивали при 50°С в течение 5 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовую кислоту (4 мг, 8%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H29N3O5S (M+H)+: 460,57; найдено: 460,0.
Пример 29
2-[3-(2-Гидрокси-1,1-диметил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
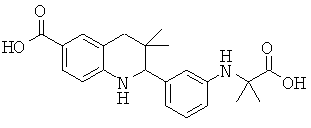
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (360 мг, 1 ммоль), 2-амино-2-метил-пропан-1-ола (0,48 мл, 5 ммоль), йодида меди(I) (115 мг, 0,6 ммоль), гидрохлорида N,N-диметилглицина (112 г, 0,8 ммоль) и карбоната калия (415 мг, 3 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(2-гидрокси-1,1-диметил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (8 мг, 2%) в виде белого порошка. LC/MS m/e: вычислено для C22H28N2O3 (М+Н)+: 369,48; найдено: 369,1.
Пример 30
3,3-Диметил-2-[3-(триметил-уреидо)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
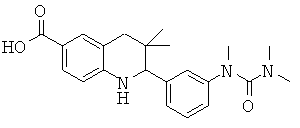
Смесь этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (970 мг, 2,5 ммоль), гидрохлорида метиламина (844 мг, 12,5 ммоль), йодида меди(1) (285 мг, 1,5 ммоль), гидрохлорида N,N-диметилглицина (280 г, 2 ммоль) и карбоната калия (3,455 г, 25 ммоль) в диметилсульфоксиде (15 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-(3-метиламино-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (761 мг, 90%) в виде светло-желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C21H26N2O2 (M+H)+: 339,45; найдено: 339,2.
К раствору этилового эфира 3,3-диметил-2-(3-метиламино-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (338 мг, 1 ммоль) в дихлорметане (5 мл) и пиридине (0,5 мл, 6 ммоль) по каплям добавляли раствор диметилкарбамилхлорида (0,1 мл, 1,1 ммоль) в дихлорметане (2 мл) при 0°С. Эту реакционную смесь перемешивали при 25°С в течение 12 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-[3-(триметил-уреидо)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (409 мг, 100%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C24H31N3O3 (М+Н)+: 410,53; найдено: 410,1.
Смесь этилового эфира 3,3-диметил-2-[3-(триметил-уреидо)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (409 мг, 1 ммоль) в метаноле (5 мл) и тетрагидрофуране (10 мл) и 30%-ного раствора гидроксида натрия в воде (5 мл) перемешивали при 60°С в течение 36 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-[3-(триметил-уреидо)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (100 мг, 26%) в виде желтого твердого вещества. LC/MS m/e: вычислено для C22H27N3O3 (М+Н)+: 382,48; найдено: 382,1.
Пример 31
3,3-Диметил-2-[3-(1-метил-уреидо)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
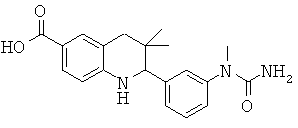
К раствору этилового эфира 3,3-диметил-2-(3-метиламино-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (169 мг, 0,5 ммоль) в уксусной кислоте (2 мл) и воде (4 мл) по каплям добавляли раствор цианата натрия (65 мг, 1 ммоль) в воде (2 мл) при 35°С. Эту реакционную смесь перемешивали при 35°С в течение 3 ч. Затем реакционную смесь экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-[3-(1-метил-уреидо)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (190 мг, 100%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C22H27N3O3 (М+Н)+: 382,48; найдено: 382,1.
Смесь этилового эфира 3,3-диметил-2-[3-(1-метил-уреидо)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (190 мг, 0,5 ммоль) в метаноле (5 мл) и тетрагидрофуране (10 мл) и 30%-ного раствора гидроксида натрия в воде (10 мл) перемешивали при 60°С в течение 36 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-[3-(1-метил-уреидо)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (28 мг, 15%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H23N3O3 (M+H)+: 354,42; найдено: 354,1.
Пример 32
2-[3-(1-Изопропил-уреидо)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
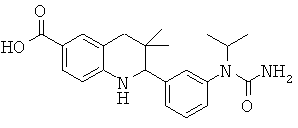
Смесь этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (970 мг, 2,5 ммоль), изопропиламина (1 мл, 12,5 ммоль), йодида меди(I) (285 мг, 1,5 ммоль), гидрохлорида N,N-диметилглицина (280 г, 2 ммоль) и карбоната калия (3,455 г, 25 ммоль) в диметилсульфоксиде (15 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением этилового эфира 2-(3-изопропиламино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (915 мг, 90%) в виде светло-желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e; вычислено для C23H30N2O2 (М+Н)+: 367,51; найдено: 367,2.
К раствору этилового эфира 2-(3-изопропиламино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (310 мг, 0,85 ммоль) в уксусной кислоте (2 мл) и воде (2 мл) по каплям добавляли раствор цианата натрия (110 мг, 1,7 ммоль) в воде (2 мл) при 40°С. Эту реакционную смесь перемешивали при 40°С в течение 4 ч. Затем реакционную смесь экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-[3-(1-изопропил-уреидо)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (347 мг, 100%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C24H31N3O3 (М+Н)+: 410,53; найдено: 410,1.
Смесь этилового эфира 2-[3-(1-изопропил-уреидо)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (347 мг, 0,85 ммоль) в метаноле (5 мл) и тетрагидрофуране (10 мл) и 30%-ного раствора гидроксида натрия в воде (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(1-изопропил-уреидо)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (29 мг, 8%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H27N3O3 (М+Н)+: 382,48; найдено: 382,1.
Пример 33
2-[3-(2-Амино-1,1-диметил-этокси)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
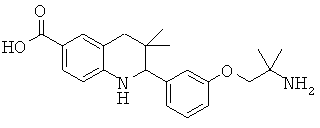
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (360 мг, 1 ммоль), 2-амино-2-метил-пропан-1-ола (0,48 мл, 5 ммоль), йодида меди(I) (115 мг, 0,6 ммоль), гидрохлорида N,N-диметилглицина (112 г, 0,8 ммоль) и карбоната калия (415 мг, 3 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(2-амино-1,1-диметил-этокси)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (7 мг, 2%) в виде белого порошка. LC/MS m/e: вычислено для C22H28N2O3 (M+H)+: 369,48; найдено: 369,1.
Пример 34
2-[3-(4,4-Диметил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
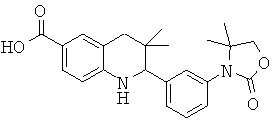
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (360 мг, 1 ммоль), 4,4-диметил-оксазолидин-2-она (575 мг, 5 ммоль), йодида меди(I) (115 мг, 0,6 ммоль), гидрохлорида N,N-диметилглицина (112 г, 0,8 ммоль) и карбоната калия (415 мг, 3 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(4,4-диметил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (3 мг, 0,4%) в виде светло-желтого масла. LC/MS m/e: вычислено для C23H26N2O4 (М+Н)+: 395,47; найдено: 395,1.
Пример 35
3,3-Диметил-2-{3-[(пирролидин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
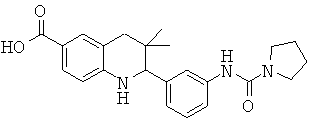
К раствору этилового эфира 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (648 мг, 2 ммоль) в дихлорметане (5 мл) и пиридине (1 мл, 12 ммоль) по каплям добавляли раствор пирролидин-1-карбонилхлорида (0,243 мл, 2,2 ммоль) в дихлорметане (2 мл) при 0°С. Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-{3-[(пирролидин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (842 мг, 100%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C25H31N3O3 (М+Н)+: 422,54; найдено: 422,2.
Смесь этилового эфира 3,3-диметил-2-{3-[(пирролидин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (842 мг, 2 ммоль) в метаноле (10 мл) и тетрагидрофуране (20 мл) и 30%-ного раствора гидроксида натрия в воде (10 мл) перемешивали при 60°С в течение 6 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-{3-[(пирролидин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (350 мг, 44%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H27N3O3 (М+Н)+: 394,49; найдено: 394,2.
Пример 36
2-[3-(3,3-Диэтил-уреидо)-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
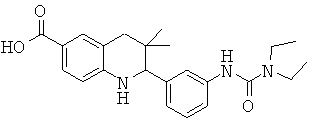
К раствору этилового эфира 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (648 мг, 2 ммоль) в дихлорметане (5 мл) и пиридине (1 мл, 12 ммоль) по каплям добавляли раствор диэтилкарбамилхлорида (0,28 мл, 2,2 ммоль) в дихлорметане (2 мл) при 0°С. Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-[3-(3,3-диэтил-уреидо)-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (846 мг, 100%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C25H33N3O3 (М+Н)+: 424,56; найдено: 424,2.
Смесь этилового эфира 2-[3-(3,3-диэтил-уреидо)-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (846 мг, 2 ммоль) в метаноле (10 мл) и тетрагидрофуране (15 мл) и 30%-ного раствора гидроксида натрия в воде (10 мл) перемешивали при 60°С в течение 16 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(3,3-диэтил-уреидо)-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (80 мг, 10%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H29N3O3 (М+Н)+: 396,51; найдено: 396,2.
Пример 37
2-[3-(6-Хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовая кислота
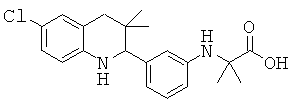
Готовили смесь 4-хлор-фениламина (6,4 г, 50 ммоль) и 3-нитро-бензальдегида (8,31 г, 55 ммоль) в этаноле (100 мл). Эту реакционную смесь нагревали в условиях дефлегмации в течение 3 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением (4-хлор-фенил)-(3-нитро-бензилиден)-амина (12 г, 92%) в виде светло-желтого масла. LC/MS m/e: вычислено для C13H9ClN2O2 (М+Н)+: 261,68; найдено: 261,0.
К смеси (4-хлор-фенил)-(3-нитро-бензилиден)-амина (12 г, 46 ммоль) и гидрата трифлата иттербия(III) (2,85 г, 4,6 ммоль) в сухом тетрагидрофуране (100 мл) при 25°С по каплям добавляли изобутиральдегид (4,64 мл, 51 ммоль) и воду (0,83 мл, 46 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 3 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 6-хлор-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-4-ола (14,3 г, 93%) в виде светло-желтого масла. LC/MS m/e: вычислено для C17H17ClN2O3 (М+Н)+: 333,79; найдено: 315,0.
К смеси 6-хлор-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-4-ола (14,3 г, 43 ммоль) и триэтилсилана (20 мл) при 25°С по каплям добавляли трифторуксусную кислоту (5 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили 6-хлор-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин (10,5 г, 77%) в виде белого твердого вещества. LC/MS m/e: вычислено для C17H17ClN2O2 (M+H)+: 317,79; найдено: 317,0.
К смеси 6-хлор-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолина (10,5 г, 33 ммоль) в 95%-ном этаноле (150 мл) и 10%-ного раствора соляной кислоты (10 мл) добавляли железо (3,72 г, 66 ммоль). Эту реакционную смесь перемешивали при 95°С в течение 3 ч. Затем нерастворимое твердое вещество отфильтровывали, фильтрат концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали 30%-ным раствором гидроксида натрия в воде (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламина (7,8 г, 82%) в виде желтого твердого вещества. LC/MS m/e: вычислено для C17H19ClN2 (М+Н)+: 287,81; найдено: 287,0.
Смесь 3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламина (1,5 г, 5,25 ммоль), метилового эфира 2-бром-2-метил-пропионовой кислоты (2,85 г, 15,7 ммоль) и карбоната калия (3,62 г, 26,25 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при 25°С в течение 5 суток. Затем реакционную смесь экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (30% этилацетата/гексаны) получили метиловый эфир 2-[3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты (450 мг, 22%) в виде коричневого масла. LC/MS m/e: вычислено для C22H27ClN2O2 (М+Н)+: 387,93; найдено: 387,1.
Смесь метилового эфира 2-[3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты (450 мг, 1,16 ммоль) в тетрагидрофуране (30 мл) и 2М гидроксида лития в воде (15 мл) перемешивали при 25°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовую кислоту (50 мг, 11%) в виде белого твердого вещества. LC/MS m/e: вычислено для C21H25ClN2O2 (M+H)+: 373,90; найдено: 373,1.
Пример 38
2-[3-(6-Циано-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовая кислота
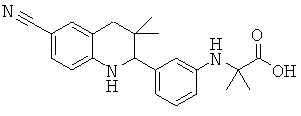
Готовили смесь 4-амино-бензонитрила (11,8 г, 100 ммоль) и 3-нитро-бензальдегида (16,6 г, 110 ммоль) в этаноле (100 мл). Эту реакционную смесь нагревали в условиях дефлегмации в течение 3 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением 4-[(3-нитро-бензилиден)-амино]-бензонитрила (21 г, 83%) в виде белого твердого вещества. LC/MS m/e: вычислено для C14H9N3O3 (M+H)+: 252,25; найдено: 252,1.
К смеси 4-[(3-нитро-бензилиден)-амино]-бензонитрила (21 г, 84 ммоль) и гидрата трифлата иттербия(III) (5,21 г, 8,4 ммоль) в сухом тетрагидрофуране (150 мл) при 25°С по каплям добавляли изобутиральдегид (8,4 мл, 92 ммоль) и воду (1,5 мл, 84 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 15 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 4-гидрокси-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонитрила (25 г, 92%) в виде светло-желтого масла. LC/MS m/e: вычислено для C18H17N3O3 (М+Н)+: 324,35; найдено: 324,1.
К смеси 4-гидрокси-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонитрила (25 г, 77 ммоль) и триэтилсилана (50 мл) при 25°С по каплям добавляли трифторуксусную кислоту (25 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили 3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонитрил (4 г, 16%) в виде белого твердого вещества. LC/MS m/e: вычислено для C18H17N3O2 (M+H)+: 308,36; найдено: 308,1.
К смеси 3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонитрила (4 г, 13 ммоль) в 95%-ном этаноле (150 мл) и 10%-ного раствора соляной кислоты (10 мл) добавляли железо (2,18 г, 39,2 ммоль). Эту реакционную смесь перемешивали при 95°С в течение 6 ч. Затем нерастворимое твердое вещество отфильтровывали, фильтрат концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали 30%-ным раствором гидроксида натрия в воде (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонитрила (0,9 г, 25%) в виде желтого твердого вещества. LC/MS m/e: вычислено для C18H19N3 (М+Н)+: 278,37; найдено: 278,1.
Смесь 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонитрила (0,64 г, 2,3 ммоль), метилового эфира 2-бром-2-метил-пропионовой кислоты (1,25 г, 6,9 ммоль) и карбоната калия (1,59 г, 11,5 ммоль) в N,N-диметилформамиде (6 мл) перемешивали при 25°С в течение 5 суток. Затем реакционную смесь экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (30% этилацетата/гексаны) получили метиловый эфир 2-[3-(6-циано-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты (500 мг, 43%) в виде коричневого масла. LC/MS m/e: вычислено для C23H27N3O2 (М+Н)+: 378,49; найдено: 378,2.
Готовили смесь метилового эфира 2-[3-(6-циано-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты (500 мг, 1,32 ммоль) в тетрагидрофуране (30 мл) и 2М гидроксида лития в воде (15 мл). Эту реакционную смесь перемешивали при 25°С в течение 36 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(6-циано-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовую кислоту (36 мг, 7%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H25N3O2 (M+H)+: 364,46; найдено: 364,1.
Пример 39
2-[3-(6-Метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2,N-диметил-пропионамид
Смесь этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (388 мг, 1 ммоль), 2-амино-2-метил-пропионовой кислоты (516 мг, 5 ммоль), йодида меди(1) (114 мг, 0,6 ммоль), гидрохлорида N,N-диметилглицина (112 г, 0,8 ммоль) и карбоната калия (415 мг, 3 ммоль) в диметилсульфоксиде (10 мл) перемешивали при 120°С в течение 12 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением этилового эфира 2-[3-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (410 мг, 100%) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C24H30N2O4 (М+Н)+: 411,52; найдено: 411,1.
Этиловый эфир 2-[3-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (410 мг, 1 ммоль), гидрохлорид метиламина (203 мг, 3 ммоль) и гексафторфосфат орто-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (570 мг, 1,5 ммоль) в дихлорметане (5 мл) и триэтиламине (0,5 мл, 3 ммоль) перемешивали при 25°С в течение 12 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-[3-(1-метил-1-метилкарбамоил-этиламино)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,4 г, 94%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C25H33N3O3 (М+Н)+: 424,56; найдено: 424,1.
Смесь этилового эфира 3,3-диметил-2-[3-(1-метил-1-метилкарбамоил-этиламино)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,4 г, 0,95 ммоль) в метаноле (10 мл) и тетрагидрофуране (20 мл) и 30%-ного раствора гидроксида натрия в воде (5 мл) перемешивали при 50°С в течение 16 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-[3-(1-метил-1-метилкарбамоил-этиламино)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (130 мг, 34%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H29N3O3 (М+Н)+: 396,51; найдено: 396,2.
К суспензии метансульфонамида (85 мг, 0,89 ммоль) в N,N-диметилформамиде (2 мл) добавляли гидрид натрия (36 мг, 0,89 ммоль). Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-[3-(1-метил-1-метилкарбамоил-этиламино)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (50 мг, 0,127 ммоль) и 1,1'-карбонилдиимидазола (41 мг, 0,253 ммоль) в N,N-диметилформамиде (1,5 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2,N-диметил-пропионамид (15 мг, 25%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H32N4O4S (М+Н)+: 473,61; найдено: 473,1.
Пример 40
2-[3-(1-Диметилкарбамоил-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
Этиловый эфир 2-[3-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (820 мг, 2 ммоль), дигидрохлорид метиламина (490 мг, 6 ммоль) и гексафторфосфат о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (1140 мг, 3 ммоль) в дихлорметане (5 мл) и триэтиламине (1,7 мл, 12 ммоль) перемешивали при 25°С в течение 12 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-[3-(1-диметилкарбамоил-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,8 г, 91%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C26H35N3O3 (M+H)+: 438,59; найдено: 438,2.
Смесь этилового эфира 2-[3-(1-диметилкарбамоил-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,8 г, 1,8 ммоль) в метаноле (10 мл) и тетрагидрофуране (20 мл) и 30%-ного раствора гидроксида натрия в воде (10 мл) перемешивали при 50°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(1-диметилкарбамоил-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (45 мг, 6%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H31N3O3 (M+H)+: 410,53; найдено: 410,1.
Пример 41
2-[3-(1,1-Диметил-2-морфолин-4-ил-2-оксо-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
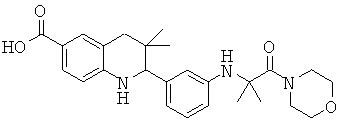
Этиловый эфир 2-[3-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (820 мг, 2 ммоль), морфолин (0,53 мл, 6 ммоль) и гексафторфосфат о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (1140 мг, 3 ммоль) в дихлорметане (10 мл) и триэтиламине (1,7 мл, 12 ммоль) перемешивали при 25°С в течение 36 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-[3-(1,1-диметил-2-морфолин-4-ил-2-оксо-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,87 г, 91%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C28H37N3O4 (М+Н)+: 480,62; найдено: 480,1.
Смесь этилового эфира 2-[3-(1,1-диметил-2-морфолин-4-ил-2-оксо-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,87 г, 1,8 ммоль) в метаноле (10 мл) и тетрагидрофуране (20 мл) и 30%-ного раствора гидроксида натрия в воде (10 мл) перемешивали при 50°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(1,1-диметил-2-морфолин-4-ил-2-оксо-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (35 мг, 4%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C26H33N3O4 (М+Н)+: 452,57; найдено: 452,1.
Пример 42
2-{3-[1,1-Диметил-2-(4-метил-пиперазин-1-ил)-2-оксо-этиламино]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
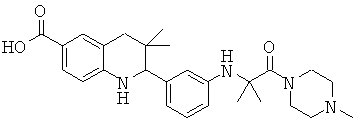
Этиловый эфир 2-[3-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (820 мг, 2 ммоль), 1-метил-пиперазин (0,67 мл, 6 ммоль) и гексафторфосфат о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (1140 мг, 3 ммоль) в дихлорметане (10 мл) и триэтиламине (1,7 мл, 12 ммоль) перемешивали при 25°С в течение 24 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-{3-[1,1-диметил-2-(4-метил-пиперазин-1-ил)-2-оксо-этиламино]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,895 г, 91%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C29H40N4O3 (М+Н)+: 493,67; найдено: 493,2.
Смесь этилового эфира 2-{3-[1,1-диметил-2-(4-метил-пиперазин-1-ил)-2-оксо-этиламино]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,895 г, 1,8 ммоль) в метаноле (10 мл) и тетрагидрофуране (20 мл) и 30%-ного раствора гидроксида натрия в воде (5 мл) перемешивали при 50°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-{3-[1,1-диметил-2-(4-метил-пиперазин-1-ил)-2-оксо-этиламино]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (4 мг, 0,4%) в виде белого твердого вещества. LC/MS m/e: вычислено для C27H36N4O3 (M+H)+: 465,61; найдено: 465,2.
Пример 43
N-Изопропил-2-[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионамид
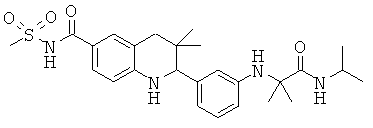
Этиловый эфир 2-[3-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (820 мг, 2 ммоль), изопропиламин (0,5 мл, 6 ммоль) и гексафторфосфат о-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (1140 мг, 3 ммоль) в дихлорметане (10 мл) и триэтиламине (0,84 мл, 6 ммоль) перемешивали при 25°С в течение 5 ч. Затем реакционную смесь экстрагировали дихлорметаном (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-[3-(1-изопропилкарбамоил-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,85 г, 94%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C27H37N3O3 (М+Н)+: 452,61; найдено: 452,2.
Смесь этилового эфира 2-[3-(1-изопропилкарбамоил-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,85 г, 1,88 ммоль) в метаноле (10 мл) и тетрагидрофуране (20 мл) и 30%-ного раствора гидроксида натрия в воде (10 мл) перемешивали при 50°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(1-изопропилкарбамоил-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (260 мг, 30%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H33N3O3 (М+Н)+: 424,56; найдено: 424,1.
К суспензии метансульфонамида (158 мг, 1,66 ммоль) в N,N-диметилформамиде (2 мл) добавляли гидрид натрия (66 мг, 1,66 ммоль). Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-[3-(1-изопропилкарбамоил-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,236 ммоль) и 1,1'-карбонилдиимидазола (77 мг, 0,473 ммоль) в N,N-диметилформамиде (1,5 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 12 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-изопропил-2-[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионамид (25 мг, 21%) в виде белого твердого вещества. LC/MS m/e: вычислено для C26H36N4O4S (М+Н)+: 501,67; найдено: 501,1.
Пример 44
2-[3-(1-Карбокси-циклопропиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
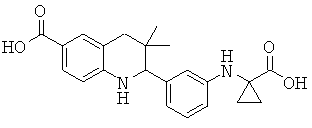
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (500 мг, 1,39 ммоль), 1-амино-циклопропанкарбоновой кислоты (700 мг, 6,95 ммоль), йодида меди(1) (159 мг, 0,85 ммоль), гидрохлорида N,N-диметилглицина (155 г, 1,11 ммоль) и карбоната калия (577 мг, 4,17 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 12 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(1-карбокси-циклопропиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (410 мг, 77%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H24N2O4 (М+Н)+: 381,45; найдено: 381,2.
Пример 45
2-[3-(3,3-Диметил-6-трифторметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовая кислота
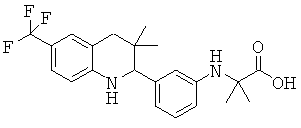
Готовили смесь 4-трифторметил-фениламина (2,6 мл, 21 ммоль) и 3-нитро-бензальдегида (3,44 г, 23 ммоль) в этаноле (100 мл). Эту реакционную смесь нагревали в условиях дефлегмации в течение 3 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением (3-нитро-бензилиден)-(4-трифторметил-фенил)-амина (5,88 г, 95%) в виде светло-желтого масла. LC/MS m/e: вычислено для C14H9F3N2O2(M+H)+: 295,24; найдено: 295,1.
К смеси (3-нитро-бензилиден)-(4-трифторметил-фенил)-амина (5,88 г, 20 ммоль) и гидрата трифлата иттербия(III) (1,24 г, 2 ммоль) в сухом тетрагидрофуране (50 мл) при 25°С по каплям добавляли изобутиральдегид (2 мл, 22 ммоль) и воду (0,36 мл, 20 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 72 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 3,3-диметил-2-(3-нитро-фенил)-6-трифторметил-1,2,3,4-тетрагидрохинолин-4-ода (7,1 г, 96%) в виде светло-желтого масла. LC/MS m/e: вычислено для C18H17F3N2O3 (М+Н)+: 367,34; найдено: 349,0.
К смеси 3,3-диметил-2-(3-нитро-фенил)-6-трифторметил-1,2,3,4-тетрагидрохинолин-4-ола (7,1 г, 19 ммоль) и триэтилсилана (20 мл) при 25°С по каплям добавляли трифторуксусную кислоту (5 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили 3,3-диметил-2-(3-нитро-фенил)-6-трифторметил-1,2,3,4-тетрагидрохинолин (2,4 г, 36%) в виде белого твердого вещества. LC/MS m/e: вычислено для C18H17F3N2O2 (M+H)+: 351,34; найдено: 351,1.
К смеси 3,3-диметил-2-(3-нитро-фенил)-6-трифторметил-1,2,3,4-тетрагидрохинолина (2,4 г, 6,8 ммоль) в 95%-ном этаноле (100 мл) и 10%-ного раствора соляной кислоты (5 мл) добавляли железо (1,2 г, 20 ммоль). Эту реакционную смесь перемешивали при 95°С в течение 3 ч. Затем нерастворимое твердое вещество отфильтровывали, фильтрат концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали 30%-ным раствором гидроксида натрия в воде (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 3-(3,3-диметил-6-трифторметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламина (1,8 г, 86%) в виде коричневого твердого вещества. LC/MS m/e: вычислено для C18H19F3N2 (M+H)+: 321,36; найдено: 321,1.
Смесь 3-(3,3-диметил-6-трифторметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламина (1,5 г, 4,7 ммоль), метилового эфира 2-бром-2-метил-пропионовой кислоты (2,55 г, 14,1 ммоль) и карбоната калия (3,24 г, 23,5 ммоль) в N,N-диметилформамиде (12 мл) перемешивали при 25°С в течение 5 суток. Затем реакционную смесь экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (30% этилацетата/гексаны) получили метиловый эфир 2-[3-(3,3-диметил-6-трифторметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты (400 мг, 20%) в виде коричневого масла. LC/MS m/e вычислено для C23H27F3N2O2 (М+Н)+: 421,48; найдено: 421,1.
Смесь метилового эфира 2-[3-(3,3-диметил-6-трифторметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты (400 мг, 0,95 ммоль) в тетрагидрофуране (30 мл) и 2М гидроксида лития в воде (15 мл) перемешивали при 25°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(3,3-диметил-6-трифторметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовую кислоту (3 мг, 0,7%) в виде светло-желтого масла. LC/MS m/e: вычислено для C22H25F3N2O2 (М+Н)+: 407,45; найдено: 407,2.
Пример 46
2-[5-(4-трет-Бутил-фенил)-пиридин-3-ил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
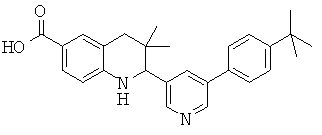
Смесь этилового эфира 4-амино-бензойной кислоты (8,06 г, 49 ммоль), 5-бром-пиридин-3-карбальдегида (10 г, 54 ммоль) и пара-толуолсульфоновой кислоты (190 мг, 1 ммоль) в толуоле (300 мл) нагревали в условиях дефлегмации в течение 12 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-[(5-бром-пиридин-3-илметилен)-амино]-бензойной кислоты (16,3 г, 100%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C15H13BrN2O2 (M+H)+: 334,19; найдено: 334,1.
К смеси этилового эфира 4-[(5-бром-пиридин-3-илметилен)-амино]-бензойной кислоты (16,3 г, 49 ммоль) и гидрата трифлата иттербия(Ш) (3,1 г, 49 ммоль) в сухом тетрагидрофуране (100 мл) при 25°С по каплям добавляли изобутиральдегид (4,98 мл, 55 ммоль) и воду (0,89 мл, 49 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 12 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(5-бром-пиридин-3-ил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (16 г, 80%) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C19H21BrN2O3 (М+Н)+: 406,29; найдено: 405,1.
К смеси этилового эфира 2-(5-бром-пиридин-3-ил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (16 г, 39,5 ммоль) и триэтилсилана (40 мл) при 25°С по каплям добавляли трифторуксусную кислоту (20 мл). Полученную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (30% этилацетата/гексаны) получили этиловый эфир 2-(5-бром-пиридин-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (4,4 г, 28%) в виде желтого твердого вещества. LC/MS m/e: вычислено для C19H21BrN2O2 (M+H)+: 390,30; найдено: 390,9.
К смеси этилового эфира 2-(5-бром-пиридин-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (778 мг, 2 ммоль), 4-трет-бутилфенилбороновой кислоты (358 мг, 2 ммоль) и тетракис(трифенилфосфин)палладия(0) (232 мг, 0,2 ммоль) в диоксане (10 мл) добавляли 2М раствор карбоната натрия в воде (2 мл). Полученную смесь подвергали воздействию микроволнового излучения в течение 1 ч при 110°С. Смесь разбавляли этилацетатом (200 мл), промывали насыщенным водным раствором бикарбоната натрия (50 мл × 2), рассолом, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением этилового эфира 2-[5-(4-трет-бутил-фенил)-пиридин-3-ил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (880 мг, 99%) в виде желтого твердого вещества. LC/MS m/e: вычислено для C29H34N2O2 (М+Н)+: 443,61; найдено: 443,2.
Смесь этилового эфира 2-[5-(4-трет-бутил-фенил)-пиридин-3-ил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (880 мг, 1,99 ммоль) в метаноле (20 мл) и тетрагидрофуране (20 мл) и 30%-ного раствора гидроксида натрия в воде (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. Остаток подвергали перекристаллизации из метанола с получением 2-[5-(4-трет-бутил-фенил)-пиридин-3-ил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (800 мг, 97%) в виде желтого твердого вещества. LC/MS m/e: вычислено для C27H30N2O2 (М+Н)+: 415,55; найдено: 415,1.
Пример 47
2-[3-(6-Циклопропансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2,N-диметил-пропионамид
К суспензии амида циклопропансульфоновой кислоты (108 мг, 0,89 ммоль) в N,N-диметилформамиде (2 мл) добавляли гидрид натрия (36 мг, 0,89 ммоль). Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-[3-(1-метил-1-метилкарбамоил-этиламино)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (50 мг, 0,127 ммоль) и 1,1'-карбонилдиимидазола (41 мг, 0,253 ммоль) в N,N-диметилформамиде (1,5 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-[3-(6-циклопропансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2,М-диметил-пропионамид (5 мг, 7%) в виде белого твердого вещества. LC/MS m/e: вычислено для C26H34N4O4S (М+Н)+: 499,65; найдено: 499,1.
Пример 48
2-[3-(6-Метансульфонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовая кислота
Готовили смесь 4-метансульфонил-фениламина (5,6 г, 33 ммоль) и 3-нитро-бензальдегида (5,45 г, 36 ммоль) в этаноле (100 мл). Эту реакционную смесь нагревали в условиях дефлегмации в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением (4-метансульфонил-фенил)-(3-нитро-бензилиден)-амина (10 г, 99%) в виде белого твердого вещества. LC/MS m/e: вычислено для C14H12N2O4S (М+Н)+: 305,33; найдено: 305,1.
К смеси (4-метансульфонил-фенил)-(3-нитро-бензилиден)-амина (10 г, 33 ммоль) и гидрата трифлата иттербия(III) (2,05 г, 3,3 ммоль) в сухом тетрагидрофуране (100 мл) при 25°С по каплям добавляли изобутиральдегид (3,3 мл, 36,3 ммоль) и воду (0,6 мл, 33 ммоль). Реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 6-метансульфонил-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-4-ола (10 г, 92%) в виде светло-желтого масла. LC/MS m/e: вычислено для C18H20N2O5S (М+Н)+: 377,43; найдено: 376,8.
К смеси 6-метансульфонил-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин-4-ола (10 г, 27 ммоль) и триэтилсилана (20 мл) при 25°С по каплям добавляли трифторуксусную кислоту (10 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (50% этилацетата/гексаны) получили 6-метансульфонил-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолин (6,5 г, 16%) в виде желтого твердого вещества. LC/MS m/e: вычислено для C18H20N2O4S (М+Н)+: 361,44; найдено: 360,8.
К смеси 6-метансульфонил-3,3-диметил-2-(3-нитро-фенил)-1,2,3,4-тетрагидрохинолина (6,5 г, 18 ммоль) в 95%-ном этаноле (100 мл) и 10%-ного раствора соляной кислоты (10 мл) добавляли железо (3,04 г, 54 ммоль). Эту реакционную смесь перемешивали при 95°С в течение 5 ч. Затем нерастворимое твердое вещество отфильтровывали, фильтрат концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали 30%-ным раствором гидроксида натрия в воде (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением 3-(6-метансульфонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламина (3,7 г, 25%) в виде желтого твердого вещества. LC/MS m/e: вычислено для C18H22N2O2S (M+H)+: 331,45; найдено: 331,1.
Смесь 3-(6-метансульфонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламина (1 г, 3 ммоль), метилового эфира 2-бром-2-метил-пропионовой кислоты (1,65 г, 9 ммоль) и карбоната калия (2,07 г, 15 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при 25°С в течение 10 суток. Затем реакционную смесь экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (30% этилацетата/гексаны) получили метиловый эфир 2-[3-(6-метансульфонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты (100 мг, 7%) в виде коричневого масла. LC/MS m/e: вычислено для C23H30N2O4S (М+Н)+: 431,57; найдено: 431,1.
Смесь метилового эфира 2-[3-(6-метансульфонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты (100 мг, 0,23 ммоль) в тетрагидрофуране (20 мл) м 2М гидроксида лития в воде (10 мл) перемешивали при 25°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(6-метансульфонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовую кислоту (19 мг, 7%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H28N2O4S (M+H)+: 417,54; найдено: 417,0.
Пример 49
N-[2-(4'-трет-Бутил-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид
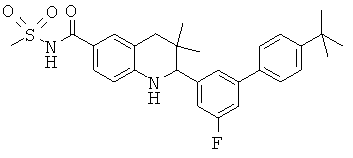
Смесь этилового эфира 4-амино-бензойной кислоты (1,65 г, 10 ммоль) и 3-бром-5-фтор-бензальдегида (2,03 г, 10 ммоль) в этаноле (20 мл) нагревали в условиях дефлегмации в течение 2 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-{[1-(3-бром-5-фтор-фенил)-метилиден]-амино}-бензойной кислоты (2,25 г, 64%) в виде белого твердого вещества. LC/MS m/e: вычислено для C16H13BrFNO2 M+: 350,2; найдено: 350,2, 352,2.
К смеси этилового эфира 4-{[1-(3-бром-5-фтор-фенил)-метилиден]-амино}-бензойной кислоты (2,25 г, 6,43ммоль) и гидрата трифлата иттербия(III) (0,40 г, 0,64 ммоль) в сухом тетрагидрофуране (10 мл) при 25°С по каплям добавляли изобутиральдегид (0,59 мл, 6,43 ммоль) и воду (0,12 мл, 6,43 ммоль). Реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(3-бром-5-фтор-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2,33 г, 86%) в виде светло-желтого масла. LC/MS m/e: вычислено для C20H21BrFNO3 M+: 422,3; найдено: 404,3, 406,3.
К смеси этилового эфира 2-(3-бром-5-фтор-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,3 г, 7,9 ммоль) и триэтилсилана (5 мл) при 25°С по каплям добавляли трифторуксусную кислоту (5 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×20 мл), промывали насыщенным водным раствором бикарбоната натрия (2×10 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(3-бром-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,2 г, 16%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H21BrFNO2 M+: 406,3; найдено: 406,2, 408,2.
Смесь этилового эфира 2-(3-бром-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,41 г, 1,0 ммоль), 4-трет-бутилбензолбороновой кислоты (0,36 г, 2,0 ммоль), хлорида бис(трифенилфосфин)палладия(II) (70,2 мг, 0,1 ммоль) и 2М карбоната натрия (1,5 мл, 3,0 ммоль) в диоксане (5 мл) нагревали в течение 3 часов при 120°С. После охлаждения до комнатной температуры смесь обрабатывали этилацетатом (50 мл) и промывали водой (20 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(4'-трет-бутил-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,17 г, 37%) в виде белого твердого вещества. LC/MS m/e: вычислено для C30H34FNO2 (М+Н)+: 460,6; найдено: 460,3.
Смесь этилового эфира 2-(4'-трет-бутил-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,17 г, 0,37 ммоль) в этаноле (3 мл) и тетрагидрофуране (5 мл) и 30%-ного раствора гидроксида натрия в воде (1 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением 2-(4'-трет-бутил-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,13 г, 80%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C28H30FNO2 (М+Н)+: 432,6; найдено: 432,3;
Смесь 2-(4'-трет-бутил-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (30 мг, 0,07 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (20 мг, 0,10 ммоль), 4-диметиламинопиридина (12,2 мг, 0,10 ммоль), метансульфонамида (20 мг, 0,21 ммоль) в дихлорметане (10 мл) нагревали в условиях дефлегмации в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили N-[2-(4'-трет-бутил-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид (11 мг, 30%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C29H33FN2O3S (М+Н)+: 509,66; найдено: 509,2.
Пример 50
N-[2-(3-Диметиламино-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид
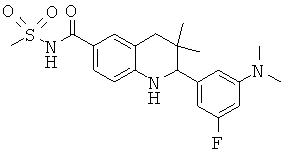
Смесь этилового эфира 2-(3-бром-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,41 г, 1,0 ммоль), дигидрохлорида метиламина (0,41 г, 5 ммоль), йодида меди(1) (0,12 г, 0,6 ммоль) и гидроксида калия (0,34, 6,0 ммоль) в DMSO (5 мл) нагревали в течение 3 часов при 120°С. После охлаждения до комнатной температуры, смесь обрабатывали этилацетатом (50 мл) и промывали водой (20 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) получили этиловый эфир 2-(3-диметиламино-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,11 г, 30%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H27FN2O2 (M+H)+: 371,47; найдено: 371,3.
Смесь этилового эфира 2-(3-диметиламино-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,11 г, 0,3 ммоль), гидрата гидроксида лития (0,12 г, 3,0 ммоль), воды (2 мл) в метаноле (3 мл) и тетрагидрофуране (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением 2-(3-диметиламино-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (35 мг, 30%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C20H23FN2O2 (М+Н)+: 343,2; найдено: 343,1.
Смесь 2-(3-диметиламино-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (10 мг, 0,03 ммоль), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (8,4 мг, 0,044 ммоль), 4-диметиламинопиридина (5,4 мг, 0,044 ммоль), метансульфонамида (8,3 мг, 0,09 ммоль) в дихлорметане (3 мл) нагревали в условиях дефлегмации в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили N-[2-(3-диметиламино-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид (5 мг, 42%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C21H26FN3O3S (М+Н)+: 420,5; найдено: 420,1.
Пример 51
2-(4'-Циано-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
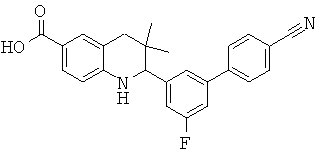
Смесь этилового эфира 2-(3-бром-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,41 г, 1,0 ммоль), 4-цианобензолбороновой кислоты (0,29 г, 2,0 ммоль), хлорида бис(трифенилфосфин)палладия(II) (70,2 мг, 0,1 ммоль) и 2М карбоната натрия (1,5 мл, 3,0 ммоль) в диоксане (4 мл) нагревали в течение 3 часов при 120°С. После охлаждения до комнатной температуры смесь обрабатывали этилацетатом (50 мл) и промывали водой (20 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(4'-циано-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,15 г, 35%) в виде белого твердого вещества. LC/MS m/e: вычислено для C27H25FN2O2 (М+Н)+: 429,5; найдено: 429,3.
Смесь этилового эфира 2-(4'-циано-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,15 г, 0,35 ммоль), гидрата гидроксида лития (0,15 г, 3,5 ммоль), воды (1 мл) в метаноле (3 мл) и тетрагидрофуране (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-(4'-циано-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (50 мг, 36%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H21FN2O2 (М+Н)+: 401,5; найдено: 401,3.
Пример 52
[2-(3,5-Дифтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты
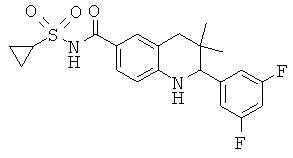
Смесь этилового эфира 4-амино-бензойной кислоты (3,3 г, 20 ммоль) и 3,5-дифтор-бензальдегида (2,84 г, 20 ммоль) в этаноле (50 мл) нагревали в условиях дефлегмации в течение 2 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-{[1-(3,5-дифтор-фенил)-метилиден]-амино}-бензойной кислоты (4,27 г, 74%) в виде белого твердого вещества. LC/MS m/e: вычислено для C16H13F2NO2 (M+H)+: 290,3; найдено: 290,2.
К смеси этилового эфира 4-{[1-(3,5-дифтор-фенил)-метилиден]-амино}-бензойной кислоты (4,27 г, 14,8 ммоль) и гидрата трифлата иттербия(III) (0,92 г, 1,48 ммоль) в сухом тетрагидрофуране (50 мл) при 25°С по каплям добавляли изобутиральдегид (1,34 мл, 14,8 ммоль) и воду (0,27 мл, 14,8 ммоль). Реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(3,5-дифтор-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (5,34 г, 100%) в виде светло-желтого масла. LC/MS m/e: вычислено для C20H21F2NO3 M+: 361,4; найдено: 344,2.
К смеси этилового эфира 2-(3,5-дифтор-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (5,34 г, 14,8 ммоль) и триэтилсилана (20 мл) при 25°С по каплям добавляли трифторуксусную кислоту (5 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(3,5-дифтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2,0 г, 41%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H21F2NO2 (M+H)+: 346,4; найдено: 346,1.
Смесь этилового эфира 2-(3,5-дифтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2,0 г, 6,1 ммоль), гидрата гидроксида лития (2,57 г, 61 ммоль), воды (5 мл) в метаноле (10 мл) и тетрагидрофуране (20 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением 2-(3,5-дифтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,84 г, 44%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C18H17F2NO2 (М+Н)+: 318,3; найдено: 318,2.
К суспензии амида циклопропансульфоновой кислоты (650 мг, 5,36 ммоль) в N,N-диметилформамиде (4 мл) добавляли гидрид натрия (210 мг, 5,36 ммоль). Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-(3,5-дифтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (210 мг, 0,67 ммоль) и 1,1'-карбонилдиимидазола (220 мг, 1,34 ммоль) в N,N-диметилформамиде (3 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли вышеуказанную суспензию амида циклопропансульфоновой кислоты и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [2-(3,5-дифтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты (40 мг, 15%) в виде белого твердого вещества. LC/MS m/e: вычислено для C21H22F2N2O3S (М+Н)+: 421,5; найдено:421,2.
Пример 53
2-(2-Фтор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
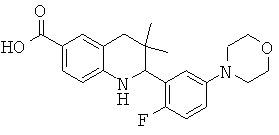
Смесь этилового эфира 4-амино-бензойной кислоты (1,65 г, 10 ммоль) и 5-бром-2-фтор-бензальдегида (2,03 г, 10 ммоль) в этаноле (20 мл) нагревали в условиях дефлегмации в течение 2 ч. Затем эту реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-{[1-(5-бром-2-фтор-фенил)-метилиден]-амино}-бензойной кислоты (2,76 г, 79%) в виде белого твердого вещества. LC/MS m/e: вычислено для C16H13BrFNO2 M+: 350,2; найдено: 350,1, 352,1.
К смеси этилового эфира 4-{[1-(5-бром-2-фтор-фенил)-метилиден]-амино}-бензойной кислоты (2,76 г, 7,9ммоль) и гидрата трифлата иттербия(III) (0,49 г, 0,79 ммоль) в сухом тетрагидрофуране (10 мл) при 25°С по каплям добавляли изобутиральдегид (0,72 мл, 7,9 ммоль) и воду (0,14 мл, 7,9 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(5-бром-2-фтор-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,33 г, 100%) в виде светло-желтого масла. LC/MS m/e: вычислено для C20H21BrFNO3 M+: 422,3; найдено: 404,2, 406,2.
К смеси этилового эфира 2-(5-бром-2-фтор-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,33 г, 7,9 ммоль) и триэтилсилана (5 мл) при 25°С по каплям добавляли трифторуксусную кислоту (1 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×20 мл), промывали насыщенным водным раствором бикарбоната натрия (2×10 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(5-бром-2-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,76 г, 24%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H21BrFNO2 M+: 406,3; найдено: 406,3, 408,2.
Смесь этилового эфира 2-(5-бром-2-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,76 г, 1,87 ммоль), морфолина (1,63 г, 18,7 ммоль), йодида меди(I) (0,21 г, 1,1 ммоль), L-пролина (0,11 г, 0,94 ммоль) и карбоната калия (0,78, 5,61 ммоль) в DMSO (3 мл) нагревали в течение 4 часов при 120°С. После охлаждения до комнатной температуры смесь обрабатывали этилацетатом (50 мл) и промывали водой (20 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) получили этиловый эфир 2-(2-фтор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,12 г, 16%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H29FN2O3 (М+Н)+: 413,5; найдено: 413,4.
Смесь этилового эфира 2-(2-фтор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,12 г, 0,29 ммоль), гидрата гидроксида лития (0,12 г, 0,29 ммоль), воды (2 мл) в метаноле (3 мл) и тетрагидрофуране (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-(2-фтор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (40 мг, 36%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H25FN2O3 (М+Н)+: 385,5; найдено: 385,3.
Пример 54
[2-(2-Фтор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты
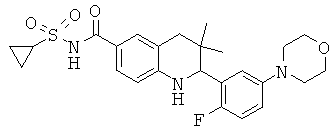
К суспензии амида циклопропансульфоновой кислоты (78,7 мг, 0,65 ммоль) в N,N-диметилформамиде (3 мл) добавляли гидрид натрия (26 мг, 0,65 ммоль). Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-(2-фтор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (50 мг, 0,13 ммоль) и 1,1'-карбонилдиимидазола (42 мг, 0,26 ммоль) в N,N-диметилформамиде (2 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли вышеуказанную суспензию амида циклопропансульфоновой кислоты и гидрида натрия в N,N-диметилформамиде, и смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [2-(2-фтор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты (19 мг, 30%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H30FN3O4S (М+Н)+: 488,6; найдено: 488,4.
Пример 55
2-(3-Хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
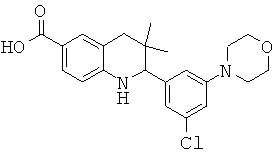
Смесь этилового эфира 4-амино-бензойной кислоты (8,3 г, 50,3 ммоль) и 3-бром-5-хлор-бензальдегида (11,0 г, 50,3 ммоль) в этаноле (100 мл) нагревали в условиях дефлегмации в течение 2 часов. Затем эту реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-{[1-(3-бром-5-хлор-фенил)-метилиден]-амино}-бензойной кислоты (6,4 г, 35%) в виде белого твердого вещества. LC/MS m/e: вычислено для C16H13BrClNO2 M+: 366,6; найдено: 366,6.
К смеси этилового эфира 4-{[1-(3-бром-5-хлор-фенил)-метилиден]-амино}-бензойной кислоты (6,4 г, 17,5 ммоль) и гидрата трифлата иттербия(III) (1,08 г, 1,75 ммоль) в сухом тетрагидрофуране (50 мл) при 25°С по каплям добавляли изобутиральдегид (1,59 мл, 17,5 ммоль) и воду (0,32 мл, 17,5 ммоль). Реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(3-бром-5-хлор-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (7,67 г, 100%) в виде светло-желтого масла. LC/MS m/e: вычислено для C20H21BrClNO3 M+: 438,8; найдено: 438,8, 440,8.
К смеси этилового эфира 2-(3-бром-5-хлор-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (7,67 г, 17,5 ммоль) и триэтилсилана (10 мл) при 25°С по каплям добавляли трифторуксусную кислоту (5 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали насыщенным водным раствором бикарбоната натрия (2×50 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(3-бром-5-хлор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,12 г, 42%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H21BrClNO2 M+: 422,8; найдено: 422,0, 424,0.
Смесь этилового эфира 2-(3-бром-5-хлор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,56 г, 3,7 ммоль), морфолина (1,60 г, 18,5 ммоль), йодида меди(I) (0,42 г, 2,2 ммоль), L-пролина (0,25 г, 2,2 ммоль) и гидроксида калия (0,12, 2,2 ммоль) в DMSO (20 мл) нагревали в течение 4 часов при 120°С. После охлаждения до комнатной температуры смесь обрабатывали этилацетатом (50 мл) и промывали водой (20 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) получили этиловый эфир 2-(3-хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,70 г, 44%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H29ClN2O3 (М+Н)+: 430,0; найдено: 429.
Смесь этилового эфира 2-(3-хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,7 г, 1,63 ммоль), гидрата гидроксида лития (0,69 г, 16,3 ммоль), воды (5 мл) в этаноле (20 мл) и тетрагидрофуране (20 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-(3-хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (200 мг, 31%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H25ClN2O3 М+: 400,9; найдено: 401,2.
Пример 56
[2-(3-Хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты
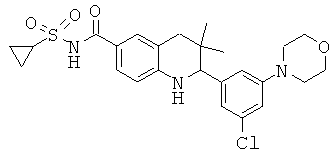
Смесь 2-(3-хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,25 ммоль), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (72 мг, 0,38 ммоль), 4-диметиламинопиридина (46 мг, 0,38 ммоль), циклопропансульфонамида (91 мг, 0,75 ммоль) в дихлорметане (3 мл) нагревали при 65°С в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили [2-(3-хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты (37,8 мг, 30%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C25H30ClN3O4S (М+Н)^ 504,1; найдено: 504,2.
Пример 57
N-[2-(3-Хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид
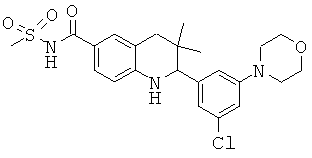
Смесь 2-(3-хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,25 ммоль), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (72 мг, 0,38 ммоль), 4-диметиламинопиридина (46 мг, 0,38 ммоль), метансульфонамида (47,5 мг, 0,50 ммоль) в дихлорметане (4 мл) нагревали при 65°С в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили N-[2-(3-хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид (35,8 мг, 30%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C23H28ClN3O4S (М+Н)+: 479,1; найдено: 478,2.
Пример 58
[2-(4-Фтор-3-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты
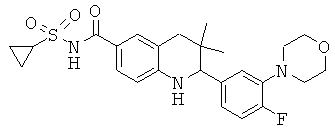
Смесь этилового эфира 4-амино-бензойной кислоты (1,65 г, 10 ммоль) и 3-бром-4-фтор-бензальдегида (2,03 г, 10 ммоль) в этаноле (100 мл) нагревали в условиях дефлегмации в течение 2 часов. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-{[1-(3-бром-4-фтор-фенил)-метилиден]-амино}-бензойной кислоты (1,6 г, 46%) в виде белого твердого вещества. LC/MS m/e: вычислено для C16H13BrCFNO2 М+: 350,2; найдено: 350,2, 352,2.
К смеси этилового эфира 4-{[1-(3-бром-4-фтор-фенил)-метилиден]-амино}-бензойной кислоты (1,6 г, 4,57 ммоль) и гидрата трифлата иттербия(III) (0,28 г, 0,457 ммоль) в сухом тетрагидрофуране (10 мл) при 25°С по каплям добавляли изобутиральдегид (0,42 мл, 4,57 ммоль) и воду (82 мг, 4,57 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×50 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(3-бром-4-фтор-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,93 г, 100%) в виде светло-желтого масла. LC/MS m/e: вычислено для C20H21BrFNO3 М+: 422,3; найдено: 404,2.
К смеси этилового эфира 2-(3-бром-4-фтор-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,93 г, 4,57 ммоль) и триэтилсилана (5 мл) при 25°С по каплям добавляли трифторуксусную кислоту (1 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×50 мл), промывали насыщенным водным раствором бикарбоната натрия (2×20 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(3-бром-4-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,63 г, 34%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H21BrFNO2 М+: 406,3; найдено: 406,2, 408,2.
Смесь этилового эфира 2-(3-бром-4-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,63 г, 1,55 ммоль), морфолина (1,35 г, 15,5 ммоль), йодида меди(I) (0,18 г, 0,93 ммоль), L-пролина (89 мг, 0,78 ммоль) и карбоната калия (0,64, 4,65 ммоль) в DMSO (3 мл) нагревали в течение 4 часов при 120°С. После охлаждения до комнатной температуры смесь обрабатывали этилацетатом (50 мл) и промывали водой (20 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) получили этиловый эфир 2-(4-фтор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,11 г, 17%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H29FN2O3 (М+Н)+: 413,5; найдено: 413,4.
Смесь этилового эфира 2-(4-фтор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,11 г, 0,27 ммоль), гидрата гидроксида лития (0,11 г, 2,7 ммоль), воды (2 мл) в тетрагидрофуране (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-(4-фтор-3-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (60 мг, 57%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H25FN2O3 (М+Н)+: 385,5; найдено: 385,3.
К суспензии амида цикпопропансульфоновой кислоты (190 мг, 1,55 ммоль) в N,N-диметилформамиде (3 мл) добавляли гидрид натрия (62 мг, 1,55 ммоль). Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-(4-фтор-3-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (120 мг, 0,31 ммоль) и 1,1'-карбонилдиимидазола (100 мг, 0,62 ммоль) в N,N-диметилформамиде (3 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли вышеуказанную суспензию амида циклопропансульфоновой кислоты и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [2-(4-фтор-3-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты (38 мг, 25%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H30FN3O4S (М+Н)+: 488,6; найдено: 488,5.
Пример 59
N-[2-(4-Фтор-3-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид
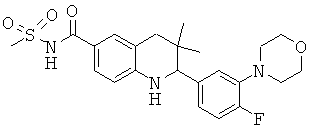
К суспензии метансульфонамида (150 мг, 1,55 ммоль) в N,N-диметилформамиде (3 мл) добавляли гидрид натрия (62 мг, 1,55 ммоль). Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-(4-фтор-3-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (120 мг, 0,31 ммоль) и 1,1'-карбонилдиимидазола (100 мг, 0,62 ммоль) в N,N-диметилформамиде (3 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-[2-(4-фтор-3-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид (36 мг, 25%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H28FN3O3S (М+Н)+: 462,6; найдено: 462,4.
Пример 60
[2-(5-Фтор-2-метил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты
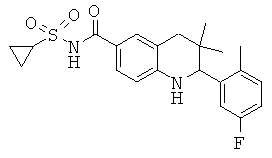
Смесь этилового эфира 4-амино-бензойной кислоты (1,65 г, 10 ммоль) и 5-фтор-2-метил-бензальдегида (1,38 г, 10 ммоль) в этаноле (10 мл) нагревали в условиях дефлегмации в течение 2 часов. Затем эту реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-{[1-(5-фтор-2-метил-фенил)-метилиден]-амино}-бензойной кислоты (2,0 г, 70%) в виде белого твердого вещества. LC/MS m/e: вычислено для C17H16FNO2 (M+H)+: 285,3; найдено: 286,3.
К смеси этилового эфира 4-{[1-(5-фтор-2-метил-фенил)-метилиден]-амино}-бензойной кислоты (3,01 г, 10,6 ммоль) и гидрата трифлата иттербия(III) (0,66 г, 1,06 ммоль) в сухом тетрагидрофуране (10 мл) при 25°С по каплям добавляли изобутиральдегид (0,96 мл, 10,6 ммоль) и воду (190 мг, 10,6 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×50 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(5-фтор-2-метил-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,78 г, 100%) в виде светло-желтого масла. LC/MS m/e: вычислено для C21H24FNO3 М+: 357,4; найдено: 340,3.
К смеси этилового эфира 2-(5-фтор-2-метил-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,78 г, 10,6 ммоль) и триэтилсилана (10 мл) при 25°С по каплям добавляли трифторуксусную кислоту (2 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×50 мл), промывали насыщенным водным раствором бикарбоната натрия (2×20 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(5-фтор-2-метил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,70 г, 19%) в виде белого твердого вещества. LC/MS m/e: вычислено для C21H24FNO2 (M+H)+: 342,4; найдено: 342,3.
Смесь этилового эфира 2-(5-фтор-2-метил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,70 г, 2,05 ммоль), гидрата гидроксида лития (0,86 г, 20,5 ммоль), воды (3 мл) в тетрагидрофуране (30 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-(5-фтор-2-метил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (260 мг, 40%) в виде белого твердого вещества. LC/MS m/e: вычислено для C19H20FNO2 (M+H)+: 314,4; найдено: 314,3.
К суспензии амида циклопропансульфоновой кислоты (250 мг, 2,1 ммоль) в N,N-диметилформамиде (3 мл) добавляли гидрид натрия (84 мг, 2,1 ммоль). Полученную смесь перемешивали при 25°С в течение 1 часа. Раствор 2-(5-фтор-2-метил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (130 мг, 0,42 ммоль) и 1,1'-карбонилдиимидазола (130 мг, 0,84 ммоль) в N,N-диметилформамиде (3 мл) перемешивали при 70°С в течение 1 ч. Затем добавляли вышеуказанную суспензию амида циклопропансульфоновой кислоты и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [2-(5-фтор-2-метил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты (40 мг, 23%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H25FN2O3S (М+Н)+: 417,5; найдено: 417,3.
Пример 61
N-[2-(3-Фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид
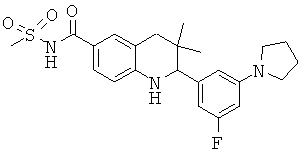
Смесь этилового эфира 2-(3-бром-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,41 г, 1,0 ммоль), пирролидина (0,21 г, 3,0 ммоль), йодида меди(I) (0,11 г, 0,6 ммоль) и гидроксида калия (33,6 мг, 0,6 ммоль) в DMSO (2 мл) нагревали в течение 3 часов при 120°С. После охлаждения до комнатной температуры смесь обрабатывали этилацетатом (50 мл) и промывали водой (20 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) получили этиловый эфир 2-(3-фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,18 г, 45%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H29FN2O2 (М+Н)+: 397,5; найдено: 397,3.
Смесь этилового эфира 2-(3-фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,18 г, 0,45 ммоль), гидрата гидроксида лития (0,19 г, 4,5 ммоль), воды (1 мл) в метаноле (3 мл) и тетрагидрофуране (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением 2-(3-фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 60%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C22H25FN2O2 (М+Н)+: 369,5; найдено: 369,2.
Смесь 2-(3-фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (50 мг, 0,14 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (39 мг, 0,20 ммоль), 4-диметиламинопиридина (24,4 мг, 0,20 ммоль), метансульфонамида (40 мг, 0,42 ммоль) в дихлорметане (3 мл) нагревали в течение 12 часов при 60°С. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили N-[2-(3-фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид (22 мг, 35%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C23H28FN3O3S (М+Н)+: 446,6; найдено: 446,2.
Пример 62
[2-(3-Фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты
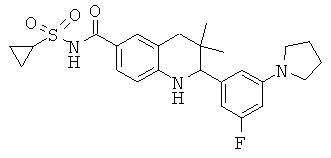
Смесь 2-(3-фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (50 мг, 0,14 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (39 мг, 0,20 ммоль), 4-диметиламинопиридина (24,4 мг, 0,20 ммоль), амида циклопропансульфоновой кислоты (51 мг, 0,42 ммоль) в дихлорметане (3 мл) нагревали в течение 12 часов при 60°С. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили [2-(3-фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты (13 мг, 20%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C25H30FN3O3S (M+H)+: 472,6; найдено: 472,2.
Пример 63
3,3-Диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
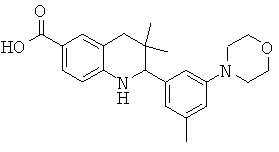
Готовили смесь этилового эфира 4-амино-бензойной кислоты (8,3 г, 50,3 ммоль) и З-бром-5-метил-бензальдегида (11,0 г, 50,3 ммоль) в этаноле (100 мл). Эту реакционную смесь нагревали в условиях дефлегмации в течение 2 часов. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-{[1 -(3-бром-5-метил-фенил)-метилиден]-амино}-бензойной кислоты (7,3 г, 50%) в виде белого твердого вещества. LC/MS m/e: вычислено для C17H16BrNO2 M+: 346,2; найдено: 346,1.
К смеси этилового эфира 4-{[1-(3-бром-5-метил-фенил)-метилиден]-амино}-бензойной кислоты (2,5 г, 7,3 ммоль) и гидрата трифлата иттербия(III) (0,45 г, 0,73 ммоль) в сухом тетрагидрофуране (15 мл) при 25°С по каплям добавляли изобутиральдегид (0,53 г, 7,3 ммоль) и воду (0,13 мл, 7,3 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(3-бром-5-метил-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,1 г, 100%) в виде светло-желтого масла. LC/MS m/e: вычислено для C21H24BrNO3 М+: 418,3; найдено: 400,1.
К смеси этилового эфира 2-(3-бром-5-метил-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (6,1 г, 14,6 ммоль) и триэтилсилана (20 мл) при 25°С по каплям добавляли трифторуксусную кислоту (10 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали насыщенным водным раствором бикарбоната натрия (2×50 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(3-бром-5-метил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,12 г, 42%) в виде белого твердого вещества. LC/MS m/e: вычислено для C21H24BrNO2 М+: 402,3; найдено: 402,1, 404,1.
Смесь этилового эфира 2-(3-бром-5-метил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,0 г, 2,5 ммоль), морфолина (2,2 г, 25 ммоль), йодида меди(1) (0,29 г, 1,5 ммоль), N,N-диметилглицина (0,28 г, 2,0 ммоль) и карбоната калия (1,04 г, 7,5 ммоль) в DMSO (6 мл) нагревали в течение 4 часов при 120°С. После охлаждения до комнатной температуры смесь обрабатывали этилацетатом (50 мл) и промывали водой (20 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) получили этиловый эфир 3,3-диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,52 г, 51%) в виде белого твердого вещества. LC/MS m/e: вычислено для C26H32N2O3 (М+Н)+: 409,6; найдено: 409,2.
Смесь этилового эфира 3,3-диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,52 г, 1,3 ммоль), гидрата гидроксида лития (0,54 г, 13 ммоль), воды (1 мл) в метаноле (2 мл) и тетрагидрофуране (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (200 мг, 31%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H23N2O3 (М+Н)+: 381,5; найдено: 381,2.
Пример 64
[3,3-Диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты
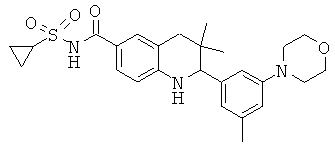
Смесь 3,3-диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (150 мг, 0,39 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (110 мг, 0,59 ммоль), 4-диметиламинопиридина (72 мг, 0,59 ммоль), циклопропансульфонамида (140 мг, 1,17 ммоль) в дихлорметане (5 мл) нагревали при 65°С в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили [3,3-диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты (45 мг, 25%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C26H33N3O4S (М+Н)+: 484,6; найдено: 484,2.
Пример 65
N-[3,3-Диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид
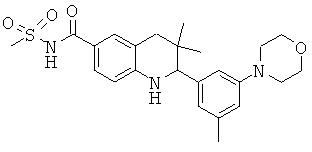
Смесь 3,3-диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (150 мг, 0,39 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (110 мг, 0,59 ммоль), 4-диметиламинопиридина (72 мг, 0,59 ммоль), метансульфонамида (110 мг, 1,17 ммоль) в дихлорметане (5 мл) нагревали при 65°С в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили N-[3,3-диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид (71 мг, 40%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C24H31N3O4S (М+Н)+: 458,6; найдено: 458,2.
Пример 66
2-(3-Метокси-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота

Готовили смесь этилового эфира 4-амино-бензойной кислоты (6,1 г, 36,9 ммоль) и 3-бром-5-метокси-бензальдегида (8,0 г, 36,9 ммоль) в этаноле (100 мл). Эту реакционную смесь нагревали в условиях дефлегмации в течение 2 часов. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-{[1-(3-бром-5-метокси-фенил)-метилиден]-амино}-бензойной кислоты (4,5 г, 34%) в виде белого твердого вещества. LC/MS m/e: вычислено для C17H16BrNO3 M+: 362,2; найдено: 362,1.
К смеси этилового эфира 4-{[1-(3-бром-5-метокси-фенил)-метилиден]-амино}-бензойной кислоты (4,5 г, 12,4 ммоль) и гидрата трифлата иттербия(III) (0,77 г, 1,24 ммоль) в сухом тетрагидрофуране (20 мл) при 25°С по каплям добавляли изобутиральдегид (0,89 г, 12,4 ммоль) и воду (0,22 мл, 12,4 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(3-бром-5-метокси-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (5,4 г, 100%) в виде светло-желтого масла. LC/MS m/e: вычислено для C21H24BrNO4 М+: 434,3; найдено: 418,1.
К смеси этилового эфира 2-(3-бром-5-метокси-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (5,4 г, 12,4 ммоль) и триэтилсилана (10 мл) при 25°С по каплям добавляли трифторуксусную кислоту (10 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали насыщенным водным раствором бикарбоната натрия (2×50 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(3-бром-5-метокси-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2,7 г, 52%) в виде белого твердого вещества. LC/MS m/e: вычислено для C21H24BrNO3 М+: 418,3; найдено: 418,1, 420,1.
Смесь этилового эфира 2-(3-бром-5-метокси-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,85 г, 2,0 ммоль), морфолина (1,77 г, 20 ммоль), йодида меди(I) (0,23 г, 1,2 ммоль), гидрохлорида N,N-диметилглицина (0,22 г, 1,6 ммоль) и карбоната калия (0,83 г, 6,0 ммоль) в DMSO (5 мл) нагревали в течение 4 часов при 120°С. После охлаждения до комнатной температуры смесь обрабатывали этилацетатом (50 мл) и промывали водой (20 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) получили этиловый эфир 3,3-диметил-2-(3-метокси-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,30 г, 36%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H32N2O4 (М+Н)+: 425,5; найдено: 425,3.
Смесь этилового эфира 3,3-диметил-2-(3-метокси-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,30 г, 0,71 ммоль), гидрата гидроксида лития (0,30 г, 7,1 ммоль), воды (1 мл) в метаноле (2 мл) и тетрагидрофуране (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-(3-метокси-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (200 мг, 31%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H28N2O4 (М+Н)+: 397,5; найдено: 397,3.
Пример 67
[2-(3-Метокси-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты
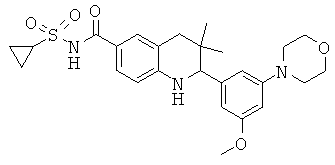
Смесь 3,3-диметил-2-(3-метокси-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (120 мг, 0,3 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (87 мг, 0,45 ммоль), 4-диметиламинопиридина (55 мг, 0,45 ммоль), циклопропансульфонамида (109 мг, 0,9 ммоль) в дихлорметане (10 мл) нагревали при 65°С в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили [3,3-диметил-2-(3-метокси-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты (52 мг, 35%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C26H33N3O5S (М+Н)+: 500,6; найдено: 500,2.
Пример 68
N-[2-(3-Метокси-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид
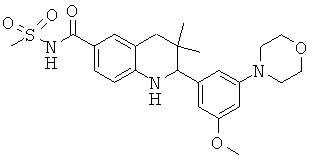
Смесь 3,3-диметил-2-(3-метокси-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (120 мг, 0,3 ммоль), гидрохлорида 1-3-диметиламинопропил)-3-этилкарбодиимида (87 мг, 0,45 ммоль), 4-диметиламинопиридина (55 мг, 0,45 ммоль), метансульфонамида (86 мг, 0,9 ммоль) в дихлорметане (10 мл) нагревали при 65°С в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили N-[3,3-диметил-2-(3-метокси-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид (57 мг, 40%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C24H31N5O5S (М+Н)+: 474,6; найдено: 474,0.
Пример 69
N-[2-(3-Циано-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид
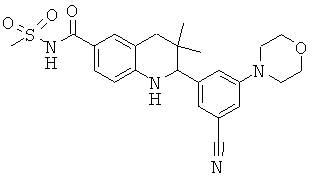
Смесь 2-(3-хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,25 ммоль), цианида натрия (24,5 мг, 0,5 ммоль), бромида никеля(II) (54,6 мг, 0,25 ммоль) в NMP (0,5 мл) перемешивали в течение 10 минут при 200°С под действием микроволнового излучения. После удаления твердого вещества остаток очищали на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) с получением 2-(3-циано-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (39 мг, 40%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H26N3O3 (М+Н)+: 392,5; найдено: 392,2.
Смесь 2-(3-циано-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (60 мг, 0,15 ммоль), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (44 мг, 0,23 ммоль), 4-диметиламинопиридина (28 мг, 0,23 ммоль), метансульфонамида (43 мг, 0,45 ммоль) в дихлорметане (10 мл) нагревали при 65°С в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили N-[2-(3-циано-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид (21 мг, 30%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C24H28N4O4S (М+Н)+: 469,6; найдено: 469,2.
Пример 70
[2-(3-Циклогексил-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты
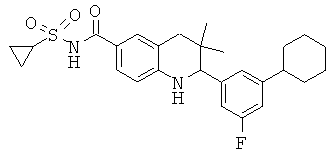
Смесь этилового эфира 2-(3-бром-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,41 г, 1,0 ммоль), 0,5М раствора бромида циклогексилцинка в тетрагидрофуране (3,0 мл, 1,5 ммоль), 1,1'-бис(дифенилфосфино)ферроцендихлорпалладия(II) (41 мг, 0,05 ммоль) и DMF (0,5 мл) в диоксане (3 мл) перемешивали при 70°С в течение 2 часов, затем обрабатывали насыщенным раствором хлорида аммония (20 мл) и экстрагировали диэтиловым эфиром (100 мл). Остаток после удаления растворителя очищали флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) с получением этилового эфира 2-(3-циклогексил-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,21 г, 51%) в виде белого твердого вещества. LC/MS m/e: вычислено для C26H32FNO2 М+: 410,6; найдено: 410,1.
Смесь этилового эфира 2-(3-циклогексил-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,21 г, 0,51 ммоль), гидрата гидроксида лития (0,22 г, 5,1 ммоль), воды (1 мл) в метаноле (2 мл) и тетрагидрофуране (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-(3-циклогексил-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (120 мг, 62%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H28FNO2 (М+Н)+: 382,5; найдено: 382,2.
Смесь 2-(3-циклогексил-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (60 мг, 0,16 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (45 мг, 0,24 ммоль), 4-диметиламинопиридина (29 мг, 0,24 ммоль), циклопропансульфонамида (58 мг, 0,48 ммоль) в дихлорметане (10 мл) нагревали при 65°С в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили [2-(3-циклогексил-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты (16 мг, 20%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C27H33FN2O3S (М+Н)+: 485,6; найдено: 485,3.
Пример 71
2-(3-Фтор-5-пиперазин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
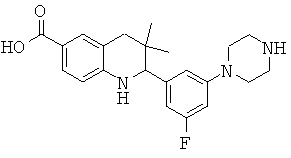
Смесь метилового эфира 2-(3-бром-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,41 г, 1,0 ммоль), пиперазина (0,26 г, 3,0 ммоль), йодида меди(I) (110 мг, 0,6 ммоль), L-пролина (69 мг, 0,6 ммоль) и гидроксида калия (33,6 мг, 0,6 ммоль) в DMSO (2 мл) перемешивали при 120°С в течение 2 часов, затем обрабатывали насыщенным раствором хлорида аммония (20 мл) и экстрагировали диэтиловым эфиром (100 мл). Остаток после удаления растворителя очищали флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (40% этилацетата/гексаны) с получением этилового эфира 2-(3-фтор-5-пиперазин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,18 г, 43%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H30FN3O2 (М+Н)+: 412,5; найдено: 412,3.
Смесь этилового эфира 2-(3-фтор-5-пиперазин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,18 г, 0,43 ммоль), гидрата гидроксида лития (0,18 г, 4,3 ммоль), воды (2 мл) в метаноле (5 мл) и тетрагидрофуране (5 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-(3-фтор-5-пиперазин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (49 мг, 30%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H26FN3O2 (М+Н)+: 384,5; найдено: 384,1.
Пример 72
3,3-Диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
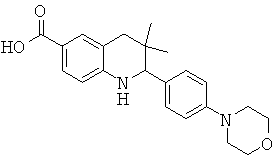
Готовили смесь этилового эфира 4-амино-бензойной кислоты (4,5 г, 27 ммоль) и 4-бром-бензальдегида (5,0 г, 27 ммоль) в этаноле (150 мл). Эту реакционную смесь нагревали в условиях дефлегмации в течение 2 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-{[1-(4-бром-фенил)-метилиден]-амино}-бензойной кислоты (6,3 г, 70%) в виде белого твердого вещества. LC/MS m/e: вычислено для C16H14BrNO2 M+: 332,2; найдено: 332,2, 334,2.
К смеси этилового эфира 4-{[1-(4-бром-фенил)-метилиден]-амино}-бензойной кислоты (9,8 г, 29,5 ммоль) и гидрата трифлата иттербия(III) (1,83 г, 2,95 ммоль) в сухом тетрагидрофуране (20 мл) при 25°С по каплям добавляли изобутиральдегид (2,1 г, 29,5 ммоль) и воду (0,53 мл, 29,5 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(4-бром-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (11,9 г, 100%) в виде светло-желтого масла. LC/MS m/e: вычислено для C20H22BrNO3 M+: 404,3; найдено: 404,1, 406,1.
К смеси этилового эфира 2-(4-бром-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (11,9 г, 29,5 ммоль) и триэтилсилана (10 мл) при 25°С по каплям добавляли трифторуксусную кислоту (10 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(4-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (6,9 г, 60%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H22BrNO2 M+: 388,3; найдено: 388,1, 390,1.
Смесь этилового эфира 2-(4-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,0 г, 2,6 ммоль), морфолина (2,24 г, 25,8 ммоль), йодида меди(1) (0,29 г, 1,55 ммоль), гидрохлорида N,N-диметилглицина (0,29 г, 2,06 ммоль) и карбоната калия (1,07, 7,74 ммоль) в DMSO (10 мл) нагревали в течение 3 часов при 120°С. После охлаждения до комнатной температуры смесь обрабатывали этилацетатом (50 мл) и промывали водой (20 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) получили этиловый эфир 3,3-диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,20 г, 20%) в виде белого твердого вещества. LC/MS m/е: вычислено для C24H30N2O3 (М+Н)+: 395,5; найдено: 395,2.
Смесь этилового эфира 3,3-диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,20 г, 0,51 ммоль), гидрата гидроксида лития (0,21 г, 5,1 ммоль), воды (1 мл) в метаноле (2 мл) и тетрагидрофуране (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (56 мг, 30%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H26N2O3 (М+Н)+: 367,5; найдено: 367,1.
Пример 73
[3,3-Диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты
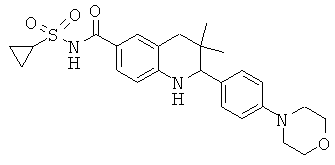
Смесь 3,3-диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (70 мг, 0,19 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (55 мг, 0,29 ммоль), 4-диметиламинопиридина (35 мг, 0,29 ммоль), циклопропансульфонамида (69 мг, 0,57 ммоль) в дихлорметане (10 мл) нагревали при 65°С в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили [3,3-диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты (24 мг, 27%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C25H31N3O4S (M+H)+: 470,6; найдено: 470,3.
Пример 74
N-[3,3-Диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид
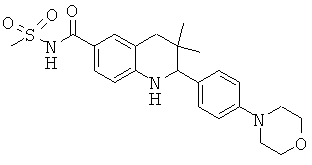
Смесь 3,3-диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (70 мг, 0,19 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (55 мг, 0,29 ммоль), 4-диметиламинопиридина (35 мг, 0,29 ммоль), метансульфонамида (54 мг, 0,57 ммоль) в дихлорметане (10 мл) нагревали при 65°С в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили N-[3,3-диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид (34 мг, 40%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C23H29N3O4S (М+Н)+: 444,6; найдено: 444,2.
Пример 75
N-{2-[3-Фтор-5-(4-изопропил-пиперазин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид
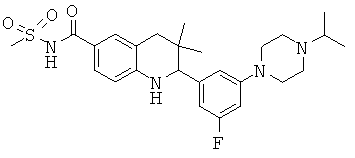
Смесь метилового эфира 2-(3-бром-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,41 г, 1,0 ммоль), 1-изопропилпиперазина (0,64 г, 5,0 ммоль), йодида меди(1) (120 мг, 0,6 ммоль), L-пролина (69 мг, 0,6 ммоль) и гидроксида калия (33,6 мг, 0,6 ммоль) в DMSO (2 мл) перемешивали при 120°С в течение 2 часов, затем обрабатывали насыщенным раствором хлорида аммония (20 мл) и экстрагировали диэтиловым эфиром (100 мл). Остаток после удаления растворителя очищали флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (40% этилацетата/гексаны) с получением этилового эфира 2-[3-фтор-5-(4-изопропил-пиперазин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,27 г, 60%) в виде белого твердого вещества. LC/MS m/e: вычислено для C27H36FN3O2 (М+Н)+: 454,6; найдено: 454,3.
Смесь этилового эфира 2-[3-фтор-5-(4-изопропил-пиперазин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,27 г, 0,60 ммоль), гидрата гидроксида лития (0,25 г, 6,0 ммоль), воды (2 мл) в метаноле (3 мл) и тетрагидрофуране (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-фтор-5-(4-изопропил-пиперазин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (89 мг, 35%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H32FN3O2 (М+Н)+: 426,6; найдено: 426,3.
К суспензии амида метансульфоновой кислоты (266 мг, 2,8 ммоль) в N,N-диметилформамиде (3 мл) добавляли гидрид натрия (112 мг, 2,8 ммоль). Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-[3-фтор-5-(4-изопропил-пиперазин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (120 мг, 0,28 ммоль) и 1,1'-карбонилдиимидазола (91,5 мг, 0,56 ммоль) в N,N-диметилформамиде (2 мл) перемешивали при 70°С в течение 1 ч. Добавляли вышеуказанную суспензию амида метансульфоновой кислоты и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-{2-[3-фтор-5-(4-изопропил-пиперазин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}метансульфонамид (20 мг, 14%) в виде белого твердого вещества. LC/MS m/e: вычислено для C26H35FN4O3S (М+Н)+: 503,7; найдено: 503,3.
Пример 76
2-[3-Фтор-5-(2-оксо-пирролидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
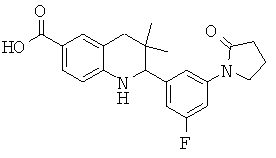
Смесь метилового эфира 2-(3-бром-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,41 г, 1,0 ммоль), пирролидин-2-она (0,24 г, 3,0 ммоль), йодида меди(I) (110 мг, 0,6 ммоль), L-пролина (69 мг, 0,6 ммоль) и гидроксида калия (33,6 мг, 0,6 ммоль) в DMSO (2 мл) перемешивали при 120°С в течение 2 часов, затем обрабатывали насыщенным раствором хлорида аммония (20 мл) и экстрагировали диэтиловым эфиром (100 мл). Остаток после удаления растворителя очищали флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) с получением этилового эфира 2-[3-фтор-5-(2-оксо-пирролидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,25 г, 61%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H27FN2O3 (М+Н)+: 411,5; найдено: 411,3.
Смесь этилового эфира 2-[3-фтор-5-(2-оксо-пирролидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,25 г, 0,61 ммоль), гидрата гидроксида лития (0,26 г, 6,1 ммоль), воды (2 мл) в метаноле (3 мл) и тетрагидрофуране (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-фтор-5-(2-оксо-пирролидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (77 мг, 33%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H23FN2O3 (М+Н)+: 383,4; найдено: 383,2.
Пример 77
N-{2-[3-Фтор-5-(2-оксо-пирролидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид
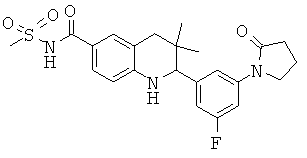
Смесь 2-[3-фтор-5-(2-оксо-пирролидин-1 -ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (130 мг, 0,34 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (98 мг, 0,51 ммоль), 4-диметиламинопиридина (62 мг, 0,51 ммоль), метансульфонамида (97 мг, 1,02 ммоль) в дихлорметане (10 мл) нагревали при 65°С в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили N-{2-[3-фтор-5-(2-оксо-пирролидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид (45 мг, 29%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C23H26FN3O4S (М+Н)+: 460,5; найдено: 460,2.
Пример 78
Метиловый эфир2-[3-(1-карбокси-1-метил-этиламино)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты
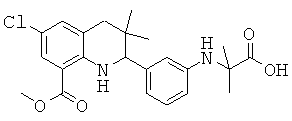
Готовили смесь метилового эфира 2-амино-5-хлор-бензойной кислоты (11,7 г, 63 ммоль) и 3-бром-бензальдегида (11,7 г, 63 ммоль) в этаноле (200 мл). Эту реакционную смесь нагревали в условиях дефлегмации в течение 2 часов. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением метилового эфира 2-{[1-(3-бром-фенил)-метилиден]-амино}-5-хлор-бензойной кислоты (5,3 г, 24%) в виде белого твердого вещества. LC/MS m/e: вычислено для C15H11BrClNO2 M+: 353,6; найдено: 353,6.
К смеси метилового эфира 2-{[1-(3-бром-фенил)-метилиден]-амино}-5-хлор-бензойной кислоты (5,3 г, 15 ммоль) и гидрата трифлата иттербия(III) (0,93 г, 1,5 ммоль) в сухом тетрагидрофуране (10 мл) при 25°С по каплям добавляли изобутиральдегид (1,08 г, 15 ммоль) и воду (0,27 мл, 15 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 2-(3-бром-фенил)-6-хлор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (6,4 г, 100%) в виде светло-желтого масла. LC/MS m/e: вычислено для C19H19BrClNO3 M+: 424,7; найдено: 408,0.
К смеси метилового эфира 2-(3-бром-фенил)-6-хлор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (6,4 г, 15 ммоль) и триэтилсилана (10 мл) при 25°С по каплям добавляли трифторуксусную кислоту (10 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали насыщенным водным раствором бикарбоната натрия (2×50 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (5% этилацетата/гексаны) получили метиловый эфир 2-(3-бром-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (2,51 г, 41%) в виде белого твердого вещества. LC/MS m/e: вычислено для C19H19BrClNO2 M+: 408,7; найдено: 408,8.
Смесь метилового эфира 2-(3-бром-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (1,2 г, 2,94 ммоль), 2-аминоизомасляной кислоты (1,20 г, 12 ммоль), йодида меди(I) (0,34 г, 1,76 ммоль), гидрохлорида N,N-диметилглицина (0,33 г, 2,35 ммоль) и карбоната калия (1,22, 8,82 ммоль) в DMSO (10 мл) нагревали в течение 4 часов при 120°С. После охлаждения до комнатной температуры смесь обрабатывали этилацетатом (50 мл) и промывали водой (20 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили метиловый эфир 2-[3-(1-карбокси-1-метил-этиламино)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (300 мг, 24%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H27ClN2O4 (М+Н)+: 431,9; найдено: 431,1.
Пример 79
6-Хлор-3,3-диметил-2-[3-(1-метил-1-метилкарбамоил-этиламино)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновая кислота
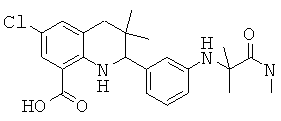
Смесь метилового эфира 2-[3-(1-карбокси-1-метил-этиламино)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (73 мг, 0,17 ммоль), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (65 мг, 0,34 ммоль), 4-диметиламинопиридина (41,5 мг, 0,34 ммоль), метанамина (0,26 мл, 0,52 ммоль) в тетрагидрофуране и триэтиламина (34 мг, 0,34 ммоль) в дихлорметане (10 мл) перемешивали в течение 48 часов. После удаления растворителя получили неочищенный продукт метиловый эфир 6-хлор-3,3-диметил-2-[3-(1-метил-1-метилкарбамоил-этиламино)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (75 мг, 100%), который использовали на следующей стадии без очистки. LC/MS m/e: вычислено для C24H30ClN3O3 (М+Н)+: 444,98; найдено: 444,1.
Смесь метилового эфира 6-хлор-3,3-диметил-2-[3-(1-метил-1-метилкарбамоил-этиламино)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (75 мг, 0,17 ммоль), гидрата гидроксида лития (71 мг, 1,7 ммоль), воды (0,5 мл) в метаноле (1 мл) и тетрагидрофуране (5 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 6-хлор-3,3-диметил-2-[3-(1-метил-1-метилкарбамоил-этиламино)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновую кислоту (24 мг, 33%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H28ClN3O3 (М+Н)+: 430,95; найдено: 430,1.
Пример 80
2-[3-(1-Карбокси-1-метил-этиламино)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновая кислота
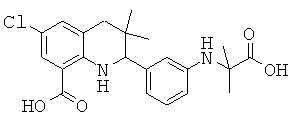
Смесь метилового эфира 2-[3-(1-карбокси-1-метил-этиламино)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (100 мг, 0,23 ммоль), гидрата гидроксида лития (98 мг, 2,3 ммоль), воды (0,5 мл) в метаноле (1 мл) и тетрагидрофуране (5 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(1-карбокси-1-метил-этиламино)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновую кислоту (24 мг, 25%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H25ClN2O4 (М+Н)+: 417,91; найдено: 417,0.
Пример 81
2-[3-(4-Ацетил-пиперазин-1-ил)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновая кислота
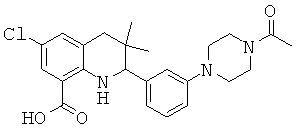
К смеси метилового эфира 2-(3-бром-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (410 мг, 1 ммоль), ацетата палладия (6,73 мг, 0,03 ммоль), карбоната цезия (0,65 г, 2 ммоль), Xantphos (4,5-бис(дифенилфосфино)-9,9-диметилксантена) (23 мг, 0,04 ммоль) и N-ацетилпиперазина (192 мг, 1,5 ммоль) в толуоле (10 мл) перемешивали при 120°С в течение 12 часов. Затем эту реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали насыщенным водным раствором хлорида натрия (2×50 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) получили метиловый эфир 2-[3-(4-ацетил-пиперазин-1-ил)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (0,25 г, 54%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H30ClN3O3 М+: 455,99; найдено: 456,1.
Смесь метилового эфира 2-[3-(4-ацетил-пиперазин-1-ил)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (247 мг, 0,54 ммоль), гидрата гидроксида лития (230 мг, 5,4 ммоль), воды (1,0 мл) в метаноле (2 мл) и тетрагидрофуране (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-[3-(4-ацетил-пиперазин-1-ил)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновую кислоту (62 мг, 26%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H28ClN3O3 М+: 441,96; найдено: 442,0.
Пример 82
6-Хлор-3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновая кислота
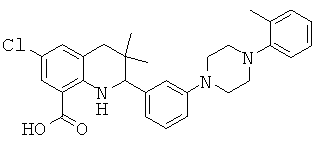
К смеси метилового эфира 2-(3-бром-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (410 мг, 1 ммоль), ацетата палладия (6,73 мг, 0,03 ммоль), карбоната цезия (0,65 г, 2 ммоль), Xantphos (23 мг, 0,04 ммоль) и гидрохлорида 1-(орто-толил)пиперазина (320 мг, 1,5 ммоль) в толуоле (10 мл) перемешивали при 120°С в течение 12 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали насыщенным водным раствором хлорида натрия (2×50 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) получили метиловый эфир 6-хлор-3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (0,36 г, 73%) в виде белого твердого вещества. LC/MS m/e: вычислено для C30H34ClN3O2 М+: 505,08; найдено: 504,2.
Смесь метилового эфира 6-хлор-3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (0,36 г, 0,73 ммоль), гидрата гидроксида лития (310 мг, 7,3 ммоль), воды (2,0 мл) в метаноле (3 мл) и тетрагидрофуране (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 6-хлор-3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновую кислоту (150 мг, 42%) в виде белого твердого вещества. LC/MS m/e: вычислено для C29H32ClN3O2 М+: 490,05; найдено: 490,1.
Пример 83
N-[2-(4'-трет-Бутил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид
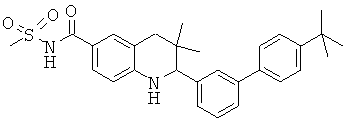
Смесь этилового эфира 4-амино-бензойной кислоты (16,5 г, 100 ммоль) и 3-бром-бензальдегида (18,5 г, 100 ммоль) в этаноле (100 мл) нагревали в условиях дефлегмации в течение 2 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-{[1-(3-бром-фенил)-метилиден]-амино}-бензойной кислоты (20 г, 60%) в виде белого твердого вещества. LC/MS m/e: вычислено для C16H14BrNO2 M+: 332,2; найдено: 332,0, 334,0.
К смеси этилового эфира 4-{[1-(3-бром-фенил)-метилиден]-амино}-бензойной кислоты (6,7 г, 20,1 ммоль) и гидрата трифлата иттербия(III) (1,25 г, 2,01 ммоль) в сухом тетрагидрофуране (15 мл) при 25°С по каплям добавляли изобутиральдегид (1,45 г, 20,1 ммоль) и воду (0,36 мл, 20,1 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(3-бром-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (8,12 г, 100%) в виде светло-желтого масла. LC/MS m/e: вычислено для C20H22BrNO3 M+: 404,3; найдено: 404,0, 406,0.
К смеси этилового эфира 2-(3-бром-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (8,12 г, 20,1 ммоль) и триэтилсилана (10 мл) при 25°С по каплям добавляли трифторуксусную кислоту (10 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2,9 г, 37%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H22BrNO2 M+: 388,3; найдено: 388,0, 390,0.
Смесь этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,50 г, 1,29 ммоль), 4-трет-бутилбензолбороновой кислоты (0,46 г, 2,58 ммоль), хлорида бис(трифенилфосфин)палладия(II) (91 мг, 0,13 ммоль) и 2М карбоната натрия (1,3 мл, 2,6 ммоль) в диоксане (5 мл) нагревали в течение 3 часов при 120°С. После охлаждения до комнатной температуры смесь обрабатывали этилацетатом (50 мл) и промывали водой (20 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(4'-трет-бутил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,28 г, 49%) в виде белого твердого вещества. LC/MS m/e: вычислено для C30H35NO2 (М+Н)+: 442,6; найдено: 442,2.
Смесь этилового эфира 2-(4'-трет-бутил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,28 г, 0,63 ммоль) в метаноле (7 мл) и тетрагидрофуране (5 мл), гидрата гидроксида лития (0,27 г, 6,3 ммоль) в воде (0,5 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением 2-(4'-трет-бутил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,18 г, 70%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C28H31NO2 (M+H)+: 414,6; найдено: 414,1.
Смесь 2-(4'-трет-бутил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (90 мг, 0,22 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (63 мг, 0,33 ммоль), 4-диметиламинопиридина (40 мг, 0,33 ммоль), метансульфонамида (63 мг, 0,66 ммоль) в дихлорметане (10 мл) нагревали в условиях дефлегмации в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили N-[2-(4'-трет-бутил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид (30 мг, 28%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C29H34N2O3S (М+Н)+: 491,67; найдено: 491,2.
Пример 84
2-(4'-Изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
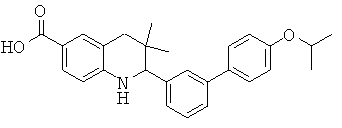
Смесь этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,43 г, 1,1 ммоль), 4-изопропокси-бензолбороновой кислоты (0,40 г, 2,2 ммоль), хлорида бис(трифенилфосфин)палладия(II) (77 мг, 0,11 ммоль) и 2М карбоната натрия (1,6 мл, 3,2 ммоль) в диоксане (10 мл) нагревали в течение 3 часов при 120°С. После охлаждения до комнатной температуры смесь обрабатывали этилацетатом (50 мл) и промывали водой (20 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(4'-изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,30 г, 62%) в виде белого твердого вещества. LC/MS m/e: вычислено для C29H33NO3 (М+Н)+: 444,6; найдено: 444,1.
Смесь этилового эфира 2-(4'-изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,30 г, 0,68 ммоль) в метаноле (2 мл) и тетрагидрофуране (15 мл) и гидрата гидроксида лития (0,28 г, 6,8 ммоль) в воде (1,0 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-(4'-изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (0,18 г, 65%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C27H29NO3 (М+Н)+: 416,5; найдено: 416,1.
Пример 85
N-[2-(4'-Изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид
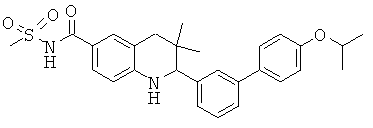
Смесь 2-(4'-изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (90 мг, 0,22 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (63 мг, 0,33 ммоль), 4-диметиламинопиридина (40 мг, 0,33 ммоль) и метансульфонамида (63 мг, 0,66 ммоль) в дихлорметане (10 мл) нагревали в условиях дефлегмации в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили N-[2-(4'-изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид (30 мг, 28%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C28H32N2O4S (М+Н)+: 493,64; найдено: 493,5.
Пример 86
[2-(4'-Изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты
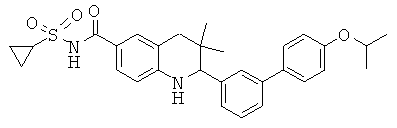
Смесь 2-(4'-изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (90 мг, 0,22 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (63 мг, 0,33 ммоль), 4-диметиламинопиридина (40 мг, 0,33 ммоль) и циклопропансульфонамида (80 мг, 0,66 ммоль) в дихлорметане (10 мл) нагревали в условиях дефлегмации в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили [2-(4'-изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты (25 мг, 22%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C30H34N2O4S (М+Н)+: 519,68; найдено: 519,4.
Пример 87
2-{3-[4-(4-Хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
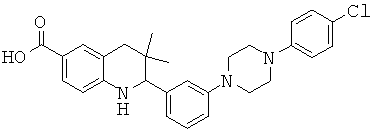
К смеси этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (388 мг, 1 ммоль), ацетата палладия (6,73 мг, 0,03 ммоль), карбоната цезия (0,65 г, 2 ммоль), Xantphos (23 мг, 0,04 ммоль) и гидрохлорида 1-(4-хлор-фенил)-пиперазина (350 мг, 1,5 ммоль) в толуоле (10 мл) перемешивали при 120°С в течение 12 часов. Затем эту реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали насыщенным водным раствором хлорида натрия (2×50 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) получили этиловый эфир 2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,20 г, 40%) в виде белого твердого вещества. LC/MS m/e: вычислено для C30H34ClN3O2 М+: 504,08; найдено: 504,2.
Смесь этилового эфира 2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,20 г, 0,40 ммоль), гидрата гидроксида лития (167 мг, 4,0 ммоль), воды (0,5 мл) в метаноле (1 мл) и тетрагидрофуране (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (100 мг, 53%) в виде белого твердого вещества. LC/MS m/e: вычислено для C28H30ClN3O2 М+: 476,02; найдено: 476,3.
Пример 88
N-(2-{3-[4-(4-Хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил)-метансульфонамид
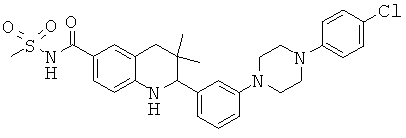
Смесь 2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,21 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (60,5 мг, 0,32 ммоль), 4-диметиламинопиридина (39 мг, 0,32 ммоль), метансульфонамида (60 мг, 0,63 ммоль) в дихлорметане (10 мл) нагревали в условиях дефлегмации в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили N-(2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил)-метансульфонамид (30 мг, 26%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C29H33ClN4O3S M+: 553,13; найдено: 553,2.
Пример 89
2-{3-[4-(2,4-Диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
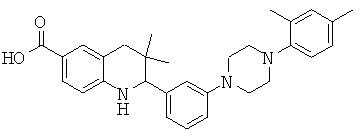
К смеси этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (388 мг, 1 ммоль), ацетата палладия (6,73 мг, 0,03 ммоль), карбоната цезия (0,65 г, 2 ммоль), Xantphos (23 мг, 0,04 ммоль) и гидрохлорида 1-(2,4-диметил-фенил)-пиперазина (285 мг, 1,5 ммоль) в толуоле (10 мл) перемешивали при 120°С в течение 12 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали насыщенным водным раствором хлорида натрия (2×50 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) получили этиловый эфир 2-{3-[4-(2,4-диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,20 г, 40%) в виде белого твердого вещества. LC/MS m/e: вычислено для C32H39N3O2 (М+Н)+: 498,7; найдено: 498,9.
Смесь этилового эфира 2-{3-[4-(2,4-диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,20 г, 0,40 ммоль), гидрата гидроксида лития (167 мг, 4,0 ммоль), воды (0,5 мл) в метаноле (1 мл) и тетрагидрофуране (10 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 2-{3-[4-(2,4-диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (150 мг, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C30H35N3O2 (M+H)+: 470,6; найдено: 470,4.
Пример 90
N-(2-{3-[4-(2,4-Диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил)-метансульфонамид
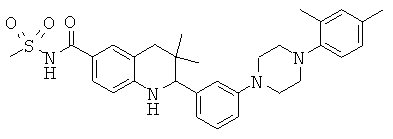
Смесь 2-{3-[4-(2,4-диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,21 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (61 мг, 0,32 ммоль), 4-диметиламинопиридина (39 мг, 0,32 ммоль) и метансульфонамида (60 мг, 0,63 ммоль) в дихлорметане (10 мл) нагревали в условиях дефлегмации в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили N-(2-{3-[4-(2,4-диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4 тетрагидрохинолин-6-карбонил)-метансульфонамид (34 мг, 30%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C31H38N4O3S (М+Н)+: 547,7; найдено: 547,2.
Пример 91
(2-{3-[4-(2,4-Диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил)-амид циклопропансульфоновой кислоты
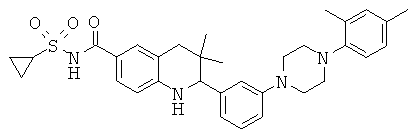
Смесь 2-{3-[4-(2,4-диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,21 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (61 мг, 0,32 ммоль), 4-диметиламинопиридина (39 мг, 0,32 ммоль) и циклопропансульфонамида (76 мг, 0,63 ммоль) в дихлорметане (10 мл) нагревали в условиях дефлегмации в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили (2-{3-[4-(2,4-диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил)-амид циклопропансульфоновой кислоты (30 мг, 25%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C33H40N4O3S (М+Н)+: 573,8; найдено: 573,3.
Пример 92
6-Фтор-3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновая кислота
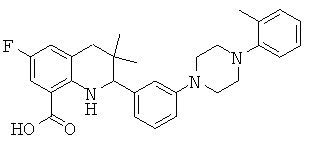
Смесь метилового эфира 2-амино-5-фтор-бензойной кислоты (15 г, 89 ммоль) и 3-бром-бензальдегида (16,4 г, 89 ммоль) в этаноле (200 мл) нагревали в условиях дефлегмации в течение 2 часов. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением метилового эфира 2-{[1-(3-бром-фенил)-метилиден]-амино}-5-фтор-бензойной кислоты (15,3 г, 52%) в виде белого твердого вещества. LC/MS m/e: вычислено для C15H11BrFNO2 M+: 336,2; найдено: 336,2.
К смеси метилового эфира 2-{[1-(3-бром-фенил)-метилиден]-амино}-5-фтор-бензойной кислоты (50 г, 59,8 ммоль) и гидрата трифлата иттербия(III) (3,7 г, 5,95 ммоль) в сухом тетрагидрофуране (30 мл) при 25°С по каплям добавляли изобутиральдегид (4,3 г, 59,5 ммоль) и воду (1,1 мл, 59,5 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 5 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 2-(3-бром-фенил)-6-фтор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (24,3 г, 100%) в виде светло-желтого масла. LC/MS m/e: вычислено для C19H19BrFNO3 М+: 408,3; найдено: 408,1.
К смеси метилового эфира 2-(3-бром-фенил)-6-фтор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (24,3 г, 59,5 ммоль) и триэтилсилана (20 мл) при 25°С по каплям добавляли трифторуксусную кислоту (20 мл). Полученную смесь перемешивали при 25°С в течение 1 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали насыщенным водным раствором бикарбоната натрия (2×50 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (5% этилацетат/гексаны) получили метиловый эфир 2-(3-бром-фенил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (10 г, 43%) в виде белого твердого вещества. LC/MS m/e: вычислено для C19H19BrFNO2 M+: 392,3; найдено: 391,9, 393,9.
Смесь метилового эфира 2-(3-бром-фенил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (1,0 г, 2,6 ммоль), ацетата палладия (17,5 мг, 0,078 ммоль), карбоната цезия (1,7 г, 5,2 ммоль), Xantphos (60,2 мг, 0,10 ммоль) и гидрохлорида 1-(орто-толил)пиперазина (830 мг, 3,9 ммоль) в толуоле (30 мл) перемешивали при 120°С в течение 12 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали насыщенным водным раствором хлорида натрия (2×50 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) получили метиловый эфир 6-фтор-3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,80 г, 63%) в виде белого твердого вещества. LC/MS m/e: вычислено для C30H34FN3O2 (М+Н)+: 488,6; найдено: 488,3.
Смесь метилового эфира 6-фтор-3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (0,80 г, 1,64 ммоль), гидрата гидроксида лития (690 мг, 16,4 ммоль), воды (1,0 мл) в метаноле (5 мл) и тетрагидрофуране (20 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 6-фтор-3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновую кислоту (400 мг, 52%) в виде белого твердого вещества. LC/MS m/e: вычислено для C29H32FN3O2 (М+Н)+: 474,6; найдено: 474,3.
Пример 93
N-(6-Хлор-2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил)-метансульфонамид
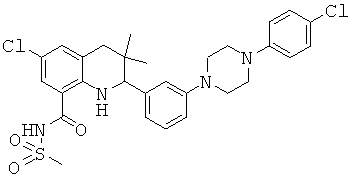
Смесь метилового эфира 2-(3-бром-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (410 мг, 1 ммоль), ацетата палладия (6,73 мг, 0,03 ммоль), карбоната цезия (0,65 г, 2 ммоль), xantphos (23 мг, 0,04 ммоль) и гидрохлорида 1-(4-хлор-фенил)пиперазина (350 мг, 1,5 ммоль) в толуоле (10 мл) перемешивали при 120°С в течение 12 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали насыщенным водным раствором хлорида натрия (2×50 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) получили метиловый эфир 6-хлор-2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (0,13 г, 25%) в виде белого твердого вещества. LC/MS m/e: вычислено для C29H31Cl2N3O2 M+: 524,5; найдено: 524,0.
Смесь метилового эфира 6-хлор-2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (0,13 г, 0,25 ммоль), гидрата гидроксида лития (104 мг, 2,5 ммоль), воды (0,5 мл) в метаноле (1 мл) и тетрагидрофуране (5 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×50 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 6-хлор-2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновую кислоту (100 мг, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C28H29Cl2N3O2 М+: 510,5; найдено: 510,0;
Смесь 2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,2 ммоль), гидрохлорида 1-3-диметиламинопропил-3-этилкарбодиимида (56 мг, 0,3 ммоль), 4-диметиламинопиридина (37 мг, 0,3 ммоль), метансульфонамида (57 мг, 0,6 ммоль) в дихлорметане (10 мл) нагревали в условиях дефлегмации в течение 12 часов. После удаления растворителя получили масляный остаток. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили N-(6-хлор-2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил)-метансульфонамид (44 мг, 37%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C29H32Cl2N4O3S (М+Н)+: 588,6; найдено: 589,2.
Пример 94
3,3-Диметил-2-[3-(4-ор/по-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновая кислота
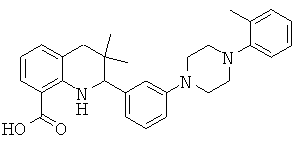
Смесь метилового эфира 2-(3-бром-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (410 мг, 1 ммоль), ацетата палладия (6,73 мг, 0,03 ммоль), карбоната цезия (0,65 г, 2 ммоль), Xantphos (23 мг, 0,04 ммоль) и гидрохлорида 1-(орто-толил)пиперазина (320 мг, 1,5 ммоль) в толуоле (10 мл) перемешивали при 120°С в течение 12 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×100 мл), промывали насыщенным водным раствором хлорида натрия (2×50 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (20% этилацетата/гексаны) получили метиловый эфир 3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (0,10 г, 21%) в виде белого твердого вещества. LC/MS m/e: вычислено для C30H35N3O2 (М+Н)+: 470,6; найдено: 470,6.
Смесь метилового эфира 3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (0,10 г, 0,21 ммоль), гидрата гидроксида лития (88 мг, 2,1 ммоль), воды (0,5 мл) в метаноле (1 мл) и тетрагидрофуране (5 мл) перемешивали при 60°С в течение 12 ч. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×20 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением масляного остатка. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор муравьиной кислоты в воде) получили 3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновую кислоту (30 мг, 31%) в виде белого твердого вещества. LC/MS m/e: вычислено для C29H33N3O2 (М+Н)+: 456,6; найдено: 456,3.
Пример 95
6-Хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновая кислота
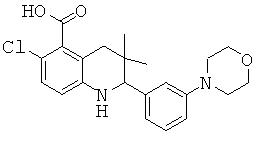
К перемешиваемому раствору 5-амино-2-хлор-бензойной кислоты (50 г, 291 ммоль) в метаноле (300 мл) по каплям добавляли тионилхлорид (45 мл, 605 ммоль) при 0°С. Затем эту смесь нагревали в условиях дефлегмации в течение 12 часов и после этого охлаждали до комнатной температуры. Затем реакционную смесь концентрировали в вакууме, и остаток растворяли в этилацетате (500 мл), промывали насыщенным водным раствором бикарбоната натрия (3×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 5-амино-2-хлор-бензойной кислоты (54 г, колич. выход) в виде палево-белого твердого вещества. LC/MS m/e: вычислено для C8H8ClNO2 (М+Н)+: 186,61; найдено: 185,9.
Раствор смеси метилового эфира 5-амино-2-хлор-бензойной кислоты (21 г, 113,2 ммоль), 3-бром-бензальдегида (21 г, 113,2 ммоль) и пара-толуолсульфоновой кислоты (431 мг, 2,2 ммоль) в толуоле (200 мл) нагревали в условиях дефлегмации в течение 12 часов. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением метилового эфира 5-[(3-бром-бензилиден)-амино]-2-хлор-бензойной кислоты (39,8 г, колич. выход) в виде палево-белого твердого вещества. MS: вычислено для C15H11BrClNO2 353,62, обнаружено (ESI+) [(M+H)+] 351,9 и 353,9.
К перемешиваемому раствору смеси метилового эфира 5-[(3-бром-бензилиден)-амино]-2-хлор-бензойной кислоты (39,8 г, 113,2 ммоль) и гидрата трифлата иттербия(III) (10,5 г, 16,9 ммоль) в сухом тетрагидрофуране (100 мл) при 25°С по каплям добавляли изобутиральдегид (10,4 мл, 113,2 ммоль) и воду (2,1 мл, 113,2 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 2-(3-бром-фенил)-6-хлор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (48 г, колич. выход) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C19H19BrClNO3 (М+Н)+: 425,73; найдено: 405,9 и 407,9.
К перемешиваемому раствору смеси метилового эфира 2-(3-бром-фенил)-6-хлор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (48 г, 113,2 ммоль) и триэтилсилана (60 мл) при 25°С по каплям добавляли трифторуксусную кислоту (30 мл). Полученную смесь перемешивали при 25°С в течение 3 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (4×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали, сушили в вакууме с получением метилового эфира 2-(3-бром-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (15 г, 32,6%) в виде белого твердого вещества. LC/MS m/e: вычислено для C19H19BrClNO2 (М+Н)+: 409,73; найдено: 407,9 и 409,9.
Смесь метилового эфира 2-(3-бром-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (1,2 г, 2,94 ммоль), морфолина (1,3 мл, 14,7 ммоль), йодида меди(1) (140 мг, 0,7 ммоль), гидрохлорида N,N-диметилглицина (206 мг, 1,5 ммоль) и карбоната калия (1,2 г, 8,8 ммоль) в диметилсульфоксиде (15 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением метилового эфира 6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (973 мг, 80%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C23H27ClN2O3 (М+Н)+: 415,94; найдено: 415,1.
К перемешиваемому раствору метилового эфир 6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (200 мг, 0,5 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (5,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (1,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновую кислоту (180 мг, 90%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C22H25ClN2O3 (М+Н)+: 401,91; найдено: 401,1.
Пример 96
N-{3,3-Диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид
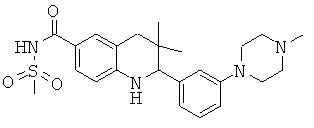
К суспензии 60% гидрида натрия (187 мг, 4,7 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли метансульфонамид (451 мг, 4,8 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (180 мг, 0,47 ммоль) и 1,1'-карбонилдиимидазола (155 мг, 1,0 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С.После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-{3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид (68 мг, 32%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H32N4O3S (М+Н)+: 457,61; найдено: 456,9.
Пример 97
[3,3-Диметил-2-(3-пиперазин-1-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты
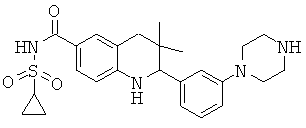
К суспензии 60% гидрида натрия (196 мг, 4,9 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли циклопропансульфонамид (605 мг, 5,0 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-(3-пиперазин-1-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (180 мг, 0,5 ммоль) и 1,1'-карбонилдиимидазола (162 мг, 1,0 ммоль) в Л/,Л/-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [3,3-диметил-2-(3-пиперазин-1 -ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты (74 мг, 32%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C25H32N4O3S (M+H)+: 469,61; найдено: 469,0.
Пример 98
[3,3-Диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид этансульфоновой кислоты
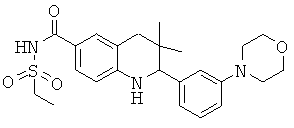
К суспензии 60% гидрида натрия (745 мг, 18,6 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли этансульфонамид (2,3 г, 19 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (690 мг, 1,9 ммоль) и 1,1'-карбонилдиимидазола (650 мг, 3,8 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию этансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°C в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид этансульфоновой кислоты (347 мг, 40%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H31N3O4S (М+Н)+: 458,61; найдено: 458,0.
Пример 99
3,3-Диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
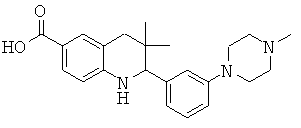
Смесь этилового эфира 4-амино-бензойной кислоты (33 г, 200 ммоль), 3-бром-бензальдегида (25,7 мл, 220 ммоль) и пара-толуолсульфоновой кислоты (760 мг, 4 ммоль) в толуоле (600 мл) нагревали в условиях дефлегмации в течение 12 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-[(3-бром-бензилиден)-амино]-бензойной кислоты (34 г, 51%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C16H14BrNO2 (М+Н)+: 333,20; найдено: 332,0 и 334,0.
К смеси этилового эфира 4-[(3-бром-бензилиден)-амино]-бензойной кислоты (29 г, 87 ммоль) и гидрата трифлата иттербия(III) (5,4 г, 8,7 ммоль) в сухом тетрагидрофуране (200 мл) при 25°С по каплям добавляли изобутиральдегид (8,8 мл, 96 ммоль) и воду (1,6 мл, 87 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(3-бром-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (30 г, 85%) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C20H22BrNO2 (М+Н)+: 405,31; найдено: 386,0 и 388,0.
К смеси этилового эфира 2-(3-бром-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (30 г, 74 ммоль) и триэтилсилана (50 мл) при 25°С по каплям добавляли трифторуксусную кислоту (15 мл). Полученную смесь перемешивали при 25°C в течение 4 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл) и сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали, сушили в вакууме с получением этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (15 г, 78%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H22BrNO2 (M+H)+: 389,31; найдено: 388,0 и 390,0.
Смесь этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (4,0 г, 10,3 ммоль), 1-метил-пиперазина (3,5 мл, 30,9 ммоль), йодида меди(1) (785 мг, 4,1 ммоль), гидрохлорида N,N-диметилглицина (1,2 г, 8,2 ммоль) и карбоната калия (6,1 г, 44,1 ммоль) в диметилсульфоксиде (30 мл) перемешивали при 120°С в течение 16 часов. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×200 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,4 г, 80%) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C25H33N3O2 (М+Н)+: 408,56; найдено: 408,2.
К перемешиваемому раствору этилового эфира 3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,0 г, 2,5 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (6,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (840 мг, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H29N3O2 (М+Н)+: 380,51; найдено: 380,0.
Пример 100
6-Хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновая кислота
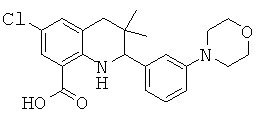
К перемешиваемому раствору 2-амино-5-хлор-бензойной кислоты (50 г, 291 ммоль) в метаноле (300 мл) по каплям добавляли тионилхлорид (45 мл, 605 ммоль) при 0°С. Затем этот раствор нагревали в условиях дефлегмации в течение 12 часов, после чего охлаждали его до комнатной температуры. Затем реакционную смесь концентрировали в вакууме, и остаток растворяли в этилацетате (500 мл), промывали насыщенным водным раствором бикарбоната натрия (3×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 2-амино-5-хлор-бензойной кислоты (54 г, колич. выход) в виде палево-белого твердого вещества. LC/MS m/e: вычислено для C8H8ClNO2 (M+H)+: 186,61; найдено: 185,9.
Раствор смеси метилового эфира 2-амино-5-хлор-бензойной кислоты (21 г, 113,2 ммоль), 3-бром-бензальдегида (21 г, 113,2 ммоль) и пара-толуолсульфоновой кислоты (431 мг, 2,2 ммоль) в толуоле (200 мл) нагревали в условиях дефлегмации в течение 12 часов. Затем эту реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением метилового эфира 2-[(3-бром-бензилиден)-амино]-5-хлор-бензойной кислоты (39,8 г, колич. выход) в виде палево-белого твердого вещества. MS: вычислено для C15H11BrClNO2 353,62; обнаружено (ESF) [(M+H)+] 351,9 и 353,9.
К перемешиваемому раствору смеси метилового эфира 2-[(3-бром-бензилиден)-амино]-5-хлор-бензойной кислоты (39,8 г, 113,2 ммоль) и гидрата трифлата иттербия(III) (10,5 г, 16,9 ммоль) в сухом тетрагидрофуране (100 мл) при 25°С по каплям добавляли изобутиральдегид (10,4 мл, 113,2 ммоль) и воду (2,1 мл, 113,2 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 2-(3-бром-фенил)-6-хлор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (48 г, колич. выход) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C19H19BrClNO3 (M+H)+: 425,73; найдено: 405,9 и 407,9.
К перемешиваемой смеси метилового эфира 2-(3-бром-фенил)-6-хлор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (48 г, 113,2 ммоль) и триэтилсилана (60 мл) при 25°С по каплям добавляли трифторуксусную кислоту (30 мл). Полученную смесь перемешивали при 25°С в течение 3 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (4×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали, сушили в вакууме с получением метилового эфира 2-(3-бром-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (23,1 г, 50%) в виде белого твердого вещества. LC/MS m/e: вычислено для C19H19BrClNO2 (M+H)+: 409,73; найдено: 407,9 и 409,9.
Смесь метилового эфира 2-(3-бром-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (5,6 г, 13,7 ммоль), морфолина (12 мл, 137 ммоль), йодида меди(1) (1,1 г, 5,4 ммоль), гидрохлорида N,N-диметилглицина (1,5 г, 10,9 ммоль) и карбоната калия (5,7 г, 41,1 ммоль) в диметилсульфоксиде (35 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением метилового эфира 6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (4,5 г, 80%) в виде желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C23H27ClN2O3 (М+Н)+: 415,94; найдено: 415,1.
К перемешиваемому раствору смеси метилового эфира 6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (400 мг, 1,0 ммоль) в метаноле (15,0 мл) и тетрагидрофуране (15,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновую кислоту (360 мг, 90%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C22H25ClN2O3 (М+Н)+: 401,91; найдено: 401,1.
Пример 101
[6-Хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбонил]-амид циклопропансульфоновой кислоты
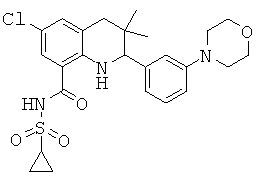
К суспензии 60% гидрида натрия (294 мг, 7,4 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли циклопропансульфонамид (908 мг, 7,5 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (300 мг, 0,75 ммоль) и 1,1'-карбонилдиимидазола (244 мг, 1,5 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбонил]-амид циклопропансульфоновой кислоты (113 мг, 30%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H30ClN3O4S (М+Н)+: 505,05; найдено: 504,0.
Пример 102
3,3-Диметил-2-(3-пиперазин-1-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
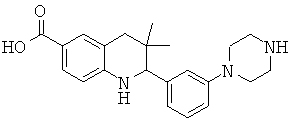
Смесь этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (4,0 г, 10,3 ммоль), пиперазина (4,5 г, 51,6 ммоль), йодида меди(1) (785 мг, 4,1 ммоль), гидрохлорида N,N-диметилглицина (1,2 г, 8,2 ммоль) и карбоната калия (4,3 г, 30,9 ммоль) в диметилсульфоксиде (20 мл) перемешивали при 120°С в течение 16 часов. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×200 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-(3-пиперазин-1-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,2 г, 80%) в виде светло-желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C24H31N3O2 (М+Н)+: 394,53; найдено: 394,1.
К перемешиваемому раствору этилового эфира 3,3-диметил-2-(3-пиперазин-1-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,0 г, 2,5 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (6,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 3,3-диметил-2-(3-пиперазин-1-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (820 мг, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H27N3O2 (М+Н)+: 366,48; найдено: 366,0.
Пример 103
N-[3,3-Диметил-2-(3-пиперазин-1-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид
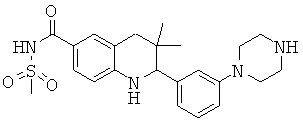
К суспензии 60% гидрида натрия (196 мг, 4,9 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли метансульфонамид (475 мг, 5 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-(3-пиперазин-1-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (180 мг, 0,5 ммоль) и 1,1'-карбонилдиимидазола (162 мг, 1,0 ммоль) в N,N-диметилформамиде (1,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-[3,3-диметил-2-(3-пиперазин-1-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид (66 мг, 30%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H30N4O3S (М+Н)+: 443,58; найдено: 442,9.
Пример 104
N-[6-Хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбонил]-метансульфонамид
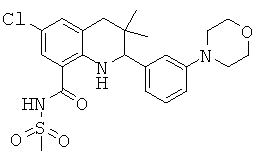
К суспензии 60% гидрида натрия (294 мг, 7,4 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли метансульфонамид (713 мг, 7,5 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (300 мг, 0,75 ммоль) и 1,1'-карбонилдиимидазола (244 мг, 1,5 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-[6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбонил]-метансульфонамид (107 мг, 30%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H30ClN3O4S (М+Н)+: 505,05; найдено: 504,0.
Пример 105
{2-[3-(2,6-Диметил-морфолин-4-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты
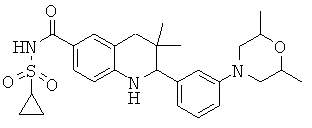
К суспензии 60% гидрида натрия (149 мг, 3,7 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли циклопропансульфонамид (460 мг, 3,8 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-[3-(2,6-диметил-морфолин-4-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (150 мг, 0,38 ммоль) и 1,1'-карбонилдиимидазола (125 мг, 0,76 ммоль) в N,N-диметилформамиде (1,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили {2-[3-(2,6-диметил-морфолин-4-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты (56 мг, 30%) в виде белого твердого вещества. LC/MS m/e: вычислено для C27H35N3O4S (М+Н)+: 498,66; найдено: 498,0.
Пример 106
2-[3-(2,6-Диметил-морфолин-4-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
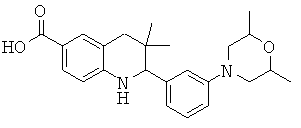
Смесь этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (4,0 г, 10,3 ммоль), 2,6-диметил-морфолина (6,4 мл, 51,6 ммоль), йодида меди(1) (785 мг, 4,1 ммоль), гидрохлорида N,N-диметилглицина (1,2 г, 8,2 ммоль) и карбоната калия (4,3 г, 30,9 ммоль) в диметилсульфоксиде (20 мл) перемешивали при 120°С в течение 16 часов. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×200 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением этилового эфира 2-[3-(2,6-диметил-морфолин-4-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,5 г, 80%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C26H34N2O3 (М+Н)+: 423,57; найдено: 423,0.
К перемешиваемому раствору этилового эфира 2-[3-(2,6-диметил-морфолин-4-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,9 г, 2,1 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (6,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-[3-(2,6-диметил-морфолин-4-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (745 мг, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H30N2O3 (М+Н)+: 395,52; найдено: 395,0.
Пример 107
(3-Гидрокси-3-метил-пирролидин-1-ил)-[2-(3-метокси-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-ил]-метанон
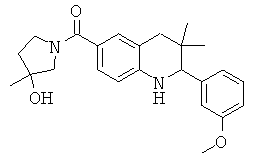
Раствор смеси метилового эфира 4-амино-бензойной кислоты (10,0 г, 66,2 ммоль), 3-метокси-бензальдегида (10,1 г, 72,7 ммоль) и пара-толуолсульфоновой кислоты (225 мг, 1,32 ммоль) в толуоле (200 мл) нагревали в условиях дефлегмации в течение 12 часов. Затем эту реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением метилового эфира 4-[(3-метокси-бензилиден)-амино]-бензойной кислоты (17,8 г, колич. выход) в виде палево-белого твердого вещества. MS: вычислено для C16H15NO3 (М+H)+: 270,3; обнаружено (ESI+) [(М+Н)+] 270,1.
К перемешиваемому раствору смеси метилового эфира 4-[(3-метокси-бензилиден)-амино]-бензойной кислоты (2,7 г, 10,0 ммоль) и гидрата трифлата иттербия(III) (620,3 мг, 1,0 ммоль) в сухом тетрагидрофуране (10 мл) при 25°С по каплям добавляли изобутиральдегид (0,93 мл, 10,2 ммоль) и воду (0,2 мл, 10,2 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 4-гидрокси-2-(3-метокси-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,4 г, колич. выход) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C20H23NO4 (M+H)+: 342,41; найдено: 324,2 и 342,2.
К перемешиваемой смеси метилового эфира 4-гидрокси-2-(3-метокси-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,4 г, 10,2 ммоль) и триэтилсилана (6,0 мл) при 25°С по каплям добавляли трифторуксусную кислоту (3,0 мл). Полученную смесь перемешивали при 25°С в течение 3 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (4×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали и сушили в вакууме с получением метилового эфира 2-(3-метокси-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,6 г, 50%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H23NO3 (М+Н)+: 326,41; найдено: 326,2.
К перемешиваемому раствору метилового эфира 2-(3-метокси-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,5, 4,6 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (5,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (1,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-(3-метокси-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (1,2 г, 90%) в виде белой пены. LC/MS m/e: вычислено для C19H21NO3 (M+H)+: 312,38; найдено: 312,2.
К перемешиваемому раствору 2-(3-метокси-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,32 ммоль), гексафторфосфата 2-(1Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония метанаминия (HATU) (243 мг, 0,64 ммоль) и триэтиламина (0,36 мл, 1,28 ммоль) в дихлорметане добавляли 3-метил-пирролидин-3-ол (66 мг, 0,38 ммоль) при комнатной температуре, и полученную смесь перемешивали при комнатной температуре в течение ночи. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили (3-гидрокси-3-метил-пирролидин-1-ил)-[2-(3-метокси-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-ил]-метанон (63 мг, 50%) в виде белой пены. LC/MS m/e: вычислено для C24H30N2O3 (M+H)+: 395,52; найдено: 395,2.
Пример 108
3,3-Диметил-2-пиридин-3-ил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
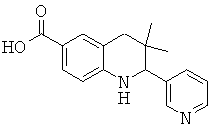
Смесь этилового эфира 4-амино-бензойной кислоты (33 г, 200 ммоль), пиридин-3-карбальдегида (24,0 г, 220 ммоль) и пара-толуолсульфоновой кислоты (760 мг, 4 ммоль) в толуоле (600 мл) нагревали в условиях дефлегмации в течение 12 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-[(пиридин-3-илметилен)-амино]-бензойной кислоты (51 г, колич. выход) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C15H14N2O2 (M+H)+: 255,29; найдено: 255,4.
К смеси этилового эфира 4-[(пиридин-3-илметилен)-амино]-бензойной кислоты (51 г, 200 ммоль) и гидрата трифлата иттербия(III) (12,4 г, 20 ммоль) в сухом тетрагидрофуране (200 мл) при 25°С по каплям добавляли изобутиральдегид (18,2 мл, 200 ммоль) и воду (3,6 мл, 200 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 4-гидрокси-3,3-диметил-2-пиридин-3-ил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (65,2 г, колич. выход) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C19H22N2O3 (М+Н)+: 327,40; найдено: 309,0.
К смеси этилового эфира 4-гидрокси-3,3-диметил-2-пиридин-3-ил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (62,5 г, 200 ммоль) и триэтилсилана (50 мл) при 25°С по каплям добавляли трифторуксусную кислоту (25 мл). Полученную смесь перемешивали при 25°С в течение 4 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали, сушили в вакууме с получением этилового эфира 3,3-диметил-2-пиридин-3-ил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (15 г, 24%) в виде белого твердого вещества. LC/MS m/e: вычислено для C19H22N2O2 (М+Н)+: 311,40; найдено: 311,1.
К перемешиваемому раствору этилового эфира 3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2,3 г, 7,5 ммоль) в метаноле (15,0 мл) и тетрагидрофуране (16,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 3,3-диметил-2-пиридин-3-ил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (1,9 г, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C17H18N2O2 (M+H)+: 283,35; найдено: 283,1.
Пример 109
2-(4'-Хлор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
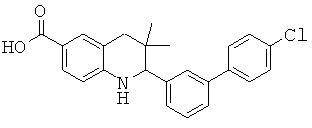
К смеси этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (4,0 г, 10,3 ммоль), 4-хлорфенилбороновой кислоты (2,1 г, 13,4 ммоль) и тетракис(трифенилфосфин)палладия(0) (1,2 г, 1,1 ммоль) в диоксане (10 мл) добавляли 2М раствор карбоната натрия в воде (10 мл, 20 ммоль). Полученную смесь подвергали воздействию микроволнового излучения в течение 60 мин при 110°С. Смесь разбавляли этилацетатом (150 мл), промывали насыщенным водным раствором бикарбоната натрия (30 мл × 2), рассолом, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(4'-хлор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,4 г, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C26H26ClNO2 (М+Н)+: 420,96; найдено: 420,5.
К перемешиваемому раствору этилового эфира 2-(4'-хлор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,5 г, 3,6 ммоль) в метаноле (15,0 мл) и тетрагидрофуране (16,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-(4'-хлор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (1,3 г, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H22ClNO2 (М+Н)+: 392,9; найдено: 392,2.
Пример 110
N-{3,3-Диметил-2-[3-(2-оксо-оксазолидин-3-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид
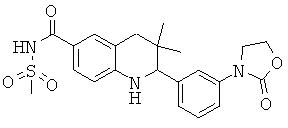
К перемешиваемому раствору этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (15 г, 38,7 ммоль) в метаноле (50,0 мл) и тетрагидрофуране (50,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (8,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (12,5 г, 90%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C18H18BrNO2 (M+H)+: 361,25; найдено: 360,0 и 362,0.
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (600 мг, 1,7 ммоль), оксазолидин-2-она (322 мг, 2,5 ммоль), йодида меди(I) (96 мг, 0,5 ммоль), гидрохлорида N,N-диметилглицина (140 мг, 1,0 ммоль) и карбоната калия (923 мг, 6,7 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 16 ч. Затем эту реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 3,3-диметил-2-[3-(2-оксо-оксазолидин-3-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (498 мг, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C21H22N2O4 (M+H)+: 367,42; найдено: 367,1.
К суспензии 60% гидрида натрия (106 мг, 2,6 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли метансульфонамид (257 мг, 2,7 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-[3-(2-оксо-оксазолидин-3-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,27 ммоль) и 1,1'-карбонилдиимидазола (87 мг, 0,55 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-{3,3-диметил-2-[3-(2-оксо-оксазолидин-3-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид (24 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H25N3O5S (М+Н)+: 444,53; найдено: 444,1.
Пример 111
8-Хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновая кислота
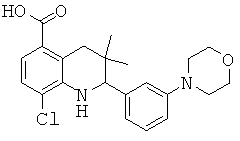
К перемешиваемому раствору 3-амино-4-хлор-бензойной кислоты (50 г, 291 ммоль) в метаноле (300 мл) по каплям добавляли тионилхлорид (45 мл, 605 ммоль) при 0°С. Затем эту смесь нагревали в условиях дефлегмации в течение 12 часов и после этого охлаждали до комнатной температуры. Затем реакционную смесь концентрировали в вакууме, и остаток растворяли в этилацетате (500 мл), промывали насыщенным водным раствором бикарбоната натрия (3×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 3-амино-4-хлор-бензойной кислоты (54 г, колич. выход) в виде палево-белого твердого вещества. LC/MS m/e: вычислено для C8H8ClNO2 (M+H)+: 186,61; найдено: 185,9.
Раствор смеси метилового эфира 3-амино-4-хлор-бензойной кислоты (21 г, 113,2 ммоль), 3-бром-бензальдегида (21 г, 113,2 ммоль) и пара-толуолсульфоновой кислоты (431 мг, 2,2 ммоль) в толуоле (200 мл) нагревали в условиях дефлегмации в течение 12 часов. Затем эту реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением метилового эфира 3-[(3-бром-бензилиден)-амино]-4-хлор-бензойной кислоты (39,8 г, колич. выход) в виде палево-белого твердого вещества. MS: вычислено для C15H11BrClNO2 353,62; найдено (ESI+) [(М+Н)+] 351,9 и 353,9.
К перемешиваемому раствору метилового эфира 3-[(3-бром-бензилиден)-амино]-4-хлор-бензойной кислоты (39,8 г, 113,2 ммоль) и гидрата трифлата иттербия(III) (10,5 г, 16,9 ммоль) в сухом тетрагидрофуране (100 мл) при 25°С по каплям добавляли изобутиральдегид (10,4 мл, 113,2 ммоль) и воду (2,1 мл, 113,2 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 2-(3-бром-фенил)-8-хлор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (48 г, колич. выход) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C19H19BrClNO3 (M+H)+: 425,73; найдено: 405,9 и 407,9.
К перемешиваемой смеси метилового эфира 2-(3-бром-фенил)-8-хлор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (48 г, 113,2 ммоль) и триэтилсилана (60 мл) при 25°С по каплям добавляли трифторуксусную кислоту (30 мл). Полученную смесь перемешивали при 25°С в течение 3 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (4×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали, сушили в вакууме с получением метилового эфира 2-(3-бром-фенил)-8-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (23,1 г, 50%) в виде белого твердого вещества. LC/MS m/e: вычислено для C19H19BrClNO2 (M+H)+: 409,73; найдено: 407,9 и 409,9.
Смесь метилового эфира 2-(3-бром-фенил)-8-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (1,2 г, 2,94 ммоль), морфолина (1,3 мл, 14,7 ммоль), йодида меди(I) (140 мг, 0,7 ммоль), гидрохлорида N,N-диметилглицина (206 мг, 1,5 ммоль) и карбоната калия (1,2 г, 8,8 ммоль) в диметилсульфоксиде (15 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением метилового эфира 8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (973 мг, 80%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C23H27ClN2O3 (М+Н)+: 415,94; найдено: 415,1.
К перемешиваемому раствору метилового эфира 8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (200 мг, 0,5 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (5,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (1,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновую кислоту (180 мг, 90%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C22H25ClN2O3 (М+Н)+: 401,91; найдено: 401,1.
Пример 112
8-Хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
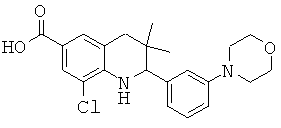
К перемешиваемому раствору 4-амино-3-хлор-бензойной кислоты (50 г, 291 ммоль) в метаноле (300 мл) по каплям добавляли тионилхлорид (45 мл, 605 ммоль) при 0°С. Затем эту смесь нагревали в условиях дефлегмации в течение 12 часов, после чего охлаждали до комнатной температуры. Затем реакционную смесь концентрировали в вакууме, и остаток растворяли в этилацетате (500 мл), промывали насыщенным водным раствором бикарбоната натрия (3×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 4-амино-3-хлор-бензойной кислоты (54 г, колич. выход) в виде палево-белого твердого вещества. LC/MS m/e: вычислено для C8H8ClNO2 (М+Н)+: 186,61; найдено: 185,9.
Раствор смеси метилового эфира 4-амино-3-хлор-бензойной кислоты (21 г, 113,2 ммоль), 3-бром-бензальдегида (21 г, 113,2 ммоль) и пара-толуолсульфоновой кислоты (431 мг, 2,2 ммоль) в толуоле (200 мл) нагревали в условиях дефлегмации в течение 12 часов. Затем эту реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением метилового эфира 4-[(3-бром-бензилиден)-амино]-3-хлор-бензойной кислоты (39,8 г, колич. выход) в виде палево-белого твердого вещества. MS: вычислено для C15H11BrClNO2 353,62; найдено: (Е5Г) [(М+Н)+] 351,9 и 353,9.
К перемешиваемому раствору метилового эфира 4-[(3-бром-бензилиден)-амино]-3-хлор-бензойной кислоты (39,8 г, 113,2 ммоль) и гидрата трифлата иттербия(III) (10,5 г, 16,9 ммоль) в сухом тетрагидрофуране (100 мл) при 25°С по каплям добавляли изобутиральдегид (10,4 мл, 113,2 ммоль) и воду (2,1 мл, 113,2 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 2-(3-бром-фенил)-8-хлор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (48 г, колич. выход) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C19H19BrClNO3 (M+H)+: 425,73; найдено: 405,9 и 407,9.
К перемешиваемой смеси метилового эфира 2-(3-бром-фенил)-8-хлор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (48 г, 113,2 ммоль) и триэтилсилана (60 мл) при 25°С по каплям добавляли трифторуксусную кислоту (30 мл). Полученную смесь перемешивали при 25°С в течение 3 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (4×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали, сушили в вакууме с получением метилового эфира 2-(3-бром-фенил)-8-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (23,1 г, 50%) в виде белого твердого вещества. LC/MS m/e: вычислено для C19H19BrClNO2 (M+H)+: 409,73; найдено: 407,9 и 409,9.
Смесь метилового эфира 2-(3-бром-фенил)-8-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,2 г, 2,94 ммоль), морфолина (1,3 мл, 14,7 ммоль), йодида меди(I) (140 мг, 0,7 ммоль), гидрохлорида N,N-диметилглицина (206 мг, 1,5 ммоль) и карбоната калия (1,2 г, 8,8 ммоль) в диметилсульфоксиде (15 мл) перемешивали при 120°С в течение 16 ч. Затем эту реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением метилового эфира 8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (973 мг, 80%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C23H27ClN2O3 (М+Н)+: 415,94; найдено: 415,1.
К перемешиваемому раствору метилового эфира 8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (700 мг, 1,8 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (5,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (1,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (630 мг, 90%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C22H25ClN2O3 (М+Н)+: 401,91; найдено: 401,1.
Пример 113
2-(3-Хлор-4-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
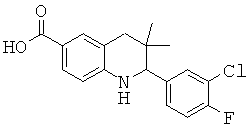
Раствор смеси этилового эфира 4-амино-бензойной кислоты (16,5 г, 100 ммоль), 3-хлор-4-фтор-бензальдегида (16,1 г, 100 ммоль) и пара-толуолсульфоновой кислоты (384 мг, 2,0 ммоль) в толуоле (200 мл) нагревали в условиях дефлегмации в течение 12 часов. Затем эту реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-[(3-хлор-4-фтор-бензилиден)-амино]-бензойной кислоты (30,8 г, колич. выход) в виде палево-белого твердого вещества. MS: вычислено для C16H13ClFNO2 306,74; найдено: (ESI+) [(М+Н)+] 306,1.
К перемешиваемому раствору смеси этилового эфира 4-[(3-хлор-4-фтор-бензилиден)-амино]-бензойной кислоты (3,1 г, 10,2 ммоль) и гидрата трифлата иттербия(III) (944 мг, 1,5 ммоль) в сухом тетрагидрофуране (10 мл) при 25°С по каплям добавляли изобутиральдегид (0,93 мл, 10,2 ммоль) и воду (0,2 мл, 10,2 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(3-хлор-4-фтор-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,8 г, колич. выход) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C20H21ClFNO3 (M+H)+: 378,85; найдено: 360,1 и 378,1.
К перемешиваемой смеси этилового эфира 2-(3-хлор-4-фтор-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,8 г, 10,2 ммоль) и триэтилсилана (6,0 мл) при 25°С по каплям добавляли трифторуксусную кислоту (3,0 мл). Полученную смесь перемешивали при 25°С в течение 3 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (4×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали и сушили в вакууме с получением этилового эфира 2-(3-хлор-4-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,8 г, 50%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H21ClFNO2 (M+H)+: 362,85; найдено: 362,2.
К перемешиваемому раствору этилового эфира 2-(3-хлор-4-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,0, 2,8 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (5,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (1,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-(3-хлор-4-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (840 мг, 90%) в виде белой пены. LC/MS m/e: вычислено для C17H17ClFNO2 (M+H)+: 334,79; найдено: 334,1.
Пример 114
[3,3-Диметил-2-(5-морфолин-4-ил-пиридин-3-ил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты
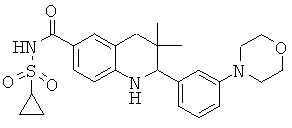
Смесь этилового эфира 4-амино-бензойной кислоты (16,5 г, 100 ммоль), 5-бром-пиридин-3-карбальдегида (18,6 г, 100 ммоль) и пара-толуолсульфоновой кислоты (380 мг, 2 ммоль) в толуоле (200 мл) нагревали в условиях дефлегмации в течение 12 ч. Затем эту реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-[(5-бром-пиридин-3-илметилен)-амино]-бензойной кислоты (33,8 г, колич. выход) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C15H13BrN2O2 (M+H)+: 334,19; найдено: 332,9 и 335,0.
К смеси этилового эфира 4-[(5-бром-пиридин-3-илметилен)-амино]-бензойной кислоты (33,8 г, 100 ммоль) и гидрата трифлата иттербия(III) (6,2 г, 10 ммоль) в сухом тетрагидрофуране (100 мл) при 25°С по каплям добавляли изобутиральдегид (9,2 мл, 100 ммоль) и воду (1,8 мл, 100 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(5-бром-пиридин-3-ил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (42,2 г, колич. выход) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C19H21BrN2O3 (M+H)+: 406,29; найдено: 405,0 и 406,9.
К смеси этилового эфира 2-(5-бром-пиридин-3-ил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (42,2 г, 100 ммоль) и триэтилсилана (30 мл) при 25°С по каплям добавляли трифторуксусную кислоту (15 мл). Полученную смесь перемешивали при 25°С в течение 4 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали, сушили в вакууме с получением этилового эфира 2-(5-бром-пиридин-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (11 г, 28,3%) в виде белого твердого вещества. LC/MS m/e: вычислено для C19H21BrN2O2 (M+H)+: 390,40; найдено: 389,0 и 391,0.
Смесь этилового эфира 2-(5-бром-пиридин-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (8,5 г, 21,94 ммоль), морфолина (19,1 мл, 219,3 ммоль), йодида меди(I) (1,7 г, 8,8 ммоль), гидрохлорида N,N-диметилглицина (2,5 г, 17,5 ммоль) и карбоната калия (9,1 г, 65,8 ммоль) в диметилсульфоксиде (35 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-(5-морфолин-4-ил-пиридин-3-ил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,5 г, 40,4%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C23H29N3O3 (М+Н)+: 396,53; найдено: 396,1.
К перемешиваемому раствору этилового эфира 3,3-диметил-2-(5-морфолин-4-ил-пиридин-3-ил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2,5 г, 6,5 ммоль) в метаноле (15,0 мл) и тетрагидрофуране (16,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 3,3-диметил-2-(5-морфолин-4-ил-пиридин-3-ил)-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (2,1 г, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C21H25N3O3 (М+Н)+: 368,45; найдено: 368,1.
К суспензии 60% гидрида натрия (535 мг, 13,7 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли циклопропансульфонамид (1,65 г, 13,8 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-(5-морфолин-4-ил-пиридин-3-ил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (500 мг, 1,38 ммоль) и 1,1'-карбонилдиимидазола (442 мг, 2,76 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [3,3-диметил-2-(5-морфолин-4-ил-пиридин-3-ил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты (256 мг, 40%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H30N4O4S (М+Н)+: 471,6; найдено: 471,1.
Пример 115
N-[8-Хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид
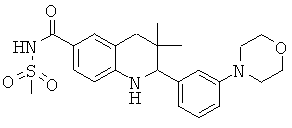
К суспензии 60% гидрида натрия (118 мг, 2,9 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли метансульфонамид (285 мг, 3,0 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (120 мг, 0,3 ммоль) и 1,1'-карбонилдиимидазола (98 мг, 0,6 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-[8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамид (43 мг, 30%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H28ClN3O4S (М+Н)+: 479,05; найдено: 478,1.
Пример 116
{3,3-Диметил-2-[3-(2-оксо-оксазолидин-3-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты
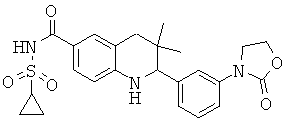
К суспензии 60% гидрида натрия (106 мг, 2,6 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли цикпопропансульфонамид (327 мг, 2,7 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-[3-(2-оксо-оксазолидин-3-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,27 ммоль) и 1,1'-карбонилдиимидазола (87 мг, 0,55 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили {3,3-диметил-2-[3-(2-оксо-оксазолидин-3-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты (25 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H27N3O5S (М+Н)+: 470,53; найдено: 470,4.
Пример 117
[6-Фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амид циклопропансульфоновой кислоты
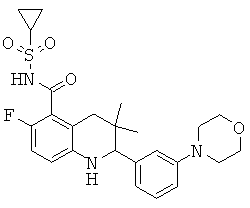
К суспензии 60% гидрида натрия (102 мг, 2,5 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли циклопропансульфонамид (315 мг, 2,6 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (100 мг, 0,26 ммоль) и 1,1'-карбонилдиимидазола (106 мг, 0,65 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°C в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амид циклопропансульфоновой кислоты (25,3 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H30FN3O4S (М+Н)+: 488,60; найдено: 488,1.
Пример 118
N-[6-Фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамид
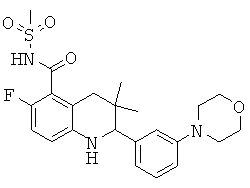
К суспензии 60% гидрида натрия (102 мг, 2,5 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли метансульфонамид (247 мг, 2,6 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (100 мг, 0,26 ммоль) и 1,1'-карбонилдиимидазола (106 мг, 0,65 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-[6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамид (36 мг, 30%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H28FN3O4S (М+Н)+: 462,56; найдено: 462,1.
Пример 119
2-[3-((S)-4-Изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
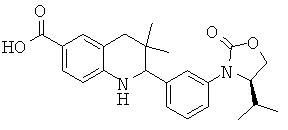
К перемешиваемому раствору этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (15 г, 38,7 ммоль) в метаноле (50,0 мл) и тетрагидрофуране (50,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (8,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (12,5 г, 90%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C18H18BrNO2 (М+Н)+: 361,25; найдено: 360,0 и 362,0.
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (600 мг, 1,7 ммоль), (S)-4-изопропил-2-оксазолидинона (322 мг, 2,5 ммоль), йодида меди(I) (96 мг, 0,5 ммоль), гидрохлорида N,N-диметилглицина (140 мг, 1,0 ммоль) и карбоната калия (923 мг, 6,7 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 16 ч. Затем эту реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-[3-((S)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (555 мг, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H28N2O4 (М+Н)+: 409,50; найдено: 409,1.
Пример 120
3,3-Диметил-2-{3-[метил-(2-метиламино-этил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
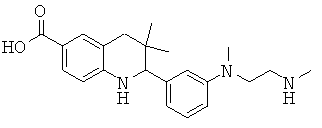
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (600 мг, 1,7 ммоль), N,N'-диметил-этан-1,2-диамина (0,37 мл, 3,4 ммоль), йодида меди(I) (96 мг, 0,5 ммоль), гидрохлорида N,N-диметилглицина (140 мг, 1,0 ммоль) и карбоната калия (923 мг, 6,7 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 3,3-диметил-2-{3-[метил-(2-метиламино-этил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (500 мг, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H29N3O2 (М+Н)+: 368,50; найдено: 368,1.
Пример 121
6-Фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновая кислота
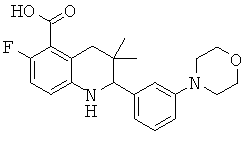
К перемешиваемому раствору 5-амино-2-фтор-бензойной кислоты (25 г, 161 ммоль) в метаноле (300 мл) по каплям добавляли тионилхлорид (30 мл, 403 ммоль) при 0°С. Затем эту смесь нагревали в условиях дефлегмации в течение 12 часов и после этого охлаждали до комнатной температуры. Затем реакционную смесь концентрировали в вакууме, и остаток растворяли в этилацетате (500 мл), промывали насыщенным водным раствором бикарбоната натрия (3×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 5-амино-2-фтор-бензойной кислоты (27,5 г, колич. выход) в виде палево-белого твердого вещества. LC/MS m/e: вычислено для C8H8FNO2 (М+Н)+: 170,16; найдено: 169,9.
Раствор смеси метилового эфира 5-амино-2-фтор-бензойной кислоты (26 г, 153,8 ммоль), 3-бром-бензальдегида (28,5 г, 153,8 ммоль) и пара-толуолсульфоновой кислоты (590 мг, 3,2 ммоль) в толуоле (200 мл) нагревали в условиях дефлегмации в течение 12 часов. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением метилового эфира 5-[(3-бром-бензилиден)-амино]-2-фтор-бензойной кислоты (51,7 г, колич. выход) в виде палево-белого твердого вещества. MS: вычислено для C15H11BrFINO2 337,16; найдено: (ESI+) [(М+Н)+] 336,0 и 338,0.
К перемешиваемому раствору смеси метилового эфира 5-[(3-бром-бензилиден)-амино]-2-фтор-бензойной кислоты (51,7 г, 153,8 ммоль) и гидрата трифлата иттербия(III) (14,3 г, 23,1 ммоль) в сухом тетрагидрофуране (100 мл) при 25°С по каплям добавляли изобутиральдегид (14 мл, 153,8 ммоль) и воду (2,8 мл, 153,8 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 2-(3-бром-фенил)-6-фтор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (63,0 г, колич. выход) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C19H19BrFNO3 (М+Н)+: 409,27; найдено: 390,0 и 392,0.
К перемешиваемой смеси метилового эфира 2-(3-бром-фенил)-6-фтор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (63,0 г, 154 ммоль) и триэтилсилана (60 мл) при 25°С по каплям добавляли трифторуксусную кислоту (30 мл). Полученную смесь перемешивали при 25°С в течение 3 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (4×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали и сушили в вакууме с получением метилового эфира 2-(3-бром-фенил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (30,2 г, 50%) в виде желтого масла. LC/MS m/e: вычислено для C19H19BrFNO2 (M+H)+: 393,27; найдено: 392,0 и 394,0.
Смесь метилового эфира 2-(3-бром-фенил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (6,0 г, 15,3 ммоль), морфолина (13,3 мл, 153 ммоль), йодида меди(1) (874 мг, 4,6 ммоль), гидрохлорида N,N-диметилглицина (1,3 г, 9,2 ммоль) и карбоната калия (8,5 г, 61,2 ммоль) в диметилсульфоксиде (15 мл) перемешивали при 120°С в течение 16 ч. Затем эту реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением метилового эфира 6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (4,8 г, 80%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C23H27FN2O3 (М+Н)+: 399,48; найдено: 399,1.
К перемешиваемому раствору метилового эфира 6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (400 мг, 1,0 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (5,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (1,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновую кислоту (345 мг, 90%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C22H25FN2O3 (М+Н)+: 385,45; найдено: 385,1.
Пример 122
2-[3-(R)-4-Изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
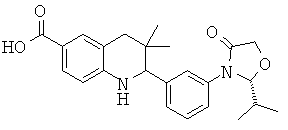
К перемешиваемому раствору этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (15 г, 38,7 ммоль) в метаноле (50,0 мл) и тетрагидрофуране (50,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (8,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (12,5 г, 90%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C18H18BrNO2 (M+H)+: 361,25; найдено: 360,0 и 362,0.
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (600 мг, 1,7 ммоль), (R)-4-изопропил-2-оксазолидинона (322 мг, 2,5 ммоль), йодида меди(I) (96 мг, 0,5 ммоль), гидрохлорида N,N-диметилглицина (140 мг, 1,0 ммоль) и карбоната калия (923 мг, 6,7 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 16 ч. Затем эту реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-[3-((R)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (555 мг, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H28N2O4 (M+H)+: 409,50; найдено: 409,1.
Пример 123
N-{2-[3-((R)-4-Изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид
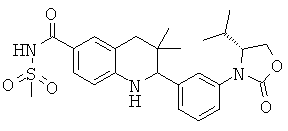
К суспензии 60% гидрида натрия (290 мг, 7,3 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли метансульфонамид (703 мг, 7,4 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-[3-((R)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (300 мг, 0,74 ммоль) и 1,1'-карбонилдиимидазола (300 мг, 1,84 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-{2-[3-((R)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид (71 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H31N3O5S (М+Н)+: 486,61; найдено: 486,1.
Пример 124
2-[3-((S)-4-Бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
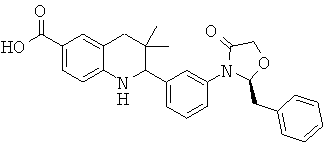
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (600 мг, 1,7 ммоль), (S)-4-бензил-оксазолидин-2-она (592 мг, 3,34 ммоль), йодида меди(1) (96 мг, 0,5 ммоль), гидрохлорида N,N-диметилглицина (140 мг, 1,0 ммоль) и карбоната калия (923 мг, 6,7 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 16 ч. Затем эту реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-[3-((S)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (609 мг, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C28H28N2O4 (М+Н)+: 457,55; найдено: 457,1.
Пример 125
{2-[3-((R)-4-Изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты
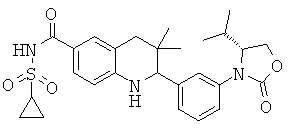
К суспензии 60% гидрида натрия (290 мг, 7,3 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли циклопропансульфонамид (895 мг, 7,4 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-[3-((R)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (300 мг, 0,74 ммоль) и 1,1'-карбонилдиимидазола (300 мг, 1,84 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили {2-[3-((R)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты (75 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C27H33N3O5S (М+Н)+: 512,65; найдено: 512,1.
Пример 126
3,3-Диметил-2-[3-(4-метил-2,3-диоксо-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
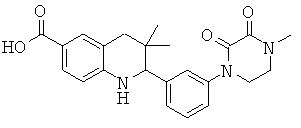
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (500 мг, 1,4 ммоль), 1-метил-пиперазин-2,3-диона (267 мг, 2,1 ммоль), йодида меди(I) (80 мг, 0,4 ммоль), гидрохлорида N,N-диметилглицина (117 мг, 0,8 ммоль) и карбоната калия (769 мг, 5,6 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 16 ч. Затем эту реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 3,3-диметил-2-[3-(4-метил-2,3-диоксо-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (456 мг, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H25N3O4 (М+Н)+: 408,47; найдено: 408,1.
Пример 127
2-[3-((R)-4-Бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
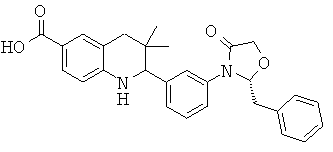
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (600 мг, 1,7 ммоль), (R)-4-бензил-оксазолидин-2-она (592 мг, 3,34 ммоль), йодида меди(I) (96 мг, 0,5 ммоль), гидрохлорида N,N-диметилглицина (140 мг, 1,0 ммоль) и карбоната калия (923 мг, 6,7 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 16 ч. Затем эту реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-[3-((R)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (609 мг, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C28H28N2O4 (М+Н)+: 457,55; найдено: 457,1.
Пример 128
N-{2-[3-((R)-4-Бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид
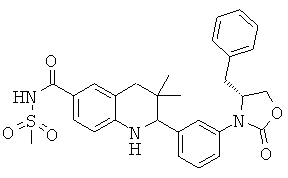
К суспензии 60% гидрида натрия (301 мг, 7,5 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли метансульфонамид (730 мг, 7,7 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-[3-((R)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (350 мг, 0,77 ммоль) и 1,1'-карбонилдиимидазола (310 мг, 1,9 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-{2-[3-((R)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид (82 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C29H31N3O5S (М+Н)+: 534,65; найдено: 534,1.
Пример 129
{3,3-Диметил-2-[3-(4-метил-2,3-диоксо-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты
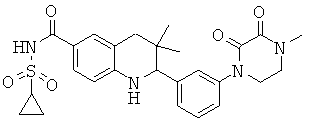
К суспензии 60% гидрида натрия (192 мг, 4,8 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли циклопропансульфонамид (593 мг, 4,9 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-[3-(4-метил-2,3-диоксо-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (200 мг, 0,5 ммоль) и 1,1'-карбонилдиимидазола (200 мг, 1,2 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамид, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили {3,3-диметил-2-[3-(4-метил-2,3-диоксо-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты (51 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C26H30N4O5S (М+Н)+: 511,62; найдено: 511,2.
Пример 130
{2-[3-((R)-4-Бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты
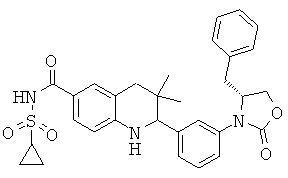
К суспензии 60% гидрида натрия (301 мг, 7,5 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли циклопропансульфонамид (930 мг, 7,7 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-[3-((R)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (350 мг, 0,77 ммоль) и 1,1'-карбонилдиимидазола (310 мг, 1,9 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили {2-[3-((R)4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты (86 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C31H33N3O5S (М+Н)+: 560,65; найдено: 560,1.
Пример 131
N-{3,3-Диметил-2-[3-(4-метил-2,3-диоксо-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид
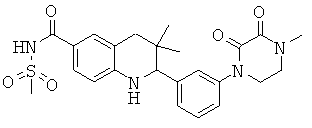
К суспензии 60% гидрида натрия (192 мг, 4,8 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли метансульфонамид (466 мг, 4,9 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-[3-(4-метил-2,3-диоксо-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (200 мг, 0,5 ммоль) и 1,1'-карбонилдиимидазола (200 мг, 1,2 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-{3,3-диметил-2-[3-(4-метил-2,3-диоксо-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид (51 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H28N4O5S (M+H)+: 485,58; найдено: 485,2.
Пример 132
{2-[3-((S)-4-Бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты
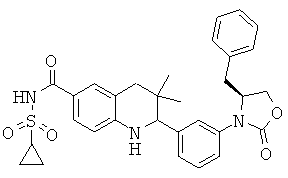
К суспензии 60% гидрида натрия (301 мг, 7,5 ммоль) в N,N-диметилформамиде (2,5 мл) добавляли циклопропансульфонамид (930 мг, 7,7 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-[3-((S)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (350 мг, 0,77 ммоль) и 1,1'-карбонилдиимидазола (310 мг, 1,9 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили {2-[3-((S)4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты (86 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C31H33N3O5S (М+Н)+: 560,65; найдено: 560,1.
Пример 133
[8-Хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амид циклопропансульфоновой кислоты
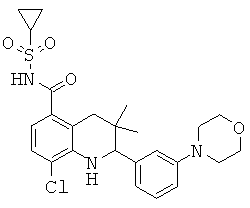
К суспензии 60% гидрида натрия (50 мг, 1,2 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли циклопропансульфонамид (151 мг, 1,3 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (50 мг, 0,13 ммоль) и 1,1'-карбонилдиимидазола (41 мг, 0,25 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амид циклопропансульфоновой кислоты (13 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H30ClN3O4S (М+Н)+: 505,05; найдено: 504,1.
Пример 134
7-Фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновая кислота
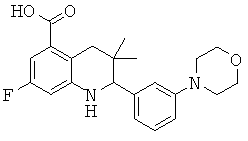
К перемешиваемому раствору 3-амино-5-фтор-бензойной кислоты (25 г, 161 ммоль) в метаноле (300 мл) по каплям добавляли тионилхлорид (30 мл, 403 ммоль) при 0°С. Затем эту смесь нагревали в условиях дефлегмации в течение 12 часов, после чего охлаждали до комнатной температуры. Затем реакционную смесь концентрировали в вакууме, и остаток растворяли в этилацетате (500 мл), промывали насыщенным водным раствором бикарбоната натрия (3×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 3-амино-5-фтор-бензойной кислоты (27,5 г, колич. выход) в виде палево-белого твердого вещества. LC/MS m/e: вычислено для C8H8FNO2 (M+H)+: 170,16; найдено: 169,9.
Раствор смеси метилового эфира 3-амино-5-фтор-бензойной кислоты (26 г, 153,8 ммоль), 3-бром-бензальдегида (28,5 г, 153,8 ммоль) и пара-толуолсульфоновой кислоты (590 мг, 3,2 ммоль) в толуоле (200 мл) нагревали в условиях дефлегмации в течение 12 часов. Затем эту реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением метилового эфира 3-[(3-бром-бензилиден)-амино]-5-фтор-бензойной кислоты (51,7 г, колич. выход) в виде палево-белого твердого вещества. MS: вычислено для C15H11BrFINO2 337,16; найдено: (ESI+) [(М+Н)+] 336,0 и 338,0.
К перемешиваемой смеси метилового эфира 3-[(3-бром-бензилиден)-амино]-5-фтор-бензойной кислоты (51,7 г, 153,8 ммоль) и гидрата трифлата иттербия(III) (14,3 г, 23,1 ммоль) в сухом тетрагидрофуране (100 мл) при 25°С по каплям добавляли изобутиральдегид (14 мл, 153,8 ммоль) и воду (2,8 мл, 153,8 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 2-(3-бром-фенил)-7-фтор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (63,0 г, колич. выход) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C19H19BrFNO3 (M+H)+: 409,27; найдено: 390,0 и 392,0.
К перемешиваемой смеси метилового эфира 2-(3-бром-фенил)-7-фтор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (63,0 г, 154 ммоль) и триэтилсилана (60 мл) при 25°С по каплям добавляли трифторуксусную кислоту (30 мл). Полученную смесь перемешивали при 25°С в течение 3 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (4×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали и сушили в вакууме с получением метилового эфира 2-(3-бром-фенил)-7-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (30,2 г, 50%) в виде желтого масла. LC/MS m/e: вычислено для C19H19BrFNO2 (M+H)+: 393,27; найдено: 392,0 и 394,0.
Смесь метилового эфира 2-(3-бром-фенил)-7-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (6,0 г, 15,3 ммоль), морфолина (13,3 мл, 153 ммоль), йодида меди(1) (874 мг, 4,6 ммоль), гидрохлорида N,N-диметилглицина (1,3 г, 9,2 ммоль) и карбоната калия (8,5 г, 61,2 ммоль) в диметилсульфоксиде (15 мл) перемешивали при 120°С в течение 16 ч. Затем эту реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением метилового эфира 7-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (4,8 г, 80%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C23H27FN2O3 (М+Н)+: 399,48; найдено: 399,1.
К перемешиваемому раствору метилового эфира 7-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (400 мг, 1,0 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (5,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (1,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 7-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновую кислоту (345 мг, 90%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C22H25FN2O3 (М+Н)+: 385,45; найдено: 385,1.
Пример 135
N-[7-Фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамид
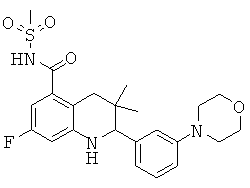
К суспензии 60% гидрида натрия (200 мг, 5,0 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли метансульфонамид (494 мг, 5,2 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 7-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (200 мг, 0,52 ммоль) и 1,1'-карбонилдиимидазола (170 мг, 1,04 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-[7-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамид (48 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H28FN3O4S (М+Н)+: 462,56; найдено: 462,1.
Пример 136
2-[3-(7-Бензил-4-оксо-5,6,7,8-тетрагидро-4Н-пиридо[3,4-d]пиримидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
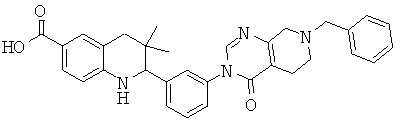
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (360 мг, 1,0 ммоль), 7-бензил-5,6,7,8-тетрагидро-3Н-пиридо[3,4-а]пиримидин-4-она (300 мг, 1,3 ммоль), йодида меди(I) (80 мг, 0,4 ммоль), гидрохлорида N,N-диметилглицина (117 мг, 0,8 ммоль) и карбоната калия (769 мг, 5,6 ммоль) в диметилсульфоксиде (5 мл) перемешивали при 120°С в течение 16 ч. Затем эту реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-[3-(7-бензил-4-оксо-5,6,7,8-тетрагидро-4Н-пиридо[3,4-d]пиримидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (320 мг, 61%) в виде белого твердого вещества. LC/MS m/e: вычислено для C32H32N4O3 (М+Н)+: 521,64; найдено: 521,2.
Пример 137
8-Фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-7-карбоновая кислота
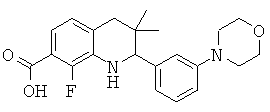
К перемешиваемому раствору 3-амино-2-фтор-бензойной кислоты (25 г, 161 ммоль) в метаноле (300 мл) по каплям добавляли тионилхлорид (30 мл, 403 ммоль) при 0°С. Затем эту смесь нагревали в условиях дефлегмации в течение 12 часов и после этого охлаждали до комнатной температуры. Затем реакционную смесь концентрировали в вакууме, и остаток растворяли в этилацетате (500 мл), промывали насыщенным водным раствором бикарбоната натрия (3×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 3-амино-2-фтор-бензойной кислоты (27,5 г, колич. выход) в виде палево-белого твердого вещества. LC/MS m/e: вычислено для C8H8FNO2 (M+H)+: 170,16; найдено: 169,9.
Раствор смеси метилового эфира 3-амино-2-фтор-бензойной кислоты (26 г, 153,8 ммоль), 3-бром-бензальдегида (28,5 г, 153,8 ммоль) и пара-толуолсульфоновой кислоты (590 мг, 3,2 ммоль) в толуоле (200 мл) нагревали в условиях дефлегмации в течение 12 часов. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением метилового эфира 3-[(3-бром-бензилиден)-амино]-2-фтор-бензойной кислоты (51,7 г, колич. выход) в виде палево-белого твердого вещества. MS: вычислено для C15H11BrFINO2 337,16; найдено: (ESF) [(М+Н)+] 336,0 и 338,0.
К перемешиваемой смеси метилового эфира 3-[(3-бром-бензилиден)-амино]-2-фтор-бензойной кислоты (51,7 г, 153,8 ммоль) и гидрата трифлата иттербия(III) (14,3 г, 23,1 ммоль) в сухом тетрагидрофуране (100 мл) при 25°С по каплям добавляли изобутиральдегид (14 мл, 153,8 ммоль) и воду (2,8 мл, 153,8 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 2-(3-бром-фенил)-8-фтор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-7-карбоновой кислоты (63,0 г, колич. выход) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C19H19BrFNO3 (M+H)+: 409,27; найдено: 390,0 и 392,0.
К перемешиваемой смеси метилового эфира 2-(3-бром-фенил)-8-фтор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-7-карбоновой кислоты (63,0 г, 154 ммоль) и триэтилсилана (60 мл) при 25°С по каплям добавляли трифторуксусную кислоту (30 мл). Полученную смесь перемешивали при 25°С в течение 3 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (4×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали, сушили в вакууме с получением метилового эфира 2-(3-бром-фенил)-8-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-7-карбоновой кислоты (30,2 г, 50%) в виде желтого масла. LC/MS m/e: вычислено для C19H19BrFNO2 (М+Н)+: 393,27; найдено: 392,0 и 394,0.
Смесь метилового эфира 2-(3-бром-фенил)-8-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-7-карбоновой кислоты (6,0 г, 15,3 ммоль), морфолина (13,3 мл, 153 ммоль), йодида меди(I) (874 мг, 4,6 ммоль), гидрохлорида N,N-диметилглицина (1,3 г, 9,2 ммоль) и карбоната калия (8,5 г, 61,2 ммоль) в диметилсульфоксиде (15 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением метилового эфира 8-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-7-карбоновой кислоты (4,8 г, 80%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C23H27FN2O3 (М+Н)+: 399,48; найдено: 399,1.
К перемешиваемому раствору метилового эфира 8-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-7-карбоновой кислоты (400 мг, 1,0 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (5,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (1,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 8-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-7-карбоновую кислоту (345 мг, 90%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C22H25FN2O3 (М+Н)+: 385,45; найдено: 385,1.
Пример 138
[7-Фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амид циклопропансульфоновой кислоты
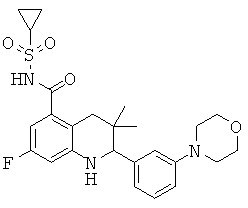
К суспензии 60% гидрида натрия (200 мг, 5,0 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли циклопропансульфонамид (630 мг, 5,2 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 7-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (200 мг, 0,52 ммоль) и 1,1'-карбонилдиимидазола (170 мг, 1,04 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [7-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амид циклопропансульфоновой кислоты (100 мг, 40%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H30FN3O4S (М+Н)+: 488,60; найдено: 488,1.
Пример 139
{6-Хлор-3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбонил}-амид циклопропансульфоновой кислоты
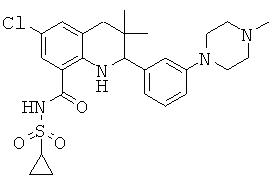
Раствор смеси метилового эфира 2-(3-бром-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (1,5 г, 3,7 ммоль), 1-метил-пиперазина (2,5 г, 14,7 ммоль), йодида меди(I) (282 мг, 1,48 ммоль), гидрохлорида N,N-диметилглицина (413 мг, 2,96 ммоль) и карбоната калия (5,6 г, 40,7 ммоль) в диметилсульфоксиде (8,0 мл) перемешивали при 120°С в течение 16 часов. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×200 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением метилового эфира 6-хлор-3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (1,3 г, 80%) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C24H30ClN3O2 (М+Н)+: 428,98; найдено: 428,1.
К перемешиваемому раствору метилового эфира 6-хлор-3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (1,0 г, 2,4 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (6,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 6-хлор-3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновую кислоту (892 мг, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H28ClN3O2 (М+Н)+: 414,95; найдено: 414,1.
К суспензии 60% гидрида натрия (114 мг, 2,8 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли циклопропансульфонамид (350 мг, 2,9 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 6-хлор-3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (120 мг, 0,3 ммоль) и 1,1'-карбонилдиимидазола (118 мг, 0,8 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили {6-хлор-3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбонил}-амид циклопропансульфоновой кислоты (62 мг, 40%) в виде белого твердого вещества. LC/MS m/e: вычислено для C26H33ClN4O3S (М+Н)+: 517,0; найдено: 517,1.
Пример 140
6-Хлор-2-(4'-изопропил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновая кислота
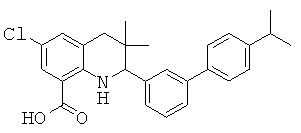
К смеси метилового эфира 2-(3-бром-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (680 мг, 1,67 ммоль), 4-изопропилфенилбороновой кислоты (320 мг, 2,0 ммоль) и тетракис(трифенилфосфин)палладия(0) (193 мг, 0,17 ммоль) в диоксане (5,0 мл) добавляли 2М раствор карбоната натрия в воде (1,7 мл). Полученную смесь подвергали воздействию микроволнового излучения в течение 2 ч при 110°С. Смесь разбавляли этилацетатом (200 мл), промывали насыщенным водным раствором бикарбоната натрия (50 мл × 2), рассолом, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили метиловый эфир 6-хлор-2-(4'-изопропил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (400 мг, 53,4%) в виде белого твердого вещества. LC/MS m/e: вычислено для C28H30ClNO2 (M+H)+: 449,01; найдено: 448,1.
К перемешиваемому раствору метилового эфира 6-хлор-2-(4'-изопропил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (400 мг, 0,9 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (6,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 6-хлор-2-(4'-изопропил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновую кислоту (351 мг, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C27H28ClNO2 (М+Н)+: 434,98; найдено: 434,0.
Пример 141
[6-Хлор-2-(4'-диметиламино-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил]-амид циклопропансульфоновой кислоты
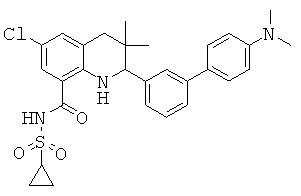
К смеси метилового эфира 2-(3-бром-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (680 мг, 1,67 ммоль), 4-диметиламинофенилбороновой кислоты (358 мг, 1,3 ммоль) и тетракис(трифенилфосфин)палладия(0) (193 мг, 0,17 ммоль) в диоксане (5,0 мл) добавляли 2М раствор карбоната натрия в воде (1,7 мл). Полученную смесь подвергали воздействию микроволнового излучения в течение 2 ч при 110°С. Смесь разбавляли этилацетатом (200 мл), промывали насыщенным водным раствором бикарбоната натрия (50 мл × 2), рассолом, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили метиловый эфир 6-хлор-2-(4'-диметиламино-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (524 мг, 70,0%) в виде белого твердого вещества. LC/MS m/e: вычислено для C27H29ClNO2 (М+Н)+: 450,01; найдено: 449,1.
К перемешиваемому раствору метилового эфира 6-хлор-2-(4'-диметиламино-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (400 мг, 0,9 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (6,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 6-хлор-2-(4'-диметиламино-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновую кислоту (351 мг, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C26H27ClN2O2 (М+Н)+: 435,98; найдено: 435,0.
К суспензии 60% гидрида натрия (91 мг, 2,2 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли циклопропансульфонамид (280 мг, 2,3 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 6-хлор-2-(4'-диметиламино-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (100 мг, 0,23 ммоль) и 1,1'-карбонилдиимидазола (94 мг, 0,58 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [6-хлор-2-(4'-диметиламино-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил]-амид циклопропансульфоновой кислоты (49 мг, 40%) в виде белого твердого вещества. LC/MS m/e: вычислено для C29H32ClN3O3S (М+Н)+: 539,11; найдено: 538,1.
Пример 142
2-(4'-трет-Бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновая кислота
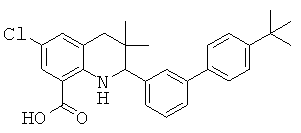
К раствору смеси метилового эфира 2-(3-бром-фенил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (1,0 г, 2,5 ммоль), 4-трет-бутилфенилбороновой кислоты (582 мг, 3,3 ммоль) и тетракис(трифенилфосфин)палладия(0) (289 мг, 0,25 ммоль) в диоксане (5,0 мл) добавляли 2М раствор карбоната натрия в воде (2,5 мл). Полученную смесь подвергали воздействию микроволнового излучения в течение 2 ч при 110°С. Смесь разбавляли этилацетатом (200 мл), промывали насыщенным водным раствором бикарбоната натрия (50 мл × 2), рассолом, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили метиловый эфир 2-(4'-трет-бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (924 мг, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C29H32ClNO2 (M+H)+: 463,04; найдено: 463,1.
К перемешиваемому раствору метилового эфира 2-(4'-трет-бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (600 мг, 1,3 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (6,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-(4'-трет-бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновую кислоту (524 мг, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C28H30ClNO2 (M+H)+: 449,01; найдено: 448,1.
Пример 143
[2-(4'-трет-Бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил]-амид циклопропансульфоновой кислоты
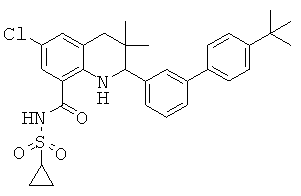
К суспензии 60% гидрида натрия (128 мг, 3,2 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли цикпопропансульфонамид (400 мг, 3,3 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-(4'-трет-бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (150 мг, 0,33 ммоль) и 1,1'-карбонилдиимидазола (136 мг, 0,84 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [2-(4'-трет-бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил]-амид циклопропансульфоновой кислоты (72 мг, 40%) в виде белого твердого вещества. LC/MS m/e: вычислено для C31H35ClN2O3S (М+Н)+: 552,11; найдено: 551,1.
Пример 144
N-[2-(4'-трет-Бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил]-метансульфонамид
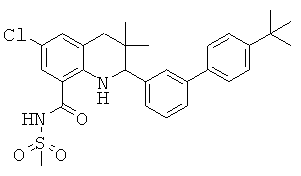
К суспензии 60% гидрида натрия (128 мг, 3,2 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли метансульфонамид (314 мг, 3,3 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-(4'-трет-бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (150 мг, 0,33 ммоль) и 1,1'-карбонилдиимидазола (136 мг, 0,84 ммоль) в N,N-диметилсрормамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-[2-(4'-трет-бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил]-метансульфонамид (69 мг, 40%) в виде белого твердого вещества. LC/MS m/e: вычислено для C29H33ClN2O3S (М+Н)+: 526,11; найдено: 525,1.
Пример 145
{2-[3-(5-Этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты
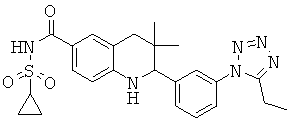
К суспензии 60% гидрида натрия (160 мг, 3,9 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли циклопропансульфонамид (484 мг, 4,0 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-[3-(5-этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (150 мг, 0,4 ммоль) и 1,1'-карбонилдиимидазола (136 мг, 0,84 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили {2-[3-(5-этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты (77 мг, 40%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H28N6O3S (М+Н)+: 481,59; найдено: 481,1.
Пример 146
N-{2-[3-(5-Этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид
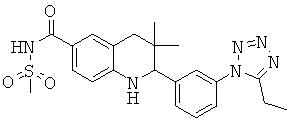
К суспензии 60% гидрида натрия (160 мг, 3,9 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли метансульфонамид (380 мг, 4,0 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-[3-(5-этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (150 мг, 0,4 ммоль) и 1,1'-карбонилдиимидазола (136 мг, 0,84 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-{2-[3-(5-этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид (72 мг, 40%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H26N6O3S (М+Н)+: 455,55; найдено: 455,2.
Пример 147
2-[3-(5-Бензил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
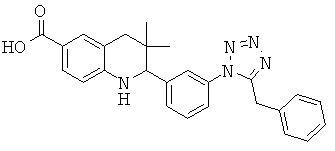
К перемешиваемому раствору фенилуксусной кислоты (850 мг, 6,2 ммоль), гексафторфосфата 2-(1Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония метанаминия (HATU) (3,5 г, 9,3 ммоль) и триэтиламина (2,6 мл, 18,6 ммоль) в дихлорметане (20 мл) добавляли этиловый эфир 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2,0 г, 6,2 ммоль) при комнатной температуре и перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-(3-фенилацетиламино-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2,7 г, колич. выход) в виде светло-желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C28H30N2O3 (М+Н)+: 443,56; найдено: 443,1.
К перемешиваемому раствору тетрахлорсилана (6,0 мл, 52 ммоль) и азида натрия (5,1 г, 78,1 ммоль) в сухом ацетонитриле (20 мл) добавляли этиловый эфир 3,3-диметил-2-(3-фенилацетиламино-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2,3 г, 5,2 ммоль) при комнатной температуре. Затем эту смесь перемешивали при комнатной температуре в течение ночи. Анализ методом LC/MS показал, что реакция прошла до конца. Реакционную смесь вливали в охлажденный в ледяной бане насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (40% этилацетата/гексаны) получили этиловый эфир 2-[3-(5-бензил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,4 г, 58,3%) в виде белого твердого вещества. LC/MS m/e: вычислено для C28H26N5O2 (М+Н)+: 468,58; найдено: 468,1.
К перемешиваемому раствору этилового эфира 2-[3-(5-бензил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,4 г, 3,0 ммоль) в метаноле (10,0 мл) и тетрагидрофуране (10,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-[3-(5-бензил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (1,2 г, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C26H25N5O2 (М+Н)+: 440,52; найдено: 440,2.
Пример 148
2-[3-(5-Этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
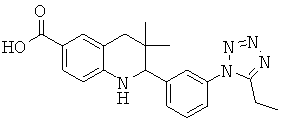
К перемешиваемому раствору этилового эфира 2-(3-амино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2,3 г, 7,1 ммоль) и пиридина (0,86 мл, 10,7 ммоль), растворенного в сухом дихлорметане (20 мл) добавляли ангидрид пропионовой кислоты (1,1 мл, 7,8 ммоль) при 0°С. Затем эту смесь перемешивали при комнатной температуре в течение 1 часа. Анализ методом LC/MS показал, что реакция прошла до конца. Реакционную смесь экстрагировали этилацетатом и поочередно промывали раствором сульфата меди(II) и рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-(3-пропиониламино-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2,7 г, колич. выход) в виде светло-желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C23H28N2O3 (М+Н)+: 381,49; найдено: 381,2.
К перемешиваемому раствору тетрахлорсилана (5,3 мл, 46,3 ммоль) и азида натрия (5,6 г, 87 ммоль) в сухом ацетонитриле (20 мл) добавляли этиловый эфир 3,3-диметил-2-(3-пропиониламино-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (2,2 г, 5,8 ммоль) при комнатной температуре. Затем эту смесь перемешивали при комнатной температуре в течение ночи. Анализ методом LC/MS показал, что реакция прошла до конца. Реакционную смесь вливали в охлажденный в ледяной бане насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (30% этилацетата/гексаны) получили этиловый эфир 2-[3-(5-этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,5 г, 66%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H27N5O2 (М+Н)+: 406,50; найдено: 406,2.
К перемешиваемому раствору этилового эфира 2-[3-(5-этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,5 г, 3,7 ммоль) в метаноле (10,0 мл) и тетрагидрофуране (10,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-[3-(5-этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (1,3 г, 90%) в виде желтоватого твердого вещества. LC/MS m/e: вычислено для C21H23N5O2 (M+H)+: 378,45; найдено: 378,2.
Пример 149
N-[7-Хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамид
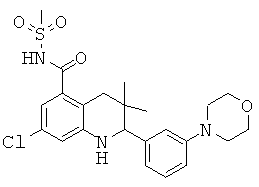
К перемешиваемому раствору 3-амино-5-хлор-бензойной кислоты (50 г, 291 ммоль) в метаноле (300 мл) по каплям добавляли тионилхлорид (45 мл, 605 ммоль) при 0°С. Затем эту смесь нагревали в условиях дефлегмации в течение 12 часов и после этого охлаждали до комнатной температуры. Затем реакционную смесь концентрировали в вакууме, и остаток растворяли в этилацетате (500 мл), промывали насыщенным водным раствором бикарбоната натрия (3×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 3-амино-5-хлор-бензойной кислоты (54 г, колич. выход) в виде палево-белого твердого вещества. LC/MS m/e: вычислено для C8H8ClNO2 (M+H)+: 186,61; найдено: 185,9.
Раствор смеси метилового эфира 3-амино-5-хлор-бензойной кислоты (21 г, 113,2 ммоль), 3-бром-бензальдегида (21 г, 113,2 ммоль) и пара-толуолсульфоновой кислоты (431 мг, 2,2 ммоль) в толуоле (200 мл) нагревали в условиях дефлегмации в течение 12 часов. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением метилового эфира 3-[(3-бром-бензилиден)-амино]-5-хлор-бензойной кислоты (39,8 г, колич. выход) в виде палево-белого твердого вещества. MS: вычислено для C15H11BrClNO2 353,62; найдено: (ESI+) [(М+Н)+] 351,9 и 353,9.
К перемешиваемой смеси метилового эфира 3-[(3-бром-бензилиден)-амино]-5-хлор-бензойной кислоты (39,8 г, 113,2 ммоль) и гидрата трифлата иттербия(III) (10,5 г, 16,9 ммоль) в сухом тетрагидрофуране (100 мл) при 25°С по каплям добавляли изобутиральдегид (10,4 мл, 113,2 ммоль) и воду (2,1 мл, 113,2 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 2-(3-бром-фенил)-7-хлор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (48 г, колич. выход) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C19H19BrClNO3 (M+H)+: 425,73; найдено: 405,9 и 407,9.
К перемешиваемой смеси метилового эфира 2-(3-бром-фенил)-7-хлор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (48 г, 113,2 ммоль) и триэтилсилана (60 мл) при 25°С по каплям добавляли трифторуксусную кислоту (30 мл). Полученную смесь перемешивали при 25°С в течение 3 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (4×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали, сушили в вакууме с получением метилового эфира 2-(3-бром-фенил)-7-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (15 г, 32,6%) в виде белого твердого вещества. LC/MS m/e: вычислено для C19H19BrClNO2 (M+H)+: 409,73; найдено: 407,9 и 409,9.
Смесь метилового эфира 2-(3-бром-фенил)-7-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (1,2 г, 2,94 ммоль), морфолина (1,3 мл, 14,7 ммоль), йодида меди(I) (140 мг, 0,7 ммоль), гидрохлорида N,N-диметилглицина (206 мг, 1,5 ммоль) и карбоната калия (1,2 г, 8,8 ммоль) в диметилсульфоксиде (15 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением метилового эфира 7-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (973 мг, 80%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C23H27ClN2O3 (М+Н)+: 415,94; найдено: 415,1.
К перемешиваемому раствору метилового эфира 7-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (800 мг, 0,5 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (5,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (1,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 7-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновую кислоту (720 мг, 90%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C22H25ClN2O3 (М+Н)+: 401,91; найдено: 401,1.
К суспензии 60% гидрида натрия (200 мг, 5,0 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли метансульфонамид (494 мг, 5,2 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 7-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (200 мг, 0,5 ммоль) и 1,1'-карбонилдиимидазола (170 мг, 1,04 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-[7-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамид (48 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C23H28ClN3O4S (М+Н)+: 478,01; найдено: 478,1.
Пример 150
[8-Фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амид циклопропансульфоновой кислоты
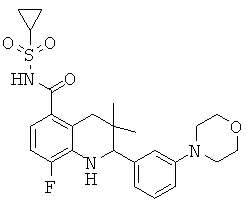
К перемешиваемому раствору 3-амино-4-фтор-бензойной кислоты (25 г, 161 ммоль) в метаноле (300 мл) по каплям добавляли тионилхлорид (30 мл, 403 ммоль) при 0°С. Затем эту смесь нагревали в условиях дефлегмации в течение 12 часов, после чего охлаждали до комнатной температуры. Затем реакционную смесь концентрировали в вакууме, и остаток растворяли в этилацетате (500 мл), промывали насыщенным водным раствором бикарбоната натрия (3×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 3-амино-4-фтор-бензойной кислоты (27,5 г, колич. выход) в виде палево-белого твердого вещества. LC/MS m/e: вычислено для C8H8FNO2 (M+H)+: 170,16; найдено: 169,9.
Раствор смеси метилового эфира 3-амино-4-фтор-бензойной кислоты (26 г, 153,8 ммоль), 3-бром-бензальдегида (28,5 г, 153,8 ммоль) и пара-толуолсульфоновой кислоты (590 мг, 3,2 ммоль) в толуоле (200 мл) нагревали в условиях дефлегмации в течение 12 часов. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением метилового эфира 3-[(3-бром-бензилиден)-амино]-4-фтор-бензойной кислоты (51,7 г, колич. выход) в виде палево-белого твердого вещества. MS: вычислено для C15H11BrFINO2 337,16; найдено: (ESI+) [(М+Н)+] 336,0 и 338,0.
К перемешиваемой смеси метилового эфира 3-[(3-бром-бензилиден)-амино]-4-фтор-бензойной кислоты (51,7 г, 153,8 ммоль) и гидрата трифлата иттербия(III) (14,3 г, 23,1 ммоль) в сухом тетрагидрофуране (100 мл) при 25°С по каплям добавляли изобутиральдегид (14 мл, 153,8 ммоль) и воду (2,8 мл, 153,8 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением метилового эфира 2-(3-бром-фенил)-8-фтор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (63,0 г, колич. выход) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C19H19BrFNO3 (M+H)+: 409,27; найдено: 390,0 и 392,0.
К перемешиваемой смеси метилового эфира 2-(3-бром-фенил)-8-фтор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (63,0 г, 154 ммоль) и триэтилсилана (60 мл) при 25°С по каплям добавляли трифторуксусную кислоту (30 мл). Полученную смесь перемешивали при 25°С в течение 3 часов. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (4×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали, сушили в вакууме с получением метилового эфира 2-(3-бром-фенил)-8-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (30,2 г, 50%) в виде желтого масла. LC/MS m/e: вычислено для C19H19BrFNO2 (М+H)+: 393,27; найдено: 392,0 и 394,0.
Смесь метилового эфира 2-(3-бром-фенил)-8-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (6,0 г, 15,3 ммоль), морфолина (13,3 мл, 153 ммоль), йодида меди(1) (874 мг, 4,6 ммоль), гидрохлорида N,N-диметилглицина (1,3 г, 9,2 ммоль) и карбоната калия (8,5 г, 61,2 ммоль) в диметилсульфоксиде (15 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением метилового эфира 8-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (4,8 г, 80%) в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C23H27FN2O3 (М+Н)+: 399,48; найдено: 399,1.
К перемешиваемому раствору метилового эфира 8-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (400 мг, 1,0 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (5,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (1,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 8-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновую кислоту (345 мг, 90%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C22H25FN2O3 (М+Н)+: 385,45; найдено: 385,1.
К суспензии 60% гидрида натрия (200 мг, 5,0 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли циклопропансульфонамид (630 мг, 5,2 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 8-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (200 мг, 0,52 ммоль) и 1,1'-карбонилдиимидазола (170 мг, 1,04 ммоль) в N,N-Диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [8-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амид циклопропансульфоновой кислоты (100 мг, 40%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H30FN3O4S (М+Н)+: 488,60; найдено: 488,1.
Пример 151
2-(4'-трет-Бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновая кислота
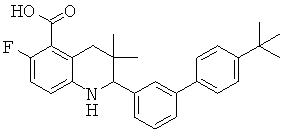
К раствору смеси метилового эфира 2-(3-бром-фенил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (1,0 г, 2,6 ммоль), 4-трет-бутилфенилбороновой кислоты (590 мг, 3,3 ммоль) и тетракис(трифенилфосфин)палладия(0) (289 мг, 0,25 ммоль) в диоксане (5,0 мл) добавляли 2М раствор карбоната натрия в воде (2,5 мл). Полученную смесь подвергали воздействию микроволнового излучения в течение 2 ч при 110°С. Смесь разбавляли этилацетатом (200 мл), промывали насыщенным водным раствором бикарбоната натрия (50 мл × 2), рассолом, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили метиловый эфир 2-(4'-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (926 мг, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C29H32FNO2 (М+Н)+: 446,58; найдено: 446,1.
К перемешиваемому раствору метилового эфира 2-(4'-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты (600 мг, 1,3 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (6,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-(4'-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновую кислоту (524 мг, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C28H30FNO2 (M+H)+: 432,56; найдено: 432,1.
Пример 152
3,3-Диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
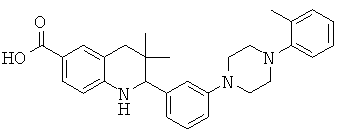
Смесь этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,2 г, 3,1 ммоль), 1-орто-толил-пиперазина (987 мг, 4,6 ммоль), йодида меди(I) (180 мг, 0,93 ммоль), гидрохлорида N,N-диметилглицина (260 мг, 1,86 ммоль) и карбоната калия (1,3 г, 9,3 ммоль) в диметилсульфоксиде (10 мл) перемешивали при 120°С в течение 16 часов. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×200 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением этилового эфира 3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,2 г, 80%) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C31H37N3O2 (М+Н)+: 484,56; найдено: 484,2.
К перемешиваемому раствору этилового эфира 3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,0 г, 2,1 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (6,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (850 мг, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C29H33N3O2 (М+Н)+: 456,61; найдено: 456,2.
Пример 153
{2-[3-(3-Фтор-азетидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты
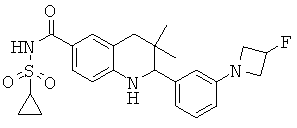
Смесь 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,2 г, 3,3 ммоль), 3-фтор-азетидина (740 мг, 6,6 ммоль), йодида меди(1) (190 мг, 1,0 ммоль), гидрохлорида N,N-диметилглицина (280 мг, 2,0 ммоль) и карбоната калия (1,8 г, 13,2 ммоль) в диметилсульфоксиде (10 мл) перемешивали при 120°С в течение 16 часов. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×200 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением 2-[3-(3-фтор-азетидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (934 мг, 80%) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C21H23FN2O2 (M+H)+: 355,43; найдено: 355,1.
К суспензии 60% гидрида натрия (165 мг, 4,1 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли циклопропансульфонамид (510 мг, 4,2 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-[3-(3-фтор-азетидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (150 мг, 0,42 ммоль) и 1,1'-карбонилдиимидазола (170 мг, 1,04 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили {2-[3-(3-фтор-азетидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амид циклопропансульфоновой кислоты (38 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C24H28FN3O3S (М+Н)+: 458,57; найдено: 458,1.
Пример 154
N-{2-[3-(3-Фтор-азетидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид
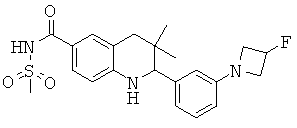
К суспензии 60% гидрида натрия (165 мг, 4,1 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли метансульфонамид (400 мг, 4,2 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-[3-(3-фтор-азетидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (150 мг, 0,42 ммоль), и 1,1'-карбонилдиимидазола (170 мг, 1,04 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-{2-[3-(3-фтор-азетидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид (36 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H26FN3O3S (М+Н)+: 432,51; найдено: 432,1.
Пример 155
N-{3,3-Диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамид
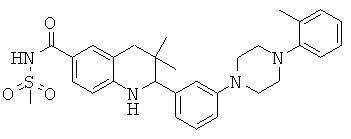
К суспензии 60% гидрида натрия (172 мг, 4,3 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли метансульфонамид (418 мг, 4,4 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (200 мг, 0,44 ммоль), и 1,1'-карбонилдиимидазола (170 мг, 1,04 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-{3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}метансульфонамид (46 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C30H36N4O3S (М+Н)+: 533,71; найдено: 533,2.
Пример 156
[2-(4'-трет-Бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбонил]-амид циклопропансульфоновой кислоты
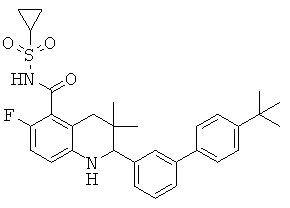
К суспензии 60% гидрида натрия (75 мг, 1,86 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли циклопропансульфонамид (242 мг, 1,9 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-(4'-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (80 мг, 0,19 ммоль) и 1,1'-карбонилдиимидазола (65 мг, 0,38 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [2-(4'-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбонил]-амид циклопропансульфоновой кислоты (21 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C31H35FN2O3S (М+Н)+: 535,70; найдено: 535,1.
Пример 157
N-[2-(4'-трет-Бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамид
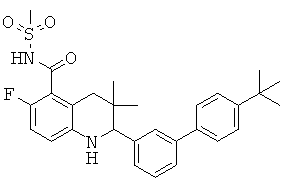
К суспензии 60% гидрида натрия (75 мг, 1,86 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли метансульфонамид (181 мг, 1,9 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-(4'-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты (80 мг, 0,19 ммоль) и 1,1'-карбонилдиимидазола (65 мг, 0,38 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили N-[2-(4'-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамид (19 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C29H33FN2O3S (М+Н)+: 509,66; найдено: 509,1.
Пример 158
3,3-Диметил-2-фенил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
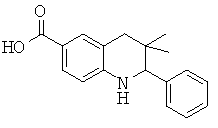
Смесь этилового эфира 4-амино-бензойной кислоты (3,3 г, 20,0 ммоль), бензальдегида (2,4 г, 22,0 ммоль) и пара-толуолсульфоновой кислоты (76 мг, 0,4 ммоль) в толуоле (60,0 мл) нагревали в условиях дефлегмации в течение 12 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-(бензилиден-амино)-бензойной кислоты (5,1 г, колич. выход) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C16H15NO2 (М+Н)+: 254,3; найдено: 254,1.
К смеси этилового эфира 4-(бензилиден-амино)-бензойной кислоты (5,1 г, 20,0 ммоль) и гидрата трифлата иттербия(III) (1,3 г, 2,0 ммоль) в сухом тетрагидрофуране (20,0 мл) при 25°С по каплям добавляли изобутиральдегид (18,2 мл, 200 ммоль) и воду (0,36 мл, 20,0 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 4-гидрокси-3,3-диметил-2-фенил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (6,6 г, колич. выход) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C20H23NO3 (М+Н)+: 326,40; найдено: 308,0.
К смеси этилового эфира 4-гидрокси-3,3-диметил-2-фенил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (6,5 г, 20,0 ммоль) и триэтилсилана (5,0 мл) при 25°С по каплям добавляли трифторуксусную кислоту (2,5 мл). Полученную смесь перемешивали при 25°С в течение 4 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали, сушили в вакууме с получением этилового эфира 3,3-диметил-2-фенил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,5 г, 24%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H23NO2 (М+Н)+: 310,40; найдено: 310,1.
К перемешиваемому раствору этилового эфира 3,3-диметил-2-фенил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (230 мг, 0,75 ммоль) в метаноле (2,5 мл) и тетрагидрофуране (3,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 3,3-диметил-2-фенил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (190 мг, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C18H19NO2 (M+H)+: 282,35; найдено: 282,1.
Пример 159
2-(4'-Изопропилкарбамоил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
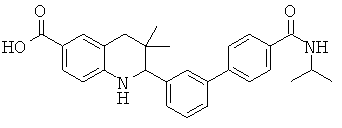
К смеси этилового эфира 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (4,0 г, 10,3 ммоль), 4-карбоксифенилбороновой кислоты (2,5 г, 15,4 ммоль) и тетракис(трифенилфосфин)палладия(0) (1,2 г, 1,1 ммоль) в диоксане (10 мл) добавляли 2М раствор карбоната натрия в воде (10 мл, 20 ммоль). Полученную смесь подвергали воздействию микроволнового излучения в течение 60 мин при 110°С. Смесь разбавляли этилацетатом (150 мл), промывали насыщенным водным раствором бикарбоната натрия (30 мл × 2), рассолом, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили этиловый эфир 2-(4'-карбокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (3,4 г, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C27H27NO4 (M+H)+: 430,52; найдено: 430,1.
К перемешиваемому раствору этилового эфира 2-(4'-карбокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (860 мг, 2 ммоль), гексафторфосфата 2-(1Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония метанаминия (HATU) (1,2 г, 3 ммоль) и триэтиламина (0,86 мл, 6 ммоль) в дихлорметане добавляли изопропиламин (0,66 мл, 8 ммоль) при комнатной температуре и перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(4'-изопропилкарбамоил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (940 мг, колич. выход) в виде светло-желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C30H34N2O3 (М+Н)+: 471,62; найдено: 471,2.
К перемешиваемому раствору этилового эфира 2-(4'-изопропилкарбамоил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (940 мг, 2 ммоль) в метаноле (15,0 мл) и тетрагидрофуране (16,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-(4'-изопропилкарбамоил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (795 мг, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C28H30N2O3 (М+Н)+: 443,56; найдено: 443,1.
Пример 160
трет-Бутиламид 3'-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-бифенил-4-карбоновой кислоты
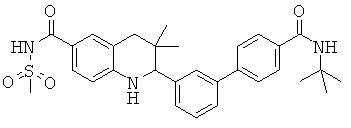
К суспензии 60% гидрида натрия (87 мг, 2,1 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли метансульфонамид (210 мг, 2,2 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-(4'-трет-бутилкарбамоил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,22 ммоль) и 1,1'-карбонилдиимидазола (72 мг, 0,44 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию метансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили трет-бутиламид 3'-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-бифенил-4-карбоновой кислоты (23 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C30H35N3O4S (M+H)+: 534,70; найдено: 534,1.
Пример 161
[2-(4'-Метансульфонил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты
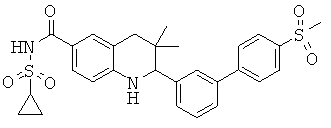
К смеси 2-(3-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (720 мг, 2,0 ммоль), 4-(метансульфонил)фенилбороновой кислоты (600 мг, 3,0 ммоль) и тетракис(трифенилфосфин)палладия(0) (347 мг, 0,3 ммоль) в диоксане (6 мл) добавляли 2М раствор карбоната натрия в воде (4 мл, 8 ммоль). Полученную смесь подвергали воздействию микроволнового излучения в течение 60 мин при 110°С. Смесь разбавляли этилацетатом (150 мл), промывали насыщенным водным раствором бикарбоната натрия (30 мл × 2), рассолом, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки флэш-хроматографией на силикагеле (силикагель от QingDao, 200-300 меш, стеклянная колонка компании Shanghai SD) (10% этилацетата/гексаны) получили 2-(4'-метансульфонил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (696 мг, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C25H25NO4S (М+Н)+: 436,55; найдено: 436,1.
К суспензии 60% гидрида натрия (91 мг, 2,2 ммоль) в N,N-диметилформамиде (1,5 мл) добавляли циклопропансульфонамид (278 мг, 2,3 ммоль) при комнатной температуре. Полученную смесь перемешивали при 25°С в течение 1 ч. Раствор 2-(4'-метансульфонил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,23 ммоль) и 1,1'-карбонилдиимидазола (75 мг, 0,46 ммоль) в N,N-диметилформамиде (2,0 мл) перемешивали при 70°С. После перемешивания при 70°С в течение 1 ч добавляли вышеуказанную суспензию циклопропансульфонамида и гидрида натрия в N,N-диметилформамиде, и эту смесь перемешивали при 25°С в течение 1 ч. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили [2-(4'-метансульфонил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амид циклопропансульфоновой кислоты (25 мг, 20%) в виде белого твердого вещества. LC/MS m/e: вычислено для C28H30N2O5S2 (М+Н)+: 539,69; найдено: 539,1.
Пример 162
2-(4'-трет-Бутилкарбамоил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
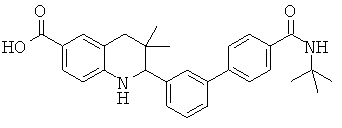
К перемешиваемому раствору этилового эфира 2-(4'-карбокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (860 мг, 2 ммоль), гексафторфосфата 2-(1Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония метанаминия (HATU) (1,2 г, 3 ммоль) и триэтиламина (0,86 мл, 6 ммоль) в дихлорметане добавляли трет-бутиламин (0,86 мл, 8 ммоль) при комнатной температуре и перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(4'-трет-бутилкарбамоил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (968 мг, колич. выход) в виде светло-желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C31H36N2O3 (М+Н)+: 485,62; найдено: 485,2.
К перемешиваемому раствору этилового эфира 2-(4'-трет-бутилкарбамоил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (968 мг, 2 ммоль) в метаноле (15,0 мл) и тетрагидрофуране (16,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (2,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-(4'-трет-бутилкарбамоил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (820 мг, 90%) в виде белого твердого вещества. LC/MS m/e: вычислено для C29H32N2O3 (М+Н)+: 457,56; найдено: 457,1.
Пример 163
2-[2-(1-Карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
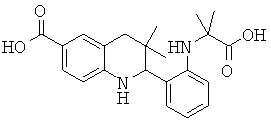
Смесь этилового эфира 4-амино-бензойной кислоты (33 г, 200 ммоль), 2-бром-бензальдегида (25,7 мл, 220 ммоль) и пара-толуолсульфоновой кислоты (760 мг, 4 ммоль) в толуоле (600 мл) нагревали в условиях дефлегмации в течение 12 ч. Затем реакционную смесь охлаждали до комнатной температуры. Растворитель удаляли в вакууме, и остаток промывали диэтиловым эфиром с получением этилового эфира 4-[(2-бром-бензилиден)-амино]-бензойной кислоты (34 г, 51%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C16H14BrNO2 (М+Н)+: 333,20; найдено: 332,0 и 334,0.
К смеси этилового эфира 4-[(2-бром-бензилиден)-амино]-бензойной кислоты (29 г, 87 ммоль) и гидрата трифлата иттербия(III) (5,4 г, 8,7 ммоль) в сухом тетрагидрофуране (200 мл) при 25°С по каплям добавляли изобутиральдегид (8,8 мл, 96 ммоль) и воду (1,6 мл, 87 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали рассолом, сушили над безводным сульфатом натрия и концентрировали в вакууме с получением этилового эфира 2-(2-бром-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (30 г, 85%) в виде светло-желтого масла, которое использовали на следующей стадии без дополнительной очистки. LC/MS m/e: вычислено для C20H22BrNO3 (М+Н)+: 405,31; найдено: 386,0 и 388,0.
К смеси этилового эфира 2-(2-бром-фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (30 г, 74 ммоль) и триэтилсилана (50 мл) при 25°С по каплям добавляли трифторуксусную кислоту (15 мл). Полученную смесь перемешивали при 25°С в течение 4 ч. Затем реакционную смесь концентрировали в вакууме, и остаток экстрагировали этилацетатом (2×200 мл), промывали насыщенным водным раствором бикарбоната натрия (2×100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растирали с метанолом. Полученный осадок собирали и сушили в вакууме с получением этилового эфира 2-(2-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (15 г, 78%) в виде белого твердого вещества. LC/MS m/e: вычислено для C20H22BrNO2 (М+Н)+: 389,31; найдено: 388,0 и 390,0.
К перемешиваемому раствору этилового эфира 2-(2-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,5 г, 3,8 ммоль) в метаноле (5,0 мл) и тетрагидрофуране (5,0 мл) добавляли 50%-ный раствор гидроксида натрия в воде (1,0 мл). Эту реакционную смесь перемешивали при 70°С в течение 6 часов. Смесь нейтрализовали 3 н. водным раствором соляной кислоты и экстрагировали этилацетатом (2×100 мл), промывали водой, сушили над безводным сульфатом натрия и затем концентрировали в вакууме с получением 2-(2-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (1,3 г, 90%) в виде светло-желтого твердого вещества. LC/MS m/e: вычислено для C18H18BrNO2 (M+H)+: 361,25; найдено: 360,0 и 362,0.
Смесь 2-(2-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (150 мг, 0,42 ммоль), йодида меди(I) (24 мг, 0,13 ммоль), 2-метилаланина (170 мг, 1,7 ммоль) и карбоната калия (174 мг, 1,26 ммоль) в диметилсульфоксиде (3 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-[2-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (128 мг, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H26N2O4 (М+Н)+: 383,46; найдено: 383,0.
Пример 164
2-[2-(1-Карбокси-циклопропиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
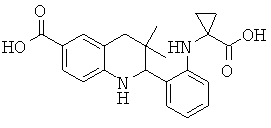
Смесь 2-(2-бром-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (150 мг, 0,42 ммоль), йодида меди(1) (24 мг, 0,13 ммоль), 1-аминоциклопропан-1-карбоксилата (170 мг, 1,7 ммоль) и карбоната калия (174 мг, 1,26 ммоль) в диметилсульфоксиде (3 мл) перемешивали при 120°С в течение 16 ч. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом (2×150 мл), промывали водой (2×50 мл) и насыщенным водным раствором хлорида аммония (2×50 мл), сушили над безводным сульфатом натрия и затем концентрировали в вакууме. После очистки на автоматизированной флэш-системе Waters (колонка: Xterra 30 мм × 100 мм, Sample Manager 2767, насос 2525, детектор: ZQ и UV 2487, система растворителей: ацетонитрил и 0,1%-ный раствор гидроксида аммония в воде) получили 2-[2-(1-карбокси-циклопропиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (128 мг, 80%) в виде белого твердого вещества. LC/MS m/e: вычислено для C22H24N2O4 (М+Н)+: 381,46; найдено: 381,1.
Пример 165
3,3-Диметил-2-(3-(1-метилпирролидин-3-илкабамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
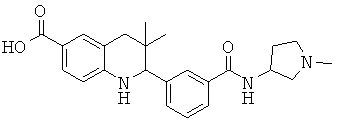
Смесь метил-3-формилбензоата (6,15 г, 37,46 ммоль) в метаноле (61,5 мл) и 2М водного раствора гидроксида натрия (37,5 мл, 75 ммоль) перемешивали при к.т. в течение 1 ч. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1) показала, что реакция прошла до конца. Реакционную смесь подкисляли 80 мл 1М водным раствором соляной кислоты до рН=2, и полученную смесь концентрировали в вакууме. Остаток экстрагировали этилацетатом 3 раза, и объединенные органические слои промывали рассолом, сушили над безводным сульфатом натрия. После удаления растворителя в вакууме получили 5,59 г 3-формилбензойной кислоты в виде белого твердого вещества. Выход: 99,5%.
К суспензии 3-формилбензойной кислоты (8,15 г, 54,3 ммоль, 1,0 экв.), 4-диметиламинопиридина (0,66 г, 5,43 ммоль, 0,1 экв.) в дихлорметане (122,5 мл) добавляли дициклогексилкарбодиимид (12,3 г, 59,71 ммоль, 1,1 экв.) в дихлорметане (81,5 мл), который находился в капельной воронке, при комнатной температуре в атмосфере азота. После окончания добавления полученную белую суспензию перемешивали в течение 1 ч. Тонкослойная хроматография (петролейный эфир:этилацетат=2:1) показала, что реакция прошла до конца. Реакционную смесь охлаждали до 0°С и фильтровали. Фильтрат промывали водой, водным раствором 10% ледяной уксусной кислоты/вода (однократно) и водой (4 раза). Объединенные органические слои сушили над безводным сульфатом натрия. Растворитель удаляли в вакууме, и остаток очищали колоночной хроматографией (петролейный эфир:этилацетат=10:1) с получением 10,63 г бензил-3-формилбензоата в виде бесцветного масла (выход: 81,5%).
К раствору метил-4-аминобензоата (7,94 г, 52,5 ммоль) в этаноле (100 мл) добавляли бензил-3-формилбензоат в этаноле (50 мл), и полученную смесь перемешивали при комнатной температуре в течение 2 ч. Выпавшее в осадок белое твердое вещество собирали фильтрованием, промывали этанолом и сушили в вакууме (50°С) с получением 15,6 г (Е)-бензил-3-((4-(метоксикарбонил)фенилимино)метил)бензоата в виде белого твердого вещества.
К раствору (Е)-бензил-3-((4-(метоксикарбонил)фенилимино)метил)бензоата (15,0 г, 40,1 ммоль, 1,0 экв.), трифторметансульфоната иттрия(III) (0,5 г, 0,8 ммоль, 0,02 экв.) в тетрагидрофуране (85 мл) в четырехгорлой колбе добавляли изобутилальдегид (3,18 г, 44,2 ммоль, 1,1 экв.) посредством шприца. Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=6:1) показала, что реакция прошла до конца. Реакционную смесь промывали водой, и водный слой экстрагировали этилацетатом (дважды). Органические слои промывали рассолом, сушили над безводным сульфатом натрия. Растворитель удаляли в вакууме, и остаток очищали колоночной хроматографией (петролейный эфир:этилацетат=5:1, затем 2:1) с получением 14,2 г метил-2-(3-(бензилоксикарбонил)фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. Выход: 78,9%. MS (ESI+APCI) M-17=428,1.
К раствору метил-2-(3-(бензилоксикарбонил)фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (14,0 г, 31,4 ммоль, 1,0 экв.), триэтилсилана (10,6 г, 91,4 ммоль, 2,91 экв.) в дихлорметане (240 мл), который находился в капельной воронке, в атмосфере азота ниже 0°С в течение 1 ч. Бесцветный раствор постепенно становился желтым. Полученной смеси давали возможность естественным образом нагреться до комнатной температуры в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=3:1) показала, что реакция прошла до конца. Реакционную смесь подщелачивали твердым карбонатом натрия до рН=7 и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали колоночной хроматографией (петролейный эфир:этилацетат=10:1) с получением 10,2 г метил-2-(3-(бензилоксикарбонил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого масла (выход: 75,6%). MS (ESI+APCI) M+1=430,2.
Смесь метил-2-(3-(бензилоксикарбонил)-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (10,2 г, 23,7 ммоль, 1,0 экв.), 2,04 г Pd/C в смеси метанол/тетрагидрофуран (об./об.=1/1, 102 мл) обрабатывали H2 при комнатной температуре в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=3:1) показала, что реакция прошла до конца. Смесь фильтровали, и фильтрат концентрировали в вакууме с получением 7,35 г 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты в виде белого твердого вещества (выход: 91,2%). MS (ESI+APCI) М+1=340,1.
К суспензии 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (150 мг, 0,44 ммоль) в дихлорметане (10 мл) добавляли N-гидроксибензотриазол (89,2 мг, 0,66 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (253 мг, 1,32 ммоль), затем добавляли 4-метилморфолин (133,5 мг, 1,32 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Затем в колбу добавляли 1-метилпирролидин-3-амин (66,1 мг, 0,66 ммоль), и реакционную смесь перемешивали в атмосфере азота в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1) и LC-MS показали, что реакция прошла до конца. Реакционную смесь гасили водой и экстрагировали дихлорметаном (дважды). Объединенные органические слои промывали 2% водным раствором гидроксида натрия (дважды) и водой (3 раза) и сушили над безводным сульфатом натрия. После удаления растворителя в вакууме получили 224 мг белого твердого вещества, которое растворяли в метаноле и обрабатывали боргидридом натрия (24 мг, 0,63 ммоль) в течение еще 3 ч. LC-MS показала, что реакция прошла до конца. Реакционную смесь гасили водой, экстрагировали смесью этилацетат/тетрагидрофуран и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 163 мг метил-3,3-диметил-2-(3-(1-метилпирролидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого твердого вещества, которое было достаточно чистым для использования на следующей стадии без дополнительной очистки.
Смесь метил-3,3-диметил-2-(3-(1-метилпирролидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (150 мг, 0,36 ммоль) в метаноле (6 мл) и 1 н. водного раствора гидроксида натрия (5,3 мл, 5,3 ммоль) нагревали в условиях дефлегмации в течение 4 ч. LC-MS показала, что реакция прошла до конца. Растворитель удаляли в вакууме, и остаток подкисляли 1 н. раствором соляной кислоты до рН=6. Выпавшее в осадок твердое вещество собирали фильтрованием и последовательно промывали ацетоном, дихлорметаном и диэтиловым эфиром с получением 78 мг 3,3-диметил-2-(3-(1-метилпирролидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 53,8%. LC-MS (М+1)=408,2.
Пример 166
3,3-Диметил-2-(3-(1-метилэтилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
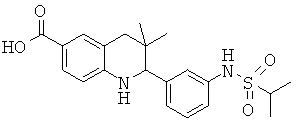
Метил-2-(3-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилат (100 мг, 0,32 ммоль) и гидроксид натрия (0,2 г, 5 ммоль) растворяли в смеси метанол/вода (10 мл/2 мл), и эту реакционную смесь оставляли нагреваться в условиях дефлегмации в течение 1,5 ч. Тонкослойная хроматография (петролейный эфир:этилацетат=3:1, Rf=0,1) показала, что реакция прошла до конца. Растворитель удаляли в вакууме, и остаток подкисляли 1М раствором соляной кислоты до рН=6. Выпавшее в осадок не совсем белое твердое вещество собирали фильтрованием и растворяли в 50 мл ацетона и сушили над сульфатом натрия. Отфильтрованный и концентрированный остаток подвергали перекристаллизации из смеси дихлорметан/гексан с получением 78 мг 2-(3-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты. Выход: 82,1%. MS (ES+APCI) M+1=297,1.
2-(3-Аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (100 мг, 0,34 ммоль) растворяли в 2 мл сухого пиридина в атмосфере азота. Затем в реакционную смесь по каплям добавляли пропан-2-сульфонилхлорид (0,1 мл, 0,89 ммоль). Реакционную смесь перемешивали в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1, Rf=0,5) показала, что реакция прошла до конца. Пиридин удаляли в вакууме, и остаток очищали колоночной хроматографией (петролейный эфир:этилацетат=1:1) с получением 50 мг 3,3-диметил-2-(3-(1-метилэтилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты. Выход: 36,8%. MS (ES+APCI) М+1=403,1.
Пример 167
3,3-Диметил-2-(3-(тетрагидрофуран-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
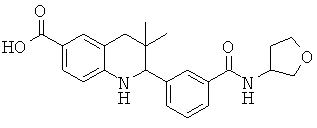
К суспензии 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (150 мг, 0,44 ммоль) в дихлорметане (10 мл) добавляли N-гидроксибензотриазол (89,2 мг, 0,66 ммоль) и соль 1-(3-диметиламинопропил)-3-этилкарбодиимида с соляной кислотой (253 мг, 1,32 ммоль), затем добавляли 4-метилморфолин (133,5 мг, 1,32 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Затем в колбу добавляли тетрагидрофуран-3-амин (57,5 мг, 0,66 ммоль), и реакционную смесь перемешивали в атмосфере азота в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1) и LC-MS показали, что реакция прошла до конца. Реакционную смесь гасили водой и экстрагировали дихлорметаном (дважды). Объединенные органические слои промывали 2% водным раствором гидроксида натрия (дважды) и водой (3 раза) и сушили над безводным сульфатом натрия. После удаления растворителя в вакууме получили 236 мг метил-3,3-диметил-2-(3-(тетрагидрофуран-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого твердого вещества, которое растворяли в метаноле и обрабатывали боргидридом натрия (24 мг, 0,63 ммоль) в течение еще 2 ч. LC-MS показала, что реакция прошла до конца. Реакционную смесь гасили водой, экстрагировали смесью этилацетат/тетрагидрофуран и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 192 мг целевого продукта в виде белого твердого вещества, которое было достаточно чистым для использования на следующей стадии без дополнительной очистки.
Смесь метил-3,3-диметил-2-(3-(тетрагидрофуран-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (185 мг, 0,44 ммоль) в метаноле (7,4 мл) и 1 н. водного раствора гидроксида натрия (6,6 мл, 6,6 ммоль) нагревали в условиях дефлегмации в течение 1 ч. LC-MS показала, что реакция прошла до конца. Растворитель удаляли в вакууме, и остаток подкисляли 1 н. раствором соляной кислоты до рН=6. Выпавшее в осадок твердое вещество собирали фильтрованием и промывали смесью дихлорметан/эфир с получением 125 мг 3,3-диметил-2-(3-(тетрагидрофуран-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 70%. LC-MS (М+1)=395,2.
Пример 168
3,3-Диметил-2-(4-(фенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
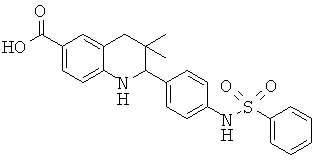
К смеси метил-2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (500 мг, 1,61 ммоль) в метаноле (10 мл) и воде (5 мл) добавляли раствор гидроксида натрия (1100 мг, 27,4 ммоль) в воде (15 мл). Полученную смесь нагревали в условиях дефлегмации до завершения реакции (контролировали тонкослойной хроматографией). Метанол удаляли под вакуумом. Остаток подкисляли 2М соляной кислотой до рН=1. Осадок собирали фильтрованием с получением 2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде желтого твердого вещества, 430 мг. Выход 94%.
К раствору 2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (100 мг, 0,34 ммоль) в пиридине (5 мл) добавляли бензолсульфонилхлорид (0,05 мл, 0,38 ммоль) посредством шприца с охлаждением в ледяной бане. По окончании добавления полученной смеси давали возможность нагреться до комнатной температуры при перемешивании в течение 24 ч. LC-MS показала, что реакция прошла до конца. Пиридин удаляли в вакууме, и остаток очищали препаративной тонкослойной хроматографией с получением 81 мг 3,3-диметил-2-(4-(фенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 65%. MS (ESI+APCI) М+1=437,54.
Пример 169
2-(3-(4-Ацетамидофенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
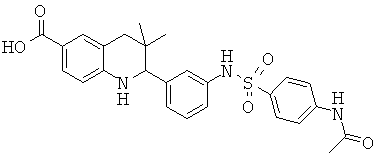
2-(3-Аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновую кислоту (100 мг, 0,34 ммоль) растворяли в 2 мл сухого пиридина в атмосфере азота. Затем в реакционную смесь по каплям добавляли 4-ацетамидобензол-1-сульфонилхлорид (209 мг, 0,85 ммоль). Реакционную смесь перемешивали в течение 20 ч. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1, Rf=0,5) показала, что реакция прошла до конца. Пиридин удаляли в вакууме, и остаток очищали колоночной хроматографией (петролейный эфир:этилацетат=1:1) с получением 85 мг 2-(3-(4-ацетамидофенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты. Выход: 51%. MS (ES+APCI) M+1=494,2.
Пример 170
2-(3-(Циклопропилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
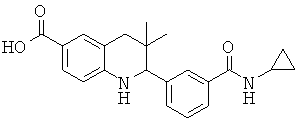
К суспензии 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (150 мг, 0,44 ммоль) в дихлорметане (10 мл) добавляли N-гидроксибензотриазол (89,2 мг, 0,66 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (253 мг, 1,32 ммоль), затем добавляли 4-метилморфолин (133,5 мг, 1,32 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Затем в колбу добавляли циклопропанамин (57,5 мг, 0,66 ммоль), и эту реакционную смесь перемешивали в атмосфере азота в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1) и LC-MS показали, что реакция прошла до конца. Реакционную смесь гасили водой и экстрагировали дихлорметаном (дважды). Объединенные органические слои промывали 2% водным раствором гидроксида натрия (дважды) и водой (3 раза) и сушили над безводным сульфатом натрия. После удаления растворителя в вакууме получили желтое масло, которое очищали перекристаллизацией из смеси дихлорметан/гексан/эфир с получением 118 мг метил-2-(3-(циклопропилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого кристаллического вещества. Выход: 70,5%.
Смесь метил-2-(3-(циклопропилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (115 мг, 0,30 ммоль) в метаноле (4,6 мл) и 1 н. водного раствора гидроксида натрия (4,5 мл, 4,5 ммоль) нагревали в условиях дефлегмации в течение 1,5 ч. LC-MS показала, что реакция прошла до конца. Растворитель удаляли в вакууме, и остаток подкисляли 1 н. раствором соляной кислоты до рН=6 и экстрагировали смесью этилацетат/тетрагидрофуран. Объединенные органические слои промывали рассолом и сушили над безводным сульфатом натрия. После удаления растворителя в вакууме получили 110 мг белого твердого вещества, которое промывали дихлорметаном с получением 70 мг 2-(3-(циклопропилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого порошка. Выход: 63,2%. LC-MS (М+1)=365,2.
Пример 171
3,3-Диметил-2-(3-(пирролидин-1-карбонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
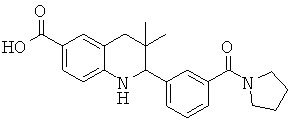
К суспензии 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (150 мг, 0,44 ммоль) в дихлорметане (10 мл) добавляли N-гидроксибензотриазол (89,2 мг, 0,66 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (253 мг, 1,32 ммоль), затем добавляли 4-метилморфолин (133,5 мг, 1,32 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Затем в колбу добавляли пирролидин (46,9 мг, 0,66 ммоль), и реакционную смесь перемешивали в атмосфере азота в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1) и LC-MS показали, что реакция прошла до конца. Реакционную смесь гасили водой и экстрагировали дихлорметаном (дважды). Объединенные органические слои промывали 2% водным раствором гидроксида натрия (дважды) и водой (3 раза) и сушили над безводным сульфатом натрия. После удаления растворителя в вакууме получили 196 мг желтого масла, которое растворяли в метаноле (3 мл) и обрабатывали боргидридом натрия (24 мг, 0,63 ммоль) в течение еще 3 ч. LC-MS показала, что реакция прошла до конца. Реакционную смесь гасили водой, экстрагировали смесью этилацетат/тетрагидрофуран и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 153 мг белого твердого вещества, которое подвергали перекристаллизации из смеси дихлорметан/гексан/эфир с получением 125 мг метил-3,3-диметил-2-(3-(пирролидин-1-карбонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата. Выход: 69,4%. MS (ESI+APCI) М+1=393,2.
Смесь метил-3,3-диметил-2-(3-(пирролидин-1-карбонил)-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (120 мг, 0,31 ммоль) в метаноле (4,8 мл) и 1 н. водного раствора гидроксида натрия (4,58 мл, 4,58 ммоль) нагревали в условиях дефлегмации в течение 2 ч. LC-MS показала, что реакция прошла до конца. Растворитель удаляли в вакууме, и остаток подкисляли 1 н. раствором соляной кислоты до рН=6. Выпавшее в осадок твердое вещество собирали фильтрованием и промывали дихлорметаном с получением 70 мг 3,3-диметил-2-(3-(пирролидин-1-карбонил)-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого порошка. Выход: 60,5%. LC-MS (М+1)=379,2.
Пример 172
2-(3-(Циклобутилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
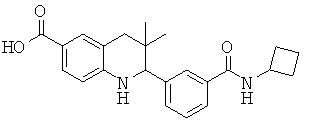
К суспензии 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (150 мг, 0,44 ммоль) в дихлорметане (10 мл) добавляли N-гидроксибензотриазол (89,2 мг, 0,66 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (253 мг, 1,32 ммоль), затем добавляли 4-метилморфолин (133,5 мг, 1,32 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Затем в колбу добавляли циклобутанамин (47 мг, 0,66 ммоль), и реакционную смесь перемешивали в атмосфере азота в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1) и LC-MS показали, что реакция прошла до конца. Реакционную смесь гасили водой и экстрагировали дихлорметаном (дважды). Объединенные органические слои промывали 2% водным раствором гидроксида натрия (дважды) и водой (3 раза) и сушили над безводным сульфатом натрия. После удаления растворителя в вакууме получили 290 мг желтого масла, которое растворяли в метаноле (3 мл) и обрабатывали боргидридом натрия (24 мг, 0,63 ммоль) в течение еще 3 ч. LC-MS показала, что реакция прошла до конца. Реакционную смесь гасили водой, экстрагировали смесью этилацетат/тетрагидрофуран и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 186 мг метил-2-(3-(циклобутилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата, который использовали на следующей стадии без дополнительной очистки. Выход: количественный. MS (ESI+APCI) М+1=393,2; 2М+1=785,3.
Смесь метил-2-(3-(циклобутилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (173 мг, 0,44 ммоль) в метаноле (6,9 мл) и 1 н. водного раствора гидроксида натрия (8,8 мл, 8,8 ммоль) нагревали в условиях дефлегмации в течение 2 ч. LC-MS показала, что реакция прошла до конца. Растворитель удаляли в вакууме, и остаток подкисляли 1 н. раствором соляной кислоты до рН=6 и экстрагировали смесью этилацетат/тетрагидрофуран. Объединенные органические слои промывали рассолом и сушили над безводным сульфатом натрия. После удаления растворителя в вакууме получили 159 мг белого твердого вещества, которое промывали смесью дихлорметан/эфир с получением 85 мг 2-(3-(циклобутилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого порошка. MS (ESI+APCI) М+1=379,2.
Пример 173
2-(3-(Изопропилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
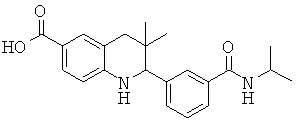
К суспензии 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-бензойной кислоты (150 мг, 0,44 ммоль) в дихлорметане (10 мл) добавляли N-гидроксибензотриазол (89,2 мг, 0,66 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (253 мг, 1,32 ммоль), затем добавляли 4-метилморфолин (133,5 мг, 1,32 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Затем в колбу добавляли пропан-2-амин (39 мг, 0,66 ммоль), и реакционную смесь перемешивали в атмосфере азота в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=3:1) и LC-MS показали, что реакция прошла до конца. Реакционную смесь гасили водой и экстрагировали дихлорметаном (дважды). Объединенные органические слои промывали 2% водным раствором гидроксида натрия (дважды) и водой (3 раза) и сушили над безводным сульфатом натрия. После удаления растворителя в вакууме получили 230 мг желтого масла, которое растворяли в метаноле (3 мл) и обрабатывали боргидридом натрия (23 мг, 0,6 ммоль) в течение еще 1 ч. LC-MS показала, что реакция прошла до конца. Реакционную смесь гасили водой, экстрагировали этилацетатом и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 175 мг белого твердого вещества, которое подвергали перекристаллизации из смеси эфир/гексан с получением 137 мг метил-2-(3-(изопропилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого кристаллического вещества. Выход: 81,4% (2 стадии). MS (ESI+APCI) М+1=381,2.
Смесь метил-2-(3-(изопропилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (120 мг, 0,315 ммоль) в метаноле (4,8 мл) и 2 н. водного раствора гидроксида натрия (3,2 мл, 6,4 ммоль) нагревали в условиях дефлегмации в течение 2 ч. Тонкослойная хроматография (петролейный эфир:этилацетат=3:1) и LC-MS показали, что реакция прошла до конца. Растворитель удаляли в вакууме с получением белого твердого вещества, которое растворяли в воде и подкисляли 1 н. раствором соляной кислоты до рН=6, экстрагировали смесью этилацетат/тетрагидрофуран, промывали рассолом и сушили над безводным сульфатом натрия. После удаления растворителя в вакууме получили 92 мг 2-(3-(изопропилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 80%. LC-MS (M+1)=367,2.
Пример 174
2-(4-Фтор-3-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
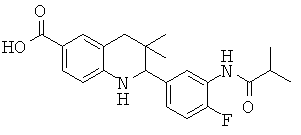
К раствору метил-2-(4-фтор-3-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (150 мг, 0,46 ммоль) и N,N-диизопропилэтиламина (0,15 мл, 0,91 ммоль) в дихлорметане (10 мл) с помощью шприца добавляли изобутирилхлорид (0,053 мл, 0,50 ммоль) при охлаждении в ледяной бане. Полученную смесь перемешивали в течение 20 ч. Растворитель удаляли в вакууме, и остаток очищали колоночной хроматографией (петролейный эфир:этилацетат=3:1) с получением 183 мг метил-2-(4-фтор-3-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата. Выход: 97%.
Смесь метил-2-(4-фтор-3-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (183 мг, 0,46 ммоль) и гидроксида натрия (312 мг, 7,8 ммоль) в смеси метанол/вода (10 мл/4 мл) нагревали в условиях дефлегмации в течение 1,5 ч. LC-MS показала, что исходное вещество не израсходовалось полностью. Растворитель удаляли в вакууме, и остаток подкисляли 2М раствором соляной кислоты дл рН=5. Выпавшее в осадок твердое вещество собирали фильтрованием, растворяли в ацетоне и сушили над безводным сульфатом магния. Растворитель удаляли в вакууме с получением 2-(4-фтор-3-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты, которую очищали перекристаллизацией из смеси дихлорметан/метанол/гексан с получением 140 мг не совсем белого кристаллического вещества. Выход: 79,3%. LC-MS (М+1)=385.
Пример 175
3,3-Диметил-2-(3-(фенилсульфонилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
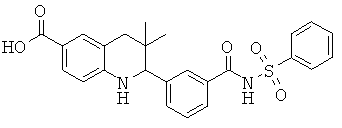
Раствор 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-бензойной кислоты (150 мг, 0,44 ммоль, 1,0 экв.) и 1,1'-карбонилдиимидазола (214 мг, 1,32 ммоль, 3,0экв.) в тетрагидрофуране (3 мл) нагревали до 60°С в течение 2 ч, затем охлаждали до комнатной температуры и обрабатывали бензолсульфонамидом (89,6 мг, 0,57 ммоль, 1,3 экв.). После перемешивания в течение 10 мин реакционную смесь обрабатывали добавлением по каплям раствора 1,8-диазабицикло[5.4.0]ундец-7-ена (221 мг, 1,45 ммоль, 3,3 экв.) в тетрагидрофуране (1 мл). После окончания добавления полученную смесь перемешивали в течение ночи. Тонкослойная хроматография (петролейный эфир: этилацетат=1:1) показала, что реакция прошла до конца. Реакционную смесь гасили рассолом и подкисляли 1 н. раствором соляной кислоты до рН=6 и экстрагировали этилацетатом (дважды). Объединенные органические слои промывали рассолом 3 раза и сушили над безводным сульфатом магния. После удаления растворителя в вакууме получили 252 мг метил-3,3-диметил-2-(3-(фенилсульфонилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого твердого вещества, которое было достаточно чистым для использования на следующей стадии без дополнительной очистки. MS (ESI+APCI) М+1=479,2.
Смесь метил-3,3-диметил-2-(3-(фенилсульфонилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (250 мг, 0,44 ммоль, 1,0 экв.) в метаноле (8 мл) и 1 н. водного раствора гидроксида натрия (6,6 мл, 6,6 ммоль, 15,0 экв.) нагревали в условиях дефлегмации в течение 1 ч. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1) и LC-MS показали, что реакция прошла до конца. Реакционную смесь концентрировали при пониженном давлении, и остаток подкисляли 1 М раствором соляной кислоты до рН=3. Выпавшее в осадок белое твердое вещество собирали фильтрованием и промывали ацетоном с получением 100 мг 3,3-диметил-2-(3-(фенилсульфонилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде не совсем белого твердого вещества. Выход: 50,4%. LC-MS (М+1)=465,1.
Пример 176
2-(3-(Циклопропилсульфонилкарбамоил)-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
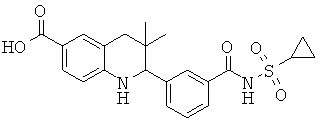
Раствор 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (150 мг, 0,44 ммоль) и 1,1'-карбонилдиимидазола (214 мг, 1,32 ммоль) в тетрагидрофуране (3 мл) нагревали до 60°С в течение 1,5 ч, затем охлаждали до комнатной температуры и обрабатывали циклопропансульфонамидом (69,1 мг, 0,57 ммоль). После перемешивания в течение 10 мин реакционную смесь обрабатывали добавлением по каплям раствора 1,8-диазабицикло[5.4.0]ундец-7-ена (221 мг, 1,45 ммоль) в тетрагидрофуране (1 мл). После окончания добавления полученную смесь перемешивали в течение еще 3 ч. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1) показала, что реакция прошла до конца. Реакционную смесь гасили рассолом, подкисляли 1 н. раствором соляной кислоты до рН=6 и экстрагировали этилацетатом (дважды). Объединенные органические слои промывали рассолом 3 раза и сушили над безводным сульфатом магния. После удаления растворителя в вакууме получили 216 мг метил-2-(3-(циклопропилсульфонилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого твердого вещества, которое было достаточно чистым для использования на следующей стадии без дополнительной очистки. MS (ESI+APCI) М+1=443,2.
Смесь метил-2-(3-(циклопропилсульфонилкарбамоил)-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (209 мг, 0,44 ммоль по теории) в метаноле (8 мл) и 1 н. водного раствора гидроксида натрия (6,6 мл, 6,6 ммоль) нагревали в условиях дефлегмации в течение 1 ч. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1) и LC-MS показали, что реакция прошла до конца. Реакционную смесь концентрировали при пониженном давлении, и остаток подкисляли 1М раствором соляной кислоты до рН=3. Выпавшее в осадок белое твердое вещество получали фильтрованием, и растворяли в дихлорметане и фильтровали. Фильтрат концентрировали в вакууме с получением 175 мг продукта в виде белого твердого вещества, которое промывали ацетоном с получением 65 мг 2-(3-(циклопропилсульфонилкарбамоил)-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты. Выход: 34,5%. MS (ESI+APCI) M+1=429,1.
Пример 177
2-(4-Хлор-3-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
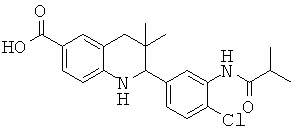
К раствору 4-хлор-3-нитробензальдегида (5,0 г, 27 ммоль) в 42 мл этанола добавляли метил-4-аминобензоат (4,07 г, 27 ммоль), и эту реакционную смесь перемешивали в течение выходных дней. Желтый осадок отфильтровывали и получили 8,47 г (Е)-метил-4-(4-хлор-3-нитробензилиденамино)бензоата в виде желтого твердого вещества (Выход=98%).
(Е)-Метил-4-(4-хлор-3-нитробензилиденамино)бензоат (8,47 г, 26,6 ммоль) и трифторметансульфонат иттрия(III) (800 мг, 1,33 ммоль) растворяли в сухом тетрагидрофуране (100 мл) и затем охлаждали до температуры ниже 0°С. При температуре ниже 0°С добавляли изобутилальдегид (2,30 г, 31,9 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение ночи. Тонкослойная хроматография показала, что большая часть исходного вещества израсходовалась. В смесь добавляли 50 мл этилацетата и 50 мл воды, и выделенный органический слой промывали рассолом. Органический слой сушили над сульфатом натрия и очищали на силикагеле с получением 4,9 г метил-2-(4-хлор-3-нитрофенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (Выход=47%). MS (ESI+APCI) M+1=373.
К раствору метил-2-(4-хлор-3-нитрофенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (8,2 г, 21 ммоль) в дихлорметане (150 мл), охлажденному до -10°С в атмосфере азота, добавляли триэтилсилан (7,08 г, 60,9 ммоль) и трифторуксусную кислоту (9,82 г, 86,1 ммоль). Полученную реакционную смесь перемешивали в течение ночи при комнатной температуре. Смесь нейтрализовали добавлением 20 г бикарбоната натрия. Твердое вещество отфильтровывали, и фильтрат упаривали для удаления растворителя. Остаток растворяли в метаноле, и нерастворимое вещество представляло собой неочищенный продукт (3,0 г). Фильтрат очищали на силикагеле с получением 170 мг метил-2-(4-хлор-3-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата.
К раствору метил-2-(4-хлор-3-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (2,82 г, 7,53 ммоль) в смеси этанол/вода (30 мл/7,5 мл) добавляли 0,5 мл концентрированного раствора соляной кислоты и порошок железа (4,21 г, 75,3 ммоль). Полученную смесь перемешивали и нагревали в условиях дефлегмации в течение 4 ч. LC-MS показала, что реакция прошла до конца. Реакционную смесь охлаждали до комнатной температуры и фильтровали. Фильтрат упаривали, и остаток очищали колоночной хроматографией на силикагеле с получением 400 мг метил-2-(3-амино-4-хлорфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде твердого вещества. Выход: 15%.
К раствору метил-2-(3-амино-4-хлорфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (182 мг, 0,53 ммоль) в дихлорметане (5 мл) добавляли N,N-диизопропилэтиламин (136 мг, 1,06 ммоль) при охлаждении в ледяной бане, затем посредством шприца добавляли изобутирилхлорид (84 мг, 0,8 ммоль) в дихлорметане (2 мл). Полученную смесь перемешивали при комнатной температуре в течение ночи. Тонкослойная хроматография (петролейный эфир: этил ацетат=10:1) показала, что реакция прошла до конца. Смесь разделяли препаративной тонкослойной хроматографией с получением 240 мг метил-2-(4-хлор-3-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата, который использовали на следующей стадии без дополнительной очистки.
Смесь метил-2-(4-хлор-3-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (216 мг, 0,52 ммоль) в метаноле (8 мл) и 4,2 мл водного раствора гидроксида натрия (1М, 4,2 ммоль) перемешивали при нагревании в условиях дефлегмации в течение 2 ч. Тонкослойная хроматография показала, что исходное вещество израсходовалось полностью. Метанол удаляли при пониженном давлении, и остаток подкисляли до рН=6 1М раствором соляной кислоты. Выпавшее в осадок твердое вещество собирали фильтрованием, растворяли в этилацетате и сушили над безводным сульфатом натрия. Растворитель удаляли в вакууме с получением 120 мг 2-(4-хлор-3-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. LC-MS (M+1)=383.
Пример 178
2-(4-Изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
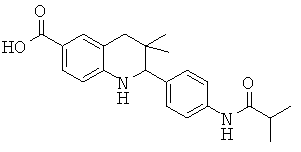
К раствору метил-2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (70 мг, 0,23 ммоль) и N,N-диизопропилэтиламина (0,09 мл, 0,52 ммоль) в дихлорметане (5 мл) добавляли изобутирилхлорид (0,04 мл, 0,34 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Растворитель удаляли, остаток промывали смесью дихлорметан/петролейный эфир, и осадок собирали с получением метил-2-(4-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого твердого вещества, 61 мг. Выход: 68%.
К смеси метил-2-(4-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (46 мг, 0,12 ммоль) в метаноле (3 мл) и воды (1,5 мл) добавляли раствор гидроксида натрия (82 мг, 2,06 ммоль) в воде (1,5 мл). Полученную смесь нагревали в условиях дефлегмации до завершения реакции (контролировали тонкослойной хроматографией). Метанол удаляли под вакуумом. Остаток подкисляли 2М соляной кислотой до рН=1. Осадок собирали фильтрованием с получением 2-(4-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде желтого твердого вещества, 40 мг. Выход 92%. MS (ESI+APCI) M+1=367,6.
Пример 179
3,3-Диметил-2-(3-(метилсульфонилкарбамоил)-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
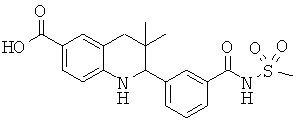
Раствор 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (150 мг, 0,44 ммоль) и 1,1'-карбонилдиимидазола (214 мг, 1,32 ммоль) в тетрагидрофуране (3 мл) нагревали до 60°С в течение 2 ч, затем охлаждали до комнатной температуры и обрабатывали метансульфонамидом (54,2 мг, 0,57 ммоль, 1,3 экв.). После перемешивания в течение 10 мин реакционную смесь обрабатывали добавлением по каплям раствора 1,8-диазабицикло[5.4.0]ундец-7-ена (221 мг, 1,45 ммоль) в тетрагидрофуране (1 мл). После окончания добавления полученную смесь перемешивали в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1) показала, что реакция прошла до конца. Реакционную смесь гасили рассолом, подкисляли 1 н. раствором соляной кислоты до рН=5 и экстрагировали этилацетатом (дважды). Объединенные органические слои промывали рассолом 3 раза, сушили над безводным сульфатом натрия. После удаления растворителя в вакууме получили 205 мг метил-3,3-диметил-2-(3-(метилсульфонилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого твердого вещества, которое очищали колоночной хроматографией (петролейный эфир:этилацетат = от 2:1 до 1:1) с получением 58 мг белого твердого вещества, которое использовали на следующей стадии.
Смесь метил-3,3-диметил-2-(3-(метилсульфонилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (58 мг, 0,14 ммоль, 1,0 экв.) в метаноле (2,5 мл) и 1 н. водного раствора гидроксида натрия (2,1 мл, 2,1 ммоль, 15,0 экв.) нагревали в условиях дефлегмации в течение 1 ч. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1) и LC-MS показали, что реакция прошла до конца. Реакционную смесь концентрировали при пониженном давлении, и остаток подкисляли 1 н. раствором соляной кислоты до рН=5. Выпавшее в осадок белое твердое вещество растворяли в этилацетате, и слои разделяли. Водный слой экстрагировали этилацетатом, и объединенные органические слои промывали рассолом и сушили над безводным сульфатом натрия. После удаления растворителя в вакууме получили 56 мг 3,3-диметил-2-(3-(метилсульфонилкарбамоил)-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде желтого твердого вещества с количественным выходом. MS (ESI+APCI) М+1=403,1.
Пример 180
2-(4-Фтор-3-(пиколинамидо)-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
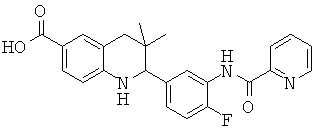
К раствору 2-(4-фтор-3-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (150 мг, 0,46 ммоль) и N,N-диизопропилэтиламина (0,15 мл, 0,91 ммоль) в дихлорметане (10 мл) добавляли пиколиноилхлорид (77 мг, 0,54 ммоль) при охлаждении в ледяной бане. После окончания добавления полученную смесь перемешивали в течение 20 ч. Растворитель удаляли в вакууме, и остаток очищали колоночной хроматографией (петролейный эфир:этилацетат=3:1) с получением 84 мг метил-2-(4-фтор-3-(пиколинамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата. Выход: 42,4%.
Смесь метил-2-(4-фтор-3-(пиколинамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (84 мг, 0,19 ммоль), гидроксида натрия (62 мг, 1,55 ммоль) в тетрагидрофуране (10 мл) и воды (2 мл) нагревали в условиях дефлегмации в течение 20 ч. LC-MS показала, что реакция прошла до конца. Растворитель удаляли в вакууме, и остаток подкисляли 1М раствором соляной кислоты до рН=5-6. Выпавшее в осадок твердое вещество собирали фильтрованием, растворяли в ацетоне и сушили над безводным сульфатом магния. После удаления растворителя в вакууме получили неочищенный продукт, который очищали перекристаллизацией из смеси дихлорметан/гексан/тетрагидрофуран с получением 30 мг 2-(4-фтор-3-(пиколинамидо)-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты. Выход: 42,1%. MS (ES+APCI) M+1=420,1.
Пример 181
2-(4-(4-Фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
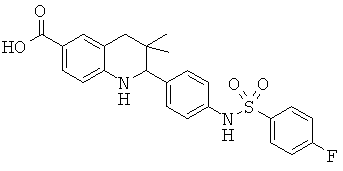
К раствору 2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (80 мг, 0,27 ммоль) в пиридине (5 мл) добавляли 4-фторбензол-1-сульфонилхлорид (57 мг, 0,30 ммоль) при охлаждении в ледяной бане. По окончании добавления полученной смеси давали возможность нагреться до комнатной температуры при перемешивании в течение ночи. LC-MS показала, что реакция прошла до конца. Пиридин удаляли в вакууме, и остаток очищали препаративной тонкослойной хроматографией с получением 74 мг 2-(4-(4-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде желтого порошка. Выход: 63%. MS (ESI+APCI) M+1=455,46.
Пример 182
2-(4-(4-Фторбензамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
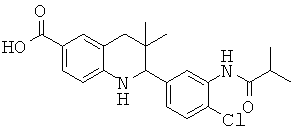
Смесь метил-4-аминобензоата (1,51 г, 10 ммоль) и 4-нитробензальдегида (1,51 г, 10 ммоль) в этаноле (30 мл) перемешивали в течение ночи с получением желтой суспензии. Выпавшее в осадок не совсем белое твердое вещество собирали и сушили в вакууме с получением (Е)-метил-4-(4-нитробензилиденамино)бензоата (2,93 г, выход 95%).
К раствору (Е)-метил-4-(4-нитробензилиденамино)бензоата (284 мг, 1 ммоль) и трифторметансульфоната иттрия(III) (62 мг, 0,1 ммоль) в тетрагидрофуране (5 мл) добавляли изобутиральдегид (72 мг, 1,5 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 ч. Тонкослойная хроматография показала, что исходное вещество израсходовалось полностью. Реакционную смесь гасили водой, и слои разделяли. Водный раствор экстрагировали дихлорметаном, и объединенные органические слои сушили над безводным сульфатом натрия. Растворитель удаляли в вакууме с получением неочищенного продукта, который очищали колоночной хроматографией (петролейный эфир/этилацетат=3:1) с получением 70 мг метил-4-гидрокси-3,3-диметил-2-(4-нитрофенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого твердого вещества. Выход: 20%.
К раствору метил-4-гидрокси-3,3-диметил-2-(4-нитрофенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (61 мг, 0,18 ммоль) и триэтилсилана (0,06 мл, 0,34 ммоль) в дихлорметане (10 мл) добавляли по каплям раствор трифторуксусной кислоты (0,04 мл, 0,51 моль) в дихлорметане (5 мл) при температуре ниже 0°С. После окончания добавления полученную смесь перемешивали при комнатной температуре в течение 24 ч, затем гасили раствором бикарбоната натрия, и слои разделяли. Органический слой сушили над безводным сульфатом натрия и концентрировали. Остаток очищали колоночной хроматографией с получением 50 мг метил-3,3-диметил-2-(4-нитрофенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого твердого вещества. Выход: 78%.
Метил-3,3-диметил-2-(4-нитрофенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилат (110 мг, 0,32 ммоль) растворяли в растворе метанол/вода и добавляли порошок железа (25 мг, 3,2 ммоль). Реакционную смесь нагревали в условиях дефлегмации в течение 2 ч. Смесь фильтровали, фильтрат концентрировали и очищали колоночной хроматографией на силикагеле (петролейный эфир/этилацетат=4:1) с получением 95 мг метил-2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого твердого вещества (выход: 96%). MS (ESI+APCI) M+1=311,5.
К раствору метил-2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (70 мг, 0,23 ммоль) и N,N-диизопропилэтиламина (0,09 мл, 0,52 ммоль) в дихлорметане (5 мл) добавляли 4-фторбензоилхлорид (54 мг, 0,34 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Растворитель удаляли в вакууме, остаток промывали смесью дихлорметан/петролейный эфир, и осадок собирали с получением метил-2-(4-(4-фторбензамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого твердого вещества, 43 мг. Выход: 37%.
К смеси метил-2-(4-(4-фторбензамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (43 мг, 0,01 ммоль) в метаноле (3 мл) и воды (1,5 мл) добавляли раствор гидроксида натрия (68 мг, 0,17 ммоль) в воде (1,5 мл). Полученную смесь нагревали в условиях дефлегмации до завершения реакции (контролировали тонкослойной хроматографией). Метанол удаляли под вакуумом. Остаток подкисляли 2М соляной кислотой до рН=1. Осадок собирали фильтрованием с получением 2-(4-(4-фторбензамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде желтого твердого вещества, 40 мг. Выход 95%. MS (ESI+APCI) M+1=419,6.
Пример 183
3,3-Диметил-2-(4-(4-метилфенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
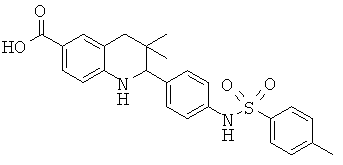
К раствору 2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (80 мг, 0,27 ммоль) в пиридине (5 мл) добавляли 4-метилбензол-1-сульфонилхлорид (57 мг, 0,30 ммоль) при охлаждении в ледяной бане. По окончании добавления полученной смеси давали возможность нагреться при перемешивании в течение ночи. LC-MS показала, что реакция прошла до конца. Пиридин удаляли в вакууме, и остаток очищали препаративной тонкослойной хроматографией с получением 70 мг 3,3-диметил-2-(4-(4-метилфенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде желтого порошка. Выход: 69%. MS (ESI+APCI) M+1=451,20.
Пример 184
2-(3-Бензамидо-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
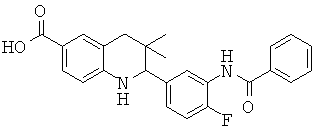
Смесь метил-4-аминобензоата (4,57 г, 30,2 ммоль) и 4-фтор-3-нитробензальдегида (5,00 г, 29,6 ммоль) в этаноле (30 мл) перемешивали при комнатной температуре в течение 16 часов (осадок образовывался в течение 30 мин). Твердый продукт собирали фильтрованием, и следовое количество растворителя удаляли под вакуумом. 8,32 г (83%) (Е)-метил-4-(4-фтор-3-нитробензилиденамино)бензоата получили в виде желтого твердого вещества.
К суспензии (Е)-метил-4-(4-фтор-3-нитробензилиденамино)бензоата (3,62 г, 12,0 ммоль) в тетрагидрофуране (24 мл) в атмосфере азота при комнатной температуре добавляли трифторметансульфонат иттрия(III) (75 мг, 0,12 ммоль) и изобутиральдегид (0,87 г, 12,0 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 20 часов (через 10 минут смесь стала прозрачной. В реакционную смесь добавляли воду, и смесь экстрагировали этилацетатом. Объединенные органические слои промывали рассолом и сушили над безводным сульфатом натрия. Растворитель удаляли, и остаток очищали колоночной хроматографией (петролейный эфир/этилацетат=3:1, силикагель) с получением метил-2-(4-фтор-3-нитрофенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата, 3,15 г (70%) в виде желтого твердого вещества.
К охлажденной в ледяной бане смеси метил-2-(4-фтор-3-нитрофенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (3,39 г, 9,06 ммоль) и триэтилсилана (3,06 г, 26,3 ммоль) в дихлорметане (180 мл) по каплям в течение 3 часов добавляли раствор трифторуксусной кислоты (4,24 г, 37,1 ммоль) в дихлорметане (90 мл). После добавления ледяную баню удаляли, и реакционную смесь перемешивали при комнатной температуре в течение 44 часов. Добавляли твердый карбонат натрия, и смесь перемешивали в течение 15 минут, фильтровали и концентрировали. Масляный остаток очищали колоночной хроматографией (силикагель, петролейный эфир/этилацетат = от 10:1 до 1:1 из-за плохой растворимости) с получением метил-2-(4-фтор-3-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата, 2,44 мг (75%), в виде желтого твердого вещества.
В колбу, оснащенную дефлегматором, загружали метил-2-(4-фтор-3-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилат (2,44 г, 6,81 ммоль), восстановленное железо (4,09 г), этанол (50 мл), воду (10 мл) и три капли концентрированной соляной кислоты. Смесь нагревали в условиях дефлегмации в течение 2 часов. Железо удаляли фильтрованием. Фильтрат концентрировали, экстрагировали этилацетатом и сушили над безводным сульфатом натрия. Растворитель удаляли, и остаток очищали колоночной хроматографией (силикагель, петролейный эфир/этилацетат=5:1) с получением метил-2-(4-фтор-3-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата, 1,90 г (85%), в виде желтого твердого вещества.
К раствору метил-2-(4-фтор-3-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (105 мг, 0,32 ммоль) в дихлорметане (5 мл) добавляли N,N-диизопропилэтиламин (83 мг, 0,64 ммоль), затем добавляли бензоилхлорид (49 мг, 0,35 ммоль) при 0°С в атмосфере азота. Реакционную смесь затем перемешивали при комнатной температуре в течение 16 часов. Растворитель удаляли, и остаток очищали препаративной тонкослойной хроматографией (силикагель, петролейный эфир/этилацетат=3:1) с получением метил-2-(3-бензамидо-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата, 130 мг (94%), в виде бледно-желтого твердого вещества. MS (ESI+APCI) М+1=433.
В круглодонной колбе смесь метил-2-(3-бензамидо-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (130 мг, 0,30 ммоль) в метаноле (3 мл) и воды (0,6 мл) обрабатывали раствором гидроксида натрия (204 мг, 5,1 ммоль) в воде (0,6 мл). Полученную смесь нагревали при нагревании в условиях дефлегмации в течение 1 ч. Метанол удаляли под вакуумом. Остаток подкисляли 1М соляной кислотой до рН=5. Осадок собирали фильтрованием и очищали препаративной тонкослойной хроматографией (силикагель, петролейный эфир/этилацетат=2:1, 5% метанол) с получением 55 мг (44%) 2-(3-бензамидо-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде бесцветного твердого вещества. MS (ESI+APCI) М+1=419.
Пример 185
2-(4-Бензамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
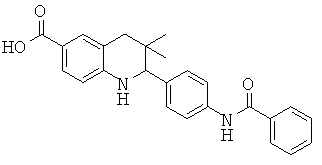
К раствору метил-2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (100 мг, 0,32 ммоль) и N,N-диизопропилэтиламина (0,11 мл, 0,64 ммоль) в дихлорметане (5 мл) добавляли бензоилхлорид (0,04 мл, 0,35 ммоль) при охлаждении в ледяной бане. После окончания добавления полученному раствору давали возможность нагреться до комнатной температуры при перемешивании в течение ночи. LC-MS показала, что реакция прошла до конца. Растворитель удаляли в вакууме, и остаток очищали препаративной тонкослойной хроматографией с получением 70 мг метил-2-(4-бензамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого твердого вещества. Выход: 53%. MS (ESI+APCI) М+1=415,20.
Смесь метил-2-(4-бензамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (67 мг, 0,16 ммоль) в метаноле (8 мл) и водного раствора гидроксида натрия (1М, 1,2 мл, 1,2 ммоль) нагревали в условиях дефлегмации в течение 5 ч. LC-MS показала, что реакция прошла до конца. Растворитель удаляли в вакууме, и остаток подкисляли 2М раствором соляной кислоты до тех пор, пока не выпало в осадок большое количество желтого твердого вещества, которое собирали фильтрованием с получением 51 мг 2-(4-бензамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты с выходом 80%. MS (ESI+APCI) М+1=401.
Пример 186
3,3-Диметил-2-(4-(пиколинамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
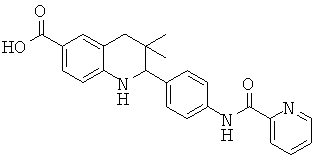
К раствору метил-2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (100 мг, 0,32 ммоль) и N,N-диизопропилэтиламина (0,11 мл, 0,64 ммоль) в дихлорметане (5 мл) добавляли свежеприготовленный пиколиноилхлорид (56 мг, 0,35 ммоль) при охлаждении в ледяной бане. После окончания добавления полученный раствор глубокого синего цвета оставляли нагреваться до комнатной температуры при перемешивании в течение ночи. LC-MS показала, что реакция прошла до конца. Растворитель удаляли в вакууме, и остаток очищали препаративной тонкослойной хроматографией с получением 70 мг метил-3,3-диметил-2-(4-(пиколинамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого твердого вещества. Выход: 52%. MS (ESI+APCI) M+1=416,20.
Смесь метил-3,3-диметил-2-(4-(пиколинамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (67 мг, 0,16 ммоль) в метаноле (8 мл) и водного раствора гидроксида натрия (1М, 1,2 мл, 1,2 ммоль) нагревали в условиях дефлегмации в течение 5 ч. LC-MS показала, что реакция прошла до конца. Растворитель удаляли в вакууме, и остаток подкисляли 2М раствором соляной кислоты до тех пор, пока в осадок не выпало большое количество желтого твердого вещества, которое собирали фильтрованием с получением 51 мг 3,3-диметил-2-(4-(пиколинамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты. Выход: 80%. MS (ESI+APCI) M+1=402.
Пример 187
3,3-Диметил-2-(3-(метилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
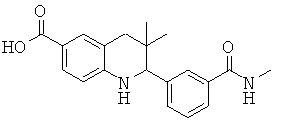
К суспензии 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (100 мг, 0,30 ммоль) в дихлорметане (6,7 мл) добавляли N-гидроксибензотриазол (59,7 мг, 0,44 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (169,7 мг, 0,44 ммоль), затем добавляли 4-метилморфолин (89,5 мг, 0,89 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Затем в колбу добавляли гидрохлорид метиламина (29,7 мг, 0,44 ммоль), и реакционную смесь перемешивали в атмосфере азота в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1) и LC-MS показали, что реакция прошла до конца. Реакционную смесь гасили водой и экстрагировали дихлорметаном (дважды). Объединенные органические слои промывали 2% водным раствором гидроксида натрия (дважды) и водой (3 раза) и сушили над безводным сульфатом натрия. После удаления растворителя в вакууме получили 122 мг неочищенного продукта в виде не совсем белого твердого вещества, которое растворяли в метаноле (3 мл) и обрабатывали боргидридом натрия (37,8 мг, 1,0 ммоль) в течение 19 ч. LC-MS показала, что реакция прошла до конца. Реакционную смесь гасили водой, экстрагировали этилацетатом и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 105 мг белого твердого вещества, которое дополнительно очищали препаративной тонкослойной хроматографией (петролейный эфир:этилацетат=1:1) с получением 87 мг метил-3,3-диметил-2-(3-(метилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого кристаллического вещества. Выход: 83,8%.
Смесь метил-3,3-диметил-2-(3-(метилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (85 мг, 0,24 ммоль) в метаноле (4,6 мл) и 1 н. водного раствора гидроксида натрия (3,6 мл, 3,6 ммоль) нагревали в условиях дефлегмации в течение 1 ч. LC-MS показала, что реакция прошла до конца. Растворитель удаляли в вакууме с получением белого твердого вещества, которое растворяли в воде и подкисляли 1 н. раствором соляной кислоты до рН=2. Выпавшее в осадок твердое вещество собирали фильтрованием и снова растворяли в водном растворе гидроксида натрия, затем подкисляли 1 М раствором соляной кислоты до рН=7. Выпавшее в осадок белое твердое вещество собирали фильтрованием и сушили в вакууме с получением 35 мг 3,3-диметил-2-(3-(метилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты. Выход: 42,9%. LC-MS (М+1)=339,2.
Пример 188
2-(3-(Циклопропанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
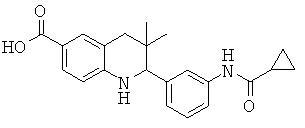
К охлажденной в ледяной бане смеси 2-(3-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (150 мг, 0,48 ммоль), циклопропанкарбоновой кислоты (86,1 мг, 0,73 ммоль), N,N-диизопропилэтиламина (0,16 мл, 0,96 ммоль) в дихлорметане (10 мл) добавляли раствор оксихлорида фосфора (0,08 мл, 0,82 ммоль). Затем реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч. LC-MS показала, что исходное вещество израсходовалось полностью. Растворитель удаляли в вакууме, и остаток очищали препаративной тонкослойной хроматографией (петролейный эфир/этилацетат=2:1) с получением 109 мг метил-2-(3-(циклопропанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде бледно-желтого твердого вещества. Выход: 59,8%.
В круглодонной колбе к смеси метил-2-(3-(циклопропанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (109 мг, 0,29 ммоль) в метаноле (5 мл) и воды (2,5 мл) добавляли раствор гидроксида натрия (196 мг, 4,90 ммоль) в воде (2,5 мл). Полученную смесь нагревали в условиях дефлегмации в течение 1,5 часов. Метанол удаляли под вакуумом. Остаток подкисляли 2М соляной кислотой до рН=5-6. Осадок собирали фильтрованием, очищали препаративной тонкослойной хроматографией (силикагель, петролейный эфир/этилацетат=3:1) с получением 2-(3-(циклопропанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде твердого продукта. (61 мг, выход: 58,2%). MS (ESI+APCI) M+1=347,2.
Пример 189
2-(3-(Циклопропанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
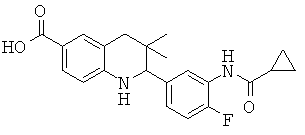
К охлажденной в ледяной бане смеси метил-2-(4-фтор-3-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (0,3 ммоль, 1,0 экв.), циклопропанкарбоновой кислоты (0,46 ммоль, 1,5 экв.), N,N-диизопропилэтиламина (0,6 ммоль, 2,0 экв.) в дихлорметане (5 мл) добавляли раствор оксихлорида фосфора (0,36 ммоль, 1,2 экв.). Затем реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов. LC-MS показала, что исходное вещество израсходовалось полностью. Реакционную смесь гасили добавлением 20 мл воды и экстрагировали этилацетатом (20 мл × 2). Объединенный органический слой концентрировали, и остаток очищали колоночной хроматографией (петролейный эфир/этилацетат=3:1) с получением 105 мг метил-2-(3-(циклопропанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде бледно-желтого твердого вещества. Выход: 89%. MS (ESI+APCI) M+1=397,2.
Смесь метил-2-(3-(циклопропанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (0,26 ммоль, 1,0 экв.) и 4,5 мл гидроксида натрия (1 моль/л) в 3 мл метанола перемешивали при нагревании в условиях дефлегмации в течение 1-2 ч. LC-MS показала, что исходное вещество израсходовалось полностью. Метанол удаляли при пониженном давлении. Остаток подкисляли до рН 5-6 1 М соляной кислотой. Образовавшееся большое количество осадка собирали фильтрованием с получением 71 мг 2-(3-(циклопропанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 72%. MS (ESI+APCI) M+1=383.
Пример 190
2-(3-(2-Хлор-4-фторбензамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
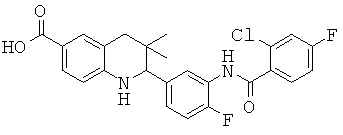
К охлажденной в ледяной бане смеси метил-2-(4-фтор-3-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (170 мг, 0,52 ммоль) и N,N-диизопропилэтиламина (140 мг, 1,03 ммоль) в 5 мл дихлорметана по каплям добавляли раствор 2-хлор-4-фторбензоилхлорида (120 мг, 0,62 ммоль) в 3 мл дихлорметана в атмосфере азота. Затем полученную смесь перемешивали при комнатной температуре в течение ночи. Тонкослойная хроматография и LC-MS показали, что исходное вещество израсходовалось полностью. Растворитель удаляли на роторном испарителе. Остаток очищали силикагелем (петролейный эфир/этилацетат=3:1) с получением 189 мг метил-2-(3-(2-хлор-4-фторбензамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого твердого вещества. Выход: 76%. MS (ESI+APCI) M+1=485.
Смесь метил-2-(3-(2-хлор-4-фторбензамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (100 мг, 0,2 ммоль), 3,1 мл водного раствора гидроксида натрия (124 мг, 3,1 ммоль) в 5 мл метанола перемешивали при нагревании в условиях дефлегмации в течение 1 ч. LC-MS показала, что исходное вещество израсходовалось полностью. Растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией (петролейный эфир/этилацетат=1:1) с получением 68 мг 2-(3-(2-хлор-4-фторбензамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде бледно-желтого твердого вещества. Выход: 72,3%. MS (ESI+APCI) M+1=471.
Пример 191
3,3-Диметил-2-(3-(пиперидин-1-карбонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
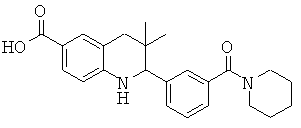
К суспензии 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (100 мг, 0,30 ммоль) в дихлорметане (6,7 мл) добавляли N-гидроксибензотриазол (59,7 мг, 0,44 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (169,7 мг, 0,44 ммоль), затем добавляли 4-метилморфолин (89,5 мг, 0,89 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Затем в колбу добавляли пиперидин (30,1 мг, 0,44 ммоль), и реакционную смесь перемешивали в атмосфере азота в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1) и LC-MS показали, что реакция прошла до конца. Реакционную смесь гасили водой и экстрагировали дихлорметаном (дважды). Объединенные органические слои промывали 2% водным раствором гидроксида натрия (дважды) и водой (3 раза) и сушили над безводным сульфатом натрия. После удаления растворителя в вакууме получили 147 мг неочищенного продукта в виде не совсем белого твердого вещества, которое растворяли в метаноле (3 мл) и обрабатывали боргидридом натрия (37,8 мг, 1,0 ммоль) в течение 27 ч. LC-MS показала, что реакция прошла до конца. Реакционную смесь гасили водой, экстрагировали этилацетатом и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 105 мг белого твердого вещества, которое дополнительно очищали перекристаллизацией из метанола с получением 69 мг метил-3,3-диметил-2-(3-(пиперидин-1-карбонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого кристаллического вещества. Выход: 57,5%.
Смесь метил-3,3-диметил-2-(3-(пиперидин-1-карбонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (68 мг, 0,24 ммоль) в метаноле (6 мл) и 1 н. водного раствора гидроксида натрия (2,5 мл, 2,5 ммоль) нагревали в условиях дефлегмации в течение 1 ч. LC-MS показала, что реакция прошла до конца. Растворитель удаляли в вакууме с получением белого твердого вещества, которое растворяли в воде и подкисляли 1 н. раствором соляной кислоты до рН=2. Выпавшее в осадок твердое вещество собирали фильтрованием и снова растворяли в водном растворе гидроксида натрия, затем подкисляли 1М раствором соляной кислоты до рН=7. Выпавшее в осадок белое твердое вещество собирали фильтрованием и сушили в вакууме с получением 55 мг 3,3-диметил-2-(3-(пиперидин-1-карбонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты. Выход: 83,8%. LC-MS (M+1)=393,2.
Пример 192
2-(3-(2-Метоксиэтилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
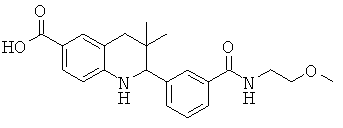
К суспензии 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (100 мг, 0,30 ммоль) в дихлорметане (6,7 мл) добавляли N-гидроксибензотриазол (59,7 мг, 0,44 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (169,7 мг, 0,44 ммоль), затем добавляли 4-метилморфолин (89,5 мг, 0,89 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Затем в колбу добавляли 2-метоксиэтанамин (26,6 мг, 0,44 ммоль), и реакционную смесь перемешивали в атмосфере азота в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=1:1) и LC-MS показали, что реакция прошла до конца. Реакционную смесь гасили водой и экстрагировали дихлорметаном (дважды). Объединенные органические слои промывали 2% водным раствором гидроксида натрия (дважды) и водой (3 раза) и сушили над безводным сульфатом натрия. После удаления растворителя в вакууме получили 130 мг неочищенного продукта в виде желтого масла, которое растворяли в метаноле (3 мл) и обрабатывали боргидридом натрия (20 мг, 0,53 ммоль) в течение еще 3 ч. LC-MS показала, что реакция прошла до конца. Реакционную смесь гасили водой, экстрагировали этилацетатом и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением сырого продукта, который дополнительно очищали колоночной хроматографией (петролейный эфир:этилацетат=1:1) от метанола с получением 100 мг метил-2-(3-(2-метокси этилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого кристаллического вещества. Выход: 85,6%.
Смесь метил-2-(3-(2-метоксиэтилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (100 мг, 0,25 ммоль) в метаноле (4,5 мл) и 1 н. водного раствора гидроксида натрия (3,7 мл, 3,7 ммоль) нагревали в условиях дефлегмации в течение 1 ч. LC-MS показала, что реакция прошла до конца. Растворитель удаляли в вакууме с получением белого твердого вещества, которое растворяли в воде и подкисляли 1 н. раствором соляной кислоты до рН=2. Выпавшее в осадок твердое вещество собирали фильтрованием, промывали водой и сушили в вакууме с получением 69 мг 2-(3-(2-метоксиэтилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты. Выход: 71,9%. LC-MS (M+1)=383,2.
Пример 193
3,3-Диметил-2-(4-(2-фенилацетамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
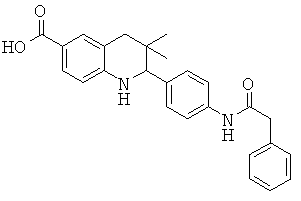
К раствору метил-2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (80 мг, 0,26 ммоль) и N,N-диизопропилэтиламина (0,09 мл, 0,52 ммоль) в дихлорметане (5 мл) добавляли 2-фенилацетилхлорид (0,05 мл, 0,34 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Растворитель удаляли, остаток промывали смесью дихлорметан/петролейный эфир, и осадок собирали с получением метил-3,3-диметил-2-(4-(2-фенилацетамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого твердого вещества, 90 мг. Выход: 81%.
К смеси метил-3,3-диметил-2-(4-(2-фенилацетамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (90 мг, 0,21 ммоль) в метаноле (3 мл) и воды (1,5 мл) добавляли раствор гидроксид натрия (143 мг, 3,57 ммоль) в воде (1,5 мл). Полученную смесь нагревали в условиях дефлегмации до завершения реакции (контролировали тонкослойной хроматографией). Метанол удаляли под вакуумом. Остаток подкисляли 2М соляной кислотой до рН=1. Осадок собирали фильтрованием с получением 3,3-диметил-2-(4-(2-фенилацетамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде желтого твердого вещества, 75 мг. Выход 85%. MS (ESI+APCI) M+1=415,6.
Пример 194
2-(3-(Циклобутанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
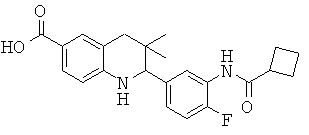
К охлажденной в ледяной бане смеси метил-2-(4-фтор-3-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (0,3 ммоль, 1,0 экв.), циклобутанкарбоновой кислоты (0,46 ммоль, 1,5 экв.), N,N-диизопропилэтиламина (0,6 ммоль, 2,0 экв.) в дихлорметане (5 мл) добавляли раствор оксихлорида фосфора (0,36 ммоль, 1,2 экв.). Затем реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов. LC-MS показала, что исходное вещество израсходовалось полностью. Реакционную смесь гасили добавлением 20 мл воды и экстрагировали этилацетатом (20 мл × 2). Объединенный органический слой концентрировали, и остаток очищали колоночной хроматографией (петролейный эфир/этилацетат=3:1) с получением метил-2-(3-(циклобутанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде бледно-желтого твердого вещества. Выход: 89%. MS (ESI+APCI) M+1=411.
Смесь метил-2-(3-(циклобутанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (0,26 ммоль, 1,0 экв.) и 4,5 мл гидроксида натрия (1 моль/л) в 3 мл метанола перемешивали при нагревании в условиях дефлегмации в течение 1-2 ч. LC-MS показала, что исходное вещество израсходовалось полностью. Метанол удаляли при пониженном давлении. Остаток подкисляли до рН 5-6 1М соляной кислотой. Образовавшееся большое количество осадка собирали фильтрованием с получением 2-(3-(циклобутанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 80%. MS (ESI+APCI) M+1=397.
Пример 195
2-(4-Хлор-3-(циклогексанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
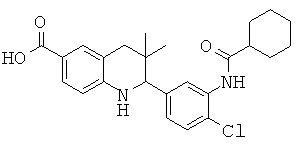
К раствору метил-2-(3-амино-4-хлорфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (200 мг, 0,58 ммоль) в 8 мл дихлорметана добавляли N,N-диизопропилэтиламин (150 мг, 1,16 ммоль) в атмосфере азота. Затем посредством шприца добавляли раствор циклогексанкарбонилхлорида (127 мг, 0,87 ммоль) при охлаждении в ледяной бане. Смесь перемешивали в течение 1,5 ч. Смесь очищали колоночной хроматографией с получением 250 мг метил-2-(4-хлор-3-(циклогексанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде неочищенного продукта. Выход: 95%.
К раствору метил-2-(4-хлор-3-(циклогексанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (380 мг, 0,835 ммоль) в метаноле (15 мл) добавляли раствор гидроксида натрия (270 мг, 6,68 ммоль) в воде (6,8 мл). Смесь перемешивали и нагревали в условиях дефлегмации в течение 5 ч. Смесь упаривали, и остаток растворяли в 15 мл воды. Водный раствор подкисляли до рН=3 1М соляной кислотой. Выпавшее в осадок твердое вещество собирали фильтрованием и растворяли в этилацетате. Органический слой сушили над сульфатом натрия. После упаривания смесь очищали на силикагеле с получением 50 мг 2-(4-хлор-3-(циклогексанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде не совсем белого твердого вещества. Выход: 14%. MS(ESI+APCI) M+1=423,2, М-1=441,0.
Пример 196
2-(3-(Циклопентанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
К охлажденной в ледяной бане смеси 2-(4-фтор-3-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (0,3 ммоль, 1,0 экв.), циклопентанкарбоновой кислоты (0,46 ммоль, 1,5 экв.), N,N-диизопропилэтиламина (0,6 ммоль, 2,0 экв.) в дихлорметане (5 мл) добавляли раствор оксихлорида фосфора (0,36 ммоль, 1,2 экв.). Затем реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов. LC-MS показала, что исходное вещество израсходовалось полностью. Реакционную смесь гасили добавлением 20 мл воды и экстрагировали этилацетатом (20 мл × 2). Объединенный органический слой концентрировали, и остаток очищали колоночной хроматографией (петролейный эфир/этилацетат=3:1) с получением метил-2-(3-(циклопентанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде бледно-желтого твердого вещества. Выход: 90%. MS (ESI+APCI) M+1=425.
Смесь метил-2-(3-(циклопентанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (0,26 ммоль, 1,0 экв.) и 4,5 мл гидроксида натрия (1 моль/л) в 3 мл метанола перемешивали при нагревании в условиях дефлегмации в течение 1-2 ч. LC-MS показала, что исходное вещество израсходовалось полностью. Метанол удаляли при пониженном давлении. Остаток подкисляли до рН 5-6 1М соляной кислотой. Образовавшееся большое количество осадка собирали фильтрованием с получением 2-(3-(циклопентанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 70%. MS (ESI+APCI) M+1=411.
Пример 197
Метил-3,3-диметил-2-(3-(пиразин-2-илкарбамоил)-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилат
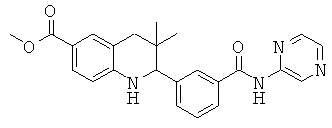
Раствор 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (330 мг, 0,88 ммоль) и 1,1'-карбонилдиимидазола (500 мг, 3,08 ммоль) в тетрагидрофуране (6 мл) нагревали до 60°С в течение 2 ч, затем охлаждали до комнатной температуры и обрабатывали пиразин-2-амином (92,2 мг, 0,97 ммоль). После перемешивания в течение 20 минут реакционную смесь обрабатывали добавлением по каплям раствора 1,8-диазабицикло[5.4.0]ундец-7-ена (670 мг, 4,4 ммоль) в тетрагидрофуране (2 мл). После окончания добавления полученную смесь перемешивали в течение ночи. Тонкослойная хроматография (дихлорметан:этилацетат=5:1) показала, что реакция почти закончилась. Реакционную смесь гасили рассолом и подкисляли 1 н. раствором соляной кислоты до рН=6 и экстрагировали этилацетатом (дважды). Объединенные органические слои промывали рассолом 3 раза и сушили над безводным сульфатом магния. После удаления растворителя в вакууме получили неочищенный продукт, который очищали колоночной хроматографией (дихлорметан:этилацетат=5:1) с получением 175 мг метил-3,3-диметил-2-(3-(пиразин-2-илкарбамоил)-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого твердого вещества. Выход: 47,5%. MS (ESI+APCI) M+1=417,2.
Пример 198
2-(4-(Циклогексанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
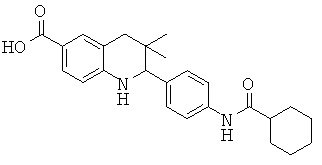
К раствору метил-2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (50 мг, 0,16 ммоль), циклогексанкарбоновой кислоты (0,03 мл, 0,24 ммоль) и N,N-диизопропилэтиламина (0,05 мл, 0,32 ммоль) в дихлорметане (5 мл) посредством шприца добавляли оксихлорид фосфора (0,02 мл, 0,24 ммоль) при температуре ниже 0°С. Смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Растворитель удаляли, остаток промывали смесью дихлорметан/петролейный эфир, и осадок собирали с получением метил-2-(4-(циклогексан карбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого твердого вещества, 42 мг. Выход: 53%.
К смеси метил-2-(4-(циклогексанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (53 мг, 0,11 ммоль) в метаноле (3 мл) и воды (1,5 мл) добавляли раствор гидроксида натрия (123 мг, 2,83 ммоль) в воде (1,5 мл). Полученную смесь нагревали при нагревании в условиях дефлегмации до завершения реакции (контролировали тонкослойной хроматографией). Метанол удаляли под вакуумом. Остаток подкисляли 2М соляной кислотой до рН=1. Осадок собирали фильтрованием с получением 2-(4-(циклогексанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде желтого твердого вещества, 50 мг. Выход 95%. MS (ESI+APCI) M+1=429,11.
Пример 199
3,3-Диметил-2-(3-(2-фенилацетамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
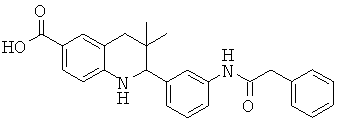
К раствору 2-(3-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (150 мг, 0,48 ммоль) и N,N-диизопропилэтиламина (0,16 мл, 0,97 ммоль) в дихлорметане (10 мл) добавляли 2-фенилацетилхлорид (0,1 мл, 0,63 ммоль) при охлаждении в ледяной бане. Полученную смесь выдерживали при 0°С в течение 10 ч. Тонкослойная хроматография (петролейный эфир:этилацетат=3:1, Rf=0,4) показала, что реакция прошла до конца. Растворитель удаляли в вакууме, и остаток очищали препаративной тонкослойной хроматографией (петролейный эфир:этилацетат=3:1) с получением 139 мг метил-3,3-диметил-2-(3-(2-фенилацетамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде не совсем белого твердого вещества. Выход: 67,1%. MS (ES+APCI) М+1-СН3О=397,1.
К смеси метил-3,3-диметил-2-(3-(2-фенилацетамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (139 мг, 0,32 ммоль) в метаноле (5 мл) и воды (2,5 мл) добавляли раствор гидроксида натрия (220 мг, 5,50 ммоль) в воде (2,5 мл). Полученную смесь нагревали при нагревании в условиях дефлегмации в течение 1,5 часов. Метанол удаляли под вакуумом. Остаток подкисляли 2М соляной кислотой до рН=5. Осадок собирали фильтрованием и очищали препаративной тонкослойной хроматографией (силикагель, петролейный эфир/этилацетат=3:1) с получением 3,3-диметил-2-(3-(2-фенилацетамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде твердого вещества (70 мг, выход: 52,2%). MS (ESI+APCI) M+1-OH=397,2.
Пример 200
2-(3-Карбамоилфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
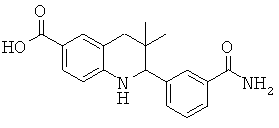
К суспензии 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (100 мг, 0,29 ммоль, 1,0 экв.) в дихлорметане (6,7 мл) добавляли N-гидроксибензотриазол (59,7 мг, 0,44 ммоль, 1,5 экв.) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (169,7 мг, 0,88 ммоль, 3,0 экв.), затем добавляли 4-метилморфолин (89,5 мг, 0,88 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 30 мин. Затем в колбу добавляли гидроксид аммония (40 мг, 0,59 ммоль, 2,0 экв.), и реакционную смесь перемешивали в течение 30 минут.LC-MS показала, что образовалось только небольшое количество продукта, поэтому в колбу добавляли дополнительно 1,0 мл водного раствора аммиака (1,0 мл, 14,7 ммоль, 50,0 экв.), и полученную смесь перемешивали в течение еще 7 ч. LC-MS показала, что реакция прошла до конца. Реакционную смесь гасили водой, слои разделяли, и водный слой экстрагировали дихлорметаном (дважды). Объединенные органические слои промывали 2% водным раствором гидроксида натрия (дважды) и рассолом (3 раза) и сушили над безводным сульфатом магния. После удаления растворителя в вакууме получили неочищенный продукт, который подвергали перекристаллизации из смеси дихлорметан/гексан с получением 85 мг метил-2-(3-карбамоилфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого кристаллического вещества. Выход: 85,1%.
Смесь метил-2-(3-карбамоилфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (84 мг, 0,25 ммоль) в метаноле (4,5 мл) и 1М водного раствора гидроксида натрия (3,2 мл, 3,2 ммоль, 13,0 экв.) нагревали в условиях дефлегмации в течение 30 мин. LC-MS показала, что реакция прошла до конца, и что образовался только целевой продукт. Растворитель концентрировали в вакууме, и остаток растворяли в воде и подкисляли 1М раствором соляной кислоты до рН=6. Выпавшее в осадок белое твердое вещество собирали фильтрованием и сушили в вакууме с получением 50 мг 2-(3-карбамоилфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 62,1%. MS (ESI+APCI) M+1=325,1.
Пример 201
3,3-Диметил-2-(3-(метилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
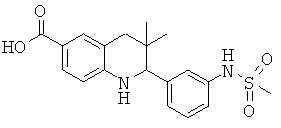
В круглодонной колбе метансульфонилхлорид (0,07 мл, 0,84 ммоль) добавляли по каплям к раствору 2-(3-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,1 г, 0,34 ммоль) в сухом пиридине (2 мл), и эту смесь перемешивали при комнатной температуре в течение 1 ч. Пиридин удаляли под вакуумом. Остаток очищали колоночной хроматографией (силикагель, петролейный эфир:этилацетат=1:1) с получением 3,3-диметил-2-(3-(метилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества (27 мг, выход: 21,3%). MS (ES+APCI) M+1=375,1.
Пример 202
2-(3-Бензамидо-5-хлорфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
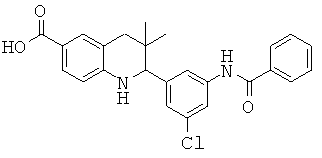
К раствору 3-хлор-5-нитробензальдегида (371 мг, 0,1 ммоль) в этаноле (6 мл) добавляли метил-4-аминобензоат (302 мг, 2,0 ммоль). Через некоторое время из полученного прозрачного желтого раствора выпал твердый осадок. Выпавшее в осадок твердое вещество отфильтровывали с получением 346 мг (Е)-метил-4-(3-хлор-5-нитробензилиденамино)бензоата в виде желтого твердого вещества. Выход=54%.
К раствору (Е)-метил 4-(3-хлор-5-нитробензилиденамино)бензоата (346 мг, 1,09 ммоль) в сухом тетрагидрофуране (4 мл) добавляли трифторметансульфонат иттрия(III) (34 мг, 0,054 ммоль). Смесь перемешивали в атмосфере азота. Затем посредством шприца добавляли раствор изобутилальдегида (95 мг, 1,30 ммоль) в тетрагидрофуране (1 мл). Смесь перемешивали в течение ночи. Реакционную смесь очищали колоночной хроматографией (петролейный эфир:этилацетат=10:1) с получением 250 мг метил-2-(3-хлор-5-нитрофенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде неочищенного продукта. (Выход=59%). MS (ESI+APCI) M+1-вода=373.
К раствору метил-2-(3-хлор-5-нитрофенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (250 мг, 0,64 ммоль) в дихлорметане (5 мл) добавляли раствор трифторуксусной кислоты (300 мг, 0,8 ммоль) в дихлорметане (5 мл) в атмосфере азота с медленным охлаждением в ледяной бане (1,5-2 ч). Полученную смесь перемешивали при комнатной температуре в течение 3 ч. Смесь обрабатывали 1 г бикарбоната натрия и фильтровали. Фильтрат концентрировали, и остаток очищали препаративной тонкослойной хроматографией с получением 125 мг метил-2-(3-хлор-5-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого твердого вещества. Выход=52%.
К раствору метил-2-(3-хлор-5-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (124 мг, 0,33 ммоль) в смеси этанол/вода (2 мл/О,5 мл) добавляли 2 капли концентрированной соляной кислоты и железо (370 мг, 6,62 ммоль). Смесь перемешивали и нагревали в условиях дефлегмации в течение 4 ч. LC-MS показала, что большая часть исходного вещества израсходовалась. Смесь сушили над силикагелем и промывали через короткую колонку смесью петролейный эфир:этилацетат=3:1 с получением 95 мг метил-2-(3-амино-5-хлорфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде коричневого твердого вещества (Выход=83%). MS (ESI+APCI) M+1=345.
К раствору метил-2-(3-амино-5-хлорфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (100 мг, 0,29 ммоль) и N,N-диизопропилэтиламина (75 мг, 0,58 ммоль) в дихлорметане (4 мл) медленно посредством шприца добавляли бензоилхлорид (49 мг, 0,35 ммоль) в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 1 ч. Выпавшее в осадок твердое вещество собирали фильтрованием с получением 65 мг метил-2-(3-бензамидо-5-хлорфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого твердого вещества. Выход: 50%. MS (ESI+APCI) M+1-вода=431.
К раствору метил-2-(3-бензамидо-5-хлорфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (61 мг, 0,14 ммоль) в метаноле (4 мл) добавляли 1М раствор гидроксида натрия (1,63 мл, 1,63 ммоль). Смесь перемешивали и нагревали в условиях дефлегмации в течение 3 ч. Смесь концентрировали, растворяли в воде и подкисляли до рН=5-6. Выпавшее в осадок твердое вещество собирали фильтрованием, растворяли в тетрагидрофуране и сушили над безводным сульфатом магния. После выпаривания органического растворителя остаток очищали колоночной хроматографией (силикагель, петролейный эфир:этилацетат=3:1) с получением 54 мг 2-(3-бензамидо-5-хлорфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 91%. MS(ESI+APCI) M+1=417.
Пример 203
2-(3-(2-(Диметиламино)этилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
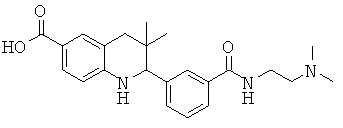
К суспензии 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (150 мг, 0,44 ммоль, 1,0 экв.) в дихлорметане (10,0 мл) добавляли N-гидроксибензотриазол (89,2 мг, 0,66 ммоль, 1,5 экв.) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (253,0 мг, 1,32 ммоль, 3,0 экв.), затем добавляли 4-метилморфолин (133,5 мг, 1,32 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 40 мин. Затем в колбу добавляли N1,N1-диметилэтан-1,2-диамин (42,7 мг, 0,48 ммоль, 1,1 экв.), и реакционную смесь перемешивали в течение 40 мин. LC-MS показала, что реакция прошла до конца. Реакционную смесь гасили водой, слои разделяли, и водный слой экстрагировали дихлорметаном (дважды). Объединенные органические слои промывали 2% водным раствором гидроксида натрия (дважды) и рассолом (3 раза) и сушили над безводным сульфатом магния. После удаления растворителя в вакууме получили 191 мг метил-2-(3-(2-(диметиламино)этилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде не совсем белого твердого вещества, которое промывали гексаном и собирали фильтрованием с получением 162 мг продукта в виде белого твердого вещества. Выход: 89,5%.
Смесь метил-2-(3-(2-(диметиламино)этилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (157 мг, 0,38 ммоль) в метаноле (6,5 мл) и 1М водного раствора гидроксида натрия (5,1 мл, 5,1 ммоль, 13,0 экв.) нагревали в условиях дефлегмации в течение 30 мин. LC-MS показала, что реакция прошла до конца, и что образовался только целевой продукт. Растворитель концентрировали в вакууме, и остаток растворяли в воде и подкисляли 1М раствором соляной кислоты до рН=6. Выпавшее в осадок белое твердое вещество собирали фильтрованием и сушили в вакууме с получением 122 мг 2-(3-(2-(диметиламино)этилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 80,5%. MS (ESI+APCI) M+1=396,2.
Пример 204
2-(3-Ацетамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
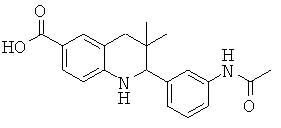
К раствору 2-(3-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (150 мг, 0,48 ммоль) и N,N-диизопропилэтиламина (0,16 мл, 0,97 ммоль) в дихлорметане (10 мл) добавляли ацетилхлорид (0,04 мл, 0,58 ммоль) при охлаждении в ледяной бане. Полученную смесь выдерживали при 0°С в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=3:1, Rf=0,4) показала, что реакция прошла до конца. Растворитель удаляли в вакууме, и остаток очищали препаративной тонкослойной хроматографией (петролейный эфир:этилацетат=3:1) с получением 129 мг метил-2-(3-ацетамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде не совсем белого твердого вещества. Выход: 71,1%.
К смеси метил-2-(3-ацетамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6- карбоксилата (129 мг, 0,37 ммоль) в метаноле (10 мл) и воды (5 мл) добавляли раствор гидроксида натрия (249 мг, 6,22 ммоль) в воде (5 мл). Полученную смесь нагревали в условиях дефлегмации в течение 1,5 часов. Метанол удаляли под вакуумом. Остаток подкисляли 2М соляной кислотой до рН=5-6. Осадок собирали фильтрованием и очищали препаративной тонкослойной хроматографией (силикагель, петролейный эфир/этилацетат=3:1) с получением 2-(3-ацетамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде твердого вещества (41 мг, выход: 33,1%). MS (ES+APCI) M+1=339,1.
Пример 205
2-(3-((1-Этилпирролидин-2-ил)метилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
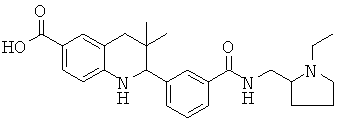
К суспензии 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (100 мг, 0,29 ммоль, 1,0 экв.) в дихлорметане (6,7 мл) добавляли N-гидроксибензотриазол (59,7 мг, 0,44 ммоль, 1,5 экв.) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (169,7 мг, 0,88 ммоль, 3,0 экв.), затем добавляли 4-метилморфолин (89,5 мг, 0,88 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 40 мин. Затем в колбу добавляли (1-этилпирролидин-2-ил)метанамин (0,33 ммоль, 1,1 экв.), и реакционную смесь перемешивали в течение 30 мин. LC-MS показала, что реакция прошла до конца. Реакционную смесь гасили водой, слои разделяли, и водный слой экстрагировали дихлорметаном (дважды). Объединенные органические слои промывали 2% водным раствором гидроксида натрия (дважды) и рассолом (3 раза) и сушили над безводным сульфатом магния. После удаления растворителя в вакууме получили 160 мг метил-2-(3-((1-этилпирролидин-2-ил)метилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого масла, которое очищали колоночной хроматографией (дихлорметан: метанол=8:1) с получением 45 мг целевого продукта в виде желтого порошка. Выход: 34,0%.
Смесь метил-2-(3-((1-этилпирролидин-2-ил)метилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (44 мг, 0,1 ммоль) в метаноле (1,6 мл) и 1М водного раствора гидроксида натрия (1,27 мл, 1,27 ммоль) нагревали в условиях дефлегмации в течение 30 мин. LC-MS показала, что реакция прошла до конца, и что образовался только целевой продукт. Растворитель выпаривали в вакууме, и остаток растворяли в воде и подкисляли 1М раствором соляной кислоты. Выпавшее в осадок не совсем белое твердое вещество собирали фильтрованием с получением 25 мг 2-(3-((1-этилпирролидин-2-ил)метилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 58,7%. MS (ESI+APCI) M+1=436,3.
Пример 206
2-(4-Фтор-3-(3-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
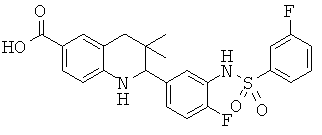
К охлажденной в ледяной бане смеси 2-(3-амино-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,19 ммоль, 1,0 экв.) в пиридине (5 мл) добавляли 3-фторбензол-1-сульфонилхлорид (0,29 ммоль, 1,5 экв.) в атмосфере азота. Затем реакционную смесь перемешивали при комнатной температуре в течение двух часов. Тонкослойная хроматография и LC-MS показали, что исходное вещество израсходовалось полностью. Реакционную смесь гасили добавлением 20 мл воды и экстрагировали этилацетатом (20 мл × 2). Объединенные органические слои концентрировали, и остаток очищали колоночной хроматографией (петролейный эфир/этилацетат=1:1) с получением 2-(4-фтор-3-(3-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде бледно-желтого твердого вещества. Выход: 65%. MS (ESI+APCI) M+1=473.
Пример 207
2-(3-(1-(трет-Бутоксикарбонил)азетидин-3-илкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
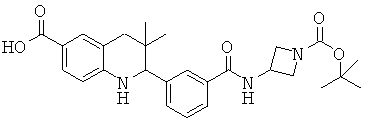
К суспензии 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (150 мг, 0,44 ммоль, 1,0 экв.) в дихлорметане (10,0 мл) добавляли N-гидроксибензотриазол (89,2 мг, 0,66 ммоль, 1,5 экв.) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (253,0 мг, 1,32 ммоль, 3,0 экв.), затем добавляли 4-метилморфолин (133,5 мг, 1,32 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 30 мин. Затем в колбу добавляли трет-бутил-3-аминоазетидин-1-карбоксилат (90,9 мг, 0,53 ммоль, 1,2 экв.), и реакционную смесь перемешивали в течение 30 мин. LC-MS показала, что реакция прошла до конца. Реакционную смесь гасили водой, слои разделяли, и водный слой экстрагировали дихлорметаном (дважды). Объединенные органические слои промывали 2% водным раствором гидроксида натрия (дважды) и рассолом (3 раза) и сушили над безводным сульфатом магния. После удаления растворителя в вакууме получили 234 мг метил-2-(3-(1-(трет-бутоксикарбонил)азетидин-3-илкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилат в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
Смесь метил-2-(3-(1-(трет-бутоксикарбонил)азетидин-3-илкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (234 мг, 0,44 ммоль по теории) в метаноле (6,8 мл) и 1М водного раствора гидроксида натрия (5,3 мл, 5,3 ммоль, 12,0 экв.) нагревали в условиях дефлегмации в течение 60 мин. LC-MS показала, что реакция прошла до конца, и что образовался только целевой продукт. Растворитель выпаривали в вакууме, и остаток растворяли в воде и подкисляли 1 М раствором соляной кислоты до рН=6. Выпавшее в осадок белое твердое вещество экстрагировали тетрагидрофураном (дважды). Объединенные органические слои промывали рассолом и сушили над безводным сульфатом магния. После удаления растворителя получили 209 мг продукта в виде белого твердого вещества, которое очищали колоночной хроматографией (чистый этилацетат) с получением 78 мг 2-(3-(1-(трет-бутоксикарбонил)азетидин-3-илкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 37,2%. MS (ESI+APCI) M+1=480,2.
Пример 208
3,3-Диметил-2-(3-(1-метилазетидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
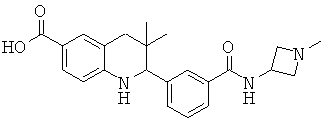
К суспензии 3-(6-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (100 мг, 0,29 ммоль) в дихлорметане (6,7 мл) добавляли N-гидроксибензотриазол (59,7 мг, 0,44 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (169,7 мг, 0,88 ммоль), затем добавляли 4-метилморфолин (89,5 мг, 0,88 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 40 мин. Затем в колбу добавляли 1-метилазетидин-3-амин (30,5 мг, 0,35 ммоль), и реакционную смесь перемешивали в течение еще 60 мин. LC-MS показала, что реакция прошла до конца. Реакционную смесь гасили водой, слои разделяли, и водный слой экстрагировали дихлорметаном (дважды). Объединенные органические слои промывали 2% водным раствором гидроксида натрия (дважды) и рассолом (3 раза) и сушили над безводным сульфатом магния. После удаления растворителя в вакууме получили 129 мг метил-3,3-диметил-2-(3-(1-метилазетидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилат в виде белого твердого вещества, которое промывали диэтиловым эфиром с получением 103 мг целевого продукта в виде белого порошка. Выход: 85,8%.
Смесь метил-3,3-диметил-2-(3-(1-метилазетидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (100 мг, 0,25 ммоль) в метаноле (3,75 мл) и 1М водного раствора гидроксида натрия (2,94 мл, 2,94 ммоль) нагревали в условиях дефлегмации в течение 1,5 ч. LC-MS показала, что реакция прошла до конца, и что образовался только целевой продукт. Растворитель выпаривали в вакууме, и остаток растворяли в воде и подкисляли 1М раствором соляной кислоты. Выпавшее в осадок белое твердое вещество собирали фильтрованием с получением 59 мг 3,3-диметил-2-(3-(1-метилазетидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 61,4%. MS (ESI+APCI) M+1=394,2.
Пример 209
2-(4-Фтор-3-(2-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
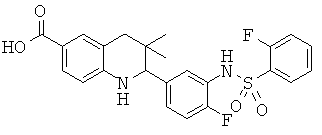
Смесь 2-(4-фтор-3-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (0,5 г, 0,52 ммоль) в метаноле (10 мл) и 1М водного раствора гидроксида натрия (26 мл, 26 ммоль) нагревали в условиях дефлегмации в течение 3 ч. LC-MS показала, что реакция прошла до конца. Растворитель удаляли в вакууме, и остаток подкисляли 1М раствором соляной кислоты до рН=6. Выпавшее в осадок твердое вещество собирали фильтрованием, промывали водой и сушили в вакууме с получением 0,48 г 2-(3-амино-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты с количественным выходом.
К охлажденной в ледяной бане смеси 2-(3-амино-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (0,19 ммоль, 1,0 экв.) в пиридине (5 мл) добавляли 2-фторбензол-1-сульфонилхлорид (0,29 ммоль, 1,5 экв.) в атмосфере азота. Затем реакционную смесь перемешивали при комнатной температуре в течение двух часов. Тонкослойная хроматография и LC-MS показали, что исходное вещество израсходовалось полностью. Реакционную смесь гасили добавлением 20 мл воды и экстрагировали этилацетатом (20 мл × 2). Объединенные органические слои концентрировали, и остаток очищали колоночной хроматографией (петролейный эфир/этилацетат=1:1) с получением 2-(4-фтор-3-(2-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде бледно-желтого твердого вещества. Выход: 69%. MS (ESI+APCI) M+1=473.
Пример 210
3,3-Диметил-2-(3-(3-фенилпропанамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
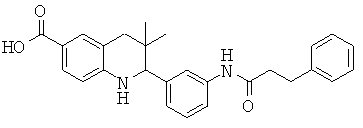
К охлажденной в ледяной бане смеси 2-(3-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (150 мг, 0,48 ммоль), 3-фенилпропановой кислоты (95 мг, 0,73 ммоль), N,N-диизопропилэтиламина (0,20 мл, 1,16 ммоль) в дихлорметане (10 мл) добавляли раствор оксихлорида фосфора (0,06 мл, 0,63 ммоль). Затем реакционную смесь перемешивали при комнатной температуре в течение ночи. LC-MS показала, что исходное вещество израсходовалось полностью. Растворитель удаляли в вакууме, и остаток очищали препаративной тонкослойной хроматографией (петролейный эфир/этилацетат=2:1) с получением 220 мг метил-3,3-диметил-2-(3-(3-фенилпропанамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде бледно-желтого твердого вещества. Выход: 90%.
К смеси метил-3,3-диметил-2-(3-(3-фенилпропанамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (222 мг, 0,50 ммоль) в метаноле (6 мл) и воды (3 мл) добавляли раствор гидроксида натрия (341 мг, 8,53 ммоль) в воде (3 мл). Полученную смесь нагревали в условиях дефлегмации в течение 1 часа. Метанол удаляли под вакуумом. Остаток подкисляли 2М соляной кислотой до рН=5-6. Осадок собирали фильтрованием и очищали препаративной тонкослойной хроматографией (петролейный эфир/этилацетат=3:1) с получением 3,3-диметил-2-(3-(3-фенилпропанамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде твердого вещества (134 мг, выход: 66,1%). MS (ES+APCI) M+1-вода=411,1.
Пример 211
2-(3-(Циклогексанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
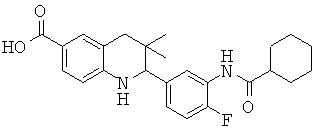
К охлажденной в ледяной бане смеси 2-(4-фтор-3-нитрофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (0,3 ммоль, 1,0 экв.), циклогексанкарбоновой кислоты (0,46 ммоль, 1,5 экв.), N,N-диизопропилэтиламина (0,6 ммоль, 2,0 экв.) в дихлорметане (5 мл) добавляли раствор оксихлорида фосфора (0,36 ммоль, 1,2 экв.). Затем реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов. LC-MS показала, что исходное вещество израсходовалось полностью. Реакционную смесь гасили добавлением 20 мл воды и экстрагировали этилацетатом (20 мл × 2). Объединенный органический слой концентрировали, и остаток очищали колоночной хроматографией (петролейный эфир/этилацетат=3:1) с получением метил-2-(3-(циклогексанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде бледно-желтого твердого вещества. Выход: 86%. MS (ESI+APCI) M+1=439.
Смесь метил-2-(3-(циклогексанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (0,26 ммоль, 1,0 экв.) и 4,5 мл гидроксида натрия (1 моль/л) в 3 мл метанола перемешивали при нагревании в условиях дефлегмации в течение 1-2 ч. LC-MS показала, что исходное вещество израсходовалось полностью. Метанол удаляли при пониженном давлении. Остаток подкисляли до рН 5-6 1М соляной кислотой. Образовавшееся большое количество осадка собирали фильтрованием с получением 2-(3-(циклогексанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 74%. MS (ESI+APCI) M-1=423.
Пример 212
2-(4-(3-Фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
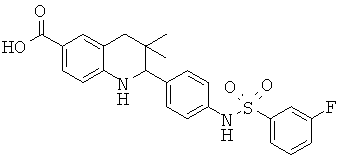
К раствору 2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (50 мг, 0,17 ммоль) в 5 мл пиридина добавляли 3-фторбензол-1-сульфонилхлорид (41 мг 0,21 ммоль) при температуре ниже 0°С. Эту смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Пиридин удаляли в вакууме, и остаток очищали препаративной тонкослойной хроматографией с получением 2-(4-(3-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде желтого твердого вещества, 43 мг. Выход: 62%. MS (ESI+APCI) M+1=455,50.
Пример 213
2-(4-(2-Фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
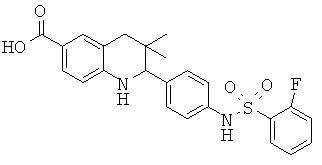
К раствору 2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (50 мг, 0,17 ммоль) в 5 мл пиридина добавляли 2-фторбензол-1-сульфонилхлорид (41 мг, 0,21 ммоль) при температуре ниже 0°С. Эту смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Пиридин удаляли в вакууме, и остаток очищали препаративной тонкослойной хроматографией с получением 2-(4-(2-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде желтого твердого вещества, 43 мг. Выход: 62%. MS (ESI+APCI) M+1=455,50.
Пример 214
2-(2-(Циклопропанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
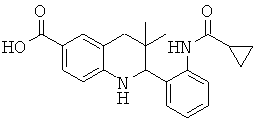
Смесь метил-4-аминобензоата (4,0 г, 26,5 ммоль) и 2-нитробензальдегида (4,2 г, 27,7 ммоль) в толуоле (50 мл) нагревали в условиях дефлегмации в аппарате Дина-Старка в течение ночи. 1H ЯМР-анализ показал, что реакция прошла до конца. Реакционную смесь охлаждали до комнатной температуры, при этом образовалось большое количество желтого твердого вещества, которое собирали фильтрованием с получением 6,3 г (Е)-метил-4-(2-нитробензилиденамино) бензоата. Выход: 84%.
К смеси (Е)-метил 4-(2-нитробензилиденамино)бензоата (3,26 г, 11,5 ммоль) и трифторметансульфоната иттрия(III) (140 мг, 0,27 ммоль) в тетрагидрофуране (28 мл) добавляли изобутилальдегид (1,9 мл, 20,6 ммоль) при комнатной температуре в атмосфере азота, затем полученную смесь перемешивали при комнатной температуре в течение ночи. Тонкослойная хроматография и LC-MS показали, что исходное вещество израсходовалось полностью. Реакционную смесь гасили водой, и слои разделяли. Водный слой экстрагировали этилацетатом дважды, и объединенные органические слои концентрировали в вакууме. Остаток очищали колоночной хроматографией (петролейный эфир/этилацетат=3:1) с получением 1,34 г метил-4-гидрокси-3,3-диметил-2-(2-нитрофенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого твердого вещества. Выход: 32,7%.
К охлажденной в ледяной бане смеси метил-4-гидрокси-3,3-диметил-2-(2-нитрофенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (1,5 г, 4,2 ммоль) и триэтилсилана (1,48 г, 12,6 ммоль) в дихлорметане (150 мл) добавляли по каплям раствор трифторуксусной кислоты (1,92 г, 16,8 ммоль) в дихлорметане (50 мл) в течение 45 минут в атмосфере азота. Смесь выдерживали при 0°С при комнатной температуре в течение 12 ч. Тонкослойная хроматография и LC-MS показали, что исходное вещество израсходовалось полностью. В реакционную смесь добавляли твердый карбонат натрия (2,0 г), и смесь перемешивали в течение 10 мин и фильтровали. Фильтрат концентрировали и очищали колоночной хроматографией (петролейный эфир/этилацетат=3:1) с получением 1,26 г метил-2-(2-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого твердого вещества. Выход: 86%.
К смеси метил-2-(2-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (1,26 г, 3,7 ммоль) и порошка железа (4,2 г, 74 ммоль) в этаноле (30 мл) добавляли каталитическое количество концентрированного раствора соляной кислоты. Полученную смесь нагревали в условиях дефлегмации в течение 3 ч. Тонкослойная хроматография показала, что реакция прошла до конца, и реакционную смесь фильтровали. Осадок на фильтре промывали этилацетатом, и объединенный фильтрат концентрировали в вакууме. Остаток очищали колоночной хроматографией (петролейный эфир/этилацетат=3:1) с получением 1,04 г метил-2-(2-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого твердого вещества. Выход: 90%.
К охлажденной в ледяной бане смеси метил-2-(2-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (80 мг, 0,26 ммоль, 1,0 экв.), циклопропанкарбоновой кислоты (33 мг, 0,34 ммоль, 1,5 экв.), N,N-диизопропилэтиламина (63 мг, 0,51 ммоль, 2,0 экв.) в дихлорметане (4 мл) добавляли раствор оксихлорида фосфора (45 мг, 0,31 ммоль, 1,2 экв.). Затем реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Тонкослойная хроматография и LC-MS показали, что исходное вещество израсходовалось полностью. Реакционную смесь гасили добавлением 20 мл воды и экстрагировали этилацетатом (20 мл × 2). Объединенные органические слои концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (петролейный эфир/этилацетат=2:1) с получением 57 мг метил-2-(2-(циклопропанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде бледно-желтого твердого вещества. Выход: 58%. MS (ESI+APCI) M+1=379.
Смесь метил-2-(2-(циклопропанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (57 мг, 0,15 ммоль, 1,0 экв.) и 1,8 мл водного раствора гидроксида натрия (2М, 3,76 ммоль, 25 экв.) в тетрагидрофуране (3 мл) перемешивали при нагревании в условиях дефлегмации в течение 3 ч. Тонкослойная хроматография показала, что исходное вещество израсходовалось полностью. Тетрагидрофуран удаляли при пониженном давлении, и остаток подкисляли до рН 5-6 1М соляной кислотой. Затем образовавшийся белый осадок собирали фильтрованием с получением 47 мг 2-(2-(циклопропанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 86%. MS (ESI+APCI) M+1=365.
Пример 215
2-(4-(Циклобутанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
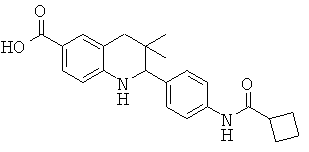
К раствору метил-2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (50 мг, 0,16 ммоль), циклобутанкарбоновой кислоты (0,025 мл, 0,24 ммоль) и N,N-диизопропилэтиламина (0,05 мл, 0,32 ммоль) в дихлорметане (5 мл) посредством шприца добавляли оксихлорид фосфора (0,02 мл, 0,24 ммоль) при температуре ниже 0°С. Смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Растворитель удаляли, остаток промывали смесью дихлорметан/петролейный эфир, и осадок собирали с получением метил-2-(4-(циклобутанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого твердого вещества, 42 мг. Выход: 67%.
К смеси метил-2-(4-(циклобутанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (42 мг, 0,21 ммоль) в метаноле (3 мл) и воды (1,5 мл) обрабатывали раствором гидроксида натрия (133 мг, 2,63 ммоль) в воде (1,5 мл). Полученную смесь нагревали в условиях дефлегмации до завершения реакции (контролировали тонкослойной хроматографией). Метанол удаляли под вакуумом. Остаток подкисляли 2М соляной кислотой до рН=1. Осадок собирали фильтрованием с получением 30 мг 2-(4-(циклобутанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде желтого твердого вещества Выход: 84%. MS (ESI+APCI) M+1=379,2.
Пример 216
2-(2-(Циклобутанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
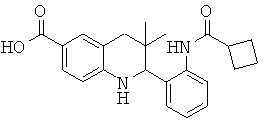
К охлажденной в ледяной бане смеси метил-2-(2-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (80 мг, 0,26 ммоль, 1,0 экв.), циклобутанкарбоновой кислоты (36 мг, 0,34 ммоль, 1,5 экв.), N,N-диизопропилэтиламина (63 мг, 0,51 ммоль, 2,0 экв.) в дихлорметане (4 мл) добавляли раствор оксихлорида фосфора (45 мг, 0,31 ммоль, 1,2 экв.). Затем реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Тонкослойная хроматография и LC-MS показали, что исходное вещество израсходовалось полностью. Реакцию гасили добавлением 20 мл воды, и реакционную смесь экстрагировали этилацетатом (20 мл × 2). Объединенные органические слои концентрировали в вакууме, и остаток очищали колоночной хроматографией на силикагеле (петролейный эфир/этилацетат=2:1) с получением 54 мг метил-2-(2-(циклобутанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде бледно-желтого твердого вещества. Выход: 53%. MS (ESI+APCI) M+1=393,2.
Смесь метил-2-(2-(циклобутанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (54 мг, 0,14 ммоль, 1,0 экв.) и 1,8 мл водного раствора гидроксида натрия (2М, 3,57 ммоль, 25 экв.) в тетрагидрофуране (3 мл) перемешивали при нагревании в условиях дефлегмации в течение 3 ч. Тонкослойная хроматография показала, что исходное вещество израсходовалось полностью. Тетрагидрофуран удаляли при пониженном давлении, и остаток подкисляли до рН 5-6 1М соляной кислотой. Затем образовавшийся в большом количестве белый осадок собирали фильтрованием с получением 40 мг 2-(2-(циклобутанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 76%. MS (ESI+APCI) М+1=379.
Пример 217
2-(4-(Циклогекс-1-енкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
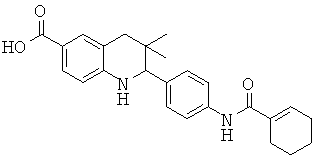
К раствору метил-2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (150 мг, 0,48 ммоль), циклогекс-1-енкарбоновой кислоты (73 мг, 0,58 ммоль) и N,N-диизопропилэтиламина (0,2 мл, 1,2 ммоль) в дихлорметане (5 мл) посредством шприца добавляли оксихлорид фосфора (0,06 мл, 0,58 ммоль) при температуре ниже 0°С. Эту смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Растворитель удаляли, остаток промывали смесью дихлорметан/петролейный эфир, и осадок собирали с получением метил-2-(4-(циклогекс-1-енкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде желтого твердого вещества, 130 мг. Выход: 60%.
Смесь метил-2-(4-(циклогекс-1-енкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (217 мг, 0,52 ммоль) в метаноле (3 мл) и воды (1,5 мл) обрабатывали раствором гидроксид натрия (353 мг, 2,63 ммоль) в воде (1,5 мл) при нагревании в условиях дефлегмации до завершения реакции (контролировали тонкослойной хроматографией). Метанол удаляли под вакуумом. Остаток подкисляли 2М соляной кислотой до рН=1. Осадок собирали фильтрованием с получением 100 мг 2-(4-(циклогекс-1-енкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде желтого твердого вещества Выход: 53%. MS (ESI+APCI) М+1=405,2.
Пример 218
2-(2-(4-Фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
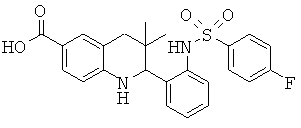
К охлажденной в ледяной бане смеси метил-2-(2-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (60 мг, 0,19 ммоль, 1,0 экв.) и пиридина (0,3 мл, 3,8 ммоль, 20 экв.) в дихлорметане (5 мл) добавляли 4-фторбензол-1-сульфонилхлорид (51 мг, 0,29 ммоль, 1,5 экв.) в атмосфере азота. Затем реакционную смесь перемешивали при комнатной температуре в течение двух часов. Тонкослойная хроматография и LC-MS показали, что исходное вещество израсходовалось полностью. Реакционную смесь гасили добавлением 20 мл воды и экстрагировали этилацетатом (20 мл × 2). Объединенные органические слои концентрировали, и остаток очищали силикагелем (петролейный эфир/этилацетат=2:1) с получением 66 мг метил-2-(2-(4-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде бледно-желтого твердого вещества. Выход: 74%. MS (ESI+APCI) M+1=469.
Смесь метил-2-(2-(4-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (66 мг, 0,14 ммоль, 1,0 экв.) и 1,4 мл водного раствора гидроксида натрия (2М, 2,8 ммоль, 20 экв.) в тетрагидрофуране (4 мл) перемешивали при нагревании в условиях дефлегмации в течение 3 ч. Тонкослойная хроматография показала, что исходное вещество израсходовалось полностью. Тетрагидрофуран удаляли при пониженном давлении, и остаток подкисляли до рН 5-6 1М соляной кислотой. Затем образовавшийся в большом количестве осадок собирали фильтрованием с получением 48 мг 2-(2-(4-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 76%. MS (ESI+APCI) M+1=455.
Пример 219
2-(2-(2-Фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
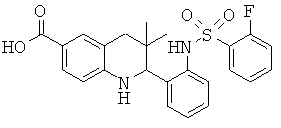
К охлажденной в ледяной бане смеси метил-2-(2-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (60 мг, 0,19 ммоль, 1,0 экв.) и пиридина (0,3 мл, 3,8 ммоль, 20 экв.) в дихлорметане (5 мл) добавляли 2-фторбензол-1-сульфонилхлорид (51 мг, 0,29 ммоль, 1,5 экв.) в атмосфере азота. Затем реакционную смесь перемешивали при комнатной температуре в течение двух часов. Тонкослойная хроматография и LC-MS показали, что исходное вещество израсходовалось полностью. Реакцию гасили добавлением 20 мо воды, и реакционную смесь экстрагировали этилацетатом (20 мл × 2). Объединенные органические слои концентрировали, и остаток очищали силикагелем (петролейный эфир/этилацетат=2:1) с получением 62 мг метил-2-(2-(2-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде бледно-желтого твердого вещества. Выход: 70%. MS (ESI+APCI) M+1=469.
Смесь метил-2-(2-(2-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (62 мг, 0,13 ммоль, 1,0 экв.) и 1,4 мл водного раствора гидроксида натрия (2М, 2,7 ммоль, 20 экв.) в тетрагидрофуране (4 мл) перемешивали при нагревании в условиях дефлегмации в течение 3 ч. Тонкослойная хроматография показала, что исходное вещество израсходовалось полностью. Тетрагидрофуран удаляли при пониженном давлении, и остаток подкисляли до рН 5-6 1М соляной кислотой. Затем образовавшуюся массу белого осадка собирали фильтрованием с получением 47 мг 2-(2-(2-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 79%. MS (ESI+APCI) M+1=455.
Пример 220
3,3-Диметил-2-(2-(фенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
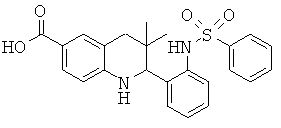
К охлажденной в ледяной бане смеси метил-2-(2-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (60 мг, 0,19 ммоль, 1,0 экв.) и пиридина (0,3 мл, 3,8 ммоль, 20 экв.) в дихлорметане (5 мл) добавляли бензолсульфонилхлорид (51 мг, 0,29 ммоль, 1,5 экв.) в атмосфере азота. Затем реакционную смесь перемешивали при комнатной температуре в течение двух часов. Тонкослойная хроматография и LC-MS показали, что исходное вещество израсходовалось полностью. Реакционную смесь гасили добавлением 20 мл воды и экстрагировали этилацетатом (20 мл × 2). Объединенные органические слои концентрировали, и остаток очищали силикагелем (петролейный эфир/этилацетат=2:1) с получением 70 мг метил-3, 3-диметил-2-(2-(фенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде бледно-желтого твердого вещества. Выход: 85%. MS (ESI+APCI) M+1=451.
Смесь метил-3,3-диметил-2-(2-(фенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (70 мг, 0,16 ммоль, 1,0 экв.) и 1,6 мл водного раствора гидроксида натрия (2М, 3,3 ммоль, 20 экв.) в тетрагидрофуране (4 мл) перемешивали при нагревании в условиях дефлегмации в течение 3 ч. Тонкослойная хроматография показала, что исходное вещество израсходовалось полностью. Тетрагидрофуран удаляли при пониженном давлении, и остаток подкисляли до рН 5-6 1М соляной кислотой. Затем образовавшуюся массу белого осадка собирали фильтрованием с получением 58 мг 3,3-диметил-2-(2-(фенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 83%. MS (ESI+APCI) M+1=437.
Пример 221
2-(3-(N-изопропилсульфамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
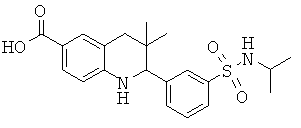
Через перемешиваемый раствор хлорида меди(I) (90 мг, 0,91 ммоль) в уксусной кислоте (60 мл) барботировали газ диоксид серы в течение 6 ч при комнатной температуре. Смесь метил-2-(3-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (992 мг, 3,20 ммоль) в концентрированной соляной кислоте (30 мл) и уксусной кислоты (10 мл) перемешивали в течение 1 часа. После охлаждения до -10°С по каплям добавляли раствор нитрита натрия (334 мг, 4,84 ммоль) в воде (7 мл) при температуре ниже -10°С. Полученную смесь перемешивали в течение 1 ч при -10°С. Полученный раствор диоксид серы-соль добавляли к вышеуказанному раствору при -10°С. После добавления смесь перемешивали в течение 24 ч при комнатной температуре. Реакционную смесь выливали на 100 г дробленого льда. Смесь экстрагировали дихлорметаном (40 мл, четыре раза). Объединенные органические слои промывали водой (40 мл, дважды), насыщенным водным раствором бикарбоната натрия (30 мл, дважды) и насыщенным рассолом (40 мл) и сушили над безводным сульфатом магния. Безводный сульфат магния удаляли фильтрованием, и органический растворитель выпаривали при пониженном давлении с получением 1,0 г метил-2-(3-(хлорсульфонил)фенил)-3,3-диметил-3,4-дигидрохинолин-6-карбоксилата. MS (ESI+APCI) M+1=394.
К перемешиваемому раствору метил-2-(3-(хлорсульфонил)фенил)-3,3-диметил-3,4-дигидрохинолин-6-карбоксилата (393 мг, 1,0 ммоль) в дихлорметане (4 мл) добавляли пропан-2-амин (60 мг, 1,0 ммоль) и N,N-диизопропилэтиламин (258 мг, 2,0 ммоль). Полученную смесь перемешивали в течение ночи. Смесь очищали препаративной тонкослойной хроматографией с получением 245 мг метил-2-(3-(N-изопропилсульфамоил)фенил)-3,3-диметил-3,4-дигидрохинолин-6-карбоксилата, который использовали напрямую.
К перемешиваемому раствору метил-2-(3-(N-изопропилсульфамоил)фенил)-3,3-диметил-3,4-дигидрохинолин-6-карбоксилата (245 мг, 0,59 ммоль) в метаноле (5 мл) добавляли 10% Pd/C (130 мг). Смесь гидрировали H2, подаваемым из баллона. После фильтрования фильтрат концентрировали и очищали препаративной тонкослойной хроматографией с получением 120 мг метил-2-(3-(N-изопропилсульфамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде сиропа (выход: 28% за три стадии).
К перемешиваемому раствору метил-2-(3-(N-изопропилсульфамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (120 мг, 0,288 ммоль) в смеси метанол/тетрагидрофуран (4 мл/4 мл) добавляли 1 н. гидроксид натрия (4,32 мл). Полученную смесь нагревали в условиях дефлегмации в течение 1,5 ч. Органический растворитель удаляли, и остаток растворяли в воде. Водный слой подкисляли до рН=4. Осадок отфильтровывали и снова растворяли в тетрагидрофуране и сушили над безводным сульфатом магния. Безводный сульфат магния удаляли, и остаток после выпаривания обрабатывали дихлорметаном с получением 33 мг 2-(3-(N-изопропилсульфамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты. Выход: 28%. MS (ESI+APCI) M+1=403,1.
Пример 222
2-(2-(3-Фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
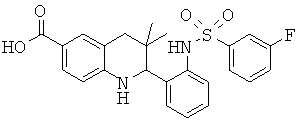
К перемешиваемому раствору метил-2-(2-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (1,0 г, 3,22 ммоль, 1,0 экв.) в пиридине (5 мл) и дихлорметане (20 мл) при 0°С по каплям добавляли раствор 3-фторбензол-1-сульфонилхлорида (940 мг, 4,83 ммоль, 1,5 экв.) в дихлорметане (30 мл). Эту смесь перемешивали при комнатной температуре в течение 6 ч. Тонкослойная хроматография и LC-MS показали, что реакция завершилась. Смесь гасили добавлением 50 мл воды и экстрагировали этилацетатом (100 мл × 3). Объединенные органические слои сушили над безводным сульфатом натрия и упаривали с получением 1,987 г метил-2-(2-(3-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (пиридин учтен) в виде светло-желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
К перемешиваемому раствору метил-2-(2-(3-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (1,99 г, 4,2 ммоль, 1,0 экв.) в смеси тетрагидрофуран/метанол (25 мл/25 мл) добавляли гидроксид натрия (24 мл, 22,63 ммоль, 5,4 экв.). Эту смесь нагревали в условиях дефлегмации при перемешивании в течение 5 ч. LC-MS показала, что 2005467-032-01 израсходовался. Смесь концентрировали, и остаток растворяли в воде. Водный слой подщелачивали до рН=4 1М соляной кислотой. Осадок отфильтровывали, промывали водой и сушили с получением 1,357 г 2-(2-(3-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде не совсем белого твердого вещества. Выход: 92,7% (за две стадии). MS (ESI+APCI) М+1=455,2.
Пример 223
3,3-Диметил-2-(2-(метилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
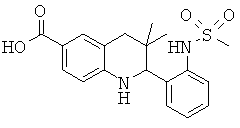
К перемешиваемому раствору метил-2-(2-аминофенил)-3,3-диметил-1,2,3,4-25 тетрагидрохинолин-6-карбоксилата (1,0 г, 3,22 ммоль, 1,0 экв.) в пиридине (5 мл, 0,0644 мл, 20,0 экв.) и дихлорметане (20 мл) при 0°С по каплям добавляли раствор метансульфонилхлорида в дихлорметане (30 мл). Эту смесь перемешивали при комнатной температуре в течение 4 ч. Тонкослойная хроматография и LC-MS показали, что реакция прошла до конца. Смесь гасили добавлением 50 мл воды и экстрагировали этилацетатом (100 мл × 2). Объединенные органические слои сушили над безводным сульфатом натрия и упаривали с получением 1,475 г метил-3,3-диметил-2-(2-(метилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (пиридин учтен) в виде светло-желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
К перемешиваемому раствору метил-3,3-диметил-2-(2-(метилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (1,475 г, 3,769 ммоль) в смеси тетрагидрофуран/метанол (30 мл/30 мл) добавляли гидроксид натрия (26,5 мл, 53,126 ммоль, 14,1 экв.). Смесь нагревали в условиях дефлегмации и перемешивали в течение 0,5 ч. LC-MS показала, что реакция прошла до конца. Смесь концентрировали, и остаток растворяли в воде. Водный слой подщелачивали до рН=4 1М соляной кислотой. Осадок отфильтровывали, промывали водой и сушили с получением 1,45 г 3,3-диметил-2-(2-(метилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде не совсем белого твердого вещества. Выход: 86,3% (за две стадии). MS (ESI+APCI) М+1=375,1.
Пример 224
3,3-Диметил-2-(3-(1-метилпирролидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновая кислота
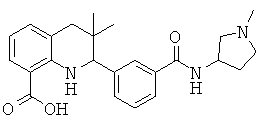
К смеси метил-2-аминобензоата (0,77 г, 5,1 ммоль) и бензил-3-формилбензоата (1,23 г, 5,1 ммоль) в тетрагидрофуране (20,5 мл) добавляли изобутилальдегид (0,48 г, 6,68 ммоль), затем добавляли трифторметансульфонат иттрия(III) (159 мг, 0,26 ммоль), и эту реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 23 ч. Тонкослойная хроматография (петролейный эфир:этилацетат=10: 1) показала, что реакция почти закончилась. Реакционную смесь гасили рассолом, и слои разделяли. Водный слой экстрагировали этилацетатом (дважды), и объединенные органические слои промывали рассолом и сушили над безводным сульфатом магния. После удаления растворителя в вакууме остаток очищали колоночной хроматографией (петролейный эфир:этилацетат=20: 1) с получением 0,66 г метил-2-(3-(бензилоксикарбонил)фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоксилата в виде желтого масла, которое использовали на следующей стадии без дополнительной очистки.
К раствору метил-2-(3-(бензилоксикарбонил)фенил)-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоксилата (0,66 г, 1,49 ммоль), триэтилсилана (0,5 г, 4,3 ммоль) в дихлорметане (10 мл) добавляли раствор трифторуксусной кислоты (0,69 г, 6,1 ммоль), который находился в капельной воронке, в атмосфере азота с охлаждением в ледяной бане. После окончания добавления полученной смеси давали возможность нагреться до комнатной температуры естественным образом в течение ночи. Тонкослойная хроматография (петролейный эфир:этилацетат=20:1) показала, что реакция прошла до конца. Реакционную смесь подщелачивали твердым карбонатом натрия до рН=6 и фильтровали. Фильтрат концентрировали в вакууме, и остаток очищали колоночной хроматографией (петролейный эфир:этилацетат=25:1) с получением 109 мг метил-2-(3-(бензилоксикарбонил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоксилата в виде желтоватого твердого вещества. Выход: 39,6%.
Смесь метил-2-(3-(бензилоксикарбонил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоксилата (108 мг, 0,25 ммоль) и Pd/C (31,6 мг) в смеси метанол/тетрагидрофуран (об./об.=1/1, 10 мл) обрабатывали Hz при комнатной температуре в течение 19 ч Тонкослойная хроматография (петролейный эфир:этилацетат=5:1) показала, что реакция прошла до конца. Смесь разделяли фильтрованием, и фильтрат концентрировали в вакууме с получением 73 мг белого твердого вещества, которое подвергали перекристаллизации из смеси дихлорметан/гексан с получением 63 мг 3-(8-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты в виде белого порошка. Выход: 73,8%.
К суспензии 3-(8-(метоксикарбонил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (63 мг, 0,19 ммоль) в дихлорметане (5,0 мл) добавляли N-гидроксибензотриазол (37,6 мг, 0,28 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (106,7 мг, 0,56 ммоль), затем добавляли 4-метилморфолин (56,3 мг, 0,56 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Затем в колбу добавляли 1-метилпирролидин-3-амин (27,9 мг, 0,28 ммоль), и реакционную смесь перемешивали в течение еще 1 ч. LC-MS показала, что реакция прошла до конца. Реакционную смесь гасили водой и разделяли. Водный слой экстрагировали дихлорметаном (дважды), и объединенные органические слои промывали 5% водным раствором гидроксида натрия (дважды) и водой (3 раза) и сушили над безводным сульфатом магния. После удаления растворителя в вакууме получили 76 мг метил-3,3-диметил-2-(3-(1-метилпирролидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-8-карбоксилат в виде белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
Смесь метил-3,3-диметил-2-(3-(1-метилпирролидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-8-карбоксилата (76 мг, 0,18 ммоль) в метаноле (2,7 мл) и водного раствора гидроксида натрия (1М, 2,34 мл, 2,34 ммоль) нагревали в условиях дефлегмации в течение 1,5 ч. LC-MS показала, что реакция прошла до конца. Растворитель удаляли в вакууме, и остаток подкисляли 1М раствором соляной кислоты до осаждения массы белого твердого вещества, которое собирали фильтрованием, промывали водой и сушили в вакууме с получением 28 мг 3,3-диметил-2-(3-(1-метилпирролидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты в виде белого твердого вещества. Выход: 38%. MS (ESI+APCI) M+1=408,2.
Пример 225
3-(6-Хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-М-(1-метилпирролидин-3-ил)бензамид
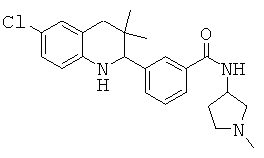
К раствору 4-хлоранилина (512 мг, 2 ммоль) и бензил-3-формилбензоата (960 мг, 2 ммоль) в дихлорметане (5 мл) добавляли изобутилальдегид (158 мг, 2,4 ммоль, 1,2 экв.), затем добавляли эфират трифторида бора (0,16 мл, 0,2 ммоль, 0,1 экв.). Полученную смесь перемешивали в течение 24 часов. Реакционную смесь гасили водой, и слои разделяли. Органический слой сушили и упаривали под вакуумом с получением неочищенного продукта, который очищали колоночной хроматографией с использованием смеси петролейный эфир/этилацетат=20:1 в качестве элюента с получением 456 мг бензил-3-(6-хлор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензоата (выход 34%) в виде желтого твердого вещества. MS (ESI+APCI) M+1=422,4.
В герметизированную пробирку добавляли бензил-3-(6-хлор-4-гидрокси-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензоат (1,98 г, 4,70 ммоль), дихлорметан (25 мл) и триэтилсилан (1,10 г, 9,40 ммоль, 2,0 экв.), затем добавляли трифторуксусную кислоту (1,61 г, 14,11 ммоль, 3,0 экв.). Герметизированную пробирку нагревали при 60°С в течение 16 ч и охлаждали до комнатной температуры. Реакционную смесь промывали насыщенным раствором бикарбоната натрия, и слои разделяли. Органический слой сушили, и остаток очищали колоночной хроматографией, используя смесь петролейный эфир/этилацетат=20:1, с получением бензил-3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензоата, 914 мг (выход 47,9%) в виде желтого твердого вещества. MS (ESI+APCI) М+1=406,2.
Смесь бензил-3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензоата (914 мг, 2,25 ммоль) в метаноле (30 мл) и водного раствора гидроксида натрия (2М, 17 мл, 34 ммоль) нагревали в условиях дефлегмации в течение 2 ч. Растворитель удаляли под вакуумом, и остаток подкисляли 2 н. раствором соляной кислоты до рН=2. Выпавшее в осадок твердое вещество собирали с получением 539 мг 3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (выход: 76%) в виде белого порошка.
К суспензии 3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)бензойной кислоты (361 мг, 1,07 ммоль) в дихлорметане (20 мл) добавляли N-гидроксибензотриазол (218 мг, 1,61 ммоль, 1,5 экв.), затем добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (616 мг, 3,22 ммоль, 3,0 экв.) и 4-метилморфолин (326 мг, 3,22 ммоль, 3,0 экв.). Через 40 мин добавляли образованное активное промежуточное соединение, и перемешивание осуществляли в течение последующих 2 ч. Добавляли воду, чтобы погасить реакцию, и органический слой промывали 1 н. гидроксидом натрия, затем рассолом. Выделенные органические слои сушили и упаривали с получением 398 мг смеси 3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-М-метилпирролидин-3-ил)бензамида (85%) и 3-(6-хлор-3,3-диметил-3,4-дигидрохинолин-2-ил)-N-(1-метилпирролидин-3-ил)бензамида (15%), которую использовали на следующей стадии без дополнительной очистки.
К смеси 3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-N-(1-метилпирролидин-3-ил)бензамида (85%) и 3-(6-хлор-3,3-диметил-3,4-дигидрохинолин-2-ил)-N-(1-метилпирролидин-3-ил)бензамида (15%) (300 мг) в смеси метанол/тетрагидрофуран (7,5 мл/7,5 мл) добавляли боргидрид натрия (0,5 г). Эту смесь перемешивали в течение 2 ч, и растворитель удаляли в вакууме. Остаток растворяли в тетрагидрофуране, промывали рассолом и разделяли. Органический слой сушили и концентрировали. Остаток очищали препаративной тонкослойной хроматографией, используя смесь дихлорметан/метанол=10:1, с получением 3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-N-(1-метилпирролидин-3-ил)бензамида, 80 мг (выход 32%), в виде светло-желтого твердого вещества. MS (ESI+APCI) М+1=398,2.
Пример 226
3,3-Диметил-2-(4-(N-метилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
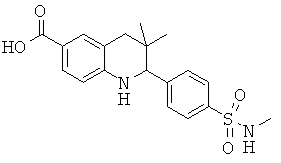
Для приготовления раствора диоксид серы - уксусная кислота хлорид меди(I) (60 мг, 0,60 ммоль) растворяли в уксусной кислоте (60 мл), затем в течение 2 ч продолжали пропускать в реакционную смесь диоксид серы. Цвет реакционной смеси становился синим.
Для синтеза диазониевой соли метил-2-(4-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилат (624 мг, 2,01 ммоль) растворяли в уксусной кислоте (6 мл) и концентрированной соляной кислоте (18 мл) в ледяной бане и охлаждали до -15°С. Затем в реакционную смесь по каплям добавляли нитрит натрия (208 мг, 3,02 ммоль) в воде (4 мл). Эту смесь энергично перемешивали в течение более одного часа, поддерживая температуру ниже -10°С.
Раствор диоксид серы - уксусная кислота по каплям добавляли в реакционную смесь диазониевой соли в ледяной бане и охлаждали до -10°С. После окончания добавления реакционной смеси давали возможность нагреться до комнатной температуры в течение трех суток. Реакционную смесь по каплям добавляли к большому количеству ледяной воды. Большое количество желтого твердого вещества выпало в осадок. Его отфильтровывали, и осадок на фильтре промывали ледяной водой. Желтое твердое вещество представляло собой целевой продукт метил-2-(4-(хлорсульфонил)фенил)-3,3-диметил-3,4-дигидрохинолин-6-карбоксилат (603 мг, выход: 76,6%). MS (ES+APCI) M+1=392,1.
В круглодонную колбу к смеси гидрохлорида метиламина (68 мг, 1,0 ммоль) и N,N-диизопропилэтиламина (0,54 мл, 3,0 ммоль) в дихлорметане (10 мл) по каплям добавляли смесь метил-2-(4-(хлорсульфонил)фенил)-3,3-диметил-3,4-дигидрохинолин-6-карбоксилата (396 мг, 1,0 ммоль) в дихлорметане (10 мл). Полученную смесь перемешивали при комнатной температуре в течение 10 часов. Реакционную смесь промывали водой несколько раз и сушили над безводным сульфатом магния. Смесь фильтровали и концентрировали с получением метил-3,3-диметил-2-(4-(N-метилсульфамоил)фенил)-3,4-дигидрохинолин-6-карбоксилата в виде желтого масла (190 мг). MS (ES+APCI) M+1=389,1.
В круглодонную колбу к раствору метил-3,3-диметил-2-(4-(N-метилсульфамоил)фенил)-3,4-дигидрохинолин-6-карбоксилата (230 мг, 0,81 ммоль) в тетрагидрофуране (10 мл) и метаноле (10 мл) добавляли Pd/C (100 мг, 40%). Полученную смесь перемешивали при комнатной температуре в течение 10 часов под давлением Н2. Смесь фильтровали и концентрировали с получением метил-3,3-диметил-2-(4-(N-метилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого твердого вещества (190 мг). MS (ES+APCI) М+1=389,1.
В круглодонной колбе смесь метил-3,3-диметил-2-(4-(N-метилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (190 мг, 0,49 ммоль) в метаноле (20 мл) и воды (2 мл) обрабатывали раствором гидроксида натрия (332 мг, 8,3 ммоль) в воде (3 мл). Полученную смесь нагревали в условиях дефлегмации в течение 1,5 часов. Метанол удаляли под вакуумом. Остаток подкисляли 2М соляной кислотой до рН=5-6. Осадок собирали фильтрованием и очищали препаративной тонкослойной хроматографией (силикагель, петролейный эфир/этилацетат=1:1) с получением 3,3-диметил-2-(4-(N-метилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (40 мг, выход: 21,9%). MS (ES+APCI) М+1=375,1.
Пример 227
3,3-Диметил-2-(3-(пирролидин-1-илсульфонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
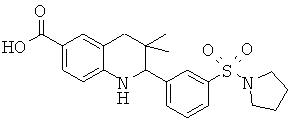
К перемешиваемому раствору пирролидина (38 мг, 0,54 ммоль) и N,N-диизопропилэтиламина (116 мг, 0,90 ммоль) в дихлорметане (4 мл) порциями добавляли метил-2-(3-(хлорсульфонил)фенил)-3,3-диметил-3,4-дигидрохинолин-6-карбоксилат (175 мг, 0,45 ммоль). Полученный желтый раствор перемешивали в течение 3 ч при комнатной температуре. Смесь очищали препаративной тонкослойной хроматографией с получением 163 мг метил-3,3-диметил-2-(3-(пирролидин-1-илсульфонил)фенил)-3,4-дигидрохинолин-6-карбоксилата, который использовали напрямую.
Смесь метил-3,3-диметил-2-(3-(пирролидин-1-илсульфонил)фенил)-3,4-дигидрохинолин-6-карбоксилата (140 мг, 0,328 ммоль) в смеси метанол/тетрагидрофуран (6 мл/6 мл) обрабатывали Н2 при комнатной температуре в течение ночи. LC-MS показала, что реакция прошла до конца. Смесь разделяли фильтрованием, и фильтрат концентрировали в вакууме с получением 110,9 мг метил-3,3-диметил-2-(3-(пирролидин-1-илсульфонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата. Выход: 78,9%.
К перемешиваемому раствору метил-3,3-диметил-2-(3-(пирролидин-1-илсульфонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (57 мг, 0,133 ммоль) в смеси метанол/тетрагидрофуран (2 мл/мл) добавляли 1 М водный раствор (2,0 мл, 2,0 ммоль). LC-MS показала, что 2005467-009-01 израсходовался. Смесь концентрировали, и остаток растворяли в воде. Водный слой подщелачивали до рН=4 1М раствором соляной кислоты. Выпавшее в осадок твердое вещество отфильтровывали и сушили с получением 35,5 мг 3,3-диметил-2-(3-(пирролидин-1-илсульфонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 64,4%. MS (ESI+APCI) M+1=415,1.
Пример 228
3,3-Диметил-2-(3-(N-метилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
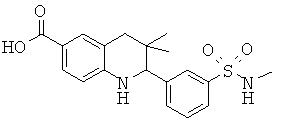
Смесь метил-3,3-диметил-2-(3-(N-метилсульфамоил)фенил)-3,4-дигидрохинолин-6-карбоксилата (175 мг, 0,438 ммоль) в смеси метанол/тетрагидрофуран (9,5 мл/9,5 мл) обрабатывали H2 при комнатной температуре в течение ночи. LC-MS показала, что реакция прошла до конца. Смесь разделяли фильтрованием, фильтрат концентрировали в вакууме, и остаток очищали колоночной хроматографией (петролейный эфир:этилацетат=5:1) с получением 143,2 мг метил-3,3-диметил-2-(3-(N-метилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата. Выход: 81,2%.
К перемешиваемому раствору метил-3,3-диметил-2-(3-(N-метилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (75 мг, 0,19 ммоль) в смеси тетрагидрофуран/метанол (2,5 мл/2,5 мл) добавляли 1М водный раствор гидроксида натрия (2,89 мл, 2,89 ммоль). Смесь нагревали в условиях дефлегмации при перемешивании в течение 1,5 ч. LC-MS показала, что 2005467-012-01 израсходовался. Смесь концентрировали, и остаток растворяли в воде. Водный слой подщелачивали до рН=4 1М раствором соляной кислоты. Выпавшее в осадок твердое вещество отфильтровывали и сушили с получением 56,7 мг 3,3-диметил-2-(3-(N-метилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 78,5%. MS (ESI+APCI) M+1=375,2.
Пример 229
3,3-Диметил-2-(3-(N-(1-метилпирролидин-3-ил)сульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
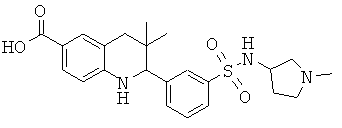
К перемешиваемому раствору 1-метилпирролидин-3-амина (52 мг, 0,52 ммоль) и N,N-диизопропилэтиламина (112 мг, 0,86 ммоль) в дихлорметане (4 мл) порциями добавляли метил-2-(3-(хлорсульфонил)фенил)-3,3-диметил-3,4-дигидрохинолин-6-карбоксилат (170 мг, 0,43 ммоль). Полученный желтый раствор перемешивали в течение 3 ч при комнатной температуре. Смесь очищали препаративной тонкослойной хроматографией с получением 152 мг метил-3,3-диметил-2-(3-(N-(1-метилпирролидин-3-ил)сульфамоил)фенил)-3,4-дигидрохинолин-6-карбоксилата, который использовали напрямую.
Смесь метил-3,3-диметил-2-(3-(N-(1-метилпирролидин-3-ил)сульфамоил)фенил)-3,4-дигидрохинолин-6-карбоксилата (152 мг, 0,33 ммоль) и 10% Pd/C (100 мг) в метаноле (3 мл) и тетрагидрофуране (3 мл) гидрировали Н2, подаваемым из баллона, при 30°С. После фильтрования фильтрат концентрировали и очищали препаративной тонкослойной хроматографией с получением 140 мг метил-3,3-диметил-2-(3-(М-(1-метилпирролидин-3-ил)сульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого твердого вещества. Выход: 92%.
К перемешиваемому раствору метил-3,3-диметил-2-(3-(N-(1-метилпирролидин-3-ил)сульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (140 мг, 0,31 ммоль) в смеси метанол/тетрагидрофуран (5 мл/5 мл) добавляли 1 н. гидроксид натрия (4,59 мл). Полученную смесь нагревали в условиях дефлегмации в течение 2,5 ч. Органические растворитель удаляли, и остаток растворяли в воде. Водный слой подкисляли до рН=4. Осадок отфильтровывали, растворяли в тетрагидрофуране и сушили над безводным сульфатом магния. Безводный сульфат магния удаляли, и остаток после выпаривания обрабатывали этилацетатом с получением 40 мг 3,3-диметил-2-(3-(N-(1-метилпирролидин-3-ил)сульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты (выход: 29%). MS (ESI+APCI) M+1=444,2.
Пример 230
3,3-Диметил-2-(3-(N-фенилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
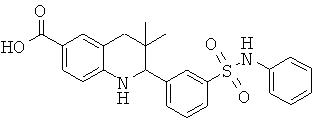
К перемешиваемому раствору анилина (50 мг, 0,52 ммоль) и N,N-диизопропилэтиламина (122 мг, 0,86 ммоль) в дихлорметане (4 мл) добавляли метил-2-(3-(хлорсульфонил)фенил)-3,3-диметил-3,4-дигидрохинолин-6-карбоксилат (170 мг, 0,43 ммоль) в дихлорметане (2 мл). Эту смесь перемешивали в течение 18 ч при комнатной температуре и очищали препаративной тонкослойной хроматографией с получением 170 мг метил-3,3-диметил-2-(3-(N-фенилсульфамоил)фенил)-3,4-дигидрохинолин-6-карбоксилата, который использовали напрямую.
Смесь метил-3,3-диметил-2-(3-(N-фенилсульфамоил)фенил)-3,4-дигидрохинолин-6-карбоксилата (170 мг, 0,38 ммоль) и 10% Pd/C (150 мг) в метаноле (4 мл) и тетрагидрофуране (5 мл) гидрировали Н2, подаваемым из баллона, при 30°С. После фильтрования фильтрат концентрировали и очищали препаративной тонкослойной хроматографией с получением 130 мг метилового эфира 3,3-диметил-2-(3-фенилсульфамоил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты.
К перемешиваемому раствору метил-3,3-диметил-2-(3-(N-фенилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (130 мг, 0,29 ммоль) в смеси метанол/тетрагидрофуран (5 мл/5 мл) добавляли 1 н. гидроксид натрия (4,33 мл). Полученную смесь нагревали в условиях дефлегмации в течение 2,5 ч. Органический растворитель удаляли, и остаток растворяли в воде. Водный слой подкисляли до рН=4. Осадок отфильтровывали, растворяли в тетрагидрофуране и сушили над безводным сульфатом магния. Безводный сульфат магния удаляли, и остаток после упаривания очищали препаративной тонкослойной хроматографией с получением 80 мг неочищенного продукта, который подвергали перекристаллизации из дихлорметана и диэтилового эфира с получением 40 мг 3,3-диметил-2-(3-(N-фенилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты. Выход: 32%. MS (ESI+APCI) M+1=437,1.
Пример 231
2-(3-(N,N-Диметилсульфамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
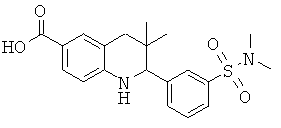
К перемешиваемому раствору дигидрохлорида метиламина (82 мг, 1,0 ммоль) и N,N-диизопропилэтиламина (388 мг, 3,0 ммоль) в дихлорметане (4 мл) добавляли раствор метил-2-(3-(хлорсульфонил)фенил)-3,3-диметил-3,4-дигидрохинолин-6-карбоксилата (394 мг, неочищенный продукт) в дихлорметане (4 мл). Эту смесь очищали препаративной тонкослойной хроматографией с получением 100 мг метил-2-(3-(N,N-диметилсульфамоил)фенил)-3,3-диметил-3,4-дигидрохинолин-6-карбоксилата, который использовали напрямую.
Смесь метил-2-(3-(N,N-диметилсульфамоил)фенил)-3,3-диметил-3,4-дигидрохинолин-6-карбоксилата (100 мг, 0,25 ммоль) и 10% Pd/C (100 мг) в метаноле (3 мл) и тетрагидрофуране (3 мл) гидрировали H2, подаваемым из баллона, при 30°С. После фильтрования фильтрат концентрировали и очищали препаративной тонкослойной хроматографией с получением 80 мг метил-2-(3-(N,N-диметилсульфамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде неочищенного продукта.
К перемешиваемому раствору метил-2-(3-(N,N-диметилсульфамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (149 мг, 0,37 ммоль) в смеси метанол/тетрагидрофуран (5 мл/5 мл) добавляли 1 н. гидроксид натрия (5,6 мл). Полученную смесь нагревали в условиях дефлегмации в течение 2,5 ч. Органический растворитель удаляли, и остаток растворяли в воде. Водный слой подкисляли до рН=4. Осадок отфильтровывали, растворяли в тетрагидрофуране и сушили над безводным сульфатом магния. Безводный сульфат магния удаляли, и остаток после упаривания обрабатывали этилацетатом с получением 29 мг 2-(3-(N,N-диметилсульфамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты. Выход: 20%. MS (ESI+APCI) M+1=389,1.
Пример 232
3,3-Диметил-2-(2-(пиколинамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
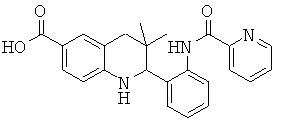
К охлажденной в ледяной бане смеси метил-2-(2-аминофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (60 мг, 0,19 ммоль, 1,0 экв.) и N,N-диизопропилэтиламина (50 мг, 0,38 ммоль, 2,0 экв.) в 4 мл дихлорметана по каплям добавляли раствор пиколиноилхлорида (40 мг, 0,29 ммоль, 1,5 экв.) в дихлорметане (1 мл). Затем полученную смесь перемешивали при комнатной температуре в течение 30 мин. Тонкослойная хроматография и LC-MS показали, что исходное вещество израсходовалось полностью. Растворитель удаляли при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (петролейный эфир/этилацетат=2:1) с получением 44 мг метил-3,3-диметил-2-(2-(пиколинамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде серого твердого вещества. Выход: 60%. MS (ESI+APCI) M+1=416,2.
Смесь метил-3,3-диметил-2-(2-(пиколинамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата (44 мг, 0,1 ммоль, 1,0 экв.) и 1,3 мл водного раствора гидроксида натрия (2М, 2,6 ммоль, 25 экв.) в тетрагидрофуране (3 мл) перемешивали при нагревании в условиях дефлегмации в течение 3 ч. Тонкослойная хроматография показала, что исходное вещество израсходовалось полностью. Тетрагидрофуран удаляли при пониженном давлении, и остаток подкисляли до рН 5-6 1М соляной кислотой. Затем образовавшуюся массу осадка собирали фильтрованием с получением 30 мг 3,3-диметил-2-(2-(пиколинамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход: 65%. MS (ESI+APCI) M+1=402.
Пример 233
2-(3-(2-Карбоксипропан-2-илокси)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновая кислота
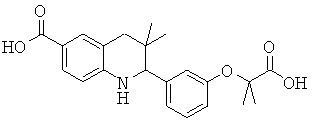
К перемешиваемому раствору метил-4-аминобензоата (381 мг, 2,5 ммоль) и метил-2-(3-формилфенокси)-2-метилпропаноата (555 мг, 2,5 ммоль) в толуоле (30 мл) приблизительно 4А MS, и оснащенном ловушкой Дина-Старка. Смесь 30 перемешивали и нагревали в условиях дефлегмации в течение 1,5 ч. 1H ЯМР-анализ показал, что исходное вещество израсходовалось. Растворитель выпаривали, и остаток напрямую использовали на следующей стадии.
К раствору (Е)-метил-4-(3-(1-метокси-2-метил-1-оксопропан-2-илокси)бензилиденамино)бензоата (888 мг, 2,5 ммоль) и трифторметансульфоната иттрия(III)(5 мл) в тетрагидрофуране (6 мл) добавляли раствор изобутилальдегида (216 мг, 3,0 ммоль) в тетрагидрофуране (1 мл) в атмосфере азота. Эту смесь перемешивали при комнатной температуре в течение 17 ч. Смесь очищали колоночной хроматографией с получением 510 мг метил-4-гидрокси-2-(3-(1-метокси-2-метил-1-оксопропан-2-илокси)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде белого твердого вещества. Выход: 48%, 2 стадии.
Смесь метил-4-гидрокси-2-(3-(1-метокси-2-метил-1-оксопропан-2-илокси)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (510 мг, 1,19 ммоль) и триэтилсилана (400 мг, 3,44 ммоль) в дихлорметане (6 мл) перемешивали и охлаждали в ледяной бане. В эту смесь медленно добавляли раствор трифторуксусной кислоты (554 мг, 4,86 ммоль) в дихлорметане (6 мл). Реакционную смесь обрабатывали карбонатом натрия и перемешивали в течение 30 мин. Смесь фильтровали, и фильтрат концентрировали и очищали колоночной хроматографией (силикагель, петролейный эфир:этилацетат=15: 1) с получением 230 мг метил-2-(3-(1-метокси-2- метил-1-оксопропан-2-илокси)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата. Выход: 47%.
К раствору метил-2-(3-(1-метокси-2-метил-1-оксопропан-2-илокси)фенил)-3,3-диметил-3,4-дигидрохинолин-6-карбоксилата (230 мг, 0,56 ммоль) в метаноле (5 мл) и тетрагидрофуране (5 мл) добавляли 10% Pd/C (100 мг). Эту смесь гидрировали H2, подаваемом из баллона, в течение 13 ч. Pd/C удаляли фильтрованием. Фильтрат концентрировали с получением 216 мг метил-2-(3-(1-метокси-2-метил-1-оксопропан-2-илокси)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата в виде сиропа. Выход: 93%.
К раствору метил-2-(3-(1-метокси-2-метил-1-оксопропан-2-илокси)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоксилата (216 мг, 0,52 ммоль) в метаноле (8 мл) и тетрагидрофуране (8 мл) добавляли 1М раствор гидроксида натрия (7,87 мл). Эту смесь перемешивали и нагревали в условиях дефлегмации в течение 1,5 ч. Смесь концентрировали, растворяли в воде и подкисляли до рН=4 1М соляной кислотой. Выпавшее в осадок твердое вещество отфильтровывали и снова растворяли в тетрагидрофуране, и органические слои сушили над безводным сульфатом магния. Остаток после выпаривания органического растворителя обрабатывали дихлорметаном с получением 60 мг 2-(3-(2-карбоксипропан-2-илокси)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты в виде белого твердого вещества. Выход выделенного вещества: 30%. MS (ESI+APCI) M+1=384.
Пример 234 Анализ ADP Quest™ для активаторов АМРК
Этот метод позволяет оценивать активность АМР-активируемой протеинкиназы (АМРК) путем детектирования аккумулирования ADP продукта с использованием набора ADP Quest и определения значений Е30 активаторов АМРК, имеющих небольшую молекулу. До использования набор ADP Quest (DiscoveRx, Fremont, CA) хранят при -20°С. Перед экспериментом набор (содержит буфер для анализа, стандартный раствор ADP, реагент А и реагент В) оттаивают и уравновешивают до комнатной температуры. Реагенты набора ADP Quest распределяют на однократно используемые аликвоты и хранят при -20°С. концентрации соединений обычно в диапазоне от 0 мкМ до 100 мкМ готовят путем 2-кратного разведения. Концентрации AMP в диапазоне от 0,98 мкМ до 1 мМ используют в качестве контроля для сравнения. В анализе буфер для анализа, реагент А и реагент В оттаивают и уравновешивают до комнатной температуры в течение 30 минут до использования. Смешивают АТР, пептидный субстрат SAMS и соединение и помещают их в 384-луночный аналитический планшет. Добавляют реагент А и В на основе протокола к набору для анализа. После добавления смеси инкубируют аналитический планшет при комнатной температуре в течение 30 минут, затем добавляют АМРК белок (Invitrogen, CA) для инициирования АМРК реакции фосфорилирования. Одновременно реакции АМР-активируемого активатора АМРК в отсутствие фермента включают в качестве пустого контроля. Флуоресцентный сигнал реакции отслеживают и регистрируют на Envision в кинетическом режиме при длине волны возбуждения 530 нм и длине волны эмиссии 590 нм. Значение Е30, определенное как кратная активация АМРК для фосфорилирования пептида SAMS без активатора и с активатором при концентрации 30 мкМ, вычисляют и анализируют с использованием Prism 5,0.
Соединения формулы (I) имеют значения Е30 от 1 до 20. Предпочтительные соединения имеют значения Е30 от 1 до 5; дополнительные предпочтительные соединения имеют значения Е30 от 1,5 до 5; еще дополнительные предпочтительные соединения имеют значения Е30 от 2 до 5.
Соединения Примеров 1-233 имеют следующие значения Е30:
Пример А
Соединение формулы (I) может быть использовано, как по сути известно, в качестве активного ингредиента для изготовления таблеток, имеющих следующую композицию:
Пример В
Соединение формулы (I) может быть использовано, как по сути известно, в качестве активного ингредиента для изготовления капсул, имеющих следующую композицию:
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИГИДРОПИРИДОФТАЛАЗИНОНОВЫЕ ИНГИБИТОРЫ ПОЛИ(АДФ-РИБОЗА)ПОЛИМЕРАЗЫ | 2009 |
|
RU2514937C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОХИНОЛИНА В КАЧЕСТВЕ АКТИВАТОРОВ АМРК | 2011 |
|
RU2615758C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ПИРАЗИНА | 2012 |
|
RU2612138C2 |
| ПРОИЗВОДНЫЕ ГЕТЕРОАРИЛПИРРОЛИДИНИЛ- И ПИПЕРИДИНИЛКЕТОНА | 2007 |
|
RU2479575C2 |
| ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ЦЕЛЕНАПРАВЛЕННОЙ ДЕГРАДАЦИИ ПОЛИПЕПТИДОВ БЫСТРО УСКОРЕННОЙ ФИБРОСАРКОМЫ | 2019 |
|
RU2830173C2 |
| МОДУЛЯТОРЫ АТФ-СВЯЗЫВАЮЩИХ ТРАНСПОРТЕРОВ | 2010 |
|
RU2552353C2 |
| НОВЫЕ 3,4-ДИГИДРО-2Н-ИЗОХИНОЛИН-1-ОНЫ И 2,3-ДИГИДРО-ИЗОИНДОЛ-1-ОНЫ | 2014 |
|
RU2689421C2 |
| АЗАИНДОЛЫ В КАЧЕСТВЕ АКТИВАТОРОВ ГЛЮКОКИНАЗЫ | 2010 |
|
RU2593369C2 |
| РЕТИНОИДОПОДОБНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ | 1996 |
|
RU2163590C2 |
| ПРОИЗВОДНЫЕ ГУАНИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА НЕЙРОПЕПТИДА FF | 2004 |
|
RU2337911C2 |
Изобретение относится к области органической химии, а именно к новым производным тетрагидрохинолина общей формулы (I) или к их фармацевтически приемлемым солям или сложным эфирам, где R1 представляет собой водород, галоген, карбоксил, алкоксикарбонил, алкилсульфониламинокарбонил или циклоалкилсульфониламинокарбонил; R2 представляет собой водород, галоген или карбоксил; R3 представляет собой водород, галоген, карбоксил, галогеноалкил, циано, алкоксикарбонил, алкилсульфонил, алкилсульфониламинокарбонил, циклоалкилсульфониламинокарбонил, карбоксилалкиламино(алкил)карбонил, алкил(гидрокси)пирролидинилкарбонил или карбоксилпирролидинилкарбонил; R4 представляет собой водород, карбоксил, алкилсульфониламинокарбонил или циклоалкилсульфониламинокарбонил; R5 представляет собой пиридинил, замещенный пиридинил, морфолинилпиридинил, фенил или замещенный фенил, где замещенный пиридинил и замещенный фенил представляют собой пиридинил и фенил, замещенные одним или двумя заместителями, указанными в формуле изобретения; где алкил, один или в комбинации, означает насыщенную алкильную группу с линейной или разветвленной цепью, содержащую от 1 до 6 атомов углерода; алкокси, один или в комбинации, означает группу алкил-O-, где алкил такой, как определено выше; циклоалкил, один или в комбинации, относится к насыщенному углеродному кольцу, содержащему от 3 до 6 атомов углерода; при условии, что 3,3-диметил-2-фенил-1,2,3,4-тетрагидрохинолин исключен. Также изобретение относится к конкретным соединениям, фармацевтической композиции на основе соединения формулы (I), применению соединения формулы (I) и способу лечения или профилактики заболеваний, основанному на использовании соединения формулы (I). Технический результат: получены новые производные тетрагидрохинолина, полезные в качестве активатора АМР-активируемой протеинкиназы (АМРК). 6 н. и 11 з.п. ф-лы, 236 пр.
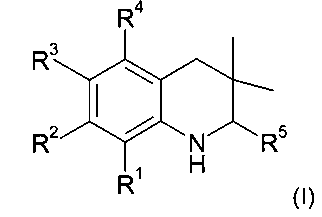
1. Соединение формулы (I)

где
R1 представляет собой водород, галоген, карбоксил, алкоксикарбонил, алкилсульфониламинокарбонил или циклоалкилсульфониламинокарбонил;
R2 представляет собой водород, галоген или карбоксил;
R3 представляет собой водород, галоген, карбоксил, галогеноалкил, циано, алкоксикарбонил, алкилсульфонил, алкилсульфониламинокарбонил, циклоалкилсульфониламинокарбонил, карбоксилалкиламино(алкил)карбонил, алкил(гидрокси)пирролидинилкарбонил или карбоксилпирролидинилкарбонил;
R4 представляет собой водород, карбоксил, алкилсульфониламинокарбонил или циклоалкилсульфониламинокарбонил;
R5 представляет собой пиридинил, замещенный пиридинил, морфолинилпиридинил, фенил или замещенный фенил, где замещенный пиридинил и замещенный фенил представляют собой пиридинил и фенил, замещенные одним или двумя заместителями, независимо выбранными из галогена, галогенофенила, алкила, циклоалкила, алкокси, циано, карбоксила, циклоалкилкарбониламино, алкилсульфониламино, фенилсульфониламино, фениламиносульфонила, галогенофенилсульфониламино, алкилфенила, алкоксифенила, цианофенила, алкиламинокарбонилфенила, алкилсульфонилфенила, пирролидинила, пиридинилкарбониламино, морфолинила, алкилморфолинила, пиперазинила, алкилпиперазинила, алкилкарбонилпиперазинила, алкилфенилпиперазинила, галогенофенилпиперазинила, оксопирролидинила, диоксоимидазолидинила, оксоимидазолидинила, алкилоксоимидазолидинила, фенил(оксо)имидазолидинила, 2-оксо-оксазолидин-3-ила, алкил-2-оксо-оксазолидин-3-ила, фенилалкил-2-оксо-оксазолидин-3-ила, диоксопиперазинила, алкилдиоксопиперазинила, аминокарбонила, алкиламинокарбонила, алкоксиалкиламинокарбонила, алкиламиноалкиламинокарбонила, циклоалкиламинокарбонила, алкилпирролидиниламинокарбонила, тетрагидрофураниламинокарбонила, алкилпирролидинилалкиламинокарбонила, алкоксикарбонилазетидиниламинокарбонила, пирролидинилкарбонила, пиперидинилкарбонила, алкилсульфониламинокарбонила, циклоалкилсульфониламинокарбонила, фенилсульфониламинокарбонила, алкилазетидиниламинокарбонила, галогеноазетидинила, алкилпирролидиниламинокарбонила, фениламинокарбонила, пиразиниламинокарбонила, аминоалкокси, карбоксилалкокси, алкилтетразолила, фенилалкилтетразолила, алкиламиносульфонила, алкилфенилсульфониламино, алкилкарбониламино, циклоалкенилкарбониламино, фенилкарбониламино, фенилалкилкарбониламино, 7-бензил-4-оксо-5,6,7,8-тетрагидро-4Н-пиридо[3,4-d]пиримидин-3-ила, алкиламинофенила, алкиламино, гидроксиалкиламино, карбоксилалкиламино, карбоксилциклоалкиламино, алкиламинокарбонилалкиламино, аминокарбонил(алкил)амино, морфолинилкарбонилалкиламино, алкилпиперазинилкарбонилалкиламино, алкиламиносульфониламино, алкилкарбониламинофенилсульфониламино, алкиламинокарбониламино, морфолинилкарбониламино, пирролидинилкарбониламино, пиперидинилкарбониламино, алкилпиперазинилкарбониламино, фенилалкиламинокарбониламино, галогенофенилкарбониламино, галогенофениламинокарбониламино, пиразинилкарбониламино, пирролидинилсульфонила и алкилпирролидиниламиносульфонила; где
алкил, один или в комбинации, означает насыщенную алкильную группу с линейной или разветвленной цепью, содержащую от 1 до 6 атомов углерода;
алкокси, один или в комбинации, означает группу алкил-O-, где алкил такой, как определено выше;
циклоалкил, один или в комбинации, относится к насыщенному углеродному кольцу, содержащему от 3 до 6 атомов углерода;
или его фармацевтически приемлемая соль или сложный эфир,
при условии, что 3,3-диметил-2-фенил-1,2,3,4-тетрагидрохинолин исключен.
2. Соединение по п.1, где R1 представляет собой водород, карбоксил или алкоксикарбонил.
3. Соединение по п.1, где R1 представляет собой водород, карбоксил или метоксикарбонил.
4. Соединение по п.1, где R2 представляет собой водород.
5. Соединение по п.1, где R3 представляет собой галоген, карбоксил, галогеноалкил, циано, алкилсульфонил, алкилсульфониламинокарбонил или циклоалкилсульфониламинокарбонил.
6. Соединение по п.1, где R3 представляет собой фторо, хлоро, карбоксил, трифторметил, циано, метилсульфонил, метилсульфониламинокарбонил или циклопропилсульфониламинокарбонил.
7. Соединение по п.1, где R4 представляет собой водород, карбоксил, метилсульфониламинокарбонил или циклопропилсульфониламинокарбонил.
8. Соединение по пп.1-7, где R5 представляет собой замещенный фенил, где замещенный фенил представляет собой фенил, замещенный одним или двумя заместителями, независимо выбранными из галогена, алкила, алкилсульфониламино, фенилсульфониламино, галогенофенилсульфониламино, алкилфенила, пирролидинила, морфолинила, алкилпиперазинила, алкилфенилпиперазинила, алкилоксоимидазолидинила, алкил-2-оксо-оксазолидин-3-ила, аминокарбонила, алкиламиноалкиламинокарбонила, алкилпирролидиниламинокарбонила, фенилсульфониламинокарбонила, алкилкарбониламино, алкиламино, карбоксилалкиламино, карбоксилциклоалкиламино и алкиламинокарбонилалкиламино.
9. Соединение по п.1, где R5 представляет собой замещенный фенил, где замещенный фенил представляет собой фенил, замещенный одним или двумя заместителями, независимо выбранными из фторо, метила, метилсульфониламино, фенилсульфониламино, фторфенилсульфониламино, трет-бутилфенила, пирролидинила, морфолинила, метилпиперазинила, диметилфенилпиперазинила, метилфенилпиперазинила, метилоксоимидазолидинила, изопропил-2-оксо-оксазолидин-3-ила, аминокарбонила, диметиламиноэтиламинокарбонила, метилпирролидиниламинокарбонила, фенилсульфониламинокарбонила, изопропилкарбониламино, диметиламино, карбоксилпропиламино, карбоксилциклопропиламино и метиламинокарбонилпропиламино.
10. Соединение по п.1, выбранное из
2-[3-(3-бензил-уреидо)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[3-(6-хлор-8-циклопропансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фенил]-амида пиразин-2-карбоновой кислоты;
3,3-диметил-2-{3-[(пиридин-3-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-{3-[(пиридин-2-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-{3-[(пиразин-2-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(3-фтор-бензоиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-карбонил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-N-фенил-бензамида;
[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида пропан-2-сульфоновой кислоты;
[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фенил]-амида пиразин-2-карбоновой кислоты;
2-(3-бензоиламино-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-{3-[3-(3-фтор-фенил)-уреидо]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-фенилкарбамоил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-[3-(3-метил-2-оксо-имидазолидин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-[3-(2-оксо-имидазолидин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(2,5-диоксо-пиперазин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(2,4-диоксо-имидазолидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(4-фтор-бензоиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-{3-[(морфолин-4-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-{3-[(пиперидин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
{[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксил]-метил-амино}-уксусной кислоты;
1-[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксил]-пирролидин-2-карбоновой кислоты;
2-(3-(N,N-диметилсульфамоиламино)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-[3-(2-оксо-3-фенил-имидазолидин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-{3-[(4-метил-пиперазин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-[3-(2-гидрокси-1,1-диметил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-[3-(1-метил-уреидо)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(1-изопропил-уреидо)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(2-амино-1,1-диметил-этокси)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(4,4-диметил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-{3-[(пирролидин-1-карбонил)-амино]-фенил}-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(3,3-диэтил-уреидо)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-[3-(6-циано-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2,N-диметил-пропионамида;
2-[3-(1-диметилкарбамоил-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(1,1-диметил-2-морфолин-4-ил-2-оксо-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-{3-[1,1-диметил-2-(4-метил-пиперазин-1-ил)-2-оксо-этиламино]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-изопропил-2-[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионамида;
2-[3-(1-карбокси-циклопропиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(3,3-диметил-6-трифторметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-[5-(4-трет-бутил-фенил)-пиридин-3-ил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(6-циклопропансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2,N-диметил-пропионамида;
2-[3-(6-метансульфонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
N-[2-(4′-трет-бутил-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
N-[2-(3-диметиламино-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
2-(4′-циано-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[2-(3,5-дифтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
2-(2-фтор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[2-(2-фтор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
2-(3-хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[2-(3-хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
N-[2-(3-хлор-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
[2-(4-фтор-3-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
N-[2-(4-фтор-3-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
[2-(5-фтор-2-метил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
N-[2-(3-фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
[2-(3-фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
3,3-диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[3,3-диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
N-[3,3-диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
2-(3-метокси-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[2-(3-метокси-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
N-[2-(3-метокси-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
N-[2-(3-циано-5-морфолин-4-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
[2-(3-циклогексил-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
2-(3-фтор-5-пиперазин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[3,3-диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
N-[3,3-диметил-2-(4-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
N-{2-[3-фтор-5-(4-изопропил-пиперазин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
2-[3-фтор-5-(2-оксо-пирролидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-{2-[3-фтор-5-(2-оксо-пирролидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
метилового эфира 2-[3-(1-карбокси-1-метил-этиламино)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
6-хлор-3,3-диметил-2-[3-(1-метил-1-метилкарбамоил-этиламино)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
2-[3-(1-карбокси-1-метил-этиламино)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
2-[3-(4-ацетил-пиперазин-1-ил)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
6-хлор-3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
N-[2-(4′-трет-бутил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
2-(4′-изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-[2-(4′-изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
[2-(4′-изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-(2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил)-метансульфонамида;
2-{3-[4-(2,4-диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-(2-{3-[4-(2,4-диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил)-метансульфонамида;
(2-{3-[4-(2,4-диметил-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил)-амида циклопропансульфоновой кислоты;
6-фтор-3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
N-(6-хлор-2-{3-[4-(4-хлор-фенил)-пиперазин-1-ил]-фенил}-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил)-метансульфонамида;
3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты;
N-{3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
[3,3-диметил-2-(3-пиперазин-1-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
[3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида этансульфоновой кислоты;
3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
[6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбонил]-амида циклопропансульфоновой кислоты;
3,3-диметил-2-(3-пиперазин-1-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-[3,3-диметил-2-(3-пиперазин-1-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
N-[6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-8-карбонил]-метансульфонамида;
{2-[3-(2,6-диметил-морфолин-4-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты;
2-[3-(2,6-диметил-морфолин-4-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
(3-гидрокси-3-метил-пирролидин-1-ил)-[2-(3-метокси-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-ил]-метанона;
3,3-диметил-2-пиридин-3-ил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4′-хлор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-{3,3-диметил-2-[3-(2-оксо-оксазолидин-3-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты;
8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-хлор-4-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
[3,3-диметил-2-(5-морфолин-4-ил-пиридин-3-ил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
N-[8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
{3,3-диметил-2-[3-(2-оксо-оксазолидин-3-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты;
[6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амида циклопропансульфоновой кислоты;
N-[6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамида;
2-[3-((S)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты;
2-[3-(R)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-{2-[3-((R)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
2-[3-((S)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
{2-[3-((R)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты
3,3-диметил-2-[3-(4-метил-2,3-диоксо-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-((R)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-{2-[3-((R)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
{3,3-диметил-2-[3-(4-метил-2,3-диоксо-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты;
{2-[3-((R)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты;
N-{3,3-диметил-2-[3-(4-метил-2,3-диоксо-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
{2-[3-((S)-4-бензил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты;
[8-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амида циклопропансульфоновой кислоты;
7-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты;
N-[7-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамида;
2-[3-(7-бензил-4-оксо-5,6,7,8-тетрагидро-4Н-пиридо[3,4-d]пиримидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
8-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-7-карбоновой кислоты;
[7-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амида циклопропансульфоновой кислоты;
{6-хлор-3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбонил}-амида циклопропансульфоновой кислоты;
6-хлор-2-(4′-изопропил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
[6-хлор-2-(4′-диметиламино-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил]-амида циклопропансульфоновой кислоты;
2-(4′-трет-бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
[2-(4′-трет-бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил]-амида циклопропансульфоновой кислоты;
N-[2-(4′-трет-бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбонил]-метансульфонамида;
{2-[3-(5-этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты;
N-{2-[3-(5-этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
2-[3-(5-бензил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(5-этил-тетразол-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
N-[7-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамида;
[8-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амида циклопропансульфоновой кислоты;
2-(4′-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты;
3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
{2-[3-(3-фтор-азетидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-амида циклопропансульфоновой кислоты;
N-{2-[3-(3-фтор-азетидин-1-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
N-{3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида;
[2-(4′-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбонил]-амида циклопропансульфоновой кислоты;
N-[2-(4′-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамида;
3,3-диметил-2-фенил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4′-изопропилкарбамоил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
трет-бутиламида 3′-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-бифенил-4-карбоновой кислоты;
[2-(4′-метансульфонил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
2-(4′-трет-бутилкарбамоил-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[2-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[2-(1-карбокси-циклопропиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(1-метилэтилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-Диметил-2-(3-(1-метилпирролидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(тетрагидрофуран-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(4-(фенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(4-ацетамидофенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклопропилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(пирролидин-1-карбонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклобутилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(изопропилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-фтор-3-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(фенилсульфонилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклопропилсульфонилкарбамоил)-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-хлор-3-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(метилсульфонилкарбамоил)-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-фтор-3-(пиколинамидо)-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-(4-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-(4-фторбензамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(4-(4-метилфенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-бензамидо-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-бензамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(4-(пиколинамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(метилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклопропанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклопропанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(2-хлор-4-фторбензамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(пиперидин-1-карбонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(2-метоксиэтилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(4-(2-фенилацетамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклобутанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-хлор-3-(циклогексанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклопентанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
метил-3,3-диметил-2-(3-(пиразин-2-илкарбамоил)-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоксилата;
2-(4-(циклогексанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(2-фенилацетамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-карбамоилфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(метилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-бензамидо-5-хлорофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(2-(диметиламино)этилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-ацетамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-((1-этилпирролидин-2-ил)метилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-фтор-3-(3-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(1-(трет-бутоксикарбонил)азетидин-3-илкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(1-метилазетидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-фтор-3-(2-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(3-фенилпропанамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(циклогексанкарбоксамидо)-4-фторфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-(3-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-(2-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(2-(циклопропанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-(циклобутанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(2-(циклобутанкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4-(циклогекс-1-енкарбоксамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(2-(4-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(2-(2-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(2-(фенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(N-изопропилсульфамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(2-(3-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(2-(метилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(1-метилпирролидин-3-илкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-N-(1-метилпирролидин-3-ил)бензамида;
3,3-диметил-2-(4-(N-метилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(пирролидин-1-илсульфонил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(N-метилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(N-(1-метилпирролидин-3-ил)сульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(N-фенилсульфамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(N,N-диметилсульфамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(2-(пиколинамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты; и
2-(3-(2-карбоксипропан-2-илокси)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты.
11. Соединение по п.1, выбранное из
2-[2-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(1-карбокси-1-метил-этиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(4-ацетил-пиперазин-1-ил)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
[2-(4′-изопропокси-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
2-[3-(1-карбокси-циклопропиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(6-метансульфонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-(2-(2-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(2-(4-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(6-метансульфониламинокарбонил-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-[3-(3,3-диметил-6-трифторметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
N-[2-(4′-трет-бутил-5-фтор-бифенил-3-ил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
2-[3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-[3-(6-циано-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-фениламино]-2-метил-пропионовой кислоты;
2-(2-(3-фторфенилсульфонамидо)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(2-(метилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(2-(фенилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
метилового эфира 2-[3-(1-карбокси-1-метил-этиламино)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
2-[2-(1-карбокси-циклопропиламино)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-[3-(1-карбокси-1-метил-этиламино)-фенил]-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
[6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-амида циклопропансульфоновой кислоты;
2-(4′-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты;
[2-(4′-трет-бутил-бифенил-3-ил)-6-фтор-3,3-диметил-1,2,3,4-тетрагидрохинолин-5-карбонил]-амида циклопропансульфоновой кислоты;
3-(6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-2-ил)-N-(1-метилпирролидин-3-ил)бензамида;
N-[6-фтор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбонил]-метансульфонамида;
N-[2-(3-фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
N-[2-(3-диметиламино-5-фтор-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-метансульфонамида;
[2-(3-фтор-5-пирролидин-1-ил-фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбонил]-амида циклопропансульфоновой кислоты;
3,3-диметил-2-[3-(3-метил-2-оксо-имидазолидин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-карбамоилфенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
6-хлор-3,3-диметил-2-(3-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-5-карбоновой кислоты;
3,3-диметил-2-(3-метил-5-морфолин-4-ил-фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(4′-трет-бутил-бифенил-3-ил)-6-хлор-3,3-диметил-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
2-(4-фтор-3-изобутирамидофенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(1-метилэтилсульфонамидо)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
2-(3-(2-(диметиламино)этилкарбамоил)фенил)-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
6-хлор-3,3-диметил-2-[3-(4-орто-толил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-8-карбоновой кислоты;
2-[3-((S)-4-изопропил-2-оксо-оксазолидин-3-ил)-фенил]-3,3-диметил-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты;
3,3-диметил-2-(3-(фенилсульфонилкарбамоил)фенил)-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты; и
N-{3,3-диметил-2-[3-(4-метил-пиперазин-1-ил)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбонил}-метансульфонамида.
12. Соединение, выбранное из 3,3-диметил-2-[3-(триметил-уреидо)-фенил]-1,2,3,4-тетрагидрохинолин-6-карбоновой кислоты или
3,3-диметил-2-{3-[метил-(2-метиламино-этил)-амино]-фенил}-1,2,3,4-тетрагидро-хинолин-6-карбоновой кислоты или их фармацевтически приемлемых солей или сложных эфиров.
13. Соединение по любому из пп.1-12 для применения в качестве терапевтически активного вещества, являющегося активатором АМР-активируемой протеинкиназы (АМРК).
14. Фармацевтическая композиция для лечения или профилактики заболеваний, связанных с регуляцией АМРК, содержащая соединение по любому из пп.1-12 в эффективном количестве и терапевтически инертный носитель.
15. Применение соединения по любому из пп.1-12 для изготовления лекарственного средства для лечения или профилактики ожирения, гипергликемии или диабета типа 2.
16. Применение соединения по любому из пп.1-12 для лечения или профилактики ожирения, гипергликемии или диабета типа 2.
17. Способ лечения или профилактики заболеваний, связанных с регуляцией AMPK, включающий введение эффективного количества соединения по любому из пп.1-12.
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Barbara Cool et al: "Identification and characterization of a small molecule AMPK | |||
Авторы
Даты
2016-11-27—Публикация
2011-04-08—Подача