Область техники, к которой относится изобретение
Настоящее изобретение относится к соединениям, пригодным в терапии, к композициям, содержащим вышеуказанные соединения, и к способам лечения заболеваний, включающим введение вышеуказанных соединений. Упомянутые соединения являются позитивными аллостерическими модуляторами (РАМ) никотинового α7-рецептора ацетилхолина.
Предпосылки создания изобретения
Никотиновые рецепторы ацетилхолина (nAChR) относятся к суперсемейству управляемых лигандами ионных каналов и управляют потоком катионов, включая кальций. nAChR эндогенно активируются ацетилхолином (ACh) и могут быть подразделены на никотиновые рецепторы нервно-мышечного синапса и нейронные никотиновые рецепторы (NNR). NNR широко экспрессируются повсюду в центральной нервной системе (CNS) и периферической нервной системе (PNS). Предполагают, что NNR играют важную роль в функции CNS путем модуляции высвобождения многих нейротрансмиттеров, как, например, среди других, ACh, норэпинефрин, допамин, серотонин и GABA, приводя к большому ряду физиологических эффектов.
На сегодняшний день сообщено о семнадцати субъединицах nAChR, которые идентифицированы как α2-α10, β1-β4, γ, δ и ε. Из этих субъединиц, девять субъединиц, от α2 до включительно α7 и от β2 до включительно β4, как известно, находятся в головном мозге млекопитающих. Существует множество функционально различных nAChR-комплексов, например, пять субъединиц α7 могут образовывать рецептор в виде гомомерного функционального пентамера или комбинации из разных субъединиц могут образовывать гетеромерные рецепторы, таким как рецепторы α4β2 и α3β4 (Gotti C. и др., Prog. Neurobiol., 2004, 74: 363-396; Gotti C. и др., Biochemical Pharmacology, 2009, 78: 703-711).
Гомомерный α7-рецептор представляет собой один из наиболее часто встречающихся NNR, вместе с α4β2-рецепторами, в головном мозге, где он в высокой степени экспрессируется в гиппокампе, коре головного мозга, таламических ядрах, вентральной тегментальной области и черном веществе (Broad L.M. и др., Drugs of the Future, 2007, 32(2): 161-170; Poorthius R.B., Biochem. Pharmacol., 2009, 1; 78(7): 668-76).
Эффективно изучена роль α7-NNR в случае нейронной передачи сигнала. Показано, что α7-NNR регулируют интернейронную возбудимость и модулируют высвобождение возбудимости, а также ингибирующих нейротрансмиттеров. В дополнение, сообщалось, что α7-NNR вовлекаются в нейрозащитные эффекты на экспериментальных моделях повреждения клеток (Shimohama S., Biol. Pharm. Bull., 2009, 32(3): 332-336).
Исследования показали, что субъединицы α7, когда экспрессируются рекомбинантно in vitro, активируются и быстро десенсибилизируются и показывают относительно более высокую проницаемость кальция по сравнению с другими NNR-комбинациями (Papke R.L. и др., J. Pharmacol. Exp. Ther., 2009, 329(2): 791-807).
Вообще, NNR вовлечены в различные когнитивные функции, таким как учение, память и внимание, и, следовательно, в нарушения CNS, как, например, болезнь Альцгеймера (AD), болезнь Паркинсона (PD), нарушение гиперактивности в отношении дефицита внимания (ADHD), синдром Туретта, шизофрения, биполярное расстройство, боль и табакозависимость (Keller J.J. и др., Behav. Brain Res., 2005, 162: 143-152; Haydar S.N. и др., Curr. Top Med. Chem., 2010, 10(2): 144-152).
α7-NNR, в особенности, также связаны с когнитивными нарушениями, включая, например, ADHD, нарушения спектра аутизма, AD, легкое когнитивное ухудшение (MCI), ассоциированное с возрастом ухудшение памяти (AAMi), сенильную деменцию, лобно-височную долевую дегенерацию, ассоциированную с ВИЧ деменцию (HAD), ассоциированное с ВИЧ когнитивное ухудшение (HIV-CI), болезнь Пика, ассоциированную с тельцами Леви деменцию, ассоциированное с рассеянным склерозом когнитивное ухудшение, васкулярную деменцию, когнитивное ухудшение при эпилепсии, ассоциированное с хрупкостью Х когнитивное ухудшение, ассоциированное с наследственной атаксией Фридрейха когнитивное ухудшение и ассоциированную с синдромом Дауна деменцию, а также когнитивное ухудшение, ассоциированное с шизофренией. В дополнение, показано, что α7-NNR вовлечены в нейрозащитные эффекты никотина как in vitro (Jonnala R.B. и др., J. Neurosci. Res., 2001, 66: 565-572), так и in vivo (Shimohama S., Brain Res., 1998, 779: 359-363), а также в передачу сигнала боли. Более конкретно, нейродегенерация лежит в основе некоторых прогрессирующих нарушений CNS, включая, но не исчерпывающим образом, AD, PD, боковой амиотрофический склероз, болезнь Гентингтона, ассоциированную с тельцами Леви деменцию, а также ослабленную функцию CNS, происходящую в результате травматического повреждения головного мозга. Например, ухудшенную функцию α7-NNR за счет бета-амилоидных пептидов, связанных с AD, подразумевают в качестве ключевого фактора в развитии когнитивных дефицитов, ассоциированных с заболеванием (Liu Q.-S. и др., PNAS, 2001, 98: 4734-4739). Таким образом, модуляция активности α7-NNR демонстрирует перспективный потенциал для предотвращения или лечения множества указанных выше заболеваний, таким как AD, другие деменции, другие нейродегенеративные заболевания, шизофрения и нейродегенерация, вместе с основной патологией, которая вовлекает в патологический процесс когнитивную функцию, включающую, например, аспекты учения, памяти и внимания (Thomsen M.S. и др., Curr. Pharm. Des., 2010, январь; 16(3): 323-343; Olincy A. и др., Arch. Gen. Psychiatry, 2006, 63(6): 630-638; Deutsch S.I., Clin. Neuropharmacol., 2010, 33(3): 114-120; Feuerbach D., Neuropharmacology, 2009, 56(1): 254-263).
NNR-Лиганды, включая α7-лиганды, также вовлечены в контроль массы, диабетическое воспаление, обсессивно-компульсивное нарушение (OCD), ангиогенез и в качестве потенциальных анальгетиков (Marrero M.B. и др., J. Pharmacol. Exp. Ther., 2010, 332(1): 173-180; Vincler M., Exp. Opin. Invest. Drugs, 2005, 14(10): 1191-1198; Rosas-Ballina M.J., J. Intern. Med., 2009, 265(6): 663-679; Arias H.R., Int. J. Biochem. Cell Biol., 2009, 41(7): 1441-1451; Tizabi Y., Biol. Psychiatry, 2002, 51(2): 164-171).
Никотин известен для повышения внимания и когнитивной характеристики, уменьшения страха, усиления сенсорного воротного механизма и аналгезии и нейрозащитных эффектов, когда его вводят. Такие эффекты опосредуются неселективным влиянием никотина на многочисленные субтипы никотинового рецептора. Однако, никотин также вызывает неблагоприятные события, таким как сердечно-сосудистые и желудочно-кишечные проблемы (Karaconji I.B. и др., Arch. Hig. Rada Toksikol., 2005, 56(4): 363-371). Следовательно, существует необходимость в индентификации субтип-селективных соединений, которые сохраняют полезные эффекты никотина или NNR-лиганда, в то время как исключают или уменьшают неблагоприятные эффекты.
Примерами описанных NNR-лигандов являются α7-NNR-агонисты, таким как DMXB-A, SSR180711 и АВТ-107, которые показали некоторые полезные воздействия на когнитивный процессинг как в случае грызунов, так и в случае людей (Н312: 1213-1222; Olincy A. и др., Arch. Gen. Psychiatry, 2006, 63(6): 630-638; Pichat P. и др., Neuropsychopharmacology, 2007, 32(1): 17-34; Bitner R.S., J. Pharmacol. Exp. Ther., 2010, 1; 334(3): 875-886). В дополнение, сообщалось, что модуляция α7-NNR ослабляет негативные симптомы у пациентов с шизофренией (Freedman R. и др., Am. J. Psychiatry, 2009, 165(8): 1040-1047).
Несмотря на полезные эффекты NNR-лигандов, остается неопределенным, может ли хроническое лечение с помощью влияющих на NNR агонистов обеспечивать субоптимальную пользу за счет пролонгированной активации и десенсибилизации NNR, в частности, α7-NNR-субтипа. В противоположность агонистам, введение позитивного аллостерического модулятора (РАМ) может усиливать эндогенную холинергическую трансмиссию без прямой стимуляции рецептора-мишени. Никотиновые РАМ могут селективно модулировать активность ACh в случае NNR, сохраняя кинетики активации и дезактивации рецептора. Соответственно, появились селективные в отношении α7-NNR РАМ (Faghih R., Recent Pat. CNS Drug Discov., 2007, 2(2): 99-106).
Следовательно, должно быть полезным повышение α7-NNR-функции за счет усиления эффекта эндогенного нейротрансмиттера ацетилхолина через РАМ. Это может усиливать эндогенную холинергическую нейротрансмиссию без прямой активации α7-NNR, подобно агонистам. В самом деле, клинически доказано, что РАМ для усиления активности канала имеют успех в случае GABA-рецепторов, где бензодиазепины и барбитураты ведут себя как РАМ, воздействуя на определенные участки (Hevers W. и др., Mol. Neurobiol., 1998, 18: 35-86).
На сегодняшний день известны только немногие NNR-РАМ, таким как 5-гидроксииндол (5-Н), ивермектин, галантамин и SLURP-1, пептид, происходящий от ацетилхолинэстеразы (AChE). Также сообщалось, что генестеин, ингибитор киназы, повышает α7-ответы. Сообщалось, что PNU-120596, производное мочевины, увеличивает эффективность ACh, а также улучшает положение в отношении дефицитов слухового воротного механизма, индуцируемых за счет амфетамина у крыс. Также сообщалось, что NS1738, JNJ-1930942 и соединение 6 потенцируют ответ ACh и проявляют полезный эффект в случае экспериментальных моделей сенсорного и когнитивного процессинга у грызунов. Другие NNR-РАМ включают производные хинуклидина, индола, бензопиразола, тиазола и бензоизотиазолов (Hurst R.S. и др., J. Neurosci., 2005, 25: 4396-4405; Faghin R., Recent Pat. CNS Drug Discov., 2007, 2(2): 99-106; Timmermann D.B., J. Pharmacol. Exp. Ther., 2007, 323(1): 294-307; Ng H.J. и др., Proc. Natl. Acad. Sci. USA, 2007, 8; 104(19): 8059-64; Dinclo T., J. Pharmacol. Exp. Ther., 2011, 336(2): 560-574).
В Международной заявке WO-2009/043784 представлены соединения общей структуры:
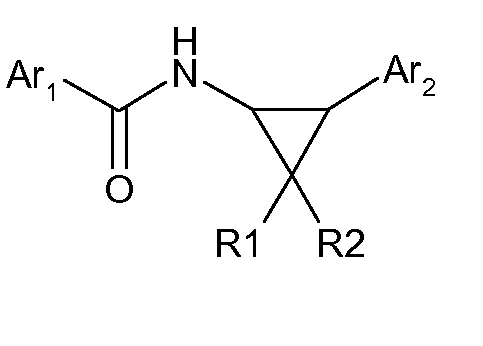
о которых сообщено, что соединения являются РАМ относительно α7-NNR.
Теперь известно, что α7-NNR-РАМ, вообще, проявляют слабую активность, имеют ряд неспецифических эффектов или могут иметь только ограниченный доступ к центральной нервной системе, где α7-NNR «обильно» экспрессируются. Соответственно, должно быть полезным идентифицирование и предусмотрение новых РАМ-соединений относительно α7-NNR и композиций для лечения заболеваний и нарушений, где принимают активное участие α7-NNR. Далее, должно быть особенно полезно, если такие соединения могут обеспечивать улучшенную эффективность лечения, тогда как уменьшаются неблагоприятные эффекты, ассоциированные с соединениями, нацеливаемыми на нейронные никотиновые рецепторы, за счет селективной модуляции α7-NNR.
В Международной заявке WO-2010/137351 представлены соединения общей структуры:
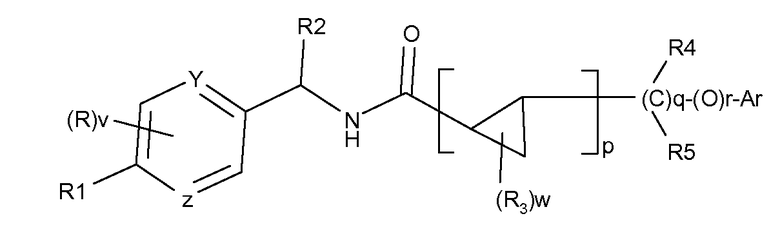
в качестве блокаторов кальциевого или натриевого канала. Подразумевают, что примеры соединений, раскрытых в Международной заявке WO 2010/137351, не включены в настоящее изобретение.
В особенности, соединения, представляющие собой {(S)-1-[5-(2,2,2-трифторэтокси)пиридин-2-ил]этил}амид (1S,2S)-2-фенил-циклопропанкарбоновой кислоты, {(S)-1-[5-(2,2,2-трифторэтокси)-пиридин-2-ил]этил}амид (1S,2S)-2-(2-хлор-4-фторфенил)-циклопропанкарбоновой кислоты и {(S)-1-[5-(2,2,2-трифторэтокси)пиридин-2-ил]этил}амид (1S,2S)-2-(2-фтор-4-метоксифенил)циклопропанкарбоновой кислоты, исключены из настоящего изобретения.
Краткое изложение сущности изобретения
Объектом настоящего изобретения является получение соединений, которые являются позитивными аллостерическими модуляторами (РАМ) никотинового рецептора ацетилхолина субтипа α7.
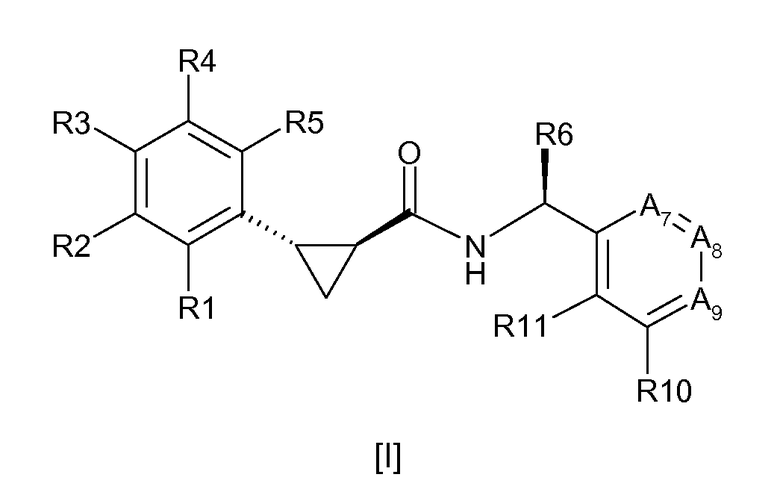
Соединения согласно настоящему изобретению определяются нижеприводимой формулой [I]:
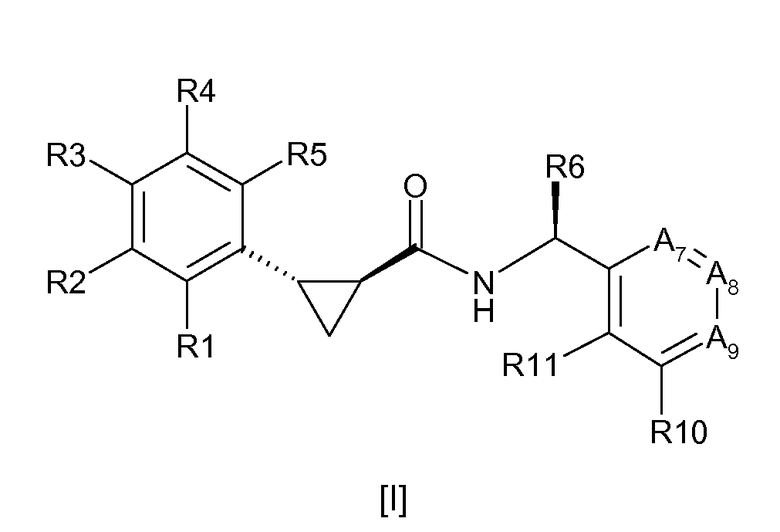
где R1, R2, R3, R4 и R5 выбирают, независимо друг от друга, из Н, С1-6-алкила, С2-6-алкенила, С2-6-алкинила, С1-6-алкокси, циано и галогена, где вышеуказанный С1-6-алкил, С2-6-алкенил и С2-6-алкинил необязательно является замещенным одним или более заместителями, независимо выбираемыми из хлора и фтора;
R6 выбирают из С1-6-алкила, С2-6-алкенила, С2-6-алкинила и С1-6-алкокси, где вышеуказанный С1-6-алкил, С2-6-алкенил и С2-6-алкинил необязательно является замещенным одним или более заместителями, независимо выбираемыми из гидрокси, С1-6-алкокси и фтора;
А7 означает С-R7 или N, А8 означает С-R8 или N и А9 означает С-R9 или N, при условии, что, по меньшей мере, один из А7, А8 или А9 означает N и не более, чем два из А7, А8 и А9 означают N;
R7, R8, R9, R10 и R11 выбирают, независимо друг от друга, из Н, С1-6-алкила, С2-6-алкенила, С2-6-алкинила, С1-6-алкокси, циано, NR12R13, С1-6-алкилсульфонила, галогена и OR14, где вышеуказанный С1-6-алкил, С2-6-алкенил, С2-6-алкинил или С1-6-алкокси необязательно является замещенным одним или более заместителями, выбираемыми из хлора, фтора, С1-6-алкокси, циано и NR12R13;
R12 и R13 независимо означают водород, С1-6-алкил, С2-6-алкенил и С2-6-алкинил;
R14 означает моноциклический насыщенный остаток, имеющий 4-6 атомов в кольце, где один из вышеуказанных атомов кольца представляет собой О, а другие представляют собой С;
или R9 и R10 могут быть связаны вместе с образованием нижеуказанного остатка:
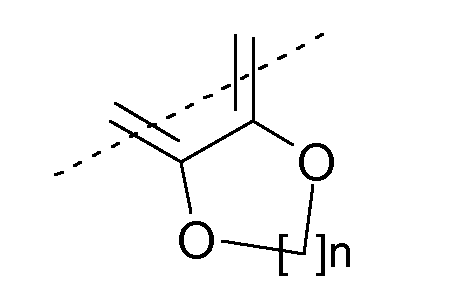
где n означает 1, 2 или 3;
и их фармацевтически приемлемые соли;
при условии, что соединение формулы [I] является другим, чем {(S)-1-[5-(2,2,2-трифторэтокси)-пиридин-2-ил]этил}амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
{(S)-1-[5-(2,2,2-трифторэтокси)пиридин-2-ил]этил}амид (1S,2S)-2-(2-хлор-4-фторфенил)циклопропанкарбоновой кислоты;
{(S)-1-[5-(2,2,2-трифторэтокси)пиридин-2-ил]этил}амид (1S,2S)-2-(2-фтор-4-метоксифенил)циклопропанкарбоновой кислоты.
В одним воплощении, данное изобретение относится к соединению согласно формуле [I], и его фармацевтически приемлемым солям, для применения в качестве лекарственного средства.
В одном воплощении, данное изобретение относится к соединению согласно формуле [I], и его фармацевтически приемлемым солям, для применения в терапии.
В одном воплощении, данное изобретение относится к соединению согласно формуле [I], и его фармацевтически приемлемым солям, для применения при лечении заболевания или нарушения, выбираемого из психоза; шизофрении; когнитивных нарушений; когнитивного ухудшения, ассоциированного с шизофренией; нарушения гиперактивности с дефицитом внимания (ADHD); нарушения спектра аутизма; болезни Альцгеймера (AD); легкого когнитивного ухудшения (MCI); ассоциированного с возрастом ухудшения памяти (AAMi); сенильной деменции; ассоциированной со СПИДом деменции; болезни Пика; ассоциированной с тельцами Леви деменции; ассоциированной с синдромом Дауна деменции; болезни Гентингтона; болезни Паркинсона (PD); обсессивно-компульсивного расстройства (OCD); травматического повреждения головного мозга; эпилепсии; посттравматического стресса; синдрома Вернике-Корсакова (WKS); посттравматической амнезии; когнитивных дефицитов, ассоциированных с депрессией; диабетом, контролем массы, воспалительными нарушениями, ослабленным ангиогенезом; бокового амиотрофического склероза и боли.
В одном воплощении, данное изобретение относится к фармацевтической композиции, содержащей соединение согласно формуле [I], и его фармацевтически приемлемые соли, и один или более фармацевтически приемлемых носителей или эксципиентов.
В одном воплощении, данное изобретение относится к набору, включающему соединение согласно формуле [I], и его фармацевтически приемлемые соли, вместе с соединением, выбираемым из перечня, состоящего из ингибиторов ацетилхолинэстеразы; антагонистов глутаматного рецептора; ингибиторов транспорта допамина; ингибиторов транспорта норадреналина; D2-антагонистов; частичных D2-агонистов; PDE10-антагонистов; 5-HT2A-антагонистов; 5-НТ6-антагонистов; KCNQ-антагонистов; блокаторов литиевого, натриевого канала; и энхансеров передачи сигнала GABA.
В одном воплощении, данное изобретение относится к способу лечения заболевания или нарушения, выбирамого из психоза; шизофрении; когнитивных нарушений; когнитивного ухудшения, ассоциированного с шизофренией; нарушения гиперактивности с дефицитом внимания (ADHD); нарушения спектра аутизма; болезни Альцгеймера (AD); легкого когнитивного ухудшения (MCI); ассоциированного с возрастом ухудшения памяти (AAMi); сенильной деменции; ассоциированной со СПИДом деменции; болезни Пика; ассоциированной с тельцами Леви деменции; ассоциированной с синдромом Дауна деменции; болезни Гентингтона; болезни Паркинсона (PD); обсессивно-компульсивного расстройства (OCD); травматического повреждения головного мозга; эпилепсии, посттравматического стресса; синдрома Вернике-Корсакова (WKS); посттравматической амнезии; когнитивных дефицитов, ассоциированных с депрессией; диабетом, контролем массы, воспалительными нарушениями, ослабленным ангиогенезом; бокового амиотрофического склероза и боли, где способ включает введение терапевтически эффективного количества соединения согласно формуле [I] и его фармацевтически приемлемых солей.
В одном воплощении, данное изобретение относится к применению соединения согласно формуле [I], и его фармацевтически приемлемых солей, для получения лекарственного средства для лечения заболевания или нарушения, выбираемого из психоза; шизофрении; когнитивных нарушений; когнитивного ухудшения, ассоциированного с шизофренией; нарушения гиперактивности с дефицитом внимания (ADHD); нарушения спектра аутизма; болезни Альцгеймера (AD); легкого когнитивного ухудшения (MCI); ассоциированного с возрастом ухудшения памяти (AAMi); сенильной деменции; ассоциированной со СПИДом деменции; болезни Пика; ассоциированной с тельцами Леви деменции; ассоциированной с синдромом Дауна деменции; болезни Гентингтона; болезни Паркинсона (PD); обсессивно-компульсивного расстройства (OCD); травматического повреждения головного мозга; эпилепсии; посттравматического стресса; синдрома Вернике-Корсакова (WKS); посттравматической амнезии; когнитивных дефицитов, ассоциированных с депрессией; диабетом, контролем массы, воспалительными нарушениями, ослабленным ангиогенезом; бокового амиотрофического склероза и боли.
Определения
В настоящем контексте, термин «необязательно замещенный» означает, что указанный остаток может или не может быть замещен, и, когда замещен, является моно-, ди- или тризамещенным, таким как с помощью 1, 2 или 3 заместителей. В некоторых случаях, заместитель независимо выбирают из группы, состоящей из С1-6-алкила, С2-6-алкенила, С2-6-алкинила, фенила, С1-6-алкокси, гидрокси и галогена. Подразумевают, что в случаях, где для «необязательно замещенного» остатка не указаны заместители, тогда положение занято атомом водорода.
В настоящем контексте, подразумевают, что термин «алкил» означает линейный, разветвленный и/или циклический насыщенный углеводород. В частности, подразумевают, что термин «С1-6-алкил» означает такой углеводород, имеющий 1, 2, 3, 4, 5 или 6 атомов углерода. Примеры С1-6-алкила включают метил, этил, пропил, бутил, пентил, гексил, циклопропил, циклобутил, циклопентил, циклогексил, метилциклопропил, 2-метилпропил и трет-бутил. Примеры замещенного С1-6-алкила включают, например, фторметил и гидроксиметил.
В настоящем контексте, подразумевают, что термин «алкенил» означает неароматический, линейный, разветвленный и/или циклический углеводород, включающий, по меньшей мере, одну углерод-углеродную двойную связь. В частности, подразумевают, что термин «С2-6-алкенил» означает такой углеводород, имеющий 2, 3, 4, 5 или 6 атомов углерода. Примеры С2-6-алкенила включают этенил, 1-пропенил, 2-пропенил, 1-бутенил, 2-бутенил и 3-бутенил и циклогексенил.
В настоящем контексте, подразумевают, что термин «алкинил» означает неароматический, линейный, разветвленный и/или цикли-ческий углеводород, включающий, по меньшей мере, одну углерод-углеродную тройную связь и необязательно также одну или более углерод-углеродных двойных связей. В частности, подразумевают, что термин «С2-6-алкинил» означает такой углеводород, имеющий 2, 3, 4, 5 или 6 атомов углерода. Примеры С2-6-алкинила включают этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил и 3-бутинил и 5-бут-1-ен-3-инил.
В настоящем контексте, подразумевают, что термин «гидрокси» означает -ОН.
В настоящем контексте, подразумевают, что термин «алкокси» означает остаток формулы -OR′, где R′ означает алкил, как определено выше. В частности, подразумевают, что термин «С1-6-алкокси» означает такой остаток, где алкильная часть имеет 1, 2, 3, 4, 5 или 6 атомов углерода. Примеры «С1-6-алкокси» включают метокси, этокси, н-бутокси и трет-бутокси.
В настоящем контексте, подразумевают, что термин «алкилсульфонил» означает -S(O)2алкил. В частности, подразумевают, что С1-6-алкилсульфонил означает такой остаток, где алкильная часть имеет 1, 2, 3, 4, 5 или 6 атомов углерода. Конкретное указание следует сделать на метилсульфонил.
В настоящем контексте, под термином «моноциклический остаток» подразумевают циклический остаток, включающий только одно кольцо, где циклический остаток может быть насыщенным или ненасыщенным.
В настоящем контексте, термины «гало» и «галоген» используют взаимозаменяемо, и относят к фтору, хлору, брому или иоду.
В настоящем контексте, термин «циано» означает группу - С≡N, которая состоит из атома углерода, связанного тройной связью с атомом азота.
В настоящем контексте, подразумевают, что термин «атом кольца» означает атомы, составляющие кольцо, и атомы кольца выбирают из С, N, O и S. В качестве примера, бензол и толуол, оба, имеют 6 атомов углерода в качестве атомов кольца, тогда как пиридин имеет 5 атомов углерода и 1 атом азота в качестве атомов кольца.
В настоящем контексте, термин «гетероатом» означает атом азота, кислорода или серы.
В настоящем контексте, термин «дейтерий» означает изотоп атома водорода, состоящий из одного протона и одного нейтрона в его ядре, и, таким образом, имеющий приблизительную массу два (2). Дейтерий представляют как D, d или 2Н. Примером заместителя, включающего дейтерий, является (2,2,2-d3)-этокси, где три атома водорода в этокси являются 2Н-изотопами.
В настоящем контексте, выражение «энантиомерный избыток» означает избыток в % соединения в смеси энантиомеров соединения. Если, например, энантиомерный избыток составляет 90%, тогда соотношение соединения к его энантиомеру составляет 95:5, и, если энантиомерный избыток составляет 95%, тогда соотношение соединения к его энантиомеру составляет 97,5:2,5. Также, выражение «диастереомерный избыток» означает избыток в % соединения в смеси диастереомеров соединения.
В настоящем контексте, фармацевтически приемлемые соли включают фармацевтически приемлемые кислотно-аддитивные соли, фармацевтически приемлемые соли металлов, соли аммония и соли алкилированного аммония. Кислотно-аддитивные соли включают соли с неорганическими кислотами, а также с органическими кислотами.
Примеры подходящих неорганических кислот включают хлористоводородную, бромистоводородную, иодистоводородную, фосфорную, серную, сульфаминовую, азотную кислоты и т.п.
Примеры подходящих органических кислот включают муравьиную, уксусную, трихлоруксусную, трифторуксусную, пропионовую, бензойную, коричную, лимонную, фумаровую, гликолевую, итаконовую, молочную, метансульфоновую, малеиновую, яблочную, малоновую, миндальную, щавелевую, пикриновую, пирувиновую, салициловую, янтарную, этансульфоновую, винную, аскорбиновую, памовую, бисметиленсалициловую, этандисульфоновую, глюконовую, цитраконовую, аспарагиновую, стеариновую, пальмитиновую, EDTA, гликолевую, п-аминобензойную, глутаминовую, бензолсульфоновую, п-толуолсульфоновую кислоты, теофиллинуксусные кислоты, а также 8-галогентеофиллины, например, 8-бромтеофиллин, и т.п. Дальнейшие примеры фармацевтически приемлемых аддитивных солей с неорганической или органической кислотой включают фармацевтически приемлемые соли, перечисленные Berge S.M. и др., J. Pharm. Sci., 1977, 66, 2, которые включены в данный контекст путем ссылки.
Примеры солей металлов включают соли лития, натрия, калия, магния и т.п.
Примеры солей аммония и алкилированного аммония включают соли аммония, метиламмония, диметиламмония, триметиламмония, этиламмония, гидроксиэтиламмония, диэтиламмония, н-бутиламмония, втор-бутиламмония, трет-бутиламмония, тетраметиламмония и т.п.
В настоящем контексте, фармацевтические носители включают инертные твердые разбавители или наполнители, стерильные водные растворы и различные органические растворители. Примеры твердых носителей включают лактозу, terra alba, сахарозу, циклодекстрин, тальк, желатин, агар, пектин, аравийскую камедь, стеарат магния, стеариновую кислоту и низшие алкиловые простые эфиры целлюлозы. Примеры жидких носителей включают, но не исчерпывающим образом, сироп, арахисовое масло, оливковое масло, фосфолипиды, жирные кислоты, амиды жирных кислот, полиоксиэтилен и воду. Подобным образом, носитель может включать любое вещество для замедленного высвобождения, известное в уровне техники, таким как глицерилмоностеарат или глицерилдистеарат, индивидуально или в смеси с воском.
В настоящем контексте, термин «терапевтически эффективное количество» соединения означает количество, достаточное для лечения, облегчения или частичного подавления клинических проявлений данного заболевания и его осложнений за счет терапевтического воздействия, включающего введение вышеуказанного соединения. Количество, достаточное для достижения этого, определяют как «терапевтически эффективное количество». Эффективные количества для каждой цели зависят от тяжести заболевания или повреждения, а также от массы и общего состояния субъекта. Должно быть понятно, что определение соответствующей дозы может быть достигнуто, используя рутинное экспериментирование, путем создания матрицы значений и тестирования разных точек матрицы, которая полностью находится в компетенции дипломированного врача.
В настоящем контексте, термин «лечение» и «обработка» означает схему лечения и наблюдение врача за пациентом с целью борьбы с его состоянием, таким как заболевание или нарушение. Подразумевают, что термин включает полный спектр обработок в случае данного состояния, от которого страдает пациент, таким как введение активного соединения для облегчения симптомов или осложнений, для замедления прогрессирования заболевания, нарушения или состояния, для облегчения или ослабления симптомов и осложнений и/или для лечения или ликвидации заболевания, нарушения или состояния, а также для предотвращения состояния, где предотвращение нужно понимать как схему лечения и наблюдение врача за пациентом с целью борьбы с заболеванием, состоянием или нарушением и включает введение активных соединений для предотвращения начала симптомов или осложнений. Профилактическая (превентивная) и терапевтическая (лечебная) обработки составляют два отдельных аспекта настоящего изобретения. Пациентом, подвергаемым лечению, предпочтительно является млекопитающее, в частности, человек.
В настоящем контексте, подразумевают, что термин «когнитивные нарушения» означает нарушения, характеризующиеся патологиями в аспектах восприятия, решения проблемы, речи, учения, рабочей памяти, памяти, социального распознавания, внимания и предшествующего вниманию процессинга, таким как, не исчерпывающим образом, нарушение гиперактивности в отношении дефицита внимания (ADHD), нарушения спектра аутизма, болезнь Альцгеймера (AD), легкое когнитивное ухудшение (MCI), ассоциированное с возрастом ухудшение памяти (AAMi), сенильная деменция, васкулярная деменция, лобно-височная долевая деменция, болезнь Пика, ассоциированная с тельцами Леви деменция и ассоциированная с синдромом Дауна деменция, ассоциированное с рассеянным склерозом когнитивное ухудшение, когнитивное ухудшение при эпилепсии, ассоциированное с хрупкостью Х когнитивное ухудшение, ассоциированное с нейрофиброматозом когнитивное ухудшение, ассоциированное с наследственной атаксией Фридрейха когнитивное ухудшение, прогрессирующий надъядерный паралич (PSP), ассоциированная с ВИЧ деменция (HAD), ассоциированное с ВИЧ когнитивное ухудшение (HIV-CI), болезнь Гентингтона, болезнь Паркинсона (PD), обсессивно-компульсивное расстройство (OCD), травматическое повреждение головного мозга, эпилепсия, посттравматический стресс, синдром Вернике-Корсакова (WKS), посттравматическая амнезия, ассоциированные с депрессией когнитивные дефициты, а также ассоциированное с шизофренией когнитивное ухудшение.
Усиливающие когнитивные свойства соединения могут быть оценены, например, путем парадигмы множественного сдвига в отношении внимания, которая представляет собой животную модель, позволяющую осуществлять оценку исполнительного функционирования путем изучения различения интрапространственного (ID) против экстрапространственного сдвига. Исследование может быть осуществлено путем тестирования, является ли соединение ослабляющим «ухудшение эффективности в отношении внимания», вызываемое субхроническим введением РСР в случае крыс, как описано Rodefer J.S. и др., Eur. J. Neurosci., 2005, 21: 1070-1076.
В настоящем контексте, подразумевают, что термин «нарушения спектра аутизма» означает нарушения, характеризующиеся широко распространенными анормальностями социальных взаимодействий и вербальной или невербальной коммуникацией, а также ограниченными интересами, повторяемым поведением и вниманием, таким как, но не исчерпывающим образом, аутизм, синдром Аспергера, первазивное нарушение развития, другим образом не специфицированное (PDD-NOS), синдром Ретта, синдром Ангельманна, хрупкость Х, синдром Ди Георга и первичное дезинтегративное расстройство.
В настоящем контексте, подразумевают, что термин «воспалительные нарушения» означает нарушения, характеризующиеся патологиями в иммунной системе, таким как, но не исчерпывающим образом, аллергические реакции и миопатии, приводящие к анормальному воспалению, а также имеют в виду неиммунные заболевания с этиологическими происхождениями при воспалительных процессах, включающие, но не исчерпывающим образом, рак, атеросклероз, остеоартрит, ревматоидный артрит и ишемическую болезнь сердца.
Подробное описание изобретения
Авторами настоящего изобретения найдено, что некоторые новые соединения являются позитивными аллостерическими модуляторами (РАМ) NNR и как таковые могут быть использованы при лечении различных нарушений.
Позитивные аллостерические модуляторы (РАМ) NNR могут быть дозированы в комбинации с другими лекарственными средствами для достижения более эффективного лечения в случае некоторых популяций пациентов. α7-NNR-PAM может действовать синергически с другим лекарственным средством, это описано в случае животных для комбинации соединений, воздействующих на никотиновые рецепторы, включая α7-NNR и D2-антагонизм (Wiker C., Int. J. Neuropsychopharmacol., 2008, 11(6): 845-850).
Таким образом, соединения согласно настоящему изобретению могут быть пригодны для лечения в комбинации с другим лекарственным средством, например, выбираемым из ингибиторов ацетилхолинэстеразы, антагонистов глутаматного рецептора, ингибиторов транспорта допамина, ингибиторов транспорта норадреналина, D2-антагонистов, частичных D2-агонистов, PDE10-антагонистов, 5-НТ2А-антагонистов, 5-НТ6-антагонистов и KCNQ-антагонистов, блокаторов литиевого, натриевого канала, энхансеров передачи сигнала GABA.
В одном воплощении, соединения согласно настоящему изобретению пригодны для лечения пациентов, которых уже подвергали лечению с помощью другого лекарственного средства, выбираемого из вышеприведенного перечня. В одном воплощении, соединения согласно настоящему изобретению адаптированы для введения одновременно с вышеуказанным другим лекарственным средством. В одном воплощении, соединения согласно настоящему изобретению адаптированы для введения последовательно с вышеуказанным другим лекарственным средством. В одном воплощении, соединения согласно настоящему изобретению используют в качестве одного лекарственного средства при лечении пациента. В одном воплощении, соединения согласно настоящему изобретению используют для лечения пациентов, которых ранее не подвергали лечению с помощью другого лекарственного средства, выбираемого из вышеприведенного перечня.
Воплощения согласно данному изобретению
В дальнейшем, раскрыты воплощения согласно данному изобретению. Первое воплощение обозначено Е1, второе воплощение обозначено Е2 и т.д.
Е1. Соединение согласно формуле [I]:
где R1, R2, R3, R4 и R5 выбирают, независимо друг от друга, из Н, С1-6-алкила, С2-6-алкенила, С2-6-алкинила, С1-6-алкокси, циано и галогена, где вышеуказанный С1-6-алкил, С2-6-алкенил и С2-6-алкинил необязательно является замещенным одним или более заместителями, независимо выбираемыми из хлора и фтора;
R6 выбирают из С1-6-алкила, С2-6-алкенила, С2-6-алкинила и С1-6-алкокси, где вышеуказанный С1-6-алкил, С2-6-алкенил и С2-6-алкинил необязательно является замещенным одним или более заместителями, независимо выбираемыми из гидрокси, С1-6-алкокси и фтора;
А7 означает С-R7 или N, А8 означает С-R8 или N и А9 означает С-R9 или N, при условии, что, по меньшей мере, один из А7, А8 или А9 означает N и не более, чем два из А7, А8 и А9 означают N;
R7, R8, R9, R10 и R11 выбирают, независимо друг от друга, из Н, С1-6-алкила, С2-6-алкенила, С2-6-алкинила, С1-6-алкокси, циано, NR12R13, С1-6-алкилсульфонила, галогена и OR14, где вышеуказанный С1-6-алкил, С2-6-алкенил, С2-6-алкинил или С1-6-алкокси необязательно является замещенным одним или более заместителями, выбираемыми из хлора, фтора, С1-6-алкокси, циано и NR12R13;
R12 и R13 независимо означают водород, С1-6-алкил, С2-6-алкенил и С2-6-алкинил;
R14 означает моноциклический насыщенный остаток, имеющий 4-6 атомов в кольце, где один из вышеуказанных атомов кольца представляет собой О, а другие представляют собой С;
или R9 и R10 могут быть связаны вместе с образованием нижеуказанного остатка:
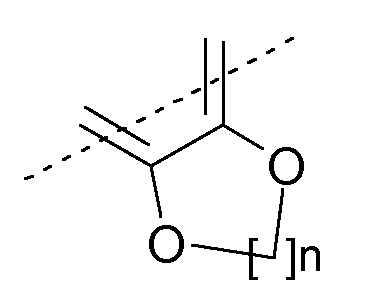
где n означает 1, 2 или 3;
и его фармацевтически приемлемые соли;
при условии, что соединение формулы [I] является другим, чем:
{(S)-1-[5-(2,2,2-трифторэтокси)пиридин-2-ил]этил}амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
{(S)-1-[5-(2,2,2-трифторэтокси)пиридин-2-ил]этил}амид (1S,2S)-2-(2-хлор-4-фторфенил)циклопропанкарбоновой кислоты;
{(S)-1-[5-(2,2,2-трифторэтокси)пиридин-2-ил]этил}амид (1S,2S)-2-(2-фтор-4-метоксифенил)циклопропанкарбоновой кислоты.
Е2. Соединение в соответствии с воплощением 1, где R1, R2, R3, R4 и R5 выбирают, независимо друг от друга, из Н, метила, фтора и хлора;
R6 выбирают из метила, гидроксиметила, метоксиметила и фторметила;
R7, R8, R9, R10 и R11 выбирают, независимо друг от друга, из Н, С1-4-алкила, С1-4-алкокси, циано, -N(CH3)2, метилсульфонила, фтора, хлора и OR14, где вышеуказанный С1-4-алкил или С1-4-алкокси необязательно является замещенным одним или более заместителями, выбираемыми из фтора, С1-4-алкокси и циано;
R14 означает моноциклический насыщенный остаток, имеющий 4-6 атомов в кольце, где один из вышеуказанных атомов кольца представляет собой О, а другие представляют собой С;
или R9 и R10 могут быть связаны вместе с образованием нижеуказанного остатка:
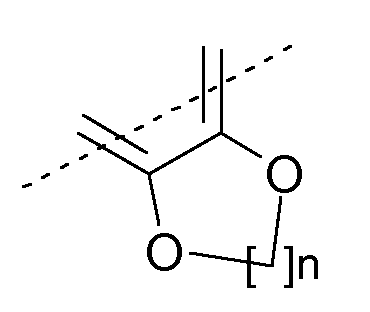
где n означает 1 или 2.
Е3. Соединение в соответствии с любым из воплощений 1-2, где R1, R2, R3, R4 и R5 выбирают, независимо друг от друга, из Н, метила, фтора и хлора.
Е4. Соединение в соответствии с любым из воплощений 1-3, где четыре или более из R1, R2, R3, R4 и R5 означают Н.
Е5. Соединение в соответствии с воплощением 4, где все из R1, R2, R3, R4 и R5 означают Н.
Е6. Соединение в соответствии с любым из воплощений 1-5, где R6 выбирают из метила, гидроксиметила, метоксиметила и фторметила.
Е7. Соединение в соответствии с воплощением 6, где R6 означает метил.
Е8. Соединение в соответствии с воплощением 6, где R6 означает гидроксиметил.
Е9. Соединение в соответствии с воплощением 6, где R6 означает метоксиметил.
Е10. Соединение в соответствии с воплощением 6, где R6 означает фторметил.
Е11. Соединение в соответствии с любым из воплощений 1-10, где R7, R8, R9, R10 и R11 выбирают, независимо друг от друга, из Н, С1-4-алкила, С1-4-алкокси, циано, -N(CH3)2, метилсульфонила, фтора, хлора и OR14, где вышеуказанный С1-4-алкил или С1-4-алкокси необязательно является замещенным одним или более заместителями, выбираемыми из фтора, С1-4-алкокси и циано;
R14 означает моноциклический насыщенный остаток, имеющий 4-6 атомов в кольце, где один из вышеуказанных атомов кольца представляет собой О, а другие представляют собой С;
или R9 и R10 могут быть связаны вместе с образованием нижеуказанного остатка:
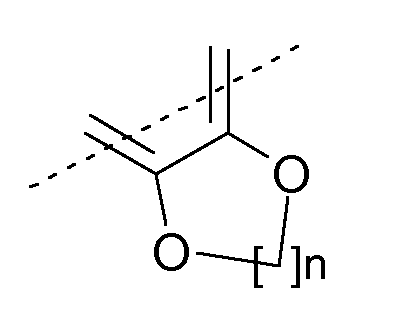
где n означает 1 или 2.
Е12. Соединение в соответствии с любым из воплощений 1 и 3-11, где R7, R8, R9, R10 и R11 выбирают, независимо друг от друга, из Н, С1-6-алкила, С2-6-алкенила, С2-6-алкинила, С1-6-алкокси, циано или галогена, где вышеуказанный С1-6-алкил, С2-6-алкенил, С2-6-алкинил или С1-6-алкокси необязательно является замещенным одним или более заместителями, выбираемыми из фтора, С1-6-алкокси и циано.
Е13. Соединение в соответствии с любым из воплощений 1-12, где R7, R8, R9, R10 и R11 выбирают, независимо друг от друга, из Н, С1-4-алкила, С2-4-алкенила, С2-4-алкинила, С1-4-алкокси, циано и галогена, где вышеуказанный С1-4-алкил, С2-4-алкенил, С2-4-алкинил или С1-4-алкокси необязательно является замещенным одним или более заместителями, выбираемыми из фтора и С1-4-алкокси.
Е14. Соединение в соответствии с любым из воплощений 1-13, где один или более атомов водорода представлен дейтерием.
Е15. Соединение в соответствии с воплощением 14, где один или более атомов водорода в R7, R8, R9, R10 и R11 представлен дейтерием.
Е16. Соединение в соответствии с любым из воплощений 14-15, где, по меньшей мере, примерно 85% соединения имеет атом дейтерия в каждом положении, обозначенный как дейтерий, и любой атом, не обозначенный как дейтерий, присутствует повсюду в его природном изотопном содержании.
Е17. Соединение в соответствии с воплощением 16, где, по меньшей мере, примерно 90% соединения имеет атом дейтерия, в каждом положении, обозначенный как дейтерий, и любой атом, не обозначенный как дейтерий, присутствует повсюду в его природном изотопном содержании.
Е18. Соединение в соответствии с любым из воплощений 1-17, где, не более, чем один из А7, А8 или А9 означает N.
Е19. Соединение в соответствии с любым из воплощений 1-18, где А7 означает N, А8 означает С-R8 и А9 означает С-R9.
Е20. Соединение в соответствии с воплощением 19, где R8, R10 и R11, все, означают Н.
Е21. Соединение в соответствии с любым из воплощений 1-18, где А8 означает N, А7 означает С-R7 и А9 означает С-R9.
Е22. Соединение в соответствии с воплощением 21, где R7, R10 и R11, все, означают Н.
Е23. Соединение в соответствии с любым из воплощений 19-22, где R9 выбирают из метила, С1-4-алкокси или циано, где вышеуказанный метил необязательно является замещенным С1-4-алкокси или одним или более атомами фтора.
Е24. Соединение в соответствии с воплощением 23, где R9 означает С1-4-алкокси и один или более атомов водорода в вышеуказанном С1-4-алкокси представлен дейтерием.
Е25. Соединение в соответствии с любым из воплощений 19-22, где R9 означает OR14, где R14 означает моноциклический насыщенный остаток, имеющий 4-6 атомов в кольце, где один из вышеуказанных атомов кольца представляет собой О, а другие представляют собой С.
Е26. Соединение в соответствии с любым из воплощений 1-18, где А9 означает N, А7 означает С-R7 и А8 означает С-R8.
Е27. Соединение в соответствии с воплощением 26, где R7, R8 и R11, все, означают Н.
Е28. Соединение в соответствии с любым из воплощений 26-27, где R10 выбирают из метила, С1-4-алкокси или циано, где вышеуказанный метил необязательно является замещенным С1-4-алкокси или одним или более атомами фтора.
Е29. Соединение в соответствии с воплощением 28, где R10 означает С1-4-алкокси и один или более атомов водорода в вышеуказанном С1-4-алкокси представлен дейтерием.
Е30. Соединение в соответствии с любым из воплощений 1-17, где два из А7, А8 или А9 означают N.
Е31. Соединение в соответствии с любым из воплощений 1-30, обладающее диастереомерным избытком, по меньшей мере, 80%, таким как, по меньшей мере, 85%, таким как, по меньшей мере, 90%, таким как, по меньшей мере, 95%.
Е32. Соединение в соответствии с воплощением 1, выбираемое из:
1. [(S)-1-(6-изопропоксипиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
2. [(S)-1-(5-метилпиридин-2-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
3. [(S)-1-(6-метоксипиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
4. [(S)-1-(6-метилпиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
5. [(S)-1-(6-цианопиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
6. [(S)-1-(6-трифторметилпиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
7. [(S)-1-(6-этоксипиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
8. [(S)-1-(6-этилпиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
9. [(S)-1-(6-метоксиметилпиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
10. {(S)-1-[6-(2,2,2-трифторэтокси)пиридин-3-ил]этил}амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
11. {(S)-1-[6-(2-метоксиэтокси)пиридин-3-ил]этил}амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
12. [(S)-1-(2-этоксипиридин-4-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
13. ((S)-1-{6-[(S)-(тетрагидрофуран-3-ил)окси]пиридин-3-ил}этил)амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
14. ((S)-1-{6-[(R)-(тетрагидрофуран-3-ил)окси]пиридин-3-ил}этил)амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
15. ((S)-1-[1,3]диоксоло[4,5-b]пиридин-6-ил-этил)амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
16. [(S)-1-(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-7-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
17. [(S)-1-(2-этоксипиримидин-5-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
18. [(S)-1-(6-хлорпиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
19. {(S)-1-[6-(оксетан-3-илокси)пиридин-3-ил]этил}амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
20. [(S)-1-(6-цианометоксипиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
21. [(R)-2-гидрокси-1-(6-пропоксипиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
22. [(R)-2-гидрокси-1-(6-трифторметилпиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
23. [(R)-1-(5-цианопиридин-2-ил)-2-гидроксиэтил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
24. [(R)-2-гидрокси-1-(6-метоксипиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
25. [(R)-2-гидрокси-1-(6-метилпиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
26. [(R)-2-гидрокси-1-(6-изопропоксипиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
27. [(R)-1-(6-этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты;
28. [(R)-1-(6-этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты;
29. [(R)-2-гидрокси-1-(6-пропоксипиридин-3-ил)этил]амида (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты;
30. [(R)-2-гидрокси-1-(6-пропоксипиридин-3-ил)этил]амида (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты;
31. [(R)-1-(6-(2,2,2-d3)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
32. [(R)-1-(6-(1,1-d2)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты;
33. [(R)-1-(6-этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
34. [(R)-1-(6-(1,1,2,2,2-d5)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты;
35. [(R)-1-(6-(2,2,2-d3)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты;
36. [(R)-1-(6-(1,1-d2)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
37. [(R)-1-(6-(1,1-d2)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты;
38. [(R)-1-(6-(1,1,2,2,2-d5)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
39. [(R)-1-(6-(2,2,2-d3)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты;
40. [(R)-1-(6-циклобутоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
41. [(R)-1-(6-циклобутоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты;
42. [(R)-1-(6-циклобутоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты;
43. ((R)-2-гидрокси-1-{6-[(R)-(тетрагидрофуран-3-ил)окси]пиридин-3-ил}этил)амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
44. (1S,2S)-N-[(1R)-2-гидрокси-1-[6-[(3S)-тетрагидрофуран-3-ил]окси-3-пиридил]этил]-2-фенилциклопропанкарбоксамида;
45. {(R)-2-гидрокси-1-[6-(тетрагидропиран-4-илокси)пиридин-3-ил]этил}амида (1S,2S)-2-((Z)-1-метиленпента-2,4-диенил)циклопропанкарбоновой кислоты;
46. [(R)-1-(6-этоксипиридин-3-ил)-2-метоксиэтил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
47. (1S,2S)-N-[(1R)-2-метокси-1-[6-[(3R)-тетрагидрофуран-3-ил]окси-3-пиридил]этил]-2-фенилциклопропанкарбоксамида;
48. (1S,2S)-N-[(1R)-2-метокси-1-[6-[(3S)-тетрагидрофуран-3-ил]окси-3-пиридил]этил]-2-фенилциклопропанкарбоксамида;
49. {(R)-2-метокси-1-[6-(тетрагидропиран-4-илокси)пиридин-3-ил]этил}амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
50. {(S)-1-[6-(оксетан-3-илокси)пиридин-3-ил]этил}амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
51. [(S)-1-(6-этансульфонилпиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
52. [(R)-1-(5-этоксипиридин-2-ил)-2-гидроксиэтил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
и фармацевтически приемлемые соли любого из этих соединений.
Е33. Применение соединения в соответствии с любым из воплощений 1-32, в качестве лекарственного средства.
Е34. Применение соединения в соответствии с любым из воплощений 1-32 в терапии.
Е35. Применение соединения в соответствии с любым из воплощений 1-32, для лечения заболевания или нарушения, выбираемого из психоза; шизофрении; когнитивных нарушений; когнитивного ухудшения, ассоциированного с шизофренией; синдрома гиперактивности с дефицитом внимания (ADHD); нарушений спектра аутизма; болезни Альцгеймера (AD); слабого когнитивного ухудшения (MCI); ассоциированного с возрастом ухудшения памяти (AAMI); сенильной деменции; ассоциированной со СПИДом деменции; болезни Пика; деменции, ассоциированной с тельцами Леви; деменции, ассоциированной с синдромом Дауна; болезни Гентингтона; болезни Паркинсона (PD); обсессивно-компульсивного расстройства (OCD); травматического повреждения головного мозга; эпилепсии; посттравматического стресса; синдрома Вернике-Корсакова (WKS); посттравматической амнезии; когнитивного дефицита, ассоциированного с депрессией; диабетом, контролем массы, воспалительными нарушениями, ослабленным ангиогенезом; бокового амиотрофического склероза и боли.
Е36. Соединение в соответствии с воплощением 35, где вышеуказанное заболевание или нарушение выбирают из шизофрении; AD; ADHD; нарушений спектра аутизма; PD; бокового амиотрофического склероза; болезни Гентингтона; ассоциированной с тельцами Леви деменции и боли.
Е37. Соединение в соответствии с воплощением 36, где вышеуказанное заболевание или нарушение выбирают из шизофрении; AD; ADHD и нарушений спектра аутизма.
Е38. Соединение в соответствии с воплощением 37, где вышеуказанное заболевание или нарушение выбирают из негативных и/или когнитивных симптомов шизофрении.
Е39. Применение соединения в соответствии с любым из воплощений 1-32 одновременно или последовательно с терапевтически эффективным количеством соединения, выбираемого из перечня, состоящего из ингибиторов ацетилхолинэстеразы; антагонистов глутаматного рецептора; ингибиторов транспорта допамина; ингибиторов транспорта норадреналина; D2-антагонистов; частичных D2-агонистов; PDE10-антагонистов; 5-НТ2А-антагонистов; 5-НТ6-антагонистов; KCNQ-антагонистов, блокаторов литиевого, натриевого канала и энхансеров передачи сигнала GABA, при лечении заболевания или нарушения согласно любому из воплощений 35-38.
Е40. Фармацевтическая композиция, включающая соединение в соответствии с любым из воплощений 1-32 и один или более фармацевтически приемлемых носителей или эксципиентов.
Е41. Композиция в соответствии с воплощением 40, которая дополнительно включает второе соединение, выбираемое из перечня, состоящего из ингибиторов ацетилхолинэстеразы; антагонистов глутаматного рецептора; ингибиторов транспорта допамина; ингибиторов транспорта норадреналина; D2-антагонистов; частичных D2-агонистов; PDE10-антагонистов; 5-НТ2А-антагонистов; 5-НТ6-антагонистов KCNQ-антагонистов; блокаторов литиевого, натриевого канала и энхансеров передачи сигнала GABA.
Е42. Композиция в соответствии с воплощением 41, где вышеуказанным вторым соединением является ингибитор ацетилхолинэстеразы.
Е43. Набор, включающий соединение в соответствии с любым из воплощений 1-32 вместе с вторым соединением, выбираемым из перечня, состоящего из ингибиторов ацетилхолинэстеразы; антагонистов глутаматного рецептора; ингибиторов транспорта допамина; ингибиторов транспорта норадреналина; D2-антагонистов; частичных D2-агонистов; PDE10-антагонистов; 5-НТ2А-антагонистов; 5-НТ6-антагонистов; KCNQ-антагонистов; блокаторов литиевого, натриевого канала и энхансеров передачи сигнала GABA.
Е44. Набор в соответствии с воплощением 43, где вышеуказанным вторым соединением является ингибитор ацетилхолинэстеразы.
Е45. Способ лечения заболевания или нарушения, выбираемого из психоза; шизофрении; когнитивных нарушений; когнитивного ухудшения, ассоциированного с шизофренией; нарушения гипер-активности с дефицитом внимания (ADHD); нарушения спектра аутизма; болезни Альцгеймера (AD); легкого когнитивного ухудшения (MCI); ассоциированного с возрастом ухудшения памяти (AAMi); сенильной деменции; ассоциированной со СПИДом деменции; болезни Пика; ассоциированной с тельцами Леви деменции; ассоциированной с синдромом Дауна деменции; болезни Гентингтона; болезни Паркинсона (PD); обсессивно-компульсивного расстройства (OCD); травматического повреждения головного мозга; эпилепсии; посттравматического стресса; синдрома Вернике-Корсакова (WKS); посттравматической амнезии; когнитивных дефицитов, ассоциированных с депрессией; диабетом, контролем массы, воспалительными нарушениями, ослабленным ангиогенезом; бокового амиотрофического склероза и боли, где способ включает введение терапевтически эффективного количества соединения в соответствии с любым из воплощений 1-32 пациенту, нуждающемуся в этом.
Е46. Способ в соответствии с воплощением 45, где вышеуказанное заболевание или нарушение выбирают из шизофрении; AD; ADHD; нарушений спектра аутизма; PD; бокового амиотрофического склероза; болезни Гентингтона; ассоциированной с тельцами Леви деменции и боли.
Е47. Способ в соответствии с воплощением 46, где вышеуказанное заболевание или нарушение выбирают из шизофрении; AD; ADHD и нарушений спектра аутизма.
Е48. Способ в соответствии с воплощением 47, где вышеуказанное лечение включает лечение негативных и/или когнитивных симптомов шизофрении.
Е49. Способ в соответствии с любым из воплощений 45-48, где вышеуказанное лечение, далее, включает введение терапевтически эффективного количества второго соединения, выбираемого из перечня, состоящего из ингибиторов ацетилхолинэстеразы; антагонистов глутаматного рецептора; ингибиторов транспорта допамина; ингибиторов транспорта норадреналина; D2-антагонистов; частичных D2-агонистов; PDE10-антагонистов; 5-НТ2А-антагонистов; 5-НТ6-антагонистов; KCNQ-антагонистов; блокаторов литиевого, натриевого канала и энхансеров передачи сигнала GABA.
Е50. Способ в соответствии с воплощением 49, где вышеуказанным вторым соединением является ингибитор ацетилхолинэстеразы.
Е51. Применение соединения в соответствии с любым из воплощений 1-32 для получения лекарственного средства для лечения заболевания или нарушения, выбираемого из психоза; шизофрении; когнитивных нарушений; когнитивного ухудшения, ассоциированного с шизофренией; нарушения гиперактивности с дефицитом внимания (ADHD); нарушения спектра аутизма; болезни Альцгеймера (AD); легкого когнитивного ухудшения (MCI); ассоциированного с возрастом ухудшения памяти (AAMi); сенильной деменции; ассоциированной со СПИДом деменции; болезни Пика; ассоциированной с тельцами Леви деменции; ассоциированной с синдромом Дауна деменции; болезни Гентингтона; болезни Паркинсона (PD); обсессивно-компульсивного расстройства (OCD); травматического повреждения головного мозга; эпилепсии; посттравматического стресса; синдрома Вернике-Корсакова (WKS); посттравматической амнезии; когнитивных дефицитов, ассоциированных с депрессией; диабетом, контролем массы, воспалительными нарушениями, ослабленным ангиогенезом; бокового амиотрофического склероза и боли.
Е52. Применение в соответствии с воплощением 51, где вышеуказанное заболевание или нарушение выбирают из шизофрении; AD; ADHD; нарушений спектра аутизма; PD; бокового амиотрофического склероза; болезни Гентингтона; ассоциированной с тельцами Леви деменции и боли.
Е53. Применение в соответствии с воплощением 52, где вышеуказанное заболевание или нарушение выбирают из шизофрении; AD; ADHD и нарушений спектра аутизма.
Е54. Применение в соответствии с воплощением 53, где вышеуказанное заболевание представляет собой позитивные, негативные и/или когнитивные симптомы шизофрении.
Е55. Применение в соответствии с любым из воплощений 51-54, где вышеуказанное получение, далее, включает применение второго соединения, выбираемого из перечня, состоящего из ингибиторов ацетилхолинэстеразы; антагонистов глутаматного рецептора; ингибиторов транспорта допамина; ингибиторов транспорта норадреналина; D2-антагонистов; частичных D2-агонистов; PDE10-антагонистов; 5-НТ2А-антагонистов; 5-НТ6-антагонистов; KCNQ-антагонистов; блокаторов литиевого, натриевого канала и энхансеров передачи сигнала GABA.
Е56. Применение в соответствии с воплощением 55, где вышеуказанным вторым соединением является ингибитор ацетилхолинэстеразы.
Соединения согласно данному изобретению могут находиться в несольватированной, а также сольватированной формах, в которых молекулы растворителя выбирают из фармацевтически приемлемых растворителей, таким как вода, этанол и т.п. Вообще, такие сольватированные формы считают эквивалентными несольватированным формам для целей настоящего изобретения.
В настоящее изобретение включены также изотопно меченые соединения, которые идентичны соединениям, заявляемым согласно формуле [I], где один или более атомов представлены атомом того же самого элемента, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа, обычно встречающегося в природе (например, 2Н, 3Н, 11С, 13С, 15N, 18F и т.п.). Конкретное указание делают относительно 2Н-замещенных соединений, то есть, соединений, где один или более атомов водорода представлен дейтерием. В одном воплощении данного изобретения, один или более атомов водорода соединения формулы [I] представлен дейтерием. Признают, что в наибольшем количестве синтетических соединений элементы присутствуют в природных изотопных относительных содержаниях и в результате имеют неотъемлемое включение дейтерия. Однако, природное изотопное относительное содержание изотопов водорода, таким как дейтерия, является несущественным (около 0,015%) относительно степени стабильного изотопного замещения соединений, указанных в данном контексте. Таким образом, как используется в данном контексте, обозначение атома как дейтерий в соответствующем положении указывает, что относительное содержание дейтерия является значительно больше, чем природное относительное содержание дейтерия. Подразумевают, что любой атом, не обозначенный как конкретный изотоп, представляет собой любой стабильный изотоп этого атома, как должно быть очевидно квалифицированному специалисту в данной области.
В одном воплощении, обозначение соответствующего положения как «D» в соединении означает минимальное включение дейтерия более, чем примерно 60% в этом положении, таким как более, чем примерно 70% в этом положении, таким как более, чем примерно 80% в этом положении, таким как более, чем примерно 85% в этом положении. В дальнейшем воплощении, обозначение положения как «D» в соединении означает минимальное включение дейтерия более, чем примерно 90% в этом положении, таким как более, чем примерно 95% в этом положении, таким как более, чем примерно 97% в этом положении, таким как более, чем примерно 99% в этом положении.
Соединения согласно настоящему изобретению имеют три асимметрических центра с фиксированной стереохимией, как указано стрелками ниже:
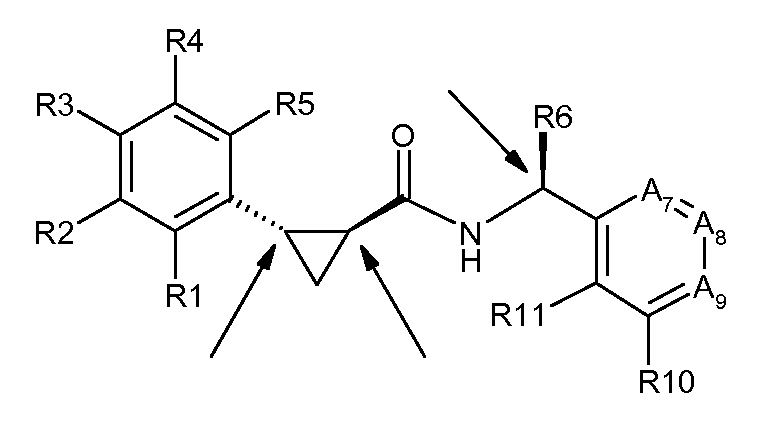
Соединения согласно настоящему изобретению могут быть получены из двух хиральных промежуточных продуктов с одним и двумя асимметрическими центрами, соответственно, как проиллюстрировано с помощью нижеприводимых примеров.
В данном контексте подразумевается, что, когда точно определена энантиомерная форма промежуточного продукта, тогда промежуточный продукт находится в энантиомерном избытке, например, по существу в чистой, моноэнантиомерной форме. Соответственно, полученные в результате соединения согласно данному изобретению имеют диастереомерный избыток, по меньшей мере, 89%. Одно воплощение данного изобретения относится к соединению согласно данному изобретению, имеющему диастереомерный избыток, по меньшей мере, 80%, таким как, по меньшей мере, 90%, предпочтительно, по меньшей мере, 95% или, по меньшей мере, 97%, относительно трех асимметрических центров, указанных выше.
В зависимости от индивидуальных заместителей R1-R14, соединения согласно настоящему изобретению, кроме того, могут иметь один или более дополнительных асимметрических центров. Подразумевают, что любые оптические изомеры (то есть, энантиомеры или диастереомеры) в форме разделенных, чистых или частично очищенных оптических изомеров и любые их смеси, включая рацемические смеси, то есть, смесь стереомеров, которая возникает, вследствие асимметрических центров в любом из заместителей R1-R14, включены в рамки настоящего изобретения.
Рацемические формы могут быть подвергнуты разделению на оптические антиподы известными методами, например, путем разделения их диастереомерных солей с помощью оптически активной кислоты и высвобождение оптически активного амина путем обработки основанием. Другой метод разделения рацематов на оптические антиподы базируется на хроматографии при использовании оптически активной матрицы. Соединения согласно настоящему изобретению также могут быть разделены посредством образования диастереомерных производных. Могут быть использованы дополнительные методы разделения оптических изомеров, известные квалифицированному специалисту в данной области. Такие методы включают методы, обсужденные J. Jaques, A. Collet и S. Wilen в руководстве «Enantiomers, Racemates and Resolutions», John Wiley and Sons, New York (1981). Оптически активные соединения также могут быть получены из оптически активных исходных веществ.
Кроме того, когда в молекуле имеется двойная связь или полностью или частично насыщенная кольцевая система, могут образовываться геометрические изомеры. Подразумевают, что любые геометрические изомеры, как разделенные, чистые или частично очищенные геометрические изомеры, или их смеси включены в рамки настоящего изобретения. Также, молекулы, имеющие связь с ограниченным вращением, могут образовывать геометрические изомеры. Также подразумевают, что они также включены в рамки настоящего изобретения.
Кроме того, некоторые из соединений согласно настоящему изобретению могут находиться в различных таутомерных формах и подразумевают, что любые таутомерные формы, которые соединения способны образовывать, включены в рамки настоящего изобретения.
Соединения согласно настоящему изобретению могут быть введены индивидуально в виде чистого соединения или в комбинации с фармацевтически приемлемыми носителями или эксципиентами, в виде или одной или множественных доз. Фармацевтические композиции согласно данному изобретению могут быть получены с фармацевтически приемлемыми носителями или разбавителями, а также любыми другими известными добавками и эксципиентами, в соответствии с обычными способами, таким как способы, раскрытые в Remington: The Science and Practice of Pharmacy, 19-е издание, под ред Gannaro, Mack Publishing Co., Easton, PA, 1985.
Фармацевтические композиции могут быть конкретно получены для введения любым подходящим путем, таким как пероральный, ректальный, назальный, пульмонарный, локальный (включая буккальный и сублингвальный), трансдермальный, интрацистернальный, интраперитонеальный, вагинальный и парентеральный (включая подкожный, внутримышечный, интратекальный, внутривенный и интрадермальный) путь, причем предпочтительным является пероральный путь. Должно быть понятно, что предпочтительный путь зависит от общего состояния и возраста субъекта, подвергаемого лечению, природы состояния, подвергаемого лечению, и выбранного активного ингредиента.
Фармацевтические композиции для перорального введения включают твердые дозированные формы, таким как капсулы, таблетки, драже, пилюли, лепешки, порошки и гранулы. Где соответствует, они могут быть получены с нанесенными покрытиями.
Жидкие дозированные формы для перорального введения включают растворы, эмульсии, суспензии, сиропы и эликсиры.
Фармацевтические композиции для парентерального введения включают стерильные водные и неводные инъецируемые растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки, реконструируемые в стерильные инъецируемые растворы или дисперсии перед использованием.
Другие, подходящие для введения формы включают суппозитории, спреи, мази, крема, гели, дозированные формы для ингаляции, кожные пластыри, имплантаты и т.д.
В одном воплощении, соединение согласно настоящему изобретению вводят в количестве от примерно 0,001 мг/кг массы тела до примерно 100 мг/кг массы тела в сутки. В особенности, суточные дозы могут быть в диапазоне от 0,01 мг/кг массы тела до примерно 50 мг/кг массы тела в сутки. Точные дозировки зависят от частоты и способа введения, пола, возраста, массы и общего состояния субъекта, подвергаемого лечению, природы и тяжести состояния, подвергаемого лечению, любых сопутствующих заболеваний, подвергаемых лечению, желательного эффекта лечения и других факторов, известных квалифицированному специалисту в данной области.
Типичная пероральная дозировка для взрослых должна находиться в диапазоне 0,1-1000 мг/ сутки соединения согласно настоящему изобретению, таким как 1-500 мг/сутки, таким как 1-100 мг/сутки или 1-50 мг/сутки.
Подходящим образом, соединения согласно данному изобретению вводят в единичной дозированной форме, содержащей вышеуказанные соединения в количестве примерно 0,1-500 мг, таким как, 10 мг, 50 мг, 100 мг, 150 мг, 200 мг или 250 мг соединения согласно настоящему изобретению.
Для парентерального введения могут быть использованы растворы соединения согласно данному изобретению в стерильном водном растворе, водном пропиленгликоле, водном витамине Е или кунжутном или арахисовом масле. Такие водные растворы должны быть подходящим образом забуферены, если необходимо, и жидкий разбавитель сначала делают изотоническим с помощью достаточного количества соли или глюкозы. Водные растворы являются особенно подходящими для внутривенного, внутримышечного, подкожного и интраперитонеального введения. Используемые стерильные водные среды, все, являются легко доступными, посредством стандартных способов, известных квалифицированному специалисту в данной области.
Подходящие фармацевтические носители включают инертные твердые разбавители или наполнители, стерильный водный раствор и различные органические растворители. Примерами твердых носителей являются лактоза, terra alba, сахароза, циклодекстрин, тальк, желатин, агар, пектин, аравийская камедь, стеарат магния, стеариновая кислота и низшие алкиловые простые эфиры целлюлозы. Примерами жидких носителей являются сироп, арахисовое масло, оливковое масло, фосфолипиды, жирные кислоты, амины жирных кислот, полиоксиэтилен и вода. Фармацевтические композиции, получаемые путем комбинирования соединения согласно данному изобретению и фармацевтически приемлемых носителей, затем без труда вводят с помощью множества дозированных форм, подходящих для раскрытых путей введения.
Готовые дозированные формы согласно настоящему изобретению, подходящие для перорального введения, могут быть представлены в виде дискретных единиц, таким как капсулы или таблетки, каждая, содержащая предопределенное количество активного ингредиента, и которые могут включать подходящий эксципиент. Кроме того, перорально доступные готовые дозированные формы могут быть в виде порошка или гранул, раствора или суспензии в водной или неводной жидкости, или в виде эмульсии масло-в-воде или вода-в-масле.
Если используют твердый носитель для перорального введения, готовой дозированной формой может быть таблетка, помещенная в твердую желатиновую капсулу, в форме порошка или пилюли или в форме пастилки или лепешки. Количество твердого носителя может изменяться, однако, обычно должно составлять от примерно 25 мг до примерно 1 г. Если используют жидкий носитель, готовая лекарственная форма может быть в виде сиропа, эмульсии, мягкой желатиновой капсулы или стерильной инъецируемой жидкости, таким как водная или неводная жидкая суспензия или раствор.
Таблетки могут быть получены путем смешения активного ингредиента с обычными добавками и/или разбавителями с последующим уплотнением смеси в обычной таблетировочной машине. Примеры добавок или разбавителей включают: кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, камеди и т.п. Могут быть использованы любые другие адъюванты или добавки, обычно применяемые для таких целей, таким как красители, ароматизаторы, консерванты и т.п., при условии, что они совместимы с активными ингредиентами.
Все ссылки, включая публикации, заявки на патенты и патенты, цитированные в данном контексте, настоящим включены путем ссылки во всей их полноте и в том же самом объеме, как если бы каждая ссылка была индивидуально и конкретно указана включенной путем ссылки и изложена во всей ее полноте в настоящем контексте (в максимальном объеме, разрешаемом законом), невзирая на какое-либо отдельно предусмотренное включение конкретных документов, сделанное в другом месте настоящего контекста.
Использование терминов в единственном числе в контексте описания данного изобретения должно быть истолковано как охватывающее как единственное число, так и множественное число, за исключением иным образом указанного в данном контексте или ясно опровергаемого контекстом. Например, термин «соединение» должен быть понятен в качестве ссылки на различные «соединения» согласно данному изобретению или конкретно описанному аспекту, за исключением иным образом указанного.
Подразумевают, что описание в данном контексте какого-либо аспекта или аспекта согласно данному изобретению, используя термины, таким как «включающий», «имеющий», «в том числе» или «содержащий» со ссылкой на элемент или элементы, предусматривает подтверждение подобного аспекта или аспекта согласно данному изобретению, который «состоит из», «по существу состоит из» или «в основном включает» тот конкретный элемент или элементы, за исключением иным образом установленного или ясно опровергаемого настоящим контекстом (например, композиция, описанная в данном контексте как включающая конкретный элемент, должна быть истолкована также как композиция, состоящая из этого элемента, за исключением иным образом установленного или ясно опровергаемого данным контекстом).
Должно быть понятно, что различные аспекты, воплощения, осуществления и признаки данного изобретения, указанные в данном контексте, могут быть заявлены отдельно или в любой комбинации.
Соединения формулы [I] могут быть получены нижеописанными способами одновременно с помощью способов синтеза, известных в области органической химии, или модификаций, которые хорошо известны квалифицированному специалисту в данной области. Исходные вещества, используемые согласно данному контексту, являются коммерчески доступными или могут быть получены рутинными способами, известными в данной области, таким как способы, описанные в стандартных справочниках, таким как «Compendium of Organic Synthetic Methods», тома I-XII (опубликовано Wiley-Interscience). Предпочтительные способы включают, но не исчерпывающим образом, способы, описанные ниже.
На схемах представлены способы, пригодные для синтеза соединений согласно настоящему изобретению. Они не ограничивают каким-либо образом рамки настоящего изобретения.
Способы получения соединений согласно данному изобретению
Соединения согласно данному изобретению формулы [I] могут быть получены из промежуточных продуктов III и II, как представлено на схеме 1.
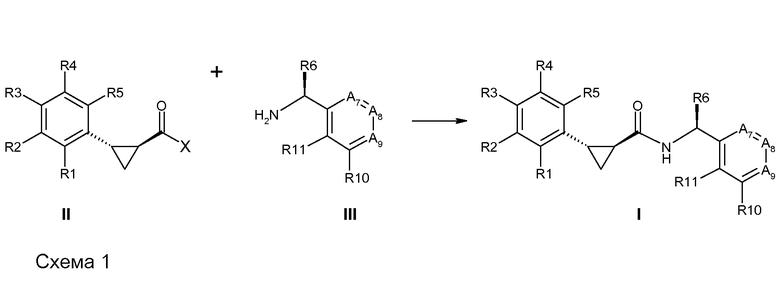
Если Х означает гидроксил, карбоновая кислота II и амин III могут быть конденсированы с образованием амида I, используя стандартную химию связывания пептида, например, как описано в руководстве «Synthetic Peptides A user′s Guide» (подготовлено к печати A. Grant, W.H. Freeman и др. (1992) ISBN 0-7167-7009-1) или как описано в руководстве Houben-Weyl, том Е22а, «Synthesis of peptides (George Thiemes Verlag, Stuttgart (2003), четвертое издание). Одним примером образования этого амида является использование реагента связывания HATU (О-(бензотриазол-1-ил)-N,N,N′,N′-тетраметилуронийгексафторфосфат). Типично, один эквивалент соединения II вводят во взаимодействие с одним эквивалентом HATU в присутствии двух эквивалентов третичного амина, например, триэтиламина, в подходящем растворителе, например, в ДМФА. Спустя короткий период времени (например, пять минут), эту смесь вводят во взаимодействие с одним эквивалентом соединения III, получая соединение I. Согласно другому примеру получения этого амида является использование 1-гидроксибензотриазола вместе с растворимым в воде карбодиимидом EDC (номер по каталогу (CAS) 25952-53-8) и триэтиламином в подходящем растворителе, например, ТГФ. Эти реакции обычно осуществляют при комнатной температуре или при температуре от 0°С до 50°С.
Если Х означает хлорид (например, получаемый из карбоновой кислоты II, Х=ОН, используя тионилхлорид), соединение III может быть введено во взаимодействие с соединением II при образовании соединения I, в присутствии третичного амина, в подходящем растворителе. Альтернативно, хлорангидрид карбоновой кислоты (II, X=Cl) может быть введен во взаимодействие с N-гидрокси-сукцинимидом, получая сложный эфир HOSU, который может быть выделен и затем введен во взаимодействие с соединением III, получая соединение I.
Способы получения промежуточных продуктов согласно данному изобретению.
Промежуточные продукты согласно данному изобретению формулы II являются либо коммерчески доступными, либо могут быть получены, как представлено на схеме 2.
Схема 2
Получение (1S,2S)-энантиомера формулы II
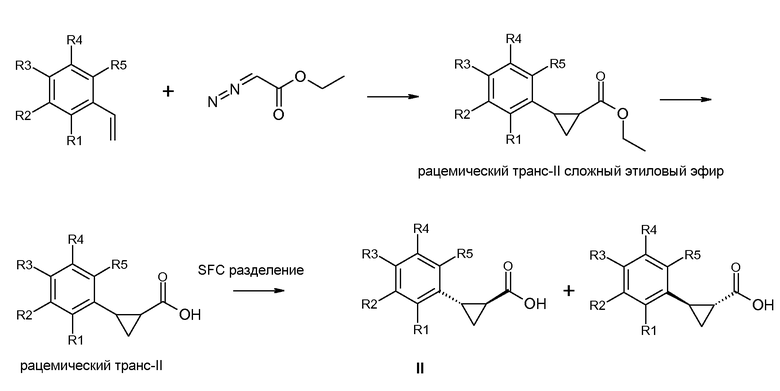
Этилдиазоацетат может быть введен во взаимодействие со стиролом, согласно схеме II, получая рацемический транс-II сложный этиловый эфир. Этот сложный эфир затем может быть гидролизован до рацемического транс-II, который затем может быть разделен на два энантиомера, используя SFC. Альтернативно, рацемический транс-II может быть разделен на два энантиомера посредством известных способов, как описано в руководстве «Enantiomers, Racemates and Resolutions» (J. Jaques и др., John Wiley and Sons, Нью-Йорк (1981)).
Другое получение соединений формулы II представлено на схеме 3. Этот способ подробно описан в Международной заявке WO-2012/037258.
Схема 3
Получение (1S,2S)-энантиомера формулы II
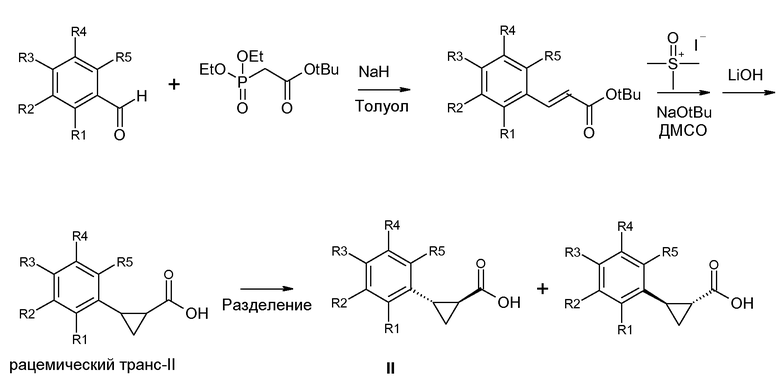
Бензальдегид, представленный на схеме 3, может быть введен во взаимодействие с анионом трет-бутилового эфира (диэтоксифосфорил)уксусной кислоты, получая, как показано, ненасыщенный сложный эфир. Циклопропанирование с последующим гидролизом затем приводит к рацемическому транс-II, который может быть разделен как описано выше.
Промежуточные продукты согласно данному изобретению формулы III являются либо коммерчески доступными, либо могут быть получены, как представлено на схеме 4, в которой R6 означает СН2ОН.
Схема 4
Получение хиральных аминов формулы III c R6=СН2ОН
Способ описан Barrow J.C. и др., Tetrahedron Letters (2001) 2051.
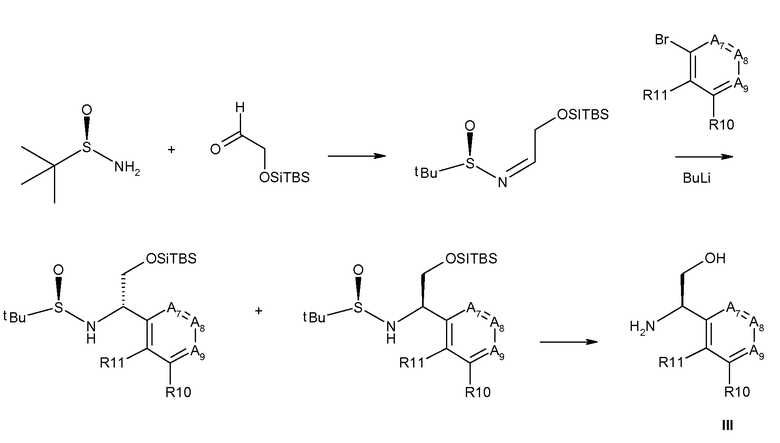
(R)-(+)-2-Метил-2-пропансульфинамид может быть введен во взаимодействие с (трет-бутилдиметилсилилокси)ацетальдегидом, как описано в литературе (Barrow J.C. и др., Tetyrahedron Letters (2001) 2051), получая сульфинимин, представленный на схеме 4. 1,2-Присоединение металлоорганического реагента (например, реактив Гриньяра или ариллитиевый реагент (представлено на схеме 4)) к этим сульфинилиминам затем приводит к двум диастереомерным защищенным аминоспиртам, представленным на схеме 4. Эти изомеры могут быть разделены, например, посредством хроматографии при использовании силикагеля и защитные группы затем удаляют при кислых условиях.
Другой способ при использовании энантиомерно-чистого трет-бутансульфинамида представлен на схеме 5 (Robak M., Herbage M., Ellman, Chem. Rev., 2010, 110, 3600-3740, и цитированные там ссылки). Для простоты, способ проиллюстрирован только для R6=CH3, однако, способ не ограничен R6=CH3.
Схема 5
Получение хиральных аминов формулы III c R6=CH3.
Способ описан Robak M., Herbage M., Ellman, Chem. Rev., 2010, 110, 3600-3740, (и в случае цитированных в данном описании ссылок).
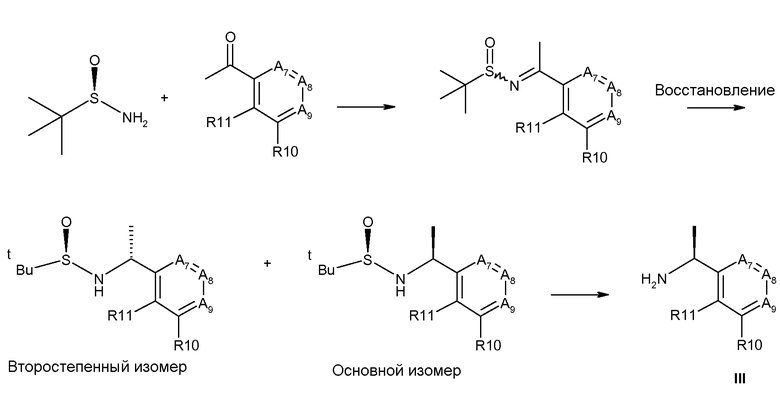
(R)-(+)-2-Метил-2-пропансульфинамид может быть введен во взаимодействие с подходящим кетоном и этоксидом титана-(IV) в подходящем растворителе, например, ТГФ, при условиях нагревания, получая сульфинилимин, представленный на схеме 5. Этот имин может быть восстановлен с некоторой селективностью, используя восстановитель (например, L-селектрид), в подходящем растворителе (например, ТГФ), при подходящей температуре (например, -70°С), с получением основного изомера и второстепенного изомера, представленных на схеме 5. Основной изомер может быть выделен, например, посредством хроматографии при использовании силикагеля и затем вспомогательное хиральное вещество может быть удалено с помощью кислоты (например, водный раствор HCl для получения соединения III).
Примеры
Настоящее изобретение должно быть проиллюстрировано следующими, не исчерпывающими примерами.
Аббревиатуры
АсОН=уксусная кислота. αD=удельное оптическое вращение. Aq=водный. BBr3=трибромид бора (используемый в виде раствора в дихлорметане (DCM); Aldrich 17,893-4). Вос2О=Вос ангидрид/ди-трет-бутилдикарбонат (например, Aldrich 19,913-3). Brine=водный насыщенный раствор хлорида натрия. CDCl3=дейтерированный хлороформ (например, Aldrich 225789). Celite=целит (вспомогательное фильтровальное вещество). CH3I=метилиодид/иодметан (например, Aldrich 28,956-6). Cs2CO3=карбонат цезия (Aldrich 441902). DCM=ДХМ=дихлорметан. DMF=ДМФА=диметилформамид, DMSO=ДМСО=диметилсульфоксид. d6-DMSO=d6-ДМСО=дейтерированный диметилсульфоксид (например, Aldrich 296147). ELSD=детектирование посредством испарительного светорассеяния. Et3N=триэтиламин. EtOAc=этилацетат. 99% EtOH=абсолютный этанол. Et2O=диэтиловый эфир. h=часы. HATU=О-(7-азабензотриазол-1-ил)-N,N,N′,N′-тетраметилуроний-гексафторфосфат. HBTU=2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуронийгексафторфосфат. i=изо. K2CO3=карбонат калия (например, Aldrich 20,961-9). LDA=диизопропиламид лития (используемый в виде раствора в смеси ТГФ/гептан/этилбензол; Fluka 62491). LC/MS=высокоэффективная жидкостная хроматография (ВЭЖХ)/масс-спектрометр. LAH=литийалюминийгидрид (используемый в виде 1 М раствора в ТГФ; Aldrich 21,277-6). МеОН=метанол. min=минуты. NaCNBH3=цианоборгидрид натрия (Aldrich 15,615-9). NaH=гидрид натрия (используемый в виде 60%-ной дисперсии; Aldrich 45,291-2). NaOH=водный раствор гидроксида натрия. Pd/C=палладий-на-угле (например, Aldrich 20,569-9). PTSA=гидрат паратолуолсульфокислоты (например, Aldrich 40,288-5). rt=комнатная температура. RT=время удерживания. sat. NaHCO3=насыщенный водный раствор гидрокарбоната натрия. sat. NH4Cl=насыщенный водный раствор хлорида аммония. SFC=сверхкритическая флэш-хроматография. TFA=ТФУК=трифторуксусная кислота. THF=ТГФ=тетрагидрофуран (высушенный над молекулярными ситами 4Å). TLC=ТСХ=тонкослойная хроматография.
Химические названия получали, используя программное обеспечение MDL ISIS/DRAW 2,5 от MDL информационных систем.
Спектроскопические способы
Способ А
LC-MS осуществляли при использовании оборудования Sciex API150EX, снабженного APPI-источником, работая по методу образования положительных ионов. ВЭЖХ состояла из Shimadzu LC10-Advp LC - насосов, SPD-M20A PDA-детектора (работающего при длине волны 254 нм) и контроллера системы SCL-10A. Автоматический пробоотборник представлял собой Gilson 215, термостат колонки представлял собой Jones Chromatography 7990R и ELS-детектор представлял собой Sedere Sedex 85.
LC-условия: колонка Waters Symmetry C-18, 3,5 мкм; 4,6×30 мм, работая при температуре 60°С со скоростью дозирования 3,0 мл/мин бинарного градиента, состоящего из воды+0,05% ТФУК (А) и метанола+0,05% ТФУК (В).
Общее время анализа: 2,8 минуты.
Время удерживания (tR) выражали в минутах, базируясь на УФ-регистрации при длине волны 254 нм.
Способ В
LC-MS осуществляли при использовании оборудования Waters Acquity UPLC-MS, состоящего из Waters Acquity, включающего устройство управления колонкой, устройство управления бинарным растворителем, систематизатор образцов, PDA-детектор (работающий при длине волны 254 нм), ELS-детектор, и SQD-MS, снабженный APPI-источником, работая по методу образования положительных ионов.
LC-условия: колонка Acquity UPLC BEH C-18, 1,7 мкм; 2,1×50 мм, работая при температуре 60°С со скоростью дозирования 1,2 мл/мин бинарного градиента, состоящего из воды +0,05% трифторуксусной кислоты (А) и ацетонитрила +5% воды +0,035% трифторуксусной кислоты (В).
Общее время анализа: 1,2 минуты.
Время удерживания (tR) выражали в минутах, базируясь на УФ-регистрации при длине волны 254 нм.
Способ С
Препаративную сверхкритическую флэш-хроматографию (SFC) осуществляли на оборудовании Berger Multigram II, работая со скоростью дозирования 50 мл/мин, при температуре 35°С и противодавлении, равном 100 бар, используя множественные вводы (проб). Колонка представляла собой колонку ChiralpakAD, 5мк, размером 250×21 мм. Элюент представлял собой СО2 (70%) и этанол (30%).
Способ D
Препаративную сверхкритическую флэш-хроматографию (SFC) осуществляли на оборудовании Thar SFC-80, работая со скоростью дозирования 60 г/мин, при температуре 35°С и противодавлении, равном 140 бар, используя множественные вводы (проб). Колонка представляла собой колонку ChiralPakAD-Н (размером 250×30 мм). Элюент представлял собой СО2 (88%) и этанол (12%).
Способ Е
Препаративную сверхкритическую флэш-хроматографию (SFC) осуществляли на оборудовании Thar SFC-200, работая со скоростью дозирования 100 г/мин, при температуре 35°С и противодавлении, равном 140 бар, используя множественные вводы (проб). Колонка представляла собой колонку ChiralPakAD-Н (размером 250×30 мм). Элюент представлял собой СО2 (90%) и этанол (10%).
Способ F
Энантиомерный избыток (ее) определяли при использовании системы Aurora Fusion A5 SFC, работая со скоростью дозирования 3 мл/мин, при температуре 40°С и противодавлении, равном 100 бар. Колонка представляла собой Chiralpak AD (размером 150×4,6 мм). Элюент представлял собой СО2 (70%) и этанол +0,1% диэтиламина (30%).
1Н-ЯМР-спектры регистрировали при 500,13 МГц, на оборудовании Bruker Avance DRX-500, при Т=303,3°К, или при 600 МГц, на оборудовании Bruker Avance AV-III-600. Значения химических сдвигов выражали в м.д. относительно тетраметилсилана, за исключением иначе указанного. Для многочисленности сигналов ЯМР использовали следующие аббревиатуры или их комбинации: с=синглет, д=дублет, м=мультиплет и уш.=уширенный.
Получение промежуточных продуктов
Получение бромпиридинов
IM1: 5-Бром-2-изопропоксипиридин
60%-ную Суспензию NaH в масле (1,5:1, гидрид нат-рия:минеральное масло, 5,20 г) добавляют, в виде двух порций, к изопропиловому спирту (150 мл), при комнатной температуре, в атмосфере азота. Смесь перемешивают при температуре 60°С в течение 30 минут. В виде двух порций, добавляют 5-бром-2-хлорпиридин (10,00 г, 51,96 ммоль), и смесь перемешивают при кипячении с обратным холодильником в течение 4 часов и затем при температуре 80°С в течение ночи. Раствор концентрируют в вакууме. Добавляют воду (50 мл) и EtOAc (50 мл) и слои разделяют. Водный слой экстрагируют с помощью EtOAc (50 мл). Объединенные органические слои промывают насыщенным солевым раствором, сушат над MgSO4, отфильтровывают и растворитель удаляют в вакууме. Сырой продукт подвергают флэш-хроматографии (диоксид кремния, 0-50% EtOAc в гептанах), получая указанное в заголовке соединение в виде прозрачного масла (8,74 г, выход: 78%).
1H ЯМР (600 МГц, ДМСО) δ 8,17 (с, 1H), 7,61 (дд, 1H), 6,59 (д, 1H), 5,23 (м, 1H), 1,33 (с, 6H).
IM2: 5-Бром-2-(2,2,2-трифторэтокси)пиридин
Синтезируют аналогично синтезу IM1, получая указанное в заголовке соединение в виде бесцветной жидкости (2,78 г, выход: 54%) достаточной степени чистоты для следующей стадии.
IM3: 5-Бром-2-пропоксипиридин
трет-Бутоксид калия (1,85 г, 16,5 ммоль) добавляют к смеси 5-бром-2-хлорпиридина (2,89 г, 15,0 ммоль) и 1-пропанола (1,230 мл, 16,5 ммоль) в ТГФ (15 мл). Реакционную смесь нагревают при температуре 120°С в течение 30 минут в микроволновом реакторе. Смесь выливают в смесь воды (50 мл) и EtOAc (100 мл). Органический слой промывают насыщенным солевым раствором, сушат над MgSO4 и выпаривают досуха. Посредством флэш-хроматографии (диоксид кремния, 0-20% EtOAc в гептанах) получают указанное в заголовке соединение в виде масла желтого цвета (3,13 г, выход: 97%) достаточной степени чистоты для следующей стадии.
IM4: 5-Бром-2-(2,2,2-d3)этоксипиридин
Синтезируют аналогично синтезу IM3, используя коммерчески доступный 2,2,2-d3-этанол (Sigma-Aldrich, номер по каталогу 329347), получая указанное в заголовке соединение в виде бесцветного масла (2,53 г, выход: 82%) достаточной степени чистоты для следующей стадии.
IM5: 5-Бром-2-(1,1,2,2,2-d5)этоксипиридин
Синтезируют аналогично синтезу IM3, используя коммерчески доступный 1,1,2,2,2-d5-этанол (Sigma-Aldrich, номер по каталогу 489336), получая указанное в заголовке соединение в виде бесцветного масла (1,16 г, выход: 87%) достаточной степени чистоты для следующей стадии.
IM6: 5-Бром-2-(1,1-d2)этоксипиридин
Синтезируют аналогично синтезу IM3, используя коммерчески доступный 1,1-d2-этанол (Sigma-Aldrich, номер по каталогу 347434), получая указанное в заголовке соединение в виде бесцветного масла (2,61 г, выход: 85%) достаточной степени чистоты для следующей стадии.
IM7: 5-Бром-2-(2-метоксиэтокси)пиридин
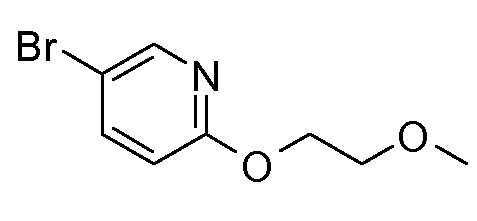
2-Метоксиэтанол (5,12 мл, 65,0 ммоль) растворяют в 1,4-диоксане (125 мл). В атмосфере азота, добавляют трет-бутоксид калия (7,00 г, 62,4 ммоль). Смесь перемешивают в течение 10 минут. Добавляют 5-бром-2-хлорпиридин (10,0 г, 52,0 ммоль) и полученную смесь кипятят с обратным холодильником в течение 2 часов. Смесь выливают в насыщенный солевой раствор и экстрагируют с помощью EtOAc. Органический слой промывают насыщенным солевым раствором, сушат над MgSO4 и выпаривают досуха. Очищают с помощью флэш-хроматографии (силикагель, гептаны/EtOAc=4:1), получая указанное в заголовке соединение в виде бесцветного масла (8,74 г, выход: 73%) достаточной степени чистоты для следующей стадии.
IM8: 5-Бром-2-метоксиметилпиридин
К раствору 5-бромпиридин-2-карбальдегида (5,00 г, 26,9 ммоль), растворенному в смеси этанола (75 мл) и ТГФ (25 мл), небольшими порциями добавляют боргидрид натрия (0,407 г, 10,8 ммоль). Спустя 45 минут, добавляют 0,5 мл воды и смесь выпаривают досуха. Маслянистый остаток подвергают флэш-хроматографии (силикагель, EtOAc/EtOH/Et3N=90:5:5), получая (5-бромпиридин-2-ил)метанол (4,81 г, выход: 86%) в виде масла бледно-желтого цвета.
Раствор этого (5-бромпиридин-2-ил)метанола (4,80 г, 23,0 ммоль) в ДМФА (25 мл), по каплям, в течение 5 минут добавляют к суспензии гидрида натрия (1,10 г, 27,6 ммоль) в ДМФА (50 мл), при температуре 0°С, в атмосфере азота. Смесь перемешивают в течение 15 минут, перед добавлением, по каплям, раствора метил-иодида (1,57 мл, 25,3 ммоль) в ДМФА (25 мл). Смесь оставляют достигать комнатной температуры и затем перемешивают в течение ночи. Смесь выливают в насыщенный солевой раствор и экстрагируют с помощью EtOAc. Объединенные органические слои тщательно промывают насыщенным солевым раствором, сушат над MgSO4 и выпаривают досуха, получая указанное в заголовке соединение в виде масла желтого цвета (4,77 г, выход: 98%) достаточной степени чистоты для следующей стадии.
IM9: 5-Бром-2-циклобутоксипиридин
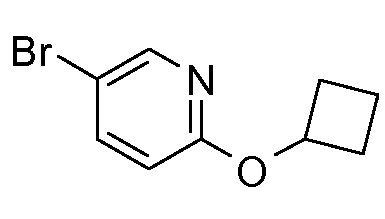
Синтезируют аналогично синтезу IM3, используя коммерчески доступный циклобутанол, получая указанное в заголовке соединение в виде прозрачного масла (2,72 г, выход: 80%) достаточной степени чистоты для следующей стадии.
IM10: 5-Бром-2-[(R)-(тетрагидрофуран-3-ил)окси]пиридин
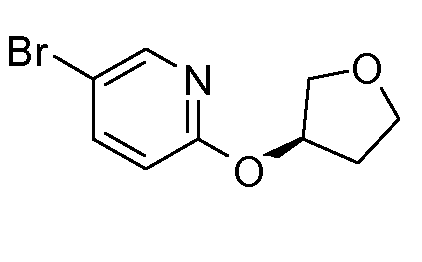
К раствору 5-бром-2-хлорпиридина (10 г, 52,1 ммоль) в 100 мл ДМФА добавляют коммерчески доступный (R)-(-)-3-гидрокситетрагидрофуран (6,87 г, 78,1 ммоль) и Cs2CO3 (33,85 г, 0,104 моль), полученную смесь нагревают при температуре 90°С в течение 36 часов. Растворитель концентрируют, и остаток экстрагируют с помощью EtOAc (500 мл), промывают водой (200 мл). Органический слой сушат над Na2SO4, концентрируют и очищают с помощью хроматографии на силикагеле (элюируя смесью петролейный эфир:EtOAc=100:1), получая 5-бром-2-[(R)-(тетрагидрофуран-3-ил)окси]пиридин (5,9 г, выход: 47%) в виде твердого вещества.
1H ЯМР (CDCl3 400 МГц): δ 8,15 (д, J=2,4 Гц, 1H), 7,61-7,64 (м, 1H), 6,64 (д, J=8,8 Гц, 1H), 5,47-5,50 (м, 1H), 3,85-4,02 (м, 4H), 2,07-2,28 (м, 2H), [α]D 20=+18,5 (C=0,189, CHCl3).
IM11: 5-Бром-2-[(S)-(тетрагидрофуран-3-ил)окси]пиридин
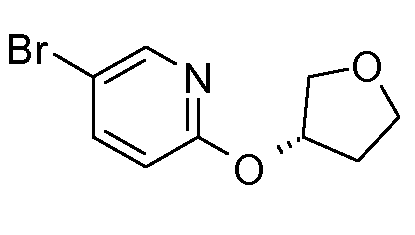
Синтезируют аналогично синтезу IM10, используя коммерчески доступный (S)-(+)-3-гидрокситетрагидрофуран, получая 5-бром-2-[(S)-(тетрагидрофуран-3-ил)окси]пиридин (9,62 г, выход: 51%) в виде твердого вещества.
1H ЯМР (CDCl3 400 МГц): δ 8,16 (d, J=2,4 Гц, 1H), 7,62-7,65 (м, 1H), 6,64-6,66 (м, 1H), 5,48-5,52 (м, 1H), 3,99-4,03 (м, 2H), 3,86-3,97 (м, 2H), 2,20-2,29 (м, 1H), 2,08-2,15(м, 1H). [α]D 20=-20,7 (С=0,21, CHCl3).
IM12: 5-Бром-2-(тетрагидропиран-4-илокси)пиридин
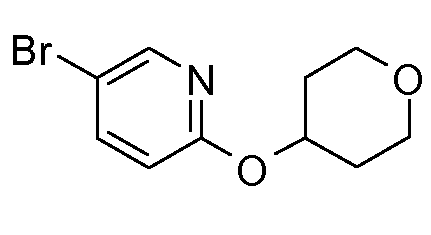
Синтезируют аналогично синтезу IM3, используя коммерчески доступный тетрагидро-4-пиранол, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
IM13: 6-Бром-[1,3]диоксоло[4,5-b]пиридин
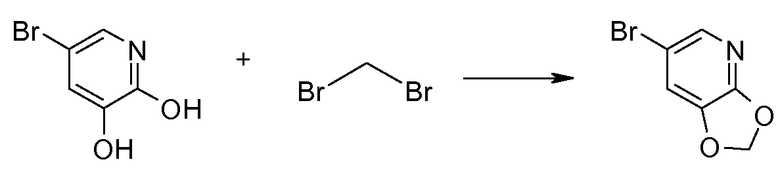
К суспензии 5-бромпиридин-2,3-диола (10,0 г, 52,63 ммоль, коммерчески доступный, номер по каталогу CAS 34206-49-0) в NMP (100 мл) добавляют К2СО3 (21,97 г, 158 ммоль) и дибромметан (10,97 г, 63,16 ммоль). Реакционную смесь нагревают при температуре 90°С в течение 16 часов. Добавляют EtOAc и соли отфильтровывают. Добавляют воду, фазы разделяют, и водный слой экстрагируют большим количеством этилацетата. Объединенные органические слои сушат над безводным Na2SO4 и концентрируют в вакууме, получая сырое соединение. Сырое соединение очищают с помощью хроматографии на силикагеле (элюент: 5% этилацетата в петролейном эфире). Получают 2,2 г (выход: 21%) 6-бром-[1,3]диоксоло[4,5-b]пиридина, в чистом состоянии согласно 1Н-ЯМР (400 МГц, ДМСО): δ 7,71 (д, 1Н, J=2 Гц), 7,55 (д, 1Н, J=2 Гц), 6,20 (с, 2Н). Температура плавления: 69-71°С.
IM14: 7-Бром-2,3-дигидро-[1,4]диоксино[2,3-b]пиридин
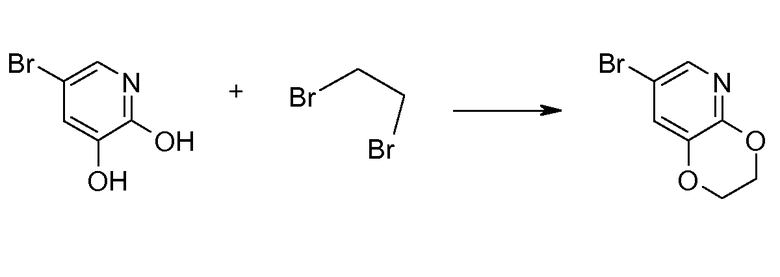
К суспензии 5-бромпиридин-2,3-диола (10,0 г, 52,63 ммоль, коммерчески доступный, номер по каталогу CAS 34206-49-0) в ДМФА (150 мл) добавляют К2СО3 (21,78 г, 158 ммоль) и 1,2-дибромэтан (11,87 г, 63,2 ммоль). Реакционную смесь нагревают при температуре 100°С в течение 5 часов. Реакционную смесь охлаждают до комнатной температуры и выливают в смесь воды со льдом, добавляют EtOAc и фазы разделяют, и водный слой экстрагируют большим количеством этилацетата. Объединенные органические слои сушат над безводным Na2SO4 и концентрируют в вакууме, получая сырое соединение. Сырое соединение очищают с помощью хроматографии на силикагеле (элюент: 10% этилацетата в петролейном эфире). Получают 2,2 г (выход: 18%) 6-бром-[1,3]диоксоло[4,5-b]пиридина, в чистом состоянии согласно 1Н-ЯМР (400 МГц, ДМСО): δ 7,85 (д, 1Н, J=2 Гц), 7,59 (д, 1Н, J=2 Гц), 4,41 (м, 2Н), 4,27 (м, 2Н).
Ацетилирование пиридинов
IM15: 1-(6-Хлорпиридин-3-ил)этанон
В круглодонную колбу вводят 5-бром-2-хлорпиридин (5,30 г, 27,6 ммоль), в ТГФ, в атмосфере азота, и охлаждают до температуры 0°С. По каплям, добавляют 1 М раствор комплекса изопропилмагнийхлорида и хлорида лития в ТГФ (40 мл), в течение 15 минут. Спустя 70 минут, по каплям, добавляют N-метокси-N-метилацетамид (4,1 мл, 38 ммоль). После перемешивания в течение 5 минут при температуре 0°С, охлаждающую баню убирают. Смесь оставляют перемешиваться в течение ночи и затем гасят путем добавления 100 мл насыщенного водного раствора NH4Cl. Смесь экстрагируют 3 раза по 100 мл EtOAc. Объединенные органические слои промывают водой, потом насыщенным солевым раствором и сушат над MgSO4. Летучие вещества выпаривают при температуре 80°С и давлении 10 мбар в течение 1 часа, получая указанное в заголовке соединение (3,596 г, выход 84%) достаточной степени чистоты для следующей стадии.
IM16: 1-(6-Изопропоксипиридин-3-ил)этанон
В круглодонную колбу вводят 5-бром-2-изопропоксипиридин (IM1) (5,00 г, 23,1 ммоль) в ТГФ (100), в атмосфере азота, и охлаждают на бане ацетон-сухой лед до температуры -66°С (внутренняя температура). По каплям, добавляют 2,5 М раствор н-бутиллития в гексане (10,1 мл, 25,3 ммоль), в течение 10 минут, поддерживая внутреннюю температуру ниже -55°С. Смесь перемешивают при температуре -65°С в течение 15 минут. Затем, по каплям, в течение 10 минут, добавляют N-метокси-N-метилацетамид (3,07 мл, 28,9 ммоль), растворенный в ТГФ (10 мл), постоянно поддерживая внутреннюю температуру ниже -65°С. После перемешивания в течение 1 часа, смесь оставляют достигать комнатной температуры. Смесь выливают в насыщенный водный раствор NH4Cl и экстрагируют с помощью EtOAc. Объединенные органические слои промывают насыщенным солевым раствором, сушат над MgSO4 и выпаривают досуха. Флэш-хроматография (диоксид кремния, гептаны/EtOAc=4:1) дает указанное в заголовке соединение в виде бесцветного масла (3,20 г, выход: 77%) достаточной степени чистоты для следующей стадии.
IM17: 1-(6-Метоксиметилпиридин-3-ил)этанон
Синтезируют аналогично синтезу IM16, исходя из IM8, получая указанное в заголовке соединение в виде бесцветной жидкости (0,379 г, выход: 17%) достаточной степени чистоты для следующей стадии.
IM18: 1-[6-(2,2,2-Трифторэтокси)пиридин-3-ил]этанон
Синтезируют аналогично синтезу IM16, исходя из IM2, получая указанное в заголовке соединение в виде бесцветной жидкости (1,234 г, выход: 48%) достаточной степени чистоты для следующей стадии.
IM19: 1-[6-(2-Метоксиэтокси)пиридин-3-ил]этанон
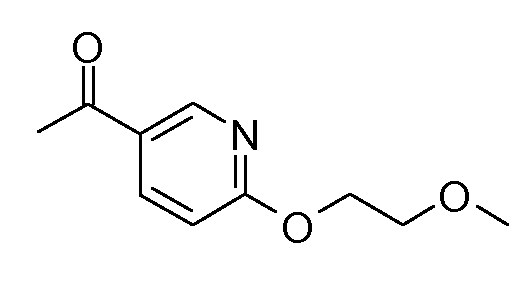
Синтезируют аналогично синтезу IM16, исходя из IM7, получая указанное в заголовке соединение в виде бесцветной жидкости (2,13 г, выход: 57%) достаточной степени чистоты для следующей стадии.
IM20: 1-(2-Этоксипиридин-4-ил)этанон
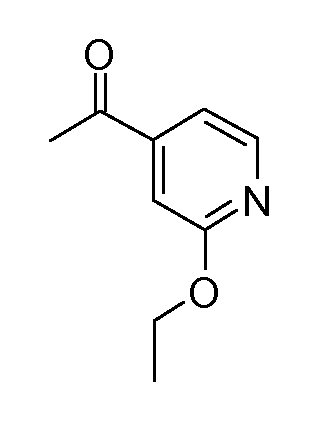
Синтезируют аналогично синтезу IM16, исходя из коммерчески доступного 4-бром-2-этоксипиридина, Synchem OHG, номер по каталогу СТ091, получая указанное в заголовке соединение в виде бесцветной жидкости (1,20 г, выход: 49%) достаточной степени чистоты для следующей стадии.
IM21: 1-[1,3]Диоксоло[4,5-b]пиридин-6-ил-этанон
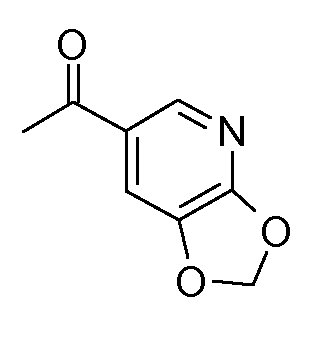
В круглодонную колбу вводят 6-бром-[1,3]диоксоло[4,5-b]пиридин, IM13, (1,74 г, 8,61 ммоль) в ДМФА (25 мл), в атмосфере азота, и добавляют трибутил(1-этоксивинил)олово (3,65 мл, 10,8 ммоль). Добавляют тетракистрифенилфосфинпалладий(0) (0,50 г, 0,43 ммоль) и раствор перемешивают при температуре 65°С в течение ночи. Смесь добавляют к воде и EtOAc, и фазы разделяют. Органическую фазу промывают насыщенным солевым раствором, сушат (MgSO4), отфильтровывают и выпаривают. Остаток растворяют в ТГФ (100 мл) и добавляют смесь воды (15 мл) и концентрированной HCl (2,5 мл), и раствор перемешивают при комнатной температуре в течение 5 минут. Раствор добавляют к насыщенному солевому раствору и насыщенному раствору NaHCO3, до тех пор, пока раствор не станет слегка щелочным. Органическую фазу экстрагируют с помощью EtOAc и фазы разделяют. Органическую фазу промывают насыщенным солевым раствором, сушат (MgSO4), отфильтровывают и выпаривают. Остаток повторно растворяют в ТГФ (10 мл), EtOAc (20 мл) и гептанах (20 мл). Смесь концентрируют до остатка, равного 25 мл, и охлаждают льдом. Твердое вещество осаждается, и его собирают путем фильтрации. Выход: 0,942 г (66%) IМ21.
1H-ЯМР (500 МГц, ДМСО) δ 8,47 (с, 1H), 8,54 (с, 1H), 6,27 (с, 2H), 2,53 (с, 3H).
IM22: 1-(2,3-Дигидро-[1,4]диоксино[2,3-b]пиридин-7-ил)этанон
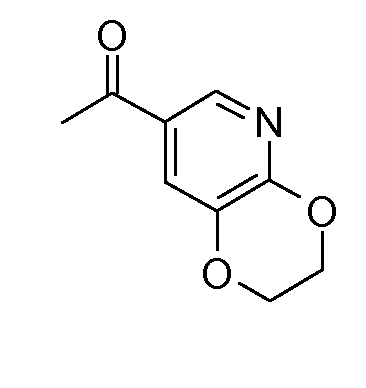
Синтезируют аналогично синтезу IM21, исходя из 7-бром-2,3-дигидро-[1,4]диоксино[2,3-b]пиридина (3,00 г, 13,9 ммоль), получая указанное в заголовке соединение в виде порошкообразного вещества белого цвета (1,84 г, выход: 74%).
1H-ЯМР (500 МГц, ДМСО) δ 8,47 (с, 1H), 8,54 (с, 1H), 6,27 (с, 2H), 2,53 (с, 3H).
IM23: 1-(6-Этилпиридин-3-ил)этанон
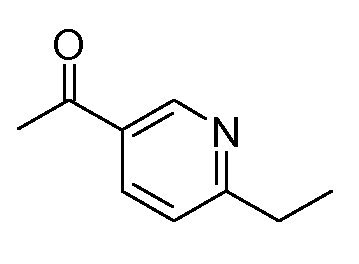
В сухую круглодонную колбу вводят 1-(6-хлор-3-пиридинил)-1-этанон (IM15) (3,596 г, 23,11 ммоль) и [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (1,694 г, 2,315 ммоль), в ТГФ (100 мл), в атмосфере азота. К этой смеси, по каплям, добавляют 1 М раствор диэтилцинка в гексане (35 мл, 35 ммоль), затем N,N-диметиламиноэтанол (0,50 мл, 5,0 ммоль). Смесь кипятят с обратным холодильником в течение 30 минут. Смесь охлаждают до комнатной температуры и затем гасят путем добавления насыщенного водного раствора NH4Cl (100 мл). Смесь отфильтровывают через слой целита. Водный слой экстрагируют с помощью EtOAc (3 раза по 100 мл). Объединенные органические слои промывают водой, насыщенным солевым раствором и затем сушат над MgSO4. С помощью флэш-хроматографии (120 г силикагеля, 0-40% EtOAc в гептанах) получают указанное в заголовке соединение в виде масла желтого цвета (0,699 г, выход: 20%) достаточной степени чистоты для следующей стадии.
Получение хиральных аминов
Хиральные амины получают, если они не являются коммерчески доступными, в соответствии с подробно описанной методикой для или 1,2-стереоселективного восстановления сульфинилиминов или 1,2-стереоселективного добавления металлоорганических реагентов к сульфинилиминам. Эти методики описаны Chellucci G., Baldino S., Chessa S., Pinna G., Soccolini S., Tetrahedron Asymmetry, 2006, 17, 3163-3169; Evans J., Ellman J., J. Org. Chem. 2003, 68, 9948-9957; и Robak M., Herbage M., Ellman J., Chem. Rev., 2010, 110, 3600-3740, и в случае цитированных в данном описании ссылок.
IM24: (S)-1-(6-Изопропоксипиридин-3-ил)этиламин
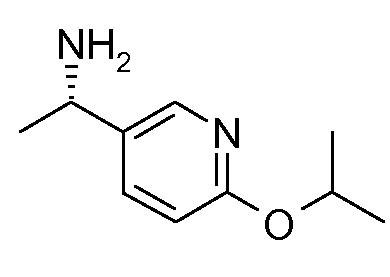
Стадия 1: Образование сульфинилимина:
1-(6-Изопропоксипиридин-3-ил)этанон, IM16, (3,20 г, 17,8 ммоль) растворяют в ТГФ (55 мл), в атмосфере азота. Добавляют R(+)-2-метил-2-пропансульфинамид (2,21 г, 18,2 ммоль) и этоксид титана (IV) (7,40 мл, 35,7 ммоль). Смесь кипятят с обратным холодильником в течение 24 часов. Смесь оставляют достигать комнатной температуры. Смесь разбавляют с помощью EtOAc (200 мл) и выливают в смесь лед/насыщенный солевой раствор. Полученную суспензию отфильтровывают через целит. Органический слой промывают насыщенным солевым раствором, сушат над MgSO4 и выпаривают досуха. С помощью флэш-хроматографии (силикагель, гептаны/EtOAc=2:1) получают [1-(6-изопропоксипиридин-3-ил)этилиден]амид (R)-2-метилпропан-2-сульфиновой кислоты (4,04 г, выход: 80%) в виде масла желтого цвета достаточной степени чистоты для следующей стадии.
Стадия 2: Восстановление имина:
В круглодонную колбу вводят [1-(6-изопропоксипиридин-3-ил)этилиден]амид (R)-2-метилпропан-2-сульфиновой кислоты (4,00 г, 14,2 ммоль) в ТГФ (50 мл), в атмосфере азота, и охлаждают до температуры -66°С (внутренняя температура). По каплям, в течение 15 минут, добавляют 1,00 М раствор L-селектрида в ТГФ (29,0 мл, 29,0 ммоль). Смесь перемешивают при температуре -70°С в течение 1 часа. Холодную смесь выливают в насыщенный водный раствор NH4Cl. Смесь экстрагируют с помощью EtOAc. Объединенные органические слои промывают насыщенным солевым раствором, сушат над MgSO4 и выпаривают досуха. С помощью флэш-хроматографии (силикагель, EtOAc) получают [(S)-1-(6-изопропоксипиридин-3-ил)этил]амид (R)-2-метилпропан-2-сульфиновой кислоты (2,91 г, выход: 72%) в виде бесцветного порошкообразного вещества. Диастереомерный избыток составляет >95%, на основании данных 1Н-ЯМР.
Стадия 3: Удаление хиральных вспомогательных веществ:
[(S)-1-(6-Изопропоксипиридин-3-ил)этил]амид (R)-2-метилпропан-2-сульфиновой кислоты (2,90 г, 10,2 ммоль) растворяют в метаноле (48 мл). По каплям, в течение 3 минут, добавляют смесь 12,0 М раствора HCl в воде (4,25 мл) и воды (4,25 мл). Смесь перемешивают при комнатной температуре в течение ночи. Смесь выпаривают досуха. Маслянистый остаток подвергают флэш-хроматографии (диоксид кремния, EtOAc/EtOH/триэтиламин=90:5:5), при использовании короткой колонки, получая (S)-1-(6-изопропоксипиридин-3-ил)этиламин, IM24, (1,71 г, выход: 93%) в виде масла бледно-желтого цвета достаточной степени чистоты для следующей стадии. Общий выход, в расчете на исходный 1-(6-изопропоксипиридин-3-ил)этанон, IM16, составляет 54%.
IM25: (S)-1-(6-Этилпиридин-3-ил)этиламин
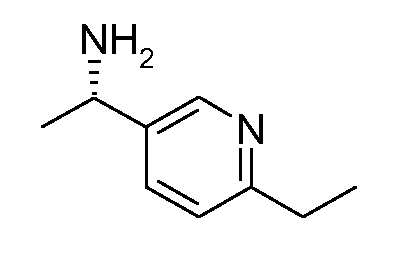
Синтезируют аналогично синтезу IM24, исходя из IM23, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
IM26: (S)-1-(6-Метоксиметилпиридин-3-ил)этиламин
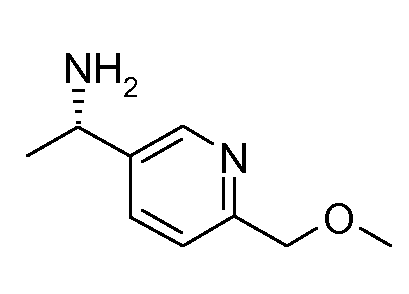
Синтезируют аналогично синтезу IM24, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
IM27: (S)-1-[6-(2,2,2-Трифторэтокси)пиридин-3-ил]этиламин
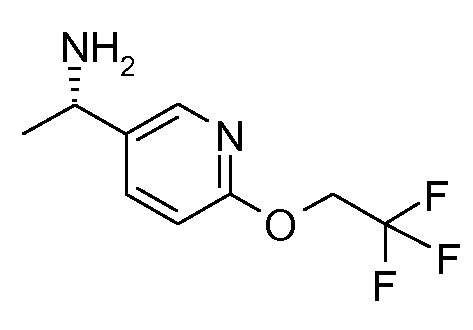
Синтезируют аналогично синтезу IM24, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
IM28: (S)-1-[6-(2-Метоксиэтокси)пиридин-3-ил]этиламин
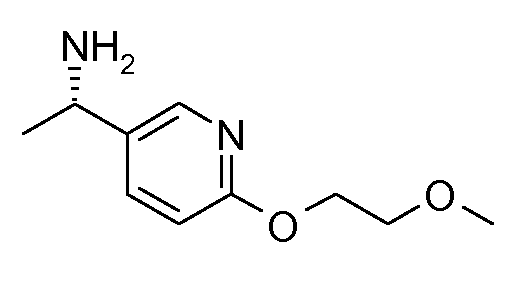
Синтезируют аналогично синтезу IM24, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
IM29: (S)-1-(2-Этоксипиридин-4-ил)этиламин
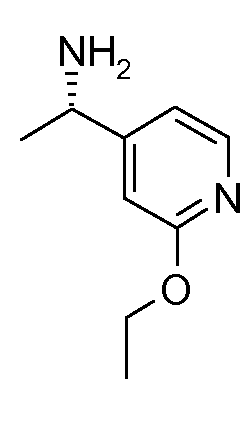
Синтезируют аналогично синтезу IM24, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
IM30: (S)-1-{6-[(S)-(Тетрагидрофуран-3-ил)окси]пиридин-3-ил}этиламин
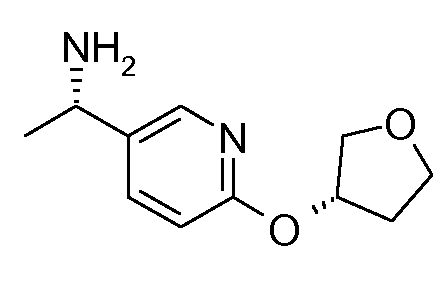
Синтезируют аналогично синтезу IM24, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
IM31: (S)-1-{6-[(R)-(Тетрагидрофуран-3-ил)окси]пиридин-3-ил}этиламин
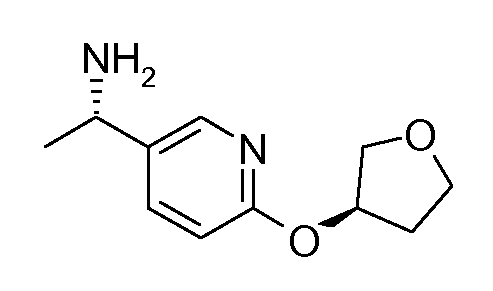
Синтезируют аналогично синтезу IM24, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
IM32: (S)-1-[1,3]Диоксоло[4,5-b]пиридин-6-илэтиламин
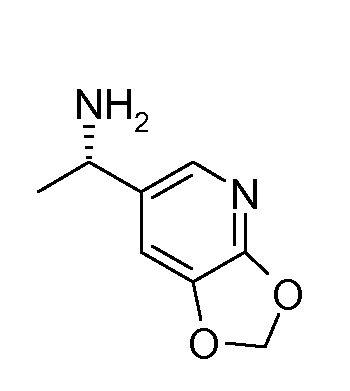
Синтезируют аналогично синтезу IM24, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
IM33: (S)-1-(2,3-Дигидро-[1,4]диоксино[2,3-b]пиридин-7-ил)этиламин
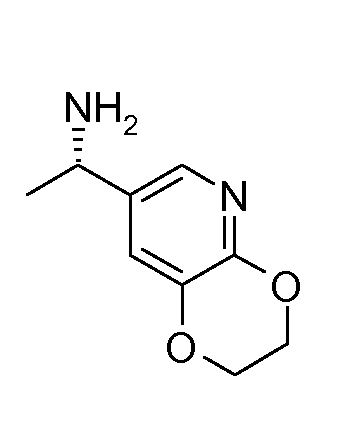
Синтезируют аналогично синтезу IM24, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
IM34: (S)-1-(2-Этоксипиримидин-5-ил)этиламин
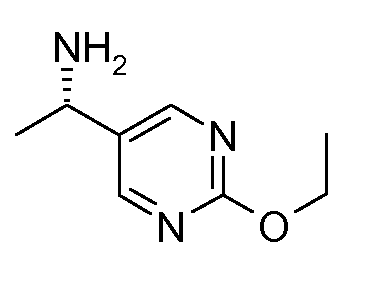
Синтезируют аналогично синтезу IM24, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
IM35: 2-[5-((S)-1-Аминоэтил)пиридин-2-илокси]этанол
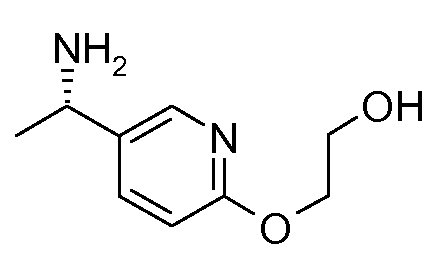
Синтезируют аналогично синтезу IM24, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
IM36: (R)-2-Амино-2-(6-пропоксипиридин-3-ил)этанол
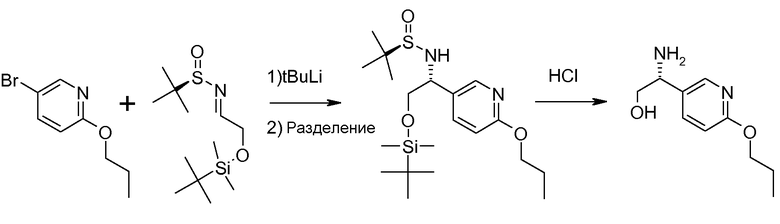
Стадия 1:
1,7 М Раствор трет-бутиллития в пентане (15,2 мл, 25,8 ммоль), по каплям, добавляют к перемешиваемому раствору 5-бром-2-пропоксипиридина, IM3, (2,54 г, 11,8 ммоль), растворенного в безводном ТГФ (29,4 мл), при температуре -78°С, в атмосфере аргона. Раствор затем перемешивают при этой же температуре в течение 30 минут. Затем, по каплям, добавляют раствор [2-(трет-бутилдиметилсиланилокси)этилиден]амида (R)-2-метилпропан-2-сульфиновой кислоты, IM49, (3,26 г, 11,8 ммоль) в безводном ТГФ (15 мл), при температуре -78°С, и раствор перемешивают при этой же температуре в течение 30 минут. Охлаждающую баню убирают, и смесь оставляют достигать комнатной температуры в течение ночи. Смесь гасят насыщенным водным раствором NH4Cl (75 мл) и EtOAc (150 мл). Фазы разделяют и органический слой промывают насыщенным солевым раствором и затем сушат над MgSO4. С помощью флэш-хроматографии (диоксид кремния, 10-100% EtOAc в гептанах), получают [(R)-2-(трет-бутилдиметилсиланилокси)-1-(6-пропоксипиридин-3-ил)этил]амид (R)-2-метилпропан-2-сульфиновой кислоты, очень быстро элюирующийся изомер, в виде прозрачного масла (2,33 г, выход: 48%) достаточной степени чистоты для следующей стадии. Диастереомерный избыток составляет >95%, на основании данных 1Н-ЯМР.
Стадия 2:
2,00 М Раствор хлороводорода в диэтиловом эфире (28 мл, 56 ммоль) добавляют к перемешиваемому раствору [(R)-2-(трет-бутилдиметилсиланилокси)-1-(6-пропоксипиридин-3-ил)этил]амида (2,33 г, 5,62 ммоль), растворенного в МеОН (11 мл), при температуре 0°С, в атмосфере аргона. После завершения добавления, охлаждающую баню убирают и раствор перемешивают при комнатной температуре в течение ночи. Смесь затем выпаривают досуха и остаток суспендируют в метиленхлориде и переносят в короткую колонку с силикагелем. После элюирования смесью EtOAc:EtOH:Et3N (90:5:5), получают (R)-2-амино-2-(6-пропоксипиридин-3-ил)этанол, IM36, в виде масла (0,813 г, выход: 74%). Общий выход, в расчете на 5-бром-2-пропоксипиридин, IM3, составляет 36%.
1H ЯМР (600 МГц, CDCl3) δ 8,61 (с, 1H), 8,60 (дд, 1H), 7,71 (д, 1H), 4,22 (т, 2H), 4,06 (м, 1H), 3,72 (м, 1H), 3,60 (м, 1H), 1,78 (м, 2H), 1,24 (м, 1H), 1,02 (м, 4H).
IM37: (R)-2-Амино-2-(6-изопропоксипиридин-3-ил)этанол
Синтезируют аналогично синтезу IM36, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии (1,07 г, общий выход, в расчете на IM1, составляет 36%).
IM38: (R)-2-Амино-2-(6-этоксипиридин-3-ил)этанол
Синтезируют аналогично синтезу IM36, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии (0,360 г, общий выход, в расчете на коммерчески доступный 5-бром-2-этоксипиридин, Apollo, номер по каталогу OR13065, составляет 35%).
IM39: (R)-2-Амино-2-(6-(1,1,2,2,2-d5)этоксипиридин-3-ил)этанол
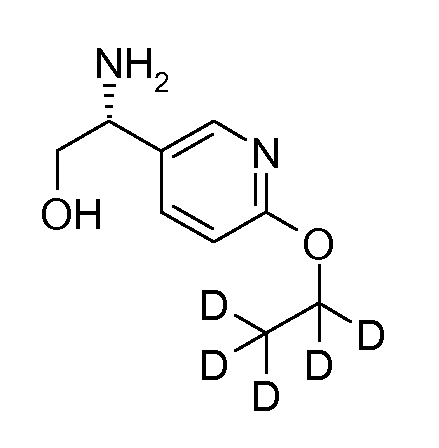
Синтезируют аналогично синтезу IM36, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии (0,500 г, общий выход, в расчете на IM5, составляет 22%).
IM40: (R)-2-Амино-2-(6-(2,2,2-d3)этоксипиридин-3-ил)этанол
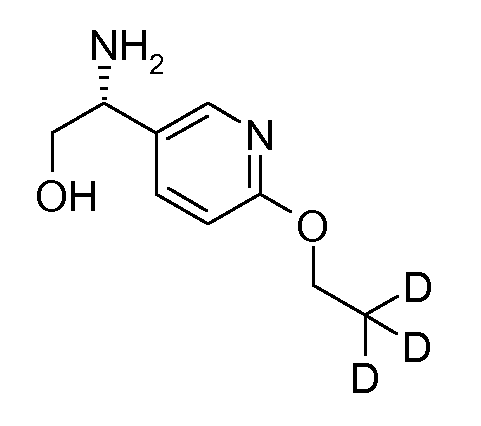
Синтезируют аналогично синтезу IM36, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии (0,647 г, общий выход, в расчете на IM4, составляет 30%).
IM41: (R)-2-Амино-2-(6-(1,1-d2)этоксипиридин-3-ил)этанол
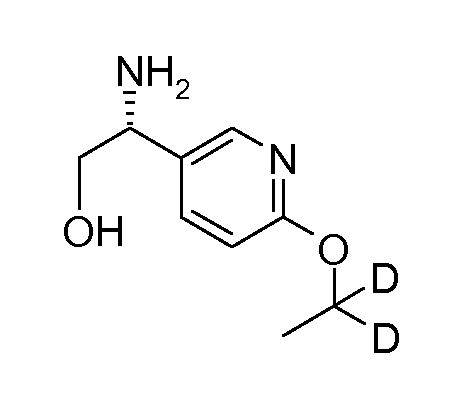
Синтезируют аналогично синтезу IM36, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии (0,380 г, общий выход, в расчете на IM6, составляет 18%).
IM42: (R)-2-Амино-2-{6-[(S)-(тетрагидрофуран-3-ил)окси]пиридин-3-ил}этанол
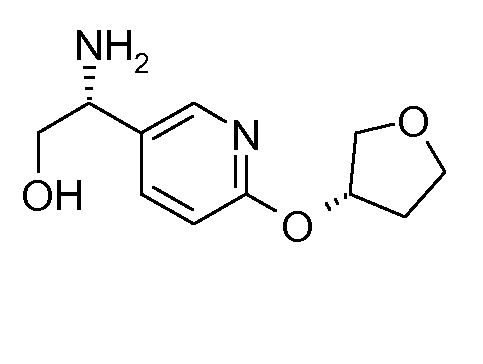
Синтезируют аналогично синтезу IM36, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
IM43: (R)-2-Амино-2-{6-[(R)-(тетрагидрофуран-3-ил)окси]пиридин-3-ил}этанол
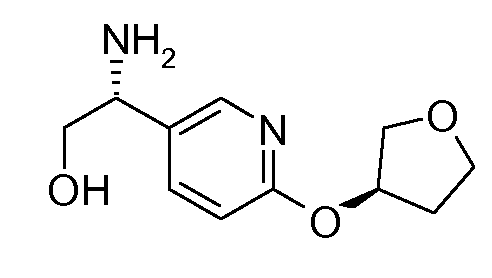
Синтезируют аналогично синтезу IM36, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
IM44: (R)-2-Амино-2-(6-циклобутоксипиридин-3-ил)этанол
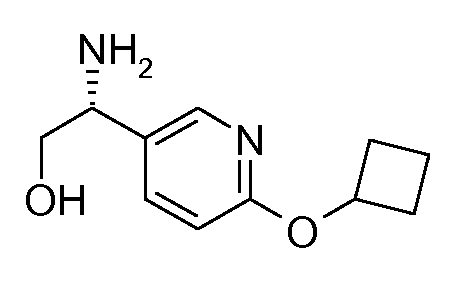
Синтезируют аналогично синтезу IM36, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
IM45: (R)-2-Амино-2-[6-(тетрагидропиран-4-илокси)пиридин-3-ил]этанол
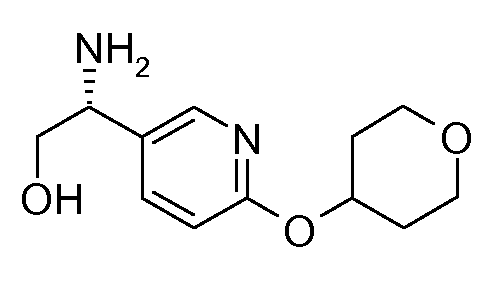
Синтезируют аналогично синтезу IM36, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии.
Получение карбоновых кислот
IM46: (1S,2S)-2-Фенилциклопропанкарбоновая кислота
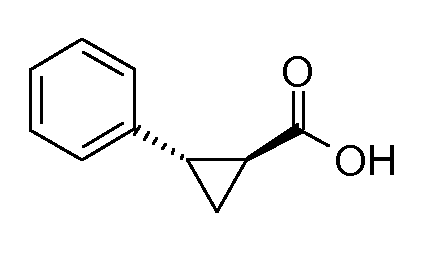
Коммерчески доступную, рацемическую транс-2-фенилциклопропанкарбоновую кислоту (Sigma-Aldrich, номер по каталогу Р22354) подвергают хиральному SFC-разделению, способ С, получая IM46 в виде масла, которое медленно отверждается при стоянии. Энантиомерная чистота составляет 95% ее (способ F). Удельное оптическое вращение [α]D 20=+300,9° (C=1% EtOH). (по литературным данным: [α]D 20=+389° (C=0,61, CHCl3), Kozikowski и др., J. Med. Chem., 2009, 52, 1885-1902), (по литературным данным: [α]D 20=+311,7° (C=1,776, EtOH), Walborsky и др., Tetrahedron, 1964, 20, 1695-1699).
IM47: (1S,2S)-2-(3-Фторфенил)циклопропанкарбоновая кислота
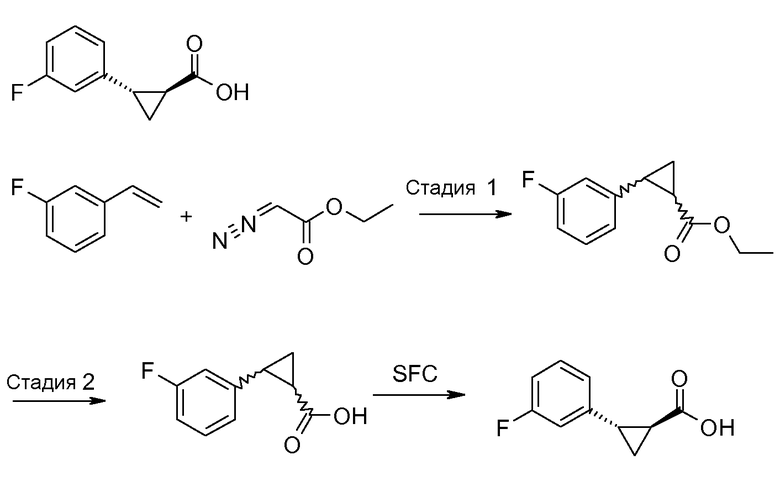
Стадия 1:
В круглодонную колбу вводят 3-фторстирол (13,0 г, 0,107 моль) в безводном метиленхлориде (130 мл). К этой смеси добавляют димер ацетата родия (1,30 г, каталитическое количество). К реакционной смеси через шприц-насос в течение 5 часов добавляют раствор этилдиазоацетата (33,28 г, 0,291 моль) в безводном метиленхлориде (130 мл) и перемешивают при комнатной температуре в течение 1 часа, в темноте. Реакционную смесь отфильтровывают через слой целита, который промывают водой, затем насыщенным солевым раствором. Органический слой сушат над Na2SO4 и выпаривают досуха. Посредством флэш-хроматографии (диоксид кремния, EtOAc/петролейный эфир=1:9) получают этиловый эфир рацемической транс-2-(3-фторфенил)циклопропанкарбоновой кислоты (13,0 г, выход: 59%) в виде бесцветной жидкости достаточной степени чистоты для следующей стадии.
Стадия 2:
К раствору этилового эфира рацемической транс-2-(3-фторфенил)циклопропанкарбоновой кислоты (13,0 г, 0,062 моль) в МеОН (310 мл) добавляют раствор КОН (35,0 г, 0,625 моль) в МеОН (150 мл), при температуре 0°С. После завершения добавления, реакционную смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь выливают в воду и экстрагируют метиленхлоридом (2 раза по 50 мл). Водный слой подкисляют с помощью 10%-ной HCl. Полученную смесь экстрагируют метиленхлоридом (2 раза по 150 мл). Объединенные органические слои сушат над Na2SO4 и выпаривают досуха, получая рацемическую транс-2-(3-фторфенил)циклопропанкарбоновую кислоту в виде бесцветного кристаллического вещества (9,5 г, выход: 85%). Разделение изомеров проводят с помощью хиральной SFC (способ D), получая указанное в заголовке соединение, (1S,2S)-2-(3-фторфенил)циклопропанкарбоновую кислоту, IM47, в виде бесцветного кристаллического вещества (3,27 г, общий выход, в расчете на 3-фторстирол, составляет 17%) достаточной степени чистоты для следующей стадии. Удельное оптическое вращение [α]D 20=+263,4° (C=1% МеОH).
IM48: (1S,2S)-2-(4-Фторфенил)циклопропанкарбоновая кислота
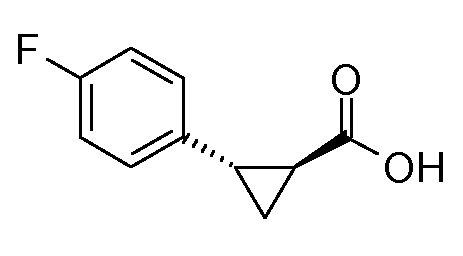
Синтезируют аналогично синтезу IM48, используя SFC, способ Е, получая указанное в заголовке соединение достаточной степени чистоты для следующей стадии (3,1 г, общий выход, в расчете на 4-фторстирол, составляет 13%). Удельное оптическое вращение [α]D 20=+263,2° (C=1% МеОH).
Другие промежуточные продукты
IM49: [2-(трет-Бутилдиметилсиланилокси)этилиден]амид (R)-2-метилпропан-2-сульфиновой кислоты
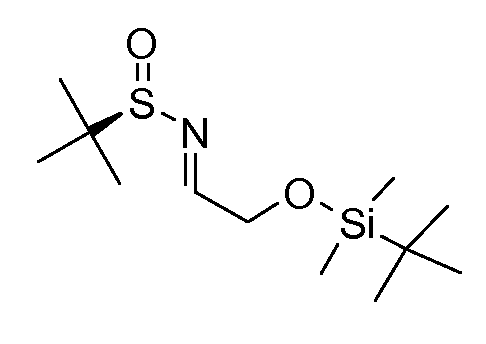
(R)-(+)-2-Метил-2-пропансульфинамид (8,70 г, 71,8 ммоль), пиридиний-п-толуолсульфонат (0,902 г, 3,59 ммоль) и MgSO4 (43,2 г, 359 ммоль) суспендируют в метиленхлориде (25 мл). По каплям добавляют раствор (трет-бутилдиметилсилилокси)ацетальдегида (25,0 г, 144 ммоль), растворенного в метиленхлориде (10 мл), при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Смесь выпаривают досуха. С помощью флэш-хроматографии (диоксид кремния, EtOAc/гептаны=1:4), получают указанное в заголовке соединение в виде масла, которое медленно отверждается при стоянии, (18,3 г, выход: 92%) достаточной степени чистоты для следующей стадии.
Пример 1
Получение типичных соединений согласно данному изобретению
Соединение 1: [(S)-1-(6-Изопропоксипиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
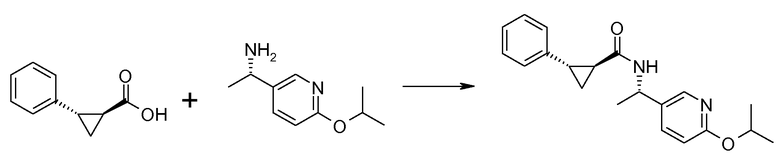
Транс-2-фенил-1-циклопропанкарбоновую кислоту, IM46, (0,590 г, 3,64 ммоль) растворяют в ДМФА (15,0 мл). Добавляют N,N,N′,N′-тетраметил-О-(7-азабензотриазол-1-ил)уронийгексафторфосфат (1,38 г, 3,63 ммоль). Затем добавляют триэтиламин (1,10 мл, 7,89 ммоль) и смесь перемешивают в течение 15 минут при комнатной температуре. Смесь, по каплям, добавляют к раствору (S)-1-(6-изопропоксипиридин-3-ил)этиламина, IM24, (0,655 г, 3,63 ммоль), растворенного в ДМФА (15,0 мл), в течение 2 минут. Смесь перемешивают при комнатной температуре в течение ночи. Смесь выпаривают досуха. Остаток переносят в колонку с силикагелем и элюируют смесью EtOAc/гептаны=1:1, получая Соединение 1 в виде твердого вещества. Это твердое вещество растворяют в EtOAc (50 мл) и к этому раствору медленно добавляют гептаны (50 мл). Смесь концентрируют в вакууме приблизительно до объема 25 мл, и этот раствор охлаждают на бане со смесью лед/вода. Образуется осадок белого цвета. Твердые вещества собирают путем фильтрации и высушивают в вакууме, получая указанное в заголовке соединение в виде бесцветного кристаллического вещества (0,794 г, выход: 67%).
LC-MS (m/z): 325,4 (МН+), tR=1,51 мин (способ А).
1H ЯМР (500 МГц, ДМСО) δ 8,57-8,50 (м, 1H), 8,06 (уш.с, 1H), 7,65-7,57 (м, 1H), 7,30-7,24 (м, 2H), 7,20-7,14 (м, 1H), 7,10 (д, J=7,5 Гц, 2H), 6,69 (д, J=8,5 Гц, 1H), 5,25-5,16 (м, 1H), 4,98-4,88 (м, 1H), 2,24-2,15 (м, 1H), 1,94-1,88 (м, 1H), 1,41-1,32 (м, 4H), 1,26 (д, J=6,2 Гц, 6H), 1,20 (ддд, J=8,5, 6,1, 4,1 Гц, 1H).
Диастереомерный избыток составляет >95%, на основании данных 1Н-ЯМР.
Соединение 2: [(S)-1-(5-Метилпиридин-2-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
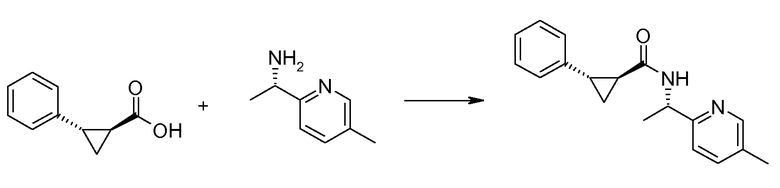
N-(3-Диметиламинопропил)-N′-этилкарбодиимидгидрохлорид (0,709 г, 3,70 ммоль) и 1-гидроксибензотриазол (0,667 г, 4,93 ммоль) добавляют к перемешиваемой смеси из IM46 (0,60 г, 3,70 ммоль) и коммерчески доступного (S)-1-(5-метилпиридин-2-ил)этиламингидрохлорида (Supplier Netchem Inc., номер по каталогу 528193) (0,426 г, 2,47 ммоль) и N,N-диизопропилэтиламина (0,859 мл, 4,93 ммоль) в ТГФ (25 мл). Раствор перемешивают при комнатной температуре в течение ночи. Добавляют воду и смесь экстрагируют с помощью EtOAc (3 раза по 80 мл). Объединенные органические фазы промывают насыщенным солевым раствором, сушат над MgSO4, отфильтровывают и растворитель выпаривают в вакууме. Сырой продукт очищают с помощью хроматографии на силикагеле (EtOAc в гептанах=1:1). Выход Соединения 2: 110 мг (16%).
LC-MS (m/z): 281,1 (МН+), tR=0,91 мин (способ А).
Соединение 3: [(S)-1-(6-Метоксипиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
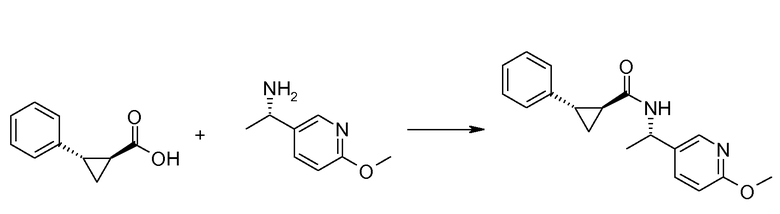
Синтезируют аналогично синтезу Соединения 1, используя IM46 и коммерчески доступный (S)-1-(6-метоксипиридин-3-ил)этиламин (Supplier Netchem Inc., номер по каталогу 517706). Выход=0,88 г (66%).
1H ЯМР (500 МГц, ДМСО) δ 8,55 (д, 1H), 8,10 (с, 1H), 7,63 (д, 1H), 7,27 (м, 2H), 7,17 (м, 1H), 7,10 (д, 2H), 6,78 (д, 1H), 4,93 (м, 1H), 3,72 (с, 3H), 2,21 (м, 1H), 1,90 (м, 1H), 1,37 (м, 4H), 1,20 (м, 1H).
LC-MS (m/z): 297,4 (МН+), tR=1,36 мин (способ А).
Соединение 4: [(S)-1-(6-Метилпиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
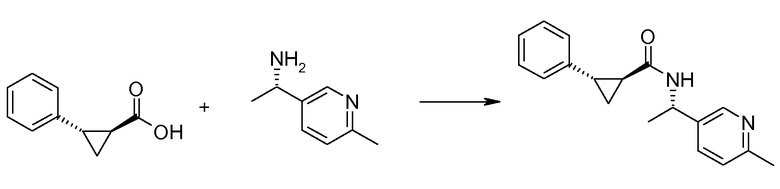
Синтезируют аналогично синтезу Соединения 1, используя IM46 и коммерчески доступный (S)-1-(6-метилпиридин-3-ил)этиламин (Supplier Netchem Inc., номер по каталогу 519526). Выход=0,27 г (21%).
1H ЯМР (600 МГц, ДМСО) δ 8,61 (д, 1H), 8,37 (с, 1H), 7,57 (д, 1H), 7,26 (м, 2H), 7,16 (м, 2H), 7,09 (д, 2H), 4,92 (м, 1H), 2,41 (с, 3H), 2,19 (м, 1H), 1,91 (м, 1H), 1,36 (м, 4H), 1,20 (м, 1H).
LC-MS (m/z): 281,2 (МН+), tR=0,86 мин (способ А).
Соединение 5: [(S)-1-(6-Цианопиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
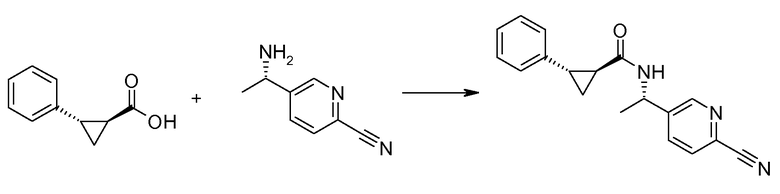
Синтезируют аналогично синтезу Соединения 2, используя IM46 и коммерчески доступный 5-((S)-1-аминоэтил)пиридин-2-карбонитрилгидрохлорид (Supplier Netchem Inc., номер по каталогу 549493). Выход=0,104 г (20%).
1H ЯМР (600 МГц, ДМСО) δ 8,76 (д, 1H), 8,71 (с, 1H), 8,02 (д, 1H), 7,94 (д, 1H), 7,29 (м, 2H), 7,19 (м, 1H), 7,12 (д, 2H), 5,03 (м, 1H), 2,21 (м, 1H), 1,92 (м, 1H), 1,40 (д, 3H), 1,37 (м, 1H), 1,23 (м, 1H).
LC-MS (m/z): 292,0 (МН+), tR=1,31 мин (способ А).
Соединение 6: [(S)-1-(6-Трифторметилпиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
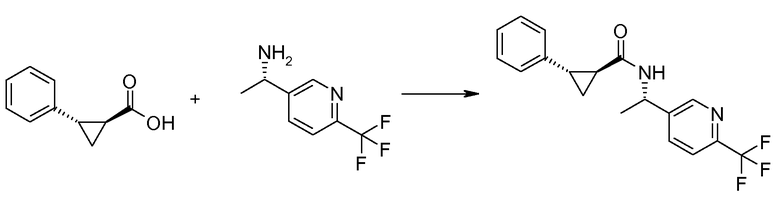
Синтезируют аналогично синтезу Соединения 2, используя IM46 и коммерчески доступный (S)-1-(6-трифторметилпиридин-3-ил)этиламингидрохлорид (Supplier Netchem Inc., номер по каталогу 517662). Выход=0,33 г (55%).
1H ЯМР (500 МГц, ДМСО) δ 8,77 (д, 1H), 8,72 (с, 1H), 7,99 (д, 1H), 7,88 (д, 1H), 7,27 (м, 2H), 7,17 (м, 1H), 7,13 (д, 2H), 5,05 (м, 1H), 2,20 (м, 1H), 1,93 (м, 1H), 1,41 (д, 3H), 1,37 (м, 1H), 1,23 (м, 1H).
LC-MS (m/z): 335,2 (МН+), tR=1,59 мин (способ А).
Соединение 7: [(S)-1-(6-Этоксипиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
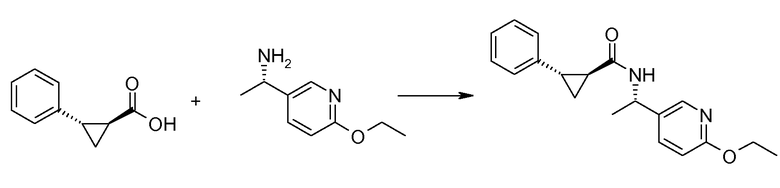
Синтезируют аналогично синтезу Соединения 2, используя IM46 и коммерчески доступный (S)-1-(6-этоксипиридин-3-ил)этиламингидрохлорид (Supplier Sial Gmbh, номер по каталогу 528261-HCl, серия LNA098). Выход=0,30 г (39%).
1H ЯМР (500 МГц, ДМСО) δ 8,54 (д, 1H), 8,08 (с, 1H), 7,62 (д, 1H), 7,27 (м, 2H), 7,16 (м, 1H), 7,12 (д, 2H), 6,73 (д, 1H), 4,92 (м, 1H), 4,25 (кв., 2H), 2,20 (м, 1H), 1,91 (м, 1H), 1,35 (м, 4H), 1,30 (т, 3H), 1,19 (м, 1H).
LC-MS (m/z): 311,4 (МН+), tR=1,45 мин (способ А).
Соединение 8: [(S)-1-(6-Этилпиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
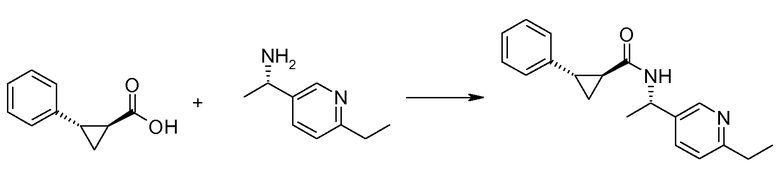
Синтезируют аналогично синтезу Соединения 1, используя IM46 и IM25. Выход=0,44 г (65%).
1H ЯМР (500 МГц, ДМСО) δ 8,51 (д, 1H), 8,41 (с, 1H), 7,27-7,14 (м, 4H), 7,10 (д, 2H), 4,96 (м, 1H), 2,72 (кв., 2H), 2,20 (м, 1H), 1,92 (м, 1H), 1,38 (м, 4H), 1,21 (м, 4H).
LC-MS (m/z): 295,1 (МН+), tR=0,90 мин (способ А).
Соединение 9: [(S)-1-(6-Метоксиметилпиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
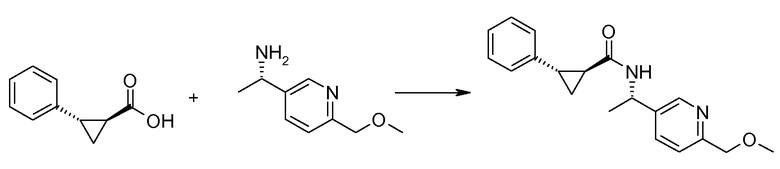
Синтезируют аналогично синтезу Соединения 1, используя IM46 и IM26. Выход=0,18 г (40%).
1H ЯМР (500 МГц, ДМСО) δ 8,63 (д, 1H), 8,10 (с, 1H), 7,71 (д, 1H), 7,37 (д, 1H), 7,27 (м, 2H), 7,17 (м, 1H), 7,10 (д, 2H), 4,97 (м, 1H), 3,37 (с, 3H), 2,21 (м, 1H), 1,93 (м, 1H), 1,39 (м, 4H), 1,20 (м, 1H).
LC-MS (m/z): 311,3 (МН+), tR=0,98 мин (способ А).
Соединение 10: {(S)-1-[6-(2,2,2-Трифторэтокси)пиридин-3-ил]этил}амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
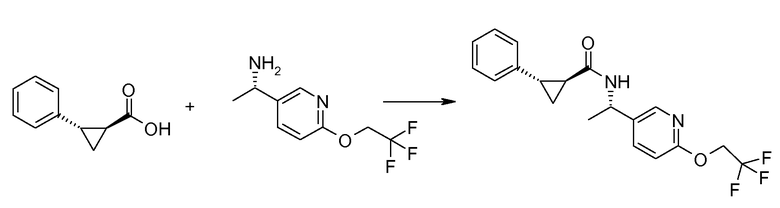
Синтезируют аналогично синтезу Соединения 1, используя IM46 и IM27. Выход=0,695 г (50%).
1H ЯМР (500 МГц, ДМСО) δ 8,62 (д, 1H), 8,12 (с, 1H), 7,73 (д, 1H), 7,27 (м, 2H), 7,15 (м, 1H), 7,10 (д, 2H), 6,95 (d), 4,97 (м, 3H), 2,20 (м, 1H), 1,91 (м, 1H), 1,37 (м, 4H), 1,20 (м, 1H).
LC-MS (m/z): 365,3 (МН+), tR=1,78 мин (способ А).
Соединение 11: {(S)-1-[6-(2-Метоксиэтокси)пиридин-3-ил]этил}амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
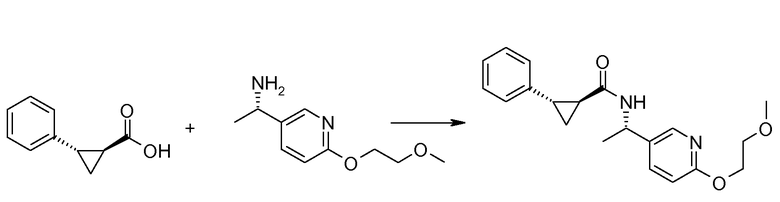
Синтезируют аналогично синтезу Соединения 1, используя IM46 и IM28. Выход=0,758 г (30%).
1H ЯМР (500 МГц, ДМСО) δ 8,57 (д, 1H), 8,08 (с, 1H), 7,65 (д, 1H), 7,26 (м, 2H), 7,17 (м, 1H), 7,10 (д, 2H), 6,78 (д, 1H), 4,92 (м, 2H), 4,32 (м, 2H), 3,62 (м, 2H), 3,27 (с, 3H), 2,20 (м, 1H), 1,89 (м, 1H), 1,37 (м, 4H), 1,20 (м, 1H).
LC-MS (m/z): 341,0 (МН+), tR=1,33 мин (способ А).
Соединение 12: [(S)-1-(2-Этоксипиридин-4-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
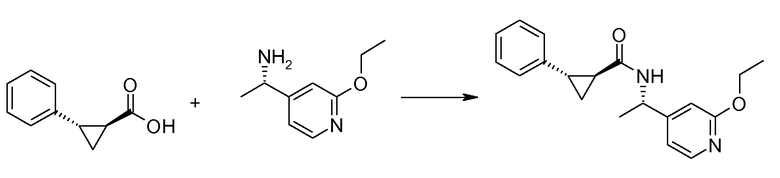
Синтезируют аналогично синтезу Соединения 1, используя IM46 и IM29. Выход=0,11 г (48%).
1H ЯМР (500 МГц, ДМСО) δ 8,55 (д, 1H), 8,06 (с, 1H), 7,30 (м, 2H), 7,19 (м, 1H), 7,14 (м,2H), 6,90 (д, 1H), 6,67 (д, 1H), 4,88 (м, 1H), 4,26 (м, 2H), 2,20 (м, 1H), 1,96 (м, 1H), 1,40-1,27 (м, 7H), 1,22 (м, 1H).
LC-MS (m/z): 311,4 (МН+), tR=1,36 мин (способ А).
Соединение 13: ((S)-1-{6-[(S)-(Тетрагидрофуран-3-ил)окси]пиридин-3-ил}этил)амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
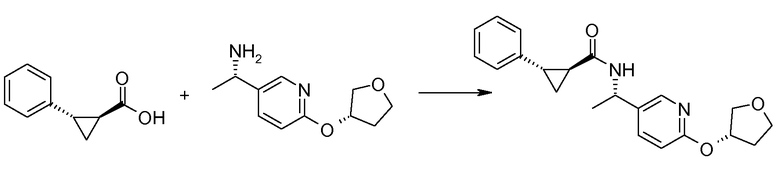
Синтезируют аналогично синтезу Соединения 1, используя IM46 и IM30. Выход=0,983 г (62%).
1H ЯМР (500 МГц, ДМСО) δ 8,55 (д, 1H), 8,09 (с, 1H), 7,64 (д, 1H), 7,27 (м, 2H), 7,16 (м, 1H), 7,11 (д, 2H), 6,78 (д, 1H), 5,48 (м, 1H), 4,96 (м, 1H), 3,92 (м, 1H), 3,85 (м, 1H), 3,74 (м, 2H), 2,21 (м, 2H), 1,95 (м, 2H), 1,37 (м, 4H), 1,19 (м, 1H).
LC-MS (m/z): 353,3 (МН+), tR=1,45 мин (способ А).
Соединение 14: ((S)-1-{6-[(R)-(Тетрагидрофуран-3-ил)окси]пиридин-3-ил}этил)амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
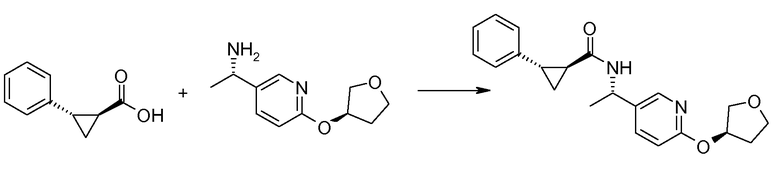
Синтезируют аналогично синтезу Соединения 1, используя IM46 и IM31. Выход=0,696 г (62%).
1H-ЯМР (500 МГц, ДМСО) δ 8,56 (д, 1H), 8,08 (с, 1H), 7,63 (д, 1H), 7,27 (м, 2H), 7,15 (м, 1H), 7,10 (д, 2H), 6,78 (д, 1H), 5,47 (м, 1H) 4,92 (м, 1H), 3,91 (м, 1H), 3,84 (м, 1H), 3,73 (м, 2H), 2,20 (м, 2H), 1,95 (м, 2H), 1,37 (м, 4H), 1,20 (м, 1H).
LC-MS (m/z): 353,3 (МН+), tR=1,45 мин (способ А).
Соединение 15: ((S)-1-[1,3]Диоксоло[4,5-b]пиридин-6-илэтил)амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
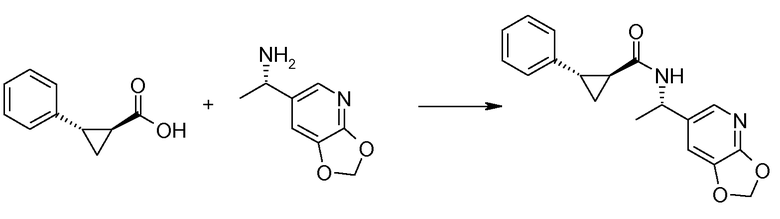
Синтезируют аналогично синтезу Соединения 1, используя IM46 и IM32. Выход=0,572 г (42%).
1H-ЯМР (500 МГц, ДМСО) δ 8,54 (д, 1H), 7,52 (с, 1H), 7,27 (м, 2H), 7,20-7,15 (м, 2H), 7,10 (д, 2H), 6,11 (с, 2H), 4,91 (м, 1H), 2,20 (м, 1H), 1,88 (м, 1H), 1,35 (м, 4H), 1,20 (м, 1H).
LC-MS (m/z): 311,1 (МН+), tR=0,61 мин (способ В).
Соединение 16: [(S)-1-(2,3-Дигидро[1,4]диоксино[2,3-b]пиридин-7-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
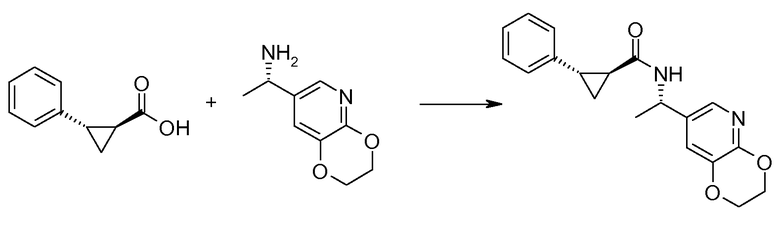
Синтезируют аналогично синтезу Соединения 1, используя IM46 и IM33. Выход=0,877 г (39%).
1H-ЯМР (500 МГц, ДМСО) δ 8,52 (д, 1H), 7,68 (с, 1H), 7,27 (м, 2H), 7,22 (с, 1H), 7,18 (м, 1H), 7,10 (д, 2H), 4,92 (м, 1H), 4,37 (д, 2H), 4,22 (д, 2H), 2,20 (м, 1H), 1,90 (м, 1H), 1,35 (м, 4H), 1,20 (м, 1H).
LC-MS (m/z): 325,5 (МН+), tR=1,28 мин (способ А).
Соединение 17: [(S)-1-(2-Этоксипиримидин-5-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
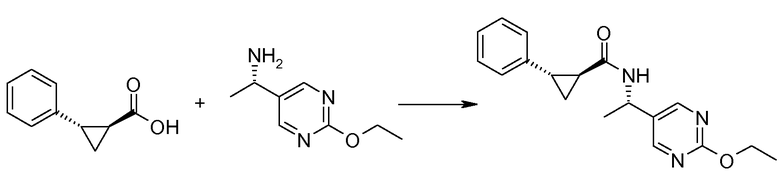
Синтезируют аналогично синтезу Соединения 1, используя IM46 и IM34. Выход=0,195 г (32%).
1H-ЯМР (600 МГц, ДМСО) δ 8,53 (д, 1H), 8,52 (с, 2H), 7,26 (м, 2H), 7,16 (с, 1H), 7,10 (д, 2H), 4,92 (м, 1H), 4,32 (м, 2H), 2,20 (м, 1H), 1,88 (м, 1H), 1,40 (д, 3H), 1,35 (м, 1H), 1,31 (т, 3H), 1,20 (м, 1H).
LC-MS (m/z): 312,2 (МН+), tR=0,62 мин (способ В).
Соединение 18: [(S)-1-(6-Хлорпиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
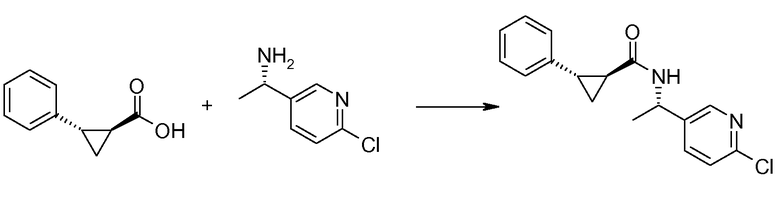
Синтезируют аналогично синтезу Соединения 1, используя IM46 и коммерчески доступный (S)-1-(6-хлорпиридин-3-ил)этиламин (Aurora building blocks, номер по каталогу А06.814.555). Выход=1,40 г (71%).
1H-ЯМР (500 МГц, ДМСО) δ 8,68 (д,1H), 8,36 (с, 1H), 7,78 (д, 1H), 7,48 (д, 1H), 7,28 (м,2H), 7,18 (м, 1H), 7,11 (д, 2H), 4,99 (м, 1H), 2,20 (м, 1H), 1,92 (м, 1H), 1,37 (м, 4H), 1,20 (м, 1H).
LC-MS (m/z): 301,2 и 303,1 (МН+), tR=0,67 мин (способ В).
Соединение 19: {(S)-1-[6-(Оксетан-3-илокси)пиридин-3-ил]этил}амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
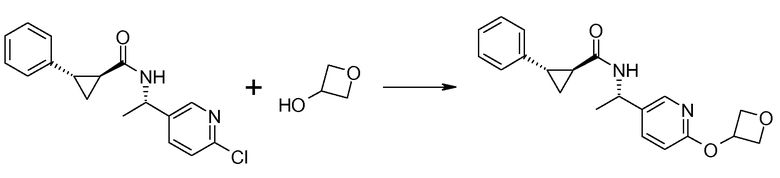
[(S)-1-(6-Хлорпиридин-3-ил)этил]амид (1S,2S)-2-фенил-циклопропанкарбоновой кислоты (Соединение 18) (2,00 г, 6,65 ммоль) растворяют в ДМФА (50 мл). Добавляют оксетан-3-ол (4,00 г, 54 ммоль) и карбонат цезия (16,2 г, 49,9 ммоль) и смесь нагревают при температуре 100°С в течение ночи. Смесь выливают в насыщенный солевой раствор и экстрагируют с помощью EtOAc. Органический слой промывают насыщенным солевым раствором, сушат (MgSO4) и отфильтровывают, и затем выпаривают досуха. Остаток переносят в колонку с силикагелем и элюируют смесью EtOAc/гептаны=1:1, получая Соединение 19 в виде твердого вещества. Это твердое вещество растворяют в смеси из ТГФ (10 мл), EtOAc (20 мл) и гептанов (10 мл). Смесь концентрируют в вакууме до объема приблизительно 15 мл, и этот раствор охлаждают на бане со смесью лед/вода. Образуется осадок белого цвета. Твердые вещества собирают путем фильтрации и высушивают в вакууме, получая указанное в заголовке соединение в виде бесцветного кристаллического вещества (0,097 г, выход: 4%).
1H-ЯМР (500 МГц, ДМСО) δ 8,55 (д, 1H), 8,04 (с, 1H), 7,70 (д, 1H), 7,25 (м, 2H), 7,15 (м, 1H), 7,10 (д, 2H), 6,87 (д, 1H), 5,52 (м, 1H), 4,95 (м, 1H), 4,87 (м, 2H), 4,53 (м, 2H), 2,20 (м, 1H), 1,90 (м, 1H), 1,37 (м, 4H), 1,21 (м, 1H).
LC-MS (m/z): 339,2 (МН+), tR=0,63 мин (способ В).
Температура плавления: 151-153°С.
Соединение 20: [(S)-1-(6-Цианометоксипиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
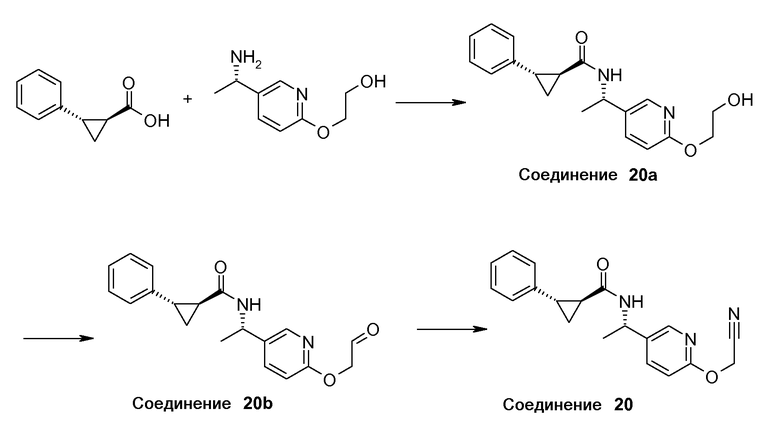
Соединение 20а синтезируют аналогично синтезу Соединения 1, используя IM46 и IM35 на первой стадии. Выход Соединения 20а=1,50 г (71%). Соединение является чистым по ТСХ (элюент EtOAc, Rf=0,5). Это вещество (1,50 г, 4,36 ммоль) растворяют в смеси ДМСО (50 мл) и ТГФ (50 мл) и добавляют 1-гидрокси-1,2-бензодиоксол-3(1Н)-он-1-оксид (1,34 г, 4,8 ммоль), и смесь перемешивают при комнатной температуре в течение ночи. Смесь добавляют к смеси насыщенного солевого раствора и EtOAc и фазы разделяют. Органические фазы сушат над MgSO4 и выпаривают. Сырой продукт очищают с помощью хроматографии на силикагеле (элюент EtOAc). Выход Соединения 20b=1,08 г (72%). Соединение является чистым по ТСХ (элюент EtOAc, Rf=0,7). Это вещество (1,05 г, 3,24 ммоль) растворяют в ТГФ (10 мл) и MeCN (50 мл) и по каплям добавляют к раствору 1-гидрокси-1,2-бензодиоксол-3(1Н)-он-1-оксида (1,36 г, 4,86 ммоль) в водном растворе аммиака (13 М раствор, 25 мл) и ТГФ (5 мл) и MeCN (5 мл). Смесь перемешивают при комнатной температуре в течение ночи. Органические фазы сушат над MgSO4 и выпаривают на роторном испарителе. Сырой продукт очищают с помощью хроматографии на силикагеле (элюент EtOAc в гептанах=4:1), получая 177 мг загрязненного продукта. К этому веществу добавляют ТГФ (10 мл) и EtOAc (10 мл) и гептаны (10 мл). Смесь выпаривают на роторном испарителе до объема приблизительно 10 мл, удаляют растворитель и затем охлаждают на бане со льдом. Осажденное твердое вещество собирают и высушивают в вакууме. Выход Соединения 20=0,054 г (5%). Соединение является чистым по LCMS и Н-ЯМР. Температура плавления: 163-165°С.
LC-MS (m/z): 322,1 (МН+), tR=1,03 мин (способ А).
1H-ЯМР (500 МГц, ДМСО) δ 8,60 (д, 1H), 8,17 (с, 1H), 7,75 (д, 1H), 7,27 (м, 2H), 7,17 (м, 1H), 7,11 (д, 2H), 6,95 (д, 1H), 5,19 (с, 2H), 4,97 (м, 1H), 2,21 (м, 1H), 1,92 (м, 1H), 1,38 (м, 4H), 1,21 (м, 1H).
Соединение 21: [(R)-2-Гидрокси-1-(6-пропоксипиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
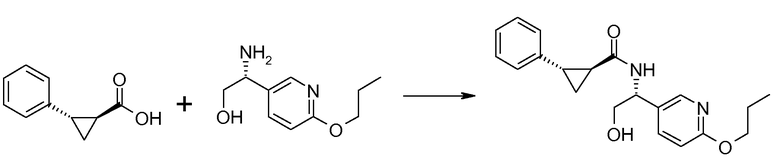
Триэтиламин (0,384 мл, 2,75 ммоль) добавляют к смеси транс-2-фенил-1-циклопропанкарбоновой кислоты, IM46, (223 мг, 1,38 ммоль) и О-(бензотриазол-1-ил)-N,N,N′,N′-тетраметилуроний-гексафторфосфата (522 мг, 1,38 ммоль), суспендированной в ДМФА (2 мл), в небольшой пробирке. Эту пробирку энергично встряхивают в течение 30 секунд и затем выдерживают в течение 5 минут. Эту смесь, по каплям, добавляют к (R)-2-амино-2-(6-пропоксипиридин-3-ил)этанолу, IM36, (270 мг, 1,4 ммоль), растворенному в ДМФА (3 мл). Спустя 1 час, смесь выливают в смесь из EtOAc (40 мл) и насыщенного солевого раствора (20 мл). Органический слой сушат над MgSO4 и выпаривают досуха. С помощью флэш-хроматографии (диоксид кремния, 10-100% EtOAc в гептанах) получают указанное в заголовке соединение в виде твердого вещества белого цвета (0,134 г, выход: 29%).
LC-MS (m/z): 341,0 (МН+), tR=1,52 мин (способ А).
1H-ЯМР (600 МГц, ДМСО) δ 8,53 (д, J=8,2 Гц, 1H), 8,04 (уш.с, 1H), 7,64-7,57 (м, 1H), 7,30-7,23 (м, 2H), 7,19-7,14 (м, 1H), 7,10 (д, J=7,3 Гц, 2H), 6,74 (д, J=8,5 Гц, 1H), 4,96-4,90 (м, 1H), 4,88-4,80 (м, 1H), 4,16 (т, J=6,7 Гц, 2H), 3,61-3,49 (м, 2H), 2,23-2,15 (м, 1H), 2,04-1,95 (м, 1H), 1,74-1,64 (м, 2H), 1,40-1,32 (м, 1H), 1,23-1,13 (м, 1H), 0,94 (т, J=7,4 Гц, 3H).
Соединение 22: [(R)-2-Гидрокси-1-(6-трифторметилпиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
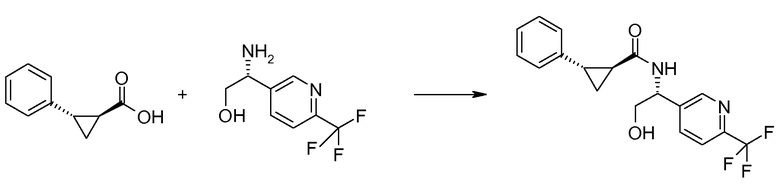
N-(3-Диметиламинопропил)-N′-этилкарбодиимидгидрохлорид (0,39 г, 2,03 ммоль) и 1-гидроксибензотриазол (0,366 г, 2,71 ммоль) добавляют к перемешиваемой смеси из IM46 (0,22 г, 1,36 ммоль) и коммерчески доступного (R)-2-амино-2-(6-трифторметилпиридин-3-ил)этанолгидрохлорида (Supplier Netchem Inc., номер по каталогу 517882) (0,494 г, 2,03 ммоль) и N,N-диизопропилэтиламина (0,472 мл, 2,71 ммоль) в ТГФ (20 мл). Раствор перемешивают при комнатной температуре в течение ночи. Добавляют воду и смесь экстрагируют с помощью EtOAc (3 раза по 80 мл). Объединенные органические фазы промывают насыщенным солевым раствором, сушат над MgSO4, отфильтровывают и растворитель выпаривают в вакууме. Сырой продукт очищают с помощью хроматографии на силикагеле (EtOAc в гептанах=10:1). Выход Соединения 22=475 мг (78%).
1H-ЯМР (500 МГц, ДМСО) δ 8,77 (д, 1H), 8,74 (с, 1H), 8,00 (д, 1H), 7,88 (д, 1H), 7,27 (м, 2H), 7,18 (м, 1H), 7,13 (д, 2H), 5,04 (м, 2H), 3,64 (м, 2H), 2,22 (м, 1H), 2,07 (м, 1H), 1,37 (м, 1H), 1,37 (м, 1H), 1,23 (м, 1H).
LC-MS (m/z): 351,1 (МН+), tR=1,51 мин (способ А).
Соединение 23: [(R)-1-(5-Цианопиридин-2-ил)-2-гидроксиэтил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
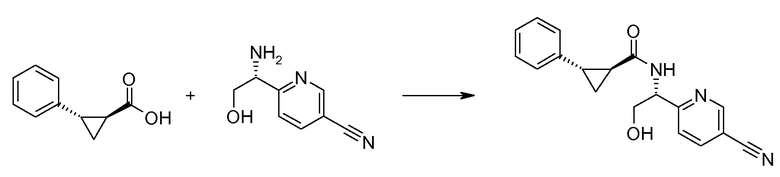
Синтезируют аналогично синтезу Соединения 22, используя IM46 и коммерчески доступный 6-((R)-1-амино-2-гидроксиэтил)никотинонитрил (Supplier Netchem Inc., номер по каталогу 549885). Выход Соединения 23=230 мг (61%).
1H-ЯМР (500 МГц, ДМСО) δ 8,97 (с, 1H), 8,72 (д, 1H), 8,26 (д, 1H), 7,52 (д, 1H), 7,27 (м, 2H), 7,18 (т, 1H), 7,11 (д, 2H), 5,05-4,95 (м, 2H), 3,70 (м, 2H), 2,20 (м, 1H), 2,17 (м, 1H), 1,36 (м, 1H), 1,20 (м, 1H).
LC-MS (m/z): 308,1 (МН+), tR=1,21 мин (способ А).
Соединение 24: [(R)-2-Гидрокси-1-(6-метоксипиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
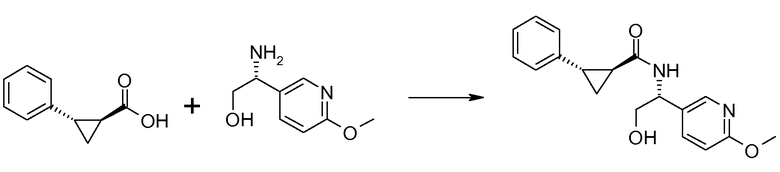
Синтезируют аналогично синтезу Соединения 22, используя IM46 и коммерчески доступный (R)-2-амино-2-(6-метоксипиридин-3-ил)этанол (Supplier Netchem Inc., номер по каталогу 517926). Выход Соединения 24=763 мг (22%).
1H-ЯМР (500 МГц, ДМСО) δ 8,53 (д, 1H), 8,09 (с, 1H), 7,63 (д, 1H), 7,27 (м, 2H), 7,15 (м, 1H), 7,12 (м, 2H), 6,77 (д, 1H), 4,95 (м, 2H), 4,85 (м, 2H), 3,83 (с, 3H), 3,57 (м, 2H), 2,21 (м, 1H), 2,00 (м, 1H), 1,37 (м, 1H), 1,19 (м, 1H).
LC-MS (m/z): 313,1 (МН+), tR=1,53 мин (способ А).
Соединение 25: [(R)-2-Гидрокси-1-(6-метилпиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
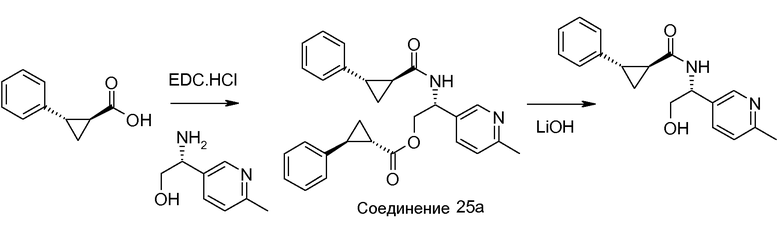
N-(3-Диметиламинопропил)-N′-этилкарбодиимидгидрохлорид (0,316 г, 1,65 ммоль) и 1-гидроксибензотриазол (0,223 г, 1,65 ммоль) добавляют к перемешиваемой смеси из IM46 (0,18 г, 1,1 ммоль) и коммерчески доступного (R)-2-амино-2-(6-метилпиридин-3-ил)этанолдигидрохлорида (Supplier Netchem Inc., номер по каталогу 549945) (0,128 г, 1,21 ммоль) и N,N-диизопропилэтиламина (0,575 мл, 3,30 ммоль) в ТГФ (10 мл). Раствор перемешивают при комнатной температуре в течение ночи. Добавляют воду и смесь экстрагируют с помощью EtOAc. Органическую фазу выпаривают на роторном испарителе, получая 140 мг Соединения 25а. LC-MS (m/z): 441,4 (МН+), tR=1,44 мин (способ А). Соединение 25а растворяют в ТГФ и добавляют LiOH (1 М раствор) и смесь перемешивают в течение 30 минут. Осажденное твердое вещество выделяют путем фильтрации и высушивают в вакууме. Выход Соединения 25=110 мг (34%).
1H-ЯМР (500 МГц, ДМСО) δ 8,53 (д, 1H), 8,09 (с, 1H), 7,63 (д, 1H), 7,27 (м, 2H), 7,15 (м, 1H), 7,12 (м, 2H), 6,77 (д, 1H), 4,95 (м, 2H), 4,85 (м, 2H), 3,83 (с, 3H), 3,57 (м, 2H), 2,21 (м, 1H), 2,00 (м, 1H), 1,37 (м, 1H), 1,19 (м, 1H).
LC-MS (m/z): 297,3 (МН+), tR=0,78 мин (способ А).
Соединение 26: [(R)-2-Гидрокси-1-(6-изопропоксипиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
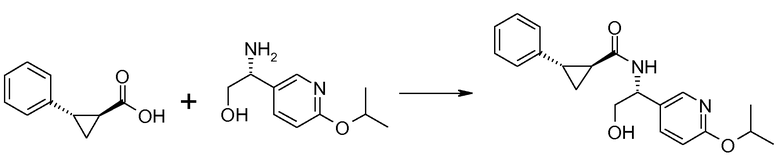
Синтезируют аналогично синтезу Соединения 21, используя IM46 и IM37. Выход Соединения 26=667 мг (77%).
1H-ЯМР (600 МГц, ДМСО) δ 8,52 (д, 1H), 8,03 (с, 1H), 7,60 (д, 1H), 7,25 (м, 2H), 7,15 (м, 1H), 7,10 (д, 2H), 6,67 (д, 1H), 5,20 (м, 1H), 4,92 (т, 1H), 4,83 (м, 1H), 3,55 (м, 2H), 2,20 (м, 1H), 2,00 (м, 1H), 1,35 (м, 1H), 1,24 (д, 6H), 1,19 (м, 1H).
LC-MS (m/z): 341,0 (МН+), tR=1,45 мин (способ А).
Соединение 27: [(R)-1-(6-Этоксипиридин-3-ил)-2-гидроксиэтил]амид (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты
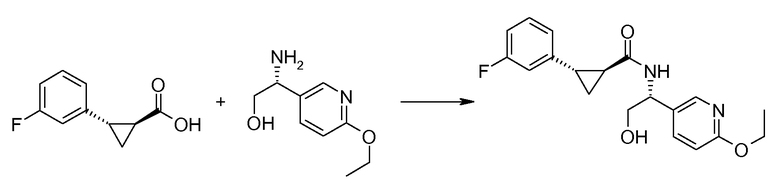
Синтезируют аналогично синтезу Соединения 21, используя IM47 и IM38. Выход Соединения 27=90 мг (19%).
1H ЯМР (600 МГц, ДМСО) δ 8,53 (д, 1H), 8,05 (с, 1H), 7,62 (м, 1H), 7,28 (м, 1H), 6,97 (м, 3H), 6,73 (д, 1H), 4,83 (м, 1H), 4,24 (м, 2H), 3,55 (м, 2H), 2,22 (м, 1H), 2,03 (м, 1H), 1,37 (м, 1H), 1,28 (т, 3H), 1,22 (м, 1H).
LC-MS (m/z): 345,0 (МН+), tR=0,63 мин (способ В).
Соединение 28: [(R)-1-(6-Этоксипиридин-3-ил)-2-гидроксиэтил]амид (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты
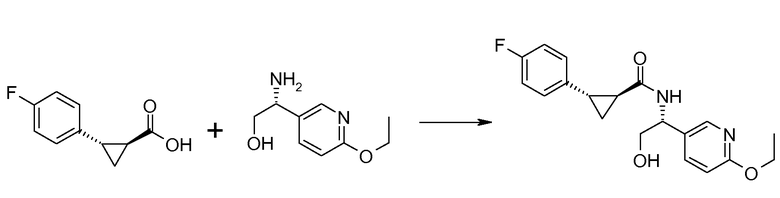
Синтезируют аналогично синтезу Соединения 21, используя IM48 и IM38. Выход Соединения 28=93 мг (54%) в виде твердого вещества белого цвета.
1H-ЯМР (600 МГц, ДМСО) δ 8,56 (д, 1H), 8,07 (с, 1H), 7,62 (м, 1H), 7,18 (м, 2H), 7,12 (м, 2H), 6,77 (д, 1H), 4,93 (т, 1H), 4,83 (м, 1H), 4,25 (дд, 2H), 3,52 (м, 2H), 2,27 (м, 1H), 1,97 (м, 1H), 1,30 (м, 4H), 1,15 (м, 1H).
LC-MS (m/z): 345,0 (МН+), tR=1,36 мин (способ А).
Соединение 29: [(R)-2-Гидрокси-1-(6-пропоксипиридин-3-ил)этил]амид (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты
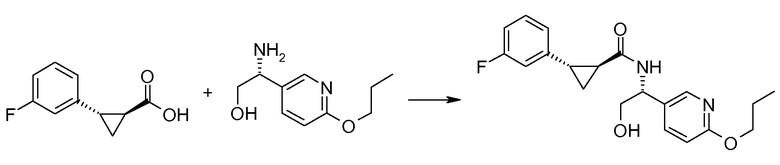
Синтезируют аналогично синтезу Соединения 21, используя IM47 и IM36. Выход=150 мг (30%).
1H ЯМР (600 МГц, ДМСО) δ 8,53 (д, 1H), 8,03 (с, 1H), 7,62 (д, 1H), 7,29 (м, 1H), 6,95 (м, 3H), 6,74 (д, 1H), 4,93 (м, 1H), 4,84 (м, 1H), 4,16 (т, 2H), 3,55 (м, 2H), 2,23 (м, 1H), 2,03 (м, 1H), 1,68 (м, 2H), 1,37 (м, 1H), 1,25 (м, 1H), 0,93 (т, 3H).
LC-MS (m/z): 359,1 (МН+), tR=1,57 мин (способ А).
Соединение 30: [(R)-2-Гидрокси-1-(6-пропоксипиридин-3-ил)этил]амид (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты
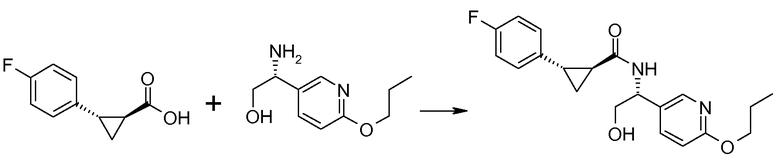
Синтезируют аналогично синтезу Соединения 21, используя IM48 и IM36. Выход=176 мг (36%).
1H-ЯМР (600 МГц, ДМСО) δ 8,52 (д, 1H), 8,05 (с, 1H), 7,63 (д, 1H), 7,14 (м, 2H), 7,09 (м, 2H), 6,74 (д, 1H), 4,92 (т, 1H), 4,85 (м, 1H), 4,15 (т, 2H), 3,55 (м, 2H), 2,22 (м, 1H), 1,97 (м, 1H), 1,70 (м, 2H), 1,34 (м, 1H), 1,18 (м, 1H), 0,92 (т, 3H).
Соединение 31: [(R)-1-(6-(2,2,2-d3)этоксипиридин-3-ил)-2-гидроксиэтил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
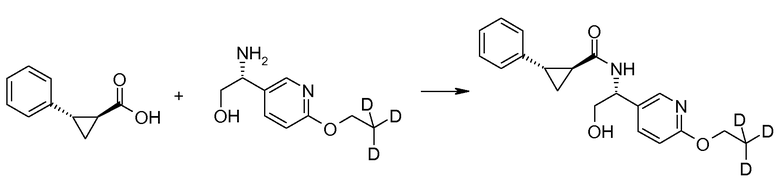
Синтезируют аналогично синтезу Соединения 21, используя IM46 и IM40. Выход=785 мг (66%).
1H ЯМР (600 МГц, CDCl3) δ 8,62 (с, 1H), 7,52 (д, 1H), 7,26 (м, 2H), 7,20 (м, 1H), 7,08 (д, 2H), 6,71 (д, 1H), 6,27 (м, 1H), 5,05 (м, 1H), 4,31 (с, 2H), 3,91 (м, 2H), 2,51 (м, 2H), 1,67 (м, 2H), 1,31 (м, 1H).
LC-MS (m/z): 330,3 (МН+), tR=1,32 мин (способ А).
Соединение 32: [(R)-1-(6-(1,1-d2)этоксипиридин-3-ил)-2-гидроксиэтил]амид (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты
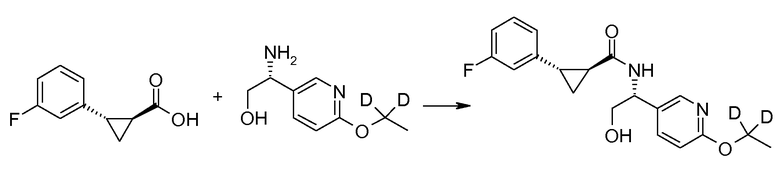
Синтезируют аналогично синтезу Соединения 21, используя IM47 и IM41. Выход=104 мг (44%).
1H ЯМР (600 МГц, ДМСО) δ 8,52 (д, 1H), 8,03 (с, 1H), 7,61 (м, 1H), 7,29 (м, 1H), 6,97 (м, 3H), 6,72 (д, 1H), 4,93 (м, 1H), 4,85 (м, 1H), 3,55 (м, 2H), 2,22 (м, 1H), 2,02 (м, 1H), 1,37 (м, 1H), 1,25 (м, 4H).
LC-MS (m/z): 347,2 (МН+), tR=0,64 мин (способ А).
Соединение 33: [(R)-1-(6-Этоксипиридин-3-ил)-2-гидроксиэтил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
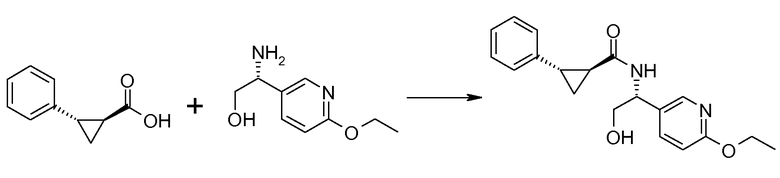
Синтезируют аналогично синтезу Соединения 22, используя IM46 и IM38. Выход=90 мг (28%).
1H-ЯМР (600 МГц, ДМСО) δ 8,53 (д, 1H), 8,06 (с, 1H), 7,52 (м, 1H), 7,26 (м, 2H), 7,16 (м, 1H), 7,10 (д, 2H), 6,73 (д, 1H), 4,95 (т, 1H), 4,87 (м, 1H), 4,25 (м, 2H), 3,55 (м, 2H), 2,20 (м, 1H), 2,02 (м, 1H), 1,36 (м, 1H), 1,28 (т, 3H), 1,20 (м, 1H).
LC-MS (m/z): 327,4 (МН+), tR=0,57 мин (способ В).
Соединение 34: [(R)-1-(6-(1,1,2,2,2-d5)этоксипиридин-3-ил)-2-гидроксиэтил]амид (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты
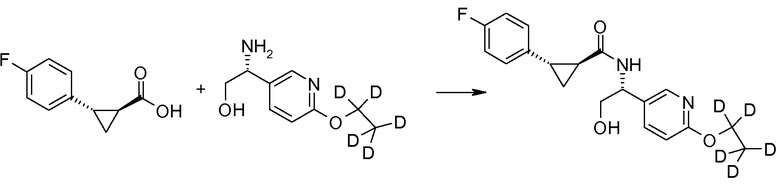
Синтезируют аналогично синтезу Соединения 21, используя IM48 и IM39. Выход=130 мг (41%).
1H ЯМР (600 МГц, ДМСО) δ 8,53 (д, 1H), 8,06 (с, 1H), 7,62 (м, 1H), 7,14 (м, 2H), 7,10 (м, 2H), 6,73 (д, 1H), 4,95 (уш.с, 1H), 4,84 (м, 1H), 3,55 (м, 2H), 2,22 (м, 1H), 1,96 (м, 1H), 1,34 (м, 1H), 1,18 (м, 1H).
LC-MS (m/z): 350,2 (МН+), tR=1,41 мин (способ А).
Соединение 35: [(R)-1-(6-(2,2,2-d3)этоксипиридин-3-ил)-2-гидроксиэтил]амид (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты
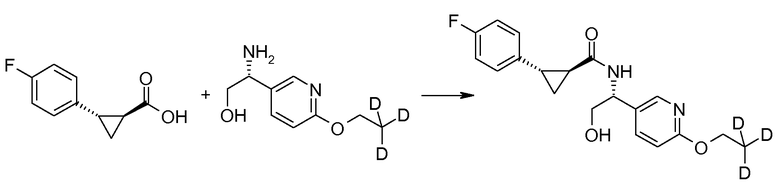
Синтезируют аналогично синтезу Соединения 21, используя IM48 и IM40. Выход=144 мг (41%).
1H ЯМР (600 МГц, ДМСО) δ 8,53 (д, 1H), 8,08 (с, 1H), 7,63 (м, 1H), 7,13 (м, 2H), 7,10 (м, 2H), 6,73 (д, 1H), 4,97 (уш.с, 1H), 4,86 (м, 1H), 4,24 (с, 2H), 3,57 (м, 2H), 2,23 (м, 1H), 1,97 (м, 1H), 1,37 (м, 1H), 1,20 (м, 1H).
LC-MS (m/z): 347,9 (МН+), tR=1,39 мин (способ А).
Соединение 36: [(R)-1-(6-(1,1-d2)этоксипиридин-3-ил)-2-гидроксиэтил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
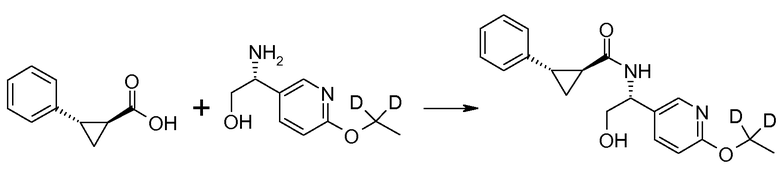
Синтезируют аналогично синтезу Соединения 21, используя IM46 и IM41. Выход=148 мг (67%).
1H ЯМР (600 МГц, ДМСО) δ 8,52 (д, 1H), 8,05 (с, 1H), 7,61 (д, 1H), 7,50 (м, 2H), 7,15 (м, 1H), 7,10 (д, 2H), 6,72 (д, 1H), 4,94 (т, 1H), 4,85 (м, 1H), 3,55 (м, 2H), 2,18 (м, 1H), 1,97 (м, 1H), 1,35 (м, 1H), 1,27 (с, 3H), 1,20 (м, 1H).
LC-MS (m/z): 329,2 (МН+), tR=0,61 мин (способ В).
Соединение 37: [(R)-1-(6-(1,1-d2)этоксипиридин-3-ил)-2-гидроксиэтил]амид (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты
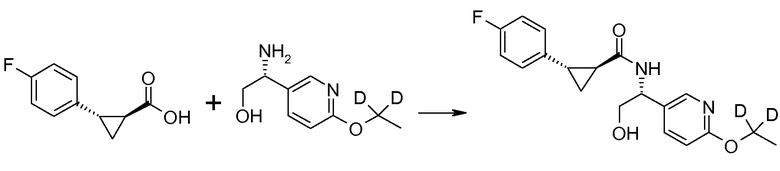
Синтезируют аналогично синтезу Соединения 21, используя IM48 и IM41. Выход=123 мг (52%).
1H ЯМР (600 МГц, ДМСО) δ 8,52 (д, 1H), 8,06 (с, 1H), 7,62 (м, 1H), 7,14 (м, 2H), 7,10 (м, 2H), 6,73 (д, 1H), 4,92 (т, 1H), 4,84 (м, 1H), 3,55 (м, 2H), 2,22 (м, 1H), 1,96 (м, 1H), 1,34 (м, 1H), 1,28 (с, 3H), 1,18 (м, 1H).
LC-MS (m/z): 347,2 (МН+), tR=1,41 мин (способ В).
Соединение 38: [(R)-1-(6-(1,1,2,2,2-d5)этоксипиридин-3-ил)-2-гидроксиэтил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
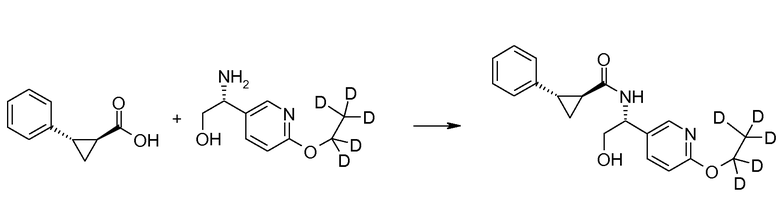
Синтезируют аналогично синтезу Соединения 21, используя IM46 и IM39. Выход=98 мг (32%).
1H-ЯМР (600 МГц, ДМСО) δ 8,52 (д, 1H), 8,05 (с, 1H), 7,61 (д, 1H), 7,26 (т, 2H), 7,16 (т, 1H), 7,10 (д, 2H), 6,72 (д, 1H), 4,93 (т, 1H), 4,83 (м, 1H), 3,55 (м, 2H), 2,18 (м, 1H), 1,99 (м, 1H), 1,35 (м, 1H), 1,20 (м, 1H).
LC-MS (m/z): 332,2 (МН+), tR=0,61 мин (способ В).
Соединение 39: [(R)-1-(6-(2,2,2-d3)этоксипиридин-3-ил)-2-гидроксиэтил]амид (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты
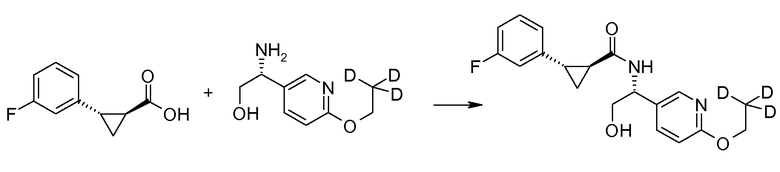
Синтезируют аналогично синтезу Соединения 21, используя IM47 и IM40. Выход=101 мг (29%).
1H ЯМР (600 МГц, ДМСО) δ 8,53 (д, 1H), 8,05 (с, 1H), 7,61 (д, 1H), 7,28 (м, 1H), 7,0-6,95 (м, 3H), 6,72 (д, 1H), 4,93 (т, 1H), 4,83 (м, 1H), 4,22 (с, 2H), 3,55 (м, 2H), 2,23 (м, 1H), 2,02 (м, 1H), 1,37 (м, 1H), 1,27 (м, 1H).
LC-MS (m/z): 348,0 (МН+), tR=1,43 мин (способ А).
Соединение 40: [(R)-1-(6-Циклобутоксипиридин-3-ил)-2-гидроксиэтил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
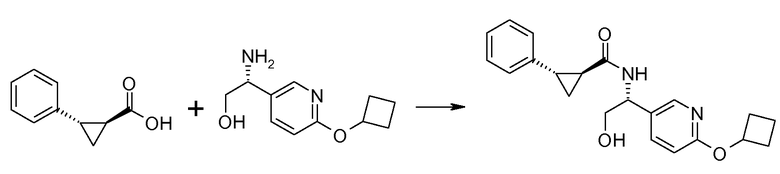
Синтезируют аналогично синтезу Соединения 21, используя IM46 и IM44. Выход=53 мг (30%).
1H-ЯМР (600 МГц, ДМСО) δ 8,50 (д, 1H), 8,03 (с, 1H), 7,61 (д, 1H), 7,25 (м, 2H), 7,16 (м, 1H), 7,10 (м, 2H), 6,71 (д, 1H), 5,09 (м, 1H), 4,90 (т, 1H), 4,82 (м, 1H), 3,55 (м, 2H), 2,37 (м, 2H), 2,21 (м, 1H), 2,00 (м, 4H), 1,76 (м, 1H), 1,61 (м, 1H), 1,32 (м, 1H), 1,20 (м, 1H).
LC-MS (m/z): 353,1 (МН+), tR=0,70 мин (способ В).
Соединение 41: [(R)-1-(6-Циклобутоксипиридин-3-ил)-2-гидроксиэтил]амид (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты
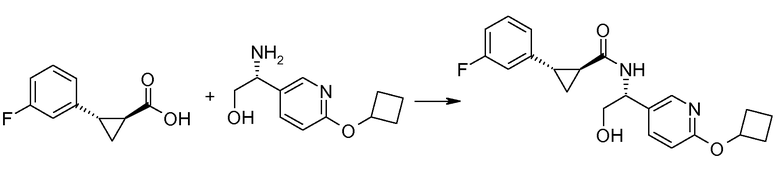
Синтезируют аналогично синтезу Соединения 21, используя IM47 и IM44. Выход=38 мг (20%).
1H ЯМР (600 МГц, ДМСО) δ 8,50 (д, 1H), 8,03 (с, 1H), 7,61 (д, 1H), 7,27 (м, 1H), 6,95 (м, 3H), 6,71 (д, 1H), 5,08 (м, 1H), 4,95 (уш. с, 1H), 4,82 (м, 1H), 3,55 (м, 2H), 2,37 (м, 2H), 2,22 (м, 1H), 2,02 (м, 4H), 1,75 (м, 1H), 1,61 (м, 1H), 1,37 (м, 1H), 1,27 (м, 1H).
LC-MS (m/z): 371,1 (МН+), tR=0,71 мин (способ В).
Соединение 42: [(R)-1-(6-Циклобутоксипиридин-3-ил)-2-гидроксиэтил]амид (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты
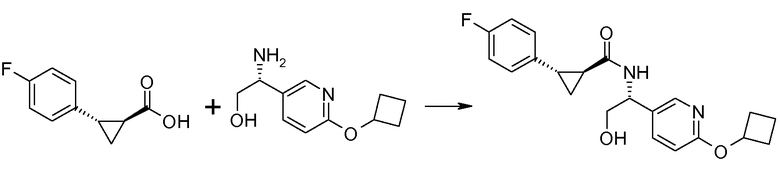
Синтезируют аналогично синтезу Соединения 21, используя IM48 и IM44. Выход=84 мг (45%).
1H-ЯМР (600 МГц, ДМСО) δ 8,50 (д, 1H), 8,03 (с, 1H), 7,61 (д, 1H), 7,14 (м, 2H), 7,09 (м, 2H), 6,71 (д, 1H), 5,08 (м, 1H), 4,92 (т, 1H), 4,82 (м, 1H), 3,55 (м, 2H), 2,37 (м, 2H), 2,21 (м, 1H), 2,05-1,95 (м, 4H), 1,75 (м, 1H), 1,61 (м, 1H), 1,32 (м, 1H), 1,17 (м, 1H).
LC-MS (m/z): 371,1 (МН+), tR=0,71 мин (способ В).
Соединение 43: ((R)-2-Гидрокси-1-{6-[(R)-(тетрагидрофуран-3-ил)окси]пиридин-3-ил}этил)амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
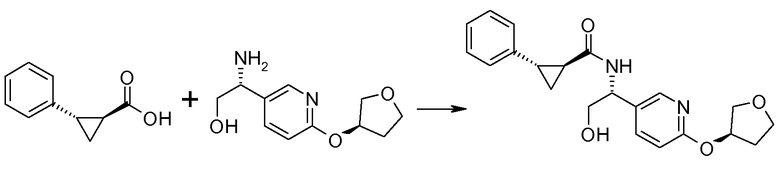
Синтезируют аналогично синтезу Соединения 21, используя IM46 и IM43. Выход=1,34 г (60%), в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,08 (с, 1H), 7,51 (д, J=8,4 Гц, 1H), 7,18-7,25 (м, 3H), 7,04-7,06 (м, 2H), 6,68-6,71(м, 1H), 6,36-6,39 (м, 1H), 5,50-5,53(м, 1H), 5,04-5,05(м, 1H), 3,88-4,01 (м, 6H), 2,48-2,50 (м, 1H), 2,21-2,26 (м, 1H), 2,11-2,13 (м, 1H), 1,62-1,71 (м, 2H), 1,27-1,31 (м, 1H).
LC-MS (m/z): 369,2 (МН+), tR=2,04 мин (способ WXE-AB01).
[α]D 20=178,6° (С=0,2, CHCl3).
Соединение 44: (1S,2S)-N-[(1R)-2-Гидрокси-1-[6-[(3S)-тетрагидрофуран-3-ил]окси-3-пиридил]этил]-2-фенилциклопропанкарбоксамид
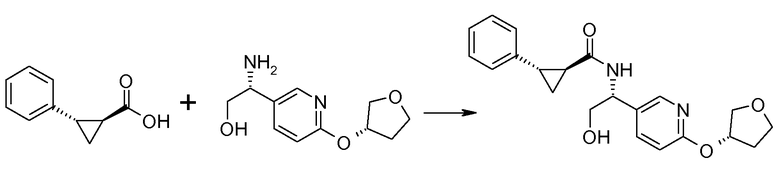
Синтезируют аналогично синтезу Соединения 21, используя IM46 и IM42. Выход=2,10 г (50%), в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3): δ 8,09 (м, 1H), 7,52-7,55 (м, 1H), 7,29 (м, 1H), 7,25-7,27 (м, 1H), 7,20-7,21 (м, 1H), 7,17-7,19 (д, J=7,2 Гц, 2H), 6,70-6,73 (д, J=8,8 Гц, 1H), 6,34-6,36 (д, J=7,2 Гц, 1H), 5,50-5,53 (м, 1H), 5,04-5,05 (д, J=6,8 Гц, 1H), 3,94-4,03 (м, 2H), 3,85-3,91 (м, 4H), 2,48-2,50 (м, 1H), 2,21-2,26 (м, 1H), 2,11-2,13 (м, 1H), 1,62-1,71 (м, 2H), 1,27-1,31 (м, 1H).
LC-MS (m/z): 369,2 (МН+), tR=2,03 мин (способ WXE-AB01).
[α]D 20=160,9° (С=0,21, CHCl3).
Соединение 45: {(R)-2-Гидрокси-1-[6-(тетрагидропиран-4-илокси)пиридин-3-ил]этил}амид (1S,2S)-2-((Z)-1-метиленпента-2,4-диенил)циклопропанкарбоновой кислоты
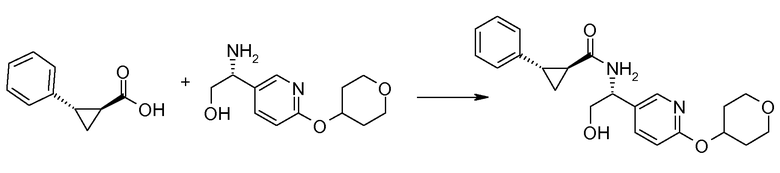
Синтезируют аналогично синтезу Соединения 1, используя IM46 и IM45. Выход=2,5 г (44%), в виде твердого вещества белого цвета.
1H ЯМР ((400 МГц, CDCl3): δ 8,09 (с, 1H), 7,52-7,55 (м, 1H), 7,27-7,28 (м, 1H), 7,25-7,26 (м, 1H), 7,20 (м, 1H), 7,06-7,08 (т, J=4,2 Гц, 2H), 6,70-6,72 (д, J=8,4 Гц, 1H), 6,34-6,36 (д, J=7,2 Гц, 1H), 5,18-5,21 (м, 1H), 5,04-5,05 (д, J=6,8 Гц, 1H), 3,62-3,99 (м, 4H), 3,56-3,62 (м, 2H), 2,46-2,50 (м, 1H), 2,01-2,06 (м, 2H), 1,74-1,80 (м, 2H), 1,62-1,70 (м, 2H), 1,27-1,30 (м, 1H).
[α]D 20=144,3° (с=0,204 г/100 мл, CHCl3).
Соединение 46: [(R)-1-(6-Этоксипиридин-3-ил)-2-метоксиэтил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
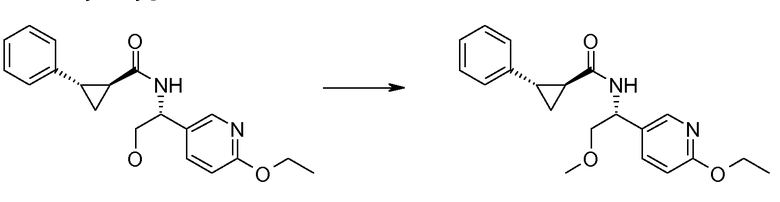
NaH (60%-ная суспензия в минеральном масле) (2,06 г, 51,5 ммоль) суспендируют в ДМФА и реакционный сосуд охлаждают на бане со льдом. К суспензии гидрида натрия, по каплям, добавляют [(R)-1-(6-этоксипиридин-3-ил)-2-гидроксиэтил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты (Соединение 33) (15 г, 46 ммоль), растворенный в ДМФА (50 мл), при температуре 5-8°С, в течение 20 минут. Раствор перемешивают в течение 30 минут. По каплям добавляют метилиодид (3,30 мл, 53,0 ммоль), растворенный в ДМФА (25 мл), при температуре 5-12°С, в течение 10 минут, и смесь перемешивают при температуре 7-8°С в течение 30 минут. Смесь добавляют к насыщенному солевому раствору и экстрагируют с помощью EtOAc. Органический слой промывают дополнительным количеством насыщенного солевого раствора, сушат (MgSO4), отфильтровывают и растворитель выпаривают. Сырой продукт очищают с помощью хроматографии на силикагеле (элюент EtOAc в гептанах=4:1). Фракции, которые содержат продукт, собирают и растворитель удаляют в вакууме. Остаток повторно растворяют в ТГФ (50 мл), EtOAc (100 мл) и гептанах (25 мл). Смесь концентрируют до объема 40 мл, оставляют стоять и охлаждают на льду. Осаждается твердое вещество белого цвета и его собирают путем фильтрации. Выход: 6,75 г (43%) Соединения 46.
LC-MS (m/z): 341,2 (МН+), tR=0,64 мин (способ B).
1H-ЯМР (500 МГц, ДМСО) δ 8,62 (д, 1H), 8,08 (уш.с, 1H), 7,63 (д, 1H), 7,27 (м, 2H), 7,17 (м, 1H), 7,10 (д, 2H), 6,74 (д, 1H), 5,05(м, 1H), 4,26 (м, 2H), 3,55-3,46 (м, 2H), 3,26 (с, 3H), 2,20 (м, 1H), 1,99 (м, 1H), 1,38 (м, 1H), 1,29 (т, 3H), 1,20 (м, 1H).
Соединение 47: (1S,2S)-N-[(1R)-2-Метокси-1-[6-[(3R)-тетрагидрофуран-3-ил]окси-3-пиридил]этил]-2-фенилциклопропанкарбоксамид
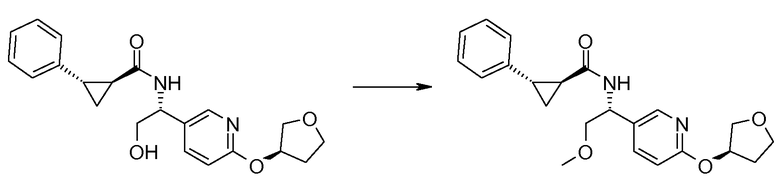
Синтезируют аналогично синтезу Соединения 46, используя Соединение 43 (0,90 г). Выход: 490 мг (53%), в виде твердого вещества.
1H ЯМР (400 МГц, CDCl3): δ 8,12 (д, J=2,4 Гц, 1H), 7,54-7,57 (м, 1H), 7,25-7,28 (м, 2H), 7,18-7,21 (м, 1H), 7,05-7,07 (м, 2H), 6,68-6,70 (д, J=8,8 Гц, 1H), 6,37-6,39 (д, J=8,0 Гц, 1H), 5,51-5,54 (м, 1H), 5,10-5,12(м, 1H), 3,87-4,04 (м, 4H), 3,66-3,69 (м, 1H), 3,60-3,63 (м, 1H), 3,38 (с, 3H), 2,45-2,46 (м, 1H), 2,21-2,26 (м, 1H), 1,60-1,68 (м, 2H), 1,25-1,28 (м, 1H).
LC-MS: tR=0,53 мин (способ B), m/z=383,2 [М+Н]+.
[α]D 20=188,2° (С=0,176, CHCl3).
Соединение 48: (1S,2S)-N-[(1R)-2-Метокси-1-[6-[(3S)-тетрагидрофуран-3-ил]окси-3-пиридил]этил]-2-фенилциклопропанкарбоксамид
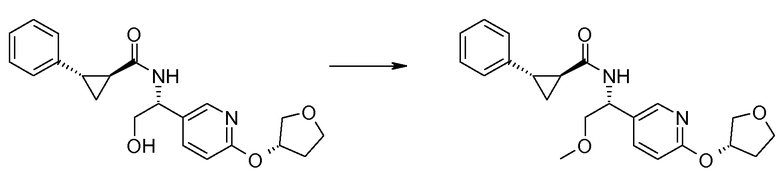
Синтезируют аналогично синтезу Соединения 46, используя Соединение 44 (841 мг). Выход: 645 мг (44%), в виде твердого вещества.
1H ЯМР (400 МГц, CDCl3): δ 8,10-8,11 (d, J=2,4 Гц, 1H), 7,54-7,57 (м, 1H), 7,25-7,28 (м, 2H), 7,18-7,21 (м, 1H), 7,05-7,07 (м, 2H), 6,68-6,70 (д, J=8,8 Гц, 1H), 6,37-6,39 (д, J=8,0 Гц, 1H), 5,51-5,54 (м, 1H), 5,10-5,12 (м, 1H), 3,87-4,04 (м, 4H), 3,66-3,69 (м, 1H), 3,60-3,63 (м, 1H), 3,38 (с, 3H), 2,45-2,46 (м, 1H), 2,21-2,26 (м, 1H), 1,60-1,68 (м, 2H), 1,25-1,28 (м, 1H).
LC-MS: tR=0,62 мин (способ B), m/z=383,2 [М+Н]+.
[α]D 20=162,5° (С=0,225, CHCl3).
Соединение 49: {(R)-2-Метокси-1-[6-(тетрагидропиран-4-илокси)пиридин-3-ил]этил}амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
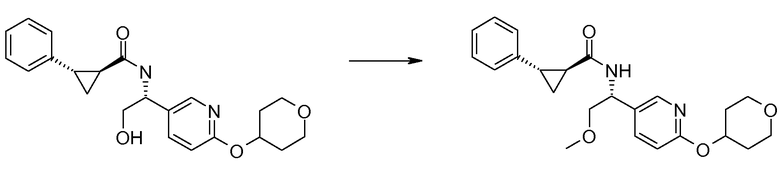
Синтезируют аналогично синтезу Соединения 46, используя Соединение 45. Выход: 343 мг (20%), в виде твердого вещества.
1H ЯМР (400 МГц, CDCl3): δ 8,10-8,11 (d, J=2,4 Гц, 1H), 7,54-7,57 (м, 1H), 7,25-7,29 (м, 2H), 7,18-7,21 (м, 1H), 7,05-7,07 (м, 2H), 6,66-6,68 (т, J=4,2 Гц, 1H), 6,38-6,40 (д, J=7,2 Гц, 1H), 5,20-5,21 (м, 1H), 5,10-5,12 (м, 1H), 3,94-3,99 (м, 2H), 3,57-3,69 (м, 4H), 3,37 (с, 3H), 2,42-2,49 (м, 1H), 2,02-2,08 (м, 2H), 1,61-1,79 (м, 4H), 1,25-1,28 (м, 1H).
[α]D 20=159,3° (С=0,198 г/100 мл, CHCl3).
LC-MS (m/z): 383,15 (МН+), tR=0,54 мин (способ B).
Соединение 50: {(S)-1-[6-(Оксетан-3-илокси)пиридин-3-ил]этил}амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
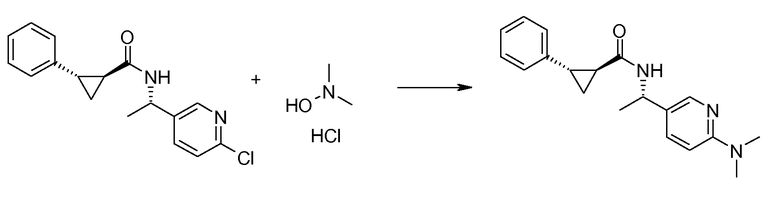
[(S)-1-(6-Хлорпиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты (Соединение 18) (2,00 г, 6,65 ммоль) растворяют в ДМФА (40 мл). Добавляют N,N-диметилгидроксиламингидрохлорид (5,00 г, 51,2 ммоль) и карбонат цезия (25 г, 76,7 ммоль) и смесь нагревают при температуре 95°С в течение 3 суток. Смесь выливают в насыщенный солевой раствор и экстрагируют с помощью EtOAc. Органический слой промывают насыщенным солевым раствором, сушат (MgSO4) и отфильтровывают и затем выпаривают досуха. Остаток переносят в колонку с силикагелем и элюируют с помощью EtOAc, получая Соединение 50 в виде твердого вещества. Это твердое вещество растворяют в смеси из ТГФ (10 мл), EtOAc (10 мл) и гептанов (10 мл). Смесь концентрируют до приблизительного объема 10 мл, и этот раствор охлаждают на бане со смесью лед/вода. Образуется осадок белого цвета. Твердые вещества собирают путем фильтрации и высушивают в вакууме, получая указанное в заголовке соединение в виде твердого вещества белого цвета (0,044 г, выход: 2%).
1H-ЯМР (500 МГц, ДМСО) δ 8,43 (д, 1H), 8,02 (с, 1H), 7,45 (д, 1H), 7,25 (м, 2H), 7,17 (м, 1H), 7,10 (д, 2H), 6,61 (д, 1H), 4,83 (м, 1H), 3,98 (м, 6H), 2,19 (м, 1H), 1,90 (м, 1H), 1,35 (м, 4H), 1,21 (м, 1H).
LC-MS (m/z): 310,2 (МН+), tR=0,46 мин (способ B).
Температура плавления: 171-181°С.
Соединение 51: [(S)-1-(6-Этансульфонилпиридин-3-ил)этил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
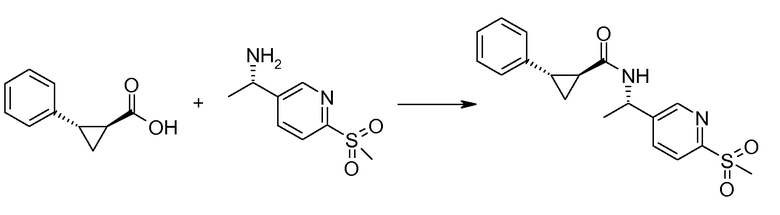
Синтезируют аналогично синтезу Соединения 1, используя IM46 и (S)-1-(6-метансульфонилпиридин-3-ил)этиламин (полученный из 1-(6-метансульфонилпиридин-3-ил)этанона, аналогично IM24, который получают из коммерчески доступного 5-бром-2-метансульфонил-пиридина, номер по каталогу CAS 98626-95-0). Выход IM46=1,54 г (68%).
1H-ЯМР (500 МГц, ДМСО) δ 8,80 (д, 1H), 8,72 (с, 1H), 8,02 (м, 2H), 7,27 (м, 2H), 7,20 (с, 1H), 7,12 (д, 2H), 5,08 (м, 1H), 3,27 (с, 3H), 2,20 (м, 1H), 1,95 (м, 1H), 1,42 (д, 3H), 1,37 (м, 1H), 1,22 (м, 1H).
LC-MS (m/z): 345,1 (МН+), tR=1,21 мин (способ А).
Соединение 52: [(R)-1-(5-Этоксипиридин-2-ил)-2-гидроксиэтил]амид (1S,2S)-2-фенилциклопропанкарбоновой кислоты
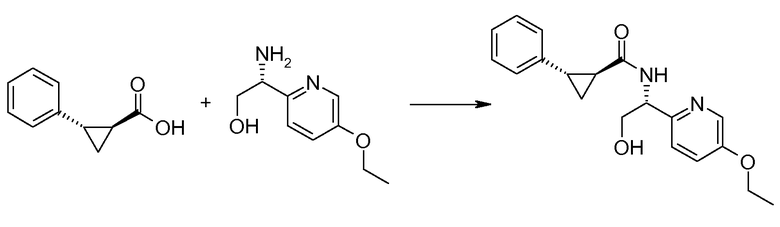
Синтезируют аналогично синтезу Соединения 21, используя IM46 и (R)-2-амино-2-(5-этоксипиридин-2-ил)этанол (получаемый из коммерчески доступного 2-бром-5-этоксипиридина; CAS 42834-01-5, аналогично IM36). Соединение 52, далее очищают SFC (колонка: Chiralpack OJ 250×30 мм, подвижная фаза: сверхкритический СО2/МеОН+NH4OH=55/45, скорость введения 50 мл/мин., температура колонки: 38°С, давление в насадке: 100 бар, температура насадки=60°С, температура испарителя=20°С, температура триммера=25°С, детектор: 220 нм). Выход=163 мг.
1H ЯМР (CDCl3 400 МГц, TMС): δ 8,15 (д, J=2,8 Гц, 1H), 7,08-7,31 (м, 6H), 7,06 (д, J=7,2 Гц, 2H), 5,11-5,15 (м, 1H), 4,00-4,08 (м, 3H), 3,87-3,90 (м, 1H), 2,47-2,52 (м, 1H), 1,63-1,76 (м, 3H), 1,43 (т, J=7,2 Гц, 3H), 1,27-1,31 (м, 1H).
[α]D 20=182,0° (с=0,234 г/100 мл, EtOH).
Анализы in vitro
Никотиновый α7-рецептор ацетилхолина представляет собой проницаемый для кальция ионный канал, активность которого может быть определена путем сверхэкспрессии в клетках млекопитающих или в ооцитах. Эти два индивидуальных анализа описаны в примерах 2 и 3, соответственно.
Пример 2: α7-NNR-потоковый анализ
Никотиновый α7-рецептор ацетилхолина представляет собой проницаемый для кальция ионный канал, активность которого может быть определена путем сверхэкспрессии в клетках млекопитающих или в ооцитах. В этой версии анализа, человеческий α7-рецептор стабильно экспрессировали в крысиной клеточной линии GH4C1. Анализ использовали для идентификации позитивных аллостерических модуляторов (РАМ) α7-рецептора. Активацию канала определяли посредством нагрузки клеток чувствительным к кальцию флуоресцентным красителем Calcium-4 (набор для анализа, выпускаемый фирмой Molecular Devices) и затем в режиме реального времени определяли изменения флуоресценции после обработки тестируемыми соединениями.
Клеточную линию ChanClone GH4C1-nAChR-α7 (от фирмы Genionics) высевали, исходя из замороженного исходного раствора, на 384-луночные планшеты на культуральные среды за 2-3 дня до эксперимента, для получения конфлюентного приблизительно на 80% слоя в день эксперимента.
Культивирование клеток и нагрузка красителем
Клеточную культуру распределяли на размером «22,5 см×22,5 см» планшеты приблизительно в количестве 100×103 клеток на см2. После инкубации в течение четырех суток в увлажненном инкубаторе при температуре 37°С и в присутствии 5% СО2, она «вырастала» до конфлюентного на 80-90% слоя и клетки собирали.
Культуральные среды:
500 мл DMEM/F12 (Gibco 31331)
50 мл FBS (Gibco 10091-155, партия 453269FD)
5 мл пирувата натрия (Gibco 11360)
5 мл пенициллина/стрептомицина (Gibco 15140)
0,1 мг/мл G-418 (Gibco 11811-064)
За два или три дня до эксперимента клетки высевали на 384-луночные планшеты из Greiner bio-one (781946, CELLCOAN, поли-D-лизин, черный, мк-прозрачный).
Среду выливали и планшет промывали с помощью PBS и оставляли высыхать. Добавляли 5 мл трипсина, клетки промывали и инкубировали (при комнатной температуре) в течение примерно 10 секунд. Быстро вводили трипсин и клетки инкубировали в течение 2 минут при температуре 37°С (если клетки уже не отслаивались). Клетки ресуспендировали в 10 мл культуральной среды и переносили в пробирки емкостью 50 мл.
Клеточную суспензию подвергали подсчету (NucleoCounter, полный подсчет клеток) из первых планшетов для оценки общего числа клеток во всей партии.
Клетки высевали на 384-луночные планшеты в количестве 30 мкл на лунку (30000 клеток на лунку), в то время как перемешивали клеточную суспензию или другим образом предотвращали клетки от преципитации.
Планшеты инкубировали при комнатной температуре в течение 30-45 минут.
Планшеты помещали в инкубатор на двое суток (37°С и 5% СО2).
Нагрузка клеток
Буфер для нагрузки представлял собой 5% об./об. набора Calcium-4 и 2,5 мМ пробенецида в буфере для анализа:
190 мл буфера для анализа
10 мл раствора из набора
2 мл 250 мМ пробенецида
Этот объем был достаточным для клеточных пластинок 3×8.
Культуральные среды удаляли из клеточных пластинок и в каждую лунку добавляли 20 мкл буфера для нагрузки. Клеточные пластинки помещали на лотки и инкубировали в течение 90 минут в инкубаторе (37°С). После этого пластинки инкубировали в течение 30 минут при комнатной температуре, однако, защищенными от света.
Теперь клеточные пластинки быстро пропускали через функциональную систему скрининга лекарственного средства (FDSS).
Буфер для анализа представлял собой HBSS с 20 мМ HEPES, рН=7,4, и 3 мМ СаСl2.
Анализ Са посредством FDSS
200 нл 10 мМ раствора соединения в ДМСО разводили в 50 мкл буфера для анализа. Конечные тест-концентрации на клеточных пластинках составляли 20-10-5-2,5-1,25-0,625-0,312-0,156-0,078-0,039 мкМ. Буфер для анализа и 3 мкМ PNU-120596 использовали для контроля.
Агонист ацетилхолин добавляли в конечной концентрации 20 мкМ (примерно ЕС100).
В FDSS7000 проводили измерение Ex480-Em540 с интервалами в 1 секунду. Базовая линия состояла из 5 рамок до добавления тестируемых соединений и более 95 рамок до добавления ацетилхолина. Измерение прекращали 30 рамок после второго добавления.
Необработанные данные для каждой лунки собирали в виде «подсчета максимальной флуоресценции» в интервале 100-131 секунд и в виде «подсчета средней флуоресценции» в интервале 96-100 секунд. Позитивная аллостерическая модуляция при втором добавлении приводила к усилению агонистического ответа с помощью тестируемого соединения по сравнению с одним агонистом.
Результаты рассчитывали в виде % модуляции за счет тестируемого соединения по сравнению со справочным PNU-120596, принятым за 100%. По этим данным строили кривые ЕС50, получая ЕС50, потенциальный барьер и максимальную стимуляцию.
Показано, что соединения согласно данному изобретению являются РАМ α7-рецептора. Соединения согласно настоящему изобретению, охарактеризованные по потоковому анализу, как правило, обладают значениями ЕС50 ниже 20000 нМ или менее, таким как ниже 10000 нМ. Многие соединения фактически имеют значения ЕС50 ниже 5000 нМ. В таблице 1 представлены значения ЕС50 для типичных соединений согласно данному изобретению.
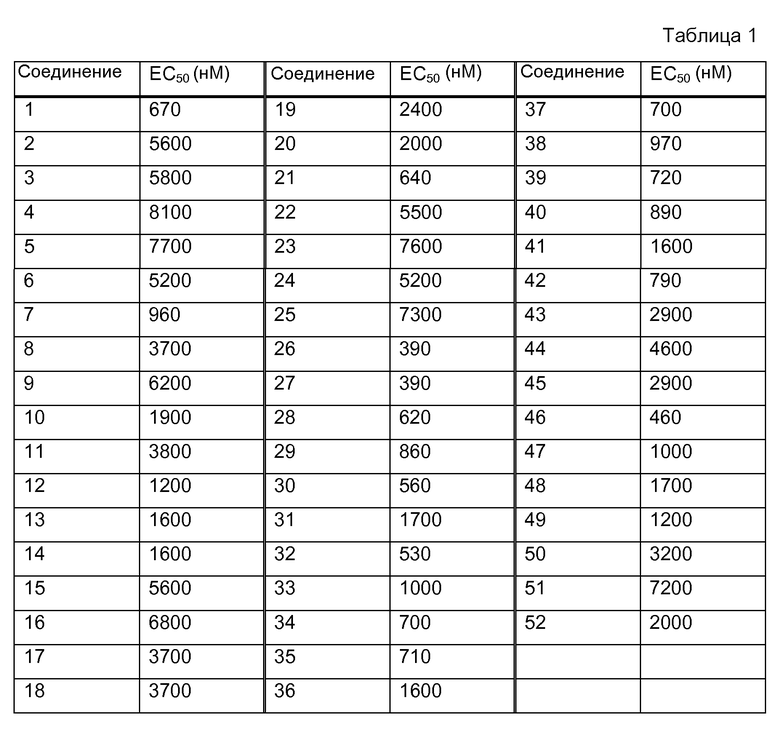
Пример 3: α7NNR-ооцитный анализ
Экспрессия nAChα7-рецепторов в Xenopus ооцитах
Ооциты хирургически удаляли из зрелой самки Xenepus laevis, анестезированной с помощью 0,4% MS-222 в течение 10-15 минут. Ооциты затем рестриктировали при комнатной температуре в течение 2-3 часов с помощью 0,5 мг/мл коллагеназы (тип IA, Sigma-Aldrich) в OR2-буфере (82,5 мМ NaCl, 2,0 мМ KCl, 1,0 мМ MgCl2 и 5,0 мМ HEPES, pH=7,6). Ооциты, избегая фолликулового слоя, отбирали и инкубировали в течение 24 часов в модифицированном солевом буфере Барта (88 мМ NaCl, 1 мМ KCl, 15 мМ HEPES, 2,4 мМ NaHCO3, 0,41 мМ CaCl2, 0,82 мМ MgSO4, 0,3 мМ Са(NO3)2), дополненном 2 мМ пирувата натрия, 0,1 Ед/л пенициллина и 0,1 мкг/л стрептомицина. Ооциты стадии IV идентифицировали и инъецировали с помощью 4,2-48 нл не содержащей нуклеазы воды, содержащей 0,1-1,2 нг кРНК, кодирующей человеческие nAChα7-рецепторы, или 3,0-32 нг кРНК, кодирующей крысиные nAChα7-рецепторы, и инкубировали при температуре 18°С в течение 1-10 суток, если их использовали для электрофизиологических регистраций.
Электрофизиологические регистрации nAChα7-рецепторов, экспрессируемых в ооцитах
Ооциты использовали для электрофизиологических регистраций спустя 1-10 суток после инъекции. Ооциты помещали в 1 мл электролита и перфузировали с помощью буфера Рингера (115 мМ NaCl, 2,5 мМ KCl, 10 мМ HEPES, 1,8 мМ CaCl2, 0,1 мМ MgCl2, рН=7,5). Клетки пронзали закупоренными агаром 0,2-1 МОм электродами, содержащими 3 М KCl и имеющими вольт-кламп при -90 мВ за счет усилителя GeneClamp 500B. Эксперименты осуществляли при комнатной температуре. Ооциты непрерывно перфузировали с помощью буфера Рингера и в перфузате использовали лекарственные средства. Ацетилхолин (30 мкМ), применяемый в течение 30 секунд, использовали в качестве стандартного агониста для активации nAChα7-рецепторов. В стандартной установке для скрининга новое тестируемое соединение 10 мкМ или 30 мкМ) использовали в течение 1 минуты предварительного применения, позволяющего осуществлять оценку агонистической активности, затем посредством, в течение 30 секунд, совместного применения с ACh (30 мкМ), позволяющего осуществлять оценку активности РАМ. Ответную реакцию относительно совместного применения сравнивали с агонистическим ответом, получаемым с помощью одного ацетилхолина. Рассчитывали индуцируемые лекарственным средством эффекты относительно как максимального ответа, так и ответа на полную нагрузку (AUC), таким образом, получая эффект индуцируемой лекарственным средством РАМ-активности в виде кратной модуляции контрольного ответа.
Для более детальных исследований, могут быть построены кривые доза-ответ для оценки максимально кратной модуляции и значений ЕС50 как для максимального, так и AUC ответов.
| название | год | авторы | номер документа |
|---|---|---|---|
| (2S,3R)-N-(2-((3-ПИРИДИНИЛ)МЕТИЛ)-1-АЗАБИЦИКЛО[2.2.2]ОКТ-3-ИЛ)БЕНЗОФУРАН-2-КАРБОКСАМИД, НОВЫЕ СОЛЕВЫЕ ФОРМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2476220C2 |
| ПРОИЗВОДНЫЕ ДИАЗАГОМОАДАМАНТАНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2549551C2 |
| ЗАМЕЩЕННЫЕ N-ФЕНИЛБИПИРРОЛИДИНКАРБОКСАМИДЫ И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕБНЫХ ЦЕЛЯХ | 2008 |
|
RU2477720C2 |
| АРИЛ-ЗАМЕЩЕННЫЕ КАРБОКСАМИДНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ БЛОКАТОРОВ КАЛЬЦИЕВЫХ ИЛИ НАТРИЕВЫХ КАНАЛОВ | 2010 |
|
RU2575168C2 |
| АМИДЫ ДИАЗАБИЦИКЛОАЛКАНОВ, СЕЛЕКТИВНЫЕ В ОТНОШЕНИИ АЦЕТИЛХОЛИНОВОГО ПОДТИПА НИКОТИНОВЫХ РЕЦЕПТОРОВ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБЫ ЛЕЧЕНИЯ С ИХ ИСПОЛЬЗОВАНИЕМ | 2007 |
|
RU2448969C2 |
| Производное пирроло[3,2-b]пиридина, полезное в качестве модулятора мускаринового ацетилхолинового рецептора (mAChR)M1 (mAChR M1) | 2014 |
|
RU2688938C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОИЗВОДНЫЕ ПИРИДОНА | 2012 |
|
RU2585287C2 |
| ЗАМЕЩЕННЫЕ ПИРИДИНОВЫЕ И ПИРАЗИНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE4 | 2014 |
|
RU2802185C2 |
| АМИДЫ ДИАЗАБИЦИКЛОАЛКАНОВ, СЕЛЕКТИВНЫЕ В ОТНОШЕНИИ АЦЕТИЛХОЛИНОВОГО ПОДТИПА НИКОТИНОВЫХ РЕЦЕПТОРОВ | 2007 |
|
RU2517693C2 |
| НЕКОНКУРЕНТНЫЕ АНТАГОНИСТЫ НИКОТИНОВЫХ РЕЦЕПТОРОВ | 2011 |
|
RU2582339C2 |
Изобретение относится к соединениям формулы [I]:
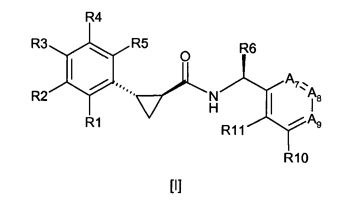
где R1, R2, R3, R4 и R5 означают Н; R6 означает гидроксиметил; А7 означает C-R7, А8 означает N и А9 означает C-R9; R7, R9, R10 и R11 выбирают, независимо друг от друга, из Н, C1-6-алкила, C1-6-алкокси, циано и C1-6-алкилсульфонила, где вышеуказанный C1-6-алкил или C1-6-алкокси необязательно является замещенным одним или более заместителями, выбираемыми из хлора, фтора и C1-6-алкокси; и его фармацевтически приемлемым солям. Соединения являются позитивными аллостерическими модуляторами (РАМ) никотинового α7-рецептора ацетилхолина. 3 н. и 10 з.п. ф-лы, 1 табл., 51 пр.
1. Соединение согласно формуле [I]:

где R1, R2, R3, R4 и R5 означают Н;
R6 означает гидроксиметил;
А7 означает C-R7, А8 означает N и А9 означает C-R9;
R7, R9, R10 и R11 выбирают, независимо друг от друга, из Н, C1-6-алкила, C1-6-алкокси, циано и C1-6-алкилсульфонила, где вышеуказанный C1-6-алкил или C1-6-алкокси необязательно является замещенным одним или более заместителями, выбираемыми из хлора, фтора и C1-6-алкокси;
и его фармацевтически приемлемые соли.
2. Соединение по п. 1, где R7, R8, R9, R10 и R11 выбирают, независимо друг от друга, из Н, C1-4-алкила, C1-4-алкокси и циано, где вышеуказанный C1-4-алкил или C1-4-алкокси необязательно является замещенным одним или более заместителями, выбираемыми из фтора и C1-4-алкокси.
3. Соединение по п. 1, где R7, R10 и R11 означают Н.
4. Соединение по п. 1, где R9 выбирают из метила, C1-4-алкокси или циано, где вышеуказанный метил необязательно является замещенным C1-4-алкокси или одним или более фтором.
5. Соединение по п. 1, выбираемое из:
[(R)-2-гидрокси-1-(6-пропоксипиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
[(R)-2-гидрокси-1-(6-трифторметилпиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
[(R)-2-гидрокси-1-(6-метоксипиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
[(R)-2-гидрокси-1-(6-метилпиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
[(R)-2-гидрокси-1-(6-изопропоксипиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
[(R)-1-(6-этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты;
[(R)-1-(6-этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты;
[(R)-2-гидрокси-1-(6-пропоксипиридин-3-ил)этил]амида (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты;
[(R)-2-гидрокси-1-(6-пропоксипиридин-3-ил)этил]амида (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты;
[(R)-1-(6-(2,2,2-d3)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
[(R)-1-(6-(1,1-d2)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты;
[(R)-1-(6-этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
[(R)-1-(6-(1,1,2,2,2-d5)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты;
[(R)-1-(6-(2,2,2-d3)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты;
[(R)-1-(6-(1,1-d2)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
[(R)-1-(6-(1,1-d2)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты;
[(R)-1-(6-(1,1,2,2,2-d5)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
[(R)-1-(6-(2,2,2-d3)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты;
[(R)-1-(6-циклобутоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты;
[(R)-1-(6-циклобутоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты;
[(R)-1-(6-циклобутоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты;
и фармацевтически приемлемые соли любого из этих соединений.
6. Соединение по п. 1, представляющее собой
[(R)-2-гидрокси-1-(6-пропоксипиридин-3-ил)этил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты или его фармацевтически приемлемую соль.
7. Соединение по п. 1, представляющее собой
[(R)-1-(6-этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(3-фторфенил)циклопропанкарбоновой кислоты или его фармацевтически приемлемую соль.
8. Соединение по п. 1, представляющее собой
[(R)-1-(6-этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты или его фармацевтически приемлемую соль.
9. Соединение по п. 1, представляющее собой
[(R)-2-гидрокси-1-(6-пропоксипиридин-3-ил)этил]амида (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты или его фармацевтически приемлемую соль.
10. Соединение по п. 1, представляющее собой
[(R)-1-(6-этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-фенилциклопропанкарбоновой кислоты или его фармацевтически приемлемую соль.
11. Соединение по п. 1, представляющее собой
[(R)-1-(6-(2,2,2-d3)этоксипиридин-3-ил)-2-гидроксиэтил]амида (1S,2S)-2-(4-фторфенил)циклопропанкарбоновой кислоты или его фармацевтически приемлемую соль.
12. Фармацевтическая композиция, содержащая соединение по любому из пп. 1-11 и один или более фармацевтически приемлемых носителей или эксципиентов, предназначенная для лечения заболевания или нарушения, выбираемого из психоза; шизофрении; когнитивных нарушений; когнитивного ухудшения, ассоциированного с шизофренией; нарушения гиперактивности с дефицитом внимания (ADHD); нарушения спектра аутизма; болезни Альцгеймера (AD); легкого когнитивного ухудшения (MCI); ассоциированного с возрастом ухудшения памяти (AAMi); сенильной деменции; ассоциированной со СПИДом деменции; болезни Пика; ассоциированной с тельцами Леви деменции; ассоциированной с синдромом Дауна деменции; болезни Гентингтона; болезни Паркинсона (PD); обсессивно-компульсивного расстройства (OCD); травматического повреждения головного мозга; эпилепсии; посттравматического стресса; синдрома Вернике-Корсакова (WKS); посттравматической амнезии; когнитивных дефицитов, ассоциированных с депрессией, диабетом, контролем массы, воспалительными нарушениями, ослабленным ангиогенезом; бокового амиотрофического склероза или боли.
13. Набор, включающий соединение по любому из пп. 1-11 вместе со вторым соединением, выбираемым из перечня, состоящего из ингибиторов ацетилхолинэстеразы; антагонистов глутаматного рецептора глутамата; ингибиторов транспорта допамина; ингибиторов транспорта норадреналина; D2-антагонистов; частичных D2-агонистов; PDE10-антагонистов; 5-НТ2А-антагонистов; 5-НТ6-антагонистов; KCNQ-антагонистов; блокаторов литиевого, натриевого канала и энхансеров передачи сигнала GABA, предназначенный для лечения заболевания или нарушения, выбираемого из психоза; шизофрении; когнитивных нарушений; когнитивного ухудшения, ассоциированного с шизофренией; нарушения гиперактивности с дефицитом внимания (ADHD); нарушения спектра аутизма; болезни Альцгеймера (AD); легкого когнитивного ухудшения (MCI); ассоциированного с возрастом ухудшения памяти (AAMi); сенильной деменции; ассоциированной со СПИДом деменции; болезни Пика; ассоциированной с тельцами Леви деменции; ассоциированной с синдромом Дауна деменции; болезни Гентингтона; болезни Паркинсона (PD); обсессивно-компульсивного расстройства (OCD); травматического повреждения головного мозга; эпилепсии; посттравматического стресса; синдрома Вернике-Корсакова (WKS); посттравматической амнезии; когнитивных дефицитов, ассоциированных с депрессией, диабетом, контролем массы, воспалительными нарушениями, ослабленным ангиогенезом; бокового амиотрофического склероза или боли.
| WO 2010137351, A1,02.12.2010 WO 2009043784, A1, 09.04.2009 WO 2004047738, A2, 10.06.2004 ; EA 19518, B1, 30.04.2014 B1. |
Авторы
Даты
2016-12-10—Публикация
2012-07-06—Подача