Уровень техники
Ежегодно миллиарды долларов тратятся на борьбу с насекомыми-вредителями, и еще миллиарды долларов теряются за счет ущерба, который они наносят. Синтетические органические химические инсектициды были основными инструментами, которые использовались для борьбы с насекомыми-вредителями, но биологические инсектициды, такие как инсектицидные белки, полученные из Bacillus thuringiensis (Bt), в некоторых областях сыграли весьма важную роль. Возможность получения устойчивых к насекомым растений посредством трансформации генов инсектицидных Bt-белков привела к революционным преобразованиям в современном сельском хозяйстве, и подчеркнула важность и значение инсектицидных белков и их генов.
Некоторые Bt-белки использовали для создания устойчивых к насекомым трансгенных растений, которые к настоящему времени были успешно зарегистрированы и стали промышленно доступными. Они включают Cry1Ab, Cry1Ac, Cry1Fа и Cry3Bb в кукурузе, Cry1Aс и Cry2Ab в хлопчатнике и Cry3A в картофеле.
Промышленно доступные продукты, экспрессирующие данные белки, экспрессируют один белок, за исключением тех случаев, когда желателен комбинированный спектр 2 инсектицидных белков (например, Cry1Ab и Cry3Bb в комбинации в кукурузе для обеспечения устойчивости соответственно к чешуекрылым вредителям и корневым нематодам), или когда независимое действие белков делает их пригодными в качестве инструмента для задержки развития резистентности у чувствительных популяций насекомых (например, Cry1Aс и Cry2Аb в комбинации в хлопчатнике для обеспечения управления резистентностью у табачной листовертки).
То есть, некоторые свойства устойчивых к насекомым трансгенных растений, которые привели к быстрому и широкому внедрению данной технологии, также дали основание полагать, что в популяциях насекомых будет развиваться резистентность к инсектицидным белкам, продуцированным такими растениями. Было предложено несколько стратегий для того, чтобы сохранить применение Bt-признаков устойчивости к насекомым, которые включают применение действующих белков в высокой дозе в комбинации с «убежищем» и альтернативно с совместным размещением других токсинов (McGaughey et al. (1998) «B.t. Resistance Management», Nature Biotechnol., 16:144-146).
Для белков, выбранных для применения в стеках управления резистентностью насекомых (IRM), требуется проявлять их инсектицидный эффект независимо, так, чтобы резистентность, возникшая к одному белку, не придавала резистентности ко второму белку (т.е. отсутствовала перекрестная резистентность к белкам). Если, например, популяция вредителей, выбранная за счет наличия резистентности к «белку А», одновременно является восприимчивой к «белку В», то заявители утверждают, что отсутствует перекрестная резистентность и что комбинация белка А и белка В будет эффективной в задержке развития резистентности к одному белку А.
При отсутствии резистентных популяций насекомых можно провести прогностические оценки, основанные на других характеристиках, предположительно связанных с механизмом действия и возможностью развития перекрестной резистентности. Было предложено использовать опосредованное рецептором связывание для идентификации инсектицидных белков, для которых, вероятно, не характерна перекрестная резистентность (van Mellaert et al., 1999). Ключевым прогностическим показателем отсутствия перекрестной резистентности в данном подходе является тот факт, что инсектицидные белки не конкурируют за рецепторы у восприимчивых видов насекомых.
В том случае, когда два Bt-токсина конкурируют у насекомых за один и тот же рецептор, и если рецептор мутирует у этого насекомого таким образом, что один из токсинов больше не связывается с рецептором и в результате больше не проявляет инсектицидной активности против этого насекомого, то это может быть случаем, когда у насекомого также будет развиваться резистентность ко второму токсину (который конкурентно связан с тем же рецептором). Однако если два токсина связываются с двумя различными рецепторами, то это может быть показателем того, что насекомое не будет одновременно обладать резистентностью к этим двум токсинам.
Белок Cry1Fa используется для борьбы со многими чешуекрылыми насекомыми, включая кукурузного стеблевого мотылька (Hübner) и кукурузную листовую совку (FAW; Spodoptera frugiperda), и белок активен против огневки сахарного тростника (SCB; Diatraea saccharalis).
Белок Cry1Fa, продуцированный в трансгенных растениях кукурузы, содержащий событие TC1507, ответственен за ведущий в отрасли признак резистентности насекомых в мероприятиях для борьбы с FAW. Белок Cry1Fa также входит в состав продуктов Herculex®, SmartStaxTM и WideStrikeTM.
Возможность проводить исследования, основанные на связывании (конкурентном или гомологичном) с рецептором с использованием белка Cry1Fa была ограничена, поскольку доступный обычный метод введения метки в белки для детектирования в тестах связывания с рецептором приводил к инактивации инсектицидной активности белка Cry1Fa.
Cry1Ab и Cry1Fa являются инсектицидными белками, которые применяются в настоящее время (по отдельности) в трансгенной кукурузе для защиты растений от различных насекомых-вредителей. Ключевым вредителем кукурузы, от которого обеспечивается защита данными белками, является кукурузный стеблевой мотылек (ECB). Патент США № 2008/0311096 относится частично к применению Cry1Ab для борьбы с резистентной к Cry1Fa популяцией ECB.
Сущность изобретения
Настоящее изобретение частично относится к удивительному открытию того, что Cry1Fa является очень активным против популяции огневки сахарного тростника (SCB), которая является резистентной к Cry1Ab. Как это будет понятно специалистам в данной области с помощью данного раскрытия, растения сахарного тростника, которые продуцируют Cry1Fa и Cry1Ab (включая инсектицидные фрагменты полноразмерных белков), будут пригодными для задержки или предупреждения развития резистентности у SCB к любому одному из данных инсектицидных белков.
Краткое описание фигур
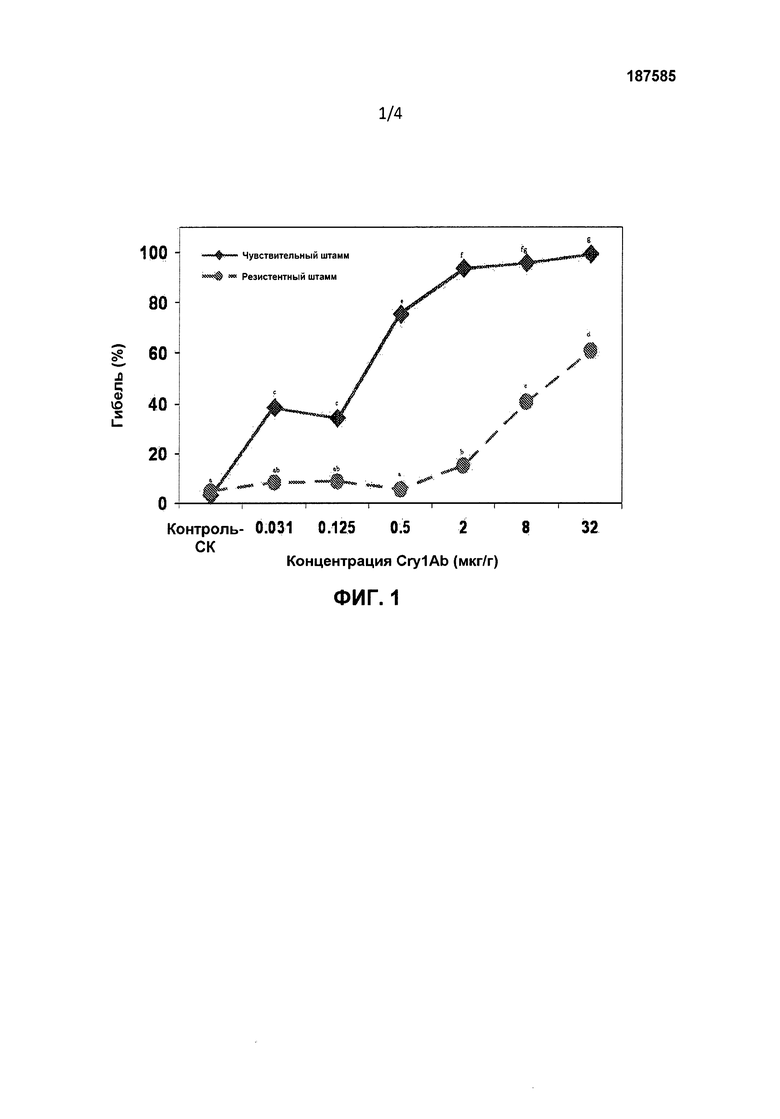
Фигура 1. Гибель (% среднее±стандартная ошибка среднего) Bt-чувствительных и Bt-резистентных штаммов Diatraea saccharalis, находящихся на корме, обработанном белком Cry1Ab Bacillus thuringiensis на 7 сутки после инокуляции. Показатель гибели определяли в виде числа мертвых личинок плюс выжившие личинки, у которых отсутствовали достоверные привесы массы тела (<0,1 мг/личинку) в 7-дневном биологическом тесте, деленное на общее число личинок в тесте. Средние значения по всем обработкам под одной буквой статистически не достоверны (Р<0,05; тест LSMEANS).
Фигура 2. Гибель (% среднее ± стандартная ошибка среднего) Bt-чувствительных и Bt-резистентных штаммов Diatraea saccharalis, находящихся на корме, обработанном белком Cry1Fa Bacillus thuringiensis на 7 сутки после инокуляции. Показатель гибели определяли в виде числа мертвых личинок плюс выжившие личинки, у которых отсутствовали достоверные привесы массы тела (<0,1 мг/личинку) в 7-дневном биологическом тесте, деленное на общее число личинок в тесте. Средние значения по всем обработкам под одной буквой статистически не достоверны (Р<0,05; тест LSMEANS).
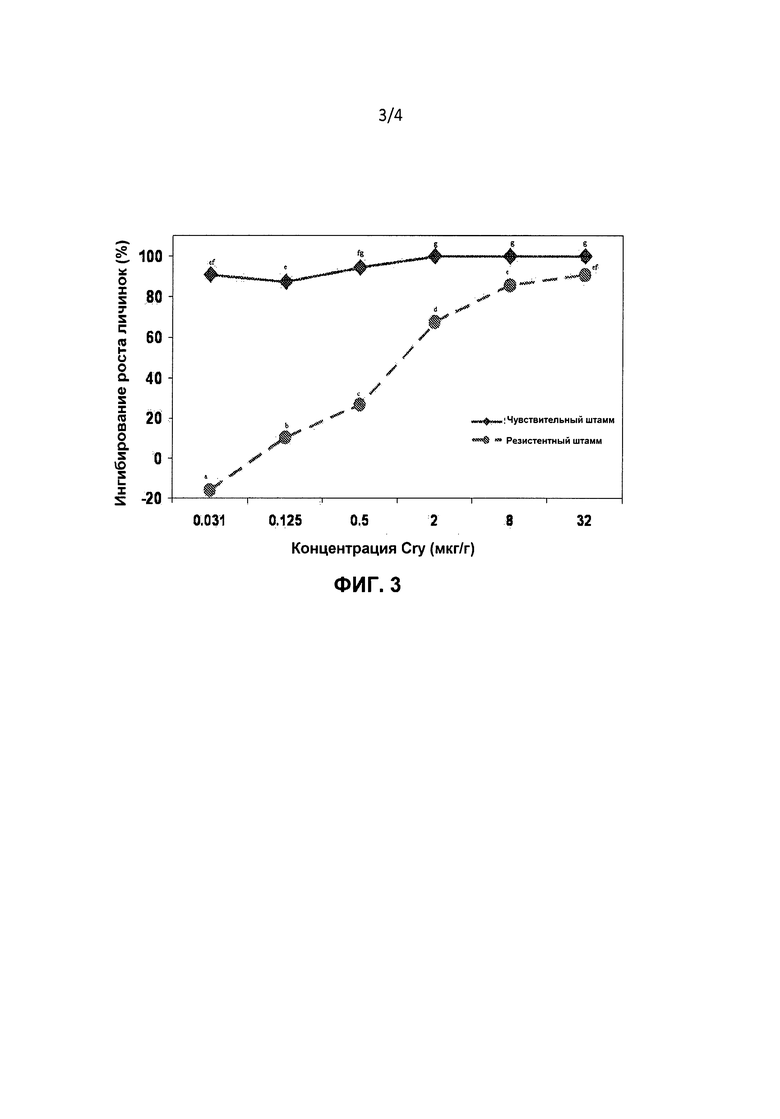
Фигура 3. Ингибирование роста личинок (% среднее ± стандартная ошибка среднего) Bt-чувствительных и Bt-резистентных штаммов Diatraea saccharalis, находящихся на корме, обработанном белком Cry1Ab Bacillus thuringiensis на 7 сутки после инокуляции. Процентные значения рассчитывали с использованием формулы: ингибирование роста (%)=100 * (масса тела личинок, находившихся на необработанном контрольном корме - масса тела личинок, находившихся на корме с Cry1Ab)/(масса тела личинок, находившихся на необработанном контрольном корме). 100% ингибирование роста относили к репликации, если отсутствовали достоверные привесы (<0,1 мг/личинку). Средние значения по всем обработкам под одной буквой статистически не достоверны (Р<0,05; тест LSMEANS).
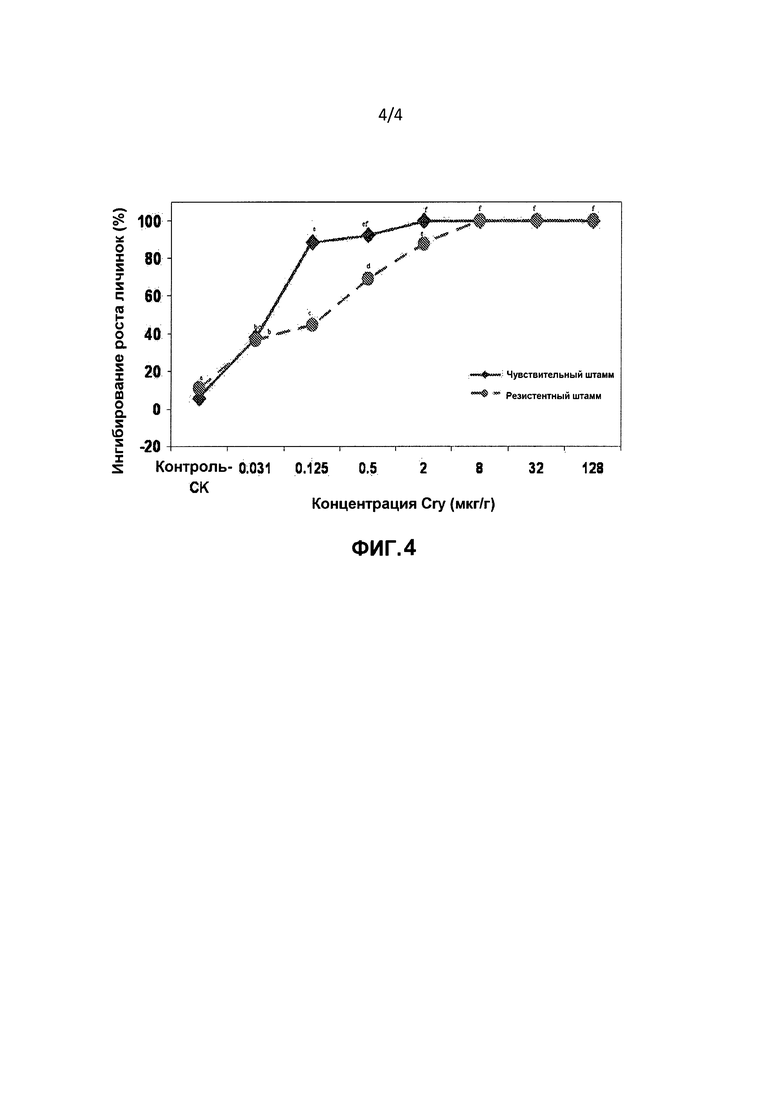
Фигура 4. Ингибирование роста личинок (% среднее ± стандартная ошибка среднего) Bt-чувствительных и Bt-резистентных штаммов Diatraea saccharalis, находящихся на корме, обработанном белком Cry1Fa Bacillus thuringiensis на 7 сутки после инокуляции. Процентные значения рассчитывали с использованием формулы:
ингибирование роста (%)=100 * (масса тела личинок, находившихся на контрольном корме, обработанном только буфером - масса тела личинок, находившихся на Bt-корме или необработанном корме (чистый контроль))/(масса тела личинок, находившихся на контрольном корме, обработанном только буфером). 100% ингибирование роста относили к репликации, если отсутствовали достоверные привесы (<0,1 мг/личинку). Средние значения по всем обработкам под одной буквой статистически не достоверны (Р<0,05; тест LSMEANS).
Подробное описание изобретения
Настоящее изобретение частично относится к удивительному открытию того, что Cry1Fa является очень активным против популяции огневки сахарного тростника (SCB; Diatraea saccharalis), которая резистентна к Cry1Ab. Следовательно, настоящее изобретение частично относится к удивительному открытию того, что Cry1Fa можно использовать в комбинации с или «в стеке» с Cry1Ab в сахарном тростнике для борьбы с развитием резистентности у SCB к любому одному из данных инсектицидных белков. Говоря иначе, настоящее изобретение частично относится к удивительному открытию того, что популяция огневки сахарного тростника, выбранная по причине резистентности к Cry1Ab, не является резистентной к Cry1Fa; огневка сахарного тростника, резистентная к токсину Cry1Ab, чувствительна (т.е. не обладает перекрестной резистентностью) к Cry1Fa. Таким образом, настоящее изобретение включает применение Cry1Fa-токсина на сахарном тростнике для борьбы с популяциями огневки сахарного тростника, которые резистентны к Cry1Ab.
Как будет понятно специалистам в данной области с помощью данного раскрытия, растения сахарного тростника, экспрессирующие cry1Fa и cry1Ab (включая их инсектицидные фрагменты), будут пригодными для задержки или предупреждения развития резистентности SCB к любому одному из данных инсектицидных белков.
Настоящее изобретение включает применение Cry1Fa и Cry1Ab для защиты сахарного тростника от повреждения и потерь урожая, вызванных огневкой сахарного тростника или популяциями огневки сахарного тростника, у которых развилась резистентность к Cry1Ab.
Таким образом, настоящее изобретение относится к стеку IRM для подавления развития резистентности к Cry1Ab и/или Cry1Fa у огневки сахарного тростника.
Частично основываясь на данных, описанных в настоящем документе, совместная экспрессия генов cry1Ab и cry1Fa в сахарном тростнике может продуцировать высокую дозу стека IRM для контроля SCB. К данной комбинации можно добавить другие белки для расширения спектра действия.
На основании этих данных можно предположить, что Cry1Fa будет эффективным в контроле популяций SCB, у которых развилась резистентность к Cry1Ab. Одной возможностью внедрения является применение данных Сгу-белков в географических зонах, в которых Cry1Ab стал неэффективным в борьбе с SCB за счет развития резистентности. Другой возможностью внедрения будет применение одного или обоих таких Cry-белков в комбинации с Cry1Ab для подавления развития резистентности у SCB к Cry1Ab.
Химерные токсины по настоящему изобретению включают полный N-концевой фрагмент, соответствующий коревому токсину Bt-токсина, в той же точке после конца фрагмента токсина белок имеет переход в гетерологичную последовательность протоксина. N-концевой фрагмент токсина в Bt-токсине далее, относится к «коревому токсину». Переход в сегмент гетерологичного протоксина имеет место примерно в соединении токсина/протоксина, или альтернативно фрагмент нативного протоксина (простирающийся за фрагментом коревого токсина) может сохраниться, с переходом в гетерологичный протоксин, расположенным даунстрим.
В качестве примера один химерный токсин по настоящему изобретению содержит полный фрагмент коревого токсина Cry1Ab (аминокислоты 1-601) и гетерологичный протоксин (аминокислоты 602 до С-конца). В одном предпочтительном варианте осуществления фрагмент химерного токсина, содержащий протоксин, получают из белка-токсина Cry1Ab. В качестве второго примера второй химерный токсин по настоящему изобретению содержит полный фрагмент коревого токсина Cry1Ca (аминокислоты 1-619) и гетерологичный протоксин (аминокислоты 620 до С-конца). В предпочтительном варианте осуществления фрагмент химерного токсина, содержащий протоксин, получают из белка-токсина Cry1Ab (указанное выше также относится к инсектицидным белкам Cry1Fa). Если не указано иначе, то последовательности можно получить, как описано в заявке на патент США №2008/0311096.
Специалистам в данной области, очевидно, понятно, что Bt-токсины, даже внутри определенного класса, такого как Cry1Fa или Cry1Ab, до некоторой степени будут варьировать в длине и точном положении перехода от фрагмента корового токсина к фрагменту протоксина. Как правило, токсины Cry1Fa имеют длину примерно от 1150 до примерно 1200 аминокислот. Обычно переход от фрагмента токсина к фрагменту протоксина составляет примерно от 50% до примерно 60% от полной длины токсина. Химерный токсин по настоящему изобретению будет включать полную экспансию данного N-концевого фрагмента корового токсина. Таким образом, химерный токсин будет включать, по меньшей мере, примерно 50% от полной длины Cry1Fa или Cry1Ab Bt-токсина. Это будет составлять, по меньшей мере, примерно 590 аминокислот. В отношении фрагмента протоксина, то полная экспансия фрагмента протоксина Cry1Ab простирается от конца фрагмента токсина до С-конца молекулы. Это примерно последние 100-150 аминокислот данного фрагмента, которые являются наиболее важными для включения в химерный токсин по настоящему изобретению.
Гены и токсины. Гены и токсины, пригодные для применения по настоящему изобретению, включают не только раскрытые полноразмерные последовательности, но также фрагменты данных последовательностей, варианты, мутанты и слитые белки, которые сохраняют специфическую пестицидную активность токсинов, конкретно приведенных в качестве примера. В том смысле, в котором в данном документе используются термины «варианты» или «вариации» генов, они относятся к нуклеотидным последовательностям, которые кодируют одни и те же токсины, или которые кодируют эквивалентные токсины, обладающие пестицидной активностью. В том смысле, в котором в данном документе используется термин «эквивалентные токсины», он относится к токсинам, обладающим такой же или по существу такой же биологической активностью против вредителей-мишеней, как и токсины по настоящему изобретению.
В том смысле, в котором в данном документе используется этот термин, границы представляют примерно 95% (Cry1Ab's и Cry1Fa's), 78% (Cry1Ab's и Cry1Fa's) и 45% (Cryl's) идентичность последовательностей согласно «Revision of the Nomenclature for the Bacillus thuringiensis Pesticidal Crystal Proteins», N.Crickmore, D.R.Zeigler, J.Feitelson, E.Schnepf, J.Van Rie, D.Lereclus, J.Baum and D.H.Dean. Microbiology and Molecular Biology Reviews (1998), Vol.62:807-813. Эти пороги отсечения молекулярной массы также могут быть применимы только к коровым токсинам (для токсинов Cry1Ab и Cry1Fa).
Специалистам в данной области, очевидно, понятно, что гены, кодирующие активные токсины, можно идентифицировать и получить несколькими способами. Конкретные гены или фрагменты генов, приведенные в качестве примера, можно получить из изолятов, депозированных в коллекции культур, как описано выше. Данные гены или их фрагменты, или варианты, также можно сконструировать синтетическим путем, например, при использовании синтезатора генов. Вариации генов можно легко сконструировать с использованием обычных способов получения точечных мутаций. Также фрагменты данных генов можно получить с использованием промышленно доступных экзонуклеаз или эндонуклеаз, следуя стандартным процедурам. Например, можно использовать ферменты, такие как Ва131, или сайт-направленный мутагенез для методичного отсечения нуклеотидов от концов таких генов. Также гены, которые кодируют активные фрагменты, можно получить с использованием различных рестриктаз. Протеазы можно использовать для непосредственного получения активных фрагментов данных токсинов.
Фрагменты и эквивалентные варианты, которые сохраняют пестицидную активность приведенных в качестве примера токсинов, будут находиться в объеме настоящего изобретения. Также за счет вырожденности генетического кода широкий ряд различных ДНК-последовательностей может кодировать аминокислотные последовательности, раскрытые в данном документе. Специалистам в данной области хорошо известно получение таких альтернативных ДНК-последовательностей, кодирующих одни и те же или по существу одни и те же токсины. Такие вариантные ДНК-последовательности находятся в объеме настоящего изобретения. В том смысле, в котором в данном документе используется термин «по существу одни и те же» последовательности, он относится к последовательностям, которые имеют аминокислотные замены, делеции, добавления или инсерции, которые не оказывают существенного отрицательного влияния на пестицидную активность. Фрагменты генов, кодирующих белки, которые сохраняют пестицидную активность, также входят в объем данного определения.
Дополнительным способом идентификации генов, кодирующих токсины, и фрагментов генов, пригодных для настоящего изобретения, является применение олигонуклеотидных зондов. Такие зонды представляют детектируемые нуклеотидные последовательности. Эти последовательности можно детектировать с использованием соответствующей метки или их можно сделать изначально флуоресцентными, как описано в международной заявке W093/16094. Как хорошо известно в данной области, если молекула зонда и образец нуклеиновой кислоты гибридизуются с образованием сильной связи между двумя молекулами, то разумно предположить, что зонд и образец имеют значительную гомологию. Предпочтительно гибридизацию проводят в жестких условиях с использованием методов, известных в данной области, описанных, например, Keller G.H., M.M.Manak (1987) DNA Probes, Stockton Press, New York, N.Y., pp.169-170. Некоторые примеры концентраций солей и комбинаций температуры являются следующими (в порядке увеличения жесткости): 2Х SSPE или SSC при комнатной температуре; 1X SSPE или SSC при 42°С; 0,1X SSPE или SSC при 42°С; 0,1X SSPE или SSC при 65°С. Детектирование зонда обеспечивает способ определения известным путем того, имела ли место гибридизация. Такой анализ зонда обеспечивает быстрый способ идентификации генов, кодирующих токсины по настоящему изобретению. Нуклеотидные сегменты, которые используются в качестве зондов по изобретению, можно синтезировать с использованием ДНК-синтезатора и стандартных методов. Такие нуклеотидные последовательности также можно использовать в качестве ПЦР-праймеров для амплификации генов по настоящему изобретению.
Некоторые токсины по настоящему изобретению конкретно приводятся в качестве примера в данном документе. Поскольку данные токсины являются только примерами токсинов по настоящему изобретению, то, очевидно, понятно, что настоящее изобретение включает вариантные или эквивалентные токсины (и нуклеотидные последовательности, кодирующие эквивалентные токсины), обладающие такой же или аналогичной пестицидной активностью примерного токсина. Эквивалентные токсины должны обладать аминокислотной гомологией с примерным токсином. Как правило, такая аминокислотная гомология будет составлять более 75%, предпочтительно более 90% и наиболее предпочтительно более 95%. Аминокислотная гомология будет наиболее высокой в наиболее важных областях токсина, которые отвечают за биологическую активность или принимают участие в определении трехмерной конфигурации, которая в конечном итоге ответственна за биологическую активность. В этом отношении приемлемы некоторые аминокислотные замены, и можно ожидать, что такие замены находятся в областях, которые не являются важными для проявления активности, или представляют собой консервативные аминокислотные замены, которые не оказывают отрицательного влияния на трехмерную конфигурацию молекулы. Например, аминокислоты можно разделить на следующие классы: неполярные, незаряженные полярные, основные и кислые. Консервативные замены, посредством которых аминокислота одного класса замещается другой аминокислотой того же типа, находятся в объеме настоящего изобретения, при условии, что замена существенно не изменяет биологическую активность соединения. Ниже приводится перечень примеров аминокислот, относящихся к каждому классу.
В некоторых случаях также можно провести неконсервативные замены. Критическим фактором является то, что такие замены не должны существенно снижать биологическую активность токсина.
Рекомбинантные хозяева. Гены, кодирующие токсины по настоящему изобретению, можно ввести в широкий ряд микробных или растительных хозяев. Экспрессия гена токсина, прямо или опосредованно, приводит к внутриклеточной продукции и сохранению пестицида. Конъюгационный перенос и рекомбинантный перенос можно использовать для получения Bt-штамма, который экспрессирует оба токсина по настоящему изобретению. Также можно трансформировать другие микроорганизмы-хозяева одним или обоими генами токсинов для получения синергического эффекта. Относительно подходящих микроорганизмов-хозяев, например, Pseudomonas, то микробы можно применить в положение вредителя, где они будут пролиферировать и поглощаться. Результатом является борьба с вредителем. Альтернативно микроорганизм, содержащий ген токсина, можно обработать в условиях, которые пролонгируют активность токсина и стабилизируют клетку. Затем на обработанную клетку, которая сохраняет токсическую активность, можно воздействовать средой вредителя-мишени.
В том случае, когда ген Bt-токсина вводят в микроорганизм-хозяин с помощью подходящего вектора, и на указанный хозяин воздействуют средой в живом состоянии, то важно, чтобы использовались определенные микроорганизмы-хозяева. Выбирают микроорганизмы-хозяева, о которых известно, что они обитают в «фитосфере» (филлоплане, филлосфере, ризосфере и/или ризоплане) одной или более интересующих культур. Данные микроорганизмы выбирают таким образом, чтобы они были способны успешно конкурировать в определенной окружающей среде (культура и другие насекомые-обитатели) с микроорганизмами дикого типа для обеспечения стабильного поддержания и экспрессии гена, экспрессирующего полипептид-пестицид, и желательно, обеспечения повышенной защиты пестицида от деградации и инактивации в окружающей среде.
Известно большое количество микроорганизмов, которые обитают в филлоплане (на поверхности листьев растений) и/или ризосфере (в почве, окружающей корни растений) широкого ряда важных сельскохозяйственных культур. Такие микроорганизмы включают бактерии, водоросли и грибы. Особый интерес представляют микроорганизмы, такие как бактерии, например, родов Pseudomonas, Erwinia, Serratia, Klebsiella, Xanthomonas, Streptomyces, Rhizobium, Rhodopseudomonas, Methylophillius, Agrobactenum, Acetobacter, Lactobacillus, Arthrobacter, Azobacter, Leuconostoc и Alacaligenes; грибы, в частности, дрожжи, например, родов Saccharomyces, Cryptococcus, Kluyveromyces, Sporobolomyces, Rhodotorula и Aureobasidium. Особый интерес представляют такие виды бактерий, которые обитают в фитосфере, как Pseudomonas syringae, Pseudomonas fluorescens, Serratia marcescens, Acetobacter xylinum, Agrobactenium tumefaciens, Rhodopseudomonas spheroids, Xanthomonas campestris, Rhizobium melioti, Alcaligenes entrophus и Azobacter vinlandii, и виды дрожжей фитосферы, такие как Rhodotorula rubra, R. glutinis, R. marina, R. aurantiaca, Cryptococcus albidus, C. diffluens, C. laurentii, Saccharomyces rosei, S. pretoriensis, S. cerevisiae, Sporobolomyces roseus, S. odorus, Kluyveromyces veronae и Aureobasidium pollulans. Особый интерес представляют пигментированные микроорганизмы.
Имеется большое количество способов интродукции Bt-гена, кодирующего токсин, в микроорганизм-хозяин в условиях, которые обеспечивают стабильное сохранение и экспрессию гена. Эти способы хорошо известны специалистам в данной области и описаны, например, в патенте США №5135867, который включен в данный документ для сведения.
Обработка клеток. Bacillus thuringiensis или рекомбинантные клетки, экспрессирующие Bt-токсины, можно обработать для пролонгирования активности токсинов и стабилизации клетки. Пестицидная микрокапсула, которая образуется, содержит Bt-токсин или Bt-токсины в клеточной структуре, которая стабилизирована и будет защищать токсин, когда микрокапсула подвергается воздействию окружающей среды вредителя-мишени. Подходящие клетки-хозяева могут включать прокариоты или эукариоты, и обычно ограничиваются клетками, которые не продуцируют веществ, токсичных для высших организмов, таких как млекопитающие. Однако можно использовать микроорганизмы, которые продуцируют вещества, токсичные для высших организмов, в том случае, когда токсичные вещества являются нестабильными, или их содержание является достаточно низким для того, чтобы избежать проявления любой возможной токсичности для млекопитающего-хозяина. В качестве хозяев особый интерес представляют прокариоты и низшие эукариоты, такие как грибы.
При обработке обычно клетки должны быть интактными и в основном находиться в пролиферативной форме, лучше не в форме спор, хотя, в некоторых случаях можно использовать споры.
Обработку клетки микроорганизма, например, микроорганизма, содержащего ген или гены Bt-токсина, можно проводить химическим или физическим методами, или комбинацией химического и/или физического методов, при условии, что метод не оказывает отрицательного влияния на свойства токсина и не снижает способности клеток защищать токсин. Примерами химических реагентов являются галогенированные соединения, в частности, галогенсодержащие соединения с 17-80 атомами. Конкретнее, можно использовать иод в мягких условиях и в течение достаточного периода времени для достижения желаемых результатов. Другие подходящие способы включают обработку альдегидами, такими как глутаральдегид; противоинфекционными препаратами, такими как зефиран хлорид и цетилпиридиний хлорид; спиртами, такими как изопропиловый и этиловый спирт; различными гистологическими фиксаторами, такими как йодный раствор Люголя, фиксатор Буэна, различные кислоты и фиксатор Хелли (смотри Humason, Gretchen L., Animal Tissue Techniques, W.H.Freeman and Company, 1967) или обработку комбинацией физического (нагревание) и химического агентов, которые сохраняют и пролонгируют активность токсина, продуцированного в клетке, когда клетку вводят в среду хозяина. Примерами физических методов являются коротковолновое облучение, такое как гамма-облучение, и рентгеновское облучение, УФ-облучение, лиофилизация и тому подобное. Способы обработки клеток микроорганизмов раскрыты в патентах США №4695455 и 4695462, которые включены в данный документ для сведения.
Как правило, клетки имеют повышенную стабильность структуры, которая повышает устойчивость к воздействию условий окружающей среды. В тех случаях, когда пестицид находится в проформе, то метод обработки клеток следует выбрать таким образом, чтобы не ингибировать процессинг проформы в зрелую форму пестицида под действием патогена вредителя-мишени. Например, формальдегид будет поперечно сшивать белки и может ингибировать процессинг проформы полипептида-пестицида. Способ обработки должен сохранять, по меньшей мере, значительную часть биологической доступности или биологической активности токсина.
Характеристики, представляющие особый интерес при выборе клетки-хозяина для целей продукции, включают простоту введения Bt-гена или Bt-генов хозяину, доступность экспрессионных систем, эффективность экспрессии, стабильность пестицида в хозяине и наличие дополнительных генетических свойств. Характеристики, представляющие особый интерес для применения в качестве микрокапсулы пестицида, включают защитные свойства для пестицида, такие как толщина клеточных стенок, пигментация и внутриклеточная упаковка или образование телец включения/выживаемость в водной среде; отсутствие токсичности для млекопитающих; привлекательность для захвата вредителями; простота в индукции гибели и фиксации без повреждения токсина и тому подобное. Другие факторы включают простоту формуляции и обращения, экономические соображения, стабильность при хранении и тому подобное.
Рост клеток. Клетку-хозяин, содержащую инсектицидный Bt-ген или Bt-гены, можно культивировать в любой обычной питательной среде, в которой ДНК-конструкция обеспечивает избирательное преимущество, обеспечивая селективную среду, в которой по существу все или все клетки сохраняют Bt-ген. Затем можно собрать такие клетки с использованием обычных методов. Альтернативно клетки можно обработать до сбора.
Bt-клетки, продуцирующие токсины по изобретению, можно культивировать с использованием обычных в данной области сред и методов ферментации. После осуществления цикла ферментации бактерии можно собрать первым отделением спор и кристаллов Bt из культурального бульона способами, известными в данной области. Выделенные споры и кристаллы Bt можно формулировать в виде смачиваемого порошка, жидкого концентрата, гранул и других препаративных форм с добавлением поверхностно-активных веществ, диспергаторов, инертных носителей и других компонентов для облегчения обращения с ними и их применения против конкретных вредителей-мишеней. Такие препаративные формы и способы применения известны в данной области.
Препаративные формы. Формулированные гранулы-приманки, содержащие аттрактант и споры, кристаллы и токсины Bt-изолятов, или рекомбинантные микроорганизмы, содержащие гены, полученные из Bt-изолятов, раскрытых в данном документе, можно вносить в почву. Формулированный продукт также можно применять в виде покрытия семян или агента для обработки корней, общей обработки растений на более поздних стадиях вегетационного периода. Для обработки растений и почвы Bt-клетками можно использовать смачиваемые порошки, гранулы или дусты, которые получают смешением с различными инертными веществами, такими как неорганические минеральные вещества (филлосиликаты, карбонаты, сульфаты, фосфаты и тому подобное) или материалы растительного происхождения (такие как измельченная сердцевина кукурузного початка, рисовая шелуха, скорлупа орехов и тому подобное). Препаративные формы могут включать адъюванты прилипатели, стабилизирующие агенты, другие пестицидные добавки или поверхностно-активные вещества. Жидкие Препаративные формы могут быть на водной или неводной основе, и их можно применять в виде пен, гелей, суспензий, эмульгируемых концентратов или тому подобное. Ингредиенты могут включать реологическую добавку, поверхностно-активные вещества, диспергаторы или полимеры.
Специалистам в данной области, очевидно, понятно, что концентрация пестицида будет варьировать в широких пределах в зависимости от природы конкретной формуляции, в частности, является ли она концентратом или предназначена для непосредственного применения. Пестицид будет находиться в концентрации, составляющей, по меньшей мере, 1% мас., или концентрация может равняться 100% мас. Сухие препаративные формы будут содержать примерно 1-95% мас. пестицида, в то время как жидкие препаративные формы обычно будут содержать примерно 1-60% мас. твердых частиц в жидкой фазе. В препаративных формах обычно будет находиться примерно от 102 до примерно 104 клеток/мг. Такие препаративные формы будут применяться в количествах примерно от 50 мг (жидкость или сухое вещество) до 1 кг или более на га.
Препаративные формы можно применять в среде обитания чешуекрылого вредителя, например, на листья или в почву, опрыскиванием, опылением, поливом или тому подобное.
Трансформация растений. Предпочтительный рекомбинантный хозяин для продукции инсектицидных белков по настоящему изобретению представляет собой трансформированное растение. Гены, кодирующие Bt-белки токсины, раскрытые в данном документе, можно вставить в растительные клетки с использованием различных способов, хорошо известных в данной области. Например, имеется большое количество клонирующих векторов, содержащих репликационную систему Escherichia coli, и маркер, который позволяет отобрать трансформированные клетки для проведения инсерции чужеродных генов в высшие растения. Векторы включают, среди прочего, например, pBR322, серии pUC, серии M13mp, pACYC184. Следовательно, фрагмент ДНК, содержащий последовательность, кодирующую Bt-белок токсин, можно вставить в вектор в подходящем сайте рестрикции. Полученную плазмиду используют для трансформации Е. coli. Клетки Е. coli культивируют в подходящей питательной среде, затем собирают и лизируют. Плазмиду выделяют.Как правило, проводят анализ последовательности, рестрикционный анализ, электрофорез и используют другие биохимические-молекулярные биологические методы в качестве методов анализа. После каждой манипуляции используемую ДНК-последовательность можно расщепить и присоединить к следующей ДНК-последовательности. Каждую последовательность плазмиды можно клонировать в одну и ту же или разные плазмиды. В зависимости от способа вставки желаемых генов в растение, могут быть необходимы другие ДНК-последовательности. Например, если для трансформации растительной клетки используют Ti- или Ri-плазмиду, то, по меньшей мере, правую границу, но часто правую и левую границу Т-ДНК Ti- или Ri-плазмиды, следует соединить в виде фланкирующей области генов, предназначенных для вставки. Применение Т-ДНК для трансформации растительных клеток интенсивно исследовалось и в достаточной мере описано в Европейском патенте 120516, Lee and Gelvin (2008), Hoekema (1985), Fraley et al. (1986) и An et al. (1985), и хорошо известно в данной области.
После интеграции вставленной ДНК в геном растения она является относительно стабильной. Обычно вектор для трансформации содержит селектируемый маркер, который придает трансформированным растительным клеткам резистентность, среди прочего, к биоциду или антибиотику, такому как биалафос, канамицин, G418, блеомицин или гигромицин. Индивидуально используемый маркер, следовательно, позволит отобрать трансформированные клетки лучше, чем клетки, которые не содержат вставленную ДНК.
Имеется большое количество методов для инсерции ДНК в растительную клетку-хозяин. Такие методы включают трансформацию Т-ДНК с использованием Agrobacterium tumefaciens или Agrobacterium rhizogenes в качестве трансформирующего агента, слияние, инъекцию, биологическую баллистику (бомбардировку микрочастицами) или электропорацию, а также другие возможные методы. Если для трансформации используют Agrobacteria, то ДНК, предназначенную для вставки, клонируют в специальные плазмиды, а именно в промежуточный вектор или бинарный вектор. Промежуточные векторы можно интегрировать в Ti- или Ri-плазмиду гомологичной рекомбинацией благодаря последовательностям, которые являются гомологичными к последовательностям Т-ДНК. Ti- или Ri-плазмида также содержит vir-область, необходимую для переноса Т-ДНК. Промежуточные векторы не могут реплицироваться самостоятельно в Agrobacteria. Промежуточный вектор можно перенести в Agrobacterium tumefaciens с помощью плазмиды-хелпера (конъюгацией). Бинарные векторы могут реплицироваться в Е. coli и Agrobacteria. Они включают селективный ген-маркер и линкер или полилинкер, который вставлен в рамку из правой и левой пограничных областей Т-ДНК. Их можно непосредственно трансформировать в Agrobacteria (Holsters et al., 1978). При использовании в качестве клетки-хозяина Agrobacterium должны содержать плазмиду, несущую vir-область. Vir-область необходима для переноса Т-ДНК в растительную клетку. Могут содержаться дополнительные Т-ДНК. Трансформированную таким образом бактерию используют для трансформации растительных клеток. Экспланты растений преимущественно можно культивировать с Agrobacterium tumefaciens или Agrobacterium rhizogenes для переноса ДНК в растительную клетку. Затем можно регенерировать целые растения из инфицированного растительного материала (например, кусочков листа, сегментов стебля, корней, а также протопластов или культивированных в суспензии клеток) в подходящей среде, которая может содержать антибиотики или биоциды по изобретению. Затем полученные таким образом растения можно тестировать на присутствие вставленной ДНК. Отсутствуют особые требования в отношении плазмид в случае методов инъекции и электропорации. Можно использовать обычные плазмиды, например, такие как производные pUC.
Трансформированные клетки развиваются в растениях обычным путем. Они могут образовать зародышевые клетки и передать трансформированный признак(и) потомству растений. Такие растения можно выращивать обычным путем и скрещивать с растениями, которые имеют те же трансформированные наследственные факторы или другие наследственные факторы. Полученные гибриды имеют соответствующие фенотипические свойства.
В предпочтительном варианте осуществления настоящего изобретения растения следует трансформировать генами, в которых кодон предпочтительно оптимизирован для применения в растениях. Смотри, например, патент США №5380831, который включен в данный документ для сведения. Несмотря на то, что в данном документе в качестве примера приводятся усеченные токсины, хорошо известно в области Bt-токсинов, что токсины массой 130 kDa (полная длина) имеют N-концевой фрагмент, который является коровым токсином, и С-концевой фрагмент является «хвостом» протоксина. Таким образом, соответствующие «хвосты» можно использовать с усеченными/коревыми токсинами по настоящему изобретению. Смотри, например, патент США №6218188 и патент США №6673990. Кроме того, в данной области известны способы получения синтетических Bt-генов для применения в растениях (Stewart and Burgin, 2007). Одним неограничивающим примером предпочтительного трансформированного растения является фертильное растение кукурузы, содержащее экспрессируемый в растении ген, кодирующий белок Cry1Fa, и дополнительно содержащее второй экспрессируемый в растении ген, кодирующий белок Cry1Ab.
Перенос (или интрогрессию) признака(ов), определяемого Cry1Ab и Cry1Fa, в инбредные линии кукурузы можно осуществить рекуррентной селекцией, например, обратным скрещиванием. В этом случае требуемую рекуррентную родительскую форму вначале скрещивают с инбредным донором (нерекуррентной родительской формой), который несет соответствующий ген(ы) для признаков, определяемых Cry1Ab и Cry1Fa. Потомство данного гибрида затем обратно скрещивают с рекуррентной родительской формой с последующей селекцией полученного потомства на требуемый признак(признаки), который предназначен для переноса от нерекуррентной родительской формы. После трех, предпочтительно, четырех, более предпочтительно пяти и более поколений обратных гибридов с рекуррентной родительской формой с селекцией на требуемый признак(и), потомство будет гетерозиготным в отношении локусов, контролирующих признак(и), который переносится, но будет таким же как рекуррентная родительская форма в отношении большинства или почти всех других генов (смотри, например, Poehlman&Sleper (1995) Breeding Field Crops, 4th Ed., 172-175; Fehr (1987) Principles of Cultivar Development, Vol.1: Theory and Technique, 360-376).
Стратегии управления резистентностью насекомых (IBM). Например, Roush et al. описывают стратегии, основанные на двух токсинах, так называемое «нагромождение» или «стекинг» для контроля инсектицидных трансгенных культур (The Royal Society. Phil. Trans. R. Soc. Lond. B. (1998) 353, 1777-1786). На веб-сайте Агентства по защите окружающей среды США (epa.gov/oppbppdl/biopesticides/pips/bt_corn_refuge_2006.htm) приводятся следующие указания для обеспечения нетрансгенных убежищ (раздел не-Bt культуры/кукуруза) для применения с трансгенными культурами.
«Специфическими структурированными требованиями для Bt-защищенной (Cry1Ab и Cry1Fa) кукурузы от кукурузного стеблевого мотылька продукты являются следующими:
структурированные убежища: 20% убежищ не-чешуекрылых с Bt-кукурузой в Кукурузном поясе; 50% убежищ не-чешуекрылых с Bt-кукурузой в Кукурузном поясе
Блоки
1. Внутренний (т.е. в Bt-поле)
2. Внешний (т.е. отдельные поля в пределах 1/2 мили (1/4 мили, если возможно) от Bt-поля для максимального произвольного скрещивания)
Полосы в поле
Полосы должны иметь ширину, по меньшей мере, 4 ряда (предпочтительно 6 рядов) для снижения эффектов, связанных с передвижением личинок».
Кроме того, Национальная Ассоциация производителей кукурузы на их веб-сайте (ncga.com/insect-resistance-management-fact-sheet-bt-corn) также приводит аналогичные указания в отношении требований для убежищ. Например:
«Требования в отношении IRM кукурузного стеблевого мотылька:
засадить, по меньшей мере, 20% территорий с кукурузой гибридами убежища;
в районах с производством хлопка убежище должно составлять 50%;
должны высаживаться в пределах 1/2 мили от гибридов убежища;
убежище можно засевать в виде полос в Bt-поле; полосы убежища должны быть шириной, по меньшей мере, 4 ряда;
убежище можно обработать обычными пестицидами только, если достигаются экономические пороги для вредителя-мишени;
нельзя использовать опрыскиваемые инсектициды на основе Bt на кукурузе убежища;
соответствующее убежище должно быть засажено в каждом хозяйстве с Bt-кукурузой».
Как утверждает Roush et al. (на страницах 1780 и 1784 правой колонки, например), «стэкинг» или «нагромождение» позволяет использовать меньшее убежище. Roush предлагает примерно 10% убежище при наличии успешного стека по сравнению (и ниже) с примерно 30-40%.
Любой из вышеуказанных процентов (такой как для 1F/1Ab) или аналогичные соотношения убежищ можно использовать для двойных или тройных стеков или пирамид по настоящему изобретению на сахарном тростнике.
Имеются различные пути обеспечения убежища, включая различные геометрические паттерны высадки в полях (упомянутые выше) и смеси семян в мешках, как дополнительно обсуждается Roush et al. (выше) и в патенте США №6551962.
Все патенты, заявки на патент, предварительные заявки и публикации, относящиеся к или цитированные в данном документе, в полном объеме включены в данный документ для сведения в той степени, до которой они не противоречат положениям данной заявки.
Последующие примеры иллюстрируют изобретение. Примеры не следует рассматривать в качестве ограничивающих изобретение.
ПРИМЕРЫ
Пример 1 - Резюме - Ответ чувствительной и резистентной к Cry1Ab огневки сахарного тростника на Cry-белок Bacillus thuringiensis Cry1Fa
Белок Cry1Fa проявлял инсектицидную активность как против Bt-чувствительных (Bt-SS), так и против Bt-резистентных (Bt-RR) штаммов огневки сахарного тростника Diatraea saccharalis. Штамм Bt-RR D. saccharalis показал 142-кратную резистентность к трипсин-активированному белку Cry1Ab. Данный Bt-резистентный штамм D. saccharalis проявил некоторую перекрестную резистентность к Cry1Fa, но соотношения резистентности были достоверно ниже (в 4 раза). На основании этих результатов можно предположить, что Cry1Fa может быть эффективным в управлении резистентностью к Cry1Ab у D. saccharalis и других видов огневки кукурузы.
Пример 2 - Материалы и методы
Cry-белки Bacillus thuringiensis
Очищенный трипсин-активированный белок Cry1Ab Bacillus thuringiensis (Bt) получали от Dr. Marianne Puztai-Carey, кафедра биохимии. Университет Кейс Вестерн Резерв, Кливленд, штат Огайо. Cry1Fa получали от Dow AgroSciences Company (Indianapolis, IN) в буферном растворе. Cry1Ab лиофилизовали с чистотой 99,9%.
Источники насекомых
Bt-чувствительный штамм (Bt-SS) D. saccharalis получали с использованием личинок, собранных на кукурузных полях около Виннсборо в Северной Лузиане в 2004 г. Bt-резистентный штамм (Bt-RR) D. saccharalis получали из семейства одной изолинии с использованием скрининга поколения F2. Данные Bt-резистентные насекомые завершили развитие личиночной стадии на производственных гибридах кукурузы Cry1Ab и проявили высокую резистентность к очищенному трипсин-активированному Cry1Ab-токсину. Во время подтверждения наличия Bt-резистентности отдельные особи Bt-резистентного штамма подвергали обратному скрещиванию с Bt-чувствительным штаммом и повторно отбирали по резистентности на ткани листа кукурузы с Cry1Ab в F2-поколении гибрида, полученного обратным скрещиванием.
Биологические тесты с насекомыми
Чувствительность штаммов Bt-SS и Bt-RR D. saccharalis к Cry1Ab и Cry1Fa определяли с использованием метода включения в корм. В каждом биологическом тесте использовали 6 или 7 концентраций Cry-белка. Пределы концентраций Bt составляли от 0,03125 до 32 мкг/г белка Cry1Ab и от 0,03125 до 128 мкг/г для оценки белка Cry1Fa. Растворы Cry-белков готовили смешением Bt-белков с соответствующим количеством дистиллированной воды для опытов с Cry1Ab или буфера для опытов с Cry1Fa. Затем растворы Bt смешивали с meridic кормом перед разливом корма в отдельные ячейки в 128-ячеечном подносе (Bio-Ba-128, C-D International, Pitman, NJ). В биологических тестах примерно 0,7 мл обработанного корма помещали в каждую ячейку с использованием шприцов на 10 мл (Becton, Dickinson and Company, Franklin Lakes, NJ). Корм, обработанный только дистиллированной водой (чистый контроль) или буфером, использовали для контрольных обработок. Одна новорожденная особь D. saccharalis (в течение <24 ч) высвобождалась на поверхности корма в каждой ячейке. После инокуляции личинок ячейки покрывали крышками с вентиляционными отверстиями (C-D International, Pitman, NJ). Подносы для постановки биологических тестов помещали в климатическую камеру при 28°С, 50% относительной влажности и фотопериоде 16:8 (свет:темнота). Регистрировали гибель личинок, массу личинок и число выживших личинок, у которых отсутствовали привесы массы тела (<0,1 мг на личинку) на 7 сутки после инокуляции. Каждую комбинацию штамма насекомых по концентрации Cry-белка повторяли четыре раза с 16-32 личинками в каждой повторности.
Анализ данных
Гибель личинок оценивали по «фактической» гибели личинок, когда учитывали число фактически погибших личинок и число выживших личинок без достоверных привесов массы тела (<0,1 мг на личинку), т.е. как мертвых или не потребляющих корм насекомых. Фактическую гибель D. saccharalis в опыте рассчитывали с использованием уравнения: фактическая гибель (%)=100 × [число мертвых личинок + число выживших личинок без достоверных привесов массы тела (<0,1 мг на личинку)]/общее количество тестированных насекомых. В значение показателя «фактической» гибели (ниже просто «гибель») личинок каждого штамма D. saccharalis вносили поправку на гибель личинок, находящихся на необработанном контрольном корме при анализе Cry1Ab или на корме, обработанном только буфером при оценке Cry1Fa. Затем скорректированные данные по концентрации/гибели обрабатывали пробит-анализом для определения концентраций Cry-белка, которые вызывали 50% гибель личинок (LC50), и соответствующих 95% доверительных интервалов (CI). Обработки, использованные в пробит-анализе, включали наиболее высокую концентрацию, которая вызывала нулевую гибель, наименьшую концентрацию, которая приводила к 100% гибели, и все данные между этим крайними значениями. Рассчитывали соотношения резистентности делением значения LC50 для штамма Bt-RR на данный показатель для штамма Bt-SS. Тест соотношения летальных доз использовали для определения того, являются ли соотношения резистентности достоверными при уровне значимости α=0,05. Двухсторонний анализ ANOVA использовали для анализа данных по гибели с последующим проведением теста LSMEANS при уровне значимости α=0,05 для определения различий в обработке.
Ингибирование роста личинок D. saccharalis на корме с белком Cry1Ab рассчитывали с использованием формулы: ингибирование роста личинок (%)=100 × (масса тела личинок на необработанном контрольном корме - масса тела личинок на Bt-корме)/(масса тела личинок на необработанном контрольном корме), в то время как для анализа Cry1Fa этот показатель рассчитывали с использованием следующей формулы: ингибирование роста личинок (%)=100 × (масса тела личинок на контрольном корме, обработанном только буфером - масса тела личинок на Bt-корме)/(масса тела личинок на контрольном корме, обработанном только буфером). 100% ингибирование роста личинок относили за счет репликации, если отсутствовали личинки, которые имели достоверные привесы массы тела (<0,1 мг/личинку). Данные по ингибированию роста анализировали двухсторонним анализом ANOVA со штаммом насекомых и концентрацией белка Cry в качестве двух основных факторов. Тесты LSMEANS использовали для определения различий между обработками при уровне значимости а=0,05. Нетрансформированные данные приведены на фигурах и в таблицах.
Пример 3 - Результаты
Гибель личинок штаммов Bt-SS и Bt-RR D. saccharalis на корме, обработанном Cry-белками
Белок Cry1Ab (фигура 1): концентрация белка Cry1Ab оказывала достоверное влияние на гибель личинок D. saccharalis обоих штаммов Bt-SS и Bt-RR (F=90,67; df=6,42; P<0,0001) (фиг.1). Гибель личинок возрастала по мере увеличения концентрации белка Cry1Ab. Достоверное повышение гибели личинок штамма Bt-SS наблюдали в концентрации 0,031 мкг/г или выше, и гибель достигала почти 100% при 32 мкг/г.Для штамма Bt-RR достоверную гибель наблюдали в концентрации 2 мкг/г, и этот показатель достигал 61% в концентрации 32 мкг/г. Наблюдали достоверные различия в гибели личинок между двумя штаммами насекомых (F=346,73; df=1,42, Р<0,0001). Гибель личинок, относящихся к штамму Bt-RR, была достоверно ниже (Р<0,05) по сравнению с насекомыми Bt-SS во всех испытанных концентрациях Cry1Ab. Взаимосвязь штамма насекомых и концентрации была также достоверной (F=18,82; df=6,42; Р<0,0001). Гибель личинок штамма Bt-RR возрастала медленнее по сравнению со штаммом Bt-SS по мере повышения концентрации Cry1Ab.
Расчетные значения LC50, основанные на гибели личинок, для штаммов Bt-SS и Bt-RR составили соответственно 0,13 и 18,46 мкг/г (таблица 1). Разница в 142 раза в значениях LC50 между двумя штаммами была статистически достоверной (Р<0,05), основываясь на тесте отношения летальных концентраций.
Белок Cry1Fa (фиг.2): белок Cry1Fa проявил инсектицидную активность и только некоторую перекрестную резистентность. Концентрация Сгу-белка оказывала достоверное влияние на гибель личинок D. saccharalis для обоих штаммов Bt-SS и Bt-RR (F=251,78; df=8,54; P<0,0001). Достоверные показатели гибели личинок наблюдали в концентрации 0,125 мкг/г для штамма Bt-SS и в концентрации 0,5 мкг/г для штамма Bt-RR, и этот показатель достигал 100% в концентрации 8 мкг/г для обоих штаммов. Различия в гибели личинок также были достоверными между двумя штаммами насекомых (F=11,82; df=1,54; P<0,0011). Штамм Bt-RR имел достоверно более низкую гибель (Р<0,05) в концентрациях 0,125; 0,5 и 2 мкг/г по сравнению со штаммом Bt-SS. Взаимосвязь штамма и концентрации также была достоверной (F=8,61; df=8,54; Р<0,0001). В общем, гибель личинок штамма Bt-RR в концентрациях Cry-белка<8 мкг/г повышалась медленнее по сравнению со штаммом Bt-SS.
Расчетные значения LC50, основанные на показателях гибели личинок, для штаммов Bt-SS и Bt-RR составили соответственно 0,29 и 1,15 мкг/г (таблица 1). Разница в 4 раза в значениях LC50 между двумя штаммами была статистически достоверной (Р<0,05), основываясь на тесте отношения летальных концентраций.
Ингибирование роста личинок D. saccharalis на корме, обработанном Cry-белком
Белок Cry1Ab (фиг.3): ингибирование роста личинок штаммов Bt-SS и Bt-RR D. saccharalis, находящихся на корме, обработанном Cry1Ab, статистически достоверно различалось среди концентраций (F=175,07; df=5,36; P<0,0001). Рост личинок Bt-SS и Bt-RR снижался по мере повышения концентраций Cry1Ab. Влияние штамма насекомых на ингибирование роста статистически различалось между штаммами Bt-SS и Bt-RR (Р=1182,51; df=1,36; P<0,0001). Ингибирование роста личинок штамма Bt-SS было достоверно выше по сравнению со штаммом Bt-RR в диапазоне всех испытанных концентраций Bt. В концентрации 0,031 мкг/г, самая низкая испытанная концентрация, Bt-RR не проявлял какого-либо ингибирования роста, но рост личинок Bt-SS ингибировался на >90% по сравнению с контролем. В концентрации 0,5 мкг/г штамм Bt-RR показывал 27% ингибирование роста, в то время как рост личинок Bt-SS практически полностью останавливался. Взаимосвязь штамма насекомых и концентрации Bt также была достоверной (F=110,72; df=5,36; P<0,0001). В общем, ингибирование роста штамма Bt-RR возрастало медленнее по мере увеличения концентрации Cry1Ab по сравнению со штаммом Bt-SS.
Белок Cry1Fa (фиг.4): ингибирование роста личинок штаммов Bt-SS и Bt-RR D. saccharalis, находящихся на корме, обработанном белком Cry1Fa, статистически достоверно различалось среди концентраций (F=301,69; df=7, 48; Р<0,0001). Ингибирование роста личинок Bt-SS было статистически достоверно выше (Р<0,05) по сравнению с личинками Bt-RR в концентрациях 0,125; 0,5 и 2 мкг/г.Влияние штамма насекомых на ингибирование роста статистически различалось между двумя штаммами насекомых (F=45,88; df=1,48; P<0,0001), и взаимосвязь штамма насекомых и концентрации Bt также достоверно различалась (F=18,38; df=7,48; Р<0,0001). Ингибирование роста личинок штамма Bt-SS возрастало быстрее по сравнению с этим показателем для штамма Bt-RR. Достоверное ингибирование роста личинок обоих штаммов насекомых наблюдали в концентрации 0,03125 мкг/г.Рост личинок штамма Bt-SS полностью ингибировался в концентрации 2 мкг/г, в то время как для Bt-RR это имело место только в концентрации 8 мкг/г.
Источники литературы
Finney, D.J. 1971. Probit analysis. Cambridge University Press, England.
Hua, G., L. Masson, J.L. Jurat-Fuentes, G. Schwab, and M.J. Adang. Binding analyses of Bacillus thuringiensis Cry d-endotoxins using brush border membrane vesicles of Ostrinia nubilalis. Applied and Environmental Microbiology 67 [2], 872-879. 2001.
LeOra Software. 1987. POLO-PC. A user's guide to probit and logit analysis. Berkeley, CA.
McGaughey, W.H., F. Gould, and W. Gelernter. Bt resistance management. Nature Biotechnology 16 [2], 144-146. 1998
Marcon, P.R.G.C, L.J. Young, K. Steffey, and B.D. Siegfried. 1999. Baseline susceptibility of the European corn borer, Ostrinia nubilalis (Hubner) (Lepidoptera: Pyralidae) to Bacillus thuringiensis toxins. J. Econ. Entomol. 92 (2): 280-285.
Robertson, L.J. and H.K. Preisler. 1992. Pesticide bioassays with arthropods. CRC Press, Boca Ranton, FL.
SAS Institute Inc. 1988. SAS procedures guide, Release 6.03 edition. SAS Institute Inc, Cary, NC.
Stone, B.F. 1968. A formula for determining degree of dominance in cases of monofactorial inheritance of resistance to chemicals. Bull. WHO 38:325-329.
Van Mellaert, FL, J. Botterman, J. Van Rie, and H. Joos. Transgenic plants for the prevention of development of insects resistant to Bacillus thuringiensis toxins. (Plant Genetic Systems N.V., Belg. 89-401499 [400246], 57-19901205. EP. 5-31-1989.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНИРОВАННОЕ ИСПОЛЬЗОВАНИЕ БЕЛКОВ CRY1Ca И CRY1Ab ДЛЯ КОНТРОЛЯ УСТОЙЧИВОСТИ НАСЕКОМЫХ | 2010 |
|
RU2596406C2 |
| КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ БЕЛКОВ CRY1Ca И CRY1Fa ДЛЯ БОРЬБЫ С РЕЗИСТЕНТНОСТЬЮ У НАСЕКОМЫХ | 2010 |
|
RU2593961C2 |
| КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ БЕЛКОВ Vip3Ab И Cry1Fa ДЛЯ ВЫРАБАТЫВАНИЯ РЕЗИСТЕНТНОСТИ К НАСЕКОМЫМ | 2010 |
|
RU2607666C2 |
| КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ БЕЛКОВ Cry1Da И Cry1Fa ДЛЯ ВЫРАБАТЫВАНИЯ РЕЗИСТЕНТНОСТИ К НАСЕКОМЫМ | 2010 |
|
RU2603257C2 |
| ПРИМЕНЕНИЕ CRY1AB В КОМБИНАЦИИ С CRY1BE ДЛЯ УПРАВЛЕНИЯ РЕЗИСТЕНТНОСТЬЮ НАСЕКОМЫХ | 2010 |
|
RU2583288C2 |
| ПРИМЕНЕНИЕ ИНСЕКТИЦИДНОГО КРИСТАЛЛИЧЕСКОГО БЕЛКА DIG3 В КОМБИНАЦИИ С CRY1AB ДЛЯ РЕГУЛИРОВАНИЯ УСТОЙЧИВОСТИ К КУКУРУЗНОМУ МОТЫЛЬКУ | 2012 |
|
RU2624031C2 |
| ПРИМЕНЕНИЕ Cry1Da В СОЧЕТАНИИ С Cry1Ca ДЛЯ УПРАВЛЕНИЯ УСТОЙЧИВЫМИ НАСЕКОМЫМИ | 2010 |
|
RU2569108C2 |
| ПРИМЕНЕНИЕ Vip3Ab В СОЧЕТАНИИ С Cry1Ca ДЛЯ УПРАВЛЕНИЯ УСТОЙЧИВЫМИ НАСЕКОМЫМИ | 2010 |
|
RU2575084C2 |
| ПРИМЕНЕНИЕ Cry1Da В СОЧЕТАНИИ С Cry1Be ДЛЯ УПРАВЛЕНИЯ УСТОЙЧИВЫМИ НАСЕКОМЫМИ | 2010 |
|
RU2590592C2 |
| ИНСЕКТИЦИДНЫЕ БЕЛКИ | 2010 |
|
RU2613778C2 |







Изобретение относится к области биохимии, в частности к растению сахарного тростника, которое обладает устойчивостью к насекомому-вредителю огневке сахарного тростника, содержащему ДНК, кодирующую Cry1Fa, и ДНК, кодирующую Cry1Ab. Также раскрыта совокупность растений сахарного тростника, содержащая не-Bacillus thuringiensis(Bt)-растения сахарного тростника, которые не экспрессируют трансгенные инсектицидные белки, и вышеуказанные трансгенные растения сахарного тростника. Изобретение позволяет эффективно бороться с огневкой сахарного тростника. 2 н. и 2 з.п. ф-лы, 4 ил., 1 табл., 3 пр.
1. Растение сахарного тростника, которое обладает устойчивостью к насекомому-вредителю огневке сахарного тростника (SCB; Diatraea saccharalis), содержащее ДНК, кодирующую инсектицидный белок Cry1Fa с последовательностью SEQ ID NO: 1, и ДНК, кодирующую инсектицидный белок Cry1Ab с последовательностью SEQ ID NO: 2.
2. Совокупность растений сахарного тростника, содержащая не-Bacillus thuringiensis(Bt)-растения сахарного тростника, которые не экспрессируют трансгенные инсектицидные белки, и трансгенные растения сахарного тростника по п. 1, где указанные трансгенные растения сахарного тростника содержат ДНК, кодирующую инсектицидный белок Cry1Fa с последовательностью SEQ ID NO: 1, и ДНК, кодирующую инсектицидный белок Cry1Ab с последовательностью SEQ ID NO: 2, где указанные He-Bt-растения сахарного тростника составляют 5-50% от всех растений в указанной совокупности растений сахарного тростника, где указанная совокупность растений сахарного тростника задерживает развитие устойчивости насекомого-вредителя огневки сахарного тростника к инсектицидному белку Cry1Ab и к инсектицидному белку Cry1Fa.
3. Совокупность растений сахарного тростника по п. 2, где указанные не-Bt-растения сахарного тростника находятся в блоках или полосах.
4. Совокупность растений сахарного тростника по п. 2, где указанная совокупность растений сахарного тростника занимает площадь более 10 акров.
| US2007006340 A1, 04.01.2007 | |||
| BRAVO A.et al., How to cope with insect resistance to Bt toxins?, 2008, Vol | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| Котел для водяного отопления с внутренним перегревателем воды для побуждения циркуляции в сети и с регулятором наружной температуры котла | 1924 |
|
SU573A1 |
| et al., Strategies to improve the insecticidal activity of Cry toxins from Bacillus thuringiensis, Peptides | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Прибор для переработки спирта в газовую смесь для двигателей внутреннего сгорания | 1920 |
|
SU589A1 |
Авторы
Даты
2016-12-10—Публикация
2010-12-16—Подача