УРОВЕНЬ ТЕХНИКИ
Люди выращивают кукурузу для использования при производстве пищи и энергии. Люди также выращивают большое количество других видов зерновых, включая сою и хлопок. Насекомые поедают и повреждают растения и, тем самым, подрывают усилия людей. Миллиарды долларов ежегодно тратятся на контроль насекомых-вредителей и, помимо этого, миллиарды долларов теряются в виде ущерба, нанесенного насекомыми. Синтетические органические химические инсектициды являются основным инструментом контроля насекомых-вредителей, но биологические инсектициды, например, обладающие инсектицидным действием белки, полученные из Bacillus thuringiensis (Bt), играют важную роль в тех же областях применения. Возможность получения устойчивых к насекомым растений путем трансформации генами Bt белков, обладающих инсектицидным действием, совершила революцию в современном сельском хозяйстве и повысила важность и ценность белков, обладающих инсектицидным действием, и их генов.
Несколько Bt белков были использованы для создания устойчивых к насекомым трансгенных растений, которые к настоящему времени успешно зарегистрированы и выведены на рынок. Указанные белки включают Cry1Ab, Cry1Ac, Cry1F и Cry3Bb у кукурузы, Cry1Ac и Cry2Ab у хлопка, и Cry3A у картофеля.
Коммерческие продукты, экспрессирующие эти белки, экспрессируют один белок за исключением случаев, когда желателен комбинированный инсектицидный спектр действия двух белков (например, Cry1Ab и Cry3Bb у кукурузы комбинируют для обеспечения устойчивости, соответственно, к чешуекрылым насекомым-вредителям и корневым червям), или когда независимое действие белков позволяет использовать их в качестве средства, замедляющего развитие устойчивости в целевой популяции насекомых (например, Cry1Ac и Cry2Ab у хлопка комбинируют для обеспечения контроля развития устойчивости у табачной листовертки-почкоеда). См. также публикацию заявки на патент США № 2009/0313717, относящуюся к белку Cry2 плюс Vip3Aa, Cry1F или Cry1A для контроля Helicoverpa zea или armigerain. WO 2009/132850 относится к использованию Cry1F или Cry1A и Vip3Aa для контроля Spodoptera frugiperda. Публикация заявки на патент США №2008/0311096 частично относится к использованию Cry1Ab для контроля ECB, устойчивого к Cry1F.
Таким образом, некоторые свойства трансгенных растений, устойчивых к насекомым, которые привели к быстрому и широкому внедрению этой технологии, но также вызвали опасения, что популяции насекомых-вредителей выработают устойчивость к обладающим инсектицидным действием белкам, продуцируемым этими растениями. Было предложено несколько стратегий для сохранения утилитарности связанных с устойчивостью к насекомым признаков, основанных на Bt, которые включали введение белков в высоких дозах в комбинации с организацией убежищ (рефугий) и поочередное или одновременное введение различных токсинов (McGaughey et al. (1998), “B.t. Resistance Management”, Nature Biotechnol. 16: 144-146).
Белки, выбранные для использования в наборе для управления устойчивостью насекомых (IRM), должны проявлять свое инсектицидное действие независимо таким образом, чтобы устойчивость, развившаяся к одному белку, не вызывала появления устойчивости ко второму белку (т.е., чтобы отсутствовала перекрестная устойчивость к белкам). Например, если популяция насекомого-вредителя, которая проявляет устойчивость к “Белку А”, является чувствительной к “Белку В”, можно сделать вывод, что перекрестная устойчивость отсутствует и, что комбинация Белка А и Белка В будет эффективной для замедления развития устойчивости к Белку А, применяемому изолированно.
При отсутствии обладающих устойчивостью популяций насекомых может быть проведен анализ на основе других характеристик, которые, как предполагается, связаны с механизмом действия и потенциалом развития перекрестной устойчивости. Были выдвинуты предположения, согласно которым для идентификации обладающих инсектицидным действием белков, которые, вероятно, не обладают свойством перекрестной устойчивости, можно использовать рецептор-опосредованное связывание (van Mellaert et al. 1999). Ключевой прогнозирующий параметр отсутствия перекрестной устойчивости, естественно присущий такому подходу, заключается в том, что белки, обладающие инсектицидным действием, не конкурируют за рецепторы у чувствительных к ним видов насекомых.
Если два Bt токсина конкурируют за один и тот же рецептор, то в случае мутации этого рецептора у насекомого, при которой один из токсинов больше не связывается с этим рецептором и, следовательно, больше не обладает инсектицидным действием в отношении этого насекомого, это насекомое может стать устойчивым также и ко второму токсину (который конкурентно связывается с тем же рецептором). При этом насекомое рассматривается как обладающее перекрестной устойчивостью к обоим Bt токсинам. Однако если два токсина связываются с различными рецепторами, это может служить указанием на то, что насекомое может не быть одновременно устойчивым к этим двум токсинам.
Например, белок Cry1Fa применим для контроля многих чешуекрылых насекомых-вредителей, включая мотылька кукурузного (ECB; Ostrinia nubilalis (Hűbner)) и кукурузную листовую совку (FAW; Spodoptera frugiperda), и проявляет активность в отношении огневки сахарного тростника (SCB; Diatraea saccharalis). Белок Cry1Fa, вырабатываемый в трансгенных растениях кукурузы, содержащих фактор TC1 507, является ответственным за развитие устойчивости к доминирующим в данной отрасли насекомым, т.е. за контроль FAW. Cry1Fa также используется в продуктах Herculex®, SmartStax™ и WideStrike™.
Дополнительные Cry токсины перечислены на веб-сайте официального комитета по номенклатуре B.t. (Crickmore et al.; lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/). В настоящее время существует примерно 60 основных групп “Cry” токсинов (Cry1-Cry59) с дополнительными Cyt токсинами, VIP токсинами и т.п. Многие группы с числовыми обозначениями имеют подгруппы, обозначенные заглавными буквами, а обозначенные заглавными буквами подгруппы имеют подгруппы, обозначенные прописными буквами. (Например, Cry1 имеет подгруппы A-L, а Cry1A имеет подгруппы a-i).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Таким образом, настоящее изобретение частично относится к применению белка Vip3Ab в комбинации с белком Cry1Ca. Растения (и площадь угодий, засеянных такими растениями), которые вырабатывают оба этих белка, включены в объем настоящего изобретения.
Настоящее изобретение частично относится к неожиданному открытию того, что Vip3Ab и Cry1Ca не конкурируют друг с другом за участки связывания в мембранных препаратах, полученных из клеток кишечника кукурузной листовой совки (FAW; Spodoptera frugiperda).
Настоящее изобретение также относится к пакетам или “пирамидам” из трех (или более) токсинов, в которых Vip3Ab и Cry1Ca являются основной парой. В некоторых предпочтительных вариантах осуществления пирамид комбинация выбранных токсинов обеспечивает активность по отношению к FAW без развития перекрестной устойчивости. Некоторые предпочтительные комбинации-пирамиды с “тремя местами действия” включают основную пару белков, плюс Cry1Fa, Cry1Da, Cry1Be или Cry1E в качестве третьего белка, воздействующего на FAW. Эти конкретные тройные пакеты, согласно настоящему изобретению, неожиданно обеспечивают три места действия у FAW. Это может способствовать смягчению или устранению требования к площадям убежищ.
В соответствии с настоящим изобретением также могут быть добавлены дополнительные токсины/гены. Например, если Cry1Fa или Cry1Be вводят в пакет вместе с парой белков по изобретению (оба белка Cry1Fa и Cry1Be проявляют активность как по отношению к FAW так и по отношению к мотыльку кукурузному (ECB)), добавление двух дополнительных белков в этот тройной пакет, в котором два дополнительных белка нацелены на ECB, обеспечит три места действия у FAW и три места действия у ECB. Эти два добавленных белка (четвертый и пятый белок) могут быть выбраны из группы, состоящей из Cry2A, Cry1I, DIG-3 и Cry1Ab, что дает в результате пакет из пяти белков, имеющих по три места действия у двух насекомых (ECB и FAW).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение частично относится к неожиданному открытию, заключающемуся в том, что Vip3Ab и Cry1Ca не конкурируют друг с другом за участки связывания в мембранных препаратах, полученных из клеток кишечника кукурузной листовой совки (FAW; Spodoptera frugiperda). Таким образом, белок Vip3Ab может быть использован в комбинации с белком Cry1Ca в трансгенной кукурузе (и других растениях, например, хлопке и сое) для замедления или предотвращения развития у FAW устойчивости к каждому из указанных белков по отдельности. Рассматриваемая пара белков может быть эффективной при защите растений (таких растений, как маис и соя) от повреждений, наносимых кукурузной листовой совкой, устойчивой к Cry. Другими словами, одна из областей применения настоящего изобретения относится к защите кукурузы и других экономически важных видов растений от повреждений и потери урожая, вызванных популяциями кукурузной листовой совки, у которых может развиться устойчивость к Vip3Ab или Cry1Ca.
В настоящем изобретении, таким образом, раскрывается пакет для управления устойчивостью насекомыми (IRM), содержащий Vip3Ab и Cry1Ca и предназначенный для предотвращения или ослабления развития у FAW устойчивости к каждому или обоим этим белкам.
Настоящее изобретение обеспечивает композиции для контроля чешуекрылых насекомых-вредителей, содержащих клетки, продуцирующие обладающий инсектицидным действием белок Vip3Ab и обладающий инсектицидным действием белок Cry1Ca.
Изобретение также относится к хозяину, трансформированному для продуцирования как обладающего инсектицидным действием белка Vip3Ab, так и обладающего инсектицидным действием белка Cry1Ca, причем указанный хозяин представляет собой микроорганизм или клетку растения. Рассматриваемый полинуклеотид(ы) предпочтительно находится в генетической конструкции под управлением промотора(ов), не принадлежащего Bacillus thuringiensis. Рассматриваемые полинуклеотиды могут содержать кодоны, используемые для усиленной экспрессии в растениях.
Дополнительно предполагается, что изобретение обеспечивает способ контроля чешуекрылых насекомых-вредителей, содержащий приведение в контакт указанных насекомых-вредителей с эффективным количеством композиции, которая содержит Vip3Ab белок, содержащий ядро токсина, и Cry1Ca белок, содержащий ядро токсина.
Один из вариантов осуществления изобретения содержит растение маиса, содержащее экспрессируемый в растении ген, кодирующий обладающий инсектицидным действием белок Cry1Ca, и экспрессируемый в растении ген, кодирующий обладающий инсектицидным действием белок Vip3Ab.
Другой вариант осуществления изобретения содержит растение маиса, в котором экспрессируемый в растении ген, кодирующий обладающий инсектицидным действием белок Cry1Ca, и экспрессируемый в растении ген, кодирующий обладающий инсектицидным действием белок Vip3Ab, были введены в указанное растение маиса путем интрогрессии.
Как описано в Примерах, исследования конкурентного связывания с рецептором с использованием меченного радиоактивным изотопом белка Cry1Ca показали, что белок Cry1Ca не конкурирует за связывание в тканях FAW, в которых происходит связывание Vip3Ab. Эти результаты также указывают на то, что комбинация белков Vip3Ab и Cry1Ca может представлять собой эффективное средство для ослабления развития устойчивости в популяциях FAW к каждому из этих белков. Таким образом, частично основываясь на данных, представленных в настоящем документе, можно предположить, что совместное продуцирование (пакетирование) белков Cry1Ca и Vip3Ab может быть использовано для получения IRM пакета с высокими дозами для FAW.
К этой паре могут быть добавлены другие белки. Например, рассматриваемое изобретение также частично относится к тройным пакетам или “пирамидам”, состоящим из трех (или более) токсинов, где Vip3Ab и Cry1Ca являются основной парой. В некоторых предпочтительных вариантах осуществления пирамиды выбранные токсины имеют три отдельных места действия у FAW. Некоторые предпочтительные комбинации для пирамиды с “тремя местами действия” включают рассматриваемую основную пару белков плюс Cry1Fa, Cry1Da, Cry1Be или Cry1E в качестве третьего белка для воздействия на FAW. Под “отдельными местами действия” подразумевается то, что каждый из данных белков не вызывает развития перекрестной устойчивости с другими белками. Эти конкретные тройные пакеты, согласно настоящему изобретению, неожиданно обеспечивают три места действия у FAW. Это может способствовать смягчению или устранению требования к площадям убежищ.
Что касается некоторых частных вариантов осуществления настоящего изобретения, авторы показали, что популяция FAW, устойчивая к инсектицидной активности белка Cry1Fa, не является устойчивой к инсектицидной активности белка Vip3Ab или инсектицидной активности белка Cry1Ca. Авторы продемонстрировали, что Cry1Ca не конкурирует за участки связывания с Cry1Fa, и что Vip3Ab не конкурирует за участки связывания с Cry1Fa в кишечнике FAW. См. US 61/284281 (поданную 16 декабря 2009) в отношении Cry1Fa и Cry1Ca, и параллельно поданную заявку PCT озаглавленную “COMBINED USE OF Vip3Ab AND Cry1Fa FOR MANAGEMENT OF RESISTANT INSECTS”.
Таким образом, пары токсинов Cry1Fa плюс Vip3Ab и Cry1Fa плюс Cry1Ca обеспечивают активность по отношению к FAW без развития перекрестной устойчивости. Неспособность Vip3Ab1 конкурировать с Cry1Ca за связывание в кишечнике FAW демонстрирует, что эти три белка-токсина (Cry1Fa, Vip3Ab, Cry1Ca) представляют тройной пакет - пирамиду токсинов Cry, которая обеспечивает три отдельных целевых участка взаимодействия в кишечнике FAW. Эти конкретные тройные пакеты, согласно настоящему изобретению, неожиданно обеспечивают воздействие на FAW без развития перекрестной устойчивости. Более того, демонстрация того, что эти три белка не конкурируют друг с другом, позволяет специалисту в данной области техники прийти к заключению, что это может способствовать смягчению или устранению требования к площадям убежищ. Настоящее раскрытие обеспечивает преимущество, заключающееся в том, что растения, экспрессирующие комбинацию Cry1Fa, Vip3Ab и Cry1Ca будут полезны для замедления или предотвращения развития у FAW устойчивости к каждому из этих белков и их комбинации.
В соответствии с настоящим изобретением также могут быть добавлены дополнительные токсины/гены. Например, если Cry1Fa или Cry1Be вводят в пакет вместе с парой белков по изобретению (оба белка Cry1Fa и Cry1Be проявляют активность как по отношению к FAW, так и по отношению к мотыльку кукурузному (ECB)), добавление двух дополнительных белков в этот тройной пакет, в котором два дополнительных белка нацелены на ECB, обеспечит три места действия у FAW и три места действия у ECB. Эти два добавленных белка (четвертый и пятый белок) могут быть выбраны из группы, состоящей из Cry2A, Cry1I, DIG-3 (см. заявку на патент США № 61/284278 (подана 16 декабря 2009) и US 2010 00269223) и Cry1Ab, что дает в результате пакет из пяти белков, имеющих по три места действия у двух насекомых (ECB и FAW)
Таким образом, одна из возможных схем обработки представляет собой использование рассматриваемой пары белков в комбинации с третьим токсином/геном и использование этого тройного пакета для ослабления развития у FAW устойчивости к каждому из этих токсинов. Соответственно, рассматриваемое изобретение также относится к тройным пакетам или “пирамидам”, состоящим из трех (или более) токсинов. В некоторых предпочтительных вариантах осуществления пирамиды выбранные токсины имеют три отдельных места действия в отношении FAW.
Среди прочих схем обработки по настоящему изобретению могут быть использованы два, три или более белков из рассматриваемых белков в регионах произрастания кукурузы, в которых FAW может формировать популяции с развившейся устойчивостью.
С учетом того, что Cry1Fa активен по отношению к FAW и ECB, Vip3Ab плюс Cry1Ca плюс Cry1Fa неожиданно обеспечивают, согласно настоящему изобретению, три места действия у FAW. Это может способствовать смягчению или устранению требования о площадях убежищ.
Cry1Fa содержится в продуктах Herculex®, SmartStax™ и WideStrike™. Рассматриваемая пара генов (Vip3Ab и Cry1Ca) может быть скомбинирована, например с содержащим Cry1Fa продуктом, таким как Herculex®, SmartStax™ и WideStrike™. Соответственно, рассматриваемая пара белков может играть значительную роль в уменьшении давления отбора на эти и другие белки. Рассматриваемая пара белков может быть использована в комбинациях из трех генов для кукурузы и других растений (например, хлопка и сои).
Как уже указывалось выше, согласно настоящему изобретению также могут быть добавлены дополнительные токсины/гены. В отношении использования Cry1E (для контроля FAW), см. заявку на патент США № 61/284278 (подана 16 декабря 2009).
Растения (и площади угодий, засеянных такими растениями), которые вырабатывают любую из рассматриваемых комбинаций белков, включены в объем настоящего изобретения. Также могут быть добавлены дополнительные токсины/гены, однако обсуждаемые выше конкретные пакеты неожиданно обеспечивают множество мест действия у FAW и ECB. Это может способствовать смягчению или устранению требования к площадям убежищ. Следовательно, засеянное таким образом поле, площадь которого превышает десять акров, входит в объем настоящего изобретения.
Для получения последовательностей любых генов и белков, раскрытых или упомянутых в настоящем документе, также может быть использован GENBANK. См. Приложение А ниже. Релевантные последовательности также доступны из патентов. Например, патент США № 5188960 и патент США № 5827514 описывают белки, содержащие ядро токсина Cry1Fa, которые являются подходящими для осуществления настоящего изобретения. Патент США № 6218188 описывает оптимизированные для растений последовательности ДНК, кодирующие белки, содержащие ядро токсина Cry1Fa, которые подходят для использования в настоящем изобретении. В US 61/284275 (подана 16 декабря 2009) раскрыты некоторые укороченные белки Cry1Ca, которые могут быть использованы в соответствии с настоящим изобретением.
Комбинации белков, описанных в настоящем документе, могут быть использованы для контроля чешуекрылых насекомых-вредителей. Взрослые чешуекрылые, например бабочки и мотыльки, в основном питаются цветочным нектаром и являются важными опылителями. Практически все личинки чешуекрылых, т.е. гусеницы, питаются растениями, и многие из них являются важными насекомыми-вредителями. Гусеницы поедают внутреннюю часть листвы, корни или стебель растения, лишая растение возможности получать питательные вещества и часто разрушая физическую опорную структуру растения. Помимо этого, гусеницы поедают плоды, ткани и хранящиеся зерно и муку, придавая этим продуктам нетоварный вид или серьезно снижая их ценность. Как используется в настоящем документе, под чешуекрылыми насекомыми-вредителями подразумеваются различные стадии жизненного цикла насекомого-вредителя, включая стадии личинки.
Некоторые химерные токсины по настоящему изобретению содержат полную N-концевую часть ядра токсина Bt и, в некоторой точке от конца части, содержащей ядро токсина, белок переходит в гетерологичную последовательность протоксина. N-концевая часть токсина Bt, обладающая инсектицидной активностью, называется “ядром” токсина. Переход от сегмента ядра токсина к сегменту гетерологичного протоксина может находиться приблизительно в месте соединения токсин/протоксин или, в качестве альтернативы, может быть сохранена часть естественного протоксина (простирающаяся за пределы части ядра токсина) с переходом в гетерологичную часть, протоксин, расположенную далее.
В качестве примера, один из химерных токсинов по настоящему изобретению представляет собой часть, относящуюся к ядру токсина Cry1Ca (приблизительно 600 аминокислот) и/или гетерологичный протоксин (остальные аминокислоты до С-конца). В одном из предпочтительных вариантов осуществления, часть химерного токсина, содержащую протоксин, получают из белка-токсина Cry1Ab. В предпочтительном варианте осуществления, часть химерного токсина, содержащую протоксин, получают из белка-токсина Cry1Ab.
Специалист в данной области техники признает, что Bt токсины, даже в рамках определенного класса, такого как Cry1Ca, немного различаются по длине и точному положению перехода от ядра токсина к части, относящейся к протоксину. Обычно токсины Cry1Ca имеют длину от примерно 1150 до примерно 1200 аминокислот. Переход от части, относящейся к ядру токсина, к части, относящейся к протоксину, обычно находится в пределах от 50% до 60% полной длины токсина. Химерный токсин рассматриваемого изобретения полностью включает указанную N-концевую часть ядра токсина. Таким образом, химерный токсин содержит по меньшей мере 50% полной длины белка-токсина Cry1 Bt, что обычно составляет по меньшей мере 590 аминокислот. Что касается части, относящейся к протоксину, то полная длина части, относящейся к протоксину Cry1Ab, простирается от конца части, относящейся к ядру токсина, до С-конца молекулы.
Гены и токсины. Гены и токсины, используемые по настоящему изобретению, включают не только раскрытые последовательности полной длины, но также фрагменты этих последовательностей, варианты, мутанты и слитые белки, которые сохраняют характеристики пестицидной активности токсинов, примеры которых приведены в настоящем документе. В настоящем документе термин “варианты” или “вариации” генов относится к нуклеотидным последовательностям, которые кодируют одни и те же токсины или которые кодируют токсины-эквиваленты, обладающие пестицидной активностью. В настоящем документе термин “токсины-эквиваленты” относится к токсинам, имеющим такую же или по существу такую же биологическую активность по отношению к целевым насекомым-вредителям, что и заявленные токсины.
В настоящем документе используются следующие ограничительные признаки: примерно 95% (для Vip3Ab и Cry1Ca), 78% (для Vip3Ab и Cry1C) и 45% (для Cry1) идентичность последовательностей согласно “Revision of the Nomenclature for the Bacillus thuringiensis Pesticidal Crystal Proteins”, N. Crickmore, D.R. Zeigler, J. Feitelson, E. Schnepf, J. Van Rie, D. Lereclus, J. Baum, and D.H. Dean. Microbiology and Molecular Biology Reviews (1998) Vol. 62: 807-813. Эти ограничения применимы только в отношении ядра токсинов.
Для специалиста в данной области техники очевидно, что гены, кодирующие активные токсины, могут быть идентифицированы и получены несколькими способами. Конкретные гены или части генов, проиллюстрированные в настоящем документе, могут быть получены из изолятов, депонированных в депозитарии культур. Эти гены или их части, или варианты также могут быть сконструированы синтетически, например, с использованием синтезатора генов. Вариации генов могут быть легко сконструированы стандартными методами для осуществления точечных мутаций. Фрагменты этих генов также могут быть получены с использованием коммерчески доступных экзонуклеаз или эндонуклеаз согласно стандартным процедурам. Например, для последовательного отщепления нуклеотидов от концов этих генов могут быть использованы такие ферменты, как Bal31, или сайт-направленный мутагенез. Гены, кодирующие активные фрагменты, также могут быть получены с использованием различных рестрикционных ферментов. Для непосредственного получения активных фрагментов указанных белков-токсинов могут быть использованы протеазы.
Фрагменты и эквиваленты, которые сохраняют пестицидную активность проиллюстрированных токсинов, также находятся в пределах объема настоящего изобретения. В силу избыточности генетического кода аминокислотные последовательности, раскрытые в настоящем документе, могут кодироваться множеством различных ДНК-последовательностей. Специалисту в данной области техники не составит труда создать такие альтернативные ДНК-последовательности, кодирующие такие же или по существу такие же токсины. Такие варианты ДНК-последовательностей находятся в пределах объема настоящего изобретения. В настоящем документе “по существу такие же” последовательности обозначают последовательности, имеющие замены, делеции, добавления или вставки, которые существенно не влияют на пестицидную активность. Это определение также охватывает фрагменты генов, кодирующие белки, которые сохраняют пестицидную активность.
Еще один способ идентификации генов, кодирующих токсины, и частей генов, пригодных согласно настоящему изобретению, состоит в использовании олигонуклеотидных зондов. Такие зонды представляют собой детектируемые нуклеотидные последовательности. Эти последовательности могут быть детектируемыми в силу наличия соответствующей метки или могут быть выполнены с возможностью их естественной флуоресценции, как описано в международной заявке WO93/16094. Как известно из уровня техники, если зонд и образец нуклеиновой кислоты гибридизуются, формируя сильную связь между двумя указанными молекулами, можно сделать достаточно обоснованное предположение, что зонд и образец являются по существу гомологичными. Предпочтительно, гибридизацию проводят в жестких условиях методом, хорошо известным из уровня техники, например, описанным в Keller, G. FL, M. M. Manak (1987) DNA Probes, Stockton Press, New York, N.Y., pp. 169-170. Некоторые примеры комбинаций концентрации соли и температуры являются следующими (в порядке возрастания жесткости): 2X SSPE или SSC при комнатной температуре; 1X SSPE или SSC при 42°C; 0,1X SSPE или SSC при 42°C; 0,1X SSPE или SSC при 65°C. Детектирование зонда обеспечивает средство для определения известным способом, произошла ли гибридизация. Такой зондовый анализ обеспечивает быстрый способ идентификации кодирующих токсин генов по настоящему изобретению. Нуклеотидные сегменты, используемые в качестве зондов, согласно изобретению, могут синтезироваться в ДНК-синтезаторе и с помощью стандартных процедур. Данные нуклеотидные последовательности также могут использоваться в качестве ПЦР-праймеров для амплификации генов по изобретению.
Варианты токсинов. В настоящем документе, в частности, приведены примеры некоторых токсинов по изобретению. Поскольку эти токсины являются всего лишь примерами токсинов по изобретению, очевидно, что настоящее изобретение содержит варианты или эквивалентные токсины (и нуклеотидные последовательности, кодирующие эквивалентные токсины), имеющие пестицидную активность, такую же или аналогичную пестицидной активности токсина, приведенного в качестве примера. Эквивалентные токсины обладают гомологией по аминокислотам с приведенным в качестве примера токсином. Такая гомология по аминокислотам обычно превышает 75%, предпочтительно превышает 90%, и наиболее предпочтительно превышает 95%. Гомология по аминокислотам является наибольшей в критических областях, которые ответственны за биологическую активность или участвуют в определении трехмерной конфигурации, которая, в конечном счете, и отвечает за биологическую активность. В этом отношении, определенные аминокислотные замены являются приемлемыми и допустимыми, если эти замены находятся в областях, которые не являются критичными для активности или представляют собой консервативные аминокислотные замены, которые не влияют на трехмерную конфигурацию молекулы. Например, аминокислоты могут быть отнесены к следующим классам: неполярные, незаряженные полярные, основные и кислые. Консервативные замены, в которых аминокислота одного класса заменяется аминокислотой из того же класса, находятся в пределах объема настоящего изобретения при условии, что замена не изменяет существенно биологическую активность соединения. Ниже приводится список примеров аминокислот, принадлежащих каждому классу.
В некоторых примерах также могут быть использованы неконсервативные замены. При этом критическим фактором является то, что такие замены не должны существенно ухудшать биологическую активность токсина.
Рекомбинантные хозяева. Гены, кодирующие токсины по настоящему изобретению, могут быть введены во множество различных микроорганизмов-хозяев или растений-хозяев. Экспрессия гена токсина приводит в результате, прямо или опосредованно, к внутриклеточному продуцированию и поддержанию пестицида. Для создания штамма Bt, экспрессирующего оба токсина по изобретению, могут быть использованы конъюгационный перенос и рекомбинантный перенос. Один или оба гена токсинов могут быть перенесены также в другие организмы-хозяева, которые могут затем использоваться для получения синергического эффекта. При использовании подходящих микроорганизмов-хозяев, например Pseudomonas, такие микроорганизмы можно применять в местах нахождения насекомого-вредителя, где они будут размножаться и попадать в кишечник насекомого, что приведет в результате к контролю насекомого-вредителя. В качестве альтернативы, микроорганизмы, содержащие ген токсина, могут быть обработаны в условиях, продлевающих активность токсина и стабилизирующих клетку. Затем обработанные клетки, которые сохраняют токсическую активность, вносят в среду обитания целевого насекомого-вредителя.
Если ген Bt токсина вводят с помощью подходящего вектора в микроорганизм-хозяин, а указанный хозяин затем вводят в среду обитания в живом состоянии, то принципиальным моментом является использование определенных микроорганизмов-хозяев. Выбираются такие микроорганизмы-хозяева, в отношении которых известно, что они обитают в “фитосфере” (филлоплане, филлосфере, ризосфере и/или ризоплане) одной или более представляющих интерес зерновых культур. Такие микроорганизмы выбирают таким образом, чтобы они обладали способностью успешно конкурировать в конкретной среде обитания (зерновой культуре или других местах обитания насекомых) с дикими типами микроорганизмов, обеспечивали стабильное поддержание и экспрессию полипептида-пестицида и, желательно, обеспечивали улучшенную защиту пестицида от разложения и инактивации под действием окружающей среды.
В отношении огромного количества микроорганизмов известно, что они обитают в филлоплане (поверхности листьев растений) и/или в ризосфере (почве, окружающей корневую систему растения) множества важных зерновых культур. Эти микроорганизмы включают бактерии, водоросли и грибы. Особый интерес представляют такие микроорганизмы, как бактерии, например, относящиеся к родам Pseudomonas, Erwinia, Serratia, Klebsiella, Xanthomonas, Streptomyces, Rhizobium, Rhodopseudomonas, Methylophilius, Agrobactenum, Acetobacter, Lactobacillus, Arthrobacter, Azotobacter, Leuconostoc и Alcaligenes; грибы, в частности, дрожжи, например, относящиеся к видам Saccharomyces, Cryptococcus, Kluyveromyces, Sporobolomyces, Rhodotorula и Aureobasidium. Особый интерес представляют такие виды, обитающих в фитосфере бактерий, как Pseudomonas syringae, Pseudomonas fluorescens, Serratia marcescens, Acetobacter xylinum, Agrobactenium tumefaciens, Rhodopseudomonas spheroides, Xanthomonas campestris, Rhizobium melioti, Alcaligenes entrophus и Azotobacter vinlandii, такие виды обитающих в фитосфере дрожжей, как Rhodotorula rubra, R. glutinis, R. marina, R. aurantiaca, Cryptococcus albidus, C. diffluens, C. laurentii, Saccharomyces rosei, S. pretoriensis, S. cerevisiae, Sporobolomyces roseus, S. odorus, Kluyveromyces veronae и Aureobasidium pollulans. Особый интерес представляют пигментированные микроорганизмы.
Существует широкий спектр способов введения Bt генов, кодирующих токсин, в микроорганизм-хозяин в условиях обеспечивающих стабильную поддержку и экспрессию этого гена. Эти способы хорошо известны специалистам в данной области техники и описаны, например, в патенте США № 5135867, который включен в настоящий документ в виде ссылки.
Обработка клеток. Клетки Bacillus thuringiensis или рекомбинантные клетки, экспрессирующие Bt токсины, могут быть обработаны с целью продления активности токсина и стабилизации клетки. Формируемая микрокапсула с пестицидом содержит Bt токсин или токсины внутри клеточной структуры, которая была стабилизирована и защищает токсин при внесении микрокапсулы в среду обитания целевого насекомого-вредителя. Подходящие клетки-хозяева могут включать либо клетки прокариот, либо эукариот, и обычно ограничены только теми клетками, которые не вырабатывают вещества, токсичные для высших организмов, таких как млекопитающие. Тем не менее, могут быть использованы организмы, вырабатывающие вещества, токсичные для высших организмов, если эти токсичные вещества являются нестабильными, или вносимое количество является настолько низким, что при этом отсутствует какая-либо вероятность интоксикации млекопитающего-хозяина. В качестве хозяев особый интерес представляют прокариоты и низшие эукариоты, такие как грибы.
При обработке клетки обычно являются интактными и по существу находятся в пролиферативной форме, а не в форме спор, хотя в некоторых случаях могут быть использованы споры.
Обработка клеток микроорганизмов, т.е. клеток, содержащих ген или гены Bt токсина, может выполняться с использованием химических или физических средств или с использованием комбинации химических и/или физических средств при условии, что эти методы не оказывают негативного влияния на свойства токсина, а также не ухудшают способность клетки защищать токсин. Примерами химических реагентов являются галогенирующие агенты, в частности галогены с атомными номерами 17-80. Более точно, можно использовать йод в мягких условиях в течение времени, достаточного для достижения желаемых результатов. Другие подходящие методы включают обработку альдегидами, такими как глутаральдегид; противоинфекционными средствами, такими как зефиран хлорид и цетилпиридинхлорид; спиртами, такими как изопропиловый спирт и этанол; различными гистологическими фиксаторами, такими как Люголь-йод, фиксатор Буэна, различные кислоты и фиксатор Helly (См. Humason, Gretchen L., Animal Tissue Techniques, W. H. Freeman and Company, 1967); или комбинацией физических (тепло) и химических агентов, которые защищают и способствуют пролонгированию активности токсина, продуцируемого в клетке при введении этой клетки животному-хозяину. Примерами физических средств являются коротковолновое излучение, такое как гамма-излучение и рентгеновское излучение, заморозка, УФ-облучение, лиофилизация и прочие. Способы обработки клеток микроорганизмов описаны в патентах США №№ 4695455 и 4695462, которые включены в настоящий документ в виде ссылки.
Клетки обычно имеют повышенную структурную стабильность, что увеличивает их устойчивость к условиям окружающей среды. Если пестицид находится в проформе, способ обработки клетки следует выбирать таким образом, чтобы патогеном целевого насекомого-вредителя не подавлялся процессинг от проформы к зрелой форме пестицида. Например, формальдегид будет сшивать белки и может подавлять процессинг проформы полипептида-пестицида. Способ обработки клетки должен способствовать сохранению по меньшей мере существенной доли биодоступности или биоактивности токсина.
Представляющие особый интерес характеристики при выборе клетки-хозяина с целью продуцирования, включают легкость введения Bt гена или генов в клетку хозяина, доступность экспрессирующей системы, эффективность экспрессии, стабильность пестицида в клетке-хозяине и наличие вспомогательных генетических возможностей. Представляющие особый интерес характеристики в случае использования в виде пестицидной микрокапсулы включают защитные свойства в отношении пестицида, такие как толстые клеточные стенки, пигментация и внутриклеточная упаковка или формирование включений; выживание в водной среде; отсутствие токсичности для млекопитающего; привлекательность для поглощения насекомыми-вредителями; легкость в уничтожении и фиксации без повреждения токсина и тому подобное. Также может рассматриваться легкость в создании и обращении, экономичность, стабильность при хранении и тому подобное.
Выращивание клеток. Клетку-хозяина, содержащую инсектицидный Bt ген или гены можно выращивать в любой подходящей питательной среде, в которой ДНК-конструкция обеспечивает селективное преимущество, обеспечивая такую селективную среду, что все или по существу все клетки сохраняют Bt ген. Затем эти клетки могут быть собраны известными методами. С другой стороны, клетки можно обрабатывать до их сбора.
Bt клетки, продуцирующие токсины по изобретению, могут быть культивированы с использованием стандартных сред и методов ферментации, известных в данной области техники. После завершения цикла ферментации бактерии могут быть собраны сначала путем выделения спор и кристаллов Bt из ферментационного бульона способами, хорошо известными в данной области. Восстановленные споры и кристаллы Bt могут быть представлены в составах в виде смачиваемого порошка, жидкого концентрата, гранул или в виде других составов с добавлением поверхностно-активных веществ, диспергирующих веществ, инертных наполнителей и других компонентов для облегчения обращения с ними и их применения по отношению к конкретным целевым насекомым-вредителям. Такие составы и процедуры нанесения хорошо известны в данной области.
Составы. Сформированные гранулы-приманки, содержащие аттрактант и споры, кристаллы и токсины Bt изолятов, или рекомбинантные микробы, содержащие гены, полученные из Bt изолятов, раскрытых в настоящем документе, могут быть внесены в почву. Сформированный продукт также может быть нанесен в виде покрытия на семена или в процессе обработки корней или обработки всего растения на поздних стадиях цикла развития кукурузы. Обработка растений и почвы Bt клетками может производиться с использованием смачиваемых порошков, гранул или пудры путем смешивания с различными инертными материалами, такими как неорганические минералы (филлосиликаты, карбонаты, сульфаты, фосфаты и т.п.) или растительными материалами (измельченной сердцевиной кукурузного початка, рисовой шелухой, ореховой скорлупой и т.п.). Составы могут включать адгезивные адъюванты, стабилизирующие агенты, другие пестицидные добавки или поверхностно-активные вещества. Жидкие составы могут быть водными или неводными и могут применяться в виде пен, гелей, суспензий, эмульгируемых концентратов и т.п. Ингредиенты могут включать реологические агенты, поверхностно-активные вещества, эмульгаторы или полимеры.
Как хорошо известно специалисту в данной области, пестицидная концентрация может варьировать в широких пределах в зависимости от природы конкретной композиции, в частности, от того, будет ли она представлять собой концентрат или будет использоваться непосредственно. Пестицид может присутствовать по меньшей мере в количестве 1 вес.% и может составлять 100% веса композиции. Сухие композиции могут содержать пестицид в количестве примерно от 1 до 95 вес.%, в то время как жидкие составы как правило, могут содержать примерно от 1 до 60 вес.% твердого вещества в жидкой фазе. Композиции, как правило, могут содержать примерно от 102 до 104 клеток/мг. Эти составы применяются в количестве от примерно 50 мг (в жидком или сухом виде) до 1 кг или более на гектар.
Составы могут наноситься на среду обитания чешуекрылого насекомого-вредителя, например на листву или на почву, путем орошения, опыления, обрызгивания и т.п.
Трансформация растений. Предпочтительным рекомбинантным хозяином для продуцирования обладающих инсектицидным действием белков по изобретению является трансформированное растение. Гены, кодирующие белки Bt токсина, как это раскрыто в настоящем документе, могут быть введены в клетки растения множеством различных методов, которые хорошо известны в данной области техники. Например, для подготовки к введению чужеродных генов в высшие растения доступно множество клонирующих векторов, содержащих репликационную систему Escherichia coli и маркер, который обеспечивает возможность отбора трансформированных клеток. В число таких векторов входят, помимо прочих, pBR322, pUC серия, M13mp серия и pACYC184. Соответственно, фрагмент ДНК, содержащий последовательность, кодирующую белок Bt токсина, может быть вставлен в вектор в подходящем сайте рестрикции. Полученная в результате плазмида используется для трансформации в E. coli. Клетки E. coli культивируют в подходящей питательной среде, затем собирают и лизируют. Плазмиды выделяют. В качестве способов анализа обычно используют секвенирование, рестрикционный анализ, электрофорез и другие биохимические и молекулярно-биологические способы. После каждой операции использованная ДНК-последовательность может быть отщеплена и присоединена к следующей ДНК-последовательности. Каждая плазмидная последовательность может быть клонирована в тех же или других плазмидах. В зависимости от способа введения в растение желаемых генов также могут быть необходимы другие ДНК-последовательности. Например, если для трансформации клетки растения используются плазмиды Ti или Ri, то по меньшей мере правый конец, а часто как правый, так и левый концы Ti или Ri плазмидной Т-ДНК, должны быть присоединены в качестве фланкирующих областей предназначенных для вставки генов. Использование Т-ДНК для трансформации клеток растений подробно исследовано и исчерпывающе раскрыто в EP 120516, Lee and Gelvin (2008), Hoekema (1985), Fraley et al, (1986) and An et al., (1985) и является хорошо известным в данной области техники.
После того как введенная ДНК интегрируется в геном растения, она становится относительно стабильной. Трансформационный вектор обычно содержит обеспечивающий возможность отбора маркер, который обеспечивает устойчивость трансформированной клетки растения к биоциду или антибиотику, такому как, например, Биалафос, Канамицин, G418, Блеомицин или Гигромицин. Отдельно используемый маркер должен, соответственно, обеспечивать отбор трансформированных клеток, а не тех клеток, которые не содержат вводимую ДНК.
Существует множество способов введения ДНК в растительную клетку-хозяина. Эти способы включают трансформацию с помощью Т-ДНК, используя Agrobacterium tumefaciens или Agrobacterium rhizogenes в качестве трансформирующего агента, слияние, инъекцию, биолистику (бомбардировку микрочастицами) или электорпорацию, а также другие возможные способы. Если для трансформации используются Agrobacteria, предназначенная для введения ДНК должна быть клонирована в специальные плазмиды, а именно, либо в промежуточный вектор, либо в бинарный вектор. Промежуточные вектора могут быть встроены в Ti или Ri плазмиду методом гомологичной рекомбинации благодаря последовательностям, которые гомологичны последовательностям в Т-ДНК. Ti или Ri плазмиды также сдержат vir-область, необходимую для переноса Т-ДНК. Промежуточные вектора не могут самореплицироваться в Agrobacteria. Промежуточный вектор может быть перенесен в Agrobacterium tumefaciens с помощью плазмиды-хелпера (конъюгация). Бинарные вектора могут самореплицироваться как в E. coli, так и в Agrobacteria. Они содержат ген маркера селекции и линкер или полилинкер, который ограничен областями правой и левой границ Т-ДНК. Они могут быть трансформированы непосредственно в Agrobacteria (Holsters et ah, 1978). Agrobacteria, используемые в качестве клеток-хозяев, должны содержать плазмиду, несущую vir-область. Vir-область необходима для переноса Т-ДНК в клетку растения. Также могут содержаться дополнительные Т-ДНК. Трансформированные таким образом бактерии используются для трансформации клеток растения. Для переноса ДНК в клетку растения растительные эксплантанты можно преимущественно культивировать с Agrobacterium tumefaciens или Agrobacterium rhizogenes. Затем из инфицированного растительного материала (например, частей листьев, сегментов стебля, корней, а также из протопластов или клеток, культивированных в суспензии) в подходящей среде, которая может содержать антибиотики или биоциды для селекции, может быть регенерировано целое растение. Полученные таким образом растения затем могут быть исследованы на наличие внедренной ДНК. В случае инъекции или электропорации к плазмидам не предъявляется никаких дополнительных требований. Возможно использование обычных плазмид, таких как, например, производные от pUC.
Трансформированные клетки растут в растениях обычным образом. Они могут формировать зародышевые клетки и передавать трансформированный признак(и) растениям-потомкам. Такие растения можно выращивать обычным способом и скрещивать с растениями, которые имеют такие же трансформированные наследственные факторы или другие наследственные факторы. Полученные в результате гибридные особи обладают соответствующими фенотипическими свойствами.
В предпочтительном варианте осуществления настоящего изобретения, растения трансформируют генами, в которых использование кодона оптимизировано для растений. См., например, патент США № 5380831, включенный в настоящий документ в виде ссылки. Хотя в настоящем документе в качестве примеров приведены укороченные токсины, в области использования Bt хорошо известно, что 130 кДа (полноразмерные) токсины имеют N-концевую половину, которая является ядром токсина, и С-концевую половину, которая представляет собой “хвост” протоксина. Таким образом, с укороченными/ядерными токсинами по настоящему изобретения можно использовать подходящие “хвосты”. См., например, патент США № 6218188 и патент США № 6673990. Помимо этого, способы создания синтетических Bt генов для использования в растениях известны в данной области техники (Stewart and Burgin, 2007). Одним из неограничивающих примеров трансформированного растения является плодоносное растение маиса, содержащее экспрессируемый растением ген, кодирующий белок Vip3Ab, и дополнительно содержащее экспрессируемый растением ген, кодирующий белок Cry1Ca.
Перенос (или интрогрессия) признака(ов) определяемого Vip3Ab и Cry1Ca в инбредные линии маиса может достигаться путем выведения растений на основе рекуррентного отбора, например, путем обратного скрещивания. В этом случае, желаемый рекуррентный родитель сначала скрещивается с донорной инбредной особью (нерекуррентным родителем), несущей подходящий ген(ы) для признаков, определяемых Vip3Ab и Cry1C. Затем потомство от этого обратного скрещивания спаривают с рекуррентным родителем с последующим отбором полученного потомства по желаемому признаку(ам), который должен быть перенесен от нерекуррентного родителя. После трех, предпочтительно, четырех, более предпочтительно, пяти или более поколений полученных методом обратного скрещивания с рекуррентным родителем в результате отбора по желаемому признаку(ам), потомство становится гетерозиготным по локусу, контролирующему переносимый признак(и), но остается подобным рекуррентному родителю по большинству или почти по всем остальным генам (см., например, Poehlman & Sleper (1995) Breeding Field Crops, 4th Ed., 172-175; Fehr (1987) Principles of Cultivar Development, Vol. 1: Theory and Technique, 360-376).
Стратегии управления устойчивостью насекомых (IRM). Например, Roush et al. описывает стратегии с двумя токсинами, что также называется созданием “пирамид” или “пакетов”, для управления трансгенными растениями, обладающими инсектицидными свойствами. (The Royal Society. Phil. Trans. R. Soc. Lond. B. (1998) 353, 1777-1786).
На другом веб-сайте Агентство США по защите окружающей среды (epa.gov/oppbppdl/biopesticides/pips/bt_corn_refuge_2006.htm) опубликовало следующие требования для обеспечения нетрансгенных (т.е. не содержащих Bt генов) убежищ (раздел зерновые культуры/кукуруза, не содержащие Bt генов) для использования с трансгенными зерновыми культурами, продуцирующими один Bt белок, активный по отношению к целевым насекомым-вредителям. “Конкретные структурированные требования к кукурузе, защищенной от кукурузного мотылька белками Bt (Cry1Ab или Cry1F) являются следующими:
Структурированные убежища:
20% убежище из кукурузы, не имеющей Bt защиты от чешуекрылых в областях, где кукуруза является основной культурой;
50% убежище из растений, не имеющих Bt защиты от чешуекрылых, в областях, где хлопок является основной культурой.
Блоки:
Внутренние (т.е. внутри Bt поля).
Внешние (т.е. отдельные поля в пределах 1/2 мили (1/4 мили, если возможно) от Bt поля для обеспечения максимального объема случайного спаривания).
Расположенные на поле полосы
Полосы должны иметь по меньшей мере 4 ряда в ширину (предпочтительно 6 рядов) для уменьшения эффекта «перемещения личинок».
Помимо этого, Национальная Ассоциация Производителей Кукурузы на своем веб-сайте (ncga.com/insect-resistance-management-fact-sheet-bt-corn) также представила похожие рекомендации в отношении требований на убежища. Например:
“Требования в отношении IRM для мотылька кукурузного:
- засевать по меньшей мере 20% от площади посева кукурузы под гибриды-убежища.
- В регионах, выращивающих хлопок, убежища должны составлять 50%.
- Посевы необходимо высаживать в пределах 1/2 мили от гибридов-убежищ.
- Убежища можно засевать в виде полос внутри Bt поля; полосы-убежища должны составлять по меньшей мере 4 ряда в ширину.
- Убежища могут обрабатываться обычными пестицидами только в случае достижения экономического порога, достигаемого для целевого насекомого.
- Основанные на Bt распыляемые инсектициды нельзя использовать в отношении кукурузы-убежища.
- Подходящие убежища необходимо высаживать на каждой ферме с Bt кукурузой”.
Как указано у Roush et al. (например, на стр. 1780 и 1784, правая колонка), создание пакетов или пирамид из двух различных белков, каждый из которых является активным в отношении целевого насекомого-вредителя, и с малой или без перекрестной устойчивости может обеспечивать возможность использования меньших убежищ. Roush указывает, что для успешно разработанного пакета размер убежища менее чем 10% может обеспечить эффект по управлению устойчивостью, сопоставимый с 50% убежищем для одиночного (на организованного в виде пирамиды) признака. Для доступных в настоящее время Bt продуктов кукурузы Агентство Защиты Окружающей Среды США требует существенно меньшего объема (обычно 5%) высаженных структурированных убежищ кукурузы, не содержащей Bt гены, чем в случае продуктов с единственным признаком (обычно 20%).
Существуют различные способы обеспечения IRM эффектов убежищ, включая различные геометрические паттерны посадок на полях (как уже упоминалось выше) и смешивание семян перед посевом как обсуждалось у Roush et al. (см. выше) и в патенте США № 6551962.
Приведенные выше процентные соотношения или близкие к ним соотношения убежищ могут использоваться для рассматриваемых двойных и тройных пакетов или пирамид. Для тройных пакетов и тремя местами действия на одного целевого насекомого-вредителя целевым значением является нулевая площадь убежища (или убежище с площадью, например, менее 5%). Это в особенности верно для коммерческих посевных площадей, например, более чем 10 акров.
Все патенты, заявки на патент, предварительные заявки и публикации, на которые приведены ссылки или которые цитируются в настоящем документе, включены в виде ссылки во всей своей полноте в той части, в которой они не противоречат сведениям, в явном виде приводимым в настоящем описании.
За исключением случаев, когда это специально оговорено или следует из контекста, грамматические формы единственного числа следует понимать как означающие “по меньшей мере один”.
Ниже приведены примеры, которые иллюстрируют способы осуществления изобретения.
Эти примеры не следует рассматривать в качестве ограничивающих. Все процентные соотношения указаны по массе, а соотношения в растворах указаны по объему. Все температуры указаны в градусах Цельсия.
ПРИМЕРЫ
Пример 1 - Получение и обработка трипсином белков Vip3Ab и Cry1Ca
Гены, кодирующие протоксины Cry1Ca и Vip3Ab1 экспрессировали в экспрессирующих штаммах Pseudomonas fluorescens, и белки полной длины выделяли в виде нерастворимых внутриклеточных телец. Промытые внутриклеточные тельца солюбилизировали перемешиванием при 37°C в буфере, содержащем 20 мМ CAPS буфера, pH 11, дополненном 10 мМ DDT и, 0,1% 2-меркаптоэтанолом, в течение 2 часов. Раствор центрифугировали при 27000x g в течение 10 минут при 37°C, супернатант обрабатывали 0,5% (вес./об.) TCPK-обработанным трипсином (Sigma). Этот раствор инкубировали при одновременном перемешивании в течение 1 часа при комнатной температуре, фильтровали, затем загружали в колонку Pharmacia Mono Q 1010, уравновешенную 20 мМ CAPS, pH 10,5. После промывки заряженной колонки буфером в количестве 2-х объемов колонки укороченный токсин элюировали, используя линейный градиент 0-0,5 M NaCl в 20 мМ CAPS в количестве 15-ти объемов колонки со скоростью потока 1,0 мл/мин. Очищенные Cry белки, укороченные трипсином, элюировали, используя примерно 0,2-0,3 M NaCl. Чистоту белков оценивали ДСН-ПААГ электрофорезом и визуализировали с помощью красителя Кумасси бриллиантового синего. В некоторых случаях объединенные фракции очищенного токсина концентрировали и загружали в колонку с Сефарозой 6 (диаметром 1,6 см, длиной 60 см) и очищали гель-хроматографией. Фракции, содержащие один пик, соответствующий молекулярному весу мономера, объединяли и концентрировали, получая препарат, гомологичный более чем на 95% белку с молекулярным весом примерно 60000 кДа.
Обработку Vip3Ab1 проводили аналогичным образом, взяв в качестве исходного белка очищенный 85 кДа белок полной длины (DIG-307). Белок (12 мг) диализовали в 50 мМ натрий фосфатного буфера, pH 8,4, затем обрабатывали путем добавления 1 мг твердого трипсина и инкубировали в течение 1 часа при комнатной температуре. Раствор загружали в MonoQ анионно-обменную колонку (диаметром 1 см, длиной 10 см) и элюировали, используя линейный градиент 0-500 мМ NaCl в 20 мМ натрий фосфатном буфере, pH 8,4, в количестве, равном 7-ми объемам колонки. Элюирование белка контролировали ДСН-ПААГ электрофорезом. Основная обработанная полоса имела молекулярный вес 65 кДа, определенный методом ДСН-ПААГ электрофореза с использованием для сравнения стандартов молекулярного веса.
Пример 2 - Йодирование Cry1Ca белка ядра токсина
Предыдущая работа показала, что Cry1Ca трудно поддается введению радиоактивной метки с использованием традиционных способов, хотя в некоторых особых случаях он может быть снабжен радиоактивной меткой и хорошо работать в анализе связывания с рецептором. Для введения радиоактивной метки в Cry1Ca было решено использовать метод с использованием 125I-меченного флуоресцеин-5-малеимида, который успешно работал при мечении Cry1Fa (Prov. 69919). Йодирование флуоресцеин-5-малеимида и последующая конъюгация этого радиоактивно меченного химического вещества с Cry1Ca обеспечили цистеин-специфическое мечение белка. Такая процедура введения радиоактивной метки является высоко специфичной по отношению к предназначенным для мечения остаткам. Сегмент Cry1Ca ядра токсина (остатки 29-619) содержит два аминокислотных цистеиновых остатка в положениях 210 и 438. Palmer et al. (1997) показал, что фенильное кольцо флуоресцеин-5-малеимида может быть йодировано с помощью радиоактивного йода. Затем йодированный флуоресцеин-5-малеимид может реагировать с белками, содержащими сульфгидрильные группы (что обеспечивается, например, свободными цистеиновыми остатками), путем алкилирования свободных цистеинов в белке, и таким образом образуя радиоактивно меченный белок. Укороченное трипсином ядро токсина Cry1Ca содержит два цистеиновых остатка и таким образом обеспечивает субстрат для алкилирования и введения радиоактивной метки в этих двух (специфических) участках белка.
Флуоресцеин-5-малеимид (F5-M) растворяли в 10 мМ ДМСО (диметилсульфоксид), затем разводили до концентрации 1 мМ забуференным фосфатом рассолом (PBS; 20 мМ фосфат натрия, 0,15 М NaCl, pH 7,5), которую определяли по коэффициенту молярной экстинкции F 5-M (68000 М-1см-1). К 100 мкл раствора PBS, содержащего две гранулы Pierce для йодирования (Thermo Fisher Scientific), добавляли 1,0 мКи Na125I за свинцовым экраном. Реакцию между компонентами проводили в течение 5 минут при комнатной температуре, затем в этот раствор добавляли 10 мкл 1 мМ раствора F 5-M. После проведения реакции йодирования в течение 10 мин удаляли раствор с помощью пипетки, и к раствору добавляли 2 мкг укороченного трипсином Cry1Ca белка ядра токсина высокой чистоты в PBS. Белок инкубировали при 4°С с раствором йодированного F 5-M в течение 48 часов, затем реакцию останавливали добавлением β-меркаптоэтанола до получения конечной концентрации, равной 14 мМ. Реакционную смесь вводили в центрифужную колонку Zeba™ (Invitrogen), уравновешенную 20 мМ CAPS, 150 мМ KCl, pH 9, и центрифугировали при 1500x g в течение 2 мин для отделения непрореагировавшего йодированного красителя от белка. 125I-меченный флуоресцеин-Cry1Ca белок ядра токсина измеряли на гамма-счетчике для определения удельной радиоактивности, исходя из предположения, что было извлечено 80% полученного белка токсина.
Удельная активность радиоактивно меченного Cry1Ca белка ядра токсина составила примерно 6,8 мкКи/мкг белка. Радиоактивно меченный белок также анализировали ДСН-ПААГ электрофорезом и визуализировали методом получения изображения с использованием люминесцентного состава для подтверждения того, что измеренная радиоактивность является ковалентно связанной с CrylCa белком ядра токсина. Окрашенные Кумасси ДСН-ПААГ гели SDS-PAGE визуализировали путем обертывания их пленкой Mylar™ (толщиной 12 мкм) и экспонирования под люминесцентным экраном Molecular Dynamics (Sunnyvale, CA) (35 см × 43 см) с длительным послесвечением в течение 1 часа. Пластины проявляли в люминесцентном устройстве визуализации Molecular Dynamics Storm 820, и изображения анализировали с помощью программного обеспечения ImageQuant™. Небольшая радиоактивность была зарегистрирована в области геля, расположенной сильно ниже полосы Cry1Ca белка ядра токсина (т.е., фрагментов, которые были по размеру меньше Cry1Ca белка ядра токсина на примерно 10 кДа и более). Эти радиоактивные вещества, видимо, представляли собой небольшие пептиды, возможно, ассоциированные с укороченным Cry1Ca белком вследствие воздействия трипсина, использованного для расщепления белка до его ядерной структуры.
Пример 3 - Сравнительный анализ связывания BBMV, выделенного из S. frugiperda, с белками ядра токсина Cry1Ca и Vip3Ab
Анализ конкурентного гомологичного и гетерологичного связывания выполняли, используя 150 мкг/мл BBMV белка и 2 нМ 125I-меченного Cry1Ca белка ядра токсина. Концентрации гомологичного конкурентного немеченного Cry1Ca белка ядра токсина, добавленного к реакционной смеси, составляли 0,1, 1, 10, 100 и 1000 нМ. Гетерологичный укороченный трипсином Vip3Ab белок исследовали при концентрациях 10 и 1000 нМ, и белки добавляли одновременно с радиоактивным Cry1Ca белком ядра токсина для гарантии наличия истинной конкуренции за связывание. Инкубацию проводили в течение 1 часа при 28°С, и 125I-меченный Cry1Ca белок ядра токсина, несвязанный с BBMV (т.е., не связанного с рецепторным белком насекомых), отделяли от связанного белка центрифугированием смеси BBMV при 16000x g в течение 8 мин и отделением супернатанта от полученного осадка. Осадок промывали три раза охлажденным льдом буфером для связывания (PBS; 11,9 мМ Na2HP04, 137 мМ NaCl, 2,7 мМ KCl, pH 7,4 плюс 0,1% бычий сывороточный альбумин; Sigma-Aldrich, St. Louis, MO) для полного удаления любого несвязанного 125I-меченного Cry1Ca. Дно центрифужной пробирки с находящимся в нем осадком отрезали и помещали в 13×100 мм стеклянную культуральную пробирку, и с помощью гамма-счетчиков подсчитывали события в течение 10 минут для получения количества связанной радиоактивности, содержащейся в осадочной фракции. Количество радиоактивности во фракции связанного белка является показателем количества белка Cry, связанного с рецептором насекомого (общее связывание). Неспецифическое связывание было представлено количеством событий, полученным в осадке в присутствии 1000 нМ немеченного Cry1Ca белка ядра токсина. Количество меченного Cry1Ca, специфически связанного с BBMV (специфическое связывание), получали вычитанием величины неспецифического связывания из величины общего связывания. Считалось, что сто процентов общего связывания представляет собой величину связывания при отсутствии любого конкурентного Cry1Fa белка ядра токсина. Данные выражены в процентах специфического связывания 125I Cry1Ca в зависимости от концентрации конкурирующего немеченного лиганда.
Пример 4 - Краткий обзор результатов
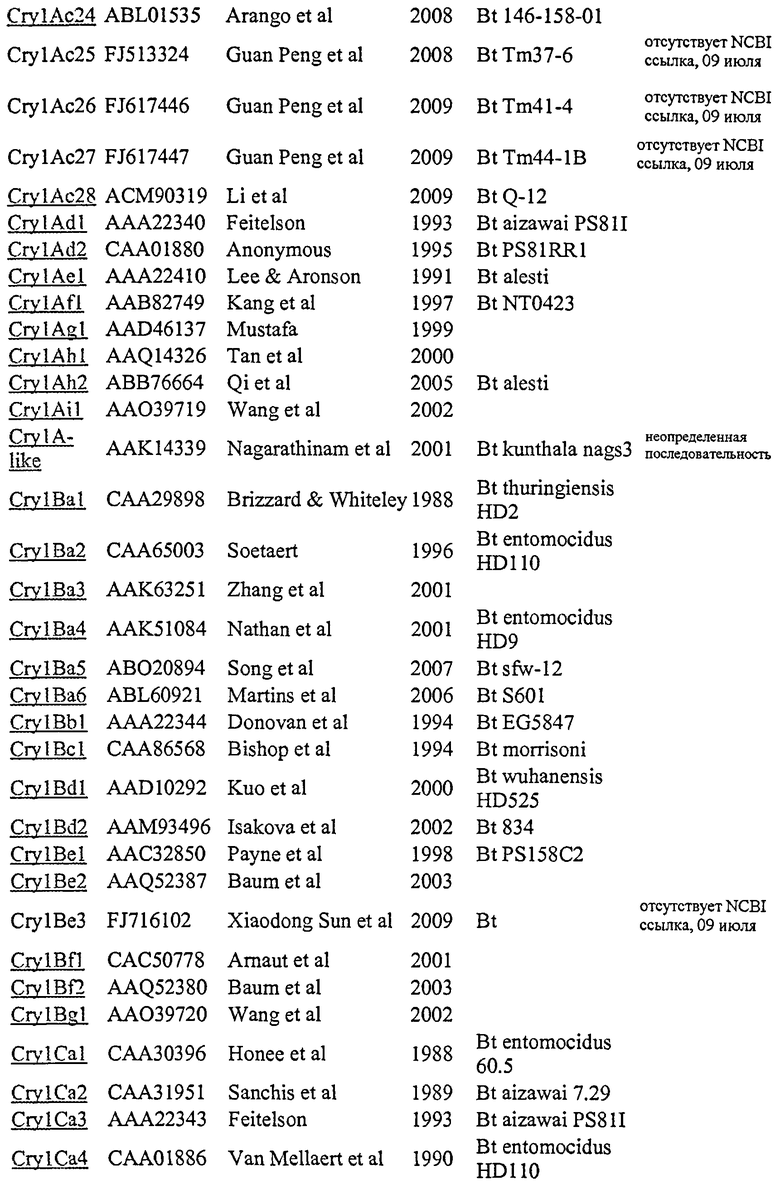
Результаты (Фиг. 1) демонстрируют, что гомологичный немеченный Cry1Ca белок эффективно замещает радиоактивно меченный Cry1Ca белок ядра токсина при специфическом связывании с BBMV белком, причем это замещение зависит от дозы. Vip3Ab не замещает связанный 125I-меченный CrylCa белок ядра токсина из рецепторного белка(ов) при обоих показанных концентрациях (10 или 1000 нМ). Самая высокая исследованная концентрация Vip3Ab (1000 нМ) в 500 раз превышает концентрацию радиоактивно меченного Cry1Ca, использованного в анализе, демонстрируя, что Vip3Ab не конкурирует эффективно с радиоактивно меченным Cry1Ca за связывание с BBMV S. frugiperda.
Фиг.1 представляет собой кривую доза-ответ для замещения 125I-меченного флуоресцеин-5-малеимид укороченного трипсином Cry1Ca в BBMV, выделенном из личинки S. frugiperda (FAW). Эта фигура показывает, что немеченный Cry1Ca (●) способен замещать меченный Cry1Ca в зависимости от дозы в диапазоне от 0,1 до 1000 нМ. На графике показана процентная доля специфически связанного меченного Cry1Ca (общее связывание минус неспецифическое связывание) в зависимости от концентрации добавленных лигандов без радиоактивной метки. Показана неспособность Vip3Ab1 (▲) без радиоактивной метки замещать специфически связанный радиоактивно меченный Cry1Ca в концентрациях 10 и 1000 нМ.
Список литературы

| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ Cry1Da В СОЧЕТАНИИ С Cry1Ca ДЛЯ УПРАВЛЕНИЯ УСТОЙЧИВЫМИ НАСЕКОМЫМИ | 2010 |
|
RU2569108C2 |
| ПРИМЕНЕНИЕ Cry1Da В СОЧЕТАНИИ С Cry1Be ДЛЯ УПРАВЛЕНИЯ УСТОЙЧИВЫМИ НАСЕКОМЫМИ | 2010 |
|
RU2590592C2 |
| ПРИМЕНЕНИЕ CRY1AB В КОМБИНАЦИИ С CRY1BE ДЛЯ УПРАВЛЕНИЯ РЕЗИСТЕНТНОСТЬЮ НАСЕКОМЫХ | 2010 |
|
RU2583288C2 |
| КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ БЕЛКОВ Vip3Ab И Cry1Fa ДЛЯ ВЫРАБАТЫВАНИЯ РЕЗИСТЕНТНОСТИ К НАСЕКОМЫМ | 2010 |
|
RU2607666C2 |
| КОНТРОЛЬ УСТОЙЧИВОСТИ НАСЕКОМЫХ С ПОМОЩЬЮ КОМБИНАЦИИ БЕЛКОВ Cry1Be И Cry1F | 2010 |
|
RU2575611C2 |
| КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ БЕЛКОВ CRY1Ca И CRY1Fa ДЛЯ БОРЬБЫ С РЕЗИСТЕНТНОСТЬЮ У НАСЕКОМЫХ | 2010 |
|
RU2593961C2 |
| КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ БЕЛКОВ Cry1Da И Cry1Fa ДЛЯ ВЫРАБАТЫВАНИЯ РЕЗИСТЕНТНОСТИ К НАСЕКОМЫМ | 2010 |
|
RU2603257C2 |
| КОМБИНИРОВАННОЕ ИСПОЛЬЗОВАНИЕ БЕЛКОВ CRY1Ca И CRY1Ab ДЛЯ КОНТРОЛЯ УСТОЙЧИВОСТИ НАСЕКОМЫХ | 2010 |
|
RU2596406C2 |
| ПРИМЕНЕНИЕ ИНСЕКТИЦИДНОГО КРИСТАЛЛИЧЕСКОГО БЕЛКА DIG3 В КОМБИНАЦИИ С CRY1AB ДЛЯ РЕГУЛИРОВАНИЯ УСТОЙЧИВОСТИ К КУКУРУЗНОМУ МОТЫЛЬКУ | 2012 |
|
RU2624031C2 |
| ИНСЕКТИЦИДНЫЕ БЕЛКОВЫЕ КОМБИНАЦИИ, СОДЕРЖАЩИЕ CRY1AB И CRY2AA, ДЛЯ РЕГУЛИРОВАНИЯ КУКУРУЗНОГО МОТЫЛЬКА И СПОСОБЫ БОРЬБЫ С УСТОЙЧИВОСТЬЮ НАСЕКОМЫХ | 2010 |
|
RU2569460C2 |











Изобретение относится к биотехнологии и представляет собой трансгенное растение, которое является устойчивым к насекомому кукурузной листовой совке, содержащее ДНК, кодирующую обладающий инсектицидным действием белок Vip3Ab, состоящий из SEQ ID NO: 1, и ДНК, кодирующую обладающий инсектицидным действием белок Cry1Ca, состоящий из SEQ ID NO: 2. Изобретение относится также к семени такого растения, множеству растений на поле, а также к способу контролирования развития устойчивости насекомого кукурузной листовой совки к белкам Vip3Ab и Cry1Ca, где способ включает приведение в контакт указанного насекомого с обладающим инсектицидным действием белком Vip3Ab, состоящим из SEQ ID NO: 1 и обладающим инсектицидным действием белком Cry1Ca, состоящим из SEQ ID NO: 2. Изобретение позволяет получить устойчивые к насекомым растения. 5 н. и 14 з.п. ф-лы, 1 ил., 4 пр.
1. Трансгенное растение, которое является устойчивым к насекомому кукурузной листовой совке, содержащее ДНК, кодирующую обладающий инсектицидным действием белок Vip3Ab, состоящий из SEQ ID NO: 1, и ДНК, кодирующую обладающий инсектицидным действием белок Cry1Ca, состоящий из SEQ ID NO: 2.
2. Трансгенное растение по п. 1, где указанное растение дополнительно содержит ДНК, кодирующую третий обладающий инсектицидным действием белок, при этом указанный третий белок выбирают из группы, состоящей из Cry1Fa, Cry1Da, Cry1Be и Cry1E.
3. Трансгенное растение по п. 2, где указанный третий белок выбирают из группы, состоящей из Cry1Fa и Cry1Be, при этом растение дополнительно содержит ДНК, кодирующую четвертый и пятый обладающие инсектицидным действием белки, выбранные из группы, состоящей из Cry2A, Cry1I, DIG-3 и Cry1Ab.
4. Семя растения по любому из пп. 1-3, содержащее ДНК, кодирующую обладающий инсектицидным действием белок Vip3Ab, состоящий из SEQ ID NO: 1, и ДНК, кодирующую обладающий инсектицидным действием белок Cry1Ca, состоящий из SEQ ID NO: 2, где указанное семя выращивают с целью контроля развития устойчивости кукурузной листовой совки к белкам Vip3Ab и Cry1Ca.
5. Множество растений на поле растений, включающее растения, не содержащие гены Bacillus thuringiensis (не содержащими Bt), которые не экспрессируют обладающие инсектицидным действием трансгенный белок, и множество трансгенных растений по любому из пп. 1-3, которые являются устойчивыми к кукурузной листовой совке, где указанные трансгенные растения содержат ДНК, кодирующую обладающий инсектицидным действием белок Vip3Ab, состоящий из SEQ ID NO: 1, и ДНК, кодирующую обладающий инсектицидным действием белок Cry1Ca, состоящий из SEQ ID NO: 2, где указанные растения, не содержащие Bt, составляют 5-40% всех зерновых растений на указанном поле, где указанное поле растений замедляет развитие устойчивости кукурузной листовой совки к белкам Vip3Ab и Cry1Ca.
6. Множество растений на поле растений по п. 5, где указанные растения, не содержащие Bt, составляют 30% всех зерновых растений на указанном поле.
7. Множество растений на поле растений по п. 5, где указанные растения, не содержащие Bt, составляют 20% всех зерновых растений на указанном поле.
8. Множество растений на поле растений по п. 5, где указанные растения, не содержащие Bt, составляют 10% всех зерновых растений на указанном поле.
9. Множество растений на поле растений по п. 5, где указанные растения, не содержащие Bt, составляют 5% всех зерновых растений на указанном поле.
10. Множество растений на поле растений по п. 5, где указанные растения, не содержащие Bt, расположены блоками или полосами.
11. Смесь семян, содержащая семена растений, не содержащих Bt, которые не экспрессируют обладающие инсектицидным действием трансгенный белок, и множество семян по п. 4, где указанные семена, не содержащие Bt, составляют 5-40% от всех семян в смеси, и указанную смесь семян выращивают с целью контроля развития устойчивости кукурузной листовой совки к обладающим инсектицидным действием белкам.
12. Смесь семян по п. 11, где указанные семена, не содержащие Bt, составляют 30% от всех семян в смеси.
13. Смесь семян по п. 11, где указанные семена, не содержащие Bt, составляют 20% от всех семян в смеси.
14. Смесь семян по п. 11, где указанные семена, не содержащие Bt, составляют 10% от всех семян в смеси.
15. Смесь семян по п. 11, где указанные семена, не содержащие Bt, составляют 5% от всех семян в смеси.
16. Множество растений на поле по любому из пп. 5-10, где указанные растения занимают более 10 акров.
17. Растение по любому из пп. 1-3, где указанное растение выбирают из группы, состоящей из кукурузы, сои и хлопка.
18. Трансгенное растение по п. 1, где указанное растение дополнительно содержит ДНК, кодирующую обладающий инсектицидным действием белок Cry1Fa.
19. Способ контролирования развития устойчивости насекомого кукурузной листовой совки к белкам Vip3Ab и Cry1Ca, где способ включает приведение в контакт указанного насекомого с обладающим инсектицидным действием белком Vip3Ab, состоящим из SEQ ID NO: 1 и обладающим инсектицидным действием белком Cry1Ca, состоящим из SEQ ID NO: 2.
| US2004197916 A1, 07.10.2004 | |||
| WO2009132850 A1, 05.11.2009 | |||
| PARDO-LOPEZ L | |||
| et al., Strategies to improve the insecticidal activity of Cry toxins from Bacillus thuringiensis, Peptides, 2009, Vol.30, N.3, pp | |||
| Прибор для переработки спирта в газовую смесь для двигателей внутреннего сгорания | 1920 |
|
SU589A1 |
| HERNANDEZ-MARTINEZ, P | |||
| et.al, Broad-spectrum cross-resistance in Spodoptera exigua from selection with a marginally toxic Cry protein | |||
| Pesticide Management Science, 2009 | |||
| Разборное приспособление для накатки на рельсы сошедших с них колес подвижного состава | 1920 |
|
SU65A1 |
| ФРАГМЕНТ ГИБРИДНОГО ТОКСИНА Bacillus thuringiensis, ОБЛАДАЮЩИЙ ИНСЕКТИЦИДНОЙ АКТИВНОСТЬЮ, КОДИРУЮЩАЯ ЕГО РЕКОМБИНАНТНАЯ ДНК, СПОСОБ БОРЬБЫ С НАСЕКОМЫМИ | 1994 |
|
RU2210593C2 |
Авторы
Даты
2016-02-10—Публикация
2010-12-16—Подача