Предшествующий уровень техники
Человек выращивает кукурузу для употребления в пищу и для энергетических целей. Человек также выращивает множество других культур, включая сою и хлопок. Насекомые поедают и повреждают растения, и тем самым наносят ущерб деятельности человека. Для борьбы с насекомыми-вредителями ежегодно тратятся миллиарды долларов, и еще миллиарды уходят на возмещение ущерба, наносимого этими вредителями. Инсектициды, синтезированные методами органической химии, являются главным инструментом, используемым для борьбы с насекомыми-вредителями, но в некоторых регионах, в борьбе с насекомыми-вредителями важную роль играют биологические инсектициды, такие как инсектицидные белки, происходящие от Bacillus thuringiensis (Bt). Возможность культивировать резистентные к насекомым растения посредством трансформации этих растений генами инсектицидных белков Bt явилась революцией в современном сельском хозяйстве и доказала важность и ценность инсектицидных белков и их генов.
Некоторые белки Bt были использованы для создания резистентных к насекомым трансгенных растений, которые успешно прошли испытания, и в настоящее время их производят в промышленном масштабе. Такими белками являются Cry1Ab, Cry1Ac, Cry1F и Cry3Bb, вводимые в кукурузу, Cry1Ac и Cry2Ab, вводимые в хлопок, и Cry3A, вводимый в картофель.
Коммерчески доступные продукты, экспрессирующие эти белки, экспрессируют только один из этих белков, за исключением случаев, когда желательно получить комбинированный инсектицидный спектр из 2 белков (например, в кукурузе, Cry1Ab и Cry3Bb объединены для вырабатывания резистентности к чешуекрылым вредителям и корневым личинкам, соответственно), или случаев, когда независимое действие этих белков делает их ценным инструментом для замедления развития резистентности к инсектицидам у восприимчивых популяций насекомых (например, Cry1Ac и Cry2Ab в хлопчатнике объединяют в целях вырабатывания у растений резистентность к табачной листовертке). См. также патент США 20090313717, который относится к белкам Cry2 плюс Vip3Aa, Cry1F или Cry1A, используемым для борьбы с Helicoverpa zea или armigerain. Заявка WO 2009132850 относится к Cry1F или Cry1A и Vip3Aa, используемым для борьбы с Spodoptera frugiperda. Патент США 2008 0311096 относится частично к белку Cry1Ab, используемому для борьбы с Cry1F-резистентным ECB.
То есть, некоторые сорта резистентных к насекомым трансгенных растений, которые быстро и повсеместно адаптируются к этой технологии, также имеют тот недостаток, что популяции вредителей вырабатывают резистентность к инсектицидным белкам, продуцируемым этими растениями. Было предложено несколько стратегий для сохранения ценных признаков резистентности к Bt-насекомым, где указанные стратегии включают использование высоких доз белков в комбинации с сохранением площадей «убежищ» нетрансгенных растений, и чередования или совместного использования различных токсинов (McGaughey et al.(1998), «Bt-Resistance Management» Nature Biotechnol. 16: 144-146).
Необходимо, чтобы белки, отобранные для использования в IRM-кластерах, обладали независимым инсектицидным действием, при котором резистентность, вырабатываемая к одному белку, не распространялась на другой белок (то есть, не наблюдалась перекрестная резистентность к белкам). Так, например, если популяция насекомых, выбранных на резистентность к «белку А», является восприимчивой к «белку В», то можно сделать вывод, что в данном случае перекрестная резистентность отсутствует, и комбинация «белок А и белок В» будет эффективной для замедления вырабатывания резистентности к одному белку А.
В случае отсутствия популяции резистентных насекомых, оценка может быть сделана исходя из других характеристик, которые, как предполагается, относятся к механизму действия и возможной перекрестной резистентности. Было высказано предположение, что применение опосредуемого рецептором связывания при идентификации инсектицидных белков, очевидно, не будет приводить к вырабатыванию перекрестной резистентности. (van Mellaert et al. 1999). Ключевым прогностическим фактором отсутствия перекрестной резистентности, появляющейся при таком подходе, является то, что инсектицидные белки не конкурируют за связывание с рецепторами у восприимчивых видов насекомых.
В случае, когда два токсина Bt конкурируют за связывание с одним и тем же рецептором, и если этот рецептор мутирует у насекомого так, что один из токсинов больше не связывается с этим рецептором, а поэтому не обладает инсектицидным действием против насекомого, то такое насекомое может приобретать резистентность ко второму токсину (который конкурентно связывается с тем же рецептором). То есть, можно сказать, что такое насекомое будет обладать перекрестной резистентностью к обоим токсинам Bt. Однако если два токсина связываются с двумя различными рецепторами, то это означает, что такое насекомое не обладает одновременной резистентностью к этим двум токсинам.
Cry1Fa может быть использован для борьбы с чешуекрылыми вредителями многих видов, включая европейского кукурузного пилильщика (ECB; Ostrinia nubilalis (Hübner)) и совку травяную (FAW; Spodoptera frugiperda), и обладает активностью против свекловичного пилильщика (SCB; Diatraea saccharalis). Белок Cry1Fa, продуцирующийся в растениях кукурузы, содержащих TC1507, ответственен за вырабатывание признака резистентности к насекомым, и этот белок применяется в ведущих областях промышленности для борьбы с совкой травяной (FAW). Cry1Fa также используется в продуктах Herculex®, SmartStax™ и WideStrike™.
Возможность проводить исследование на связывание с рецептором (конкурентное или гомологичное) с использованием белка Cry1Fa имеет определенные ограничения, поскольку при применении большинства методов мечения белков для детектирования в анализах на связывание с рецептором происходит инактивация инсектицидной активности белка Cry1Fa.
Дополнительные токсины Cry перечислены на web-сайте офиса Комитета по номенклатуре B.t. (Crickmore et al; lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/). В настоящее время известно примерно 60 основных групп токсинов «Cry» (Cry1-Cry59), и кроме того, существуют другие токсины, такие как токсины Cyt и токсины VIP и т.п. Многие токсины из каждой пронумерованной группы имеют подгруппы, обозначенные прописными буквами, а подгруппы, обозначенные прописными буквами, в свою очередь, подразделяются на подгруппы (суб-подгруппы), обозначенные строчными буквами (например, Cry1 имеет подгруппу A-L, а Cry1A имеет подгруппу a-i).
Краткое описание сущности изобретения
Настоящее изобретение частично основано на неожиданном обнаружении того факта, что популяция травяной совки (Spodoptera frugiperda; FAW), отобранная на резистентность к инсектицидной активности белка Cry1Fa, не является резистентной к инсектицидной активности белка Vip3Ab. Рассматриваемая пара токсинов не обладает перекрестной резистентностью по отношению к FAW.
Для специалиста в данной области очевидно, что преимущество такого открытия состоит в том, что растения, экспрессирующие Vip3Ab и Cry1Fa или их инсектицидные части, могут быть использованы для замедления или предупреждения развития резистентности к любому из этих отдельно взятых инсектицидных белков.
Настоящее изобретение также подтверждается обнаружением того факта, что Vip3Ab и Cry1Fa не конкурируют друг с другом за сайты связывания в кишечнике FAW.
Таким образом, настоящее изобретение относится, в частности, к применению белка Vip3Ab в комбинации с белком Cry1Fa. Растения (и площади, засеянные такими растениями), которые продуцируют Vip3Ab плюс Cry1Fa, входят в объем настоящего изобретения.
Настоящее изобретение также относится, в частности, к трехкомпонентным кластерам или «пирамидам» из трех (или более) токсинов, где токсины Vip3Ab и Cry1Fa представляет собой базовую пару. В некоторых предпочтительных вариантах пирамиды, выбранный(ые) токсин(ы) не обладает(ют) перекрестной резистентностью по отношению к FAW. Некоторыми предпочтительными белками для этих трехкомпонентных комбинаций пирамиды являются Cry1Fa плюс Vip3Ab плюс Cry1C плюс Cry1D, Cry1Be или Cry1E. В соответствии с настоящим изобретением, эти конкретные трехкомпонентные кластеры, как было неожиданно обнаружено авторами изобретения, преимущественно, не обладают перекрестной резистентностью по отношению к FAW. Это позволяет снизить или вообще избежать потребности в площадях-«убежищах» нетрансгенных культур.
Что касается Cry1Fa, обладающего активностью против FAW и европейского кукурузного пилильщика (ECB), то исходя из представленных здесь данных, можно сделать вывод, что может быть также выбрана кластер-тетрада (из четырех компонентов) для использования четырех белков, где три из этих четырех белков не обладают перекрестной резистентностью по отношению к ЕСВ, и три из этих четырех белков не обладают перекрестной резистентностью по отношению к FAW. Это может быть достигнуто с использованием Cry1Be (обладающего активностью против ЕСВ и FAW) вместе с рассматривамой парой белков плюс один дополнительный белок, обладающий активностью против ЕСВ. Такими кластерами-тетрадами согласно изобретению являются: Cry1F плюс Cry1Be плюс Vip3Ab (активный против FAW) плюс Cry1Ab, Cry2A, Cry1I или DIG-3 (активный против ECB).
Краткое описание графического материала
Фиг. 1. Гистограмма ингибирования роста (столбцы) и гибели насекомых (♦) в зависимости от дозы полноразмерного Vip3Ab1, направленного против Spodoptera frugiperda дикого типа (J.E. Smith), (FAW) и Cry1Fa-резистентной Spodoptera frugiperda (J.E. Smith), (rFAW). Процент ингибирования роста вычисляли путем сравнения средней массы 8 личинок, обработанных только буфером, с массой личинок, обработанных токсином в течение 5 дней.
Фиг. 2. Флуоресцентная визуализация 125I-Cry1Fa, связанного с BBMV от S. frugiperda, с последующим разделением с помощью электрофореза в ДСН-ПААГ. Образцы брали в дубликате. Концентрация 125I-Cry1Fa составляла 1 нМ. Контроль означает уровень связывания 125I-Cry1Fa с BBMV в отсутствии любого конкурентно связывающегося лиганда. 1000 нМ Cry1Fa означает уровень связывания 125I-Cry1Fa с BBMV в присутствии 1000 нМ Cry1Fa, не содержащего радиоактивной метки, где указанный уровень связывания указывает на полное вытеснение радиоактивно меченного лиганда из белка BBMV. 1000 нМ Vip3Ab1 означает уровень связывания 125I-Cry1Fa с BBMV в присутствии 1000 нМ Vip3Ab1, не содержащего радиоактивной метки, где указанный уровень связывания указывает на то, что этот белок не обладает способностью вытеснять 125I-Cry1Fa из BBMV S. frugiperda даже при концентрации, в 1000 раз превышающей концентрацию радиоактивно меченного лиганда.
Фиг. 3. Флуоресцентная визуализация 125I-Cry1Fa, связанного с BBMV S. frugiperda дикого типа (FAW) или Cry1Fa-резистентной S. frugiperda (rFAW), с последующим разделением с помощью электрофореза в ПААГ с ДСН. Образцы брали в дубликате. Концентрация 125I-Cry1Fa составляла 2,5 нМ. FAW-0 означает уровень связывания 125I-Cry1Fa с BBMV S. frugiperda дикого типа в отсутствии какого-либо конкурентно связывающегося лиганда. FAW-1000 нМ Cry1Fa означает уровень связывания 125I-Cry1Fa с BBMV S. frugiperda дикого типа в присутствии 1000 нМ не меченного радиоактивной меткой Cry1Fa, где такой уровень связывания указывает на вытеснение радиоактивно меченного лиганда из белка BBMV. rFAW-0 означает уровень связывания 125I- Cry1Fa с BBMV Cry1Fa-резистентной S. frugiperda в отсутствии любого конкурентно связывающегося лиганда. Следует обратить внимание на отсутствие связывания 125I-Cry1Fa с BBMV, происходящими от резистентной FAW. rFAW-1000 нМ Cry1Fa означает уровень связывания 125I-Cry1Fa с BBMV в присутствии 1000 нМ Vip3Ab1, не содержащего радиоактивную метку, где такой уровень связывания также указывает на неспособность 125I-Cry1Fa связываться с BBMV от Cry1Fa-резистентной S. frugiperda.
Подробное описание изобретения
Как сообщается в настоящей заявке, токсин Vip3Ab, продуцируемый в трансгенной кукурузе и в других растениях (например, в хлопчатнике и сое), обнаруживает высокую эффективность в борьбе против совки травяной (FAW; Spodoptera frugiperda), у которой вырабатывается резистентность к активности Cry1Fa. Таким образом, настоящее изобретение частично основано на неожиданном обнаружении того факта, что совка травяная, резистентная к действию Cry1Fa, является восприимчивой (то есть, не обладает перекрестной резистентностью) к действию Vip3Ab. В соответствии с другим вариантом, настоящее изобретение также частично основано на неожиданном обнаружении того факта, что токсин Vip3Ab является эффективным для защиты растений (таких как растения кукурузы) от поражения Cry1Fa-резистентной совки травяной. Обсуждение этого вредителя приводится, например, в публикации Tabashnik, PNAS (2008), vol. 105 no. 49, 19029-19030.
Настоящее изобретение включает применение токсина Vip3Ab для защиты кукурузы и других экономически ценных видов растений от поражения вредителями, и снижения урожайности, вызываемого поеданием этих растений совкой травяной или популяциями совки травяной, у которых вырабатывается резистентность к Cry1Fa.
Настоящее изобретение также относится к IRM-кластеру, используемому для предупреждения или замедления развития резистентности совки травяной к Cry1Fa.
Настоящее изобретение также относится к композициям, используемым для борьбы с чешуекрылыми вредителями, в клетках которых продуцируется белок, содержащий коровый токсин Cry1Fa, и белок, содержащий коровый токсин Vip3Ab.
Настоящее изобретение также относится к хозяину, трансформированному так, чтобы он продуцировал белок, содержащий коровый токсин Cry1Fa, и белок, содержащий коровый токсин Vip3Ab, где указанным хозяином является клетка микроорганизма или растения. Рассматриваемый(ые) полинуклеотид(ы) предпочтительно присутствует(ют) в генетической конструкции под контролем промотора (функционально присоединенного к промотору или содержащего этот промотор), не являющегося промотором Bacillus thuringiensis. Рассматриваемые полинуклеотиды могут содержать обычно встречающиеся в этом растении кодоны, способствующие повышению уровня экспрессии в растении.
Настоящее изобретение также относится к способу борьбы с чешуекрылыми вредителями, включающему контактирование указанных вредителей или среды их обитания с эффективным количеством композиции, которая содержит белок, включающий коровый токсин Cry1Fa, а также белок, включающий коровый токсин Vip3Ab.
В одном из своих вариантов, настоящее изобретение относится к растению кукурузы, включающему экспрессируемый в этом растении ген, который кодирует белок, содержащий коровый токсин Vip3Ab, и экспрессируемый в этом растении ген, который кодирует белок, содержащий коровый токсин Cry1Fa, и к семенам такого растения.
В другом своем варианте, настоящее изобретение относится к растению кукурузы, где экспрессируемый в этом растении ген, который кодирует белок, содержащий коровый токсин Vip3Ab, и экспрессируемый в этом растении ген, который кодирует белок, содержащий коровый токсин Cry1Fa, были введены в указанные растения кукурузы и в семена таких растений путем интрогрессии.
Как описано в примерах, исследования по конкурентному связыванию, проводимые с использованием радиоактивно меченного белка, содержащего коровый токсин Vip3Ab, показали, что белок, содержащий коровый токсин Cry1Fa, не конкурирует за связывание в тканях насекомого FAW, с которыми связывается Vip3Ab. Полученные результаты также показали, что комбинации белков Cry1Fa и Vip3Ab представляют собой эффективное средство для снижения вырабатывания резистентности популяции FAW к Cry1Fa (и аналогичным образом, вырабатывания резистентности к Vip3Ab), и следовательно, для повышения уровня резистентности растений кукурузы, экспрессирующих оба белка, к этому вредителю. Таким образом, исходя частично из описанных данных, можно сделать вывод, что совместное продуцирование (кластеризация) белков Vip3Ab и Cry1Fa может быть применено в целях получения IRM-кластера с высокой дозой для борьбы с FAW. Что касается Cry1Fa, обладающего активностью против FAW и европейского кукурузного пилильщика (ECB), то рассматриваемая пара токсинов обладает не-конкурентным действием против FAW.
Для расширения спектра действия против насекомых, к этой паре могут быть добавлены и другие белки. В другом своем варианте, настоящее изобретение относится к применению белков Cry1Fa и Vip3Ab в комбинации с другим третьим токсином/геном, и к применению такого трехкомпонентного кластера для снижения развития резистентности у FAW к любому из этих токсинов. Таким образом, в другом своем варианте, настоящее изобретение относится к применению двух, трех или более белков в сельскохозяйственных регионах, в которых могут развиваться резистентные популяции FAW.
В соответствии с этим, настоящее изобретение также относится, в частности, к трехкомпонентным кластерам или «пирамидам» из трех (или более) токсинов, где указанные токсины Cry1Fa и Vip3Ab представляют собой базовую пару.
В некоторых предпочтительных вариантах пирамиды, три выбранных белка не обладают перекрестной резистентностью против FAW. Некоторые предпочтительные комбинации пирамид «тройного действия» представляют собой Cry1Fa плюс Vip3Ab плюс любой из Cry1C или Cry1D. См., заявку США рег.№ 61/284281 (поданную 16 декабря, 2009), в которой показано, что Cry1C является активным против Cry1F-резистентной FAW, и заявку США рег.№ 61/284252 (поданную 16 декабря, 2009), в которой показано, что Cry1D является активным против Cry1F-резистентной FAW. В этих двух заявках также показано, что Cry1C не конкурирует с Cry1F за связывание с мембранными препаратами FAW, и что Cry1D не конкурирует с Cry1F за связывание с мембранными препаратами FAW. В некоторых вариантах изобретения, Cry1Be или Cry1E могут быть объединены с Vip3A и Cry1F в качестве третьего белка против FAW. Описание применения Cry1Be вместе с Cry1F можно найти в заявке США рег.№ 61/284290 (поданной 16 декабря, 2009). Описание применения Cry1E вместе с Cry1F можно найти в заявке США рег.№ 61/284278 (поданной 16 декабря, 2009). В соответствии с настоящим изобретением, эти конкретные трехкомпонентные кластеры белков, как было неожиданно обнаружено авторами изобретения, преимущественно не обладают перекрестной резистентностью по отношению к FAW. Это позволяет снизить или вообще избежать потребности в площадях-«убежищах» нетрансгенных культур.
Исходя из представленных здесь данных, можно сделать вывод, что может быть также выбрана кластер-тетрада (из четырех компонентов) для использования четырех белков, где три из этих четырех белков не обладают перекрестной резистентностью по отношению к ЕСВ, и три из этих четырех белков не обладают перекрестной резистентностью по отношению к FAW. Это может быть достигнуто с использованием Cry1Be (обладающего активностью против ЕСВ и FAW) и Cry1Fa (обладающим активностью против ЕСВ и FAW), вместе с рассматривамым Vip3Ab (обладающим активностью против FAW) и с четвертым белком, токсичным по отношению к ЕСВ. (См. заявку США рег.№ 61/284290, поданную 16 декабря, 2009 и относящуются к комбинациям Cry1Fa и Cry1Be). Примерами кластеров-тетрад согласно изобретению являются:
Cry1F плюс Cry1Be плюс Vip3Ab (активный против FAW) плюс Cry1Ab, Cry2A, Cry1I или DIG-3 – все они активны против ECB).
DIG-3 описан в патенте США 2010 00269223.
Растения (и площади, засеянные такими растениями), которые продуцируют любую из рассматриваемых комбинаций белков, входят в объем настоящего изобретения. Могут быть также добавлены дополнительные токсины/гены, и эти конкретные трехкомпонентные кластеры, обсуждаемые выше, будут, как было неожиданно обнаружено, преимущественно действовать против FAW и/или ЕСВ по нескольким механизмам. Это позволяет снизить или избежать потребности в площадях-«убежищах» нетрансгенных культур. Таким образом, в настоящем изобретении рассматривается посевная площадь свыше 10 акров.
Для получения последовательностей любых описанных или упомянутых здесь генов и белков можно также обратиться в GENBANK. См. ниже Приложение A.
В патенте США No. 5188960 и в патенте США No. 5827514 описаны белки, которые содержат коровый токсин Cry1Fa, и которые могут быть использованы для осуществления настоящего изобретения. В патенте США № 6218188 описаны оптимизированные для растения последовательности ДНК, кодирующие белки, которые содержат коровый токсин Cry1Fa, и которые могут быть использованы в настоящем изобретении.
Cry1Fa также используется в продуктах Herculex®, SmartStax™ и WideStrike™. Ген vip3Ab может быть введен, например, в продукт Cry1Fa, такой как Herculex®, SmartStax™ и WideStrike™. В соответствии с этим, применение Vip3Ab позволяет значительно снизить давление отбора на эти и другие промышленные продукты. Таким образом, Vip3Ab может быть использован в комбинации из 3 генов для кукурузы и других растений (например, хлопчатника и сои).
Комбинации белков, описанных в настоящем изобретении, могут быть использованы для борьбы с чешуекрылыми вредителями. Взрослые чешуекрылые, например, бабочки и моли, питаются, главным образом, нектаром и играют значительную роль в опылении. Почти все личинки чешуекрылых, то есть, гусеницы, поедают растения, и многие из них являются опасными вредителями. Гусеницы живут на листьях или поедают внутреннюю часть листьев, либо они повреждают корни или стебли растения, что приводит к истощению питательных веществ у растения, и в большинстве случаев, к разрушению основной физической структуры растения. Кроме того, гусеницы повреждают плоды, ткани и хранящееся зерно и муку, в результате чего продукты либо вообще становятся непригодными для продажи, либо их коммерческая ценность значительно снижается. Используемый здесь термин «чешуекрылые вредители» также относится к различным стадиям жизненного цикла вредителя, включая стадии развития личинок.
Некоторые химерные токсины согласно изобретению содержат полноразмерную часть N-концевого корового токсина Bt, и в определенном положении, расположенном за концом части корового токсина, этот белок переходит в гетерологичную последовательность протоксина. N-концевая, инсектицидно активная часть токсина Bt называется «коровым токсином». Переход от корового сегмента токсина в гетерологичный сегмент протоксина может происходить приблизительно в области стыка токсин/протоксин, или альтернативно, часть нативного протоксина (простирающаяся за пределы коровой части токсина) может сохраняться, причем, переход в гетерологичную часть протоксина может происходить ниже.
В качестве примера может служить один химерный токсин согласно изобретению, который представляет собой полноразмерную часть корового токсина Cry1Fa (примерно первые 600 аминокислот) и гетерологичный протоксин (остальной белок до С-конца). В одном предпочтительном варианте изобретения, часть химерного токсина, содержащая протоксин, происходит от токсина белка Cry1Ab. В предпочтительном варианте изобретения, часть химерного токсина, содержащая протоксин, происходит от токсина белка Cry1Ab.
Для специалистов в данной области очевидно, что токсины Bt, даже токсины, принадлежащие к определенному классу, такому как Cry1F, могут до некоторой степени варьироваться по своей длине и точной локализации перехода от части корового токсина в часть протоксина. Обычно, токсин Cry1Fa имеет длину примерно от 1150 до 1200 аминокислот. Переход от части корового токсина в часть протоксина обычно происходит на участке между частями, составляющими примерно от 50% и примерно до 60% от всей длины токсина. Химерный токсин согласно изобретению включает полноразмерную область N-концевой части корового токсина. Таким образом, химерный токсин содержит по меньшей мере примерно 50% полноразмерного белка Cry1Fa токсина Bt. Этот белок имеет длину, обычно составляющую по меньшей мере примерно 590 аминокислот. Что касается части протоксина, то полноразмерная область части протоксина Cry1Ab простирается от конца части корового токсина до С-конца молекулы.
Гены и токсины. Гены и токсины, используемые в настоящем изобретении, включают не только описанные здесь полноразмерные последовательности, но также и фрагменты этих последовательностей, варианты, мутанты и гибридные белки, которые сохраняют характерную пестицидную активность токсинов, конкретно описанных в настоящей заявке. Используемые здесь термины «варианты» или «модификации» генов означают нуклеотидные последовательности, которые кодируют те же самые токсины или токсины, эквивалентные токсинам, обладающим пестицидной активностью. Используемый здесь термин «эквивалентные токсины» означает токсины, обладающие такой же или, по существу, такой же биологической активностью против вредителей-мишеней, как и заявленные токсины.
Используемые здесь пределы идентичности составляют приблизительно 95% (Cry1F и Vip3Ab), 78% (Cry1F и Vip3Ab) и 45% (Cry1 и Vip3) в соответствии с «изменениями номенклатуры для пестицидных кристаллических белков Bacillus thuringiensis» («Revision of the Nomenclature for the Bacillus thuringiensis Pesticidal Crystal Proteins», N. Crickmore, D.R. Zeigler, J. Feitelson, E. Schnepf, J. Van Rie, D. Lereclus, J. Baum, and D.H. Dean. Microbiology and Molecular Biology Reviews (1998) Vol 62: 807-813). Такие пределы могут быть также применены только для коровых токсинов (например, для Cry1Fa).
Для специалистов в данной области очевидно, что гены, кодирующие активные токсины, могут быть идентифицированы и получены несколькими способами. Специфические гены или части генов, описанные в настоящей заявке, могут быть получены из изолятов, депонированных в депозитариях культур. Эти гены или их части или варианты могут быть также сконструированы путем синтеза, например, на синтезаторе генов. Варианты генов могут быть легко сконструированы стандартными методами получения точковых мутаций. Кроме того, фрагменты этих генов могут быть получены с использованием коммерчески доступных экзонуклеаз или эндонуклеаз в соответствии со стандартными процедурами. Так, например, для систематического отщепления нуклеотидов от концов этих генов могут быть использованы ферменты, такие как Bal31, либо может быть применен сайт-направленный мутагенез. Гены, кодирующие активные фрагменты, могут быть также получены с использованием различных рестриктирующих ферментов. Для непосредственного получения активных фрагментов этих белков-токсинов могут быть использованы протеазы.
Фрагменты и эквиваленты, которые сохраняют пестицидную активность описанных здесь токсинов, входят в объем настоящего изобретения. Кроме того, вследствие избыточности генетического кода, ряд различных последовательностей ДНК может кодировать описанные здесь аминокислотные последовательности. Специалист в данной области может легко получить такие альтернативные последовательности ДНК, кодирующие те же самые или, по существу, те же самые токсины. Такие варианты последовательностей ДНК входят в объем настоящего изобретения. Используемый здесь термин «по существу, те же самые» последовательности означает последовательности, имеющие аминокислотные замены, делеции, добавления или инсерции, которые фактически не оказывают влияния на пестицидную активность. В это определение также входят фрагменты генов, кодирующих белки, сохраняющие пестицидную активность.
Другим методом идентификации генов, кодирующих токсины и части генов, используемых в настоящем изобретении, является применение олигонуклеотидных зондов. Такими зондами являются детектируемые нуклеотидные последовательности. Эти последовательности могут быть детектированы с помощью соответствующей метки, либо они могут быть изначально сделаны флуоресцентными, как описано в Международной заявке No. WO93/16094. Специалистам хорошо известно, что если молекула-зонд и образец нуклеиновой кислоты гибридизуются посредством образования прочной связи между двумя молекулами, то разумно предположить, что такой зонд и образец будут обладать значительной гомологией. Гибридизацию, предпочтительно, проводят в жестких условиях с применением методов, хорошо известных специалистам, например, описанных Keller, G. Н., M. M. Manak (1987) DNA Probes, Stockton Press, New York, N.Y., pp. 169-170. Ниже приводятся некоторые примеры комбинаций концентраций соли и температур (в порядке возрастания жесткости): 2 х SSPE или SSC при комнатной температуре; 1 х SSPE или SSC при 42°C; 0,1 х SSPE или SSC при 42°C; 0,1 х SSPE или SSC при 65°C. Детектирование зонда представляет собой известный метод, применяемый для того, чтобы определить, происходит гибридизация или нет. Такой анализ с использованием зонда представляет собой быстрый метод идентификации токсин-кодирующих генов согласно изобретению. Нуклеотидные сегменты, используемые в качестве зондов согласно изобретению, могут быть синтезированы на синтезаторе ДНК в соответствии со стандартными процедурами. Эти нуклеотидные последовательности могут быть также использованы в качестве ПЦР-праймеров для амплификации генов согласно изобретению.
Варианты токсинов. Некоторые токсины согласно изобретению конкретно описаны в настоящей заявке. Поскольку эти токсины приводятся здесь просто в качестве примеров токсинов согласно изобретению, то следует отметить, что настоящее изобретение включает варианты токсинов или эквивалентные токсины (и нуклеотидные последовательности, кодирующие эквивалентные токсины), обладающие такой же пестицидной активностью, как и представленный здесь токсин, или аналогичной активностью. Эквивалентные токсины имеют аминокислотную последовательность, гомологичную аминокислотной последовательности представленного здесь токсина. Такая гомология аминокислотных последовательностей обычно составляет более чем 75%, предпочтительно, более чем 90%, а наиболее предпочтительно, более, чем 95%. Гомология аминокислотных последовательностей является наивысшей в критических областях токсина, ответственных за биологическую активность или определяющих трехмерную конфигурацию, которая, в конечном счете, ответственна за биологическую активность. В соответствии с этим, некоторые аминокислотные замены являются допустимыми и могут присутствовать в тех областях, которые не играют важной роли в сообщении активности, или являются консервативными аминокислотными заменами, которые не влияют на трехмерную конфигурацию молекулы. Так, например, аминокислоты могут быть подразделены на следующие классы: неполярные, незаряженные полярные, основные и кислотные. Таким образом, при консервативных заменах, аминокислоту одного класса заменяют другой аминокислотой того же типа, и такая замена входит в объем настоящего изобретения, при условии, что она, фактически, не будет влиять на биологическую активность соединения. Ниже представлен список примеров аминокислот, принадлежащих к каждому классу.
В некоторых случаях могут быть также сделаны неконсервативные замены. Важным фактором является то, что такие замены не должны значительно снижать биологическую активность токсина.
Рекомбинантные хозяева. Гены, кодирующие токсины согласно изобретению, могут быть введены микробным или растительным хозяевам широкого ряда. Экспрессия гена токсина приводит, прямо или опосредованно, к продуцированию пестицида внутри клеток и к его сохранению в этих клетках. Для получения штамма Bt, экспрессирующего оба токсина согласно изобретению, может быть применен конъюгативный и рекомбинантный перенос. Другие организмы-хозяева могут быть также трансформированы одним или обоими генами токсинов, используемыми для достижения синергического эффекта. С использованием подходящих микробов-хозяев, например, Pseudomonas, эти микробы могут быть внесены в места обитания вредителей, где они могут размножаться и поедать эти микробы. Это будет приводить к уничтожению вредителей. Альтернативно, микроб, содержащий ген токсина, может быть обработан в условиях, способствующих пролонгированию активности токсина и стабилизации клетки. Обработанная клетка, которая сохраняет токсическую активность, может быть затем внесена в среду обитания вредителей-мишеней.
Если ген токсина Bt вводят микробу-хозяину посредством подходящего вектора, и если указанный хозяин вносят в среду обитания в живом виде, то важно, чтобы были использованы определенные микробы-хозяева. При этом, выбирают такие микроорганизмы-хозяева, которые, как известно, занимают определенную «фитосферу» (филлоплан, филлосферу, ризосферу и/или ризоплан) одного или нескольких представляющих интерес культур. Эти микроорганизмы выбирают так, чтобы они обладали способностью успешно конкурировать в конкретных условиях (в культуре и в другой среде обитания насекомых) с микроорганизмами дикого типа, и обеспечивали стабильное сохранение и экспрессию генов, кодирующих полипептид-пестицид, а желательно, лучшую защиту пестицида от разрушения и инактивации в условиях окружающей среды.
Известно, что большое число микроорганизмов обитает на филлоплане (на поверхности листьев растений) и/или на ризосфере (в почве, окружающей корни растений) ценных сельскохозяйственных культур широкого ряда. Такими микроорганизмами являются бактерии, водоросли и грибы. Особый интерес представляют такие микроорганизмы, как бактерии, например, бактерии рода Pseudomonas, Erwinia, Serratia, Klebsiella, Xanthomonas, Streptomyces, Rhizobium, Rhodopseudomonas, Methylophilius, Agrobactenum, Acetobacter, Lactobacillus, Arthrobacter, Azotobacter, Leuconostoc и Alcaligenes; грибы, а в частности, дрожжи, например, дрожжи рода Saccharomyces, Cryptococcus, Kluyveromyces, Sporobolomyces, Rhodotorula и Aureobasidium. Особый интерес представляют такие виды бактерий фитосфер, как Pseudomonas syringae, Pseudomonas fluorescens, Serratia marcescens, Acetobacter xylinum, Agrobactenium tumefaciens, Rhodopseudomonas spheroides, Xanthomonas campestris, Rhizobium melioti, Alcaligenes entrophus и Azotobacter vinlandii; и дрожжей-фитосфер, таких как Rhodotorula rubra, R. glutinis, R. marina, R. aurantiaca, Cryptococcus albidus, C. diffluens, C. laurentii, Saccharomyces rosei, S. pretoriensis, S. cerevisiae, Sporobolomyces roseus, S. odorus, Kluyveromyces veronae и Aureobasidium pollulans. Особый интерес представляют пигментированные микроорганизмы.
Для введения гена Bt, кодирующего токсин, микроорганизму-хозяину в условиях, обеспечивающих стабильное сохранение гена и стабильную экспрессию гена, могут быть применены методы широкого ряда. Такие методы хорошо известны специалистам в данной области и описаны, например, в патенте США No. 5135867, который вводится в настоящее описание посредством ссылки.
Обработка клеток. Bacillus thuringiensis или рекомбинантные клетки, экспрессирующие токсины Bt, могут быть обработаны в целях пролонгирования активности токсина и стабилизации клеток. Образующаяся пестицидная микрокапсула содержит токсин или токсины Bt в клеточной структуре, которая стабилизирует и защищает токсин в случае, когда эту микрокапсулу вносят в среду обитания вредителя-мишени. Подходящими клетками-хозяевами могут быть прокариоты или эукариоты, и такими клетками обычно являются, но не ограничиваются ими, клетки, которые не продуцируют вещества, являющиеся токсичными для высших организмов, таких как млекопитающие. Однако могут быть также использованы микроорганизмы, которые продуцируют вещества, токсичные для высших организмов, но, при этом, эти токсические вещества являются нестабильными, или уровень их введения является достаточно низким, что исключает возможность какого-либо токсического воздействия на млекопитающего-хозяина. В качестве хозяев, особый интерес представляют прокариоты и низшие эукариоты, такие как грибы.
Обрабатываемые клетки обычно являются интактными и, по существу, находятся в пролиферативной форме, а не в форме спор, хотя, в некоторых случаях могут использоваться и споры.
Обработка микробных клеток, например, микробов, содержащих ген или гены токсина B.t., может быть осуществлена химическими и/или физическими методами, или комбинацией химических и физических методов, при условии, что такой метод не будет оказывать негативного влияния на свойства токсина и не будет приводить к снижению способности клеток защищать токсин. Примерами химических реагентов являются галогенирующие агенты, а в частности, галогены с атомными номерами 17-80. Более конкретно, может быть использован йод в мягких реакционных условиях в течение определенного периода времени, достаточного для достижения желаемых результатов. Другими подходящими методами являются обработка альдегидами, такими как глутаральдегид; противоинфекционными агентами, такими как хлорид зефирана и хлорид цетилпиридиния; спиртами, такими как изопропиловый спирт и этанол; различными гистологическими фиксаторами, такими как йод Люголя, фиксатор Боуина; различные кислоты и фиксатор Хелли (см: Humason, Gretchen L., Animal Tissue Techniques, W. H. Freeman and Company, 1967); или комбинацией физического метода (нагревания) и химических агентов, которые сохраняют и пролонгируют активность токсина, продуцируемого в клетках, введенных в среду обитания хозяина. Примерами физических методов являются коротковолновое излучение, такое как гамма-излучение и рентгеновское излучение, замораживание, УФ-облучение, лиофилизация и т.п. Методы обработки микробных клеток описаны в патентах США №№ 4695455 и 4695462, которые вводятся в настоящее описание посредством ссылки.
Эти клетки обычно имеют повышенную структурную стабильность, что приводит к увеличению резистентности к условиям окружающей среды. Если пестицид присутствует в форме предшественника, то способ обработки клеток должен быть выбран так, чтобы он не приводил к ингибированию процессинга предшественника с образованием зрелой формы пестицида под действием патогена вредителя-мишени. Так, например, формальдегид будет обеспечивать перекрестное сшивание с белками, и тем самым ингибировать процессинг предшественника полипептидного пестицида. Способ обработки должен сохранять по меньшей мере значительную степень биологической доступности или биологической активности токсина.
Свойствами, представляющими особый интерес для продуцирования при выборе клетки-хозяина, являются простота введения гена или генов B.t. хозяину, доступность экспрессионных систем, эффективность экспрессии, стабильность пестицида в хозяине и наличие дополнительных генетических признаков. Представляющими интерес технологическими свойствами пестицидных микрокапсул являются их протективная способность в отношении пестицида, например, толщина клеточных стенок, пигментация и внутриклеточная упаковка или способность образовывать тельца включения; выживаемость в водной среде; отсутствие токсичности для млекопитающих; привлекательность с точки зрения поедания вредителями; простота утилизации; фиксация без повреждения токсина и т.п. Другими рассматриваемыми свойствами являются простота приготовления препарата и его транспортировки, материальные затраты, стабильность при сохранении и т.п.
Культивирование клеток. Клетки-хозяева, содержащие инсектицидный ген или гены B.t., могут быть выращены в любой подходящей питательной среде, в которой ДНК-конструкция будет обеспечивать селективное преимущество, то есть, обеспечивать селективную среду, в которой все или почти все клетки будут сохранять ген B.t. Затем эти клетки могут быть собраны обычными способами. Альтернативно, эти клетки могут быть обработаны до их сбора.
Клетки B.t., продуцирующие токсины согласно изобретению, могут быть культивированы с использованием стандартных сред и методом ферментации. После завершения цикла ферментации, бактерии могут быть собраны сначала путем отделения спор и кристаллов B.t. от сбраживаемого бульона стандартными методами. Выделенные споры и кристаллы B.t. могут быть приготовлены в виде смачиваемого порошка; жидкого концентрата; гранул или других препаратов, полученных путем добавления поверхностно-активных веществ, диспергирующих веществ, инертных носителей и других компонентов, облегчающих транспортировку и обработку ими конкретных вредителей-мишеней. Такие процедуры приготовления и применения хорошо известны специалистам.
Препараты. Приготовленные гранулы-приманки, содержащие аттрактант и споры, кристаллы и токсины изолятов B.t., или рекомбинантные микробы, содержащие гены, полученные из описанных здесь изолятов B.t., могут быть внесены в почву. Приготовленный продукт может быть применен в виде покрытия, наносимого на семена, или препарата для обработки корней или всего растения на последних стадиях цикла выращивания сельскохозяйственной культуры. Для обработки растений и почвы, клетки B.t. могут быть приготовлены в виде смачиваемых порошков, гранул или дустов, путем смешивания с различными инертными материалами, такими как неорганические минеральные вещества (филлосиликаты, карбонаты, сульфаты, фосфаты и т.п.) или растительные материалы (измельченные в порошок початки кукурузы, рисовая шелуха, скорлупа грецкого ореха и т.п.). Такие препараты могут включать адъюванты типа «распылителей-связующих вещества», стабилизирующие агенты, другие пестицидные добавки или поверхностно-активные вещества. Жидкие препараты могут быть водными или безводными, и могут быть использованы в виде пен, гелей, суспензий, эмульгируемых концентратов или т.п. Ингредиентами могут быть реологические агенты, поверхностно-активные вещества, эмульгаторы, диспергирующие вещества или полимеры.
Как известно специалистам в данной области, концентрация пестицида может значительно варьироваться в зависимости от природы конкретного препарата, а в частности, в зависимости от того, используется ли он в виде концентрата или в чистом виде. Пестицид составляет по меньшей мере 1% по массе, а может составлять 100% по массе. Сухие препараты могут составлять примерно 1-95% по массе пестицида, а жидкие препараты обычно составляют примерно 1-60% по массе твердых веществ в жидкой фазе. Эти препараты обычно содержат примерно от 102 до 104 клеток/мг. Эти препараты могут быть введены в количестве примерно от 50 мг (в жидком или в сухом виде) до 1 кг или более на гектар.
Препараты могут быть внесены в среду обитания чешуекрылых вредителей, например, нанесены на листья или почву путем распыления, опыливания, орошения или т.п.
Трансформация растений. Предпочтительными рекомбинантными хозяевами, которые могут быть использованы для продуцирования инсектицидных белков согласно изобретению, являются трансформированные растения. Гены, кодирующие описанные здесь белки токсинов Bt, могут быть введены в растительные клетки с применением различных методов, хорошо известных специалистам. Так, например, существует большое число клонирующих векторов, содержащих систему репликации в Escherichia coli, и маркер, позволяющий проводить отбор трансформированных клеток, и эти векторы могут быть использованы в целях получения препарата для инсерции чужеродных генов в высшие растения. Векторы содержат, например, inter alia pBR322, серии pUC, серии M13mp, pACYC184. В соответствии с этим, ДНК-фрагмент, имеющий последовательность, кодирующую белок токсина Bt, может быть встроен в вектор в подходящий рестрикционный сайт. Полученную плазмиду используют для трансформации E. coli. Клетки E. coli культивируют в подходящей питательной среде, а затем собирают и подвергают лизису. Затем эту плазмиду выделяют. Методами анализа обычно являются анализ последовательности, рестрикционный анализ, электрофорез и другие методы, применяемые в биохимии и молекулярной биологии. После каждой манипуляции, используемая последовательность ДНК может быть расщеплена и присоединена к следующей последовательности ДНК. Каждая последовательность плазмиды может быть клонирована в одной и той же или в других плазмидах. В зависимости от метода встраивания нужных генов в растение, могут оказаться необходимыми и другие последовательности ДНК. Так, например, если плазмиду Ti или Ri используют для трансформации клеток растения, то по меньшей мере правую границу, а в большинстве случаев, правую и левую границы Т-ДНК-плазмиды Ti или Ri присоединяют в качестве фланкирующей области встраиваемых генов. Использование T-ДНК для трансформации клеток растений было тщательно исследовано и подробно описано в EP 120516, Lee and Gelvin (2008), Hoekema (1985), Fraley et al., (1986), и An et al., (1985), и хорошо известно специалистам.
После интеграции встроенной ДНК в геном растения, такая ДНК становится относительно стабильной. Трансформирующий вектор обычно содержит селективный маркер, который сообщает трансформированным клеткам растения резистентность к биоциду или антибиотику, таким как биалафос, канамицин, G418, блеомицин или гигромицин, inter alia. С использованием отдельно взятого маркера можно, соответственно, осуществлять отбор трансформированных клеток, а не клеток, которые не содержат встроенную ДНК.
Существует много методов, подходящих для встраивания ДНК в клетки растений-хозяев. Такими методами являются трансформация молекулой T-ДНК с использованием Agrobacterium tumefaciens или Agrobacterium rhizogenes в качестве трансформирующих агентов, слияние, инжекция, биобаллистические методы (бомбардировка микрочастицами) или электропорация, а также другие возможные методы. Если для трансформации используются агробактерии, то встраиваемую ДНК клонируют в конкретные плазмиды, а именно, в промежуточный вектор или в бинарный вектор. Промежуточные векторы могут быть интегрированы в плазмиду Ti или Ri посредством гомологичной рекомбинации с использованием последовательностей, гомологичных последовательностям, присутствующим в T-ДНК. Плазмида Ti или Ri также содержит область vir, необходимую для переноса T-ДНК. Промежуточные векторы не могут сами реплицироваться в агробактериях. Промежуточный вектор может быть перенесен в Agrobacterium tumefaciens с помощью хелперной плазмиды (конъюгирование). Бинарные векторы могут сами реплицироваться как в E. coli, так и в агробактериях. Они содержат селективный маркерный ген и линкер или полилинкер, которые замыкают правую и левую пограничные области T-ДНК. Они могут быть трансформированы непосредственно в агробактерии (Holsters et al., 1978). Агробактерия, используемая в качестве клетки-хозяина, содержит плазмиду, несущую область vir. Область vir необходима для переноса T-ДНК в клетку растения. Может также присутствовать и дополнительная T-ДНК. Трансформированную таким образом бактерию используют для трансформации клеток растений. Растительные эксплантаты могут быть преимущественно культивированы с Agrobacterium tumefaciens или Agrobacterium rhizogenes для переноса ДНК в клетку растения. Затем целые растения могут быть выращены из инфицированного растительного материала (например, из кусочков листьев, сегментов стеблей, корней, а также протопластов или клеток, культивированных суспензионным методом) в подходящей среде, которая может содержать антибиотики или биоциды для отбора. Затем выращенные таким образом растения могут быть протестированы на присутствие встроенной ДНК. В случае инжекции и электропорации, каких-либо специальных требований к получению плазмид не предъявляется. При этом, могут быть использованы стандартные плазмиды, такие как, например, производные pUC.
Трансформированные клетки развиваются в растении как обычно. Они могут образовывать зародышевые клетки и передавать трансформированный(ые) признак(и) потомству. Такие растения могут быть выращены обычным способом и скрещены с растениями, имеющими трансформированные наследуемые факторы или другие наследуемые факторы. Полученные гибридные растения имеют соответствующие фенотипические свойства.
В предпочтительном варианте изобретения, растения трансформируют генами, в которых встречаемость кодонов оптимизирована для растений. См., например, патент США No. 5380831, который вводится в настоящее описание посредством ссылки. Хотя в настоящей заявке описаны некоторые усеченные токсины, однако, специалистам по Bt хорошо известно, что токсины, принадлежащие к типу токсинов длиной 130 кДа (полноразмерные), имеют N-концевую половину, которая представляет собой коровый токсин, и С-концевую половину, которая представляет собой протоксиновый «хвост». Таким образом, соответствующие «хвосты» могут быть использованы вместе с усеченными/коровыми токсинами согласно изобретению. См., например, патент США № 6218188 и патент США № 6673990. Кроме того, методы создания синтетических генов Bt для их использования в растениях известны специалистам (Stewart and Burgin, 2007). Одним из неограничивающих примеров предпочтительного трансформированного растения является фертильное растение кукурузы, содержащее экспрессируемый в растении ген, кодирующй белок Cry1Fa, а также второй экспрессируемый в растении ген, кодирующй белок Vip3Ab.
Перенос (или интрогрессия) Cry1Fa- и Vip3Ab-детерминированного(ых) признака(ов) в инбредные линии кукурузы может быть достигнут путем рекуррентного селективного скрещивания, например, возвратного скрещивания. В этом случае, нужное рекуррентное растение сначала скрещивают с инбредным донором (нерекуррентным родителем), который несет соответствующий(ие) ген(ы), сообщающий(е) Cry1F- и Vip3Ab-детерминированные признаки. Затем потомство этого кросса подвергают возвратному скрещиванию с рекуррентным растением с последующим отбором полученного потомства на нужный(ые) признак(и), перенесенный(е) от нерекуррентного родителя. Через три, предпочтительно, четыре, а еще более предпочтительно, через пять или более поколений «бэккроссов» с рекуррентным родителем с отбором на нужный(е) признак(и), потомство будет гетерозиготным по локусам, контролирующим перенесенный(е) признак(и), но оно будет аналогично рекуррентному родителю по большинству или почти по всем другим генам (см., например, Poehlman & Sleper (1995) Breeding Field Crops, 4th Ed., 172-175; Fehr (1987) Principles of Cultivar Development, Vol. 1: Theory and Technique, 360-376).
Стратегии выращивания культур, резистентных к насекомым (IRM). Например, Roush и сотрудниками были описаны стратегии с использованием двух токсинов, также называемые созданием «пирамид» или «кластеров» для выращивания трансгенных культур, обладающих инсектицидными свойствами. (The Royal Society. Phil. Trans. R. Soc. Lond. B. (1998) 353, 1777-1786).
На web-сайте Агенства США по защите окружающей среды (epa.gov/oppbppdl/biopesticides/pips/bt_corn_refuge_2006. htm) опубликованы следующие требования по обеспечению площадей-убежищ с нетрансгенными культурами (то есть, не-B.t.) культурами (земельного участка с сельскохозяйственными не-Bt-культурами/кукурузой) для их использования под трансгенные культуры, продуцирующие один белок Bt, обладающий активностью против вредителей-мишеней.
«Конкретными структурными требованиями к продуктам из Bt-кукурузы (Cry1Ab или Cry1F), защищенной от кукурузного пилильщика, являются:
Структурные площади-«убежища»: 20% площади-убежища под Bt- кукурузу, не защищенную от Чешуекрылых в Кукурузном поясе;
50% площади-убежища под Bt-хлопчатник, не защищенный от Чешуекрылых в Хлопковом поясе;
Блоки:
Внутренние (то есть, в полях с Bt)
Внешние (то есть, отдельные поля в пределах ½ мили (по возможности ¼ мили) от Bt-поля для максимизации свободного скрещивания)
Полоски регулярно обрабатываемых сельскохозяйственных земель:
Эти полоски должны иметь ширину по меньшей мере в 4 ряда (предпочтительно, 6 рядов) для снижения числа случаев миграции личинок».
Кроме того, Национальная ассоциация производителей кукурузы, на своем web-сайте (ncga.com/insect-resistance-management-fact-sheet-bt-corn) также опубликовала аналогичное руководство по требованиям для площадей-убежищ. Так, например:
«Требования к IRM в случае кукурузного пилильщика:
- Засевать по меньшей мере 20% акров кукурузой для сохранения нетрансгенных гибридов
- В регионах выращивания хлопчатника, должно оставаться 50% площади-убежища
- Должно быть засеяно 1/2 мили нетрансгенными гибридами
- Площади-убежища могут быть засеяны полосами на Bt-поля; площади-убежища должны быть засеяны в виде полос, которые должны иметь ширину по меньшей мере в 4 ряда
- Площади-убежища могут быть обработаны стандартными пестицидами только, если достигаются экономические пороги для насекомых-мишеней
- Распыляемые инсектициды на основе Bt не могут быть использованы на площадях-убежищах под кукурузу
- Соответствующее убежище должно быть засеяно Bt-кукурузой на каждой ферме»
Как указывали Roush и сотрудники (например, на страницах 1780 и 1784 в правой колонке), кластеры или пирамиды из двух различных белков, каждый из которых является эффективным против вредителей-мишеней с минимальной перекрестной резистентностью или с отсутствием такой резистентности, могут быть использованы на более мелких «убежищах» нетрансгенных растений. Roush высказал предположение, что для успешного использования кластеров, площадь-убежище, размер которого составляет менее, чем 10%, может быть возделана культурой с резистентностью, сравнимой с резистентностью культур, возделываемой примерно на 50% площади-убежища для одного (не-пирамидного) токсина. Что касается доступных в настоящее время продуктов из кукурузы, содержащих «пирамидные» Bt, то Агенство США по защите окружающей среды требует, чтобы значительно меньшая (обычно 5%) площадь структурного убежища была засеяна не-Bt кукурузой, а не культурой с одним токсином (обычно 20%).
Существуют различные пути обеспечения IRM-эффектов использования площадей-убежищ, включая различные геометрические схемы засева на поля (как упоминалось выше) и смеси семян в одном пакете, что также обсуждается Roush и др. (см. выше), и в патенте США № 6551962.
Вышеуказанные проценты или аналогичные соотношения площадей-убежищ могут быть использованы для рассматриваемых двухкомпонентных или трехкомпонентных кластеров или пирамид. Для трехкомпонентных кластеров с тремя механизмами действия против одного вредителя-мишени, убежища вообще быть не должно (или например, площадь-убежище должна быть менее 5%). Это особенно справедливо для площадей под коммерческие культуры, например, свыше 10 акров.
Все патенты, патентные заявки, предварительные заявки и публикации или цитируемые в них работы во всей своей полноте вводятся в настоящее описание посредством ссылки в той степени, в которой они соответствуют детальному описанию настоящей заявки.
Если это не указано или не подразумевается конкретно, то используемые здесь артикли «a», «an» и «the» означают «по меньшей мере один».
Ниже приводятся примеры, которые иллюстрируют способы практического осуществления настоящего изобретения. Эти примеры не должны рассматриваться как ограничение объема изобретения. Все проценты даны по массе, а все соотношения смесей растворителей даны по объему, если это не оговорено особо. Все температуры даны в градусах Цельсия.
ПРИМЕРЫ
Пример 1 – Краткое описание примеров
В представленных ниже примерах показано, что Vip3Ab1 обладает активностью против личинок Spodoptera frugiperda (совки травяной) дикого типа и против собранного на полях штамма Spodoptera frugiperda, который был обнаружен в Пуэрто-Рико, и который является резистентным к кристаллическому токсину CrylFa Bacillus thuringiensis. Эти биологические данные подтвержадают, что Vip3Ab1 может быть использован для предотвращения развития резистентности насекомых к Cry1, поскольку насекомые, у которых развивается резистентность к токсинам CrylFa, остаются чувствительными к токсичности Vip3Ab1.
Аналогичным образом, в Spodoptera frugiperda, 125I-меченный CrylFa связывается с белками-рецепторами, и такое связывание может быть вытеснено с использованием нерадиоактивного CrylFa. Однако, в этих экспериментах было показано, что Vip3Ab1 не может вытеснять 125I-CrylFa при связывании с его рецептором. Эти результаты показали, что Vip3Ab1 имеет уникальный сайт связывания по сравнению с CrylFa. Способность Vip3Ab1 вырабатывать токсичность против насекомых, которые являются резистентными к CrylFa, обусловлена его неспособностью взаимодействовать с сайтом, с которым связываются эти токсины. Имеются и другие данные, которые указывают на то, что природа резистентности Spodoptera frugiperda к CrylFa обусловлена неспособностью CrylFa связываться с BBMV, выделенными из этого насекомого. Биологическая активность Vip3Ab1 против CrylFa-резистентных личинок S. frugiperda, который теряет свою способность связываться с CrylFa, также подтверждает отсутствие взаимодействия Vip3Ab1 с сайтом-мишенью, в отличие от CrylFa.
Пример 2 –
Очистка и процессинг белков CrylFa и Vip3Ab1 трипсином
Гены, кодирующие протоксины CrylFa и Vip3Ab1, были экспрессированы в экспрессионных штаммах Pseudomonas fluorescens, а полноразмерные белки были выделены в виде нерастворимых телец включения. Промытые тельца включения солюбилизировали путем перемешивания при 37°C в буфере, содержащем 20 мМ буфера CAPS, pH 11 + 10 мМ DDT + 0,1% 2-меркаптоэтанола, в течение 2 часов. Раствор центрифугировали при 27000 x g в течение 10 минут при 37°C, и супернатант обрабатывали 0,5% (масс/об) TCPK-обработанным трипсином (Sigma). Этот раствор инкубировали при смешивании в течение еще 1 часа при комнатной температуре, фильтровали, а затем загружали на колонку Pharmacia Mono Q 1010, уравновешенную 20 мМ CAPS, pH 10,5. После промывки загруженной колонки 2 колоночными объемами буфера, усеченный токсин элюировали 15 колоночными объемами линейного градиента 0–0,5 M NaCl в 20 мМ CAPS при скорости потока 1,0 мл/мин. Очищенные трипсином усеченные белки Cry элюировались примерно при 0,2-0,3 M NaCl. Чистоту белков оценивали с помощью электрофореза в ДСН-ПААГ и визуализировали с использованием кумасси бриллиантового голубого. В некоторых случаях, объединенные фракции очищенного токсина концентрировали и загружали на колонку с Superose 6 (диаметром 1,6 см, длиной 60 см), а затем очищали с помощью эксклюзионной хроматографии. Фракции, содержащие одиночный пик мономера с соответствующей молекулярной массой, объединяли и концентрировали, в результате чего получали более чем 95% гомогенный препарат белка, имеющего молекулярную массу примерно 60000 кДа.
Процессинг Vip3Ab1 достигался аналогичным образом, где в качестве исходного белка использовали очищенный полноразмерный белок массой 85 кДа (DIG-307), поставляемый Monte Badger. Белок (12 мг) диализовали в 50 мМ натрий-фосфатный буфер, pH 8,4, а затем обрабатывали путем добавления 1 мг твердого трипсина и инкубирования в течение 1 часа при комнатной температуре. Раствор загружали на анионообменную колонку MonoQ (диаметром 1 см, длиной 10 см), и элюировали 7 колоночными объемами линейного градиента NaCl от 0 до 500 мМ в 20 мМ натрий-фосфатного буфера, pH 8,4. Мониторинг элюирования белка осуществляли с помощью электрофореза в ДСН-ПААГ. Главная полоса процессированного белка имела молекулярную массу 65 кДа, как было определено с помощью электрофореза в ДСН-ПААГ с использованием стандартов молекулярной массы для сравнения.
Пример 3 – Биоанализы насекомых
Очищенные белки тестировали на инсектицидную активность в биоанализах, проводимых с использованием только что вылупившихся личинок Spodoptera frugiperda (J.E. Smith), которым давали искусственный корм для насекомых. CrylF-резистентных FAW собирали на полях кукурузы Herculex I (CrylFa) в Пуэрто-Рико, и помещали в инсектарий Dow AgroSciences Insectary для непрерывного размножения. Характеризация этого резистентного штамма FAW описана в Международном отчете Шленца и др. (Schlenz et al, 2008).
Биоанализы насекомых проводили в 128-луночных пластиковых планшетах для биоанализов насекомых (C-D International, Pitman, NJ). Каждая лунка содержала 0,5 мл корма для чешуекрылых многих видов (Southland Products, Lake Village, AR). 40 мкл-аликвоты очищенного белка Cry или Vip3Ab1, разведенные до различных концентраций в 10 мМ CAPS, pH 10,5, или контрольный раствор наносили пипеткой на поверхность в 1,5 см2 каждой лунки с кормом (26,7 мкл/см2). Было протестировано 16 лунок на образец. Негативный контроль представлял собой буферный раствор, не содержащий белка. Позитивный контроль включал препараты Cry1F. Обработанные лунки выдерживали в вытяжном шкафу до тех пор, пока жидкость на поверхности корма не испарялась или не абсорбировалась в этом корме.
В течение нескольких часов размножения, отдельные личинки собирали увлажненной щеткой из верблюжьей шерсти и помещали на обработанный корм, одну личинку на лунку. Затем зараженные лунки герметично закрывали клейкими прозрачными пластиковыми пластинами, и снабжали отверстием для газообмена (C-D International). Планшеты для биоанализа выдерживали в регулируемых условиях окружающей среды [28°С, относительная влажность (ОВ) приблизительно 40%, 16 ч:8 ч (день:ночь)]. Через 5 дней регистрировали общее число насекомых, обработанных каждым образцом белка, число погибших насекомых и массу выживших насекомых.
Пример 4 – Иодирование токсинов CrylFa
Сообщалось, что Cry1F оказывает негативное влияние на токсичность и связывающую способность этого белка, как показал тест, проведенный с использованием личинок табачной листовертки и BBMV, выделенных у этих насекомых (Luo et al, 1999; Sheets and Storer, 2001). Такая инактивация, предположительно, обусловлена потребностью в присутствии немодифицированных тирозиновых остатков рядом с сайтом связывания белка. При проведении реакции иодирования Cry1F методом с использованием иодсодержащих сфер, белок полностью теряет свою способность специфически связываться с BBMV, полученными от H. virescens. При применении нерадиоактивного NaI для иодирования Cry1F, проводимого методом с использованием иодсодержащих сфер, было обнаружено, что иодированный Cry1F также теряет свою инсектицидную активность против H. virescens.
Более ранние исследования, проводимые заявителями в своей лаборатории, показали, что Cry1Fa может быть флуоресцентно помечен конъюгированными с малеимидом реагентами для мечения, которые специфически алкилируют белки в положениях цистеиновых остатков. Поскольку обработанный трипсином коровый токсин Cry1Fa содержит один цистеиновый остаток в положении 205, то мечение белка таким реагентом приводит к алкилированию белка в одном специфическом сайте. Было определено, что Cry1Fa может быть флуоресцентно помечен флуоресцеин-5-мелеимидом, и что меченный белок сохраняет свою инсектицидную активность. Исходя из сохранения биологической активности Cry1Fa, меченного флуоресцеином в положении цистеина, авторами настоящего изобретения было установлено, что может быть также проведено радиоактивное иодирование флуоресцентной части метки методом, описанным Palmer et al. (Palmer et al., 1997), и присоединение этой метки к цистеину CrylFa, где указанный радиоактивно меченный Cry1Fa сохраняет свою биологическую активность.
Флуоресцеин-5-малеимид растворяли в 10 мМ (4,27 мг/мл) в ДМСО, а затем разводили в 1 мМ в PBS, как было определено по его коэффициенту молярной экстинкции 68000 M-1см-1. К 70 мкл раствора PBS, включающего две иодсодержащих сферы, добавляли 0,5 мКи Na-125I, а затем закрывали свинцовым кожухом. Этот раствор перемешивали при комнатной температуре в течение 5 минут, а затем добавляли 10 мкл 1 мМ флуоресцеин-5-малеимид. Реагенты оставляли на 10 минут для прохождения реакции, а затем удаляли с иодсодержащих сфер. К прореагировавшему раствору добавляли 2 мкг усеченного и в высокой степени очищенного и обработанного трипсином корового токсина Cry1Fa в PBS. Белок инкубировали с иодированным раствором флуоресцеин-5-малеимида в течение 48 часов при 4°C. Реакцию завершали добавлением 2-меркаптоэтанола до 14 мМ. Затем, реакционную смесь добавляли в центрифужную колонку Zebra, уравновешенную в 20 мМ CAPS, 150 мМ KCl, pH 9, и центрифугировали при 1500 x g в течение 2 минут для отделения непрореагировавшего иодированного красителя от белка. 125I-меченный флуоресцеин-Cry1Fa подсчитывали на гамма-счетчике для определения удельной активности этого соединения, предположительно, в расчете на то, что количество этого соединения будет составлять 80% от количества исходного токсина. Белок также охарактеризовывали с помощью электрофореза в ДСН-ПААГ и визуализировали путем флуоресцентной визуализации для того, чтобы убедиться, что измеренная радиоактивность ковалентно связана с белком Cry1Fa.
Пример 5 - Получение и фракционирование солюбилизированных BBMV
Стандартные методы количественной оценки белка и электрофореза в полиакриламидном геле с ДСН осуществляли, например, как описано в руководстве Сэмбрука и др. (Sambrook and Russell, 2001) и в более поздних изданиях. Личинки S. frugiperda в последней возрастной стадии выдерживали в условиях голодания в течение ночи, а затем, после охлаждения на льду в течение 15 минут, вскрывали. Ткань средней части кишечника удаляли из полости тела, а заднюю часть кишечника оставляли присоединенной к покровному слою. Среднюю часть кишечника помещали в 9 объемов охлажденного льдом гомогенизирующего буфера (300 мМ маннит, 5 мМ EGTA, 17 мМ основания трис, pH 7,5), в который была добавлена смесь ингибиторов протеазы (Sigma-Aldrich P-2714), разведенная в соответствии с рекомендации поставщиков. Ткань гомогенизировали 15-ю импульсами, подаваемыми стеклянным гомогенизатором ткани. BBMV получали методом MgCl2–преципитации, описанным Вольферсбергером (Wolfersberger, 1993). Вкратце, равный объем 24 мМ раствора MgCl2 в 300 мМ маннита смешивали с гомогенатом, выделенным из средней части кишки, перемешивали в течение 5 минут и оставляли на льду на 15 минут. Раствор центрифугировали при 2500 x g в течение 15 минут при 4°C. Супернатант сохраняли, и осадок суспендировали в исходном объеме 0,5 х разведенного гомогенизирующего буфера, а затем снова центрифугировали. Два супернатанта объединяли и центрифугировали при 27000 x g в течение 30 минут при 4°С с получением фракции BBMV. Осадок суспендировали в буфере для хранения BBMV (10 мМ HEPES, 130 мМ KCl, 10% глицерин, pH 7,4) до получения концентрации белка примерно 3 мг/мл. Концентрацию белка определяли с использованием BSA в качестве стандарта.
Перед замораживанием образцов определяли L-лейцин-п-нитроанилид-аминопептидазную активность (фермента-маркера для фракции BBMV). Вкратце, 50 мкл L-лейцин-п-нитроанилида (1 мг/мл в PBS) добавляли в 940 мл 50 мМ трис-HCl в стандартную кювету. Эту кювету помещали в спектрофотометр Cary 50 Bio, установленный на ноль для считывания оптической плотности на длине волны 405 нм, и реакцию инициировали добавлением 10 мкл либо гомогената средней части кишки насекомого, либо BBMV-препарата, полученного от насекомого. Затем проводили мониторинг увеличения оптической плотности на 405 нм в течение 5 минут при комнатной температуре. Удельную активность гомогената и BBMV-препаратов определяли по кинетике возрастания оптической плотности в течение периода времени, за который наблюдалось линейное возрастание оптической плотности, на единицу общего белка, используемого в анализе, по следующему уравнению:
ΔOD/(мин•мг) = скорость увеличения количества аминопептидазы (ΔOD/мл•мин/[белок] (мг/мл)
Удельная активность этого фермента обычно в 7 раз выше, чем активность, наблюдаемая в исходной фракции гомогената средней кишки. BBMV разделяли на 250 мкл-аликвоты, быстро замораживали в жидком N2 и хранили при -80°C.
Пример 6 - Электрофорез
Анализ белков с помощью электрофореза в ДСН-ПААГ проводили в восстанавливающих условиях (то есть, в 5% β-меркаптоэтаноле, BME) и в денатурирующих условиях (то есть, при нагревании в течение 5 минут, при 90°С в присутствии 4% ДСН). Белки загружали на лунки с 4-20% трис-глициновым полиакриламидным гелем (BioRad; Hercules, CA) и разделяли под напряжением 200 вольт в течение 60 минут. Полосы белка детектировали путем окрашивания кумасси бриллиантовым голубым R-250 (BioRad) в течение одного часа, и обесцвечивали раствором 5% метанола в 7% уксусной кислоте. Гели визуализировали и анализировали на визуализаторе BioRad Fluro-S Multi Imager™. Относительные молекулярные массы полос белка определяли путем сравнения с подвижностью белков с известной молекулярной массой, наблюдаемыми в образце лэддера белка BenchMark™ (Invitrogen, Carlsbad, CA), загруженного на одну лунку геля.
Пример 7 – Визуализация
Радиоактивную чистоту иодированных белков Cry и радиоактивность Cry1Fa в анализах на ингибирование определяли с помощью электрофореза в ДСН-ПААГ и визуализации флуоресцентным методом. Вкратце, ДСН-ПААГ-гели визуализировали путем обертывания гелей в пленку Mylar (толщиной 12 мкм), а затем, после разделения и фиксации белка, гель экспонировали под флуоресцирующим экраном с накоплением Molecular Dynamics (35 см × 43 см) по меньшей мере в течение ночи и до 4 дней. Планшеты проявляли с помощью флуоресцентного визуализатора Molecular Dynamics Storm 820, и изображение анализировали с помощью компьютерной программы ImageQuant™.
Пример 8 – Краткое описание результатов
Результаты по уничтожению насекомых, полученные в биоанализах полноразмерного белка Vip3Ab1, протестированного в различных дозах на его действие против личинок S. frugiperda дикого типа и CrylFa-резистентных личинок S. frugiperda, представлены на фиг. 1. Гибель личинок S. frugiperda дикого типа составляла 100% при самой высокой тестируемой концентрации (9000 нг/см2), а при более низких дозах, процент гибели был ниже. LC50 оценивали примерно при 2000 нг/см2. Vip3Ab1 оказался в высокой степени эффективным в отношении ингибирования роста личинок S. frugiperda, при этом более, чем 95%-ное ингибирование роста наблюдалось при концентрациях 1000 нг/см2 и выше. Высокий уровень ингибирования роста, наблюдаемый для личинок S. frugiperda обоих типов, позволяет предположить, что процент гибели этих насекомых, по всей вероятности, будет возрастать под действием этого белка в течение более длительного периода времени.
Был также проведен биоанализ для сравнения биологической активности Vip3Ab1 против S. frugiperda дикого типа и против CrylFa-резистентной S. frugiperda (фиг. 1). Процент ингибирования роста представлен вертикальными столбцами, а процент гибели насекомых представлен ромбами. Гибель насекомых, измеряемая в течение 5 дней после воздействия токсина, была ниже на 50% для насекомых обоих типов при всех тестируемых концентрациях. При этом, наблюдалась явная зависимость ингибирования роста от дозы. Vip3Ab1 давал >95%-ное ингибирование роста CrylFa-чувствительных и CrylFa-резистентных личинок S. frugiperda при концентрации выше 1000 нг/см2, и примерно 50%-ное ингибирование роста личинок S. frugiperda дикого типа при концентрации примерно 40 нг/см2. Vip3Ab1 давал более, чем 50%-ное ингибирование роста CrylFa-резистентных личинок S. frugiperda при всех тестируемых концентрациях, где самая низшая концентрация составляла 4,1 нг/см2. Таким образом, Vip3Ab1 обладал высокой активностью против CrylFa-резистентных личинок S. frugiperda.
Были проведены повторные биоанализы для получения средних летальных концентраций (LC50), и средних рост-ингибирующих концентраций (GI50). В таблице 2 указаны GI50 и 95%-ные доверительные интервалы, полученные при воздействии Vip3Ab1 на CrylFa-чувствительные и CrylFa-резистентные личинки Spodoptera frugiperda по сравнению с контролем.
Таблица 2
39,3 мг (rFAW)
35,9 мг (rFAW)
Анализы на конкурентное связывание радиоактивной метки проводили для того, чтобы определить, взаимодействует ли Vip3Ab1 с тем же сайтом, с которым связывается CrylFa у FAW. Анализ на конкурентное связывание проводили для измерения способности Vip3Ab конкурировать за связывание с 125I-меченным CrylFa. На фигуре 2 проиллюстрирована флуоресцентная визуализация радиоактивного CrylFa, фракционированного путем проведения электрофореза в ПААГ с ДСН после связывания с белками BBMV. В отсутствии каких-либо конкурирующих лигандов может быть детектирован 125I-CrylFa, ассоциированный с белком BBMV. При инкубировании в присутствии 1000 нМ немеченного CrylFa (в концентрации, которая в 500 раз превышает концентрацию меченного белка, используемого в данном анализе) наблюдалась очень низкая радиоактивность, соответствующая 125I- CrylFa. Таким образом, как и ожидалось, полученный результат показал, что немеченный CrylFa эффективно конкурирует с радиоактивным CrylFa за связывание с белками-рецепторами, поскольку эти гомологичные белки связываются с тем же самым сайтом. При проведении того же самого эксперимента с использованием 1000 нМ немеченного белка Vip3Ab1 в качестве конкурирующего белка, авторами настоящего изобретения не было обнаружено каких-либо изменений уровня связывания 125I-CrylFa с белками BBMV от S. frugiperda, что указывает на то, что Vip3Ab1 не конкурирует за связывание с 125I-CrylFa. Этот результат показал, что Vip3Ab1 не связывается с сайтом, с которым связывается CrylFa.
У насекомых может развиваться резистентность к токсичности белков Cry по различным биохимическим механизмам, но большинство общеизвестных механизмов обусловлено снижением способности белка токсина Cry связываться с его специфическим рецептором в кишечнике насекомого (Heckel et al., 2007; Tabashnik et al., 2000; Xu et al, 2005). Это, очевидно, может быть вызвано небольшими точковыми мутациями, крупными делециями генов или другими генетическими или биохимическими механизмами. Для понимания природы резистентности насекомых к CrylFa, авторами были проведены исследования BBMV-белков, происходящих от CrylFa-резистентных S. frugiperda, в результате чего было обнаружено, что BBMV, полученные от CrylFa-резистентных насекомых, обладали гораздо меньшей способностью связываться с 125I-меченным CrylFa по сравнению с BBMV, полученными от насекомых дикого типа (фигура 3). Таким образом, механизм вырабатывания резистентности S. frugiperda к CrylFa обусловлен значительным снижением уровня связывания CrylFa с BBMV, происходящими от резистентных насекомых. Поскольку на фиг. 2 показано, что Vip3Ab1 не конкурирует за связывание с CrylFa, то это еще раз подтверждает, что Vip3Ab1 не должен действовать по механизму резистентности, по которому происходит связывание CrylFa с его специфическим рецептором. Этот результат был подтвержден в биоанализах. Таким образом, Vip3Ab1 дополняет активность CrylFa, в том смысле, что он обладает биологической активностью против тех же насекомых, но тем не менее, он не связывается с теми же сайтами рецепторов, с которыми связываются все эти белки Cry, а поэтому он не действует по механизму резистентности, который должен приводить к снижению уровня связывания с токсином Cry. Исходя из этих исследований, авторами был сделан вывод, что Vip3Ab1 представляет собой превосходный токсин против насекомых, который, при его объединении с CrylFa, может быть использован как средство для предотвращения вырабатывания резистентности у насекомых, где указанное средство будет обладать биологической активностью против насекомых, у которых может развиваться резистентность к любому одному их этих белков, а также уничтожать резистентных насекомых.
Библиография

Приложение А
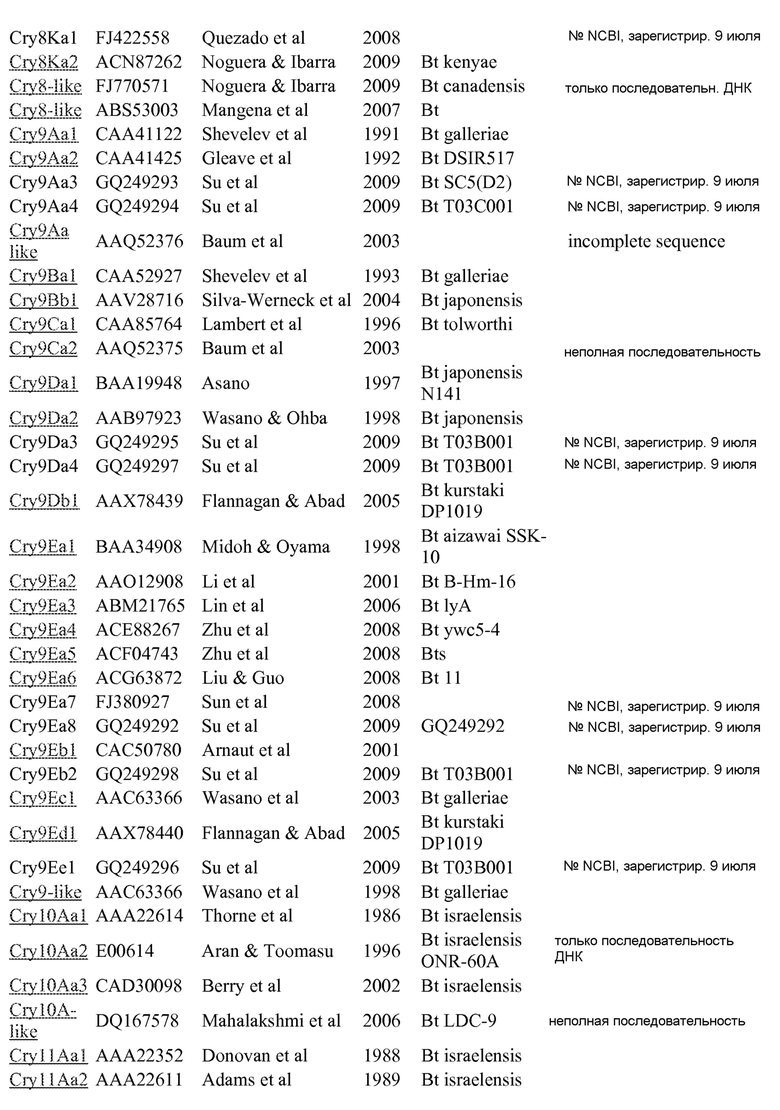
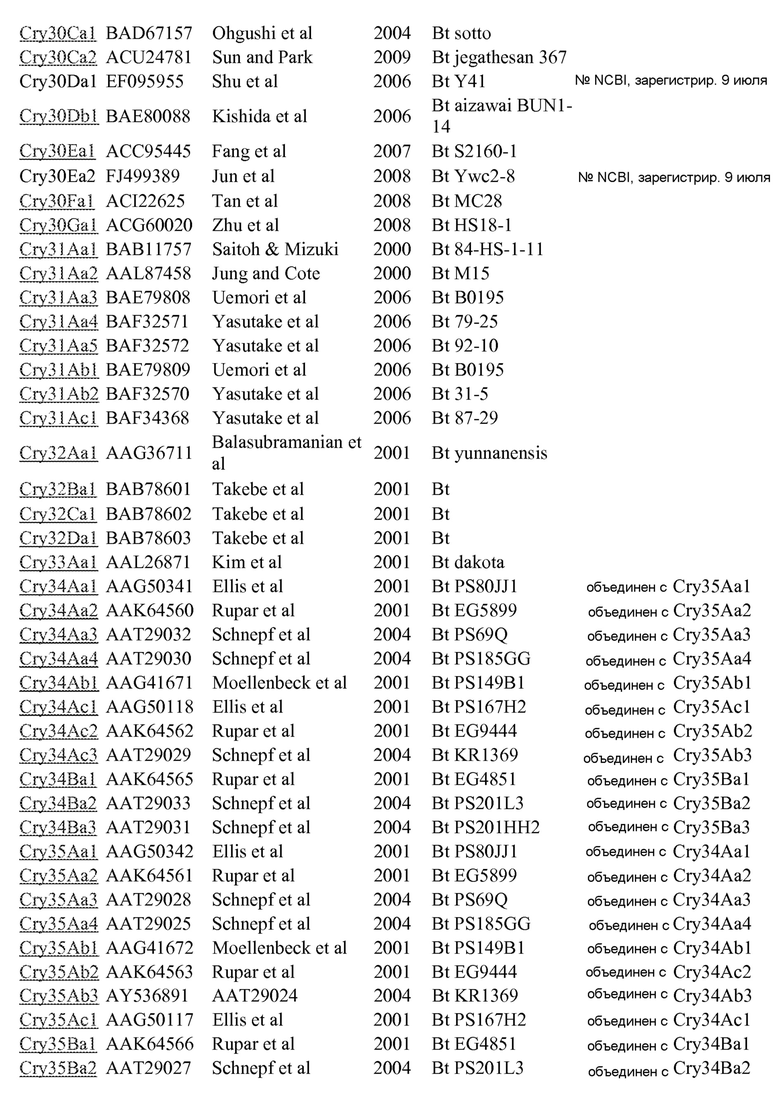
Список дельта-эндотоксинов – Crickmore et al. web-сайт (указанный в заявке)
Регистрационный номер для доступа в NCBI






| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ БЕЛКОВ Cry1Da И Cry1Fa ДЛЯ ВЫРАБАТЫВАНИЯ РЕЗИСТЕНТНОСТИ К НАСЕКОМЫМ | 2010 |
|
RU2603257C2 |
| КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ БЕЛКОВ CRY1Ca И CRY1Fa ДЛЯ БОРЬБЫ С РЕЗИСТЕНТНОСТЬЮ У НАСЕКОМЫХ | 2010 |
|
RU2593961C2 |
| ПРИМЕНЕНИЕ Vip3Ab В СОЧЕТАНИИ С Cry1Ca ДЛЯ УПРАВЛЕНИЯ УСТОЙЧИВЫМИ НАСЕКОМЫМИ | 2010 |
|
RU2575084C2 |
| КОНТРОЛЬ УСТОЙЧИВОСТИ НАСЕКОМЫХ С ПОМОЩЬЮ КОМБИНАЦИИ БЕЛКОВ Cry1Be И Cry1F | 2010 |
|
RU2575611C2 |
| ПРИМЕНЕНИЕ CRY1AB В КОМБИНАЦИИ С CRY1BE ДЛЯ УПРАВЛЕНИЯ РЕЗИСТЕНТНОСТЬЮ НАСЕКОМЫХ | 2010 |
|
RU2583288C2 |
| КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ VIP3AB И CRY1AB ДЛЯ РЕГУЛИРОВАНИЯ УСТОЙЧИВЫХ НАСЕКОМЫХ | 2011 |
|
RU2608500C2 |
| ПРИМЕНЕНИЕ Cry1Da В СОЧЕТАНИИ С Cry1Ca ДЛЯ УПРАВЛЕНИЯ УСТОЙЧИВЫМИ НАСЕКОМЫМИ | 2010 |
|
RU2569108C2 |
| ПРИМЕНЕНИЕ Cry1Da В СОЧЕТАНИИ С Cry1Be ДЛЯ УПРАВЛЕНИЯ УСТОЙЧИВЫМИ НАСЕКОМЫМИ | 2010 |
|
RU2590592C2 |
| КОМБИНИРОВАННОЕ ИСПОЛЬЗОВАНИЕ БЕЛКОВ CRY1Ca И CRY1Ab ДЛЯ КОНТРОЛЯ УСТОЙЧИВОСТИ НАСЕКОМЫХ | 2010 |
|
RU2596406C2 |
| ИНСЕКТИЦИДНЫЕ КОМБИНАЦИИ БЕЛКОВ ДЛЯ БОРЬБЫ С СОВКОЙ ТРАВЯНОЙ И КУКУРУЗНЫМ МОТЫЛЬКОМ И СПОСОБЫ УПРАВЛЕНИЯ УСТОЙЧИВОСТЬЮ НАСЕКОМЫХ | 2010 |
|
RU2577141C2 |






Изобретение относится к области биохимии, в частности к трансгенному растению, которое имеет устойчивость к совке травяной (FAW; Spodoptera frugiperda), содержащее ДНК, кодирующую Vip3Ab, ДНК, кодирующую Cry1Fa, и ДНК, кодирующую третий белок, выбранный из группы, состоящей из CrylC, CrylD и CrylE, его семени, а также к способу предотвращения вырабатывания у совки травяной резистентности к белкам Vip3Ab и Cry1Fa с его использованием. Также раскрыта совокупность растений в поле, содержащая множество вышеуказанных трансгенных растений и растения, не содержащие белки Bacillus thuringiensis (не-Bt растения), и смесь семян, содержащая семена не-Bt растений и множество вышеуказанных семян. Изобретение также относится к композиции для борьбы с чешуекрылыми вредителями, содержащей клетки, экспрессирующие Cry1Fa, Vip3Ab и третий белок, выбранный из группы, состоящей из Cry1C, Cry1D и Cry1E, а также к способу борьбы с совкой травяной с ее использованием. Изобретение позволяет эффективно бороться с совкой травяной. 15 н. и 19 з.п. ф-лы, 3 ил., 2 табл., 8 пр.
1. Трансгенное растение, которое имеет резистентность к совке травяной (FAW; Spodoptera frugiperda), содержащее ДНК, кодирующую инсектицидный белок Vip3Ab с SEQ ID NO: 2, ДНК, кодирующую инсектицидный белок Cry1Fa с SEQ ID NO: 1, и ДНК, кодирующую третий инсектицидный белок, где указанный третий белок выбран из группы, состоящей из CrylC, CrylD и CrylE.
2. Семя растения по п. 1, содержащее ДНК, кодирующую инсектицидный белок Vip3Ab с SEQ ID NO: 2, ДНК, кодирующую инсектицидный белок CryFa с SEQ ID NO: 1, и ДНК, кодирующую третий инсектицидный белок, где указанный третий белок выбран из группы, состоящей из CrylC, CrylD и CrylE, где указанное семя сеют для замедления развития резистентности совки травяной к белкам Cry1Fa и Vip3Ab.
3. Трансгенное растение по п. 1, где ДНК, кодирующая инсектицидный белок Vip3Ab с SEQ ID NO: 2, ДНК, кодирующая инсектицидный белок CryFa с SEQ ID NO: 1, и ДНК, кодирующая третий инсектицидный белок, где указанный третий белок выбран из группы, состоящей из CrylC, CrylD и CrylE, введены в указанное растение путем интрогрессии.
4. Семя растения по п. 3, содержащее ДНК, кодирующую инсектицидный белок Vip3Ab с SEQ ID NO: 2, ДНК, кодирующую инсектицидный белок Cry1Fa с SEQ ID NO: 1, и ДНК, кодирующую третий инсектицидный белок, где указанный третий белок выбран из группы, состоящей из CrylC, CrylD и CrylE, где указанное семя сеют для замедления развития резистентности совки травяной к белкам Cry1Fa и Vip3Ab.
5. Совокупность растений в поле, содержащая растения, которые не содержат белки Bacillus thuringiensis, (не-Bt растения), и совокупность трансгенных растений по п. 1, где указанные трансгенные растения содержат ДНК, кодирующую инсектицидный белок Vip3Ab с SEQ ID NO: 2, ДНК, кодирующую инсектицидный белок CryFa с SEQ ID NO: 1, и ДНК, кодирующую третий инсектицидный белок, где указанный третий белок выбран из группы, состоящей из CrylC, CrylD и CrylE, где указанные не-Bt растения составляют менее чем 40% от всех сельскохозяйственных культур в указанной совокупности растений, где указанная совокупность растений замедляет развитие резистентности совки травяной к белкам Cry1Fa и Vip3Ab, и где указанная совокупность растений содержит по меньшей мере одно не-Bt растение.
6. Совокупность растений в поле растений по п. 5, где указанные не-Bt растения составляют менее чем 30% от всех сельскохозяйственных культур в указанной совокупности растений.
7. Совокупность растений в поле растений по п. 5, где указанные не-Bt растения составляют менее чем 20% от всех сельскохозяйственных культур в указанной совокупности растений.
8. Совокупность растений в поле растений по п. 5, где указанные не-Bt растения составляют менее чем 10% от всех сельскохозяйственных культур в указанной совокупности растений.
9. Совокупность растений в поле растений по п. 5, где указанные не-Bt растения составляют менее чем 5% от всех сельскохозяйственных культур в указанной совокупности растений.
10. Смесь семян, содержащая семена растений, которые не содержат белки Bacillus thuringiesis, (не-Bt растений), и множество семян по п. 2, где указанные семена не-Bt растений составляют менее чем 40% от всех семян в указанной смеси, где указанную смесь семян сеют для замедления развития резистентности совки травяной к белкам Cry1Fa и Vip3Ab, и где указанная смесь содержит по меньшей мере одно семя не-Bt растения.
11. Смесь семян по п. 10, где указанные семена не-Bt растений составляют менее чем 30% от всех семян в указанной смеси.
12. Смесь семян по п. 10, где указанные семена не-Bt растений составляют менее чем 20% от всех семян в указанной смеси.
13. Смесь семян по п. 10, где указанные семена не-Bt растений составляют менее чем 10% от всех семян в указанной смеси.
14. Смесь семян по п. 10, где указанные семена не-Bt растений составляют менее чем 5% от всех семян в указанной смеси.
15. Способ предотвращения вырабатывания у насекомого совки травяной (FAW; Spodoptera frugiperda) резистентности к белкам Cry1Fa и Vip3Ab, происходящим от Bacillus thuringiensis, где указанный способ включает посев семян для получения совокупности растений, содержащих ДНК, кодирующую инсектицидный белок Vip3Ab с SEQ ID NO: 2, ДНК, кодирующую инсектицидный белок CryFa с SEQ ID NO: 1, и ДНК, кодирующую третий инсектицидный белок, где указанный третий белок выбран из группы, состоящей из CrylC, CrylD и CrylE, и контактирование указанного насекомого с указанной совокупностью трансгенных растений.
16. Трансгенное растение по п. 1, где указанный третий белок представляет собой CrylC.
17. Совокупность растений в поле, содержащая растения, которые не содержат белки Bacillus thuringiensis, (не-Bt растения), и совокупность трансгенных растений по п. 16, где указанные не-Bt растения составляют менее чем примерно 20% от всех сельскохозяйственных культур на указанном поле, где указанная совокупность растений замедляет развитие резистентности совки травяной к белкам Cry1Fa и Vip3Ab, и где указанная совокупность растений содержит по меньшей мере одно не-Bt растение.
18. Совокупность растений в поле, содержащая растения, которые не содержат белки Bacillus thuringiensis, (не-Bt растения), и совокупность растений по п. 16, где указанные не-Bt растения составляют менее чем 10% от всех сельскохозяйственных культур в указанной совокупности растений, где указанная совокупность растений замедляет развитие резистентности совки травяной к белкам Cry1Fa и Vip3Ab, и где указанная совокупность растений содержит по меньшей мере одно не-Bt растение.
19. Способ предотвращения вырабатывания у насекомого совки травяной резистентности к белкам Cry1Fa и Vip3Ab, происходящим от Bacillus thuringiensis, где указанный способ включает посев семян для получения совокупности растений по п. 18 и контактирование указанного насекомого с указанной совокупностью трансгенных растений.
20. Композиция для борьбы с чешуекрылыми вредителями, содержащая клетки, экспрессирующие инсектицидно активное количество белка с SEQ ID NO: 1, содержащего коровый токсин Cry1Fa, белка Vip3Ab с SEQ ID NO: 2 и третьего инсектицидного белка, где указанный третий белок выбран из группы, состоящей из Cry1C, Cry1D и Cry1E, где указанные чешуекрылые вредители представляют собой совку травяную, которая является резистентной или к Cry1Fa, или к Vip3Ab.
21. Композиция по п. 20, содержащая хозяина, трансформированного так, чтобы он экспрессировал белок, содержащий коровый токсин Cry1F, белок Vip3Ab и третий инсектицидный белок, где указанный третий белок выбран из группы, состоящей из Cry1C, Cry1D и Cry1E где указанным хозяином является микроорганизм или клетка растения.
22. Способ борьбы с чешуекрылыми вредителями, включающий обработку указанных вредителей или среду обитания этих вредителей инсектицидно активным количеством композиции по п. 20, где указанные чешуекрылые вредители представляют собой совку травяную, которая является резистентной или к Cry1Fa, или к Vip3Ab.
23. Трансгенное растение по п. 1, где указанный третий представляет собой CrylE.
24. Трансгенное растение по п. 23, где указанное растение продуцирует четвертый белок и пятый белок, выбранные из группы, состоящей из Cry2A, CrylI, CrylAb и DIG-3.
25. Трансгенное растение по п. 16, где указанное растение продуцирует четвертый белок, выбранный из группы, состоящей из Cry2A, CrylI, CrylAb и DIG-3.
26. Способ предотвращения вырабатывания у насекомого совки травяной резистентности к белкам Cry1Fa и Vip3Ab, где указанный способ включает посев семян для получения совокупности растений по п. 25 и контактирование указанного насекомого с указанной совокупностью трансгенных растений.
27. Совокупность растений в поле, содержащая растения, которые не содержат белки Bacillus thuringiensis, (не-Bt растения), и множество трансгенных растений по п. 25, где указанные не-Bt растения составляют менее чем 10% от всех сельскохозяйственных культур в указанной совокупности растений, где указанная совокупность растений замедляет развитие резистентности совки травяной к белкам Cry1Fa и Vip3Ab, и где указанная совокупность растений содержит по меньшей мере одно не-Bt растение.
28. Совокупность растений по п. 27, где указанная совокупность содержит менее чем примерно 5% не-Bt растений.
29. Способ предотвращения вырабатывания у насекомого совки травяной резистентности к белкам Cry1Fa и Vip3Ab, где указанный способ включает посев семян для получения совокупности растений по п. 27 или 28 и контактирование указанного насекомого с указанной совокупностью трансгенных растений.
30. Смесь семян, содержащая семена растений, которые не содержат белки Bacillus thurinigiensis (не-Bt растений), и совокупность семян растений по п. 25, где указанные семена не-Bt растений составляют менее чем 10% от всех семян в указанной смеси, где указанную смесь семян сеют для замедления развития резистентности совки травяной к белкам Cry1Fa и Vip3Ab, и где указанная смесь семян содержит по меньшей мере одно семя не-Bt растения.
31. Совокупность растений по любому из пп. 5, 17 и 27, где указанные растения занимают площадь более чем 10 акров.
32. Растение по любому из пп. 1, 16, 23 и 25, где указанное растение выбрано из группы, состоящей из кукурузы, сои и хлопчатника.
33. Растение по любому из пп. 1, 16, 23 и 25, где указанным растением является растение кукурузы.
34. Трансгенное растение по п. 1, где указанный третий белок представляет собой Cry1D.
| WO2009132850 A1, 05.11.2009.BRAVO A.et al., How to cope with insect resistance to Bt toxins?, 2008, Vol | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| Котел для водяного отопления с внутренним перегревателем воды для побуждения циркуляции в сети и с регулятором наружной температуры котла | 1924 |
|
SU573A1 |
| et al., Strategies to improve the insecticidal activity of Cry toxins from Bacillus thuringiensis, Peptides | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2017-01-10—Публикация
2010-12-16—Подача