Изобретение относится к биотехнологии, в частности к генетической инженерии. Может быть использовано для получения интерлейкина-13 (ИЛ-13) человека.
Интерлейкин-13 человека (ИЛ-13) может быть использован в терапии ревматоидного артрита [Cleaver C.S., Rowan A.D., Cawston Т.Е. Interleukin 13 blocks the release of collagen from bovine nasal cartilage treated with proinflammatory cytokines. Ann. Reum. Dis., 2001, V.60, No.2, pp.150-157], ВИЧ-инфекции и сопутствующих заболеваний [Husain S.R., Puri R.K. Interleukin-13 fusion cytotoxin as a potent targeted agent for AIDS-Kaposi's sarcoma xenograft. Blood. 2000, V.95, No.11, pp.3506-3513], онкологических заболеваний [Kawakami K., Kawakami M., Joshi В.Н., Puri R.K. Interleukin-13 receptor-targeted cancer therapy in an immunodeficient animal model of human head and neck cancer. Cancer Res., 2001, V.61, No.16, pp.6194-6200]. Кроме того, интерлейкин-13 используется при выращивании дендритных клеток и лечении рака кожи [Salcedo M., Bercovici N., Taylor R., Vereecken P., Massicard S., Duriau D., Vemel-Pauillac F., Boyer A., Baron-Bodo V., Mallard E., Bartholeyns J., Goxe В., Latour N., Leroy S., Prigent D., Martial P., Sales F., Laporte M., Bruyns C., Romet-Lemonne J.L., Abastado J.P., Lehmann F., Velu T. Vaccination of melanoma patients using dendritic cells loaded with an allogeneic tumor cell lysate. Cancer Immunol. Immunother., 2006, V.55, No.7, pp.819-829.].
Известен способ получения интерлейкина-13 человека, основанный на экспрессии в клетках мышиной миеломы [Cannon-Carlson S., Varnerin J., Tsarbopoulos A., Jenh C.H., Сох М.А., Chou C.C., Connelly N., Zavodny P., Tang J.C. Expression, purification, and characterization of recombinant human interleukin-13 from NS-O cells. Protein Expr. Purif, 1998, V.12, No.2, pp.239-248]. Недостатком этого метода является, при довольно высоком выходе целевого продукта (6 мг очищенного активного белка из 1 л культуры), высокая цена на компоненты питательных сред для эукариот и наличие модификаций интерлейкина-13, требующих дополнительных дорогостоящих стадий очистки.
Известен способ получения интерлейкина-13 человека микробиологическим синтезом [Eisenmesser E.Z., Kapust R.B., Nawrocki J.P., Mazzulla M.J., Pannell L.K., Waugh D.S., Byrd R.A. Expression, purification, refolding, and characterization of recombinant human interleukin-13: utilization of intracellular processing. Protein Expr. Purif, 2000, V.20, No.2, pp.186-195]. Синтезируемый белок накапливается в нерастворимом виде в телах включения, что, с одной стороны, требует введения стадии ренатурации для получения биологически активной формы полипептида, а с другой стороны, упрощает процедуру очистки целевого белка от полипептидных компонентов клетки. Недостатками описанного способа являются весьма умеренный для микробиологического синтеза выход целевого белка, а также большой расход индуктора, требуемый для достижения экспрессии.
Известен наиболее близкий к заявленному способ, описанный в работе [Thompson J.P., Debinski W. Mutants of interleukin 13 with altered reactivity toward interleukin 13 receptors. J. Biol. Chem., 1999, V.272, No.42, pp.29944-29950]. Рекомбинантная плазмидная ДНК содержит кДНК зрелого интерлейкина-13 человека под контролем промотора фага Т7. Синтез белка осуществляют при добавлении индуктора, изопропил-β-D-тиогалактопиранозида (ИПТГ), до конечной концентрации 250 мкМ. Полученный в виде телец включения белок солюбилизируют в растворе, содержащем гуанидинхлорид, ренатурируют путем разбавления и очищают с помощью ионообменной хроматографии. В результате получают интерлейкин-13 человека с общим выходом 1,5 мг/л культуральной жидкости.
Недостатком способа-прототипа является относительно низкий уровень синтеза интерлейкина-13, использование больших количеств ИПТГ для индукции, а также высокий базальный уровень синтеза белка, свойственный системам экспрессии на основе промотора фага Т7 [Novagen pET System Manual, 11th Edition].
Изобретение решает задачу получения полипептида со свойствами интерлейкина-13 человека, а также увеличения уровня его биосинтеза при одновременном снижении количества добавляемого индуктора.
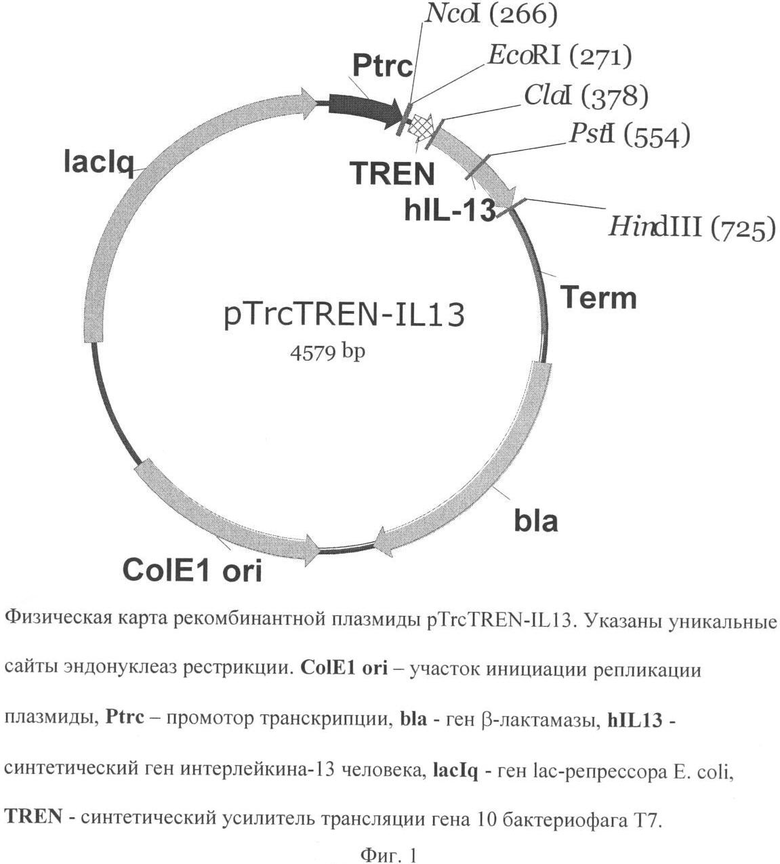
Поставленная задача решается путем конструирования рекомбинантной плазмидной ДНК pTrcTREN-IL13, кодирующей полипептид со свойствами интерлейкина-13 человека с молекулярной массой 2,83 Md (4,579 т.п.о.), состоящей из:
ClaI/HindIII - фрагмента ДНК плазмиды pTrcTEGF длиной 4,232 т.п.о., включающего trc-промотор Е. coli, синтетический усилитель трансляции TREN гена 10 бактериофага Т7, терминатор транскрипции фага лямбда, ген bla β-лактамазы, определяющий устойчивость трансформированных плазмидой pTrcTREN-IL13 клеток к ампициллину, участок ori инициации репликации;
фланкированной сайтами рестрикции ClaI и HindIII оптимизированной для бактериальной экспрессии кДНК длиной 0,347 т.п.о., кодирующей аминокислотную последовательность зрелой формы интерлейкина-13 человека; и содержащей уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: NcoI - 266, EcoRI - 271, ClaI - 378, PstI - 554, HindIII - 725; а также за счет штамма бактерий Escherichia coli BL21(DE3)/pTrcTREN-IL13 - продуцента полипептида со свойствами интерлейкина-13 человека.
Рекомбинантная плазмидная ДНК pTrcTREN-IL13 кодирует индуцибельный синтез полипептида со свойствами интерлейкина-13 человека, а штамм Escherichia coli BL21(DE3)/pTrcTREN-IL13 обеспечивает синтез этого полипептида с уровнем экспрессии не ниже 15% суммарного клеточного белка. Индуцибельный высокий уровень синтеза целевого полипептида обеспечивается тем, что плазмида pTrcTREN-IL13 содержит trc-промотор Е. coli и синтетический усилитель трансляции гена 10 бактериофага Т7, а также оптимизацией 5'-концевой последовательности гена интерлейкина-13 человека.
На фиг.1 представлена физическая карта рекомбинантной плазмиды pTrcTREN-IL13; на фиг.2 - нуклеотидная последовательность кДНК интерлейкина-13 человека (с оптимизированным 5'-концом) с прилегающими регуляторными элементами; на фиг.3 - аминокислотная последовательность полипептида интерлейкина-13 человека, кодируемого рекомбинантной плазмидой pTrcTREN-IL13.
Особенностью предложенной плазмидной конструкции является то, что оптимизированная для бактериальной экспрессии кДНК зрелого интерлейкина-13 человека находится под контролем trc-промотора Е. coli, а для усиления трансляции используется синтетический усилитель трансляции (TREN), что в совокупности обеспечивает индуцибельный синтез целевого белка с надежной регуляцией и высоким выходом, достигаемым при малых концентрациях индуктора.
Оптимизация нуклеотидной последовательности 5'-конца гена ИЛ-13 достигается путем клонирования по сайтам узнавания рестриктаз ClaI и SacI олигонуклеотидного дуплекса, обеспечивающего введение 9 нуклеотидных замен с целью разрушения стабильной вторичной структуры мРНК, которая может препятствовать эффективной инициации трансляции [Худяков Ю.Е., Калинина Т.И., Неплюева B.C., Смирнов В.Д. Корреляция между эффективностью инициации трансляции и вторичной структурой мРНК у гибридного гена cro-lacIZ. Молекулярная биология, 1987, том 21, вып.6, стр.1504-1512]. Указанные замены являются синонимическими, т.е. не отражаются на аминокислотной последовательности целевого белка.
Для получения штамма-продуцента полипептида со структурой интерлейкина-13 человека трансформируют компетентные клетки Escherichia coli BL21(DE3) рекомбинантной плазмидой pTrcTREN-IL13.
Полученный штамм Escherichia coli BL21(DE3)/pTrcTREN-IL13 характеризуется следующими признаками.
Морфологические признаки. Клетки мелкие палочковидной формы, грамотрицательные, неспороносные, 1×3-5 мкм, подвижные.
Культуральные признаки. При росте на плотной среде LA колонии круглые, гладкие, полупрозрачные, блестящие, серые, край ровный, диаметр колоний 1-3 мм; консистенция пастообразная. Рост в жидкой среде LB характеризуется ровным помутнением с образованием легкого осадка.
Физико-биохимические признаки. Клетки растут при температуре 4-42°С при оптимуме рН 6,8-7,2. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (до 200 мкг/мл), обусловленную наличием в плазмиде гена бета-лактамазы.
Штамм Е. coli BL21(DE3)/pTrcTREN-IL13 обеспечивает индуцибельный синтез полипептида со свойствами интерлейкина-13 человека в количестве не менее 15% от суммарного клеточного белка при концентрации индуктора 0,05 мМ. В отличие от прототипа в данном штамме достигается в 3 раза более высокий выход целевого белка при использовании 1/5 от указанного в прототипе количества индуктора. Совокупность перечисленных свойств штамма Е. coli BL21(DE3)/pTrcTREN-IL13 обусловливает большую технологичность процесса получения рекомбинантного полипептида.
Изобретение иллюстрируют следующие примеры.
Пример 1. Конструирование промежуточной рекомбинантной плазмидной ДНК pUC18-IL13.
Кодирующую последовательность интерлейкина-13 для его экспрессии в бактериальных клетках получают путем сплайсинга in vitro экзонов гена hIL-13, синтезированных на матрице cos23 (космида, содержащая гены интерлейкина-4 и интерлейкина-13 (hIL-13) человека [Smirnov D.V., Smirnova M.G., Korobko V.G., Frolova E.I. Tandem arrangement of human genes for interleukin-4 and interleukin-13: resemblance in their organization. Gene, 1995, V.155, No.2, pp.277-81]) при помощи полимеразной цепной реакции (ПЦР) со специфическими олигонуклеотидными синтетическими праймерами, с использованием метода введения временных рестриктных сайтов.
Амплификацию кДНК экзонов гена интерлейкина-13 человека осуществляют следующим образом: к 0.5 мкг космидной ДНК cos23 прибавляют по 100 пмоль прямого и обратного праймеров (326 и 327 для первого (фрагмент 1), 328 и 329 для второго (фрагмент 2), 330 и 331 для третьего (фрагмент 3) и 332 и 333 для четвертого (фрагмент 4) экзонов гена, состав праймеров приведен в Таблице), 8 мкл смеси, содержащей 2,5 мМ каждого из дезоксинуклеозидтрифосфатов, 10 мкл 10-кратного буфера (100 мМ трис-HCl, рН 8,8, 500 мМ KCl, 15 мМ MgCl2), 2 ед. Taq ДНК-полимеразы (Fermentas, Литва) и деионизованную воду до 100 мкл. Полимеразную цепную реакцию (ПЦР) проводят в следующем режиме: денатурация - 1 мин, 94°С; отжиг - 30 сек, 52°С; достройка - 40 сек, 72°С; количество циклов - 35.
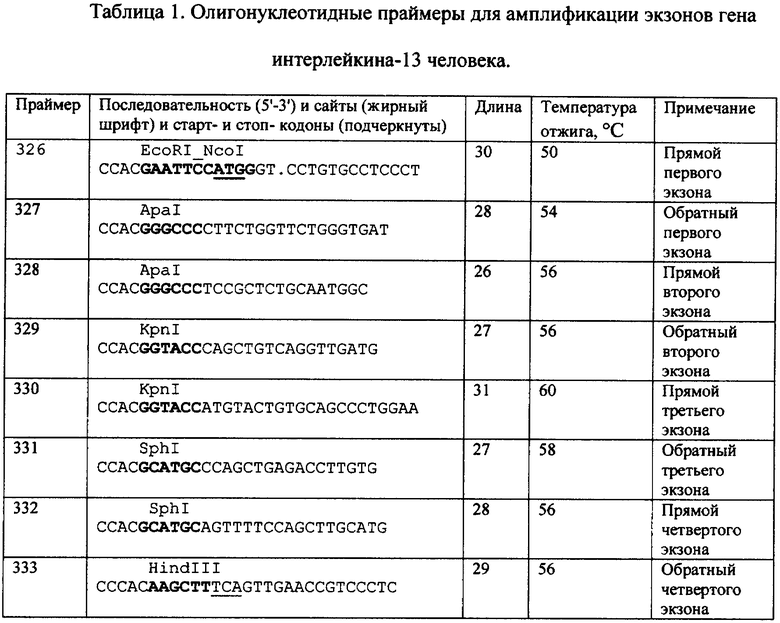
5 мкг плазмидной ДНК pUC18 (Fermentas. Литва: GenBank/EMBL accession number L09136) обрабатывают 10 ед. рестриктазы Sph I и 10 ед. рестриктазы HinDIII (Fermentas, Литва) 1,5 ч при 37°С в 24 мкл 0.5-кратного калий-глутаматного буфера KGB (1x; 100 мМ глутамат калия, 25 мМ Трис-ацетат (рН 7.6). 10 мМ Mg-ацетат, 0.5 мМ 2-меркаптоэтанол [McClelland M., Hanish J., Nelson M., Patel Y. KGB: a single buffer for all restriction endonucleases. Nucleic Acids Res., 1988, V.16, No.1, p.364; Hanish J., McClelland M. Activity of DNA modification and restriction enzymes in KGB, a potassium glutamate buffer. Gene Anal. Tech., 1988, V.5, No.5, pp.105-107]), и из полученного гидролизата выделяют линеаризованную плазмидную ДНК переносом на DEAE-мембрану NA-45 (Schleicher & Schuell, Германия) из 0,8%-ного агарозного геля.
2,5 мкг полученного в результате ПЦР фрагмента 4 длиной 0,128 т.п.о. обрабатывают 10 ед. рестриктазы Sph I и 10 ед. рестриктазы HinDIII (Fermentas, Литва) 1,5 ч при 37°С в 0.5-кратном буфере KGB, из полученного гидролизата выделяют фрагмент ДНК длиной 0,109 т.п.о. переносом на DEAE-мембрану NA-45 (Schleicher & Schuell, Германия) из 2%-ного агарозного геля.
0,5 мкг полученного фрагмента 4 длиной 0,109 т.п.о. и 0,1 мкг векторной части плазмиды pUC18 длиной 2,676 т.п.о. сшивают при помощи лигазной реакции в течение 4 ч при 12°С в 15 мкл раствора, содержащего 40 мМ Трис-HCl (рН 7,8), 10 мМ MgCl2, 10 мМ дитиотреитол, 0,5 мМ аденозинтрифосфата и 3 ед. Вейса Т4 ДНК-лигазы (Fermentas, Литва). 10 мкл реакционной смеси используют для трансформации 200 мкл компетентных клеток Escherichia coli XL-1 Blue ("Stratagene", США). 1/10 часть от общего количества клеток, использованных для трансформации, высевают на LB-агар, содержащий 100 мкг/мл ампициллина. В процессе рассева клеток на поверхность агара добавляют 100 мкл 0.1 М раствора ИПТГ и 20 мкл 4%-ного раствора 5-бромо-4-хлоро-3-индоксил-β-D-галактозида.
Конструирование промежуточной рекомбинантной плазмидной ДНК pUC-IV позволяет использовать принцип цветной селекции для поиска клонов, содержащих встраиваемый фрагмент. Из выросших белых клонов выделяют плазмидную ДНК и анализируют рестрикционным анализом. Отбирают плазмидные ДНК, содержащие нужный набор рестрикционных фрагментов. Определяют нуклеотидную последовательность отобранных ДНК и окончательно отбирают плазмидные ДНК, в которых нуклеотидная последовательность кДНК четвертого экзона интерлейкина-13 полностью соответствует данным, приведенным на Фиг.2.
Затем 5 мкг плазмидной ДНК pUC-IV обрабатывают 10 ед. рестриктазы Sph I и 10 ед. рестриктазы Kpnl (Fermentas, Литва) 1,5 ч при 37°С в 24 мкл 0.5-кратного калий-глутаматного буфера KGB, и из полученного гидролизата выделяют линеаризованную плазмидную ДНК переносом на DEAE-мембрану NA-45 (Schleicher & Schuell, Германия) из 0,8%-ного агарозного геля.
2,5 мкг полученного в результате ПЦР фрагмента 3 длиной 0,127 т.п.о. обрабатывают 10 ед. рестриктазы Sph I и 10 ед. рестриктазы KpnI (Fermentas, Литва) 1,5 ч при 37°С в 0.5-кратном буфере KGB, из полученного гидролизата выделяют фрагмент ДНК длиной 0,113 т.п.о. переносом на DEAE-мембрану NA-45 (Schleicher & Schuell, Германия) из 2%-ного агарозного геля.
0,5 мкг полученного фрагмента 4 длиной 0,113 т.п.о. и 0,1 мкг векторной части плазмиды pUC18-IV длиной 2,643 т.п.о. сшивают при помощи лигазной реакции в течение 4 ч при 12°С в 15 мкл раствора, содержащего 40 мМ триса-HCl (рН 7,8), 10 мМ MgCl2, 10 мМ дитиотреитола, 0,5 мМ аденозинтрифосфата и 3 ед. Вейса Т4 ДНК-лигазы (Fermentas, Литва). 10 мкл реакционной смеси используют для трансформации 200 мкл компетентных клеток Escherichia coli XL-1 Blue ("Stratagene", США). 1/10 часть от общего количества клеток, использованных для трансформации, высевают на LB-агар, содержащий 100 мкг/мл ампициллина.
Из выросших клонов выделяют плазмидную ДНК и анализируют рестрикционным анализом. Отбирают плазмидные ДНК, содержащие нужный набор рестрикционных фрагментов. Определяют нуклеотидную последовательность отобранных клонов промежуточной рекомбинантной плазмидной ДНК pUC-III-IV и окончательно отбирают плазмидные ДНК, в которых нуклеотидная последовательность кДНК третьего и четвертого экзонов интерлейкина-13 полностью соответствует данным, приведенным на Фиг.2.
По 2,5 мкг полученных в результате ПЦР фрагментов 1 и 2 (длиной 0,096 и 0,067 т.п.о. обрабатывают 10 ед. рестриктазы Ара I (Fermentas, Литва) 1,5 ч при 37°С в 24 мкл 0.5-кратного калий-глутаматного буфера КОВ, из полученных гидролизатов выделяют фрагменты ДНК длиной 0,091 и 0,058 т.п.о. переносом на DEAE - мембрану NA-45 (Schleicher & Schuell, Германия) из 2%-ного агарозного геля и сшивают при помощи лигазной реакции в течение 4 ч при 12°С в 15 мкл раствора, содержащего 40 мМ Трис-HCl (рН 7,8), 10 мМ MgCl2, 10 мМ дитиотреитола, 0,5 мМ аденозинтрифосфата и 3 ед. Вейса Т4 ДНК-лигазы (Fermentas, Литва). После этого с целью обогащения реакционной смеси полученной кДНК первого и второго экзонов гена интерлейкина-13 человека осуществляют амплификацию следующим образом: к 2 мкл лигазной смеси прибавляют по 100 пмоль прямого и обратного праймеров (326 и 329, состав праймеров см. Таблица), 8 мкл смеси, содержащей 2,5 мМ каждого из дезоксинуклеозидтрифосфатов, 10 мкл 10-кратного буфера (100 мМ трис-HCl, рН 8,8, 500 мМ KCl, 15 мМ MgCl2), 2 ед. Taq ДНК-полимеразы (Fermentas, Литва) и воду до 100 мкл. Полимеразную цепную реакцию (ПЦР) проводят в следующем режиме: денатурация - 1 мин, 94°С; отжиг - 30 сек, 52°С; достройка - 40 сек, 72°С; количество циклов - 35. Из полученной смеси продуктов реакции выделяют фрагмент ДНК длиной 0,149 т.п.о. переносом на DEAE-мембрану NA-45 (Schleicher & Schuell, Германия) из 1,5%-ного агарозного геля. 2,5 мкг полученного фрагмента 1-2 обрабатывают 10 ед. рестриктазы EcoRI и 10 ед. рестриктазы KpnI (Fermentas, Литва) 1,5 ч при 37°С в 24 мкл 0.5-кратного калий-глутаматного буфера КОВ, из полученного гидролизата выделяют фрагмент ДНК длиной 0,139 т.п.о. переносом на DEAE-мембрану NA-45 (Schleicher & Schuell, Германия) из 1,5%-ного агарозного геля.
5 мкг рекомбинантной плазмидной ДНК pUC-III-IV обрабатывают 10 ед. рестриктазы EcoRI и 10 ед. рестриктазы KpnI (Fermentas, Литва) 1,5 ч при 37°С в 24 мкл 0.5-кратного калий-глутаматного буфера KGB, и из полученного гидролизата выделяют линеаризованную плазмидную ДНК переносом на DEAE-мембрану NA-45 (Schleicher & Schuell, Германия) из 0,8%-ного агарозного геля.
0,5 мкг полученного фрагмента 1-2 длиной 0,139 т.п.о. и 0,1 мкг векторной части плазмиды pUC18-III-IV длиной 2,865 т.п.о. сшивают при помощи лигазной реакции в течение 4 ч при 12°С в 15 мкл раствора, содержащего 40 мМ триса-HCl (рН 7,8), 10 мМ MgCl2, 10 мМ дитиотреитола, 0,5 мМ аденозинтрифосфата и 3 ед. Вейса Т4 ДНК-лигазы (Fermentas, Литва). 10 мкл реакционной смеси используют для трансформации 200 мкл компетентных клеток Escherichia coli XL-1 Blue ("Stratagene", США). 1/10 часть от общего количества клеток, использованных для трансформации, высевают на LB-агар, содержащий 100 мкг/мл ампициллина.
Из выросших клонов выделяют плазмидную ДНК и анализируют рестрикционным анализом. Отбирают плазмидные ДНК, содержащие нужный набор рестрикционных фрагментов. Определяют нуклеотидную последовательность плазмидной ДНК из отобранных клонов и окончательно отбирают плазмидные ДНК (промежуточная рекомбинантная плазмида pUC-I-IV), в которых нуклеотидная последовательность кДНК всех четырех экзонов интерлейкина-13, разделенных не входящими в кодирующую последовательность сайтами клонирования, полностью соответствует данным, приведенным на Фиг.2.
Использованные для клонирования экзонов сайты узнавания рестриктаз ApaI, KpnI и SphI, при обработке соответствующими рестриктазами образующие 3'-концы, удаляют с помощью фрагмента Кленова в присутствии дезоксирибонуклеозидтрифосфатов.
Эксперимент проводят следующим образом. Плазмидную ДНК pUC-I-IV обрабатывают соответствующей рестриктазой при 37°С в течение 45 минут в 0.5-кратном калий-глутаматном буфере KGB. После этого добавляют буфер KGB до однократного, смесь дезоксирибонуклеозидтрифосфатов до конечной концентрации 0.1 мМ каждого и 1 единицу активности фрагмента Кленова (Fermentas, Литва). Инкубируют при 37°С в течение 10 минут, после чего инактивируют фрагмент Кленова прогреванием при 70°С в течение 10 минут. Далее добавляют АТР до концентрации 2 мМ, реакционную смесь разбавляют в 2 раза для достижения кратности 0.5 буфера KGB и 1 мМ АТР, добавляют 1 единицу активности лигазы фага Т4 и инкубируют при 12°С в течение 2 часов. После этого лигазу инактивируют прогреванием смеси при 70°С в течение 10 минут, а затем добавляют 1 единицу активности рестриктазы, сайт которой удаляется в каждом случае. Инкубируют при 37°С 20 минут для отбраковывания плазмид с неудаленным сайтом, затем аликвоту реакционной смеси используют для трансформации бактериальных клеток. Отбор клонов ведут по отсутствию удаляемого сайта. Корректность удаления проверяют секвенированием по методу Сэнгера.
Соответствие полученной кодирующей последовательности гена интерлейкина-13 человека в плазмиде pUC18-IL13 литературным данным доказывают секвенированием фрагмента по двум цепям в области встроенной кДНК.
Пример 2. Конструирование рекомбинантной плазмидной ДНК pTrcTREN-IL13.
5 мкг плазмидной ДНК pUC18-IL13 обрабатывают последовательно рестриктазами SacI и HinDIII (Fermentas, Литва) и из полученного гидролизата выделяют в 1%-ном геле легкоплавкой агарозы фрагмент длиной 305 т.п.о., содержащий ген ИЛ-13.
5 мкг плазмидной ДНК pTrcTEGF обрабатывают последовательно рестриктазами ClaI и HinDIII (Fermentas, Литва) в течение 2 ч при 37°С в 50 мкл буферного раствора, содержащего 33 мМ трис-ацетата (рН 7,9), 10 мМ ацетата магния, 66 мМ ацетата калия, и из полученного гидролизата выделяют в 1%-ном геле легкоплавкой агарозы векторную ДНК длиной 4,232 т.п.о.
0,5 мкг полученного фрагмента и 0,1 мкг векторной ДНК соединяют при помощи лигазной реакции в 20 мкл буфера для лигирования (Fermentas), содержащего 2 ед. Т4 ДНК-лигазы (Fermentas, Литва) с 50-кратным молярным избытком олигонуклеотидного дуплекса:
CGATATGGGTCCAGTTCCACCATCTACTGCATTGAGAGAGCT
TATACCCAGGTCAAGGTGGTAGATGACGTAACTCTC
10 мкл реакционной смеси используют для трансформации 100 мкл компетентных клеток XL-1 Blue. 1/10 клеток, использованных для трансформации, высевают на LB-агар, содержащий 75 мкг/мл ампициллина. Из выросших клонов выделяют целевую плазмидную ДНК pTrcTREN-IL13 и анализируют ее путем обработки набором эндонуклеаз рестрикции HaeIII HinDIII, ClaI, SacI и PstI с последующим электрофоретическим анализом длин рестрикционных фрагментов в 5% полиакриламидном геле.
Окончательно структуру рекомбинантной ДНК pTrcTREN-IL13 подтверждают определением нуклеотидной последовательности в области встроенного фрагмента, содержащего ген интерлейкина-13 человека с оптимизированной 5'-концевой последовательностью.
Пример 3. Получение и определение продуктивности штамма-продуцента полипептида со свойствами интерлейкина-13 человека.
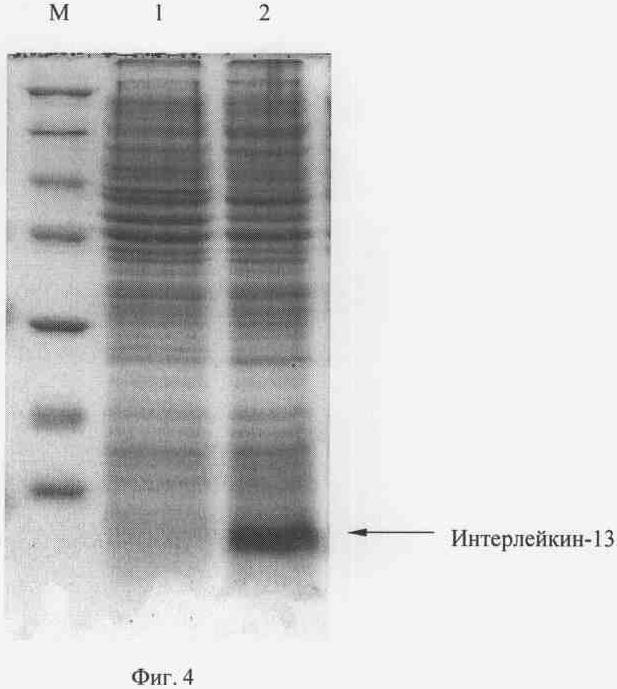
Рекомбинантной плазмидной ДНК pTrcTREN-IL13 трансформируют компетентные клетки Escherichia coli BL21(DE3) (Novagen) и получают штамм-продуцент полипептида со свойствами интерлейкина-13 человека. Клетки Е. coli В L21(DE3)/pTrcTREN-IL13 выращивают при 37°С в 20 мл жидкой среды LB, содержащей 125 мкг/мл ампициллина, в течение 16 ч на качалке при 175 об/мин. Полученную ночную культуру в объеме 200 мкл переносят в 10 мл жидкой среды LB (разбавление до оптической плотности 0.1-0.15 при длине волны 560 нм), содержащей 125 мкг/мл ампициллина, и выращивают до оптической плотности 0,7 (длина волны 560 нм) при 37°С при 185 об/мин. Добавляют ИПТГ до конечной концентрации 0,05 и 1 мМ, после чего клетки выращивают в течение 3 часов. Отбирают пробу культуры в количестве 1 оптическая единица (длина волны 560 нм) и центрифугируют 5 мин при скорости 6000 об/мин. Осажденные клетки суспендируют в 100 мкл буфера, содержащего 125 мМ трис-HCl, рН 6,8, 20% глицерин, 3% додецилсульфат натрия, 3% меркаптоэтанол, 0,005% бромфеноловый синий, инкубируют 10 мин в кипящей водяной бане, образцы объемом 10 мкл анализируют электрофорезом в 15% полиакриламидном геле с додецилсульфатом натрия. Гель окрашивают Кумасси R-250 (фиг.4), сканируют и рассчитывают процентное содержание рекомбинантного белка в лизатах с использованием программы Scion Image (Scion Corp., США). По данным сканирования полипептид интерлейкин-13 человека составляет 15% от общего клеточного белка при индукции 0,05 мМ ИПТГ. На фиг.4 представлена электрофореграмма лизатов клеток штамма-реципиента Е. coli BL21(DE3) (дорожка 1), штамма-продуцента Е. coli BL21(DE3)/pTrcTREN-IL13 (дорожка 2) в 15%-ном полиакриламидном геле (М - белковые маркеры молекулярной массы; стрелкой указан полипептид ИЛ-13).
Пример 4. Выделение и характеризация рекомбинантного полипептида со свойствами интерлейкина-13 человека.
Проводят индукцию биосинтеза интерлейкина-13 в клетках штамма-продуцента Е. coli BL21(DE3)/pTrcTREN-IL13 ИПТГ (конечная концентрация 0,05 мМ) в течение 3 ч. Клетки центрифугируют.
1 г влажной биомассы индуцированных клеток ресуспендируют в 5 мл буфера А (50 мМ Трис-HCl, рН 8.0, 1 мМ EDTA, 100 мМ NaCl), добавляют раствор лизоцима до конечной концентрации 1 мг/мл и инкубируют во льду 20 минут, после чего разрушают клетки обработкой в ультразвуковом дезинтеграторе УЗДН-2Т, не допуская нагрева выше 10°С. Затем добавляют MgCl2 до 5 мМ и ДНКазу до конечной концентрации 10 мкг/мл, инкубируют 30 минут при 25°С. Полученную суспензию центрифугируют, осадок промывают буфером А, содержащим 0.1% Тритон Х-100 и 2М мочевину (2 раза по 20 мл), и растворяют в 2 мл буфера В (50 мМ Na2HPO4, рН 6.0, 6 М гуанидин-HCl, 1 мМ ЭДТА, 20 мМ DTT) в течение 1 ч при комнатной температуре при перемешивании. Раствор центрифугируют, супернатант пропускают через мини-колонку с Н-γ-гелем (0,5 мл) для избавления от гидрофобных примесей, после чего наносят на предварительно уравновешенную буфером С (50 мМ Na2HPO4, рН 8.0, 4 М гуанидин-HCl, 1 М NaCl, 1 мМ ЭДТА, 50 мМ β-МЭ) колонку с Sephacryl S-200 и проводят гель-фильтрацию в этом же буфере со скоростью 2,5 мл/ч. Объединенные фракции, имеющие по данным белкового электрофореза чистоту более 90%, ренатурируют разбавлением в 4 раза буфером А, содержащим 1М глицин и 10 мМ окисленный глутатион. Окончательное освобождение от денатурирующих агентов достигается трехкратным диализом против буфера D (25 мМ Na2HPO4, рН 7,5, 1 мМ EDTA, 100 мМ NaCl), после чего раствор белка концентрируют с использованием метода ультрафильтрации через мембрану YM3 в ячейке Amicon.
Средний выход очищенного таким образом ИЛ-13 составляет около 1 мг из 1 г биомассы, что соответствует 1 мг белка из 100 мг лиофилизированной биомассы, или 5 мг из 1 л бактериальной культуры.
N-концевую аминокислотную последовательность определяют на секвенаторе 477А и ФТГ анализаторе 120А фирмы "Applied Biosystems", США. Препарат рекомбинантного интерлейкина-13 человека имеет следующую структуру N-конца молекулы: Met-Gly-Pro-Val-Pro-Pro-Ser-Thr-Ala-Leu..., т.е. соответствует структуре N-конца природного интерлейкина-13 человека с дополнительным метиониновым остатком, не влияющим на его биологические свойства.
Анализ вторичной структуры полипептида интерлейкина-13 осуществляют методом кругового дихроизма на приборе J500C фирмы JASCO (Япония). По данным анализа, доля аминокислотных остатков, входящих в состав α-спиральных участков составляет 0.47±5.0*10-3, β-листа - 0.05±9.6*10-3, нерегулярной структуры 0.47±8.5*10-3, что в пределах погрешности опыта совпадает с данными анализа ЯМР растворимой формы интерлейкина-13 человека [Eisenmesser E.Z., Horita D.A., Altieri A.S., Byrd R.A. Solution structure ofinterleukin-13 and insights into receptor engagement. J. Mol. Biol., 2001, Vol.310, pp.231-241].
Таким образом, заявляемое техническое решение позволяет получить полипептид со структурой и свойствами, идентичными структуре и свойствам природного интерлейкина-13 человека; биосинтез полипептида индуцируется добавлением ИПТГ до конечной концентрации всего 0,05 мМ, и при этом уровень его синтеза составляет не менее 15% от суммарного клеточного белка за счет того, что ген интерлейкина-13 оптимизирован для бактериальной экспрессии и находится под контролем trc-промотора Е. coli, а трансляция белка усиливается за счет синтетического усилителя трансляции. Все это позволяет значительно повысить технологичность и экономичность процесса получения рекомбинантного интерлейкина-13 за счет значительного снижения расхода индуктора при одновременном увеличении выхода целевого продукта в 3 раза.


Изобретение относится к области генетической инженерии и может быть использовано для получения интерлейкина-13 (ИЛ-13) человека. На основании плазмиды pTrcTEGF и оптимизированной для бактериальной экспрессии кДНК, кодирующей зрелую форму интерлейкина-13 человека, сконструирована рекомбинантная плазмидная ДНК pTrcTREN-IL13. Эта плазмидная ДНК обеспечивает биосинтез полипептида со свойствами интерлейкина-13 человека в клетках Е. coli. В результате трансформации штамма бактерий Escherichia coli BL21(DE3) данной плазмидой получен штамм E. coli BL21(DE3)/pTrcTREN-IL13/pTrcTREN-IL13, продуцирующий полипептид со свойствами интерлейкина-13 человека. Применение изобретения обеспечивает увеличение уровня гетерологичной экспрессии полипептида со свойствами интерлейкина-13 человека при пониженном количестве индуктора. 2 н.п. ф-лы, 4 ил., 1 табл.
| J | |||
| Biol | |||
| Chem., 1999, v.272, №.42, p.29944-29950 | |||
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PTRCTE-LEP, КОДИРУЮЩАЯ ПОЛИПЕПТИД СО СВОЙСТВАМИ ЛЕПТИНА ЧЕЛОВЕКА, И ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ПОЛИПЕПТИДА СО СВОЙСТВАМИ ЛЕПТИНА ЧЕЛОВЕКА | 2000 |
|
RU2185438C2 |
| РЫБЧИН В.Н | |||
| Основы генетической инженерии | |||
| - СПб.: СПбГТУ, 2002, с.321-323 | |||
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PGGF 8, КОДИРУЮЩАЯ ПОЛИПЕПТИД СО СВОЙСТВАМИ ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА И ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ПОЛИПЕПТИДА СО СВОЙСТВАМИ ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА | 1996 |
|
RU2113483C1 |
Авторы
Даты
2008-09-20—Публикация
2006-11-21—Подача