Данное изобретение относится к полипептиду, обладающему активностью, индуцирующей защиту против биотического стресса у растений, кодирующей его нуклеотидной последовательности, микроорганизму, композициям и способам. Более конкретно, данное изобретение относится к полипептиду субтилизину, имеющему происхождение из Acremonium stnctum, где такой полипептид обладает элиситорной активностью. Согласно конкретному воплощению изобретения полипептид кодируется нуклеотидной последовательностью SEQ ID NO: 1 или последовательностями, по меньшей мере на 90% гомологичными ей, и имеет аминокислотную последовательность SEQ ID NO: 2 или последовательности, по меньшей мере на 90% гомологичные ей, где такой полипептид обладает элиситорной активностью.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Земляника представляет собой фрукт, обладающий замечательными характеристиками, который можно употреблять в пищу свежим, высушенным, замороженным или консервированным. С экономической точки зрения земляника представляет собой очень важную культуру, учитывая используемое количество ресурсов и технологий, не говоря уже о дополнительном значении, которое может быть приобретено за счет того, что можно обеспечить ее промышленное производство и экспорт.
Одной из главных проблем производства земляники является большое число заболеваний и вредителей (биотического стресса), которые поражают культурные сорта земляники, что приводит к ограничению продукции и качества плодов. Главной причиной биотического стресса для земляники являются грибковые заболевания.
Существует много заболеваний, наиболее часто встречающимися из которых являются следующие.
Корневая гниль и гниль корневой шейки: несколько заболеваний, вызываемых грибами родов Phytophthora, Rhizoctonia и Colletotrichum (антракноз).
Заболевания листьев: Xanthomonas fragariae (угловатая пятнистость листьев); Gnomonia comari (некорневая пятнистость); Mycosphaerella fragariae или Ramularia (пятнистость листьев); Diplocarpon earliana (ожог или пятнистость листьев); Dendrophoma/Phomopsis obscurans (пятнистость); Sphaerotheca maculans (мучнистая роса); Colletotrichum spp. (антракноз).
Заболевания цветков и плодов: Rhizopus stolonifer (гниль); Botrytis cinerea (серая плесень); Colletotrichum spp. (антракноз).
Антракноз земляники, вызываемый грибковым комплексом Colletotrichum, определенно является заболеванием, которое оказывает наиболее неблагоприятное воздействие на культуру, поражая почти каждый орган растения и приводя к большим потерям как в продукции плодов, так и в теплицах (выгонка рассады), в основном в тропических и субтропических агроклиматических регионах.
В результате широкого разнообразия патогенов (по меньшей мере три различных вида) почти все разновидности земляники чувствительны к антракнозу. С точки зрения генетического улучшения культуры сложно объединить в одном сорте гены, придающие определенные характеристики в отношении продукции, тепличного разведения и устойчивости к заболеваниям, и еще сложнее к заболеванию, вызываемому различными патогенами, такому как антракноз.
Управление культурой вместе с химическими обработками способствуют уменьшению заболеваемости антракнозом. Тем не менее, чрезмерное использование агрохимикатов оказывает сильное воздействие на деградацию экосистемы и на здоровье сельскохозяйственных рабочих, а также на загрязнение воды и на содержание токсичных остатков в пище, не говоря уже о том, что способствует возникновению устойчивых к фунгицидам штаммов грибов и имеет непосредственное влияние на устранение естественных врагов вредителей. Избыток фунгицидных остатков в плоде может вызывать серьезные проблемы при продвижении на рынок или экспорте земляники из-за несоответствия стандартам качества, предъявляемым местными органами управления или рынками импорта.
В настоящее время существует основное всеобщее соглашение относительно содействия, в целом, требующего ответственного отношения или устойчивого сельского хозяйства посредством развития производственных систем, интегрирующих агрономические методы, оказывающие низкое влияние на окружающую среду (интегрированное производство). Среди различных биологических подходов, охватываемых в рамках биотехнологии, включено использование сортов с увеличенной устойчивостью (в результате обычного или основанного на молекулярной биотехнологии генетического улучшения), а также средств биологического контроля (ВСА).
ВСА могут (1) действовать непосредственно на патоген, как в случае "антагонистических микроорганизмов"; (2) оказывать непрямое действие посредством взаимодействия в растении-хозяине, обеспечивая защиту против заболевания, путем: передачи гиповирулентности вирулентным штаммам, таким образом, нейтрализуя такое заболевание или (3) путем активации защитных механизмов растения, известных как "индуцированная устойчивость" или "предварительная иммунизация".
Растения защищают себя от потенциальных инвазирующих патогенов либо через морфологические структуры, действующие как физические барьеры, которые подавляют проникновение и развитие патогена, либо путем биохимических реакций, происходящих в различных тканях растений, продуцируя токсичные для патогена вещества или создавая условия, которые подавляют проникновение и развитие микроорганизма в хозяине. Такая защита может быть либо представлена частью растения, представляющей неспецифическую защиту против широкого диапазона микроорганизмов, либо индуцирована в присутствии поражающего патогена. В последнем случае растения, как и другие живые существа, активируют свои собственные системы защиты, когда они распознают молекулу, имеющую происхождение из патогенного микроорганизма, или когда они обнаруживают любую молекулу, образующуюся во время инвазии патогена, любую из которых называют "индуктором" или "элиситором" защиты.
Во взаимодействиях растение/патоген индуцирующие молекулы оповещают о присутствии инвазирующего патогена, когда патоген распознается растением-хозяином (Nürnberger, 1999. Cell Mol. Life Sci. 55, 167-182). При раннем распознавании элиситоров поражающего патогена растение производит быструю активацию своих механизмов защиты, которые блокируют инфекцию, останавливая продвижение патогена. В этом случае утверждают, что взаимодействие растение/патоген несовместимо, поскольку не приводит в результате к заболеванию, фитопатогенный штамм определяют как невирулентный (Keen, 1990. Annu. Rev. Genet. 24, 447-463). Наоборот, у растения развивается заболевание тогда, когда оно неспособно обнаружить агрессию патогена или когда оно обнаруживает заболевание (его элиситоры) поздно, и, несмотря на запуск некоторых механизмов защиты, они не достаточны для своевременной остановки инвазии, таким образом, утверждают, что взаимодействие растение/патоген является совместимым, и штамм считают вирулентным.
Во время грибковой инфекции растения могут распознавать агрессор при помощи ряда элиситоров. Некоторые из индуцирующих молекул имеют происхождение из патогена (несобственные факторы) и могут присутствовать на грибковой поверхности (например, хитин и глюкановые фрагменты) или секретироваться патогеном (например, белки авирулентности); в то время как другие молекулы (известные как собственные факторы) продуцируются растением во время грибковой инвазии, такие как в случае фрагментов стенки растительной клетки (например, олигогалактуронаты, хитин, гептаглюканы, моносилированные гликопептиды), высвобождающихся из полимерных предшественников под действием гидролитических ферментов инвазирующего патогена (Кподде, 1996. The Plant Cell 8, 1711-1722). Таким образом, элиситоры могут быть классифицированы как предварительно образованные соединения, которые присутствуют на поверхности патогена, или как индуцируемые, так как они синтезируются при взаимодействии между патогеном и растением-хозяином.
Как правило, распознавание патогена и последующая активация резистентных ответов на заболевание у растений могут происходить на уровне видов (например, видовая устойчивость или устойчивость растения-нехозяина, или сортовая неспецифическая устойчивость хозяина, или врожденный иммунитет) или на уровне генотипа (сортовая специфическая устойчивость хозяина). Специфическая устойчивость сорта проявляется у заданного сорта против одного или сниженного числа патогенных штаммов и представляет то, что известно как ответ типа "ген к гену", генетически определяемый комплементарной парой, кодируемой геном авирулентности (Avr) патогена, и продуктом гена устойчивости (R) растения.
Таким образом, когда белок AVR непосредственно или опосредованно распознается устойчивым растением-хозяином, он действует в качестве "специфического элиситора" защиты и может быть обнаружен системой контроля растения. Тем не менее, врожденный иммунитет представляет собой преобладающую форму устойчивости у всех видов растений. В этом ответе значительное разнообразие продуктов, ассоциированных с так называемыми "общими элиситорными" микроорганизмами, вызывает защитный ответ у множества видов растений и не зависит от конкретного сорта. Термин "патоген-ассоциированный молекулярный паттерн" (РАМР) относится к любой молекуле, способной активировать систему защиты растения, и он может быть обнаружен у широкого диапазона патогенов (Bent and Mackey, 2007. Annu. Rev. Phytopathol. 45, 399-436). Kamoun (Kamoun, 2006. Annu. Rev. Phytopathol. 44, 41-60) сообщают об элиситорах, продуцируемых патогенными для растений грибами оомицетами, тогда как Stergiopoulos et al. (Stergiopoulos and de Wit, 2009. Annu. Rev. Phytopathol. 47, 233-263) описывают известные на данный момент времени белки грибковой авирулентности.
После распознавания элиситора идентифицирован ряд цитологических сдвигов и биохимических ответов в растительных клетках. С биохимической точки зрения можно сказать, что индуктор взаимодействует с одним рецептором на клеточной поверхности, который обнаруживает внеклеточный сигнал и преобразует его во внутриклеточные сигналы, трансдукция которых предполагает (а) ионные трансмембранные жидкости (т.е. вход Ca2+, H+ и Cl-); (б) продукцию активных форм кислорода, таких как H2O2, O2- и т.д., токсичных для клеток, производя "окислительный взрыв"; (в) продукцию окиси азота (NO); г) фосфорилирование/дефосфорилирование митоген-активируемых протеинкиназ (MAPK) и других кальций-зависимых протеинкиназ (CDPK).
Эти сигналы дают начало ранним защитным ответам в области инфицирования и поздним защитным ответам в удаленных участках растения.
Локальные защитные ответы на элиситоры подразумевают регуляцию нескольких генов, которые вносят вклад в формирование защитных физиологических условий против инвазирующих патогенов. В области инфицирования такие ответы включают генерирование активных форм кислорода (ROS), быструю аккумуляцию нескольких ферментов и метаболитов, таких как, например,, белки, вовлеченные в продукцию сигналов, таких как салициловая кислота (SA), жасмонаты и/или этилен, и ферменты, связанные с метаболизмом фенилпропаноиднов (PAL: фениламмоний-лиаза, CHS: халконсинтаза и т.д.) и биосинтезом фитоалексинов, низкомолекулярные вторичные метаболиты, обладающие антимикробной активностью, и так называемые PR-белки (белки, связанные с патогенезом). Такая защита ограничена участком, окружающим область проникновения патогена.
В некоторых случаях клетки в области инфицирования могут претерпевать процесс клеточной гибели, который обычно становится видимым как гиперчувствительный ответ. Гиперчувствительный ответ (HR) заключается в быстрой и локализованной гибели клеток хозяев, инвазированных патогеном, посредством явления некроза или запрограммированной клеточной гибели (PCD). Это явление ассоциировано с утолщением в клеточной стенке пораженных клеток путем локальных лигнификаций и аккумуляции каллозы, перекрестного связывания богатых гидроксипролином гликопротеинов (HRGP), активации ферментов, вовлеченных в перекрестное связывание молекул в качестве стратегии растения ограничить колонизацию областями инфицирования.
Салициловая кислота (SA) представляет собой растительный гормон, который наряду с другими функциями ингибирует каталазу, усугубляющую окислительный стресс, а также координирует экспрессию подгруппы PR-белков, которых разделяют на три класса: хитиназы, глюканазы и хитин-связывающие белки. В заключение, для того, чтобы убить или успешно остановить инвазирующий микроорганизм, требуется специальная и точно выверенная по времени координация индуцированных защитных ответов.
Локальная инфекция часто приводит к индукции похожих защитных ответов в неинфицированных растительных тканях, таким образом приводя к устойчивости к последующим инфекциям (Kuć, 1982. BioScience 32, 854-860). Данная линия защиты приводит к аккумуляции белков и гидролитических ферментов по всему организму, таким образом, она названа "системной" (Hunt and Ryals, 1996. Crit. Rev. Plant Sci. 15, 583-606). Она обычно обеспечивает устойчивость к первичному индуцирующему агенту (вирулентный патовар), а также к широкому диапазону других грибковых, бактериальных и вирусных патогенов (иммунизация). Когда данный защитный ответ опосредован действием авирулентного патогена, тогда его называют "системной приобретенной устойчивостью" (SAR). Кроме того, системная устойчивость также может быть запущена ризосферным непатогенным микроорганизмом, и в этом случае ее называют "индуцированной системной устойчивостью" (ISR); или она может быть индуцирована повреждениями (механическим повреждением).
Различные системные защитные ответы, ассоциированные с инфицированиями патогеном, включают индукцию нескольких генов PR, аккумуляцию фитоалексинов, индукцию ROS и микро-HR.
Вышеописанное предполагает, что индукция системного защитного ответа широкого спектра (или SAR, или ISR) может быть использована в качестве стратегии "иммунизации" для того, чтобы предупредить или снизить заболевания урожая (индуцированная устойчивость или IR). Для земляники применение IR предложено для того, чтобы контролировать Phytophthora spp.(Eikemo et al., 2003. Plant Dis. 87, 345-350) и Botrytis (Adikaram et al., 2002. Australasian Plant Pathology 31(3), 223-229). Данное явление защиты растения-хозяина, которое первоначально было названо как "перекрестная защита", было использовано в качестве средства управления вызванными вирусом заболеваниями путем предварительной инокуляции ослабленными штаммами того же самого вируса, приводя, таким образом, к тому, что вирус, инокулированный первым, предупреждал развитие более позднего вируса. Затем стало ясно, что также возможно увеличить устойчивость к труднопреодолимым штаммам грибкового патогена путем предварительной инокуляции авирулентным генотипом тех же самых видов грибов или путем нанесения ризосферного непатогенного микроорганизма; как изложено выше, указанное последним явление было названо ISR в противоположность SAR.
В отличие от ответа, индуцированного ризосферным непатогенным микроорганизмом, реализация SAR-подобной системы в полевых условиях, которая подразумевает непосредственное инфицирование растения живым патогенным микроорганизмом, невозможна, поскольку она вызывает серьезные проблемы, среди которых стоит упомянуть, что возможно, что авирулентный штамм, используемый для защиты сорта, может вызвать заболевание в других восприимчивых генотипах (Fulton, 1986. Annu. Rev. Phytopathol. 24, 67-81). Биотехнологический вариант решения этой проблемы и индукции устойчивости включает инактивацию патогена и нанесение фрагментов различных патогенных культур (непатогенных экстрактов), которые сохраняют активность индукции защиты и в то же самое время утрачивают патогенный потенциал, то есть использование фракций инактивированного патогена, содержащих агент(ы), индуцирующий(ие) защиту. Более глубокие знания об указанной системе дадут возможность непосредственного нанесения элиситорных молекул, происходящих из взаимодействия растение/авирулентный патоген, способных обеспечить устойчивость против заболеваний путем индукции системного защитного ответа широкого спектра (SAR-элиситор), для экспрессии такого гена авирулентности патогена в трансгенных растениях.
В настоящее время известно очень немного элиситоров, которые могут эффективно индуцировать устойчивость. Для земляники зарегистрированные биопестициды с элиситорным действием включают белки гарпин (товарный знак: MESSENGER®), альтернатива использованию метилбромида, который является эффективным против бактериальной пятнистости листьев, бактериальной тристецы, бактериальной пятнистости, некоторых грибковых заболеваний; и хитозан (товарный знак: ELEXA-4®), который является активным против галовых тлей и пылевидной милдью и серой плесени. Тем не менее, до сих пор не был предложен какой-либо тип метода биологического управления для контроля антракноза (Colletotrichum spp.) у земляники.
В свете изложенного выше, испытывая недостаток решений относительно обеспечения новых способов лечения и/или предупреждения заболевания, авторы изобретения идентифицировали в данной заявке новый белок, выделяемый в среду Acremonium strictum, и очистили его до гомогенного состояния. Данный белок действует в качестве фактора авирулентности (элиситор), запуская различные защитные механизмы, иммунизирующие растение, таким образом делая его устойчивым к заболеваниям, таким как антракноз, вызываемый Colletotrichum spp.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Предложен полипептид субтилизин, обладающий элиситорной (индуцирующей) активностью защиты против биотического стресса у растений, имеющий происхождение из Acremonium strictum, например, Acremonium strictum SS71, депонированного в немецком центре депонирования DSMZ под номером доступа DSM 24396, и обладающий элиситорной активностью. Полипептид кодируется нуклеотидной последовательностью SEQ ID NO: 1 или последовательностями, по меньшей мере на 90% гомологичными ей, и имеет аминокислотную последовательность SEQ ID NO: 2 или последовательности, по меньшей мере на 90% гомологичные ей, где такой полипептид обладает элиситорной активностью.
Предложена нуклеотидная последовательность, кодирующая элиситорный полипептид, представленный в последовательности SEQ ID NO: 1 или последовательностях, по меньшей мере на 90% гомологичных ей.
Предложен микроорганизм, продуцирующий элиситорный полипептид, представляющий собой штамм Acremonium strictum SS71, депонированный в немецком центре депонирования DSMZ под номером доступа DSM 24396.
Предложена композиция, полезная для индукции устойчивости к биотическим факторам у растений, содержащая конидии Acremonium strictum и эксципиенты, например, содержащая от 1×103 до 1×108 конидий/мл. Предпочтительно, композиция содержит конидии штамма Acremonium strictum SS71, депонированного в немецком центре депонирования DSMZ под номером доступа DSM 24396.
Предложена композиция, полезная для индукции устойчивости к биотическим факторам у растений, содержащая Acremonium strictum. Предпочтительно, композиция содержит экстракт штамма Acremonium strictum SS71, депонированного в немецком центре депонирования DSMZ под номером доступа DSM 24396. Экстракт может представлять собой бесклеточный супернатант или конидиальный экстракт.
Предложена композиция, содержащая от 2,5 до 15 мкг/мл элиситорного полипептида.
Предложен способ получения и очистки элиситорного полипептида, включающий следующие стадии:
(а) культивирование Acremonium strictum, предпочтительно Acremonium strictum SS71 под номером доступа DSM 24396;
(б) извлечение супернатанта;
(в) концентрирование супернатанта и
(г) ультрафильтрацию продукта, полученного на предшествующей стадии.
Предложен способ индукции устойчивости к патогенам у растений, включающий нанесение на такое растение композиции, имеющей происхождение из Acremonium strictum, например, штамма Acremonium strictum SS71 под номером доступа DSM 24396. Композиция может представлять собой: конидиальную суспензию штамма, бесклеточный экстракт, конидиальный экстракт, культуральный супернатант, раствор элиситорного полипептида или их комбинацию. Конидиальная суспензия может быть нанесена в концентрации от 1×103 до 1×108 конидий/мл, бесклеточный экстракт может быть представлен в концентрации от 0,4 до 9 мкг белка/мл, конидиальный экстракт может быть представлен в концентрации от 0,12 до 1,5 мкг белка/мл, и раствор элиситорного полипептида может быть представлен в концентрации от 2,5 до 15 мкг/мл. Поскольку элиситор генерирует неспецифический системный ответ, то способ по изобретению обеспечивает защиту против широкого диапазона патогенов, эффективную для противогрибковой, противобактериальной и противовирусной защиты. Способ может быть применен, среди прочего, в отношении следующих патогенов: Colletotrichum spp., Botrytis cinera или Xanthomonas fragariae. Кроме того, механизмы защиты, запускаемые элиситором, широко распространены в царстве растений, причем способ эффективен для любого типа растения, в частности eudicotyledons, такого как земляника (Fragaria × ananassa), томат (Solarium lycopersicon) или Arabidopsis thaliana, путем опрыскивания надземных частей, пропитывания или орошения.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1: Фиг.1 иллюстрирует степень тяжести заболевания (DSR) антракноза у растений земляники сорта Pájaro, обработанного экстрактами, содержащими элиситор, за 48 часов до инокуляции вирулентным изолятом С.acutatum M11. Растения оценивали через 40 DAI (суток после инокуляции) М11. СЕ: конидиальный экстракт (10 мкг белка/мл), полученный путем обработки ультразвуком; SN: жидкий культуральный супернатант, выращенный в PG (картофельно-глюкозной) среде до стационарной фазы (10 мкг белка/мл). Ctr-PC: инфицированный М11 растительный контроль, предварительно инокулированный авирулентным штаммом (SS71) A. strictum. Ctr.-Ca: инфицированный М11 растительный контроль без предварительной обработки. DSR означает оценку тяжести заболевания.
Фиг.2: на Фиг.2А показана температурная чувствительность элиситорной активности. Анализы осуществляли с концентрированными и диализированными культуральными супернатантами изолята A. strictum SS71, выращенного в PG среде до стационарной фазы. (A) SN: экстракт без обработки. SN1: экстракт, нагретый до кипения в кипящей водяной бане в течение 15 мин; SN2: экстракт, нагретый до 120°С путем автоклавирования (избыточное давление 1 атм (101325 Па)) в течение 15 мин. На Фиг.2В показана чувствительность элиситорной активности к расщеплению протеиназой K. SN: экстракт без обработки; SNA: экстракт, обработанный протеиназой К (100 мкг/мл) в течение 1 часа при 50°С; и SNB: экстракт, обработанный в течение 12 часов при 50°С. Контроли: Ctr.-PC: инфицированные М11 растения, предварительно инокулированные авирулентным штаммом (SS71) A.strictum. Ctr.-Ca: инфицированные М11 растения без предварительной обработки. Анализы проводили через 40 DAI. DSR означает оценку тяжести заболевания.
Фиг.3: на Фиг.3 показана первая стадия очистки грибкового элиситора по изобретению в профиле, полученном из хроматографического разделения FPLC с использованием анионообменной Q-матрицы, уравновешенной при 7,5 (Pharmacia). Элюирование осуществляли с использованием ступенчатого возрастающего градиента NaCl (0-100%). Активность сконцентрирована в пике
Фиг.4: на Фиг.4 показана вторая стадия очистки грибкового элиситора по изобретению в профиле, полученном из хроматографического разделения FPLC с использованием матрицы гидрофобного взаимодействия Phenyl Superose HP (Pharmacia), уравновешенной Tris-HCl (50 мМ, pH 7,5), EDTA (этилендиаминтетрауксусная кислота) (1 мМ) и (NH4)2SO4 (1,5 М), и с элюцией с использованием ступенчатого уменьшающегося градиента (NH4)2SO4 (100-0%). Активность сконцентрирована в пуле IV.
Фиг.5: на Фиг.5 показаны белки, представленные во фракциях с I по IV (общая загрузка 20 мкг), полученных при помощи FPLC в Phenyl Superose HP (Фиг.4), разделенных при помощи 12% SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия). Активность сконцентрирована в пуле IV. Стрелка указывает на активный элиситорный белок, очищенный впоследствии до гомогенности (Фиг.6).
Фиг.6: на Фиг.6 показан SDS-PAGE при 10% активной субфракции (7 мкг общего белка), полученной посредством повторной хроматографии пула IV при помощи Phenyl Superose HP с элюцией в тем же самых условиях, как упомянутые на Фиг.4, с использованием ступенчатого обратного градиента (NH4)2SO4 (100-0%). Активный белок элюируют с колонки Phenyl Superose HP при концентрации (NH4)2SO4 0,5 М.
Фиг.7: на Фиг.7 показано изображение растений, обработанных и необработанных элиситором по изобретению (2,5 мкг белка/мл) и после инфицирования вирулентным изолятом (М11) С.acutatum через 40 суток после инокуляции. В верхнем ряду изображены растения, предварительно обработанные элиситором, а в нижнем ряду изображены растения, обработанные водой (контроль вирулентности), соответственно, за 48 ч до инокуляции патогеном М11.
Фиг.8: на Фиг.8 показаны картины аккумуляции активных форм кислорода (ROS) через 4 ч после обработки путем опрыскивания элиситором (10 мкг белка/мл) листьев земляники сорта Pájaro. (А) Аккумуляция H2O2, обнаруживаемая при помощи DAB (способ с использованием диаминобензойной кислоты), (В) аккумуляция O2- (супероксидный анион), обнаруживаемая при помощи NBT (способ с использованием нитросинего тетразолия) и (С) в качестве контроля лист, обработанный водой. Масштабная линейка указывает 100 мкм.
Фиг.9: на Фиг.9 показаны изображения аккумуляции аутофлуоресцирующих частиц после обработки путем пропитывания элиситором (50 мкл, 10 мкг белка/мл) листьев земляники сорта Pájaro. (А) Лист, обработанный в нулевой момент времени или обработанный водой, (В) флуоресценция через 12 часов после обработки и (С) флуоресценция через 72 часа после обработки. Изображения получали во флуоресцентном микроскопе (320 нм, Leitz). Масштабная линейка указывает 300 мкм.
Фиг.10: на Фиг.10 показаны изображения аккумуляции каллозы в листьях земляники сорта Pájaro через 7 суток после обработки путем опрыскивания элиситором (10 мкг белка/мл; А) или водой (контроль; В); или 2 суток после инокуляции вирулентным изолятом С.acutatum M11 растений, обработанных за 7 суток до этого элиситором (10 мкг белка/мл; С); и в качестве контроля растения, лишь инфицированные М11 (D). Масштабная линейка указывает 100 мкм.
Фиг.11: на Фиг.11 показана диаграмма, отображающая аккумуляцию салициловой кислоты в листьях земляники сорта Pájaro после обработки путем опрыскивания водой □, ВТН (S-метилбензо[1,2,3]тиадиазол-7-карботиокислота), являющейся аналогом SA (0,5 мМ)  , и элиситором (15 мкг белка/мл) ■.
, и элиситором (15 мкг белка/мл) ■.
Фиг.12: на Фиг.12 показана схема эксперимента, внешний вид растений земляники сорта Pájaro после различных обработок и значения DSR через 40 DAI. Один из листьев растений обрабатывали элиситором (стрелка) за 7 суток до инфицирования оставшейся наземной части путем опрыскивания вирулентным изолятом С.acutatum M11 (1,5×106 конидий/мл). (А) растения, предварительно обработанные элиситором (5 мкг белка/мл), (В) растения, предварительно обработанные ВТН (0,5 мМ), (С) растения, предварительно обработанные SA (0,5 мМ) и (D) водой. DSR означает оценку тяжести заболевания.
Фиг.13: на Фиг.13 показана диаграмма, отображающая симптоматику заболевания в нескольких сортах земляники, предварительно обработанных элиситором (10 мкг белка/мл), имеющим происхождение из A.strictum SS71. DSR означает оценку тяжести заболевания.
Фиг.14: на Фиг.14 показана диаграмма, отображающая измерения продукции NO (окись азота) и ROS (H2O2) в культуре клеток томата (Solarium lycopersicon) при помощи флуоресцентных зондов. Флуоресцентный зонд DAF-FMDA использовали для обнаружения NO, а зонд H2DCF-DA использовали для обнаружения ROS, в обоих случаях λвозбужд. составляла 480 нм; λизлуч. составляла 525 нм. Время инкубации составляло 30 минут при комнатной температуре. Элиситор использовали в концентрации 10 мкг/мл для NO и 5 мкг/мл для ROS; ксиланазу (индукторный контроль) в концентрации 100 мкг/мл для NO и 10 мкг/мл для ROS.
Фиг.15: на Фиг.15 показаны изображения максимальной продукции внутриклеточной перекиси водорода с флуоресцентным зондом дихлорфлуоресцеиндиацетатом (DCFH-DA) в листьях Arabidopsis thaliana, обнаруживаемой при помощи флуоресцентной микроскопии (УФ (ультрафиолетовый) свет). Панель (А) соответствует ткани листа контрольных растений, обработанных путем опрыскивания водой через 2 hpt (часа после обработки), тогда как панель (В) соответствует обработке элиситором в тот же момент времени (2 hpt). Единицы масштаба указывают на 100 мкм.
Фиг.16: на Фиг.16 показаны изображения, отображающие изменение со временем образования супероксидного радикала, обнаруживаемого путем окрашивания NBT листьев Arabidopsis thaliana, обработанных элиситором через 2 hpt (A), 4 hpt (В) и 6 hpt (С), и их соответствующие контроли (обработанные водой) в каждый момент времени (D-F).
Фиг.17: на Фиг.17 показаны аминокислотные последовательности (метод Эдмана) трех проанализированных фрагментов (триптическое расщепление) защитного элиситорного полипептида массой 34 кДа по настоящему изобретению, выделенного из A.strictum.
Фиг.18: на Фиг.18 показана нуклеотидная последовательность, кодирующая полипептид с элиситорной активностью по настоящему изобретению; А: полноразмерная нуклеотидная последовательность зрелого транскрипта или комплементарной ДНК (кДНК) (SEQ ID NO: 1); В: нуклеотидные последовательности, представляющие максимально близкие значения, и их видовые источники, полученные при помощи Blast X.
Фиг.19: (А): показана последовательность элиситорного белка, имеющего происхождение из нуклеотидной последовательности кДНК (SEQ ID NO: 2); (В): аминокислотные последовательности, представляющие максимально близкие значения, и видовые источники, полученные при помощи Blast Р; (С): структура субтилизина, полученного из Trichoderma koningii, показывающая ингибиторный домен 19 и каталитический домен S8. Показано, что полученные последовательности, представляющие собой фрагменты изобретения (элиситорный белок защиты растений массой 34 кДа), находятся в пределах каталитического домена белка (пептидаза S8). Также показана длина аминокислотной последовательности каждого домена.
Фиг.20: на Фиг.20 показаны сдвиги поглощения при λ, равной 405 нм, с течением времени. Кривые показывают протеолитическую активность элиситорного белка при 15 мкг/мл (▲) и субтилизина из Bacillus subtilis (0,04 мкг/мл), использованного в качестве положительного контроля (■). Кривая (♦) свидетельствует о аутопротеолитической активности хромогенного субстрата. Увеличение поглощения является следствием ферментативной реакции протеолиза хромогенного субстрата N-Suc-Ala-Ala-Pro-Phe-p-NA путем высвобождения p-NA (п-нитроанилид) (λ равна 405 нм).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ
Для целей настоящей заявки на изобретение термины "элиситор или элиситоры" относятся к любому соединению, способному индуцировать любой тип защитного ответа у растения. Элиситоры могут представлять собой молекулы самой различной природы: белки, углеводы, липиды, небольшие пептиды, небольшие соединения гетерогенного происхождения, такие как вторичные метаболиты, сахар и/или аминокислотные производные, жирные кислоты и их комбинации.
Элиситорная способность имеет то же самое значение, что и активность, индуцирующая защиту против стресса у растений, например,, биотического стресса.
С другой стороны, используемый в данной заявке термин "индуцированная устойчивость" (IR) относится к явлению, при котором растение, подвергнутое соответствующей стимуляции своей защиты путем предварительного воздействия элиситором, приобретает повышенный уровень устойчивости против патогенов.
Антракноз представляет собой грибковое заболевание, которое вызывает голонекроз в вегетативной части растения. Инфекционная форма видов Colletotrichum spp., вызывающая антракноз, представляет собой конидии, которые при прорастании проникают через устьица, трихомы или непосредственно через эпидермис листьев растений, и поражают проводящую ткань (ксилему), вызывая опоясывание черешка. Симптомы начинают проявляться в верхней части черешка и продолжаются с поражением корневой шейки (видоизмененный стебель), приводя к смерти растения. Оценку тяжести симптомов антракноза осуществляют на черешке в соответствии со шкалой, установленной Delp и Milholand (Delp and Milholand, 1980. Plant Dis. 64, 1071-1073), которая устанавливает оценку тяжести заболевания (DSR). Данная шкала DSR варьирует от 1 до 5, увеличиваясь в соответствии с тяжестью симптомов заболевания, определенных в черешках. Различные степени тяжести классифицируют следующим образом:
- степень инфицирования №1: без поражений;
- степень инфицирования №2: поражения длиной менее чем 3 мм и неглубокие темные пятна вдоль черешка (небольшие черные точки);
- степень инфицирования №3: поражения длиной 3-10 мм, темные пятна, обычно окруженные красным цветом;
- степень инфицирования №4: тяжелые поражения и опоясывание черешка, которые могут затрагивать до 50% его длины;
- степень инфицирования №5: очень тяжелое поражение с опоясыванием черешка, которое может затрагивать более чем 50% его длины и/или приводить к гибели растение.
Протокол, использованный для оценки развития антракноза в настоящей заявке, был следующим:
1) поражения оценивают в черешках трех полностью раскрывшихся самых молодых листьев;
2) в том случае, когда имеется несколько степеней симптомов в одном и том же растении, тогда используют максимальную степень в момент наблюдения;
3) симптомы заболевания оценивают через 9, 21, 30, 40 суток после инокуляции (dpi: суток после инокуляции) вирулентным патогеном в соответствии с улучшенной процедурой Salazar et al., 2001 (REDBIO Brasil) и 2002 (REDBIO Argentina).
Для практических целей и упрощения при представлении результатов в настоящей заявке приведены только степени симптомов через 40 суток после инокуляции (40 dpi) для каждого фитопатологического анализа.
Развитие заболевания и полное восстановление партии растений рассматривали в качестве стандартов оценки. Восстановление растения определяют в соответствии с DSR в конце оценки, т.е. 40 суток (DSR40), где:
- DSR40 равна 1, полное восстановление или отсутствие заболевания;
- DSR40 равна 2, частичное восстановление;
- DSR40 равна 3-5, сохранение заболевания.
Восстановление растения представляет собой меру эффективности индуктора защиты в отношении продукта, используемого при обработке растения.
В данной заявке предложен элиситор, дающий возможность предупреждения и/или лечения заболеваний растения, таких как антракноз. Более конкретно, в настоящем изобретении предложен полипептид, кодируемый нуклеотидной последовательностью SEQ ID NO: 1 или последовательностями, по меньшей мере на 90% гомологичными ей. В предпочтительном воплощении, такой полипептид содержит аминокислотную последовательность SEQ ID NO: 2 или последовательности, по меньшей мере на 90% гомологичные ей, где такой полипептид обладает элиситорной активностью. В еще одном более предпочтительном воплощении полипептид по настоящему изобретению имеет происхождение из штамма Acremonium strictum, предпочтительно такой штамм представляет собой штамм Acremonium strictum SS71, депонированный в соответствии с Будапештским договором 14 декабря 2010 года в немецком центре депонирования DSMZ под номером доступа DSM 24396.
Полипептид по настоящему изобретению был получен после оценки нескольких локальных изолятов различных штаммов грибковых патогенов земляники из северо-западной области Аргентины, многие из которых соответствуют различным видам Colletotrichum, включающим комплекс грибов, ответственных за антракноз в культуре земляники: С.fragariae, С.acutatum, С.gloeosporioides. В результате данной оценки выделенный и очищенный штамм SS71, идентифицированный как Acremonium strictum, представляющий собой объект изобретения, оказался вирулентным для некоторых сортов земляники (т.е. сорта Chandler), в то же время он является полностью авирулентным для других сортов земляники, таких как земляника сорта Pájaro. Штамм Acremonium strictum SS71 экспрессирует полипептид, имеющий аминокислотную последовательность SEQ ID NO: 2 или последовательности, по меньшей мере на 90% гомологичные ей, где такой полипептид обладает элиситорной активностью.
В результате анализа, проведенного на различных изолятах, можно видеть, что взаимодействие растение/патоген является высокоспецифичным, т.е. оно зависит от генотипа растения и патогена (патовара или штамма). Различные патовары могут оказывать влияние на определенный генотип земляники с различными степенями тяжести, и наоборот, различные сорта земляники и их разновидности отвечают различными способами, когда их подвергают контрольному заражению одним и тем же патогенным изолятом.
Была установлена система перекрестной защиты у сорта Pájaro между авирулентным изолятом A.strictum SS71 и вирулентным изолятом С.acutatum (М11). Например,, данная система была обнаружена путем инокуляции сначала надземных частей здоровых растений живыми конидиями изолята SS71 и после трех суток живыми конидиями изолята М11, выявляя, что заболевание не было вызвано. Использовали клетки в конидиальном состоянии.
Также показано, что растения сорта Pájaro после инфицирования A. strictum SS71 приобретают устойчивость против вирулентных штаммов Colletotrichum spp., Botrytis cinera и Xanthomonas fragariae. Также обнаружено, что данная защита возникает в результате взаимодействия между сортом Pájaro и авирулентным патоваром, индуцирующим ответ типа SAR.
Данное заключение имеет интересные следствия для формирования агрономического управления заболеваниями сельскохозяйственных культур при минимальном воздействии на здоровье человека и состояние окружающей среды.
В предпочтительном воплощении реализация агрономической системы биологического контроля в полевых условиях может быть осуществлена на основе перекрестной защиты, инокулируя растения непосредственно живым штаммом или конидиями A.strictum SS71. Учитывая даже то, что штамм является авирулентным против сорта Pájaro, он способен индуцировать заболевание у восприимчивых разновидностей. Желательно получать непатогенные экстракты, обладающие элиситорной способностью, для получения композиций, которые запускают защитный ответ, и лучше получать и использовать соединение, обладающее элиситорной активностью, для приготовления композиции для индукции системы защиты растения.
Еще одно предпочтительное воплощение заключается в непосредственном нанесении элиситорной молекулы по настоящему изобретению для иммунизации и предупреждения грибковых заболеваний культур, таких как земляника. Помимо того, что данная технология экологически безопасна, она может представлять собой еще одну применимую в агрономии альтернативу ввиду ее безвредности.
Перекрестная защита была обнаружена против С.acutatum M11, предварительно инокулируя растения сорта Pájaro суспензией живых конидий штамма A.strictum SS71 в концентрации 1,5×106 конидий/мл.
Кроме того, был проанализирован конидиальный экстракт (СЕ) A. strictum SS71, полученный путем обработки ультразвуком, и было проанализировано изменение симптомов заболевания (DSR) с течением времени (dpi) в анализах с двойной обработкой. Анализ симптомов заболевания осуществляли с использованием предельных значений, 1 - когда происходило полное восстановление (отсутствие симптомов антракноза) и 5 - когда восстановление не происходило.
Когда растения опрыскивали конидиальным экстрактом (СЕ), полученным при помощи обработки клеток ультразвуком для их разрушения, были достигнуты степени симптомов заболевания, близкие к достигнутым у контролей с перекрестной защитой, демонстрируя то же самое полное восстановление (DSR равна 1) после 40 суток, близкое к контролям (Фиг.1); т.е. СЕ демонстрирует высокоэффективную защиту против вирулентного штамма, вызывающего заболевание антракноз. Данный результат свидетельствует о том, что: (а) присутствие живых конидий авирулентного патогена (A.strictum SS71) по изобретению не требуется для запуска устойчивости против вирулентного патогена (С. acutatum M11); (б) среда, содержащая конидии патогена, инактивированного путем лизиса клеток физической обработкой, способна сохранять индуцирующую активность, представленную в таких конидиях в активном состоянии, с равной эффективностью защиты.
Анализировали присутствие активного агента в жидком культуральном супернатанте авирулентного патогена A.strictum по изобретению, выращенного при оптимальных условиях до стационарной фазы. Для этой цели использовали обычную картофельно-глюкозную (PG) среду и измеряли активность, представленную в бесклеточном супернатанте (SN). Было обнаружено, что супернатант культуры (SN), выращенной в PG среде, достигает значение DSR, равное 1, через 30 суток, сохраняемое в течение всего периода оценки (DSR40 равна 1; Фиг.1), таким образом, обработка SN приводит к раннему полному восстановлению растений. Это означает, что SN обеспечивает максимальную эффективность защиты (DSR40 равна 1) тем же самым путем, что и контроль с перекрестной защитой. Данный результат свидетельствует о том, что активность с максимальной эффективностью защиты получена для жидкого культурального супернатанта, подразумевая, что активный ингредиент может экскретироваться в культуральную среду.
На основе упомянутых выше результатов видно, что максимальная эффективность защиты получена для всех анализируемых фракций A. strictum SS71 по изобретению (DSR равна 1) тем же самым путем, что и для контроля с перекрестной защитой, с СЕ и SN; таким образом, можно сделать заключение о том, что они оба демонстрируют высокоэффективную защитную активность. Эти эксперименты подтверждают, что "индуцирующая сила" может быть выделена во фракции СЕ и SN, с использованием которых достигнута максимальная защита.
Протокол и схема эксперимента, использованные для оценки защитной активности различных полученных фракций (СЕ и SN), подробно изложены в таблице 2 (см. примеры).
Для характеристики элиситора определяли химическую природу активных ингредиентов и их технологические возможности. Анализировали температурную стабильность элиситорной активности. Для данной цели использовали супернатант SN, содержащий в качестве активного ингредиента соединение, обладающее "индуцирующей силой", с высокой степенью очистки. В этом отношении SN подвергали двум температурным обработкам различной интенсивности: (А) нагревание до кипения (100°С) в течение 15 минут (SN1), достаточное для денатурации больших белков (как правило, молекулярная масса больше чем 10000 Да) и недостаточное для разрушения других соединений отличной химической природы, таких как углеводы, липиды и т.д.; и (Б) автоклавирование (121°С) в течение 15 минут (SN2), представляющее собой более сильную обработку, которая разрушает большую часть соединений, за исключением метаболитов с маленькой молекулярной массой, устойчивых к высоким температурам, термоустойчивых пептидов и т.д.
На Фиг.2А показаны результаты, свидетельствующие о том, что супернатант, подвергнутый обеим температурным обработкам, приводит к развитию заболевания, которое весьма похоже на положительный контроль С.acutatum М11. Как SN1, так и SN2, а также контроль с вирулентным штаммом демонстрируют DSR, равную 5; в случае нагретых супернатантов, такая оценка достигается после 30 суток, тогда как в случае положительного контроля она достигается после 21 суток. Во всех случаях растения погибают после обработки. Из этого можно сделать вывод о том, что активность, индуцирующая защиту, практически полностью утрачивается при серьезном температурном воздействии.
Как представлено на Фиг.2В, тот же самый эффект наблюдается тогда, когда SN инкубируют с протеиназой К в течение ночи (12 часов) при оптимальных для такой ферментативной активности условиях (50°С), которую широко используют для протеолитического расщепления.
Представленные результаты свидетельствуют о том, что основное активное соединение, участвующее в индукции защитного ответа, утрачивает свою активность не только вследствие менее серьезной температурной обработки (нагревание при 100°С в течение 15 минут), вероятно за счет расщепления пептидных связей, но также под действием протеазы (протеиназа K), таким образом, позволяя сделать заключение о том, что соединение имеет белковую природу.
Для лучшего понимания способа получения полипептида по настоящему изобретению в данной заявке описан пример воплощения для отнесения защитного действия против С.acutatum, ассоциированного с полным супернатантом, имеющим происхождение из авирулентного патовара Acremonium strictum (изолят SS71) по изобретению, к одной очищенной молекуле. В этом случае прежде всего идентифицирован(ы) внеклеточный(ые) белок(белки) с индуцирующей активностью. Для этого разработан и оптимизирован протокол очистки для извлечения белка в больших количествах и с высокой степенью очистки (одна полоса на SDS-PAGE или один пик на FPLC); для достижения такого протокола эксперименты проводили в 2 стадии.
(а) Оптимизация условий выращивания культуры грибов для максимального получения элиситорной активности.
Полная защита растения достигается путем предварительной обработки растения аксеническим супернатантом культуры изолята Acremonium strictum SS71 в среде PG (картофельно-глюкозной, незабуференной, исходный pH равен 6,75), выращенной при 28°С в статичной форме (без перемешивания) с непрерывным освещением белым светом до достижения фазы стационарного роста (21 суток). Общее содержание белка в конечном супернатанте составляло 8,43 мкг белка/мл.
(б) Выделение внеклеточного белка с индуцирующей активностью из среды PG.
Как продемонстрировано в примерах, активность на каждой стадии очистки отслеживали при помощи двух параллельных методов: (а) продукция ROS (Н2О2 и O2-) через 4 ч и (б) защита против вирулентного изолята С. acutatum M11.
Протокол очистки включает следующие стадии.
I. Исходная обработка для консервации.
Для удаления мицелия культуры центрифугировали при 16300g в течение 30 минут при 4°С. Супернатант извлекали и фильтровали через диатомовую землю и затем через фильтрующую мембрану с диаметром пор 0,22 мкм. Данная фракция соответствует аксеническому 1-кратному (неразбавленному) супернатанту (бесклеточному), который хранили замороженным при -20°С до последующего использования.
II. Концентрированно компонентов образца. 1-кратный супернатант 10-кратно концентрировали путем лиофилизации и затем дополнительно 4-кратно путем добавления PEG (полиэтиленгликоль) к образцу и диализа в течение ночи (ON) при 4°C с мембраной с отсечением 12 кДа.
III. Удаление большей части примесей. Данный этап осуществляли в две стадии.
(а) Ультрафильтрация с использованием мембраны с отсечением 10 кДа. Объем концентрированного супернатанта уменьшался в 10 раз (в общем в 400 раз), с сохранением индуцирующей активности, удерживаемой мембраной (молекулярная масса больше чем 10 кДа).
б) Анионообменная хроматография. Удерживаемый раствор с основной активностью затем фракционировали с использованием системы FPLC (Pharmacia) и колонки, упакованной матрицей Q Sepharose Fast Flow (Q) (Pharmacia-FPLC), уравновешенной буфером Tris-HCl с pH 7,5, и элюировали путем увеличения ионной силы: ступенчатый возрастающий градиент NaCl с концентрациями 0,24 М (8 мин), 0,38 М (8 мин) и 1 М (10 мин). Элюированные фракции собирали вместе в 4 белковых пула, которые подвергали фитопатологическим исследованиям (Фиг.3). Обнаружено, что активность, индуцирующая защиту, сконцентрирована в пике I.
Предварительная обработка растения "проточным" элюатом с колонки Q при pH 7,5 вызывает полную защиту против вирулентного изолята М11, тогда как высокая, хотя и неполная защита достигается с белковым пулом II, который слабо взаимодействует с матрицей (элюированный с 0,24 М NaCl).
Эти результаты приводят к заключению о том, что жидкий культуральный супернатант авирулентного изолята Acremonium strictum SS71 по изобретению содержит два или более чем два белка, обладающих индуцирующей защиту активностью, которые демонстрируют различные pI (изоэлектрическая точка). Тем не менее, поскольку максимальная активность, индуцирующая устойчивость к антракнозу, получена для фракции белков, которые не взаимодействуют с анионообменной матрицей Q при pH 7,5, данный пул основного белка (pI более 8) был выбран для продолжения очистки.
IV. Удаление весьма близких следовых примесей ("доочистка").
Белки, несвязанные с матрицей Q (пул I), разделяли при помощи хроматографии через матрицу гидрофобного взаимодействия. Для такой цели пул 1 в условиях с высокой ионной силой загружали в колонку гидрофобного взаимодействия Phenyl Superose HP (PS), адаптированной к системе FPLC. Матрицу предварительно уравновешивали буфером Tris HCl 50 мМ с pH 7,5, добавляя 1 мМ EDTA и (NH4)2SO4 в концентрации 1,5 М, и после загрузки с нее осуществляли элюцию посредством уменьшения ионной силы путем применения уменьшающегося градиента концентраций (NH4)2SO4, достигая таким образом профиль, представленный на Фиг.4. Обнаружено, что индуцирующая активность элиситора сконцентрирована в пике IV.
Когда белки, несвязанные с матрицей Q, прогоняли через матрицу PS, было обнаружено, что защитная активность разделяется среди трех фракций, элюированных путем уменьшения ионной силы: пулы II, III и IV, которые при исследовании в 12%-ном полиакриламидном геле не содержали одиночных полос белков (Фиг.5). Основная активность сконцентрирована в пике IV. NoBoe хроматографическое разделение осуществляли с использованием той же самой системы (матрица и буферы), но с применением ступенчатого градиента (NH4)2SO4, имеющего 5 промежуточных этапов. С использованием данного способа получали 10 хроматографических пиков, содержащих одиночные белки, о чем свидетельствуют одиночные полосы на SDS-PAGE (10%), окрашенном кумасси синим-R. Обнаружение элиситорной защитной активности осуществляли путем опрыскивания одного листа на растение (n равно 4) каждой из полученных фракций, доведенной до концентрации 2,5 мкг белка/мл. Результаты показали, что пик 7, элюированный (NH4)2SO4 в концентрации 0,5 М, обеспечивает растениям полную защиту против антракноза (DSR40 равна 1), а также индуцирует продукцию ROS (NBT и DAB положительные красители).
Как представлено на Фиг.6, когда пик 7 разделяют при помощи 10% SDS-PAGE, одиночная полоса интенсивно окрашивается кумасси синим-R. Активный белок элюируют с колонки 0,5 М (NH4)2SO4.
До гомогенности очищали основной белок 34 кДа, который способен индуцировать системную устойчивость против воздействия вирулентного изолята С.acutatum M11.
Элиситорный полипептид представляет собой новый белок, отличный от протеаз, о которых сообщали ранее. Для подтверждения этого, хотя какие-либо совпадения с белковыми последовательностями, описанными для Acremonium spp., не были обнаружены среди 100 наилучших вариантов, полученных при помощи Blast-P, проведенного с последовательностью элиситорного белка, степень его идентичности исследовали в отношении всех белков, которые были идентифицированы как протеазы или протеазоподобные белки в данном роду.
В таблице 1 обобщены характеристики аминокислотных последовательностей белков рода Acremonium (продуцирующий организм, источник, удлинение, Mr, количество аминокислот и функция) и их сравнение с элиситорным белком (процент идентичных аминокислот и пропусков, полученный в результате выравнивания с каждым из них).
Во всех геномных и протеомных базах данных было сообщено только о 6 последовательностях протеазоподобных белков, продуцируемых различными видами Acremonium spp.; две из них определили на экспериментальной основе и соответствуют частичной аминоконцевой последовательности с доказанной протеолитической функцией (№ доступа Р85156, Sub-E1, 40 а.к. (аминокислот)) ((№ доступа Р85157, Sub-E2, 18 а.к.), тогда как оставшиеся четыре представляют собой последовательности, выводимые по гомологии с библиотеками геномной ДНК. Среди этих последних последовательностей описаны внутренний протеазный фрагмент ((№ доступа ААС09289.1, Pr.) и три полноразмерных последовательности, соответствующие субтилизиноподобной сериновой протеазе ((№ доступа BAF62454.1; Sub-Е3), предшественнику щелочной протеиназы ((№ доступа ВАА00765.1; Pr.Alc) и цефалоспорин-C-ацетилгидролазе ((№ доступа САВ87194.1; АсН).
Таблица 1.
Описание протеазоподобных белков Acremonium spp., зарегистрированных в белковых базах данных (Uniprot)
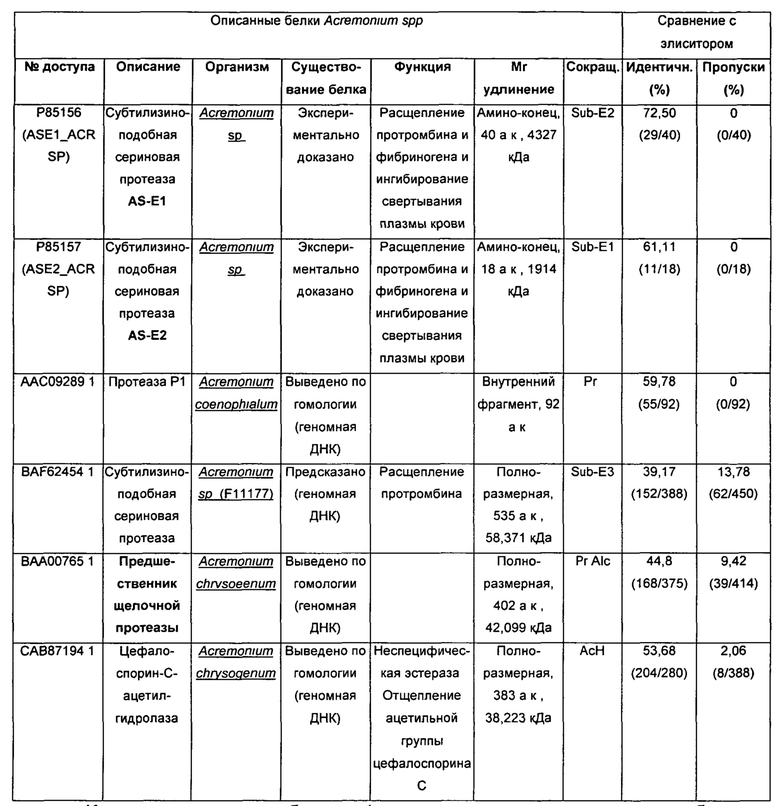
Как показано в таблице 1, выравнивания элиситорного белка с фрагментами Sub-E1, Sub-E2 и Pr приводит к высоким значениям идентичности, варьирующим приблизительно от 59,8 до 72,5%, без прерывающих пропусков при выравниваниях последовательностей. Тем не менее, короткая аминокислотная последовательность (40-92 а.к.) этих белков не допускает какое-либо заключение о гомологичности с элиситорным белком, поскольку не известно более чем 75% их последовательности.
С другой стороны, в отношении описанных полноразмерных протеаз из Acremonium spp. элиситорный белок демонстрирует 39,2% идентичности с Sub-Е3 и 44,8% идентичности с щелочной протеазой Pr.Alc; тем не менее, в обоих выравниваниях имел место очень высокий процент пропусков (13,8% и 9,4%, соответственно). Sub-Е3 представляет собой единственную полноразмерную последовательность субтилизиноподобной сериновой протеазы, описанной в Acremonium spp, которая дополнительно демонстрирует экспериментально доказанную протеолитическую активность (Liu et al., 2007). Тем не менее, данная протеаза демонстрирует очень низкий процент сходства (39,2%) по сравнению с индуцирующим защиту субтилизином, выделенным из A.strictum.
Неожиданно, самое высокое значение идентичности (53,7% идентичности и 2,1% пропусков) элиситорного белка соответствует белку A.Chrysogenum AcH. Он представляет собой неспецифичную эстеразу, которая действует путем устранения антибиотической ацетильной группы цефалоспорина С. Несмотря на то, что он лишен протеолитической активности, AcH был включен в анализ ввиду сходства его последовательности с сериновыми протеазами.
Следующее сравнение демонстрирует выравнивание, осуществленное с амино-концевыми последовательностями всех протеаз, о которых сообщалось для Acremonium spp., включая элиситорный белок, демонстрируя вариабельность амино-концевой области между этими протеазами.

Анализы, осуществленные для определения элиситорной активности, представлены на Фиг.7. Растения, обработанные элиситором, демонстрируют тот же самый общий статус, что и контрольные растения с перекрестной защитой, и представляют собой полностью здоровые растения (DSR40 равна 1) большого размера. Также подтверждено то, что фракции, имеющие происхождение из авирулентного патогенного изолята A.strictum SS71 по изобретению, не демонстрируют какой-либо тип вирулентности против генотипа Fragaria vesca (дикая земляника), который является высокочувствительным к данному типу грибковых патогенов. Эти результаты согласуются с возможностью использования этих фракций для предоставления защиты в полевых условиях против антракноза культурной землянике (F. × ananassa) сорта Pájaro.
Протокол и схема эксперимента, использованные для оценки индукции устойчивости против антракноза различных полученных очищенных фракций, подробно приведены в таблице 2 (см. примеры).
Был охарактеризован защитный ответ у земляники, индуцированный фракциями авирулентного патогена и полипептидом по настоящему изобретению, обладающим элиситорной активностью.
Были проанализированы явления, ассоциированные с защитой растений, вызываемой полипептидом по изобретению, имеющим происхождение из авирулентного патогенного изолята A.strictum SS71.
Защитные реакции оценивали в листьях земляники сорта Pájaro, обработанного активными предварительно очищенными экстрактами, имеющими происхождение из культур изолята SS71 по изобретению, и такие результаты затем подтверждали с чистым индуцирующим белком. Во время этих анализов обнаружены аккумуляция активных форм кислорода (H2O2 и О2-), ассоциированных с окислительным взрывом; продукция окиси азота (NO); аккумуляция фенольных соединений; микроскопический гиперчувствительный ответ (микро-HR); утолщение клеточной стенки путем лигнификации и путем отложения каллозы; аккумуляция салициловой кислоты и экспрессия генов, ассоциированных с защитным ответом и системной приобретенной устойчивостью (SAR), например, PR-белков. Указанное выше свидетельствует о том, что достигается общая индуцированная защита растения, обнаруженная у всех видов растений, исследованных до настоящего времени. Некоторые из этих ответов были исследованы и обнаружены у других видов растений после нанесения белка субтилизина, выделенного из A.strictum (томат и Arabidopsis). В результате этих экспериментов можно сделать заключение о том, что существует общий эффект в различных культурах против грибковых и бактериальных патогенов, который также подкрепляется положительными результатами устойчивости против Colletotrichum spp. (биотрофный гриб), Botrytis cinerea (некротрофный гриб) и Xanthomonas fragariae (бактерии). Как упомянуто выше, ответ против элиситора по изобретению включает аккумуляцию салициловой кислоты, которая индуцирует устойчивость не только против грибковых и бактериальных патогенов, но также против вирусов. Следовательно, настоящее изобретение также полезно для индукции у растений устойчивости против вирусов.
Окислительный взрыв оценивали по аккумуляции ROS. Было проанализировано, предшествует ли защитному действию, обнаруженному у растений, предварительно обработанных элиситором, биохимические маркеры, обычно ассоциированные с защитой, а также аккумуляция супероксидного ион-радикала (O2-) и перекиси водорода (H2O2) путем гистохимического окрашивания NBT (нитросиним тетразолием) и DAB (диаминобензидином), соответственно.
Продукция H2O2 (DAB+) и иона O2- (NBT+) обнаружена в областях нанесения через 2 часа после обработки (hpt) элиситором. Анализировали как проксимальные молодые листья, так и дистальные листья (не обработанные). Максимальная продукция обнаружена для ROS через 4 hpt, как показано на Фиг.8А для H2O2 и Фиг.8В для иона O2-. Тем не менее, обнаружение супероксидного иона становится гистохимически почти не выполнимым в более поздние моменты времени, тогда как уровни перекиси водорода сохраняются на высоком уровне через 12 hpt. Наоборот, продукция каких-либо активных форм кислорода не обнаружена в контрольных растениях, обработанных средой PG или водой (Фиг.8С).
Когда чистым белком пропитывали абаксиальную сторону молодого листа растения, тогда продукция ROS была обнаружена (красители DAB+ и NBT+) в отдельных микросайтах, однородно распределенных по поверхности подвергнутого пропитыванию листа (проксимальная ткань) и не подвергнутых пропитыванию листьев (дистальная ткань), известная как системные микроокислительные взрывы.
Оценивали аккумуляцию аутофлуоресцирующих соединений. Результаты, представленные на Фиг.9, показывают что листья, пропитанные активными экстрактами или чистым белком, демонстрируют сильный аутофлуоресцирующий сигнал при 329 нм, обнаруживаемый при УФ-освещении в точке пропитки, сопровождаемый некротическим поражением ткани, тогда как листья, пропитанные водой (контроль), не демонстрируют обнаруживаемую аутофлуоресценцию или тканевый некроз. Оценку аутофлуоресценции осуществляли в точке инфильтрации в различные моменты времени после индукции. В момент времени 12 hpt (часов после обработки) при Уф-освещении обнаружено заметное присутствие желтой аутофлуоресценции (Фиг.9В) с постепенным увеличением интенсивности, достигая своего максимума в момент времени 72 hpt (Фиг.9С). В точке инфильтрации контрольных растений аутофлуоресценция не обнаружена (Фиг.9А). Желтая аутофлуоресценция вероятно является следствием высвобождения фенольных соединений, происходящих из фенилпропаноидного пути (т.е. фитоалексины), который сильно активируется во время HR.
Также анализировали изменения в составе клеточной стенки, вызванные защитным ответом, путем оценки отложения каллозы. Для этой цели анализировали воду (контроль), клеточные экстракты с индуцирующей защиту активностью и очищенный белок субтилизин в отношении их способности индуцировать аккумуляцию каллозы в клеточных стенках растения земляники. На Фиг.10 показаны растения, аккумулирующие каллозу через 7 суток после обработки чистым элиситорным белком из штамма SS71 (Фиг.10В), тогда как никакая аккумуляция не обнаружена у растений, обработанных водой (Фиг.10А). Тем не менее, на Фиг.10 также показано, что каллоза откладывается даже в более высоких концентрациях в растениях, пропитанных вирулентным изолятом С.acutatum M11, которые были предварительно индуцированы элиситором за 7 суток перед инфицированием (Фиг.10С). Обнаружено, что отложение каллозы сначала происходит в отдельных эпидермальных клетках, а затем она аккумулируется в соседних группах клеток, образующих матрицу, действующую в качестве сплошного физического барьера для прекращения инвазии патогена.
Салициловую кислоту (SA) количественно определяли во флоэме растений земляники, пропитанных чистым элиситорным белком в концентрации 2,5 мкг белка/мл. SA выделяли из черешков в различные моменты времени (0, 24, 48, 72 и 96 часов после обработки (htp)), очищали при помощи обращенно-фазовой хроматографии и количественно определяли при помощи флуоресцентной спектроскопии с возбуждением при 296 нм.
Растения, обработанные ВТН, а также очищенным белком субтилизином, демонстрировали значимое увеличение концентраций SA во флоэме через 72 hpt, достигая концентрации 3,72 мкг/мл во флоэмном эксудате, тогда как обработанные водой контрольные растения демонстрировали в 2,5 раза меньшее значение (1,45 мкг/мл эксудата). На Фиг.11 показано, что растения, обработанные водой, не демонстрировали значимого увеличения SA в процессе эксперимента, тогда как растения, обработанные элиситором, демонстрировали значимое увеличение через 72 hpt, также как и обработанные ВТН (0,5 мМ) растения, использованные в качестве чувствительного к SAR положительного контроля.
Эксперименты проводили для определения того, способны ли экстракты, обладающие индуцирующей защиту активностью, и чистый белок (субтилизин) транслоцировать защитный сигнал и, таким образом, индуцировать SAR-подобный ответ. Для этой цели осуществляли опрыскивание одного листа растения чистым белком (5 мкг белка/мл) и через 7 суток после обработки (7 dpt) оставшуюся часть растения инфицировали конидиальной суспензией вирулентного изолята М11. ВТН и SA использовали в качестве SAR-индуцирующих положительных контролей, тогда как отрицательный контроль получали при помощи опрыскивания водой.
Как представлено в таблице, прилагаемой к Фиг.12, растения, предварительно обработанные путем опрыскивания одного листа элиситором по настоящему изобретению, демонстрируют DSR менее чем 1,5 через 40 суток после инокуляции (dpi), также как и растения, обработанные ВТН и SA, тогда как растения, предварительно обработанные водой, погибали через 10 dpi (DSR равна 5). Это подтверждает то, что элиситор обеспечивает растению защиту системного типа, поскольку растения, у которых обрабатывали только один лист, не демонстрировали симптомы заболевания.
Для исследования индуцирующего устойчивость действия элиситорного полипептида по настоящему изобретению осуществляли анализ защиты на других сортах земляники и на различных видах растений. Чистый элиситор по изобретению, имеющий происхождение из изолята SS71, обеспечивает защиту различных сортов земляники при контрольном заражении вирулентным штаммом С.acutatum.
Различные имеющиеся в продаже разновидности земляники, демонстрирующие взаимодействие несовместимого типа (например, сорта Pájaro и Camarosa) или взаимодействие совместимого типа (например, сорта Milsei Tudla, Chandler), тестировали в отношении индукции защиты против патогена после обработки элиситором из SS71. После обработки индуктором все растения подвергали контрольному заражению вирулентным штаммом для каждого сорта, С.acutatum M11 (изолят из сорта Chandler в Manantial-Tucumán), МР3 (изолят из Aroma в Mar del Plata) или LCF 1-05 (изолят из фруктов Camarosa в Lules-Tucumán).
На Фиг.13 показано, что после обработки элиситором сорта Pájaro и Camarosa не демонстрируют симптомы заболевания (DSR равна 1) через 40 dpi, тогда как растения сортов М.Tudla и Chandler демонстрировали различные степени развития заболевания в зависимости от изолята, использованного для инфицирования. Эти результаты показывают, что в общем все разновидности демонстрируют меньшие значения симптомов заболевания по сравнению с контрольными растениями и в большинстве случаев продемонстрировали заметное восстановление через 30 dpi (DSR равна 1-2).
Элиситор, имеющий происхождение из SS71, приводил к развитию высокоэффективной защиты против антракноза у устойчивых к SS71 сортов (где он ведет себя как авирулентный), в то же время приводя к частичной защите у чувствительных к SS71 сортов (где он ведет себя как вирулентный).
На Фиг.13 также показано, что степень защиты особенно зависит от используемого изолята. Хотя элиситор может быстро контролировать инфекцию, вызванную М11, во всех анализируемых сортах, защита от заболевания отличается для изолятов МР3 и LCF1.
Эти результаты позволяют сделать заключение о том, что элиситор по изобретению обладает индуцирующей активностью широкого спектра, поскольку он способен индуцировать защитные ответы у других сортов и против других патогенов, хотя и с различными степенями защиты.
Изучали индукцию реакций, ассоциированных с защитой у других видов растений. Например,, исследовали воздействие элиситора на культуру клеток томата (Lycospersicum solarium), анализируя то, способен ли элиситор индуцировать аккумуляцию ROS и NO (окись азота) в качестве биохимических маркеров защиты растения. Очищенный белок (субтилизин) добавляли до конечной концентрации 5 мкг/мл или 10 мкг/мл к культурам клеток для оценки изменения во времени ROS или NO, соответственно, при помощи измерений флуоресценции. На Фиг.14 показано, что клетки томата демонстрируют сильную и быструю аккумуляцию ROS и NO в течение первых 30 минут после добавления элиситора. Контрольные клетки не демонстрируют какую-либо аккумуляцию ROS или NO выше базовых значений.
Дополнительно, изучали способность элиситора индуцировать продукцию ROS у растений Arabidopsis thaliana. Для этой цели параллельно исследовали продукцию перекиси водорода и продукцию супероксидного радикала. Внутриклеточную перекись водорода оценивали при помощи флуоресцентного зонда дихлорфлуоресцеиндиацетата (DCFH-DA), обнаруживая пик взрыва вследствие обработки чистым элиситорным белком. Данный результат подтверждает способность белка по изобретению индуцировать внутриклеточную аккумуляцию перекиси водорода, несмотря на тот факт, что пик аккумуляции не соответствует в точности моменту времени, обнаруженному для земляники, где максимум обнаруживается через 4 hpt (Фиг.15).
Аккумуляцию супероксидного радикала в листьях A. thaliana оценивали при помощи NBT (см. выше), обнаруживая пик аккумуляции через 4 hpt, согласующийся с образованием супероксида в землянике, тогда как контрольные листья не демонстрировали какую-либо реакцию (Фиг.16).
Для того, чтобы представить химическую и молекулярную характеристику полипептида по настоящему изобретению, обладающего индуцирующей устойчивость активностью, молекулярную массу данного белка определяли при помощи 10% SDS-PAGE (с β-меркаптоэтанолом) с использованием программного обеспечения PD Quest (BioRad), получая приблизительное значение 34 кДа. Полипептид демонстрирует pI около 9,5, определенную экспериментально при помощи электрофореза с изоэлектрическим фокусированном.
Получили NH2-концевую последовательность предварительно восстановленного и алкилированного белка, перенесенного на PVDF (поливинилиденфторидную) мембрану, а также три внутренние пептидные последовательности, полученные при помощи триптического расщепления в геле восстановленного и алкилированного белка. На Фиг.17 показаны пептидные последовательности с молекулярной массой 1095,19, 2441,2 и 1938,1 msms. Анализ выравнивания показал, что все пептидные последовательности обладают, причем каждая по отдельности, высоким сходством с грибковыми протеазами из семейства субтилизинов. Наибольшие значения идентичности последовательности соответствуют субтилизину из Arthroderma spp. (или Trichophyton spp.) для пептида с молекулярной массой 2441,2 и белку субтилизину из Aspergillus spp. для пептида с молекулярной массой 1938,1.
Олигонуклеотидные праймеры были сконструированы, исходя из последовательности пептидного фрагмента, представленной на Фиг.17, зная то, что первый пептид соответствует амино-концу белка. Соответствующая последовательность кДНК, полученная при помощи протокола амплификации, соответствующей транскрипту полноразмерного зрелого элиситорного белка и его выведенной нуклеотидной последовательности, представлена на Фиг.18А. Имея доступ к полноразмерной последовательности кДНК элиситора, схожесть данной последовательности сравнивали с последовательностями в базах данных последовательностей белков и ДНК для получения информации о функции белка и его принадлежности к тому или иному семейству белков. В соответствии с данным исследованием сделали заключение, что выделенная последовательность в действительности представляет собой сериновую протеазу семейства субтилизинов.
Для завершения изучения и подтверждения результатов принадлежность данного белка также исследовали при помощи Blast P. Для этой цели использовали аминокислотную последовательность, выведенную из нуклеотидной последовательности, представленной на Фиг.18, получая таким образом последовательность, представленную на Фиг.19А. Данный анализ подтвердил, что выделенная последовательность соответствует сериновой протеазе семейства субтилизинов (Фиг.19В).
Для лучшего представления относительных позиций доменов, обладающих более высоким сходством, осуществили сравнение полных последовательностей между аминокислотной последовательностью субтилизина из A.strictum и последовательностями, относящимися к семейству субтилизинов. Для этой цели выбрали субтилизин из Trichoderma koningii, Metarhizium anisopliae var. anisopliae, Ophiocordyceps sinensis, Paecilomyces lilacinus, поскольку они обладают высокой степенью идентичности как нуклеотидной (Blast X), так и аминокислотной (Blast P) последовательностей. Структура субтилизина из Trichoderma koningii взята в качестве модели, поскольку он имеет высокую идентичность последовательности с элиситорным субтилизином A.strictum. На Фиг.19С представлено относительное положение секвенированных фрагментов элиситора из A.strictum относительно охарактеризованных доменов субтилизина из Т.koningii. Представленные результаты позволили сделать заключение о том, что амино-конец расположен в области, находящейся между ингибиторным доменом 19 и пептидазным доменом S8, имеющим протеазную функцию, тогда как другие две секвенированные внутренние пептидные последовательности расположены в пептидазном домене S8. Ингибиторный домен 19 пептидазы обнаружен в незрелой форме всех указанных проанализированных субтилизинов.
Эти результаты показывают, что незрелый элиситорный белок претерпевает посттрансляционное созревание, заключающееся в расщеплении ингибиторного домена 19, который может представлять собой сигнальный пропептид для экспорта во внеклеточную среду. На основе результатов, представленных выше, авторам изобретения стало известно, что последовательности в домене, обладающем протеазной функцией, являются высококонсервативными, следовательно, авторы изобретения могут сделать вывод, что такие белки демонстрируют протеолитическую активность.
Для экспериментального определения того, имеет ли субтилизиноподобный элиситорный белок протеолитическую функцию, исследовали его способность вызывать протеолитическое расщепление с использованием специфического хромогенного субстрата (N-сукцинил-Ala-Ala-Pro-Phe-пара-нитроанилида), высвобождающего p-NA, поглощающего излучение с длиной волны 405 нм. На Фиг.20 показано, что элиситорный белок (15 мкг/мл) действует на хромогенный субстрат, вызывая с течением времени его протеолиз, как и субтилизин из Bacillus subtilis (0,04 мкг/мл), используемый в качестве положительного контроля.
После очистки до гомогенности элиситорный белок демонстрирует протеолитическую активность в отношении субтилизин-специфического хромогенного субстрата, т.е. он имеет in vitro субтилизиноподобную протеазную функцию.
Данное изобретение лучше проиллюстрировано следующими примерами, которые не следует рассматривать как ограничение объема изобретения. Наоборот, следует однозначно понимать, что могут быть использованы его другие воплощения, модификации и эквиваленты, которые при ознакомлении с настоящей заявкой могут быть предложены специалистами в данной области техники без отступления от сущности настоящего изобретения и/или объема прилагаемой формулы изобретения.
Примеры
Пример 1: использованные материалы и среды
Растения земляники
Использовали растения земляники Fragaria × ananassa Duchesne сорт Pájaro и дикую землянику вида Fragaria vesca; все доступны из банка идиоплазм Pro/Frutilla.
Материал получали в три стадии: (1) выращивание культуры меристемы in vitro; (2) рустовка и 3) размножение растения столонами.
(1) Из культуры in vitro меристемы растительный материал очищали и размножали в аксенических условиях с контролируемым ростом (температура: 25°С, фотопериод: 16 ч света). (2) Затем его подвергали рустовке в лотках с использованием смеси земли и перлита в качестве стерильного субстрата (2:1). После четырех недель растения переносили в пластиковые горшки высотой 8 см и диаметром 8,5 см, получая таким образом маточные всходы. (3) Эти маточные всходы выращивали в ростовых камерах с контролируемой температурой (25-27°С), влажностью (70%) и фотопериодом (16 ч) в условиях, которые являются оптимальными для образования столонов. Все растения, использованные в процедурах эксперимента, получали при помощи фиксации столонов маточных всходов (бесполое размножение) на стерильном субстрате в аксенических условиях и затем последующего выращивания в тех же самых условиях. Приблизительно через две недели после укоренения новые всходы отделяли от маточного растения и оставляли расти в течение еще 12-14 недель. То есть маточные всходы выращивают до тех пор, пока они не достигают возраста 14-16 недель, имея по меньшей мере четыре полностью распустившихся листа, демонстрируя относительно раннюю стадию роста для всходов. В течение этого периода всходы поливали исключительно дистиллированной водой дважды в неделю и не осуществляли превентивное нанесение фунгицидов или удобрений.
Ответ системы перекрестной защиты A.strictum SS71/C.acutatum М11 оценивали у сорта Pájaro, у которого указанный ответ был определен и охарактеризован.
Экотип дикой земляники Fragaria vesca использовали во всех анализах в качестве положительного контроля вирулентности штамма из-за его чрезвычайной чувствительности к штамму A.strictum SS71. Данный генотип также использовали в качестве контроля инактивации A.strictum SS71 во фракциях, имеющих происхождение из такого штамма, для демонстрации того, что они не вызывают какого-либо заболевания, причем последнее служит доказательством применимости данной методологии биоконтроля в полевых условиях.
Растения Arabidopsis
Семена дикого типа Arabidopsis thaliana (экотип Columbia) проращивали на среде MS (разведенной в два раза), дополненной 1% сахарозой и 0,8% агаром. Когда на всходах появлялись два листа, тогда их переносили на стерильный субстрат и оставляли в ростовых камерах в оптимальных для роста условиях (22°С, 70% влажности, 12 ч свет) до 4-недельного возраста.
Клеточные культуры в суспензии
Клетки выращивали в суспензии (Solarium lycopersicon сорта Money Maker; линия Msk8) при 24°С в темноте при 125 об./мин в среде MS (Duchefa, Haarlem, The Netherlands), дополненной 5,4 мкМ NAA (нафтилуксусная кислота), 1 мкМ 6-бензиладенина и витаминами (Duchefa), как описано ранее (Felix et al., 1991. Plant Physiol. 97, 19-25).
Грибы
Использовали следующие штаммы: Acremonium strictum SS71 по изобретению и штамм Colletotrichum acutatum M11 для инфицирования. Эти штаммы использовали в системе перекрестной защиты A.strictum/C.acutatum, определенной у сорта Pájaro. В данной системе штамм SS71 продуцирует соединение с защитной элиситорной активностью, а штамм М11 представляет собой вирулентный штамм против сорта Pájaro, используемый для оценки индуцирующей активности, демонстрируемой путем увеличенной устойчивости к антракнозу (вызываемому М11) у растений, предварительно обработанных штаммом SS71.
Для исследования защитной элиситорной активности против антракноза у других сортов земляники использовали другие штаммы Colletotrichum acutatum (например, МР3, LCF1), обладающие вирулентными свойствами в отношении соответствующих сортов.
Культуральные среды
Авирулентные патогенные штаммы A. strictum по изобретению культивировали в среде картофельно-глюкозный агар с 1,5% агаром (APG 1,5%). После плавления среду охлаждали до 45-50°С и распределяли по стерильным чашкам Петри (15 мл на чашку) после добавления стрептомицина сульфата (Richet) до конечной концентрации 300 мкг/мл. Жидкую культуру штамма A.strictum SS71 выращивали на картофельно-глюкозной (PG) среде, которая имеет такой же состав, что и среда APG без добавления агара, и приготовлена при помощи идентичного способа.
Условия культивирования
Штаммы хранили в конидиальных суспензиях (107-108 конидий/мл) в 50%-ном глицерине и поддерживали в замороженном состоянии при -70°С.
Культуры на твердой среде
Культуры различных штаммов на твердой среде получали при помощи высевания мицелия на среде APG 1,5% или путем высевания конидий, поддерживаемых в глицерине, и затем инкубировали в течение 10 суток в условиях, обеспечивающих оптимальный рост (28°С) и споруляцию (непрерывное освещение белым светом).
Жидкие культуры
Культуры в жидкой среде для штамма A.strictum по изобретению получали путем инокуляции 40 мл культуральной среды (PG), содержащейся в стеклянных контейнерах объемом 100 мл, таким объемом водной конидиальной суспензии, чтобы получить конечную концентрацию 106 конидий/мл культуральной среды. Конидиальную суспензию готовили в сутки проведения анализа из новой культуры на чашках (см. "приготовление конидиальной суспензии" ниже). Затем инокулированную жидкую среду инкубировали в оптимальных и благоприятных для споруляции условиях, т.е. 28°С при непрерывном освещении белым светом и без встряхивания, до стационарной фазы роста (21 суток). Данная культура обозначена как SN.
За культурами наблюдали при помощи макроскопических и микроскопических исследований. Макроскопическое исследование является качественным, позволяя обнаруживать: образование сверху мицелиальной пленки, цвет, мутность или непрозрачность, степень уплотненности и прочность. Микроскопические исследования заключались в наблюдении при 40-кратном увеличении за влажным препаратом (между предметным и покровным стеклами) для оценки чистоты и однородности культуры и отсутствия нетипичных клеток, указывающих на какую-либо контаминацию.
Пример 2
Приготовление конидиальной суспензии
Суспензию готовили в стерильных условиях из новых культур штамма A.strictum SS71 или М11, выращиваемых на среде APG при 1,5%. Конидии собирали путем соскребания поверхности колонии стерильной петлей или шпателем. Затем конидии ресуспендировали в определенном объеме стерильной дистиллированной воды (5 или 15 мл). Конидии перемешивали на вортексе в течение 1 минуты и фильтровали через некоторое количество волокнистой ткани с использованием стерильного шприца. Конидии подсчитывали в камере с сеткой Нейбауэра и затем в зависимости от предполагаемого использования суспензии осуществляли две различные процедуры.
Для анализов, где суспензию живых конидий штамма A.strictum SS71 или С.acutatum M11 использовали для инокуляции растений, суспензию корректировали путем разведения стерильной дистиллированной водой до концентрации конидий 1,5×106 конидий/мл. Наконец Tween 20 добавляли к суспензии до конечной концентрации 0,1% об./об. в качестве поверхностно-активного агента.
Для анализов с инокуляцией, где использовали инактивированный штамм A. strictum SS71 (см. "фитопатологические анализы" ниже), конидии авирулентного патогена инактивировали до разведения, осуществляемого для корректирования концентрации до желаемого значения. В этих случаях Tween 20 не использовали, чтобы избежать возможного взаимодействия между данным поверхностно-активным агентом и активным соединением.
Пример 3
Способ получения конидиального экстракта (СЕ)
Концентрированную конидиальную суспензию авирулентного Acremonium strictum SS71 по изобретению (в концентрации 108 конидий/мл) фракционировали на аликвоты объемом 1,5 мл в пробирках объемом 2 мл. Каждую аликвоту обрабатывали при помощи ультразвука до исчезновения типичной опалесценции суспензии, получая прозрачную жидкость. Для этой цели суспензию подвергали ультразвуковой обработке в течение 15 минут периодическими импульсами (каждый цикл ультразвуковой обработки составлял 20 секунд, отделяясь друг от друга периодами покоя 10 секунд) интенсивностью 60% и мощностью 40 Вт в ледяной бане. Использовали оборудование Brandon Sonifier Tune 40 с титановым наконечником. Пробирку, содержащую конидиальную суспензию, поддерживали в ледяной бане (0-4°С) для того, чтобы избежать перегрева.
После ультразвуковой обработки образца влажный препарат подвергали микроскопическому исследованию (40-кратное увеличение) для определения степени конидиальной деструкции по сравнению с исходной концентрацией, чтобы оценить эффективность клеточного лизиса при помощи способа ультразвуковой обработки. Затем продукт ультразвуковой обработки фильтровали через мембрану (Millipore GV в PVDF) с диаметром пор 0,45 мкм для удаления оставшихся клеток и конидий, не разрушившихся во время обработки. Также определяли концентрацию белка с получением значений около 1,5 мкг белка/мл. Обработанную суспензию затем разбавляли стерильной дистиллированной водой до достижения концентрации равной 1,5×106 конидий/мл относительно исходного количества конидий, что позволяет получить конечную концентрацию 0,12 мкг белка/мл. Данная фракция обозначена в данной заявке как СЕ.
Объемы суспензии, а также длительность и циклы ультразвуковой обработки стандартизировали для оптимизации клеточного лизиса.
Пример 4
Получение жидкого культурального супернатанта (SN)
Исходные культуры представляли собой две одинаковые жидкие культуры (среда PG) A.strictum SS71, каждая объемом 40 мл, которые инокулировали и инкубировали, как объяснено выше. После завершения стадии роста каждую культуру центрифугировали при 10400д в течение 20 мин при 4°С, осадок удаляли и супернатант извлекали. Затем супернатанты обеих культур собирали, и оставшийся осадок вновь центрифугировали при 10400д в течение 30 минут при 4°С. Затем извлеченный супернатант подвергали последующим фильтрациям в стерильных условиях для удаления ресуспендированных конидий. Сначала его фильтровали через фильтровальную бумагу Whatman №2, затем через мембранный фильтр из нитрата целлюлозы Millipore с диаметром пор 0,8 мкм и наконец через мембранный фильтр из нитрата целлюлозы Millipore с диаметром пор 0,45 мкм. Аксенический фильтрат представляет собой бесклеточный жидкий культуральный супернатант (SN). В этом случае извлекали объем 25 мл, в котором, как определили, концентрация белка составляет 8,43 мкг белка/мл.
Две культуральные фракции A.strictum SS71, как бесклеточный экстракт (СЕ), так и жидкий культуральный супернатант (SN), подвергали контролю на стерильность, заключающемуся во внесении фильтрованного продукта в виде бороздок на стерильную свежую среду APG 1,5% с последующей инкубацией на чашках в течение 48 ч при 28°С и при непрерывным освещением белым светом. Отсутствие грибкового роста подтверждало отсутствие живых клеток в фильтрате, как вегетативных клеток в экстрактах, так и репродуктивных структур (конидий) в фильтратах.
Пример 5
Характеристика элиситора, представленного в SN, приготовленном из Acremonium strictum по изобретению
Определение температурной стабильности
Для определения температурной стабильности активного соединения использовали две температурных обработки различной степени тяжести. Для этой цели бесклеточный супернатант жидкой культуры SS71 объемом 25 мл, который сохраняет способность обеспечивать защиту против штамма С. acutatum, вызывающего антракноз, подвергали следующим воздействиям.
А - Нагреванию путем кипячения в водяной бане (100-95°С в течение 15 мин при атмосферном давлении) (продукт SN1).
Б - Автоклавированию (121°С в течение 15 мин при избыточном давлении 1 атм (101325 Па)) (продукт SN2).
Содержание белка в образцах, соответствующих обеим обработкам, находилось ниже предела обнаружения используемого способа.
В - Протеолизу протеиназой К (SIGMA): к раствору, обладающему элиситорной активностью (10 мкг белка/мл), добавляли фермент до конечной концентрации 100 мкг протеиназы/мл, и его инкубировали при 50°С в течение 1 часа (данный экстракт обозначен как SNA) или в течение ночи (12 ч, данный экстракт обозначен как SNB).
Продукты, полученные после каждой инактивирующей обработки (продукты СЕ и SN и их производные: 1, 2, А, В), использовали для опрыскивания растений во время предварительной обработки до инокуляции (см. "фитопатологические анализы: система двойной обработки").
Пример 6: фитопатологические анализы: система двойной обработки
Схема эксперимента, использованная для оценки перекрестной защиты, заключается в стратегии двойной обработки, подробно описанной ниже.
1) Первая обработка: ИНДУКЦИЯ: заключается в опрыскивании надземных частей растения (черешки и листовые пластинки) до тех пор, пока с них не начнет капать, одной из фракций после различных обработок штамма A.strictum SS71 (фракции СЕ и SN). Полагают, что объем 5 мл является достаточным для увлажнения всех листьев 3-месячного всхода (4 полностью распустившихся листа).
2) После завершения первой обработки растения переносили в камеру для мониторинга, где их выращивали в условиях контролируемой влажности (70%), температуры (28°С) и фотопериода (16 ч света) в течение 72 ч (или в некоторых случаях в течение 7 суток). Замечание: период времени между первой и второй обработками в основном предназначен для того, чтобы обеспечить возможность активации механизмов защиты растения путем элиситорного действия.
3) Вторая обработка: ИНОКУЛЯЦИЯ: после завершения установленного периода (3-7 суток) надземные части (черешки и листья) растений, которые подвергли первой обработке, вновь опрыскивали до тех пор, пока с них не начнет капать, но в этом случае суспензией изолята М11 С.acutatum 1,5×106 конидий/мл, являющегося высоковирулентным в отношении сорта Pájaro. Замечание: на этой стадии живую конидиальную суспензию этого штамма всегда использовали для запуска взаимодействия совместимого типа (контроль заболевания) против разновидности земляники, используемой в анализе (сорт Pájaro), чтобы таким образом достичь приобретаемой растениями степени защиты против заболевания антракноза.
4) Непосредственно после второй инокуляции растения помещали в камеру для создания стресса (темнота, 100%-ная влажность, 30-32°С) и содержали в ней в течение 24 ч для того, чтобы вызвать открытие устьиц и способствовать прорастанию вирулентных патогенных конидий и проникновению инфекционных гиф в устьица и трихомы растений.
5) Наконец, растения переносили в камеру для мониторинга в условия, которые помимо того, что дают возможность для роста растения, также благоприятствуют развитию грибкового патогена. Растения поддерживали в этих условиях в течение 40 суток для оценки симптомов растения после инфицирования. На этой стадии определяли, возник ли антракноз или нет, в зависимости от уровня защиты, который достигается за счет различных обработок.
Контроли, использованные в проведенных анализах, были следующими.
1) Контроль состояния растения: множество растений сорта Pájaro получило идентичную обработку, что и анализируемые растения, но с использованием стерильной дистиллированной воды в обоих опрыскиваниях. В этих условиях растения не должны были демонстрировать симптомы заболевания.
2) Контроль перекрестной защиты (контроль индуцирующей способности штамма A.strictum SS71): множество растений сорта Pájaro подвергали первой инокуляции живой конидиальной суспензией авирулентного штамма A.strictum SS71 в концентрации 1,5×106 конидий/мл и через 72 ч (первые 24 ч в стрессовых условиях) второй инокуляции живыми конидиями вирулентного изолята С.acutatum M11 в той же самой концентрации. Данный эксперимент использовали для контроля того, что авирулентный патоген не утрачивал способность к "элиситорному" защитному ответу у сорта Pájaro, так чтобы растения не демонстрировали симптомы заболевания.
3) Положительный контроль вирулентности Colletotrichum acutatum (контрольный изолят М11, используемый для второй инокуляции): множество растений сорта Pájaro подвергали идентичной обработке, что и анализируемые растения, но с использованием стерильной дистиллированной воды. В этом случае у растений должно было развиться заболевание и увядание в течение максимального периода, составляющего 21 сутки.
4) Разбавитель (жидкая культуральная среда) в качестве положительного контроля неактивности (отсутствие активных соединений): для проверки того, что действие, производимое супернатантом, используемым в анализах, возникает в результате присутствия активных соединений, происходящих исключительно вследствие роста грибов, а не из используемой жидкой культуральной среды, в отношении множества растений сорта Pájaro осуществляли обработку, идентичную обработке анализируемой партии, но первую обработку заменяли на опрыскивание средой PG. Ожидаемые результаты такой обработки представляли собой растения, у которых развивалось заболевание и увядание в течение максимального периода, составляющего 21 сутки.
5) Положительный контроль Acremonium strictum (штамм SS71, продуцирующий элиситор и используемый в первой инокуляции системы перекрестной защиты). Для подтверждения того, что штамм A. strictum SS71 является активным и может запускать заболевание у генотипов, чувствительных к одному и тому же патогену, в отношении множества растений дикой земляники F.vesca (высокочувствительных) осуществляли однократную инокуляцию живой конидиальной суспензией такого штамма в концентрации 1,5×106 конидий/мл, которая является той же самой, что и концентрация, используемая для того, чтобы обеспечивать ответ перекрестной защиты у сорта Pájaro. У растений должно было развиться заболевание, и они должны были погибнуть приблизительно через 7 суток после инокуляции.
6) Положительный контроль на безвредность фракций, полученных из такого штамма, содержащих или не содержащих элиситор, если таковые имеются. Для подтверждения того, что экстракты и супернатанты не содержат агентов, являющихся фитотоксическими или патогенными для культуры земляники, и, таким образом, безвредны, и их можно применять в полевых условиях, множество растений дикой земляники F.vesca, высокочувствительных к A.strictum SS71, инокулировали каждой из фракций этих патогенных культур (СЕ, SN или субфракциями в результате очистки) в той же самой концентрации, что и концентрация, используемая для оценки устойчивости, индуцированной у сорта Pájaro. Растения не должны были демонстрировать симптомы заболевания.
Эксперименты проводили трижды, и каждый фитопатологический анализ осуществляли рандомизированно с 4 растениями на экспериментальную партию и 4 растениями для каждого контроля. Представленные результаты соответствуют среднему значению (ξ) одного из повторных опытов, поскольку дисперсия (s2) между обоими повторными опытами была практически нулевой. В таблице 2 обобщены проведенные эксперименты и контроли, использованные в данном примере.
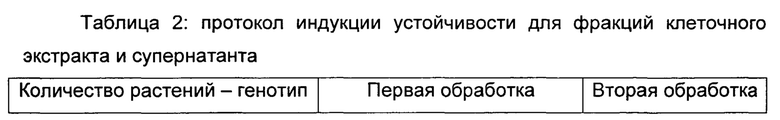
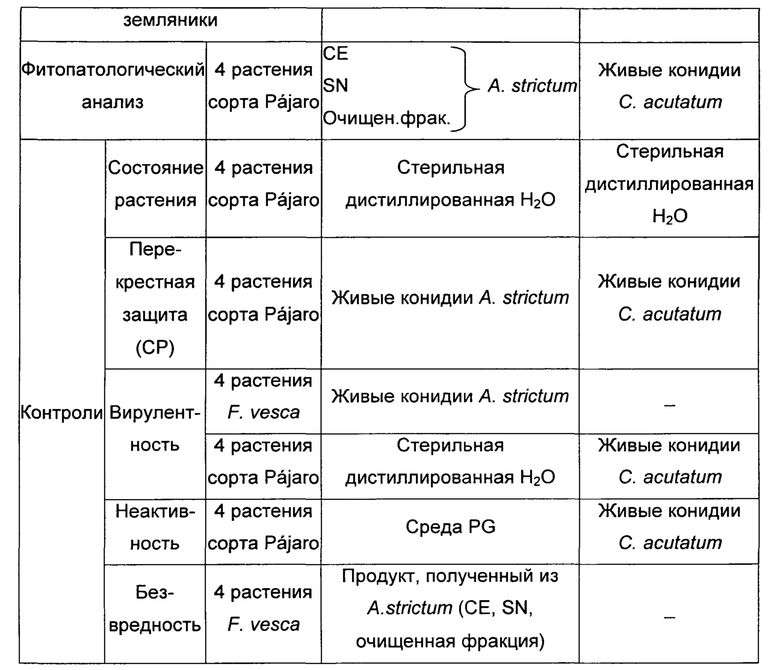
Статистический анализ данных
Использовали программное обеспечение Statistix (1996 Windows Analytical software). Исследовали среднюю арифметическую DSR как измерение положения. Программное обеспечение рассчитывало среднее арифметическое значений DSR (среднее четырех статистических единиц каждого повторного опыта), соответствующих четвертому периоду оценки (40 суток) для каждого фитопатогенного анализа, осуществляемого с фракциями культур A.strictum, полученными при помощи различных способов обработки. Ctr-PC означает контроль перекрестной защиты, a Ctr-Ca означает положительный контроль инфицирования живыми конидиями С.acutatum. Сравнение между различными способами анализа производили при помощи "теста LSD (наименьшая значимая разность)" и "теста Тьюки" со степенью значимости 5% (α=0,05) в обоих случаях. Для исследования дисперсии данных по сравнению со средними значениями осуществили дисперсионный анализ (ANOVA).
Пример 6
Очистка элиситора
Элиситор по настоящему изобретению очищали из супернатанта 21-суточной культуры штамма A. strictum SS71, выращиваемой при 28°С при непрерывном освещении белым светом в среде PG без перемешивания (фракция SN). После культивирования в течение 21 суток супернатант собирали путем центрифугирования при 10000g (30 мин, 4°С) и фильтровали через диатомовую землю и затем через мембрану Millipore с диаметром 0,22 мкм. Аксенический супернатант замораживали и концентрировали в 10 раз в вакууме (лиофилизация).
Экстракт затем пропускали через диализную трубку (отсечение 12 кДа) и дополнительно концентрировали в 4 раза путем дегидратации с использованием PEG (MW (молекулярная масса) 15000-20000; Sigma) при 4°С. Концентрированный экстракт подвергали ультрафильтрации под давлением газообразного азота через молекулярный фильтр (отсечение 30 кДа; AMICON). Оставшуюся на мембране фракцию извлекали, промывая поверхность мембраны буфером 20 мМ Tris-HCl (pH 7,5). Элиситорную активностью измеряли в концентрате и в фильтрате, подтверждая то, что вся активность сохранялась во фракции с большей молекулярной массой, задерживаемой мембраной. Экстракт, содержащий активный элиситорный полипептид, подвергали двум стадиям хроматографического разделения при помощи FPLC: анионный обмен и гидрофобное взаимодействие.
Для первой хроматографии использовали колонку Sepharose Q Fast Flow (Pharmacia-FPLC), а для второй колонку Phenyl Superose HP (GE-FPLC), обе адаптированные к системе FPLC, с регистрацией при А, равной 280 нм. Матрицу Sepharose Q уравновешивали 20 мМ Tris HCl (pH 7,5) и элюировали путем увеличения ионной силы при помощи ступенчатого градиента NaCl в три стадии: 0,24 М (8 мин), 0,38 М (8 мин) и 1 М (10 мин); скорость потока 1 мл/мин. Фракцию с элиситорной активностью, соответствующую промывке колонки (фракция, элюируемая без соли), собирали и подвергали новой хроматографии с использованием колонки Phenyl Superose HP (GE-FPLC), уравновешенной буфером А: 50 мМ Tris HCl (pH 7,5), EDTA (1 мМ) и (NH4)2SO4 (1,5 М). Элюирующий буфер В имеет тот же состав, что и буфер А, но без добавления (NH4)2SO4. Образцы элюировали путем уменьшения ионной силы при ступенчатом градиенте соли (NH4)2SO4, разделенном на 8 стадий: 22% В (5 мин), 30% В (7 мин), 40% (7 мин), 50% (7 мин), 70% (5 мин), 80% (5 мин), 90% (5 мин), 100% (10 мин); скорость потока равна 1 мл/мин. Активность всех фракций тестировали при помощи двух параллельных способов, анализируя продукцию ROS и защиту растения против патогена С.acutatum M11.
Фракцию, элюируемую при 0,5 М (NH4)2SO4, обнаружили в виде одного пика (пик 7, Фиг.6), и она продемонстрировала обе анализируемые активности. Данный пик собирали и обессоливали дважды; сначала путем диализа против бидистиллированной воды и затем путем пропускания через ультратонкую колонку Sephadex G25 (SIGMA). На каждой стадии очистки количественно оценивали общее содержание белков и их разделяли при помощи SDS-PAGE в полиакриламидных гелях (12%), окрашивали кумасси бриллиантовым синим и/или серебром (Sambrook. et. al, 1989. Molecular cloning, a laboratory manual. Second edition). Обессоленная фракция, элюированная с колонки HP (пик 7) демонстрировала одну полосу 34 кДа на SDS-PAGE (10%).
Определение общего белка: метод Брэдфорда
Содержание общего белка в водорастворимых образцах определяли с использованием набора для анализа белка "Bio-Rad Protein Assay Kit II", основанного на методе Брэдфорда (Bradford, 1976. Anal. Biochem. 72, 248-254). Продукты, полученные до этой стадии, использовали в первой обработке фитопатологических анализов индуцированной устойчивости.
Пример 7: оценка элиситорной активности на каждой стадии очистки
Элиситорную активность на каждой стадии очистки оценивали у растений земляники, анализируя аккумуляцию ROS (например, Н2О2 и О2-) и защиту против антракноза. В последнем случае ее определяли при помощи фитопатологических анализов способности различных фракций и очищенного белка защищать растение против вирулентных патогенов. Методология, используемая для фитопатологических анализов, была изложена выше.
Оценка окислительного взрыва
Аккумуляцию Н2О2 обнаруживали при помощи гистохимического окрашивания DAB (у земляники) или флуоресцентного зонда DCFH-DA (у Arabidopsis), а аккумуляцию O2- обнаруживали при помощи гистохимического окрашивания NBT (у обоих видов).
Для оценки развития окислительного взрыва отслеживали образование перекиси водорода и супероксидного радикала в различные моменты времени. Для этой цели растения земляники (сорт Pájaro) обрабатывали элиситором в концентрации 10 мкг/мл и в различные моменты времени, находящиеся в диапазоне от 0 до 12 часов после обработки (hpt) элиситором, 10 проксимальных или дистальных молодых листьев срезали и инкубировали в растворе, содержащем 0,1% (масс./об.) DAB, 10 мМ MES (2-(N-морфолино)этансульфоновая кислота), рН 3,8 (для обнаружения перекиси) или 0,1% (масс./об.) NBT, 10 мМ азид натрия, 10 мМ фосфат калия (pH 7,8) без добавления NADPH (восстановленный никотинамидадениндинуклеотидфосфат) (для обнаружения супероксида). Листья затем инкубировали в течение периода времени от 2 до 8 ч в темноте под давлением газообразного азота. После инкубации ткань фиксировали и обесцвечивали путем нагревания в 95%-ном этаноле (масс./об.), осветляли смесью молочная кислота/глицерин/H2O [3:3:4] в течение 24 ч и закрепляли на предметном стекле с 60% глицерином. Гистохимическое окрашивание наблюдали и документировали при помощи микроскопа Olympus BH-2 с цифровой камерой. Растения, обработанные водой и стерильной средой PG, использовали в качестве отрицательных контролей.
Внутриклеточное обнаружение перекиси водорода в листовой ткани Arabidopsis осуществляли при помощи флуоресцентного зонда DCFH-DA. Готовили маточный раствор с концентрацией 10 мМ в DMSO, а рабочий раствор готовили в концентрации 40 мкм в 10 мМ фосфатном буфере (pH 7,4). Листья, собранные в различные моменты времени после обработки элиситором, инкубировали в растворе DCFH-DA в темноте под давлением газообразного азота в течение 15 минут и незамедлительно наблюдали под флуоресцентным микроскопом. Для обнаружения флуоресценции использовали микроскопические наблюдения и фотографирование на микроскопе модели Olympus BXS1, оборудованном эпифлуоресцентной системой типа U-LH 100HG, фильтром возбуждения U-MWB2 и цифровой камерой. Обнаружение аниона O2- осуществляли при помощи гистохимического окрашивания NBT, как описано выше для земляники.
Количественная оценка при помощи флуоресценции продукции NO и ROS в клетках томата (Solarium lycopersicon), культивируемых в суспензии
Культуры клеток томата в возрасте 4-5 суток в суспензии подвергали различным обработкам в микротитровальных планшетах (для измерений флуоресценции). Обнаружение ROS (Н2О2) в клетках осуществляли с использованием флуоресцентного зонда H2DCF диацетата (2',7'-дифтордигидрофлуоресцеин диацетат) (Molecular Probes). Последний, первоначально описанный для фагоцитов, адаптировали и модифицировали для измерения реакции окислительного взрыва в индуцированных элиситором клеточных культурах в суспензии при помощи анализов в микропланшетной многоканальной автоматической флуоресцентной системе. Количественную оценку окиси азота (NO) в клетках осуществляли с использованием флуоресцентного зонда DAF-FM диацетата (4-амино-5-метиламино-2',7'-дифлуоресцеин диацетат) (Molecular Probes).
Девяносто мкл суспензии клеточной культуры осторожно добавляли в виде аликвот с помощью микропипетки в лунки 96-луночного микротитровального планшета (Grein Lader), содержащего 0,025 мкМ H2DCF-DA или 0,5 мкМ DAF-FM-DA и 10 мкл элиситора с различными концентрациями (конечная концентрация 5 или 10 мкг/мл, соответственно). Микропланшет немедленно переносили во флуориметр для проведения измерений. Продуцируемую клетками флуоресценцию, возникающую в результате реакции окислительного взрыва, непрерывно регистрировали в течение 30 минут в микропланшетном флуориметре Fluoroskan Acsent (Termo Electron Company, Vantaa, Finland) с использованием фильтров Chroma D480-40 и D525-30 (Chroma Technology Corp, Rockingham, VT, AS) с использованием λвозбужд. равной 480 нм и λизлуч. равной 525 нм.
Флуоресценцию в каждой индивидуальной лунке измеряли каждые 20 миллисекунд в течение 2 минут при 25°С. Между измерениями клеточные суспензии встряхивали при 120 об./мин с вращением 1 см при 25°С. Все эксперименты проводили в трех повторностях. Образующуюся в результате флуоресценцию выражали в виде относительной продукции ROS. Контрольные клетки обрабатывали 20 мкл преинкубационной среды вместо элиситора. Ксиланазу, имеющую происхождение из Trichoderma viride, использовали в качестве контроля индукции ROS и NO в концентрации 10 и 100 мкг/мл, соответственно. Контрольные эксперименты также осуществляли со скавенжерами NO (cPTIO: калиевая соль 2-(4-карбоксифенил)-4,4,5,5-тетраметилимидазолин-1-оксил-3-оксида) и ингибиторами фермента синтазы оксида азота (аргининовые конкуренты), NADPH-оксидазы (апоцинин) и обоих ферментов (DPI: дифенилйодоний) для подавления источника флуоресцентных частиц. Обработку ингибиторами осуществляли путем инкубации клеток за 30 минут до обработки.
Анализ отложения каллозы
Для обнаружения аккумуляции каллозы листья земляники обрабатывали и окрашивали. Растения опрыскивали очищенным элиситорным белком (10 мкг/мл) или водой. Листья собирали через 7 суток после обработки элиситором (7 dpi). В качестве положительного контроля отложение каллозы оценивали у растений, инфицированных вирулентным изолятом С.acutatum M11 через 7 суток после обработки. В данном случае листья анализировали через 48 часов после инокуляции М11, и затем ткань осветляли и дегидратировали со 100% EtOH в течение ночи. Осветленную ткань последовательно переносили в этанольные растворы в 67 мМ буфере K2HPO4 (рН 12) с уменьшающейся концентрацией от 100% до 0% (например, 100%, 75%, 50%, 25% и 0%) и затем окрашивали в течение 1 часа при комнатной температуре 0,01% анилиновым синим в 67 мМ K2HPO4 (pH 12). Окрашенный материал затем помещали в 30% глицерин и проверяли с использованием ульрафиолетовой эпифлуоресценции в микроскопе модели Olympus BXS1, упомянутом выше.
Определение салициловой кислоты
Салициловую кислоту (SA) определяли в экссудате флоэмы листьев растений сорта Pájaro, опрысканных элиситором (15 мкг/мл). После опрыскивания листья собирали в различные моменты времени для экстракции жидкости флоэмы. Контроли эксперимента состояли из растений, обработанных водой (отрицательный), ВТН и вирулентным изолятом С.acutatum М11 в качестве положительных контролей. В различные моменты времени после обработки экссудат флоэмы собирали с использованием микропипетки из черешков полностью распустившихся листьев двух растений и вместе помещали в один образец. Концентрацию SA определяли для каждого момента времени. Экссудаты помещали в охлажденный подкисленный 100% этанол (pH 2,5) для осаждения белков и других высокомолекулярных соединений.
После удаления нерастворимых веществ путем центрифугирования (12000g в течение 15 минут при 4°С), этанольные экстракты переносили в предварительно взвешенные микроцентрифужные пробирки и концентрировали досуха в вакууме с использованием концентратора для образцов SVC 200 SpeedVac Sample Concentrator (Savant Instrumentos Co., Farmingale, NY). После высушивания пробирки взвешивали для расчета сухой массы, и образцы ресуспендировали в 250 мкл 30% метанола.
Отделение SA осуществляли при помощи HPLC с использованием обращенно-фазовой колонки С18 (Phenomenex, CV (объем колонки) равен 3,4 мл), уравновешенной в 30% метаноле. Запуски осуществляли при скорости подвижной фазы 0,5 мл/мин и с линейным градиентом элюирования метанолом (0-100% в течение 15 минут) и затем удерживания при 100% в течение 20 минут. SA определяли спектрофотометрически при 280 нм с использованием УФ-детектора и пика SA, элюируемой 100% метанолом в использованных условиях. Количественный анализ осуществляли при помощи флуоресценции с использованием спектрофлуориметра с подсчетом фотонов ISS-PC1. Концентрацию салициловой кислоты определяли в каждой собранной фракции при помощи HPLC (λвозбужд. равна 296 нм, λизлуч. равна 408 нм). Каждую величину определяли как среднее значение между двумя повторными опытами типичного эксперимента, проведенного в двух параллелях. Данные выражали в виде общей SA на грамм сухой массы экссудата. Обнаружение аутофлуоресценции
Поскольку сообщалось о том, что развитие защитного ответа может быть ассоциировано с аккумуляцией аутофлуоресцирующих соединений, исследовали присутствие аутофлуоресцирующих соединений в листьях земляники после обработки экстрактами, содержащими элиситор, причем чистый белок и другие растворы использовали в качестве контролей. Обработку осуществляли путем пропитывания через абаксиальную сторону молодого листа объема приблизительно 50 мкл воды или элиситора (10 мкг/мл) с использованием безыгольного шприца, и реакцию контролировали в течение 96 ч при помощи УФ эпифлуоресценции (329 нм). Микрофотографии получали на микроскопе ВН-2 Olympus.
Пример 8: молекулярная характеристика элиситора
Микросеквенирование, обнаружение сходства и выравнивание
Элиситорный полипептид, очищенный при помощи хроматографии с гидрофобным взаимодействием с использованием системы FPLC, разделяли на 12%-ном полиакриламидном геле в денатурирующих условиях с использованием буферной системы Tris-глицин с SDS и затем подвергали электроблоттингу на мембрану Immobilon-PSQ с диаметром пор 0,1 мкм в 10 мМ буфере CAPS (3-(циклогексиламино)-1-пропансульфокислота) (pH 11).
Полосу, соответствующую полипептиду, экстрагировали из геля и подвергали микросеквенированию при помощи реакции расщепления по Эдману с использованием газофазного секвенатора 476 Applied Biosystems. Полученные аминокислотные последовательности сравнивали с известными последовательностями, хранящимися в базах данных, с использованием программного обеспечения BLAST и программного обеспечения DNAMAN (версия 4-03).
Создание экспрессионной библиотеки изолята, продуцирующего элиситор (SS71)
Для получения полноразмерной последовательности элиситорного полипептида клонировали транскрипт кДНК. Экспрессионную библиотеку создавали на основе грибкового мицелия культуры SS71, выращиваемой в жидкой среде PG до стационарной фазы.
Тотальную РНК грибкового мицелия штамма SS71 выделяли следующим образом: каждый образец (приблизительно 1,2 грамма) измельчали с использованием ступки и пестика с жидким N2 и гомогенизировали с 8 мл экстракционного буфера, предварительно нагретого до 65°С.
Композиция экстракционного буфера, используемого для выделения РНК, была следующей: Tris-HCl, 100 мМ (pH 8); EDTA, 25 мМ (pH 8); NaCl, 2,5 М; СТА, 2%; PVP (поливинилпирролидон), 2%; спермидин, 0,5 г/л; β-меркаптоэтанол, 2%. После гомогенизации смесь инкубировали при 65°С в течение 30 мин при интенсивном встряхивании каждые 5 мин. После центрифугирования при 5000g в течение 10 мин при 4°С супернатант фильтровали через колонку QIAShredder (Qiagen) и в течение одного часа инкубировали на льду. Затем ее дополнительно центрифугировали при 14000g в течение 10 мин при 4°С для удаления любого оставшегося растительного материала в суспензии. Супернатант очищали при помощи двух экстракций равным объемом смеси хлороформ/изоамиловый спирт (24:1) с последующим центрифугированием при 14000g в течение 5 мин при 4°С. Очищенный раствор затем осаждали с 1/4 объема 10 М LiCl и инкубировали при 4°С в течение ночи. На следующий день осадок центрифугировали при 14000g в течение 45 мин при 4°С, и осадок промывали 70%-ным этанолом и ресуспендировали в 100 мкл бидистиллированной воды, обработанной 0,1% об./об. DEPC (диэтилпирокарбонат). Наконец осуществляли окончательную очистку и обработку ДНКазой "непосредственно в колонке" с использованием, соответственно, наборов RNAeasy MiniKit и RNase-Free DNase Set (Qiagen) в соответствии с инструкциями производителя. Концентрацию и чистоту тотальных образцов РНК определяли спектрофотометрически путем измерения поглощений при 260, 230 и 280 нм. Концентрацию тотальной РНК рассчитывали с использованием следующей формулы:
РНК [нг/мкл]=А260 × фактор разведения × FC,
где FC представляет собой коэффициент пересчета (нг/мкл): 1 единица поглощения составляет приблизительно 40 нг/мкл РНК.
Чистоту с точки зрения контаминации белком и углеводом/полифенолами оценивали при помощи отношений А260/А280 и А260/А230 (оба должны быть больше 2).
После количественной оценки образцы немедленно использовали в реакциях обратной транскрипции или хранили до последующего использования при -80°С, будучи осажденными 1/10 объема ацетата натрия и 2 объемами этанола. Соответствующую библиотеку кДНК использовали для реакций амплификации при помощи ПЦР (полимеразная цепная реакция).
Выделение последовательности, кодирующей элиситорный полипептид, при помощи ПЦР с использованием вырожденных праймеров
Полувырожденные праймеры использовали для амплификации последовательностей ДНК, кодирующих элиситорный белок из A. strictum.
Внутренние и амино-концевые секвенированные пептиды элиситорного белка использовали для конструирования олигонуклеотидных праймеров, обладающих самой низкой возможной степенью вырожденности (вариации нуклеотидов по позиции). Для этой цели области, содержащие аминокислоты с меньшим разнообразием генетического кода (например,: триптофан), использовали в качестве матриц, а также менее консервативные аминокислотные области для того, чтобы избежать получения кДНК, кодирующей белок, гомологичный интересующему белку с защитной элиситорной активностью защиты против заболевания.
При конструировании праймеров принимались во внимание следующие критерии: (1) наиболее часто используемые кодоны у видов Acremonium strictum и других видов Acremonium spp. и (2) кодоны, обнаруженные в белках с высокой идентичностью последовательности (полученные в результате поиска, выполненного при помощи BLAST), которые относятся к другим видам.
Использованные полувырожденные праймеры представляли собой:
NH2 F1 (N1): 5'-GCNTAYACNACNCARGCNT-3' (SEQ ID NO: 3);
NH2 F2 (N2): 5-CAGGCBWSBGCBCCBTGG-3 (SEQ ID NO: 4);
внутренняя F (IF): 5ATYATYGCYGGYATYAACTAYG-3' (SEQ ID NO: 5);
внутренняя R (IR): 5-CRTAGTTRATRCCRGCRATRAT-3' (SEQ ID NO: 6);
COOH R1 (C1): 5-RATVACRCCVGTVGTVGCRAT-3' (SEQ ID NO: 7);
COOH R2 (C2): 5-GTTVGGVGTRCCVWSVGGR-3' (SEQ ID NO: 8).
С целью селективно выделить последовательность, соответствующую белку с элиситорной активностью, осуществили три последовательные амплификации с использованием различных комбинаций вырожденных праймеров.
Протокол, используемый для амплификации при помощи ПЦР, был следующим.
1: Исходную амплификацию осуществляли для обогащения образца интересующим продуктом с использованием самых удаленных смысловых и антисмысловых праймеров (N1 и C2). Двадцать нг кДНК из экспрессионной библиотеки использовали в качестве матрицы для реакции ПЦР.
2: Второй тип амплификации путем гнездовой ПЦР осуществляли с использованием в качестве матрицы продукта амплификации, полученного в результате первой ПЦР, разбавленного в 125 раз в реакционной смеси (2 мкл разведения 1/10 в конечном объеме 25 мкл). В данной амплификации использовали самые внутренние смысловые и антисмысловые праймеры (N2 и C1). 1,5%-ный агарозный гель использовали для визуализации амплифицированного продукта. Полосы, соответствующие кандидатам, отбирали в соответствии с их размером в геле, вырезали из геля и очищали при помощи набора для очистки полос.
3: Затем проводили две независимые реакции ПЦР с использованием в качестве матрицы раствора нуклеиновой кислоты, очищенной на предшествующей стадии (4 мкл), происходящей из одной полосы 800 п.н., амплифицированной при помощи гнездовой ПЦР. Для каждой реакции амплификации использовали внутренний праймер (IF или IR) в комбинации с амино-концевым праймером N2 (N2/IR) или в комбинации с карбокси-концевым праймером (C1/IF).
Сумма размеров полос, полученных при использовании N2/IR и C1/IF, должна быть равна массе полосы, из которой они происходят (приблизительно 800 п.о.). Комбинируя праймеры N2/IR, получили одну полосу подходящей интенсивности 350 п.о, а с C1/IF получили одну полосу приблизительно 500 п.о.
Реакции осуществляли в конечном реакционном объеме 25 мкл, содержащем 50 мМ KCI, 20 мМ Tris-HCl (pH 8,4), 1,5 мМ MgCl2, 2 мкМ каждого праймера (смыслового и антисмыслового), 0,2 мМ каждого dNTP (дезоксирибонуклеотидтрифосфата) и 0,75 Е Taq-ДНК-полимеразы (Invitrogen).
Условия реакций ПЦР включали исходную денатурацию в течение 10 мин при 94°С, с последующими 40 последовательными циклами по 45 с при 94°С (денатурация), 30 с при 55°С (гибридизация праймера) и 1,5 мин при 72°С (элонгация праймера). Наконец, окончательный период элонгации составил 10 мин при 72°С.
Оптимальные температуры для гибридизации праймера определяли после тестирования при различных температурах, находящихся в диапазоне от 45°С до 55°С. Дополнительно, для оптимизации условий реакции тестировали различные концентрации MgCl2, концентрацию геномной ДНК и каждого из праймеров. Реакции амплификации проводили в термоциклере РТС-100 от MJ Research Inc.
Разделение и очистка продуктов ПЦР
40 мкл общего реакционного объема загружали в ТВЕ/1,5% агарозный гель, и продукты амплификации разделяли при помощи электрофореза при 90 В в течение 1 часа, затем окрашивали бромистым этидием и визуализировали при помощи УФ трансиллюминатора (320 нм).
На второй и третьей стадии амплификации, где обнаружены полосы с подходящими интенсивностью и размером, полосы вырезали из геля, очищали, как изложено ниже, и концентрировали, элюируя в объеме 20 мкл. Аликвоту 5 мкл очищенных фрагментов использовали для их повторной амплификации при помощи ПЦР с использованием тех же самых условий и тех же самых праймеров, что и использованные в исходной амплификации. Наконец, присутствие ампликона подтверждали при помощи электрофореза.
Клонирование и секвенирование продуктов ПЦР
Во всех случаях продукты ПЦР клонировали непосредственно в клонирующий вектор pCR®2.1 (Invitrogen). Вектор pCR®2.1 содержит промоторы РНК-полимераз бактериофагов Т7 и Т3, фланкирующие область множественного клонирования в кодирующей области фермента β-галактозидазы (lac Z). Клонированные фрагменты секвенировали с использованием секвенирующих праймеров, располагающихся выше и ниже промоторов бактериофага в соответствии с указаниями производителя.
Получение компетентных клеток Е.coli
Аликвоту 100 мкл чистой культуры Escherichia coli DH5α в экспоненциальной фазе роста инокулировали в 40 мл свежей среды и выращивали при 37°С и 250 об./мин до оптической плотности 0,6 (ОП при 550 нм). Культуру, полученную в этих условиях, поддерживали в ледяной бане в течение 10 мин и затем центрифугировали при 4°С в течение 10 мин при 7000 об./мин. Супернатант удаляли и клетки ресуспендировали в 5 мл стерильного 0,1 М CaCl2. Ресуспендированные клетки оставляли на льду на 20 мин, центрифугировали, как указано выше, и после асептического отбора супернатанта клетки осторожно ресуспендировали в 500 мкл 0,1 М CaCl2, предварительно охлажденного при 4°С. Клеточную суспензию хранили в холодильнике при 4°С в течение ночи.
Трансформация
Трансформацию компетентных клеток осуществляли посредством температурного шока в соответствии с Sambrock et al. (Sambrook et al., 1989. Molecular cloning, a laboratory manual. Second edition).
Проверка вставок и секвенирование
Для каждого события клонирования 10 белых колоний отбирали для дальнейшего анализа и выращивали в течение 24 часов на планшетах с агаром LB, дополненном 100 мкг/мл ампициллина. Из этих колоний готовили жидкие культуры в 8-10 мл среды LB с ампициллином (100 мкг/мл). Плазмиды затем экстрагировали и очищали в соответствии с Sambrook et al. (Sambrook et al., 1989. Molecular cloning, a laboratory manual. Second edition).
Плазмиды элюировали в 100 мкл стерильной бидистиллированной воды, и целостность и количество ДНК проверяли, как описано в разделе 2.3. Идентификацию положительных клонов (проверку вставок) проводили при помощи методики ПЦР с использованием универсальных праймеров Т3 (5'-ATTAACCCTCACTAAAGGGA-3') (SEQ ID NO: 9) и Т7 (5'-TAATACGACTCACTATAGGG-3') (SEQ ID NO: 10) в реакционном объеме 20 мкл, содержащем 1-кратный буфер для Taq-полимеразы без Mg, 2 мМ MgCl2, 0,5 мкМ каждого прамера, 0,2 мМ каждого dNTP, 1 Е Taq-ДНК-полимеразы (Promega) и 50 нг плазмидной ДНК. Условия реакции были следующими: денатурация в течение 2 мин при 95°С, 30 циклов по 30 с при 95°С, 30 с при 52°С и 1 мин при 72°C с последующим окончательным добавлением 5 мин при 72°С. Продукты ПЦР разделяли на 1% агарозных гелях в 0,5-кратном ТВЕ, окрашивали бромистым этидием и визуализировали при Уф-освещении. Те же самые праймеры, что и использованные для проверки вставки, использовали для секвенирования каждой вставки в обоих направлениях.
Редактирование последовательности и поиск гомологии ДНК-белок
Полученные последовательности вначале анализировали при помощи алгоритмов VecScreen и ORF Finder (http://.ncbi.nim.nih.gov/) для удаления векторных последовательностей и идентификации потенциальных открытых рамок считывания, соответственно. Программное обеспечение DNAMAN версия 5.2.2 (Lynnon Biosoft, Quebec, Canada) использовали для сборки нуклеотидных последовательностей и получения выведенных аминокислотных последовательностей. Нуклеотидные и аминокислотные последовательности сравнивали с последовательностями, депонированными в базе данных GenBank NR с использованием эвристических алгоритмов Blast X и Blast P. Ожидаемое пороговое значение было установлено на уровне 0,0001 (е-значение), которое представляет собой значение, эмпирически определенное для рандомизированного фильтрования ожидаемых выравниваний вследствие размера области поиска. При помощи программ CDSearch (NCBI), SMART 5 и Pfam (Sanger Institute) определяли присутствие структурных мотивов и/или консервативных доменов.
Конструирование специфических праймеров
Для подтверждения последовательности, соответствующей зрелому транскрипту кДНК элиситорного белка, сконструировали специфические праймеры из консенсусной нуклеотидной последовательности, полученной из 10 выбранных клонов. Кроме того, также выбирали менее консервативные области семейства субтилизинов, которые не содержат вариабельных нуклеотидов в последовательностях различных клонов. Праймеры конструировали с использованием программного обеспечения DNAMAN версии 5.2.2.
GSPvar-F: 5'-GGCCCAACTGGCTACACC-3' (SEQ ID NO: 11)
GSPvar-R: 5'-ATGGCGACGATGCGGTTG-3' (SEQ ID NO: 12)
Полное секвенирование кДНК с использованием методологии RACE-ПЦР Полноразмерную последовательность транскрибируемой комплементарной ДНК (кДНК) или зрелый транскрипт, соответствующий элиситорному белку, получали при помощи методики RACE (быстрая амплификация концов кДНК) в соответствии с Frohman et al. (Frohman et al., 1988. Proc. Natl. Acad. Sci. USA. 85, 8998-9002).
Использовали систему GeneRacer от Invitrogen, основанную на методике, в которой используется РНК-лигаза (RLM-RACE: быстрая амплификация концов кДНК, опосредованная РНК-лигазой), следуя указаниям производителя.
Получали RACE-подобную экспрессионную библиотеку продуцирующего элиситор патогенного изолята A. strictum SS71, включающую первые цепи кДНК с сайтами отжига для праймеров GeneRacer с 5'- и 3'-концов. Кратко, система технологии GeneRacer основана на обработке выделенной мРНК фосфатазой (CIP), которая удаляет фосфатные группы, присутствующие на 5'-конце частично деградированных мессенджеров, таким образом, что только с мессенджерами, имеющими полноразмерную последовательность и защищенными кэпом или структурой типа "кэп", может продолжиться протокол клонирования. Затем, мРНК обрабатывают пирофосфатазой (ТАР), которая удаляет данный "кэп" с недеградированной мРНК, оставляя фосфатную группу в 5'-положении, которая может быть связана олигонуклеотидом РНК со специфической последовательностью, которую будут использовать в процессе амплификации, типичном для методики RACE.
Конструирование специфических праймеров для RACE
Конструирование ген-специфических праймеров (GSP), которые отжигаются с 5'- и 3'-концами интересующего генного фрагмента, осуществляли с использованием программы DNAMAN версии 5.2.2 (Lynnon Biosoft, Quebec, Canada) в соответствии с приведенными ниже критериями.
- высокотемпературный отжиг (больше 72°С), который достигается за счет длины праймеров (24-28 нуклеотидов) и высокого содержания GC (50-70%);
- низкое содержание GC к 3'-концу праймеров (не больше чем два остатка G или С в последних 5 основаниях);
- отсутствие самокомплементарности в праймере и отсутствие последовательностей, комплементарных используемым праймерам GeneRacer;
- конструирование гнездовых праймеров (гнездовая RACE), расположенных в первой амплифицированной последовательности для увеличения специфичности с использованием методики гнездовой ПЦР, которая заключается во второй амплификации с использованием в качестве матрицы продукта первой амплификации. Характеристики этих внутренних праймеров должны быть подобны упомянутым выше.
Для получения нуклеотидной последовательности 5'- и 3'-концов зрелого транскрипта, соответствующего элиситорному белку, с использованием методики типа RACE конструировали специфические праймеры в соответствии с требованиями, описанными выше, исходя из последовательности, подтвержденной путем клонирования с праймерами GSPvar-F и GSPvar-R.
Праймеры, использованные для получения 5'-конца, представляли собой:
GSP RACE-R (GSP-5): 5'-GATGTTGTTGTCGATCAAGGACTTGG-3' (SEQ IDNO: 13);
GSP RACE Nested-R (GSPN-5): 5'-TGCCTTGGTAGGAGACAAGCTGGAA-3' (SEQ ID NO: 14);
Праймеры, использованные для получения 3'-конца, представляли собой:
GSP RACE-F (GSP-3): 5'-AGCTTGTCTCCTACCAAGGCAGCAA-3' (SEQ ID NO: 15);
GSP Race Nested-F (GSPN-3): 5'-GGCCAAGTCCTTGATCGACAACAAC-3' (SEQ ID NO: 16);
Праймеры, поставляемые в наборе RACE, являются следующими:
GeneRacer™ 5' (R-5): 5'-CGACTGGAGCACGAGGACACTGA-3' (SEQ ID NO: 17);
GeneRacer™ 5' Nested (RN-5): 5'-GGACACTGACATGGACTGAAGGAGTA-3' (SEQ ID NO: 18);
GeneRacer™ 3' (R-3): 5'-GCTGTCAACGATACGCTACGTAACG-3' (SEQ ID NO: 19);
GeneRacer™ 3' Nested (RN-3): 5'-CGCTACGTAACGGCATGACAGTG-3' (SEQ ID NO: 20).
Далее представлена схема с относительным расположением всех праймеров, описанных в изложенной выше методике RACE-ПЦР:
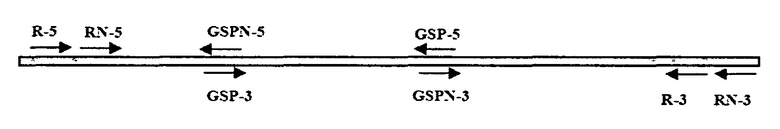
Амплификации при помощи ПЦР
Для минимизации неспецифического отжига праймеров ("misspriming") для реакций амплификации использовали высокоточный фермент Platinum Taq DNA Polymerase High Fidelity (Invitrogen) в соответствии с указаниями производителя.
Реакции осуществляли в конечном объеме 50 мкл, содержащем 1-кратный буфер для ПЦР, 0,2 мМ каждого dNTP, 2 мМ MgSO4, 0,6 мкМ 5'- или 3'-праймера GeneRacer, 0,2 мкМ 5'- или 3'-специфического праймера (GSP-5 или GSP-3, соответственно), 2,5 Е Taq-ДНК-полимеразы Platinum и 1 мкл разведения 1/5 продукта обратной транскрипции RACE экспрессионной библиотеки, сконструированной на основе выделенного продуцента SS71. Программа термоциклера, используемая для применения способа "тачдаун" ПЦР, была следующей:
- исходная денатурация: 94°С в течение 2 минут;
- 5 циклов при 94°С в течение 30 с и 72°С в течение 4 мин (1 мин/т.п.н. ДНК);
- 5 циклов при 94°С в течение 30 с и 70°С в течение 4 мин;
- 25 циклов при 94°С в течение 30 с, 66°С в течение 30 с и 68°С в течение 4 мин;
- окончательное удлинение: 68°С в течение 10 мин.
Продукты ПЦР разделяли и визуализировали на 1% агарозных гелях, как описано в 2.4.
Гнездовая ПЦР
Амплификации осуществляли при помощи гнездовой ПЦР из первого продукта амплификации. Реакции осуществляли в конечном объеме 50 мкл, содержащем 1-кратный буфер для ПЦР, 0,2 мМ каждого dNTP, 2 мМ MgSO4, 0,2 мкМ 5'- или 3'-гнездового праймера GeneRacer, 0,2 мкМ 5'- или 3'-специфического праймера (GSPN-5 или GSPN-3, соответственно), 1 Е Taq-ДНК-полимеразы Platinum и 1 мкл разведения 1/10 исходного продукта ПЦР. Используемая программа ПЦР была следующей:
- исходная денатурация: 94°С в течение 2 минут;
- 25 циклов при 94°С в течение 30 с, 66°С в течение 30 с и 68°С в течение 4 мин;
- окончательное удлинение: 68°С в течение 10 мин.
Продукты ПЦР разделяли и визуализировали на 1% агарозных гелях. В том случае, если имелась более чем одна полоса, каждую из них выделяли из геля, очищали и клонировали, как описано выше. Наконец, 3 рекомбинантных клона отбирали для каждого события амплификации/трансформации, которые очищали и секвенировали в обоих направлениях с использованием универсальных праймеров Т3 и Т7, как описано выше.
Пример 9: определение субтилизиноподобной протеолитической активности
Поскольку анализ нуклеотидных и аминокислотных последовательностей позволил предположить, что белок может представлять собой субтилизиноподобную протеазу, были проведены анализы для определения протеолитической активности in vitro. Для этой цели оценивали способность гидролизовать хромогенный пептидный субстрат N-Suc-Ala-Ala-Pro-Phe-pNA, специфический для трипсина/субтилизина. Протеолитическое расщепление приводит к высвобождению пара-нитроанилида, который поглощает при λ равной 405 нм (Moallaei et al., 2006. Mycopathologia 161, 369-375). Сначала определяли оптимальные условия для ферментативной активности элиситорного белка (температура, рН). Для дополнительной характеристики и подтверждения функции протеазы также исследовали действие специфических ингибиторов в отношении различных протеаз на протеолитическую активность элиситора по изобретению, имеющего происхождение из SS71.
Пример 10: Обработка растений земляники конидиями штамма A. strictum SS71
Конидии штамма A. strictum SS71 ресуспендировали, как представлено в примере 2. Ими опрыскивали растения земляники сортов Pájaro, Chandler, Milsei, Camarosa и Sweet Charlie в концентрации 105, 106 и 107 конидий/мл. Индукцию защитного ответа у растений оценивали посредством мониторинга окислительного взрыва путем измерения аккумуляции H2O2 и О2-, определения увеличения SA, продукции PR-белков, утолщения растительной клеточной стенки, транслокации сигнала от листа к оставшейся части растения (системный ответ), защиты против различных вирулентных изолятов рода Colletotrichum spp., вызывающих антракноз, и других патогенов земляники (Botrytis cinerea, Xanthomonas fragariae), устойчивости к последующим инфекциям вирулентными изолятами и долговременного ответа с течением времени (длительность или устойчивость с течением времени).
Пример 11: обработка растения СЕ экстрактом штамма A. strictum SS71
Конидиальный экстракт (СЕ) получали путем ультразвуковой обработки конидий штамма A. strictum SS71, как представлено в примере 3. Надземные части растений земляники опрыскивали СЕ в концентрации 1,5 мкг белка/мл. Интересно то, что СЕ сохраняет свою активность, будучи разведенным в 12 раз, достигая конечной концентрации 0,12 мкг/мл белка.
Индукцию защитных ответов у растений земляники оценивали по защите против различных вирулентных изолятов рода Colletotrichum spp., вызывающих антракноз у различных генотипов земляники (Pájaro, Chandler Milsei и Camarosa), и других патогенов земляники (В.cinerea и X.fragariae). Кроме того, продукция ROS (Н2О2 и O2-) обнаружена тогда, когда растения земляники обрабатывали СЕ в концентрации 0,12 мкг/мл.
Пример 12: обработка растения экстрактом SN штамма A strictum SS71
Бесклеточный супернатант (SN) извлекали из культуры изолята A. strictum SS71, выращенной при 28°С без перемешивания при непрерывном освещении белым светом до достижения стационарной фазы (21 сутки), как представлено в примере 4. Надземные части растений земляники опрыскивали 1-кратным (неразбавленным) SN, соответствующим общей концентрации 8,43 мкг белка/мл. SN сохранял свою элиситорную активность, будучи разбавленным приблизительно в 21 раз, достигая конечной концентрации всего лишь 0,4 мкг белка/мл.
Индукцию защитных ответов у растений земляники оценивали по устойчивости к заболеванию, оцениваемой по защите против различных вирулентных изолятов рода Colletotrichum spp., вызывающих антракноз у различных генотипов земляники (Pájaro, Chandler Milsei и Camarosa), и других патогенов земляники (В.cinerea и X.fragariae) у сорта Pájaro. Устойчивость к антракнозу достигают путем обработки одного листа растения, формируя системный защитный ответ.
Когда растения земляники сорта Pájaro обрабатывали 1-кратным SN (8,43 мкг белка/мл), аккумуляцию ROS (H2O2 и O2-) и микроскопические HR обнаруживали не только в обработанной ткани, но также и в необработанных листьях (микровзрывы и микросистемный HR). Другие обнаруженные защитные ответы представляли собой увеличение уровня SA, утолщение стенок растительных клеток вследствие аккумуляции лигнина и аккумуляции аутофлуоресцирующих частиц, возникающей в результате аккумуляции соединений фенилпропаноидного пути. Эти ответы также обнаруживали при нанесении аксенических SN, разведенных в 5 раз (приблизительно 2 мкг белка/мл). Когда клеточные культуры томата (Solarium lycopersicon) обрабатывали 1-кратным SN (8,43 мкг белка/мл), обнаружили увеличенную аккумуляцию ROS и NO. Кроме того, 1-кратный SN (8,43 мкг белка/мл) приводил к отложению каллозы в клеточной стенке и аккумуляции ROS (H2O2 и O2-) у растений A.thaliana.
Пример 13: обработка растения очищенным элиситорным полипептидом штамма A.strictum SS71
Субтилизиноподобный элиситорный полипептид очищали из бесклеточного супернатанта (SN) культуры изолята A.strictum SS71, как представлено в примере 7. Надземные части растений земляники опрыскивали указанным элиситорным полипептидом в различных концентрациях полипептида от 2,5 до 15 мкг/мл в зависимости от исследуемого защитного ответа.
Индукцию защитных ответов у растений оценивали по устойчивости к заболеванию, когда полипептид наносили в минимальной концентрации 2,5 мкг/мл и оптимальной концентрации 10 мкг/мл. Обнаружили защиту против различных вирулентных изолятов Colletotrichum spp., вызывающих антракноз у различных генотипов земляники (ответ широкого спектра), и против других патогенов земляники (Botrytis cinerea, X.fragariae) у сорта Pájaro. Устойчивость к антракнозу, в частности, достигается путем обработки одного листа растения элиситорным полипептидом в концентрации 5 мкг/мл, и представляет собой системный защитный ответ.
Когда растения земляники сорта Pájaro обрабатывали элиситорным полипептидом в концентрации 10 мкг/мл, обнаруживали аккумуляцию ROS (H2O2 и O2-) и микроскопический HR даже в необработанной листовой ткани (микровзрывы и микросистемный HR), утолщение растительной клеточной стенки вследствие аккумуляции каллозы и лигнина, аккумуляцию аутофлуоресцирующих частиц, происходящих из фенилпропаноидного пути и индукцию генов, кодирующих PR-белки (хитиназы, глюканазы). Обработка элиситорным полипептидом в концентрации 15 мкг/мл вызывала аккумуляцию SA. С другой стороны, увеличенная аккумуляция ROS и NO была обнаружена в клеточных культурах томата (Solarium lycopersicon), обработанных элиситорным полипептидом в конечной концентрации 10 и 5 мкг/мл, соответственно. Кроме того, элиситорный полипептид в концентрации 10 мкг/мл способен индуцировать аккумуляцию каллозы в растительной клеточной стенке и окислительный взрыв (H2O2 и O2-) у растений A.thaliana.
Библиография
Adikaram, N.K.B.; Joyce, D.C. and Terry, L.A. (2002). Biocontrol activity and induced resistance as a possible mode of action for Aureobasidium pullulans against grey mould of strawberry fruit. Australasian Plant Pathology 31(3), 223-229.
Bent, A. and Mackey, D. (2007). Elicitors, Effectors and R Genes: The New Paradigm and Lifetime supply of Questions. Annu. Rev. Phytopathol. 45, 399-436.
Bradford, M. (1976). A rapid and sensitive method for the determination of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72, 248-254.
Delp B.R. and Milholland R.D. (1980). Evaluating strawberry plants for resistance to Colletotrichum fragariae. Plant Disease 64, 1071-1073.
Eikemo, H.; Stensvand, A. and Tronsmo, A.M. (2003). Induced Resistance as a Possible Means to Control Diseases of Strawberry Caused by Phytophthora spp. Plant Disease 87, 345-350.
Felix, G., Grosskopof, D.G., Regenass, M., Basse, C.W. and Boiler, T. (1991) Elicitor-Induced Ethylene Biosynthesis in Tomato Cells. Plant Physiol. 97, 19-25.
Frohman M.A., Dush M.K. and Martin G.R. (1988) Rapid production of full-length cDNAs from rare transcripts: amplification using a single gene-specific oligonucleotide. Proc. Natl. Acad. Sci. USA. 85, 8998-9002.
Fulton, R.W. (1986). Practices and precautions in the use of cross-protection for virus disease control. Annu. Rev. Phytopathol. 24, 67-81.
Hunt, M and Ryals, J. (1996). Systemic acquired resistance signal transduction. Crit. Rev. Plant Sci. 15, 583-606.
Kamoun, S. (2006). A Catalogue of the Effector Secretome of Plant Pathogenic Oomycetes.
Annu. Rev. Phytopathol. 44, 41-60. Keen, N.T. (1990). Gene-for-gene complementarity in plant-pathogen interactions. Annu. Rev. Genet. 24, 447-463.
Knogge, W. (1996). Fungal Infection of Plants. The Plant Cell 8, 1711-1722.
Kuc J. (1982) Induced immunity to plant disease. BioScience 32, 854-860.
Liu С, Matsushita Y, Shimizu K, Makimura K, Hasumi K. (2007) Activation of prothrombin by two subtilisin-like serine proteases from Acremonium sp. Biochem Biophys Res Commun. 2007 Jun 22:358(1):356-62. Epub 2007 Apr 30.
Moallaei, H., Zaini, F., Larcher, G., Beucher, B. and Bouchara, J.P. (2006). Partial purification and characterization of a 37 kDa extracellular proteinase from Trichophyton vanbreuseghemii. Mycopathologia 161, 369-375.
Nurnberger, Т. (1999). Signal perception in plant pathogen defense. Cell Mol. Life Sci. 55, 167-182.
Salazar, S.M.; Diaz Ricci, J.C. y Castagnaro, A.P. (2001). Caracterizacion de la Protection Cruzada en Frutilla (Fragaria ananassa Duch.) como una estrategia de Biocontrol de la Antracnosis. IV Encuentro Latinoamericano de Biotecnologia Vegetal (REDBIO 2001). Goiania, Brasil.
Salazar, S.M.; Diaz Ricci, J.C. у Castagnaro A.P. (2002). Respuesta defensiva en fresa (Fragaria ananassa) desencadenada por un patogeno avirulento. V Simposio Nacional de Biotecnologia Vegetal (REDBIO Argentina 2002). Buenos Aires, Argentina.
Sambrook, J., Fritsch, E.F., and Maniatis, T. (1989). Molecular cloning, a laboratory manual. Second edition. Cold Spring Harbor Laboratory Press, New York.
Stergiopoulos, I. and de Wit, P.J.G.M. (2009). Fungal Effector Proteins. Annu. Rev. Phytopathol. 47, 233-263.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНСТРУКЦИЯ ДНК, КОНСТРУКЦИЯ РЕКОМБИНАНТНОЙ ДНК И СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЙ | 1994 |
|
RU2136757C1 |
| БАКТЕРИАЛЬНЫЕ ФАКТОРЫ ВИРУЛЕНТНОСТИ И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2004 |
|
RU2465331C2 |
| БЕЛКИ, ИНДУЦИРУЮЩИЕ МНОЖЕСТВЕННУЮ УСТОЙЧИВОСТЬ РАСТЕНИЙ К ФИТОПАТОГЕНАМ И ВРЕДИТЕЛЯМ | 2004 |
|
RU2333220C2 |
| ГЕН, ПРИДАЮЩИЙ УСТОЙЧИВОСТЬ К PHYTOPHTHORA INFESTANS (ФИТОФТОРОЗУ) В СЕМЕЙСТВЕ SOLANACEAE | 2003 |
|
RU2361920C2 |
| ОПРЕДЕЛЕНИЕ ГРИБКОВЫХ ПАТОГЕНОВ С ИСПОЛЬЗОВАНИЕМ РЕАКЦИЙ ПОЛИМЕРИЗАЦИИ ЦЕПИ | 1995 |
|
RU2161196C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ ГОРИЗОНТАЛЬНОЙ (ЧАСТИЧНОЙ) УСТОЙЧИВОСТИ СОРТОВ КАРТОФЕЛЯ К ФИТОФТОРОЗУ ПО УРОВНЮ АГРЕССИВНОСТИ ПАТОГЕНА PHYTOPHTHORA INFESTANS (MONT.) DE BARY | 2003 |
|
RU2260935C2 |
| ВАКЦИНА ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ ПРОТИВ РЕОВИРУСА ПТИЦ | 2015 |
|
RU2701808C2 |
| КЛОСТРИДИАЛЬНЫЙ ТОКСИН NetB | 2008 |
|
RU2474587C2 |
| НОВЫЙ ПТИЧИЙ АСТРОВИРУС | 2009 |
|
RU2547589C2 |
| ШТАММ MICROBACTERIUM, КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ БОРЬБЫ С ФУЗАРИОЗОМ | 2012 |
|
RU2634386C2 |





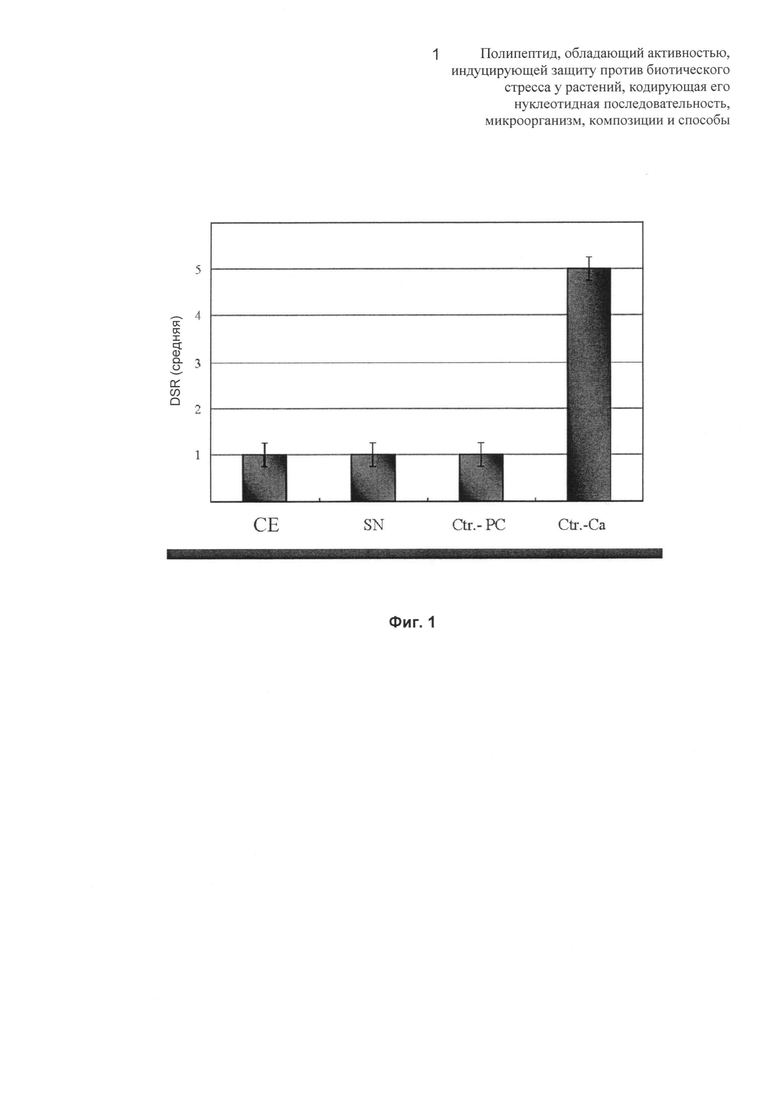
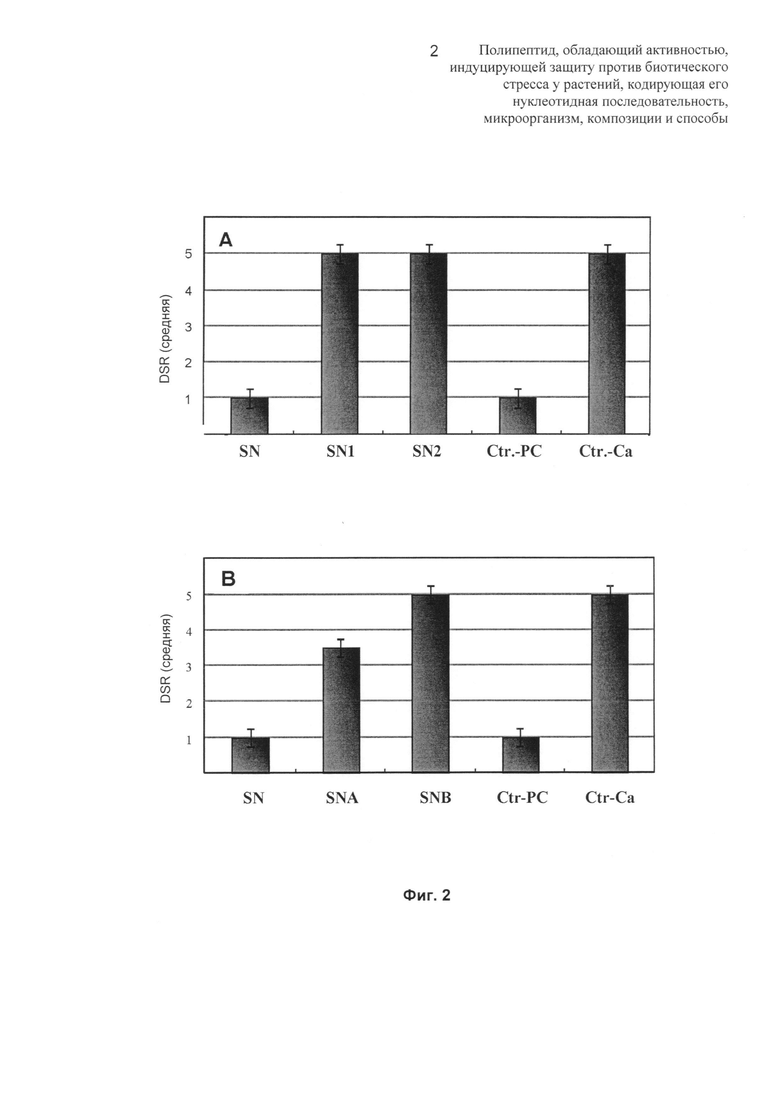
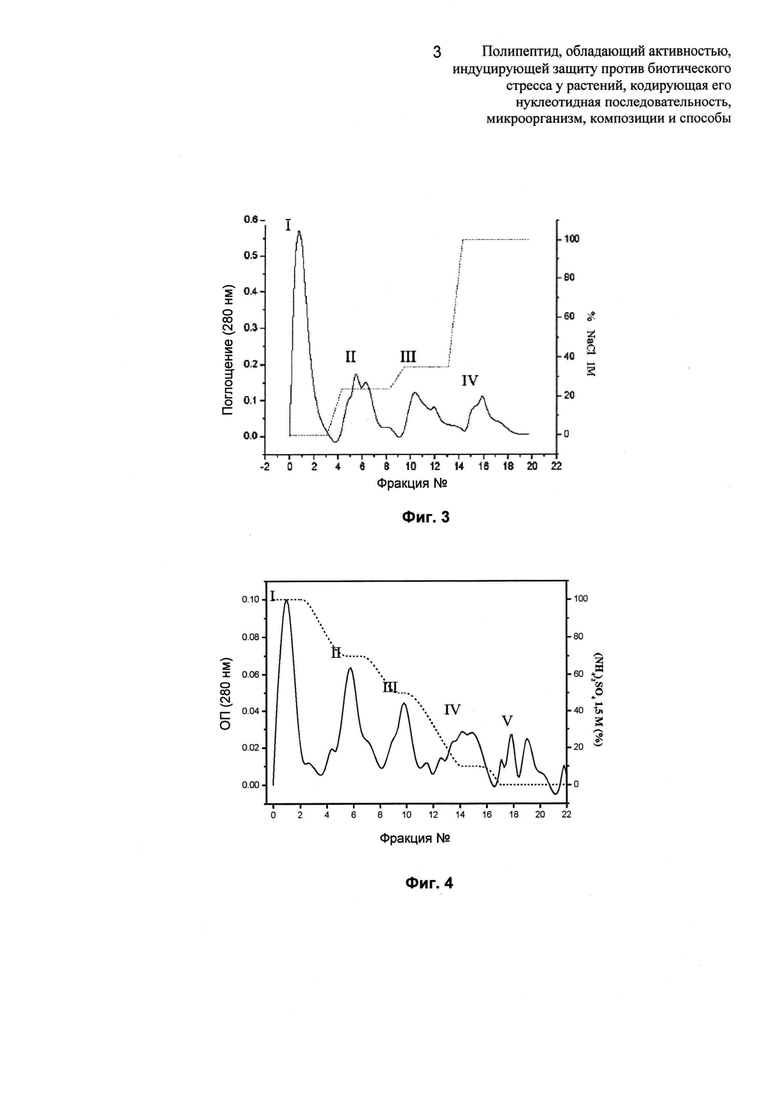
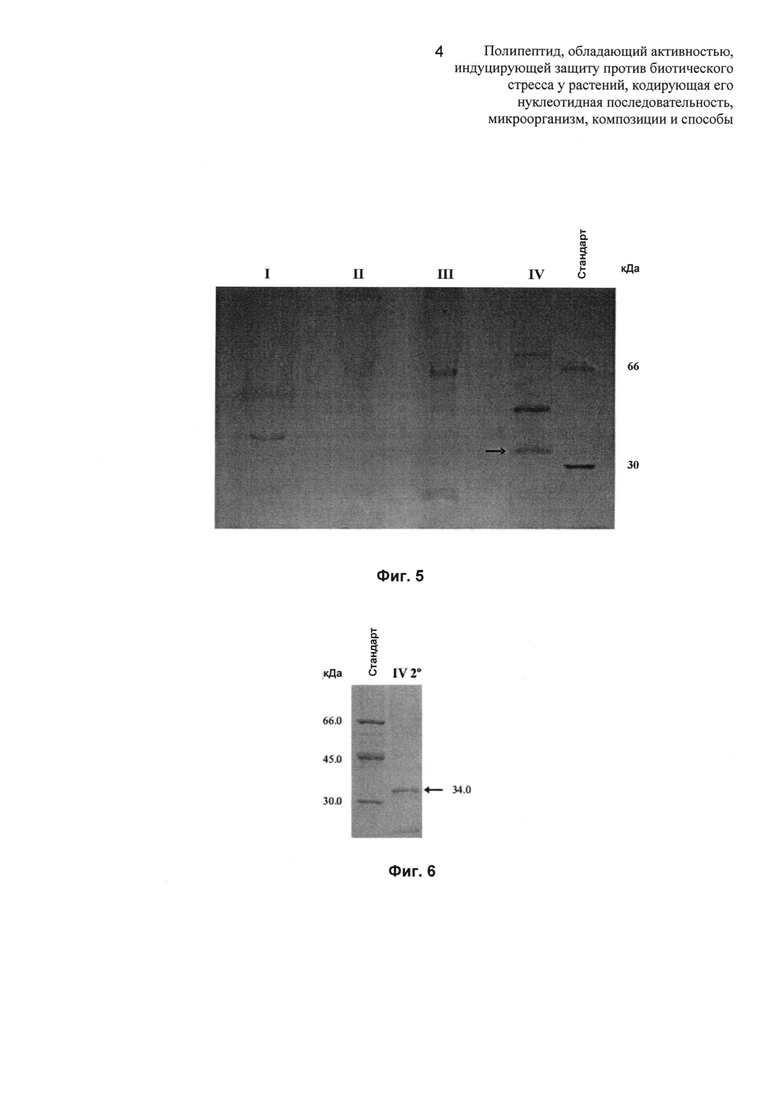

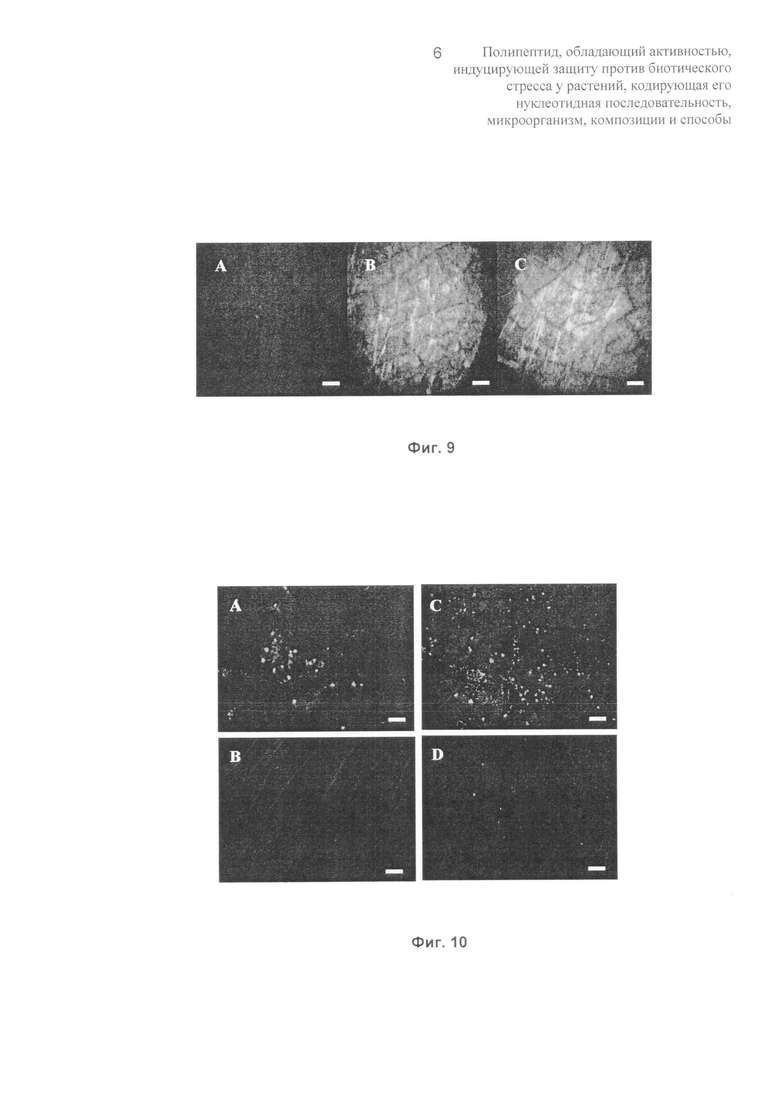
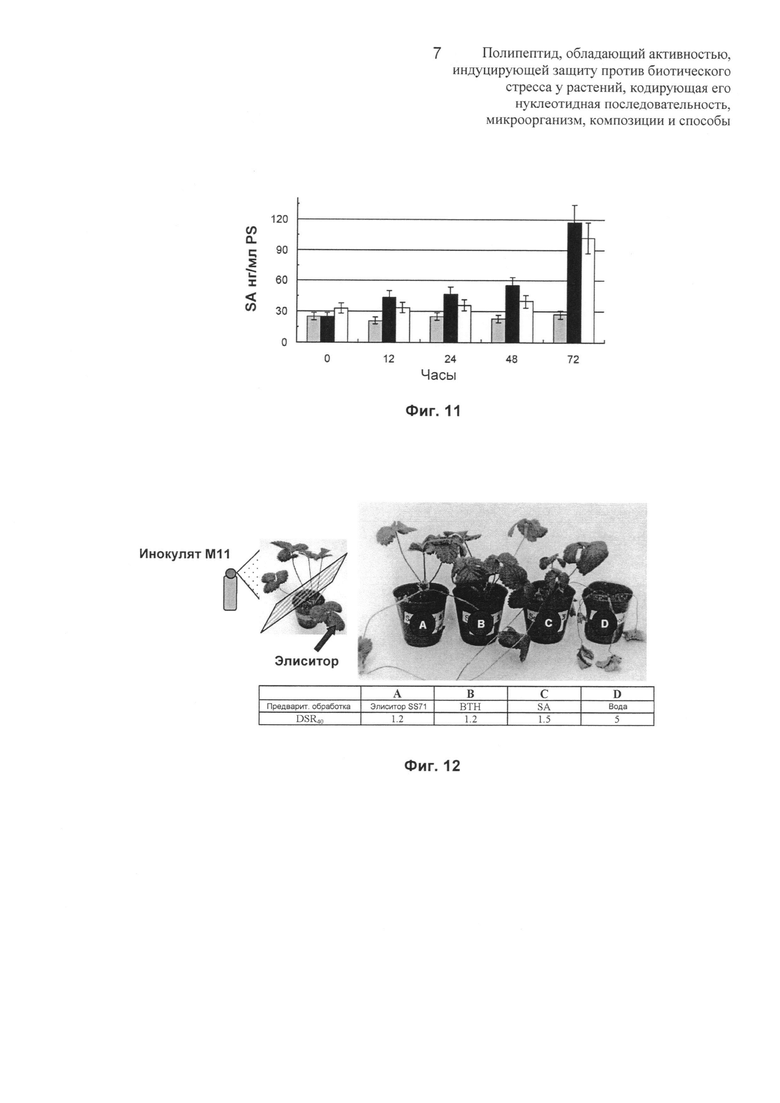
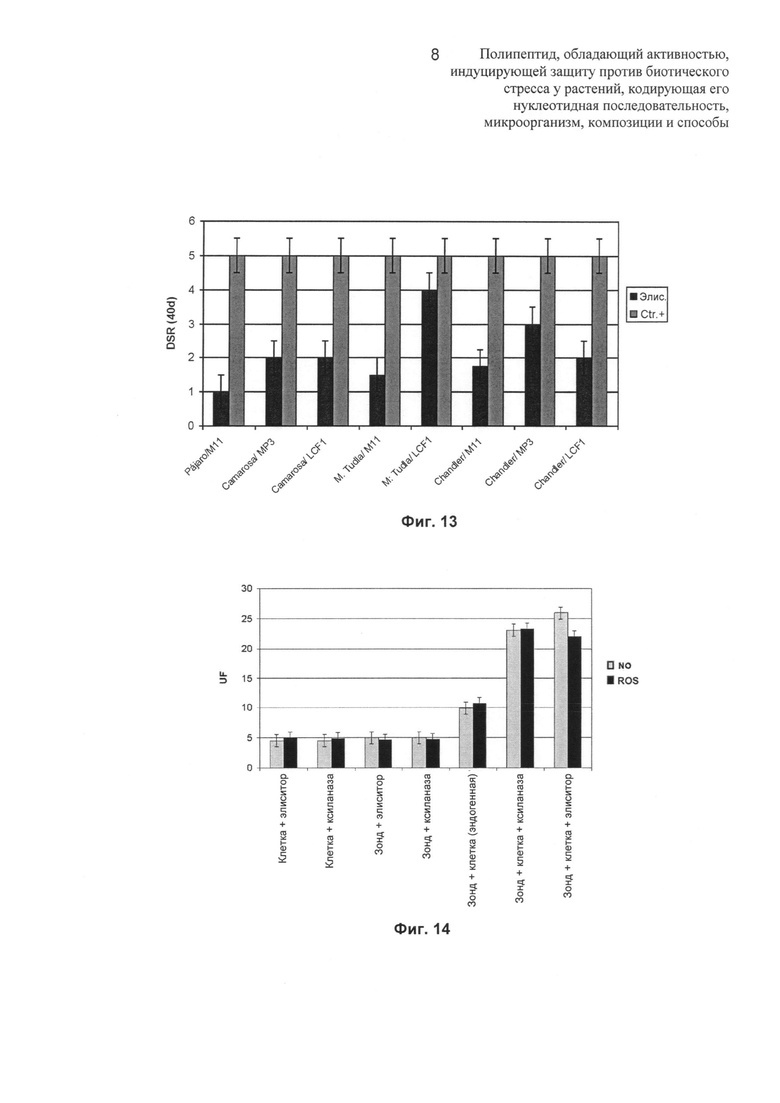
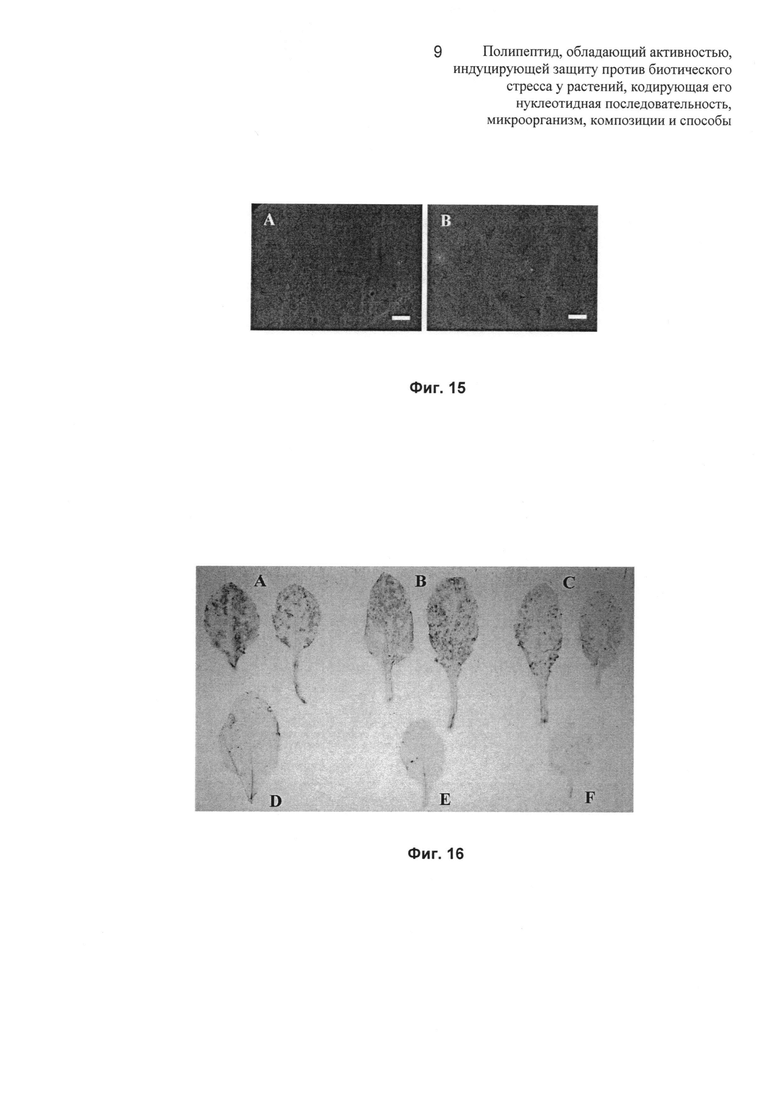



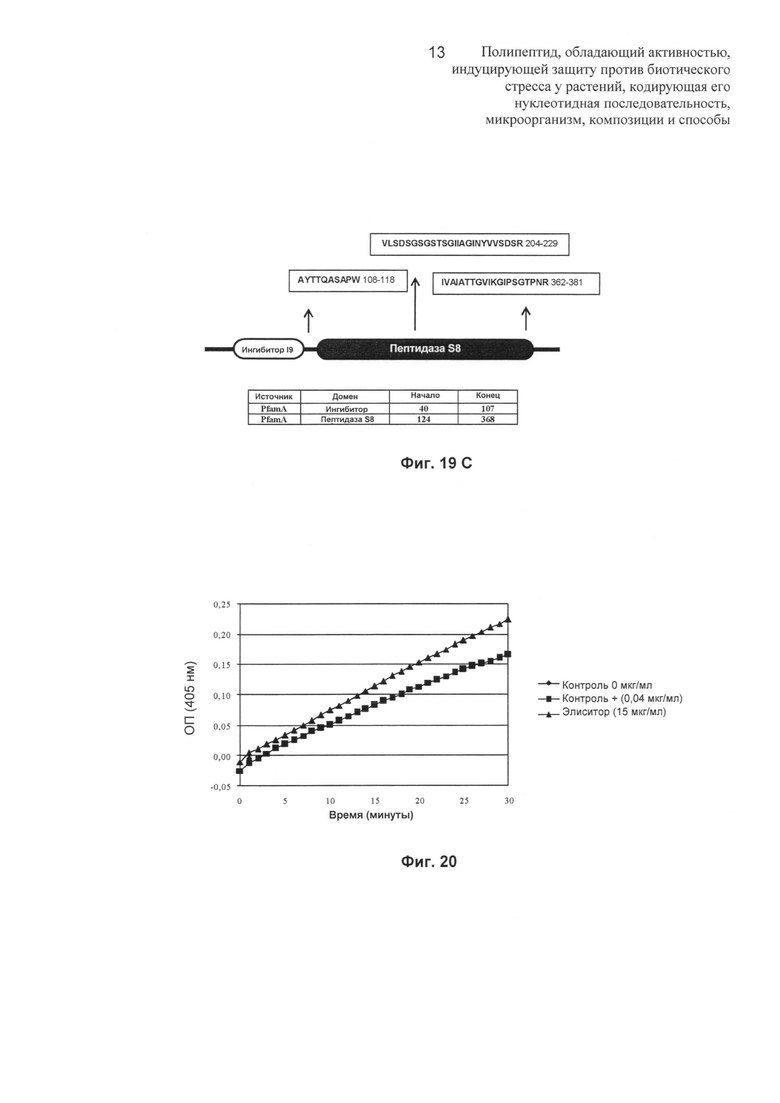
Изобретение относится к биотехнологии и представляет собой полипептид с элиситорной активностью в отношении иммунного ответа на патогены у растений, представляющий собой субтилизин, имеющий происхождение из штамма Acremonium strictum, где такой полипептид имеет аминокислотную последовательность SEQ ID NO: 2. Изобретение относится таже к молекуле нуклеиновыой кислоты, кодирующей такой полипептид, микроорганизму, трансформированному такой нуклеиновой кислотой, а также к композиции, содержащей конидии такого микроорганизма. Изобретение позволяет расширить ассортимент элиситоров в отношении иммунного ответа на патогены, применяемые для растений. 10 н. и 16 з.п. ф-лы, 20 ил., 2 табл., 13 пр.
1. Полипептид с элиситорной активностью в отношении иммунного ответа на патогены у растений, представляющий собой субтилизин, имеющий происхождение из штамма Acremonium strictum, где такой полипептид имеет аминокислотную последовательность SEQ ID NO: 2.
2. Полипептид по п. 1, где штамм Acremonium strictum представляет собой штамм Acremonium strictum SS71, депонированный в немецком центре депонирования DSMZ под номером доступа DSM 24396.
3. Полипептид по п. 1, кодируемый нуклеотидной последовательностью SEQ ID NO: 1 или последовательностями, по меньшей мере на 90% идентичными SEQ ID NO: 1.
4. Молекула нуклеиновой кислоты, кодирующая полипептид по п. 1, имеющая последовательность SEQ ID NO: 1 или последовательности, по меньшей мере на 90% подобные последовательности SEQ ID NO: 1.
5. Микроорганизм, в который была введена молекула нуклеиновой кислоты по п. 4, экспрессирующий полипептид, обладающий элиситорной активностью в отношении иммунного ответа на патогены у растений, где указанный полипептид имеет аминокислотную последовательность SEQ ID NO: 2.
6. Микроорганизм, экспрессирующий полипептид, обладающий элиситорной активностью в отношении иммунного ответа на патогены у растений, где микроорганизм представляет собой штамм Acremonium strictum SS71, депонированный в немецком центре депонирования DSMZ под номером доступа DSM 24396.
7. Композиция, обладающая элиситорной активностью в отношении иммунного ответа на патогены у растений, содержащая конидии штамма Acremonium strictum SS71, депонированного в немецком центре депонирования DSMZ под номером доступа DSM 24396, поверхностно-активный агент и эксципиенты.
8. Композиция по п. 7, где концентрация конидий составляет от 1×103 до 1×108 конидий/мл.
9. Конидиальный экстракт, обладающий элиситорной активностью в отношении иммунного ответа на патогены у растений, полученный способом, включающим следующие стадии:
а) культивирование штамма Acremonium strictum SS71, депонированного в немецком центре депонирования DSMZ под номером доступа DSM 24396,
б) сбора конидий из культуры со стадии (а);
в) суспендирование конидий, полученных на стадии (б), в воде;
г) подвергание суспензии со стадии (в) клеточному лизису; и
д) удаление оставшихся клеток и не разрушившихся конидий из продукта лизиса.
10. Конидиальный экстракт по п. 9, где указанный способ дополнительно включает стадию (е), на которой продукт стадии (д) разбавляют.
11. Конидиальный экстракт по п. 9 или п. 10, содержащий от 0,12 до 1,5 мкг белка/мл.
12. Бесклеточный культуральный супернатант, обладающий элиситорной активностью в отношении иммунного ответа на патогены у растений, полученный способом, включающим следующие стадии:
а) выращивание штамма Acremonium strictum SS71, депонированного в немецком центре депонирования DSMZ под номером доступа DSM 24396, в жидкой культуре до завершения стадии роста;
б) отделение клеток и конидий от культуральной среды.
13. Бесклеточный культуральный супернатант по п. 12, где указанный способ дополнительно включает стадию (в), на которой культуральную среду, отделенную на стадии (б), разбавляют.
14. Бесклеточный культуральный супернатант по п. 12 или п. 13, содержащий от 0,4 до 9 мкг белка/мл.
15. Раствор, обладающий элиситорной активностью в отношении иммунного ответа на патогены у растений, содержащий от 2,5 до 15 мкг/мл полипептида по п. 1, и где указанный полипептид был предварительно очищен.
16. Способ получения и очистки полипептида по п. 1, включающий следующие стадии:
а) культивирование штамма Acremonium strictum, экспрессирующего полипептид, обладающий элиситорной активностью в отношении иммунного ответа на патогены у растений, где указанный полипептид имеет аминокислотную последовательность SEQ ID NO: 2;
б) извлечение супернатанта;
в) концентрирование супернатанта и
г) ультрафильтрацию продукта, полученного на предшествующей стадии.
17. Способ по п. 16, где Acremonium strictum представляет собой штамм Acremonium strictum SS71, депонированный в немецком центре депонирования DSMZ под номером доступа DSM 24396.
18. Способ по п. 16, дополнительно включающий по меньшей мере одну стадию хроматографической очистки после ультрафильтрации.
19. Способ по п. 18, где стадию очистки осуществляют путем анионообменной хроматографии.
20. Способ по п. 19, дополнительно включающий стадию хроматографии гидрофобного взаимодействия в дополнение к указанной стадии очистки путем анионообменной хроматографии.
21. Способ индукции устойчивости растения к стрессу, вызванному патогеном, включающий нанесение на такое растение конидиальной суспензии штамма Acremonium strictum SS71, депонированного в немецком центре депонирования DSMZ под номером доступа DSM 24396, как определено в п. 7 или п. 8, конидиального экстракта штамма Acremonium strictum SS71, депонированного в немецком центре депонирования DSMZ под номером доступа DSM 24396, как определено в любом из пп. 9-11, культурального супернатанта штамма Acremonium strictum SS71, депонированного в немецком центре депонирования DSMZ под номером доступа DSM 24396, как определено в любом из пп. 12-14, раствора полипептида по п. 1, как определено в п. 15, или их комбинаций.
22. Способ по п. 21, где конидиальную суспензию наносят в концентрации от 1×103 до 1×108 конидий/мл.
23. Способ по п. 21, где бесклеточный культуральный супернатант содержит от 0,4 до 9 мкг белка/мл.
24. Способ по п. 21, где конидиальный экстракт содержит от 0,12 до 1,5 мкг белка/мл.
25. Способ по п. 21, где раствор полипептида содержит от 2,5 до 15 мкг/мл полипептида по п. 1.
26. Способ по п. 21, где стресс растения вызывается инфекцией патогенами, выбранными из группы, включающей Colletotrichum spp., Botrytis cinera и Xanthomonas fragariae.
| СПОСОБ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ РАСТЕНИЙ К ПАТОГЕННЫМ МИКРООРГАНИЗМАМ | 2005 |
|
RU2380419C2 |
| CN 101235355 A, 06.08.2008. | |||
Авторы
Даты
2017-01-10—Публикация
2012-03-16—Подача