Предметом настоящего изобретения являются устойчивые к патогенам растения и, в частности, устойчивые к патогенам растения, у которых устойчивость к патогенам возникает в ответ на поражение патогенами, например вирусами, а также конструкции ДНК для применения в таких растениях и способы введения индуцируемой вирусами устойчивости в растения.
Вирусные инфекции растений часто являются причиной неблагоприятных изменений в росте, нежелательных морфологических изменений, снижения урожая и тому подобного. Такие инфекции часто обуславливают повышенную чувствительность инфицированных растений к другим растительным патогенам и вредителям.
Вирусные частицы обычно содержат относительно небольшое количество генетического материала (однонитевая или двунитевая РНК или ДНК), защищенного белком или белками, которые у некоторых типов вирусов могут также быть окружены липидными мембранами, построенными из материала хозяина, образующими инфекционные частицы. Размножение вирусов зависит от клеток-хозяев, поэтому их можно рассматривать как внутриклеточных паразитов.
Растения обладают рядом защитных механизмов, позволяющих ограничивать воздействия вирусной инфекции. К их числу относятся так называемые горизонтальные или частичные устойчивости, являющиеся полигенными по своей природе, и так называемые вертикальные устойчивости, моногенные по природе.
Горизонтальную устойчивость сложно успешно вводить в растения в процессе реализации селекционных программ, однако вертикальная устойчивость может быть относительно легко введена в растения в рамках селекционных программ. Гены, кодирующие устойчивость к вирусам, могут работать конституитивно пассивным образом, то есть без обязательной индукции генной экспрессии. Конституитивно экспрессируемая устойчивость к вирусам включает в качестве механизмов действия неспецифическую устойчивость, выносливость, то есть ингибирование развития болезни, иммунность, то есть ингибирование транспорта, либо наличие антивирусных агентов и тому подобное. С другой стороны, гены, кодирующие устойчивость к вирусам в растениях, могут быть активно задействованы посредством индукции экспрессии гена или генов, кодирующих устойчивость к вирусам. Примером такой системы является реакция сверхчувствительности.
Выявленные у растений так называемые реакции сверхчувствительности (СЧР) в общем характеризуются гибелью растительных клеток в области проникновения патогена сразу же после инфицирования. Продвижение патогена через инфицированные или зараженные клетки ограничивается или блокируется благодаря некрозу зараженных клеток и/или клеток, окружающих зараженную клетку. Кроме того, СЧР включает серию дополнительных или вторичных защитных реакций и накопление определенных белков и вторичных метаболитов, приводящих к общему увеличению уровня устойчивости к поражению патогенами. В целом полагают, что СЧР реакции, развивающиеся в организмах, включают продукт гена устойчивости в растительной клетке, который распознает и взаимодействует с элиситорным элементом, то есть продуктом гена авирулентности патогена. Распознавание элиситорного элемента в клетках устойчивого растения вызывает СЧР реакцию, которая в свою очередь ограничивает проникновение патогена в отдельную клетку или клетки, либо самое большее, в небольшое количество растительных клеток в их ближайшем окружении.
Примером СЧР-опосредованной устойчивости к вирусной инфекции является устойчивость растений табака, несущих N' ген устойчивости к тобамовирусам, таким как BTM (TMV) и BToM (ToMV), которые содержат авирулентный ген белка оболочки. К настоящему времени было идентифицировано свыше двадцати отдельных доминантных генов устойчивости СЧР-типа, которые присутствуют у многих агрономически значимых культур, включая табак, томат, картофель, перец, латук и тому подобное.
Несмотря на кажущееся изобилие источников устойчивости к определенным вирусам, у многих культур до сих пор отсутствуют эффективные гены устойчивости к основным вирусным патогенам [1]. В результате поиска наборов зародышевой плазмы дикого типа были идентифицированы только несколько приемлемых источников устойчивости к вирусам, которые могут быть успешно введены в агрономически значимые культуры. Примером является отсутствие генов вертикальной устойчивости к вирусу огуречной мозаики (ВОМ) у многих типов агрономически значимых культур, включая томат, перец, огурец, дыню, латук и тому подобное, но не ограничиваясь ими.
Селекционеры растений непрерывно пытаются создавать сорта культурных видов растений, выносливых или устойчивых к специфическим вирусным штаммам. Раньше гены, ответственные за устойчивость к вирусам, переносили из диких типов, родственных культурным растениям, в промышленные сорта посредством скрещиваний. Пренос имеющейся в природе устойчивости из генного пула дикого типа в сорт является утомительной процедурой, в ходе которой ген(ы), ответственный за устойчивость, сначала должен быть идентифицирован в растительных видах, являющихся источником (донором), а затем введен в генный пул промышленного сорта. Устойчивость или выносливость, приобретаемая таким путем, как правило активна только против одного или в лучшем случае, нескольких штаммов интересующих вирусов. Кроме того, недостатком является также и то, что реализация селекционной программы для получения агрономически значимых растений занимает длительное время, измеряемое годами.
В качестве альтернативы была разработана система, именуемая как "перекрестная защита". Перекрестная защита - это явление, при котором инфицирование растения одним штаммом вируса защищает это растение против гиперинфицирования вторым родственным вирусным штаммом. Способ перекрестной защиты предпочтительно включает применение для инфицирования растений авирулентных вирусных штаммов, которые ингибируют вторичное инфицирование вирулентным штаммом этого же вируса. Однако применение естественной системы перекрестной защиты может иметь ряд недостатков. Способ очень трудоемок, поскольку требует инокуляции каждой отдельной растительной культуры, и существует опасность того, что авирулентный штамм может мутировать в вирулентный штамм, превращаясь тем самым в возбудителя болезни растения. Другой потенциальной опасностью является то, что авирулентный в одном растительном виде вирусный штамм может действовать как вирулентный штамм в других растительных видах.
Генетически модифицированная перекрестная защита является формой устойчивости к вирусам, которая фенотипически сходна с естественной перекрестной защитой, но реализуется посредством экспрессии генетической информации белка вирусной оболочки из генома генетически модифицированного растения. Известно, что экспрессия гена белка оболочки вируса табачной мозаики штамма U1 (BTM-U1) из генома трансгенного растения может привести к замедлению развития симптомов после инфицирования любым штаммом ВТМ. Аналогичным образом опосредованная белком оболочки защита была реализована также для вируса мозаики люцерны (ВЛМ), Х-вируса картофеля (КВХ) и вируса огуречной мозаики (ВОМ). Для некоторых растительных вирусов, например лютеовирусов, в трансгенном растении трудно получить существенные количества соответствующего белка оболочки и, следовательно, устойчивость к вирусам обычно понижена. Кроме того, любая указанная степень защиты требует того, чтобы растение продуцировало белок оболочки непрерывно и таким образом создает энергетическую нагрузку на растение. В силу этих ограничений коммерческая значимость этого способа остается неопределенной.
Следующим примером генетически модифицированной устойчивости к вирусам является введение сателлитной РНК растительных вирусов, при котором экспрессия введенного генетического материала модифицирует растительный вирус или его воздействие.
Целью настоящего изобретения является создание возможно наиболее надежно разработанной системы устойчивости растений к вирусам по сравнению с уже разработанными устойчивостями, известными из уровня техники, базирующейся на непосредственно индуцируемой патогеном экспрессии молекул в целевых тканях растения, происходящей до того, как внедряющийся патоген сможет сам развиться в растении - хозяине.
Другой целью изобретения является комбинирование технологии генно-инженерной трансформации растений с естественно существующими в растительной ткани защитными механизмами против растительных вирусов.
Согласно настоящему изобретению предлагают конструкцию ДНК растительного вируса, способную кодировать прямо или опосредованно молекулу минус-смысловой РНК, способной взаимодействовать с РНК-зависимой РНК-полимеразой, кодируемой внедряющимся вирусом таким образом, что по меньшей мере один элиситорный элемент продуцируется как следствие взаимодействия с РНК-зависимой РНК-полимеразой, кодируемой указанным внедряющимся вирусом.
В другой реализации изобретения предлагают конструкцию рекомбинантной ДНК растительного вируса, способную кодировать молекулу плюс-смысловой РНК, способной взаимодействовать с РНК-зависимой РНК-полимеразой, кодируемой внедряющимся вирусом, продуцирующей в результате этого взаимодействия молекулу плюс-смысловой РНК, которая способна кодировать по меньшей мере один элиситорный элемент, способный элисировать естественную защитную растительную реакцию в растении при инвазии в растение указанного внедряющегося вируса.
Конструкция ДНК растительного вируса может быть получена из любого вирусного источника, способного поражать растение, однако предпочтительно, чтобы ДНК растительного вируса получали из такого вирусного источника, о котором известно, что он поражает, предполагается, что он поражает или который способен поражать агрономически перспективный растительный тип. Это может быть либо ДНК природного растительного вируса, модифицированная соответствующим образом для экспрессии, либо ДНК, полученная синтетическим путем. ДНК растительного вируса должна быть способна кодировать в растительных клетках транскрипцию в последовательность РНК, комплементарную (например минус-смысловую) к вирусной РНК (например плюс-смысловой). Кроме того, ДНК растительного вируса должна содержать участок или его сегмент, который при транскрипции с образованием минус-смысловой РНК и дальнейшей транскрипции в плюс-смысловую РНК при трансляции плюс- смысловой РНК способен обеспечивать образование по меньшей мере одного элиситорного элемента или его части, достаточной для элисирования естественного защитного механизма растений против внедряющегося вируса. Приемлемыми источниками ДНК или РНК растительных вирусов являются источники, происходящие из растительных вирусов, способных поражать такие растительные типы, как томаты, перцы, дыни, латук, цветная капуста, брокколи, капуста, брюссельская капуста, сахарная свекла, кукуруза, сахарная кукуруза, лук, морковь, лук-порей, огурцы, табак и тому подобное. Также в качестве источников ДНК или РНК растительных вирусов приемлемы источники, получаемые из растительных вирусов, способных поражать растительные типы, относящиеся к декоративным культурам, такие как недотрога, бегония, петуния, пеларгонии (герани, фиалка, цикламен, вербена, барвинок, тагетес, примула, сенполия и тому подобное).
Молекула минус-смысловой РНК является молекулой, которая содержит по меньшей мере один цистрон или его часть, соответствующую по меньшей мере части указанной ДНК растительного вируса и способна обеспечивать образование молекулы плюс-смысловой РНК, транскрибируемой с указанной молекулы минус-смысловой РНК, которая способна кодировать и обеспечивать образование по меньшей мере одного элиситорного элемента или его части в растительных клетках. Минус-смысловая РНК может транскрибироваться прямо с указанной ДНК растительного вируса либо может транскрибироваться с плюс-смысловой РНК, синтезированной с указанной ДНК. Как таковая минус-смысловая РНК, транскрибируемая с плюс-смысловой РНК, именуется, для целей настоящего изобретения, как опосредованно транскрибируемая с указанной ДНК. Ориентация или полярность цистрона или цистронов либо их частей, локализованных на молекуле минус-смысловой РНК, может быть таковой, что элиситорный элемент может не кодироваться непосредственно после транскрипции с конструкции ДНК растительного вируса. Генетический код цистрона или цистронов либо их частей локализован на нити, комплементарной к молекуле минус-смысловой РНК, а именно плюс-смысловой РНК. Цистрон, кодирующий элиситорный элемент, становится доступным для трансляции тогда, когда последовательность минус-смысловой вирусной РНК реплицируется РНК-зависимой РНК-полимеразой, кодируемой внедряющимся вирусом, с образованием молекулы плюс-смысловой РНК.
К минус-смысловым РНК по тексту относятся также те молекулы РНК, которые могут быть охарактеризованы как имеющие двусмысловые характеристики, такие как молекулы РНК тосповирусов и тому подобное. В таких случаях минус-смысловая РНК содержит по меньшей мере один цистрон, соответствующий части ДНК указанного растительного вируса и способна обеспечивать образование плюс-смысловой РНК, транскрибируемой с указанной минус-смысловой РНК, которая способна кодировать и обеспечивать образование по меньшей мере одного элиситорного элемента или его части в растительных клетках.
Молекула плюс-смысловой вирусной РНК представляет собой молекулу, которая способна прямо или опосредованно кодировать по меньшей мере один элиситорный элемент или его часть, способную экспрессироваться и обладать способностью элисировать естественную или сконструированную растительную защиту в клетках растений. Молекула плюс-смысловой РНК является также молекулой, которая комплементарна вирусной минус-смысловой РНК и при трансляции в растительных клетках способна обеспечивать образование прямо или опосредованно по меньшей мере одного элиситорного элемента. Таким образом, молекула вирусной смысловой РНК может рассматриваться как молекула РНК, комплементарная молекуле минус-смысловой РНК.
К плюс-смысловым РНК по тексту относятся также те молекулы РНК, которые могут быть охарактеризованы как имеющие двусмысловые характеристики. В таких случаях плюс-смысловая РНК содержит по меньшей мере один цистрон, соответствующий части указанной ДНК растительного вируса и способна прямо кодировать и обеспечивать образование по меньшей мере одного элиситорного элемента или его части в растительных клетках.
Количество элиситорного элемента, который экспрессируется в растительной клетке, должно быть достаточным для того, чтобы элисировать по меньшей мере клеточную растительную защитную реакцию против внедряющегося вируса, приводя к возникновению естественной или сконструированной защитной реакции растений, эффективно блокирующей или ограничивающей дальнейшее воздействие вируса. Тем самым, молекулы плюс-смысловой РНК, если они являются комплементом минус-смысловой РНК или двусмысловой РНК, должны быть способны обеспечивать образование элиситорных элементов, которые способны запускать или элисировать естественную или сконструированную защитную реакцию растений, причем происходит это посредством прямой трансляции либо посредством взаимодействия с вирусной РНК-зависимой РНК-полимеразой (например, с помощью генерированной субгеномной РНК). В зависимости от типа элисируемых защитных реакций растений должен быть один или более элиситорных элементов, в конечном счете кодируемых плюс-смысловой РНК. Последовательность вирусной плюс-смысловой РНК предпочтительно является последовательностью, в которой по меньшей мере один вирусный цистрон замещен по меньшей мере одним цистроном, кодирующим элиситорный элемент, способный экспрессироваться в растительных клетках и обладающим способностью элисировать в растительной ткани естественную или сконструированную растительную защитную реакцию.
Элиситорным элементом может быть любой элемент, транслируемый с цистрона плюс-смысловой РНК, получаемого из ДНК растительного вируса, как это было описано ранее, и это могут быть белок, полипептид или пептид либо их фрагменты. Примерами предпочтительных элиситорных элементов являются так называемые элиситорные белки и/или клеточные ингибиторные белки.
Элиситорный белок - это белок, который при наличии его в растительной ткани способен элисировать, запускать или индуцировать реакцию сверхчувствительности (СЧР), которая является естественным защитным механизмом растений против внедряющихся патогенов, таких как вирусы. Элиситорные белки могут быть производными растительных вирусов, например белки оболочки, белки, участвующие в движении от клетки к клетке, геликазы, РНК-зависимые РНК-полимеразы и тому подобное. Кроме того, элиситорные белки могут происходить или быть получены из других растительных патогенов, таких как бактерии, грибы, нематоды и тому подобное.
Клеточный ингибиторный белок - это белок, который в случае наличия в растительной ткани оказывает вредное воздействие на растительную клетку, приводя к ингибированию клеточного роста, например клеточного деления, и/или гибели клетки. Клеточные ингибиторные агенты включают рибонуклеазы, протеиназы, рибосомальные ингибиторные белки, белки, разрушающие клеточные оболочки и т. д., но не ограничиваются ими.
Молекулы минус- и плюс-смысловой РНК можно рассматривать как РНК растительного вируса, поскольку они являются продуктами конструкции растительной ДНК, как описано ранее, и включают геном или сегмент генома растительного вируса. В таких РНК растительных вирусов определенные нуклеотидные фрагменты могут быть либо замещены другими фрагментами, либо удалены. Замена и/или делеция нуклеотидов или сегментов, содержащих нуклеотиды, должна иметь такой характер, чтобы не влиять на способность молекулы РНК воспроизводиться или копироваться в инфицированных вирусом растительных клетках. Кроме того, замещение и/или делеция нуклеотидов, кодонов или сегментов, содержащих нуклеотиды, должно иметь такой характер, чтобы не нарушать способность РНК-зависимой РНК-полимеразы внедряющегося вируса узнавать и воздействовать на молекулу РНК (в плюс- или минус-смысловой ориентации), и тем самым инициировать последовательность описанных событий, приводящих к продуцированию эффективного количества элиситорного элемента, способного элисировать естественную или сконструированную защитную реакцию растений. Примерами соответствующих молекул РНК растительных вирусов являются молекулы геномной РНК или их сегменты, выбранные из группы, включающей потивирусы, потексивирусы, тобамовирусы, лютеовирусы либо геномную РНК нуклеовирусов, бромовирусов, тосповирусов и тому подобное или их сегменты, но не ограничиваются ими.
ДНК растительных вирусов находится под контролем экспрессии промотора, способного функционировать в растениях, и содержит терминатор, способный функционировать в растениях.
Промотор - это нуклеотидная последовательность, расположенная выше сайта инициации транскрипции и содержащая все регуляторные области, необходимые для транскрипции. Примерами промоторов, пригодных для применения в конструкциях ДНК по настоящему изобретению, являются промоторы вирусного, грибного, бактериального, животного и растительного происхождения, способные функционировать в растительных клетках. Предпочтительный промотор должен экспрессировать ДНК конституитивно, как это имеет место во всех живых тканях растения. Следует учитывать, что используемый промотор должен обеспечивать усиление экспрессии ДНК растительного вируса в степени, достаточной для продуцирования количества РНК, способного кодировать по меньшей мере один элиситорный элемент, способный элисировать естественную растительную защиту в трансформированном растении при заражении растения вирусом. Количество РНК, которое должно быть транскрибировано, может варьировать в зависимости от типа растения. Примерами соответствующих промоторов являются промоторы 35S (CaMV 35S) и 19S (CaMV 19S) вируса мозаики цветной капусты, промоторы нопа-линсинтетазы и октопинсинтетазы, промотор теплового шока 80 (hsp 80) и тому подобное.
Терминатор рассматривают как (A) последовательность ДНК, расположенную после вирусной ДНК, кодирующей транскрипцию в последовательность РНК, которая способна к автокаталитическому саморасщеплению с высвобождением терминаторной последовательности из последовательности рекомбинантной вирусной РНК, с последующей (Б) последовательностью ДНК на конце транскрипционной единицы, которая сигнализирует терминацию транскрипции. Этими элементами являются 3'-нетранслируемые последовательности, содержащие сигналы полиаденилирования, которые вызывают присоединение полиаденилатных последовательностей к 3' концу первичных транскриптов. Примерами последовательностей, обозначенных как (А), являются саморасщепляющиеся молекулы РНК или рибозимы, такие как рибонуклеаза Р, Tetrahymena L-19 промежуточная последовательность, рибозимы головки, РНК Hepatitis дельта вируса, митохондриальная VS РНК Neurospora и тому подобное [2]. Последовательности, упоминаемые как (Б), могут быть выделены из грибов, бактерий, животных и/или растений. Примерами особенно перспективных для применения в конструкциях ДНК по изобретению последовательностей являются сигнал полиаденилирования нопалин-синтетазы Agrobacterium tumefaciens, сигнал 35S полиаденилирования CaMV и сигнал зеинового полиаденилирования из Zea mays.
Последовательность ДНК или РНК комплементарна другой последовательности ДНК или РНК, если она способна образовывать с ней связанный посредством водородных связей комплекс в соответствии с правилами спаривания оснований в соответствующих условиях гибридизации. Для целей настоящего изобретения соответствующие условия гибридизации могут включать (но не ограничиваются этим), например, инкубацию в течение приблизительно 16 часов при 42oC в буферной системе, содержащей 5 x стандартный раствор цитрата (СРЦ), 0,5%-ный додецилсульфат натрия (ДДС), 5 x Denhardt's раствор, 50%-ный формамид и 100 мкг/мл носителя ДНК или РНК (в дальнейшем буферная система), с последующей промывкой 3х в буфере, содержащем 1 x СРЦ и 0,1%-ный ДДС, при 65oC каждый раз в течение приблизительно одного часа. Таким образом, сигнал гибридизации, полученный для молекулы РНК или ДНК, например показание авторадиограммы, должен быть достаточно ясным для специалиста с целью подтверждения того, что полученная молекула ДНК или РНК может быть успешно применена при создании конструкций ДНК растительных вирусов, пригодных для использования по изобретению. Естественно, такая молекула РНК или ДНК должна быть способна проявлять требуемую активность, как описано в тексте. Таким образом, замещение и/или делеция нуклеотидов, кодонов или сегментов, содержащих нуклеотиды, должно иметь такой характер, чтобы не нарушать способность конструкции ДНК по изобретению кодировать молекулу минус-смысловой РНК, описанную в тексте, которая способна быть узнанной и взаимодействовать с РНК-зависимой РНК-полимеразой внедряющегося вируса и инициировать тем самым описанную здесь последовательности событий, приводящую к продуцированию эффективного количества элиситорного элемента, способного элисировать естественную или сконструированную защитную реакцию растений.
Соответствующие условия гибридизации, применяемые в настоящем изобретении, могут включать инкубацию в буферной системе в течение приблизительно 16 часов при 49oC и промывку 3x в буфере, содержащем 0,1 х СРЦ и 0,1%-ный ДДС при 55oC каждый раз в течение приблизительно часа. Более предпочтительно, чтобы условия гибридизации могли включать инкубацию в буферной системе в течение приблизительно 16 часов при 55oC и промывки 3x в буфере, содержащем 0,1 x СРЦ и 0,1%-ный ДДС при 65oC каждый раз в течение приблизительно часа. Естественно, любая молекула РНК или ДНК, помещенная в такие условия гибридизации, должна быть способной проявлять необходимую активность, как описано в тексте.
В изобретении предлагают также вектор, способный вводить конструкцию ДНК по изобретению в растения, и способы получения таких векторов. Термин вектор, применяемый в тексте, обозначает переносчик, посредством которого молекулы ДНК или их фрагменты могут быть введены в организм хозяина. Приемлемыми переносчиками являются плазмиды, чистая ДНК, вводимая путем микроинъекции, пушки для частиц и тому подобное [3].
Применяемый в тексте термин растения используют в широком смысле, он обозначает дифференцированные растения, а также недифференцированный растительный материал, например протопласты, растительные клетки, семена, проростки и тому подобное, который при соответствующих условиях может развиваться в зрелые растения, их потомство и их части, такие как черенки и плоды таких растений.
Далее в изобретении рассматривают растения, содержащие в своем геноме конструкцию ДНК по изобретению, и способы получения таких растений.
Растения согласно изобретению имеют пониженную чувствительность к болезням, вызываемым соответствующими вирусами, и не обладают недостатками и ограничениями растений, полученных классическими способами и методами генетической инженерии, обсуждавшимися в тексте.
Изобретение иллюстрируют следующие отдельные примеры с сопровождающими рисунками.
Фиг. 1: Схематическое изображение взаимодействия белков, кодируемых в патогене и растении, приводящего к индукции реакции СЧР.
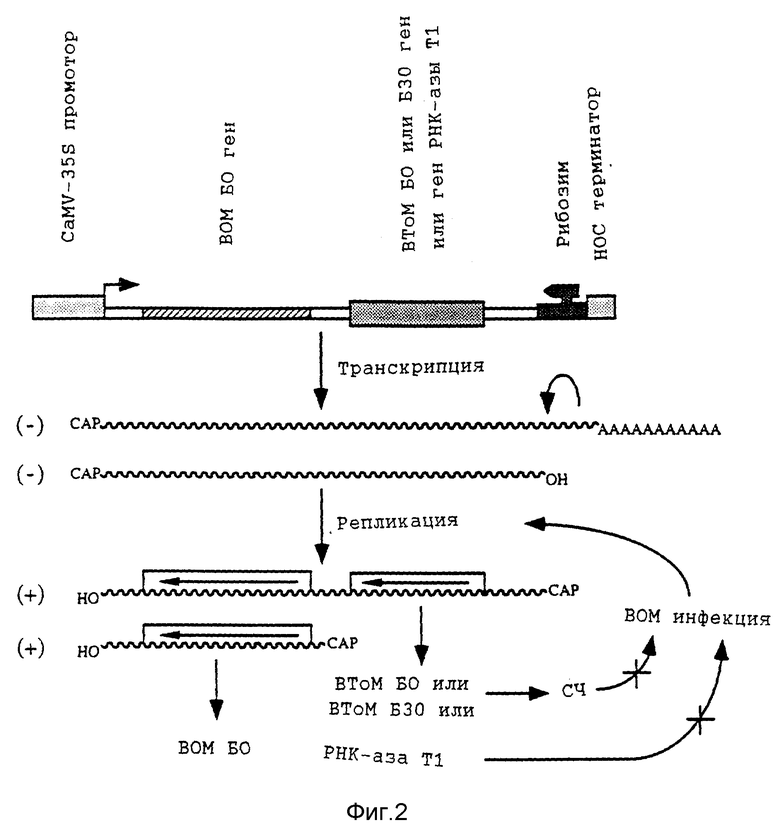
Фиг. 2: Схематическое изображение ВОМ устойчивых растений табака или томата, полученных путем экспрессии молекулы минус-смысловой ВОМ РНК 3, в которой БД ген замещен геном, кодирующим элиситор (BToM БО или БЗО) или клеточный ингибиторный белок (РНК-аза Т1).
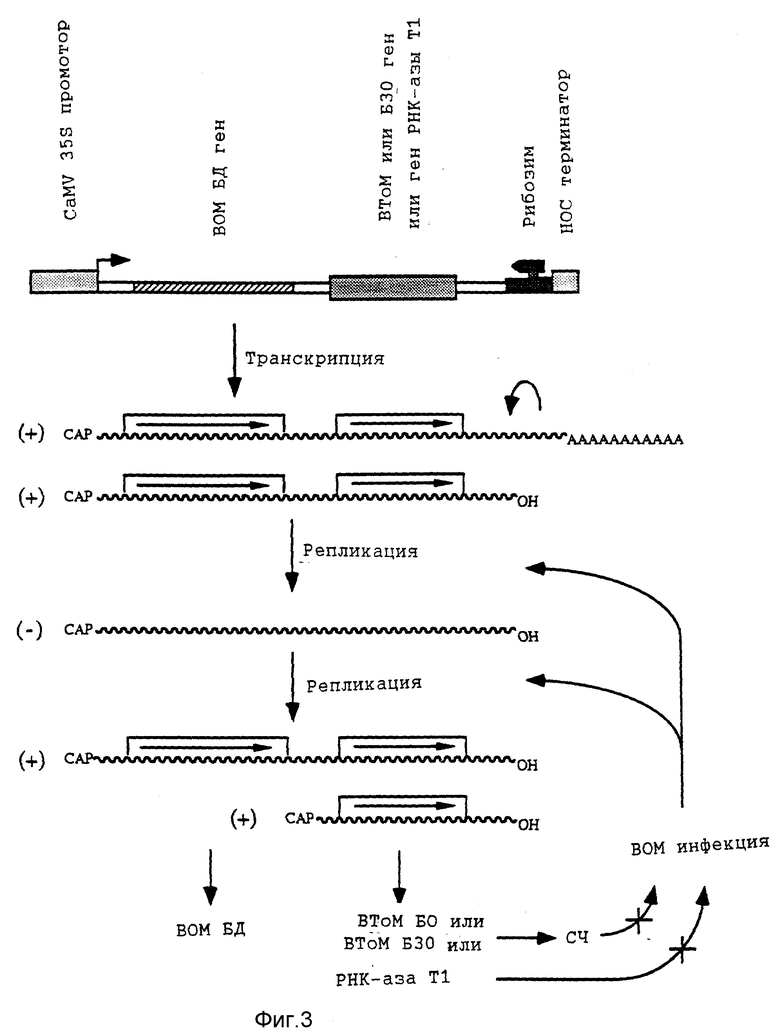
Фиг. 3: Схематическое изображение ВОМ устойчивых растений табака или томатов, полученных путем экспрессии молекулы плюс-смысловой ВОМ РНК 3, в которой БО ген замещен геном, кодирующим элиситор (ВТоМ БО или БЗО) или клеточный ингибиторный белок (РНК-аза Т1).
Последовательность 1: РНК 3 химерного вируса огуречной мозаики (SEQ ID N 1).
Последовательность 2: Белок оболочки ВТоМ (соответствующий нуклеотидам 123-600 Послед. N. 1) (SEQ ID N 2).
Последовательность 3: Белок оболочки вируса огуречной мозаики, соответствующий нуклеотидам 897-1550 Послед. N 1 (SEQ ID N 3).
Последовательность 4: РНК 3 химерного вируса огуречной мозаики (SEQ ID N 4).
Последовательность 5: РНК-аза Т1, соответствующая положениям 123-437 Послед. N. 4 (SEQ ID N 5).
Последовательность 6: РНК 3 химерного вируса огуречной мозаики, кодирующая БЗО BToM (SEQ ID N 6).
Последовательность 7: БЗО ВТоМ, соответствующий нуклеотидам 123- 914 Послед. N. 7 (SEQ ID N 7).
Последовательность 8: РНК химерного S вируса бронзовости томата, кодирующая белок оболочки ВТоМ и неструктурный белок, НС (NSs) в противоположной полярности (SEQ ID N 8).
Последовательность 9: Неструктурный белок, НС (в противоположной полярности), соответствующий нуклеотидам 1141-2543 Послед. N. 8 (SEQ ID N 9).
Примеры. Все ВОМ, BБT (TSWV) и ВТоМ РНК-овые последовательности, представленные в тексте, описаны как последовательности ДНК единственно с целью единообразия. Следует иметь ввиду, что это сделано только для удобства.
Сорта Nicotiana tabacum и Lycopersicon esculentum, применяемые в исследованиях по трансформации растений, выращивают в стандартных тепличных условиях. Стерильный материал эксплантатов выращивают на стандартной МС среде [4], содержащей соответствующие концентрации фитогормонов и сахарозы.
Бактерию Е. coli выращивают на роторных качалках при 37oC в стандартной LB-среде. Штаммы Agrobacterium tumefaciens выращивают при 28oC в Мин А среде с добавкой 0,1%-ной глюкозы [5].
Во всех методиках клонирования Е. coli штамм JM83, (F-, Δ(lac-pro), ara rpsL, ⊘80, dlacZM15) применяют в качестве предпочтительного реципиента рекомбинантных плазмид.
Бинарные вектора конъюгируют с Agrobacterium tumefaciens штамм LBA 4404, штаммом, содержащим vir-область Ti-плазмиды [6], в трехродительском скрещивании с применением Е. coli НВ101, содержащего плазмиду pRK2013 в качестве хелперного штамма [7]. Соответствующие Agrobacterium tumefaciens реципиенты селектируют на среде, содержащей рифампицин (50 мкг/мл) и канамицин (50 мкг/мл).
Клонирование фрагментов в вектора pUC19 [8], pBluescript (Stratagene), pBIN19 [9] или их производные, рестрикционно-ферментный анализ ДНК, трансформацию Е. coli реципиентных штаммов, выделение плазмидной ДНК как маленького, так и большого размера, ник-трансляцию, in vitro транскрипцию, сиквенс ДНК, блоттинг по Саузерну и гель-электрофорез ДНК проводят согласно стандартным методикам [10, 5].
Амплификацию ДНК в ходе полимеразной цепной реакции (ПЦР) проводили согласно рекомендациям изготовителя Taq полимеразы (Perkin Elmer Cetus). Амплификацию РНК путем обратной транскрипции и последующую стандартную амплификацию ДНК проводили с применением Gene Амп РНК ПЦР согласно рекомендациям изготовителя (Perkin Elmer Cetus).
Пример 1: Выделение ВОМ частиц и их генетического материала.
ВОМ серотипа I выделяют из растений тыквы и поддерживают на тыкве посредством механического переноса. Вирус выделяют из листьев системно инфицированного растения тыквы в основном согласно способу [11]. Приблизительно 100 мкг вируса в объеме 250 мкл экстрагируют фенолом, затем смесью фенола и хлороформа и наконец хлороформом. РНК осаждают этанолом и собирают центрифугированием. Осадок растворяют в 20 мкл воды.
Пример 2: Выделение ВТоМ частиц и их генетического материала.
ВТоМ, выделенный из растений томата, поддерживают на табаке посредством механического переноса. Вирус выделяют из листьев системно инфицированного растения табака в основном согласно способу [12]. Приблизительно 200 мкг вируса в объеме 300 мкл экстрагируют фенолом, затем смесью фенола и хлороформа и наконец хлороформом. РНК осаждают этанолом и собирают центрифугированием. Осадок растворяют в 50 мкл воды.
Пример 3: Молекулярное клонирование ВОМ РНК 3.
Последовательность РНК 3 ВОМ получают, применяя ПЦР на основе РНК, на очищенной ВОМ РНК (Perkin Elmer Cetus supra). Конструируют два праймера, ZUP 069:
(5' TTTGGATCCA CGTGGTCTCC TTTTGGAG 3'), (посл. 10),
который комплементарен первым 16-ти нуклеотидам на 3' конце РНК 3 ВОМ (Поcл. N. 1), и ZUP 068:
(5' TTTGGATCCG TAATCTTACC ACT 3'), (посл. 11),
который идентичен первым 14-ти нуклеотидам на 5' конце РНК 3 ВОМ (Посл. N. 1). Оба праймера содержат BamH1 сайты рестрикции, позволяющие осуществлять последующее клонирование молекул амплифицированной ДНК. Выделенную ВОМ РНК подвергают Gene Амп РНК ПЦР, а полученный ПЦР фрагмент элюируют из агарозного геля и клонируют в Sma1-линеаризированнуго pUC19, получая в результате рекомбинантную плазмиду pZU181.
Пример 4: Молекулярное клонирование ВБТ S РНК.
Путем встраивания кДНК клонов 520 и 614 в уникальный EcoRI сайт с образованием pTSWV-S1 был сконструирован кДНК клон, содержащий почти полную ВБТ S РНК-специфическую последовательность [13]. Полную последовательность ВБТ S РНК получают, применяя ПЦР на основе РНК на очищенной pTSWV-S1 ДНК (Perkin Elmer Cetus supra). Конструируют два праймера, ZUP250:
5' (TTTGGATCCA GAGCAATCGT GTCAATTTTG TGTTCATACC TTAAC) 3', (посл. 12),
который содержит 36 нуклеотидов, идентичных первым 36-ти нуклеотидам на 5' конце ВБТ S РНК (Посл. N. 8), и ZUP251:
5' (TTTGGATCCA GAGCAATTGT GTCAGAATTTTTGTTCATAAT CAAACCTCACTT) 3', (посл. 13),
который содержит 43 нуклеотида, комплементарных первым 43-м нуклеотидам на 3' конце ВБТ S РНК (Посл. N. 8). Оба праймера содержат BamH1 сайты рестрикции, позволяющие осуществлять последующее клонирование молекул амплифицированной ДНК. Полученный ПЦР фрагмент элюируют из агарозного геля и клонируют в Sma1-линеаризированную pUC19, получая в результате рекомбинантную плазмиду pTSWV-S2.
Пример 5: Молекулярное клонирование БО и БЗО генов ВТоМ.
Последовательность генов, соответствующих белку оболочки (БО) и БЗО ВТоМ получают, используя ПЦР на основе РНК. Праймер ZUP112 может располагаться с любой стороны стартового кодона трансляции БО гена ВТоМ РНК:
5' GTATTAACCA TGGCTTACTC 3' (содержащий 13 нуклеотидов, идентичных нуклеотидам 121-133 Посл. N. 1), (посл. 14.),
праймер ZUP113 может располагаться с любой стороны стоп-кодона трансляции БО гена ВТоМ РНК:
5' GCACCCATGG ATTTAAGATG 3' (содержащий 16 нуклеотидов, комплементарных нуклеотидам 595-610 Поcл. N. 1), (посл. 15),
праймер ZUP117 может располагаться с любой стороны стартового кодона трансляции БЗО гена ВТоМ РНК:
5' TATTTCTCCA TGGCTCTAGT 3' (содержащий 13 нуклеотидов, идентичных нуклеотидам 121-133 Поcл. N. 6), (посл. 16),
праймер ZUP118 может располагаться с любой стороны стоп-кодона трансляции БЗО гена ВТоМ РНК:
5' GAGTAAGCCA TGGTTAATAC 3' (содержащий 13 нуклеотидов, комплементарных нуклеотидам 911-923 Посл. N. 6), (посл. 17).
Праймеры содержат Nco1 сайты рестрикции, позволяющие осуществлять последующее клонирование молекул амплифицированной ДНК. Выделенную ВТоМ РНК подвергают Gene Амп РНК ПЦР. Полученные ПЦР фрагменты элюируют из агарозного геля и клонируют в Sma1-линеаризированную pUC19, получая в результате рекомбинантные плазмиды pZU183 (содержащую БО ген) и pZU206 (содержащую БЗО ген).
Пример 6: Синтез гена рибонуклеазы Т1.
Последовательность гена, соответствующего рибонуклеазе Т1, синтезируют на коммерческом ДНК-синтезаторе (Pharmacia LKB, Gene assembler plus) как праймер ZUP110 (содержащий нуклеотиды, идентичные нуклеотидам 121-293 Поcл. N. 4):
5' TTTCCATGGC ATGCGACTAC ACTTGCGGTT CTAACTGCTA CTCTTCTTCA GACGTTTCTA CTGCTCAAGC TGCCGGATAT AAACTTCACG AAGACGGTGA AACTGTTGGA TCTAATTCTT ACCCACACAA ATACAACAAC TACGAAGGTT TTGATTTCTC TGTGAGCTCT CCCTAC 3', (посл. 18),
и праймер ZUP111 (содержащий нуклеотиды, комплементарные нуклеотидам 278-446 Посл. N. 4):
5' GGGCCATGGT TATGTACATT CAACGAAGTT GTTACCAGAA GCACCAGTGT GAGTGATAAC ACCAGCATGT TGGTTGTTTT CGTTGAAGAC GACACGGTCA GCACCTGGAG AAGGACCAGA GTAAACATCA CCGCTAGAGA GGATAGGCCA TTCGTAGTAG GGAGAGCTCA С 3', (посл. 19).
Оба праймера содержат Nco1 сайты рестрикции, позволяющие осуществлять последующее клонирование молекул амплифицированной ДНК. Праймеры отжигают и подвергают стандартной ДНК ПЦР. Амплифицированный фрагмент ДНК элюируют из агарозного геля и клонируют в Sma1-линеаризированную pUC19, получая рекомбинантную плазмиду pZU230.
Пример 7: Конструирование и экспрессия вектора pZU-A.
Промоторный фрагмент 35S вируса мозаики цветной капусты (ВЦкМ) выделяют из рекомбинантной плазмиды pZ027, производной pUC19, несущей в виде Hindlll-PstI фрагмента длиной 444 т.п.н. Hincll-HphI область 35S промотора ВЦкМ штамма Cabb-S [14]. Нуклеотидные последовательности ВЦкМ штаммов очень схожи у различных штаммов. 35S промоторный фрагмент вырезают из pZ027 в виде EcoRI-PstI фрагмента длиной 472 т.п.н., который содержит: часть полилинкерной области, 437 т. п. н. нетранскрибируемой области и сайта инициации транскрипции и 7 т.п.н. нетранслируемой лидерной области, не содержащей никаких 35S инициаторов трансляции. 35S промоторный фрагмент лигируют с помощью Т4 лигазы в ЕсоRI-PstI линеаризированную pZO008. Плазмида pZO008 несет сигнал полиаденилирования нопалинсинтетазы (НОС) в виде Pstl-Hindlll фрагмента длиной 270 т.п.н. Полученная рекомбинантная плазмида pZU-A несет 35S промотор, уникальный PstI сайт и НОС терминатор [15].
Пример 8: Конструирование вектора для трансформации растений, который продуцирует транскрипт, реплицируемый при инфицировании ВОМ (CMV)
5' конец минус-смысловой РНК 3 ВОМ встраивают непосредственно в сайт инициации транскрипции CaMV 35S промотора с помощью двух праймеров, ZUP 148 (посл. 20):
5' CCACGTCTTC AAAGCAAG 3' (комплементарного нуклеотидам CaMV 35S промотора), и праймера ZUP 146 (посл. 21):
5' CTTCGCACCT TCGTGGGGGC TCCAAAAGGA GACCACCTCT CCAAATGAAA 3' (содержащего нуклеотиды, комплементарные нуклеотидам 1860-1827 Посл. N. 1)
с pZU-A в качестве матрицы в стандартной ДНК ПЦР реакции. Амплифицированный фрагмент ДНК подвергают рестрикции по EcoRV и клонируют в EcoRV линеаризированную pZU-A. Полученную плазмиду подвергают рестрикции по BstXI и PstI и концентрируют в агарозном геле. pZU181 подвергают рестрикции по PstI и BstXI, вставку ДНК размером 2,1 т.п.н. концентрируют в агарозном геле, а затем клонируют в сконцентрированную в геле производную pZU-A, получая в результате pCMV3AS-1.
Кодирующий белок движения (БД) домен pCMV3AS-1 замещают уникальным Ncol сайтом клонирования и вниз от 3' конца минус--смысловой РНК 3 ВОМ клонируют головную структуру Hepatitis дельта вирусной РНК посредством ПЦР амплификации двух фрагментов ДНК, используя pCMV3AS-1 в качестве матрицы. Первый фрагмент ДНК амплифицируют, применяя праймеры ZUP050:
5' AGCTGCTAAC GTCTTATTAA G 3' (содержащий нуклеотиды, комплементарные нуклеотидам 1020-1039 Посл. N. 1) (посл. 22),
и ZUP329:
5' GTCTTTAGCA CCATGGTG 3' ( содержащий нуклеотиды, идентичные нуклеотидам 604-612 Посл. N. 1) (посл. 23).
Фрагмент ДНК подвергают рестрикции по Nru1 и Nco1 и из агарозного геля элюируют фрагмент ДНК длиной 411 т.п.н. (положения 607-1016 Посл. N. 1). Второй фрагмент ДНК амплифицируют, применяя праймеры ZUP327:
5' GGAGAGCCAT GGCTCGGG 3' (содержащий нуклеотиды, комплементарные нуклеотидам 115-126 Посл. N. 1) (посл. 24)
и ZUP350, праймер, синтезированный из нуклеотидов, включающих нуклеотиды, комплементарные антигеномной РНК hepatitis дельта вируса, как описано [16] , лигированных с нуклеотидами, идентичными нуклеотидам 1-14 (3' конец праймера) Посл. N. 1:
5' TTTCTGCAGA TCTTAGCCAT CCGAGTGGA CGTGCGTCCT CCTTCGGATG CCCAGGTCGG ACCGCGAGGA GGTGGAGATG CCATGCCGAC CCGTAATCTT ACCACT) 3' (посл. 25).
Фрагмент ДНК подвергают рестрикции по Pst1 и Nco1 и из агарозного геля элюируют фрагмент ДНК длиной 208 т.п.н. Оба выделенных фрагмента ДНК клонируют в pCMV3AS-1, линеаризированную по Pst1 и Nru1, получая в результате pCMV3AS-2. Гены, кодирующие элиситоры (пример 5) или клеточные ингибиторные белки (пример 6) могут быть клонированы в виде Ncol фрагментов ДНК в уникальный Nco1 сайт pCMV3AS-2. Полученные производные pCMV3AS-2 плазмиды подвергают рестрикции по HindIII, а из агарозного геля элюируют фрагменты ДНК, содержащие химерные гены, которые затем лигируют в линеаризированную по Hindlll pBIN19, получая бинарные вектора для трансформации растений pBINCMV3-CP, pBINCMV3-РЗО и pBINCMV3-TI, соответственно.
Пример 9: Конструирование вектора для трансформации растений, который продуцирует транскрипт, реплицируемый при инфицировании ВБТ (TSWV).
5' конец минус-смысловой ВБТ S РНК встраивают непосредственно в сайт инициации транскрипции, CaMV 35S промотора с применением двух праймеров ZUP148 (Пример 8), и праймера ZUP255:
5' ACACAATTGC TCTCCTCTCC AAATGAAA 3' (содержащего нуклеотиды, идентичные нуклеотидам 2608-2621 Посл. N. 8) (посл. 26)
с pZU-A в качестве матрицы в стандартной ДНК ПЦР реакции. Амплифицированный фрагмент ДНК подвергают рестрикции по EcoRV и клонируют в EcoR5 линеаризированную pZU-A. Полученную плазмиду подвергают рестрикции по Mun1 и Pst1 и концентрируют в агарозном геле. pTSWV-S2 подвергают рестрикции по Pst1 и Mun1, фрагмент ДНК длиной 2,9 т.п.н. концентрируют в агарозном геле, а затем клонируют в элюированную из геля производную pZU-A, получая pTSWVSAS-1.
N-кодирующий домен pTSWVSAS-1 замещают уникальным Nco1 сайтом клонирования, а вниз от 3' конца минус-смысловой ВБТ S РНК клонируют головную структуру Hepatitis delta вирусной РНК, путем ПЦР амплификации двух фрагментов ДНК с применением pTSWVSAS-1 в качестве матрицы. Первый фрагмент ДНК амплифицируют с применением праймера ZUP252 (noсл. 27):
5' GACCCGAAAG GGACCAATTT С 3' (содержащего нуклеотиды, комплементарные нуклеотидам 911-930 Посл. N. 8)
и ZUP253 (посл. 28):
5' TTTCCATGGC TGTAAGTTAA ATT 3' (содержащего нуклеотиды, идентичные нуклеотидам 636-655 Поcл. N. 8).
Фрагмент ДНК подвергают рестрикции по Bal1 и Nco1, и из агарозного геля элюируют фрагмент ДНК (положения 636-911 Последовательности N. 8) длиной 269 т. п. н. Второй фрагмент ДНК амплифицируют с применением праймеров ZUP254 (посл. 29):
5' TTTCCATGGT GATCGTAAAA G 3' (содержащего нуклеотиды, комплементарные нуклеотидам 140-157 Посл. N. 8)
и ZUP255, праймера, синтезированного из нуклеотидов, включающих нуклеотиды, комплементарные антигеномной РНК hepatitis delta вируса, как описано [16] , лигируют с нуклеотидами, идентичными нуклеотидам 1-14 (3' конец праймера) Посл. N. 8:
5' TTTCTGCAGA TCTTAGCCAT CCGAGTGGAC GTGCGTCCTC CTTCGGATGC CCAGGTCGGA CCGCGAGGAG GTGGAGATGC CATGCCGACC CAGAGCAATC GTGTC 3' (посл. 30).
Скорректированный перечень последовательностей I - 30 см. далее.
Фрагмент ДНК подвергают рестрикции по Pst1 и Nco1, и из агарозного геля элюируют фрагмент ДНК длиной 245 т.п.н. Оба выделенных фрагмента ДНК клонируют в pTSWVSAS-1, линеаризированную по Pst1 и Bal1, с образованием pTSWVSAS-2. Гены, кодирующие элиситоры (пример 5) или клеточные ингибиторные белки (пример 6) клонируют в виде Ncol фрагментов ДНК в уникальный Nco1 сайт pTSWVSAS-2. Полученные pTSWVSAS-2 производные плазмиды подвергают рестрикции по Xba1, а фрагменты ДНК, содержащие химерные гены, выделяют из агарозного геля и лигируют с Xba1 линеаризированной pBIN19, с образованием бинарных векторов для трансформации растений pBINTSWVS-CP (Посл. N. 8), pBINTSWVS-РЗО и pBINTSWVS-T1, соответственно.
Пример 10: Выбор соответствующих растений-хозяев.
1) Табак, Nicotiana tabacum var. Samsun EN. Сорт табака, несущий N' ген N. sylvestris, дающий реакцию сверхчувствительности при инфицировании ВТоМ. БО ВТоМ элисирует сильную СЧР защитную реакцию в этом хозяине.
2) Томат, Lycopersicon esculentum var. ATV847, родительская линия для коммерческих гибридов Yaiza и Gemma. Линия томата, несущая Tm-22 ген устойчивости к ВТоМ. Было показано, что БЗО ВТоМ элисирует реакцию СЧР у этого устойчивого генотипа [17, 18].
Пример 11: Трансформация бинарных векторов в растительный материал табака и томата.
Способы переноса бинарных векторов в растительный материал хорошо разработаны и известны специалистам. Существующие отличия в методиках имеют место благодаря отдельным различиям в применяемых штаммах Agrobacterium, различным источникам материала эксплантата, различиям в регенерационных системах в зависимости как от сорта, так видов используемых растений.
Бинарные вектора для трансформации растений, описанные выше, применяют в экспериментах по трансформации растений согласно следующим способам. Бинарные векторные конструкции переносят посредством трехродительского скрещивания в акцепторный штамм Agrobacterium tumefaciens с последующим анализом по Саузерну экс-конъюгатов для подтверждения соответствующего переноса конструкции в акцепторный штамм, инокуляции и сокультивирования стерильного материала эксплантанта с выбранным штаммом Agrobacterium tumefaciens, селективного подавления штамма Agrobacterium tumefaciens с помощью соответствующих антибиотиков, селекции трансформированных клеток при росте на селективной среде, содержащей канамицин, переноса ткани на среду, индуцирующую корнеобразование, переноса проростков в почву, анализ сохранности конструкции путем анализов по Саузерну выделенной из трансгенного растения тотальной ДНК, анализа на соответствующую функцию встроенного химерного гена путем анализа по Норзерну и/или ферментных анализов и Вестерн-блоттинга белков [5] .
Пример 12: Экспрессия химерных последовательностей в клетках растений табака и томата.
РНК экстрагируют из листьев регенерированных растений следующим способом. В жидком азоте растирают в тонкоизмельченный порошок 200 мг листового материала. Добавляют 800 мкл буфера для экстракции РНК (100 мМ Трис-HCl (pH 8,0), 500 мМ NaCl, 2 мМ ЭДТА, 200 мМ β- Меркаптоэтанола, 0,4% ДДС), экстрагируют гомогенат фенолом и собирают нуклеиновые кислоты путем осаждения спиртом. Ресуспендируют нуклеиновые кислоты в 0,5 мл 10 мМ Трис-HCl (pH 8,0), 1мМ ЭДТА, добавляют LiCl до конечной концентрации 2 М, оставляют на льду максимально в течение 4 часов и собирают РНК центрифугированием. Ресуспендируют в 400 мкл 10 мМ Трис-HCl (pH 8,0), 1 мМ ЭДТА и осаждают спиртом, окончательно ресуспендируют в 50 мкл 10 мМ Трис-HCl (pH 8,0), 1мМ ЭДТА. РНК разделяют на гелях глиоксоль/агароза и блоттируют с Genescreen, как описано [19] . Последовательности рекомбинантной вирусной РНК определяют с помощью ДНК или РНК зондов, меченных [32P], [35S] или путем применения способов с введением нерадиоактивных меток. Основываясь на анализах по Норзерну, определяют, в какой степени регенерированные растения экспрессируют химерные рекомбинантные вирусные гены.
Растения, трансформированные последовательностями рекомбинантной вирусной ДНК, подвергают также блоттингу по Вестерну после инокуляции соответствующим вирусом. Из листьев трансформированных растений посредством их измельчения в буфере для приготовления образцов согласно [20] экстрагируют белки. Навеску 50 мкг белка подвергают электрофорезу в 12,5%-ном ДДС-полиакриламидном геле согласно [20]. Разделенные белки переносят электрофоретически на нитроцеллюлозу согласно [21]. Перенесенные белки взаимодействуют с антисывороткой, полученной против очищенных частиц ВТоМ или против очищенного БЗО белка согласно [21]. Основываясь на результатах анализов по Вестерну определяют, что трансформированные растения действительно экспрессируют элиситорные белки после инокуляции соответствующим вирусом.
Пример 13: Устойчивость растений табака и томата к ВОМ и ВБТ инфекции.
Трансформированные растения выращивают в теплице в стандартных карантинных условиях для того, чтобы предотвратить любую возможность инфицирования патогенами. Трансформанты самоопыляются, а образовавшиеся семена собирают. Растения следующего поколения анализируют на наличие сегрегации встроенного гена, а затем инфицируют ВОМ или ВБТ посредством механической инокуляции. Ткань растений, системно инфицированных ВОМ или ВБТ, измельчают в 5 объемах охлажденного на льду буфера для экстракции (10 мМ фосфатный буфер) и втирают в присутствии порошка карборунда в первые два полностью развернутые листа проростков приблизительно 5-недельного возраста. В течение 3-х недель после инокуляции следят за развитием симптомов у инокулированных растений.
Растения, содержащие последовательности ДНК ВОМ или последовательности ДНК ВБТ, обладают пониженной чувствительностью к ВОМ или ВБТ инфекциям по сравнению с нетрансформированными контрольными растениями, у которых тяжелые системные ВОМ или ВБТ симптомы развиваются в течение 7 дней после инокуляции.





















Конструкции ДНК предназначены для придания растениям устойчивости к патогенам и могут быть использованы в селекции растений. Введение конструкций ДНК, кодирующих молекулы минус- или плюс-смысловых РНК, способных взаимодействовать с РНК-зависимой РНК-полимеразой, кодируемой вирусом при его внедрении в растение, приводит к продуцированию в этом растении молекулы плюс-смысловой РНК или элиситорного элемента. Продуцирование элиситорного элемента в виде пептида, полипептида или протеина включает естественный механизм защиты растения против проникающих в него патогенов. 3 с. и 9 з.п. ф-лы, 3 ил.
| Огнетушитель | 0 |
|
SU91A1 |
| Способ получения трансгенных растений табака, устойчивых к вирусу табачной мозаики | 1990 |
|
SU1782991A1 |
Авторы
Даты
1999-09-10—Публикация
1994-06-03—Подача