Область техники, к которой относится изобретение
Изобретение относится к области медицины, стоматологии, молекулярной биологии и клинико-лабораторной диагностики и может быть использовано для определения выраженности нагноения (гноетечения) тканей пародонта по наличию в соскобе из пародонтального кармана РНК интерлейкина-8 (IL-8). Изобретение может быть использовано для выявления степени гноетечения у пациентов с различными формами пародонтита (включая агрессивный и хронический), в том числе после потери зуба, в тех случаях, когда интенсивность этого процесса не позволяет осуществлять визуальное обнаружение гноя, а также в тканях, соприкасающихся с имплантатами и другими ортодонтическими конструкциями. Использование метода обеспечивает высокочувствительную и объективную количественную характеристику степени нагноения исследуемого участка пародонта, что позволяет оценивать риск возникновения острого локального воспаления и разрушения пародонта в будущем, приживаемость имплантатов и других ортодонтических конструкций, оценивать эффективность лечебных мероприятий.
Уровень техники
Данные эпидемиологических исследований свидетельствуют, что распространенность воспалительных заболеваний пародонта среди взрослого населения составляет до 90% [Грудянов А.И. и соавт., 1998; Дмитриева Л.А., 2001]. На столь высоком фоне прослеживается тенденция к дополнительному увеличению частоты распространенности атипичных форм заболеваний пародонта, к числу которых относятся агрессивные формы пародонтита.
В качестве основной причины возникновения хронического пародонтита большинством авторов рассматривается инфицирование поверхности пародонта патогенными бактериями [Page R.C., 1985, 1991; Tanner A.C.R. et al., 2005]. В полости рта выявлено не менее 700 видов микроорганизмов, однако в качестве истинных пародонтопатогенов большинство авторов называют только виды Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Tannerella forsythensis, Treponema denticola и Candida albicans [Finoti L.S. et al., 2013]. В результате реакции организма на бактериальную инфекцию происходит деструкция тканей, сопровождающаяся прогрессирующим разрушением кости альвеолярного отростка, и, в конечном итоге, потерей зуба [Dong Y. et al., 2015].
Возникновение и течение любого заболевания инфекционной природы определяется силой ответной реакции организма [Dosseva-Panova V.T. et al., 2014]. Характер этого ответа зависит от антигенной специфичности ранее приобретенного иммунитета и в значительной степени определяется генотипом человека [Gilowski L. et al., 2012]. При этом только часть наблюдаемых реакций организма на инфекцию можно рассматривать в качестве протективных [Gemmell Е. et al., 2007]. Помимо этого, нередко возникают реакции нейтрального характера - бесполезные с точки зрения защиты организма, но оттягивающие не себя ресурсы иммунной системы [Graswinckel J.E.M. et al., 2004], а также аутотоксические реакции, вызывающие повреждение и гибель собственных клеток и тканей. Нередко именно аутотоксические реакции определяют патофизиологическую картину заболевания в целом. Кроме того, при рассмотрении бактериальных инфекций, возникающих на слизистых оболочках человека, к которым относится и пародонт, необходимо принимать в расчет симбиотические и антагонистические отношения между бактериями.
Исследования в области этиологии как агрессивного, так и хронического пародонтита привели к выявлению факта резкого подъема активности матриксинов (матриксных протеиназ, синтезируемых, в частности, фибробластами и макрофагами пародонта) при возникновении воспаления пародонта любой природы [ A. et al., 2007]. Особенно существенно - в сотни и тысячи раз, при этом возрастает активность нейтрофильной коллагеназы ММР8 и желатиназы ММР9: ферментов, участвующих в конечных стадиях деградации коллагена [Javed F. et al., 2014]. На этом основании большинство исследователей делают вывод об аутопротеолитической природе деградации соединительнотканного матрикса пародонта, лежащего в основе пародонтита [Jayaprakash К. et al., 2014]. При этом роль бактериальных протеиназ в качестве разрушителей коллагена и других компонентов матрикса рассматривается как сигнальная, хотя иногда ей также приписывается существенное значение. Однако этой точке зрения во многом противоречит тот факт, что подъем активности коллагеназ, непосредственно способных атаковать нативный коллаген, например ММР1 и ММР13, ни в одном исследовании не удалось связать с поражением пародонта [Kinney J.S., 2014]. Между тем, активация одних только терминальных матриксинов, даже достигающая нескольких порядков по сравнению с базовым уровнем, не способна влиять на целостность коллагеновой основы пародонтальной связки.
A. et al., 2007]. Особенно существенно - в сотни и тысячи раз, при этом возрастает активность нейтрофильной коллагеназы ММР8 и желатиназы ММР9: ферментов, участвующих в конечных стадиях деградации коллагена [Javed F. et al., 2014]. На этом основании большинство исследователей делают вывод об аутопротеолитической природе деградации соединительнотканного матрикса пародонта, лежащего в основе пародонтита [Jayaprakash К. et al., 2014]. При этом роль бактериальных протеиназ в качестве разрушителей коллагена и других компонентов матрикса рассматривается как сигнальная, хотя иногда ей также приписывается существенное значение. Однако этой точке зрения во многом противоречит тот факт, что подъем активности коллагеназ, непосредственно способных атаковать нативный коллаген, например ММР1 и ММР13, ни в одном исследовании не удалось связать с поражением пародонта [Kinney J.S., 2014]. Между тем, активация одних только терминальных матриксинов, даже достигающая нескольких порядков по сравнению с базовым уровнем, не способна влиять на целостность коллагеновой основы пародонтальной связки.
При рассмотрении влияния ММР8 и ММР9 на деградацию матрикса пародонта важным вопросом является регуляторный механизм подъема их активности [Moutsopoulos N.M. et al., 2015]. Исследования, выполненные методами ПЦР в реальном времени и иммуноферментного анализа показывают существенное увеличение уровня мРНК ММР8 и ММР9 [Noack В. et al., 2009], а также соответствующих белковых продуктов [Ram V.S. et al., 2015]. Однако эти показатели лишь опосредованно отражают уровень активности соответствующих ферментов [Salminen A. et al., 2014]. Дело в том, что большая часть матриксинов любой нормальной ткани находится в форме предшественников, лишенных ферментативной активности. Активация предшественников происходит по каскадному механизму, причем активация терминальных ММР (желатиназ и стромелизинов) достигается преимущественно за счет протеолитической активности матриксинов, находящихся в начале сигнального пути. Таким образом, сама по себе гиперпродукция предшественников ММР8 и ММР9, несомненно, имеющая место при воспалении пародонта, не является достаточным условием для подъема активности этих протеаз: для этого требуется еще предварительная активация ММР1, ММР2 и ММР3 [Trivedi S. et al., 2015]. Мало того, присутствие в тканях ингибиторов ММР - TIMP1, TIMP2, TIMP3 и TIMP4, общая концентрация которых в несколько раз превышает концентрацию любой ММР, позволяет полностью подавлять активность даже тех молекул ММР, которые подверглись протеолитической активации и не имеют в составе пропептида (как правило, пропептид проявляет высокую ингибирующую активность в отношении собственной ММР) [ О. et al., 2014].
О. et al., 2014].
Но опубликованные экспериментальные данные не дают никаких свидетельств того, что подобные процессы имеют место при воспалении пародонта. При этом, однако, необходимо иметь в виду, что используемые в современных работах методы ПЦР-РВ, ИФА и ФА практически не позволяют отличать активную форму ММР от предшественника [Schaumann Т. et al., 2013]. Тем более трудной эта задача является в отношении первичных ММР (ММР1, ММР2 и ММР3), концентрация которых в тканях существенно ниже, чем терминальных ММР (ММР8 и ММР9).
Резюмируя сказанное, необходимо отметить, что роль ММР8 и ММР9 в деградации пародонтальной связки и альвеолярной кости нуждается в конкретизации, хотя статистическую связь между гиперпродукцией предшественников этих матриксинов и тяжестью пародонтита можно считать доказанной.
Еще одним хорошо освещенным в литературе моментом, касающимся роли ММР8 и ММР9 в развитии пародонтита, является механизм активации их синтеза лимфокинами. Существуют неопровержимые доказательства того, что продукция ММР8 и ММР9 на пораженных участках пародонта коррелирует с увеличением концентрации там лимфокинов острого неспецифического ответа на инвазию (Тh1-тип): IL-1β, IL-12, IL-18, TNFα, лиганда-активатора NF-κВ (RANKL) и остеопротегерина (OPG). Напротив, повышение концентрации лимфокинов, стимулирующих антиген-зависимый ответ (Тh2-тип): IL-10 и IL-4 коррелирует с падением продукции ММР8 и ММР9. В то же время наблюдается повышение продукции IL-17 - фактора, стимулирующего заживление раневой поверхности после устранения инфекции [Finoti L.S. et al., 2014]. При исследовании смывов пародонта этот процесс удается наблюдать в основном на стадии ремиссии пародонтита. Имеются и прямые доказательства того, что стимуляция культивируемых in vitro фибробластов Тh1-лимфокинами: IL-1β, IL-12, IL-18, TNFα и RANKL на 2-3 порядка повышает уровень накопления предшественников металлопротеиназ, прежде всего, ММР8 и ММР9 (результаты определения мРНК и кодируемых ими белков-предшественников совпадают) [Finoti L.S. et al., 2013]. Таким образом, лимфокины должны рассматриваться в качестве одного из ключевых факторов активации продукции предшественников ММР в ответ на инвазию. При обобщении изложенных фактов вырисовывается следующая сигнальная цепь ответа на бактериальную инвазию, при определенных обстоятельствах способная вызывать распад пародонтальной связки [Fine D.H. et al., 2000]:
1) бактерии, их специфические сигнальные факторы или продукты распада (липополисахарид и ДНК) воздействуют на TLR-рецепторы (TLR1, TLR4, TLR9) поверхности резидентных клеток пародонта (фибробластов или макрофагов);
2) клетки пародонта, получившие стимул, выбрасывают лимфокины острого неспецифического ответа (Th1): IL-1β, IL-12, IL-18, TNFα и RANKL;
3) лимфокины Тh1-ответа вызывают гиперпродукцию металлопротеиназ ММР8 и ММР9. Эта реакция, вероятно, необходима для облегчения миграции в очаг инфекции лимфоцитов из циркуляции, а также облегчения проникновения компонентов комплемента и других бактерицидных факторов крови в очаг инфекции. За повышение проницаемости стенок сосудистых капилляров отвечает IL-6, формально относимый к лимфокинам Тh2-ответа. Одновременно все перечисленные факторы стимулируют положительный хемотаксис Т-лимфоцитов и NK-клеток из периферической крови, которые, в свою очередь, мобилизуются из костного мозга и региональных лимфоузлов;
4) в случае быстрого подавления развития инфекции за счет факторов Тh1-ответа вызвавший его стимул исчезает и все перечисленные реакции угасают;
5) в случае нечувствительности инфекции к Тh1-ответу за счет IL-12-зависимой выработки тормозного медиатора IL-10 и активности привлеченных в очаг NK и Т-клеток через небольшое время (1-2 суток или менее) происходит подавление Тh1-ответа и стимулируется Тh2-ответ, опосредующий выработку специфических антител к антигенам проникших во внутреннюю среду бактерий. Накопление антител стимулирует резкое усиление ударной мощи комплемента и цитотоксических клеток в отношении инфекционного агента, опсонизацию макрофагов, что приводит к подавлению инфекции. В качестве маркера накопления на пародонте лимфоцитов целесообразно рассматривать IL-2, который не может вырабатываться другими типами клеток;
6) в случае нарушения переключения Th1/Th2 ответа происходит неконтролируемое накопление ММР, приводящее к хроническому воспалению, распаду коллагенового матрикса пародонтальной связки и постепенной резорбции кости. Эти явления и лежат в основе известной клинической картины как агрессивного, так и хронического пародонтита.
Основным хемотактическим фактором привлечения нейтрофилов в очаг инфекции является IL-8 [Anovazzi G. et al., 2013]. Имеются многочисленные экспериментальные данные о локальном подъеме уровня IL-8 в очагах воспаления, в том числе при хроническом пародонтите [Микробиология и иммунология для стоматологов], что заставляет некоторых авторов причислять его к факторам Тh1-ответа. По мнению других авторов, эта точка зрения не вполне точна, поскольку накопление IL-8 в инфицированных тканях происходит, как правило, в течение длительного срока (несколько дней), не сопоставимого с длительностью протективной фазы Тh1-ответа [Bai D. et al., 2015]. Скорее, IL-8-зависимый нейтрофильный ответ можно охарактеризовать как реакцию, призванную прикрыть паузу между протективными фазами Th1 (антиген-независимого) и Th2 (антиген-зависимого) ответов. В случае пародонтита любой формы гиперпродукцию IL-8 можно рассматривать как маркер, свидетельствующий о неудаче попыток иммунной системы сдержать инфекцию за счет Тh1-ответа. При этом тип клеток, являющийся основным источником IL-8, остается неизвестным [Borilova-Linhartova P. et al., 2013]. Несомненно также, что длительная и массивная инфильтрация избытка нейтрофилов в ткань пародонта не может обеспечить протективности иммунного ответа, хотя не исключено, что при первом контакте нейтрофилов с бактериями они способны в течение определенного срока сдерживать развитие инфекции и даже полностью стерилизовать небольшие очаги инвазии [de Goncalves L.S. et al., 2006].
Большинство работ по экспериментальному исследованию механизмов индукции синтеза IL-8 при пародонтите выполнено на модели клеток гингивиального эпителия человека, в частности на иммортализованной клеточной линии ОВА-9 или на первичных гингивиальных фибробластах. Примером такой работы является статья Savitri et al., 2014, «Малеат ирзогладина ингибирует индукцию синтеза toll-рецепторов 2 типа и IL-8, индуцированную Porphyromonas gingivalis, в клетках гингивиального эпителия человека». В работе постулируется, что малеат ирзогладина (ИМ) является общеизвестным регулятором воспаления и состояния плотных межклеточных контактов. Авторы поставили целью исследовать влияние этого биологически активного вещества на взаимодействие эпиталиальных клеток десны с пародонтопатогеном P. gingivalis. Выбор этой бактерии, входящей в красный комплекс пародонтопатогенов по Сокранскому, в качестве модели авторами не аргументировался, но можно предполагать, что причиной этого является относительная легкость культивирования этого вида по сравнению с другими известными пародонтопатогенами. В качестве технического средства авторы использовали стимуляцию клеток человека in vitro цельными клетками P. gingivalis или ее очищенным полисахаридом. Уровень продукции клетками IL-8 и TLR2 (компонент системы антиген-независимого (врожденного) иммунитета) определяли с помощью ПЦР в реальном времени. С целью изучения зависимости между уровнем синтеза IL-8 и TLR2 экспрессию гена TLR2 в культуре подавляли путем трансфекции клеток малыми интерферирующими РНК (siRNA). Было показано, что ИМ снимает эффект индукции синтеза IL-8 P. gingivalis или ее очищенным полисахаридом на клетках ОВА-9 (Р<0,01). Точно такой эффект наблюдается и в отношении TLR2, причем как на культуре ОВА-9, так и на первичных фибробластах (Р<0,01). Результаты ПЦР-РВ были подтверждены иммуногистохимическим окрашиванием. Показано, что стимуляция пептидогликаном (типовым лигандом TLR2) в сочетании с ИМ приводит к снижению уровня продукции другого toll-рецептора TLR4 (Р<0,01). Напротив, липополисахарид Escherichia coli, основной лиганд TLR4, не влиял на уровень синтеза мРНК TLR2. Индуцирующий эффект полисахарида P. gingivalis на продукцию мРНК TLR4 снимался добавлением ИМ. Нарушение синтеза TLR2 с помощью siRNA приводило к снижению уровня синтеза мРНК IL-8 под действием P. gingivalis или ее полисахарида на клетках ОВА-9.
В работе шведских авторов Palm et al., 2013, «Porphyromonas gingivalis снижает уровень иммунного ответа фибробластов» утверждается, что P. gingivalis является основной причиной развития хронического пародонтита. При этом в качестве основного фактора патогенности этой бактерии, обеспечивающей также ее защиту и выживание на пародонте, называют гингвипаины - протеиназы семейства папаина. Отталкиваясь от этого, авторы исследовали поведение P. gingivalis в культуре первичных фибробластов слизистой десны и кожи человека. В качестве определяемого параметра служил уровень накопления хемокинов и цитокинов, в частности TNFα и CXCL8 (IL-8). Измерение уровня продукции этих факторов проводили с помощью ИФА и цитокинового теста. Авторы сделали вывод, что TNFα-зависимый синтез CXCL8 полностью подавляется живыми клетками P. gingivalis, тогда как клетки P. gingivalis, убитые нагреванием, не оказывают влияния на скорость продукции фибробластами CXCL8. Добавление ингибиторов аргинин-специфичной протеазы частично снимало эффект супрессии стимулирующего действия TNFα на синтез CXCL8. Кроме того, в присутствии ингибитора аргинин-специфичной протеазы восстанавливался синтез ряда других провоспалительных медиаторов, подавленный живой культурой P. gingivalis. На этом основании авторы делают предположение о ключевой роли аргинин-специфичной протеазы P. gingivalis в подавлении иммунного ответа на микрофлору пародонта.
В работе Schaumann et al., 2013, «Возможная иммуномодулирующая активность глицина при воспалении десны» описаны эксперименты по воздействию глицина на клетки эпителия десны. Авторы предположили существование специфических рецепторов глицина и выполнили эксперименты по их поиску гистохимическими методами. Первичные фибробласты эпителия десны в культуре обрабатывали IL-1β в присутствии или в отсутствие глицина, после чего с помощью ПЦР в реальном времени исследовалась динамика синтеза IL-6 и IL-8. Кроме того, с помощью иммунофлуоресцентной микроскопии исследовался транспорт регуляторного фактора NFκB в ядро. Было показано, что стимуляция глицином усиливает эффективность действия IL-1β в качестве индуктора синтеза мРНК IL-6 и IL-8, а также интенсифицирует транспорт в ядро NFκB. Таким образом, глицин способствует ослаблению воспаления эпителия десны. По мнению авторов, существует перспектива применения глицина в качестве антивоспалительного средства при пародонтите.
В работе шведских авторов Salminen A et al., 2014, «Цитокины и хемокины по-разному экспрессируются у больных пародонтитом: возможная роль TGFβ1 в качестве маркера заболевания» утверждается, что тяжелая форма пародонтита повышает риск развития системных заболеваний воспалительной природы, прежде всего атеросклероза. С учетом этого они провели комплексное исследование представленности различных цитокинов и лимфокинов в сыворотке крови, слюне и пародонтальных смывах больных пародонтитом и контрольной выборки лиц со здоровым пародонтом. Наиболее значимым отличием выборки больных оказался сниженный уровень IL-6 в крови и слюне. Напротив, уровень CXCL8 (IL-8) в крови не отличался, в слюне он был снижен, а в пародонтальных смывах - повышен. Лимфокин Т-клеточного происхождения IL-2 в крови и слюне пациентов обеих выборок содержался в одинаковой концентрации, но его содержание в пародонтальных смывах больных было существенно снижено. Неожиданным результатом оказалось существенное повышение уровня TGFβ1 в крови, слюне и пародонтальных смывах больных ХП. Исследуя это наблюдение, авторы обнаружили, что стимуляция фибробластов in vitro живыми клетками P. gingivalis дикого типа или их беспротеазных мутантов приводит к снижению уровня продукции CXCL8 и IL-6 и повышению экспрессии TGFJ31. По мнению авторов, основным фактором, ответственным за этот эффект, является лизин-специфичная цистеиновая протеиназа P. gingivalis гингвипаин Kgp. Авторы считают TGFβ1 одним из основных кандидатов на роль фактора, опосредующего системные эффекты воспаления пародонта.
Известен патент РФ №2381746 «Способ диагностики степени тяжести пародонтита». Изобретение относится к стоматологии и применяется для диагностики степени тяжести пародонтита. Метод состоит в том, что измеряют длины корней зубов на нижней и на верхней челюсти, а именно одного из одноименных зубов челюсти: клык, премоляр, первый и второй моляры. Способ позволяет увеличить возможности диагностики при сглаженной клинической картине пародонтита. По утверждениям авторов, заявленный способ диагностики степени тяжести пародонтита решает задачу создания соответствующего способа, осуществление которого обеспечивает достижение технического результата, заключающегося в возможности диагностики степени тяжести пародонтита, когда стадия обострения в явном виде себя не проявляет; в повышении достоверности способа; в упрощении и в повышении безопасности способа; в повышении оперативности.
Эффективность предложенного способа диагностики пародонтита авторы объясняют выполненными ими наблюдениями за механизмом функционирования пародонта в качестве системы крепления зубов и обеспечения жевательной функции. В результате авторами установлена корреляция между степенью тяжести воспалительного процесса в пародонте, степенью деструкции костной ткани межальвеолярной перегородки и анатомическим строением зубов, а именно длиной корней зубов. На основании статистических данных, полученных при обследовании больных, авторами доказано, что метрическая характеристика зубов, а именно длина корня, может использоваться для предсказания тяжести протекания пародонтита даже в случаях, когда обострение заболевания в явном виде себя не проявляет, а клиническая картина сглажена.
Известен патент РФ №2451937 «Способ диагностики рака молочной железы по уровню РНК интерлейкинов IL-8 и/или IL-18 в плазме крови». Изобретение относится к области медицины, онкологии и молекулярной биологии и может быть использовано для диагностики рака молочной железы. Способ основан на измерении в плазме крови уровня РНК интерлейкинов IL-8 и/или IL-18 и сравнении уровня представленности РНК IL-8 и/или IL-18 с уровнем представленности референсных транскриптов. Для осуществления способа используют обратную транскрипцию и полимеразную цепную реакцию в «реальном времени». В качестве референсных транскриптов используют РНК ABL, и/или HPRT, и/или IL-1b. Результат исследования считают положительным при разнице уровней представленности РНК IL-8 и HPRT более десяти раз. Использование заявленного способа позволяет осуществлять раннюю диагностику рака молочной железы. Патент не описывает применения ПЦР в реальном времени для диагностики пародонтита, не содержит описания метода определения мРНК IL-8 в смывах пародонта и последовательностей праймеров и зондов. Таким образом, заявляемое изобретение не нарушает прав интеллектуальной собственности, описанной в патенте РФ №2451937.
Известен патент РФ №2180119 «Способ ранней диагностики сепсиса у новорожденных». Изобретение относится к методам ранней лабораторной диагностики септической инфекции у новорожденных. Способ заключается в исследовании уровня цитокинов: интерлейкина-8 (ИЛ8) и фактора некроза опухоли (ФНО), и при концентрации ИЛ8 более 5 пг/мл и ФНО более 2 пг/мл диагностируют развитие септической инфекции. Техническим результатом является получение высокочувствительного метода ранней диагностики септической инфекции у новорожденных, что позволяет поставить клинический диагноз с наибольшей степенью вероятности и в максимально ранние сроки. Способ не использует ПЦР, в том числе ПЦР в реальном времени, и не применим в пародонтологии, так как не описывает калибровку и пробоподготовку к анализу пародонтальных смывов.
Таким образом, в настоящее время в РФ нет действующих аналогов заявляемого изобретения.
Описание (раскрытие) изобретения
Предложен способ определения степени нагноения на пародонте путем оценки уровня РНК гена интерлейкина-8 (IL-8) человека в соскобах из пародонтального кармана.
В образцах биологического материала (соскобах) пациентов с нагноением (гноетечением) по сравнению с контрольной группой существенно возрастает относительное количество РНК гена IL-8 в сравнении с референсным маркером (транскриптом).
Для оценки уровня представленности РНК гена IL-8 в соскобах можно использовать методы обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР) с регистрацией накопления продуктов реакции в режиме «реального времени», а также любые иные стандартные методы оценки уровня представленности транскриптов (NASBA, гибридизация на микрочипах, NGS и др.).
На основании экспериментальных данных при сравнении пациентов с нагноением (гноетечением) и условно-здоровых пациентов без признаков воспалительных заболеваний тканей пародонта методом ОТ-ПЦР «в реальном времени» были получены и проанализированы результаты определения уровня представленности мРНК гена IL-8 относительно референсной РНК гена β2-микроглобулина человека и относительно уникального (не повторяющегося) фрагмента генома человека.
Основным критерием для постановки диагноза хронический генерализованный пародонтит (ХГП) являлось разрушение зубодесневого прикрепления. Степень тяжести устанавливали на основании глубины пародонтальных карманов и степени деструкции костной ткани.
В базу данных заносили следующие клинические характеристики пациентов, используя цифровые коды:
1) Возраст: до 40 лет - 1, от 41 до 55 - 2, свыше 56 - 3;
2) Пол: мужской - 1, женский - 2;
3) Степень заболевания пародонта: 0 - без патологии, 1 - гингивит (в выборке отсутствовали), 2 - легкая степень ХГП, 3 - средняя степень ХГП, 4 - тяжелая степень ХГП, 5 - агрессивный пародонтит;
4) Кровоточивость: 0 - нет, 1 - есть;
5) Гноетечение: 0 - нет, 1 - есть;
6) Оголение корней зубов: 0 - нет, 1 - есть;
7) Патологическая подвижность зубов: 0 - нет, 1 - есть;
8) Потеря зубов: 0 - нет, 1 - есть;
9) Глубина пародонтального кармана: 0 - 0-1 мм, 1 - 1,1-5,0 мм, 2 - 5,1-10 мм, 3 - более 10 мм;
10) Индекс SL;
11) Индекс GW;
12) Индекс Мюллемана;
13) Табакокурение: 0 - нет, 1 - есть;
14) Неблагоприятная наследственность в анамнезе: 0 - нет; 1 - по материнской линии; 2 - по отцовской линии; 3 - по материнской и отцовской линиям; 4 - прочие родственники.
Смывы пародонтальных карманов извлекали из наиболее глубоких участков с помощью стерильных бумажных эндодонтических штифтов. Забор материала проводился в двух повторностях от каждого пациента.
Для выделения РНК штифты консервировали в пробирках типа Эппендорф объемом 1,5 мл, содержащих по 0,5 мл фиксатора для стабилизации РНК в биологических образцах IntactRNA (ЗАО «Евроген», Россия, каталожный номер № ВС031).
Непосредственно перед выделением материал смыва осаждали центрифугированием на настольной центрифуге в течение 5 мин. Из пробирки тщательно удаляли супернатант, представляющий собой раствор фиксатора IntactRNA. Очистку РНК проводили при помощи реагента ExtractRNA (ЗАО «Евроген», Россия, каталожный номер № ВС032) в соответствии с инструкцией производителя. Полученную РНК растворяли в 10 мкл деионизированной воды. Препараты РНК хранили при температуре -70°С не более 6 месяцев. Очистку от геномной ДНК не проводили.
Для синтеза кДНК использовали набор реактивов Mint (ЗАО «Евроген», Россия, каталожный номер № SK001) в соответствии с инструкцией производителя. Полученный препарат кДНК использовали для проведения ПЦР «в реальном времени».
Оценку уровня представленности транскриптов проводили при помощи коммерческих наборов реагентов: для анализа уровня РНК интерлейкина-8 использовали комплект реагентов ИммуноГенетика РНК IL-8 (ООО «НПО ДНК-Технология», Россия, каталожный номер R1-R180-N3/4), для анализа референсного маркера использовали комплект реагентов для выявления мРНК β2-микроглобулина В2М (ООО «НПО ДНК-Технология», Россия, каталожный номер R1-P805-23/9).
Значение порогового цикла (Ct) для соответствующего маркера в образце детектирующий амплификатор определял автоматически.
Результаты анализа представлены в Таблице 1.
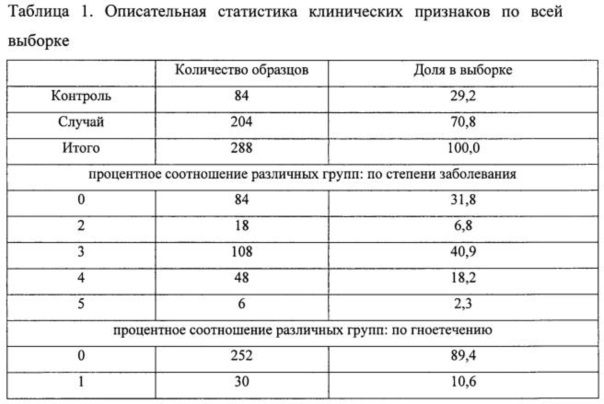
Анализировали содержание в пародонтальных смывах специфических транскрипта провоспалительного лимфокина интерлейкин-8 (IL-8). Кроме того, проводилась оценка содержания суммарной геномной РНК человека по маркеру КВМ. Результаты сравнительного анализа выборок представлены в Таблицах.

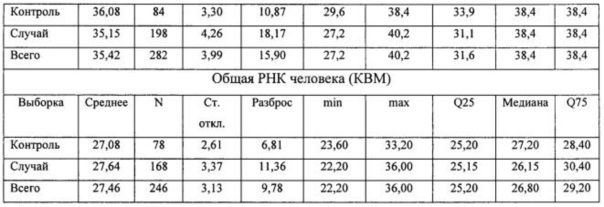
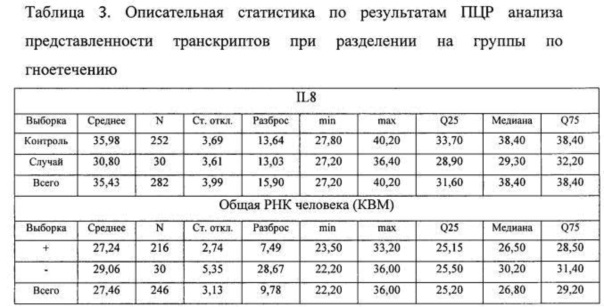
Для оценки степени различия параметров в выборках использовался критерий Манна-Уитни. При описании результата рассчитывалась медиана признака, квантили и непосредственное значение степени достоверности (р). Результаты сравнительного анализа представлены в таблице 4.
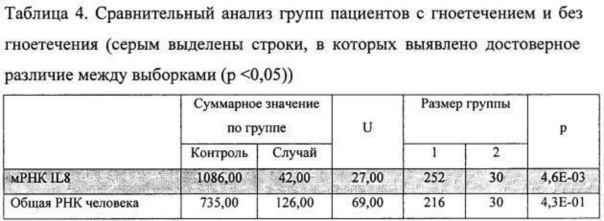
Проведенный статистический анализ позволил сделать следующие заключения:
При анализе пациентов с гноетечением и без гноетечения выявлена достоверная разница в содержании на пародонте мРНК IL-8. При исследовании общей РНК человека на пародонте аналогичной закономерности не выявляется, что говорит о специфичности реакции гиперпродукции IL-8 на пародонте при гноетечении. Это наблюдение позволяет предполагать, что при анализе транскриптома пародонта мРНК IL-8 должна рассматриваться в качестве маркера хемотактического фактора нейтрофилов, вызывающего их инфильтрацию на поверхность пародонта.
Отношение уровней представленности в образце исследуемых маркеров определяют по формуле:
[IL-8]/[Ref]=2(СtRef-CtIL-4) (формула 1),
где IL-8 - мРНК интерлейкина-8;
Ref - мРНК референсного маркера, например В2М;
Ct - значение порогового цикла для соответствующего маркера в образце, определяемое детектирующим амплификатором автоматически.
При этом, если отношение уровней экспрессии ≤16, следует диагностировать наличие нагноения (гноетечения) в исследуемой точке пародонта, а при отношении уровней экспрессии >16 - отсутствие нагноения (гноетечения).
Осуществление (реализация) изобретения
Клинический материал собирали на базе ЦНИСиЧЛХ МЗ РФ. Было обследовано 288 пациентов в возрасте от 21 до 63 лет без тяжелой соматической патологии. В исследуемой выборке находилось 204 пациента с диагнозом «пародонтит» и 84 пациента без патологии пародонта.
Смывы пародонтальных карманов получали, отбирая содержимое из наиболее глубоких участков с помощью стерильных бумажных эндодонтических штифтов (размер №25), которые затем помещали в пробирку с 1,5 мл реактива РНК-латер (консервант для РНК) (Life technologies - Invitrogen, каталожный номер №7020) и транспортировали в лабораторию в охлажденном состоянии в течение не более 6 час.
Забор проводили в двух повторностях от каждого пациента. На стадии выделения РНК и проведения ПЦР-анализа каждая повторность обрабатывалась отдельно.
Непосредственно перед выделением материал смыва осаждали центрифугированием на настольной центрифуге в течение 5 мин. Из пробирки тщательно удаляли супернатант, представляющий собой раствор фиксатора РНК-латер и вносили 200 мкл лизирующего раствора (4 М изотиоцианата гуанидина), образец тщательно перемешивали и выдерживали в течение 1 мин при комнатной температуре. Далее в пробирку с образцом вносили 100 мкл водонасыщенного фенола (органическая фаза двухфазной системы фенол - буфер Трис-НСl 40 мМ, рН 8,0) и 100 мкл смеси хлороформа и изоамилового спирта (24:1). Содержимое тщательно перемешивали на вортексе и инкубировали в течение 5 мин при комнатной температуре, периодически повторяя перемешивание. Пробирки центрифугировали на настольной центрифуге при 13000g в течение 10 мин. Тщательно избегая захвата органической фазы и интерфазы на поверхности раздела фаз, отбирали верхнюю (водную) фазу и переносили в чистую пробирку, к ней добавляли 200 мкл смеси хлороформа и изоамилового спирта (24:1). Центрифугировали на настольной центрифуге при 13000g в течение 5 мин. Отбирали верхнюю (водную) фазу и переносили в чистую полипропиленовую пробирку объемом 1,5 мл. К водной фазе добавляли чистый изопропиловый спирт объемом 200 мкл (или в пропорции 1:1 по отношению к собранной водной фазе), перемешивали содержимое 5-6-кратным переворачиванием пробирки. Пробирки центрифугировали на настольной центрифуге при 13000g в течение 10 мин. Супернатант тщательно удаляли с помощью водоструйного насоса, не касаясь осадка, содержащего нуклеиновые кислоты. Осадок промывали, внося в пробирку 100 мкл 70% водного этилового спирта и переворачивая пробирку 5-6 раз.
Пробирки центрифугировали на настольной центрифуге при 13000g в течение 10 мин. Супернатант тщательно удаляли с помощью водоструйного насоса, не касаясь осадка, содержащего нуклеиновые кислоты. Осадок высушивали при температуре 50°С при открытой крышке пробирки в течение 5 мин.
К осадку добавляли 16,5 мкл дистиллированной воды, закрывали крышки пробирок и инкубировали при температуре 50°С в течение 5 мин. Пробирки встряхивали на настольном вортексе, добиваясь полного растворения. Препараты РНК хранили при температуре -20°С не более двух месяцев.
Препараты, выделенные по методике, описанной выше, очищали от примеси геномной ДНК обработкой ДНКазой, свободной от РНКаз. Для этого к препарату суммарных нуклеиновых кислот объемом 15,5 мкл добавляли препарат ДНКазы, свободной от РНКаз, объемом 1 мкл, содержащий 1-5 ед. ферментативной активности. Смесь инкубировали при 37°С в течение 30 мин. После этого фермент инактивировали прогреванием смеси при 95°С в течение 5 мин. Капли со стенок пробирок собирали центрифугированием в течение 3-5 сек.
Для проведения обратной транскрипции использовали коммерческий набор реагентов производства ООО «НПО ДНК-Технология» (Россия). Ингредиенты набора «ОТ-буфер», «Праймеры OT-IL-8» из комплекта реагентов для обратной транскрипции оттаивали при комнатной температуре в течение 10 мин. Капли со стенок пробирок собирали центрифугированием в течение 3-5 сек.
Реакционную смесь для проведения обратной транскрипции готовили согласно инструкции производителя по следующей прописи в стерильной пробирке объемом 1,5 мл:
1. ОТ-буфер-2×(N+1)мкл;
2. «Праймеры + dNTP»-(N+1) мкл;
3. Обратная транскриптаза MuMLV 2 ед./мкл - 0,5×(N+1) мкл,
где N - количество анализируемых образцов с учетом отрицательного контроля. Капли со стенок пробирок собирали центрифугированием в течение 3-5 сек.
В пробирки, содержащие по 16,5 мкл препарата подготовленной РНК, добавляли по 3,5 мкл смеси для обратной транскрипции. При постановке отрицательного контроля использовали пробирку, содержащую 16,5 мкл очищенной воды. Перемешивали реакционные смеси 5-7-кратным пипетированием. Пробирки инкубировали при 40°С в течение 30 мин, затем останавливали реакцию прогреванием при 95°С в течение 5 мин. Капли со стенок пробирок собирали центрифугированием в течение 3-5 сек. Препарат ДНК, соответствующий 1/10 объема одного смыва (50 мкл), растворяли в 50 мкл элюирующего раствора (из набора реагентов «Проба-ГС»). В качестве матрицы для проведения одной ПЦР-реакции использовали 5 мкл полученного препарата.
ПЦР проводили следующим образом:
1. Смесь готовили в стрипованных пробирках Scintific Specialties Inc. (SSI) Part # 3135-00 UltraFlux Flat Cap PCR Tubes 200 μL, unit 1×125 tube strips with caps.
2. Промаркировали ряды пробирок для каждого исследуемого образца с учетом отрицательного контрольного образца (К(-)) и положительного контрольного образца (К(+)) и 2 пробирки для контроля фона флуоресценции.
3. В пробирки внесли буфер «Н» объемом 20 мкл, в состав которого входят все компоненты смеси для проведения ПЦР реакции, за исключением ДНК-полимеразы и ДНК-матрицы.
Состав буфера «Н» (для получения 20 мкл смеси), мкл:
18 - ПНР буфер (Комплект реагентов для ПЦР амплификации, ООО «НПО ДНК-Технология», Россия),
1,695 - вода,
0,27 - dNTP 25 мМ,
0,014 - праймер 1, 100 мМ,
0,014 - праймер 2, 100 мМ,
0,007 - зонд (Fam), 50 мМ.
4. В каждую пробирку внесли каплю расплавленного парафина, отделив реакционную смесь.
5. Подготовили раствор Tag-полимеразы (Комплект реагентов для ПЦР амплификации, ООО «НПО ДНК-Технология», Россия), встряхнув пробирку на вортексе и сбросив капли со стенок.
6. Внесли в каждую промаркированную пробирку (кроме пробирок контроля фона) по 10 мкл раствора Tag-полимеразы, не повреждая слой парафина.
7. Добавили в каждую пробирку по капле минерального масла, не повреждая слой парафина.
8. В пробирку с исследуемым образцом внесли по 5 мкл препарата ДНК, не повреждая слой парафина.
9. В пробирку с положительным контролем (К(+)) внесли 5 мкл положительного контрольного образца ДНК, в пробирки с отрицательным контролем (К(-)) и контролем фона внести 5 мкл отрицательного контрольного образца или воды, соответственно, не повреждая слой парафина.
10. Центрифугировали пробирки на микроцентрифуге 3-5 сек.
11. Установили пробирки в детектирующий амплификатор.
Для проведения ПЦР использовали следующие олигонуклеотидные праймеры и зонды:
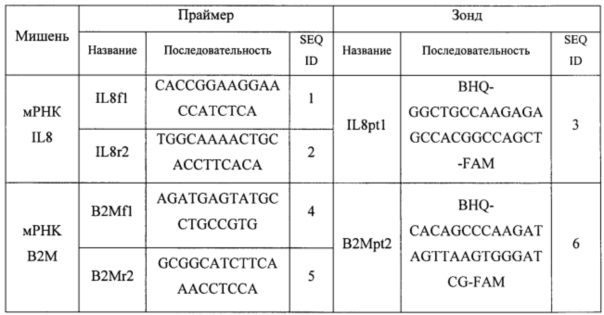
Пробирки (приготовленные, как описано выше) устанавливали в детектирующий термоциклер ДТ-прайм (ООО «НПО ДНК-Технология», Москва) и проводили реакцию со следующими параметрами циклирования:
Программа амплификации (50 циклов):
1. 94,0°С-01'30ʺ
2. 94,0°С-00'10ʺ
3. 64,0°С-00'15ʺ (+ считывание флуоресценции)
Настройки анализа, устанавливаемые на приборе:
Метод - Геометрический (Ср) (BF), cr=9, vt=10, tp=30, tv=5
Для каждой реакции программное обеспечение термоциклера автоматически вычисляло величину порогового цикла Ct. Полученные величины усредняли по двум образцам одной серии.
Если отношение уровней маркеров ≤16, подтверждали клинический диагноз нагноения (гноетечения) в исследуемой точке пародонта, а при отношении уровней маркеров >16 - отсутствие нагноения (гноетечения).
Источники информации
1. Anovazzi G, Finoti LS, Corbi SC, Kim YJ, Marcaccini AM, Gerlach RF, Capela MV, Orrico SR, Cirelli JA, Scarel-Caminaga RM. Interleukin 4 haplotypes of susceptibility to chronic periodontitis are associated with IL-4 protein levels but not with clinical outcomes of periodontal therapy. // Hum Immunol. - 2013. - Vol. 74, №12, doi: 10.1016/j.humimm. 2013.08.286.
2. Bai D, Nakao R, Ito A, Uematsu H, Senpuku H. Immunoreactive antigens recognized in serum samples from mice intranasally immunized with Porphyromonas gingivalis outer membrane vesicles. // Pathog Dis. - 2015. Vol. 73. №3.
3. Berdeli A., Emingil G., Gurkan A. et al. Association of the IL-1RN2 allele with periodontal diseases. // Clin. Biochem. - 2006. - Vol. 39. - P. 357-362.
4. Borilova-Linhartova P, Vokurka J, Poskerova H, Fassmann A, Izakovicova Holla L. Haplotype analysis of interleukin-8 gene polymorphisms in chronic and aggressive periodontitis. // Mediators Inflamm. - 2013; 2013: 342351.
5. de Goncalves L.S., Ferreira S.M., Souza C.O. et al. IL-1 gene polymorphism and periodontal status of HIV Brazilians on highly active antiretroviral therapy. // Acq. Immun. Defic. Syndr. - 2006. - Vol. 20. - P. 1779-1781.
6. Dosseva-Panova VT, Popova CL, Panov VE. Subgingival microbial profile and production of proinflammatory cytokines in chronic periodontitis. // Folia Med (Plovdiv). - 2014. - Jul. - Vol. 56, №3. - P. 152-60.
7. Fine D.H., Kaplan J.B., Kachlany S.C. et al. How we got attached to Actinobacillus actinomycetemcomitans: A model for infectious diseases. // Periodontol. - 2000. - 2006. - Vol. 42. - P. 114-157.
8. Finoti L.S., Anovazzi G., Pigossi S.C, Corbi S.C, Teixeira S.R., Braido G.V., Kim Y.J., Orrico S.R., Cirelli J.A., Mayer M.P., Scarel-Caminaga R.M. Periodontopathogens levels and clinical response to periodontal therapy in individuals with the interleukin-4 haplotype associated with susceptibility to chronic periodontitis. // Eur. J. Clin. Microbiol. Infect. Dis. - 2013. - Vol. 32, №12. - P. 1501-9.
9. Finoti L.S., Anovazzi G., Pigossi S.C, Corbi S.C, Teixeira S.R., Braido G.V., Kim Y.J., Orrico S.R., Cirelli J.A., Mayer M.P., Scarel-Caminaga R.M. Periodontopathogens levels and clinical response to periodontal therapy in individuals with the interleukin-4 haplotype associated with susceptibility to chronic periodontitis. // Eur. J. Clin. Microbiol. Infect. Dis. - 2013. - Vol. 32, №12. - P. 1501-9.
10. Fujise О., Miura M., Hamachi Т. et al. Risk of Porphyromonas gingivalis recolonization during the early period of periodontal maintenance in initially severe periodontitis sites. // J. Periodontol. - 2006. - Vol. 77, №8. - P. 1333-1339.
11. Gemmell E., Yamazaki K., Seymour G.J. The role of T cells in periodontal disease: homeostasis and autoimmunity. // Periodontol. - 2000. - 2007. - Vol. 43. - P. 14-40.
12. Gilowski L., Kondzielnik P., Wiench R., Plocica I., Strojek K.,  T.F. Efficacy of short-term adjunctive subantimicrobial dose doxycycline in diabetic patients-randomized study. // Oral. Dis. - 2012. - Vol. 18, №8. - P. 763-70.
T.F. Efficacy of short-term adjunctive subantimicrobial dose doxycycline in diabetic patients-randomized study. // Oral. Dis. - 2012. - Vol. 18, №8. - P. 763-70.
13.  P.F., Huang H., McAninley S., Alfant В., Harrison P., Aukhil I., Walker C., Shaddox L.M. Periodontal treatment reduces matrix metalloproteinase levels in localized aggressive periodontitis. // J. Periodontol. - 2013. - Vol. 84, №12. - P. 1801-8.
P.F., Huang H., McAninley S., Alfant В., Harrison P., Aukhil I., Walker C., Shaddox L.M. Periodontal treatment reduces matrix metalloproteinase levels in localized aggressive periodontitis. // J. Periodontol. - 2013. - Vol. 84, №12. - P. 1801-8.
14. Graswinckel J.E.M., van der Velden U., van Winkelhoff A.J. et al. Plasma antibody levels in periodontitis patients and controls // J. Clin. Periodontol. - 2004. - Vol. 31. -P. 562-568.
15.  A., Emingil G., Saygan B.H. et al. Matrix metalloproteinase-2, -9, and -12 gene polymorphisms in generalized aggressive periodontitis. // J. Periodontol. - 2007. - Vol. 78, №12. - P. 2338-2347.
A., Emingil G., Saygan B.H. et al. Matrix metalloproteinase-2, -9, and -12 gene polymorphisms in generalized aggressive periodontitis. // J. Periodontol. - 2007. - Vol. 78, №12. - P. 2338-2347.
16. Guzeldemir E., Gunhan M., Ozcelik O. et al. Interleukin-1 and tumor necrosis factoralpha gene polymorphisms in Turkish patients with localized aggressive periodontitis. // J. Oral Sci. - 2008. - Vol. 50. - P. 151-159.
17. Javed F., Ahmed H.B., Mikami Т., Almas K., Romanos G.E., Al-Hezaimi K. Cytokine profile in the gingival crevicular fluid of rheumatoid arthritis patients with chronic periodontitis. // J. Investig. Clin. Dent. - 2014. - Vol.5, №1. - P. 1-8.
18. Jayaprakash K., Khalaf H., Bengtsson T. Gingipains from Porphyromonas gingivalis play a significant role in induction and regulation of CXCL8 in THP-1 cells. // BMC Microbiol. - 2014. - Vol. 18. - P. 14-193.
19. Khosropanah H., Sarvestani E.K., Mahmoodi A., Golshah M. Association of IL-8 (-251A/T) gene polymorphism with clinical parameters and chronic periodontitis. // J. Dent (Tehran). - 2013. - Vol. 10(4). - P. 312-8.
20. Kinney J.S., Morelli Т., Oh M., Braun T.M., Ramseier C.A., Sugai J.V., Giannobile W.V. Crevicular fluid biomarkers and periodontal disease progression. // J. Clin. Periodontol. - 2014. - Vol. 41(2). - P. 113-20.
21. Moutsopoulos NM, Chalmers NI, Barb JJ, Abusleme L, Greenwell-Wild T, Dutzan N, Paster BJ, Munson PJ, Fine DH, Uzel G, Holland SM. Subgingival microbial communities in leukocyte adhesion deficiency and their relationship with local immunopathology. // PLoS Pathog. - 2015. - Vol.5. - P. 11(3).
22. Noack В., Gorgens H., Lorenz K. et al. TLR4 and IL-18 gene variants in chronic periodontitis: impact on disease susceptibility and severity. // Immunol. Invest. -2009. - Vol. 38, №3-4. - P. 297-310.
23. Page R.C. Critical issues in periodontal research. // J. Dent. Res. - 1995. - Vol. 74. - P. 1118-1128.
24. Palm E, Khalaf H, Bengtsson T. Porphyromonas gingivalis downregulates the immune response of fibroblasts. // BMC Microbiol. - 2013. - Vol. 10. - P. 13-155.
25. Ram VS, Parthiban, Sudhakar U, Mithradas N, Prabhakar R. Bonebiomarkers in periodontal disease: a review article. // J Clin. Diagn Res. - 2015. Vol. 9(1). - P. 07-10.
26. Salminen A., Gursoy U.K., Paju S.,  K.,
K.,  P., Buhlin К.,
P., Buhlin К.,  E., Nieminen M.S., Sorsa T., Sinisalo J., Pussinen P.J. Salivary biomarkers of bacterial burden, inflammatory response, and tissue destruction in periodontitis. // J Clin Periodontol. - 2014. - Vol. 41(5). - P. 442-50.
E., Nieminen M.S., Sorsa T., Sinisalo J., Pussinen P.J. Salivary biomarkers of bacterial burden, inflammatory response, and tissue destruction in periodontitis. // J Clin Periodontol. - 2014. - Vol. 41(5). - P. 442-50.
27. Schaumann T, Kraus D, Winter J, Wolf M, Deschner J,  A. Potential immune modularly role of glycine in oral gingival inflammation. // Clin Dev Immunol. - 2013. - PubMed PMID: 24348681.
A. Potential immune modularly role of glycine in oral gingival inflammation. // Clin Dev Immunol. - 2013. - PubMed PMID: 24348681.
28. Tanner A.C.R., Kent R. Jr., Dyke Van T. et al. Clinical and other risk indicators for early periodontitis in adults. // J. Periodontal. - 2005. -Vol. 76, №4. - P. 573-581.
29. Trivedi S, Lai N, Mahdi AA, Singh B, Pandey S. Association of salivary lipid peroxidation levels, antioxidant enzymes, and chronic periodontitis. // Int J Periodontics Restorative Dent. - 2015. - Vol. 35(2). - P. 14-9.
30.  O, Becerik S, Tervahartiala T, Sorsa T, Atilla G, Emingil G. The effect of adjunctive chlorhexidine mouthrinse on GCF MMP-8 and TIMP-1 levels in gingivitis: a randomized placebo-controlled study. // BMC Oral Health. - 2014. - Vol. 20. - P. 14:55.
O, Becerik S, Tervahartiala T, Sorsa T, Atilla G, Emingil G. The effect of adjunctive chlorhexidine mouthrinse on GCF MMP-8 and TIMP-1 levels in gingivitis: a randomized placebo-controlled study. // BMC Oral Health. - 2014. - Vol. 20. - P. 14:55.
31. Грудянов А.И., Дмитриева Л.А., Максимовский Ю.М. Пародонтология: современное состояние, вопросы и направления научных разработок. // Пародонтология. - 1998. - №3 (9). - С. 5-7.
32. Ребриков Д.В. Патент РФ №2451937. Способ диагностики рака молочной железы по уровню РНК интерлейкинов IL-8 и/или IL-18 в плазме крови.
33. Уварова Л.В., Еловикова Т.М. Патент РФ №2381746. Способ диагностики степени тяжести пародонтита. Заявка от 17.11.2008. Опубл. 20.02.2010 (прекратил действие).
34. Эстрин В.В., Ефанова Е.А., Пухтинская М.Г. Патент РФ №2180119. Способ ранней диагностики сепсиса у новорожденных. Заявка от 21.12.1998. Опубл. 27.02.2002.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оценки защитной эффективности работы неспецифического иммунитета на поверхности пародонта на основе полимеразной цепной реакции в реальном времени | 2015 |
|
RU2619174C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНОТИПА ЧЕЛОВЕКА ПО ПОЛИМОРФИЗМУ В ГЕНЕ МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ ММР9-1562 С>Т (rs3918242) | 2012 |
|
RU2548811C2 |
| СПОСОБ ОЦЕНКИ ИНТЕНСИВНОСТИ РЕАКЦИИ ВОСПАЛЕНИЯ У БОЛЬНЫХ ХРОНИЧЕСКИМ ПАРОДОНТИТОМ | 2008 |
|
RU2397707C1 |
| Способ оценки обсемененности пародонта патогенными бактериями с применением полимеразной цепной реакции в реальном времени | 2015 |
|
RU2607046C2 |
| Способ оценки прогрессирования хронического пародонтита и набор реагентов для его осуществления | 2021 |
|
RU2777783C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕНОТИПА ЧЕЛОВЕКА ПО ПОЛИМОРФИЗМУ В ГЕНЕ КОЛЛАГЕНА II ТИПА COL2A1 C>A (RS1635529) | 2012 |
|
RU2518301C1 |
| Способ включения в группу риска по развитию сахарного диабета типа 2 у больных хроническим пародонтитом | 2017 |
|
RU2671569C1 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПО УРОВНЮ ЭКСПРЕССИИ мРНК IL-10 И/ИЛИ IL-17 В ПЛАЗМЕ КРОВИ | 2020 |
|
RU2752971C1 |
| Способ оценки состояния пародонта человека на устойчивость к развитию хронического генерализованного пародонтита на основании количественного определения бактерии-пародонтопротектора Streptococcus sanguinis методом ПЦР-РВ | 2015 |
|
RU2621858C2 |
| Способ оценки состояния пародонта человека на устойчивость к развитию хронического генерализованного пародонтита на основании количественного определения бактерии-пародонтопротектора Veillonella parvula методом ПЦР в реальном времени | 2015 |
|
RU2619172C1 |
Изобретение относится к области медицины, стоматологии, молекулярной биологии и клинико-лабораторной диагностики. Описан способ определения выраженности нагноения (гноетечения) тканей пародонта. Способ основан на измерении в соскобах с пародонта уровня РНК гена интерлейкина-8 (IL-8) относительно представленности референсной РНК или ДНК. Полученные показатели используют для вычисления отношения уровней для каждого конкретного образца. Значение полученного показателя интерпретируется как маркер нагноения. Изобретение может быть использовано для определения гноетечения у индивидуальных пациентов с агрессивным и хроническим пародонтом, в том числе после потери зуба, в тех случаях, когда интенсивность этого процесса не позволяет осуществлять визуальное обнаружение гноя, а также в тканях, соприкасающихся с имплантами и другими ортодонтическими конструкциями. Использование метода обеспечивает высокочувствительную и объективную количественную характеристику степени нагноения исследуемого участка пародонта, что позволяет оценивать риск возникновения острого локального воспаления и разрушения пародонта в будущем, приживаемость имплантов и других ортодонтических конструкций, оценивать эффективность лечебных мероприятий. 2 з.п. ф-лы, 4 табл.
1. Способ диагностики нагноения (гноетечения) тканей пародонта, отличающийся тем, что в соскобах из области поражения измеряется уровень мРНК гена интерлейкина-8 (IL-8) и сравнивается с уровнем мРНК референсных транскриптов; на основании полученных уровней генетических маркеров вычисляется их отношение, при этом если отношение уровней маркеров ≤16, следует диагностировать наличие нагноения (гноетечения) в исследуемой точке пародонта, а при отношении уровней маркеров >16 - отсутствие нагноения (гноетечения).
2. Способ по п. 1, отличающийся тем, что в качестве метода определения уровня мРНК используют обратную транскрипцию и полимеразную цепную реакцию «в реальном времени».
3. Способ по п. 1, отличающийся тем, что в качестве референсных маркеров используют мРНК гена В2М человека.
| WO 2013162100 A1, 31.10.2013 | |||
| WO 2005023314 A1, 17.03.2005 | |||
| НАБОР РЕАГЕНТОВ ДЛЯ ОПРЕДЕЛЕНИЯ ДНК ПАРОДОНТОПАТОГЕННЫХ МИКРОБОВ Prevotella intermedia sensu stricto, Bacteroides forsythus, Treponema denticola, Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis ПРИ ПОМОЩИ МУЛЬТИПЛЕКСНОЙ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2005 |
|
RU2306341C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ПАРОДОНТА ПО СОСТОЯНИЮ ЛОКАЛЬНЫХ ФАКТОРОВ НЕСПЕЦИФИЧЕСКОЙ ЗАЩИТЫ ПОЛОСТИ РТА | 2009 |
|
RU2390775C1 |
Авторы
Даты
2017-01-10—Публикация
2015-05-29—Подача