Ссылка на перечень последовательностей
Данная заявка содержит перечень последовательностей в форме, адаптированной для чтения на компьютере, который включен в данный документ ссылкой.
Область техники, к которой относится изобретение
Настоящее изобретение относится к вариантам альбумина или его фрагментам или к химерным полипептидам, включающим вариант альбумина или его фрагменты, у которых изменен период полужизни по сравнению с альбумином, его фрагментом или химерным полипептидом, включающим альбумин или его фрагмент.
Описание предшествующего уровня техники
Альбумин является белком, естественно встречающимся в плазме крови млекопитающих, где он является наиболее представленным белком. Он играет важные роли в поддержании целевого осмотического давления, а также в транспорте различных веществ в кровотоке.
Альбумины описаны в различных видах, включая человека, свинью, мышь, крысу, кролика и козу, и они имеют между собой высокую степень гомологии последовательностей и структуры.
Альбумин связывается in vivo со своим рецептором, неонатальным Fc-рецептором (FcRn) «Brambell», и известно, что это взаимодействие является важным для периода полужизни альбумина в плазме. FcRn представляет собой белок, связанный с мембраной, экспрессирующийся во многих типах клеток и тканей. Было обнаружено, что FcRn предохраняет альбумин от внутриклеточной деградации (Roopenian D. С. and Akilesh, S. (2007), Nat. Rev. Immunol 7, 715-725.). FcRn представляет собой бифункциональную молекулу, которая способствует поддержанию высокого уровня IgG и альбумина в сыворотке млекопитающих, таких как люди.
В то время как взаимодействие FcRn-иммуноглобулин (IgG) описано в данной области, взаимодействие FcRn-альбумин описано в меньшей степени. Главный сайт связывания с FcRn локализован внутри DIII (381-585). Andersen et al (2010). Clinical Biochemistry 43, 367-372. Данные демонстрируют, что IgG и альбумин связываются по отдельности с отдельными сайтами на FcRn (Andersen et al. (2006), Eur. J. Immunol 36, 3044-3051; Chaudhury et al. (2006), Biochemistry 45, 4983-4990.).
Известно, что мышиный FcRn связывается с IgG мышей и людей, тогда как человеческий FcRn, по-видимому, является более селективным (Ober et al. (2001) Int. Immunol 13, 1551-1559). Andersen et al. (2010). В публикации Journal of Biological Chemistry 285(7):4826-36 описана аффинность человеческого и мышиного FcRn для каждого альбумина, мышиного и человеческого (все возможные комбинации). Не наблюдали никакого связывания альбумина из каждого вида с каждым рецептором при физиологическом рН. При кислом рН наблюдали 100-кратное отличие в аффинности связывания. Во всех случаях связывание альбумина и IgG из каждого вида с обоими рецепторами было аддитивным.
Человеческий сывороточный альбумин (англ. human serum albumin, HSA) хорошо описан в виде полипептида из 585 аминокислот, последовательность которого можно обнаружить в Peters, Т., Jr. (1996) All about Albumin: Biochemistry, Genetics and Medical, Applications pp10, Academic Press, Inc., Orlando (ISBN 0-12-552110-3). Он обладает характерным связыванием с рецептором FcRn, с которым он связывается при рН 6, но не при рН 7,4.
Было обнаружено, что период полужизни HSA в плазме составляет приблизительно 19 дней. Был идентифицирован природный вариант, имеющий более низкий период полужизни в плазме (Peach, R. J. and Brennan, S. 0., (1991) Biochim Biophys Acta. 1097:49-54), содержащий замену D494N. Замена дает в данном варианте сайт N-гликозилирования, который отсутствует в альбумине дикого типа. Неизвестно, является ли гликозилирование или аминокислотная замена ответственной за изменение периода полужизни.
Альбумин обладает продолжительным периодом полужизни в плазме и благодаря этому свойству предполагается его использование при доставке лекарственных средств. Альбумин конъюгировали с фармацевтически полезными соединениями (WO 2000/69902А), и было обнаружено, что конъюгат поддерживал продолжительный период полужизни альбумина в плазме. Полученный в результате период полужизни конъюгата в плазме, как правило, был продолжительнее, чем период полужизни в плазме индивидуального полезного терапевтического соединения.
Кроме того, альбумин сливали с терапевтически полезными пептидами (WO 2001/79271 А и WO 2003/59934 А), что обычно приводило в результате к тому, что химерный продукт обладал активностью терапевтически полезного пептида и обладал значительно более продолжительным периодом полужизни в плазме, чем индивидуально терапевтически полезные пептиды.
В публикации Otagiri et al (2009), Biol. Pharm, Bull. 32(4), 527-534, раскрыто, что известно 77 вариантов альбумина, из которых 25 обнаружены в домене III. Было продемонстрировано, что природный вариант, лишенный последних 175 аминокислот на С-конце, обладает уменьшенным периодом полужизни (Andersen et al (2010), Clinical Biochemistry 43, 367-372). Iwao et al.(2007) изучали период полужизни природных вариантов человеческого альбумина с использованием мышиной модели и обнаружили, что K541E и K560E обладали уменьшенным периодом полужизни, Е501К и Е570К обладали увеличенным периодом полужизни, и К573Е почти не имел влияния на период полужизни (Iwao, et. al. (2007) В.В.А. Proteins and Proteomics 1774, 1582-1590).
Galliano et al (1993) Biochim. Biophys. Acta 1225, 27-32 раскрывают природный вариант E505K. Minchiotti et al. (1990) раскрывают природный вариант K536E. Minchiotti et al (1987) Biochim. Biophys. Acta 916, 411-418 раскрывают природный вариант K574N. Takahashi et al (1987) Proc. Natl. Acad. Sci. USA 84, 4413-4417, раскрывают природный вариант D550G. Carison et al (1992). Proc. Nat. Acad. Sci. USA 89, 8225-8229, раскрывают природный вариант D550A.
Альбумин обладает способностью связываться с рядом лигандов, и они становятся ассоциированными (ассоциаты) с альбумином. Это свойство применяли для увеличения периода полужизни лекарственных средств в плазме, обладающих способностью нековалентно связываться с альбумином. Этого можно добиться путем связывания фармацевтически полезного соединения, которое обладает слабыми свойствами связывания с альбумином, или не обладает ими, с компонентом, обладающим свойствами связывания с альбумином. См. обзорную статью и ссылку в ней, Kratz (2008). Journal of Controlled Release 132, 171-183.
Альбумин используется в препаратах фармацевтически полезных соединений, в которых таким препаратом может быть, например, в частности, наночастица или микрочастица альбумина. В этих примерах доставка фармацевтически полезного соединения или смеси соединений может выигрывать от изменения аффинности альбумина к его рецептору, причем было продемонстрировано, что полезное соединение ассоциируется с альбумином для доставки.
Неясно, что определяет период полужизни образованных ассоциатов в плазме (в частности, например, «Levemir®», Kurtzhals P et al. Biochem. J. 1995; 312:725-731), конъюгатов или химерных полипептидов, но, по-видимому, этот период является результатом комбинации альбумина и выбранного фармацевтически полезного соединения/полипептида. Была бы целесообразной возможность контроля периода полужизни в плазме данных конъюгатов альбумина, ассоциатов или химерных полипептидов альбумина, так чтобы можно было добиваться более продолжительного или более короткого периода полужизни в плазме, чем данный, с помощью ассоциации, конъюгации или слияния с целью возможности конструирования конкретного лекарственного средства согласно особенностям признаков, которые предназначены для лечения.
Известно, что альбумин накапливается и катаболизируется в опухолях, также было продемонстрировано, что он накапливается в воспаленных суставах индивидуумов, страдающих ревматоидным артритом. См. обзорную статью и ссылку в ней, Kratz (2008). Journal of Controlled Release 132, 171-183. Предполагается, что варианты HSA с увеличенной аффинностью к FcRn будут предпочтительными для доставки фармацевтически полезных соединений.
Еще более целесообразным может быть получение вариантов альбумина, которые обладают слабой способностью связывания с FcRn или не связываются с ним, с целью получения более коротких периодов полужизни или контролируемой фармакокинетики в сыворотке, как описано в работе Kenanova et al (2009) J. Nucl. Med.; 50 (Supplement 2):1582).
Сущность изобретения
В настоящем изобретении предлагаются варианты исходного альбумина с улучшенными свойствами по сравнению с исходным альбумином. Конкретно, в изобретении предлагаются варианты исходного альбумина, у которых период полужизни в плазме отличается от периода полужизни исходного альбумина.
Настоящее изобретение относится к выделенным вариантам альбумина или его фрагментам, или к химерным полипептидам, включающим вариант альбумина или его фрагменты, из исходного альбумина, включающего изменение в одном или нескольких позициях, соответствующих позициям 417, 440, 464, 490, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 541, 542, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584 зрелого полипептида SEQ ID NO:2, где вариант не является вариантом, состоящим из SEQ ID NO:2, содержащей замену D494N, E501K, K541E, D550G,A, K573E или K574N.
Изменение в одном или нескольких положениях независимо может быть выбрано из замен, вставок и делеций, где замена является предпочтительной.
Настоящее изобретение также относится к выделенным полинуклеотидам, кодирующим варианты; к конструктам нуклеиновых кислот, векторам и клеткам-хозяевам, включающим полинуклеотиды; а также к способам получения вариантов.
Настоящее изобретение также относится к конъюгатам или ассоциатам, включающим вариант альбумина или его фрагмент по изобретению, а также полезный терапевтический компонент, или к химерному полипептиду, включающему вариант альбумина или его фрагмент по изобретению и полипептид-партнер по слиянию.
Изобретение дополнительно относится к композициям, включающим вариант альбумина, его фрагмент, химерный полипептид, включающий вариант альбумина или его фрагмент по изобретению, или к конъюгатам, включающим вариант альбумина или его фрагмент по изобретению, или к ассоциатам, включающим вариант альбумина или его фрагмент по изобретению. Композиции предпочтительно являются фармацевтическими композициями.
Изобретение дополнительно относится к фармацевтической композиции, включающей вариант альбумина, его фрагмент, химерный полипептид, включающий вариант альбумина или его фрагмент, или к конъюгатам, включающим вариант альбумина или его фрагмент, или к ассоциатам, включающим вариант альбумина или его фрагмент, где указанный вариант альбумина, его фрагмент, химерный полипептид, включающий вариант полипептида или его фрагмент, или конъюгаты, включающие вариант альбумина или его фрагмент, или ассоциаты, включающие вариант альбумина или его фрагмент, обладают отличающимся периодом полужизни в плазме по сравнению с соответствующим периодом полужизни в плазме HSA или его фрагмента, химерного полипептида, включающего HSA или его фрагмент, или конъюгатов или ассоциатов HSA или его фрагментов, включающих HSA или его фрагмент.
Краткое описание чертежей
На фигуре 1 представлена карта рестрикции экспрессирующей плазмиды pDB4082.
На фигуре 2 представлена карта рестрикции экспрессирующей плазмиды pDB2305.
На фигуре 3 представлена карта рестрикции экспрессирующей плазмиды pDB4005.
На фигуре 4 представлены SPR сенсограммы 10 мкМ альбумина, инъецированного поверх shFcRn HSA (JTA) = свободный от жирных кислот HSA, приобретенный у «Sigma-Aldrich» (A3782), HSA (Novozymes) = Коммерческий Рекомбинантный человеческий сывороточный альбумин (РЕКОМБУМИН).
На фигуре 5 представлено тИФА-связывание shFcRn-GST с вариантами человеческого сывороточного альбумина (HSA) (100-0,045 μг/мл). Связывание WT, D494N, D494Q и D494A, рН 6 и рН 7,4. Связывание WT, D494N, D494N/T496A и Т496А при рН 6 и рН 7,4. Связывание WT, E495Q и Е495А при рН 6 и рН 7,4.
На фигуре 6 представлены сенсограммы связывания 0,2 цМ вариантов HSA с иммобилизованным shFcRn (~4600 РЕ). WT, D494N, D494Q, D494A, D494N/T496A и Т496А.
На фигуре 7 представлены характерные сенсограммы связывания 1 [М вариантов HSA с иммобилизованным shFcRn (~1400 РЕ). WT, D494N, D494Q, D494A, D494N/T496A и Т496А.
На фигуре 8 представлено относительное связывание вариантов HSA по сравнению с WT на основе двух независимых SPR-экспериментов, представленных (А) на фигуре 6 и (В) на фигуре 7.
На фигуре 9 представлен тИФА-анализ: (А) связывания shFcRn с альбуминами человека, осла, быка, овцы, козы или кролика при рН 6. (В) связывания shFcRn с альбумином морской свинки, хомяка, крысы и курицы при рН 6. (С) связывания shFcRn с альбуминами человека, осла, быка, овцы, козы или кролика при рН 7,4. (D) связывания shFcRn с альбумином морской свинки, хомяка, крысы и курицы при рН 7,4. (Е) относительного связывания различных альбуминов. Относительное связывание человеческого альбумина с shFcRn определено как равное 1. Значения тИФА-анализа соответствуют средним значениям дублированных экспериментов.
На фигуре 10 представлено SPR: Связывание shFcRn-GST с альбумином из различных видов при рН 6 и рН 7,4. Характерные сенсограммы, демонстрирующие связывание 5 рМ альбумина из различных видов; (А) человек, (В) осел, (С) бык, (D) коза, (Е) овца, (F) кролик, (G) собака, (Н) морская свинка, (I) хомяк, (J) крыса, (K) мышь и (L) курица. Варианты альбумина инъецировали поверх иммобилизованного связанного с GST shFcRn (~2100 РЕ). Инъекции осуществляли при 25°С со скоростью 40 мкл/мин.
На фигуре 11 представлены SPR-сенсограммы выбранных HSA-мутантов по сравнению с HSA дикого типа. 20 мкМ (А) WT и Р499А (В) WT и K500A, (С) WT и K536A, (D) WT и Р537А и (Е) WT и K538A и (F) WT и K537A инъецировали поверх иммобилизованного shFcRn при рН 6 (~1500 РЕ)
На фигуре 12 представлены SPR-сенсограммы HSA-мутантов по сравнению с WT HSA. 10 мкМ (А) WT и K573A (В) WT и K573C, (С) WT и K573F, (D) WT и K573G и (Е) WT и K573L и (F) WT и K573M, (G) WT и K573Q, (Н) WT и K573R и (I) WT и К573Т и (J) WT и K573V инъецировали поверх иммобилизованного shFcRn при рН 5,5 и рН7,4. Инъекции осуществляли при 25°С со скоростью потока 80 мкл/мин.
На фигуре 13 представлены SPR-сенсограммы HSA-мутантов по сравнению с HSA дикого типа. 10 мкМ (А) WT и K573D (В) WT и K573E, (С) WT и K573H, (D) WT и K573I и (Е) WT и K573N и (F) WT и K573P, (G) WT и K573S, (Н) WT и К573* и (I) WT и K573W и (J) WT и K573Y инъецировали поверх иммобилизованного shFcRn при рН 5,5 и рН 7,4. Инъекции осуществляли при 25°С со скоростью потока 80 мкл/мин.
На фигуре 14 представлены SPR-сенсограммы HSA-мутантов по сравнению с HSA дикого типа. 20 мкМ (A) WT и E492G+K538H+K541N+E542D (В) WT и E492T+N503K+K541A, (С) WT и E492P+N503K+K541G+E542P, (D) WT и E492H+E501P+N503H+E505D +T506S+T540S+K541E и (Е) WT и A490D+E492T+V493L+E501P+N503D+A504E +E505K+T506F+K541D и (F) WT и E492G+V493P+K538H+K541N+E542D инъецировали поверх иммобилизованного shFcRn при рН 6. Инъекции осуществляли при 25°С со скоростью потока 80 мкл/мин.
На фигуре 15 представлены SPR-сенсограммы HSA-мутантов по сравнению с HSA дикого типа. Двадцать мкМ (А) WT, (В) H440Q, (С) H464Q и (D) H535Q инъецировали поверх иммобилизованного shFcRn при рН 6. Инъекции осуществляли при 25°С со скоростью потока 80 мкл/мин.
На фигуре 16 представлены SPR-сенсограммы HSA-мутанта K500E по сравнению с HSA дикого типа. Десять мкМ HSA-мутанта K500E инъецировали поверх иммобилизованного shFcRn при рН 5,75. Инъекции осуществляли при 25°С со скоростью потока 30 мкл/мин.
На фигуре 17 представлена карта рестрикции экспрессирующей плазмиды pDB3017.
На фигуре 18 представлена карта рестрикции экспрессирующей плазмиды pDB3021.
На фигуре 19 представлена карта рестрикции экспрессирующей плазмиды pDB3056.
На фигуре 20 представлена карта рестрикции экспрессирующей плазмиды pDB3165.
На фигуре 21 представлена карта рестрикции экспрессирующей плазмиды pDB4172.
На фигуре 22 представлена карта рестрикции экспрессирующей плазмиды pDB4267.
На фигуре 23 представлена карта рестрикции экспрессирующей плазмиды pDB4285.
На фигуре 24 представлена хроматограмма ГП-ВЭЖХ HSA дикого типа и конъюгатов мутанта K573P-HRP для анализа shFcRn. Инъецировали по 25 осуществляли на колонку «TSK G3000SWXL» (Tosoh Bioscience), как описано в материалах и методах.
На фигуре 25 представлено разделение в полиакриламидном геле с додецилсульфатом магния (ДСН-ПААГ) с последующими визуальной (А) и в ультрафиолете (В) детекцией Флуоресцеина, конъюгированного с альбумином. HSA::F5M (Дорожка 1), K573P::F5M (Дорожка 2) и rHA стандарт (Дорожка 3).
На фигуре 26 представлены свойства связывания shFcRn с вариантами HSA. 10 мкМ WT rHA и Е492Т(А), WT rHA и D494N/E495Q/T496A(B), WT rHA и N503D(C), WT rHA и N503K(D), WT rHA и E492T/N503D(E), WT rHA и E495Q/T496A(F), WT rHA и K538H(G), WT rHA и E492D(H) инъецировали поверх иммобилизованного shFcRn при рН5,5.
На фигуре 27 представлены свойства связывания shFcRn с вариантами HSA. 10 мкМ WT rHA и K541A(1) и WT rHA и K541N(J) инъецировали поверх иммобилизованного shFcRn при рН 5,5
На фигуре 28 представлено конкурентное связывание K573A и K573P, измеренное с помощью инъекции shFcRn (100 нМ) поверх иммобилизованного HSA (~2500 РЕ) при рН 6 отдельно или с предварительной инкубацией с различными количествами HSA.
На фигуре 29 представлено конкурентное связывание вариантов HSA-FLAG, измеренное с помощью инъекции shFcRn (100 нМ) поверх иммобилизованного HSA (~2500 РЕ) при рН 6 отдельно или вместе с различными количествами вариантов HSA-FLAG.
На фигуре 30 представлено конкурентное связывание вариантов HSA-IL1Ra, измеренное с помощью инъекции shFcRn (100 нМ) поверх иммобилизованного HSA (~2500 РЕ) при рН 6 отдельно или вместе с различными количествами вариантов HSA-IL1Ra.
На фигуре 31 представлено конкурентное связывание scFv-химерных вариантов HSA, измеренное с помощью инъекции shFcRn (100 нМ) поверх иммобилизованного HSA (~2500 РЕ) при рН 6 отдельно или вместе с различными количествами (А) вариантов scFv-HSA-FLAG или (В) вариантов HSA-scFv-FLAG.
На фигуре 32 представлено связывание HSA, его вариантов с одной, двумя и тремя мутациями с shFcRn. Образцы по 10 мкМ каждого варианта HSA инъецировали поверх иммобилизованного shFcRn при рН 5,5 или при рН 7,4.
Подробное описание изобретения
Настоящее изобретение относится к выделенным вариантам альбумина или его фрагментов, или к химерным полипептидам, включающим вариант альбумина или его фрагменты, из исходного альбумина, включающего изменение в одном или в нескольких позициях, соответствующих позициям 417, 440, 464, 490, 492, 493, 494, 495, 496, 499, 500. 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 541, 542, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584 зрелого полипептида SEQ ID NO:2, где вариант не является вариантом, состоящим из SEQ ID NO:2, содержащей замену D494N, Е501К, K541E, D550G,A, K573E или K574N.
Изменение в одном или нескольких положениях независимо может быть выбрано из замен, вставок и делеций, где замена является предпочтительной.
Определения
Вариант: Термин «вариант» обозначает полипептид, полученный из исходного альбумина с помощью одного или нескольких изменений, т.е. замены, вставки и/или делеций в одном или более (в нескольких) положениях. Замена обозначает замещение аминокислоты, занимающей положение, другой аминокислотой; делеция обозначает удаление аминокислоты, занимающей положение; и вставка обозначает добавление 1 или нескольких, предпочтительно, 1-3 аминокислот непосредственно по соседству с аминокислотой, занимающей положение.
Мутант: Термин «мутант» обозначает полинуклеотид, кодирующий вариант.
Альбумин дикого типа: Термин альбумин «дикого типа» (WT) обозначает альбумин, имеющий такую же аминокислотную последовательность, что и природный, обнаруженный у животных или человека.
Предшественник или исходный альбумин: «предшественник» или «исходный альбумин» обозначает альбумин, в котором специалистом были осуществлены изменения с получением вариантов альбумина по настоящему изобретению. Предшественник может быть природным (дикого типа) полипептидом или его аллелем или даже его вариантом.
FcRn и shFcRn: Термин «FcRn» обозначает человеческий неонатальный Fc-рецептор (FcRn). «shFcRn» представляет собой растворимую рекомбинантную форму FcRn.
smFcRn: Термин «smFcRn» представляет собой растворимую рекомбинантную форму мышиного неонатального Fc-рецептора.
Выделенный вариант: Термин «выделенный вариант» обозначает вариант, который модифицирован специалистом и отделен полностью или частично, по меньшей мере, от одного компонента, с которым он существует в естественном состоянии. В одном аспекте, вариант является чистым, по меньшей мере, на 1%, например, по меньшей мере, на 5%, по меньшей мере, на 10%, по меньшей мере, на 20%, по меньшей мере, на 40%, по меньшей мере, на 60%, по меньшей мере, на 80% и, по меньшей мере, на 90%, как определено с помощью ДСН-ПААГ или ГП-ВЭЖХ.
По существу чистый вариант: Термин «по существу чистый вариант» обозначает препарат, который содержит, по большей мере, 10%, по большей мере, 8%, по большей мере, 6%, по большей мере, 5%, по большей мере, 4%, по большей мере, 3%, по большей мере, 2%, по большей мере, 1%. и, по большей мере, 0,5% по массе другого полипептидного материала, с которым он ассоциирован в естественном или рекомбинантном виде. Предпочтительно, если вариант является чистым, по меньшей мере, на 92%, например, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99%, по меньшей мере, на 99,5% и 100% чистым относительно массы суммарного пептидного материала, присутствующего в препарате. Варианты по настоящему изобретению предпочтительно представлены по существу в чистом виде. Этого можно добиться, например, получением варианта с помощью хорошо известных рекомбинантных методов и с помощью методов очистки.
Зрелый полипептид: Термин «зрелый полипептид» обозначает полипептид в его конечной форме после трансляции и любых пост-трансляционных модификаций, таких как N-концевое процессирование, C-концевое укорачивание, гликозилирование, фосфорилирование и т.д. В одном аспекте, зрелый полипептид содержит аминокислоты 1-585 SEQ ID NO:2, с включением посттрансляционных модификаций.
Последовательность, кодирующая зрелый полипептид: Термин «последовательность, кодирующая зрелый полипептид» обозначает полинуклеотид, который кодирует зрелый полипептид альбумина. В одном аспекте, последовательность кодирующая зрелый полипептид содержит нуклеотиды 1-1758 SEQ ID NO:1.
Идентичность последовательности; Родство двух аминокислотных или двух нуклеотидных последовательностей описывается параметром «идентичность последовательности».
Для целей настоящего изобретения, степень идентичности последовательности между двумя аминокислотными последовательностями определяется с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48:443-453) осуществляемого в программе «Needle» пакета «EMBOSS» (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16:276-277), предпочтительно, версии 3.0.0 или более поздней. Оптимальные используемые параметры: штраф за открытие делеции 10, штраф за продолжение делеции 0,5, и подстановочная матрица «EBLOSUM62» (EMBOSS версия BLOSUM62). Данные на выходе программы «Needle», отмеченные как «самая протяженная идентичность», (полученные с использованием параметра -nobrief) используют в качестве процента идентичности и рассчитывают следующим образом:
(Идентичные остатки × 100)/(Длина выравнивания - Суммарное количество дедеций в выравнивании)
Для целей настоящего изобретения степень идентичности последовательности между двумя дезоксирибонуклеотидными последовательностями определяется с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, выше), который осуществляется в программе «Needle» пакета программ «EMBOSS» (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, выше), предпочтительно, версии 3.0.0 или более поздней. Оптимальные используемые параметры: штраф за открытие делеции 10, штраф за продолжение делеции 0,5, и подстановочная матрица «EDNAFULL» (EMBOSS версия NCBI NUC4.4). Данные на выходе программы «Needle», отмеченные как «самая протяженная идентичность», (полученные с использованием параметра -nobrief) используют в качестве процента идентичности и рассчитываются следующим образом:
(Идентичные дезоксирибонуклеотиды × 100)/(Длина выравнивания - Суммарное количество делеции в выравнивании)
Фрагмент: термин «фрагмент» обозначает полипептид, содержащий одну или более (несколько) аминокислот, делегированных с N- и/или С-конца альбумина, и/или внутренний участок альбумина, который сохраняет способность связываться с FcRn. Фрагменты могут состоять из одной непрерывной последовательности, полученной из HSA, или они могут содержать две или несколько последовательностей, полученных из HSA. Фрагменты по изобретению имеют размер более чем приблизительно 20 аминокислотных остатков, предпочтительно, более чем 30 аминокислотных остатков, более предпочтительно, более чем 40 аминокислотных остатков, более предпочтительно, более чем 50 аминокислотных остатков, более предпочтительно, более чем 75 аминокислотных остатков, более предпочтительно, более чем 100 аминокислотных остатков, более предпочтительно, более чем 200 аминокислотных остатков, более предпочтительно, более чем 300 аминокислотных остатков, более предпочтительно, более чем 400 аминокислотных остатков, и наиболее предпочтительно, более чем 500 аминокислотных остатков.
Аллельный вариант: Термин «аллельный вариант» обозначает любую из двух или более альтернативных форм гена, занимающего тот же хромосомный локус. Аллельный вариант в естественной среде образуется посредством мутации и может приводить в результате к появлению полиморфизма внутри популяций. Генные мутации могут быть молчащими (без изменений в кодируемом полипептиде) или могут кодировать полипептиды, имеющие измененные аминокислотные последовательности. Аллельный вариант полипептида представляет собой полипептид, кодируемый аллельным вариантом гена.
Кодирующая последовательность: термин «кодирующая последовательность» обозначает полинуклеотид, который непосредственно определяет аминокислотную последовательность транслируемого полипептидного продукта. Границы кодирующей последовательности, как правило, определяются открытой рамкой считывания, которая обычно начинается со старт-кодона ATG или с альтернативных старт-кодонов, таких как GTG и TTG, и заканчивается стоп-кодоном, таким как ТАА, TAG и TGA. Кодирующая последовательность может представлять собой ДНК, кДНК, синтетический или рекомбинантный полинуклеотид.
кДНК: термин «кДНК» обозначает ДНК-молекулу, которая может быть получена с помощью обратной транскрипции из зрелой, сплайсированной мРНК-молекулы, полученной из эукариотической клетки. кДНК лишена интронных последовательностей, которые могут присутствовать в соответствующей геномной ДНК. Исходный первичный РНК-транскрипт представляет собой предшественник мРНК, которая процессируется через ряд стадий, включающих сплайсинг, перед появлением зрелой сплайсированной мРНК.
Конструкт нуклеиновой кислоты: термин «конструкт нуклеиновой кислоты» обозначает молекулу нуклеиновой кислоты, либо одноцепочечную либо двухцепочечную, которая выделена из природного гена или модифицирована так, чтобы содержать сегменты нуклеиновых кислот, не существующие в естественной среде или которые являются синтетическими. Термин конструкт нуклеиновой кислоты является синонимом термину «экспрессирующая кассета», если конструкт нуклеиновой кислоты содержит контрольные последовательности, требующиеся для экспрессии кодирующей последовательности по настоящему изобретению.
Контрольные последовательности: термин «контрольные последовательности» обозначает все компоненты, необходимые для экспрессии полинуклеотида, кодирующего вариант по настоящему изобретению. Каждая контрольная последовательность может быть нативной или чужеродной полинуклеотиду, кодирующему вариант, или нативной или чужеродной друг другу. Такие контрольные последовательности включают в частности лидер, последовательность полиаденилирования, пропептидную последовательность, промотор, последовательность сигнального пептида и терминатор транскрипции. Минимально контрольные последовательности включают промотор и стоп-сигналы транскрипции и трансляции. Контрольные последовательности могут быть обеспечены линкерами для целей введения специфических сайтов рестрикции, облегчающих лидирование контрольных последовательностей внутри кодирующей области полинуклеотида, кодирующего вариант.
Функционально связанная: термин «функционально связанная» обозначает конфигурацию, в которой контрольная последовательность расположена в подходящем положении относительно кодирующей последовательности полинуклеотида, так чтобы контрольная последовательность направляла экспрессию кодирующей последовательности.
Экспрессия: термин «экспрессия» включает любую стадию, вовлеченную в продукцию варианта, включающую в частности транскрипцию, пост-транскрипционные модификации, трансляцию, пост-трансляционные модификации и секрецию.
Экспрессирующий вектор; термин «экспрессирующий вектор» обозначает линейную или циклическую молекулу ДНК, которая включает полинуклеотид, кодирующий вариант, и который функционально связан с дополнительными нуклеотидами. обеспечивающими его экспрессию.
Клетка-хозяин: термин «клетка-хозяин» обозначает любой тип клетки, которая восприимчива к трансформации, трансфекции, трансдукции и так далее, конструктом нуклеиновой кислоты или экспрессирующим вектором, включающим полинуклеотид по настоящему изобретению. Термин «клетка-хозяин» охватывает любое потомство родительской клетки, которое не идентично родительской клетке благодаря мутациям, встречающимся во время репликации.
Период полужизни в плазме: период полужизни в плазме идеально определяется in vivo у подходящих индивидуумов. Однако в связи с тем, что определение занимает много времени и дорого и неизбежны этические проблемы при осуществлении эксперимента на животных или на человеке, целесообразно использование in vitro анализа для определения того, уменьшается или увеличивается период полужизни в плазме. Известно, что связывание альбумина с его рецептором FcRn важно для периода полужизни в плазме, и корреляция между связыванием рецептора и периодом полужизни в плазме такова, что более высокая аффинность альбумина к его рецептору приводит к более продолжительному периоду полужизни в плазме. Таким образом, для настоящего изобретения более высокая аффинность альбумина к FcRn рассматривается как показатель увеличенного периода полужизни в плазме, а более низкая аффинность альбумина к его рецептору рассматривается как показатель уменьшенного периода полужизни в плазме.
В данной заявке и в формуле изобретения связывание альбумина с его рецептором FcRn описано с использованием термина аффинность и выражений «более сильная» или «более слабая». Таким образом, следует понимать, что предполагается, что молекула, имеющая более высокую аффинность к FcRn, чем HSA, связывается более сильно с FcRn, чем HSA, и предполагается, что молекула, имеющая более низкую аффинность к FcRn, чем HSA, связывается слабее с FcRn, чем HSA.
Под терминами «более продолжительный период полужизни в плазме» или «более короткий период полужизни в плазме» и под аналогичными выражениями понимают связь с соответствующей молекулой исходного альбумина. Таким образом, более продолжительный период полужизни в плазме по отношению к варианту альбумина по изобретению означает, что вариант обладает более продолжительным периодом полужизни в плазме, чем соответствующий альбумин, имеющий ту же последовательность за исключением изменения(ий) в позициях, соответствующих 417, 440, 464, 490, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 541, 542, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584 в SEQ ID NO:2.
Правила обозначений вариантов
Для целей настоящего изобретения, зрелый полипептид, раскрытый в SEQ ID NO:2, используют для определения соответствующего аминокислотного остатка в другом альбумине. Аминокислотная последовательность другого альбумина выравнивается со зрелым полипептидом, раскрытым в SEQ ID NO:2, и на основании выравнивания номер аминокислотного положения, соответствующий любому аминокислотному остатку в зрелом полипептиде, раскрытом в SEQ ID NO:2, определяется с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48:443-453) осуществляемого в программе «Needle» пакета «EMBOSS» (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16:276-277), предпочтительно, версии 3.0.0 или более поздней.
Идентификация соответствующего аминокислотного остатка в другом альбумине можно подтвердить выравниванием множества полипептидных последовательностей с использованием «ClustalW» (Larkin et al., 2007, Bioinformatics 23:2947-2948).
Если другой полипептид (или белок) отличается от зрелого полипептида SEQ ID NO:2 так, что традиционное сравнение на основе последовательностей не способно детектировать их связь (Lindahl and Elofsson, 2000, J. Mol. Biol. 295:613-615), то возможно применение других алгоритмов сравнения парных последовательностей. Можно достичь более высокой чувствительности поиска на основании последовательностей с использованием программ поиска, которые применяют вероятностные представления семейства полипептидов (профили) для поиска в базах данных. Например, программа «PSI-BLAST» генерирует профили через итерационный поиск в базах данных и способна детектировать отдаленные гомологи (Atschul et al., 1997, Nucleic Acids Res. 25:3389-3402). Еще более высокой чувствительности можно добиться, если семейство или суперсемейство полипептида имеет одного или нескольких представителей в базах данных белковых структур. Программы, такие как «GenTHREADER» (Jones, 1999, J. Mol. Biol. 287:797-815; McGuffin and Jones, 2003, Bioinformatics 19:874-881) используют информацию из различных источников («PSI-BLAST», предсказание вторичной структуры, профили структурного выравнивания и потенциал сольватации) на входе в нейтральную сеть, которая предсказывает сворачивание структуры для рассматриваемой последовательности. Аналогично, метод Gough et al., 2000, J. Mol. Biol. 313:903-919, можно применить для выравнивания последовательности неизвестной структуры в моделях суперсемейств, присутствующих в базе данных SCOP. Эти выравнивания в свою очередь можно использовать для получения моделей гомологии полипептидов, и такие модели можно оценивать на предмет точности с использованием различных средств, разработанных для таких целей.
Для выявления и получения структурных выравниваний белков известной структуры доступны несколько инструментов и ресурсов. Например, было проведено структурное выравнивание суперсемейства белков SCOP и результаты выравнивания доступны для загрузки. Две или большее количество белковых структур можно выровнять с помощью различных алгоритмов, таких как матрица расстояний (Holm and Sander, 1998, Proteins 33:88-96) или комбинаторное удлинение (Shindyalov and Bourne, 1998, Protein Engineering 11:739-747), а осуществление этих алгоритмов можно дополнительно применять к базам данных для рассматриваемой структуры с использованием представляющей интерес структуры с целью обнаружения возможных структурных гомологов (например, Holm and Park, 2000, Bioinformatics 16:566-567).
В описании вариантов альбумина по настоящему изобретению, номенклатура, описанная ниже, адаптирована для простоты поиска. Применяют принятые IUPAC однобуквенное или трехбуквенное сокращения названий аминокислот.
Замены. Для аминокислотной замены используют следующую номенклатуру: Исходная аминокислота, положение, замененная аминокислота. Соответственно, например, замена треонина на аланин в положении 226 обозначается как «Thr226Ala» или «Т226А». Множественные мутации разделены добавлением знаков («+»), например, «Gly205Arg+Ser411Phe» или «G205R+S411F», характеризующих замены в положениях 205 и 411 глицина (G) на аланин (R) и серина (S) на фенилаланин (F), соответственно. На фигурах также используются знаки («/»), например, «E492T/N503D», которые следует рассматривать как взаимозаменяемые со знаком («+»).
Делеции. Для аминокислотной делеции используют следующую номенклатуру: Исходная аминокислота, положение*. Соответственно, делеция глицина в положении 195 обозначается как «Gly195*» или «G195*». Множественные делеции разделяются знаками («+»), например, «Gly195*+Ser411*» или «G195*+S411*».
Вставки. Для вставки аминокислот используют следующую номенклатуру: Исходная аминокислота, положение, исходная аминокислота, вставленная аминокислота. Соответственно, вставка лизина после глицина в положении 195 обозначается как «Gly195GlyLys» или «G195GK». Вставка множества аминокислот обозначается [Исходная аминокислота, положение, исходная аминокислота, вставленная аминокислота #1, вставленная аминокислота #2; и т.д.]. Например, вставка лизина и аланина после глицина в положении 195 обозначается как «Gly195GlyLysAla» или «G195GKA».
В таких случаях вставленные аминокислотный остаток(остатки) нумеруются путем добавления буквы нижнего регистра к положению аминокислотного остатка, предшествующего вставленному аминокислотному остатку (остаткам). В вышеописанном примере последовательность, таким образом, будет следующей:
Множественные изменения. Варианты, включающие множественные изменения, разделяются путем добавления знаков («+»), например, «Arg170Tyr+Gly195Glu» или «R170Y+G195E», описывают замену на тирозин и глутаминовую кислоту аргинина и глицина в положениях 170 и 195, соответственно.
Различные замены. Там где могут вводиться в положение различные замены, то они разделяются запятой, например, «Arg170Tyr,Glu» описывает замену аргинина на тирозин или глутаминовую кислоту в положении 170. Таким образом, «Tyr167Gly,Ala+Arg170Gly,Ala» обозначает следующие варианты:
«Tyr167Gly+Arg170Gly», «Tyr167Gly+Arg170Ala», «Tyr167Ala+Arg170Gly», и «Tyr167Ala+Arg170Ala».
Исходный альбумин
Альбумины представляют собой белки и относятся к наиболее представленному белку в плазме млекопитающих, и альбумины из большого числа млекопитающих охарактеризованы биохимическими методами и/или по анализу последовательности. Некоторые альбумины, например, человеческий сывороточный альбумин (HSA), также описан кристаллографически с определением структуры.
HSA представляет собой предпочтительный альбумин по изобретению, и является белком, состоящим из 585 аминокислот, и имеет молекулярную массу 67 кДа. В его естественном состоянии он не гликозилирован. Аминокислотная последовательность HSA представлена в SEQ ID NO:2. Специалисту в данной области будет понятно, что могут существовать природные аллели, по существу обладающие такими же свойствами, как HSA, но содержащие одну ли несколько аминокислотных замен по сравнению с SEQ ID NO:2, и авторы изобретения также предполагают использование таких аллелей в качестве исходного альбумина по изобретению.
Альбумины, как правило, имеют продолжительный период полужизни в плазме, составляющий приблизительно 20 дней или более, например, HSA имеет период полужизни в плазме 19 дней. Известно, что продолжительный период полужизни в плазме HSA опосредован взаимодействием с его рецептором FcRn, однако понимание точного механизма продолжительности периода полужизни HSA не является существенным для данного изобретения.
Согласно изобретению, термин «альбумин» обозначает белок, имеющий такую же или очень похожую трехмерную структуру, что у HSA и обладает продолжительным периодом полужизни в плазме. В качестве примеров белков альбуминов по изобретению могут быть упомянуты человеческий сывороточный альбумин, сывороточный альбумин приматов (такой как сывороточный альбумин шимпанзе, сывороточный альбумин гориллы), сывороточный альбумин грызуна (такой как сывороточный альбумин хомяка, сывороточный альбумин морской свинки, мышиный альбумин и крысиный сывороточный альбумин), бычий сывороточный альбумин, лошадиный сывороточный альбумин, ослиный сывороточный альбумин, кроличий сывороточный альбумин, козий сывороточный альбумин, овечий сывороточный альбумин, собачий сывороточный альбумин, куриный сывороточный альбумин и свиной сывороточный альбумин. HSA, раскрытый в SEQ ID NO:2, или любой его природный аллель является предпочтительным альбумином по изобретению.
Исходный альбумин, его фрагмент или часть альбумина химерного полипептида, включающего альбумин или его фрагмент по изобретению, как правило, обладает идентичностью последовательности с последовательностью HSA, представленной в SEQ ID NO:2, составляющей, по меньшей мере, 60%, предпочтительно, по меньшей мере, 70%, предпочтительно, по меньшей мере, 80%, предпочтительно, по меньшей мере, 85%, предпочтительно, по меньшей мере, 86%, предпочтительно, по меньшей мере, 87%, предпочтительно, по меньшей мере, 88%, предпочтительно, по меньшей мере, 89%, предпочтительно, по меньшей мере, 90%, предпочтительно, по меньшей мере, 91%, предпочтительно, по меньшей мере, 92%, предпочтительно, по меньшей мере, 93%, предпочтительно, по меньшей мере, 94%, предпочтительно, по меньшей мере, 95%, более предпочтительно, по меньшей мере, 96%, более предпочтительно, по меньшей мере, 97%, более предпочтительно, по меньшей мере, 98% и наиболее предпочтительно, по меньшей мере, 99%.
Предшественник предпочтительно включает или состоит из аминокислотной последовательности SEQ ID NO:2. В другом аспекте, предшественник включает или состоит из зрелого полипептида SEQ ID NO:2.
В другом аспекте, предшественник представляет собой аллельный вариант зрелого полипептида SEQ ID NO:2.
Во втором аспекте, предшественник кодируется полинуклеотидом, который гибридизуется при условиях низкой жесткости, при условиях пониженной жесткости, при условиях умеренной жесткости, при условиях умеренной-повышенной жесткости, при условиях повышенной жесткости или при условиях высокой жесткости с (i) последовательностью, кодирующей зрелый полипептид SEQ ID NO:1, (и) последовательностью, кодирующей зрелый полипептид SEQ ID NO:1, или (iii) полноразмерной комплементарной цепью (i) или (ii) (J. Sambrook, E.F. Fritsch, and Т. Maniatis, 1989, Molecular Cloning, A Laboratory Manual, 2d edition, Cold Spring Harbor, New York).
Полинуклеотид SEQ ID NO:1 или его подпоследовательность, а также аминокислотная последовательность SEQ ID NO:2 или ее фрагмент, можно применить для создания нуклеотидных зондов для идентификации и клонирования ДНК, кодирующей предшественник из штаммов различного происхождения или из различных видов согласно способам, хорошо известным в данной области. В частности, такие зонды можно применить для гибридизации с геномной ДНК или кДНК представляющего интерес рода или вида согласно стандартной процедуре блоттинга по Саузерну с целью идентификации и выделения соответствующего гена. Такие зонды могут быть значительно короче, чем цельная последовательность, но должны составлять по длине, по меньшей мере, 14, например, по меньшей мере, 25, по меньшей мере, 35, или по меньшей мере, 70 нуклеотидов. Предпочтительно, если зонд нуклеиновой кислоты составляет по длине, по меньшей мере, 100 нуклеотидов, например, по меньшей мере, 200 нуклеотидов, по меньшей мере, 300 нуклеотидов, по меньшей мере, 400 нуклеотидов, по меньшей мере, 500 нуклеотидов, по меньшей мере, 600 нуклеотидов, по меньшей мере, 700 нуклеотидов, по меньшей мере, 800 нуклеотидов, или, по меньшей мере, 900 нуклеотидов. Можно применять зонды как в виде ДНК, так и виде РНК. Зонды, как правило, метят для детекции соответствующего гена (например, с помощью 32Р, 3H, 35S, биотина или авидина). Такие зонды охвачены настоящим изобретением.
Библиотеку геномной ДНК или кДНК, полученная из других организмов, можно подвергнуть скринингу для поиска ДНК, которая гибридизуется с описанными выше зондами, и которая кодирует предшественник. Геномная или другая ДНК из других организмов может быть электрофоретически разделена на агарозном или полиакриламидном геле или с использованием других методов разделения. ДНК из таких библиотек или разделенная ДНК можно перенести и иммобилизовать на нитроцеллюлозной мембране или на другом подходящем материале-подложке. С целью идентификации клона или ДНК, которые гомологичны SEQ ID NO:1 или ее субпоследовательности, в Саузерн-блот-анализе используют материал-подложку.
Для целей настоящего изобретения, гибридизация указывает на то, что полинуклеотид гибридизуется с меченым нуклеотидным зондом, соответствующим полинуклеотиду, представленном в SEQ ID NO:1, ее комплементарной цепи или ее субпоследовательности, в условиях гибридизации от низкой до высокой жесткости. Молекулы, с которыми гибридизуется зонд, могут быть обнаружены, например, с помощью рентгеновской пленки или любых других средств детекции, известных в данной области.
В одном аспекте, зонд нуклеиновой кислоты представляет собой последовательность, кодирующую зрелый полипептид SEQ ID NO:1. В другом аспекте зонд нуклеиновой кислоты представляет собой нуклеотиды 1-1785 SEQ ID NO:1. В другом аспекте зонд нуклеиновой кислоты представляет собой полинуклеотид, который кодирует полипептид SEQ ID NO:2 или его фрагмент. В другом аспекте зонд нуклеиновой кислоты представляет собой SEQ ID NO:1.
Для длинных зондов длиной, по меньшей мере, 100 нуклеотидов жесткость условий предгибридизации и гибридизации определяют от условий низкой до высокой жесткости при 42°С в 5Х SSPE, 0,3% ДСН, 200 микрограмм/мл фрагментированной и денатурированной ДНК спермы лосося, а также 25% формамид для условий низкой и пониженной жесткости, 35% формамид для умеренной и умеренной-повышенной жесткости, или 50% формамид для повышенной или высокой жесткости согласно стандартной процедуре блоттинг-анализа по Саузерну оптимально в течение 12-24 часов. Материал-подложку в конце промывают три раза каждый по 15 минут с использованием 2Х SSC, 0,2% ДСН при 45°С (низкая жесткость), 50°С (пониженная жесткость), 55°С (умеренная жесткость), 60°С (умеренная-повышенная жесткость), 65°С (повышеннаят жесткость), или 70°С (высокая жесткость).
Для коротких зондов, длина которых составляет от около 15 нуклеотидов до около 70 нуклеотидов, условия жесткости определяются как предгибридизация и гибридизация при температуре ниже расчетной Tm на около 5°С-10°С, которую рассчитывали согласно Bolton and McCarthy (1962, Proc. Natl. Acad. Sci. USA 48:1390) в 0,9 M NaCl, 0,09 M Tris-HCl pH 7,6, 6 мМ EDTA, 0,5% NP-40, 1X раствор Денхардта, 1 мМ натрий-фосфат, 1 мМ натрий-монофосфат, 0,1 мМ АТР, и 0,2 мг дрожжевой РНК на 1 мл согласно стандартной процедуре Саузерн-блот-анализа, оптимально в течение 12-24 часов. В конце материал-подложку промывали один раз в 6Х SCC вместе с 0,1% ДСН в течение 15 минут и дважды каждый раз по 15 минут с использованием 6Х SSC при температуре на 5°С-10°С ниже расчетной Tm.
В третьем аспекте, предшественник кодируется полинуклеотидом, идентичность последовательности которого с последовательностью, кодирующей зрелый полипептид SEQ ID NO:1, составляет, по меньшей мере, 60%, например, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99%, или 100%, и который кодирует полипептид, способный функционировать в качестве альбумина. В любом из воплощений, предшественник кодируется полинуклеотидом, включающим или состоящим из SEQ ID NO:1.
Получение вариантов
В следующем аспекте, изобретение относится к способу получения варианта альбумина, его фрагменту или к химерному полипептиду, включающему вариант альбумина или его фрагмент, причем способ включает стадии:
а. Идентификации одного или нескольких положений аминокислотных остатков, важных для связывания альбумина с FcRn, в альбумине или его фрагменте или в части альбумина в химерном полипептиде, включающем альбумин или его фрагмент;
b. Получения нуклеиновой кислоты, кодирующей указанный альбумин, его фрагмент или часть альбумина в химерном полипептиде, включающем альбумин или его фрагмент;
c. Модификации нуклеиновой кислоты, полученной в b., так чтобы один или несколько аминокислотных остатков, расположенных в позициях, идентифицированном в а., были удалены, вставлены или заменены на другую аминокислоту;
d. Экспрессии модифицированной нуклеиновой кислоты в подходящей клетке-хозяине; и
е. Извлечения варианта альбумина, его фрагмента или химерного полипептида, включающего варианта альбумина или его фрагмент.
Идентификация одного или нескольких положений аминокислотных остатков, важных для связывания альбумина с FcRn, в альбумине, его фрагменте или в части альбумина в химерном полииептиде, может быть осуществлена несколькими путями, включающими, в частности, неспецифический мутагенез с последующим анализом полученных мутантов и сравнением с немутированной исходной молекулой, и путем идентификации на основе рассмотрения структур необязательно следующей за получением вариантов, имеющих идентифицированные изменения и путем сравнения с немутированной исходной молекулой.
Предпочтительный способ идентификации одного или нескольких положений аминокислотных остатков, которые следует изменить для получения варианта HSA, обладающего измененным связыванием с FcRn по сравнению с природным HSA, включает следующие стадии:
i) идентификацию альбумина из организма, отличного от человека, и обладающего другими свойствами связывания с FcRn;
ii) идентификацию аминокислотных остатков человеческого сывороточного альбумина, взаимодействующих с FcRn;
iii) сравнение первичной и/или третичной структуры идентифицированного альбумина из организма, отличного от человека, и человеческого сывороточного альбумина в отношении аминокислотных остатков, идентифицированных в стадии ii) и идентификация аминокислотных остатков, которые отличаются у альбумина из организма, отличного от человека, и у человеческого сывороточного альбумина, и которые ответственны за наблюдаемые отличия в связывании; и
iv) необязательно получение вариантов HSA в позициях, идентифицированных в стадии iii) и подтверждение того, что полученные варианты обладают измененным связыванием с FcRn по сравнению с HSA.
Стадия i) выше может быть осуществлена с использованием анализа SPR, описанного ниже. Однако специалисту понятно, что возможно применение других способов идентификации альбуминов из организмов, отличных от человека, и обладающих другими свойствами связывания с FcRn по сравнению с HSA, и что способ не зависит от того, как идентифицируют из организма, отличного от человека альбумин, имеющий другие свойства связывания.
В одном предпочтительном воплощении идентифицированный не относящийся к человеку альбумин обладает более сильным связыванием с FcRn, чем HSA. Примеры не относящихся к человеку альбуминов, имеющих более сильное связывание с FcRn, чем у HSA, включают ослиный сывороточный альбумин, кроличий сывороточный альбумин, собачий сывороточный альбумин, сывороточный альбумин хомяка, сывороточный альбумин морской свинки, мышиный сывороточный альбумин и крысиный сывороточный альбумин. Стадию ii) можно осуществить с учетом структуры FcRn, HSA и комплекса их связывания. При отсутствии доступной структуры комплекса связывания возможно применение модели, в которой структура HSA стыкуется со структурой FcRn и таким образом определяют аминокислотные остатки HSA, взаимодействующие с FcRn.
В другом предпочтительном воплощении идентифицированный не относящийся к человеку альбумин обладает более слабым связыванием с FcRn, чем HSA. Примеры не относящихся к человеку альбуминов, обладающих более слабым связыванием с FcRn, чем HSA, включают бычий сывороточный альбумин, козий сывороточный альбумин, овечий сывороточный альбумин и куриный сывороточный альбумин. Стадию ii) можно осуществить с учетом структуры FcRn, HSA и комплекса их связывания. При отсутствии доступной структуры комплекса связывания возможно применение модели, в которой структура HSA стыкуется со структурой FcRn и таким образом определяют аминокислотные остатки HSA, взаимодействующие с FcRn.
В данном изобретении и в формуле изобретения аминокислотные остатки HSA, взаимодействующие с FcRn, представляют собой любые аминокислотные остатки HSA, расположенные на расстоянии менее чем 10А от аминокислоты в FcRn, или любой аминокислотный остаток, вовлеченный в водородную связь, ионную связь или неполярное взаимодействие с аминокислотным остатком, который расположен на расстоянии менее чем 10А от аминокислоты в FcRn. Предпочтительно, аминокислотные остатки в HSA расположены на расстоянии менее чем 10Å от аминокислот в FcRn, более предпочтительно, менее чем 6Å от аминокислот в FcRn и наиболее предпочтительно на расстоянии менее чем 3Å от аминокислот в FcRn.
Стадия iii) и iv) можно осуществлять с помощью методов, хорошо известных специалистам в данной области.
Настоящее изобретение также относится к способам получения варианта альбумина или его фрагментов или химерных полипептидов, включающих вариант альбумина или его фрагмент, или ассоциатов варианта альбумина или его фрагмента, которые включают: (а) введение в исходный альбумин или в его фрагменты или в химерные полипептиды, включающие исходный альбумин или его фрагменты, изменения в одной или нескольких позициях, соответствующих позициям 417, 440, 464, 490, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 541, 542, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584 зрелого полипептида SEQ ID NO:2; и (b) извлечение варианта альбумина или его фрагментов, или химерных полипептидов, включающих вариант альбумина или его фрагменты.
Варианты могут быть получены специалистами в данной области с использованием любой процедуры мутагенеза, известной в данной области, такой как сайт-направленный мутагенез, синтетический генный конструкт, полусинтетический генный конструкт, неспецифический мутагенез и т.д.
Сайт-направленный мутагенез представляет собой метод, в котором создаются одна или несколько мутаций в одном или нескольких определенных участках в полинуклеотиде, кодирующем предшественник.
Сайт-направленный мутагенез может быть осуществлен in vitro с помощью ПЦР, включающей использование олигонуклеотидных праймеров, содержащих целевую мутацию. Сайт-направленный мутагенез также можно осуществить in vitro с помощью кассетного мутагенеза, который состоит из гидролиза плазмиды, включающей полинуклеотид, кодирующий предшественник, рестриктазой по сайту фермента рестрикции и последующего лигирования олигонуклеотида, содержащего мутацию. Обычно фермент рестрикции гидролизует плазмиду и в олигонуклеотид одинаково, что позволяет лигировать плазмиды и вставки друг с другом. См., например, Scherer and Davis, 1979, Proc. Natl. Acad. Sci. USA 76:4949-4955; и Barton et al., 1990, Nucleic Acids Res. 18:7349-4966.
Сайт-направленный мутагенез также может быть осуществлен in vivo с помощью методов, известных в данной области. См., например, Патентную заявку США No. 2004/0171154; Storici et al., 2001, Nature Biotechnol. 19:773-776; Kren et al., 1998, Nat. Med. 4:285-290; and Calissano and Macino, 1996, Fungal Genet. Newslett. 43:15-16.
В настоящем изобретение возможно применение любой процедуры сайт-направленного мутагенеза. Существует множество коммерчески доступных наборов реактивов, которые можно использовать для получения вариантов.
Конструирование синтетических генов включает синтез молекулы разработанного полинуклеотида, который кодирует представляющий интерес полипептид. Синтез гена может быть осуществлен с применением множества методов, таких как технология мультиплексных микрочипов, описанная Tian et al. (2004, Nature 432:1050-1054), и сходные технологии, в которых олигонуклеотиды синтезируют и собирают на фотопрограммируемых микроструйных чипах.
Точечная или множественные аминокислотные замены, делеции и/или вставки могут быть осуществлены и проверены известными способами мутагенеза, рекомбинации и/или перетасовки, сразу после проведения соответствующей процедурой скрининга, как, например, процедуры, раскрытой в Reidhaar-Olson and Sauer, 1988, Science 241:53-57; Bowie and Sauer, 1989, Proc. Natl. Acad. Sci. USA 86:2152-2156; WO 95/17413; или WO 95/22625. Другие способы, которые могут быть осуществлены, включают ПЦР в условиях, способствующих ошибкам (англ. error-prone), фаговый дисплей (например, Lowman et al., 1991, Biochemistry 30:10832-10837; Патент США No. 5223409; WO 92/06204) и область-направленный мутагенез (Derbyshire et al., 1986, Gene 46: 145; Ner et al, 1988, DNA 7:127).
Способы мутагенеза/перетасовки можно объединять со способами
высокопроизводительного автоматизированного скрининга для детекции активности клонированного, подвергнутого мутагенезу полипептида, экспрессируемого клетками-хозяевами (Ness et al., 1999, Nature Biotechnology 17:893-896). Подвергнутые мутагенезу молекулы ДНК, которые кодируют активные полипептиды, могут быть извлечены из клеток-хозяев и быстро отсеквенированы с использованием стандартных способов, известных в данной области. Эти способы дают возможность быстрого определения важности индивидуальных аминокислотных остатков в полипептиде.
Конструирование полусинтетического гена осуществляли при объединении аспектов конструирования полусинтетического гена и/или сайт-направленного мутагенеза и/или случайного мутагенеза и/или перетасовки. Конструирование полусинтетического гена представляет собой способ применения синтезируемых фрагментов полинуклеотида в комбинации с методами ПЦР. Таким образом, определенные участки генов могут быть синтезированы de novo, в то время как другие участки могут быть амплифицированы с помощью сайт-специфичных праймеров для мутагенеза, при этом другие участки могут быть подвергнуты амплификации ПЦР в условиях, способствующих ошибкам, или в условиях, не способствующих ошибкам. Полинуклеотидные последовательности могут быть затем перетасованы.
Варианты
В настоящем изобретении также предлагаются варианты альбумина или их фрагменты или химерные полипептиды, включающие вариант альбумина или его фрагменты или исходный альбумин, которые содержат изменения в одной или нескольких позициях, соответствующих позициям 417, 440, 464, 490, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 541, 542, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584 в SEQ ID NO:2, где каждое изменение независимо представляет собой замену, вставку или делецию при условии, что вариант не является SEQ ID NO:2 с заменами D494N, E501K, К541Е, D550G,A, K573E или K574N.
Вариант альбумина, его фрагмент или часть альбумина в химерном полипептиде, включающем альбумин или его фрагмент по изобретению, как правило, обладает идентичностью последовательности с последовательностью HSA, представленной в SEQ ID NO:2, составляющей, по меньшей мере, 60%, предпочтительно, по меньшей мере, 70%, предпочтительно, по меньшей мере, 80%, предпочтительно, по меньшей мере, 85%, предпочтительно, по меньшей мере, 90%, более предпочтительно, по меньшей мере, 95%, более предпочтительно, по меньшей мере, 96%, более предпочтительно, по меньшей мере, 97%, более предпочтительно, по меньшей мере, 98% и наиболее предпочтительно, по меньшей мере, 99%.
В одном аспекте количество изменений в вариантах по настоящему изобретению составляет 1-20, например, 1-10 и 1-5, как, например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 изменений.
Вариант альбумина, его фрагменты или химерный полипептид, включающий вариант альбумина или его фрагмент, обладает измененным периодом полужизни в плазме по сравнению с исходным альбумином, его фрагментами или химерным полипептидом, включающим вариант альбумина или его фрагмент.
В особенно предпочтительном воплощении, исходный альбумин представляет собой HSA и его вариант, фрагмент или химерный полипептид, включающий вариант альбумина или его фрагмент, который обладает измененным периодом полужизни в плазме по сравнению с HSA, соответствующим фрагментом или химерным полипептидом, включающим HSA или его фрагмент.
Корреляция между связыванием альбумина с его рецептором и периодом полужизни в плазме была реализована авторами настоящего изобретения на основе природного аллеля HSA D494N. Авторы изобретения проанализировали этот аллель и обнаружили, что он обладает более низкой аффинностью к своему рецептору FcRn.
Кроме того, было раскрыто, что трансгенная мышь, имеющая природный FcRn, замененный на человеческий FcRn, содержит более высокий уровень сывороточного альбумина, чем у обычной мыши; см. (J Exp Med. (2003) 197(3):315-22). Авторы изобретения обнаружили, что человеческий FcRn имеет более высокую аффинность к мышиному сывороточному альбумину, чем мышиный FcRn к мышиному сывороточному альбумину, и, таким образом, наблюдаемое повышение уровня сывороточного альбумина у трансгенных мышей соответствует более высокой аффинности между сывороточным альбумином и его рецептором, что подтверждает корреляцию между связыванием альбумина с FcRn и периодом полужизни в плазме. Кроме того, в работе Kenanova et al (2009) J. Nucl. Med.; 50 (Supplement 2):1582) было продемонстрировано, что в мышиной модели варианты альбумина, которые либо обладают слабым связыванием с FcRn, либо не связываются с ним, имеют уменьшенный период полужизни в плазме.
Один из путей определения повышенной или пониженной аффинности варианта альбумина к FcRn относительно исходного альбумина, заключается в описанном ниже применении Поверхностного Плазменного Резонанса (SPR). Специалисту в данной области понятно, что возможно применение других способов определения повышенной или пониженной аффинности варианта альбумина к FcRn относительно исходного альбумина, например, путем определения и сравнения констант связывания KD. Таким образом, согласно изобретению предполагается, что вариант альбумина, имеющий KD ниже, чем KD природного HSA, имеет более длинный период полужизни в плазме, чем HSA, а вариант альбумина, имеющий KD выше, чем KD природного HSA, имеет более короткий период полужизни в плазме, чем HSA.
Варианты альбумина или его фрагменты или химерные полипептиды, включающие альбумин или его фрагменты, содержат одно или несколько изменений, таких как замены, делеции или вставки, в одной или нескольких позициях, соответствующих позициям в HSA, выбранным из группы, состоящей из 417, 440, 464, 490, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 541, 542, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584. Замена может представлять собой любую замену, в которой аминокислота в последовательности природного альбумина заменяется на другую аминокислоту, выбранную из оставшихся 19 природных аминокислот.
В одном аспекте вариант включает изменение в одной или нескольких позициях, соответствующих позициям 417, 440, 464, 490, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 541, 542, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584 в SEQ ID NO:2. В другом аспекте вариант включает изменение в двух позициях, соответствующих любой из 417, 440, 464, 490, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 541, 542, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584 в SEQ ID NO:2. В другом аспекте вариант включает изменение в трех позициях, соответствующих любой из 417, 440, 464, 490, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 541, 542, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584 в SEQ ID NO:2. В еще одном аспекте вариант включает изменение в каждой позиции, соответствующей позициям 417, 440, 464, 490, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 541, 542, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584 в SEQ ID NO:2.
В другом аспекте вариант включает замену Q417A,H в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену H440Q в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену H464Q в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену A490D в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену E492G,T,P,H в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену V493P,L в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену D494N,Q,A,E,P в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену E495Q,A в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену Т496А в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену Р499А в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену K500E,G,D,A,S,C,P,H,F,N,W,T,M,Y,V,Q,L,I,R в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену E501A,P,Q в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену N503K,D,H в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену А504Е в зрелом полипептиде SEQ ID NO:2, В другом аспекте вариант включает замену E505K, D в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену T506F, S в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену H510Q в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену H535Q в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену K536A в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену Р537А в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену K538A,Н в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену T540S в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену K541A,D,G,N,E в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену E542P,D в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену D550N в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену K573Y,W,P,H,F,V,I,T,N,S,G,M,C,A,E,Q,R,L,D в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену K574N в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену Q580K в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену L575F в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену А577Т,Е в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену A578R,S в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену S579C,T в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену Q580K в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену A581D в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену А582Т в зрелом полипептиде SEQ ID NO:2. В другом аспекте вариант включает замену G584A в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 417. В другом аспекте аминокислоту в позиции, соответствующей позиции 417, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Ala или His. В другом аспекте вариант включает замену Q417A,H в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 440. В другом аспекте аминокислоту в позиции, соответствующей позиции 440, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Ala. В другом аспекте вариант включает замену H440Q в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 464. В другом аспекте аминокислоту в позиции, соответствующей позиции 464, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Ala. В другом аспекте вариант включает замену H464Q в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 490. В другом аспекте, аминокислоту в положении, соответствующем 490, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val. В другом аспекте вариант включает замену A490G в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 492. В другом аспекте аминокислоту в позиции, соответствующей позиции 492, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Gly. В другом аспекте вариант включает замену E492G в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 493. В другом аспекте аминокислоту в позиции, соответствующей позиции 493, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Pro. В другом аспекте вариант включает замену V493P в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 494. В другом аспекте аминокислоту в позиции, соответствующей позиции 494, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Asn, Gln или Ala. В другом аспекте вариант включает замену D494N,Q,A в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 495. В другом аспекте аминокислоту в позиции, соответствующей позиции 495, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Gln или Ala. В другом аспекте вариант включает замену E495Q или А в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 496. В другом аспекте аминокислоту в позиции, соответствующей позиции 496, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Ala. В другом аспекте вариант включает замену Т496А в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 499. В другом аспекте аминокислоту в позиции, соответствующей позиции 499, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Ala. В другом аспекте вариант включает замену Р499А в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 500. В другом аспекте аминокислоту в позиции, соответствующей позиции 500, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Ala. В другом аспекте вариант включает замену K500E,G,D,A,S,C,P,H,F,N,W,T,M,Y,V,Q,L,I,R в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 501. В другом аспекте аминокислоту в позиции, соответствующей позиции 501, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Ala или Gln для уменьшения аффинности, и на Pro для повышения аффинности. В другом аспекте вариант включает замену E501A,Q,P в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 503. В другом аспекте аминокислоту в позиции, соответствующей позиции 503, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Asp или Lys, или His. В другом аспекте вариант включает замену N503D,K,H в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 504. В другом аспекте аминокислоту в позиции, соответствующей позиции 504, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val. В другом аспекте вариант включает замену А504 в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 505. В другом аспекте аминокислоту в позиции, соответствующей позиции 505 заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val. В другом аспекте вариант включает замену E505D в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 506. В другом аспекте аминокислоту в позиции, соответствующей позиции 506, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val. В другом аспекте вариант включает замену T506S,F в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 510. В другом аспекте аминокислоту в позиции, соответствующей позиции 510, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Gln. В другом аспекте вариант включает замену H510Q в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 535. В другом аспекте аминокислоту в позиции, соответствующей позиции 535, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Gln. В другом аспекте вариант включает замену H535Q в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 536. В другом аспекте аминокислоту в позиции, соответствующей позиции 536, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Ala. В другом аспекте вариант включает замену K536A в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 537. В другом аспекте аминокислоту в позиции, соответствующей позиции 537, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Ala. В другом аспекте вариант включает замену Р537А в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 538. В другом аспекте аминокислоту в позиции, соответствующей позиции 538, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Ala. В другом аспекте вариант включает замену K538H, А в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 540. В другом аспекте аминокислоту в позиции, соответствующей позиции 540, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val. В другом аспекте вариант включает замену T540S в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 541. В другом аспекте аминокислоту в позиции, соответствующей позиции 541, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Gly, Asp или Ala. В другом аспекте вариант включает замену K541G,DA,N в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 542. В другом аспекте аминокислоту в позиции, соответствующей позиции 542, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Asp или Pro. В другом аспекте вариант включает замену E542D, Р в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 550. В другом аспекте аминокислоту в позиции, соответствующей позиции 550, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Asn для уменьшения аффинности, и на Glu для увеличения аффинности.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 573. В другом аспекте аминокислоту в позиции, соответствующей позиции 573, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Tyr, Trp, Pro, His, Phe, Val, Ile, Thr, Asn, Ser, Gly, Met, Cys, Ala, Glu, Gln, Arg, Leu, Asp.В другом аспекте вариант включает замену K573Y,W,P,H,F,V,I,T,N,S,G,M,C,A,E,Q,R,L,D в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 574. В другом аспекте аминокислоту в позиции, соответствующей позиции 574, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Asn. В другом аспекте вариант включает замену K574N в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 575. В другом аспекте аминокислоту в позиции, соответствующей позиции 575, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Phe. В другом аспекте вариант включает замену L575F в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 577. В другом аспекте аминокислоту в позиции, соответствующей позиции 577 заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Thr или Glu. В другом аспекте вариант включает замену А577ТЕ в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 578. В другом аспекте аминокислоту в позиции, соответствующей позиции 578, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Arg или Ser. В другом аспекте вариант включает замену A578R,S в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 579. В другом аспекте аминокислоту в позиции, соответствующей позиции 579, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Cys или Thr. В другом аспекте вариант включает замену S579C,T в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 580. В другом аспекте аминокислоту в позиции, соответствующей позиции 580, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Lys. В другом аспекте вариант включает замену Q580K в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 581. В другом аспекте аминокислоту в позиции, соответствующей позиции 581, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Asp. В другом аспекте вариант включает замену A581D в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 582. В другом аспекте аминокислоту в позиции, соответствующей позиции 582, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Thr. В другом аспекте вариант включает замену А582Т в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменение в позиции, соответствующей позиции 584. В другом аспекте аминокислоту в позиции, соответствующей позиции 584, заменяют на Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, или Val, предпочтительно на Ala. В другом аспекте вариант включает замену G584A в зрелом полипептиде SEQ ID NO:2.
В другом аспекте вариант включает изменения в позициях, соответствующих позициям 494 и 496 в SEQ ID NO:2, таким как описанные выше.
В другом аспекте вариант включает изменения в позициях, соответствующих позициям 492 и 493 в SEQ ID NO:2, таким как описанные выше.
В другом аспекте вариант включает изменения в позициях, соответствующих позициям 494 и 417 в SEQ ID NO:2, таким как описанные выше.
В другом аспекте вариант включает изменения в позициях, соответствующих позициям 492 и 503 в SEQ ID NO:2, таким как описанные выше.
В другом аспекте вариант включает изменения в позициях, соответствующих позициям 492 и 573 в SEQ ID NO:2, таким как описанные выше.
В другом аспекте вариант включает изменения в позициях, соответствующих позициям 492, 503 и 573 в SEQ ID NO:2, таким как описанные выше.
В одном воплощении, вариант альбумина или его фрагменты или химерные полипептиды, включающие вариант альбумина или его фрагменты по изобретению, содержат одну замену в позиции, соответствующей позиции HSA, выбранном из группы, состоящей из 417, 440, 464, 490, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 541, 542, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584 в SEQ ID NO:2, при условии, что вариант альбумин не является вариантом, состоящим из SEQ ID NO:2 с заменой D494N, E501K, K541E, D550G,A, K573E or K574N. Вариант альбумина, его фрагмент или химерные полипептиды, включающие вариант альбумина или его фрагмент по изобретению, могут включать дополнительные замены, вставки или делеции в одном или более (в нескольких) позициях, соответствующих позициям в HSA.
В другом воплощении, вариант альбумина или его фрагменты или химерные полипептиды, включающие вариант альбумина или его фрагменты по изобретению, содержат две, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать, двадцать или еще более замен в позициях, соответствующих позициям в HSA, выбранным из группы, состоящей из 417, 440, 464, 490, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 541, 542, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584 SEQ ID NO:2. Вариант альбумина, его фрагмент или химерные полипептиды, включающие вариант альбумин или его фрагмент по изобретению, могут включать дополнительные замены, вставки или делеции в одном или более (в нескольких) позициях, соответствующих позициям в HSA.
В следующем воплощении, варианты альбумина или его фрагменты или химерные полипептиды, включающие вариант альбумина или его фрагмент по изобретению, имеют период полужизни в плазме, продолжительнее, чем период полужизни в плазме исходного альбумина, его фрагмента или химерного полипептида, включающего исходный альбумин или его фрагмент. Согласно данному воплощению примеры включают варианты альбумина или его фрагменты или химерные полипептиды, включающие вариант альбумина или его фрагмент, которые несут замену в положении, соответствующем 492, 503, 542, 550, 573, 574, 580, 581, 582 или 584 в SEQ ID NO:2. Предпочтительные замены согласно данному воплощению изобретения включают замену аминокислотного остатка в положении 492 в SEQ ID NO:2, на остаток G, замену аминокислотного остатка в положении 503 в SEQ ID NO:2, на остаток Н или K, замену аминокислотного остатка в положении 550 в SEQ ID NO:2 на остаток Е, замену аминокислотного остатка в положении 573 в SEQ ID NO:2 на остаток Y,W,P,H,F,V,I,T,N,S,G,M,C,A,E,Q,R,L или D, замену аминокислотного остатка в положении 574 в SEQ ID NO:2 на остаток N, замену аминокислотного остатка в положении, соответствующем 580 в SEQ ID NO:2 на остаток K. Другие предпочтительные варианты содержат замену в положении, соответствующем 492 в SEQ ID NO:2, на остаток G, и замену в положении, соответствующем 473 в SEQ ID NO:2, на остаток А или Р. Другой предпочтительный вариант содержит ряд замен в положении, соответствующем 492 в SEQ ID NO:2, на остаток Н, и в положении 503 в SEQ ID NO:2.
Другие предпочтительные варианты содержат замену в положении, соответствующем 492 в SEQ ID NO:2 на остаток G, и замену в позиции, соответствующей позиции 503 в SEQ ID NO:2, на Н или K, и замену в положении 573 в SEQ ID NO:2 на остаток А или Р.
В следующем воплощении, варианты альбумина или его фрагменты или химерные полипептиды, включающие вариант альбумина или его фрагмент по изобретению, имеют период полужизни в плазме, короче, чем период полужизни в плазме исходного альбумина, его фрагмента или химерного полипептида, включающего исходный альбумин или его фрагмент.Примеры согласно данному воплощению включают варианты альбумина или его фрагменты или химерные полипептиды, включающие вариант альбумина или его фрагмент, которые несут замену в положении, соответствующем 417, 440, 494, 495, 496, 499, 500, 501, 536, 537, 538, 541, 494+496 или 492+493 в SEQ ID NO:2. Предпочтительные замены включают замены, соответствующие Q417A, H440Q, D494E+Q417H, D494N,Q,A, E495Q,A, T496A, D494N+T496A or, P499A, K500A, Е501А, E501Q, K536A, Р537А, K538A, K541G, K541A K541D или D550N в SEQ ID NO:2.
В другом воплощении изобретения, варианты альбумина или его фрагменты или химерные полипептиды, включающие вариант альбумина или его фрагмент по изобретению утратили свою способность связываться с FcRn. В этой связи предполагается, что варианты альбумина или его фрагменты или химерные полипептиды, включающие вариант альбумина или его фрагменты утратили способность связываться с FcRn, если измеренные для варианта резонансные единицы SPR, описанном ниже, составляют менее чем 10% измеренных резонансных единиц для соответствующего исходного альбумина или его фрагмента. Примеры согласно данному воплощению включают варианты альбумина или его фрагменты или химерные полипептиды, включающие вариант альбумина или его фрагмент, которые несут замену в положении, соответствующем 464, 500, 510 или 535 в SEQ ID NO:2. Предпочтительные замены включают замены, соответствующие H464Q, K500A,P,C,S,A,D,G H510Q или H535Q в SEQ ID NO:2.
Дополнительно к одной или нескольким заменам в одном или нескольких позициях, соответствующих позициям 417, 464, 490, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 541, 542, 550, 573, 574, 580 581, 582 и 584 в SEQ ID NO:2, вариант альбумина или его фрагменты или химерные полипептиды, включающие вариант альбумина или его фрагменты по изобретению, могут нести дополнительные замены, делеции или вставки в других положениях молекул. Такие дополнительные замены, делеции или вставки можно применять с целью изменения других свойств молекул, таких как, без ограничения перечисленным, измененное гликозилирование; введение реакционноспособных групп поверхности, таких как тиольные группы, удаление/образования сайта карбамоилирования; и т.д.
Остатки, которые могут быть изменены с целью обеспечения реакционноспособных остатков на поверхности, и которые преимущественно можно применять в настоящем изобретении, раскрыты в патентной заявке WO 2010/092135 (включенной ссылкой). Особенно предпочтительные остатки включают положения, соответствующие положениям SEQ ID NO:2.
В качестве примеров изменений, которые могут быть сделаны в SEQ ID NO:2 или в соответствующих положениях в других альбуминах с целью обеспечения реакционноспособных групп на поверхности, включают изменения, соответствующие следующим изменениям в SEQ ID NO:2: L585C, D1C, А2С, D562C, А364С, А504С, Е505С, Т79С, Е86С, D129C, D549C, А581С, D121C, Е82С, S270C, А578С, L595LC, D1DC, А2АС, D562DC, А364АС, А504АС, Е505ЕС, Т79ТС, Е86ЕС, D129DC, D549DC, А581АС, А581АС, D121DC, Е82ЕС, S270SC, А579АС, С360*, С316*, С75*, С168*, С558*, С361*, С91*, С124*, С169* и С567*. В ином случае, цистеиновый остаток может быть добавлен к N- или С-концу альбумина.
Полинуклеотиды
Настоящее изобретение также относится к выделенным полинуклеотидам, которые кодируют любой из вариантов по настоящему изобретению.
Нуклеотидные конструкты
Настоящее изобретение также относится к конструктам нуклеиновых кислот, включающим полинуклеотид, кодирующий вариант по настоящему изобретению, функционально связанный с одной или несколькими контрольными последовательностями, которые направляют экспрессию кодирующей последовательности в подходящей клетке-хозяине в условиях, совместимых с контрольными последовательностями.
Для обеспечения экспрессии варианта полинуклеотид можно обрабатывать различными способами. Операции с полинуклеотидом перед его вставкой в вектор могут быть целесообразны или необходимы в зависимости от экспрессирующего вектора. Методы модификации полинуклеотидов, в которых используются методы рекомбинантной ДНК, хорошо известны в данной области.
Контрольная последовательность может представлять собой промоторную последовательность, которая распознается клеткой-хозяином для экспрессии полинуклеотида. Промоторная последовательность содержит последовательности контроля транскрипции, которые опосредуют экспрессию варианта. Промотором может быть любая последовательность нуклеиновой кислоты, которая демонстрирует транскрипционную активность в клетке-хозяине, включая мутантный, укороченный и гибридный промоторы, и которая может быть получена из генов, кодирующих внеклеточные или внутриклеточные полипептиды, гомологичные или гетерологичные по отношению к клетке-хозяину.
В дрожжевом хозяине, применяемые промоторы получают из генов энолазы Saccharomyces cerevisiae (ENO-1), протеазы A Saccharomyces cerevisiae (PRA1), протеазы В Saccharomyces cerevisiae (PRB1), фактора элонгации трансляции Saccharomyces cerevisiae (TEF1), фактора элонгации трансляции Saccharomyces cerevisiae (TEF2), галактокиназы Saccharomyces cerevisiae (GAL1), алкогольдегидрогеназы/глицеральдегид-3-фосфат дегидрогеназы Saccharomyces cerevisiae (ADH1, ADH2/GAP), триозафосфат изомеразы Saccharomyces cerevisiae (TPI), металлотионенина Saccharomyces cerevisiae (CUP1), и 3-фосфоглицерат киназы Saccharomyces cerevisiae. Другие применяемые промоторы для дрожжевых клеток-хозяев описаны у Romanes et al., 1992, Yeast 8: 423-488.
Контрольная последовательность также может представлять собой подходящую последовательность терминации транскрипции, которая распознается клеткой-хозяином для терминации транскрипции. Терминаторная последовательность функционально связана с 3’-концом полинуклеотида, кодирующего вариант. Возможно использование любого терминатора, который функционален в клетке-хозяине.
Предпочтительные терминаторы для дрожжевых клеток-хозяев получают из генов энолазы Saccharomyces cerevisiae, цитохрома С Saccharomyces cerevisiae (CYC1), алкогольдегидрогеназы Saccharomyces cerevisiae (ADH1) и глицеральдегид-3-фосфат-дегидрогеназы Saccharomyces cerevisiae. Другие применяемые терминаторы для дрожжевых клеток-хозяев описаны у Romanes et al., 1992, выше.
Контрольной последовательностью также может быть подходящая лидерная последовательность, нетранслируемый участок мРНК, который важен для трансляции клеткой-хозяином. Лидерная последовательность функционально связана с 5’-концом полинуклеотида, кодирующего вариант. Может использоваться любая лидерная последовательность, которая функциональна в клетке-хозяине.
Подходящие лидеры для дрожжевых клеток-хозяев получают из генов энолазы Saccharomyces cerevisiae, 3-фосфоглицерат киназы Saccharomyces cerevisiae, альфа-фактора Saccharomyces cerevisiae и алкогольдегидрогеназы/глицеральдегид-3-фосфат-дегидрогеназы Saccharomyces cerevisiae (ADH1/GAP).
Контрольной последовательностью также может быть последовательность полиаденилирования, функционально связанная с 3’-концом кодирующей вариант последовательности, которая при транскрипции распознается клеткой-хозяином в качестве сигнала для добавления остатков полиаденозина к транскрибируемой мРНК. Возможно применение любой последовательности полиаденилирования, которая функциональна в клетке-хозяине.
Применяемые последовательности полиаденилирования для дрожжевых клеток-хозяев описаны в Guo and Sherman, 1995, Mol. Cellular Biol. 15:5983-5990.
Контрольной последовательностью также может быть участок, кодирующий сигнальный пептид, который кодирует сигнальный пептид, связанный с N-концом варианта и который направляет вариант на путь секреции из клетки. 5’-конец кодирующей последовательности полинуклеотида, может по существу содержать участок, кодирующий сигнальный пептид, естественно связанный в рамке считывания трансляции вместе с сегментом, кодирующего участка, который кодирует вариант. В ином случае, 5’-конец кодирующей последовательности может содержать участок, кодирующий сигнальный пептид, который является чужеродным для кодирующей последовательности. Участок, кодирующий чужеродный сигнальный пептид, может требоваться там, где кодирующая последовательность в естественной форме не содержит участка, кодирующего сигнальный пептид. В ином случае, участок, кодирующий чужеродный сигнальный пептид, может легко заменять участок, кодирующий естественный сигнальный пептид с целью повышения секреции варианта. Однако возможно применение любого участка, кодирующего сигнальный пептид, который направляет экспрессирующийся вариант по секреторному пути клетки-хозяина.
Применяемые сигнальные пептиды для дрожжевых клеток-хозяев получают из генов альфа-фактора Saccharomyces cerevisiae и инвертазы Saccharomyces cerevisiae. Другие применяемые последовательности, кодирующие сигнальный пептид, описаны в Romanes et al., 1992, выше.
В случае, когда на N-конце варианта присутствуют оба участка, сигнального пептида и пропептида, участок пропептида располагается после N-конца варианта, а участок сигнального пептида располагается после N-конца участка пропептида.
Методы получения
Варианты по настоящему изобретению могут быть получены с помощью методов, хорошо известных специалистам в данной области. Один подходящий путь заключается в клонировании нуклеиновой кислоты, кодирующей исходный альбумин или его фрагмент или химерный полипептид, включающий исходный альбумин или его фрагмент, в модификации указанной нуклеиновой кислоты введением целесообразных замен в одной или нескольких позициях, соответствующих позициям 417, 464, 490, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 541, 542, 550, 573, 574 и 580 в SEQ ID NO:2, где вариант не является вариантом, состоящим из SEQ ID NO:2, содержащей замену D494N, E501K, K541E, D550G,A, K573E или K574N, в получении подходящего генетического конструкта, где модифицированная нуклеиновая кислота находится в функциональной связи с подходящими регуляторными генетическими элементами, такими как промотор, терминатор, сайты активации, сайты связывания с рибосомой и т.д., во введении генетического конструкта в подходящий организм-хозяин, в культивировании трансформированного организма в условиях, приводящих к экспрессии варианта, и в извлечении варианта. Все эти методы известны в данной области, и разработка подходящего способа получения конкретного варианта по изобретению находится в компетенции обычного практикующего специалиста в данной области.
Вариант полипептида по изобретению также может быть связан с сигнальной последовательностью с целью получения варианта полипептида, секретируемого в ростовую среду в процессе культивирования трансформированного организма-хозяина. Как правило, предпочтительно иметь вариант полипептида, секретируемый в ростовую среду с целью облегчения его извлечения и очистки.
Методы получения варианта полипептида также раскрыты в WO 2009019314 (включена ссылкой), и эти методы также могут быть применены к настоящему изобретению.
Альбумины успешно экспрессировали в качестве рекомбинантных белков в ряде хозяев, включающих грибы (включающие, без ограничения перечисленным, Aspergillus (WO06066595), Kluyveromyces (Fleer 1991, Bio/technology 9, 968-975), Pichia (Kobayashi 1998 Therapeutic Apheresis 2, 257-262) и Saccharomyces (Sleep 1990, Bio/technology 8, 42-46)), бактерии (Pandjaitab 2000, J. Allergy Clin. Immunol. 105, 279-285)), животных (Barash 1993, Transgenic Research 2, 266-276) и растения (включающие, без ограничения перечисленным, картофель и табак (Sijmons 1990, Bio/technology 8, 217 and Farran 2002, Transgenic Research 11, 337-346). Вариант полипептида по изобретению предпочтительно получают рекомбинантно в подходящей клетке-хозяине. В принципе возможно применение любой клетки-хозяина, способной продуцировать полипептид в подходящих количествах, и выбор подходящей клетки-хозяина по изобретению находится в компетенции обычного практикующего специалиста. Предпочтительным организмом-хозяином являются дрожжи, предпочтительно выбранные из Saccharomycacae, более предпочтительно Saccharomyces cerevisiae.
Варианты полипептидов по изобретению могут быть извлечены и очищены из ростовой среды с использованием комбинации известных методов разделения, таких как фильтрация, центрифугирование, хроматография и методы аффинного разделения и т.д. Очистка вариантов по изобретению с использованием конкретной комбинации таких известных стадий изобретения находится в компетенции обычного практикующего специалиста. В качестве примера методов очистки, которые могут применяться к вариантам по настоящему изобретению, могут быть упомянуты методы, раскрытые в WO0044772.
Варианты полипептидов по изобретению можно использовать для доставки терапевтически полезного соединения животному или человеческому индивидууму, которому это необходимо. Такие терапевтически полезные соединения включают, без ограничения перечисленным, метки и легко детектируемые соединения для применения в диагностике, таких как различные методы визуализации; фармацевтически активные соединения, такие как лекарственные соединения, или компоненты специфического связывания, такие как антитела. Варианты по изобретению могут быть даже связаны с двумя или несколькими различными терапевтически полезными соединениями, например, с антителом или лекарственным средством, которые придают объединенной молекуле способность специфичного связывания с целевой мишенью и таким образом обеспечивают высокую концентрацию связанного лекарственного средства на конкретной мишени.
Химерные полипептиды
Варианты альбумина или его фрагменты по изобретению также могут быть слиты с партнером по слиянию, отличным от полипептида альбумина. Партнером по слиянию в принципе может быть любой полипептид, но предпочтительно это полипептид обладающий терапевтическими или диагностическими свойствами. Химерные полипептиды, включающие альбумин или его фрагменты, известны в данной области. Было обнаружено, что такой химерный полипептид, включающий альбумин или его фрагмент, и полипептид-партнер по слиянию имеют более продолжительный период полужизни в плазме по сравнению с неслитым полипептидом-партнером по слиянию. Согласно изобретению возможно изменение периода полужизни в плазме химерных полипептидов по изобретению по сравнению с соответствующими химерными полипептидами, известными в данной области.
Один или несколько терапевтических полипептидов могут быть слитыми с N-концом, С-концом альбумина, могут быть вставлены в шпильку структуры альбумина или может иметь место любая их комбинация. Терапевтический полипептид может включать или не включать линкерные последовательности, разделяющие различные компоненты химерного полипептида.
Методы, относящиеся к сливанию альбумина и его фрагментов, известны в данной области, и специалисту будет понятно, что такие методы также можно применять в настоящем изобретении. WO 2001/79271 А и WO 2003/59934 А также содержат примеры терапевтических полипептидов, которые могут быть слиты с альбумином или его фрагментами, и эти примеры также применимы к настоящему изобретению.
Конъюгаты
Варианты альбумина или его фрагменты по изобретению могут быть конъюгированы со второй молекулой с использованием методов, известных в данной области. Указанная вторая молекула может включать диагностический компонент и в данном воплощении конъюгат может применяться в качестве диагностического средства, такого как визуализация; или вторая молекула может быть терапевтическим соединением и в данном воплощении конъюгат может применяться для терапевтических целей терапевтического соединения, где конъюгат будет обладать терапевтическими свойствами терапевтического соединения, а также продолжительным периодом полужизни в плазме альбумина. Конъюгаты альбумина и терапевтической молекулы известны в данной области, и было подтверждено, что такие конъюгаты обладают продолжительным периодом полужизни в плазме по сравнению с не конъюгированными, свободными терапевтическими молекулами, как таковыми. Конъюгаты могут быть соответствующим образом связаны посредством свободной тиогруппы, присутствующей на поверхности HSA (аминокислотный остаток 4 зрелого HSA) с помощью хорошо известных химических методов.
В одном предпочтительном аспекте, вариант альбумина или его фрагмент конъюгирован с полезным терапевтическим соединением, и конъюгат используется для лечения патологического состояния у пациента, которому это показано, причем патологическое состояние является респонсивным на конкретное выбранное терапевтическое соединение. Методы конъюгации такого терапевтического соединения с вариантом альбумина или фрагментом известны в данной области. В WO 2009/019314 раскрыты примеры методов, подходящих для конъюгации терапевтического соединения с полипептидом, которые также могут применяться по настоящему изобретению. Кроме того, в WO 2009/019314 раскрыты примеры соединений и компонентов, которые могут быть конъюгированы замещенным трансферрином, и эти примеры также можно применять в настоящем изобретении. Описание WO 2009/019314 включено в данный документ ссылкой.
HSA в своей естественной форме содержит одну свободную тиольную группу, которая подходит для конъюгации. В качестве конкретного воплощения в аспекте вариант альбумина или его фрагмент может включать дополнительные модификации, полученные для образования дополнительных тиольных групп на поверхности. Это полезно в том смысле, что полезная нагрузка варианта альбумина или его фрагмента увеличивается так, что с каждой молекулой варианта альбумина или его фрагмента может быть конъюгирована более чем одна молекула терапевтического соединения, или два или несколько различных терапевтических соединений могут быть конъюгированы к каждой молекулой варианта альбумина или его фрагмента, например, соединения, обладающие свойствами направленного воздействия, такие как антитело, специфичное, например, к опухоли; и цитотоксическое лекарственное средство, конъюгированное с вариантом альбумина или его фрагментом, с получением в результате высокоспецифичного лекарственного средства против опухоли. Описание конкретных остатков, которые могут быть модифицированы для обеспечения дополнительных свободных тиольных групп на поверхности, можно обнаружить в прилагаемой патентной заявке WO 2010/092135, которая включена в данный документ ссылкой.
Ассоциаты
Варианты альбумина или его фрагменты также можно применять в виде «ассоциатов». В связи с этим подразумевается, что термин «ассоциат» обозначает соединение, включающее вариант альбумина или его фрагмент, и другое соединение, связанное или ассоциированное с вариантом альбумина или его фрагментом нековалентным связыванием. В качестве примера такого ассоциата может быть упомянут ассоциат, состоящий из варианта альбумина и липида, связанного с альбумином посредством гидрофобного взаимодействия. Такие ассоциаты известны в данной области, и они могут быть получены хорошо известными методами. В качестве примера предпочтительного ассоциата по изобретению может быть упомянут ассоциат, включающий вариант альбумина и паклитаксел.
Другие применения
Вариант альбумина ли его фрагменты или химерные полипептиды, включающие вариант альбумина или его фрагменты по изобретению полезны тем, что период их полужизни в плазме изменен по сравнению с исходным альбумином или его фрагментами или с химерными полипептидами, включающими исходный альбумин или его фрагменты. Это изменение предпочтительно в том смысле, что период полужизни конъюгатов, включающих вариант альбумина или его фрагмент или химерного полипептида, включающего вариант альбумина или его фрагмент, или ассоциата, включающего вариант альбумина или его фрагмент по изобретению в плазме, может быть выбран согласно конкретной терапевтической цели.
Например, для конъюгата, ассоциата или химерного полипептида, используемого для визуализации у животных или человека, где компонент визуализации обладает очень коротким периодом полужизни, а конъюгат или химерный полипептид, включающий HSA, имеет период полужизни в плазме, более продолжительный, чем необходимо для целей визуализации, то предпочтительным является применение варианта альбумина или его фрагмента по изобретению, имеющего более короткий период полужизни в плазме по сравнению с исходным альбумином или его фрагментом, для обеспечения конъюгатов или химерных полипептидов, имеющих период полужизни в плазме достаточно продолжительный для целей визуализации, но достаточно короткий для выведения из организма конкретного пациента, в котором его применяют.
В другом примере для конъюгата, ассоциата или химерного полипептида, включающего терапевтическое соединение, эффективное для лечения или ослабления конкретного патологического состояния у пациента, которому показано такое лечение, было бы предпочтительно применение варианта альбумина или его фрагмента, имеющего более продолжительный период полужизни в плазме, чем у исходного альбумина или его фрагмента для получения ассоциатов или конъюгатов или химерных полипептидов, имеющих более продолжительный период полужизни в плазме, который будет полезен из-за того, что введение ассоциата или конъюгата или химерного полипептида по изобретению можно проводить с меньшей частотой или в меньшей дозе с меньшими побочными эффектами по сравнению со случаем, когда используют исходный альбумин или его ассоциаты или его фрагмент.
В следующем аспекте изобретение относится к композициям, включающим вариант альбумина, его ассоциаты или его фрагмент, вариант фрагмента альбумина или его ассоциаты или химерные полипептиды, включающие вариант альбумина или его фрагмент по изобретению. Композиции предпочтительно являются фармацевтическими композициями. Композиция может быть получена с помощью методов, известных в данной области, таких как раскрытые в руководствах по фармацевтике.
В конкретном воплощении, композиции включают вариант альбумина или его фрагмент по изобретению и соединение, включающее фармацевтически полезный компонент и альбуминсвязывающий домен (англ. albumin binding domain, ABD). Согласно изобретению ABD обозначает участок, компонент или домен, способный связываться in vivo с циркулирующим в кровотоке альбумином, таким образом осуществляя транспорт в кровотоке ABD и любого соединения или компонента, связанного с указанным ABD. ABD известны в данной области, и было показано, что они очень тесно связаны с альбумином, так что соединение, включающее ABD, связанный с альбумином, будет в определенной степени вести себя как одна молекула. Авторы изобретения догадались, что использование варианта альбумина или его фрагмента по изобретению вместе с соединением, включающим фармацевтически полезный компонент и ABD, позволяет изменить период полужизни соединения, включающего фармацевтически полезный компонент и ABD, в плазме, по сравнению со случаем, когда указанное соединение инъецировали пациенту отдельно, которому это показано, или вводили состав, включающий природный альбумин или его фрагмент.
Вариант альбумина или его фрагменты, конъюгаты, включающие вариант альбумина или его фрагмент, или химерный полипептид, включающий вариант альбумина или его фрагмент, или ассоциат, включающий вариант альбумина или его фрагмент по изобретению, также может быть включен в нано- или микрочастицы с помощью методов, хорошо известных в данной области. Предпочтительный способ получения нано- или микрочастиц, который можно применять к вариантам альбумина или его фрагментам по изобретению, раскрыт в WO 2004/071536, который включен в данный документ ссылкой.
Композиции
Настоящее изобретение также направлено на применение варианта альбумина или его фрагмента или химерных полипептидов, включающих вариант альбумина или его фрагмент, или конъюгата, включающего вариант альбумина или его фрагмент, или ассоциата, включающего вариант альбумина или его фрагмент, для получения фармацевтической композиции, в которой вариант альбумина или его фрагмента, или химерные полипептиды, включающие вариант альбумина или его фрагмент, или ассоциат, включающий вариант альбумина или его фрагмент, имеют измененный период полужизни в плазме по сравнению с HSA или по сравнению с соответствующим его фрагментом или химерным полипептидом, включающим HSA или его фрагмент, или с конъюгатом, включающим HSA.
В связи с этим подразумевается, что соответствующий фрагмент HSA обозначает фрагмент HSA, который совпадает и содержит то же количество аминокислот, как и фрагмент или вариант альбумина, с которыми его сравнивают. Аналогично подразумевается, что соответствующий химерный полипептид, включающий HSA, или конъюгат, включающий HSA, обозначает молекулы, имеющие такой же размер и ту же аминокислотную последовательность, что и химерный полипептид конъюгата, включающего вариант альбумина, с которым его сравнивают.
Предпочтительно, если вариант альбумина или его фрагмент или химерные полипептиды, включающие вариант альбумина или его фрагменты, или конъюгат, включающий вариант альбумина или его фрагмент, имеет период полужизни в плазме длиннее, чем период полужизни в плазме у HSA или его соответствующего фрагмента или у химерного полипептида, включающего HSA или его фрагмент.
В ином случае это может выражаться в том, что вариант альбумина или его фрагмент или химерные полипептиды, включающие вариант альбумина или его фрагменты, или конъюгат, включающий вариант альбумина или его фрагмент, имеет KD к FcRn меньше, чем соответствующее KD для HSA или его соответствующего фрагмента или химерного полипептида, включающего HSA или его фрагмент. Предпочтительно, если KD варианта альбумина или его фрагментов или химерных полипептидов, включающих вариант альбумина или его фрагмент, или для конъюгата, включающего вариант альбумина или его фрагмент, к FcRn составляет менее чем 0,9Х KD для HSA, более предпочтительно, менее чем 0,5Х KD для HSA, более предпочтительно, менее чем 0,1X KD для HSA, еще более предпочтительно, менее чем 0,05Х KD для HSA, еще более предпочтительно, менее чем 0,02Х KD для HSA и наиболее предпочтительно, менее чем 0,01X KD для HSA.
Вариант альбумина или его фрагмент или химерные полипептиды, включающие вариант полипептида или его фрагмент, или конъюгат, включающий вариант полипептида или его фрагмент, предпочтительно представляет собой вариант альбумина или его фрагмент или химерные полипептиды, включающие вариант альбумина или его фрагмент, или конъюгат, включающий вариант альбумина или его фрагмент по изобретению.
Настоящее изобретение дополнительно описано следующими примерами, которые не следует рассматривать как ограничивающие объем притязаний изобретения.
Примеры
Материалы и методы
тИФА:
В лунки наносили покрытие в виде HSA дикого типа или вариантов, разведенных в фосфатно-солевом буфере (PBS) до установленных концентраций, инкубировали в течение ночи при 4 С, а затем блокировали с помощью 4% обезжиренного молока (Acumedia) в течение 1 часа при комнатной температуре. Затем лунки промывали четыре раза с помощью PBS/0,005% «TWEEN® 20» (PBS/T), pH 6, перед добавлением в каждую лунку глутатион-3-трансферазы (GST), слитой с ()shFcRn (0,5 μg/мл), как описано в FEBS J. 2008 Aug;275(16):4097-110 с) предварительно инкубированной с поликлональными козьими антителами к GST, конъюгированными с пероксидазой хрена (HRP (1:5000; GE Healthcare), разведенными в 4% обезжиренном молоке с PBS/0,005% «TWEEN® 20» (PBS/T), pH 6, и инкубировали 1,5 ч при комнатной температуре с последующей четырехкратной промывкой PBS/T, pH 6. 100 μ1 субстрата тетраметилбензидина (ТМВ) (Calbiochem) добавляли в каждую лунку и инкубировали в течение 45 мин перед добавлением 100 μ1 0,25 М HCl. Поглощение измеряли при 450 нм с помощью спектрофотометра «Sunrise TECAN» (TECAN, Маннедорф, Швейцария).
Тот же анализ тИФА повторяли с PBS/T pH 7,4.
Поверхностный плазменный резонанс (SPR):
SPR-эксперименты проводили с помощью прибора «Biacore 3000» (GE Healthcare). В проточных ячейках сенсорных чипов СМ5 конденсировали shFcRn-GST (~1400-5000 РЕ) химической реакцией конденсации аминогрупп, как описано в протоколе, предоставленном производителем. Конденсацию осуществляли путем инъекции 10 мкг/мл белка в 10 мМ растворе ацетата натрия pH 5 (GE healthcare). Фосфатный буфер (67 мМ фосфатный буфер, 0,15М NaCl, 0,005% TWEEN® 20) при pH 6) использовали в качестве рабочего буфера и буфера для разведения. Регенерации поверхностей добивались с помощью инъекций буфера HBS-EP (0,01M HEPES, 0.15M NaCl, 3 мМ EDTA, 0,005% ПАВ Р20) при pH 7.4 (Biacore АВ). Для связывания с иммобилизованным shFcRn-GST, 1-0,5 μМ каждого варианта HSA инъецировали над поверхностью с постоянной скоростью потока (40 мкл/мл) при 25 С. Во всех экспериментах данные приводили к нулю и вычитали эталонную ячейку. Оценку данных осуществляли в программном обеспечении «BIAevaluation 4.1» (BIAcore АВ).
Тот же SPR-анализ повторяли с буфером HBS-EP рН 7,4.
Для целей данного патента если не указано иное, HSA, WT HSA, rHA обозначают рекомбинантный человеческий сывороточный альбумин, коммерчески доступный под зарегистрированной торговой маркой «RECOMBUMIN» (доступен у Novozymes Biopharma UK Ltd, Ноттингем, Великобритания), который использовали в примерах.
Сывороточный альбумин из других видов: Альбумины являются рекомбинантными, когда это указано и получены с использованием последовательностей, взятых из общедоступных баз данных. Или приобретены у коммерческих поставщиков.
FcRn Экспрессия и очистка растворимого человеческого (shFcRn) и мышиного (smFcRn) FcRn:
Способы получения плазмид, экспрессирующих shFcRn и smFcRn, экспрессию и очистку каждого гетеродимера можно найти в Bemtzen et al. (2005) J. Immunol. Methods 298:93-104). В ином случае, гетеродимер shFcRn FcRn получали в «GeneArt AG» (Германия). Последовательности двух субъединиц гетеродимера можно найти в SEQ ID NO:3 и SEQ ID NO:4. Растворимый рецептор экспрессировали в клетках HEK293 и очищали из надосадочной жидкости культуры с помощью хроматографических колонок «Ni-HiTrap».
Пример 1. Получение вариантов
Получение специфичных плазмид, экспрессирующих мутантный HSA.
Методы экспрессии мутантных вариантов HSA и химерных вариантов HSA разрабатывали с использованием нескольких технологий. Применяли стандартные методы молекулярной биологии, такие как описаны в Sambrook, J. and D. W. Russell, 2001. Molecular Cloning: a laboratory manual, 3rd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.
Метод 1. Аминокислотные замены в HAS, подробно описанные в таблице 1
С помощью генной сборки (GeneArt AG, Германия) получали синтетические фрагменты ДНК NcoI/SacI (859 п.о.), содержащие точечные мутации внутри гена, кодирующего HSA (SEQ ID NO:1), для введения целевой аминокислотной замены в транслируемый белок. В таблице 2 подробно описаны кодоны, используемые для введения аминокислотных замен в ген, кодирующий HSA. Нуклеотидная последовательность синтетического фрагмента, кодирующего неизмененные аминокислоты (т.е. дикого типа) была идентична последовательности в pDB2243 (описанной в WO 00/44772). Синтетические нуклеотидные фрагменты лигировали в гидролизованную по NcoI/SacI pDB2243 с получением плазмид pDB3876-pDB3886 (таблица 1). Для получения экспрессирующих плазмид, pDB3876-pDB3886 (см. таблицу 1) гиролизовали по NotI и Pvul, разделяли фрагменты ДНК на 0,7% (масс./об.) ТАЕ-геле, и очищали из агарозного геля с помощью набора реактивов «Qiagen Gel Extraction Kit» согласно инструкциям производителя фрагменты длиной 2992 п.о. (‘NotI-кассеты’, включающие промотор PRB1, ДНК, кодирующие слитую лидерную последовательность (FL) (раскрытые в WO 2010/092135), нуклеотидную последовательность, кодирующую HSA и ADH1-терминатор; см. фигуру 1). ‘NotI-кассеты’ лигировали в обработанную NotI/креветочной щелочной фосфатазой (Roche) «дезинтегрированную» плазмиду pSAC35, раскрытую в ЕР-А-286 424 и описанную в Sleep, D., et al. (1991) Bio/Technology 9, 183-187. Смеси дотирования использования для трансформации химически компетентных клеток Е.coli DH5α. Экспрессирующие плазмиды pDB3887 - pDB3897, р8АС35-производные, содержащие «NotI-кассеты», идентифицировали стандартными методами. Дезинтегрированные плазмиды pDB3887 - pDB3897 и pDB2244 (Для экспрессии HSA дикого типа, описанной в WO 00/44772) (таблица 1) использовали для трансформации S. cerevisiae ВХР10 cir0 (которые ранее были описаны в WO/2001/079480), как описано ниже.
n/a = Heприменимо. pDB3876-pDB3886 - плазмиды субклонирования.
Способ 2. Продуцирование вариантов HSA D494N+E4950+T496A и E495Q+T496A
Способ на основе ПЦР применяли с использованием набора реагентов «QuickChange Lightening Kit» (Statagene), для введения точечных мутаций в HSA. Олигонуклеотидные пары хАР094 (SEQ ID NO:5)/xAP095 (SEQ ID NO:6) и хАР096 (SEQ ID NO:7)/xAP097 (SEQ ID NO:8) использовали для получения двух вариантов HSA (D494N+E495Q+T496A и E495Q+T496A, соответственно). Плазмиду pDB3927 (раскрытую в WO 2010/092135) использовали в качестве матрицы ДНК, и ниже приведена методика, рекомендованная производителем набора реагентов. Полученные плазмиды назвали pDB3995 и pDB3996 (содержат кассеты, экспрессирующие HSA D494N+E495Q+T496A и E495Q+T496A, соответственно). pDB3995 и pDB3996 гидролизовали с помощью BstEII/BsrBI и очищали линеаризованные молекулы ДНК стандартными методами. 100 нг каждой гидролизованной BstEII/BsrBI ДНК, очищенной с помощью набора реактивов для очистки продуктов ПЦР «Qiagen» в соответствии с инструкциями производителя, смешивали индивидуально со 100 нг гидролизованной Acc65I/BamHI pDB3936) (раскрыта в WO 2010/092135) и использовали для непосредственной трансформации S. cerevisiae ВХР10 cir0 с помощью набора реактивов для трансформации дрожжей «Sigma», как описано ниже.
Способ 3. Аминокислотные замены в HSA, подробно описанные в таблице 3
Плазмиду pDB3927 (раскрытой в WO 2010/092135) (ссодержащей нуклеотидные последовательности, кодирующие HSA, идентичный альбумину в pDB2243) обрабатывали для получения аминокислотных замен внутри зрелого белка HSA. Получали синтетические фрагменты ДНК (GeneArt AG, Германия или DNA2.0 Inc, США) (фрагменты NcoI/Bsu36I, AvrII/SphI или SacI/SphI), содержащие точечные мутации в кодирующем HSA гене, для введения требуемой аминокислотной замены(замен) в транслируемую белковую последовательность. В таблице 2 подробно описаны кодоны, используемые для введения аминокислотных замен в ген, кодирующий HSA. Нуклеотидная последовательность синтетического фрагмента, кодирующего неизмененные аминокислоты (т.е. дикого типа), была идентична последовательности в pDB3927. Синтетические фрагменты ДНК субклонировали в гидролизованную по NcoI/Bsu36I, AvrII/SphI, SacI/Sph pDB3927 (описанную в РСТ 11527.204-WO) с получением pDB4006-pDB4010, pDB4083-pDB4101 и pDB4103-pDB4111 и pDB4194, pDB4200, pDB4202 (см. таблицу 3).
Аналогично, с помощью генной сборки (DNA2.0 Inc., США) получали фрагменты BamHI/SalI, содержащие точечные мутации в нуклеотидной последовательности, кодирующей HSA, и лигировали в гидролизованную по BamHI/SalI pDW964 (описанную в WO 2010/092135) с получением плазмид pDB3986-pDB3989 (таблица 3).
C-концевой участок аминокислот в позициях 573-585 (KKLVAASQAALGL) (SEQ ID NO:9) в HSA мутировали в соответствующий сывороточному альбумину макаки (PKFVAASQAALA) (SEQ ID NO:10), мыши (PNLVTRCKDALA) (SEQ ID NO:11), кролика (PKLVESSKATLG) (SEQ ID NO:12) и овцы (PKLVASTQAALA) (SEQ ID NO:13). Кодоны, используемые для введения каждой аминокислотной замены, представлены в таблице 2. С помощью генной сборки (DNA2.0 Inc., США) получали синтетические фрагменты ДНК (SacI/SphI) (нуклеотидная последовательность синтетического фрагмента, кодирующего неизмененные аминокислоты (т.е. дикого типа) была идентична последовательности в pDB3927), субклонировали в гидролизованную по SacI/SphI pDB3927 с получением плазмид pDB4114-4117 (таблица 3).
Плазмиды pDB3883 (таблица 1), pDB4094 и pDB4095 (таблица 3) гидролизовали NcoI/SacI, и фрагменты длиной 857 п.о. из каждого гидролизата очищали перед лигированием в гидролизованную по NcoI/SacI pDB4006 или pDB4110 (8,688 тыс. п.о.) (таблица 3) с получением pDB4156-pDB4161.
Экспрессирующие плазмиды получали in vivo (т.е. посредством гомологичной рекомбинации в S. cerevisiae; метод, который называется репарация пропусков (gap repair) или in vivo-клонирование - см. Orr-Weaver & Szostak. 1983. Proc. Natl. Acad. Sci. USA. 80:4417-4421). Модифицированные плазмиды, перечисленные в таблице 3, гидролизовали с помощью BstEII/BsrBI, и линеаризованные молекулы ДНК очищали стандартными методами. 100 нг каждой гидролизованной по BstEII/BsrBI ДНК, очищенной с использованием набора реагентов для очистки продуктов ПНР «Qiagen», согласно инструкциям производителя, смешивали индивидуально со 100 нг гидролизованной по Acc65I/BamHI pDB3936 (раскрыто в WO 2010/092135) и использовали для непосредственной трансформации S. cerevisiae BXP10 cir0 с помощью набора реактивов для трансформации дрожжей «Sigma», как описано ниже.
Способ 4. Пермутированная библиотека HSA K500 и K573
ПЦР использовали для получения двух пермутированных библиотек, в которых кодоны, кодирующие аминокислоты 500 или 573 зрелого HAS, изменяли (мутировали) на альтернативные аминокислоты, отличные от дикого типа, и кодоны терминации (K5XXSTOP). Конструировали мутагенные олигонуклеотиды (таблица 4 и таблица 5) для амплификации ДНК, кодирующей HSA, и внедряли требуемые изменения. А именно, для изменений в положении 500 в качестве матричной ДНК использовали pDB4082 (фигура 1). pDB4082 является производным pDB2305 (раскрытой в ЕР1788084) и ее получали следующим образом. pDB2305 (фигура 2) гидролизовали по NsiI/SpeI и получали фрагмент длиной 8,779 тыс. п.о., который самолигировался с образованием pDB4005 (фигура 3). Полученный генной сборкой (DNA2.0 Inc, США) синтетический фрагмент ДНК (BsaI/SphI), (SEQ ID NO:1), который содержал 3’-участок промотора PRB1, модифицированную слитую лидерную последовательность, нуклеотидную последовательность, кодирующую HSA и 5’-участок модифицированного терминатора ADH1), лигировали в гидролизованную по HindIII/SphI pDB4005 (фигура 3) с получением pDB4082. Замечание. Сайт HindIII в сайте промотора PRB1 удаляли и вводили внутрь нуклеотидной последовательности, кодирующей HAS, сайт SacII.
Для пермутированной библиотеки для позиции 500 в HSA, получали нуклеотидную последовательность, кодирующую HSA, соответствующую последовательности между сайтами SalI/HindIII (см. плазмидную карту pDB4082, фигура 1), с помощью набора реактивов «New England Biolabs Phusion» (таблица 6) и олигонуклеотидов, перечисленных в таблице 4. В таблице 7 дано описание использованного способа ПЦР.
С помощью pDB3927 в качестве матрицы. ДНК получали пермутированную библиотеку для аминокислоты в позиции 573 в HAS, и амплифицировали кодирующую альбумин ДНК, соответствующую последовательности между сайтами NcoI и Bsu36I с использованием олигонуклеотидов, подробно описанных в таблице 5.
Для вариантов альбумина с позициями 500 и 573, каждый продукт ПЦР очищали с помощью набора реактивов «PCR-clean up» (согласно инструкциям производителя), гидролизовали с помощью SalI/HindIII (библиотека для позиции 500) или NcoI/Bsu36I (библиотека для позиции 573). Затем гидролизованную ДНК очищали с помощью набора реактивов «Qiagen PCR-clean» и дотировали в гидролизованную по SalI/HindIII или NcoI/Bsu36I плазмиды pDB4082 или pDB3927, соответственно, заменяя эквивалентную нативную последовательность. Лигазные смеси трансформировали в Е.coli DH5α, с последующим выделением плазмид из трансформантов с помощью набора реактивов для минипрепаративного выделения ДНК «Qiagen» (согласно инструкциям производителя), а правильные конструкты идентифицировали с помощью рестрикционного анализа. Таким образом получали коллекцию плазмид, pDB4204 - pDB4222 (библиотека для позиции 500) и pDB4173 - pDB4190 (библиотека для позиции 573), содержащих гены альбумина, которые отличаются только по последовательности, соответствующей кодону аминокислоты в позиции 500 или 573, таблица 4 и 5, соответственно). Специфические изменения в каждой плазмиде подтверждали секвенированием.
Полученные плазмиды использовали для создания с помощью in vivo-клонирования, описанного выше, экспрессирующих плазмид и дрожжей, продуцирующих химерный альбумин. То есть, S. cerevisiae трансформировали с помощью набора реактивов для трансформации дрожжей «Sigma» (как описано ниже), с использованием смеси 100 нг плазмиды, гидролизованной по BstEII/BsrBI, содержащей вариант HSA, и 100 нг плазмиды pDB3936, гидролизованной по Acc65I/BamHI.
Трансформация S. cerevisiae
S. cerevisiae BXP10 cir0 (описанные ранее в WO/2001/079480) или штамм A cir0 (описанный в WO/2005/061718) рассевали штрихом на чашки с YEPD (1% (масс./об.) дрожжевой экстракт, 2% (w/v) бактопептон, 2% (масс./об.) глюкоза, 1.5% агар) и выращивали перед трансформацией в течение 4 дней при 30°С. 1 μg цельной плазмиды (т.е. циклической плазмиды) или, для репарации пропусков, 100 нг гидролизованной по BstEII/BsrBI или NsiI/PvuI плазмиды, содержащей вариант HSA или химерный вариант HSA, и 100 нг гидролизованной по Acc65I/BamHI плазмиды pDB3936 использовали для трансформации S. cerevisiae с помощью набора реактивов для трансформации дрожжей «Sigma» с модифицированного способа с ацетатом лития (набора реактивов для трансформации дрожжей «Sigma», YEAST-1, протокол 2; Ito et al. (1983) J. Bacteriol., 153, 16; Elble, (1992) Biotechniques, 13, 18). Протокол незначительно изменили введением перед тепловым шоком инкубации смесей трансформации при комнатной температуре в течение 4 ч. После теплового шока клетки быстро центрифугировали перед ресуспендированием в 200 (ал 1М сорбитола, затем наносили на поверхность чашек с агаром BMMD (состав BMMD описан у Sleep et al., (2001), Yeast, 18, 403). Чашки инкубировали при 30°С в течение 4 дней перед тем как индивидуальные колонии переносили на чашки со свежим агаром BMMD. Номера дрожжевых штаммов подробно описаны в таблице 1.
Концентраты для каждого дрожжевого штамма готовили следующим образом: каждую дрожжевую колонию инокулировали петлей в бульон BMMD и растили в течение 24 ч при 30°C с вращательным встряхиванием на скорости 200 об./мин. Клетки собирали центрифугированием при 1900 × g в течение 5 мин в центрифуге «Sorval RT600», 15 мл надосадочной жидкости удаляли и заменяли 40% (масс./об.) трегалозой. Клетки ресуспендировали и переносили в криопробирки (1 мл) для хранения при -80°С.
Рост S. cerevisiae в перемешиваемых колбах
Каждый дрожжевой штамм инокулировали в среду BMMD (10 мл) (0,17% (масс./об.) дрожжевой азотной основы без аминокислот и сульфата аммония (Difco), 37,8 мМ сульфат аммония, 29 мМ лимонной кислоты, 142 мМ дегидрата ортофосфата натрия рН 6,5, 2% (масс./об.) глюкозы) и растили в течение 12 ч при 30°C с вращательным встряхиванием на скорости 200 об./мин. Аликвоту каждой стартовой культуры (4 мл) использовали для инокуляции 2 × 200 мл среды BMMD и растили в течение 36 ч при 30°C с вращательным встряхиванием на скорости 200 об./мин. Клетки собирали фильтрацией через 0,2 мкм мембрану вакуумного фильтра (Stericup, Millipore), включающего префильтр GF-D (Whatman), а надосадочную жидкость сохраняли для очистки.
Первичная концентрация
Сохраненные надосадочные жидкости культур концентрировали проточной фильтрацией вдоль потока с помощью системы «Pall Filtron LV», оборудованной фильтром «Omega 10KD» (0.093 кв. м2) (кассета «LV CentramateTM», Pall Filtron) с трансмембранным давлением 20 фунтов на квадр. дюйм и со степенью рециркуляции 180 мл/мин.
Ферментация
Проводили периодическую ферментацию с подпиткой в ферментере 10 л «Sartorius Biostat С» при 30°С; рН отслеживали и регулировали при необходимости путем добавления аммиака или серной кислоты. Аммиак также обеспечивал источник азота для культур. Уровень растворенного кислорода отслеживали и связывали его со скоростью встряхивания для поддержания уровня насыщения >20%. Инокулят растили в перемешиваемых колбах в буферизованной минимальной среде (рецептура). Для фазы загрузки культуры инокулировали в среду ферментера (приблизительно 50% объема ферментера), содержащего 2% (масс./об.) сахарозы. Стадию подпитки автоматически запускали при резком подъеме уровня растворенного кислорода. Сахарозу поддерживали в ограничивающих рост концентрациях путем контроля скорости подпитки для установленной номинальной скорости роста. Подпитка состояла из среды ферментации, содержащей 50% (масс./об.) сахарозы, фактически описанную Collins. (Collins, S.H., (1990) Production of secreted proteins in yeast, in: T.J.R. Harris (Ed.) Protein production by biotechnology, Elsevier, London, pp.61-77).
Количественная оценка ГП-ВЭЖХ
Очищенные варианты альбумина, химерные варианты и конъюгаты анализировали с помощью ГП-ВЭЖХ и количественную оценку проводили следующим образом. Инъекции 25 мкл проводили на колонки «TSK G3000SWXL» (Tosoh Bioscience) 7,8 внутр. диаметр, мм × длина 300 мм, с предколонкой «TSK SW» (Tosoh Bioscience) 6 мм внутр. диаметр, × 40 мм длина. Образцы хроматографировали в 25 мМ фосфата натрия, 100 мМ сульфата натрия, 0,05% (масс./об.) азид натрия, рН 7 на скорости 1 мл/мин. Образцы количественно оценивали детекцией в УФ при 280 нм, по площади пика относительно стандарта рекомбинантного человеческого альбумина с известной концентрацией (10 мг/мл) и корректировали по их относительному коэффициенту поглощения.
Очистка вариантов альбумина из перемешиваемых колб
Варианты альбумина очищали из перемешиваемых колб (или надосадочную жидкость культуры или концентрированную надосадочную жидкость культуры) с использованием одной стадии хроматографии на матрице, аффинной к альбумину («AlbuPure™» - ProMetic BioSciences, Inc.). Хроматографию осуществляли с постоянной линейной скоростью 240 см/ч. Надосадочные жидкости культур наносили при высоте слоя 6 см, загрузке 2 мл, предварительно уравновешенной с 50 мМ ацетатом натрия рН5,3. После прогона колонку промывали с помощью уравновешивающего буфера в количестве 10 объемов колонки (ОК), а затем 50 мМ ацетата аммония рН 8 (10 ОК). Продукт элюировали либо 50 мМ ацетатом аммония, 10 мМ октаноатом рН 8, 50 мМ ацетатом аммония, 30 мМ октаноатом натрия, 200 мМ хлорида натрия рН 7, либо 200 мМ тиоцианата калия. Колонку очищали 0,5 М NaOH (3 ОК) и 20 мМ NaOH (3,5 ОК). Фракцию элюата каждого варианта альбумина концентрировали и подвергали диафильтрации против 10 объемов 50 мМ хлорида натрия («Vivaspin20» 10,000 MWCO PES с опциональными банками для диафильтрации, «Sartorius»). Очищенные варианты альбумина оценивали количественно с помощью ГП-ВЭЖХ, как описано выше.
Очистка химерных вариантов альбумина из перемешиваемых колб
Химерные варианты альбумина очищали из перемешиваемых колб с использованием одной стадии хроматографии на матрице, аффинной к альбумину («AlbuPure™» - ProMetic BioSciences, Inc.). Хроматографию осуществляли с постоянной линейной скоростью 240 см/ч. Надосадочные жидкости культур или концентрированные надосадочные жидкости культур наносили при высоте слоя 6 см, загрузке 2 мл, предварительно уравновешенной 50 мМ ацетатом натрия рН 5,3. После прогона колонку промывали уравновешивающим буфером в количестве 10 объемов колонки (ОК), затем 50 мМ ацетата аммония рН8 (10 ОК). Продукт элюировали либо 50 мМ ацетатом аммония, 10 мМ октаноатом рН 8, 50 мМ ацетатом аммония, 30 мМ октаноатом натрия, 200 мМ хлорида натрия рН 7, 50 мМ ацетатом аммония, 100 мМ октаноатом натрия рН 9 или 200 мМ тиоцианатом калия. Колонку очищали 0,5 М NaOH (3 ОК) и 20 мМ NaOH (3,5 ОК). Фракцию элюата каждого химерного варианта альбумина концентрировали и подвергали диафильтрации против 10 объемов 25 mM Tris, 150 мМ NaCl, 2 мМ KCl, рН 7,4 («Vivaspin20» 10,000 MWCO PES с опциональными банками для диафильтрации, «Sartorius»). Очищенные варианты альбумина оценивали количественно с помощью ГП-ВЭЖХ, как описано выше.
Очистка вариантов альбумина после ферментации
Варианты альбумина очищали из надосадочных жидкостей периодических ферментации с подпиткой с высокой плотностью клеток после разделения центрифугированием в центрифуге «Sorvall RC ЗС» (DuPont). Надосадочную жидкость культуры хроматографировали через колонку с высотой слоя 11 см при загрузке 8,6 мл с заказанной синтезированной аффинной к альбумину матрицей («AlbuPure™» - ProMetic BioSciences, Inc.), как описано выше. Продукт элюировали описанным выше буфером элюции, со скоростью потока 120 см/ч. Чистоту элюированной фракции(ий) анализировали с помощью ГП-ВЭЖХ. (выше) и гель-электрофореза в полиакриламидном геле с додецилсульфатом натрия (ДСН-ПААГ) в восстанавливающих условиях для очистки и если необходимо концентрировали («Vivaspin20» 10,000 MWCO PES) и наносили на колонку 2,4×96 см, заполненную «Superdex 75», прогоняли со скоростью потока 39 см/ч в 25 мМ Tris, 150 мМ NaCl, 2 мМ KCl, рН 7,4. Пик фракционировали, анализировали с помощью ГП-ВЭЖХ и собирали с целью получения представляющего интерес мономерного белка. Собранные фракции концентрировали («Vivaspin 20» 10,000 MWCO PES, «Sartorius»).
Все белки, для которых проводили анализ свойств связывания с рецептором (FcRn), и или другой анализ, количественно оценивали с помощью ГП-ВЭЖХ, как описано выше, с поправкой на их относительные коэффициенты поглощения.
Пример 2. Определение свойств связывания HSA, выделенного из крови, и рекомбинантного человеческого альбумина с рецептором (shFcRn)
Фактически не содержащий жирных кислот HSA (Sigma-Aldrich) дополнительно очищали с помощью эксклюзионной хроматографии, как описано в Andersen et al (2010), J.Biol.Chem. 285, (7), 4826-4836. 10 μМ мономерного HSA и rHA анализировали с помощью SPR, как описано выше, данные представлены на фигуре 4.
Непосредственное сравнение HSA (выделенного из крови) с рекомбинантным человеческим альбумином (Рекомбумин) при одинаковой концентрации (10 мкМ) (фигура 4А и 4В) демонстрирует, что для обоих образцов связывание с иммобилизованным shFcRn (рН 6, рН 7,4, соответственно) было обратимым и рН-зависимым. Кроме того, Bosse et al (2005). J. Clin. Pharmacol. 45; 57-67 при сравнении HSA с рекомбинантным человеческим альбумином продемонстрировали для них эквивалентный период полужизни в in vivo исследовании на человеке.
Пример 3. Определение свойств связывания вариантов альбумина с рецептором (shFcRn)
Использовали два традиционных анализа связывания с FcRn, тИФА и SPR. Существует два главных различия между анализами: в системе тИФА HSA наносят в виде покрытия непосредственно в лунки, a shFcRn-GST добавляют в раствор, тогда как в анализе SPR shFcRn-GST иммобилизован на чип СМ5, а HSA инъецируют в раствор. рН может варьировать в обоих системах.
Варианты анализировали с помощью тИФА при рН 6 и рН 7,4. Результаты представлены на фигуре 5. Значения анализа тИФА соответствуют средним значениям дублированных экспериментов.
С помощью SPR варианты анализировали при рН 6 и рН 7,4. Результаты для репрезентативных количеств вариантов представлены на фигуре 6 для концентрации вариантов 0,2 мкМ, а на фигуре 7 для концентрации вариантов 1 мкМ.
Представленные на фигурах 6 и 7 данные SPR нормализовали, и относительное связывание вариантов при каждой концентрации представили на фигуре 8А и В, соответственно.
Результат анализа заключается в том, что все проверенные варианты обладают характерным связыванием с рецептором при рН 6, но не связываются при рН 7,4. Варианты D494N,Q,A, E495Q,A, T496A, и D494N+T496A демонстрируют уменьшенное связывание с рецептором по сравнению с HSA.
Пример 4. Определение свойств связывания вариантов альбумина с рецептором (shFcRn/smFcRn)
Используя метод анализа SPR, представленный ниже, рассчитывали константу ассоциации Ka, константу диссоциации Kd и константу связывания KD для HSA и мышиного сывороточного альбумина (MSA), связывающегося с человеческим и мышиным FcRn (таблица 8).
анализы SPR - SPR осуществляли на приборе «BIAcore 3000» (GE Healthcare) с использованием чипов СМ5, а иммобилизацию вариантов smFcRn-GST и shFcRn-GST или smFcRn осуществляли с помощью набора реактивов для конденсации аминогруппы (GE Healthcare). Образцы белка (10 мкг/мл) инъецировали в 10 мМ ацетата натрия при рН 4,5 (GE Healthcare), как описано в инструкции производителя. Непрореагировавшие компоненты на поверхности блокировали с помощью 1 М этаноламина. Для всех экспериментов в качестве рабочего буфера или буфера разведения использовали фосфатный буфер (67 мМ фосфатный буфер, 0,15 М NaCl, 0,005% «TWEEN® 20») при рН 6 или при рН 7,4, или буфер HBS-P (0,01 М HEPES, 0,15 М NaCl, 0,005% ПАВ Р20) при рН 7,4. Измерения кинетики осуществляли с использованием иммобилизованной поверхности низкой плотности (100-200 резонансных единиц (РЕ)). Последовательные разведения hIgG1 (2000,0-31,2 нМ), mIgG1 (1000,0-15,6 нМ), MSA (20,0-0,3 μM) и HSA (200,0-3,1 μМ) инъецировали при рН 6 или рН 7,4, со скоростью потока 50 μл/минуту при 25°С. Аддитивное связывание фиксировали с помощью инъекции HSA (10 μМ), MSA (5 μM), hIgG1 (100 нМ) или mIgG1 (100 нМ) отдельно или по два одновременно при 25°С на скорости 20 μл/мин. при рН 6 поверх иммобилизованного shFcRn (~600 РЕ) или smFcRn (~600 РЕ). Конкурентное связывание измеряли путем инъекции shFcRn (50 нМ) или smFcRn (100 нМ) отдельно или вместе с различными количествами HSA или MSA (10,0-0,05 μМ) поверх иммобилизованного HSA (~2600 РЕ) или MSA (~2000 РЕ). Во всех случаях для коррекции неспецифического связывания и эффектов от объема буфера, ответы, полученные от контрольных поверхностей и пустых инъекций, вычитали из каждой кривой взаимодействия. Значения скорости кинетики рассчитывали с использованием определенных моделей (модель лигандов Ленгмюра 1:1, модель гетерогенных лигандов и аффинная модель равновесного состояния), предлагаемых программным обеспечением «BIAevaluation 4.1». Точность подбора, описанная статистической величиной 7,2, которая описывает среднее квадратичное, была ниже, чем 2 при всех оценках аффинности.
KD получали с помощью программного обеспечения «BIAevaluation 4.1», используя везде модель лигандов Ленгмюра 1:1. Кинетические значения представляют среднее от трех экспериментов. ND: не определено. NA: не запрашивалось
Пример 5. Связывание альбуминов из других видов с человеческим FcRn
Коммерчески доступный альбумин животного (либо «Sigma-Aldrich», либо «Calbiochem») дополнительно очищали, как описано в Andersen et al (2010). J.Biol.Chem. 285, (7), 4826-4836. Связывание ослиного сывороточного альбумина, бычьего сывороточного альбумина, козьего сывороточного альбумина, овечьего сывороточного альбумина, кроличьего сывороточного альбумина, собачьего сывороточного альбумина, сывороточного альбумина хомяка, сывороточного альбумина морской свинки, крысиного сывороточного альбумина и куриного сывороточного альбумина с shFcRn определяли с использованием методов, описанных в материалах и методах. Результаты тИФА представлены на фигуре 9A-D, а относительное связывание резюмировано на фигуре 9Е.
Результаты SPR представлены на фигуре 10, где показано связывание при рН 6 и рН 7,4 для каждого вида альбумина. В таблице 10 представлен обзор реакций относительного связывания, измеренного с использованием тИФА и SPR:
Иерархия от сильнейшего до слабейшего связывания следующая: морская свинка = /> кролик > хомяк/собака > крыса/мышь > осел > человек > корова > коза/овца > курица. Эти данные показали, что животные альбумины обладают различными аффинностями к shFcRn.
Пример 6. Кинетика варианта HSA для shFcRn
Константы связывания для вариантов по изобретению определяли согласно методам, описанным в Материалах и Методах.
KD получали с помощью программного обеспечения «BIAevaluation 4.1», используя во всех случаях модель лигандов Ленгмюра 1:1. Кинетические значения представляют среднее от трех экспериментов. ND: не определено.
Результаты соответствуют выводам, сделанным в примере 3 на основании данных SPR и тИФА, но кроме того продемонстрировано, что E492G обладает повышенной аффинностью к рецептору.
Пример 7. Конкурентный анализ вариантов HSA
Конкурентный анализ вариантов HSA, полученных в примере 1, и WT HSA осуществляли с помощью способов, описанных в примере 4. Результаты представлены на фигуре 15.
Результаты демонстрируют, что вариант E492G в отличие от Е492Н Е492Р и E492G+V493P, связывается с shFcRn сильнее, чем HSA.
Пример 8. Анализ замен Q417
С помощью способа примера 1 конструировали варианты HSA, содержащие замены Q417A и D494E+Q417H. Кинетические свойства этих вариантов, протестированных способами из Материалов и Методов, представлены в таблице 12.
Данные/демонстрируют, что варианты Q417A и D494E+Q417H с рецептором связываются слабее, чем HSA дикого типа.
Пример 9. Анализ вариантов HSA в позициях 499, 500, 536, 537, 538 и 573
С помощью способа примера 1 конструировали варианты HSA, содержащие замены Р499А, K500A, K536A, Р537А, K538A и K573A. Свойства связывания с рецептором этих вариантов проверяли, как описано в Материалах и Методах. Результаты представлены на фигуре 11.
Данные демонстрируют, что варианты Р499А, K536A, Р537А и K538A обладают сниженной аффинностью связывания с shFcRn по сравнению с HSA. Вариант К500А почти полностью утратил свою способность связываться с shFcRn, a K573A обладает увеличенной аффинностью связывания с shFcRn, оба по сравнению с HSA.
Пример 10. Анализ вариантов HSA в позиции 501
С помощью способа примера 1 конструировали варианты HSA, содержащие замены Е501А и E501Q. Кинетические свойства этих вариантов тестировали, как описано в материалах и методах.
Данные демонстрируют, что варианты Е501А и E501Q обладают незначительно уменьшенной аффинностью связывания с shFcRn по сравнению с HSA.
Пример 11. Анализ вариантов HSA в позиции 573
С помощью способа примера 1 конструировали варианты HSA, содержащие замену в позиции 573. Получали все варианты в позиции 573 и проверяли свойства связывания этих вариантов с рецептором, как описано в материалах и методах, но с помощью анализа SPR, осуществляемого при рН5,5. Результаты представлены в таблице 14 ниже и на фигурах 12 и 13.
Результаты демонстрируют, что все варианты, содержащие замену в положении 573, обладают улучшенным связыванием с shFcRn по сравнению с WT HSA. В частности, варианты K573F, K573H, K573P, K573W и K573Y с shFcRn имеют KD более чем в 10 раз ниже, чем у исходного HSA. Вариант K573STOP представляет собой укороченный альбумин, содержащий стоп-кодон в положении 573. Сенсограмма для варианта K573STOP демонстрирует значительно уменьшенное связывание по сравнению с WT HSA и дает высокое значение KD. Увеличение аффинности, которое было продемонстрировано для варианта K573E, природного варианта, охарактеризованного Otagiri (2009). Biol.Pharm. Bull. 32(4) 527-534, который, по прогнозу, имеет увеличенный период полужизни in vivo.
Пример 12. Анализ других вариантов HSA
С помощью способа примера 1 конструировали варианты HSA, содержащие замены E492G, E492G+N503H, N503H, D550E, E492G+N503K, Е542Р, H440Q, K541G, K541D, D550N E492G+K538H+K541N+E542D, E492T+N503K+K541A, E492P+N503K+K541G+E542P, E492H+E501P+N503H+E505D+T506S+T540S+K541E, A490D+E492T+V493L+E501P+N503D+A504E+E505K+T506F+K541D, E492G+V493P+K538H+K541N+E542D. Свойства связывания с рецептором этих вариантов проверяли, как описано в Материалах и Методах, и результаты представлены в таблице 15 и на фигуре 14.
Результаты демонстрируют, что для положения 550, замена на Е приводит увеличению аффинности, в то время как замена на N приводит к уменьшению аффинности к shFcRn при рН 6. Когда данный анализ повторили для замены D550E при рН 5,5, то не заметили наблюдаемого увеличения аффинности. Замена на аминокислоту (Е) поддерживает и улучшает связывание. Однако замена аминокислоты на незаряженные аминокислотные остатки уменьшает связывание при рН 6,0. На основании этого наблюдения мы предполагаем, что замены на основные аминокислоты в данном положении (Н, K и R) будут приводить к дальнейшему уменьшению связывания.
Пример 13. Мутации в остатках His
С помощью способа примера 1 получали следующие варианты: H440Q, H464Q, H510Q и H535Q. На фигуре 15 представлены сенсограммы SPR этих вариантов, взаимодействующих с shFcRn, как описано в материалах и методах.
Обнаружено, что вариант H440Q, связывался с аффинностью, сравнимой с аффинностью HSA. Напротив, H464Q, H510Q и H535Q обладали значительно меньшей аффинностью к shFcRn. Данный факт подтверждает ранее опубликованные данные о том, что мутагенез остатка гистидина уменьшает связывание HSA с shFcRn (Wu et al (2010). PEDS, 23(10)789-798). Wu et al. продемонстрировали укороченный период полужизни для диател химерных белков (scFv-DIII)2 в мышах в порядке удаления от самых медленных к самым быстрым: Db-DIII WT>H535A>H510A>H464A>Db. На основании аффинности к shFcRn и при сравнении с smFcRn (пример 5) мы могли бы предсказать порядок выведения у людей (для замен глутамина (Q)) WT>H440Q>H510Q>H464Q>H535Q.
Пример 14. Дополнительные варианты
С помощью способа примера 1 получали следующие варианты HSA: K574N и Q580K. Связывание вариантов с FcRn проверяли с помощью SPR, как описано в Материалах и Методах, а результаты представили в таблице 16.
Результаты демонстрируют, что варианты K574N и Q580K связываются с shFcRn сильнее.
Пример 15. Анализ вариантов HSA в позиции 500
С помощью способа примера 1 конструировали варианты HSA, содержащие замену в позиции 500. Создавали все варианты в позиции 500, и проверяли свойства связывания этих вариантов с рецептором. Для всех анализов использовали «Biacore X», «Biacore X100» и «Sensor Chip CM5», оба поставлялись «GE Healthcare». shFcRn, полученный с помощью «GeneArt AG» (Германия) (разведенный до 10 мкг/мл в 10 мМ ацетата натрия pH5.0 (G E Healthcare)), иммобилизовали в проточной ячейке 2 (FC2) в количестве 1600-2200 единиц чувствительности (ЕЧ) посредством стандартной конденсации аминогрупп, как указано в инструкциях производителя (GE Healthcare). Иммобилизацию пустого контроля осуществляли в проточной ячейке 1 (FC1) для того, чтобы она служила эталонной ячейкой. Для стабилизации анализа, сначала прогоняли 3-5 стартовых цикла только с рабочим буфером (67 мМ фосфатного буфера, 0,15М NaCl, 0.005% «Tween 20» при рН5,75±0,25) с последующей регенерацией. Библиотеку вариантов WT rHA и К500 инъецировали в различных концентрациях (1 мкМ - 150 мкМ) в течение 90 с при постоянной скорости потока (30 мкл/мин) при 25°C с последующей регенерацией поверхности буфером HBS-EP pH7,4 (GE Healthcare) до восстановления приблизительной исходной точки ЕЧ (обычно бывает достаточно 12 с импульса).
Результаты представлены в таблице 17 и на фигуре 16
Результаты демонстрируют, что варианты K500R и K500I имеют, соответственно, увеличенную и сравнимую аффинность к shFcRn по сравнению с WT HSA. Вариант К500Е связывался с иммобилизованным shFcRn, но все еще демонстрировал характерную рН-зависимость взаимодействия с FcRn. Данный комплекс очень стабилен, так что такой кинетический анализ невозможен (фигура 16). Все остальные варианты обладают уменьшенным связыванием с shFcRn по сравнению с wt rHA.
Все варианты связывались с shFcRn (в некоторой степени) при рН 5,5. Отсутствие связывания вариантов библиотеки K500 с shFcRn детектировали при рН 7,4.
Пример 16. Химерные полипептиды
Получение химерных альбуминов, содержащих мутеины альбумина
Плазмиды, содержащие экспрессирующие кассеты для получения scFv (vHvL) генетически слитого с HSA, либо на N-, либо на С-конце, или на обоих (описано у Evans et al., 2010. Protein Expression and Purification. 73,113-124), модифицировали так, чтобы была возможность получения химерных альбуминов с использованием in vivo клонирования (описанного выше). То есть, pDB3017 (фигура 17), pDB3021 (фигура 18), pDB3056 (фигура 19) гидролизовали NsiI/SpeI, и NsiI-фрагменты, соответствующие 9,511 тыс. п.о., 9,569 тыс. п.о. и 8,795 тыс. п.о., соответственно, очищали стандартными методами. Очищенные NsiI-фрагменты самолигировались и использовались для трансформации химически компетентных клеток Е.coli DH5α с получением pDB4168, pDB4169 и pDB4170, соответственно (таблица 18).
Аналогично, pDB3165 (содержащую бивалентную химеру) (фигура 20) гидролизовали NotI, и экспрессирующую кассету (фрагмент длиной 4,506 тыс. п.о.) очищали перед лигированием в гидролизованную по NotI pDB3927 с получением pDB4172 (фигура 21, таблица 18).
Синтетические SalI/Bsu36I фрагменты ДНК (269 п.о.), которые содержат точечные мутации внутри нуклеотидной последовательности, кодирующей альбумин, для введения аминокислотных замен, соответствующих K500A, или D550N или K573P в транслируемую белковую последовательность альбумина, получали с генной сборкой (GeneArt AG, Germany). SalI/Bsu36I фрагменты отдельно лигировали в гидролизованные по SalI/Bsu36I pDB4168-pDB4170 и pDB4172 и использовали для трансформации химически компетентных клеток Е.coli DH5a стандартными методами для получения плазмид pDB4265 - pDB4276 (таблица 18).
Аналогично, для введения замены K573A в транслируемую белковую последовательность альбумина с помощью ПЦР (с помощью стандартных методов) получали фрагмент ДНК. ПЦР осуществляли с помощью набора реактивов «New England Biolabs Phusion» с использованием в качестве ДНК-матрицы pDB4267 (фигура 22), а в качестве олигонуклеотидов хАР238 (SEQ ID NO:53) и хАР239 (SEQ ID NO:54):
В таблице 19 дано описание циклов ПЦР
Продукт ПЦР очищали, гидролизовали с помощью SalI/Bsu36I, дотировали выделенный фрагмент (269 п.о.) в гидролизованные по SalI/Bsu36I pDB4168-pDB4170 и pDB4172 и использовали для трансформации химически компетентных клеток Е.coli DH5α. Полученные в результате плазмиды (pDB4277 - pDB4280) перечислены в таблице 18.
Нуклеотидную последовательность, кодирующую метку FLAG, удаляли из плазмид pDB4168 и pDB4268-4270 (плазмиды для экспрессии scFv, слитого по N-концу с HSA, и мутантов HSA K500A, D550N и K573P, соответственно. pDB4168 и pDB4268-4270 (таблица 18) гидролизовали по Bsu36I/SphI для удаления продукта длиной 231 п.о., включающего 3’-участок гена, кодирующего HSA, нуклеотидной последовательности, кодирующей метку FLAG и 5’-участок терминатора ADH1. Фрагмент Bsu36I/SphI (207 п.о.), включающий 3’-участок гена, кодирующего HSA, и 5’-участок терминатора mADH1 (SEQ ID1), из pDB4181 лигировали в Bsu36I/SphI-гидролизованные pDB4168 и pDB4268-pDB4270 с использованием стандартных методов. Смеси лигирования использовали для трансформации химически компетентных клеток Е.coli DH5α с использованием стандартных методов с генерированием плазмид pDB4281-pDB4284 (таблица 18)
pDB4265-pDB4284 гидролизовали BstEII/BsrBI и линеаризованные молекулы ДНК очищали с использованием стандартных методов. 100 нг образцов ДНК BstEII/BsrBI смешивали со 100 нг гидролизованной по Acc65I/BamHI pDB3936 и использовали для трансформации S. cerevisiae ВХР10 cir0 с использованием набора реагентов для трансформации дрожжей «Sigma», как описано ниже. В каждом случае экспрессирующие плазмиды получали в дрожжах с помощью гомологичной рекомбинации (in vivo клонирование) между плазмидой, содержащей химерный альбумин (pDB4265-pDB4280) (таблица 18) и pDB3936.
Плазмиды pDB3017, pDB3021, pDB3056 и pDB3165 (химерные HSA дикого типа, описанные Evans et al., 2010. Protein Expression and Purification. 73, 113-124) использовали для трансформации S. cerevisiae Штамм Acir0 (описанный в WO/2005/061718) с использованием набора реактивов для трансформации дрожжей «Sigma», как описано ниже.
Нуклеотидную последовательность, кодирующую человеческий IL-1RA (рецепторный антагонист интерлейкина -1) (учетный номер: САА59087), получали синтетически генной сборкой. Нуклеотидную последовательность синтетического фрагмента 708 п.о. (Bsu36I/SphI-фрагмент) представлена в SEQ ID NO:55 и включает 3’-участок гена, кодирующего HSA, Нуклеотидную последовательность, кодирующую GS-линкер, Нуклеотидную последовательность, кодирующую человеческий IL-1RA (N84Q для удаления N-связанного мотива гликозилирования), и 5’-участок терминатора ADH1. Синтетический фрагмент ДНК можно лигировать в гидролизованную по Bsu36I/SphI pDB3927 с получением pDB2588.
Плазмиды, содержащие экспрессирующие кассеты для продуцирования IL-1RA, генетически слитого с С-концом HSA, и вариантов HSA K500A, D550N, K573A и K573P, получали следующим образом. pDB2588 гидролизовали Bsu36I/SphI, и фрагмент длиной 705 п.о., содержащий ‘3-участок гена, кодирующего HSA, Нуклеотидную последовательность, кодирующую GS-линкер, нуклеотидную последовательность, кодирующую человеческий IL1-RA (N84Q), и 5’-участок модифицированного терминатора ADH1 S. cerevisiae (SEQ ID3) очищали с использованием стандартных методов, затем лигировали в гидролизованную по Bsu36I/SphI в pDB4006 (содержащую экспрессирующую кассету HSA K573A), pDB4010 (содержащую экспрессирующую кассету HSA D550N), pDB4086 (содержащую экспрессирующую кассету HSA K500A), pDB4110 (содержащую экспрессирующую кассету HSA K573P) с получением pDB4287, pDB4286, pDB4285 и pDB4288, соответственно (например, см. фигуру 23). pDB4285-pDB4288 гидролизовали по NsiI/PvuI и линеаризованные молекулы ДНК очищали с использованием стандартных методов. 100 нг гидролизованных по NsiI/PvuI образцов ДНК смешивали с 100 нг гидролизованных по Acc65I/BamHI pDB3936 (9721 п.о.) (т.е. in vivo клонирование) и использовали для трансформации S. cerevisiae (т.е. для in vivo клонирования) с помощью набора реактивов для трансформации дрожжей «Sigma», как описано ниже.
Получение штамма S. cerevisiae, который экспрессирует HSA, генетически слитый с GS-линкером и IL1-RA (N84Q) (см. таблицу 18), можно было осуществить, следуя способам, описанным выше.
С помощью SPR, описанного выше, анализировали связывание химерных полипептидов с FcRn, и получили следующие результаты:
В примере 8 было продемонстрировано, что вариант K500A фактически не связывается с shFcRn, в примере 10 было продемонстрировано, что варианты K573P и K573A связываются с shFcRn сильнее, чем HSA, а в примере 11 было продемонстрировано, что вариант D550N связывается с FcRn слабее, чем HSA.
В настоящем примере продемонстрировано, что наблюдаемое различие в свойствах связывания также отражается в химерных полипептидах в различных конфигурациях: химерные по С-концу с небольшим компонентом (HSA-FLAG), химерные по С-концу с более длинным полипептидом (HSA-IL1RA); химерные по N-концу с полипептидом (scFv-HSA); химерные по N- и С-концу (scFv-HSA-FLAG и scFv-HSA-scFv-FLAG).
Пример 17. Конъюгация белка пероксидазы хрена с альбумином и с вариантом K573P.
Для анализа конъюгации в качестве контрольной молекулы использовали коммерчески доступный рекомбинатный альбумин (Рекомбумин™). Для данного примера конечную концентрацию 200 мг/мл варианта альбумина K573P по изобретению очищали из периодической ферментации с подпиткой способом, описанным в материалах и методах. Проводили двухстадийную очистку:
В первой стадии использовали колонку (объем слоя приблизительно 400 мл, высота слоя 11 см), заполненную матрицей «AlbuPweTM» (ProMetic). Ее уравновешивали с 50 мМ ацетатом натрия, рН 5,3 и загружали чистой надосадочной жидкостью культуры при рН приблизительно 5,5-6,5, приблизительно с 20 мг/мл матрицы. Затем колонку промывали приблизительно 5 объемами колонки раствором 50 мМ ацетата натрия, рН 5,3, 50 мМ фосфата натрия, рН 6, 50 мМ фосфата натрия, рН 7 и 50 мМ ацетата аммония, рН 8, соответственно. Связанный белок элюировали приблизительно двумя объемами колонки 50 мМ ацетата аммония, 10 мМ октаноата, рН 7. Скорость потока для всего процесса очистки составила 154 мл/мин.
Для второй стадии, элюат из первой стадии разводили приблизительно в два раза водой с получением проводимости 2,5±0.5 мС/см после коррекции рН 5,5±0,3 уксусной кислотой. Раствор загружали в DEAE-Сефарозную быстропроточную колонку (GE Healthcare) (объем слоя приблизительно 400 мл, высота слоя 11 см), уравновешенную 80 мМ ацетатом натрия, 5 мМ октаноата, рН 5,5. Приблизительная загрузка составила 30 мг белка/мл матрицы. Колонку промывали приблизительно 5 объемами колонки раствором 80 мМ ацетата натрия, 5 мМ октаноата, рН 5,5. Затем приблизительно 10 объемами колонки 15,7 мМ тетрабората калия, рН 9,2. Связанный белок элюировали двумя объемами колонки раствором 110 мМ тетрабората калия, 200 мМ хлорида натрия, рН приблизительно 9. Скорость потока составила 183 мл/мин во время стадий загрузки и промывания, и 169 мл/мин во время стадии элюции.
Элюат концентрировали и подвергали диафильтрации против 145 мМ NaCl, с использованием мембраны «Pall Centramate Omega 10000 Nominal MWCO» с получением конечной концентрации белка приблизительно 200 мг/мл.
Оба раствора по 200 мг/мл, концентрированный раствор rHA и варианта альбумина K573P, разводили до 5 мг/мл, с использованием фосфатно-солевого буфера (PBS), рН регулировали до значения рН 6,5-6,7. Данные условия гарантировали благоприятную рН-среду для малеимидной реакционноспособной группы пероксидазы хрена с активированным малеимидом «EZ-Link® Maleimide Activated Horseradish Peroxidase» (Thermo Scientific) для реакции со свободным сульфгидрилом, с образованием стабильной тиоэфирной связи. 2 мг пероксидазы хрена с активированным малеимидом (HRP) «EZ-Link® Maleimide Activated Horseradish Peroxidase» смешивали или с 1 мл 5 мг/мл rHA, или с вариантом альбумина K573P. Данная смесь гарантировала приблизительно двухкратный молярный избыток альбумина или варианта альбумина K573P. Смесь минимально инкубировали при 4°С, в течение 24 часов. Затем реакционную смесь проверяли для конъюгации с использованием ГП-ВЭЖХ.
Для отделения неконъюгированных образцов (rHA, или вариант альбумина К573Р и непрореагировавшей HRP) от соответствующих конъюгированных образцов, образцы сначала концентрировали («Vivaspin 20», 10,000 MWCO PES, «Sartorius»), а затем по отдельности наносили на колонку «Tricorn Superdex™ 200, 10/300 GL» (GE Healthcare), прогоняли со скоростью потока 45 см/ч в PBS. Элюированный пик фракционировали и анализировали с использованием ГП-ВЭЖХ. Фракции, содержащие конъюгированные образцы, собирали, концентрировали и подвергали диафильтрации против 50 мМ NaCl и анализировали с помощью ГП-ВЭЖХ для демонстрации (фигуре 24).
Затем эти образцы анализировали описанным в данном документе способом «Biacore» (таблица 21). Пример демонстрирует, что K573P сохраняет свою повышенную аффинность к shFcRn по сравнению с WT HSA.
Пример 18. Конъюгация флуоресцеина с альбумином и с вариантом K573P.
Используемые в примере 17 два одинаковых образца альбумина также являлись исходным материалом для данного примера. То есть приблизительно по 200 мг/мл rHA или варианта альбумина K573P.
Флуоресцеин-5-Малеимид (F5M), «Thermo Scientific» растворяли в диметилформамиде до конечной концентрации 25 мг/мл. Затем дополнительно разводили в 18 мл PBS, регулировали рН до значения приблизительно рН 6,5. К данному раствору добавляли или 1 мл 200 мг/мл rHA или 1 мл 200 мг/мл варианта альбумина K573P. Это дает приблизительно 20-кратный конечный молярный избыток F5M. Данные образцы инкубировали и конъюгировали в течение ночи при 4°С, в темноте так, чтобы у малеимидной группы F5M была возможность прореагировать в основном со свободной сульфгидрильной группой, присутствующей в обоих образцах альбумина.
После ночного инкубирования, аликвоты реакционных смесей подвергали интенсивной диафильтрации против 50 мМ NaCl для удаления неконъюгированного F5M, («Vivaspin 20», 10,000 MWCO PES, «Sartorius»). Конъюгацию подтверждали визуализацией в ультрафиолете конъюгированного флуоресцеина:: альбумина согласно стандартному анализу ДСН-ПААГ (фигура 25).
Затем диафильтрванные образцы анализировали способом «Biacore», описанным в данном документе (таблица 21). Данные пример демонстрирует, что конъюгация небольшой молекулы либо с rHA, либо с вариантом, например, с K573P, не оказывает влияние на тенденцию аффинности связывания с shFcRn.
Пример 19. Дополнительные варианты альбумина
С помощью способа примера 1 получали следующие варианты: Е492Т, N503D, E492T+N503D, K538H, E542D, D494N+E495Q+T496A, E495Q+T496A, N403K, K541A и K541N. Проводили анализ SPR, как описано в примере 15, результаты представили на фигурах 26 и 27.
На фигурах 30А и 30B показан эффект связывание альбумина или вариантов альбумина с shFcRn.
Замены N503D, D494N+E495Q+T496A E492T+N503D, E495Q+T496A в HSA оказывали отрицательное воздействие на связывание с shFcRn при рН 5,5.
Пример 20. Варианты альбумина по С-концу.
С помощью способа примера 1 получали следующие варианты. Связывание с shFcRn определяли, как описано в материалах и методах, результаты представили в таблице 22.
Пример демонстрирует, что для всех протестированных замен человеческого альбумина по С-концу наблюдали увеличение связывания относительно донорного альбумина. Все донорные последовательности, содержащие замену K573P, продемонстрировали значительное увеличение связывания, но меньше чем K573P сам по себе (таблица 20).
Пример 21. Конкурентный анализ связывания химерных вариантов альбумина
Исследования конкурентного связывания с использованием химерных вариантов альбумина и выбор вариантов альбумина, полученных как в примере 1, осуществляли как в примере 4. Результаты представлены на фигурах 28-31.
Для химерных вариантов HSA-FLAG и N+C-концевых scFv HSA-FLAG иерархия конкурентного связывания была идентичной иерархии данных аффинности индивидуальных вариантов HSA (нехимерных и химерных). Для IL1Ra прогноз для вариантов K573P, K573A, и K500A оказался верным, однако D550N, по-видимому, ингибирует более эффективно, чем химера с диким типом.
Пример 22. Дополнительные варианты HSA
С помощью способа примера 1 получали следующие варианты: HSA E492G+K573A, HSA E492G+N503K+K573A, HSA E492G+N503H+K573A, HSA E492G+K573P, HSA E492G+N503K+K573P, HSA E492G+N503H+K573P. Анализ SPR осуществляли, как описано в Материалах и Методах. Результаты (фигура 32) демонстрируют, что по сравнению с HSA дикого типа, рН 5,5 все варианты HSA связывают с shFcRn более сильно. Наблюдали отсутствие связывания при рН 7,4.
HSA E492G+K573A, HSA E492G+N503K+K573A, в отличии от HSA E492G+N503H+K573A, обладали минимально улучшенным связыванием по сравнению с HSA K573A. Комбинация вариантов, содержащих K573P, не показала улучшенного связывания по сравнению с вариантом K573P.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАРИАНТЫ АЛЬБУМИНА | 2013 |
|
RU2670063C2 |
| ВАРИАНТЫ АЛЬБУМИНА | 2012 |
|
RU2650784C2 |
| Химерный улучшенный рекомбинантный фактор VIII | 2015 |
|
RU2647769C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2011 |
|
RU2663123C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2727452C1 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2011 |
|
RU2774414C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2642310C2 |
| ПОЛИПЕПТИДЫ | 2011 |
|
RU2577964C2 |
| CD40L-СПЕЦИФИЧНЫЕ КАРКАСНЫЕ СТРУКТУРЫ, ПРОИСХОДЯЩИЕ ИЗ Tn3, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2704992C2 |
| PSMA×CD3 БИСПЕЦИФИЧЕСКОЕ ОДНОЦЕПОЧЕЧНОЕ АНТИТЕЛО С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2009 |
|
RU2559531C2 |
















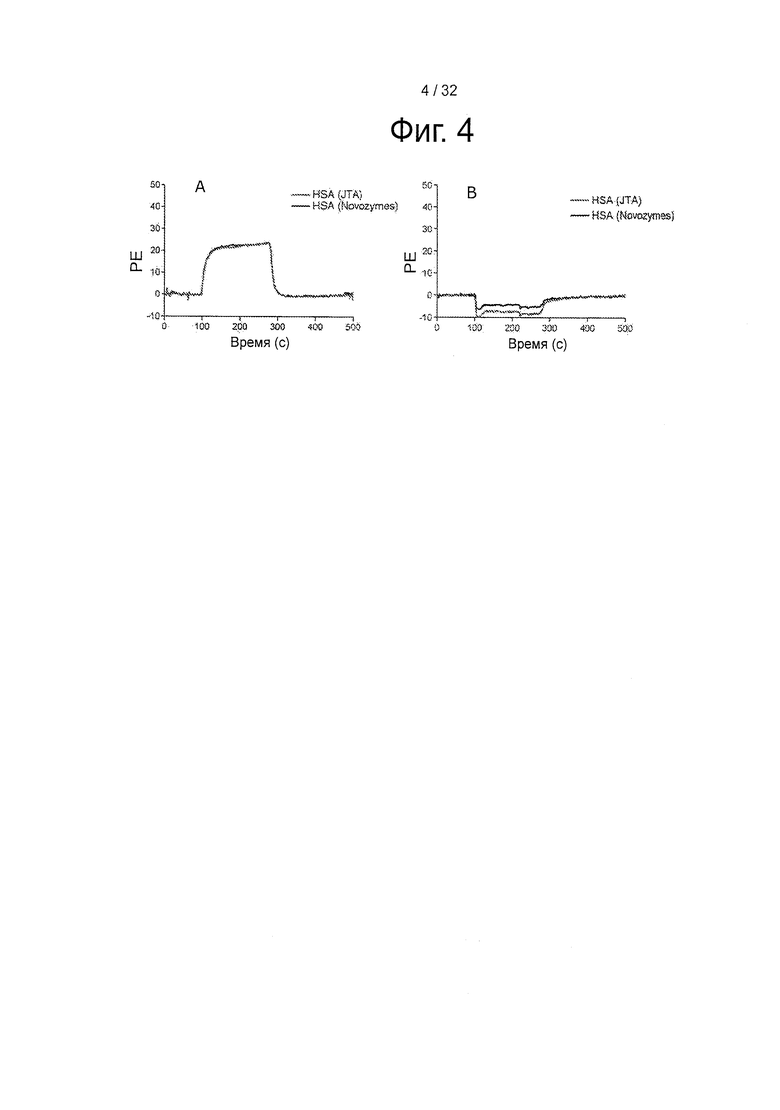
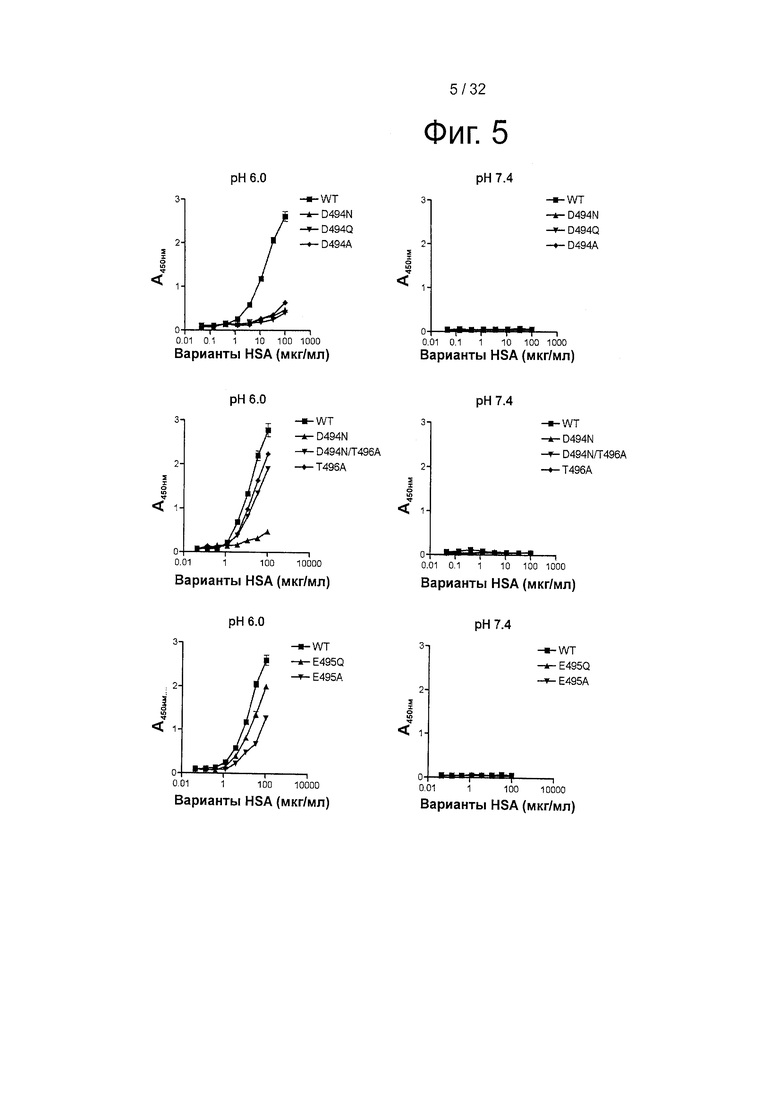
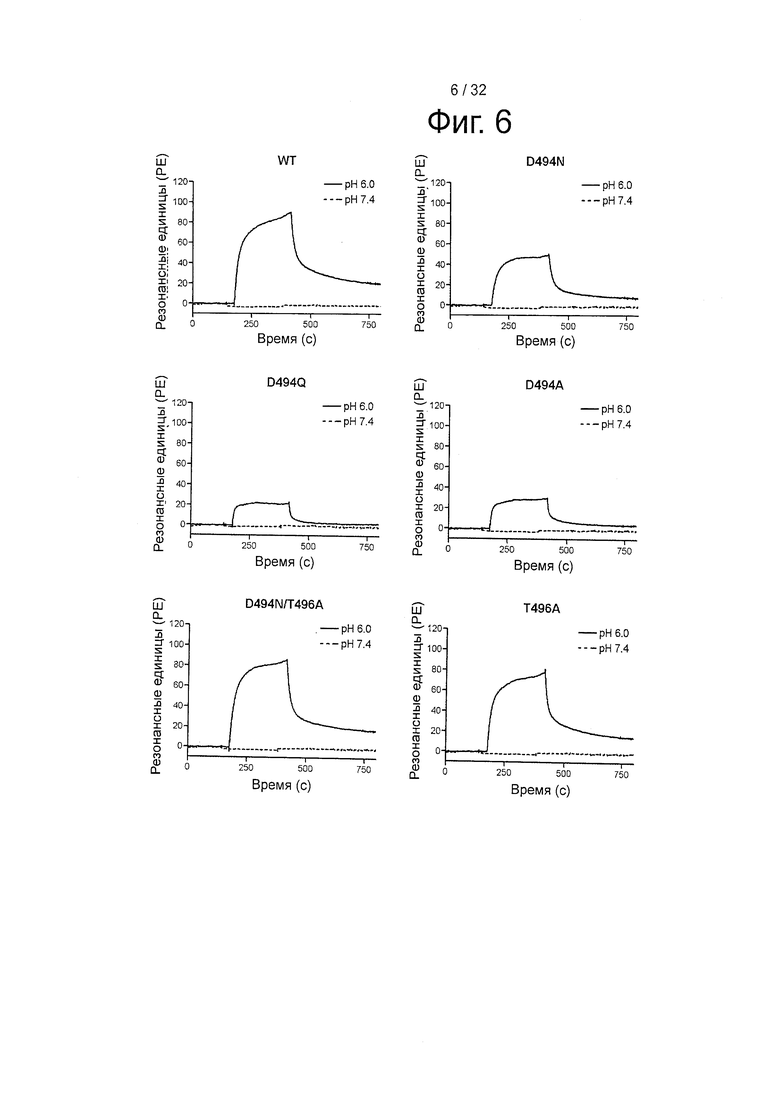

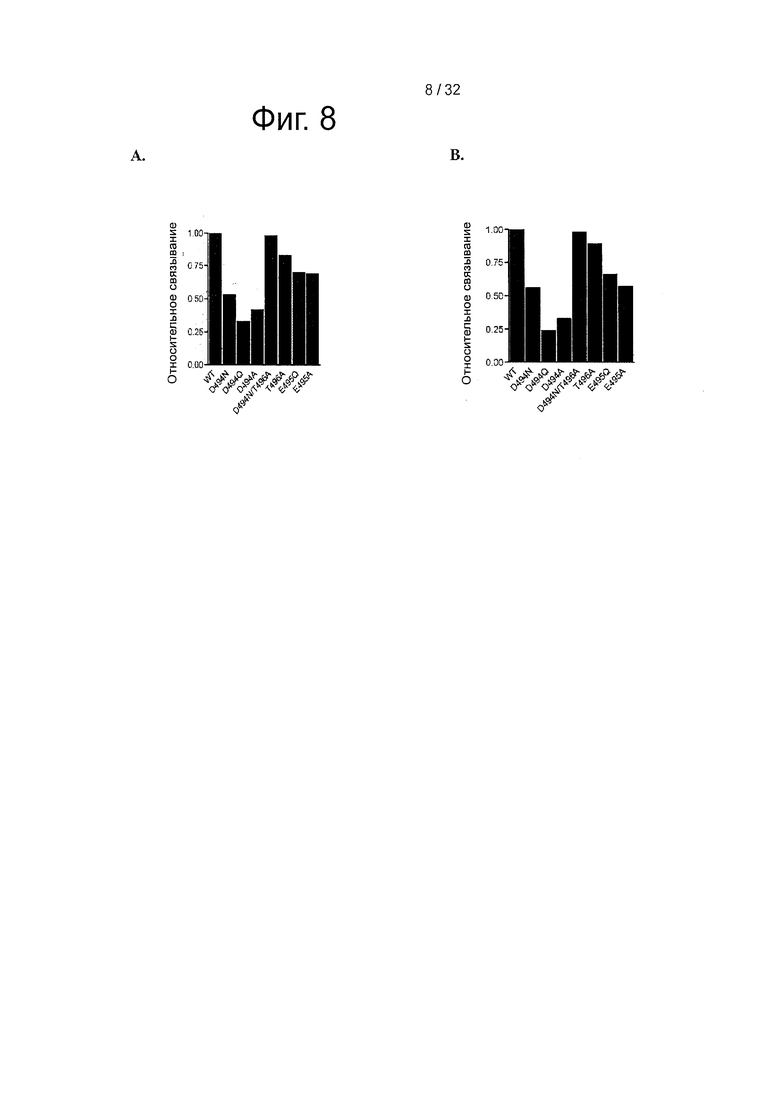
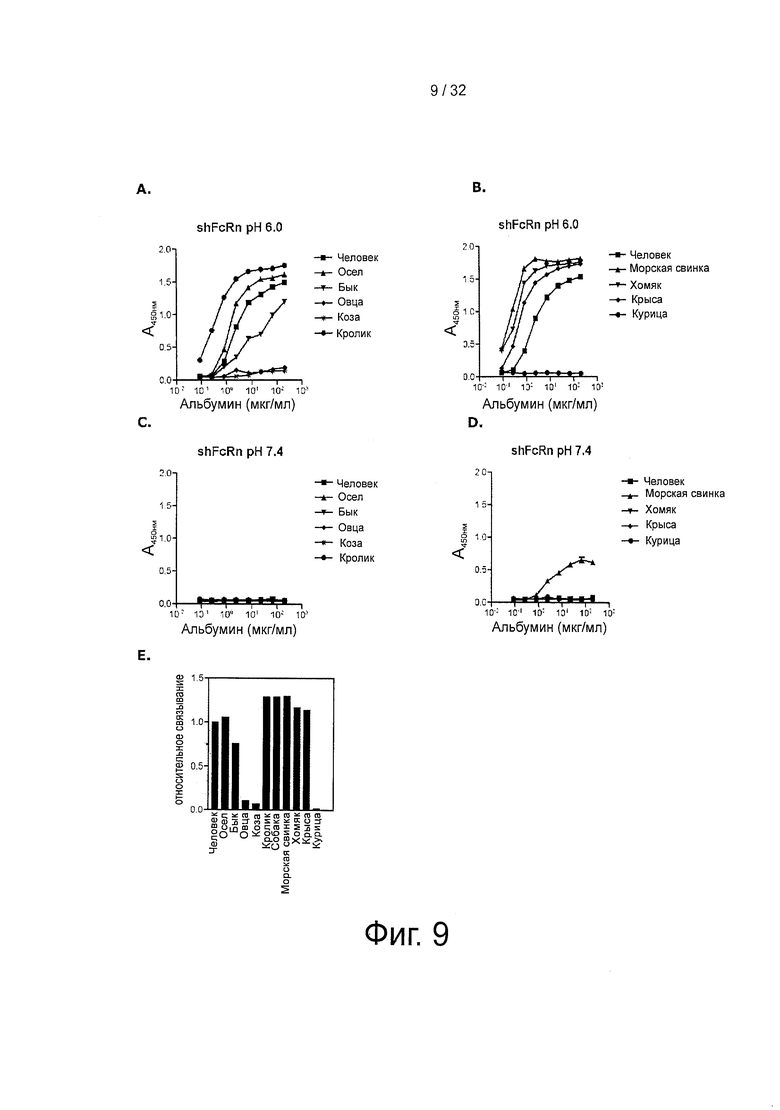
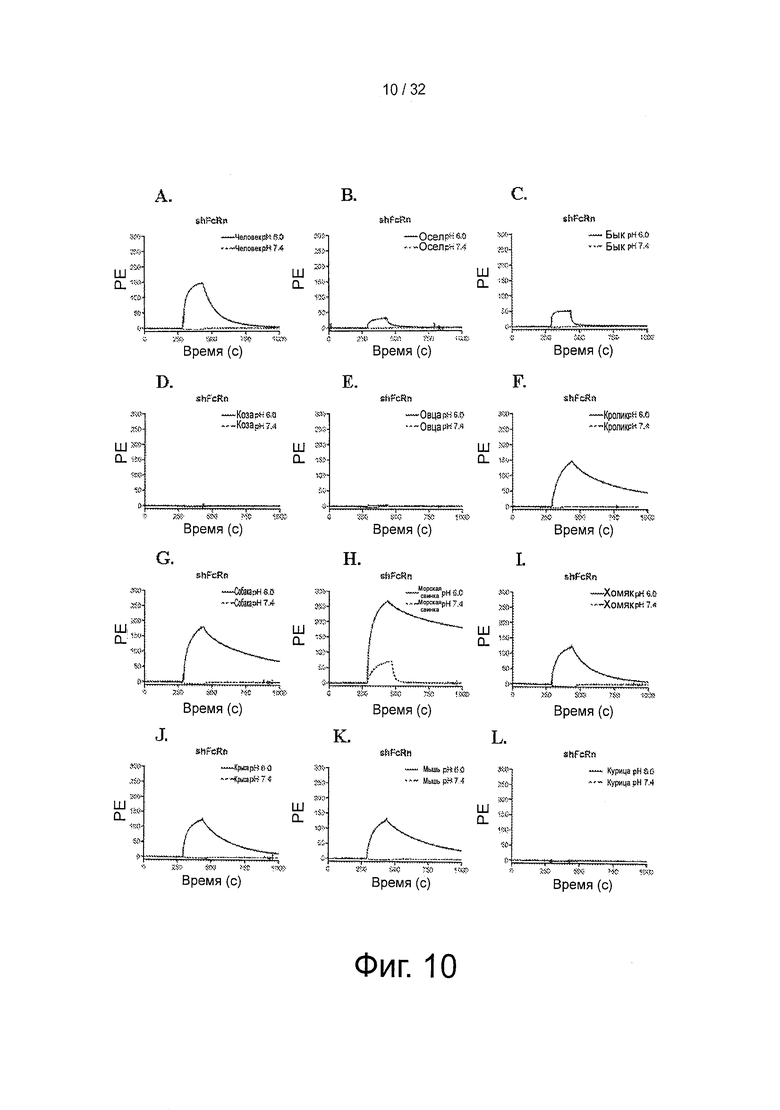
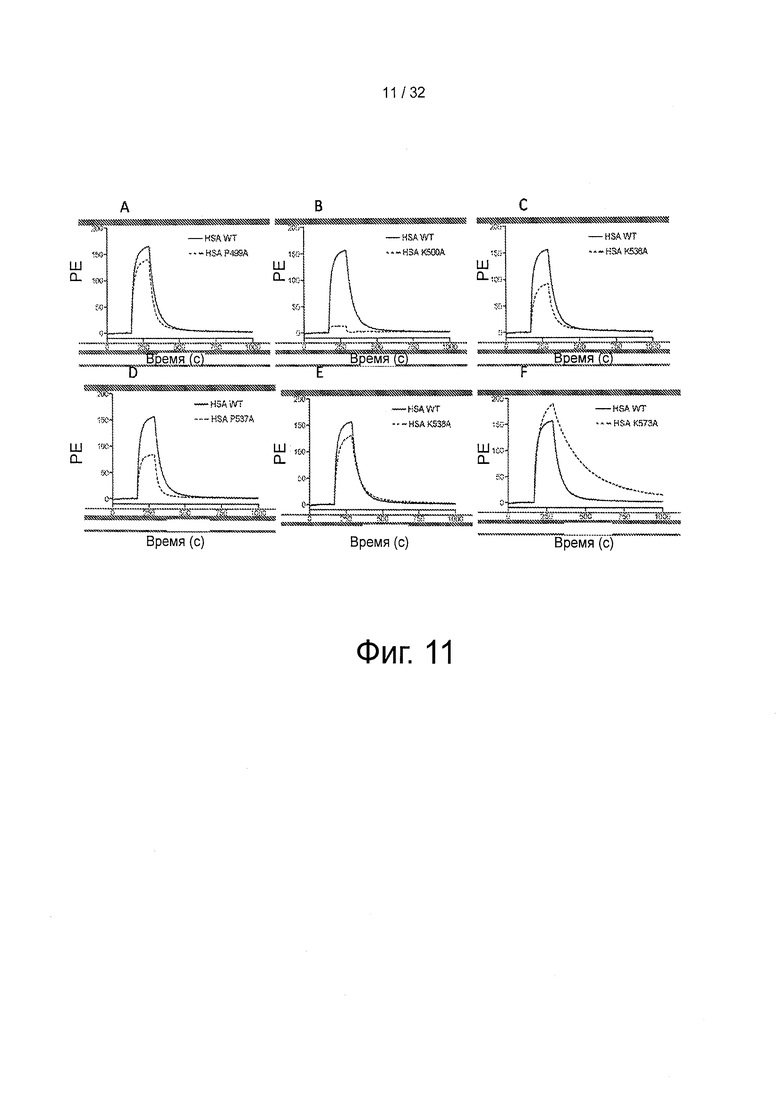
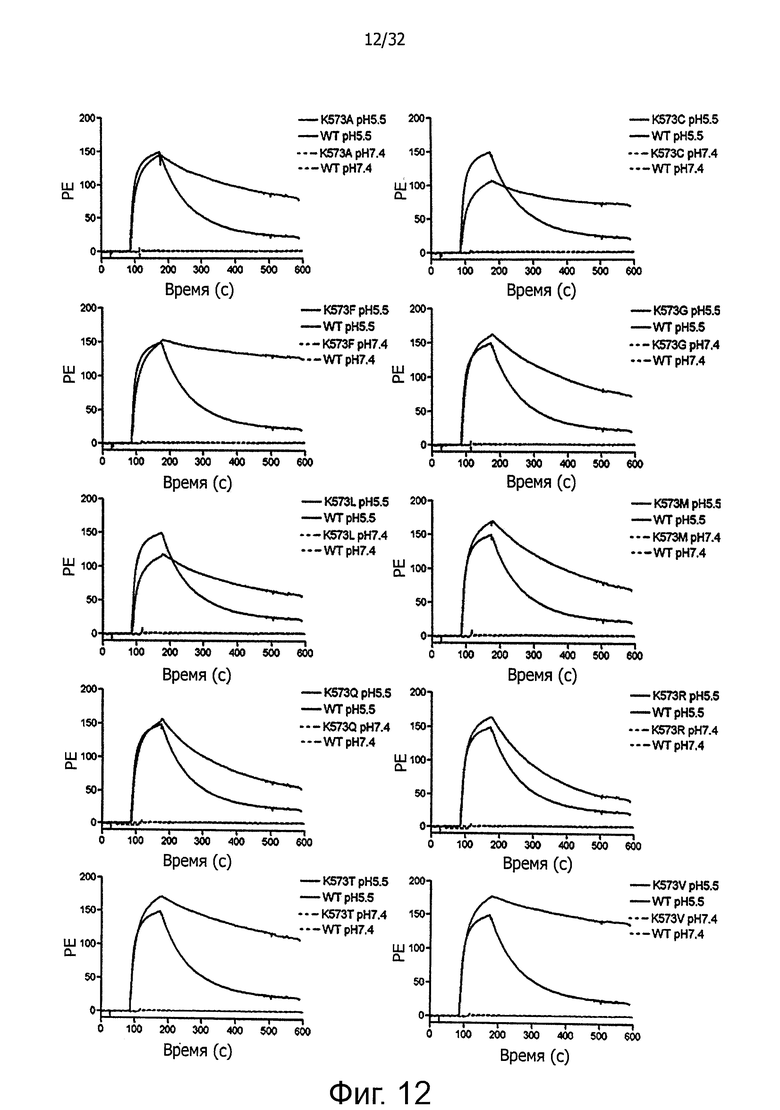
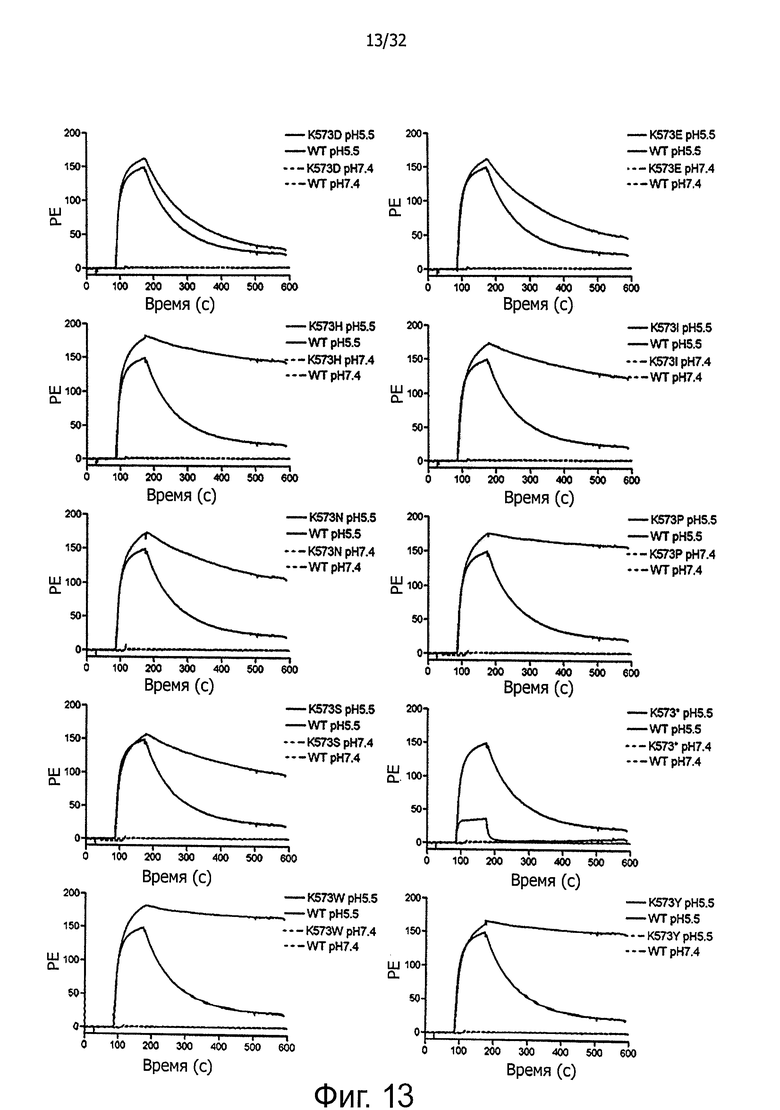
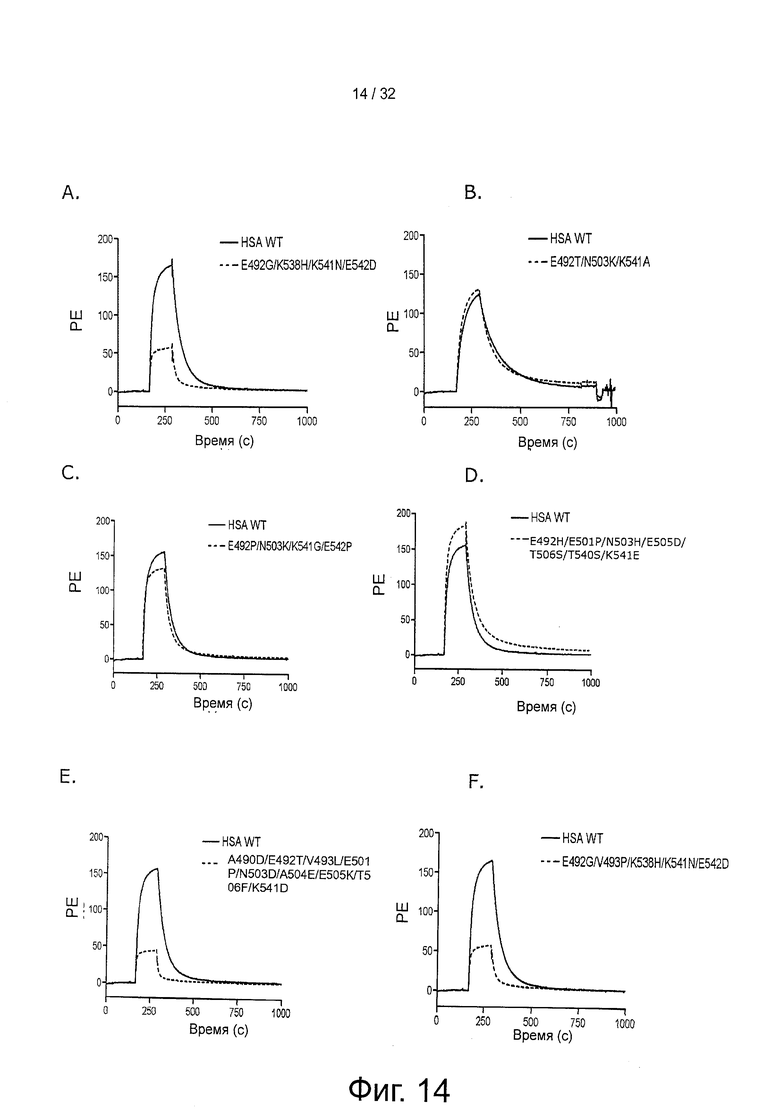
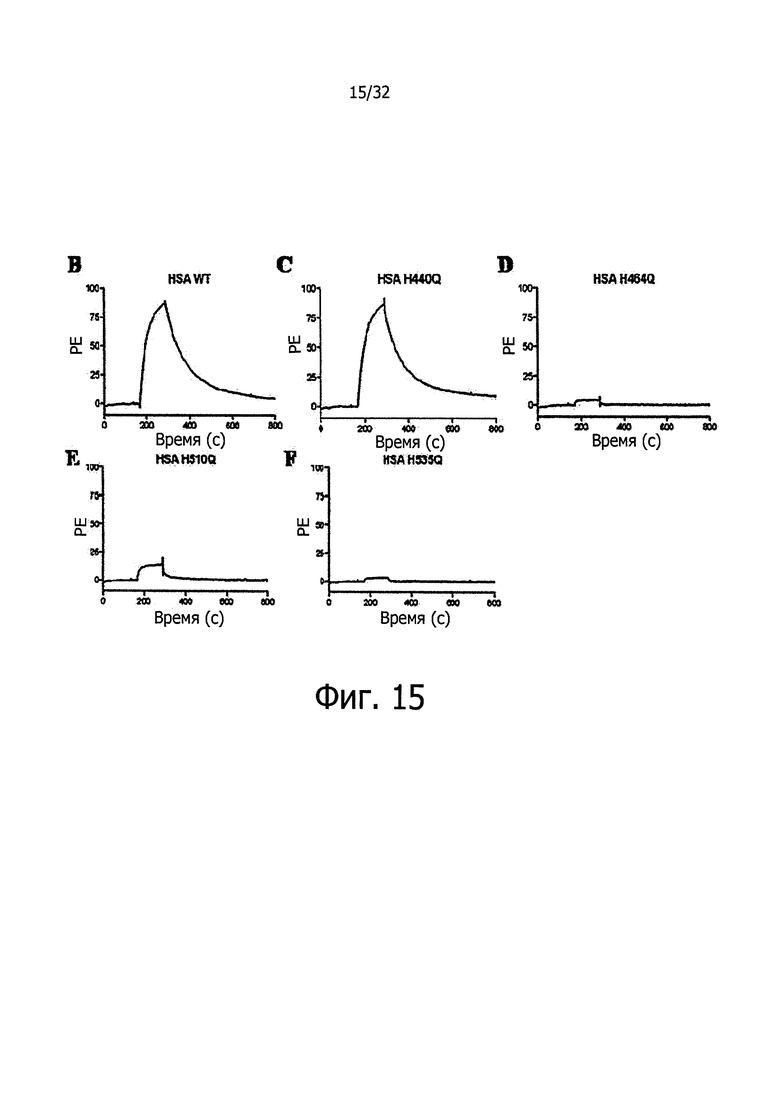
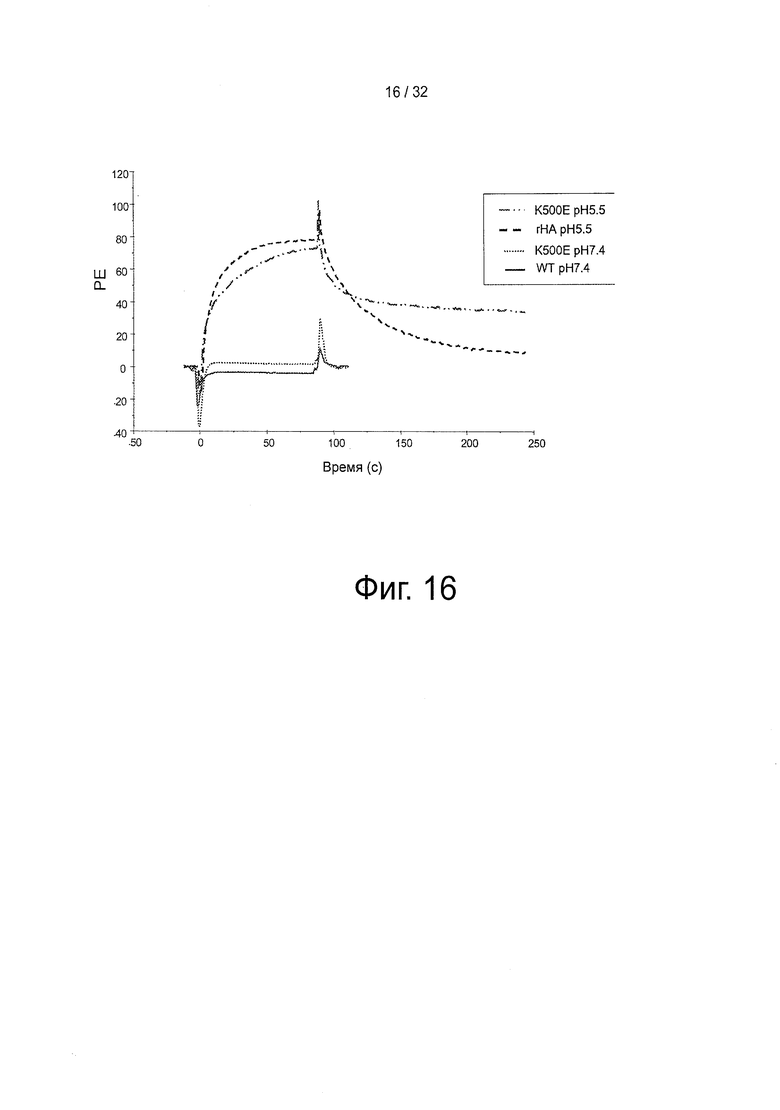
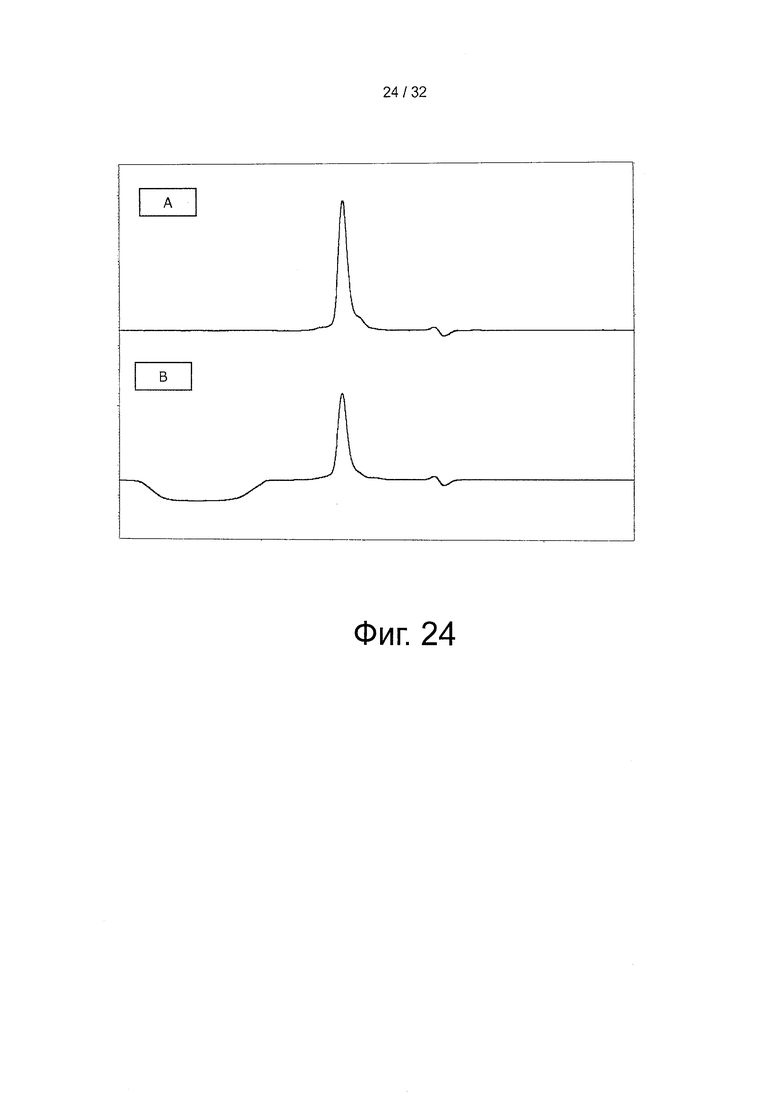

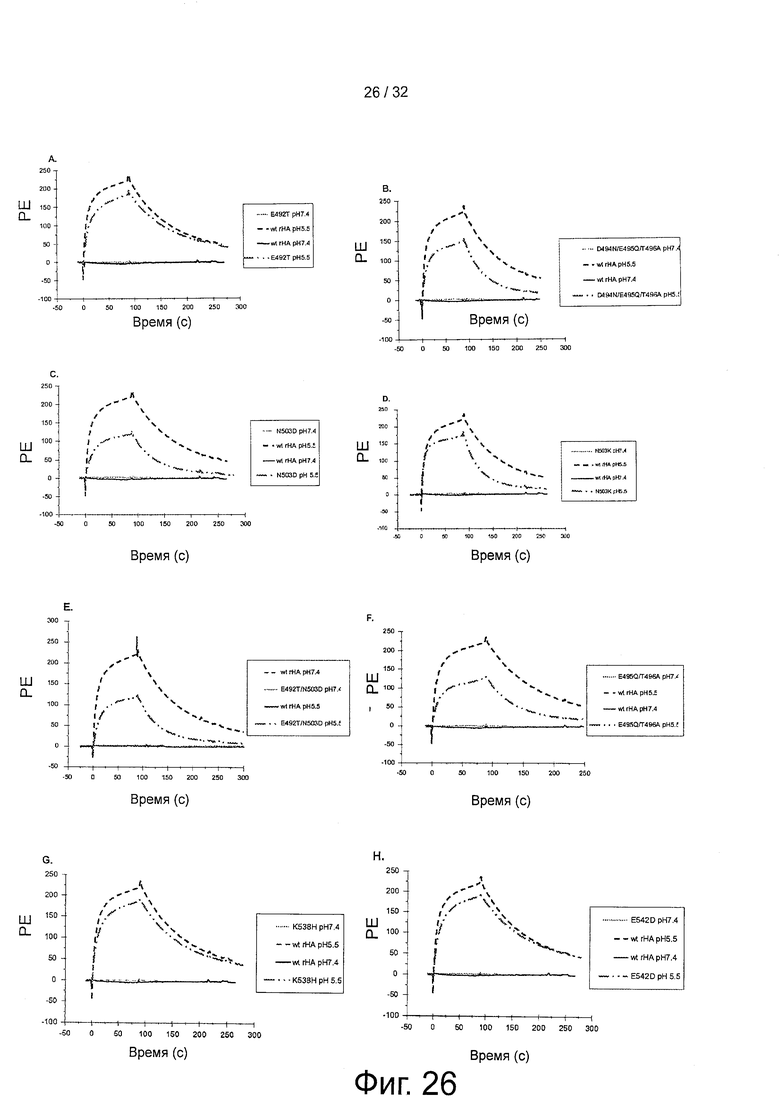
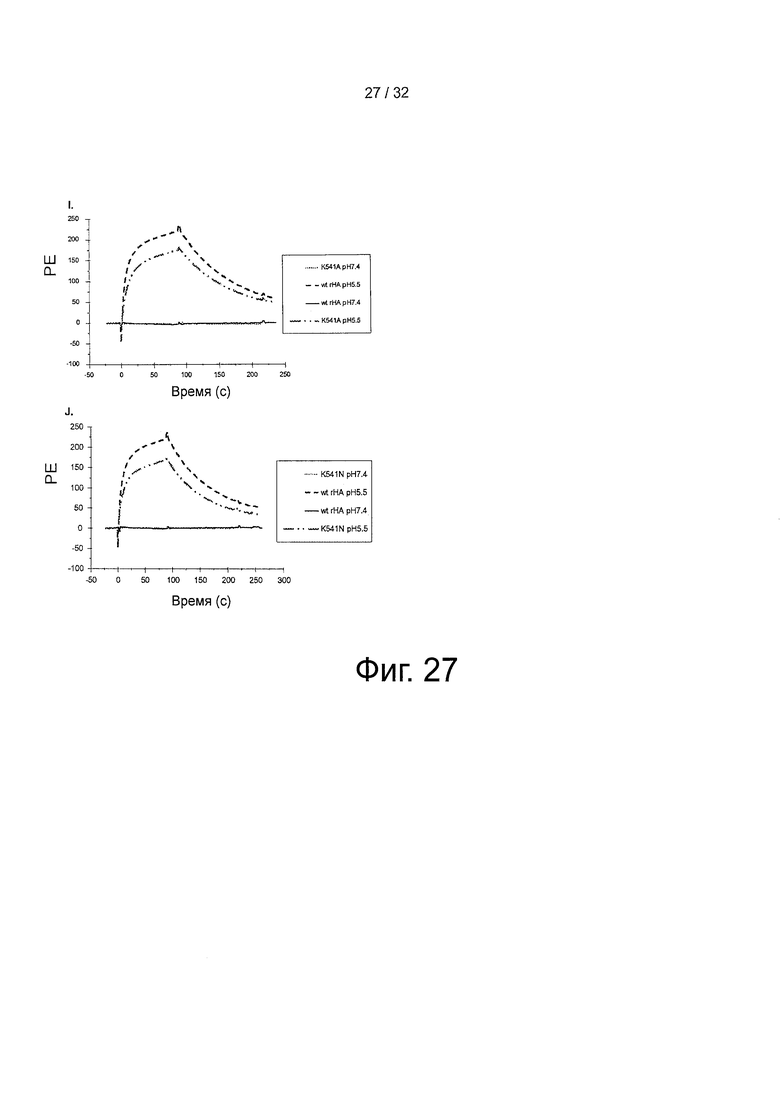
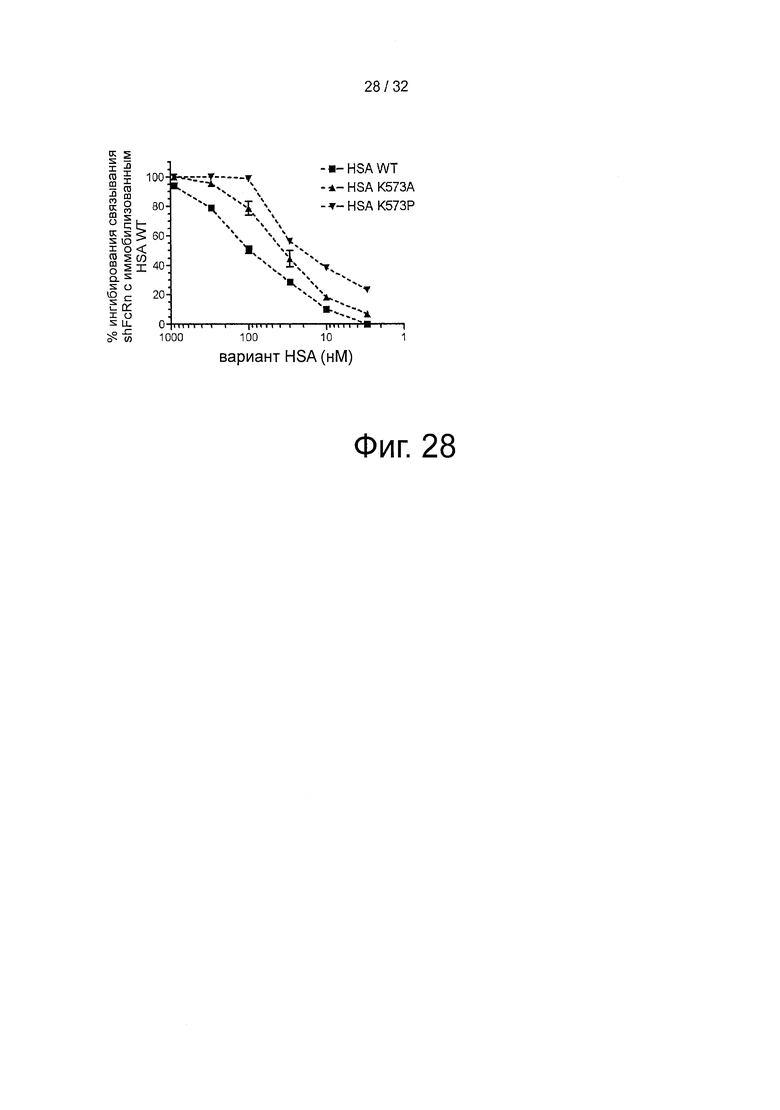
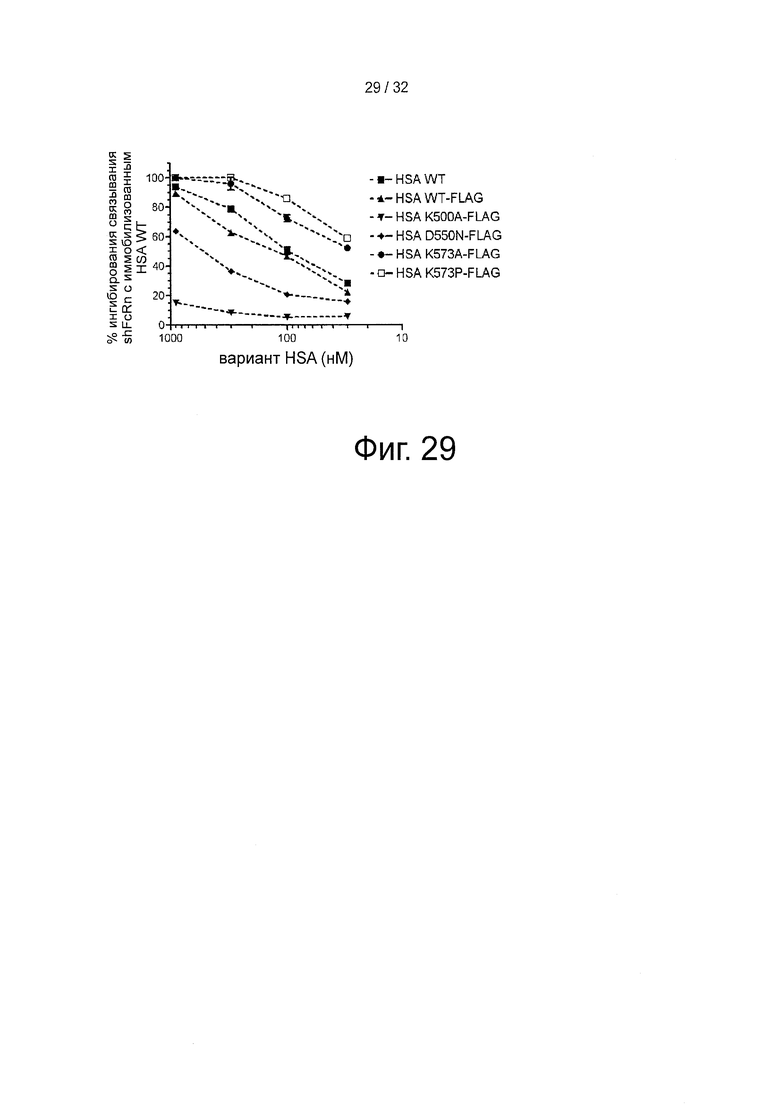
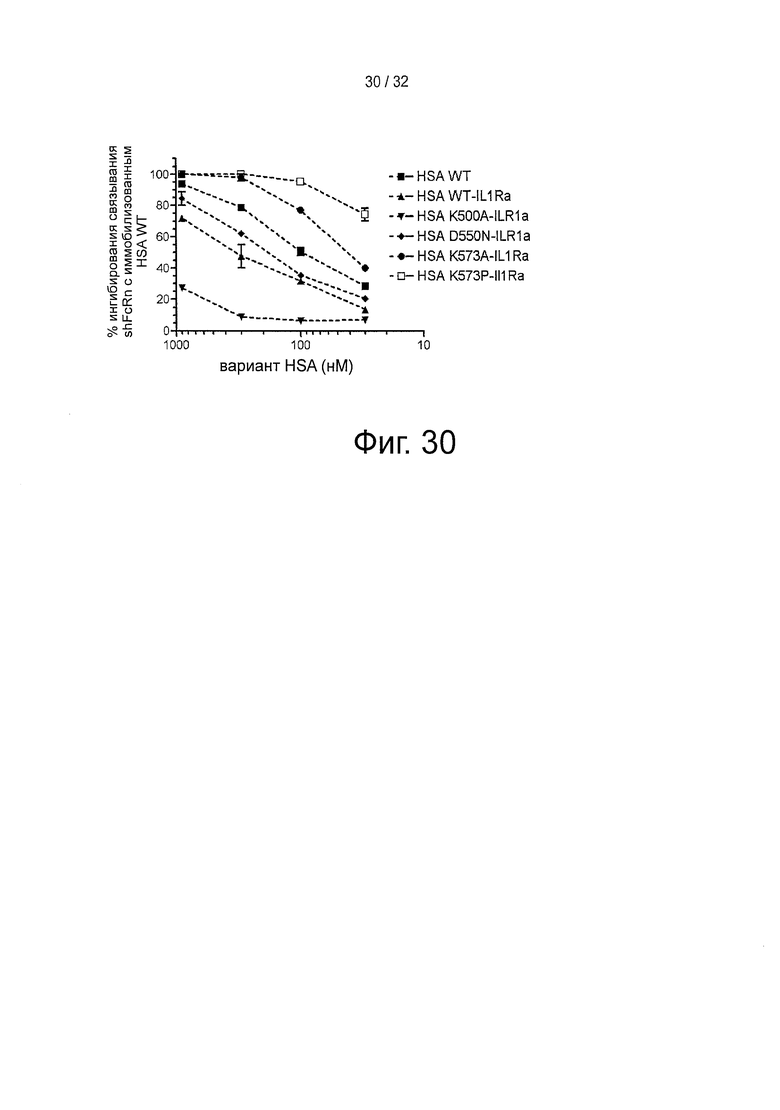
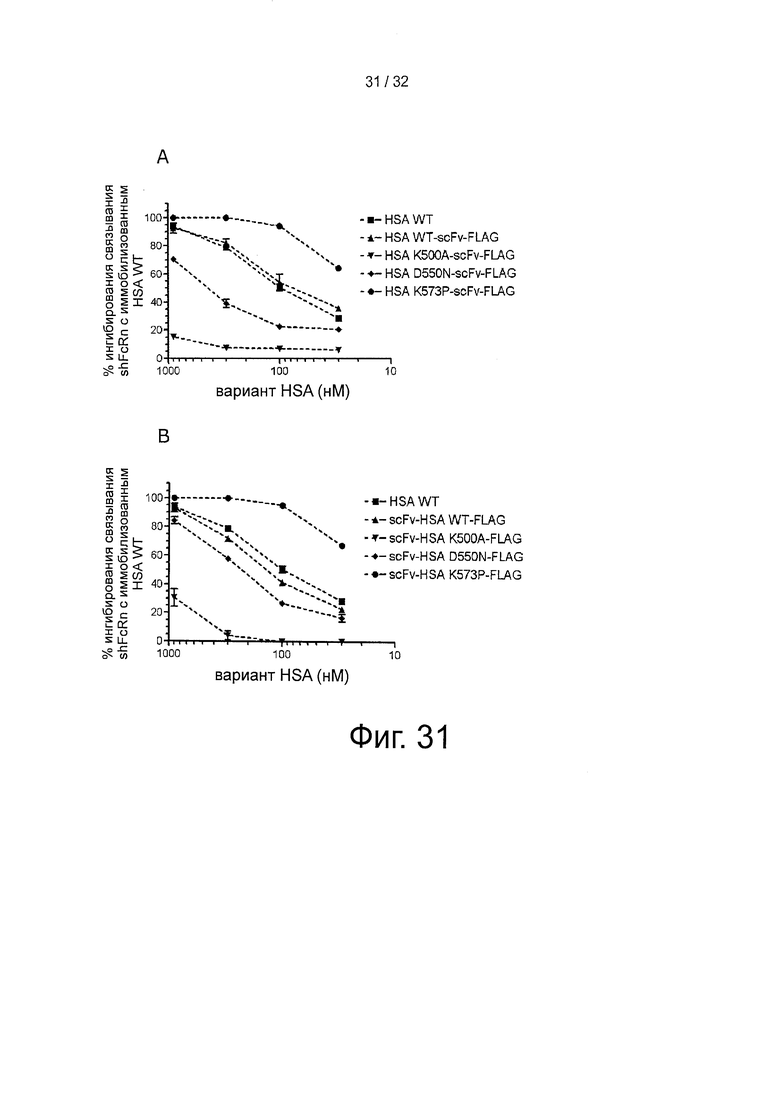
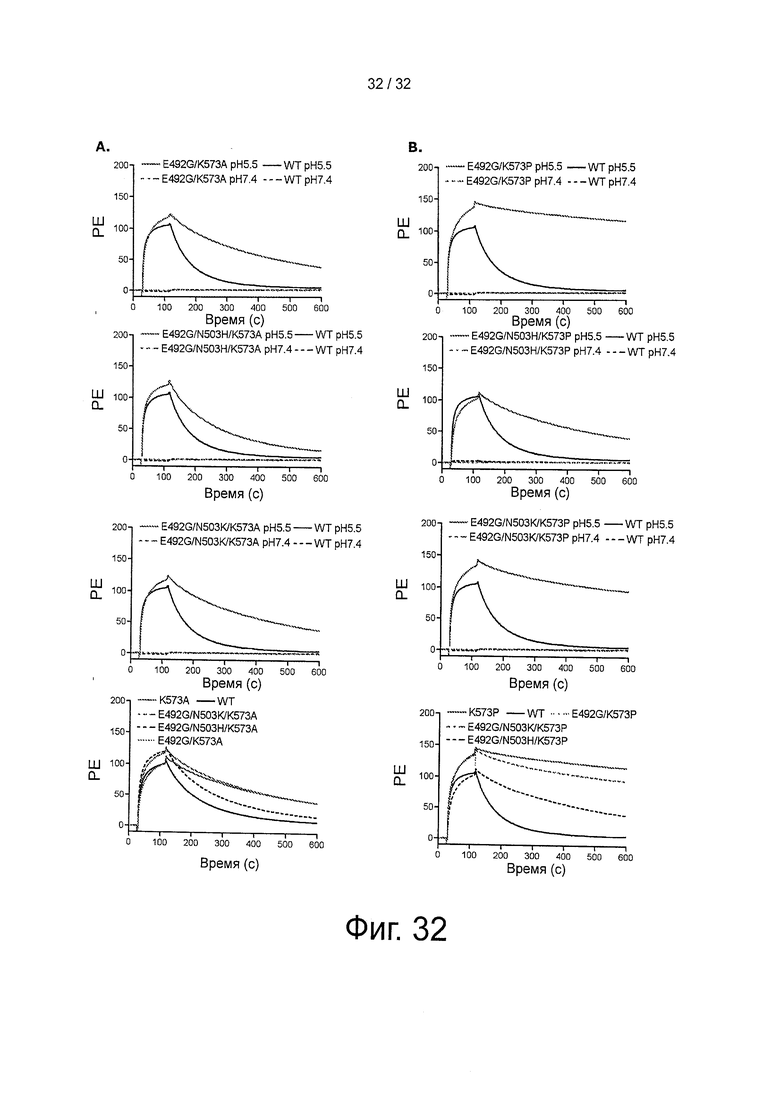
Настоящее изобретение относится к области биотехнологии, конкретно к получению вариантов альбумина, у которых изменен период полужизни в плазме по сравнению с исходным альбумином, и может быть использовано в медицине. Получают вариант альбумина, содержащий одну или несколько замен относительно SEQ ID NO: 2, выбранных из следующих: 1) E492A, C, D, F, G, H, I, K, L, M, N, Q, R; 2) K500I, R; 3) N503H; 4) E505Q; 5) H510D; 6) D550E, H, I, M, N, R, S, W; 7) K573A, C, D, F, G, H, I, L, M, N, P, R, S, V, W, Y; 8) K574D, F, G, H, I, L, M, P, R, S, T, V, W, Y; 9) A578F; 10) S579C; 11) Q580I, K, M, R, V; или 12) G584D. Изобретение позволяет получить вариант альбумина или его фрагмент, обладающий способностью связываться с FcRn, или химерный полипептид, включающий указанный вариант альбумина или его фрагмент, имеющий увеличенный период полужизни в плазме или увеличенную аффинность связывания с FcRn по сравнению с исходным альбумином, его фрагментом или химерным полипептидом. 6 н. и 4 з.п. ф-лы., 32 ил., 22 табл., 22 пр.
1. Способ получения варианта альбумина, его фрагмента, обладающего способностью связываться с FcRn, или химерного полипептида, включающего указанный вариант альбумина или его фрагмент и полипептид, имеющий терапевтические или диагностические свойства, который включает стадии:
a. получения нуклеиновой кислоты, кодирующей исходный альбумин, имеющий по меньшей мере 80% идентичности последовательности с SEQ ID NO: 2;
b. модификации последовательности стадии а для кодирования варианта альбумина, его фрагмента, обладающего способностью связываться с FcRn, или химерного полипептида, включающего указанный вариант альбумина или его фрагмент, в котором присутствует одна или несколько замен, соответствующих заменам в SEQ ID NO: 2, выбранным из:
H440A,C,D,E,F,G,I,K,L,M,N,P,Q,R,S,T,V,W,Y;
H464C,D,E,F,G,I,K,L,M,N,P,Q,R,S,T,V,W,Y;
E492A,C,D,F,G,H,I,K,L,M,N,P,Q,R,S,T,V,W,Y;
D494A,C,E,F,G,H,I,K,L,M,N,P,Q,R,S,T,V,W,Y;
E495A,C,D,F,G,H,I,K,L,M,N,P,Q,R,S,T,V,W,Y;
T496A,C,D,E,F,G,H,I,K,L,M,N,P,Q,R,S,V,W,Y;
P499A,C,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V,W,Y;
K500A,C,D,E,F,G,H,I,L,M,N,Q,R,S,T,V,W,Y;
E501A,C,D,F,G,H,I,K,L,M,N,P,Q,R,S,T,V,W,Y;
N503A,C,D,E,F,G,H,I,K,L,M,P,Q,R,S,T,V,W,Y;
E505A,C,D,F,G,H,I,K,L,M,N,P,Q,R,S,T,V,W,Y;
H510C,D,F,G,I,K,L,M,N,P,Q,R,S,T,V,W,Y;
H535C,D,F,G,I,K,L,M,N,P,Q,R,S,T,V,W,Y;
K536A,C,D,E,F,G,H,I,L,M,N,P,Q,R,S,T,V,W,Y;
P537A,C,D,E,F,G,H,I,K,L,M,N,Q,R,S,T,V,W,Y;
K538A,C,D,E,F,G,H,I,L,M,N,P,Q,R,S,T,V,W,Y;
K541A,C,D,F,G,H,I,L,M,N,P,Q,R,S,T,V,W,Y;
E542A,C,D,F,G,H,I,K,L,M,N,P,Q,R,S,T,V,W,Y;
D550C,E,F,H,I,K,L,M,N,P,Q,R,S,T,V,W,Y;
K573A,C,D,F,G,H,I,L,M,N,P,R,S,V,W,Y;
K574C,D,F,G,H,I,L,M,P,Q,R,S,T,V,W,Y;
L575A,C,D,E,F,G,H,I,K,M,N,P,Q,R,S,T,V,W,Y;
A578C,D,E,F,G,H,I,K,L,M,N,P,Q,R,S,T,V,W,Y;
S579A,C,D,E,F,G,H,I,K,L,M,N,P,Q,R,T,V,W,Y;
Q580A,C,D,E,F,G,H,I,K,L,M,N,P,R,S,T,V,W,Y; или
G584A,D,E,F,H,I,K,L,M,N,P,Q,R,S,T,V,W,Y;
и имеющего по меньшей мере 98% идентичность последовательности с SEQ ID NO: 2;
c. введения модифицированной последовательности стадии b в подходящую клетку-хозяина;
d. выращивания клеток в подходящей ростовой среде в условиях, приводящих к экспрессии варианта альбумина, его фрагмента или химерного полипептида, включающего указанный вариант альбумина или его фрагмент; и
e. извлечения варианта альбумина, его фрагмента или химерного полипептида, включающего вариант альбумина или его фрагмент, из ростовой среды;
где у варианта альбумина, его фрагмента или химерного полипептида, включающего указанный вариант альбумина или его фрагмент, период полужизни в плазме отличается от исходного альбумина, его фрагмента или химерного полипептида, включающего указанный вариант альбумина или его фрагмент.
2. Вариант альбумина или его фрагмент, обладающий способностью связываться с FcRn, или химерный полипептид, включающий указанный вариант альбумина или его фрагмент, имеющий увеличенный период полужизни в плазме или увеличенную аффинность связывания с FcRn по сравнению с исходным альбумином, его фрагментом или химерным полипептидом, включающим указанный исходный альбумин или его фрагмент, содержащий одну или несколько замен относительно SEQ ID NO: 2, выбранных из следующих:
E492A,C,D,F,G,H,I,K,L,M,N,Q,R;
K500I,R;
N503H;
E505Q;
H510D;
D550E,H,I,M,N,R,S,W;
K573A,C,D,F,G,H,I,L,M,N,P,R,S,V,W,Y;
K574D,F,G,H,I,L,M,P,R,S,T,V,W,Y;
A578F;
S579C;
Q580I,K,M,R,V; или
G584D; и
где вариант имеет по меньшей мере 98% идентичности последовательности с SEQ ID NO: 2.
3. Вариант альбумина, его фрагмент или химерный полипептид, включающий указанный вариант альбумина или его фрагмент, по п. 2, который содержит одну или несколько замен, соответствующих следующим заменам в SEQ ID NO: 2: K573Y,W,P,H,F,V,I,T,N,S,G,M,C,A,E,Q,R,L,D, K573P+K574N+A577T+A578R+S579C+Q580K+A581D+G584A,
K573P+A577E+A578S+Q580K+A582T, K573P+A578S+S579T+G584A, K573P+L575F+G584A, E492G, N503K, K500R N503H, D550E, Q580K и E492G+N503K, E492G+N503H, E492H+E501P+N503H+E505D+T506S+T540S+K541E, E492G+K573A, E492G+N503K+K573A, E492G+N503H, E492G+K573P, E492G+N503K+K573P, E492G+N503H+K573P.
4. Вариант альбумина, его фрагмент или химерный полипептид, включающий указанный вариант альбумина или его фрагмент, по п. 2, содержащий одно или несколько дополнительных изменений, которые образуют тиогруппу на его поверхности.
5. Вариант альбумина, его фрагмент или химерный полипептид, включающий указанный вариант альбумина или его фрагмент, по п. 2, в котором идентичность последовательности варианта альбумина, его фрагмента или химерного полипептида, включающего указанный вариант альбумина или его фрагмент, с SEQ ID NO: 2 составляет более чем 80%, предпочтительно более чем 90%, более предпочтительно более чем 95%, более предпочтительно более чем 96%, еще более предпочтительно более чем 97%, более предпочтительно, более чем 98% и наиболее предпочтительно, более чем 99%.
6. Вариант альбумина, его фрагмент или химерный полипептид, включающий указанный вариант альбумина или его фрагмент, по любому из предшествующих пунктов, представляющий собой вариант фрагмента альбумина или химерный полипептид, включающий вариант фрагмента альбумина, где фрагмент включает по меньшей мере 100 аминокислот, более предпочтительно по меньшей мере 200 аминокислот, более предпочтительно по меньшей мере 300 аминокислот, более предпочтительно по меньшей мере 400 аминокислот и наиболее предпочтительно по меньшей мере 500 аминокислот.
7. Нуклеиновая кислота, кодирующая вариант альбумина, его фрагмент или химерный полипептид, включающий указанный вариант альбумина или его фрагмент, по п. 2.
8. Конъюгат с увеличенным периодом полужизни в плазме или увеличенной аффинностью связывания с FcRn, состоящий из варианта альбумина или его фрагмента по п. 2, конъюгированного с полезным терапевтическим компонентом.
9. Ассоциат, имеющий увеличенный период полужизни в плазме или увеличенную аффинностью связывания с FcRn, состоящий из варианта альбумина или его фрагмента по п. 2, связанного или ассоциированного с полезным терапевтическим компонентом посредством нековалентного связывания.
10. Химерный полипептид, имеющий увеличенный период полужизни в плазме или увеличенную аффинностью связывания с FcRn, состоящий из варианта альбумина или его фрагмента по п. 2, и полипептида-партнера по слиянию, который имеет терапевтические или диагностические свойства.
| US 20060051859 A1, 09.03.2006 | |||
| WO 2007021494 A2, 22.02.2007 | |||
| WO 2004011499 A1, 05.02.2004 | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| KENANOVA V | |||
| ET AL., HSA Domain III as a protein scaffold with defined serum pharmacokinetics, THE JOURNAL OF NUCLEAR MEDICINE, 2009, v | |||
| Устройство для выпрямления многофазного тока | 1923 |
|
SU50A1 |
| Аппарат для электролиза воды | 1924 |
|
SU1582A1 |
| KRAGH-HANSEN U | |||
| ET AL., Effect of genetic variation on the thermal stability of human serum albumin, BIOCHIMICA ET BIOPHYSICA ACTA, 2005, v | |||
| Пишущая машина для арабского шрифта | 1923 |
|
SU1747A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Горный компас | 0 |
|
SU81A1 |
| СЛИТЫЕ БЕЛКИ АЛЬБУМИНА | 2005 |
|
RU2369404C2 |
Авторы
Даты
2017-01-10—Публикация
2010-11-01—Подача