Настоящая заявка содержит Перечень последовательностей в электронном виде, который включен сюда в виде ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение касается вариантов альбумина либо их фрагментов или слитых полипептидов, содержащих варианты альбумина или их фрагменты с измененным сродством связывания с FcRn и/или измененным временем полужизни по сравнению с альбумином, его фрагментами или слитыми полипептидами, содержащими альбумин или его фрагмент. Изобретение позволяет адаптировать сродство связывания и/или период полужизни альбумина к требованиям и пожеланиям клиента или к его применению.
Уровень техники
Альбумин - это белок, который естественным образом присутствует в плазме крови млекопитающих, где он является самым распространенным белком. Он играет важную роль в поддержании требуемого осмотического давления крови, а также в транспорте различных веществ в кровотоке. Изучены альбумины из многих видов, включая человека, свиней, мышей, крыс, кроликов и коз, и все они обладают высокой степенью гомологичности последовательности и структурной гомологии.
Альбумин связывается in vivo со своим рецептором, неонатальным Fc-рецептором (FcRn) "Brambell", и это взаимодействие важно для полужизни альбумина в плазме. FcRn является мембранным белком, который экспрессируется во многих типах клеток и тканей. Установлено, что FcRn спасает альбумин от внутриклеточного распада (Roopenian D.C. and Akilesh S. (2007) Nat. Rev. Immunol. 7, 715-725). FcRn является бифункциональной молекулой, которая способствует поддержанию высокого уровня IgGs и альбумина в сыворотке млекопитающих и человека.
В то время как взаимодействие FcRn-иммуноглобулин (IgG) было подробно описано в предшествующем уровне техники, взаимодействие FcRn-альбумин изучено не столь хорошо. Основной сайт связывания FcRn локализован в DIII (381-585), см. Andersen et al. (2010) Clinical Biochemistry 43, 367-372. Данные указывают на то, что IgG и альбумин связываются некооперативным образом с разными участками на FcRn (Andersen et al. (2006) Eur. J. Immunol. 36, 3044-3051; Chaudhury et al. (2006) Biochemistry 45, 4983-4990).
Известно, что мышиный FcRn связывает IgG мыши и человека, в то время как FcRn человека является более разборчивым (Ober et al. (2001) Int. Immunol. 13, 1551-1559). В работе Andersen et al. (2010) Journal of Biological Chemistry 285(7): 4826-36 описано сродство FcRn человека и мыши для каждого альбумина мыши и человека (все возможные комбинации). При физиологическом рН не наблюдалось никакого связывания альбумина из обоих видов ни с каким рецептором. При кислом рН наблюдалось 100-кратное различие по сродству связывания. Во всех случаях связывание альбумина и IgG из обоих видов с обоими рецепторами было аддитивным.
Сывороточный альбумин человека (HSA) хорошо изучен, и представляет собой полипептид из 585 аминокислот, последовательность которого приведена в Peters Т., Jr. (1996) All about Albumin: Biochemistry, Genetics and Medical Applications, pp.10, Academic Press, Inc., Orlando (ISBN 0-12-552110-3). Ему присуще характерное связывание со своим рецептором FcRn, с которым он связывается при рН 6,0, но не при рН 7,4.
Время полужизни HSA в плазме составляет примерно 19 дней. Обнаружен природный вариант с меньшим временем полужизни в плазме (Peach R.J. and Brennan S.O. (1991) Biochim. Biophys. Acta 1097: 49-54), который содержит замену D494N. Эта замена создает сайт N-гликозилирования у этого варианта, которого нет у альбумина дикого типа. Неизвестно, что именно - гликозилирование или аминокислотная замена ответственна за изменение времени полужизни.
Альбумин обладает длительным временем полужизни в плазме и вследствие этого свойства его предлагали использовать для доставки лекарственных препаратов. Альбумин конъюгировали с фармацевтически полезными соединениями (WO 2000/69902 A) и оказалось, что у конъюгатов сохраняется длительное время полужизни альбумина в плазме. При этом время полужизни в плазме у конъюгатов обычно было значительно больше, чем у данных терапевтических соединений самих по себе.
Кроме того, альбумин подвергали генетическому слиянию с терапевтически полезными пептидами (WO 2001/79271 А и WO 2003/59934 А), при этом оказалось, что продукт слияния обладает активностью терапевтически полезного пептида и значительно большим временем полужизни в плазме, чем у терапевтически полезных пептидов самих по себе.
В работе Otagiri et al. (2009) Biol. Pharm. Bull. 32(4), 527-534, описано более 70 вариантов альбумина, из них 25 содержат мутации в домене III. Природный вариант, у которого отсутствуют 175 аминокислот на С-конце, обладает пониженным временем полужизни (Andersen et al. (2010) Clinical Biochemistry 43, 367-372). Iwao et al. (2007) исследовали время полужизни природных вариантов альбумина человека на мышиной модели и обнаружили, что К541Е и К560Е обладают меньшим временем полужизни, Е501К и Е570К обладают большим временем полужизни, а время полужизни К573Е почти не меняется (Iwao et al. (2007) B.B.A. Proteins and Proteomics 1774, 1582-1590).
В работе Galliano et al. (1993) Biochim. Biophys. Acta 1225, 27-32 описан природный вариант Е505К. В работе Minchiotti et al (1990) описан природный вариант К536Е. В работе Minchiotti et al. (1987) Biochim. Biophys. Acta 916, 411-418 описан природный вариант K574N. В работе Takahashi et al. (1987) Proc. Natl. Acad. Sci. USA 84, 4413-4417 описан природный вариант D550G. В работе Carlson et al. (1992) Proc. Nat. Acad. Sci. USA 89, 8225-8229 описан природный вариант D550A.
В WO 2011/051489 (РСТ/ЕР 2010/066572) описан целый ряд точечных мутаций у альбумина, которые модулируют связывание альбумина с FcRn, в WO 2010/092135 описан ряд точечных мутаций у альбумина, которые увеличивают количество тиолов, доступных для конъюгирования в альбумине, но в описании ничего не говорится о влиянии мутаций на связывание альбумина с FcRn. В WO 2011/103076 описаны варианты альбумина, которые содержат замены в домене III HSA.
Альбумин обладает способностью к связыванию ряда лигандов, при этом они становятся связанными (связываются) с альбумином. Это свойство было использовано для продления времени полужизни в плазме у лекарственных средств, обладающих способностью к нековалентному связыванию с альбумином. Это может осуществляться и путем связывания фармацевтически полезного соединения, почти или совсем не обладающего свойством связываться с альбумином, с молекулой, обладающей свойством связываться с альбумином. См. обзорную статью и приведенные в ней ссылки: Kratz (2008) Journal of Controlled Release 132, 171-183.
Альбумин используется при получении препаратов фармацевтически полезных соединений, причем такие препараты могут включать, без ограничения, наночастицы или микрочастицы альбумина. При этом доставка фармацевтически полезного соединения или смеси соединений может получить выгоду от изменения сродства альбумина к своему рецептору, если полезное соединение действительно связывается с альбумином как средством доставки.
Пока не ясно, чем определяется время полужизни в плазме у образующихся ассоциатов (таких, к примеру, как Levemir®, см. Kurtzhals P. et al., Biochem. J. 1995, 312: 725-731), конъюгатов или слитых полипептидов, но, по-видимому, это является результатом комбинации альбумина с выбранным фармацевтически полезным соединением или полипептидом. Желательно иметь возможность контролировать время полужизни в плазме у данных конъюгатов, ассоциатов альбумина или слитых полипептидов альбумина с тем, чтобы можно было увеличивать или уменьшать время полужизни в плазме по сравнению с таковым у компонентов ассоциации, конъюгирования или слияния, для того, чтобы иметь возможность разработать определенный препарат в соответствии с особенностями показаний, подлежащих лечению.
Известно, что альбумин накапливается и подвергается катаболизму в опухолях, а также накапливается в воспаленных суставах больных ревматоидным артритом. См. обзорную статью и приведенные в ней ссылки: Kratz (2008) Journal of Controlled Release 132, 171-183. Предполагается, что варианты HSA с повышенным сродством к FcRn окажутся выгодными для доставки полезных соединений.
Также было бы желательно иметь варианты альбумина, почти или совсем не обладающие способностью связываться с FcRn, чтобы обеспечить более короткое время полужизни или контролируемую фармакокинетику в сыворотке, как описано Kenanova et al. (2009) J. Nucl. Med. 50 (Suppl. 2): 1582).
У Kenanova et al. (2010, Protein Engineering, Design & Selection 23(10): 789-798; WO 2010/118169) описана модель стыковки, которая включает структурную модель домена III HSA (выполненную при рН 7-8) и структурную модель FcRn (выполненную при рН 6,4). У Kenanova et al. сказано, что позиции 464, 505, 510, 531 и 535 в домене III способны взаимодействовать с FcRn. Согласно Chaudhury et al. (2006), особый интерес представляют гистидины в положениях 464, 510 и 535, которые, согласно Kenanova (2010), обладают значительно меньшим сродством и меньшим временем полужизни у мышей. Однако работа Kenanova et al. ограничивается доменом III HSA и поэтому рассматривает HSA не в его естественной интактной конфигурации. Кроме того, выявленные позиции приводят к снижению сродства к рецептору FcRn.
В международной патентной заявке WO 2011/051489 (РСТ/ЕР 10/066572) описан первый класс вариантов альбумина с модулированным (например, повышенным или пониженным) сродством связывания с рецептором FcRn вследствие одной или нескольких точечных мутаций в последовательности альбумина. В международной патентной заявке WO 2011/124718 (РСТ/ЕР 2011/055577) описан второй класс вариантов альбумина с модулированным сродством связывания с рецептором FcRn, которые содержат домен III альбумина с одним или несколькими другими доменами альбумина и необязательно содержат одну или несколько точечных мутаций.
Представленные в настоящем изобретении варианты с модулированным сродством связывания с рецептором FcRn и, путем получения целого ряда молекул, позволяют адаптировать сродство связывания, (а тем самым) и время полужизни к различным требованиям. Такая подгонка может варьировать от большого увеличения сродства связывания с FcRn и/или времени полужизни до небольшого увеличения сродства связывания с FcRn и/или времени полужизни, от небольшого уменьшения сродства связывания с FcRn и/или времени полужизни до большого уменьшения сродства связывания с FcRn и/или времени полужизни. Таким образом, молекулы альбумина можно использовать для подгонки сродства связывания с FcRn и/или времени полужизни слитых полипептидов, конъюгатов, ассоциатов, наночастиц и композиций, содержащих молекулы альбумина.
Сущность изобретения
Изобретением предусмотрен способ идентификации и/или проектирования вариантов альбумина, обладающих лучшими свойствами по сравнению с исходным альбумином. В WO 2011/051489 (РСТ/ЕР 2010/066572) описан ряд точечных мутаций у альбумина, модулирующих связывание альбумина с FcRn. Эти точечные мутации использовали для разработки модели стыковки, включающей HSA и FcRn. Модель стыковки использовали для идентификации тех участков альбумина, которые взаимодействуют с FcRn при связывании, а тем самым и тех мутаций, которые будут изменять сродство связывания между альбумином и FcRn по отношению к сродству связывания между HSA дикого типа и FcRn.
Изобретением предусмотрены варианты альбумина с улучшенными свойствами по сравнению с исходным или контрольным альбумином. В частности, изобретением предусмотрены варианты альбумина с измененным сродством связывания с FcRn и/или измененным временем полужизни в плазме по сравнению с исходным или контрольным альбумином.
Таким образом, изобретение касается выделенных вариантов альбумина либо их фрагментов или слитых полипептидов, содержащих варианты альбумина или их фрагменты, из исходного или контрольного альбумина, содержащего изменения по одному или нескольким положениям, соответствующим тем положениям в альбумине, которые эквивалентны положениям в SEQ ID NO: 2, выбранным из: (а) 492-538; (b) 505, 531, 524, 472, 108, 190, 197 и 425; (с) 186-201; (d) 457-472; (e) 414-426; (f) 104-120; (g) 75-91; (h) 144-150; (i) 30-41, (j) 550-585 и (k) 276, 410 и 414, на одно или несколько из числа А, С, D, E, F, G, H, I, К, L, M, N, P, Q, R, S, Т, V, W, Y и/или стоп-кодон в положении от 497 до 585;
при этом предпочтительно, если полипептид содержит одно или несколько изменений, выбранных из (i) группы, состоящей из позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, и/или (ii) группы, состоящей из позиций 34, 38,40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены одной или нескольких из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены одной или нескольких из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), и/или (iii) группы, состоящей из позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е); то полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, вставленный или замещенный в положении, выбранном из позиций 497-585.
Изобретение также включает введение стоп-кодона в положение от остатка 497 до 585, т.е. в любое из позиций 497, 498, 499, 500, 501, 502, 503, 504, 505, 506, 507, 508, 509, 510, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 535, 536, 537, 538, 539, 540, 541, 542, 543, 544, 545, 546, 547, 548, 549, 550, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 566, 567, 568, 569, 570, 571, 572, 573, 574, 575, 576, 577, 578, 579, 580, 581, 582, 583, 584, 585 (или эквивалентных позиций относительно SEQ ID NO: 2). Введение стоп-кодона может осуществляться вместо или вместе с одним или несколькими из приведенных здесь изменений.
Изобретением предусмотрены варианты альбумина либо их фрагменты с измененным сродством связывания с FcRn по сравнению с исходным или контрольным альбумином, которые содержат изменения (как-то замены, делеции или вставки) по:
(a) одному или нескольким положениям, соответствующим позициям в SEQ ID No: 2 из числа позиций 30, 31, 32, 33, 35, 36, 37, 39, 41, 77, 78,79, 81, 84, 85, 87, 88, 89, 105, 106, 107, 108, 109, 110, 111, 112, 117, 118, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197; и/или
(b) одному или нескольким положениям, соответствующим позициям в SEQ ID No: 2 из числа позиций 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 276; и/или
(c) одному или нескольким положениям, соответствующим позициям в SEQ ID No: 2 из числа позиций 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 462, 463, 465, 466, 467, 468, 469, 470, 472, 497, 498, 502, 507, 508, 509, 511, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 534, 551, 552, 553, 554, 555, 556, 557, 561, 566, 568, 569, 570, 571, 572, 576, 583;
причем измененное сродство связывания у варианта или его фрагмента будет относительно сродства связывания у контрольного альбумина, типа исходного альбумина или его фрагмента, не содержащего изменений.
Положения, приведенные в (а) (выше), могут находиться в первом домене (например, домене I) полипептида типа альбумина, например, HSA. Положения, приведенные в (b) (выше), могут находиться во втором домене (например, домене II) полипептида типа альбумина, например, HSA. Положения, приведенные в (с) (выше), могут находиться в третьем домене (например, домене III) полипептида типа альбумина, например, HSA.
Вариант альбумина или его фрагмент может дополнительно включать изменения (например, замены или вставки) по одному или нескольким положениям, соответствующим следующим позициям в SEQ ID No: 2:
(i) из числа позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582, 584,
(ii) из числа позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены по одной или нескольким из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены по одной или нескольким из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), и/или
(iii) из числа позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е).
Предпочтительно исходный альбумин и/или вариант альбумина содержит или состоит из:
(a) полипептида, по меньшей мере на 60% идентичного по последовательности зрелому полипептиду по SEQ ID NO: 2;
(b) полипептида, кодируемого таким полинуклеотидом, который гибридизуется в условиях низкой жесткости с (i) кодирующей последовательностью зрелого полипептида по SEQ ID NO: 1 или (ii) полноразмерной последовательностью, комплементарной к (i);
с) полипептида, кодируемого таким полинуклеотидом, который по меньшей мере на 60% идентичен кодирующей последовательности зрелого полипептида по SEQ ID NO: 1; и/или
(d) фрагмента зрелого полипептида по SEQ ID NO: 2.
Изменения по одному или нескольким положениям могут быть независимо выбраны из замен, вставок и делеций, причем предпочтительны замены.
Изобретение также касается выделенных полинуклеотидов, кодирующих варианты; конструкций из нуклеиновых кислот, векторов и клеток-хозяев, содержащих полинуклеотиды; и способов получения этих вариантов.
Изобретение также касается конъюгатов или ассоциатов, содержащих варианты альбумина или их фрагменты по изобретению и полезные терапевтические молекулы, или слитых полипептидов, содержащих варианты альбумина или их фрагменты по изобретению и полипептиды-партнеры по слиянию.
Изобретение также касается композиций, содержащих варианты альбумина, их фрагменты, слитые полипептиды, содержащие варианты альбумина или их фрагменты, либо конъюгаты, содержащие варианты альбумина или их фрагменты по изобретению, либо ассоциаты, содержащие варианты альбумина или их фрагменты по изобретению. Композиции предпочтительно являются фармацевтическими композициями.
Изобретение также касается фармацевтических композиций, содержащих варианты альбумина, их фрагменты, слитые полипептиды, содержащие варианты альбумина или их фрагменты, либо конъюгаты, содержащие варианты альбумина или их фрагменты, либо ассоциаты, содержащие варианты альбумина или их фрагменты, причем данные варианты альбумина, их фрагменты, слитые полипептиды, содержащие варианты альбумина или их фрагменты, либо конъюгаты, содержащие варианты альбумина или их фрагменты, либо ассоциаты вариантов альбумина или их фрагментов обладают измененным сродством связывания с FcRn и/или измененным временем полужизни в плазме по сравнению с соответствующим сродством связывания и/или временем полужизни в плазме у HSA или его фрагмента, слитого полипептида, содержащего HSA или его фрагмент, либо конъюгатов или ассоциатов HSA или его фрагмента, содержащих HSA или его фрагмент.
Краткое описание фигур
Фиг.1. Множественное выравнивание аминокислотных последовательностей (i) полноразмерного зрелого HSA (Hu_1_2_3), (ii) варианта альбумина, содержащего домен I и домен III HSA (Hu_1_3), (iii) варианта альбумина, содержащего домен II и домен III HSA (Hu_2_3), (iv) полноразмерного альбумина Macaca mulatta (Mac_mul), (v) полноразмерного альбумина Rattus norvegicus (Rat) и (vi) полноразмерного альбумина Mus musculus (Mouse). Стрелками указаны позиции 500, 550 и 573 (относительно полноразмерного HSA). На фиг.4 домены I, II и III приводятся как 1, 2 и 3 (соответственно).
Фиг.2. Множественное выравнивание аминокислотных последовательностей зрелого альбумина от человека, овцы, мыши, кролика и козы и незрелых альбуминов от шимпанзе ("Chimp"), макаки, хомяка, морской свинки, крысы, коровы, лошади, осла, собаки, курицы и свиньи. Указаны начальные и концевые аминокислоты доменов 1, 2 и 3 (как это определено Dockal et al. (Journal of Biological Chemistry, 1999, Vol. 274(41): 29303-29310)) относительно зрелого альбумина человека.
Фиг.3. Консервативные группы аминокислот на основании их свойств.
Фиг.4. Доменная архитектура HSA и свойства связывания с shFcRn у гибридных молекул HSA. (А) Общая структура shFcRn, показывающая расположение рН-зависимой гибкой петли (оранжевая полоска непосредственно под меткой 'His 166') и His-166 относительно IgG-связывающего сайта (красные остатки в виде шариков и палочек (остатки типа шариков на палочках ниже метки 'α2' и слева от меток 'Glu115', 'Glu116' и 'IgG') (23). (В) Кристаллическая структура полноразмерного HSA состоит из трех α-спиральных доменов: DI (розовый), DII (оранжевый) и DIII (голубой/синий) (19). DIII разделен на субдомены DIIIa (голубой) и DIIIb (синий). (С) Доменная организация сконструированных гибридных молекул HSA (DI-DII, DI-DIII, DII-DIII, DIII; домены закрашены по той же схеме, что и на фиг.4А и 4В). (D) Миграция в геле SDS-PAGE вариантов доменов HSA. (E) SPR-сенсограммы HSA дикого типа и комбинаций доменов, которые пропускали над иммобилизованным shFcRn при рН 6,0. (F) Данные ELISA, показывающие рН-зависимое связывание HSA дикого типа, DIIIa HSA и HSA Bartin с shFcRn при рН 7,4 и рН 6,0.
Фиг.5. Структурные последствия HSA Casebrook на связывание с shFcRn. (А) Сеть взаимодействий вокруг Asp-494 в HSA крупным планом. Asp-494 располагается в петле, соединяющей субдомены DIIIa (голубой) и DIIIb (синий). Asp-494 образует ионное взаимодействие с Arg-472 и водородную связь с Gln417, которые оба локализованы в субдомене DIIIa. Asp-494 также образует водородную связь с Thr-496, тем самым стабилизируя петлю, соединяющую DIIIa и DIIIb. (В) Миграция в геле SDS-PAGE мутантов D494N, D494A, D494Q, E495Q, Е495А, Т496А и D494N/T496A. SPR-сенсограммы, показывающие связывание shFcRn с HSA дикого типа и (С) с полученными рекомбинантным способом мутантами Casebrook (D494N), D494A и D494Q. (D) E495Q и Е495А и (Е) Т496А и D494N/T496A при рН 6,0. (F) SPR-сенсограммы связывания shFcRn с HSA дикого типа и Casebrook, выделенным из гетерозиготного пациента. (G) Конкурентное связывание HSA дикого типа и Casebrook с shFcRn при рН 6,0. Рецептор в присутствии оттитрованных количеств HSA дикого типа или Casebrook пропускали над иммобилизованным HSA. (H) SPR-сенсограммы, показывающие связывание shFcRn с HSA дикого типа и Q417A при рН 6,0.
Фиг.6. Консервативные гистидины являются существенными для связывания с shFcRn. (А) Расположение отдельных остатков в DIII HSA. Остатки в петле, соединяющей субдомены DIIIa и DIIIb, отобранные для мутагенеза (Asp-494, Glu-495, Lys-500 и Glu-501), а также дополнительные остатки, расположенные возле соединительной петли, при этом консервативные гистидины (His-464, His-510 и His-536) и Lys-536 и Pro-537 представлены в виде шариков и палочек (бордовые). Неконсервативный His-440 располагается дистально. Последняя С-концевая α-спираль выделена желтым (помечена как 'С-концевая α-спираль'). SPR-сенсограммы связывания shFcRn с HSA дикого типа и (В) Р499А, К500А и Е501А, и (С) H440Q, H464Q, H510Q и H535Q, а также (С) К536А, Р537А и К538А при кислом рН (6,0).
Фиг.7. His-166 стабилизирует гибкую петлю рН-зависимым образом. Область петли НС FcRn при различных значениях рН крупным планом. (А) При низком рН (4,2), положительно заряженный His-166 формирует стабилизированную зарядом водородную связь с Glu-54 и Tyr-60 в пределах выходящей на поверхность петли в shFcRn (23). (В) При высоком рН (8,2) ослабляется взаимодействие незаряженного His-166 с Glu-54 и Tyr-60, а петля между остатками Trp-51 и Tyr-60 становится гибкой и структурно разупорядоченной (представлено пунктирной линией) (8). (С) Связывание shFcRn дикого типа и мутантов (E54Q, Q56A и Н166А) с оттитрованным количеством HSA, фиксированного в лунках ELISA при рН 6,0.
Фиг.8. Предложенная модель стыковки shFcRn-HSA.
(A) Схема стыковки молекул в двух ориентациях, на которой показаны НС FcRn (зеленый, помечен как 'FcRnα1', 'FcRnα2' и 'FcRnα3'), β2m (серый) и три α-спиральные домены HSA: DI (розовый), DII (оранжевый) и DIII (голубой/синий). DIII делится на субдомены DIIIa (голубой) и DIIIb (синий).
(B) Поверхность раздела при взаимодействии между shFcRn (зеленый контур) и HSA (синяя поверхность на пространственной диаграмме, темно-серая по серой шкале) на модели стыковки крупным планом. С-терминальный конец HSA (темно-синий, темно-серый по серой шкале) и петля, соответствующая остаткам 490-510 между субдоменами DIIIa и DIIIb, образуют щель на поверхности HSA, в которую может входить рН-зависимая и гибкая петля из shFcRn (остатки 51-59). His-166 shFcRn может образовывать сильные, стабилизированные зарядами взаимодействия с остатками Glu-54 и Glu-505 из HSA. К тому же Glu-505 из HSA может взаимодействовать с Arg-162 из shFcRn. Могут образовываться солевые мостики между Lys-150 и Glu-151 из shFcRn и Glu-501 и Lys-500 из HSA. На поверхности HSA образуется щель между петлей, соединяющей DIIIa и DIIIb, и α-спиралью, охватывающей остатки 520-535. При низком рН His-161 из shFcRn может взаимодействовать с Glu-531 из HSA, и комплекс может быть усилен солевым мостиком между Glu-168 из shFcRn и Lys-524 из HSA.
(C) Поверхность раздела при взаимодействии между shFcRn (зеленая поверхность на пространственной диаграмме в левом нижнем углу) и HSA (розовый, синий и голубой контуры на ленточной диаграмме) на модели стыковки. Петля β-шпильки из shFcRn вклинивается между доменами DI (розовый, включая метки 'Lys190', 'Asp108' и 'Arg197') и DIIIa (голубой, включая метки 'Glu425' и 'His464') из HSA. Asp110 из shFcRn может быть партнером для Lys190 или Arg197 из HSA после некоторых структурных перестроек в этой интерфазе. Консервативный His464 располагается в α-спирали DIIIa, контактирующей с петлей β-шпильки.
Фиг.9. Представление модели стыковки shFcRn-HSA. (A-B) Представлены две ориентации комплекса. Альбумин представлен пространственной диаграммой, а FcRn - в виде ленточной диаграммы. Основная часть интерфазы связывания HSA выделена розовым (по серой шкале - в виде самого темного, почти черного участка, DI (CBI)), тогда как зона, расположенная дистально от интерфазы, представлена как DII (оранжевая), а DIII разделен на субдомены DIIIa (голубой) и DIIIb (синий).
Фиг.10. Связывание shFcRn-GST с серией мутаций HSA Casebrook (100-0,045 мкг/мл) при рН 6,0 и рН 7,4. Значения ELISA представляют среднее из двух повторов.
Фиг.11. Связывание варианта HSA Casebrook, выделенного из гетерозиготного индивида, и HSA дикого типа (200-1,625 мкг/мл) с shFcRn-GST при рН 6,0.
Фиг.12. Спектры CD HSA дикого типа и вариантов Casebrook при рН 6,0. Исследовали по 5 мкМ каждого варианта, а представленные спектры представляют среднее из 5 запусков.
Фиг.13. Анализ методом восстановительного SDS-PAGE гистидиновых вариантов HSA. Дорожка 1, SeeBlue® Plus2 (6 мкл) и по 1 мкг на дорожку (2) H440Q, (3) H464Q, (4) H510Q и (5) H535Q.
Фиг.14. Связывание усеченных вариантов HSA дикого типа и варианта HSA 568stop (усеченный вариант, у которого отсутствуют последние 17 аминокислот). Связывание усеченного по С-концу варианта HSA с shFcRn. По 10 мкМ каждого пропускали над иммобилизованным shFcRn (2000 RU) при рН 6,0.
Фиг.15. Связывание shFcRn-GST с HSA дикого типа и HSA E168A (200-0,045 мкг/мл) при рН 6,0 и рН 7,4. Значения ELISA представляют среднее из двух повторов.
Фиг.16. Предложенная модель стыковки shFcRn-HSA, показывающая, в двух ориентациях, одновременное связывание двух лигандов (IgG и HSA) с FcRn.
Фиг.17. Сравнение связанного с жирными кислотами и свободного HSA не показывает никаких существенных перестроек внутри субдомена DIII HSA при связывании, но значительный сдвиг ориентации DI HSA относительно DIII HSA. Myr: миристат; β2m: β2-микроглобулин.
Фиг.18. Выборка альфа-углеродов из файла PDB по HSA (SEQ ID No. 2) из модели стыковки HSA и FcRn, описанной в примере 1.
Фиг.19. Выборка альфа-углеродов из файла PDB по FcRn (SEQ ID No. FcRn) из модели стыковки HSA и FcRn, описанной в примере 1.
Фиг.20. Связывание укороченных по С-концу вариантов HSA с shFcRn. По 10 мкМ каждого варианта пропускали над иммобилизованным shFcRn-GST (2000 RU) при рН 6,0.
Фиг.21. Конкурентное связывание укороченных по С-концу вариантов HSA. Конкурентное связывание оценивали путем пропускания shFcRn-GST (100 нМ), одного или вместе с серийными разведениями вариантов HSA, над иммобилизованным HSA (~2200 RU) при рН 6,0.
Фиг.22. Точечные мутации в С-концевой части HSA модулируют связывание с shFcRn. По 10 мкМ HSA дикого типа и (A) HSA Q580A, (В) HSA K574A и (С) HSA K573P/Q580A пропускали над иммобилизованным shFcRn-GST (~2000 RU) при рН 6,0.
Фиг.23. Связывание с shFcRn HSA дикого типа, HSA K573P и HSA N111Q/K573P при рН 5,5. Образцы пропускали над иммобилизованным shFcRn-HIS (~1500-2500 RU) при рН 5,5.
Фиг.24. Предложенная модель стыковки shFcRn-HSA, показывающая пространственные взаимоотношения между shFcRn (пространственная диаграмма) и DI, DII и DIII HSA (ленточная диаграмма), включая петли HSA, содержащие позиции 78-88 и 108-112.
Раскрытие сущности изобретения
Изобретение касается выделенных вариантов альбумина либо их фрагментов или слитых полипептидов, содержащих варианты альбумина или их фрагменты, из исходного или контрольного альбумина, содержащих изменения в одном или нескольких положениях, которые влияют и/или участвуют во взаимодействии между альбумином и FcRn, предпочтительно изменения в одном или нескольких положениях, соответствующих позициям 30-41, 75-91, 104-120, 144-150, 186-201, 414-426, 457-472, 492-538, 550-585, 276, 410 и/или 411 зрелого полипептида по SEQ ID NO: 2, при этом предпочтительно, если вариант, его фрагмент или слитый белок содержит одну или несколько замен в положениях, выбранных из (i) группы, состоящей из позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, и/или (ii) группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены по одной или нескольким из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, остатка не Cys) на Cys и/или делеции или замены по одной или нескольким из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), то вариант, его фрагмент или слитый белок также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585.
Предпочтительными изменениями являются те, что производятся в положениях, эквивалентных позициям 534, 505, 111, 527, 510 и/или 108 (согласно SEQ ID No: 2). Более предпочтительны замены K534V, E505Q, N111D, T527M, H510D и D108A или такие же замены в положениях, эквивалентных им. Также предпочтительны замены K534I, K534L, D108E и N111E или такие же замены в положениях, эквивалентных им, так как они представляют очень консервативные замены для K534V, D108A и N111D. Предпочтительными являются изменения в положениях, эквивалентных петле, включающей позиции 105-120 (согласно SEQ ID No: 2), более предпочтительно в положениях, эквивалентных позициям 106-115, и еще более предпочтительно в положениях, эквивалентных позициям 108, 109, 110, 111 и 112. Специалисты смогут идентифицировать позиции, эквивалентные позициям SEQ ID No: 2, как описано здесь.
Изобретением предусмотрены варианты альбумина или их фрагменты с измененным сродством связывания с FcRn по сравнению с исходным или контрольным альбумином, которые содержат изменения (как-то замены, делеции или вставки) в:
(a) одному или нескольким положениям, соответствующим позициям в SEQ ID No: 2 из числа позиций 30, 31, 32, 33, 35, 36, 37, 39, 41, 77, 78, 79, 81, 84, 85, 87, 88, 89, 105, 106, 107, 108, 109, 110, 111, 112, 117, 118, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197; и/или
(b) одному или нескольким положениям, соответствующим позициям в SEQ ID No: 2 из числа позиций 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 276; и/или
(c) одному или нескольким положениям, соответствующим позициям в SEQ ID No: 2 из числа позиций 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 462, 463, 465, 466, 467, 468, 469, 470, 472, 497, 498, 502, 507, 508, 509, 511, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 534, 551, 552, 553, 554, 555, 556, 557, 561, 566, 568, 569, 570, 571, 572, 576, 583;
причем измененное сродство связывания у варианта или его фрагмента будет относительно сродства связывания у контрольного типа исходного альбумина или его фрагмента, не содержащего изменений.
Положения, приведенные в (а) (выше), могут находиться в первом домене (например, домене I) полипептида типа альбумина, например, HSA. Положения, приведенные в (b) (выше), могут находиться во втором домене (например, домене II) полипептида типа альбумина, например, HSA. Положения, приведенные в (с) (выше), могут находиться в третьем домене (например, домене III) полипептида типа альбумина, например, HSA.
Вариант альбумина или его фрагмент может дополнительно включать изменения (как-то замены или вставки) по одному или нескольким положениям, соответствующим следующим позициям в SEQ ID No: 2:
(i) из числа позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582, 584,
(ii) из числа позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены по одной или нескольким из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены по одной или нескольким из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), и/или
(iii) из числа позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е).
Предпочтительно исходный альбумин и/или вариант альбумина содержит или состоит из:
(a) полипептида, по меньшей мере на 60% идентичного по последовательности зрелому полипептиду по SEQ ID NO: 2;
(b) полипептида, кодируемого таким полинуклеотидом, который гибридизуется в условиях низкой жесткости с (i) кодирующей последовательностью зрелого полипептида по SEQ ID NO: 1 или (ii) полноразмерной последовательностью, комплементарной к (i);
с) полипептида, кодируемого таким полинуклеотидом, который по меньшей мере на 60% идентичен кодирующей последовательности зрелого полипептида по SEQ ID NO: 1; и/или
(d) фрагмента зрелого полипептида по SEQ ID NO: 2.
Изменения по одному или нескольким положениям могут быть независимо выбраны из замен, вставок и делеций, причем предпочтительны замены.
Изобретение также включает введение стоп-кодона в положение от остатка 497 до 585 (или эквивалентное положение согласно SEQ ID NO: 2) либо от остатка 497 (или эквивалентного положения согласно SEQ ID NO: 2) до последнего остатка последовательности зрелого альбумина. Введение стоп-кодона может осуществляться вместо или вместе с одним или несколькими из приведенных здесь изменений.
Изобретение также позволяет адаптировать сродство связывания (а тем самым и период полужизни) молекулы альбумина с рецептором FcRn к требованиям конкретного клиента или применения. Такая подгонка может варьировать от сильного увеличения времени полужизни до небольшого увеличения времени полужизни, от небольшого уменьшения времени полужизни до сильного уменьшения времени полужизни. Таким образом, молекулы альбумина можно использовать для подгонки времени полужизни слитых полипептидов, конъюгатов, ассоциатов, наночастиц и композиций, содержащих молекулы альбумина. Изобретение особенно подходит для фармацевтических препаратов. Некоторые фармацевтические препараты получают преимущество от увеличения времени полужизни, например, для увеличения интервала между дозами. Некоторые фармацевтические препараты получают преимущество от сокращения времени полужизни, например, для ускорения выведения из организма пациента. Таким образом, применение молекул альбумина по изобретению в фармацевтических препаратах позволяет адаптировать время полужизни препарата по желанию.
Определения
Вариант. Термин "вариант" означает полипептид, полученный из исходного альбумина посредством одного или нескольких изменений, т.е. замен, вставок и/или делеций, по одному или нескольким положениям. Замена означает замену аминокислоты, занимающей положение, на другую аминокислоту; делеция означает удаление аминокислоты, занимающей положение; а вставка означает добавление 1 или нескольких, например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, предпочтительно 1-3 аминокислот, непосредственно примыкающих к аминокислоте, занимающей позицию. В отношении замен 'в непосредственной близости' может означать с N-стороны (выше) или С-стороны ('ниже) от аминокислоты, занимающей позицию ('названной аминокислоты'). Таким образом, для аминокислоты, названной/пронумерованной 'X', вставка может быть в положении 'Х+1' ('выше') или в положении 'Х-1' ('ниже).
Мутант. Термин "мутант" означает полинуклеотид, кодирующий вариант.
Альбумин дикого типа. Термин альбумин "дикого типа" (WT) означает альбумин с такой же аминокислотной последовательностью, что встречается в природе у животных или человека.
FcRn и shFcRn. Термин "FcRn" означает неонатальный Fc-рецептор (FcRn) человека. shFcRn означает растворимую рекомбинантную форму FcRn. hFcRn означает гетеродимер из SEQ ID NO: 30 (укороченной тяжелой цепи Fc-рецептора главного комплекса гистосовместимости класса I (FCGRT)) и SEQ ID NO: 31 (β2-микроглобулина). SEQ ID NO: 30 и 31 вместе образуют hFcRn.
smFcRn. Термин "smFcRn" означает растворимую рекомбинантную форму неонатального Fc-рецептора мыши.
Выделенный вариант. Термин "выделенный вариант" означает такой вариант, который был модифицирован рукой человека и отделен полностью или частично от как минимум одного компонента, вместе с которым он встречается в природе. Вариант может быть очищен по меньшей мере на 1%, например, по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 40%, по меньшей мере на 60%, по меньшей мере на 80% или по меньшей мере на 90% при определении методом SDS-PAGE или GP-HPLC.
По существу чистый вариант. Термин "по существу чистый вариант" означает препарат, который содержит не более 10%, не более 8%, не более 6%, не более 5%, не более 4%, не более 3%, не более 2%, не более 1% или не более 0,5% масс. другого полипептидного материала, с которым он естественным образом или рекомбинантно связан. Предпочтительно вариант очищен по меньшей мере на 92%, например, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% масс. от всего полипептидного материала, присутствующего в препарате. Варианты по изобретению предпочтительно присутствуют по существу в чистом виде. Это может осуществляться, к примеру, путем получения варианта хорошо известными рекомбинантными методами и методами очистки.
Зрелый полипептид. Термин "зрелый полипептид" означает полипептид в его окончательном виде после трансляции и любых пост-трансляционных модификаций, таких как N-терминальный процессинг, С-терминальное укорочение, гликозилирование, фосфорилирование и т.д. Зрелый полипептид могут составлять аминокислоты 1-585 по SEQ ID NO: 2, с включением любых пост-трансляционных модификаций.
Последовательность, кодирующая зрелый полипептид. Термин "последовательность, кодирующая зрелый полипептид", означает полинуклеотид, который кодирует зрелый полипептид альбумина. Последовательность, кодирующую зрелый полипептид, могут составлять нуклеотиды 1-1758 по SEQ ID NO: 1.
Идентичность последовательности. Родственность между двумя аминокислотными последовательностями или между двумя нуклеотидными последовательностями описывается параметром "идентичность последовательности".
Для целей изобретения степень идентичности последовательности между двумя аминокислотными последовательностями определяется по алгоритму Needleman-Wunsch (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), который реализован в программе Needle из пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версии 3.0.0 или более поздней. Обычно используются такие параметры: штраф за открытие пробела = 10, штраф за расширение пробела = 0,5 и матрица замен EBLOSUM62 (версия EMBOSS матрицы BLOSUM62). В качестве степени идентичности используется результат программы Needle, который обозначается как "longest identity" (он получается при использовании опции - nobrief) и рассчитывается следующим образом:
(идентичные остатки × 100)/(длина выравнивания - общее количество пробелов при выравнивании).
Для целей изобретения степень идентичности последовательности между двумя последовательностями дезоксирибонуклеотидов определяется по алгоритму Needleman-Wunsch (Needleman and Wunsch, 1970, supra), который реализован в программе Needle из пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, supra), предпочтительно версии 3.0.0 или более поздней. Обычно используются такие параметры: штраф за открытие пробела = 10, штраф за расширение пробела = 0,5 и матрица замен EDNAFULL (версия EMBOSS матрицы NUC4.4 NCBI). В качестве степени идентичности используется результат программы Needle, который обозначается как "longest identity" (он получается при использовании опции - nobrief) и рассчитывается следующим образом:
(идентичные дезоксирибонуклеотиды × 100)/(длина выравнивания - общее количество пробелов при выравнивании).
Фрагмент. Термин "фрагмент" означает такой полипептид, у которого одна или несколько аминокислот из N- и/или С-конца альбумина и/или внутренней области альбумина подверглись делеции, но который сохранил способность связываться с FcRn. Фрагмент может состоять из одной непрерывной последовательности, происходящей из HSA, или же он может содержать одну или несколько последовательностей, происходящих из HSA. Фрагменты по изобретению имеют размер больше, чем примерно 20 аминокислотных остатков, предпочтительно более 30 аминокислотных остатков, более предпочтительно более 40 аминокислотных остатков, более предпочтительно более 50 аминокислотных остатков, более предпочтительно более 75 аминокислотных остатков, 100 аминокислотных остатков, более предпочтительно более 200 аминокислотных остатков, более предпочтительно более 300 аминокислотных остатков, еще более предпочтительно более 400 аминокислотных остатков и наиболее предпочтительно более 500 аминокислотных остатков. Фрагмент может содержать или состоять из одного или нескольких доменов альбумина, как-то DI+DII, DI+DIII, DII+DIII, DIII+DIII, DI+DIII+DIII, DIII+DIII+DIII, либо фрагментов таких доменов или комбинаций доменов.
Домены I, II и III можно определить по отношению к HSA (SEQ ID NO: 2). Например, домен I HSA может содержать или состоять из аминокислот 1-194 (± 1-15 аминокислот) по SEQ ID NO: 2, домен II HSA может содержать или состоять из аминокислот 192-387 (± 1-15 аминокислот) по SEQ ID NO: 2, а домен III может содержать или состоять из аминокислотных остатков 381-585 (± 1-15 аминокислот) по SEQ ID NO: 2. "± 1-15 аминокислот" означает, что номер остатка может отклоняться на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислот к С-концу и/или к N-концу от указанного положения аминокислоты. Примеры доменов I, II и III описаны в Dockal et al. (Journal of Biological Chemistry, 1999, Vol. 274(41): 29303-29310) и Kjeldsen et al. (Protein Expression and Purification, 1998, Vol 13: 163-169) и приведены в таблице ниже.
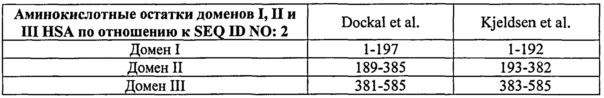
Специалист сможет определить домены I, II и III в альбуминах не человека по выравниванию аминокислотной последовательности с HSA, к примеру, по алгоритму Needleman-Wunsch (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), который реализован в программе Needle из пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версии 3.0.0 или более поздней. Обычно используются такие параметры: штраф за открытие пробела = 10, штраф за расширение пробела = 0,5 и матрица замен EBLOSUM62 (версия EMBOSS матрицы BLOSUM62). Другие программы включают MUSCLE (Multiple sequence comparison by log-expectation, Robert C. Edgar, version 3.6, http://www.drive5.com/muscle, см. Edgar (2004) Nucleic Acids Research 32(5), 1792-97; и Edgar (2004) BMC Bioinformatics, 5(1): 113), которую можно использовать с настройками по умолчанию, как описано в Руководстве пользователя (версия 3.6, сентябрь 2005 г. Также для любых аспектов изобретения можно использовать и более поздние версии MUSCLE, чем версия 3.6). Примеры выравниваний представлены на фиг.1 и 2.
Аллельный вариант. Термин "аллельный вариант" означает любую из двух альтернативных форм гена, занимающих один и тот же локус на хромосоме. Аллельные изменения возникают естественным образом в результате мутаций и могут приводить к полиморфизму в популяциях. Генные мутации могут быть молчащими (нет изменений у кодируемого полипептида) или могут кодировать полипептиды, имеющие изменения в аминокислотных последовательностях. Аллельный вариант полипептида - это полипептид, кодируемый аллельным вариантом гена.
Кодирующая последовательность. Термин "кодирующая последовательность" означает такой полинуклеотид, который непосредственно определяет аминокислотную последовательность своего транслируемого полипептидного продукта. Как правило, границы кодирующей последовательности определяются открытой рамкой считывания, которая обычно начинается со стартового кодона ATG или альтернативных стартовых кодонов, таких как GTG и TTG, и заканчивается стоп-кодоном, таким как ТАА, TAG или TGA. Кодирующая последовательность может представлять собой ДНК, кДНК, синтетический или рекомбинантный полинуклеотид.
кДНК. Термин "кДНК" означает такую молекулу ДНК, которая может быть получена при обратной транскрипции из зрелой, подвергшейся сплайсингу молекулы мРНК, полученной из эукариотической клетки. У кДНК отсутствуют последовательности интронов, которые могут присутствовать в соответствующей геномной ДНК. Исходный, первичный РНК-транскрипт является предшественником той мРНК, которая подвергается обработке через ряд стадий, включая сплайсинг, после чего появляется в виде зрелой, подвергшейся сплайсингу мРНК.
Нуклеиново-кислотная конструкция. Термин "нуклеиново-кислотная конструкция" означает молекулу нуклеиновой кислоты, одно- или двухцепочечной, которая выделена из природного гена или модифицирована так, чтобы она содержала сегменты нуклеиновых кислот таким образом, который не существует в природе, или же она является синтетической. Термин нуклеино-кислотная конструкция является синонимом термина "экспрессионная кассета", если нуклеиново-кислотная конструкция содержит контрольные последовательности, необходимые для экспрессии кодирующей последовательности по изобретению.
Контрольные последовательности. Термин "контрольные последовательности" означает все компоненты, необходимые для экспрессии полинуклеотида, кодирующего вариант по изобретению. Каждая контрольная последовательность может быть своей или чужеродной для полинуклеотида, кодирующего вариант, или же своей или чужеродной друг для друга. Такие контрольные последовательности включают, без ограничения, лидерную последовательность, последовательность полиаденилирования, пропептидную последовательность, промотор, последовательность сигнального пептида и терминатор транскрипции. Как минимум, контрольная последовательность включает промотор и сигналы прекращения транскрипции и трансляции. Контрольные последовательности могут быть снабжены линкерами с целью введения специфических сайтов рестрикции, облегчающих лигирование контрольной последовательности в кодирующую область полинуклеотида, кодирующего вариант.
Функционально связанные. Термин "функционально связанные" означает такую конфигурацию, в которой контрольная последовательность располагается в надлежащем положении по отношению к кодирующей последовательности полинуклеотида таким образом, чтобы контрольная последовательность управляла экспрессией кодирующей последовательности.
Экспрессия. Термин "экспрессия" включает любые стадии, участвующие в вырабатывании варианта, включая, без ограничения, транскрипцию, пост-транскрипционные модификации, трансляцию, пост-трансляционные модификации и секрецию.
Экспрессирующий вектор. Термин "экспрессирующий вектор" означает линейную или кольцевую молекулу ДНК, содержащую полинуклеотид, кодирующий вариант и функционально связанный с другими нуклеотидами, способствующими его экспрессии.
Клетки-хозяева. Термин "клетки-хозяева" означает клетки любого типа, которые подвержены трансформации, трансфекции, трансдукции и т.п. с помощью нуклеиново-кислотной конструкции или экспрессирующего вектора, содержащего полинуклеотид по изобретению. Термин "клетки-хозяева" охватывает такое потомство родительской клетки, которое не совпадает с исходными клетками вследствие мутаций, происходящих во время репликации.
Время полужизни в плазме. Время полужизни в плазме в принципе определяется in vivo у подходящих индивидов. Однако, поскольку это требует времени и недешево и неизбежно возникают этические проблемы, связанные с проведением экспериментов на животных или человеке, то желательно использовать анализ in vitro для определения того, увеличивается или уменьшается время полужизни в плазме. Известно, что для времени полужизни в плазме важно связывание альбумина со своим рецептором FcRn, причем корреляция между связыванием рецептора и временем полужизни в плазме такова, что повышение сродства альбумина к своему рецептору ведет к увеличению времени полужизни в плазме. Таким образом, для изобретения повышение сродства альбумина к FcRn свидетельствует об увеличении времени полужизни в плазме, и снижение сродства альбумина к своему рецептору свидетельствует об уменьшении времени полужизни в плазме.
В настоящей заявке и формуле изобретения связывание альбумина со своим рецептором FcRn описывается с помощью термина "сродство" и выражений "сильнее" или "слабее". Таким образом, следует иметь в виду, что молекула, имеющая большее сродство к FcRn, чем HSA, связывается с FcRn сильнее, чем HSA, а молекула с меньшим сродством к FcRn, чем HSA, связывается с FcRn слабее, чем HSA.
Термины "увеличение времени полужизни в плазме" или "уменьшение времени полужизни в плазме" и аналогичные им выражения следует понимать по отношению к соответствующей исходной или контрольной или соответствующей молекуле альбумина. Так, увеличение времени полужизни в плазме по отношению к варианту альбумина по изобретению означает то, что у варианта время полужизни в плазме больше, чем у соответствующего альбумина с такими же последовательностями, за исключением описанных здесь изменений, например, по одному или нескольким положениям, соответствующим 30-41, 75-91, 104-120, 144-150, 186-201, 414-426, 457-472, 492-538, 550-585, 276, 410 и/или 411 зрелого полипептида по SEQ ID NO: 2, при этом предпочтительно, если вариант, его фрагмент или слитый полипептид содержит одно или несколько изменений, выбранных из (i) группы, состоящей из позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, (ii) группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены одной или нескольких из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены одной или нескольких из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), или (iii) группы, состоящей из позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е); то полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, вставленный или замененный в положении, выбранном из позиций 497-585, либо от остатка 497 (или эквивалентного положения относительно SEQ ID NO: 2) до последнего остатка в последовательности зрелого альбумина. Введение стоп-мутации может происходить вместо или вместе с одним или несколькими из приведенных здесь изменений.
Контрольный. Контрольным является тот альбумин, слитый белок, конъюгат, композиция, ассоциат или наночастица, с которым сравнивается вариант, слитый белок, конъюгат, композиция, ассоциат или наночастица альбумина. Контроль может содержать или состоять из полноразмерного альбумина (как-то HSA или его природного аллеля) или его фрагмента. Контроль также может обозначаться как 'соответствующий' альбумин, слитый белок, конъюгат, композиция, ассоциат или наночастица, которому соответствует вариант, слитый белок, конъюгат, композиция, ассоциат или наночастица альбумина. Контроль может содержать или состоять из HSA (SEQ ID NO: 2) или его фрагмента, слитого белка, конъюгата, ассоциата, наночастиц или микрочастиц. Предпочтительно контроль идентичен ("исследуемому") полипептиду, слитому белку, конъюгату, композиции, ассоциату, наночастицам или микрочастицам по изобретению, за исключением молекулы альбумина. Предпочтительно контрольная молекула альбумина содержит или состоит из альбумина (например, HSA, SEQ ID NO: 2) или его фрагмента. Аминокислотная последовательность контрольной молекулы альбумина может быть длиннее, короче или, предпочтительно, такой же (± 1-15 аминокислот) по длине, что и аминокислотная последовательность ("исследуемой") молекулы альбумина из полипептида, конъюгата, композиции, ассоциата, наночастиц или микрочастиц по изобретению.
Эквивалентные положения аминокислот. По всему описанию положения аминокислот определяются по отношению к полноразмерному зрелому сывороточному альбумину человека (т.е. без лидерной последовательности, SEQ ID NO: 2). Тем не менее, специалистам должно быть ясно, что изобретение также касается вариантов альбуминов не человека, (например, приведенных в настоящем описании) и/или фрагментов альбумина человека или не человека. Эквивалентные положения во фрагментах сывороточного альбумина человека, в альбуминах животных и их фрагментах, слитых белках и других производных или вариантов можно определить путем сравнения аминокислотных последовательностей при попарном (например, ClustalW) или множественном (например, MUSCLE) выравнивании. Например, из фиг.1 видно, что положения, эквивалентные позициям 500, 550 и 573 в полноразмерном сывороточном альбумине человека, легко идентифицируются в сывороточном альбумине человека и в альбуминах других видов. Позиции 500, 550 и 573 показаны стрелками. Другие подробности представлены ниже в таблице 1.
Таблица 1.
Пример идентификации эквивалентных позиций в HSA, альбуминах животных и во фрагментах альбумина
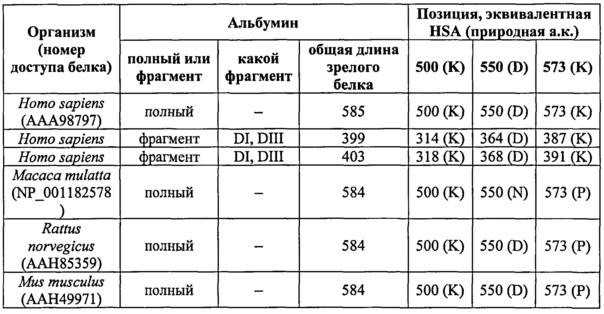
Фиг.1 была создана программой MUSCLE с использованием параметров по умолчанию, в том числе результаты в формате ClustalW 1.81. Первичные данные были подвергнуты затенению с помощью программы BoxShade 3.21 (http://www.ch.embnet.org/software/BOX_form.html) и параметров: формат данных: RTF_new; размер шрифта: 10; консенсусная линия: no consensus line; доля последовательностей (которая должна совпадать с затенением): 0,5; формат ввода последовательностей: ALN. Таким образом, по всему описанию положения аминокислот, определенные в сывороточном альбумине человека, также применимы к эквивалентным позициям во фрагментах, производных или вариантах и слитых белках сывороточного альбумина человека и животных из других видов и их фрагментах и слитых белках. Такие эквивалентные позиции могут иметь (i) различные номера остатков в природном белке и/или (ii) различные природные аминокислоты в природном белке.
Кроме того, из фиг.2 видно, что во фрагментах (например, доменах) альбумина можно определить эквивалентные положения относительно SEQ ID NO: 2 (HSA).
Правила обозначения вариантов
Для целей настоящего изобретения зрелый полипептид, приведенный в SEQ ID NO: 2, используется для определения соответствующих аминокислотных остатков в других альбуминах. Аминокислотная последовательность другого альбумина выравнивается со зрелым полипептидом, приведенным в SEQ ID NO: 2, и на основании их выравнивания определяются номера положений аминокислот, соответствующих любым аминокислотным остаткам в зрелом полипептиде, приведенном в SEQ ID NO: 2, по алгоритму Needleman-Wunsch (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), который реализован в программе Needle из пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версии 3.0.0 или более поздней.
Идентификацию соответствующего аминокислотного остатка в другом альбумине можно проверить выравниванием множественных полипептидных последовательностей с помощью "ClustalW" (Larkin et al., 2007, Bioinformatics 23: 2947-2948).
Когда другой полипептид (или белок) отклоняется от зрелого полипептида по SEQ ID NO: 2 так, что традиционное сравнение на основе последовательностей не способно выявить их взаимоотношения (Lindahl and Elofsson, 2000, J. Mol. Biol. 295: 613-615), то можно использовать другие попарные алгоритмы сравнения последовательностей. Большая чувствительность при поиске на основе последовательности достигается при использовании таких поисковых программ, в которых используются вероятностные представления семейств полипептидов (профили) для поиска в базах данных. Например, программа PSI-BLAST генерирует профили посредством итеративного процесса поиска в базах данных и способна обнаружить удаленные гомологи (Atschul et al., 1997, Nucleic Acids Res. 25: 3389-3402). Еще большая чувствительность может быть достигнута, если в семействе или подсемействе пептидов имеется один или несколько представителей в базах данных по структуре белков. В таких программах, как GenTHREADER (Jones, 1999, J. Mol. Biol. 287: 797-815; McGuffin and Jones, 2003, Bioinformatics 19: 874-881), используется информация из различных источников (PSI-BLAST, предсказание вторичной структуры, профили структурного выравнивания и потенциалы сольватации) в качестве исходных данных для нейронной сети, предсказывающей структурную укладку для введенной последовательности. Точно так же для выравнивания последовательностей с неизвестной структурой в рамках моделей суперсемейств, представленных в базе данных SCOP, можно использовать метод Gough et al., 2000, J. Mol. Biol. 313: 903-919. В свою очередь, эти выравнивания можно использовать для создания моделей гомологии для полипептида, а такие модели можно оценить на точность с помощью различных средств, разработанных для этой цели.
Для белков с известной структурой имеется несколько инструментов и ресурсов для поиска и создания структурных выравниваний. Например, суперсемейства белков SCOP были подвергнуты структурному выравниванию, и эти выравнивания доступны и их можно загрузить. Две или несколько белковых структур можно подвергнуть выравниванию с помощью различных алгоритмов, таких как матрица выравнивания по расстояниям (Holm and Sander, 1998, Proteins 33: 88-96) или комбинаторное наращивание (Shindyalov and Bourne, 1998, Protein Engineering 11: 739-747), причем реализация этих алгоритмов может дополнительно использоваться для поиска в структурных базах данных по представляющей интерес структуре с целью обнаружения возможных структурных гомологов (например, Holm and Park, 2000, Bioinformatics 16: 566-567).
При описании вариантов альбумина по изобретению применяется описанная ниже номенклатура, адаптированная для удобства пользования. Используются принятые IUPAC однобуквенные или трехбуквенные сокращения для аминокислот. Термин "точечная мутация" и/или "изменение" включает делеции, вставки и замены.
Замены. В отношении замены аминокислот применяется следующая номенклатура: исходная аминокислота, позиция, замещающая аминокислота. Соответственно, к примеру, замена треонина на аланин в положении 226 обозначается как "Thr226Ala" или "Т226А". Множественные мутации (или изменения) отделяются друг от друга знаком сложения ("+"), например, "Gly205Arg+Ser411Phe" или "G205R+S411F", представляющие замены в положениях 205 и 411 глицина (G) на аргинин (R) и серина (S) на фенилаланин (F), соответственно. На рисунках также используется ("/"), например, "E492T/N503D", что следует понимать как взаимозаменяемое со знаком ("+").
Делеции. В отношении делеции аминокислот применяется следующая номенклатура: исходная аминокислота, позиция*. Соответственно, делеция глицина в положении 195 обозначается как "Gly195*" или "G195*". Множественные делеции отделяются знаками сложения ("+"), например, "Gly195*+Ser411*" или "G195*+S411*".
Вставки. Как изложено выше, вставка может быть с N-стороны ('выше, 'Х-1') или С-стороны ('ниже, 'Х+1') от аминокислоты, занимающей положение ("данной или исходной аминокислоты", 'X').
В отношении вставки аминокислот с С-стороны ('ниже, 'Х+1') от исходной аминокислоты (X) применяется следующая номенклатура: исходная аминокислота, позиция, исходная аминокислота, вставленная аминокислота. Соответственно, вставка лизина после глицина в положении 195 обозначается как "Gly195GlyLys" или "G195GK". Вставка нескольких аминокислот обозначается так: исходная аминокислота, позиция, исходная аминокислота, вставленная аминокислота №1, вставленная аминокислота №2 и т.д. Например, вставка лизина и аланина после глицина в положении 195 обозначается как "Gly195GlyLysAla" или "G195GKA".
В таких случаях вставленные аминокислотные остатки нумеруются путем добавления строчных букв к номеру положения аминокислотного остатка перед вставленным аминокислотным остатком (остатками). Таким образом, в приведенном выше примере последовательность должна быть такой:

В отношении вставки аминокислот с N-стороны ('выше, 'Х-1') от исходной аминокислоты (X) применяется следующая номенклатура: исходная аминокислота, позиция, вставленная аминокислота, исходная аминокислота. Соответственно, вставка лизина (К) перед глицином (G) в положении 195 обозначается как "Gly195LysGly" или "G195KG". Вставка нескольких аминокислот обозначается так: исходная аминокислота, положение, вставленная аминокислота №1, вставленная аминокислота №2 и т.д., исходная аминокислота. Например, вставка лизина (К) и аланина (А) перед глицином в положении 195 обозначается как "Gly195LysAlaGly" или "G195KAG". В таких случаях вставленные аминокислотные остатки нумеруются добавлением строчных букв со штрихом к номеру положения аминокислотного остатка после вставленного аминокислотного остатка. Таким образом, в приведенном выше примере последовательность должна быть такой:

Множественные изменения. Варианты, содержащие несколько изменений, отделяются знаками сложения ("+"), например, "Arg170Tyr+Gly195Glu" или "R170Y+G195E", что означает замену аргинина и глицина на тирозин и глутаминовую кислоту в положениях 170 и 195, соответственно.
Различные замены. Там, где в одно положение могут вводиться различные замены, эти замены разделяются запятой, например, "Arg170Tyr,Glu" означает замену аргинина на тирозин или глутаминовую кислоту в положении 170. Таким образом, "Tyr167Gly,Ala+Arg170Gly,Ala" означает следующие варианты:
"Tyr167Gly+Arg170Gly", "Tyr167Gly+Arg170Ala", "Tyr167Ala+Arg170Gly" и "Tyr167Ala+Arg170Ala".
Исходный альбумин
Альбумин - это белок, который является самым распространенным белком в плазме крови у млекопитающих, а альбумины из большого числа млекопитающих были охарактеризованы биохимическими методами и/или информацией по последовательности. Некоторые альбумины, например, сывороточный альбумин человека (HSA), также были охарактеризованы кристаллографически и была определена их структура (HSA: He X.M., Carter D.C. (1992) "Atomic structure and chemistry of human serum albumin". Nature 358 (6383): 209-15; альбумин лошади: Но J.X. et al. (2001) "X-ray and primary structure of horse serum albumin (Equus caballus) at 0.27-nm resolution". Eur J Biochem. 215(1): 205-12).
Термин "исходный" или "исходный альбумин" означает такой альбумин, в котором производятся изменения рукой человека для получения вариантов альбумина по изобретению. Исходным может быть природный полипептид (дикого типа) или его аллель и даже его вариант.
Термин "альбумин" означает белок, имеющий такую же и/или очень близкую трехмерную структуру, что и HSA или домены HSA, и обладает близкими свойствами. Близкими трехмерными структурами являются, к примеру, структуры альбуминов из видов, указанных для исходного альбумина. Главными свойствами альбумина является его способность регулировать объем плазмы крови, так как он вносит до 85% осмотического эффекта нормальной плазмы, длительное время полужизни в плазме, примерно 19 дней ± 5 дней, связывание лигандов, например, связывание эндогенных молекул, таких как кислые, липофильные соединения, включая билирубин, жирные кислоты, гемин и тироксин (см. также таблицу 1 в работе Kragh-Hansen et al, 2002, Biol. Pharm. Bull. 25, 695, включенной сюда в виде ссылки), связывание небольших органических соединений с кислыми или электроотрицательными характеристиками, например, такими лекарственными препаратами, как варфарин, диазепам, ибупрофен и паклитаксель (см. также таблицу 1 в Kragh-Hansen et al., 2002, Biol. Pharm. Bull. 25, 695, включенной сюда в виде ссылки). Не обязательно все из этих свойств должны выполняться, чтобы охарактеризовать белок или фрагмент, как альбумин.
Предпочтительным альбумином по изобретению является HSA, который представляет собой белок, состоящий из 585 аминокислотных остатков, с молекулярной массой в 67 кДа. В природном виде он не гликозилирован. Аминокислотная последовательность HSA представлена в SEQ ID NO: 2. Специалистам должно быть известно, что могут существовать природные аллели, имеющие практически те же свойства, что и HSA, но с одной или несколькими аминокислотными заменами по сравнению с SEQ ID NO: 2, причем авторы изобретения также предусматривают использование таких природных аллелей в качестве исходного альбумина по изобретению.
Альбумины обычно обладают длительным временем полужизни в плазме, примерно в 20 дней или больше, например, время полужизни HSA в плазме составляет 19 дней. Известно, что длительное время полужизни в плазме у HSA опосредовано через его взаимодействие со своим рецептором FcRn, однако понимание или знание точного механизма, определяющего длительное время полужизни HSA, не является существенным для изобретения.
В соответствии с изобретением термин "альбумин" означает белок, имеющий такую же или очень близкую трехмерную структуру, что и HSA, и обладающий длительным временем полужизни. В качестве примера белков альбумина по изобретению можно привести сывороточный альбумин человека (например, ААА98797 or P02768-1, SEQ ID NO: 2 (зрелый), SEQ ID NO: 4 (незрелый)), сывороточный альбумин приматов (как-то сывороточный альбумин шимпанзе (например, выведенная последовательность ХР_517233.2, SEQ ID NO: 5), сывороточный альбумин гориллы или сывороточный альбумин макаки (например, NP_001182578, SEQ ID NO: 6), сывороточный альбумин грызунов (как-то сывороточный альбумин хомячка (например, A6YF56, SEQ ID NO: 7), сывороточный альбумин морской свинки (например, Q6WDN9-1, SEQ ID NO: 8), сывороточный альбумин мыши (например, ААН49971 или Р07724-1 version 3, SEQ ID NO: 9) и сывороточный альбумин крысы (например, ААН85359 или Р02770-1 version 2, SEQ ID NO: 10)), бычий сывороточный альбумин (например, сывороточный альбумин коровы Р02769-1, SEQ ID NO: 11), конский сывороточный альбумин, как-то сывороточный альбумин лошади (например, Р35747-1, SEQ ID NO: 12) или сывороточный альбумин осла (например, Q5XLE4-1, SEQ ID NO: 13), сывороточный альбумин кролика (например, Р49065-1 version 2, SEQ ID NO: 14), сывороточный альбумин козы (например, ACF10391, SEQ ID NO: 15), сывороточный альбумин овцы (например, Р14639-1, SEQ ID NO: 16), сывороточный альбумин собаки (например, Р49822-1, SEQ ID NO: 17), сывороточный альбумин курицы (например, Р19121-1 version 2, SEQ ID NO: 18) и сывороточный альбумин свиньи (например, Р08835-1 version 2, SEQ ID NO: 19), или полипептид, по меньшей мере на 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или на 99% идентичный по аминокислотной последовательности такому альбумину. Исходным или контрольным альбумином может быть искусственный вариант типа HSA K573P (SEQ ID NO: 3) или химерный альбумин типа N-концевой части HSA и С-концевой части альбумина макаки (SEQ ID NO: 20), N-концевой части HSA и С-концевой части альбумина мыши (SEQ ID NO: 21), N-концевой части HSA и С-концевой части альбумина кролика (SEQ ID NO: 22), N-концевой части HSA и С-концевой части альбумина овцы (SEQ ID NO: 23).
Другие примеры альбумина, которые также включены в рамки настоящей заявки, включают овальбумин (например, Р01012.pro: овальбумин курицы; O73860.pro: овальбумин индейки). Предпочтительным альбумином по изобретению является HSA, приведенный в SEQ ID NO: 2, или любой его природный аллель.
Исходный альбумин, его фрагмент или альбуминовая часть слитого полипептида, содержащего альбумин или его фрагмент по изобретению, обычно по последовательности идентичен последовательности HSA, приведенной в SEQ ID NO: 2, по меньшей мере на 60%, предпочтительно по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, предпочтительно по меньшей мере на 86%, предпочтительно по меньшей мере на 87%, предпочтительно по меньшей мере на 88%, предпочтительно по меньшей мере на 89%, предпочтительно по меньшей мере на 90%, предпочтительно по меньшей мере на 91%, предпочтительно по меньшей мере на 92%, предпочтительно по меньшей мере на 93%, предпочтительно по меньшей мере на 94%, предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 96%, более предпочтительно по меньшей мере на 97%, более предпочтительно по меньшей мере на 98% и наиболее предпочтительно по меньшей мере на 99%. Идентичность последовательности может быть по всей длине SEQ ID NO: 2 или же молекулы, состоящей или содержащей фрагмент типа одного или нескольких доменов SEQ ID NO: 2, как-то молекулы, состоящей или содержащей домен III (например, SEQ ID NO: 27), молекулы, состоящей или содержащей домен II и домен III (например, SEQ ID NO: 25), молекулы, состоящей или содержащей домен I и домен III (например, SEQ ID NO: 24), молекулы, состоящей или содержащей две копии домена III (например, SEQ ID NO: 26), молекулы, состоящей или содержащей три копии домена III (например, SEQ ID NO: 28) либо молекулы, состоящей или содержащей домен I и две копии домена III (например, SEQ ID NO: 29).
Исходный альбумин предпочтительно содержит или состоит из аминокислотной последовательности SEQ ID NO: 4. Исходный альбумин может содержать или состоять из зрелого полипептида SEQ ID NO: 2.
В другом воплощении исходный альбумин является аллельным вариантом зрелого полипептида SEQ ID NO: 2.
Исходный альбумин может кодироваться полинуклеотидом, который гибридизуется в условиях очень низкой жесткости, в условиях низкой жесткости, в условиях средней жесткости, в условиях средневысокой жесткости, в условиях высокой жесткости или в условиях очень высокой жесткости с (i) кодирующей последовательностью зрелого полипептида SEQ ID NO: 1, (ii) кодирующей последовательностью зрелого полипептида по SEQ ID NO: 1, или (iii) полноразмерной последовательностью, комплементарной к (i) или (ii) (J. Sambrook, E.F. Fritsch, and T. Maniatis, 1989, Molecular Cloning, A Laboratory Manual, 2nd ed., Cold Spring Harbor, New York).
Полинуклеотид по SEQ ID NO: 1 или его подпоследовательность, а также аминокислотная последовательность по SEQ ID NO: 2 или ее фрагмент может использоваться для разработки зондов из нуклеиновой кислоты для идентификации и клонирования ДНК, кодирующей исходную форму, из штаммов различных родов или видов в соответствии с методами, хорошо известными в данной области. В частности, такие зонды можно использовать для гибридизации с геномной ДНК или кДНК искомого рода или вида, по стандартным методикам Саузерн-блоттинга, чтобы идентифицировать и выделить из нее соответствующий ген. Такие зонды могут быть значительно короче, чем полная последовательность, но должны составлять по меньшей мере 14, например, по меньшей мере 25, по меньшей мере 35 или по меньшей мере 70 нуклеотидов в длину. Предпочтительно, длина зонда из нуклеиновой кислоты составляет по меньшей мере 100 нуклеотидов, например, по меньшей мере 200 нуклеотидов, по меньшей мере 300 нуклеотидов, по меньшей мере 400 нуклеотидов, по меньшей мере 500 нуклеотидов, по меньшей мере 600 нуклеотидов, по меньшей мере 700 нуклеотидов, по меньшей мере 800 нуклеотидов или по меньшей мере 900 нуклеотидов. Можно использовать зонды как из ДНК, так и РНК. Как правило, зонды для определения соответствующего гена метятся (к примеру, с помощью 32Р, 3H, 35S, биотина или авидина). Такие зонды охватываются изобретением.
Можно подвергнуть скринингу библиотеку геномной ДНК или кДНК, полученную из таких других организмов, на предмет ДНК, гибридизирующейся с описанными выше зондами, и кодирующей исходную форму. Геномную или иную ДНК из таких других организмов можно разделить методом электрофореза в агарозном или полиакриламидном геле или другими методами разделения. ДНК из библиотеки или выделенную ДНК можно перенести и иммобилизовать на нитроцеллюлозе или другом подходящем материале носителя. Материал носителя используется в Саузерн-блоте для идентификации клона или ДНК, гомологичной SEQ ID NO: 1 или ее подпоследовательности.
Для целей настоящего изобретения гибридизация означает, что полинуклеотид гибридизуется с меченым нуклеотидным зондом, соответствующим полинуклеотиду, приведенному в SEQ ID NO: 1, комплементарной ему цепи или его подпоследовательности, в условиях низкой или очень низкой жесткости. Молекулы, с которыми гибридизируется зонд, можно детектировать, к примеру, с помощью рентгеновской пленки или любого другого метода, известного в данной области.
Зонд из нуклеиновой кислоты может содержать или состоять из кодирующей последовательности зрелого полипептида по SEQ ID NO: 1, т.е. нуклеотидов 1-1785 из SEQ ID NO: 1. Зонд из нуклеиновой кислоты может содержать или состоять из полинуклеотида, кодирующего полипептид по SEQ ID NO: 2 или его фрагмент.
Для длинных зондов длиной по меньшей мере 100 нуклеотидов условия от очень низкой до очень высокой жесткости определяются как пред-гибридизация и гибридизация при 42°С в растворе 5×SSPE, 0,3% SDS, 200 мкг/мл фрагментированной и денатурированной ДНК из спермы лосося и 25% формамида для очень низкой и низкой жесткости, 35% формамида для средней и средневысокой жесткости или же 50% формамида для высокой и очень высокой жесткости, по стандартной методике Саузерн-блоттинга, оптимально в течение от 12 до 24 ч. Наконец, материал носителя отмывают три раза по 15 мин с помощью 2×SSC, 0,2% SDS при 45°С (очень низкая жесткость), 50°С (низкая жесткость), 55°С (средняя жесткость), 60°С (средневысокая жесткость), 65°С (высокая жесткость) или 70°С (очень высокая жесткость).
Для коротких зондов длиной примерно от 15 нуклеотидов до 70 нуклеотидов условия жесткости определяются как пред-гибридизация и гибридизация при температуре на 5°С до 10°С ниже значения Tm, рассчитанного согласно Bolton and McCarthy (1962, Proc. Natl. Acad. Sci. USA 48: 1390), в растворе 0,9 М NaCl, 0,09 M трис-HCl рН 7,6, 6 мМ EDTA, 0,5% NP-40, 1×раствора Денхардта, 1 мМ пирофосфата натрия, 1 мМ раствора одноосновного фосфата натрия, 0,1 мМ АТР и 0,2 мг/мл дрожжевой РНК по стандартной методике Саузерн-блоттинга, оптимально в течение от 12 до 24 ч. Наконец, материал носителя отмывают один раз в 6×SSC плюс 0,1% SDS в течение 15 мин и два раза по 15 мин в 6×SSC при температуре на 5°С до 10°С ниже рассчитанного значения Tm.
Исходная форма может кодироваться полинуклеотидом с последовательностью, идентичной кодирующей последовательности зрелого полипептида по SEQ ID NO: 1 по меньшей мере на 60%, например, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100%, которая кодирует полипептид, способный функционировать в качестве альбумина. В одном воплощении исходная форма кодируется полинуклеотидом, содержащим или состоящим из SEQ ID NO: 1.
Альбуминовая часть
Альбуминовая часть слитого полипептида, конъюгата, ассоциата, наночастиц или композиции, содержащей вариант альбумина или его фрагмент по изобретению, может именоваться как 'молекула альбумина' или 'альбуминовый компонент'. Полипептид по изобретению может содержать или состоять из молекулы альбумина.
Далее описаны определенные аспекты изобретения.
Получение вариантов
Первый аспект изобретения касается способа получения полипептида, который является вариантом альбумина, его фрагментом или слитым полипептидом, содержащим вариант альбумина или его фрагмент, у которого предпочтительно изменено сродство к FcRn (предпочтительно shFcRn) или время полужизни (например, в плазме) относительно контрольного альбумина, причем способ включает стадии:
а. идентификация положений одного или нескольких аминокислотных остатков, важных для связывания альбумина с FcRn или времени полужизни (например, в плазме), у альбумина или его фрагмента или альбуминовой части слитого полипептида, содержащего альбумин или его фрагмент;
b. получение нуклеиновой кислоты, кодирующей данный альбумин, его фрагмент или альбуминовую часть слитого полипептида, содержащего альбумин или его фрагмент;
с. модифицирование нуклеиновой кислоты, полученной на стадии b, так, чтобы по одному или нескольким аминокислотным остаткам, расположенным в положениях, установленных на стадии а, были изменения типа делеции, замены или вставки, наиболее предпочтительно замены;
d. экспрессирование модифицированной нуклеиновой кислоты в подходящих клетках-хозяевах; и
е. выделение варианта альбумина, его фрагмента или слитого полипептида, содержащего вариант альбумина или его фрагмент.
Идентификация положений одного или нескольких аминокислотных остатков, важных для связывания альбумина с FcRn или времени полужизни (например, в плазме) у альбумина, его фрагмента или альбуминовой части слитого полипептида, может проводиться различными способами, включая, без ограничения, случайный мутагенез с последующим анализом полученных мутантов и сравнением с немутантной исходной или контрольной молекулой, и идентификацию на основе структурных особенностей, необязательно с последующим созданием вариантов, имеющих идентифицированные изменения, и сравнением их с немутантной исходной молекулой.
Контрольные альбумины приведены здесь, причем особенно предпочтительно контрольный альбумин представлен HSA (SEQ ID No: 2).
Предпочтительный способ идентификации положений одного или нескольких аминокислотных остатков, подлежащих изменению для того, чтобы получить вариант HSA с измененным связыванием с FcRn или временем полужизни (например, в плазме) по сравнению с природным HSA, включает следующие стадии:
i) получение трехмерной структуры (модели) альбумина типа HSA;
ii) получение трехмерной структуры (модели) FcRn;
iii) использование структуры альбумина (i) и структуры FcRn (ii) для моделирования структуры комплекса, образующегося при связывании альбумина с FcRn, получая при этом 'модель стыковки';
iv) использование 'модели стыковки' для идентификации тех аминокислотных остатков у альбумина, которые взаимодействуют с FcRn или участвуют во взаимодействии с FcRn.
Стадии iii) и iv) можно выполнять с применением методов, хорошо известных специалистам.
Стыковочная модель может быть получена с использованием любого подходящего метода или программного обеспечения. Подходящее программное обеспечение включает такие программы на основе быстрого преобразования Фурье, как программа для стыковки белков ZDOCK Fast Fourier Transform (Chen R et al. (2003) Proteins 52(1): 80-87). Что касается построения модели для стыковки FcRn и альбумина, то предпочтительно, чтобы модель альбумина содержала домен III и по меньшей мере один из доменов I и II, а предпочтительно все домены. Предпочтительно альбумин представлен HSA (например, SEQ ID No: 2). Предпочтительно модель альбумина выполняется при рН 7-8. Модель альбумина может представлять собой или основываться на кристаллической структуре HSA при 2,5 Ǻ (PDB-код: 1bm0 (Sugio S. et al. (1999) Protein Eng. 12(6): 439-446). Предпочтительно FcRn представлен FcRn человека и наиболее предпочтительно растворимым FcRn человека. Предпочтительно модель FcRn выполняется при рН меньше 6,4, к примеру, при рН, равном или меньше рН 6,3, 6,2, 6,1, 6, 5,9, 5,8, 5,7, 5,6, 5,5, 5,4, 5,3, 5,2, 5,1, 5,0, 4,9, 4,8, 4,7, 4,6, 4,5, 4,4, 4,3, 4,2, 4,1, 4,0, 3,9, 3,8, 3,7, 3,6, 3,5, 3,4, 3,3, 3,2, 3,1, 3,0. Более предпочтительно значение рН составляет от 3,7 до 4,7, от 4,0 до 4,4 и наиболее предпочтительно 4,2. Преимуществом низкого рН является то, что оно лучше представляет естественные физиологические условия, при которых альбумин связывается с FcRn. Модель FcRn может представлять собой или основываться на структуре FcRn с разрешением в 2,7 Ǻ при рН 8,2 (PDB-код: 1exu).
В дополнение к первой модели FcRn можно использовать и вторую модель FcRn, причем предпочтительно вторая модель выполняется при отличных от первой модели значениях рН, например, при более высоком рН, как-то при рН, равном или больше 6,4, 6,8, 7,0, 7,2, 7,4, 7,6, 7,8, 8,0, 8,2, 8,4, 8,6, 8,8 или 9,0. Преимуществом использования дополнительной модели FcRn является то, что можно исследовать влияние рН на связывание между FcRn и молекулой альбумина. Таким образом, можно сравнивать стыковочные модели, созданные для FcRn при различных значениях рН, для идентификации аминокислотных остатков, участвующих в связывании альбумина с FcRn при одном рН, но не при другом, т.е. рН-зависимое связывание.
Идентификация тех аминокислотных остатков у альбумина, которые взаимодействуют с FcRn или участвуют во взаимодействии с FcRn, может выполняться вручную и/или визуально.
Необязательно способ получения и/или способ идентификации может включать сравнение первичной структуры и/или третичной структуры второго альбумина (например, не альбумина человека) с первичной структурой и/или третичной структурой альбумина из стадии (i) для идентификации аминокислот, эквивалентных аминокислотам, идентифицированным на стадии (iv). Сравнение первичной структуры может проводиться путем выравнивания последовательностей между вторым альбумином и альбумином из стадии (i). Сравнение вторичной структуры может проводиться с помощью общедоступного программного обеспечения типа PDBeFold (также известного как SSM), интерактивного сервиса для сравнения структуры белков в режиме 3D (например, версии 2.36 или более поздней, доступной на http://www.ebi.ac.uk/msd-srv/ssm/ и описанной в таких публикациях, как Krissinel et al. (2004) Acta Cryst. D60, 2256-2268; и Krissinel (2007) Bioinformatics 23, 717-723).
Необязательно способ получения и/или способ идентификации может включать получение вариантов альбумина по положениям, определенным на стадии (iv) или (v), и проверки (например, посредством анализа сродства связывания) того, что у полученных вариантов изменилось связывание с FcRn по сравнению с контролем типа альбумина из стадии (i). Анализ сродства связывания может проводиться методом поверхностного плазменного резонанса (например, как описано здесь) и/или методом ELISA (например, как изложено в WO 2011/051489 (РСТ/ЕР 10/066572), включенной сюда в виде ссылки) и/или проверки того, что у полученных вариантов изменилось время полужизни, например, в плазме, по сравнению с контролем типа альбумина (i). Тем не менее, специалистам должно быть понятно, что для идентификации полипептидов, обладающих отличными от HSA свойствами связывания с FcRn, могут применяться и другие методы, которые не зависят от того, каким образом был идентифицирован полипептид, имеющий другие свойства связывания с FcRn.
В соответствии с первым аспектом изобретения, те аминокислотные остатки альбумина, которые влияют на связывание альбумина с FcRn или на время полужизни (например, в плазме), предпочтительно располагаются в одном или нескольких из следующих участков: (а) 505, 531, 524, 472, 108, 190, 197 и 425; (b) 492-538; (с) 186-201; (d) 457-472; (e) 414-426; (f) 104-120; (g) 75-91; (h) 144-150; (i) 30-41, (j) 550-585 и (k) 276, 410 и 414 с одним или несколькими из А, С, D, E, F, G, H, I, К, L, M, N, P, Q, R, S, Т, V, W, Y и/или стоп-кодоном в положении от 497 до 585; при этом предпочтительно, если полипептид содержит одно или несколько изменений, выбранных из (i) группы, состоящей из позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, и/или (ii) группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены одной или нескольких из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены одной или нескольких из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), и/или (iii) группы, состоящей из позиций 82, 114, 119, 464, 201, 505, 510, 513, 533, 535, 536, 550, 560, 563, 565, 573, 574 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е); то полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, вставленный или замещенный в положении, выбранном из позиций 497-585 (позиции представлены относительно SEQ ID NO: 2, однако изобретение также включает эквивалентные позиции в других последовательностях, чем SEQ ID No: 2).
Кроме того, может проводиться введение стоп-кодона по любому из положений 497-585, т.е. любой из позиций 497, 498, 499, 500, 501, 502, 503, 504, 505, 506, 507, 508, 509, 510, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 535, 536, 537, 538, 539, 540, 541, 542, 543, 544, 545, 546, 547, 548, 549, 550, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 566, 567, 568, 569, 570, 571, 572, 573, 574, 575, 576, 577, 578, 579, 580, 581, 582, 583, 584, 585 (или эквивалентных позиций относительно SEQ ID NO: 2). Введение может осуществляться путем вставки или замены. Введение такого стоп-кодона может проводиться в дополнение к или вместо описанных здесь изменений.
Таким образом, в первом аспекте изобретения предусмотрены варианты альбумина или их фрагменты с измененным сродством связывания с FcRn по сравнению с исходным или контрольным альбумином, которые содержат изменения (как-то замены, делеции или вставки) по:
(a) одному или нескольким положениям, соответствующим позициям в SEQ ID No: 2 из числа позиций 30, 31, 32, 33, 35, 36, 37, 39, 41, 77, 78, 79, 81, 84, 85, 87, 88, 89, 105, 106, 107, 108, 109, 110, 111, 112, 117, 118, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197; и/или
(b) одному или нескольким положениям, соответствующим позициям в SEQ ID No: 2 из числа позиций 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199; и/или
(c) одному или нескольким положениям, соответствующим позициям в SEQ ID No: 2 из числа позиций 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 462, 463, 465, 466, 467, 468, 469, 470, 472, 497, 498, 502, 507, 508, 509, 511, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 534, 551, 552, 553, 554, 555, 556, 557, 561, 566, 568, 569, 570, 571, 572, 576, 583;
причем измененное сродство связывания у варианта или его фрагмента будет относительно сродства связывания у контрольного типа исходного альбумина или его фрагмента, не содержащего изменений.
Положения, приведенные в (а) (выше), могут находиться в первом домене (например, домене I) полипептида типа альбумина, например, HSA. Положения, приведенные в (b) (выше), могут находиться во втором домене (например, домене II) полипептида типа альбумина, например, HSA. Положения, приведенные в (с) (выше), могут находиться в третьем домене (например, домене III) полипептида типа альбумина, например, HSA.
Вариант альбумина или его фрагмент может дополнительно содержать изменения (как-то замены или вставки) по одному или нескольким положениям, соответствующим следующим позициям в SEQ ID No: 2:
(i) из числа 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582, 584,
(ii) из числа 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены одной или нескольких из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из нативного остатка (например, не остатка Cys) на Cys и/или делеции или замены одной или нескольких из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), и/или
(iii) из числа 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е).
Предпочтительно исходный альбумин и/или вариант альбумина содержит или состоит из:
(a) полипептида, по меньшей мере на 60% идентичного по последовательности зрелому полипептиду по SEQ ID NO: 2;
(b) полипептида, кодируемого таким полинуклеотидом, который гибридизуется в условиях низкой жесткости с (i) кодирующей последовательностью зрелого полипептида по SEQ ID NO: 1 или (ii) полноразмерной последовательностью, комплементарной к (i);
с) полипептида, кодируемого таким полинуклеотидом, который по меньшей мере на 60% идентичен кодирующей последовательности зрелого полипептида по SEQ ID NO: 1; и/или
(d) фрагмента зрелого полипептида по SEQ ID NO: 2.
Дальнейшие предпочтения для первого аспекта изобретения представлены после тринадцатого аспекта изобретения. Специалистам должно быть ясно, что любой аспект изобретения можно комбинировать с другим аспектом или аспектами изобретения и/или с одним или несколькими другими предпочтениями для аспектов изобретения и/или с другими приведенными здесь сведениями.
Второй аспект изобретения касается способа получения варианта альбумин или его фрагментов или слитых полипептидов, содержащих вариант альбумина или его фрагмент, либо ассоциатов варианта альбумина или его фрагмента, который включает:
(а) введение в исходный альбумин или его фрагменты или слитые полипептиды, содержащие исходный альбумин или его фрагменты, изменений по одному или нескольким положениям, соответствующим позициям 30-41, 75-91, 104-120, 144-150, 186-201, 414-426, 457-472, 492-538, 550-585, 276, 410 и/или 411 у зрелого полипептида по SEQ ID NO: 2, при этом предпочтительно, если полипептид содержит одно или несколько изменений, выбранных из (i) группы, состоящей из позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, и/или (ii) группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены одной или нескольких из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены одной или нескольких из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), и/или (iii) группы, состоящей из позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е); то полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, вставленный или замещенный в положении, выбранном из позиций 497-585; и
(b) выделение варианта альбумина или его фрагментов или слитых полипептидов, содержащих вариант альбумина или его фрагменты.
Таким образом, можно выбирать положения из одного или нескольких из: 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 492, 493, 494, 495, 496, 497, 498, 499, 500, 501, 502, 503, 504, 505, 506, 507, 508, 509, 510, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 535, 536, 537, 538, 550, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 573, 574, 575, 576, 577, 578, 579, 580, 581, 582, 583, 584, 585.
Кроме того, может проводиться введение стоп-кодона по любому из положений 497-585, т.е. любой из позиций 497, 498, 499, 500, 501, 502, 503, 504, 505, 506, 507, 508, 509, 510, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 535, 536, 537, 538, 539, 540, 541, 542, 543, 544, 545, 546, 547, 548, 549, 550, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 566, 567, 568, 569, 570, 571, 572, 573, 574, 575, 576, 577, 578, 579, 580, 581, 582, 583, 584, 585 (или эквивалентных позиций относительно SEQ ID NO: 2). Введение может осуществляться путем вставки или замены. Введение такого стоп-кодона может проводиться в дополнение к или вместо описанных здесь изменений.
Таким образом, второй аспект изобретения касается способа получения варианта альбумина или его фрагментов или слитых полипептидов, содержащих вариант альбумина или его фрагменты, либо ассоциатов варианта альбумина или его фрагментов, который включает:
введение в исходный альбумин или его фрагменты или слитые полипептиды, содержащие исходный альбумин или его фрагменты, изменений по одному или нескольким положениям, соответствующим позициям у варианта альбумина или его фрагмента с измененным сродством связывания с FcRn по сравнению с исходным или контрольным альбумином, содержащим изменения (как-то замены, делеции или вставки) по:
(a) одному или нескольким положениям, соответствующим позициям в SEQ ID No: 2 из числа позиций 30, 31, 32, 33, 35, 36, 37, 39, 41, 77, 78, 79, 81, 84, 85, 87, 88, 89, 105, 106, 107, 108, 109, 110, 111, 112, 117, 118, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197; и/или
(b) одному или нескольким положениям, соответствующим позициям в SEQ ID No: 2 из числа позиций 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 276; и/или
(c) одному или нескольким положениям, соответствующим позициям в SEQ ID No: 2 из числа позиций 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 462, 463, 465, 466, 467, 468, 469, 470, 472, 497, 498, 502, 507, 508, 509, 511, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 534, 551, 552, 553, 554, 555, 556, 557, 561, 566, 568, 569, 570, 571, 572, 576, 583;
причем измененное сродство связывания у варианта или его фрагмента будет относительно сродства связывания у контрольного типа исходного альбумина или его фрагмента, не содержащего изменений.
Положения, приведенные в (а) (выше), могут находиться в первом домене (например, домене I) полипептида типа альбумина, например, HSA. Положения, приведенные в (b) (выше), могут находиться во втором домене (например, домене II) полипептида типа альбумина, например, HSA. Положения, приведенные в (с) (выше), могут находиться в третьем домене (например, домене III) полипептида типа альбумина, например, HSA.
Вариант альбумина или его фрагмент может дополнительно включать изменения (например, замены или вставки) по одному или нескольким положениям, соответствующим следующим позициям в SEQ ID No: 2:
(i) из числа 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582, 584,
(ii) из числа 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены по одной или нескольким из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены по одной или нескольким из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), и/или
(iii) из числа 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е).
Предпочтительно исходный альбумин и/или вариант альбумина содержит или состоит из:
(a) полипептида, по меньшей мере на 60% идентичного по последовательности зрелому полипептиду по SEQ ID NO: 2;
(b) полипептида, кодируемого таким полинуклеотидом, который гибридизуется в условиях низкой жесткости с (i) кодирующей последовательностью зрелого полипептида по SEQ ID NO: 1 или (ii) полноразмерной последовательностью, комплементарной к (i);
с) полипептида, кодируемого таким полинуклеотидом, который по меньшей мере на 60% идентичен кодирующей последовательности зрелого полипептида по SEQ ID NO: 1; и/или
(d) фрагмента зрелого полипептида по SEQ ID NO: 2.
Варианты могут быть получены специалистами при использовании любой методики мутагенеза, известной в данной области, такой как сайт-направленный мутагенез, конструирование синтетических генов, конструирование полусинтетических генов, случайный мутагенез, перетасовка и др.
Сайт-направленный мутагенез представляет собой метод, при котором создается одна или несколько мутаций (изменений) по одному или нескольким заданным сайтам в полинуклеотиде, кодирующем исходную форму.
Сайт-направленный мутагенез может осуществляться in vitro методом ПЦР с применением олигонуклеотидных праймеров, содержащих требуемую мутацию. Сайт-направленный мутагенез также может осуществляться in vitro методом кассетного мутагенеза, включающим расщепление рестрикционным ферментом по сайту в плазмиде, содержащей полинуклеотид, кодирующий исходную форму, и последующее лигирование олигонуклеотида, содержащего мутацию, с полинуклеотидом. Обычно и плазмида, и олигонуклеотид расщепляется одним и тем же рестрикционным ферментом, что позволяет лигировать плазмиду и вставку друг с другом. Например, см. Scherer and Davis, 1979, Proc. Natl. Acad. Sci. USA 76: 4949-4955; и Barton et al., 1990, Nucleic Acids Res. 18: 7349-4966.
Сайт-направленный мутагенез также может осуществляться in vivo способами, известными в данной области. Например, см. U.S. Patent Application Publication No. 2004/0171154; Storici et al., 2001, Nature Biotechnol. 19: 773-776; Kren et al., 1998, Nat. Med. 4: 285-290; и Calissano and Macino, 1996, Fungal Genet. Newslett. 43: 15-16.
В настоящем изобретении можно использовать любые методы сайт-направленного мутагенеза. Существует много коммерческих наборов, которые можно использовать для получения вариантов.
Конструирование синтетических генов влечет за собой синтез in vitro заданной молекулы полинуклеотида, кодирующего нужный полипептид. Синтез генов может осуществляться с применением ряда методов, таких как мультиплексная технология на основе микрочипов, описанная Tian et al. (2004, Nature 432: 1050-1054), и аналогичные технологии, в которых синтезируются олигонуклеотиды, которые собираются на фото-программируемые микрожидкостные чипы.
Можно произвести одиночные или множественные замены, делеции и/или вставки аминокислот и протестировать их с применением известных методов мутагенеза, рекомбинации и/или перетасовки с последующей подходящей процедурой скрининга, как это описано в Reidhaar-Olson and Sauer, 1988, Science 241: 53-57; Bowie and Sauer, 1989, Proc. Natl. Acad. Sci. USA 86: 2152-2156; WO 95/17413; или WO 95/22625. Другие методы, которые можно использовать, включают ПЦР сниженной точности, фаговый дисплей (например, Lowman et al., 1991, Biochemistry 30: 10832-10837; U.S. Patent No. 5,223,409; WO 92/06204) и направленный на участок мутагенез (Derbyshire et al., 1986, Gene 46: 145; Ner et al., 1988, DNA 7: 127).
Методы мутагенеза/перетасовки можно комбинировать с высокопроизводительными, автоматизированными методами скрининга для выявления активности клонированных, подвергнутых мутагенезу полипептидов, экспрессируемых клетками-хозяевами (Ness et al., 1999, Nature Biotechnology 17: 893-896). Подвергнутые мутагенезу молекулы ДНК, кодирующие активные полипептиды, можно выделить из клетокхозяев и быстро просеквенировать с применением известных в данной области методов. Эти методы позволяют быстро определить значение отдельных аминокислотных остатков в полипептиде.
Конструирование полусинтетических генов осуществляется путем комбинирования аспектов конструирования синтетических генов и/или сайт-направленного мутагенеза и/или случайного мутагенеза и/или перетасовки. Типичным способом полусинтетического конструирования является использование синтезируемых полинуклеотидных фрагментов в сочетании с методами ПЦР. При этом определенные участки генома могут синтезироваться de novo, тогда как другие участки могут быть амплифицированы с помощью праймеров для сайт-направленного мутагенеза, а еще другие участки могут быть подвергнуты амплификации методом ПЦР пониженной точности или ПЦР иного типа. После этого субпоследовательности полинуклеотида могут быть подвергнуты перетасовке.
Дальнейшие предпочтения для второго аспекта изобретения представлены после тринадцатого аспекта изобретения.
Варианты
В третьем аспекте изобретения предусмотрены варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или его фрагменты, из исходного альбумина, содержащего изменения по одному или нескольким положениям, соответствующим позициям 30-41, 75-91, 104-120, 144-150, 186-201, 414-426, 457-472, 492-538, 550-585, 276, 410 и/или 411 у зрелого полипептида по SEQ ID NO: 2, при этом предпочтительно, если полипептид содержит одно или несколько изменений, выбранных из (i) группы, состоящей из позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, и/или (ii) группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены одной или нескольких из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены одной или нескольких из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), и/или (iii) группы, состоящей из позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е); то полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, вставленный или замещенный в положении, выбранном из позиций 497-585.
Кроме того, в любое из положений 497-585 может быть введен стоп-кодон. Введение может осуществляться путем вставки или замены. Введение такого стоп-кодона может быть в дополнение или вместо описанных здесь мутаций.
Таким образом, в третьем аспекте изобретения предусмотрены варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина, из исходного альбумина, содержащего изменения (как-то замены, делеции или вставки) по:
(а) одному или нескольким положениям, соответствующим позициям в SEQ ID No: 2 из числа позиций 30, 31, 32, 33, 35, 36, 37, 39, 41, 77, 78, 79, 81, 84, 85, 87, 88, 89, 105, 106, 107, 108, 109, 110, 111, 112, 117, 118, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197; и/или
(b) одному или нескольким положениям, соответствующим позициям в SEQ ID No: 2 из числа позиций 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199; и/или
(c) одному или нескольким положениям, соответствующим позициям в SEQ ID No: 2 из числа позиций 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 462, 463, 465, 466, 467, 468, 469, 470, 472, 497, 498, 502, 507, 508, 509, 511, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 534, 551, 552, 553, 554, 555, 556, 557, 561, 566, 568, 569, 570, 571, 572, 576, 583.
Положения, приведенные в (а) (выше), могут находиться в первом домене (например, домене I) полипептида типа альбумина, например, HSA. Положения, приведенные в (b) (выше), могут находиться во втором домене (например, домене II) полипептида типа альбумина, например, HSA. Положения, приведенные в (с) (выше), могут находиться в третьем домене (например, домене III) полипептида типа альбумина, например, HSA.
Вариант альбумина или его фрагмент может дополнительно включать изменения (например, замены или вставки) по одному или нескольким положениям, соответствующим следующим позициям в SEQ ID No: 2:
(i) из числа позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582, 584,
(ii) из числа позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены по одной или нескольким из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены по одной или нескольким из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), и/или
(iii) из числа позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е).
Предпочтительно исходный альбумин и/или вариант альбумина содержит или состоит из:
(a) полипептида, по меньшей мере на 60% идентичного по последовательности зрелому полипептиду по SEQ ID NO: 2;
(b) полипептида, кодируемого таким полинуклеотидом, который гибридизуется в условиях низкой жесткости с (i) кодирующей последовательностью зрелого полипептида по SEQ ID NO: 1 или (ii) полноразмерной последовательностью, комплементарной к (i);
с) полипептида, кодируемого таким полинуклеотидом, который по меньшей мере на 60% идентичен кодирующей последовательности зрелого полипептида по SEQ ID NO: 1; и/или
(d) фрагмента зрелого полипептида по SEQ ID NO: 2.
Вариант альбумин, его фрагмент или альбуминовая часть слитого полипептида, содержащая вариант альбумина или его фрагмент по изобретению по последовательности обычно идентичен последовательности HSA, приведенной в SEQ ID NO: 2, по меньшей мере на 60%, предпочтительно по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 96%, более предпочтительно по меньшей мере на 97%, более предпочтительно по меньшей мере на 98% и наиболее предпочтительно по меньшей мере на 99%.
В одном аспекте количество изменений у вариантов по изобретению составляет 1-20, например, 1-10 или 1-5, как-то 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 изменений.
Вариант альбумин, его фрагмент или слитый полипептид, содержащий вариант альбумина или его фрагмент, обладает измененным сродством связывания с FcRn и/или измененным временем полужизни в плазме по сравнению с исходным или контрольным альбумином, его фрагментом или слитым полипептидом, содержащим альбумин или его фрагмент.
В особенно предпочтительном воплощении исходный или контрольный альбумин представлен HSA, а вариант альбумина, его фрагмент или слитый полипептид, содержащий вариант альбумина или его фрагмент, обладает измененным сродством связывания с FcRn и/или измененным временем полужизни в плазме по сравнению с HSA, соответствующим фрагментом или слитым полипептидом, содержащим HSA или его фрагмент.
Корреляция между связыванием альбумина со своим рецептором и временем полужизни в плазме была установлена авторами настоящего изобретения, исходя из природного аллеля HSA D494N. Авторы ранее анализировали этот аллель и обнаружили, что он обладает меньшим сродством связывания со своим рецептором FcRn, чем сродство связывания HSA дикого типа с FcRn.
Кроме того, было показано, что трансгенные мыши, у которых природный FcRn мыши заменен на FcRn человека, имеют более высокий уровень альбумина в сыворотке, чем нормальные мыши (J Exp Med. (2003) 197(3): 315-22). Авторы изобретения еще раньше обнаружили, что FcRn человека обладает большим сродством к сывороточному альбумину мыши, чем FcRn мыши к сывороточному альбумину мыши, поэтому наблюдаемое повышение уровня сывороточного альбумина у трансгенных мышей соответствует более высокому сродству между сывороточным альбумином и его рецептором, что подтверждает корреляцию между связыванием альбумина с FcRn и временем полужизни. Кроме того, варианты альбумина, которые почти или совсем не связываются с FcRn, обладают меньшим временем полужизни на мышиной модели: Kenanova et al. (2009) J. Nucl. Med. 50 (Suppl. 2): 1582).
Один из способов определения того, что сродство к FcRn у варианта альбумина повышено или понижено по сравнению с исходным или контрольным альбумином, является метод поверхностного плазменного резонанса (SPR), как описано ниже. Специалисты должны понимать, что для определения того, что сродство к FcRn у варианта альбумина повышено или понижено по сравнению со сродством к FcRn у исходного или контрольного альбумина, могут применяться и другие способы, например, определение и сравнение константы связывания KD. Так, согласно изобретению, те варианты альбумина по изобретению, у которых значение KD меньше, чем KD у природного HSA, должны обладать большим временем полужизни, чем HSA, а те варианты альбумина, у которых значение KD больше, чем KD у природного HSA, должны обладать меньшим временем полужизни, чем HSA.
Варианты альбумина либо их фрагменты или слитые полипептиды, содержащие альбумин или его фрагменты, содержат одно или несколько изменений, как-то замен, делеций или вставок, по одному или нескольким положениям, соответствующим положениям в HSA, выбранным из группы, состоящей из позиций 30-41, 75-91, 104-120, 144-150, 186-201, 414-426, 457-472, 492-538, 550-585, 276, 410 и/или 411 зрелого полипептида по SEQ ID NO: 2, и/или введение стоп-кодона по любому из положений 497-585 зрелого полипептида по SEQ ID NO: 2, при этом предпочтительно, если полипептид содержит одно или несколько изменений, выбранных из (i) группы, состоящей из позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, (ii) группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены одной или нескольких из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены одной или нескольких из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), или (iii) группы, состоящей из позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е); то полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, вставленный или замещенный в положении, выбранном из позиций 497-585. Введение может осуществляться путем вставки или замены. Введение такого стоп-кодона может проводиться в дополнение или вместо описанных здесь изменений. Замена может представлять собой любую замену, при которой аминокислота в последовательности природного альбумина заменяется на другую аминокислоту, выбранную из остальных 19 встречающихся в природе аминокислот.
В одном аспекте вариант содержит изменения по одному или нескольким положениям, соответствующим позициям 30-41, 75-91, 104-120, 144-150, 186-201, 414-426, 457-472, 492-538, 550-585, 276, 410 и/или 411 зрелого полипептида по SEQ ID NO: 2, при этом предпочтительно, если полипептид содержит одно или несколько изменений, выбранных из (i) группы, состоящей из позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, (ii) группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены одной или нескольких из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены одной или нескольких из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), или (iii) группы, состоящей из позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е); то полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, вставленный или замещенный в положении, выбранном из позиций 497-585.
В другом аспекте вариант содержит изменения по двум или нескольким положениям, соответствующим позициям 30-41, 75-91, 104-120, 144-150, 186-201, 414-426, 457-472, 492-538, 550-585 и/или 276, 410, 411 зрелого полипептида по SEQ ID NO: 2, при этом предпочтительно, если вариант, его фрагмент или слитый полипептид содержит одну или несколько замен в положениях 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, то вариант, его фрагмент или слитый полипептид содержит одну или несколько замен в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, вставленный или замещенный в положении, выбранном из позиций 497-585. Также предпочтительно, если полипептид содержит одно или несколько изменений, выбранных из (i) группы, состоящей из позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, (ii) группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены одной или нескольких из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены одной или нескольких из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), или (iii) группы, состоящей из позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е); то полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, вставленный или замещенный в положении, выбранном из позиций 497-585.
В другом аспекте вариант содержит изменения по трем положениям, соответствующим любым из позиций 30-41, 75-91, 104-120, 144-150, 186-201, 414-426, 457-472, 492-538, 550-585, 276, 410 и/или 411 зрелого полипептида по SEQ ID NO: 2, при этом предпочтительно, если полипептид содержит одно или несколько изменений, выбранных из (i) группы, состоящей из позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, (ii) группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены одной или нескольких из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены одной или нескольких из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), или (iii) группы, состоящей из позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е); то полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, вставленный или замещенный в положении, выбранном из позиций 497-585.
Возможные вставки или замены для каждой из указанных позиций представлены ниже в таблице 2.
Таблица 2.
Возможные и предпочтительные изменения у исходного альбумина, причем положения приводятся относительно SEQ ID NO: 2, однако изобретение также включает эквивалентные положения и в других последовательностях, чем SEQ ID No: 2.
В вышеприведенной таблице 2 все привязано к HSA (SEQ ID NO: 2). Однако изобретение также включает варианты альбумина не человека или фрагменты альбумина человека или не человека, содержащие приведенные здесь изменения в положениях, эквивалентных тем, что указаны для HSA. Специалисты смогут определить эквивалентные положения путем выравнивания последовательности с SEQ ID NO: 2.
Вариант также может содержать изменения в одном или нескольких положениях, выбранных из группы, состоящей из 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (номера по SEQ ID No. 2), в особенности замены или вставки Cys по одному или нескольким из этих положений. Например, замены по одному или нескольким положениям из числа 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из нативного остатка (например, не остатка Cys) на Cys для введения Cys, который может использоваться для конъюгации через свою тиоловую группу, и/или делеции или замены по одному или нескольким положениям из числа 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys, который может разрушить существующую дисульфидную связь с образованием Cys, который будет доступен для конъюгации через свою тиоловую группу. Можно производить изменения по одному или нескольким из этих положений по отдельности или, что более предпочтительно, в сочетании с другим или другими из приведенных здесь положений.
Вариант также может содержать изменения в одном или нескольких положениях, выбранных из группы, состоящей из 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (номера по SEQ ID No. 2). Можно производить изменения по одному или нескольким из этих положений по отдельности или, что более предпочтительно, в сочетании с другим или другими из приведенных здесь положений. Предпочтительно, если изменение выбрано, в частности, из одной или нескольких из следующих замен: D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е, то оно сочетается с изменениями по другому или другим из приведенных здесь положений.
Во избежание сомнений, во все аспекты изобретения входят варианты альбумина, содержащие С-концевое укорочение на 1-88 аминокислот, которые тоже образуют аспект изобретения сами по себе. Таким образом, вариант может содержать или состоять из альбумина, имеющего последовательность, эквивалентную положениям от 1 до 497-584 по SEQ ID NO: 2. Такой вариант может быть получен путем введения стоп-кодона в любое из положений 497, 498, 499, 500, 501, 502, 503, 504, 505, 506, 507, 508, 509, 510, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 535, 536, 537, 538, 539, 540, 541, 542, 543, 544, 545, 546, 547, 548, 549, 550, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 566, 567, 568, 569, 570, 571, 572, 573, 574, 575, 576, 577, 578, 579, 580, 581, 582, 583, 584, 585. При этом альбумин может быть укорочен на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88 позиций по отношению к исходному альбумину или его фрагменту, из которого он происходит. Предпочтительно усечение должно составлять не более, чем 88 аминокислот, поэтому предпочтительно, чтобы альбумин был укорочен не более, чем на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88 аминокислот по отношению к исходному альбумину или его фрагменту, из которого он происходит. Менее предпочтительно, чтобы вариант содержал стоп-кодон в положении 406, 407, 408, 409, 410, 411 или 585. Вариант может и не содержать одно или несколько изменений, описанных здесь. Укороченные формы могут именоваться как 'фрагменты'.
Предпочтительно усечения приходятся на положения 500-584, например, от 573 или 574 до 584. При этом такие варианты укорочены по отношению к исходному альбумину, например, HSA (SEQ ID NO: 2), но это же в равной степени относится и к фрагментам альбумина типа DII+DIII, DIII или DI+DIII. Специалист сможет определить расположение усечения в таком фрагменте путем выравнивания фрагмента с HSA. Таким образом, вариант может содержать по меньшей мере 85-99,5% от N-концевой части исходного альбумина или его фрагмента, как-то по меньшей мере 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 99,5% N-концевой части. Предпочтительно укороченные формы содержат 85, 86, 97 или 98% от N-концевой части исходного альбумина или его фрагмента. Соответственно, способы получения, фрагменты, слитые полипептиды, конъюгаты, наночастицы, ассоциаты и композиции могут включать и такие усеченные варианты. Предпочтительно, чтобы у усеченного варианта сохранялось положение 573 (или эквивалентное ему). Также предпочтительно, чтобы аминокислота в положении 573 была представлена Pro, Trp или Tyr.
В одном воплощении варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты по изобретению, содержат одну замену в положении, соответствующем положению в HSA, выбранному из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585 в SEQ ID NO: 2.
В одном воплощении варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты по изобретению, содержат одну замену в положении, соответствующем положению в HSA, выбранному из группы, состоящей из позиций 30, 31, 32, 33, 35, 36, 37, 39, 41, 77, 78, 79, 81, 84, 85, 87, 88, 89, 105, 106, 107, 108, 109, 110, 111, 112, 117, 118, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 462, 463, 465, 466, 467, 468, 469, 470, 472, 497, 502, 507, 508, 509, 511, 513, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 534, 551, 552, 553, 554, 555, 556, 557, 561, 568, 569, 570, 571, 572, 576, 583 в SEQ ID NO: 2.
Варианты альбумина, их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты по изобретению, могут содержать дополнительные замены, вставки или делеции по одному или нескольким положениям, соответствующим другим положениям в HSA.
В другом воплощении варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты по изобретению, содержат две, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать, двадцать или даже больше замен в положениях, соответствующих положениям в HSA, выбранным из группы, состоящей из позиций 30-41, 75-91, 104-120, 144-150, 186-201, 414-426, 457-472, 492-538, 550-585, 276, 410 и/или 411 зрелого полипептида по SEQ ID NO: 2, при этом предпочтительно, если полипептид содержит одно или несколько изменений, выбранных из (i) группы, состоящей из позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, (ii) группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены одной или нескольких из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены одной или нескольких из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), или (iii) группы, состоящей из позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е); то полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, вставленный или замещенный в положении, выбранном из позиций 497-585. Варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты по изобретению, могут содержать дополнительные замены, вставки или делеции по одному или нескольким положениям, соответствующим другим положениям в HSA.
В следующем воплощении варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты по изобретению, обладают большим временем полужизни, чем время полужизни у исходного или контрольного альбумина, его фрагмента или слитого полипептида, содержащего исходный или контрольный альбумин либо его фрагмент, и/или большим сродством связывания с FcRn.
В следующем воплощении варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты по изобретению, обладают меньшим временем полужизни, чем время полужизни у исходного или контрольного альбумина, его фрагмента или слитого полипептида, содержащего исходный или контрольный альбумин либо его фрагмент, и/или меньшим сродством связывания с FcRn.
Наряду с одной или несколькими заменами в одном или нескольких положениях, соответствующих позициям 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585 в SEQ ID NO: 2, варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты по изобретению, могут содержать дополнительные замены, делеции или вставки в других положениях молекул. Такие дополнительные замены, делеции или вставки могут применяться для того, чтобы изменить другие свойства молекул, такие, без ограничения, как изменения по гликозилированию, введение таких реакционноспособных групп на поверхность, как тиоловые группы, удаление/создание сайта карбамоилирования; и др.
Остатки, которые можно подвергать изменениям для того, чтобы получить реакционноспособные остатки на поверхности и которые предпочтительно могут быть применимы к изобретению, приведены в WO 2010/092135 (включена сюда в виде ссылки). Особенно предпочтительными остатками являются положения, которые соответствуют положениям в SEQ ID NO: 2.
Примеры изменений, которые можно производить в SEQ ID NO: 2 или в соответствующих положениях у других альбуминов для того, чтобы получить реакционноспособные тиоловые группы на поверхности, включают изменения, соответствующие следующим изменениям в SEQ ID NO: 2: L585C, D1C, А2С, D562C, А364С, А504С, Е505С, Т79С, Е86С, D129C, D549C, А581С, D121C, Е82С, S270C, А578С, L595LC, D1DC, А2АС, D562DC, А364АС, А504АС, Е505ЕС, Т79ТС, Е86ЕС, D129DC, D549DC, А581АС, А581АС, D121DC, Е82ЕС, S270SC, А579АС, С360*, С316*, С75*, С168*, С558*, С361*, С91*, С124*, С169* и С567*. С другой стороны, можно добавить остаток цистеина к N- или С-концу альбумина. Термин "реакционноспособный тиол" означает и/или включает тиоловые группы, происходящие из Cys, которые не связаны дисульфидной связью с цистеином и/или которые стерически доступны для связывания с таким партнером, как партнер по конъюгации.
Полинуклеотиды
Четвертый аспект изобретения касается выделенных полинуклеотидов, кодирующих любые из вариантов по изобретению. Полинуклеотид может быть выделенным полинуклеотидом. Полинуклеотид может содержаться в векторе (типа плазмиды) и/или в клетках-хозяевах.
Нуклеиново-кислотная конструкция
Изобретение также касается нуклеиново-кислотной конструкции, содержащей полинуклеотиды, кодирующие варианты по изобретению, функционально связанные с одной или несколькими контрольными последовательностями, направляющими экспрессию кодирующей последовательности в подходящих клетках-хозяевах в условиях, совместимых с контрольными последовательностями.
Полинуклеотидами можно манипулировать различными способами, чтобы обеспечить экспрессию варианта. Манипулирование полинуклеотидом перед его встраиванием в вектор может быть желательно или необходимо в зависимости от экспрессирующего вектора. Методы модификации полинуклеотидов методами рекомбинантной ДНК хорошо известны в данной области.
Контрольная последовательность может представлять собой последовательность промотора, которая распознается клетками-хозяевами для экспрессии полинуклеотида. Последовательность промотора содержит контролирующие транскрипцию последовательности, обеспечивающие экспрессию варианта. Промотором может быть любая последовательность нуклеиновой кислоты, которая проявляет транскрипционную активность в клетках-хозяевах, включая мутантные, усеченные и гибридные промоторы, которые могут быть получены из генов, кодирующих внеклеточные или внутриклеточные полипептиды, гомологичные либо гетерологичные клеткам-хозяевам.
Для дрожжевых клеток полезные промоторы получаются из генов енолазы Saccharomyces cerevisiae (ENO-1), протеазы A Saccharomyces cerevisiae (PRA1), протеазы В Saccharomyces cerevisiae (PRB1), фактора элонгации трансляции 1 Saccharomyces cerevisiae (TEF1), фактора элонгации трансляции 2 Saccharomyces cerevisiae (TEF2), галактокиназы Saccharomyces cerevisiae (GAL1), алкогольдегидрогеназы/глицеральдегид-3-фосфатдегидрогеназы Saccharomyces cerevisiae (ADH1, ADH2/GAP), триозофосфатизомеразы Saccharomyces cerevisiae (TPI), металлотионеина Saccharomyces cerevisiae (CUP1) и 3-фосфоглицераткиназы Saccharomyces cerevisiae. Другие подходящие промоторы для дрожжевых клеток описаны в Romanos et al., 1992, Yeast 8: 423-488.
Специалистам известны подходящие промоторы для использования на клетках риса и млекопитающих, таких как СНО или НЕК. Для клеток риса полезные промоторы получаются из гена 35S-PHK вируса мозаики цветной капусты (CaMV35S), алкогольдегидрогеназы кукурузы (Adh1) и альфа-Amy3.
Для клеток млекопитающих типа СНО или НЕК полезные промоторы получаются из гибридного промотора цитомегаловируса (CMV) и CAG (гибрид из раннего элемента энхансера CMV и промотора бета-актина курицы), вакуолизирующего обезьяньего вируса 40 (SV40).
Контрольная последовательность также может представлять собой последовательность подходящего терминатора транскрипции, которая распознается клетками-хозяевами для терминации транскрипции. Последовательность терминатора функционально связана с 3'-концом полинуклеотида, кодирующего вариант. Можно использовать любой терминатор, который будет функциональным в клетках-хозяевах.
Предпочтительные терминаторы для дрожжевых клеток-хозяев получаются из генов енолазы Saccharomyces cerevisiae, цитохрома с Saccharomyces cerevisiae (CYC1), алкогольдегидрогеназы Saccharomyces cerevisiae (ADH1) и глицеральдегид-3-фосфат дегидрогеназы Saccharomyces cerevisiae. Другие полезные терминаторы для дрожжевых клеток описаны в Romanos et al., 1992, supra. Специалистам известны терминаторы, подходящие для использования на клетках риса и млекопитающих, таких как СНО или НЕК. Например, для клеток риса предпочтительные терминаторы получаются из нопалинсинтазы Agrobacterium tumefaciens (Nos) и гена 35S-PHK вируса мозаики цветной капусты (CaMV35S).
Контрольная последовательность также может представлять собой последовательность, нетранслируемого участка мРНК, который важен для трансляции в клетках-хозяевах. Последовательность лидера функционально связана с 5'-концом полинуклеотида, кодирующего вариант. Можно использовать любую последовательность лидера, которая будет функциональной в клетках-хозяевах.
Подходящие последовательности лидера для дрожжевых клеток получают из генов енолазы Saccharomyces cerevisiae (ENO-1), 3-фосфоглицераткиназы Saccharomyces cerevisiae, α-фактора Saccharomyces cerevisiae и алкогольдегидрогеназы/глицеральдегид-3-фосфатдегидрогеназы Saccharomyces cerevisiae (ADH2/GAP).
Контрольная последовательность также может представлять собой последовательность полиаденилирования, которая функционально связана с 3'-концом последовательности, кодирующей вариант, а при транскрипции распознается клетками-хозяевами в качестве сигнала для добавления остатков полиаденозина к транскрибируемой мРНК. Можно использовать любую последовательность полиаденилирования, которая будет функциональной в клетках-хозяевах.
Подходящие последовательности полиаденилирования для дрожжевых клеток-хозяев описаны в Guo and Sherman, 1995, Mol. Cellular Biol. 15: 5983-5990.
Контрольная последовательность также может представлять собой участок, кодирующий сигнальный пептид, который кодирует сигнальный пептид, связанный с N-концом варианта, и направляет вариант в секреторный путь клетки. 5'-конец кодирующей последовательности полинуклеотида может от природы содержать участок, кодирующий сигнальный пептид, естественным образом связанный в одной рамке считывания трансляции с сегментом кодирующей области, кодирующим вариант. И наоборот, 5'-конец кодирующей последовательности может содержать участок, кодирующий сигнальный пептид, который является чужеродным для кодирующей последовательности. Участок, кодирующий чужеродный сигнальный пептид, может потребоваться в том случае, когда кодирующая последовательность не содержит от природы участок, кодирующий сигнальный пептид. С другой стороны, участок, кодирующий чужеродный сигнальный пептид, может просто заменять участок, кодирующий природный сигнальный пептид, в целях усиления секреции варианта. Тем не менее, можно использовать любой участок, кодирующий сигнальный пептид, который направляет экспрессируемый вариант в секреторный путь клетки-хозяина.
Подходящие сигнальные пептиды для дрожжевых клеток-хозяев получаются из генов α-фактора Saccharomyces cerevisiae и инвертазы Saccharomyces cerevisiae. Другие подходящие последовательности, кодирующие сигнальные пептиды, описаны в Romanos et al., 1992, supra. Специалистам известны подходящие сигнальные пептиды для использования на клетках риса и клетках млекопитающих, таких как СНО или НЕК.
Если на N-конце варианта присутствуют участки и сигнального пептида, и пропептида, то участок пропептида располагается возле N-конца варианта, а участок сигнального пептида располагается возле N-конца участка пропептида.
Дальнейшие предпочтения для четвертого аспекта изобретения представлены после тринадцатого аспекта изобретения.
Способы получения
Пятый аспект изобретения касается способа получения вариантов по изобретению. Варианты по изобретению могут быть получены с помощью методов, хорошо известных специалистам. Одним из удобных способов является клонирование нуклеиновой кислоты, кодирующей исходный альбумин либо его фрагмент или слитый полипептид, содержащий альбумин или его фрагмент, модифицирование данной нуклеиновой кислоты для введения требуемых замен в одно или несколько положений, соответствующих позициям 30-41, 75-91, 104-120, 144-150, 186-201, 414-426, 457-472, 492-538, 550-585, 276, 410 и/или 411 зрелого полипептида по SEQ ID NO: 2, при этом предпочтительно, если полипептид содержит одно или несколько изменений, выбранных из (i) группы, состоящей из позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, (ii) группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены одной или нескольких из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены одной или нескольких из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), или (iii) группы, состоящей из позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е); то полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, вставленный или замещенный в положении, выбранном из позиций 497-585, получение подходящей генетической конструкции, в которой модифицированная нуклеиновая кислота находится в функциональной связи с подходящими регуляторными генетическими элементами, такими как промотор, терминатор, сайты активации, сайты связывания с рибосомами и т.д., введение генетической конструкции в подходящий организм-хозяин, культивирование трансформированного организма-хозяина в условиях, ведущих к экспрессии варианта, и выделение варианта. Все эти методы известны в данной области, а разработка подходящего способа получения определенного варианта по изобретению находится в компетенции рядовых специалистов.
Вариант полипептида по изобретению также может соединяться с сигнальной последовательностью для того, чтобы вариант полипептида секретировался в культуральную среду в процессе культивирования трансформированного организма-хозяина. Как правило, выгодно иметь вариант полипептида, который секретируется в культуральную среду, потому что это облегчает выделение и очистку.
Методы получения вариантов полипептидов также изложены в WO 2009019314 (включено в виде ссылки), и эти способы также могут применяться в изобретении.
Альбумины успешно экспрессировали в виде рекомбинантных белков в целом ряде организмов, включая грибы (в том числе Aspergillus (WO 06066595), Kluyveromyces (Fleer 1991, Bio/technology 9, 968-975), Pichia (Kobayashi 1998 Therapeutic Apheresis 2, 257-262) и Saccharomyces (Sleep 1990, Bio/technology 8, 42-46)), бактерии (Pandjaitab 2000, J. Allergy Clin. Immunol. 105, 279-285)), животных (Barash 1993, Transgenic Research 2, 266-276) и растения (в том числе картофель и табак (Sijmons 1990, Bio/technology 8, 217, и Farran 2002, Transgenic Research 11, 337-346), а также рис (например, Oryza sativa) и клетки млекопитающих, такие как СНО и НЕК. Варианты полипептидов по изобретению предпочтительно получают рекомбинантным способом в подходящих клетках-хозяевах. В принципе можно использовать любые клетки-хозяева, способные вырабатывать полипептид в подходящем количестве, а выбор клетокхозяев по изобретению находится в компетенции рядовых специалистов. Предпочтительным организмом-хозяином являются дрожжи, предпочтительно выбранные из числа Saccharomycacae, более предпочтительно Saccharomyces cerevisiae.
Варианты полипептидов по изобретению могут быть выделены и очищены из культуральной среды с использованием комбинации известных методов разделения, таких как фильтрация, центрифугирование, хроматография и аффинные методы разделения и др. Очистка вариантов по изобретению с использованием определенной комбинации таких известных стадий разделения находится в компетенции рядовых специалистов. В качестве примера методов очистки в применении к вариантам по изобретению можно привести методы, изложенные в WO 00/44772.
Варианты полипептидов по изобретению могут применяться для доставки терапевтически полезных соединений (включая профилактически полезные соединения типа вакцин) в организм нуждающегося в этом животного или человека. Такие терапевтически полезные соединения включают, без ограничения, метки и легко определяемые соединения для применения в диагностике, как-то в различных методах визуализации; фармацевтически активные соединения типа лекарственных препаратов или связывающиеся специфически молекулы типа антител. Варианты по изобретению даже могут соединяться с двумя или несколькими различными терапевтически полезными соединениями, например, антителом и лекарственным препаратом, что придает комбинированной молекуле способность к специфическому связыванию с требуемой мишенью и тем самым обеспечивает высокую концентрацию присоединенного препарата у данной конкретной мишени.
Дальнейшие предпочтения для пятого аспекта изобретения представлены после тринадцатого аспекта изобретения.
Слитые полипептиды
Шестой аспект изобретения касается слитых полипептидов. Следовательно, варианты альбумина или их фрагменты по изобретению могут быть слиты с неальбуминовым полипептидным партнером по слиянию. В принципе партнером по слиянию может быть любой полипептид, но вообще предпочтительно, чтобы партнером по слиянию был полипептид, обладающий терапевтическими, профилактическими (включая вакцины), диагностическими, визуализационными или другими полезными свойствами. Такие свойства можно назвать "фармацевтически полезными свойствами". Слитые полипептиды, содержащие альбумин или его фрагменты, известны в данной области. Было обнаружено, что такие слитые полипептиды, содержащие альбумин или его фрагмент и полипептид-партнер по слиянию обладают большим временем полужизни в плазме по сравнению с не слитым полипептидом-партнером самим по себе. В соответствии с изобретением можно изменять время полужизни слитых полипептидов по изобретению по сравнению с соответствующими слитыми полипептидами из предшествующего уровня техники. "Изменения" включают как увеличение времени полужизни, так и уменьшение времени полужизни. Предпочтительным является увеличение времени полужизни. Изобретение позволяет адаптировать время полужизни к желательному сроку.
Одна или несколько терапевтических, профилактических (включая вакцины), диагностических, визуализационных или других полезных молекул могут быть слиты по N-концу, С-концу альбумина, вставлены в петлю из структуры альбумина или по любой комбинации из них. Это может включать и линкерные последовательности, разделяющие различные компоненты слитого полипептида.
Сведения касательно слияния альбумина или его фрагментов известны в данной области, а специалистам известно, что такие сведения могут быть применимы и к настоящему изобретению. WO 2001/79271 A (в частности, стр.9 и/или таблица 1), WO 2003/59934 А (в частности, с.9 и/или таблица 1), WO 03/060071 (в частности, таблица 1) и WO 01/079480 (в частности, таблица 1) (которые все включены сюда в виде ссылки во всей полноте) также содержат примеры терапевтических, профилактических (включая вакцины), диагностических, визуализационных и других полезных полипептидов, которые могут быть слиты с альбумином или его фрагментами, причем эти примеры применимы и к настоящему изобретению. Дальнейшие предпочтения для шестого аспекта изобретения представлены после тринадцатого аспекта изобретения.
Конъюгаты
Седьмой аспект изобретения касается конъюгатов (и конъюгирования). Следовательно, варианты альбумина или его фрагменты по изобретению могут быть конъюгированы со второй молекулой ("партнером по конъюгации") с применением известных в данной области методов. Партнером по конъюгации может быть терапевтическая, профилактическая (включая вакцины), диагностическая, визуализационная или другая полезная молекула. Партнером по конъюгации может быть полипептид или не полипептидное химическое вещество. Партнером по конъюгации может быть полипептид, химическое вещество (например, синтезированный химическим способом лекарственный препарат) или нуклеиновая кислота (например, ДНК, РНК, siPHK).
Данная вторая молекула может включать диагностическую или визуализационную молекулу, и в этом воплощении конъюгат может быть полезен в качестве инструмента диагностики, например, в томографии; или же вторая молекула может представлять собой терапевтическое или профилактическое (например, вакцина) соединение, и в этом воплощении конъюгат может использоваться в терапевтических или профилактических (например, вакцинация) целях, при этом конъюгат будет обладать терапевтическими или профилактическими свойствами терапевтического или профилактического соединения, а также желательным временем полужизни в плазме, которое обеспечит альбуминовая часть конъюгата. Конъюгаты альбумина с терапевтическими молекулами известны в данной области, и было установлено, что такие конъюгаты имеют большее время полужизни в плазме по сравнению с неконъюгированной, свободной терапевтической молекулой самой по себе. В соответствии с изобретением, можно изменять сродство связывания с FcRn и/или время полужизни конъюгата по изобретению в плазме по сравнению с соответствующими конъюгатами из предшествующего уровня техники. "Изменение" включает как увеличение времени полужизни в плазме, так и уменьшение времени полужизни в плазме, как повышение сродства связывания с FcRn, так и снижение сродства связывания с FcRn. Предпочтительным является повышение времени полужизни в плазме и/или сродства связывания с FcRn. Конъюгаты легко соединяются через свободную тиоловую группу, находящуюся на поверхности HSA (остаток аминокислоты 34 у зрелого HSA) с применением хорошо известных химических методов.
В одном особенно предпочтительном аспекте вариант альбумина или его фрагмент конъюгирован с полезным терапевтическим или профилактическим (включая вакцины) соединением, а конъюгат применяется для лечения таких заболеваний у нуждающихся в этом пациентов, которые реагируют на определенное выбранное терапевтическое соединение. Методы конъюгирования таких терапевтически полезных соединений с вариантами альбумина или их фрагментами известны в данной области. В WO 2009/019314 (включенной сюда путем ссылки во всей полноте) приведены примеры методов, пригодных для конъюгирования терапевтических соединений с полипептидами, которые применимы и к настоящему изобретению. Также в WO 2009/019314 приведены примеры соединений и молекул, которые могут быть конъюгированы с замещенным трансферином, и эти примеры также применимы к изобретению. Содержание WO 2009/019314 включено сюда путем ссылки.
HSA в своей природной форме содержит одну свободную тиоловую группу (у Cys34), которую удобно использовать для конъюгации. В качестве конкретного воплощения данного аспекта вариант альбумина или его фрагмент может содержать дополнительные модификации, служащие для создания дополнительных свободных тиоловых групп на поверхности. Это дает преимущество в том, что повышается полезная нагрузка у варианта альбумина или его фрагмента с тем, что с каждой молекулой варианта альбумина или его фрагмента можно конъюгировать более одной молекулы терапевтического (например, профилактического) соединения, или же с каждой молекулой варианта альбумина или его фрагмента можно конъюгировать два или несколько различных терапевтических соединений, например, соединение, обладающее свойствами таргетинга типа антитела, к примеру, специфичного к опухоли; и цитотоксический препарат, конъюгированный с вариантом альбумина или его фрагментом, получая высокоспецифичное лекарственное средство против опухоли. Сведения о конкретных остатках, которые могут быть модифицированы для получения дополнительных свободных тиоловых групп на поверхности, приводятся в параллельной патентной заявке WO 2010/092135, которая включена путем ссылки.
С другой стороны, партнер по конъюгации может быть конъюгирован со слитым полипептидом (описанным здесь) с образованием молекулы, содержащей партнера по слиянию, слитого с альбумином, а также партнера по конъюгации, конъюгированного с тем же самым альбумином или даже с партнером по слиянию.
Дальнейшие предпочтения для седьмого аспекта изобретения представлены после тринадцатого аспекта изобретения.
Ассоциаты
Восьмой аспект изобретения касается ассоциатов. Следовательно, варианты альбумина или их фрагменты могут применяться также и в виде "ассоциатов". При этом термин "ассоциат" означает соединение, содержащее вариант альбумина или его фрагмент и другое соединение, связанное или ассоциированное с вариантом альбумина или его фрагментом нековалентными связями. В качестве примера таких ассоциатов можно привести ассоциат, состоящий из варианта альбумина и липида, связанного с альбумином гидрофобными взаимодействиями. Такие ассоциаты известны в данной области, и они могут быть получены хорошо известными методами. В качестве примера предпочтительного ассоциата по изобретению можно привести ассоциат, содержащий вариант альбумина и таксан, таксол или производное таксола (например, паклитаксель). Другие примеры ассоциатов содержат терапевтические, профилактические (включая вакцины), диагностические, визуализационные и другие полезные молекулы.
Время полужизни ассоциата альбумина по изобретению может быть больше или меньше, чем время полужизни самого "другого соединения". Время полужизни ассоциата альбумина по изобретению может быть больше или меньше, чем время полужизни у аналогичного/эквивалентного ассоциата альбумина, содержащего контрольный альбумин типа нативного HSA (вместо варианта или производного альбумина по изобретению) и "другое соединение". Также и сродство связывания с FcRn у ассоциата альбумина по изобретению может быть больше или меньше, чем сродство связывания с FcRn у аналогичного/эквивалентного ассоциата альбумина, содержащего контрольный альбумин типа нативного HSA (вместо варианта или производного альбумина по изобретению) и "другое соединение". Способы получения ассоциатов хорошо известны специалистам в данной области, например, получение рецептур (путем ассоциации) HSA с липидными соединениями описано в Hussain R. and Siligardi G. (2006) International Journal of Peptide Research and Therapeutics, vol.12, no.3, pp.311-315. Дальнейшие предпочтения для восьмого аспекта изобретения представлены после тринадцатого аспекта изобретения.
Другие применения
Девятый аспект изобретения касается применения вариантов альбумина, их фрагментов, слитых белков или конъюгатов либо наночастиц или ассоциатов. Варианты альбумина или их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты по изобретению, имеют преимущество в том, что у них изменяется сродство связывания в FcRn и/или время полужизни в плазме по сравнению с исходным или контрольным альбумином либо его фрагментами или слитыми полипептидами, содержащими исходный или контрольный альбумин или его фрагменты. Это дает преимущество в том, что можно выбрать сродство связывания с FcRn и/или время полужизни в плазме у конъюгатов, содержащих вариант альбумина или его фрагмент или слитый полипептид, содержащий вариант альбумина или его фрагмент, или ассоциатов, содержащих вариант альбумина или его фрагмент по изобретению, в соответствии с определенной терапевтической задачей.
Например, для конъюгатов, ассоциатов или слитых полипептидов, используемых в целях визуализации у животных или человека, когда визуализирующая молекула имеет очень короткое время полужизни, а конъюгат или слитый полипептид, содержащий HSA, имеет намного большее время полужизни в плазме, чем это нужно для визуализации, было бы выгодно использовать вариант альбумина или его фрагмент по изобретению, обладающий более коротким временем полужизни в плазме, чем у исходного или контрольного альбумина или его фрагмента с тем, чтобы получить конъюгаты слитых полипептидов с таким временем полужизни в плазме, которое будет достаточно продолжительным для визуализации, но достаточно коротким для выведения из организма того пациента, которому его вводили.
В другом примере для конъюгатов, ассоциатов или слитых полипептидов, содержащих терапевтическое соединение, эффективное для лечения или ослабления определенного заболевания у пациента, нуждающегося в таком лечении, было бы выгодно использовать вариант альбумина или его фрагмент, имеющий большее время полужизни в плазме, чем у исходного или контрольного альбумина или его фрагмента с тем, чтобы получить ассоциаты или конъюгаты или слитые полипептиды с большим временем полужизни в плазме, которые будут иметь преимущество в том, что ассоциат или конъюгат или слитый полипептид по изобретению можно было бы вводить реже или в меньших дозах при меньшем количестве побочных эффектов по сравнению с использованием исходного или контрольного альбумина или его ассоциатов или фрагментов. Например, изобретением предусмотрен способ лечения пролиферативных заболеваний у индивидов, включающий введение индивиду эффективного количества ассоциата по изобретению, при этом ассоциат содержит таксан, таксол или производное таксола (например, паклитаксель).
В следующем аспекте изобретение касается композиций, содержащих варианты альбумина, их ассоциаты или фрагменты, фрагменты вариантов альбумина или их ассоциаты или слитые полипептиды, содержащие варианты альбумина или их фрагменты по изобретению. Предпочтительно композиции представляют собой фармацевтические композиции. Композиции могут быть получены известными в данной области методами, которые изложены в признанных руководствах по фармацевтике. Поскольку у вариантов альбумина, их фрагментов, слитых полипептидов, конъюгатов или ассоциатов сродство связывания с FcRn и/или время полужизни в плазме модулировано, т.е. оно больше или меньше, чем у контрольной молекулы, то у композиции тоже будет измененное сродство связывания с FcRn и/или модулированное время полужизни в плазме по сравнению с эквивалентной композицией, содержащей контрольную молекулу вместо описанного здесь варианта альбумина, его фрагмента, слитого полипептида, конъюгата или ассоциата. Композиция может быть представлена вакциной. Полипептид по изобретению может быть активным началом препарата или наполнителем. Необязательно композиция имеет вид стандартной дозовой формы.
Предпочтительно варианты альбумина, их фрагменты, слитые полипептиды, конъюгаты или ассоциаты имеют большее время полужизни в плазме, чем у контрольной молекулы, например, композиция та же самая, только альбуминовый компонент (например, вариант альбумина, его фрагмент, слитый белок, конъюгат или ассоциат) представлен альбумином дикого типа (например, HSA) или его вариантом, фрагментом, слитым полипептидом, конъюгатом или ассоциатом.
В предпочтительном воплощении композиции содержат вариант альбумина или его фрагмент по изобретению и соединение, содержащее фармацевтически полезную часть и домен связывания альбумина (ABD). В соответствии с изобретением ABD означает сайт, отрезок или домен, способный связываться с циркулирующим альбумином in vivo и тем самым осуществлять транспорт в кровотоке ABD и любых соединений или молекул, связанных с данным ABD. ABD's известны в данной области, и было показано, что они связываются очень прочно с альбумином, так что соединение, содержащее связанный с ABD альбумин, в определенной степени ведет себя как единая молекула. Авторы изобретения поняли, что использование вариантов альбумина или их фрагментов по изобретению вместе с соединением, содержащим фармацевтически полезную часть и ABD, дает возможность изменять сродство связывания с FcRn и/или время полужизни в плазме у соединения, содержащего фармацевтически полезную часть и ABD, по сравнению с тем, когда данное соединение вводится нуждающемуся в этом пациенту само по себе или в лекарственной форме, содержащей природный альбумин или его фрагмент.
Варианты альбумина или их фрагменты, либо конъюгаты, содержащие варианты альбумина или их фрагменты, либо слитые полипептиды, содержащие варианты альбумина или их фрагменты, либо ассоциаты, содержащие варианты альбумина или их фрагменты по изобретению, также могут быть включены в нано- или микрочастицы при помощи хорошо известных в данной области методов. Предпочтительный способ получения нано- или микрочастиц, который применим к вариантам альбумина или их фрагментам по изобретению, изложен в WO 2004/071536, WO 2008/007146 или Oner & Groves (Pharmaceutical Research, vol 10(9), 1993, pages 1387-1388), которые включены сюда путем ссылки.
Дальнейшие предпочтения для девятого аспекта изобретения представлены после тринадцатого аспекта изобретения.
Композиции
Десятый аспект изобретения касается композиций. Следовательно, изобретение также направлено на применение вариантов альбумина или их фрагментов либо слитых полипептидов, содержащих варианты альбумина или их фрагменты, либо конъюгатов, содержащих варианты альбумина или их фрагменты, либо ассоциатов, содержащих варианты альбумина или их фрагменты, для изготовления фармацевтических композиций, причем варианты альбумина или их фрагменты либо слитые полипептиды, содержащие варианты альбумина или их фрагменты, либо конъюгаты, содержащие варианты альбумина или их фрагменты, либо ассоциаты, содержащие варианты альбумина или их фрагменты, обладают измененным сродством связывания с FcRn и/или измененным временем полужизни в плазме по сравнению с HSA или соответствующим его фрагментом или слитым полипептидом, содержащим HSA или его фрагмент, или конъюгатом, содержащим HSA.
При этом 'соответствующий фрагмент' HSA означает такой фрагмент HSA, который совмещается с и имеет такое же количество аминокислот, что и фрагмент варианта альбумина, с которым он сравнивается. Точно так же 'соответствующий' слитый полипептид, содержащий HSA, или конъюгат, содержащий HSA, должен означать молекулы, имеющие такой же размер и аминокислотную последовательность, что и слитый полипептид или конъюгат, содержащий тот вариант альбумин, с которым он сравнивается. Дальнейшие предпочтения для десятого аспекта изобретения представлены после тринадцатого аспекта изобретения.
Наночастицы
Одиннадцатый аспект изобретения касается наночастиц, содержащих приведенные здесь варианты, слитые полипептиды, конъюгаты, ассоциаты, наночастицы, композиции или полинуклеотиды.
Методы включения молекул в нано- или микрочастицы известны в данной области. Предпочтительные способы получения нано- или микрочастиц, которые применимы к вариантам альбумина, их фрагментам, слитым полипептидам, конъюгатам или ассоциатам по изобретению, изложены в WO 2004/071536, WO 2008/007146 и Oner & Groves (Pharmaceutical Research, vol 10(9), 1993, pages 1387-1388), которые включены сюда путем ссылки. Предпочтительно средний диаметр наночастиц составляет от 5 до 1000 нм, более предпочтительно 5, 10, 20, 30, 40, 50, 80, 100, 130, 150, 200, 300, 400, 500, 600, 700, 800, 900, or 999 to 5, 10, 20, 30, 40, 50, 80, 100, 130, 150, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 нм. Преимущество микрочастиц диаметром менее 200 нм, а еще более предпочтительно менее 130 нм, заключается в том, что они поддаются стерилизации фильтрованием через фильтры на 0,2 мкм (микрон). Предпочтительно средний диаметр микрочастиц составляет от 1000 нм (1 мкм) до 100 мкм (микрон), более предпочтительно от 1, 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 до 1, 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 мкм (микрон).
Дальнейшие предпочтения для одиннадцатого аспекта изобретения представлены после тринадцатого аспекта изобретения.
Двенадцатый аспект настоящего изобретения касается применения вариантов, слитых полипептидов, конъюгатов, ассоциатов, наночастиц, композиций или полинуклеотидов, приведенных здесь, в способах лечения или профилактики или диагностики. В некоторых ситуациях было бы выгодно использовать варианты альбумина, их фрагменты, слитые полипептиды, конъюгаты, ассоциаты или композиции с большим временем полужизни в плазме, чем у контрольной молекулы или композиции, так как это дает преимущество в том, что варианты альбумина, их фрагменты, слитые полипептиды, конъюгаты, ассоциаты или композиции можно было бы вводить реже или в меньших дозах (а тем самым и с меньшим количеством побочных эффектов) по сравнению с использованием контрольной молекулы или композиции. Что касается применения вариантов, слитых полипептидов, конъюгатов, ассоциатов, наночастиц, композиций или полинуклеотидов, то молекула альбумина может содержать одно или несколько из приведенных здесь изменений.
Дальнейшие предпочтения для двенадцатого аспекта изобретения представлены после тринадцатого аспекта изобретения.
В тринадцатом аспекте изобретения предусмотрен способ изменения времени полужизни молекул, включающий:
(a) если молекула представляет собой полипептид, то слияние или конъюгирование молекулы с приведенным здесь полипептидом или с приведенным здесь конъюгатом; ассоциирование молекулы с приведенным здесь полипептидом или с приведенным здесь конъюгатом; включение молекулы в приведенные здесь наночастицы или в приведенные здесь композиции;
(b) если молекула не представляет собой полипептид, то конъюгирование молекулы с приведенным здесь полипептидом или с приведенным здесь конъюгатом; ассоциирование молекулы с приведенным здесь полипептидом или с приведенным здесь конъюгатом; включение молекулы в приведенные здесь наночастицы или в приведенные здесь композиции.
Примеры "молекул" включают молекулы, применимые в терапии, профилактике (включая те, что применяются в вакцинах либо в качестве активного фармацевтического ингредиента, либо в качестве наполнителя), визуализации или диагностике, типа тех, что описаны здесь.
Предпочтения
Далее представлены предпочтения для всех аспектов изобретения. Специалистам должно быть понятно, что любой аспект изобретения можно комбинировать с другим аспектом или аспектами изобретения и/или с одним или несколькими предпочтениями для всех аспектов изобретения и/или с другими приведенными здесь раскрытиями.
Варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты, их фрагменты, конъюгаты, наночастицы, ассоциаты или композиции могут иметь большее или меньшее время полужизни в плазме, предпочтительно большее, чем время полужизни в плазме соответствующего альбумина либо его фрагмента или слитых полипептидов, содержащих альбумин или его фрагменты, его фрагментов, конъюгатов, наночастиц, ассоциатов или композиций, или же более сильное или менее сильное связывание с FcRn, предпочтительно менее сильное. Предпочтительно варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты, их фрагменты, конъюгаты, наночастицы, ассоциаты или композиции имеют большее время полужизни в плазме, чем время полужизни в плазме у HSA или соответствующего альбумина либо его фрагментов или слитых полипептидов, содержащих альбумин или его фрагменты, их фрагментов, конъюгатов, наночастиц, ассоциатов или композиций.
С другой стороны, это можно выразить и так, что варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты, их фрагменты, конъюгаты, наночастицы, ассоциаты или композиции имеют меньшие значения KD для FcRn (например, shFcRn), чем соответствующее значение KD для FcRn у HSA или соответствующего его фрагмента или слитого полипептида, содержащего HSA или его фрагмент. Предпочтительно значение KD у вариантов альбумина либо их фрагментов или слитых полипептидов, содержащих варианты альбумина или их фрагменты, их фрагментов, конъюгатов, наночастиц, ассоциатов или композиций составляет менее 0,9×KD для FcRn у HSA, более предпочтительно менее 0,5×KD для FcRn у HSA, более предпочтительно менее 0,1×KD для FcRn у HSA, еще более предпочтительно менее 0,05×KD для FcRn у HSA, еще более предпочтительно менее 0,02×KD для FcRn у HSA и наиболее предпочтительно менее 0,01×KD для FcRn у HSA (где × означает "умноженное на"). Значение KD у вариантов альбумина либо их фрагментов или слитых полипептидов, содержащих варианты альбумина или их фрагменты, их фрагментов, конъюгатов, наночастиц, ассоциатов или композиций может находиться между значением KD для FcRn у альбумина дикого типа (например, SEQ ID No. 2) и значением KD для FcRn у HSA K573P (SEQ ID No. 3). Такие значения KD означают большее сродство связывания, чем сродство связывания между HSA и FcRn. Большее сродство связывания указывает на большее время полужизни, к примеру, время полужизни в плазме.
С другой стороны, варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты, их фрагменты, конъюгаты, наночастицы или композиции могут иметь меньшее время полужизни в плазме, чем время полужизни в плазме у HSA или соответствующего его фрагмента или слитого полипептида, содержащего HSA или его фрагмент.
Это можно выразить и так, что варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты, их фрагменты, конъюгаты, наночастицы, ассоциаты или композиции имеют большие значения KD для FcRn (например, shFcRn), чем соответствующее значение KD для FcRn у HSA или соответствующего его фрагмента или слитого полипептида, содержащего HSA или его фрагмент, его фрагмента, конъюгата, наночастиц, ассоциата или композиции. Предпочтительно значение KD у вариантов альбумина либо их фрагментов или слитых полипептидов, содержащих варианты альбумина или их фрагменты, их фрагментов или конъюгатов, содержащих варианты альбумина или их фрагменты, составляет более 2×KD для FcRn у HSA, более предпочтительно более 5×KD для FcRn у HSA, более предпочтительно более 10×KD для FcRn у HSA, еще более предпочтительно более 25×KD для FcRn у HSA и еще более предпочтительно более 50×KD для FcRn у HSA. Варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты, их фрагменты, конъюгаты, наночастицы, ассоциаты или композиции могут и совсем не связываться с FcRn.
Варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты, их фрагменты, конъюгаты, наночастицы, ассоциаты или композиции, содержащие варианты альбумина или их фрагменты, предпочтительно представляют собой варианты альбумина либо их фрагменты или слитые полипептиды, содержащие варианты альбумина или их фрагменты, их фрагменты, конъюгаты, наночастицы, ассоциаты или композиции, содержащие варианты альбумина или их фрагменты по изобретению. Меньшее сродство связывания указывает на меньшее время полужизни, к примеру, время полужизни в плазме.
Одним из преимуществ изобретения является то, что оно позволяет адаптировать время полужизни альбумина, вариантов альбумина или их фрагментов либо слитых полипептидов, содержащих варианты альбумина или их фрагменты, их фрагментов, конъюгатов, наночастиц или композиции таким образом, чтобы получить такое сродство связывания или время полужизни, которое соответствует потребностям клиента.
При определении и/или сравнении значений KD можно использовать один или несколько (а предпочтительно все) из следующих параметров:
прибор: Biacore 3000 (GE Healthcare)
проточная ячейка: сенсорный чип СМ5
FcRn: FcRn человека, предпочтительно растворимый FcRn человека, необязательно конъюгированный с тэгом типа GST
количество FcRn: 1500-2500 отн. ед.
химизм присоединения: присоединение по аминам (например, как описано в методике, предоставленной изготовителем прибора)
способ присоединения: присоединение может осуществляться путем введение 10 мкг/мл белка в 10 мМ ацетате натрия рН 5,0 (GE Healthcare). В качестве рабочего буфера и буфера для разведения можно использовать фосфатный буфет (67 мМ фосфатный буфер, 0,15 М NaCl, 0,005% Tween 20) при рН 6,0. Регенерация поверхности может проводиться путем введения буфера HBS-EP (0,01 М HEPES, 0,15 М NaCl, 3 мМ EDTA, 0,005% сурфактанта Р20) при рН 7,4 (Biacore AB)
вводимое количество исследуемой молекулы (например, HSA или варианта): 1,0-0,5 мМ
скорость введения при введении: постоянная, например, 40 мкл/мл
температура при введении: 25°С
программное обеспечение для анализа данных: программа BIAevaluation 4.1 (BIAcore AB).
В изобретении приводятся те положения в SEQ ID NO: 2 (а тем самым и эквивалентные положения у альбуминов и фрагментов из сыворотки человека и альбуминов из сыворотки других видов), которые можно подвергнуть изменениям для того, чтобы модулировать (повысить или уменьшить) сродство связывания и/или время полужизни например, время полужизни в плазме у альбумина, его фрагментов, слитых полипептидов, конъюгатов, ассоциатов, наночастиц или композиций. Изменения могут представлять собой замены, вставки или делеции. Предпочтительны замены.
Замены или вставки могут включать или не включать введение консервативных аминокислот, т.е. консервативных по отношению к аминокислоте в данном положении. Примеры консервативных аминокислот представлены группами из фиг.3: алифатические, ароматические, гидрофобные, заряженные, полярные, положительные, мелкие и небольшие.
Предпочтительными положениями являются те, которые взаимодействуют с FcRn при связывании и/или влияют на взаимодействие альбумина, его фрагментов, слитых полипептидов, конъюгатов, ассоциатов, наночастиц или композиций с FcRn.
Предпочтительные положения соответствуют положениям в SEQ ID NO: 2, выбранным из позиций: (а) 492-538; (b) 505, 531, 524, 472, 108, 190, 197 и 425; (с) 186-201; (d) 457-472; (e) 414-426; (f) 104-120; (g) 75-91; (h) 144-150; (i) 30-41, (j) 550-585 и (k) 276, 410 и 414, с одним или несколькими из А, С, D, E, F, G, H, I, К, L, М, N, P, Q, R, S, Т, V, W, Y и/или стоп-кодоном в положении от 497 до 585;
при этом предпочтительно, если полипептид содержит одно или несколько изменений, выбранных из (i) группы, состоящей из позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, (ii) группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены одной или нескольких из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены одной или нескольких из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), и/или (iii) группы, состоящей из позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, H464N, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е); то полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, вставленный или замещенный в положении, выбранном из позиций 497-585.
Более предпочтительно, если полипептид содержит одно или несколько изменений, выбранных из (ii) группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 (в особенности замены одной или нескольких из позиций 34, 38, 40, 76, 80, 82, 83, 86, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 из природного остатка (например, не остатка Cys) на Cys и/или делеции или замены одной или нескольких из позиций 91, 200, 461, 514, 558, 559, 567 из Cys на остаток не Cys), и/или (iii) группы, состоящей из позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 (в особенности одной или нескольких из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е); то полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 35, 36, 37, 39, 41, 77, 78, 79, 81, 84, 85, 87, 88, 89, 105, 106, 107, 108, 109, 110, 111, 112, 117, 118, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 462, 463, 465, 466, 467, 468, 469, 470, 472, 497, 502, 507, 508, 509, 511, 513, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 534, 551, 552, 553, 554, 555, 556, 557, 561, 568, 569, 570, 571, 572, 576, 583, и/или стоп-кодон, вставленный или замещенный в положении, выбранном из позиций 497-585.
В соответствии с изобретением, предпочтительно, если вариант альбумина содержит изменение, выбранное из D63N, Е82К, Е84К, D87N, L90P, К106Е, R114G, Е119К, V146E, Н464А, C201F, D494N, Е501К, Е503К, Е505К, Н510А, I513N, D518N, К525Е, Е529К, V533M, Н535А, К536Е, I537N, D550G, D550A, V557M, К560Е, D563N, Е565К, Е570К, К573Е, K574N, К574Е, К584Е, то это изменение представлено в сочетании с одним или несколькими изменениями, описанными здесь. Могут быть представлены и другие изменения в одной или нескольких их позиций 63, 82, 84, 87, 90, 106, 114, 119, 146, 464, 201, 494, 501, 503, 505, 510, 513, 518, 525, 529, 533, 535, 536, 537, 550, 550, 557, 560, 563, 565, 570, 573, 574, 574, 584 в сочетании с одним или несколькими изменениями, описанными здесь.
Может быть введен стоп-кодон по любому из положений 497-585, т.е. по любому из положений 497, 498, 499, 500, 501, 502, 503, 504, 505, 506, 507, 508, 509, 510, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 535, 536, 537, 538, 539, 540, 541, 542, 543, 544, 545, 546, 547, 548, 549, 550, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 566, 567, 568, 569, 570, 571, 572, 573, 574, 575, 576, 577, 578, 579, 580, 581, 582, 583, 584, 585, более предпочтительно от 570 до 585 (или эквивалентном положении относительно SEQ ID NO: 2). Введение может осуществляться путем вставки или замены. Введение такого, стоп-кодона может проводиться в дополнение или вместо описанных здесь изменений.
Для вставки одной или нескольких аминокислот с N-стороны ("Х-1") от аминокислоты в положении, выбранном из группы, состоящей из позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, не обязательно может быть дополнительное изменение, выбранное из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, введенный или замещенный в положении, выбранном из 497-585.
С другой стороны, для вставки одной или нескольких аминокислот с С-стороны ("Х+1") от аминокислоты в положении, выбранном из группы, состоящей из позиций 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584, предпочтительно должно быть дополнительное изменение, выбранное из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, введенный или замещенный в положении, выбранном из 497-585.
Аминокислотным остатком HSA, взаимодействующим с FcRn, считается любой аминокислотный остаток HSA, расположенным менее чем в 10 Ǻ (к примеру, менее чем в 5 Ǻ) от какой-либо аминокислоты в FcRn, или же любой аминокислотный остаток, участвующий в образовании водородной связи, солевого мостика либо в полярном или неполярном взаимодействии с аминокислотным остатком, расположенным менее чем в 10 Ǻ от какой-либо аминокислоты в FcRn. Предпочтительно такие аминокислотные остатки в HSA располагаются менее чем в 10 Ǻ от аминокислот в FcRn, более предпочтительно менее чем в 6 Ǻ от аминокислот в FcRn и наиболее предпочтительно менее чем в 3 Ǻ от аминокислот в FcRn.
Предпочтительно аминокислотные остатки альбумина, которые влияют на связывание альбумина с FcRn, располагаются на поверхности связывания типа связывающей поверхности, приведенной на фиг.9 (розовая, по серой шкале это выглядит как самый темный, почти черный участок). Аминокислоты могут находиться в той части связывающей поверхности, которая представлена доменом I, или в той части связывающей поверхности, которая представлена доменом III альбумина.
Таким образом, одно или несколько изменений могут находиться в домене I, например, в положениях, выбранных из группы, состоящей из 30-41, 75-91, 104-120, 144-150, 186-201. Одно или несколько изменений могут находиться в домене II, например, в положении 276. Одно или несколько изменений могут находиться в домене III, например, в положениях, выбранных из группы, состоящей из 414-426, 457-472, 492-538, 550-585.
Особенно предпочтительны позиции 83, 108, 109, 110, 111, 112, 105-120, 190, 197, 425, 472, 505, 510, 524, 527, 531, 534.
Предпочтительно полипептид сохраняет практически такую же третичную структуру (или, для фрагмента, соответствующую часть структуры), что и контрольный или исходный альбумин типа HSA. Специалистам должен быть понятен термин "практически такая же третичная структура", имея в виду, что ожидается некоторая степень вариаций по третичной структуре, так как все белки имеют некоторую степень структурной гибкости. Это в особенности относится к полипептидам, обладающим большим сродством связывания с FcRn, чем у исходного или контрольного альбумина (например, HSA).
Необязательно могут сохраняться один или несколько остатков His относительно исходного альбумина. Например, относительно SEQ ID NO: 2 могут сохраняться один или несколько из следующих остатков His: 3, 9, 39, 67, 105, 128, 146, 242, 247, 288, 338, 367, 440, 464, 510, 535. Сохраняются один или несколько, предпочтительно все, из остатков His в домене I (т.е. 3, 9, 39, 67, 105, 128, 146.). Сохраняются один или несколько, предпочтительно все, из остатков His в домене II (т.е. 242, 247, 288, 338, 367). Сохраняются один или несколько, предпочтительно все, из остатков His в домене III (т.е. 440, 464, 510, 535). Могут сохраняться один или несколько или все три из His 464, 510, 535.
Предпочтительно у полипептида сохраняются по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 или 17 дисульфидных связей альбумина. У полипептида, происходящего из полноразмерного альбумина, предпочтительно сохраняются все дисульфидные связи, обычно присутствующие в этом альбумине. У полипептида, происходящего из фрагмента альбумина, предпочтительно сохраняются все дисульфидные связи, обычно присутствующие в этом фрагменте. Предпочтительно сохраняется Cys-34 (или его эквивалент в альбуминах не человека).
Если изменение находится в положении, выбранном из одного или нескольких из 75, 90, 91, 200, 461, 514, 558, 559 и 567, то предпочтительно также должно быть одно или несколько изменений в положениях, выбранных из группы, состоящей из 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или стоп-кодон, введенный или замещенный в положении, выбранном из 497-585.
Для полипептидов, в особенности полипептидов, содержащих только одно изменение, предпочтительно изменение не включает замену на Cys, вставку Cys и/или делецию остатка, разрушающую дисульфидную связь и тем самым создающую дополнительный подверженный конъюгации Cys внутри полипептида. Особенно предпочтительно, чтобы изменения по одному или нескольким положениям из 75, 90, 91, 200, 461, 514, 558, 559 и 567 не представляли замену Cys на любую другую аминокислоту (A, D, Е, F, G, Н, I, К, L, M, N, P, Q, R, S, Т, V, W, Y), не представляли делецию Cys, не представляли замену или делецию партнера по дисульфидной связи у этого Cys, то есть предпочтительно, чтобы Cys в одном или нескольких положениях из 53, 62, 75, 90, 91, 101, 124, 168, 169, 177, 200, 245, 246, 253, 265, 278, 279, 289, 316, 360, 361, 369, 392, 437, 438, 448, 461, 476, 477, 487, 514, 558, 559, 567 не подвергались делеции, замене и/или вставке. Наиболее предпочтительно, чтобы ни один Cys, который обычно участвует в образовании дисульфидной связи, не подвергался делеции, замене и/или вставке. Таким образом, предпочтительно, если изменение приходится на одно или несколько положений из числа 34, 38, 40, 76, 79, 80, 82, 83, 86, 104, 113, 115, 116, 471, 490, 496, 498, 501, 503, 504, 505, 506, 512, 538, 542, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585, то это изменение не представляет замену на Cys и/или вставку Cys.
Для всех аспектов изобретения предпочтительно, чтобы в положении 573 (или эквивалентном ему) находился остаток Pro, Trp или Tyr. Поэтому, когда имеется 2 или несколько изменений, то предпочтительно, чтобы в положении 573 (или эквивалентном ему) находился Pro, Trp или Tyr.
Для всех аспектов изобретения партнеры по слиянию у полипептидов и/или конъюгатов могут составлять одно или несколько из следующего: лиганд 4-1ВВ, 5-спираль, хемокин С-С человека, хемокин L105 человека, хемокин L105 человека, именуемый huL105_3, монокин, индуцируемый гамма-интерфероном (MIG), частичный белок CXCR4B, основный белок тромбоцитов (РВР), α1-антитрипсин, гомолог ACRP-30; компонент комплемента C1q С, экспрессируемый в аденоидах хемокин (ADEC), aFGF; FGF-1, AGF, белок AGF, альбумин, этопозид, ангиостатин, вакцина против сибирской язвы, антитела, специфичные к коллапсину, антистатин, антитела против TGF семейства бета, антитромбин III, АРМ-1; ACRP-30; фамоксин, различные аполипопротеины, арилсульфатаза В, белок b57, BCMA, белок β-тромбоглобулина (бета-TG), bFGF; FGF2, факторы свертывания крови, фермент процессинга BMP - фурин, BMP-10, BMP-12, BMP-15, BMP-17, BMP-18, BMP-2B, BMP-4, BMP-5, BMP-6, BMP-9, костный морфогенетический белок-2, кальцитонин, кальпаин-10а, кальпаин-10b, кальпаин-10с, вакцина против рака, карбоксипептидаза, хемокин С-С, МСР2, вариант CCR5, CCR7, CCR7, mAb к CD11a, CD137; рецепторный белок 4-1ВВ, mAb к CD20, CD27, CD27L, CD30, лиганд CD30, иммунотоксин CD33, CD40, CD40L, mAb к CD52, белок Cerebus, хемокин эотаксин., хемокин hIL-8, хемокин hMCP1, хемокин hMCP1a, хемокин hMCP1b, хемокин hMCP2, хемокин hMCP3, хемокин hSDF1b, хемокин МСР-4, хемокин ТЕСК и вариант ТЕСК, полноразмерный и зрелый хемокин-подобный белок IL-8M1, полноразмерный и зрелый хемокин-подобный белок IL-8M10, хемокин-подобный белок IL-8M3, полноразмерный и зрелый хемокин-подобный белок IL-8M8, полноразмерный и зрелый хемокин-подобный белок IL-8M9, полноразмерный и зрелый хемокин-подобный белок PF4-414, полноразмерный и зрелый хемокин-подобный белок PF4-426, полноразмерный и зрелый хемокин-подобный белок PF4-M2, вакцина против холеры, хондромодулин-подобный белок, лиганд c-kit; SCF; фактор роста тучных клеток; MGF; фактор стволовых клеток из фибросаркомы, CNTF и такие его фрагменты, как-то CNTFAx15' (аксокин™), факторы свертывания крови в пре- и активных формах, коллагены, mAb к С5 комплемента, активирующий соединительную ткань белок-III, mAb к СТАА16.88, СТАР-III, CTLA4-Ig, CTLA-8, СХС3, СХС3, CXCR3; рецептор-3 хемокина СХС, циановирин-N, дарбепоэтин, именуемый exodus и обозначаемый huL105_7, DIL-40, ДНКаза, EDAR, mAb к рецептору EGF, ENA-78, эндостатин, эотаксин, активирующий эпителиальные нейтрофилы белок-78, рецептор ЕРО; EPOR, эритропоэтин (ЕРО) и миметики ЕРО, эутропин, белок exodus, фактор IX, фактор VII, фактор VIII, фактор Х и фактор XIII, ингибиторный белок лиганда FAS (DcR3), FasL, FasL, FasL, FGF, FGF-12; фактор-1, гомологичный фактору роста фибробластов, FGF-15, FGF-16, FGF-18, FGF-3; INT-2, FGF-4; гелонин, HST-1; HBGF-4, FGF-5, FGF-6; гепарин-связывающий секретируемый трансформирующий фактор-2, FGF-8, FGF-9; фактор активации глии, фибринонген, flt-1, лиганд flt-3, альфа-субъединица фолликулостимулирующего гормона, бета-субъединица фолликулостимулирующего гормона, фоллитропин, фракталкин, фрагменты миофибриллярного белка тропонина I, FSH, галактозидаза, галектин-4, G-CSF, GDF-1, генная терапия, фактор роста из глиомы, глюкагон, глюкагон-подобные пептиды, глюкоцереброзидаза, глюкозооксидаза, глюкозидаза, гликоделин-А; связанный с прогестероном белок эндометрия, GM-CSF, гонадотропин, хемотаксический белок-2 гранулоцитов (GCP-2), гранулоцитарный и макрофагальный колониестимулирующий фактор, гормон роста, связанный с ростом альфа-онкоген (GRO-alpha), связанный с ростом бета онкоген (GRO-beta), связанный с ростом гамма-онкоген (GRO-gamma), hAPO-4; TROY, hCG, поверхностный антиген гепатита В, вакцина против гепатита В, mAb к рецептору HER2, гирудин, gp120 HIV, gp41 HIV, HIV пептид-ингибитор HIV, пептиды, ингибирующие протеазы HIV, ингибиторы протеазы HIV-1, вакцина против HPV, белок 6Ckine человека, белок Act-2 человека, ингибирующий адипогенез фактор человека, рецептор стимулирующего В-клетки фактора-2 человека, β-хемокин H1305 человека (МСР-2), хемокин С-С человека DGWCC, белок ELC хемокина СС человека, хемокин типа СС - интерлейкин С человека, белок ССС3 человека, хемокин CCF18 человека, белок хемокина типа СС человека, обозначаемый SLC (вторичный лимфоидный хемокин), короткие формы хемокина бета-8 человека, хемокин С10 человека, хемокин СС-2 человека, хемокин СС-3 человека, хемокин CCR-2 человека, хемокин Ckbeta-7 человека, хемокин ENA-78 человека, хемокин эотаксин человека, хемокин α-GRO человека, хемокин β-GRO человека, хемокин НСС-1 человека, хемокин I-309 человека, хемокин IP-10 человека, хемокин L105_3 человека, хемокин L105_7 человека, хемокин MIG человека, белок хемокина β-MIG человека, хемокин α-MIP-1 человека, хемокин β-MIP-1 человека, хемокин α-MIP-3 человека, хемокин β-MIP-3 человека, хемокин PF4 человека, белок-хемокин 331D5 человека, белок-хемокин 61164 человека, рецептор хемокинов человека CXCR3, хемокин α-SDF1 человека, хемокин β-SDF1 человека, хемокин ZSIG-35 человека, белок Chr19Kine человека, CKbeta-9 человека, хемокин человека СХ3С из 111 аминокислот, интерлейкин-40 DNAX человека, хемокин С-С DVic-1 человека, последовательность белка I EDIRF человека, последовательность белка II EDIRF человека, хемокин эотаксин типа СС из эозиноцитов человека, экспрессируемый в эозинофилах хемокин человека (EEC), тропонин С быстрых мышц человека, тропонин I быстрых мышц человека, субъединица С тропонина быстрых мышц человека, субъединица I тропонина быстрых мышц человека, субъединица Т тропонина быстрых мышц человека, экспрессируемый в селезенке плода хемокин человека, FSEC, рецептор GM-CSF человека, хемокин Gro-альфа человека, хемокин Gro-бета человека, хемокин Gro-гамма человека, белок IL-16 человека, последовательность белка IL-1RD10 человека, IL-1RD9 человека, альфа-цепь рецептора IL-5 человека, рецептор IL-6 человека, белок hIL8RA рецептора IL-8 человека, белок hIL8RB рецептора IL-8 человека, белок рецептора IL-9 человека, вариант #3 белка рецептора IL-9 человека, фрагмент варианта белка рецептора IL-9 человека, фрагмент #3 варианта белка рецептора IL-9 человека, интерлейкин 1-дельта человека, интерлейкин 10 человека, интерлейкин 18 человека, производные интерлейкина 18 человека, предшественник интерлейкина 1-бета человека, вспомогательный белок рецептора интерлейкина 1 человека, β-антагонист рецептора интерлейкина 1 человека, рецептор 3-го типа интерлейкина 1 человека, интерлейкин-10 человека (предшественник), рецептор интерлейкина-11 человека, субъединица в 40 кДа интерлейкина-12 человека, рецептор β-1 интерлейкина-12 человека, рецептор β-2 интерлейкина-12 человека, белок р35 интерлейкина-12 человека, белок р40 интерлейкина-12 человека, рецептор интерлейкина-12 человека, альфа-рецептор интерлейкина-13 человека, бета-рецептор интерлейкина-13 человека, интерлейкин-15 человека, рецептор интерлейкина-15 человека из клона Р1, рецептор интерлейкина-17 человека, белок интерлейкина-18 (IL-18) человека, интерлейкин-3 человека, рецептор интерлейкина-3 человека, вариант интерлейкина-3 человека, рецептор интерлейкина-4 человека, интерлейкин-5 человека, интерлейкин-6 человека, интерлейкин-7 человека, интерлейкин-7 человека, интерлейкин-8 (IL-8) человека, антагонист внутриклеточного рецептора IL-1 человека, слитый белок IP-10 человека и гипервариабельного участка gp120 HIV-1, слитый белок IP-10 человека и центрального эпитопа Muc-1 (VNT) человека, печеночный и регулируемый активацией хемокин (LARC) человека, полноразмерный и зрелый белок Lkn-1 человека, полноразмерный и зрелый белок хемокина молочных желез (MACK) человека, зрелый хемокин Ckbeta-7 человека, зрелый Gro-альфа человека, зрелый полипептид Gro-гамма человека, применяемый для лечения сепсиса, слитый белок МСР-3 человека и центрального эпитопа Muc-1 (VNT) человека, белок MI10 человека, белок MI1A человека, хемоаттрактантный фактор моноцитов hMCP-1 человека, хемоаттрактантный фактор моноцитов hMCP-3 человека, последовательность хемоаттрактантного пробелка моноцитов (МСРР) человека, хемокиноподобный домен нейротактина человека, хемокин H174 типа СХС без ELR человека, хемокин IP10 типа СХС без ELR человека, хемокин Mig типа СХС без ELR человека, мутанты PAI-1 человека, белок человека с активностью IL-16, вторичный лимфоидный хемокин (SLC) человека, белок SISD человека, STCP-1 человека, хемокин из стромальных клеток человека, SDF-1, экспрессирующийся при реакции Т-клеток смешанных лимфоцитов хемокин человека (ТМЕС), тимусный и регулируемый активацией цитокин человека (TARC), экспрессируемый в тимусе человека, TNF-альфа человека, TNF-бета человека (LT-альфа), последовательность белка хемокина эотаксина-3 типа СС человека, рецептор интерлейкина-1 II типа человека, белок интерлейкина-4 дикого типа человека (hIL-4), белок ZCHEMO-8 человека, гуманизированные антитела против VEGF и их фрагменты, гиалуронидаза, субъединица ICE в 10 кДа, субъединица ICE в 20 кДа, субъединица ICE в 22 кДа, идуронат-2-сульфатаза, идуронидаза, α-IL-1, β-IL-1, ингибитор IL-1 (IL-1i), зрелый IL-1, рецептор IL-10, IL-11, субъединица р40 IL-12, IL-13, IL-14, IL-15, рецептор IL-15, IL-17, рецептор IL-17, IL-19, фрагменты IL-1i, антагонист рецептора IL1, IL-21 (TIF), содержащий IL-3 слитый белок, мутантные белки IL-3, варианты IL-3, IL-4, мутеин IL-4, мутеин Y124G IL-4, мутеин Y124X IL-4, мутеины IL-4, рецептор IL-5, IL-6, рецептор IL-6, клон рецептора IL-7, рецептор IL-8, вариант зрелого белка IL-9 (версия Met117), иммуноглобулины или молекулы на основе иммуноглобулинов либо их фрагменты (например, Small Modular ImmunoPharmaceutical™ ("SMIP") или dAb, Fab'-фрагменты, фрагменты F(ab')2, scAb, scFv или scFv), включая, без ограничения, плазминоген, вакцина против гриппа, α-ингибин, β-ингибин, инсулин, инсулиноподобный фактор роста, mAb к интегрину, интер-альфа-ингибитор трипсина, индуцируемый γ-интерфероном белок (IP-10), интерфероны (как-то разновидности α-интерферона и разновидности β-интерферона и разновидности γ-интерферона), интерлейкин 6, рецептор интерлейкина 8 (IL-8), рецептор В интерлейкина 8, интерлейкин-1α, связанный с рецептором интерлейкина-2 белок р43, интерлейкин-3, мутеины интерлейкина-4, белок интерлейкина-8 (IL-8), интерлейкин-9, зрелый белок интерлейкина-9 (IL-9) (версия с Thr117), интерлейкины (как-то IL10, IL11 и IL2), вакцина против японского энцефалита, ингибитор калликреина, фактор роста кератиноцитов, белки с доменом Kunitz (такие как апротинин, предшественник амилоидного белка и те, что описаны в WO 03/066824, слитые с альбумином или без него), LACI, лактоферрин, латентный β-TGF-связывающий белок II, лептин, экспрессируемый в печени хемокин-1 (LVEC-1), экспрессируемый в печени хемокин-2 (LVEC-2), LT-альфа, LT-бета, лютеинизирующий гормон, вакцина против болезни Lyme, лимфотактин, аналог хемокина из макрофагов MDC (n+1), аналог хемокина из макрофагов MDC-eyfy, аналог хемокина из макрофагов MDC-yl, хемокин из макрофагов, MDC, хемокин из макрофагов (MDC), маспин; ингибитор протеаз 5, рецептор МСР-1, МСР-1а, MCP-1b, МСР-3, рецептор МСР-4, M-CSF, ингибирующий меланому белок, мембраносвязанные белки, интерлейкин-9 Met117 человека, α-MIP-3, β-MIP-3, γ-MIP, MIRAP, модифицированные белки Rantes, моноклональные антитела, МР52, мутантный интерлейкин-6 S176R, миофибриллярный сократительный белок тропонин I, натрийуретический пептид, β-фактор роста нервов, β2-фактор роста нервов, нейрофилин-1, нейрофилин-2, нейротактин, нейротрофин-3, нейротрофин-4, нейротрофин-4а, нейротрофин-4b, нейротрофин-4с, нейротрофин-4d, активирующий нейтрофилы пептид-2 (NAP-2), рецептор NOGO-66, NOGO-A, NOGO-B, NOGO-C, новый β-хемокин, обозначаемый РТЕС, модифицированный по N-концу хемокин GroHEK/hSDF-1α, модифицированный по N-концу хемокин GroHEK/hSDF-1β, модифицированный по N-концу хемокин met-hSDF-1α, модифицированный по N-концу хемокин met-hSDF-1β, OPGL, остеогенный Белок-1; ОР-1; ВМР-7, остеогенный белок-2, OX40; ACT-4, OX40L, окситоцин (нейрофизин I), паратгормон, Patched, Patched-2, PDGF-D, анатоксин коклюша, экспрессируемый в гипофизе хемокин (PGEC), плацентарный фактор роста, плацентарный фактор роста-2, ингибитор-1 активатора плазминогена; PAI-1, ингибитор-2 активатора плазминогена, PAI-2, тромбоцитарный фактор роста, тромбоцитарный фактор роста Bv-sis, предшественник тромбоцитарного фактора роста А, предшественник тромбоцитарного фактора роста В, mAb к тромбоцитам, тромбоцитарный фактор роста эндотелиальных клеток (PD-ECGF), цепь А тромбоцитарного фактора роста, цепь В тромбоцитарного фактора роста, полипептид, используемый для лечения сепсиса, вариант препроаполипопротеида "milano", вариант препроаполипопротеида "paris", пре-тромбин, хемокин СС "ILINCK" приматов, хемокин СХС "IBICK" приматов, проинсулин, пролактин, пролактин-2, просаптид, пептиды-ингибиторы протеаз, белок С, белок S, протромбин, проурокиназа, RANTES, RANTES 8-68, RANTES 9-68, пептиды RANTES, рецептор RANTES, рекомбинантный интерлейкин-16, резистин, рестриктоцин, ингибиторы ретровирусных протеаз, рицин, вакцина против ротавируса, mAb к RSV, сапорин, сарцин, секретируемые и трансмембранные полипептиды, сывороточная холинэстераза, сывороточные белки (типа факторов свертывания крови), растворимый белок-3 киназы рецептора BMP, растворимый рецептор VEGF, ингибиторный фактор стволовых клеток, вакцина против стафилококка, стромальный фактор-1α, стромальный фактор-1β, субстанция Р (тахикинин), пептид Т1249, пептид Т20, эндонуклеаза Т4, TACI, Tarc, β1-TGF, β2-TGF, интерлейкин-9 Thr117 человека, тромбин, тромбопоэтин, производное-1 тромбопоэтина, производное-2 тромбопоэтина, производное-3 тромбопоэтина, производное-4 тромбопоэтина, производное-5 тромбопоэтина, производное-6 тромбопоэтина, производное-7 тромбопоэтина, экспрессируемый в тимусе хемокин (ТЕСК), тиреотропный гормон, антикоагулянтный пептид клеща, белок Tim-1, предшественник α-TNF, TNF-R, TNF-RII; р75 рецептора TNF; рецептор Death, tPA, трансферрин, трансформирующий β-фактор роста, пептиды тропонина, усеченный моноцитарный хемотаксический белок-2 (6-76), усеченный белок RANTES (3-68), фактор некроза опухолей, уратоксидаза, урокиназа, вазопрессин (нейрофизин II), VEGF R-3; flt-4, рецептор VEGF; KDR; flk-1, VEGF-110, VEGF-121, VEGF-138, VEGF-145, VEGF-162, VEGF-165, VEGF-182, VEGF-189, VEGF-206, VEGF-D, VEGF-E; VEGF-X, фактор фон Виллебранда, моноцитарный хемотаксический белок-2 дикого типа, β9-ZTGF, альтернативные антителам каркасы, например, антикалины, аднектины, фрагменты фибриногена, наночастицы типа верблюжьих наночастиц, инфестин, и/или любые из молекул, приведенных в WO 01/79271 (в частности, на стр.9 и/или в таблице 1), WO 2003/59934 (в частности, в таблице 1), WO 03/060071 (в частности, в таблице 1) или WO 01/079480 (в частности, в таблице 1) (каждая включена сюда в виде ссылки во всей полноте).
Кроме того, конъюгаты могут содержать один или несколько химиотерапевтических препаратов, таких как: 13-цис-ретиноевая кислота, 2-CdA, 2-хлордезоксиаденозин, 5-азацитидин, 5-фторурацил, 5-FU, 6-меркаптопурин, 6-МР, 6-TG, 6-тиогуанин, абраксан, аккутан®, актиномицин D, адриамицин, адруцил®, агрилин®, алакорт®, алдеслейкин, алемтузумаб, ALIMTA, алитретиноин, алкабан-AQ®, алкеран®, вся-транс-ретиноевая кислота, α-интерферон, алтретамин, аметоптерин, амифостин, аминоглутетимид, анагрелид, анандрон®, анастрозол, арабинозилцитозин, ара-С, аранесп®, аредиа®, аримидекс®, аромазин®, арранон®, триоксид мышьяка, аспарагиназа, ATRA, авастин®, азацитидин, BCG, BCNU, бевацизумаб, бексаротен, BEXXAR®, бикалутамид, BiCNU, бленоксан®, блеомицин, бортезомиб, бусульфан, бусульфекс®, С225, лейковорин кальция, кампат®, камптосар®, камптотецин-11, капецитабин, карак™, карбоплатин, кармустин, кармустин на подложке, касодекс®, СС-5013, CCNU, CDDP, CeeNU, церубидин®, цетуксимаб, хлорамбуцил, цисплатин, цитроворум-фактор, кладрибин, кортизон, космеген®, СРТ-11, циклофосфамид, цитадрен®, цитарабин, цитарабин в липосомах, цитозар-U®, цитоксан®, дакарбазин, дакоген, дактиномицин, альфа-дарбепоэтин, дасатаниб, дауномицин, даунорубицин, даунорубицин гидрохлорид, даунорубицин в липосомах, DaunoXome®, декадрон, децитабин, дельта-кортеф®, дельтазон®, денилейкин дифтитокс, депоЦит™, дексаметазон, дексаметазон ацетат, дексаметазон фосфат натрия, дексазон, дексразоксан, DHAD, DIC, диодекс, доцетаксель, доксил®, доксорубицин, доксорубицин в липосомах, дроксия™, DTIC, DTIC-Dome®, дуралон®, эфудекс®, элигард™, элленс™, элоксатин™, элспар®, эмцит®, эпирубицин, альфа-эпоэтин, эрбитукс™, эрлотиниб, L-аспариганаза Erwinia, эстрамустин, этиол, этопофос®, этопозид, этопозид фосфат, эулексин®, эвиста®, эксеместан, фарестон®, фаслодекс®, фемара®, филграстим, флоксуридин, флудара®, флударабин, фтороплекс®, фторурацил, фторурацил (крем), флуоксиместерон, флутамид, фолиновая кислота, FUDR®, фулвестрант, G-CSF, гефитиниб, гемцитабин, гемтузумаб озогамицин, гемзар®, гливек™, глиадел® на подложке, GM-CSF, госерелин, гранулоцитарный колониестимулирующий фактор, гранулоцитарный и макрофагальный колониестимулирующий фактор, галотестин®, герцептин®, гекадрол, гексален®, гексаметилмеламин, НММ, гикамтин®, гидреа®, гидрокорт ацетат®, гидрокортизон фосфат натрия, гидрокортизон сукцинат натрия, гидрокортон фосфат, гидроксимочевина, ибритумомаб, ибритумомаб тиуксетан, идамицин®, идарубицин, ифекс®, IFN-альфа, ифосфамид, IL-11, IL-2, иматиниб мезилат, имидазол карбоксамид, интерферон альфа, интерферон альфа-2b (PEG-конъюгат), интерлейкин-2, интерлейкин-11, интрон А® (интерферон альфа-2b), иресса®, иринотекан, изотретиноин, кидролаза®, ланакорт®, лапатиниб, L-аспарагиназа, LCR, леналидомид, летрозол, лейковорин, лейкеран, лейкин™, лейпролид, лейрокристин, лейстатин™, ара-С в липосомах, Liquid Pred®, ломустин, L-PAM, L-сарколизин, лупрон®, лупрон депо®, матулан®, максидекс, мехлорэтамин, мехлоретамин гидрохлорид, медралон®, медрол®, мегас®, мегестрол, мегестрол ацетат, мелфалан, меркаптопурин, месна, меснекс™, метотрексат, метотрексат натрия, метилпреднизолон, метикортен®, митомицин, митомицин-С, митоксантрон, М-преднизол®, МТС, МТХ, мустарген®, мустин, мутамицин®, милеран®, милоцел™, милотарг®, навелбин®, неларабин, неосар®, нейласта™, неймега®, нейпоген®, нексавар®, ниландрон®, нилутамид, нипент®, азотистый иприт, новалдекс®, новантрон®, октреотид, октреотид ацетат, онкоспар®, онковин®, онтак®, онксал™, опревелкин, орапред®, оразон®, оксаплатин, таксол и производные таксола, например, паклитаксель или связанный с белком паклитаксель, памидронат, панитумумаб, панретин®, параплатин®, педиапред®, PEG-интерферон, пегаспаргаза, пегфилграстим, PEG-Intron™, PEG-L-аспарагиназа, пеметрексед, пентостатин, фенилаланиновый иприт, платинол®, платинол-AQ®, преднизолон, преднизон, прелон®, прокарбазин, Procrit®, пролейкин®, пролифепроспан 20 с кармустином на подложке, пуринетол, ралоксифен, ревлимид®, ревматрекс®, ритуксан®, ритуксимаб, роферон-А® (интерферон альфа-2а), рубекс®, рубидомицин гидрохлорид, сандостатин®, сандостатин LAR®, сарграмостин, Solu-кортеф®, Solu-медрол®, сорафениб, Sprycel™, STI-571, стрептозоцин, SU11248, сунитиниб, сулент®, тамоксифен, тарцева®, таргретин®, таксол®, таксотер®, темодар®, темозоломид, тенипозид, TESPA, талидомид, таломид®, TheraCys®, тиогуанин, тиогуанин Tabloid®, тиофосфамид, тиоплекс®, тиотепа, TICE®, топозар®, топотекан, торемифен, тоситумомаб, трастузумаб, третиноин, трексалл™, трисенокс®, TSPA, Tykerb®, VCR, вектибикс™, велбан®, велкад®, вепезид®, весаноид®, виадур™, видаза®, винбластин, винбластин сульфат, винказар Pfs®, винкристин, винорелбин, винорелбин тартрат, VLB, VM-26, вориностат, VP-16, вумон®, кселода®, заносар®, зевалин™, зинекард®, золадекс®, золедроновая кислота, золинза, зомета®; радиофармацевтические препараты, такие как углерод-11, углерод-14, хром-51, кобальт-57, кобальт-58, эрбий-169, фтор-18, галлий-67, золото-198, индий-111, индий-113m, йод-123, йод-125, йод-131, железо-59, криптон-81m, азот-13, кислород-15, фосфор-32, рений-186, рубидий-82, самарий-153, селен-75, стронций-89, технеций-99m, таллий-201, тритий, ксенон-127, ксенон-133, иттрий-90; визуализирующие вещества, такие как гадолиний, магнетит, марганец, технеций, 125I, 131I, 32P, 201Tl, лопамидол, PET-FDG.
Дополнительные партнеры по слиянию, партнеры по конъюгации и/или молекулы для введения в наночастицы, ассоциаты или композиции по изобретению включают: препараты против акромегалии, например, соматулин, ланреотид, октреотид, сандостатин; антитромботики, например, бивалирудин, ангиомакс, далтепарин, фрагмин, еноксапарин, ловенокс, дротрекогин альфа (например, активированный), ксигрис, гепарин; соединения для вспомогательной репродуктивной терапии, например, хориогонадотропин, овидрел, фоллитропин альфа/бета; ферменты, например, гиалуронидаза, гиленекс; препараты против диабета, например, экзенатид, биетта, глюкагон, инсулин, лираглутид, альбиглутид, агонисты GLP-1, эксендин или аналогы эксендина; соединения, применяемые в диагностике, например, протирелин, типинон TRH Thyrel, секретин (например, синтетический человеческий), хиргостим, тиреотропный гормон (например, альфа), тиреогенные препараты для эритропоэза, например, дарбепоэтин альфа, аранесп, эпоэтин альфа, эпоген, эпрекс; препараты для лечения генетических дефектов, например, пегадемаза, препараты для лечения недостаточного роста, например, адаген, мекасермин, ринфабат, препараты для лечения кистозного фиброза, например, альфа-дорназа, пульмозим, препараты для лечения метаболических расстройств, например, бета-агалсидаза, фабразим, альфа-алглюкозидаза, миозим, ларонидаза, алдуразим, препараты для внутриочагового лечения половых бородавок, например, интерферон альфа-n3, альферон N, препараты для лечения гранулематозных заболеваний, например, интерферон гамма-1b, актиммун; препараты для лечения недостаточного роста, например, пегвисомант, сомаверт, соматропин, генотропин, нютропин, гуматроп, серостим, протропин; препараты для лечения сердечной недостаточности, например, несиритид, натрекор; препараты для лечения гемофилии, например, факторы свертывания, например, фактор VIII, геликсат FS, когенат FS, фактор IX, BeneFix, фактор VIIa, новосевен, десмопрессин, стимат, DDAVP; гемопоэтические препараты, например, филграстим (G-CSF), нейпоген, опрелвекин, неймега, пегфилграстим, нейласта, сарграмостим; препараты для лечения гепатита С, например, интерферон альфа-2а, роферон А, интерферон альфа-2b, интрон А, интерферон альфакон-1, инферген, пегинтерферон альфа-2а, пегасис, пегинтерферон альфа-2b, PEG-интрон; препараты для лечения ВИЧ, например, энфувиртид, фузеон; Fab-фрагменты, например, Fab (антитромбин), абциксимаб, ReoPro; моноклональные антитела, например, даклизумаб, зенапакс; противовирусные моноклональные антитела, например, паливизумаб, синагис; моноклональные антитела для лечения астмы, например, омализумаб, ксолаир; моноклональные антитела для применения в диагностической визуализации, например, аркитумомаб, CEA-Scan, капромаб пендетид, ProstaScint, сатумомаб пендетид, OncoScint CR/OV, Fab-фрагменты для применения в диагностической визуализации, например, нофетумомаб, верлума; иммунодепрессантные моноклональные антитела, например, басиликсимаб, симулект, муромонаб-CD3, ортоклон ОКТ3; моноклональные антитела для лечения злокачественных образований, например, алемтузумаб, кампат, ибритумомаб тиуксетан, зевалин, ритуксимаб, ритуксан, трастузузмаб, герцептин; моноклональные антитела для лечения ревматоидного артрита (RA), например, адалимумаб, хумира, инфликсимаб, ремикад; моноклональные антитела для применения в качестве препаратов для радиоиммунотерапии, например, тоситумомаб и йод 131I, тоситумомаб, бекшар; препараты для лечения дегенерации желтого пятна, например, пегаптаниб, макуген; препараты для лечения злокачественных образований, например, алдезлейкин, пролейкин, интерлейкин-2, аспарагиназа, элспар, расбуриказа, элитек, денилейкин дифтитокс, онтак, пегаспаргаза, онкаспар, госерелин, лейпролид; препараты для лечения рассеянного склероза (MS), например, глатирамер ацетат (например, сополимер-1), копаксон, интерферон бета-1а, авонекс, ребиф, интерферон бета-1b, бетасерон; препараты для лечения мукозита, например, палифермин, кепиванс; препараты для лечения дистонии, например, нейротоксин, ботулиновый токсин типа А, ботокс, ботокс косметический, ботулиновый токсин типа В, Myobloc; препараты для лечения остеопороза, например, терипаратид, фортео; препараты для лечения псориаза, например, алефацепт, амевив; препараты для лечения RA, например, абатацепт, оренсия, анакинра, кинерет, этанерцепт, энбрел; тромболитики, например, альтеплаза, активаза, rtPA, анистреплаза, эминаза, ретеплаза, ретаваза, стрептокиназа, стрептаза, тенектеплаза, TNKаза, урокиназа, аббокиназа, кинлитик; препараты для лечения остеопороза, например, кальцитонин (например, лосося), миакальцин, фортикаль, препараты для лечения кожных язв, например, бекаплермин, регранекс, коллагеназа, сантил.
Такие полипептиды и химические соединения могут именоваться диагностическими молекулами, терапевтическими молекулами, профилактическими молекулами или полезными молекулами.
Предпочтительно партнером по слиянию и/или партнером по конъюгации не является альбумин, его вариант или фрагмент.
Один или несколько терапевтических или профилактических полипептидов могут быть слиты по N-концу, С-концу альбумина, вставлены в петлю из структуры альбумина или по любой комбинации из них. Это может включать и линкерные последовательности, разделяющие различные компоненты слитого полипептида.
Сведения касательно слияния альбумина или его фрагментов известны в данной области, а специалистам известно, что такие сведения могут быть применимы и к настоящему изобретению. WO 2001/79271 A и WO 2003/59934 A (включенные сюда в виде ссылки) также содержат примеры терапевтических и профилактических полипептидов, которые могут быть слиты с альбумином или его фрагментами, причем эти примеры применимы и к настоящему изобретению.
Далее изобретение раскрывается на следующих примерах, которые не следует понимать как ограничивающие объем изобретения.
Примеры
Материалы и методы
Получение мутантов HSA и гибридных молекул, включая получение усеченных по С-концу вариантов альбумина
Варианты альбумина получали с применением методов, известных специалистам, к примеру, методами из WO 2011/051489 (РСТ/ЕР 10/066572) или методом ПЦР с помощью мутагенных олигонуклеотидных праймеров.
Получение shFcRn. Конструирование и получение рекомбинантных вариантов shFcRn, таких как shFcRn с тегом GST, было описано ранее (36). С другой стороны, гетеродимер shFcRn с тегом HIS получали так, как описано в WO 2011/124718.
ELISA. Метод ELISA на микропланшетах с нанесенными вариантами HS, shFcRn с тегом GST и козьими антителами против GST, конъюгированными с пероксидазой хрена, выполняли согласно Andersen et al. (2012, Nature Communications 3:610, DOI:10.1038/ncomms1607).
Поверхностный плазменный резонанс. Использовали прибор Biacore 3000 (GEHealthcare) с сенсорными чипами СМ5, на которых фиксировали shFcRn-GST (~1000-2000 RU) методом конденсации с аминами, как описано производителем. Конденсацию проводили путем введения 10-12 мкг/мл каждого белка в 10 мМ ацетате натрия, рН 4,5 (GE Healthcare). Во всех экспериментах в качестве рабочего буфера и буфера для разведения использовали фосфатный буфер (67 мМ фосфатного буфера, 0,15 М NaCl, 0,005% Tween 20) при рН 6,0 или 7,4 либо буфер HBS-P (0,01 М HEPES, 0,15 М NaCl, 0,005% сурфактанта Р20) при рН 7,4. Кинетические измерения проводили путем введения серийных разведений вариантов HSA (80-0,1 мкМ) при 25°С при скорости потока в 50 мкл/мин. Во всех экспериментах данные корректировали с учетом нуля и вычитали значение в контрольной ячейке. Кинетические значения скорости рассчитывали по заданным моделям (модель Langmuir с лигандом 1:1 и модель стационарного сродства), встроенным в программу BIAevaluation 4.1.
Конкурентное связывание измеряли путем пропускания shFcRn (100 нМ) самого по себе или вместе с титрованным количеством вариантов HSA (1000-0,015 нМ) над иммобилизованным HSA (~2000-2500 RU). Степень связывания (%) shFcRn с HSA, иммобилизованным на чипе, рассчитывали делением общего ответа SPR, полученного при введении одного лишь shFcRn, на ответ при преинкубации с вариантом HSA.
Спектроскопия кругового дихроизма
Спектры кругового дихроизма (CD) регистрировали на спектрополяриметре Jasco J-810 (Jasco International Co., Ltd., Tokyo Japan), откалиброванном по d-камфор-10-сульфонату аммония (Icatayama Chemicals, Tokyo Japan). Все измерения проводились при концентрации HSA в 2 мг⋅мл-1 в 10 мМ PBS (рН 6,0) без добавления NaCl, при 23°С, в кварцевых кюветах (Starna, Essex, UK) с длиной пути в 0,1 см. Каждый образец сканировали по 7 раз при 20 нм⋅мин-1 (полоса пропускания в 1 нм) с постоянной времени в 1 сек, а диапазон длин волн составлял 190-260 нм. Полученные данные усредняли и вычитали спектр контроля (без образца). Содержание элементов вторичной структуры рассчитывали после сглаживания (подвижное среднее, ширина конволюции = 5) по данным эллиптичности с помощью программы для нейронной сети CDNN версии 2.1 и прилагаемой нейронной сети на основе 33-членного базисного комплекта ENREF_38 (Bohm et al. (1992) Protein Eng. 5, 191-195).
Методика стыковки. Модели стыковки HSA и shFcRn создавали с помощью программы для стыковки белков ZDOCK на основе быстрого преобразования Фурье (37). Координаты для DIII HSA (остатки 382-582) получали на основании кристаллической структуры HSA при 2,5 Ǻ (PDB-код 1bm0) (19). Использовали две различные модели shFcRn: с разрешением структуры FcRn в 2,7 Ǻ при рН 8,2 (PDB-код 1exu) и с разрешением структуры в 2,6 Ǻ при рН 4,2 (PDB-код 3m17) (98, 23). В модель рецептора при стыковке включали домен β2m, который присутствует в обеих структурных моделях shFcRn. Программу ZDOCK запускали с предпочтением для расположения стыковки при двух гистидинах His-161 и His-166 в FcRn и остатках His-464, His-510 и His-535 в HSA. Все фигуры для кристаллической структуры разрабатывали с помощью PyMOL (DeLano Scientific) по описанным здесь кристаллографическим данным.
Пример 1. Составление модели стыковки
Модели стыковки HSA и shFcRn создавали с помощью программы для стыковки белков ZDOCK на основе быстрого преобразования Фурье (Chen R et al. (2003) Proteins 52(1): 80-87). Координаты для DIII HSA (остатки 382-582) определяли, основываясь на кристаллической структуре HSA при 2,5 Ǻ (PDB-код 1bm0; Sugio S et al. (1999) Protein Eng. 12(6): 439-446). Использовали две различные модели shFcRn: с разрешением структуры FcRn в 2,7 Ǻ при рН 8,2 (PDB-код 1exu) и с разрешением структуры в 2,6 Ǻ при рН 4,2 (PDB-код 3m17) (West et al. (2000) Biochemistry 39(32): 9698-9708; Mezo AR et al. (2010) J Biol Chem 285(36): 27694-27701). В модель рецептора при стыковке включали домен β2m, который присутствует в обеих структурных моделях shFcRn. Программу ZDOCK запускали с предпочтением для расположения стыковки при двух гистидинах His-161 и His-166 в FcRn и остатках His-464, His-510 и His-535 в HAS на границе раздела между белками. Все изображения кристаллической структуры разрабатывали с помощью PyMOL (DeLano Scientific) по описанным выше кристаллографическим данным.
Программа выдала одну модель для стыковки субдомена DIII при shFcRn с упорядоченной петлей при рН 4,2 и восемь моделей для shFcRn при рН 8,2, но без остатков петли 52-59. Из этих восьми моделей пять дали явно ошибочные (несовместимые) расположения, судя по положению доменов DI и DII HSA, и были отброшены. Остальные три модели были тесно связаны и имели одно и то же общее структурное расположение. При наложении на них формы FcRn при низком рН оказалось, что структурированная петля не создает никаких серьезных конфликтов со стыкованным HSA. Окончательная отобранная модель (координаты представлены на фиг.18 и 19) выявляет зоны взаимодействия, которые очень хорошо согласуются с полученными данными по связыванию (фиг.8А). В частности, длинная петля между субдоменами DIIIa и DIIIb (490-510), а также С-концевая часть (последняя С-концевая α-спираль) HSA образуют расщелину на поверхности HSA, в которую может входить рН-зависимая и гибкая петля из shFcRn (остатки 51-60) (фиг.8В). Структура shFcRn показывает, что His-166 стабилизирует петлю посредством внутримолекулярного взаимодействия с Glu-54 (фиг.7А), однако модель стыковки свидетельствует, что His-166 может дополнительно участвовать в связывании с Glu-505 из HSA (фиг.8В). Glu-505 также может взаимодействовать с Arg-162 рецептора. Ключевая роль His-510 подтверждается тем, что он будет взаимодействовать с Glu-54 в пределах рН-зависимой петли домена α1 (фиг.8В). Мутация His-510 (H510Q) уменьшает связывание в 14 раз (фиг.3с, таблица 1). Таким образом, His-166 в hFcRn и His-510 в HSA, по-видимому, участвуют в регуляции ионной сети в глубине поверхности взаимодействия hFcRn-HSA.
Модель также предсказывает возможные солевые мостики между Lys-150 и Glu-151 из shFcRn с Glu-501 и Lys-500 из HSA, соответственно (фиг.8В). Это согласуется с данными по связыванию, свидетельствующими о снижении способности к связыванию у вариантов HSA, мутированных по этим положениям (фиг.6В). Кроме того, модель предполагает ключевую роль альфа-спирали в С-концевой части HSA. Это подтверждается тем, что удаление последних 17 аминокислот из DIIIb почти устраняет связывание с shFcRn (фиг.14).
Другая расщелина на поверхности HSA образуется между петлей, соединяющей DIIIa-DIIIb, и одной из других α-спиралей из DIIIb (остатки 520-535). При этом His-161 shFcRn может взаимодействовать с Glu-531 при кислом рН (фиг.8В). Это согласуется с предыдущими результатами, когда было обнаружено снижение сродства связывания в 10 раз при мутации His-161 (Andersen JT et al., 2006). Консервативный остаток гистидина 166 в тяжелой цепи неонатального Fc-рецептора человека является критическим для рН-зависимого связывания с альбумином (Eur J Immunol 36(11): 3044-3051). Комплекс HSA-shFcRn может дополнительно усиливаться солевым мостиком, образующимся между Glu-168 из shFcRn и Lys-524 из DIII, что подтверждается тем, что мутация Glu-168 умеренно снижает связывание с HSA (фиг.15).
Более того, His-535 может выгодно взаимодействовать с Phe-157, тогда как His-464 локализуется возле β-шпильки в FcRn, охватывающей остатки 99-102, которые вклиниваются между доменом DI и субдоменом DIIIa в HSA (фиг.8С). При этом Asp-101 shFcRn имеет несколько возможных партнеров в DI, таких как Arg-197 и Lys-190, однако они обязательно должны подвергаться некоторым конформационным изменениям для того, чтобы приблизиться к Asp-101. Интересно, что β-шпилька имеет две различные конформации в зависимости от рН (West et al., 2000). Это предполагает, что Asp-101 действительно располагается в гибком элементе shFcRn. Кристаллическая структура и характеристики связывания с иммуноглобулином G у связанного с главным комплексом гистосовместимости Fc-рецептора человека (West et al. (2000) Biochemistry 39(32): 9698-9708) и рентгеновские кристаллические структуры мономерных и димерных пептидных ингибиторов в комплексе с неонатальным Fc-рецептором человека - FcRn (Mezo AR et al. (2010) J Biol Chem 285(36): 27694-27701) свидетельствуют о том, что он образует гибкий элемент в shFcRn.
Связанный с МНС класса I FcRn эволюционировал так, чтобы он защищал IgG и альбумин от катаболизма (5, 8, 22). В то время, как связывание FcRn с IgG изучалось очень подробно в течение десятилетий, открытое недавно взаимодействие его с альбумином еще плохо изучено на молекулярном уровне. Представленные здесь данные свидетельствуют о важности некоторых взаимодействующих поверхностей на обеих молекулах и показывают, что их взаимодействие чувствительно к рН, что способствует их повторной утилизации (рециклингу) в клетках.
Тот факт, что DIII сам по себе, в отличие от DI+DII, может связываться с рецептором, что модулируется рН, убедительно свидетельствует о том, что DIII содержит основное ядро сайта связывания с FcRn, что согласуется с предыдущим сообщением (9). Однако данные также свидетельствуют о роли DI в связывании, например, модель стыковки предполагает взаимодействие между FcRn и DI HSA. Более конкретно, у самого DIII сродство значительно слабее, чем сродство у полноразмерного HSA, что свидетельствует о том, что в связывание с рецептором может вносить умеренный вклад и DI или DII, прямо или косвенно. Данные также показывают, что конструкция DI-DIII связывается с hFcRn несколько сильнее, чем сам DIII HSA. Это может быть связано со структурной стабилизацией DIII или с тем, что DI взаимодействует с hFcRn при слиянии с DIII, хотя DI при слиянии DI-DIII попадает в другое место, чем DI в полноразмерном HSA. Интересно, что модель предполагает, что возможны некоторые взаимодействия между DI и shFcRn.
Несколько HSA полиморфизмов, локализованных в DIII (16), могут влиять на связывание с рецептором и тем самым на их уровни в крови. Один из таких полиморфизмов, Casebrook, с одной точечной мутацией, вводящей сайт N-гликозилирования, присутствует примерно у 35% альбумина дикого типа у гетерозиготных носителей (20). Введение этой мутации в альбумин кролика дало вариант со сниженным на 50% временем полужизни при введении кроликам (24). Исходя из этих наблюдений, был получен вариант HSA, имитирующий Casebrook (WO 2011/051489, РСТ/ЕР 10/066572, включены сюда в виде ссылки), и оказалось, что у него наблюдается 2-кратное снижение сродства связывания с shFcRn. To же самое наблюдалось у варианта Casebrook, выделенного из гетерозиготного индивида, при этом проявлялось снижение на 50% способности конкурировать за связывание с shFcRn в присутствии альбумина дикого типа. При изучении кристаллической структуры shFcRn, выполненной при кислом рН, оказалось, что частично выходящий на поверхность и протонированный His-166 участвует в стабилизации петли, которая была разупорядочена при щелочном рН, посредством связывания с кислой (Glu-54) и полярной (Tyr-60) аминокислотой, соответственно. Разупорядочение петли может объясняться депротонированием His-166 при щелочном рН, которое, вероятно, регулирует гибкость и конформацию петли рН-зависимым образом.
В общей сложности четыре остатка гистидина в DIII HSA индивидуально подвергали мутации на остатки глутамина. Оказалось, что для связывания при кислом рН важны три высоко консервативных остатка гистидина (His-464, His-510 и His-535). Информацию о важности остатков гистидина, присутствующих в DIII, а также важности His-166 в FcRn для связывания с HSA, использовали при разработке стыковки комплекса HSA-shFcRn. В соответствии с молекулярными данными, DIII составляет основную часть поверхности взаимодействия при незначительном вкладе со стороны DI. Кроме того, было показано, что сайты связывания IgG и альбумина не перекрываются и они не мешают связыванию друг друга (9, 21). Это хорошо согласуется со стыковочной моделью, в которой нет никаких препятствий для одновременного связывания двух лигандов (фиг.16). Так или иначе, не исключено, что связывание альбумина индуцирует конформационные изменения у рецептора или наоборот.
После изучения стыковочной модели не было обнаружено прямых контактов между сайтом прикрепления олигосахарида (Asn-494), присутствующим у варианта HSA Casebrook, и shFcRn. Однако Asp-494 входит в состав N-концевого участка широкой петли (490-510), соединяющей DIIIa и DIIIb, поэтому весьма вероятно, что изменения в составе N-концевой части петли индуцируют конформационные изменения по всей петле. Структурное значение остатков Asp-494 и Glu-495 подтверждается тем, что оба они являются высоко консервативными между различными видами (фиг.2). Важно отметить, что модель стыковки предполагает, что некоторые остатки в С-концевой части петли находятся в непосредственном контакте с платформой α1-α2 у рецептора, при этом ключевыми остатками являются His-510 и Glu-505 у HSA, а также Glu-54 у shFcRn. His-510 является одним из трех консервативных остатков гистидина, а мутация этого остатка (т.е. H510Q) значительно снижает связывание с shFcRn. Из остальных двух консервативных остатков гистидина у HSA, участвующих в связывании с FcRn, His-535 может усиливать комплекс HSA-FcRn посредством ароматического стэкинга или стабилизации петли между субдоменами DIIIa и DIIIb в HSA. His-464 может взаимодействовать, прямо или косвенно, с гибким элементом β-шпильки в FcRn. Интересно, что эта петля с β-шпилькой является наиболее гибкой частью в FcRn, за исключением рН-зависимой петли, стабилизированной His-166, судя по сравнению кристаллических структур при низком и высоком рН. Гибкая петля с β-шпилькой в shFcRn находится в контакте как с α-спиралью в HSA, содержащей His-464, так и с длинной петлей в DI, что предполагает непрямую конформационную "настройку" интерфейса shFcRn-HSA с участием DI и DIIIa. Таким образом, данные свидетельствуют, что остатки гистидина и FcRn, и альбумина являются фундаментальными для оптимального рН-зависимого связывания. Эти данные подтверждают исследование, показывающее, что мутации консервативных остатков гистидина на аланин приводят к увеличению клиренса HSA у мутантов DIII, слитых с фрагментами антител при введении мышам, однако не было показано корреляции со связыванием FcRn (25). Кроме того, с эволюционной точки зрения интересно, что две совершенно не родственные растворимые молекулы с различными функциями эволюционировали так, что они связываются с одним и тем же клеточным рецептором сходным рН- и гистидин-зависимым образом, что в обоих случаях приводит к спасению от деградации и удлинению времени полужизни.
Главной функцией альбумина является транспортировка жирных кислот, которые связываются асимметрично с гидрофобными карманами внутри или между тремя доменами (1, 26, 27). Домен DIII HSA содержит два сайта связывания с высоким сродством, а жирные кислоты связываются возле петли между DIIIa и DIIIb HSA, которая также содержит несколько остатков, влияющих на связывание с FcRn. Сравнение связанного с жирными кислотами и свободного HSA (19, 27) не показывает существенных перестановок в пределах субдомена DIII HSA при связывании, но значительный сдвиг в ориентации DI HSA относительно DIII HSA (фиг.17). В сущности, наложение DIII при связывании жирных кислот HSA на соответствующий FcRn-связывающий домен на модели стыковки свидетельствует, что DI может отходить от FcRn при связывании жирных кислот.
Функция FcRn - регуляция времени полужизни может использоваться в терапевтических и диагностических целях, как уже обсуждалось (28, 29). Очевидно, что перспективными кандидатами являются биологически активные пептиды и небольшие белки, полученные из комбинаторных библиотек или методами молекулярной инженерии, однако они (и все препараты) могут не проявить убедительного эффекта in vivo в связи с очень коротким временем полужизни вследствие того, что их размеры находятся ниже порога выведения из почек, а также подверженности деградации протеазами (30, 31). Это ограничивает переход таких молекул из разряда ведущих кандидатов в разряд лекарственных препаратов на рынке. Чтобы преодолеть эти препятствия, можно воспользоваться увеличением времени полужизни IgG или альбумина, которое контролируется FcRn. Некоторые примеров показывают, что генетическое слияние терапевтических белков с Fc IgG или HSA улучшает биораспределение и фармакокинетику (29).
Время полужизни IgG в сыворотке также можно сильно улучшить дальше того, к чему привела природа в ходе эволюции. Это область интенсивных исследований, которые привели к созданию искусственных вариантов IgG с точечными мутациями в Fc-части, что привело к улучшению рН-зависимого связывания с FcRn, а тем самым и к увеличению времени полужизни in vivo (4, 5, 32). До сих пор не было представлено никаких примеров для альбумина, за исключением того, что альбумин мыши связывается с shFcRn гораздо сильнее, чем HSA (21). Модель стыковки, представленная в настоящем исследовании, может способствовать разработке новых вариантов HSA с увеличенным временем полужизни в плазме, что может быть привлекательным для доставки как химических, так и биологических препаратов.
Опухоли и воспаленные ткани проявляют повышенное накопление альбумина из-за протекающих капилляров и дефектного лимфатического дренажа (33). Следовательно, терапевтические или диагностические средства на основе альбумина будут накапливаться в месте опухоли или воспаления. Кроме того, тонкая настройка времени полужизни альбумина может оказаться привлекательным подходом также и в отношении таргетинга опухолей и визуализации из-за токсичности слитых молекул для тканей. Модуляция времени полужизни IgG путем снижения сродства к FcRn, как оказалось, улучшает соотношение между опухолью и нормальной тканью и тем самым улучшает визуализацию опухолей (34, 35). Описанные в этой работе варианты HSA с существенно меньшим или промежуточным сродством связывания с FcRn могут служить привлекательными кандидатами для альбумина.
В WO 2011/051489 (РСТ/ЕР 10/066572; включено сюда в виде ссылки) показано, что определенное положение в альбумине (например, позиция 573 в HSA) может быть замещено любой другой аминокислотой, чтобы изменить сродство связывания с FcRn. Так, изменение в сигнальном положении дает группу вариантов альбумина с другим сродством связывания, чем у исходного альбумина (HSA дикого типа, SEQ ID NO: 2). Для позиции 573 все варианты проявляли лучшее связывание с shFcRn по сравнению с HSA дикого типа. В частности, у вариантов K573F, К573Н, К573Р, K573W и K573Y значение KD для shFcRn было более чем в 10 раз ниже, чем у исходного HSA. Вариант K573Stop является укороченным альбумином со стоп-код оном в положении 573, у которого значительно снижается связывание по сравнению с HSA дикого типа.
Пример 2. Идентификация участков HSA, необходимых для оптимального связывания с FcRn, при изменении которых будет меняться сродство связывания между FcRn и альбумином
На основе модели стыковки были визуально установлены положения тех аминокислотных остатков, которые локализованы непосредственно на поверхности взаимодействия между альбумином и FcRn или локализованы в непосредственной близости к ней. Эти положения выделены затемнением на фиг.9 и соответствуют положениям в домене I альбумина: 30-41, 75-91, 104-120, 144-150 и 186-201 и положениям в домене III альбумина: 414-426, 457-572, 492-538 и 550-585.
Пример 3. Определение положения аминокислот, участвующих в связывании HSA с FcRn. DIII участвует в рН-зависимом связывании с FcRn
Альбумин состоит из трех гомологичных доменов (DI, DII и DIII), содержащих α-спирали, стабилизированные сложной сетью из 12 остатков цистеина, образующих 6 дисульфидных мостиков (19). Три домена соединяются петлями и образуют сердцевидную структуру (фиг.4В). Два предыдущих исследования указывают на то, что DIII альбумина важен для связывания с FcRn (2, 17). Чтобы проверить это и подробно исследовать, какой вклад вносит каждый отдельный домен в сайт связывания с FcRn, было получено несколько вариантов доменов (DI-DIII, DII-DIII, DI-DII, DIII), а также полноразмерный HSA (фиг.4С) в дрожжевых клетках (фиг.4D). Связывание каждого из них с иммобилизованным растворимым рекомбинантным FcRn человека (shFcRn-GST) измеряли методом поверхностного плазменного резонанса (SPR), при этом вводили равные количества вариантов доменов при рН 6,0 и рН 7,4. Вариант, состоящий только из DIII, связывается с shFcRn, а вариант, у которого отсутствует DIII, не связывается (фиг.4Е). Кроме того, вариант DI-DIII связывается с shFcRn немного сильнее, чем один лишь DIII (таблица 2а). С другой стороны, DII вроде как не вносит вклада в связывание.
Каждый из трех доменов HSA содержит два субдомена, а и b. Чтобы установить важность С-концевого субдомена DIIIb, был получен вариант HSA, у которого этот домен был делегирован (HSA DIIIa). Отсутствие DIIIb полностью устраняло связывание с shFcRn (фиг.4F). Для сравнения включали рекомбинантный вариант HSA Bartin (17), при этом подтвердилось то, что DIIIb важен для связывания рецептора. Эти результаты свидетельствуют, что интактный DIII важен для связывания с рецептором.
Таблица 2а.
Кинетика связывания вариантов HSA с shFcRn-GST по данным SPR
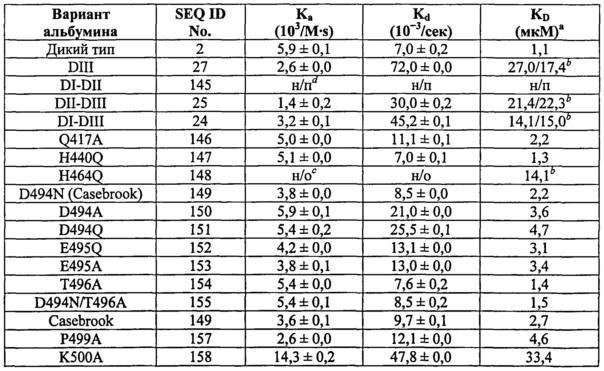
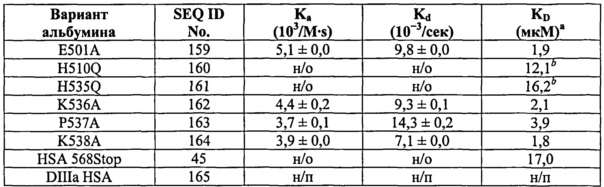
a Кинетические константы скорости получали с использованием простой модели бимолекулярного взаимодействия первого порядка (1:1) Ленгмюра, в которой предполагается, что одна молекула HSA связывается с одним FcRn. Кинетические значения представляют собой среднее из трех измерений.
b Стационарные константы сродства получали с использованием модели равновесного связывания (Req), встроенной в программу BIAevaluation 4.1. Кинетические значения представляют собой среднее из трех измерений.
c н/о, не определено из-за отсутствия или очень слабого связывания.
d н/п, не получено из-за быстрой кинетики связывания.
Casebrook - точечная мутация в DIII HSA, которая изменяет связывание с FcRn
В норме HSA не гликозилирован, но существуют немногие исключения за счет редких полиморфизмов (16). Один из таких вариантов (Casebrook) содержит замену одного нуклеотида, которая изменяет кодирование с Asp на Asn по остатку аминокислоты 494 (20), локализованной в том тяже аминокислот (остатки 490-510), который образует длинную петлю, соединяющую субдомены DIIIa и DIIIb (фиг.5А и 6А). Этот природный полиморфизм вводит мотив гликозилирования (494Asn-Glu-Thr496) и прикрепления N-связанного олигосахарида. Было проведено исследование миграции при SDS-PAGE и связывания с FcRn у ряда рекомбинантных вариантов HSA, что позволило нам вскрыть роль олигосахарида и индивидуальных аминокислот при 494Asn-Glu-Thr496. Рекомбинантная версия Casebrook (D494N) мигрировала медленнее, чем HSA дикого типа при SDS-PAGE, что отражает присоединение олигосахаридных остатков (фиг.5В). Кроме того, у шести вариантов: D494A, D494Q, E495Q, Е495А, Т496А и D494N/T496A, мотив гликозилирования был нарушен, вследствие чего все они мигрировали подобно дикому типу (фиг.5В).
Все варианты проверяли на связывание с иммобилизованным shFcRn методом SPR, при этом выявлялись четкие различия по связыванию при кислых значениях рН в следующем порядке от самого сильного до самого слабого связывания: дикий тип >Т496А>D494N/T496A>D494N>E495Q Е495А>D494A>D494Q (фиг.5C-F, таблица 2а). Аналогичная тенденция наблюдалась при исследовании связывания методом ELISA (фиг.10). Кинетика связывания проявляла различия в скорости диссоциации у большинства мутантов, за исключением D494N (Casebrook), который проявлял 2-кратное снижение сродства связывания в результате изменения констант ассоциации и диссоциации. Мутации Asp-494 и Glu-495 на Ala или Gln оказывали большое влияние на связывание с рецептором, тогда как мутация у фланкирующего Thr-496 оказывала лишь небольшое влияние на связывание. Вариант HSA Casebrook, выделенный из гетерозиготного индивида, связывался с shFcRn аналогично рекомбинантному (фиг.5F, фиг.11, таблица 2а).
У гетерозиготных индивидов вариант Casebrook присутствует на уровне в 2-3 раза ниже, чем нормальный HSA (20). Чтобы воспроизвести ситуацию in vivo, при которой вариант Casebrook существует в присутствии большого количества HSA дикого типа, который конкурирует за связывание с FcRn, проводили анализ конкурентного связывания методом SPR и обнаружили, что способность варианта Casebrook к конкуренции за связывание с рецептором снижалась почти на 50% по сравнению с HSA дикого типа (фиг.5G), что отражает 2-кратное снижение сродства связывания (таблица 2а).
Структурные последствия Casebrook - стабильность соединяющей DIIIa-DIIIb петли
Исследовали целостность и укладку у мутантов HSA методом кругового дихроизма. У мутантов не наблюдалось никаких серьезных отличий от HSA дикого типа ни при рН 7,4, ни при рН 6,0 (фиг.12, таблица 3).
Таблица 3.
Элементы вторичной структуры, определенные методом CD
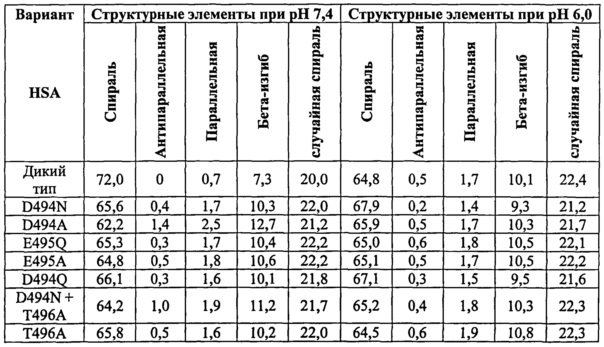
Затем изучали кристаллическую структуру HSA (19) и оказалось, что Asp-494 участвует во внутримолекулярной сети полярных взаимодействий с участием аминокислот в обоих субдоменах DIII, а и b (фиг.5А). Карбоксильная боковая цепь Asp-494 образует стабилизированный зарядом солевой мостик с Arg-472, а также водородные связи с Gln-417 и с Thr-496. N-связанное гликозилирование Asn-494 должно уменьшить его способность к образованию водородных связей и устранить отрицательный компонент солевого мостика, что может быть важным для стабилизации петли. В поддержку этого служит то, что мутация Q417A также уменьшает связывание с shFcRn (фиг.5Н, таблица 2а). Кроме того, гликозилирование, т.е. введение громоздкой молекулы, может очень сильно дестабилизировать N-концевую часть петли, охватывающую остатки 490-495, и тем самым изменить ее конформацию.
Помимо Asp-494, Glu-495 и Thr-496 в N-концевой части петли, подвергали мутагенезу Pro-499, Lys-500 и Glu-501 в середине петли (фиг.6А) и исследовали его влияние на связывание shFcRn. Для Р499А и Е501А отмечались умеренные эффекты, тогда как К500А резко уменьшала связывание с рецептором (фиг.6В, таблица 2а).
Роль консервативных остатков гистидина в DIII HSA
Руководствуясь тем, что остатки гистидина играют ключевую роль в сильно зависящем от рН взаимодействии IgG-FcRn (4, 5), оценивали роль 4 остатков гистидина, находящихся в DIII HSA. Из них 3 являются сильно консервативными между видами (His-464, His-510 и His-535), а один - нет (His-440) (фиг.2). В то время, как His-440 и His-464 находятся внутри субдомена DIIIa, His-510 располагается на конце петли, соединяющей субдомены DIIIa и DIIIb, a His-535 находится в одной из α-спиралей DIIIb (фиг.6А). Все 4 остатка гистидина индивидуально подвергали мутации на глутамин (фиг.13) и проверяли на связывание с shFcRn при рН 6,0. Мутация каждого из 3 консервативных остатков гистидина почти полностью устраняла связывание, тогда как мутация неконсервативного His-440 не устраняла (фиг.6С, таблица 2а). Таким образом, данные указывают на то, что 3 остатка гистидина внутри DIII являются ключевыми для рН-зависимого связывания с FcRn, что соответствует потребности в консервативных остатках гистидина на сгибе области Fc у IgG (His-310 и His-435).
Кроме того, было показано, что когда аминокислоты в непосредственной близости от His-535 (Lys-536, Pro-537 и Lys-538) индивидуально подвергаются мутации на остатки аланина, то связывание также ослабляется (фиг.6D, таблица 2а). В целом данные по связыванию свидетельствуют, что структура центральной части DIII важна для рН-зависимого связывания с FcRn.
Картирование сайта связывания на FcRn
Ранее мы установили, что сильно консервативные остатки гистидина, локализованные в α2-домене НС FcRn мыши и человека, важны для связывания альбумина (His-168 и His-166, соответственно) (21, 22). Для выяснения молекулярного механизма изучали кристаллическую структуру shFcRn, которая была недавно выполнена в кислых условиях (рН 4,2) (фиг.4А) (23). Как оказалось, His-166 участвует в сети внутримолекулярных взаимодействий с участием стабилизированных зарядами водородных связей с Glu-54 и Tyr-60, которые находятся на выходящей на поверхность петле в домене α1 (остатки 51-60) (фиг.7А). При низком рН His-166 должен иметь положительный заряд, что говорит о том, что взаимодействие незаряженного His-166 с Glu-54 и Tyr-60 будет ослабляться или устраняться при физиологических значениях рН, что приведет к более гибкой петле. Такое объяснение подтверждается тем, что этот участок петли структурно разупорядочен в кристаллической структуре shFcRn, выполненной при щелочном рН (рН 8,5) (фиг.7В). Кроме того, соответствующая петля также упорядочена в определенной конформации в кристаллической структуре FcRn крысы в комплексе с Fc IgG2a крысы, выполненной при кислом рН (6). Сравнение двух структур FcRn человека при низком и высоком значении рН указывает на ключевую регулирующую роль His-166 в запирании и высвобождении гибкой петли между Trp-51 и Tyr-60 (фиг.7а и 7b).
Glu-54 также участвует во взаимодействии с Gln-56 (фиг.7А). Для изучения важности Glu-54 и Gln-56 оба остатка индивидуально подвергали мутации с глутамина на аланинин, соответственно, и два полученных варианта рецептора (shFcRn E54Q и shFcRn Q56A) проверяли на связывание с HSA методом ELISA при рН 6,0 (по методике, описанной в WO 2011/051489 (РСТ/ЕР 10/066572), включенной сюда в виде ссылки). Влияние мутации E54Q было поразительным, так как почти не проявлялось связывание HSA с рецептором, а вариант Q56A частично потерял способность связываться с HSA (фиг.7С). Таким образом, данные свидетельствуют о важной структурной роли His-166 в стабилизации петли из α1-домена shFcRn рН-зависимым образом через связывание с Glu54, причем упорядоченная структура этой петли при кислом рН является необходимым условием для эффективного связывания альбумина.
Пример 4. Усечение С-концевой части HSA модулирует связывание с shFcRn
Экспрессионные конструкции для усеченных мутантов HSA (таблица 6, ниже) получали методом ПЦР с репарацией пробелов. Продукты ПЦР получали с помощью полимеразы Phusion (New England Biolabs) в соответствии с инструкцией производителя, используя в качестве матрицы pDB3927 (описана в WO 2010/092135, включенной сюда в виде ссылки) и олигонуклеотиды (таблица 4 и 5). При этом получали ДНК, в которой определенные кодоны (т.е. аминокислоты 568 и 572-585, за исключением позиции 573) заменяли на стоп-кодон трансляции амино-ТАА. Эти продукты ПЦР клонировали в плазмиды и использовали для получения экспрессирующих плазмид в дрожжевых клетках методом репарации пробелов.
Таблица 4.
Усеченные молекулы HSA
В таблице 4 варианты альбумина поименованы таким образом, что "HSA 585stop" означает такой вариант HSA, у которого природная аминокислота в положении 585 заменена на стоп-кодон.
В частности, для экспрессирующей конструкции HSA568stop использовали олигонуклеотиды хАР314 и хАР307, чтобы амплифицировать фрагмент в 493 п.о. из pDB3927, содержащий последовательность ДНК, кодирующей DIII HSA, в соответствии с инструкциями производителя. Стоп-кодон встраивали в олигонуклеотид хАР307 таким образом, чтобы трансляция последовательности ДНК, кодирующей HSA, заканчивалась после аминокислоты 567. ПЦР-фрагмент расщепляли AvrII/Bsu36I, очищали с помощью набора Qiagen PCR-clean up (в соответствии с инструкциями производителя) и лигировали в pDB3927, расщепленную AvrII/Bsu36I. Продукты лигирования трансформировали в Е.coli DH5α, а затем из трансформантов выделяли плазмиды (набор Qiagen Miniprep, согласно инструкциям производителя) и идентифицировали правильные конструкции с помощью рестрикционного анализа. В результате получали экспрессирующую HSA568stop конструкцию pDB4557.
Экспрессирующие конструкции для HSA572stop и от HSA574stop до HSA581stop получали с помощью олигонуклеотидов таким же образом, что и конструкцию HSA568stop (таблица 5), получая плазмиды от pDB4548 до pDB4556 (таблица 4).
Для конструкций от HSA582stop до HSA585stop (1,122 kb) фрагменты из pDB3927 подвергали ПЦР-амплификации с помощью олигонуклеотидов (таблица 5). ПЦР-фрагменты по отдельности расщепляли BglII/HindIII, выделяли и лигировали в pDB2923 (Finnis C.J. et al. (2010) High-level production of animal-free recombinant transferrin from Saccharomyces cerevisiae. Microb. Cell Fact. 9:87)), получая плазмиды #10D, #11B, #12C и #13D, соответственно. Плазмиды от #10D до #13D расщепляли AvrII/SphI и из каждой выделяли фрагменты в 666 п.о. (содержащие ДНК, кодирующую С-концевую часть альбумина) и лигировали в AvrII/SphI-расщепленную pDB3927, получая конструкции для репарации пробелов от pDB4544 до pDB4557, соответственно (таблица 4).
Плазмиды от pDB4544 до pDB4557 расщепляли NsiI/PvuI, выделяли ДНК (набор Qiagen PCR Purification kit, согласно инструкциям производителя), а затем использовали, вместе с Acc65I/BamHI-расщепленной pDB3936, для совместной трансформации S.cerevisiae BXP10cir0, как описано выше, получая экспрессирующие плазмиды в дрожжевых клетках путем репарации пробелов.
Для каждого полученного штамма дрожжей готовили запасные культуры. Нужным штаммом инокулировали 10 мл бульона BMMD (0,17% масс. дрожжевой азотистой основы без аминокислот и сульфата аммония (Difco), 37,8 мМ сульфата аммония, 36 мМ лимонной кислоты, 126 мМ двунатриевого кислого ортофосфата рН 6,5, 2% масс. глюкозы, доводили до рН 6,5 с помощью NaOH) и культивировали в течение 48 ч при 30°С на круговой качалке при 200 об/мин. Затем по 5 мл каждой культуры смешивали с равным объемом 40% масс. трегалозы и порции в 1 мл переносили в криопробирки для хранения при -80°С.
Конструирование дрожжевого штамма, вырабатывающего вариант HSA573stop, описано в WO 2011/0541489 (включено сюда в виде ссылки).
Таблица 5.
Последовательности олигонуклеотидов для получения усеченных мутантов HSA


Получали следующие варианты (фрагменты) и определяли их связывание с shFcRn-GST, как описано в «Материалах и методах». В частности, кодоны, кодирующие аминокислоты в С-концевой части HSA, индивидуально заменяли на ТАА (т.е. стоп-кодон трансляции), получая усеченные варианты HSA из таблицы 6. Данные по связыванию вариантов HSA с shFcRn представлены в таблице 6 и на фиг.20 и 21.
Таблица 6.
Кинетика связывания усеченных вариантов HSA с shFcRn-GST по данным SPR
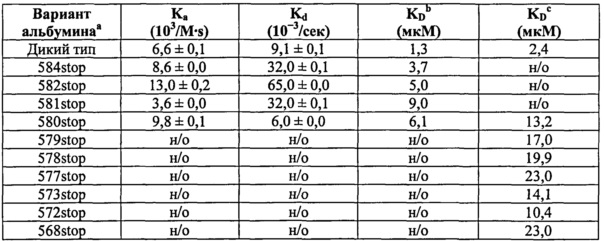
а Различные разведения вариантов HSA пропускали над иммобилизованным shFcRn (~2000 RU).
b Кинетические константы скорости получали с использованием простой модели бимолекулярного взаимодействия первого порядка (1:1). Кинетические значения представляют собой среднее из двух измерений.
c Стационарные константы сродства получали с использованием модели равновесного связывания (Req), встроенной в программу BIAevaluation 4.1.
d н/о, не определяли.
Данные таблицы 6 и фиг.20 показывают важное значение С-концевой части HSA при рН-зависимом связывании с shFcRn. Как ни удивительно, удаление последней аминокислоты (Leu585) снижало связывание с рецептором на 50% по сравнению с HSA дикого типа, а дальнейшее усечение усиливало эффект (фиг.20).
Точно так же наблюдалась общая тенденция к снижению сродства с увеличением длины усечения при анализе конкурентного связывания (фиг.21), т.е. конкуренция постепенно уменьшается с удалением большего числа аминокислот.
Определение значений KD показало сильное воздействие С-концевых усечений (таблица 4).
Пример 5. Изменения в С-концевой части HSA модулируют связывание с shFcRn
Экспрессионные конструкции для мутантов HSA (таблица 7, ниже) получали методом ПЦР с репарацией пробелов. Это делали путем создания продуктов ПЦР с помощью полимеразы Phusion (New England Biolabs) в соответствии с инструкцией производителя, используя в качестве матрицы pDB3927 и олигонуклеотиды (таблицы 7 и 8). Каждый ПЦР-фрагмент расщепляли AvrII/Bsu36I, очищали с помощью набора Qiagen PCR-clean up (в соответствии с инструкциями производителя) и лигировали в pDB3927, расщепленную AvrII/Bsu36I. Продукты лигирования трансформировали в Е.coli DH5α, а затем из трансформантов выделяли плазмиды (набор Qiagen Miniprep, в соответствии с инструкциями производителя) и идентифицировали правильные конструкции путем секвенирования.
Таблица 7.
Изменения в С-концевой части HSA
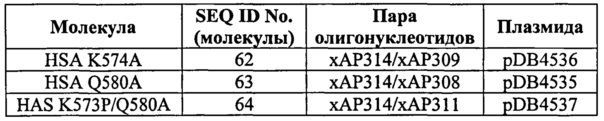
Таблица 8.
Последовательности олигонуклеотидов для получения изменений в С-концевой части HSA
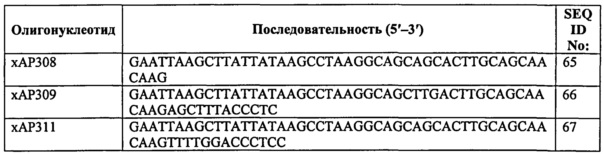
Плазмиды от pDB4535 до pDB4537, содержащие нужные замены (таблица 7), расщепляли NsiI/PvuI, выделяли ДНК (набор Qiagen PCR Purification kit, согласно инструкциям производителя), а затем использовали, вместе с Acc65I/BamHI-расщепленной pDB3936, для совместной трансформации S.cerevisiae BXP10cir0, как описано выше, получая экспрессирующие плазмиды в дрожжевых клетках путем репарации пробелов. Для каждого полученного дрожжевого штамма готовили запасные культуры, как описано выше.
Получали следующие варианты и определяли их сродство связывания с shFcRn-GST, как описано в «Материалах и методах». Результаты представлены в таблице 9 и на фиг.22.
Таблица 9.
Кинетика связывания вариантов HSA с shFcRn-GST по данным SPR
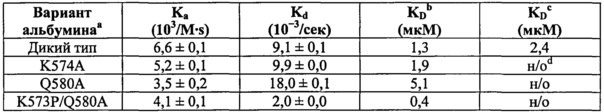
a Различные разведения вариантов HSA пропускали над иммобилизованным shFcRn (~2000 RU).
b Кинетические константы скорости получали с использованием простой модели бимолекулярного взаимодействия первого порядка (1:1). Кинетические значения представляют собой среднее из двух измерений.
с Стационарные константы сродства получали с использованием модели равновесного связывания (Req), встроенной в программу BIAevaluation 4.1.
d н/о, не определяли.
Данные являются еще одним свидетельством важности С-концевой части HSA при рН-зависимом связывании с shFcRn. Как оказалось, замены Q580 и К574 на аланин снижают сродство связывания примерно в 2 и 4 раза, соответственно (фиг.22 и таблица 5). Двойной мутант (комбинация К573Р с Q580A) вызывал улучшение сродства к shFcRn. В целом данные из примеров 4 и 5 показывают важность аминокислот в последней α-спирали DIIIb для связывания альбумина с shFcRn.
Пример 6. Анализ сродства связывания вариантов альбумина с shFcRn методом SPR
Варианты альбумина получали в соответствии с приведенными ниже способами.
Получение плазмид, для экспрессии определенные мутеины HSA
Варианты HSA экспрессировали с применением нескольких стандартных методов молекулярной биологии типа описанных в Sambrook J. and Russell D.W., 2001 (Molecular Cloning: A Laboratory Manual, 3rd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y). Ниже описаны два метода, которые используются для введения мутаций в последовательность HSA, в зависимости от их близости к подходящим рестрикционным сайтам в плазмиде pDB3964, кодирующей HSA дикого типа (как описано в WO 2010/092135, включенной сюда в виде ссылки).
Метод 1. Если существуют рестрикционные сайты, расположенные проксимально к требуемой мутации, то разрабатывали мутагенные олигонуклеотиды, охватывающие и требуемое изменение, и соответствующие рестрикционные сайты (таблицы 10 и 11). При реакции ПЦР использовали соответствующие праймеры (описанные в таблицах 12 и 13) с помощью набора Phusion kit от New England Biolabs и pDB3964 в качестве матрицы. Полученные продукты очищали (набор QIAquick PCR Purification kit, в соответствии с инструкциями производителя). Продукты ПЦР расщепляли соответствующими рестрикционными ферментами (таблица 10) и выделяли (набор QIAquick Gel Extraction kit, в соответствии с инструкциями производителя). Полученные фрагменты лигировали с соответствующим образом расщепленной pDB3964 с тем, чтобы последовательность HSA дикого типа была заменена последовательностью HSA, содержащей нужную мутацию. Продукты лигирования трансформировали в клетки Е.coli DH5α и выделяли плазмиды (набор Qiagen Plasmid Plus, в соответствии с инструкциями производителя). Все плазмиды секвенировали для проверки того, что последовательность HSA содержала мутации только в нужном положении.
Таблица 10.
Плазмиды и замены аминокислот и соответствующие праймеры (см. также таблицу 2)
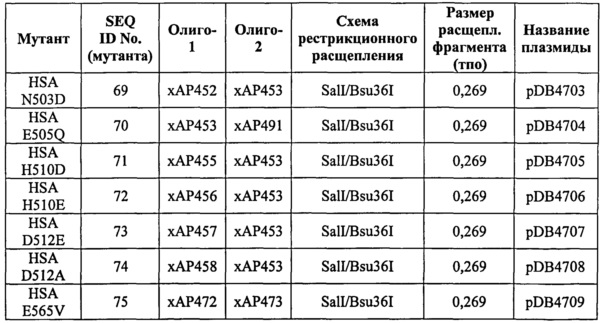
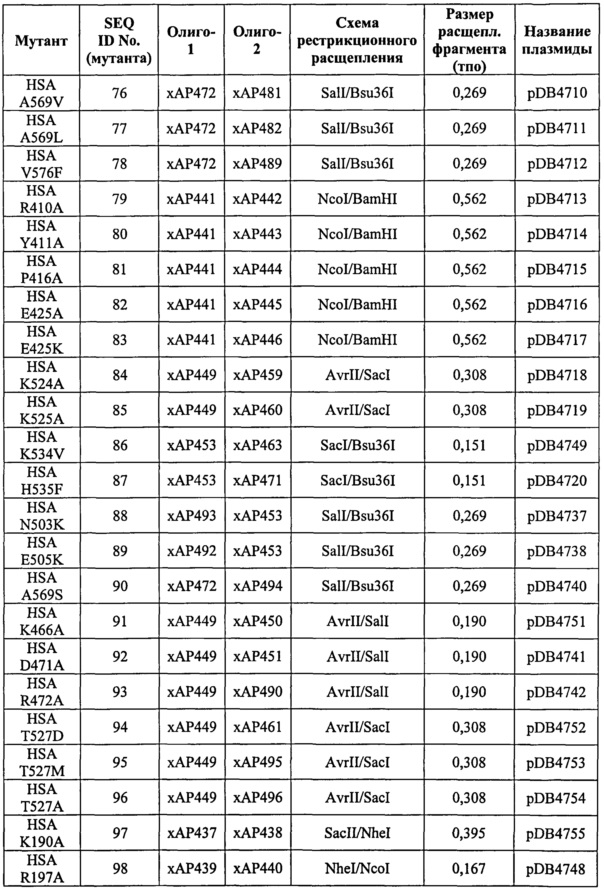
Таблица 11.
Олигонуклеотиды для мутагенеза
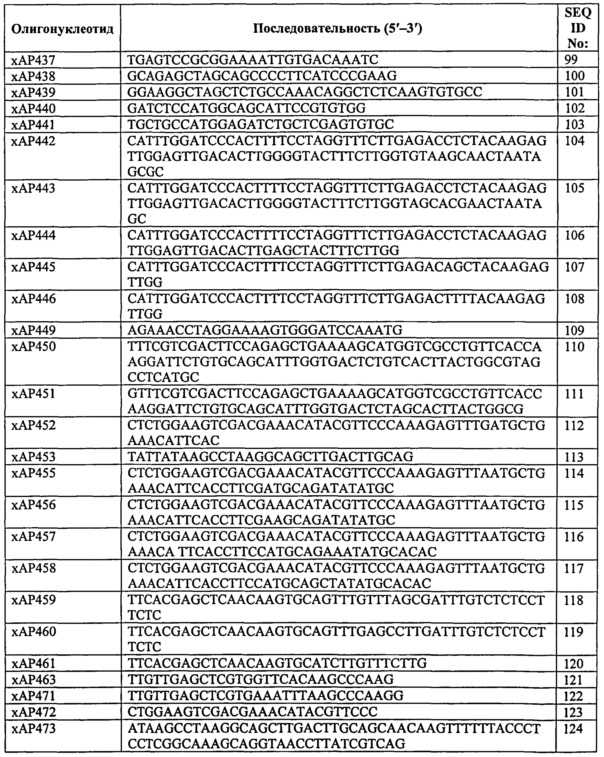

Таблица 12.
Компоненты реакции ПЦР
Таблица 13.
Условия реакции ПЦР

Метод 2. Если же не было рестрикционных сайтов поблизости от требуемой мутации, то получали синтетические фрагменты ДНК путем сборки гена (GeneArt, Life Technologies) таким образом, чтобы они содержали мутации внутри гена HSA и подходящие сайты рестрикции для вставки в плазмиду pDB3964, кодирующую HSA дикого типа, при этом последовательность нуклеотидов у синтетического фрагмента, кодирующего незамененные аминокислоты, была идентична таковой у pDB3964 (см. таблицы 14 и 15). Синтетические конструкции расщепляли рестрикционными ферментами, приведенными в таблице 14, выделяли нужные фрагменты (набор QIAquick Gel Extraction kit) и лигировали с соответствующим образом расщепленной pDB3964 с тем, чтобы последовательность HSA дикого типа была заменена последовательностью HSA, содержащей нужную мутацию. Продукты лигирования трансформировали в клетки Е.coli DH5α и выделяли плазмиды (набор Qiagen Plasmid Plus, в соответствии с инструкциями производителя). Все плазмиды секвенировали для проверки того, что последовательность HSA содержала мутации только в нужном положении.
Таблица 14.
Плазмиды и аминокислотные замены
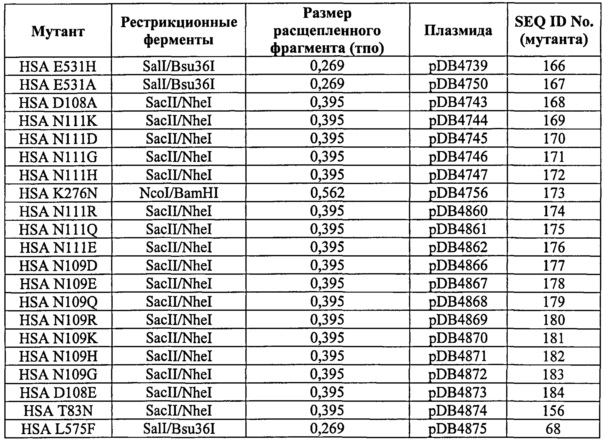
Таблица 15.
Кодоны, использовавшиеся для введения замен аминокислот в HSA
Получение комбинаций мутантов с К573Р
Комбинированных мутантов получали (таблица 16), комбинируя подгруппу мутаций, описанных в таблице 10 и 14, с вариантом HSA K573P (плазмида pDB4110). Из плазмиды pDB4110 выделяли фрагмент в 0,358 тпо, кодирующий ДНК варианта K573P, путем расщепления рестрикционными ферментами SacI/SphI, очищали его с помощью набора QIAquick Gel Extraction Kit и лигировали в pDB4704, pDB4716 и pDB4753 (см. таблицу 10), расщепленные теми же ферментами, получая варианты HSA E505Q/K573P, Е425А/К573Р и Т527М/К573Р, соответственно. Других комбинированных мутантов получали путем расщепления pDB4110 рестрикционными ферментами NaeI/NcoI, выделения, как описано выше, и лигирования с эквивалентными фрагментами из pDB4745, pDB4746 и pDB4747 (описаны в таблице 14), получая комбинированных мутантов N111D/K573P, N111G/K573P и N111H/K573P, соответственно. Для получения мутанта K534V/K573P получали синтетическую ДНК, содержащую обе нужные мутации, методом сборки гена (GeneArt, Life Technologies). Фрагмент расщепляли по сайтам рестрикции SalI/Bsu36I, выделяли, как описано выше, и лигировали в соответствующим образом расщепленную pDB3964. Для получения комбинированных мутантов N111R/K573P, N111Q/K573P и N111E/K573P из конструкций GeneArt по сайтам рестрикции SacII/NheI выделяли фрагменты, содержащие мутации N111, и клонировали в соответствующим образом расщепленную pDB3964, содержащую фрагмент SacI/SphI pDB4110, кодирующий мутацию К573Р (обозначается как pDB4852), как описано выше. Лигированные плазмиды трансформировали в клетки Е.coli, а затем выделяли плазмиды (набор Qiagen Plasmid Plus, согласно инструкциям производителя). Все плазмиды подвергали секвенированию для проверки того, что последовательность HSA содержала мутации только в нужных положениях.
Таблица 16.
Комбинированные мутанты HSA
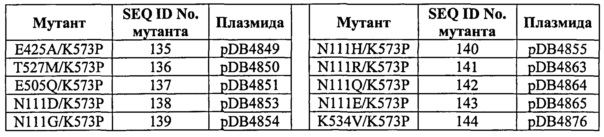
Получение экспрессирующих плазмид и дрожжевых стоков
Получение экспрессирующих плазмид и трансформацию S.cerevisiae проводили, как описано выше, с тем отличием, что клетки высеивали штрихом на чашки с BMMD с добавлением 0,69 г/л CSM-Leu (MP Biomedicals).
Стоки получали либо 48-часовым способом, описанным выше (pDB4703-pDB4720, pDB4737-pDB4756, pDB4849-pDB4855), либо 24-часовым способом, описанным в WO 2011/051489 (pDB4860-pDB4876), с тем отличием, что в обоих случаях использовали бульон BMMS (0,17% масс. дрожжевой азотистой основы без аминокислот и сульфата аммония (Difco), 37,8 мМ сульфата аммония, 36 мМ лимонной кислоты, 126 мМ двунатриевого кислого ортофосфата рН 6,5, 2% масс. сахарозы, доводили до рН 6,5 с помощью NaOH).
Анализ методом SPR
Анализ методом SPR проводили на приборе Biacore 3000 (GE Healthcare). Иммобилизацию проводили на чипах СМ5, на которых фиксировали shFcRn (GeneArt 1025291) методом конденсации с аминами, согласно инструкциям производителя. Уровень иммобилизованного shFcRn-HIS составлял 1500-2500 RU, что достигалось введением 5-10 мкг/мл shFcRn в ацетате натрия рН 5,0 (GE Healthcare). Поверхность чипов стабилизировали при постоянной подаче (5 мкл/мин) рабочего буфера - буфера HBS-EP (0,01 М HEPES, 0,15 М NaCl, 3 мМ EDTA, 0,005% сурфактанта Р20) при рН 7,4 (GE Healthcare)) при 25°С в течение ~1-2 ч. После стабилизации лиганда поверхность чипов праймировали (×2) двухосновным/одноосновным фосфатным буфером рН 5,5 и обрабатывали введением 5-12×45 мкл двухосновного/одноосновного фосфатного буфера при 30 мкл/мин с последующими стадиями регенерации HBS_EP (12 сек) между каждым введением. Затем поверхности проверяли на активность путем введения 3×45 мкл положительного контроля при 30 мкл/мин, а затем импульсной регенерацией за 12 сек. Кинетические измерения проводили при введении разведений (100 мкМ - 1 мкМ) HSA и вариантов HSA при 30 мкл/мин над иммобилизованным shFcRn при 25°С. Вычитали значение в контрольной ячейке, а для получения кинетических данных и проверки значений KD использовали программу BIAevaluation 4.1.
Варианты представляли собой альбумин (SEQ ID NO: 2), содержащий по одной точечной мутации, выбранной из: D108A, N111D, N111G, N111H, N111K, K190A, R197A, K276N, R410A, Y411A, P416A, E425A, E425K, K466A, D471A, R472A, N503D, N503K, E505K, E505Q, H510D, H510E, D512A, D512E, K524A, K525A, T527A, T527D, T527M, E531A, E531H, K534V, H535F, E565V, A569L, A569S, A569V и V576F.
Сначала варианты анализировали методом SPR для определения их реакции связывания (RU) с shFcRn. Для определения KD отбирали только те варианты, которые проявляли реакцию связывания больше чем на 20% выше или ниже, чем реакция связывания у альбумина дикого типа (таблице 18, ниже). В качестве контроля использовали HSA дикого типа и HSA с мутацией К573Р.
Таблица 18.
Сродство связывания вариантов альбумина с shFcRn-HIS

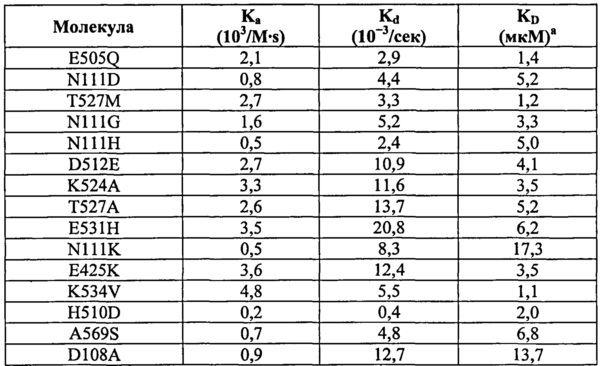
* Среднее из 5 повторов, поэтому значения ka и kd не приводятся.
Варианты с меньшим значением KD, чем у HSA дикого типа, имеют более высокое сродство связывания с shFcRn. И наоборот, варианты с большим значением KD, чем у HSA дикого типа, имеют более низкое сродство связывания с shFcRn.
Данные для положений 108 и 111 подтверждают участие петли, включающей положения 105-120, во взаимодействии с FcRn и тем самым прогнозируют, что изменения в любом положении в пределах этой петли будут модулировать сродство связывания альбумина с FcRn.
Пример 7. Анализ методом SPR сродства связывания вариантов альбумина с shFcRn-HIS
Варианты представляли собой альбумин (SEQ ID NO: 2), содержащий по одной точечной мутации, выбранной из: N111D, N111G, N111H, N111D/K573P, N111G/K573P, N111H/K573P, E505Q, E425A, T527M, E505Q/K573P, E425A/K573P и Т527М/К573Р, и были получены, как описано выше.
Таблица 19.
Сродство связывания вариантов альбумина с shFcRn-HIS
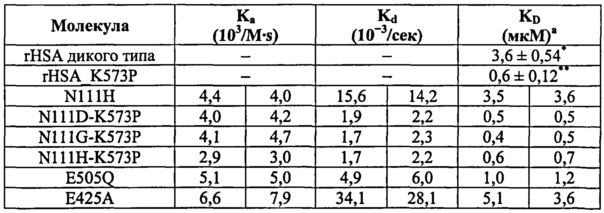
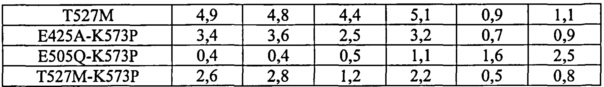
* Среднее из 8 и стандартное отклонение.
** Среднее из 5 и стандартное отклонение.
Варианты с меньшим значением KD, чем у HSA дикого типа, имеют более высокое сродство связывания с shFcRn. И наоборот, варианты с большим значением KD, чем у HSA дикого типа, имеют более низкое сродство связывания с shFcRn.
Данные показывают, что повышение сродства при добавлении К573Р соответствует самой замене К573Р.
Пример 8. Анализ методом SPR сродства связывания вариантов альбумина с shFcRn-HIS
Варианты представляли собой альбумин (SEQ ID NO: 2), содержащий по одной точечной мутации, выбранной из: N111R, N111Q, N111E, N111R/K573P, N111Q/K573P, N111E/K573P, N109D, N109E, N109Q, N109R, N109K, N109H, N109G, D108E, T83N, L575F и K534V/K573P, и были получены, как описано выше.
Таблица 20.
Сродство связывания вариантов альбумина с shFcRn-HIS
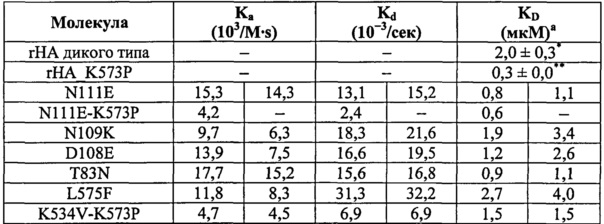
* Среднее из 11 и стандартное отклонение.
** Среднее из 5 и стандартное отклонение.
Полученные данные свидетельствуют о роли петли 108-111 в связывании HSA с FcRn, судя по снижению сродства связывания у вариантов D108A и N111K (таблица 18). Дополнительные мутации в позиции 111 проявляют различное сродство связывания, от снижения сродства у варианта N111K до варианта N111E, проявляющего повышение сродства к FcRn по сравнению с HSA дикого типа (таблица 20). Вариант N111Q/K573P (фиг.23) дает кривую связыванию с повышением реакции и снижением диссоциации, что соответствует замене К573Р. Относительное положение участка петли 108-112 из HSA и FcRn (фиг.24) свидетельствует о том, что этот участок может вносить вклад в связывание с FcRn, как это предположено в примере 6.
Относительное положение соседнего участка петли из домена 1, содержащего остатки 78-88 (фиг.24), свидетельствует о том, что этот участок может вносить вклад в связывание с FcRn. Это подтверждается тем, что вариант T83N проявляет повышение сродства к FcRn по сравнению с HSA дикого типа (таблица 20).
Можно прогнозировать, что мутации соседних остатков, в частности Е82, Р110 и L112 (фиг.24), будут изменять сродство связывания HSA с FcRn.
Изобретение, описанное и заявленное здесь, не должно ограничиваться рамками изложенных здесь конкретных аспектов, так как эти аспекты служат для иллюстрации некоторых аспектов изобретения. Любые эквивалентные аспекты должны входить в объем настоящего изобретения. Так, из предшествующего описания специалистам должны быть очевидными различные модификации изобретения в дополнение к представленным и описанным здесь. Такие модификации также должны входить в объем прилагаемой формулы изобретения. В случае конфликта должно преобладать настоящее описание, включая определения.
СПИСОК ЛИТЕРАТУРЫ К ПРИМЕРАМ 1, 2, 3
1. Peters T, Jr. (1985) Serum albumin. Adv Protein Chem 37: 161-245.
2. Chaudhury С et al. (2003) The major histocompatibility complex-related Fc receptor for IgG (FcRn) binds albumin and prolongs its lifespan. J Exp Med 197(3): 315-322.
3. Anderson CL et al. (2006) Perspective - FcRn transports albumin: relevance to immunology and medicine. Trends Immunol 27(7): 343-348.
4. Roopenian DC & Akilesh S (2007) FcRn: the neonatal Fc receptor comes of age. Nat Rev Immunol 7(9): 715-725.
5. Ward ES & Ober RJ (2009) Chapter 4: Multitasking by exploitation of intracellular transport functions the many faces of FcRn. Adv Immunol 103: 77-115.
6. Burmeister WP, Huber AH, & Bjorkman PJ (1994) Crystal structure of the complex of rat neonatal Fc receptor with Fc. Nature 372(6504): 379-383.
7. Burmeister WP, Gastinel LN, Simister NE, Blum ML, & Bjorkman PJ (1994) Crystal structure at 2.2 Ǻ resolution of the MHC-related neonatal Fc receptor. Nature 372(6504): 336-343.
8. West AP, Jr. & Bjorkman PJ (2000) Crystal structure and immunoglobulin G binding properties of the human major histocompatibility complex-related Fc receptor. Biochemistry 39(32): 9698-9708.
9. Chaudhury C, Brooks CL, Carter DC, Robinson JM, & Anderson CL (2006) Albumin binding to FcRn: distinct from the FcRn-IgG interaction. Biochemistry 45(15): 4983-4990.
10. Ober RJ, Martinez C, Lai X, Zhou J, & Ward ES (2004) Exocytosis of IgG as mediated by the receptor, FcRn: an analysis at the single-molecule level. Proc Natl Acad Sci USA 101(30): 11076-11081.
11. Ober RJ, Martinez C, Vaccaro C, Zhou J, & Ward ES (2004) Visualizing the site and dynamics of IgG salvage by the MHC class I-related receptor, FcRn. J Immunol 172(4): 2021-2029.
12. Prabhat P et al. (2007) Elucidation of intracellular recycling pathways leading to exocytosis of the Fc receptor, FcRn, by using multifocal plane microscopy. Proc Natl Acad Sci USA 104(14): 5889-5894.
13. Roopenian DC et al. (2003) The MHC class I-like IgG receptor controls perinatal IgG transport, IgG homeostasis, and fate of IgG-Fc-coupled drugs. J Immunol 170(7): 3528-3533.
14. Montoyo HP et al. (2009) Conditional deletion of the MHC class I-related receptor FcRn reveals the sites of IgG homeostasis in mice. Proc Natl Acad Sci USA 106(8): 2788-2793.
15. Wani MA et al. (2006) Familial hypercatabolic hypoproteinemia caused by deficiency of the neonatal Fc receptor, FcRn, due to a mutant beta2-microglobulin gene. Proc Natl Acad Sci USA 103(13): 5084-5089.
16. Minchiotti L, Galliano M, Kragh-Hansen U, & Peters T, Jr. (2008) Mutations and polymorphisms of the gene of the major human blood protein, serum albumin. Hum Mutat 29(8): 1007-1016.
17. Andersen JT, Daba MB, & Sandlie I (2010) FcRn binding properties of an abnormal truncated analbuminemic albumin variant. Clin Biochem 43(4-5): 367-372.
18. Andersen JT & Sandlie I (2007) A receptor-mediated mechanism to support clinical observation of altered albumin variants. Clin Chem 53(12): 2216.
19. Sugio S, Kashima A, Mochizuki S, Noda M, & Kobayashi К (1999) Crystal structure of human serum albumin at 2.5 Ǻ resolution. Protein Eng 12(6): 439-446.
20. Peach RJ & Brennan SO (1991) Structural characterization of a glycoprotein variant of human serum albumin: albumin Casebrook (494 Asp-Asn). Biochim Biophys Acta 1097(1): 49-54.
21. Andersen JT, Daba MB, Berntzen G, Michaelsen ТЕ, & Sandlie I (2010) Cross-species binding analyses of mouse and human neonatal Fc receptor show dramatic differences in immunoglobulin G and albumin binding. J Biol Chem 285(7): 4826-4836.
22. Andersen JT, Dee Qian J, & Sandlie I (2006) The conserved histidine 166 residue of the human neonatal Fc receptor heavy chain is critical for the pH-dependent binding to albumin. Eur J Immunol 36(11): 3044-3051.
23. Mezo AR, Sridhar V, Badger J, Sakorafas P, & Nienaber V (2010) X-ray crystal structures of monomeric and dimeric peptide inhibitors in complex with the human neonatal Fc receptor, FcRn. J Biol Chem 285(36): 27694-27701.
24. Sheffield WP, Marques JA, Bhakta V, & Smith IJ (2000) Modulation of clearance of recombinant serum albumin by either glycosylation or truncation. Thromb Res 99(6): 613-621.
25. Kenanova VE et al. (2010) Tuning the serum persistence of human serum albumin domain III: diabody fusion proteins. Protein Eng Des Sel 23(10): 789-798.
26. Simard JR et al. (2005) Locating high-affinity fatty acid-binding sites on albumin by X-ray crystallography and NMR spectroscopy. Proc Natl Acad Sci USA 102(50): 17958-17963.
27. Curry S, Mandelkow H, Brick P, & Franks N (1998) Crystal structure of human serum albumin complexed with fatty acid reveals an asymmetric distribution of binding sites. Nat Struct Biol 5(9): 827-835.
28. Kuo TT et al. (2010) Neonatal Fc receptor: from immunity to therapeutics. J Clin Immunol 30(6): 777-789.
29. Andersen JT & Sandlie I (2009) The versatile MHC class I-related FcRn protects IgG and albumin from degradation: implications for development of new diagnostics and therapeutics. Drug Metab Pharmacokinet 24(4): 318-332.
30. Werle M & Bernkop-Schnurch A (2006) Strategies to improve plasma half-life time of peptide and protein drugs. Amino Acids 30(4): 351-367.
31. McGregor DP (2008) Discovering and improving novel peptide therapeutics. Curr Opin Pharmacol 8(5): 616-619.
32. Zalevsky J et al. (2010) Enhanced antibody half-life time improves in vivo activity. Nat Biotechnol 28(2): 157-159.
33. Stehle G et al. (1997) Plasma protein (albumin) catabolism by the tumor itself-implications for tumor metabolism and the genesis of cachexia. Crit Rev Oncol Hematol 26(2): 77-100.
34. Kenanova V et al. (2005) Tailoring the pharmacokinetics and positron emission tomography imaging properties of anti-carcinoembryonic antigen single-chain Fv-Fc antibody fragments. Cancer Res 65(2): 622-631.
35. Kenanova V et al. (2007) Radioiodinated versus radiometal-labeled anti-carcinoembryonic antigen single-chain Fv-Fc antibody fragments: optimal pharmacokinetics for therapy. Cancer Res 67(2): 718-726.
36. Andersen JT et al. (2008) Ligand binding and antigenic properties of a human neonatal Fc receptor with mutation of two unpaired cysteine residues. FEBS J 275(16): 4097-4110.
37. Chen R, Li L, & Weng Z (2003) ZDOCK: an initial-stage protein-docking algorithm. Proteins 52(1): 80-87.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАРИАНТЫ АЛЬБУМИНА | 2013 |
|
RU2670063C2 |
| ВАРИАНТЫ АЛЬБУМИНА | 2010 |
|
RU2607374C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2728861C1 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2698655C2 |
| CD40L-СПЕЦИФИЧНЫЕ КАРКАСНЫЕ СТРУКТУРЫ, ПРОИСХОДЯЩИЕ ИЗ TN3, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2826189C2 |
| CD40L-СПЕЦИФИЧНЫЕ КАРКАСНЫЕ СТРУКТУРЫ, ПРОИСХОДЯЩИЕ ИЗ Tn3, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2704992C2 |
| УСОВЕРШЕНСТВОВАННЫЕ СВЯЗЫВАЮЩИЕСЯ С СЫВОРОТОЧНЫМ АЛЬБУМИНОМ ВЕЩЕСТВА | 2018 |
|
RU2789495C2 |
| СЛИТЫЕ КОНСТРУКЦИИ ЛЕКАРСТВЕННОГО СРЕДСТВА И КОНЪЮГАТЫ | 2005 |
|
RU2428431C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2642310C2 |
| РЕКОМБИНАНТНЫЕ БЕЛКИ С ДОМЕНАМИ CCN И СЛИТЫЕ БЕЛКИ | 2020 |
|
RU2825102C2 |















































































































































































































































































































































































































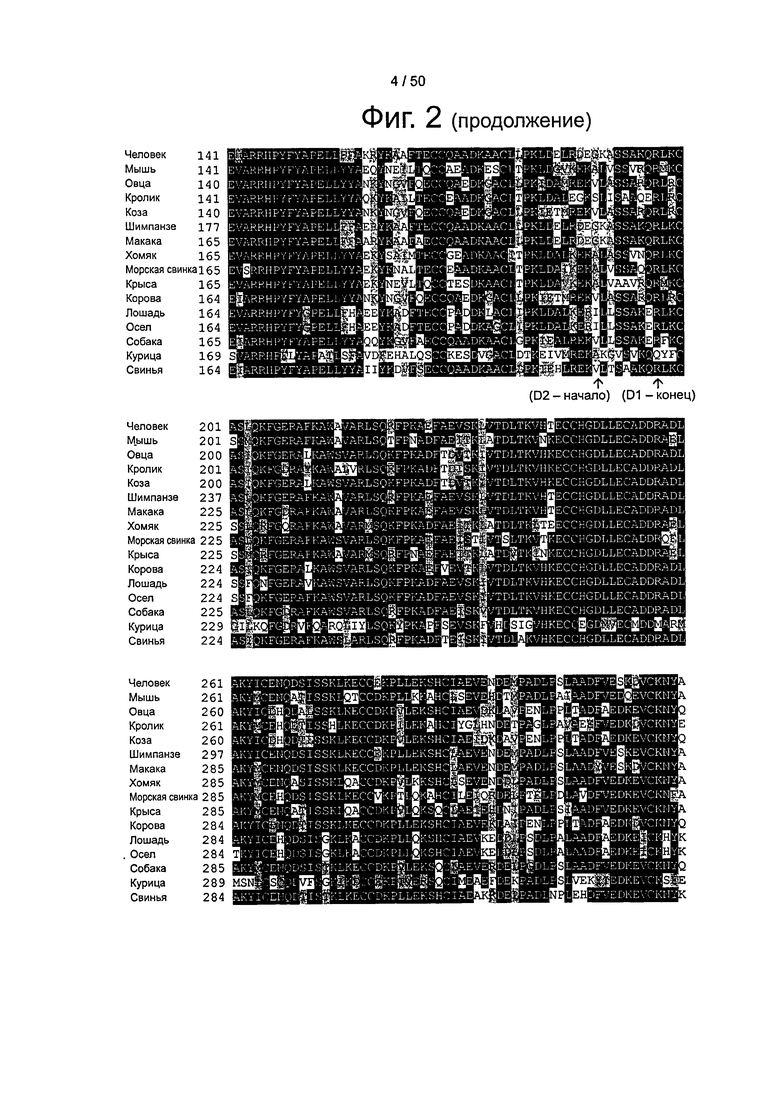


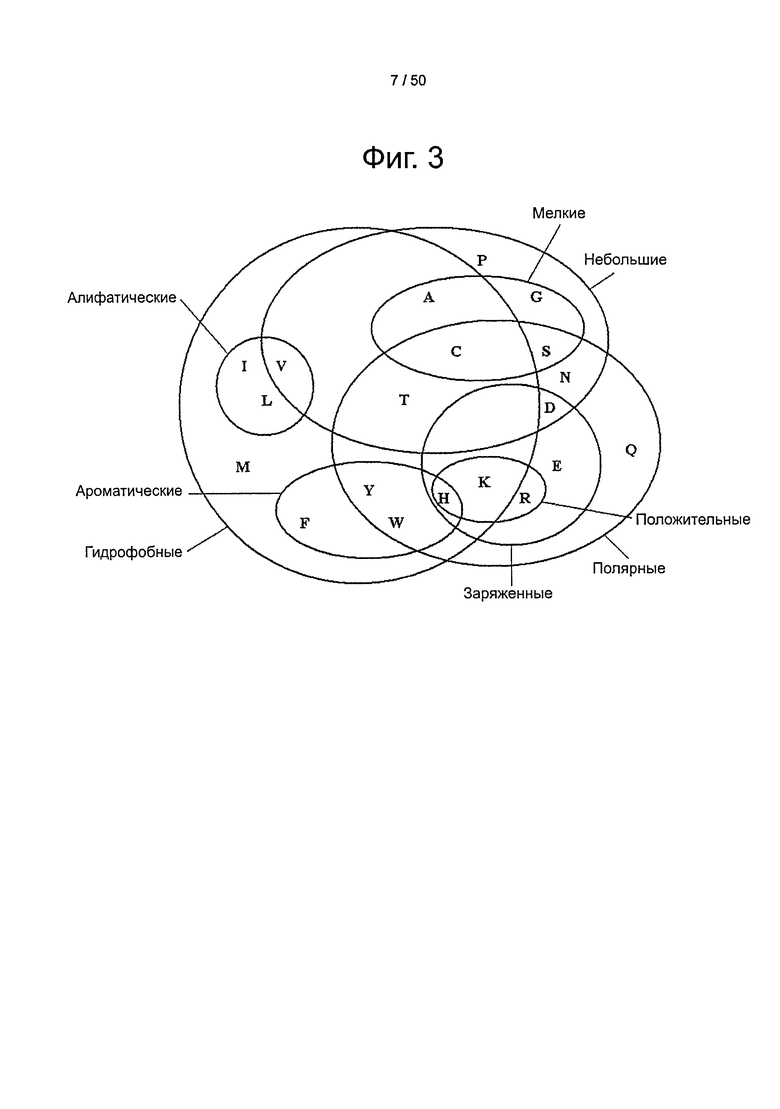

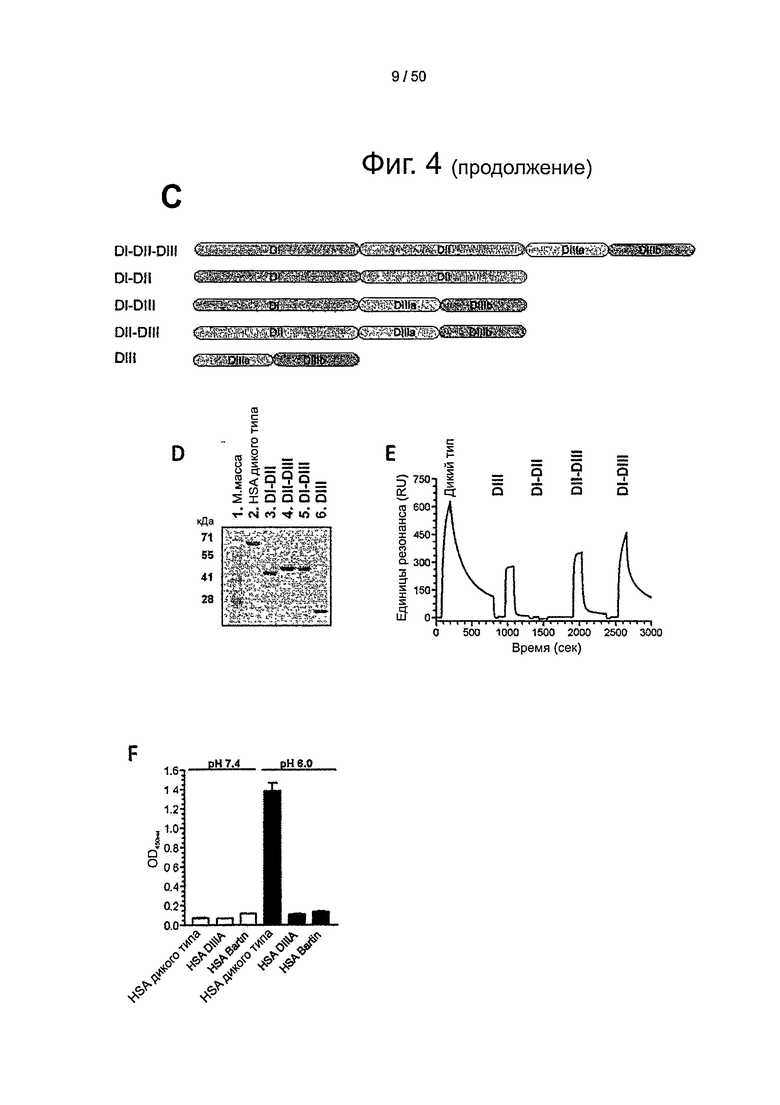
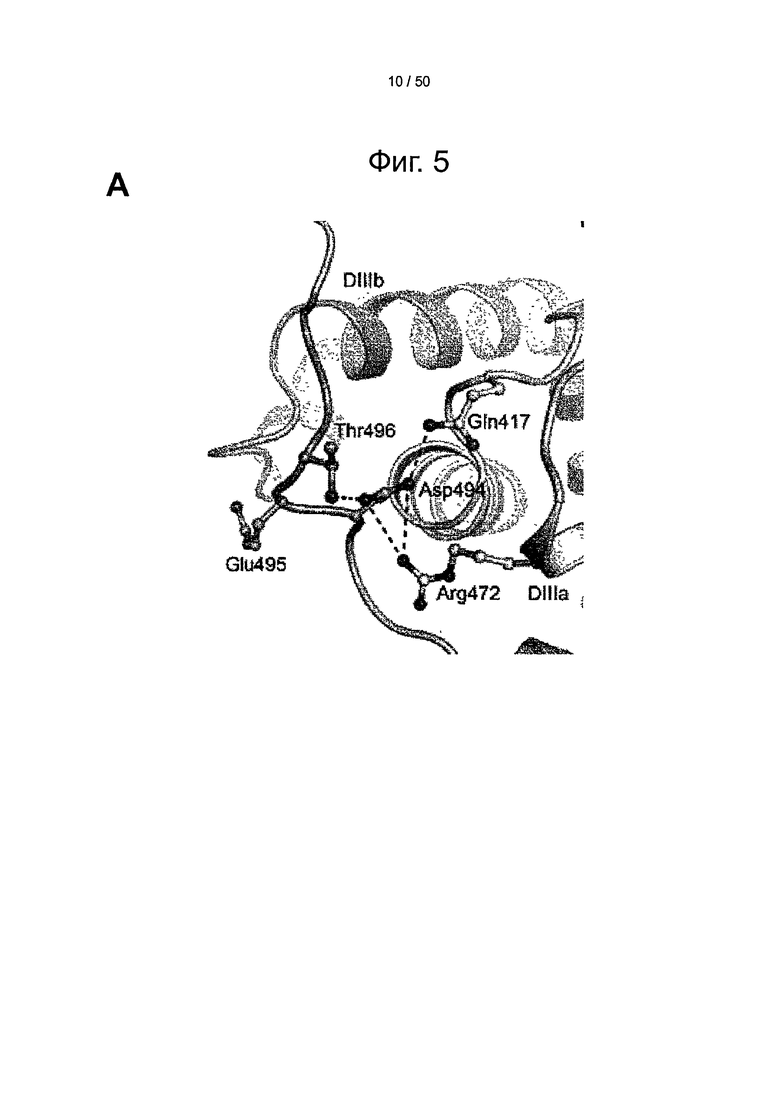
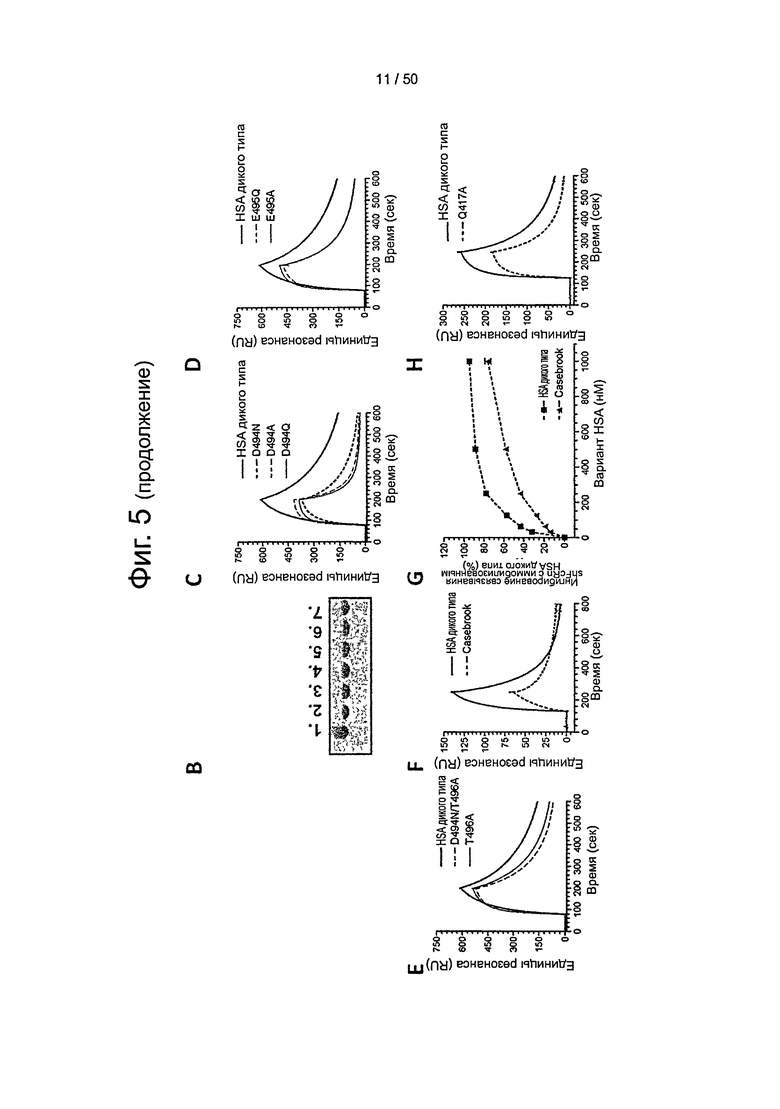
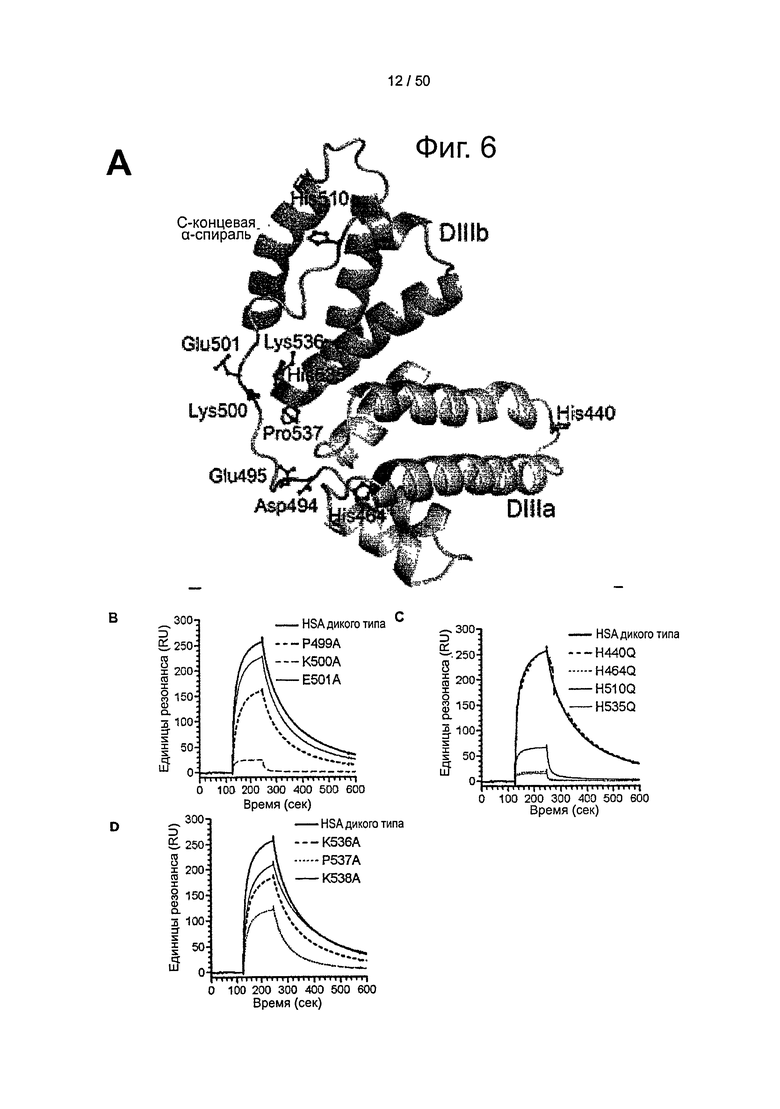
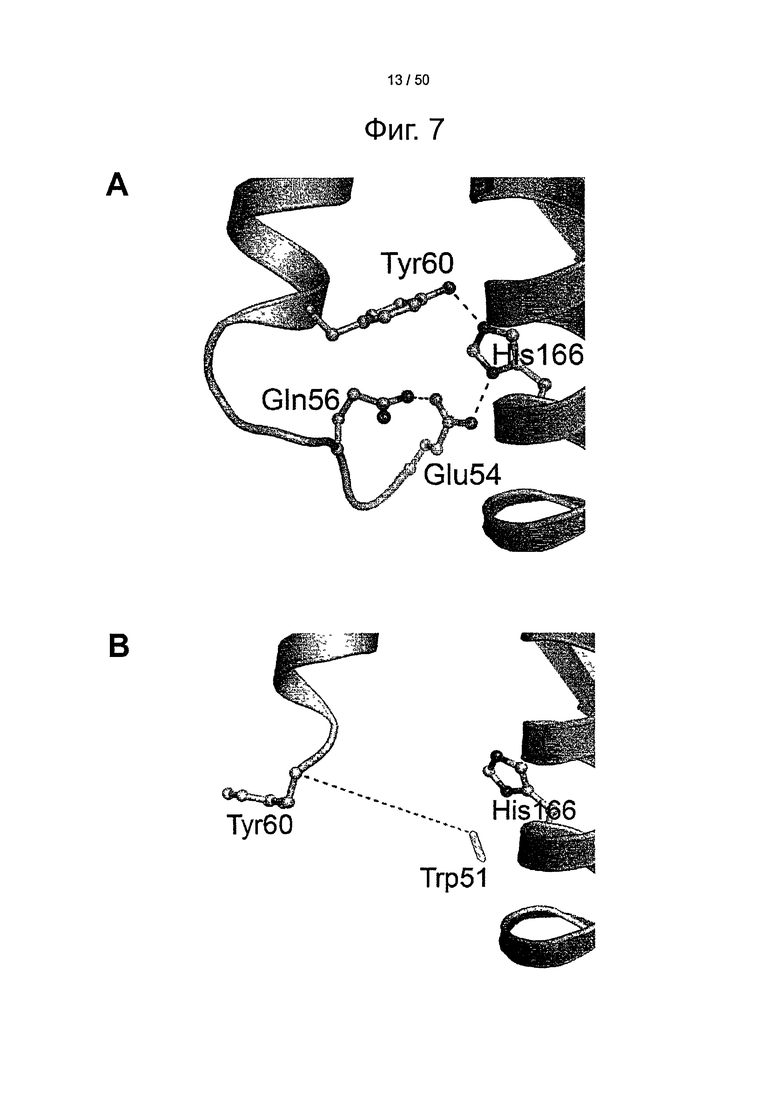
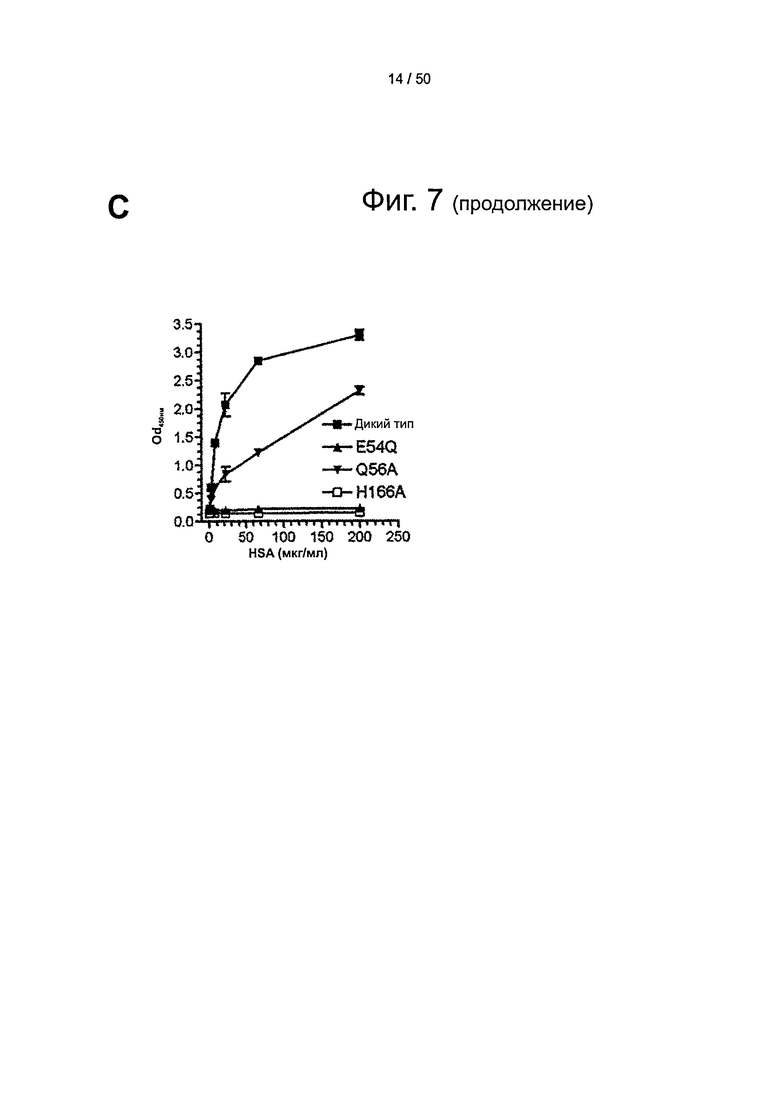
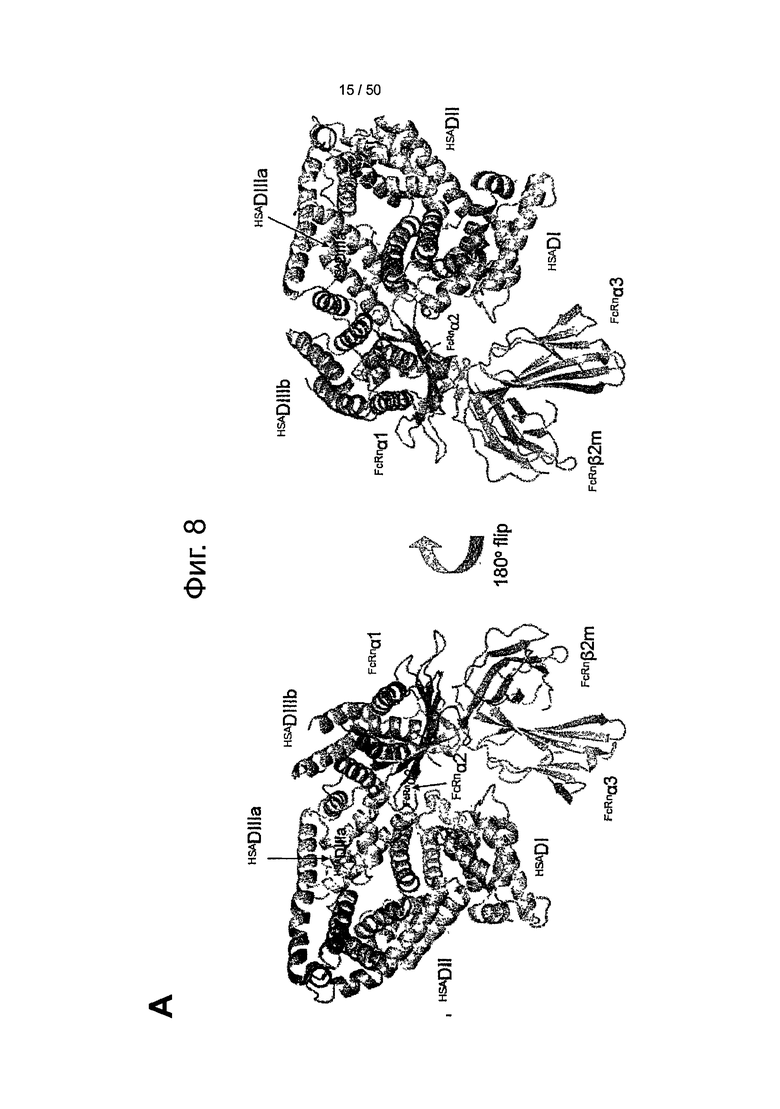
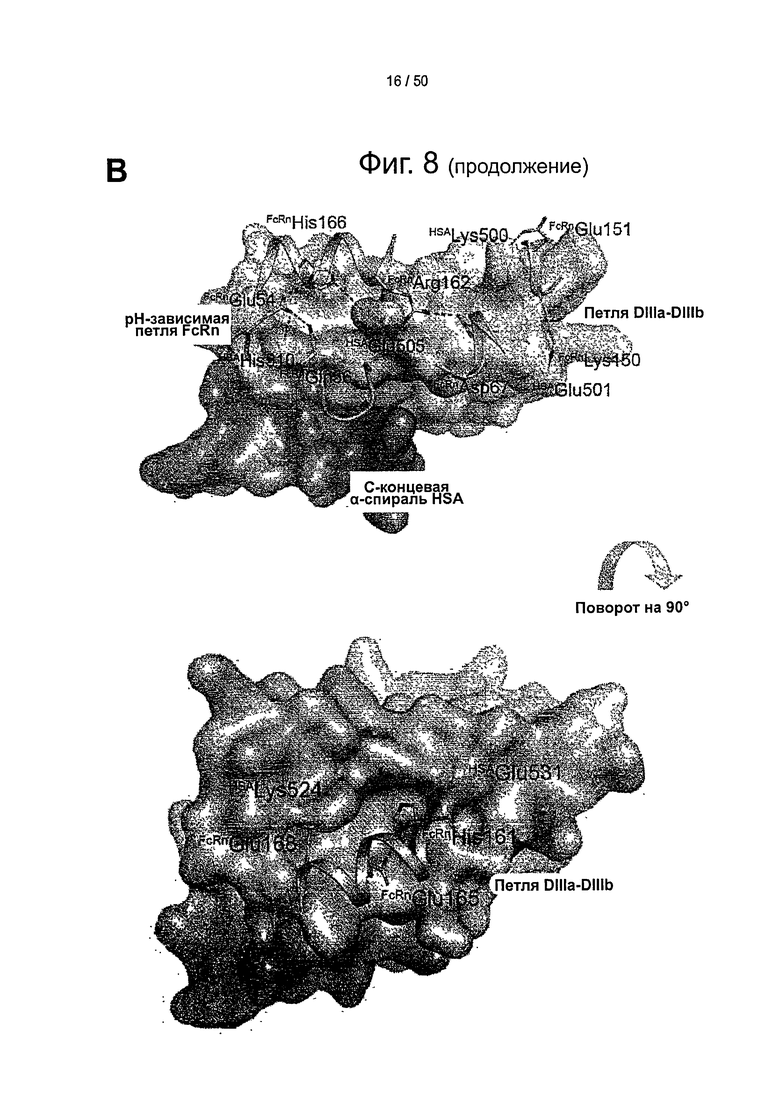

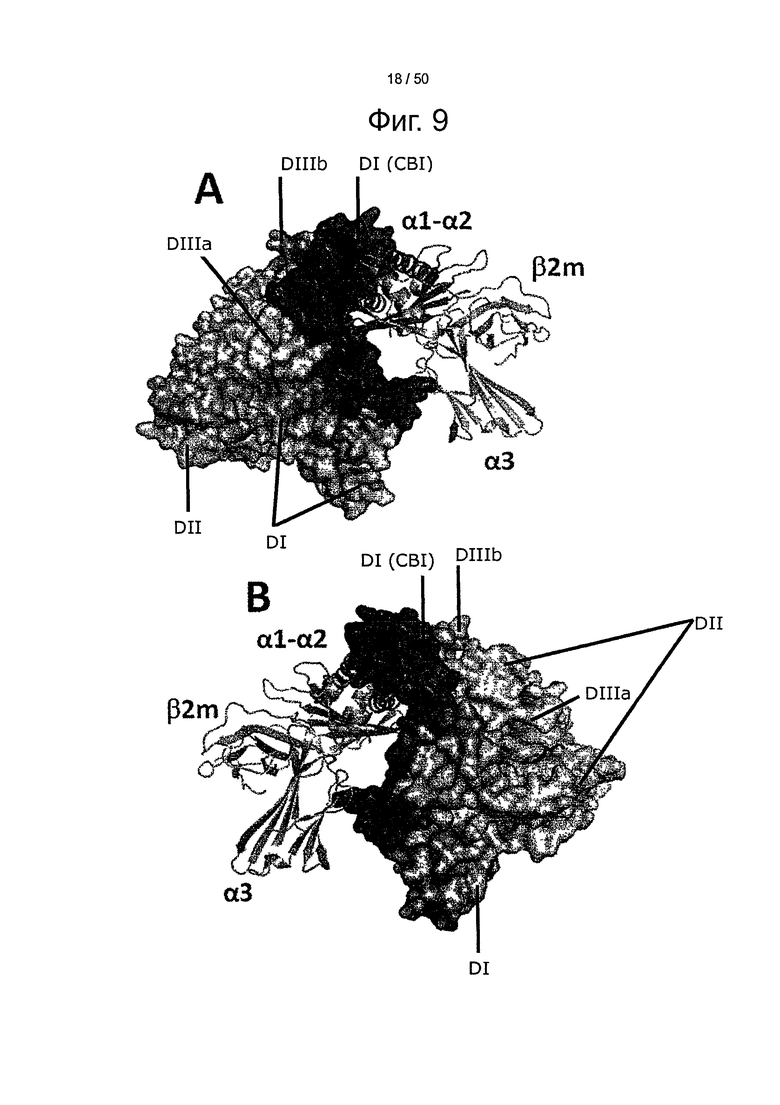
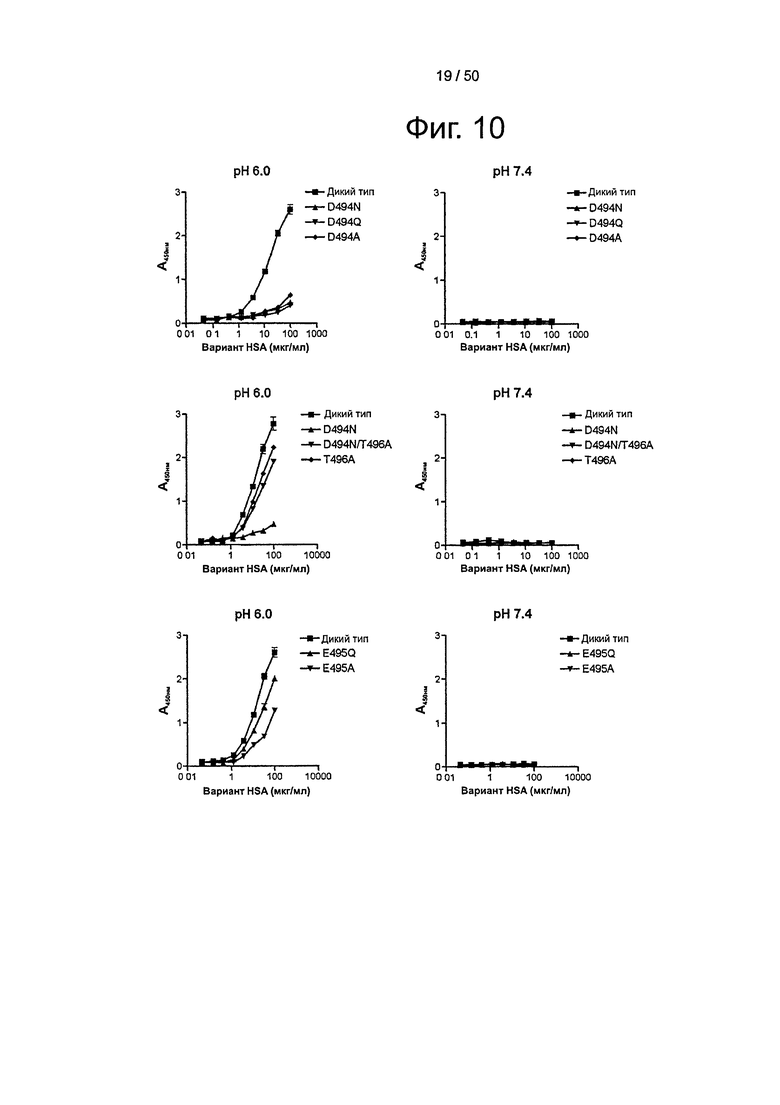
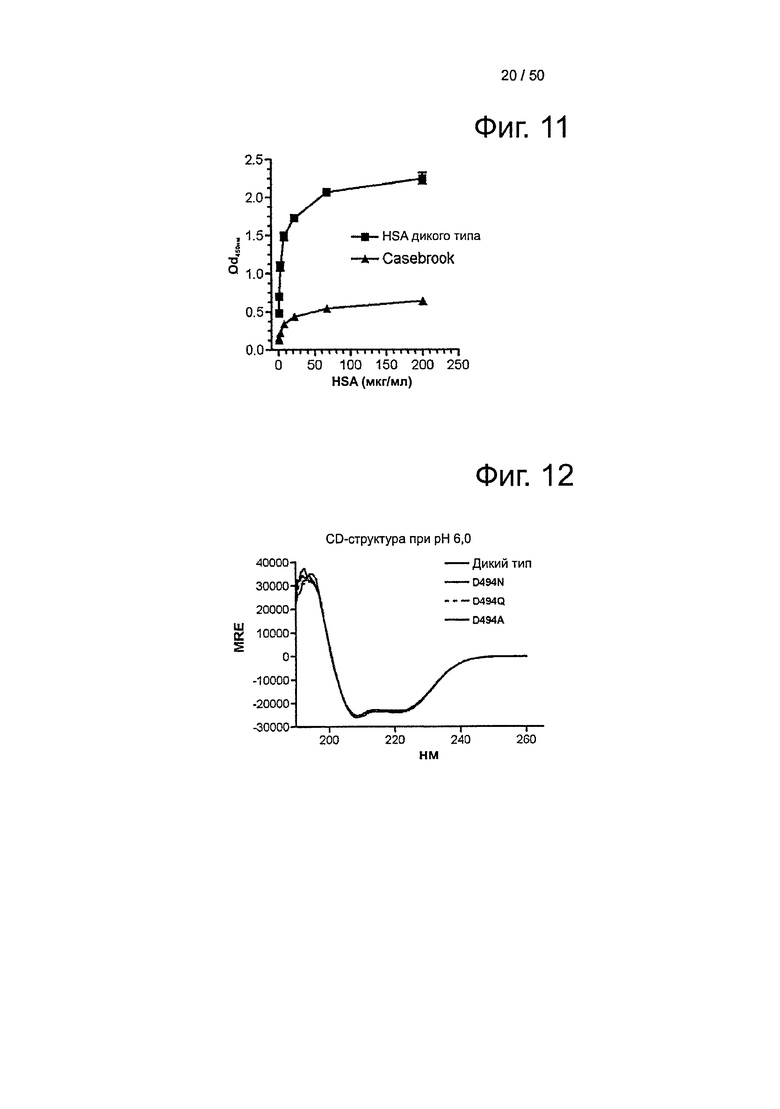
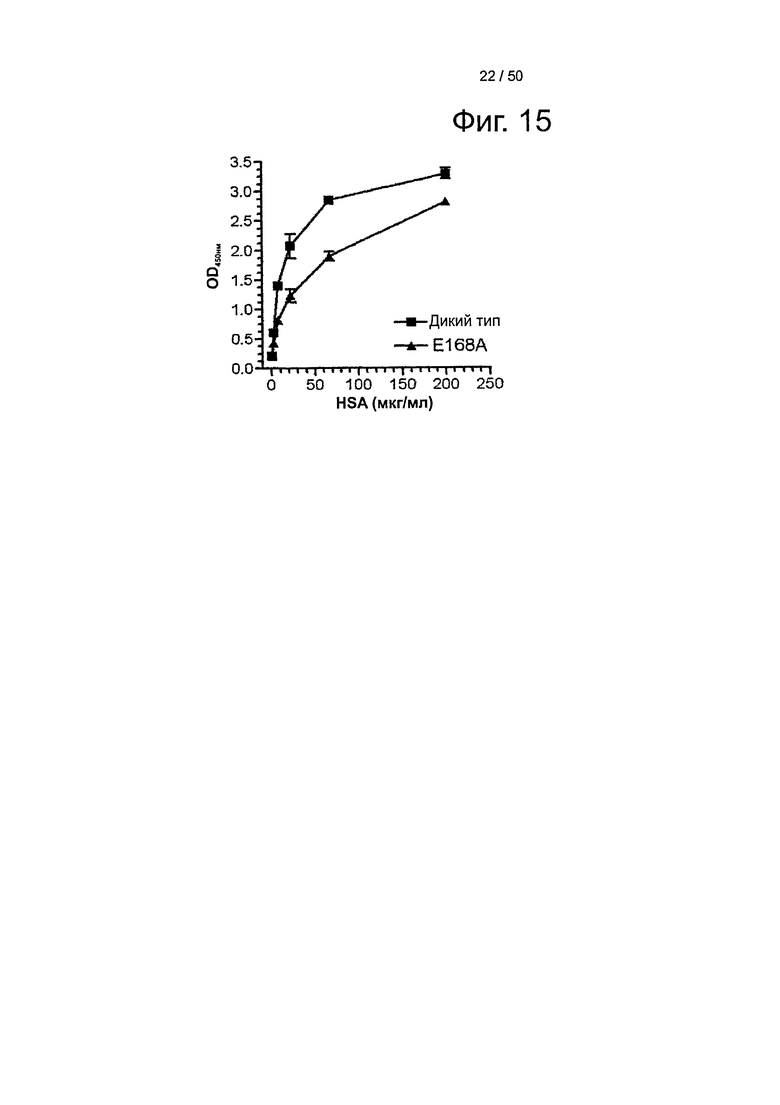
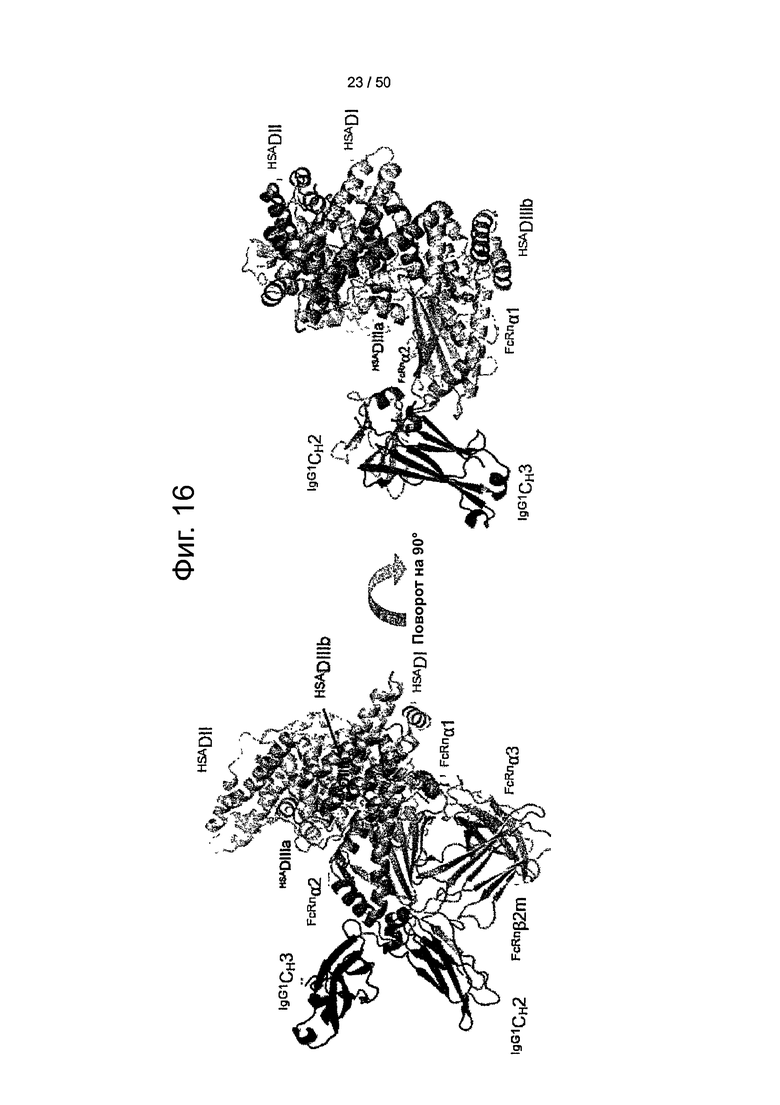
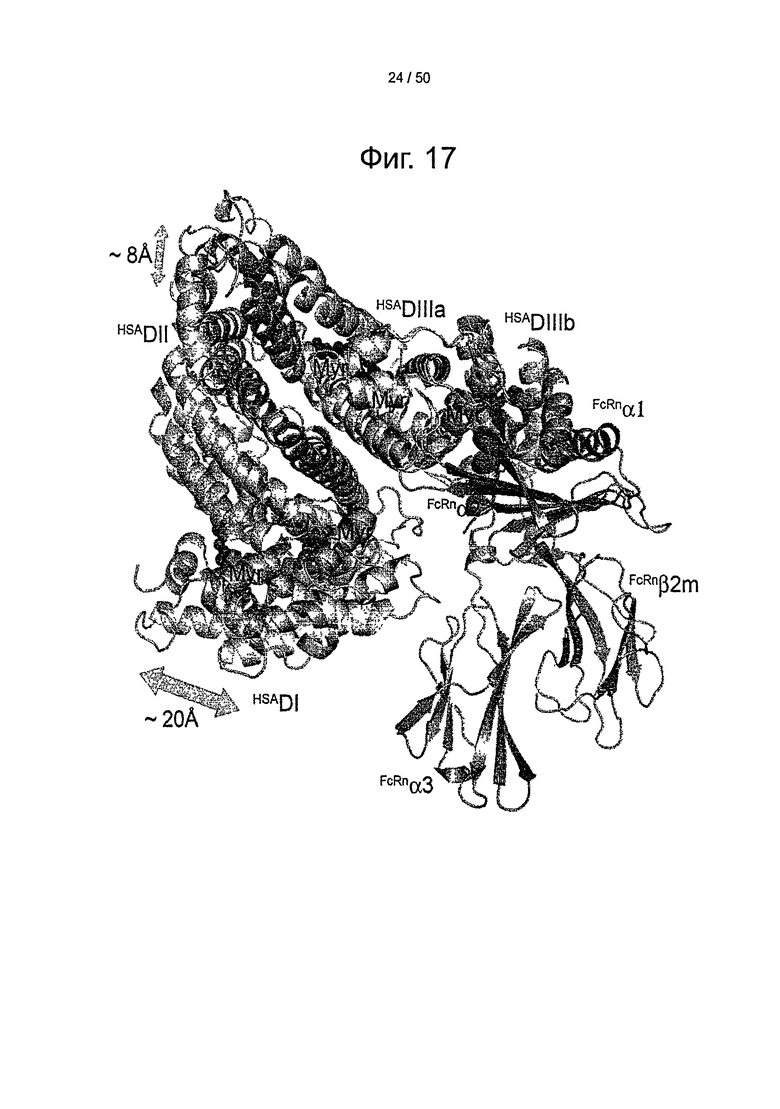


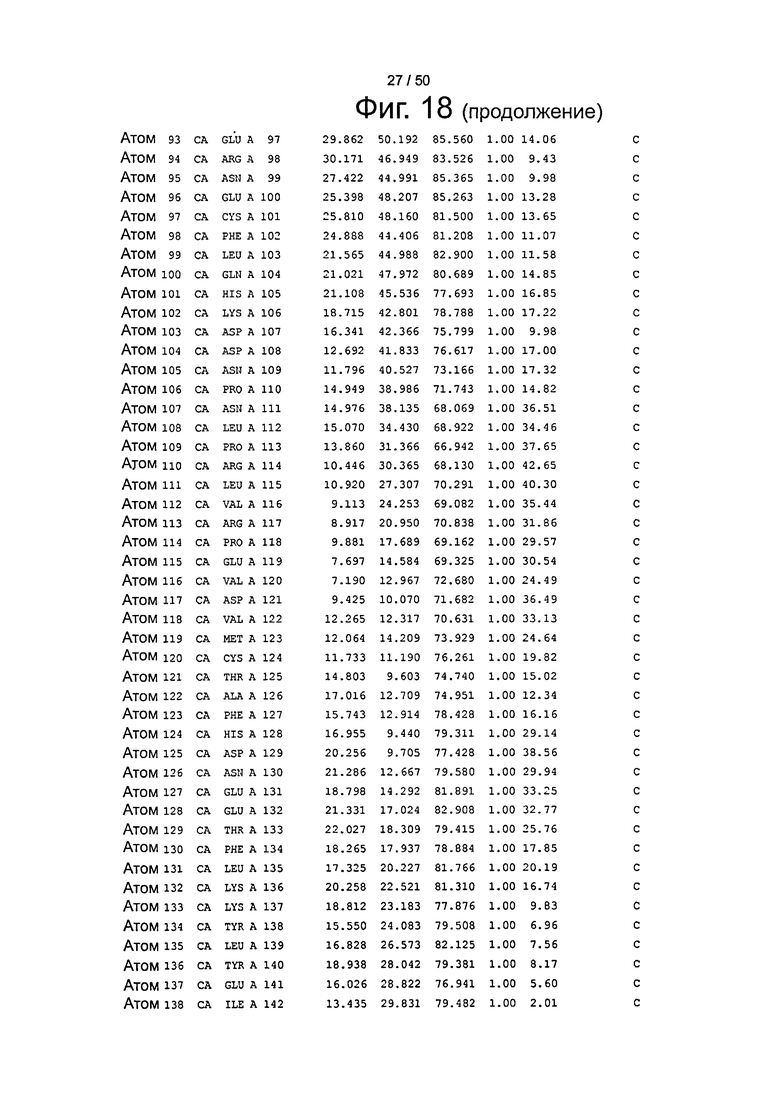
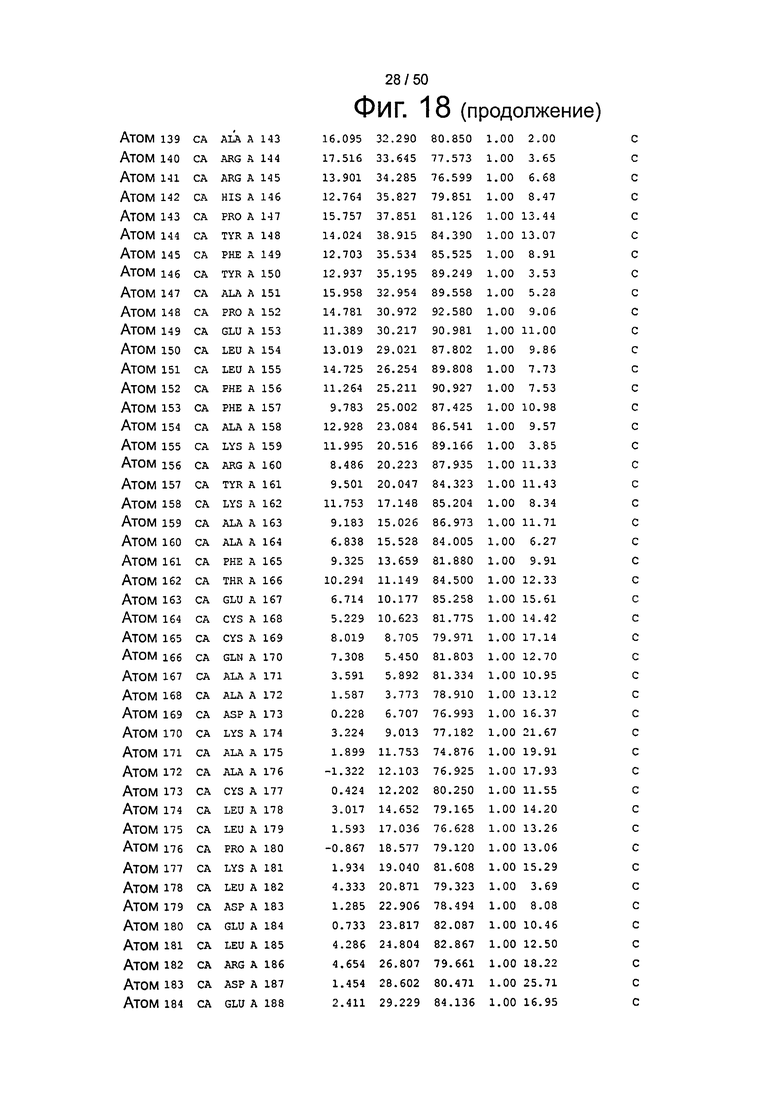
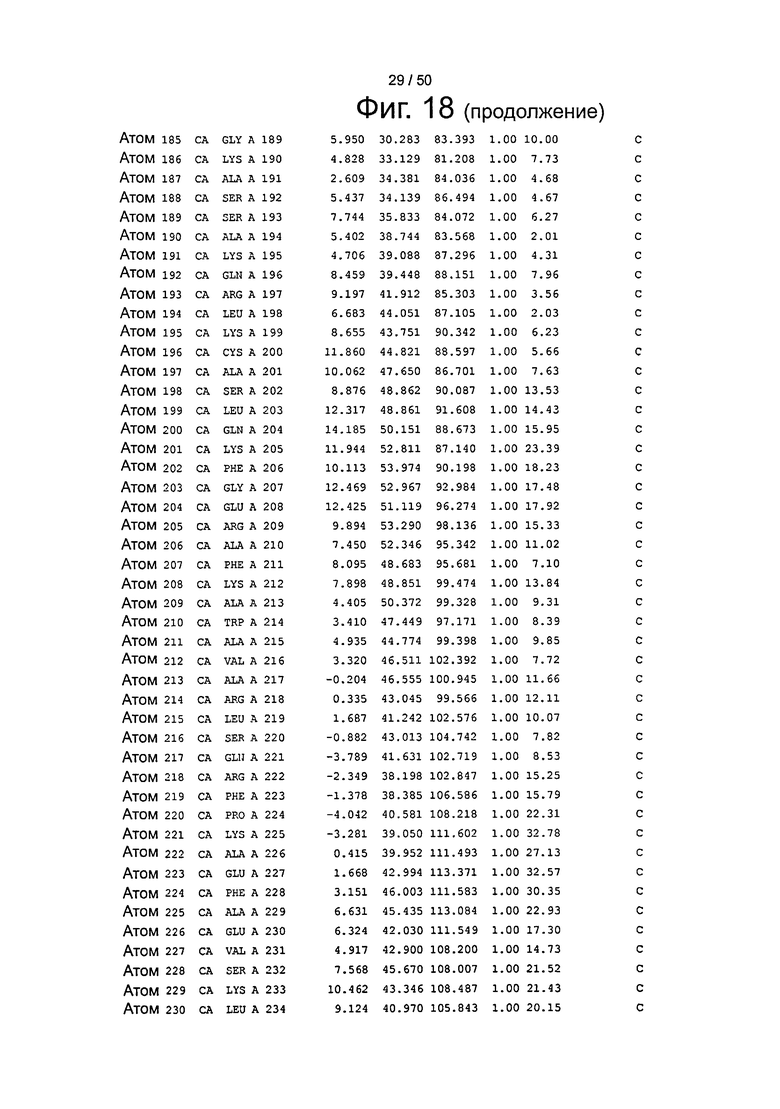



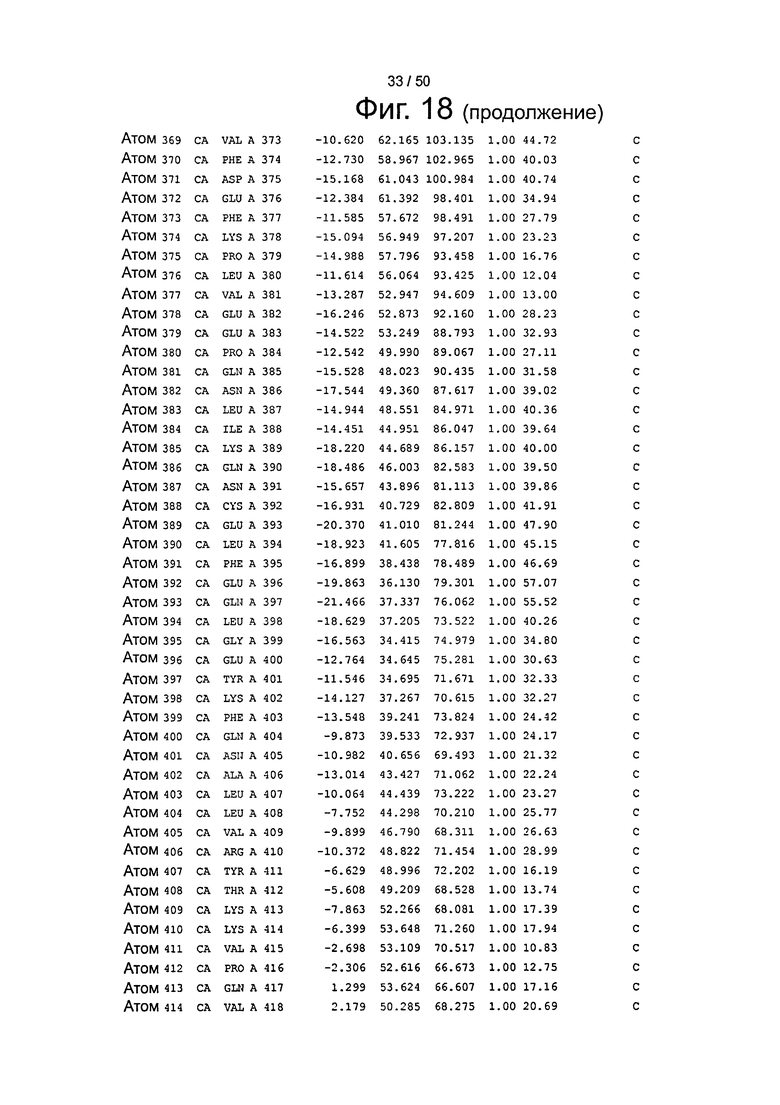

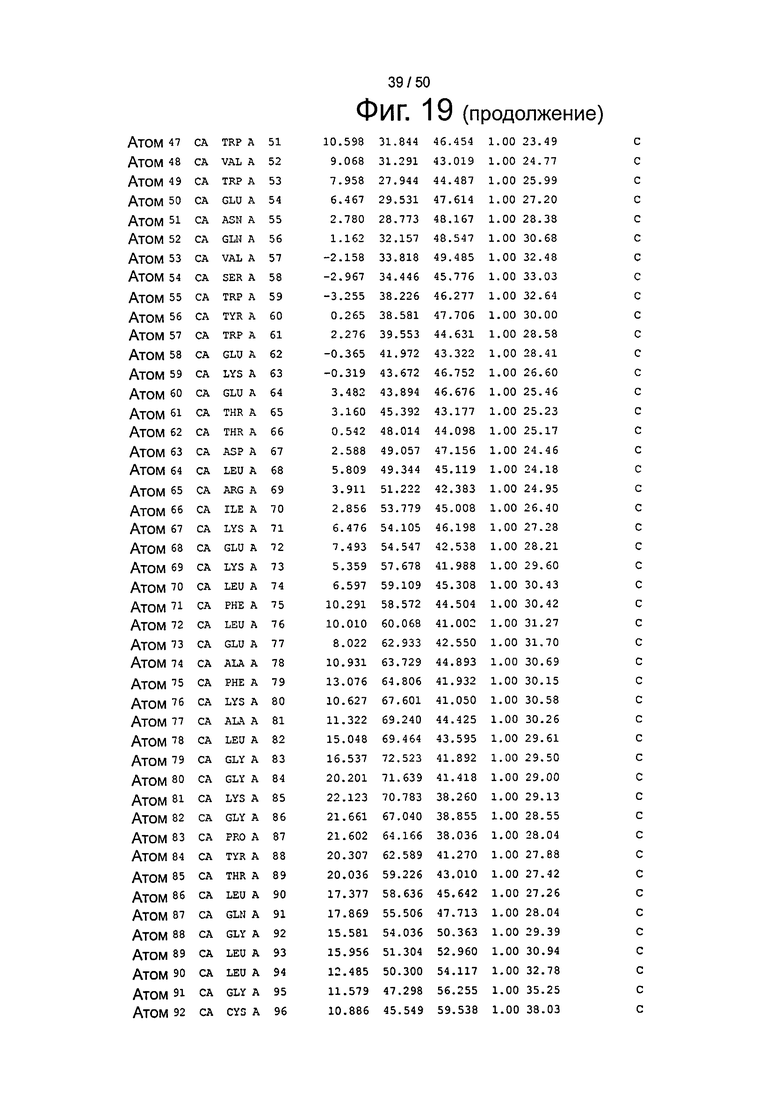
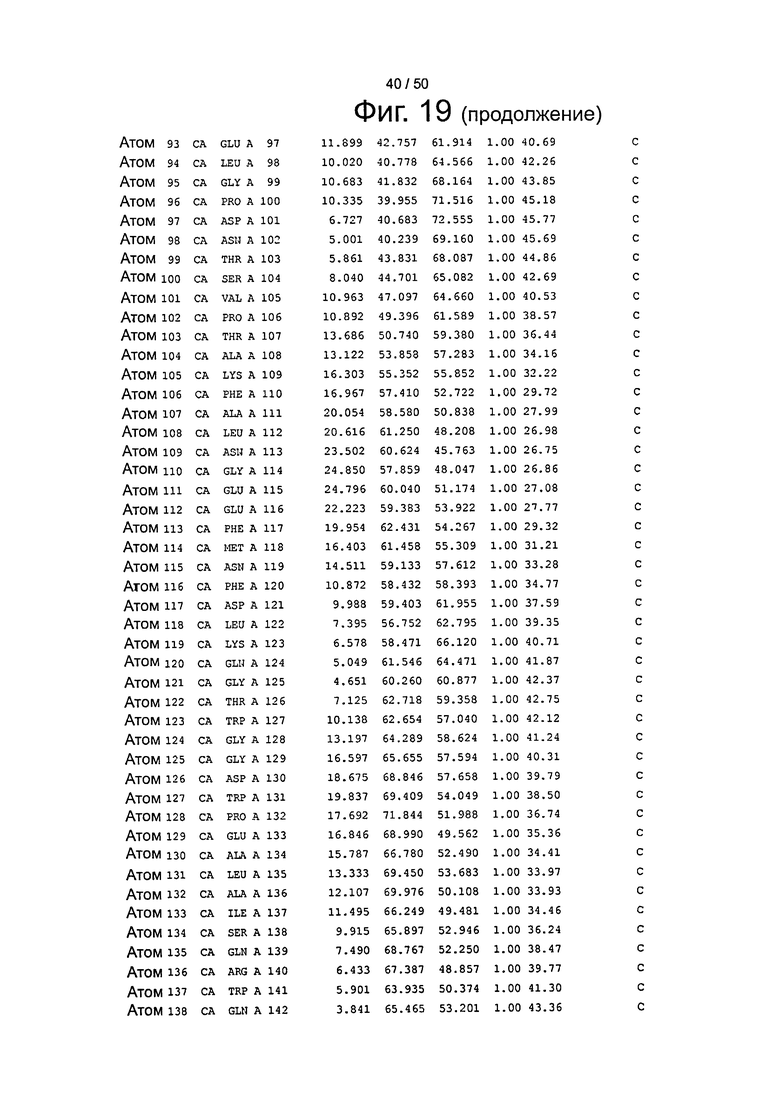
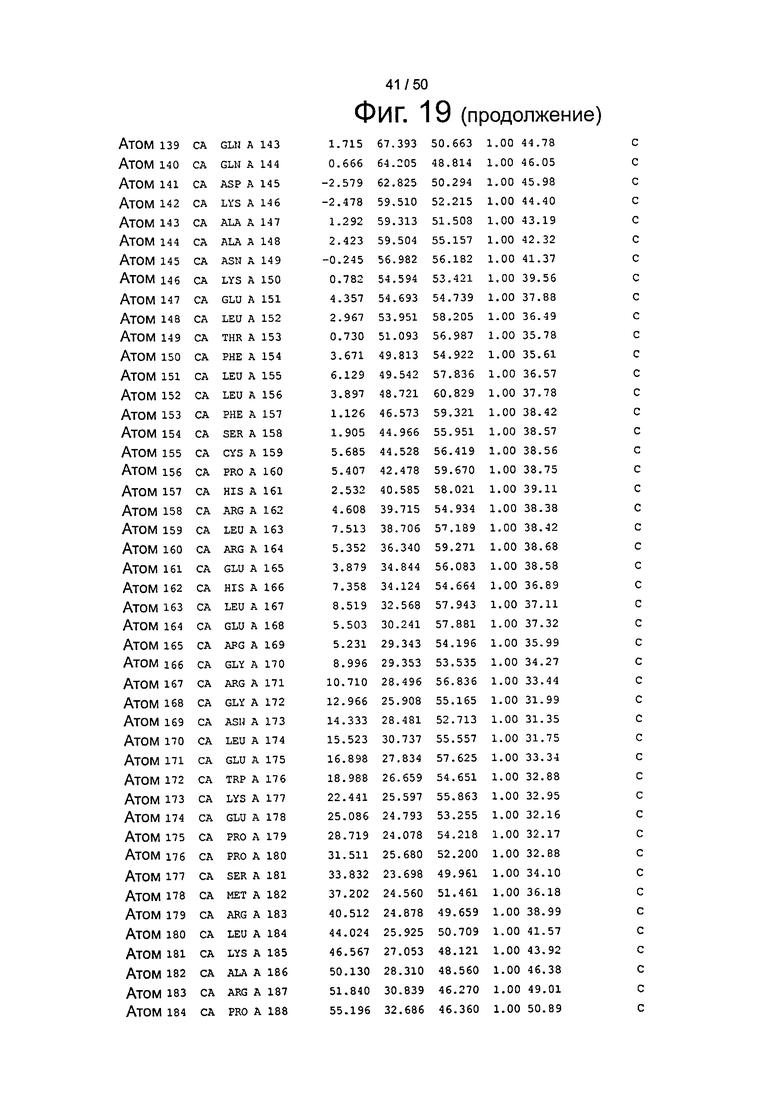

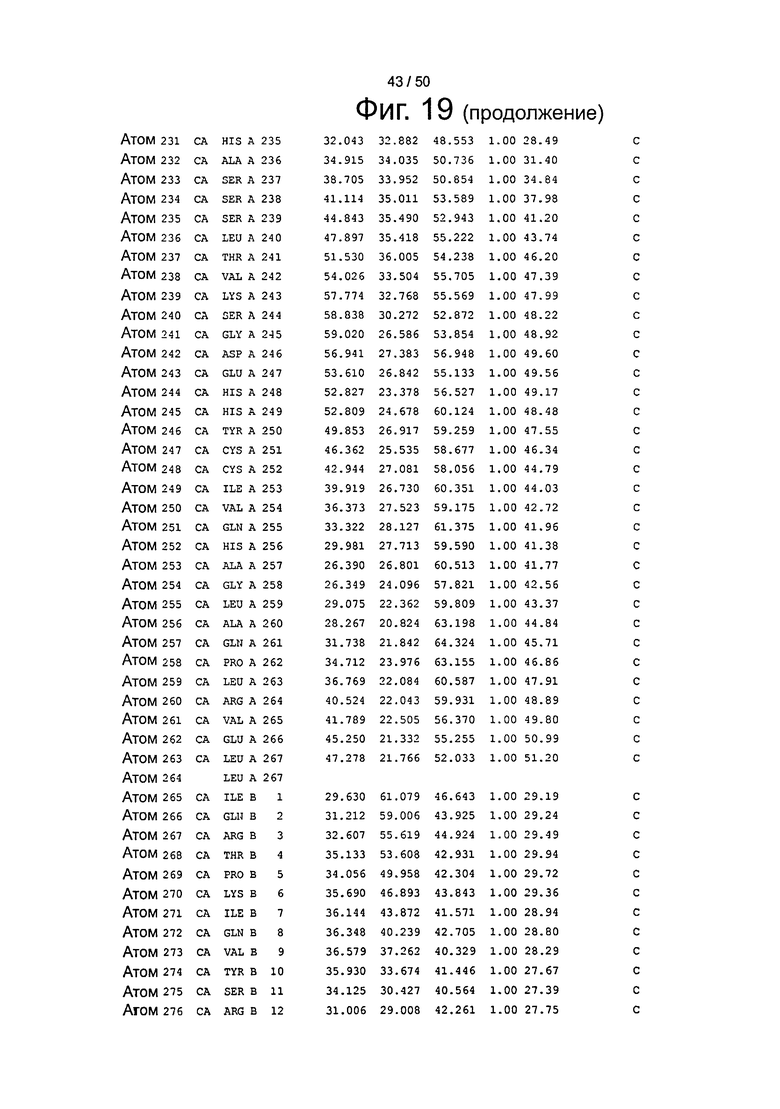
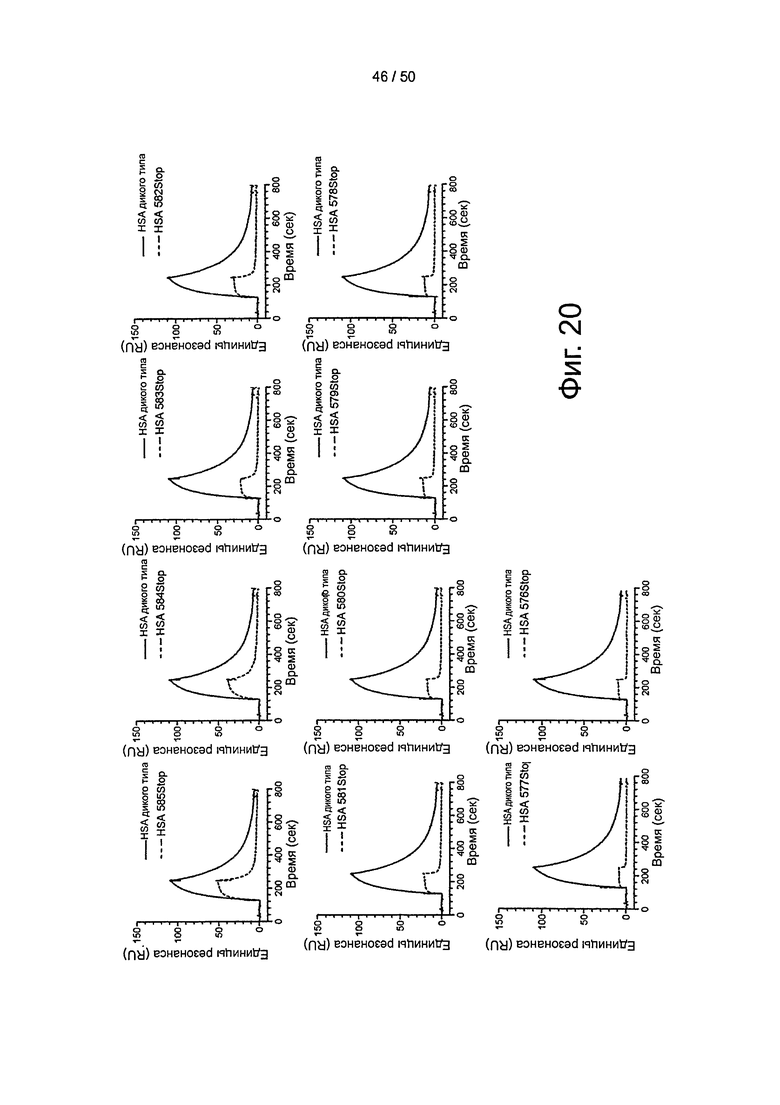
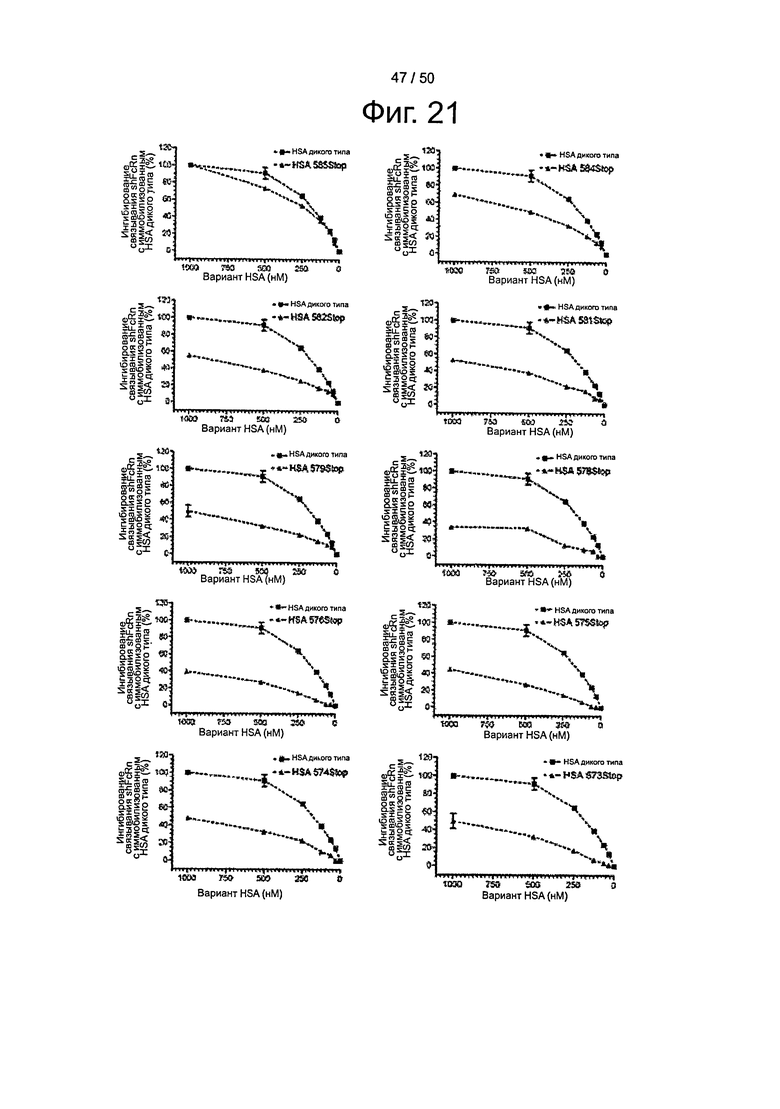
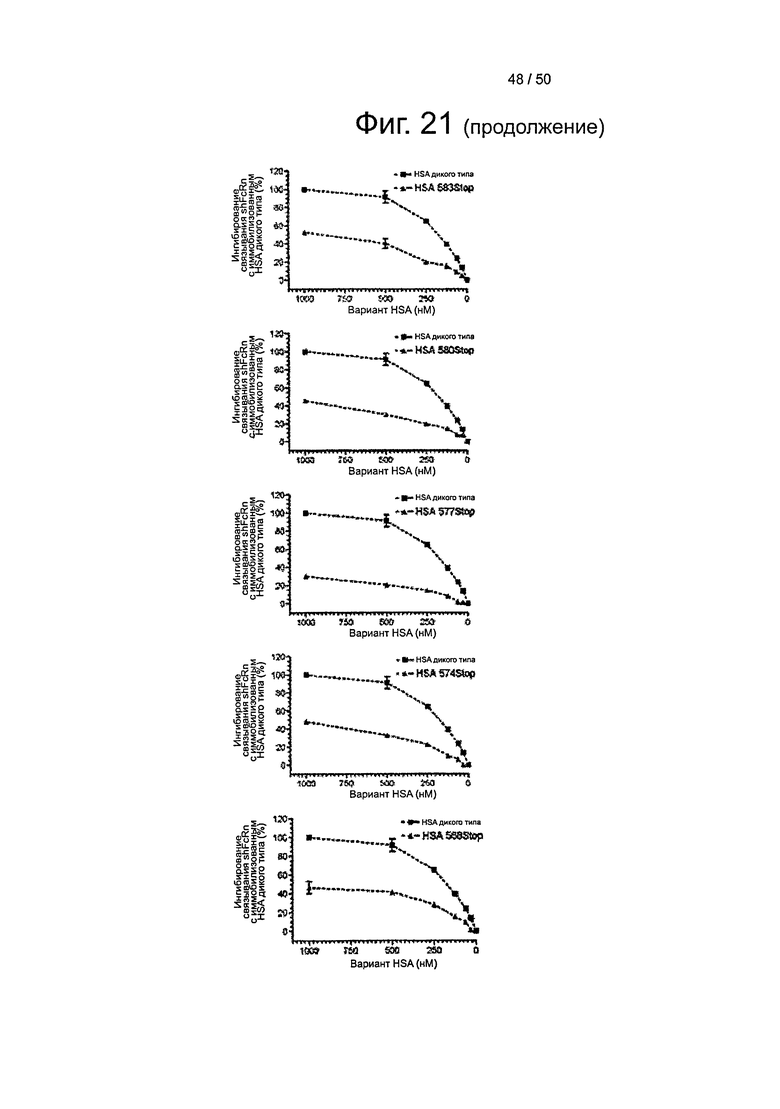
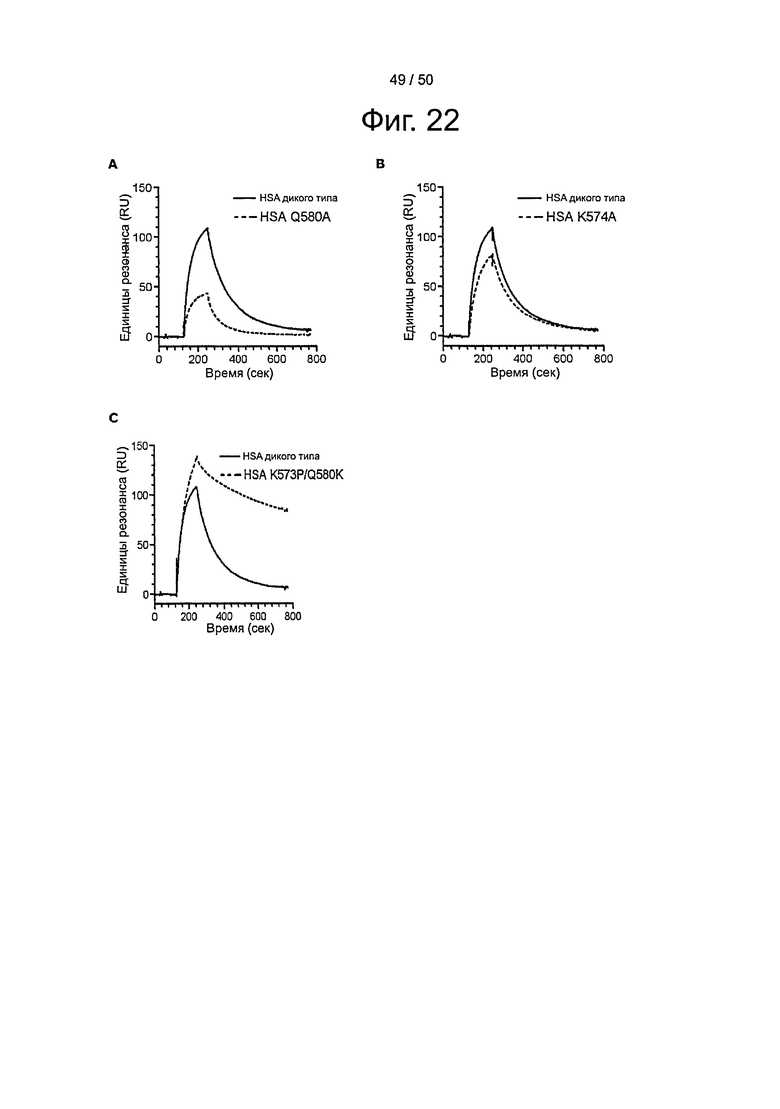
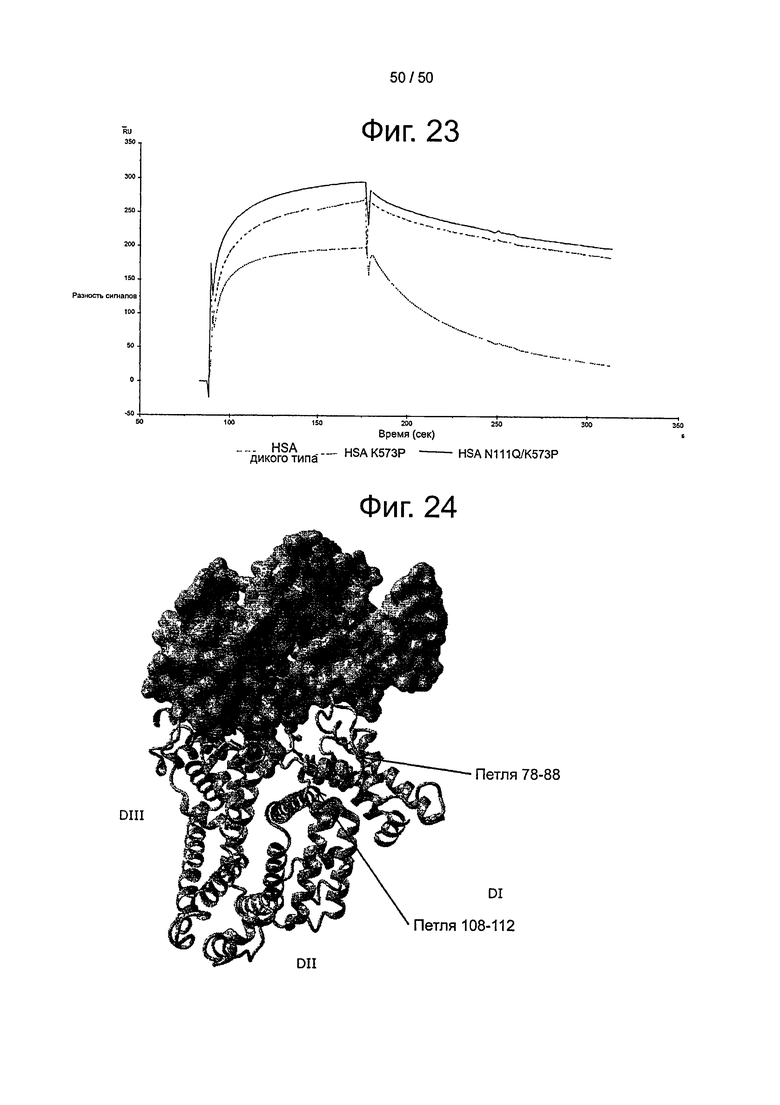
Изобретение относится к области биотехнологии, конкретно к получению вариантов альбумина, что может быть использовано в медицине. Получают полипептиды, характеризующиеся по меньшей мере 90% идентичностью с исходным человеческим альбумином, а также их конъюгаты, слитые с ними белки, ассоциаты, наночастицы и фармацевтические композиции. Изобретение позволяет получить варианты альбумина с более сильным сродством связывания с FcRn и большим временем полужизни в плазме по сравнению с исходным альбумином. 30 н. и 21 з.п. ф-лы, 24 ил., 20 табл., 8 пр.
ИСПРАВЛЕННАЯ Формула изобретения
1. Способ получения полипептида, который является вариантом альбумина, или вариантом фрагмента альбумина,
где фрагмент альбумина содержит более 100 аминокислотных остатков последовательности альбумина, где у него одна или более (несколько) аминокислот удалены с аминоконца и/или карбоксильного конца альбумина и/или из внутренней области альбумина, и где фрагмент сохраняет способность связывать FcRn,
где полипептид обладают сродством связывания с FcRn, которое сильнее по сравнению со сродством связывания с FcRn у контрольного альбумина или его фрагмента, характеризующийся тем, что коэффициент связывания варианта альбумина или варианта фрагмента альбумина с FcRn составляет менее 0,9KD контрольного альбумина или контрольного фрагмента альбумина с FcRn,
причем способ включает:
(a) обеспечение нуклеиновой кислоты, кодирующей исходный альбумин, который по меньшей мере на 80% идентичен последовательности SEQ ID NO: 2;
(b) модифицирование последовательности из стадии (a) так, чтобы она кодировала полипептид, который является вариантом альбумина или его фрагментом, содержащий одно или несколько изменений по одному или нескольким положениям, соответствующим положениям в SEQ ID NO: 2, выбранным из: (a) любой из позиций 75-91 (предпочтительно 83); (b) любой из позиций 492-538; (c) позиций 505, 531, 524, 472, 108, 190, 197 и 425; (d) любой из позиций 186-201; (e) любой из позиций 457-472; (f) любой из позиций 414-426; (g) любой из позиций 104-120; (h) любой из позиций 144-150; (i) любой из позиций 30-41, (j) любой из позиций 550-585, (k) любой из позиций 276, 410 и 414, на одно или несколько из A, C, D, E, F, G, H, I, K, L, M, N, P, Q, R, S, T, V, W, Y; при этом,
если полипептид содержит изменение в положении, соотвествующем позиции 79 в SEQ ID NO: 2, то изменение в положении, соотвествующем позиции 79 в SEQ ID NO: 2 представляет собой замену, выбранную из A, D, E, F, G, H, I, K, L, M, N, P, Q, R, S, V, W или Y, или изменение является вставкой с N-стороны или C-стороны, которая непосредственно прилегает к положению, соответствующему позиции 79 в SEQ ID NO: 2 и где вставка выбрана из A, D, E, F, G, H, I, K, L, M, N, P, Q, R, S, T, V, W или Y, и где
если полипептид содержит одно или несколько изменений, выбранных из:
(i) группы, состоящей из позиций 75, 90, 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584;
(ii) вставки Cys с N-стороны или C-стороны, которая непосредственно прилегает к, или замены на Cys в одном или более (нескольких) положениях из группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585;
(iii) изменений по одному или более (нескольким) положениям из числа 91, 200, 461, 514, 558, 559, 567, разрушающих дисульфидную связь; и/или
(iv) D63N, E82K, E84K, D87N, L90P, K106E, R114G, E119K, V146E, H464A, H464N, C201F, D494N, E501K, E503K, E505K, H510A, I513N, D518N, K525E, E529K, V533M, H535A, K536E, I537N, D550G, D550A, V557M, K560E, D563N, E565K, E570K, K573E, K574N, K574E, K584E; то
полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или С-концевое укорочение на 1-88 аминокислот, полученное путем введения стоп-кодона в положении кодирующей нуклеиновой кислоты, соответствующим положению, выбранному из позиций 497-585 в SEQ ID NO: 2;
(c) введение модифицированной последовательности из стадии (b) в подходящие клетки-хозяева;
(d) культивирование клеток в подходящей культуральной среде в условиях, ведущих к экспрессии полипептида; и
(e) выделение полипептида из культуральной среды;
при этом полипептид обладает более сильным сродством связывания с FcRn и/или большим временем полужизни в плазме по сравнению с временем полужизни у исходного альбумина, контрольного альбумина либо его фрагмента или слитого полипептида.
2. Способ получения слитого полипептида, содержащего вариант альбумина или вариант фрагмента альбумина,
где фрагмент альбумина содержит более 100 аминокислотных остатков последовательности альбумина, где у него одна или более (несколько) аминокислот удалены с аминоконца и/или карбоксильного конца альбумина и/или из внутренней области альбумина, и где фрагмент сохраняет способность связывать FcRn,
где слитый полипептид обладает сродством связывания с FcRn, которое сильнее по сравнению со сродством связывания с FcRn у контрольного слитого полипептида, содержащего альбумин или его фрагмент, характеризующийся тем, что коэффициент связывания слитого полипептида, содержащего указанный вариант альбумина или указанный вариант фрагмента альбумина, с FcRn составляет менее 0,9KD контрольного слитого полипептида, содержащего указанный альбумин или указанный фрагмент альбумина, с FcRn,
причем способ включает:
(a) обеспечение нуклеиновой кислоты, кодирующей исходный альбумин, который по меньшей мере на 80% идентичен последовательности SEQ ID NO: 2;
(b) модифицирование последовательности из стадии (a) так, чтобы она кодировала полипептид, который является слитым полипептидом, содержащим вариант альбумина или его фрагмент, содержащий одно или несколько изменений по одному или нескольким положениям, соответствующим положениям в SEQ ID NO: 2, выбранным из: (a) любой из позиций 75-91 (предпочтительно 83); (b) любой из позиций 492-538; (c) позиций 505, 531, 524, 472, 108, 190, 197 и 425; (d) любой из позиций 186-201; (e) любой из позиций 457-472; (f) любой из позиций 414-426; (g) любой из позиций 104-120; (h) любой из позиций 144-150; (i) любой из позиций 30-41, (j) любой из позиций 550-585, (k) любой из позиций 276, 410 и 414, на одно или несколько из A, C, D, E, F, G, H, I, K, L, M, N, P, Q, R, S, T, V, W, Y; при этом,
если слитый полипептид содержит изменение в положении, соотвествующем позиции 79 в SEQ ID NO: 2, то изменение в положении, соотвествующем позиции 79 в SEQ ID NO: 2 представляет собой замену, выбранную из A, D, E, F, G, H, I, K, L, M, N, P, Q, R, S, V, W или Y, или изменение является вставкой с N-стороны или C-стороны, которая непосредственно прилегает к положению, соответствующему позиции 79 в SEQ ID NO: 2 и где вставка выбрана из A, D, E, F, G, H, I, K, L, M, N, P, Q, R, S, T, V, W или Y, и где
если слитый полипептид содержит одно или несколько изменений в одном или нескольких положениях, соответствующих положениям в SEQ ID NO: 2, выбранным из:
(i) группы, состоящей из позиций 75, 90, 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584;
(ii) вставки Cys с N-стороны или C-стороны, которая непосредственно прилегает к, или замены на Cys в одном или более (нескольких) положениях из группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585;
(iii) изменений по одному или более (нескольким) положениям из числа 91, 200, 461, 514, 558, 559, 567, разрушающих дисульфидную связь; и/или
(iv) D63N, E82K, E84K, D87N, L90P, K106E, R114G, E119K, V146E, H464A, H464N, C201F, D494N, E501K, E503K, E505K, H510A, I513N, D518N, K525E, E529K, V533M, H535A, K536E, I537N, D550G, D550A, V557M, K560E, D563N, E565K, E570K, K573E, K574N, K574E, K584E; то
слитый полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций, соответствующих положениям 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585 в SEQ ID NO: 2, и/или С-концевое укорочение на 1-88 аминокислот, полученное путем введения стоп-кодона в положении кодирующей нуклеиновой кислоты, соответствующим положению, выбранному из позиций 497-585 в SEQ ID NO: 2;
(c) введение модифицированной последовательности из стадии (b) в подходящие клетки-хозяева;
(d) культивирование клеток в подходящей культуральной среде в условиях, ведущих к экспрессии полипептида; и
(e) выделение слитого полипептида из культуральной среды;
при этом слитый полипептид обладает более сильным сродством связывания с FcRn и/или большим временем полужизни в плазме по сравнению с временем полужизни у контрольного слитого полипептида, содержащего исходный альбумин либо его фрагмент.
3. Способ по п. 1 или 2, при этом,
(а) если полипептид по п. 1 или слитый полипептид по п. 2 содержит одно или более изменений, выбранных из (ii) группы, состоящей из позиций, соответствующих позициям 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585, или группы, состоящей из позиций 82, 114, 119, 464, 201, 505, 510, 513, 533, 535, 536, 550, 560, 563, 565, 573, 574 в SEQ ID NO: 2; то
полипептид или слитый полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций, соответствующих позициям 30, 31, 32, 33, 35, 36, 37, 39, 41, 77, 78, 79, 81, 84, 85, 87, 88, 89, 105, 106, 107, 108, 109, 110, 111, 112, 117, 118, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 462, 463, 465, 466, 467, 468, 469, 470, 472, 497, 502, 507, 508, 509, 511, 513, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 534, 551, 552, 553, 554, 555, 556, 557, 561, 568, 569, 570, 571, 572, 576, 583 в SEQ ID NO: 2, и/или С-концевое укорочение на 1-88 аминокислот, полученное путем введения стоп-кодона в положении кодирующей нуклеиновой кислоты, соответствующем положению, выбранному из позиций 497-585 в SEQ ID NO: 2;
(b) если изменение(я) находится в одном или более (нескольких) положениях, соответствующих положениям 75, 90, 91, 200, 461, 514, 558, 559 и 567 в SEQ ID NO: 2, то это изменение(я) не является заменой с Cys на любую другую аминокислоту, не является делецией Cys, и не является заменой или делецией партнера по дисульфидной связи у этого Cys;
(c) если изменение(я) находится в одном или более (нескольких) положениях, соответствующих положениям 34, 38, 40, 76, 79, 80, 82, 83, 86, 104, 113, 115, 116, 471, 490, 496, 498, 501, 503, 504, 505, 506, 512, 538, 542, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585 в SEQ ID NO: 2, то изменение не является заменой на Cys, и не является инсерцией Cys;
(d) если полипептид по п. 1 или слитый полипептид по п. 2 содержит изменение в положении, соотвествующем одному или нескольким из положений 464, 510 или 535 в SEQ ID NO: 2, то изменение в положении, соотвествующем одному или нескольким из положений 464, 510 или 535 в SEQ ID NO: 2, представляет собой замену, выбранную из C, D, E, F, G, I, K, L, M, N, P, Q, R, S, T, V, W или Y, или изменение представляет собой вставку с N-стороны или C-стороны, которая непосредственно прилегает к одному или нескольким положениям, соответствующим позициям 464, 510 или 535 в SEQ ID NO: 2, которая выбрана из A, C, D, E, F, G, I, K, L, M, N, P, Q, R, S, T, V, W или Y;
(e) все остатки His в положениях, соответствующих положениям 440, 464, 510, 535 в SEQ ID NO: 2 сохранены.
4. Способ по п. 1 или 2, при этом контрольным является HSA (SEQ ID No: 2) либо его фрагмент или слитый полипептид, содержащий HSA или его фрагмент, наиболее предпочтительно SEQ ID NO: 2.
5. Способ по любому из п.п. 1-4, при этом изменения представляют собой замены.
6. Полипептид, который является вариантом альбумина, или вариантом фрагмента альбумина,
где указанный вариант альбумина или указанный вариант фрагмента альбумина характеризуется по меньшей мере 90% идентичностью последовательности с SEQ ID NO: 2,
где фрагмент альбумина содержит более 100 аминокислотных остатков последовательности альбумина, где у него одна или более (несколько) аминокислот удалены с аминоконца и/или карбоксильного конца альбумина и/или из внутренней области альбумина, и где фрагмент сохранил способность связывать FcRn,
где полипептид обладает более сильным сродством связывания с FcRn по сравнению со сродством связывания с FcRn у исходного альбумина, контрольного альбумина или их фрагментов, характеризующийся тем, что коэффициент связывания варианта альбумина или варианта фрагмента альбумина с FcRn составляет менее 0,9KD контрольного альбумина или контрольного фрагмента альбумина с FcRn,
причем полипептид содержит одно или более изменений по одному или нескольким положениям, соответствующим положениям в SEQ ID NO: 2, выбранным из позиций: (a) 75-91 (предпочтительно 83); (b) 492-538; (c) 505, 531, 524, 472, 108, 190, 197 и 425; (d) 186-201; (e) 457-472; (f) 414-426; (g) 104-120; (h) 144-150; (i) 30-41, (j) 550-585, (k) любой из 276, 410 и 414, на одно или несколько из числа A, C, D, E, F, G, H, I, K, L, M, N, P, Q, R, S, T, V, W, Y; при этом
если полипептид содержит изменение в положении, соотвествующем позиции 79 в SEQ ID NO: 2, то изменение в положении, соотвествующем позиции 79 в SEQ ID NO: 2, представляет собой замену, выбранную из A, D, E, F, G, H, I, K, L, M, N, P, Q, R, S, V, W или Y, или вставкой с N-стороны или C-стороны, которая непосредственно прилегает к положению, соотвествующему позиции 79 в SEQ ID NO: 2, и где вставка выбрана из A, D, E, F, G, H, I, K, L, M, N, P, Q, R, S, T, V, W или Y, и
если полипептид содержит одно или несколько изменений, выбранных из:
(i) группы, состоящей из позиций 75, 90, 417, 464, 492, 493, 494, 495, 496, 499, 500, 501, 503, 504, 505, 506, 510, 535, 536, 537, 538, 540, 550, 573, 574, 575, 577, 578, 579, 580, 581, 582 и 584;
(ii) вставки Cys с N-стороны или C-стороны, которая непосредственно прилегает к, или замены на Cys по одному или более (нескольким) положениям из группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 104, 113, 115, 116, 471, 496, 498, 501, 503, 504, 505, 506, 512, 538, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585;
(iii) изменений по одному или нескольким положениям из числа 91, 200, 461, 514, 558, 559, 567, разрушающих дисульфидную связь; и/или
(iv) группы, состоящей из позиций D63N, E82K, E84K, D87N, L90P, K106E, R114G, E119K, V146E, H464A, H464N, C201F, D494N, E501K, E503K, E505K, H510A, I513N, D518N, K525E, E529K, V533M, H535A, K536E, I537N, D550G, D550A, V557M, K560E, D563N, E565K, E570K, K573E, K574N, K574E, K584E, то
полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 461, 462, 463, 465, 466, 467, 468, 469, 470, 471, 472, 497, 498, 502, 507, 508, 509, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 567, 568, 569, 570, 571, 572, 576, 583, 585, и/или С-концевое укорочение на 1-88 аминокислот, полученное путем введения стоп-кодона в положении кодирующей нуклеиновой кислоты, соответствующем положению, выбранному из позиций 497-585 в SEQ ID NO: 2.
7. Полипептид по п.6, где
(а) если полипептид содержит одно или несколько изменений, выбранных из (ii) группы, состоящей из позиций 34, 38, 40, 75, 76, 80, 82, 83, 86, 90, 91, 104, 113, 115, 116, 200, 461, 471, 496, 498, 501, 503, 504, 505, 506, 512, 514, 538, 550, 558, 559, 560, 562, 564, 565, 567, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585, или группы, состоящей из позиций 82, 114, 119, 464, 201, 505, 510, 513, 533, 535, 536, 550, 560, 563, 565, 573, 574, то
полипептид также содержит одно или несколько изменений в положениях, выбранных из группы, состоящей из позиций 30, 31, 32, 33, 35, 36, 37, 39, 41, 77, 78, 79, 81, 84, 85, 87, 88, 89, 105, 106, 107, 108, 109, 110, 111, 112, 117, 118, 120, 144, 145, 146, 147, 148, 149, 150, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 201, 276, 410, 411, 414, 415, 416, 418, 419, 420, 421, 422, 423, 424, 425, 426, 457, 458, 459, 460, 462, 463, 465, 466, 467, 468, 469, 470, 472, 497, 502, 507, 508, 509, 511, 513, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 534, 551, 552, 553, 554, 555, 556, 557, 561, 568, 569, 570, 571, 572, 576, 583, и/или С-концевое укорочение на 1-88 аминокислот, полученное путем введения стоп-кодона в положении кодирующей нуклеиновой кислоты, соответствующем положению, выбранному из позиций 497-585 в SEQ ID NO: 2;
(b) если изменение(я) находится в одном или более (нескольких) положениях из 75, 90, 91, 200, 461, 514, 558, 559 и 567, то изменение не является заменой с Cys на любую другую аминокислоту, не является делецией Cys, и не является заменой или делецией партнера по дисульфидной связи у этого Cys;
(c) если изменение(я) находится в одном или более (нескольких) положениях из 34, 38, 40, 76, 79, 80, 82, 83, 86, 104, 113, 115, 116, 471, 490, 496, 498, 501, 503, 504, 505, 506, 512, 538, 542, 550, 560, 562, 564, 565, 573, 574, 577, 578, 579, 580, 581, 582, 584, 585, то изменение не является заменой на Cys, и не является инсерцией Cys;
(d) если полипептид содержит изменение в положении, соотвествующем одному или нескольким из положений 464, 510 или 535 в SEQ ID NO: 2, то изменение в положении, соотвествующем одному или нескольким из положений 464, 510 или 535 в SEQ ID NO: 2, представляет собой замену, выбранную из C, D, E, F, G, I, K, L, M, N, P, Q, R, S, T, V, W или Y, или изменение представляет собой вставку с N-стороны или C-стороны, которая непосредственно прилегает к одному или нескольким положениям, выбранным из позиций 464, 510 или 535 в SEQ ID NO: 2, которая выбрана из A, C, D, E, F, G, I, K, L, M, N, P, Q, R, S, T, V, W или Y;
(e) все остатки His в положениях, соответствующих положениям 440, 464, 510, 535 в SEQ ID NO: 2 сохранены.
8. Полипептид по п. 7, при этом контрольным является HSA (SEQ ID NO: 2) либо его фрагмент.
9. Полипептид по п. 8, при этом изменение представляет собой замену.
10. Полипептид по любому из п.п. 6-9, содержащий одно или несколько дополнительных изменений, обеспечивающих конъюгируемую тиоловую группу на полипептиде.
11. Полипептид по любому из п.п. 6-10, при этом последовательность полипептида идентична SEQ ID NO: 2 больше чем на 80%, предпочтительно больше чем на 90%, более предпочтительно больше чем на 95%, более предпочтительно больше чем на 96%, еще более предпочтительно больше чем на 97%, более предпочтительно больше чем на 98% и наиболее предпочтительно больше чем на 99%.
12. Полипептид по любому из п.п. 6-9, при этом фрагмент содержит по меньшей мере 200 аминокислот, более предпочтительно по меньшей мере 300 аминокислот, еще более предпочтительно по меньшей мере 400 аминокислот и наиболее предпочтительно по меньшей мере 500 аминокислот.
13. Слитый полипептид, включающий полипептид по любому из п.п. 6-12 и полипептид-партнер по слиянию, выбранный из терапевтических, профилактических, диагностических, визуализирующих или других полезных групп,
характеризующийся тем, что коэффициент связывания слитого полипептида с FcRn составляет менее 0,9KD контрольного слитого полипептида с FcRn,
где контрольный слитый полипептид является слитым полипептидом, содержащим контрольный альбумин или контрольный фрагмент альбумина, как определено в любом из пунктов 6-12, и полипептид-партнер по слиянию.
14. Конъюгат, включающий полипептид по любому из п.п. 6-12 или слитый полипептид поп. 13 и партнера по конъюгации,
характеризующийся тем, что коэффициент связывания конъюгата с FcRn составляет менее 0,9KD контрольного конъюгата с FcRn,
где контрольный конъюгат содержит контрольный альбумин или контрольный фрагмент альбумина, как определено в любом из пунктов 6-12, или контрольный слитый полипептид, как определено в п. 13, и партнера по конъюгации.
15. Конъюгат по п. 14, при этом партнером по конъюгации является терапевтическая, профилактическая, диагностическая, визуализирующая или другая полезная группа.
16. Ассоциат, включающий полипептид по любому из п.п. 6-12 или слитый полипептид по п. 13 и терапевтическую, профилактическую, диагностическую, визуализирующую или другую полезную группу,
характеризующийся тем, что коэффициент связывания ассоциата с FcRn составляет менее 0,9KD контрольного ассоциата с FcRn,
где контрольный ассоциат содержит контрольный альбумин или контрольный фрагмент альбумина, как определено в любом из пунктов 6-12, или контрольный слитый полипептид, как определено в п. 13, и терапевтическую, профилактическую, диагностическую, визуализирующую или другую полезную группу.
17. Наночастица или микрочастица, содержащая полипептид по любому из п.п. 6-12, слитый полипептид по п. 13, конъюгат по п. 14 или 15 либо ассоциат по п. 16,
характеризующаяся тем, что коэффициент связывания наночастицы или микрочастицы с FcRn составляет менее 0,9KD контрольной наночастицы или микрочастицы с FcRn,
где контрольная наночастица или микрочастица содержит контрольный альбумин или контрольный фрагмент альбумина, как определено в любом из пунктов 6-12, или контрольный слитый полипептид по п. 13, или контрольный конъюгат, как определено в п. 14, или контрольный ассоциат, как определено в п. 16.
18. Фармацевтическая композиция, содержащая полипептид по любому из п.п. 6-12 и терапевтически полезное соединение, или слитый полипептид, конъюгат, ассоциат либо наночастицу или микрочастицу по любому из п.п. 13-17, содержащие терапевтически полезное соединение, в эффективных количествах, при этом у полипептида, слитого полипептида, конъюгата, ассоциата либо наночастицы или микрочастицы сродство связывания с FcRn сильнее чем сродство связывания с FcRn у композиции, содержащей соответствующий исходный альбумин, контрольный альбумин, его фрагмент или слитый полипептид, конъюгат, ассоциат либо наночастицу или микрочастицу, содержащую указанный исходный альбумин, контрольный альбумин либо его фрагмент или слитый полипептид.
19. Композиция по п. 18, у которой сродство связывания полипептида, слитого полипептида, конъюгата, ассоциата либо наночастицы или микрочастицы с FcRn сильнее, чем сродство связывания HSA с FcRn.
20. Композиция по п. 18, при этом у варианта полипептида, слитого полипептида, конъюгата, ассоциата либо наночастицы или микрочастицы коэффициент связывания с FcRn составляет менее 0,9KD HSA с FcRn, более предпочтительно менее 0,5KD HSA с FcRn, более предпочтительно менее 0,1KD HSA с FcRn, еще более предпочтительно менее 0,05KD HSA с FcRn, еще более предпочтительно менее 0,02KD HSA с FcRn и наиболее предпочтительно менее 0,01KD HSA с FcRn.
21. Композиция по п. 18, содержащая полипептид по любому из п.п. 6-12, слитый полипептид по п. 13, конъюгат по п. 14 или 15, ассоциат по п. 16 либо наночастицу или микрочастицу по п. 17, которая дополнительно содержит соединение, содержащее домен связывания альбумина (ABD) и терапевтическую, профилактическую, диагностическую, визуализирующую или другую полезную группу.
22. Композиция по любому из п.п. 18-21, содержащая фармацевтически приемлемый носитель.
23. Применение полипептида по любому из п.п. 6-12, для увеличения сродства связывания с FcRn или увеличения времени полужизни, предпочтительно в плазме, у терапевтической, профилактической, диагностической, визуализирующей или другой полезной группы.
24. Применение слитого полипептида по п. 13 для увеличения сродства связывания с FcRn или увеличения времени полужизни, предпочтительно в плазме, у терапевтической, профилактической, диагностической, визуализирующей или другой полезной группы.
25. Применение конъюгата по п. 14 или 15 для увеличения сродства связывания с FcRn или увеличения времени полужизни, предпочтительно в плазме, у терапевтической, профилактической, диагностической, визуализирующей или другой полезной группы.
26. Применение ассоциата по п. 16 для увеличения сродства связывания с FcRn или увеличения времени полужизни, предпочтительно в плазме, у терапевтической, профилактической, диагностической, визуализирующей или другой полезной группы.
27. Применение наночастицы или микрочастицы по п. 17 для увеличения сродства связывания с FcRn или увеличения времени полужизни, предпочтительно в плазме, у терапевтической, профилактической, диагностической, визуализирующей или другой полезной группы.
28. Применение композиции по любому из п.п. 18-22 для увеличения сродства связывания с FcRn или увеличения времени полужизни, предпочтительно в плазме, у терапевтической, профилактической, диагностической, визуализирующей или другой полезной группы.
29. Способ увеличения сродства связывания с FcRn у молекул, который включает, если молекула представляет собой полипептид, слияние молекулы с полипептидом по любому из п.п. 6-12 или с конъюгатом по п. 14 или 15.
30. Способ увеличения сродства связывания с FcRn у молекул, который включает, если молекула представляет собой полипептид, конъюгирование молекулы с полипептидом по любому из п.п. 6-13 или с конъюгатом по п. 14 или 15.
31. Способ увеличения сродства связывания с FcRn у молекул, который включает, если молекула представляет собой полипептид, ассоциирование молекулы с полипептидом по любому из п.п. 6-13 или с конъюгатом по п. 14 или 15.
32. Способ увеличения сродства связывания с FcRn у молекул, который включает, если молекула представляет собой полипептид, включение молекулы в ассоциат по п. 16, в наночастицу или микрочастицу по п. 17 или в композицию по любому из п.п. 18-22.
33. Способ увеличения сродства связывания с FcRn у молекул, который включает, если молекула не представляет собой полипептид, конъюгирование молекулы с полипептидом по любому из п.п. 6-13 или с конъюгатом по п. 14 или 15.
34. Способ увеличения сродства связывания с FcRn у молекул, который включает, если молекула не представляет собой полипептид, ассоциирование молекулы с полипептидом по любому из п.п. 6-13 или с конъюгатом по п. 14 или 15.
35. Способ увеличения сродства связывания с FcRn у молекул, который включает, если молекула не представляет собой полипептид, включение молекулы в ассоциат по п. 16, в наночастицу или микрочастицу по п. 17 или в композицию по любому из п.п. 18-22.
36. Способ по любому из п.п. 29-35, при этом молекула представляет собой терапевтическую, профилактическую, диагностическую, визуализирующую или другую полезную группу.
37 Нуклеиновая кислота, кодирующая полипептид по любому из п.п. 6-12.
38. Нуклеиновая кислота, кодирующая слитый полипептид по п. 13.
39. Вектор экспрессии, содержащий нуклеиновую кислоту по п. 37.
40. Вектор экспрессии, содержащий нуклеиновую кислоту по п. 38.
41. Клетка-хозяин для экспрессии полипептида по любому из пунктов 6-12, где клетка-хозяин содержит нуклеиновую кислоту по п. 37 или вектор по п. 39.
42. Клетка-хозяин по п. 41, где клеткой-хозяином является эукариотическая, предпочтительно дрожжевая (как-то Saccharomyces cerevisiae) клетка или клетка млекопитающих (как-то CHO или HEK) либо растительная клетка (как-то рисовая).
43. Клетка-хозяин для экспрессии слитого полипептида по пункту 13, где клетка-хозяин содержит нуклеиновую кислоту по п. 38 или вектор по п. 40.
44. Клетка-хозяин по п. 43, где клеткой-хозяином является эукариотическая, предпочтительно дрожжевая (как-то Saccharomyces cerevisiae) клетка или клетка млекопитающих (как-то CHO или HEK) либо растительная клетка (как-то рисовая).
45. Способ профилактики или лечения, включающий введение субъекту полипептида, слитого полипептида, конъюгата, композиции, ассоциата, наночастицы или микрочастицы либо полинуклеотида по любому из п.п. 6-22.
46. Способ диагностики, включающий введение субъекту полипептида, слитого полипептида, конъюгата, композиции, ассоциата, наночастицы или микрочастицы, либо полинуклеотида по любому из п.п. 6-22.
47. Способ получения полипептида, который является вариантом альбумина, или вариантом фрагмента альбумина или слитым полипептидом, содержащим указанный вариант альбумина или указанный вариант фрагмента альбумина, где полипептид или слитый полипептид обладает увеличенным сродством связывания с FcRn по сравнению со сродством связывания контрольного альбумина, его фрагмента или слитого полипептида с FcRn,
характеризующаяся тем, что коэффициент связывания варианта альбумина, варианта фрагмента альбумина или слитого полипептида, содержащего указанные вариант альбумина или указанный вариант фрагмента альбумина, с FcRn, составляет менее 0,9KD указанного контрольного альбумина, контрольного фрагмента альбумина или контрольного слитого полипептида, содержащего указанные альбумин или фрагмент альбумина с FcRn,
где фрагмент альбумина содержит более 100 аминокислотных остатков последовательности альбумина, где у него одна или более (несколько) аминокислот удалены с аминоконца и/или карбоксильного конца альбумина и/или из внутренней области альбумина, и где фрагмент сохраняет способность связывать FcRn,
где способ включает стадии:
(a) идентификацию положений одного или нескольких аминокислотных остатков, важных для связывания альбумина с FcRn, у альбумина либо его фрагмента или альбуминовой части слитого полипептида, содержащего альбумин или его фрагмент путем:
(i) получения трехмерной структуры (модели) альбумина, как-то остатков 1-585 HSA (SEQ ID NO. 2);
(ii) получения трехмерной структуры (модели) FcRn, причем структура выполняется при pH, равном или меньше 6,3;
(iii) использования структуры альбумина (i) и структуры FcRn (ii) для моделирования структуры комплекса, образующегося при связывании альбумина с FcRn, получая при этом модель стыковки;
(iv) использования модели стыковки для идентификации тех аминокислотных остатков у альбумина, которые взаимодействуют с FcRn или влияют на взаимодействие альбумина с FcRn;
(b) получение нуклеиновой кислоты, кодирующей указанный полипептид;
(c) модифицирование нуклеиновой кислоты, полученной на стадии (b), так, чтобы по одному или нескольким аминокислотным остаткам, расположенным в положениях, установленных на стадии (a), были изменения;
(d) экспрессирование модифицированной нуклеиновой кислоты в подходящих клетках-хозяевах; и
(e) выделение полипептида.
48. Способ по п. 47, при этом предусмотренная трехмерная структура (модель) FcRn выполняется при pH от 3,7 до 4,7.
49. Способ по п. 47 или 48, при этом контрольным является HSA (SEQ ID No: 2) либо его фрагмент или слитый полипептид, содержащий HSA или его фрагмент, наиболее предпочтительно SEQ ID NO: 2.
50. Способ по п. 47, при этом изменения представляют собой замены.
51. Способ по любому из п.п. 47-50, при этом стадия (a) дополнительно включает:
(v) сравнение первичной структуры и/или третичной структуры второго альбумина (например, не альбумина человека) с первичной структурой и/или третичной структурой альбумина из стадии (i) для идентификации аминокислот, эквивалентных аминокислотам, идентифицированным на стадии (iv); и/или
(vi) получение полипептида, содержащего одно или несколько изменений, идентифицированных на стадии (iv) или (v), и проверка (например, посредством анализа сродства связывания) того, что у полученного полипептида изменилось сродство связывания с FcRn по сравнению со сродством связывания с FcRn у альбумина из стадии (i).
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| СНИЖЕНИЕ ИММУНОГЕННОСТИ СЛИТЫХ БЕЛКОВ | 2002 |
|
RU2333919C2 |
Авторы
Даты
2018-04-17—Публикация
2012-05-04—Подача