Родственные заявки
В настоящей заявке испрашивается приоритет предварительной заявки на патент США № 61/502055, поданной 28 июля 2011 г.; предварительной заявки на патент США № 61/570394, поданной 14 декабря 2011 г.; предварительной заявки на патент США № 61/577204, поданной 19 декабря 2011 г.; и предварительной заявки на патент США № 61/638168, поданной 25 апреля 2012 г. Содержание каждой из этих заявок во всей своей полноте вводится в настоящее описание посредством ссылки.
Область, к которой относится изобретение
Настоящее изобретение относится к молекулам, в частности, к полипептидам, а более конкретно, к слитым белкам, которые включают серпиновый полипептид или аминокислотную последовательность, полученную из серпиновых полипептидов, и второй полипептид. Кроме того, настоящее изобретение относится к слитым белкам, которые включают серпиновый полипептид или аминокислотную последовательность, полученную из серпиновых полипептидов, второй полипептид и третий полипептид. Более конкретно, настоящее изобретение относится к слитым белкам, которые включают по меньшей мере один серпиновый полипептид и второй полипептид, или к слитым белкам, которые включают по меньшей мере серпиновый полипептид, второй полипептид и третий полипептид, где указанные второй и третий полипептиды слитых белков согласно изобретению могут представлять собой по меньшей мере один из нижеследующих полипептидов, таких как: Fc-полипептид или аминокислотная последовательность, полученная из Fc-полипептида; направленный на цитокин полипептид или последовательность, полученная из направленного на цитокин полипептида; полипептид, включающий домен WAP, или последовательность, полученная из WAP-содержащего полипептида; или альбуминовый полипептид или аминокислотная последовательность, полученная из полипептида сывороточного альбумина. Настоящее изобретение также относится к способам применения указанных молекул для ряда терапевтических или диагностических показаний, а также к способам продуцирования указанных молекул.
Предшествующий уровень техники
Нарушение активности сериновой протеазы или дисбаланс между протеазами и ингибиторами протеаз могут приводить к опосредованной протеазой деструкции ткани и к воспалительным ответам. В соответствии с этим, необходимо разработать терапевтические средства и способы лечения, которые были бы направлены на устранение аберрантной активности сериновой протеазы и/или дисбаланса между протеазами и ингибиторами протеаз. Кроме того, усиление терапевтических эффектов может быть достигнуто посредством ослабления передачи аберрантного цитокинового сигнала и активности сериновой протеазы. Кроме того, было продемонстрировано, что серпиновые белки обладают противоинфекционной активностью, тогда как направленное действие воспалительных цитокинов, как было показано, повышает риск развития инфекции. Слитые белки согласно изобретению могут подавлять воспалительную активность цитокинов и снижать риск развития инфекции.
Сущность изобретения
Описанные здесь слитые белки включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, полученную из серпинового полипептида (Полипептид 1), и второй полипептид (Полипептид 2). Кроме того, описанные здесь слитые белки включают серпиновый полипептид или аминокислотную последовательность, полученную из серпинового полипептида (Полипептид 1), второй полипептид (Полипептид 2) и третий полипептид (Полипептид 3). Используемые здесь термины «слитый белок» и «слитый полипептид» являются синонимами и означают серпиновый полипептид или аминокислотную последовательность, полученную из серпинового полипептида, которые функционально присоединены по меньшей мере ко второму полипептиду или к аминокислотной последовательности, полученной по меньшей мере из второго полипептида. Отдельные элементы слитого белка могут быть связаны друг с другом различными способами, включая, например, прямое связывание, связывание посредством промежуточного соединения или спейсерного пептида, связывание посредством линкерной области, связывание посредством шарнирной области или связывание посредством линкерной и шарнирной области. В некоторых вариантах изобретения, линкерная область может находиться в последовательности шарнирной области или, альтернативно, шарнирная область может находиться в последовательности линкерной области. Предпочтительно, чтобы линкерная область имела пептидную последовательность. Так, например, линкерный пептид включает последовательность, содержащую приблизительно от 0 до 40 аминокислот, например, от 0 до 35 аминокислот, от 0 до 30 аминокислот, от 0 до 25 аминокислот или от 0 до 20 аминокислот. Предпочтительно, чтобы шарнирная область имела пептидную последовательность. Так, например, шарнирный пептид включает последовательность, содержащую приблизительно от 0 до 75 аминокислот, например, от 0 до 70 аминокислот, от 0 до 65 аминокислот или от 0 до 62 аминокислот. В тех вариантах, в которых слитый белок включает линкерную область и шарнирную область, предпочтительно, чтобы и линкерная область и шарнирная область представляли собой пептидную последовательность. В этих вариантах, шарнирный пептид и линкерный пептид, взятые вместе, включают последовательность, содержащую приблизительно от 0 до 90 аминокислот, например, от 0 до 85 аминокислот или от 0 до 82 аминокислот.
В некоторых вариантах изобретения, серпиновый полипептид и второй полипептид могут быть связаны посредством промежуточного связывающего белка. В некоторых вариантах изобретения, серпиновая часть и вторая полипептидная часть слитого белка могут быть связаны нековалентной связью.
В некоторых вариантах изобретения, слитые белки согласно изобретению могут быть представлены одной из нижеследующих формул, в направлении от N-конца к C-концу или от C-конца к N-концу:
Полипептид 1(a) - шарнирная областьm - Полипептид 2(b);
Полипептид 1(a) - линкерn - Полипептид 2(b);
Полипептид 1(a) - линкерn - шарнирная областьm - Полипептид 2(b);
Полипептид 1(a) - шарнирная областьm - линкерn - Полипептид 2(b);
Полипептид 1(a) - Полипептид 2(b)- Полипептид 3(c);
Полипептид 1(a) - шарнирная областьm - Полипептид 2(b)- шарнирная областьm - Полипептид 3(c);
Полипептид 1(a)-линкерn - Полипептид 2(b)- линкерn -Полипептид 3(c);
Полипептид 1(a) - шарнирная областьm - линкерn - Полипептид 2(b) -шарнирная областьm - линкерn - Полипептид 3(c) - Полипептид 1(a) - линкерn - шарнирная областьm - Полипептид 2(b) - линкерn - шарнирная областьm- Полипептид 3(c),
где n равно целому числу от 0 до 20, m равно целому числу от 1 до 62 и a, b и c равны целому числу по меньшей мере 1. Эти варианты изобретения включают вышеуказанные конструкции и любые их варианты или комбинации. Так, например, в этих формулах полипептиды могут также располагаться в следующем порядке: Полипептид 3(с) - Полипептид 1(a)- Полипептид 2(b), Полипептид 2(b) - Полипептид 3(с) - Полипептид 1(a) или в любом другом порядке или в том и другом порядке.
В некоторых вариантах изобретения, последовательность Полипептида 1 включает серпиновый полипептид. Серпины представляют собой группу белков с аналогичными структурами, и эти белки были впервые идентифицированы как серия белков, способных ингибировать протеазы. Серпиновыми белками, подходящими для их применения в описанных здесь слитых белках, являются, например, но не ограничиваются ими, альфа-1-антитрипсин (AAT), белок, родственный антитрипсину (SERPINA2), альфа 1-антихимотрипсин (SERPINA3), каллистатин (SERPINA4), ингибитор эластазы моноцитов-нейтрофилов (SERPINB1), PI-6 (SERPINB6), антитромбин (SERPINC1), ингибитор активатора плазминогена 1 (SERPINE1), альфа-2-антиплазмин (SERPINF2), ингибитор комплемента 1 (SERPING1) и нейросерпин (SERPINI1).
В некоторых вариантах изобретения, последовательность Полипептида 1 включает полипептидную последовательность альфа-1-антитрипсина (AAT) или аминокислотную последовательность, полученную из ААТ. В некоторых вариантах изобретения, последовательность Полипептида 1 включает часть белка AAT. В некоторых вариантах изобретения, последовательность Полипептида 1 включает по меньшей мере часть петли реакционного сайта белка AAT. В некоторых вариантах изобретения, часть петли реакционного сайта белка AAT включает по меньшей мере аминокислотную последовательность:
GTEAAGAMFLEAIPMSIPPEVKFNK (SEQ ID NO: 1).
В предпочтительном варианте изобретения, последовательность полипептида AAT или аминокислотная последовательность, полученная из AAT, представляет собой последовательность человеческого полипептида AAT или последовательность, полученную из указанной последовательности.
В некоторых вариантах изобретения, слитый белок включает полноразмерную человеческую полипептидную последовательность AAT, имеющую нижеследующую аминокислотную последовательность:


В некоторых вариантах изобретения, слитый белок включает человеческую полипептидную последовательность AAT, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 2.
В некоторых вариантах изобретения, полипептидная последовательность ААТ представляет собой аминокислотную последовательность полипептида AAT или получен из одной или более человеческих полипептидных последовательностей AAT, имеющихся в GenBank под регистрационными №№ AAB59495.1, CAJ15161.1, P01009.3, AAB59375.1, AAA51546.1, CAA25838.1, NP 001002235.1, CAA34982.1, NP_001002236.1, NP_000286.3, NP_001121179.1, NP_001121178.1, NP_001121177.1, NP_001121176.16, NP_001121175.1, NP_001121174.1, NP_001121172.1 и/или AAA51547.1.
В некоторых вариантах изобретения слитые белки имеют одну или более мутаций. Так, например, слитый белок имеет по меньшей мере одну мутацию в положении метионинового (Met) остатка в серпиновой части слитого белка. При таких Met-мутациях, остаток Met может быть заменен любой аминокислотой. Так, например, остаток Met может быть заменен аминокислотой, имеющей гидрофобную боковую цепь, такой как, например, лейцин (Leu, L). Не ограничиваясь какой-либо теорией, авторы лишь отмечают, что мутация(и) в Met предотвращает(ют) окисление и последующую инактивацию ингибирующей активности слитых белков согласно изобретению. В некоторых вариантах изобретения, остаток Met может быть заменен заряженным остатком, таким как, например, глутамат (Glu, E). В некоторых вариантах изобретения, мутация Met находится в положении 358 AAT-полипептида. Так, например, мутация Met представляет собой Met358Leu (M358L). В некоторых вариантах изобретения, мутация Met находится в положении 351 AAT-полипептида. Так, например, мутация Met представляет собой Met351Glu (M351E). В некоторых вариантах изобретения, мутация Met находится в положении 351 и в положении 358 AAT-полипептида, например, мутация Met представляет собой Met351Glu (M351E) и Met358Leu (M358L). Так, например, петля реакционного сайта этого варианта слитого AAT-полипептида имеет следующую последовательность: GTEAAGAEFLEAIPLSIPPEVKFNK (SEQ ID NO: 32). В некоторых вариантах изобретения, мутация Met находится в положении 351 и в положении 358 AAT-полипептида, например, мутация Met представляет собой Met351Leu (M351L) и Met358Leu (M358L). Так, например, петля реакционного сайта этого варианта слитого AAT-полипептида имеет следующую последовательность: GTEAAGALFLEAIPLSIPPEVKFNK (SEQ ID NO: 33).
В некоторых вариантах изобретения, второй полипептид (Полипептид 2) серпинового слитого белка представляет собой Fc-полипептид или полипептид, полученный из Fc-полипептида. Эти варианты имеют здесь общее название «слитые белки «серпин-Fc»». Описанные здесь слитые белки «серпин-Fc» включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, полученную из серпина, и Fc-полипептид или аминокислотную последовательность, полученную из Fc-полипептида. В некоторых вариантах изобретения слитый белок «серпин-Fc» включает один серпиновый полипептид. В других вариантах изобретения слитые белки «серпин-Fc» включают более, чем один серпиновый полипептид, и эти варианты имеют здесь общее название «слитый белок «серпин(a')-Fc»», где (a') равно целому числу по меньшей мере 2. В некоторых вариантах изобретения, каждый серпиновый полипептид в слитом белке «серпин(a')-Fc» включает одну и ту же аминокислотную последовательность. В других вариантах изобретения, каждый серпиновый полипептид в слитом белке «серпин(a')-Fc» включает серпиновые полипептиды с отличающимися аминокислотными последовательностями. Серпиновые полипептиды слитых белков «серпин(a')-Fc» могут находиться в любом положении указанного слитого белка.
В некоторых вариантах изобретения, серпиновый полипептид слитого белка «серпин-Fc» включает по меньшей мере аминокислотную последовательность части петли реакционного сайта белка AAT. В некоторых вариантах изобретения, часть петли реакционного сайта белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:1. В некоторых вариантах изобретения, серпиновый полипептид слитого белка «серпин-Fc» включает по меньшей мере аминокислотную последовательность варианта части петли реакционного сайта белка AAT. В некоторых вариантах изобретения, вариант части петли реакционного сайта белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:32 или SEQ ID NO:33. В некоторых вариантах изобретения, серпиновый полипептид слитого белка «серпин-Fc» включает по меньшей мере полноразмерную полипептидную последовательность человеческого ААТ, имеющую аминокислотную последовательность SEQ ID NO: 2. В некоторых вариантах изобретения, серпиновый полипептид слитого белка «серпин-Fc» включает полипептидную последовательность человеческого AAT, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 2 или 32 или 33.
В некоторых вариантах изобретения, серпиновый полипептид слитого белка «серпин-Fc» включает полипептидную последовательность AAT, которая представляет собой одну или более человеческих последовательностей ААТ или аминокислотную последовательность, полученную из указанных последовательностей AAT, имеющихся в GenBank под регистрационными №№ AAB59495.1, CAJ15161.1, P01009.3, AAB59375.1, AAA51546.1, CAA25838.1, NP_001002235.1, CAA34982.1, NP_001002236.1, NP_000286.3, NP_001121179.1, NP_001121178.1, NP_001121177.1, NP_001121176.16, NP_001121175.1, NP_001121174.1, NP_001121172.1 и/или AAA51547.1.
В некоторых вариантах изобретения, Fc-полипептид слитого белка представляет собой человеческий Fc-полипептид, например, последовательность Fc-полипептида человеческого IgG или аминокислотную последовательность, полученную из последовательности Fc-полипептида человеческого IgG. Так, например, в некоторых вариантах изобретения, Fc-полипептид представляет собой Fc-полипептид человеческого IgG1 или аминокислотную последовательность, полученную из последовательности Fc-полипептида человеческого IgG1. В некоторых вариантах изобретения, Fc-полипептид представляет собой Fc-полипептид человеческого IgG2 или аминокислотную последовательность, полученную из последовательности Fc-полипептида человеческого IgG2. В некоторых вариантах изобретения, Fc-полипептид представляет собой Fc-полипептид человеческого IgG3 или аминокислотную последовательность, полученную из последовательности Fc-полипептида человеческого IgG3. В некоторых вариантах изобретения, Fc-полипептид представляет собой Fc-полипептид человеческого IgG4 или аминокислотную последовательность, полученную из последовательности Fc-полипептида человеческого IgG4. В некоторых вариантах изобретения, Fc-полипептид представляет собой Fc-полипептид человеческого IgМ или аминокислотную последовательность, полученную из последовательности Fc-полипептида человеческого IgM.
В некоторых вариантах изобретения, в которых слитый белок согласно изобретению включает Fc-полипептид, такой Fc-полипептид слитого белка, включает последовательность Fc-полипептида человеческого IgG1, имеющую нижеследующую аминокислотную последовательность:

В некоторых вариантах изобретения, в которых слитый белок согласно изобретению включает Fc-полипептид, такой Fc-полипептид слитого белка, включает последовательность Fc-полипептида человеческого IgG1, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 3.
В некоторых вариантах изобретения, в которых слитый белок согласно изобретению включает Fc-полипептид, этот Fc-полипептид был мутирован или модифицирован так, чтобы он повышал уровень связывания с FcRn. В этих вариантах изобретения, мутированный или модифицированный Fc-полипептид имеет следующие мутации: Met252Tyr, Ser254Thr, Thr256Glu (M252Y, S256T, T256E) или Met428Leu и Asn434Ser (M428L, N434S), пронумерованные по системе нумерации Кэбата. В некоторых вариантах изобретения, часть Fc-полипептида была мутирована или как-либо иначе модифицирована в целях нарушения Fc-опосредуемой димеризации. В этих вариантах изобретения, слитый белок является мономерным по своей природе.
В некоторых вариантах изобретения, в которых слитый белок согласно изобретению включает Fc-полипептид, такой Fc-полипептид слитого белка включает последовательность Fc-полипептида человеческого IgG2, имеющую нижеследующую аминокислотную последовательность:

В некоторых вариантах изобретения, в которых слитый белок согласно изобретению включает Fc-полипептид, такой Fc-полипептид слитого белка включает последовательность Fc-полипептида человеческого IgG2, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 4.
В некоторых вариантах изобретения, в которых слитый белок согласно изобретению включает Fc-полипептид, такой Fc-полипептид слитого белка включает последовательность Fc-полипептида человеческого IgG3, имеющую нижеследующую аминокислотную последовательность:

В некоторых вариантах изобретения, в которых слитый белок согласно изобретению включает Fc-полипептид, такой Fc-полипептид слитого белка включает последовательность Fc-полипептида человеческого IgG3, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID №: 5.
В некоторых вариантах изобретения, в которых слитый белок согласно изобретению включает Fc-полипептид, такой Fc-полипептид слитого белка включает последовательность Fc-полипептида человеческого IgG4, имеющую нижеследующую аминокислотную последовательность:

В некоторых вариантах изобретения, в которых слитый белок согласно изобретению включает Fc-полипептид, такой Fc-полипептид слитого белка включает последовательность Fc-полипептида человеческого IgG4, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID №: 6.
В некоторых вариантах изобретения, в которых слитый белок согласно изобретению включает Fc-полипептид, такой Fc-полипептид слитого белка включает последовательность Fc-полипептида человеческого IgМ, имеющую нижеследующую аминокислотную последовательность:

В некоторых вариантах изобретения, в которых слитый белок согласно изобретению включает Fc-полипептид, такой Fc-полипептид слитого белка включает последовательность Fc-полипептида человеческого IgМ, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 7.
В некоторых вариантах описанных здесь слитых белков, второй полипептид (Полипептид 2) серпинового слитого белка представляет собой направленный на цитокин полипептид или получен из направленного на цитокин полипептида. Эти варианты имеют здесь общее название «слитые белки серпин - направленный на цитокин полипептид». Описанные здесь «слитые белки серпин - направленный на цитокин полипептид» включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, полученную из серпинового полипептида, и направленный на цитокин полипептид, или их производные. В некоторых вариантах изобретения, слитый белок серпин - направленный на цитокин полипептид включает один серпиновый полипептид. В других вариантах изобретения, слитый белок серпин - направленный на цитокин полипептид включает более, чем один серпиновый полипептид, и эти варианты имеют здесь общее название «слитые белки серпин(a')-направленный на цитокин полипептид», где (a') представляет целое число по меньшей мере 2. В некоторых вариантах изобретения, каждый серпиновый полипептид в слитом белке серпин(a')-направленный на цитокин полипептид включает одну и ту же аминокислотную последовательность. В других вариантах изобретения, каждый серпиновый полипептид в слитом белке серпин(a')-направленный на цитокин полипептид включает серпиновые полипептиды с отличающимися аминокислотными последовательностями.
В некоторых вариантах изобретения направленный на цитокин полипептид слитого белка серпин - направленный на цитокин полипептид представляет собой цитокиновый рецептор или получен из цитокинового рецептора. В предпочтительном варианте изобретения, направленный на цитокин полипептид или аминокислотная последовательность, полученная из цитокинового рецептора, представляют собой человеческую последовательность цитокинового рецептора или последовательность, полученную из указанной последовательности. В других вариантах изобретения направленным на цитокин полипептидом является антитело или его фрагмент, например, антитело против цитокина или фрагмент антитела против цитокина. В предпочтительном варианте изобретения, направленный на цитокин полипептид или аминокислотную последовательность, полученную из указанного антитела или его фрагмента, получают из последовательности химерного, гуманизованного или полностью человеческого антитела. Термин «фрагмент антитела» включает одну цепь, Fab-фрагмент, F(ab')2-фрагмент, scFv, scAb, dAb, однодоменное антитело с тяжелой цепью и однодоменное антитело с легкой цепью.
В других вариантах изобретения, направленный на цитокин полипептид связывается с цитокиновым рецептором и предотвращает связывание цитокина с рецептором. В других вариантах изобретения, направленным на цитокин полипептидом является антитело или его фрагмент, например, антитело против цитокинового рецептора или фрагмент антитела против цитокинового рецептора.
В некоторых вариантах изобретения, серпиновый полипептид слитых белков серпин - направленный на цитокин полипептид включает по меньшей мере аминокислотную последовательность части петли реакционного сайта белка AAT. В некоторых вариантах изобретения, часть петли реакционного сайта белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:1. В некоторых вариантах изобретения, серпиновый полипептид слитых белков серпин - направленный на цитокин полипептид включает по меньшей мере аминокислотную последовательность варианта части петли реакционного сайта белка AAT. В некоторых вариантах изобретения, вариант части петли реакционного сайта белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:32 или SEQ ID NO:33. В некоторых вариантах изобретения, серпиновый полипептид слитого белка серпин - направленный на цитокин полипептид включает по меньшей мере полноразмерную человеческую полипептидную последовательность ААТ, имеющую аминокислотную последовательность SEQ ID NO: 2, или последовательность, полученную из этой последовательности. В некоторых вариантах изобретения, серпиновый полипептид слитого белка серпин - направленный на цитокин полипептид включает человеческую полипептидную последовательность AAT, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 2 или 32 или 33.
В некоторых вариантах изобретения, серпиновый полипептид слитого белка серпин - направленный на цитокин полипептид включает полипептидную последовательность AAT, которая представляет собой одну или более человеческих полипептидных последовательностей ААТ или аминокислотную последовательность, полученную из указанных последовательностей AAT, имеющихся в GenBank под регистрационными №№ AAB59495.1, CAJ15161.1, P01009.3, AAB59375.1, AAA51546.1, CAA25838.1, NP_001002235.1, CAA34982.1, NP_001002236.1, NP_000286.3, NP_001121179.1, NP_001121178.1, NP_001121177.1, NP_001121176.16, NP_001121175.1, NP_001121174.1, NP_001121172.1 и/или AAA51547.1.
Слитый белок серпин - направленный на цитокин полипептид может включать часть слитого белка серпин - Fc. Так, например, антитело содержит Fc-полипептид. Поэтому, в некоторых вариантах изобретения, в которых направленным на цитокин полипептидом является цитокин-связывающее антитело, слитый белок серпин - направленный на цитокин полипептид содержит часть слитого белка серпин - Fc. Кроме того, большинство рецепторных слитых белков, обладающих терапевтической активностью, представляет собой слитые Fc-белки. Таким образом, в некоторых вариантах изобретения, в которых слитым белком серпин - направленный на цитокин полипептид является слитый белок серпин - цитокиновый рецептор, слитый белок серпин - направленный на цитокин полипептид может, помимо серпиновой части и части цитокинового рецептора, включать Fc-полипептид.
В некоторых вариантах изобретения, в которых слитый белок серпин - направленный на цитокин полипептид включает последовательность Fc-полипептида, указанная последовательность Fc-полипептида включает аминокислотную последовательность любой из SEQ ID NO: 3, 4, 5, 6 или 7 или последовательность, полученную из указанной последовательности. В некоторых вариантах изобретения, в которых слитый белок серпин - направленный на цитокин полипептид включает последовательность Fc-полипептида, указанная последовательность Fc-полипептида по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична любой из аминокислотных последовательностей SEQ ID NO: 3, 4, 5, 6 или 7. В некоторых вариантах изобретения, серпиновый полипептид и направленный на цитокин полипептид функционально присоединены друг к другу посредством линкерной области, например, посредством линкера глицин - серин или линкера на основе глицина - серина. В некоторых вариантах изобретения, серпиновый полипептид и направленный на цитокин полипептид функционально присоединены друг к другу посредством шарнирной области. В некоторых вариантах изобретения, серпиновый полипептид и направленный на цитокин полипептид функционально присоединены друг к другу посредством линкерной области и шарнирной области. В других вариантах изобретения, серпиновый полипептид и направленный на цитокин полипептид непосредственно связаны друг с другом.
В некоторых вариантах изобретения описанных здесь слитых белков, второй полипептид (Полипептид 2) серпинового слитого белка представляет собой полипептид, содержащий домен кислотного белка молочной сыворотки (WAP), или аминокислотную последовательность, полученную из полипептида, содержащего домен WAP. Эти варианты имеют здесь общее название «слитые белки серпин - домен WAP». Слитые белки серпин - домен WAP включают по меньшей мере серпиновый полипептид или по меньшей мере аминокислотную последовательность, полученную из этого серпина; и полипептид, содержащий домен WAP или аминокислотную последовательность, полученную из полипептида, содержащего домен WAP. В некоторых вариантах изобретения, слитый белок серпин - домен WAP включает один серпиновый полипептид. В других вариантах изобретения, слитый белок серпин – направленный на WAP полипептид включает более, чем один серпиновый полипептид. Эти варианты имеют здесь общее название «слитые белки серпин(a')-домен WAP», где (a') равно целому числу по меньшей мере 2. В некоторых вариантах изобретения, серпиновые полипептиды в слитом белке серпин(a')- домен WAP включают одну и ту же аминокислотную последовательность. В других вариантах изобретения, серпиновые полипептиды в слитом белке серпин(a') - направленный на цитокин полипептид включают серпиновые полипептиды с отличающимися аминокислотными последовательностями.
Эти слитые белки серпин - домен WAP включают полипептидную последовательность, содержащую домен WAP или полипептидную последовательность, которая представляет собой полипептид, содержащий домен WAP, или последовательность, полученную из указанной последовательности. Домен WAP представляет собой эволюционно консервативный мотив последовательности из 50 аминокислот, содержащей восемь цистеинов, расположенных в сердцевине с характерной структурой из 4 дисульфидов (также называемой коровым мотивом из четырех дисульфидов). Мотив последовательности домена WAP представляет собой функциональный мотив, отличающийся тем, что в ряде белков он обладает активностью, направленной на ингибирование сериновой протеазы.
Полипептидами, содержащими домен WAP и подходящими для их использования в описанных здесь слитых белках, являются, например, но не ограничиваются ими, ингибитор секреторной протеазы лейкоцитов (SLPI), элафин и эппин.
В некоторых вариантах изобретения, последовательность полипептида, содержащего домен WAP в слитом белке, включает последовательность полипептида-ингибитора секреторной протеазы лейкоцитов (SLPI) или аминокислотную последовательность, полученную из SLPI. Эти варианты называются здесь «слитыми белками серпин - последовательность, полученная из SLPI». В некоторых вариантах изобретения, полипептидная последовательность SLPI содержит часть белка SLPI, такую как, например, домен WAP2 или его субчасть. В предпочтительном варианте изобретения, последовательность полипептида SLPI или аминокислотная последовательность, полученная из SLPI, представляет собой последовательность человеческого полипептида SLPI или последовательность, полученную из этой последовательности.
В некоторых вариантах слитых белков серпин - SLPI согласно изобретению, последовательность SLPI или последовательность слитого белка, полученная из SLPI, включает полноразмерную последовательность человеческого полипептида SLPI, имеющую нижеследующую аминокислотную последовательность:

В некоторых вариантах слитых белков серпин - SLPI согласно изобретению, последовательность SLPI или последовательность слитого белка, полученная из SLPI, включает последовательность человеческого полипептида SLPI, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 8.
В некоторых вариантах слитых белков серпин - SLPI согласно изобретению, последовательность SLPI или последовательность слитого белка, полученная из SLPI, включает часть полноразмерной последовательности человеческого полипептида SLPI, где указанная часть имеет нижеследующую аминокислотную последовательность:

В некоторых вариантах слитых белков серпин - SLPI согласно изобретению, последовательность SLPI или последовательность слитого белка, полученная из SLPI, включает последовательность человеческого полипептида SLPI, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 9.
В некоторых вариантах слитых белков серпин - SLPI согласно изобретению, последовательность SLPI или последовательность слитого белка, полученная из SLPI, включает домен WAP2 полноразмерной последовательности человеческого полипептида SLPI, где указанный домен WAP2 имеет нижеследующую аминокислотную последовательность:

В некоторых вариантах слитых белков серпин - SLPI согласно изобретению, последовательность SLPI или последовательность слитого белка, полученная из SLPI, включает последовательность человеческого полипептида SLPI, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 10.
В некоторых вариантах слитых белков серпин - SLPI согласно изобретению, последовательность полипептида SLPI или аминокислотная последовательность, полученная из SLPI, представляет собой одну или более человеческих последовательностей полипептида SLPI или полученная из указанных последовательностей SLPI, имеющихся в GenBank под регистрационными №№ CAA28187.1, NP_003055.1, EAW75869.1, P03973.2, AAH20708.1, CAB64235.1, CAA28188.1, AAD19661.1 и/или BAG35125.1.
В некоторых вариантах слитых белков серпин - SLPI согласно изобретению, последовательность полипептида SLPI или последовательность слитого белка, полученная из SLPI, включает последовательность человеческого полипептида SLPI, которая имеет модификацию в положении метионинового (Met) остатка. При таких Met-мутациях, остаток Met может быть заменен любой аминокислотой. Так, например, остаток Met может быть заменен аминокислотой, имеющей гидрофобную боковую цепь, такой как, например, лейцин (Leu, L) или валин (Val, V). Не ограничаваясь какой-либо теорией, авторы лишь отмечают, что мутация(и) в Met предотвращает(ют) окисление и последующую инактивацию ингибирующей активности слитых белков согласно изобретению. В некоторых вариантах изобретения, мутация Met находится в положении 98 полипептида SLPI. Так, например, модифицированная последовательность полипептида SLPI слитого белка серпин - SLPI имеет мутации M98L или M98V в SEQ ID NO: 8.
В других вариантах изобретения, полипептидная последовательность слитого белка, содержащая домен WAP, включает полипептидную последовательность элафина или аминокислотную последовательность, полученную из элафина. Эти варианты называются здесь «слитыми белками серпин - элафин». В некоторых вариантах изобретения, полипептидная последовательность элафина включает часть белка элафина, такую как, например, домен WAP или его субчасть. В предпочтительном варианте изобретения, полипептидная последовательность элафина или аминокислотная последовательность, полученная из элафина, представляет собой полипептидную последовательность человеческого элафина или последовательность, полученную из указанной последовательности.
В некоторых вариантах слитых белков серпин - элафин, указанный слитый белок включает полноразмерную полипептидную последовательность человеческого элафина, имеющую нижеследующую аминокислотную последовательность:

В некоторых вариантах слитых белков серпин - элафин, указанный слитый белок включает полипептидную последовательность человеческого элафина, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 11.
В некоторых вариантах слитых белков серпин - элафин, указанный слитый белок включает часть полноразмерной полипептидной последовательности человеческого элафина, где указанная часть имеет нижеследующую аминокислотную последовательность:

В некоторых вариантах слитых белков серпин - элафин, указанный слитый белок включает полипептидную последовательность человеческого элафина, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 12.
В некоторых вариантах слитых белков серпин - элафин, указанный слитый белок включает домен WAP полноразмерной полипептидной последовательности человеческого элафина, где указанный домен WAP имеет нижеследующую аминокислотную последовательность:
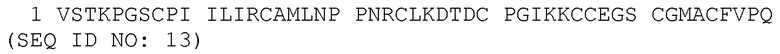
В некоторых вариантах слитых белков серпин - элафин, указанный слитый белок включает полипептидную последовательность человеческого элафина, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 13.
В некоторых вариантах слитых белков серпин - элафин, полипептидную последовательность элафина или аминокислотную последовательность, полученную из полипептида элафина, получают из одной или более человеческих полипептидных последовательностей элафина, имеющихся в GenBank под регистрационными №№ P19957.3, NP_002629.1, BAA02441.1, EAW75814.1, EAW75813.1, Q8IUB2.1 и/или NP_542181.1.
В других вариантах изобретения, полипептидная последовательность слитого белка, содержащая домен WAP, включает полипептидную последовательность эппина или аминокислотную последовательность, полученную из эппина. Эти варианты называются здесь «слитыми белками серпин(a') - эппин». В некоторых вариантах изобретения, полипептидная последовательность эппина слитого белка серпин - эппин включает часть белка эппина, такую как, например, домен WAP или его субчасть. В предпочтительном варианте изобретения, полипептидная последовательность эппина или аминокислотная последовательность, полученная из эппина, представляют собой человеческую полипептидную последовательность эппина или последовательность, полученную из указанной последовательности.
В некоторых вариантах слитых белков серпин - эппин, полипептидная последовательность эппина или аминокислотная последовательность, полученная из полипептида эппина, представляют собой одну или более человеческих полипептидных последовательностей эппина, или получают из указанных последовательностей, имеющихся в GenBank под регистрационными №№ 095925.1, NP_065131.1, AAH44829.2, AAH53369.1, AAG00548.1, AAG00547.1 и/или AAG00546.1.
В некоторых вариантах изобретения, серпиновый полипептид слитого белка серпин - домен WAP включает по меньшей мере аминокислотную последовательность части петли реакционного сайта белка AAT. В некоторых вариантах изобретения, часть петли реакционного сайта белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:1. В некоторых вариантах изобретения, серпиновый полипептид слитого белка серпин - WAP включает по меньшей мере аминокислотную последовательность варианта части петли реакционного сайта белка AAT. В некоторых вариантах изобретения, вариант части петли реакционного сайта белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:32 или SEQ ID NO:33. В некоторых вариантах изобретения, серпиновый полипептид слитого белка серпин - домен WAP включает по меньшей мере полноразмерную человеческую полипептидную последовательность ААТ, имеющую аминокислотную последовательность SEQ ID NO: 2. В некоторых вариантах изобретения, серпиновый полипептид слитого белка серпин - домен WAP включает человеческую полипептидную последовательность AAT, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 2 или 32 или 33.
В некоторых вариантах изобретения, серпиновый полипептид слитого белка серпин - домен WAP включает полипептидную последовательность AAT, которая представляет собой одну или более человеческих последовательностей ААТ или аминокислотную последовательность, полученную из указанных последовательностей AAT, имеющихся в GenBank под регистрационными №№ AAB59495.1, CAJ15161.1, P01009.3, AAB59375.1, AAA51546.1, CAA25838.1, NP_001002235.1, CAA34982.1, NP_001002236.1, NP_000286.3, NP_001121179.1, NP 001121178.1, ΝΡ_0011121177.1, NP_001121176.16, NP_001121175.1, NP_001121174.1, NP_001121172.1 и/или AAA51547.1.
В некоторых вариантах изобретения, слитый белок серпин - домен WAP может также включать Fc-полипептид или аминокислотную последовательность, полученную из Fc-полипептида. Эти варианты называются здесь общим термином «слитые белки серпин - Fc - домен WAP». В этих вариантах, указанный термин не определяет какой-либо конкретный порядок расположения элементов. Так, например, компоненты слитого белка могут располагаться в следующем порядке: серпин - Fc - домен WAP, серпин - домен WAP - Fc или в любом другом порядке. Описанные здесь слитые белки серпин - Fc - домен WAP включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, полученную из серпина; полипептид, содержащий домен WAP или аминокислотную последовательность, полученную из полипептида, содержащего домен WAP, и Fc-полипептид или аминокислотную последовательность, полученную из Fc-полипептида.
В некоторых вариантах изобретения, в которых слитый белок серпин - домен WAP включает последовательность Fc-полипептида, указанная последовательность Fc-полипептида может иметь аминокислотную последовательность SEQ ID NO: 3-7. В других вариантах изобретения, в которых слитый белок серпин - домен WAP включает последовательность Fc-полипептида, указанная последовательность Fc-полипептида может иметь последовательность, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91 %, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 3-7. В некоторых вариантах изобретения, слитый белок серпин - домен WAP может также включать полипептид альбумина или аминокислотную последовательность, полученную из полипептида альбумина. Эти варианты называются здесь общим термином «слитые белки серпин - альбумин - домен WAP». В этих вариантах, указанный термин не определяет какой-либо конкретный порядок расположения элементов. Так, например, компоненты слитого белка могут располагаться в следующем порядке: серпин - альбумин - домен WAP, серпин - домен WAP - альбумин или в любом другом порядке. Описанные здесь слитые белки серпин - альбумин - домен WAP включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, полученную из серпина; полипептид, содержащий домен WAP, или аминокислотную последовательность, полученную из полипептида, содержащего домен WAP, и полипептид альбумина или аминокислотную последовательность, полученную из полипептида альбумина.
В некоторых вариантах изобретения, в которых слитый белок серпин - домен WAP включает полипептидную последовательность альбумина, указанная полипептидная последовательность альбумина включает описанную здесь аминокислотную последовательность SEQ ID NO: 14-15. В других вариантах изобретения, в которых слитый белок серпин - домен WAP включает полипептидную последовательность альбумина, указанная полипептидная последовательность альбумина по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична любой из аминокислотных последовательностей, представленных SEQ ID NО: 14 или 15.
В некоторых вариантах изобретения, второй полипептид (Полипептид 2) слитого серпинового белка представляет собой полипептид альбумина или получен из полипептида альбумина. Эти варианты называются здесь общим термином «слитые белки серпин(a') - альбумин». Описанные здесь слитые белки серпин - альбумин включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, полученную из серпина, и полипептид альбумина или аминокислотную последовательность, полученную из полипептида альбумина. Кроме того, настоящее изобретение относится к слитым белкам серпин - альбумин-связывающий полипептид, где указанный альбумин функционально присоединен к серпину посредством молекулы, связывающейся с промежуточным соединением. В описании настоящей заявки, серпин нековалентно или ковалентно связан с альбумином человеческой сыворотки.
В тех вариантах изобретения, в которых слитый белок согласно изобретению включает полипептидную последовательность альбумина, полипептидная последовательность альбумина слитого белка представляет собой полипептид альбумина человеческой сыворотки (HSA) или аминокислотную последовательность, полученную из HSA. В некоторых вариантах изобретения, слитый белок включает полипептидную последовательность HSA, имеющую нижеследующую аминокислотную последовательность:

В тех вариантах изобретения, в которых слитый белок согласно изобретению включает полипептидную последовательность альбумина, полипептидная последовательность альбумина слитого белка включает полипептидную последовательность альбумина человеческой сыворотки, где указанная последовательность по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 14.
В тех вариантах изобретения, в которых слитый белок согласно изобретению включает полипептидную последовательность альбумина, полипептидная последовательность альбумина слитого белка включает домен 3 полипептидной последовательности альбумина человеческой сыворотки, где указанная последовательность имеет нижеследующую аминокислотную последовательность:

В тех вариантах изобретения, в которых слитый белок согласно изобретению включает полипептидную последовательность альбумина, полипептидная последовательность альбумина слитого белка включает полипептидную последовательность альбумина человеческой сыворотки, где указанная последовательность по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 15.
В некоторых вариантах изобретения, в которых слитый белок согласно изобретению включает полипептидную последовательность альбумина, указанный слитый белок присоединен к альбумину человеческой сыворотки посредством промежуточного альбумин-связывающего полипептида. Альбумин-связывающим полипептидом может быть антитело или его фрагмент, либо такой полипептид получен из антитела или его фрагмента. В предпочтительном варианте изобретения, альбумин-связывающий полипептид или аминокислотную последовательность, полученную из антитела или его фрагмента, получают из последовательности химерного, гуманизованного или полностью человеческого антитела. Термин «фрагмент антитела» включает одну цепь, Fab-фрагмент, F(ab')2-фрагмент, scFv, scAb, dAb, однодоменное антитело с тяжелой цепью и однодоменное антитело с легкой цепью. Кроме того, альбумин-связывающим полипептидом может быть альбумин-связывающий пептид. Другим вариантом настоящего изобретения является гибрид серпин - альбумин-связывающий полипептид, где указанным альбумин-связывающим полипептидом является домен 3 стрептококкового G-белка или последовательность, полученная из домена 3 стрептококкового G-белка.
В некоторых вариантах изобретения, серпиновый полипептид слитых белков серпин(a') - альбумин включает по меньшей мере аминокислотную последовательность части петли реакционного сайта белка AAT. В некоторых вариантах изобретения, часть петли реакционного сайта белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:1. В некоторых вариантах изобретения, серпиновый полипептид слитого белка серпин - альбумин включает по меньшей мере аминокислотную последовательность варианта части петли реакционного сайта белка AAT. В некоторых вариантах изобретения, вариант части петли реакционного сайта белка AAT включает по меньшей мере аминокислотную последовательность SEQ ID NO:32 или SEQ ID NO:33. В некоторых вариантах изобретения, серпиновый полипептид слитых белков серпин - альбумин включает по меньшей мере полноразмерную человеческую полипептидную последовательность ААТ, имеющую аминокислотную последовательность SEQ ID NO: 2. В некоторых вариантах изобретения, серпиновый полипептид слитых белков серпин - альбумин включает человеческую полипептидную последовательность AAT, которая по меньшей мере на 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности SEQ ID NO: 2 или 32 или 33.
В некоторых вариантах изобретения, серпиновый полипептид слитых белков серпин - альбумин включает полипептидную последовательность AAT, которая представляет собой одну или более человеческих последовательностей ААТ или аминокислотную последовательность, полученную из указанных последовательностей AAT, имеющихся в GenBank под регистрационными №№ AAB59495.1, CAJ15161.1, P01009.3, AAB59375.1, AAA51546.1, CAA25838.1, NP_001002235.1, CAA34982.1, NP_001002236.1, NP_000286.3, NP_001121179.1, NP_001121178.1, ΝΡ_001121177.1, NP_001121176.16, NP_001121175.1, NP_001121174.1, NP_001121172.1 и/или AAA51547.1.
В некоторых вариантах изобретения, слитые белки были модифицированы так, чтобы они повышали уровень протеолитического расщепления или как-либо иначе ингибировали протеолитическое расщепление, например, путем введения мутаций в один или более сайтов протеолитического расщепления. В некоторых вариантах изобретения, слитые белки были модифицированы так, чтобы они изменяли или как-либо иначе модулировали эффекторную функцию Fc слитого белка, но при этом, сохраняли способность связывания и ингибирующую функцию, которыми обладает немодифицированный слитый белок. Примерами эффекторных функций Fc являются, но не ограничиваются ими, связывание с Fc-рецептором, предупреждение высвобождения провоспалительных медиаторов после связывания с Fc-рецептором, фагоцитоз, модифицированная антитело-зависимая клеточно-опосредуемая цитотоксичность (ADCC), модифицированная комплемент-зависимая цитотоксичность (CDC), модифицированное гликозилирование в положении остатка Asn297 (пронумерованного в соответствии с Европейской нумерацией Кэбата, Kabat et al. 1991 Sequences of Proteins of Immunological Interest) Fc-полипептида. В некоторых вариантах изобретения, слитые белки были мутированы или как-либо иначе модифицированы так, чтобы такие мутации или модификации влияли на связывание с Fc-рецептором. В некоторых вариантах изобретения, Fc-полипептид был модифицирован так, чтобы такая модификация повышала уровень связывания с FcRn. Примерами мутаций Fc-полипептидов, повышающих уровень связывания с FcRn, являются Met252Tyr, Ser254Thr, Thr256Glu (M252Y, S256T, T256E) (нумерация по Кэбату, Dall'Acqua et al. 2006, J. Biol Chem. Vol 281(33) 23514-23524) или Met428Leu и Asn434Ser (M428L, N434S) (Zalevsky et al. 2010 Nature Biotech, Vol. 28(2) 157-159). (Европейская нумерация Кэбата, Kabat et al. 1991 Sequences of Proteins of Immunological Interest). В некоторых вариантах изобретения, часть Fc-полипептида была мутирована или как-либо иначе модифицирована так, чтобы такая мутация или модификация приводила к нарушению Fc-опосредованной димеризации (Ying et al 2012 J. Biol Chem. 287(23): 19399-19408). В этих вариантах изобретения, слитый белок является мономерным по своей природе.
Описанные здесь слитые белки и их варианты обладают ингибирующей активностью, например, активностью, направленной на ингибирование сериновой протеазы, такой как эластаза человеческих нейтрофилов (NE), то есть, хемотрипсин, принадлежащий к сериновой протеазе, которая секретируется нейтрофилами в процессе вырабатывания воспалительного ответа. Описанные здесь слитые белки полностью или частично ослабляют или как-либо иначе модулируют экспрессию или активность сериновой протеазы после связывания с сериновой протеазой или после какого-либо другого взаимодействия с сериновой протеазой, например, с человеческой сериновой протеазой. Снижение или модуляция биологической функции сериновой протеазы являются полными или частичными после взаимодействия слитых белков с белком, полипептидом и/или пептидом человеческой сериновой протеазы. Считается, что слитые белки полностью ингибируют экспрессию или активность сериновой протеазы в том случае, когда уровень экспрессии или активности сериновой протеазы в присутствии слитого белка снижается по меньшей мере на 95%, например, на 96%, 97%, 98%, 99% или 100% по сравнению с уровнем экспрессии или активности сериновой протеазы в отсутствии взаимодействия, например, в отсутствии связывания с описанным здесь слитым белком. Считается, что слитые белки частично ингибируют экспрессию или активность сериновой протеазы в том случае, когда уровень экспрессии или активности сериновой протеазы в присутствии слитого белка снижается менее, чем на 95%, например, на 10%, 20%, 25%, 30%, 40%, 50%, 60%, 75%, 80%, 85% или 90% по сравнению с уровнем экспрессии или активности сериновой протеазы в отсутствии взаимодействия, например, в отсутствии связывания с описанным здесь слитым белком.
Описанные здесь слитые белки могут быть использованы в различных терапевтических, диагностических и профилактических целях. Так, например, слитые белки могут быть использованы для лечения ряда заболеваний и расстройств у индивидуума. В некоторых вариантах изобретения, серпиновые слитые белки, включая описанные здесь слитые белки, могут быть использованы для лечения, ослабления симптомов, уменьшения тяжести заболевания или расстройства и/или замедления их прогрессирования у индивидуума, страдающего таким заболеванием или расстройством, или у индивидуума с риском развития такого заболевания или расстройства, выбранного из заболевания, ассоциированного с дефицитом альфа-1-антитрипсина (AAT), эмфиземы, хронической обструктивной болезни легких (ХОБЛ), острого респираторного дистресс-синдрома (ОРДС), аллергической астмы, кистозного фиброза, рака легких, ишемического реперфузионного повреждения, включая, например, ишемическое/реперфузионное повреждение после трансплантации сердца; инфаркта миокарда, ревматоидного артрита, септического артрита, псориатического артрита, анкилозирующего спондилита, болезни Крона, псориаза, диабета типа I и/или типа II, бактериальных инфекций, грибковых инфекций, вирусных инфекций, пневмонии, сепсиса, реакции трансплантат против хозяина (GVHD), заболевания, связанного с заживлением ран, системной красной волчанки и рассеянного склероза.
Фармацевтические композиции согласно изобретению содержат слитый белок согласно изобретению, включая модифицированные слитые белки и другие варианты, а также подходящий носитель. Указанные фармацевтические композиции могут быть включены в наборы, такие как, например, диагностические наборы.
Краткое описание графического материала
На фиг. 1A схематически представлены некоторые варианты слитых белков серпин - Fc согласно изобретению. Серпин может присутствовать в любом положении слитого белка. Также представлен слитый белок серпин - Fc, включающий более, чем один серпиновый полипептид. На фиг. 1B представлена фотография геля ПААГ с ДСН, на которой указаны сывороточный AAT (дорожка 1), AAT-Fc1 (дорожка 2, Fc человеческого IgG1) и AAT-EL-Fc1 (дорожка 3, мутации Met351Glu, Met358Leu в AAT, Fc человеческого IgG1). На фиг. 1C представлен график, иллюстрирующий ингибирование эластазной активности нейтрофилов слитыми белками AAT-Fc. На фиг. 1D представлена фотография геля ПААГ с ДСН, на которой указан четырехвалентный AAT-Fc-AAT, имеющий два полипептида AAT на Fc-полипептид. На фиг. 1E представлен график, иллюстрирующий ингибирование эластазной активности нейтрофилов четырехвалентным слитым белком AAT-Fc-AAT. На фиг. 1F представлен график, иллюстрирующий эффект элюирования со смолы, содержащей белок А, при низком pH, где NE-ингибирующая способность слитого белка AAT-Fc, элюирующегося при низком рН, резко снижалась. На фиг. 1G представлен график, указывающий на то, что двойной мутант AAT-EL-Fc (с мутациями Met351Glu, Met358Leu) является резистентным к Η2О2-инактивации (конц.) по сравнению с ААТ дикого типа и с AAT-EM-Fc, имеющим одну мутацию (Met351Glu). На фиг. 1H представлен график, иллюстрирующий скорость выведения сывороточного AAT (sdAAT) из сыворотки по сравнению со скоростью выведения AAT-Fc у крыс, которым была введена доза 10 мг/кг белка (3 крысы/тестируемый белок). Время полужизни AAT-Fc значительно превышало время полужизни sdAAT.
На фиг. 2A схематически представлены некоторые варианты слитых белков серпин - направленный на цитокин полипептид согласно изобретению. Серпин может быть присоединен к тяжелой цепи антитела, к легкой цепи антитела или к обеим цепям антитела. Также представлены слитые белки серпин - цитокиновый рецептор. На фиг. 2B представлена фотография геля ПААГ с ДСН, на которой указано антитело D2E7 (дорожка 1) и антитело D2E7 с AAT, присоединенным к тяжелой цепи (дорожка 2). На фиг. 2C представлен график, иллюстрирующий ингибирование элестазной активности нейтрофилов антителом D2E7, связанным с AAT. Сывороточный AAT представлен как позитивный контроль, а антитело D2E7, взятое отдельно, представлено как негативный контроль для ингибирования NE.
На фиг. 3A схематически представлены некоторые варианты слитых белков серпин-Fc-WAP. На фиг. 3B представлена фотография геля ПААГ с ДСН, на которой указаны AAT-Fc-элафин (дорожка 1) и AAT-Fc-SLPI (дорожка 2). На фиг. 3C представлен график, иллюстрирующий ингибирование элестазной активности нейтрофилов слитым белком AAT-Fc-элафин и слитым белком AAT-Fc-SLPI. Слитый белок AAT-Fc и сывороточный AAT включены для сравнения.
На фиг. 4A схематически представлены некоторые варианты слитых белков AAT-HSA. На фиг. 4B представлена фотография геля ПААГ с ДСН, на которой указан гибрид AAT-HSA. На фиг. 4C представлен график, иллюстрирующий ингибирование элестазной активности нейтрофилов гибридом AAT-HSA по сравнению с ингибированием эластазной активности сывороточным AAT.
Подробное описание изобретения
Эластаза человеческих нейтрофилов (NE) представляет собой сериновую протеазу химотрипсин, секретируемую нейтрофилами в процессе воспаления. Нарушение NE-активности приводит к прогрессируемому разрушению эластиновых тканей и к медленной деструкции альвеолярных структур легких и, тем самым, приводит к развитию эмфиземы и фиброза легких (Lungarella et al. 2008 Int. J. Biochem. Cell Biol. 40: 1287). В большинстве случаев, нарушение активности NE вызывается дисбалансом между протеазой и ее природным ингибитором, альфа-1-антитрипсином (AAT). Такой дисбаланс может быть вызван усилением инфильтрации нейтрофилов в легкие, как это наблюдается в легких курильщиков и пациентов с кистозным фиброзом (КФ) или с острым респираторным дистресс-синдромом (ОРДС). И наоборот, дефицит AAT, который обычно является результатом точковой мутации, стимулирующей агрегацию и аккумуляцию ATT в печени, приводит к тому, что легкие становятся объектом неконтролируемой NE-активности. У индивидуумов с дефицитом AAT повышается риск развития эмфиземы, ХОБЛ, болезни печени и множества других состояний.
Дефицит AAT наблюдается приблизительно у 100000 американцев (по данным Фонда Альфа-1), и многие из них умирают в возрасте от 30 до 40 лет. В настоящее время существует очень немного лекарственных средств для лечения дефицита ATT, разрешенных FDA (Prolastin®, Aralast™, Zemaira®, Glassia™). Каждое лекарственное средство представляет собой природный AAT, выделенный из собранной человеческой плазмы, однако, очевидно, что этих средств будет явно недостаточно для удовлетворения клинических потребностей в будущем. Кроме того, эти продукты имеют короткое время полужизни в сыворотке (T1/2 составляет приблизительно 5 дней), и для их еженедельного вливания требуются высокие дозы (60 мг/кг массы тела). По оценкам специалистов, современные материальные затраты на эти лекарственные средства составляют приблизительно 400 миллионов долларов. Рынок AAT-подобных лекарственных средств, вероятно, будет значительно расширяться, если учесть, что, по оценкам специалистов, почти у 95% индивидуумов с дефицитом AAT этот диагноз пока не поставлен, и если учесть, что эти лекарственные средства могут быть эффективными для лечения патологий, характеризующихся повышенной NE-активностью у индивидуумов, у которых не наблюдается дефицита AAT (например, у индивидуумов с кистозным фиброзом (КФ), острым респираторным дистресс-синдромом (ОРДС), с энфиземой, вызванной курением, и/или ХОБЛ).
Было высказано предположение, что AAT обладает широким спектром противовоспалительной активности (Tilg et al 1993, J. Exp. Med. 178: 1629-1636, Libert et al 1996 Immunol. 157:5126-5129, Pott et al., Journal of Leukocyte Biology 85 2009, Janciauskiene et al. 2007, J. Biol Chem. 282(12): 8573-8582, Nita et al 2007, Int. J. Biochem. Cell Biol. 39: 1165-1176). Недавно было обнаружено, что AAT может быть использован для лечения различных патологий у человека, не относящихся к наиболее распространенным воспалительным заболеваниям легких. Было обнаружено, что человеческий AAT не вызывает у мышей клинических и гистопатологических признаков экспериментального аутоиммунного энцефаломиелита (ЭАЭ), что позволяет предположить, что такое лекарственное средство может быть использовано для лечения аутоиммунных заболеваний, таких как рассеянный склероз или системная красная волчанка (СКВ) (Subramanian et al. 2011 Metab. Brain. Dis. 26: 107-113). Было показано, что сывороточный AAT обладает активностью у грызунов с моделью реакции трансплантат против хозяина (GVHD) (Tawara et al. 2011, Proc. Natl. Acad. Sci. USA 109: 564-569, Marcondes et al. 2011, Blood Nov 3; 118(18):5031-9), и исходя из этого было проведено клиническое испытание с участием человека, в котором использовали AAT для лечения индивидуумов, страдающих острой GVHD, не поддающейся лечению стероидами (NCT01523821). Кроме того, AAT является эффективным у животных с моделями диабета типа I и типа II, а именно, способствует снижению воспаления, защищает островковые клетки от апопотоза и обеспечивает надежную адаптацию аллотрансплантата островковых клеток (Zhang et al. 2007 Diabetes 56: 1316-1323, Lewis et al. 2005 Proc. Natl. Acad. Sci. USA 102: 12153-12158, Lewis et al. 2008 Proc. Natl. Acad. Sci. USA 105: 16236-16241, Kalis et al. 2010, Islets 2:185-189). В настоящее время был проведен ряд клинических испытаний по лечению диабета типа I у человека на ранней стадии с использованием сывороточных продуктов AAT (NCT01183468, NCT01319331, NCT01304537).
Современные сывороточные продукты AAT подвергают тщательной очистке и тестированию на отсутствие патогенных вирусов, однако, риск передачи инфекционных агентов все же не может быть полностью исключен. Кроме того, недостаточное количество сыворотки ограничивает возможность продуцирования сывороточного AAT. Для решения проблем, связанных с сывороточными продуктами и их получением, были предприняты попытки экспрессировать рекомбинантный AAT. Впрочем, после работы над этим в течение 20 лет, специалистам удалось создать ряд терапевтически ценных рекомбинантных AAT, которые уже должны поступить в продажу (Kamaukhova et al. 2006, Amino Acids 30:317). Подобно продуктам, выделенным из плазмы, рекомбинантные варианты AAT страдают теми недостатками, что они имеют короткое время полужизни в сыворотке, низкий выход продукта и плохое распределение в легких.
Слитые белки согласно изобретению обладают улучшенными функциональными свойствами по сравнению с немодифицированной молекулой AAT. Присоединение полипептида AAT ко второму полипептиду, который взаимодействует с Fc-рецептором новорожденных (FcRn), приводит к увеличению времени полужизни в сыворотке, что обеспечивает потребность пациентов во введении высоких доз. Такими взаимодействующими с FcRn полипептидами слитого белка являются Fc-полипептиды иммуноглобулина (Ig), полученные из человеческих IgG1, IgG2, IgG3, IgG4 или IgM, и производные человеческого альбумина. В некоторых вариантах изобретения, в AAT-часть слитого белка вводят мутации, которые делают эту молекулу более резистентной к инактивации окислением. Так, например мутации Met351Glu, Met358Leu (AAT-EL-Fc) продемонстрировали резистентность к инактивации под действием Η2О2-окисления (фиг. 1G). Хотя AAT представляет собой природный противовоспалительный белок, однако, в некоторых своих вариантах настоящее изобретение относится к повышению способности ослаблять воспаление посредством присоединения полипептида AAT к направленному на цитокин полипептиду. Присоединение двух противовоспалительных функциональных групп, полученных из AAT и второго полипептида, дает возможность получить более эффективный терапевтический белок, чем любой полипептид, взятый отдельно. Кроме того, присоединение AAT, обладающего противоинфекционной активностью, будет снижать риск возникновения инфекции после введения большинства цитокин-содержащих биологических средств. В некоторых своих вариантах, настоящее изобретение относится к более активным противовоспалительным и противоинфекционным белкам, полученным путем присоединения полипептида AAT к полипептиду, содержащему домен WAP. Как и ожидалось, слитые белки согласно изобретению обладают высокой терапевтической ценностью и являются гораздо более эффективными, чем современные сывороточные продукты AAT.
Для увеличения времени полужизни рекомбинантного ААТ была применена техника рекомбинантных ДНК в целях создания гибрида гена AAT с Fc-доменом человеческого IgG1, IgG2, IgG3, IgG4, IgM, или HSA, так, чтобы предполагаемый белковый продукт представлял собой AAT, за которым расположен Fc-домен ((AAT-Fc (IgG1), AAT-Fc (IgG2), AAT-Fc (IgG3), AAT-Fc (IgG4), AAT-Fc (IgM)), или AAT, за которым расположен HSA. Хотя известно, что присоединение Fc-доменов или HSA к некоторым белкам, белковым доменам или пептидам может приводить к увеличению их времени полужизни (см., например, Jazayeri et al., BioDrugs 22, 11-26, Huang et al. (2009) Curr. Opin. Biotechnol. 20, 692-699, Kontermann et al. (2009) BioDrugs 23, 93-109, Schmidt et al. (2009) Curr. Opin. Drug Discov. Devel. 12, 284-295), однако, неизвестно, может ли присоединение Fc-домена или HSA к AAT способствовать «правильной» укладке и сохранению активности, направленной на ингибирование NE, или увеличению времени полужизни рекомбинантного AAT. Было показано, что слитые белки согласно изобретению являются сильными ингибиторами NE и имеют увеличенное время полужизни в сыворотке, а в некоторых вариантах изобретения, они обладают резистентностью к окислению. В других вариантах изобретения описанные здесь слитые белки приобретают уникальные свойства при введении других функциональных полипептидов, включая направленные на цитокин полипептиды и полипептиды, содержащие домен WAP.
Описанные здесь слитые белки включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, полученную из серпина, и второй полипептид. В некоторых своих вариантах настоящее изобретение относится, например, к серпиновому полипептиду, присоединенному к человеческим IgG1-Fc, IgG2-Fc, IgG3-Fc, IgG4-Fc, IgM-Fc или к производным HSA. Было высказано предположение, что описанный здесь серпиновый гибрид может быть использован для лечения различных заболеваний, включая, например, но не ограничиваясь ими, заболевание, ассоциированное с дефицитом альфа-1-антитрипсина (AAT), эмфизему, хроническую обструктивную болезнь легких (ХОБЛ), острый респираторный дистресс-синдром (ОРДС), аллергическую астму, кистозный фиброз, рак легких, ишемическое реперфузионное повреждение, включая, например, ишемическое/реперфузионное повреждение после трансплантации сердца; инфаркт миокарда, ревматоидный артрит, септический артрит, псориатический артрит, анкилозирующий спондилит, болезнь Крона, псориаз, диабет типа I и/или типа II, бактериальные инфекции, грибковые инфекции, вирусные инфекции, пневмонию, сепсис, реакцию «трансплантат против хозяина» (GVHD), заболевание, связанное с заживлением ран, системную красную волчанку и рассеянный склероз.
В некоторых вариантах изобретения, описанные здесь слитые белки включают по меньшей мере полипептид альфа-1-антитрипсина (AAT) или аминокислотную последовательность, полученную из ААТ, и второй полипептид. Так, например, настоящее изобретение относится к альфа-1-антитрипсину (AAT), присоединенному к человеческим IgG1-Fc, IgG2-Fc, IgG3-Fc, IgG4-Fc, IgM-Fc или к производным HSA.
В некоторых вариантах изобретения, описанные здесь слитые белки включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, полученную из серпинового полипептида, и направленный на цитокин полипептид или аминокислотную последовательность, полученную из направленного на цитокин полипептида. Так, например, настоящее изобретение относится к серпиновому полипептиду или к последовательности, полученной из серпинового полипептида, присоединенного к человеческому цитокиновому рецептору или к его производному. В другом своем варианте, настоящее изобретение относится к серпиновому полипептиду или к последовательности, полученной из серпинового полипептида, присоединенного к цитокин-связывающему антителу, например, к антителу против цитокинов, или к последовательности, полученной из цитокин-специфического антитела, например, антитела против цитокинов, или к последовательности, полученной из фрагмента цитокин-специфического антитела, например, фрагмента антитела против цитокинов. Так, например, настоящее изобретение относится к серпиновому полипептиду или к последовательности, полученной из серпинового полипептида, присоединенного к направленному на цитокин полипептиду, где указанный направленный на цитокин полипептид связывается с любым из нижеследующих человеческих цитокинов, таких как TNFα, IgE, IL-12, IL-23, IL-6, IL-1α, IL-1β, IL-17, IL-13, IL-4, IL-10, IL-2, IL-18, IL-27 или IL-32.
Так, например, в некоторых вариантах изобретения, направленный на цитокин полипептид связывается с TNFα и представляет собой любой из нижеследующих направленных на TNFα полипептидов или последовательностей, полученных из нижеследующих направленных на TNFα полипептидов: Remicade®, Humira®, Simponi®, Cimiza®, Enbrel® или ATN-103 и ATN-192.
Так, например, в некоторых вариантах изобретения, направленный на цитокин полипептид связывается с IgE и представляет собой любой из нижеследующих направленных на IgE полипептидов или последовательностей, полученных из нижеследующих направленных на IgE полипептидов: Xolair или FcsRI.
Так, например, в некоторых вариантах изобретения, направленный на цитокин полипептид связывается с общей субъединицей p40 IL-12 и IL-23 и представляет собой полипептид Stelara® или последовательности, полученные из полипептида Stelara®.
Так, например, Stelara®, то есть, направленный на цитокин полипептид связывается с IL-13 и включает полипептид CDP7766 или последовательности, полученные из полипептида CDP7766.
В некоторых вариантах изобретения, описанные здесь слитые белки включают по меньшей мере полипептид альфа-1-антитрипсина (AAT) или аминокислотную последовательность, полученную из ААТ, и направленный на цитокин полипептид или аминокислотную последовательность, полученную из направленного на цитокин полипептида. Так, например, настоящее изобретение относится к ингибитору альфа-1-антитрипсина (AAT), присоединенному к направленному на цитокин полипептиду, где указанный направленный на цитокин полипептид связывается с любым из нижеследующих человеческих цитокинов: TNFα, IgE, IL-6, IL-1α, IL-1β, IL-12, IL-17, IL-13, IL-23, IL-4, IL-10, IL-2, IL-18, IL-27 или IL-32.
В некоторых вариантах изобретения, направленный на цитокин полипептид связывается с цитокиновым рецептором и предупреждает связывание цитокина. Так, например, настоящее изобретение включает серпин, присоединенный к антителу против цитокинового рецептора. Так, например, настоящее изобретение относится к ингибитору альфа-1-антитрипсина (AAT), присоединенному к направленному на цитокин полипептиду, где указанный направленный на цитокин полипептид связывается с рецептором любого из нижеследующих человеческих цитокинов, таких как: TNFα, IgE, IL-6, IL-1α, IL-1β, IL-12, IL-17, IL-13, IL-23, субъединица p40 IL-12 и IL-23, IL-4, IL-10, IL-2, IL-18, IL-27 или IL-32.
Так, например, в некоторых вариантах изобретения, направленный на цитокин полипептид связывается с рецептором IL-6 и включает полипептид Actemra® (описанный в публикации патента EP0628639) или полипептид ALX-0061 (описанный в WO2010/115998), или последовательности, полученные из полипептида Actemra® или полипептида ALX-0061.
Так, например, Actemra®, то есть, направленный на цитокин полипептид связывается с рецептором IL-6 и включает полипептид тоцилизумаб или последовательности, полученные из полипептида тоцилизумаба.
Конъюгирование воспалительных цитокинов и иммуностимулирующих агентов, опосредуемое терапевтическими белками, продемонстрировало клиническую эффективность этих белков в лечении множества воспалительных состояний. Наиболее распространенными белками, используемыми в качестве направленных на цитокин агентов, являются растворимые цитокиновые рецепторы и моноклональные антитела и их фрагменты. Существенным недостатком технологии конъюгирования с цитокинами является повышенный риск инфицирования пациентов, как было продемонстрировано в случае использования TNFα-содержащих биологических средств, таких как Remicade®, Humira®, Simponi®, Cimiza® и Enbrel®, и p40 IL-12/23-связывающего антитела, Stelara®. Такой недостаток, очевидно, является общей проблемой, возникающей при конъюгировании лекарственных средств с воспалительными цитокинами, которое приводит к подавлению иммунной системы пациентов. AAT и другие серпиновые белки представляют определенный интерес, поскольку они обладают проивоинфекционной и противовоспалительной активностью. Таким образом, слитые белки серпин - направленный на цитокин полипептид согласно изобретению могут устранять нарушение цитокиновой активности и снижать риск возникновения инфекции.
В некоторых вариантах изобретения, описанные здесь слитые белки включают серпиновый полипептид или аминокислотную последовательность, полученную из серпина; полипептид, содержащий домен WAP или аминокислотную последовательность, полученную из полипептида, содержащего домен WAP; и Fc-полипептид или аминокислотную последовательность, полученную из Fc-полипептида. Так, например, настоящее изобретение относится к серпиновому полипептиду, к полипептиду, содержащему домен WAP и к производным человеческих IgG1-Fc, IgG2-Fc, IgG3-Fc, IgG4-Fc или IgM-Fc, функционально присоединенных друг к другу в любой функциональной комбинации. В некоторых вариантах изобретения, белок, содержащий домен WAP, представляет собой человеческий SLPI или получен из человеческого SLPI. В других вариантах изобретения, белок, содержащий домен WAP, представляет собой человеческий элафин или получен из человеческого элафина. В некоторых вариантах изобретения, описанные здесь слитые белки включают по меньшей мере полипептид альфа-1-антитрипсина (AAT) или аминокислотную последовательность, полученную из ААТ, и полипептид SLPI или аминокислотную последовательность, полученную из SLPI. В некоторых вариантах изобретения, описанные здесь слитые белки включают по меньшей мере полипептид AAT или аминокислотную последовательность, полученную из AAT, и полипептид элафина или аминокислотную последовательность, полученную из элафина.
SPLI и элафин представляют собой белки, содержащие домен WAP, которые обладают активностью, направленной на ингибирование сериновой протеазы. Оба этих белка обладают противовоспалительной функцией. Кроме того, эти белки обладают противоинфекционной активностью широкого ряда, направленной против множества штаммов бактерий, вирусов и грибов.
В некоторых вариантах изобретения, описанные здесь слитые белки включают по меньшей мере серпиновый полипептид или аминокислотную последовательность, полученную из серпина, и полипептид альбумина человеческой сыворотки (HSA) или аминокислотную последовательность, полученную из полипептида HSA. Другие варианты изобретения включают слитые белки серпин - альбумин-связывающий полипептид, где указанный альбумин-связывающий полипептид ответственен за ассоциацию серпина и HSA. Таким образом, настоящее изобретение относится к ковалентному и нековалентному связыванию серпинового полипептида и полипептида HSA, или последовательностей, полученных из серпинового полипептида или полипептида HSA. Так, например, настоящее изобретение относится к серпиновому полипептиду, связанному с человеческим HSA или с производными HSA, или к пептидам или полипептидам, связывающимся с HSA.
В некоторых вариантах изобретения, описанные здесь слитые белки включают по меньшей мере полипептид альфа-1-антитрипсина (AAT) или аминокислотную последовательность, полученную из ААТ, и полипептид HSА или аминокислотную последовательность, полученную из полипептида HSА. Так, например, настоящее изобретение относится к альфа-1-антитрипсину (AAT), связанному с HSА или с фрагментом, полученным из HSА, или с альбумин-связывающим полипептидом.
В некоторых вариантах изобретения, описанные здесь слитые белки включают серпиновый полипептид или аминокислотную последовательность, полученную из серпина; полипептид HSА или аминокислотную последовательность, полученную из полипептида HSA и полипептид, содержащий домен WAP, или аминокислотную последовательность, полученную из полипептида, содержащего домен WAP. В некоторых вариантах изобретения, описанные здесь слитые белки включают по меньшей мере полипептид альфа-1-антитрипсина (AAT) или аминокислотную последовательность, полученную из ААТ, полипептид HSА или аминокислотную последовательность, полученную из полипептида HSА, и полипептид SLPI или аминокислотную последовательность, полученную из SLPI. В других вариантах изобретения, описанные здесь слитые белки включают по меньшей мере полипептид альфа-1-антитрипсина (AAT) или аминокислотную последовательность, полученную из ААТ, полипептид HSА или аминокислотную последовательность, полученную из полипептида HSА, и полипептид элафина или аминокислотную последовательность, полученную из элафина.
Слитые белки согласно изобретению могут быть легко продуцированы в клеточных экспрессионных системах млекопитающих. Так, например, для экспрессии описанных здесь серпиновых слитых белков могут быть с успехом использованы клетки яичника китайского хомячка (CHO), клетки почек человеческого эмбриона (HEK) 293, клетки COS, PER.C6®, клетки NS0, SP2/0, YB2/0. Важно отметить, что клеточные экспрессионные системы млекопитающих продуцируют белки, которые, в основном, являются более оптимальными для их применения в терапии. В отличие от экспрессионных систем бактерий, насекомых или дрожжей, клеточные экспрессионные системы млекопитающих продуцируют белки, которые имеют характер гликозилирования, аналогичный характеру гликозилирования природных человеческих белков или такой же характер гликозилирования. Характер гликозилирования белка может существенно влиять на стабильность в сыворотке, фармакокинетику, биологическое распределение, укладку белка и функциональные свойства. Поэтому, важным преимуществом в этих экспрессионных системах млекопитающих, в отличие от других систем, является их способность продуцировать терапевтические белки. Кроме того, большинство клеточных экспрессионных систем млекопитающих (например, клеток CHO, NS0, PER.C6®) могут быть легко получены промышленным способом в целях продуцирования терапевтических белков, удовлетворяющих клиническим требованиям. Описанные здесь слитые белки обладают улучшенными функциональными свойствами по сравнению с природной формой AAT, и могут быть продуцированы в экспрессионных системах млекопитающих в клинических и коммерческих целях. Некоторые варианты изобретения включают систему очистки, позволяющую выделять серпиновые слитые белки, сохраняющие свою способность ингибировать NE. Важно отметить, что способ очистки согласно изобретению может быть с успехом включен в современные производственные процессы, проводимые на основе коммерчески доступных клеток млекопитающих.
Если это не оговорено особо, научные и технические термины, используемые в настоящем изобретении, имеют общепринятые значения, понятные среднему специалисту в данной области. Кроме того, если это не следует из контекста описания изобретения, то при употреблении терминов в единственном числе подразумевается, что эти термины также относятся к указанным объектам во множественном числе, и наоборот. Вообще говоря, номенклатура, используемая здесь в описании методов культивирования клеток и тканей, методов молекулярной биологии и химии белков и олиго- или полинуклеотидов, а также методов гибридизации, хорошо известна и широко применяется специалистами. В технологии рекомбинантных ДНК, в синтезе олигонуклеотидов, в культивировании тканей и в трансформации (например, электропорации и липофекции) применяются стандартные методы. Ферментативные реакции и методы очистки осуществляют в соответствии с рекомендациями производителей или известными методами, а также методами, описанными в настоящей заявке. Вышеупомянутые методы и процедуры обычно осуществляют стандартными способами, хорошо известными специалистам и описанными в различных общих и специальных руководствах, цитируемых и обсуждаемых в описании настоящей заявки. См., например, Sambrook et al. Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)). Номенклатура, используемая здесь в описании лабораторных методов и методов, применяемых в аналитической химии, химии органического синтеза и в медицинской и фармацевтической химии, хорошо известна и широко применяется специалистами. Химический синтез, химические анализы, приготовление фармацевтических препаратов, составление рецептур, а также введение препаратов пациентам и лечение пациентов осуществляют стандартными методами. Термин «пациент» включает человека и животных.
Следует отметить, что введение терапевтических молекул в соответствии с настоящим изобретением может быть осуществлено в комбинации с подходящими носителями, буферами, наполнителями и другими агентами, которые вводят в препараты в целях улучшения транспорта, доставки, переносимости препаратов и т.п. Многие способы приготовления фармацевтических препаратов можно найти в соответствующих руководствах, известных всем химикам-фармацевтам, таких как руководство Remington's Pharmaceutical Sciences (15th ed, Mack Publishing Company, Easton, PA (1975)), в частности, см. главу 87, Blaug, Seymour. Такими препаратами являются, например, порошки, пасты, мази, гели, воски, масла, липиды, везикулы, содержащие липиды (катионные или анионные) (такие как Липофектин™), ДНК-конъюгаты, безводные абсорбирующие пасты, эмульсии типа «масло в воде» и «вода в масле», эмульсии, содержащие карбовакс (полиэтиленгликоли с различными молекулярными массами), полутвердые гели и полутвердые смеси, содержащие карбовакс. Любые из вышеперечисленных смесей могут быть использованы для лечения и терапии в соответствии с настоящим изобретением, при условии, что активный ингредиент, присутствующий в таком препарате, не был инактивирован, и что такой препарат является физиологически совместимым и хорошо переносится при соответствующем способе введения. См., также Baldrick P. «Pharmaceutical excipient development: the need for preclinical guidance» Regul. Toxicol Pharmacol. 32(2):210-8 (2000), Wang W. «Lyophilization and development of solid protein pharmaceuticals». Int. J. Pharm. 203(1-2): 1-60 (2000), Charman WN «Lipids, lipophilic drugs, and oral drug delivery-some emerging concepts» J. Pharm. Sci. 89(8):967-78 (2000), Powell et al. «Compendium of excipients for parenteral formulations» PDA J. Pharm. Sci. Technol. 52:238-311 (1998) и цитируемые там работы, включенные для получения дополнительной информации, относящейся к препаратам, наполнителям и носителям, хорошо известным химикам-фармацевтам.
Терапевтические препараты согласно изобретению, включающие слитый белок согласно изобретению, могут быть использованы для устранения или ослабления симптомов заболевания или расстройства, ассоциированного с нарушением активности сериновой протеазы у индивидуума. Настоящее изобретение также относится к способам устранения или ослабления симптомов заболевания или расстройства, ассоциированного с нарушением активности сериновой протеазы у индивидуума. Схема терапии включает выявление индивидуума, например, человека, страдающего заболеванием или расстройством (или подверженного риску развития заболевания или расстройства), ассоциированным с нарушением активности сериновой протеазы, где такое выявление осуществляют стандартными методами, включая проведение любых различных клинических и/или лабораторных процедур. Термин «пациент» включает человека и животных. Термин «индивидуум» включает человека и других млекопитающих.
Эффективность лечения определяют любым известным методом диагностики или терапии конкретного заболевания или расстройства, ассоциированного с нарушением активности сериновой протеазы. Ослабление одного или более симптомов заболевания или расстройства, ассоциированного с нарушением активности сериновой протеазы, означает, что указанный слитый белок дает нужный клинический эффект.
Методами скрининга слитых белков, обладающих нужной специфичностью, являются, но не ограничиваются ими, твердофазный иммуноферментный анализ (ELISA), ферментативные анализы, проточная цитометрия и другие иммунологически опосредуемые методы, известные специалистам.
Описанные здесь слитые белки могут быть использованы в известных методах, относящихся к определению локализации и/или количества мишени, такой как сериновая протеаза, например, в целях измерения уровней этих мишеней в соответствующих физиологических образцах; в целях диагностики, визуализации белка и т.п. Используемые здесь термины «физиологический образец» и «биологический образец» являются синонимами и включают ткани, клетки и биологические жидкости, выделенные у индивидуума, а также ткани, клетки и жидкости, присутствующие у индивидуума. Поэтому, в определении терминов «физиологический образец» и «биологический образец» входят кровь и фракция или компонент крови, включая сыворотку крови, плазму крови или лимфу.
В данном варианте изобретения, слитые белки, специфичные к данной мишени, или производные, фрагменты, аналоги или гомологи таких белков, содержащие мишень-связывающий домен, используются в качестве фармакологически активных соединений (далее называемых «терапевтическими средствами»).
Слитый белок согласно изобретению может быть использован для выделения конкретной мишени стандартными методами, такими как иммуноафинный метод, хроматография или иммунопреципитация. Детектирование может быть облегчено путем связывания (то есть, физического присоединения) слитого белка с детектируемым веществом. Примерами детектируемых веществ являются различные ферменты, простетические группы, флуоресцентные вещества, люминесцентные вещества, биолюминесцентные вещества и радиоактивные вещества. Примерами подходящих ферментов являются пероксидаза хрена, щелочная фосфатаза, β-галактозидаза или ацетилхолинэстераза; примерами подходящих комплексов простетических групп являются стрепатавидин/биотин и авидин/биотин; примерами подходящих флуоресцентных веществ являются умбеллиферон, флуоресцеин, флуоресцеинизотиоцианат, родамин, дихлортриазиниламин-флуоресцеин, данзилхлорид или фикоэритрин; примером люминесцентного вещества является люминол; примерами биолюминесцентных веществ являются люцифераза, люциферин и экворин, а примерами подходящих радиоактивных веществ являются 125I, 131I, 35S или 3Н.
Терапевтически эффективное количество слитого белка согласно изобретению обычно означает количество, необходимое для достижения терапевтического эффекта. Как указывалось выше, такой целью может быть связывание слитого белка с его мишенью, которое, в некоторых случаях, влияет на функционирование этой мишени. Количество, необходимое для введения, также зависит от аффинности специфического связывания слитого белка с его мишенью, а также от скорости, с которой вводимый слитый белок свободно переходит из одного участка в другой участок организма индивидуума, которому он был введен. Общие интервалы терапевтически эффективных доз слитого белка или его фрагмента могут составлять, но не ограничиваются ими, например, приблизительно от 0,1 мг/кг массы тела до 250 мг/кг массы тела. Общая частота введения доз может составлять, например, в пределах от двух раз в день до одного раза в месяц.
При использовании фрагментов слитого белка предпочтительным является наименьший ингибирующий фрагмент, который специфически связывается с мишенью. Так, например, пептидные молекулы могут быть сконструированы так, чтобы они сохраняли способность связываться с мишенью. Такие пептиды могут быть получены методом химического синтеза и/или методами рекомбинантных ДНК (см., например, Marasco et al, Proc. Natl. Acad. Sci. USA, 90: 7889-7893 (1993)). Препарат может также содержать более, чем одно активное соединение, необходимое для лечения конкретного заболевания, предпочтительно, соединения со взаимодополняющими активностями, которые не оказывают негативного воздействия друг на друга. Альтернативно или дополнительно, композиция может содержать агент, который усиливает ее функцию, такой как, например, цитотоксический агент, цитокин, химиотерапевтический агент, рост-ингибирующий агент, противовоспалительный агент или противоинфекционный агент. Такие молекулы могут присутствовать в комбинации в количествах, которые являются эффективными для достижения нужной цели.
Активные ингредиенты могут быть также заключены в микрокапсулы, полученные, например, методами коацервации или межфазной полимеризации, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и в полиметилметакрилатные микрокапсулы, соответственно, в коллоидные системы доставки лекарственных средств (например, в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии.
Препараты, используемые для введения in vivo, должны быть стерильными. Это может быть легко достигнуто путем фильтрации через стерильные фильтрующие мембраны.
Могут быть получены препараты пролонгированного высвобождения. Подходящими примерами препаратов прологнированного высвобождения являются полупроницаемые матрицы, состоящие из твердых гидрофобных полимеров, содержащих слитый белок, где указанные матрицы получают в виде сформованных изделий, например, пленок или микрокапсул. Примерами матриц прологнированного высвобождения являются сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтил-метакрилат) или поливиниловый спирт, полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамат, неразлагаемый этиленвинилацетат, разлагаемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты, и ацетата лейпролида) и поли-D-(-)-3-гидроксимасляная кислота. Полимеры, такие как этиленвинилацетат и сополимер молочной кислоты и гликолевой кислоты высвобождают молекулы более, чем за 100 дней, а некоторые гидрогели высвобождают белки за более короткие промежутки времени.
Фармацевтические композиции
Слитые белки согласно изобретению (также называемые здесь «активными соединениями») и их производные, фрагменты, аналоги и гомологи могут быть включены в фармацевтические композиции, подходящие для введения. Такие композиции обычно содержат слитый белок и фармацевтически приемлемый носитель. Используемый здесь термин «фармацевтически приемлемый носитель» включает любые и все растворители, дисперсионные среды, материалы для покрытий, антибактериальные и противогрибковые агенты; агенты, придающие изотоничность, агенты, замедляющие абсорбцию и т.п., совместимые со способом введения фармацевтической композиции. Подходящие носители описаны в самом последнем издании классического руководства Remington's Pharmaceutical Sciences, в соответствующем разделе, который вводится в настоящее описание посредством ссылки. Предпочтительными примерами таких носителей или разбавителей являются, но не ограничиваются ими, вода, физиологический раствор, растворы Рингера, раствор декстрозы и 5% альбумин человеческой сыворотки. При этом, могут быть также использованы липосомы и безводные носители, такие как жирные масла. Применение таких сред и агентов для введения фармацевтически активных веществ хорошо известно специалистам. В описанных здесь композициях могут быть использованы любые стандартные среды или агенты, при условии, что они будут совместимыми с активным соединением. В эти композиции могут быть также включены дополнительные активные соединения.
Фармацевтическую композицию согласно изобретению приготавливают так, чтобы она была совместима с нужным способом введения. Примерами таких способов введения являются парентеральное введение, например, внутривенное введение, интрадермальное введение, подкожное введение, пероральное введение (например, введение путем ингаляции), чрескожное введение (то есть, местное введение), введение через слизистую и ректальное введение. Растворы или суспензии для парентерального, интрадермального или подкожного введения могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физиологический раствор, жирные масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатообразующие агенты, такие как этилендиаминтетрауксусная кислота (EDTA); буферы, такие как ацетаты, цитраты или фосфаты; и агенты, придающие тоничность, такие как хлорид натрия или декстроза. pH может быть скорректирован путем добавления кислот или оснований, таких как соляная кислота или гидроксид натрия. Препарат для парентерального введения может быть заключен в ампулы, одноразовые шприцы или сосуды для введения дробных доз, изготовленные из стекла или пластика.
Фармацевтическими композициями, подходящими для инъекций, являются стерильные водные растворы (то есть, водорастворимые композиции) или дисперсии и стерильные порошки для немедленного приготовления препаратов в виде стерильных инъецируемых растворов или дисперсий. Для внутривенного введения, подходящими носителями являются физиологический раствор, бактериостатическая вода, Cremophor EL™ (BASF, Parsippany, N.J.) или забуференный фосфатом физиологический раствор (PBS). Во всех случаях, такая композиция должна быть стерильной и должна обладать текучестью, достаточной для легкого наполнения шприца. Эта композиция должна быть стабильной в условиях ее изготовления и хранения, а также должна быть защищена от контаминирующего действия микроорганизмов, таких как бактерии и грибы. Таким носителем может быть растворитель или дисперсионная среда, содержащая, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п.) и их подходящие смеси. Нужная текучесть может поддерживаться, например, с использованием вещества для покрытия, такого как лецитин, благодаря сохранению нужного размера частиц, в случае дисперсии, и с использованием поверхностно-активных веществ. Предупреждение воздействия микроорганизмов может быть достигнуто с использованием различных антибактериальных и противогрибковых агентов, таких как, например, парабены, хлорбутанол, фенол, аскорбиновая кислота, тимерозал и т.п. Во многих случаях может оказаться предпочтительным включение в композицию агентов, придающих изотоничность, таких как, например, сахара, многоатомные спирты, такие как маннит и сорбит, и хлорид натрия. Пролонгированное всасывание инъецируемых композиций может быть достигнуто путем включения в композицию агента, замедляющего всасывание, например, моностеарата алюминия и желатина.
Стерильные растворы для инъекций могут быть приготовлены путем включения активного соединения в необходимом количестве в соответствующем растворителе или в комбинации, если это необходимо, с ингредиентами, перечисленными выше, и последующей стерилизации на фильтре. Дисперсии обычно приготавливают путем включения активного соединения в стерильный наполнитель, который содержит основную дисперсионную среду и необходимые другие ингредиенты, перечисленные выше. Методы получения стерильных порошков в целях приготовления стерильных растворов для инъекций включают вакуумную сушку и лиофилизацию с получением порошка, содержащего активный ингредиент и любой дополнительный нужный ингредиент, полученный из предварительно отфильтрованного стерильного раствора.
Композиции для перорального введения обычно включают инертный разбавитель или пищевой носитель. Эти композиции могут быть заключены в желатиновые капсулы или спрессованы в таблетки. Активное соединение, предназначенное для терапевтического перорального введения, может быть введено вместе с наполнителем и приготовлено в форме таблеток, пастилок или капсул. Композиции для перорального введения могут быть также приготовлены с использованием жидкого носителя, применяемого как жидкость для полоскания рта, где указанное соединение в жидком носителе приготавливают в виде препарата для перорального введения, в виде препарата для полоскания, в виде отхаркивающего средства или в виде препарата для проглатывания. Фармацевтически совместимые связывающие агенты и/или адъюванты могут быть включены как часть композиции. Таблетки, драже, капсулы, пастилки и т.п. могут содержать любой из нижеследующих ингредиентов или любые соединения аналогичной природы, а именно: связывающее вещество, такое как микрокристаллическая целлюлоза; трагакантовая камедь или желатин; наполнитель, такой как крахмал или лактоза; дезинтегрирующий агент, такой как альгиновая кислота, примогель или кукурузный крахмал; замасливатель, такой как стеарат магния или Sterotes; вещество, повышающее скольжение, такое как коллоидная двуокись кремния; подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как перечная мята, метилсалицилат или апельсиновая отдушка.
Соединения, вводимые путем ингаляции, доставляют в форме аэрозольного спрея из контейнера под давлением или дозирующего устройства, содержащего подходящий пропеллент, например, газ, такой как диоксид углерода, или из аэрозольного распылителя.
Системное введение может также представлять собой введение через слизистую или чрескожное введение. В препаратах для введения через слизистую или чрескожного введения используются подходящие пенетранты, проникающие через барьер. Пенетранты, применяемые для введения через слизистую, по существу известны специалистам, и ими являются, например, детергенты, соли желчных кислот и производные фузидиновой кислоты. Введение через слизистую может быть осуществлено с помощью интраназальных спреев или суппозиториев. Для трансдермального введения, активные соединения приготавливают в виде твердых мазей, жидких мазей, гелей или кремов, по существу, известных специалистам.
Соединения могут быть также получены в форме суппозиториев (например, содержащих стандартные основы для суппозиториев, такие как масло какао и другие глицериды) или удерживающих клизм для ректального введения.
В одном из вариантов изобретения, активные соединения приготавливают вместе с носителями, которые защищают соединение от его быстрого выведения из организма, в результате чего получают препараты пролонгированного высвобождения, включая имплантаты и микроинкапсулированные системы доставки. При этом, могут быть использованы биологически разлагаемые и биологически совместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Методы получения таких препаратов известны специалистам. Материалы могут быть также получены у таких компаний, как Alza Corporation и Nova Pharmaceuticals, Inc. Липосомные суспензии могут быть также использованы в виде фармацевтически приемлемых носителей. Эти суспензии могут быть получены методами, известными специалистам, например, методами, описанными в патенте США № 4522811.
Для простоты введения и равномерного распределения доз, особенно предпочтительно, чтобы композиции для перорального или парентерального введения были приготовлены в виде унифицированной лекарственной формы. Используемый здесь термин «унифицированная лекарственная форма» означает физически дискретные формы, подходящие для их введения индивидууму в виде унифицированных доз, где каждую унифицированную дозу, содержащую предварительно определенное количество активного соединения в комбинации с необходимым фармацевтическим носителем вычисляют так, чтобы такая доза давала нужный терапевтический эффект. Спецификация для унифицированных лекарственных форм согласно изобретению может быть составлена исходя из нижеследующих факторов, и непосредственно зависит от этих факторов, а именно: уникальных свойств активного соединения и конкретного терапевтического эффекта, а также ограничений, известных специалистам в области составления рецептуры лекарственных средств, таких как активное соединение для лечения индивидуума.
Фармацевтические композиции могут быть включены в контейнер, упаковку или дозирующее устройство, содержащие инструкции по введению таких фармацевтических композиций.
Настоящее изобретение подробно описано в нижеследующих примерах, которые не должны рассматриваться как ограничение объема изобретения, сформулированного в формуле изобретения.
Примеры
Пример 1: Слитые белки AAT-Fc и их варианты
Неограничивающими репрезентативными примерами слитых белков AAT-Fc согласно изобретению являются нижеследующие последовательности. Хотя эти примеры включают конкретную шарнирную последовательность и/или линкерную последовательность, однако, слитые белки согласно изобретению могут быть получены с использованием любой шарнирной последовательности и/или линкерной последовательности, которые имеют подходящую длину и/или гибкость. Альтернативно, слитые белки могут быть получены без использования шарнирной последовательности и/или линкерной последовательности. Так, например, полипептидные компоненты могут быть непосредственно присоединены друг к другу.
Репрезентативным слитым белком AAT-Fc является описанный здесь слитый белок AAT-hFc1 (Fc человеческого IgG1). Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 2), а полипептидная IgG-Fc-часть слитого белка показана курсивом (SEQ ID NO: 3).
AAT-hFc1 (Fc человеческого IgG1)

Репрезентативным примером слитого белка AAT-Fc является описанный здесь слитый белок AAT-hFc2 (Fc человеческого IgG2). Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 2), а полипептидная IgG-Fc-часть слитого белка показана курсивом (SEQ ID NO: 4).
AAT-hFc2 (Fc человеческого IgG2)




Репрезентативным слитым белком AAT-Fc является описанный здесь слитый белок AAT-MM-EL-hFc1 (Fc человеческого IgG1, Met351Glu/Met358Leu). Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 34), полипептидная IgG-Fc-часть слитого белка показана курсивом (SEQ ID NO: 3), мутация Met351Glu показана в рамке, а мутация Met358Leu показана серым.
AAT-MM-EL-hFcl (Fc человеческого IgG1, Met351Glu/Met358Leu)

Репрезентативным слитым белком AAT-Fc является описанный здесь слитый белок AAT-MM-EL-hFc2 (Fc человеческого IgG2, Met351Glu/Met358Leu). Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 34), полипептидная IgG-Fc-часть слитого белка показана курсивом (SEQ ID NO: 4), мутация Met351Glu показана в рамке, а мутация Met358Leu показана серым.
AAT-MM-EL-hFc2 (Fc человеческого IgG2, Met351Glu/Met358Leu)


Репрезентативным слитым белком AAT-Fc является описанный здесь слитый белок AAT-MM-LL-hFc1 (Fc человеческого IgG1, Met351Glu/Met358Leu). Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 35), полипептидная IgG-Fc-часть слитого белка показана курсивом (SEQ ID NO: 3), мутация Met351Leu показана черным, а мутация Met358Leu показана серым.
AAT-MM:LL-hFc1 (Fc человеческого IgG1, Met351Leu/Met358Leu)

Репрезентативным слитым белком AAT-Fc является описанный здесь слитый белок AAT-MM:LL-hFc2 (Fc человеческого IgG2, Met351Leu/Met358Leu). Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 35), полипептидная IgG-Fc-часть слитого белка показана курсивом (SEQ ID NO: 4), мутация Met351Leu показана черным, а мутация Met358Leu показана серым.
AAT-MM-LL-hFc2 (Fc человеческого IgG2, Met351Leu/Met358Leu)

Репрезентативным слитым белком AAT-Fc является описанный здесь слитый белок AAT-hFcl-AAT (человеческий IgG1). Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 2), а полипептидная IgG-Fc-часть слитого белка показана курсивом (SEQ ID NO: 3).
AAT-hFc1-AAT (человеческий IgG1)



Эти репрезентативныые слитые белки AAT-Fc были получены нижеследующими методами.
Ген, кодирующий человеческий AAT, был подвергнут ПЦР-амплификации из кДНК печени человека (Zyagen). Специфические точковые мутации в гене, кодирующем AAT или Fc-область, были введены с помощью ПЦР с перекрыванием. AAT-кодирующий ген клонировали в одной рамке считывания с геном, кодирующим шарнирную область, за которым следуют CH2-домен и CH3-домен человеческого IgG1, IgG2, IgG3, IgG4 или IgM, в экспрессионный вектор млекопитающего, содержащий секреторную сигнальную последовательность млекопитающего, расположенную выше сайта инсерции гена AAT. Эти экспрессионные векторы переносили в клетки млекопитающих (а в частности, в клетки HEK293 или CHO) и культивировали в течение нескольких дней в 8% CО2 при 37C. Рекомбинантные слитые белки AAT-Fc выделяли из супернатанта экспрессирующих клеток с помощью хроматографии на белке А. Важно отметить, что для элюирования слитого белка AAT-Fc со смолы, содержащей белок А, использовали буфер, имеющий почти нейтральный pH (элюирующий буфер Gentle Ag/Ab, Thermo Scientific). Слитый белок AAT-Fc не мог быть элюирован со смолы, содержащей белок А, стандартным методом элюирования при низком pH, поскольку, после обработки буфером с низким рН, способность AAT ингибировать NE снижается, что, вероятно, обусловлено олигомеризацией AAT, опосредуемой низким рН. На фиг. 1F проиллюстрировано влияние элюирования при низком pH на способность AAT ингибировать эластазу нейтрофилов. Слитый белок AAT-Fc может быть очищен либо на белке А, либо с использованием элюирующего буфера почти с нейтральным рН на матрице с аффинностью к альфа-1-антитрипсину CaptureSelect® (BAC BV).
Очищенные слитые белки AAT-Fc тестировали на активность путем определения их способности ингибировать эластазу нейтрофилов (NE). На фиг. 1B и 1D проиллюстрирован восстанавливающий ПААГ с ДСН, содержащий очищенные сывороточные АAT (sdAAT) и слитые белки AAT-Fc (фиг. 1В - дорожка 1: sdAAT, дорожка 2: AAT-Fc (SEQ ID NO: 16), дорожка 3: AAT-EL-Fc (SEQ ID NO: 18), фиг. 1D - AAT-Fc-AAT (SEQ ID NO: 20). Эти белки визуализировали путем окрашивания кумасси синим.
Для мониторинга эластазной активности человеческих нейтрофилов (NE) проводили анализ на флуоресцентном микропланшете. Ингибирующую активность определяли по последующему снижению остаточной активности NE с помощью нижеследующего анализа. Аналитический буфер состоял из 100 мМ триса, pH 7,4, 500 мМ NaCl и 0,0005% тритона X-100. Человеческую NE использовали в конечной концентрации 5 нМ (но может быть также использована концентрация 1-20 нМ). В данном анализе, флуоресцентный пептидный субстрат AAVP-AMC использовали в конечной концентрации 100 мкΜ. Считывание результатов анализа проводили на планшет-ридере Gemini EM компании Molecular Devices с такими кинетическими параметрами, как длины волн возбуждения и излучения 370 нм и 440 нм, соответственно, и отсечка на 420 нм. Результаты анализа считывали в течение 10 минут при комнатной температуре со сканированием каждые 5-10 секунд. Vmax в секунду соответствует остаточной NE-активности, по которой строили кривую зависимости для каждой концентрации ингибитора. Отрезок, отсекаемый на оси х, означает концентрацию ингибитора, необходимую для полной инактивации NE в исходной концентрации в данном анализе. В этих анализах, AAT человеческой сыворотки (sdAAT) использовали в качестве позитивного контроля. Слитые белки AAT-Fc обладали сильной активностью, направленной на ингибирование NE, как показано на фиг. 1C. Гибрид, в котором два полипептида AAT присоединены к одному Fc-полипептиду (AAT-Fc-AAT), обладает более высокой активностью по сравнению с sdAAT и слитым белком AAT-Fc, содержащим только один полипептид AAT (фиг. 1E). Представленные здесь и впервые полученные данные продемонстрировали, что AAT может быть присоединен к Fc-области и сохраняет способность ингибировать NE. Интересно отметить, что слитый белок AAT-Fc-AAT, как было обнаружено, является более сильным ингибитором NE.
На фиг. 1F продемонстрировано, что слитый белок AAT-EL-Fc (M35IE, M358L) обладает резистентностью к инактивации окислением. Слитые белки AAT, AAT-Fc (дикого типа), AAT-EL-Fc (M351E, M358L) и AAT-EM-Fc (M351E) обрабатывали 33 мМ H2О2 и сравнивали с необработанными слитыми белками в анализах на ингибирование NE. Уровень ингибирования NE слитым белком AAT-EL-Fc не снижался под действием окисления, в отличие от других тестируемых белков.
Кроме того, слитый белок AAT-Fc имел более длительное время полужизни в сыворотке крыс по сравнению с временем полужизни AAT в сыворотке (фиг. 1H). В этих исследованиях, 3 крысам на каждый тестируемый белок i.v. инъецировали 10 мг/кг sdAAT или AAT-Fc. Пробу сыворотки брали через различные промежутки времени в течение 48 часов. Концентрацию ATT в сыворотке определяли с помощью анализа ELISA. Полученные данные продемонстрировали, что слитые белки согласно изобретению, в отличие от сывороточного AAT, обладают улучшенными фармакокинетическими свойствами и превосходным форматом лечения многих воспалительных состояний и инфекционных заболеваний у человека.
Пример 2: направленные на AAT-TNFα молекулы слитых белков
В представленных здесь исследованиях описано несколько неограничивающих примеров рекомбинантных производных AAT, содержащих человеческий AAT, присоединенный к анти-TNFα антителу или к производному рецептора TNFα. Эти примеры приводятся ниже для дополнительной иллюстрации отличительных признаков настоящего изобретения. В этих примерах также проиллюстрирована методика осуществления настоящего изобретения. Эти примеры не должны рассматриваться как ограничение заявленного изобретения.
Описанные ниже слитые белки включают направленные на цитокин полипептидные последовательности, которые были получены или получают из (i) анти-TNFα антитела D2E7 (также известного как адалимумаб или Humira®) или (ii) внеклеточного домена рецептора TNFα типа 2 (TNFR2-ECD). Полипептидная AAT-часть слитого белка подчеркнута, константные области антитела (CH1-шарнирная область-CH2-CH3 или CL) даны курсивом, а D2E7-VH, D2E7-VK и TNFR2-ECD даны жирным шрифтом. Хотя эти примеры включают конкретную шарнирную последовательность и/или линкерную последовательность, однако, слитые белки согласно изобретению могут быть получены с использованием любой шарнирной последовательности и/или линкерной последовательности, которые имеют подходящую длину и/или гибкость. Альтернативно, слитые белки могут быть получены без использования шарнирной последовательности и/или линкерной последовательности.
Репрезентативным слитым белком AAT-TNFα является описанный здесь слитый белок «D2E7-легкая цепь-AAT-(G3S)2-линкер». Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 2), D2E7-VK показан жирным шрифтом (SEQ ID NO: 37), а константные области антитела показаны курсивом (SEQ ID NO: 38).
D2E7-легкая цепь-AAT-(G3S)2-линкер


Репрезентативным слитым белком AAT-TNFα является описанный здесь слитый белок «D2E7-легкая цепь-AAT-ASTGS-линкер». Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 2), D2E7-VK показан жирным шрифтом (SEQ ID NO: 37), а константные области антитела показаны курсивом (SEQ ID NO: 38).
D2E7-легкая цепь-AAT-ASTGS-линкер

Репрезентативным слитым белком AAT-TNFα является описанный здесь слитый белок «D2E7-тяжелая цепь-AAT-(G3S)2-линкер». Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 2), D2E7-VН показан жирным шрифтом (SEQ ID NO: 39), а константные области антитела показаны курсивом (SEQ ID NO: 40).
D2E7-тяжелая цепь-AAT-(G3S)2-линкер



Репрезентативным слитым белком AAT-TNFα является описанный здесь слитый белок «D2E7-тяжелая цепь-AAT-ASTGS-линкер». Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 2), D2E7-VН показан жирным шрифтом (SEQ ID NO: 39), а константные области антитела показаны курсивом (SEQ ID NO: 40).
D2E7-тяжелая цепь-AAT-ASTGS-линкер

Репрезентативным слитым белком AAT-TNFα является описанный здесь слитый белок «TNFR2-ECD-Fc1-AAT-(G3S)2-линкер». Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 2), TNFR2-ECD показан жирным шрифтом (SEQ ID NO: 41), а константные области антитела показаны курсивом (SEQ ID NO: 42).
TNFR2-ECD-Fcl-AAT-(G3S)2-линкер

Репрезентативным слитым белком AAT-TNFα является описанный здесь слитый белок «TNFR2-ECD-Fc1-AAT-ASTGS-линкер». Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 2), TNFR2-ECD показан жирным шрифтом (SEQ ID NO: 41), а константные области антитела показаны курсивом (SEQ ID NO: 42).
TNFR2-ECD-Fcl-AAT-ASTGS-линкер


Эти репрезентативные AAT-TNFα-конъюгирующие молекулы слитого белка были получены нижеследующими методами.
Гены, кодирующие вариабельные области тяжелой цепи (VH) и вариабельные области каппа (VK) анти-TNFα антитела D2E7, получали методом генного синтеза. Ген D2E7-VH клонировали в одной рамке считывания с геном, кодирующим константную область тяжелой цепи человеческого антитела IgG1, состоящей из CH1-домена, шарнирного домена, CH2-домена и СН3-домена, в экспрессионный вектор млекопитающих, содержащий секреторную сигнальную последовательность млекопитающего, расположенную выше сайта инсерции VH-домена (D2E7-HC). Ген D2E7-VK клонировали в одной рамке считывания с геном константного домена (CL) легкой цепи каппа человеческого антитела в экспрессионный вектор млекопитающих, содержащий секреторную сигнальную последовательность млекопитающего, расположенную выше сайта инсерции VК-домена (D2E7-LC). AAT-кодирующий ген и соседнюю 5'-линкерную последовательность клонировали в одной рамке считывания с 3'-концом кодирующих последовательностей либо гена CH3-домена тяжелой цепи D2E7 (D2E7-HC-AAT), либо гена CL-домена легкой цепи D2E7 (D2E7-LC-AAT) в вышеописанные экспрессионные векторы млекопитающих. Внеклеточный домен рецептора 2 TNFα (TNFR2-ECD) генерировали посредством генного синтеза и клонировали в одной рамке считывания с геном, кодирующим шарнирную область, за которой следует CH2-домен и CH3-домен человеческого IgG1 (hFc1), в экспрессионный вектор млекопитающих, содержащий секреторную сигнальную последовательность млекопитающего, расположенную выше сайта инсерции TNFR2-ECD. AAT-кодирующий ген и соседнюю 5'-линкерную последовательность клонировали в одной рамке считывания с 3'-концом гена, кодирующего TNFR2-ECD-hFc1, в экспрессионный вектор млекопитающих (TNFR2-ECD-hFc1-AAT).
Экспрессионный вектор D2E7-HC-AAT переносили вместе с экспрессионным вектором D2E7-LC или D2E7-LC-AAT в клетки млекопитающих (а в частности, в клетки HEK293 или CHO) для продуцирования антитела D2E7 с AAT, присоединенным к C-концу тяжелой цепи или к C-концу тяжелой цепи и легкой цепи, соответственно. D2E7-LC-AAT переносили вместе с экспрессионным вектором D2E7-HC в клетки млекопитающих для продуцирования антитела D2E7 с AAT, присоединенным к C-концу легкой цепи. Экспрессионный вектор TNFR2-hFcl-AAT переносили в клетки млекопитающих. Трансфицированные клетки культивировали в течение нескольких дней в 8% CО2 при 37C.
Рекомбинантные слитые белки-конъюгаты АAT-TNFα, выделяли из супернатанта экспрессирующих клеток с помощью хроматографии на белке A. Для элюирования слитых белков-конъюгатов ААТ-TNFα из смолы, содержащей белок А, использовали буфер, имеющий почти нейтральный pH (элюирующий буфер Gentle Ag/Ab, Thermo Scientific).
На фиг. 2B показан ПААГ-ДСН-гель, содержащий одно антитело D2E7 (дорожка 1) и вариант, где AAT присоединен к тяжелой цепи D2E7 (дорожка 2). Белки визуализировали путем окрашивания кумасси синим.
Очищенные молекулы слитых белков-конъюгатов AAT-TNFα тестировали на активность путем определения их способности ингибировать эластазу нейтрофилов. В этих анализах, AAT человеческой сыворотки (sdAAT) использовали в качестве позитивного контроля. Анализы на ингибирование NE проводили, как описано выше. На фиг. 2C продемонстрировано, что слитые белки-конъюгаты AAT-TNFα, имели такую же активность, направленную на ингибирование эластазы нейтрофилов, как и sdAAT, что указывает на то, что присоединение AAT к антителу не влияло на ингибирующую активность этого AAT.
Пример 3. AAT-Fc-SLPI и AAT-Fc-элафин
В представленных здесь исследованиях описано несколько неограничивающих примеров рекомбинантных производных AAT, содержащих человеческий AAT, присоединенный к белку, содержащему домен WAP. Эти примеры приводятся ниже для дополнительной иллюстрации отличительных признаков настоящего изобретения. В этих примерах также проиллюстрирована методика осуществления настоящего изобретения. Полипептидная AAT-часть слитого белка подчеркнута, Fc-часть показана курсивом, а полипептид, содержащий домен WAP, показан жирным шрифтом. Хотя эти примеры включают конкретную шарнирную последовательность и/или линкерную последовательность, однако, слитые белки согласно изобретению могут быть получены с использованием любой шарнирной последовательности и/или линкерной последовательности, которые имеют подходящую длину и/или гибкость. Альтернативно, слитые белки могут быть получены без использования шарнирной последовательности и/или линкерной последовательности. Так, например, полипептидные компоненты могут быть непосредственно присоединены друг к другу.
Репрезентативным слитым белком AAT-Fc-SLPI является описанный здесь слитый белок AAT-hFc1-SLPI (Fc человеческого IgG1). Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 2), Fc-часть показана курсивом (SEQ ID NO: 3), а полипептид, содержащий домен WAP, показан жирным шрифтом (SEQ ID NO: 9).
AAT-hFc1-SLPI (Fc человеческого IgG1)


Репрезентативным слитым белком AAT-Fc-SLPI является описанный здесь слитый белок AAT-hFc1-SLPI (Fc человеческого IgG1). Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 2), Fc-часть показана курсивом (SEQ ID NO: 3), а полипептид, содержащий домен WAP, показан жирным шрифтом (SEQ ID NO: 12).
AAT-hFc1-элафин (Fc человеческого IgG1)


Гены, кодирующие SLPI и элафин, подвергали ПЦР-амплификации из кДНК селезенки человека (Zyagen). Эти гены клонировали в экспрессионные векторы млекопитающих, описанные в примере 1, где ген SLPI или элафина встраивали в одной рамке считывания с геном AAT-Fc. Эти экспрессионные векторы переносили в клетки млекопитающих (а в частности, в клетки HEK293 или CHO) и культивировали в течение нескольких дней в 8% CО2 при 37C. Рекомбинантные слитые AAT – Fc - домен WAP выделяли из супернатанта экспрессирующих клеток с помощью хроматографии на белке А. Для элюирования слитого белка AAT – Fc - домен WAP со смолы, содержащей белок А, использовали буфер, имеющий почти нейтральный pH (элюирующий буфер Gentle Ag/Ab, Thermo Scientific).
На фиг. 3В показан ПААГ-ДСН-гель, содержащий слитые белки AAT – Fc - домен WAP (дорожка 1: AAT-Fc-элафин; дорожка 2: AAT-Fc-SLPI). Белки визуализировали путем окрашивания кумасси синим. Очищенные слитые белки AAT – Fc - домен WAP тестировали на активность путем определения их способности ингибировать эластазу нейтрофилов. Анализы на ингибирование NE проводили, как описано выше. В этих анализах, AAT человеческой сыворотки (sdAAT) и слитый белок AAT-Fc использовали в качестве позитивного контроля. Слитые белки-конъюгаты AAT – Fc - домен WAP, по сравнению с sdAAT, обладали более высокой активностью, направленной на ингибирование эластазы нейтрофилов (NE) (фиг. 3С).
Пример 4. AAT-альбумин
В представленных здесь исследованиях описано несколько неограничивающих примеров рекомбинантных производных AAT, содержащих человеческий AAT, присоединенный к полипептиду альбумина. Эти примеры приводятся ниже для дополнительной иллюстрации отличительных признаков настоящего изобретения. В этих примерах также проиллюстрирована методика осуществления настоящего изобретения. Эти примеры не должны рассматриваться как ограничение заявленного изобретения. Полипептидная AAT-часть подчеркнута, а альбуминовая часть показана курсивом. Так, например, полипептидные компоненты могут быть непосредственно присоединены друг к другу.
Репрезентативным слитым белком AAT-альбумин является описанный здесь слитый белок AAT-HSA. Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 2), а полипептид альбумина показан курсивом (SEQ ID NO: 14).
AAT-HSA

Репрезентативным слитым белком AAT - альбумин является описанный здесь ААТ-домен 3. Как показано ниже, полипептидная AAT-часть слитого белка подчеркнута (SEQ ID NO: 2), а полипептид альбумина показан курсивом (SEQ ID NO: 15).
AAT-домен 3-HSA


Ген, кодирующий альбумин человеческой сыворотки (HSA), подвергали ПЦР-амплификации из кДНК печени человека (Zyagen). Был получен экспрессионный вектор млекопитающего, в котором ген, кодирующий HSA или домен 3 HSA, клонировали в одной рамке считывания с 3'-концом AAT-кодирующего гена, содержащего секреторную сигнальную последовательность млекопитающего, расположенную выше AAT.
Эти экспрессионные векторы переносили в клетки млекопитающих (а в частности, в клетки HEK293 или CHO) и культивировали в течение нескольких дней в 8% CО2 при 37C. Рекомбинантные слитые белки AAT-HSA выделяли из супернатанта экспрессирующих клеток с помощью хроматографии на матрице с аффинностью к альфа-1-антитрипсину CaptureSelect® (BAC BV), где связывающий буфер состоял из 20 мМ триса, 150 мМ NaCl, pH 7,4, а элюирующий буфер состоял из 20 мМ триса, 2M MgCl2, pH 7,4.
На фиг. 4В показан ПААГ-ДСН-гель, содержащий слитый белок AAT-HSA. Белки визуализировали путем окрашивания кумасси синим. Очищенные слитые белки AAT-HSA тестировали на активность путем определения их способности ингибировать эластазу нейтрофилов. Анализы на ингибирование NE проводили, как описано выше. В этих анализах, AAT человеческой сыворотки (sdAAT) использовали в качестве позитивного контроля. Слитые белки AAT-HSA обладали такой же активностью, направленной на ингибирование NE, как и sdAAT, что указывало на то, что связывание с альбумином не приводило к снижению способности ААТ ингибировать NE (фиг. 4С).
Другие варианты изобретения
Хотя в настоящей заявке дано подробное описание настоящего изобретения, однако, оно приводится лишь в целях иллюстрации и не должно рассматриваться как ограничение объема изобретения, который определен прилагаемой формулой изобретения. Настоящее изобретение может включать другие аспекты, преимущества и модификации, не выходящие за рамки объема нижеследующей формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2727452C1 |
| СЛИТЫЕ ПОЛИПЕПТИДЫ, СОДЕРЖАЩИЕ ДОМЕН WAP, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2639526C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2728861C1 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2698655C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2746550C2 |
| СЛИТНЫЕ БЕЛКИ ИММУНОГЛОБУЛИНОВ | 2008 |
|
RU2530168C2 |
| ПОЛИПЕПТИДЫ | 2011 |
|
RU2577964C2 |
| Нуклеотидная последовательность, кодирующая слитый белок, состоящий из функционального фрагмента человеческого IL-1RA и константной части тяжелой цепи человеческого IgG4 | 2023 |
|
RU2821896C1 |
| Нуклеотидная последовательность, кодирующая слитый белок, состоящий из растворимого экстраклеточного фрагмента человеческого IL-6R и константной части тяжелой цепи человеческого IgG4 | 2023 |
|
RU2818329C1 |
| ГОМОДИМЕРНЫЙ СЛИТЫЙ БЕЛОК, ИМЕЮЩИЙ АКТИВНОСТЬ ИНГИБИТОРА АНГИОГЕНЕЗА (ВАРИАНТЫ), МОЛЕКУЛА ДНК, КОДИРУЮЩАЯ ГОМОДИМЕРНЫЙ СЛИТЫЙ БЕЛОК, ВЕКТОР ДЛЯ ЭКСПРЕССИИ ГОМОДИМЕРНОГО СЛИТОГО БЕЛКА, СПОСОБ ТРАНСФЕКЦИИ КЛЕТКИ МЛЕКОПИТАЮЩЕГО И СПОСОБ ПОЛУЧЕНИЯ ГОМОДИМЕРНОГО СЛИТОГО БЕЛКА | 1999 |
|
RU2240328C2 |
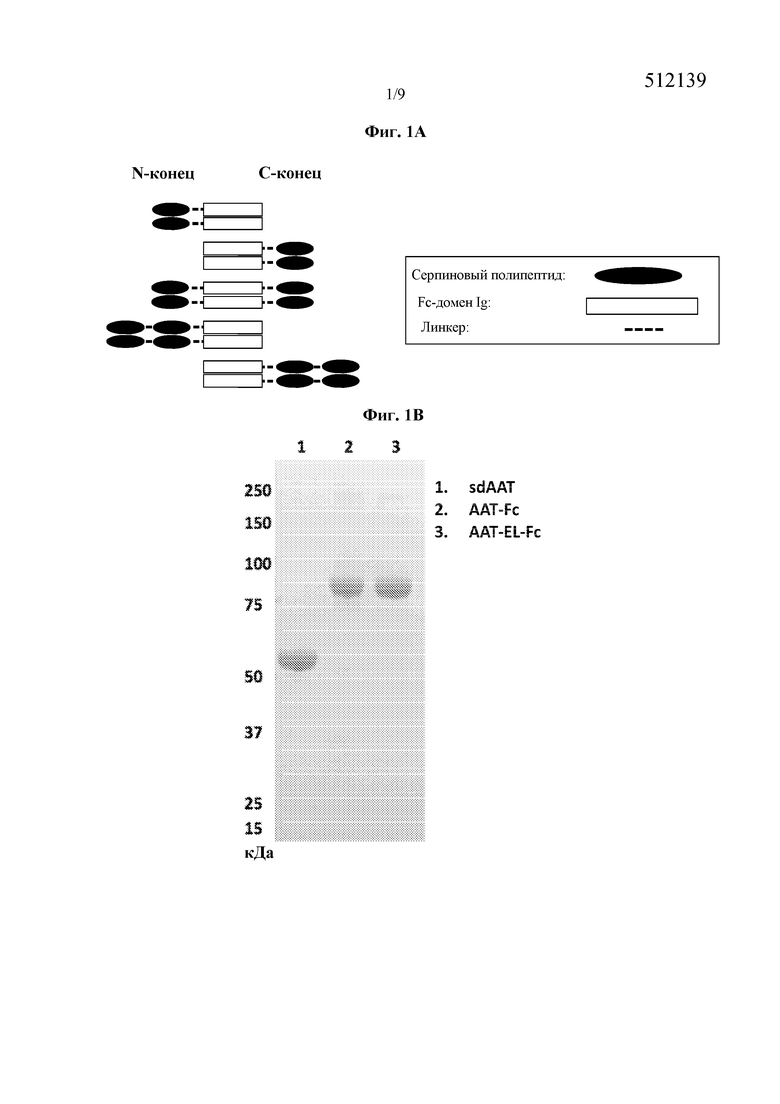
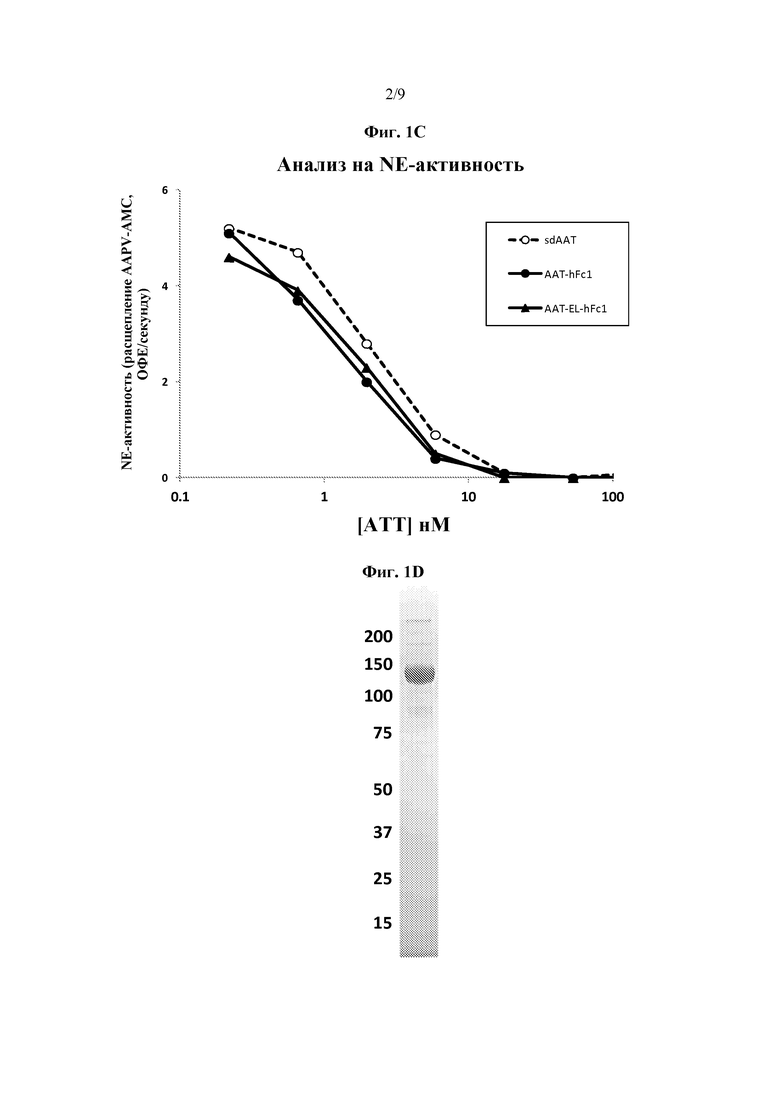

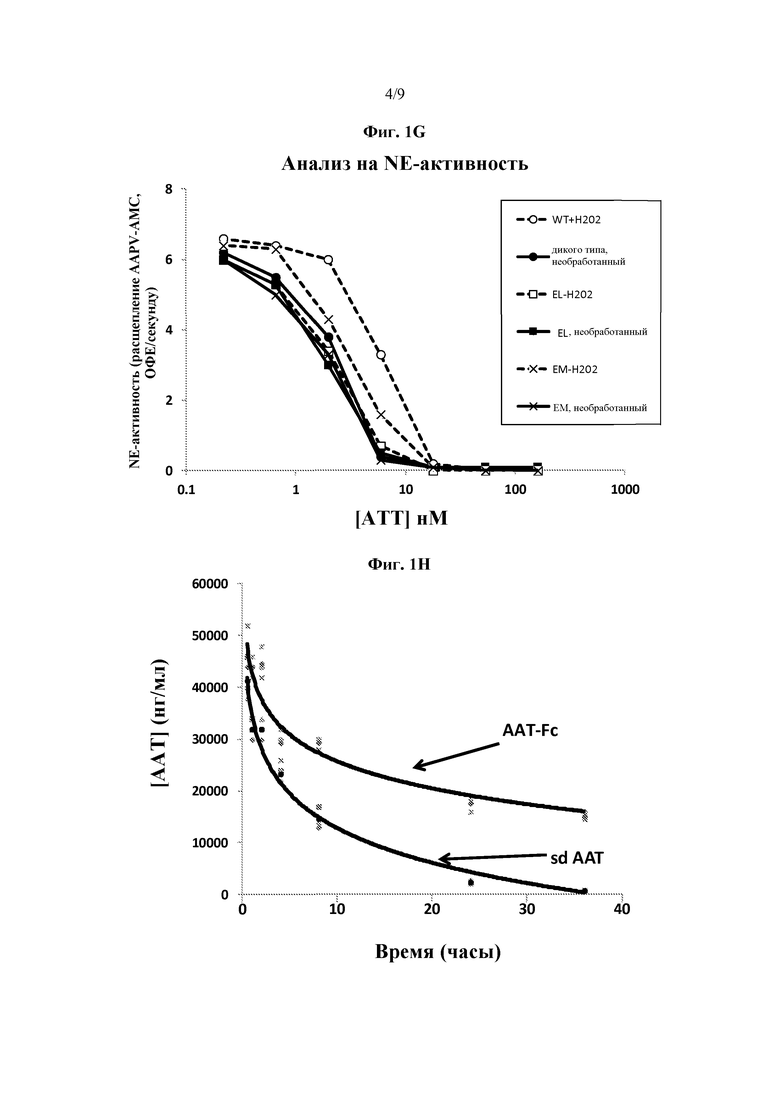

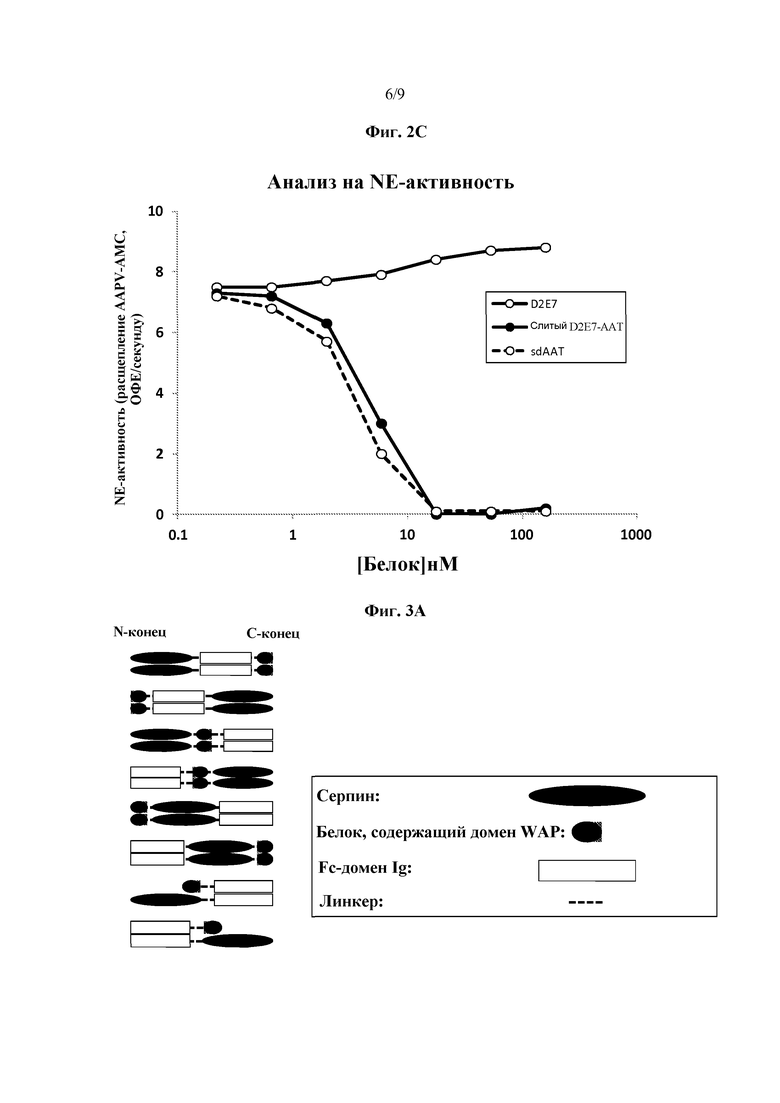

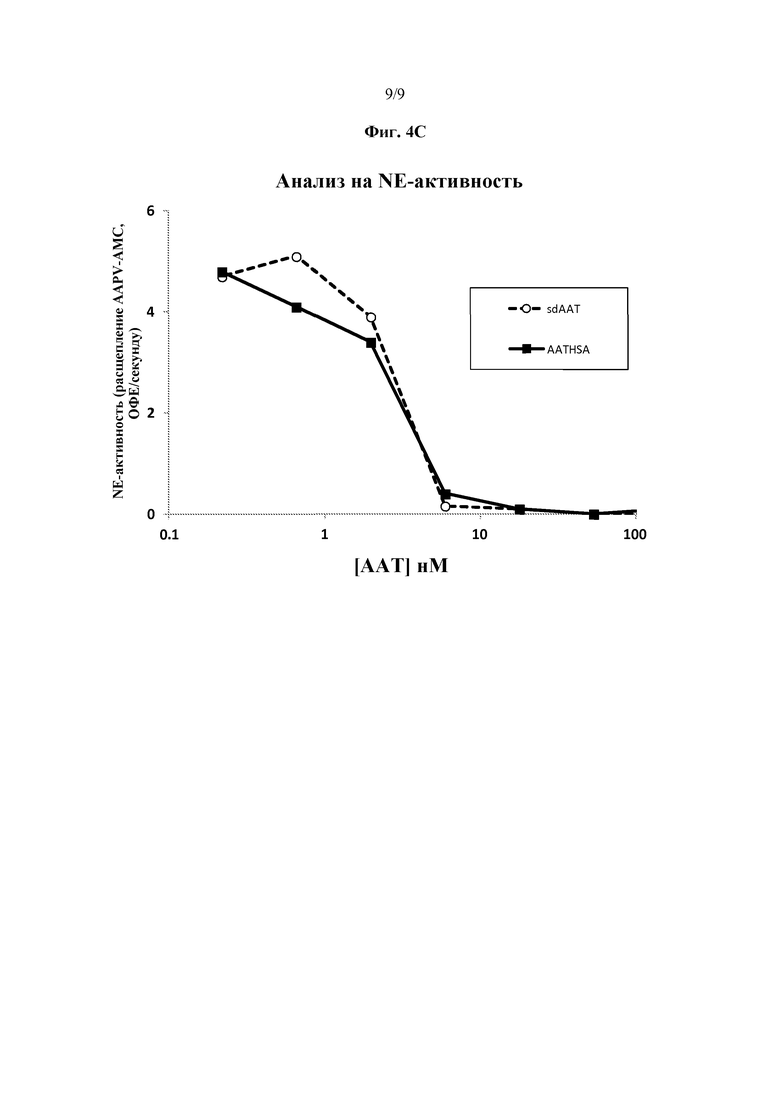
Изобретение относится к области биотехнологии, конкретно к слитым белкам для ингибирования серин-протеаз, и может быть использовано в медицине. Получают слитые белки имеющие, по меньшей мере, один человеческий полипептид альфа-1-антитрипсина (ААТ), функционально связанный с Fc-полипептидом иммуноглобулина, имеющего аминокислотную последовательность, которая по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO: 6. Изобретение позволяет получить слитый полипептид, способный эффективно ингибировать активность серин-протеаз и облегчать, таким образом, симптомы заболеваний или расстройств, связанных с избыточной экспрессией или активностью серин-протеаз у нуждающегося в этом субъекта. 7 н. и 11 з.п. ф-лы, 4 ил., 4 пр.
1. Выделенный слитый белок для ингибирования сериновых протеаз, имеющий по меньшей мере один человеческий полипептид альфа-1-антитрипсина (ААТ), имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 32 и SEQ ID NO: 33, где полипептид ААТ функционально связан с Fc-полипептидом иммуноглобулина, имеющим аминокислотную последовательность, которая по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO: 6.
2. Выделенный слитый белок по п. 1, где полипептид ААТ и Fc-полипептид иммуноглобулина функционально связаны друг с другом посредством шарнирной области, линкерной области или шарнирной области и линкерной области.
3. Выделенный слитый белок для ингибирования сериновых протеаз, имеющий по меньшей мере один человеческий полипептид альфа-1-антитрипсина (ААТ), имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 32 и SEQ ID NO: 33, где полипептид ААТ функционально связан с Fc-полипептидом иммуноглобулина, имеющим аминокислотную последовательность, которая по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO: 6, где пептидная последовательность содержит аминокислотную последовательность EPKSCDKTHTCPPCP, ERKCCVECPPCP, EPKSCDKTHTCPPCP или GGGSGGGS.
4. Выделенный слитый белок по п. 1, где полипептид ААТ содержит аминокислотную последовательность SEQ ID NO: 1, функционально связанную с Fc-полипептидом иммуноглобулина, содержащим аминокислотную последовательность SEQ ID NO: 6.
5. Выделенный слитый белок по п. 1, где полипептид ААТ содержит аминокислотную последовательность SEQ ID NO: 2, функционально связанную с Fc-полипептидом иммуноглобулина, содержащим аминокислотную последовательность SEQ ID NO: 6.
6. Выделенный слитый белок по п. 1, где полипептид ААТ содержит аминокислотную последовательность SEQ ID NO: 32, функционально связанную с Fc-полипептидом иммуноглобулина, содержащим аминокислотную последовательность SEQ ID NO: 6.
7. Выделенный слитый белок по п. 1, где полипептид ААТ содержит аминокислотную последовательность SEQ ID NO: 33, функционально связанную с Fc-полипептидом иммуноглобулина, содержащим аминокислотную последовательность SEQ ID NO: 6.
8. Выделенный слитый белок для ингибирования сериновых протеаз, имеющий по меньшей мере один человеческий полипептид альфа-1-антитрипсина (ААТ), имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 32 и SEQ ID NO: 33, где полипептид ААТ функционально связан с Fc-полипептидом иммуноглобулина, имеющим аминокислотную последовательность, которая по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO: 6, где указанный слитый белок дополнительно включает полипептид, содержащий домен WAP, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9-13.
9. Выделенный слитый белок для ингибирования сериновых протеаз, имеющий по меньшей мере один человеческий полипептид альфа-1-антитрипсина (ААТ), имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 32 и SEQ ID NO: 33, где полипептид ААТ функционально связан с Fc-полипептидом иммуноглобулина, имеющим аминокислотную последовательность, которая по меньшей мере на 98% идентична аминокислотной последовательности SEQ ID NO: 6, где указанный слитый белок дополнительно включает полипептид SLPI, содержащий аминокислотную последовательность SEQ ID NO: 9 или аминокислотную последовательность SEQ ID NO: 10.
10. Выделенный слитый белок по п. 1, где указанный Fc-полипептид иммуноглобулина был модифицирован для усиления связывания с FcRn.
11. Выделенный слитый белок по п. 1, где указанный Fc-полипептид иммуноглобулина содержит по меньшей мере одну из нижеследующих мутаций: Met252Tyr, Ser254Thr, Thr256Glu, Met428Leu или Asn434Ser.
12. Выделенный слитый белок по п. 1, где указанный Fc-полипептид иммуноглобулина содержит по меньшей мере одну мутацию в положении, выбранном из группы, состоящей из Met252, Ser254, Thr256, Met428 или Asn434.
13. Применение слитого белка по любому из пп. 1-12 в производстве лекарственного средства для лечения или ослабления симптомов заболевания или расстройства, ассоциированного с избыточной экспрессией или активностью сериновой протеазы у индивидуума, нуждающегося в этом.
14. Применение слитого белка по любому из пп. 1-12 в производстве лекарственного средства для лечения или ослабления воспаления или симптомов воспалительного заболевания или расстройства, а также снижения риска инфицирования у индивидуума, нуждающегося в этом.
15. Применение слитого белка по любому из пп. 1-12 в производстве лекарственного средства для снижения риска инфицирования у индивидуума, нуждающегося в этом.
16. Применение по любому из пп. 13-15, где указанным индивидуумом является человек.
17. Применение по п. 13, где указанное заболевание или расстройство выбрано из эмфиземы, хронической обструктивной болезни легких (ХОБЛ), острого респираторного дистресс-синдрома (ОРДС), аллергической астмы, кистозного фиброза, рака легких, ишемического реперфузионного повреждения, ишемического/реперфузионного повреждения после трансплантации сердца; инфаркта миокарда, ревматоидного артрита, септического артрита, псориатического артрита, анкилозирующего спондилита, болезни Крона, псориаза, диабета типа I и/или типа II, пневмонии, сепсиса, реакции «трансплантат против хозяина» (GVHD), заболевания, связанного с заживлением ран, системной красной волчанки и рассеянного склероза.
18. Применение по п. 15, где указанная инфекция выбрана из бактериальных инфекций, грибковых инфекций или вирусных инфекций.
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| NOCENTINI G | |||
| Glucocorticoid-induced tumor necrosis factor receptor-related (GITR)-Fc fusion protein inhibits GITR triggering and protects from the inflammatory response after spinal cord injury, Mol | |||
| Pharmacol., 2008, v.73, is.6, p.1610-1621 | |||
| ИНГИБИТОР СЕРИНОВЫХ ПРОТЕАЗ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 1999 |
|
RU2232760C2 |
Авторы
Даты
2018-01-24—Публикация
2012-06-28—Подача