Область техники, к которой относится изобретение
Изобретение относится к области модификации белков, в частности касается аналогов тимозина бета 4 с пролонгированным временем циркуляции в крови. Оно может быть использовано для получения аналогов человеческого тимозина бета 4.
Уровень техники
Тимозин бета 4 - это пептид, вырабатываемый клетками тимусовой железы, который участвует в регуляции полимеризации актина, а также участвует в пролиферации, миграции и дифференциации клеток. Эти свойства тимозина бета 4 определяют его ценность в качестве медицинского препарата, особенно при лечении ишемической болезни сердца.
Тимозин бета 4 человека представляет собой 43-членный пептид ацетилированный по N-концевой α - аминогруппе.
Немодифицированный тимозин бета 4 получают биотехнологическим методом с помощью технологии рекомбинантной ДНК и далее модифицируют путем избирательного химического ацетилирования N-концевой альфа аминогруппы. Такой способ описан в работах (К.А. Бейрахова, В.Н. Степаненко, А.И. Мирошников, Р.С. Есипов / Биотехнологический способ получения ацетилированного тимозина бета 4 // Биоорганическая химия, 2011, том 37, №2, с. 1-10), (Д.А. Макаров, Т.И. Муравьева, В.Н. Степаненко, В.И. Швец, Р.С. Есипов, 2014. Оптимизация и масштабирование лабораторного метода получения рекомбинантного тимозина-бета 4 человека до пилотного производства. Биотехнология 4, 35-44).
Природный тимозин бета 4 - коротко живущий пептид, и период его полувыведения из крови напрямую зависит от вводимой дозы в организм [Mora СА, Baumann СА, Paino JE, Goldstein AL, Badamchian M / Biodistribution of synthetic thymosin beta 4 in the serum, urine, and major organs of mice // Int. J. Immunopharmacol. 1997 Jan; 19 (1): 1-8], что создает трудности при его администрировании. Стандартный подход, применяемый для повышения стабильности терапевтического белка, заключается в присоединении к нему химическими или энзиматическими методами различных защитных групп, обеспечивающих защиту от протеалитических ферментов [Jevsevar S, Kunstelj М, Porekar VG. PEGylation of the therapeutic proteins. Biotechnol J. 2010 Jan; 5 (1): 1 13-28; Schlapschy M, Binder U, Börger C, Theobald I, Wachinger K, Kisling S, Haller D, Skerra A. PASylation: a biological alternative to PEGylation for extending the plasma half-life of pharmaceutically active proteins. ProteinEngDesSel. 2013 Aug; 26 (8): 489-501; Susanne M Mumby. Reversible palmitoylation of signaling proteins / Current Opinionin Cell Biology Volume 9, Issue 2, April 1997, Pages 148-154]. Но принципиальная сложность такого подхода по отношению к тимозину бета 4 заключается в том, что химическая модификация тимозина бета 4 предпочтительна только по N-концевой альфа аминогруппе. Присоединение функциональной группы к любому другому аминокислотному остатку внутри пептида изменит его нативную структуру, что в свою очередь, приведет к потере его биологической активности. Известно, что биологическая активность тимозина бета 4 определяется активными сайтами в коротких пептидных последовательностях, так например, его основной актин-связывающий сайт расположен в аминокислотных остатках 17-22, основной сайт, проявляющий антиапоптозную активность и осуществляющий защиту от токсичности располагается в аминокислотных остатках 1-15, а сайт, представляющий собой первые четыре аминокислотных остатка Ac-SPDK, первый из которых ацетилирован по N-концевой – альфа-аминогруппе, обладает широким спектром биологической активности. Связано это с тем, что природная пострансляционная модификация пептида - присоединение ацетильной группы происходит именно по N-концевой альфа аминогруппе тимозина бета 4. Поскольку концентрация тимозина бета 4 в крови уже через 2 часа падает до базального уровня после его администрирования [Mora СА, Baumann СА, Paino JE, Goldstein AL, Badamchian M. Biodistribution of synthetic thymosin beta 4 in the serum, urine, and major organs of mice. Int JImmunopharmacol. 1997 Jan; 19 (1): 1-8], существует потребность в аналогах тимозина бета 4 с пролонгированным временем циркуляции в крови.
Раскрытие изобретения
Настоящее изобретение относится к созданию стабильного в токе крови аналога тимозина бета 4 посредством региоселективного химического ПЭГилирования тимозина бета 4. Конкретнее, настоящее изобретение раскрывает способ получения модифицированного тимозина бета 4 с пролонгированной стабильностью в токе крови с высоким выходом, за счет региоспецифической моноконъюгации тимозина бета 4 с ПЭГ-альдегидом по свободной N-концевой альфа аминогруппе тимозина бета 4.
Изобретение иллюстрируется следующими рисунками.
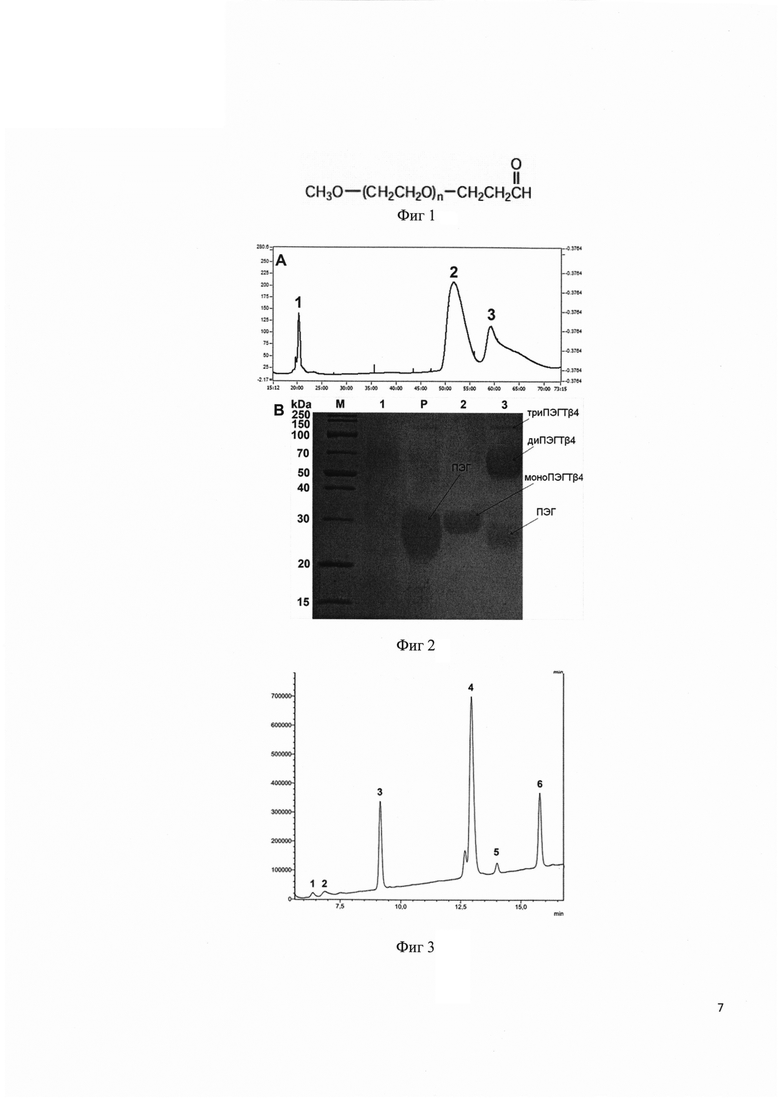
Фиг 1. Формула пропиональдегидного производного ПЭГ.
Фиг 2. А - Профиль полупрепаративной ОФ ВЭЖХ выделения моноПЭГилированного тимозина бета 4. 1 - дезацетилтимозин бета 4, 2 - моноПЭГилированный тимозин бета 4, 2 - побочные продукты реакции. В - Электрофоретический анализ фракций полупрепаративной ОФ ВЭЖХ. М - стандарт универсальных масс, 1 - дезацетилтимозин бета 4, Р - ПЭГ, 2 - моноПЭГилированный тимозин бета 4, 3 - диПЭГилированный тимозин бета 4.
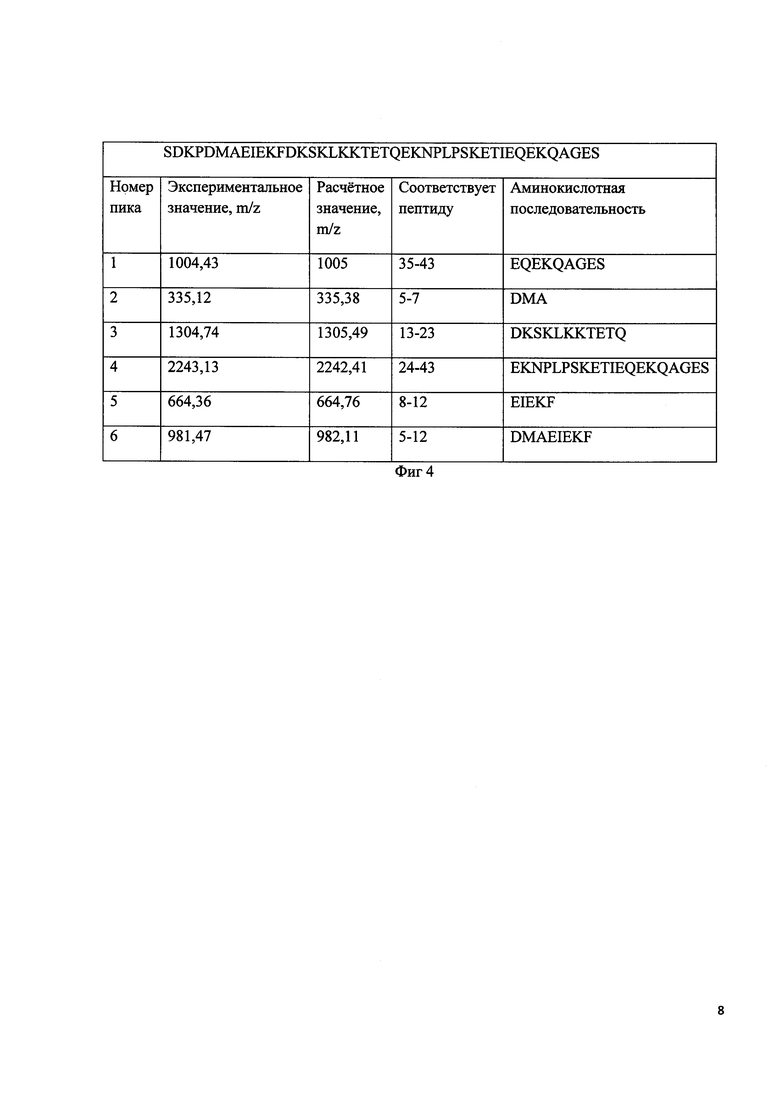
Фиг 3. Хроматографический профиль продуктов протеолитического расщепления конъюгата ПЭГ с тимозином бета 4.
Фиг 4. Однобуквенная последовательность дезацетилтимозина бета 4. Результаты протеолитического расщепления моноПЭГилированного тимозина бета 4.
Подробное описание изобретения
Химическая модификация молекулы белка ПЭГом адресно направлена на улучшение переносимости препарата, снижение иммуногенности и повышение периода его полужизни. Также важными свойствами модифицированных ПЭГ - молекул являются высокая гидрофильность и способность обволакивать молекулу белка, которые формируют принципиально новые физико-химические свойства измененного пептида.
Высокое содержание атомов водорода позволяет молекуле ПЭГ связаться с молекулами воды, что влечет за собой формирование "водного облака" вокруг модифицированной молекулы "ПЭГ-белок", за счет чего значительно повышается ее гидродинамический радиус. Характерным аспектом изобретения является региоспецифический способ ПЭГилирования, включающий моноселективную конъюгацию ПЭГ-альдегида с тимозином бета 4 по свободной N-концевой альфа аминогруппе пептида в буферном растворе для ПЭГилирования при мольном соотношении белок/ПЭГ 1:4. Техническим результатом региоселективной химической модификации является образование моноПЭГилированного тимозина бета 4, выход которого составляет не ниже 70%.
Под буферным раствором для ПЭГилирования подразумевается многокомпонентный водно-органический буферный раствор, содержащий 10% ацетонитрила, который обеспечивает постоянное значение pH 4,0 для осуществления моноселективной конъюгации ПЭГ-альдегида с тимозином бета 4 по свободной N-концевой альфа аминогруппе пептида. Такой буфер с концентрацией от 5 мМ до 100 мМ может содержать соли уксусной, лимонной, глутаминовой, фосфорной, сорбиновой, янтарной кислот или 2-(N-морфолино)этансульфоновую кислоту (MES), список не ограничивается перечисленным.
Техническим результатом изобретения является получение моноПЭГилированного тимозина бета 4, обладающего в 5 раз большим временем полувыведения из плазмы крови по сравнению с тимозином бета 4.
Осуществление изобретения
Пример 1
Получение моноПЭГилированного тимозина бета 4.
К растворенному в буфере (50 мМ ацетат натрия, 10% ацетонитрила, pH 4) дезацетилтимозину бета 4 добавляют 80 мг цианборгидрида натрия и 80 мг пропиональдегидного производного ПЭГ, тщательно перемешивают и инкубируют в течение 3 ч при 25°С. Реакционную смесь разбавляют в 10 раз дистиллированной водой и наносят на колонну Диасорб 130 С16Т, 8 мкм, 15×250 мм. Разделение проводят в градиенте 80% ацетонитрила с 0,1% ТФУ (30-70% за 60 мин). Идентификацию образующегося моноПЭГилированного тимозина бета 4 проводят методом электрофореза в денатурирующих условиях. Фракции, содержащие моноПЭГилированный тимозин бета 4 более 98%, объединяют и лиофилизуют. На фигуре 2 под буквой А изображен профиль полупрепаративной хроматографической очистки моноПЭГилированного тимозина бета 4, где пик 1 соответствует дезацетилтимозину бета 4, пик 2 - моноПЭгилированнй тимозин бета 4, пик 3 - смесь ди и триПЭГилированных тимозинов бета 4. Под буквой В изображен электрофоретический анализ фракций полупрепаративной очистки моноПЭГилированного тимозина бета 4, где М - универсальный стандарт масс, 1 - дезацетилтимозин бета 4, Р - ПЭГ, 2 - моноПЭГилированный тимозин бета 4, 3 - смесь ди- и триПЭгилированных тимозинов бета 4.
Пример 2
Подтвержедение структуры моноПЭГилированного тимозина бета 4.
Лиофилизованный аналог тимозина бета 4 и химически синтезированный тимозин бета 4 в количестве 200 мкг (считают по пептиду), растворяют в 50 мкл буфера (50 мМ Трис/HCl, pH 8,0), затем добавляют 5 мкл 0,067 мг/мл раствора Asp-N протеиназы (0,335 мкг) и инкубируют в течение 3 ч при 37°С. Протеолитическую смесь анализируют методом хромато-масс-спектрометрии. Хроматографические профили продуктов протеолитического расщепления соответствуют профилям на фиг 3. Молекулярные массы фрагментов пептидов соответствуют значениям на фиг 4.
Пример 3
Тестирование стабильности аналога тимозина бета 4 и химически синтезированного тимозина бета 4 на сыворотке крови.
Стабильность определяют как время, за которое в сыворотке крови остается 50% пептида от исходного количества (Т1/2). Сыворотку крови выделяют из крови кролика по стандартным протоколам. Расфасовывают по 50 мкл и замораживают на -70°С. Расфасованную сыворотку крови используют однократно. Тестируемые образцы растворяют в стерильном физиологическом растворе и вводят в концентрации 10 мг/млв 50 мкл сыворотки крови и инкубируют в течение 1-24 ч при 37°С. Смесь анализируют методом хромато-масс-спектрометрии. Стабильность измеряют по изменению площади поглощения исследуемого образца со временем. Результаты обрабатывают статистически, достоверность отличий результатов определяют параметрическим методом. Для тимозина бета 4 Т1/2 соответствует 2 ч, для ПЭГилированного тимозина бета 4 Т1/2 соответствует 10 ч.
Группа изобретений относится к области биотехнологии и может быть использована в медицине и фармацевтической промышленности. Разработан способ региоселективного химического N-концевого ПЭГилирования тимозина бета 4. Данным способом получен моноконъюгат ПЭГ с тимозином бета 4, обладающий улучшенными фармакокинетическими свойствами. Подтверждена модификация N-концевой альфа аминогруппы тимозина бета 4. Применение изобретения позволяет получить моноПЭГилированный тимозин бета 4 с высоким выходом. 2 н.п. ф-лы, 4 ил., 3 пр.
1. Способ получения моноконъюгата полиэтиленгликоля с тимозином бета 4, включающий растворение дезацетилтимозина бета 4 в многокомпонентном водно-органическом буфере со значением рН 4, обеспечивающем региоселективное ПЭГилирование и содержащем цианборгидрид натрия и пропиональдегидное производное ПЭГ, тщательное перемешивание и инкубирование в течение 3 ч при 25°С, очистку методом ОФ ВЭЖХ и лиофилизацию.
2. Ковалентный моноконъюгат полиэтиленгликоля с тимозином бета 4, устойчивый к деградации в токе крови, полученный способом по п. 1.
Авторы
Даты
2017-01-10—Публикация
2015-11-23—Подача