Область изобретения
Настоящее изобретение относится к детекции нуклеотидных последовательностей-мишеней с использованием разных температур детекции.
Сведения о родственном уровне техники
Для детекции нуклеотидных последовательностей-мишеней широко используются способы детекции в режиме реального времени, в которых детекция нуклеотидных последовательностей-мишеней осуществляется совместно с мониторингом амплификации мишеней в режиме реального времени. Как правило, в таких способах детекции в режиме реального времени используют меченые зонды или праймеры, специфически гибридизующиеся с нуклеотидными последовательностями-мишенями. Примеры способов применения гибридизации меченых зондов с нуклеотидными последовательностями-мишенями включают способ с применением "молекулярных маяков", в котором используются имеющие шпилечную структуру зонды с двумя метками (Tyagi et al., Nature Biotechnology, v. 14, MARCH 1996), способ HyBeacon (French D.J. et al., Mol. Cell Probes, 15(6): 363-374 (2001)), способ с применением гибридизационных зондов, в котором используются два зонда, каждый из которых помечен донором и акцептором (Bernad et al., 147-148, Clin. Chem., 2000, 46) и способ Lux (Light Upon extension), в котором используются меченные одиночной меткой олигонуклеотиды (патент США №7537886). В данной области техники также широко применяется TaqMan-способ (патенты США №№5210015 и 5538848), в котором используются зонды с двумя метками и их расщепление под действием 5'-нуклеазной активности ДНК-полимеразы.
Примеры способов использования меченых праймеров включают способ с применением праймеров "sunrise" (Sunrise™ - торговая марка фирмы Oncor) (Nazarenko et al., 2516-2521, Nucleic Acids Research, 1997, v. 25, №12 и патент США №6117635), способ с применением праймеров типа "scorpion" (Scorpion™ - торговая марка фирмы D×S Ltd) (Whitcombe et al., 804-807, Nature Biotechnology, v. 17, AUGUST 1999 и патент США №6326145) и способ с применением TSG (target signal generating - генерирующих сигнал от мишени) праймеров (WO 2011/078441).
В качестве альтернативных подходов были предложены способы детекции в режиме реального времени с использованием дуплексов, образующихся в зависимости от присутствия нуклеотидных последовательностей-мишеней: анализ "Invader" (US 5691142, US 6358691 и US 6194149), способ с PTOCE (PTO cleavage and extension - расщеплением и удлинением зондирующего и метящего олигонуклеотида (PTO; от англ. probing and tagging oligonucleotide)) (WO 2012/096523), способ с PCE-SH (PTO Cleavage and Extension-Dependent Signaling Oligonucleotide Hybridization - гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения PTO) (WO 2013/115442), способ с PCE-NH (PTO Cleavage and Extension-Dependent Non-Hybridization - отсутствием гибридизации, зависящим от расщепления и удлинения PTO) (PCT/KR2013/012312).
При использовании описанных выше традиционных технологий детекции в режиме реального времени детектируют сигналы, генерируемые флуоресцентными метками при выбранной температуре детекции в процессе амплификации сигнала, ассоциированном или не ассоциированном с амплификацией мишеней. Если в соответствии с традиционными технологиями детекции в режиме реального времени детектируют множество нуклеотидных последовательностей-мишеней в одной реакционной пробирке с использованием метки одного типа, то генерируемые сигналы для нуклеотидных последовательностей-мишеней не отличаются друг от друга. Ввиду этого, в традиционных технологиях детекции в режиме реального времени, как правило, применяют разные типы меток для детекции множества нуклеотидных последовательностей-мишеней. Анализ плавления с использованием разницы в Tпл позволяет детектировать множество нуклеотидных последовательностей-мишеней даже с использованием метки одного типа. Тем не менее анализ плавления имеет серьезные недостатки, заключающиеся в том, что продолжительность его проведения превышает затраты времени в выполняемых в режиме реального времени технологиях и конструирование зондов с разными значениями Tпл становится более затруднительным по мере увеличения числа последовательностей-мишеней.
Соответственно, если будут разработаны новые способы или подходы, не зависящие от анализа плавления, для детекции множества нуклеотидных последовательностей-мишеней в одном реакционном сосуде с использованием метки одного типа и детектора одного типа, то они дадут возможность детектировать множество нуклеотидных последовательностей-мишеней значительно более удобным образом, с существенно более высокой экономичностью и эффективностью. Помимо этого, сочетание новых способов с другими способами детекции (например, с анализом плавления) даст возможность осуществлять детекцию множества нуклеотидных последовательностей-мишеней в одном реакционном сосуде с использованием метки одного типа с существенно более высокой эффективностью.
По всей этой заявке сделаны ссылки на различные патенты и публикации, и упоминания о них приведены в скобках. Тем самым описание этих патентов и публикаций во всей их полноте включено в эту заявку посредством ссылок с целью более полного описания данного изобретения и состояния области техники, к которой это изобретение имеет отношение.
Сущность изобретения
Авторы настоящего изобретения провели интенсивные исследования с целью разработки новых способов для детекции множества нуклеотидных последовательностей-мишеней в одном реакционном сосуде с использованием метки одного типа и детектора одного типа. В результате авторы изобретения обнаружили, что получение сигналов для нуклеотидных последовательностей-мишеней при скорректированных значениях температуры детекции, результаты детекции которых затем соответствующим образом интерпретируют, тем самым дает возможность детектировать множество нуклеотидных последовательностей-мишеней в одном реакционном сосуде с использованием метки одного типа и детектора одного типа значительно более удобным образом, с существенно более высокой экономичностью и эффективностью.
Соответственно, данным изобретением решается задача разработки способа и набора для детекции двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции.
Другой задачей данного изобретения является разработка способа и набора для генотипирования SNP (single nucleotide polymorphism - однонуклеотидный полиморфизм) нуклеотидной последовательности в образце с использованием разных температур детекции.
Еще одной задачей данного изобретения является разработка способа и набора для детекции по меньшей мере трех нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции.
Следующей задачей данного изобретения является разработка способа и набора для детекции по меньшей мере двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции и анализа плавления.
Еще одной задачей данного изобретения является разработка способа и набора для детекции по меньшей мере трех нуклеотидных последовательностей-мишеней в образце с использованием анализа температур детекции и анализа плавления.
Другой задачей данного изобретения является разработка пригодного для ввода в компьютер информационного носителя, содержащего инструкции для конфигурирования процессора, с целью осуществления способа определения присутствия двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции.
Еще одной задачей данного изобретения является разработка устройства для детекции нуклеотидной последовательности-мишени в образце с использованием разных температур детекции.
Следующей задачей данного изобретения является разработка компьютерной программы, предназначенной для хранения на пригодном для ввода в компьютер информационном носителе, для конфигурирования процессора, с целью осуществления способа определения присутствия двух нуклеотидных последовательностей-мишеней в образце.
Еще одной задачей данного изобретения является разработка пригодного для ввода в компьютер информационного носителя, содержащего инструкции для конфигурирования процессора с целью осуществления способа определения присутствия по меньшей мере трех нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции.
Другие задачи и преимущества настоящего изобретения станут очевидны из следующего далее подробного описания в сочетании с прилагаемыми формулой изобретения и графическими материалами.
Краткое описание графических материалов
На Фиг. 1а представлены результаты детекции по настоящему изобретению с использованием разных температур детекции в случае детекции нуклеотидной последовательности-мишени (геномной ДНК из Chlamydia trachomatis, СТ), имеющей относительно высокую температуру детекции (72°C), нуклеотидной последовательности-мишени (геномной ДНК из Neisseria gonorrhoeae, NG), имеющей относительно низкую температуру детекции (60°C), и их комбинации. Сигналы для СТ и NG генерировали, используя способ с PTOCE с применением ПЦР (полимеразная цепная реакция) в режиме реального времени.
На Фиг. 1b представлены результаты определения присутствия нуклеотидных последовательностей-мишеней, имеющих относительно низкую температуру детекции, по соотношению между сигналом при относительно высокой температуре детекции и сигналом при относительно низкой температуре детекции.
На Фиг. 1c представлены результаты определения присутствия нуклеотидных последовательностей-мишеней, имеющих относительно низкую температуру детекции, путем построения зависимостей соотношений между сигналом при относительно высокой температуре детекции и сигналом при относительно низкой температуре детекции.
На Фиг. 1d и 1e представлены результаты определения присутствия нуклеотидных последовательностей-мишеней, имеющих относительно низкую температуру детекции, по разнице между сигналом при относительно высокой температуре детекции и сигналом при относительно низкой температуре детекции, при этом сигнал при относительно высокой температуре детекции корректируют с учетом порогового значения и используют для получения данной разницы.
На Фиг. 2а представлены результаты детекции по настоящему изобретению с использованием разных температур детекции в случае детекции нуклеотидной последовательности-мишени (геномной ДНК из Chlamydia trachomatis, СТ), имеющей относительно высокую температуру детекции (72°C), нуклеотидной последовательности-мишени (геномной ДНК из Neisseria gonorrhoeae, NG), имеющей относительно низкую температуру детекции (60°C), и их комбинации. Сигнал для СТ генерировали, используя TaqMan-способ с ПЦР в режиме реального времени, а сигнал для NG генерировали, используя способ с PTOCE с применением ПЦР в режиме реального времени.
На Фиг. 2b представлены результаты определения присутствия нуклеотидных последовательностей-мишеней, имеющих относительно низкую температуру детекции, по соотношению между сигналом при относительно высокой температуре детекции и сигналом при относительно низкой температуре детекции.
На Фиг. 2c представлены результаты определения присутствия нуклеотидных последовательностей-мишеней, имеющих относительно низкую температуру детекции, путем построения зависимостей соотношений между сигналом при относительно высокой температуре детекции и сигналом при относительно низкой температуре детекции.
На Фиг. 2d и 2e представлены результаты определения присутствия нуклеотидных последовательностей-мишеней, имеющих относительно низкую температуру детекции, по разнице между сигналом при относительно высокой температуре детекции и сигналом при относительно низкой температуре детекции, при этом сигнал при относительно высокой температуре детекции корректируют с учетом порогового значения и используют для получения данной разницы.
На Фиг. 3 представлены результаты детекции нуклеотидной последовательности-мишени (геномной ДНК из Chlamydia trachomatis, СТ), имеющей относительно высокую температуру детекции (72°C), нуклеотидной последовательности-мишени (геномной ДНК из Neisseria gonorrhoeae, NG), имеющей относительно низкую температуру детекции (60°C), и их комбинации по данным как ПЦР в режиме реального времени с использованием разных температур детекции, так и анализа плавления. Сигнал для СТ генерировали, используя TaqMan-способ с ПЦР в режиме реального времени, а сигнал для NG генерировали, используя способ с PTOCE-плавлением.
На Фиг. 4a представлены результаты SNP-генотипирования по настоящему изобретению с использованием разных температур детекции с применением ПЦР в режиме реального времени. ДНК, кодирующую MTHFR (метилентетрагидрофолат-редуктаза) (C677T), из генома человека использовали в качестве матриц (последовательностей-мишеней). Осуществляли детекцию гомозиготы дикого типа (СС), мутантной гомозиготы (ТТ) и гетерозиготы (СТ). Все сигналы генерировали, используя способ с PTOCE с применением ПЦР в режиме реального времени.
На Фиг. 4b представлены результаты SNP-генотипирования с использованием соотношения между сигналом при относительно высокой температуре детекции и сигналом при относительно низкой температуре детекции.
На Фиг. 5а-5с представлены результаты детекции по настоящему изобретению с использованием разных температур детекции для детекции трех последовательностей-мишеней (геномной ДНК из Neisseria gonorrhoeae (NG), геномной ДНК из Chlamydia trachomatis (СТ) и геномной ДНК из Mycoplasma genitalium (MG)). Сигнал для MG генерировали, используя TaqMan-способ с ПЦР в режиме реального времени, а сигналы для СТ и NG генерировали, используя способ с PTOCE с применением ПЦР в режиме реального времени. "95°C" выбирали в качестве температуры детекции сигнала для MG; "72°C" выбирали в качестве температуры детекции сигнала для СТ, а "60°C" выбирали в качестве температуры детекции сигнала для NG с учетом средств генерации сигнала (signal-generating means).
На Фиг. 5d представлены значения конечный-ΔRFU, рассчитанные с использованием значений RFU (relative fluorescence units - относительные единицы флуоресценции) в конечных точках при 95°C и 72°C, для определения присутствия геномной ДНК СТ.
На Фиг. 5е представлены значения конечный-ΔRFU, рассчитанные с использованием значений RFU в конечных точках при 72°C и 60°C, для определения присутствия геномной ДНК NG.
Подробное описание данного изобретения
Наиболее характерный признак настоящего изобретения касается детекции множества нуклеотидных последовательностей-мишеней с использованием метки одного типа и детектора одного типа в одном реакционном сосуде. В настоящем изобретении используются разные температуры детекции, что дает возможность осуществления детекции множества нуклеотидных последовательностей-мишеней в одном реакционном сосуде, даже применяя метку одного типа. Элементы настоящего изобретения выбраны в соответствии с данным признаком настоящего изобретения и из них выстроен неожиданный способ детекции нуклеотидных последовательностей-мишеней.
В случае традиционных способов ПЦР в режиме реального времени для детекции двух нуклеотидных последовательностей-мишеней в одном реакционном сосуде требуется применение флуоресцентных меток двух типов или анализа плавления.
В настоящем изобретении используются протоколы ПЦР в режиме реального времени для детекции двух нуклеотидных последовательностей-мишеней с использованием флуоресцентной метки одного типа в одном реакционном сосуде. Альтернативно, настоящее изобретение дает возможность осуществления детекции двух нуклеотидных последовательностей-мишеней посредством детекции одной из двух нуклеотидных последовательностей-мишеней с использованием ПЦР в режиме реального времени, а другой с использованием анализа плавления.
В настоящем изобретении используются данные, полученные авторами изобретения, говорящие о том, что детекция сигналов регулируется температурами в соответствии со средствами генерации сигнала для нуклеотидных последовательностей-мишеней.
Например, если в качестве средства генерации сигнала для детекции первой нуклеотидной последовательности-мишени используется гибридизация зонда с нуклеотидной последовательностью-мишенью, то температура, при которой зонд гибридизуется с первой нуклеотидной последовательностью-мишенью, позволяет генерировать и детектировать сигналы, указывающие на присутствие первой нуклеотидной последовательности-мишени. Напротив, температура, при которой данный зонд не гибридизуется с первой нуклеотидной последовательностью-мишенью, не позволяет генерировать и детектировать никакого сигнала. В этом отношении следует принимать во внимание, что имеются температуры, при которых сигнал генерируется, и температуры, при которых сигнал не генерируется, и это зависит от используемых средств генерации сигнала.
При применении таких средств генерации сигнала значения температуры, при которых зонд гибридизуется с первой нуклеотидной последовательностью-мишенью, может служить в качестве температуры детекции для первой нуклеотидной последовательности-мишени. Значения температуры, при которых зонд не гибридизуется с первой нуклеотидной последовательностью-мишенью, не может служить в качестве температуры детекции.
Если гибридизацию зонда используют также для детекции второй нуклеотидной последовательности-мишени, то температуру ее детекции можно определить с учетом наличия температурного диапазона, в котором генерируются или не генерируются сигналы.
Если значение Tпл зонда, используемого для детекции второй нуклеотидной последовательности-мишени, ниже такового для зонда, используемого для детекции первой нуклеотидной последовательности-мишени, то сигнал для первой нуклеотидной последовательности-мишени можно детектировать при относительно более высокой температуре, при этом сигнал для второй нуклеотидной последовательности-мишени не будет генерироваться. Другими словами, имеется разница в температурах генерирования и детекции сигналов от двух средств генерации сигнала для двух нуклеотидных последовательностей-мишеней.
Если в образце одновременно присутствуют две нуклеотидные последовательности-мишени, то имеется температурный диапазон, позволяющий генерировать сигнал для первой нуклеотидной последовательности-мишени и не генерировать сигнала для второй нуклеотидной последовательности-мишени. В то же время в диапазоне температур, находящемся ниже данного температурного диапазона, генерируются сигналы для этих двух нуклеотидных последовательностей-мишеней.
Учитывая эти два температурных диапазона, можно определить температуру детекции для каждой из нуклеотидных последовательностей-мишеней. Относительно высокая температура детекции может быть выбрана из первого температурного диапазона, и эту относительно высокую температуру детекции задают первой нуклеотидной последовательности-мишени. Относительно низкая температура детекции может быть выбрана из последнего температурного диапазона, и эту относительно низкую температуру детекции задают второй нуклеиновой кислоте-мишени.
Согласно настоящему изобретению сигнал при относительно высокой температуре детекции измеряют для определения присутствия первой нуклеотидной последовательности-мишени. Согласно настоящему изобретению детекция при относительно высокой температуре детекции позволяет осуществить способ определения присутствия первой нуклеотидной последовательности-мишени.
Важный технический признак настоящего изобретения относится к выявлению сигнала, детектируемого при относительно низкой температуре детекции, для определения присутствия второй нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, используя как сигнал при относительно высокой температуре детекции, так и сигнал при относительно низкой температуре детекции.
Альтернативно, авторы настоящего изобретения рассмотрели возможность того, что первую нуклеотидную последовательность-мишень можно детектировать при относительно высокой температуре детекции, используя разные температуры детекции, а вторую нуклеотидную последовательность-мишень можно детектировать с использованием анализа плавления в качестве другого подхода для генерирования сигнала. Средство генерации сигнала, используемое для анализа плавления, может обеспечить получение сигнала при конкретной температуре в процессе детекции в режиме реального времени. Таким образом, даже если детекцию одной из двух нуклеотидных последовательностей-мишеней осуществляют с использованием анализа плавления, необходимо, чтобы эти две нуклеотидные последовательности-мишени имели разные температуры детекции.
Настоящее изобретение может быть воплощено в соответствии с различными аспектами, которые приведены ниже:
(a) детекция двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции;
(b) SNP-генотипирование нуклеотидной последовательности в образце с использованием разных температур детекции;
(c) детекция по меньшей мере трех нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции;
(d) детекция двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции и анализа плавления; и
(e) детекция по меньшей мере трех нуклеотидных последовательностей-мишеней в образце с использованием анализа температур детекции и анализа плавления.
I. Детекция двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции
Согласно одному из аспектов данного изобретения предложен способ детекции двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции, включающий:
(a) инкубирование образца с двумя средствами генерации сигнала для детекции двух нуклеотидных последовательностей-мишеней в одном реакционном сосуде и детекцию генерируемого сигнала с использованием детектора одного типа; при этом каждую из нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала; при этом одна из двух нуклеотидных последовательностей-мишеней имеет относительно высокую температуру детекции, а другая имеет относительно низкую температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом относительно высокая температура детекции представляет собой температуру, допускающую генерирование сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, а относительно низкая температура детекции представляет собой температуру, допускающую генерирование как сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, так и сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции; при этом сигналы, генерируемые с использованием этих двух средств генерации сигнала, не различаются детектором одного типа; при этом детекцию осуществляют как при относительно высокой температуре детекции, так и при относительно низкой температуре детекции; и
(b) определение присутствия двух нуклеотидных последовательностей-мишеней на основе сигналов, детектируемых на стадии (a); при этом (1) присутствие нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, определяют на основе сигнала, детектируемого при относительно высокой температуре детекции, а (2) присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, определяют по разнице между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции.
В соответствии с традиционными способами применения ПЦР в режиме реального времени, в которых используют кривые амплификации, в данной области техники общеизвестно, что невозможно провести дифференцированную детекцию множества нуклеотидных последовательностей-мишеней, применяя средства генерации сигнала, обеспечивающие получение неразличимых идентичных сигналов.
Настоящее изобретение позволяет преодолеть ограничения, связанные с этим широко распространенным в данной области техники мнением, и приводит к получению неожиданных результатов в отношении детекции нуклеотидных последовательностей-мишеней в значительной степени усовершенствованным способом.
Настоящее изобретение будет описано более подробно ниже.
Стадия (a). Инкубирование со средствами генерации сигнала и детекция сигналов
В первую очередь, анализируемый образец инкубируют с двумя средствами генерации сигнала для детекции двух нуклеотидных последовательностей-мишеней в одном реакционном сосуде и затем генерируемый сигнал детектируют, используя детектор одного типа. Сигналы, генерируемые двумя средствами генерации сигнала, не различаются детектором одного типа.
В настоящем изобретении используются средства генерации сигнала с целью генерирования сигналов для нуклеотидных последовательностей-мишеней. Каждую из нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала. Использованный в данном описании термин "средства генерации сигнала" относится к любому веществу, применяемому при генерировании сигналов, указывающих на присутствие нуклеотидных последовательностей-мишеней, включая, например, олигонуклеотиды, метки и ферменты. Альтернативно, использованный в данном описании термин "средства генерации сигнала" можно применять в отношении любых способов, в которых используются данные вещества для генерирования сигналов.
Согласно одному из воплощений данного изобретения инкубирование проводят в условиях, допускающих генерирование сигналов с использованием средств генерации сигнала. Такие условия включают температуры, концентрации солей и pH растворов.
Примеры олигонуклеотидов, служащих в качестве средств генерации сигнала, включают олигонуклеотиды, предназначенные для специфической гибридизации с нуклеотидными последовательностями-мишенями (например, зонды и праймеры); когда зонды или праймеры, гибридизованные с нуклеотидными последовательностями-мишенями, расщепляются с высвобождением фрагмента, олигонуклеотиды, служащие в качестве средств генерации сигнала, включают захватывающие олигонуклеотиды (capture oligonucleotides), предназначенные для специфической гибридизации с данным фрагментом; когда фрагмент, гибридизованный с захватывающим олигонуклеотидом, удлиняется с образованием удлиненной цепи, олигонуклеотиды, служащие в качестве средств генерации сигнала, включают олигонуклеотиды, предназначенные для специфической гибридизации с данной удлиненной цепью; олигонуклеотиды, служащие в качестве средств генерации сигнала, включают олигонуклеотиды, предназначенные для специфической гибридизации с захватывающим олигонуклеотидом; и олигонуклеотиды, служащие в качестве средств генерации сигнала, включают их комбинации.
Несмотря на то, что принцип генерирования сигналов является одним и тем же, считается, что средства генерации сигнала, включающие используемые олигонуклеотиды с разными последовательностями, могут быть разными.
Метка может быть соединена с олигонуклеотидами или может находиться в свободной форме. Метка может встраиваться в продукты удлинения во время реакции удлинения.
Когда в процессе генерирования сигналов используют расщепление олигонуклеотидов, примеры фермента включают 5'-нуклеазу и 3'-нуклеазу, в частности, полимеразу нуклеиновых кислот, обладающую 5'-нуклеазной активностью, полимеразу нуклеиновых кислот, обладающую 3'-нуклеазной активностью, или нуклеазу FEN (Flap EndoNuclease - флэп-эндонуклеаза).
В настоящем изобретении сигналы можно генерировать, по-разному используя различные описанные выше вещества.
Согласно одному из воплощений, по меньшей мере одно из двух средств генерации сигнала представляет собой средство генерации сигнала для генерирования сигнала способом, зависящим от образования дуплекса.
Согласно одному из воплощений средства генерации сигнала для каждой из нуклеотидных последовательностей-мишеней представляют собой средства генерации сигнала для генерирования сигнала способом, зависящим от образования дуплекса.
Согласно одному из воплощений данный дуплекс включает двухцепочечную нуклеотидную последовательность-мишень.
Использованное в данном описании выражение "генерирование сигнала способом, зависящим от образования дуплекса" в сочетании со средствами генерации сигнала относится к тому, что получение детектируемого сигнала будет зависеть от ассоциации или диссоциации двух молекул нуклеиновой кислоты. Данное выражение означает, что получение сигнала обеспечивается дуплексом (например, дуплексом между содержащим метку детектирующим олигонуклеотидом (detection oligonucleotide) и нуклеотидной последовательностью), образование которого зависит от присутствия нуклеотидной последовательности-мишени. Помимо этого, данное выражение означает, что получение сигнала обеспечивается посредством ингибирования гибридизации при образовании дуплекса (например, дуплексом между содержащим метку детектирующим олигонуклеотидом и нуклеотидной последовательностью), при этом данное ингибирование вызывается образованием другого дуплекса.
В частности, сигнал генерируется в результате образования дуплекса между нуклеотидной последовательностью-мишенью и детектирующим олигонуклеотидом, специфически гибридизованным с этой нуклеотидной последовательностью-мишенью.
Использованный в данном описании термин "детектирующий олигонуклеотид" относится к олигонуклеотиду, который вовлечен в генерирование предназначенного для детекции сигнала. Согласно одному из воплощений настоящего изобретения детектирующий олигонуклеотид включает олигонуклеотид, который вовлечен в фактическое генерирование сигнала. Например, гибридизация или отсутствие гибридизации детектирующего олигонуклеотида с другим олигонуклеотидом (например, нуклеотидной последовательностью-мишенью или олигонуклеотидом, содержащим нуклеотидную последовательность, комплементарную детектирующему олигонуклеотиду) является определяющим признаком генерирования сигнала.
Согласно одному из воплощений настоящего изобретения детектирующий олигонуклеотид содержит по меньшей мере одну метку.
Сигнал в результате образования дуплекса между нуклеотидной последовательностью-мишенью и детектирующим олигонуклеотидом может генерироваться различными способами, включая способ "scorpion" (Whitcombe et al., Nature Biotechnology, 17: 804-807 (1999)), способ "sunrise" (или Amplifluor) (Nazarenko et al., Nucleic Acids Research, 25(12): 2516-2521 (1997) и патент США №6117635), способ Lux (патент США №7537886), способ Plexor (Sherrill СВ., et al., Journal of the American Chemical Society, 126: 4550-45569 (2004)), способ молекулярных "маяков" (Tyagi et al., Nature Biotechnology, v. 14, MARCH 1996), способ HyBeacon (French D.J. et al., Mol. Cell Probes, 15(6): 363-374 (2001)), способ с применением смежных гибридизационных зондов (Bernard, P.S. et al., Anal. Biochem., 273: 221(1999)) и способ с применением LNA (locked nucleic acid - "закрытая" нуклеиновая кислота) (патент США №6977295).
В частности, такой сигнал генерируется дуплексом, образованным способом, зависящим от расщепления опосредующего олигонуклеотида (mediation oligonucleotide), специфически гибридизованного с нуклеотидной последовательностью-мишенью.
Использованный в данном описании термин "опосредующий олигонуклеотид" относится к олигонуклеотиду, который опосредует образование дуплекса, не содержащего нуклеотидной последовательности-мишени.
Согласно одному из воплощений настоящего изобретения само расщепление опосредующего олигонуклеотида не генерирует сигнала, а в последующие реакции генерирования сигнала после гибридизации и расщепления опосредующего олигонуклеотида вовлечен фрагмент, образованный в результате такого расщепления.
Согласно одному из воплощений сами гибридизация или расщепление опосредующего олигонуклеотида не генерируют сигнала.
Согласно одному из воплощений настоящего изобретения опосредующий олигонуклеотид включает олигонуклеотид, который гибридизуется с нуклеотидной последовательностью-мишенью и расщепляется с высвобождением фрагмента, опосредуя образование дуплекса. В частности, фрагмент опосредует образование дуплекса в результате удлинения этого фрагмента на захватывающем олигонуклеотиде.
Согласно одному из воплощений настоящего изобретени, опосредующий олигонуклеотид содержит (1) 3'-концевой узнающий мишень участок (3'-targeting portion), содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеотидной последовательности-мишени, и (2) 5'-концевой тегирующий участок (5-tagging portion), содержащий нуклеотидную последовательность, не комплементарную нуклеотидной последовательности-мишени.
Согласно одному из воплощений настоящего изобретения, в результате расщепления опосредующего олигонуклеотида высвобождается фрагмент, и этот фрагмент специфически гибридизуется с захватывающим олигонуклеотидом и удлиняется на захватывающем олигонуклеотиде.
Согласно одному из воплощений настоящего изобретения опосредующий олигонуклеотид, гибридизованный с нуклеотидными последовательностями-мишенями, расщепляется с высвобождением фрагмента, и этот фрагмент специфически гибридизуется с захватывающим олигонуклеотидом, и этот фрагмент удлиняется с образованием удлиненной цепи, что приводит к образованию удлиненного дуплекса между удлиненной цепью и захватывающим олигонуклеотидом, обеспечивая получение сигнала, указывающего на присутствие нуклеотидной последовательности-мишени.
Согласно одному из воплощений настоящего изобретения, если используют третий олигонуклеотид, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную удлиненной цепи, то в результате гибридизации третьего олигонуклеотида и удлиненной цепи образуется дуплекс другого типа, обеспечивая получение сигнала, указывающего на присутствие нуклеотидной последовательности-мишени.
Согласно одному из воплощений настоящего изобретения, если используют третий олигонуклеотид, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную захватывающему олигонуклеотиду, то образование дуплекса между данным третьим олигонуклеотидом и захватывающим олигонуклеотидом ингибируется в результате образования дуплекса между удлиненной цепью и захватывающим олигонуклеотидом, приводя к получению сигнала, указывающего на присутствие нуклеотидной последовательности-мишени.
Согласно одному из воплощений настоящего изобретения, фрагмент, удлиненная цепь, захватывающий олигонуклеотид, третий олигонуклеотид или их комбинация могут работать в качестве детектирующего олигонуклеотида.
Сигнал от дуплекса, образованного способом, зависящим от расщепления опосредующего олигонуклеотида, может генерироваться различными способами, включая способ с PTOCE (расщеплением и удлинением PTO) (WO 2012/096523), способ с PCE-SH (гибридизацией сигнального олигонуклеотида, зависящей от расщепления и удлинения PTO) (WO 2013/115442) и способ с PCE-NH (отсутствием гибридизации, зависящим от расщепления и удлинения PTO) (PCT/KR2013/012312).
Со ссылкой на термины, описанные в приведенных выше ссылках, соответствующими примерами олигонуклеотидов являются следующие: опосредующий олигонуклеотид, который соответствует зондирующему и метящему олигонуклеотиду (PTO), захватывающий олигонуклеотид, который соответствует захватывающему и матричному олигонуклеотиду (СТО; capturing and templating oligonucleotide) и третий олигонуклеотид, который соответствует сигнальному олигонуклеотиду (SO; signaling oligonucleotide) или гибридизующемуся олигонуклеотиду (НО; hybridization oligonucleotide), соответственно. SO, НО, СТО, удлиненная цепь или их комбинация могут взять на себя роль детектирующего олигонуклеотида.
Сигнал от дуплекса, образованного способом, зависящим от расщепления опосредующего олигонуклеотида, включает сигнал, получение которого обеспечивается посредством ингибирования образования другого дуплекса дуплексом, образованным способом, зависящим от расщепления опосредующего олигонуклеотида (например, способом с PCE-NH).
Например, когда сигнал от дуплекса, образованного способом, зависящим от расщепления опосредующего олигонуклеотида, генерируют способом с PTOCE, средство генерации сигнала содержит располагающийся "вверх по течению" олигонуклеотид и зондирующий и метящий олигонуклеотид (PTO), содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеотидной последовательности-мишени, захватывающий и матричный олигонуклеотид (СТО), подходящую метку и матричную полимеразу нуклеиновых кислот, обладающую 5'-нуклеазной активностью. PTO содержит (1) 3'-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеотидной последовательности-мишени, и (2) 5'-концевой тегирующий участок, содержащий нуклеотидную последовательность, не комплементарную нуклеотидной последовательности-мишени. СТО содержит в направлении 3'→5' (1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому тегирующему участку или части 5'-концевого тегирующего участка PTO, и (2) матричный участок, содержащий нуклеотидную последовательность, не комплементарную 5'-концевому тегирующему участку и 3'-концевому узнающему мишень участку PTO.
Конкретный пример генерирования сигналов способом с PTOCE включает стадии:
(a) гибридизации нуклеотидной последовательности-мишени с располагающимся "вверх по течению" олигонуклеотидом и PTO; (b) приведения в контакт продукта со стадии (a) с ферментом, обладающим 5'-нуклеазной активностью, в условиях, подходящих для расщепления PTO; при этом располагающийся "вверх по течению" олигонуклеотид или его удлиненная цепь индуцирует расщепление PTO ферментом, обладающим 5'-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка PTO; (c) гибридизации фрагмента, высвободившегося из PTO, с СТО; при этом фрагмент, высвободившийся из PTO, гибридизуется с захватывающим участком СТО; и (d) осуществления реакции удлинения с использованием продукта со стадии (c) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком СТО, удлиняется и образуется удлиненный дуплекс; причем удлиненный дуплекс имеет величину Tпл, регулируемую (1) последовательностью и/или длиной этого фрагмента, (2) последовательностью и/или длиной СТО либо (3) последовательностью и/или длиной фрагмента и последовательностью и/или длиной СТО; при этом удлиненный дуплекс обеспечивает получение сигнала от мишени посредством (1) по меньшей мере одной метки, соединенной с фрагментом и/или СТО, (2) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, (3) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения и метки, соединенной с фрагментом и/или СТО, или (4) интеркалирующей метки; и (e) детекции удлиненного дуплекса путем измерения сигнала от мишени при предварительно заданной температуре, при которой удлиненный дуплекс сохраняет свою двухцепочечную форму; тем самым присутствие удлиненного дуплекса указывает на присутствие нуклеотидной последовательности-мишени. В этом случае способ дополнительно включает повторение всех или некоторых из стадий (a)-(e) с денатурацией между повторяющимися циклами.
Во фразе "денатурация между повторяющимися циклами" термин "денатурация" означает разделение молекулы двухцепочечной нуклеиновой кислоты на молекулы одноцепочечной нуклеиновой кислоты.
На стадии (a) способа с PTOCE вместо располагающегося "вверх по течению" олигонуклеотида для амплификации нуклеотидной последовательности-мишени можно использовать комплект праймеров. В этом случае способ дополнительно включает повторение всех или некоторых из стадий (а)-(е) с денатурацией между повторяющимися циклами.
Способ с PTOCE можно классифицировать как способ, при котором фрагмент PTO, гибридизованный с СТО, удлиняется с образованием удлиненной цепи, и эту удлиненную цепь затем детектируют. Способ с PTOCE характеризуется тем, что детекцию образования удлиненной цепи осуществляют, используя дуплекс между удлиненной цепью и СТО.
Существует другой подход для детекции образования удлиненной цепи. Например, детекцию образования удлиненной цепи можно осуществлять, используя олигонуклеотид, специфически гибридизованный с удлиненной цепью (например, как в способе с PCE-SH). В этом способе получение сигнала может обеспечиваться посредством (1) метки, соединенной с олигонуклеотидом, специфически гибридизованным с удлиненной цепью, (2) метки, соединенной с олигонуклеотидом, специфически гибридизованным с удлиненной цепью, и метки, соединенной с фрагментом PTO, (3) метки, соединенной с олигонуклеотидом, специфически гибридизованным с удлиненной цепью, и метки, встраиваемой в удлиненную цепь во время реакции удлинения, или (4) метки, соединенной с олигонуклеотидом, специфически гибридизованным с удлиненной цепью, и интеркалирующим красителем. Альтернативно, получение сигнала может обеспечиваться посредством (1) метки, соединенной с удлиненной цепью, или (2) интеркалирующего красителя.
Альтернативно, детекцию образования удлиненной цепи осуществляют другим способом, при котором детектируют ингибирование гибридизации СТО с олигонуклеотидом, способным к специфической гибридизации с СТО (например, как в способе с PCE-NH). Такое ингибирование считается показателем присутствия нуклеотидной последовательности-мишени. Получение сигнала может обеспечиваться посредством (1) метки, соединенной с олигонуклеотидом, способным к гибридизации с СТО, (2) метки, соединенной с СТО, (3) метки, соединенной с олигонуклеотидом, способным к гибридизации с СТО, и метки, соединенной с СТО, или (4) интеркалирующей метки.
Согласно одному из воплощений олигонуклеотид, способный к специфической гибридизации с СТО, имеет последовательность, перекрывающуюся с фрагментом PTO.
Согласно одному из воплощений детектирующий олигонуклеотид включает олигонуклеотид, способный к специфической гибридизации с удлиненной цепью (например, как в способе с PCE-SH), и олигонуклеотид, способный к специфической гибридизации с СТО (например, как в способе с PCE-NH). Согласно одному из воплощений детектирующий олигонуклеотид включает удлиненную цепь, образованную во время реакции, или СТО.
Способы на основе PTOCE обычно включают образование удлиненной цепи в зависимости от присутствия нуклеотидной последовательности-мишени. Термин "способ на основе PTOCE" используется в данном описании в предположении, что он охватывает различные способы получения сигналов, включающие образование удлиненной цепи посредством расщепления и удлинения PTO.
Пример генерирования сигналов с использованием способов на основе PTOCE включает стадии: (а) гибридизации нуклеотидной последовательности-мишени с располагающимся "вверх по течению" олигонуклеотидом и PTO; (b) приведения в контакт продукта со стадии (а) с ферментом, обладающим 5'-нуклеазной активностью, в условиях, подходящих для расщепления PTO; при этом располагающийся "вверх по течению" олигонуклеотид или его удлиненная цепь индуцирует расщепление PTO ферментом, обладающим 5'-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка PTO; (c) гибридизации фрагмента, высвободившегося из PTO, с СТО, при этом фрагмент, высвободившийся из PTO, гибридизуется с захватывающим участком СТО; (d) осуществления реакции удлинения с использованием продукта со стадии (c) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком СТО, удлиняется с образованием удлиненной цепи; и (e) детекции образования удлиненной цепи путем детекции сигнала, генерируемого в зависимости от присутствия удлиненной цепи. На стадии (a) вместо располагающегося "вверх по течению" олигонуклеотида для амплификации нуклеотидной последовательности-мишени можно использовать комплект праймеров. В этом случае способ дополнительно включает повторение всех или некоторых из стадий (a)-(e) с денатурацией между повторяющимися циклами.
Согласно одному из воплощений сигнал, генерируемый в результате образования дуплекса, включает сигналы, индуцируемые посредством гибридизации с образованием дуплекса (например, гибридизации с образованием дуплекса как такового или гибридизации третьего олигонуклеотида), или посредством ингибирования гибридизации третьего олигонуклеотида вследствие образования дуплекса.
Согласно одному из воплощений средства генерации сигнала для каждой из нуклеотидных последовательностей-мишеней представляют собой средства генерации сигнала с использованием образования дуплекса способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью.
Согласно одному из воплощений, по меньшей мере одно из двух средств генерации сигнала представляет собой средство генерации сигнала для генерирования сигнала способом, зависящим от расщепления детектирующего олигонуклеотида.
В частности, сигнал генерируется в результате гибридизации детектирующего олигонуклеотида с нуклеотидной последовательностью-мишенью и затем расщепления детектирующего олигонуклеотида.
Сигнал, полученный в результате гибридизации детектирующего олигонуклеотида с нуклеотидной последовательностью-мишенью и затем расщепления детектирующего олигонуклеотида, может генерироваться различными способами, включая способ с применением TaqMan-зондов (патент США №5210015 и патент США №5538848).
Если сигнал генерируется с использованием способа с применением TaqMan-зондов, то средства генерации сигнала включают комплект праймеров для амплификации нуклеотидной последовательности-мишени, TaqMan-зонд, имеющий подходящую метку (например, систему двух взаимодействующих меток (interactive dual label)), и полимеразу нуклеиновых кислот, обладающую 5'-нуклеазной активностью. TaqMan-зонд, гибридизованный с нуклеотидной последовательностью-мишенью, расщепляется в процессе амплификации мишени и генерирует сигнал, указывающий на присутствие нуклеотидной последовательности-мишени.
Конкретный пример генерирования сигнала с использованием способа с применением TaqMan-зондов включает стадии: (а) гибридизации комплекта праймеров и TaqMan-зонда, имеющего подходящую метку (например, систему двух взаимодействующих меток), с нуклеотидной последовательностью-мишенью; (b) амплификации нуклеотидной последовательности-мишени с использованием продукта со стадии (а) и полимеразы нуклеиновых кислот, обладающей 5'-нуклеазной активностью, при этом TaqMan-зонд расщепляется с высвобождением этой метки; и (c) детекции генерирования сигнала от высвободившейся метки.
В частности, сигнал генерируется в результате расщепления детектирующего олигонуклеотида способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью.
Согласно одному из воплощений настоящего изобретения, если опосредующий олигонуклеотид, гибридизованный с нуклеотидными последовательностями-мишенями, расщепляется с высвобождением фрагмента, то этот фрагмент специфически гибридизуется с детектирующим олигонуклеотидом и этот фрагмент индуцирует расщепление детектирующего олигонуклеотида.
Согласно одному из воплощений настоящего изобретения, если опосредующий олигонуклеотид, гибридизованный с нуклеотидными последовательностями-мишенями, расщепляется с высвобождением фрагмента, то этот фрагмент удлиняется с расщеплением детектирующего олигонуклеотида, содержащего гибридизующуюся нуклеотидную последовательность, комплементарную захватывающему олигонуклеотиду.
Сигнал, полученный в результате расщепления детектирующего олигонуклеотида способом, зависящим от расщепления опосредующего олигонуклеотида, может генерироваться различными способами, включая анализ «Invader» (патент США № US 5691142), способ с РСЕС (РТО cleavage and extension-dependent cleavage - расщеплением, зависящим от удлинения и расщепления РТО) (WO 2012/134195) и способ, описанный в патенте США №7309573. В частности, способ, описанный в патенте США №7309573, можно рассматривать как один из способов на основе РТОСЕ, в котором используется генерирование сигналов в результате расщепления, и в данном способе образование удлиненной цепи можно детектировать посредством детекции расщепления олигонуклеотида, специфически гибридизованного с СТО в результате образования удлиненной цепи. В анализе «Invader» образуется фрагмент в результате расщепления опосредующего олигонуклеотида и индуцируются последующие реакции расщепления без какого-либо удлинения данного фрагмента.
Согласно одному из воплощений настоящего изобретения, если сигнал генерируется способом, зависящим от расщепления детектирующего олигонуклеотида, то в результате расщепления детектирующего олигонуклеотида индуцируется изменение сигнала или высвобождается меченый фрагмент, предназначенный для детекции.
Если средство генерации сигнала генерирует сигнал посредством одновременного расщепления детектирующего олигонуклеотида и образования дуплекса, то такое средство генерации сигнала может рассматриваться как средство генерации сигнала, обеспечивающее получение сигнала посредством расщепления, при условии, что его используют для генерирования сигнала посредством расщепления.
Согласно одному из воплощений генерирование сигналов способом, зависящим от расщепления детектирующего олигонуклеотида, используется для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции. Если сигнал генерируется посредством расщепления детектирующего олигонуклеотида, то высвободившуюся в результате расщепления метку можно детектировать при любых температурах. Таким образом, сигнал, генерируемый в результате расщепления детектирующего олигонуклеотида, не может быть применен для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, требуя ограничения температуры детекции.
Согласно одному из воплощений генерирование сигнала, зависящее от расщепления детектирующего олигонуклеотида, используют исключительно для одной нуклеотидной последовательности-мишени. Если генерирование сигнала, зависящее от расщепления детектирующего олигонуклеотида, используют для обеих из двух нуклеотидных последовательностей-мишеней, то эти две нуклеотидные последовательности-мишени невозможно дифференцированно детектировать в зависимости от температуры детекции.
Согласно одному из воплощений данного изобретения средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, представляет собой средство генерации сигнала с использованием расщепления детектирующего олигонуклеотида, а средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, представляет собой средство генерации сигнала с использованием образования дуплекса.
Согласно одному из воплощений данного изобретения средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, представляет собой средство генерации сигнала с использованием расщепления детектирующего олигонуклеотида, а средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, представляет собой средство генерации сигнала с использованием образования дуплекса способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью.
Согласно одному из воплощений детектирующий олигонуклеотид содержит по меньшей мере одну метку.
Согласно одному из воплощений настоящего изобретения детектирующий олигонуклеотид может состоять по меньшей мере из одного олигонуклеотида. Согласно одному из воплощений настоящего изобретения, если детектирующий олигонуклеотид состоит из множества олигонуклеотидов, то он может иметь метку в различных вариантах. Например, один олигонуклеотид среди множества олигонуклеотидов может иметь по меньшей мере одну метку, все олигонуклеотиды из множества могут иметь по меньшей мере одну метку или одна часть олигонуклеотидов может иметь по меньшей мере одну метку, а другая часть может не иметь метки.
Сигналы, генерируемые двумя средствами генерации сигнала, не различаются детектором одного типа. Термин "сигналы не различаются детектором одного типа" означает, что сигналы невозможно отличить друг от друга при использовании детектора одного типа ввиду того, что они имеют идентичные или по существу идентичные свойства сигналов (например, оптические свойства, длину волны излучения и электрический сигнал). Например, если для двух нуклеотидных последовательностей-мишеней используют одну и ту же метку (например, FAM (карбоксифлуоресцеин)), а для детекции на длине волны излучения от FAM используют детектор одного типа, то сигналы невозможно дифференцированно детектировать.
Использованный в данном описании термин "сигнал одного типа" относится к сигналам с идентичными или по существу идентичными свойствами сигналов (например, оптическими свойствами, длиной волны излучения и электрическим сигналом). Например, FAM и CAL Fluor 610 генерируют сигналы разных типов.
Использованный в данном описании термин "детектор одного типа" относится к средству детекции сигнала одного типа. В детекторе, содержащем несколько каналов (например, фотодиодов) для сигналов нескольких разных типов, каждый канал (например, фотодиод) соответствует "детектору одного типа".
Согласно одному из воплощений данного изобретения два средства генерации сигнала содержат идентичную метку, и сигналы от этой метки не различаются детектором одного типа.
Метка, используемая в настоящем изобретении, включает различные метки, известные в данной области техники. Например, метка, используемая в настоящем изобретении, включает одиночную метку, систему двух взаимодействующих меток, интеркалирующий краситель и встраиваемую метку.
Одиночная метка включает, например, флуоресцентную метку, люминесцентную метку, хемилюминесцентную метку, электрохимическую метку и металлическую метку. Согласно одному из воплощений одиночная метка обеспечивает получение иного сигнала (например, сигнала иной интенсивности) в зависимости от ее присутствия в двойной цепи или одиночной цепи. Согласно одному из воплощений одиночная метка представляет собой флуоресцентную метку. Предпочтительные типы и сайты связывания одиночных флуоресцентных меток, используемых в данном изобретении, описаны в патентах США №№7537886 и 7348141, идеи которых включены в данное описание посредством ссылки во всей своей полноте. Например, одиночная флуоресцентная метка включает JOE (2',7'-диметокси-4',5'-дихлорофлуоресцеин), FAM, TAMRA (тетраметилродамин), ROX (6-карбокси-Х-родамин) и метку на основе флуоресцеина. Одиночная метка может быть присоединена к олигонуклеотидам различными методами. Например, метку присоединяют к зондам через спейсер, содержащий атомы углерода (например, 3-углеродный спейсер, 6- углеродный спейсер или 12-углеродный спейсер).
В качестве репрезентативной системы взаимодействующих меток система меток при FRET (fluorescence resonance energy transfer - резонансном переносе энергии флуоресценции) включает в себя флуоресцентную репортерную молекулу (донорную молекулу) и молекулу-гаситель (акцепторную молекулу). При FRET донор энергии является флуоресцентным, а акцептор энергии может быть флуоресцентным или не быть флуоресцентным. Для другой формы систем взаимодействующих меток донор энергии не является флуоресцентным, например, является хромофором, а акцептор энергии является флуоресцентным. Для еще одной формы систем взаимодействующих меток донор энергии является люминесцентным, например биолюминесцентным, хемилюминесцентным, электрохемилюминесцентным, а акцептор является флуоресцентным. Система взаимодействующих меток включает двойную метку на основе "контакт-опосредованного гашения" (Salvatore et al., Nucleic Acids Research, 2002 (30), №21, e122 и Johansson et al., J. Am. Chem. Soc, 2002 (124), pp. 6950-6956). Система взаимодействующих меток включает любую систему меток, в которой изменение сигнала индуцируется взаимодействием между по меньшей мере двумя молекулами (например, красителя).
Репортерная молекула и молекула-гаситель для применения в настоящем изобретении могут включать любые молекулы, известные в данной области техники. Примерами их являются: Су2™ (506), YO-PRO™-1 (509), YOYO™-1 (509), кальцеин (517), FITC (флуоресцеинизотиоцианат) (518), FluorX™ (519), Alexa™ (520), родамин 110 (520), Oregon Green™ 500 (522), Oregon Green™ 488 (524), RiboGreen™ (525), Rhodamine Green™ (527), родамин 123 (529), Magnesium Green™ (531), Calcium Green™ (533), TO-PRO™-1 (533), TOT01 (533), JOE (548), BODIPY530/550 (550), Dil (565), BODIPY TMR (568), BODIPY558/568 (568), BODIPY564/570 (570), Cy3™ (570), Alexa™ 546 (570), TRITC (тетраметилродамин-изотиоцианат) (572), Magnesium Orange™ (575), фикоэритрин R&B (575), родамин-фаллоидин (575), Calcium Orange™ (576), пиронин Y (580), родамин В (580), TAMRA (582), Rhodamine Red™ (590), Cy3.5™ (596), ROX (608), Calcium Crimson™ (615), Alexa™ 594 (615), техасский красный (615), нильский красный (628), Y0-PR0™-3 (631), YOYO™-3 (631), R-фикоцианин (642), С-фикоцианин (648), TO-PRO™-3 (660), ТОТО3 (660), DiD DilC(5) (665), Су5™ (670), тиадикарбоцианин (671), Су5.5 (694), HEX (556), ТЕТ (536), Biosearch Blue (447), CAL Fluor Gold 540 (544), CAL Fluor Orange 560 (559), CAL Fluor Red 590 (591), CAL Fluor Red 610 (610), CAL Fluor Red 635 (637), FAM (520), флуоресцеин (520), флуоресцеин-С3 (520), Pulsar 650 (566), Quasar 570 (667), Quasar 670 (705) и Quasar 705 (610). Числа в скобках представляют собой длину волны, соответствующую максимуму излучения, в нанометрах. Предпочтительно, чтобы репортерная молекула и молекула-гаситель включали JOE, FAM, TAMRA, ROX и другую метку на основе флуоресцеина.
Подходящая флуоресцентная молекула и подходящие пары репортер-гаситель описаны в ряде публикаций, которые приведены ниже: Pesce et al., editors, Fluorescence Spectroscopy (Marcel Dekker, New York, 1971); White et al., Fluorescence Analysis: A Practical Approach (Marcel Dekker, New York, 1970); Berlman, Handbook of Fluorescence Spectra of Aromatic Molecules, 2nd Edition (Academic Press, New York, 1971); Griffiths, Color and Constitution of Organic Molecules (Academic Press, New York, 1976); Bishop, editor, Indicators (Pergamon Press, Oxford, 1972); Haugland, Handbook of Fluorescent Probes and Research Chemicals (Molecular Probes, Eugene, 1992); Pringsheim, Fluorescence and Phosphorescence (Interscience Publishers, New York, 1949); Haugland, R.P., Handbook of Fluorescent Probes and Research Chemicals, 6th Edition (Molecular Probes, Eugene, Oreg., 1996); патенты США №№3996345 и 4351760.
Стоит отметить, что в настоящем изобретении может быть использована нефлуоресцентная молекула-гаситель (например, "черный" гаситель или темный гаситель), способная гасить флуоресценцию в широком диапазоне длин волн или на конкретной длине волны.
В системе генерирования сигналов, содержащей молекулы репортера и гасителя, термин "репортер" охватывает донора FRET, а термин "гаситель" охватывает другого партнера (акцептора) FRET. Например, в качестве репортера используют краситель на основе флуоресцеина, а в качестве гасителя краситель на основе родамина.
Система двух взаимодействующих меток может быть соединена с одной цепью дуплекса. Если данная цепь, содержащая систему двух взаимодействующих меток, переходит в одноцепочечное состояние, то она формирует шпильку или принимает структуру случайного клубка, индуцируя гашение между двумя взаимодействующими метками в этой системе. Если эта цепь формирует дуплекс, гашение ослабляется. Альтернативно, если система двух взаимодействующих меток соединена с нуклеотидами, расположенными близко друг к другу в этой цепи, то гашение между двумя взаимодействующими метками в этой системе происходит. Если эта цепь формирует дуплекс и затем расщепляется, то гашение ослабляется.
Каждая из двух взаимодействующих меток в этой системе может быть соединена с каждой из двух цепей дуплекса. Образование дуплекса индуцирует гашение, а денатурация дуплекса приводит к отсутствию гашения. Альтернативно, если одна из двух цепей расщепляется, то это может приводить к отсутствию гашения.
Примеры интеркалирующих красителей для применения в данном изобретении включают SYBR™ Green I, PO-PRO™-1, BO-PRO™-1, SYTO™43, SYTO™44, SYTO™45, SYTOX™Blue, POPO™-1, POPO™-3, BOBO™-1, BOBO™-3, LO-PRO™-1, JO-PRO YO-PRO™1, TO-PRO™1, SYTO™11, SYTO™13, SYTO™15, SYTO™16, SYTO™20, SYTO™23, TOTO™-3, YOYO™3, GelStar™ и триазоловый оранжевый. Эти интеркалирующие красители специфически интеркалируют в двухцепочечные молекулы нуклеиновых кислот, генерируя сигналы.
В способе генерирования сигналов можно использовать встраиваемую метку путем встраивания метки в процессе удлинения праймера (например, в способе Plexor; Sherrill СВ., et al., Journal of the American Chemical Society, 126: 4550-45569 (2004)). Встраиваемую метку также можно использовать для генерирования сигнала дуплексом, образованным способом, зависящим от расщепления опосредующего олигонуклеотида, гибридизованного с нуклеотидной последовательностью-мишенью.
Обычно встраиваемая метка может быть соединена с нуклеотидами. Также можно использовать нуклеотид, содержащий неприродное основание.
Использованный в данном описании термин "неприродное основание" относится к производным природных оснований, таких как аденин (А), гуанин (G), тимин (Т), цитозин (С) и урацил (U), которые способны к образованию связанных водородными связями пар оснований. Использованный в данном описании термин "неприродное основание" включает в себя основания, характеризующиеся другими картинами образования пар оснований по сравнению с природными основаниями как исходными соединениями (mother compounds), как описано, например, в патентах США №№5432272, 5965364, 6001983 и 6037120. Образование пар оснований между неприродными основаниями заключается в образовании двух или трех водородных связей, как и у природных оснований. Образование пар оснований между неприродными основаниями также происходит с учетом специфичности. Конкретные примеры неприродных оснований включают следующие основания в комбинациях пар оснований изо-С/изо-G, изо-dC/изо-dG, К/Х, H/J и M/N (см. патент США №7422850).
Если сигнал генерируют способом с РТОСЕ, то нуклеотид, встраиваемый в процессе реакции удлинения, может иметь первое неприродное основание, а СТО может содержать нуклеотид, имеющий второе неприродное основание, обладающее аффинностью специфического связывания с первым неприродным основанием.
Использованный в данном описании термин "нуклеиновая кислота-мишень", "нуклеотидная последовательность-мишень" или "последовательность-мишень" относится к нуклеотидной последовательности, представляющей интерес для детекции или количественного определения. Нуклеотидная последовательность-мишень содержит последовательность в форме одиночной цепи, а также в форме двойной цепи. Нуклеотидная последовательность-мишень содержит последовательность, изначально присутствующую в образце нуклеиновой кислоты, а также последовательность, заново образованную в реакциях.
Нуклеотидная последовательность-мишень может включать любые молекулы ДНК (гДНК (геномная ДНК) и кДНК (комплементарная ДНК)), РНК и их гибриды (химерную нуклеиновую кислоту). Последовательность может быть представлена или в двухцепочечной, или в одноцепочечной форме. Если нуклеиновая кислота в качестве исходного вещества является двухцепочечной, то предпочтительно перевести эти две цепи в одноцепочечную или частично одноцепочечную форму. Известные способы разделения цепей включают, но не ограничиваются этим, нагревание, обработку щелочью, формамидом, мочевиной и глиоксалем, ферментативные методы (например, действие геликаз) и связывание белков. Например, разделения цепей можно достичь посредством нагревания при температуре, изменяющейся в диапазоне от 80°С до 105°С. Общие методы осуществления такой обработки приведены в Joseph Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2001).
Если в качестве исходного материала используют мРНК, то перед проведением стадии отжига необходимо провести стадию обратной транскрипции, детали которой можно найти в Joseph Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2001); и Noonan K.F. et al., Nucleic Acids Res., 16: 10366 (1988). Для проведения обратной транскрипции можно использовать олигонуклеотид dT в качестве праймера, способный гибридизоваться с поли(А)-хвостом мРНК, случайные праймеры или мишень-специфичные праймеры.
Нуклеотидная последовательность-мишень включает любую природную нуклеиновую кислоту прокариотического, эукариотического (например, из простейших и паразитов, грибов, дрожжей, высших растений, низших и высших животных, в том числе млекопитающих и человека), вирусного (например, из вирусов герпеса, вируса иммунодефицита человека (ВИЧ), вируса гриппа, вируса Эпштейна-Барр, вируса гепатита, полиовируса и т.д.) или вироидного происхождения. Молекула нуклеиновой кислоты также может представлять собой молекулу любой нуклеиновой кислоты, которая была получена или может быть получена методами рекомбинантной ДНК или химическим синтезом. Таким образом, нуклеотидная последовательность может быть обнаружена в природе или может не встречаться в природе. Нуклеотидная последовательность-мишень может включать известные или неизвестные последовательности.
Использованный в данном описании термин "образец" относится к любой клетке, ткани или жидкости из биологического источника либо любой другой среды, которую можно предпочтительно оценить согласно данному изобретению, включая вирус, бактерии, ткань, клетку, кровь, сыворотку крови, плазму крови, лимфу, молоко, мочу, фекалии, внутриглазную жидкость, слюну, семенную жидкость, экстракты головного мозга, спинномозговую жидкость (SCF), аппендикс, экстракты ткани селезенки и миндалин, амниотическую жидкость, асцитическую жидкость и небиологические образцы (например, пищу и воду). Помимо этого, образец включает молекулы существующих в природе нуклеиновых кислот, выделенных из биологических источников, и молекулы синтетических нуклеиновых кислот.
Согласно одному из воплощений данного изобретения стадию (а) проводят в процессе амплификации сигнала одновременно с амплификацией нуклеиновой кислоты.
В настоящем изобретении сигнал, генерируемый средством генерации сигнала, может быть амплифицирован одновременно с амплификацией мишени. Альтернативно, данный сигнал может быть амплифицирован вообще без амплификации мишени.
Согласно одному из воплощений данного изобретения генерирование сигнала осуществляют в способе, включающем амплификацию сигнала вместе с амплификацией мишени.
Согласно одному из воплощений данного изобретения амплификацию мишеней осуществляют с использованием ПЦР (полимеразная цепная реакция). ПЦР широко применяется в данной области техники для амплификации мишеней, включая в себя циклы, состоящие из денатурации последовательности-мишени, отжига (гибридизации) данной последовательности-мишени с праймерами и удлинения праймеров (Mullis et al., патенты США №№4683195, 4683202 и 4800159; Saiki et al., (1985) Science, 230, 1350-1354). Сигнал может быть амплифицирован посредством совместного применения описанных выше способов генерирования сигнала (например, TaqMan-способа и способов на основе РТОСЕ) с методом ПЦР. Согласно одному из воплощений настоящего изобретения предложено получение сигналов с использованием метода ПЦР в режиме реального времени. Согласно одному из воплощений амплификацию нуклеотидной последовательности-мишени осуществляют с использованием ПЦР (полимеразная цепная реакция); LCR (ligase chain reaction - лигазная цепная реакция; см. Wiedmann М., et al., "Ligase chain reaction (LCR) - overview and applications". PCR Methods and Applications, 1994 Feb, 3(4): S51-64), GLCR (gap filling LCR - LCR с заполнением бреши; см. WO 90/01069, ЕР 439182 и WO 93/00447), Q-beta (Q-beta replicase amplification - амплификации с использованием Q-бета-репликазы; см. Cahill P., et al., Clin. Chem., 37(9): 1482-5 (1991); патент США №5556751), SDA (strand displacement amplification - амплификация с замещением цепей; см. G.T. Walker et al., Nucleic Acids Res., 20(7): 1691-1696 (1992), EP 497272), NASBA (nucleic acid sequence-based amplification -амплификация, основанная на последовательности нуклеиновых кислот; см. Compton, J. Nature, 350 (6313): 912 (1991)), ТМА (transcription-mediated amplification -транскрипционно-опосредованная амплификация; см. Hofmann W.P. et al., J. Clin. Virol., 32(4): 289-93 (2005); патент США №5888779) или RCA (rolling circle amplification - амплификация по типу катящегося кольца; см. Hutchison С.А. et al., Proc. Natl. Acad. Sci. USA, 102: 17332-17336 (2005)).
Используя описанные выше способы амплификации, можно амплифицировать последовательности-мишени путем повторения серии реакций с изменением или без изменения температуры. Один элемент (unit) процесса амплификации, включающий повторение серии реакций, называется "циклом". Элементом циклов может быть названо число повторений или время, в зависимости от способов амплификации.
Например, детекцию сигналов можно осуществить в каждом цикле амплификации, нескольких выбранных циклах или в конечной точке реакции. Согласно одному из воплощений, если сигналы детектируют по меньшей мере для двух циклов, то детекцию сигнала в отдельном цикле можно осуществить при всех температурах детекции или при некоторых выбранных температурах детекции. Согласно одному из воплощений данного изобретения детекцию осуществляют при относительно высокой температуре детекции для циклов с нечетными номерами и при относительно высокой температуре детекции для циклов с четными номерами.
Согласно одному из воплощений данного изобретения инкубирование проводят в условиях, позволяющих осуществлять амплификацию мишени, равно как и генерирование сигнала с использованием средств генерации сигнала.
Согласно одному из воплощений данного изобретения стадию (а) проводят в процессе амплификации сигнала без амплификации нуклеиновой кислоты.
Если сигнал генерируют с использованием способов, включающих расщепление олигонуклеотида, то такой сигнал может быть амплифицирован вообще без амплификации мишени. Например, стадия (а) может быть проведена с амплификацией сигналов, но без амплификации последовательностей-мишеней согласно способу СРТ (cycling probe technology - технология циклического зонда) (Duck Р, et al., Biotechniques, 9: 142-148 (1990)), анализу «Invader» (патенты США №№6358691 и 6194149), способам на основе РТОСЕ (например, способу с PCE-SH, способу с PCE-NH и способу с РСЕС) или способу CER (cyclic exonucleolytic reaction - циклическая экзонуклеолитическая реакция) (WO 2011/037306).
Используя описанные выше способы амплификации сигналов, можно амплифицировать сигналы путем повторения серии реакций с изменением или без изменения температуры. Один элемент процесса амплификации, включающий повторение серии реакций, называется "циклом". Элементом циклов может быть названо число повторений или время, в зависимости от способов амплификации.
Например, генерирование и детекция сигналов могут быть осуществлены для каждого цикла амплификации, для нескольких выбранных циклов или в конечной точке реакции.
Амплификацию нуклеотидной последовательности-мишени осуществляют с использованием средства амплификации мишени, включающего комплект праймеров для амплификации и полимеразу нуклеиновых кислот.
Согласно одному из воплощений настоящего изобретения можно использовать полимеразу нуклеиновых кислот, обладающую нуклеазной активностью (например, 5'-нуклеазной активностью или 3'-нуклеазной активностью). Согласно одному из воплощений настоящего изобретения можно использовать полимеразу нуклеиновых кислот, не обладающую нуклеазной активностью.
Полимераза нуклеиновых кислот, используемая в настоящем изобретении, представляет собой термостабильную ДНК-полимеразу, полученную из ряда бактериальных видов, включая Thermus aquaticus (Taq), Themnus thermophilus (Tth), Thermus filiformis, Thermus flavus, Thermococcus literalis, Thermus antranikianii, Thermus caldophilus, Thermus chliarophilus, Thermus igniterrae, Thermus lacteus, Thermus oshimai, Thermus ruber, Thermus rubens, Thermus scotoductus, Thermus silvanus, Thermus species 205, Thermus species sps 17, Thermotoga maritima, Thermotoga neapolitana, Thermosipho africanus, Thermococcus litoralis, Thermococcus barossi, Thermococcus gorgonarius, Pyrococcus woesei, Pyrococcus horikoshii, Pyrococcus abyssi, Pyrodictium occultum, Aquifex pyrophilus и Aquifex aeolieus. В частности, термостабильная ДНК-полимераза представляет собой Taq полимеразу.
Согласно одному из воплощений настоящего изобретения амплификацию нуклеотидной последовательности-мишени осуществляют с использованием асимметричной ПЦР. Соотношение праймеров может быть выбрано с учетом расщепления или гибридизации располагающихся "вниз по течению" олигонуклеотидов.
В процессе или после инкубирования (взаимодействия) образца с двумя средствами генерации сигнала с целью генерирования сигнала, генерируемый сигнал детектируют, используя детектор одного типа.
Одна из двух нуклеотидных последовательностей-мишеней имеет относительно высокую температуру детекции, а другая имеет относительно низкую температуру детекции, определяемую с использованием соответствующего средства генерации сигнала.
Использованное в данном описании выражение "нуклеотидная последовательность-мишень имеет температуру детекции, определяемую с использованием соответствующиего средства генерации сигнала" относится к тому, что нуклеотидная последовательность-мишень детектируется при температуре детекции, предварительно заданной для данной нуклеотидной последовательности-мишени, что позволяет детектировать генерируемый сигнал от средства генерации сигнала, разработанного для генерирования сигнала при данной температуре детекции.
Согласно одному из воплощений настоящего изобретения одну температуру детекции, определяемую с использованием соответствующего средства генерации сигнала, задают одной нуклеотидной последовательности-мишени.
Относительно высокая температура детекции представляет собой температуру, допускающую генерирование сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, а относительно низкая температура детекции представляет собой температуру, допускающую генерирование как сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, так и сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции.
Один из признаков настоящего изобретения заключается в дифференцированном определении присутствия двух нуклеотидных последовательностей-мишеней путем детектирования при разных температурах детекции сигналов, указывающих на присутствие этих двух нуклеотидных последовательностей-мишеней.
Согласно одному из воплощений, температуры детекции для нуклеотидных последовательностей-мишеней предварительно задаются с учетом температурного диапазона, допускающего генерирование сигнала с использованием средств генерации сигнала.
В настоящем изобретение используется тот факт, что имеется конкретный температурный диапазон, допускающий генерирование сигнала способом, зависящим от средства генерации сигнала.
Например, если средство генерации сигнала генерирует сигнал в результате гибридизации (или ассоциации) двух молекул нуклеиновой кислоты и не генерирует сигнала при отсутствии их гибридизации (или при их диссоциации), то сигнал генерируется при температурах, допускающих гибридизацию двух молекул нуклеиновой кислоты, однако, никакого сигнала не генерируется при температурах, при которых не происходит гибридизации двух молекул нуклеиновой кислоты. Соответственно, имеется конкретный температурный диапазон, допускающий генерирование сигнала (т.е. детекцию сигнала), и другой температурный диапазон, не допускающий генерирования сигнала. Температурные диапазоны зависят от величины Тпл для гибрида из двух молекул нуклеиновой кислоты, применяемых в качестве средств генерации сигнала.
Если применяют способ генерирования сигнала с использованием фрагмента с меткой, высвободившегося после расщепления, то детекцию такого сигнала теоретически можно осуществлять при любой температуре (например, 30-99°С).
Температуру детекции выбирают из температурного диапазона, допускающего генерирование сигнала с использованием такого средства генерации сигнала.
Термин "диапазон температур детекции" используется в данной заявке для конкретного описания температурного диапазона, допускающего генерирование сигнала (т.е. детекцию сигнала).
Если имеются разные диапазоны температур детекции в зависимости от средств генерации сигнала для двух нуклеотидных последовательностей-мишеней, то в качестве относительно высокой температуры детекции может быть выбран неперекрывающийся диапазон температур детекции. Нуклеотидную последовательность-мишень, детектируемую с использованием средства генерации сигнала, обеспечивающего относительно высокую температуру детекции, определяют как нуклеотидную последовательность-мишень, имеющую относительно высокую температуру детекции. В качестве относительно низкой температуры детекции может быть выбран перекрывающийся диапазон температур детекции. Нуклеотидную последовательность-мишень, детектируемую с использованием средства генерации сигнала, обеспечивающего относительно низкую температуру детекции и не обеспечивающего относительно высокой температуры детекции, определяют как нуклеотидную последовательность-мишень, имеющую относительно низкую температуру детекции.
Согласно одному из воплощений область неперекрывания и область перекрывания невозможно различимо отличить друг от друга. Например, сигнал, обеспечиваемый нуклеотидной последовательностью-мишенью, имеющей относительно низкую температуру детекции, может генерироваться с намного более низкой интенсивностью при относительно высокой температуре детекции, выбранной для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции. В этом случае проблема ложного сигнала, обусловленная сигналом, обеспечиваемым нуклеотидной последовательностью-мишенью, имеющей относительно низкую температуру детекции, при относительно высокой температуре детекции может быть преодолена путем соответствующего выбора референсного значения (reference value) для определения значимости сигналов, детектируемых при относительно высокой температуре детекции.
Согласно одному из воплощений, температуры детекции могут быть предварительно заданы с учетом неперекрывающегося диапазона температур детекции и перекрывающегося диапазона температур детекции среди температур детекции.
Согласно одному из воплощений, температуры детекции, заданные для нуклеотидных последовательностей-мишеней, отличаются друг от друга по меньшей мере на 2°С, 3°С, 4°С, 5°С, 7°С, 8°С, 9°С, 10°С, 11°С, 12°С, 15°С или 20°С.
Согласно настоящему изобретению, температура для детекции присутствия каждой из нуклеотидных последовательностей-мишеней может быть установлена с учетом средств генерации сигнала.
Согласно одному из воплощений данного изобретения для одной из двух нуклеотидных последовательностей-мишеней задают относительно высокую температуру детекции, а для другой задают относительно низкую температуру детекции, и затем конструируют средства генерации сигнала, подходящие для данных температур детекции, после чего проводят стадию (а).
Согласно одному из воплощений, относительно высокая температура детекции и относительно низкая температура детекции, при которых осуществляют детекцию, могут быть заданы предварительно. Например, для относительно высокой температуры детекции и относительно низкой температуры детекции предварительно задают 72°С и 60°С, соответственно, и затем конструируют средства генерации сигнала, подходящие для данных температур детекции, после чего проводят стадию (а).
Согласно одному из воплощений, сначала конструируют средства генерации сигнала для двух нуклеотидных последовательностей-мишеней, а затем для этих двух нуклеотидных последовательностей-мишеней устанавливают температуры детекции, после чего проводят стадию (а).
Согласно одному из воплощений данного изобретения, если средство генерации сигнала генерирует сигнал способом, зависящим от образования дуплекса, то температуру детекции выбирают с учетом величины Тпл дуплекса.
Согласно одному из воплощений данного изобретения, если средство генерации сигнала генерирует сигнал способом, зависящим от образования дуплекса, то температуру детекции регулируют путем корректировки величины Тпл дуплекса.
Например, если сигнал генерируют с использованием детектирующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью (например, зондом Lux, зондом "молекулярный маяк", зондом HyBeacon и смежным гибридизационным зондом), то детекцию сигнала успешно осуществляют при предварительно заданной температуре путем корректировки величины Тпл для олигонуклеотида. Если используют праймер типа "scorpion", то детекцию сигнала успешно осуществляют при предварительно заданной температуре путем корректировки величины Тпл для той части, которая подлежит гибридизации с удлиненной цепью.
Если сигнал генерируется дуплексом, образованным в зависимости от присутствия нуклеотидной последовательности-мишени, то детекцию сигнала успешно осуществляют при предварительно заданной температуре путем корректировки величины Тпл дуплекса. Например, если сигнал генерируется способом с РТОСЕ, то детекцию сигнала успешно осуществляют при предварительно заданной температуре путем корректировки величины Тпл удлиненного дуплекса, образованного в результате удлинения фрагмента РТО на СТО.
Способы на основе РТОСЕ имеют преимущества, заключающиеся в легкости корректировки величин Тпл дуплекса или третьего гибрида, гибридизация которого зависит от дуплекса.
Согласно одному из воплощений данного изобретения, если средство генерации сигнала генерирует сигнал способом, зависящим от расщепления детектирующего олигонуклеотида, то температуру детекции выбирают произвольным образом. Другими словами, может быть выбрана любая температура при условии, что можно детектировать сигнал, генерируемый в результате расщепления детектирующего олигонуклеотида. Как описано выше, если сигнал генерируется способом, зависящим от расщепления детектирующего олигонуклеотида, то метку, высвободившуюся в результате такого расщепления, можно детектировать при разных температурах.
Согласно одному из воплощений, если сигнал генерируется способом, зависящим от расщепления детектирующего олигонуклеотида, то температуру детекции выбирают такой, чтобы она представляла собой самую относительно высокую температуру детекции.
Как обсуждалось выше, температуру детекции определяют с учетом диапазона температур детекции в зависимости от средства генерации сигнала. Поэтому детекцию сигнала при конкретной температуре детекции можно описать следующим образом: детекция при относительно высокой температуре детекции предназначена для детекции нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, и детекция при относительно низкой температуре детекции предназначена для детекции как нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, так и для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции.
Например, если оба сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, и нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, генерируются способом с РТОСЕ, то сигнал для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, генерируется удлиненным дуплексом, имеющим величину Тпл, подходящую для относительно высокой температуры детекции, а сигнал для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, генерируется удлиненным дуплексом, имеющим величину Тпл, подходящую для относительно низкой температуры детекции. Если сигнал детектируют при относительно высокой температуре детекции, то удлиненный дуплекс, имеющий величину Тпл, подходящую для относительно низкой температуры детекции, диссоциирует с переходом в одиночную цепь, и поэтому никакого сигнала не генерируется, тем самым детектируется только сигнал для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции. Если сигнал детектируют при относительно низкой температуре детекции, то и удлиненный дуплекс, имеющий величину Тпл, подходящую для относительно высокой температуры детекции, и удлиненный дуплекс, имеющий величину Тпл, подходящую для относительно низкой температуры детекции, оба сохраняют свою форму дуплекса, тем самым детектируются оба сигнала, и сигнал для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, и сигнал для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции.
В другом примере, если сигнал для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, генерируется TaqMan-способом, а сигнал для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, генерируется способом с РТОСЕ, то получение сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, обеспечивается высвободившейся флуоресцентной меткой, а получение сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, обеспечивается удлиненным дуплексом, имеющим величину Тпл, подходящую для относительно низкой температуры детекции. Если сигнал детектируют при относительно высокой температуре детекции, то удлиненный дуплекс, имеющий величину Тпл, подходящую для относительно низкой температуры детекции, диссоциирует с переходом в одиночную цепь, и поэтому никакого сигнала не генерируется, тем самым детектируется только сигнал от высвободившейся флуоресцентной метки для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции. Если сигнал детектируют при относительно низкой температуре детекции, то детектируется не только сигнал, обеспечиваемый удлиненным дуплексом, имеющим величину Тпл, подходящую для относительно низкой температуры детекции, но также сигнал от высвободившейся флуоресцентной метки, тем самым детектируются оба сигнала, и сигнал для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, и сигнал для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции.
Детектор, используемый в настоящем изобретении, включает любые средства, способные детектировать сигналы. Например, если используют сигналы флуоресценции, то в качестве детекторов можно применять фотодиоды, подходящие для детекции сигналов флуоресценции. Детекция с применением детектора одного типа означает, что детекцию осуществляют, используя детектор, способный детектировать сигнал одного типа, или используя любой канал (т.е. фотодиод) детектора, содержащего несколько каналов (т.е. фотодиодов).
Согласно одному из воплощений, термин "генерирование сигналов" включает в себя "генерирование или гашение сигналов" и "усиление или ослабление сигналов" от меток.
Стадия (b). Определение присутствия нуклеотидных последовательностей-мишеней
После детекции сигнала присутствие двух нуклеотидных последовательностей-мишеней определяют на основе сигнала, детектируемого на стадии (а).
Присутствие нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, определяют на основе сигнала, детектируемого при относительно высокой температуре детекции. Присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, определяют по разнице между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции.
Сигналы, используемые для определения присутствия мишени, имеют различные характеристики сигналов с точки зрения детекции сигнала, например, интенсивность сигнала (например, величину RFU (относительных единиц флуоресценции) или, в случае проведения амплификации, величины RFU для конкретного цикла, для выбранных циклов или в конечной точке), форму (или картину) изменения сигнала или значение Ct (threshold cycle - пороговый цикл) либо величины, получаемые в результате математической обработки этих характеристик.
Согласно одному из воплощений данного изобретения, если кривую амплификации получают с использованием ПЦР в режиме реального времени, то для определения присутствия мишени можно выбирать и использовать различные величины сигналов (или характеристики) из кривой амплификации (интенсивность, значение Ct или данные кривой амплификации).
Характеристики сигнала, полученного при относительно высокой температуре детекции, можно использовать как таковые для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции.
Альтернативно, для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, можно использовать модифицированный сигнал, получаемый в результате математической обработки характеристик сигнала.
Характеристики сигналов при относительно высокой температуре детекции как таковые и относительно низкой температуре детекции как таковые можно использовать для получения разницы между сигналами при относительно высокой температуре детекции и относительно низкой температуре детекции.
Альтернативно, один или оба сигнала при относительно высокой температуре детекции и относительно низкой температуре детекции можно модифицировать, проводя математическую обработку характеристик сигнала, и использовать для получения разницы между сигналами при относительно высокой температуре детекции и относительно низкой температуре детекции.
Согласно одному из воплощений, термин "сигнал" в сочетании с фразой "сигналы, детектируемые при относительно высокой температуре детекции и относительно низкой температуре детекции" включает в себя не только сигнал, получаемый при температуре детекции как таковой, но также и модифицированный сигнал, получаемый в результате математической обработки данного сигнала.
Согласно одному из воплощений, если проводят математическую обработку, то характеристики сигнала должны представлять собой характеристики, легко поддающиеся математической обработке. В конкретном воплощении математическая обработка включает вычисление (например, операции сложения, умножения, вычитания и деления), проводимое в отношении сигналов, или получение других величин на основе сигналов. Сигналы, используемые для определения присутствия нуклеотидных последовательностей-мишеней по настоящему изобретению обычно представляют собой значимый сигнал. Другими словами, эти сигналы представляют собой сигнал, который генерируется в зависимости от присутствия нуклеотидных последовательностей-мишеней. Вместе с тем, если рассчитывают разницу между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции, то для расчета такой разницы можно использовать незначимый сигнал, такой как фоновые сигналы. В этом отношении следует понимать, что сигналы, используемые для определения присутствия нуклеотидных последовательностей-мишеней, охватывают не только значимые сигналы, но также и незначимые сигналы, при условии, что они могут быть использованы для расчета данной разницы или включены в способ определения.
Согласно одному из воплощений, значимость детектируемых сигналов можно определить, используя пороговое значение. Например, пороговое значение предварительно задают на основании отрицательного контроля, учитывая фоновые сигналы детектора, чувствительность или используемую метку, а затем можно определять значимость сигналов от образцов.
Если сигнал (т.е. значимый сигнал) детектируется при относительно высокой температуре детекции, то это означает, что нуклеотидная последовательность-мишень, имеющая относительно высокую температуру детекции, присутствует.
Незначимый сигнал также может быть представлен в данном описании выражением "отсутствие сигнала" или "отсутствие детекции сигнала".
Использованный в данном описании термин "на основе сигнала" в сочетании с определением присутствия нуклеотидных последовательностей-мишеней означает, что присутствие нуклеотидных последовательностей-мишеней определяют непосредственно или опосредованно, используя или модифицируя сигналы, генерируемые от средств генерации сигнала, в том числе используя численные значения для сигналов или их модифицированных вариантов, используя присутствие/отсутствие сигналов и сравнивая сигнал с порогом. Не подразумевается никакого различия между терминами "на основе сигнала" и "с использованием сигнала", и эти термины будут применены взаимозаменяемо.
Использованный в данном описании термин "определение на основе сигнала" со ссылкой на определение присутствия нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, может включать определение присутствия нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, с учетом значимости сигнала, детектируемого при относительно высокой температуре детекции.
Согласно данному изобретению присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, определяют на основе сигнала, детектируемого при относительно высокой температуре детекции, и сигнала, детектируемого при относительно низкой температуре детекции.
Если сигнал детектируют при относительно низкой температуре детекции, то указанный сигнал как таковой не позволяет определить присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции. Причина этого заключается в том, что при относительно низкой температуре детекции может детектироваться сигнал для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции.
Данный признак настоящего изобретения относится к использованию сигнала, детектируемого при относительно высокой температуре детекции, для анализа сигнала, детектируемого при относительно низкой температуре детекции.
Интересно отметить, что авторы настоящего изобретения обнаружили, что если сигналы, указывающие на присутствие одной нуклеотидной последовательности-мишени, детектируют в одном реакционном сосуде при двух предварительно заданных температурах детекции, то имеет место изменение сигнала согласно определенной(ому) закономерности (правилу).
Например, изменение сигналов между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции, для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, демонстрирует определенную(ое) закономерность (правило). Например, интенсивности этих сигналов могут быть идентичными или по существу идентичными либо интенсивности этих сигналов могут быть разными, но в конкретном диапазоне при двух температурах детекции.
Данный признак настоящего изобретения относится к применению этих наблюдений для детекции нуклеотидных последовательностей-мишеней.
Поскольку сигналы для нуклеотидной последовательности-мишени в одном реакционном сосуде детектируют, используя только различие в температурах детекции (например, без какого-либо изменения количества мишени или без каких-либо изменений условий, относящихся к буферной системе), то имеется определенная(ое) закономерность (правило) изменения сигналов для этих двух температур детекции. Беря за основу эту определенную(ое) закономерность (правило) изменения сигналов, сигнал, детектируемый при относительно высокой температуре детекции, можно использовать для анализа сигнала, детектируемого при относительно низкой температуре детекции.
Согласно одному из воплощений способ по настоящему изобретению осуществляют в условиях, которые допускают наличие определенной(ого) закономерности (правила) изменения сигналов для нуклеотидной последовательности-мишени в случае двух температур детекции.
Согласно одному из воплощений присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, определяют способом, при котором сигнал, детектируемый при относительно низкой температуре детекции, анализируют с использованием сигнала, детектируемого при относительно высокой температуре детекции, чтобы проверить, содержит ли сигнал, детектируемый при относительно низкой температуре детекции, сигнал, предоставляемый нуклеотидной последовательностью-мишенью, имеющей относительно низкую температуру детекции.
Для анализа сигнала, детектируемого при относительно низкой температуре детекции, с использованием сигнала, детектируемого при относительно высокой температуре детекции, можно получить значение разницы между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции, и затем провести ее анализ.
Согласно одному из воплощений данного изобретения, величина (или вклад) сигнала, поступающего от нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, в сигнале, детектируемом при относительно низкой температуре детекции, может быть получена в соответствии с принципом использования сигнала при относительно высокой температуре детекции.
Согласно одному из воплощений, присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, определяют по разнице между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции.
Например, (1) если в образце присутствует только нуклеотидная последовательность-мишень, имеющая относительно высокую температуру детекции, то сигнал детектируют как при относительно высокой температуре детекции, так и при относительно низкой температуре детекции. Сигнал, детектируемый при относительно высокой температуре детекции, скорее всего будет отличаться от сигнала, детектируемого при относительно низкой температуре детекции. Такая разница, вполне вероятно, будет находиться в пределах конкретного диапазона, по той причине, что все условия, за исключением температур детекции, являются общими. Если рассчитанная для образца разница попадает в пределы конкретного диапазона, то сигнал, детектируемый при относительно низкой температуре детекции, будет обусловлен только нуклеотидной последовательностью-мишенью, имеющей относительно высокую температуру детекции. Другими словами, можно сделать заключение, что нуклеотидная последовательность-мишень, имеющая относительно низкую температуру детекции, в образце отсутствует.
(2) Если в образце присутствуют как нуклеотидная последовательность-мишень, имеющая относительно высокую температуру детекции, так и нуклеотидная последовательность-мишень, имеющая относительно низкую температуру детекции, то сигналы детектируют как при относительно высокой температуре детекции, так и при относительно низкой температуре детекции. Разница между этими сигналами становится более заметной, чем разница в случае (1), поскольку присутствует нуклеотидная последовательность-мишень, имеющая относительно низкую температуру детекции. Используя эту разницу, можно определить присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
(3) Если в образце присутствует нуклеотидная последовательность-мишень, имеющая относительно низкую температуру детекции, то сигнал детектируется при относительно низкой температуре детекции и не детектируется при относительно высокой температуре детекции. Отсутствие детекции сигнала при относительно высокой температуре детекции указывает на отсутствие нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, поэтому можно считать, что сигнал, детектируемый при относительно низкой температуре детекции, обусловлен нуклеотидной последовательностью-мишенью, имеющей относительно низкую температуру детекции, на основании чего можно определить присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
Альтернативно, в случае (3) такую разницу можно получить, используя незначимый сигнал (например, фоновый сигнал), детектируемый при относительно высокой температуре детекции. В этом альтернативном варианте разница вполне вероятно будет заметно отличаться от разницы в случае (1), на основании чего можно определить присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
Разница между сигналами, детектируемыми при температурах детекции, может быть получена в соответствии с широким разнообразием подходов.
Использованный в данном описании термин "разница" в сочетании с выражением "на основе (или с использованием) разницы между сигналами" включает в себя не только разницу, получаемую в результате математической обработки сигналов как таковых или модифицированных сигналов, но также разницу, обусловленную присутствием и отсутствием сигналов. Например, эта разница может быть получена путем вычисления соотношения между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции, или путем вычитания этих сигналов. Альтернативно, эту разницу можно получить, модифицируя сигнал при температуре детекции и сравнивая его с сигналом при другой температуре детекции. Разница между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции, может быть выражена различным образом. Например, такую разницу можно выразить в виде численных значений, в виде наличия/отсутствия сигнала или в виде графика с характеристиками сигнала.
Согласно одному из воплощений данного изобретения разница между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции, включает разницу, получаемую в результате математической обработки сигнала, детектируемого при относительно высокой температуре детекции, и сигнала, детектируемого при относительно низкой температуре детекции.
Согласно одному из воплощений данного изобретения, если сигнал не детектируется при относительно высокой температуре детекции, то определение присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, проводят на основе сигнала, детектируемого при относительно низкой температуре детекции, с учетом отсутствия детекции сигнала при относительно высокой температуре детекции. Это воплощение относится к тому, что использование разницы, обусловленной присутствием и отсутствием сигналов при двух температурах детекции, позволяет провести определение присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
Согласно одному из воплощений, фоновый сигнал, детектируемый при относительно высокой температуре детекции, можно принимать за "0" или "1" для расчета разницы.
Согласно одному из воплощений, если в ходе вычисления получают отрицательное значение, то его преобразуют в абсолютную величину и используют, получая разницу.
Согласно одному из воплощений данного изобретения, сигнал для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, является расчетным параметром для анализа сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
Сигналы для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, и разница между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции, могут иметь разные размерности или единицы измерения либо могут иметь одинаковые размерности или единицы измерения.
Использованный в данном описании термин "определение на основе разницы" включает в себя определение исходя из наличия/отсутствия разницы, определение исходя из величины или диапазона для разницы с численным значением и определение исходя из графического представления этой разницы. Кроме того, "определение на основе разницы" включает получение какой-либо величины (например, Ct) для нуклеиновой кислоты-мишени, имеющей относительно низкую температуру детекции, на основе данной разницы.
Использованный в данном описании термин "на основе разницы" в сочетании с определением присутствия нуклеотидных последовательностей-мишеней означает, что присутствие нуклеотидных последовательностей-мишеней определяют непосредственно или опосредованно, используя или модифицируя разницу между сигналами, в том числе используя численные значения для разницы или ее модифицированных вариантов, используя наличие/отсутствие сигналов и сравнивая разницу с порогом. Не подразумевается никакого различия между терминами "на основе разницы" и "с использованием разницы", и эти термины будут применены взаимозаменяемо.
Математическую обработку сигналов можно выполнить, используя различные методы вычислений и их модификации.
Согласно одному из воплощений данного изобретения математическая обработка сигналов для получения разницы между сигналами представляет собой вычисление отношения сигнала, детектируемого при относительно низкой температуре детекции, к сигналу, детектируемому при относительно высокой температуре детекции. Согласно одному из воплощений данного изобретения математическая обработка сигналов для получения разницы между сигналами представляет собой вычисление отношения сигнала, детектируемого при относительно высокой температуре детекции, к сигналу, детектируемому при относительно низкой температуре детекции.
Использованный в данном описании термин "отношение" означает зависимость между двумя числами. Используя это отношение, можно определить присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции. Если отношение сигнала, детектируемого при относительно низкой температуре детекции, к сигналу, детектируемому при относительно высокой температуре детекции, является значащим, то называют индикатором присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции. Например, если отношение интенсивности сигнала в конечной точке, детектируемого при относительно низкой температуре детекции, к интенсивности сигнала в конечной точке, детектируемого при относительно высокой температуре детекции, является значащим (например, возрастание интенсивности в конечной точке), то это указывает на присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
Математическую обработку можно выполнить по-разному.
Математическую обработку можно выполнить с применением ЭВМ. Например, сигналы можно подвергнуть математической обработке в процессоре, находящемся в детекторе или в устройстве для проведения ПЦР в режиме реального времени. Альтернативно, математическую обработку сигналов можно выполнить вручную, в частности, в соответствии с предварительно заданным алгоритмом.
Согласно одному из воплощений данного изобретения, в зависимости от подходов к получению разницы, для анализа того, является ли полученное значение разницы указанием на присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, может быть применено понятие порога. Например, порог задают предварительно с учетом разности, полученной для стандартного образца, содержащего нуклеиновую кислоту-мишень, имеющую относительно высокую температуру детекции, и нуклеиновую кислоту-мишень, имеющую относительно низкую температуру детекции. Для определения порога можно дополнительно учитывать отрицательный контроль, чувствительность или вид используемой метки.
Согласно одному из воплощений данного изобретения, в зависимости от подходов к получению разницы, присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, можно определить, используя значение полученной разницы как таковой. Например, сигнал при относительно высокой температуре детекции, можно умножить на значение порога, а затем можно получить разницу между сигналом после умножения и сигналом при относительно низкой температуре детекции. В частности, порог задают предварительно с учетом разницы, полученной для стандартного образца, содержащего нуклеиновую кислоту-мишень, имеющую относительно высокую температуру детекции, и нуклеиновую кислоту-мишень, имеющую относительно низкую температуру детекции.
Согласно одному из воплощений данного изобретения порог задается пользователем или автоматически.
В одном из воплощений, если разница между сигналами при относительно высокой температуре детекции и относительно низкой температуре детекции для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, увеличивается, то это с большой долей вероятности снизит ошибки детекции при использовании порога.
В одном из воплощений, если сигналы, предоставляемые нуклеотидной последовательностью-мишенью, имеющей относительно высокую температуру детекции, проявляют закономерность (правило), демонстрирующую(ее) небольшую разницу или отсутствие какой-либо разницы для двух температур детекции, то сигнал, детектируемый при относительно высокой температуре детекции, можно использовать без дополнительных модификаций как при вычислении разницы, так и при определении присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, с использованием данной разности.
В конкретном воплощении, если сигналы проявляют закономерность (правило), демонстрирующую(ее) разницу в пределах конкретного диапазона, то сигнал при относительно высокой температуре детекции может быть подвергнут модификации, отражающей разницу при определении присутствия нуклеотидной последовательности-мишени.
Референсное значение представляет собой значение, отражающее закономерность (правило) изменения сигнала при разных температурах.
Согласно одному из воплощений данного изобретения референсное значение представляет собой значение, отражающее закономерность (правило) изменения в сигналах при двух разных температурах детекции для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции.
Например, если сигналы при относительно высокой температуре детекции и относительно низкой температуре детекции для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, являются идентичными или по существу идентичными, и величину разницы в сигналах при этих двух температурах детекции рассчитывают путем вычитания сигналов, то референсное значение для сигналов при этих двух температурах детекции для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, равно "0". В другом примере, если величину разницы в сигналах при двух температурах детекции рассчитывают путем деления сигналов, то референсное значение для сигналов при этих двух температурах детекции для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, равно "1".
Вместе с тем, если сигналы при относительно высокой температуре детекции и относительно низкой температуре детекции для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, отличаются друг от друга, и величину разницы в этих двух сигналах рассчитывают путем вычитания сигналов, то референсное значение является положительной величиной или отрицательной величиной, отличной от "0", для сигналов при этих двух температурах детекции для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции. В другом примере, если величину разницы в сигналах при двух температурах детекции рассчитывают путем деления сигналов, то референсное значение будет выше или ниже 1, кроме "1", для сигналов при этих двух температурах детекции для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции.
В конкретном воплощении, если сигналы при относительно высокой температуре детекции и относительно низкой температуре детекции для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, отличаются друг от друга, то величина разницы в этих двух сигналах попадает в конкретный диапазон.
В конкретном воплощении, разница в сигналах при относительно высокой температуре детекции и относительно низкой температуре детекции, предоставляемая нуклеотидной последовательностью-мишенью, имеющей относительно высокую температуру детекции, может быть выражена через референсное значение. В конкретном воплощении референсное значение в случае, когда сигналы при относительно высокой температуре детекции и относительно низкой температуре детекции, предоставляемые нуклеотидной последовательностью-мишенью, имеющей относительно высокую температуру детекции, отличаются друг от друга, может отличаться более чем на 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5%, 5%, 5,5%, 6%, 6,5%, 7%, 7,5%, 8%, 8,5%, 9%, 9,5%, 10%, 12%, 15%, 20% или 30% по сравнению с референсным значением в случая, когда эти два сигнала являются одинаковыми.
В одном из воплощений, если разница между сигналами при относительно высокой температуре детекции и относительно низкой температуре детекции для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, увеличивается, то большим преимуществом будет уменьшение ошибок детекции при определении присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, путем использования референсного значения для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции.
В конкретном воплощении, референсное значение для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, можно использовать при определении присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, если референсное значение для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, рассчитанное, исходя из сигналов при этих двух температурах детекции, отличается более чем на 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5%, 5%, 5,5%, 6%, 6,5%, 7%, 7,5%, 8%, 8,5%, 9%, 9,5%, 10%, 12%, 15%, 20% или 30% по сравнению с референсным значением для случая, когда эти два сигнала являются одинаковыми.
Согласно одному из воплощений, если сравнение проводят для определения возможности использования референсного значения, то это референсное значение рассчитывают путем деления сигналов. Согласно одному из воплощений способ вычисления референсного значения для определения возможности использования референсного значения может быть одним и тем же способом вычисления референсного значения для детекции нуклеотидной последовательности-мишени или отличаться от него.
Согласно одному из воплощений референсное значение используют для определения нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, на основе разницы между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции. В частности, референсное значение относится к нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции.
Согласно одному из воплощений данного изобретения референсное значение можно применять для анализа возможности указания полученной разницы на присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
Согласно одному из воплощений данного изобретения референсное значение можно применять для получения разницы между сигналом при относительно высокой и сигналом при относительно низкой температуре детекции. Например, значение сигнала при относительно высокой температуре детекции можно умножить или поделить на референсное значение для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, и затем можно получить разницу между помноженным или поделенным значением сигнала и значением сигнала при относительно низкой температуре детекции. В другом примере, значение сигнала при относительно низкой температуре детекции можно умножить или поделить на референсное значение для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, и затем можно получить разницу между помноженным или поделенным значением сигнала и значением сигнала при относительно высокой температуре детекции.
Согласно одному из воплощений данного изобретения референсное значение используют для определения порога. Согласно одному из воплощений данного изобретения референсное значение используют в качестве порога с модификацией или без модификации данного значения. Термины "порог" и "референсное значение", использованные в данном описании для определения присутствия нуклеотидных последовательностей-мишеней посредством анализа разницы между сигналами, могут иметь одинаковое значение или смысл.
Альтернативно, если референсное значение применяют для получения разницы между сигналом при относительно высокой и сигналом при относительно низкой температуре детекции, то можно использовать дополнительное значение порога для определения значимости данной разницы, т.е. для определения возможности указания данной разницы на присутствие нуклеиновой кислоты-мишени, имеющей относительно низкую температуру детекции.
Согласно одному из воплощений, если присутствует нуклеотидная последовательность-мишень, имеющая относительно высокую температуру детекции, то референсное значение используют для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
Случай, при котором присутствует нуклеотидная последовательность-мишень, имеющая относительно высокую температуру детекции, включает случай, при котором детектируют значимый сигнал, указывающий на присутствие нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции.
Согласно одному из воплощений, если нуклеотидная последовательность-мишень, имеющая относительно высокую температуру детекции, отсутствует, то для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, возможно используют референсное значение.
Случай, при котором отсутствует нуклеотидная последовательность-мишень, имеющая относительно высокую температуру детекции, включает случай, при котором детектируется только сигнал с интенсивностью, аналогичной интенсивности фонового сигнала.
Согласно одному из воплощений данного изобретения, для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, в таком способе используют референсное значение, полученное посредством (1) инкубирования нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, со средством генерации сигнала для детекции нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, в другом реакционном сосуде, нежели реакционный сосуд на стадии (а), (2) детекции сигналов как при относительно высокой температуре детекции, так и при относительно низкой температуре детекции и (3) затем получения разницы между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции.
Согласно одному из воплощений разница между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции, полученная выше в пункте (3), представляет собой некоторое значение, и это значение используют в качестве референсного значения с модификацией или без модификации.
Согласно одному из воплощений референсное значение может быть получено путем вычисления соотношения между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции, или путем вычитания этих сигналов. Согласно одному из воплощений данного изобретения референсное значение получают путем вычисления соотношения между сигналом, детектируемым при относительно низкой температуре детекции, и сигналом, детектируемым при относительно высокой температуре детекции. Согласно одному из воплощений данного изобретения референсное значение получают путем вычисления соотношения между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции.
Согласно одному из воплощений способы вычисления разницы для сигналов от образца и разницы для получения референсного значения могут быть одинаковыми или разными. Например, первый может быть осуществлен путем вычитания этих двух сигналов, а последний путем деления этих двух сигналов. Альтернативно, и первый и последний способы могут быть осуществлены путем деления этих двух сигналов с получением значения отношения.
Согласно одному из воплощений данного изобретения средства генерации сигнала для получения референсного значения могут быть такими же, как и для детекции нуклеотидной последовательности-мишени.
В случае нуклеотидной последовательности-мишени референсные значения могут быть получены в различных реакционных условиях, включая количество компонента (например, нуклеотидной последовательности-мишени, средств генерации сигнала, ферментов или дезоксинуклеотидтрифосфатов (dNTP)), pH буфера или продолжительность реакции. Согласно одному из воплощений данного изобретения референсное значение может быть получено в реакционных условиях, достаточных для получения насыщенного сигнала по завершении реакции. Согласно одному из воплощений данного изобретения разница между сигналами, полученными при вычислении референсного значения, лежит в пределах конкретного диапазона, и референсное значение выбирают в пределах этого конкретного диапазона или с указанием на этот конкретный диапазон. Согласно одному из воплощений данного изобретения референсное значение может быть выбрано в соответствии с максимальным или минимальным значением конкретного диапазона или с указанием на максимальное или минимальное значение этого конкретного диапазона. В частности, референсное значение можно модифицировать с учетом стандартной вариации референсных значений, полученных в различных условиях, приемлемых диапазонов ошибок, специфичности или чувствительности.
Согласно одному из воплощений данного изобретения референсные значения могут быть получены в одинаковых реакционных условиях, используемых для образца, включая количество компонентов (ферментов или праймеров для амплификации, если они применяются), рН буфера, способ проведения реакции. Согласно одному из воплощений данного изобретения референсные значения могут быть получены с использованием процесса амплификации сигнала одновременно с амплификацией нуклеиновой кислоты или без амплификации нуклеиновой кислоты.
Согласно одному из воплощений данного изобретения, если имеется значимое различие между референсным значением и разницей, полученной для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, то тогда считают, что нуклеотидная последовательность-мишень, имеющая относительно низкую температуру детекции, присутствует. Референсное значение может быть выражено с использованием величины такого же типа, как и разница, полученная для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции (например, как соотношение значений интенсивностей сигналов в конечной точке).
В конкретном примере, если соотношение значения интенсивности сигнала в конечной точке, детектируемого при относительно высокой температуре детекции, и значения интенсивности сигнала в конечной точке, детектируемого при относительно низкой температуре детекции, составляет 1,8, а референсное значение составляет 1,1, то можно сделать заключение, что имеется значимое различие между референсным значением и разницей, полученной для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции. Это указывает на присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
Согласно одному из воплощений, если разница для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, равна референсному значению или превышает его, то тогда считают, что нуклеотидная последовательность-мишень, имеющая относительно низкую температуру детекции, присутствует.
Согласно одному из воплощений, если разница для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, является такой же, как референсное значение или меньше его, то тогда считают, что нуклеотидная последовательность-мишень, имеющая относительно низкую температуру детекции, присутствует.
Альтернативно, референсное значение можно использовать для расчета разницы между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции. Например, разницу для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, рассчитывают таким образом, что сигнал (например, в RFU), детектируемый при относительно высокой температуре детекции, умножают (или делят) на референсное значение для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, и затем результат умножения (или деления) вычитают из сигнала (например, в RFU), детектируемого при относительно низкой температуре детекции. Если разница имеет значение больше (или меньше) "0" или некоторого предварительно заданного значения, то можно считать, что нуклеотидная последовательность-мишень, имеющая относительно низкую температуру детекции, присутствует.
В другом примере, разницу для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, рассчитывают таким образом, что сигнал (например, в RFU), детектируемый при относительно низкой температуре детекции, умножают (или делят) на референсное значение для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, и затем результат умножения (или деления) вычитают из сигнала (например, в RFU), детектируемого при относительно высокой температуре детекции. Если разница имеет значение больше (или меньше) "0" или некоторого предварительно заданного значения, то можно считать, что нуклеотидная последовательность-мишень, имеющая относительно низкую температуру детекции, присутствует.
Согласно одному из воплощений предварительно заданное значение может выступать в роли порога.
Согласно одному из воплощений референсное значение используют для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, когда детектируют сигнал для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, или когда разницу между сигналами при относительно высокой температуре детекции и относительно низкой температуре детекции получают с помощью математических вычислений.
Согласно одному из воплощений, если сигналы генерируют в режиме реального времени совместно с амплификацией мишени с использованием ПЦР, то математическая обработка сигналов включает вычисления соотношения интенсивности сигнала, детектируемого при относительно высокой температуре детекции, и интенсивности сигнала, детектируемого при относительно низкой температуре детекции, в каждом цикле амплификации. На основании результатов вычислений строят график зависимости (такого соотношения) от числа циклов и используют для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
Согласно одному из воплощений, если сигналы генерируют в режиме реального времени совместно с амплификацией мишени с использованием ПЦР, то величина Ct относится к сигналу для детекции мишени.
Значение Ct для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, можно определить, используя сигналы, детектируемые при относительно высокой температуре детекции и при относительно низкой температуре детекции, как приведено в качестве примера ниже. Сначала для анализируемого образца проводят ПЦР в режиме реального времени и получают сигналы, детектируемые при относительно высокой температуре детекции и при относительно низкой температуре детекции, после чего получают кривые амплификации для этих двух температур детекции.
(а) В случае детектирования при относительно высокой температуре детекции, если не не получают никакого значения Ct для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, то можно считать, что нуклеотидная последовательность-мишень, имеющая относительно высокую температуру детекции, отсутствует. Затем, из кривой амплификации, полученной при относительно низкой температуре детекции, рассчитывают значение Ct для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции. Если нуклеотидная последовательность-мишень, имеющая относительно низкую температуру детекции, также отсутствует, то не получают никакого значения Ct для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
(b) В случае детектирования при относительно высокой температуре детекции, если получают значение Ct для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, то тогда рассчитывают отношение значения RFU, полученного при относительно низкой температуре детекции, к значению RFU, полученному при относительно высокой температуре детекции, в цикле, для которого получают значение Ct. Также рассчитывают отношения значений RFU, полученных в циклах, следующих за циклом, для которого значение Ct получено. (1) Если все отношения значений RFU находятся ниже референсного значения (например, значения, полученного с использованием только нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, как описано выше), то считают, что нуклеотидная последовательность-мишень, имеющая относительно низкую температуру детекции, отсутствует. Поэтому не получают никакого значения Ct для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции. (2) Если все отношения значений RFU находятся выше референсного значения, то значение Ct, рассчитанное из кривой амплификации, полученной при относительно низкой температуре детекции, принимают за значение Ct для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции. (3) Если отношение значений RFU в цикле, для которого значение Ct получено, находится ниже референсного значения, а отношение значений RFU после некоторого конкретного цикла находится выше референсного значения, то этот конкретный цикл принимают за значение Ct для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
Если рассчитанные отношения являются такими же, как референсное значение, то определение может быть сделано произвольным образом. Например, в приведенных выше примерах описывается, что такое определение выполняют, учитывая, будут ли данные отношения ниже или не ниже референсных значений. Помимо этого, такое определение может быть выполнено с учетом того, будут ли данные отношения выше или не выше референсных значений.
Значение Ct для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, можно рассчитать альтернативным образом так, как приведено ниже: для каждого цикла рассчитывают отношение значения RFU, полученного при относительно низкой температуре детекции, к значению RFU, полученному при относительно высокой температуре детекции; и затем рассчитывают значение Ct с учетом порогового значения.
Значение Ct для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, можно рассчитать альтернативным образом так, как приведено ниже: значение RFU, полученное при относительно высокой температуре детекции в каждом цикле, модифицируют, используя референсное значение для каждого цикла; для каждого цикла рассчитывают отношение значения RFU, полученного при относительно низкой температуре детекции, к модифицированному значению RFU; и затем рассчитывают значение Ct.
Согласно одному из воплощений данного изобретения, в результате использования сигнала, детектируемого при относительно высокой температуре детекции, получают квалификационное значение (qualifying value) для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, а в результате указанного использования разности получают квалификационное значение для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
Согласно одному из воплощений данного изобретения, в результате использования разности получают квалификационное значение для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, и такое квалификационное значение получают в результате (1) математической обработки сигнала, детектируемого при относительно высокой температуре детекции, и сигнала, детектируемого при относительно низкой температуре детекции, или (2) использования сигнала, детектируемого при относительно низкой температуре детекции, с учетом отсутствия детекции какого-либо сигнала при относительно высокой температуре детекции, если данный сигнал не детектируется при относительно высокой температуре детекции.
Квалификационные значения можно подвергнуть дальнейшей математической обработке с получением модифицированных значений. Квалификационные значения используют для определения присутствия двух нуклеотидных последовательностей-мишеней в образце.
Согласно одному из воплощений, один реакционный сосуд дополнительно содержит по меньшей мере один дополнительный комплект, при этом каждый из них содержит два дополнительных средства генерации сигнала, для детекции других нуклеотидных последовательностей-мишеней, нежели эти две нуклеотидные последовательности-мишени; при этом сигналы, генерируемые каждым комплектом из двух средств генерации сигнала в таком сосуде, различаются, и эти сигналы детектируют, используя, соответственно, детекторы разных типов. Например, если в двух средствах генерации сигнала на стадии (а) используется метка FAM, а в двух дополнительных средствах генерации сигнала используется метка Quasar 570, то сигналы, генерируемые FAM-меченными средствами генерации сигнала в сосуде, отличаются от сигналов, генерируемых Quasar 570-меченными средствами генерации сигнала, и поэтому для детекции двух разных типов излучения необходимы детекторы двух типов.
Согласно одному из воплощений данного изобретения две нуклеотидные последовательности-мишени содержат нуклеотидную вариацию, и одна из этих двух нуклеотидных последовательностей-мишеней содержит нуклеотидную вариацию одного типа, а другая содержит нуклеотидную вариацию другого типа.
Термин "нуклеотидная вариация", использованный в данном описании, относится к любым одиночным или множественным нуклеотидным заменам, делециям или вставкам в последовательности ДНК в конкретном положении среди непрерывных сегментов ДНК, которые в других случаях являются одинаковыми в последовательности. Такие непрерывные сегменты ДНК включают ген или любую другую часть хромосомы. Такие нуклеотидные вариации могут быть результатом мутации или представлять собой вариации полиморфных аллелей. Например, нуклеотидная вариация, детектируемая в настоящем изобретении, включает SNP (однонуклеотидный полиморфизм), мутацию, делецию, вставку, замену и транслокацию. Примером нуклеотидной вариации являются многочисленные вариации в геноме человека (например, вариации в гене MTHFR (метилентетрагидрофолат-редуктаза)), вариации, вовлеченные в возникновение лекарственной устойчивости у патогенных микроорганизмов, и вызывающие онкогенез вариации. Термин "нуклеотидная вариация", использованный в данном описании, включает в себя любую вариацию в конкретном положении в нуклеотидной последовательности. Другими словами, термин нуклеотидная вариация включает в себя дикий тип и любой его мутантный тип в конкретном положении в нуклеотидной последовательности.
Согласно одному из воплощений данного изобретения, нуклеотидная вариация, детектируемая в соответствии с настоящим изобретением, представляет собой SNP (однонуклеотидный полиморфизм).
Согласно одному из воплощений данного изобретения, один из SNP-содержащих аллелей имеет относительно высокую температуру детекции, а другой имеет относительно низкую температуру детекции, определяемую с использованием соответствующих средств генерации сигнала.
Преимущества настоящего изобретения становятся более заметными в случае детекции SNP.
Если температура детекции для аллеля дикого типа является относительно высокой температурой детекции, а температура детекции для мутантного аллеля является относительно низкой температурой детекции, и образец представляет собой мутантную гомозиготу, то сигнал не будет детектироваться при относительно высокой температуре детекции и сигнал будет детектироваться при относительно высокой температуре детекции. Такой образец будет идентифицирован, как не содержащий аллеля дикого типа и содержащий аллель мутантного типа. В то же время, даже если для образца с мутантной гомозиготой генерируется ложный сигнал при относительно высокой температуре детекции, то результат вычисления разницы между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции, для определения присутствия SNP-содержащего аллеля, имеющего относительно низкую температуру детекции, позволяет проверить, является ли сигнал, детектируемый при относительно высокой температуре детекции, ложноположительным сигналом или нет. Причина заключается в том, что гетерозигота по SNP содержит аллель дикого типа и мутантный аллель в соотношении 1:1.
II. SNP-генотипирование с использованием разных температур детекции
Согласно другому аспекту данного изобретения предложен способ SNP-генотипирования нуклеотидной последовательности в образце с использованием разных температур детекции, включающий:
(а) инкубирование образца, содержащего нуклеотидную последовательность, содержащую сайт SNP (однонуклеотидного полиморфизма), и средство генерации сигнала для детекции SNP-содержащих аллелей в одном реакционном сосуде, и детекцию генерируемого сигнала с использованием детектора одного типа; при этом каждый из SNP-содержащих аллелей детектируют с использованием соответствующего средства генерации сигнала; при этом один из SNP-содержащих аллелей имеет относительно высокую температуру детекции, а другой имеет относительно низкую температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом относительно высокая температура детекции представляет собой температуру, допускающую генерирование сигнала для SNP-содержащего аллеля, имеющего относительно высокую температуру детекции, а относительно низкая температура детекции представляет собой температуру, допускающую генерирование как сигнала для SNP-содержащего аллеля, имеющего относительно низкую температуру детекции, так и сигнала для SNP-содержащего аллеля, имеющего относительно высокую температуру детекции; при этом сигналы, генерируемые такими средствами генерации сигнала, не различаются детектором одного типа; при этом детекцию осуществляют как при относительно высокой температуре детекции, так и при относительно низкой температуре детекции; и
(b) определение SNP-генотипа по разнице между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции, на стадии (а).
Поскольку настоящее изобретение в целом следует первому аспекту данного изобретения, описанному выше, общие для них части описания опущены, чтобы избежать излишнего дублирования, приводящего к усложнению данного описания. При обращении к описаниям для первого аспекта, с целью описания этого аспекта, следует иметь в виду, что стадия (b) этого аспекта частично отличается от стадии (b) первого аспекта. Поэтому, специалистам в данной области техники будет понятно, что некоторые части описания для первого аспекта могут быть непосредственно использованы в описаниях для стадии (b) этого аспекта, а другие части описания могут быть использованы в описаниях для стадии (b) этого аспекта с изменениями.
Стадия (а). Инкубирование со средствами генерации сигнала и детекция сигналов
В первую очередь, образец, содержащий нуклеотидную последовательность, содержащую сайт SNP (однонуклеотидного полиморфизма), инкубируют со средством генерации сигнала для детекции SNP-содержащих аллелей в одном реакционном сосуде и затем генерируемый сигнал детектируют, используя детектор одного типа. Сигналы, генерируемые средствами генерации сигнала, не различаются детектором одного типа.
Нуклеотидная последовательность, содержащая сайт SNP, может включать пару хромосом человека.
Один из SNP-содержащих аллелей имеет относительно высокую температуру детекции, а другой имеет относительно низкую температуру детекции, определяемую с использованием соответствующего средства генерации сигнала, при этом относительно высокая температура детекции представляет собой температуру, допускающую генерирование сигнала для SNP-содержащего аллеля, имеющего относительно высокую температуру детекции, а относительно низкая температура детекции представляет собой температуру, допускающую генерирование как сигнала для SNP-содержащего аллеля, имеющего относительно низкую температуру детекции, так и сигнала для SNP-содержащего аллеля, имеющего относительно высокую температуру детекции.
Согласно одному из воплощений данного изобретения стадию (а) проводят в процессе амплификации сигнала одновременно с амплификацией нуклеиновой кислоты.
Согласно одному из воплощений данного изобретения стадию (а) проводят в процессе амплификации сигнала без амплификации нуклеиновой кислоты.
Стадия (b). Определение SNP-генотипа
После детекции сигнала проводят SNP-генотипирование на основе разницы между сигналом, детектируемым при относительно высокой температуре детекции и сигналом, детектируемым при относительно низкой температуре детекции, на стадии (а).
Настоящее изобретение позволяет проводить SNP-генотипирование только на основе разницы между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции, без определения присутствия SNP-содержащего аллеля, имеющего относительно высокую температуру детекции.
Согласно одному из воплощений указанную разницу получают путем математической обработки сигнала, детектируемого при относительно высокой температуре детекции, и сигнала, детектируемого при относительно низкой температуре детекции.
Согласно одному из воплощений, данную разницу получают путем вычисления соотношения между сигналами, детектируемыми при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции.
Согласно одному из воплощений, для расчета указанной разницы используют фоновый сигнал, детектируемый при относительно высокой температуре детекции.
Согласно одному из воплощений, фоновый сигнал, детектируемый при относительно высокой температуре детекции, можно принимать за "0" или "1" для расчета данной разницы.
Согласно одному из воплощений, если в ходе вычисления получают отрицательное значение, то его преобразуют в абсолютную величину и используют, получая разницу.
Согласно одному из воплощений данного изобретения стадию (b) для определения SNP-генотипа проводят без определения присутствия SNP-содержащего аллеля, имеющего относительно высокую температуру детекции. SNP-генотипирование проводят, используя разницу между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции.
Причина, по которой не требуется определения присутствия SNP-содержащего аллеля, имеющего относительно высокую температуру детекции, заключается в том, что имеется три SNP-генотипа, и гетерозигота по SNP содержит аллель дикого типа и мутантный аллель в соотношении 1:1. Сочетая данную причину с принципом настоящего изобретения, можно проводить SNP-генотипирование без определения присутствия SNP-содержащего аллеля, имеющего относительно высокую температуру детекции.
Согласно одному из воплощений данного изобретения образец с гомозиготой, содержащей аллель с SNP, имеющий относительно высокую температуру детекции, демонстрирует разницу (например, отношение) в пределах конкретного диапазона, образец с гетерозиготой демонстрирует разницу (например, отношение) в пределах другого конкретного диапазона, и образец с гомозиготой, содержащей аллель с SNP, имеющий относительно низкую температуру детекции, демонстрирует разницу (например, отношение) в пределах иного конкретного диапазона.
Согласно одному из воплощений данного изобретения конкретный диапазон для каждого SNP-генотипа может быть связан с референсным значением для каждого такого SNP-генотипа.
Согласно одному из воплощений данного изобретения, для определения SNP-генотипа в данном способе используется по меньшей мере одно из референсных значений для гомозиготы, в состав которой входит SNP-содержащий аллель, имеющий относительно высокую температуру детекции, для гомозиготы, в состав которой входит SNP-содержащий аллель, имеющий относительно низкую температуру детекции, и для гетерозиготы.
Согласно одному из воплощений данного изобретения, для определения SNP-генотипа в данном способе используются все три референсных значения. Согласно одному из воплощений данного изобретения, для определения SNP-генотипа в данном способе используются по меньшей мере два референсных значения для гомозиготы, в состав которой входит SNP-содержащий аллель, имеющий относительно высокую температуру детекции, и для гетерозиготы.
Согласно одному из воплощений, для проведения SNP-генотипирования в данном способе используется референсное значение, полученное посредством (1) инкубирования гомозиготы, в состав которой входит SNP-содержащий аллель, имеющий относительно высокую температуру детекции, со средством генерации сигнала для детекции SNP-содержащего аллеля, имеющего относительно высокую температуру детекции, в другом реакционном сосуде, нежели реакционный сосуд на стадии (а), (2) детекции сигналов как при относительно высокой температуре детекции, так и при относительно низкой температуре детекции, и (3) затем получения разницы между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции.
Согласно одному из воплощений, для проведения SNP-генотипирования в данном способе используется референсное значение, полученное посредством (1) инкубирования гетерозиготы, в состав которой входит как SNP-содержащий аллель, имеющий относительно высокую температуру детекции, так и SNP-содержащий аллель, имеющий относительно низкую температуру детекции, с соответствующими средствами генерации сигнала, в другом реакционном сосуде, нежели реакционный сосуд на стадии (а), (2) детекции сигналов как при относительно высокой температуре детекции, так и при относительно низкой температуре детекции, и (3) затем получения разницы между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции.
Согласно одному из воплощений, для проведения SNP-генотипирования в данном способе используется референсное значение, полученное посредством (1) инкубирования гомозиготы, в состав которой входит SNP-содержащий аллель, имеющий относительно низкую температуру детекции, со средством генерации сигнала для детекции SNP-содержащего аллеля, имеющего относительно низкую температуру детекции, в другом реакционном сосуде, нежели реакционный сосуд на стадии (а), (2) детекции сигналов как при относительно высокой температуре детекции, так и при относительно низкой температуре детекции, и (3) затем получения разницы между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции.
Согласно одному из воплощений, для SNP-генотипирования образца рассчитывают разницу между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции, и сравнивают с референсными значениями для каждого SNP-генотипа.
Согласно одному из воплощений референсное значение может быть получено путем вычисления соотношения между сигналами, детектируемыми при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции.
Согласно одному из воплощений данного изобретения референсное значение может быть получено в реакционных условиях, достаточных для получения насыщенного сигнала по завершении реакции. Например, чтобы получить референсное значение для гетерозиготы, в состав которой входят как SNP-содержащий аллель, имеющий относительно высокую температуру детекции, так и SNP-содержащий аллель, имеющий относительно низкую температуру детекции, реакционные условия, как например, содержание каждого SNP-содержащего аллеля, выбирают таким образом, чтобы по завершении реакции получить насыщенный сигнал для каждого SNP-содержащего аллеля. Согласно одному из воплощений данного изобретения разница между сигналами, полученными при вычислении референсного значения, лежит в конкретном диапазоне, и референсное значение выбирают в пределах этого конкретного диапазона или с указанием на этот конкретный диапазон.
Если температура детекции для аллеля дикого типа представляет собой относительно высокую температуру детекции, температура детекции для мутантного аллеля представляет собой относительно низкую температуру детекции, и соотношение между сигналами, детектируемыми при относительно высокой температуре детекции и относительно низкой температуре детекции, рассчитывают для получения разницы, то образец с гомозиготой дикого типа показывает соотношение в пределах конкретного диапазона, а образец с гетерозиготой показывает соотношение в пределах другого конкретного диапазона.
Например, образец с гомозиготой дикого типа показывает соотношение приблизительно 1,0, а образец с SNP-гетерозиготой показывает соотношение приблизительно 2,0.
Если образец относится к мутантной гомозиготе, то для вычисления соотношения между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции, можно использовать фоновый сигнал, детектируемый при относительно высокой температуре детекции. В этом случае, рассчитанное соотношение может показывать величину, значительно большую 2,0, что указывает на то, что SNP-генотип образца относится к мутантной гомозиготе. Альтернативно, рассчитанное соотношение может показывать величину, принадлежащую конкретному диапазону соотношения (например, приблизительно 9,0), который демонстрирует образец с мутантной гомозиготой.
Кроме того, даже если для образца с мутантной гомозиготой при относительно высокой температуре детекции генерируется ложный сигнал, то данное соотношение будет показывать величину, значительно большую 2,0, что указывает на то, что SNP-генотип образца относится к мутантной гомозиготе.
Таким образом, что касается SNP-генотипа, то настоящее изобретение позволяет определить SNP-генотип посредством использования только разницы между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции.
Согласно одному из воплощений указанная разница предусматривает получение квалификационного значения путем математической обработки сигнала, детектируемого при относительно высокой температуре детекции, и сигнала, детектируемого при относительно низкой температуре детекции.
Согласно одному из воплощений референсное значение получают, используя стандартный образец, содержащий гомозиготу дикого типа, мутантную гомозиготу или гетерозиготу, и используют для анализа разницы, полученной для тестируемых образцов.
III. Детекция по меньшей мере трех нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции
Согласно еще одному аспекту данного изобретения предложен способ детекции по меньшей мере трех нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции, включающий:
(a) инкубирование образца по меньшей мере с тремя средствами генерации сигнала для детекции по меньшей мере трех нуклеотидных последовательностей-мишеней в одном реакционном сосуде и детекцию генерируемого сигнала с использованием детектора одного типа; при этом каждую из по меньшей мере трех нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала; при этом каждая из по меньшей мере трех нуклеотидных последовательностей-мишеней имеет свою температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом температура детекции представляет собой температуру, допускающую генерирование не только сигнала для нуклеотидной последовательности-мишени, имеющей данную температуру детекции, но также и сигнала для нуклеотидной последовательности-мишени, имеющей более высокую температуру детекции, чем данная температура детекции; при этом сигналы, генерируемые этими средствами генерации сигнала, не различаются детектором одного типа; при этом детекцию осуществляют при каждой из разных температур детекции; и
(b) определение присутствия по меньшей мере трех нуклеотидных последовательностей-мишеней на основе сигналов, детектируемых на стадии (а); при этом, если определяют присутствие нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, среди по меньшей мере трех нуклеотидных последовательностей-мишеней, то присутствие нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции, определяют по разнице между сигналом, детектируемым при одной или более температурах детекции, превышающих данную конкретую температуру детекции, и сигналом, детектируемым при данной конкретной температуре детекции; при этом, если данная конкретная температура детекции является самой относительно высокой температурой детекции среди температур детекции, то присутствие нуклеотидной последовательности-мишени определяют на основе сигнала, детектируемого при данной конкретной температуре детекции.
Поскольку настоящее изобретение в целом следует первому аспекту данного изобретения, описанному выше, общие для них части описания опущены, чтобы избежать излишнего дублирования, приводящего к усложнению данного описания.
Стадия (а). Инкубирование со средствами генерации сигнала и детекция сигналов
В первую очередь, анализируемый образец инкубируют по меньшей мере с тремя средствами генерации сигнала для детекции по меньшей мере трех нуклеотидных последовательностей-мишеней в одном реакционном сосуде и затем генерируемый сигнал детектируют, используя детектор одного типа. Сигналы, генерируемые по меньшей мере тремя средствами генерации сигнала не различаются детектором одного типа.
Количество нуклеотидных последовательностей-мишеней, подлежащих детектированию в соответствии с настоящим изобретением, не ограничено и включает более чем 3, 4, 5, 6, 7, 8, 9 и 10 нуклеотидных последовательностей-мишеней в одном реакционном сосуде.
Каждую из по меньшей мере трех нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала. Каждая из по меньшей мере трех нуклеотидных последовательностей-мишеней имеет свою температуру детекции, определяемую с использованием соответствующего средства генерации сигнала.
Согласно одному из воплощений, температуры детекции, установленные для нуклеотидных последовательностей-мишеней, отличаются друг от друга по меньшей мере на 2°C, 3°C, 4°C, 5°C, 7°C, 8°C, 9°C, 10°C, 11°C, 12°C, 15°C или 20°C.
Одна из нуклеотидных последовательностей-мишеней имеет самую относительно высокую температуру детекции. Средство генерации сигнала, способное обеспечивать получение сигнала при самой относительно высокой температуре детекции, используют для детекции нуклеотидной последовательности-мишени, имеющей самую относительно высокую температуру детекции.
Температура детекции представляет собой температуру, допускающую генерирование не только сигнала для нуклеотидной последовательности-мишени, имеющей данную температуру детекции, но также и сигнала для нуклеотидной последовательности-мишени, имеющей более высокую температуру детекции, чем данная температура детекции. Детекцию осуществляют при каждой из разных температур детекции.
Согласно одному из воплощений стадию (а) проводят в процессе амплификации сигнала одновременно с амплификацией нуклеиновой кислоты.
Согласно одному из воплощений стадию (а) проводят в процессе амплификации сигнала без амплификации нуклеиновой кислоты.
Согласно одному из воплощений, по меньшей мере одно из средств генерации сигнала представляет собой средство генерации сигнала для генерирования сигнала способом, зависящим от образования дуплекса.
Согласно одному из воплощений средства генерации сигнала для каждой из нуклеотидных последовательностей-мишеней представляют собой средства генерации сигнала для генерирования сигнала способом, зависящим от образования дуплекса.
Согласно одному из воплощений сигнал генерируется в результате образования дуплекса между нуклеотидной последовательностью-мишенью и детектирующим олигонуклеотидом, специфически гибридизованным с данной нуклеотидной последовательностью-мишенью. Согласно одному из воплощений сигнал генерируется дуплексом, образованным способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью.
Согласно одному из воплощений данного изобретения средства генерации сигнала для каждой из нуклеотидных последовательностей-мишеней представляют собой средства генерации сигнала с использованием образования дуплекса способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного нуклеотидной последовательностью-мишенью.
Согласно одному из воплощений, по меньшей мере одно из средств генерации сигнала представляет собой средство генерации сигнала для генерирования сигнала способом, зависящим от расщепления детектирующего олигонуклеотида.
Согласно одному из воплощений сигнал генерируется в результате гибридизации детектирующего олигонуклеотида с нуклеотидной последовательностью-мишенью и затем расщепления детектирующего олигонуклеотида. Согласно одному из воплощений сигнал генерируется в результате расщепления детектирующего олигонуклеотида способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью.
Согласно одному из воплощений, генерирование сигнала способом, зависящим от расщепления детектирующего олигонуклеотида, используют для нуклеотидной последовательности-мишени, имеющей самую относительно высокую температуру детекции, среди по меньшей мере трех нуклеотидных последовательностей-мишеней.
Согласно одному из воплощений данного изобретения средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей самую относительно высокую температуру детекции, представляет собой средство генерации сигнала с использованием расщепления детектирующего олигонуклеотида, а средства генерации сигнала для других нуклеотидных последовательностей-мишеней представляют собой средства генерации сигнала с использованием образования дуплекса.
Согласно одному из воплощений данного изобретения средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей самую относительно высокую температуру детекции, представляет собой средство генерации сигнала с использованием расщепления детектирующего олигонуклеотида, а средства генерации сигнала для других нуклеотидных последовательностей-мишеней представляют собой средства генерации сигнала с использованием образования дуплекса способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью.
Согласно одному из воплощений данного изобретения, в результате расщепления опосредующего олигонуклеотида высвобождается фрагмент, и этот фрагмент опосредует образование дуплекса или расщепление детектирующего олигонуклеотида путем удлинения данного фрагмента на захватывающем олигонуклеотиде.
Согласно одному из воплощений данного изобретения по меньшей мере три средства генерации сигнала содержат идентичную метку, и сигналы от этой метки не различаются детектором одного типа.
Согласно одному из воплощений данного изобретения, если средство генерации сигнала генерирует сигнал способом, зависящим от образования дуплекса, то температуру детекции выбирают на основе величины Тпл дуплекса.
Согласно одному из воплощений данного изобретения, если средство генерации сигнала генерирует сигнал способом, зависящим от расщепления детектирующего олигонуклеотида, то температуру детекции выбирают произвольным образом. Согласно одному из воплощений данного изобретения, средство генерации сигнала с использованием расщепления детектирующего олигонуклеотида может обеспечивать использование самой относительно высокой температуры детекции.
Согласно одному из воплощений, температуры детекции для нуклеотидных последовательностей-мишеней предварительно задают с учетом температурного диапазона, допускающего генерирование сигнала данными средствами генерации сигнала.
Согласно одному из воплощений температуру детекции для каждой нуклеотидной последовательности-мишени предварительно задают с учетом температурного диапазона, допускающего генерирование сигнала с использованием средства генерации сигнала для детекции каждой нуклеотидной последовательности-мишени. Температуры детекции можно предварительно задавать с учетом неперекрывающегося диапазона температур детекции и перекрывающегося диапазона температур детекции и из температур детекции.
Детекцию при конкретной температуре детекции осуществляют с целью детектирования сигнала для нуклеотидной последовательности-мишени, имеющей данную температуру детекции, но также и сигнала для нуклеотидной последовательности-мишени, имеющей более высокую температуру детекции, чем данная температура детекции. Детекцию при самой относительно высокой температуре детекции осуществляют с целью детектирования сигнала для нуклеотидной последовательности-мишени, имеющей самую относительно высокую температуру детекции.
Например, если нуклеотидные последовательности-мишени содержат три последовательности-мишени, и для этих трех последовательностей-мишеней задают температуры детекции 72°C, 60°C и 50°C, соответственно, то детекция при 50°C включает не только детекцию сигнала для нуклеотидной последовательности-мишени, имеющей температуру детекции 50°C, но также детекцию сигналов для нуклеотидных последовательностей-мишеней, имеющих температуру детекции 70°C и 60°C, соответственно.
Один из признаков настоящего изобретения относится к дифференцированному определению присутствия по меньшей мере трех нуклеотидных последовательностей-мишеней путем детектирования при разных температурах детекции сигналов, указывающих на присутствие этих по меньшей мере трех нуклеотидных последовательностей-мишеней.
Стадия (b). Определение присутствия по меньшей мере трех нуклеотидных последовательностей-мишеней
После детекции сигнала присутствие по меньшей мере трех нуклеотидных последовательностей-мишеней определяют на основе сигнала, детектируемого на стадии (а).
Согласно одному из воплощений присутствие нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, определяют способом, при котором сигнал, детектируемый при данной конкретной температуре детекции, анализируют с использованием сигнала, детектируемого при температурах детекции, превышающих данную конкретную температуру детекции, чтобы проверить, содержит ли сигнал, детектируемый при данной конкретной температуре детекции, сигнал, предоставляемый нуклеотидной последовательностью-мишенью, имеющей данную конкретную температуру детекции, или нет.
Если необходимо определить присутствие нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, среди по меньшей мере трех нуклеотидных последовательностей-мишеней, то присутствие нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции, определяют по разнице между сигналом, детектируемым при одной или более температурах детекции, превышающих данную конкретную температуру детекции, и сигналом, детектируемым при данной конкретной температуре детекции. Если данная конкретная температура детекции является самой относительно высокой температурой детекции среди температур детекции, то присутствие нуклеотидной последовательности-мишени определяют на основе сигнала, детектируемого при данной конкретной температуре детекции.
Согласно одному из воплощений указанная разница представляет собой разницу, получаемую в результате математической обработки сигнала, детектируемого при одной или более температурах детекции, превышающих данную конкретную температуру детекции, и сигнала, детектируемого при данной конкретной температуре детекции.
Согласно одному из воплощений, если сигнал не детектируется при температурах детекции, превышающих данную конкретную температуру детекции, то определение присутствия нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции, осуществляют на основе сигнала, детектируемого при данной конкретной температуре детекции, с учетом отсутствия детекции сигнала при температурах детекции, превышающих данную конкретную температуру детекции. Это воплощение относится к тому, что использование разницы, обусловленной присутствием и отсутствием сигналов, позволяет провести определение присутствия нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции.
Например, исходя из того, что нуклеотидные последовательности-мишени содержат четыре последовательности-мишени, для этих четырех последовательностей-мишеней задают температуры детекции 72°C, 60°C, 50°C и 40°C, соответственно, и на стадии (а) детектируют сигналы при температурах детекции 60°C, 50°C и 40°C. Если необходимо определить присутствие нуклеотидной последовательности-мишени, имеющей температуру детекции 40°C, то присутствие нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции (40°C) определяют, используя разницу между сигналом, детектируемым при одной или более температурах детекции (60°C и 50°C), превышающих данную конкретную температуру детекции (40°C), и сигналом, детектируемым при данной конкретной температуре детекции. Более наглядно, для определения присутствия нуклеотидной последовательности-мишени, имеющей температуру детекции 40°C, можно использовать разницу между сигналом, детектируемым при 60°C, и сигналом, детектируемым при 40°C, разницу между сигналом, детектируемым при 50°C, и сигналом, детектируемым при 40°C, или обе эти разницы.
Присутствие нуклеотидных последовательностей-мишеней, имеющих другие температуры детекции (т.е. 60°C и 50°C), может быть определено соответственно так, как изложено выше.
Термин "разница между сигналом, детектируемым при одной или более температурах детекции, превышающих данную конкретную температуру детекции, и сигналом, детектируемым при данной конкретной температуре детекции" подразумевает, что данную разницу получают для сигналов при двух температурах детекции. Один из этих сигналов представляет собой сигнал, детектируемый при одной из температур детекции, превышающих данную конкретную температуру детекции, а другой представляет собой сигнал, детектируемым при данной конкретной температуре детекции. Если число температур детекции, превышающих данную конкретную температуру детекции, больше двух, то и число полученных разниц может быть больше двух.
Термин "разница между сигналом, детектируемым при одной или более температурах детекции, и сигналом, детектируемым при данной конкретной температуре детекции" подразумевает не только разницу между сигналами, детектируемыми при двух температурах детекции, но также разницу, получаемую с использованием разницы между сигналами при этих двух температурах детекции, и сигналом, детектируемым при другой температуре детекции.
Альтернативно, согласно одному из воплощений присутствие нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции (60°C), определяют, используя разницу, получаемую в результате математической обработки сигнала, детектируемого при одной или более температурах детекции (72°C), превышающих данную конкретную температуру детекции (60°C), и сигнала, детектируемого при данной конкретной температуре детекции. В случае отсутствия детекции сигнала при более высокой температуре детекции (72°C), для вычисления данной разницы можно использовать фоновый сигнал.
Согласно одному из воплощений, при отсутствии детекции сигнала при температуре детекции (72°C), превышающей конкретную температуру детекции (60°C), присутствие нуклеотидной лоследовательности-мишени, имеющей данную конкретную температуру детекции (60°C), определяют, используя сигнал, детектируемый при данной конкретной температуре детекции (60°C) с учетом отсутствия детекции сигнала при температуре детекции (72°C), превышающей данную конкретную температуру детекции (60°C).
Если сигнал детектируют при самой высокой температуре детекции (72°C), то можно сделать заключение, что присутствует нуклеотидная последовательность-мишень, имеющая самую относительно высокую температуру детекции.
Согласно одному из воплощений, если необходимо определить присутствие нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, среди по меньшей мере трех нуклеотидных последовательностей-мишеней, то присутствие нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции, определяют, используя разницу между сигналом, детектируемым при температуре детекции, непосредственно более высокой, чем данная конкретная температура детекции, и сигналом, детектируемым при данной конкретной температуре детекции.
Согласно одному из воплощений, использованием разницы включает использование разницы, получаемой в результате математической обработки сигнала, детектируемого при температуре детекции, непосредственно более высокой, чем данная конкретная температура детекции, и сигнала, детектируемого при данной конкретной температуре детекции.
Согласно одному из воплощений, если сигнал не детектируется при температуре детекции, непосредственно более высокой, чем конкретная температура детекции, то использование разницы включает использование сигнала, детектируемого при данной конкретной температуре детекции, с учетом отсутствия детекции сигнала при температуре детекции, непосредственно более высокой, чем данная конкретная температура детекции.
Например, если необходимо определить присутствие нуклеотидной последовательности-мишени, имеющей температуру детекции 40°C, то присутствие нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции, определяют, используя разницу между сигналом, детектируемым при температуре детекции (50°C), непосредственно более высокой, чем данная конкретная температура детекции (40°C), и сигналом, детектируемым при данной конкретной температуре детекции.
Согласно одному из воплощений, для определения того, указывают ли сигналы, детектируемые при температурах детекции 50°C и 40°C, на присутствие нуклеотидных последовательностей-мишеней, имеющих температуры детекции 50°C и 40°C, необходимо использовать референсное значение.
Согласно одному из воплощений данного изобретения, в зависимости от подходов к получению разницы, для анализа того, является ли полученное значение разницы указанием на присутствие нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, может быть применено понятие порога.
Согласно одному из воплощений данного изобретения, в зависимости от подходов к получению разницы, присутствие нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, можно определить, используя значение самой полученной разницы. Например, предварительное указание порогового значения для получения разницы является примером воплощения такого непосредственного использования самой разницы.
Согласно одному из воплощений данного изобретения референсное значение используют для определения присутствия нуклеотидных последовательностей-мишеней.
В конкретном воплощении разница в сигналах при данной конкретной температуре детекции и температуре детекции, превышающей данную конкретную температуру детекции, предоставляемая нуклеотидной последовательностью-мишенью, имеющей температуру детекции, превышающую данную конкретную температуру детекции, может быть выражена через референсное значение.
В конкретном воплощении, референсное значение для случая, когда сигналы при конкретной температуре детекции и температуре детекции, превышающей данную конкретную температуру детекции, предоставляемые нуклеотидной последовательностью-мишенью, имеющей температуру детекции, превышающую данную конкретную температуру детекции, отличаются друг от друга, может отличаться более чем на 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5%, 5%, 5,5%, 6%, 6,5%, 7%, 7,5%, 8%, 8,5%, 9%, 9,5%, 10%, 12%, 15%, 20% или 30% по сравнению с референсным значением для случая, когда эти два сигнала являются одинаковыми.
В конкретном воплощении, референсное значение для нуклеотидной последовательности-мишени, имеющей температуру детекции, превышающую конкретную температуру детекции, можно использовать при определении присутствия этой нуклеотидной последовательности-мишени, имеющей конкретную низкую температуру детекции, если референсное значение для нуклеотидной последовательности-мишени, имеющей температуру детекции, превышающую данную конкретную температуру детекции, рассчитанное, исходя из сигналов при этих двух температурах детекции, может отличаться более чем на 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5%, 5%, 5,5%, 6%, 6,5%, 7%, 7,5%, 8%, 8,5%, 9%, 9,5%, 10%, 12%, 15%, 20% или 30% по сравнению с референсным значением для случая, когда эти два сигнала являются одинаковыми.
Согласно одному из воплощений, если сравнение проводят для определения возможности использования референсного значения, то это референсное значение рассчитывают путем деления сигналов. Согласно одному из воплощений способ вычисления референсного значения для определения возможности использования референсного значения может быть одним и тем же способом вычисления референсного значения для детекции нуклеотидной последовательности-мишени или отличаться от него.
Согласно одному из воплощений, если сигналы для множества нуклеотидных последовательностей-мишеней детектируют при температуре детекции, превышающей конкретную температуру детекции, то референсное значение для множества нуклеотидных последовательностей-мишеней используют с учетом закономерности изменения сигнала при измененных температурах детекции для множества нуклеотидных последовательностей-мишеней.
Согласно одному из воплощений, если присутствует нуклеотидная последовательность-мишень, имеющая температуру детекции, превышающую конкретную температуру детекции, то референсное значение используют для определения присутствия нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции.
Случай, когда присутствует нуклеотидная последовательность-мишень, имеющая температуру детекции, превышающую конкретную температуру детекции, включает случай, когда при температуре детекции, превышающей данную конкретную температуру детекции, детектируют значимый сигнал, указывающий на присутствие нуклеотидной последовательности-мишени, имеющей температуру детекции, превышающую данную конкретную температуру детекции.
Согласно одному из воплощений, если нуклеотидная последовательность-мишень, имеющая температуру детекции, превышающую конкретную температуру детекции, отсутствует, то референсное значение возможно используют для определения присутствия нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции.
Случай, когда нуклеотидная последовательность-мишень, имеющая температуру детекции, превышающую конкретную температуру детекции, отсутствует, включает случай, когда детектируют только сигнал с интенсивностью, аналогичной интенсивности фонового сигнала.
Референсные значения могут быть предварительно получены для всех комбинаций или для некоторых отдельных комбинаций нуклеотидных последовательностей-мишеней. Согласно одному из воплощений данного изобретения референсное значение представляет собой разницу между сигналами при температурах детекции, полученных для указанных выше комбинаций.
Согласно одному из воплощений данного изобретения референсное значение может быть получено в реакционных условиях, достаточных для получения насыщенного сигнала по завершении реакции. Например, чтобы получить референсное значение для комбинации из двух нуклеотидных последовательностей-мишеней, реакционные условия, как например, содержание каждой нуклеотидной последовательности-мишени, выбирают таким образом, чтобы по завершении реакции получить насыщенный сигнал для каждой нуклеотидной последовательности-мишени. Согласно одному из воплощений данного изобретения разница между сигналами, полученными при вычислении референсного значения, лежит в конкретном диапазоне, и референсное значение выбирают в пределах этого конкретного диапазона или с указанием на этот конкретный диапазон.
Референсные значения можно использовать для определения значимости разницы, полученной для образца, с учетом способа получения разницы и практических результатов детекции. Референсные значения можно использовать для получения разницы для образца, тем самым они вовлечены в определение присутствия нуклеиновой кислоты-мишени.
Согласно одному из воплощений данного изобретения, для определения присутствия нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, в данном способе используют по меньшей мере одно референсное значение из референсных значений, полученных посредством (1) инкубирования всех комбинаций нуклеотидных последовательностей-мишеней, имеющих температуры детекции выше данной конкретной температуры детекции, с соответствующими средствами генерации сигнала в другом реакционном сосуде, нежели реакционный сосуд на стадии (а), (2) детекции сигналов не только при одной или более температурах детекции, превышающих данную конкретную температуру детекции, но также и при данной конкретной температуре детекции, и (3) затем получения разницы между сигналом, детектируемым при одной или более температурах детекции, превышающих данную конкретную температуру детекции, и сигналом, детектируемым при данной конкретной температуре детекции.
Если согласно настоящему изобретению предполагается детектировать по меньшей мере три нуклеотидные последовательности-мишени, то с учетом различных комбинаций нуклеотидных последовательностей-мишеней с разной комбинацией двух температур детекции, выбранных для детекции сигналов, могут быть получены различные референсные значения.
Согласно одному из воплощений данного изобретения присутствие нуклеотидных последовательностей-мишеней определяют в порядке их температур детекции, начиная от нуклеотидной последовательности-мишени, имеющей самую высокую температуру детекции, до нуклеотидной последовательности-мишени, имеющей самую низкую температуру детекции, и в зависимости от способов определения присутствия мишени выбирают подходящие референсные значения и их используют.
В приведенном выше примере, для получения референсного значения для определения присутствия нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции (40°C), все комбинации (т.е. нуклеотидную последовательность-мишень, имеющую температуру детекции 60°C, нуклеотидную последовательность-мишень, имеющую температуру детекции 50°C, и комбинацию нуклеотидных последовательностей-мишеней, имеющих температуры детекции 60°C и 50°C) нуклеотидных последовательностей-мишеней, имеющих температуры детекции (60°C и 50°C), превышающие данную конкретную температуру детекции (40°C), инкубируют со средствами генерации сигнала для генерирования сигналов; сигналы детектируют не только при одной или более температурах детекции (60°C и 50°C), превышающих данную конкретную температуру детекции (40°C), но также и при данной конкретной температуре детекции (40°C); и затем сигнал, детектируемый при одной или более температурах детекции, превышающих данную конкретную температуру детекции, и сигнал, детектируемый при данной конкретной температуре детекции, используют для получения разницы между данными сигналами. В соответствии с этим же способом получают референсные значения для определения присутствия нуклеотидных последовательностей-мишеней, имеющих другие температуры детекции (т.е. 60°C и 50°C).
Альтернативно, для определения присутствия нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, в данном способе дополнительно используют по меньшей мере одно референсное значение из референсных значений, полученных посредством (1) инкубирования всех комбинаций нуклеотидных последовательностей-мишеней, имеющих температуры детекции выше данной конкретной температуры детекции, с соответствующими средствами генерации сигнала в другом реакционном сосуде, нежели реакционный сосуд на стадии (а), (2) детекции сигналов как при температуре детекции, непосредственно более высокой, чем данная конкретная температура детекции, так и при данной конкретной температуре детекции, и (3) затем получения разницы между сигналом, детектируемым при температуре детекции, непосредственно более высокой, чем данная конкретная температура детекции, и сигналом, детектируемым при данной конкретной температуре детекции, для получения разницы между сигналами.
В приведенном выше примере, для получения референсного значения с целью определения присутствия нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции (40°C), все комбинации (т.е. нуклеотидную последовательность-мишень, имеющую температуру детекции 60°C, нуклеотидную последовательность-мишень, имеющую температуру детекции 50°C, и комбинацию нуклеотидных последовательностей-мишеней, имеющих температуры детекции 60°C и 50°C) нуклеотидных последовательностей-мишеней, имеющих температуры детекции (60°C и 50°C), превышающие данную конкретную температуру детекции (40°C), инкубируют со средствами генерации сигнала для генерирования сигналов; сигналы детектируют как при температуре детекции (50°C), непосредственно более высокой, чем данная конкретная температура детекции (40°C), так и при данной конкретной температуре детекции (40°C); и затем сигнал, детектируемый при температуре детекции (50°C), непосредственно более высокой, чем данная конкретная температура детекции, и сигнал, детектируемый при данной конкретной температуре детекции (40°C), используют для получения разницы между данными сигналами. В соответствии с этим же способом получают референсные значения для определения присутствия нуклеотидных последовательностей-мишеней, имеющих другие температуры детекции (т.е. 60°C и 50°C).
Согласно одному из воплощений данного изобретения референсное значение получают путем вычисления соотношения между сигналами, детектируемыми при одной из температур детекции, превышающей конкретную температуру детекции, и при данной конкретной температуре детекции, или путем выполнения операции вычитания в отношении этих сигналов. Согласно одному из воплощений данного изобретения референсное значение получают путем вычисления отношения сигнала, детектируемого при конкретной температуре детекции, к сигналу, детектируемому при одной из температур детекции, превышающей данную конкретную температуру детекции. Согласно одному из воплощений данного изобретения референсное значение получают путем вычисления отношения сигнала, детектируемого при одной из температур детекции, превышающей конкретную температуру детекции, к сигналу, детектируемому при данной конкретной температуре детекции.
Согласно одному из воплощений, если с использованием референсного значения получают значение порога для определения присутствия нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, то его можно получить, используя конкретное референсное значение или некоторые референсные значения из референсных значений, полученных для различных комбинаций нуклеотидных последовательностей-мишеней. Например, если анализируют возможное отсутствие одной нуклеотидной последовательности-мишени, имеющей температуру детекции, превышающую конкретную температуру детекции, то для определения порога применяют референсные значения, полученные для комбинации нуклеотидных последовательностей-мишеней, не содержащих эту нуклеотидную последовательность-мишень.
В одном из воплощений, если детектируют по меньшей мере три нуклеотидные последовательности-мишени, то для проверки присутствия нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, предварительно получают стандартный образец, содержащий комбинации нуклеотидных последовательностей-мишеней за исключением нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции, и затем получают референсные значения. С учетом данных референсных значений получают значение порога для определения присутствия нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции.
Согласно одному из воплощений, использование сигнала, детектируемого при конкретной температуре детекции, включает получение квалификационного значения для определения присутствия нуклеотидной последовательности-мишени, имеющей самую относительно высокую температуру детекции, а использование разницы включает получение квалификационного значения для определения присутствия нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции.
Согласно одному из воплощений данного изобретения, использование разницы включает получение квалификационного значения для определения присутствия нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, и данное квалификационное значение получают в результате (1) математической обработки сигнала, детектируемого при одной или более температурах детекции, превышающих данную конкретную температуру детекции, и сигнала, детектируемого при данной конкретной температуре детекции, или (2) использования сигнала, детектируемого при данной конкретной температуре детекции, с учетом отсутствия детекции сигнала при одной или более температурах детекции, превышающих данную конкретную температуру детекции, если данный сигнал не детектируется при одной или более температурах детекции, превышающих данную конкретную температуру детекции.
Согласно одному из воплощений данного изобретения стадию (b) проводят, сначала определяя присутствие нуклеотидной последовательности-мишени, имеющей самую относительно высокую температуру детекции, а затем последовательно определяя присутствие нуклеотидных последовательностей-мишеней, имеющих относительно более низкие температуры детекции, в порядке убывания.
Согласно одному из воплощений, один реакционный сосуд дополнительно содержит по меньшей мере один дополнительный комплект, при этом каждый из них содержит по меньшей мере три дополнительных средства генерации сигнала, для детекции других нуклеотидных последовательностей-мишеней, нежели по меньшей мере эти три нуклеотидные последовательности-мишени; при этом сигналы, генерируемые каждым комплектом из по меньшей мере трех средств генерации сигнала в таком сосуде, различаются, и эти сигналы детектируют, используя, соответственно, детекторы разных типов.
Согласно одному из воплощений данного изобретения нуклеотидные последовательности-мишени содержат нуклеотидную вариацию (в частности, SNP).
IV. Детекция двух нуклеотидных последовательностей-мишеней с использованием разных температур детекции и анализа плавления
Согласно следующему аспекту данного изобретения предложен способ детекции двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции и анализа плавления, включающий:
(a) инкубирование образца с двумя средствами генерации сигнала для детекции двух нуклеотидных последовательностей-мишеней в одном реакционном сосуде и детекцию генерируемого сигнала с использованием детектора одного типа; при этом каждую из нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала; при этом одна из двух нуклеотидных последовательностей-мишеней имеет относительно высокую температуру детекции, а другая имеет относительно низкую температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом относительно высокая температура детекции представляет собой температуру, допускающую генерирование сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, а относительно низкая температура детекции представляет собой температуру, допускающую генерирование как сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, так и сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции; при этом сигналы, генерируемые этими двумя средствами генерации сигнала, не различаются детектором одного типа; при этом детекцию осуществляют при относительно высокой температуре детекции;
(b) проведение анализа плавления для продукта инкубирования со стадии (а) в диапазоне температур для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции; и
(c) определение присутствия нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, на основе сигнала, детектируемого на стадии (а), и присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, с использованием результата анализа плавления со стадии (b).
Стадия (а). Инкубирование со средствами генерации сигнала и детекция сигналов
В первую очередь, анализируемый образец инкубируют со средствами генерации сигнала для детекции двух нуклеотидных последовательностей-мишеней в одном реакционном сосуде и затем генерируемый сигнал детектируют, используя детектор одного типа. Сигналы, генерируемые этими двумя средствами генерации сигнала, не различаются детектором одного типа.
Каждую из нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала. Одна из двух нуклеотидных последовательностей-мишеней имеет относительно высокую температуру детекции, а другая имеет относительно низкую температуру детекции, определяемую с использованием соответствующего средства генерации сигнала.
Согласно одному из воплощений настоящего изобретения нуклеотидную последовательность-мишень, имеющую относительно высокую температуру детекции, детектируют с применением способа детекции в режиме реального времени с использованием своей температуры детекции, а нуклеотидную последовательность-мишень, имеющую относительно низкую температуру детекции, детектируют с использованием анализа плавления.
Детекцию на стадии (а) проводят при относительно высокой температуре детекции, а не при относительно низкой температуре детекции.
Средство генерации сигнала, допускающее генерирование сигнала в процессе анализа плавления, выбирают для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
Согласно одному из воплощений, поскольку в средстве генерации сигнала, предназначенном для анализа плавления, применяется гибридизация и денатурация дуплекса, то может генерироваться сигнал, зависящий от реакционных условий на стадии (а).
Согласно одному из воплощений средство генерации сигнала для генерирования сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, должно быть сконструировано таким образом, чтобы не генерировать никакого сигнала при относительно высокой температуре детекции.
Согласно четвертому аспекту данного изобретения средство генерации сигнала для генерирования сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, может генерировать сигнал или не генерировать сигнала, зависящего от реакционных условий на стадии (а). Даже если сигнал для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, может генерироваться в конкретных реакционных условиях, то такой генерируемый сигнал не детектируется, поскольку детекцию сигнала проводят при относительно высокой температуре детекции на стадии (а).
Ввиду того, что сигнал для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, может генерироваться и детектироваться на стадии (b), то генерирования данного сигнала на стадии (а) не добиваются.
Согласно одному из воплощений, средство генерации сигнала для анализа плавления не включает средство, генерирующее сигнал с использованием расщепления меченых зондов или меченого дуплекса. Поскольку в анализе плавления используют величину Тпл для гибридных структур, то следует не допускать расщепления детектируемых гибридных структур. При наличии расщепления может не происходить образования пиков плавления или возможно значительное снижение чувствительности детекции. Помимо этого, сигнал в результате такого расщепления, вероятно, будет ложноположительным сигналом для способа детекции в режиме реального времени.
Стадию (а) проводят в условиях, допускающих генерирование по меньшей мере сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции.
Согласно одному из воплощений стадию (а) проводят в процессе амплификации сигнала одновременно с амплификацией нуклеиновой кислоты.
Согласно одному из воплощений стадию (а) проводят в процессе амплификации сигнала без амплификации нуклеиновой кислоты.
Согласно одному из воплощений, по меньшей мере одно из средств генерации сигнала представляет собой средство генерации сигнала для генерирования сигнала способом, зависящим от образования дуплекса.
Согласно одному из воплощений средства генерации сигнала для каждой из нуклеотидных последовательностей-мишеней представляют собой средство генерации сигнала для генерирования сигнала способом, зависящим от образования дуплекса.
Согласно одному из воплощений сигнал генерируется в результате образования дуплекса между нуклеотидной последовательностью-мишенью и детектирующим олигонуклеотидом, специфически гибридизованным с данной нуклеотидной последовательностью-мишенью. Согласно одному из воплощений сигнал генерируется дуплексом, образованным способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью.
Согласно одному из воплощений, по меньшей мере одно из средств генерации сигнала представляет собой средство генерации сигнала для генерирования сигнала способом, зависящим от расщепления детектирующего олигонуклеотида. Согласно одному из воплощений сигнал генерируется в результате гибридизации детектирующего олигонуклеотида с нуклеотидной последовательностью-мишенью и затем расщепления детектирующего олигонуклеотида. Согласно одному из воплощений сигнал генерируется в результате расщепления детектирующего олигонуклеотида способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью.
Согласно одному из воплощений, средства генерации сигнала для каждой из нуклеотидных последовательностей-мишеней представляют собой средство генерации сигнала с использованием образования дуплекса способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью.
Согласно одному из воплощений генерирование сигнала способом, зависящим от расщепления детектирующего олигонуклеотида, используют для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции.
В частности, использование генерирования сигнала способом, зависящим от расщепления детектирующего олигонуклеотида, для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, имеет очень большое преимущество по следующим причинам: (1) температуру детекции можно выбирать в относительно широком температурном диапазоне; (2) можно выбрать гораздо более высокую температуру по сравнению с подходами с применением гибридизации; и (3) можно обеспечить отсутствие сигнала при проведении анализа плавления, выбирая подходящие средства генерации сигнала и реакционные условия (например, путем выбора средств генерации сигнала, не способных обеспечивать получение сигналов в результате только гибридизации без расщепления, или выбора условий, допускающих расщепление большей части детектирующих олигонуклеотидов).
Средство генерации сигнала для генерирования сигнала способом, зависящим от образования дуплекса (например, с применением "молекулярного маяка"), также может обеспечивать получение сигнала в результате расщепления под действием 5'-нуклеазы, зависящего от реакционных условий. Средство генерации сигнала может рассматриваться как средство генерации сигнала, способное обеспечивать получение сигнала посредством расщепления, при условии, что его используют для генерирования сигнала посредством расщепления.
Согласно одному из воплощений, средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, представляет собой средство генерации сигнала с использованием расщепления детектирующего олигонуклеотида, а средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, представляет собой средство генерации сигнала с использованием образования дуплекса.
Согласно одному из воплощений, средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, представляет собой средство генерации сигнала с использованием расщепления детектирующего олигонуклеотида, а средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, генерирует сигнал посредством дуплекса, образованного способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с данной нуклеотидной последовательностью-мишенью.
Согласно одному из воплощений два средства генерации сигнала содержат идентичную метку, и сигналы от этой метки не различаются детектором одного типа.
После инкубирования (взаимодействия) образца с двумя средствами генерации сигнала для генерирования сигнала генерируемый сигнал детектируют, используя детектор одного типа. Детекцию проводят при относительно высокой температуре детекции, допускающей генерирование сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции.
Стадия (b). Анализ плавления
После этого проводят анализ плавления продукта инкубирования со стадии (а) в диапазоне температур для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
В настоящей заявке описывается проведение стадии (b) после детекции на стадии (а) только для удобного описания. С учетом принципа, лежащего в основе настоящего изобретения, будет понятно, что стадию (b) можно проводить до детекции на стадии (а). Поэтому способ, включающий стадию (b) до детекции на стадии (а), также включен в объем настоящего изобретения.
Стадию (b) можно проводить, используя различные способы анализа плавления, известные специалисту в данной области техники. Подразумевается, что термин "анализ плавления", использованный в данном описании, охватывает не только анализ плавления в узком смысле, но также и анализ гибридизации, если не указано иное. Анализ плавления в узком смысле относится к способу, при котором диссоциацию дуплексов измеряют в условия увеличения жесткости, осуществляемого путем корректировки температур. Анализ гибридизации в узком смысле относится к способу, при котором ассоциацию дуплексов измеряют в условиях уменьшения жесткости, осуществляемого путем корректировки температур жесткости. Подразумевается, что термин "кривая плавления" или "пик кривой плавления", использованный в данном описании, охватывает не только кривую плавления или пик кривой плавления из анализа плавления в узком смысле, но также и кривой гибридизации или пика кривой гибридизации из анализа гибридизации, если не указано иное. Кривая плавления или кривая гибридизации может быть получена с использованием традиционных технологий, например, так, как описано в патентах США №№6174670 и 5789167; Drobyshev et al., Gene 188: 45 (1997); Kochinsky and Mirzabekov, Human Mutation, 19: 343 (2002); Livehits et al., J. Biomol. Structure Dynam., 11: 783 (1994) и Howell et al., Nature Biotechnology, 17: 87 (1999). Например, кривая плавления или кривая гибридизации может представлять собой графическое изображение или отображение изменения выходного сигнала в зависимости от изменения такого параметра, как жесткость условий гибридизации. Можно построить график зависимости выходного сигнала непосредственно от параметра гибридизации. В типичном случае кривая плавления или кривая гибридизации будут характеризоваться выходным сигналом, например флуоресценцией, который указывает на относительное количество дуплексной структуры (то есть на степень гибридизации), отложенным по оси Y, и параметром гибридизации, отложенным по оси X.
Описание анализа кривой плавления (гибридизации) и анализа пиков плавления (гибридизации) будет приведено со ссылкой на описания патента США №8039215.
В анализе плавления используют величины "Тпл". Использованный в данном описании термин "Тпл" относится к температуре плавления, при которой половина популяции двухцепочечных молекул нуклеиновой кислоты диссоциирована до одноцепочечных молекул. Величина Тпл определяется длиной и содержанием G/C-пар в гибридизованных нуклеотидах. Величину Тпл можно рассчитать традиционными методами, такими как правило Уоллеса (R.B. Wallace et al., Nucleic Acids Research, 6: 3543-3547 (1979)) и метод ближайших соседей (SantaLucia J. Jr., et al., Biochemistry, 35: 3555-3562 (1996); Sugimoto N., et al., Nucleic Acids Res., 24: 4501-4505 (1996)).
Согласно одному из воплощений стадию (b) проводят, детектируя сигналы, генерируемые при увеличении температур (анализ плавления в узком смысле). Альтернативно, стадию (b) проводят, детектируя сигналы, генерируемые при уменьшении температур (анализ гибридизации в узком смысле).
Согласно одному из воплощений средство генерации сигнала, используемое для анализа плавления, включает любое средство генерации сигнала с использованием образования дуплекса в диапазоне температур. Кроме того, для анализа плавления, среди средств генерации сигнала для способов детекции в режиме реального времени, скорее используются средства, генерирующие сигналы в результате гибридизации детектирующего олигонуклеотида, чем в результате реакции расщепления.
Согласно одному из воплощений стадию (b) проводят с использованием средства генерации сигнала для генерирования сигнала способом, зависящим от образования дуплекса. В частности, стадию (b) проводят с использованием средства генерации сигнала, генерирующего сигнал в результате образования дуплекса способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью.
Сигнал от дуплекса, образованного способом, зависящим от расщепления опосредующего олигонуклеотида, может генерироваться различными способами, включая способ с РТОСЕ-плавлением (WO 2012/096523), способ с PCE-SH-плавлением (WO 2013/115442) и способ с PCE-NH-плавлением (PCT/KR2013/012312). Способ с РТОСЕ-плавлением, способ с PCE-SH-плавлением и способ с PCE-NH-плавлением соответствуют способу на основе РТОСЕ с анализом плавления, способу с PCE-SH с анализом плавления и способу с PCE-NH с анализом плавления, соответственно. Среди способов на основе РТОСЕ, для анализа плавления на стадии (b) применяются способы, в которых в результате расщепления не генерируется никакого сигнала.
Способ с РТОСЕ-плавлением, способ с PCE-SH-плавлением и способ с РСЕ-NH-плавлением также описаны в более ранних патентных документах.
Стадии (а)-(b), проводимые с использованием способа с РТОСЕ-плавлением, представляют собой следующие стадии:
(а) гибридизации нуклеотидной последовательности-мишени с располагающимся "вверх по течению" олигонуклеотидом и РТО; (b) приведения в контакт продукта со стадии (а) с ферментом, обладающим 5'-нуклеазной активностью, в условиях, подходящих для расщепления РТО; при этом располагающийся "вверх по течению" олигонуклеотид или его удлиненная цепь индуцирует расщепление РТО ферментом, обладающим 5'-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка РТО; (с) гибридизации фрагмента, высвободившегося из РТО, с СТО; при этом фрагмент, высвободившийся из РТО, гибридизуется с захватывающим участком СТО; (d) осуществления реакции удлинения с использованием продукта со стадии (с) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком СТО, удлиняется и образуется удлиненный дуплекс; причем удлиненный дуплекс имеет величину Тпл, регулируемую (1) последовательностью и/или длиной этого фрагмента, (2) последовательностью и/или длиной СТО либо (3) последовательностью и/или длиной фрагмента и последовательностью и/или длиной СТО; (е) плавления удлиненного дуплекса в диапазоне температур с получением сигнала от мишени, указывающего на присутствие удлиненного дуплекса; при этом сигнал от мишени обеспечивается посредством (1) по меньшей мере одной метки, соединенной с фрагментом и/или СТО, (2) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, (3) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, и метки, соединенной с фрагментом и/или СТО, или (4) интеркалирующей метки; и (f) детекции удлиненного дуплекса путем измерения сигнала от мишени; тем самым присутствие удлиненного дуплекса указывает на присутствие нуклеотидной последовательности-мишени.
В этом случае способ с РТОСЕ-плавлением дополнительно включает повторение всех или некоторых из стадий (a)-(f) с денатурацией между повторяющимися циклами. На стадии (а) способа с РТОСЕ-плавлением можно использовать комплект праймеров для амплификации нуклеотидной последовательности-мишени вместо располагающегося "вверх по течению" олигонуклеотида. В этом случае способ дополнительно включает повторение всех или некоторых из стадий (a)-(f) с денатурацией между повторяющимися циклами.
Стадии (а)-(b) по настоящему изобретению, проводимые с использованием способов на основе РТОСЕ с плавлением представляют собой следующие стадии:
(а) гибридизации нуклеотидной последовательности-мишени с располагающимся "вверх по течению" олигонуклеотидом и РТО; (b) приведения в контакт продукта со стадии (а) с ферментом, обладающим 5'-нуклеазной активностью, в условиях, подходящих для расщепления РТО; при этом располагающийся "вверх по течению" олигонуклеотид или его удлиненная цепь индуцирует расщепление РТО ферментом, обладающим 5'-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5'-концевой тегирующий участок или часть 5'-концевого тегирующего участка РТО; (с) гибридизации фрагмента, высвободившегося из РТО, с СТО; при этом фрагмент, высвободившийся из РТО, гибридизуется с захватывающим участком СТО; (d) осуществления реакции удлинения с использованием продукта со стадии (с) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком СТО, удлиняется с образованием удлиненной цепи; и (е) проведения анализа плавления в диапазоне температур посредством детекции сигнала, генерируемого в зависимости от присутствия удлиненной цепи.
Стадия (с). Определение присутствия нуклеотидных последовательностей-мишеней
И наконец, присутствие нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, определяют, используя сигнал, детектируемый на стадии (а), а присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, определяют, используя результат анализа плавления на стадии (b).
Согласно одному из воплощений данного изобретения нуклеотидные последовательности-мишени содержат нуклеотидную вариацию (в частности, SNP).
Неожиданные результаты по настоящему изобретению могут быть получены тогда, когда средство генерации сигнала для генерирования сигнала в результате расщепления при детекции в режиме реального времени, объединяют со средством генерации сигнала для генерирования сигнала посредством дуплекса, образованного способом, зависящим от расщепления опосредующего олигонуклеотида, гибридизованного с нуклеотидной последовательностью-мишенью, в случае анализа плавления. В этом случае средство генерации сигнала, вовлеченное в образование дуплекса и генерирующее сигнал непосредственно с использованием расщепления, следует исключить при проведении анализа плавления.
Следует отметить, что настоящее изобретение осуществляют, комбинируя способ с применением средств генерации сигнала для генерирования сигнала в результате расщепления (например, TaqMan-способ), в качестве способа в режиме реального времени, и способа на основе РТОСЕ с использованием плавления, в качестве анализа плавления, обеспечивая получение наиболее убедительных результатов.
Согласно одному из воплощений в результате использования сигнала, детектируемого на стадии (а), получают квалификационное значение для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции.
Согласно одному из воплощений данного изобретения нуклеотидные последовательности-мишени содержат нуклеотидную вариацию (в частности, SNP).
V. Детекция по меньшей мере трех нуклеотидных последовательностей-мишеней с использованием разных температур детекции и анализа плавления
Согласно еще одному аспекту данного изобретения предложен способ детекции по меньшей мере трех нуклеотидных последовательностей-мишеней в образце с использованием анализа температур детекции и анализа плавления, включающий:
(а) инкубирование образца по меньшей мере с тремя средствами генерации сигнала для детекции по меньшей мере трех нуклеотидных последовательностей-мишеней в одном реакционном сосуде и детекцию генерируемого сигнала с использованием детектора одного типа; при этом каждую из по меньшей мере трех нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала; при этом каждая из по меньшей мере трех нуклеотидных последовательностей-мишеней имеет свою температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом температура детекции представляет собой температуру, допускающую генерирование сигнала не только для нуклеотидной последовательности-мишени, имеющей данную температуру детекции, но также и сигнала для нуклеотидной последовательности-мишени, имеющей более высокую температуру детекции, чем данная температура детекции; при этом сигналы, генерируемые этими средствами генерации сигнала, не различаются детектором одного типа; при этом некоторые из по меньшей мере трех нуклеотидных последовательностей-мишеней детектируют с использованием анализа температур детекции, и детекцию осуществляют как при температуре детекции для указанных некоторых из по меньшей мере трех нуклеотидных последовательностей-мишеней, так и при одной или более температурах детекции, превышающих данные температуры детекции;
(b) проведение анализа плавления для продукта инкубирования со стадии (а) в диапазоне температур для определения присутствия других нуклеотидных последовательностей-мишеней, отличающихся от указанных некоторых из по меньшей мере трех нуклеотидных последовательностей-мишеней; и
(c) определение (1) присутствия указанных некоторых из нуклеотидных последовательностей-мишеней на основе сигнала, детектируемого на стадии (а); при этом, если определяют присутствие нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, среди указанных некоторых из по меньшей мере трех нуклеотидных последовательностей-мишеней, то присутствие нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции, определяют по разнице между сигналом, детектируемым при одной или более температурах детекции, превышающих данную конкретную температуру детекции, и сигналом, детектируемым при данной конкретной температуре детекции; при этом, если данная конкретная температура детекции является самой относительно высокой температурой детекции среди температур детекции, то присутствие этой нуклеотидной последовательности-мишени определяют на основе сигнала, детектируемого при данной конкретной температуре детекции; и (2) присутствия других нуклеотидных последовательностей-мишеней, отличающихся от указанных некоторых из по меньшей мере трех нуклеотидных последовательностей-мишеней, определяемых по результату анализа плавления на стадии (b).
Поскольку настоящее изобретение в целом следует аспектам данного изобретения от первого до четвертого, описанным выше, общие для них части описания опущены, чтобы избежать излишнего дублирования, приводящего к усложнению данного описания.
Стадия (а). Инкубирование со средствами генерации сигнала и детекция сигналов
В первую очередь, анализируемый образец инкубируют по меньшей мере с тремя средствами генерации сигнала для детекции по меньшей мере трех нуклеотидных последовательностей-мишеней в одном реакционном сосуде и затем генерируемый сигнал детектируют, используя детектор одного типа. Сигналы, генерируемые по меньшей мере тремя средствами генерации сигнала, не различаются детектором одного типа.
Одна из нуклеотидных последовательностей-мишеней имеет самую относительно высокую температуру детекции. Для детекции нуклеотидной последовательности-мишени, имеющей самую относительно высокую температуру детекции, используют средство генерации сигнала, способное обеспечить получение сигнала при самой относительно высокой температуре детекции.
В настоящем изобретении некоторые из по меньшей мере трех нуклеотидных последовательностей-мишеней детектируют с использованием анализа температур детекции, а другие детектируют с использованием анализа плавления.
Термин "некоторые" в выражении "некоторые из по меньшей мере трех нуклеотидных последовательностей-мишеней" включает в себя "одну или более" мишеней. Использованный в данном описании термин "анализ температур детекции" относится к способу детекции в режиме реального времени, включающему детекцию при разных температурах, для детекции нуклеотидной последовательности-мишени, если не указано иное.
Средства генерации сигнала, предназначенные для генерирования сигнала для нуклеотидной последовательности-мишени, анализируемой с использованием анализа плавления, могут генерировать или не генерировать такой сигнал в зависимости от реакционных условий на стадии (а). Ввиду того, что сигнал для нуклеотидной последовательности-мишени, анализируемой с использованием анализа плавления, может генерироваться и детектироваться на стадии (b), то генерирования данного сигнала на стадии (а) не добиваются.
Для каждой из по меньшей мере трех нуклеотидных последовательностей-мишеней необходимо использовать средство генерации сигнала, имеющее температуру детекции, отличающуюся от других.
Согласно одному из воплощений, поскольку в средстве генерации сигнала, предназначенном для анализа плавления, применяется гибридизация и денатурация дуплекса, то может генерироваться сигнал, зависящий от реакционных условий на стадии (а).
Согласно одному из воплощений стадию (а) проводят в условиях, подходящих для генерирования по меньшей мере сигнала для нуклеотидной последовательности-мишени, анализируемой с использованием анализа температур детекции.
Согласно одному из воплощений выбор нуклеотидных последовательностей-мишеней, анализируемых с использованием анализа температур детекции, проводят с учетом температур детекции. В частности, в первую очередь выбирают нуклеотидную последовательность-мишень, имеющую самую высокую температуру детекции, а затем выбирают некоторые последовательности в порядке убывания температур детекции.
Согласно одному из воплощений стадию (а) проводят в процессе амплификации сигнала одновременно с амплификацией нуклеиновой кислоты.
Согласно одному из воплощений стадию (а) проводят в процессе амплификации сигнала без амплификации нуклеиновой кислоты.
Согласно одному из воплощений, по меньшей мере одно из средств генерации сигнала представляет собой средство генерации сигнала для генерирования сигнала способом, зависящим от образования дуплекса.
Согласно одному из воплощений, средства генерации сигнала для каждой из нуклеотидных последовательностей-мишеней представляют собой средства генерации сигнала для генерирования сигнала в результате образования дуплекса.
Согласно одному из воплощений сигнал генерируется в результате образования дуплекса между нуклеотидной последовательностью-мишенью и детектирующим олигонуклеотидом, специфически гибридизованным с данной нуклеотидной последовательностью-мишенью. Согласно одному из воплощений сигнал генерируется дуплексом, образованным способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью.
Согласно одному из воплощений данного изобретения средства генерации сигнала для каждой из нуклеотидных последовательностей-мишеней представляют собой средства генерации сигнала с использованием образования дуплекса способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью.
Согласно одному из воплощений, по меньшей мере одно из средств генерации сигнала представляет собой средство генерации сигнала для генерирования сигнала способом, зависящим от расщепления детектирующего олигонуклеотида. Согласно одному из воплощений сигнал генерируется в результате гибридизации детектирующего олигонуклеотида с нуклеотидной последовательностью-мишенью и затем расщепления детектирующего олигонуклеотида. Согласно одному из воплощений сигнал генерируется в результате расщепления детектирующего олигонуклеотида способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью.
Согласно одному из воплощений генерирование сигнала способом, зависящим от расщепления детектирующего олигонуклеотида, используют только для нуклеотидной последовательности-мишени, имеющей самую относительно высокую температуру детекции, среди по меньшей мере трех нуклеотидных последовательностей-мишеней.
Согласно одному из воплощений данного изобретения, средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей самую относительно высокую температуру детекции, представляет собой средство генерации сигнала с использованием расщепления детектирующего олигонуклеотида, а средства генерации сигнала для других нуклеотидных последовательностей-мишеней представляют собой средства генерации сигнала с использованием образования дуплекса.
Согласно одному из воплощений данного изобретения, средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей самую относительно высокую температуру детекции, представляет собой средство генерации сигнала с использованием детектирующего олигонуклеотида, а средства генерации сигнала для других нуклеотидных последовательностей-мишеней представляют собой средства генерации сигнала с использованием образования дуплекса способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью.
Например, сигнал для нуклеотидной последовательности-мишени, имеющей самую относительно высокую температуру детекции, генерируют с использованием TaqMan-способа, а сигналы для других нуклеотидных последовательностей-мишеней генерируют с использованием способа с РТОСЕ, способа с PCE-SH или способа с PCE-NH.
Согласно одному из воплощений данного изобретения, по меньшей мере три средства генерации сигнала содержат идентичную метку, и сигналы от данной метки не различаются детектором одного типа.
Количество нуклеотидных последовательностей-мишеней, подлежащих детектированию в соответствии с настоящим изобретением, не ограничено и включает более чем 3, 4, 5, 6, 7, 8, 9 и 10 нуклеотидных последовательностей-мишеней в одном реакционном сосуде.
После инкубирования (взаимодействия) образца по меньшей мере с тремя средствами генерации сигнала с целью генерирования сигнала, генерируемый сигнал детектируют, используя детектор одного типа. Согласно одному из воплощений некоторые из по меньшей мере трех нуклеотидных последовательностей-мишеней детектируют с использованием анализа температур детекции и детекцию осуществляют как при температуре детекции указанных некоторых из по меньшей мере трех нуклеотидных последовательностей-мишеней, так и при одной или более температурах детекции, превышающих данные температуры детекции.
Согласно одному из воплощений сигналы детектируют при всех температурах детекции, необходимых для проведения анализа температур детекции.
Генерируемый сигнал детектируют, используя детектор одного типа. Каждая из по меньшей мере трех нуклеотидных последовательностей-мишеней имеет свою температуру детекции, определяемую с использованием соответствующего средства генерации сигнала. Температура детекции представляет собой температуру, допускающую генерирование сигнала не только для нуклеотидной последовательности-мишени, имеющей данную температуру детекции, но также и сигнала для нуклеотидной последовательности-мишени, имеющей более высокую температуру детекции, чем данная температура детекции.
Согласно одному из воплощений нуклеотидные последовательности-мишени, подлежащие детектированию с использованием анализа температур детекции, имеют более высокие температуры детекции, чем детектируемые с использованием анализа плавления.
Стадия (b). Анализ плавления
Для определения присутствия других нуклеотидных последовательностей-мишеней, нежели указанные некоторые из по меньшей мере трех нуклеотидных последовательностей-мишеней, проводят анализ плавления для продукта инкубирования со стадии (а) в диапазоне температур.
В настоящей заявке описывается проведение стадии (b) после детекции на стадии (а) только для удобного описания. С учетом принципа, лежащего в основе настоящего изобретения, будет понятно, что стадию (b) можно проводить до детекции на стадии (а). Поэтому способ, включающий стадию (b) до детекции на стадии (а), также включен в объем настоящего изобретения.
Согласно одному из воплощений стадию (b) проводят с использованием средства генерации сигнала для генерирования сигнала способом, зависящим от образования дуплекса. В частности, стадию (b) проводят в соответствии со способом на основе РТОСЕ с использованием плавления.
Стадия (с). Определение присутствия нуклеотидных последовательностей-мишеней
И наконец, присутствие по меньшей мере трех нуклеотидных последовательностей-мишеней в образце определяют, используя сигнал, детектируемый на стадии (а), и результат анализа плавления на стадии (b).
Присутствие некоторых из нуклеотидных последовательностей-мишеней определяют, используя сигнал, детектируемый на стадии (а). Если определяют присутствие нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, среди указанных некоторых из по меньшей мере трех нуклеотидных последовательностей-мишеней, то присутствие нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции, определяют, используя разницу между сигналом, детектируемым при одной или более температурах детекции, превышающих данную конкретную температуру детекции, и сигналом, детектируемым при данной конкретной температуре детекции. Если конкретная температура детекции является самой относительно высокой температурой детекции среди температур детекции, то присутствие нуклеотидной последовательности-мишени определяют, используя сигнал, детектируемый при данной конкретной температуре детекции.
Согласно одному из воплощений, в данном способе дополнительно используют референсное значение для определения присутствия нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, полученное посредством (1) инкубирования всех комбинаций нуклеотидных последовательностей-мишеней, имеющих температуры детекции, превышающие данную конкретную температуру детекции, со средствами генерации сигнала в другом реакционном сосуде, нежели реакционный сосуд на стадии (а), (2) детекции сигналов не только при одной или более температурах детекции, превышающих данную конкретную температуру детекции, но также и при данной конкретной температуре детекции, и (3) затем получения разницы между сигналом, детектируемым при одной или более температурах детекции, превышающих данную конкретную температуру детекции, и сигналом, детектируемым при данной конкретной температуре детекции.
Альтернативно, в данном способе дополнительно используют референсное значение для определения присутствия нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, полученное посредством (1) инкубирования всех комбинаций нуклеотидных последовательностей-мишеней, имеющих температуры детекции, превышающие данную конкретную температуру детекции, со средствами генерации сигнала в другом реакционном сосуде, нежели реакционный сосуд на стадии (а), (2) детекции сигналов как при температуре детекции, непосредственно более высокой, чем данная конкретная температура детекции, так и при данной конкретной температуре детекции, и (3) затем получения разницы между сигналом, детектируемым при температуре детекции, непосредственно более высокой, чем данная конкретная температура детекции, и сигналом, детектируемым при данной конкретной температуре детекции.
Согласно одному из воплощений, если для получения разницы между сигналами или получения референсных значений для нуклеотидных последовательностей-мишеней, детектируемых с использованием анализа температур детекции, требуется детекция сигналов при температурах детекции для нуклеотидных последовательностей-мишеней, детектируемых с использованием анализа плавления, то могут быть собраны и использованы сигналы при температурах детекции для нуклеотидных последовательностей-мишеней, детектируемых с применением анализа плавления.
Присутствие других нуклеотидных последовательностей-мишеней, отличающихся от некоторых из по меньшей мере трех нуклеотидных последовательностей-мишеней, подлежащих определению с использованием анализа температур детекции, определяют по результату анализа плавления на стадии (b).
Согласно одному из воплощений стадию (d) проводят, сначала определяя присутствие нуклеотидной последовательности-мишени, имеющей самую относительно высокую температуру детекции, а затем последовательно определяя присутствие нуклеотидных последовательностей-мишеней, имеющих относительно более низкие температуры детекции, в порядке убывания.
Согласно одному из воплощений, определение присутствия нуклеотидной последовательности-мишени с использованием анализа плавления можно применять при определении присутствия нуклеотидной последовательности мишени с использованием анализа температур детекции (например, для выбора референсных значений).
Если в режиме реального времени детектируют по меньшей мере три нуклеотидные последовательности-мишени, то генерирование сигналов в результате используют только для одной нуклеотидной последовательности-мишени. Что касается других нуклеотидных последовательностей-мишеней, то для улучшения эффективности и быстроты выполнения анализа можно применять способы на основе РТОСЕ.
Согласно одному из воплощений данного изобретения нуклеотидные последовательности-мишени содержат нуклеотидную вариацию (в частности, SNP).
VI. Наборы для детекции нуклеотидных последовательностей-мишеней с использованием нескольких температур детекции
Согласно другому аспекту данного изобретения предложен набор для детекции двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции, содержащий:
(a) два средства генерации сигнала для детекции двух нуклеотидных последовательностей-мишеней; при этом каждую из нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала; при этом одна из двух нуклеотидных последовательностей-мишеней имеет относительно высокую температуру детекции, а другая имеет относительно низкую температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом относительно высокая температура детекции представляет собой температуру, допускающую генерирование сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, а относительно низкая температура детекции представляет собой температуру, допускающую генерирование как сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, так и сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции; при этом сигналы, генерируемые этими двумя средствами генерации сигнала, не различаются детектором одного типа; при этом детекцию осуществляют как при относительно высокой температуре детекции, так и при относительно низкой температуре детекции; и
(b) инструкцию, в которой описан аспект I способа по настоящему изобретению, озаглавленный как "Детекция двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции".
Согласно еще одному аспекту данного изобретения предложен набор для SNP-генотипирования нуклеотидной последовательности в образце с использованием разных температур детекции, содержащий:
(a) средство генерации сигнала для детекции SNP-содержащих аллелей; при этом каждый из SNP-содержащих аллелей детектируют с использованием соответствующего средства генерации сигнала; при этом один из SNP-содержащих аллелей имеет относительно высокую температуру детекции, а другой имеет относительно низкую температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом относительно высокая температура детекции представляет собой температуру, допускающую генерирование сигнала для SNP-содержащего аллеля, имеющего относительно высокую температуру детекции, а относительно низкая температура детекции представляет собой температуру, допускающую генерирование как сигнала для SNP-содержащего аллеля, имеющего относительно низкую температуру детекции, так и сигнала для SNP-содержащего аллеля, имеющего относительно высокую температуру детекции; при этом сигналы, генерируемые средствами генерации сигнала не различаются детектором одного типа; при этом детекцию осуществляют как при относительно высокой температуре детекции, так и при относительно низкой температуре детекции; и
(b) инструкцию, в которой описан аспект II способа по настоящему изобретению, озаглавленный как "SNP-генотипирование с использованием разных температур детекции".
Согласно следующему аспекту данного изобретения предложен набор для детекции по меньшей мере трех нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции, содержащий:
(а) по меньшей мере три средства генерации сигнала для детекции по меньшей мере трех нуклеотидных последовательностей-мишеней; при этом каждую из по меньшей мере трех нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала; при этом каждая из по меньшей мере трех нуклеотидных последовательностей-мишеней имеет свою температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом температура детекции представляет собой температуру, допускающую генерирование не только сигнала для нуклеотидной последовательности-мишени, имеющей данную температуру детекции, но также и сигнала для нуклеотидной последовательности-мишени, имеющей более высокую температуру детекции, чем данная температура детекции; при этом сигналы, генерируемые этими средствами генерации сигнала, не различаются детектором одного типа; при этом детекцию осуществляют при каждой из этих разных температур детекции; и
(b) инструкцию, в которой описан аспект III способа по настоящему изобретению, озаглавленный как "Детекция по меньшей мере трех нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции".
Согласно еще одному аспекту данного изобретения предложен набор для детекции двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции и анализа плавления, содержащий:
(а) два средства генерации сигнала для детекции двух нуклеотидных последовательностей-мишеней; при этом каждую из нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала; при этом одна из двух нуклеотидных последовательностей-мишеней имеет относительно высокую температуру детекции, а другая имеет относительно низкую температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом относительно высокая температура детекции представляет собой температуру, допускающую генерирование сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, а относительно низкая температура детекции представляет собой температуру, допускающую генерирование как сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, так и сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции; при этом сигналы, генерируемые этими двумя средствами генерации сигнала, не различаются детектором одного типа; при этом детекцию осуществляют при относительно высокой температуре детекции; при этом средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, представляет собой средство генерации сигнала с использованием расщепления детектирующего олигонуклеотида, а средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, представляет собой средство генерации сигнала с использованием образования дуплекса; и
(b) инструкцию, в которой описан аспект IV способа по настоящему изобретению, озаглавленный как "Детекция двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции и анализа плавления".
Согласно другому аспекту данного изобретения предложен набор для детекции по меньшей мере трех нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции и анализа плавления, содержащий:
(a) по меньшей мере три средства генерации сигнала для детекции по меньшей мере трех нуклеотидных последовательностей-мишеней; при этом каждую из по меньшей мере трех нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала; при этом каждая из по меньшей мере трех нуклеотидных последовательностей-мишеней имеет свою температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом температура детекции представляет собой температуру, допускающую генерирование не только сигнала для нуклеотидной последовательности-мишени, имеющей данную температуру детекции, но также и сигнала для нуклеотидной последовательности-мишени, имеющей более высокую температуру детекции, чем данная температура детекции; при этом сигналы, генерируемые этими средствами генерации сигнала, не различаются детектором одного типа; при этом некоторые из по меньшей мере трех нуклеотидных последовательностей-мишеней детектируют с использованием анализа температур детекции и детекцию осуществляют как при температуре детекции для указанных некоторых из по меньшей мере трех нуклеотидных последовательностей-мишеней, так и при одной или более температурах детекции, превышающих данные температуры детекции; при этом средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей самую относительно высокую температуру детекции, представляет собой средство генерации сигнала с использованием расщепления детектирующего олигонуклеотида, а средства генерации сигнала для других нуклеотидных последовательностей-мишеней представляют собой средства генерации сигнала с использованием образования дуплекса; и
(b) инструкцию, в которой описывается аспект V способа по настоящему изобретению, озаглавленный как "Детекция по меньшей мере трех нуклеотидных последовательностей-мишеней с использованием разных температур детекции и анализа плавления".
Поскольку наборы по данному изобретению готовят для осуществления способов по настоящему изобретению, общие для них части описания опущены, чтобы избежать излишнего дублирования, приводящего к усложнению данного описания.
Все наборы по настоящему изобретению, описанные выше, возможно могут включать в себя реагенты, необходимые для проведения амплификации мишени с использованием реакций ПЦР (например, ПЦР-реакций), такие как буферы, кофакторы ДНК-полимераз и дезоксирибонуклеотид-5-трифосфаты. Возможно, что данные наборы также могут включать в себя молекулы различных полинуклеотидов, обратную транскриптазу, различные буферы и реагенты, и антитела, ингибирующие ДНК-полимеразную активность. Наборы также могут включать в себя реагенты, необходимые для проведения реакций положительного и отрицательного контроля. Оптимальные количества реагентов для использования в данной реакции могут быть легко определены специалистом в данной области техники на основе информации, содержащейся в настоящем описании. Компоненты набора могут находиться в отдельных контейнерах, или в одном контейнере могут находиться несколько компонентов.
Инструкции для описания или практического осуществления способов по настоящему изобретению могут быть записаны на подходящем носителе. Например, инструкции могут быть напечатаны на такой основе, как бумага и пластик. В других воплощениях инструкции могут быть представлены в виде файла с данными для электронного хранения, присутствующего на подходящем пригодном для ввода в компьютер информационном носителе, таком как CD-ROM и дискета. В следующих воплощениях инструкции с руководством к действию могут быть не представлены в наборе, но при этом должна быть предусмотрена возможность получения инструкций из удаленного источника, например, через интернет. Примером этого воплощения является набор, в который входит веб-адрес, где можно просмотреть инструкции и/или с которого эти инструкции могут быть загружены.
VII. Информационный носитель и устройство для детекции нуклеотидных последовательностей-мишеней с использованием нескольких температур детекции
Поскольку информационный носитель, устройство и компьютерная программа по настоящему изобретению, описанные ниже, предназначены для осуществления способов по настоящему изобретению с использованием компьютера, общие для них части описания опущены, чтобы избежать излишнего дублирования, приводящего к усложнению данного описания.
Согласно другому аспекту данного изобретения предложен пригодный для ввода в компьютер информационный носитель, содержащий инструкции для конфигурирования процессора с целью осуществления способа определения присутствия двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции, (способа) включающего:
(a) получение как сигнала, детектируемого при относительно высокой температуре детекции, так и сигнала, детектируемого при относительно низкой температуре детекции; при этом каждую из нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала; при этом генерируемый сигнал детектируют, используя детектор одного типа; при этом одна из двух нуклеотидных последовательностей-мишеней имеет относительно высокую температуру детекции, а другая имеет относительно низкую температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом относительно высокая температура детекции представляет собой температуру, допускающую генерирование сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, а относительно низкая температура детекции представляет собой температуру, допускающую генерирование как сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, так и сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции; и
(b) определение присутствия двух нуклеотидных последовательностей-мишеней на основе полученного сигнала; при этом (1) присутствие нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, определяют на основе сигнала, детектируемого при относительно высокой температуре детекции, а (2) присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, определяют по разнице между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции.
Согласно одному из воплощений, если нуклеотидная последовательность-мишень, имеющая относительно высокую температуру детекции, присутствует, то референсное значение для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, используют для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
Согласно одному из воплощений настоящего изобретения референсное значение для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, хранят на пригодном для ввода в компьютер информационном носителе. Согласно одному из воплощений настоящего изобретения пригодный для ввода в компьютер информационный носитель содержит инструкции для ввода референсного значения при осуществлении данного способа. Согласно одному из воплощений настоящего изобретения пригодный для ввода в компьютер информационный носитель дополнительно содержит инструкции для конфигурирования процессора с целью осуществления способа получения референсного значения.
Согласно другому аспекту данного изобретения предложена компьютерная программа, предназначенная для хранения на пригодном для ввода в компьютер информационном носителе, для конфигурирования процессора с целью осуществления способа определения присутствия двух нуклеотидных последовательностей-мишеней в образце, (способа) включающего:
(a) получение как сигнала, детектируемого при относительно высокой температуре детекции, так и сигнала, детектируемого при относительно низкой температуре детекции; при этом каждую из нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала; при этом генерируемый сигнал детектируют, используя детектор одного типа; при этом одна из двух нуклеотидных последовательностей-мишеней имеет относительно высокую температуру детекции, а другая имеет относительно низкую температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом относительно высокая температура детекции представляет собой температуру, допускающую генерирование сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, а относительно низкая температура детекции представляет собой температуру, допускающую генерирование как сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, так и сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции; и
(b) определение присутствия двух нуклеотидных последовательностей-мишеней на основе полученного сигнала; при этом (1) присутствие нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, определяют на основе сигнала, детектируемого при относительно высокой температуре детекции, а (2) присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, определяют по разнице между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции.
Согласно еще одному аспекту данного изобретения предложена компьютерная программа, хранящаяся на пригодном для ввода в компьютер информационном носителе, для конфигурирования процессора с целью осуществления описанного выше способа детекции двух нуклеотидных последовательностей-мишеней.
Согласно одному из воплощений настоящего изобретения компьютерная программа содержит референсное значение для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции. Согласно одному из воплощений настоящего изобретения компьютерная программа содержит инструкции для ввода референсного значения при осуществлении данного способа. Согласно одному из воплощений настоящего изобретения компьютерная программа дополнительно содержит инструкции для конфигурирования процессора с целью осуществления способа получения референсного значения.
Будучи заранее сформулированными в процессоре, программные инструкции действуют, давая команду процессору к выполнению описанного выше способа по настоящему изобретению. Программные инструкции могут содержать инструкцию для получения первого сигнала и второго сигнала, а также инструкцию для определения присутствия двух нуклеотидных последовательностей-мишеней с использованием полученных сигналов.
Описанный выше способ по настоящему изобретению осуществляется процессором, таким как процессор в автономном компьютере, в подсоединенном к сети компьютере или в устройстве сбора данных, как например, находящееся в приборе для проведения ПЦР в режиме реального времени.
Типы пригодного для ввода в компьютер информационного носителя включают различные информационные носители, такие как CD-R (compact disc-recordable - записываемый компакт-диск), CD-ROM (compact disc read-only memory - компакт-диск, доступный только для чтения), DVD (digital versatile disc - цифровой видеодиск), флэш-память, гибкий диск, жесткий диск, портативный HDD (hard (magnetic) disk drive - жесткий диск), USB (universal serial bus - "универсальная последовательная шина"), магнитная лента, мини-диск, энергонезависимая карта памяти, EEPROM (electrically erasable programmable read-only memory - электрически стираемое перепрограммируемое постоянное запоминающее устройство), оптический диск, оптический информационный носитель, RAM (Random Access Memory - оперативная память), ROM (read-only memory - постоянное запоминающее устройство), системная память и веб-сервер.
Данные (например, интенсивность, количество циклов амплификации и температура детекции), связанные с сигналами, могут быть получены с использованием нескольких механизмов. Например, данные могут быть собраны процессором, вмонтированным в устройство для сбора данных ПЦР. Данные могут поступать в процессор в режиме реального времени по мере их сбора, или они могут храниться в блоке памяти или буферном запоминающем устройстве и поступать в процессор после завершения эксперимента. Аналогичным образом, набор данных может поступать в отдельную систему, такую как стационарная компьютерная система, посредством сетевого соединения (например, LAN (local area network - локальная вычислительная сеть), VPN (virtual private network - виртуальная частная сеть), интранет и интернет) или прямого соединения (например, USB или другого прямого проводного или беспроводного соединения) с устройством сбора данных, или поступать на съемный носитель данных, такой как CD, DVD, гибкий диск, портативный HDD или тому подобное, в автономную компьютерную систему. Аналогичным образом, набор данных может поступать в серверную вычислительную систему посредством сетевого соединения (например, LAN, VPN, интранета, интернета и беспроводной коммуникационной сети) с клиентом, например, на ноутбук или стационарную компьютерную систему. После получения или сбора данных проводится процесс анализа данных с получением обработанного сигнала, исходя из разницы между сигналами, используемыми для определения присутствия нуклеотидных последовательностей-мишеней в случае, если сигнал детектируют при относительно высокой температуре детекции. Процессор обрабатывает полученные данные, связанные с сигналами, с получением обработанного сигнала, отражающего разницу между сигналами для двух температур детекции. Например, процессор обрабатывает полученные данные с получением отношения сигнала, детектируемого при относительно низкой температуре детекции, к сигналу, детектируемому при относительно высокой температуре детекции.
Инструкции для конфигурирования процессора с целью осуществления настоящего изобретения могут быть включены в логическую систему. Инструкции можно загружать и хранить в модуле памяти (например, на жестком диске или другом запоминающем устройстве, таком как локальная или подсоединенная RAM или ROM), однако нахождение инструкций может быть предусмотрено на любом информационном носителе программного обеспечения, таком как портативный HDD, USB, гибкий диск, CD и DVD. Компьютерная программа для реализации настоящего изобретения может быть выполнена с использованием различных языков программирования, таких как С, С++, Java, Visual Basic, VBScript, JavaScript, Perl и XML. Помимо этого, согласно настоящему изобретению можно использовать различные языки и протоколы для внешнего и внутреннего хранения и передачи данных и команд.
Согласно еще одному аспекту данного изобретения предложено устройство для детекции нуклеотидной последовательности-мишени в образце с использованием разных температур детекции, содержащее (а) компьютерный процессор и (b) описанный выше пригодный для ввода в компьютер информационный носитель, соединяемый с компьютерным процессором.
Согласно одному из воплощений данное устройство дополнительно содержит реакционный сосуд для размещения образца и средств генерации сигнала, средство регулирования температуры для регулирования температуры в реакционном сосуде и/или детектор одного типа для детекции сигналов, генерируемых средствами генерации сигнала.
Согласно одному из воплощений компьютерный процессор дает возможность детектору одного типа не только детектировать сигналы, генерируемые средствами генерации сигнала при относительно высокой температуре детекции и при относительно низкой температуре детекции, но также рассчитывать разницу между сигналом, детектируемым при относительно высокой температуре детекции, и сигналом, детектируемым при относительно низкой температуре детекции. Процессор может быть устроен таким образом, чтобы один процессор мог выполнять две функции: управление детекцией при двух температурах детекции и вычисление разницы. Альтернативно, процессорный модуль может быть устроен таким образом, чтобы эти две функции выполняли два процессора, соответственно.
Первой существенной особенностью устройства является наличие процессора, дающего возможность устройству детектировать сигналы, генерируемые при двух температурах детекции. Согласно одному из воплощений, если сигнал генерируется одновременно с амплификацией нуклеотидной последовательности-мишени, то устройство содержит процессор, дающий возможность устройству детектировать сигналы, генерируемые при двух температурах детекции в каждом цикле амплификации.
Второй существенной особенностью устройства является наличие процессора для обработки сигнала, детектируемого при двух температурах детекции, для получения разницы между сигналами. Согласно одному из воплощений разница между сигналами выражается в виде численных значений в результате математической обработки.
Согласно одному из воплощений процессор может быть реализован путем установки программного обеспечения в традиционные устройства для детекции нуклеотидных последовательностей-мишеней (например, в устройство для ПЦР в режиме реального времени). Согласно одному из воплощений устройство содержит процессор, дающий возможность устройству детектировать сигналы по меньшей мере при двух температурах детекции и осуществлять математическую обработку по меньшей мере двух результатов детекции.
Согласно еще одному аспекту данного изобретения предложен пригодный для ввода в компьютер информационный носитель, содержащий инструкции для конфигурирования процессора с целью осуществления способа определения присутствия по меньшей мере трех нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции, (способа) включающего:
(a) получение сигналов, детектируемых по меньшей мере при трех температурах детекции; при этом каждую из по меньшей мере трех нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала; при этом каждая из по меньшей мере трех нуклеотидных последовательностей-мишеней имеет свою температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом температура детекции представляет собой температуру, допускающую генерирование не только сигнала для нуклеотидной последовательности-мишени, имеющей данную температуру детекции, но также и сигнала для нуклеотидной последовательности-мишени, имеющей более высокую температуру детекции, чем данная температура детекции; при этом сигналы, генерируемые этимих средствами генерации сигнала, не различаются детектором одного типа; при этом детекцию осуществляют при каждой из разных температур детекции; и
(b) определение присутствия по меньшей мере трех нуклеотидных последовательностей-мишеней на основе полученного сигнала; при этом, если определяют присутствие нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, среди по меньшей мере трех нуклеотидных последовательностей-мишеней, то присутствие нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции, определяют по разнице между сигналом, детектируемым при одной или более температурах детекции, превышающих данную конкретную температуру детекции, и сигналом, детектируемым при данной конкретной температуре детекции; при этом, если данная конкретная температура детекции является самой относительно высокой температурой детекции среди температур детекции, то присутствие данной нуклеотидной последовательности-мишени определяют на основе сигнала, детектируемого при данной конкретной температуре детекции.
Согласно одному из воплощений настоящего изобретения референсные значения хранят на пригодном для ввода в компьютер информационном носителе. Согласно одному из воплощений настоящего изобретения пригодный для ввода в компьютер информационный носитель содержит инструкции для ввода референсного значения при осуществлении способа. Согласно одному из воплощений настоящего изобретения пригодный для ввода в компьютер информационный носитель дополнительно содержит инструкции для конфигурирования процессора с целью осуществления способа получения референсных значений.
Согласно еще одному аспекту данного изобретения предложена компьютерная программа, хранящаяся или предназначенная для хранения на пригодном для ввода в компьютер информационном носителе, для конфигурирования процессора с целью осуществления описанного выше способа детекции по меньшей мере трех нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции.
Согласно другому аспекту данного изобретения предложен пригодный для ввода в компьютер информационный носитель, содержащий инструкции для конфигурирования процессора с целью осуществления способа SNP-генотипирования нуклеотидной последовательности в образце с использованием разных температур детекции, (способа) включающего:
(а) получение как сигнала, детектируемого при относительно высокой температуре детекции, так и сигнала, детектируемого при относительно низкой температуре детекции; при этом каждый из SNP-содержащих аллелей детектируют с использованием соответствующего средства генерации сигнала; при этом один из SNP-содержащих аллелей имеет относительно высокую температуру детекции, а другой имеет относительно низкую температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом относительно высокая температура детекции представляет собой температуру, допускающую генерирование сигнала для SNP-содержащего аллеля, имеющего относительно высокую температуру детекции, а относительно низкая температура детекции представляет собой температуру, допускающую генерирование как сигнала для SNP-содержащего аллеля, имеющего относительно низкую температуру детекции, так и сигнала для SNP-содержащего аллеля, имеющего относительно высокую температуру детекции;
(b) определение SNP-генотипа по разнице между полученными сигналами.
Согласно одному из воплощений настоящего изобретения референсные значения для гомозиготы, в состав которой входит SNP-содержащий аллель, имеющий относительно высокую температуру детекции, и/или гетерозиготы, и/или гомозиготы, в состав которой входит SNP-содержащий аллель, имеющий относительно низкую температуру детекции, хранят на пригодном для ввода в компьютер информационном носителе. Согласно одному из воплощений настоящего изобретения пригодный для ввода в компьютер информационный носитель содержит инструкции для ввода референсного значения при осуществлении способа. Согласно одному из воплощений настоящего изобретения пригодный для ввода в компьютер информационный носитель дополнительно содержит инструкции для конфигурирования процессора с целью осуществления способа получения референсных значений.
Согласно еще одному аспекту данного изобретения предложена компьютерная программа, хранящаяся или предназначенная для хранения на пригодном для ввода в компьютер информационном носителе, для конфигурирования процессора с целью осуществления описанного выше способа SNP-генотипирования нуклеотидной последовательности в образце с использованием разных температур детекции.
Согласно одному из воплощений настоящего изобретения компьютерная программа содержит референсные значения для гомозиготы, в состав которой входит SNP-содержащий аллель, имеющий относительно высокую температуру детекции, и/или гетерозиготы, и/или гомозиготы, в состав которой входит SNP-содержащий аллель, имеющий относительно низкую температуру детекции. Согласно одному из воплощений настоящего изобретения компьютерная программа содержит инструкции для ввода референсного значения при осуществлении способа. Согласно одному из воплощений настоящего изобретения компьютерная программа дополнительно содержит инструкции для конфигурирования процессора с целью осуществления способа получения референсных значений.
Согласно другому аспекту данного изобретения предложен пригодный для ввода в компьютер информационный носитель, содержащий инструкции для конфигурирования процессора с целью осуществления способа детекции двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции и анализа плавления, (способа) включающего:
(a) получение как сигнала при относительно высокой температуре детекции для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, так и сигнала, полученного с использованием анализа плавления в диапазоне температур, для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции; при этом каждую из нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала; при этом одна из двух нуклеотидных последовательностей-мишеней имеет относительно высокую температуру детекции, а другая имеет относительно низкую температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом относительно высокая температура детекции представляет собой температуру, допускающую генерирование сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, а относительно низкая температура детекции представляет собой температуру, допускающую генерирование как сигнала для нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, так и сигнала для нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции; при этом для определения присутствия нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, проводят анализ плавления в диапазоне температур; и
(b) определение присутствия двух нуклеотидных последовательностей-мишеней на основе полученных сигналов; при этом присутствие нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, определяют на основе сигнала при относительно высокой температуре детекции, а присутствие нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции, определяют на основе сигнала, полученного в результате анализа плавления.
Согласно еще одному аспекту данного изобретения предложена компьютерная программа, хранящаяся или предназначенная для хранения на пригодном для ввода в компьютер информационном носителе, для конфигурирования процессора с целью осуществления описанного выше способа детекции двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции и анализа плавления.
Согласно другому аспекту данного изобретения предложен пригодный для ввода в компьютер информационный носитель, содержащий инструкции для конфигурирования процессора с целью осуществления способа детекции по меньшей мере трех нуклеотидных последовательностей-мишеней в образце с использованием анализа температур детекции и анализа плавления, (способа) включающего:
(а) получение как (1) сигнала при температуре детекции некоторых из по меньшей мере трех нуклеотидных последовательностей-мишеней и при одной или более температурах детекции, превышающих данные температуры детекции, для определения присутствия некоторых из по меньшей мере трех нуклеотидных последовательностей-мишеней, так и (2) сигнала, полученного с использованием анализа плавления в диапазоне температур, для определения присутствия других нуклеотидных последовательностей-мишеней, отличающихся от указанных некоторых из по меньшей мере трех нуклеотидных последовательностей-мишеней; при этом каждую из по меньшей мере трех нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала; при этом каждая из по меньшей мере трех нуклеотидных последовательностей-мишеней имеет свою температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом данная температура детекции представляет собой температуру, допускающую генерирование не только сигнала для нуклеотидной последовательности-мишени, имеющей данную температуру детекции, но также и сигнала для нуклеотидной последовательности-мишени, имеющей более высокую температуру детекции, чем данная температура детекции; при этом указанные некоторые из по меньшей мере трех нуклеотидных последовательностей-мишеней детектируют с использованием анализа температур детекции и детекцию осуществляют как при температуре детекции указанных некоторых из по меньшей мере трех нуклеотидных последовательностей-мишеней, так и при одной или более температурах детекции, превышающих данные температуры детекции; при этом для определения присутствия других нуклеотидных последовательностей-мишеней, отличающихся от указанных некоторых из по меньшей мере трех нуклеотидных последовательностей-мишеней, проводят анализ плавления в диапазоне температур; и
(b) определение (1) присутствия указанных некоторых из нуклеотидных последовательностей-мишеней на основе полученного сигнала; при этом, если определяют присутствие нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, среди указанных некоторых из по меньшей мере трех нуклеотидных последовательностей-мишеней, то присутствие нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции, определяют по разнице между сигналом, детектируемым при одной или более температурах детекции, превышающих данную конкретную температуру детекции, и сигналом, детектируемым при данной конкретной температуре детекции; при этом, если данная конкретная температура детекции является самой относительно высокой температурой детекции среди температур детекции, то присутствие нуклеотидной последовательности-мишени определяют, используя сигнал, детектируемый при данной конкретной температуре детекции; и (2) присутствия других нуклеотидных последовательностей-мишеней, отличающихся от указанных некоторых из по меньшей мере трех нуклеотидных последовательностей-мишеней, на основе сигнала, полученного в результате анализа плавления.
Согласно еще одному аспекту данного изобретения предложена компьютерная программа, хранящаяся или предназначенная для хранения на пригодном для ввода в компьютер информационном носителе, для конфигурирования процессора с целью осуществления описанного выше способа детекции по меньшей мере трех нуклеотидных последовательностей-мишеней в образце с использованием анализа температур детекции и анализа плавления.
Отличительные признаки и преимущества данного изобретения будут обобщены ниже.
(a) Настоящее изобретение, в котором используются разные температуры детекции, дает возможность детектировать множество нуклеотидных последовательностей-мишеней в традиционных методах в режиме реального времени в одном реакционном сосуде даже с применением метки одного типа. При использовании традиционных технологий детекцию множества нуклеотидных последовательностей-мишеней выполняют с использованием анализа плавления после амплификации мишеней. В отличие от этого, для осуществления настоящего изобретения не требуется проведения анализа плавления после амплификации мишеней, в связи с чем продолжительность анализа значительно уменьшается.
(b) Интересно отметить, что авторы настоящего изобретения обнаружили, что если сигнал для нуклеотидной последовательности-мишени генерируют с использованием средства генерации сигнала, то (1) появляется возможность регулирования детекции сигнала при конкретной температуре в зависимости от типа средства генерации сигнала, и (2), в случае детекции сигнала при двух выбранных температурах детекции, сигналы, детектируемые при этих двух разных температурах детекции, изменяются согласно определенной закономерности. Авторы настоящего изобретения применили эти наблюдения для детекции нуклеотидных последовательностей-мишеней, осуществляя тем самым настоящее изобретение.
(с) В настоящем изобретении с использованием разных температур детекции для каждой из нуклеотидных последовательностей-мишеней к получению неожиданных результатов может приводить применение средства генерации сигнала, используемого для получения сигнала посредством дуплекса, образованного способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью (например, в способах на основе РТОСЕ). Во-первых, в способах с использованием опосредующего олигонуклеотида, таких как способы на основе РТОСЕ, можно легко регулировать величину Тпл образованного дуплекса для обеспечения удобного выбора температур детекции. Во-вторых, если при применении способа, обеспечивающего получение сигнала непосредственно от зонда, гибридизованного с нуклеотидной последовательностью-мишенью, вместе с этим используют, для амплификации мишеней, полимеразу, обладающую 5'-нуклеазной активностью, то зонд по всей вероятности будет расщеплен под действием 5'-нуклеазной активности, что может повлиять на интерпретацию сигналов. Поскольку в способах с использованием опосредующего олигонуклеотида, таких как способы на основе РТОСЕ, 5'-нуклеазную активность, как правило, применяют для расщепления опосредующего олигонуклеотида, то такой проблемы, связанной с интерпретацией получаемого в результате сигнала, обычно не возникает. И наконец, в способах с использованием опосредующего олигонуклеотида, таких как способы на основе РТОСЕ, может образовываться дуплекс, имеющий конкретное значение Тпл, поскольку дуплекс имеет последовательность, не зависящую от последовательности нуклеиновой кислоты-мишени. В отличие от этого, в способах с использованием зондов, предназначенных для непосредственной гибридизации с нуклеотидной последовательностью-мишенью, ввиду того, что по меньшей мере одна цепь образованного дуплекса содержит последовательность, комплементарную нуклеотидной последовательности-мишени, может образовываться дуплекс, имеющий непредполагаемую величину Тпл, когда имеется вариацию нуклеотидной последовательности-мишени.
(d) В одном из воплощений данного изобретения для детекции множества нуклеотидных последовательностей-мишеней с применением разных температур детекции в режиме реального времени к получению неожиданных результатов может приводить сочетание (1), для одной нуклеотидной последовательности-мишени, средства генерации сигнала для генерирования сигнала способом, зависящим от расщепления детектирующего олигонуклеотида (например, TaqMan-способом), и (2), для другой нуклеотидной последовательности-мишени, средства генерации сигнала для получения сигнала посредством дуплекса, образованного способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с данной нуклеотидной последовательностью-мишенью (например, способами на основе РТОСЕ).
В способе с применением расщепления детектирующего олигонуклеотида, как правило, используется фермент, обладающий 5'-нуклеазной активностью (в частности, Taq-полимераза), для расщепления детектирующего олигонуклеотида. В традиционных способах генерирования сигнала с использованием непосредственной гибридизации детектирующих зондов (например, способе "молекулярных маяков", способе с применением гибридизационных зондов или способе Hybeacon) эти детектирующие зонды с большой долей вероятности будут расщепляться под действием фермента, обладающего 5'-нуклеазной активностью (в частности, Taq-полимеразы). Расщепление детектирующих зондов может приводить к уменьшению чувствительности ввиду расходования детектирующих зондов (например, в способе с применением гибридизационных зондов) или к получению ложноположительного сигнала в способах с зависящим от расщепления получением сигнала (например, в способе "молекулярных маяков"). Несмотря на то, что в способах с применением меченых праймеров (например, в способе "sunrise" или способе "scorpion") нет связанных с расщеплением затруднений, как в способах с применением зондов, их недостатки заключаются в том, что саму величину Тпл ампликона необходимо контролировать для регулирования температур детекции. В противоположность этому, поскольку в способах на основе РТОСЕ применяется расщепление опосредующего олигонуклеотида, специфически гибридизованного с нуклеотидной последовательностью-мишенью, на них не оказывает влияния фермент, обладающий 5'-нуклеазной активностью (в частности, Taq-полимераза). Помимо этого, в способах на основе РТОСЕ можно легко регулировать величину Тпл образованного дуплекса для обеспечения удобного выбора температур детекции.
(e) В одном из воплощений данного изобретения для детекции множества нуклеотидных последовательностей-мишеней в одном реакционном сосуде с использованием детекции в режиме реального времени для некоторых мишеней и анализа плавления для других мишеней могут быть выбраны и применены средства генерации сигнала, соответствующие характеристикам анализируемых нуклеотидных последовательностей-мишеней, которые позволяют детектировать множество нуклеотидных последовательностей-мишеней гораздо более эффективным образом.
(f) В одном из воплощений данного изобретения для детекции множества нуклеотидных последовательностей-мишеней с использованием детекции в режиме реального времени и анализа плавления средство генерации сигнала для генерирования сигнала способом, зависящим от расщепления детектирующего олигонуклеотида (например, TaqMan-способом), для нуклеотидной последовательности-мишени, детектируемой в режиме реального времени, позволяет детектировать множество нуклеотидных последовательностей-мишеней значительно более удобным образом с существенно более высокой эффективностью. В способе с использованием расщепления детектирующего олигонуклеотида, таком как TaqMan-способ, осуществляется расщепление детектирующего зонда. В некоторых реакционных условиях возможно может происходить расщепление большинства детектирующих зондов. В этом случае отсутствует дуплекс, допускающий генерирование сигнала в анализе плавления, по окончании проводимой в режиме реального времени реакции, в результате чего легко можно выбрать значение Тпл для других нуклеотидных последовательностей-мишеней, подлежащих детекции с использованием анализа плавления.
(g) В одном из воплощений данного изобретения для детекции множества нуклеотидных последовательностей-мишеней с использованием детекции в режиме реального времени и анализа плавления к получению неожиданных результатов может приводить сочетание (1), для одной нуклеотидной последовательности-мишени, средства генерации сигнала для генерирования сигнала способом, зависящим от расщепления детектирующего олигонуклеотида (например, TaqMan-способом), и (2), для другой нуклеотидной последовательности-мишени, средства генерации сигнала для получения сигнала посредством дуплекса, образованного способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с данной нуклеотидной последовательностью-мишенью (например, способами на основе РТОСЕ).
Как показывают традиционные технологии с применением гибридизации между нуклеотидными последовательностями-мишенями и детектирующими олигонуклеотидами, имеются серьезные проблемы, такие как уменьшение чувствительности (включая уменьшение чувствительности в анализе плавления) ввиду расщепления зондов и генерирования обусловленных этим расщеплением ложных сигналов. Настоящее изобретение полностью свободно от таких проблем. В способах на основе РТОСЕ можно легко регулировать величину Тпл применяемых для детекции дуплексов, так что можно легко выбрать температуры детекции, используемые для детекции в режиме реального времени, и соответствующую пику плавления величину Тпл, используемую для анализа плавления.
Теперь настоящее изобретение будет описано более подробно в примерах. Специалистам в данной области техники будет очевидно, что эти примеры предназначены для более конкретного иллюстрирования, и объем настоящего изобретения, как он изложен в прилагаемой формуле изобретения, не ограничивается данными примерами.
ПРИМЕРЫ
Пример 1. Детекция двух мишеней с использованием способа с РТОСЕ с применением ПЦР в режиме реального времени, включающего детекцию сигнала при разных температурах
Далее авторы изобретения исследовали, можно ли в одном реакционном сосуде детектировать две нуклеиновые кислоты-мишени с использованием одного канала детекции и способа с РТОСЕ с применением ПЦР в режиме реального времени, включающего детекцию сигнала при разных температурах.
Для удлинения располагающихся "вверх по течению" праймеров и располагающихся "вниз по течению" праймеров, расщепления РТО и удлинения фрагмента РТО использовали Taq ДНК-полимеразу, обладающую 5'-нуклеазной активностью. В качестве нуклеотидных последовательностей-мишеней использовали геномную ДНК из Neisseria gonorrhoeae (NG) и геномную ДНК из Chlamydia trachomatis (СТ).
Для детекции СТ и NG использовали способ с РТОСЕ с применением ПЦР в режиме реального времени. При наличии мишени РТО расщепляется, и образуется фрагмент РТО. Фрагмент РТО отжигается с захватывающим участком СТО, удлиняется на матричном участке СТО, и образует удлиненный дуплекс с СТО (дуплексный СТО). Образование удлиненного дуплекса обеспечивает получение сигнала, и можно получить кривую амплификации, измеряя сигнал при температуре образования удлиненного дуплекса.
В этом примере "72°С" выбирали в качестве температуры детекции сигнала для СТ, а "60°С" выбирали в качестве температуры детекции сигнала для NG с учетом средств генерации сигнала. Удлиненный дуплекс, образованный в зависимости от присутствия СТ или NG, имеет регулируемое значение Тпл, скорректированное в соответствии с его последовательностью и длиной. В этом примере последовательность и длина удлиненного дуплекса для СТ предназначены для того, чтобы получить сигнал, который генерируется в результате образования дуплекса при 72°С. В то же время, последовательность и длина удлиненного дуплекса для NG предназначены для того, чтобы получить сигнал, который генерируется в результате образования дуплекса при 60°С, но не для получения сигнала при 72°С, поскольку происходит диссоциация и дуплекс не образуется. При температуре детекции 72°С будет генерироваться и детектироваться сигнал для СТ. При температуре детекции 60°С будет генерироваться и детектироваться сигнал для NG, а также сигнал для СТ.
РТО и СТО блокированы углеродным спейсером по своим 3'-концам, чтобы препятствовать их удлинению. СТО помечен молекулой-гасителем (BHQ-2) и флуоресцентной репортерной молекулой (CAL Fluor Red 610) на своем матричном участке (SEQ ID NO 4 и 8).
Готовили три реакционные пробирки, содержащие СТ, NG, смесь СТ и NG, и одну контрольную без мишени, соответственно.
Последовательности располагающегося "вверх по течению" праймера, располагающегося "вниз по течению" праймера, РТО и СТО, использованных в этом примере, представляют собой:
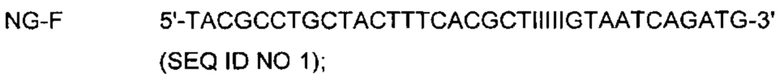
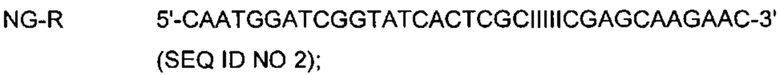
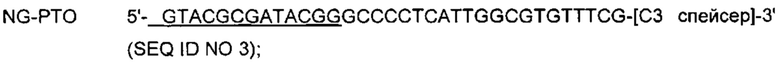

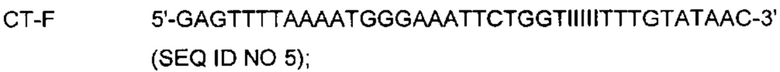
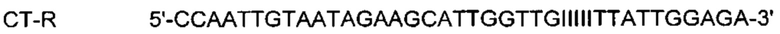


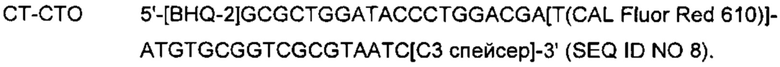
(I: дезоксиинозин).
(Подчеркнутыми буквами отмечен 5'-концевой тегирующий участок РТО).
ПЦР в режиме реального времени проводили в конечном объеме 20 мкл, содержащем нуклеиновую кислоту-мишень (10 пг геномной ДНК из NG, 10 пг геномной ДНК из СТ или смесь 10 пг геномной ДНК из NG и 10 пг геномной ДНК из СТ), 5 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO 1) и 5 пмоль располагающегося "вниз по течению" праймера (SEQ ID NO 2) для амплификации мишени NG, 3 пмоль РТО (SEQ ID NO 3), 1 пмоль СТО (SEQ ID NO 4), 5 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO 5) и 5 пмоль располагающегося "вниз по течению" праймера (SEQ ID NO 6) для амплификации мишени СТ, 3 пмоль РТО (SEQ ID NO 7), 1 пмоль СТО (SEQ ID NO 8) и 10 мкл смеси 2× Master Mix (в конечной концентрации 200 мкМ dNTP, 2 мМ MgCl2, 2 единицы Taq ДНК-полимеразы). Пробирки, содержащие реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad) в течение 5 мин при 50°С; реакционную смесь подвергали денатурации в течение 15 мин при 95°С и подвергали 50 циклам по 30 с при 95°С, 60 с при 60°С, 30 с при 72°С. Детекцию сигнала осуществляли при 60°С и 72°С каждого цикла.
Как показано на Фиг. 1А, сигналы детектировали при 72°С в присутствии СТ (пробирки 1 и 3). В случае присутствия исключительно NG сигнал детектировали при 60°С, но не при 72°С (пробирка 2). Никакого сигнала не детектировали в отсутствие нуклеиновых кислот-мишеней (пробирка 4). Результаты Фиг. 1А показывают, что при относительно высокой температуре детекции, 72°С, сигнал для СТ, имеющей относительно высокую температуру детекции, генерируется, а сигнал для NG, имеющей относительно низкую температуру детекции, не генерируется. Таким образом, должно быть очевидно, что детекция сигналов при относительно высокой температуре детекции допускала определение по меньшей мере присутствия СТ, имеющей относительно высокую температуру детекции. Кроме того, в случае пробирки 2, использование разницы, обусловленной отсутствием сигнала при относительно высокой температуре детекции и присутствием сигнала при относительно низкой температуре детекции, допускало определение присутствия NG, имеющей относительно низкую температуру детекции.
Разницу между сигналами, детектируемыми как при относительно высокой температуре детекции, так и при относительно низкой температуре детекции, рассчитывали, используя различные подходы, чтобы исследовать, имеется ли возможность детекции присутствия NG, имеющей относительно низкую температуру детекции, даже в присутствии или в отсутствие сигнала от СТ, имеющей относительно высокую температуру детекции (Фиг. 1В-1Е).
На Фиг. 1В показано отношение значений RFU в конечных точках при 72°С и 60°С (все значения RFU получали и экспортировали из данных анализа "Аппроксимация кривой с вычитанием фона" в программном обеспечении прибора). Данное соотношение, в случае присутствия исключительно СТ (пробирка 1), составляло 1,2, однако оно же в присутствии и СТ, и NG (пробирка 3) составляло 2,1. Кроме того, это соотношение в случае присутствия исключительно NG (пробирка 2) и в отсутствие какой-либо нуклеиновой кислоты-мишени (пробирка 4) составляло 36,7 и 0,7, соответственно. Для определения присутствия или отсутствия NG использовали порог 1,5. На основании этого порога подтверждали присутствие NG в пробирках 2 и 3 и отсутствие NG в пробирках 1 и 4. Порог определяли с учетом соотношения в конечной точке для пробирки, содержащей только СТ. Что касается пробирки 2, в которой может быть установлено отсутствие СТ, имеющей относительно высокую температуру детекции, порог для сигнала при относительно низкой температуре детекции может быть установлен независимо, вместо применения значения 1,5.
Другой подход с использованием сигналов при 72°С и 60°С заключается в расчете соотношения сигналов флуоресценции при 72°С и 60°С в каждом из циклов и построения зависимости такого соотношения от числа циклов (все значения RFU, обработанные для построения такой зависимости, получали и экспортировали из данных анализа "Без вычитания фона" в программном обеспечении прибора). Для определения присутствия или отсутствия NG использовали порог 0,1. Порог определяли с учетом построенной зависимости для соотношений в случае пробирки, содержащей только СТ. Как показано на Фиг. 1С, присутствие NG выявляли в пробирках 2 и 3, и для NG значения Ct составляли 32,90 и 33,18, соответственно. Никакого значения Ct не получали в случае пробирок 1 и 4. Вместо расчета этих соотношений можно вычесть интенсивность флуоресценции при 60°С из значений интенсивности при 72°С в каждом из циклов и построить зависимость результатов от числа циклов для детекции мишеней.
Применение значений индивидуального порога для анализа сигналов, полученных при 60°С для каждой пробирки, представляет собой другой способ детекции присутствия NG, имеющей относительно низкую температуру детекции, посредством использования сигнала, указывающего на присутствие СТ при относительно высокой температуре детекции. В случае, если такой сигнал детектируется при 72°С, индивидуальный порог для сигнала в случае пробирок при 60°С рассчитывали, умножая каждое значение конечный-RFU при 72°С на значение порога (1,5). Порог (1,5) определяли с учетом соотношения в конечной точке для пробирки, содержащей только СТ (см. Фиг. 1В). В случае, если такой сигнал не детектируется при 72°С, выбирают индивидуальный порог для сигнала в случае пробирок при 60°С и используют с учетом фонового сигнала, чувствительности и вариации сигнала или диапазона ошибок устройства, в соответствии с общими установками порога. В этом примере "200" определяли в качестве индивидуального порога для сигнала при 60°С.
Как показано на Фиг. 1D и Фиг. 1Е, на основании значения индивидуального порога при 60°С подтверждали присутствие NG в пробирке 2 и пробирке 3 и, кроме того, получали для NG значения Ct, составляющие 31,32 и 35,83, соответственно. Никакого значения Ct для NG в пробирках 1 и 4 не получали.
Эти результаты указывают на то, что в способе с РТОСЕ в режиме реального времени, включающем детекцию сигналов при двух температурах, (1) детекция сигналов при относительно высокой температуре детекции допускает детектирование нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, и (2) сигналы, полученные при относительно высокой температуре детекции и при относительно низкой температуре детекции, можно использовать для детектирования нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
Таким образом, две нуклеиновые кислоты-мишени можно детектировать в одном реакционном сосуде с использованием одного канала детекции и способа с РТОСЕ с применение ПЦР в режиме реального времени, включающего детекцию сигнала при разных температурах.
Пример 2. Детекция двух мишеней с использованием способа с TaqMan/PTOCE с применением ПЦР в режиме реального времени, включающего детекцию сигнала при разных температурах Авторы изобретения исследовали, можно ли в одном реакционном сосуде детектировать две нуклеиновые кислоты-мишени с использованием одного канала детекции и способа с TaqMan/PTOCE с применением ПЦР в режиме реального времени, включающего детекцию сигнала при разных температурах.
Для удлинения располагающихся "вверх по течению" праймеров и располагающихся "вниз по течению" праймеров, расщепления TaqMan-зонда, расщепления РТО и удлинения фрагмента РТО использовали Taq ДНК-полимеразу, обладающую 5'-нуклеазной активностью. В качестве нуклеотидных последовательностей-мишеней использовали геномную ДНК из Neisseria gonorrhoeae (NG) и геномную ДНК из Chlamydia trachomatis (СТ).
Для детекции СТ использовали TaqMan-способ с применением ПЦР в режиме реального времени. Если СТ присутствует, то TaqMan-зонд расщепляется, и высвобождается меченый фрагмент. Можно получить кривую амплификации, измеряя сигнал от меченого фрагмента. Для детекции NG использовали способ с РТОСЕ с применением ПЦР в режиме реального времени.
В этом примере "72°С" выбирали в качестве температуры детекции сигнала для СТ, а "60°С" выбирали в качестве температуры детекции сигнала для NG с учетом средств генерации сигнала. Удлиненный дуплекс, образованный в зависимости от присутствия NG, имеет регулируемое значение Тпл, скорректированное в соответствии с его последовательностью и длиной. В этом примере последовательность и длина удлиненного дуплекса предназначены для того, чтобы получить сигнал, который генерируется в результате образования дуплекса при 60°С, но не для получения сигнала при 72°С, поскольку происходит диссоциация и дуплекс не образуется. При температуре детекции 72°С будет генерироваться и детектироваться сигнал для СТ. При температуре детекции 60°С будет генерироваться и детектироваться сигнал для NG, а также сигнал для СТ.
TaqMan-зонд помечен флуоресцентной репортерной молекулой (CAL Fluor Red 610) на своем 5'-конце и молекулой-гасителем (BHQ-2) на своем 3'-конце (SEQ ID NO 9). РТО и СТО блокированы углеродным спейсером по своим 3'-концам, чтобы препятствовать их удлинению. СТО помечен молекулой-гасителем (BHQ-2) и флуоресцентной репортерной молекулой (CAL Fluor Red 610) на своем матричном участке (SEQ ID NO 4).
Готовили три реакционные пробирки, содержащие СТ, NG, смесь СТ и NG, и одну контрольную без мишени, соответственно.
Последовательности располагающегося "вверх по течению" праймера, располагающегося "вниз по течению" праймера, РТО, СТО и TaqMan-зонда, использованных в этом примере, представляют собой:

(I: дезоксиинозин).
(Подчеркнутыми буквами отмечен 5'-концевой тегирующий участок РТО).
ПЦР в режиме реального времени проводили в конечном объеме 20 мкл, содержащем нуклеиновую кислоту-мишень (10 пг геномной ДНК из NG, 10 пг геномной ДНК из СТ или смесь 10 пг геномной ДНК из NG и 10 пг геномной ДНК из СТ), 10 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO 1) и 10 пмоль располагающегося "вниз по течению" праймера (SEQ ID NO 2) для амплификации мишени NG, 5 пмоль РТО (SEQ ID NO 3), 1 пмоль СТО (SEQ ID NO 4), 10 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO 5) и 12 пмоль располагающегося "вниз по течению" праймера (SEQ ID NO 6) для амплификации мишени СТ, 1 пмоль TaqMan-зонда (SEQ ID NO 9) и 10 мкл смеси 2х Master Mix (в конечной концентрации 200 мкМ dNTP, 2 мМ MgCI2, 2 ед. Taq ДНК-полимеразы). Пробирки, содержащие реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad) в течение 5 мин при 50°С; реакционную смесь подвергали денатурации в течение 15 мин при 95°С и подвергали 50 циклам по 30 с при 95°С, 60 с при 60°С, 30 с при 72°С. Детекцию сигнала осуществляли при 60°С и 72°С каждого цикла.
Как показано на Фиг. 2А, сигналы детектировали при 72°С в присутствии СТ (пробирки 1 и 3). В случае присутствия исключительно NG сигнал детектировали при 60°С, но не при 72°С (пробирка 2). Никакого сигнала не детектировали в отсутствие нуклеиновых кислот-мишеней (пробирка 4). Результаты Фиг. 2А показывают, что при относительно высокой температуре детекции, 72°С, сигнал для СТ, имеющей относительно высокую температуру детекции, генерируется, а сигнал для NG, имеющей относительно низкую температуру детекции, не генерируется. Таким образом, должно быть очевидно, что детекция сигналов при относительно высокой температуре детекции, допускала определение по меньшей мере присутствия СТ, имеющей относительно высокую температуру детекции. Кроме того, в случае пробирки 2, использование разницы, обусловленной отсутствием сигнала при относительно высокой температуре детекции и присутствием сигнала при относительно низкой температуре детекции, допускало определение присутствия NG, имеющей относительно низкую температуру детекции.
Разницу между сигналами, детектируемыми как при относительно высокой температуре детекции, так и при относительно низкой температуре детекции, рассчитывали, используя различные подходы, чтобы исследовать, имеется ли возможность детекции присутствия NG, имеющей относительно низкую температуру детекции, даже в присутствии или в отсутствие сигнала от СТ, имеющей относительно высокую температуру детекции (Фиг. 2В-2Е).
На Фиг. 2В показано соотношение значений RFU в конечных точках при 72°С и 60°С (все значения RFU получали и экспортировали из данных анализа "Аппроксимация кривой с вычитанием фона" в программном обеспечении прибора). Данное соотношение, в случае присутствия исключительно СТ (пробирка 1), составляло 1,1, однако оно же в присутствии и СТ, и NG (пробирка 3) составляло 1,8. Кроме того, это соотношение в случае присутствия исключительно NG (пробирка 2) и в отсутствие какой-либо нуклеиновой кислоты-мишени (пробирка 4) составляло 1278,0 и 1,0, соответственно. Для определения присутствия или отсутствия NG использовали порог 1,2. На основании этого порога подтверждали присутствие NG в пробирках 2 и 3 и отсутствие NG в пробирках 1 и 4. Порог определяли с учетом соотношения в конечной точке для пробирки, содержащей только СТ. Альтернативно, Что касается пробирки 2, в которой может быть установлено отсутствие СТ, имеющей относительно высокую температуру детекции, порог для сигнала при относительно низкой температуре детекции может быть установлен независимо, вместо применения значения 1,2.
Другой подход с использованием сигналов при 72°С и 60°С заключается в расчете соотношения сигналов флуоресценции при 72°С и 60°С в каждом из циклов и построения зависимости такого соотношения от числа циклов (все значения RFU, обработанные для построения какой зависимости, получали и экспортировали из данных анализа "Без вычитания фона" в программном обеспечении прибора). Для определения присутствия или отсутствия NG использовали порог 0,1. Порог определяли с учетом построенной зависимости для соотношений в случае пробирки, содержащей только СТ. Как показано на Фиг. 2С, присутствие NG выявляли в пробирках 2 и 3, и для NG значения Ct составляли 37,88 и 37,20, соответственно. Никакого значения Ct не получали в случае пробирок 1 и 4. Вместо расчета этих соотношений можно вычесть интенсивность флуоресценции при 60°С из значений интенсивности при 72°С в каждом из циклов и построить зависимость результатов от числа циклов для детекции мишеней.
Применение значений индивидуального порога для анализа сигналов, полученных при 60°С для каждой пробирки, представляет собой другой способ детекции присутствия NG, имеющей относительно низкую температуру детекции, посредством использования сигнала при относительно высокой температуре детекции. В случае, если такой сигнал, указывающий на присутствие СТ, детектируется при 72°С, индивидуальный порог для сигнала в случае пробирок при 60°С рассчитывали, умножая каждое значение конечного-RFU при 72°С на значение порога (1,2). Порог (1,2) определяли с учетом соотношения в конечной точке для пробирки, содержащей только СТ (см. Фиг. 2В). В случае, если такой сигнал не детектируется при 72°С, выбирают индивидуальный порог для сигнала в случае пробирок при 60°С и используют с учетом фонового сигнала, чувствительности и вариации сигнала или диапазона ошибок устройства, в соответствии с общими установками порога. В этом примере, "200" определяли в качестве индивидуального порога для сигнала при 60°С.
Как показано на Фиг. 2D и Фиг. 2Е, на основании значения индивидуального порога при 60°С подтверждали присутствие NG в пробирке 2 и пробирке 3 и, кроме того, получали для NG значения Ct, составляющие 36,21 и 37,07, соответственно. Никакого значения Ct для NG в пробирках 1 и 4 не получали.
Эти результаты указывают на то, что в способе с TaqMan/PTOCE в режиме реального времени, включающем детекцию сигналов при двух температурах, (1) детекция сигналов при относительно высокой температуре детекции допускает детектирование нуклеотидной последовательности-мишени, имеющей относительно высокую температуру детекции, и (2) сигналы, полученные при относительно высокой температуре детекции и при относительно низкой температуре детекции, можно использовать для детектирования нуклеотидной последовательности-мишени, имеющей относительно низкую температуру детекции.
Таким образом, две нуклеиновые кислоты-мишени можно детектировать в одном реакционном сосуде с использованием одного канала детекции и способа с TaqMan/PTOCE с применение ПЦР в режиме реального времени, включающего детекцию сигнала при разных температурах.
Пример 3. Детекция двух мишеней с использованием ПЦР в режиме реального времени и анализа плавления
Авторы изобретения исследовали, можно ли в одном реакционном сосуде детектировать две нуклеиновые кислоты-мишени с использованием одного канала детекции и сочетания ПЦР в режиме реального времени и анализа плавления.
Для удлинения располагающихся "вверх по течению" праймеров и располагающихся "вниз по течению" праймеров, расщепления TaqMan-зонда, расщепления РТО и удлинения фрагмента РТО использовали Taq ДНК-полимеразу, обладающую 5'-нуклеазной активностью. В качестве нуклеотидных последовательностей-мишеней использовали геномную ДНК из Neisseria gonorrhoeae (NG) и геномную ДНК из Chlamydia trachomatis (СТ).
Для детекции СТ использовали TaqMan-способ с применением ПЦР в режиме реального времени, а для детекции NG использовали анализ с РТОСЕ и плавлением. Если присутствует СТ, то TaqMan-зонд расщепляется, и высвобождается меченый фрагмент. Если присутствует NG, то РТО расщепляется, и образуется фрагмент РТО. Фрагмент РТО отжигается с захватывающим участком СТО, удлиняется на матричный участок СТО, и образуется удлиненный дуплекс с СТО (дуплексный СТО).
Чтобы выполнить детекцию только сигнала флуоресценции, генерируемого в результате расщепления TaqMan-зонда в процессе ПЦР в режиме реального времени, детекцию сигнала флуоресценции осуществляют при температуре, при которой удлиненный дуплекс диссоциирует, то есть не происходит образования дуплекса и не генерируется сигнал от удлиненного дуплекса, образованного посредством РТОСЕ. В процессе плавления измеряют сигнал, получая пик плавления, указывающий на присутствие удлиненного дуплекса, образованного в зависимости от присутствия NG.
TaqMan-зонд помечен флуоресцентной репортерной молекулой (CAL Fluor Red 610) на своем 5'-конце и молекулой-гасителем (BHQ-2) на своем 3'-конце (SEQ ID NO 9). РТО и СТО блокированы углеродным спейсером по своим 3'-концам, чтобы препятствовать их удлинению. СТО помечен молекулой-гасителем (BHQ-2) и флуоресцентной репортерной молекулой (CAL Fluor Red 610) на своем матричном участке (SEQ ID NO 4).
Последовательности располагающегося "вверх по течению" праймера, располагающегося "вниз по течению" праймера, РТО, СТО и TaqMan-зонда, использованных в этом примере, представляют собой:

(I: дезоксиинозин).
(Подчеркнутыми буквами отмечен 5'-концевой тегирующий участок РТО).
ПЦР в режиме реального времени проводили в конечном объеме 20 мкл, содержащем нуклеиновую кислоту-мишень (10 пг геномной ДНК из NG, 10 пг геномной ДНК из СТ или смесь 10 пг геномной ДНК из NG и 10 пг геномной ДНК из СТ), 10 пмоль располагающегося "вверх по течению" праймера (SEQ ID N0 1) и 10 пмоль располагающегося "вниз по течению" праймера (SEQ ID NO 2) для амплификации мишени NG, 5 пмоль РТО (SEQ ID NO 3), 1 пмоль СТО (SEQ ID N0 4), 10 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO 5) и 12 пмоль располагающегося "вниз по течению" праймера (SEQ ID NO 6) для амплификации мишени СТ, 1 пмоль TaqMan-зонда (SEQ ID NO 9) и 10 мкл смеси 2× Master Mix (в конечной концентрации 200 мкМ dNTP, 2 мМ MgCl2, 2 ед. Taq ДНК- полимеразы). Пробирки, содержащие реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad) в течение 5 мин при 50°С; реакционную смесь подвергали денатурации в течение 15 мин при 95°С и подвергали 50 циклам по 30 с при 95°С, 60 с при 60°С, 30 с при 72°С. Детекцию сигнала осуществляли при 72°С каждого цикла. После реакции пробирку помещали на 5 мин при 55°С. Проводили анализ кривой плавления, измеряя сигнал флуоресценции в процессе повышения температуры от 55°С до 95°C с интервалом 0,5°С.
Как показано на Фиг. 3, в присутствии СТ получали кривую амплификации при проведении ПЦР в режиме реального времени, но не наблюдали никакого пика плавления в анализе плавления (пробирка 1). В присутствии NG не получали кривой амплификации при проведении ПЦР в режиме реального времени, однако в анализе плавления наблюдали пик плавления с ожидаемым значением Тпл (66°С) для удлиненного дуплекса, образованного в зависимости от присутствия NG (пробирка 2). В присутствии СТ и NG наблюдали сигналы при проведении как способа ПЦР в режиме реального времени, так и способа с применением анализа плавления (пробирка 3). Никакого сигнала не детектировали в отсутствие нуклеиновых кислот-мишеней (пробирка 4).
Эти результаты указывают на то, что с использованием одного канала детекции можно детектировать несколько нуклеиновых кислот-мишеней, применяя сочетание ПЦР в режиме реального времени и анализа плавления.
Пример 4. SNP-генотипирование с применением способа ПЦР в режиме реального времени, включающего детекцию сигнала при разных температурах
Авторы изобретения исследовали, можно ли применять способ ПЦР в режиме реального времени, включающий детекцию сигналов при разных температурах, для SNP-генотипирования в одном реакционном сосуде с использованием одного канала детекции.
Для удлинения располагающегося "вверх по течению" праймера и располагающегося "вниз по течению" праймера, расщепления РТО и удлинения фрагмента РТО использовали Taq ДНК-полимеразу, обладающую 5'-нуклеазной активностью. В качестве нуклеотидных последовательностей-мишеней использовали гомозиготу дикого типа (С), гомозиготу мутантного типа (Т) и гетерозиготу, содержащие ДНК, кодирующую MTHFR (С677Т), из генома человека.
Способ с РТОСЕ с применением ПЦР в режиме реального времени использовали для детекции аллеля дикого типа (С) и аллеля мутантного типа (Т), содержащих ДНК, кодирующую MTHFR (С677Т), из генома человека. Если присутствует аллель-мишень, то РТО расщепляется и образуется фрагмент РТО. Фрагмент РТО отжигается с захватывающим участком СТО, удлиняется матричном участке СТО и образуется удлиненный дуплекс с СТО (дуплексный СТО). Образование удлиненного дуплекса обеспечивает получение сигнала, и можно получить кривую амплификации, измеряя сигнал при температуре образования удлиненного дуплекса.
В этом примере "72°С" выбирали в качестве температуры детекции сигнала для аллеля дикого типа (С), а "55°С" выбирали в качестве температуры детекции сигнала для аллеля мутантного типа (Т) с учетом средств генерации сигнала. Удлиненный дуплекс, образованный в зависимости от присутствия аллеля дикого типа (С) или аллеля мутантного типа (Т), имеет регулируемое значение Тпл, скорректированное в соответствии с его последовательностью и длиной. В этом примере последовательность и длина удлиненного дуплекса для аллеля дикого типа (С) предназначены для того, чтобы получить сигнал, который генерируется в результате образования дуплекса при 72°С. В то же время последовательность и длина удлиненного дуплекса для аллеля мутантного типа (Т) предназначены для того, чтобы получить сигнал, который генерируется в результате образования дуплекса при 55°С, но не для получения сигнала при 72°С, поскольку происходит диссоциация и дуплекс не образуется. При температуре детекции 72°С будет генерироваться и детектироваться сигнал для аллеля дикого типа (С). При температуре детекции 55°С будет генерироваться и детектироваться сигнал для аллеля мутантного типа (Т), а также сигнал для аллеля дикого типа (С).
РТО и СТО блокированы углеродным спейсером по своим 3'-концам, чтобы препятствовать их удлинению. СТО помечен молекулой-гасителем (BHQ-2) и флуоресцентной репортерной молекулой (CAL Fluor Red 610) на своем матричном участке (SEQ ID NO 13 и 15).
Последовательности располагающегося "вверх по течению" праймера, располагающегося "вниз по течению" праймера, РТО и СТО, использованных в этом примере, представляют собой:


(I: дезоксиинозин).
(Подчеркнутыми буквами отмечен 5'-концевой тегирующий участок РТО).
ПЦР в режиме реального времени проводили в конечном объеме 20 мкл, содержащем нуклеиновую кислоту-мишень (1 нг ДНК, кодирующей MTHFR (С677Т), из генома человека, в случае гомозиготы дикого типа (С), 1 нг ДНК, кодирующей MTHFR (С677Т), из генома человека в случае мутантной (Т) гомозиготы или 1 нг ДНК, кодирующей MTHFR (С677Т), из генома человека в случае гетерозиготы), 5 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO 10) и 5 пмоль располагающегося "вниз по течению" праймера (SEQ ID NO 11), по 3 пмоль каждого РТО (SEQ ID NO 12 и 14), по 1 пмоль каждого СТО (SEQ ID NO 13 и 15) и 10 мкл смеси 2× Master Mix (в конечной концентрации 200 мкМ dNTP, 2 мМ MgCI2, 2 ед. Taq ДНК-полимеразы). Пробирки, содержащие реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad) в течение 5 мин при 50°С; реакционную смесь подвергали денатурации в течение 15 мин при 95°С и подвергали 50 циклам по 30 с при 95°С, 60 с при 55°С, 30 с при 72°С. Детекцию сигнала осуществляли при 55°С и 72°С каждого цикла.
Как показано на Фиг. 4А, сигналы детектировали при 72°С и 55°С в присутствии гомозиготы дикого типа (С) (пробирка 1) или в присутствии гетерозиготы (пробирка 3). В присутствии мутантной (Т) гомозиготы интенсивный сигнал детектировали при 55°С, но очень слабый сигнал при 72°С (пробирка 2). Никакого сигнала не детектировали в отсутствие нуклеиновых кислот-мишеней (пробирка 4).
На Фиг. 4В показано соотношение значений RFU в конечных точках при 72°С и 55°С (все значения RFU получали и экспортировали из данных анализа "Аппроксимация кривой с вычитанием фона" в программном обеспечении прибора). Соотношение в присутствии гомозиготы дикого типа (С) (пробирка 1) составляло 1,2, а соотношение в присутствии гетерозиготы (пробирка 3) составляло 1,9. Такая разница между этими двумя соотношениями указывает на то, что в пробирке, содержащей гетерозиготу, вместе с аллелем дикого типа (С) присутствует мутантный (Т) аллель. В то же время, соотношение, полученное в случае мутантной (Т) гомозиготы, имело относительно очень высокое значение, поскольку значение RFU при 72°С было низким (пробирка 2). Учитывая тот факт, что аллель дикого типа и мутантный аллель присутствуют в гетерозиготе в соотношении 1:1, слабый сигнал, детектируемый при 72°С в присутствии гомозиготы мутантного типа, может быть оценен как ложноположительный сигнал. Согласно способу по настоящему изобретению для SNP-генотипирования, значение соотношения служит для определения того, является ли сигнал при относительно высокой температуре детекции ложным сигналом или нет.
Эти результаты указывают на то, что способ с применением ПЦР в режиме реального времени, включающий детекцию сигналов при разных температурах, можно применять для SNP-генотипирования с использованием одного канала детекции, и что разницу в сигналах, полученных при относительно высокой температуре детекции и при относительно низкой температуре детекции, можно использовать для SNP-генотипирования.
Пример 5. Детекция нескольких мишеней с использованием способа с TaqMan/PTOCE с применением ПЦР в режиме реального времени, включающего детекцию сигнала при разных температурах
Авторы изобретения исследовали, можно ли в одном реакционном сосуде детектировать три нуклеиновых кислоты-мишени с использованием одного канала детекции и способа с TaqMan/PTOCE с применением ПЦР в режиме реального времени, включающего детекцию сигнала при разных температурах.
Для удлинения располагающихся "вверх по течению" праймеров и располагающихся "вниз по течению" праймеров, расщепления TaqMan-зонда, расщепления РТО и удлинения фрагмента РТО использовали Taq ДНК-полимеразу, обладающую 6'-нуклеазной активностью. В качестве нуклеотидных последовательностей-мишеней использовали геномную ДНК из Neisseria gonorrhoeae (NG), геномную ДНК из Chlamydia trachomatis (СТ) и геномную ДНК из Mycoplasma genitalium (MG).
Для детекции MG использовали TaqMan-способ с применением ПЦР в режиме реального времени. Для детекции СТ и NG использовали способ с РТОСЕ с применением ПЦР в режиме реального времени.
В этом примере "95°С" выбирали в качестве температуры детекции сигнала для MG, "72°С" выбирали в качестве температуры детекции сигнала для СТ, а "60°С" выбирали в качестве температуры детекции сигнала для NG с учетом средств генерации сигнала. В этом примере последовательность и длина удлиненного дуплекса СТ или NG предназначены для того, чтобы получить сигнал, который генерируется в результате образования дуплекса при 72°С или 60°С, соответственно, но не для получения сигнала при 95°С, поскольку происходит диссоциация и дуплекс не образуется. При температуре детекции 95°С будет генерироваться и детектироваться сигнал для MG. При температуре детекции 72°С будет генерироваться и детектироваться сигнал для СТ, а также сигнал для MG. Кроме того, при температуре детекции 60°С будет генерироваться и детектироваться сигнал для NG, а также сигнал для MG и СТ.
TaqMan-зонд помечен флуоресцентной репортерной молекулой (CAL Fluor Red 610) на своем 5'-конце и молекулой-гасителем (BHQ-2) на своем 3'-конце (SEQ ID NO 18). РТО и СТО блокированы углеродным спейсером по своим 3'-концам, чтобы препятствовать их удлинению. СТО помечен молекулой-гасителем (BHQ-2) и флуоресцентной репортерной молекулой (CAL Fluor Red 610) на своем матричном участке (SEQ ID NO 4 и 8).
Готовили семь реакционных пробирок, содержащих NG, СТ, MG; смесь NG и СТ, смесь NG и MG, смесь СТ и MG; смесь NG, СТ и MG; и одну контрольную без мишени, соответственно.
Последовательности располагающегося "вверх по течению" праймера, располагающегося "вниз по течению" праймера, РТО, СТО и TaqMan-зонда, использованных в этом примере, представляют собой:

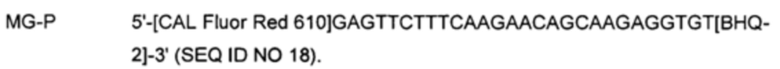
(I: дезоксиинозин).
(Подчеркнутыми буквами отмечен 5'-концевой тегирующий участок РТО).
ПЦР в режиме реального времени проводили в конечном объеме 20 мкл, содержащем нуклеиновую кислоту-мишень (10 пг геномной ДНК из NG, 10 пг геномной ДНК из СТ, 10 пг геномной ДНК из MG, смесь геномной ДНК из NG и СТ, по 10 пг каждой, смесь геномной ДНК из NG и MG, по 10 пг каждой, смесь геномной ДНК из СТ и MG, по 10 пг каждой, смесь геномной ДНК из NG, СТ и MG, по 10 пг каждой), 5 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO 1) и 5 пмоль располагающегося "вниз по течению" праймера (SEQ ID NO 2) для амплификации мишени NG, 3 пмоль РТО (SEQ ID NO 3), 1 пмоль СТО (SEQ ID NO 4), 5 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO 5) и 5 пмоль располагающегося "вниз по течению" праймера (SEQ ID NO 6) для амплификации мишени СТ, 3 пмоль РТО (SEQ ID NO 7), 1 пмоль СТО (SEQ ID NO 8), 5 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO 16) и 5 пмоль располагающегося "вниз по течению" праймера (SEQ ID NO 17) для амплификации мишени MG, 1 пмоль TaqMan-зонда (SEQ ID NO 18) и 10 мкл смеси 2× Master Mix (в конечной концентрации 200 мкМ dNTP, 2 мМ MgCl2, 2 ед. Taq ДНК-полимеразы). Пробирки, содержащие реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad) в течение 5 мин при 50°С; реакционную смесь подвергали денатурации в течение 15 мин при 95°С и подвергали 50 циклам по 30 с при 95°С, 60 с при 60°С, 30 с при 72°С. Детекцию сигнала осуществляли при 60°С, 72°С и 95°С каждого цикла.
Как показано на Фиг. 5А, 5В и 5С, сигналы, детектируемые при 95°С, давали авторам изобретения возможность определения по меньшей мере присутствия MG, имеющей самую относительно высокую температуру детекции (95°С), в пробирках 3, 5, 6 и 7.
Использование разницы, обусловленной отсутствием сигнала при самой относительно высокой температуре детекции (95°С) и присутствием сигнала при относительно средней температуре детекции (72°С), давало авторам изобретения возможность определения присутствия СТ, имеющей относительно среднюю температуру детекции (72°С), в пробирках 2 и 4.
Кроме того, использование разницы, обусловленной отсутствием сигнала при относительно средней температуре детекции (72°С) и присутствием сигнала при самой относительно низкой температуре детекции (60°С), давало авторам изобретения возможность определения присутствия NG, имеющей самую относительно низкую температуру детекции (60°С), в пробирке 1.
Разницу между сигналами, детектируемыми при 95°С, 72°С и 60°С, рассчитывали путем вычитания конечного-RFU (конечный-ΔRFU), чтобы исследовать, можно ли идентифицировать совместное присутствие СТ или NG с другими мишенями в одном реакционном сосуде.
На Фиг. 5D показаны значения конечного-ΔRFU, рассчитанные с использованием значений RFU в конечных точках при 95°С и 72°С (все значения RFU получали и экспортировали из данных анализа "Аппроксимация кривой с вычитанием фона" в программном обеспечении прибора). Для определения присутствия СТ использовали порог "300". Порог определяли с учетом конечного-ΔRFU в случае пробирок, не содержащих СТ (пробирки 1, 3 и 5). На основании этого порога подтверждали присутствие СТ в пробирках 2, 4, 6 и 7.
На Фиг. 5Е показаны значения конечного-ΔRFU, рассчитанные с использованием значений RFU в конечных точках при 72°С и 60°С (все значения RFU получали и экспортировали из данных анализа "Аппроксимация кривой с вычитанием фона" в программном обеспечении прибора). Для определения присутствия NG использовали порог "800". Порог определяли с учетом конечного-ΔRFU в случае пробирок, не содержащих NG (пробирки 2, 3 и 6). На основании этого порога подтверждали присутствие NG в пробирках 1, 4, 5 и 7.
Эти результаты указывают на то, что в способе с TaqMan/PTOCE в режиме реального времени, включающем детекцию сигналов при трех температурах, (1) детекция сигналов при самой относительно высокой температуре детекции допускает детекцию нуклеотидной последовательности-мишени, имеющей самую относительно высокую температуру детекции, и (2) разницу, полученную от сигналов при разных температурах детекции, можно использовать для идентификации нуклеотидных последовательностей-мишеней, имеющих температуры детекции ниже самой высокой температуры детекции.
Таким образом, в одном реакционном сосуде можно детектировать несколько нуклеиновых кислот-мишеней с использованием одного канала детекции и способа с TaqMan/PTOCE с применением ПЦР в режиме реального времени, включающего детекцию сигнала при разных температурах.
Основываясь на описании предпочтительного воплощения настоящего изобретения, следует понимать, что его варианты и модификации, соответствующие сущности изобретения, могут стать очевидными специалистам в данной области техники, и объем данного изобретения следует определять прилагаемой формулой изобретения и ее эквивалентами.
--->
Перечень последовательностей
<110> SEEGENE, INC.
<120> DETECTION OF TARGET NUCLEIC ACID SEQUENCES USING DIFFERENT
DETECTION TEMPERATURES
<130> PP140137
<150> KR PCT/KR2014/006714
<151> 2014-07-23
<150> KR 10-2014-0037310
<151> 2014-03-28
<150> US 61/979,545
<151> 2014-04-15
<150> KR PCT/KR2014/004173
<151> 2014-05-09
<160> 18
<170> KopatentIn 2.0
<210> 1
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> NG-F
<220>
<221> misc_feature
<222> (22)..(26)
<223> n denotes deoxyinosine
<400> 1
tacgcctgct actttcacgc tnnnnngtaa tcagatg 37
<210> 2
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> NG-R
<220>
<221> misc_feature
<222> (22)..(26)
<223> n denotes deoxyinosine
<400> 2
caatggatcg gtatcactcg cnnnnncgag caagaac 37
<210> 3
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> NG-PTO
<400> 3
gtacgcgata cgggcccctc attggcgtgt ttcg 34
<210> 4
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> NG-CTO
<400> 4
tttttttttt tttttttttg tactgcccgt atcgcgtac 39
<210> 5
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> CT-F
<220>
<221> misc_feature
<222> (26)..(30)
<223> n denotes deoxyinosine
<400> 5
gagttttaaa atgggaaatt ctggtnnnnn tttgtataac 40
<210> 6
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> CT-R
<220>
<221> misc_feature
<222> (26)..(30)
<223> n denotes deoxyinosine
<400> 6
ccaattgtaa tagaagcatt ggttgnnnnn ttattggaga 40
<210> 7
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> CT-PTO
<400> 7
gattacgcga ccgcatcaga agctgtcatt ttggctgcg 39
<210> 8
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> CT-CTO
<400> 8
gcgctggata ccctggacga tatgtgcggt cgcgtaatc 39
<210> 9
<211> 26
<212> DNA
<213> Artificial Sequence
<220>
<223> CT-P
<400> 9
catcagaagc tgtcattttg gctgcg 26
<210> 10
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<223> M677-F
<220>
<221> misc_feature
<222> (18)..(22)
<223> n denotes deoxyinosine
<400> 10
ccaccccgaa gcagggannn nngaggctga cc 32
<210> 11
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> M677-R
<220>
<221> misc_feature
<222> (20)..(24)
<223> n denotes deoxyinosine
<400> 11
caagtgatgc ccatgtcggn nnnngccttc acaa 34
<210> 12
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> M677-W-PTO
<400> 12
ggtcccgacg ttagctcccg cagacacctt ctccttc 37
<210> 13
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> M677-W-CTO
<400> 13
cctcggtgcc acgccatcgg ttcttctaac gtcgggacc 39
<210> 14
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> M677-M-PTO
<400> 14
acgtcgattc gcactcccgc agacaccttc tccttcaa 38
<210> 15
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> M677-M-CTO
<400> 15
tttttttttt tttttttttt tattctgcga atcgacgt 38
<210> 16
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> MG-F
<220>
<221> misc_feature
<222> (23)..(27)
<223> n denotes deoxyinosine
<400> 16
aaaacccacg gaaatgatga gannnnnatt ggttctac 38
<210> 17
<211> 41
<212> DNA
<213> Artificial Sequence
<220>
<223> MG-R
<220>
<221> misc_feature
<222> (27)..(30)
<223> n denotes deoxyinosine
<400> 17
ctcgttaatt tacctattcc attttgnnnn nctgataaaa g 41
<210> 18
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> MG-P
<400> 18
gagttctttc aagaacagca agaggtgt 28
<---
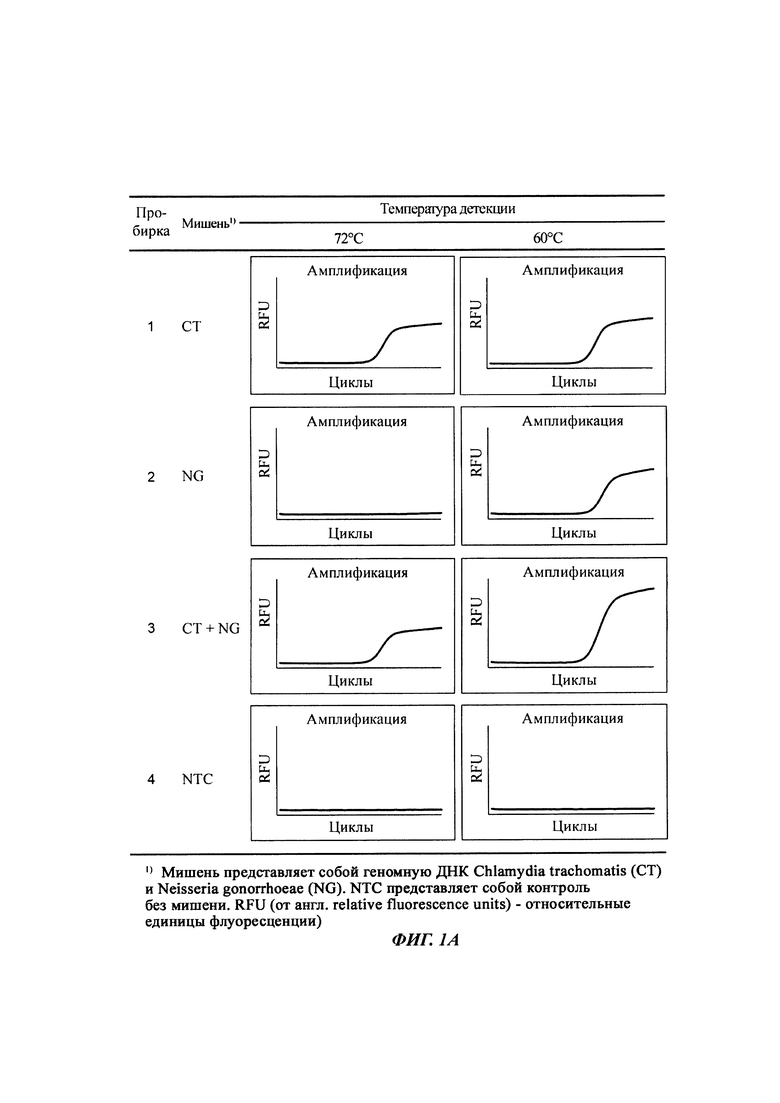
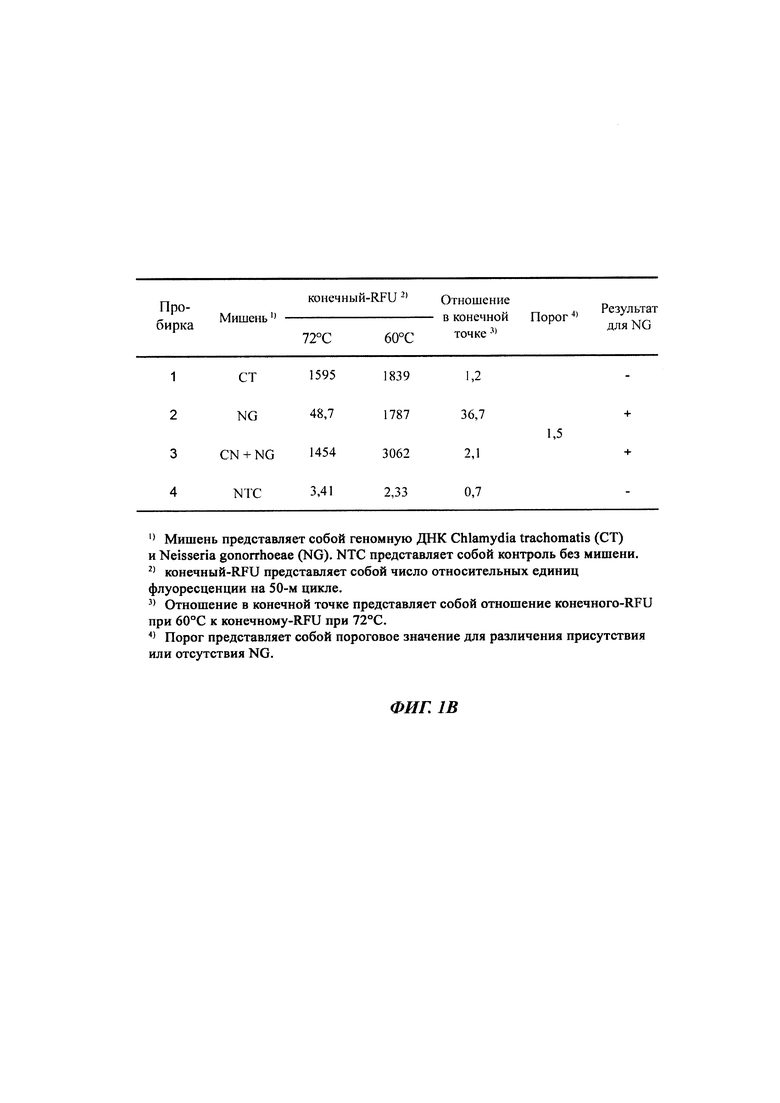
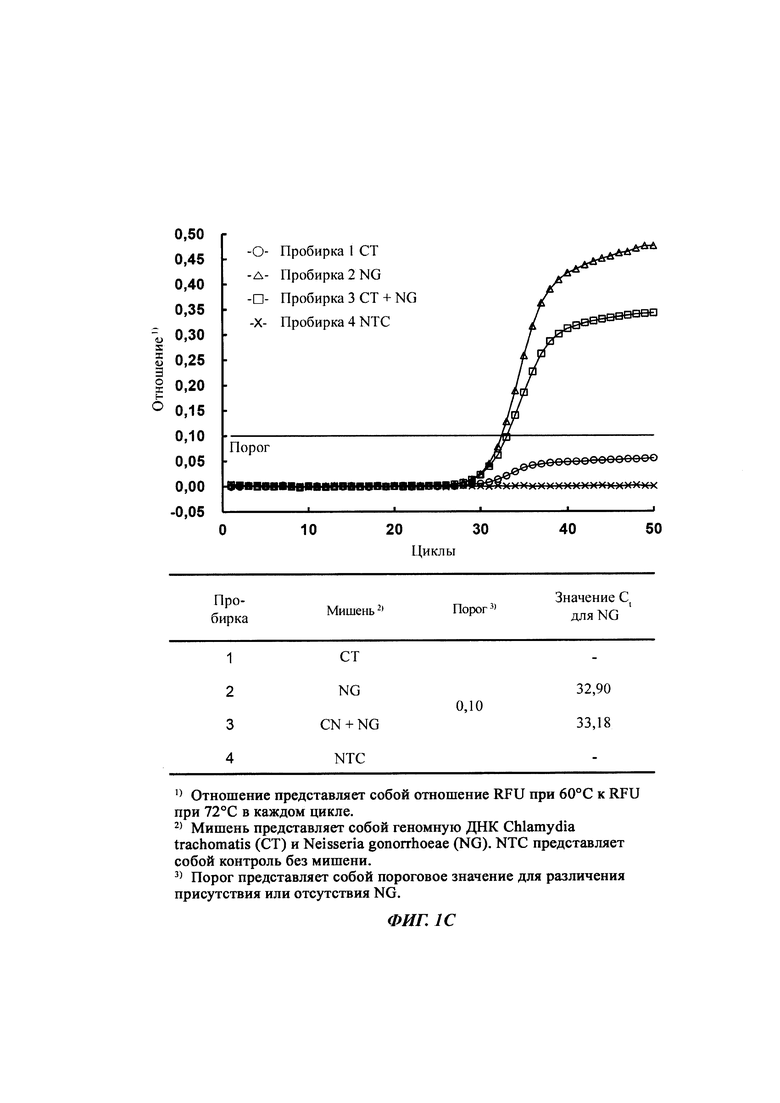
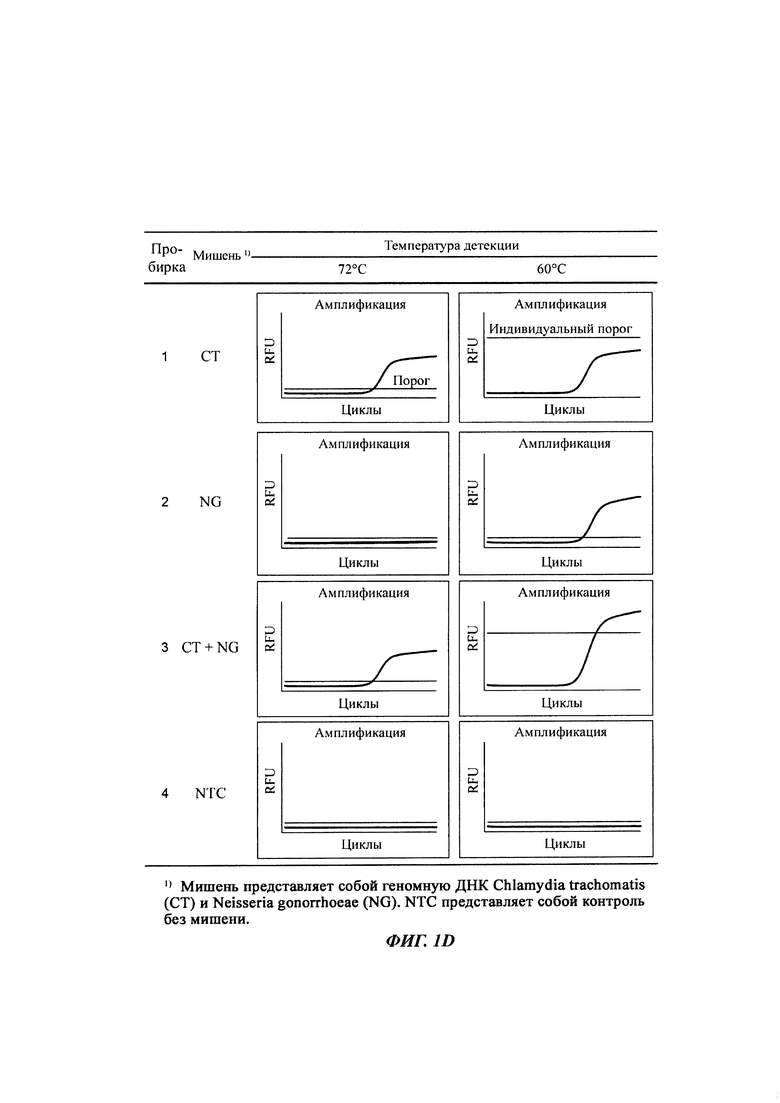

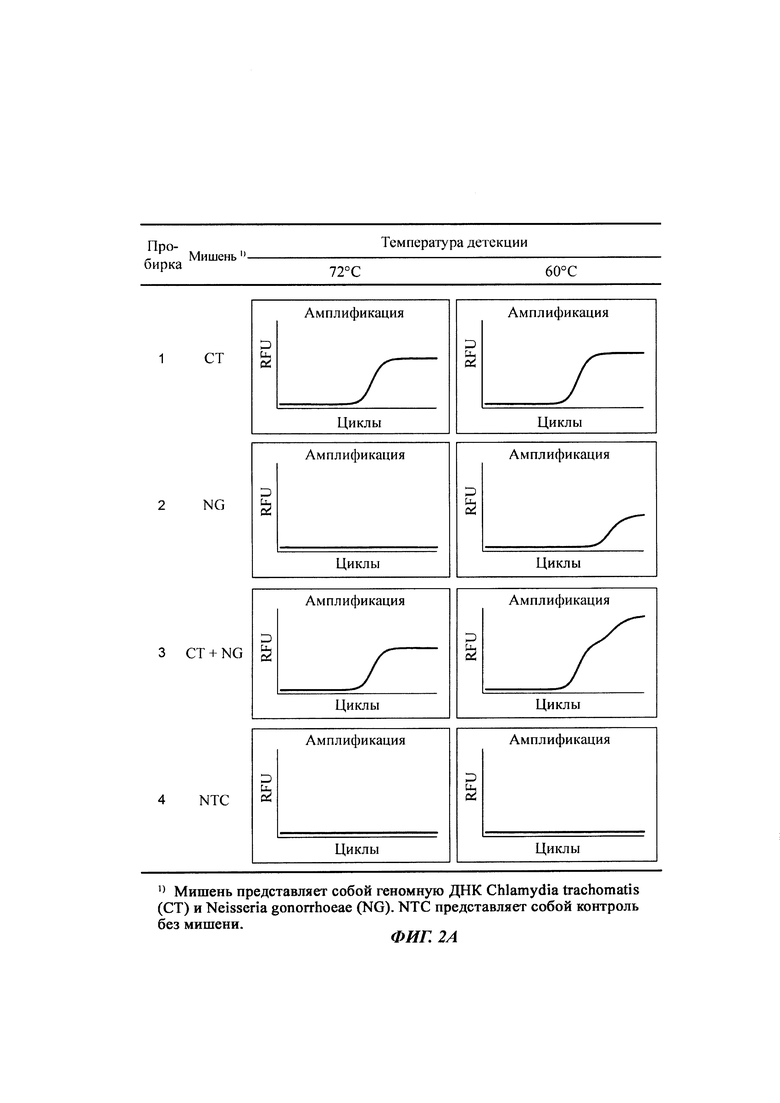


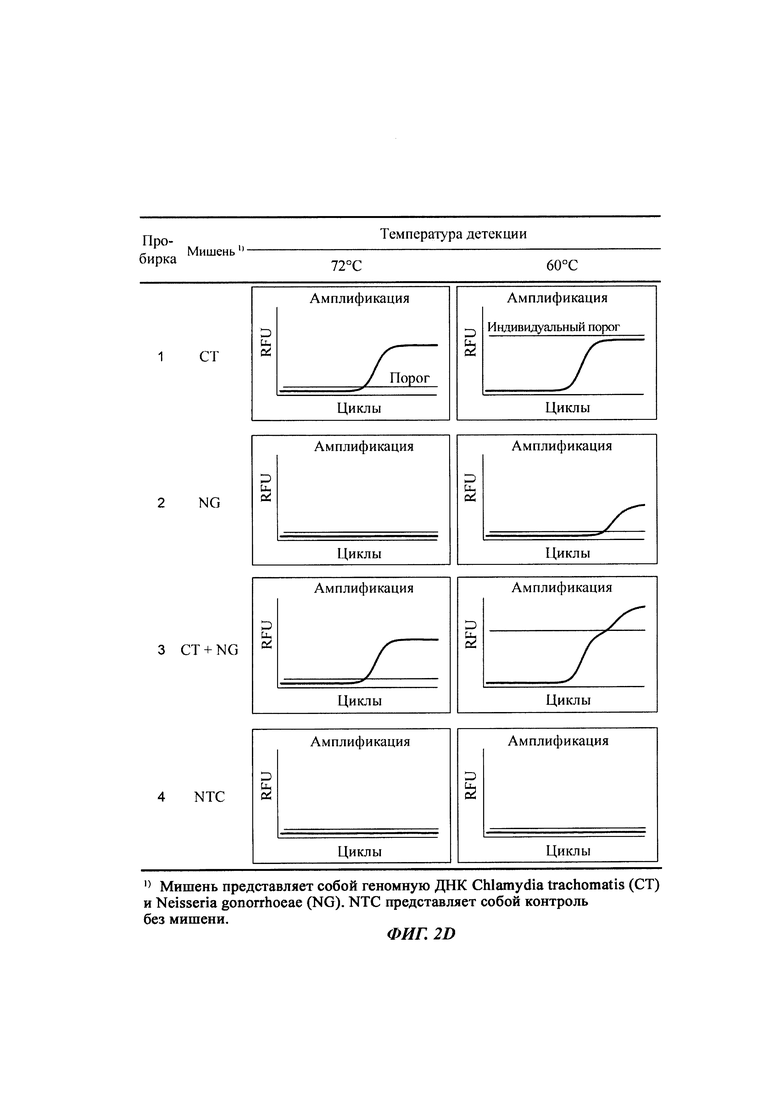
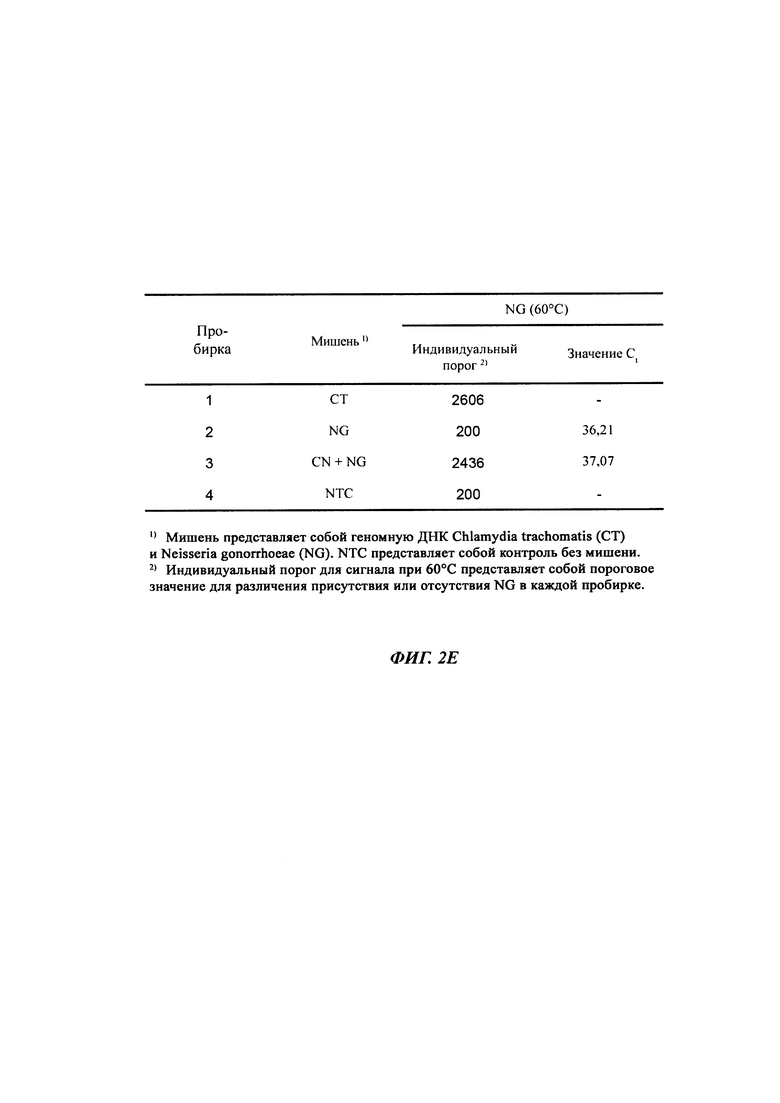
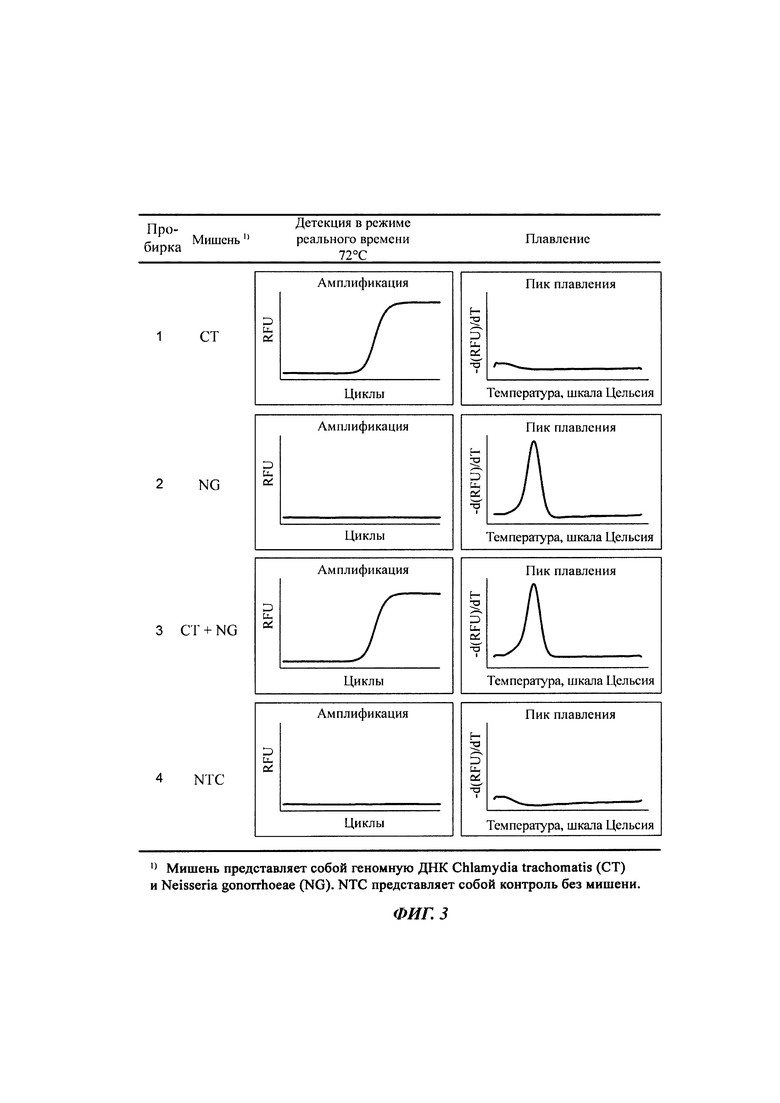
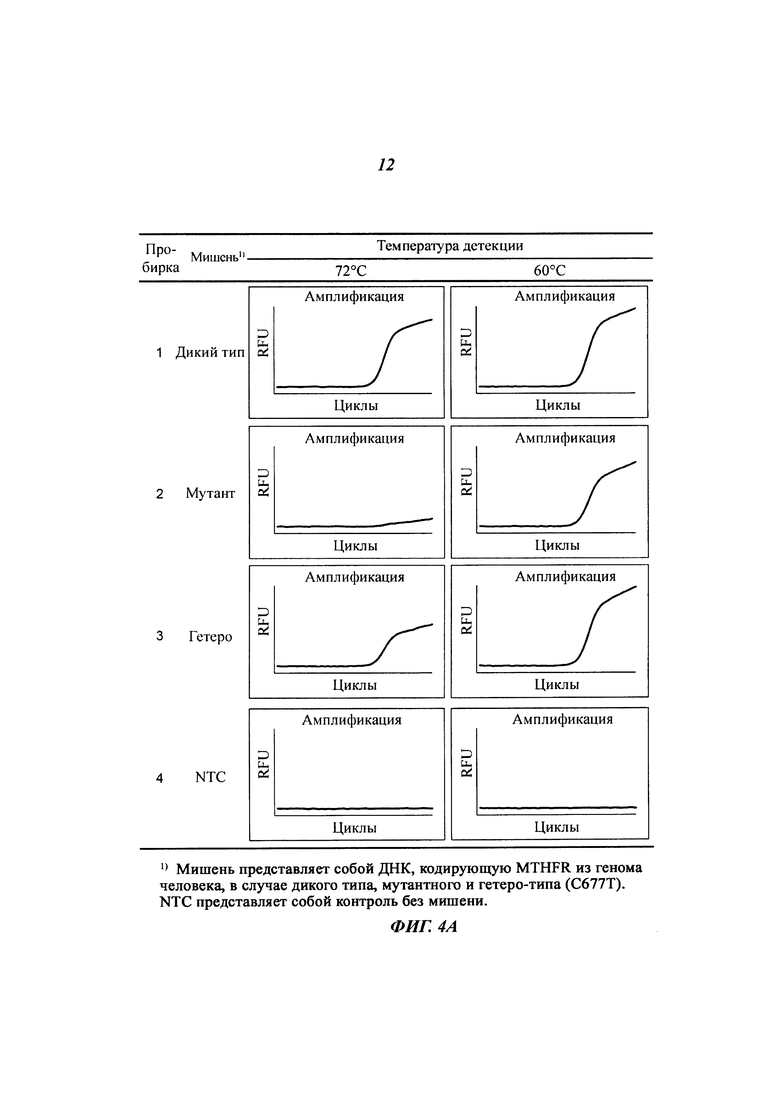
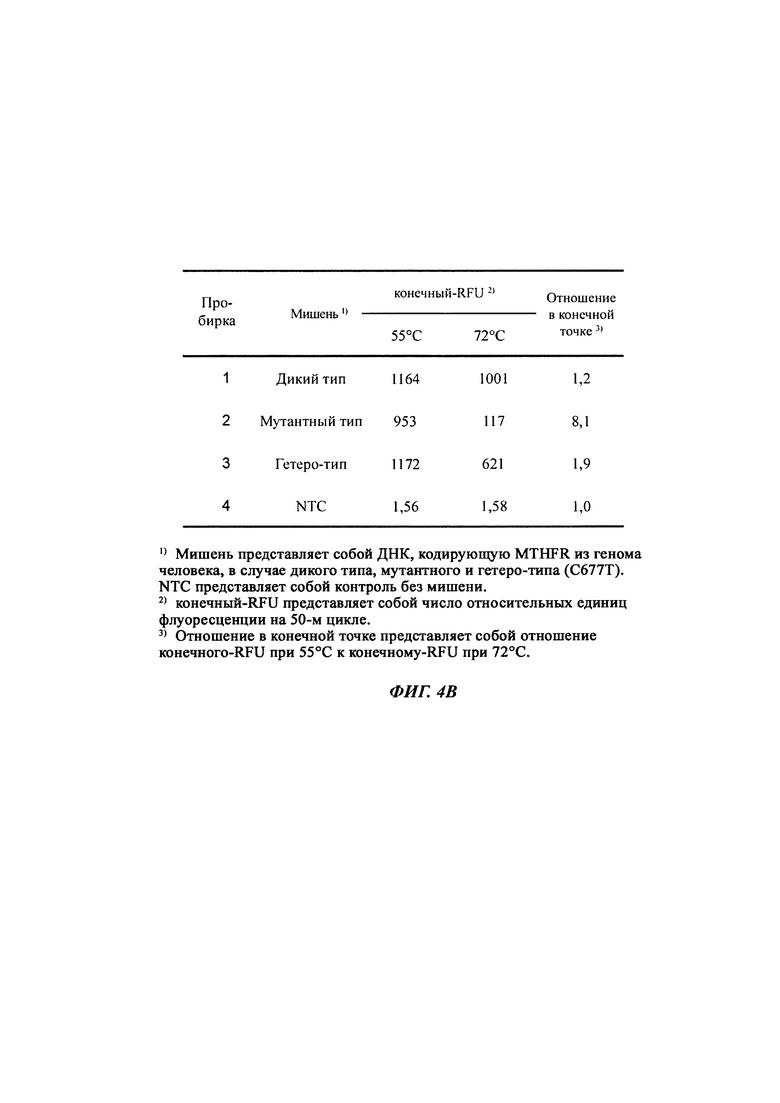
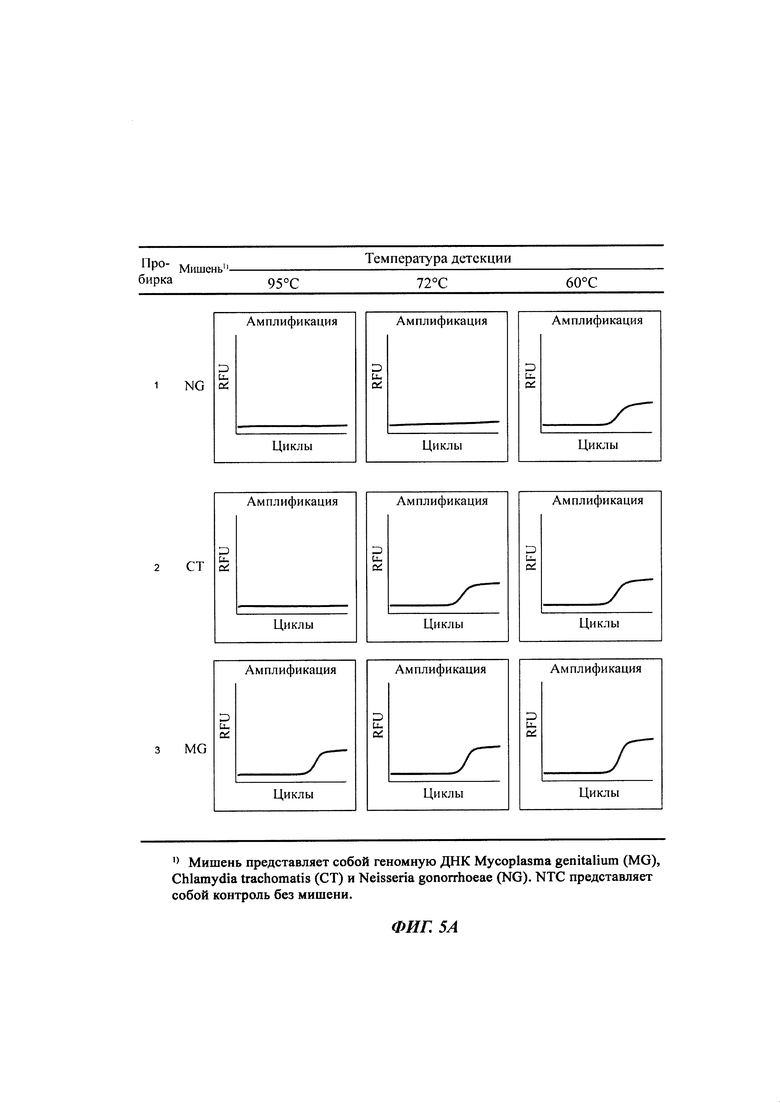
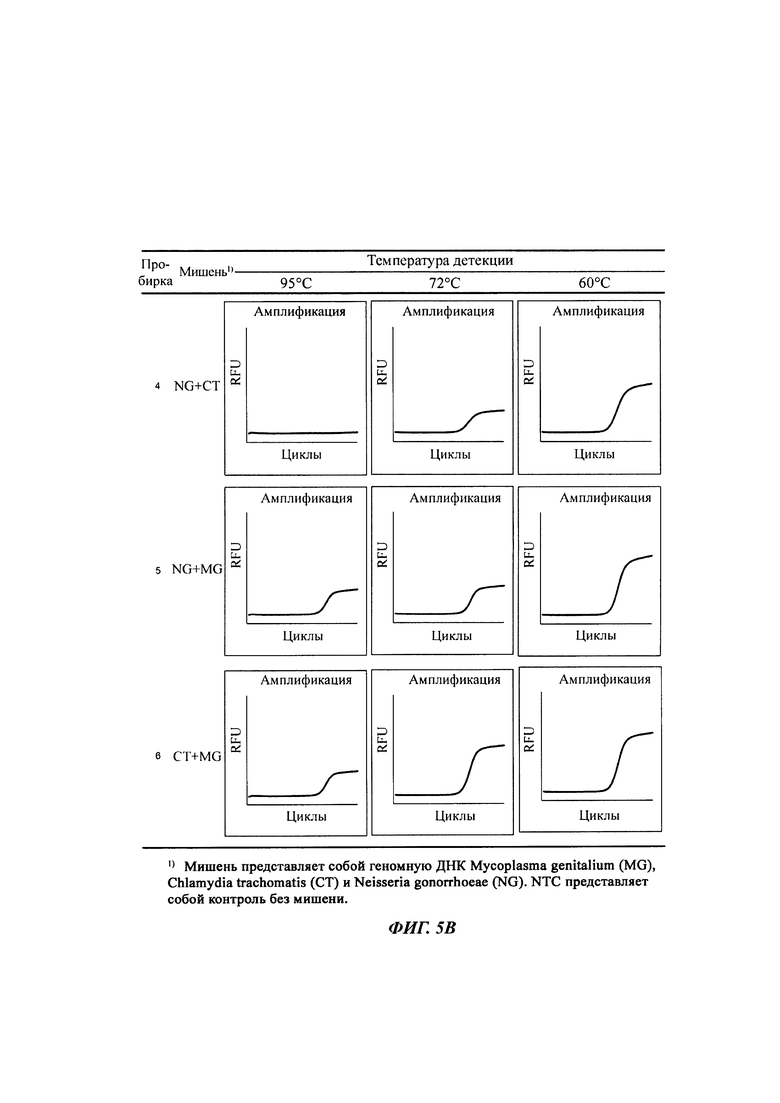
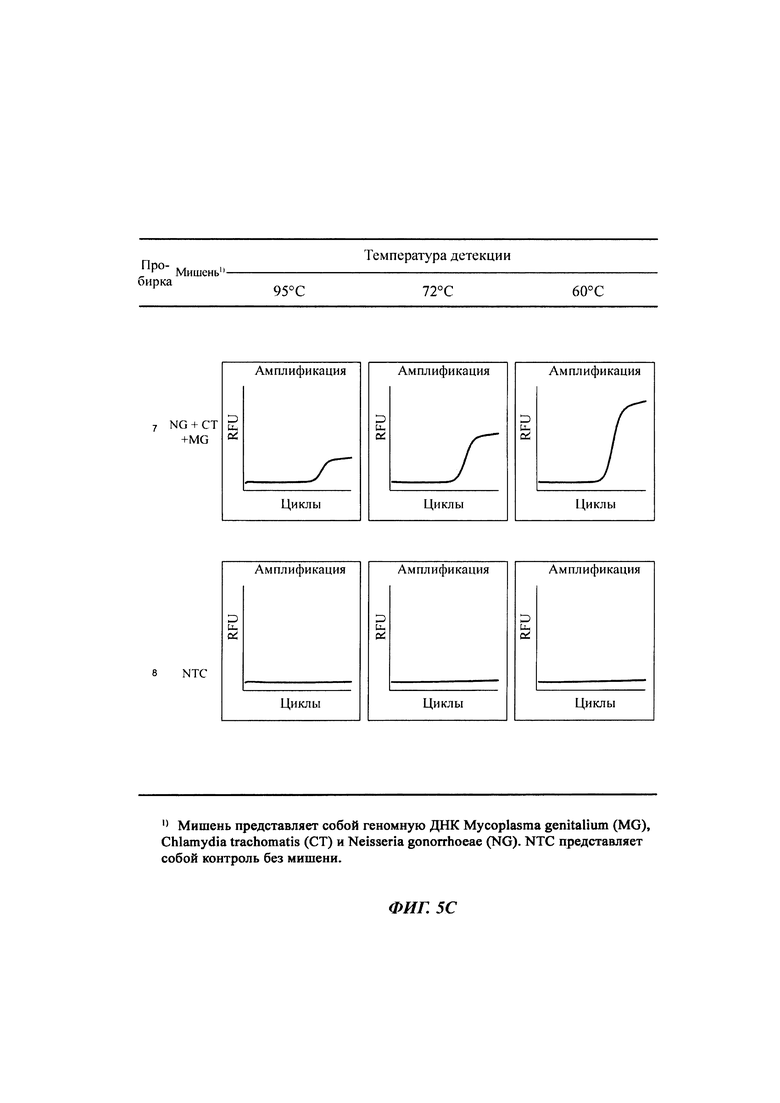
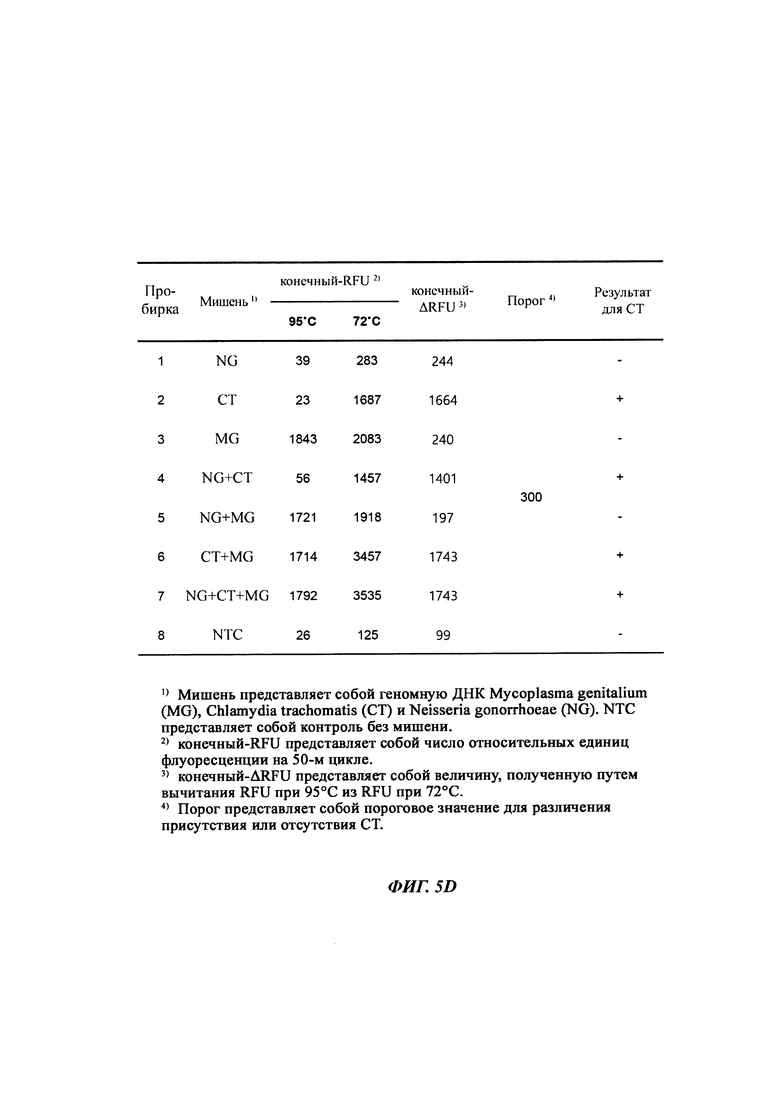
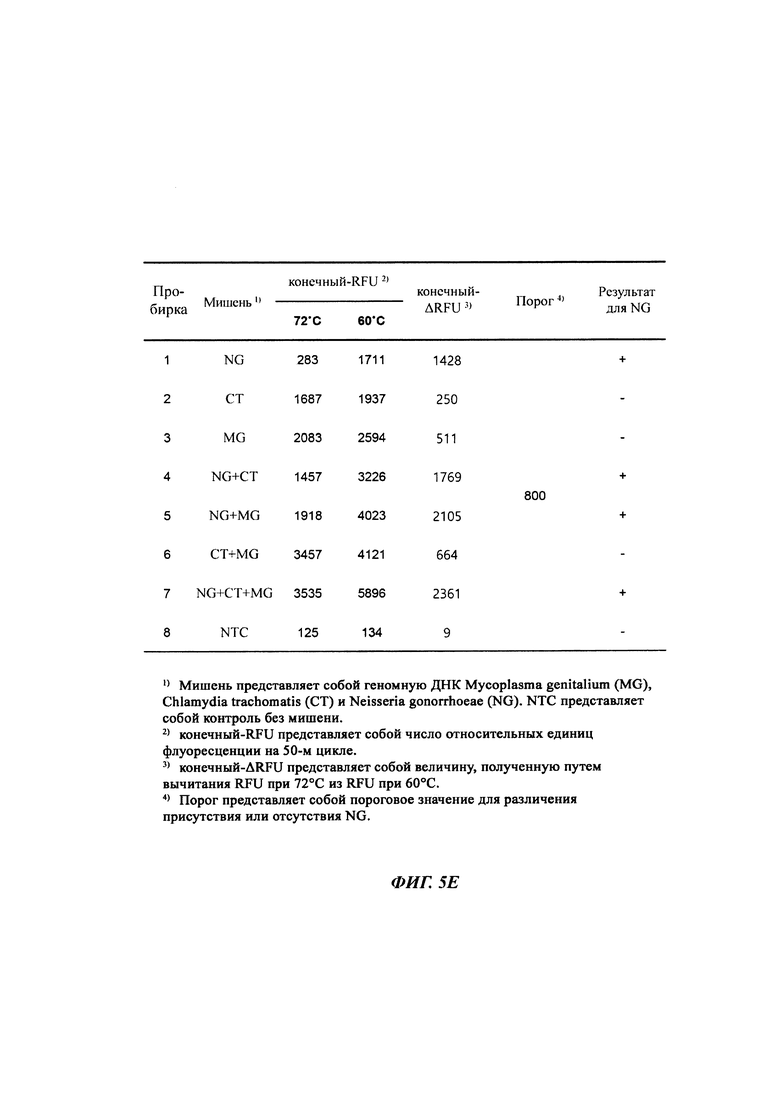
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая пригодный для ввода в компьютер информационный носитель (варианты). В одном варианте реализации изобретения пригодный для ввода информационный носитель содержит инструкции для конфигурирования процессора с целью осуществления способа определения присутствия двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции, где способ включает стадии получения как сигнала, детектируемого при высокой температуре детекции, так и сигнала, детектируемого при низкой температуре детекции, и определения присутствия двух нуклеотидных последовательностей-мишеней на основе полученных сигналов. Изобретение расширяет арсенал средств для детекции последовательностей-мишеней в образце с использованием разных температур детекции. 2 н. и 18 з.п. ф-лы, 18 ил., 5 пр.
1. Пригодный для ввода в компьютер информационный носитель, содержащий инструкции для конфигурирования процессора с целью осуществления способа определения присутствия двух нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции, где указанный способ включает:
(a) получение как сигнала, детектируемого при высокой температуре детекции, так и сигнала, детектируемого при низкой температуре детекции; при этом каждую из нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала; где указанное соответствующее средство генерации сигнала представляет собой соответствующее генерирующее сигнал вещество, содержащее олигонуклеотид, который специфически гибридизируется с соответствующей нуклеотидной последовательностью-мишенью; при этом генерируемые сигналы детектируют, используя детектор; при этом одна из двух нуклеотидных последовательностей-мишеней имеет высокую температуру детекции, а другая имеет низкую температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом высокая температура детекции представляет собой температуру, допускающую генерирование сигнала для нуклеотидной последовательности-мишени, имеющей высокую температуру детекции, а низкая температура детекции представляет собой температуру, допускающую генерирование как сигнала для нуклеотидной последовательности-мишени, имеющей низкую температуру детекции, так и сигнала для нуклеотидной последовательности-мишени, имеющей высокую температуру детекции; и
(b) определение присутствия двух нуклеотидных последовательностей-мишеней на основе полученных сигналов; при этом (1) присутствие нуклеотидной последовательности-мишени, имеющей высокую температуру детекции, определяют на основе сигнала, детектируемого при высокой температуре детекции, а (2) присутствие нуклеотидной последовательности-мишени, имеющей низкую температуру детекции, определяют по разнице между сигналом, детектируемым при высокой температуре детекции, и сигналом, детектируемым при низкой температуре детекции.
2. Пригодный для ввода в компьютер информационный носитель по п. 1, где средства генерации сигнала для каждой из нуклеотидных последовательностей-мишеней представляют собой средства генерации сигнала для генерирования сигнала способом, зависящим от образования дуплекса.
3. Пригодный для ввода в компьютер информационный носитель по п. 1, где средства генерации сигнала для каждой из нуклеотидных последовательностей-мишеней представляют собой средства генерации сигнала с использованием образования дуплекса способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с данной нуклеотидной последовательностью-мишенью.
4. Пригодный для ввода в компьютер информационный носитель по п. 1, где средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей высокую температуру детекции, представляет собой средство генерации сигнала с использованием расщепления детектирующего олигонуклеотида, содержащего по меньшей мере одну метку, а средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей низкую температуру детекции, представляет собой средство генерации сигнала с использованием образования дуплекса; где указанная метка выбрана из группы, состоящей из флуоресцентной метки, люминесцентной метки, хемилюминесцентной метки, электрохимической метки и металлической метки.
5. Пригодный для ввода в компьютер информационный носитель по п. 1, где средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей высокую температуру детекции, представляет собой средство генерации сигнала с использованием расщепления детектирующего олигонуклеотида, а средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей низкую температуру детекции, представляет собой средство генерации сигнала с использованием образования дуплекса способом, зависящим от расщепления опосредующего олигонуклеотида, специфически гибридизованного с данной нуклеотидной последовательностью-мишенью.
6. Пригодный для ввода в компьютер информационный носитель по п. 1, где два различных средства генерации сигнала содержат идентичную метку, и сигналы от этой метки не различаются детектором; где указанная метка выбрана из группы, состоящей из флуоресцентной метки, люминесцентной метки, хемилюминесцентной метки, электрохимической метки и металлической метки.
7. Пригодный для ввода в компьютер информационный носитель по п. 1, где указанная разница представляет собой разницу, получаемую в результате математической обработки сигнала, детектируемого при высокой температуре детекции, и сигнала, детектируемого при низкой температуре детекции.
8. Пригодный для ввода в компьютер информационный носитель по п. 1, где, если сигнал не детектируется при высокой температуре детекции, то определение присутствия нуклеотидной последовательности-мишени, имеющей низкую температуру детекции, проводят на основе сигнала, детектируемого при низкой температуре детекции, с учетом отсутствия детекции сигнала при высокой температуре детекции.
9. Пригодный для ввода в компьютер информационный носитель по п. 1, где, если присутствует нуклеотидная последовательность-мишень, имеющая высокую температуру детекции, то для определения присутствия нуклеотидной последовательности-мишени, имеющей низкую температуру детекции, используют референсное значение.
10. Пригодный для ввода в компьютер информационный носитель по п. 9, где для определения присутствия нуклеотидной последовательности-мишени, имеющей низкую температуру детекции, в данном способе используют референсное значение, полученное посредством (1) инкубирования нуклеотидной последовательности-мишени, имеющей высокую температуру детекции, со средством генерации сигнала для детекции нуклеотидной последовательности-мишени, имеющей высокую температуру детекции, в другом реакционном сосуде,
нежели реакционный сосуд на стадии (a), (2) детекции сигналов как при высокой температуре детекции, так и при низкой температуре детекции и (3) затем получения разницы между сигналом, детектируемым при высокой температуре детекции, и сигналом, детектируемым при низкой температуре детекции.
11. Пригодный для ввода в компьютер информационный носитель по п. 1, где две нуклеотидные последовательности-мишени содержат нуклеотидную вариацию, выбранную из группы, состоящей из SNP (однонуклеотидного полиморфизма), мутации, делеции, вставки, замены и транслокации, и одна из этих двух нуклеотидных последовательностей-мишеней содержит нуклеотидную вариацию одного типа, а другая содержит нуклеотидную вариацию другого типа.
12. Пригодный для ввода в компьютер информационный носитель, содержащий инструкции для конфигурирования процессора с целью осуществления способа определения присутствия от 3 до 10 нуклеотидных последовательностей-мишеней в образце с использованием разных температур детекции, где указанный способ включает:
(a) получение сигналов, детектируемых при 3-10 температурах детекции; при этом каждую из указанных 3-10 нуклеотидных последовательностей-мишеней детектируют с использованием соответствующего средства генерации сигнала; где указанное соответствующее средство генерации сигнала представляет собой соответствующее генерирующее сигнал вещество, содержащее олигонуклеотид, который специфически гибридизируется с соответствующей нуклеотидной последовательностью-мишенью; при этом каждая из указанных 3-10 нуклеотидных последовательностей-мишеней имеет разную температуру детекции, определяемую с использованием соответствующего средства генерации сигнала; при этом температура детекции представляет собой температуру, допускающую генерирование не только сигнала для нуклеотидной последовательности-мишени, имеющей данную температуру детекции, но также и сигнала для нуклеотидной последовательности-мишени, имеющей более высокую температуру детекции, чем данная температура детекции; при этом детекцию осуществляют при каждой из разных температур детекции; и
(b) определение присутствия указанных 3-10 нуклеотидных последовательностей-мишеней на основе полученных сигналов; при этом, если определяют присутствие нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, среди указанных 3-10 нуклеотидных последовательностей-мишеней, то присутствие нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции, определяют по разнице между сигналом, детектируемым при одной или более температурах детекции, превышающих данную конкретную температуру детекции, и сигналом, детектируемым при данной конкретной температуре детекции; при этом, если данная конкретная температура детекции является самой высокой температурой детекции среди температур детекции, то присутствие нуклеотидной последовательности-мишени определяют на основе сигнала, детектируемого при данной конкретной температуре детекции.
13. Пригодный для ввода в компьютер информационный носитель по п. 12, где стадию (b) проводят, сначала определяя присутствие нуклеотидной последовательности-мишени, имеющей самую высокую температуру детекции, а затем последовательно определяя присутствие нуклеотидных последовательностей-мишеней, имеющих более низкие температуры детекции, в порядке убывания.
14. Пригодный для ввода в компьютер информационный носитель по п. 12, где средства генерации сигнала для каждой из нуклеотидных последовательностей-мишеней представляют собой средства генерации сигнала для генерирования сигнала способом, зависящим от образования дуплекса.
15. Пригодный для ввода в компьютер информационный носитель по п. 12, где средство генерации сигнала для нуклеотидной последовательности-мишени, имеющей самую высокую температуру детекции, представляет собой средство генерации сигнала с использованием расщепления детектирующего олигонуклеотида, а средство генерации сигнала для других нуклеотидных последовательностей-мишеней представляют собой средство генерации сигнала с использованием образования дуплекса.
16. Пригодный для ввода в компьютер информационный носитель по п. 12, где указанные 3-10 различных средств генерации сигнала содержат идентичную метку, и сигналы от этой метки не различаются детектором; где указанная метка выбрана из группы, состоящей из флуоресцентной метки, люминесцентной метки, хемилюминесцентной метки, электрохимической метки и металлической метки.
17. Пригодный для ввода в компьютер информационный носитель по п. 12, где указанная разница включает разницу, получаемую в результате математической обработки сигнала, детектируемого при одной или более температурах детекции, превышающих данную конкретную температуру детекции, и сигнала, детектируемого при данной конкретной температуре детекции.
18. Пригодный для ввода в компьютер информационный носитель по п. 12, где, если сигнал не детектируется при температурах детекции, превышающих данную конкретную температуру детекции, то определение присутствия нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции, проводят на основе сигнала, детектируемого при данной конкретной температуре детекции, с учетом отсутствия детекции сигнала при температурах детекции, превышающих данную конкретную температуру детекции.
19. Пригодный для ввода в компьютер информационный носитель по п. 12, где, если присутствует нуклеотидная последовательность-мишень, имеющая температуру детекции выше указанной конкретной температуры детекции, то в данном способе для определения присутствия нуклеотидной последовательности-мишени, имеющей данную конкретную температуру детекции, используют по меньшей мере одно референсное значение.
20. Пригодный для ввода в компьютер информационный носитель по п. 19, где для определения присутствия нуклеотидной последовательности-мишени, имеющей конкретную температуру детекции, в данном способе используют по меньшей мере одно референсное значение из референсных значений, полученных посредством (1) инкубирования всех комбинаций нуклеотидных последовательностей-мишеней, имеющих более высокие температуры детекции, чем данная конкретная температура детекции, с соответствующими средствами генерации сигнала в другом реакционном сосуде, нежели реакционный сосуд на стадии (a), (2) детекции сигналов не только при одной или более температурах детекции, превышающих данную конкретную температуру детекции, но также и при данной конкретной температуре детекции, и (3) затем получения разницы между сигналом, детектируемым при одной или более температурах детекции, превышающих данную конкретную температуру детекции, и сигналом, детектируемым при данной конкретной температуре детекции.
| ИНФОРМАЦИОННЫЙ НОСИТЕЛЬ ЗАПИСИ, УСТРОЙСТВО ДЛЯ ЗАПИСИ И/ИЛИ ВОСПРОИЗВЕДЕНИЯ ДАННЫХ В И/ИЛИ ИЗ ИНФОРМАЦИОННОГО НОСИТЕЛЯ ЗАПИСИ, СПОСОБ ЗАПИСИ И/ИЛИ ВОСПРОИЗВЕДЕНИЯ ДАННЫХ В И/ИЛИ ИЗ ИНФОРМАЦИОННОГО НОСИТЕЛЯ ЗАПИСИ И МАШИНОЧИТАЕМЫЙ НОСИТЕЛЬ ЗАПИСИ, НА КОТОРОМ ХРАНИТСЯ ПРОГРАММА ДЛЯ ВЫПОЛНЕНИЯ СПОСОБА | 2006 |
|
RU2351999C2 |
| СТАНДАРТНЫЙ АНАЛОГОВЫЙ ИНТЕРФЕЙС ДЛЯ МНОГОЯДЕРНЫХ ПРОЦЕССОРОВ | 2007 |
|
RU2417412C2 |
Авторы
Даты
2022-09-28—Публикация
2014-12-09—Подача