Изобретение относится к медицине, в частности к способам лечения гнойных ран методом фотодинамической терапии (ФДТ).
Проблема лечения локальных бактериальных инфекций - гнойно-воспалительных заболеваний мягких тканей - остается актуальной, несмотря на успехи клинической медицины и фармакологической науки. Имеется множество антибактериальных препаратов, в том числе антибиотиков, но их применение для лечения заболеваний микробной этиологии приводит к появлению устойчивых к химиотерапии микроорганизмов. В связи с этим метод ФДТ приобретает все большее значение при лечении локальных инфекционных процессов. Преимущество метода ФДТ заключается в отсутствии развития резистентности микроорганизмов к данному виду лечения. Важным является также локальный характер бактерицидного эффекта, который лимитируется раневой поверхностью, что позволяет избежать побочного эффекта - губительного системного действия на нормальную флору организма, характерного для применения антибиотиков и антисептиков. Кроме того, эффективность противомикробного действия ФДТ не убывает при длительном лечении хронических гнойно-воспалительных заболеваний мягких тканей.
В настоящее время известно достаточно большое количество фотосенсибилизаторов (ФС) и средств на основе ФС для проведения ФДТ. Для лечения гнойных ран наибольшее применение нашли средства в виде гидрогелей, в которых ФС иммобилизован на биорастворимом полимере (RU 2286780, МПК А61К 31/409, 10.11.2006; RU 2314806, МПК А61К 31/409, 20.01.2008; RU 2396994, МПК A61N 5/067, А61К 31/409, 20.08.2010; RU 2465899, А61К 31/40, 10.11.2012; RU 2530589, А61К 31/409, А61Р 17/02, 10.10.2014). Использование ФС в виде геля упрощает процедуру ФДТ и позволяет точно локализовать ФС в пределах раневой поверхности.
Известные способы лечения гнойных ран методом ФДТ, включающим облучение раны лазером при длине волны 660±0,03 нм, плотности мощности ~1,0 Вт/см2 и с плотностью энергии 25-35 Дж/см2, различаются используемым средством для ФДТ.
Например, известен способ лечения гнойных ран, описанный в патенте RU 2286780, опубл. 10.11.2006. Способ включает следующее: в гнойную рану вводят гель "Фотодитазин" на основе эфиров метилгидроксиэтилцеллюлозы (производство фирмы «Вета-Гранд»), содержащий 0,5-1,5% глюкаминовой соли хлорина Е6, длительность аппликации геля составляет 2 часа. Далее проводят облучение раны лазером. Недостатками данного известного способа являются высокая концентрация ФС в используемом средстве для ФДТ и большая длительность его выдерживания на ране, что приводит к значительному накоплению ФС в здоровых тканях.
В патенте RU 2396994, опубл. 20.08.2010 в качестве средства для ФДТ используют модифицированный гель «Фотодитазин» на основе эфиров метилгидроксиэтилцеллюлозы, содержащий 0,5-1,5% диметилглюкаминовой соли хлорина Е6, для чего перед нанесением геля на поверхность раны его смешивают с 25%-ным водным раствором полиэтиленоксида в объемном отношении гель:раствор полиэтиленоксида 10:2-3. Модифицированный гель выдерживают на поверхности раны в течение 15-30 мин, после чего остатки невпитавшегося геля смывают раствором антисептика и проводят облучение лазером. Способ позволяет сократить время выдерживания средства для ФДТ на поверхности раны, что существенно снижает содержание ФС в здоровые тканях. Недостатками данного способа являются его сложность, недостаточная эффективность и высокая концентрация ФС в используемом средстве для ФДТ.
В способе лечения гнойных ран, описанном в патенте RU 2530589, опубл. 10.10.2014, средство для ФДТ перед лазерным облучением не удаляют с поверхности раны. В качестве средства для ФДТ используют водный гель, включающий диметилглюкаминовую соль хлорина Е6 и биорастворимый полимер, иммобилизованные на наночастицах гидроксиапатита. Биорастворимый полимер представляет собой смесь плюроника F127 и натриевой соли карбоксиметилцеллюлозы. Недостатком данного способа лечения является сложность получения используемого средства для ФДТ.
Во всех известных способах лечения гнойных ран методом ФДТ используются средства для ФДТ, не обладающие избирательным действием на грамотрицательую или грамположительную группу бактерий, что снижает их эффективность. До настоящего времени не проводились исследования влияния свойств используемых средств для ФДТ на патогенные возбудители различной групповой принадлежности с целью поиска средств для лечения гнойных ран методом ФДТ, обладающих избирательным действием либо на грамположительные, либо на грамотрицательные бактерии.
Задачей изобретения является разработка способа фотодинамической терапии гнойных ран - вариантов, обладающих избирательным действием либо на грамположительные, либо на грамотрицательные бактерии, что обеспечит повышение эффективности лечения методом ФДТ и позволит снизить концентрацию ФС в используемом при проведении ФДТ средстве.
Решение поставленной задачи достигается:
- предлагаемым способом фотодинамической терапии гнойных ран, в котором согласно изобретению при лечении гнойных ран, инфицированных преимущественно грамположительными бактериями, используют средство в виде гидрогеля на основе фотодитазина и биорастворимого полимера сульфата хитозана при следующем соотношении компонентов, мас. %:
при этом фотодинамическую терапию осуществляют в два сеанса.
Фотодинамическую терапию проводят с использованием лазерного излучения с плотностью мощности не более 1,5 Вт/см2 и с плотностью энергии 25-30 Дж/см2;
- предлагаемым способом фотодинамической терапии гнойных ран, в котором согласно изобретению при лечении гнойных ран, инфицированных преимущественно грамотрицательными бактериями, используют средство в виде гидрогеля на основе фотодитазина и биорастворимого полимера плюроника F127 при следующем соотношении компонентов, мас. %:
при этом фотодинамическую терапию осуществляют в два сеанса.
Фотодинамическую терапию проводят с использованием лазерного излучения с плотностью мощности не более 1,5 Вт/см2 и с плотностью энергии 25-30 Дж/см2;
- предлагаемым способом фотодинамической терапии гнойных ран, в котором согласно изобретению при лечении гнойных ран, инфицированных бактериями обеих групп по Граму, фотодинамическую терапию проводят в два сеанса, при этом для первого сеанса фотодинамической терапии используют средство в виде гидрогеля на основе фотодитазина и биорастворимого полимера плюроника F127 при следующем соотношении компонентов, мас. %:
для второго сеанса фотодинамической терапии используют средство в виде гидрогеля на основе фотодитазина и биорастворимого полимера сульфата хитозана при следующем соотношении компонентов, мас. %:
Фотодинамическую терапию проводят с использованием лазерного излучения с плотностью мощности не более 1,5 Вт/см2 и с плотностью энергии 25-30 Дж/см2.
При создании изобретения были выполнены экспериментальные исследования, в том числе in vivo, в которых исследовалась эффективность антибактериального действия различных комплексов ФС с биорастворимыми полимерами в отношении гноеродной флоры различной групповой принадлежности. Экспериментально определено оптимальное соотношение компонентов в используемом в предлагаемом способе средстве для ФДТ.
Сравнительная фотокаталитическая активность различных ФС и их комплексов с различными полимерами исследовалась на модельной реакции фотоокисления триптофана при лазерном облучении в водном растворе. Полученные результаты показали, что исследованные ФС: фотодитазин, димегин, фотогем незначительно различаются по фотокаталитической активности, наиболее активным является фотодитазин (диметилглюкаминовая соль хлорина Е6). В предлагаемом способе (вариантах) можно использовать или фотодитазин, или димегин, или фотогем, фотодитазин является наиболее предпочтительным.
В качестве биорастворимых полимеров для иммобилизации на них ФС использовались натриевая соль карбоксиметилцеллюлозы, плюроник F127, поливиниловый спирт, сульфат хитозана. Наибольшая фотокаталитическая активность наблюдалась для комплекса фотодитазина с плюроником F127, наименьшая - для комплексов ФС с поливиниловым спиртом, поэтому в экспериментах in vivo он не исследовался.
В экспериментах in vivo нами использовались белые лабораторные крысы. В соответствии с Европейской конвенцией (Страсбург, 1986) и Хельсинкской декларацией Всемирной медицинской ассоциации о гуманном обращении с животными (2000), а также с требованиями приказа №267 МЗ РФ от 19.06.2003 «Правила по обращению, содержанию, обезболиванию и умерщвлению экспериментальных животных» животных содержали в стандартных условиях вивария по одной особи в клетке, кормили комплексным гранулированным лабораторным кормом при постоянном доступе к воде.
На экспериментальной модели инфицированной полнослойной плоскостной раны кожи проведено сравнительное изучение динамики заживления гнойных ран методом ФДТ с использованием комплексов ФС-биорастворимый полимер с различной химической структурой компонентов для выявления избирательного действия комплекса на ту или иную группу бактерий по Граму.
В качестве экспериментальной модели раны использована модель полнослойной плоскостной раны (Л.И. Слуцкий, 1969; А.В. Shekhter et al., 2005). Животных наркотизировали внутримышечным введением раствора золетила (Zoletil 100, Virbac S.A., Italia) из расчета 6 мг действующего вещества на 1 кг массы тела животного в комбинации с рометаром (Rometar, Spofa, Praha) из расчета 0,5 мл на 1 кг массы тела. На предварительно депилированной коже спины в межлопаточной области по трафарету иссекали концентрический (диаметром ~ 8-10 мм) лоскут кожи с подкожной клетчаткой вплоть до собственной фасции. В образовавшийся дефект вводили муфтообразное тефлоновое кольцо. Таким образом, у всех животных получали раны стандартного размера, площадью 300 мм2.
В соответствии с Методическими рекомендациями по экспериментальному (доклиническому) изучению лекарственных препаратов для местного лечения гнойных ран (МЗ СССР, 1989) для создания инфицированной (гнойной) раны зажимом Кохера травмировали собственную фасцию и мышцы дна раны и на ее поверхность, ограниченную кольцом, наносили 0,5 мл взвеси микробной культуры. По верхнему срезу цилиндрической части кольца фиксировали целлофановую пленку для предотвращения высыхания раны и внешнего загрязнения.
Для инфицирования ран использовали взвесь суточной ассоциированной микробной культуры. В ассоциации содержались патогенные возбудители разной групповой принадлежности:
- грамположительные бактерии - Staphylococcus aureus S7 (клинический штамм);
- грамотрицательные бактерии - Escherichia coli АТСС 8739 (стандартный штамм, используемый для тестирования антимикробной активности) и Pseudomonas aeruginosa.
Выполнено пять групп экспериментов (I и II группы - контрольные) по 6 животных в каждой с использованием различных средств для лечения ран методом ФДТ (в I контрольной группе раны обрабатывали хлоргексидином) (см. таблицу).

Через сутки после нанесения раны и ее инфицирования в группах II-V начинали сеансы ФДТ, в контрольной группе I раны обрабатывали раствором хлоргексидина. Сеансы ФДТ проводили следующим образом: на поверхность раны наносили исследуемое средство в виде гидрогеля на основе фотосенсибилизатора и биорастворимого полимера (в контрольной группе II наносили 1%-ный водный раствор фотодитазина) в количестве 0,1 г на 1 см2 раневой поверхности, выдерживали в течение 20 мин и проводили облучение раневой поверхности низкоинтенсивным лазерным излучением отечественного аппарата «Аткус-2» с длиной волны 663±0,03 нм при плотности мощности 1 Вт/см2 и с плотностью энергии 25-30 Дж/см2.
Измерение микробной обсемененности экспериментальных ран у крыс производилось:
- через 24 часа после инфицирования (перед 1-м сеансом ФДТ);
- сразу после 1-го сеанса ФДТ;
- перед 2-м сеансом ФДТ, который проводили через сутки после 1-го сеанса;
- сразу после 2-го сеанса ФДТ.
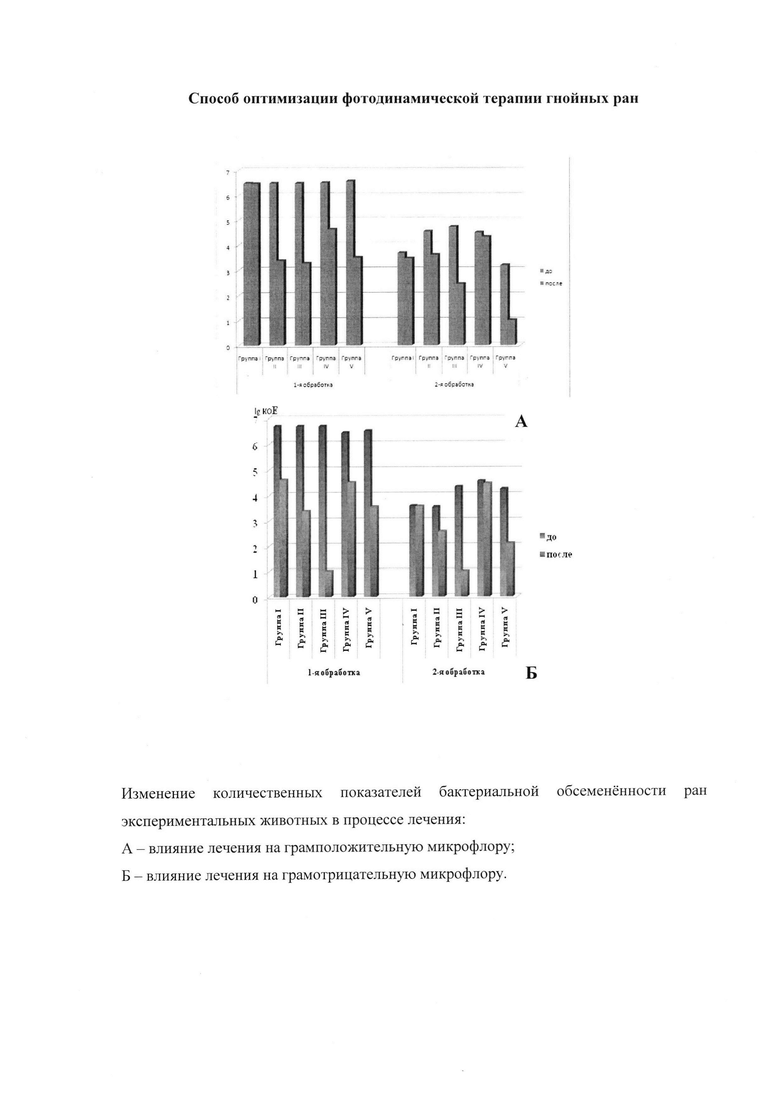
Через 24 часа после инфицирования (перед 1-м сеансом ФДТ) инициальная контаминация ран во всех группах животных была практически одинаковой и составила: для кокковой флоры 3,00±0,05⋅106-3,80±0,05⋅106 Е; для ассоциации Escherichia coli и Pseudomonas aeruginosa - 2,80±0,05⋅106-5,00±0,05⋅106 Е.
В контрольной группе I первичная обработка ран раствором хлоргексидина привела к уменьшению числа грамотрицательных бактерий (Escherichia coli и Pseudomonas aeruginosa) до 4,20±0,05⋅104 Е, но не повлияла на количество стафилококков. Повторная обработка ран хлоргексидином привела к незначительному снижению уровня обсемененности как кокковой, так и палочковой флоры.
Во всех опытных группах (III-V) и контрольной группе II после 1-го сеанса ФДТ присутствие стафилококков уменьшилось по логарифмическому показателю в 1,5-2 раза. В группах II, IV и V то же самое наблюдалось и в отношении грамотрицательных бактерий.
Но в группе III, где в качестве средства для ФДТ использовали комплекс фотодитазина с плюроником F127, в посевах из ран число проросших колоний грамотрицательных палочек было меньше 10 бактерий/мл (<1,0±0,05⋅10 Е). После 2-го сеанса ФДТ в группе III грамотрицательные бактерии не высевались, дополнительное уменьшение количества стафилококков было незначительным. Такие результаты позволяют говорить об избирательности воздействия комплекса фотодитазин-плюроник F127 при проведении ФДТ в отношении грамотрицательной флоры.
2-й сеанс ФДТ в группах II, IV и V в отношении кокковой инфекции привел к неодинаковым результатам: в группах II и IV (как и в группе III) дополнительное уменьшение количества стафилококков было незначительным, тогда как в группе V, где в качестве средства для ФДТ использовали комплекс фотодитазин-сульфат хитозана, после 2-го сеанса ФДТ, кокковая флора с поверхности ран практически не высевалась: число КОЕ/мл было меньше 1,0±0,05⋅10 Е (lg КОЕ/мл<1), то есть в отношении грамположительной флоры наиболее эффективным является комплекс фотодитазин-сульфат хитозана.
Высеваемость грамотрицательных бактерий в группах II, IV и V после 2-го сеанса ФДТ также уменьшилась, но не так заметно как для комплекса фотодитазин-плюроник F127 (группа III). Комплекс фотодитазин-натриевая соль карбоксиметилцеллюлозы не отличается ни избирательностью в отношении микрофлоры, ни высокой активностью.
Для наглядности изменение количественных показателей бактериальной обсемененности ран экспериментальных животных в процессе лечения представлено на чертеже: диаграмма А - влияние лечения на грамположительную микрофлору; диаграмма Б - влияние лечения на грамотрицательную микрофлору.
Полученные данные микробиологического исследования мазков раневого экссудата экспериментальных животных в процессе лечения позволили разработать предлагаемый способ оптимизации ФДТ гнойных ран (варианты).
Для определения оптимального соотношения компонентов в используемых в предлагаемом способе (вариантах) комплексах ФС-биорастворимый полимер нами были проведены исследования на модельной реакции фотоокисления триптофана при лазерном облучении в водном растворе. По полученным в ходе эксперимента результатам (определялась константа скорости фотоокисления триптофана) было установлено, что массовое соотношение ФС и сульфата хитозана в комплексе должно быть не менее 1:15, а ФС и плюроника F127 не менее 1:20, иначе скорость фотохимической реакции заметно падает. При увеличении количества ФС в комплексе до соотношения 1:3 для сульфата хитозана и до 1:4 для плюроника F127 скорость фотоокисления растет, но при дальнейшем увеличении содержания ФС рост скорости реакции прекращается.
Приводим примеры использования предлагаемого изобретения при лечении гнойных ран методом ФДТ.
Пример 1.
Пациентка Н., 24 лет, поступила в отделение хирургической инфекции ГКБ №51 с диагнозом: Карбункул лопаточной области справа, сахарный диабет II типа, декомпенсация на фоне отказа от приема медикаментозной терапии и злоупотребления алкоголем. Жалобы при поступлении: на боль и припухлость в правой лопаточной области. Из анамнеза известно, что длительное время страдает сахарным диабетом II типа, на медикаментозной терапии препаратом глюкофаж. За последние 3 года отмечает эпизод данного заболевания дважды. За 6 дней до поступления отметила появление болезненного инфильтрата в правой лопаточной области. Боль, отек и гиперемия нарастали, появилась субфебрильная лихорадка. Пациентка обратилась в СМП и была срочно госпитализирована в стационар. При осмотре: состояние относительно удовлетворительное, температура тела 38.3°С. Лейкоцитоз 14,0×109/л. Местно: в лопаточной области справа имеется инфильтрат, размером 4,0 см × 6,5 см с выраженным перифокальным воспалительным отеком до 5 см от очага. В центре инфильтрата определяются несколько гнойно-некротических стержней и пустул. При пальпации через пустулы выделяется гной, определяются симптомы "сита" и "пчелиных сот". Операция: выполнена первичная хирургическая обработка гнойного очага. Карбункул иссечен в пределах здоровых тканей, образовалась рана размерами 4,5 см × 7,5 см. Взят посев гнойного отделяемого на микрофлору и чувствительность к антибактериальным препаратам. Высеяны антибиотикорезистентные штаммы S. aureus.
На следующий день произведена перевязка - в дне и на стенках раны имеются фибринозно-гнойные наложения, нежизнеспособные ткани, рана санирована растворами антисептиков. На раневую поверхность нанесено средство в виде гидрогеля в количестве 0,1 г на 1 см2, содержащее 0,5 мас. % фотодитазина и 3,0 мас. % сульфата хитозана (вода - остальное). Рана укрыта стерильной полиэтиленовой повязкой на 20 минут. После чего раневую поверхность засветили низкоинтенсивным лазерным излучением отечественного аппарата "Аткус-2" с длиной волны 663±0,03 нм при плотности мощности 1,0 Вт/см2 и с плотностью энергии 30 Дж/см2. Затем на рану наложили повязку с 1%-ным водным раствором йодопирона. На следующие сутки перифокальные воспалительные явления значительно уменьшились, но в области дна раны сохранились участки некротических тканей. В соответствии с предлагаемым способом оптимизации ФДТ гнойных ран сеанс лазерной ФДТ с использованием вышеуказанного средства повторили. После повторного сеанса лазерной ФДТ рана очистилась от гнойно-некротических масс, отмечено активное развитие грануляционной ткани и краевой эпителизации. Пациентка в удовлетворительном состоянии выписана на 9-е сутки после иссечения карбункула, послеоперационная рана в стадии грануляции и краевой эпителизации. Пациентка осмотрена на 20-е сутки. Рана зажила вторичным натяжением мягким эластичным рубцом.
Пример 2.
Пациентка С., 46 лет, поступила в отделение хирургической инфекции ГКБ №51 с диагнозом: Синдром диабетической стопы, смешанная форма. Влажная гангрена левой стопы, сахарный диабет I типа, декомпенсация. Жалобы при поступлении: на боль, отек и гиперемию в области левой стопы. Из анамнеза известно, что длительное время страдает сахарным диабетом I типа, на инсулинотерапии. За неделю до поступления "натерла" ногу обувью во время длительного хождения, после чего в месте повреждения появился отек, покраснение и боль. Затем (со слов пациентки) процесс распространился на всю стопу и присоединилась лихорадка до 39,5°С. При осмотре: состояние средней степени тяжести, ближе к тяжелому, гипертермия 38,2°С. Лейкоцитоз 20,0×109/л. Местно: левая стопа выраженно увеличена в размерах за счет лимфостаза, отечна, гиперемирована, в области головки 1-й плюсневой кости имеется свищевое отверстие, при пальпации из которого поступает сливкообразный гной с характерным экхарозным запахом. Пульсация на тыле стопы значительно снижена. Рентгенография левой стопы: остеопороз, деструкция головки I-й и II-й плюсневых костей. Операция: сделаны клиновидные разрезы на тыльной и подошвенной поверхностях левой стопы в проекции II-го пальца, верхушки разрезов находятся на уровне средней трети плюсневых костей. Взят посев гнойного отделяемого на микрофлору и чувствительность к антибактериальным препаратам. Произведена резекция головок I и II плюсневых костей Листоновскими щипцами, иссечен подошвенный апоневроз в пределах здоровых тканей, удалены межпальцевые сухожилия, сухожилия сгибателей и разгибателей правой стопы иссечены на протяжении. Рана промыта 3%-ным раствором перекиси водорода. Гемостаз с прошиванием. На рану наложена асептическая повязка. Результат посева на микрофлору: Escherichia coli и Pseudomonas aeruginosa.
На следующий день произведена перевязка - в дне и на стенках раны имеются фибринозно-гнойные наложения, нежизнеспособные ткани, рана санирована растворами антисептиков. На раневую поверхность нанесено средство в виде гидрогеля в количестве 0,1 г на 1 см2, содержащее 1,0 мас. % фотодитазина и 3,0 мас. % плюроника F127 (вода - остальное). Рана укрыта стерильной полиэтиленовой повязкой на 20 минут. После чего раневую поверхность засветили низкоинтенсивным лазерным излучением отечественного аппарата "Аткус-2" с длиной волны 663±0,03 нм при плотности мощности 1,0 Вт/см2 и с плотностью энергии 30 Дж/см2. Затем на рану наложили повязку с 1%-ным водным раствором йодопирона. Пациентке назначен курс антибактериальной терапии. После повторного сеанса ФДТ пациентка отметила улучшение в виде снижения боли, отека и отсутствия лихорадки. Местно: гиперемия и отек вокруг раны уменьшились, количество отделяемого из раны сократилось, отмечаются краевая эпителизация и появление грануляционной ткани. Пациентка выписана в удовлетворительном состоянии на 15-е сутки.
Послеоперационная рана в стадии грануляции и краевой эпителизации. Пациентка осмотрена на 30-е сутки. Рана зажила вторичным натяжением мягким эластичным рубцом. Опорная функция конечности сохранена.
Пример 3.
Пациент Д., 55 лет, поступил в отделение хирургической инфекции ГКБ №51 с диагнозом: Хроническая лимфовенозная недостаточность. Трофические язвы правой голени. В анамнезе длительный эпизод курения. Жалобы при поступлении: на боль, отек и наличие язв в области правой голени. Из анамнеза известно, что пациент длительное время страдает хронической лимфовенозной недостаточностью, лечился консервативно по месту жительства. Около года назад отметил изменения цвета кожи, появление локальных участков пигментации, а затем и появление язв. При осмотре: состояние средней степени тяжести, температура тела 37,5°С. Лейкоцитоз 17,0×109/л. Местно: правая голень выраженно отечна, ярко гиперемирована. В области правой голени по передней поверхности имеются множественные гнойно-некротические трофические язвы различного диаметра от 2 до 10 см, по задней поверхности, начиная с н/з и до подколенной ямки, имеется инфильтрат, отмечается флюктуация. Операция: под в/в наркозом произведена ревизия ран на передней и задней поверхности правой голени. Интраоперационно раны на передней поверхности были объединены и суммарная площадь составила 25 см × 6 см × 2 см, по задней поверхности в области верхней трети раны вскрыт гнойный затек, выделилось до 30 мл гнойного отделяемого (взят посев гнойного отделяемого на микрофлору и чувствительность к антибактериальным препаратам), дно представлено некрозами подкожно-жировой клетчатки, фасцией голени. Произведена некрэктомия в пределах здоровых тканей. Вся некротизированная подкожная жировая клетчатка удалена с помощью острой ложечки. Раны санированы растворами антисептиков и рыхло тампонированы перекисью водорода. Контроль на гемостаз - сухо. Асептическая повязка. Результат посева на микрофлору: Staphylococcus Aureus, Escherichia coli и Pseudomonas aeruginosa.
На следующие сутки на перевязке отмечаются гнойно-некротическое расплавление мягких тканей, некроз сухожилий и подкожной клетчатки. Все гнойно-некротические массы удалены в пределах здоровых тканей. На раневую поверхность нанесено средство в виде гидрогеля в количестве 0,1 г на 1 см2, содержащее 1,0 мас. % фотодитазина и 3,0 мас. % плюроника F127 (вода - остальное). Рана укрыта стерильной полиэтиленовой повязкой на 20 мин. После чего раневую поверхность засветили низкоинтенсивным лазерным излучением отечественного аппарата "Аткус-2" с длиной волны 663±0,03 нм при плотности мощности 1,0 Вт/см2 и с плотностью энергии 30 Дж/см2. На рану наложена повязка с 1%-ным раствором йодопирона. Пациенту назначен курс антибактериальной терапии. При следующей смене повязок количество некрозов и гнойно-некротической ткани значительно уменьшилось. Пациенту был проведен второй сеанс ФДТ с использованием средства в виде гидрогеля в количестве 0,1 г на 1 см2, содержащего 0,5 мас. % фотодитазина и 3,0 мас. % сульфата хитозана (вода - остальное). Пациент выписан в удовлетворительном состоянии на 13-е сутки после госпитализации. Местно: послеоперационные раны без признаков воспаления, активно гранулируют. При осмотре на 22-е сутки раны полностью зажили вторичным натяжением эластичным рубцом без применения пластических операций.
Таким образом, предлагаемый способ оптимизации фотодинамической терапии гнойных ран (варианты) обладает избирательным действием либо на грамположительные, либо на грамотрицательные бактерии и обеспечивает повышение эффективности лечения методом ФДТ. Способ (варианты) позволяет предотвращать рост в ране остаточной микрофлоры и развитие вторичных некрозов, позволяет снизить концентрацию ФС в используемом при проведении ФДТ средстве.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ГНОЙНЫХ РАН, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ГНОЙНЫХ РАН | 2013 |
|
RU2530589C1 |
| КОМПОЗИЦИЯ ГИДРОГЕЛЯ ДЛЯ ЛЕЧЕНИЯ ДЕФЕКТОВ ПОКРОВНЫХ ТКАНЕЙ МЕТОДОМ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2020 |
|
RU2730850C1 |
| СПОСОБ ЛЕЧЕНИЯ ОЖОГОВЫХ РАН | 2011 |
|
RU2460555C1 |
| СПОСОБ ЛЕЧЕНИЯ ИШЕМИЧЕСКИХ ЯЗВ НИЖНИХ КОНЕЧНОСТЕЙ | 2011 |
|
RU2457873C1 |
| СПОСОБ ЛЕЧЕНИЯ ОБШИРНЫХ ГНОЙНЫХ РАН МЯГКИХ ТКАНЕЙ | 2009 |
|
RU2396994C1 |
| СПОСОБ ЛЕЧЕНИЯ АБСЦЕДИРУЮЩЕГО ФУРУНКУЛА | 2009 |
|
RU2407565C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ МЕТОДОМ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2006 |
|
RU2314806C1 |
| Средство для лечения гнойно-воспалительных процессов мягких тканей и слизистых оболочек. | 2021 |
|
RU2774440C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ИНАКТИВАЦИИ ГРАМОТРИЦАТЕЛЬНЫХ ПАТОГЕННЫХ МИКРООРГАНИЗМОВ | 2021 |
|
RU2781892C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОГО ЛЕЧЕНИЯ ОСТРОГО И ХРОНИЧЕСКОГО ГНОЙНОГО ГАЙМОРИТА | 2002 |
|
RU2228775C1 |
Группа изобретений относится к медицине, а именно к хирургии и лазерной медицине, и может быть использовано для фотодинамической терапии (ФДТ) гнойных ран. Для лечения гнойных ран, инфицированных преимущественно грамположительными бактериями, используют средство в виде гидрогеля на основе фотодитазина и биорастворимого полимера сульфата хитозана при следующем соотношении компонентов, мас. %: фотодитазин - 0,2-1,0; сульфат хитозана - 1,5-3,0; вода - остальное. При этом ФДТ осуществляют в два сеанса. Для лечения гнойных ран, инфицированных преимущественно грамотрицательными бактериями, используют средство в виде гидрогеля на основе фотодитазина и биорастворимого полимера плюроника F127 при следующем соотношении компонентов, мас. %: фотодитазин - 0,2-1,0; плюроник F127 - 3,0-4,0; вода - остальное. При этом ФДТ осуществляют также в два сеанса. Для лечения гнойных ран, инфицированных бактериями обеих групп по Граму, ФДТ проводят в два сеанса, при этом для первого сеанса фотодинамической терапии используют средство в виде гидрогеля на основе фотодитазина и биорастворимого полимера плюроника F127 при следующем соотношении компонентов, мас. %: фотосенсибилизатор - 0,2-1,0; плюроник F127 - 1,5-4,0; вода - остальное; для второго сеанса фотодинамической терапии используют средство в виде гидрогеля на основе фотодитазина и биорастворимого полимера сульфата хитозана, при следующем соотношении компонентов, мас. %: фотосенсибилизатор - 0,2-1,0; сульфат хитозана - 1,5-3,0; вода - остальное. Предложенные способы обеспечивают повышение эффективности лечения за счет избирательного воздействия на грамположительные и грамотрицательные бактерии, снижение концентрации используемого фотосенсибилизатора в средстве, используемом для проведения ФДТ, предотвращения роста в ране остаточной микрофлоры и развития вторичных некрозов. 3 н. и 3 з.п. ф-лы, 1 ил., 1 табл., 3 пр.
1. Способ фотодинамической терапии гнойных ран, отличающийся тем, что при лечении гнойных ран, инфицированных преимущественно грамположительными бактериями, используют средство в виде гидрогеля на основе фотодитазина и биорастворимого полимера сульфата хитозана при следующем соотношении компонентов, мас. %:
при этом фотодинамическую терапию осуществляют в два сеанса.
2. Способ по п. 1, отличающийся тем, что фотодинамическую терапию проводят с использованием лазерного излучения с плотностью мощности 1,0 Вт/см2 и с плотностью энергии 30 Дж/см2.
3. Способ фотодинамической терапии гнойных ран, отличающийся тем, что при лечении гнойных ран, инфицированных преимущественно грамотрицательными бактериями, используют средство в виде гидрогеля на основе фотодитазина и биорастворимого полимера плюроника F127 при следующем соотношении компонентов, мас. %:
при этом фотодинамическую терапию осуществляют в два сеанса.
4. Способ по п. 3, отличающийся тем, что фотодинамическую терапию проводят с использованием лазерного излучения с плотностью мощности 1,0 Вт/см2 и с плотностью энергии 30 Дж/см2.
5. Способ фотодинамической терапии гнойных ран, отличающийся тем, что при лечении гнойных ран, инфицированных бактериями обеих групп по Граму, фотодинамическую терапию проводят в два сеанса, при этом для первого сеанса фотодинамической терапии используют средство в виде гидрогеля на основе фотодитазина и биорастворимого полимера плюроника F127 при следующем соотношении компонентов, мас. %:
для второго сеанса фотодинамической терапии используют средство в виде гидрогеля на основе фотодитазина и биорастворимого полимера сульфата хитозана, при следующем соотношении компонентов, мас. %:
6. Способ по п. 5, отличающийся тем, что фотодинамическую терапию проводят с использованием лазерного излучения с плотностью мощности 1,0 Вт/см2 и с плотностью энергии 30 Дж/см2.
| ГЕЙНИЦ А.В | |||
| и др | |||
| "Фотодинамическая терапия гнойных и длительно не заживающих ран" - пособие для врачей, М., 2004 | |||
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ГНОЙНЫХ РАН, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ГНОЙНЫХ РАН | 2013 |
|
RU2530589C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ МЕТОДОМ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2006 |
|
RU2314806C1 |
| СПОСОБ ЛЕЧЕНИЯ АБСЦЕДИРУЮЩЕГО ФУРУНКУЛА | 2009 |
|
RU2407565C1 |
| WO 2004084817 A2 07.10.2004 | |||
| ТОЛСТЫХ П.И | |||
| и др | |||
| "Оптимизация фотохимической терапии гнойных ран мягких тканей" // "Лазерная медицина", том 18, выпуск 4, 2014, стр.26 | |||
| ТОЛСТЫХ П.И | |||
| и др | |||
| "Теоретические и практические аспекты лазерной фотохимии для лечения гнойных ран" // "Российский биотерапевтический журнал", N4, том 7, 2008, стр.20-24 | |||
| SHRESTHA A et al | |||
| "The effect of tissue inhibitors on the antibacterial activity of chitosan nanoparticles and photodynamic therapy" | |||
| J Endod | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| VUKICEVIC M et al | |||
| "Poloxamer-based curcumin solid dispersions for ex tempore preparation of supersaturated solutions intended for antimicrobial photodynamic therapy" | |||
| Pharm Dev Technol | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
Авторы
Даты
2017-02-02—Публикация
2015-12-09—Подача