Область техники, к которой относится изобретение
Описаны фармацевтические композиции, которые включают комбинации соединения ингибитора гистондеацетилазы (HDAC) и бендамустина для лечения рака. Кроме того, описаны способы лечения с использованием фармацевтических композиций и режимы дозирования.
Уровень техники
Ацетилированное состояние нуклеосомальных гистонов играет важную роль в регуляции экспрессии генов. Деацетилирование нуклеосомальных гистонов катализируется группой ферментов, известных как гистондеацетилазы (HDAC), среди которых имеется одиннадцать известных изоформ. Деацетилирование гистонов приводит к конденсации хроматина, вызывая репрессию транскрипции, тогда как ацетилирование индуцирует локализованную релаксацию в специфических участках хромосом для обеспечения более широкого доступа к транскрипционному механизму для облегчения транскрипции.
В опухолевых клетках селективные ингибиторы ферментов HDAC вызывают гиперацетилирование гистонов. Это изменяет регуляцию транскрипции поднабора генов, в том числе многих опухолевых супрессоров, генов, участвующих в контроле клеточного цикла, клеточном делении и апоптозе. Кроме того, ингибиторы HDAC, как сообщалось, ингибируют рост опухоли in vivo. Ингибирование роста опухоли сопровождается гиперацетилированием гистонов и тубулина, и может включать множество механизмов.
Ингибиторы HDAC блокируют пролиферацию раковых клеток in vitro и in vivo. N-Гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамид (Соединение 1) представляет собой ингибитор HDAC на основе гидроксамата, предназначенный для лечения рака у человека.
Раскрытие изобретения
Раскрыты фармацевтические композиции, способы лечения рака, режимы дозирования и комбинированные терапии. Представлен способ лечения или предупреждения рака у пациента, включающий стадию введения указанному пациенту бендамустина и ингибитора гистондеацетилазы (HDAC).
В некоторых вариантах осуществления рак представляет собой карциному, опухоль, новообразование, лимфому, меланому, глиому, саркому и бластому. В определенных вариантах осуществления карцинома выбрана из группы, состоящей из: карциномы, аденокарциномы, аденокистозной карциномы, аденосквамозной карциномы, адренокортикальной карциномы, высокодифференцированной карциномы, плоскоклеточной карциномы, серозной карциномы, мелкоклеточной карциномы, инвазивной плоскоклеточной карциномы, крупноклеточной карциномы, карциномы островковых клеток, овсяно-клеточной карциномы, плоскоклеточной карциномы, недифференцированной карциномы, бородавчатой карциномы, почечно-клеточной карциномы, серозной папиллярной аденокарциномы, карциномы из клеток Меркеля, гепатоцеллюлярной карциномы, карциномы мягких тканей, карциномы бронхиальных желез, капиллярной карциномы, карциномы бартолиновой железы, базальноклеточной карциномы, карциносаркомы, папилломы/карциномы, светлоклеточной карциномы, эндометриоидной аденокарциномы, мезотелиальной, метастатической карциномы, мукоэпидермоидной карциномы, холангиокарциномы, актинического кератоза, цистаденомы и гепатического аденоматоза.
В определенных других вариантах осуществления опухоль выбрана из группы, состоящей из: астроцитарных опухолей, злокачественных мезотелиальных опухолей, герминогенных опухолей яичников, супратенториальных примитивных нейроэктодермальных опухолей, опухолей Вильмса, опухолей гипофиза, внегонадных герминогенных опухолей, гастриномы, герминогенных опухолей, гестациозной трофобластической опухоли, опухолей мозга, пинеальных и супратенториальных примитивных нейроэктодермальных опухолей, опухоли гипофиза, соматостатин-секретирующей опухоли, опухоли эндодермального синуса, карциноида, центральной церебральной астроцитомы, глюкагономы, гепатической аденомы, инсулиномы, медуллоэпителиомы, плазмацитомы, випомы и феохромоцитомы. В определенных вариантах осуществления новообразование выбрано из группы, состоящей из интраэпителиальной неоплазии, множественной миеломы/неоплазмы плазматических клеток, неоплазмы плазматических клеток, плоскоклеточной интраэпителиальной неоплазии, эндометриальной гиперплазии, фокальной нодулярной гиперплазии, гемангиоэндотелиомы и злокачественной тимомы.
В определенных других вариантах осуществления лимфома выбрана из группы, состоящей из: лимфомы нервной системы, СПИД-ассоциированной лимфомы, кожной T-клеточной лимфомы, неходжкинской лимфомы, лимфомы и макроглобулинемии Вальденстрема. В определенных вариантах осуществления лимфома представляет собой индолентную лимфому. В конкретных вариантах осуществления индолентная лимфома представляет собой одну или несколько из фолликулярной лимфомы, хронического лимфоцитарного лейкоза/мелкоклеточного лимфоцитарной лимфомы (CLL/SLL), экстранодальной лимфомы маргинальной зоны (MALT), лимфомы маргинальной зоны (MZL) и макроглобулинемии Вальденстрема. В определенных предпочтительных вариантах осуществления меланома выбрана из группы, состоящей из: акральной лентигинозной меланомы, поверхностной распространяющейся меланомы, увеальной меланомы, злокачественной меланомы лентиго, меланомы, внутриглазной меланомы, аденокарциномы, нодулярной меланомы и гемангиомы. В определенных вариантах осуществления саркома выбрана из группы, состоящей из: аденомы, аденосаркомы, хондосаркомы, эндометриальной стромальной саркомы, саркомы Юинга, саркомы Капоши, лейомиосаркомы, рабдомиосаркомы, саркомы, саркомы матки, остеосаркомы, нейрофибросаркомы, злокачественной опухоли оболочек периферических нервов (MPNST) и псевдосаркомы. В некоторых вариантах осуществления в способе по пункту 3 глиома выбрана из группы, состоящей из: глиомы, глиомы ствола головного мозга и глиомы гипоталамической области и зрительного пути. В некоторых других вариантах осуществления бластома выбрана из группы, состоящей из: пульмональной бластомы, плевропульмональной бластомы, ретинобластомы, нейробластомы, медуллобластомы, глиобластомы и геманглиобластомы.
В одном варианте осуществления представлен способ лечения или предупреждения рака у пациента, включающий стадию введения указанному пациенту бендамустина и ингибитора гистондеацетилазы (HDAC), при этом рак представляет собой лимфому из клеток мантийной зоны, диффузную B-крупноклеточную лимфому, индолентную лимфому, множественную миелому или рак толстой кишки.
В определенных вариантах осуществления введение бендамустина и ингибитора гистондеацетилазы (HDAC) является одновременным. В определенных других вариантах осуществления введение бендамустина и ингибитора гистондеацетилазы (HDAC) является последовательным, при этом бендамустин вводят в первую очередь. В определенных вариантах осуществления введение бендамустина и ингибитора гистондеацетилазы (HDAC) является последовательным, при этом ингибитор HDAC вводят в первую очередь. В некоторых других вариантах осуществления введение бендамустина и ингибитора HDAC осуществляют поочередно.
В определенных вариантах осуществления предлагается способ лечения или предупреждения рака у пациента, включающий стадию введения указанному пациенту бендамустина и ингибитора гистондеацетилазы (HDAC), при этом ингибитор HDAC представляет собой: N-гидрокси-4-[2-(4-метоксихинолин-2-илкарбониламино)этокси]бензамид; N-гидрокси-4-[2S-(транс-циннамоиламино)бутокси]бензамид; N-гидрокси-4-[2R-(транс-циннамоиламино)бутокси]бензамид; N-гидрокси-4-{2-[4-(2-метоксиэтокси)хинолин-2-илкарбониламино]этокси}бензамид; N-гидрокси-4-[2S-(бензотиофен-2-илкарбониламино)бутокси]-бензамид; N-гидрокси-4-{2S-[бензофуран-2-илкарбониламино]бутокси}бензамид; N-гидрокси-4-{2-[3-(метоксиметил)бензофуран-2-илкарбониламино]этокси}бензамид; N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(i-пропоксиметил)бензофуран-2-илкарбониламино]этокси}бензамид; N-гидрокси-4-{2-[3-(3-гидроксипропоксиметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(2-метоксиэтилоксиметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(пирролидин-1-илметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(пиперидин-1-илметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(4-метилпиперазин-1-илметил)бензофуран-2-илкарбониламино]-этокси}бензамид; N-гидрокси-4-{2-[5-(тетрагидропиран-4-илокси)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[5-(2-пирролидин-1-илэтилокси)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2S-[5-(2-пирролидин-1-илэтилокси)бензофуран-2-илкарбониламино]бутокси}-бензамид; N-гидрокси-4-{2-[5-(2-пирролидин-1-илэтилокси)бензофуран-2-илкарбониламино]-1R-метил-этокси}бензамид; N-гидрокси-4-{2-[(3-(бензофуран-2-ил)-4-(диметиламино)-бут-2-еноил)амино]-этокси}бензамид, или его фармацевтически приемлемую соль. В некоторых вариантах осуществления ингибитор HDAC представляет собой HCl соль N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамида.
В определенных вариантах осуществления изобретение обеспечивает фармацевтические композиции, содержащие бендамустин и ингибитор HDAC, при этом комбинация бендамустина и ингибитора HDAC является пригодной для раздельного, последовательного и/или одновременного введения. В определенных вариантах осуществления пациент предварительно обработан ингибитором HDAC до введения бендамустина. В некоторых вариантах осуществления эффективную дозу ингибитора HDAC вводят в течение периода до одной недели перед терапией бендамустином. В некоторых вариантах осуществления эффективную дозу ингибитора HDAC вводят в течение периода до пяти дней перед введением эффективного количества бендамустина. В некоторых вариантах осуществления эффективную дозу ингибитора HDAC вводят в течение периода от одного до трех дней перед введением эффективного количества бендамустина. В некоторых вариантах осуществления эффективную дозу ингибитора HDAC вводят в течение периода от одной до двух недель перед введением эффективного количества бендамустина. В одном варианте осуществления эффективную дозу ингибитора HDAC вводят за двадцать четыре часа до введения эффективного количества бендамустина.
В одном варианте осуществления предлагается способ ингибирования роста опухоли, включающий приведение в контакт опухоли с бендамустином и ингибитором гистондеацетилазы (HDAC) в количестве, эффективном для ингибирования роста опухоли.
В другом варианте осуществления предлагается фармацевтическая композиция в твердой лекарственной форме, пригодной для перорального введения, при этом композиция содержит: активный инградиент, который представляет собой Соединение 1:
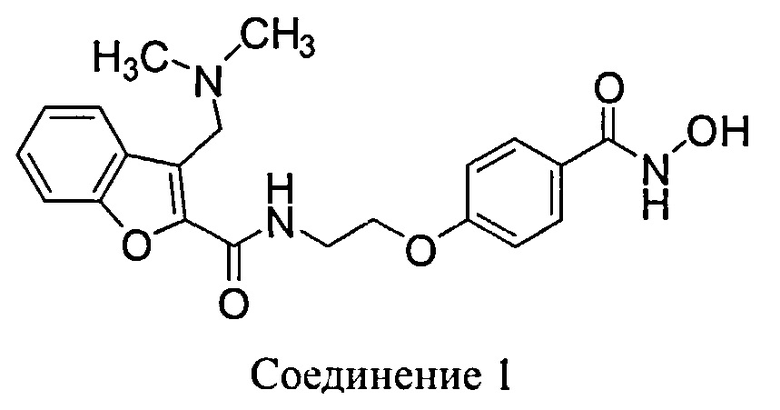
или его фармацевтически приемлемую соль; и второй активный ингредиент, который представляет собой бендамустин или его фармацевтически приемлемый сложный эфир, соль или сольват; и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество. В определенных вариантах осуществления соль представляет собой тозилатную соль. В определенных вариантах осуществления указанная композиция представляет собой пероральную твердую фармацевтическую композицию с контролируемым высвобождением. В определенных вариантах осуществления этой твердой дозированной фармацевтической композиции, один или больше чем один активный ингредиент присутствует в виде соли и фармацевтическая композиция полностью высвобождает указанный активный ингредиент(ы): (i) с постоянной скоростью в течение периода от примерно 6 часов до примерно 10 часов после перорального введения человеку; (ii) с уменьшающейся скоростью в течение периода от примерно 6 часов до примерно 10 часов после перорального введения человеку; или (iii) в виде импульсов в течение периода от примерно 6 часов до примерно 10 часов после перорального введения человеку. В определенных вариантах осуществления соль представляет собой тозилатную соль. В определенных других вариантах осуществления пероральная твердая дозированная фармацевтическая композиция с контролируемым высвобождением представляет собой композицию, которая высвобождает менее чем примерно 10% активных ингредиентов в желудке после перорального введения человеку.
В определенных вариантах осуществления пероральная твердая дозированная фармацевтическая композиция с контролируемым высвобождением содержит активные ингредиенты в матрице контролируемого высвобождения. В определенных других вариантах осуществления фармацевтическая композиция представлена в форме таблетки с энтеросолюбильным покрытием. В других вариантах осуществления фармацевтическая композиция содержит частицы активных ингредиентов.
В других вариантах осуществления фармацевтическая композиция содержит от примерно 10 до примерно 1000 мг, от примерно 25 до примерно 600 мг, от примерно 50 до примерно 200 мг и примерно 100 мг каждого активного ингредиента. В следующих вариантах осуществления фармацевтическая композиция является пригодной для раздельного, последовательного и/или одновременного введения бендамустина и ингибитора HDAC.
В одном аспекте описан способ лечения рака у человека, включающий: введение человеку фармацевтической композиции, содержащей ингибитор гистондеацетилазы (HDAC), циклами, состоящими из ежедневного введения фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 9 последовательных дней с последующим отсутствием введения фармацевтической композиции, содержащей ингибитор HDAC, в течение от 2 до 7 последовательных дней. В некоторых вариантах осуществления способ лечения рака у человека включает: введение человеку фармацевтической композиции, содержащей ингибитор гистондеацетилазы (HDAC), циклами, состоящими из ежедневного введения фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 9 последовательных дней с последующим отсутствием введения фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 7 последовательных дней.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 9 последовательных дней включает: ежедневное введение двух фармацевтических композиций с немедленным высвобождением, содержащих ингибитор HDAC, при этом две фармацевтические композиции с немедленным высвобождением вводят последовательно, при этом вторую фармацевтическую композицию с немедленным высвобождением вводят с интервалом от примерно 4 до примерно 6 часов после введения первой фармацевтической композиции с немедленным высвобождением; или ежедневное введение одной пероральной твердой дозированной фармацевтической композиции с контролируемым высвобождением, содержащей ингибитор HDAC.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 9 последовательных дней включает ежедневное введение ингибитора HDAC в количестве, достаточном для поддержания эффективных концентраций в плазме крови ингибитора HDAC у человека в течение, по меньшей мере, примерно 6 последовательных часов в дни дозирования. В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 9 последовательных дней включает ежедневное введение ингибитора HDAC в количестве, достаточном для поддержания эффективных концентраций в плазме крови ингибитора HDAC у человека в течение, по меньшей мере, примерно 6 последовательных часов в дни дозирования, но не более 14 последовательных часов.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 9 последовательных дней включает ежедневное введение ингибитора HDAC в количестве, достаточном для поддержания эффективных концентраций в плазме крови ингибитора HDAC у человека в течение от примерно 6 последовательных часов до примерно 8 последовательных часов в дни дозирования.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 9 последовательных дней включает: ежедневное введение двух фармацевтических композиций с немедленным высвобождением, содержащих ингибитор HDAC, при этом две фармацевтические композиции с немедленным высвобождением вводят последовательно с интервалом от 4 до 6 часов; или ежедневное введение одной пероральной твердой дозированной фармацевтической композиции с контролируемым высвобождением, содержащей ингибитор HDAC.
В некоторых вариантах осуществления одна пероральная твердая дозированная фармацевтическая композиция с контролируемым высвобождением, содержащая ингибитор HDAC, обеспечивает по существу такое же высвобождение in vivo у человека, как и две фармацевтические композиции с немедленным высвобождением, содержащие ингибитор HDAC, вводимые последовательно с интервалом от 4 до 6 часов.
В некоторых вариантах осуществления ингибитор HDAC представляет собой: N-гидрокси-4-[2-(4-метоксихинолин-2-илкарбониламино)этокси]бензамид; N-гидрокси-4-[2S-(транс-циннамоиламино)бутокси]бензамид; N-гидрокси-4-[2R-(транс-циннамоиламино)бутокси]бензамид; N-гидрокси-4-{2-[4-(2-метоксиэтокси)хинолин-2-илкарбониламино]этокси}бензамид; N-гидрокси-4-[2S-(бензотиофен-2-илкарбониламино)бутокси]-бензамид; N-гидрокси-4-{2S-[бензофуран-2-илкарбониламино]бутокси}бензамид; N-гидрокси-4-{2-[3-(метоксиметил)бензофуран-2-илкарбониламино]этокси}бензамид; N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(i-пропоксиметил)бензофуран-2-илкарбониламино]этокси}бензамид; N-гидрокси-4-{2-[3-(3-гидроксипропоксиметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(2-метоксиэтилоксиметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(пирролидин-1-илметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(пиперидин-1-илметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(4-метилпиперазин-1-илметил)бензофуран-2-илкарбониламино]-этокси}бензамид; N-гидрокси-4-{2-[5-(тетрагидропиран-4-илокси)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[5-(2-пирролидин-1-илэтилокси)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2S-[5-(2-пирролидин-1-илэтилокси)бензофуран-2-илкарбониламино]бутокси}-бензамид; N-гидрокси-4-{2-[5-(2-пирролидин-1-илэтилокси)бензофуран-2-илкарбониламино]-1R-метил-этокси}бензамид; N-гидрокси-4-{2-[(3-(бензофуран-2-ил)-4-(диметиламино)-бут-2-еноил)амино]-этокси}бензамид, или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления ингибитор HDAC представляет собой HCl соль N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамида.
В некоторых вариантах осуществления ингибитор HDAC представляет собой тозилатную соль N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамида.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей HCl соль N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамида, в течение от 5 до 9 последовательных дней включает: ежедневное введение двух фармацевтических композиций с немедленным высвобождением, содержащих HCl соль Соединения 1, при этом две фармацевтические композиции с немедленным высвобождением вводят с интервалом от 4 до 6 часов; или ежедневное введение одной пероральной твердой дозированной фармацевтической композиции с контролируемым высвобождением.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей HCl соль N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамида, в течение от 5 до 9 последовательных дней включает ежедневное введение от примерно 10 мг до примерно 300 мг HCl соли N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамида.
В некоторых вариантах осуществления рак представляет собой гематологический рак, солидную опухоль или саркому. В некоторых вариантах осуществления рак представляет собой рак молочной железы, рак толстой кишки, колоректальную карциному, немелкоклеточный рак легких, мелкоклеточный рак легких, рак печени, рак яичников, рак предстательной железы, рак шейки матки, рак мочевого пузыря, карциному желудка, гастроинтестинальную стромальную опухоль, рак поджелудочной железы, герминогенные опухоли, мастоцитому, нейробластому, мастоцитоз, рак яичка, глиобластому, астроцитому, B-клеточную лимфому, T-клеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому, индолентную лимфому, меланому, миелому, острый миелоцитарный лейкоз (AML), острый лимфобластный лейкоз (ALL), миелодиспластический синдром и хроническую миелогенную лейкемию.
В некоторых вариантах осуществления способ дополнительно включает введение человеку, по меньшей мере, одного дополнительного терапевтического агента, выбранного из ДНК-повреждающих агентов; ингибиторов топоизомеразы I или II; алкилирующих агентов; ингибиторов PARP; ингибиторов протеосом; антиметаболитов РНК/ДНК; антимитотических агентов; иммуномодулирующих средств; антиангиогенных препаратов; ингибиторов ароматазы; гормономодулирующих препаратов; апоптоз-индуцирующих агентов; ингибиторов киназы; моноклональных антител; абареликса; ABT-888; алдеслейкина; алдеслейкина; алемтузумаба; алитретиноина; аллопуринола; альтретамина; амифостина; анастрозола; триоксида мышьяка; аспарагиназы; азацитидина; AZD-2281; бендамустина; перифозина; леналиномида; хлорохина; бевацизумаба; бексаротена; блеомицина; бортезомиба; BSI-201; бусульфана; калустерона; капецитабина; карбоплатина; карфилозиба; кармустина; целекоксиба; цетуксимаба; хлорамбуцила; цисплатина; кладрибина; клофарабина; циклофосфамида; цитарабина; липосомальной формы цитарабина; дакарбазина; дактиномицина; дарбепоетина альфа; дазатиниба; липосомальной формы даунорубицина; даунорубицина; децитабина; денилейкина; дексразоксана; доцетаксела; доксорубицина; липосомальной формы доксорубицина; дромостанолона пропионата; эпирубицина; эпоэтина альфа; эрлотиниба; эстрамустина; этопозида фосфата; этопозида; экземестана; филграстима; флоксуридина; флударабина; фторурацила; фулвестранта; гефитиниба; гемцитабина; гемтузумаба озогамицина; гозерелина ацетата; гистрелина ацетата; гидроксимочевины; ибритумомаба тиуксетана; идарубицина; ифосфамида; иматиниба мезилата; интерферона альфа-2а; Интерферона альфа-2b; иринотекана; леналидомида; летрозола; лейковорина; леупролида ацетата; левамизола; ломустина; меклоретамина; мегестерола ацетата; мелфалана; меркаптопурина; метотрексата; метоксалена; митомицина-C; митотана; митоксантрона; нандролона фенпропионата; неларабина; NPI-0052; нофетумомаба; опрелвекина; оксалиплатина; паклитаксела; связанных с белком частиц паклитаксела; палифермина; памидроната; панитумумаба; пегадемазы; пегаспаргазы; пегфилграстима; пеметрекседа динатрия; пентостатина; пипобромана; пликамицина; митрамицина; порфимера натрия; прокарбазина; квинакрина; RAD001; расбуриказы; ритуксимаба; сарграмостима; Сарграмостима; сорафениба; стрептозоцина; сунитиниба малата; тамоксифена; темозоломида; тенипозида; тестолактона; талидомида; тиогуанина; тиотепа; топотекана; торемифена; тозитумомаба; тозитумомаба/I-131 тозитумомаба; трастузумаба; третиноина; урацилового иприта; валрубицина; винбластина; винкристина; винорелбина; вориностата; золедроната; и золедроновой кислоты. В определенных вариантах осуществления ингибитор HDAC (напр., Соединение 1) вводят человеку в комбинации с бендамустином и ритуксимабом.
В некоторых вариантах осуществления способ дополнительно включает лучевую терапию.
В одном варианте осуществления способ включает введение человеку алкилирующего агента в комбинации с ингибитором HDAC, раскрытым в настоящем документе. В одном варианте осуществления аклилирующий агент представляет собой бендамустин. В другом варианте осуществления способ включает введение человеку бендамустина, также известного как Рибомустин или Треанда, в комбинации с ингибитором HDAC.
В одном аспекте, описанном здесь, предлагается способ лечения рака у человека, включающий введение человеку фармацевтической композиции, содержащей HCl соль N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамида (Соединение 1) и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество, циклами, состоящими из ежедневного введения фармацевтической композиции, содержащей HCl соль Соединения 1, в течение от 5 до 9 последовательных дней с последующим отсутствием введения фармацевтической композиции, содержащей HCl соль Соединения 1, в течение от 5 до 7 последовательных дней. В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей HCl соль Соединения 1, в течение от 5 до 9 последовательных дней включает ежедневное введение двух доз фармацевтической композиции с немедленным высвобождением, содержащих HCl соль Соединения 1, при этом две дозы с немедленным высвобождением вводят с интервалом от 4 до 6 часов.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей HCl соль Соединения 1, в течение от 5 до 9 последовательных дней включает введение одной пероральной твердой дозированной фармацевтической композиции с контролируемым высвобождением, как описано в настоящем документе.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей HCl соль Соединения 1, в течение от 5 до 9 последовательных дней включает от примерно 10 мг до примерно 300 мг HCl соли Соединения 1.
В одном аспекте способ лечения рака с помощью ингибитора HDAC, как описано здесь, уменьшает случаи развития тромбоцитопении 4 степени у человека, имеющего рак.
В одном аспекте предлагается применение HCl соли Соединения 1 для изготовления фармацевтической композиции с контролируемым высвобождением для перорального введения человеку, имеющему рак.
В одном аспекте предлагается применение фармацевтической композиции HCl соли Соединения 1 с контролируемым высвобождением для лечения рака у человека.
В одном аспекте предлагается режим дозирования фармацевтической композиции для применения в лечении рака у человека, при этом фармацевтическая композиция включает Соединение 1 или его фармацевтически приемлемую соль, и режим дозирования уменьшает число случаев развития тромбоцитопении 4 степени у человека, имеющего рак.
В одном аспекте в настоящем документе раскрыта пероральная твердая дозированная фармацевтическая композиция с контролируемым высвобождением, содержащая Соединение 1:
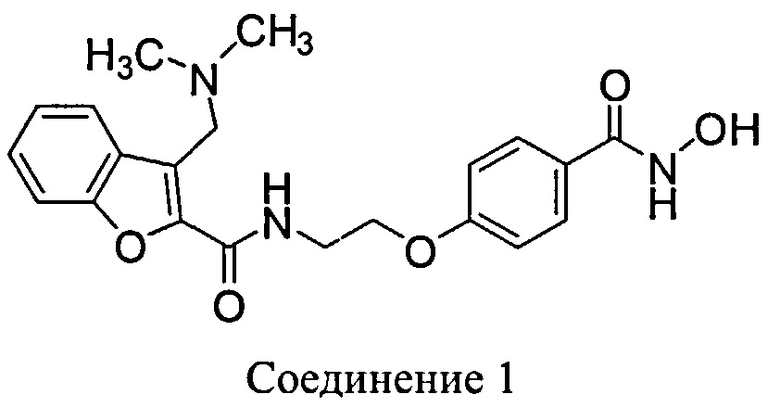
или его фармацевтически приемлемую соль и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество, при этом фармацевтическая композиция полностью высвобождает Соединение 1 или его фармацевтически приемлемую соль в течение от примерно 6 часов до примерно 10 часов после перорального введения человеку.
В одном аспекте Соединение 1 присутствует в фармацевтических композициях в виде HCl соли (Соединение 1, HCl). В некоторых вариантах осуществления Соединение 1 присутствует в фармацевтических композициях в виде тозилатной соли.
В некоторых вариантах осуществления фармацевтическая композиция полностью высвобождает Соединение 1, HCl: (i) с постоянной скоростью в течение периода от примерно 6 часов до примерно 10 часов после перорального введения человеку; (ii) с уменьшеющейся скоростью в течение периода от примерно 6 часов до примерно 10 часов после перорального введения человеку; или (iii) в виде импульсов в течение периода от примерно от 6 часов до примерно 10 часов после перорального введения человеку.
В некоторых вариантах осуществления фармацевтическая композиция полностью высвобождает Соединение 1, HCl в течение 10 часов после перорального введения человеку.
В некоторых вариантах осуществления фармацевтическая композиция высвобождает менее чем около 10% Соединения 1, HCl в желудке после перорального введения человеку.
В некоторых вариантах осуществления фармацевтическая композиция не высвобождает Соединение 1, HCl в желудке после перорального введения человеку.
В некоторых вариантах осуществления фармацевтическая композиция содержит Соединение 1, HCl в матрице контролируемого высвобождения.
В некоторых вариантах осуществления фармацевтическая композиция представлена в форме таблетки с энтеросолюбильным покрытием.
В некоторых вариантах осуществления энтеросолюбильное покрытие содержит: гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилметилцеллюлозу, метилцеллюлозу, этилцеллюлозу, ацетат целлюлозы, ацетат-фталат целлюлозы, ацетат-тримеллитат целлюлозы, фталат гидроксипропилметилцеллюлозы, фталат сложного-простого эфира целлюлозы, фталат гидроксипропилцеллюлозы, щелочные соли ацетат-фталата целлюлозы, щелочноземельные соли ацетат-фталата целлюлозы, фталат гидроксипропилметилцеллюлозы, ацетат-фталат целлюлозы, натрий-карбоксиметилцеллюлозу, полимеры и сополимеры акриловой кислоты, терполимер этилакрилата/метилметакрилата/триметиламмоний хлорид этилметакрилата, сополимер метакриловой кислоты/этилакрилата, сополимер метакриловой кислоты/метилметакрилата, поливинилпирролидон, поливинилацетат, фталат поливнилацетата, сополимер винилацетата и кротоновой кислоты, шеллак, аммонизированный шеллак, шеллак-цетиловый спирт или шеллак-н-бутилстеарат.
В некоторых вариантах осуществления фармацевтическая композиция содержит частицы Соединения 1, HCl.
В некоторых вариантах осуществления фармацевтическая композиция полностью высвобождает Соединение 1, HCl в виде импульсов в течение периода от примерно 6 часов до примерно 10 часов.
В некоторых вариантах осуществления фармацевтическая композиция содержит, по меньшей мере, две различные группы частиц Соединения 1, HCl.
В некоторых вариантах осуществления фармацевтическая композиция содержит первую группу частиц Соединения 1, HCl с отсроченным высвобождением и вторую группу частиц Соединения 1, HCl с отсроченным высвобождением.
В некоторых вариантах осуществления, частицы Соединения 1, HCl с отсроченным высвобождением представлены в форме шариков, пеллет, гранул или мини-таблеток.
В некоторых вариантах осуществления первая группа частиц Соединения 1, HCl с отсроченным высвобождением задерживает высвобождение Соединения 1, HCl, по меньшей мере, на 1-2 часа после перорального введения человеку.
В некоторых вариантах осуществления вторая группа частиц Соединения 1, HCl с отсроченным высвобождением задерживает высвобождение Соединения 1, HCl, по меньшей мере, на 3-6 часов после перорального введения человеку.
В некоторых вариантах осуществления высвобождение Соединения 1, HCl из второй группы частиц с отсроченным высвобождением происходит через 2-6 часов после высвобождения, по меньшей мере, половины количества Соединения 1, HCl из первой группы частиц с отсроченным высвобождением после введения человеку.
В некоторых вариантах осуществления фармацевтическая композиция высвобождает Соединение 1, HCl в виде двух импульсов, при этом второе импульсное высвобождение Соединения 1, HCl происходит через 2-6 часов после первого импульсного высвобождения Соединения 1, HCl после перорального введения человеку.
В некоторых вариантах осуществления количество Соединения 1, HCl является одинаковым в двух группах частиц.
В некоторых вариантах осуществления покрытие с отсроченным высвобождением на первой группе частиц с отсроченным высвобождением отличается от покрытия с отсроченным высвобождением на второй группе частиц с отсроченным высвобождением.
В некоторых вариантах осуществления покрытия с отсроченным высвобождением включают чувствительное к pH покрытие или нечувствительное к pH покрытие.
В некоторых вариантах осуществления фармацевтическая композиция представлена в форме пеллет, шариков, гранул или мини-таблеток в капсуле.
В некоторых вариантах осуществления фармацевтическая композиция представлена в форме пеллет, шариков или гранул, которые прессованы в одну таблетку.
В некоторых вариантах осуществления фармацевтическая композиция содержит примерно от 10 мг до 300 мг Соединения 1, HCl.
В некоторых вариантах осуществления фармацевтическая композиция обеспечивает нормализованное по дозе среднее значение AUC0-8h от приблизительно 0.0035 до приблизительно 0.0124 (мкМ⋅ч)/(мг/м2) при пероральном введении человеку.
В одном аспекте фармацевтическая композиция предназначена для применения в лечении рака у человека. В некоторых вариантах осуществления рак представляет собой гематологический рак, солидную опухоль или саркому. В некоторых вариантах осуществления рак представляет собой рак молочной железы, рак толстой кишки, колоректальный рак, немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак печени, рак яичника, рак предстательной железы, рак матки, рак шейки матки, рак мочевого пузыря, рак желудка, гастроинтестинальную стромальную опухоль, рак поджелудочной железы, герминогенные опухоли, мастоцитому, нейробластому, мастоцитоз, рак яичка, глиобластому, астроцитому, лимфому, меланому, миелому, острый миелоцитарный лейкоз (AML), острую лимфоцитарную лейкемию (ALL), миелодиспластический синдром и хроническую миелогенную лейкемию. В одном аспекте рак представляет собой лимфому или лейкоз. В одном аспекте рак представляет собой B-клеточную лимфому, T-клеточную лимфому, индолентную лимфому, лимфому Ходжкина или неходжкинскую лимфому. В одном аспекте рак представляет собой неходжкинскую лимфому.
В некоторых вариантах осуществления фармацевтическая композиция применяется совместно с лучевой терапией.
В некоторых вариантах осуществления фармацевтическая композиция применяется в комбинации, по меньшей мере, с одним дополнительным терапевтическим агентом, выбранным из ДНК-повреждающих агентов; ингибиторов топоизомеразы I или II; алкилирующих агентов; ингибиторов PARP; ингибиторов протеосом; антиметаболитов РНК/ДНК; антимитотических агентов; иммуномодулирующих средств; антиангиогенных препаратов; ингибиторов ароматазы; гормономодулирующих препаратов; апоптоз-индуцирующих агентов; ингибиторов киназы; моноклональных антител; абареликса; ABT-888; алдеслейкина; алдеслейкина; алемтузумаба; алитретиноина; аллопуринола; альтретамина; амифостина; анастрозола; триоксида мышьяка; аспарагиназы; азацитидина; AZD-2281; бендамустина; перифозина; леналиномида; хлорохина; бевацизумаба; бексаротена; блеомицина; бортезомиба; BSI-201; бусульфана; калустерона; капецитабина; карбоплатина; карфилозиба; кармустина; целекоксиба; цетуксимаба; хлорамбуцила; цисплатина; кладрибина; клофарабина; циклофосфамида; цитарабина; липосомальной формы цитарабина; дакарбазина; дактиномицина; дарбепоетина альфа; дазатиниба; липосомальной формы даунорубицина; даунорубицина; децитабина; денилейкина; дексразоксана; доцетаксела; доксорубицина; липосомальной формы доксорубицина; дромостанолона пропионата; эпирубицина; эпоэтина альфа; эрлотиниба; эстрамустина; этопозида фосфата; этопозида; экземестана; филграстима; флоксуридина; флударабина; фторурацила; фулвестранта; гефитиниба; гемцитабина; гемтузумаба озогамицина; гозерелина ацетата; гистрелина ацетата; гидроксимочевины; ибритумомаба тиуксетана; идарубицина; ифосфамида; иматиниба мезилата; интерферона альфа-2а; Интерферона альфа-2b; иринотекана; леналидомида; летрозола; лейковорина; леупролида ацетата; левамизола; ломустина; меклоретамина; мегестерола ацетата; мелфалана; меркаптопурина; метотрексата; метоксалена; митомицина-C; митотана; митоксантрона; нандролона фенпропионата; неларабина; NPI-0052; нофетумомаба; опрелвекина; оксалиплатина; паклитаксела; связанных с белком частиц паклитаксела; палифермина; памидроната; панитумумаба; пегадемазы; пегаспаргазы; пегфилграстима; пеметрекседа динатрия; пентостатина; пипобромана; пликамицина; митрамицина; порфимера натрия; прокарбазина; квинакрина; RAD001; расбуриказы; ритуксимаба; сарграмостима; Сарграмостима; сорафениба; стрептозоцина; сунитиниба малата; тамоксифена; темозоломида; тенипозида; тестолактона; талидомида; тиогуанина; тиотепа; топотекана; торемифена; тозитумомаба; тозитумомаба/I-131 тозитумомаба; трастузумаба; третиноина; урацилового иприта; валрубицина; винбластина; винкристина; винорелбина; вориностата; золедроната; и золедроновой кислоты.
Предлагаются готовые изделия, которые включают упаковочный материал, соединение ингибитора HDAC, описанное в настоящем документе, которое является эффективным для селективного ингибирования активности гистондеацетилазы, внутри упаковочного материала, и этикетку, на которой указано, что соединение или композиция, или его фармацевтически приемлемая соль, фармацевтически приемлемый N-оксид, фармацевтически активный метаболит, фармацевтически приемлемое пролекарство, или фармацевтически приемлемый сольват используется для ингибирования активности гистондеацетилазы, или для лечения, предупреждения или уменьшения интенсивности одного или более симптомов заболевания или состояния, на которые будет оказывать благоприятное воздействие ингибирование активности гистондеацетилазы.
В некоторых вариантах осуществления фармацевтические композиции, описанные в настоящем документе, которые включают ингибитор HDAC, формулированы таким образом, чтобы быть пригодными для перорального введения человеку.
В некоторых вариантах осуществления фармацевтические композиции, описанные в настоящем документе, которые включают ингибитор HDAC, формулированы таким образом, чтобы быть пригодными для внутривенного введения человеку.
Другие задачи, признаки и преимущества способов, соединений и композиций, описанных в настоящем документе, станут очевидными из следующего подробного описания. Тем не менее, следует понимать, что подробное описание и конкретные примеры, показывающие конкретные варианты осуществления, представлены только в качестве иллюстрации, поскольку различные изменения и модификации в пределах сущности и объема изобретения станут очевидными для специалистов в данной области из данного подробного описания.
Краткое описание фигур
На ФИГУРЕ 1 представлены результаты in vitro исследований режимов дозирования. Показано влияние режима дозирования ингибитора HDAC (т.е. Соединения 1) на гибель опухолевых клеток.
На ФИГУРЕ 2 представлены результаты моделирования режимов дозирования Соединения 1 и эффекты на клеточные линии Jurkat и НСТ116.
На ФИГУРЕ 3 представлены результаты терапии бендамустином и ингибитором HDAC (т.е. Соединением 1) солидных опухолей, в частности злокачественных опухолей толстой кишки HCT-116. Показаны эффекты различных уровней доз каждого активного агента, а также комбинации бендамустина и ингибитора HDAC (т.е. Соединения 1).
На ФИГУРЕ 4 представлены результаты терапии бендамустином и ингибитором HDAC (т.е. Соединением 1) клеток множественной миеломы U266 по данным мониторинга апоптоза с помощью проточной цитометрии. Показаны эффекты различных уровней доз каждого активного агента, а также комбинации бендамустина и ингибитора HDAC (т.е. Соединения 1).
На ФИГУРАХ 5A-5B показаны результаты терапии бендамустином и ингибитором HDAC (т.е. Соединением 1) клеток лимфомы DLCL2 но данным мониторинга апоптоза с помощью проточной цитометрии. На Фиг. 5A показаны эффекты различных уровней доз каждого активного агента, а также комбинации бендамустина и ингибитора HDAC (т.е. Соединения 1). На Фиг. 5B показаны эффекты различных уровней доз каждого активного агента, а также комбинации бендамустина и ингибитора HDAC (т.е. Соединения 1), при этом клетки лимфомы предварительно обработаны ингибитором HDAC (т.е. Соединением 1) за день до однодневного лечения комбинацией бендамустина и ингибитора HDAC (т.е. Соединения 1).
На ФИГУРАХ 6A, 6B и 6C показана роль RAD51 в синергической противораковой активности бендамустина и ингибитора HDAC (т.е. Соединения 1). На Фиг. 6A показаны результаты вестерн-блоттинга, указывающие на супрессию экспрессии RAD51 в двух клеточных линиях множественной миеломы, обработанных ингибитором HDAC (т.е. Соединением 1), а также комбинацией ингибитора HDAC (т.е. Соединения 1) и бендамустина. На Фиг. 6B - Фиг. 6C показан эффект комбинации бендамустина и ингибитора HDAC (т.е. Соединения 1) в двух клеточных линиях множественной миеломы по данным мониторинга апоптоза с помощью проточной цитометрии.
На ФИГУРЕ 7 показано изменение объемов опухолей у мышиных самок SCID при терапии индивидуально ингибитором HDAC (т.е. Соединением 1), бендамустином, а также комбинацией бендамустина и ингибитора HDAC (т.е. Соединения 1).
На ФИГУРЕ 8 показаны клетки множественной миеломы H929, обработанные ингибитором HDAC (т.е. Соединением 1), описанным в настоящем документе, (200 нМ) и/или бендамустином (50 мкМ) в течение 1 или 3 дней. Последовательность добавления тестировали путем добавления в первую очередь бендамустина или ингибитора HDAC (т.е. Соединения 1), затем добавления второго через 24 ч. Добавление ингибитора HDAC (т.е. Соединения 1) с последующим бендамустином через 24 ч вызвало наибольшую гибелб клеток в этих сериях.
На ФИГУРЕ 9 показано, что предварительная обработка ингибитором HDAC (т.е. Соединением 1), описанным в настоящем документе, подавляет индуцированное бендамустином повышение экспрессии RAD51, ингибируя, таким образом, восстановление повреждения ДНК и усиливая действие бендамустина.
На ФИГУРЕ 10 показано эффективное синергическое действие ингибитора HDAC (т.е. Соединения 1), описанного в настоящем документе, с бортезомибом в нейробластоме.
На ФИГУРЕ 11 показано синергическое действие ингибитора HDAC (т.е. Соединения 1), описанного в настоящем документе, с хлорохином, который является ингибитором аутофагии.
На ФИГУРЕ 12 показано, что перифозин является синергическим с ингибитором HDAC (т.е. Соединением 1) в опухолевых клетках толстой кишки.
На ФИГУРЕ 13 показано, что ингибитор HDAC (т.е. Соединение 1), описанный в настоящем документе, является синергическим с цисплатином при всех концентрациях в резистентной к платине клеточной линии опухоли яичников.
Осуществление изобретения
Рак считается заболеванием, обусловленным генетическими дефектами, такими как мутации и делении в генах, а также хромосомными нарушениями, которые приводят к потере функции генов-супрессоров опухолей и/или приобретению функции или геперактивации онкогенов.
Рак характеризуется изменениями экспрессии генов в масштабе генома в опухоли. Эти изменения содействуют способности опухоли прогрессировать на протяжении клеточного цикла, избегать апоптоза или становиться резистентной к химиотерапии. Ингибиторы HDAC могут поменять развитие некоторых из этих изменений в обратном направлении и восстановить паттерн, сходный с паттерном нормальной клетки.
Геном человека состоит из сложной сети генов, которые включаются или выключаются в зависимости от потребностей клетки. Одним из путей, посредством которых гены включаются или выключаются, является химическая модификация гистоновых белков. Гистоновые белки представляют собой структурные компоненты хромосом и формируют скелет, на основании которого организуется ДНК, генетический материал. Хорошо изученной модификацией гистонов является ацетилирование и деацетилирование, модификации, которые катализируются семейством ферментов, известных как гистон-ацетилтрансферазы и гистондеацетилазы.
Ингибирование ферментов HDAC Соединением 1 нарушает баланс в сторону ацетилированного состояния, то есть состояния, которое обеспечивает старт транскрипции, что может рассматриваться как включение гена «on». В случае, когда клетка обработана Соединением 1, вначале включаются волны ранее «молчащих» генов. Некоторые из этих генов сами по себе являются регуляторами и будут активировать или подавлять экспрессию еще других генов. Результатом является набор изменений в экспрессии генов: отдельные гены являются включенными, тогда как другие находятся в выключенном состоянии.
После химиотерапии и/или лучевой терапии некоторые опухоли пациентов могут «включать» определенные гены как стратегию опухоли адаптироваться к терапии и стать резистентной к гибели клеток. Одним примером генетического изменения, которое возникает во многих видах рака, является активация гена RAD51 репарации ДНК. В ответ на обработку ДНК-повреждающей химиотерапией или лучевой терапией, опухоли будут часто «включать» гены репарации ДНК (в том числе RAD51) как стратегию адаптации для того, чтобы помочь опухоли восстановить повреждение ДНК, произведенное этими агентами. В доклинических моделях Соединение 1 было способно «выключать» RAD51 (и другие гены репарации ДНК), эффективно блокируя способность опухоли восстанавливать свою поврежденную ДНК, сенсибилизируя опухоль к химиотерапии и лучевой терапии.
Доклинические исследования активностей ингибитора HDAC
В доклинических исследованиях было обнаружено, что ингибиторы HDAC, такие как Соединение 1, обладают специфическими в отношении опухолей противораковыми активностями. Эти исследования обеспечили важную информацию об активностях in vitro и in vivo ингибиторов HDAC, таких как Соединение 1, и определили молекулярный механизм, лежащий в основе противораковых эффектов.
In vitro: Соединение 1 является активным в отношении многих линий опухолевых клеток и является эффективным в мышиных моделях опухолей легких, толстой кишки, предстательной железы, поджелудочной железы и головного мозга.
Ех vivo: Соединение 1 является активным в первичных опухолях человека от пациентов с раком толстой кишки, яичника, легких и многими гематологическими злокачественными опухолями.
Обширные исследования на безопасность и токсикологические исследования были проведены на многих видах животных. Был изучен механизм действия Соединения 1, который включает комплексный подход к опухолевым клеткам: повышающая регуляция р21 и других супрессоров опухоли, и генов клеточного цикла; индукция образования активных форм кислорода и уменьшение активности антиоксидантных путей; изменение гомеостаза кальция и увеличенный стресс эндоплазматического ретикулума (ER); понижающая регуляция путей ДНК-репарации и увеличенное повреждение ДНК; прямая индукция апоптоза посредством гибели рецепторов и активации каспаз.
Соединение 1 представляет собой ингибитор HDAC на основе гидроксамата. В настоящем документе описаны фармацевтические композиции, которые включают Соединение 1, а также фармакокинетические и фармакодинамические стратегии, режимы дозирования, а также способы лечения злокачественных опухолей у человека в виде монотерапия или комбинированной терапии. Терапевтический и фармакодинамический эффект Соединения 1
В клинических испытаниях, в которых принимали участие пациенты, имеющие рак. Соединение 1 в форме раствора вводили в дозе 2 мг/кг в виде однократной пероральной дозы и в виде многократных доз путем 2-часового IV вливания. Системное воздействие, измеренное как AUC0⋅⋅∞ для IV и перорального дозирования, составило, соответственно, 5.9 мкМ*ч и 1.45 мкМ*ч, что указывает на то, что биодоступность при пероральном введении составляет примерно 27% у человека.
Терапевтический эффект ингибитора HDAC (напр., Соединения 1) достигается у людей, имеющих рак, путем введения ингибитора HDAC перорально дважды в сутки (при этом две дозы вводят последовательно с интервалом от примерно 4 до примерно 6 часов), перорально три раза в сутки (при этом дозы вводят последовательно с интервалом от примерно 4 до примерно 6 часов), внутривенно или непрерывно. Указанные выше режимы дозирования позволяют поддерживать эффективные концентрации ингибитора HDAC в плазме крови у человека в течение, по меньшей мере, 6 последовательных часов.
Терапевтический эффект Соединения 1 достигается у людей, имеющих рак, путем введения Соединения 1 (пероральных капсул с немедленным высвобождением) дважды в сутки, при этом две дозы вводят с интервалом от примерно 4 до примерно 6 часов. В некоторых вариантах осуществления дозирование дважды в сутки уменьшает случаи развития тромбицитопении по сравнению с дозированием три раза в сутки.
Для терапевтического эффекта эффективные концентрации Соединения 1 в плазме крови у людей должны поддерживаться в течение, по меньшей мере, 6 последовательных часов, по меньшей мере, 7 последовательных часов или, по меньшей мере, 8 последовательных часов каждый день в дни дозирования. Для терапевтического эффекта эффективные концентрации Соединения 1 в плазме крови у людей должны поддерживаться в течение, по меньшей мере, 6 последовательных часов каждый день в дни дозирования. Для терапевтического эффекта эффективные концентрации Соединения 1 в плазме крови у людей должны поддерживаться в течение, по меньшей мере, 7 последовательных часов каждый день в дни дозирования. В некоторых вариантах осуществления для терапевтического эффекта эффективные концентрации Соединения 1 в плазме крови у людей должны поддерживаться в течение от примерно 6 последовательных часов до примерно 8 последовательных часов каждый день в дни дозирования. В некоторых вариантах осуществления эффективные концентрации Соединения 1 в плазме крови у людей должны поддерживаться в течение, по меньшей мере, 6 последовательных часов, но не более 12, 13 или 14 последовательных часов в дни дозирования. В некоторых вариантах осуществления поддержание эффективной концентрации Соединения 1 в плазме крови в течение, по меньшей мере, 6 последовательных часов, но не более 14 последовательных часов в дни дозирования повышает эффективность ингибирования роста клеток опухоли и сводит к минимуму случаи развития тромбоцитопении. В некоторых вариантах осуществления поддержание эффективных концентраций Соединения 1 в плазме крови в течение от примерно 6 последовательных часов до примерно 8 последовательных часов в дни дозирования повышает эффективность ингибирования роста клеток опухоли и сводит к минимуму случаи развития тромбоцитопении.
Пероральная биодоступность у людей Соединения 1, введенного в виде капсул с немедленным высвобождением или перорального раствора, была определена равной примерно 27%. Различие в фармакокинетике наблюдалось у лабораторных животных между состоянием натощак и состоянием после приема пищи. Оказалось, что Соединение 1 преимущественно абсорбируется в кишечнике.
В одном аспекте представлены способы обеспечения терапевтического и фармакодинамического эффекта ингибитора HDAC, такого как Соединение 1, или его фармацевтически приемлемой соли, которые включают введение ингибитора HDAC или его фармацевтически приемлемой соли в виде лекарственной формы с контролируемым высвобождением. Лекарственные формы с контролируемым высвобождением допускают дозирование один раз в сутки. Лекарственные формы с контролируемым высвобождением также допускают высвобождение активного агента (т.е. ингибитора HDAC, такого как Соединение 1 или его фармацевтически приемлемая соль) скорее в кишечнике, а не в желудке.
В одном аспекте лекарственная форма с контролируемым высвобождением представляет собой систему доставки лекарственного средства, содержащую множество частиц. Системы доставки лекарственного средства, содержащие множество частиц, представляют собой пероральные лекарственные формы, состоящие из множества малых дискретных единиц, каждая из которых проявляет некоторые желательные характеристики. В этих системах доза активных веществ разделена на множество субъединиц, обычно состоящих из множества сферических частиц с диаметром 0.05-2.00 мм. Лекарственные формы, содержащие множество частиц, представляют собой фармацевтические лекарственные формы, в которых активное вещество присутствует в виде некоторого количества маленьких независимых субъединиц. Для доставки рекомендуемой общей дозы эти субъединицы наполняют в капсулы или прессуют в таблетки. Множество частиц в меньшей степени зависят от эвакуации содержимого желудка, что приводит к меньшей интер- и интра-индивидуальной изменчивости времени транзита пищи по желудочно-кишечному тракту. Они также лучше распределяются и реже вызывают местное раздражение или испытывают влияние от присутствия пищи.
Лекарственные формы, содержащие множество частиц, обеспечивают преимущества, такие как увеличенная биодоступность, уменьшенный риск местного раздражения и предсказуемое опорожнение желудка. В некоторых вариантах осуществления системы, содержащие множество частиц, показывают лучше воспроизводимое фармакокинетическое поведение, чем обычные лекарственные формы.
После распада лекарственной формы с контролируемым высвобождением (напр., таблетки или капсулы), который происходит в течение нескольких минут, отдельные частицы субъединиц быстро проходят через ЖК тракт. Если эти субъединицы имеют диаметр меньше, чем 2 мм, они могут покидать желудок непрерывно, даже если привратник желудка закрыт.Это приводит к более низкой интра- и интер-индивидуальной изменчивости в уровнях в плазме и биодоступности.
Другие пероральные лекарственные формы с контролируемым высвобождением могут обеспечить те же преимущества, которые наблюдаются в системах доставки лекарственного средства, содержащих множество частиц.
Лекарственные каникулы
Тромбоцитопения представляет собой побочный эффект, наблюдаемый у людей, которые получают лечение соединением ингибитора HDAC. Тромбоцитопения представляет собой состояние, при котором число тромбоцитов в крови ниже нормального уровня. Это может привести к более легкому образованию синяков и обильному кровотечению из ран или кровотечению слизистых оболочек и других тканей. Тромбоцитопению обычно сглаживают путем уменьшения суточной дозы соединения ингибитора HDAC, которая вводится человеку. Однако уменьшение суточной дозы соединения ингибитора HDAC может не обеспечить терапевтический и фармакодинамический эффект соединения ингибитора HDAC.
В настоящем документе представлены режимы дозирования для достижения терапевтического и фармакодинамического эффекта ингибитора HDAC с ограниченными случаями развития тромбоцитопении 4 степени, которые включают 5-9 последовательных дней ежедневного дозирования ингибитора HDAC в количестве, достаточном для поддержания эффективных концентраций в плазме крови ингибитора HDAC в течение, по меньшей мере, 6 последовательных часов в каждый день дозирования, с последующими 5-9 последовательными днями отсутствия дозирования ингибитора HDAC. В некоторых вариантах осуществления в дни дозирования эффективные концентрации в плазме крови ингибитора HDAC поддерживаются в течение, по меньшей мере 6, по меньшей мере 7 или по меньшей мере 8 последовательных часов, но не более 12, 13 или 14 последовательных часов. В некоторых вариантах осуществления в дни дозирования ингибитор HDAC вводят в количестве, достаточном для поддержания эффективных концентраций в плазме крови ингибитора HDAC в течение от примерно 6 последовательных часов до примерно 8 последовательных часов. В некоторых вариантах осуществления ингибитор HDAC вводят перорально. В некоторых вариантах осуществления в дни дозирования эффективные концентрации в плазме крови ингибитора HDAC поддерживаются в течение не более чем 12, 13 или 14 последовательных часов. В других вариантах осуществления ингибитор HDAC вводят парентерально.
В настоящем документе представлены режимы дозирования для достижения терапевтического и фармакодинамического эффекта ингибитора HDAC с ограниченными случаями развития тромбоцитопении 4 степени, которые включают: (а) пероральное дозирование ингибитора HDAC дважды в сутки (пероральной фармацевтической композиции с немедленным высвобождением) в течение 7 последовательных дней, с последующими 7 последовательными днями отсутствия дозирования ингибитора HDAC; или (b) дозирование ингибитора HDAC один раз в сутки (пероральной фармацевтической композиции с контролируемым высвобождением) в течение 7 последовательных дней, с последующими 7 последовательными днями отсутствия дозирования ингибитора HDAC. Вышеуказанный режим дозирования также включает 5-9 последовательных дней дозирования ингибитора HDAC, с последующими 2-9 последовательными днями отсутствия дозирования ингибитора HDAC.
В настоящем документе представлены режимы дозирования для достижения терапевтического и фармакодинамического эффекта Соединения 1 с ограниченными случаями развития тромбоцитопении 4 степени, которые включают: (а) пероральное дозирование Соединения 1 (пероральной фармацевтической композиции с немедленным высвобождением) дважды в сутки в течение 7 последовательных дней, с последующими 7 последовательными днями отсутствия дозирования Соединения 1; (b) дозирование Соединения 1 (пероральной фармацевтической композиции с контролируемым высвобождением) один раз в сутки в течение 7 последовательных дней, с последующими 7 последовательными днями отсутствия дозирования Соединения 1. Вышеуказанный режим дозирования также включает 5-9 последовательных дней дозирования Соединения 1, с последующими 2-9 последовательными днями отсутствия дозирования Соединения 1.
Вышеуказанный режим дозирования также включает 5-9 последовательных дней дозирования Соединения 1, с последующими 2-9 последовательными днями отсутствия дозирования Соединения 1.
Соединения-ингибиторы HDAC
N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамид (Соединение 1) имеет следующую структуру:
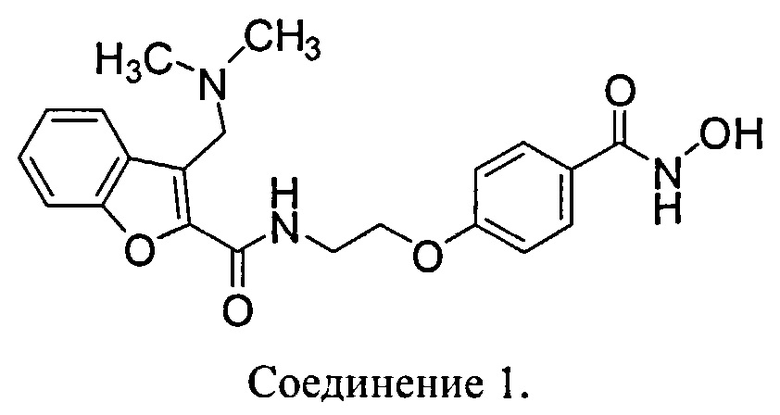
В одном аспекте Соединение 1 используется в фармацевтических композициях и способах, раскрытых здесь, в виде фармацевтически приемлемой соли. В одном аспекте Соединение 1 используется в виде хлористоводородной соли. В одном аспекте Соединение 1 используется в виде тозилатной соли.
Дополнительные фармацевтически приемлемые соли Соединения 1 включают: (а) соли, образованные либо при замещении кислотного протона Соединения 1 ионом металла, таким как, например, ион щелочного металла (напр., лития, натрия, калия), ион щелочноземельного металла (напр., магния или кальция) или ион алюминия, либо при замещении катионом аммония 
Дополнительные фармацевтически приемлемые соли включают соли, описанные в Berge с соавт., J. Pharm. Sci. 1977, 66, 1-19; и "Handbook of Pharmaceutical Salts, Properties, and Use," Stah and Wermuth, Ed.; Wiley-VCH and VHCA, Zurich, 2002.
В некоторых вариантах осуществления сайты на ароматической кольцевой части соединений, описанных в настоящем документе, которые чувствительны к различным метаболическим реакциям, модифицированы таким образом, чтобы снижать, минимизировать или устранять различные метаболические реакции Такие модификации включают введение подходящих заместителей в ароматические кольцевые структуры, таких как, в качестве примера только, галогены, дейтерий и тому подобное. В одном аспекте соединения-ингибиторы HDAC, описанных в настоящем документе, являются дейтерированными на участках, подверженных метаболическим реакциям.
Соединения, описанные в настоящем документе, включают меченные изотопами соединения, которые идентичны соединениям, указанным в различных формулах и структурах, представленных в настоящем документе, за исключением того, что один или более атом заменен атомом, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа, характерного для природной формы соединения. Примеры изотопов, которые могут быть включены в соединения по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фтора и хлора, такие как, например, 2H, 3H, 13C, 14C, 15N, 17O, 18O, 35S, 18F, 36Cl, соответственно. Определенные меченные изотопами соединения, описанные в настоящем документе, например соединения, в которые введены радиоактивные изотопы, такие как 3H и 14C, применимы для анализов распределения лекарственных средств и/или субстрата в тканях. Кроме того, замена такими изотопами, как дейтерий, т.е. 2H, может обеспечивать некоторые терапевтические преимущества, обусловленные более высокой метаболической стабильностью, например, увеличением периода полураспада in vivo или снижением необходимой дозировки.
Другие соединения-ингибиторы HDAC для использования в фармацевтических композициях, фармакокинетических стратегиях, режимах дозирования, способах лечения и комбинированных терапиях, описанные в настоящем документе, включают соединения, имеющие структуру Формулы (1):
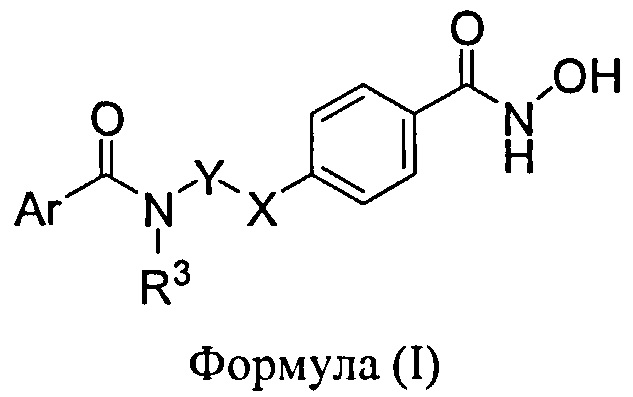
в которой
X представляет собой -O-, -NR2- или -S(O)n, где n равен 0, 1 или 2 и R2 представляет собой водород, -CH3, -CH2CH3;
Y представляет собой этилен, пропилен, 1-метилпропилен, 2-метилпропилен, -CH(C2H5)CH2-, -CH(CH(CH3)2)CH2- и -CH(CH3)CH2-;
R3 представляет собой водород, -CH3 или -CH2CH3;
Ar представляет собой фенил, нафтил, хинолинил, бензофуранил, бензотиенил, транс фенил CH=CH- или транс (бензофуран-2-ил)CH=CH-, где Ar является необязательно замещенным одним или двумя заместителями, независимо выбранными из хлора, фтора, трифторметила, метила, этила, метокси, этокси, метилендиокси, -ОН, 1-циклопропилпиперидин-4-илокси, 1-(2,2,2-трифторэтил)пиперидин-4-илокси, N,N-диметиламинометила, N,N-диэтиламинометила, 2-метоксиэтоксиметила, феноксиметила, 2-метоксиэтокси, 2-морфолин-4-илэтокси, пиридин-3-илметокси, 2-гидроксиэтокси, 2-N,N-диметиламиноэтокси, метоксиметила, 3-i-пропоксиметила, мофолин-4-илметила, 3-гидроксипропилоксиметила, 2-фторфеноксиметила, 3-фторфеноксиметила, 4-фторфеноксиметила, 3-метоксипропилоксиметила, пиридин-4-илоксиметила, 2,4,6-трифторфеноксиметила, 2-оксопиридин-1-илметила, 2,2,2-трифторэтоксиметила, 4-имидазол-1-илфеноксиметила, 4-[1.2.4-триазин-1-ил-феноксиметила, 2-фенилэтила, пирролидин-1-илметила, пиперидин-1-илметила, 4-трифторметилпиперидин-1-илметила, 4-метилпиперазин-1-илметила, 3,3,3-трифторпропилоксиметила, 4-фторфенилтиометила, 4-фторфенилсульфинилметила, 4-фторфенилсульфонилметила, пиридин-3-илметилоксиметила, тетрагидрониран-4-илокси, 2,2,2-трифторэтилокси, 2-пирролидин-1-илэтилокси, пиперидин-4-илокси, N-метил-N-бензиламинометила, N-метил-N-2-фенилэтиламинометила, 3-гидрохсипроиилтиометила, 3-гидроксипропилсульфинилметила, 3-гидроксипропилсульфонил-метила, N-метил-N-2-индол-3-илэтиламинометила, 2-(4-трифторметилфенил)этила, 2-(3-трифторметоксифенил)этила, N-гидроксиаминокарбонил-метиламинометила или 3-(2-карбоксиэтиламино-метила); или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления Ar представляет собой бензофуран-2-ил и является монозамещенным в 3-положении бензофуран-2-ильного кольца N,N-диметиламинометилом, N,N-диэтиламинометилом, 2-фторфеноксиметилом, 3-фторфеноксиметилом, 4-фторфеноксиметилом, гидроксил-4-илоксиметилом, 2,4,6-трифторфенокси-метилом, 2-оксопиридин-1-илметилом, 2,2,2-трифторэтокси-метилом, 4-имидазол-1-илфенокси-метилом, 4-[1.2.4-триазин-1-ил-феноксиметилом, 2-фенилэтилом, 3-гидроксипропилоксиметилом, 2-метоксиэтилоксиметилом, пирролидин-1-илметилом, пиперидин-1-илметилом, 4-трифторметилпиперидин-1-илметилом, 4-метилпиперазин-1-илметилом, 3,3,3-трифторпропилоксиметилом, 4-фторфенилтиометилом, 4-фторфенилсульфинилметилом, 4-фторфенилсульфонилметилом, 2-(3-трифторметоксифенилэтилом), N-метил-N-бензиламинометилом, N-метил-N-2-фенилэтиламинометилом, 3-гидроксипропил-тиометилом, 3-гидроксипропилсульфинил-метилом, 3-гидроксипропил-сульфонилметилом, N-метил-N-2-индол-3-илэтиламинометилом, 2-(4-трифторметилфенил)этилом, N-гидроксиаминокарбонил-метиламинометилом или 2-карбоксиэтиламинометилом.
В некоторых вариантах осуществления Ar представляет собой бензофуран-2-ил и является монозамещенным в 3-положении бензофуран-2-ильного кольца N,N-диметиламинометилом, N,N-диэтиламинометилом, 2-метоксиэтоксиметилом, метоксиметилом, 3-i-пропоксиметилом, морфолин-4-илметилом, 3-гидроксипропилоксиметилом, 3-метоксипропилоксиметилом, пирролидин-1-илметилом или пиперидин-1-илметилом.
В некоторых вариантах осуществления Ar представляет собой бензофуран-2-ил и является замещенным в 5-положении бензофуран-2-ильного кольца 1-циклопропилпиперидин-4-илокси, пиперидин-4-илокси, тетрагидропиран-4-илокси, 2,2,2-трифторэтокси, 2-пирролидин-1-илэтилокси или 1-(2,2,2-трифторэтил)пиперидин-4-илокси.
В некоторых вариантах осуществления Ar представляет собой транс фенил CH=CH-, где фенил необязательно замещен одним или двумя заместителями, независимо выбранными из метила, этила, метокси, этокси, метилендиокси или -ОН. В отдельных вариантах осуществления Ar представляет собой транс фенил CH=CH-.
В некоторых вариантах осуществления Ar представляет собой нафтил, при этом нафтил необязательно замещен одним или двумя заместителями.
В некоторых вариантах осуществления Ar представляет собой хинолинил, при этом хинолинил необязательно замещен одним или двумя заместителями.
В некоторых вариантах осуществления Ar представляет собой хинолинил, при этом хинолинил необязательно замещен одним или двумя заместителями, независимо выбранными из хлора, фтора, трифторметила, метила, этила, метокси, этокси, метилендиокси, -ОН, 2-метоксиэтокси, 2-гидроксиэтокси, метоксиметила, 3-i-пропоксиметила, 3-гидроксипропилоксиметила, 3-метоксипропилоксиметила или 3,3,3-трифторпропилоксиметила.
В некоторых вариантах осуществления Х представляет собой -О- и R3 представляет собой водород.
В некоторых вариантах осуществления Х представляет собой -S(O)n и R3 представляет собой водород.
В некоторых вариантах осуществления Y представляет собой этилен. В отдельных вариантах осуществления Y представляет собой этилен или -CH(C2H5)CH2-. В отдельных вариантах осуществления Y представляет собой -CH(C2H5)CH2-.
В некоторых вариантах осуществления Х представляет собой -O-; R3 представляет собой водород; и Y представляет собой этилен или -CH(C2H5)CH2-.
Еще другие соединения-ингибиторы HDAC, которые предполагаются для применения в фармацевтических композициях, фармакокинетических стратегиях, режимах дозирования, способах лечения и комбинированных терапиях, включают соединения, имеющие структуру Формулы (II):
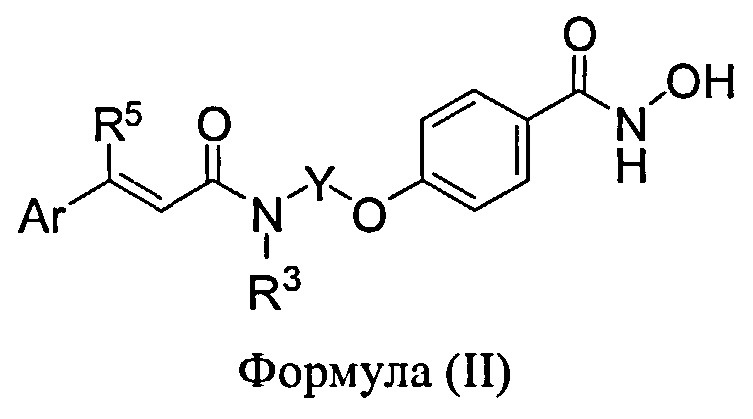
в которой
Х представляет собой -O-, -NR2- или -S(O)n, где n равен 0, 1 или 2 и R2 представляет собой водород, -CH3, -CH2CH3;
Y представляет собой этилен, пропилен, 1-метилнропилен, 2-метилпропилен, -CH(C2H5)CH2-, -CH(CH(CH3)2)CH2- и -CH(CH3)CH2-;
R3 представляет собой водород, -CH3 или -CH2CH3;
Ar представляет собой фенил, нафтил, хинолинил, бензофуранил или бензотиенил, при этом Ar необязательно замещен одним или двумя заместителями, независимо выбранными из хлора, фтора, трифторметила, метила, этила, метокси, этокси, метилендиокси, -ОН;
R5 представляет собой трифторметил, метил, этил, N,N-диметиламинометил, N-диэтиламинометил, 2-метоксиэтоксиметил, феноксиметил, метоксиметил, 3-i-пропоксиметил, морфолин-4-илметил, 3-гидроксипропилоксиметил, 2-фторфеноксиметил, 3-фторфеноксиметил, 4-фторфенокси-метил, 3-метоксипропилоксиметил, пиридин-4-илоксиметил, 2,4,6-трифторфеноксиметил, 2-оксопиридин-1-илметил, 2,2,2-трифторэтоксиметил, 4-имидазол-1-илфеноксиметил, 2-фенилэтил, пирролидин-1-илметил, пиперидин-1-илметил, 3-трифторметилпиперидин-1-илметил, 4-метилпиперазин-1-илметил, 3,3,3-трифторпропилоксиметил, 4-фторфенилтиометил, 4-фторфенилсульфинилметил, 4-фторфенилсульфонилметил, пиридин-3-илметилоксиметил, N-метил-N-бензиламинометил, N-метил-N-2-фенилэтиламинометил, 3-гидроксипропилтиометил, 3-гидроксипропил-сульфинилметил, 3-гидроксипропилсульфонил-метил, N-метил-N-2-индол-3-илэтиламинометил, 2-(4-трифторметилфенил)этил, 2-(3-трифторметоксифенил)этил, N-гидроксиаминокарбонил-метиламинометил или 3-(2-карбоксиэтиламино-метил); или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления Ar представляет собой бензофуранил.
В некоторых вариантах осуществления R5 представляет собой N,N-диметиламинометил, N-диэтиламинометил, пирролидин-1-илметил или пиперидин-1-илметил.
В некоторых вариантах осуществления ингибитор HDAC выбран из: N-гидрокси-4-[2-(4-метоксихинолин-2-илкарбониламино)этокси]бензамида; N-гидрокси-4-[2S-(транс-циннамоиламино)бутокси]бензамида; N-гидрокси-4-[2R-(транс-циннамоиламино)бутокси]бензамида; N-гидрокси-4-{2-[4-(2-метоксиэтокси)хинолин-2-илкарбониламино]этокси}бензамида; N-гидрокси-4-[2S-(бензотиофен-2-илкарбониламино)бутокси]-бензамида; N-гидрокси-4-{2S-[бунзофуран-2-илкарбониламино]бутокси}бензамида; N-гидрокси-4-{2-[3-(метоксиметил)бензофуран-2-илкарбониламино]этокси}бензамида; N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}бензамида; N-гидрокси-4-{2-[3-(i-пропоксиметил)бензофуран-2-илкарбониламино]этокси}бензамида; N-гидрокси-4-{2-[3-(3-гидроксипропоксиметил)бензофуран-2-илкарбониламино]этокси}-бензамида; N-гидрокси-4-{2-[3-(2-метоксиэтилоксиметил)бензофуран-2-илкарбониламино]этокси}-бензамида; N-гидрокси-4-{2-[3-(пирролидин-1-илметил)бензофуран-2-илкарбониламино]этокси}-бензамида; N-гидрокси-4-{2-[3-(пиперидин-1-илметил)бензофуран-2-илкарбониламино]этокси}-бензамида; N-гидрокси-4-{2-[3-(4-метилпиперазин-1-илметил)бензофуран-2-илкарбониламино]-этокси}бензамида; N-гидрокси-4-{2-[5-(тетрагидропиран-4-илокси)бензофуран-2-илкарбониламино]этокси}-бензамида; N-гидрокси-4-{2-[5-(2-пирролидин-1-илэтокси)бензофуран-2-илкарбониламино]этокси}-бензамида; N-гидрокси-4-{2S-[5-(2-пирролидин-1-илэтилокси)бензофуран-2-илкарбониламино]бутокси}-бензамида; N-гидрокси-4-{2-[5-(2-пирролидин-1-илэтилокси)бунзофуран-2-илкарбониламино]-1R-метил-этокси}бензамида; и N-гидрокси-4-{2-[(3-(бензофуран-2-ил)-4-(диметиламино)-бут-2-еноил)амино]-этокси}бензамида; или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления ингибитор HDAC выбран из ингибиторов HDAC, раскрытых в WO 2004/092115 или WO 2005/097770, обе из которых включены в настоящий документ путем отсылки.
Формы и фазы
Ингибиторы HDAC (напр., Соединение 1), в том числе их фармацевтически приемлемые соли и фармацевтически приемлемые сольваты, представлены в различных формах, включая, но без ограничения, аморфную фазу, частично кристаллические формы, кристаллические формы, измельченные формы и формы наночастиц. Кристаллические формы известны как полиморфы. Полиморфы включают различные конфигурации укладки кристаллов одного и того же элементного состава соединения. Такие конфигурации могут существенно влиять на физико-химические свойства, параметры технологии изготовления и обработки, а также срок годности или стабильность активного вещества и вспомогательных веществ. Полиморфы обычно характеризуются различными картинами дифракции рентгеновских лучей, инфракрасными спектрами, температурами плавления, плотностью, твердостью, формой кристаллов, оптическими и электрическими свойствами, стабильностью и растворимостью. Различные факторы, такие как растворитель для перекристаллизации, скорость кристаллизации и температура хранения, могут привести к преобладанию одной кристаллической формы. В одном аспекте кристаллическая форма ингибитора HDAC (напр., Соединения 1) используется в фармацевтических композициях, раскрытых в настоящем документе. В одном аспекте кристаллическая форма HCl соли Соединения 1 используется в фармацевтической композиции, раскрытой в настоящем документе. В одном аспекте аморфное Соединение 1 используется в фармацевтических композициях, раскрытых в настоящем документе. В одном аспекте аморфная HCl соль Соединения 1 используется в фармацевтической композиции, раскрытой в настоящем документе.
Терминология
«Биодоступность» относится к процентной доле массы введенного ингибитора HDAC (напр., Соединения 1) или фармацевтически приемлемой соли, доставляемой в общий кровоток исследуемого животного или человека. Общую дозу (AUC(0-∞)) лекарственного средства при внутривенном введении обычно определяют как 100% биодоступность (F%). «Биодоступность при пероральном введении» относится к степени, в которой ингибитор HDAC (напр., Соединение 1) или фармацевтически приемлемая соль всасывается в общий кровоток при пероральном применении фармацевтической композиции, по сравнению с внутривенной инъекцией.
«Концентрация в плазме крови» относится к концентрации ингибитора HDAC (напр., Соединения 1) или фармацевтически приемлемой соли в плазменном компоненте крови субъекта. Следует понимать, что концентрация в плазме ингибитора HDAC (напр., Соединения 1) или фармацевтически приемлемой соли может значительно варьироваться у субъектов вследствие изменчивости метаболизма и/или взаимодействий с другими терапевтическими агентами. В одном аспекте концентрация в плазме ингибитора HDAC (напр., Соединения 1) или фармацевтически приемлемой соли варьируется от субъекта к субъекту. Сходным образом, такие величины, как максимальная концентрация в плазме (Cmax) или время, необходимое для достижения максимальной концентрации в плазме (Tmax), или общая площадь под кривой изменения концентрации в плазме в зависимости от времени (AUC(0-∞)), варьируются от субъекта к субъекту. Вследствие этой изменчивости, в одном варианте осуществления, количество, необходимое для получения «терапевтически эффективного количества» ингибитора HDAC (напр., Соединения 1) или фармацевтически приемлемой соли, варьируется от субъекта к субъекту.
«Эффективные концентрации в плазме крови» ингибитора HDAC относятся к количествам ингибитора HDAC в плазме крови, которые приводят к уровням воздействия, которые являются эффективными для лечения рака.
«Абсорбция лекарственного средства» или «абсорбция», как правило, относится к процессу перемещения лекарственного средства из участка введения лекарственного средства через барьер в кровеносный сосуд или участок действия, например, лекарственное средство перемещается из желудочно-кишечного тракта в портальную вену или лимфатическую систему.
«Измеряемая концентрация в сыворотке крови» или «измеряемая концентрация в плазме крови» описывает концентрацию в сыворотке крови или плазме крови, обычно измеряемую в мг, мкг или нг терапевтического агента на мл, дл или л сыворотки крови, абсорбированного в общий кровоток после введения. Используемые в настоящем документе измеряемые концентрации в плазме обычно измеряют в нг/мл или мкг/мл.
«Фармакодинамика» относится к факторам, которые определяют биологический ответ, наблюдаемый в отношении концентрации лекарственного средства в участке действия.
«Фармакокинетика» относится к факторам, которые определяют достижение и поддержание надлежащей концентрации лекарственного средства в участке действия.
Фармацевтические композиции
В одном варианте осуществления пероральные фармацевтические композиции формулированы обычным способом с использованием одного или более физиологически приемлемых носителей (т.е. неактивных ингредиентов), включая вспомогательные вещества и добавки, которые облегчают переработку активных соединений в препараты, которые используются фармацевтически. Пригодные методики, носители и вспомогательные вещества включают такие, которые описаны, например, в Remington: The Science and Practice of Pharmacy, Nineteenth Ed (Easton, Pa.: Mack Publishing Company, 1995); Hoover, John E., Remington’s Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania 1975; Liberman, H.A. and Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; и Pharmaceutical Dosage Forms and Drug Delivery Systems, Seventh Ed. (Lippincott Williams & Wilkins 1999), полное содержание которых включено в настоящий документ путем отсылки.
Термин «фармацевтическая композиция» относится к смеси активного агента (или ингредиента) с другими неактивными химическими компонентами, такими как носители, стабилизаторы, разбавители, диспергирующие вещества, суспендирующие вещества, загустители, покрытия и/или вспомогательные вещества. Фармацевтическая композиция облегчает введение соединения в организм человека. В одном аспекте активный агент представляет собой ингибитор HDAC (напр., Соединение 1). В одном аспекте активный агент представляет собой HCl соль Соединения 1.
«Контролируемое высвобождение», используемое в настоящем документе, относится к любому профилю высвобождения, который не полностью представляет собой немедленное высвобождение.
Для перорального введения ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль, такую как HCl соль, формулируют путем объединения активного соединения с фармацевтически приемлемыми носителями или вспомогательными веществами. Такие носители позволяют формулировать ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль в виде таблеток, порошков, пилюль, капсул и тому подобного, для перорального приема пациентом, подлежащим лечению.
Фармацевтические композиции будут включать, по меньшей мере, один фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество, и ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль в качестве активного ингредиента.
В других вариантах осуществления фармацевтические композиции включают, по меньшей мере, один фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество, и ингибитор HDAC или его фармацевтически приемлемую соль в комбинации с бендамустином.
Пероральные твердые дозированные лекарственные формы, описанные в настоящем документе, включают частицы ингибитора HDAC (напр., Соединения 1) или его фармацевтически приемлемой соли, находящиеся в кристаллической форме, аморфной фазе, полукристаллической форме, полуаморфной фазе, или их смесей.
В одном аспекте фармацевтические композиции, описанные в настоящем документе, представлены в форме пероральной твердой дозированной лекарственной формы. Пероральные твердые дозированные лекарственные формы включают: таблетки, пилюли, капсулы, порошки, мини-таблетки, частицы, шарики, пеллеты и тому подобное.
Фармацевтические композиции, описанные здесь, включают ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль, и одно или более из следующего: (а) связывающие вещества; (b) покрытия; (с) дезинтегрирующие агенты; (d) наполнители (разбавители); (е) лубриканты; (f) глиданты (усилители скольжения); (g) добавки для прессования; (h) красители; (i) подсластители; (j) консерванты; (k) суспендирующие/диспергирующие агенты; (l) пленкообразователи/покрытия; (m) улучшающие вкус и запах вещества (корригенты); (n) печатные краски; (о) желирующие вещества; (р) второй терапевтически активный агент.
В одном аспекте фармацевтические композиции, описанные здесь, дополнительно к ингибитору HDAC (напр., Соединению 1) или его фармацевтически приемлемой соли включают одно или более из следующего: (а) стеарат магния; (b) лактозу; (с) микрокристаллическую целлюлозу; (d) силикатированную микрокристаллическую целлюлозу; (е) маннит; (f) крахмал (кукурузный); (g) диоксид кремния; (h) доксид титана; (i) стеариновую кислоту; (j) гликолят крахмала натрия; (k) желатин; (l) тальк; (m) сахарозу; (n) аспартам; (о) стеарат кальция; (р) повидон; (q) прежелатинизированный крахмал; (r) гидроксипропилметилцеллюлозу; (s) OPA продукты (покрытия & чернила); (t) кроскармеллозу; (u) гидроксипропилцеллюлозу; (v) этилцеллюлозу; (w) фосфат кальция (двухосновный); (x) кросповидон; (y) шеллак (и глазурь); (z) карбонат натрия.
Кроме того, в настоящем документе обеспечены фармацевтические композиции, содержащие активный ингредиент или его фармацевтически приемлемую соль, сольват или пролекарство в фармацевтически приемлемом наполнителе, носителе, разбавителе или вспомогательном веществе, или их смеси, и одно или более контролирующих высвобождение вспомогательных веществ, как описано в настоящем документе. Пригодные наполнители для лекарственной формы с модифицированным высвобождением включают, но без ограничения, гидрофильные или гидрофобные матричные устройства, растворимые в воде покрытия разделяющего слоя, энтеросолюбильные покрытия, осмотические устройства, устройства, состоящие из множества частиц, и их комбинации. Фармацевтические композиции могут также содержать не контролирующие высвобождение вспомогательные вещества.
В настоящем документе обеспечены фармацевтические композиции в дозированных лекарственных формах с пленочным покрытием, которые содержат комбинацию активного ингредиента или его фармацевтически приемлемой соли, сольвата или пролекарства; и одно или более вспомогательных веществ, используемых в производстве таблеток, для формирования ядра таблетки обычными способами изготовления таблеток и последующего покрытия ядра. Ядра таблеток могут быть изготовлены с использованием обычных методов грануляции, например, влажной или сухой грануляции, необязательно с измельчением гранул, и последующим прессованием и нанесением покрытия. Способы грануляции описаны, например, в Voigt, страницы 156-69.
Пригодные вспомогательные вещества для изготовления гранул представляют собой, например, порошкообразные наполнители, необязательно обладающие свойствами улучшать текучесть, например тальк, диоксид кремния, например синтетическая аморфная безводная кремниевая кислота типа Syloid® (фирма Grace), например SYLOID 244 FP, микрокристаллическая целлюлоза, например типа Avicel® (фирма FMC Corp.), например типов AVICEL PH101, 102, 105, RC581 или RC 591, типа Emcocel® (фирма Mendell Corp.) или типа Elcema® (фирма Degussa); углеводы, такие как сахара, сахарные спирты, крахмалы или производные крахмала, например лактоза, декстроза, сахароза, глюкоза, сорбит, маннит, ксилит, картофельный крахмал, маисовый крахмал, рисовый крахмал, пшеничный крахмал или амилопектин, трикальцийфосфат, двузамещенный кальция фосфат или трисиликат магния; связывающие вещества, такие как желатин, трагакант, агар, альгиновая кислота, простые эфиры целлюлозы, например метилцеллюлоза, карбоксиметилцеллюлоза или гидроксипропилметилцеллюлоза, полиэтиленгликоли или гомополимеры этиленоксида, в частности имеющие степень полимеризации приблизительно от 2.0×103 до 1.0×105 и молекулярную массу приблизительно от 1.0×105 до 5.0×106, например, вспомогательные вещества, известные под торговой маркой Polyox® (фирма Union Carbide), поливинилпирролидон или повидоны, в частности имеющие среднюю молекулярную массу приблизительно 1000 и степень полимеризации приблизительно от 500 до 2500, а также агар или желатин; поверхностно-активные вещества, например анионогенные поверхностно-активные вещества типа алкилсульфатов, например, н-додецилсульфат, н-тетрадецилсульфат, н-гексадецилсульфат или н-октадецилсульфат натрия, калия или магния, или типа алкилэфирсульфата, например н-додецилоксиэтилсульфат, н-тетрадецилоксиэтилсульфат, н-гексадецилоксиэтилсульфат или н-октадецилоксиэтилсульфат натрия, калия или магния, или типа алкилсульфонатов, например н-додекансульфонат, н-тетрадекансульыонат, н-гексадекансульфонат или н-октадекансульфонат натрия, калия или магния, или неионогенные поверхностно-активные вещества типа эфира многоатомного спирта и жирной кислоты, такие как сорбитан монолаурат, моноолеат, моностеарат или монопальмитат, сорбитан тристеарат или триолеат, полиоксиэтиленовые аддукты эфиров многоатомного спирта и жирной кислоты, такие как полиоксиэтиленсорбитан монолаурат, моноолеат, моностеарат, монопальмитат, тристеарат или триолеат, полиэтиленгликолевые эфиры жирной кислоты, такие как полиоксиэтилстеарат, стеарат полиэтиленгликоля 400, стеарат полиэтиленгликоля 2000, в частности блок-полимеры этиленоксида/пропиленоксида типа Plronics® (фирма BWC) или Synperonic® (фирма ICI).
Кроме того, в настоящем документе обеспечены фармацевтические композиции в дозированных лекарственных формах с энтеросолюбильным покрытием, которые содержат комбинацию активного ингредиента или его фармацевтически приемлемой соли, сольвата или пролекарства, и одно или несколько контролирующих высвобождение вспомогательных веществ, применяющихся в дозированной лекарственной форме с энтеросолюбильным покрытием. Фармацевтические композиции могут также содержать не контролирующие высвобождение вспомогательные вещества.
Дополнительно обеспечены фармацевтические композиции в дозированной лекарственной форме, которая содержит компонент с мгновенным высвобождением и, по меньшей мере, один компонент с отсроченным высвобождением, и может обеспечить прерывистое высвобождение соединения в виде, по меньшей мере, двух последовательных импульсов с интервалом от 0.5 часов до 8 часов. Фармацевтические композиции содержат комбинацию активного ингредиента и одно или несколько контролирующих высвобождение и не контролирующих высвобождение вспомогательных веществ, таких как вспомогательные вещества, пригодные для разрываемой полупроницаемой мембраны и в качестве набухающих веществ.
К тому же, в настоящем документе обеспечены фармацевтические композиции в дозированной лекарственной форме для перорального введения субъекту, которая содержит комбинацию активного ингредиента или его фармацевтически приемлемой соли, сольвата или пролекарства; и один или более фармацевтически приемлемых вспомогательных веществ или носителей, заключенную в промежуточный реакционноспособный слой, содержащий устойчивый к действию желудочного сока полимерный слоистый материал, частично нейтрализованный щелочью и имеющий катионнообменную емкость, и устойчивый к действию желудочного сока внешний слей.
В настоящем документе обеспечены фармацевтические композиции, которые содержат активный ингредиент в форме гранул с энтеросолюбильным покрытием, в виде капсул с отсроченным высвобождением для перорального введения.
Фармацевтические композиции, обеспеченные в настоящем документе, могут быть обеспечены в стандартных лекарственных формах или лекарственных формах, содержащих несколько доз. Стандартные лекарственные формы, используемые в настоящем документе, относятся к физически дискретным единицам, пригодным для введения человеческим и животным субъектам, и упакованы по отдельности, как известно в данной области. Каждая разовая доза содержит предварительно определенное количество активного ингредиента(ов), достаточное для получения желаемого терапевтического эффекта, в сочетании с необходимыми фармацевтическими носителями или вспомогательными веществами. Примеры стандартных лекарственных форм включают индивидуально упакованные таблетки и капсулы. Стандартные лекарственные формы можно вводить по частям или несколько. Лекарственная форма, содержащая несколько доз, представляет собой совокупность идентичных стандартных лекарственных форм, упакованных в один контейнер и предназначенных для введения в виде отдельных стандартных лекарственных форм. Примеры лекарственных форм, содержащих несколько доз, включают бутыли с таблетками или капсулами.
Фармацевтические лекарственные формы могут быть формулированы различными способами и могут обеспечить разнообразные профили высвобождения лекарственного средства, в том числе немедленное высвобождение, замедленное высвобождение и отсроченное высвобождение. В некоторых случаях может быть желательным предотвратить высвобождение лекарственного средства после введения лекарственного средства до тех пор, пока не пройдет некоторое количество времени (т.е. регулируемое по времени высвобождение), обеспечить в основном непрерывное высвобождение в течение предварительно установленного периода времени (т.е. замедленное высвобождение) или обеспечить высвобождение сразу же после введения лекарственного средства (т.е. немедленное высвобождение).
Пероральные лекарственные формы, которые включают ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль, представлены в форме таблеток, капсул, пилюль, пиллет, шариков, гранул, порошков. Капсулы содержат смеси активного соединения(й) с инертными наполнителями и/или разбавителями, такими как фармацевтически приемлемые крахмалы (напр., кукурузный, картофельный или маниоковый крахмал), сахара, искусственные подсластители, порошкообразные целлюлозы, такие как кристаллическая и микрокристаллическая целлюлозы, мука, желатины, камеди и т.п. Лекарственные формы в виде таблеток изготовлены обычными методами прессования, влажной грануляции или сухой грануляции и с использованием фармацевтически приемлемых разбавителей, связывающих веществ, лубрикантов, дезинтегрирующих агентов, модифицирующих поверхность агентов (включая поверхностно-активные вещества), суспендирующих или стабилизирующих агентов, включая, но без ограничения, стеарат магния, стеариновую кислоту, тальк, лаурилсульфат натрия, микрокристаллическую целлюлозу, кальций-карбоксиметилцеллюлозу, поливинилпирролидон, желатин, альгиновую кислоту, аравийскую камедь, ксантановую камедь, цитрат натрия, комплексные силикаты, карбонат кальция, глицин, декстрин, сахарозу, сорбит, дикальцийфосфат, сульфат кальция, лактозу, каолин, маннит, хлорид натрия, тальк, сухие крахмы и сахарную пудру. В некоторых вариантах осуществления представлены модифицирующие поверхность агенты, которые включают неионогенные и анионогенные модифицирующие поверхность агенты. Например, модифицирующие поверхность агенты включают, но без ограничения, полоксамер 188, хлорид бензалкония, стеарат кальция, цетостеариловый спирт, эмульгирующий воск цетомакрогол, сложные эфиры сорбита, коллоидный диоксид кремния, фосфаты, додецилсульфат натрия, алюмосиликат магния и триэтаноламин.
В одном аспекте пероральные лекарственные формы, описанные в настоящем документе, используют стандартные лекарственные формы с задержанным или отсроченным высвобождением для изменения абсорбции активного соединения(й).
Связывающие вещества или гранулирующие агенты придают когезионную способность таблетке для обеспечения интактного состояния таблетки после спрессовывания. Пригодные связывающие вещества или гранулирующие агенты включают, но без ограничения, крахмалы, такие как кукурузный крахмал, картофельный крахмал и прежелатинизированный крахмал (напр., STARCH 1500); желатин; сахара, такие как сахароза, глюкоза, декстроза, меласса и лактоза; природные и синтетические смолы, такие как аравийская камедь, альгиновая кислота, альгинаты, экстракты ирландского мха, Panwar камедь, гхатти камедь, экстракт слизи шелухи семян подорожника, карбоксиметилцеллюлоза, метил целлюлоза, поливинилпирролидон (PVP), вигум, арабиногалактаны лиственницы, порошок трагаканта и гуаровая камедь; целлюлозы, такие как этилцеллюлоза, ацетат целлюлозы, кальций-карбоксиметилцеллюлоза, натрий-карбоксиметилцеллюлоза, метил целлюлоза, гидроксиэтилцеллюлоза (НЕС), гидроксипропилцеллюлоза (НРС), гидроксипропилметилцеллюлоза (НРМС); микрокристаллические целлюлозы, такие как AVICEL®-PH-101, AVICEL®-PH-103, AVICEL® RC-581, AVICEL®-PH-105 (FMC Corp., Marcus Hook, PA); и их смеси. Пригодные наполнители включают, но без ограничения, тальк, карбонат кальция, микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстраты, каолин, маннит, кремниевую кислоту, сорбит, крахмал, прежелатинизированный крахмал и их смеси. Содержание связывающих веществ составляют примерно от 50% до 99% по массе в фармацевтических композициях, обеспеченных в настоящем документе.
Пригодные разбавители включают, но без ограничения, дикальцийфосфат, сульфат кальция, лактозу, сорбит, сахарозу, инозитол, целлюлозу, каолин, маннит, хлорид натрия, сухой крахмал и сахарную пудру.
Пригодные дезинтегрирующие агенты включают, но без ограничения, агар; бентонит; целлюлозы, такие как метилцеллюлоза и карбоксиметилцеллюлоза; продукты леса; натуральную губку; катионообменные смолы; альгиновую кислоту; камеди, такие как гуаровая камедь и вигум HV; цитрусовую пульпу; сшитые целлюлозы, такие как кроскармеллоза; сшитые полимеры, такие как кросповидон; сшитые крахмалы; карбонат кальция; микрокристаллическую целлюлозу, такую как натрия гликолят крахмала; полиакрилин калия; крахмалы, такие как кукурузный крахмал, картофельный крахмал, тапиоковый крахмал и прежелатинизированный крахмал; глины; альгины; и их смеси. Количество дезинтегрирующего агента в фармацевтических композициях, обеспеченных в настоящем документе, изменяется в зависимости от типа лекарственной формы и легко определяется специалистами в данной области. В одном аспекте фармацевтические композиции, обеспеченные в настоящем документе, могут содержать примерно от 0.5 до 15%, или примерно от 1 до 5% по массе дезинтегрирующего агента.
Пригодные лубриканты включают, но без ограничения, стеарат кальция; стеарат магния; минеральное масло; легкое минеральное масло; глицерин; сорбит; маннит; гликоли, такие как глицерина бегенат и полиэтиленгликоль (PEG); стеариновую кислоту; лаурилсульфат натрия; тальк; гидрогенизированное растительное масло, в том числе арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; стеарат цинка; этилолеат; этиллауреат; агар; крахмал; ликоподий; диоксид кремния или силикагели, такие как AEROSIL® 200 (W.R. Grace Co., Baltimore, MD) и CAB-O-SIL® (Cabot Co. of Boston, MA); и их смеси. В одном аспекте фармацевтические композиции, обеспеченные в настоящем документе, содержат примерно от 0.1 до 5% но массе лубриканта.
Пригодные вещества, способствующие скольжению, включают коллоидный диоксид кремния, CAB-O-SIL® (Cabot Co. of Boston, MA) и безасбестовый тальк. Красители включают любые из одобренных, сертифицированных, водорастворимых красителей для пищевой и химической промышленности (FD&C) и водонерастворимых красителей для пищевой и химической промышленности (FD&C), суспендированных в гидроокиси алюминия, а также цветные лаки и их смеси. Цветной лак представляет собой комбинацию, полученную путем адсорбции водорастворимого красителя на гидроокиси тяжелого металла, приводящей к образованию нерастворимой формы красителя.
Следует понимать, что многие носители и вспомогательные вещества могут выполнять несколько функций, даже в одной и той же лекарственной форме.
В следующих вариантах осуществления фармацевтические композиции, обеспеченные здесь, могут быть представлены в виде спрессованных таблеток, тритурационных таблеток, быстрорастворимых таблеток, многократно прессованных таблеток или таблеток с энтеросолюбильным покрытием, таблеток с сахарным покрытием или таблеток с пленочным покрытием.
Энтеросолюбильные покрытия представляют собой покрытия, которые противостоят действию желудочной кислоты, но растворяются или разрушаются в кишечнике.
В одном аспекте пероральная твердая дозированная лекарственная форма, раскрытая в настоящем документе, включает энтеросолюбильное покрытие(я). Энтеросолюбильные покрытия включают одно или более из следующего: ацетат-фталат целлюлозы; сополимеры метилметакрилата и метакриловой кислоты; ацетат сукцинат целлюлозы; фталат-гидроксипропилметилцеллюлозы; ацетат-сукцинат гидроксипропил-метилцеллюлозы (гипромеллозы ацетата сукцинат); фталат поливинилацетата (PVAP); сополимеры метилметакрилата и метакриловой кислоты; сополимеры метакриловой кислоты; ацетат целлюлозы (и его сукцинатный и фталатный вариант); сополимеры стирола и малеиновой кислоты; сополимер полиметакриловой кислоты и акриловой кислоты; гидроксиэтил этилцеллюлозы фталат; ацетат-сукцинат гидроксипропилметилцеллюлозы; ацетат тстрагидрофталат целлюлозы; акриловая смола; шеллак.
Энтеросолюбильное покрытие представляет собой покрытие, нанесенное на таблетку, пилюлю, капсулу, пеллет, шарик, гранулу, частицу и т.д. таким образом, что оно не растворяется до тех пор, пока не достигнет тонкого кишечника.
Таблетки с сахарным покрытием представляют собой спрессованные таблетки, окруженные сахарным покрытием, которое может быть полезным для маскирования неприятных вкусов и запахов, а также для защиты таблеток от окисления.
Таблетки с пленочным покрытием представляют собой спрессованные таблетки, которые покрыты тонким слоем или пленкой водорастворимого материала. Пленочные покрытия включают, но без ограничения, гидроксиэтилцеллюлозу, натрий-карбоксиметилцеллюлозу, полиэтиленгликоль 4000 и ацетат-фталат целлюлозы. Пленочные покрытия придают те же самые общие свойства, что и сахарное покрытие. Многократно прессованные таблетки представляют собой прессованные таблетки, изготовленные путем больше чем одного цикла прессования, включая многослойные таблетки, а также таблетки, покрытые путем прессования или сушки.
Лекарственные формы в виде таблеток могут быть изготовлены из активного ингредиента в порошкообразных, кристаллических или гранулированных формах, взятого отдельно или в сочетании с одним или более носителями или вспомогательными веществами, описанными в настоящем документе, включая связывающие вещества, дезинтегрирующие агенты, полимеры с контролируемым высвобождением, лубриканты, разбавители и/или красители. Ароматизаторы и подсластители являются особенно полезными при изготовлении жевательных таблеток и таблеток для рассасывания.
Фармацевтические композиции, обеспеченные в настоящем документе, могут быть представлены в виде мягких или твердых капсул, которые могут быть изготовлены из желатина, метилцеллюлозы, крахмала или альгината кальция. Твердая желатиновая капсула, также известная как капсула с сухим наполнителем (DFC), состоит из двух частей, одна из которых насаживается на другую, полностью закрывая, таким образом, активный ингредиент. Мягкая эластичная капсула (SEC) представляет собой мягкую, глобулярную оболочку, такую как желатиновая оболочка, которую пластифицируют путем добавления глицерина, сорбита или подобного полиола. Капсулы также могут иметь покрытие, известное специалистам в данной области, позволяющее модифицировать или замедлить растворение активного ингредиента.
Красители и вкусовые добавки могут быть использованы во всех указанных выше лекарственных формах.
Фармацевтические композиции, обеспеченные в настоящем документе, могут быть формулированы в виде дозированных лекарственных форм с немедленным или модифицированным высвобождением, включая формы с отсроченным, замедленным, импульсным, контролируемым, нацеленным и программируемым высвобождением.
Фармацевтические композиции, обеспеченные в настоящем документе, представлены в виде дозированных лекарственных форм с немедленным или модифицированным высвобождением, включая формы с отсроченным, замедленным, импульсным, контролируемым, нацеленным и программируемым высвобождением.
Контролируемое высвобождение
В одном аспекте фармацевтические композиции, обеспеченные в настоящем документе, представлены в виде дозированной лекарственной формы с контролируемым высвобождением. Используемый в настоящем документе термин «контролируемое высвобождение» относится к дозированной лекарственной форме, которая характеризуется другой скоростью или другим участком высвобождения активного ингредиента(ов), чем дозированная лекарственная форма с немедленным высвобождением при пероральном введении. Дозированные лекарственные формы с контролируемым высвобождением включают отсроченное, продленное, пролонгированное, замедленное, импульсное, модифицированное, таргетное, программируемое высвобождение. Фармацевтические композиции, входящие в состав дозированных лекарственных форм с контролируемым высвобождением, изготовлены с использованием ряда устройств и способов модифицированного высвобождения, известных специалистам в данной области, которые включают, но без ограничения, матриксные устройства контролируемого высвобождения, устройства с осмотическим контролем высвобождения, устройства контролируемого высвобождения, состоящие из множества частиц, ионообменные смолы, энтеросолюбильные покрытия, многослойные покрытия и их комбинации. Скорость высвобождения активного ингредиента(ов) также можно модифицировать путем варьирования размеров частиц.
Фармацевтические пероральные твердые дозированные лекарственные формы, в том числе лекарственные формы, описанные здесь, которые включают ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль, формулированы для обеспечения контролируемого высвобождения ингибитора HDAC (напр., Соединения 1) или его фармацевтически приемлемой соли.
В противоположность композициям с немедленным высвобождением, композиции с контролируемым высвобождением делают возможной доставку агента в организм человека в течение длительного периода времени в соответствии с заданным профилем. Такие скорости высвобождения могут обеспечить терапевтически эффективные уровни агента в течение длительного периода времени и, таким образом, обеспечить более длительный период фармакологического ответа. Такие более длительные периоды ответа обеспечивают много внутренних преимуществ, которые не достигаются с помощью соответствующих препаратов короткого действия с немедленным высвобождением. В одном аспекте композиции с контролируемым высвобождением ингибитора HDAC (напр., Соединения 1) или его фармацевтически приемлемой соли обеспечивают терапевтически эффективные уровни ингибитора HDAC (напр., Соединения 1) в течение длительного периода времени и, таким образом, обеспечивают более длительный период фармакологического ответа.
В некоторых вариантах осуществления твердые дозированные лекарственные формы, описанные здесь, могут быть формулированы в виде пероральных дозированных лекарственных форм с отсроченным высвобождением, покрытых энтеросолюбильной оболочкой, т.е. в виде пероральной дозированной лекарственной формы фармацевтической композиции, описанной здесь, которая использует энтеросолюбильное покрытие для достижения высвобождения в тонком кишечнике желудочно-кишечного тракта. Дозированная лекарственная форма с энтеросолюбильным покрытием представляет собой прессованную или формованную, или экструдированную таблетку/форму (покрытую или непокрытую), содержащую гранулы, порошок, пеллеты, шарики или частицы активного ингредиента и/или другие компоненты композиции, которые сами по себе являются покрытыми или непокрытыми. В одном аспекте пероральная дозированная лекарственная форма с энтеросолюбильным покрытием может представлять собой капсулу (покрытую или непокрытую), содержащую пеллеты, шарики или гранулы твердого носителя или композиции, которые сами по себе являются покрытыми или непокрытыми.
Используемый в настоящем документе термин «отсроченное высвобождение» относится к такой доставке, при которой высвобождение может быть осуществлено в некотором в большинстве случаев предсказуемом месте кишечника, дистальнее, чем оно могло бы быть осуществлено при отсутствии изменений, вызванных отсроченным высвобождением. В некоторых вариантах осуществления способом отсрочки высвобождения является покрытие. Любые покрытия должны наноситься с толщиной, достаточной для того, чтобы не все покрытие растворялось в желудочно-кишечных жидкостях при pH ниже около 5, но при этом растворялось при pH около 5 и выше. Предполагается, что любой анионный полимер, проявляющий pH-зависимый профиль растворимости, можно использовать в качестве энтеросолюбильного покрытия при практическом осуществлении настоящего изобретения для достижения доставки в нижний отдел желудочно-кишечного тракта. В некоторых вариантах осуществления полимеры, предназначенные для использования в настоящем изобретении, представляют собой анионные карбоксилсодержащие полимеры. В других вариантах осуществления полимеры и их совместимые смеси, а также некоторые из их свойств включают, но без ограничения, следующее:
Шеллак, также называемый как очищенный сырой шеллак. Это покрытие растворяется в среде при pH>7;
Акриловые полимеры. Свойства акриловых полимеров (в первую очередь их растворимость в биологических жидкостях) могут изменяться в зависимости от степени и типа замещения. Примеры пригодных акриловых полимеров включают сополимеры метакриловой кислоты и сопослимеры метакрилата аммония. Доступны серии Eudragit E, L, R, S, RL, RS и NE (Rohm Pharma) в виде солюбилизированных в органическом растворителе, водной дисперсии или сухих порошков. Серии Eudragit RL, NE и RS нерастворимы в желудочно-кишечном тракте, но являются проницаемыми и используются главным образом для доставки в толстую кишку. Серия Eudragit E растворяются в желудке. Серии Eudragit L, L-30D и S нерастворимы в желудке и растворяются в кишечнике;
Производные целлюлозы. Примерами пригодных производных целлюлозы являются: этилцеллюлоза; реакционные смеси неполных уксуснокислых эфиров целлюлозы и ангидрида фталевой кислоты. Свойства могут изменяться в зависимости от степени и типа замещения. Ацетат-фталат целлюлозы (CAP) растворяется при pH>6. Aquateric (FMC) является водной системой и представляет собой высушенный распылением САР-псевдолатекс с частицами <1 мкм. Другие компоненты в Aquateric могут включать плюроники (pluronics), разновидности Tween и ацетилированные моноглицериды. Другие пригодные производные целлюлозы включают: ацетат-тримеллитат целлюлозы (Eastman); метилцеллюлозу (Pharmacoat, Methocel); фталат гидроксипропилметилцеллюлозы (НРМСР); сукцинат гидроксипропилметилцеллюлозы (HPMCS); и ацетат-сукцинат гидроксипропилметилцеллюлозы (напр., AQOAT (Shin Etsu)). Свойства могут изменяться в зависимости от степени и типа замещения. Например, НРМСР, такой как марки HP-50, HP-55, HP-55S, HP-55F, является пригодным. Свойства могут изменяться в зависимости от степени и типа замещения. Например, пригодные марки ацетата сукцината гидроксипропилметилцеллюлозы включают, но без ограничения, AS-LG (LF), который растворяется при pH 5, AS-MG (MF), который растворяется при pH 5.5, и AS-HG (HF), который растворяется при более высоком pH. Эти полимеры предлагаются в виде гранул или тонкоизмельченных порошков для водных дисперсий;
Фталат поливинилацетата (PVAP). PVAP растворяется при pH>5 и является значительно менее проницаемым для водяного пара и желудочного сока.
В некоторых вариантах осуществления покрытие может содержать и, как правило, содержит пластификатор, и возможно другие вспомогательные вещества покрытия, такие как красители, тальк и/или стеарат магния, которые хорошо известны в данной области. Пригодные пластификаторы включают триэтилцитрат (Citroflex 2), триацетин (глицеринтриацетат), ацетилтриэтилцитрат (Citroflec A2), Carbowax 400 (полиэтиленгликоль 400), диэтилфталат, трибутилцитрат, ацетилированные моноглицериды, глицерин, сложные эфиры жирных кислот, пропиленгликоль и дибутилфталат. В частности, анионные карбоксилсодержащие акриловые полимеры обычно содержат 10-25% по массе пластификатора, главным образом, дибутилфталата, полиэтиленгликоля, триэтилцитрата и триацетина. Для нанесения покрытий используют обычные методы нанесения покрытия, такие как покрытие распылением или нанесение оболочки. Толщина покрытия должна быть достаточной для гарантии того, что пероральная лекарственная форма остается интактной до достижения желаемой области местной доставки в кишечнике.
Помимо пластификаторов в покрытия могут быть добавлены красители, средства для устранения клейкости, поверхностно-активные вещества, противовспенивающие агенты, лубриканты (напр., карнаубский воск или PEG) для солюбилизации или диспергирования материала покрытия, а также для улучшения свойств покрытия и покрытого продукта.
Особенно пригодным метакриловым сополимером является Eudragit L®, в особенности L-30D® и Eudragit 100-55®, изготовленные фирмой Rohm Pharma, Германия. В Eudragit L-30D® соотношение свободных карбоксильных групп к группам сложного эфира составляет приблизительно 1:1. Кроме того, известно, что сополимер нерастворим в желудочно-кишечных жидкостях, имеющих pH ниже 5.5, обычно 1.5-5.5, то есть значении pH, которое обычно присутствует в жидкости верхнего отдела желудочно-кишечного тракта, но легко растворяется или частично растворяется при pH выше 5.5, то есть значении pH, присутствующем в тонком кишечнике.
В некоторых вариантах осуществления материалы включают шеллак, акриловые полимеры, производные целлюлозы, поливинилацетатфталат и их смеси. В других вариантах осуществления материалы включают серии Eudragit® E, L, RL, RS, NE, L, L300, S, 100-55, ацетат-фталат целлюлозы, Aquateric, ацетат-тримеллитат целлюлозы, этилцеллюлозу, фталат гидроксипропилметилцеллюлозы, ацетат-сукцинат гидроксипропилметилцеллюлозы, поливинилацетатфталат и Cotteric.
Для некоторых типов лекарственных средств предпочтительным является высвобождение лекарственного средства «импульсами», при этом единичная дозированная лекарственная форма обеспечивает начальную дозу лекарственного средства с последующим интервалом отсутствия высвобождения, после которого высвобождается вторая доза лекарственного средства с последующим одним или более дополнительными интервалами отсутствия высвобождения и высвобождением лекарственного средства «импульсами». Альтернативно, высвобождение лекарственного средства не происходит в течение некоторого периода времени после введения дозированной лекарственной формы, после чего доза лекарственного средства высвобождается, с последующим одним или несколькими дополнительными интервалами отсутствия высвобождения и высвобождением лекарственного средства «импульсами».
Импульсная доставка лекарственного средства является полезной, например, с активными агентами, которые имеют короткий период полураспада, вводимыми два или три раза в сутки, с активными агентами, которые интенсивно пресистемно метаболизируются, и с активными агентами, которые должны сохранять определенные уровни в плазме крови для того, чтобы обладать оптимальными фармакодинамическими эффектами.
Дозированная лекарственная форма с импульсным высвобождением может обеспечить один или более импульсов немедленного высвобождения в заданные моменты времени после контролируемого времени задержки или в определенных местах. Дозированные лекарственные формы с импульсным высвобождением, включая лекарственные формы, описанные в настоящем документе, которые включают ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль, вводят с использованием разнообразных лекарственных форм с импульсным высвобождением, которые были описаны. Например, такие лекарственные формы включают, но без ограничения, описанные в патентах США №№5011692, 5017381, 5229135, 5840329, 4871549, 5260068, 5260069, 5508040, 5567441 и 5837284. В одном варианте осуществления дозированная лекарственная форма с контролируемым высвобождением представляет собой пероральную твердую дозированную лекарственную форму с импульсным высвобождением, включающую, по меньшей мере, две группы частиц (т.е. множество частиц), каждая из которых содержит композицию, описанную в настоящем документе. Первая группа частиц обеспечивает дозу ингибитора HDAC (напр., Соединения 1) или его фармацевтически приемлемой соли по существу с немедленным высвобождением при приеме внутрь млекопитающим. Первая группа частиц может быть непокрытой, или иметь покрытие и/или герметизирующее вещество. Вторая группа частиц включает покрытые частицы, которые включают примерно от 2% до 75%, предпочтительно примерно от 2.5% до 70%, и более предпочтительно примерно от 40% до 70% по массе общей дозы ингибитора HDAC (напр., Соединения 1) или его фармацевтически приемлемой соли в указанной лекарственной форме в смеси с одним или более связывающими веществами. Покрытие включает фармацевтически приемлемый ингредиент в количестве, достаточном для обеспечения задержки примерно от 2 часов до 7 часов после приема внутрь перед высвобождением второй дозы. Пригодные покрытия включают одно или более дифференцирование разлагаемых покрытий, таких как, в качестве примера только, pH-чувствительные покрытия (энтеросолюбильные покрытия), такие как акриловые смолы (напр., Eudragit® EPO, Eudragit® L30D-55, Eudragit® FS 30D Eudragit® L100-55, Eudragit® L100, Eudragit® S100, Eudragit® RD100, Eudragit® E100, Eudragit® L12.5, Eudragit® S12.5 и Eudragit® NE30D, Eudragit® NE 40D), взятые отдельно или смешанные с производными целлюлозы, напр., этил целлюлозой, или неэнтеросолюбильные покрытия, имеющие переменную толщину для обеспечения дифференцированного высвобождения препарата, который включает ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль.
Устройства контролируемого высвобождения, состоящие из множества частиц
В некоторых вариантах осуществления фармацевтические композиции, описанные здесь, представляют собой устройство контролируемого высвобождения, состоящее из множества частиц, которое содержит совокупность частиц, гранул или пеллет с диаметром в интервале примерно от 10 мкм до 3 мм, примерно от 50 мкм до 2.5 мм, или примерно от 100 мкм до 1 мм. Такое множество частиц изготовлено путем влажной грануляции, сухой грануляции, экструзии/сферонизации, валикового прессования, плавления-замораживания, покрытия ядер распылением и их комбинаций. Смотри, например, Multiparticulate Oral Drug Delivery; Marcel Dekker: 1994; и Pharmaceutical Pelletization Technology; Marcel Dekker: 1989.
Другие вспомогательные вещества или носители, описанные здесь, могут быть смешаны с фармацевтическими композициями, чтобы облегчить обработку и образование множества частиц. Полученные частицы сами по себе могут составлять устройство из множества частиц, или они могут быть покрыты разными пленкообразующими веществами, такими как энтеросолюбильные полимеры, набухаемые в воде и водорастворимые полимеры. Множество частиц может быть дополнительно обработано с получением капсул или таблеток.
Кишечная защитная система всасывания лекарственного средства (IPDAS) представляет собой технологию изготовления таблеток, состоящих из множества частиц, включающих шарики высокой плотности с контролируемым высвобождением, которые прессуют в форму таблеток. Шарики могут быть изготовлены такими методами, как экструзионная сферонизация, и контролируемое высвобождение может быть достигнуто путем использования различных полимерных систем для покрытия полученных шариков. Альтернативно, лекарственное средство также может быть нанесено на инертный носитель, такой как зерно нонпарель для получения множества частиц с мгновенным высвобождением. Контролируемое высвобождение может быть достигнуто путем формирования полимерной мембраны на этих множествах частиц с мгновенным высвобождением. После приема внутрь таблетки IPDAS, она быстро распадается и распространяет шарики, содержащие лекарственное средство, в желудке, которые затем проходят в двенадцатиперстную кишку и вдоль желудочно-кишечного тракта контролируемым и ступенчатым образом, независимо от приема пищи. Высвобождение активного ингредиента из множества частиц возникает посредством процесса диффузии через полимерную мембрану и/или микроматрицу полимерного/активного ингредиента, образованную в экструдированных/сферонизированных множествах частиц. Жедудочно-кишечная защита IPDAS осуществляется за счет природы множества частиц лекарственной формы, что обеспечивает широкое распространение лекарственного средства по всему желудочно-кишечному тракту.
Система абсорбции перорального сфероидального лекарственного средства (SODAS) представляет собой технологию изготовления множества частиц, которая обеспечивает изготовление потребительских лекарственных форм и отвечает напрямую индивидуальным потребностям кандидатных лекарственных средств. Это может обеспечить ряд специализированных профилей высвобождения лекарственного средства, в том числе немедленного высвобождения лекарственного средства с последующим замедленным высвобождением для того, чтобы вызвать быстрое начало действия, которое сохраняется в течение, по меньшей мере, 12 часов. Альтернативно, противоположный сценарий может быть достигнут, когда высвобождение лекарственного средства отсрочено на несколько часов.
Программированная система абсорбции перорального лекарственного средства (PRODAS) представлена в виде некоторого количества мини-таблеток, содержащихся в твердой желатиновой капсуле. Система, таким образом, объединяет преимущества технологии таблетирования с капсулой. Возможно введение многих различных мини-таблеток, при этом каждая формулирована индивидуально и запрограммирована на высвобождение лекарственного средства в различных участках желудочно-кишечного тракта. Эти комбинации могут включать мини-таблетки с немедленным высвобождением, отсроченным высвобождением и/или контролируемым высвобождением. Также, возможно введение мини-таблеток с различными размерами таким образом, чтобы была возможна высокая нагрузка лекарственного средства. Их размер изменяется, как правило, в диапазоне 1.5-4 мм в диаметре.
Многие другие типы систем с контролируемым высвобождением известны специалистам в данной области и являются пригодными для применения с лекарственными формами, описанными в настоящем документе. Примеры таких систем доставки включают, например, системы на основе полимеров, таких как полимолочная и полигликолевая кислоты, полиангидриды и поликапролактон; пористые матрицы, системы, не основанные на полимерах, представляющие собой липиды, включая стерины, такие как холестерин, сложные эфиры холестерина и жирные кислоты, или нейтральные жиры, такие как моно-, ди- и триглицериды; гидрогелевые системы высвобождения; силиконовые системы; системы на основе пептидов; восковые покрытия, лекарственные формы, подверженные биологическому разрушению, прессованные таблетки с применением обычных связывающих веществ и тому подобное. Смотри, напр., Liberman с соавт., Pharmaceutical Dosage Forms, 2 Ed., Vol. 1, p. 209-214 (1990); Singh с соавт., Encyclopedia of Pharmaceutical Technology, 2nd Ed., p. 751-753 (2002); патенты США №№4327725, 4624848, 4968509, 5461140, 5456923, 5516527, 5622721, 5686105, 5700410, 5977175, 6465014 и 6932983.
Матриксные устройства контролируемого высвобождения
В некоторых вариантах осуществления фармацевтические композиции, обеспеченные здесь, представлены в дозированной лекарственной форме с модифицированным высвобождением, которая изготовлена с использованием матриксного устройства контролируемого высвобождения, известного специалистам в данной области (смотри, Takada с соавт. в "Encyclopedia of Controlled Drug Delivery," Vol. 2, Mathiowitz ed., Wiley, 1999).
В одном варианте осуществления фармацевтические композиции, обеспеченные здесь в дозированной лекарственной форме с модифицированным высвобождением, формулированы с использованием эродируемого матриксного устройства, которое содержит набухаемые в воде, эродируемые или растворимые полимеры, в том числе синтетические полимеры и полимеры природного происхождения, и их производные, такие как полисахариды и белки.
Материалы, пригодные для получения эродируемой матрицы, включают, но без ограничения, хитин, хитозан, декстран и пуллулан; агаровую камедь, гуммиарабик, камедь карайя, камедь плодоворожкового дерева, трагакант, каррагенаны, гхатти-камедь, гуаровую камедь, ксантановую камедь и склероглюкан; крахмалы, такие как декстрин и мальтодекстрин; гидрофильные коллоиды, такие как пектин; фосфатиды, такие как лецитин; альгинаты; альгинат пропиленгликоля; желатин; коллаген; и целлюлозные полимеры, такие как этилцеллюлоза (ЕС), метилэтилцеллюлоза (МЕС), карбоксиметилцеллюлоза (CMC), CMEC, гидроксиэтилцеллюлоза (НЕС), гидроксипропилцеллюлоза (НРС), ацетат целлюлозы (СА), пропионат целлюлозы (СР), бутират целлюлозы (СВ), ацетат-бутират целлюлозы (CAB), CAP, CAT, гидроксипропилметил целлюлоза (НРМС), НРМСР, HPMCAS, ацетат-тримеллитат гидроксипропилметилцеллюлозы (НРМСАТ) и этилгидроксиэтилцеллюлоза (ЕНЕС); поливинилпирролидон; поливиниловый спирт; поливинилацетат; сложные эфиры глицерина и жирных кислот; полиакриламид; полиакриловая кислота; сополимеры этакриловой кислоты или метакриловой кислоты (EUDRAGIT®, Rohm America, Inc., Piscataway, NJ); поли(2-гидроксиэтилметакрилат); полилактиды; сополимеры L-глютаминовой кислоты и этил-L-глютамат; разлагаемые сополимеры молочной кислоты и гликолевой кислоты; поли-D-(-)-3-гидроксимасляная кислота; и другие производные акриловой кислоты, такие как гомополимеры и сополимеры бутилметакрилата, метилметакрилат, этилметакрилат, этилакрилат, (2-диметиламиноэтил)метакрилат и хлорид (триметиламиноэтил)метакрилата.
В некоторых вариантах осуществления фармацевтические композиции формулированы с устройством, представляющим собой неэродируемую матрицу. Активный ингредиент(ы) растворен или диспергирован в инертной матрице и высвобождается преимущественно за счет диффузии через инертную матрицу после введения. Материалы, пригодные для использования в качестве не поддающейся эрозии матрицы, включают, но без ограничения, нерастворимые пластики, такие как полиэтилен, полипропилен, полиизопрен, полиизобутилен, полибутадиен, полиметилметакрилат, полибутилметакрилат, хлорированный полиэтилен, поливинилхлорид, сополимеры метилакрилата и метилметакрилата, сополимеры этилена и винилацетата, сополимеры этилена и пропилена, сополимеры этилена и этилакрилата, винилхлорида сополимеры с винилацетатом, винилиденхлоридом, этиленом и пропиленом, иономер полиэтилентерефталата, бутилкаучук, эпихлоргидриновые каучуки, сополимер этилена и винилового спирта, терполимер этилена/винилацетата/винилового спирта и сополимер этилена и винилоксиэтанола, поливинилхлорид, пластифицированный нейлон, пластифицированный полиэтилентерефталат, натуральный каучук, силиконовые каучуки, полидиметилсилоксаны, сополимеры карбоната кремния и; гидрофильные полимеры, такие как этилцеллюлоза, ацетат целлюлозы, кросповидон и сшитый частично гидролизованный поливинилацетат; и жирные соединения, такие как карнаубский воск, микрокристаллический воск и триглицериды.
В матриксной системе с контролируемым высвобождением требуемую кинетику высвобождения можно контролировать, например, путем варьирования типа используемого полимера, вязкости полимера, размера частиц полимера и/или активного ингредиента(ов), отношения активного ингредиента(ов) к полимеру и другим вспомогательным веществам композиций.
В одном аспекте дозированные лекарственные формы с модифицированным высвобождением изготовлены способами, известными специалистам в данной области, в том числе прессованием, сухой или влажной грануляцией с последующим прессованием, грануляцией из расплава с последующим прессованием.
В некоторых вариантах осуществления матриксная система с контролируемым высвобождением включает энтеросолюбильное покрытие таким образом, что высвобождение лекарственного средства осуществляется в желудке.
Устройства с осмотическим контролем высвобождения
В некоторых вариантах осуществления фармацевтические композиции, обеспеченные здесь в дозированной лекарственной форме с модифицированным высвобождением, изготовлены с использованием устройства с осмотическим контролем высвобождения, включая однокамерную систему, двухкамерную систему, технологию асимметричных мембран (АМТ) и вытесняющую ядерную систему (ECS). Как правило, такие устройства содержат, по меньшей мере, два компонента: (а) ядро, которое содержит активный ингредиент(ы); и (b) полупроницаемую мембрану, по меньшей мере, с одним каналом доставки, которая обволакивает ядро. Полупроницаемая мембрана контролирует поступление воды в ядро из используемой водной среды, вызывая высвобождение лекарственного средства в результате вытеснения через канал(ы) доставки.
В дополнение к активному ингредиенту(ам) ядро осмотического устройства необязательно содержит средство, изменяющее осмотическое давление, которое создает движущую силу, обеспечивающую перенос воды из используемой среды в ядро устройства. Один класс средств, изменяющих осмотическое давление, представляет собой набухаемые в воде гидрофильные полимеры, которые также называют «осмополимеры» и «гидрогели», которые включают, но без ограничения, гидрофильные виниловые и акриловые полимеры, полисахариды, такие как альгинат кальция, полиэтиленоксид (РЕО), полиэтиленгликоль (PEG), полипропиленгликоль (PPG), поли(2-гидроксиэтилметакрилат), поли(акриловая) кислота, поли(метакриловая) кислота, поливинилпирролидон (PVP), поперечносшитый PVP, поливиниловый спирт (PVA), сополимеры PVA/PVP, сополимеры PVA/PVP, содержащие гидрофобные мономеры, такие как метилметакрилат и винилацетат, гидрофильные полиуретаны, содержащие большие блоки РЕО, кроскармеллоза натрия, каррагенан, гидроксиэтилцеллюлоза (НЕС), гидроксипропилцеллюлоза (НРС), гидроксипропилметилцеллюлоза (НРМС), карбоксиметилцеллюлоза (CMC) и карбоксиэтилцеллюлоза (СЕС), альгинат натрия, поликарбофил, желатин, ксантановая камедь и натриевая соль гликолята крахмала.
Другой класс осмотических средств, изменяющих осмотическое давление, представляют собой осмогены, которые могут поглощать воду, влияя на градиент осмотического давления на границе окружающего покрытия. Пригодные осмогены включают, но без ограничения, неорганические соли, такие как сульфат магния, хлорид магния, хлорид кальция, хлорид натрия, хлорид лития, сульфат калия, фосфаты калия, карбонат натрия, сульфит натрия, сульфат лития, хлорид калия и сульфат натрия; сахара, такие как декстроза, фруктоза, глюкоза, инозитол, лактоза, мальтоза, маннит, раффиноза, сорбит, сахароза, трегалоза и ксилит; органические кислоты, такие как аскорбиновая кислота, бензойная кислота, фумаровая кислота, лимонная кислота, малеиновая кислота, себациновая кислота, сорбиновая кислота, адипиновая кислота, эдетовая кислота, глутамовая кислота, п-толуолсульфоновая кислота, янтарная кислота и винная кислота; мочевина; а также их смеси.
Чтобы изменить скорость начальной доставки активного ингредиента(ов) из дозированной лекарственной формы, можно использовать средства, изменяющие осмотическое давление, которые обладают разными скоростями растворения. Например, аморфные сахара, такие как Mannogeme EZ (SPI Pharma, Lewes, DE), можно использовать для обеспечения более быстрой доставки в течение первой пары часов для быстрого получения желательного терапевтического эффекта, и постепенного и непрерывного высвобождения остального количества для поддержания желательного уровня терапевтического или профилактического эффекта в течение длительного периода времени. В этом случае активный ингредиент(ы) высвобождается с такой скоростью, которая позволяет компенсировать количество метаболизируемого и выводимого активного ингредиента.
Ядро также может содержать широкий ряд других вспомогательных веществ и носителей, как описано здесь, для повышения эффективности дозированной лекарственной формы или способствования стабильности или обработке.
Материалы, используемые для получения полупроницаемой мембраны, включают различные сорта акриловых полимеров, винилы, сложные эфиры, полиамиды, сложные полиэфиры и производные целлюлозы, которые являются водопроницаемыми и нерастворимыми в воде при физиологически значимых pH или которые можно сделать нерастворимыми в воде путем химического изменения, такого как сшивка. Примеры полимеров, пригодных для получения покрытия, включают пластифицированные, непластифицированные и упрочненные ацетат целлюлозы (СЛ), диацетат целлюлозы, триацетат целлюлозы, пропионат СА, нитрат целлюлозы, ацетат-бутират целлюлозы (CAB), этилкарбамат СА, CAP, метилкарбамат СА, сукцинат СА, ацетат-тримеллитат целлюлозы (CAT), диметиламиноацетат СА, этилкарбонат СА, хлорацетат СА, этилоксалат СА, метилсульфонат СА, бутилсульфонат СА, п-толуолсульфонат СА, ацетат агара, триацетат амилозы, ацетат бета-глюкана, триацетат бета-глюкана, диметилацетат ацетальдегида, триацетат камеди плодоворожкового дерева, гидроксилированный этилен-винилацетат, ЕС, PEG, PPG, сополимеры PEG/PPG, PVP, НЕС, НРС, CMC, СМЕС, НРМС, НРМСР, HPMCAS, НРМСАТ, поли(акриловые) кислоты и сложные эфиры, а также поли(метакриловые) кислоты и сложные эфиры и их сополимеры, крахмал, декстран, декстрин, хитозан, коллаген. желатин, полиалкены, простые полиэфиры, полисульфоны, полиэфирсульфоны, полистиролы, поливинилгалогениды, поливиниловые сложные и простые эфиры, природные и синтетические воски.
Полупроницаемая мембрана также может представлять собой гидрофобную микропористую мембрану, в которой поры в основном заполнены газом и не смачиваются водной средой, но являются проницаемыми для водяного пара, как описано в патенте США №5798119. Такая гидрофобная, но проницаемая для водяного пара мембрана обычно состоит из гидрофобных полимеров, таких как полиалкены, полиэтилен, полипропилен, политетрафторэтилен, производные полиакриловой кислоты, простые полиэфиры, полисульфоны, полиэфирсульфоны, полистиролы, поливинилгалогениды, поливинилиденфторид, поливиниловые сложные и простые эфиры, природные и синтетические воски.
Канал(ы) доставки на полупроницаемой мембране можно получить после нанесения покрытия путем механического или лазерного высверливания. Канал(ы) доставки также могут быть формированы in situ путем эрозии пробки водорастворимого материала или путем перфорации более тонкой части мембраны над углублением в ядре. Кроме того, каналы доставки могут быть формированы в процессе нанесения покрытия, например, как в случае асимметричных мембранных покрытий, относящихся к типу, раскрытому в патентах США №№5612059 и 5698220.
Общее количество высвобождаемого активного ингредиента(ов) и скорость высвобождения зачастую можно модулировать, варьируя толщину и пористость полупроницаемой мембраны, состав ядра, а также число, размер и положение каналов доставки.
Фармацевтические композиции в дотированной лекарственной форме с осмотическим контролем высвобождения могут, кроме того, содержать дополнительные обычные вспомогательные вещества или носители, описанные здесь, для улучшения характеристик или обработки лекарственной формы.
Дозированные лекарственные формы с осмотическим контролем высвобождения могут быть изготовлены в соответствии с обычными способами и методами, известными специалистам в данной области (смотри Remington: The Science and Practice of Pharmacy, выше; Santus и Baker, J. Controlled Release 1995, 35, 1-21; Verma с соавт., Drug Development and Industrial Pharmacy 2000, 26, 695-708; Verma с соавт., J. Controlled Release 2002, 79, 7-27).
В других вариантах осуществления фармацевтические композиции, обеспеченные здесь, формулированы в виде дозированной лекарственной формы АМТ с контролируемым высвобождением, которая содержит асимметричную осмотическую мембрану, покрывающую ядро, в состав которой входит активный ингредиент(ы) и другие фармацевтически приемлемые вспомогательные вещества. Смотри патент США №5612059 и WO 2002/17918. Дозированные лекарственные формы АМТ с контролируемым высвобождением могут быть изготовлены в соответствии с обычными способами и методами, известными специалистам в данной области, включая прямое прессование, сухую грануляцию, влажную грануляцию и нанесение покрытия окунанием.
В некоторых вариантах осуществления фармацевтические композиции, обеспеченные здесь, формулированы в виде дозированной лекарственной формы ESC с контролируемым высвобождением, которая содержит осмотическую мембрану, покрывающую ядро, в состав которой входит активный ингредиент(ы), гидроксиэтилцеллюлоза и другие фармацевтически приемлемые вспомогательные вещества или носители.
Многослойные таблетки
В одном аспекте лекарственная форма с контролируемым высвобождением представлена в форме многослойной таблетки. Многослойные таблетки включают инертное ядро, на которое слоями нанесено лекарственное средство (плюс необязательно вспомогательные вещества) с последующим энтеросолюбильным покрытием. Второй слой лекарственного средства нанесен на первое энтеросолюбильное покрытие с последующим вторым энтеросолюбильным покрытием, нанесенным на второй слой лекарственного средства. Энтеросолюбильные покрытия должны гарантировать высвобождение лекарственного средства из каждого слоя с интервалом, по меньшей мере, 3-6 часов.
Немедленное высвобождение
В некоторых вариантах осуществления фармацевтические композиции, обеспеченные здесь в дозированной лекарственной форме в немедленным высвобождением, обеспечивают высвобождение не менее 75% терапевтически активного ингредиента или комбинации, и/или отвечают требованиям по распадаемости или растворению для таблеток с немедленным высвобождением конкретных терапевтических агентов или комбинации, содержащейся в ядре таблетки, как указано в USP XXII, 1990 (The United States Pharmacopeia.) Фармацевтические композиции с немедленным высвобождением включают капсулы, таблетки, пероральные растворы, порошки, шарики, пеллеты, частицы и тому подобное.
Парентеральное введение
В некоторых вариантах осуществления фармацевтические композиции для местного или системного введения, обеспеченные здесь, можно вводить парентерально путем инъекции, инфузии или имплантации. Парентеральное введение в данном описании включает внутривенное, внутриартериальное, внутрибрюшинное, внутриоболочечное, внутрижелудочковое, внутриуретральное, надчревное, внутричерепное, внутримышечное, внутрисуставное и подкожное введение.
В других вариантах осуществления фармацевтические композиции, обеспеченные здесь, могут быть формулированы в любые дозированные лекарственные формы, пригодные для парентерального введения, включая растворы, суспензии, эмульсии, мицеллы, липосомы, микросферы, наносистемы и твердые формы, пригодные для приготовления растворов или суспензий в жидкости перед инъекцией. Такие дозированные лекарственные формы могут быть изготовлены с помощью обычных способов, известных специалистам в области фармацевтики (смотри Remington: The Science and Practice of Pharmacy, выше).
Фармацевтические композиции, предполагаемые для парентерального введения, могут включать один или более фармацевтически приемлемых носителей и вспомогательных веществ, включая, но без ограничения, водные среды, смешиваемые с водой среды, неводные среды, противомикробные средства или консерванты, защищающие от роста микроорганизмов, стабилизаторы, средства, повышающие растворимость, средства, регулирующие тоничность, забуферивающие средства, антиоксиданты, местные обезболивающие средства, суспендирующие и диспергирующие средства, увлажняющие или эмульгирующие средства, комплексообразующие средства, связывающие или хелатирующие средства, криопротекторы, лиопротекторы, загущающие средства, регуляторы pH и инертные газы.
Пригодные водные среды включают, но без ограничения, воду, солевой раствор, физиологический раствор или фосфатный буферный раствор (PBS), инъекционный раствор хлорида натрия, инъекционный раствор Рингера, изотонический раствор декстрозы для инъекций, стерильную воду для инъекций, раствор декстрозы и лактатсодержащий раствор Рингера для инъекций. Неводные среды включают, но без ограничения, нелетучие масла растительного происхождения, касторовое масло, кукурузное масло, хлопковое масло, оливковое масло, арахисовое масло, масло мяты перечной, сафлоровое масло, кунжутное масло, соевое масло, гидрогенезированные растительные масла, гидрогенезированное соевое масло и среднецепочечные триглицериды кокосового масла и масла пальмовых семян. Смешиваемые с водой среды включают, но без ограничения, этанол, 1,3-бутандиол, жидкий полиэтиленгликоль (например, полиэтиленгликоль 300 и полиэтиленгликоль 400), пропиленгликоль, глицерин, N-метил-2-пирролидон, диметилацетамид и диметилсульфоксид.
Пригодные противомикробные средства или консерванты включают, но без ограничения, фенолы, крезолы, ртутные препараты, бензиловый спирт, хлорбутанол, метил- и пропил-п-гидроксибензоаты, тимеросал, бензалкония хлорид, бензетония хлорид, метил- и пропилпарабены и сорбиновую кислоту. Пригодные средства для регуляции тоничности включают, но без ограничения, хлорид натрия, глицерин и декстрозу. Пригодные забуферивающие средства включают, но без ограничения, фосфаты и цитраты. Пригодные антиоксиданты включают антиоксиданты, описанные в настоящем документе, в том числе бисульфит и метабисульфит натрия. Пригодные местные обезболивающие включают, но без ограничения, гидрохлорид прокаина. Пригодные суспендирующие и диспергирующие средства включают суспендирующие и диспергирующие вещества, описанные в настоящем документе, в том числе карбоксиметилцеллюлозу натрия, гидроксипропилметилцеллюлозу и поливинилпирролидон. Пригодные эмульгирующие средства включают средства, описанные в настоящем описании, в том числе полиоксиэтиленсорбита монолаурат, полиоксиэтиленсорбита моноолеат 80 и триэтаноламина олеат. Пригодные связывающие или хелатирующие средства включают, но без ограничения, EDTA. Пригодные средства, регулирующие pH, включают, но без ограничения, гидроксид натрия, соляную кислоту, лимонную кислоту и молочную кислоту. Пригодные комплексообразующие средства включают, но без ограничения, циклодекстрины, в том числе альфа-циклодекстрин, бета-циклодекстрин, гидроксипропил-бета-циклодекстрин, сульфобутиловый эфир-бета-циклодекстрин, и сульфобутиловый эфир 7-бета-циклодекстрин (CAPTISOL®, CyDex, Lenexa, KS).
В некоторых вариантах осуществления фармацевтические композиции, обеспеченные здесь, могут быть формулированы для введения одной или множества доз. Лекарственные формы, содержащие разовую дозу, упаковываны в ампулу, флакон или шприц. Лекарственные формы для парентерального введения, содержащие множество доз, должны содержать противомикробное средство в бактериостатических или фунгистатических концентрациях. Все парентеральные лекарственные формы должны быть стерильными, как известно и принято в данной области.
В одном варианте осуществления фармацевтические композиции обеспечены в виде готовых к использованию стерильных растворов. В другом варианте осуществления фармацевтические композиции обеспечены в виде стерильных сухих растворимых продуктов, включающих лиофилизированные порошки и гиподермальные таблетки, предназначенные для восстановления средой перед применением. В еще другом варианте осуществления фармацевтические композиции обеспечены в виде готовых к использованию стерильных суспензий. В еще другом варианте осуществления фармацевтические композиции обеспечены в виде стерильных сухих нерастворимых продуктов, предназначенных для восстановления средой перед применением. В еще другом варианте осуществления фармацевтические композиции обеспечены в виде готовых к использованию стерильных эмульсий.
Фармакокинетический анализ
В одном варианте осуществления любой стандартный протокол фармакокинетической оценки применяется для определения профиля концентрации в плазме крови у людей после введения лекарственной формы, описанной в настоящем документе, которая включает ингибитор HDAC (напр., Соединение 1), и, таким образом, установления, отвечает ли данная лекарственная форма фармакокинетическим и фармакодинамическим критериям, изложенным в настоящем документе. Например, рандомизированное перекрестное исследование однократной дозы проводили с использованием группы здоровых взрослых субъектов-людей. Количество субъектов должно быть достаточным для обеспечения адекватного контроля отклонения в статистическом анализе и обычно составляет около 10 или больше, хотя для некоторых целей меньшая группа является достаточной. Каждый субъект получает введение в нулевой момент времени однократной дозы (напр., дозы, содержащей примерно от 10 мг до 300 мг Соединения 1). Образцы крови собирают от каждого субъекта перед введением (напр., за 15 минут) и через несколько интервалов времени после введения. В некоторых случаях несколько образцов берут в течение первого часа и после этого берут реже. Например, образцы крови собирают в момент времени 0 (предоза), через 0.25, 0.5, 1, 2, 3, 4, 6, 8, 12 и 16 часов после введения. Если тех же самых субъектов используют для исследования второго тестируемого состава, то перед введением второго состава должен пройти период, составляющий, по меньшей мере, 10 дней. Плазму отделяют от образцов крови путем центрифугирования и отделенную плазму анализируют на ингибитор HDAC (напр., Соединение 1) с помощью утвержденной методики жидкостной хроматографии высокого разрешения/тандемной масс-спектрометрии (например, LC-MS/MS, LC/APCI-MS/MS), такой как, например, Ramu с соавт., Journal of Chromatography В, 751 (2001) 49-59).
Любая лекарственная форма, дающая желаемый фармакокинетический профиль и фармакодинамические эффекты, является пригодной для введения в соответствии с представленными способами.
Способы дозирования и режимы лечения
В одном варианте осуществления композиции, которые включают ингибитор HDAC (напр., Соединение 1), описанные здесь, вводят людям, имеющим рак, в количестве, достаточном для частичного купирования по меньшей мере одного из симптомов рака. Количества, эффективные для этого применения, зависят от тяжести и течения рака, предшествующей терапии, состояния здоровья пациента, веса и ответа на лекарственные средства, и/или заключения лечащего врача.
В некоторых вариантах осуществления введение соединения, композиций или терапий, описанных здесь, включает длительное применение. В конкретных вариантах осуществления длительное применение используется в определенных случаях, когда состояние пациента не улучшается и/или по назначению врача. В определенных вариантах осуществления длительное применение включает введение в течение длительного периода времени, в том числе, например, на протяжении продолжительности жизни пациента для уменьшения интенсивности или иного контроля, или ограничения симптомов рака.
В некоторых вариантах осуществления введение соединений, композиций или терапий, описанных здесь, производится непрерывно.
В некоторых вариантах осуществления доза подлежащего введению лекарственного средства временно отменяется на некоторый промежуток времени (то есть «лекарственные каникулы»). Длительность лекарственных каникул изменяется от 4 дней до 9 дней.
В одном аспекте фармацевтические композиции, которые включают ингибитор HDAC (напр., Соединение 1), вводят людям, имеющим рак, циклами, которые включают последовательные дни ежедневного введения ингибитора HDAC (напр., Соединения 1) с последующими последовательными днями отсутствия введения ингибитора HDAC (напр., Соединения 1). Такой режим дозирования ингибитора HDAC (напр., Соединения 1) обеспечивает достижение фармакодинамического ответа на ингибитор HDAC (напр., Соединение 1) с ограниченными случаями развития тромбоцитопении 4 степени. Тромбоцитопения 4 степени обычно включает случаи, когда человек имеет число тромбоцитов меньше, чем 25000 на мм2. В одном аспекте фармацевтические композиции, которые включают ингибитор HDAC (напр., Соединение 1), вводят людям, имеющим рак, циклами, которые включают 5, 6, 7, 8 или 9 последовательных дней ежедневного введения ингибитора HDAC (напр., Соединения 1) с последующими 5, 6, 7, 8 или 9 последовательными днями отсутствия введения ингибитора HDAC (напр., Соединения 1).
В случае, если человек получает сопутствующую терапию вторым лекарственным средством, отличным от ингибитора HDAC (напр., Соединения 1), то терапию вторым лекарственным средством не прекращают в дни отсутствия введения ингибитора HDAC (напр., Соединения 1). В одном аспекте, в случае, если человек получает сопутствующую терапию вторым лекарственным средством, отличным от ингибитора HDAC (напр., Соединения 1), то лечение вторым лекарственным средством прекращают в дни отсутствия введения ингибитора HDAC (напр., Соединения 1).
В одном аспекте лекарственные формы с немедленным высвобождением ингибитора HDAC (напр., Соединения 1) вводят человеку дважды в сутки. В одном аспекте, лекарственные формы с немедленным высвобождением ингибитора HDAC (напр., Соединения 1) вводят человеку дважды в сутки, при этом две дозы с немедленным высвобождением вводят с интервалом примерно от 3 часов до 6 часов.
В одном аспекте лекарственные формы с контролируемым высвобождением ингибитора HDAC (напр., Соединения 1) вводят человеку один раз в сутки. В одном аспекте лекарственные формы с контролируемым высвобождением ингибитора HDAC (напр., Соединения 1), которые вводят человеку один раз в сутки, обеспечивают такое же количество ингибитора HDAC (напр., Соединения 1), которое будет получено в результате ежедневного дозирования двух лекарственных форм с немедленным высвобождением ингибитора HDAC (напр., Соединения 1). В одном аспекте лекарственные формы с контролируемым высвобождением ингибитора HDAC (напр., Соединения 1), которые вводят человеку один раз в сутки, обеспечивают такое же количество ингибитора HDAC (напр., Соединения 1), которое будет получено в результате ежедневного дозирования двух лекарственных форм с немедленным высвобождением ингибитора HDAC (напр., Соединения 1), при этом две дозы с немедленным высвобождением вводят с интервалом примерно от 3 часов до 6 часов.
Суточные дозы
В некоторых вариантах осуществления количество ингибитора HDAC (напр., Соединения 1) или его фармацевтически приемлемой соли, вводимого в комбинации с алкилирующим агентом, таким как, в качестве примера только, бендамустин, варьируется в зависимости от факторов, включающих, в качестве неограничивающего примера, тип используемой лекарственной формы, тип рака и его тяжесть, индивидуальные параметры человека (напр., масса тела, возраст), и/или способ введения. В различных вариантах осуществления желаемая доза подходящим образом представлена в форме разовой дозы или в форме разделенных доз, вводимых одновременно (или в течение короткого периода времени) или с подходящими интервалами, например, в форме двух, трех, четырех или более суб-доз в сутки.
В одном варианте осуществления ингибитор HDAC вводят, как указано здесь, в комбинации с бендамутином, который вводят в некоторых вариантах осуществления путем внутривенной инъекции. В одном варианте осуществления ингибитор HDAC вводят, как указано здесь, в комбинации с бендамустином, который вводят в День 1 и День 2 21-дневного цикла лечения.
В некоторых вариантах осуществления фармацевтические композиции, описанные здесь, представлены в единичных дозированных лекарственных формах, пригодных для введения точных величин доз. В единичной дозированной лекарственной форме состав разделен на единичные дозы, содержащие нужные количества ингибитора HDAC (напр., Соединения 1) или его фармацевтически приемлемой соли. В одном варианте осуществления единичная доза представлена в форме упаковки, содержащей дискретные количества композиции. Неограничивающими примерами служат упакованные таблетки или капсулы, и порошки во флаконах или ампулах. В одном варианте осуществления композиции в форме водных суспензий упакованы в неподдающиеся повторной герметизации контейнеры на одну дозу. Альтернативно, используются поддающиеся повторной герметизации контейнеры на несколько доз, и в этом случае в композицию обычно включают консервант.
Суточные количества Соединения 1 или его фармацевтически приемлемой соли, которые вводят человеку, изменяются от примерно 10 мг/мм2 до примерно 200 мг/мм2. В одном аспекте суточные количества Соединения 1 или его фармацевтически приемлемой соли, которые вводят человеку, изменяются от примерно 30 мг/мм2 до примерно 90 мг/мм2. В одном аспекте суточные количества Соединения 1 или его фармацевтически приемлемой соли, которые вводят человеку, включают примерно 20 мг/мм2, примерно 30 мг/мм2, примерно 40 мг/мм2, примерно 50 мг/мм2, примерно 60 мг/мм2, примерно 70 мг/мм2, примерно 80 мг/мм2 или примерно 90 мг/мм2.
В одном аспекте Соединение 1 или его фармацевтически приемлемую соль вводят в виде лекарственной формы с немедленным высвобождением, которая включает примерно 20 мг/мм2, примерно 30 мг/мм2, примерно 40 мг/мм2, примерно 50 мг/мм2, примерно 60 мг/мм2, примерно 70 мг/мм2, примерно 80 мг/мм2 или примерно 90 мг/мм2 Соединения 1. В одном аспекте Соединение 1 или его фармацевтически приемлемую соль вводят в виде лекарственной формы с немедленным высвобождением, которая включает примерно 30 мг/мм2 Соединения 1 или его фармацевтически приемлемой соли.
В одном аспекте ингибитор HDAC (напр., Соединение 1) вводят в виде двух лекарственных форм с немедленным высвобождением, при этом вторую лекарственную форму с немедленным высвобождением вводят через примерно от 4 часов до 6 часов после введения первой дозы. Каждая лекарственная форма с немедленным высвобождением содержит одинаковое количество ингибитора HDAC (напр., Соединения 1) или его фармацевтически приемлемой соли, как описано в настоящем документе. Две лекарственные формы с немедленным высвобождением обеспечивают устойчивые уровни в плазме крови ингибитора HDAC (напр., Соединения 1), которые необходимы для терапевтического и фармакодинамического эффекта при сведении к минимуму побочных эффектов. В одном аспекте устойчивые уровни в плазме крови ингибитора HDAC (напр., Соединения 1) сохраняются в течение примерно от 6 часов до 8 часов.
В одном аспекте Соединение 1 или его фармацевтически приемлемую соль вводят в виде лекарственной формы с контролируемым высвобождением, которая включает примерно 30 мг/мм2, примерно 40 мг/мм2, примерно 50 мг/мм2, примерно 60 мг/мм2, примерно 70 мг/мм2, примерно 80 мг/мм2 или примерно 90 мг/мм2 Соединения 1. В одном аспекте Соединение 1 или его фармацевтически приемлемую соль вводят в виде лекарственной формы с контролируемым высвобождением, которая включает примерно 60 мг/мм2 Соединения 1 или его фармацевтически приемлемой соли.
В одном аспекте лекарственные формы с немедленным высвобождением включают примерно от 10 мг до 300 мг Соединения 1. В одном аспекте лекарственные формы с немедленным высвобождением включают примерно от 20 мг до 200 мг Соединения 1.
В одном аспекте лекарственные формы с контролируемым высвобождением включают примерно от 20 мг до 600 мг Соединения 1. В одном аспекте лекарственные формы с контролируемым высвобождением включают примерно от 40 мг до 400 мг Соединения 1.
Типы рака
В одном аспекте ингибитор HDAC (напр., Соединение 1) или его фармацевтическую соль применяют для лечения рака у человека. В одном аспекте ингибитор HDAC (напр., Соединение 1) или его фармацевтическую соль применяют для лечения гематологического рака у человека. В одном аспекте ингибитор HDAC (напр., Соединение 1) или его фармацевтическую соль применяют для лечения солидной опухоли у человека.
Гематологический рак включает рак крови или костного мозга, такой как лейкоз или лимфома.
Лимфома представляет собой рак, который начинает развиваться в клетках иммунной системы. Существует две основные категории лимфом. Одним видом является лимфома Ходжкина, которая отличается присутствием типа клетки, называемой клеткой Рида-Штернберга. Другая категория представляет собой неходжкинскую лимфому, которая включает большую разнотипную группу злокачественных опухолей клеток иммунной системы. Неходжкинская лимфома может дополнительно подразделяться на злокачественные опухоли, которые имеют индолентное (медленно растущее) течение, и опухоли, которые имеют агрессивное (быстро растущее) течение.
Лейкоз является раком, который начинает развиваться в кроветворной ткани, такой как костный мозг, и приводит к образованию большого количества клеток крови и поступлению их в кровоток.
В одном аспекте рак представляет собой солидную опухоль или лимфому, или лейкоз. В одном аспекте рак представляет собой карциному, саркому, лимфому, лейкоз, герминогенные опухоли, бластические опухоли или бластому.
В одном аспекте ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль применяют для лечения рака, выбранного из следующих категорий: Сердца: саркома (ангиосаркома, фибросаркома, рабдомиосаркома, липосаркома), миксома, рабдомиома, фиброма, липома и тератома; Легких: бронхогенная карцинома (плоскоклеточная, недифференцированная мелкоклеточная, недифференцированная крупноклеточная, аденокарцинома), альвеолярная (бронхиолярная) карцинома, бронхиальная аденома, саркома, лимфома, хондроматозная гамартома, мезотелиома; Желудочно-кишечного тракта: рак пищевода (плоскоклеточная карцинома, аденокарцинома, лейомиосаркома, лимфома), желудка (карцинома, лимфома, лейомиосаркома), подлежудочной железы (протоковая аденокарцинома, инсулинома, глюкагонома, гастринома, карциноидные опухоли, випома), тонкого кишечника (аденокарцинома, лимфома, карциноидные опухоли, саркома Калоши, лейомиома, гемангиома, липома, нейрофиброма, фиброма), толстого кишечника (аденокарцинома, тубулярная аденома, ворсинчатая аденома, гамартома, лейомиома); Мочеполового тракта: рак почек (аденосарцинома, опухоль Вильмса (нефробластома), лимфома, лейкемия), мочевого пузыря и уретры (плоскоклеточная карцинома, переходноклеточная карцинома, аденокарцинома), предстательной железы (аденокарцинома, саркома), яичек (семинома, тератома, эмбриональная кацинома, тератокарцинома, хориокарцинома, саркома, карцинома гиюсных клеток, фиброма, фиброаденома, аденоматоидные опухоли, липома); Печени: гепатома (карцинома клеток печени), холангиокарцинома, гепатобластома, ангиосаркома, аденома клеток печени, гемангиома; Скелета: остеогенная саркома (остеосаркома), фибросаркома, злокачественная фиброзная гистиоцитома, хондросаркома, саркома Юинга, злокачественная лимфома (ретикулоклеточная саркома), множественная миелома, злокачественная гигантоклеточная хордома, остеохронфрома (костнохрящевые экзостозы), доброкачественная хондрома, хондробластома, хондромиксофиброма, остеоид-остеома и гигантоклеточные опухоли; Нервной системы: рак черепа (остеома, гемангиома, гранулема, ксантома, деформирующий остоз), мягких мозговых оболочек (менингиома, менингиосаркома, глиоматоз), мозга (астроцитома, медуллобластома, глиома, эпендимома, герминома [пинеалома], мультиформная глиобластома, олигодендроглиома, шваннома, ретинобластома, врожденные опухоли), спинного мозга (нейрофиброма, менингиома, глиома, саркома); Гинекологические: рак матки (эндометриальная карцинома), шейки матки (карцинома шейки матки, предопухолевая дисплазия шейки матки), яичников (карцинома яичников [серозная цистаденокарцинома, муцинозная цистаденокарцинома, эндометриоидные опухоли, целиобластома, светлоклеточная карцинома, неклассифицированная карцинома], опухоли зернистых клеток, опухоли клеток Сертоли-Лейдига, дисгерминома, злокачественная тератома), вульвы (плоскоклеточная карцинома, интраэпителиальная карцинома, аденокарцинома, фибросаркома, меланома), влагалища (светлоклеточная карцинома, плоскоклеточная карцинома, ботриоидная саркома [эмбриональная рабдомиосаркома], фаллопиевых труб (карцинома); Гематологические: рак крови (миелоидная лейкемия [острая и хроническая], острая лимфобластическая лейкемия, хронический лимфоцитарный лейкоз, миелопролиферативный синдром, множественная миелома, миелодистпластический синдром), болезнь Ходжкина, неходжкинская лимфома [злокачественная лимфома]; Кожные: меланома в поздней стадии, злокачественная меланома, карцинома базальных клеток; плоскоклеточная карцинома, саркома Капоши, диспластия родинок, липома, ангиома, дерматофиброма, келоиды, псориаз; Надпочечников: нейробластома; карцинома желчного пузыря.
В одном аспекте рак представляет собой рак молочной железы, рак толстой кишки, колоректальную карциному, немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак печени, рак яичника, рак предстательной железы, рак шейки матки, рак мочевого пузыря, карциному желудка, гастроинтестинальные стромальные опухоли, рак поджелудочной железы, герминогенные опухоли, мастоцитому, нейробластому, мастоцитоз, рак яичка, глиобластому, астроцитому, лимфому, меланому, миелому, острый миелоцитарный лейкоз (AML), острый лимфоцитарный лейкоз (ALL), миелодиспластический синдром и хронический миелогенный лейкоз (CML).
В одном аспекте рак представляет собой лимфому. В одном аспекте лимфома представляет собой B-клеточную лимфому, T-клеточную лимфому, лимфому Ходжкина или неходжкинскую лимфому.
В одном аспекте рак представляет собой T-клеточную лимфому или лейкемию.
В одном аспекте T-клеточная лимфома представляет собой периферическую T-клеточную лимфому. В другом аспекте T-клеточная лимфома или лейкемия представляет собой T-клеточную лимфобластную лейкемию/лимфому. В еще другом аспекте T-клеточная лимфома представляет собой кожную T-клеточную лимфому. В другом аспекте T-клеточная лимфома представляет собой T-клеточную лимфому взрослых. В одном аспекте T-клеточная лимфома представляет собой периферическую T-клеточную лимфому, лимфобластную лимфому, кожную T-клеточную лимфому, NK/T-клеточную лимфому или T-клеточную лейкемию/лимфому взрослых.
В одном варианте осуществления рак представляет собой саркому. Саркома является раком, который начинает развиваться в мышцах, жировой, фиброзной ткани, кровеносных сосудах или других поддерживающих тканях тела человека. Саркома включает любое из следующего: альвеолярную саркому мягких тканей, ангиосаркому, дерматофибросаркому, десмоидную опухоль, десмопластическую мелкокруглоклеточную опухоль, внескелетную хондросаркому, внескелетную остеосаркому, фибросаркому, гемангиоперицитому, гемангиосаркому, саркому Капоши, лейомиосаркому, липосаркому, лимфангиосаркому, злокачественную фиброзную гистиоцитому, нейрофибросаркому, злокачественную опухоль оболочек периферических нервов (MPNST), рабдомиосаркому, синовиальную саркому, злокачественную мелкоклеточную торакапульмональную опухоль (askin’s tumor), опухоль Юинга, злокачественную гемангиоэндотелиому, злокачественную шванному, остеосаркому, хондросаркому.
В одном аспекте ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль и в некоторых вариантах осуществления в комбинации с бендамустином применяют для лечения саркомы мягких тканей у человека.
В одном аспекте ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль и в некоторых вариантах осуществления в комбинации с бендамустином применяют для лечения миелодиспластического синдрома (MDS) у человека.
В одном аспекте ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль и в некоторых вариантах осуществления в комбинации с бендамустином применяют для лечения хронической миелогенной лейкемии (CML) у человека.
В одном аспекте ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль и в некоторых вариантах осуществления в комбинации с бендамустином применяют для лечения неходжкинской лимфомы у человека. В одном аспекте ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль применяют для лечения болезни Ходжкина у человека.
В одном аспекте ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль и в некоторых вариантах осуществления в комбинации с бендамустином применяют для лечения множественной миеломы у человека.
В одном аспекте ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль и в некоторых вариантах осуществления в комбинации с бендамустином применяют для лечения хронического лимфоцитарного лейкоза. В одном аспекте ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль применяют для лечения острого лимфоцитарного лейкоза.
В одном аспекте ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль и в некоторых вариантах осуществления в комбинации с бендамустином применяют для лечения солидной опухоли у человека.
В одном аспекте ингибитор HDAC (напр., Соединение 1) или его фармацевтически приемлемую соль и в некоторых вариантах осуществления в комбинации с бендамустином применяют для лечения саркомы у человека.
Дополнительные комбинированные терапии
В одном варианте осуществления композиции и способы, описанные здесь, также применяют в сочетании с другими терапевтическими реагентами, которые выбраны по их конкретному терапевтическому значению для рака, подлежащего лечению. В большинстве случаев нет необходимости вводить композиции, описанные здесь и в вариантах осуществления, в которых применяется комбинированная терапия, и другие агенты в одной и той же фармацевтической композиции, и ввиду различных физических и химических свойств введение осуществляют различными способами. В одном варианте осуществления начальное введение осуществляется согласно установленным протоколам и затем, на основании наблюдаемых эффектов, дополнительно изменяют дозу, способы введения и время введения.
В определенных вариантах осуществления конкретный выбор используемых соединений зависит от диагноза лечащих врачей и их мнения о состоянии пациента и подходящем протоколе лечения. В различных вариантах осуществления соединения вводят одновременно (напр., одновременно, в основном одновременно или в рамках одного и того же протокола лечения) или последовательно, в зависимости от характера ракового заболевания, состояния пациента и фактического выбора используемых соединений. В определенных вариантах осуществления определение порядка введения и числа повторных введений каждого терапевтического агента на протяжении протокола лечения основано на оценке заболевания, по поводу которого проводится лечение, и состояния пациента.
В одном варианте осуществления, следует понимать, что режим дозирования для лечения рака изменяется в соответствии с различными факторами. Эти факторы включают тип рака, которым страдает человек, а также возраст, массу тела, половую принадлежность, питание и состояние здоровья человека. Таким образом, в одном варианте осуществления фактически применяемый режим дозирования варьируется в широких пределах и, следовательно, отличается от режимов дозирования, изложенных в настоящем документе. В определенных вариантах осуществления лечение рака комбинацией ингибитора HDAC (напр., Соединения 1) и дополнительного агента позволяет уменьшить эффективное количество ингибитора HDAC (напр., Соединения 1) и/или второго агента.
Лекарственные формы, описанные здесь, вводят и дозируют согласно надлежащей медицинской практике, принимая во внимание клиническое состояние конкретного пациента, способ введения, график введения и другие факторы, известные практикующим врачам.
Рассмотренные фармацевтические композиции обеспечивают терапевтически эффективное количество ингибитора HDAC (напр., Соединения 1), что позволяет осуществлять введение один раз в сутки, два раза в сутки, три раза в сутки и т.д. В одном аспекте фармацевтические композиции обеспечивает эффективное количество ингибитора HDAC (напр., Соединения 1), которое позволяет осуществлять дозирование один раз в сутки.
В определенных случаях предпочтительно вводить ингибитор HDAC (напр., Соединение 1) в комбинации с другим терапевтическим агентом.
В определенных вариантах осуществления терапевтическая эффективность ингибитора HDAC (напр., Соединения 1) увеличена путем введения адъюванта (т.е. сам по себе адъювант обладает минимальным терапевтическим полезным эффектом, но в комбинации с другим терапевтическим агентом общий терапевтический полезный эффект на пациента увеличивается). В некоторых вариантах осуществления полезный эффект, испытываемый пациентом, увеличен путем введения ингибитора HDAC (напр., Соединения 1) с другим терапевтическим агентом (что также включает схему лечения), также имеющим полезный терапевтический эффект. В конкретных вариантах осуществления при лечении рака, включающем введение ингибитора HDAC (напр., Соединения 1), увеличенный терапевтический эффект достигается также путем введения пациенту других терапевтических агентов или терапий рака. В различных вариантах осуществления введение пациенту ингибитора HDAC (напр., Соединения 1) в комбинации со вторым агентом обеспечивает пациента, например, аддитивным или синергическим полезным эффектом.
Терапевтически эффективные дозы варьируются при применении лекарственных средств в лечебных комбинациях. Определение терапевтически эффективных доз лекарственных средств и других агентов при использовании в схемах комбинированного лечения достигается любым способом. Например, может применяться регулярное дозирование, то есть обеспечение более частого введения меньших доз для сведения к минимуму токсических побочных эффектов. В определенных случаях комбинированная терапия обеспечивает терапевтическое количество одного или обоих, ингибитора HDAC (напр., Соединения 1) и второго агента, которое меньше, чем количество, которое будет получено при введении каждого агента по отдельности.
Режим комбинированной терапии включает, в качестве неограничивающего примера, режимы лечения, в которых введение ингибитора HDAC (напр., Соединения 1) инициируют перед, во время или после лечения вторым агентом, и продолжат до любого момента времени во время лечения вторым агентом или после прекращения лечения вторым агентом. Это также включает терапии, в которых ингибитор HDAC (напр., Соединение 1) и второй агент, использующийся в комбинации, вводят одновременно или в различные моменты времени и/или с уменьшенными или увеличенными интервалами во время лечебного периода. Комбинированное лечение, кроме того, включает периодические терапии, которые начинают и останавливают в разные моменты времени для содействия клиническому сопровождению пациента.
В любом случае несколько терапевтических агентов (один из которых представляет собой ингибитор HDAC (напр., Соединение 1)) вводят в любом порядке, в том числе, например, одновременно. При одновременном введении несколько терапевтических агентов представлено в различных вариантах осуществления в одной единой форме или в нескольких формах (исключительно в качестве примера, либо в форме одной пилюли, либо в форме двух отдельных пилюль). В различных вариантах осуществления один из терапевтических агентов вводят в нескольких дозах, или оба вводят в нескольких дозах. В определенных вариантах осуществления, в которых введение нескольких агентов не является одновременным, время между введением нескольких агентов представляет собой любой приемлемый интервал, включающий, например, от более чем нуля недель до менее чем четырех недель. В некоторых вариантах осуществления способы комбинирования, композиции и препараты включают ингибитор HDAC (напр., Соединение 1), второй агент и третий агент. В дополнительных вариантах осуществления также используются дополнительные агенты.
В определенных вариантах осуществления начальное введение осуществляют посредством перорального введения, такого как, например, пилюля, капсула, таблетка, раствор, суспензия и тому подобное, или их комбинации. В определенных вариантах осуществления ингибитор HDAC (напр., Соединение 1) вводят, как только это становится возможным после обнаружения или подозрения начала развития рака и в течение периода времени, необходимого для лечения рака. В определенных вариантах осуществления введение агентов, лекарственных форм или композиций, описанных в настоящем документе, производят в течение времени, необходимого для лечения рака, включая, в качестве неограничивающего примера, по меньшей мере 2 недели, по меньшей мере 1 месяц или более 1 месяца.
В одном аспекте ингибитор HDAC (напр., Соединение 1) вводят человеку в комбинации, по меньшей мере, с одним дополнительным терапевтическим агентом, выбранным из ДНК-повреждающих агентов; ингибиторов топоизомеразы I или II; алкилирующих агентов; ингибиторов PARP; ингибиторов протеосом; антиметаболитов РНК/ДНК; антимитотических агентов; иммуномодулирующих средств; антиангиогенных препаратов; ингибиторов ароматазы; гормономодулирующих препаратов; апоптоз-индуцирующих агентов; ингибиторов киназы; моноклональных антител; абареликса; ABT-888; алдеслейкина; алдеслейкина; алемтузумаба; алитретиноина; аллопуринола; альтретамина; амифостина; анастрозола; триоксида мышьяка; аспарагиназы; азацитидина; AZD-2281; бендамустина; перифозина; леналиномида; хлорохина; бевацизумаба; бексаротена; блеомицина; бортезомиба; BSI-201; бусульфана; калустерона; капецитабина; карбоплатина; карфилозиба; кармустина; целекоксиба; цетуксимаба; хлорамбуцила; цисплатина; кладрибина; клофарабина; циклофосфамида; цитарабина; липосомальной формы цитарабина; дакарбазина; дактиномицина; дарбепоетина альфа; дазатиниба; липосомальной формы даунорубицина; даунорубицина; децитабина; денилейкина; дексразоксана; доцетаксела; доксорубицина; липосомальной формы доксорубицина; дромостанолона пропионата; эпирубицина; эпоэтина альфа; эрлотиниба; эстрамустина; этопозида фосфата; этопозида; экземестана; филграстима; флоксуридина; флударабина; фторурацила; фулвестранта; гефитиниба; гемцитабина; гемтузумаба озогамицина; гозерелина ацетата; гистрелина ацетата; гидроксимочевины; ибритумомаба тиуксетана; идарубицина; ифосфамида; иматиниба мезилата; интерферона альфа-2a; Интерферона альфа-2b; иринотекана; леналидомида; летрозола; лейковорина; леупролида ацетата; левамизола; ломустина; меклоретамина; мегестерола ацетата; мелфалана; меркаптопурина; метотрексата; метоксалена; митомицина-C; митотана; митоксантрона; нандролона фенпропионата; неларабина; NPI-0052; нофетумомаба; опрелвекина; оксалиплатина; паклитаксела; связанных с белком частиц паклитаксела; палифермина; памидроната; панитумумаба; пегадемазы; пегаспаргазы; пегфилграстима; пеметрекседа динатрия; пентостатина; пипобромана; пликамицина; митрамицина; порфимера натрия; прокарбазина; квинакрина; RAD001; расбуриказы; ритуксимаба; сарграмостима; Сартрамостима; сорафениба; стрептозоцина; сунитиниба малата; тамоксифена; темозоломида; тенипозида; тестолактона; талидомида; тиогуанина; тиотепа; топотекана; торемифена; тозитумомаба; тозитумомаба/I-131 тозитумомаба; трастузумаба; третиноина; урацилового иприта; валрубицина; винбластина; винкристина; винорелбина; вориностата; золедроната; и золедроновой кислоты. В некоторых вариантах осуществления ингибитор HDAC (напр., Соединение 1) вводят человеку в комбинации с бендамустином и ритуксимабом.
В одном аспекте ингибитор HDAC (напр., Соединение 1) вводят человеку в комбинации с ингибитором топоизомеразы, тубулин-связывающим агентом, агентом, взаимодействующим с ДНК, ДНК-алкилирующим агентом и/или комплексом платины.
В одном аспекте ингибитор HDAC (напр., Соединение 1) вводят человеку в комбинации с оксалиплатином, ингибитором тирозинкиназы, иринотеканом (CPT-11), азацитидином, флударибином или бендамустином.
Ингибиторы тирозинкиназы включают, но без ограничения, эрлотиниб, гефитиниб, лапатиниб, вандетаниб, нератиниб, лапатиниб, нератиниб, акситиниб, сунитиниб, сорафениб, лестауртиниб, семаксаниб, седираниб, иматиниб, нилотиниб, дазатиниб, босутиниб, лестауртиниб, ваталаниб и соратиниб.
В одном аспекте ингибитор HDAC (напр., Соединение 1) вводят человеку в комбинации с ДНК-повреждающим противораковым агентом и/или лучевой терапией.
ДНК-повреждающие противораковые агенты и/или лучевая терапия включают, но без ограничения, ионизирующее излучение, радиомиметические лекарственные средства, монофункциональные алкиляторы (напр., алкилсульфонаты, нитрозомочевины, темозоломид), бифункциональные алкиляторы (азотистый иприт, митомицин С, цисплатин), антиметаболиты (напр., 5-фторурацил, тиопурины, фолатные аналоги), ингибиторы топоизомеразы (напр., камптотецины, этопозид, доксорубицин), ингибиторы репликации (напр., афидиколин, гидросимочевина), цитотоксические/цитостатические агенты, антипролиферативные агенты, ингибиторы фенил-протеин-трансферазы, азотистые иприты, нитрозомочевина, ингибиторы ангиогенеза, ингибиторы клеточной пролиферации и сигнальных путей выживания, апоптоз-индуцирующие агенты, агенты, которые влияют на контрольные точки клеточного цикла, бифосфонаты или любые их комбинации.
В одном аспекте ингибитор HDAC (напр., Соединение 1) вводят человеку в комбинации с ингибитором внутренней множественной лекарственной устойчивости (MDR), в частности MDR, связанной с высокими уровнями экспрессии транспортных белков. Такие ингибиторы MDR включают ингибиторы p-гликопротеина (P-gp), такие как LY335979, XR9576, ОС144-093, R101922, VX853 и PSC833 (валсподар).
В одном аспекте ингибитор HDAC (напр., Соединение 1) вводят человеку в комбинации с противорвотными средствами для лечения тошноты или рвоты, в том числе острой, отсроченной, поздней и ожидаемой рвоты, которая может быть вызвана применением ингибитора HDAC (напр., Соединения 1), отдельно или в сочетании с радиационной терапией. Противорвотные средства включают антагонисты рецептора нейрокинина 1, антагонисты 5НТ3-рецепторов (такие как ондансетрон, гранисетрон, трописетрон, палоносетрон и затисетрон), агонисты CABAB-рецепторов (такие как баклофен), кортикостероиды (такие как дексаметазон, преднизон, преднизолон или другие, такие как раскрытые в патентах США №№2789118; 2990401; 3048581; 3126375; 3929768; 3996359; 3928326 и 3749712), антагонисты допамина (такие как домперидон, дроперидол, галоперидол, хлорпромазин, прометазин, прохлорперазин, метоклопрамид), антигистамины (антагонисты Н1-рецепторов гистамина, такие как циклизин, дифенгидрамин, дименгидринат, меклизин, прометазин, гидроксизин), каннабиноиды (такие как каннабис, маринол, дронабинол) и другие (такие как триметобензамид; имбирь, эметрол, пропофол).
В одном аспекте ингибитор HDAC (напр., Соединение 1) вводят человеку в комбинации с противорвотным средством, выбранным из антагониста рецепторов нейрокинина-1, антагониста 5НТ3-рецепторов и кортикостероида.
В другом аспекте ингибитор HDAC (напр., Соединение 1) вводят человеку в комбинации с агентом, полезным в лечении анемии. Такой агент для лечения анемии представляет собой, например, активатор рецепторов эритропоэза длительного действия (такой как эпоэтин-альфа).
В другом аспекте ингибитор HDAC (напр., Соединение 1) вводят человеку в комбинации с агентом, полезным для лечения нейтропении. Примеры агентов, полезных для лечения нейтропении, включают, но без ограничения, гематопоэтический фактор роста, который регулирует выработку и функцию нейтрофилов, такой как гранулоцитарный колониестимулирующий фактор (G-CSF). Примеры G-CSF включают филграстим.
В отдельных вариантах осуществления ингибитор HDAC (напр., Соединение 1) вводят человеку в комбинации с ингибитором, по меньшей мере, одного фермента CYP. В ситуациях, когда ингибитор HDAC метаболизируется одним или несколькими ферментами CYP, совместное введение с ингибитором CYP уменьшает метаболизм in vivo ингибитора HDAC и улучшает фармакокинетические свойства ингибитора HDAC.
Другие комбинированные терапии раскрыты в WO 08/082856 и WO 07/109178, содержание которых включено в полном объеме в настоящий документ посредством отсылки.
Лучевая терапия
В одном аспекте ингибитор HDAC (напр., Соединение 1) вводят в комбинации с радиационной терапией. Радиационная терапия, также называемая лучевой терапией, представляет собой лечение рака и других заболеваний ионизирующим излучением. Ионизирующее излучение осаждает энергию, которая повреждает или разрушает клетки в обрабатываемой области («целевой ткани») путем повреждения их генетического материала, делая невозможным для этих клеток продолжать рост. Несмотря на то, что радиационное излучение повреждает как раковые клетки, так и нормальные клетки, последние в большей степени способны самостоятельно восстанавливаться и функционировать соответствующим образом. Радиационная терапия может применяться для лечения локализованных солидных опухолей, таких как рак кожи, языка, гортани, мозга, молочной железы, предстательной железы, толстой кишки, матки и/или шейки матки. Радиационная терапия также может применяться для лечения лейкоза и лимфомы (рака кроветворных клеток и лимфатической системы, соответственно).
Методы доставки радиационного излучения в раковые клетки состоят в помещении радиоактивных имплантов непосредственно в опухоль или полость тела. Это называется внутренняя лучевая терапия (близкофокусная лучевая терапия, внутритканевое облучение и внутриполостное облучение представляют собой виды внутренней лучевой терапии). С использованием внутренней лучевой терапии доза излучения концентрируется в небольших областях, и пациент остается в госпитале в течение нескольких дней. Внутренняя лучевая терапия часто применяется в отношении рака языка, матки, предстательной железы, толстой кишки и шейки матки.
Термин «лучевая терапия» или «ионизирующее излучение» включает все формы излучения, включая, но без ограничения, α, β и γ излучение и ультрафиолетовый свет. Лучевая терапия совместно или без сопутствующей или последующей химиотерапии является эффективным способом воздействия на рак головы и шеи, молочной железы, кожи, аногенитального рака и некоторых незлокачественных заболеваний, таких как келоидная, десмоидная опухоль, гемангиома, артериовенозная мальформация и гистоцитоз X.
Обеспечены способы применения ингибитора HDAC (напр., Соединения 1) для снижения побочного эффекта, вызванного по меньшей мере одним другим терапевтическим лечением, такого как индуцированный излучением фиброз нормальных тканей или индуцированный химиотерапией некроз тканей, при этом способы, обеспеченные в настоящем документе, к тому же синергически ингибируют рост клеток опухоли с помощью лучевой терапии и других противораковых агентов. RAD51
Повреждение ДНК вызывает хромосомальную нестабильность, онкогенез, гибель клеток и тяжелую дисфункцию клеток. Система восстановления ДНК является исключительно важной для выживания живых клеток. Два главных механизма восстановления ДНК, вовлеченные в восстановление разрывов двунитиевой ДНК, представляют собой гомологическую рекомбинацию (HR) и негомологичное соединение концов (NHEJ). Эукариотический ген RAD51 является ортологом Escherichia coli RecA, и продукт гена белок RAD51 играет центральную роль в гомологичной рекомбинации.
Много терапевтических терапий, таких как противораковые средства, проявляют свои терапевтические эффекты посредством своей способности производить повреждение ДНК клеток. Если клетки, такие как раковые клетки, имеют активные механизмы восстановления ДНК, терапевтические эффекты таких терапий могут быть нарушены и высокие дозы могут потребоваться для достижения желаемых терапевтических эффектов.
В одном аспекте ингибитор HDAC (напр., Соединение 1) применяется для понижения клеточной активности восстановления ДНК у человека, имеющего рак.
В одном аспекте представлены способы лечения рака путем использования ингибитора HDAC (напр., Соединения 1) для уменьшения клеточной активности восстановления ДНК в комбинированной терапии. Описаны способы комбинированной терапии, в которых ингибитор HDAC (напр., Соединение 1) препятствует механизму восстановления ДНК, включающему RAD51 или BRCA1.
В одном аспекте представлены способы лечения рака, связанного с дефектом в негомологическом соединении концов ДНК, включающие: (a) введение человеку, имеющему рак, связанный с дефектом в негомологическом соединении концов ДНК, терапевтически эффективного количества ингибитор HDAC (напр., Соединения 1); и b) введение человеку терапии, способной повреждать клеточную ДНК.
Дефекты в негомологическом соединении концов ДНК включают дефект в гене, выбранном из группы, состоящей из Ku70, Ku80, Ku86, Ku, PRKDC, LIG4, XRCC4, DCLRE1C и XLF. В одном аспекте рак выбран из лимфомы Буркетта, хронической миелогенной лейкемии и B-клеточной лимфомы. В одном аспекте рак представляет рак, описанный в настоящем документе.
В одном аспекте ингибитор HDAC (напр., Соединение 1) применяюется для лечения альтернативного удлинения теломера (ATL) позитивного рака у человека.
Дополнительные комбинированные терапии, стратегии лечения и тому подобное, которые включают ингибирование активности RAD51 (напр., ингибитор HDAC (напр., Соединение 1)), раскрыты в патенте США 20080153877 и WO 08/082856 (оба из которых включены в настоящий документ путем отсылки).
Наборы/готовые изделия
В настоящем документе также описаны наборы и готовые изделия для использования в терапевтических способах применения, описанных в настоящем документе. Такие наборы включают носитель, упаковку или контейнер, который разделен на ячейки для одной или нескольких контейнеров, таких как флаконы, тубы и тому подобное, при этом каждый контейнер(ы) содержит один из отдельных элементов для применения в способе, описанном в настоящем документе. Пригодные контейнеры включают, например, бутыли, флаконы, шприцы и пробирки. В одном варианте осуществления контейнеры изготовлены из различных материалов, таких как стекло или пластик.
Готовые изделия, обеспеченные в настоящем документе, включают упаковочные материалы. Упаковочные материалы для упаковки в фармацевтических упаковочных продуктах включают, например, патенты США №№5323907, 5052558 и 5033252. Примеры фармацевтических упаковочных материалов включают, но без ограничения, блистерные упаковки, бутылки, тубы, ингаляторы, сумки, контейнеры, бутыли и любой упаковочный материал, пригодный для выбранного состава, а также предполагаемого способа введения и лечения. Предполагают широкий спектр составов соединений и композиций, предложенных в настоящем документе.
Такие наборы необязательно содержат идентификационное описание или этикетку, или инструкции по его применению в способах, описанных в настоящем документе.
В одном варианте осуществления этикетка находится на контейнере или связана с ним. В одном варианте осуществления этикетка находится на контейнере, при этом буквы, цифры или другие символы, образующие этикетку, формованы или выгравированы на самом контейнере, этикетка может быть присоединена к контейнеру, когда она присутствует в резервуаре или носителе, в котором также находится котейнер, например, в виде листовки-вкладыша в упаковке. В одном варианте осуществления этикетка используется для краткого обозначения того, что содержимое следует использовать для конкретных терапевтических применений. На этикетке также указаны инструкции по применению содержимого, например как в способах, описанных в настоящем документе.
В некоторых вариантах осуществления фармацевтические композиции представлены в упаковке или диспенсерном устройстве, которое содержит одну или несколько стандартных лекарственных форм, содержащих соединение, обеспеченное в настоящем документе. Упаковка, например, содержит металлическую или пластиковую фольгу, такую как блистерная упаковка. В одном варианте осуществления упаковка или диспенсерное устройство снабжено инструкцией по введению. В одном варианте осуществления упаковка также снабжена уведомлением, связанным с контейнером, в форме, предписанной правительственным органом, регулирующим изготовление, применение или продажу фармацевтических продуктов, при этом указанное уведомление отражает разращение указанного органа на форму лекарственного средства для применения у людей или в ветеринарии. Такое уведомление, например, представляет собой маркировку, одобренную Управлением по контролю за продуктами и лекарственными средствами США для лекарственных средств, отпускаемых по рецепту, или одобренный вкладыш для продукта.
Примеры
Данные примеры представлены только с иллюстративной целью и не предназначены для ограничения объема формулы изобретения, представленной в настоящем документе.
Синтез Соединения 1, HCl
Соединение 1, HCl готовили, как указано в Примере 7 Патента США №7276612, содержание которого включено в настоящий документ полностью путем отсылки.
Пример 1: IV Раствор Соединения 1
Соединение 1 формулировали в виде растворов для внутривенного (IV) введения для первичных клинических испытаний у человека. Раствор IV представляет собой водный раствор препарата, предназначенный для введения путем вливания после разбавления изотоническим физиологическим раствором. Каждый флакон одноразового использования содержит 25 мл 5 мг/мл (0.5%) раствора Соединения 1 в изотоническом физиологическом растворе и 50 мМ лактатного буфера, pH 4.0-4.5. Все вспомогательные вещества в препаратах для клинического исследования имеют фармакопейную степень очистки и обычно применяются в парентеральных препаратах. Количественный состав препарата представлен в Таблице 1. Рекомендуемым условием хранения является 2-8°C.
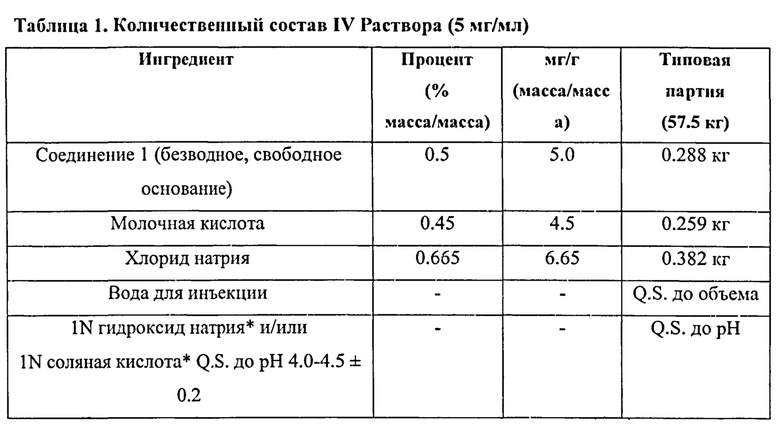
Пример 2: Капсулы с немедленным высвобождением
Капсулы с немедленным высвобождением формулировали путем смешивания HCl соли Соединения 1 с микрокристаллической целлюлозой, лактозой и стеаратом магния, и затем добавления смеси в желатиновые капсулы (смотри Таблицу 2). Капсулы изготовлены в двух дозировках. Дозировка 20 мг включает 20 мг HCl соли Соединения 1 в твердой желатиновой капсуле, размер 4, оранжево-красного цвета (Swedish orange). Дозировка 100 мг включает 100 мг HCl соли Соединения 1 в твердой желатиновой капсуле, размер 2, темно-зеленого цвета. Капсулы упакованы по 30 штук (30сс) в бутыли из полиэтилена высокой плотности (HDPE) и герметично запечатаны посредством индукционной запайки и закрыты безопасной для детей винтовой крышкой. Дозировка 20 мг упакована в виде 50 капсул на бутыль. Дозировка 100 мг упакована в виде 30 капсул на бутыль. Бутыли хранятся при контролируемой комнатной температуре 20-25°C (68-77°F).

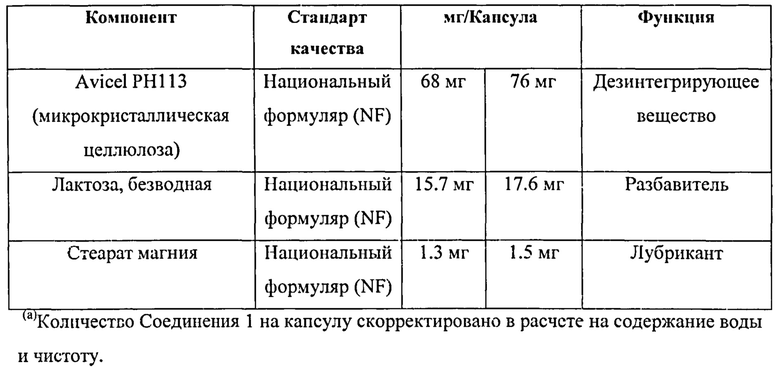
Пример 3: Препарат со спланированным по времени импульсным высвобождением, состоящий из множества частиц
80 грамм хлорида натрия и 24 грамма поливинилпирролидона растворяли в 1.2 килограммах воды и в полученном растворе суспендировали 400 грамм порошкообразного Соединения 1, HCl.
В аппарате псевдоожиженного слоя для нанесения оболочек 400 грамм зерен из крахмала/сахара (30/50 меш) суспендируют в теплом воздухе и наносят распылением суспензию Соединения 1, HCl до тех пор, пока зерна не будут равномерно покрыты лекарственном средством с желаемой активностью.
Стеарат магния в изопропиловом спирте смешивают с Eudragit NE30D (фирмы Rohm Pharma of Weiterstadt, Германия) в соотношении сухого полимера к стеарату магния два к 1. Достаточное количество полимерной суспензии распыляют на активные ядра для обеспечения пленочного покрытия конкретной толщины для достижения конкретного времени задержки и скорости высвобождения для популяции пеллет. Готовые покрытые пеллеты сушат при 50°C в течение 2 часов для обеспечения полного удаления влаги для стабилизации содержимого ядра.
Процедуру повторяют, по меньшей мере, с еще одной партией с использованием другой толщины покрытия для получения другого времени задержки и скорости высвобождения. В этом примере было приготовлено две популяции, одна с 10% увеличением массы и одна с 30% увеличением массы покрытия. Стандартные дозы готовят путем смешивания двух популяций вместе в предварительно определенных пропорциях и заполняют смесью капсулы.
После перорального введения стандартной дозы человеку первая популяция пеллет не начинает высвобождение Соединения 1, HCl до тех пор, пока не пройдет интервал времени, составляющий примерно 2-3 часа. Вторая популяция пеллет не начинает высвобождение Соединения 1, HCl до тех пор, пока не пройдет интервал времени, составляющий примерно 6-7 часов. Среднее время высвобождения (время, когда высвобождается половина лекарственного средства) каждой популяции пеллет должно быть отделено друг от друга интервалом, составляющим, по меньшей мере, 3-4 часа.
Аппататы псевдоожиженного слоя для нанесения оболочек хорошо известны в данной области, однако могут быть использованы другие аппараты для нанесения оболочек и способы, хорошо известные в данной области.
Пример 4: Альтернативный препарат со спланированным по времени импульсным высвобождением, состоящий из множества частиц
Активные ядра получают, как описано в Примере 3. Стеарат магния и пластификатор триацетин смешивают с суспензией Eudragit RS 30D в весовом соотношении по сухому веществу 1:0.6:2. Полимерной суспензией покрывают ядра, как описано в Примере 3, получая множество популяций, каждая из которых имеет конкретную толщину покрытия для обеспечения конкретного времени задержки и скорости высвобождения лекарственного средства в используемой водной среде.
Различные популяции пеллет смешивают, и смесь используют для заполнения капсул, как описано в Примере 3.
Пример 5: Препарат с импульсным высвобождением - Таблетки в капсуле
Лекарственную форму с импульсным высвобождением для введения Соединения 1, HCl соли, изготавливают путем (1) формулирования двух индивидуальных прессованных таблеток, каждая из которых имеет разный профиль высвобождения, с последующим (2) инкапсулированием двух таблеток в желатиновую капсулу и затем закрытием и герметизацием капсулы. Компоненты двух таблеток представляют собой следующие.

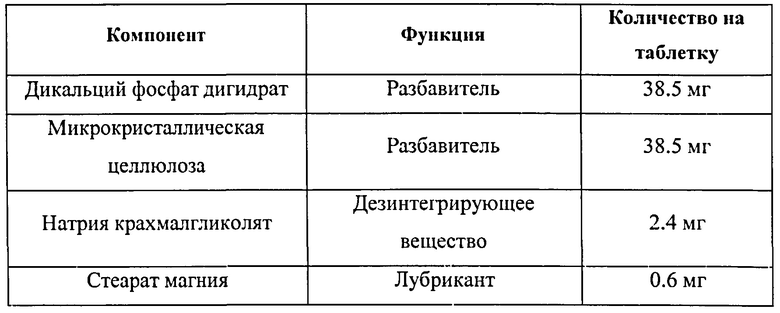
Таблетки изготовлены путем влажной грануляции индивидуальных частиц лекарственного средства и других компонентов ядра с использованием гранулятора с псевдоожиженным слоем, или путем прямого прессования смеси компонентов. Таблица 1 представляет собой лекарственную форму с немедленным высвобождением, высвобождающую активный агент полностью в течение 1-2 часов после введения.
На половину таблеток с немедленным высвобождением нанесено Покрытие с отсроченным высвобождением №1 для обеспечения Таблетки 2. Таблетка 2 задерживает высвобождение Соединения 1, HCl примерно на 3-5 часов после введения. На половину таблеток с немедленным высвобождением нанесено Покрытие с отсроченным высвобождением №2 для обеспечения Таблетки 3. Таблетка 3 задерживает высвобождение Соединения 1, HCl примерно на 4-9 часов после введения. Покрытие наносится с использованием обычных методов нанесения покрытия, таких как нанесение покрытия распылением или тому подобное.
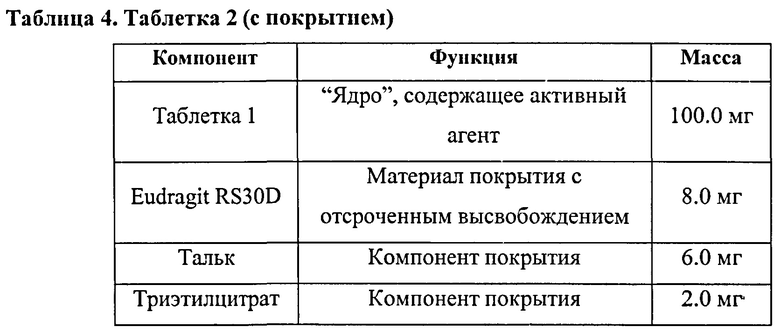

Пероральное введение капсулы пациенту должно привести к профилю высвобождения, имеющему два импульса, с начальным высвобождением Соединения 1, HCl, возникающим примерно через 3-5 часов после введения, и высвобождением Соединения 1, HCl из второй таблетки, возникающим примерно через 7-9 часов после введения.
Пример 6: Препарат с импульсным высвобождением - Шарики в капсуле или таблетка
Способ по Примеру 5 повторяют, за исключением того, что шарики, содержащие лекарственное средство, используют вместо таблеток. Шарики с немедленным высвобождением готовят путем покрытия лекарственным средством инертного материала подложки, такого как лактоза. Шарики с немедленным высвобождением покрывают энтеросолюбильным материалом покрытия в количестве, достаточном для обеспечения периода времени, в течение которого высвобождение отсутствует, составляющего примерно 3-5 часов. Вторую фракцию шариков готовят путем покрытия шариков с немедленным высвобождением энтеросолюбильным материалом покрытия в большем количестве, достаточном для обеспечения периода, в течение которого высвобождение отсутствует, составляющего примерно 7-9 часов. Две группы покрытых шариков инкапсулируют, как описано в Примере 5, или прессуют в присутствии смягчающего агента в стандартную таблетку с пульсирующим высвобождением.
Пример 7: Таблетка с замедленным высвобождением
Таблетки с замедленным высвобождением Соединения 1, HCl готовят сначала путем приготовления вспомогательного вещества с замедленным высвобождением. Вспомогательное вещество с замедленным высвобождением готовят путем сухого смешивания требуемых количеств ксантановой камеди, смолы плодоворожкового дерева, фармацевтически приемлемого гидрофобного полимера и инертного разбавителя в высокоскоростном смесителе/грануляторе в течение 2 минут. Во время работы чопперов/импеллеров добавляют воду, и смесь гранулируют еще в течение 2 минут. Гранулированный материал затем сушат в сушит еле с псевдоожиженным слоем для потери массы при высушивании («LOD») между 4 и 7%. Гранулированный материал затем измельчают с использованием экранов 20 меш. Ингредиенты вспомогательных веществ с замедленным высвобождением представлены в Таблице 6 ниже:

Далее, вспомогательное вещество с замедленным высвобождением, приготовленное, как подробно описано выше, перемешивают в сухом состоянии с требуемым количеством Соединения 1, HCl в V-смесителе в течение 10 минут. Добавляют пригодное количество таблетированного лубриканта Pruv® (стеарилфумарат натрия, NF) для последующих образцов и смесь перемешивают еще в течение 5 минут. Эту конечную смесь прессуют в таблетки, при этом каждая таблетка содержит 10% по массе Соединения 1, HCl. Масса полученных таблеток составляет 500 мг (Диаметр равен 3/8 дюйма; твердость 2.6 Кр). Состав таблеток указан в Таблице 7 ниже.

Затем проводят тестирование таблеток на растворимость. Тесты на растворимость выполняют на автоматизированном оборудовании для определения скорости растворения USP (Лопастного типа II, буфер pH 7.5, 50 об/мин в 500 мл). Таблетки должны высвобождать примерно 30% Соединения 1, HCl за 2 часа с последующим замедленным высвобождением таким образом, что примерно 98% Соединения 1, HCl высвобождается по истечении 12 часов.
Пример 8: Покрытые таблетки с замедленным высвобождением
Вспомогательное вещество с замедленным высвобождением готовят, как описано выше, путем сухого смешивания требуемых количеств ксантановой камеди, смолы пловорожкового дерева и инертного разбавителя. Дополнительные 2 минуты грануляции используют после добавления компонентов (всего 4 минуты грануляции после добавления). Водную дисперсию этилцеллюлозы замещают водой, как описано в указанных выше способах. Компоненты вспомогательного вещества с замедленным высвобождением описаны в Таблице 8.
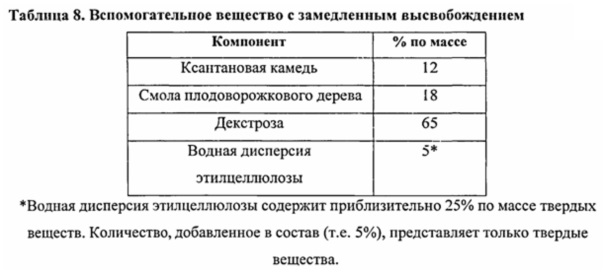
Ксантановую камедь и смолу плодоворожкового дерева перемешивают в сухом состоянии в V-смесителе в течение 10 минут, добавляют декстрозу, и смесь перемешивают еще в течение 5 минут. Затем добавляют водную дисперсию этилцеллюлозы с последующим перемешиванием дополнительно в течение 5 минут. Полученный гранулированный материал затем прессуют в таблетки с натрия стеарил фумаратом в качестве лубриканта для таблетирования. Таблетки затем покрывают дополнительной водной дисперсией этилцеллюлозы. Для этого этилцеллюлозу (Surelease®, 400 г) смешивают с водой (100 г) для формирования водной суспензии. После этого таблетки покрывают на установке для нанесения оболочки Keith Machinery (диаметр 350 мм; скорость вращения 20 об/мин; сопло распылителя 0.8 мм; температура в слое таблеток 40°-50°C; загрузка на партию 1 кг; сухой воздух - Conair Prostyle 1250, 60°-70°C). Таблетки покрывают до увеличения массы примерно на 5%. Таблетки должны весить примерно 500 мг. Состав таблеток представлен в Таблице 9 ниже:

Тесты на растворимость выполняют на автоматизированном оборудовании для определения скорости растворения USP таким образом, чтобы смоделировать прохождение через желудочно-кишечный тракт. Покрытые таблетки не должны высвобождать больше, чем 10% Соединения 1, HCl в течение первых 1-2 часов и затем должны высвобождать Соединение 1, HCl с постоянной скоростью так, чтобы примерно от 90% до 100% Соединения 1, HCl высвобождалось по истечении 12 часов.
Пример 9: Профили высвобождения in vitro
Профили растворения получены с использованием аппарата United States Pharmacopeia Apparatus I при 37°C и 100 об/мин. Среда растворения изменяется с течением времени, начиная с 0.1 N HCl в течение 0-2 часов. В период от 2 до 4 часов средой является фосфатный буфер с pH 6.5, и в период от 4 до 24 часов средой является фосфатный буфер с pH 7.5.
Альтернативно, профили растворения получали с использованием аппарата USP Типа III (VanKel Bio-Dis II).
Пример 10: Протокол растворения in vitro после приема пищи/натощак
Тестируемые препараты оценивают в различных условиях полного растворения для определения влияния pH, среды, перемешивания и аппарата. Тесты на растворимость выполняют с использованием аппарата USP Тип III (VanKel Bio-Dis II). Для определения различий, в случае присутствия, в кинетике растворения между состоянием после приема пищи и состоянием натощак для серий препаратов, проводят эксперименты по растворению in vitro в растворе, содержащем 30% арахисового масла («после приема пищи») для моделирования желудочно-кишечного тракта с обычной нагрузкой жира, входящего в рацион. Контролем служат скорости растворения, определенные в растворе, не содержащем нагрузки жиров («натощак»). Протокол pH-время (изменяющийся от кислоты до щелочи для моделирования процесса переваривания) представлен ниже в Таблице 10. Скорость перемешивания составляет 15 об/мин. Объем тестируемого образца составляет 250 мл.
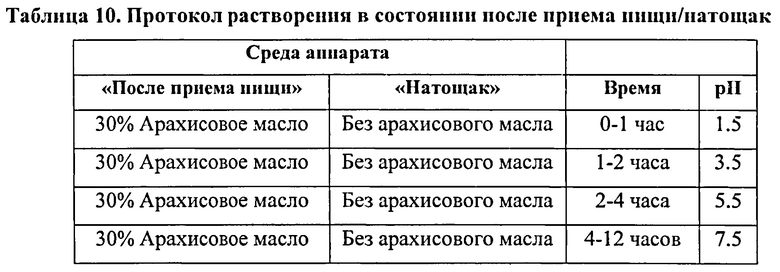
Предполагается, что энтеросолюбильное покрытие на таблетке позволит получить таблетку, которая обеспечивает скорости растворения, которые значительно не различаются между состояниями после приема пищи и натощак.
Пример 11: Исследование схемы дозирования in vitro
Фармакокинетические данные (pk), полученные от пациентов-людей, использовали для моделирования разных режимов дозирования с использованием клеточных линий человека: Jurkat (T-лимфобластная лейкемия) и HCT-116 (рак толстой кишки). Клеточные линии человека обрабатывали с использованием или без использования ингибитора HDAC (напр., Соединения 1). Клетки выращивали, обрабатывали в соответствии с различными режимами и концентрациями для моделирования соответствующего режима дозирования (непрерывная низкая доза: 0.2 мкМ; внутривенно (IV): 2 мкМ 3 часа + 0.3 мкМ 4 часа; перорально BID: 0.4 мкМ 4 часа × 2, 4 часов интервал; перорально последовательно BID: 0.4 мкМ 8 часов; перорально последовательно TID: 0.266 мкМ 12 часов), затем промывали для имитации in vivo PK человека.
На Фигурах 1 и 2 представлены сводные результаты исследований режима дозирования in vitro. Было определено, что непрерывное воздействие ингибитора HDAC (т.е. Соединения 1) в течение, по меньшей мере, 8 часов обеспечивает хорошую эффективность. Пероральное BID дозирование является более эффективным при последовательном приеме (т.е. с интервалом 4 часа), чем с прерыванием, аналогично IV дозированию, смоделированному с воздействием в течение 8 часов. Дозирование перорально три раза в день (tid) было лучше, чем дозирование дважды в день (bid), достигая непрерывного уровня 0.2 мкМ.
Жизнеспособность клеток изучали путем анализа апоптоза с использованием сортировки клеток с активированной флуоресценцией (FACS) после окрашивания аннексином V-FITC и пропидием йодидом (PI). Вкратце, после обработки, 1×106 клеток промывали фосфатно-солевым буферным раствором (PBS) и затем метили аннексином V-FITC/PI в связывающем буфере согласно протоколу производителя. Флуоресцентные сигналы FITC и PI детектировали, соответственно, при 518 нм и 620 нм на Beckman Coulter FACS instrument (Fullerton, CA). Данные анализировали с помощью программного обеспечения Flow Jo software (Tree Star, Ashland, OR).
Пример 12: Фаза 1 клинического исследования безопасности и переносимости пероральной капсульной формы Соединения 1, HCl у пациентов с распространенным раком
Речь идет о Фазе 1 исследования безопасности, фармакокинетики и фармакодинамики с эскалацией дозы Соединения 1, HCl, вводимого перорально пациентам с распространенным раком.
Цель:
Целью данного исследования является определение самой высокой дозы Соединения 1, HCl, которую можно принимать без вызывания серьезных побочных эффектов у пациентов с распространенным раком. В исследование рассматривается безопасность исследуемого лекарственного средства (Соединения 1, HCl) и переносимость схемы лечения пациентами.
Дизайн исследования
На Фазе 1 исследования с эскалацией дозы, до 7 кагорт будут получать Соединение 1, HCl перорально в дозах, начинающихся от 30 мг/м2, с интервалом приблизительно 4-6 часов, до 90 мг/м2, 2 или 3 раза в сутки в соответствии с 3 различными режимами дозирования в пределах 28-дневного цикла (5 дней дозирования с последующими 2 днями отсутствия дозирования; 5 дней дозирования с последующими 9 днями отсутствия дозирования; 7 дней дозирования с последующими 7 днями отсутствия дозирования) до достижения максимальной переносимой дозы.
Отбор участников исследования
Пациенты должны удовлетворять следующим критериям: Возраст не менее 18 лет; гистологически подтверждено, измеряемая солидная опухоль, неходжкинская лимфома, болезнь Ходжкина, хронический лимфоцитарный лейкоз или множественная миелома, которая рецидивировала после стандартной терапии или в отношении которой не существует стандарной терапии; способность проглатывать пероральные капсулы без затруднений; ожидаемая продолжительность жизни >12 недель; статус по шкале ECOG ≤2; Креатинин ≤1.5 × институционная верхняя граница нормального диапазона (ULN); Общий билирубин ≤1.5 × институционная ULN (если не повышена в результате задокументированного синдрома Гилберта); AST и ALT ≤2.5 × институционная ULN (≤5 × институционная ULN в присутствии метастаз в печени); Число тромбоцитов ≥100000/мкл; ANC ≥1500/мкл; Hgb ≥9.0 г/дл; Пациенты с ранее проходящими лечение, стабильными, асимптоматическими метастазами в головной мозг, которые не принимают кортикостероиды, являются включенными; Желание и готовность подписать письменное информированное согласие.
Результаты
При доставке посредством лекарственной формы в виде капсулы с немедленным высвобождением терапевтический эффект Соединения 1 был достигнут с помощью 2 или 3 последовательных доз (каждую дозу вводили с ингервалом от 4 до 6 часов) в дни, запланированные для дозирования. Дозы давали каждый день в одно и то же время. В диапазоне ежедневного воздействия от 0.63 до 2.15 мкМ⋅ч, последовательное дозирование три раза в день (TID) было связано с более высокой средней степенью тромбоцитопении, по сравнению с последовательным дозированием два раза в день (BID). При доставке посредством лекарственной формы в виде капсулы с немедленным высвобождением терапевтический эффект Соединения 1 был достигнут с помощью 2 доз, вводимых с интервалом от 4 до 6 часов в дни, запланированные для дозирования. Две дозы давали каждый день в одно и то же время, при этом вторую дозу вводили прибизительно с интервалом от 4 до 6 часов после первой дозы.
У пациентов с солидной опухолью и лимфомой фармакодинамический ответ на Соединение 1 был достигнут с ограниченным развитием тромбоцитопении 4 степени (число тромбоцитов <25000 на мм2), когда пациенты получали лекарственное средство циклами, состоящими из 7 последовательных дней перорального дозирования с последующими 7 последовательными днями отсутствия дозирования. В случае, если пациент испытывает связанное с лечением понижение уровня тромбоцитов до <25000 на мм2, степень развития тромбоцитопении может быть ослаблена путем дозирования циклами, состоящими из 5 последовательных дней перорального дозирования с последующими 9 последовательными днями отсутствия дозирования.
Следующую фармакокинетическую информацию определяли для пациентов, которые получали капсульную лекарственную форму Примера 2 в дозе 30 мг/мм2. Раковые пациенты с солидной опухолью получали капсульную лекарственную форму Примера 2 в дозе 30 мг/мм2. Образцы крови, которые собирали вплоть до 24 часов после дозирования, анализировали для оценки фармакокинетики. Плазму крови собирали путем центрифугирования и хранили приблизительно при -70°C до анализа. Концентрации Соединения 1 определяли в плазме крови с использованием HPLC градиентной системы (Hewlett Packard модель 1100), конфигурированной с Sciex API 3000 и колонкой с обращенной фазой (Phenomenex, Luna C18, 3.0 мкм, 50 × 2 мм i.d.). Градиент мобильной фазы состоял из 0.2% муравьиной кислоты в воде (А) и 0.2% муравьиной кислоты в метаноле (В). Скорость потока составляла 0.4 мл/мин и скорость прохождения составляла 2.75 минут. Фармакокинетический анализ выполняли с использованием WinNonlin Professional Edition (Pharsight Corporation, Version 5.2). Использовали номинальные моменты времени отбора образцов и номинальные уровни доз. Значчение AUC0-4h для концентраций в плазме крови Соединения 1 составило 0.272±0.051 мкм⋅ч (среднее ± SE).
95% доверительный интервал для среднего значения AUC0-8h при дозе 60 мг/мм2 установлен равным от 0.210 до 0.742 мкМ⋅ч на основе однократного дозирования 30 мг/мм2 капсульной лекарственной формы с немедленным высвобождением. Нормализованное по дозе среднее значение AUC0-8h для вводимой один раз в день пероральной лекарственной формы с контролируемым высвобождением рассчитано как изменяющееся в диапазоне от 0.0035 до 0.0124 (мкМ⋅ч)/(мг/м2).
Примет 13: Комбинированная терапия: Бортезомиб и Соединение 1 в моделях нейробластомы in vitro и in vivo
Существующая в настоящее время терапия нейробластомы часто не имеет успеха по причине резистентности к химиотерапии. Настоящее исследование изучает эффекты Соединения 1 и ингибитора протеасомы, бортезомиба, в терапии нейробластомы.
Клеточные линии нейробластомы и полученные от пациента культуры первичной нейробластомы обрабатывали бортезомибом, Соединением 1 по отдельности или комбинацией обоих агентов в течение 48 часов. Клетки также обрабатывали ингибиторами HDAC, вориностатом, бутиратом натрия и вальпроевой кислотой, и жизнеспособность оценивали с помощью анализов методом окрашивания кальцеином AM. мРНК из обработанных клеток оценивали через 6 и 24 часа с использованием экспрессионных библиотек U133+ мРНК и Ingenuity analysis. Дихлорфлуоресцеин (DCF) использовали для определения содержания активных форм кислорода (ROS). Анализы жизнеспособности клеток повторяли в присутствии N-ацетилцистеина (NAC). Расщепление каспазы-3 и PARP оценивали с помощью вестерн-блоттинга. 107 клеток SMS-KCNR подкожно инъецировали безтимусным мышам и обрабатывали ежедневными дозами 0.5 мг/кг бортезомиба, 12.5 мг/кг Соединения 1 или комбинацией двух агентов. Опухоли измеряли и делали снимок два раза в неделю.
Клеточные линии нейробластомы и клетки пациента показали чувствительность к бортезомибу и Соединению 1 с IC50 для бортезомиба <50 нМ и IC50 для Соединения 1 <200 нМ. Комбинация бортезомиба и Соединения 1 была синергической. Анализ экспрессии показал повышение экспрессии NOTCH 2 и его лигандов, а также c-jun. Экспрессия обоих, NFk-B и MYCN, была значительно подавлена. Анализ DCF показал формирование ROS, и анализы жизнеспособности показали ингибирование опосредованного каспазой апоптоза в присутствии NAC. Мышиная модель ксенографта нейробластомы показала уменьшение объема опухоли у мышей, обработанных бортезомибом и Соединением 1 по сравнению с группами, обработанными одним агентом, со значительным преимуществом по выживаемости.
Бортезомиб и Соединение 1 синергически ингибируют рост нейробластомы in vitro и in vivo (Фиг. 10). Эта комбинированная терапия является эффективной и хорошо переносимой в мышиных моделях.
Пример 14: Комбинированная терапия бендамустином и ингибиторами HDAC в лечении рака
Рак толстой кишки: Солидные опухоли HCT-116 (Рак толстой кишки) обрабатывали ингибитором HDAC (т.е. Соединением 1) или бендамустином, или комбинацией соединения 1 и бендамустина. Клетки выращивали, обрабатывали в соответствии с различными режимами и концентрациями для моделирования соответствующего режима дозирования, затем промывали для имитации in vivo PK человека. В случае комбинации бендамустина и ингибитора HDAC (т.е. Соединения 1) клетки сначала обрабатывали изменяющимися дозами ингибитора HDAC (т.е. Соединения 1) в течение 18 часов, с последующй обработкой изменяющимися дозами бендамустина в течение 3 дней.
Как видно на Фиг. 3, введение до 100 мкМ бендамустина при отсутствии ингибитора HDAC (т.е. Соединения 1) приводит только к около 10% нежизнеспособных клеток. Однако, как ясно указывает Фиг. 3, комбинация бендамустина и ингибитора HDAC (т.е. Соединения 1) является очень активной и значительно более эффективной, чем соединения, вводимые индивидуально. Как показано в Таблице 11, комбинация имеет показатель аддитивности (CI) ниже 1, что указывает на синергический механизм действия. Таким образом, Бендамустин и Соединение 1 синергически ингибируют рак толстой кишки как in vitro, так и in vivo.
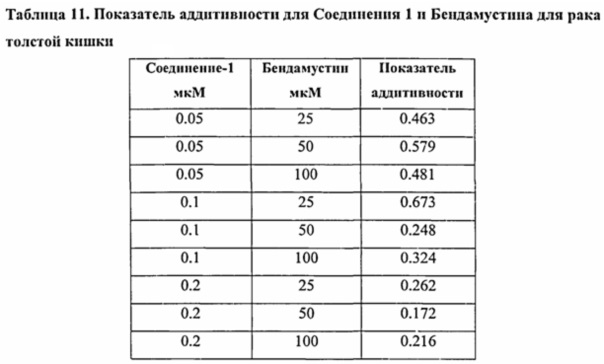
Множественная миелома: Три различных клеточных линии множественной миеломы U266, NCI-H929 и RPMI-8266 тестировали на синергическую активность ингибитора HDAC (т.е. Соединения 1) и бендамустина. На Фиг. 4 показаны результаты для клеточной линии U266. Большое увеличение маркеров апоптоза для клеток, обработанных комбинацией бендамустина и Соединения 1, показывает, что комбинация без сомнения является сильным ингибитором множественной миеломы. В Таблице 12 комбинация имеет показатель аддитивности (CI) ниже 1, что указывает на синергический механизм действия. Бендамустин и Соединение 1 синергически ингибируют множественную миелому как in vitro, так и in vivo.

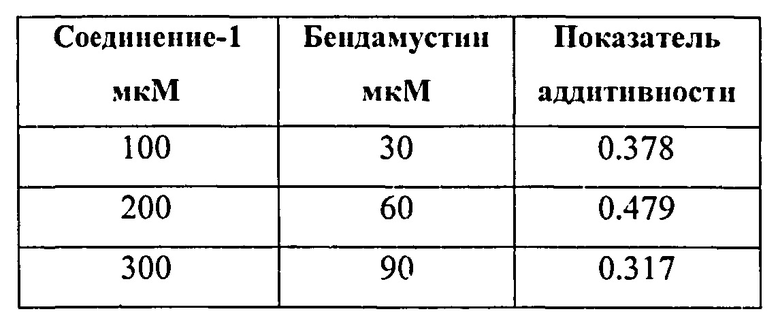
Лимфома: Эффект комбинированного введения ингибитора HDAC (т.е. Соединения 1) и бендамустина исследовали в различных типах лимфомы. Синергическую активность наблюдали для комбинации ингибитора HDAC (т.е. Соединения 1) и бендамустина в лимфоме из клеток мантийной зоны, а также в диффузной крупноклеточной лимфоме. На Фиг. 5A и 5B показано увеличение маркеров апоптоза в клетках лимфомы, обработанных ингибитором HDAC (т.е. Соединением 1) и/или бендамустином. Фигуры ясно указывают на повышенную эффективность комбинации бендамустина с ингибитором HDAC (т.е. Соединением 1). В Таблице 13 показано, что комбинация имеет показатель аддитивности (CI) ниже 1, что указывает на синергический механизм действия. На основе Фиг. 5A-5B и Таблицы 13 можно сделать заключение, что Бендамустин и Соединение 1 синергически ингибируют лимфому как in vitro, так и in vivo.
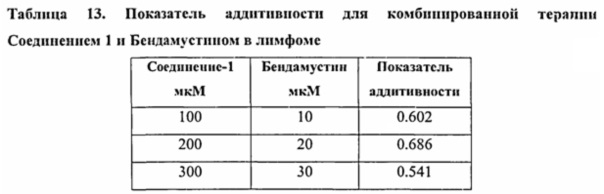
Предварительная обработка ингибитором HDAC обеспечивает очень хорошее потенцирование комбинации с бендамустином
Клетки множественной миеломы H929 обрабатывали ингибитором HDAC (т.е. Соединением 1 при 200 нМ) или бендамустином (50 мкМ) в течение от 1 до 3 дней. Последовательность добавления испытывали путем добавления первым бендамустина или ингибитора HDAC, затем добавления второго через 24 ч. Введение ингибитора HDAC (т.е. Соединения 1) с последующим бендамустином через 24 часа привело к гибели большинства клеток в этих сериях (Фиг. 8).
Пример 15: Роль RAD51 в синергической функции Бендамустина и ингибиторов HDAC
Ген RAD51 ассоциирован с рядом ключевых раковых генов, в том числе BRCA1, BCRA2 и супрессора опухоли, р53. Активность RAD51 регулируется прямыми белок-белковыми взаимодействиями с р53. В случае, когда р53 отсутствует или мутирован, RAD51 обладает повышенной активностью по восстановлению ДНК. Чистый эффект увеличенной активности RAD51 состоит в том, чтобы дать возможность раковым клеткам эффективно восстанавливать повреждение ДНК для нейтрализации лечения, проводимого с использованием лучевой терапии и химиотерапии.
Как видно на Фиг 3, введение до 100 мкМ бендамустина при отсутствии ингибитора HDAC (т.е. Соединения 1) приводит только к около 10% нежизнеспособных клеток. Однако, как показано на Фиг. 3, комбинация бендамустина и ингибитора HDAC (т.е. Соединения 1) является очень активной и значительно более эффективной, чем соединения, вводимые индивидуально. Как показано в Таблице 11, комбинация имеет показатель аддитивности (CI) ниже 1, что указывает на синергический механизм действия (на основе способа Chou и Talay с использованием программного обеспечения Calcusyn (Biosoft, Ferguson, МО)). Таким образом, Бендамустин и Соединение 1 синергически ингибируют рак толстой кишки как in vitro, так и in vivo.
На Фиг. 6A показана понижающая регуляция RAD51 ингибитором HDAC (т.е. Соединением 1) и комбинацией ингибитора HDAC (т.е. Соединения 1) и бендамустина. Выдвинута гипотеза о том, что синергическая активность комбинации ингибитора HDAC (т.е. Соединения 1) и бендамустина может быть обусловлена понижающей регуляцией RAD51 ингибитором HDAC (т.е. Соединением 1). RAD51 представляет важный компонент гомологической рекомбинации (HR), один из двух важных путей восстановления в клетках двухцепочечного разрыва ДНК (DSB); второй путь, негомологичное соединение концов (NHEJ), представленный в настоящем документе двумя его компонентами Ku-70 и DNA-PKcs, не подвергается влиянию этих терапий. На Фиг. 6B и 6C показано, что комбинация Соединения 1 и бендамустина приводит к синергически увеличенному расщеплению каспазы и апоптозу в клеточных линиях множественной миеломы NCI-H929 и U266. Согласно представленному выше объяснению, синергическая активность против множественной миеломы комбинации бендамустин - Соединение 1 может быть обусловлена понижением уровней RAD51, вызванным ингибитором HDAC (т.е. Соединением 1).
На Фиг. 9 показано, что в клетках Jurkat предварительная обработка ингибитором HDAC (т.е. Соединением 1) подавляет повышающую регуляцию RAD51, ингибируя, таким образом, восстановление повреждения ДНК и потенцируя действие бендамустина. Клетки предварительно обрабатывали за день 0.2 мкМ ингибитора HDAC (т.е. Соединения 1), затем в первый день добавляли 20 мкМ бендамустина.
Пример 16: Исследование ингибирования роста опухоли на мышиных самках SCID, несущих H929 (множественную миелому), которым вводили ингибитор HDAC отдельно или в комбинации с бендамустином.
Ингибирование опухолевого роста клеточной линии H929 оценивали у мышиных самок SCID, которым вводили ингибитор HDAC, такой как Соединение 1 BID интраперитонеально (IP) в течение 5 последовательных дней с последующими 2 днями отсутствия дозирования в течение от 2 до 3 полных циклов дозирования. Мышей подкожно инокулировали в правый задний пах клетками H929 ММ при плотности 1×107 клеток в объеме 100 мкл/мышь. 4 группы животных (n=8/группа) получали носитель (BID, IP, 5 дней/неделю), только PCI-24781 (12 мг/кг BID, IP, 5 дней/неделю), только бендамустин 5.0 мг/кг (qd, IP, 2 дня/неделю Tu, Th) или комбинацию. Измерение массы тела и размеров опухолей проводили не реже 2 раз каждую неделю для всех животных. Образцы крови и опухоли брали по окончании исследования для фармакодинамических оценок.
Как показано на Фиг. 7, ингибитор HDAC и бендамустин по отдельности показали ингибирование роста опухоли, составляющее, соответственно, 73% и 79%, тогда как комбинация продемонстрировала значительно лучшее ингибирование роста опухоли, составляющее 93%. Потери массы тела в конце исследования составили <2.2% для отдельных агентов и 8.1% для комбинации. Таким образом, комбинация ингибитора HDAC с бендамустином производила значительно большее ингибирование роста опухоли H929 множественной миеломы по сравнению с агентами, взятыми по отдельности, с приемлемой токсичностью, измеренной по потере массы тела.
Пример 17: Ингибитор HDAC в комбинации с хлорохином, перифозином или платиной
Ингибитор HDAC в комбинации с хлорохином:
Как показано на Фиг. 11, ингибиторы HDAC (напр., Соединение 1), описанные в настоящем документе, действуют синергически с хлорохином. Хлорохин представляет собой ингибитор аутофагии. Таким образом, была выдвинута гипотеза о том, что комбинация направляет клетки опухоли и/или миеломы на путь апоптоза, активированного ингибитором HDAC (т.е. Соединением 1).
Ингибитор HDAC в комбинации с перифозином:
Перифозин является ингибитором пути АКТ. Как показано на Фиг. 12, предварительная обработка клеток HCT-116 в течение до 24 часов ингибитором HDAC (т.е. Соединением 1) с последующим введением перифозона приводит к синергическому действию перифозона и ингибитора HDAC (т.е. Соединения 1) в клеточных линиях миеломы и клетках опухоли толстой кишки.
Ингибитор HDAC (т.е. Соединение 1) в комбинации с платиной:
Оказалось, что ингибиторы HDAC, описанные в настоящем документе, ингибируют клетки опухоли синергически с содержащими платину агентами, такими как цисплатин и карбоплатин. Важно отметить, что в опухолевых клетках, резистентных к платине, ингибиторы HDAC продемонстрировали эффективное ингибирование опухоли в комбинации с цисплатином и/или карбоплатином. На Фиг. 13 продемонстрировано синергическое ингибирование резистентных к платине клеток опухоли яичника комбинацией цисплатина и ингибитора HDAC (т.е. Соединения 1), описанного в настоящем документе.
Примеры и варианты осуществления, описанные в настоящем документе, представлены только в иллюстративных целях и различные модификации или изменения, предложенные специалистам в данной области, включены в сущность и описание изобретения, и объем прилагаемой формулы изобретения. Специалистам в данной области следует учесть, что определенные компоненты, указанные в приведенных выше примерах, могут быть заменены на другие функционально эквивалентные компоненты, например разбавители, связывающие вещества, лубриканты, наполнители, покрытия и тому подобное.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЙ РЕЖИМ ПРИЕМА N-ГИДРОКСИ-4-{2-[3-(N, N-ДИМЕТИЛАМИНОМЕТИЛ)БЕНЗОФУРАН-2-ИЛКАРБОНИЛАМИНО]ЭТОКСИ}БЕНЗАМИДА | 2012 |
|
RU2600793C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ПРИМЕНЕНИЕМ ИНГИБИТОРА АУТОФАГИИ НА ОСНОВЕ ТИОКСАНТОНА | 2011 |
|
RU2627588C2 |
| СПОСОБЫ ЛЕЧЕНИЯ АССОЦИИРОВАННЫХ С ВИРУСОМ ФОРМ РАКА С ПОМОЩЬЮ ИНГИБИТОРОВ ГИСТОНДЕАЦЕТИЛАЗЫ | 2020 |
|
RU2819782C2 |
| КОМБИНИРОВАННЫЕ ТЕРАПИИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2759963C2 |
| СПОСОБЫ ИНДУКЦИИ КОНЕЧНОЙ ДИФФЕРЕНЦИРОВКИ | 2010 |
|
RU2530648C2 |
| СПОСОБЫ ВОЗДЕЙСТВИЯ НА ТРАНСКРИПЦИОННЫЙ КОНТРОЛЬ В СУПЕРЭНХАНСЕРНЫХ ОБЛАСТЯХ | 2015 |
|
RU2737508C2 |
| СПОСОБ ИНДУКЦИИ КОНЕЧНОЙ ДИФФЕРЕНЦИРОВКИ | 2003 |
|
RU2320331C2 |
| СПОСОБЫ ИНДУКЦИИ КОНЕЧНОЙ ДИФФЕРЕНЦИРОВКИ | 2003 |
|
RU2394022C2 |
| КОМБИНАЦИЯ ИНГИБИТОРА ГИСТОНДЕАЦЕТИЛАЗЫ И ИНГИБИТОРА ПРОТЕИНКИНАЗЫ И ЕЕ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2770754C1 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ИНГИБИТОРОМ EZH2 | 2018 |
|
RU2754131C1 |
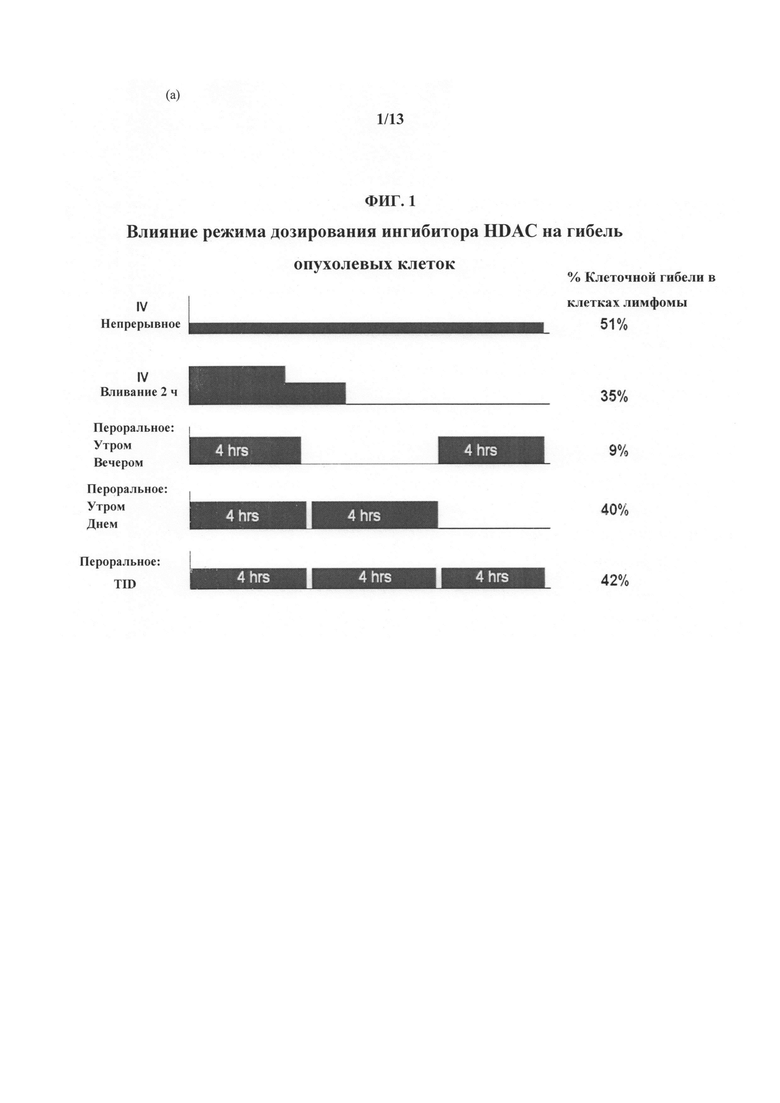
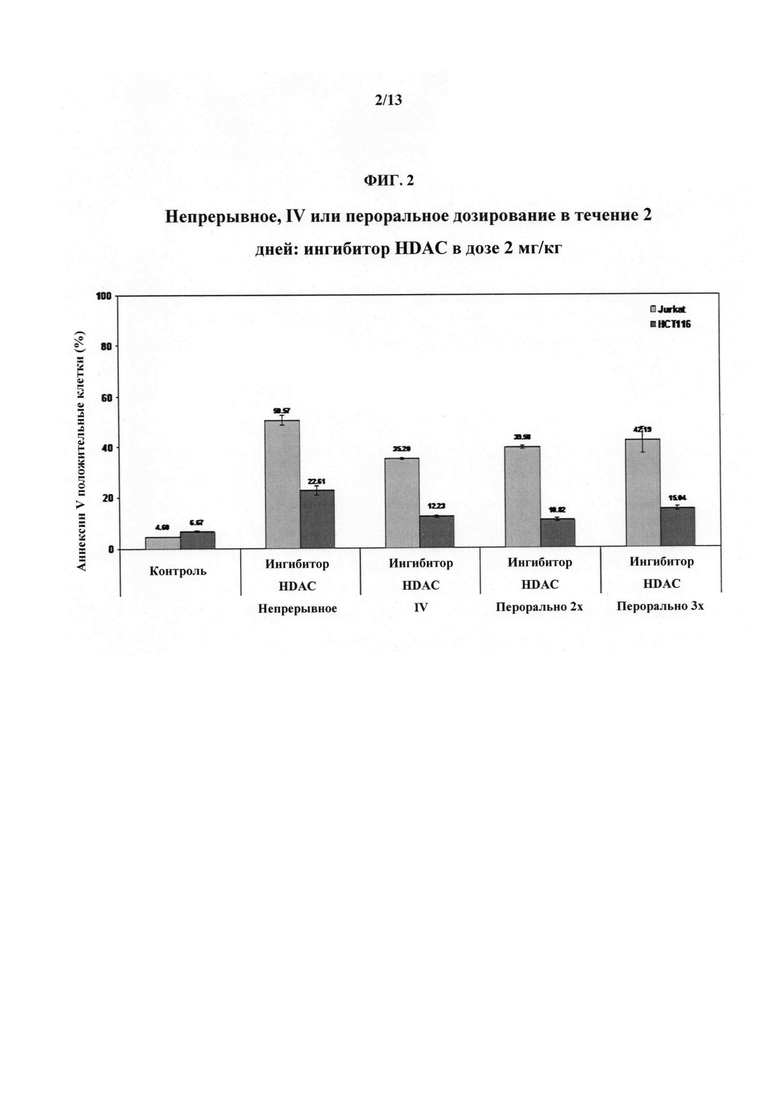
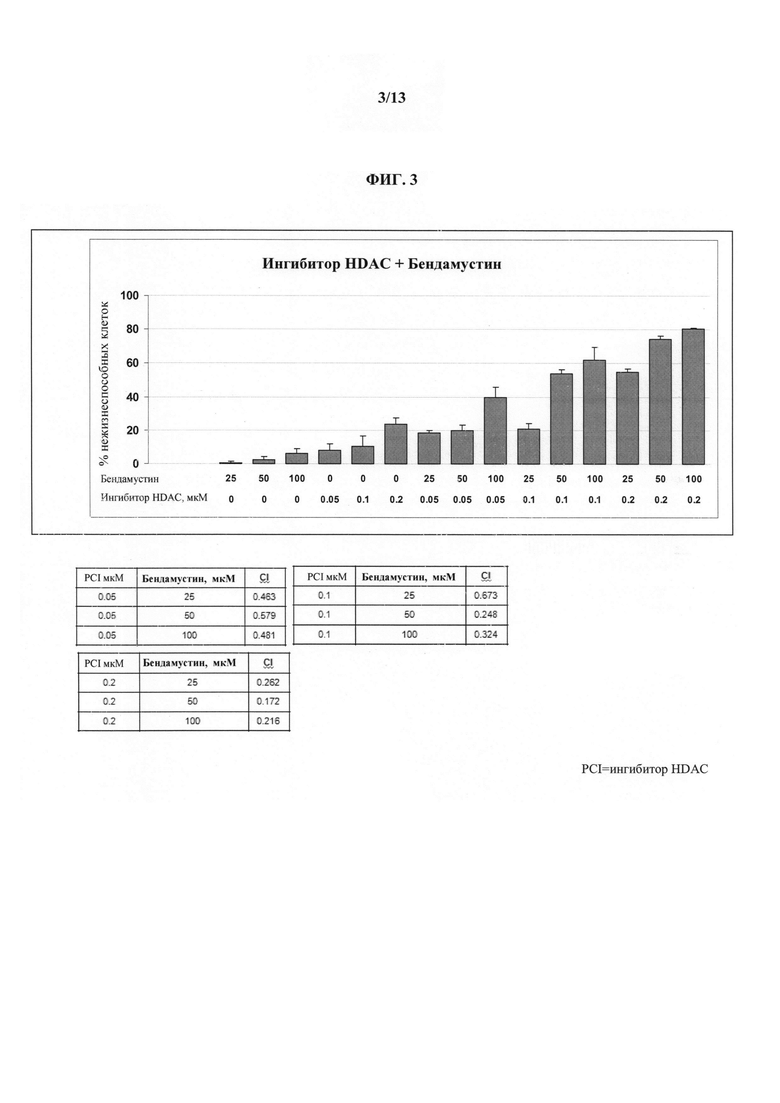
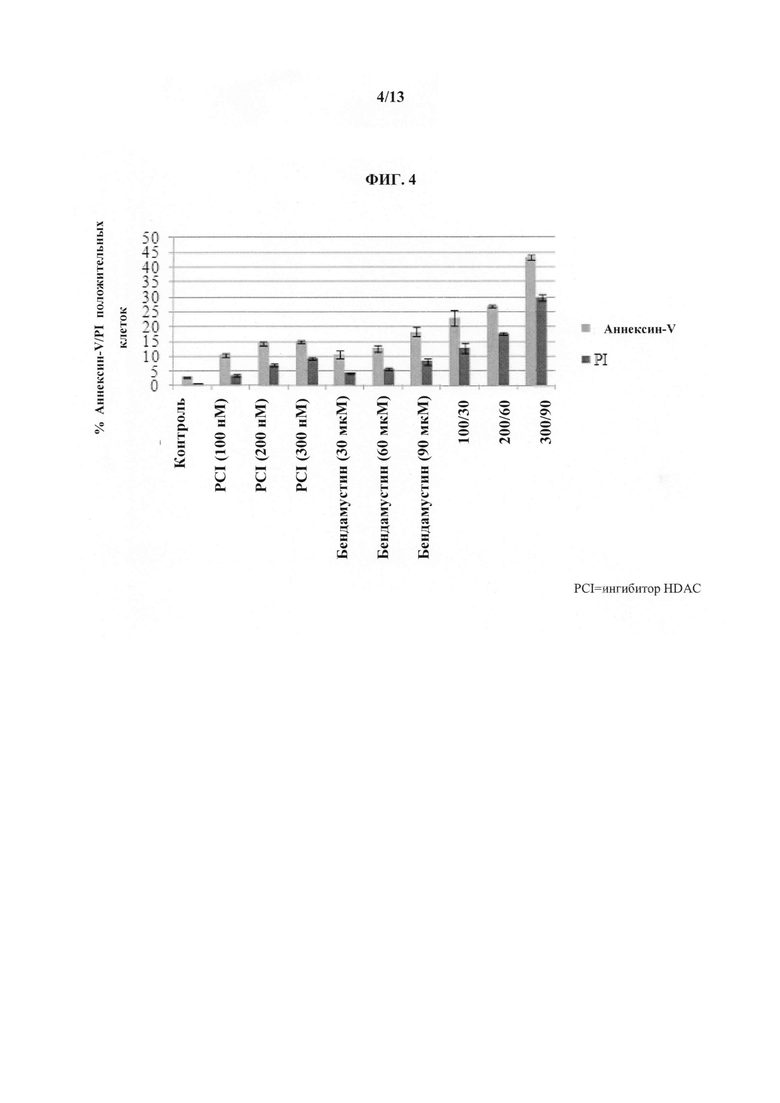
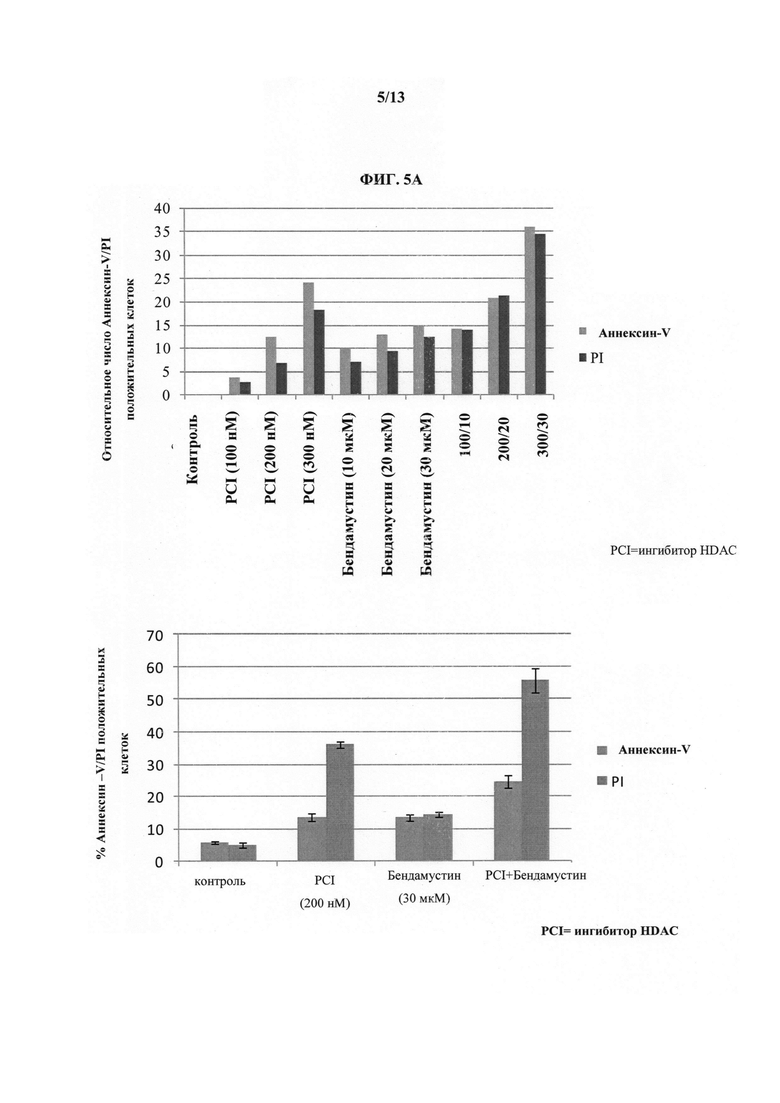
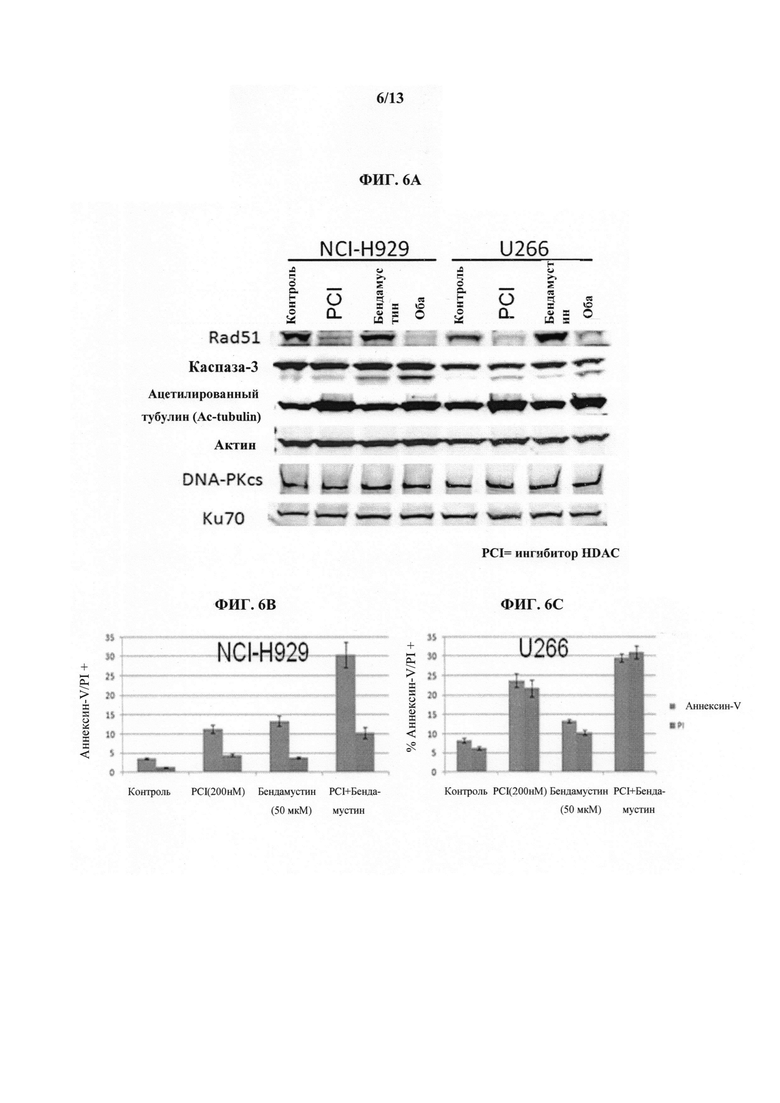
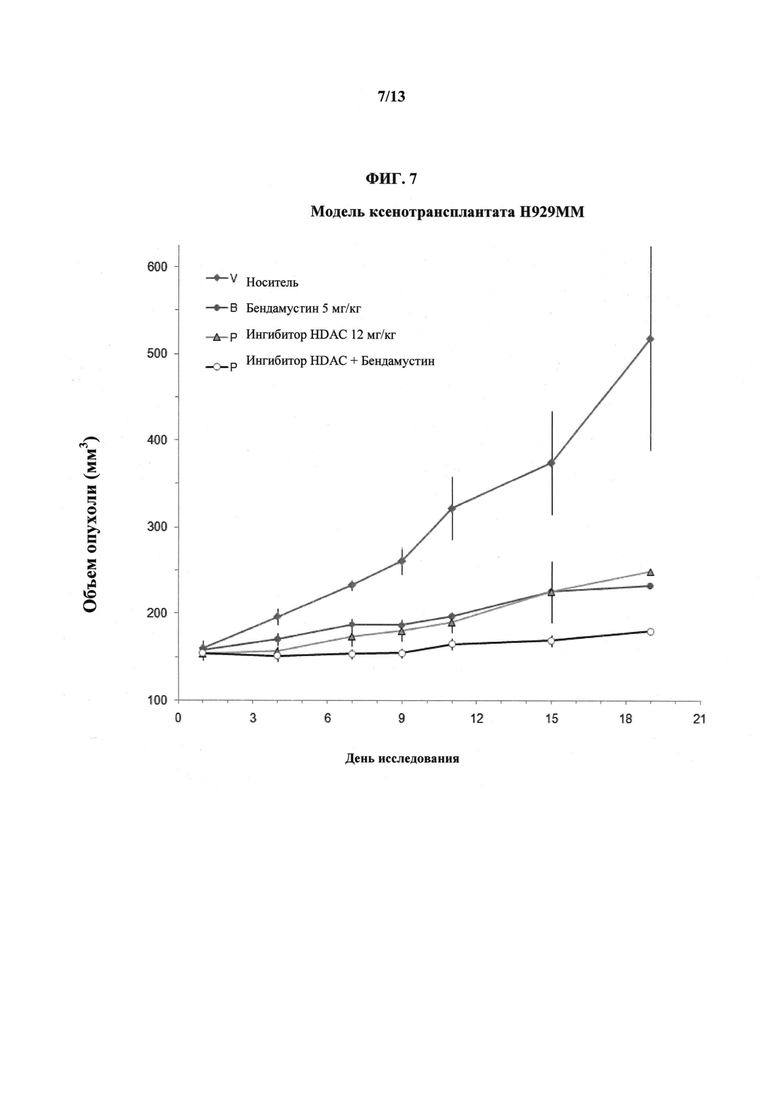
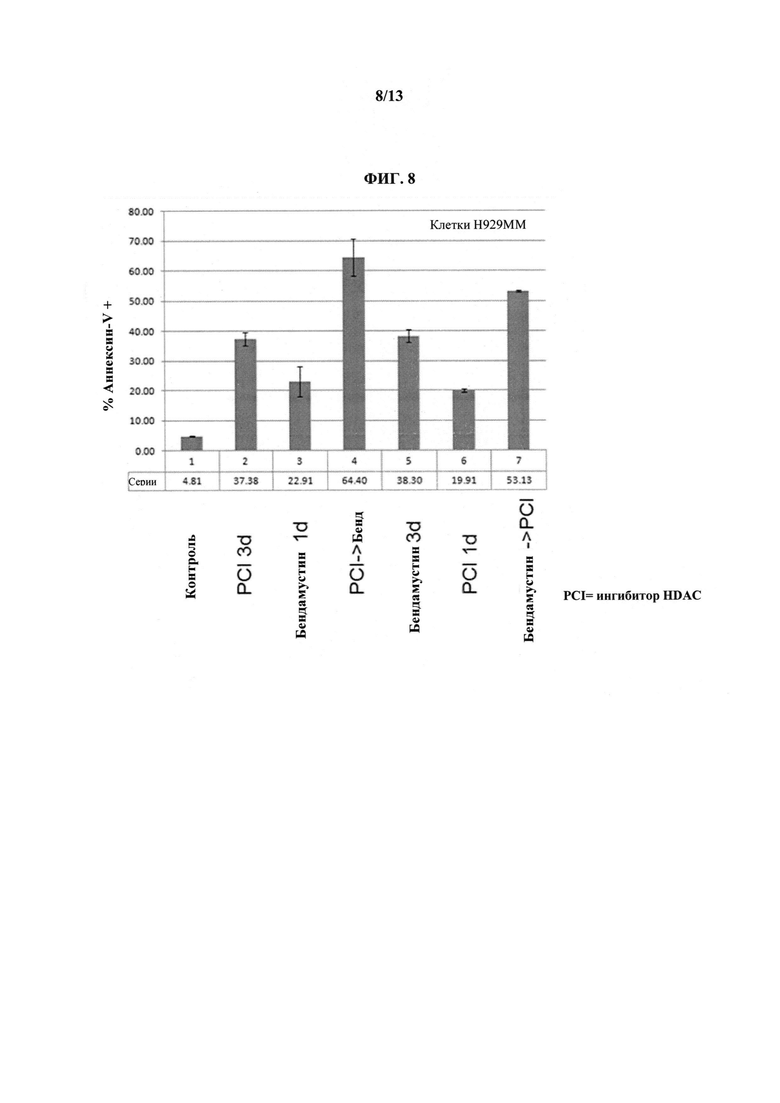
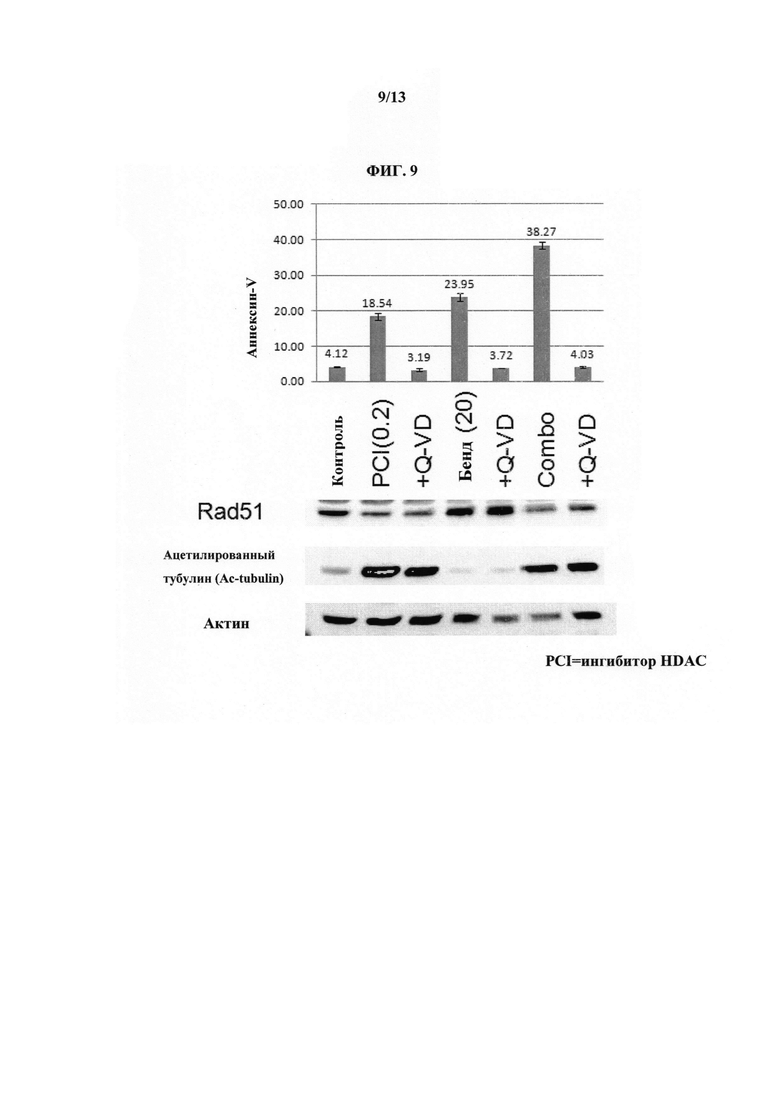
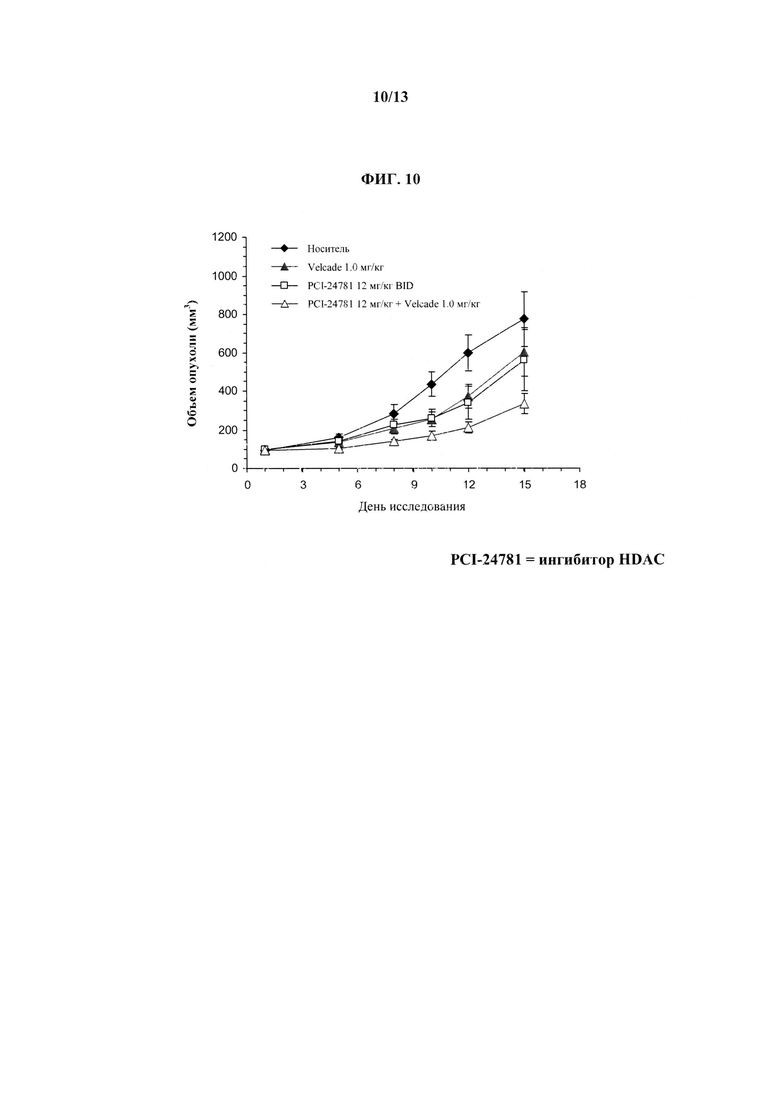
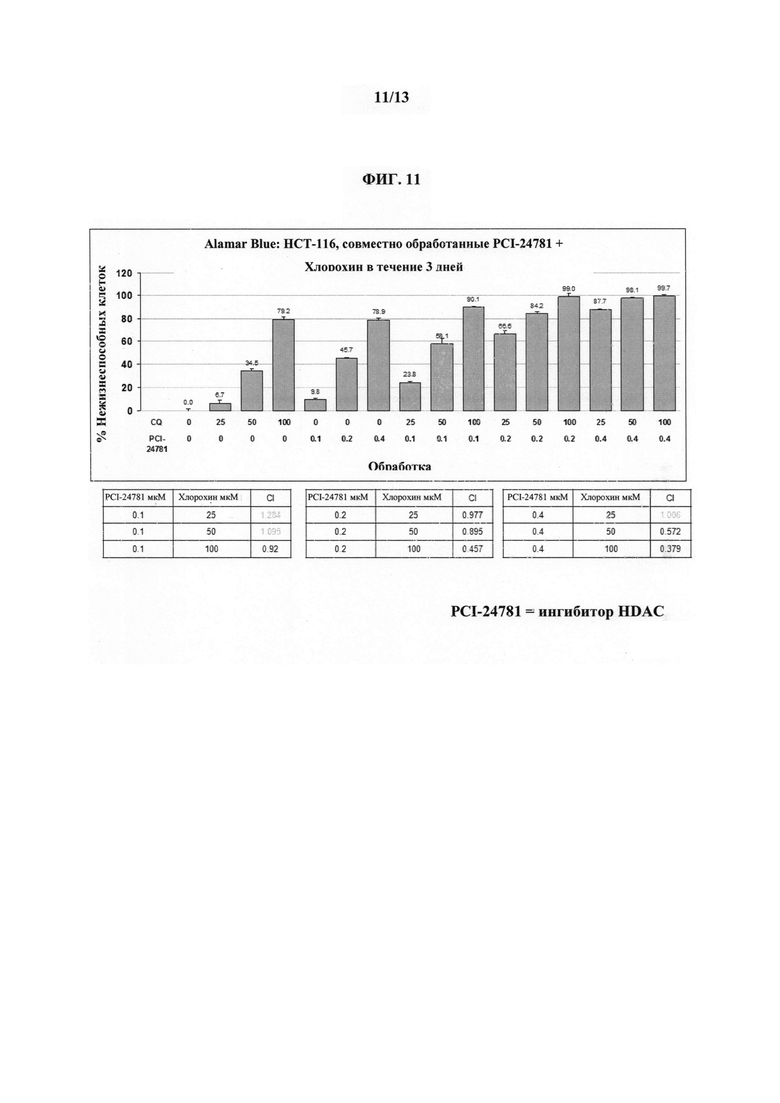
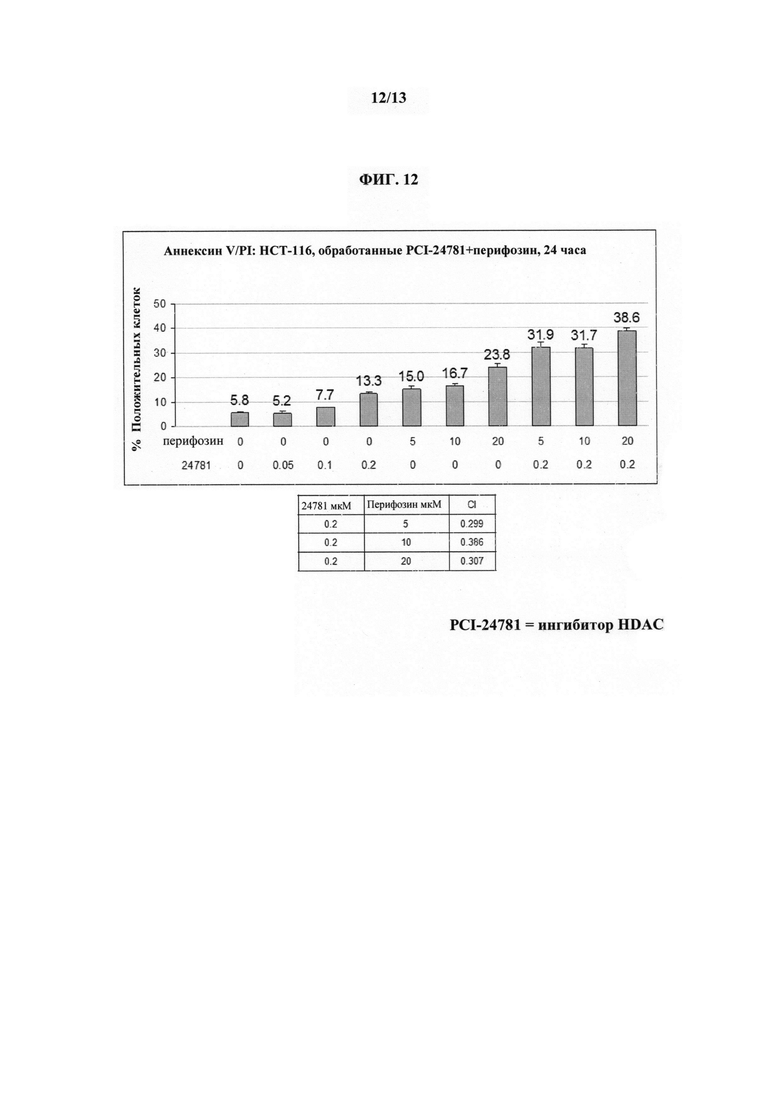
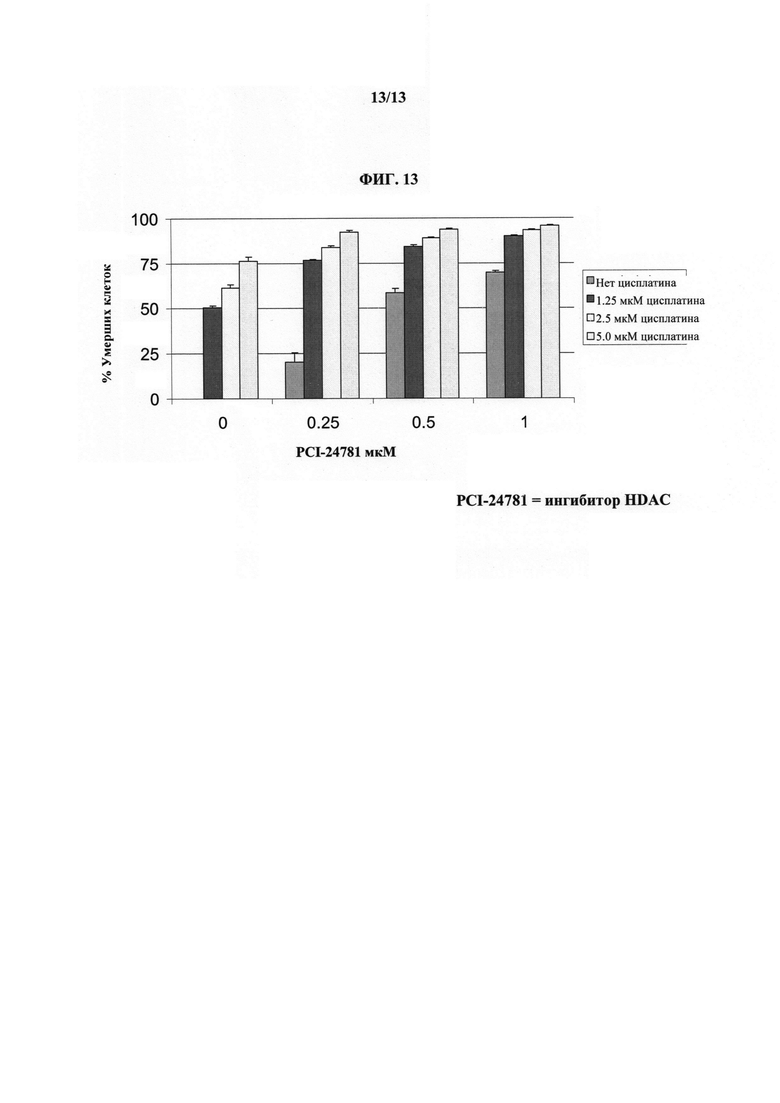
Группа изобретений относится к области фармацевтики. Описана комбинация для лечения рака у пациента, включающая бендамустин или его фармацевтически приемлемую соль и ингибитор HDAC. В качестве ингибитора HDAC используется Соединение 1 или его фармацевтически приемлемая соль. Также описано применение указанной композиции для лечения рака у пациента. Изобретение обеспечивает реализацию указанного назначения. 2 н. и 8 з.п. ф-лы, 13 ил., 17 пр., 13 табл.
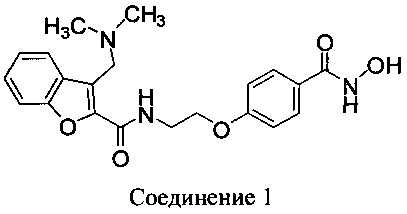
1. Комбинация бендамустина или его фармацевтически приемлемой соли и ингибитора HDAC, в которой ингибитор HDAC представляет собой Соединение 1:
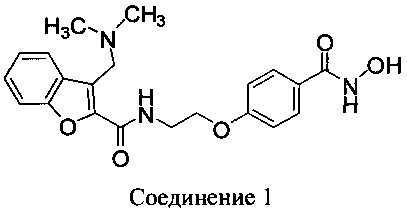
или его фармацевтически приемлемую соль, для лечения рака у пациента, нуждающегося в этом.
2. Комбинация по п. 1, в которой бендамустин или его фармацевтически приемлемая соль и ингибитор HDAC находятся в раздельных дозированных формах.
3. Комбинация по п. 1, в которой ингибитор HDAC представляет собой HCl соль Соединения 1.
4. Применение комбинации (а) бендамустина или его фармацевтически приемлемой соли и (b) Соединения 1:
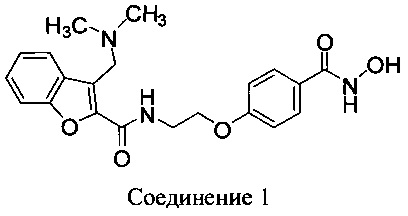
или его фармацевтически приемлемой соли, для лечения рака у пациента, нуждающегося в этом.
5. Применение по п. 4, где рак представляет собой карциному, опухоль, новообразование, лимфому, меланому, глиому, саркому и бластому.
6. Применение по п. 4, в котором рак представляет собой лимфому из клеток мантийной зоны, диффузную В-крупноклеточную лимфому, множественную миелому, или рак толстой кишки, или неходжкинскую лимфому.
7. Применение по п. 4, в котором введение бендамустина и Соединения 1 или его фармацевтически приемлемой соли является последовательным, при этом бендамустин вводят в первую очередь.
8. Применение по п. 4, в котором введение бендамустина и Соединения 1 или его фармацевтически приемлемой соли является последовательным, при этом Соединение 1 или его фармацевтически приемлемую соль вводят в первую очередь.
9. Применение по п. 4, в котором введение бендамустина и Соединения 1 или его фармацевтически приемлемой соли является поочередным.
10. Применение по п. 4, в котором фармацевтически приемлемая соль Соединения 1 представляет собой HCl соль Соединения 1.
| WO 2009127609 А1, 22.10.2009 | |||
| WO 2004092115 А2, 28.10.2004 | |||
| WO 2009063054 А1, 22.05.2009 | |||
| WO 2008082856 А1, 10.07.2008 | |||
| Автоматический останов к машинам для плетения резиновой тесьмы на случай обрыва основы | 1928 |
|
SU13324A1 |
| CHESON B.D | |||
| Optimal use of bendamustine in chronic lymphocytic leukemia, non-Hodgkin lymphomas, and multiple myeloma: treatment recommendations from an international consensus panel | |||
| Clin Lymphoma Myeloma Leuk | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
Авторы
Даты
2017-02-06—Публикация
2011-09-13—Подача