УРОВЕНЬ ТЕХНИКИ
Область техники, к которой относится изобретение
Настоящее изобретение в целом относится к способам лечения заболеваний, модулируемых суперэнхансерами, а также композициям, предназначенным для этого.
Описание предшествующего уровня техники
Суперэнхансеры представляют собой крупные кластеры транскрипционно активных областей ДНК, которые направляют экспрессию генов, которые контролируют клеточную идентичность. Регуляция суперэнхансеров нарушается при многих заболеваниях, включающих, без ограничения, рак. Суперэнхансеры рекрутируют факторы транскрипции, кофакторы, регуляторы хроматина, сигнальные ферменты (например, киназы) и транскрипционный аппарат (например, РНК-полимеразу II), которые формируют крупный комплекс, который регулирует экспрессию множества генов одновременно, которые необязательно находятся в непосредственной близости по отношению к линейной форме ДНК (Smith and Shilatifard, 2014, Nature Structural and Molecular Biology 21(3):210-219). Суперэнхансеры позволяют клеткам эффективно регулировать группы генов, которые согласованно действуют, определяя или поддерживая клеточную идентичность. Было продемонстрировано, что раковые клетки перепрограммируют суперэнхансерные комплексы, изменяя транскрипционную активность раковой клетки, что приводит к онкогенезу, метастазу и развитию заболевания. Фактически было установлено, что многие заболевания, даже не включая рак, являются, в конечном счете, результатом нарушения функции суперэнхансерных комплексов (Cell 2013, Nov 7; 155(4):934-47).
Известные компоненты суперэнхансерного комплекса включают циклинзависимые киназы (например, Cdk9), белки, содержащие бромодомены и экстратерминальный домен (BET) (например, Brd4), гистондеацетилазы (HDAC), гистонацетилтрансферазы (например, p300), гистондеметилазы (например, Lsd1), гистонметилтрансферазы (например, Dot1L) и другие. Эти компоненты обычно участвуют в типичной регуляции транскрипции. Однако ингибирование функции компонентов суперэнхансеров, как было показано, производило более сильное воздействие на регулируемые суперэнхансерами гены по сравнению с генами, регулируемыми обычными энхансерными элементами (Loven et al., 2013,.Cell 153(2):320-334). Одной из возможных причин данного наблюдения является обогащение транскрипционными и хроматинмодифицирующими белками в суперэнхансерах по сравнению с обычными энхансерами. Например, комплекс Медиатор (который включает Cdk8) и Brd4 присутствуют и в суперэнхансерах, и в обычных энхансерах. Однако количество Медиатора в суперэнхансере по сравнению с обычным энхансером, как обнаружили, было выше в 25 раз (Hnisz, et al., 2013, Cell 155:934-947). Точно так же уровень Brd4 в суперэнхансерах, как было показано, был приблизительно в 20 раз выше, чем в обычных энхансерах (Hnisz, et al., 2013, Cell 155:934-947).
Гены, экспрессируемые с суперэнхансеров, как было показано, опосредуют прогрессирование заболевания при некоторых типах рака. Например, при множественной миеломе (MM) опухолевые клетки часто имеют транслокацию, которая помещает суперэнхансерный элемент рядом с геном MYC (Hnisz, et al., 2013, Cell 155:934-947). Подобные изменения были обнаружены у больных острым лимфообластным лейкозом (Т-ОЛЛ), раком легкого, раком поджелудочной железы, раком толстой и прямой кишки, раком молочной железы, хроническим миелогенным лейкозом (ХМЛ), глиобластомой, лимфобластным, раком шейки матки и раком предстательной железы (Hnisz, et al., 2013, Cell 155:934-947).
Хотя были достигнуты успехи, в уровне техники сохраняется потребность в улучшенном воздействии на суперэнхансеры и в способах лечения заболеваний, опосредуемых суперэнхансерами. Настоящее изобретение удовлетворяет эту потребность и обеспечивает соответствующие преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Коротко, в вариантах осуществления настоящего изобретения предложены способы лечения заболевания, включающие введение ингибиторов двух из более компонентов суперэнхансеров. В одном варианте осуществления в описании предложен способ лечения опосредованного суперэнхансером заболевания у нуждающегося в этом млекопитающего, включающий введение млекопитающему эффективного количества по меньшей мере двух из следующих терапевтических средств:
i) ингибитор циклинзависимой киназы;
ii) ингибитор бромодомена;
iii) ингибитор гистонметилтрансферазы;
iv) ингибитор гистондеацетилазы; и
v) ингибитор гистондеметилазы.
Также предложены фармацевтические композиции, включающие по меньшей мере два из предыдущих терапевтических средств.
Эти и другие аспекты изобретения будут очевидны при обращении к следующему подробному описанию. С этой целью в настоящем документе представлены различные источники, в которых более подробно описана определенная справочная информация, методики, соединения и/или композиции, при этом каждый из них настоящим полностью включен посредством отсылки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигурах идентичные номера позиций обозначают одинаковые элементы. Размеры и относительные положения элементов на фигурах не представлены обязательно в масштабе, причем некоторые из таких элементов необязательно увеличены и перемещены для улучшения читаемости фигуры. Кроме того, конкретные формы элементов, как показано, не должны передавать какую-либо информацию относительно фактической формы конкретных элементов, и были выбраны лишь для простоты различения на фигурах.
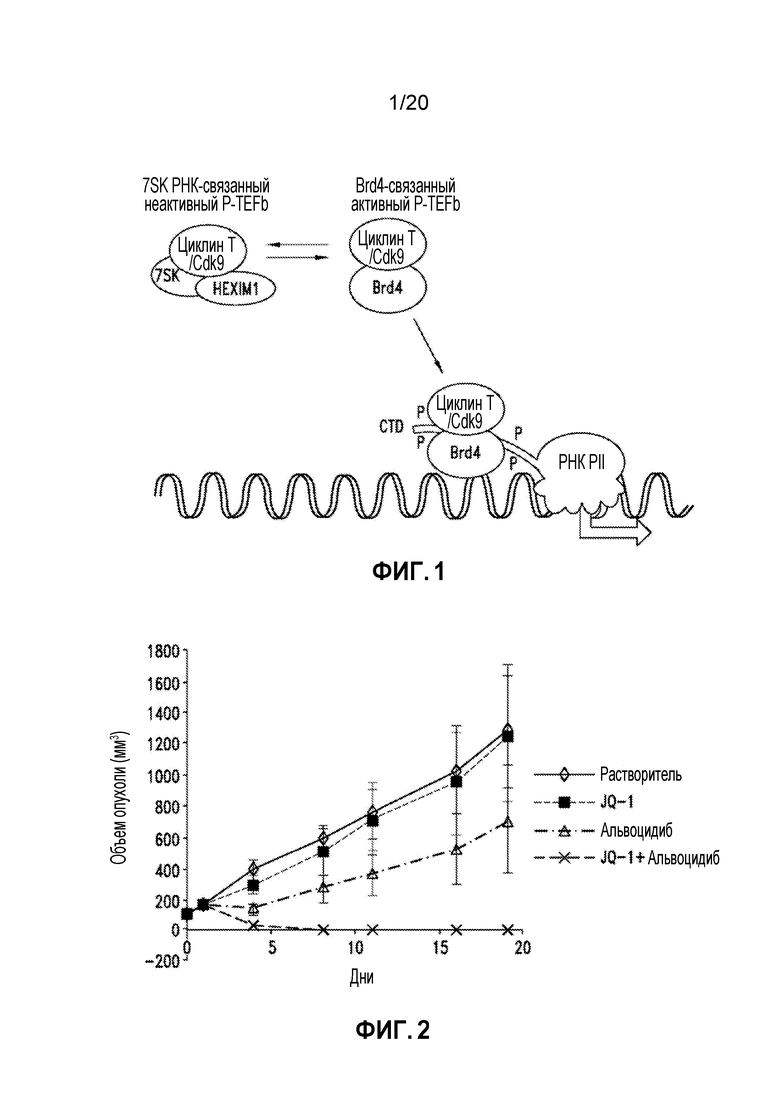
На Фиг. 1 показан предполагаемый механизм Brd4 активации Cdk9 на участках инициации транскрипции.
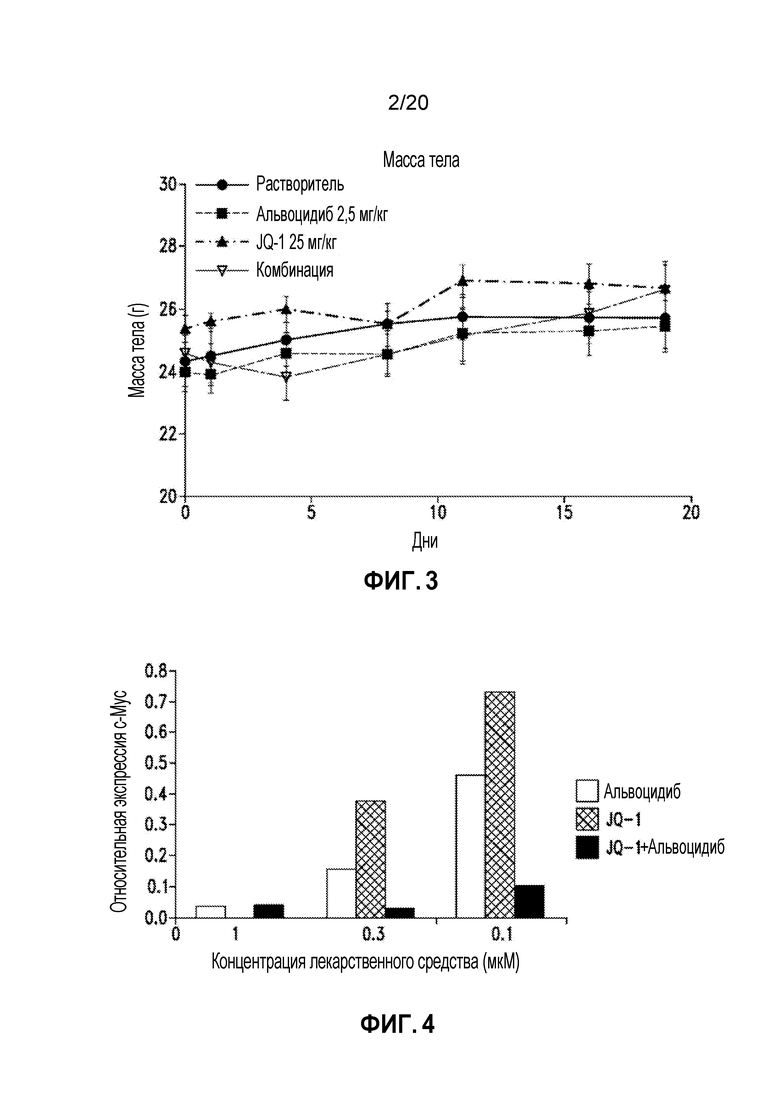
На Фиг. 2 представлено подтверждение синергического эффекта между ингибиторами Cdk9 и Brd4.
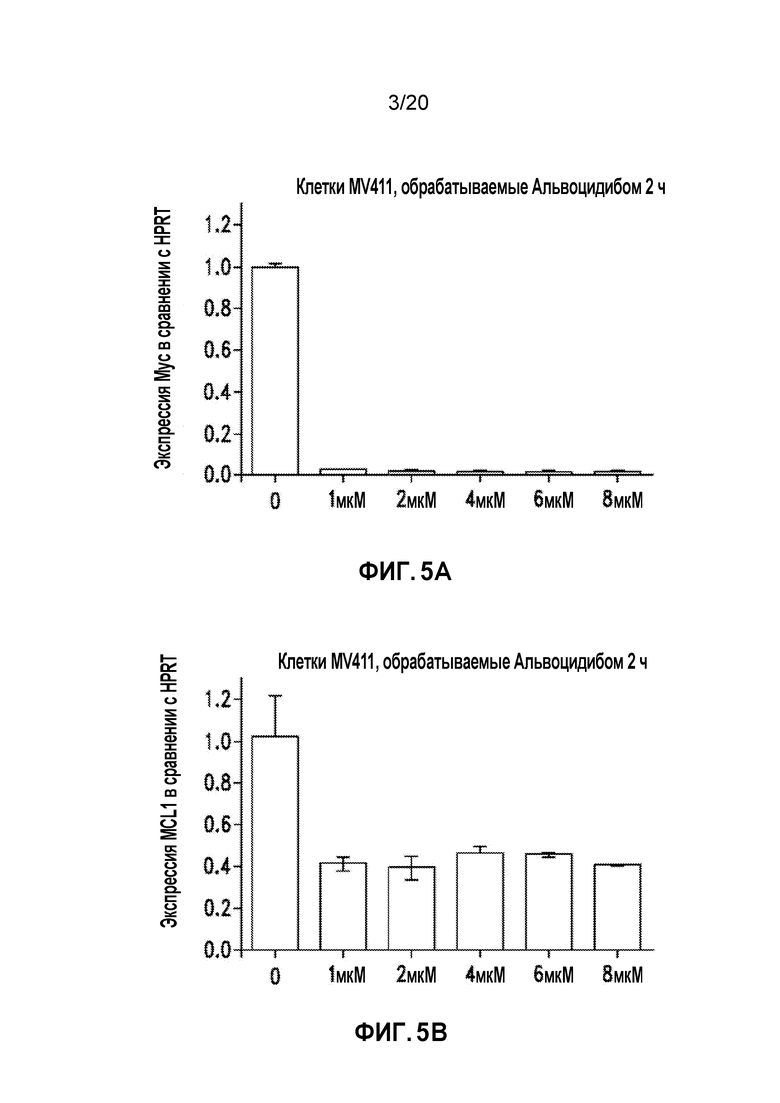
На Фиг. 3 показано увеличение веса мышей, получавших растворитель, альвоцидиб, JQ1 или комбинацию альвоцидиба и JQ1.
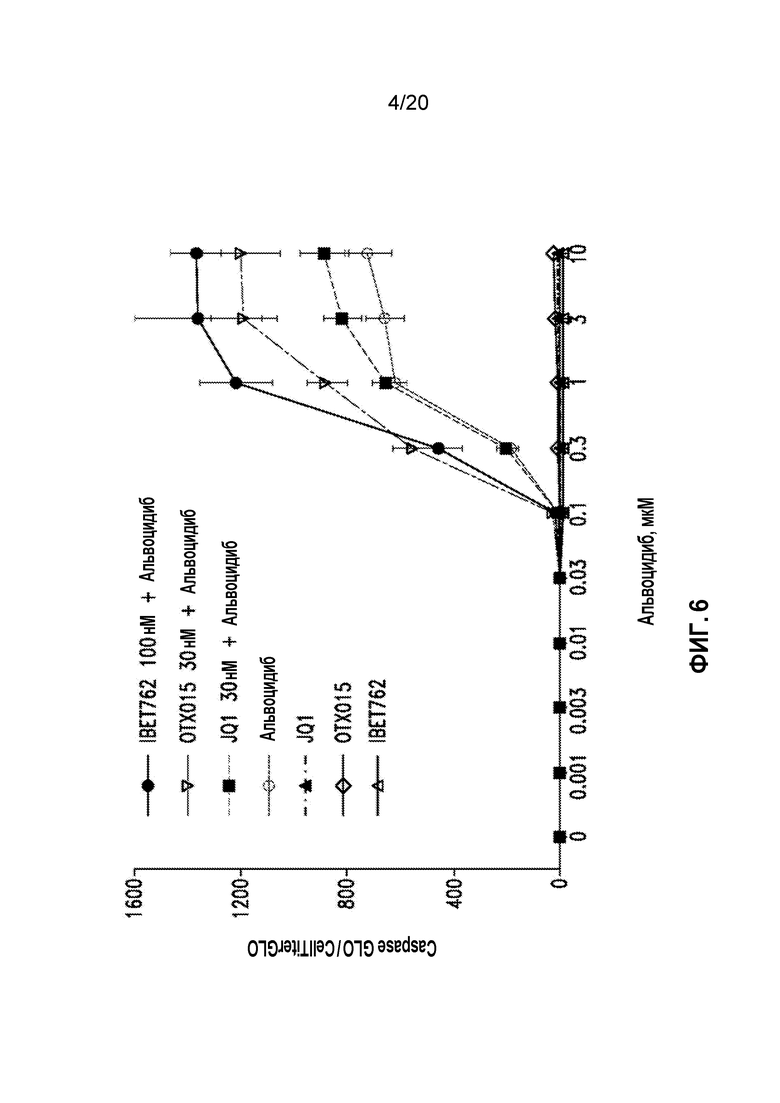
На Фиг. 4 представлено подтверждение синергического эффекта между ингибиторами Cdk9 и Brd4 на уровне опосредуемой суперэнхансерами транскрипции.
Фиг. 5А и 5B являются гистограммами, на которых показано ингибирование экспрессии MYC (Фиг. 5A) и MCL-1 (Фиг. 5B) под действием альвоцидиба в клетках MV4-11.
На Фиг. 6 представлены данные по апоптозу для клеток MV4-11, обработанных альвоцидибом или ингибиторами BRD4 отдельно и в комбинации.
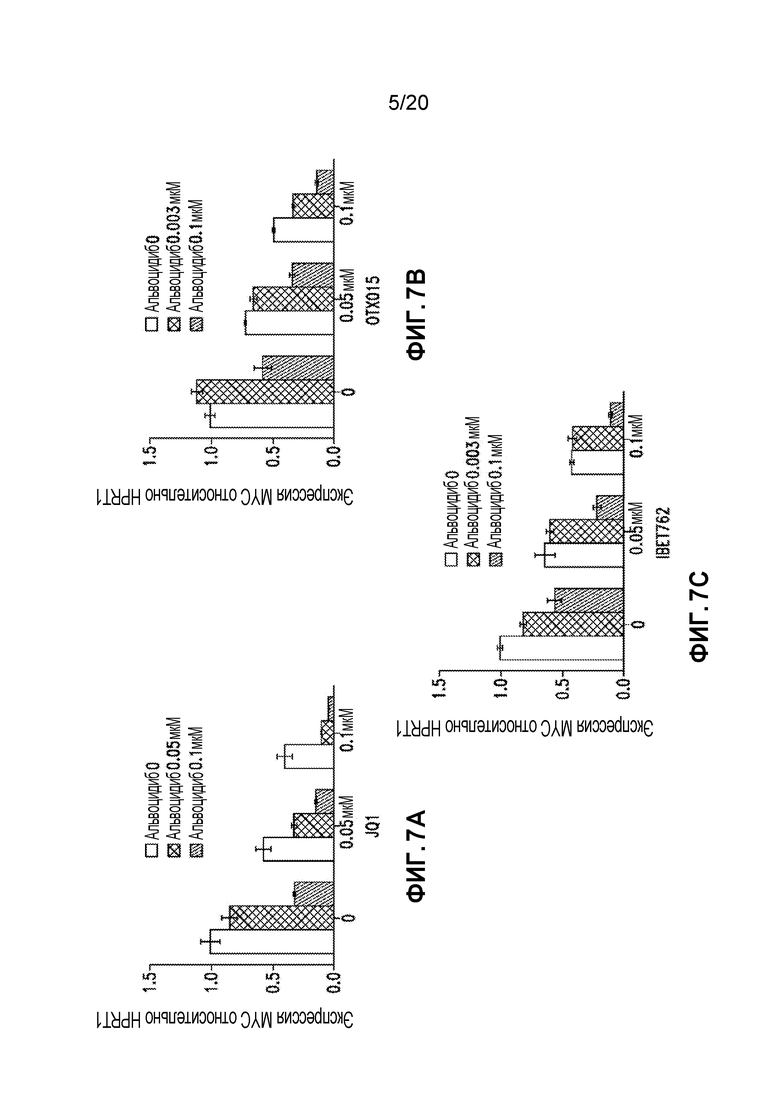
Фиг. 7A-C являются графиками, на которых показана экспрессия MYC в присутствии альвоцидиба, JQ1 (7А), OTX (7B) и IBET762 (7C) в виде отдельных средств и в комбинации.
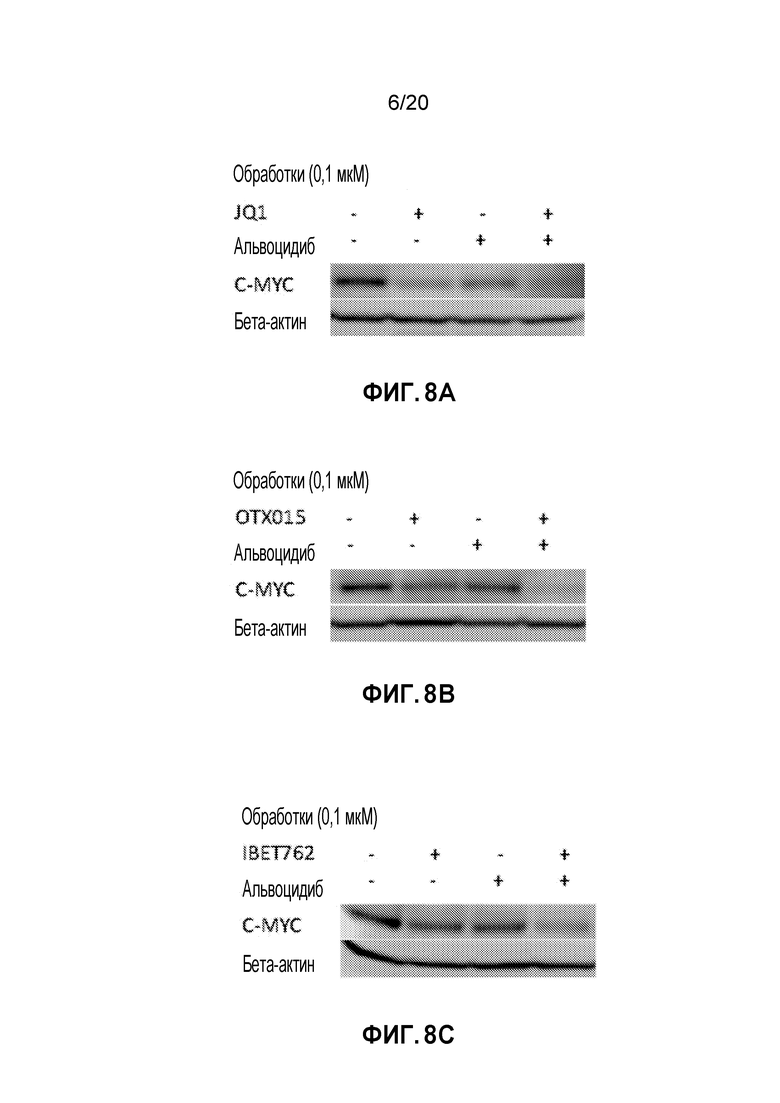
Фиг. 8A-C являются вестерн-блотами на экспрессию MYC в присутствии альвоцидиба, JQ1 (8А), OTX (8B) и IBET762 (8C) в виде отдельных средств и в комбинации.
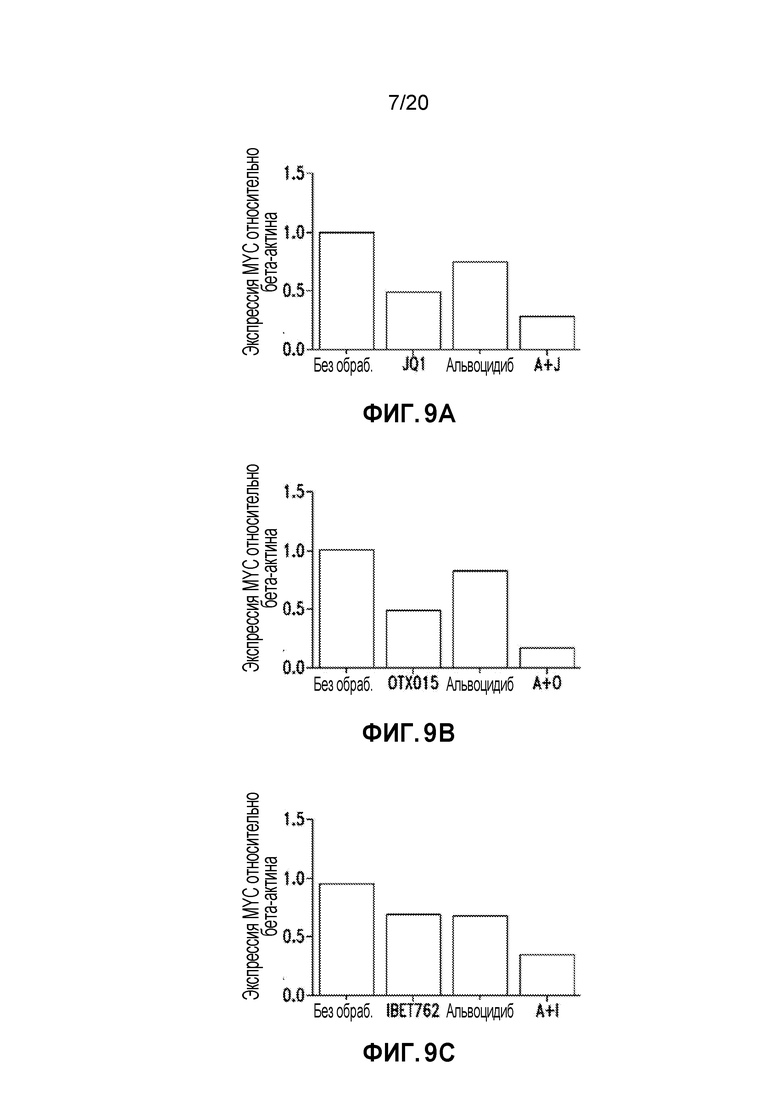
Фиг. 9A-C являются гистограммами, на которых показан количественный анализ вестерн-блотов Фиг. 8A-C. Данные для JQ1 представлены на Фиг. 8A, данные для OTX015 представлены на Фиг. 8B, и данные для IBET762 представлены на Фиг. 9C.
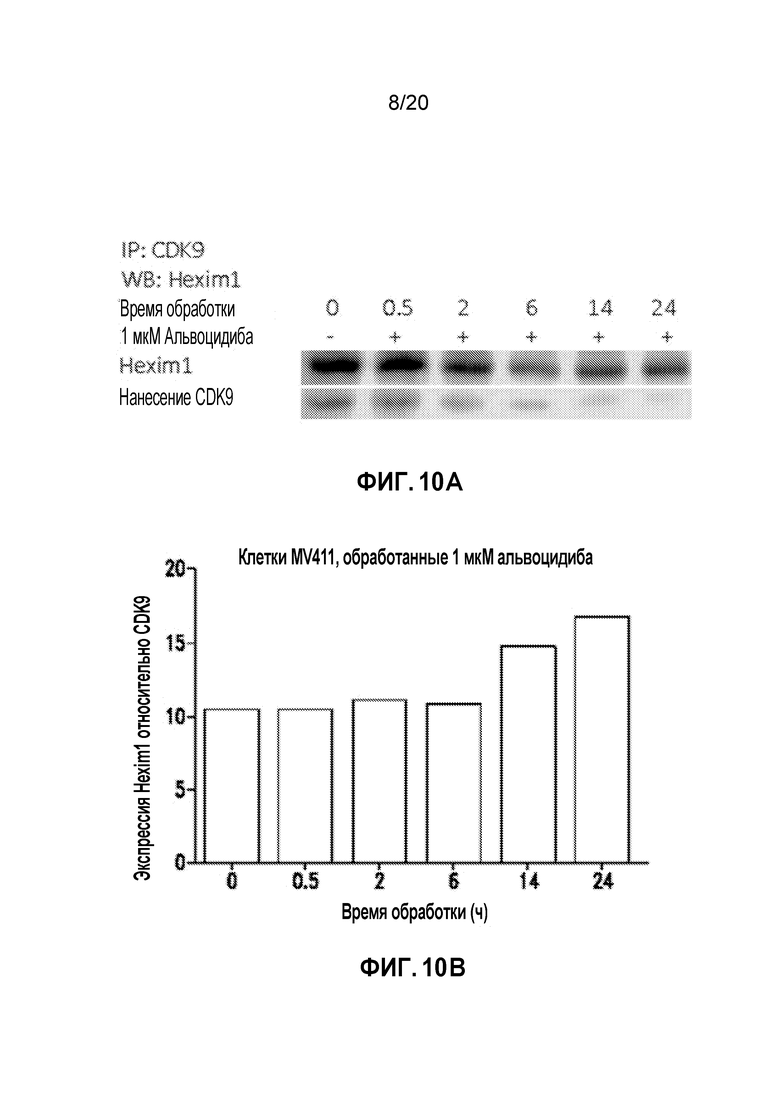
Фиг. 10A является репрезентативным вестерн-блотом для клеток MV4-11, обработанных альвоцидибом. На Фиг. 10B представлен количественный анализ вестерн-блота Фиг. 10A.
Фиг. 11A является репрезентативным вестерн-блотом для эксперимента с повышением дозы в клетках MV4-11, обработанных альвоцидибом. На Фиг. 11B представлен количественный анализ вестерн-блота Фиг. 11A.
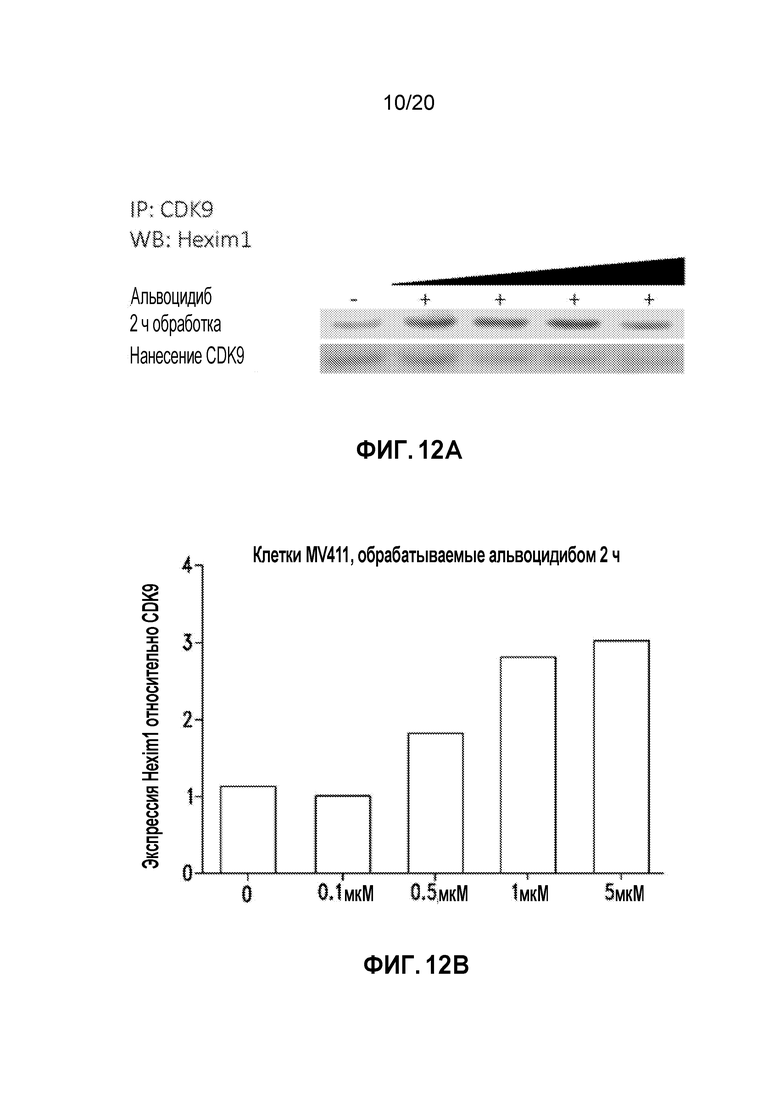
Фиг. 12A является репрезентативным вестерн-блотом для клеток MV4-11, обработанных альвоцидибом в течение 2 часов в различных дозах. На Фиг. 12B представлен количественный анализ вестерн-блота Фиг. 12A.
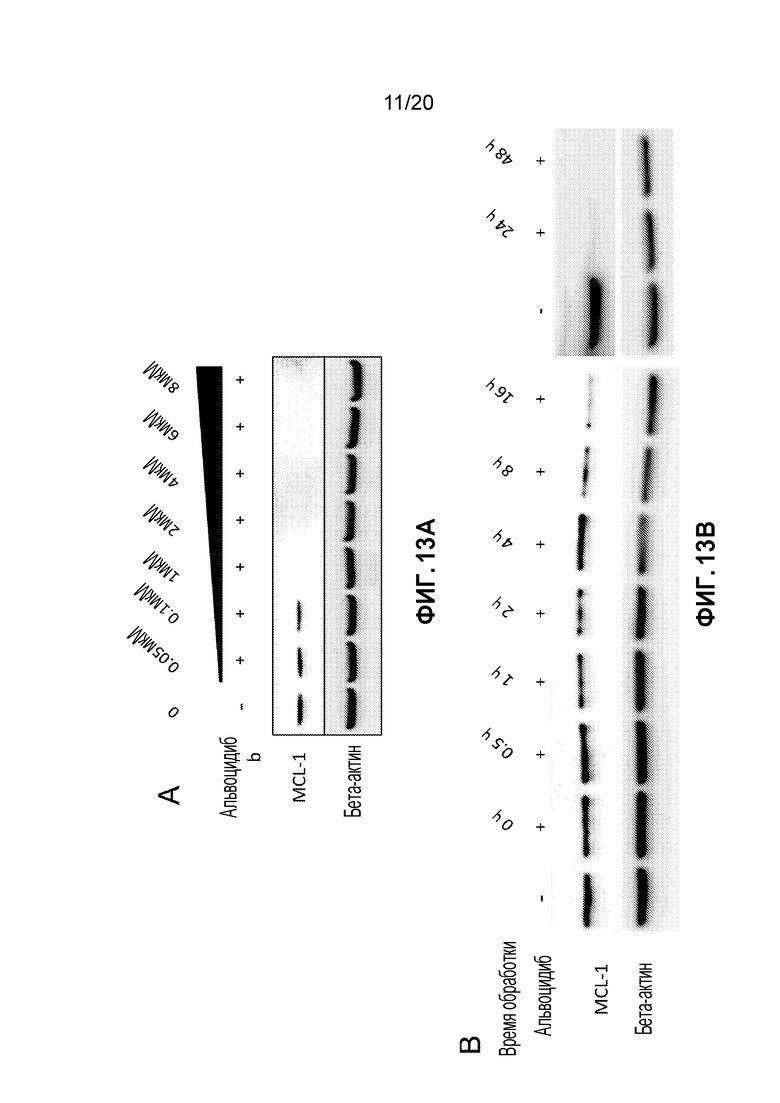
Фиг. 13A является репрезентативным вестерн-блотом для эксперимента с повышением дозы в клетках A549, обработанных альвоцидибом. Фиг. 13B является репрезентативным вестерн-блотом для клеток A549, обработанных альвоцидибом в течение определенных периодов времени.
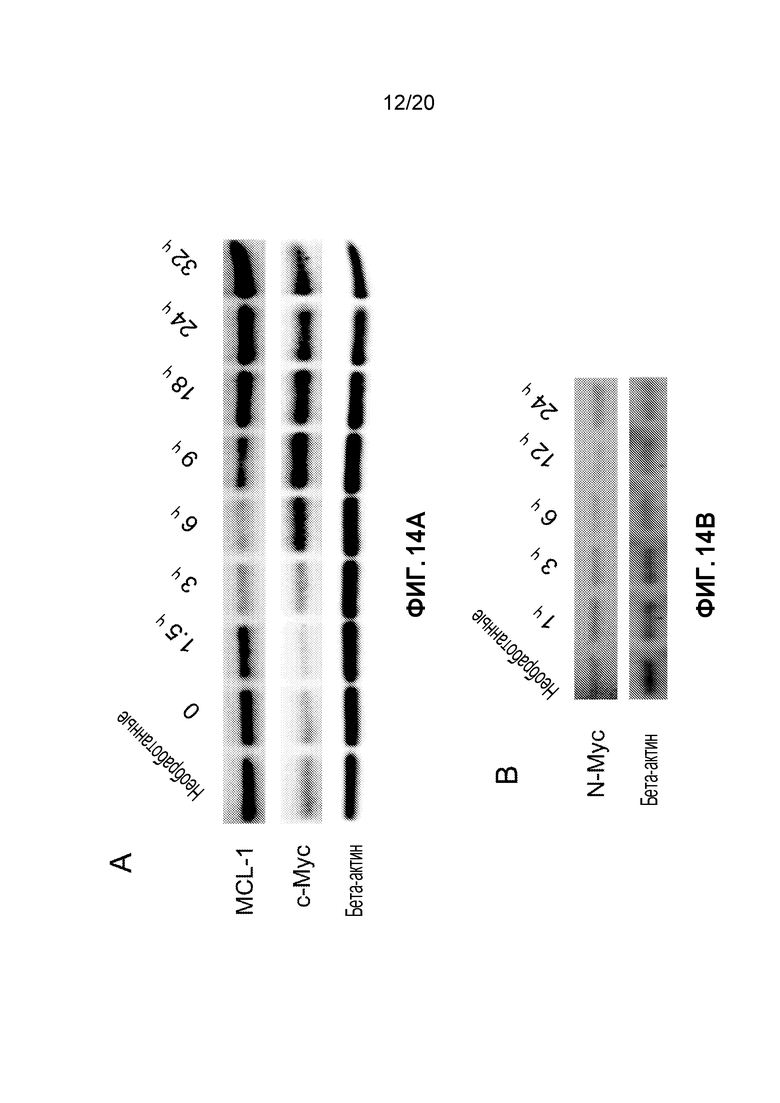
Фиг. 14A является репрезентативным вестерн-блотом для эксперимента с зависимостью от времени для клеток A549, обработанных альвоцидибом. На Фиг. 14B показано то же для клеток SK-N-AS.
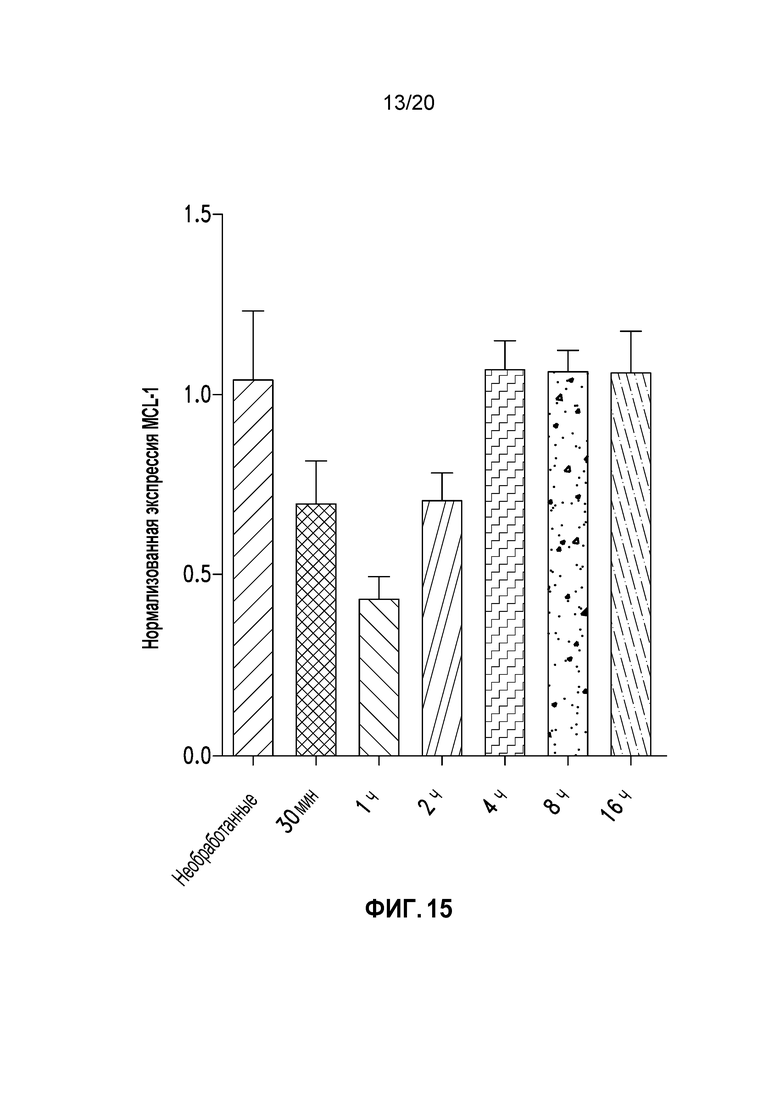
На Фиг. 15 представлен количественный анализ репрессии мРНК в клетках MV4-11, обработанных альвоцидибом, с зависимостью от времени.
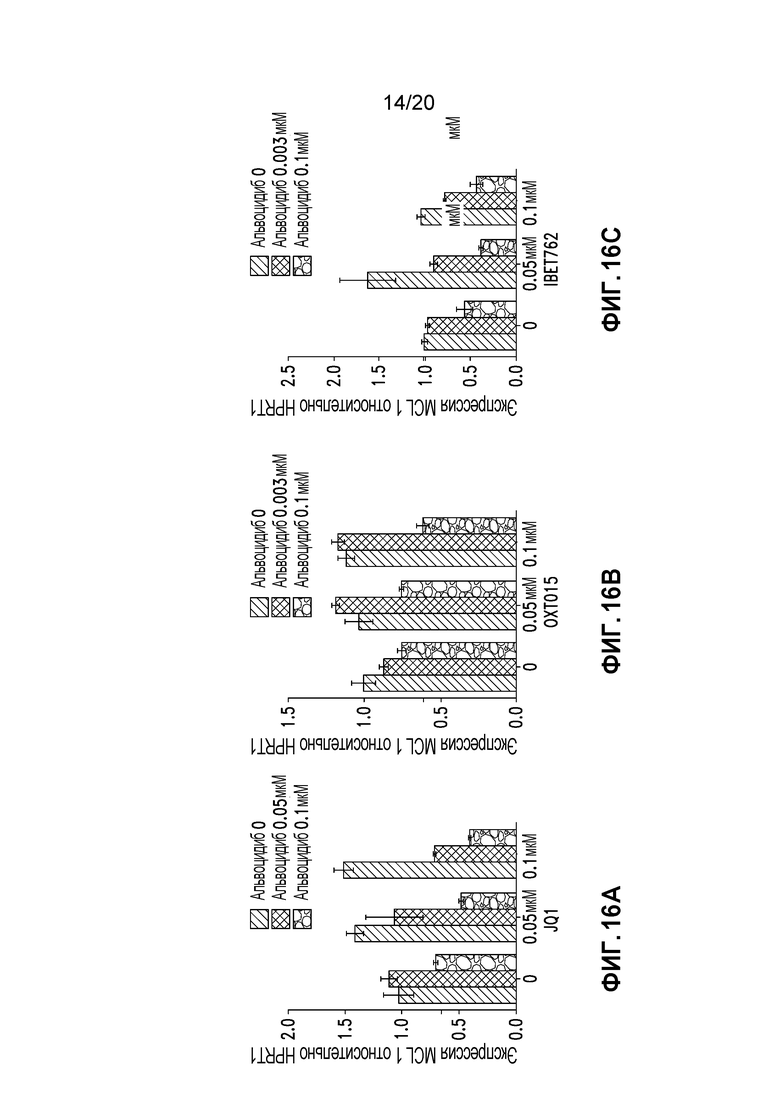
Фиг. 16A-C являются графиками, на которых показана экспрессия MCL-1 в присутствии альвоцидиба, JQ-1 (16А), OTX (16B) и IBET762 (16C) в виде отдельных средств и в комбинации.
Фиг. 17 является графиком, на котором показана экспрессия MCL-1 в присутствии альвоцидиба и JQ-1 в виде отдельных средств и в комбинации в пределах вводимых концентраций.
Фиг. 18 является репрезентативным вестерн-блотом, на котором показана экспрессия c-MYC в клетках A549 в присутствии альвоцидиба и JQ-1 в виде отдельных средств и в комбинации
На Фиг. 19 представлены данные по апоптозу для клеток A549 в присутствии альвоцидиба или JQ-1 ингибиторов отдельно и в комбинации.
На Фиг. 20 представлены данные по апоптозу для клеток A549 в присутствии динациклиба или JQ-1 ингибиторов отдельно и в комбинации.
Фиг. 21A и Фиг. 21B являются графиками, на которых показана экспрессия MYC и MCL-1 в клетках A549 в присутствии альвоцидиба в пределах вводимых концентраций.
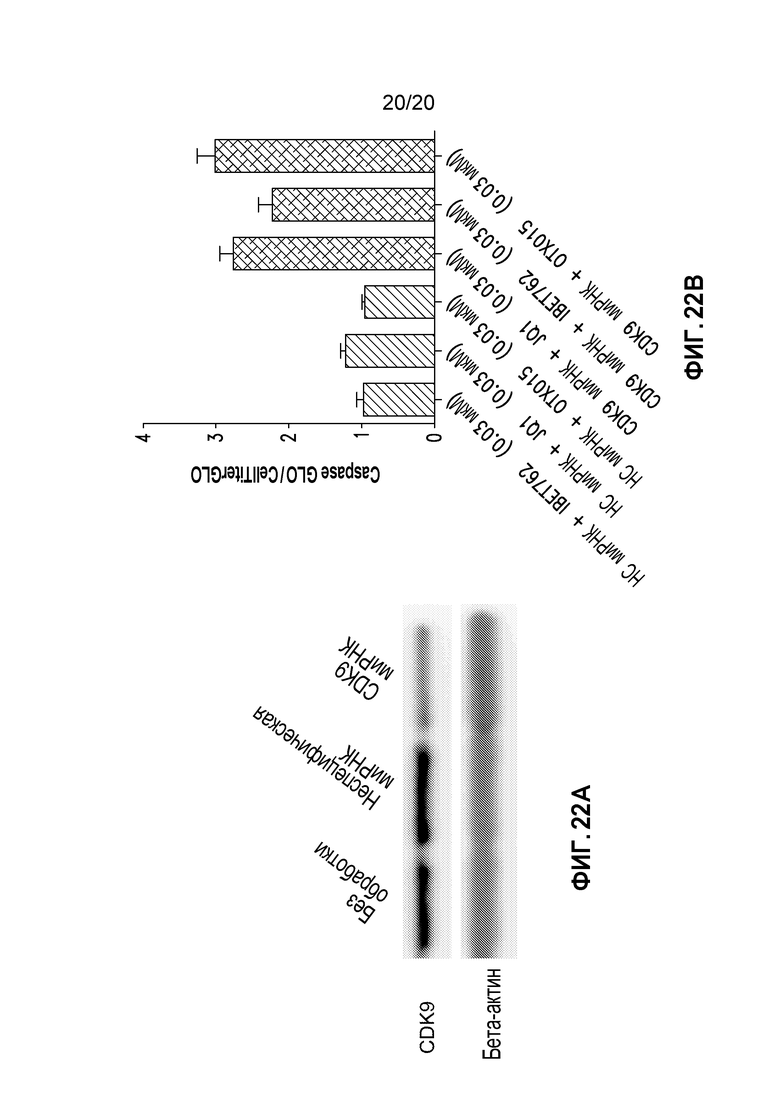
Фиг. 22A является репрезентативным вестерн-блотом, на котором показаны уровни CDK9 без обработки, при обработке неспецифической миРНК и при обработке CDK9-специфической миРНК. На Фиг. 22B представлены данные по апоптозу для клеток A549 при обработке ингибиторами BET и неспецифической или CDK9-специфической миРНК.
ПОДРОБНОЕ ОПИСАНИЕ
В следующем описании представлены некоторые определенные детали для обеспечения полного понимания различных вариантов осуществления изобретения. Впрочем, специалисту в данной области будет очевидно, что изобретение может быть осуществлено на практике без таких деталей.
Если из контекста не следует иное, по всему тексту настоящего описания и формулы изобретения слово "включают" и его вариации, такие как "включает" и "включающий" следует понимать в открытом, включительном смысле, то есть как "включающий, но не ограниченный".
Ссылка по всему тексту настоящего описания на "один вариант осуществления" или "вариант осуществления" означает, что конкретный признак, структура или особенность, описанные применительно к варианту осуществления, включены по меньшей мере в один вариант осуществления данного изобретения. Таким образом, появления фраз "в одном варианте осуществления" или "в варианте осуществления" в различных местах по всему тексту настоящего описания не должны обязательно относиться к одному и тому же варианту осуществления. Кроме того, конкретные признаки или особенности могут быть объединены любым подходящим образом в одном или более вариантах осуществления.
"Млекопитающее" включает людей и домашних животных, таких как лабораторные животные и животные-компаньоны (например, кошки, собаки, свиньи, рогатый скот, овцы, козы, лошади, кролики), и недомашних животных, таких как дикие животные и т.п.
"Фармацевтическая композиция" относится к лекарственной форме соединения изобретения и среды, общепринятой в уровне техники для доставки биологически активного соединения млекопитающим, например людям. Такая среда включает все фармацевтически приемлемые носители, разбавители или вспомогательные вещества для этого.
"Эффективное количество" или "терапевтически эффективное количество" относятся к такому количеству соединения изобретения, которое при введении млекопитающему, предпочтительно человеку, является достаточным для лечения, как определено ниже, связанного с суперэнхансером состояния или заболевания у млекопитающего, предпочтительно человека. Количество соединения изобретения, которое составляет "терапевтически эффективное количество", изменяется в зависимости от соединения, состояния и его тяжести, способа введения и возраста млекопитающего, подвергаемого лечению, но может быть стандартно определено средним специалистом в данной области с учетом его собственных знаний и настоящего описания.
"Лечение" при использовании в настоящем описании охватывает лечение заболевания или состояния, представляющего интерес, у млекопитающего, предпочтительно человека, имеющего заболевание или состояние, представляющее интерес, и включает:
(i) предотвращение возникновения заболевания или состояния у млекопитающего, в частности, когда такое млекопитающее предрасположено к состоянию, но его наличие у него еще не было диагностировано;
(ii) ингибирование заболевания или состояния, т.е. остановку его развития;
(iii) облегчение заболевания или состояния, т.е. регрессию заболевания или состояния; или
(iv) облегчение симптомов, вызванных заболеванием или состоянием, т.е. облегчение боли, без воздействия на первопричинное заболевание или состояние. При использовании в настоящем описании термины "заболевание" и "состояние" могут использоваться попеременно или могут отличаться тем, что конкретное заболевание или состояние может не иметь известного этиологического фактора (так как этиология еще не была установлена), и поэтому еще не известно как заболевание, а только как нежелательное состояние или синдром, в котором более или менее специфический синдром был определен врачами.
I. СПОСОБЫ
В некоторых вариантах осуществления способы могут применяться для нарушения функции суперэнхансера и/или для предотвращения, лечения или облегчения симптома, связанного с заболеванием, нарушением или патологическим состоянием, включающим функцию суперэнхансера, предпочтительно поражающим людей. Соединения, которые в случае совместного или последовательного применения ингибируют активность двух или больше компонентов суперэнхансеров, будут применяться в предотвращении, лечении, облегчении или уменьшении симптомов или прогрессирования рака, такого как острый миелоидный лейкоз (ОМЛ) и рак легкого. В настоящем изобретении предложены способы ингибирования суперэнхансеров, включающие введение двух или более ингибиторов компонентов суперэнхансеров, описанных в настоящей заявке, в терапевтически эффективном количестве нуждающемуся в этом субъекту. Субъект может быть человеком, не относящимся к человеку приматом, грызуном, псовым, кошачьим, копытным, бычьим, лошадиным или относиться к другим видам.
Таким образом, в одном варианте осуществления в настоящем описании предложен способ лечения опосредованного суперэнхансером заболевания у нуждающегося в этом млекопитающего, включающий введение млекопитающему эффективного количества по меньшей мере двух из следующих терапевтических средств:
i) ингибитора циклинзависимой киназы;
ii) ингибитора бромодомена;
iii) ингибитора гистонметилтрансферазы;
iv) ингибитора гистондеацетилазы; и
v) ингибитора гистондеметилазы.
В некоторых вариантах осуществления способы включают введение ингибитора циклинзависимой киназы и ингибитора бромодомена (BET).
Два или более терапевтических средств могут вводить совместно или вводить последовательно. Например, можно вводить первое терапевтическое средство и после достаточного промежутка времени вводят второе терапевтическое средство. Средний специалист в данной области сумеет подобрать подходящую схему введения на основе стандартных методов и знаний.
В некоторых вариантах осуществления по меньшей мере одно из терапевтических средств ингибирует белки циклинзависимые киназы (Cdk), такие как Cdk4, Cdk6, Cdk7, Cdk8, Cdk9, Cdk10 и/или Cdk11. В некоторых вариантах осуществления ингибитор циклинзависимой киназы ингибирует Cdk7, Cdk9 или и ту, и другую. В некоторых вариантах осуществления терапевтическим средством является динациклиб (ACS Med. Chem. Lett. 2010 May 17; 1(5):204-8; Mol. Cancer Ther. 2010 Aug; 9(8):2344-53; Merck, Sharp and Dohme), AT7519 (J. Med. Chem. 2008 Aug 28; 51(16):4986-99; Astex Pharmaceutical), палбоциклиб (J. Med. Chem. 2005 Apr 7; 48(7):2388-406; Pfizer) или альвоцидиб (Int. J. Oncol. 1996 Dec 9(6):1143-68), например альвоцидиб. В некоторых вариантах осуществления по меньшей мере одним из терапевтических средств является CDK9-специфическая миРНК, альвоцидиб или динациклиб. В некоторых вариантах осуществления по меньшей мере одним из терапевтических средств является альвоцидиб.
В других вариантах осуществления по меньшей мере одно из терапевтических средств ингибирует белки с бромодоменами, такие как Brd2, Brd3, Brd4 и/или BrdT, например Brd4. В некоторых из таких вариантов осуществления терапевтическим средством является JQ-1 (Nature 2010 Dec 23; 468(7327):1067-73), BI2536 (ACS Chem. Biol. 2014 May 16; 9(5):1160-71; Boehringer Ingelheim), TG101209 (ACS Chem. Biol. 2014 May 16; 9(5):1160-71), OTX015 (Mol. Cancer Ther. November 201312; C244; Oncoethix), IBET762 (J Med Chem. 2013 Oct 10; 56(19):7498-500; GlaxoSmithKline), IBET151 (Bioorg. Med. Chem. Lett. 2012 Apr 15; 22(8):2968-72; GlaxoSmithKline), PFI-1 (J. Med. Chem. 2012 Nov 26; 55(22):9831-7; Cancer Res. 2013 Jun 1; 73(11):3336-46; Structural Genomics Consortium) или CPI-0610 (Constellation Pharmaceuticals). В других вариантах осуществления по меньшей мере одно из терапевтических средств ингибирует белки гистондеацетилазы (HDAC). Белки HDAC можно группировать в классы по гомологии с дрожжевыми белками HDAC, при этом Класс I состоит из HDAC1, HDAC2, HDAC3 и HDAC8; Класс IIa состоит из HDAC4, HDAC5, HDAC7 и HDAC9; Класс IIb состоит из HDAC6 и HDAC10; и Класс IV состоит из HDAC11. В некоторых из таких вариантов осуществления терапевтическим средством является трихостатин A, вориностат (Proc. Natl. Acad. Sci. U.S.A. 1998 Mar 17; 95(6):3003-7), гивиностат, абексиностат (Mol. Cancer Ther. 2006 May; 5(5):1309-17), белиностат (Mol. Cancer Ther. 2003 Aug; 2(8):721-8), панобиностат (Clin. Cancer Res. 2006 Aug 1; 12(15):4628-35), ресминостат (Clin. Cancer Res. 2013 Oct 1; 19(19):5494-504), квизиностат (Clin. Cancer Res. 2013 Aug 1; 19 (15):4262-72), депсипептид (Blood. 2001 Nov 1; 98(9):2865-8), энтиностат (Proc. Natl. Acad. Sci. U.S.A. 1999 Apr 13; 96(8):4592-7), моцетиностат (Bioorg. Med. Chem. Lett. 2008 Feb 1; 18(3):1067-71) или вальпроевая кислота (EMBO J. 2001 Dec 17; 20(24):6969-78). Например, в некоторых вариантах осуществления терапевтическим средством является панобиностат. В других вариантах осуществления по меньшей мере одним терапевтическим средством является панобиностат или SAHA.
В других вариантах осуществления по меньшей мере одно из терапевтических средств ингибирует белки гистонметилтрансферазы, такие как DOT1-подобную гистонметилтрансферазу (Dot1L). В некоторых из таких вариантов осуществления терапевтическим средством является EPZ004777, EPZ-5676 (Blood. 2013 Aug 8; 122(6):1017-25) или SGC0946 (Nat. Commun. 2012; 3:1288), например EPZ-5676.
В некоторых вариантах осуществления одно из выбранных терапевтических средств ингибирует гистондеметилазы, например лизинспецифические деметилазы, такие как лизинспецифическую деметилазу 1А (Lsd1). В некоторых из таких вариантов осуществления терапевтическим средством является HCI-2509 (BMC Cancer. 2014 Oct 9; 14:752), транилципромин или ORY-1001 (J. Clin. Oncol 31, 2013 (suppl; abstr e13543). В других вариантах осуществления терапевтическим средством является HCI-2509.
В некоторых других вариантах осуществления способ включает введение млекопитающему эффективного количества ингибитора циклинзависимой киназы и ингибитора бромодомена. Например, в некоторых вариантах осуществления ингибитором циклинзависимой киназы является CDK9-специфическая миРНК или альвоцидиб. В некоторых других вариантах осуществления ингибитором циклинзависимой киназы является альвоцидиб. В различных вариантах осуществления вышеуказанного ингибитором бромодомена является JQ1. В других различных вариантах осуществления вышеуказанного ингибитором бромодомена является IBET762. В еще большем количестве вариантов осуществления вышеуказанного ингибитором бромодомена является OTX015.
Таким образом, в некоторых вариантах осуществления способ включает введение млекопитающему эффективного количества альвоцидиба и эффективного количества JQ1. В других вариантах осуществления способ включает введение млекопитающему эффективного количества альвоцидиба и эффективного количества IBET762. В еще большем количестве вариантов осуществления способ включает введение млекопитающему эффективного количества альвоцидиба и эффективного количества OTX015.
В других определенных вариантах осуществления способ включает введение млекопитающему эффективного количества ингибитора циклинзависимой киназы и ингибитора гистондеацетилазы. В некоторых из таких вариантов осуществления ингибитором циклинзависимой киназы является альвоцидиб. В других вариантах осуществления вышеуказанного ингибитором гистондеацетилазы является панобиностат.
В других определенных вариантах осуществления способ включает введение млекопитающему эффективного количества ингибитора циклинзависимой киназы и ингибитора гистонметилтрансферазы. В некоторых из таких вариантов осуществления ингибитором циклинзависимой киназы является альвоцидиб.
В других определенных вариантах осуществления способ включает введение млекопитающему эффективного количества ингибитора циклинзависимой киназы и ингибитора гистондеметилазы. В некоторых из таких вариантов осуществления ингибитором циклинзависимой киназы является альвоцидиб.
Большое разнообразие форм рака, в том числе солидные опухоли и лейкозы (например, острый миелоидный лейкоз), поддаются способам, раскрытым в настоящей заявке. Типы рака, которые можно лечить в различных вариантах осуществления, включают, без ограничения: аденокарциному молочной железы, предстательной железы и толстой кишки; все формы бронхогенной карциномы легкого; миелоидный; меланому; гепатому; нейробластому; папиллому; апудому; хористому; бранхиому; злокачественный карциноидный синдром; карциноидную болезнь сердца; и карциному (например, Уокер, базальноклеточную, базально-плоскоклеточную, Брауна-Пирс, протоковую, опухоль Эрлиха, Кребс 2, из клеток Меркеля, муцинозную, немелкоклеточную легкого, овсяноклеточную, папиллярную, скиррозную, бронхиолярную, бронхогенную, плоскоклеточную и переходноклеточную). Дополнительные типы рака, которые можно лечить, включают: гистиоцитарные заболевания; лейкоз; гистиоцитоз злокачественный; болезнь Ходжкина; иммунопролиферативное заболевание тонкого кишечника; неходжкинскую лимфому; плазмоцитому; ретикулоэндотелиоз; меланому; хондробластому; хондрому; хондросаркому; фиброму; фибросаркому; гигантоклеточные опухоли; гистиоцитому; липому; липосаркому; мезотелиому; миксому; миксосаркому; остеому; остеосаркому; хордому; краниофарингиому; дисгерминому; гамартому; мезенхимому; мезонефрому; миосаркому; амелобластому; цементому; одонтому; тератому; тимому; трофобластическую опухоль. Кроме того, следующие типы рака также считают поддающимися лечению: аденому; холангиому; холестеатому; цилиндрому; цистаденокарциному; цистаденому; гранулезоклеточную опухоль; гинандробластому; гепатому; гидраденому; инсулому; опухоль из клеток Лейдига; папиллому; опухоль из клеток Сертоли; текаклеточную опухоль; лейомиому; лейомиосаркому; миобластома; миому; миосаркому; рабдомиому; рабдомиосаркому; эпендимому; ганглионеврому; глиому; медуллобластому; менингиому; нейрилеммому; нейробластому; нейроэпителиому; нейрофиброму; неврому; параганглиому; нехромафинную параганглиому. Типы рака, которые можно лечить, также включают, без ограничения перечисленными, ангиокератому; ангиолимфоидную гиперплазию с эозинофилией; склерозирующую ангиому; ангиоматоз; гломангиому; гемангиоэндотелиому; гемангиому; гемангиоперицитому; гемангиосаркому; лимфангиому; лимфангиомиому; лимфангиосаркому; пинеалому; карциносаркому; хондросаркому; филлоидную цистосаркому; фибросаркому; гемангиосаркому; лейомиосаркому; лейкосаркому; липосаркому; лимфангиосаркому; миосаркому; миксосаркому; карциному яичника; рабдомиосаркому; саркому; новообразования; нейрофиброматоз и цервикальную дисплазию.
II. ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Другие варианты осуществления направлены на фармацевтические композиции. Фармацевтическая композиция включает любые два (или более) любых из вышеуказанных ингибиторов и фармацевтически приемлемый носитель. Например, в некоторых вариантах осуществления фармацевтическая композиция включает фармацевтически приемлемый носитель или вспомогательное вещество и по меньшей мере два из следующих терапевтических средств:
i) ингибитор циклинзависимой киназы;
ii) ингибитор бромодомена;
iii) ингибитор гистонметилтрансферазы;
iv) ингибитор гистондеацетилазы; и
v) ингибитор гистондеметилазы.
Терапевтические средства могут быть любым из описанных в настоящей заявке или известных в уровне техники. В некоторых вариантах осуществления композиция включает ингибитор циклинзависимой киназы, такой как альвоцидиб или динациклиб.
В других определенных вариантах осуществления фармацевтическая композиция включает ингибитор циклинзависимой киназы и ингибитор бромодомена. Например, в некоторых из таких вариантов осуществления ингибитором циклинзависимой киназы является альвоцидиб. В других из предыдущих вариантов осуществления ингибитором бромодомена является JQ1. В других различных вариантах осуществления вышеуказанного ингибитором бромодомена является IBET762. В еще большем количестве вариантов осуществления вышеуказанного ингибитором бромодомена является OTX015.
Таким образом, в некоторых вариантах осуществления фармацевтическая композиция включает фармацевтически приемлемый носитель или вспомогательное вещество, альвоцидиб и JQ1. В других вариантах осуществления фармацевтическая композиция включает фармацевтически приемлемый носитель или вспомогательное вещество, альвоцидиб и IBET762. В еще большем количестве вариантов осуществления фармацевтическая композиция включает фармацевтически приемлемый носитель или вспомогательное вещество, альвоцидиб и OTX015.
В различных вариантах осуществления фармацевтическая композиция включает ингибитор циклинзависимой киназы и ингибитор гистондеацетилазы. В некоторых из таких вариантов осуществления ингибитором циклинзависимой киназы является альвоцидиб. В других из предыдущих вариантов осуществления ингибитором гистондеацетилазы является панобиностат.
В различных вариантах осуществления фармацевтическая композиция включает ингибитор циклинзависимой киназы и ингибитор гистонметилтрансферазы. В некоторых из таких вариантов осуществления ингибитором циклинзависимой киназы является альвоцидиб.
В различных вариантах осуществления фармацевтическая композиция включает ингибитор циклинзависимой киназы и ингибитор гистондеметилазы. В некоторых из таких вариантов осуществления ингибитором циклинзависимой киназы является альвоцидиб
В некоторых вариантах осуществления фармацевтическая композиция изготовлена для приема внутрь. В других вариантах осуществления фармацевтическая композиция изготовлена для инъекции.
Подходящие пути введения включают, без ограничения перечисленным, пероральное, внутривенное, ректальное, аэрозольное, парентеральное, глазное, легочное, чресслизистое, трансдермальное, вагинальное, ушное, назальное и наружное введение. Кроме того, только в качестве примера, парентеральная доставка включает внутримышечные, подкожные, внутривенные, внутрикостные инъекции, а также интратекальные, прямые внутрижелудочковые, внутрибрюшинные, внутрилимфатические и интраназальные инъекции.
В некоторых вариантах осуществления соединение, как описано в настоящей заявке, вводят местным, а не системным путем, например, путем инъекции соединения непосредственно в орган, часто в депо препарате или лекарственной форме с замедленным высвобождением. В определенных вариантах осуществления лекарственные формы пролонгированного действия вводят путем имплантации (например, подкожно или внутримышечно) или внутримышечной инъекции. Кроме того, в других вариантах осуществления лекарственное средство вводят в системе направленной доставки лекарственного средства, например, в липосоме, покрытой органоспецифическим антителом. В таких вариантах осуществления липосомы направлены на и селективно захватываются органом. В других вариантах осуществления соединение, как описано в настоящей заявке, предоставлено в виде лекарственной формы с быстрым высвобождением, в виде лекарственной формы с пролонгированным высвобождением или в виде лекарственной формы с высвобождением средней длительности. В других вариантах осуществления соединение, описанное в настоящей заявке, применяют наружно.
Соединения согласно изобретению являются эффективными в широком диапазоне доз. Например, при лечении взрослых людей дозы от 0,01 до 1000 мг, от 0,5 до 100 мг, от 1 до 50 мг в день и от 5 до 40 мг в день являются примерами доз, которые применяются в некоторых вариантах осуществления. Примерная доза составляет 10-30 мг в день. Точная доза будет зависеть от пути введения, формы, в которой вводят соединение, субъекта, проходящего лечение, массы тела субъекта, проходящего лечение, и от предпочтения и опыта лечащего врача.
В некоторых вариантах осуществления соединение изобретения вводят в одной дозе. Как правило, такое введение осуществляют путем инъекции, например внутривенной инъекции, с целью быстро ввести средство. Однако в качестве подходящих используются и другие пути. Однократная доза соединения изобретения также может применяться для лечения острого состояния.
В некоторых вариантах осуществления соединение изобретения вводят в многократных дозах. В некоторых вариантах осуществления введение дозы производят приблизительно один, два, три раза, четыре раза, пять раз, шесть раз или больше шести раз в день. В других вариантах осуществления введение дозы производят приблизительно один раз в месяц, один раз в две недели, один раз в неделю или один раз в два дня. В другом варианте осуществления соединение изобретения и другое вещество вводят вместе от приблизительно одного раза в день до приблизительно 6 раз в день. В другом варианте осуществления введение соединения изобретения и средства продолжается в течение менее чем приблизительно 7 дней. В еще одном варианте осуществления введение продолжается в течение более чем приблизительно 6, 10, 14, 28 дней, двух месяцев, шести месяцев или одного года. В некоторых случаях непрерывное введение доз обеспечивают и продолжают столько, сколько необходимо.
Введение соединений изобретения может продолжаться столько, сколько необходимо. В некоторых вариантах осуществления соединение изобретения вводят в течение более чем 1, 2, 3, 4, 5, 6, 7, 14 или 28 дней. В некоторых вариантах осуществления соединение изобретения вводят в течение менее чем 28, 14, 7, 6, 5, 4, 3, 2 или 1 дня. В некоторых вариантах осуществления соединение изобретения вводят длительно на непрерывной основе, например, для лечения хронических эффектов.
В некоторых вариантах осуществления соединения изобретения вводят в дозах. Из-за вариабельности фармакокинетики соединения между субъектами индивидуализацию схемы введения применяют в некоторых вариантах осуществления. Дозы соединения изобретения могут быть определены при помощи стандартных экспериментов с учетом настоящего описания и/или могут быть подобраны средним специалистом в данной области.
В некоторых вариантах осуществления соединения, описанные в настоящей заявке, включены в фармацевтические композиции. В определенных вариантах осуществления фармацевтические композиции изготовлены стандртным способом при использовании одного или нескольких физиологически приемлемых носителей, включающих вспомогательные вещества и вспомогательные средства, которые облегчают обработку действующих веществ в препаратах, которые могут применяться фармацевтически. Надлежащее изготовление лекарственной формы зависит от выбранного пути введения. Любые фармацевтически приемлемые методы, носители и вспомогательные вещества используются как подходящие для изготовления фармацевтических композиций, описанных в настоящей заявке: Remington: The Science and Practice of Pharmacy, Nineteenth Ed (Easton, Pa.: Mack Publishing Company, 1995); Hoover, John E., Remingtonʹs Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania 1975; Liberman, H.A. and Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; и Pharmaceutical Dosage Forms and Drug Delivery Systems, Seventh Ed. (Lippincott Williams & Wilkins1999).
В настоящей заявке предложены фармацевтические композиции, включающие ингибиторы, воздействующие по меньшей мере на два компонента суперэнхансера, выбранные из следующего: i) циклинзависимые киназы (Cdk); ii) подсемейство белков с бромодоменами, содержащих бромодомены и экстратерминальный домен (BET); iii) DOT1-подобная гистонметилтрансфераза (Dot1L); iv) гистондеацетилазы класса I, II и IV (HDAC); и v) лизинспецифическая деметилаза 1А (Lsd1), и фармацевтически приемлемый разбавитель(и), вспомогательное вещество(а) или носитель(и). Охвачены все комбинации действующих веществ, представленные в разделе комбинированной терапии ниже и по всему тексту настоящего описания.
Фармацевтическая композиция при использовании в настоящем описании относится к смеси ингибиторов, воздействующих по меньшей мере на два компонента суперэнхансера, с другими химическими компонентами, такими как носители, стабилизаторы, разбавители, диспергирующие вещества, суспендирующие вещества, загустители и/или вспомогательные вещества. В некоторых вариантах осуществления фармацевтическая композиция облегчает введение соединения в организм. В некоторых вариантах осуществления, в которых используются способы лечения или применение, предложенные в настоящей заявке, терапевтически эффективные количества двух или более ингибиторов, воздействующих по меньшей мере на два компонента суперэнхансера, предложенных в настоящей заявке, вводят в фармацевтической композиции млекопитающему, имеющему заболевание, нарушение или состояние, подвергаемое лечению. В определенных вариантах осуществления млекопитающим является человек. В некоторых вариантах осуществления терапевтически эффективные количества изменяются в зависимости от тяжести заболевания, возраста и относительного состояния здоровья субъекта, активности используемого соединения и других факторов. Соединения, описанные в настоящей заявке, применяются отдельно или в комбинации с одним или более терапевтическими средствами в качестве компонентов смесей.
В одном варианте осуществления ингибиторы, воздействующие по меньшей мере на два компонента суперэнхансера, включены в водный раствор. В определенных вариантах осуществления водный раствор выбран, только в качестве примера, из физиологически совместимого буфера, такого как раствор Хэнка, раствор Рингера или физиологический солевой буфер. В других вариантах осуществления ингибиторы, воздействующие по меньшей мере на два компонента суперэнхансера, включены в лекарственную форму для чресслизистого введения. В определенных вариантах осуществления лекарственные формы для чресслизистого введения включают вещества, способствующие проникновению, которые соответствуют барьеру, через который требуется проникнуть. В других вариантах осуществления, где соединения, описанные в настоящей заявке, включены в лекарственную форму для других парентеральных инъекций, способствующие лекарственные формы включают водные или неводные растворы. В определенных вариантах осуществления такие растворы включают физиологически совместимые буферные растворы и/или вспомогательные вещества.
В другом варианте осуществления соединения, описанные в настоящей заявке, включены в лекарственную форму для приема внутрь. Соединения, описанные в настоящей заявке, включают в лекарственную форму путем объединения действующих веществ, например, с фармацевтически приемлемыми носителями или вспомогательными веществами. В различных вариантах осуществления соединения, описанные в настоящей заявке, включены в лекарственные формы для перорального применения, которые включают, только в качестве примера, таблетки, порошки, пилюли, драже, капсулы, жидкости, гели, сиропы, настойки, пасты, суспензии и т.п.
В некоторых вариантах осуществления фармацевтические препараты для перорального применения получают путем смешивания одного или нескольких твердых вспомогательных веществ с одним или более соединениями, описанными в настоящей заявке, необязательно с размолом полученной смеси и обработкой смеси гранул, после добавления подходящих вспомогательных средств, при необходимости, с получением таблеток или сердцевин драже. Подходящими вспомогательными веществами являются, в частности, наполнители, такие как сахар, в том числе лактоза, сахароза, маннит или сорбит; препараты целлюлозы, такие как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, микрокристаллическая целлюлоза, гидроксипропилметилцеллюлоза, натрий-карбоксиметилцеллюлоза; или другие, такие как: поливинилпирролидон (ПВП или повидон) или фосфат кальция. В определенных вариантах осуществления необязательно добавляют разрыхлители. Разрыхлители включают, только в качестве примера, сшитую кроскармеллозу натрия, поливинилпирролидон, агар или альгиновую кислоту или ее соль, такую как альгинат натрия.
В одном варианте осуществления лекарственные формы, такие как сердцевины драже и таблетки, покрывают одной или более подходящими оболочками. В определенных вариантах осуществления концентрированные растворы сахара используют для покрытия лекарственной формы оболочкой. Растворы сахара необязательно содержат дополнительные компоненты, такие как, только в качестве примера, гуммиарабик, тальк, поливинилпирролидон, карбопол гель, полиэтиленгликоль и/или диоксид титана, растворы лака и подходящие органические растворители или смеси растворителей. Красители и/или пигменты также необязательно добавляют к покрытиям в идентификационных целях. Кроме того, красители и/или пигменты необязательно используют для обозначения различных комбинаций доз активных соединений.
В определенных вариантах осуществления терапевтически эффективные количества ингибиторов, воздействующих по меньшей мере на два компонента суперэнхансера, описанные в настоящей заявке, включены в другие лекарственные формы для перорального применения. Лекарственные формы для перорального применения включают твердые капсулы, изготовленные из желатина, а также мягкие герметичные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит. В определенных вариантах осуществления твердые капсулы содержат действующие вещества в смеси с одним или более наполнителями. Наполнители включают, только в качестве примера, лактозу, связующие вещества, такие как крахмалы и/или смазывающие вещества, такие как тальк или стеарат магния, и, необязательно, стабилизаторы. В других вариантах осуществления мягкие капсулы содержат одно или более активных соединений, которые растворены или суспендированы в подходящей жидкости. Подходящие жидкости включают, только в качестве примера, одно или более из нелетучего масла, вазелинового масла или жидкого полиэтиленгликоля. Кроме того, необязательно добавляют стабилизаторы.
В других вариантах осуществления терапевтически эффективные количества ингибиторов, воздействующих по меньшей мере на два компонента суперэнхансера, описанные в настоящей заявке, включены в лекарственную форму для буккального или подъязычного введения. Лекарственные формы, подходящие для буккального или подъязычного введения, включают, только в качестве примера, таблетки, пастилки или гели. В других вариантах осуществления соединения, описанные в настоящей заявке, включены в лекарственную форму для парентеральной инъекции, в том числе лекарственные формы, подходящие для болюсного введения или непрерывной инфузии. В определенных вариантах осуществления лекарственные формы для инъекции представлены в виде стандартной лекарственной формы (например, в ампулах) или во многодозовых контейнерах. В лекарственные формы для инъекции необязательно добавляют консерванты. В других вариантах осуществления фармацевтические композиции изготовлены в форме, подходящей для парентеральной инъекции, в виде стерильных суспензий, растворов или эмульсий в масляных или водных растворителях. Парентеральные лекарственные формы для инъекции необязательно содержат такие вспомогательные вещества, как суспендирующие, стабилизирующие и/или диспергирующие вещества. В определенных вариантах осуществления фармацевтические композиции для парентерального введения включают водные растворы активных соединений в водорастворимой форме. В дополнительных вариантах осуществления суспензии активных соединений (например, соединений структуры (I)) изготовлены в виде подходящих масляных суспензий для инъекции. Подходящие липофильные растворители или среды для применения в фармацевтических композициях, описанных в настоящей заявке, включают, только в качестве примера, нелетучие масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, или липосомы. В некоторых определенных вариантах осуществления водные суспензии для инъекции содержат вещества, которые увеличивают вязкость суспензии, такие как натрий-карбоксиметилцеллюлозу, сорбит или декстран. Необязательно суспензия содержит подходящие стабилизаторы или вещества, которые увеличивают растворимость соединений, что позволяет получать высококонцентрированные растворы. В альтернативе, в других вариантах осуществления, действующее вещество находится в порошковой форме для восстановления подходящим растворителем, например стерильной апирогенной водой, перед применением.
В других вариантах осуществления ингибиторы, воздействующие по меньшей мере на два компонента суперэнхансера, применяют наружно. Соединения, описанные в настоящей заявке, включают во множество наружно применяемых композиций, таких как растворы, суспензии, лосьоны, гели, пасты, лечебные стики, бальзамы, кремы или мази. Такие фармацевтические композиции необязательно содержат солюбилизаторы, стабилизаторы, повышающие тоничность вещества, буферы и консерванты.
В других вариантах осуществления ингибиторы, воздействующие по меньшей мере на два компонента суперэнхансера, включены в лекарственную форму для трансдермального введения. В определенных вариантах осуществления трансдермальные лекарственные формы применяют с помощью устройств трансдермальной доставки и пластырей трансдермальной доставки, при этом они могут быть липофильными эмульсиями или буферизированными водными растворами, растворенными и/или диспергированными в полимере или адгезиве. В различных вариантах осуществления такие пластыри предназначены для непрерывной, периодической доставки фармацевтических средств или доставки по требованию. В дополнительных вариантах осуществления трансдермальная доставка ингибиторов, воздействующих по меньшей мере на два компонента суперэнхансера, достигается посредством ионтофоретических пластырей и т.п. В некоторых вариантах осуществления трансдермальные пластыри обеспечивают контролируемую доставку ингибиторов, воздействующих по меньшей мере на два компонента суперэнхансера. В определенных вариантах осуществления скорость абсорбции замедляют при помощи регулирующих скорость абсорбции мембран или посредством включения соединения в полимерную матрицу или гель. В альтернативных вариантах осуществления усилители абсорбции используются для увеличения абсорбции. Усилители абсорбции или носители включают абсорбируемые фармацевтически приемлемые растворители, которые помогают проникновению через кожу. Например, в одном варианте осуществления трансдермальные устройства имеют форму бандажа, включающего поддерживающий элемент, резервуар, содержащий соединение, необязательно с носителями, необязательно регулирующий скорость барьер для доставки соединения в кожу реципиента с контролируемой и установленной скоростью в течение длительного периода времени, и средства для закрепления устройства на коже.
В других вариантах осуществления ингибиторы, воздействующие по меньшей мере на два компонента суперэнхансера, включены в лекарственную форму для введения ингаляцией. Различные формы, подходящие для введения ингаляцией, включают, без ограничения, аэрозоли, спреи или порошки. Фармацевтические композиции ингибиторов, воздействующих по меньшей мере на два компонента суперэнхансера, удобно доставлять в форме аэрозоля, поступающего из упаковок под давлением или небулайзера с применением подходящего пропеллента (например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа). В определенных вариантах осуществления единичную дозу аэрозоля под давлением определяют с помощью клапана, выпускающего измеренное количество. В некоторых вариантах осуществления изготавливают капсулы и картриджи, такие как, только в качестве примера, желатиновые, для использования в ингаляторе или инсуффляторе, содержащие порошковую смесь соединения и подходящую порошковую основу, такую как лактоза или крахмал.
В других вариантах осуществления ингибиторы, воздействующие по меньшей мере на два компонента суперэнхансера, включены в композиции для ректального применения, такие как растворы для ректального введения, ректальные гели, ректальные пены, ректальные аэрозоли, суппозитории, гелевые суппозитории или удерживаемые клизмы, содержащие стандартные суппозиторные основы, такие как масло какао или другие глицериды, а также синтетические полимеры, такие как поливинилпирролидон, ПЭГ и т.п. В суппозиторных формах композиций низкоплавкий воск, такой как, без ограничения, смесь глицеридов жирных кислот, необязательно в сочетании с маслом какао, плавится первым.
В некоторых вариантах осуществления фармацевтические композиции изготавливают любым стандартным способом при использовании одного или более физиологически приемлемых носителей, включающих вспомогательные вещества и вспомогательные средства, которые облегчают переработку активных соединений в препараты, которые можно применять фармацевтически. Надлежащая лекарственная форма зависит от выбранного пути введения. Любые фармацевтически приемлемые методы, носители и вспомогательные вещества необязательно используют в качестве подходящих. Фармацевтические композиции, включающие ингибиторы, воздействующие по меньшей мере на два компонента суперэнхансера, производят с применением стандартного способа, такого как, только в качестве примера, процессы обычного смешивания, растворения, гранулирования, дражирования, растирания, эмульгирования, инкапсулирования, включения или прессования.
Фармацевтические композиции включают по меньшей мере один фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество и ингибиторы, воздействующие по меньшей мере на два компонента суперэнхансера, описанные в настоящей заявке, в качестве действующего вещества. Действующее вещество находится в форме свободной кислоты или свободного основания, или в форме фармацевтически приемлемой соли. Кроме того, способы и фармацевтические композиции, описанные в настоящей заявке, включают применение N-оксидов, кристаллических форм (также известных как полиморфные формы), а также активных метаболитов таких соединений, обладающих активностью того же типа. Все таутомеры соединений, описанных в настоящей заявке, включены в объем соединений, представленных в настоящей заявке. Кроме того, соединения, описанные в настоящей заявке, охватывают как несольватированные, так и сольватированные формы с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п. Сольватированные формы ингибиторов, воздействующих по меньшей мере на два компонента суперэнхансера, представленных в настоящей заявке, также считаются раскрытыми в настоящей заявке. Кроме того, фармацевтические композиции необязательно включают другие лекарственные или фармацевтические средства, носители, вспомогательные вещества, такие как консерванты, стабилизаторы, смачивающие или эмульгирующие вещества, ускорители растворения, соли для регулирования осмотического давления, буферы и/или другие терапевтически ценные вещества.
Способы получения композиций, включающих ингибиторы, воздействующие по меньшей мере на два компонента суперэнхансера, описанные в настоящей заявке, включают включение соединений в лекарственные формы с одним или более инертными, фармацевтически приемлемыми вспомогательными веществами или носителями, с получением твердого, полутвердого вещества или жидкости. Твердые композиции включают, без ограничения, порошки, таблетки, диспергируемые гранулы, капсулы, облатки и суппозитории. Жидкие композиции включают растворы, в которых растворено соединение, эмульсии, включающие соединение, или раствор, содержащий липосомы, мицеллы или наночастицы, включающие соединение, как раскрыто в настоящей заявке. Полутвердые композиции включают, без ограничения, гели, суспензии и кремы. Форма фармацевтических композиций, описанных в настоящей заявке, включает жидкие растворы или суспензии, твердые формы, подходящие для раствора или суспензии в жидкости перед применением, или в виде эмульсий. Эти композиции также необязательно содержат незначительные количества нетоксичных вспомогательных веществ, таких как смачивающие или эмульгирующие вещества, регуляторы pH и т.д.
В некоторых вариантах осуществления фармацевтическая композиция, включающая ингибиторы, воздействующие по меньшей мере на два компонента суперэнхансера, иллюстративно находится в форме жидкости, в которой средства присутствуют в растворе и/или в суспензии. Как правило, когда композицию вводят в виде раствора или суспензии, первая часть средства присутствует в растворе, а вторая часть средства присутствует в форме частиц, в суспензии в жидкой матрице. В некоторых вариантах осуществления жидкая композиция включает гелевую лекарственную форму. В других вариантах осуществления жидкая композиция является водной.
В некоторых вариантах осуществления полезные водные суспензии содержат один или более полимеров в качестве суспендирующих веществ. Полезные полимеры включают водорастворимые полимеры, такие как целлюлозные полимеры, например гидроксипропилметилцеллюлозу, и нерастворимые в воде полимеры, такие как поперечно сшитые карбоксил-содержащие полимеры. Некоторые фармацевтические композиции, описанные в настоящей заявке, включают мукоадгезивный полимер, выбранный, например, из карбоксиметилцеллюлозы, карбомера (полимера акриловой кислоты), полиметилметакрилата, полиакриламида, поликарбофила, сополимера акриловой кислоты/бутилакрилата, альгината натрия и декстрана.
Полезные фармацевтические композиции также необязательно включают солюбилизирующие вещества, способствующие растворимости ингибиторов, воздействующих по меньшей мере на два компонента суперэнхансера. Термин "солюбилизирующее вещество" обычно включает средства, которые приводят к образованию мицеллярного раствора или истинного раствора вещества. Некоторые приемлемые неионогенные поверхностно-активные вещества, например полисорбат 80, могут применяться в качестве солюбилизирующих веществ, как и офтальмологически приемлемые гликоли, полигликоли, например полиэтиленгликоль 400, и эфиры гликолей.
Кроме того, полезные фармацевтические композиции необязательно включают один или более регуляторов pH или буферных веществ, в том числе кислоты, такие как уксусную, борную, лимонную, молочную, фосфорную и соляную кислоты; основания, такие как гидроксид натрия, фосфат натрия, борат натрия, цитрат натрия, ацетат натрия, лактат натрия и трис-гидроксиметиламинометан; и буферы, такие как цитрат/декстрозу, бикарбонат натрия и хлорид аммония. Такие кислоты, основания и буферы включают в количестве, требуемом для поддержания pH композиции в приемлемом диапазоне.
Кроме того, полезные композиции также необязательно включают одну или более солей в количестве, требуемом для приведения осмоляльности композиции в приемлемый диапазон. Такие соли включают соли, которые содержат катионы натрия, калия или аммония и анионы хлорид, цитрат, аскорбат, борат, фосфат, бикарбонат, сульфат, тиосульфат или бисульфит; подходящие соли включают хлорид натрия, хлорид калия, тиосульфат натрия, бисульфит натрия и сульфат аммония.
Другие полезные фармацевтические композиции необязательно включают один или более консервантов для подавления микробной активности. Подходящие консерванты включают ртутьсодержащие вещества, такие как мерфен и тиомерсал; стабилизированный диоксид хлора; и соединения четвертичного аммония, такие как хлорид бензалкония, бромид цетилтриметиламмония и хлорид цетилпиридиния.
Тем не менее, другие полезные композиции включают один или несколько поверхностно-активных веществ для повышения физической стабильности или для других целей. Подходящие неионогенные поверхностно-активные вещества включают полиоксиэтилен глицериды жирных кислот и растительные масла, например, полиоксиэтилен (60) гидрогенизированное касторовое масло; и полиоксиэтилен алкилэфиры и алкилфенилэфиры, например, октоксинол 10, октоксинол 40.
Тем не менее, другие полезные композиции включают один или несколько антиоксидантов для увеличения химической стабильности при необходимости. Подходящие антиоксиданты включают, только в качестве примера, аскорбиновую кислоту и метабисульфит натрия.
В некоторых вариантах осуществления композиции в форме водной суспензии упакованы в однодозовые контейнеры, неподдающиеся повторной герметизации. В альтернативе используются многодозовые, поддающиеся повторной герметизации контейнеры, при этом в таком случае в композицию обычно включают консервант.
В альтернативных вариантах осуществления другие системы доставки применяются для гидрофобных фармацевтических соединений. Липосомы и эмульсии являются примерами средств доставки или носителей, полезных в настоящей заявке. В некоторых вариантах осуществления также применяются органические растворители, такие как N-метилпирролидон. В дополнительных вариантах осуществления соединения, описанные в настоящей заявке, доставляют с применением системы замедленного высвобождения, такой как полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие терапевтическое средство. В настоящей заявке могут применяться различные материалы замедленного высвобождения. В некоторых вариантах осуществления капсулы с замедленным высвобождением высвобождают соединения в течение от нескольких недель до более чем 100 дней. В зависимости от химической природы и биологической стабильности терапевтического реагента используются дополнительные стратегии белковой стабилизации.
В некоторых вариантах осуществления лекарственные формы, описанные в настоящей заявке, включают один или более антиоксидантов, металлохелатирующих веществ, тиолсодержащих соединений и/или других обычных стабилизирующих веществ. Примеры таких стабилизирующих веществ включают, без ограничения: (a) от приблизительно 0,5% до приблизительно 2% в/об глицерина, (b) от приблизительно 0,1% до приблизительно 1% в/об метионина, (c) от приблизительно 0,1% до приблизительно 2% в/об монотиоглицерина, (d) от приблизительно 1 мм до приблизительно 10 мМ ЭДТА, (e) от приблизительно 0,01% до приблизительно 2% в/об аскорбиновой кислоты, (f) от 0,003% до приблизительно 0,02% в/об полисорбата 80, (g) от 0,001% до приблизительно 0,05% в/об полисорбата 20, (h) аргинин, (i) гепарин, (j) декстран сульфат, (k) циклодекстрины, (l) пентозан полисульфат и друге гепариноиды, (m) двухвалентные катионы, такие как магний и цинк; или (n) их комбинации.
В некоторых вариантах осуществления концентрация одного или более ингибиторов, включенных в фармацевтические композиции настоящего изобретения, составляет меньше чем 100%, 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1%, 0,09%, 0,08%, 0,07%, 0,06%, 0,05%, 0,04%, 0,03%, 0,02%, 0,01%, 0,009%, 0,008%, 0,007%, 0,006%, 0,005%, 0,004%, 0,003%, 0,002%, 0,001%, 0,0009%, 0,0008%, 0,0007%, 0,0006%, 0,0005%, 0,0004%, 0,0003%, 0,0002% или 0,0001% в/в, в/об или об/об.
В некоторых вариантах осуществления концентрация одного или более ингибиторов изобретения превышает 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 19,75%, 19,50%, 19,25% 19%, 18,75%, 18,50%, 18,25% 18%, 17,75%, 17,50%, 17,25% 17%, 16,75%, 16,50%, 16,25% 16%, 15,75%, 15,50%, 15,25% 15%, 14,75%, 14,50%, 14,25% 14%, 13,75%, 13,50%, 13,25% 13%, 12,75%, 12,50%, 12,25% 12%, 11,75%, 11,50%, 11,25% 11%, 10,75%, 10,50%, 10,25% 10%, 9,75%, 9,50%, 9,25% 9%, 8,75%, 8,50%, 8,25% 8%, 7,75%, 7,50%, 7,25% 7%, 6,75%, 6,50%, 6,25% 6%, 5,75%, 5,50%, 5,25% 5%, 4,75%, 4,50%, 4,25%, 4%, 3,75%, 3,50%, 3,25%, 3%, 2,75%, 2,50%, 2,25%, 2%, 1,75%, 1,50%, 125%, 1%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1%, 0,09%, 0,08%, 0,07%, 0,06%, 0,05%, 0,04%, 0,03%, 0,02%, 0,01%, 0,009%, 0,008%, 0,007%, 0,006%, 0,005%, 0,004%, 0,003%, 0,002%, 0,001%, 0,0009%, 0,0008%, 0,0007%, 0,0006%, 0,0005%, 0,0004%, 0,0003%, 0,0002% или 0,0001% в/в, в/об, или об/об.
В некоторых вариантах осуществления концентрация одного или более ингибиторов изобретения находится в диапазоне от приблизительно 0,0001% приблизительно до 50%, от приблизительно 0,001% до приблизительно 40%, от приблизительно 0,01% до приблизительно 30%, от приблизительно 0,02% до приблизительно 29%, от приблизительно 0,03% до приблизительно 28%, от приблизительно 0,04% до приблизительно 27%, от приблизительно 0,05% до приблизительно 26%, от приблизительно 0,06% до приблизительно 25%, от приблизительно 0,07% до приблизительно 24%, от приблизительно 0,08% до приблизительно 23%, от приблизительно 0,09% до приблизительно 22%, от приблизительно 0,1% до приблизительно 21%, от приблизительно 0,2% до приблизительно 20%, от приблизительно 0,3% до приблизительно 19%, от приблизительно 0,4% до приблизительно 18%, от приблизительно 0,5% до приблизительно 17%, от приблизительно 0,6% до приблизительно 16%, от приблизительно 0,7% до приблизительно 15%, от приблизительно 0,8% до приблизительно 14%, от приблизительно 0,9% до приблизительно 12%, от приблизительно 1% до приблизительно 10% в/в, в/об или об/об.
В некоторых вариантах осуществления концентрация одного или более ингибиторов изобретения находится в диапазоне от приблизительно 0,001% приблизительно до 10%, от приблизительно 0,01% до приблизительно 5%, от приблизительно 0,02% до приблизительно 4,5%, от приблизительно 0,03% до приблизительно 4%, от приблизительно 0,04% до приблизительно 3,5%, от приблизительно 0,05% до приблизительно 3%, от приблизительно 0,06% до приблизительно 2,5%, от приблизительно 0,07% до приблизительно 2%, от приблизительно 0,08% до приблизительно 1,5%, от приблизительно 0,09% до приблизительно 1%, от приблизительно 0,1% до приблизительно 0,9% в/в, в/об или об/об.
В некоторых вариантах осуществления количество одного или более ингибиторов изобретения меньше или равно 10 г, 9,5 г, 9,0 г, 8,5 г, 8,0 г, 7,5 г, 7,0 г, 6,5 г, 6,0 г, 5,5 г, 5,0 г, 4,5 г, 4,0 г, 3,5 г, 3,0 г, 2,5 г, 2,0 г, 1,5 г, 1,0 г, 0,95 г, 0,9 г, 0,85 г, 0,8 г, 0,75 г, 0,7 г, 0,65 г, 0,6 г, 0,55 г, 0,5 г, 0,45 г, 0,4 г, 0,35 г, 0,3 г, 0,25 г, 0,2 г, 0,15 г, 0,1 г, 0,09 г, 0,08 г, 0,07 г, 0,06 г, 0,05 г, 0,04 г, 0,03 г, 0,02 г, 0,01 г, 0,009 г, 0,008 г, 0,007 г, 0,006 г, 0,005 г, 0,004 г, 0,003 г, 0,002 г, 0,001 г, 0,0009 г, 0,0008 г, 0,0007 г, 0,0006 г, 0,0005 г, 0,0004 г, 0,0003 г, 0,0002 г или 0,0001 г.
В некоторых вариантах осуществления количество одного или более ингибиторов изобретения превышает 0,0001 г, 0,0002 г, 0,0003 г, 0,0004 г, 0,0005 г, 0,0006 г, 0,0007 г, 0,0008 г, 0,0009 г, 0,001 г, 0,0015 г, 0,002 г, 0,0025 г, 0,003 г, 0,0035 г, 0,004 г, 0,0045 г, 0,005 г, 0,0055 г, 0,006 г, 0,0065 г, 0,007 г, 0,0075 г, 0,008 г, 0,0085 г, 0,009 г, 0,0095 г, 0,01 г, 0,015 г, 0,02 г, 0,025 г, 0,03 г, 0,035 г, 0,04 г, 0,045 г, 0,05 г, 0,055 г, 0,06 г, 0,065 г, 0,07 г, 0,075 г, 0,08 г, 0,085 г, 0,09 г, 0,095 г, 0,1 г, 0,15 г, 0,2 г, 0,25 г, 0,3 г, 0,35 г, 0,4 г, 0,45 г, 0,5 г, 0,55 г, 0,6 г, 0,65 г, 0,7 г, 0,75 г, 0,8 г, 0,85 г, 0,9 г, 0,95 г, 1 г, 1,5 г, 2 г, 2.5, 3 г, 3.5, 4 г, 4,5 г, 5 г, 5,5 г, 6 г, 6,5 г, 7 г, 7,5 г, 8 г, 8,5 г, 9 г, 9,5 г или 10 г.
В некоторых вариантах осуществления количество одного или более ингибиторов изобретения находится в диапазоне 0,0001-10 г, 0,0005-9 г, 0,001-8 г, 0,005-7 г, 0,01-6 г, 0,05-5 г, 0,1-4 г, 0,5-4 г или 1-3 г.
ПРИМЕРЫ
ПРИМЕР 1
ВЛИЯНИЕ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ НА ОБЪЕМ ОПУХОЛИ
Линия клеток ОМЛ, MV4-11, является MLL слитой и FLT3-ITD положительной. Слияние MLL делает эту клеточную линию особо зависимой от функции суперэнхансеров для направления онкогенеза. Клетки MV4-11 подкожно имплантировали бестимусным мышам Nu/Nu и оставляли для приживления, пока опухоли не достигали 100-200 мм3. JQ-1, ингибитор белков BET, и альвоцидиб, ингибитор Cdk, применяли отдельно и в комбинации для определения влияния лекарственного средства (средств) на объем опухоли. Животных разделяли на 4 группы и назначали один из четырех способов лечения: растворитель, 25 мг/кг JQ-1, 2,5 мг/кг альвоцидиба или комбинацию двух указанных средств в указанных дозах. Лекарственные средства вводили внутрибрюшинно, один раз в день в течение 5 дней, в общей сложности в течение 3 недель. Объем опухоли измеряли два раза в день с помощью штангенциркуля. Результаты показаны на Фигуре 2. JQ-1 в дозе 25 мг/кг не показал измеримой активности, поскольку он приближался к контрольному растворителю. Альвоцидиб в дозе 2,5 мг/кг показал умеренную активность, причем размер опухолей составлял приблизительно 50% от размера в группе растворителя в ходе исследования. Неожиданно комбинация этих двух средств в указанных дозах полностью останавливала рост опухолей у этих мышей в день 8. Опухоли не были обнаружены ни у одной из мышей (n=8) по завершении исследования в группе комбинации. Масса тела у всех животных была сопоставима в ходе исследования. Увеличение веса у мышей в группе растворителя и в группе отдельных лекарственных средств могло быть связано с ростом опухолей. Увеличение веса у мышей, получавших комбинированное лечение, могло быть связано с общим состоянием здоровья мышей и потреблением корма.
Эти результаты служат убедительным доказательством наличия синергии между альвоцидибом и JQ-1, а также подтверждением концепции воздействия на суперэнхансерный комплекс по двум или болеее пунктам.
ПРИМЕР 2
ВЛИЯНИЕ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ НА ЭКСПРЕССИЮ C-MYC
Ген c-MYC, как известно, регулируется суперэнхансерным комплексом в клетках ОМЛ. JQ-1, ингибитор белков BET, и альвоцидиб, ингибитор Cdk, применяли отдельно и в комбинации для определения влияния лекарственного средства (средств) на экспрессию c-MYC. Клетки MV4-11 обрабатывали различными концентрациями альвоцидиба и/или JQ-1 в течение 2 часов. Также были включены обработанные ДМСО контроли. Обработку останавливали лизисом клеток и выделяли РНК для анализа ОТ-кПЦР. Экспрессию c-MYC определяли и нормализовали по гену домашнего хозяйства, HPRT1, и по обработанному ДМСО контролю. Результаты показаны на Фигуре 3. Альвоцидиб и JQ-1 снижали экспрессию c-MYC при отдельном применении; однако даунрегуляция c-MYC была намного более выраженной в случае применения двух средств в комбинации. Опять же, эти данные демонстрируют сильную синергию между двумя средствами и обеспечивают хорошее обоснование метода воздействия на суперэнхансерный комплекс посредством множества механизмов.
ПРИМЕР 3
ВЛИЯНИЕ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ НА IC50
MOLM13 и MV4-11 представляют собой MLL слитые и FLT3-ITD положительные линии клеток ОМЛ. Обе клеточных линии обрабатывали 20 нМ альвоцидиба, ингибитора Cdk, в течение 48 часов, или ДМСО в качестве контроля, с последующим добавлением JQ-1, ингибитора белков BET, в различных концентрациях (10 мкМ - 0,0003 мкМ), или с добавлением панобиностата, ингибитора HDAC, в различных концентрациях (10 мкМ - 0,0003 мкМ) в течение дополнительных 48 часов. По завершении жизнеспособность клеток измеряли с помощью реагента Cell Titer GLO. Значения IC50 определяли для JQ-1 и панобиностата с низкой дозой альвоцидиба и без. Результаты показаны в Таблице 1 ниже. Добавление 20 нМ альвоцидиба увеличивало активность JQ-1, как показало в 2 раза более низкое значение IC50. Добавление 20 нМ альвоцидиба увеличивало активность панобиностата (ингибитора HDAC), как продемонстрировали в 3-6 раз более низкие значения IC50. Эти данные демонстрируют увеличенную активность комбинации ингибиторов Cdk и белков BET и ингибиторов Cdk и HDAC по сравнению с отдельными ингибиторами.
Таблица 1
Альвоцидиб снижает IC50 для JQ-1 и Панобиностата
ПРИМЕР 4
ИНГИБИРОВАНИЕ ЭКСПРЕССИИ MYC И MCL-1 АЛЬВОЦИДИБОМ
Для определения MYC- и MCL-1-ингибирующей активности альвоцидиба клетки MV4-11 обрабатывали альвоцидибом в течение двух часов и определяли экспрессию MYC и MCL-1 относительно HPRT. Данные показывают, что альвоцидиб в качестве отдельного средства полностью блокировал экспрессию MYC в клетках MV4-11 (Фигура 5A) и уменьшал экспрессию MCL-1 на 60% (Фигура 5B).
ПРИМЕР 5
АЛЬВОЦИДИБ В КОМБИНАЦИИ С ИНГИБИТОРАМИ BRD4 УВЕЛИЧИВАЛ АПОПТОЗ В КЛЕТКАХ MV4-11
Клетки MV4-11 сеяли при плотности 1000 клеток в лунку в 384-луночные планшеты. Ингибитор BRD4 (IBET762, OTX015 или JQ1) добавляли в одной дозе к клеткам на 24 часа. Альвоцидиб добавляли на 24 часа с уменьшением дозы. Добавляли Cell Titer GLO и Caspase GLO и измеряли люминесценцию через 48 часов. Одиночные дозы ингибиторов BRD4 в комбинации с альвоцидибом при серийном разведении продемонстрировали синергическое увеличение активности каспазы, что указывает на то, что альвоцидиб в комбинации с ингибиторами BRD4 синергически увеличивает апоптоз раковых клеток MV4-11 по сравнению с альвоцидибом или индивидуальными ингибиторами BRD4 по отдельности (Фигура 6).
ПРИМЕР 6
АЛЬВОЦИДИБ В КОМБИНАЦИИ С ИНГИБИТОРАМИ BRD4 СНИЖАЕТ ЭКСПРЕССИЮ MYC И MCL-1 В КЛЕТКАХ MV4-11 ЛУЧШЕ, ЧЕМ ОБРАБОТКА ОТДЕЛЬНЫМИ СРЕДСТВАМИ
Клетки MV4-11 сеяли (1 миллион клеток) в 6-луночные планшеты и обрабатывали альвоцидибом или ингибитором BRD4 (IBET762, OTX015 или JQ1) по отдельности или обрабатывали комбинацией альвоцидиба и ингибитора BDR4 (IBET762, OTX015 или JQ1). После обработки клетки исследовали с помощью ОТ-ПЦР. Комбинация альвоцидиба и ингибитора BRD4 снижала экспрессию MYC лучше, чем обработка отдельными средствами (Фигуры 7A-C). Комбинация альвоцидиба и ингибитора BRD4 также снижала экспрессию MCL-1 лучше, чем обработка отдельными средствами (Фигуры 16A-C).
В аналогичном эксперименте клетки MV4-11 сеяли (3 миллиона клеток) в колбы T75 и обрабатывали альвоцидибом или ингибитором BRD4 (IBET762, OTX015 или JQ1) по отдельности или обрабатывали комбинацией альвоцидиба и ингибитора BDR4 (IBET762, OTX015 или JQ1) в течение 3 часов. Клетки исследовали с помощью вестерн-блоттинга, который показал снижение экспрессии MYC во всех обработанных образцах (Фигуры 8A-C). Количественный анализ вестерн-блотов показал, что комбинация альвоцидиба (0,1 мМ) и ингибитора BRD4 (0,1 мМ) снижала экспрессию MYC лучше, чем обработка отдельными средствами (Фигуры 9A-C).
ПРИМЕР 7
АЛЬВОЦИДИБ ВРЕМЯ- И ДОЗОЗАВИСИМО УВЕЛИЧИВАЕТ СВЯЗЫВАНИЕ CDK9 И БЕЛКОВ HEXIM1
Клетки MV4-11 сеяли и обрабатывали альвоцидибом при одинаковых концентрациях и дозах. Клетки собирали в определенное время и подвергали обработке лизисным буфером с высокой концентрацией соли и иммунопреципитации с последующим вестерн-блоттингом. Данные показывают, что 1 мМ альвоцидиба увеличивает связывание CDK9 и Hexim1 с зависимостью от времени. Репрезентативный вестерн-блот представлен на Фигуре 10A, и количественный анализ вестерн-блота показан на Фигуре 10B. На Фигурах 11A и 11B приведены результаты исследования с повышением дозы, выполненного согласно вышеуказанной общей методике. Данные показывают, что различные дозы альвоцидиба изменяют связывание CDK9 и Hexim1 в получасовой момент времени. Доза 500 нМ альвоцидиба продемонстрировала увеличенное связывание CDK9/Hexim1. Репрезентативный вестерн-блот представлен на Фигуре 11A с количественным анализом вестерн-блота на Фигуре 11B.
Подобные эксперименты показывают, что 2-часовая обработка различными дозами альвоцидиба демонстрирует дозозависимое увеличение связывания CDK9/Hexim1. Репрезентативный вестерн-блот представлен на Фигуре 12A с количественным анализом вестерн-блота на Фигуре 12B.
ПРИМЕР 8
АЛЬВОЦИДИБ ВРЕМЯ- И ДОЗОЗАВИСИМО РЕПРЕССИРУЕТ РЕГУЛИРУЕМЫЕ СУПЕРЭНХАНСЕРНЫМ КОМПЛЕКСОМ ГЕНЫ
Клетки A549 являются альвеолярными базальными эпителиальными клетками аденокарциномы человека, используемыми в качестве легочной эпителиальной модели II типа (солидная опухоль). Эти клетки сеяли и обрабатывали альвоцидибом при идентичных концентрациях и дозах. Обработку останавливали лизисом клеток и выделяли РНК для анализа ОТ-кПЦР. Данные показывают, что альвоцидиб времязависимо подавляет регулируемые суперэнхансерным комплексом гены в клетках солидной опухоли. Репрезентативный вестерн-блот представлен на Фигуре 13A. Экспрессию мРНК определяли и нормализовали по β-актину и контролю. Альвоцидиб полностью блокировал экспрессию мРНК в моменты времени 24 и 48 часов.
На Фигуре 13B представлены результаты исследования с повышением дозы, выполненного согласно методике, приведенной в данном примере, при этом лизис клеток проводили через 2 часа после обработки альвоцидибом. Диапазон доз (0,05 мкМ - 8 мкМ) использовали для демонстрации экспрессии мРНК и регрессии в ответ на альвоцидиб с зависимостью от дозы для клеток A549. Данные показывают, что различные дозы альвоцидиба изменяют экспрессию мРНК в момент времени 2 часа с заметной репрессией при дозе 0,1 мкМ альвоцидиба. Полную репрессию наблюдали в анализе при дозах от 1 мкМ до 8 мкМ по сравнению с контролем по β-актину и растворителю.
ПРИМЕР 9
АЛЬВОЦИДИБ ВРЕМЯЗАВИСИМО ПОДАВЛЯЕТ ЭКСПРЕССИЮ БЕЛКА В КЛЕТКАХ СОЛИДНОЙ ОПУХОЛИ И НЕЙРОБЛАСТОМЫ
Клетки A549 и клетки SK-N-AS (линию клеток нейробластомы надпочечника человека) сеяли и обрабатывали альвоцидибом в концентрациях 100 нМ и 300 нМ соответственно. Клетки собирали в определенное время, выделяли суммарный белок и детектировали с помощью вестерн-блоттинга. Данные показывают, что альвоцидиб времязависимо подавляет экспрессию белков MCL-1 и c-MYC/N-MYC посредством ингибирования CDK9. Репрезентативный вестерн-блот представлен на Фигурах 14А и 14B.
ПРИМЕР 10
АЛЬВОЦИДИБ ВРЕМЯЗАВИСИМО ПОДАВЛЯЕТ ЭКСПРЕССИЮ мРНК В КЛЕТКАХ MV4-11
Клетки MV4-11 сеяли и обрабатывали альвоцидибом в концентрации 100 нМ. Клетки собирали через 0,5, 1, 3, 4, 8 и 16 часов после обработки. Клетки собирали и выполняли детектирование мРНК с помощью анализа ОТ-кПЦР, как описано в предыдущих примерах. Экспрессию MCL-1 сравнивали с экспрессией контрольных и необработанных клеток. На Фигуре 15 показано, что альвоцидиб времязависимо подавляет экспрессию мРНК MCL-1. Экспрессия MCL-1 репрессирована в момент времени 30 минут, достигает максимальной репрессии через 1 час после введения дозы и уменьшается в момент времени 2 часа. По-видимому, ингибирование экспрессии отсутствует в момент времени 3 часа.
ПРИМЕР 11
АЛЬВОЦИДИБ В КОМБИНАЦИИ С JQ-1 УМЕНЬШАЕТ ЭКСПРЕССИЮ MCL-1 И C-MYC В КЛЕТКАХ A549 ЛУЧШЕ, ЧЕМ ОБРАБОТКА ОТДЕЛЬНЫМИ СРЕДСТВАМИ
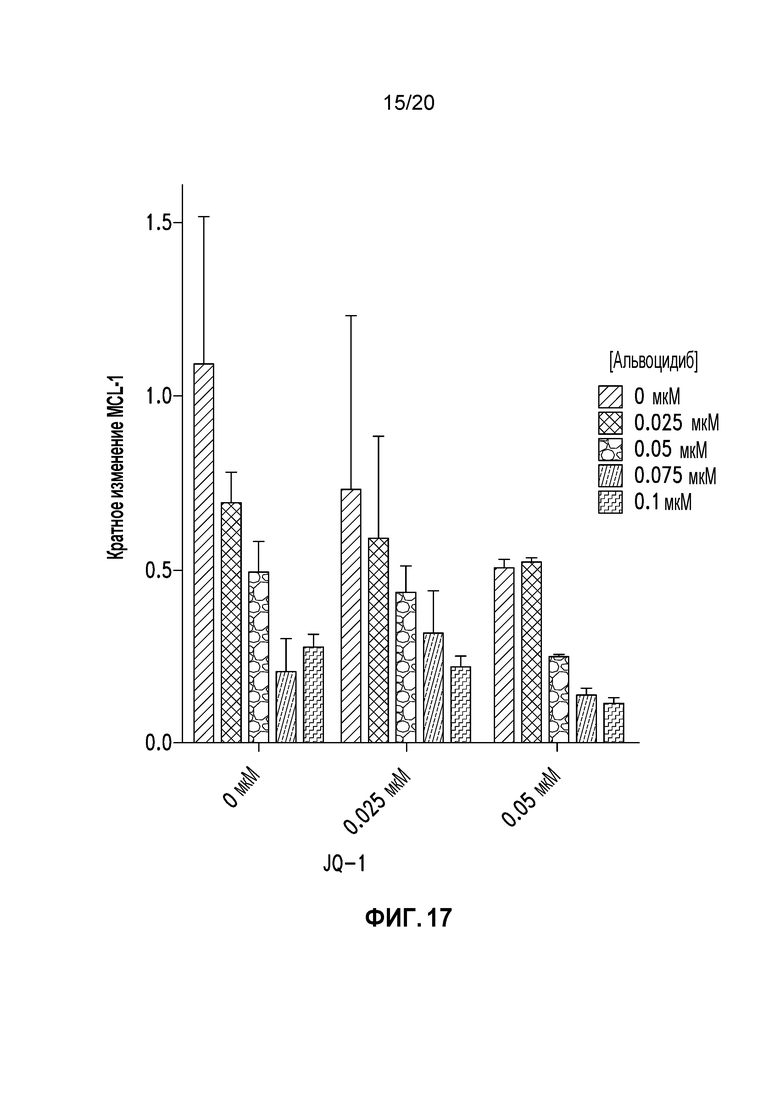
Клетки A549 сеяли и обрабатывали альвоцидибом при концентрациях в пределах от 0 нМ до 100 нМ в комбинации с JQ-1 при концентрациях в пределах от 0 нМ до 50 нМ. Клетки сначала обрабатывали JQ-1 в течение 1 часа, после чего обрабатывали альвоцидибом в течение 2 часов. После обработки клеток солидной опухоли клетки собирали и детектировали мРНК с помощью ОТ-кПЦР, как описано в предыдущих примерах. На Фигуре 17 показано, что альвоцидиб времязависимо подавляет экспрессию мРНК MCL-1 посредством ингибирования CDK9.
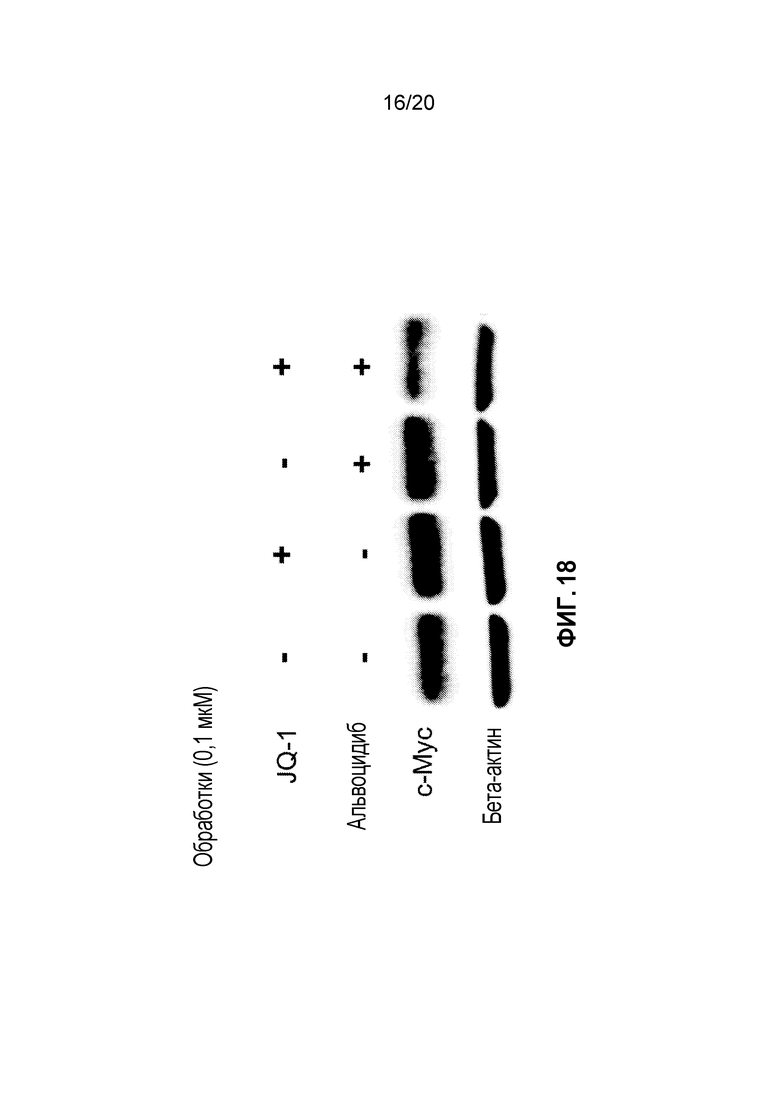
На Фигуре 18 показано, что в случае комбинирования альвоцидиба с JQ-1 экспрессия белка c-MYC подавлена в клетках A549. Клетки получали так же, как описано в этом примере, и затем обрабатывали в течение 2 часов 100 нМ альвоцидиба и 100 нМ JQ-1, как указано на Фигуре 18. После обработки клетки собирали и выполняли детектирование белка с помощью стандартных методик иммуноблотинга.
ПРИМЕР 12
АЛЬВОЦИДИБ В КОМБИНАЦИИ С JQ-1 ДОЗОЗАВИСИМО УВЕЛИЧИВАЕТ АПОПТОЗ В КЛЕТКАХ A549
Клетки A549 обрабатывали JQ-1 при концентрациях в пределах от 0,03 до 10 мкМ в течение 24 часов (Фигура 19). После обработки JQ-1 в течение 24 часов, добавляли альвоцидиб при концентрации 100 нМ. Добавляли Cell Titer GLO и Caspase GLO и измеряли люминесценцию через 48 часов после введения дозы. Повышение доз JQ-1 в комбинации с постоянными дозами альвоцидиба продемонстрировало синергическое увеличение активности каспазы. При введении дозы 1 мкМ JQ-1 в комбинации с дозой 100 нМ альвоцидиба наблюдали более чем 3-кратное увеличение апоптотической реакции. Такое увеличение указывает, что альвоцидиб в комбинации с JQ-1 синергически увеличивает апоптоз в раковых клетках A549 по сравнению с альвоцидибом или JQ-1 по отдельности (Фигура 19).
ПРИМЕР 13
ДИНАЦИКЛИБ В КОМБИНАЦИИ С JQ-1 ДОЗОЗАВИСИМО УВЕЛИЧИВАЕТ АПОПТОЗ В КЛЕТКАХ A549
Клетки A549 обрабатывали JQ-1 в концентрациях в пределах от 0,03 до 10 мкМ в течение 24 часов (Фигура 20). После обработки JQ-1 в течение 24 часов, добавляли динациклиб в концентрации 3 нМ. Добавляли Cell Titer GLO и Caspase GLO и измеряли люминесценцию через 48 часов после введения дозы. Повышение доз JQ-1 в комбинации с постоянными дозами динациклиба продемонстрировало синергическое увеличение активности каспазы. При введении дозы 1 мкМ JQ-1 в комбинации с дозой 3 нМ динациклиба наблюдали более чем 4-кратное увеличение апоптотической реакции. Такое увеличение указывает, что динациклиб в комбинации с JQ-1 синергически увеличивает апоптоз в раковых клетках A549 по сравнению с динациклибом или JQ-1 по отдельности (Фигура 20).
ПРИМЕР 14
АЛЬВОЦИДИБ СНИЖАЕТ ЭКСПРЕССИЮ MCL-1 И C-MYC В КЛЕТКАХ A549
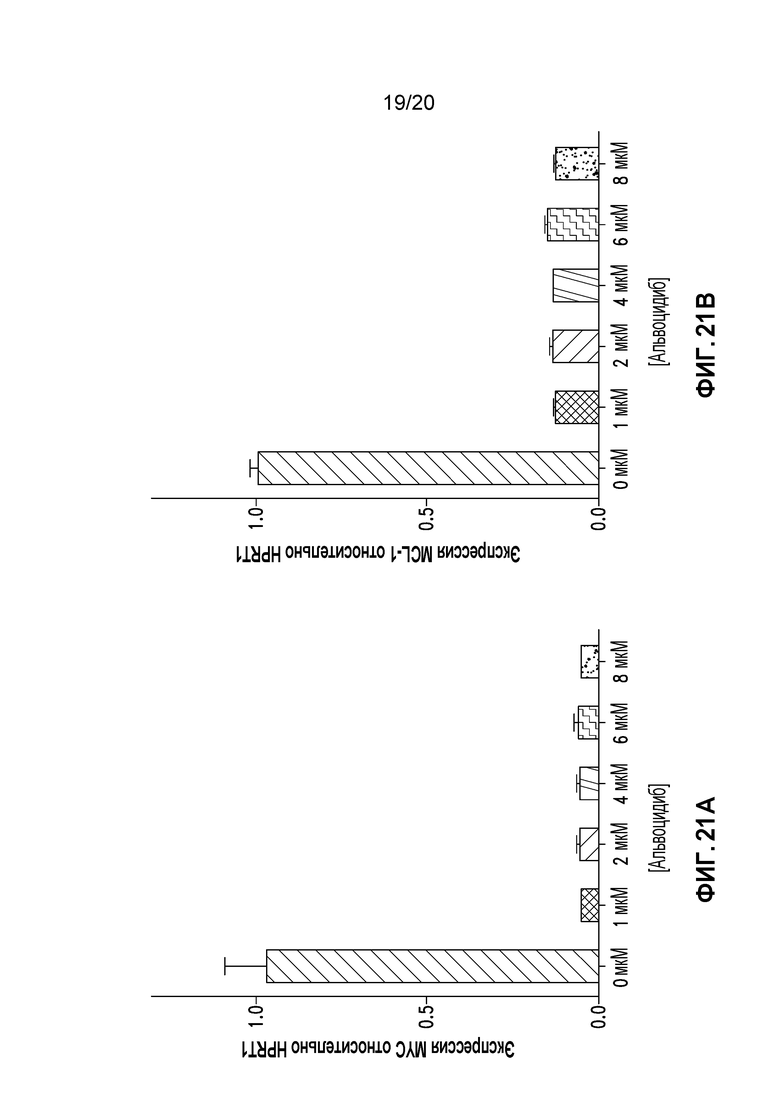
Клетки A549 сеяли и обрабатывали альвоцидибом в концентрациях в пределах от 0 мкМ до 8 мкМ в течение 2 часов. После обработки клеток солидной опухоли клетки собирали и детектировали мРНК с помощью ОТ-кПЦР, как описано в предыдущих примерах. На Фигуре 21A показано, что альвоцидиб дозозависимо подавляет экспрессию мРНК MYC относительно HPRT1. На Фигуре 21B показано, что альвоцидиб дозозависимо подавляет экспрессию мРНК MCL-1 относительно HPRT1.
ПРИМЕР 15
CDK9-СПЕЦИФИЧЕСКАЯ миРНК СИНЕРГИЧЕСКИ ДЕЙСТВУЕТ С ИНГИБИТОРАМИ BET, УМЕНЬШАЯ ЭКСПРЕССИЮ БЕЛКА И УВЕЛИЧИВАЯ АПОПТОЗ В КЛЕТКАХ A549
Клетки A549 сеяли и обрабатывали неспецифической миРНК или CDK9-специфической миРНК в течение 48 часов. Экспрессию белка измеряли относительно контроля для необработанной неспецифической миРНК и CDK9-специфической миРНК. На Фигуре 22A показано определенное уменьшение CDK9 относительно необработанной и неспецифической миРНК, тогда как β-актин остается постоянным.
Для оценки индукции апоптоза выполняли вышеописанную процедуру с последующей обработкой в течение 48 часов ингибитором BET (IBET762, JQ-1 или OTX015) в концентрации 0,03 мкМ. После 48-часовой обработки ингибитором BET добавляли Cell Titer GLO и Caspase GLO и измеряли люминесценцию для оценки жизнеспособности клеток и апоптоза. На Фигуре 22B показано приблизительно 2-3-кратное увеличение активности при обработке клеток ингибиторами BET в комбинации с неспецифической миРНК по сравнению с ингибиторами BET с CDK9-специфической миРНК.
Все патенты США, публикации заявок на патенты США, заявки на патенты США, иностранные патенты, иностранные заявки на патенты и непатентные публикации, указанные в настоящем описании, полностью включены посредством отсылкой в случае, если они не противоречат настоящему описанию.
На основании вышеизложенного следует понимать, что хотя определенные варианты осуществления изобретения были описаны в настоящем документе в целях иллюстрации, различные модификации могут быть сделаны без отступления от сущности и объема изобретения. Таким образом, изобретение не ограничено кроме как прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНИРОВАННЫЕ ТЕРАПИИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2759963C2 |
| БИВАЛЕНТНЫЕ ИНГИБИТОРЫ БРОМОДОМЕНОВ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2742035C2 |
| ЛЕЧЕНИЕ СОСТОЯНИЙ, АССОЦИИРОВАННЫХ С ГИПЕРИНСУЛИНЕМИЕЙ | 2015 |
|
RU2722179C2 |
| ПРОГНОЗИРОВАНИЕ ОТВЕТА НА АЛЬВОЦИДИБ С ПОМОЩЬЮ АНАЛИЗА ПРОФИЛЯ МИТОХОНДРИЙ | 2016 |
|
RU2717829C2 |
| МОДУЛЯТОРЫ ПРОТЕОЛИЗА НА ОСНОВЕ ИМИДОВ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2704807C2 |
| ЛЕЧЕНИЕ ОПУХОЛЕЙ КОМБИНАЦИЕЙ ОНКОЛИТИЧЕСКОГО АДЕНОВИРУСА, ИНГИБИТОРА CDK4/6 И ДОПОЛНИТЕЛЬНОГО ТЕРАПЕВТИЧЕСКОГО АГЕНТА | 2020 |
|
RU2835886C1 |
| ЛЕЧЕНИЕ ОПУХОЛЕЙ КОМБИНАЦИЕЙ ОНКОЛИТИЧЕСКОГО АДЕНОВИРУСА И ИНГИБИТОРА CDK4/6 | 2019 |
|
RU2811278C2 |
| ПРОЛЕКАРСТВА АЛЬВОЦИДИБА, ИМЕЮЩИЕ ПОВЫШЕННУЮ БИОДОСТУПНОСТЬ | 2016 |
|
RU2752729C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМБИНАЦИИ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2017 |
|
RU2726367C2 |
| ЦИАНОТИЕНОТРИАЗОЛОДИАЗЕПИНЫ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2750164C2 |



Настоящая группа изобретений относится к медицине, а именно к онкологии, и касается лечения рака путем воздействия на транскрипционный контроль в суперэнхансерных областях. Для этого вводят эффективное количество альвоцидиба в комплексе с ингибитором бромодомена, представляющим собой ОТХ015 или IBET762. Это обеспечивает эффективное лечение рака за счет синергетического усиления апоптоза опухолевых клеток указанными компонентами. 2 н. и 16 з.п. ф-лы, 22 ил., 1 табл., 15 пр.
1. Способ лечения рака у нуждающегося в этом млекопитающего, включающий введение млекопитающему эффективного количества:
i) альвоцидиба или его фармацевтически приемлемой соли, и
ii) ингибитора бромодомена (BRD), выбранного из OTX015 и IBET762, или их фармацевтически приемлемых солей.
2. Способ по п.1, где ингибитором BRD является OTX015.
3. Способ по п.1, где ингибитором BRD является IBET762.
4. Способ по любому из пп.1-3, где раком является острый миелоидный лейкоз.
5. Способ по любому из пп.1-3, где раком является лейкоз.
6. Способ по любому из пп.1-3, где раком является солидная опухоль.
7. Способ по любому из пп.1-3, где раком является рак молочной железы, предстательной железы или толстой кишки.
8. Способ по любому из пп.1-3, где альвоцидиб или его фармацевтически приемлемую соль и ингибитор BRD вводят последовательно.
9. Способ по любому из пп.1-3, где альвоцидиб или его фармацевтически приемлемую соль и ингибитор BRD вводят совместно.
10. Фармацевтическая композиция для лечения рака, включающая фармацевтически приемлемый носитель или вспомогательное вещество, эффективное количество альвоцидиба или его фармацевтически приемлемой соли, и эффективное количество ингибитора бромодомена (BRD), выбранного из OTX015 и IBET762, или их фармацевтически приемлемых солей.
11. Фармацевтическая композиция по п.10, где ингибитором BRD является OTX015.
12. Фармацевтическая композиция по п.10, где ингибитором BRD является IBET762.
13. Фармацевтическая композиция по любому из пп.10-12, где раком является острый миелоидный лейкоз.
14. Фармацевтическая композиция по любому из пп.10-12, где раком является лейкоз.
15. Фармацевтическая композиция по любому из пп.10-12, где раком является солидная опухоль.
16. Фармацевтическая композиция по любому из пп.10-12, где раком является рак молочной железы, предстательной железы или толстой кишки.
17. Фармацевтическая композиция по п.10, где альвоцидиб или его фармацевтически приемлемая соль и ингибитор BRD предназначены для последовательного введения.
18. Фармацевтическая композиция по п.10, где альвоцидиб или его фармацевтически приемлемая соль и ингибитор BRD предназначены для совместного введения.
| FISKUS W | |||
| Et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Насос | 1917 |
|
SU13A1 |
| СИНЕРГИЧЕСКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМБИНАЦИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2007 |
|
RU2438664C2 |
| WO 03028001 A2, 03.04.2003 | |||
| CHAN D | |||
| et al | |||
| "Belinostat and panobinostat (HDACI): in vitro and in vivo studies in thyroid cancer" | |||
Авторы
Даты
2020-12-01—Публикация
2015-11-06—Подача